Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen
Forord
Sist faglig oppdatert: 14.10.2019
Mange medisinske faggrupper har i en årrekke lagt ned et betydelig arbeid for å komme frem til konsensusbaserte faglige anbefalinger for diagnostikk og behandling av ulike typer kreft. Som ledd i Nasjonal strategi for kreftområdet (2006–2009) fikk Helsedirektoratet i oppdrag å videreutvikle og oppdatere faggruppenes anbefalinger til nasjonale handlings-programmer for kreftbehandling, i nært samarbeid med fagmiljøene, de regionale helseforetakene, Nasjonalt kunnskapssenter for helsetjenesten, og andre relevante myndigheter. Nasjonale handlings-programmer for kreftbehandling skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
Målgruppen for handlingsprogrammet er spesialister og blivende spesialister innen ulike medisinske spesialiteter som indremedisin, kirurgi, onkologi, gynekologi, anestesi og allmenn-medisin. Annet helsepersonell som arbeider med den aktuelle pasientgruppen, som sykepleiere, fysioterapeuter, ernæringsfysiologer, sosionomer, prester og psykologer, utgjør også en selvsagt målgruppe. Det samme gjelder pasienter og pårørende som møter palliative problemstillinger.
Nasjonale retningslinjer fra Helsedirektoratet er å betrakte som anbefalinger og råd, basert på oppdatert faglig kunnskap som er fremskaffet på en systematisk, kunnskapsbasert måte. De nasjonale retningslinjene gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet, og er ment som et hjelpemiddel ved de avveininger tjenesteyterne må gjøre for å oppnå forsvarlighet og god kvalitet i tjenesten. Nasjonale retningslinjer er ikke direkte rettslig bindende for mottagerne, men bør langt på vei være styrende for de valg som skal tas. Ved å følge oppdaterte nasjonale retningslinjer vil fagpersonell bidra til å oppfylle kravet om faglig forsvarlighet. Dersom en velger løsninger som i vesentlig grad avviker fra de nasjonale retningslinjene, bør en dokumentere dette og være forberedt på å begrunne sine valg. Sykehusenes eiere og ledelse bør tilrettelegge virksomheten slik at de nasjonale retningslinjene kan følges.
Målet med handlingsprogrammet for palliasjon i kreftomsorgen er å forbedre behandlingen av pasienter med inkurable kreftsykdommer og begrenset levetid, og å sikre et like godt behandlingstilbud i hele landet. Deler av handlingsprogrammet kan også være til nytte i behandlingen av kreftpasienter tidligere i sykdomsforløpet. Dette gjelder for eksempel retningslinjene for behandling av symptomer som smerte og kvalme. Palliativ behandling gjelder ikke bare kreftpasienter, og de mer generelle delene av handlingsprogrammet er derfor også relevante og aktuelle utenfor kreftomsorgen.
Innholdet i nasjonale retningslinjer for palliasjon i kreftomsorgen vil vurderes årlig og om nødvendig oppdateres. Oppdateringen utføres av en arbeidsgruppe som består av representanter fra fagmiljøet, FHI og Helsedirektoratet.
Helsedirektoratet takker arbeidsgruppen for stor innsats i utarbeidelsen av de nasjonale retningslinjene.
Disse nasjonale retningslinjene for palliasjon i kreftomsorgen er publisert 14. oktober 2019.
Bjørn Guldvog
Helsedirektør
Innhold og omfang
Sist faglig oppdatert: 14.10.2019
Handlingsprogrammet for palliasjon i kreftomsorgen tar for seg behandling, pleie og omsorg til kreftpasienter. Tradisjonelt har den palliative pasientpopulasjonen vært avgrenset til kreftpasienter med antatt forventet levetid mindre enn 9–12 måneder. De senere årene har det imidlertid blitt fokus på at palliasjon er et pasientsentrert fagfelt som inkluderer pasienter med alle typer livstruende sykdom. Per i dag omfatter dette handlingsprogrammet hovedsakelig pasienter med kreft, både av historiske grunner og fordi en stor del av eksisterende dokumentasjon om palliasjon er knyttet til kreftpasienter. Imidlertid vil generelle forhold som er omtalt i handlingsprogrammet, også ha gyldighet for pasienter med andre diagnoser.
Palliasjon utøves innenfor de fleste fagområder og på alle nivåer i helsetjenesten. Palliasjon bør integreres med onkologi og andre medisinske spesialiteter tidlig i sykdomsforløpet, også der målet er helbredelse (kurativ fase) eller stabilisering av sykdommen og livsforlengelse. Behov for palliative tjenester vil ofte være økende når det erkjennes at sykdommen ikke lenger kan kontrolleres og frem til pasienten dør. Palliasjon inkluderer også sorgarbeid og oppfølging av etterlatte.
Handlingsprogrammets oppbygning og innhold
Palliasjon utøves på alle nivåer av helsetjenesten, og i stor grad utenfor spesialiserte, palliative enheter. Mange andre pasientgrupper enn kreftpasienter har behov for god palliativ behandling. Kapittel 4, Symptomer og tilstander, er den mest kreftspesifikke delen av handlingsprogrammet, men også denne er relevant for behandling av pasienter med andre diagnoser. De tre andre hovedkapitlene (kapittel 1, 2 og 3) er relevante for alt helsepersonell som møter og behandler pasienter med en dødelig sykdom og kort forventet levetid. Kapittel 2 (Kjennetegn og utfordringer ved palliasjon) og 4 (Symptomer og tilstander) gir konkret veiledning for utøvere av palliasjon på alle nivåer i helsetjenesten.
Kapittel 1. Innledning
I dette kapittelet beskrives grunntrekkene ved palliasjon, som pasientpopulasjonen, pårørende, organisering, samarbeid, tverrfaglighet og grunnleggende elementer i utredning og behandling. De ulike elementene utdypes i senere kapitler.
Kapittel 2. Kjennetegn og utfordringer ved palliasjon
Kapittelet beskriver innholdet i palliativt arbeid og forhold ved den palliative populasjonen som krever spesiell kompetanse. Innholdet er basert på etablert faglig praksis både nasjonalt og internasjonalt. For tema der evidensgradering er funnet mulig og relevant, er dette gjennomført.
Kapittel 3. Økonomiske ytelser
Langvarig sykdom kan føre til at inntekten i en husholdning endrer seg dramatisk over få år. Dette kapittelet vil belyse et utvalg rettigheter og ytelser som er av betydning for pasienter, pårørende og etterlatte som er medlem av folketrygden. Kapitlet har lenker til relevante nettsider som omhandler aktuelle ytelser, refusjonsordninger og rettigheter.
Kapittel 4. Symptomer og tilstander
Kapittelet består av kliniske retningslinjer for utredning og behandling av en del sentrale symptomer og tilstander innenfor palliasjon. I all hovedsak gjelder retningslinjene pasienter med kreftsykdom. Dette kapitlet er i 2019 utvidet til å inneholde tilstanden malign medullakompresjon og beskrivelse av behandlingstilbudet palliativ strålebehandling av skjelettmetastaser.
Kapittel 5. Prosess og metode for utarbeiding av retningslinjene
I dette kapittelet er det beskrevet arbeidsmåtene brukt i utarbeidelsen av handlingsprogrammet, og hvilke fagpersoner som har deltatt i arbeidsgruppene helt fra første utgave i 2007.
Oppdatering 2019 – IS-2800
Alle kapitlene i handlingsprogrammet er gjennomgått og oppdatert i 2019, unntatt vedleggene om kompetanse og organisering, der en del av innholdet er utdatert. Det er iverksatt en oppdatering av disse.
Vedlegg 1: Organisering (Ikke oppdatert 2019)
Vedlegg 2: Kompetanse (Ikke oppdatert 2019)
Vedlegg 3: Aktuelle nettadresser
Innledning
Hva er palliasjon
Sist faglig oppdatert: 14.10.2019
Palliasjon er et fagområde hvor hovedfokuset er lindring og best mulig livskvalitet for pasienter og deres pårørende i hele forløpet av livstruende sykdom. Kunnskap om grunnsykdommen og om ulike behandlingsmetoder, systematisk symptomkartlegging og lindring, samarbeid på tvers av profesjoner og nivåer i helsetjenesten, aktiv pasientmedvirkning og ivaretakelse av pårørende står sentralt. Cicely Saunders som etablerte moderne palliasjon, var tidlig en pionér innen pasientsentrert oppfølging (D. Clark, 2007). På engelsk benyttes «palliative medicine» om det medisinske fagfeltet, mens «palliative care» benyttes for å beskrive faget som helhet. På norsk benyttes «palliativ medisin» og «palliasjon» tilsvarende. Palliasjon beskrives ofte også som «lindrende behandling, pleie og omsorg». Begrepet palliasjon vil hovedsakelig bli benyttet i dette handlingsprogrammet.
Palliasjon skal praktiseres på alle områder og nivåer i helsetjenesten, og er en naturlig del av de fleste kliniske spesialiteter, men har også et innhold som ikke dekkes av noe annet fagområde (Leve med kreft. Nasjonal kreftstrategi (2018–2022), 2018; På liv og død: palliasjon til alvorlig syke og døende, 2017).Handlingsprogrammet omhandler palliasjon til kreftpasienter, som regel i ikke-kurativ fase, men mye av innholdet er relevant også for andre pasientgrupper. Målgruppen er helsearbeidere i alle profesjoner som arbeider med kreftpasienter i kommune- eller i spesialisthelsetjenesten. Dette første kapittelet vil gi en kortfattet oversikt over fagfeltet. Detaljer om hvert tema vil bli presentert i egne kapitler.
Fokusområder i palliasjon
Evidensbasert praksis
Systematisk kartlegging av symptomer og behov
Symptomlindring
Kommunikasjon
Helhetlig tilnærming
Pasient og pårørende i fokus
Samarbeid og tverrfaglighet
Best mulig livskvalitet
Mest mulig hjemmetid
Omsorg ved livets slutt
Oppfølging av etterlatte
Definisjon
Sist faglig oppdatert: 14.10.2019
Verdens helseorganisasjon (WHO) definerer palliasjon som følger (Helsedirektoratet, 2015; WHO definition of palliative care):
Palliativ behandling, pleie og omsorg er en tilnærmingsmåte som har til hensikt å forbedre livskvaliteten til pasienter og deres familier i møte med livstruende sykdom, gjennom forebygging og lindring av lidelse, ved tidlig identifisering, grundig kartlegging, vurdering og behandling av smerte, og andre problemer av fysisk, psykososial og åndelig art.
Pasienter med livstruende sykdom opplever ofte lange sykdomsforløp med mange ulike faser. Mange får sykdomsrettet behandling i flere år, og opplever ulike bivirkninger og symptomer, og har mange tapsopplevelser underveis (figur 1.1). WHO vektlegger at palliasjon skal benyttes i hele sykdomsforløpet, og ikke bare ved livets slutt:
Palliasjon er aktuelt tidlig i sykdomsforløpet sammen med annen behandling som har til hensikt å forlenge livet, som for eksempel medikamentell kreftbehandling og strålebehandling, og omfatter også undersøkelser som er nødvendige for å forstå og håndtere symptomer og komplikasjoner som sykdommen medfører.
I tillegg angir WHO følgende viktige presiseringer om palliasjon:1
- Lindrer smerte og andre plagsomme symptomer;
- Anerkjenner døden som en naturlig del av livet;
- Har verken til hensikt å fremskynde eller utsette døden;
- Inkluderer psykologiske og åndelige/eksistensielle aspekter i pasientomsorgen;
- Tilbyr nødvendig hjelp og støtte slik at pasientene kan leve et så aktivt liv som mulig frem til døden inntreffer;
- Tilbyr nødvendig hjelp og støtte slik at pårørende kan håndtere både pasientens sykdom og egen sorgprosess;
- Bruker en tverrfaglig tilnærming for å ivareta pasienter og pårørendes behov, også i sorgprosessen hvis påkrevd;
- Skal forbedre livskvaliteten og kan også virke positivt på sykdomsforløpet.

1 Arbeidsgruppen har fått oversatt kulepunktene ved hjelp av et oversetterfirma og eksperter i fagmiljøet etter anbefaling fra EORTC.
Sykdomsfaser og behandlingsintensjon
Sist faglig oppdatert: 14.10.2019
Pasienter med livstruende sykdommer vil ha ulike behov og ulik symptombyrde i løpet av sykdomsforløpet. Behandling gis med ulik intensjon i ulike faser av sykdommen. I forhold til kreft, er det vanlig å skille mellom kurativ, livsforlengende og palliativ behandlingsintensjon (På liv og død: palliasjon til alvorlig syke og døende, 2017). Det er sentralt å avklare hvilken intensjon iverksatt behandling og tiltak skal ha, og å sørge for at pasienten og pårørende har oppfattet dette. Dersom behandlingen gis med livsforlengende og/eller palliativ intensjon, må bivirkninger og effekt i mye større grad veies opp mot hverandre enn når hensikten er å kurere sykdommen.
I den kurative fasen vil det i mange tilfeller være mulig å isolere en eller to patofysiologiske årsaker til symptomene. I palliativ fase er ofte diagnostikken mer krevende, da pasientens plager kan ha flere ulike årsaker samtidig, for eksempel residiv av kreftsykdom, ettervirkninger av gjennomgått behandling, metabolske forandringer og psykiske reaksjoner på sykdom. Pasienter med langtkommen sykdom kan ha mange symptomer av fysisk og psykisk karakter samtidig. Pasienter i palliativ fase kjennetegnes ved:
- Komplekse symptombilder med bakgrunn i både fysiske, psykiske, sosiale og åndelige/eksistensielle forhold
- Hyppige og raske endringer i symptombildet
- Akutte tilstander og komplikasjoner som krever rask vurdering og behandling
- Tap av fysisk funksjon og økende hjelpe- og pleiebehov
- Sviktende organfunksjon(er)
- Endret farmakokinetikk/-dynamikk
Omsorg ved livets slutt har tradisjonelt vært i fokus i palliasjon (Rosland, von Hofacker, & Paulsen, 2006) og er fortsatt en sentral del av faget (På liv og død: palliasjon til alvorlig syke og døende, 2017). God omsorg og lindring ved livets slutt er sentralt både for pasienten og de pårørende, uavhengig av grunnsykdom. Å erkjenne at pasienten er døende, og å snakke åpent om det, er svært viktig for å unngå belastende undersøkelser og uhensiktsmessig bruk av avansert medisinsk overvåkning og behandling. Ved ikke å erkjenne at pasienten er døende, fratar vi pasienten og pårørende muligheten til en verdig avslutning på livet samt muligheten for å ta avskjed (J. Ellershaw & Wilkinson, 2011). Dette øker risikoen for helseplager og kompliserte sorgprosesser hos de etterlatte. God symptomlindring og god kommunikasjon med pasienten og pårørende er derfor sentralt, ikke minst ved livets avslutning.
Pasienter opplever ofte senbivirkninger etter kreftbehandling. En stor andel sliter med både smerter, utmattelse og andre kroniske plager som påvirker deres livskvalitet og gjør dem avhengige av ulike former for kontinuerlig helsehjelp (van den Beuken-van Everdingen et al., 2007). Parallellt med et økt behandlingstilbud der flere helbredes for kreftsykdom, og de aller fleste lever svært mye lenger også når sykdommen ikke kan helbredes, vil et økende antall pasienter ha behov for hjelp til å håndtere kroniske og tildels alvorlige helseplager som følge av sykdom eller behandling (van den Beuken-van Everdingen, Hochstenbach, Joosten, Tjan-Heijnen, & Janssen, 2016).
Pasientens medbestemmelse og forhåndssamtaler
Sist faglig oppdatert: 14.10.2019
Kartlegging av pasientens preferanser, hvordan hun/han ønsker å benytte tiden sin, og å bidra til refleksjon omkring avveininger mellom å fortsette sykdomsrettet behandling eller ikke, er sentralt for å oppnå best mulig livskvalitet. Begrepene «advance care planning» og «forhåndssamtaler» benyttes ofte om denne prosessen (Friis & Forde, 2017; Sudore et al., 2017). Generelt er pasientperspektivet i større grad i fokus i palliasjon enn i mange andre medisinske spesialiteter, hvor ofte sykdommen og selve behandlingen innehar en større plass. Kontakt med spesialisert palliasjon tidlig i sykdomsforløpet vil kunne hjelpe pasienten og familien til å mestre situasjonen, og til å delta aktivt i valg som angår egen sykdom og behandling (Ferrell, Temel, Temin, & Smith, 2017).
Organisering av palliative tjenester
Sist faglig oppdatert: 14.10.2019
Samarbeid på tvers av spesialiteter, profesjoner og helsetjenestenivåene bedrer kvaliteten på tjenestene. Integrasjon mellom palliasjon og tradisjonell somatisk medisin er anbefalt og ønskelig (Ferrell et al., 2017; På liv og død: palliasjon til alvorlig syke og døende, 2017). Dette gjelder spesielt innen onkologi hvor palliasjon som fagfelt startet og i dag er mest utbredt. Også innen medisinske fagfelt som for eksempel hjertemedisin, lungemedisin, nevrologi, geriatri osv., er integrasjon av palliasjon av stor betydning. Integrasjon kjennetegnes blant annet ved en tydelig oppgave- og ansvarsfordeling mellom spesialist innen grunnsykdommen og lege med spesialisert kunnskap om palliasjon, samt mellom spesialist- og kommunehelsetjenesten og innad i kommunehelsetjenesten (På liv og død: palliasjon til alvorlig syke og døende, 2017). Pasienten og pårørende bør oppleve forutsigbarhet, ansvarsavklaring og kontinuitet i behandlingskjeden, og at nødvendige helsetjenester er tilgjengelige når de trenger det (Helse- og omsorgsdepartementet).
Pasienter med behov for palliative tjenester vil vekselvis ha behov for tilbud fra fastlege, kommune- og spesialisthelsetjenesten. Pasientrettet, individualisert behandling krever at pasienten får palliasjon der han eller hun til enhver tid oppholder seg. God organisering av helsetjenestene er helt nødvendig for å få dette til. Fastlegen bør kunne ivareta pasientens behov for forståelse av totalsituasjonen, og spiller en viktig rolle gjennom hele sykdomsforløpet. Gjennom sykdommens ulike faser vil behovet for palliasjon endre seg, og det vil være varierende behov for spesialisert palliativ behandling.
Mange pasienter ønsker å tilbringe mest mulig tid hjemme eller så nær hjemmet som mulig (Helse- og omsorgsdepartementet), og mange ønsker å dø hjemme (Gomes, Calanzani, Gysels, Hall, & Higginson, 2013). For å oppnå dette, må fastlege, hjemmetjeneste og øvrig kommunehelsetjeneste og spesialisthelsetjeneste samarbeide tett (Danielsen, Sand, Rosland, & Førland, 2018). Overføring av informasjon og kunnskap om den enkelte pasientens situasjon og behandling ved skifte av behandlingsnivå, skal være så sømløs som mulig for å sikre god kvalitet og trygghet. Bruk av pasienttilpassede forløp og individuell plan er viktige verktøy for å skape best mulig samhandling og kontinuitet.
Tverrfaglighet
Sist faglig oppdatert: 14.10.2019
Totalsituasjonen og symptombildet for mange pasienter med uhelbredelig sykdom er kompleks og sammensatt. Grundige tverrfaglige vurderinger, både på tvers av de medisinske spesialitetene og ulike profesjoner, er derfor avgjørende for å oppnå god symptomlindring. Palliasjon handler også om hjelp til mestring og hjelp til å leve så aktivt som mulig inntil døden. En aktiv tverrfaglig tilnærming kan bidra til å oppnå dette. Faste tverrfaglige møtepunkter er sentrale for å sikre gode, helhetlige vurderinger som grunnlag for behandling. Følgende profesjoner kan være involvert i et spesialisert palliativt tilbud: lege, sykepleier, fysioterapeut, ergoterapeut, sosionom, klinisk ernæringsfysiolog, logoped, prest, psykolog/psykiater og psykiatrisk sykepleier. Sammensetningen av palliative team vil variere ut ifra lokale forhold. Spisskompetanse innenfor palliasjon, samt god dialog og felles forståelse av pasientens situasjon, er nødvendig for å oppnå gode behandlingsresultater.
Kartlegging av symptomer
Sist faglig oppdatert: 14.10.2019
God palliasjon forutsetter systematisk kartlegging av pasientens symptomer, behov, ressurser og totalsituasjon (S. Kaasa et al., 2008). Grundig anamnese og adekvat klinisk undersøkelse er kjernen i diagnostikken. Symptomer bør kartlegges regelmessig ved bruk av kjente, validerte metoder, uavhengig av sykdomsfase og behandlingsintensjon. Den enkleste, vanligste og anbefalte metoden å kartlegge symptomintensitet på, er at pasienten selv graderer intensitet av symptomet på en numerisk skala (NRS) fra 0 til 10 med et forankringspunkt i hver ende. Det er også viktig å kartlegge og angi pasientens funksjonsnivå for eksempel med ECOG/WHO status, da dette både er en viktig prognostisk faktor og et sentralt utgangspunkt for videre tiltak. Fagpersoner fra det tverrfaglige teamet bør benyttes aktivt i kartleggingsprosessen.
I tillegg til systematisk symptomkartlegging, anamnese og klinisk undersøkelse, kan det være riktig å supplere med blodprøver og bildediagnostikk. Utredningen må gjennomføres eller begrenses i samsvar med behandlingsintensjon og pasientens preferanser. Allmenntilstand, forventet levetid og gevinst av for eksempel bildediagnostikk, skal vurderes. God kunnskap om pasientens grunnsykdom, behandlingsmulighetene, samt pasientens livssituasjon, er påkrevd. Særlig ved langkommet sykdom, vil det sentrale målet med alle tiltak være bedre symptomlindring og/eller livskvalitet. Prinsippet som derfor bør følges hos denne pasientgruppen, er at resultater av gjennomført diagnostikk bør ha behandlingsmessig konsekvens. Etter systematisk kartlegging, kan målrettet behandling iverksettes. Valg av behandling baseres ofte på en kombinasjon av funn fra kartleggingen og empiri, og skal alltid skje i åpen dialog med pasienten og gjerne også hans eller hennes nærmeste pårørende. Det er sentralt at alle tiltak evalueres systematisk.
Grunnleggende prinsipper for kartlegging og behandling
- La pasienten angi sin opplevelse av situasjonen og sin forståelse av symptomer og plager
- Bruk numerisk skala fra 0 til 10 for pasientrapportering av symptomintensitet
- Kartlegg og grader funksjonsnivået ved bruk av ECOG/WHO status
- Kartlegg patofysiologiske forhold når det er mulig, dersom det får behandlingsmessige konsekvenser
- Involver fagpersoner fra det tverrfaglige teamet
- Iverksett tiltak etter gjeldende retningslinjer og i henhold til pasientens mål og ønsker
- Evaluer effekten av behandlingen
- Presiser hva som menes med effekt
- Evaluer ett tiltak om gangen (hvis mulig)
- Evaluer både medikamentelle og ikke-medikamentelle tiltak
- Vurder alltid aktuelle tiltak i lys av forventet levetid
- Ha kontinuerlig dialog med pasient og ev. pårørende om behandling, tiltak og prognose
Pårørende
Sist faglig oppdatert: 14.10.2019
Livstruende sykdom rammer både pasienten og familien. Pårørende har en sentral rolle, både i hjemmet og på institusjon. WHOs definisjon av palliasjon omfatter også omsorg for pårørende. Pårørende er definert som «den pasienten oppgir som pårørende». Kreftpasienter lever lenger med alvorlig sykdom enn tidligere, og de pårørende følger ofte pasienten tett gjennom krevende undersøkelser og behandling i mange år, og lever med frykt for å miste den som er syk. Flere studier har vist at belastningen hos mange pårørende medfører både redusert psykisk og fysisk helse, utfordring i relasjoner og krevende sorgprosesser (Stajduhar et al., 2010).
Pårørendes behov må anerkjennes og ivaretas. Relativt enkle grep i klinisk praksis kan bidra til å bedre situasjonen for pårørende, som for eksempel å la pårørende delta på konsultasjoner, gi god informasjon om pasientens helsetilstand, og sørge for at pårørende blir sett og ivaretatt når de ledsager pasienten. Systematisk kartlegging av pårørendes behov har vist å gi gevinst (Grande, Austin, Ewing, O'Leary, & Roberts, 2017).
Pasientens samtykke er påkrevd for å dele informasjon om helsetilstanden. Barn og unge som pårørende har en særskilt plass i lovverket og i klinisk praksis. Helsepersonell har plikt til å kartlegge om pasienten har mindreårige barn og skal bidra til å ivareta behovet for informasjon og nødvendig oppfølging som mindreårige barn med alvorlig syk forelder kan ha.
Sorgarbeid og ivaretakelse av de etterlatte er også en del av palliasjon. Å tilby de etterlatte en samtale med helsepersonell som kjente pasienten godt, fire til seks uker etter dødsfallet, er nyttig i sorgbearbeidingen, og dette er innarbeidet rutine i mange palliative enheter. Etterlatte bør oppfordres til å ta kontakt med egen fastlege ved behov samt informeres om muligheten for å delta i lokale sorggrupper. Helsepersonell har en særlig plikt til å sikre at barn som opplever at foreldre eller søsken dør, blir ivaretatt.
Kompetanse
Sist faglig oppdatert: 14.10.2019
For å møte de komplekse og sammensatte behovene til pasient og pårørende, trenger helsepersonell god kompetanse – både om grunnsykdommen og om palliasjon. Alle som arbeider med pasienter med livstruende sykdom, i alle faser av et sykdomsforløp, skal beherske grunnleggende palliasjon. Kunnskapen bør opparbeides i løpet av grunnutdanningene. Helsepersonell som arbeider ved spesialiserte, palliative enheter i kommune- og spesialisthelsetjenesten, bør ha spesialisert kompetanse i palliasjon. Gode ferdigheter i å kommunisere med pasienter og pårørende i en sårbar situasjon er sentralt, uavhengig av sykdomsfase og arbeidssted.
Frivillige
Sist faglig oppdatert: 14.10.2019
Bruk av frivillige har lange tradisjoner i palliasjon både nasjonalt og internasjonalt. Mange pasienter sliter med store psykososiale utfordringer som ikke kan avhjelpes tilstrekkelig gjennom den organiserte helsetjenesten, og ofte strekker heller ikke familien til. Å ha en uformell samtalepartner, eller en som kan bistå med praktiske utfordringer i hjemmet eller under innleggelse i helseinstitusjon, eller bare være tilstede, kan være både livsberikende og støttende, og gi økt livskvalitet. Bruk av frivillige er omtalt og anbefales i flere nasjonale dokumenter (Helsedirektoratet, 2015; Kultur- og kirkedepartementet; På liv og død: palliasjon til alvorlig syke og døende, 2017). Bruk av frivillige krever et godt system for opplæring og ivaretakelse av de frivillige samt koordinering.
Oppsummering
Sist faglig oppdatert: 14.10.2019
Palliasjon er et fagområde med hovedfokus på livskvalitet. Selv om handlingsprogrammet i hovedsak omhandler palliasjon hos kreftpasienter, er svært mye av innholdet relevant også for andre pasientgrupper. Å introdusere den palliative tilnærmingsmåten tidlig i forløpet av en livstruende sykdom bidrar til bedre livskvalitet gjennom ulike sykdomsfaser. Pasientens medbestemmelse og god dialog gjennom forhåndssamtaler er sentralt. God organisering av behandlingstilbudet med sømløse overganger mellom nivåene, og godt samarbeid på tvers av spesialiteter og profesjoner, er avgjørende for å oppnå god kvalitet på tjenestene. Palliasjon innebærer en systematisk og tverrfaglig tilnærming der pasientens totale livssituasjon, og de pårørende, er i sentrum. Faglig kompetanse er påkrevd hos alle involverte. Palliasjon kan bidra til best mulig livskvalitet og et verdig liv til tross for usikker livsprognose. Intensjonen med dette handlingsprogrammet er å sette fokus på disse elementene, og bidra til oppdatert og evidensbasert kunnskap og kompetanse for helsearbeidere i alle profesjoner.
Kjennetegn og utfordringer ved palliasjon
Innledning
Sist faglig oppdatert: 14.10.2019
Palliasjon omfatter ivaretakelse av både fysiske, psykiske, sosiale og åndelige/eksistensielle behov. Fagfeltet kjennetegnes derfor av en tverrfaglig tilnærming med høy grad av samarbeid og samhandling, der også pasienten og de pårørende inngår som en del av teamet.
Dette kapittelet tar for seg en del av de utfordringene helsepersonell stadig står overfor i palliativt arbeid, mens kapittel Symptomer og tilstander gir retningslinjer for behandling av noen av de vanligste symptomer og tilstander ved langtkommen kreftsykdom.
Følgende tema vil bli belyst i dette kapitlet:
- Kommunikasjon
- Ivaretakelse av fysisk funksjon
- Ivaretakelse av ernæringsmessige behov
- Pårørende
- Åndelige og eksistensielle utfordringer
- Den døende pasienten
- Dokumentasjon og kommunikasjon mellom aktørene
Kommunikasjon
Sist faglig oppdatert: 14.10.2019
Kommunikasjonsutfordringer i palliasjon
Best mulig livskvalitet for pasienten er den overordnede målsettingen for all palliativ behandling og pleie. Siden livskvalitet er subjektiv og derfor kun kan kartlegges ved å kommunisere med pasienten, blir gode ferdigheter i kommunikasjon spesielt viktig i møte med pasienter i palliativ fase av en kreftsykdom (L. Fallowfield & Jenkins, 1999; Kringlen, Finset, & Kringlen, 1999; Levy, 1998). Disse pasientene har ofte begrenset forventet levetid, men forskjellige sykdomsforløp, varierte symptombilder, ulik kulturell bakgrunn, varierende utdanningsnivå og sosial bakgrunn og ulik personlighet. Selv om det foreligger en rekke studier av kommunikasjonen mellom behandlere og kreftpasienter generelt, eller kreftpasienter i palliativ fase spesielt, gir litteraturen begrenset empirisk støtte til spesifikke prosedyrer eller teknikker (Detmar, Muller, Wever, Schornagel, & Aaronson, 2001; Lesley Fallowfield, 2010).
Møtet mellom pasient og behandler kan variere fra situasjoner preget av akutte, medisinske tilstander til samtaler om psykiske plager og eksistensielle problemstillinger (L. Fallowfield & Jenkins, 2004). Med mulig unntak for de akuttmedisinske situasjonene, inkludert delirium, skal fokus for samtalene i palliasjon både være sykdom og pasient (sykdomssentrert og pasientsentrert intervjustil). Det innebærer at pasientens oppfatning av, og perspektiv på, situasjonen skal komme frem i samtalen. På den måten kan pasienten bli en mer aktiv part i de behandlingsvalg som treffes, og hans/hennes behov vil komme klarere frem.
Av didaktiske grunner kan hensikten med samtaler mellom behandler og pasient inndeles i oppgaveorienterte sider (som å kartlegge pasientens helseproblemer eller å «gi informasjon») og i emosjonelle sider (som å samtale om eksistensielle forhold). Ofte vil en og samme samtale fylle begge hensikter.
Oppgaveorientert kommunikasjon
En sentral oppgave vil ofte være å kartlegge pasientens sykdomsbilde og hjelpebehov. Ved oppgaveorientert kommunikasjon vil samtalen typisk veksle mellom «åpne» og «lukkede» spørsmål, hvor hensikten i en førstegangskonsultasjon er en mest mulig systematisk kartlegging. Ideelt skal en slik samtale ha karakter av dialog og ikke av utspørring. Den som spør, får bare svar, heter det, og behandlerens evne til å lytte og respondere på pasientens verbale og non-verbale kommunikasjon er av sentral betydning for å etablere en god dialog.
Informasjon om «alvorlige nyheter»
Den canadiske onkologen Robert Buckman har lansert en mal (SPIKES) for hvordan en bør presentere informasjon om en kreftdiagnose, annen alvorlig sykdom eller sykdomsprogresjon (Baile et al., 2000). SPIKES-protokollen beskriver presentasjonen i 6 trinn:
| 1 Setting | Privat og uforstyrret. |
|
| Øye til øye. |
|
| Pasient (og lege!) rimelig bekvemme. |
|
| Vurder om andre enn lege og pasient skal være til stede. |
| 2 Perception | Hva er pasientens oppfatning av situasjonen? |
| 3 Invitation | Hva ønsker pasienten å vite? |
| 4 Knowledge | Gi kunnskap og informasjon i tilpassede doser. |
| 5 Empathy | Ta del i pasientens reaksjoner. Forhold deg aktivt til pasientens emosjonelle respons. |
| 6 Summary | Summer opp. Legg strategi for videre handling. |
Hensikten med denne tilnærmingen er å skape en prosess mellom behandler og pasient, og motvirke at informasjon om alvorlig sykdom blir en prosedyre. Formidlingen av faktiske, medisinske opplysninger er derfor kun ett av de seks trinnene.
Internasjonalt har denne malen fått en dominerende plass i opplæringen i å overbringe alvorlige nyheter. Malen er også egnet for samtaler om sykdoms-progresjon, manglende muligheter for livsforlengende behandling eller leveutsikter. Fra pasientens perspektiv vil «graden av alvorlig nyhet» være lik avstanden mellom forventning og formidlet realitet. For en pasient som er sterkt innstilt på ytterligere onkologisk behandling, vil informasjon om at dette ikke lenger er mulig, være mer truende enn for en pasient som har innsett og forsonet seg med at onkologisk behandling ikke lenger kan hjelpe. Kognitiv svikt (permanent som ved demens eller forbigående som etter operasjoner), eller et svært høyt angstnivå, kan begrense evnen til å motta informasjon.
Kommunikasjon om emosjonelle forhold
I tillegg til sykdommen og manifestasjoner av denne, er eksistensielle spørsmål, pasientens psykiske tilstand og relasjoner til de nærmeste sentrale forhold når livet nærmer seg slutten. De to siste forhold er av spesiell betydning i livets aller siste fase. Kontinuitet med oppfølgning over tid av samme helsepersonell er en viktig forutsetning for at pasienten vil ta opp disse vanskelige temaene.
Mange behandlere kvier seg for å adressere forhold utenfor det strikt medisinske, med begrunnelse om at slike tema ikke ligger innenfor «behandlingskontrakten».
Helt konkret kan en høy angst-skår på et ESAS-skjema være en god innfallsvinkel til å adressere pasientens psykiske tilstand. Et åpent spørsmål som kommenterer skåren, kan være en god åpning. Hvis pasienten ikke ønsker å samtale om sin psykiske tilstand, er dette lett å akseptere, samtidig som vedkommende får invitasjon til å komme tilbake til temaet på et senere tidspunkt.
For psykiske symptomer skal dette lede til en diagnostisk konklusjon og vurdering av behandlingsmuligheter. Tilpasningsforstyrrelse med angst og depressive symptomer er den hyppigst forekommende psykiatriske diagnosen hos kreftpasienter. Ved denne tilstanden vil en vel tilrettelagt samtale i de fleste tilfeller ha en symptomreduserende effekt. Samtalen kan eventuelt suppleres med et mildt sedativum, og bør alltid følges opp med ytterligere samtaler.
Samtale med de pårørende
Moderne palliasjon vektlegger ivaretakelse av familien/pårørende, og familie-medlemmer inkluderes i mange samtaler både av oppgaveorientert og emosjonell karakter (Emanuel, Fairclough, Wolfe, & Emanuel, 2004; Lederberg, 1998). Prinsipielt bør man alltid vurdere berettigelsen av å samtale med familien samlet eller pasient og familie hver for seg. Samtidig bør behandleren strengt overholde lovverkets bestemmelser om informasjon om pasientens helsetilstand til andre. Jo mer samtalen er rettet mot emosjonelle aspekter, jo større grunn er det til å avstå fra fellessamtaler, med mindre dette er eksplisitt avtalt eller gjøres med en definert hensikt hvor fellessamtale er indisert.
Fastlåste, familiære konflikter kan vekke sterke ønsker hos behandlere om å skape forsoning når livet går mot slutten. Ofte er dette ikke mulig. Samtaler i teamet for å skape en felles forståelse uten å ta parti i konflikten, er da ofte nødvendig.
En annen kommunikasjonsmessig utfordring kan være at medlemmer i en familie har ulik oppfatning av prognosen. Ønsker blant de pårørende om å skåne pasienten for informasjon om leveutsiktene, er en variant av dette. Prinsipielt bør det tilstrebes å presentere fakta som de er, og det er vist at flertallet av pasienter i palliativ fase ønsker å samtale om sin forestående død. SPIKES-protokollen kan også anvendes som en mal for samtaler om leveutsikter med pasientens familie. Også i denne situasjonen er det viktig å få et best mulig inntrykk av de pårørendes oppfatning før informasjon presenteres.
Familien kan i tillegg til det forestående tapet ha egne bekymringer for tiden etter dødsfallet, for eksempel bekymring for hvordan én eller flere av de etterlatte vil klare seg. Hvis ikke pasienten deler dette perspektivet, vil det ofte være hensiktsmessig å møte familien til samtale om slike forhold uten pasienten til stede.
Etterlattesamtaler brukes rutinemessig ved de fleste palliative enheter og er en god anledning til å fange opp spesielle behov for hjelp hos det mindretall av etterlatte som har dette. I tillegg til individuelle og familiære særtrekk, kan raske og dramatiske sykdomsforløp medføre en komplisert sorgprosess (Kissane, 2005; Ringdal et al., 2004).
Forberedende kommunikasjon om livets sluttfase (forhåndssamtaler)
En viktig del av kommunikasjonen med kronisk og alvorlig syke pasienter er å gi dem mulighet til å snakke om den siste fasen av livet og om døden (Friis & Forde, 2015). I den nasjonale veilederen om «Beslutningsprosesser for begrensning av livsforlengende behandling hos alvorlig syke og døende» står det bl.a. at helsepersonell på en hensynsfull måte skal sørge for at de pasienter som ønsker det, gis mulighet til å tilkjennegi sine ønsker og verdier rundt livets avslutning (Helsedirektoratet, 2009). Slik forberedende kommunikasjon som på engelsk kalles «Advance care planning – ACP», er på norsk tidligere kalt forberedende samtaler, senere omtalt som føre-var samtaler, men det er nå besluttet å bruke betegnelsen forhåndssamtaler (Friis & Forde, 2017).
National Health Service (NHS) i England har på sin hjemmeside informasjon om Advance care planning som et hjelpemiddel for pasienter, familie og helsepersonell i beslutningsprosesser i livets siste fase (NHS, 2018). På St. Christopher’s Hospice benyttes en såkalt «Advance care plan» hvor pasientene blir bedt om å svare på bl.a. følgende: Ønsket sted for pleie når pasienten ikke lenger kan ta vare på seg selv, ønsket sted å dø, hvem pasienten anser som sin nærmeste, om pasienten har en tro som er viktig for vedkommende, hva som bekymrer pasienten mest i forhold til vedkommendes helsetilstand, om pasienten har skrevet testamente (Advance care plan: personal preferences and choises of end of life care, 2010). Det er også spørsmål om organdonasjon, hjerte-/lungeredning og «livstestamente». Ved å svare på disse spørsmålene hjelpes pasienten og de pårørende til å tenke over prioriteringer og ønsker for den siste fasen. Foreløpig finnes det ikke noen slik allment tilgjengelig plan oversatt til norsk, men en veileder om forhåndssamtaler på sykehjem er nylig utgitt ved Senter for medisinsk etikk UiO (Thoresen et al., 2017). Et forslag til livstestamente basert på strukturererte forhåndssamtaler: «Dine ønsker for livets siste tid – forberedende samtaler» vil bli gjort tilgjengelig som fagprosedyre på Helsebiblioteket våren 2019 (Dine ønsker for livets siste tid - forberedende samtaler, 2018).
Uttalelser fra en kompetent pasient har alltid forrang. Når pasienten ikke er samtykkekompetent, må en legge vekt på pålitelig og relevant informasjon fra pårørende, et gyldig livstestamente, en oppnevnt stedfortreder eller helsepersonell som kjenner pasienten (Dine ønsker for livets siste tid - forberedende samtaler, 2018; Helsedirektoratet, 2009).
I veilederen «Beslutningsprosesser ved begrensing av livsforlengende behandling» (Helsedirektoratet, 2009) defineres livsforlengende behandling «som all behandling og alle tiltak som kan utsette en pasients død». Noen av eksemplene som nevnes er: hjerte-lungeredning, kjemoterapi, ernærings- og væskebehandling og antibiotika. Følgende eksempler trekkes frem for å vise hva som kan menes med «nytteløs behandling»:
- Behandling uten effekt (f.eks. verken livsforlengelse eller lindring)
- Sannsynligheten for effekt er svært liten
- Nytten av behandlingen er liten i forhold til plagsomme bivirkninger
- Nytten av behandlingen er svært liten i forhold til kostnaden
Veilederen fremhever at det ikke finnes sikre kriterier for å hevde at hjerte-lungeredning er nytteløs, bortsett fra ved omfattende irreversibel multiorgansvikt (Lippert, Raffay, Georgiou, Steen, & Bossaert, 2010), og ved kreft med omfattende metastasering og funksjonsnivå dårligere enn ECOG 2 (Helsedirektoratet, 2009; Kjørstad & Haugen, 2013). Videre understrekes det at alder ikke er en indikator i seg selv.
Helsepersonell har ikke plikt til å informere pasienter eller pårørende om at behandlingsteamet har besluttet å avstå fra hjerte-lungeredning (HLR minus) dersom tiltaket vurderes som nytteløs behandling (Helsedirektoratet, 2009; Kjørstad & Haugen, 2013).
Dersom en lege likevel velger å ta opp temaet HLR minus, bør dette ikke gjøres isolert, men som en naturlig del av en samtale om livets siste fase, helst med helsepersonell som har kjent pasienten over tid. Dokumentasjon i journal og kurvepapirer om HLR minus er viktig for å sørge for nødvendig informasjon til helsepersonell (ofte i vakt og uten inngående kjennskap til pasienten), slik at pasienten og de pårørende sikres verdighet og ro når døden inntreffer.
Ivaretakelse av fysisk funksjon
Sist faglig oppdatert: 14.10.2019
Tap av fysisk funksjon
De fleste kreftpasienter, og andre pasienter med livstruende sykdom, vil oppleve en gradvis reduksjon i fysisk funksjonsnivå. Hos kreftpasienter kan dette skyldes den generelle sykdomsprosessen, lokale sykdomsmanifestasjoner, tumorrettet behandling, komorbiditet og inaktivitet som følge av sykdom og behandling. Det antas at en betydelig del av kreftpasienters tap av fysisk funksjon skyldes inaktivitet.
Ernæringssvikt med vekttap og muskelatrofi som følge, dyspné, pareser og patologiske frakturer er eksempler på sykdomsrelaterte faktorer som fører til redusert fysisk funksjon og fare for inaktivitet. Pasienter med langtkommet sykdom har økt fallrisiko (Stone, Lawlor, & Kenny, 2011), og redsel for fall kan føre til inaktivitet. Inaktivitet disponerer for komplikasjoner fra bevegelsesapparatet, fordøyelsessystemet, respirasjonsorganer og sirkulasjonssystemet, og kan bidra til utvikling av obstipasjon, pneumoni, sår, ødemer, dyp venetrombose, muskelatrofi, kontrakturer og smerter fra muskel-skjelettapparatet, samt bidra til angst og depresjon. Dette vil igjen ha negativ innvirkning på funksjonsnivået, og kan på den måten lede inn i en negativ spiral.
Hvordan funksjonsnivået endres i løpet av sykdomsforløpet, vil være ulikt for den enkelte pasient. Bivirkninger av medikamentell behandling, kirurgiske inngrep og sykdomsrelaterte hendelser, som for eksempel malign medullakompresjon og patologiske frakturer, kan gi et bratt fall, mens det i gode perioder kan være en stigning i funksjonsnivået. De fleste kreftpasienter har et svingende og slakt nedadgående fysisk funksjonsnivå, med bratt fall den siste levetiden.
Tap av fysisk funksjon fører til redusert selvstendighet og påvirker muligheten for livsutfoldelse, og vil dermed ha psykososiale følger, medføre økt hjelpebehov og redusert livskvalitet (S. R. Cohen & Leis, 2002). Det er av stor betydning å kartlegge, forebygge og behandle tap av fysisk funksjon. Dette bør være i fokus hos hele behandlingsteamet.
Kartlegging av funksjonsnivå
Kartlegging og beskrivelse av funksjonsnivå bør inngå i den generelle utredningen av kreftpasienter. Årsakene til redusert fysisk funksjon bør kartlegges. Grundigere kartlegging ved fysio- og/eller ergoterapeut er aktuelt som utgangspunkt for rehabilitering, for å kunne måle effekt av ulike typer tiltak og som hjelp til vurdering av pleiebehov. Innen palliasjon benyttes flere måleinstrumenter. Fysisk funksjon kan måles ved selvrapportering, ved observasjon og/eller objektive tester.
Selvrapportering
Flere kartleggingsskjema for måling av helserelatert livskvalitet har spørsmål som dekker aspekter av fysisk funksjon, f.eks. Rand-SF 36. Dette gjelder også spørreskjema utviklet for kreftpasienter, som f.eks. EORTC QLQ-C30. De ulike skjemaene vektlegger til dels ulike aspekter og har ulik spørsmålsformulering. Felles for de to nevnte skjemaene er at de i stor grad måler evne til forflytning. Bruk av Edmonton Symptom Assessment Scale (ESAS) kan gi nyttig informasjon om mulige årsaker til nedsatt fysisk funksjon. https://helse-bergen.no/kompetansesenter-i-lindrande-behandling/palliasjon-verktoy-for-helsepersonell/esas-symptomregistrering. Bruk av ESAS omtales også under 2.8 Dokumentasjon og kommunikasjon mellom aktørene.
Observasjon og objektive tester
Aktuelle verktøy for gradering av funksjonsnivå som brukes innen onkologi og palliasjon er Karnofsky Performance Scale (KPS) og Eastern Cooperative Oncology Group (ECOG) / WHO Performance Scale. KPS er inndelt i 11 kategorier mellom 100 % (full funksjon) og 0 % (død) og benyttes ofte i kliniske studier, mens ECOG/WHO gir en grov beskrivelse av funksjon, og er inndelt fra 0 (normal aktivitet uten restriksjoner) til 4 (fullt sengeliggende og pleietrengende). Det er sentralt med tanke på behandlingsvalg å skille mellom ECOG 2 eller 3, altså om pasienten er oppe og i bevegelse henholdsvis mer eller mindre enn halvparten av dagen.
| Beskrivelse | WHO-status | Karnofsky-funksjonsstatus | |
|---|---|---|---|
| I stand til å utføre enhver normal aktivitet uten begrensing | 0 | 100 % | Normal, ingen plager eller subjektive tegn på sykdom |
| 90 % | Klarer normal aktivitet, sykdommen gir lite symptomer | ||
| Ikke i stand til krevende aktivitet, men oppgående og i stand til å utføre lett arbeid | 1 | 80 % | Klarer med nød normal aktivitet. Sykdommen gir en del symptomer |
| 70 % | Klarer seg selv, ute av stand til normal aktivitet eller aktivt arbeid | ||
| Oppegående og i stand til all egenpleie, men ikke stand til noe arbeid. Oppe og i bevegelse mer enn 50 % av våken tid | 2 | 60 % | Trenger noe hjelp, men klarer stort sett å tilfredsstille egne behov |
| 50 % | Trenger betydelig hjelp og stadig medisinsk omsorg | ||
| Bare i stand til begrenset egenpleie, bundet til seng eller stol mer enn 50 % av våken tid | 3 | 40 % | Ufør, trenger spesiell hjelp og omsorg |
| 30 % | Helt ufør, hospitalisering nødvendig, men fare for død er ikke overhengende | ||
| Helt hjelpetrengende, klarer ikke noen egenpleie, helt bundet til seng eller stol | 4 | 20 % | Svært syk, hospitalisering og understøttende behandling nødvendig |
| 10 % | Moribund, dødsprosessen er i sterk frammarsj | ||
| 0 % | Død | ||
Barthel ADL-Indeks registrerer grad av uavhengighet i ulike ADL (Activities of Daily Living)-funksjoner og er hovedsakelig til bruk for sykepleiere, ergoterapeuter og fysioterapeuter.
Edmonton Functional Assessment Tool (EFAT) gir en mer detaljert funksjonsutredning og er sensitiv hos palliative pasienter med lavt fysisk funksjonsnivå (T. Kaasa & Wessel, 2001). EFAT registrerer symptomer som påvirker funksjonsnivået, og hva pasienten kan gjøre på oppfordring, og baserer seg på både samtale/spørsmål og tester. EFAT er oversatt til norsk og er et aktuelt kartleggingsredskap for pasienter i palliativ fase. EFAT kan integreres i en fysioterapeutisk undersøkelse sammen med undersøkelse av andre faktorer som har betydning for fysisk funksjon, som f.eks. muskelstyrke, leddutslag, respirasjon, spenningsnivå, nevrologiske utfall og ødem.
Aktuelle funksjonstester er: Shuttle Walk Test, 3- eller 6-minutters gangtest, Sit to Stand Test, Timed up and go (TUG), Bergs balanse skala (BBS), Short Physical Performance Battery (SPPB) eller deler av denne, Hand Grip Strength Test (gir mål på generell muskelstyrke). Linker til disse testene finnes i avsnittet Fysioterapi ved kreft i palliativ fase i Fysioterapi ved kreft på Helsedirektoratets nettside om kreft: https://helsedirektoratet.no/kreft/fysioterapi-ved-kreft#kartlegging-og-undersøkelse
Forebygging og begrensning av funksjonstap
Å forebygge og begrense funksjonstap som følge av immobilisering er viktig. Å legge til rette for bevegelse og fysisk aktivitet i hele sykdomsforløpet kan bidra til dette. Også ved langtkommen sykdom bør teamet ha en felles målsetting om å hjelpe pasienten til å opprettholde høyest mulig funksjonsnivå og grad av selvstendighet. Dette gjelder både hjemmeboende pasienter og pasienter innlagt på sykehus og i sykehjem. God symptomlindring er avgjørende for å begrense immobilisering.
Følgende tiltak anbefales (Frantzen, 2016):
- Tilpasning av hjelpemidler for å unngå immobilisering. Dette kan være skinner, ortoser og korsetter ved pareser, smerter eller bruddfare, ulike ganghjelpemidler eller transportrullestol for å øke pasientens aksjonsradius.
- Å la pasienten beholde mest mulig egen kontroll i stelle- og forflytnings-situasjoner.
- Tilrettelegging for bevegelse og aktivitet ved innleggelse i institusjon, samt unngå unødig sengeleie.
- Veiledning i bevegelse og forflytning, f.eks. ved skjelettmetastaser, bruddfare, bevegelsesrelaterte smerter og ved usikkerhet og frykt for bevegelse.
- Tilbud om tilpasset trening hvor dette er mulig, individuelt eller i grupper.
- Henvisning til fysioterapeut for utsatte pasienter.
Tverrfaglig tilnærming ved funksjonstap
Generelle prinsipper
Å fremme et optimalt funksjonsnivå er et viktig mål. Hva dette innebærer for den enkelte pasient, vil avhenge av både sykdomsfase, motivasjon og andre individuelle faktorer.
- Årsakene til redusert fysisk funksjon må kartlegges og behandles i størst mulig grad. God lindring av smerter og andre plager er en forutsetning for fysisk aktivitet og aktiv rehabilitering. Dette innebærer også å møte psykologiske og åndelige/eksistensielle behov.
- Teamet må finne frem til en felles, realistisk målsetting. Sykdomsfase, prognose og annen medisinsk informasjon, pleiemessige og psykososiale forhold – sammen med pasientens ønsker, behov og motivasjon – må legges til grunn.
- Best mulig ernæring har betydning for å opprettholde fysisk funksjon.
- Riktig dosert aktivitet, og god balanse mellom aktivitet og hvile, er avgjørende.
- Henvisning til individuell trening hos fysio- og/eller ergoterapeut bør vurderes.
- Henvisning til gruppetrening bør vurderes dersom det fins aktuelle lokale treningstilbud.
- Henvisning til rehabiliteringsinstitusjon kan være aktuelt.
- Teamet må være oppmerksom på fallrisiko og ev. innføre «fallscreening».
- Mål for tilnærmingen må hele tiden evalueres og tilpasses sykdomsutviklingen og pasientens tilstand og ønsker.
Aktuelle tiltak
Effekt av fysisk aktivitet generelt er godt dokumentert. Studier av fysisk aktivitet hos kreftpasienter generelt viser at tilpasset trening under og etter kreftbehandling har positiv effekt på både fysiologiske og psykologiske faktorer; som fysisk funksjon, kardiovaskulær kapasitet, fatigue, psykisk velbefinnende, søvn og generell livskvalitet (Galvao & Newton, 2005; L. Oldervoll & Stene, 2016). I senere år har det kommet både norske og internasjonale studier som viser at bevegelse og trening på et tilpasset nivå har stor betydning for mange kreftpasienter, også ved langtkommen sykdom (Dittus, Gramling, & Ades, 2017; Gulde, Oldervoll, & Martin, 2011; L. M. Oldervoll et al., 2011). Det er ikke dokumentert negativ effekt av fysisk aktivitet hos pasienter i palliativ fase.
Følgende tiltak er aktuelle (Frantzen, 2016; L. Oldervoll & Stene, 2016):
- Felles strategi i pleieteamet for håndtering, stell og forflytning av pasienten. Det må legges til grunn at pasienten får beholde mest mulig egen kontroll og være mest mulig selvstendig.
- Legge til rette for aktivitet og unngå unødig sengeleie.
- Tilpasning av ADL-hjelpemidler og trening av dagliglivets funksjoner.
- Trening av forflytning/funksjonstrening. Det er viktig at funksjonstreningen samordnes med pleiepersonalets og pårørendes håndtering av pasienten i stell og forflytning.
- Tilpasning av hjelpemidler (se under forebygging), og hjelp til å tilpasse seg varige funksjonstap.
- Øvelsesbehandling: Type trening og dosering vil variere gjennom ulike faser av sykdommen. Treningen kan variere fra trening etter vanlige treningsprinsipper for styrke, bevegelighet, utholdenhet og balanse til lette, tilpassete øvelser i seng, med hovedvekt på å fremme sirkulasjon og pust, vedlikeholde bevegelighet og lindre. Treningen bør også ha fokus på gjenværende ressurser, og den bør oppleves positiv og meningsfull. Treningen kan foregå i grupper, som individuell behandling eller som egentrening. Bassengtrening er et godt alternativ der dette er mulig.
- Trening og veiledning knyttet til spesielle tilstander, f.eks. skjelettmetastaser, opptrening etter truende tverrsnittslesjon, lungesykdommer / symptomer fra lungene og nevrologiske tilstander / sykdommer.
Kontraindikasjoner/forsiktighetsregler
Aktiviteten bør ikke fremprovosere smerter eller andre symptomer som vedvarer etter at aktiviteten er avsluttet. Det bør utøves forsiktighet med fysisk aktivitet ved lav hemoglobin, lave blodplateverdier og uttalt kakeksi. Ved utbredte skjelettmetastaser bør en være forsiktig med styrketrening med manuell motstand, og unngå rotasjon under vektbæring på grunn av fare for brudd (L. Oldervoll & Stene, 2016). Personalet må være oppmerksomme på økende smerter fra skjelettet og på symptomer på malign medullakompresjon. Det er også viktig å være oppmerksom på eventuell utvikling av proksimale myopatier ved bruk av høye doser kortikosteroider, og på svimmelhet og falltendens som medikamentbivirkning. Den positive verdien av tiltak og trening må være større enn eventuelle negative konsekvenser, som f.eks. bruk av pasientens tid og krefter. Det må hele tiden være pasientens valg og ønsker som står i sentrum.
Ivaretakelse av ernæringsmessige behov
Sist faglig oppdatert: 14.10.2019
Problemstillinger
Opptil 85 % av pasientene ved palliative enheter rapporterer vekttap, og årsakene er mange (Baracos, 2006; Sarhill et al., 2003). Lokale sykdomsmanifestasjoner, behandling og komorbiditet kan gi symptomer og plager som reduserer appetitt og matinntak (Baracos, 2006; Bye et al., 2013). I tillegg kan pasienten utvikle kreftrelatert kakeksi som følge av den generelle sykdomsprosessen (K. C. Fearon, 2008). Om problemene ikke identifiseres er det en risiko for at pasienten utvikler underernæring. En skal derfor alltid forsøke å utrede mulige årsaker til vekttapet. Dersom en avdekker symptomer eller plager som kan føre til at en spiser lite, som for eksempel forstoppelse, soppinfeksjoner, munntørrhet eller andre svelge- og spisevansker, skal dette behandles samtidig som en forsøker å optimalisere matinntaket (J. Arends et al., 2017).
Underernæring
Underernæring er definert som et vedvarende, utilstrekkelig inntak av energi og næringsstoffer (Cederholm et al., 2017). Ved mangel på energi (kalorier) bryter kroppen ned fettvev og til dels vev som inneholder protein, slik som muskelmasse. Dette fører til vekttap og endret kroppssammensetning. Underernæring er uheldig fordi det bidrar til økt sykelighet samt redusert fysisk funksjon og velvære. Siden utilstrekkelig energiinntak er viktigste årsaken til underernæring, vil tiltak som økt inntak av mat, næringsdrikker, enteral eller parenteral ernæring bidra til at vekttap stopper og nedbryting av kroppsmasse opphører. Lavt matinntak er imidlertid sjelden eneste årsak til at pasienter med utbredt kreftsykdom går ned i vekt (Jeejeebhoy, 2012). Mange har også ulike grader av kreftrelatert kakeksi.
Kakeksi
Kakeksi er en vanlig tilstand hos kreftpasienter, og rammer opp til 80 % av alle pasienter med utbredt sykdom. Tilstanden er vanligst ved pankreas- og ventrikkelkreft, og ikke like vanlig ved for eksempel brystkreft. Kreftkakeksi er definert som et multifaktorielt syndrom, og kjennetegnes ved pågående muskeltap (med eller uten tap av fettvev) som ikke fullt ut kan reverseres ved optimal næringstilførsel. Patofysiologien er preget av en negativ protein- og energibalanse, drevet av en varierende kombinasjon av redusert matinntak og endret metabolisme (K. Fearon et al., 2011). Pasienter med kakeksi opplever nedsatt funksjonsevne, tap av matlyst, tidlig metthetsfølelse og kraftløshet. Tilstanden kan gi redusert livskvalitet, og bidra til økt kjemoterapitoksisitet og redusert overlevelse.
Patofysiologien som ligger til grunn for kakeksiutviklingen består av komplekse interaksjoner mellom inflammasjon, nevrohormonelle forandringer, økt katabolisme og redusert muskel- og fett anabolisme. Inflammasjon er antatt å være en av de viktigste faktorene som fører til kakeksi, ved blant annet å påvirke appetittregulering og muskelnedbryting. Den komplekse patofysiologien gjør det utfordrende å utvikle en effektiv behandling (K. C. H. Fearon, Glass, & Guttridge, 2012). Det er likevel en økende forståelse av at dersom behandling av kakeksi skal lykkes, er det viktig å starte behandlingen tidlig, og det er sannsynligvis nødvendig med en multimodal tilnærming (Solheim & Laird, 2012). Det er i dag ingen god behandling tilgjengelig for å reversere kakeksi helt, utover det å kurere kreftsykdommen.
Kakeksi blir beskrevet som et syndrom med 3 stadier, pre-kakeksi, kakeksi og refraktær kakeksi. Alle pasienter som får kakeksi går nødvendigvis ikke fra pre-kakeksi til refraktær kakeksi. Diagnosekriteriene for de forskjellige stadiene er foreløpig ikke helt ferdigstilte. Pre-kakeksi beskrives om de som har mindre enn 5 % vekttap siste 6 måneder, noe appetitt tap og/eller forhøyet CRP. Kakeksi er vekttap over 5 % siste 6 måneder, eller vekttap over 2 % i tillegg til en kroppsmasseindeks (KMI, kg/m2) under 20 eller sarkopeni (K. Fearon et al., 2011). Pasienter har refraktær kakeksi når de ikke lenger responderer på tumorrettet behandling, forventet levetid er kortere enn 3 måneder og WHO status er 3 eller 4. Både i forbindelse med pre-kakeksi og kakeksi gjelder det at en så godt som mulig skal sannsynliggjøre at ikke utilstrekkelig matinntak er årsaken vekttap, og at pasienten ikke er underernært. Kakeksi vil derfor ofte være en eksklusjonsdiagnose.
Pasienter som er i en pre-kakektisk fase bør ikke behandles på samme måte som pasienter med refraktær kakeksi, og målet med behandlingen er ikke det samme. Ved pre-kakeksi er målet å opprettholde eller øke vekt og fysisk funksjon, ved refraktær kakeksi er det viktigste symptomlindring og bedring av pasientens livskvalitet. Pasienter med refraktær kakeksi kan også tilbys behandling i form av ernæringsveiledning og individuelt tilrettelagt fysisk aktivitet, men det er da viktig at behandlingen blir gitt på en måte som ikke påfører pasienten ekstra psykisk belastning (Radbruch, Elsner, Trottenberg , Strasser, & Fearon, 2010).
Utredning
Alle kreftpasienter bør fortløpende observeres med tanke på vekttap, redusert matlyst og matinntak (Jann Arends, 2018). Følgende praksis er anbefalt for å forebygge og behandle underernæring som følge av sykdom og/eller behandling:
- Gjør en risikovurdering
- Gjennomfør kartlegging
- Sett i gang tiltak
Risikovurdering
Det er anbefalt at alle kreftpasienter vurderes for ernæringsmessig risiko (Nasjonal faglig retningslinje for forebygging og behandling av underernæring, Helsedirektoratet) (Helsedirektoratet, 2013). Det er anbefalt å bruke anerkjente skjema for å vurdere risiko for underernæring (Malnutrition Universal Screening Tool (MUST) (Stratton et al., 2004), Nutritional risk screening (NRS2002) (Kondrup, Rasmussen, Hamberg, & Stanga, 2003) og Subjective Global Assessment Questionnaire (SGA) (Detsky et al., 1987; Vigano et al., 2014). Vekt og vektutvikling er viktige indikatorer for risiko for underernæring og inngår i risikovurderingen. Om pasienten er i risiko for underernæring gjøres en grundigere kartlegging, blant annet for å finne mulige årsaker til vekttap, slik at målrettet behandling om mulig kan iverksettes.
Kartlegging
- Anamnese/klinisk undersøkelse: Måle vekt og høyde. NB: Ødemer, ascites og fedme kan kamuflere vekttap. Graden av vekttap beregnes i prosent (vekttap i kg x 100/tidligere vekt). Det er viktig å vurdere både graden av vekttap og over hvor lang tid vekttapet har pågått.
- Spør om matlyst og appetitt, og om matinntaket er redusert (redusert hyppighet av måltider samt mengde mat).
- Kartlegge underliggende årsaker til dårlig appetitt og vekttap (smerter, munntørrhet, svelgevansker, obstipasjon, dehydrering, depresjon, angst, mataversjoner og kvalme m.m.). ESAS er et eksempel på kartleggingsverktøy for symptomer.
- Undersøk klinisk og anamnestisk tap av muskelmasse, f.eks. som følge av immobilisering, eller proksimal myopati grunnet bruk av kortikosteroider
- Vurdere funksjonsstatus (Karnofsky eller WHO).
- Ha kunnskap om status av underliggende sykdom/kreftsykdom, prognose samt videre planlagt behandling og oppfølging.
Supplerende undersøkelser
- Registrering av matinntak i 3 dager ved hjelp av enkel kaloriregistrering, ev. intervju med pasienten for kartlegging av mat- og drikkeinntak siste døgn (24-timers intervju).
- Eksempler på kostregistreringsskjema for inneliggende pasienter er tilgjengelig i Kosthåndboken fra Helsedirektoratet. https://helsedirektoratet.no/retningslinjer/kosthandboken-veileder-i-erneringsarbeid-i-helse-og-omsorgstjenesten
- Den viktigste biomarkøren for kakeksi er forhøyet CRP, men CRP er ingen spesifikk markør for kakeksi.
- Albuminverdien er ofte lav ved underernæring, men påvirkes også av andre faktorer som infeksjon og inflammasjon generelt.
- I praksis brukes sjeldent målinger av muskelmasse for å finne grad av sarkopeni.
Tiltak
Generelle tiltak
- Uønsket vekttap bør tas alvorlig, og bør forsøkes reversert/stabilisert om mulig. Hva som er rimelig å oppnå, vil variere i betydelig grad. Det er sannsynligvis større mulighet for å stabilisere vekten dersom vekt- og funksjonstap ikke har vært for stort. Det er vanskelig å snu vekttapet når pasienten har systemisk inflammasjon
- Det er helt avgjørende at man behandler underliggende årsak(er) til dårlig ernæringsstatus hvis dette er mulig (smertestillende, laxantia, kvalmestillende, behandling mot soppstomatitt m.m.) (Del Fabbro et al., 2011)
- Alle pasienter med kakeksi bør få informasjon om tilstanden, fortrinnsvis sammen med pårørende. De bør få realistisk informasjon om hva medikamenter, ernærings- og treningstiltak kan bidra med
- Det er viktig at pasienter, pårørende og helsepersonell er klar over behandlingsintensjonen, og at tiltak uten effekt blir seponert
- Avhengig av pasientens totalsituasjon (forventet levetid, sannsynlig bidrag av kakeksi versus andre underliggende årsaker til vekttap – for eksempel tarm obstruksjon, pancreasinsuffisiens, smerter osv.) og planlagt kreftbehandling, vil mål for tiltakene variere betydelig. For enkelte er det viktig å øke eller stabilisere ernæring og fysisk funksjon. For andre bør fokus være å redusere psykososialt stress og øke måltidsglede. God informasjon kan bidra til å redusere forskjellen mellom hva pasient og pårørende tror det er nødvendig å spise, og det pasienten faktisk klarer å spise. Det er viktig å vektlegge at det ikke er et mål i den siste tiden av livet at matinntaket skal være som hos en frisk person.
- Informasjon og råd om trening og ernæring må bli gitt på en slik måte at det ikke øker pasientenes psykososiale belasting
Psykososiale tiltak
Mat er mer enn energi og næringsstoffer. Mat har også en viktig sosial, kulturell, psykologisk og symbolsk betydning i alle faser av livet. Redusert appetitt medfører at pasientene opplever at de ikke lenger får tatt del i viktige aspekter av livet, noe som har stor betydning for den enkeltes livskvalitet.
Erfaringsmessig har mange helsearbeidere tradisjonelt hatt lite fokus på kakeksi. Dette øker pasienter og pårørendes forvirring og bekymring, også ved svært langtkommen kreftsykdom. For mange pasienter er det viktig at man anerkjenner vekttapet slik at man kan få en dialog om utfordringene pasienten opplever. De trenger informasjon om hva kakeksi er, og råd om hvordan de skal forholde seg til tilstanden (Reid, McKenna, Fitzsimons, & McCance, 2010). Det er viktig at man informerer både pasient og pårørende, da appetittløshet og manglende matinntak ofte oppleves problematisk av begge parter, men ikke alltid på samme måte.
Tilrettelegging for økt inntak av mat og drikke
Det første en bør vurdere er spisesituasjonen (miljø, sittestilling, selskap osv.). Er det mulig å optimalisere miljøet rundt måltidene slik at pasienten kan spise mer? Deretter bør en se om det er mulig å øke kaloriinnholdet i maten (energitett), uten nødvendigvis å øke matens volum. Som tillegg til dette kan en vurdere å øke antall måltider ved å spise mellommåltider, eller supplere med næringsdrikker (hjemmelagede eller ferdigproduserte). Næringsdrikker kan være mer effektivt tilskudd av energi og proteiner enn vanlig mat, men er ikke tenkt brukt i stedet for mat dersom pasientene i utgangspunktet spiser noe selv. Pasienten bør derfor få råd om å ta næringsdrikkene som et tillegg til hovedmåltidene.
Mange kreftpasienter opplever smaksforandringer. Sammen med kvalme og dårlig matlyst kan det være et problem å akseptere visse smaker. Den enkelte bør prøve seg fram og få mulighet til å velge blant ulike matretter og typer av næringsdrikker for å opprettholde energiinntaket over tid (Ravasco, 2005).
Praktiske råd:
- Tilby individuelt tilpassede, små og hyppige måltider (6–8 per dag)
- Ha snacks, mellommåltider eller næringsdrikker lett tilgjengelig
- Tilby kaloririk drikke fremfor vann
- Tilby mat når pasienten er mest opplagt
- At man spiser er viktigere enn hva man spiser
- Tilrettelegg for endret konsistens ved tygge- eller svelgeproblemer
- Tilrettelegg for enklest mulig matlaging dersom pasienten må lage mat selv
- Ved langsom ventrikkeltømming tåles ofte små, karbohydratrike måltider (frukt, kjeks, ristet brød osv.) bedre enn protein- og fettrike måltider
- Vurder å tilby daglig multivitamintilskudd og tran ved ensidig kosthold. Inntak av høyere doser av vitaminer er ikke anbefalt.
Medisinsk ernærings- og væskebehandling
Pasienter som ikke kan spise (for eksempel grunnet tarmobstruksjon eller tumor i ØNH-området) bør i utgangspunktet vurderes snarlig for medisinsk ernæring. Pasienter som har inntatt mindre enn 60 % av beregnet kaloribehov i 10 dager eller mer sammenhengende, eller allerede er underernært, bør vurderes for medisinsk ernæringsbehandling (sondeernæring eller intravenøs ernæring) dersom andre tiltak er prøvd uten effekt, og pasienten er godt informert om fordeler og ulemper, og selv ønsker slik behandling. Dette gjelder i hovedsak pasienter som har forventet levetid over 1–3 måneder (J. Arends et al., 2006).
En slik medisinsk ernæringsbehandling bør bare gis til pasienter med avansert uhelbredelig kreft etter at man har vurdert behandling av symptomer som hindrer næringsinntak, og man har god kjennskap til prognose og kartlagt mulige konsekvenser av kreftbehandlingen. Den mulige effekten av ernæringsbehandling, og hvor lang tid man trenger for å oppnå en slik effekt, bør også vurderes.
Videre må en forventet positiv effekt av tiltak vurderes som bedre enn eventuelle ulemper med ernæringsbehandling. Målene kan for eksempel være stabilisering av vekt (ikke på grunn av økende ødem), mindre fatigue eller på annet vis bedre livskvalitet.
Det er ingen randomiserte studier som viser bedret overlevelse ved medisinsk ernæringsbehandling alene hos pasienter med avansert kreft uten tarmobstruksjon, men en liten studie har vist noe bedre livskvalitet etter 3 måneders behandling med tilleggsbehandling med parenteral ernæring (Obling, Wilson, Pfeiffer, & Kjeldsen, 2017). For øvrig er det kun observasjonsstudier av selekterte pasientgrupper som ser på effekten av behandling med parenteral ernæring hos pasienter med avansert kreft, hvilket betyr at evidensen for dette tiltaket er lav.
Det bør alltid lages en plan for medisinsk ernæringsbehandling sammen med pasient og pårørende. Planen bør ha klare mål og fastsatt tid for evaluering. Dersom man er i tvil om det er indisert med sonde eller intravenøs ernæring, er det fornuftig å diskutere problemstillingen grundig med pasient og pårørende. På den måten kan de få realistiske forventinger til tiltaket og akseptere en avtale om seponering av behandlingen etter en viss tid dersom man ikke har oppnådd ønsket effekt.
Beregning av energi- og væskebehov
Følgende verdier kan brukes for å beregne energi- og væskebehov ved vurdering av inntak eller i forbindelse med oppstart av aktiv ernærings- og væskebehandling:
- Oppegående pasienter: 30–35 kcal/kg/dag
- Sengeliggende pasienter: 25–30 kcal/kg/dag
- Eldre over 70 år: Anbefalte mengder energi reduseres med 10 %
- Væskebehov: Tommelfingerregel: 30–35 ml/kg/dag. Obs: Korriger for eventuelle tap
EAPC har utarbeidet retningslinjer for vurdering av ernærings- og væskebehandling til palliative pasienter. Disse kan være til hjelp i beslutningsprosessen (Bozzetti et al., 1996).
Praktiske anbefalinger:
- Enteral rute er å foretrekke fremfor intravenøs ernæring så lenge det er mulig
- Vurder sondeernæring (nasogastrisk eller via PEG) dersom pasienten ikke kan ta til seg mat og drikke per os, slik som ved f.eks. kreft i øre-nese-hals-området eller obstruksjon i øvre gastrointestinal traktus
- Vurder muligheten for å gi intravenøs væske og ernæring dersom det ikke er mulig å gi ernæring enteralt (obstruksjon i nedre GI-traktus, ikke mulig å legge ned sonde, eller pasienten ønsker intravenøst)
Ved forventet levetid under 1–3 måneder er sondeernæring eller intravenøs ernæring vanligvis ikke indisert (J. Arends et al., 2017) Det finnes imidlertid unntak for situasjoner der næringsinntaket går ned i en periode som følge av andre årsaker enn progredierende kreftsykdom. Dette kan for eksempel være for å hjelpe pasienten gjennom et operativt inngrep, en infeksjon eller annen komplikasjon, eller i forbindelse med samtidig tumorrettet behandling. Intravenøs ernæring bør også forsøkes ved kompliserte gastrointestinale tilstander, som malign tarmobstruksjon, hvor det er usikkerhet omkring prognosen. Det er vanlig å stoppe eller redusere mengden ernæring hvis pasienten begynner å akkumulere væske eller får bivirkninger av behandlingen.
Medikamentell behandling
En Cochrane-oversikt fra 2005 (Yavuzsen, Davis, Walsh, LeGrand, & Lagman, 2005) fant at bare megestrolacetat (Megace) og kortikosteroider hadde vist tilstrekkelig effekt på appetitt til at medikamentene burde bli brukt i klinisk praksis. Det er ingen medikamenter i bruk for å bedre muskelmasse/vekt eller fysisk funksjon på lengre sikt. Ingen nye fase III-studier har foreløpig endret konklusjonen fra 2005.
Megestrolacetat (Megace) har vært undersøkt i flere systematiske oversikter og metaanalyser. En systematisk gjennomgang (Ruiz Garcia, Lopez-Briz, Carbonell Sanchis, Gonzalvez Perales, & Bort-Marti, 2013) viste at Relativ Risk (RR) for appetittforbedring var 2.57 (1.48–4.49), RR for vektøkning 1.55 (1.06–2.26) og RR for ødemer 1.36, (1.07–1.72)). Optimal dose er ikke fastlagt, men er trolig 160–800 mg daglig. Bivirkningene er også doseavhengige. Den viktigste bivirkningen, bortsett fra væskeretensjon, er risiko for tromboembolisme. Det er også vist at megestrol acetat muligens kan gi overdødelighet (Ruiz Garcia et al., 2013). Megestrolacetat har ingen effekt på muskelmasse, og ingen betydelig effekt på livskvalitet. Megestrolacetat kan være å foretrekke fremfor kortikosteroider hos pasienter der den dårlige matlysten spesielt går ut over pasientens livskvalitet, og forventet levetid er over 2–3 måneder. Forslag til dosering: 320 mg daglig i 2–3 uker, nedtrapping til 160 mg daglig ved effekt, og seponering om effekt ikke foreligger (Nordoy, Thoresen, Kvikstad, & Svensen, 2006). Behandlingseffekten er i studier lite undersøkt utover 8–12 uker.
Glukokortikosteroider kan øke livskvalitet, appetitt, trivsel og funksjon samt redusere kvalme. Vekt er ofte ikke signifikant påvirket. Kortikosteroider har alvorlige bivirkninger som proksimal myopati, immunsuppresjon og insulinresistens. Effekten av kortikosteroider på appetitt opphører etter en del uker. Behandlingen er mest egnet for pasienter med kort levetid, og med andre symptomer hvor steroider kan være av nytte (for eksempel leverspreng, kvalme og hjerneødem). Kortikosteroider kan også anbefales brukt i forbindelse med viktige livshendelser der bedre appetitt er av betydning for pasienten, slik som ved familiehøytider. Dexamethason er mest studert og ofte brukt grunnet liten mineralkortikoid effekt, men de forskjellige steroider er ikke undersøkt mot hverandre, og det er lite grunnlag for å anbefale ett kortikosteroid fremfor et annet. Forslag til dosering: 15 mg prednisolon per dag i maksimalt 1–3 uker, eller ekvipotente doser metylprednisolon eller dexamethason. Seponeres etter få dager ved manglede effekt (Holtan et al., 2007).
Metoklopramid (Afipran) kan øke ventrikkeltømmingen og lindre tidlig metthetsfølelse og kvalme, men har ikke effekt på ernæringsstatus. Det er relativt lite evidens bak bruken ved kakeksi, men medikamentet er forholdsvis lite toksisk i lave doser og erfaringsmessig kan pasienter ha god effekt. Forslag til dosering: 10 mg en halv time før tre hovedmåltider. Seponeres etter få dager ved manglede effekt. Det er diskutert problemer ved langtidsbruk, særlig med tanke på nevrologiske bivirkninger hos eldre.
Med dagens kunnskap anbefales ikke behandling med cannabinoider, NSAIDs eller foreløpige godkjente androgener utenfor kliniske studier. Det er noe sprikende data om effekten av omega 3 fettsyrer på muskelmasse, fysisk funksjon og vekt.
Svært mange andre medikamenter har vært utprøvd i behandlingen av kakeksi. Flere av medikamentene kan ha vist dårligere resultater på grunn av manglende multimodale intervensjoner (ingen intervensjon med tanke på andre symptomer som påvirker ernæring, næringsinntak eller fysisk aktivitet) eller fordi behandlingen har startet for sent i sykdomsforløpet. Det er også mange medikamenter som er under pågående utprøving. Ett av disse er anamorelin. Dette medikamentet har i kliniske studier vist gode resultater på blant annet muskelmasse og appetitt. Per i dag er anamorelin ikke godkjent for bruk utenfor kliniske studier. (Temel et al., 2016).
Fysisk aktivitet
Mange kreftpasienter med avansert sykdom opplever å være trøtte (fatigue) som følge av sykdom og behandling. Trøtthet er et meget plagsomt symptom som påvirker livskvaliteten negativt. Dette fører ofte pasientene inn i en ond sirkel, med reduksjon av daglig fysisk aktivitet, som igjen fører til reduksjon av muskelmasse, muskelstyrke, aerob kapasitet og fysisk funksjon.
Det er god evidens for å anbefale fysisk aktivitet hos kreftpasienter med god prognose (Jones & Alfano, 2013; Segal et al., 2017). Fysisk aktivitet kan redusere muskelkatabolisme og øke anabolisme (Segal et al., 2017), samt ha potensiale til å redusere inflammasjon. Dette er alle viktige elementer i patofysiologien bak kreftrelatert kakeksi.
Få studier har vurdert effekten av fysisk aktivitet hos pasienter med avansert kreftsykdom, men mange pasienter er både i stand til og villige til å delta i fysisk aktivitet (L. M. Oldervoll et al., 2011; L. M. Oldervoll et al., 2005). En nylig systematisk oppsummering av studier med fysisk aktivitet hos kreftpasienter med avansert sykdom viser god effekt på fysisk form, reduksjon av trøtthet og opprettholdelse av livskvalitet (Dittus et al., 2017).
Kreftpasienter med avansert sykdom bør advares mot inaktivitet om mulig. Pasienten bør oppmuntres til noe daglig aktivitet og finne en balanse mellom hvile og aktivitet. Rådene må individualiseres ut fra tidligere erfaring med fysisk aktivitet, motivasjon og funksjonsnivået til den enkelte pasient.
For andre kan et tilrettelagt og mer strukturert opplegg for fysisk aktivitet med styrke- og kondisjonsøvelser etter råd fra fysioterapeut være hensiktsmessig. Trening under veiledning viser best effekt på livskvalitet og fysisk form (Fong et al., 2012). Det er viktig at råd om fysisk aktivitet blir gitt på en slik måte at det ikke øker den psykososiale belastingen disse pasienten allerede opplever.
Ernæring i livets aller siste fase
Forholdene skal legges til rette for best mulig symptomlindring og livskvalitet (Dy & Apostol, 2010). Det er ikke nødvendig å fokusere på vekt og dekning av ernæringsbehov, men pasienten skal få den næringen han/hun ønsker. De fleste pasienter vil ikke føle sult i denne fasen, men både pasient og pårørende har ofte et behov for informasjon som må dekkes.
Væskebehandling i terminalfasen er også omdiskutert, og oftest ikke indisert (Dev, Dalal, & Bruera, 2012). Hvis det er indikasjon for hydrering, er det tilstrekkelig med 500–1000 ml væske per døgn. Tørr munn skal behandles primært med lokalbehandling, og ikke systemisk behandling, da dette ikke nødvendigvis lindres ved parenteral væsketilførsel (Nordoy et al., 2006).
- Praktiske anbefalinger: Små slurker med vann / godt munnstell og minimalt med mat er tilstrekkelig for å redusere tørst og sult i terminalfasen
- Behandling av munntørrhet er viktig
- Er man usikker på om dehydrering er av betydning for pasientens funksjon, kan man forsøke å gi 500 ml NaCl over 2–4 timer og se om det bedrer situasjonen. Uten klar bedring er det stor sett ikke indisert med videre væskebehandling.
Utviklingssenter for sykehjem og hjemmetjenester Buskerud har utviklet et e-læringsprogram som heter «Velkommen til bords» der blant annet mat og drikke i livets sluttfase er diskutert http://www.velkommentilbords.no/
Anbefalinger
Identifisering av underernæring og ernæringsmessig risiko
For å oppdage risiko for underernæring på et tidlig tidspunkt, anbefales det å kartlegge vekt og vektutvikling, kroppsmasseindeks og matinntak hos alle pasienter ved kreftdiagnose, og å gjenta dette jevnlig i sykdomsforløpet. Hvor ofte og hvor lenge kartleggingen skal foregå er avhengig av den kliniske situasjonen. (D)
Valg av tiltak hos pasienter med uhelbredelig kreft må diskuteres med pasienten. Beslutning om tiltak må tas etter vurdering av forventet nytte i forhold til livskvalitet, overlevelse og eventuell byrde forbundet med tiltaket. (D)
Ernæring
Underernærte pasienter, eller pasienter med risiko for underernæring, som er i stand til å spise, bør få tilbud om energi- og næringstett kost i kombinasjon med næringsdrikker. (A)
Aktiv ernæringsbehandling (sonde- eller intravenøs ernæring) kan vurderes til personer som ikke får dekket sine ernæringsmessige behov gjennom mat og næringsdrikker. (B)
Der hvor pasienten har fungerende mage- og tarmfunksjon er sondeernæring førstevalget framfor intravenøs ernæring. (A)
Dersom det ikke er mulig å gi sondeernæring (obstruksjon i nedre GI-traktus, ikke mulig å legge ned sonde) kan en vurdere å gi intravenøs ernæring. (B)
Medikamentell behandling
Det er avgjørende å behandle symptomer (for eksempel: kvalme, depresjon, smerte) og tilstander (for eksempel soppstomatitt, forstoppelse, GI obstruksjon) for å hindre at disse bidrar til redusert næringsinntak. (C)
Vurder kortvarig (1–3 uker) bruk av kortikosteroider for å øke appetitten hos pasienter med uhelbredelige kreft, men vær oppmerksom på bivirkninger (f.eks. myopati, insulinresistens, infeksjoner). (A)
Progestin kan vurderes brukt for å øke appetitten hos pasienter med uhelbredelig kreft, men det er viktig å være klar over potensielt meget alvorlig bivirkninger (f.eks. tromboembolisme). (A)
Fysisk aktivitet og ernæringsutfordringer
Kreftpasienter med uhelbredelig kreft anbefales om mulig å fortsette å være fysisk aktive og unngå inaktivitet for å opprettholde muskelstyrke, muskelmasse og fysisk funksjon best mulig. (B)
Tilpasset styrketrening, i tillegg til kondisjonstrening, kan være hensiktsmessig for å opprettholde muskelstyrke og muskelmasse hos pasienter som er i stand til å gjennomføre det. (D)
Pårørende
Sist faglig oppdatert: 14.10.2019
Ifølge WHO (WHO definition of palliative care) skal palliativ behandling, pleie og omsorg ta utgangspunkt i pasienten og familiens psykososiale situasjon, og tilby tiltak for å forebygge og lindre utfordringer som familien møter i forbindelse med alvorlig sykdom og tap. Ifølge WHO skal palliativ omsorg blant annet:
- Tilby familien et støtteapparat og hjelp til å håndtere tiden med sykdom og tap
- Tilby tverrfaglig og koordinert oppfølging for å kartlegge fysiske, psykososiale og eksistensielle forhold, og tilby tilpasset oppfølging til pasient og pårørende over tid.
Familietilnærming i palliasjon
Ved alvorlig sykdom bør helsehjelp i form av psykososial støtte rettes mot pasient og familien som helhet, både gjennom sykdomsperioden og etter dødsfall. Kartlegging av pasientens familie og nettverk er viktig for valg av samarbeidsform som inkluderer pasientens nærmeste best mulig (Stensheim, Hjermstad, & Loge, 2016).
Helsedirektoratets veileder om pårørende i helse- og omsorgstjenesten (Helsedirektoratet, 2018) gir nasjonale anbefalinger for hvordan oppfølging og tilbud til pårørende kan systematiseres. Målet med veilederen er at:
- Pårørende blir involvert i helse- og omsorgstjenesten til beste for pasienten/brukeren og pårørende
- Barn som pårørende blir fanget opp tidlig og får nødvendig informasjon, støtte og oppfølging
- Voksne pårørende med omsorgsoppgaver og/eller belastninger tilbys individuelt tilpasset støtte og avlastning, oppfølging og veiledning. Dette gjelder spesielt for pårørende med krevende omsorgsoppgaver og belastninger.
Psykososial støtte til pårørende
Ved alvorlig sykdom bør pasienten få tilbud om familiesamtaler, og pasient og pårørende bør få tilbud om samtaler hver for seg (Helsedirektoratet, 2018). Dialog med pårørende om pasientens sykdom forutsetter pasientens samtykke (Lov om pasient- og brukerrettigheter (pasient- og brukerrettighetsloven)). Pårørende ved alvorlig sykdom vil uavhengig av pasientens samtykke ha utbytte og rett på informasjon som gjelder dem, rettigheter, mulighet for kurs og grupper, avlastning, støttesamtaler osv. (Helsedirektoratet, 2018). Dersom pasienten har barn eller søsken under 18 år, har helsepersonell en særlig plikt til systematisk kartlegging og oppfølging av familien. Se avsnitt lengre ned om Familier der barn er pårørende.
Psykososial kartlegging
Helse og omsorgstjenestene skal være forebyggende, og bidra til å støtte og avlaste pårørende som over tid opplever stor totalbelastning grunnet alvorlig sykdom i familien (Helsedirektoratet, 2018). Pasienten og pårørendes psykososiale situasjon bør kartlegges tidlig og gjentas regelmessig gjennom sykdomsforløpet (Stensheim et al., 2016). Hensikten med psykososial kartlegging er å:
- Forebygge at problemer oppstår ved å gi informasjon, råd og veiledning om mestringsstrategier, om aktuelle rettigheter og offentlige hjelpe- og støtteordninger
- Fange opp sårbare familier som har særlig behov for psykososial støtte
- Avdekke behov for hjelp både i forhold til det følelsesmessige, praktiske, økonomiske, fysiske og sosiale.
- Tilby tilrettelegging for individuell plan og koordinerte tjenester
- Formidle kontakt med hjelpeinstanser, både for pasient og pårørende
Kartlegge pårørendes omsorgsoppgaver, ressurser og behov for støtte
Pårørende som opplever å stå alene med store omsorgsoppgaver over tid har risiko for å utvikle:
- Søvnproblemer, konsentrasjonsvansker, nedsatt energinivå
- Bekymring, stress, angst, depresjon
- Ulike smertetilstander, nedsatt immunforsvar, kostholdsrelaterte problemer (Helsedirektoratet, 2018)
Helsetjenestene skal forebygge unødig belastning hos pårørende og bør tidlig og systematisk kartlegge:
- Omfanget av omsorgsoppgaver og praktiske oppgaver
- Tilknytning til arbeidslivet eller utdanningsløp
- Sosialt nettverk og støttepersoner i nettverket
- Ferie, fritid, mulighet til å forlate hjemmet, sosialt samvær med andre, aktiviteter
- Opplevelsen av mestring og motivasjon til omsorgsarbeidet
- Fysiske belastninger (som tunge løft), nattarbeid eller avbrudd i nattesøvnen
- Psykiske belastninger hos pårørende som følge av situasjonen
- Mulighet til å ivareta egen helse
- Kunnskap om pasientens eller brukerens helsetilstand
- Kunnskap om helse- og omsorgstjenesten
- Økonomisk situasjon og materielle ressurser
Både spesialisthelsetjenesten og den kommunale helse og omsorgstjenesten bør ha en systematisk tilnærming til hvordan kartlegge og ivareta pårørendes behov for støtte (Stajduhar et al., 2010). The Carer Support Needs Assessment Tool (CSNAT) er en anbefalt tilnærming for støtte til pårørende i palliativ behandling (Grande et al., 2017). Den kommunale helse og omsorgstjenesten skal tilby tilpasset oppfølging til pårørende som har særlig tyngende omsorgsarbeid. Oppfølging fra kommunen kan være i form av informasjon, opplæring, avlastning og omsorgsstønad til den pårørende (Lov om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven)).
Individuelle samtaler med pårørende
Pårørende bør tilbys individuelle samtaler og veiledning ved behov. Samtalene bør foregå regelmessig og ta utgangspunkt i pårørendes opplevde situasjon (Helsedirektoratet, 2018).
- Hvordan opplever de situasjonen
- Hva bidrar til opplevelse av mestring og kontroll
- Hva tenker de om situasjonen de er i
- Hvordan opplever de kommunikasjon med den som er syk og andre i familien
- Hva tenker de om støtte fra eget nettverk
- Balanse mellom omsorgsoppgaver, egen kapasitet og egne behov
- Samhandling og samarbeid med helse- og omsorgstjenestene
- Informasjon om lokale støttetilbud
Tema som pårørende bør informeres om individuelt eller i gruppe
- Hjelpeapparat, rettigheter og støtteordninger
- Vanlige reaksjoner hos pårørende
- Mestring av livssituasjonen ved langvarig sykdom
- Sykdom, behandling og oppfølging
- Rett på koordinerte tjenester
- Kunnskap om ivaretakelse av egen helse, parforhold og foreldrefunksjon
- Informasjon om ulike opplæringstilbud
Familier med særlig behov for psykososial støtte
Hvordan en familie håndterer utfordringer og belastning som følge av at en i familien er syk, varierer og stiller ulike krav til oppfølging. Tidligere erfaringer, tilgang til støtte og ressurspersoner i eget nettverk, tilknytning til skole, arbeid er individuelle faktorer som er av betydning for mestring (Stensheim et al., 2016). Familier som har særlig behov for støtte til å håndtere en ny hverdag og livssituasjon bør henvises til psykososial oppfølging og sosionom i det palliative teamet, kommunalt eller i spesialisthelsetjenesten.
Følgende pasienter og familier bør få oppfølging av helsepersonell med kompetanse i nettverks- og familiearbeid- det være seg sosionom eller kommunepsykolog i samarbeid med fastlege, kommunale kreftsykepleiere, helsesøstre, kontaktlærer, etc.:
- Pasienter som er eneforsørger for barn
- Pasienter/familier med lite nettverk
- Familier som er preget av konflikt
- Familier som har det økonomisk vanskelig
- Familier som uttrykker bekymring for pårørendes belastning/helse
Det er viktig å bruke og koordinere de lokale ressursene til å dekke de aktuelle behovene best mulig. Der det er store konflikter, eller familien på andre måter strever med å løse de utfordringene de står overfor, kan det være behov for å trekke inn eller henvise til ressurser som familievern, barnevern, barne- og ungdomspsykiatrisk behandling (BUP), kommunepsykolog eller psykiater. Dette avhenger av problemets art, omfang og hvem som er bærer av det (82). Sosionom på sykehus skal ha særlig kompetanse i nettverks- og familiearbeid, og bred kunnskap om rettigheter, hjelpe- og støtteordninger. Ifølge Nasjonal Kreftstrategi 2018–2022, bør sosionomtjenesten på sykehus jobbe forebyggende, og gi veiledning slik at familien får hjelp til å håndtere og omstille seg praktisk og mentalt til en ny livssituasjon, både ved sykdom og etter dødsfall i familien (Leve med kreft. Nasjonal kreftstrategi (2018–2022), 2018).
Familier der barn er pårørende
Barnefamilier er særlig sårbare for endringer og bekymringer som følger av alvorlig sykdom og dødsfall i familien. Helsepersonell i Norge har en lovpålagt plikt til å systematisk bidra til å ivareta mindreårige barn som er pårørende til, eller etterlatte etter foreldre eller søsken. Helsepersonells plikt til kartlegging og oppfølging av familier med barn under 18 år er særlig forankret i (Lov om helsepersonell m.v. (helsepersonelloven); Lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven)):
- Helsepersonelloven § 10a. Helsepersonells plikt til å bidra til å ivareta mindreårige barn som er pårørende til foreldre eller søsken.
- Helsepersonelloven § 10b. Helsepersonells plikt til å bidra til å ivareta mindreårige barn som er etterlatte etter foreldre eller søsken
- Spesialisthelsetjenesteloven § 3‑7 a. Om barneansvarlig personell mv.
Helsedirektoratets veileder om pårørende i helse- og omsorgstjenesten (Helsedirektoratet, 2018) beskriver tiltak for kartlegging og oppfølging av familier der barn er pårørende eller etterlatte. I tillegg har Nasjonalt kompetansenettverk for barn som pårørende utarbeidet fagprosedyrer for ivaretakelse av barn som pårørende (Ferdige fagprosedyrer: barn og unge, 2018).
Helsepersonell skal kjenne nasjonale føringer og være kjent med rutiner på egen arbeidsplass, og sikre forsvarlig oppfølging av familier der barn er pårørende eller etterlatte (Helsedirektoratet, 2018).
Når pasienten er alene om omsorgen for barn under 18 år
Det særlig viktig å fange opp situasjoner der barn har få eller ingen andre omsorgspersoner utenom forelderen som er syk. Helsepersonell bør avklare om pasienten har en plan for hvordan de ønsker at omsorgen for barna skal bli ivaretatt ved forverring av sykdom og ved dødsfall, og om barna og andre involverte er informert. Dette er pasienter som bør henvises til sosionom i det palliative teamet / i kommunen for samarbeid. Der det er uavklart hvem som kan ivareta barna etter et dødsfall, skal det så tidlig som mulig etableres et samarbeid og dialog mellom pasient og barnevernstjenesten. Et systematisk samarbeid mellom pasient, pasientens nettverk, familievern, barnevern og fosterhjemstjeneste kan være aktuelt.
Ved bekymring for barnas omsorgssituasjon
Dersom helsepersonell er bekymret for om barnas omsorgsbehov er ivaretatt, skal helsepersonell iverksette tiltak som sikrer barnet nødvendig omsorg. Den som yter helsehjelp skal i sitt arbeid være oppmerksom på forhold som kan føre til tiltak fra barnevernstjenesten. Helsepersonell skal melde fra til barnevernstjenesten når det er grunn til å tro at barn er, eller vil bli, mishandlet, utsatt for alvorlige mangler ved den daglige omsorgen, eller annen alvorlig omsorgssvikt (Lov om helsepersonell m.v. (helsepersonelloven)).
Nasjonalt kompetansnettverk for barn som pårørende (www.barnsbeste.no), arbeider for at barn som pårørende, og deres familier, får den oppfølgingen de har behov for. Dette gjøres gjennom rådgivning, systemarbeid, fagutvikling, forskning og formidling.
Håndtere dilemma i møte med pårørende
Helsepersonell vil ofte stå i valgsituasjoner og dilemma der verdier kommer i konflikt med hverandre, og der det finnes gode innvendinger mot alle handlingsalternativer (Helsedirektoratet, 2018). Eksempler på dilemma der pårørende er involvert:
- Når pasient eller bruker ikke vil dele informasjon med sine pårørende og pårørende er fortvilet over ikke å få informasjon
- Når helsepersonellets faglige vurderinger går på tvers av pasientens eller pårørendes vurderinger
- Når en pasient eller bruker ikke vil at barna skal få informasjon om sykdommen, mens faglige vurderinger tilsier at barnet har behov for informasjon
- Når pårørende har sterke meninger om helsehjelpen som ikke deles av pasienten
Etisk bevissthet og refleksjon hos helsepersonell kan forebygge konflikter og gi nye perspektiver og løsninger når man opplever et dilemma. Sørg for å få belyst saken så godt som mulig ved å innhente alle relevante opplysninger, og etterspørre aktuelle verdier, hensyn og argumenter fra partene (Helsedirektoratet, 2018).
Grunnleggende elementer i en etisk refleksjonsprosess kan være:
- Hva består dilemmaet av?
- Er bakgrunnsinformasjonen tilstrekkelig?
- Hvem er involvert? Hvilke relasjoner inngår?
- Hva er rammene, aktuell lov og regelverk?
- Hvilke verdier og holdninger virker inn på individ og systemnivå?
- Hvilke handlingsalternativer finnes, og hva er konsekvensene av disse for alle involverte?
- Velg det handlingsalternativet som best ivaretar hensynet til den enkelte
Noen ganger kan det være aktuelt å søke bistand fra Klinisk etisk komite (KEK).
Åndelige og eksistensielle utfordringer
Sist faglig oppdatert: 14.10.2019
Palliasjon omfatter også de åndelige og eksistensielle aspekter ved behandling og omsorg for pasienter (jf. WHO-definisjonen). Hospice-bevegelsen og fremveksten av palliasjon som fagfelt har bidratt sterkt til økt oppmerksomhet om åndelig omsorg i helsetjenesten (McClement, 2015; Saunders, 2003).
I engelskspråklig litteratur brukes begrepet «spiritual care». Direkte oversatt kan «åndelig omsorg» stå som en samlebetegnelse for personalets tilnærming og innsats i forhold til eksistensielle og åndelige utfordringer og behov i siste livsfase. Betegnelsen «åndelig omsorg» kan imidlertid gi for snevre eller feilaktige assosiasjoner. Nedenfor presenteres noe av bredden i aktuelle «åndelige» spørsmålsstillinger, uansett tro og livssyn.
Den europeiske palliative organisasjonen EAPC definerer det åndelige området («spirituality») som
«den dynamiske dimensjonen ved menneskelivet som er relatert til hvordan personer, både som individer og fellesskap, opplever, uttrykker og/eller søker mening, hensikt og transcendens, og måten de er knyttet til øyeblikket, til seg selv, til andre, til naturen, til det betydningsfulle og/eller det hellige» (EAPC Task Force on Spiritual Care in Palliative Care, 2019).
EAPC utdyper denne definisjonen ved å peke på tre ulike dimensjoner ved det åndelige området:
- Eksistensielle utfordringer (dvs. spørsmål knyttet til identitet, mening, lidelse og død, skyld og skam, forsoning og tilgivelse, frihet og ansvar, håp og fortvilelse, kjærlighet og glede).
- Verdier og holdninger (det som er viktig for hver enkelt person, slik som forholdet til seg selv, familie, venner, arbeid, ting, naturen, kunst og kultur, etikk og moral, og selve livet).
- Religiøs og livssynsmessig forankring (tro, overbevisning og praksis, forholdet til Gud, den ytterste virkelighet eller det transcendente).
Litteraturen viser at flertallet av pasientene – uavhengig av livssyn – i sin siste levetid er opptatt av spørsmål innen åndelige området, vidt forstått (Balboni et al., 2013; Evangelista et al., 2016)
Kort beskrivelse av det åndelige området
Det åndelige området kan altså beskrives med tre hoveddimensjoner, som ofte griper over i hverandre:
1. Eksistensielle utfordringer
Under dette punktet er det naturlig å samle spørsmål som er knyttet til den enkeltes forståelse av hva det er å være et menneske og til menneskelivets grunnvilkår, slik som eksemplene ovenfor viser. Slike grunnleggende spørsmål om livet, døden og mening angår alle mennesker i større eller mindre grad.
Eksistensielle utfordringer vil oftest bli mer fremtredende i forbindelse med alvorlig og livstruende sykdom. Det å erfare alvorlig sykdom, usikkerhet om behandling og døden som mulig utgang, er en eksistensiell krise som aktualiserer spørsmål som: Hvorfor skjer dette med meg? Kommer jeg til å dø? Finnes det noe etter døden? Hvem er jeg nå, når jeg mister kontroll over eget liv og er helt avhengig av hjelp fra andre? Hvordan skal mine nærmeste klare seg videre? (Cobb, Puchalski, & Rumbold, 2012)
For mange mennesker er døden et tabu som er vanskelig å snakke om og forholde seg til. Mange kan streve med å møte det ukjente, med tap av kontroll og med å fastholde håp i møte med døden. Dette gjelder både pasienter og pårørende. I mange tilfeller vil den syke selv ha kommet lengre enn de pårørende når det gjelder å erkjenne og akseptere døden. Det kan i så fall medføre at de pårørende i begrenset grad er tilgjengelige for å ta del i pasientens følelser og tanker om døden.
2. Verdier og holdninger
Den verdimessige dimensjonen ligner den foregående, men kan være nyttig å skille ut som eget punkt. Her dreier det seg om refleksjon over hva som virkelig er viktig og mest verdifullt for den enkelte. Kriser og alvorlig sykdom utfordrer våre verdier og valg, og det er ikke uvanlig at pasienter revurderer hva som er viktig for dem (verdiavklaring).
Når livet går mot slutten, blir slike problemstillinger ofte påtrengende, ikke minst fordi pasientene må prioritere hva de vil bruke sine begrensede krefter på. De verdimessige utfordringene kan komme til uttrykk i spørsmål som: Hva er det viktigste for meg i den situasjonen jeg nå befinner meg i? Er jeg fortsatt verdifull som menneske, med alle mine nåværende begrensninger?
Ofte vil forholdet til den nærmeste familie bli stående som det aller viktigste ved slike verdiavklaringer. Dette kan også reise behov for å bekrefte relasjoner eller noen ganger å søke forsoning med sine kjære.
3. Religiøs og livssynsmessig forankring
Tro og livssyn handler om de svar og holdepunkter mennesker relaterer til eller søker i møte med livsspørsmålene. Svært ofte innebærer det en tro på eller søken mot en høyere makt, eller at noe utenfor vår erfaringsverden oppfattes som hellig. Det er imidlertid også mange som har forankring i et ikke-religiøst livssyn.
Tro og livssyn kommer til uttrykk både i form av tanker og refleksjoner som den enkelte gjør seg, gjennom tilhørighet til et tros- eller livssynssamfunn, eller ved å praktisere ritualer som gir språk og form til personens søken og lengsel.
Ritualer og symboler kan for mange mennesker være viktige holdepunkt i møte med sykdom og død. De kan også gi språk til tanker og følelser som ellers er vanskelige å uttrykke. Det kan dreie seg om allmenne ritualer og symbolhandlinger, som å tenne lys og lytte til musikk, men også spesifikt kristne ritualer som Fadervår, nattverd eller velsignelsen.
I vår kultur er en kristen forståelsesramme mest utbredt, selv om det ikke nødvendigvis innebærer en tilslutning til trosgrunnlaget i et bestemt kirkesamfunn. Ifølge statistikk fra SSB, er om lag 70 % av befolkningen medlemmer av Den norske kirke. Mange vil referere til sin barnetro som et trygt holdepunkt i livskriser og i møte med døden. I økende grad møter vi i vårt samfunn også andre religioner eller religiøst pregede livssyn som ikke definerer seg innenfor et etablert «trossystem». Det er også et økende antall som relaterer seg til et ikke-religiøst humanistisk livssyn.
Alvorlig og livstruende sykdom aktualiserer spørsmål relatert til tro og livssyn, og det kan også utfordre de svar og holdepunkter den enkelte har levd etter: Er det tilstrekkelig det fundamentet jeg har bygget livet mitt på? Kan jeg nå finne håp og mening i det jeg tror på? For noen pasienter vil troen være en naturlig kilde til håp og mening, andre kan oppleve at fundamentet vakler eller ha behov for å søke nye holdepunkt i en krevende livssituasjon.
Ivaretakelse av åndelige behov, omsorg og støtte
På bakgrunn av disse tre dimensjonene rommer åndelig omsorg for alvorlig syke og døende pasienter og deres pårørende
- Å være oppmerksom på de utfordringer pasient og pårørende står overfor når det gjelder eksistensielle spørsmål, verdier, tro og livssyn
- Å lytte innenfor rammen av pasientens egen livshistorie til de erfaringer og tyngdepunkter som pasienten vektlegger
- Å støtte opp under pasientens forsøk på mestring i møte med disse utfordringene
- Å støtte og hjelpe pasienten underveis med utgangspunkt i hans/hennes eget livssyn eller eventuelle ønske om å endre eller utvikle dette
- Å legge til rette for at pasienten og de pårørende kan utøve sin tro eller livssyn, og ved behov bistå dem til det.
I likhet med andre områder, gjelder det også for det åndelige området at det må kartlegges på forsvarlig måte. I tillegg til å avklare pasientens og pårørendes bakgrunn, kultur og tilhørighet til et tros- eller livssynssamfunn, bør kartleggingen også vende seg mot pasientens individuelle opplevelse, ønsker og behov. En slik kartlegging må ta hensyn til at spørsmål relatert til det åndelige området oppleves som svært personlige. Mange vil ha begrenset eller ingen erfaring med å sette ord på eller dele sine tanker rundt slike spørsmål. Å nærme seg disse spørsmålene krever både tid, oppmerksomt nærvær, sensitivitet og at man ikke går for fort fram. Samtidig bør helsepersonell være klar over at de ofte vil være naturlige samtalepartnere, ettersom rollen legger opp til en relasjon med stor grad av nærhet og fortrolighet.
Aktuelle spørsmål kan være: Hvordan er det for deg å oppleve det som hender deg nå? Hva er viktig for deg nå? Hva håper du på? Hva er du bekymret for? Er det noe som kan hjelpe deg å komme gjennom det som nå har hendt? Hva har vært til hjelp for deg tidligere i livet, når du opplevde krevende ting? For mange mennesker er det slik at de har en tro som kan være til hjelp for dem når livet blir vanskelig. Er det slik for deg? Kartleggingsverktøyet HOPE har fått en viss utbredelse som et hjelpemiddel til å strukturere en samtale om slike tema, og det inneholder også en del forslag til spørsmål som kan være aktuelle (Anandarajah & Hight, 2001; Blaber, Jone, & Willis, 2015).
Mange mennesker har gjennom livet hatt lite bevissthet om egen tro og livssyn. For noen er det først i livskriser at slike spørsmål for alvor melder seg. Helsepersonell må derfor være oppmerksom på at behov kan og vil endre seg underveis. Alvorlig sykdom kan også aktivere en latent livssynsforankring.
Åndelig omsorg handler mer om nærvær enn om handlinger. Det handler ikke om å ha svar på de store livsspørsmålene, men heller om mot til å være nær, også når man kjenner seg hjelpeløs. Det innebærer å være til stede, lytte aktivt, støtte og oppmuntre, mobilisere pasientens og omgivelsenes ressurser.
Å ha tid til å lytte, være sensitiv, vise respekt og anerkjenne og respondere på menneskers individuelle behov er eksempler på holdninger og ferdigheter som bidrar til å ivareta den åndelige omsorgen. Viktige forutsetninger hos hjelperen er også evne til å være helt og fullt til stede i møte med lidelse, omsorgsfullt nærvær og visshet om at man alltid kan gjøre noe som er av verdi for den andre. Helsepersonell bør selvsagt også på dette området arbeide tverrfaglig og henvise videre når det er aktuelt (Cobb et al., 2012).
Et økende tros- og livssynsmangfold medfører behov for grunnleggende interkulturell kompetanse. Kulturell identitet er sammen med tro og livssyn en viktig ramme for hvordan mennesker forholder seg til kriser og utfordringer. Kulturformidlingsintervjuet er et redskap for å bygge en terapeutisk relasjon på tvers av kulturelle forskjeller, gi bedre grunnlag for kliniske avgjørelser, planlegge behandlingsforløp og identifisere mulige ressurser i og utenfor den kliniske konteksten (Jackson, 2015). Det er viktig for både pasienter og pårørende å bli møtt av personell som har kunnskap, interesse og forståelse for deres kultur og tradisjoner. Samarbeidsrådet for tros- og livssynssamfunn (STL), som er en paraplyorganisasjon for tros- og livssynssamfunn, har i utredningen «Livsfaseriter» tatt med en kortfattet oversikt over de ulike livssyns tolkningshorisont, og hvilke ritualer som praktiseres ved dødsleie og gravferd. Dette kan gi helsepersonell mulighet til å skaffe seg en grunnleggende kunnskap i møte med livssynsmangfold (Plesner & Døving, 2009).
Rett til tros- og livssynsutøvelse hører til de grunnleggende menneskeretter, og den gjelder også de som på grunn av sykdom eller nedsatt funksjonsevne trenger bistand for å utøve sin tro eller livssyn. Regjeringen har i rundskriv til landets kommuner fastslått at denne rettigheten utløser en plikt for helse- og omsorgstjenesten til å legge til rette for den enkeltes mulighet til fri tros- og livssynsutøvelse (Rett til egen tros- og livssynsutøvelse, 2009).
Den enkelte helsearbeider bør strekke seg langt for å etterkomme pasienters og pårørendes ønsker på dette feltet. Pasientens behov skal stå i sentrum, samtidig som man tar hensyn og finner løsninger dersom ansatte ut fra sin overbevisning opplever det konfliktfylt å delta i ritualer eller lignende.
Retningslinjer for åndelig omsorg
De åndelige utfordringene angår alle, men varierer fra pasient til pasient og med sykdommens ulike stadier. Følgende retningslinjer kan være en hjelp til å ivareta åndelig omsorg på en god måte (Puchalski et al., 2009; Spiritual support services, 2004):
Grunnprinsipper for åndelig omsorg
- Åndelig omsorg skal inngå som en del av den helhetlige omsorgen til pasienter og pårørende. Behov for åndelig omsorg skal kartlegges på en forsvarlig måte på linje med pasientens og de pårørendes øvrige behov.
- Behovet for åndelig omsorg kan variere over tid. Personalet må derfor stadig ha oppmerksomhet mot dette området.
- Tilbudet må omfatte ulike former for støtte, tilpasset den enkeltes behov og ønsker. Ingen skal påtvinges samtaler omkring slike tema.
- Pasientens verd og egenart skal alltid respekteres gjennom å beskytte og styrke vedkommendes verdighet, identitet og integritet.
- Det åndelige området er følsomt for de fleste, og mange er også ekstra sårbare på dette feltet. Kommunikasjon om disse forhold krever derfor ekstra varsomhet.
- Erfaringsmessig kan det være vanskelig å videreføre et tilbud innenfor åndelig omsorg etter utskrivning til hjemmet eller ved overføring til ny institusjon. Dette området bør følges opp på linje med andre områder i ivaretakelsen av pasienten og familien.
Ressurspersoner for åndelig omsorg
Pasientens egen mestringsevne må ikke undervurderes. I tillegg er det viktig å tenke bredt når det gjelder mulige ressurspersoner:
- Pasientens familie, venner og øvrige nettverk.
- Alle ansatte (inkludert frivillige), uavhengig av profesjon.
- Ledere for tros- og livssynssamfunn.
- Ulike terapeuter og veiledere.
- Institusjonsprester og andre utdannede sjelesørgere (diakoner, helsearbeidere med videreutdanning i sjelesorg). Sykehus- og sykehjemsprester har et særlig ansvar for gjennomføringen av, og kvaliteten på, den åndelige omsorgen i sine institusjoner. Dette betyr også at de må kunne formidle kontakt til representanter for andre tros- og livssynssamfunn, når det er behov for det. Disse fagpersonene er som regel avhengig av at andre personalgrupper kartlegger behov og henviser pasienten. Institusjonsprestene vil også kunne veilede andre personalgrupper i forhold til åndelig omsorg.
Egenskaper og kvalifikasjoner hos hjelperne
Åndelig omsorg er et felles ansvar for hele det palliative miljøet. Likevel må tjenesten i praksis utføres av enkeltpersoner. I tillegg til kvalifikasjoner i form av utdanning og menneskelig erfaring, bør helsepersonell som er involvert i åndelig omsorg reflektere over, og arbeide med, følgende punkter:
- Evne til empati og innlevelse i menneskelivets ulike sider og menneskers forskjellighet.
- Forholdet til egen åndelighet, tro og død.
- Egen motivasjon for å tenke helhetlig omkring den alvorlig syke og døendes situasjon, og evne til å oppdage og respondere adekvat på åndelige problemstillinger.
- Evne til oppmerksomhet mot og respekt for pasientenes og pårørendes egne åndelige mestringsforsøk.
- Kunnskap om det åndelige området, og hvordan alvorlig sykdom og død influerer dette.
- Evne til lytting og til å være til stede, også i situasjoner der man føler seg hjelpeløs og maktesløs.
- Evne til fleksibel og forståelsesfull kommunikasjon som forener ærlighet og følsomhet.
- Evne til å leve med uløste spørsmål, både hos seg selv og hos pasient og pårørende.
- Evne til å nyttiggjøre seg veiledning og «debriefing».
- Evne til å sette seg selv og egne problemer og løsninger til side for å gi plass til (den) andre.
Flere studier konkluderer med at eksistensielle spørsmål er av stor betydning for alvorlig syke og døende, og at religiøs tro kan bidra til mestring ved alvorlig sykdom (McClain, Rosenfeld, & Breitbart, 2003; Y. C. Wang & Lin, 2016). Det bør stimuleres til ytterligere forskning omkring forholdet mellom åndelig støtte og livskvalitet i livets siste fase (Selman et al., 2018)
Den døende pasienten
Sist faglig oppdatert: 14.10.2019
En sentral målsetning i palliasjon er å tilstrebe at pasienten kan få dø der vedkommende ønsker, og legge forholdene til rette for en verdig død. Dette er derfor et viktig tema i kommunikasjonen med den døende og de pårørende når livet går mot slutten.
Tegn på at pasienten er døende
Når døden nærmer seg, ser en ofte en del typiske endringer hos pasienten (Lacey, 2015; Rosland et al., 2006):
- Økt søvnbehov
- Tiltagende fysisk svekkelse, økende behov for sengeleie
- Avtagende interesse for omgivelsene, mindre respons til de nærmeste
- Svekket orienteringsevne, ofte periodevis forvirring
- Tiltagende redusert interesse for å ta til seg mat og drikke
- Problemer med å ta tabletter
Kommunikasjon og informasjon
For å kunne ivareta behovene til den døende pasienten, er det viktig å diagnostisere at vedkommende er døende (John Ellershaw & Wilkinson, 2003). Det er også viktig at hele teamet er innforstått med denne vurderingen. Informasjon om at pasienten er døende, må formidles til pasient og pårørende. Når denne informasjonen er gitt, blir det enklere for pårørende og personalet å legge til rette for en verdig død i samsvar med pasientens ønsker. Hvis en ikke diagnostiserer at pasienten er døende, eller unnlater å informere de pårørende om dette, kan det skape usikkerhet, kommunikasjonsproblemer og urealistiske forventninger. Det kan også føre til fortvilelse over at pasienten ikke blir bedre til tross for de tiltak som blir gjort. Samtidig må en være åpen for at pasientens tilstand kan endre seg, slik at pasienten ikke lenger er umiddelbart døende.
De pårørende må informeres om symptomer som kan oppstå, som uro, forvirring, surkling og endring av hudfarge. Når en pasient er døende, kommer ofte spørsmål om inntak av mat og drikke. Det må gis informasjon om at pasienten har sluttet å spise og drikke fordi vedkommende er døende. En må også forklare at livslengden ikke påvirkes av at det ikke gis væske og ernæring i denne fasen, og at pasienten heller ikke lider av sult eller tørste. Munntørrhet hos døende behandles best med regelmessig munnstell.
Tiltaksplan for ivaretakelse av den døende
En tiltaksplan for døende pasienter bør inneholde følgende delmål (John Ellershaw & Wilkinson, 2003; Treatment for the dying patient: The Liverpool Care pathway, 2011):
- Optimal lindring av plagsomme symptomer
- Seponering av uhensiktsmessig behandling
- Pasient og pårørende er forberedt på at pasienten er døende og forstår innholdet i tiltaksplanen
- Pasientens eksistensielle og åndelige behov er ivaretatt
- Pårørende er inkludert og ivaretatt
- Planen bør også inneholde klare retningslinjer i forhold til forventet utvikling og mulige komplikasjoner
Tiltaksplanen Liverpool Care Pathways hadde svært gode intensjoner og var i de rette hender et glimrende verktøy for bedre pleie og omsorg av døende, men ble massivt kritisert for bl.a. manglende sikkerhetsrutiner for feilvurderinger, og er nå faset helt ut (Seymour & Clark, 2018). I Norge har vi nå tatt i bruk en videreføring av denne planen: Livets siste dager – plan for lindring i livets sluttfase, som er innført som tiltaksplan på en rekke sykehus og sykehjemsavdelinger, og som også kan brukes av hjemmesykepleien (Iversen, 2016).
Optimal lindring av plagsomme symptomer
Det forutsettes gode prosedyrer med medikamentelle tiltak for å lindre vanlige symptomer som smerter, dyspne, forvirring, uro, angst, kvalme og surkling i luftveiene. Aktuelle medikamenter bør kunne gis subcutant, da denne (parenterale) administrasjonsformen beherskes både på sykehjem og i hjemmesykepleien. Pasienter som trenger jevnlige medikamentdoser og ikke lenger kan ta nødvendige medikamenter per os, vil være best hjulpet med kontinuerlig subcutan infusjon.
Smertepumpe med utstyr rekvireres fra Helseforetakene ved Behandlingshjelpemidler, også for hjemmeboende pasienter. (Søknadsskjema ligger på www.behandlingshjelpemidler.no)
Følgende medikamenter anbefales og skal gjøres tilgjengelig i siste livsfase når peroral behandling ikke lenger er hensiktsmessig:
| Morfin: | For smertelindring og lindring av tung pust |
| Midazolam: | For lindring av angst og uro, kramper og delir |
| Haloperidol: | For lindring av kvalme, og uro/agitasjon når man ikke kommer til målet med midazolam |
| Glucopyrron: | Til lindring av surkling i luftveiene hos døende pasienter |
Dosering utenfor institusjon
Morfin med startdose 2,5 mg hos opioidnaive, og opp til 20 mg per dose hos pasienter som allerede står fast på opiater, kan gis av hjemmesykepleier på ordinasjon av lege. Ved dosering over 200 mg/døgn skal spesialisthelsetjenesten konsulteres og eventuelt overta behandlingsansvaret.
Ved kjent nyresvikt og GFR< 30, kan man isteden bruke oxynorm i samme dosering som morfin.
Midazolam med startdose 1 mg, og opp til 2,5 mg per dose inntil maks 20 mg/d, kan gis av hjemmespleier på ordinasjon av lege. Ved behov for høyere doser skal spesialisthelsetjensten konsulteres og eventuelt overta behandlingsansvaret.
Haloperidol: startdose 0,5 mg x 2, ved behov for døgndoser over 10 mg skal spesialisthelsetjenesten konsulteres.
Glucopyrron: startdose 0,2 mg, deretter 0,2 mg x 5, start 2 timer etter bolus. Maks døgndose 1,2 mg. Hvis behandlingstid strekker seg over mer enn 3 døgn/72 timer, skal spesialisthelsetjenesten konsulteres.
Bruk av subkutan pumpe anbefales. Se informasjon om bruk av subcutan infusjonspumpe under Helse-Bergens nettsider for lindrande behandling:
Lindrende sedering kan være indisert i spesielle tilfeller. Den norske legeforening har utarbeidet retningslinjer for lindrende sedering til døende (Retningslinjer for lindrende sedering i livets sluttfase, 2014). Kliniske etikkomiteer kan være en ressurs i slike og lignende situasjoner.
Dokumentasjon og kommunikasjon mellom aktørene
Sist faglig oppdatert: 14.10.2019
Relevant og oppdatert dokumentasjon må være tilgjengelig på rett sted til rett tid. Dette stiller krav til alle ledd i behandlingskjeden. Utvikling av elektroniske løsninger kan være til god hjelp.
Taushetsplikt og juridiske forhold
Taushetsbelagte opplysninger kan bare videreformidles når den opplysningene gjelder har samtykket, eller når det er gitt unntak i lov. Pasienten kan samtykke til at helsepersonell utleverer opplysninger om personlige eller andre helsemessige forhold til andre. Foreldre skal samtykke for barn under 16 år.
Helsepersonell kan gi opplysninger til annet samarbeidende personell som deltar i behandlingen av pasienten når det er nødvendig for helsehjelpen, dersom ikke pasienten motsetter seg dette.
Retten til individuell plan er regulert i pasient- og brukerrettighetsloven § 2‑5. Helsepersonell har ansvar for å melde ifra om behovet for individuell plan, og har plikt til å medvirke i arbeidet med denne, jf. helsepersonelloven §§ 38 a og 4 annet ledd. Utfyllende bestemmelser knyttet til individuell plan finnes i Forskrift om habilitering og rehabilitering, individuell plan og koordinator (FOR-2011-12-16-1256).
Dersom pasienten ikke gir sitt samtykke til utlevering av opplysninger eller opprettelse av individuell plan, skal dette journalføres. Innholdet i dokumentasjonen.
Dokumentasjonen i palliasjon bør legge vekt på følgende aspekter:
- Hvor pasienten er i sykdomsforløpet – utviklingen av sykdomsbildet og pasientens tilstand og behov
- Vurdering av hensiktsmessige tiltak – har pasienten spesielle ønsker eller reservasjoner?
- Hva som skal/bør gjøres dersom det oppstår nye situasjoner eller komplikasjoner
- Hvilken informasjon som er formidlet til pasient og pårørende – hva vet pasienten?
Felles kjernedokumentasjon
Det må arbeides mot en dokumentasjon som kan brukes av alle i nettverket. Denne informasjonen kan være et vedlegg til en eventuell individuell plan.
Minimumskrav til tilgjengelig dokumentasjon for pasienten og alt helsepersonell som kommer til pasienten:
- Liste over kontaktpersoner, inkl. fastlege, ev. koordinator i kommunen, behandlingsansvarlig lege og/eller koordinator på sykehus, telefonnummer til hjemmesykepleien, ev. fysioterapeut/ergoterapeut og andre involverte fagpersoner
- Oppdatert medikamentliste
- Opplysninger fra siste sykehusopphold (utskrivningsnotat, epikrise, sykepleierapport, epikrise fra andre faggrupper)
- ESAS-skjema (ESAS-r: https://helse-bergen.no/kompetansesenter-i-lindrande-behandling/palliasjon-verktoy-for-helsepersonell/esas-symptomregistrering)
Henvisning/innleggelse
En henvisning bør inneholde følgende:
- Aktuell problemstilling
- Medikamentliste
- Definert kontaktperson eller koordinator i hjemmesykepleien (inkl. telefonnummer)
- Fastlege (inkl. telefonnummer)
- ESAS-registrering av ny dato
- Planlagt oppfølging
Utskrivning
Utskrivning bør varsles i god tid, og utskrivning av pasienter med komplekse problemer rett før helg bør i størst mulig grad unngås. Ved utskrivning skal sykepleierapport og epikrise følge pasienten. Sistnevnte bør inkludere følgende:
- Forløp og status
- Oppdatert medikamentliste
- ESAS-profil
- Ansvar for og avtalt oppfølging
- Råd/veiledning vedrørende forventet utvikling og mulige komplikasjoner
- Informasjon som er gitt pasienten og ev. pårørende
Individuell plan og koordinator
Pasienter som trenger et koordinert tjenestetilbud, skal ha en plan som skal omfatte alle aktuelle tjenesteområder, jf. Forskrift om individuell plan, Helse- og omsorgstjenesteloven og Spesialisthelsetjenesteloven (Forskrift om individuell plan etter helselovgivningen og sosialtjenesteloven; Individuell plan 2010 – veileder til forskrift om individuell plan, 2010; Lov om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven); Lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven)). Både kommunen og helseforetaket har ansvar for å utarbeide individuell plan til pasienter som har behov for det, men i henhold til nytt lovverk har kommunen ansvaret for å koordinere arbeidet dersom begge nivåer er involvert. Både helseforetaket og kommunen skal også tilby koordinator til pasienter med behov for komplekse eller langvarige og koordinerte tjenester. Koordinator skal sørge for nødvendig oppfølging av den enkelte pasient, samt sikre samordning av tjenestetilbudet og fremdrift i arbeidet med planen.
I palliasjon må utformingen og omfanget av den individuelle planen tilpasses pasientens spesielle situasjon med stadig endring i tilstanden og vekslende behov for oppfølging og tiltak.
Hovedmålet for planen må være at den bidrar til en helhetlig og forutsigbar tjeneste med tydelig oppgavefordeling og tydelige avtaler om tilgjengelighet og oppfølging.
Erfaringen tilsier at en slik plan er svært nyttig og burde tilbys flere pasienter. Informasjon om individuell plan for kreftpasienter i palliativ fase, samt eksempel på en slik individuell plan, finnes hos kompetansetjenesten for lindrende behandling (oslo-universitetssykehus.no).
Individuell plan skal inneholde:
- Pasientens skriftlige samtykke
- En koordinator, f.eks. hjemmesykepleier
- Pasientens mål
- En ansvarlig tjenesteyter for hvert tjenesteområde
- Kontaktoversikt og ansvarsfordeling, inkl. kveld, natt og helg
- Avtalt oppfølging
- Klare retningslinjer for hvor og hvordan ev. innleggelse skal ordnes. Dersom åpen retur-begrepet brukes, skal dette være klart definert.
Også pasienter som ikke ønsker individuell plan, har rett på koordinator.
Møtesteder og kontakt
Felleskonsultasjon er en nyttig måte for aktørene å møtes på, særlig ved komplekse problemstillinger og der hjemmeomsorg planlegges. De aktuelle behandlingsnivåer og instanser bør være representert. Initiativet kan komme fra kommunehelsetjenesten, sykehusavdeling eller palliativt team.
God tilgjengelighet for telefonkontakt er viktig både for hjemmesykepleie, ev. kreftkoordinator, fastlege og sykehusavdeling. Dialog mellom aktørene er spesielt viktig i starten av et samarbeid og når pasientens tilstand er ustabil, ofte mot livets avslutning.
Samhandlingsprosedyrer for behandlingsnettverket
I henhold til nytt lovverk i forbindelse med samhandlingsreformen (Helse- og omsorgsdepartementet), er det inngått samarbeidsavtaler mellom alle helseforetak og kommunene i foretaksområdet (Lov om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven)). Avtalene omfatter blant annet retningslinjer for samarbeid i tilknytning til innleggelse og utskrivning, og om pasienter som antas å ha behov for kommunale tjenester etter utskrivning fra institusjon. I flere foretaksområder er det inngått egne delavtaler om palliativ behandling. Erfaringsmessig krever dette fagområdet så høy grad av samhandling at samarbeidet bør forankres i en egen delavtale, selv om dette ikke er pålagt i lovverket. Rutiner for individuell plan, og rutiner/sjekkliste ved utskrivning, bør også være nedfelt i metodebok.
Økonomiske ytelser
Økonomiske ytelser, refusjonsordninger og rettigheter ved alvorlig sykdom
Sist faglig oppdatert: 14.10.2019
Langvarig sykdom kan føre til at inntekten i en husholdning endrer seg dramatisk over få år. Noen har økonomisk buffer for dette, andre vil få økonomiske bekymringer eller problemer (Harlo & Kvikstad, 2016).
Folketrygdlovens formål er å gi økonomisk trygghet ved å sikre inntekt og kompensere for særlige utgifter ved f. eks. sykdom og skade, uførhet, alderdom, dødsfall, og aleneomsorg for barn. Folketrygden skal videre bidra til utjevning av inntekt og levekår over den enkelte persons livsløp og mellom grupper av personer. De fleste ytelser utløses av endret tilknytning til arbeid, endret funksjonsevne, økte utgifter til medisiner, reise osv. I tillegg finnes ytelser og velferdstjenester som utløses av individuelle, behovsprøvde økonomiske forhold (Lov om folketrygd (folketrygdloven)).
Helse – og sosialfaglig personell skal bidra til å skape forutsigbarhet og gi informasjon om aktuelle ytelser og hvordan man søker. Dette kapittelet vil belyse et utvalg rettigheter og ytelser som er av betydning for pasienter, pårørende og etterlatte som er medlem av folketrygden. Ved sykdom hos barn, og ved sykdom hos personer som ikke er medlem av folketrygden gjelder eget regelverk (Lov om folketrygd (folketrygdloven)).
Kapitlet tar for seg følgende tema:
Klinisk tilnærming
Sårbare situasjoner
Folketrygdens ytelser ved sykdom
Uføretrygd og kurantsak
Pleiepenger og andre ytelser for pårørende
Ytelser ved dødsfall
Egenandeler og frikort
Legemiddelinformasjon, refusjon over blå resept
Reiseutgifter
Nettsider om ytelser og rettigheter
Klinisk tilnærming
Sist faglig oppdatert: 14.10.2019
Kartlegging av inntekt og tilknytning til arbeid
Helse- og sosialfaglig personell bør systematisk kartlegge pasientens tilknytning til arbeid, inntekt og ytelser fra NAV, dette for å avdekke behov for oppfølging og for å sikre at pasienten og familien har søkt om de ytelsene de har rett på som følge av alvorlig sykdom og funksjonsendring.
- Er pasienten i et arbeidsforhold?
- Mottar pasienten ytelser fra NAV, hvilke og hvor lenge?
- Hvor mange bor i husstanden, er de flere som har inntekt?
- Har pasienten opplevd at inntekt, utgifter eller funksjonsnivå har endret seg som følge av sykdom?
- Har pasienten økonomiske bekymringer eller behov for informasjon om rettigheter?
Behovet for konkret bistand varierer. Ofte vil kartlegging av sosioøkonomisk situasjon supplert med informasjon, råd og veiledning i forhold til aktuelle problemstillinger være tilstrekkelig. Mange vil trenge konkret hjelp til å finne og fylle ut søknadsskjema og sikre at krav til dokumentasjon og frister overholdes (Harlo & Kvikstad, 2016).
Spesielt sårbare situasjoner
Sist faglig oppdatert: 14.10.2019
Noen grupper er spesielt sårbare for endring og en plan for individuell oppfølging er nødvendig for å forebygge sosiale og økonomiske konsekvenser av sykdom. Følgende grupper bør få tilbud om oppfølging fra sosionom på sykehus eller i den kommunale helse og omsorgstjenesten:
- Pasienter under 18 år
- Ungdom/studenter over 18 år
- Pasienter som er alene med omsorg for barn under 18 år
- Pasienter med svakt sosialt nettverk
- Pasienter som er selvstendig næringsdrivende, spesielt enkeltmannsforetak
- Pasienter som tidligere har hatt store psykososiale belastninger
- Pasienter som har tilbakefall av sykdom
- Pårørende som har en omfattende pleie og omsorgsrolle
- Pårørende som har behov for praktisk eller økonomisk støtte som følge av sykdom i familien
Samarbeid med sosionom
Sosionomer i sykehus, og i den kommunale helse og omsorgstjenesten har spisskompetanse og bred kunnskap om rettigheter, hjelpe- og støtteordninger og kan gi adekvat informasjon, råd og veiledning. Sosionomer har kompetanse i nettverks-og familiearbeid og vil ut i fra pasienten og familiens behov koordinere samarbeid med NAV, sosiale tjenester, barnevern, familievern, boligkontor og andre sosialfaglige etater.
Folketrygdens ytelser ved bortfall av inntekt
Sist faglig oppdatert: 14.10.2019
Forvaltning, søknad og satser
Ytelser og stønader administreres av ulike aktører som NAV stat, NAV kommunale tjenester, Helseøkonomiforvaltningen (HELFO), helseforetak, den kommunale helse og omsorgsforvaltningen og fylkeskommunen. I tillegg finnes legater og andre private ordninger som kan være til nytte for noen. Informasjon om vilkår, og skjema for søknad hentes fra aktørenes nettside (tabell 3.1, kapittel Støtte til reiseutgifter og andre ordninger). Noen søknadsskjema kan også hentes via elektronisk pasientjournal (EPJ). Søknader må som hovedregel fylles ut og undertegnes av søker, og dokumenteres med legeerklæring.
Grunnbeløpet i Folketrygden (forkortes vanligvis til G) benyttes som grunnlag for å beregne forsikrings-, trygde- og pensjonsytelser. Beløpets størrelse vedtas årlig av Stortinget. Per 1. mai 2019 utgjorde Folketrygdens grunnbeløp (1 G) kr 99 858.
Sykepenger
For å ha rett til sykepenger må man som hovedregel ha vært i arbeid i minst 4 uker før man ble arbeidsufør, og ha en arbeidsinntekt på minst 0,5 G per år. Arbeidsevnen må være redusert med minst 20 % for rett til sykepenger. Man kan få sykepenger i 52 uker, ytelsen er inntektsberegnet med maksimumsbeløp fra folketrygden på 6xG (Arbeidstakere kan ha avtale om at arbeidsgiver dekker lønn under sykdom utover 6xG). For å opparbeide seg rett til ny sykepengeperiode må man være helt arbeidsfør i minst 26 uker.
Selvstendig næringsdrivende og frilanser har rett til sykepenger fra 17. dag. For selvstendig næringsdrivende utgjør sykepengene 65 prosent av sykepengegrunnlaget og for frilanser utgjør sykepengene 100 prosent av sykepengegrunnlaget. Det kan mot en premie tegnes forsikring i trygden for de første 16 kalenderdagene og/eller for 100 prosent dekningsgrad.
Pasienten må sykmeldes / sette fram krav om sykepenger, også når vedkommende er innlagt i helseinstitusjon. Pasienten må undertegne kravet om sykepenger før det sendes til NAV.
Tidspunktet der pasienten går over fra sykepenger til annen ytelse, er særskilt viktig å være oppmerksom på. Ytelser som kommer etter sykepenger gir som regel lavere utbetaling. NAV inviterer pasienten til en samtale når det er 3 måneder igjen av sykepengeperioden for å orientere om hvilke ytelser som kan være aktuelle etter at rettighet til sykepenger går ut.
Reisetilskudd
Det kan ytes reisetilskudd i stedet for sykepenger til yrkesaktive (arbeidstakere, selvstendig næringsdrivende og frilansere). Pasienten må på grunn av sykdom eller skade være midlertidig ute av stand til å reise til og fra arbeidsstedet på vanlig måte. Lege attesterer behov for reisetilskudd på sykmeldingsblanketten, støtten utbetales mot kvitteringer.
Arbeidsavklaringspenger (AAP)
Vilkår for arbeidsavklaringspenger er at arbeidsevnen er redusert med minst 50 % på grunn av sykdom eller skade (Lov om folketrygd (folketrygdloven)). Stønaden skal sikre inntekt i en overgangsperiode hvor pasienten har behov for arbeidsrettede tiltak, medisinsk behandling eller annen oppfølging fra NAV for å komme i arbeid. Arbeidsavklaringspenger ytes i utgangspunktet inntil 3 år. I særlige tilfeller kan stønadsperioden forlenges i ytterligere 2 år.
Arbeidsavklaringspenger utgjør 66 % av pasientens pensjonsgivende inntekt. Den pensjonsgivende inntekten beregnes enten på grunnlag av inntekten året før arbeidsevnen ble nedsatt, eller på grunnlag av gjennomsnittet av den pensjonsgivende inntekten de tre siste årene før samme tidspunkt. Pensjonsgivende inntekt over 6xG regnes ikke med i beregningsgrunnlaget.
Pasienter som ikke har hatt lønnsinntekt eller ikke har mottatt andre ytelser før arbeidsevnen ble nedsatt, vil kunne motta arbeidsavklaringspenger tilsvarende en årlig minsteytelse på 2 ganger grunnbeløpet (G). Pasienter som fyller vilkårene for både sykepenger og arbeidsavklaringspenger, har rett til å få ytelsen som gir høyest utbetaling.
For å få utbetalt arbeidsavklaringspenger må pasienten sende inn meldekort hver 14. dag. Dersom dette vurderes som unødig tyngende, kan det søkes fritak fra meldekort ved å kontakte NAV og dokumentere situasjonen med legeerklæring.
Flere tjenestepensjonsordninger gir utbetaling til medlemmer som mottar arbeidsavklaringspenger eller er midlertidig ute av arbeid. Den enkelte bør undersøke vilkår for tjenestepensjonskassa de er medlem av.
Se utfyllende informasjon på NAV.no og i folketrygdloven (Lov om folketrygd (folketrygdloven))
Uføretrygd og kurantsak
Sist faglig oppdatert: 14.10.2019
Dersom inntektsevnen er varig nedsatt som følge av sykdom eller skade med 50 % eller mer, er det aktuelt å søke om uføretrygd. Uføretrygd kan graderes og kombineres med arbeid.
For å ha rett på uføretrygd må følgende vilkår være innfridd:
- Søker skal være mellom 18 og 67 år
- Søker må ha vært medlem av folketrygden i de siste tre årene før sykdom
- Sykdom eller skade må være hovedårsaken til at inntektsevnen er nedsatt.
- Hensiktsmessig behandling og arbeidsrettede tiltak må være gjennomført.
- Inntektsevnen må være varig nedsatt med minst 50 prosent på grunn av sykdom og/eller skade. (For den som har Arbeidsavklaringspenger på søknadstidspunktet er det tilstrekkelig at inntektsevnen er varig nedsatt med minst 40 prosent).
Uføretrygden utgjør 66 prosent av gjennomsnittsinntekten de 3 beste av de 5 siste årene før sykdom. Det er kun årlig inntekt opptil 6 ganger folketrygdens grunnbeløp (G) som tas med i beregningen av uføretrygden. Uføretrygd justeres for trygdetid (antall år med medlemskap i folketrygden). Personer som forsørger for barn under 18 år, kan ha rett til barnetillegg
Minstesats for uføretrygd utgjør 2.48 ganger folketrygdens grunnbeløp (G) for enslige. Satsen justeres for dem som er samboere eller gift. Satser for unge uføre er noe høyere, det stilles særlige krav til alder ved uføretidspunktet.
Se utfyllende informasjon på NAV.no og i folketrygdloven (Lov om folketrygd (folketrygdloven))
Uføretrygd, definisjon av kurantsak
Det må i kurantsaker foreligge en alvorlig sykdom som fører til at hele inntektsevnen er varig nedsatt. Hva som anses som alvorlig sykdom, må ut fra de medisinske opplysningene vurderes i hvert enkelt tilfelle. Når kriteriene for kurantsak er oppfylt, skal saken behandles straks. Eksempler på hva som kan anses som alvorlig sykdom i denne sammenheng:
- Langtkommen kreft med spredning
- Alvorlig kronisk hjertesvikt
- Alvorlig kronisk lungesvikt
- Alvorlige hodeskader
- Psykisk utviklingshemming
- Kronisk psykose
- Andre tilsvarende alvorlige sykdommer som direkte forklarer bortfalt inntektsevne
Utfyllende informasjon finnes på NAV.no og i folketrygdloven (Lov om folketrygd (folketrygdloven)).
Pleiepenger og andre ytelser for pårørende
Sist faglig oppdatert: 14.10.2019
Velferdspermisjon 10 dager per år
Arbeidstaker har rett til permisjon i inntil 10 dager hvert kalenderår for å gi nødvendig omsorg til foreldre, ektefelle, samboer eller registrert partner. Det er arbeidsgiver som avgjør om velferdspermisjon blir gitt med eller uten lønn. Flere arbeidsplasser, særlig i det offentlige, har tariffestet rett til velferdspermisjon med lønn ved alvorlig sykdom og død i nær familie.
Utfyllende informasjon i Arbeidsmiljøloven (Lov om arbeidsmiljø, arbeidstid og stillingsvern mv. (arbeidsmiljøloven))
Pleiepenger for nærstående i livets sluttfase
Pleiepenger kan erstatte arbeidsinntekt når en pårørende pleier en nærstående i livets sluttfase. NAV kan utbetale pleiepenger i inntil 60 arbeidsdager for hver pasient.
De 60 dagene kan deles mellom flere pårørende og trenger ikke å tas ut sammenhengende. Nærstående kan få pleiepenger både når de gir pleien i hjemmet til den pleietrengende og når de gir pleien i eget hjem. Man kan ikke ta ut pleiepenger for dagene pasienten er innlagt i institusjon.
Sats for pleiepenger ytes etter de samme bestemmelsene som gjelder for sykepenger ved egen sykdom. Det er ingen arbeidsgiverperiode ved pleiepenger. Det er vanlig at arbeidsgiver utbetaler pleiepenger over lønn til arbeidstaker, for så å søke refusjon fra NAV for de dagene arbeidstaker har tatt ut pleiepenger. NAV kan evt. utbetale pleiepenger til arbeidstaker direkte.
Den som skal gi pleie fyller ut og signerer skjema «søknad om pleiepenger i livets sluttfase» (NAV 09–12.05) Pasientens lege beskriver diagnose, alvorlighetsgrad av sykdommen, og behov for tilsyn og pleie i hjemmet. Pasienten må selv samtykke til at de ønsker å motta pleie fra den som søker. Søknadskjema for pleiepenger hentes frem ved å logge inn på www.nav.no, de fleste institusjoner og leger har tilgang til skjema via EPJ.
Både fastlege og lege i spesialisthelsetjenesten har tilgang til å skrive legeerklæring til søknad om pleiepenger for nærstående i livets sluttfase.
Utfyllende informasjon finnes på NAV.no og i folketrygdloven (Lov om folketrygd (folketrygdloven)).
Hjelpestønad
Pasienten kan søke om hjelpestønad fra NAV dersom han har pleiebehov / nødvendig tilsyn som utføres av pårørende / nærstående. Sykdommen må være varig eller ha en varighet på minst 2–3 år. Det er tilstrekkelig at et hjelpebehov på 2,5 timer per uke er påvist. Hjelpestønad kan ytes også om pasienten får hjemmesykepleie.
Fra januar 2019 er sats for hjelpestønad til særskilt tilsyn og pleie kr 1229,– per måned, kr. 14748,– per år.
Kommunens ansvar overfor pårørende
Til personer med særlig tyngende omsorgsarbeid skal kommunen tilby nødvendig pårørendestøtte blant annet i form av:
- Råd og veiledning
- Avlastning
- Omsorgsstønad
Kommunen skal kartlegge pårørendes behov for støtte og fatte vedtak etter lov om kommunale helse og omsorgstjenester.
Utfyllende informasjon finnes i Helse og omsorgstjenesteloven (Lov om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven)) og i Pårørendeveilederen fra Helsedirektoratet (Helsedirektoratet, 2018).
Sykdom hos pårørende
Omsorg for familiemedlemmer / nære pårørende vil i seg selv ikke gi rett på sykepenger, men pårørendes situasjon kan oppleves så tyngende at den fører til sykdom. I slike tilfeller må den pårørende oppsøke egen fastlege for vurdering. Den pårørendes fastlege må vurdere om sykdomsvilkåret er oppfylt, og om det er behov for sykemelding eller tilpasset arbeidssituasjon for en periode (Sykmelderveileder, 2018).
Ytelser ved dødsfall
Sist faglig oppdatert: 14.10.2019
Et dødsfall kan føre til store økonomiske endringer for dem som skal leve videre. Mange familier ønsker å forberede seg på hva de kan ha i vente ved å søke råd om ytelser og muligheter for økonomisk støtte etter et dødsfall. Hvilke ytelser som er aktuelle for den enkelte, avhenger bl.a. av økonomi og deltakelse i arbeidslivet. Alle ytelsene søkes via NAV.
Gjenlevendepensjon
Gjenlevendepensjon består av grunnpensjon, tilleggspensjon og/eller særtillegg. Tilleggspensjon beregnes ut ifra avdødes pensjonsopptjening og gir 55 % av det avdøde ville fått dersom han var ufør eller pensjonist på dødstidspunktet. Registrert partnerskap er likestilt med ekteskap. Bestemmelsene i Folketrygden som gjelder ektefeller, gjelder også samboere som har eller har hatt felles barn eller tidligere har vært gift med hverandre. Gjenlevende må selv søke om gjenlevendepensjon (Lov om folketrygd (folketrygdloven)).
Overgangsstønad til gjenlevende ektefelle/partner
Dersom ekteskapet har vart i mindre enn 5 år og den avdøde og gjenlevende ikke har barn sammen kan gjenlevende ha rett til overgangsstønad i en omstillingsperiode etter dødsfallet, hvis gjenlevende er i en omstillingsprosess etter dødsfallet, tar utdanning, har daglig omorg for avdødes særkullsbarn (det forutsetter at omsorgen startet før dødsfallet og har fortsatt uten opphold).
Gravferdsstønad
Gravferdsstønad (Lov om folketrygd (folketrygdloven)) er en behovsprøvd ytelse med et tak på kr 23 990 (2019). Informasjon og søknadsskjema er tilgjengelig på NAV.no. Begravelsesbyrå er ofte behjelpelig med å søke denne ytelsen.
Båretransport
Når et medlem i folketrygden dør i Norge og båren med den avdøde må transporteres over en strekning som er lengre enn 20 km, blir nødvendige utgifter til transport (ut over en egenandel på 2 399 kroner) dekket til nærmeste naturlige gravplass i forhold til det stedet avdøde var bosatt. Det gjelder særlige regler når dødsfallet skjer utenfor Norge. Det er også særlige regler når dødsfallet skyldes yrkesskade. Utfyllende informasjon finnes på NAV.no og i folketrygdloven (Lov om folketrygd (folketrygdloven)).
Barnepensjon
Pensjonen gis uavhengig av om foreldrene var gift, skilt eller samboere. Barnepensjon varierer i størrelse avhengig av antall barn og om barnet er foreldreløs eller om en av foreldrene lever. Dersom en av foreldrene lever, utgjør stønaden for det første barnet 40 % av 1 G, og for de øvrige barna utgjør satsen 25 % av 1 G per år for hvert barn. Den samlede pensjonen deles likt mellom barna og utbetales frem til fylte 18 år.
Der begge foreldre er døde, vil pensjonen for det eldste barnet tilsvare 1 G + 55 % av tilleggspensjonen til den av foreldrene som hadde best opptjening. For barn nr. 2 utgjør satsen 40 % av 1 G per år. For hvert øvrige barn utgjør satsen 25 % av 1 G per år. Den samlede stønaden deles likt mellom barna.
Tjenestepensjonsordninger hos siste arbeidsgiver og andre pensjons- og forsikringsordninger kan gi tilleggspensjon.
Utfyllende informasjon finnes på NAV.no og i folketrygdloven (Lov om folketrygd (folketrygdloven)).
Egenandeler og frikort
Sist faglig oppdatert: 14.10.2019
Ytelser ved behov for helsetjenester, legemidler, behandling, utstyr, næringsmidler, og transport som følge av sykdom.
Frikort for helsetjenester
Privatpersoner får frikort for helsetjenester når de har betalt over et visst beløp i egenandeler. De slipper da å betale egenandeler for resten av kalenderåret. Behandlere og tjenesteytere må rapportere alle godkjente egenandeler minst hver 14. dag. Når egenandelstak er nådd vil Helfo automatisk sende ut frikort til pasienten som slipper å betale egenandeler ut kalenderåret.
Utfyllende informasjon finnes på helfo.no og i folketrygdloven (Lov om folketrygd (folketrygdloven)).
Legemiddelinformasjon, refusjon over blå resept
Sist faglig oppdatert: 14.10.2019
Refusjon over blå resept for utgifter til legemidler, næringsmidler og medisinsk forbruksmateriell.
Legemidler
Forhåndsgodkjent refusjon (blåreseptforskriften § 2)
Mange legemidler går automatisk på blå resept (Forskrift om stønad til dekning av utgifter til viktige legemidler mv. (blåreseptforskriften)) med forhåndsgodkjent refusjon (§ 2). Legemidler på blå resept er knyttet opp mot refusjonskoder, det kan i tillegg være knyttet vilkår til behandlingen for at legemidlet skal bli refundert på blå resept. Det er legens ansvar at vilkårene er oppfylte. Informasjon om forhåndsgodkjent refusjon finnes i Legemiddelverkets legemiddelsøk og i Felleskatalogens nettversjon (se nettreferanser i tabell 3.1 i kapittel Støtte til reiseutgifter og andre ordninger).
Mange legemidler er flyttet fra blåreseptordningen og blir nå finansierte av helseforetakene, H-resept (Forskrift om helseforetaksfinansierte reseptlegemidler til bruk utenfor sykehus). Pasientene betaler ikke egenandel for H-reseptlegemidler.
§ 2 ‑90 Refusjon ved palliativ behandling i livets sluttfase.
Blåreseptforskriften § 2 refusjonskode -90 omfatter palliativ behandling i livets sluttfase, uavhengig av diagnose (Forskrift om stønad til dekning av utgifter til viktige legemidler mv. (blåreseptforskriften)). Livets sluttfase er i denne sammenheng definert (av Direktoratet for medisinske produkter) til å være når kurativ behandling som mål er avsluttet eller umulig. Det generelle kravet om at det skal være behov for legemiddelet i minst tre måneder gjelder ikke ved refusjon på § 2 -90.
Alle leger kan rekvirere legemiddel på blå resept på § 2 -90, det er som regel ikke krav til spesialistkompetanse for refusjon etter denne refusjonskoden. Pasientene betaler ikke egenandel for legemiddel som blir dekket på blå resept under § 2 -90.
Legemidler i følgende legemiddelgrupper har forhåndsgodkjent refusjon etter § 2 -90:
- Paracetamol
- NSAIDs
- Opioider
- Kortikosteroider
- Antidepressiva mot smerter
- Antiepileptika mot smerter
- Muskelrelakserende midler
- Apotekframstilte, vanedannende legemidler
- Innhold i smertekassetter
- Hostestillende og slimløsende midler
- Søvnfremkallende og roende midler
- Kortikosteroider
- Kvalmestillende midler
- Avførende og stoppende midler
- Antiinfektiva
- Protonpumpehemmere, saltsyresekresjonshemmende midler
- Oktreotid
- Lavmolekylært heparin
I tillegg blir noen legemidler, utenom gruppene over, dekket, bl.a. glykopyrron, butylskopolamin, ketamin og noen antihistaminer.
Bemerk at ikke alle preparater i gruppene over går automatisk på blå resept!
Hvilke preparater som har refusjon, kan sjekkes ut i Legemiddelverkets legemiddelsøk og i Felleskatalogens nettversjon ved å trykke «T» i preparatteksten.
Det gjelder dessuten egne refusjonsregler for apotekframstilte legemidler og legemidler som brukes i smertekasetter. Direktoratet for medisinske produkter gir oversikt over virkestoffer med forhåndsgodkjent refusjon og informasjon om refusjonsvilkår (PDF).
Stønad etter individuell søknad (blåreseptforskriften § 3)
For legemidler som ikke har forhåndsgodkjent refusjon, kan legen søke Helfo om individuell stønad på vegne av pasienten (helfo.no). Utfyllt søknad gir rett til takst H1.
Det ble gjort omfattende endringer i regelverket for søknad om stønad ved årsskiftet 2017–2018. Søknadene skal vurderes utfra tilstandens alvorlighet, nytte av behandlingen og ressursbruk. Det er legen som må dokumentere dette, i de fleste tilfeller må søknaden komme fra spesialist.
Utfyllende informasjon om stønad etter individuell søknad finnes i rundskrivet til blåreseptforskriften. Pasienten betaler ikke egenandel dersom vedtaket blir gjort på refusjonskode -90 eller andre koder som fritar for betaling av egenandel.
Næringsmidler
Sykdom som hindrer tilførsel av vanlig mat eller opptak av viktige næringsstoff, gir grunnlag for stønad til næringsmidler på blå resept (Forskrift om stønad til dekning av utgifter til viktige legemidler mv. (blåreseptforskriften)). Pasienter med kreft/immunsvikt eller annen sykdom som medfører at næringsmidler er nødvendig, får dette dekket på blåresept.
Både blå resept og søknadsskjema til HELFO må fylles ut av lege på skjema HELFO 05.14.10 (pdf).Utfylt søknad gir rett til takst H1.
Det er, i utgangspunktet, kun næringsmidler på Helfos produkt- og prisliste som blir refundert. Pasienten betaler vanlig egenandel inntil frikort er oppnådd. Parenteral ernæring er klassifisert som legemiddel, søknadsskjema for legemidler må brukes for å få dette dekket på blå resept. Mer informasjon om næringsmidler på blåresept finner du på helfo.no..
Forbruksmateriell til bruk ved sondeernæring og parenteral ernæring dekkes av det regionale helseforetaket. Se www.behandlingshjelpemidler.no.
Medisinsk forbruksmateriell
Medisinsk forbruksmateriell dekkes over blåreseptordningen (Forskrift om stønad til dekning av utgifter til viktige legemidler mv. (blåreseptforskriften)) § 5, med til sammen 14 punkt, de mest sentrale punktene er:
§ 5 pkt. 1: Bleier og annet utstyr ved inkontinens
§ 5 pkt. 2: Kateter og anna utstyr ved urinretensjon
§ 5 pkt. 5: Stomiutstyr til stomiar frå urinvegar og tarm
§ 5 pkt. 14: Måle- og administrasjonsutstyr
-
- Målebeger og sprøyter som blir brukt til medisinering gjennom munnen
- Sprøyter og kanyler som blir brukt til å sette legemiddel subkutant eller intramuskulært
- Utstyr til ernæring og til sc-/iv/epidural-behandling (butterfly, subkutan infusjonskanyle) dekkes ikke, se Behandlingshjelpemidler under.
Det er bare forbruksmateriell som er oppført i Helfos produkt- og prislister (tabell 3.1, Støtte til reiseutgifter og andre ordninger) som dekkes på blå resept, pasienten betaler vanlig egenandel inntil frikort er oppnådd.
Behandlingshjelpemidler
Sist faglig oppdatert: 14.10.2019
Behandlingshjelpemidler er medisinsk utstyr og forbruksmateriell som benyttes utenfor sykehus. Helseforetakene har ansvar for å låne ut behandlingshjelpemidler med tilhørende forbruksmateriell.
Smertepumper
Smertepumper er behandlingshjelpemidler og helseforetakenes ansvar, også om pasienten får hjemmesykepleie. Oppstart av smertepumpe er ofte et nøkkelpunkt for å få til terminal pleie i hjemmet, og derfor en hastesak. Det kreves underskrift av sykehuslege ved søknad om behandlingshjelpemidler. Mer informasjon og nasjonalt søknadsskjema finnes på www.behandlingshjelpemidler.no og kan fås fra den lokale enheten for behandlingshjelpemidler.
Helseforetak og kommuner bør sammen utarbeide klare rutiner for utlån og vedlikehold av smertepumper, slik at disse kan skaffes til veie for hjemmeboende pasienter på kort varsel, også utenom vanlig arbeidstid.
Pasientene betaler ikke egenandel for behandlingshjelpemidler, for fullstendig oversikt over helseforetakenes ansvar, se www.behandlingshjelpemidler.no (tabell 3.1, Støtte til reiseutgifter og andre ordninger).
Bidragsordning for materiell til behandling av kroniske og alvorlige sår og fistler
Det kan ytes bidrag til nødvendige utgifter til bandasjemateriell og medisinsk forbruksmateriell, samt reseptfrie legemiddel, til behandling av kroniske og alvorlige sår og fistler, som f.eks. kreftsår og liggesår. Behov for materiellet må vare mer enn tre måneder i løpet av et kalenderår (Lov om folketrygd (folketrygdloven)).
Lege må fylle ut og pasienten må sende inn skjemaet: Legeerklæring ved søknad om bidrag til bandasjemateriell og medisinsk forbruksmateriell (skjema Helfo 05-22.07). Pasienten må sende originale kvitteringer fra apotek og bandasjist til Helfo for å få refusjon. Etter bidragsordningen kan 90 % av utgiftene som er over egenandelen per kalenderår refunderes. Sats for egenandeler er kr. 1891,– i 2019. Helfo må ha mottatt søknaden senest innen 30. juni året etter at pasienten har hatt utgiftene.
Dersom sårene stelles av hjemmesykepleien, er det kommunen som skal dekke utgiftene til materiell. Dersom pasienten er innlagt i institusjon skal institusjonen dekke utgiftene. Rundskriv til § 5‑22 – Bidrag til spesielle formål (bidragsordningen).
Støtte til reiseutgifter og andre ordninger
Sist faglig oppdatert: 14.10.2019
Pasientreiser
Mange pasienter trenger transport til lege, fysioterapeut og sykehus. Som hovedregel gis det dekning for billigste reisemåte med rutegående transport til nærmeste sted der helsetjenesten kan gis. Hvis pasienten har behov for annen transport, f.eks. egen bil eller drosje, må pasienten få en rekvisisjon som bekrefter at helsetilstanden gjør det nødvendig med transport som tilsier økte kostnader (Forskrift om pasienters, ledsageres og pårørendes rett til dekning av utgifter ved reise til helsetjenester (pasientreiseforskriften)).
Hvis pasienten benytter seg av retten til fritt sykehusvalg, kreves det en høyere egenandel for reise mellom hjemstedet og behandlingsstedet. Transportkostnaden ved fritt sykehusvalg går ikke inn under egenandelskort 1.
Reiser for pårørende
Nære pårørendes nødvendige utgifter ved reise til en pasient som har livstruende sykdom, har omsorg for barn under 14 år og ikke makter å reise hjem. Det er forutsatt at behandlingen varer minst to uker og at det foreligger uttalelse fra behandlende lege. Reisen dekkes etter samme regler som for pasientreiser. Dekningen er begrenset til én reise per uke (Forskrift om pasienters, ledsageres og pårørendes rett til dekning av utgifter ved reise til helsetjenester (pasientreiseforskriften)).
Reiseutgifter ved permisjon
Ved livstruende sykdom har pasienten rett til å få dekket reiseutgifter ved permisjon fra sykehusoppholdet. Det må foreligge en bekreftelse fra behandlende lege på at pasienten lider av livstruende sykdom (Forskrift om pasienters, ledsageres og pårørendes rett til dekning av utgifter ved reise til helsetjenester (pasientreiseforskriften)).
Grunnstønad
Formålet med grunnstønad er å kompensere for visse ekstra utgifter pga sykdom. Sykdommen må være varig eller ha en varighet på minst 2–3 år. Utgiftene som søkes dekket, må falle inn under følgende områder:
- Transport, herunder drift av pasientens bil (aldersgrense for pasient 70 år)
- Teksttelefon og i særlige tilfeller telefon (økonomiske vilkår)
- Drift av tekniske hjelpemidler
- Slitasje på klær og sengetøy
- Bruk av protese og lignende
- Fordyret kosthold (streng vurdering av dietter, kun i forbindelse med cøliaki o.l.)
- Førerhund
Ekstrautgiftene må minst tilsvare sats 1 for grunnstønad og må dokumenteres eller sannsynliggjøres.
Satser for grunnstønad per måned (2019):
sats 1: kr 686, sats 2: kr 1047, sats 3: kr 1372, sats 4: kr 2021, sats 5: kr 2739, sats 6: kr 3421
Kommunale og fylkeskommunale ordninger
Kommunen og Fylkeskommunen har ansvar for å tilby tjenester og velferdsordninger som skal tilrettelegge for at innbyggerne kan leve et mest mulig selvstendig liv på tross av sykdom og funksjonsnedsettelse. Tjenester brukerstyrt personlig assistent (BPA), omsorgsstønad, TT-kort og parkeringsordning for funksjonshemmede er eksempler på dette.
NAV – sosiale tjenester: NAV-sosiale tjenester gir råd, veiledning og behovsprøvd økonomisk bistand for personer som på grunn av økonomiske forhold ikke har mulighet til å betale f.eks. egenandeler for helsetjenester.
Utgifter som ikke dekkes av andre ordninger
Legater: En kan søke om økonomisk støtte gjennom ulike legater. Pasienter som har en kreftdiagnose kan søke om økonomisk støtte fra Kreftforeningen. Søknadsskjema kan sendes elektronisk eller skrives ut fra Kreftforeningen sin nettside (Se tabell under).
Tabell 3.1
Arbeids- og velferdsforvaltningen (NAV) | |
Helseøkonomiforvaltning for helseaktører | |
| Direktoratet for medisinske produkter | |
Medisinsk forbruksmateriell | |
Norges lover | |
Regional kompetansetjeneste for lindrende behandling/legemiddelinformasjon | |
Legemiddelsøk | |
Helseinformasjon for privatpersoner | |
Kreftforeningen | |
Felleskatalogens nettversjon |
Symptomer og tilstander
Innledning
Sist faglig oppdatert: 14.10.2019
Bakgrunn
En rekke symptomer og tilstander opptrer med varierende hyppighet hos pasienter med langtkommen sykdom. Dette handlingsprogrammets intensjon er å systematisere og standardisere symptomlindring i nasjonal sammenheng.
De hyppigst forekommende symptomene og tilstandene hos den aktuelle pasientgruppen er omtalt.2
2 I den reviderte utgaven fra 2019 er retningslinjer for malign medullakompresjon og palliativ strålebehandling lagt til. I det videre arbeidet vil retningslinjene for flere av symptomene/tilstandene bli revidert, og nye vil bli utarbeidet.
Generelle prinsipper for symptomlindring
Følgende prinsipper for effektiv symptomlindring er sentrale:
- Still en diagnose av den bakenforliggende mekanisme eller årsak til symptomet
- Angrip årsaken så sant det er mulig
- Kartlegg systematisk
- Individualiser behandlingen
- Gjør behandlingen så enkel som mulig
- Gjør en fortløpende evaluering av effekt og bivirkninger
Effektiv symptomlindring forutsetter også trygghet og god ivaretakelse av pasienten og hans/hennes behov. Nære pårørende må også ivaretas. Et godt terapeutisk miljø vil få pasienten til å føle seg trygg og slappe av, slik at man når lenger med de behandlingsmessige tiltak. Fortløpende saklig, men skånsom informasjon om sykdomsutvikling og behandling er et viktig middel til å beholde en god og åpen kommunikasjon mellom pasient/pårørende og behandlingsteamet.
Alle tiltak bør fortløpende vurderes ut fra intensjon og effekt, der virkning og bivirkninger veies opp mot hverandre. Pasientens og de pårørendes ønsker må hele tiden tas med i vurderingen, og best mulig livskvalitet må være hovedmålet.
Et sammensatt sykdomsbilde
Pasienter med uhelbredelig, progressiv sykdom kjennetegnes av et sammensatt symptombilde som varierer over tid og ofte endres raskt. Symptomene skyldes ofte både den aktuelle sykdommen, andre kroniske sykdommer og gjennomgått behandling. I tillegg kan sykdomsbildet kompliseres av infeksjoner og svikt i vitale funksjoner. Pasientene har som regel behov for en rekke ulike medikamenter, som i seg selv kan gi nye, behandlingstrengende bivirkninger og i tillegg risiko for utilsiktede medikamentinteraksjoner og -intoleranse. Vekttap, endret metabolisme og sviktende organfunksjoner kan gi bivirkninger av medikamenter, også av preparater som pasienten tidligere har tolerert. Mange får behandling med kortikosteroider, som kan svekke immunforsvaret og maskere infeksjoner og andre komplikasjoner.
For å begrense den medikamentelle behandlingen, bør det stilles spørsmål ved verdien av ulike typer forebyggende og livslang behandling. Unødvendige medikamenter bør seponeres. Dette gjelder særlig behandling/profylakse av hjerte/kar-sykdommer. Antihypertensiva og statiner vil f.eks. ofte kunne reduseres og seponeres når kreftsykdommen skrider frem.
Smerte
Sist faglig oppdatert: 14.10.2019
Definisjon
Smerte er en ubehagelig sensorisk og emosjonell opplevelse som følge av faktisk eller potensiell vevsødeleggelse. Smerte er alltid subjektiv (R. Bell, 2009).
Smerte er et sammensatt fenomen, som influeres av fysiske, psykiske, sosiale, kulturelle og åndelige/eksistensielle forhold. Begrepet «total pain» brukes ofte i palliasjon for å beskrive denne kompleksiteten (Richmond, 2005).
Etiologi og forekomst
Smerte er et subjektivt og plagsomt symptom. Omkring 50 % av kreftpasientene generelt, og omkring 70 % av kreftpasientene med langtkommen sykdom, opplever smerte (Goudas, Bloch, Gialeli-Goudas, Lau, & Carr, 2005; van den Beuken-van Everdingen et al., 2016).
Smerte hos kreftpasienter kan være:
- Tumorrelatert (ca. 70 % av all kreftsmerte). Tumorbiologi er viktig for smertens patofysiologi. Ulike krefttyper har ulike metastasemønstre og derav ulike smertebilder. Endring i smertemønster hos den enkelte pasient skyldes tumorprogresjon inntil det motsatte er bevist.
- Behandlingsrelatert (ca. 20 % av kreftsmerte). Tumorrettet behandling som kirurgi, strålebehandling og kjemoterapi kan forårsake smerter, både akutt og på lang sikt.
- Relatert til generell svekkelse som følge av alvorlig sykdom (f.eks. liggesår, obstipasjon, mucositt, herpes zoster, muskelatrofi) og til andre sykdommer enn kreftsykdommen (f.eks. iskemisk hjertesykdom, artrose og andre degenerative sykdommer).
Fortsatt er det mange kreftpasienter som ikke får optimal smertebehandling, særlig pasienter med metastatisk sykdom og kort forventet levetid (Deandrea, Montanari, Moja, & Apolone, 2008; Holtan et al., 2007). Det er påvist mange årsaker til dette, blant annet følgende (Caraceni et al., 2012; Holtan et al., 2007; S. Kaasa et al., 2011):
- Kartlegging og klassifikasjon av symptomer generelt – og smerte spesielt – er ofte mangelfull i klinisk praksis.
- Velfunderte behandlingsprinsipper blir ofte ikke anvendt i klinisk praksis. Eksempler er Verdens Helseorganisasjons smertetrapp, europeiske, evidensbaserte retningslinjer for medikamentell smertebehandling (Caraceni et al., 2012) og dette handlingsprogrammet.
- Analgetika og onkologiske behandlingsmodaliteter blir ikke kombinert på en optimal måte, slik som for eksempel kombinasjon av opioider, ko-analgetika og smertelindrende strålebehandling.
- Pasientene blir ikke fulgt godt nok opp etter at smertebehandlingen er igangsatt.
Klassifisering av smerten danner grunnlag for behandlingsbeslutninger og prognostiske vurderinger. For å stille en så presis smertediagnose som mulig, må man ta hensyn til alle aspekter av smerteopplevelsen. Gjennom systematiske studier har man identifisert de viktigste faktorer som best beskriver pasientens smerte og som er avgjørende for behandlingsvalget: smerteintensitet, smertelokalisasjon, forekomst av gjennombruddssmerte, nevropatisk smerte og psykisk stress/depresjon (Knudsen et al., 2012; S. Kaasa et al., 2011). Hver av disse faktorene må videre kartlegges ved bruk av standardiserte verktøy og/eller gjennom et strukturert intervju. Der en slik kartlegging avdekker et komplekst smertebilde, kan det indikere at det kan være vanskelig å oppnå smertelindring, og at pasienten vil trenge en bred tilnærming.
Utredning
Systematisk, standardisert og nøyaktig kartlegging er en forutsetning for å stille en korrekt smertediagnose, og grunnlaget for god smertebehandling. Kartleggingen inkluderer anamnese, klinisk undersøkelse, bruk av standardiserte kartleggingsverktøy, billeddiagnostikk og andre supplerende undersøkelser. Andre årsaker til smerten enn pasientens kreftsykdom må også vurderes. Gjentatt kartlegging for å evaluere behandlingseffekt er avgjørende. Pasientens egenvurdering er å foretrekke. Anbefalte kartleggingsverktøy (skjema) er beskrevet i et eget avsnitt i dette kapitlet.
Anamnese
Forhold som har betydning for å velge optimal behandling for den aktuelle tilstanden, vektlegges:
- Tumortype og -utbredelse
- Tidligere og ev. pågående tumorrettet behandling, behandlingsrespons
- Tidsaspekt (varighet av sykdom, sykdomsprognose, varighet av symptomer, inkludert smerte)
- Komorbiditet
- Smerteintensitet
- Smertemønster (hvilesmerte, utløsende/lindrende faktorer, døgnvariasjon)
- Gjennombruddssmerte
- Smertekvalitet, inkludert nevropatisk smerte
- Lokalisasjon(er) av smerte
- Ledsagende symptomer (bl.a. pareser, sensibilitetsutfall, problemer med vannlating og/eller avføring)
- Pasientens generelle situasjon:
- Forekomst av andre subjektive symptomer, særlig depresjon og/eller angst (bruk ESAS)
- Søvn
- Psykososiale og eksistensielle aspekter
- Fysisk og kognitiv funksjon
- Tidligere og aktuell smertebehandling, inkl. respons på behandlingen
- Tidligere og nåværende misbruk av alkohol og/eller andre rusmidler
Faktorer av spesiell betydning for kartlegging og behandling av smerte
Bruk av standardiserte kartleggingsverktøy bidrar til å sikre et mest mulig komplett bilde av pasientens smerte. Det er imidlertid flere utfordringer med å bruke slike verktøy i klinisk praksis. De fleste verktøy er utviklet til bruk i kliniske studier og er ganske tidkrevende og til dels vanskelig å benytte for svekkede pasienter. Mange verktøy er dessuten utviklet til bruk i andre pasientpopulasjoner, og vil bare ha delvis relevans for palliative kreftpasienter.
Det arbeides både nasjonalt og internasjonalt med å forenkle og tilpasse relevant kartleggingsverktøy til bruk hos den palliative pasientpopulasjonen (S. Kaasa et al., 2011), og målet er at dette kan implementeres i pasientens elektroniske journal. Inntil dette er på plass, må man bruke eksisterende verktøy. Mange av disse har kortversjoner som er enklere i bruk i klinisk praksis.
Følgende aspekter ved smerten må spesielt kartlegges:
Smerteintensitet
Spørsmålet «Hvor sterk har smerten vært i gjennomsnitt siste 24 timer og/eller siste uke?», med standardiserte svar på en 11-punkts numerisk smerteskala (NRS-11) med ankerordene «ingen smerte» og «verst tenkelig smerte», anbefales brukt (S. Kaasa et al., 2011).
Lokalisasjon
Kroppskart hvor pasienten selv markerer hvor smerten er lokalisert, bør brukes.
Gjennombruddssmerte
En vanlig brukt definisjon er: «Forbigående økning av smerte som oppstår på bakgrunn av en ellers stabil smerte som er adekvat behandlet med langtidsvirkende opioider», men det finnes mange definisjoner (Haugen, Hjermstad, Hagen, Caraceni, & Kaasa, 2010). Arbeid pågår for å oppnå enighet om begrepsbruk og relevant kartlegging til bruk i klinisk praksis og forskning.
Basisutredning av gjennombruddssmerte:
Følgende spørsmål er grunnleggende for å avdekke mulig forekomst av gjennombruddssmerte: Har pasienten kortvarige forverringer av smerte, enten en forverring av en vanlig, konstant smerte eller en smerte som er forskjellig fra den konstante smerten? (Hagen et al., 2008).
Dersom pasienten ut fra dette spørsmålet har gjennombruddssmerte, anbefales utvidet kartlegging av følgende faktorer:
- Er konstant smerte adekvat behandlet? (definert som ≤ 3 på NRS 11 > 12 timer per dag siste uke)
- Intensitet av gjennombruddssmerten (NRS-11)
- Lokalisasjon av gjennombruddssmerten (kroppskart)
- Utløsende og lindrende faktorer for gjennombruddssmerten (inkl. effekt av analgetika)
- Hvor ofte har pasienten gjennombruddssmerte i løpet av et døgn?
- Hvor lang tid varer et anfall av gjennombruddssmerte?
Kartleggingen kan også suppleres med pasientens selvrapportering av symptomer. Det finnes flere spørreskjema for selvrapportering av gjennombruddssmerte (Haugen et al., 2010), men disse er per i dag for omfattende til bruk i daglig klinisk arbeid.
Nevropatisk smerte
International Association for the Study of Pain (IASP) definerer nevropatisk smerte som «smerte som oppstår som en direkte konsekvens av en lesjon eller sykdom som påvirker det somatosensoriske systemet» (Treede et al., 2008).
IASP Neuropathic Pain Special Interest Group anbefaler bruk av fire kriterier for å kartlegge forekomst av nevropatisk smerte (Treede et al., 2008). Disse er utviklet for ikke-malign smerte og er her tilpasset for bruk hos kreftpasienter. Kriteriene anbefales brukt inntil oppdaterte retningslinjer foreligger for kreftrelatert smerte.
- Smerten har en nevroanatomisk plausibel utbredelse
- Anamnestisk sannsynlig affeksjon av perifert eller sentralt nervevev
- Klinisk undersøkelse (sensorisk testing) påviser distinkt nevroanatomisk utbredelse av smerten (for eksempel allodyni)
- Supplerende undersøkelse bekrefter tumorvev som kan forklare nevropatisk smerte (for eksempel MR)
Mulig nevropatisk smerte: Kriterium 1 og 2 er oppfylt.
Sannsynlig nevropatisk smerte: Kriterium 3 eller 4 er oppfylt,
Definitivt nevropatisk smerte: Alle fire kriterier er oppfylt.
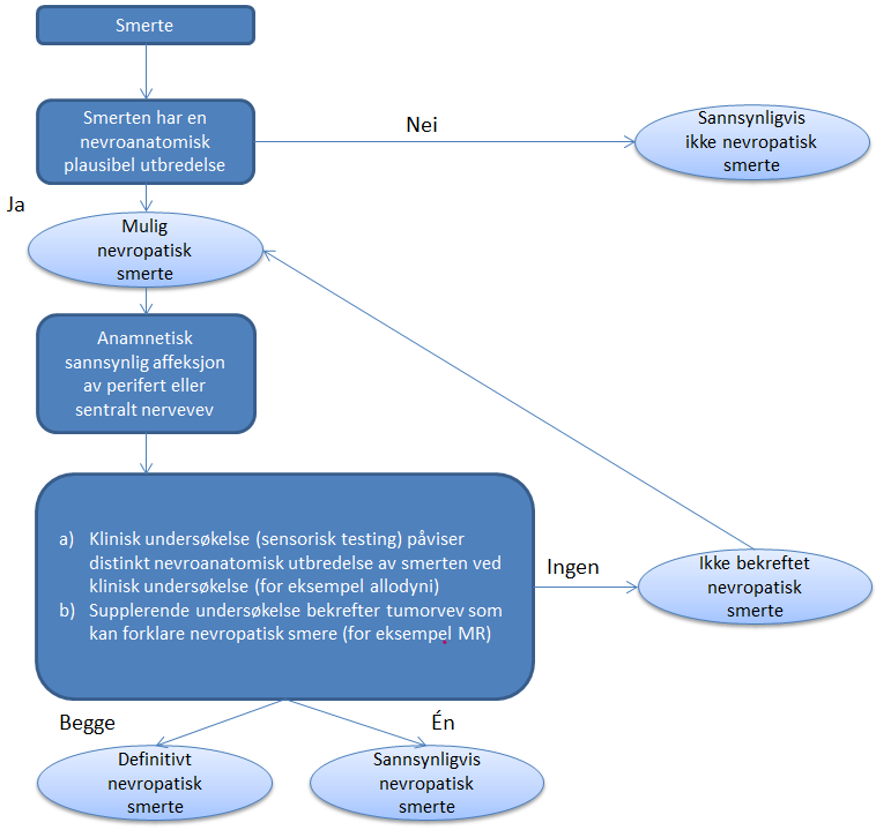
Klinisk undersøkelse er avgjørende for å klassifisere smerte som nevropatisk (Haanpaa et al., 2011). Sensorisk testing er viktigst i denne sammenheng, og inkluderer undersøkelse av følsomhet for berøring, vibrasjon, stikk («pinprick») og kulde/varme. I spesielle tilfeller kan det være aktuelt å bruke elektronevromyografi.
Selvrapportering av smerte med mulig nevropatisk komponent er også en mulig kartleggingsmåte. Det finnes en rekke spørreskjema for dette. For tiden pågår det arbeid for å oppnå internasjonal enighet om hvilket kartleggingsverktøy som skal anbefales for klinisk praksis.
Depresjon og psykiske symptomer
Kreftpasienter som har smerte opplever relativt ofte psykisk stress, men spørsmålet om kausalitet er fremdeles uavklart (Laird, Boyd, Colvin, & Fallon, 2009). Når kreftsmerte skal behandles, er det viktig å kartlegge om pasienten har symptomer relatert til depresjon og/eller angst. Numerisk skala fra 0 til 10 (NRS-11) er anbefalt som kartleggingsverktøy.
Utvidet kartlegging av psykiske symptomer
Ved mistanke om depresjon anbefales strukturert klinisk intervju samt bruk av et relevant spørreskjema, for eksempel: Patient Health Questionnaire (PHQ) eller Hospital Anxiety and Depression Scale (HADS) (Andersen et al., 2014).
Klinisk undersøkelse
Grundig generell klinisk undersøkelse, inkludert nevrologisk undersøkelse, anbefales. Kartlegg spesielt sensibilitetsforstyrrelser med tanke på nevropatisk smerte (se over).
Supplerende undersøkelser
Valg av supplerende undersøkelser baseres på anamnese, symptomer og funn ved klinisk undersøkelse:
- Blodprøver med infeksjonsstatus, serum-Ca (ev. ionisert Ca) og ALP
- Radiologisk diagnostikk (f.eks. skjelettrøntgen, CT thorax/abdomen, MR caput/total-columna, UL pleura/pericard/galleveier/urinveier)
- Nukleærmedisinsk diagnostikk eller nevrofysiologisk undersøkelse vurderes i særskilte tilfeller
Gjentakelse av undersøkelser må alltid vurderes når smertemønsteret endrer seg.
Forebygging
Smerte forebygges ved adekvat medisinering i form av kontinuerlig tilførsel av analgetika som holder grunnsmerten i sjakk, og adekvat opplegg for gjennombruddssmerter. Vurder alltid muligheten for årsaksrettet behandling.
Behandling
Generelle behandlingsprinsipper
- Helhetlig vurdering av pasientens smerteproblem.
- Medikamentell behandling relateres til smerteintensitet, smerteklassifikasjon og pasientens allmenntilstand.
- WHOs smertetrapp er det grunnleggende prinsippet for behandling av kreftsmerter.
- Hovedprinsippet er faste doser peroralt samt behovsmedisinering for gjennombruddssmerter.
- Pasienter som får opioider skal ha laksantia profylaktisk.
- Ved nyoppståtte smerter bør effektiv lindring kunne oppnås innen tre døgn. Dette forutsetter kontinuerlig oppfølging og dosejustering.
- Ved manglende effekt tross adekvat behandlingsopplegg, skal høyere kompetansenivå konsulteres.
- Tilstreb et behandlingsopplegg som praktisk lar seg gjennomføre med hensyn til levering og administrering. Dette angår forhold som tilberedning, blandbarhet og holdbarhet av medikamenter/løsninger, og ressurser i f.eks. hjemmesykepleien. Standardmedikamenter bør i hovedsak brukes.
- Skriftlig behandlingsplan – og skriftlig informasjon til pasienten – bør foreligge.
Behandlingsstrategi
- Årsaksrettet behandling (kirurgi, hormonbehandling, kjemoterapi, målrettet medikamentell behandling og/eller strålebehandling) skal alltid vurderes.
- Prinsippene skissert i WHOs smertetrapp følges (se nedenfor).
- Tilleggsbehandling med andre smertelindrende medikamenter må alltid vurderes ved utilfredsstillende effekt eller ved mistanke om nevropatisk smerte.
- Invasiv smertebehandling (blokader, spinal/epidural applikasjon og nevrolyse) vurderes ved utilstrekkelig lindring.
- Nevrolytisk blokade (cøliakus-blokade) bør vurderes tidlig i forløpet ved pankreaskreft (Arcidiacono, Calori, Carrara, McNicol, & Testoni, 2011).
Medikamentell behandling
Ikke-opioide analgetika (WHO trinn I analgetika)
- Paracetamol har en gunstig bivirkningsprofil, påvirker ikke mageslimhinnen, og har dokumentert effekt mot moderate, akutte smerter (Nabal et al., 2012). Ved svelgproblemer må nytte av effekt vurderes på grunn av tablettstørrelse og doseringsintervall.
- Paracetamol kan kombineres med NSAIDs, og har vist additiv virkning ved akutte smerter. Tilsvarende dokumentasjon finnes ikke for kreftrelaterte smerter.
- NSAIDs demper effektivt smerte ved inflammasjon relatert til tumor og skjelettaffeksjon (Nabal et al., 2012).
- Det er ikke påvist sikker forskjell i effekt mellom ulike NSAIDs (Nabal et al., 2012).
- Alvorlige bivirkninger er hyppige ved NSAIDS, og smertelindrende effekt må alltid veies opp mot bivirkninger.
Opioider
Følgende anbefalinger og evidensnivå er basert på European Association for Palliative Care (EAPC) sine evidensbaserte retningslinjer for behandling av kreftsmerter med opioider, publisert i februar 2012 (Caraceni et al., 2012). Evidensnivå er angitt som S (strong) = sterk anbefaling, og W (weak) = svak anbefaling, ad modum GRADE. Se for øvrig metodekapitlet for nærmere omtale av litteratursøk og evidensnivå. Anbefalingene er tilpasset de medikamenter som for tiden er tilgjengelig på det norske markedet. Nyere dokumentasjon er lagt til der det er relevant.
WHO trinn II: Opioider ved svak til moderat smerte
Hos pasienter med relativt stabil, svak til moderat smerte som ikke er tilfredsstillende smertelindret med paracetamol eller NSAIDs gitt regelmessig per os, vil tillegg av kodein per os kunne gi god smertelindring uten betydelige bivirkninger.
Alternativt kan lave doser trinn III opioider (morfin < 30 mg/d eller oksykodon < 20 mg/d) brukes i stedet for kodein (W).
Tabell 4.1
Opioider ved moderat smerte hos opioid-naive pasienter
| Kodein | Trinn II opioid, kan brukes alene eller i kombinasjon med paracetamol, maxdose ≤ 360 mg/døgn |
|---|---|
| Morfin | Trinn II opioid i lav dose, ≤ 30 mg/døgn |
| Oksykodon | Trinn II opioid i lav dose, ≤ 20 mg/døgn, |
| Hydromorfon | Trinn II opioid i lav dose, ≤ 4 mg/døgn |
WHO trinn III: Opioider ved sterke smerter
Det finnes ingen vitenskapelig evidens for forskjeller mellom morfin, oksykodon og hydromorfon gitt peroralt, verken i effekt eller bivirkningsprofil (W).
Morfin er det medikamentet vi har mest erfaring med. Det anbefales som førstevalg ut fra lang klinisk erfaring og fra et økonomisk synspunkt (Caraceni, Pigni, & Brunelli, 2011). Morfin har et bredt spekter av tilberedningsformer og konsentrasjoner, tilgjengelig både for peroral bruk i form av tabletter (korttidsvirkende og depottabletter), mikstur og depotgranulat til mikstur, som stikkpiller og til injeksjon (im /iv /sc og spinalt). Morfin tolereres godt av de aller fleste. Det gir ikke organskader, selv ved lang tids bruk. Ved peroralt inntak er den biologiske tilgjengeligheten omtrent 1/3 av inntatt mengde, men kan variere inter-individuelt fra 15 til 50 %. Morfin har flere metabolitter, med både analgetiske og ikke analgetiske virkninger, som man må ta hensyn til ved vedvarende høy dosering. Nyresvikt reduserer utskillelsen av morfinmetabolitter (King, Forbes, Hanks, Ferro, & Chambers, 2011).
Følgende alternative opioider er alminnelig tilgjengelig:
Oksykodon finnes i tablettform både som korttidsvirkende og depottabletter, samt til injeksjon. Stoffet er ekvipotent med morfin gitt parenteralt, men på grunn av bedre biologisk tilgjengelighet vil 10 mg oksykodon gitt peroralt tilsvare ca. 15 mg peroralt morfin. Ingen analgetisk aktive metabolitter. Samme bivirkningsprofil som morfin.
Hydromorfon er fem til syv ganger så potent som morfin og finnes både som korttidsvirkende kapsler og langtidsvirkende depotkapsler, samt som injeksjonspreparat med ulike konsentrasjoner opp til 50 mg/ml. Dette muliggjør høykonsentrert opioidinfusjon der morfin blir upraktisk på grunn av mengde medikament som må administreres. Metabolittene er ikke analgetisk aktive. Bivirkninger er som ved andre sterke opioider.
Fentanyl er ca. 100 ganger mer potent enn morfin, og har ingen aktive metabolitter. På grunn av høy fettløselighet kan fentanyl passere intakt hud og slimhinne. Fentanylplaster har ca. tre døgns virketid. Bruk av fentanylplaster forutsetter at smerten er stabil. Fentanyl administrert enten som nesespray, sublingvaltabletter eller buccal film har vesentlig raskere innsettende effekt enn peroral morfin, og bør vurderes brukt ved gjennombruddssmerte (Hansen, Mathiesen, Trautner, & Dahl, 2012; Jandhyala, Fullarton, & Bennett, 2013). Den hurtig innsettende effekten av fentanylpreparatene kan hos enkelte pasienter medføre blant annet svimmelhet og kvalme, og dermed begrense nytteverdien. Fentanyl benyttes også i medikamentblandinger til epidurale/intratekale infusjoner sammen med et lokalanestetikum.
Buprenorfin har høy affinitet til opioidreceptorer (spesielt μ-type), men er definert som en partiell agonist, det vil si at buprenorfin ikke gir full opioideffekt selv ved maksimal reseptorbinding, og det er derfor et «tak» for den analgetiske virkningen. I praksis er dette ikke et problem, og i EAPCs retningslinjer er buprenorfin likestilt med de andre trinn 3 opioidene (Deandrea, Corli, Moschetti, & Apolone, 2009). Buprenorfin har meget lav biotilgjengelighet (< 20 %) og markedsføres som langtidsvirkende smerteplaster, sublingvale tabletter og injeksjon. Buprenorfin har ingen aktive metabolitter og kan brukes både ved lever- og nyresvikt. Den markedsførte plasterstyrken i Norge er imidlertid svært lav, og derfor lite anvendelig ved kreftrelaterte smerter.
Metadon omtales i et eget punkt i EAPC-retningslinjene. Metadon benyttes lite som første valg, men er det best dokumenterte medikament ved opioidskifte. Metadon har også virkning som NMDA-reseptorantagonist og er derfor velegnet ved nevropatisk smerte. Som enkeltdose parenteralt er medikamentet ekvipotent med morfin, men vesentlig større biologisk tilgjengelighet gjør 10 mg metadon peroralt ekvipotent med 20–30 mg morfin peroralt. Ekvipotensforholdet er avhengig av dosestørrelse og endres ved repeterte doser. Biotilgjengelighet er høyere enn morfin, parenteral ekvipotensdose i forhold til peroral: 1:2. På grunn av sammensatt farmakokinetikk med lang halveringstid og stort distribusjonsvolum, er metadon velegnet til langtidsbehandling, men samtidig er det en fare for akkumulasjon og overdosering. Behandling med metadon er derfor en spesialistoppgave. Metadon har ingen aktive metabolitter og både nedbrytning og utskillelse er uavhengig av nyrefunksjon (Fredheim et al., 2006; Moksnes et al., 2011).
Ketobemidon ble mye brukt tidligere, men pga manglende dokumentasjon og sviktende tilgjengelighet er det ikke lenger anbefalt brukt i palliasjon.
Titrering av opioider
Den individuelle respons på opioider er svært varierende, og titrering til adekvat dosenivå er derfor avgjørende for tilfredsstillende smertelindring.
Både hurtigvirkende og depotpreparater per os (morfin, oksykodon og hydromorfon) kan benyttes ved dosetitrering (W). Hurtigvirkende preparat må uansett være tilgjengelig som ekstra behovsdoser ved utilstrekkelig smertelindring.
Opioidskifte og relativ potens
Pasienter som behandles med et trinn III opioid og som ikke oppnår tilfredsstillende smertelindring og/eller får plagsomme bivirkninger, kan profittere på skifte til et alternativt opioid (W).
Tabell 4.2
Ekvianalgetisk potens i forhold til peroral morfin (Caraceni et al., 2012)
| Medikament | Ekvianalgetisk potens | Evidensgrad |
|---|---|---|
| Morfin | 1 |
|
| Kodein (po) | 1/10 |
|
| Oksykodon (po) | 1,5 | S |
| Hydromorfon | 5 | W |
| TD Fentanyl | 100 | S |
Det er viktig å være oppmerksom på at ekvianalgetisk potens er forskjellig fra ekvianalgetisk dose.
Eksempel: 60 mg peroral morfin svarer til 25 mikrogram /t TD fentanyl (ekvivalent til 0,6 mg/døgn).
Metadon: Ekvianalgetisk potens i forhold til peroral morfin varierer, i tillegg gjør lang halveringstid omregning komplisert.
Tabellen gjelder for pasienter som er tilfredsstillende smertelindret av første opioid.
Ved opioidskifte på grunn av utilfredsstillende smertelindring og/eller plagsomme bivirkninger, anbefales lavere startdose enn utregnet fra tabell 4.2 (klinisk erfaring). Dosetitreringen må følges nøye ut fra klinisk respons.
Subcutan og intravenøs administrasjon av opioider
Subkutan administrasjon av morfin er første valg hvis pasienten ikke kan behandles med peroralt eller transdermalt opioid (S). Intravenøs administrasjon bør vurderes hvis subkutan administrasjon er kontraindisert (S) (perifere ødemer, koagulasjonssykdommer, dårlig perifer sirkulasjon, behov for store volum og doser).
Intravenøs administrasjon bør benyttes for opioidtitrering når rask smertekontroll kreves (S), med overgang til subkutan administrering så snart smertene er under kontroll.
Ved subkutan og intravenøs administrering kan pasientkontrollert analgesi (PCA) benyttes til pasienter som ønsker, og er i stand til, å benytte bolusdoser som behovsmedikasjon (W).
Ved endring fra oral til subkutan eller intravenøs administrering med morfin, er relativ analgetisk potens 1: 3 (W).
Subkutan injeksjon virker i løpet av ca 15 min., og ved overgang til peroral behovsmedisinering må pasientene informeres om at de ikke kan vente effekt før etter minst 30 min. I de aller fleste situasjoner er dette tilstrekkelig, men dersom hurtigere effekt behøves, kan fentanyl nesespray benyttes, enten alene eller i kombinasjon med et peroralt preparat (se nedenfor). Dette er en bedre løsning enn subkutane injeksjoner, i og med at pasienten kan beholde sin autonomi og styre ekstradosene selv uten å være avhengig av infusjonspumpe.
Oksykodon, hydromorfon og ketobemidon er velprøvde alternativer ved subkutan administrasjon.
Spinal administrasjon av opioider
Spinal (epidural eller intratecal) administrasjon av opioider i kombinasjon med lokalanestetika eller klonidin bør vurderes til pasienter som ikke er tilfredsstillende smertelindret, eller hvor bivirkningene er uakseptable til tross for optimal behandling med perorale og parenterale opioider og ikke-opioide analgetika (W).
Opioider ved gjennombruddssmerter
Gjennombruddssmerter kan behandles med hurtigvirkende, peroralt opioid eller med buccale eller intranasale fentanylpreparater. Sistnevnte preparater kan være å foretrekke på grunn av raskere effekt og kortere virketid, men begrenses av antall doseringer daglig (maks 4). Kombinasjonsløsninger kan være gode alternativer.
Hurtigvirkende opioider med kort halveringstid kan benyttes profylaktisk ved forutsigbare smerter, 20–30 min før smerteprovokasjon (W).
Bruk av opioider til pasienter med nyre- og/eller leversvikt
Opioider bør brukes med forsiktighet til pasienter med alvorlig nyresvikt (GFR<30 ml/min) (W).
EAPC retningslinjene anbefaler fentanyl eller buprenorfin som førstevalg (Caraceni et al., 2012; King et al., 2011). Alternativt kan morfin i reduserte doser eller redusert dosefrekvens benyttes i korttidsbehandling. Dette er spesielt aktuelt hos døende pasienter.
Det er begrenset dokumentasjon for at hydromorfon og oksykodon kan være et bedre valg enn morfin (Dean, 2004). Metadon har ingen aktive metabolitter og kan brukes uendret ved nyresvikt.
Ved opioidbehandling til pasienter med leversvikt foreligger det ikke tilstrekkelig kvalitet på data til å kunne gi en terapianbefaling. Som en generell forsiktighetsregel gjelder at pasienter med alvorlig nyre- og/eller leversvikt vil ha både økt og forlenget effekt av alle medikamenter med CNS-påvirkning.
Behandling av opioidrelatert kvalme
For oppdaterte anbefalinger om behandling av opioidrelatert kvalme, se kapittel om kvalme.
Behandling av opioidrelatert obstipasjon
For anbefalinger om behandling av opioidrelatert obstipasjon, se kapittel om obstipasjon. Generelt gjelder at alle pasienter som benytter opioider skal benytte laksantia.
Behandling av opioid-relaterte CNS symptomer
Dosereduksjon av opioider bør vurderes ved opioidrelaterte bivirkninger som delirium, hallusinasjoner, myoklonus og hyperalgesi (W). Dette er vanligvis tegn på overdosering.
Methylphenidat (Ritalin®) kan brukes for å redusere opioid-indusert sedasjon (W), men det terapeutiske vinduet er smalt. De norske forskrivningsreglene for methylphenidat er meget strenge, og denne behandlingen blir derfor sjelden brukt.
Bruk av paracetamol og NSAIDs i tillegg til trinn III opioider
NSAIDs og paracetamol kan bidra til bedre smertelindring eller redusert opioidbehov (W).
Begrenset bruk av NSAIDs anbefales på grunn av risiko for alvorlige bivirkninger, spesielt til gamle og til pasienter med nyresvikt, hjertesvikt og leversvikt. Paracetamol bør foretrekkes på grunn av bivirkningsprofil (W), men medikamentets effekt er ikke godt dokumentert.
Adjuvante medikamenter ved nevropatisk smerte
Amitriptylin eller gabapentin bør vurderes til pasienter med nevropatisk kreftsmerte som ikke er tilfredsstillende smertelindret med opioider (S). Pregabalin/gabapentin er et alternativ. Kombinasjon med opioider gir ofte mer CNS-bivirkninger, og nøye dosetitrering av begge medikamenttyper er nødvendig.
Ketamin er et anestetikum som utøver sin virkning via blokade av NMDA-reseptoren. I små doser på 1–1,5 mg/kg/d er ketamin uten anestetisk effekt, men har vært benyttet for å gi en analgetisk tilleggseffekt særlig ved nevropatiske smerter. Imidlertid har randomiserte studier vedrørende ketamin som adjuvans ved nevropatiske smerter så langt vært negative (R. F. Bell, Eccleston, & Kalso, 2017). Prekliniske studier kan tyde på at pasienter med sentral hyperalgesi kan være en pasientgruppe som hypotetisk kan profitere på bruk av ketamin, men ESMOs retningslinjer for smerte foreslår dette som et tema for videre klinisk forskning (Fallon et al., 2018).
Annen, adjuvant medikamentell behandling
- Ved utilstrekkelig generell smertelindring benyttes ofte tillegg av ett eller flere medikamenter med antatt analgetisk tilleggseffekt.
- Aktuelle medikamentgrupper er lokalanestetika, NMDA-reseptor-antagonister, og alfa2-agonister. Evidens for effekt av disse medikamentene varierer. Effekten begrenses dessuten ofte av plagsomme bivirkninger.
- Kortikosteroider har også vært mye benyttet, men en ny, randomisert studie viser ingen sikker smertelindrende effekt ved kreftsmerte (Paulsen et al., 2014). Preparatet kan ha effekt ved å redusere ødem.
- Benzodiazepiner er indisert ved angst, uro og søvnproblemer. Medikamenter med kort halveringstid bør velges, eks. oxazepam 10–25 mg inntil x 3–4/døgn (Loge, 2008; Salt, Mulvaney, & Preston, 2017). Som et parenteralt alternativ anbefales sc. midazolam 1–2 mg/dose inntil 20 mg/d. Dette er spesielt aktuelt hos døende (Mercadante et al., 2011).
Spesielle smerteutfordringer
- Visceral smerte: Cøliakus-blokade bør vurderes tidlig i forløpet hos pasienter med sterke smerter forårsaket av tumor i pankreas.
- Nevropatisk smerte: Erfaringsmessig er det verdt å forsøke antiepileptika og/eller antidepressiva, ev. kortikosteroider, ved nervekompresjon. Blokader kan være effektive.
- Skjelettsmerte: Strålebehandling bør alltid vurderes.
Annen behandling
Årsaksrettet behandling bør alltid vurderes, også ved avansert sykdom.
Strålebehandling, kirurgi, kjemoterapi, hormonterapi, målrettede legemidler og benresorpsjonshemmere, er aktuelle muligheter.
Palliativ strålebehandling
Strålebehandling lindrer effektivt smerter relatert til skjelettmetastaser. Forventet tid til effekt etter palliativ strålebehandling av skjelettmetastaser er 2–4 uker. I perioden etter strålebehandling er det ofte behov for nedtrapping av opioiddosen. Rebestråling kan gis dersom det skulle være behov for det. Strålebehandling kan også ha smertelindrende effekt ved bløtdelsmetastaser og ved hjernemetastaser. (Se kapittel Palliativ strålebehandling av skjelettmetastaser).
Kirurgi
Stabiliserende kirurgi ved patologiske fakturer, avlasting ved tarmobstruksjon og ulike typer stenting, er eksempler på prosedyrer som gir svært effektiv symptomlidning og som må vurderes, selv langt ut i sykdomsforløpet. Kirurgi bør også vurderes vedtverrsnittslesjoner. Kirurgisk behandling omtales i de respektive handlingsprogrammene for ulike krefttyper.
Systemisk tumorrettet behandling
Hormonbehandling, tradisjonelle cytostatika og målrettede medikamenter (medikamenter med biologisk angrepsvinkel) kan gi god symptomlindring. Spesialist i onkologi er en sentral samarbeidspartner for å vurdere indikasjon for slik behandling.
Benresorpsjonshemmere
Dokumentasjon om smertelindrende effekt av bisfosfonater er begrenset. Bisfosfonater reduserer antall skjelettrelaterte hendelser (SRE – patologiske frakturer, behov for ortopedisk kirurgi, behov for strålebehandling og forekomst av hyperkalsemi), og forlenger tid til slike hendelser hos pasienter med skjelettmetastaser fra en rekke ulike primærtumores, men først etter minst seks måneders behandling. Blant de mest brukte bisfosfonater er zoledronat, bondronat og pamidronat. Et relativt nytt alternativ er denosumab, et monoklonalt antistoff som gjenkjenner og bindes til RANK-ligand, et viktig signalstoff i benstoffskiftet. En fordel med denosumab er at det kan gis subcutant. I en metaanalyse ble det konkludert med at denosumab gir signifikant større reduksjon i antall SREs og lengre tid til forekomst av SREs enn zoledronat og pamidronat. Når det gjelder smertelindring, ble det ikke funnet noen sikker forskjell i effekt mellom denosumab og bisfosfonater, men data var ikke sterke nok til å konkludere (Ford et al., 2013). Behandling med bisfosfonater på denne indikasjon bør skje i samarbeid med onkolog.
Andre behandlingstiltak
Smertelindrende fysioterapitiltak bør vurderes fortløpende. Avlastende hjelpemidler kan forebygge og lindre smerter. Ivaretakelse av psykososiale og åndelige/eksistensielle behov er også viktig for pasientens totale smerteopplevelse. (Se mer detaljert omtale i kapittel Kjennetegn og utfordringer ved palliasjon.)
Refusjonsordning for analgetika
Gjeldende refusjonsordninger for medikamenter er omtalt under Legemiddelinformasjon, refusjon over blå resept.
Smertestillende legemidler og bilkjøring
Smertestillende legemidler som inneholder opioider kan påvirke både oppmerksomhet, våkenhet og reaksjonsevne, og dermed redusere kjøreferdighetene på liknende måte som alkohol. Førerkortforskriften har derfor bestemmelser om bilkjøring og bruk av ulike legemidler som nødvendigvis vil begrense enkeltpersoners mulighet til å kjøre. De norske helsekravene tar utgangspunkt i EUs helsekrav til sjåfører.
Helsepersonell, og spesielt leger som forordner smertestillende legemidler, har plikt til å gjøre pasienten oppmerksom på virkningen legemidlene har på kjøreevnen og at man ikke har rett til å kjøre bil når man ikke oppfyller helsekravene.
Ifølge Forskrift om helsekrav til bilførere mv. § 2 (FOR 1984-07-13-1467) har lege
«plikt til å advare innehaver av førerkort dersom legen ved undersøkelse finner det av helsemessige grunner uforsvarlig at personen fortsetter å kjøre motorvogn.»
Førerkortforskriften vedlegg 1 fra oktober 2016 har bestemmelser om maksimumsdoser for smertestillende legemidler som kan påvirke kjøreevnen. Bestemmelsene skiller mellom opioider ved kronisk smertebehandling og opioider ved kortvarig smertebehandling, jf. vedlegg 1 annet ledd § 36 nr. 5 og 6.
Ved bruk av opioider til kronisk smertebehandling er helsekrav i førerkortgruppe 2 og 3 ikke oppfylt. For førerkortgruppe 1 er helsekrav oppfylt dersom:
- Det er klar medisinsk indikasjon
- Det er minst en uke etter siste doseøkning
- Det brukes en maksimal døgndose som tilsvarer inntil 300 mg morfinekvivalenter per os
- Legemidlene er langtidsvirkende, og
- Det har gått 8 timer etter inntak av ekstra dose korttidsvirkende opioid
Ved kortvarig smertebehandling med opioider er helsekravet ikke oppfylt for noen førerkortgruppe ved kontinuerlig medisinering gjennom døgnet, selv om dette er innenfor rammen av anbefalte døgndoser. Ved inntak av enkeltdose er helsekravet bare oppfylt dersom enkeltdosen er anbefalt av lege og legemiddelet inntas minimum 8 timer før kjøring. Både ved kronisk smertebehandling og kortvarig behandling må det i tillegg gjøres en helhetsvurdering av om legemiddelbruken medfører en helsesvekkelse som kan gi økt trafikksikkerhetsrisiko.
Etter forskriften vedlegg 1 § 37 må maksimumsdosen halveres ved bruk av andre legemidler opplistet i § 36, herunder benzodiazepiner, benzodiazepinlignende legemidler og bruk av antihistaminer som sovemiddel. Ved bruk av tre legemidler opplistet i § 36 er helsekrav ikke oppfylt.
«Førerkort – veileder til helsekrav» (IS-2541) fra oktober 2016 går nærmere inn på kriteriene for å vurdere om helsekravene er oppfylt ved bruk av opioider og ved kombinasjon med andre legemidler.
Hvis pasienten kortvarig ikke oppfyller helsekravene (under 6 måneder), er det tilstrekkelig at legen informerer pasienten om at han eller hun ikke har rett til å kjøre bil før helsekravene er oppfylt. Anser legen at helsekravene ikke vil være oppfylt i mer enn seks måneder, skal legen også gi melding til fylkesmannen, jf. helsepersonelloven § 34.
Det skal dokumenteres i pasientens journal at slik informasjon er gitt, og det anbefales at det gis både muntlig og skriftlig informasjon til pasienten.
Dyspné
Sist faglig oppdatert: 14.10.2019
Definisjon
Subjektiv opplevelse av pustebesvær hos pasienter med sykdom i lunger og/eller andre organer som påvirker respirasjonssystemet.
- Dyspné har ofte et kronisk forløp. Plagene utløses spesielt ved anstrengelser, og forsterkes av angst.
- Det er ofte lite samsvar mellom pasientens opplevelse og de objektive funn
- Dyspné er vanskeligere å behandle enn smerter, og medfører dårlig livskvalitet og reduserte leveutsikter
- Dyspné i hvile, eller utløst av minimale anstrengelser, er et dårlig prognostisk tegn
- Akutt oppstått dyspné kan være forårsaket av akutt respirasjonssvikt, en potensielt livstruende tilstand som krever umiddelbart tilsyn og vurdering av lege.
Etiologi og forekomst
Ved siden av smerter, er dyspné én av de hyppigst forekommende plager ved langtkommen kreftsykdom. Dyspné er sammen med hoste hovedsymptomet hos pasienter med langtkommen lungekreft eller lungemetastaser (Kvale, Simoff, & Prakash, 2003).
Hos pasienter som trenger lindrende behandling for ikke-malign sykdom, slik som langtkommet hjerte- og lungesykdom, er dyspné ofte det dominerende symptomet.
Årsaksmekanismer for dyspné
Dyspné kan være (Ripamonti, 1999):
- direkte tumorrelatert pga. tumorinnvekst i alveoler, bronkier og pleura, som gir redusert ventilatorisk reserve (både restriktiv og obstruktiv ventilasjonspåvirkning)
- indirekte relatert til grunnsykdommen gjennom komplikasjoner (pneumoni, lungeemboli, anemi, kakeksi, pleuravæske, ascites)
- behandlingsrelatert (lungetoksisitet/pneumonitt, lungefibrose)
- relatert til andre, tilstøtende sykdommer (KOLS, hjertesvikt)
- relatert til angst (panikkanfall)
Utredning
Anamnese
Følgende forhold må vektlegges:
- Tidsforløp
- Døgnvariasjon
- Tidligere hjerte-/lungesykdom
- Utløsende faktorer
- Innvirkning på søvn
Klinisk undersøkelse
Undersøkelsen må være målrettet, og spesielt kartlegge respirasjonsmønster og respirasjonsfrekvens.
Supplerende undersøkelser
- Blodprøver med hemoglobin og infeksjonsstatus
- Pulsoksimeter-saturasjonsmåling i hvile og ved anstrengelse, med og uten oksygentilførsel
- Radiologisk undersøkelse (rtg thorax, CT-thorax)
Andre aktuelle undersøkelser brukes årsaksrettet, og må styres av anamnese og kliniske funn:
- Spirometri
- Full lungemedisinsk utredning med bronkoskopi
- Arteriell blodgassanalyse ved mistanke om respirasjonssvikt
Akutt oppstått dyspné krever rask og aktiv diagnostikk for å finne årsaken og sette inn adekvat behandling.
Forebygging
God ivaretakelse i et trygt medisinsk miljø er avgjørende for at pasienten klarer å mestre sine plager. Dette har også stor betydning for de pårørende.
Frisk luft er effektivt. Åpent vindu eller bruk av vifte og en kald klut på pannen kan redusere opplevelsen av å få for lite luft. Håndholdt vifte foretrekkes fremfor bordvifte. Det er også viktig å hjelpe pasienten til godt leie i sengen og gode hvilestillinger.
Behandling
Kausal behandling
Kausal behandling bør tilstrebes der det er mulig. Følgende tilnærminger må vurderes:
- Tumorrettet behandling (kjemoterapi, strålebehandling)
- Stent ved trakeal/bronkial obstruksjon
- Laserbehandling ved endobronkial tumor
- Pleuradrenasje ev. pleurodese ved pleuravæske
- Ascitestapping
- Blodtransfusjon
- Antibiotika
- Effektiv syreblokade ved refluksproblematikk
- Analgetika ved pleurale smerter
Symptomatisk behandling
Opioider:
- Det er god dokumentasjon for effekt av systemisk opioidbehandling (evidensnivå B) (Allard, Lamontagne, Bernard, & Tremblay, 1999; Jennings, Davies, Higgins, & Broadley, 2001; Ripamonti, 1999)
- Opioider demper subjektivt besvær og senker oksygenbehovet. Kroppens toleranse for hypoksi og hyperkapni øker, og respirasjonsmønsteret bedres.
- Opioider administreres først og fremst systemisk, men kan også gis som inhalasjon. Det foreligger flere rapporter om subjektiv nytte av opioidinhalasjoner med mindre bivirkninger enn systemisk behandling. Det bemerkes dog en viss risiko for bronkospasme. Det finnes ingen studier som viser bedre effekt av inhalasjon enn av systemisk behandling.
Doseringseksempler:
Systemisk morfin:
Opioidnaive: Startdose anbefales noe lavere enn ved smerter.
Hos opioidbrukere kan 25–50 % økning av opioiddosen forsøkes, dosen titreres etter effekt (Kloke & Cherny, 2015).
Inhalasjon:
Morfin 10–40 mg/dose, fentanyl 25–50 ug/dose.
Anxiolytisk behandling
Angst er ofte en viktig tilleggskomponent ved dyspné. Angst forsterker det subjektive besværet og øker oksygenbehovet. Kontinuerlig tilstedeværelse av kompetent helsepersonell gir pasienten trygghet slik at kontroll kan gjenvinnes.
Benzodiazepiner kan forsøkes der dyspnéanfall utløses eller forsterkes av angst.
Benzodiazepiner reduserer angst og stress, bidrar til å optimalisere respirasjons-mønsteret og fører til redusert respirasjonsarbeid (Ripamonti, 1999)
Fysikalsk behandling
Det er god dokumentasjon for effekt av fysikalsk behandling hos pasienter med KOLS og kronisk lungesvikt. Dette har klar overføringsverdi til kreftpasienter (Kvale et al., 2003; Ripamonti, 1999)
- Fysioterapi kan bidra til effektivisering og optimalisering av respirasjons-mønsteret. Basal og rolig respirasjon tilstrebes.
- I kombinasjon med enkle teknikker for avspenning eller autogen trening kan fysioterapi senke angstnivået
- Fysikalsk behandling er til god nytte hos pasienter med slimproblemer
TENS eller akupunktur har ingen dokumentert effekt på dyspné.
Oksygenbehandling
Oksygen må betraktes som et medikament som krever en klar indikasjon for bruk.
Hensikten med oksygenterapi er å motvirke dyspné som er direkte forårsaket av hypoksi. Det er mange grunner til å advare mot liberal bruk av oksygen til kreftpasienter (Booth et al., 2004; Cranston, Crockett, & Currow, 2008):
- Effekten av oksygenterapi ved langtkommen kreftsykdom er dårlig dokumentert
- Pasientens bevegelsesfrihet reduseres
- Langvarig oksygenbruk kan gi lungeskader og redusert lungefunksjon
En forutsetning for start av oksygenterapi er derfor at det er påvist kronisk eller anstrengelsesutløst hypoksi, og at oksygentilførsel reverserer hypoksien. Hypoksi må dokumenteres med saturasjonsmåling (pulsoksimetri).
Behandlingsalternativer:
- «Short burst»-terapi, dvs. kortvarig inhalasjon av oksygen på maske eller nesekateter før og/eller etter større anstrengelser, kan være indisert ved anstrengelsesutløst hypoksi (fall i oksygenmetning på > 4 %) (evidensnivå B) (Roberts, 2004)
- Oksygentilførsel under aktivitet/anstrengelse kan forsøkes dersom aktivitetsnivået bedres vesentlig (> 10 % økt gangdistanse ved tilførsel av 2–3 l oksygen per min) (Hately, Laurence, Scott, Baker, & Thomas, 2003)
- Ved akutt respirasjonssvikt kan oksygentilførsel gi god symptomlindring. Behandlingen bør avsluttes så snart situasjonen er under kontroll.
- Nytten av kontinuerlig oksygenterapi (>15 timer/døgn) er ikke dokumentert hos kreftpasienter og bør derfor unngås (Cranston et al., 2008)
Frisk luft er et godt alternativ til oksygen (Booth & Wade, 2003). Kald og frisk luft mot ansiktet ved hjelp av vifte eller åpent vindu reduserer opplevelsen av dyspné og er spesielt egnet ved dyspné uten samtidig alvorlig hypoksi. Frisk luft kan også lindre ved alvorlig hypoksi der oksygentilførsel ikke har noen sikker effekt.
Lindring av slimproblemer
Bronkolytika:
- Ingen evidens for generell nytte hos lungekreftpasienter (153;160)
- Intensivert behandling anbefales hos KOLS-pasienter med samtidig lungekreft
- Kan ha effekt ved bronkospasme utløst av sykdom eller nødvendige medikamenter, og gis ev. i forkant av opioidinhalasjon
- Dosering som ved KOLS
Mukolytika:
- Generelt dårlig dokumentasjon
- Kan forverre slimproblemer, men angis å ha nytte ved samtidig KOLS
- Kan prøves ved plagsomt, seigt slim
Mukostatisk behandling:
Antikolinergika (f.eks. skopolamin, glykopyrron) anbefales mot «hypersalivasjon» hos pasienter med ALS. Strålebehandling av spyttkjertler kan være effektivt.
Antikolinergika kan være nyttige i terminalfasen for å redusere dødsralling.
Saltvannsinhalasjoner, fukting av inhalasjonsluft:
Fukting ved oksygentilførsel har ingen sikker nytte. Intermitterende saltvanns-inhalasjoner kan benyttes som slimløsende behandling sammen med fysioterapi. Det er ingen sikker evidens for slik behandling hos kreftpasienter, men nytte er vist ved KOLS (Khan & O'Driscoll, 2004).
Obstruktivt besvær
Kortikosteroider:
Kortikosterioder kan redusere bronkialt ødem og dermed obstruktivt besvær.
Både systemisk behandling og inhalasjonsbehandling kan forsøkes. Effekt av behandlingen bør kunne måles som subjektiv lindring av dyspné og bedret ventilasjon.
CPAP/BIPAP kan benyttes kortvarig ved bronkial obstruksjon i påvente av annen spesifikk behandling (stent, brachyterapi, kjemoterapi). I terminalfasen er effekten svært usikker.
Kronisk respirasjonssvikt
Oppstart av respiratorbehandling, eller annen kronisk ventilasjonsstøtte, er en komplisert avgjørelse på spesialistnivå. Den krever en full gjennomdrøftning av gevinst versus ulemper og omkostninger, som nøye må gjennomgås med pasient, pårørende og hjelpeapparatet rundt pasienten og familien. Mest aktuelt er dette ved alvorlige nevromuskulære sykdommer som ALS og muskeldystrofier. Kreftpasienter som utvikler kronisk respirasjonssvikt på grunn av sykdommen, skal ikke tilbys respiratorbehandling (Escalante et al., 2000).
Munntørrhet og andre plager i munn og svelg
Sist faglig oppdatert: 14.10.2019
Definisjoner
God munnhelse er viktig for god livskvalitet hos kreftpasienter. Munntørrhet (xerostomi) forekommer ofte hos disse pasientene. Begrepet munntørrhet/xerostomibrukes om den subjektive følelsen av tørrhet i munnen, mens hyposalivasjon er den objektivt målte reduksjon i spyttproduksjon. Overflod av spytt, hypersalivasjon (sialore), er sjeldnere hos kreftpasienter, men kan være et stort problem ved visse nevrologiske sykdommer. Smerter i munnhulen, smaksforstyrrelser, dårlig ånde (halitosis), tale- og svelgvansker (dysfagi) og ulike infeksjoner er andre plager. Oral mukositt er en smertefull, ulcererende inflammasjonstilstand i munnslimhinnen som bivirkning til kjemoterapi og strålebehandling mot hode og hals. Stomatitt er betegnelsen for enhver inflammatorisk prosess i munnslimhinnen.
Etiologi og forekomst
Forstyrrelser i munnhelsen er vanlig hos kreftpasienter. Munntørrhet rapporteres hos inntil 80 % av palliative pasienter. Andre munnhelseproblemer rapporteres hos 30–50 % av pasientene. Orale bivirkninger av kreftbehandling estimeres til 10 % ved adjuvant kjemoterapi, 40 % ved kurativ kjemoterapi, og inntil 100 % ved hematologiske kreftsykdommer og ved strålebehandling der munnhulen er inkludert i strålefeltet.
Behandling med ugunstig innvirkning på munnhelsen:
- Strålebehandling mot hode og hals
- Kjemoterapi
- Legemidler med antikolinerg og/eller sympatomimetisk virkning og bivirkninger
- Opioider
- Glukokortikoider
- Bisfosfonater
Andre forhold som kan påvirke munnhelsen:
- Dehydrering
- Redusert tygging
- Redusert immunforsvar
- Endret bakterieflora og sekundære infeksjoner
- Angst og depresjon
Utredning
Anamnese
Sykehistorien bør inneholde opplysninger om tidligere og ev. pågående tumorrettet behandling, symptomer fra fordøyelseskanalen og legemiddelbruk. Det er viktig å få informasjon om hvilke daglige tann- og munnhygieniske tiltak den syke gjennomfører, om type tannkrem og tannbørste, tiltak for å fukte munnslimhinnen osv.
Hyposalivasjon kan måles med sialometri. Munntørrhet kan graderes med NRS (numerical rating scale) fra 0–10.
Klinisk undersøkelse
En rutinemessig undersøkelse av munn og svelg bør gjennomføres hos alle kreftpasienter. Minimumsutstyr er to trespatler, en kompress til å holde tungen og godt lys. Man inspiserer og beskriver:
- Over- og underleppens slimhinne
- Slimhinnen i kinn og gane
- Tungens kanter, over- og underside
- Tannkjøttet
- Tannstatus, ev. løse tenner
- ev. patologiske forandringer
WHO graderingsskala for mukositt:
0 = nomalt funn
1 = sårhet i munnslimhinnen med eller uten erytem
2 = erytem og sår, men pasienten kan svelge mat
3 = sår med uttalt erytem, pasienten kan ikke svelge fast føde
4 = peroralt inntak av ernæring ikke mulig
Munntørrhet kan graderes med spateltesten der en trespatel trekkes over munnslimhinnen: Fuktighetsgrad beskrives avhengig av om friksjonen er normal, eller lett, middels eller sterkt forøket. Ved mistanke om infeksjon bør det gjøres mikrobiologisk dyrkning i medium for sopp, aerobe og anaerobe mikrober.
Behandling
Munntørrhet/Xerostomi og hyposalivasjon
Behandlingen bør om mulig være årsaksrettet, enten forebyggende eller rettet mot utløsende årsak, når problemet har oppstått. Målet er å bevare den normale, fysiologiske tilstanden i munnhulen best og lengst mulig ved å redusere skadelige innflytelser. Ofte er det vanskelig å unngå eller avstå fra bruk av legemidler med ugunstig effekt eller fra tumorrettet behandling (kjemoterapi og strålebehandling). Det er enklere å sette inn lindrende tiltak på forhånd for å hindre utvikling av alvorlige forstyrrelser i munnhelsen.
Intensitetsmodulert strålebehandling (IMRT) kan gi redusert påvirkning av spyttkjertlene ved strålebehandling av ØNH-kreft. Parotiskjertlene er mest følsomme for stråling.
Kariesutvikling kan komme i løpet av få måneder ved etablert hyposalivasjon.
Før oppstart av aggressiv kjemoterapi eller strålebehandling som omfatter munnhulen og/eller spyttkjertler, skal alle kreftpasienter få orale forhold vurdert og ev. behandlet, helst hos tannlege og tannpleier med spesialkompetanse. Godt samarbeid mellom behandlingsteamet på kreftavdelingen og tannlegepersonell er viktig.
Symptomatiske tiltak
Dersom spyttstimulerende midler skal virke, må spyttkjertlene ikke ha mistet evnen til å produsere spytt, slik det blant annet kan være etter strålebehandling mot hode eller hals.
Fluor:
Fluor forebygger kariesutvikling ved munntørrhet (evidensnivå A). Fluor tannkrem suppleres med fluor sugetabletter eller fluor tyggegummi, fluorid gel eller skylling med 0,05 % fluorløsning daglig.
Tyggegummi:
Tygging stimulerer spyttproduksjonen (evidensnivå A). Tyggegummi finnes med tilsatt fluor, xylitol som hemmer bakterievekst, ev. med basisk pH som nøytraliserer syrer som starter kariesangrep.
Sugetabletter:
Sugetabletter kan inneholde fruktsyrer, fluor og xylitol. Sugeprosessen stimulerer spyttproduksjonen.
Spytterstatningsmidler:
Disse innholder ulike viskositetsforhøyende og smørende stoffer som karboksymetylcellulose eller mucin. Virkningen er kortvarig. Hyppig skylling med lunkent fysiologisk saltvann (evidensnivå A), eller vanlig vann, er et godt alternativ.
Natriumbikarbonat-skyllinger (en teskje i en stor kopp vann) gir grunnlag for god munnhygiene (evidensnivå A).
Slimløsende midler:
Ved tykt og seigt spytt virker askorbinsyreholdige tabletter og acetylcystein brusetabletter slimløsende (evidensnivå C). De spalter mucinmolekylene og har en viss antibakteriell virkning.
Tannbørste:
Ved munntørrhet og såre slimhinner bør tannbørsten være myk for å unngå slimhinneskader.
Tannkrem:
Vanlig tannkrem inneholder som regel kunstig såpe eller natriumlaurylsulfat som skummiddel. Slik såpe kan skade det beskyttende mucinlaget i munnslimhinnen (evidensnivå A). Det samme gjelder flere munnskyllevæsker. Ved munntørrhet bør man bruke tannkrem uten denaturerende såpestoffer som natriumlaurylsulfat.
Kostråd:
Hyppige måltider med mye sukker er ugunstig. Kunstige søtningsstoffer bør foretrekkes. Det anbefales å drikke rikelig, men ikke bare vann. Sportsdrikker, mineralvann og fruktte kan anbefales, men drikke med lav pH kan gi erosjonsskader på tannemaljen. Maten bør ha myk konsistens. Tørr og sterkt krydret mat, alkohol og tobakk bør unngås.
Klorheksidin-skyllinger skal ikke brukes rutinemessig på grunn av ugunstig påvirkning på normal munnflora.
Pilokarpin:
Ved intakte spyttkjertler øker pilokarpin spyttproduksjonen (evidensnivå A), men grunnet bivirkninger er den samlede effekt usikker. Pilokarpin tabletter er ikke registrert i Norge.
Munnskyllevæske:
Munnskyllevæske som er overmettet med calcium og fosfat, kan virke positivt på tørre og såre munnslimhinner og dekalsinert tannemalje (evidensnivå C).
Hypersalivasjon (sialore)
Problemet kan skyldes medikamenter eller svulster, men også at pasientene har vanskelig for å svelge unna spyttet. Skopolamin, enten som depotplaster eller som injeksjon, eller glykopyrron parenteralt, kan redusere problemet (evidensnivå A).
Ved ALS og visse andre nevrologiske tilstander med kort forventet levetid, kan strålebehandling av spyttkjertlene eller injeksjoner av botulinumtoksin i parotiskjertlene ha god effekt (evidensnivå B).
Infeksjoner i munnhulen
Soppinfeksjoner
- Oral candidose (oral candidiasis) er den vanligste infeksjonen i munnhulen hos kreftpasienter. Candida species, særlig candida albicans, er ansvarlig for nesten alle infeksjonene. Candida species finnes i normalfloraen hos ca 1 av 3 friske uten å gi kliniske infeksjonstegn.
- Immunsuppresjon, behandling med antibiotika eller kortikosteroider, munntørrhet, sukkersyke og forandret ernæringsstatus, kan bidra til å utløse klinisk candidose.
- Akutt pseudomembranøs candidose (trøske), atrofisk erytematøs candidose, protesestomatitt i munnhulen og angulær cheilitt i munnvikene, er ulike kliniske manifestasjoner av candidainfeksjon. De kan opptre alene eller i kombinasjon, noen ganger uten å gi symptomer.
- I tillegg til munnhulen, vil soppangrep ofte involvere svelg og spiserør
- Diagnosen stilles ut fra klinisk undersøkelse og mikrobiologisk dyrkning
Medikamentell behandling
- Forebygging bør vurderes hos disponerte pasienter (se over)
- God hygiene og munnpleie bør kombineres med ev. medikamentell behandling
Metaanalyser viser evidens for at antimykotika som absorberes fra mage-tarm-kanalen både forebygger og helbreder soppinfeksjoner i munnhulen. Det er imidlertid tendens til økende resistensutvikling mot denne type antimykotika. Det er ikke evidens for antimykotisk effekt av midler som ikke absorberes fra mage-tarm-kanalen, for eksempel nystatin mikstur.
Düsseldorfblanding inneholder både klorheksidin og nystatin, substanser som in vitro reduserer hverandres virkning. Virkning er ikke dokumentert.
Aktuelle preparater:
- Triazolderivater – flukonazol kaps. 50–100 mg x 1 (evidensnivå A)
- Imidazolderivater – ketokonazol tbl. 200 mg x 1. Obs. levertoksisitet (evidensnivå A)
- Mikonazol krem og klotrimazol krem til lokalt bruk (cheilitt eller protesestomatitt)
- Antibiotika – amfotericin B sugetabletter, 10 mg x 4 (evidensnivå C) (Uegnet ved munntørrhet)
Bakterie- og virusinfeksjoner
- Munnhulens mikroflora består av et mangfold av bakteriearter som er med på å danne en normal biofilm. Kjemoterapi og lokal strålebehandling kan skade denne mukosabarrieren med fare for mikrobiell invasjon, og forårsake både lokale (periodontitt, gingivitt, mukositt, spyttkjertelinfeksjoner) og systemiske infeksjoner. Vurdering hos tannlege kan være aktuelt.
- Kjemoterapi, lokal strålebehandling, immunsuppresjon og dårlig munnhygiene kan forårsake en forskyvning fra en grampositiv mot en gramnegativ dominert bakterieflora
- God munnhygiene er et viktig ledd i forebygging og behandling av infeksjoner. Klorheksidinløsning – 0,2 % fortynnet med like deler vann – kan supplere munnhygienen ved infeksjon, men er ikke rutinetiltak ved vanlig, forebyggende munnpleie
- Antibiotikabehandling baseres på resultatet av mikrobiologisk dyrkning
- Herpes simplex virus type 1 er vanlig og kan forårsake smertefulle ulcerasjoner ved oral mukositt. Acyklovir, eller valaciklovir, er aktuelle ved forebyggelse eller behandling, vanligvis som lokalbehandling (evidensnivå A)
- For karies, periodontitt og munnhuleproblemer ved systemiske infeksjoner hos neutropene pasienter o.a., vises til spesiallitteratur
Oral mukositt
- Oral mucositt kan ha varierende alvorlighetsgrad (se WHOs graderingsskala gjengitt ovenfor, under avsnittet Utredning).
- Høydosebehandling med stamcellestøtte (HMAS), og annen aggressiv kjemoterapi, forårsaker oral og gastrointestinal mukositt hos opptil 100 % av pasientene. Hos denne gruppen kan mukositten være så smertefull at den umuliggjør alt peroralt inntak i flere uker, og parenteral ernæring blir nødvendig.
- Smertelindring kan gis lokalt, for eksempel med lidokain viskøs (evidensnivå A), lokal morfinbehandling (morfin mikstur 2 mg/ml, 15 ml holdes i munnen 3 min. og spyttes ut. Kan gjentas inntil x 6, ev. oftere) (evidensnivå A). Ofte behøves parenteral tilførsel av opioider (evidensnivå A). Multinational Association for Supportive Care in Cancer (MASCC) oppdaterte i 2005 sine retningslinjer for mukosittbehandling. Det foreligger få vitenskapelig baserte tiltak på dette feltet.
- Behandling:
- Støttebehandling med ulike hygieniske tiltak for pleie av munnslimhinnen har stor betydning, og det er utarbeidet munnpleieprotokoller (vurdering av tverrfaglig team med blant annet tannlege, bruk av munnpleiesett med pasientinformasjon) som har god forebyggende og lindrende effekt sammenlignet med ingen munnpleierutiner (evidensnivå A)
- Kryoterapi («ice chips» før, under og etter bolus 5-FU, melphalan) (evidensnivå A).
- Keratinocytt-vekstfaktor for høydose kjemoterapi med stamcellestøtte i behandling av hematologiske kreftsykdommer (evidensnivå A). Dette er en svært kostbar behandling.
- Low-level laser terapi (LLLT) ved oral mukositt forårsaket av onkologisk behandling (evidensnivå A).
- Flere typer intervensjoner har vært prøvd som forebygging og behandling, men resultatene har vært motstridende. De er derfor ikke inkludert i kliniske retningslinjer for oral mukosittbehandling. Eksempler på slik behandling er: Amifostine (cytoproteksjon før enkelte onkologiske behandlinger), allopurinol munnskylling, benzydamin før og under strålebehandling, laserbehandling, hematologisk vekstfaktor, overmettet kalsium-fosfat-munnskyllevæske, isegan, pilokarpin, glutamin, humant placentaekstrakt, immunglobulin og betaglukan.
- Lokale, ikke-medikamentelle tiltak: suge isbiter, hyppige skyllinger med lunkent saltvann, munnpleiesett (se nedenfor).
- Bruk av klorheksidin-skylling anbefales ikke.
Osteoradionekrose og osteonekrose
Dette er alvorlige, smertefulle skader på kjevebenet som kan oppstå etter henholdsvis strålebehandling og høypotente bisfosfonater, særlig etter tannekstraksjoner. De viktigste risikofaktorene er dårlig munnhygiene og dårlig tannstatus før behandling. Av betydning er også diabetes mellitus, revmatoid artritt og bruk av medikamenter som påvirker tilhelingsevnen i ben- og bløtvev, f eks kortikosteroider. God sanering hos tannlege før oppstart av behandling er derfor svært viktig.
Behandling av smerter i munnhulen
- Se overfor under oral mukositt
- Skylling av munnen med en blanding av lidokain viskøs og paracetamol mikstur blandet i kremfløte
- Triamcinolon munnsalve ved smertefulle after («munnskåld»)
- Vurder NSAID som systemisk behandling, f eks ibuprofen eller diklofenac ved smertetilstander grunnet inflammasjon i mukosa
Munnpleiesett
Ulike midler som kan bidra til å bevare munnhelsen kan leveres i egne munnpleiesett.
Eksempel på pasientinformasjon i munnpleiesett:
«God munnhelse er viktig for ditt velvære. Under langvarig sykdom kan munnhelsen ta skade. Det kan være en følge både av sykdommen og behandlingen du får. Tørrhet og infeksjoner med sopp og bakterier i munnslimhinnen kan føre til tale- og svelgvansker, vond smak i munnen, nedsatt smaksfølelse, redusert appetitt, dårlig ånde og tannråte. Munnslimhinnen kan bli sår og smertefull. I tillegg til ubehaget kan det bli vanskelig å vedlikeholde god munnhygiene.
- Munnpleiesettet inneholder flere midler som er viktige for å bevare god munnhelse:
- Myk tannbørste
- Tannkrem med mildt såpestoff
- Sugetabletter med xylitol og fluor
- Smørende gel for munnslimhinnen
- Sukkerfri tyggegummi
- Leppepomade
Vær forsiktig med sukkerholdige drikker, drops, pastiller og andre søtsaker. Mye sukker øker faren for munntørrhet og tannråte. Drikk rikelig, men husk kroppens saltbalanse; drikk ikke bare vann og saft, men også saltholdige drikker, for eksempel mineralvann og sportsdrikker. For å stimulere spyttproduksjonen, kan du suge på isbiter, tygge ananas, frosne bær eller c-vitamin- tyggetabletter, eller drikke vann med litt presset sitron. Hyppig skylling av munnen med lunkent saltvann anbefales (9 gram bordsalt (= 1 spiseskje) i 1 liter vann). Hvis du tross god munnpleie er plaget med økende svie og belegg i munnslimhinnen, trenger du kanskje annen hjelp eller behandling i tillegg.»
Nasjonalt nettverk for fagprosedyrer har utarbeidet en prosedyre for munnstell til voksne pasienter med alvorlig sykdom, i all hovedsak beregnet på palliative pasienter https://www.helsebiblioteket.no/fagprosedyrer/ferdige/munnstell-til-voksne-pasienter
Trygderettigheter
Ifølge folketrygdloven § 5‑6 har pasienter med kreft i hode-halsregionen rett til å få trygderefusjon ved behandling hos tannlege og tannpleier til offentlige takster. Pasienter med dokumentert redusert spyttsekresjon har også trygderettigheter dersom tannlegen kan påvise sammenheng mellom munntørrhet og redusert tannhelse.
Bruker man privat tannlege, må man være innstilt på å betale mellomlegg.
Kilder
Bjordal JM, Bensadoun RJ, Tunèr J, Frigo L, Gjerde K, Lopes-Martins RA. A systematic review with meta-analysis of the effect of low-level laser therapy (LLLT) in cancer therapy-induced oral mucositis. Support Care Cancer 2011;19(8):1069-77.
Cerchietti LCA, Navigante AH, Bonomi MR, Zaderajko MA, Menendez PR, Pogany CA, Roth BM. Effect of Topical Morphine for Mucositis-Associated Pain following Concomitant Chemoradiotherapy for Head and Neck Carcinoma. Cancer 2002;95(10):2230–6.
Clarkson JE, Worthington HV, Eden TOB. Interventions for preventing oral candidiasis for patients with cancer receiving treatment. Cochrane Database Syst Rev 2007;(1):CD003807.
Clarkson JE, Worthington HV, Eden TOB. Interventions for treating oral mucositis for patients with cancer receiving treatment. Cochrane Database Syst Rev 2010;(8):CD001973.
Davies A, Finlay I, red. Oral care in advanced disease. Oxford: Oxford University Press; 2005.
Davies AN, Daniels C, Pugh R, Sharma K. A comparison of artificial saliva and pilocarpine in the management of xerostomia in patients with advanced cancer. Palliat Med 1998;12(2):105–11.
Davies AN. A comparison of artificial saliva and chewing gum in the management of xerostomia in patients with advanced cancer. Palliat Med 2000;14(3):197–203.
de Conno F, Sbanotto A, Ripamonti C, Ventafridda V. Mouth care. I: Doyle D, Hanks G, Cherny N, Calman K, red. Oxford textbook of palliative medicine. 3 utg. Oxford: Oxford University Press; 2004. s. 673-87.
Harris DJ, Eilers J, Harriman A, Cashavelly BJ, Maxwell C. Putting evidence into practice: evidence-based interventions for the management of oral mucositis [oversiktsartikkel]. Clin J Oncol Nurs 2008;12(1):141–52.
Hegarty AM, Hodgson TA. Management of xerostomia and salivary hypofunction. Prog Palliat Care 2008;16(1):21–30.
Just-Nübling G, Gentschew G, Meissner K, Odewald J, Staszewski S, Helm EB, Stille W. Fluconazole prophylaxis of recurrent oral candidiasis in HIV-positive patients. Eur J Clin Microbiol Infect Dis 1991;10(11):917–21
Moore PA, Guggenheimer J. Medication-induced hyposalivation: etiology, diagnosis and treatment [oversiktsartikkel]. Compend Contin Educ Dent 2008;29(1):50–5
Multinational Association of Supportive Care in Cancer. Summary of Evidence-based Clinical Practice Guidelines for Care of Patients with Oral and Gastrointestinal Mucositis (2005 Update). [s.l.]: MASCC; 2005. Tilgjengelig fra: http://www.mascc.org/assets/documents/Guidelines_mucositis.pdf
New approaches to preventing xerostomia [lederartikkel]. J Support Oncol 2006;4(2):87–8.
Oneschuk D, Hanson J, Bruera E. A survey of mouth pain and dryness in patients with advanced cancer. Support Care Cancer 2000;8(5):372-6.
Ottesen S, Normann A. Munntørrhet og andre plager i munn og svelg. I: Ottesen S, Normann A, Nilsen L, red. Kreft og fordøyelsesplager: informasjon til helsepersonell. 4. oppl. [i.e. utg.]. Oslo: Kreftforeningen; 2007. s. 28-39.
Rubenstein EB, Peterson DE, Schubert M, Keefe D, McGuire D, Epstein J, et al. Clinical practice guidelines for the prevention and treatment of cancer therapy-induced oral and gastrointestinal mucositis. Cancer 2004;100(9 Suppl):2026-46
Saadeh CE. Chemotherapy- and radiotherapy-induced oral mucositis: review of preventive strategies and treatment. Pharmacotherapy 2005;25(4):540-54
Toth BB, Chambers MS, Fleming TJ, Lemon JC, Martin JW. Minimizing oral complications of cancer treatment. Oncology (Williston Park, NY) 1995;9(9):851-8; discussion 8, 63-6.
Wiseman M. The treatment of oral problems in the palliative patient. J Can Dent Assoc 2006;72(5):453-8.
Worthington HV, Clarkson JE, Eden TOB. Interventions for treating oral candidiasis for patients with cancer receiving treatment. Cochrane Database Syst Rev 2010;(7):CD001972.
Worthington HV, Clarkson JE, Bryan G, Furness S, Glenny AM, Littlewood A, et al. Interventions for preventing oral mucositis for patients with cancer receiving treatment. Cochrane Database Syst Rev 2011;(4):CD000978.
Kvalme
Sist faglig oppdatert: 14.10.2019
Definisjon
Kvalme omfatter her både kvalme, oppkast og brekninger. Kvalme er en subjektiv opplevelse, mens oppkast er en objektiv hendelse. Kvalme, oppkast og brekninger er tre ulike symptomer, men behandles ofte under ett.
Etiologi og forekomst
Kvalme og oppkast er vanlige problemer ved langtkommet kreftsykdom. 40–70 % av disse pasientene er kvalme i større eller mindre grad (Teunissen et al., 2007). Hos noen kan kvalme oppleves som det mest plagsomme ved sykdommen. Omtrent 30 % av dem som opplever kvalme, plages i tillegg av oppkast (P. Glare, Pereira, Kristjanson, Stockler, & Tattersall, 2004).
Enkelte grupper av pasienter har større tendens til å oppleve kvalme enn andre, se tabellen under. (Foubert & Vaessen, 2005; P. Glare, Miller, Nikolova, & Tickoo, 2011; Haughney, 2004).
Tabell 4.3
Predisponerende og forverrende faktorer ved kvalme/oppkast
|
Det finnes mange årsaker til kvalme, og genesen er ofte multifaktoriell. Hos opptil 75 % kan årsaken likevel fastsettes (Stephenson & Davies, 2006). De ulike årsakene kan deles i noen større hovedgrupper (Ang, Shoemaker, & Davis, 2010; Bentley & Boyd, 2001; P. Glare et al., 2011; Lichter, 1993; Stephenson & Davies, 2006; Wood, Shega, Lynch, & Von Roenn, 2007). Mange av årsakene kan videre grupperes som tumor-relaterte, behandlingsrelaterte, sekundære til generell svekkelse, eller relatert til en komorbid tilstand:
Ventrikkelretensjon/forsinket ventrikkeltømming:
-
- Tumor-relatert: Intra- eller ekstraluminal tumorinvasjon, paraneoplastisk syndrom, anatomiske forhold som komprimerer ventrikkel (f.eks ascites, hepatomegali, splenomegli, store intraabdominale tumores)
- Behandlings-relatert: Opioider, anticholinergika
- Komorbiditet: Gastritt, diabetisk gastropati
Metabolske forstyrrelser / kjemiske årsaker:
-
- Tumor-relatert: Hyperkalsemi, hyponatremi, uremi, anoreksi-kakeksi-syndrom, paraneoplastisk syndrom
- Behandlings-relatert: Ernæringsterapi, væsketerapi, steroider. De fleste legemidler kan i gitte situasjoner gi kvalme. Vær spesielt oppmerksom på anticholinergika, NSAIDS, opioider, jern, immunterapi, endokrin behandling, digitalis og antibiotika som mulig årsak. Husk at medikamenter som pasienten har brukt lenge, kan gi nye symptomer pga. redusert nyre- eller leverfunksjon, endret metabolisme eller endret kroppsvekt.
- Komorbiditet: Organsvikt, infeksjon, hyperglykemi
Viscerale årsaker:
-
- Dårlig munnhygiene/infeksjoner, gastritt, ulcus ventriculi/duodeni, tarmobstruksjon, obstipasjon, peritoneal carcinomatose
Intrakranielle årsaker:
-
- Primære og sekundære intracerebrale tumores, meningeale metastaser
Korticale årsaker:
-
- Angst
- Sensorisk input, inkludert smerte
- Andre psykisk betinget / psykisk forsterket (inkludert betinget kvalme)
Vestibulære årsaker:
-
- Bevegelsesutløst
Andre årsaker:
-
- Kjemoterapi-indusert kvalme og oppkast (vil ikke bli nærmere omtalt her)
- Radioterapi-indusert kvalme og oppkast (vil ikke bli nærmere omtalt her)
- Postoperativ kvalme og oppkast (vil ikke bli nærmere omtalt her)
- Infeksjoner
- Relatert til autonom svikt
De ovennevnte hovedgruppene av årsaksmekanismer kan relateres til et sett signalveier og reseptorsystemer (P. Glare et al., 2011; E. A. Laugsand et al., 2011; Wood et al., 2007):
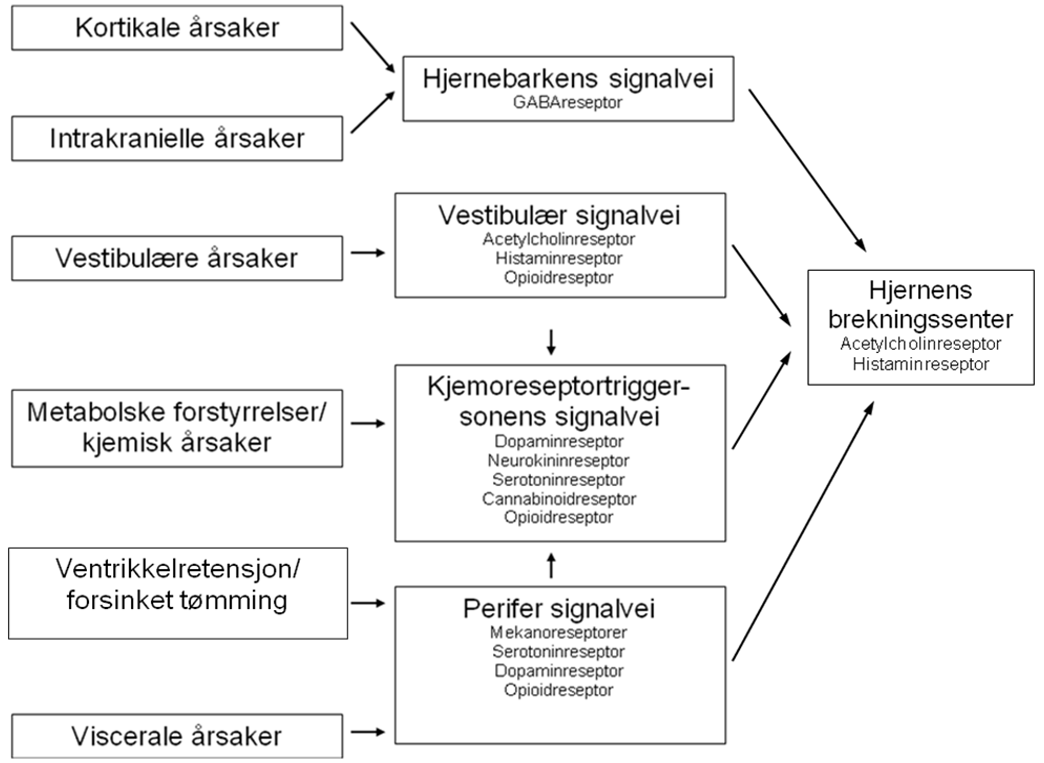
Utredning
Det finnes flere kartleggingsverktøy for vurdering av kvalme/oppkast innen palliasjon. De fleste slike er tidkrevende å bruke, få har blitt evaluert i palliative populasjoner og det finnes ingen internasjonal enighet om hvilket verktøy som egner seg best (Saxby, Ackroyd, Callin, Mayland, & Kite, 2007). I Norge har man valgt å bruke ESAS (Edmonton Symptom Assessment System) som en generell registrering av symptomer hos palliative pasienter, og skjemaet inkluderer kvalme, men ikke oppkast. Oppkast er med i EAPC grunnleggende datasett (Sigurdardottir et al., 2014). Nøyaktig diagnostikk er imidlertid nødvendig for forebygging og valg av korrekt behandling.
Anamnese
- Kvalme, oppkast og brekninger bør vurderes hver for seg
- Kvalme registreres med NRS (numerical rating scale) 0–10 (ESAS)
- Oppkast og brekninger registreres med antall per 24 timer, eventuelt brukes såkalt numerical rating scale (NRS) (Sigurdardottir et al., 2014)
- Dersom oppkast: Noter volum og utseende
Følgende forhold må vektlegges:
- Tidsaspekt: Tidspunkt for debut, hvor ofte, hvor lenge, ev. døgnvariasjon, konstant/intermitterende
- Intensitet
- Relasjon til matinntak, kroppsstilling, bevegelse
- Nåværende og tidligere utløsende faktorer (lukt, syn, smak, annet)
- Væskeinntak siste døgn
- Andre symptomer fra mage/tarm
- Andre ledsagende symptomer
- Medikamentanamnese
Hensikten med et målrettet anamneseopptak er at mulige årsaker skal kunne sorteres innenfor en av hovedgruppene nevnt over (Ang et al., 2010; P. Glare et al., 2011; Harris, 2010):
Ventrikkelretensjon/forsinket ventrikkeltømming: Typisk intermitterende kvalme assosiert med tidlig metthet og følelse av oppblåsthet etter måltid. Bedres av oppkast; oppkast har vanligvis lite volum og kan inneholde mat.
Metabolske forstyrrelser / kjemiske årsaker: Typisk vedvarende kvalme, forverret ved syn og lukt av mat, bedres ikke av oppkast. Best forenlig med metabolske eller kjemiske årsaker som aktiverer kjemoreseptortriggersonen i hjernen. Endret mental status, ev. delirium/forvirring, kan finnes ved uremi, hyponatremi, hyper/hypoglykemi, hyperkalsemi.
Viscerale årsaker: Typisk intermitterende kvalme assosiert med magekramper og endret avføringsmønster. Bedres av oppkast som kan tilta til et stort volum og være preget av galle eller avføring. Kan indikere tarmobstruksjon.
Intrakranielle årsaker: Typisk kvalme og oppkast om morgenen, gjerne assosiert med hodepine. Dette er best forenlig med økt intrakranielt trykk. Nakkestivhet kan finnes ved meningeal affeksjon.
Corticale årsaker: Kvalme og oppkast assosiert med for eksempel angst indikerer kortikal komponent.
Vestibulære årsaker: Kvalme forverret ved bevegelse og ledsaget av svimmelhet indikerer vestibulær komponent.
Andre årsaker:
-
- Infeksjoner: F. eks pancreatitt med epigastriesmerter som stråler mot rygg.
- Obstipasjonsutløst: Oppblåsthet, redusert tømmingsfrekvens
- Relatert til kakeksi og autonom svikt: Synkope-episoder, tidlig metthet.
Klinisk undersøkelse
- Generell klinisk status
- Inkl. hydreringsstatus, ernæringsstatus/kakeksi, infeksjonstegn, smertebilde
- Grundig og målrettet undersøkelse med tanke på hovedgruppene av årsaksmekanismer
- Inkl. munn og svelg: Candida, ulcera?
- Inkl. abdomen: Distensjon, palpable oppfylninger, klingende tarmlyder, faeces i ampullen, ascites?
- Inkl. nevrologisk undersøkelse: Papilleødem? Nevrologiske utfall?
Supplerende undersøkelser
Blodprøver er en enkel undersøkelse for å belyse visse årsaker til kvalme og bør tas rutinemessig før valg av behandling. Prøvene bør kunne belyse følgende:
- Elektrolyttforstyrrelser (Na, K, Cl, Ca, Mg, fosfat)
- Nyresvikt (kreatinin, urinstoff)
- Leversvikt (bilirubin, LD, ALP, ALAT, GT, albumin)
- Infeksjon (CRP, Lpk, diff telling)
- Anemi (Hb)
- Diabetes (glukose)
- Forhøyede legemiddelkonsentrasjoner (f.eks. digitoxin, teofyllamin, karbamazepin)
- Syre-base-forstyrrelser (blodgass)
Valg av andre supplerende undersøkelser styres av anamnese og funn ved klinisk undersøkelse, og brukes for å bekrefte eller avkrefte visse årsaker til kvalme:
- Rtg. oversikt abdomen: Aktuelt for å utelukke obstipasjon, tarmobstruksjon.
- Ultralyd/CT abdomen
- Gastroskopi
- MR/CT caput: Aktuelt ved intraktabel kvalme, oppkast og delirium eller nevrologiske utfall.
Forebygging
Forebygging er spesielt viktig i tilfeller hvor det foreligger kjente predisponerende eller forverrende faktorer for kvalme/oppkast. Aktuelle tiltak kan være:
- Unngå utløsende årsak(er)
- Tilrettelegging av miljøet (syn, lukt og smak, frisk luft)
- Små og hyppige måltider, «nøytral mat»
- Ro og hvile
- God behandling av smerte og andre symptomer, inkludert ivaretakelse av pasientens psykiske helse (psykiske faktorer kan forsterke eller utløse kvalme)
- Økt væskeinntak og behandling av dehydrering, gi iv væske om nødvendig
- Korrigering av elektrolyttforstyrrelser (hypokalemi, hyponatremi, hyperkalsemi) og hypo‑/hyperglykemi
- Om mulig seponere eller bytte ut kvalmefremmende medikamenter: jern, antibiotika, digoxin, SSRI, NSAIDs.
Behandling
Etter å ha kartlagt mulige årsaker til kvalmen, er første tiltak i tillegg til å kontinuere de generelle, forebyggende tiltak (se avsnittet over), å korrigere eventuelle reversible årsaker som obstipasjon, elektrolyttforstyrrelser, infeksjoner etc (se listen over årsaker).
Dersom reversible årsaker ikke kan påvises, må man ty til symptomatisk behandling med antiemetika. Ved slik behandling gjelder noen generelle prinsipper:
- Peroral administrering av antiemetika bør unngås til oppkast og et ev. tarmhinder er avhjulpet. Dette gjelder også peroral administrering av annen symptomlindrende behandling. Suppositorier kan brukes der dette finnes, men parenteral (iv eller sc) administrering er som regel et bedre alternativ.
- Generelt bør en vurdere å gå opp til maksimal tolererbar dose av et medikament før det byttes til et annet. 2/3 av pasientene klarer seg med bare ett antiemetikum (Ang et al., 2010). Førstevalget gis som fast medikasjon. Et førstevalg som bare er gitt ved behov, regnes ikke som tilstrekkelig utprøvd (Davis & Hallerberg, 2010).
- Dersom førstevalg ikke har noen effekt overhodet, seponeres medikamentet. Nytt medikament bør da velges fra en annen gruppe.
- Ved partiell effekt beholdes medikamentet samtidig som ett fra en prinsipielt annen gruppe legges til (Bruera et al., 1996; Wood et al., 2007). Kombinasjon av to medikamenter fra samme gruppe bør unngås, da det gir liten eller ingen tilleggseffekt og øker risiko for bivirkninger. Dette gjelder spesielt dopaminantagonister.
De fleste antiemetiske legemidler er reseptorantagonister. En oversikt over medikamentene er gitt i tabellen under.
Tabell 4.4
Oversikt over antiemetika (P. Glare et al., 2004), (Harris, 2010)
Egnet til å behandle kvalme forårsaket av blodbårne, toksiske stimuli som påvirker kjemoreseptortriggersonen. Eksempler på dette er kvalme ved hyperkalsemi, nyresvikt og leversvikt samt medikamentutløst kvalme.
Brukes først og fremst ved bevegelsesrelatert eller opioidindusert kvalme, samt ved økt intrakranielt trykk. Kan brukes ved GI-obstruksjon.
Brukes ved bevegelsesutløst kvalme og i forbindelse med tarmobstruksjon for å minske sekresjonen (evidensnivå C).
forts.
Brukes mot kjemoterapi- eller stråleindusert kvalme (evidensnivå A). Kan også være mer effektive enn metoklopramid for å kontrollere kvalme/oppkast ved avansert kreftsykdom, uavhengig av genese (evidensnivå B). Brukes med forsiktighet ved leversvikt og ved fare for lang QT-tid.
Brukes i lav dose som tillegg til andre antiemetika (evidensnivå B). Kan brukes som hjelpemiddel for å oppheve malign tarmobstruksjon (høy dose) (evidensnivå A), og brukes som symptomatisk behandling ved hjernemetastaser (høy dose) (evidensnivå C).
Forsøkes ved dysmotorikk i øvre del av mage-tarmkanalen (gastroparese) (evidensnivå C). Skal ikke benyttes ved tarmobstruksjon, GI-blødning, perforasjon eller like etter kirurgi.
Kan brukes ved betydelig angstkomponent eller betinget kvalme (evidensnivå C).
|
Det finnes i dag to prinsipielt ulike angrepsmåter for symptomatisk behandling av kvalme. Disse er: 1) den etiologiske/mekanistiske måten og 2) den empiriske måten. Responsraten i studier som har benyttet den etiologiske måten, er 56–93 %, mens responsraten i studier som har benyttet den empiriske måten, er 75–93 % i ukontrollerte studier og 18–52 % i randomiserte studier (Ang et al., 2010). De to ulike fremgangsmåtene har ikke blitt direkte sammenlignet, og det er derfor fortsatt uvisst hva som er mest hensiktsmessig (P. A. Glare et al., 2008). I tråd med internasjonale retningslinjer anbefales det å forsøke den etiologiske algoritmen for behandling ved kjent årsak eller mekanisme (Ang et al., 2010; Harris, 2010).
Medikamentell behandling ved kjent årsak eller mekanisme
Ved den etiologiske tilnærmingen styres valg av medikament etter antatt årsak til kvalmen og av hvilken neurotransmitter som mest sannsynlig er involvert i patogenesen (evidensnivå B) (Ang et al., 2010; Bentley & Boyd, 2001; Harris, 2010; Lichter, 1993; Stephenson & Davies, 2006; Wood et al., 2007).
- Ventrikkelretensjon/forsinket ventrikkeltømming
- Metoklopramid
- Haloperidol
- Levomepromazin
- Serotonin-antagonist
- Metabolske forstyrrelser / kjemiske årsaker
- Haloperidol
- Metoklopramid
- Serotonin-antagonist
- Levomepromazin
- Cyclizin
- Viscerale årsaker, inkl partiell malign tarmobstruksjon
- Metoklopramid (dersom ikke komplett tarmobstruksjon)
- Serotonin-antagonist
- Cyclizin
- Kortikosteroider (reduserer tumorassosiert inflammasjon)
- Levomepromazin
- Oktreotid
- Butylskopolamin
- Intrakranielle årsaker
- Deksametason/metylprednisolon
- Cyclizin
- Levomepromazin
- Kortikale årsaker
- Diazepam
- Vestibulære årsaker
- Cyclizin, prometazin
- Levomepromazin
- Skopolamin
Opioidindusert kvalme oppstår ofte ved oppstart av opioider og ved doseøkninger. Hos noen vil toleranseutviklingen føre til at kvalmen forsvinner innen 3–5 dager, mens andre forblir kvalme. Pasientene bør informeres om kvalme som bivirkning, at den sannsynligvis blir kortvarig, men at de bør ta det med ro og ha mulighet for å hvile mye de første dagene. Patofysiologien bak opioidindusert kvalme er relatert til 4 mekanismer: 1) obstipasjon, 2) gastroparese, 3) stimulering av kjemoreseptortriggersonen og 4) sensitisering av labyrinten og det vestibulære apparat (Harris, 2010). Det er gjort en gjennomgang av effekt av ulike strategier ved kvalme/oppkast blant kreftpasienter som får opioider (E. A. Laugsand et al., 2011):
- Bytte opioid: Denne strategien synes å ha effekt (f. eks ved bytte fra morfin til oksykodon eller hydromorfon, og fra transdermal fentanyl til metadon) (evidensnivå B), men det er uvisst hvilke andre opioider enn de nevnte man kan bytte fra/til. For dose-konversjons-ratioer se kapittel om smertebehandling.
- Bytte administrasjonsform for opioid: Denne strategien synes å ha effekt (f. eks ved bytte fra per oral morfin til subkutan) (evidensnivå B), men det er uvisst hvilke andre ruter det lønner seg å bytte fra/til, og for hvilke opioider dette gjelder.
- Redusere opioid-dose (f. eks ved bruk av ko-analgetika): Denne strategien er ikke tilstrekkelig utprøvd til at den kan anbefales som aktuell behandling ved opioidindusert kvalme.
- Effekt av antiemetika: Aktuelle medikamenter som har vist effekt, er metoklopramid, olanzapin, risperidon, haloperidol, skopolamin, tropisetron
Basert på ovennevnte, er det ikke mulig å komme med en anbefalt tiltaksrekkefølge ved opioidindusert kvalme (E. A. Laugsand et al., 2011).
Medikamentell behandling ved ukjent årsak og/eller mekanisme
Ved den empiriske tilnærmingen styres valg av medikament av en forutbestemt rekkefølge av antiemetika som skal forsøkes, uavhengig av underliggende årsak. Denne tilnærmingen kan benyttes under pågående utredning, men kan som nevnt også benyttes som den eneste strategien ved behandling av kvalme uten kjent årsak eller mekanisme. Den beskrevne rekkefølgen nedenfor er basert på retningslinjer utarbeidet ved internasjonale institusjoner (Ang et al., 2010):
- Dopaminantagonist i form av metoklopramid er førstevalg
- Haloperidol er andrevalg
- Ved utilfredsstillende effekt vurderes serotonin- (5-HT3-) antagonist
- Ved utilfredsstillende effekt vurderes metylprednisolon
- Ved utilfredsstillende effekt vurderes levomepromazin, olanzapin eller prochlorperazin
- Ved utilfredsstillende effekt og pasienten er i livets sluttfase, kan lindrende sedering vurderes
Alternative, ikke-medikamentelle metoder:
- Flere alternative metoder er rapportert forsøkt i behandlingen av kvalme, eksempelvis hypnose, massasje, musikkterapi, adferdsterapi, terapeutisk berøring og urter, f.eks. ingefær. Studiene som foreligger er få og med lav kvalitet (Ernst, 2009). Følgelig kan anbefalinger ikke utformes.
- Akupunktur har dokumentert effekt ved kjemoterapi- og anestesiindusert kvalme, samt ved svangerskapskvalme, men dokumentasjonen ved bruk hos pasienter med avansert kreftsykdom er fortsatt mangelfull (A. J. Cohen, Menter, & Hale, 2005; Standish, Kozak, & Congdon, 2008). Bruk av placebo-bånd og akupressurbånd er like effektivt (Brown, North, Marvel, & Fons, 1992).
Obstipasjon
Sist faglig oppdatert: 14.10.2019
Definisjon
Obstipasjon (forstoppelse) er passasje av lite/hard avføring, sjelden og med vanskeligheter (De Graeff & Krol, 2009; Larkin et al., 2008). Pasienter som angir defekasjon mindre enn tre ganger per uke, eller som rapporterer smerte/ubehag i forbindelse med defekasjon, oppblåsthet eller en følelse av inkomplett tømning, bør undersøkes med tanke på obstipasjon (Larkin et al., 2008).
Obstipasjon ledsages ofte av ett eller flere av følgende symptomer:
- Utspilt/oppblåst abdomen
- Smerter, ubehag eller pressfornemmelse med diffus lokalisasjon i abdomen (viscerale smerter) og/eller anorektalt
- Allmennsymptomer: Dårlig matlyst, kvalme, oppkast, hodepine, vond smak i munnen, flatulens, rastløshet, konfusjon
- Hemoroider, analfissurer, perianale abscesser, urinretensjon
- Ev. paradoksal obstipasjonsdiaré, med eller uten inkontinens
Klinisk er det to aspekter som må tas hensyn til ved definisjon av obstipasjon hos palliative pasienter:
- Målbare symptomer: frekvens og karakteristika ved defekasjon
- Pasientens opplevelse: nivå av ubehag, endring i avføringsmønster
Etiologi og forekomst
>Obstipasjon forekommer hos 50–60 % av pasienter med langtkommet kreftsykdom, og hos nesten 90 % av dem som bruker opioider (Ahmedzai & Boland, 2010). Både generelle predisponerende faktorer (se tabell 4.5), «benigne» årsaker og direkte følger av kreftsykdommen, eller behandlingen av denne, kan forårsake obstipasjon.
Tabell 4.5
Predisponerende og forverrende faktorer ved obstipasjon (Locke, Pemberton, & Phillips, 2000; I. Mancini & Bruera, 1998; McMillan, 2004; Miles, Fellowes, Goodman, & Wilkinson, 2006; S. Smith, 2001; Woolery et al., 2008)
|
Obstipasjon oppstår enten på grunn av seigt eller hardt tarminnhold, eller på grunn av treg eller hindret tarmpassasje. Hos palliative pasienter er det ofte en kombinasjon av disse to mekanismene. Det er vanlig å skille mellom ikke-obstruktiv obstipasjon og obstruktiv obstipasjon, hvor sistnevnte har en mekanisk årsak. Det er av stor betydning å påvise en eventuell mekanisk årsak til obstipasjon, siden konservativ behandling i slike tilfeller ofte ikke vil føre til bedring.
Årsaker til ikke-obstruktiv obstipasjon
- Bivirkning av opioider. Ved påvirkning av µ-opioidreseptor i det submukosale plexus reduseres sekresjon, gastrointestinal motilitet og peristaltikk, samtidig som intestinalt væskeopptak økes (Ahmedzai & Boland, 2010).
- Bivirkning av cytostatika eller annen tumorrettet medikamentell behandling. Spesielt vinka-alkaloider, oxaliplatin og thalidomid.
- Bivirkning av andre medikamenter: antikolinergika (antidepressiva, antipsykotika og antiparkinsonmidler), serotoninantagonister, diuretika, antiarrytmika, antihistaminer, barbiturater, kalsiumblokkere, betablokkere, NSAIDs, antacida, jern og kalsium
- Nevrologisk tilstand, f.eks. slagsekvele, multippel sklerose, parkinsonisme, muskeldystrofier, medullakompresjon og ekspansive prosesser i sentralnervesystemet, paraneoplastisk autonom dysfunksjon
- Metabolsk sykdom, f.eks. hypothyreose, diabetes mellitus, Cushings syndrom, hyperparathyreoidisme, overvekt
- Metabolsk forstyrrelse, f. eks. dehydrering, hypokalemi, hyperkalsemi og uremi
- Primær idiopatisk obstipasjon, f.eks. colon inertia eller «slow transit constipation» og irritabel-tarm-syndrom
- Smertefull tilstand anorektalt (f. eks proktitt etter stråling, hemoroider, analfissurer)
- Sekundære faktorer: depresjon, demens, redusert matinntak, redusert væskeinntak, redusert inntak av fiber, inaktivitet, trøtthet, konfusjon, delir
Årsaker til obstruktiv obstipasjon
- Obstruerende svulster i tarm
- Svulster i bukhule/bekken som obstruerer tarm ved å komprimere den fra utsiden, f.eks. intraabdominale primærsvulster og/eller metastaser
- Godartet striktur i tarm, f.eks. fibrose etter strålebehandling, iskemiske anastomosestrikturer, strikturer forårsaket av adheranser og herniering, strikturer etter divertikulitter og iskemisk kolitt
- Godartet avløpshinder i bekkenbunnsområdet, f.eks. rektocele, slimhinneprolaps, intern herniering, megarektum, bekkenbunnsatrofi, sensibilitetstap i anorektalområdet eller bekkenbunns-dyssynergi («anismus»)
Utredning
Nøyaktig diagnostikk er nødvendig for valg av rett behandling og for forebygging (evidensnivå C). Det er generell enighet om at pasientens selvrapportering av obstipasjon er et utilstrekkelig mål (K. Clark & Currow, 2012). Det finnes flere spesifikke kartleggingsverktøy for vurdering av tarmfunksjon, men de fleste er tidkrevende å bruke, tar ikke hensyn til den underliggende normalvariasjonen i tarmfunksjon og baserer seg enten på kvantitative data eller pasientens selvrapportering. Svært få av dem er evaluert i palliative populasjoner, og ingen av dem er derfor på nåværende tidspunkt spesielt anbefalt (evidensnivå C). ESAS (Edmonton Symptom Assessment System), som allerede er mye brukt i palliasjon, har bevist sin nytte for å kunne bedre behandlingen av obstipasjon (Follwell et al., 2009). I revidert utgave av skjemaet inngår ikke obstipasjon som et eget spørsmål, men pasienten kan selv føre det på som et tiende problem. I EAPC grunnleggende datasett er obstipasjon tatt med.
Anamnese
Grundig anamneseopptak som inkluderer følgende (Larkin et al., 2008; Librach et al., 2010):
- Kvantitet og kvalitet av avføring
- Hvor mye? Hvor ofte? Mønster? Tidspunkt for forrige avføring?
- Konsistens? Farge? Lukt? Blod eller slim?
- Kontinent eller inkontinent?
- Endringer i tarmfunksjonen
- Hvordan var tarmfunksjonen før kreftsykdommen inntraff, og hvordan er den nå?
- Hvor ofte, hvor mye måtte pasienten presse tidligere. Endret avføringstrang?
- Smerter eller ubehag
- Har avføringstrang, men forhindres grunnet rektale smerter eller bevegelsesutløst smerte?
- Følelse av inkomplett tømning
- Avføringstrang også etter nylig toalettbesøk?
- Viktigheten av regelmessig tarmtømning for pasienten
- Angstsymptomer eller uro knyttet til nytt avføringsmønster?
- Ytre faktorer som påvirker avføringsmønsteret
- Toalettforhold
- Behov for hjelp til å komme til eller på toalettet
- Predisponerende og forverrende faktorer (se tabell 4.5 over)
- Andre sykdommer
- Medikamenter
Klinisk undersøkelse:
- Generell klinisk status
- Grundig undersøkelse av abdomen, rektum, bekkenbunn og analområde
- Abdomen: distensjon, synlig peristaltikk, økte tarmlyder, palpable oppfylninger, ascites ved perkusjon
- Rektum: sfinktertonus, faeces i ampullen, palpable tumores, hemoroider, analfissurer, dilatert rektum
- Vurdering av hydreringsstatus
Supplerende undersøkelser
Styres ut fra anamnese og klinisk undersøkelse.
- Blodprøver: Hb, Na, K, kreatinin, FT4, TSH, total og ionisert Ca, fosfat, albumin og glukose
- Røntgenundersøkelser: Røntgen oversikt abdomen eller CT for påvisning av intraabdominale tumormasser. Kontrastundersøkelser gjøres i dag kun på spesiell indikasjon og eventuelt etter CT
- Endoskopi (rektoskopi, koloskopi) for diagnostikk og ev. endoskopisk behandling av distal obstruksjon
Forebygging
Siden obstipasjon er hyppig forekommende og svært belastende, bør vår holdning være aktivt forebyggende. Det er spesielt viktig å forebygge i tilfeller hvor det foreligger kjente predisponerende faktorer, eller der det benyttes medikamenter med klart obstiperende virkning, først og fremst opioider. Det er en kunstfeil å forskrive opioider uten samtidig å starte medikamentell obstipasjonsprofylakse (unntak er pasienter med en kronisk diarétilstand eller ileostomi, samt døende pasienter).
Målsettingen er først og fremst å forebygge konsekvensene av obstipasjon (f. eks abdominal distensjon, smerter, kvalme/oppkast, hemoroider, analfissurer etc). Det er som regel urealistisk å oppnå samme avføringsmønster som før sykdommen inntraff. Bevisstgjøring/opplæring av pasienten, kostholdsråd og ikke-farmakologisk intervensjon er minst like viktig som medikamentell behandling (evidensnivå C) (De Graeff & Krol, 2009). Følgende tiltak vurderes og eventuelt iverksettes:
- Økt væskeinntak og behandling av dehydrering. Minimum 1,5 liter væske daglig (evidensnivå C) (De Graeff & Krol, 2009; Larkin et al., 2008).
- God smerte- og symptomlindring, inkludert ivaretakelse av pasientens psykiske helse. Dette vil fremme fysisk funksjon og ofte bedre næringsinntaket.
- Adekvat næringsinntak så sant det er mulig.
- Kostholdsråd (fibertilskudd, fruktblandinger), men merk at det for de fleste pasienter kreves en betydelig økning i fiberinntak for å oppnå effekt. Fibertilskudd alene hos obstiperte kreftpasienter regnes som inadekvat behandling (evidensnivå C) (De Graeff & Krol, 2009; Larkin et al., 2008).
- Økt fysisk aktivitet (evidensnivå C) (De Graeff & Krol, 2009). Vurder fysikalsk behandling.
- Korrigering av elektrolyttforstyrrelser (hypokalemi, hyperkalsemi) og hyperglykemi.
- Behandling av eventuell depresjon: samtale- og/eller farmakoterapi.
- Om mulig seponering av obstiperende medikamenter (f. eks antikolinergika) (evidensnivå B) (K. Clark, Lam, Agar, Chye, & Currow, 2010).
- Tilrettelegging av toalettforhold, inkludert hjelpemidler. Pasienter anbefales å bruke toalettet 20 min etter frokost (evidensnivå C). Bekken i sengen bør unngås (evidensnivå C) (Librach et al., 2010)
- Medikamentell profylakse (se også tabell 4.6 under). Aktuelle medikamenter forsøkes i lav dose, gjerne om kvelden:
- Ved hard avføring velg bløtgjørende, smørende eller volumøkende midler som laktulose, makrogol, ev. flytende parafin eller ispaghula. Rikelig væskeinntak er nødvendig for optimal virkning.
- Ved bløt avføring velg tarmstimulerende midler som natriumpikosulfat, bisakodyl eller sennaglykosider. Disse kombineres som regel med bløtgjørende, smørende eller volumøkende midler.
- Dersom diaré oppstår, tas opphold i laksantiatilførselen i 1-2 dager. Start så på nytt, ev. med halv dose. Dersom pasienten har fått kombinasjon av ulike laksantia, kan det være aktuelt å seponere det tarmstimulerende middelet.
- Dersom kolikksmerter oppstår, økes mengden bløtgjørende middel relativt til dosen stimulerende middel (Larkin et al., 2008).
- Dersom fekal inkontinens oppstår, reduseres dosen bløtgjørende middel relativt til dosen stimulerende middel, og stimulerende middel kan ev. økes (Larkin et al., 2008).
Behandling
Behandling av manifest obstipasjon hos en kreftpasient kan være svært utfordrende. Der det er mulig, bør predisponerende eller forverrende faktorer for obstipasjonen behandles og/eller korrigeres (se tabell 4.6 og under forebygging). Behandlingen av manifest obstipasjon styres etter antatt årsaksmekanisme (Miles et al., 2006).
Tabell 4.6
Oversikt over laksantia
|
Medikamentell behandling av ikke-obstruktiv obstipasjon
Tross grundig utredning og opprettholdelse av forebyggende tiltak, opplever mange pasienter i den palliative fasen behandlingskrevende obstipasjon der årsaksmekanismen forblir ukjent (se figur 4.3 nedenfor). I slike tilfeller er tiltaksrekkefølgen:
- Kombinasjon av bløtgjørende og stimulerende middel (evidensnivå C) (Larkin et al., 2008). Begynn med lav dose, gjerne om kvelden. Større doser deles. Aktuelle midler forsøkes i økende doser, titrering på individuell basis (evidensnivå C) (Droney et al., 2008; Larkin et al., 2008). Dersom fekal lekkasje oppstår, reduseres bløtgjørende, mens stimulerende ev. økes. Dersom kolikk-smerter oppstår, økes bløtgjørende relativt til stimulerende (evidensnivå C) (Larkin et al., 2008). Gjentatte systematiske oversikter har ikke kunnet påvise at en bestemt type eller kombinasjon av laksantia er bedre enn andre (evidensnivå C) (Miles et al., 2006).
- Retrograd tømning via suppositorier eller klyster
- Digital fjerning.
Hos de fleste palliative pasienter er det en rekke faktorer som disponerer for obstipasjon, inkludert bruk av opioider. Dette er viktig å huske på når en skal velge behandling. Det er dessuten interindividuell variasjon i forekomst av obstipasjon blant pasienter som får opioider (Droney et al., 2008). Noen opplever ikke obstipasjon selv om de ikke får laksantia. Noen opplever ikke obstipasjon fordi de får adekvat laksantiaprofylakse, mens noen forblir obstiperte til tross for høye doser og kombinasjon av ulike laksantia. Det er gjort en gjennomgang av effekt av ulike strategier ved obstipasjon blant langtkomne kreftpasienter som får opioider (Ahmedzai & Boland, 2010; Woolery et al., 2008):
- Redusere opioid-dose (evidensnivå C) (f.eks ved å legge til ikke-opioide ko-analgetika, nerveblokkade, behandle smerten med radioterapi/kjemoterapi/kirurgi). Anbefalt av EAPC (Caraceni et al., 2012).
- Bytte opioid: Sammenlignet med vannløselige opioider som morfin og oksykodon, gir mer fettløselige opioider som fentanyl og buprenorfin mindre obstipasjon ved samme grad av analgetisk effekt (evidensnivå A) (A. J. Clark et al., 2004; Radbruch et al., 2000). Å bytte til metadon gir lavere forbruk av laksantia (evidensnivå B) (Tamayo & Diaz-Zuluaga, 2004), men er en spesialistoppgave.
- Bytte administrasjonsvei for det aktuelle opioidet (evidensnivå B), for eksempel ved å redusere dosen, bytte opioid eller bytte administrasjonsvei for opioidet (Caraceni et al., 2012).
- Effekt av perorale laksantia:
- Laktulose og makrogol er like effektive i å redusere antall harde avføringer, og det er ingen forskjell i bivirkninger (evidensnivå A) (Freedman et al., 1997).
- Laktulose og sennaglykosider er like effektive i å redusere antall dager uten defekasjon, og det er ingen forskjell i bivirkninger (evidensnivå B) (Agra et al., 1998).
- Natriumpikosulfat er mer effektivt enn laktulose (evidensnivå B) (Wirz et al., 2012).
- Effekt av rektale laksantia:
- Natriumfosfat: Kan være assosiert med elektrolyttforstyrrelser og bør unngås blant eldre i palliativ behandling (evidensnivå B) (Mendoza, Legido, Rubio, & Gisbert, 2007).
- Effekt av opioidantagonister:
- Metylnaltrekson (evidensnivå A): Indisert ved opioidindusert obstipasjon når respons på vanlige laksantia ikke har vært tilstrekkelig. Sammenlignet med placebo gir preparatet økt frekvens av defekasjon innen 4-24 timer, redusert forbruk av andre laksantia og bedring i subjektiv opplevelse av obstipasjon (Candy, Jones, Goodman, Drake, & Tookman, 2011). Perifert virkende opioidantagonister har den fordel at de ikke passerer blod-hjernebarrieren, og kan derfor gis parenteralt uten tap av analgesi. Kontraindisert ved mekanisk obstruksjon og annen intraabdominal patologi. Doseres etter vekt, se felleskatalogen.
- Nalokson (evidensnivå B): I studier vist at dose på inntil 5 mg/døgn po kun i ubetydelig grad blokkerer sentrale reseptorer, mens perifere reseptorer blokkeres i høy grad. Vanlig dosering er Nalokson injeksjonsvæske pr os (blandet med vann) i startdose 0,4 mg x 4 første dag, 0,8 mg x 4 andre dag. Seponeres hvis ingen effekt etter to døgn. Kontraindisert ved mekanisk obstruksjon pga. fare for tarmperforasjon.
- Nalokson kombinert med oksykodon (evidensnivå A): Sammenlignet med placebo gir preparatet økt frekvens av defekasjon innen 2-6 uker (Meissner et al., 2009). Sammenlignet med oksykodon alene gir preparatet bedret tarmfunksjon, færre obstipasjonssymptomer, økt antall spontane tarmtømninger og redusert behov for tradisjonelle laksantia (Lowenstein et al., 2009). Nalokson blokkerer opioidreseptorene både sentralt og perifert. Peroral administrasjon gir bare 1 % systemisk biotilgjengelighet på grunn av nedbrytning i lever, og dermed blokkeres ikke den analgetiske virkningen av opioidet. Kan brukes i stedet for oksykodon opp til 80 mg, eller som tillegg ved høyere doser. Kontraindisert ved moderat til alvorlig nedsatt leverfunksjon. Bør heller ikke brukes hos pasienter med peritoneal carcinomatose eller stenoserende svulster i mage-tarmkanalen og bekkenet. Dosen økes over noen dager grunnet fare for økende buksmerter i starten.
- Naloxegol (evidensnivå A) har i flere studier med dosering 25 mg én gang daglig i opptil 4 uker, sammenliknet med placebo, vist bedret tarmtømming uten plagsomme bivirkninger, og er godkjent med refusjon til behandling av opioidindusert forstoppelse hos voksne som har hatt inadekvat respons på laxantia.
Basert på ovennevnte er tiltaksrekkefølgen for opioidindusert obstipasjon som følger:
- Kombinasjon av bløtgjørende og stimulerende middel (Caraceni et al., 2012). Laksantiadosen relativt til opioid-dosen (laksantia-dose/opioid-dose, ratio (LOR)) er lavere blant menn og yngre pasienter, samt hvis pasienten behandles med metadon eller har kreft som involverer abdomen (I. L. Mancini, Hanson, Neumann, & Bruera, 2000).
- Bruk av suppositorier eller klyster
- Digital fjerning
- Forsøke opioidantagonist som metylnaltrekson eller nalexogol, ev. kombinasjonpreparat med oxycodon og naloxon (ESMO guidelines 2018 (Larkin et al., 2018))
Til tross for kombinasjonsbehandling vil manifest, refraktær obstipasjon likevel ofte kreve hospitalisering og intensiv tarmtømming over flere dager. Slike belastende tømningsregimer tolereres ofte dårlig. Etter en gjennomgang av relevante studier, har man konkludert med at en innen palliasjon kan ha nytte av å følge gastroenterologiske retningslinjer for en supplerende utredning (K. Clark & Currow, 2012) for å skille mellom a) forstyrret nevro-muskulær funksjon i colon og b) forstyrret nevro-muskulær funksjon i defekasjons-strukturer. Utredningen kan inkludere blant annet måling av oroanal transitt-tid, anorektal manometri eller ballong ekspulsjons-test. Effekten av denne utvidede algoritmen er foreløpig ikke vitenskapelig dokumentert. Dersom slik ekstra utredning ikke fører fram, kan følgende konservative tiltak forsøkes, samtidig som den forebyggende behandlingen fortsettes (evidensnivå C):
- Retrograd tømning med gjentatte miniklyster med glyserol eller miniklyster/stikkpiller med bisakodyl. Fullstendig rektal lavage med temperert, isotont saltvann i doser på 1–2 liter kan ev. vurderes.
- Antegrad tømning med perorale tarmtømningsmidler som natriumfosfatsalter eller makrogol
- Makrogol kan være et godt alternativ for pasienter som klarer å drikke større væskemengder (4–8 poser makrogol løses i ½–1 l vann)
- Digital fjerning av impaktert fæces i rektumampullen, ev. i narkose eller diazepam-sedasjon, etter forutgående bløtgjøring med glyserol
- Erfaringsmessig finnes det enkelte tilfeller av ikke-obstruktiv obstipasjon der alle konservative tiltak viser seg utilstrekkelige. Invasiv intervensjon må da vurderes. En avlastende ileostomi kan i slike tilfeller også gi gevinst i form av at stadige sykehusinnleggelser med gjentatte, ofte svært belastende tømninger kan unngås.
Medikamentell behandling av obstruktiv obstipasjon
Oversikten over de ulike årsakene til obstruktiv obstipasjon viser at denne tilstanden sjelden oppstår akutt. Dermed følger også at klassisk strangulasjon av tarm er sjelden, og at akutt kirurgi derfor sjelden er indisert. Ved mekanisk obstruksjon skal man alltid først overveie invasiv intervensjon (se kapittel Malign obstruksjon i mage-tarmkanalen), før andre tiltak vurderes.
Aktuelle invasive tiltak:
- Endoskopisk dilatasjon, debulking eller stenting
- Palliativ reseksjon
- Bypass-operasjon (enterogastro-, entero-entero- eller enterocolon anastomose)
- Anleggelse av gastro-, entero- eller colostomi. Anleggelse av en enkel, toløpet bøyle-ileostomi er som regel et lite belastende inngrep, som av og til kan utføres i lokalanestesi.
I den aktuelle pasientpopulasjonen er det viktig å finne riktig balanse mellom potensiell risiko og gevinst. Følgende overveielser bør gjøres når man skal velge mellom invasiv eller non-invasiv (medikamentell) behandling:
- Pasientens ønsker
- Prognose, inkludert forventet levetid (hvis måned(-er), taler det for invasiv)
- Klinisk tilstand (alder, komorbiditet, ernæringsstatus, stadium av sykdom)
- Funn ved kartlegging av obstruksjonen (antall, nivå, årsak)
- Aktuelle invasive tiltak (gjennomførbarhet, effekt, risiko, gevinst)
Beslutningen om å utsette en sterkt redusert kreftpasient for et kirurgisk inngrep, må alltid treffes på grunnlag av en grundig analyse av pasientens totale situasjon, og aldri utelukkende på grunnlag av objektive funn.
Dersom invasive tiltak ikke er aktuelt, eller det dreier seg om partiell obstruksjon som foreløpig ikke er aktuell for invasive tiltak, kan konservativ, medikamentell behandling gi god symptomlindring. Initialt forsøkes behandling etter de prinsipper som er beskrevet under ikke-obstruktiv obstipasjon. Dersom nødvendig, forsøkes medikamentell behandling av tarmobstruksjon/ileus, se Malign obstruksjon i mage-tarmkanalen.
Alternative, ikke-medikamentelle metoder
Misrakasneham er brukt i tradisjonell indisk medisin. Middelet inneholder olje, melk og 21 ulike urter. Det synes å være like effektivt, og med samme grad av bivirkning, som senna (evidensnivå C) (Ramesh, Kumar, Rajagopal, Balachandran, & Warrier, 1998). En systematisk gjennomgang av litteraturen fant ingen påviselig effekt av massasje eller aromaterapi (evidensnivå B) (Shin et al., 2016).
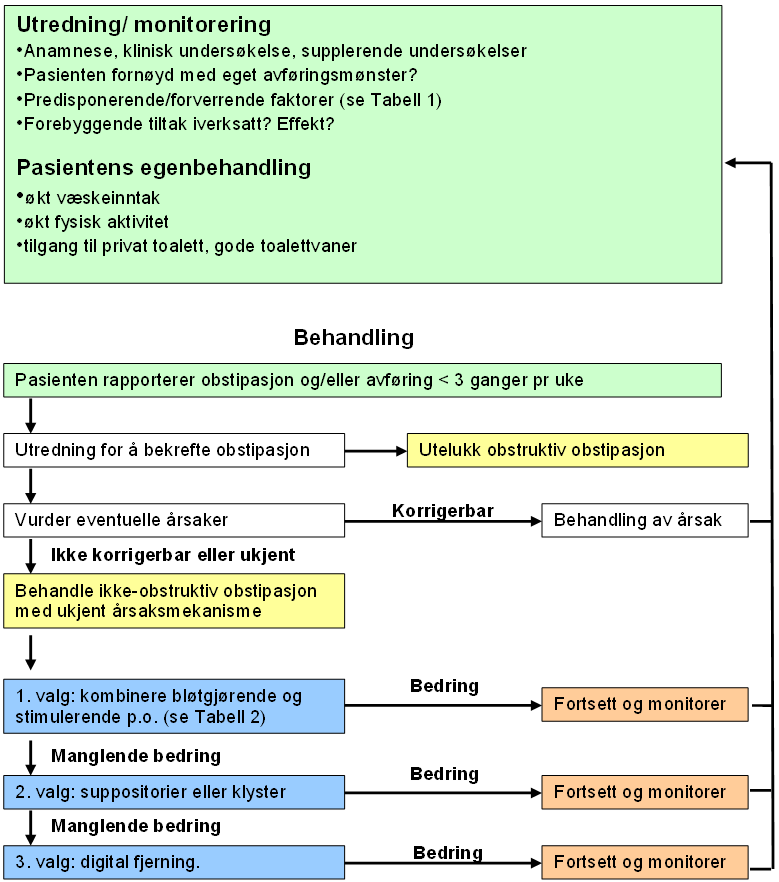
Ved opioidindusert obstipasjon kan opioidantagonister prøves i tillegg ved manglende effekt av de beskrevne behandlingstiltak (se ESMO guidelines 2018 (Larkin et al., 2018)).
Malign obstruksjon i mage-tarmkanalen
Sist faglig oppdatert: 14.10.2019
Definisjon
Malign obstruksjon i mage-tarmkanalen er en tilstand med delvis eller fullstendig mekanisk okklusjon av fordøyelseskanalen på bakgrunn av kreftsykdom. Dette gir endringer av fysiologiske funksjoner som medfører symptomer, og som kan utvikle seg til livstruende tilstander.
Etiologi og forekomst
Malign obstruksjon i mage-tarmkanalen kan forårsakes både av primære svulster i mage-tarmkanalen, innvekst fra andre primærsvulster (for eksempel gynekologisk kreft) og av metastaser (for eksempel fra brystkreft eller malignt melanom). Prinsipielt kan alle deler av fordøyelseskanalen fra øsofagus til analåpningen rammes. Forekomsten varierer sterkt i de ulike avsnitt. De vanligste lokalisasjoner er i tynntarm, tykk- eller endetarm, sjeldnere i distale øsofagus og ventrikkel/duodenum.
Dette avsnittet omhandler generelle anbefalinger for pasienter der målsettingen er symptomlindring, der kurativ behandling av obstruksjonen ikke er aktuell.
Generelle prinsipper for utredning og behandling
Håndtering av malign obstruksjon i mage-tarmkanalen tar sikte på best mulig symptomkontroll basert på adekvat, men samtidig skånsom utredning av pasienten. Grunnlaget for behandlingen er å definere et realistisk behandlingsmål ut fra pasientens generelle tilstand, sykdomsstadium, konkrete undersøkelsesresultater samt forventet livslengde. En strukturert og hensiktsmessig utredning er en viktig forutsetning for valg av en minst mulig belastende, men samtidig effektiv behandling. Invasive tiltak må veies opp mot ikke-invasive/medikamentelle behandlingsalternativer. Utredning og valg av behandling bør helst skje i et samarbeid mellom aktuelle medisinske spesialiteter.
Kommunikasjon med pasienten og pårørende om forventninger og ønsker i forhold til realistiske behandlingsmuligheter er viktig i denne prosessen. Valg av behandling må i størst mulig grad ta hensyn til pasientens ønsker. Det er særlig viktig å formidle informasjon om andre, ikke-invasive behandlingsalternativer når invasive tiltak ikke kan anbefales.
Øsofagus
Stenosesymptomer er hovedsymptom ved spiserørskreft, fra ulike grader av dysfagi til fullstendig opphevet passasje. Flertallet av pasientene (ca 75 %) er ikke kandidater for kurativ behandling ut fra sykdomsutbredelsen ved diagnosetidspunktet. I tillegg vil en del pasienter som initialt behandles med kurativ intensjon, trenge palliativ behandling på grunn av sykdomsprogresjon.
Innleggelse av selvekspanderende metallstent (SEMS) er det viktigste tiltaket for å behandle passasjeforstyrrelser og perforasjon. For supplerende opplysninger og evidensgradering vises det til Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av spiserørskreft:
Ventrikkel og duodenum
Obstruksjoner i øvre del av mage-tarmkanalen kan forårsakes av primær ventrikkelkreft, duodenalkreft eller andre kreftsykdommer som hindrer passasjen gjennom ventrikkel og duodenum (Gastric outlet obstruksjon). De viktigste behandlingsalternativene er ventrikkelreseksjon i palliativ hensikt, bypassoperasjon eller selvekspanderende metallstent i duodenum (SEMS).
Det er først og fremst symptomer (blødning fra tumor eller obstruksjon) som er viktig å vurdere. I tillegg er pasientens alder og allmentilstand, sykdomsutbredelse og forventet levetid av betydning ved valg av behandling hos enkeltpasienter:
- Palliativ reseksjon er indisert ved symptomgivende tumor dersom tumor er resektabel og pasienten er i god allmenntilstand med relativt lang forventet levetid (anslagsvis >6 måneder).
- Bypass-operasjoner (gastro-enterostomi) har bedre langtidsresultater sammenlignet med SEMS og bør overveies ved gastric outlet obstruksjon som skyldes ikke-resektabel tumor hos en pasient med en forventet levetid >3 måneder (Jeurnink et al., 2007)
- Selvekspanderende metallstent settes inn endoskopisk og anbefales som en mindre invasiv metode hos pasienter med langtkommet sykdom og kort forventet levetid. Korttidsresultatene anses som bedre sammenlignet med bypasskirurgi, men det forekommer hyppigere reokklusjon med behov for nye prosedyrer (Jeurnink et al., 2007). Stent vil likevel være det foretrukne alternativet for de fleste pasientene.
- Perkutan gastrostomi, enten endoskopisk (PEG) eller radiologisk, kan overveies som en mini-invasiv avlastning ved obstruksjoner som ikke kan behandles med ovennevnte metoder (Campagnutta & Cannizzaro, 2000).
For supplerende opplysninger og evidensgradering vises det til Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av ventrikkelcancer (kreft i magesekken): https://helsedirektoratet.no/retningslinjer/nasjonalt-handlingsprogram-med-retningslinjer-for-diagnostikk-behandling-og-oppfolging-av-kreft-i-magesekken-ventrikkelkreft
Galleveier
Definisjon
Malign obstruksjon av galleveiene defineres som delvis eller komplett avløpshinder forårsaket av stenoser/strikturer i gallegangene på bakgrunn av malign sykdom. Vanligvis er obstruksjonen lokalisert til de ekstrahepatiske galleveiene, men stenoser kan forekomme på alle nivåer.
Avlastning av galleveier er viktig i palliativ sammenheng, først og fremst hos pasienter med symptomgivende ikterus (kløe, kolangitt). Hovedmålsetting er å bedre livskvaliteten hos disse pasientene (Abraham, Barkun, & Barkun, 2002).
Etiologi og forekomst
Den vanligste årsaken til malign gallegangsobstruksjon er pankreaskreft (bukspyttkjertelkreft). Minst 80 % av pasientene med periampullære pancreassvulster har kliniske tegn til kolestase (ikterus, hudkløe) på diagnosetidspunktet (Gouma, Busch, & Van Gulik, 2006). Primære kreftsvulster i galleveiene er relativt sjeldne, men obstruksjonstegn er vanlig også hos disse pasientene (Singhal, van Gulik, & Gouma, 2005). De ekstrahepatiske galleveier kan i tillegg obstrueres ved ytre trykk («masse-effekt») på grunn av andre maligne lesjoner (for eksempel lymfeknutemetastaser) lokalisert til leverhilus eller i ligamentum hepatoduodenale.
Benigne årsaker til obstruksjon kan også forekomme hos kreftpasienter.
Utredning
Anamnese og klinisk undersøkelse
Kliniske symptomer og tegn på ekstrahepatisk kolestase er ikterus, mørk urin, lys avføring og ofte hudkløe. Generelle symptomer som kvalme, nedsatt appetitt og vekttap er også vanlige. Det er viktig å få fram om det har vært symptomer på kolangitt (feber, smerter, frysninger) hos pasienter med galleveisobstruksjon.
Supplerende undersøkelser
Ultralydundersøkelse av lever/galleveier og pankreas gjøres først. Undersøkelsen kan avdekke om det er tegn til dilaterte galleveier (intra- eller ekstrahepatisk), tumorforandringer i pankreas, suspekte lesjoner i lever eller ascites. Ytterligere bildediagnostikk omfatter CT, gjerne supplert med MR og MRCP, eller endoskopisk ultrasonografi (EUS). ERCP brukes nå nesten utelukkende i terapeutisk sammenheng (Szklaruk, Tamm, & Charnsangavej, 2002).
Den kliniske utredningen skal bidra til:
- å identifisere de pasientene som ut fra sin generelle allmenntilstand og sykdomsstadium/‑utbredelse ikke kan tilbys omfattende («kurativ») kirurgi, men som kan ha nytte av palliative intervensjoner eller andre tiltak for å lindre plagsomme symptomer
- å identifisere de pasientene som kan ha nytte av onkologisk behandling
- å velge en mest mulig skånsom og effektiv metode for avlastning av galleveier ut fra pasientens symptomer og plager, og på bakgrunn av de foreliggende sykdomsforandringer. Vurdering av den enkelte pasient bør skje i samarbeid mellom gastrokirurg, onkolog, radiolog, gastroenterolog og palliativmedisiner. En rasjonell og adekvat utredning danner grunnlaget for en god behandlingsplan. Både muligheter for underbehandling og risiko for nytteløs overbehandling er viktige aspekter å ta hensyn til i denne sammenhengen.
Indikasjoner for avlastning av galleveiene:
- Lindre subjektive symptomer på grunn av ikterus (hudkløe)
- Behandle/forebygge infeksjon (kolangitt)
- Lindre smerter
Behandling
Palliativ avlastning av galleveisobstruksjon gjøres nå i hovedsak ved mini-invasive prosedyrer (Artifon et al., 2006; Espat, Brennan, & Conlon, 1999; Gouma et al., 2006). Behandling med interne gallestenter gir effektiv og skånsom avlastning (evidensnivå C). Selvekspanderende metallstenter (SEMS) har fordeler framfor plaststenter, som oftere disloseres eller okkluderes (Moss, Morris, & Mac Mathuna, 2006; Prat et al., 1998) (evidensnivå B).
Den endoskopiske metoden (terapeutisk ERCP m/innleggelse av stent) er vanligvis den foretrukne. Ultralydveiledet perkutan transhepatisk kolangiografi og drenasje (PTC/PTD) er et godt alternativ (van Delden & Lameris, 2008), men reserveres vanligvis for pasienter der endoskopisk stentbehandling ikke er mulig eller mislykkes (evidensnivå C).
Fotodynamisk endoskopisk behandling (PDT) av gallegangsstrikturer har vist lovende resultater, også i kombinasjon med stentbehandling eller kirurgi (Müller et al., 2005; Ortner et al., 2003; Rauws, 2006; Witzigmann et al., 2006) (evidensnivå B).
Hvilken plass operative palliative prosedyrer skal ha, er fortsatt gjenstand for diskusjon (Connor et al., 2007). Flere metoder er mulige, men by-pass ved hjelp av segment III kolangio-jejunostomi blir ofte benyttet (Traynor, Castaing, & Bismuth, 1987). Høy prosedyrerelatert mortalitet (6–12 %) og komplikasjonsrate (17–51 %) gjør at ikke-operative metoder vurderes som mer egnet for denne pasientgruppen (Singhal et al., 2005) (evidensnivå C).
Tynntarm, tykktarm og endetarm
Definisjon, etiologi og forekomst
Malign tarmobstruksjon er en tilstand med delvis eller komplett opphevet passasje i tarmen på bakgrunn av malign sykdom.
Tilstanden forekommer hyppigst hos pasienter med langtkommen gastro-intestinal kreftsykdom og gynekologisk kreftsykdom, oftest eggstokkreft (ovarialcancer). Prevalensen angitt i ulike studier ligger mellom 5 og 42 % hos pasienter medeggstokkreft, og mellom 10 og 28 % hos pasienter med kolorektalkreft (Ripamonti, 1994). Metastaserende brystkreft og malignt melanom er de hyppigste ekstra-abdominale kreftsykdommer som forårsaker malign tarmobstruksjon. Hos opp til 1/3 av pasientene med mistenkt malign tarmobstruksjon foreligger en benign årsak (hyppigst obstipasjon, adheranser/arr, fibrose etter strålebehandling, innvendig herniering/strangulasjon – obs inneklemt brokk).
Differensialdiagnostisk må man tenke på neuromuskulære forstyrrelser som kan gi et funksjonelt stopp i tarmpassasjen (pseudoobstruksjon).
Utredning
Anamnese
Tarmobstruksjon kan være komplett eller inkomplett med ett eller flere obstruksjonsnivåer. De hyppigste symptomer er magesmerter, kvalme, oppkast og utspilt mage. Konstante smerter skyldes distensjon av tarm, mens takvise smerter forårsakes av tarmkontraksjoner.
|
| Høyt hinder | Tynntarmshinder | Lavt hinder |
|---|---|---|---|
| Brekninger | +++ | ++ | + |
| Utspilt abdomen | – | ++ | +++ |
| Takvise smerter | – | ++ | –/+ |
Klinisk undersøkelse
Generell klinisk undersøkelse med grundig undersøkelse av abdomen, som inkluderer inspeksjon, auskultasjon, perkusjon, palpasjon og rektal eksplorasjon.
Supplerende undersøkelser
Multidetektor-CT anbefales som førstevalg ved utredning av malign tarmobstruksjon (Hodel et al., 2009) (evidensnivå C). Denne metoden har både sensitivitet og spesifisitet >90 %, og svært høy diagnostisk treffsikkerhet når det gjelder sykdomsutbredelse og obstruksjonsnivå(er). Treffsikkerhet av rtg. oversikt abdomen er mye lavere og tillater i mye mindre grad diagnostikk av nivå, type og utbredelse av obstruksjonen enn CT. Undersøkelser med bariumkontrast (tarmpassasje, rtg. colon) utføres kun på spesielle indikasjoner, og bør i så fall gjøres etter CT-diagnostikk, da bariumrester i tarmene vil redusere kvaliteten av CT-undersøkelser.
Målet for utredningen er å kartlegge:
- Forekomst av mekanisk obstruksjon eller funksjonell tilstand
- Årsaken(e) til obstruksjonen
- Nivå og antall av obstruksjon(er)
Behandling
Valg av behandling er avhengig av pasientens ønsker og kliniske tilstand (alder, komorbiditet, ernæringsstatus, sykdomsstadium), funn ved supplerende undersøkelser (årsak til og nivå, antall og grad av obstruksjon) og aktuelle behandlingsalternativer.
Vurdering bør skje i et team av spesialister fra ulike fagområder (gastrokirurg, onkolog, palliativmedisiner, radiolog), og må også omfatte onkologiske behandlingsmuligheter.
Viktige faktorer for behandlingsvalg:
- Mekanisk obstruksjon eller funksjonell årsak?
- Hvilke intervensjoner er realistiske og gjennomførbare?
- Hvilken prosedyre er den mest effektive og skånsomme?
- Hvilken risiko er knyttet til en eventuell prosedyre?
Tilgjengelige behandlingsalternativer omfatter hele spekteret av intervensjoner, fra åpen kirurgi til mini-invasive prosedyrer (endoskopi, intervensjonsradiologi). Indikasjonsstillingen krever en nøye avveining av risiko for uønskede følger av behandlingen mot forventet gevinst. Dette er spesielt viktig når behandlingsintensjonen er bedring av livskvalitet.
Kirurgi
Kirurgi inkluderer åpne og laparoskopiske inngrep: Anleggelse av stomi, bypass- operasjon og ev. reseksjon (evidensnivå C). Ved proksimal stomi bør gevinsten vurderes mot problemer knyttet til «high output» stomi (>1000 ml sekresjon per døgn).
Dersom man bestemmer seg for et kirurgisk inngrep, skal pasienten ha optimal pre- og postoperativ behandling og pleie. Inngrepet bør gjøres elektivt av erfarne og interesserte kirurger.
Kontraindikasjoner mot abdominalkirurgi:
- Pasienten ønsker ikke inngrepet
- Redusert allmenntilstand
- Uttalt karsinomatose og/eller ascites
- Obstruksjon på flere nivåer
- Kort forventet levetid
- Andre faktorer som høy alder, komorbiditet, dårlig ernæringsstatus, utbredt malign sykdom
- Tidligere palliative kirurgiske inngrep
Endoskopiske prosedyrer
- Selv-ekspanderende metallstent (SEMS): Det er beskrevet en suksessrate på > 94 % for plassering av stent, og en klinisk responsrate på vel 90 % (Sebastian, Johnston, Geoghegan, Torreggiani, & Buckley, 2004) (evidensnivå B). En nylig publisert norsk multisenter studie viser signifikant forbedring av pasientenes opplevelse av obstruksjonssymptomer to uker etter stentbehandling, og signifikant forbedret opplevelse av generell helsetilstand (L. Larssen et al., 2011) (evidensnivå B). Flertallet av colonstentene fungerte bra etter 3 måneder (78 %) og 6 måneder (60 %), med behov for median én re-intervensjon hos pasienter med stentokklusjon, de aller fleste som endoskopisk prosedyre (Lene Larssen et al., 2012) (evidensnivå B). Stenter kan tettes til av tarminnhold eller tumorinnvekst. Stentmigrasjon ses i forbindelse med tumorreduksjon som følge av onkologisk behandling, og ved innvekst av tumor utenfra. Endoskopiske prosedyrer bør utføres under iv analgesi og sedasjon, og tolereres som regel godt.
- Distale rectumtumores egner seg ikke for stenting
- Endoskopisk behandling av blødninger eller tumor ved hjelp av Argon plasma koagulasjon
- Endoskopisk Laserbehandling (tumorreduksjon)
Perkutan endoskopisk gastrostomi (PEG)
PEG-sonde kan gi en effektiv avlastning av mage-tarmkanalen ved høye obstruksjoner, men også hos pasienter der kirurgisk behandling ikke er aktuell (Meyer & Pothuri, 2006) (evidensnivå C). PEG-sonden kan erstatte naso-gastrisk sonde, som oppleves ubehagelig av de fleste. PEG gir dessuten mulighet for å drikke, og man kan også vurdere å gi medikamenter via PEG-sonden.
Prosedyren utføres ved hjelp av gastroskopi i lett sedasjon og tåles godt. Ascites og/eller lokal tumorvekst omkring ventrikkel anses ikke lenger som absolutte kontraindikasjoner (Pothuri et al., 2005). Alternativ til endoskopisk anleggelse er perkutan gastrostomi som intervensjonsradiologisk prosedyre.
Medikamentell behandling ved malign tarmobstruksjon
Medikamentell behandling av malign tarmobstruksjon skal benyttes når intervensjonsbasert behandling ikke er indisert eller mulig, eller som adjuvans ved en prosedyre. Behandlingen retter seg hovedsakelig mot følgende symptomer:
- Smerter
- Kvalme og brekninger
- Kolikk og sekresjon
Alle medikamenter gis parenteralt.
Smerter: Kontinuerlig subcutan tilførsel av morfin i dosering tilsvarende 1/3–1/2 peroral døgndose er første valg. Alternativt kan fentanylplaster brukes (se retningslinjer for smertebehandling)
Kvalme: Haloperidol 1–3 mg/d som sc infusjon initialt, kan økes til 5 mg/d. Alternativt levomepromazin sc 5–25 mg om kvelden eller som infusjon (ikke blandbart med morfin og butylskopolamin i pumpe). Metoclopramid er vanligvis kontraindisert på grunn av motilitetsstimulerende effekt.
Kolikk og væsketap/sekresjon: Anticholinergica virker lindrende på kolikksmerter ved å redusere tarmenes peristaltikk og er første valg. Butylskopolamin 60–120 mg/d i subcutan infusjon. Ved utilstrekkelig effekt gis octreotid, som lindrer kvalme og oppkast ved å hemme sekresjonen i mage-tarmkanalen; startdose 400–450 µg/d, videre 200–600 µg/d avhengig av respons. Octreotid kan ikke blandes med morfin og haloperidol i pumpe, gis derfor som sc injeksjon x 2–3, ev. i egen pumpe.
Behandling med morfin, haloperidol og butylskopolamin som kontinuerlig subcutan infusjon kalles gjerne «ileuspumpe».
Steroider kan ha effekt både på smerter, kvalme og ødem i tarmen, og kan bidra til å redusere obstruksjonssymptomer. Deksametason i dose 8–16 mg/d gitt iv eller sc x 1–2. Dette kan også forsøkes i 1–2 døgn før man tar endelig stilling til kirurgisk behandling.
Behandlingsmål:
Målet med medikamentell behandling er å gi god lindring av smerter og kvalme, at pasienten kan drikke, har ingen eller få brekninger per døgn og klarer seg uten nasogastrisk sonde.
Væske og ernæring
Når obstruksjon oppstår hos pasienter i terminalfasen (siste leveuke), skal pasienten vanligvis verken ha væske eller ernæring parenteralt. For pasienter med noe lenger forventet levetid er det viktig å sørge for adekvat væskebehandling ved store væsketap fra tarmen. Denne pasientgruppen har imidlertid ikke nytte av parenteral ernæring. Hos pasienter med bedre prognose (eks. eggstokkreft) kan parenteral ernæring gi god livskvalitet og forlenget levetid. Ved dårlig toleranse eller når pasientens sykdom forverres tross optimal behandling, trappes først parenteral ernæring og deretter væsketilførsel langsomt ned.
Delirium
Sist faglig oppdatert: 14.10.2019
Definisjon
Delirium er definert som akutt (timer eller dager) forstyrrelse av bevissthetsnivået med redusert evne til å fokusere, fastholde eller skifte oppmerksomhet. Dette kan ledsages av endringer i kognitive funksjoner, slik som nedsatt hukommelse, desorientering eller persepsjonsforstyrrelse(r) (hallusinasjoner (oftest syn) og/eller vrangforestillinger) som ikke skyldes demens. Tilstanden skal skyldes en medisinsk tilstand.
- Delirium deles i tre typer: Hyperaktiv, hypoaktiv og blandet. Ved den siste veksler pasienten mellom en slumrende tilstand (hypoaktivitet) og hyperaktiv, ofte formålsløs atferd.
- Cirka 30–35 % av delir er hyperaktive, 20–25 % er hypoaktive og 40–45 % er av blandet type
- Delirium har ofte et svingende forløp gjennom døgnet, hvor pasienten tidvis kan fremstå adekvat for så å fremby manifeste symptomer
- Såkalt terminalt delirium (under dødsprosessen) kan også være dominert av hyperaktivitet, hypoaktivitet eller veksling mellom hyper- og hypoaktivitet
Etiologi og forekomst
Delirium er den nest hyppigste psykiatriske diagnosen blant kreftpasienter, og forekomsten er rapportert mellom 20 % og 80 %. Hos de aller fleste døende observeres deliriøse symptomer (terminalt delirium).
Årsakssammenhengen er multifaktoriell, og hos de fleste kan mer enn én årsak påvises.
Av didaktiske grunner skilles mellom predisponerende og utløsende årsaker. Opioider er trolig den hyppigste utløsende årsaken hos palliative pasienter.
Basert på skjønn, presenteres her årsaker funnet relevante for palliativ medisin.
Predisponerende årsaker
- Hjerneorganisk lidelse, inklusive demens
- Tidligere hjerneskade, inklusive spredning av kreftsykdom til hjerne
- Høy alder
- Alvorlig somatisk sykdom
- Nedsatt allmenntilstand, inklusive underernæring
- Rusmiddelmisbruk
- Sansesvikt
Utløsende årsaker
- Psykoaktive legemidler med antikolinerg effekt, f.eks. opioider, benzodiazepiner, antidepressiva og antiepileptika
- Andre medikamenter, f.eks. kortikosteroider. (Obs. medikamentinteraksjoner)
- Hypoksi
- Dehydrering
- Infeksjon
- Nyre- og leversvikt
- Brå seponering av alkohol eller medikamenter
- Elektrolyttforstyrrelser, f.eks. hyperkalsemi
- Metabolske forstyrrelser, f.eks. hypoglykemi
Utredning
Årsaksrettet diagnostikk skal alltid gjennomføres hvis den kan få terapeutiske konsekvenser. Det innebærer at alle pasienter med delirium som ikke opptrer i livets aller siste fase, bør utredes. Omfanget av, og innholdet i, utredningen bør være tilpasset den kliniske situasjonen.
Anamnese
Delirium underdiagnostiseres. Det er derfor viktig å få frem og stole på rapporter fra pasient og pårørende.
I tillegg til vanlig anamneseopptak, inkludert sykehistorie, medikamenter, stimulantia og naturlige funksjoner, bør opplysninger om følgende vektlegges:
- Endring i atferd og kommunikasjon
- Endring i søvn-våkenhetssyklus
- Treg og manglende respons på stimuli
- Sviktende nærhukommelse og desorientering
Klinisk undersøkelse
Generell klinisk undersøkelse med fokus på predisponerende og utløsende årsaker, ev. supplert med nevrologisk undersøkelse.
Kognitive funksjoner må registreres systematisk som en integrert del av den kliniske undersøkelsen, f.eks. ved hjelp av MMSE kortversjon, se nedenfor.
Supplerende undersøkelser
- En rekke blodprøver kan være aktuelle, se predisponerende og utløsende faktorer
- O2-måling (pulsoksimeter-saturasjonsmåling)
- Billeddiagnostikk av hjernen er ikke indisert som standard utredning med mindre pasienten har en kreftform hvor hjerneaffeksjon er sannsynlig, eller der andre symptomer tyder på en slik genese
- Tre instrumenter kan supplere den kliniske undersøkelsen: MMSE, CAM og MDAS (se nedenfor). Alle de tre instrumentene er oversatt til norsk. De to siste er oversatt i fellesskap av fagpersoner i det palliative miljøet og ledende norske geriatere, og er tilgjengelige på hjemmesiden til Norsk Geriatrisk Forening: https://www.legeforeningen.no/foreningsledd/fagmed/norsk-forening-for-geriatri/
Mini Mental State Exam (MMSE):
MMSE måler svikt i kognitive funksjoner generelt (dvs. skiller ikke delirium og demens). Kun fire av de i alt 20 spørsmålene/oppgavene er nødvendige for å predikere delirium med høy spesifisitet og sensitivitet (> 0,90) (se ref. (Fayers et al., 2005)). De fire spørsmålene/oppgavene er å angi årstall for inneværende år, angi dagens dato, stave «sverd» baklengs og kopiere en figur.
Instrumentet anbefales ikke brukt i sin helhet med mindre en bredere kartlegging av kognitive funksjoner er ønsket
Confusion Assessment Method (CAM):
CAM er en operasjonalisering av kriteriene for delirium i DSM-IIIR, men passer også for DSM-IV. Instrumentet er velegnet for diagnostikk og monitorering av delirium.
Memorial Delirium Assessment Method (MDAS):
MDAS er utviklet for å gradere type og omfang av delirium. Instrumentet er egnet til å monitorere forløpet av delirium i klinikk eller forskning.
Aktuelle differensialdiagnoser
De mest aktuelle differensialdiagnosene er mani, psykose av annen art og demens.
- Mani er ikke ledsaget av bevissthetsforstyrrelse og svikt i kognitive funksjoner, og vil oftest opptre hos personer med kjent bipolar lidelse
- Psykoser av annen art, f.eks. paranoide psykoser, er ikke ledsaget av bevissthetsforstyrrelse og svikt i kognitive funksjoner. Som oftest vil også tilstanden være kjent fra før.
- Demens har en mer gradvis debut, og tilstanden er som oftest erkjent av nærstående familiemedlemmer eller andre. Demens er ikke ledsaget av bevissthetsforstyrrelse.
Hvis en person med kjent demens brått endrer atferd og presenterer typiske symptomer på delirium, skal den akutte tilstanden oppfattes som et delirium.
Forebygging
Aktuelle intervensjoner kan være optimalisering av søvn-våkenhetssyklus og systematisk monitorering av kognitive funksjoner, inklusive bevisshet.
Det er per i dag ikke vist at forløpet av delirium påvirkes i gunstig retning av medikamentell profylakse med f.eks. haloperidol. Enkelte geriatriske sentra gir likevel haloperidol profylaktisk til eldre pasienter innlagt etter hoftebrudd og med høy risiko for utvikling av delirium.
På tross av begrenset evidens, kan det være grunnlag for å systematisk monitorere og ev. sette inn tiltak overfor definerte symptomer i utvalgte grupper av palliative pasienter med antatt høy risiko, f.eks. pasienter innlagt på palliative enheter. Litteraturen kan indikere at søvnforstyrrelse er et velegnet symptom å monitorere med hensyn på forebyggende intervensjoner.
Behandling
Før symptomrettet behandling igangsettes, må legen og det øvrige behandlingsteamet vurdere mulige årsaker til tilstanden, hvor behandlingen best bør finne sted, hvem som skal informeres om tilstanden og behandlingen, og hvordan informasjonen best kan gis.
Årsaksrettet behandling (oksygenering, rehydrering, dosereduksjon av medikamenter osv.) skal alltid tilstrebes og igangsettes på klinisk indikasjon. Slik behandling er som regel ikke aktuell ved terminalt delirium.
Et hyperaktivt delirium vil ofte ledsages av usikkerhet blant personalet på posten hvor pasienten er innlagt. God informasjon og planlegging av behandlingen for et definert tidsrom vil vanligvis gi den ro rundt pasienten som tilstanden krever. For både pasient og pårørende er delirium skremmende, og tilpasset informasjon til disse er derfor også viktig.
Miljømessige tiltak
Følgende tiltak anbefales for å tilrettelegge miljøet rundt pasienten:
- Stimulus-begrensning
- Markering av døgnrytme
- Realitetsorientering
- Stabil personalkontakt
- Introduksjon av kjente objekter/personer
- Fysisk aktivitet
Det er svak vitenskapelig dokumentasjon både for miljømessige tiltak og informasjon, men tiltakene må likevel anses som en ønsket standard for pleie av pasienter med delirium.
Medikamentell behandling:
I de siste anbefalinger fra ESMO er medikamentell intervensjon betydelig nedtonet, da man ikke finner studier som støtter effekt av medikamentell behandling. Fokus skal være interaksjonsproblematikk og ev. seponering (ESMO 2018 (Bush et al., 2018)).
Haloperidol har tradisjonelt vært førstevalgspreparat basert på foreliggende dokumentasjon, bivirkninger/kontraindikasjoner og klinisk erfaring.
Klinisk er det god erfaring for at haloperidol tolereres av de fleste, at akutte dystonier (mest aktuelle akutte bivirkning) sjelden observeres og at døgndosen ofte er for lav.
Optimal dosering og doseringsintervall for haloperidol er sprikende og lite studert. En vanlig dosering er 0,5–2 mg po inntil 4 ganger/døgn, ev. 0,5 mg iv hver halve time inntil effekt.
Flere av de andre medikamentene har bivirkninger og/eller kontraindikasjoner som begrenser bruksområdet vesentlig. F.eks. får de nyere, såkalte atypiske antipsykotika (olanzapine og risperidone) for tiden tiltagende oppmerksomhet på grunn av kardiovaskulære bivirkninger.
Tabell 4.7
| Medikament | Evidens-nivå | Indikasjon | Døgndose (peroral) | Kontraindikasjoner | Bivirkninger |
|---|---|---|---|---|---|
| Haloperidol | A–B | Delirium | 0,8–28 mg | Forlenget QT-tid | Ekstrapyramidale |
| Risperidone | B | Delirium | 0,5–2 mg | Kardiovaskulær lidelse / økt risiko for slik lidelse | Kardiovaskulære hendelser |
| Olanzapine | B | Delirium | 2,5–13,5 mg | Kardiovaskulær lidelse / økt risiko for slik lidelse | Kardiovaskulære hendelser |
| Klorpromazine | B | Delirium | 10–70 mg | Nedsatt bevissthet grunnet intoksikasjon | Ekstrapyramidale, sedasjon, blodtrykksfall |
| Midazolam | B | Uro, agitasjon | 10–30 mg (iv)2 | Kjent overfølsomhet | Respirasjons-depresjon |
| Klometiazol | C | Uro, agitasjon | 300 mg x 3–4 / 600 mg vesp | Svekket lungefunksjon | Blodtrykksfall, forstyrret respirasjon |
Juridiske aspekter
Behandling av delirium kan innebære både
- Behandling i form av injeksjon av psykofarmaka
- Repetert injeksjon av psykofarmaka mens pasienten holdes
En pasient med delirium vil ofte ikke være samtykkekompetent. Helsepersonellet må vurdere samtykkekompetansen før behandlingstiltaket iverksettes.
For en pasient over 18 år som ikke er samtykkekompetent, og ikke yter motstand, kan pasient- og brukerrettighetsloven § 4‑6 komme til anvendelse, dersom bestemmelsens vilkår vurderes oppfylt. Behandling kan da besluttes av den som er ansvarlig for helsehjelpen.
Dersom pasient som ikke er samtykkekompetent, yter motstand mot behandlingen, vil pasient- og brukerrettighetsloven kap. Symptomer og tilstander, unntaksvis kunne komme til anvendelse. Det forutsettes da at legemiddelet/behandling med psykofarmaka kun skal anvendes i en tidsavgrenset periode, hvor formålet er å komme i posisjon til å behandle den underliggende kreftsykdommen/smertetilstanden. Vilkårene i loven må vurderes i hvert konkrete tilfelle, med grunnlag i pasientens situasjon. Vedtak treffes da av den som er ansvarlig for helsehjelpen.
Behandling av deliriøse symptomer i livets aller siste fase
- Årsaksrettet behandling eller medikamentell behandling av hypoaktive, deliriøse symptomer er hos de langt fleste ikke indisert
- Hyperaktive, deliriøse symptomer bør vurderes med hensyn på korrigerbare årsaker (smerte, dehydrering, hypoksi, panikkangst osv.). Behandling med siktemål å sedere pasienten bør initieres.
- Dersom sedering er indisert, er trolig midazolam mest anvendelig. Alternativet kan være å øke dosen av annen aktuell medikasjon (som haloperidol) til ønsket grad av sedasjon oppnås. Medikamenter bør i denne fasen titreres inntil ønsket effekt er oppnådd. Vanligvis trengs lavere doser enn i andre situasjoner. Doseringsforslag: Midazolam, 5-10 mg/døgn sc som startdose.
Kilder
American Psychiatric Association. Diagnostic and statistical manual of mental disorders: DSM-IV. 4 utg. Washington, D.C: APA; 1994.
Aizawa K, Kanai T, Saikawa Y, Takabayashi T, Kawano Y, Miyazawa N, et al. A novel approach to the prevention of postoperative delirium in the elderly after gastrointestinal surgery. Surg Today 2002;32(4):310-4.
Breitbart W, Strout D. Delirium in the terminally ill. Clin Geriatr Med 2000;16(2):357-72.
Breitbart W, Gibson C, Tremblay A. The delirium experience: delirium recall and delirium-related distress in hospitalized patients with cancer, their spouses/caregivers, and their nurses. Psychosomatics 2002;43(3):183-94.
Centeno C, Sanz A, Bruera E. Delirium in advanced cancer patients. Palliat Med 2004;18(3):184-94.
Cole MG. Delirium: effectiveness of systematic interventions. Dement Geriatr Cogn Disord 1999;10(5):406-11.
Fainsinger RL, De Moissac D, Mancini I, Oneschuk D. Sedation for delirium and other symptoms in terminally ill patients in Edmonton. J Palliat Care 2000;16(2):5-10.
Fainsinger RL, Waller A, Bercovici M, Bengtson K, Landman W, Hosking M, et al. A multicentre international study of sedation for uncontrolled symptoms in terminally ill patients. Palliat Med 2000;14(4):257-65.
Hjermstad M, Loge JH, Kaasa S. Methods for assessment of cognitive failure and delirium in palliative care patients: implications for practice and research. Palliat Med 2004;18(6):494-506.
Inouye SK, Bogardus ST, Jr., Charpentier PA, Leo-Summers L, Acampora D, Holford TR, et al. A multicomponent intervention to prevent delirium in hospitalized older patients. N Engl J Med 1999;340(9):669-76.
Lawlor PG, Gagnon B, Mancini IL, Pereira JL, Hanson J, Suarez-Almazor ME, et al. Occurrence, causes, and outcome of delirium in patients with advanced cancer: a prospective study. Arch Intern Med 2000;160(6):786-94.
Marcantonio ER, Flacker JM, Wright RJ, Resnick NM. Reducing delirium after hip fracture: a randomized trial. J Am Geriatr Soc 2001;49(5):516-22.
Morita T, Tei Y, Tsunoda J, Inoue S, Chihara S. Underlying pathologies and their associations with clinical features in terminal delirium of cancer patients. J Pain Symptom Manage 2001;22(6):997-1006.
Ranhoff AH. Medikamentell behandling av delilrium hos eldre. Tidsskr Nor Laegeforen 2004;124(23):3072-4.
Rockwood K, Bhat R. Should we think before we treat delirium? Intern Med J 2004;34(3):76-8.
Terapianbefaling: Medikamentell behandling av atferdsforstyrrelser og psykologiske symptomer (BPSD) hos personer med demens. Oslo: Statens legemiddelverk; 2004.
Weber JB, Coverdale JH, Kunik ME. Delirium: current trends in prevention and treatment. Intern Med J 2004;34(3):115-21.
Malign medullakompresjon
Sist faglig oppdatert: 14.10.2019
Definisjon og problemstilling
Malign medullakompresjon (MMK) er en tilstand med kompresjon av medulla spinalis og/eller cauda equina som følge av tumorvekst inn i spinalkanalen og/eller intramedullære metastaser (Ropper & Ropper, 2017). Oftest skyldes dette metastaser i ryggsøylen, men meningeal eller intraspinal tumorvekst kan også forekomme. Kompresjon av conus medullaris og cauda equina har liknende etiologi og behandling. Nevrologisk status før behandlingen, og varighet av eventuelle nevrologiske utfall, er de viktigste prognostiske faktorene for funksjon etter behandlingen (George, Jeba, Ramkumar, Chacko, & Tharyan, 2015; Metastatic spinal cord compression in adults, 2014; Metastatic spinal cord compression in adults: risk assessment, diagnosis and management, 2008). Å fatte mistanke tidlig om at pasienten kan ha medullakompresjon, og å iverksette korrekte tiltak raskt, er sentralt for å opprettholde pasientens funksjonsnivå. Standardisert pasientforløp anbefales benyttet for å sikre god pasientbehandling (På liv og død: palliasjon til alvorlig syke og døende, 2017). Som eksempler kan Oslo universitetssykehus (Malign medullakompresjon (MMK) - Standardisert pasientforløp. I: eHåndboken for Oslo universitetssykehus, 2018) og St. Olavs hospitals (Standardisert pasientforløp: Malign medullakompresjon, 2018) pasientforløp for malign medullakompresjon nevnes.
Epidemiologi, etiologi og patogenese
Insidensen av medullakompresjon hos kreftpasienter er omkring 1–6 %. De fleste pasientene er over 50 år gamle. Lungekreft, prostatakreft, myelomatose og brystkreft er de hyppigst forekommende primærdiagnosene. Myelomatose, lymfom og prostatakreft har høyest sykdomsspesifikk insidens av medullakompresjon (Mak et al., 2011). Medullakompresjon kan være første symptom på kreftsykdom: i 20 % av tilfellene foreligger ingen erkjent kreftdiagnose. De fleste tilfeller av medullakompresjon forekommer i thorakalcolumna og lumbalcolumna, mens tilstanden oppstår sjeldnere i cervicalcolumna. Opptil 1/3 av pasientene har multiple affeksjonsnivåer (George et al., 2015; Ropper & Ropper, 2017).
De vanligste mekanismene ved medullakompresjon er direkte tumorvekst inn i epiduralrommet av metastaser i virvelcorpora og patologisk fraktur av virvelcorpora med fragmentering og spinal instabilitet. Vekst inn i spinalkanalen gjennom nevroforamina kan forekomme fra en paraspinal tumor, ved f.eks. lymfom. I sjeldne tilfeller kan malign medullakompresjon forårsakes av metastaser til ryggmargshinner, såkalt leptomeningeal karsinomatose, eller av metastaser til selve ryggmargen (Metastatic spinal cord compression in adults: risk assessment, diagnosis and management, 2008). Irreversibel ryggmargsskade skyldes ischemi.
Utredning
Ved ikke tidligere kjent kreftdiagnose og flere aktuelle differensialdiagnoser, er det spesielt viktig med en bred diagnostisk tilnærming, inkludert orienterende blodprøver, tumormarkører, aktuell bildediagnostikk og biopsi. Dette for å utelukke tilstander hvor behandlingsopplegget avviker fra primær strålebehandling eller kirurgi (f.eks. nydiagnostisert metastatisk prostatakreft, lymfom og småcellet lungekreft).
Anamnese og klinisk undersøkelse
Ryggsmerter er vanligste symptom ved medullakompresjon, og forekommer hos ca. 90 % av pasientene (George et al., 2015). Smertene kan debutere uker til måneder før diagnose og er oftest progressive, både i intensitet og utbredelse. Det er vanlig med en kombinasjon av nevropatisk og nociseptiv smerte, som ofte forverres av hoste, nysing eller Valsalva manøver. Det er ikke alltid godt samsvar mellom smertenivå og nivå for strukturell kompresjon (Levack et al., 2002). Nevrologiske symptomer utvikles ofte gradvis i løpet av uker til måneder etter smertedebut, men forløpet kan også være langt mer akutt med utvikling av paralyse i løpet av timer til dager. Ca. ¾ av pasientene har fokale kraftsvekkelser med gangvansker som ubehandlet kan progrediere med ataksi og eventuelt paralyse som resultat. Mer enn halvparten av pasientene har registrert sensibilitetsforstyrrelser og/eller blære-/tarmsymptomer ved diagnosetidspunkt (George et al., 2015; Metastatic spinal cord compression in adults: risk assessment, diagnosis and management, 2008; Ropper & Ropper, 2017).
Klinisk undersøkelse inkluderer nevrologisk status med vurdering av kraftprestasjoner i over- og underekstremiteter og generell sensibilitet, inkludert i perineum. Spesielt bør det legges vekt på gangfunksjon (om pasienten går med eller uten støtte, eventuelt ataktisk gange), kraftprestasjoner for fleksjon/ekstensjon i hofter, knær og ankler, eventuell sensibilitetsgrense på trunkus, sfinktertonus vurdert ved rektaleksplorasjon, samt blærefunksjon.
For å kunne ta stilling til om situasjonen er stabil eller progredierende, skal nevrologisk status vurderes gjentatte ganger. Vakthavende lege, eller lege på sengepost, bør tilse pasienten minst to ganger per døgn inntil tumorrettet behandling er iverksatt. Også de første dagene etter iverksatt behandling, er det viktig å fange opp endringer og på nytt vurdere om korrekt behandling er valgt. Nevrologisk undersøkelse anbefales gjennomført daglig. Sykepleier og fysioterapeut må også ha fokus på nevrologisk funksjon og rapportere endringer til behandlingsansvarlig lege. Blæreskanning skal gjøres 1 x daglig, og oftere ved mistanke om forverring. Bruk av ASIA-Impairment scale anbefales brukt for klassifisering og dokumentasjon av nevrologisk funksjon (www.asia-spinalinjury.org):
| ASIA-A | Komplett | Ingen muskelfunksjon og ingen følelse under skadenivå |
| ASIA-B | Inkomplett | Ingen motorisk funksjon under skadenivå. Bevart sensorisk funksjon |
| ASIA-C | Inkomplett | Bevart motorisk og sensorisk funksjon under skadenivå, men ingen praktisk nyttig funksjon |
| ASIA-D | Inkomplett | Muskelfunksjon og sensorisk funksjon under skadenivå som gir praktisk nyttig funksjon (styrke 3 eller bedre på en skala fra 1–5 i 50 % av musklene under skadenivå) |
| ASIA-E | Normal | Ubetydelig nevrologiske begrensninger som følge av ryggmargsskaden |
Blodprøver
Orienterende blodprøver med hematologi, CRP, elektrolytter, nyre- og leverfunksjonsprøver kan være aktuelle både i forhold til differensialdiagnostikk og tumorstatus, hvor også analyse av aktuelle tumormarkører kan være indisert.
Bildediagnostikk
Magnetresonans, MR, er anbefalt bildediagnostikk. Retrospektive og observasjonelle prospektive studier har vist at MR har sensitivitet, spesifisitet og positiv prediktiv verdi på opp mot 95 % ved mistenkt MMK (Loblaw, Perry, Chambers, & Laperriere, 2005; Metastatic spinal cord compression in adults: risk assessment, diagnosis and management, 2008), og skiller godt mellom benign og malign årsak til MMK. MR gir også bedre framstilling av medulla enn CT.
Siden omtrent 1/3 av pasienten har medullakompresjon i to eller flere nivåer, samt at faktisk nivå for kompresjon kan korrelere dårlig med nivå for sensibilitetsforstyrrelse, skal det gjøres MR av hele columna (Cook et al., 1998; Loughrey, Collins, Todd, Brown, & Johnson, 2000). Ved manifeste nevrologiske utfall, bør MR totalcolumna utføres som øyeblikkelig hjelp. Ved symptomer fra nedre del av columna og ved radikulære smerter til underekstremitetene, bør man supplere med MR bekken med coronale snitt for å avdekke en mulig perifer nervekompresjon. Ved ev. kontraindikasjon mot MR-undersøkelse, kan det gjøres målrettet CT-undersøkelse (McCurdy & Shanholtz, 2012). CT columna av aktuelt avsnitt er nødvendig dersom pasienten skal gjennomgå kirurgi, og ved uklarhet om stabilitet.
Hittil ukjent kreftdiagnose / cancer origo incerta
Hos pasienter uten kjent kreftdiagnose, bør utredningen inneholde elementer som kan bidra til å avklare tilstanden. Det vises til Helsedirektoratets Pakkeforløp for metastaser med ukjent utgangspunkt for ytterligere detaljer.
Følgende elementer vektlegges:
- Klinisk undersøkelse: Husk å undersøke bryster, testikler og rektum/prostata
- Ad myelomatose eller solitært plasmacytom: Ved mistanke gjøres P-protein-elektroforese og P-lette kjeder for å lete etter paraprotein. Dette kan foreligge ved både solitær og utbredt sykdom, og vil vanligvis være en sterk indikator på at det foreligger en malign plasmacelleneoplasi. Benmargsutstryk vil være en rask undersøkelse for å avklare om pasienten har myelomatose.
- Ad lymfom: Mistenkes lymfom, kan behandling med steroider ødelegge for diagnostikk, ettersom man av og til oppnår rask respons. Hos pasienter med kun beskjedne utfall eller ingen utfall, må man derfor vurdere om steroider kan utsettes til biopsier er sikret.
- Tumormarkører: En rekke tumormarkører vil kunne gi mistanke om primærtumor, for eksempel: PSA (prostata-kreft), CEA (gastro-intestinal kreft) og HCG/APF (testikkel-kreft/germinalcelle-tumor)
- Histologisk undersøkelse må prioriteres hos pasienter med MMK der man ikke på forhånd har noen sikker diagnose
Dersom kirurgisk behandling av MMK er aktuelt, vil en viktig fordel være at man får materiale til histologisk undersøkelse.
Differensialdiagnoser
Osteoporotisk kompresjonsfraktur, spinal stenose og mellomvirvelskive sykdom er benigne muskelskjelett tilstander som må vurderes. Betennelser både i form av spinal epidural abscess (hvor staph. aureus, men også mycobacterium tuberculosis kan være aktuelle agens), og myelitt av forskjellige årsaker er mulige differensialdiagnoser. I etterkant av f.eks. spinal punksjon, må også muligheten for spinalt epiduralt hematom has i mente, spesielt ved trombocytopeni. Medullære infarkt kan også forekomme. Leptomeningeale metastaser kan gi både lokale, sammensatte og mer diffuse nevrologiske symptomer.
Behandling
Rask oppstart av korrekt behandling kan bidra til å bevare nevrologisk funksjon (Metastatic spinal cord compression in adults, 2014; Metastatic spinal cord compression in adults: risk assessment, diagnosis and management, 2008). Behandlingsmål inkluderer bevaring av nevrologisk funksjon, kontroll av lokal tumorvekst, ryggstabilitet samt smertelindring (McCurdy & Shanholtz, 2012). Valg av behandling må i stor grad basere seg på vurdering av pasientens totale situasjon. Primærdiagnose, utbredelse av sykdommen, tidligere behandling, foreliggende behandlingsmuligheter, alder, allmenntilstand (ECOG status), komorbiditet, kognitiv funksjon og medikamenter er sentrale faktorer for vurderingen. Estimert forventet levetid bør ligge til grunn for behandlingsvalg med tanke på forventet effekt og belastninger ved gjennomføring (George et al., 2015).
Medullakompresjon er en øyeblikkelig hjelp situasjon hvor rask intervensjon kan bidra til at man når behandlingsmål. Ved allerede tapt gangfunksjon vil bare ca ¼ av pasientene gjenvinne mobilitet ved strålebehandling (George et al., 2015). For de fleste pasientene vil kortikosteroider og strålebehandling være mest aktuell behandling. For de dårligste kan kortikosteroider alene være hensiktsmessig, mens for selekterte pasienter kan kirurgi etterfulgt av postoperativ strålebehandling gi best resultat. For hormonterapinaive pasienter med metastatisk prostatakreft anbefales medisinsk kastrasjon med LHRH antagonist eller kirurgisk kastrasjon, mens kjemoterapi er aktuelt for pasienter med småcellet lungekreft og lymfom ved medullakompresjon. (Se forøvrig de aktuelle nasjonale handlingsprogrammene).
Kortikosteroider
Kortikosteroider virker antiinflammatorisk, reduserer tumorødem og har en etablert plass i behandling av symptomgivende medullakompresjon (George et al., 2015; Metastatic spinal cord compression in adults, 2014; Metastatic spinal cord compression in adults: risk assessment, diagnosis and management, 2008). Ved MMK og manifeste nevrologiske utfall bør behandling med kortiosteroider startes så snart som mulig. Deksametason 4 mg x 4, eller methylprednisolon (Medrol R) 16 mg x 4, anbefales med senere gradvis dosereduksjon. Høyere døgndoser anbefales ikke grunnet usikker tilleggsgevinst, samt betydelig økt bivirkningsrisiko (George et al., 2015; Kumar et al., 2017). Vær oppmerksom på bivirkninger som høye blodsukkerverdier, infeksjoner, oral candidose og i sjeldne tilfeller tarmperforasjon. Nedtrapping bør startes så raskt det lar seg gjøre. Supplering med syrehemmende behandling er omdiskutert, men ved høye doser kortiosteroider er det ofte indikasjon for ulcusprofylakse i form av for eksempel protonpumpehemmer.
Strålebehandling
Strålebehandling anbefales som den primære behandlingsmodaliteten for pasienter med stabil rygg, og for pasienter som ikke er aktuelle for kirurgi (George et al., 2015). Evidensgrunnlaget for definitive anbefalinger vedrørende fraksjoneringsregimer ved MMK har tidligere ikke vært tilstrekkelig. Imidlertid har flere randomiserte studier blitt publisert de siste årene.
For pasienter med forventet levetid på mindre enn seks måneder, anbefales endosert strålebehandling, hvor 8 Gy x 1 er best dokumentert (George et al., 2015). Hypofraksjonert strålebehandling har i randomiserte studier vist å gi samme gevinst når det gjelder fysisk funksjon og smertelindring, men behov for rebestråling forekommer oftere enn ved bruk av mer fraksjonert behandling.
Randomiserte studier har sammenlignet fraksjoneringsregimene (og tilsvarende) 4 Gy x 5 og 3 Gy x 10 for pasienter med MMK med forventet levetid kortere enn ett år uten å finne forskjeller i funksjon og overlevelse (Rades et al., 2016). Ved estimert forventet levetid kortere enn ett år anbefales derfor 4 Gy x 5, og ved estimert forventet levetid lenger enn ett år, anbefales 3 Gy x 10 (George et al., 2015).
Avanserte teknikker som stereotaktisk strålebehandling er prøvd ut for pasienter med spinale metastaser med god effekt i ikke-randomiserte studier, men det mangler data sammenligningsstudier med konvensjonell strålebehandling (Lutz et al., 2017), selv om slike pågår (Braam, Lambin, & Bussink, 2016).
Kirurgi
En randomisert studie har vist bedre resultat etter kirurgi kombinert med strålebehandling enn etter strålebehandling alene (Patchell et al., 2005). Denne studien har imidlertid blitt kritisert, bl.a. fordi 1/3 av pasientene randomisert til strålebehandling alene hadde ustabil rygg (George et al., 2008). Følgende er konkludert i det nyeste Cochrane reviewet om medullakompresjon (George et al., 2015):
- Pasienter med tap av gangfunksjon i mindre enn 48 timer, lokalisert medullakompresjon og forventet levetid på mer enn tre måneder, kan profittere på kirurgi. Nøye pasientseleksjon er avgjørende.
- Ambulante pasienter med dårlige prognostiske faktorer for strålebehandling (spinal instabilitet, kompresjon på grunn av beinfragmenter, raskt progredierende nevrologiske symptomer) kan være aktuelle for kirurgi, forutsatt god forventet overlevelse.
Mobilisering
Pasienter med malign medullakompresjon skal som hovedregel mobiliseres så raskt som mulig etter evne og til smertegrensen. Hos pasienter der instabilitet i columna er sannsynlig, skal mobilisering foregå kontrollert uten rotasjon eller andre store bevegelser i ryggraden. Strengt sengeleie er aktuelt hos noen få pasienter med antatt ustabilitet i columna. Tiltaket skal forordnes av lege. Det er ikke evidens fra randomiserte studier til støtte for å benytte strengt sengeleie (Lee, Grant, Kennedy, & Kilbride, 2015). Slik immobilisering kan ha negative effekter på stemningsleie og smerte (Paniagua-Collado & Cauli, 2018), i tillegg til kjente konsekvenser som for eksempel trombembolisme, dekubitus og muskelatrofi. Tidlig fysioterapi kan bidra til å bevare muskelstyrke og koordinasjon, og forebygge fall. Pasienter med MMK skal som hovedregel henvises så raskt som mulig til fysioterapeut, og bør også vurderes av ergoterapeut.
Palliasjon
Pasienter med malign medullakompresjon har ofte flere symptomer og opplever en utfordrende situasjon. Pasientene bør ha kontakt med spesialisert palliativ medisin (palliativt team) så tidlig som mulig (S. Kaasa et al., 2018).
Anbefalinger
Malign medullakompresjon med nevrologiske utfall er en øyeblikkelig-hjelp tilstand.
Pasienter med mistenkt malign medullakompresjon skal, med mindre kontraindikasjoner finnes, utredes med MR av totalcolumna for raskest mulig avklaring (B).
Pasienter med klinisk mistanke om eller påvist medullakompresjon, skal behandles med kortikosteroider, med mindre helt spesielle kontraindikasjoner foreligger. Doser ut over tilsvarende 16 mg dexametason/døgn har vist å gi økt risiko for bivirkninger (B).
Strålebehandling er anbefalt som primærbehandling for ambulante pasienter med stabil rygg, og for de som ikke er kandidater for kirurgi (B).
Pasienter med tap av gangfunksjon i mindre enn 48 timer, lokalisert medullakompresjon og forventet levetid mer enn 3 måneder, kan profittere på kirurgi (A).
Ambulante pasienter med dårlige prognostiske faktorer for strålebehandling kan være aktuelle for kirurgi, forutsatt god forventet overlevelse (B).
For pasienter med forventet levetid kortere enn 6 måneder bør det gis endosert strålebehandling, for eksempel 8 Gy x 1 (A).
For pasienter med forventet levetid omkring ett år anbefales mer fraksjonert strålebehandling, fortrinnsvis f.eks. 4 Gy x 5. Ved god allmenntilstand og mer enn ett års forventet levetid, anbefales 3 Gy x 10 (A).
Palliativ strålebehandling av skjelettmetastaser
Sist faglig oppdatert: 14.10.2019
Definisjon
Høyenergetisk ekstern strålebehandling av skjelettmetastaser.
Strålebehandling ved malign medullakompresjon: se kapittel Malign medullakompresjon.
Epidemiologi, etiologi og patofysiologi
Skjelettmetastaser er vanlig ved langtkommen kreftsykdom, og er tredje hyppigste metastaselokalisasjon etter lever og lunger (Sze, Shelley, Held, & Mason, 2004). Oftest ser man skjelettmetastaser ved bryst-, prostata-, lunge- og nyrekreft, samt ved kreft i skjoldbruskkjertelen (Doyle & Hanks, 2010). Lokalisasjon av skjelettmetastaser kan variere med primærtumors lokalisasjon, men generelt er rygg, bekken og ribben/sternum vanligst (Kakhki, Anvari, Sadeghi, Mahmoudian, & Torabian-Kakhki, 2013; C. Wang, Shen, & Zhu, 2015). Skjelettmetastaser er den hyppigste årsaken til smerter hos kreftpasienter (H. S. Smith & Barkin, 2014). I tillegg til smerter, kan skjelettmetastaser forårsake patologiske frakturer og medullakompresjon. Tumoraffeksjon av skjelettet skyldes oftest hematogent spredte kreftceller (DeVita, Rosenberg, & Hellman, 2005). Metastaser kan karakteriseres som osteoblastiske (ofte kalt sklerotiske) eller osteolytiske, men dette representerer egentlig ytterpunktene av et kontinuum. Den enkelte pasient kan ha både osteolytiske og sklerotiske metastaser, eller blandede lesjoner. Prostatakreft gir hovedsakelig sklerotiske skjelettmetastaser, myelomatose gir osteolyse, mens man ved brystkreft kan finne både osteolytiske og sklerotiske metastaser (Roodman, 2004).
Utredning
Anamnese og kliniske funn
Smerte er vanligste symptom ved skjelettmetastaser. Smertene kan være lokalisert eller mer diffust avgrenset, avhengig av metastaselokalisasjon. Lesjoner i ekstremitetene gir ofte mer veldefinerte og distinkte smerter enn lesjoner i rygg og bekken. Radikulære smerter, kraftnedsettelse i ekstremiteter, samt affeksjon av blære-/tarmfunksjon, gir mistanke om påvirkning av nerverøtter, medulla spinalis og/eller cauda equina. Smerter som forverres ved belasting er ofte assosiert med grad av beinmineraltap. Bryst-, lunge-, nyre- og skjoldbruskkjertelkreft er vanligste årsaker til patologiske frakturer (H. S. Smith & Barkin, 2014).
Bildediagnostikk
Tomrøntgen
Initial utredning av en kreftpasient med beinsmerte kan inkludere vanlig tomrøntgen tatt i to projeksjoner (Doyle & Hanks, 2010). Undersøkelsen gir et godt bilde av skjelettstruktur, men tap av minst 30 % kortikal og 50 % medullær beintetthet er nødvendig for at en lytisk lesjon skal være synlig. Derfor anses dette som en mindre sensitiv undersøkelse for å påvise skjelettmetastaser (Edelstyn, Gillespie, & Grebbell, 1967).
Skjelettscintigrafi
Skjelettscintigrafi gir billedmessig framstilling av hele skjelettet med en sensitivitet for beinsykdom på 72–84 % (Eustace et al., 1997; Galasko, 1969). Sensitiviteten er høyest ved aktive sklerotiske lesjoner. Små osteolytiske lesjoner kan overses. Andre ulemper er dårlig framstilling av beinstruktur og lav spesifisitet. I dag benyttes ofte en lavdose CT som tillegg for å bidra til bedre anatomisk framstilling.
Computertomografi – CT
CT gir en god framstilling av kortikal beinstruktur, f. eks i forhold til mistenkte frakturer, som kan være vanskelig å se på MR (Doyle & Hanks, 2010).
Magnetresonans – MR
MR gir bedre framstilling av bløtvevs- og beinmargsaffeksjon enn CT, og er et verdifullt verktøy for å studere anatomiske karakteristika ved skjelettmetastaser. Undersøkelsen gir imidlertid ikke detaljinformasjon om strukturen i den aktuelle skjelettdel, derfor må alltid kombinasjon med andre bildemodaliteter som tomrøntgen og/eller CT vurderes (Doyle & Hanks, 2010). MR av totalcolumna er anbefalt bildediagnostikk ved mistanke om malign medullakompresjon (Husband, Grant, & Romaniuk, 2001).
Positron-emisjonstomografi/Computertomografi – PET-CT
Ved enkelte krefttyper, f.eks. lungekreft, har det blitt vanlig å benytte PET-CT for påvisning av eventuelle klinisk okkulte fjernmetastaser. I dag benyttes hovedsakelig fluorodeoxyglucose (FDG)-opptak. Grad av opptak gjenspeiler cellenes metabolske aktivitet. Mange kreftceller har høyt opptak av FDG (f.eks. lungekreft), mens andre krefttyper har mindre opptak (f.eks. prostatakreft). For krefttyper med høyt opptak, er PET-CT i dag vurdert å være den mest sensitive og spesifikke teknikken for påvisning av fjernmetastaser generelt (Langer, 2010).
Behandling
Strålebehandling av skjelettmetastaser ved smerteindikasjon
Palliativ strålebehandling har i lang tid vært etablert behandling av smertefulle skjelettmetastaser. Tradisjonelt har slik strålebehandling vært gitt som fraksjonert behandling. Imidlertid viser dokumentasjon fra de siste 15–20 årene at endosert behandling har like god smertelindrende effekt. Både randomiserte studier, oversiktsartikler og metaanalyser har vist likeverdig smertelindring av endosert strålebehandling sammenlignet med fraksjonert behandling (E. Chow, Harris, Fan, Tsao, & Sze, 2007; Sze, Shelley, Held, Wilt, & Mason, 2003; Wu, Wong, Johnston, Bezjak, & Whelan, 2003). Likevel viser praksisundersøkelser at fraksjonerte regimer fortsatt er vanlig (Fairchild et al., 2009; T. S. Laugsand, Kaasa, Romundstad, Johannesen, & Lund, 2013).
Det foreligger en oppdatert systematisk oversiktsartikkel basert på 34 randomiserte studier med totalt mer enn 6000 inkluderte pasienter (Rich et al., 2018). Samlet responsrate var lik, med behandlingsrespons hos 61 % (23 % komplett respons) av pasientene som fikk endosert regime og 62 % (24 % komplett respons) av pasientene som fikk fraksjonert regime. 16 studier rapporterte rebehandlingsrater. Man fant at 20 % av pasientene som fikk endosert regime ble rebestrålt, vs. 8 % av pasientene som hadde fått fraksjonert regime. 12 studier rapporterte forekomst av patologiske frakturer. Risikoen for patologisk fraktur var ikke signifikant forskjellig mellom behandlingsregimene, og var gjennomgående < 5 %. Seks studier rapporterte forekomst av medullakompresjon, og det var ikke statistisk signifikant forskjell mellom fraksjoneringsregimene. Endosert-regimet i alle randomiserte studier inkluderte 8 Gy, som er den vanligste dosen ved engangdosert strålebehandling (R. Chow et al., 2017). Data fra flere randomiserte studier har ikke vist forskjell i langtidstoksisitet mellom regimene (Lutz et al., 2017).
Basert på solid evidens vedrørende strålebehandling av smertefulle skjelettmetastaser, anbefales endosert regime med 8 Gy x 1. Dette er mindre belastende for pasientene, og er samfunnsøkonomisk å foretrekke.
Om rebehandling blir aktuelt, er konsensusanbefaling fra The International Bone Metastases Working Party at dette vurderes tidligst fire uker etter avsluttet initial strålebehandling (E. Chow et al., 2012), noe som også er brukt i studier (Chiu et al., 2015). Fraksjonering ved rebestråling av smertefulle skjelettmetastaser er studert i langt mindre grad enn i primærsituasjonen. Klinisk praksis har ofte vært rebestråling med et fraksjonert regime. Imidlertid finnes det data fra en randomisert studie med non-inferiority design som kan gi støtte for endosert behandling med 8 Gy x 1, også ved rebestråling av smertefulle skjelettmetastaser (E. Chow et al., 2014). 58 % av pasientene i en meta-analyse fikk redusert smerte der komplett, partiell og overall respons rate ble rapportert til henholdsvis 20 %, 50 % og 68 % (Chiu et al., 2015). Konklusjonen fra en samlet analyse viser at effekten av rebestråling med endoserte og fraksjonerte regimer er nærmest identiske, også hvor initial strålebehandling har vært gitt med et fraksjonert regime (E. Chow et al., 2014).
Stereotaktisk strålebehandling kan være aktuelt ved columnametastaser uten affeksjon av spinalkanalen, men dose – og om det best er brukt ved førstegangs bestråling eller rebestråling – er uavklart (Guckenberger et al., 2014; Hashmi et al., 2016).
Strålebehandling av skjelettmetastaser ved andre indikasjoner enn smerte
Strålebehandling av skjelettmetastaser kan også være aktuelt ved andre indikasjoner enn smerte alene. Postoperativt etter kirurgi for (truende) patologisk fraktur, eventuelt i stedet for kirurgi ved truende patologisk fraktur, samt ved ønske om tumorreduksjon ved ekstraossøs skjelettmetastasekomponent, er aktuelle tilstander. Det finnes ikke god støtte fra prospektive randomiserte studier for fraksjoneringsvalg i disse situasjonene.
Rasjonalet for postoperativ strålebehandling inkluderer i tillegg til smertelindring, stimulering av remineralisering og beintilheling. Derigjennom kan man oppnå bedret funksjon og redusert risiko for (re)fraktur og løsning av fikseringsmateriale eller protese. Data fra retrospektive studier kan gi støtte for bedret funksjonsstatus ved postoperativ strålebehandling (Townsend, Rosenthal, Smalley, Cozad, & Hassanein, 1994; Townsend, Smalley, Cozad, Rosenthal, & Hassanein, 1995). Fraksjoneringsvalg er basert på teoretiske betraktninger, empiri og tradisjon, og det har vært vanlig å anbefale 3 Gy x 10. I en nylig publisert oversiktsartikkel angis at en totaldose på 20–30 Gy kan fremme tilhelingsprosessen (Johnstone & Lutz, 2014).
Det finnes ingen randomiserte studier som sammenligner strålebehandling og operasjon ved truende patologisk fraktur på grunn av osteolyse, og det er vanlig å anbefale kirurgi ved stor frakturfare. Det finnes imidlertid støtte for at primær strålebehandling kan fremme reparasjon av patologisk beinstruktur og redusere behovet for kirurgisk intervensjon (Cheng, Seitz, & Eyre, 1980; Harada et al., 2010). Det har vært vanlig å anbefale 20–30 Gy gitt med 5–10 fraksjoner ved strålebehandling av skjelettmetastaser på grunn av frakturrisiko, selv om altså store materialer som sammenligner effekt av endosert og fraksjonert strålebehandling ikke kan påvise signifikant forskjell i risiko for patologisk fraktur (E. Chow et al., 2012). Likeledes anbefales ofte fraksjonert strålebehandling med totaldose 20–30 Gy ved store ekstraossøse metastasekomponenter (Johnstone & Lutz, 2014).
Strålebehandling må i likhet med alle behandlinger hos pasienter med kort forventet levetid og nedsatt allmenntilstand (ECOG ≥ 3), vurderes med tanke på om pasienten er tjent med behandlingen ved å veie eventuelle ulemper opp mot forventet effekt i samråd med pasienten.
Anbefalinger
- Strålebehandling har godt dokumentert smertelindrende effekt ved skjelettmetastaser (A).
- Endosert strålebehandling med 8 Gy x 1 anbefales for smertefulle skjelettmetastaser (A).
- 8 Gy x 1 kan også vurderes ved rebestråling av smertefulle skjelettmetastaser (B).
- Ved andre indikasjoner enn smerte er det dårlig dokumentasjon for endosert strålebehandling, og fraksjonert strålebehandling anbefales (C).
Prosess og metode for utarbeidelse av retningslinjene
Hva er nasjonale retningslinjer?
Sist faglig oppdatert: 14.10.2019
Nasjonal helseplan (2007–2010)3 klargjør at Helsedirektoratet, innenfor rettslige rammer, har en normerende rolle for helsetjenesten på tvers av helseregioner og tjenestenivå. Helsedirektoratet er derved eneste aktør som har mandat til å lage nasjonale retningslinjer for helsetjenesten. Nasjonal helseplan gir Helsedirektoratet en koordinerende rolle for å utvikle overordnede referanserammer for kreftomsorgen, sammen med de regionale helseforetakene, kommunene og andre relevante myndighetsorganer og tjenester.
Nasjonale retningslinjer fra Helsedirektoratet er å betrakte som anbefalinger og råd, basert på oppdatert faglig kunnskap som er fremskaffet på en systematisk, kunnskapsbasert måte. De nasjonale retningslinjene gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet og er ment som et hjelpemiddel ved de avveininger tjenesteyterne må gjøre for å oppnå forsvarlighet og god kvalitet i tjenesten.
Nasjonale retningslinjer er ikke rettslig bindende for mottakerne, men skal som faglig normerende langt på vei være styrende for de valg som skal tas. Ved å følge oppdaterte nasjonale retningslinjer vil fagpersonell bidra til å oppfylle kravet om faglig forsvarlighet i lovverket. Dersom en velger løsninger som i vesentlig grad avviker fra nasjonale faglige retningslinjer bør en dokumentere dette, og være forberedt på å begrunne sitt valg.
3 Særtrykk av St.prp. nr. 1 (2006–2007) kapittel 6.
Kunnskapsbasert prosess
Sist faglig oppdatert: 14.10.2019
Helsedirektoratet legger til grunn at alle nasjonale retningslinjer skal være utarbeidet etter en metode med vekt på forskningsbasert kunnskap, tydelig og tilgjengelig dokumentasjon, brukermedvirkning, tverrfaglighet, fokus på praksis, implementering og oppdatering.
Det er en omfattende prosess å lage gode retningslinjer som tilfredsstiller krav til prosess, metode og transparens som er det nivå Helsedirektoratet og andre liknende organisasjoner har lagt til grunn for utforming av anbefalinger.
Palliativ medisin er et nytt fagfelt i akademisk sammenheng til tross for at faget representerer det sentrale elementet i medisinsk praksis før fremveksten av den moderne medisinen på slutten av 1800-tallet. Evidensgrunnlaget er av denne grunn begrenset, og utgjør en stor utfordring for dagens praksis. Vi håper og tror at dette vil endres i de kommende årene. I dette programmet er evidensgrunnlaget spesifisert for de delene av programmet der arbeidsgruppen har funnet det relevant i forhold til innholdet.
I første utgave av retningslinjen samarbeidet arbeidsgruppen og Nasjonalt kunnskapssenter for helsetjenesten (nå FHI) på følgende måte for å sikre en god håndtering av kunnskapsgrunnlaget:
- I en tidlig fase av arbeidet avklarte arbeidsgruppen hva retningslinjene skulle omfatte når det gjaldt palliativ behandling og oppfølging av kreftpasienter. Retningslinjene var en videreføring av arbeidet utført i regi av Norsk forening for palliativ medisin med retningslinjer for symptomlindrende behandling
- Kunnskapssenteret samarbeidet med arbeidsgruppen ved å gjennomgå daværende faglige anbefalinger (Retningslinjer for symptomlindrende behandling, NFPM 2007) med hensyn til metode og hvilket kunnskapsgrunnlag de var basert på.
- Arbeidsgruppen samarbeidet med Helsedirektoratet og Kunnskapssenteret i vurderingen av hvilke områder det varbehov for kunnskapsstøtte fra Kunnskapssenteret.
- Kunnskapssenteret identifiserte og formidlet kunnskapsbaserte internasjonale retningslinjer og systematiske oversikter ved søk på følgende nettsteder:
Søk etter retningslinjer:
-
- Guidelines international network: http://www.g-i-n.net/
- NICE, UK: http://www.nice.org.uk/page.aspx?o=home
- SIGN, Scotland: http://www.sign.ac.uk/
- AHRQ, US: http://www.guideline.gov/
- AAHPM, US: https://www.nationalcoalitionhpc.org/ncp/
- NCCN, US: https://www.nccn.org/guidelines/category_1
- Cancer care Ontario: https://www.cancercareontario.ca/en
- NFPM, Norge: http://www.palliativmed.org
Søk etter systematiske oversikter:
-
- CRD-databasene: http://www.crd.york.ac.uk/crdweb/
- Cochrane Library: http://www.mrw.interscience.wiley.com/cochrane/cochrane_search_fs.html
- Clinical evidence: https://www.bmj.com/specialties/clinical-evidence
Kriterier for evidensnivå
A: Minst en RCT i tillegg til annen litteratur av god kvalitet og konsistens som støtter den aktuelle anbefalingen.
B: Støtte i godt gjennomførte kliniske studier, men ingen RCT.
C: Dokumentasjon fra rapporter utarbeidet av ekspertkomitéer eller vurdering fra respekterte, kliniske autoriteter, men ingen direkte klinisk evidens av god kvalitet.
Eksempel: Er det kun funnet støtte i Oxford Textbook of Palliative Medicine, er evidensnivået vurdert som C.
Bakgrunn og arbeidsprosess
Sist faglig oppdatert: 14.10.2019
Utvikling av de nasjonale handlingsprogrammene for kreftbehandling var et viktig tiltak under Nasjonal strategi for kreftområdet 2006–2009 (forlenget til 2011). Og videre utvikling av de nasjonale handlingsprogrammene var en kjerneoppgave i oppfølging av Sammen mot kreft – Nasjonal Kreftstrategi 2013–2017, og i videreføringen og oppdateringen av denne, jf. Nasjonal kreftstrategi Leve med kreft (2018-2022). Nasjonale handlingsprogrammer for kreftbehandling skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
Nasjonale faggrupper tilsluttet Onkologisk Forum hadde i en årrekke arbeidet med og utviklet behandlingsveiledere og handlingsprogram for ulike krefttyper. Helsedirektoratet ønsket i arbeidet med nasjonale handlingsprogrammer, som ledd i Nasjonal strategi for kreftområdet, å ta utgangspunkt i og bygge på dette arbeidet. Helsedirektoratet rettet derfor i november 2005 en henvendelse til Norsk forening for palliativ medisin (NFPM) og ba om forslag til representanter til en arbeidsgruppe som skulle settes sammen av personer med fagekspertise, representanter fra Nasjonalt kunnskapssenter for helsetjenesten og Helsedirektoratet. Det ble bedt om at alle nødvendige faggrupper skulle være representert, og at gruppen skulle bestå av fagfolk fra alle helseregioner. Norsk Sykepleierforbund og Norsk Fysioterapeutforbund ble også bedt om å stille med representanter. Norsk Palliativ Forening stilte med to representanter, hvorav den ene også representerte kliniske ernæringsfysiologer.
RHFene medvirket i arbeidet gjennom representasjon i prosjektets styrings- og referansegruppe, samt ved mulighet til å gi tilbakemelding på arbeidsgruppenes sammensetning. RHFene ble også bedt om at fagfolk innenfor rammen av sin arbeidstid ble fristilt til retningslinjearbeidet, jf. Bestillerdokumentet fra Helse- og omsorgsdepartementet.
Det første Nasjonale handlingsprogram for palliasjon ble utgitt i november 2007. Dette var utarbeidet av en arbeidsgruppe med følgende sammensetning:
- Jon Håvard Loge, psykiater, Kompetansesenter for lindrende behandling, Ullevål universitetssykehus, leder Norsk forening for palliativ medisin
- Dagny Faksvåg Haugen, onkolog, Kompetansesenter i lindrende behandling Helseregion Vest, Haukeland universitetssjukehus og Institutt for kreftforskning og molekylærmedisin, NTNU
- Nina Aass, onkolog, Regionalt kompetansesenter for lindrende behandling, Helse Sør, Kreftklinikken, Radiumhospitalet, Rikshospitalet HF, styremedlem Norsk forening for palliativ medisin
- Aart Huurnink, spesialist i allmennmedisin, Lindrende enhet, Boganes sykehjem, Stavanger, styremedlem Norsk forening for palliativ medisin
- Knut Skarholt, spesialist i allmennmedisin, Klosterhagen legesenter, Skien
- Edel Nandrup, kreftsykepleier, Kreftavdelingen, Sykehuset Asker og Bærum
- Grete Søbstad, kreftsykepleier, Seksjon lindrende behandling, St. Olavs Hospital
- Tone-Lise Frantzen, spesialfysioterapeut, Sunniva klinikk for lindrende behandling, Haraldsplass Diakonale Sykehus, Bergen, og Kompetansesenter i lindrende behandling Helseregion Vest, representant for Norsk Fysioterapeutforbund
- Unni Vidvei Nygaard, fysioterapeut, Hospice Lovisenberg, Lovisenberg Diakonale Sykehus, leder Norsk Palliativ Forening
- Guro Berge Smedshaug, klinisk ernæringsfysiolog, Kreftklinikken, Radiumhospitalet, Rikshospitalet HF, styremedlem Norsk Palliativ Forening
- Bjørg Nitteberg Sørensen, spesialist i infeksjonssykdommer, Statens legemiddelverk
- Krystyna Hviding, Nasjonalt kunnskapssenter for helsetjenesten; bisto fagpersonene i arbeidet.
Skriftlige bidrag ble også levert av følgende personer utenfor arbeidsgruppen:
- Hilde Ovedia Alquist, sosionom, Avdeling for lindrende behandling, Kreftsenteret, Ullevål universitetssykehus
- Per Engstrand, anestesilege, Avdeling for lindrende behandling, Kreftsenteret, Ullevål universitetssykehus
- Bente Ervik, kreftsykepleier, cand. polit., Kompetansesenter for lindrende behandling Helseregion Nord, Universitetssykehuset Nord-Norge
- Tor Johan Grevbo, sykehusprest/professor, Hospice Lovisenberg, Lovisenberg Diakonale Sykehus og Høgskolen Diakonova, Oslo
- Hilde Beate Gudim, spesialist i allmennmedisin, Skui legekontor, Bærum
- Sigrunn Øygarden Gundersen, førstelektor, Avdeling for helse- og sosialfag, Høgskolen i Telemark
- Torunn Haugstøl, kreftsykepleier, Palliativ enhet, Sykehuset Telemark
- Ragnhild Helgesen, spesialsykepleier, Kompetansesenter i lindrende behandling Helseregion Vest, Haukeland universitetssjukehus
- Marit Slåen Jordhøy, spesialist i onkologi og indremedisin, Sykehuset Innlandet, Gjøvik
- Wenche Mohr, anestesi- og kreftsykepleier, Avdeling for lindrende behandling, Kreftsenteret, Ullevål universitetssykehus
- Jan Henrik Rosland, anestesilege, professor, Sunniva klinikk for lindrende behandling, Haraldsplass Diakonale Sykehus og Universitetet i Bergen
- Borrik Schjødt, psykologspesialist, Smerteklinikken, Haukeland universitetssjukehus
- Sigrid Skarholt, kreftsykepleier, Palliativ enhet, Sykehuset Telemark
- Elisabeth Strand, spesialergoterapeut, Hospice Lovisenberg, Lovisenberg Diakonale Sykehus
- Rune Svensen, kirurg, Kirurgisk klinikk, Haukeland Universitetssjukehus
- Trygve Aasgaard, musikkterapeut/førsteamanuensis, Høgskolen i Oslo
- Trine Lise Aasheim, musikkterapeut, Hospice Lovisenberg
Helsedirektoratet nedsatte i februar 2008 en ny arbeidsgruppe for å arbeide med oppdatering og videreutvikling av Nasjonalt handlingsprogram for palliasjon utgitt i november 2007. Arbeidsgruppen fikk følgende sammensetning:
- Nina Aass, Kreftklinikken, Radiumhospitalet og Kompetansesenter for lindrende behandling Helseregion Sør-Øst, Ullevål universitetssykehus
- Dagny Faksvåg Haugen, Kompetansesenter i lindrende behandling Helseregion Vest, Haukeland universitetssjukehus, og Institutt for kreftforskning og molekylærmedisin, NTNU
- Lotte Rogg, Kreftsenteret, Ullevål universitetssykehus, Institutt for sykehusmedisin, Ullevål, og Institutt for medisinske basalfag, Universitetet i Oslo
- Jan Henrik Rosland, Sunniva klinikk for lindrende behandling, Haraldsplass Diakonale Sykehus, og Institutt for kirurgiske fag, Universitetet i Bergen (leder)
I arbeidet var det nødvendig å inkludere flere ressurspersoner og gruppen ble derfor utvidet med følgende deltakere:
- Jørgen Hansen, Anestesiavdelingen, Nordlandssykehuset, Bodø
- Anne Kvikstad, Seksjon lindrende behandling, Kreftavdelingen, og Kompetansesenter i lindrende behandling Midt-Norge, St Olavs Hospital
- Hartwig Kørner, Kir.avd, Stavanger universitetssykehus, Institutt for kirurgiske fag, Universitetet i Bergen, og Kompetansesenter i lindrende behandling Helseregion Vest
- Stig Ottesen, Avd. for lindrende behandling, Kreftsenteret, Ullevål universitetssykehus
Skriftlige bidrag ble også levert av følgende personer utenfor arbeidsgruppen:
- Line Solheim, Avdeling medisinsk serviceklinikk, Haraldsplass Diakonale Sykehus og Kompetansesenter i lindrende behandling Helseregion Vest
- Marit Gudim, Kreftsenteret og Kompetansesenter for lindrende behandling Helseregion Sør-Øst, Ullevål universitetssykehus
- Jon Arne Søreide, Kir.avd, Stavanger universitetssykehus og Institutt for kirurgiske fag, Universitetet i Bergen
Oppdatering 2010
Følgende kapitler ble revidert i 2010:
Kapittel 1: Innledning
Kapittel 2: Sosiale og trygdemessige forhold for pasienter som får palliativ behandling
Kapittel 3: Smerte
I tillegg ble to nye temaer inkludert i kapittel 3:
- Munntørrhet og andre plager i munn og svelg
- Malign obstruksjon i magetarmkanalen
Oppdatering 2013
I 2012 gikk en ny arbeidsgruppe i gang med videre oppdatering av handlingsprogrammet. I mars 2013 ble arbeidsgruppen formelt oppnevnt for å oppdatere handlingsprogrammet sammen med Helsedirektoratet og Nasjonalt kunnskapssenter for helsetjenesten.
Arbeidsgruppen hadde følgende medlemmer:
- Nina Aass, Oslo universitetssykehus HF
- Dagny Faksvåg Haugen, Helse Bergen HF, Haukeland universitetssjukehus
- Jan Henrik Rosland, Helse Bergen HF, Haukeland universitetssjukehus
- Marit Jordhøy, Sykehuset Innlandet HF
- Tom Dønnem, Universitetssykehuset Nord-Norge HF
- Anne Kari Knudsen, St Olavs hospital HF
- Følgende fagpersoner ble oppnevnt for å styrke ergoterapidelen i handlingsprogrammet:
- Elisabeth Strand, Lovisenberg diakonale sykehus
- Ingebjørg Børsheim, Høgskolen i Bergen
Også i revisjonen av 2013 bidro en rekke fagpersoner utenfor arbeidsgruppen:
- Hartwig Kørner, Stavanger universitetssykehus og Kompetansesenter i lindrende behandling Helseregion Vest
- Stig Ottesen, Oslo universitetssykehus
- Bente Ervik, Kompetansesenter for lindrende behandling Helseregion Nord, Universitetssykehuset Nord-Norge
- Torunn Wester, Kompetansesenter for lindrende behandling, helseregion sør-øst, Oslo universitetssykehus
- Tone-Lise Frantzen, Haraldsplass Diakonale Sykehus og Kompetansesenter i lindrende behandling Helseregion Vest
- Sissel Harlo, Kompetansesenter for lindrende behandling, helseregion sør-øst, Oslo universitetssykehus
- Marit Gudim, Oslo universitetssykehus
- Line Solheim, Haraldsplass Diakonale Sykehus
- Asta Bye, Kompetansesenter for lindrende behandling, helseregion sør-øst, Oslo universitetssykehus og Høgskolen i Oslo og Akershus
- Malene Slott, Oslo universitetssykehus
- Lars Helge Myrseth, Tasta sykehjem og Kompetansesenter i lindrende behandling Helseregion Vest
- Borrik Schjødt, Haukeland universitetssjukehus
Oppdatering 2015
Hele handlingsprogrammet ble ikke revidert i 2015, kun kapitlene om sosiale og trygdemessige forhold, smerte, kvalme og obstipasjon. I tillegg ble det gjort noen endringer i kapittel 3 om forløpstider i forbindelse med innføring av Pakkeforløp for kreft.
I tillegg til den nasjonale arbeidsgruppen med representanter fra alle helseregioner, har følgende medforfattere bidratt i arbeidet med oppdateringen i 2015:
- Sosiale og trygdemessige forhold for pasienter som får palliativ behandling: Sosionom og familieterapeut Sissel Harlo, Oslo universitetssykehus
- Smerte: Professor/seksjonsoverlege Pål Klepstad, St. Olavs Hospital og overlege Hilde Roaldset, Oslo universitetssykehus
- Kvalme: Lege i spesialisering/PhD Eivor Laugsand, Sykehuset Levanger
- Obstipasjon: Lege i spesialisering/PhD Eivor Laugsand, Sykehuset Levanger
Oppdatering 2019
I februar 2018 ble det oppnevnt en ny oppdateringsgruppe med følgende personer:
- Jan Henrik Rosland, (leder), overlege, Haraldsplass Diakonale Sykehus
- Sigve Andersen, overlege, Universitetssykehuset Nord-Norge
- Peder Broen, overlege, Trondhjem Kommune
- Anne-Lise Eidsvåg, kreftsykepleier, St. Olavs Hospital (til okt. 18)
- Grete Søbstad, kreftsykepleier, St. Olavs Hospital (fra okt. 18)
- Helene Faber-Rod, psykolog, Helgelandssykehuset
- Tone-Lise Frantzen, onkologisk fysioterapeut, Haraldsplass Diakonale Sykehus
- Karin Frydenberg, fastlege, Skreia legesenter
- Sissel Harlo, sosionom, Oslo Universitetssykehus
- Olav Hevrøy, overlege, Haukeland Universitetsjukehus
- Anne Kari Knudsen, overlege, Oslo Universitetssykehus
- Birthe Lie Hauge, overlege, Stavanger Universitetssykehus
Representant fra FHI: Hilde T. Myrhaug.
I tillegg til oppdateringsgruppen har følgende personer bidratt med innspill:
- Tora Solheim, Åsta Bye, Line Oldervoll, Trude Balstad (Ivaretakelse av ernæringsmessige behov)
- Lars Helge Myrset, Aart Huurnink og Dagny Faksvåg Haugen (Åndelig og eksistensiell utfordringer)
- Erik Løhre og Nina Aass (Malign medullakompresjon og Palliativ strålebehandling)
Alle kapitlene i handlingsprogrammet er gjennomgått og oppdatert i 2019, unntatt vedleggene om kompetanse og organisering, der en del av innholdet er utdatert. Det er iverksatt en oppdatering av disse, og en ny utgave av handlingsprogrammet vil foreligge før utgangen av 2019.
Kapittel 1 og kapittel 2 har gjennomgått en omfattende oppdatering. Temaet "Økononomiske ytelser" er omfattende oppdatert, og blitt et eget hovedkapittel (kapittel 3). To helt nye temaer- Malign medullakompresjon og Palliativ strålebehandling av skjelettmetastaser - er lagt til hovedkapittel 4, Symptomer og tilstander. De andre underkapitlene i kapittel 4 er gjennomgått med tanke på å fjerne direkte feil, men uten at innholdet for øvrig er endret. Alle netthenvisninger er oppdatert.
WHOs definisjon av palliasjon med tilhørende presiserende kulepunkter er tidligere ikke oversatt til norsk i sin helhet. I kapittel 1 presenteres det en grundig gjennomarbeidet oversettelse, som ønskes brukt som den offisielle norske oversettelsen. Oversettelsesarbeidet bygger på anfalinger fra EORTC, med to uavhengige oversettere, og som deretter er gjennomgått og revidert av oppdateringsgruppen, med ekstern støtte i det norske fagmiljøet i palliasjon.
Metoder anvendt ved oppdatering av retningslinjene
Sist faglig oppdatert: 14.10.2019
Retningslinjene er basert på systematiske litteratursøk og gjeldende anbefalinger, der Oxford Textbook of Palliative Medicine er anvendt som referansedokument (Cherny, 2015).
På områder der det ikke finnes dokumentasjon innenfor palliasjon, har man benyttet dokumentasjon fra andre fagfelt. Representativitet og validitet er kommentert med hensyn til overførbarhet til palliasjon.
Evidensnivå er vurdert med utgangspunkt i tilgjengelig litteratur etter gitte kriterier (Metoder og verktøy 2016).
For alle emner er det søkt i databasene PubMed og Cochrane Library.
I PubMed er det søkt på spesifiserte søkeord med begrensningen (Limits: Publication types): Randomized Controlled Trial, Review og Meta-Analysis.
Dette er supplert med åpne søk etter artikler utgitt etter avsluttet litteratursøk for RCT, som hovedsak begrenset til de siste 5 år.
Er det foretatt søk i andre databaser, er dette oppgitt under de enkelte emner.
Habilitet
Sist faglig oppdatert: 14.10.2019
Alle gruppens medlemmer er i forbindelse med arbeidet bedt om å oppgi potensielle interessekonflikter. Ingen interessekonflikter er oppgitt. Helsedirektoratet har vurdert arbeidsgruppens medlemmer som habile i forhold til utarbeiding av nasjonalt handlingsprogram for palliasjon.
Organisering
Sist faglig oppdatert: 14.10.2019
(Ikke oppdatert 2019)
Innledning
Palliasjon foregår innenfor de fleste fagområder og på alle nivåer i helsevesenet.
Samtidig som grunnleggende palliasjon skal utøves overalt der man tar hånd om alvorlig syke og døende, skal helsetjenestene romme et særskilt, organisert, palliativt tilbud på alle nivåer.
I dette vedlegget gis en standard for det palliative tilbudet ved de ulike organisatoriske enhetene i spesialist- og kommunehelsetjenesten. Hver enhets oppgaver beskrives sammen med krav til klinisk tilbud og organisering, inkludert personale, lokaler og utstyr.
Anbefalingene bygger på offentlige utredninger og rapporter (1-6), samt Standard for palliasjon (7).
Sykehusavdelinger
Sist faglig oppdatert: 14.10.2019
Oppgaver
Alle avdelinger som har kreftpasienter eller andre pasienter med behov for palliasjon, skal gi god smerte- og symptomlindring og god terminal pleie og omsorg.
Klinisk tilbud
- Avdelingen skal beherske grunnleggende palliasjon (se kap. Innledning).
- Avdelingen skal ha kunnskap om hvilke pasienter som bør henvises til palliativt senter, onkologisk avdeling/poliklinikk og smerteklinikk.
Organisering
- Det skal være en definert ansvarsfordeling mellom avdelingen og palliativt senter/team ved håndtering av felles pasienter. Palliativt team vil vanligvis ha en konsulentfunksjon.
- Alle avdelinger (ev. poster) som har palliative pasienter, skal ha en ressurssykepleier som er med i kompetansenettverket i foretaket.
- De ansatte bør få tilbud om veiledning.
Personale
- Minimum en fast ansatt lege bør ha god kompetanse i palliasjon (nivå B, se Vedlegg 2).
- Alle poster som behandler kreftpasienter, bør ha ansatt kreftsykepleier.
- Avdelingen skal ha tilgang til fysioterapeut, prest og sosionom.
Lokaler og utstyr
- Enerom for alvorlig syke pasienter og terminal pleie
- Samtalerom
- Fasiliteter for pårørende
Onkologiske avdelinger
Sist faglig oppdatert: 14.10.2019
Oppgaver
Palliasjon er en stor del av virksomheten ved en kreftavdeling. Avdelingen skal gi god smerte- og symptomlindring, og har et særlig ansvar for tumorrettet behandling til palliative pasienter.
Klinisk tilbud
Avdelingen skal beherske grunnleggende palliasjon (se kap. Innledning). Utover dette står tre modaliteter sentralt:
1. Medikamentell smerte- og symptomlindring
- Kunnskapene bør være så gode at man kan tilby de fleste pasientene optimal symptomlindring.
- Det er imidlertid viktig at pasienter som trenger henvisning videre, fort blir identifisert og henvisning effektuert.
2. Strålebehandling
Palliativ strålebehandling er spesielt viktig ved følgende tilstander:
- Smerter pga skjelettmetastaser eller innvekst i nerveplexus. God smertelindring vil kunne oppnås i 50-80 % av tilfellene.
- Symptomgivende hjernemetastaser
- Truende tverrsnittslesjon(er) pga. metastaser til columna
- Blødning fra urinveiene
- Hemoptyse, dyspné og hoste pga. svulster sentralt i luftveiene
- Plagsomme hud- og lymfeknutemetastaser
3. Medikamentell tumorrettet behandling
- Palliativ kjemoterapi og beslektede terapiformer utgjør en sentral del av behandlingsarmamentariet ved en onkologisk avdeling.
- Bedring av pasientens livskvalitet skal være målet for behandlingen.
- Redusert tumorbyrde pga. kjemoterapieffekt vil ofte føre til reduksjon av symptomer eller utsettelse av tidspunkt for at symptomer oppstår.
- Det onkologiske miljøet har et ansvar for at effektiv kjemoterapi benyttes.
- Miljøet har også et stort ansvar for at kjemoterapi ikke benyttes når den er ineffektiv, eller når forventningen om effekt er meget lav.
- Påført toksisitet som følge av ineffektiv kjemoterapi er ikke akseptabel.
Organisering
- Onkologisk avdeling skal ha organisert samarbeid med sykehusets palliative senter. Samarbeidet skal omfatte både FOU og klinisk virksomhet. Det skal være en definert ansvarsfordeling ved håndtering av felles pasienter.
- Avdelingen (postene) skal ha ressurssykepleiere som er med i kompetanse-nettverket i foretaksområdet.
- Videre- og etterutdanning for de ansatte må prioriteres.
- Personalet skal ha tilbud om veiledning.
Personale
- Legene skal ha god kompetanse i palliasjon (minimum nivå B, se Vedlegg 2).
- Avdelingen bør ha høy andel kreftsykepleiere, med god kompetanse i palliasjon.
- Avdelingen skal ha tilknyttet fysioterapeut, prest og sosionom.
- Avdelingen bør ha fast samarbeid med ernæringsfysiolog og psykolog, ev. psykiater.
Lokaler og utstyr
- Enerom for alvorlig syke pasienter og terminal pleie
- Fasiliteter for pårørende, med mulighet for overnatting
- Samtalerom
Onkologisk poliklinikk på mindre sykehus
Sist faglig oppdatert: 14.10.2019
Oppgaver
Mindre sykehus vil ofte ikke ha palliativt senter og heller ikke onkologisk avdeling. Onkologisk poliklinikk vil da ha et spesielt ansvar for palliasjon på sykehuset, ev. i samarbeid med smertepoliklinikken.
Klinisk tilbud
- Poliklinikken skal minimum beherske grunnleggende palliasjon (se kap. Innledning).
- Personalet skal ha kunnskap om hvilke pasienter som bør henvises til avdelinger/ team med spesialkompetanse i onkologi eller palliasjon som poliklinikken ikke selv rår over.
- Personalet har konsulentfunksjon overfor sykehusets øvrige avdelinger og primærhelsetjenesten.
Organisering
- Poliklinikken skal ha organisert samarbeid med de avdelinger på sykehuset som behandler kreftpasienter, med den nærmeste onkologiske avdelingen og med palliativt senter i foretaket.
- Minst en sykepleier ved poliklinikken bør ha funksjon som ressurssykepleier og være med i kompetansenettverket i foretaket.
Personale
- Poliklinikken skal ha ansatt kreftsykepleier.
- Legene og sykepleierne bør ha god kompetanse i palliasjon (nivå B, se Vedlegg 2).
- Poliklinikken bør ha tilgang til prest, sosionom og fysioterapeut.
Lokaler og utstyr
- Tilstrekkelig antall undersøkelses- og behandlingsrom
- Samtalerom
Smerteklinikk på sykehus
Sist faglig oppdatert: 14.10.2019
Definisjon
Smerteklinikkene er konsulentenheter for å vurdere problematiske smertetilstander.
Tilbudet omfatter
- Smertepoliklinikk ved mindre sykehus
- Smerteklinikk ved større sykehus
- Tverrfaglig smerteklinikk ved universitetssykehus
Oppgaver
Alle enhetene skal ta seg av alle typer vanskelige smertetilstander, herunder kreftsmerter hos inneliggende og polikliniske pasienter.
Klinisk tilbud/organisering/personale/lokaler
Det vises til Helsedirektoratets utredningsserie nr. 2 1988: Smerteklinikkvirksomhet i Norge (IK-2264) og Retningslinjer for smertelindring, Den norske legeforening 2009.
Enhetene skal inneha spesiell kompetanse i behandling av komplekse kreftsmerter og beherske de vanligste invasive og neurolytiske behandlingsmetoder.
Smertepoliklinikken/-klinikken skal ha organisert samarbeid med palliativt senter (på regionsykehus: regionalt palliativt senter) og enhetene kan med fordel være samlokalisert. Lege ved smerteklinikken/-poliklinikken bør være en del av det palliative teamet.
Regionalt palliativt senter
Sist faglig oppdatert: 14.10.2019
Definisjon
Regionalt palliativt senter er den regionale kompetansebasen i palliasjon. Senteret består av
- Klinisk del
- FOU/kompetansesenterdel
Senteret skal bygge opp og spre kompetanse i palliasjon i regionen. Det skal være en aktiv pådriver for og følge opp etableringen av det organiserte kompetanse-nettverket i palliasjon i regionen. Den kliniske delen av regionalt palliativt senter vil også fungere som et palliativt senter på sykehus i sitt opptaksområde.
Oppgaver
1. Klinisk del:
Funksjon som palliativt senter på sykehus for området der regionsykehuset har sentral-/lokalsykehusfunksjon, og for sykehusets øvrige avdelinger.
Regional funksjon som referanseavdeling for palliative sentre på sykehus i regionen:
- Råd og veiledning
- Mottak av pasienter med spesielt kompliserte plager og symptomer. Dette innbefatter også psykiske, sosiale og åndelige/eksistensielle forhold.
- Mottak av pasienter som trenger diagnostikk, vurdering eller behandling i 3. linjetjenesten
- Utdannings-, hospiterings- og praksismuligheter, inkludert funksjon som utdanningssted for Kompetanseområde palliativ medisin
- Base for kliniske studier og annen forskning
2. FOU/kompetansesenter:
- Enhet med universitetstilknytning og minimum hovedstilling i palliativ medisin, professor I og/eller førsteamanuensis (jf. NOU 1999:2)
- Undervisning på grunn-, videre- og etterutdanningene for yrkesgrupper som inngår i det palliative teamet
- Fagdager, kurs og seminarer for 1.- og 2.-linjetjenesten
- Forskning og fagutvikling
- Utarbeidelse av prosedyrer og retningslinjer for eget helseforetak og egen region, inkludert kompetansenettverk av ressurssykepleiere, jf. palliativt senter på sykehus. Nasjonalt samarbeid om nasjonale retningslinjer.
- Bistand til plan- og utredningsarbeid for organisering og utbygging av palliasjon i regionen og nasjonalt
- Oppfølging av palliative tiltak og prosjekter i regionen
Klinisk tilbud
Det kliniske tilbudet vil være tilsvarende som ved Palliativt senter på sykehus, se dette.
Organisering
- Det regionale palliative senteret kan organiseres på ulike måter: Senteret kan være en organisatorisk enhet under en annen klinikk/avdeling i sykehuset, men skal være fysisk atskilt/markert. Senteret kan også være en egen administrativ enhet, ev. skilt i en klinisk del og en FOU-del.
- FOU-delen bør ha tilknytning til Det medisinske fakultet.
- Senteret skal ha egen leder med resultatansvar.
- Det medisinsk-faglige ansvar skal ligge hos lege med overlegekompetanse. Overlegen bør ha godkjenning i Kompetanseområde palliativ medisin.
- Senteret skal ha samarbeid med de palliative sentrene på sykehus i regionen og med de andre regionale sentrene.
- Sammen med de palliative sentrene på sykehus i regionen skal regionalt palliativt senter samarbeide med palliative enheter i sykehjem i opptaksområdet.
- Sammen med de palliative sentrene på sykehus i regionen har regionalt palliativt senter ansvaret for nettverket av ressurssykepleiere og ev. andre kompetansenettverk innen lindrende behandling i sitt opptaksområde.
- Senteret skal samarbeide med høyskoler og organisasjoner.
- FOU-delen/kompetansesenteret bør forankres i hele helseregionen, f.eks. ved desentraliserte stillinger eller samarbeidsavtaler.
- Regionalt palliativt senter skal ha organisert samarbeid med den regionale onkologiske avdeling og med den tverrfaglige smerteklinikken på universitetssykehuset. Senteret bør være samlokalisert med smerteklinikken.
- Det skal settes av personale og tid til FOU på bemannings- og arbeids-/ tjenesteplaner.
- Regionalt palliativt senter skal være tilgjengelig for henvendelser fra helsepersonell. Man bør tilstrebe tilgjengelighet på heldøgnsbasis.
- Sengetallet må dimensjoneres i forhold til både lokalsykehusfunksjon og regionsfunksjon. Sengetallet må stå i forhold til både befolkningstall og grunnlag for rasjonell drift.
- De ansatte bør ha individuelle fagplaner. Videreutdanning må prioriteres og tilrettelegges. Personalet skal ha tilbud om veiledning.
Personale
Regionalt palliativt senter skal være tverrfaglig bemannet. Bemanningen må ta høyde for senterets oppgaver innenfor undervisning, forskning og fagutvikling. På grunn av økte oppgaver innenfor FOU bør også bemanningen på regional palliativ enhet være økt i forhold til palliativt senter på sykehus. Dette gjelder alle faggrupper i teamet.
Lokaler
Senteret skal ha egne, egnede lokaler til den kliniske virksomheten og FOU/ kompetansesenterdelen
Palliativt senter på sykehus
Sist faglig oppdatert: 14.10.2019
Definisjon
Består av et tverrfaglig behandlingsteam (palliativt team) med ambulant funksjon til hjemmebesøk og konsulentvirksomhet i sykehusets avdelinger. Teamet innehar bred kompetanse i palliasjon. Palliativt team er en obligatorisk del av et palliativt senter.
Senteret kan også inneholde senger: palliativ enhet. Dette skal være en definert enhet (eventuelt definerte senger) der pasientene skal være inneliggende for palliativ behandling. Enheten skal drives som ”akuttsenger” med vekt på problemløsning med aktiv diagnostikk og behandling. Kort liggetid tilstrebes. Det palliative teamet skal ha ansvar for behandling av pasienter innlagt på enheten (større enheter vil ha eget, tverrfaglig sammensatt personale). Enheten skal også kunne inkludere pasienter med andre hoveddiagnoser enn kreft.
En palliativ sengeenhet på 2-6 senger er beregnet å kunne yte service til en befolkning på ca. 150 – 200 000.
Det palliative teamet
Det palliative teamet skal ha bred kompetanse i akutt palliasjon. Teamet er et sentralt bindeledd mellom 1.- og 2.-linjetjenesten. Teamet skal ha ukentlige fellesmøter der pasienter diskuteres. Den kompetanse teamet ikke selv rår over, skal det formidle gjennom sine kontakter på sykehuset eller i regionen for øvrig, ev. utenfor denne.
Oppgaver:
- Ambulant service til pasientens hjem og sykehjem
- Polikliniske konsultasjoner
- Konsulentvirksomhet ved sykehusets avdelinger
- Vurdering av problemstilling og planlegging av oppholdet før innleggelse i den palliative enheten
- Smerte- og symptomlindring ved den palliative enheten
- Vurdering, råd og hjelp ved sosiale og åndelige/eksistensielle problemer
Palliativ enhet
Oppgaver:
- Akuttsenger med vekt på problemløsning. Kort liggetid, dvs 5-7 dager, tilstrebes.
- Aktiv diagnostikk og behandling i forhold til symptomlindring og optimalisering av funksjon
- Planlegging av pasientens videre oppfølging
- Muligheter for opphold i pasientens terminalfase
Klinisk tilbud på palliativt senter
- Kartlegging, vurdering og innsats i forhold til
- Fysiske
- Psykiske
- Sosiale
- Åndelige/eksistensielle
symptomer og problemer
- Avanserte prosedyrer for smerte- og symptomlindring, som
- Subkutan og intravenøs infusjon av medikamenter
- Væske- og ernæringsterapi
- Opioidskifte
- Epidural- og spinalkateter for smertebehandling
- Mulighet for å gi lindrende sedering til døende (ev. i samarbeid med intensivavsnitt)
- Vurdering og gjennomføring av relevant onkologisk behandling, ev. ved videre henvisning
- God tilgang til laboratorieservice, røntgen (inkludert CT og MR), isotopundersøkelser, behandlingsrom for invasive prosedyrer
- Systematisk arbeid for familie/pårørende
- Systematisk sorgarbeid
- Systematisk bruk av individuell plan
- God tilgjengelighet for samarbeidspartnere. Ved hastesaker tilsyn samme eller neste virkedag.
FOU
Det palliative senteret skal ha FOU som en del av sin virksomhet. I samarbeid med regionalt palliativt senter bør virksomheten omfatte
- Utarbeidelse av prosedyrer og retningslinjer for eget helseforetak, inkludert nettverket av ressurssykepleiere
- Undervisning: Fagdager, kurs og seminarer for 1.- og 2.-linjetjenesten
- Utdanning til Kompetanseområde palliativ medisin
- Hospitering for ulike yrkesgrupper
- Systematisere undervisningsopplegg eller hospitering for utdanningskandidater ved sykehuset
- Deltakelse i forsknings- og fagutviklingsprosjekter
Organisering
- Det palliative senteret kan være en organisatorisk enhet under en annen klinikk/avdeling i sykehuset, men skal være fysisk atskilt/markert.
- Senteret bør ha egen resultat- og budsjettansvarlig leder, med klare ansvarsforhold.
- Det medisinskfaglige ansvar skal ligge hos lege med overlegekompetanse.
- Palliativ enhet bør ha god bemanning av sykepleiere og andre aktuelle faggrupper (se nedenfor) og ha høy pleiefaktor på dagtid. Ved små enheter kan det være hensiktsmessig å ha delvis felles bemanning med annen avdeling/post om kvelden og natten og i deler av helgen.
- Senteret skal ha formalisert samarbeid med smerteklinikk (ev. anestesiavdeling) og onkologisk avdeling/poliklinikk.
- Det palliative senteret og smerteklinikken bør være samlokalisert.
- Senteret skal ha organisert samarbeid med sitt regionale palliative senter og med palliative enheter i sykehjem i sitt nedslagsfelt.
- I samarbeid med regionalt palliativt senter har senteret det organisatoriske ansvaret for kompetansenettverk i sitt helseforetaksområde.
- De ansatte bør ha individuelle fagplaner. Videreutdanning bør prioriteres og tilrettelegges.
- De ansatte skal ha tilbud om veiledning.
- Det skal settes av personale og tid til FOU på bemannings- og arbeids-/ tjenesteplaner.
Pasientansvar
(se også kapittelet Ansvar)
- Ambulant funksjon: Det palliative teamet vil ha konsulentfunksjon (veiledende og rådgivende funksjon) overfor behandlingsansvarlig lege og det øvrige behandlingsteamet i eller utenfor sykehus. Teamet kan i kortere perioder etter avtale ta over ansvaret for oppfølging og behandling, f.eks. under arbeid med kompliserte psykososiale problemer eller oppstart av spesiell behandling.
- Palliativ enhet: Lege og det øvrige personalet ved enheten har ansvar for pasienter innlagt på palliativ enhet.
- Vakttjeneste: Vakttjeneste og eventuelt vaktsamarbeid må være klart definert, f.eks. service fra vakthavende team ved den avdeling/seksjon palliativt senter er administrativt underlagt, med klar ansvarsfordeling.
- Oppfølging etter utskrivning: Ved utskrivning fra palliativ enhet skal relevante aktører være orientert og ansvar fordelt, jf. individuell plan. Det må være avklart hvor ev. ny innleggelse skal skje. Om begrepet åpen retur benyttes, må dette være klart definert.
Personale
De ansatte (unntatt kontorpersonalet) bør ha klinisk erfaring fra palliativ medisin.
Leger:
Antall årsverk avhenger av ønsket kapasitet. Minimum en overlege, som skal ha spesialistkompetanse fra relevant klinisk spesialitet. Legen bør ha godkjenning i Kompetanseområde palliativ medisin (se Vedlegg 2). Legen skal ha palliasjon som hovedaktivitet. Med hovedaktivitet menes at legens stilling skal være utlyst som en stilling i det palliative teamet eller på den palliative enheten. Stillingen skal være legens hovedstilling, og mer enn halvparten av legens kliniske arbeid skal være innenfor teamet eller enheten.
Flere legespesialister bør være fast engasjert på senteret, som (deltids)ansatt eller på konsulentbasis. I tillegg til onkolog og anestesiolog (smertelege) er indre-medisiner, kirurg, psykiater og spesialist i allmennmedisin særlig aktuelle. For å skape et fagmiljø er det viktig at flere leger har arbeidssted på senteret.
Palliativt senter bør også ha lege i spesialisering (i rotasjon).
Sykepleiere:
Minst en sykepleierstilling til det ambulante teamet. Sykepleieren skal ha erfaring fra palliasjon og relevant videreutdanning.
Sengene på palliativ enhet bør ha styrket bemanning med erfarne sykepleiere med relevant videreutdanning.
Kontorfaglig personale:
Tilstrekkelig service til klinisk virksomhet og FOU-del.
Andre faggrupper:
Fysioterapeut, prest og sosionom skal alltid være tilknyttet. Minimum to skal ha fast tilknytning til teamet, formalisert gjennom ansettelse eller skriftlig avtale. I tillegg bør større sentre også ha tilknyttet ernæringsfysiolog, ergoterapeut og psykolog eller psykiater (se over).
Lokaler og utstyr
- Stille enerom
- Fasiliteter for pårørende, med mulighet for overnatting
- Samtalerom
- Møterom, vaktrom og tilstrekkelige kontorarealer
Dagbehandling
Sist faglig oppdatert: 14.10.2019
Definisjon
Palliativ behandling, pleie og omsorg gitt som dagbehandling til polikliniske pasienter. Innholdet må ha en sammensetning og varighet som klart skiller tilbudet fra en poliklinisk konsultasjon. Dagbehandling kan gis på poliklinikken på palliativt senter, på palliativ enhet eller på egen dagavdeling.
Klinisk tilbud
Dagbehandling skal være et medisinsk tilbud med lege- og sykepleiertjenester og tilgang til konsultasjoner hos alle medlemmer av det palliative teamet.
- Kartlegging, vurdering og innsats i forhold til
- Fysiske
- Psykiske
- Sosiale
- Åndelige/eksistensielle
symptomer og problemer
- Vurdering og gjennomføring av relevant onkologisk behandling, ev. ved videre henvisning
- God tilgang til laboratorieservice og røntgen
- Systematisk arbeid for familie/pårørende
- Systematisk sorgarbeid
I tillegg kan dagbehandling omfatte tilbud av mer sosialmedisinsk karakter for å fremme mestring, samt ulike trivselstiltak.
Organisering
Dagbehandling gis på palliativt senter. Dersom dagbehandlingen gis på egen dagavdeling, skal denne være en del av senteret. Vedr. organisering henvises til dette avsnittet under Regionalt palliativt senter og Palliativt senter på sykehus.
Det trengs et visst pasientgrunnlag for å opprette et eget dagtilbud (dagavdeling).
Personale
Dagavdeling skal ha egne sykepleiere, ev. kan pleierne rotere mellom palliativ enhet/team og dagavdelingen. Stillingene for andre yrkesgrupper i det palliative teamet må dimensjoneres for å ivareta pasienter som får dagbehandling.
Lokaler og utstyr
Dagavdeling skal ha
- Legekontor
- Tilstrekkelig antall undersøkelserom/behandlingsrom for konsultasjon hos andre medlemmer i det tverrfaglige teamet
- Samtalerom/grupperom
- Hvilerom
- Kjøkken og spiserom/stue
- ev. rom for arbeidstrening og lignende aktiviteter
Dersom dagbehandling gis på poliklinikk eller palliativ enhet, skal lokaler og utstyr være dimensjonert for dette.
Palliativ enhet i sykehjem, sykestue eller distriktmedisinsk senter
Sist faglig oppdatert: 14.10.2019
Definisjon
Enhet innad i sykehjemmet som er organisatorisk tilrettelagt og har faglig kompetent personale for å kunne gi mer avansert palliativ behandling og pleie enn det som kan tilbys i en vanlig sykehjemsavdeling. Tilsvarende vil gjelde for sykestue og distriktsmedisinsk senter.
Størrelsen på norske kommuner varierer betydelig både med hensyn til areal og innbyggertall. Organiseringen av palliative enheter i sykehjem må derfor tilpasses lokale forhold. I store og mellomstore kommuner er en byomfattende enhet i tett samarbeid med det lokale helseforetaket aktuelt. Små kommuner, der bare et fåtall pasienter trenger palliativ behandling i løpet av et år, kan vurdere interkommunalt samarbeid om en felles sengeenhet. Dette krever at kommunen kan delegere myndighetsutøvelse til interkommunale organer eller andre kommuner.
En palliativ sykehjemsenhet er neppe realistisk i enkeltkommuner med færre enn 10-15 000 innbyggere. Et annet alternativ kan være øremerkede sykehjemssenger som benyttes etter behov.
Oppgaver
- Korttidsplass for justering av symptomlindrende behandling, optimalisering av funksjon og planlegging av videre oppfølging
- Korttidsopphold for å avlaste pårørende
- Kort- eller langtidsopphold for symptomlindrende behandling, pleie og omsorg inntil døden
Enhetens målgruppe vil være alle pasienter i enhetens definerte opptaksområde med alvorlig sykdom, kort forventet levetid og behov for palliative tjenester i kommunehelsetjenesten utover det en vanlig sykehjemsavdeling kan tilby.
Enheten skal også være et tilbud til yngre pasienter.
Pasientene vil komme fra hjemmet eller fra sykehus.
Klinisk tilbud
- Kartlegging, vurdering og innsats i forhold til
- Fysiske
- Psykiske
- Sosiale
- Åndelige/eksistensielle
Symptomer og problemer
- Prosedyrer for smerte- og symptomlindring, som
- Subkutan og intravenøs infusjon av medikamenter
- Subkutan og intravenøs væskebehandling
- Blodtransfusjon
- Kvalifisert pleie
- Fysioterapi
- Laboratorieservice
- Rutiner for henvisning til palliativ behandling, f.eks. strålebehandling
- Systematisk arbeid for familie/pårørende
- Systematisk sorgarbeid
Organisering
- Sykehjemmet inngår i kommunale planer. Organisatorisk bør en palliativ enhet ligge inn under sykehjemmet.
- Enheten kan være en organisatorisk enhet under en annen avdeling/post i sykehjemmet, men bør være fysisk atskilt/markert.
- En palliativ sykehjemsenhet skal ha minst fire senger. Beregningen av sengetallet må ta høyde for at målgruppen også omfatter yngre pasienter.
- Enheten bør ha klart definerte inntakskriterier, tilpasset den enkelte kommunes behov. Kriteriene må ha en klar forankring i kommunens helse- og omsorgsledelse.
- Innleggelser vurderes på kommunens inntaksmøte. Brukerkoordinator med oversikt over aktuelle pasienter i kommunen bør delta på inntaksmøtene. Det samme gjelder representanter fra utførerenhetene (hjemmesykepleie og lege/sykepleier fra den palliative enheten). Direkte henvisning fra palliativt senter på sykehus til sykehjemsenheten kan eventuelt avtalefestes.
- Enheten skal ha eget pleiepersonell (sykepleiere og hjelpepleiere), med økt bemanning i forhold til vanlige sykehjemsavdelinger og god bemanning av sykepleiere. Det bør tilstrebes pleiefaktor 1:2 på dagtid. Ved små enheter kan det være hensiktsmessig å ha helt eller delvis felles bemanning med annen avdeling/post om kvelden og natten og i deler av helgen, men det må være sykepleier til stede på alle vakter.
- Pleiepersonalet bør ikke ansettes i mindre enn 50 % stilling.
- Enheten skal ha økt legebemanning i forhold til vanlige sykehjemsavdelinger. Behovet for legetjenester vil i noen grad avhenge av enhetens inntakskriterier, men legen skal ha minst 2-3 timer tjeneste på enheten per pasient per uke. Det er en fordel om legen i arbeidstiden kan være tilgjengelig på telefon utover dette. Ved planlagt fravær skal det være vikar. Vikaren skal være informert om pasientene og aktuelle problemstillinger.
- Vaktordning for leger bør følge rutinene ved sykehjemmet for øvrig.
- Gjennom god planlegging bør bruk av legevaktlege begrenses til et minimum.
- Enheten skal ha et strukturert samarbeid med fastlegene og hjemmetjenestene.
- Enheten skal ha et strukturert samarbeid med det palliative senteret i det lokale helseforetaket. Samarbeidet bør være formalisert gjennom en forpliktende avtale på overordnet nivå. Samarbeidet bør omfatte inntak av pasienter, felles visittgang for legene, felles faglig oppdatering, hospitering og felles møtesteder. Rotasjonsordninger for legene, med mulighet for tjeneste på palliativ enhet i sykehjemmet og på palliativt senter i foretaket, bør tilstrebes.
- Det regionale palliative senteret bør delta i oppfølgingen av den palliative sykehjemsenheten, innbefattet adekvat evaluering og kvalitetssikring og medvirkning til nødvendige justeringer for kvalitetsforbedring. Sammen med det palliative senteret i det lokale helseforetaket kan det regionale senteret bidra til sykehjemsenhetens undervisningsprogram og medvirke til at enheten deltar i forskningsprosjekter og gir tellende tjeneste til Kompetanseområde palliativ medisin.
- Sykepleier fra enheten bør være med i nettverket av ressurssykepleiere i foretaksområdet.
- Enheten skal legge til rette for etter- og videreutdanning for personalet og ha en plan for undervisning.
- De ansatte bør ha tilbud om veiledning.
Personale
Egen, fast lege må være tilknyttet enheten. Legen bør være spesialist i allmennmedisin eller annen relevant klinisk spesialitet som indremedisin, anestesiologi eller onkologi, og skal ha kompetanse i palliasjon tilsvarende nivå B.
Godkjenning i Kompetanseområde palliativ medisin er ønskelig ved større enheter (se Vedlegg 2).
Lege fra palliativt senter (palliativt team) i foretaket skal ha konsulentfunksjon ved enheten.
Enheten skal fortrinnsvis ha sykepleiere med relevant videreutdanning.
Hjelpepleiere kan også være ansatt ved enheten. Hjelpepleierne bør ha relevant videreutdanning (se Vedlegg 2).
Andre faggrupper:
Fysioterapeut, prest og sosionom skal alltid være tilknyttet, ev. i deltidsstilling eller på konsulentbasis.
Lokaler og utstyr
- Enerom med eget bad og nødvendige tekniske pleiefasiliteter
- Fasiliteter for pårørende, med mulighet for overnatting
- Samtalerom
- Vaktrom og legekontor
- Helst stue og kjøkkenfasiliteter
Sykehjem uten palliativ enhet
Sist faglig oppdatert: 14.10.2019
Oppgaver
Legge til rette for og gi god symptomlindring og god terminal pleie og omsorg for alle pasientene i sykehjemmet.
Klinisk tilbud
- Alle sykehjem skal beherske grunnleggende palliasjon (se kap. Innledning)
- Alle sykehjem bør utarbeide og kvalitetssikre prosedyrer for smerte- og symptomlindring og terminal pleie
Organisering og personale
- Minst en sykepleier fra sykehjemmet bør være med i nettverket av ressurssykepleiere i foretaket
- Sykehjemslegen bør ha god kompetanse i palliasjon, tilsvarende nivå B (se Vedlegg 2)
- Legetjenestene bør organiseres slik at bruk av legevaktlege begrenses til et minimum
- Sykehjemmet skal ha tilgang til andre relevante faggrupper, minimum prest og fysioterapeut
- Det bør legges til rette for god kontakt med og mulighet for råd og veiledning fra enheter med spesialkompetanse i palliasjon: Palliativ enhet i nærliggende sykehjem og/eller palliativt senter i det lokale helseforetaket.
Lokaler og utstyr
- Enerom for terminal pleie
- Fasiliteter for pårørende
- Samtalerom
Øremerkede palliative senger i sykehjem
I små kommuner kan en egen palliativ sykehjemsenhet være uhensiktsmessig og vanskelig å gjennomføre. Et alternativ kan være å øremerke en eller et par sykehjemssenger for palliativ behandling og benytte disse etter behov. Senger øremerket for palliasjon kan være en motiverende organisering som gir økt fokus på fagfeltet, er kompetansegenererende og har positive ringvirkninger for sykehjemmet som helhet.
Palliative senger i sykehjem krever tilfredsstillende lokaliteter (skjerming, mulighet for overnatting for pårørende) og tilstrekkelig kompetanse hos personalet til å gi god grunnleggende palliasjon. Minst en sykepleier bør ha videreutdanning i kreftsykepleie eller palliativ omsorg. Sykehjemmet skal ha tilgang til andre relevante faggrupper, minimum prest og fysioterapeut. Samarbeid med palliativt senter i det lokale helseforetaket og med regionalt palliativt senter er nødvendig.
Hjemmebasert omsorg
Sist faglig oppdatert: 14.10.2019
Definisjon
Den palliative behandling, pleie og omsorg som pasient og pårørende trenger når pasienten tilbringer hele eller deler av den siste tiden av livet i hjemmet.
Oppgaver
- Skaffe pasient og pårørende de lege-, pleie- og omsorgstjenester som det til enhver tid er behov for
- Koordinere tjenestene rundt pasienten
Klinisk tilbud
Grunnleggende palliasjon skal beherskes (se kap. Innledning). Tilbudet skal omfatte
- Hjemmesykepleie
- Hjelp til å anskaffe nødvendige hjelpemidler
- Oppfølging og nødvendige hjemmebesøk fra fastlegen
- Vurdering og innsats fra andre faggrupper eller instanser i kommunen (prest, fysioterapeut, sosionom, kreftkoordinator, koordinerende enhet osv.) etter behov
- Nødvendig samarbeid med spesialisthelsetjenesten, herunder palliativt team
- Henvisning til og samarbeid med sykehjem / palliativ enhet i sykehjem etter behov
Organisering
- Ansvaret for hjemmebasert omsorg vil i all hovedsak ligge hos den kommunale pleie- og omsorgstjenesten (hjemmesykepleien) og fastlegen. Enkelte steder fins særskilte ordninger, f.eks. Fransiscushjelpen i Oslo, som er et ambulant tilbud med døgntjeneste.
- Hjemmesykepleien og fastlegen skal samarbeide med palliativt team når dette er nødvendig for å gi god behandling og pleie. Palliativt team vil i hovedsak ha en konsulentfunksjon.
- Minst en sykepleier i hver kommune/sone bør være med i nettverket av ressurssykepleiere i foretaksområdet. Dersom kreftsykepleier er ansatt i kommunen, vil det være naturlig at kreftsykepleier har denne funksjonen. Ressurssykepleier skal bistå det øvrige personalet i hjemmesykepleien med råd og veiledning, og kan om nødvendig også delta i pleien. Ressurssykepleier er kontaktperson for palliativt senter i foretaket.
- Mange kommuner har etter hvert fått ansatt kreftkoordinator. Kreftkoordinators funksjon og organisatoriske plassering avhenger av kommunestørrelse og -organisering. Det skal være en definert ansvars- og funksjonsfordeling og faste samarbeidsrutiner mellom kreftkoordinator og ressurssykepleier. I mindre kommuner kan det være naturlig at samme person (kreftsykepleier) har begge funksjoner.
- Pasienter med behov for sammensatte tjenester har rett til en koordinator i kommunen (jf. individuell plan). Denne funksjonen bør vanligvis tillegges ressurssykepleier eller en annen sykepleier i hjemmesykepleien.
- Den hjemmebaserte omsorgen må organiseres slik at pasient og pårørende kan ha tilgang til kvalifisert hjelp døgnet rundt. Dette innebærer:
- Det må være tilgjengelig heldøgnstjeneste i hjemmesykepleien. Mobiltelefonnummer til hjemmesykepleien skal alltid være tilgjengelig for pasient og pårørende.
- Koordinator skal påse at det er faste avtaler i hjemmet etter pasientens behov.
- Fastlegen bør foreta hjemmebesøk etter avtale med pasient/pårørende og hjemmesykepleien. Det må utarbeides en rutine for legehjelp utenom arbeidstid
- Ved planlagt fravær må fastlegen gjøre avtale med annen kollega og orientere om pasienten/familien og de mulige problemer som kan oppstå.
- Fastlegen har det koordinerende ansvaret for den medisinske behandlingen av pasienten. I spesielle tilfeller kan sykehusets palliative team overta behandlingsansvaret.
Personale
Pasientens fastlege og tilstrekkelig pleiepersonell fra hjemmesykepleien. Alle kommuner bør ha ansatt kreftsykepleier.
Hjelpepleiere kan også arbeide med palliative pasienter i hjemmebasert omsorg.
Andre yrkesgrupper som fysioterapeut, prest og sosionom må kunne trekkes inn etter behov. Det samme gjelder kreftkoordinator.
Omsorgsboliger, serviceboliger, boliger med personalbase og lignende ordninger
Personer som bor i denne type boliger, er å regne som hjemmeboende og skal få dekket sitt behov for lege- og pleietjenester gjennom sin fastlege og kommunens hjemmetjenester (se over). Erfaringsmessig har imidlertid mange av disse beboerne et behov for lege- og pleietjenester som tilsvarer behovet hos beboere i sykehjem. Noen kommuner har derfor innført en ordning med tilsynslege eller rådgivende lege for sine omsorgsboliger. Dersom beboeren har en annen fastlege, kan dette føre til at vedkommende forholder seg til flere leger.
Det er viktig for sykehus og sykehjem å være seg disse forhold bevisst ved utskrivning av pasienter med behov for pleietjenester og/eller tett oppfølging fra lege til denne type boliger.
Utviklingssenter for sykehjem og hjemmetjenester
Sist faglig oppdatert: 14.10.2019
Definisjon
Utviklingssenter for sykehjem og hjemmetjenester (USHT) er en nasjonal satsing som skal bidra til gode pleie- og omsorgstjenester i kommunene. Satsingen er tilskuddsfinansiert av Helsedirektoratet og er en videreutvikling av satsingen «Undervisningssykehjem» som startet i 1999 (10).
Satsingen og strategidokumentet for utviklingssentrene skal evalueres i 2015.
Oppgaver
Utviklingssenteret skal være pådriver for kunnskap og kvalitet i sykehjem og hjemmetjenester i sitt fylke, innenfor følgende områder:
- Fag- og tjenesteutvikling innen lokalt og nasjonalt definerte satsingsområder
- Videreutvikling av praksistilbudet til elever, lærlinger og studenter
- Kompetanseutvikling hos ansatte
- Tilrettelegging for forskning og utvikling i helse- og omsorgstjenesten
Palliasjon er ett av fokusområdene for utviklingssentrene. En rekke av sentrene har prosjekter/kompetansetilbud innen lindrende behandling (utviklingssenter.no)
Organisering
- Som hovedregel er det to utviklingssentre i hvert fylke, ett for sykehjem og ett for hjemmetjenester. Sentrene skal samarbeide, og i noen fylker er de slått sammen til ett senter.
- Administrativ ledelse i vertskommunen er ansvarlig for utviklingssenteret. Senteret skal ha klar forankring i relevant kommunalt organ. Intern organisering avgjøres lokalt av ledelsen i sykehjemmet/hjemmetjenesten; oppgavene kan være plassert i en forsknings- og utviklingsavdeling eller tilsvarende.
- Senteret skal ha samarbeidsavtaler med aktuelle helseforetak, utdannings- og forskningsinstitusjoner. Hvert utviklingssenter skal ha et bredt sammensatt fag- og samarbeidsråd.
- Senteret skal involvere alle kommuner i fylket i prosjekter, kunnskapsspredning og fagnettverk
- Senteret skal ha kompetanse og kapasitet til veiledning av studenter, elever og lærlinger og være godkjent praksissted for elever og studenter fra ulike fagområder
- Utviklingssentrene samarbeider innen egen region. Helsedirektoratet arrangerer et årlig nasjonalt seminar for alle utviklingssentrene.
- Det regionale kompetansesenteret for lindrende behandling er en naturlig samarbeidspartner som gir utviklingssentrene mulighet til å delta i faglige nettverk innen palliasjon
Kompetansenettverk av ressurssykepleiere
Sist faglig oppdatert: 14.10.2019
Definisjon
Et nettverk av sykepleiere med definert ansvarsområde og funksjon innenfor palliasjon i foretaksområdet.
Det bør være en ressurssykepleier i hver kommune/sone, i hvert sykehjem og på hver sykehusavdeling (ev. post) som behandler kreftpasienter.
Nettverket er sentralt for å ivareta kontinuiteten i pleie- og omsorgstilbudet til kreftpasientene og for å spre kompetanse om palliasjon i hele foretaksområdet.
Oppgaver
Nettverket har følgende funksjoner:
- Klinisk virksomhet på arbeidsplassen:
Ressurssykepleier har et spesielt ansvar for
- Organiseringen av pleie- og omsorgstjenestene for palliative kreftpasienter på sin avdeling / i sin sone (jf. Grunnleggende palliasjon, kap. Innledning)
- Veiledning og rådgivning overfor sine kolleger, og trenger ikke selv være pasientansvarlig sykepleier for pasientene
Det er naturlig at ressurssykepleier
- Sammen med avdelingsledelsen er ansvarlig for gode systemer og rutiner for oppfølging og pleie av palliative pasienter, inkludert terminal pleie
- Har oversikt over de palliative pasientene i sin avdeling/sone
- Informeres og konsulteres om disse pasientene
- Ofte har rollen som koordinator for individuell plan
- Er kontaktperson for det palliative senteret
Ressurssykepleier på sykehusavdeling kan fungere som bindeledd mellom avdelingen og 1.-linjetjenesten (flere steder kalt kontaktsykepleier).
- Samhandling – systemarbeid:
- Nettverket skal utarbeide og/eller implementere rutiner for samarbeid og samhandling i området, f.eks. rutiner for innleggelse i og utskrivning fra sykehus, sjekklister, retningslinjer for åpen retur.
- Kompetanseheving:
- Ressurssykepleierne skal tilbys en kompetansepakke når de utnevnes til denne funksjonen.
- De skal også ha systematisk videre kompetanseheving og oppfølging.
- Ressurssykepleier har selv et ansvar for å videreformidle kompetanse på sin arbeidsplass, inkludert informasjon om felles rutiner og samhandlingsprosedyrer.
Organisering
- Det palliative senteret skal i samarbeid med regionalt palliativt senter ha ansvaret for kompetansenettverket av ressurssykepleiere i sitt foretaksområde.
- Det kan være naturlig å samarbeide med andre institusjoner og organisasjoner om driften av nettverket, f.eks. høyskoler eller Kreftforeningen.
- Nettverket bør forankres i forpliktende samarbeidsavtaler mellom kommuner og helseforetak og ev. andre involverte parter.
- Det bør lages en ledelsesgruppe med ledere fra kommuner og klinikker/avdelinger ved sykehuset. Ressurssykepleierne bør være representert i ledelsesgruppen. For større nettverk kan en organisering med styringsgruppe og driftsgruppe være hensiktsmessig (styringsgruppen har da et overordnet ansvar for nettverket, mens driftsgruppen står for den daglige driften).
- Nettverket bør ha minst en samling i halvåret, med fokus på samhandling og kompetanseheving. Samlingene bør veksle mellom møter i lokale nettverksgrupper og samlinger for hele foretaksområdet. Lokale nettverksgrupper bør være sammensatt av ressurssykepleiere fra både kommune- og spesialisthelsetjenesten.
- Ressurssykepleier rapporterer til sin leder og har behov for oppfølging og tilrettelegging for å kunne fylle sin rolle.
- Arbeidsgiver har et ansvar for å tilrettelegge det daglige arbeidet slik at ressurssykepleier kan utøve sin funksjon. Dette kan innebære at ressurssykepleier får en soneovergripende funksjon og/eller frisettes i forhold til vanlig turnus. Kommunens størrelse og organisering vil være avgjørende for hvor stor del av arbeidstiden slike ordninger bør gjelde for.
- Arbeidsgiver må legge til rette for at ressurssykepleier kan delta på nettverkssamlinger og andre aktuelle kurs/konferanser.
- Ressurssykepleierne bør få mulighet til å hospitere på palliativt senter, onkologisk poliklinikk eller onkologisk sengepost, helst etter et definert hospiteringsprogram.
- Ressurssykepleierne bør ha tilbud om faglig veiledning.
Personale
- Ressurssykepleier bør ha kompetanse i palliasjon tilsvarende nivå B (se Vedlegg 2).
- Alle kommuner bør ha ansatt kreftsykepleier, og det er naturlig at kreftsykepleier får funksjonen som ressurssykepleier.
- Tverrfaglig videreutdanning i palliativ omsorg er også en aktuell bakgrunn.
- Der det ikke finnes sykepleiere med relevant videreutdanning, må funksjonen som ressurssykepleier gis til sykepleiere som har spesiell interesse for kreftpasienter, arbeider med denne pasientgruppen og er personlig egnet.
- Kommunale kreftkoordinatorer bør være med i kompetansenettverket av ressurssykepleiere, også om de ikke har funksjon som ressurssykepleier, jf avsnitt om Hjemmebasert omsorg
Kompetansenettverk av andre faggrupper
Sist faglig oppdatert: 14.10.2019
Kompetansenettverk bør også dannes av andre faggrupper som deltar i behandling og pleie av alvorlig syke og døende. Flere steder er det f.eks. opprettet nettverk for fysio- og ergoterapeuter. Det regionale palliative senteret bør stimulere til dannelsen av slike nettverk og følge opp arbeidet. Organiseringen av nettverkene bør følge malen fra sykepleiernettverket.
Ansvar
Sist faglig oppdatert: 14.10.2019
De fleste pasienter i en palliativ situasjon ønsker å tilbringe mest mulig tid i hjemmet. Samtidig har de fleste behov for sykehusbehandling i perioder, og i økende grad gis også palliativ behandling og pleie i sykehjem. Pasientene flytter altså mellom ulike organisatoriske enheter, samtidig som de har behov for tett oppfølging. Ansvarsfordeling og -avklaring blir dermed spesielt viktig.
Begrepet ansvarlig lege beskriver en aktiv rolle knyttet til behandling og oppfølging av pasienten, der også det juridiske aspektet ivaretas.
Fastlegen (11)
- Er pasientens ansvarlige lege som har det overordnede, koordinerende ansvar for omsorg og behandling
- Har et listeansvar som "dekker alle allmennlegeoppgaver innen somatikk, psykisk helse og rus for innbyggerne på listen dersom ikke annet er presisert i lov eller forskrift" (Fastlegeforskriften)
- Er ansvarlig for den medisinske behandlingen av pasienten i hjemmet. Fastlegen skal gi tilbud om hjemmebesøk til egne pasienter som på grunn av sin helsetilstand eller funksjonsevne ikke er i stand til å møte til konsultasjon på legekontoret, eller når dette anses nødvendig for å sikre pasienten forsvarlig helsehjelp
- Skal samarbeide med ressurssykepleier, hjemmesykepleien og sykehjem (pleie- og omsorgstjenestene)
- Bør ut fra sin rolle som fastlege ta ledelsen ved aktivt å initiere, prioritere, koordinere og følge opp nødvendig diagnostikk og behandling i samarbeid med spesialisthelsetjenesten. Dette innebærer også å trekke inn andre faggrupper eller ressurser (som kommunefysioterapeut, lokal prest, sosionom, kreftkoordinator osv.) når dette er nødvendig for å sikre en helhetlig tilnærming til pasientens problemer og behov.
Ordningen med pasientansvarlig lege i sykehus ble fjernet fra lov og forskrifter i 2011. Ved lovendringene som er kommet i forbindelse med samhandlingsreformen (9), er en ny bestemmelse om koordinator i spesialisthelsetjenesten kommet inn (12).
Koordinator i spesialisthelsetjenesten
- Skal oppnevnes for pasienter med behov for komplekse eller langvarige og koordinerte tjenester i spesialisthelsetjenesten
- Skal tilbys uavhengig av om pasienten ønsker individuell plan
- Skal sørge for nødvendig oppfølging av den enkelte pasient
- Skal sikre samordning av tjenestetilbudet i forbindelse med institusjonsopphold og overfor andre tjenesteytere
- Skal sikre fremdrift i arbeidet med individuell plan
- Bør være lege, men annet helsepersonell kan være koordinator når det anses hensiktsmessig og forsvarlig
Behandlingsansvarlig lege
- Er enhver lege som igangsetter, endrer eller avslutter et behandlingsregime
- Har ansvar for sin forordning
- Bør gjøre endringene i samarbeid med pasientens fastlege eller koordinator, så sant det er mulig
Lege på palliativt senter
- har vanligvis konsulentfunksjon overfor fastlege, sykehjemslege eller behandlingsansvarlig lege i sykehus
- kan overta behandlingsansvaret og har da ansvar for en definert ordinasjon i den definerte tidsperioden denne gjennomføres, f.eks. ”all smertebehandling i perioden fra da til da”. Dette kan være hensiktsmessig for å sikre god kvalitet på et igangsatt regime. Denne type temporært behandlingsansvar må avtales med behandlingsansvarlig lege i hjemmet (fastlegen) eller på institusjon, med klar fordeling av ansvar
- har som hovedregel behandlingsansvar for pasienter innlagt på palliativ enhet.
For å sikre kontinuiteten er det viktig å ha nært samarbeid med behandlingsansvarlig lege og koordinator ved pasientens moderavdeling.
De to første punktene over vil også gjelde lege ved smerteklinikk.
Lege i sykehjem, sykestue og distriktsmedisinsk senter
- Vil ha behandlingsansvar for pasienter innlagt på institusjonen
- Skal ha nært samarbeid med pasientens fastlege og behandlingsansvarlig lege på sykehus
Lege ved palliativ enhet i sykehjem, sykestue eller distriktsmedisinsk senter vil på tilsvarende måte ha behandlingsansvar for pasienter innlagt på den palliative enheten.
Ressurssykepleier
- Skal ha en definert myndighet til å ivareta fagutvikling og vedlikeholde prosedyrer og retningslinjer innenfor palliativ sykepleie, inklusive å arbeide for at rutiner for samhandling og samarbeid fungerer i henhold til avtaler
Ressurssykepleier i hjemmesykepleien og i sykehjem
- Vil sammen med fastlegen/sykehjemslegen ofte være bindeledd mot palliativt senter eller andre avdelinger i spesialisthelsetjenesten og skal bidra til at kontinuiteten i pleie- og omsorgstilbudet ivaretas
- Skal bistå med råd og veiledning til det øvrige personalet
Ressurssykepleier i hjemmesykepleien vil ofte ha rollen som koordinator for individuell plan, kfr. avsnittet Dokumentasjon og kommunikasjon mellom aktørene
Sykepleier
- Kan i utstrakt grad ha myndighet til å
- Gjennomføre praktiske prosedyrer
- Følge opp definerte behandlingsregimer, f.eks. invasiv smertebehandling
Ansvarlig lege skal definere doseringsrammene for medikamentelle ordinasjoner.
- Skal være sertifisert til å håndtere slike prosedyrer
Øvrige yrkesgrupper på palliativt senter
- Vil også i de fleste tilfeller ha en konsulentfunksjon i forhold til pasientansvarlig lege og annet personell som deltar i behandlingen av pasienten i eller utenfor sykehus
- Kan ha temporært behandlings-/oppfølgingsansvar for pasienter henvist til teamet, jf. over
- Har et særlig ansvar for å gi råd og veiledning til egen yrkesgruppe
- Vil være en del av det ansvarlige behandlingsteamet for pasienter innlagt på palliativ enhet
Systemansvar
Systemansvaret ligger hos linjelederne på de ulike organisasjonsnivåene. Dette innebærer et totalt resultatansvar, som inkluderer ansvaret for organisering, samarbeid, drift og økonomi, i tillegg til oppfølging av en definert faglig standard.
Det regionale helseforetaket har ansvar for etablering, oppfølging og kvalitetssikring av kompetansesenteret og kompetansenettverket på regionalt nivå som beskrevet ovenfor. Dette skjer bl.a. gjennom prioritering av økonomiske rammetilskudd, legehjemler og oppfølging av kvalitetsindikatorer.
Referanser
Sist faglig oppdatert: 14.10.2019
- Norges offentlige utredninger. Omsorg og kunnskap – norsk kreftplan. NOU 1997: 20
- Norges offentlige utredninger. Livshjelp. Pleie og omsorg for uhelbredelig syke og døende. NOU 1999: 2
- Nasjonal strategi for arbeid innenfor kreftomsorgen – kvalitet, kompetanse og kapasitet. Rapport til Helsedepartementet, juni 2004
- Norges offentlige utredninger. Fra stykkevis til helt – en sammenhengende helsetjeneste. NOU 2005: 3
- Nasjonal strategi for kreftområdet 2006-2011. Helse- og omsorgsdepartementet 2006.
- Standard for palliasjon. Oslo: Norsk forening for palliativ medisin, Den norske lægeforening; 2004 https://www.legeforeningen.no/om-oss/publikasjoner/standard-for-palliasjon/
- Lov om helsepersonell m.v. (helsepersonelloven) http://www.lovdata.no/all/nl-19990702-064.html (206.2013)
- Mestring, muligheter og mening. Framtidas omsorgsutfordringer. (Omsorgsplan 2015). St.meld. nr. 25 (2005-2006). Helse- og omsorgsdepartementet.
- Samhandlingsreformen. Rett behandling - på rett sted - til rett tid. St.meld. nr. 47 (2008-2009).
- Utvikling gjennom kunnskap. Utviklingssenter for sykehjem og hjemmetjenester - en nasjonal satsing. Overordnet strategi 2011-2015. Helsedirektoratet 2010, publikasjon IS-1858.
- Forskrift om fastlegeordning i kommunene. Helse- og omsorgsdepartementet 29. august 2012.
- Lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven). http://www.lovdata.no/all/hl-19990702-061.html (27.06.2013)
Kompetanse
Sist faglig oppdatert: 14.10.2019
(Ikke oppdatert 2019)
En grunnleggende forutsetning for optimal palliasjon er at hele personalet har den nødvendige faglige kompetanse. Med faglig kompetanse menes både kunnskaper, ferdigheter og holdninger.
I dette vedlegget beskrives krav til kompetanse for aktuelle yrkesgrupper innenfor palliasjon og hvordan denne kompetansen kan oppnås per i dag. Arbeidsgruppen fremmer også en rekke forslag til tiltak for å heve kompetansen innenfor palliasjon.
Kompetansenivåer
Siden lindrende behandling utføres på alle nivåer i helsevesenet, differensierer internasjonale læreplaner mellom tre ulike kompetansenivåer (1-7). Dette er gjort mest systematisk for leger og sykepleiere, men arbeidsgruppen har ønsket å bruke denne malen for alle yrkesgrupper som gir behandling, pleie og omsorg til palliative pasienter.
Nivå A: Grunnleggende kompetanse. Denne skal alle helsearbeidere innenfor de aktuelle yrkesgruppene inneha, og den må formidles i grunnutdannelsen.
Nivå B: Nødvendig kompetanse for helsearbeidere som behandler palliative pasienter som en del av sitt kliniske arbeid, både i kommunehelsetjenesten og på sykehus.
Nivå C: Nødvendig kompetanse for helsearbeidere som leder eller arbeider i palliative team og på palliative enheter. Dette nivået tilsvarer spesialistnivået.
Alle faggruppene på palliativt senter trenger spisskompetanse innen sitt eget fagfelt for å kunne bidra best mulig i teamets tverrfaglige tilbud til pasienten og de pårørende. Det er også viktig at alle faggrupper deltar i forskning og fagutvikling.
Nettverk av ressurssykepleiere i palliasjon er beskrevet i vedlegg 1. Tilsvarende regionale nettverk bør dannes av andre faggrupper.
På nasjonalt plan fins spesialforeninger eller interessegrupper innenfor onkologi og palliasjon i flere av yrkesforeningene.
Sykepleiere
Sist faglig oppdatert: 14.10.2019
Kompetansekrav
Nivå B
Sykepleiere som gir behandling og pleie til kreftpasienter og andre pasienter i
palliativ fase, skal forstå, ha erfaringskunnskap og handlingskompetanse i forhold til
- kreftsykdommer og ulike behandlingsformer for kreft, samt ha grunnleggende kunnskaper om andre aktuelle pasientgrupper (f eks geriatriske og nevrologiske pasienter)
- palliasjon som fagfelt
- konsekvenser av sykdom og behandling for pasient og pårørende
- rådgivning og veiledning til pasienter og pårørende og kolleger på eget arbeidssted
- barn som pårørende og relevante systemer for å ivareta sårbare grupper/personer
- systematisk symptomkartlegging, observasjon og evaluering
- smertebehandling og annen symptomlindrende behandling
- ivaretakelse av døende, inkludert diagnostisering av når pasienten er døende
- sykepleierens rolle i tverrfaglig samarbeid
- kommunikasjon med alvorlig syke pasienter og deres pårørende
- reaksjoner på alvorlig sykdom
- etiske vurderinger i forbindelse med alvorlig sykdom og livets avslutning
- systemkunnskap – lover, rettigheter og plikter i forhold til palliative pasienter
- betydningen av identitets-, etnisitets- og kulturforståelse i møte med lidelse
- ivaretakelse av og støtte til pasienter/pårørende i forhold til livskvalitet, mestring og bearbeiding av sorg og kriser
- nettverksarbeid og tverretatlig samarbeid
- organisering av det palliative tilbudet
- sykepleierens ansvar for koordinering av tjenestene rundt pasienten
- helsepersonells individuelle ansvar for faglig forsvarlighet
- å delta i prosjektarbeid i fagfeltet
- prinsipper for kunnskapsbasert praksis
Nivå C
Kompetansekravene på dette nivået bygger på EAPCs anbefalinger for videreutdanning i palliativ sykepleie (7). Kompetanse på nivå C skal sette sykepleieren i stand til å fylle sin rolle i det palliative teamet og innebærer at sykepleieren skal
- ha gode kommunikasjonsferdigheter
- kunne intervenere i eksistensielle problemstillinger og hjelpe pasienten til å mestre situasjonen
- kunne vurdere konsekvenser av alvorlig sykdom for både pasienten og familien/pårørende
- ha inngående og oppdaterte kunnskaper og ferdigheter i kartlegging: Systematisk observasjon, dokumentasjon og evaluering av fysiske, psykiske, sosiale og åndelige/ eksistensielle symptomer og behov
- ha kunnskaper og ferdigheter i smerte- og symptomlindring
- ha kunnskap om sykdomsutvikling og kunne bidra til et sykdomsforløp der god symptomkontroll ivaretas ved strategiske og forebyggende tiltak
- ha en tydelig faglig identitet og kunne bidra aktivt i kliniske beslutninger
- kunne delta i målrettet tverrfaglig samarbeid og faglige diskusjoner
- kunne koordinere tjenester i samarbeid med andre aktører i nettverket slik at pasienter og pårørende opplever trygghet og kontinuitet
- kunne gi råd og veiledning om kliniske problemstillinger til kolleger i og utenfor sykehus
- kunne identifisere, reflektere over og diskutere etiske dilemmaer i palliasjon
- ha kjennskap til organiseringen av palliative tilbud på lokalt, nasjonalt og internasjonalt nivå
- kunne undervise, veilede og informere om palliasjon til helsepersonell, studenter, politikere og publikum
- ha kjennskap til etiske og metodiske prinsipper for forskning innenfor palliasjon
- kunne finne fram til og anvende ny relevant forskningskunnskap
- kunne initiere og delta i forskning og fagutvikling
- ha tverretatlig forståelse og kunnskap
- kunne anvende kunnskap om identitets-, etnisitets- og kulturforståelse i møte med lidelse
- ha forståelse for eksistensielle problemstillinger med relevans for palliasjon, f.eks. i forhold til verdighet, integritet, anerkjennelse, makt – avmakt, avhengighet, krenkelse og sosialisering/tilpasning
- kunne ivareta og støtte pasienter/pårørende i forhold til livskvalitet, mestring og bearbeiding av sorg og kriser
Utdanning
Nivå A: Bachelorutdanningen i sykepleie gir grunnleggende kunnskap om lindrende behandling.
Nivå B: Godkjent videreutdanning i kreftsykepleie eller palliasjon / palliativ sykepleie eller annen videreutdanning som inneholder palliasjon som hoved- eller delemne, for eksempel aldring og eldreomsorg eller intensivsykepleie. Studiet må inneholde klinisk praksis i forhold til palliasjon. Kompetansen kan også oppnås ved relevant praksis og godkjente kurs, ev. som klinisk spesialist innen fagfeltet etter kriterier fastsatt av Norsk sykepleierforbund eller gjennom kompetanseprogram for ressurssykepleiere
Nivå C: Fagspesifikk klinisk videreutdanning i palliativ sykepleie er ikke etablert i Norge. Per i dag er den mest relevante utdanning videreutdanning som nevnt under nivå B, supplert med relevante kurs og praksis fra spesialisert palliativ virksomhet.
Nivå C kan også oppnås med relevant masterutdanning med fordypning/masteroppgave i palliasjon og lang klinisk praksis innen fagområdet.
Forslag til tiltak
Nivå A: Sørge for at høyskolene/universitetene og det kliniske fagfelt samarbeider i forhold til undervisning i grunnleggende palliativ sykepleie.
Nivå B: Sørge for at palliativ sykepleie er en obligatorisk del i ramme- og fagplaner for de tidligere nevnte videreutdanningene. Omfanget av faget må tilpasses videreutdanningens målsetting. Kurs må godkjennes som meritterende i forhold til klinisk spesialist i sykepleie og følge kompetansekrav beskrevet i dette handlingsprogrammet.
Nivå C: Det anbefales å etablere en rammegodkjent, fagspesifikk videreutdanning i palliativ sykepleie. Kreftsykepleie må være en sentral del av utdanningen da majoriteten av pasientene på palliative enheter er kreftpasienter. Utdanningsprogrammet må også vektlegge kompetanse i forhold til andre pasientgrupper i behov av palliasjon.
Det må også være et tilbud om masterprogram i palliasjon, ev. med fordypning i palliasjon.
De kliniske fagmiljøene må samarbeide med utdanningsinstitusjonene i forhold til innhold i fagplaner. Videre må en utvikle fordypningskurs/-program for sykepleiere som har gjennomført de tidligere nevnte, relevante videreutdanningene. Det må legges til rette for godkjente, kliniske praksisplasser i spesialisert palliativ virksomhet i spesialist- og kommunehelsetjenesten.
Leger
Sist faglig oppdatert: 14.10.2019
Kompetansekrav
I Storbritannia har palliativ medisin vært en egen spesialitet siden 1987 (1-2, 6). Det britiske curriculum for palliativ medisin har også vært basis for EAPCs anbefalinger (3) og Svensk läroplan i palliativ medicin (4).
Curriculum omfatter følgende emner:
- Fysiske aspekter: Sykdomsprosessen, smerte- og symptomkontroll, farmakologi, komorbiditet
- Den døende pasient
- Psykososiale aspekter: Ivaretakelse av familien, kommunikasjon, psykologiske reaksjoner, sorg
- Religiøse og kulturelle aspekter
- Etiske aspekter
- Tverrfaglig teamarbeid. Tilnærming til palliative pasienter, beslutningslære
- Organisatoriske aspekter
- FOU. Kvalitetsforbedring og forskningsmetodikk i populasjoner med avansert sykdom
Nivå B
Alle leger som behandler kreftpasienter, skal
- Kjenne ulike smertetyper og virkningen av ulike lindrende metoder
- Kunne utføre undersøkelse, kartlegging og diagnostikk av smerter og andre symptomer
- Kjenne til og kunne bruke vanlige verktøy for symptomregistrering (ESAS-r og andre kartleggingsskjema)
- Kjenne betydningen av adekvat diagnostikk for å klargjøre årsaken til smerter og andre symptomer, og kunne utføre eller henvise til slik diagnostikk
- Kunne forebygge og behandle smerte, kvalme, obstipasjon og andre plager fra kreftsykdommer
- Ha innsikt i øyeblikkelig hjelp-tilstander hos kreftpasienter, spesielt truende tverrsnittslesjon, vena cava superior-syndrom og hypercalcemi, og vite hvordan disse behandles
- Sørge for at pasientene blir adekvat vurdert i forhold til tumorrettet behandling, og ha henvisningsrutiner for dette
- Kjenne WHOs smertetrapp
- Kunne starte opp behandling med subkutan smertepumpe for tilførsel av analgetika og ev. andre medikamenter, f.eks. kvalmestillende
- Kjenne til komplikasjoner til og bivirkninger av behandlingene, og kunne behandle disse
- Ha henvisningsrutiner til relevant palliativ behandling for pasienter med uhelbredelig kreft
- Samarbeide tverrfaglig med andre spesialister og profesjoner, og kunne lage en behandlingsplan hvor man tar hensyn til både fysiske, psykiske, sosiale og åndelige/eksistensielle aspekter
- Kunne gjøre relevante etiske vurderinger i samarbeid med pasienten, familien og annet helsepersonell
Nivå C
Kompetanse tilsvarende nivå C skal sette legen i stand til fulltids virksomhet som overlege i spesialisert palliativ virksomhet (palliativt team / palliativ enhet), med ansvar for et betydelig antall pasienter med avansert, livstruende sykdom og komplekse problemstillinger. Dette ansvaret innebærer
- Å forstå sykdommens biologi og naturlige forløp, inkludert grunnleggende forståelse av patofysiologiske mekanismer
- Å diagnostisere, forebygge og behandle smerter og andre plagsomme symptomer hos pasienter med avansert, livstruende sykdom, med en helhetlig tilnærming som inkluderer både fysiske, psykiske, sosiale og åndelige/eksistensielle aspekter
- Å kartlegge og vurdere daglig i hvor stor grad smerte- og symptomkontroll er oppnådd
- Å ha kunnskap om de viktigste onkologiske behandlingsformer og anvende disse i samarbeid med onkolog
- Å tilkalle leger fra andre medisinske spesialiteter når det er nødvendig for diagnostikk og behandling
- Å bidra aktivt til teambygging og samarbeid mellom yrkesgruppene i det palliative teamet
- Å undervise og informere om palliasjon til kolleger, andre helsearbeidere og publikum
- Å koordinere tjenester i samarbeid med pasientens fastlege slik at pasienten og de pårørende opplever tilbudene som en sammenhengende behandlingskjede
- Å samarbeide med andre yrkesgrupper for å forebygge patologiske sorgreaksjoner i familier
- Å gi råd og veiledning om kliniske problemstillinger til kolleger i og utenfor sykehus
- Å delta i forskning og fagutvikling innenfor palliativ medisin
Utdanning
Nivå A: Ved alle de medisinske fakultetene skal studentene gis en grunnutdanning i palliasjon. Timetallet varierer fra lærested til lærested, men per 2013 har både NTNU og Universitetet i Bergen et undervisningsopplegg med totalt 35 timer i løpet av studiet, inkludert praktisk tjeneste. Undervisningen omfatter smerte- og symptomlindring, omsorg ved livets slutt, organisering, etikk og kommunikasjon i palliativ sammenheng.
Nivå B: Spesialistutdanning i allmennmedisin, generell indremedisin, generell kirurgi, gastrokirurgi, urologi, anestesiologi, gynekologi og geriatri kan fortsatt fullføres uten at man har sikret at spesialisten har kompetanse i palliativ medisin tilsvarende nivå B.
Obligatorisk kurs i symptomlindring er tatt inn i de nye spesialistreglene for onkologi.
Norsk forening for palliativ medisin og de regionale kompetansesentrene for lindrende behandling arrangerer i samarbeid kurs i palliasjon tilsvarende nivå B for både allmennleger og sykehusleger.
Nivå C: Fra 2011 gjennomfører Helsedirektoratet på oppdrag fra Helse- og omsorgsdepartementet en forsøksordning med palliativ medisin som formelt kompetanseormåde (8). Et kompetanseområde defineres som et veldefinert medisinsk fagområde som griper inn i tre eller flere spesialiteter.
For å få godkjenning i Kompetanseområde palliativ medisin må legen (9)
- Være spesialist i en klinisk spesialitet
- Ha gjennomført Nordic Specialist Course in Palliative Medicine eller tilsvarende utdanning (10)
- Ha to års tjeneste i spesialisert palliativ virksomhet
- Beherske praktiske ferdigheter i henhold til en sjekkliste
Minst 12 måneder av tjenesten må være ved palliativt senter med team og sengeenhet (i sykehus). Inntil 12 måneder kan være ved palliativt senter uten sengeenhet eller ved palliativ enhet i sykehjem eller distriktsmedisinsk senter.
For at tjenesten skal telle til kompetanseområdet, må palliativt senter være godkjent som utdanningssted. Tjeneste ved palliativ enhet i sykehjem må forhåndsgodkjennes. I hele utdanningsperioden skal legen ha godkjent veileder og følge et utdanningsprogram.
Det er et mål at alle overleger på palliativt senter og ved større palliative enheter i sykehjem skaffer seg denne godkjenningen.
Nærmere opplysninger:
Handlingsprogrammets vedlegg 2.2 Leger
Forslag til tiltak
Nivå A: For å sikre en basiskompetanse hos alle leger bør alle universitetene gi en grunnutdanning i palliativ medisin som omfatter temaene som er nevnt over (nivå A).
Nivå B: I Sammen mot kreft. Nasjonal kreftstrategi 2013-2017 er ett av målene å «sikre at palliativ medisin er dekket innenfor obligatoriske kurs i spesialistutdanningen for leger i onkologi, kirurgi, gynekologi, indremedisin, allmennmedisin og andre relevante spesialiteter» (11). Spesialitetskomiteene i de nevnte spesialitetene må derfor vurdere dette.
De regionale kompetansesentrene for lindrende behandling og Norsk forening for palliativ medisin bør samarbeide for å sikre et kurstilbud på nivå B for spesialistkandidater innen flest mulig spesialiteter.
Nivå C: Helseforetak og kommuner må samarbeide om tilrettelagte utdanningsløp slik at flere leger kan oppnå godkjenning i Kompetanseområde palliativ medisin. I første omgang må flere palliative sentre søke godkjenning som utdanningssted til kompetanseområdet.
Fysioterapeuter
Sist faglig oppdatert: 14.10.2019
Kompetansekrav
Nivå B
Fysioterapeuter som behandler kreftpasienter og andre pasienter i palliativ fase, skal ha
- Grunnleggende kjennskap til palliasjon som fagfelt, organisering av det palliative tilbudet og kjennetegn ved den palliative kultur
- Grunnleggende kjennskap til palliativ medisin (symptomer og symptomlindring)
- Grunnleggende kunnskap om kreftsykdommer og kreftbehandling og deres innvirkning på fysisk funksjon
- Grunnleggende kunnskap og ferdigheter i fysioterapi til pasienter i palliativ fase:
- Generelle prinsipper for kartlegging, målsetting og valg av tiltak
- Fysisk aktivitet i palliativ fase
- Smertelindrende tiltak
- Lymfødembehandling i palliativ fase
- Aktuelle tiltak ved andre vanlige symptomer og tilstander hos pallaitive pasienter, f eks dyspne, skjelettmetastaser, nevrologiske symptomer og fatigue
- Forsiktighetsregler og kontraindikasjoner i palliativ fase
- Kjennskap til etiske problemstillinger og kommunikasjonsmessige utfordringer i møte med palliative pasienter og deres pårørende
Nivå C
Kompetanse tilsvarende nivå C skal sette fysioterapeuten i stand til å fylle sin rolle i det palliative teamet. Fysioterapeuten skal
- Ha kunnskap som beskrevet på nivå B
- Ha god kompetanse i å foreta fysioterapeutisk undersøkelse og kartlegging av pasienter i palliativ fase og kunne planlegge mål og tiltak sammen med pasient og pårørende
- Ha inngående og oppdaterte kunnskaper om relevante fysioterapeutiske tiltak og ha gode kliniske ferdigheter
- Ha kompetanse i lymfødembehandling
- Ha gode kommunikasjonsferdigheter
- Ha kunnskap om psykososiale og åndelige/eksistensielle aspekter ved palliasjon
- Kunne samhandle aktivt med resten av behandlingsteamet og på tvers av nivåene
- Kunne informere, undervise og veilede pasienter, pårørende og helsepersonell, inkludert egen faggruppe, både i kommune- og spesialisthelsetjenesten
- Kunne arbeide kunnskapsbasert og delta i forskning og fagutvikling
Utdanning
Nivå A: Undervisningen om kreft og palliasjon i grunnutdanningen varierer fra lærested til lærested, og det er i dag ingen felles fagplan.
Nivå B: Norsk Fysioterapeutforbund (NFF) arrangerer kurs innen onkologisk fysioterapi og lymfologi. Etter revisjon i 2009 inneholder kursrekken 7 kurs på totalt 192 t: Teoretisk grunnkurs i onkologisk fysioterapi (5 dager), grunnkurs i lymfødembehandling (5 dager), Fysioterapi i palliasjon (3 dager), Kreft og fysisk aktivitet (2 dager) samt tre diagnoserettede kurs (hvert av kursene på 2-3 dager). Skandinavisk Forum for Lymfologi arrangerer etterutdanning i komplett fysikalsk lymfødembehandling, 160 t.
Følgende kurs anses som nødvendige for å oppnå kompetanse på nivå B for fysioterapeuter som arbeider med kreftpasienter i palliativ fase: Teoretisk grunnkurs, grunnkurs i lymfødembehandling og kurset Fysioterapi i palliasjon. I tillegg vil tverrfaglige kurs og konferanser innen palliasjon gi viktig kompetanse.
Fysioterapeuter som arbeider med palliative pasienter med andre diagnoser enn kreft, vil ha nytte av kurs fra andre fagområder, f.eks. innen nevrologi, geriatri og hjerte- og lungesykdommer.
Nivå C: Det fins ingen egen spesialitet i palliativ fysioterapi, men spesialiteten onkologisk fysioterapi er svært relevant for fysioterapeuter som arbeider med kreftpasienter i palliativ fase. Andre spesialiteter, som allmenn fysioterapi, geriatri, hjerte- og lungefysioterapi eller nevrologisk fysioterapi, kan også være relevant, men må da bygges på med kurs i palliasjon. Spesialistgodkjenning i NFF krever nå en helsefaglig mastergrad i tillegg til praksis og kunnskap innenfor spesialistområdet, men kan i en overgangsfase (t.o.m. 2015) også oppnås etter gammel ordning som innebærer to og et halvt års etter- og videreutdanning samt tre årsverk praksis innen spesialistområdet.
De fleste sykehus har innført stillinger for spesialfysioterapeuter med avtalefestede krav til kompetanse. Disse kravene inneholder en kombinasjon av praksis innenfor et gitt fagfelt og fagspesifikke kurs og/eller videreutdanning tilsvarende omtrent 1 års etter- og videreutdanning.
Fysioterapeuter på nivå C bør være spesialist i onkologisk fysioterapi eller ha kompetanse tilsvarende krav til spesialfysioterapeut med vekt på palliasjon og onkologi eller andre relevante fagfelt. Tverrfaglig videreutdanning i palliativ omsorg kan inngå i en slik kompetanseoppbygging. Man bør også ha noe utdanning eller kurs innen kommunikasjon og veiledning.
Forslag til tiltak
Nivå A: Minimum 10 t i onkologisk fysioterapi og palliasjon bør inn i grunnutdanningen på alle lærestedene. Dette skal inkludere lymfødembehandling og annen fysioterapi til kreftpasienter og minimum 3 t spesifikt om palliasjon.
Nivå B: Krav om kompetanse i palliasjon tilsvarende nivå B bør legges inn i alle spesialistutdanningene som omfatter palliative pasienter (allmenn fysioterapi, onkologisk fysioterapi, geriatrisk fysioterapi, hjerte- og lungefysioterapi, nevrologisk fysioterapi, barne- og ungdomsfysioterapi, kvinnehelse og psykomotorisk fysioterapi).
Sosionomer
Sist faglig oppdatert: 14.10.2019
Kompetansekrav
Nivå B
Sosionomer som arbeider med kreftpasienter, må ha grunnleggende kunnskaper om årsaker til, hyppighet og forløp av de vanligste kreftsykdommene. De trenger grundig kjennskap til folketrygdens regelverk og erfaring fra samarbeid med NAV- trygd.
Nivå C
Kompetanse tilsvarende nivå C skal sette sosionomen i stand til å fylle sin rolle i det palliative teamet. Sosionomen skal
- Ha kunnskap om sosiale aspekter ved alvorlig sykdom, inklusive økonomiske konsekvenser, aktuelle støtteordninger og det offentlige og private hjelpeapparatet
- Ha kunnskap om psykologiske aspekter ved alvorlig sykdom
- ha kunnskap om kreftsykdommer og kreftbehandling, med særlig fokus på palliasjon
- Ha kunnskap om palliasjon ved ikke-maligne sykdommer
- Kunne arbeide med pasienter og familier: Kartlegge behov, vurdere aktuelle tiltak og bistå med nødvendig tilrettelegging
- Kunne samhandle aktivt med resten av behandlingsteamet
- Kunne informere og veilede pasienter, pårørende og helsepersonell, inkludert egen faggruppe, både i kommune- og spesialisthelsetjenesten
- Kunne delta i forskning og fagutvikling innen sitt fagområde
Utdanning
Nivå A: Grunnutdanningen for sosionomer (3-årig bachelorstudium i sosialt arbeid) varierer noe fra lærested til lærested. Utdanningen har begrenset fokus på somatisk sykdom, men inneholder ellers fag med relevans for palliasjon.
Nivå B/C: Tverrfaglig videreutdanning i palliativ omsorg er aktuell for sosionomer. Videreutdanning i familieterapi og etterutdanning i velferdsfag kan også være relevant.
Kliniske ernæringsfysiologer
Sist faglig oppdatert: 14.10.2019
Kompetansekrav
Nivå B
Alle kliniske ernæringsfysiologer som behandler kreftpasienter i palliativ fase, skal
- Ha kunnskap om de vanligste kreftsykdommene
- Ha kjennskap til ulike behandlingsformer ved kreft og ha kunnskap om hvordan bivirkninger av behandling kan påvirke ernæringssituasjonen
- Være i stand til å kartlegge og vurdere ernæringsstatus og ernæringsbehov ut fra sykehistorie, høyde og vekt, blodprøver, kostholdsanamnese og -registrering, der også pasientens sosiale situasjon, behandling og prognose tas med i vurderingen
- Kunne redegjøre for begrepet cancer kakeksi
- Kunne foreslå praktiske kostholdsråd til kreftpasienter i forhold til ulike faser i sykdomsutviklingen og i forhold til behandlingsopplegg
- Kjenne til ernæringsprodukter som kan være aktuelle ved kreft
- Utarbeide og følge opp planer for aktiv ernæringsbehandling (sonde- eller parenteral ernæring)
Nivå C
Kompetanse tilsvarende nivå C skal sette den kliniske ernæringsfysiologen i stand til å fylle sin rolle i det palliative teamet. Den kliniske ernæringsfysiologen skal
- Ha grunnleggende kunnskap om fagfeltet palliasjon og palliativ medisin
- Ha kunnskap om spesielle problemstillinger i palliativ fase, spesielt i relasjon til ernæring, for å kunne delta i beslutningsprosesser omkring ernæringsbehandling
- Kunne samhandle aktivt med resten av behandlingsteamet
- Ha kunnskap om og ferdigheter i kommunikasjon med alvorlig syke pasienter
- Gi informasjon og støtte til pasienter, pårørende og helsepersonell i spørsmål som angår ernæring i palliativ fase, både på sykehus, andre institusjoner og i hjemmet
- Undervise og informere om ernæring til studenter, kolleger, andre helsearbeidere og publikum
- Delta i forskning og fagutvikling innen sitt fagområde
Utdanning
Nivå A: Grunnutdanningen inneholder aspekter innen onkologi og ernæring, inkludert palliative problemstillinger. Studentene har obligatorisk sykehuspraksis.
Nivå B: Det finnes ingen formell videreutdanning i palliasjon for kliniske ernæringsfysiologer. Kliniske ernæringsfysiologers forening og tilsvarende foreninger i Norden (nordisk tverrfaglig videreutdanning) arrangerer med jevne mellomrom relevante kurs. På internasjonale kongresser, f.eks. i regi av ESPEN (European Society for Clinical Nutrition and Metabolism) arrangeres årlige kurs i klinisk ernæring som kan være aktuelle.
Nivå C: Det finnes ingen spesialitet innen onkologi eller egne videreutdanninger i palliasjon for kliniske ernæringsfysiologer i Norge. Spesialkompetanse i palliasjon må skaffes via tverrfaglige kurs og relevant praksis
Ergoterapeuter
Sist faglig oppdatert: 14.10.2019
Kompetansekrav
Nivå C
Ergoterapeuter som behandler kreftpasienter og andre pasienter i palliativ fase, skal ha:
- Kunnskap om palliasjon som fagfelt, kjennetegn ved den palliative kultur og organisering av det palliative tilbudet
- Grunnleggende kjennskap til palliativ medisin (symptomer og symptomlindring samt fokus på best mulig livskvalitet)
- Grunnleggende kunnskap om kreftsykdommer og kreftbehandling og sykdommens og behandlingens innvirkning på fysisk, kognitiv, sosial og emosjonell funksjon
- Grunnleggende kunnskap og ferdigheter i ergoterapi til pasienter i palliativ fase:
- Ta utgangspunkt i og understøtte pasientens egne ressurser, ønsker og behov
- Gjennomføre kartlegging, målsetting og valg av tiltak
- Bidra til god livskvalitet gjennom funksjonsvurdering, optimalisering av funksjon og støtte/tilrettelegging for utførelse av ønsket aktivitet
- Medvirke til lindring av vanlige symptomer og tilstander hos palliative pasienter
- Kompensere for tapte funksjoner gjennom å tilrettelegge miljøet for utfoldelse og deltakelse i meningsfull aktivitet i hverdagslivet, herunder søke om tekniske hjelpemidler
- Være kjent med forsiktighetsregler og kontraindikasjoner i palliativ fase
- Kjennskap til etiske problemstillinger og kommunikasjonsmessige utfordringer i møte med palliative pasienter og deres pårørende
Nivå C
Kompetanse tilsvarende nivå C skal sette ergoterapeuten i stand til å fylle sin rolle i det palliative teamet. Ergoterapeuten skal:
- Ha dybdekunnskap på områder beskrevet for nivå B
- Ha god kompetanse i å foreta ergoterapeutisk undersøkelse og kartlegging av pasienter i palliativ fase og kunne planlegge mål og tiltak sammen med pasient og pårørende
- Ha inngående og oppdaterte kunnskaper om relevante ergoterapeutiske tiltak og ha gode kliniske ferdigheter
- Ha kunnskaper om og evne til å møte personer med kognitiv funksjonsnedsettelse eller utfall som følge av langtkommen kreftsykdom
- Ha gode kommunikasjonsferdigheter og kunne arbeide prosessuelt i forhold til enkeltpasienter, familier og grupper
- Ha kunnskap om psykososiale og åndelige/eksistensielle aspekter ved palliasjon
- Kunne samhandle aktivt med resten av behandlingsteamet og på tvers av nivåer
- Kunne informere, undervise og veilede pasienter, pårørende og helsepersonell, inkludert egen faggruppe, både i kommune- og spesialisthelsetjenesten
- Kunne arbeide kunnskapsbasert og delta i forskning og fagutvikling
Utdanning
Nivå A: Undervisning om kreft og palliasjon i grunnutdanningen varierer fra lærested til lærested, og det er i dag ingen felles fagplan.
Nivå B: Norsk ergoterapeutforbund (https://ergoterapeutene.org/) arrangerer ulike kurs som kan være aktuelle, selv om de ikke begrenser seg til fagutøvelse direkte rettet mot palliasjon. Kurs om klientsentrert arbeid i spesialistområdene eldres helse, psykisk helse, somatisk helse og allmennhelse kan være aktuelle. Ergoterapeuter som arbeider med palliative pasienter med andre diagnoser enn kreft, vil ha nytte av kurs fra andre fagområder, f.eks. innen nevrologi, geriatri og hjerte- og lungesykdommer. Tverrfaglige kurs og konferanser innen palliasjon vil kunne gi viktig kompetanse.
Nivå C: Det fins ingen egen spesialitet i palliativ ergoterapi, men spesialitetene somatisk helse, allmennhelse og eldres helse er relevante for ergoterapeuter som arbeider med pasienter i palliativ fase. For nivå C må slike spesialiteter bygges ut med kurs i palliasjon.
Spesialistgodkjenning i Norsk Ergoterapeutforbund er nå under revisjon, og vil i løpet av de nærmeste år (2014-2017) kreve en helsefaglig mastergrad i tillegg til kunnskap og praksis innen spesialistområdet. Det vil bli en overgangsfase der godkjenning kan oppnås etter gammel ordning. Noen sykehus har innført stillinger for spesialergoterapeut med avtalefestede krav til kompetanse. Disse kravene inneholder en kombinasjon av praksis i fagfelt og fagspesifikke kurs og/eller videreutdanning tilsvarende omtrent 1 års etter- og videreutdanning.
Ergoterapeuter på nivå C bør være spesialergoterapeut med vekt på palliasjon eller relevant fagfelt. Tverrfaglig videreutdanning i palliativ omsorg kan inngå i en slik kompetanseoppbygging. Mastergrad der tema i fordypningsoppgaven er relevant, kan også være aktuelt. Man bør også ha videreutdanning eller kurs i kommunikasjon og veiledning.
Forslag til tiltak
Nivå A: Minimum 5 t onkologi og palliasjon bør inn i grunnutdanningen på alle læresteder. Dette skal inkludere opplæring med vekt på klientsentrering og forebyggende, behandlende og kompenserende tiltak for palliative pasienter. Pårørende og kulturelt mangfold bør omtales i undervisningen, i tilegg til eksistensielle aspekter og mestring av det å leve med alvorlig sykdom. Både gruppebaserte og individuelle intervensjoner bør være del av innholdet.
Nivå B: Krav om kompetanse i palliasjon tilsvarende nivå B bør legges inn i alle spesialistutdanningene (somatisk helse, allmennhelse, barns helse, psykisk helse og eldres helse).
Hjelpepleiere
Sist faglig oppdatert: 14.10.2019
Kompetansekrav
Hjelpepleiere arbeider med palliasjon i både kommune- og spesialisthelsetjenesten. Hjelpepleiere kan arbeide ved palliative enheter i sykehjem.
Nivå B/C
Hjelpepleiere som skal arbeide ved palliative enheter i sykehjem (14), skal:
- Ha grunnleggende forståelse for hva det innebærer å få en kreftdiagnose
- Vite hvordan en kreftsykdom kan virke inn på pasienten, familien og det sosiale nettverket, både fysisk, psykisk, sosialt og åndelig/eksistensielt
- Ha kunnskap om og forståelse for sorg og krisereaksjoner
- Ha kjennskap til hospicefilosofien og etiske utfordringer i livets sluttfase
- Ha mot til og erfaring i å samtale med alvorlig syke og deres pårørende
- Ha kunnskap om de vanligste kreftsykdommene, symptomer, lindrende pleie og behandlingsformer
- Ha kjennskap til komplementære og alternative behandlingsformer og en kritisk tilnærming når det gjelder disse
- Ha et bevisst forhold til egne verdier knyttet til sykdom, lidelse og død og til eget faglig og personlig engasjement og begrensninger
- Kunne ta initiativ til, organisere og iverksette tiltak i samarbeid med den syke, de pårørende og andre samarbeidspartnere
- Kjenne til de ulike faginstansene, hjelpeapparatet og andre yrkesgrupper innen kreftomsorg og lindrende behandling
- Kunne arbeide tverrfaglig og på tvers av helsetjenestenivåer
- Kjenne til sosiale rettigheter og trygdelovgivning som berører den kreftsyke, familien og arbeidsplassen
Utdanning
Nivå A: Videregående opplæring i helse- og sosialfag skal sikre at hjelpepleieren har grunnleggende kompetanse i palliasjon. Hjelpepleiere skal beherske symptomkartlegging ved hjelp av ESAS.
Nivå B/C: Videreutdanning i kreftomsorg og lindrende pleie gir nødvendig kompetanse (14).
Prester
Sist faglig oppdatert: 14.10.2019
Kompetansekrav
Nivå C
Kompetanse tilsvarende nivå C skal sette presten i stand til å fylle sin rolle i det palliative teamet. Presten skal kunne:
- Vurdere pasienter med komplekse symptombilder i forhold til åndelige og eksistensielle problemstillinger
- Gi kvalifisert åndelig omsorg, som inkluderer
- Å være til stede på pasientens premisser og samtidig være tydelig i rollen som prest
- Å samtale med pasienter og pårørende om deres åndelige/eksistensielle behov og problemstillinger
- Å tilrettelegge og bistå med utforming av ritualer for pasienter, pårørende og personalet
- Å gi råd og veiledning om åndelige og eksistensielle spørsmål knyttet til andre religioner og kulturer og ev. formidle kontakt med relevante representanter/fagpersoner
- Forstå og håndtere kriser og krisereaksjoner
- Forstå og håndtere sorgreaksjoner
- Arbeide med kommunikasjon mellom helsepersonell og pasient/pårørende
- Arbeide i forhold til familier og ev. andre nettverk
- Samhandle aktivt med resten av behandlingsteamet og kjenne sykehuset som system
- Gi informasjon og veiledning til helsepersonell i spørsmål som angår åndelig omsorg
- Undervise og informere studenter, kolleger, andre helsearbeidere og publikum om åndelige og eksistensielle utfordringer ved alvorlig sykdom og håndtering av disse
- Delta i forskning og fagutvikling
Utdanning
Nivå A: Profesjonsutdanning med praktisk-teologisk seminar gir en basisutdanning i sjelesorg og åndelig omsorg.
Nivå B: Pastoral-klinisk utdanning (PKU) eller tilsvarende videreutdanning gir nødvendig kompetanse. Kompetansen kan også oppnås gjennom videreutdanningen Omsorg ved livets slutt: Samtaler med alvorlig syke og døende i lokalmenigheten (20 studiepoeng).
Nivå C: Presteforeningen har utformet kriterier for Spesialitet i praktisk prestetjeneste innen helse- og sosialsektoren (https://www.prest.no/artikkel/spesialist-i-praktisk-prestetjeneste-innen-helse-og-sosialsektor/f ). Disse kriteriene legges også til grunn for kompetansekrav for prester i palliasjon. Det forutsettes at tjeneste ved en palliativ enhet eller kreftavdeling inngår i den praksis som er grunnlag for spesialiseringen, samt at emner innen palliasjon inngår i den pastoral- eller helsefaglige fordypningen.
Diakoner
Diakoner har en treårig bachelorgrad innen helse- og sosialfag eller pedagogikk, og master i diakoni som inneholder en teoretisk og en praktisk-kirkelig del.
Enkelte diakoner arbeider i palliative team. For å kunne fylle sin rolle i teamet, må diakonen ha kompetanse som beskrevet under nivå C for prester.
Psykologer
Sist faglig oppdatert: 14.10.2019
Kompetansekrav
Nivå C
Kompetanse tilsvarende nivå C skal sette psykologspesialisten i stand til å fylle sin rolle i det palliative teamet. Psykologspesialisten skal kunne:
- Gjøre en psykososial vurdering av pasient og pårørende, inkludert vurdering av angst og depresjon
- Håndtere kriser og krisereaksjoner
- Vurdere og håndtere sorgreaksjoner og selvmordsrisiko
- Arbeide med kommunikasjon mellom helsepersonell og pasient/pårørende
- Arbeide i forhold til familier
- Samhandle aktivt med resten av behandlingsteamet og kjenne sykehuset som system
- Anvende avspenning og/eller lignende teknikker i behandlingen (hypnose, autogen trening mv.)
- Anvende anerkjent traumebehandlingsteknikker (kognitiv atferdsterapi, EMDR (Eye Movement Desensitization and Reprocessing) mv.)
- Anvende en bio-psyko-sosial forståelse av smertetilstander
- Gi informasjon og støtte til pasienter, pårørende og helsepersonell i spørsmål som angår psykologiske reaksjoner ved alvorlig sykdom
- Undervise og informere studenter, kolleger, andre helsearbeidere og publikum om psykologiske reaksjoner ved alvorlig sykdom og håndtering av disse
- Delta i forskning og fagutvikling
Utdanning
Nivå A: Profesjonsutdanning i psykologi leder fram til godkjenning som psykolog. Alle godkjente psykologer kan arbeide med kliniske problemstillinger.
Nivå B: En psykolog uten spesialistutdanning bør ha veiledning fra spesialist eller særskilt kompetent psykolog dersom vedkommende skal arbeide med palliative problemstillinger.
Nivå C: Gjennomført spesialistutdanning med varighet på minimum 5 år og særskilte krav til praksis, veiledning og kurs samt en skriftlig oppgave kvalifiserer til psykologspesialist. Det er ingen spesialutdanning innenfor helsepsykologi, men både klinisk psykologi og samfunnspsykologi er relevante for palliasjon. Spesialkompetanse innenfor palliasjon må skaffes via kurs og relevant praksis.
Forslag til tiltak
Norsk psykologforening bør arbeide mot en spesialitet i helsepsykologi der bl.a. palliative problemstillinger inngår.
Andre faggrupper
Sist faglig oppdatert: 14.10.2019
Kravene vil gjelde andre yrkesgrupper som arbeider innenfor palliasjon, f.eks. musikk-, kunst- og litteraturterapeuter.
Kompetansekrav
Nivå C
Kompetanse tilsvarende nivå C skal sette fagpersonen i stand til å fylle sin rolle i det palliative teamet. I tillegg til sin fagspesifikke kompetanse, skal vedkommende kunne:
- Kommunisere med alvorlig syke og deres pårørende
- Samhandle aktivt med resten av behandlingsteamet og kjenne sykehuset som system
- Informere og undervise pasienter, pårørende og helsepersonell om sitt fagområde
- Delta i forskning og fagutvikling innen sitt fagområde
Utdanning
Nivå B/C: Dette vil variere mellom fagområdene. F.eks. innbefatter masterstudium i musikkterapi ved Norges musikkhøgskole og Universitetet i Bergen kunnskap og ferdigheter innenfor palliativ musikkterapi i tillegg til undervisning i psykologi, pedagogikk og ulike samarbeidsformer. Studentene kan få praksis på palliativt senter og kan skrive hovedoppgave om temaer knyttet til palliativ musikkterapi.
Det finnes ingen spesifikk videreutdanning i palliasjon for noen faggruppe, men tverrfaglig videreutdanning i palliativ omsorg er aktuell.
Referanser
Sist faglig oppdatert: 14.10.2019
- Palliative Medicine Curriculum for Medical Students, General Professional Training and Higher Specialist Training. Southampton: Association for Palliative Medicine of Great Britain and Ireland; 1991
- Curriculum for Higher Specialist Training in Palliative Medicine, including Syllabus for Higher Specialist Training in Palliative Medicine. Southampton: Association for Palliative Medicine of Great Britain and Ireland; 2001
- Report and Recommendations of a Workshop on Palliative Medicine Education and Training for Doctors in Europe. European Association for Palliative Care (EAPC); 1993
- Svensk läroplan i palliativ medicin. Svensk Förening för Palliativ Medicin; 2001 www.sfpm.se
- Smeding Rm, Westerberg Larsson H. The Nordic Core Curriculum in Palliative Care. Nordic Cancer Union; 2004
- Specialty Training Curriculum for Palliative Medicine. London: Joint Royal Colleges of Physicians Training Board; August 2010.
- A guide for the development of palliative nursing education in Europe. European Association for Palliative Care (EAPC); 2004
- Kompetanseområde i palliativ medisin. Prosjektplan. Helsedirektoratet: Fagrådet for kompetanseområdet palliativ medisin, 01. november 2010.
- Målbeskrivelse for kompetanseområdet palliativ medisin. Helsedirektoratet nov. 2010.
https://www.helsedirektoratet.no/retningslinjer/palliasjon-i-kreftomsorgen-handlingsprogram/kompetanse/leger - Nordic Specialist Course in Palliative Medicine. Danish Association for Palliative Medicine (DSPaM), Swedish Association for Palliative Medicine (SFPM), Norwegian Association for palliative Medicine (NFPM), Finnish Association for Palliative Medicine (SPLY), and Icelandic Association for Palliative Care; 2003 www.nscpm.org
- Sammen – mot kreft. Nasjonal kreftstrategi 2013-2017. Oslo: Helse- og omsorgsdepartementet; 2013.
https://www.iccp-portal.org/system/files/plans/kreftstrategien_2013.pdf - Emneboken til Masterstudium i Klinisk ernæring. Oslo: Universitetet i Oslo; 2007
- Veileder for kliniske ernæringsfysiologer: Ernæring ved langtkommen kreftsykdom. Klinisk ernæringsfysiologers forening (KEFF); 2007
- Videreutdanning i kreftomsorg og lindrende pleie for helse- og sosialpersonell med videregående opplæring. Oslo: Helsedirektoratet; januar 2005. IS-1220
Aktuelle nettadresser
Sist faglig oppdatert: 14.10.2019
Helseregion Nord | https://unn.no/fag-og-forskning/regional-kompetansetjeneste-for-lindrende-behandling-lindring-i-nord |
Helseregion Midt-Norge | |
Helseregion Vest | https://helse-bergen.no/kompetansesenter-i-lindrande-behandling |
Helseregion Sør-Øst | |
PallReg, nasjonalt register over palliative virksomheter |
Norsk Palliativ Forening | |
Norsk forening for palliativ medisin | https://www.legeforeningen.no/foreningsledd/spesial/norsk-forening-for-palliativ-medisin/ |
Kreftforeningen | |
Termik | |
Røde Kors |
Arbeids- og velferdsforvaltningen (NAV) | |
Behandlingshjelpemidler | |
Helsebiblioteket | |
Kommunal pensjonskasse | |
Lovdata | |
Folkehelseinstituttet | |
Offentlig servicekontor | |
Regjeringen og departementene | |
Helsedirektoratet | |
Statens lånekasse | |
Statens pensjonskasse |
ASCO (American Society of Clinical Oncology) | |
ESMO (European Society for Clinical Oncology) | https://www.esmo.org/Guidelines/Supportive-and-Palliative-Care |
ESMO Designated Centres of Integrated Oncology & Palliative Care | https://www.esmo.org/Patients/Designated-Centres-of-Integrated-Oncology-and-Palliative-Care |
European Palliative Care Research Centre | |
EAPC (European Association for Palliative Care) | |
IAHPC (International Association for Hospice and Palliative Care) | |
National Institute for Health and Clinical Excellence: Supportive and Palliative Care | |
Palliative drugs | |
Center to Advance Palliative Care, New York |
Referanser
Sist faglig oppdatert: 14.10.2019
Abraham, N. S., Barkun, J. S., & Barkun, A. N. (2002). Palliation of malignant biliary obstruction: a prospective trial examining impact on quality of life. Gastrointestinal endoscopy, 56(6), 835-841. https://doi.org/10.1067/mge.2002.129868
Advance care plan: personal preferences and choises of end of life care. (2010). London: St. Christophers Hospice. Hentet fra https://www.stchristophers.org.uk/leaflet/advance-care-planning/
Agra, Y., Sacristan, A., Gonzalez, M., Ferrari, M., Portugues, A., & Calvo, M. J. (1998). Efficacy of senna versus lactulose in terminal cancer patients treated with opioids. Journal of pain and symptom management, 15(1), 1-7. https://doi.org/10.1016/s0885-3924(97)00276-5
Ahmedzai, S. H., & Boland, J. (2010). Constipation in people prescribed opioids. BMJ clinical evidence, 2010.
Allard, P., Lamontagne, C., Bernard, P., & Tremblay, C. (1999). How effective are supplementary doses of opioids for dyspnea in terminally ill cancer patients? A randomized continuous sequential clinical trial. Journal of pain and symptom management, 17(4), 256-265.
Anandarajah, G., & Hight, E. (2001). Spirituality and medical practice: Using the HOPE questions as a practical tool for spiritual assessment. 63(1), 81-89.
Andersen, B. L., DeRubeis, R. J., Berman, B. S., Gruman, J., Champion, V. L., Massie, M. J., . . . Rowland, J. H. (2014). Screening, assessment, and care of anxiety and depressive symptoms in adults with cancer: an American Society of Clinical Oncology guideline adaptation. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 32(15), 1605-1619. https://doi.org/10.1200/jco.2013.52.4611
Ang, S. K., Shoemaker, L. K., & Davis, M. P. (2010). Nausea and vomiting in advanced cancer. American Journal of Hospice and Palliative Medicine, 27(3), 219-225. https://doi.org/10.1177/1049909110361228
Arcidiacono, P. G., Calori, G., Carrara, S., McNicol, E. D., & Testoni, P. A. (2011). Celiac plexus block for pancreatic cancer pain in adults. The Cochrane database of systematic reviews, (3), CD007519. https://doi.org/10.1002/14651858.CD007519.pub2
Arends, J. (2018). Struggling with nutrition in patients with advanced cancer: nutrition and nourishment-focusing on metabolism and supportive care. 29, ii27-ii34. https://doi.org/10.1093/annonc/mdy093
Arends, J., Bachmann, P., Baracos, V., Barthelemy, N., Bertz, H., Bozzetti, F., . . . Preiser, J. C. (2017). ESPEN guidelines on nutrition in cancer patients. Clinical nutrition (Edinburgh, Scotland), 36(1), 11-48. https://doi.org/10.1016/j.clnu.2016.07.015
Arends, J., Bodoky, G., Bozzetti, F., Fearon, K., Muscaritoli, M., Selga, G., . . . Zander, A. (2006). ESPEN guidelines on enteral nutrition: Non-surgical oncology. Clinical nutrition (Edinburgh, Scotland), 25(2), 245-259. https://doi.org/10.1016/j.clnu.2006.01.020
Artifon, E. L., Sakai, P., Cunha, J. E., Dupont, A., Filho, F. M., Hondo, F. Y., . . . Raju, G. S. (2006). Surgery or endoscopy for palliation of biliary obstruction due to metastatic pancreatic cancer. The American journal of gastroenterology, 101(9), 2031-2037. https://doi.org/10.1111/j.1572-0241.2006.00764.x
Baile, W. F., Buckman, R., Lenzi, R., Glober, G., Beale, E. A., & Kudelka, A. P. (2000). SPIKES-A six-step protocol for delivering bad news: application to the patient with cancer. The oncologist, 5(4), 302-311.
Balboni, M. J., Sullivan, A., Amobi, A., Phelps, A. C., Gorman, D. P., Zollfrank, A., . . . Balboni, T. A. (2013). Why is spiritual care infrequent at the end of life? Spiritual care perceptions among patients, nurses, and physicians and the role of training. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 31(4), 461-467. https://doi.org/10.1200/jco.2012.44.6443
Baracos, V. E. (2006). Cancer-associated cachexia and underlying biological mechanisms. Annual review of nutrition, 26, 435-461. https://doi.org/10.1146/annurev.nutr.26.061505.111151
Bell, R. Retningslinjer for smertelindring. Oslo: Den norske legeforening.
Bell, R. F., Eccleston, C., & Kalso, E. A. (2017). Ketamine as an adjuvant to opioids for cancer pain. The Cochrane database of systematic reviews, 6, CD003351. https://doi.org/10.1002/14651858.CD003351.pub3
Bentley, A., & Boyd, K. (2001). Use of clinical pictures in the management of nausea and vomiting: a prospective audit. Palliative medicine, 15(3), 247-253. https://doi.org/10.1191/026921601678576239
Blaber, M., Jone, J., & Willis, D. (2015). Spiritual care: which is the best assessment tool for palliative settings? International journal of palliative nursing, 21(9), 430-438. https://doi.org/10.12968/ijpn.2015.21.9.430
Booth, S., & Wade, R. (2003). Oxygen or air for palliation of breathlessness in advanced cancer. Journal of the Royal Society of Medicine, 96(5), 215-218.
Booth, S., Wade, R., Johnson, M., Kite, S., Swannick, M., & Anderson, H. (2004). The use of oxygen in the palliation of breathlessness. A report of the expert working group of the Scientific Committee of the Association of Palliative Medicine. Respiratory medicine, 98(1), 66-77.
Bozzetti, F., Amadori, D., Bruera, E., Cozzaglio, L., Corli, O., Filiberti, A., . . . Trompino, G. (1996). Guidelines on artificial nutrition versus hydration in terminal cancer patients. European Association for Palliative Care. Nutrition (Burbank, Los Angeles County, Calif.), 12(3), 163-167.
Brown, S., North, D., Marvel, M. K., & Fons, R. (1992). Acupressure wrist bands to relieve nausea and vomiting in hospice patients: do they work? The American journal of hospice & palliative care, 9(4), 26-29. https://doi.org/10.1177/104990919200900409
Bruera, E., Seifert, L., Watanabe, S., Babul, N., Darke, A., Harsanyi, Z., & Suarez-Almazor, M. (1996). Chronic nausea in advanced cancer patients: a retrospective assessment of a metoclopramide-based antiemetic regimen. Journal of pain and symptom management, 11(3), 147-153.
Braam, P., Lambin, P., & Bussink, J. (2016). Stereotactic versus conventional radiotherapy for pain reduction and quality of life in spinal metastases: study protocol for a randomized controlled trial. Trials, 17, 61. https://doi.org/10.1186/s13063-016-1178-7
Bush, S. H., Lawlor, P. G., Ryan, K., Centeno, C., Lucchesi, M., Kanji, S., . . . Committee, E. G. (2018). Delirium in adult cancer patients: ESMO Clinical Practice Guidelines. Annals of oncology : official journal of the European Society for Medical Oncology, 29(Supplement_4), iv143-iv165. https://doi.org/10.1093/annonc/mdy147
Bye, A., Jordhoy, M. S., Skjegstad, G., Ledsaak, O., Iversen, P. O., & Hjermstad, M. J. (2013). Symptoms in advanced pancreatic cancer are of importance for energy intake. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer, 21(1), 219-227. https://doi.org/10.1007/s00520-012-1514-8
Campagnutta, E., & Cannizzaro, R. (2000). Percutaneous endoscopic gastrostomy (PEG) in palliative treatment of non-operable intestinal obstruction due to gynecologic cancer: a review. European journal of gynaecological oncology, 21(4), 397-402.
Candy, B., Jones, L., Goodman, M. L., Drake, R., & Tookman, A. (2011). Laxatives or methylnaltrexone for the management of constipation in palliative care patients. The Cochrane database of systematic reviews, (1), CD003448. https://doi.org/10.1002/14651858.CD003448.pub3
Caraceni, A., Hanks, G., Kaasa, S., Bennett, M. I., Brunelli, C., Cherny, N., . . . Zeppetella, G. (2012). Use of opioid analgesics in the treatment of cancer pain: evidence-based recommendations from the EAPC. The Lancet. Oncology, 13(2), e58-68. https://doi.org/10.1016/s1470-2045(12)70040-2
Caraceni, A., Pigni, A., & Brunelli, C. (2011). Is oral morphine still the first choice opioid for moderate to severe cancer pain? A systematic review within the European Palliative Care Research Collaborative guidelines project. Palliative medicine, 25(5), 402-409. https://doi.org/10.1177/0269216310392102
Cederholm, T., Barazzoni, R., Austin, P., Ballmer, P., Biolo, G., Bischoff, S. C., . . . Singer, P. (2017). ESPEN guidelines on definitions and terminology of clinical nutrition. Clinical nutrition (Edinburgh, Scotland), 36(1), 49-64. https://doi.org/10.1016/j.clnu.2016.09.004
Cheng, D. S., Seitz, C. B., & Eyre, H. J. (1980). Nonoperative management of femoral, humeral, and acetabular metastases in patients with breast carcinoma. Cancer, 45(7), 1533-1537.
Cherny, N. I. (2015). Oxford textbook of palliative medicine (5. utg.). Oxford: Oxford University Press.
Chiu, N., Chiu, L., Popovic, M., DeAngelis, C., Lutz, S., Zhang, N., . . . Chow, E. (2015). Re-irradiation for painful bone metastases: evidence-based approach. Annals of palliative medicine, 4(4), 214-219. https://doi.org/10.3978/j.issn.2224-5820.2015.10.02
Chow, E., Harris, K., Fan, G., Tsao, M., & Sze, W. M. (2007). Palliative radiotherapy trials for bone metastases: a systematic review. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 25(11), 1423-1436. https://doi.org/10.1200/jco.2006.09.5281
Chow, E., Hoskin, P., Mitera, G., Zeng, L., Lutz, S., Roos, D., . . . Kumar, E. (2012). Update of the international consensus on palliative radiotherapy endpoints for future clinical trials in bone metastases. International journal of radiation oncology, biology, physics, 82(5), 1730-1737. https://doi.org/10.1016/j.ijrobp.2011.02.008
Chow, E., van der Linden, Y. M., Roos, D., Hartsell, W. F., Hoskin, P., Wu, J. S., . . . Wong, R. K. (2014). Single versus multiple fractions of repeat radiation for painful bone metastases: a randomised, controlled, non-inferiority trial. The Lancet. Oncology, 15(2), 164-171. https://doi.org/10.1016/s1470-2045(13)70556-4
Chow, R., Hoskin, P., Hollenberg, D., Lam, M., Dennis, K., Lutz, S., . . . Chow, E. (2017). Efficacy of single fraction conventional radiation therapy for painful uncomplicated bone metastases: a systematic review and meta-analysis. Annals of palliative medicine, 6(2), 125-142. https://doi.org/10.21037/apm.2016.12.04
Clark, A. J., Ahmedzai, S. H., Allan, L. G., Camacho, F., Horbay, G. L., Richarz, U., & Simpson, K. (2004). Efficacy and safety of transdermal fentanyl and sustained-release oral morphine in patients with cancer and chronic non-cancer pain. Current medical research and opinion, 20(9), 1419-1428. https://doi.org/10.1185/030079904x2114
Clark, D. (2007). From margins to centre: a review of the history of palliative care in cancer. The Lancet. Oncology, 8(5), 430-438. https://doi.org/10.1016/s1470-2045(07)70138-9
Clark, K., & Currow, D. C. (2012). Assessing constipation in palliative care within a gastroenterology framework. Palliative medicine, 26(6), 834-841. https://doi.org/10.1177/0269216311414756
Clark, K., Lam, L. T., Agar, M., Chye, R., & Currow, D. C. (2010). The impact of opioids, anticholinergic medications and disease progression on the prescription of laxatives in hospitalized palliative care patients: a retrospective analysis. Palliative medicine, 24(4), 410-418. https://doi.org/10.1177/0269216310363649
Cobb, M., Puchalski, C. M., & Rumbold, B. (2012). Oxford textbook of spirituality in healthcare. Oxford: Oxford University Press.
Cohen, A. J., Menter, A., & Hale, L. (2005). Acupuncture: role in comprehensive cancer care--a primer for the oncologist and review of the literature. Integrative cancer therapies, 4(2), 131-143. https://doi.org/10.1177/1534735405276419
Cohen, S. R., & Leis, A. (2002). What determines the quality of life of terminally ill cancer patients from their own perspective? Journal of palliative care, 18(1), 48-58.
Connor, S., Barron, E., Redhead, D. N., Ireland, H., Madhavan, K. K., Parks, R. W., & Garden, O. J. (2007). Palliation for suspected unresectable hilar cholangiocarcinoma. European journal of surgical oncology : the journal of the European Society of Surgical Oncology and the British Association of Surgical Oncology, 33(3), 341-345. https://doi.org/10.1016/j.ejso.2006.11.005
Cook, A. M., Lau, T. N., Tomlinson, M. J., Vaidya, M., Wakeley, C. J., & Goddard, P. (1998). Magnetic resonance imaging of the whole spine in suspected malignant spinal cord compression: impact on management. Clinical oncology (Royal College of Radiologists (Great Britain)), 10(1), 39-43.
Cranston, J. M., Crockett, A., & Currow, D. (2008). Oxygen therapy for dyspnoea in adults. The Cochrane database of systematic reviews, (3), CD004769. https://doi.org/10.1002/14651858.CD004769.pub2
Danielsen, B. V., Sand, A. M., Rosland, J. H., & Førland, O. (2018). Experiences and challenges of home care nurses and general practitioners in home-based palliative care – a qualitative study. BMC palliative care, 17(1), 95. https://doi.org/10.1186/s12904-018-0350-0
Davis, M. P., & Hallerberg, G. (2010). A systematic review of the treatment of nausea and/or vomiting in cancer unrelated to chemotherapy or radiation. Journal of pain and symptom management, 39(4), 756-767. https://doi.org/10.1016/j.jpainsymman.2009.08.010
De Graeff, A., & Krol, R. J. A. Constipation: Nation-wide guideline. Version 2.0. Nederland: Integraal Kankercentrum Nederland. Hentet 3. januar 2019, fra http://oncoline.nl/richtlijn/item/pagina.php?richtlijn_id=694&unique=04cd813c4e3401baa2d352000459b710&noframes=true
Dean, M. (2004). Opioids in renal failure and dialysis patients. Journal of pain and symptom management, 28(5), 497-504. https://doi.org/10.1016/j.jpainsymman.2004.02.021
Deandrea, S., Corli, O., Moschetti, I., & Apolone, G. (2009). Managing severe cancer pain: the role of transdermal buprenorphine: a systematic review. Therapeutics and clinical risk management, 5(5), 707-718.
Deandrea, S., Montanari, M., Moja, L., & Apolone, G. (2008). Prevalence of undertreatment in cancer pain. A review of published literature. Annals of oncology : official journal of the European Society for Medical Oncology, 19(12), 1985-1991. https://doi.org/10.1093/annonc/mdn419
Del Fabbro, E., Hui, D., Dalal, S., Dev, R., Nooruddin, Z. I., & Bruera, E. (2011). Clinical outcomes and contributors to weight loss in a cancer cachexia clinic. Journal of palliative medicine, 14(9), 1004-1008. https://doi.org/10.1089/jpm.2011.0098
Detmar, S. B., Muller, M. J., Wever, L. D., Schornagel, J. H., & Aaronson, N. K. (2001). The patient-physician relationship. Patient-physician communication during outpatient palliative treatment visits: an observational study. Jama, 285(10), 1351-1357.
Detsky, A. S., McLaughlin, J. R., Baker, J. P., Johnston, N., Whittaker, S., Mendelson, R. A., & Jeejeebhoy, K. N. (1987). What is subjective global assessment of nutritional status? JPEN. Journal of parenteral and enteral nutrition, 11(1), 8-13. https://doi.org/10.1177/014860718701100108
Dev, R., Dalal, S., & Bruera, E. (2012). Is there a role for parenteral nutrition or hydration at the end of life? Current opinion in supportive and palliative care, 6(3), 365-370. https://doi.org/10.1097/SPC.0b013e328356ab4a
DeVita, V. T., Rosenberg, S. A., & Hellman, S. (2005). Cancer : principles & practice of oncology (7. utg.). Philadelphia: Lippincott Williams & Wilkins.
Dine ønsker for livets siste tid - forberedende samtaler. (2018). [Fagprosedyre under publisering 2018]. Oslo: Oslo Universitetssykehus. Hentet 20. desember 2018, fra https://www.helsebiblioteket.no/fagprosedyrer/pabegynte/livets-siste-tid-kartleggingsverktoy
Dittus, K. L., Gramling, R. E., & Ades, P. A. (2017). Exercise interventions for individuals with advanced cancer: A systematic review. Preventive medicine, 104, 124-132. https://doi.org/10.1016/j.ypmed.2017.07.015
Doyle, D., & Hanks, G. W. C. (2010). Oxford textbook of palliative medicine (4. utg.). Oxford: Oxford University Press.
Droney, J., Ross, J., Gretton, S., Welsh, K., Sato, H., & Riley, J. (2008). Constipation in cancer patients on morphine. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer, 16(5), 453-459. https://doi.org/10.1007/s00520-007-0373-1
Dy, S. M., & Apostol, C. C. (2010). Evidence-based approaches to other symptoms in advanced cancer. Cancer journal (Sudbury, Mass.), 16(5), 507-513. https://doi.org/10.1097/PPO.0b013e3181f45877
EAPC Task Force on Spiritual Care in Palliative Care. [Nettdokument]. Belgia: European Association of Palliative Care.
Edelstyn, G. A., Gillespie, P. J., & Grebbell, F. S. (1967). The radiological demonstration of osseous metastases. Experimental observations. Clinical radiology, 18(2), 158-162.
Ellershaw, J., & Wilkinson, S. (2003). Care of the dying: a pathway to excellence. Oxford: Oxford University Press.
Ellershaw, J., & Wilkinson, S. (2011). Care of the dying: a pathway to excellence (2. utg.). Oxford: Oxford University Press.
Emanuel, E. J., Fairclough, D. L., Wolfe, P., & Emanuel, L. L. (2004). Talking with terminally ill patients and their caregivers about death, dying, and bereavement: is it stressful? Is it helpful? Archives of internal medicine, 164(18), 1999-2004. https://doi.org/10.1001/archinte.164.18.1999
Ernst, E. (2009). Massage therapy for cancer palliation and supportive care: a systematic review of randomised clinical trials. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer, 17(4), 333-337. https://doi.org/10.1007/s00520-008-0569-z
Escalante, C. P., Martin, C. G., Elting, L. S., Price, K. J., Manzullo, E. F., Weiser, M. A., . . . Rubenstein, E. B. (2000). Identifying risk factors for imminent death in cancer patients with acute dyspnea. Journal of pain and symptom management, 20(5), 318-325.
Espat, N. J., Brennan, M. F., & Conlon, K. C. (1999). Patients with laparoscopically staged unresectable pancreatic adenocarcinoma do not require subsequent surgical biliary or gastric bypass. Journal of the American College of Surgeons, 188(6), 649-655; discussion 655-647.
Eustace, S., Tello, R., DeCarvalho, V., Carey, J., Wroblicka, J. T., Melhem, E. R., & Yucel, E. K. (1997). A comparison of whole-body turboSTIR MR imaging and planar 99mTc-methylene diphosphonate scintigraphy in the examination of patients with suspected skeletal metastases. AJR. American journal of roentgenology, 169(6), 1655-1661. https://doi.org/10.2214/ajr.169.6.9393186
Evangelista, C. B., Lopes, M. E., Costa, S. F., Batista, P. S., Batista, J. B., & Oliveira, A. M. (2016). Palliative care and spirituality: an integrative literature review. Revista brasileira de enfermagem, 69(3), 591-601. https://doi.org/10.1590/0034-7167.2016690324i
Fairchild, A., Barnes, E., Ghosh, S., Ben-Josef, E., Roos, D., Hartsell, W., . . . Chow, E. (2009). International patterns of practice in palliative radiotherapy for painful bone metastases: evidence-based practice? International journal of radiation oncology, biology, physics, 75(5), 1501-1510. https://doi.org/10.1016/j.ijrobp.2008.12.084
Fallon, M., Giusti, R., Aielli, F., Hoskin, P., Rolke, R., Sharma, M., & Ripamonti, C. I. (2018). Management of cancer pain in adult patients: ESMO Clinical Practice Guidelines. Annals of oncology : official journal of the European Society for Medical Oncology, 29(Supplement_4), iv166-iv191. https://doi.org/10.1093/annonc/mdy152
Fallowfield, L. (2010). Communication with the patient and family in palliative medicine. I: G. Hanks (red.), Oxford textbook of palliative medicine (4. utg., s. 333-341). Oxford: Oxford University Press.
Fallowfield, L., & Jenkins, V. (1999). Effective communication skills are the key to good cancer care. European journal of cancer (Oxford, England : 1990), 35(11), 1592-1597.
Fallowfield, L., & Jenkins, V. (2004). Communicating sad, bad, and difficult news in medicine. Lancet (London, England), 363(9405), 312-319. https://doi.org/10.1016/s0140-6736(03)15392-5
Fayers, P. M., Hjermstad, M. J., Ranhoff, A. H., Kaasa, S., Skogstad, L., Klepstad, P., & Loge, J. H. (2005). Which mini-mental state exam items can be used to screen for delirium and cognitive impairment? Journal of pain and symptom management, 30(1), 41-50. https://doi.org/10.1016/j.jpainsymman.2005.05.001
Fearon, K., Strasser, F., Anker, S. D., Bosaeus, I., Bruera, E., Fainsinger, R. L., . . . Baracos, V. E. (2011). Definition and classification of cancer cachexia: an international consensus. The Lancet. Oncology, 12(5), 489-495. https://doi.org/10.1016/s1470-2045(10)70218-7
Fearon, K. C. (2008). Cancer cachexia: developing multimodal therapy for a multidimensional problem. European journal of cancer (Oxford, England : 1990), 44(8), 1124-1132. https://doi.org/10.1016/j.ejca.2008.02.033
Fearon, K. C. H., Glass, D. J., & Guttridge, D. C. (2012). Cancer cachexia: mediators, signaling, and metabolic pathways. Cell Metabolism, 16(2), 153-166. https://doi.org/10.1016/j.cmet.2012.06.011
Ferdige fagprosedyrer: barn og unge. (2018). [Nettside]. Oslo: Helsebiblioteket.no. Hentet 7. desember 2018, fra https://www.helsebiblioteket.no/fagprosedyrer/ferdige/?subject=243978
Ferrell, B. R., Temel, J. S., Temin, S., & Smith, T. J. (2017). Integration of palliative care Into standard oncology care: ASCO clinical practice guideline update summary. Journal of oncology practice, 13(2), 119-121. https://doi.org/10.1200/jop.2016.017897
Follwell, M., Burman, D., Le, L. W., Wakimoto, K., Seccareccia, D., Bryson, J., . . . Zimmermann, C. (2009). Phase II study of an outpatient palliative care intervention in patients with metastatic cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 27(2), 206-213. https://doi.org/10.1200/jco.2008.17.7568
Fong, D. Y., Ho, J. W., Hui, B. P., Lee, A. M., Macfarlane, D. J., Leung, S. S., . . . Cheng, K. K. (2012). Physical activity for cancer survivors: meta-analysis of randomised controlled trials. BMJ (Clinical research ed.), 344, e70. https://doi.org/10.1136/bmj.e70
Ford, J. A., Jones, R., Elders, A., Mulatero, C., Royle, P., Sharma, P., . . . Mowatt, G. (2013). Denosumab for treatment of bone metastases secondary to solid tumours: systematic review and network meta-analysis. European journal of cancer (Oxford, England : 1990), 49(2), 416-430. https://doi.org/10.1016/j.ejca.2012.07.016
Forskrift om helseforetaksfinansierte reseptlegemidler til bruk utenfor sykehus. FOR-2015-06-12-646. Hentet fra https://lovdata.no/dokument/SF/forskrift/2015-06-12-646?q=FOR-2015-06-12-646
Forskrift om individuell plan etter helselovgivningen og sosialtjenesteloven. FOR-2004-12-23-1837. Hentet fra https://lovdata.no/dokument/LTI/forskrift/2004-12-23-1837
Forskrift om pasienters, ledsageres og pårørendes rett til dekning av utgifter ved reise til helsetjenester (pasientreiseforskriften). FOR-2015-06-25-793. Hentet fra https://lovdata.no/dokument/SF/forskrift/2015-06-25-793?q=FOR-2015-06-25-793
Forskrift om stønad til dekning av utgifter til viktige legemidler mv. (blåreseptforskriften). FOR-2007-06-28-814. Hentet fra https://lovdata.no/dokument/SF/forskrift/2007-06-28-814?q=FOR-2007-06-28-814
Foubert, J., & Vaessen, G. (2005). Nausea: the neglected symptom? European Journal of Oncology Nursing, 9(1), 21-32. https://doi.org/10.1016/j.ejon.2004.03.006
Frantzen, T. (2016). Fysioterapi i palliativ fase. I: I. L. Nesvold, T.-L. Frantzen, & K. L. Tagholdt (red.), Fysioterapi til kreftpasienter (s. 64-72). Oslo: Norsk Fysioterapeutforbund, faggruppen for onkologi og lymfologi.
Fredheim, O. M., Kaasa, S., Dale, O., Klepstad, P., Landro, N. I., & Borchgrevink, P. C. (2006). Opioid switching from oral slow release morphine to oral methadone may improve pain control in chronic non-malignant pain: a nine-month follow-up study. Palliative medicine, 20(1), 35-41. https://doi.org/10.1191/0269216306pm1099oa
Freedman, M. D., Schwartz, H. J., Roby, R., & Fleisher, S. (1997). Tolerance and efficacy of polyethylene glycol 3350/electrolyte solution versus lactulose in relieving opiate induced constipation: a double-blinded placebo-controlled trial. Journal of clinical pharmacology, 37(10), 904-907.
Friis, P., & Forde, R. (2015). Advance care planning discussions with geriatric patients. Tidsskr Nor Legeforen, 135(3), 233-235. https://doi.org/10.4045/tidsskr.14.0175
Friis, P., & Forde, R. (2017). Forhåndssamtaler = Advance care planning. Tidsskr Nor Legeforen, 137(6), 462. https://dx.doi.org/10.4045/tidsskr.16.1049
Galasko, C. S. (1969). The detection of skeletal metastases from mammary cancer by gamma camera scintigraphy. The British journal of surgery, 56(10), 757-764.
Galvao, D. A., & Newton, R. U. (2005). Review of exercise intervention studies in cancer patients. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 23(4), 899-909. https://doi.org/10.1200/jco.2005.06.085
George, R., Jeba, J., Ramkumar, G., Chacko, A. G., Leng, M., & Tharyan, P. (2008). Interventions for the treatment of metastatic extradural spinal cord compression in adults. The Cochrane database of systematic reviews, (4), CD006716. https://doi.org/10.1002/14651858.CD006716.pub2
George, R., Jeba, J., Ramkumar, G., Chacko, A. G., & Tharyan, P. (2015). Interventions for the treatment of metastatic extradural spinal cord compression in adults. The Cochrane database of systematic reviews, (9), CD006716. https://doi.org/10.1002/14651858.CD006716.pub3
Glare, P., Miller, J., Nikolova, T., & Tickoo, R. (2011). Treating nausea and vomiting in palliative care: a review. Clinical interventions in aging, 6, 243-259. https://doi.org/10.2147/cia.s13109
Glare, P., Pereira, G., Kristjanson, L. J., Stockler, M., & Tattersall, M. (2004). Systematic review of the efficacy of antiemetics in the treatment of nausea in patients with far-advanced cancer. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer, 12(6), 432-440. https://doi.org/10.1007/s00520-004-0629-y
Glare, P. A., Dunwoodie, D., Clark, K., Ward, A., Yates, P., Ryan, S., & Hardy, J. R. (2008). Treatment of nausea and vomiting in terminally ill cancer patients. Drugs, 68(18), 2575-2590. https://doi.org/10.2165/0003495-200868180-00004
Gomes, B., Calanzani, N., Gysels, M., Hall, S., & Higginson, I. J. (2013). Heterogeneity and changes in preferences for dying at home: a systematic review. BMC palliative care, 12, 7. https://doi.org/10.1186/1472-684x-12-7
Goudas, L. C., Bloch, R., Gialeli-Goudas, M., Lau, J., & Carr, D. B. (2005). The epidemiology of cancer pain. Cancer investigation, 23(2), 182-190.
Gouma, D. J., Busch, O. R., & Van Gulik, T. M. (2006). Pancreatic carcinoma: palliative surgical and endoscopic treatment. HPB : the official journal of the International Hepato Pancreato Biliary Association, 8(5), 369-376. https://doi.org/10.1080/13651820600804021
Grande, G. E., Austin, L., Ewing, G., O'Leary, N., & Roberts, C. (2017). Assessing the impact of a Carer Support Needs Assessment Tool (CSNAT) intervention in palliative home care: a stepped wedge cluster trial. BMJ supportive & palliative care, 7(3), 326-334. https://doi.org/10.1136/bmjspcare-2014-000829
Guckenberger, M., Mantel, F., Gerszten, P. C., Flickinger, J. C., Sahgal, A., Letourneau, D., . . . Kersh, R. (2014). Safety and efficacy of stereotactic body radiotherapy as primary treatment for vertebral metastases: a multi-institutional analysis. Radiation oncology (London, England), 9, 226. https://doi.org/10.1186/s13014-014-0226-2
Gulde, I., Oldervoll, L. M., & Martin, C. (2011). Palliative cancer patients' experience of physical activity. Journal of palliative care, 27(4), 296-302.
Hagen, N. A., Stiles, C., Nekolaichuk, C., Biondo, P., Carlson, L. E., Fisher, K., & Fainsinger, R. (2008). The Alberta Breakthrough Pain Assessment Tool for cancer patients: a validation study using a delphi process and patient think-aloud interviews. Journal of pain and symptom management, 35(2), 136-152. https://doi.org/10.1016/j.jpainsymman.2007.03.016
Hansen, M. S., Mathiesen, O., Trautner, S., & Dahl, J. B. (2012). Intranasal fentanyl in the treatment of acute pain--a systematic review. Acta anaesthesiologica Scandinavica, 56(4), 407-419. https://doi.org/10.1111/j.1399-6576.2011.02613.x
Harada, H., Katagiri, H., Kamata, M., Yoshioka, Y., Asakura, H., Hashimoto, T., . . . Nishimura, T. (2010). Radiological response and clinical outcome in patients with femoral bone metastases after radiotherapy. Journal of radiation research, 51(2), 131-136.
Harlo, S., & Kvikstad, A. (2016). Økonomiske støtteordninger ved alvorlig sykdom og dødsfall. I: S. Kaasa, J. H. Loge, & D. R. F. Haugen (red.), Palliasjon: nordisk lærebok (3. utg., s. 172-188). Oslo: Gyldendal akademisk.
Harris, D. G. (2010). Nausea and vomiting in advanced cancer. British medical bulletin, 96, 175-185. https://doi.org/10.1093/bmb/ldq031
Hashmi, A., Guckenberger, M., Kersh, R., Gerszten, P. C., Mantel, F., Grills, I. S., . . . Sahgal, A. (2016). Re-irradiation stereotactic body radiotherapy for spinal metastases: a multi-institutional outcome analysis. Journal of neurosurgery. Spine, 25(5), 646-653. https://doi.org/10.3171/2016.4.spine151523
Hately, J., Laurence, V., Scott, A., Baker, R., & Thomas, P. (2003). Breathlessness clinics within specialist palliative care settings can improve the quality of life and functional capacity of patients with lung cancer. Palliative medicine, 17(5), 410-417. https://doi.org/10.1191/0269216303pm752oa
Haugen, D. F., Hjermstad, M. J., Hagen, N., Caraceni, A., & Kaasa, S. (2010). Assessment and classification of cancer breakthrough pain: a systematic literature review. Pain, 149(3), 476-482. https://doi.org/10.1016/j.pain.2010.02.035
Haughney, A. (2004). Nausea & vomiting in end-stage cancer. The American journal of nursing, 104(11), 40-48; quiz 49.
Helse- og omsorgsdepartementet. Samhandlingsreformen: rett behandling – på rett sted – til rett tid (St.meld. nr. 47 (2008-2009)). Hentet fra https://www.regjeringen.no/contentassets/d4f0e16ad32e4bbd8d8ab5c21445a5dc/no/pdfs/stm200820090047000dddpdfs.pdf
Helsedirektoratet. (2009). Beslutningsprosesser ved begrensning av livsforlengende behandling hos alvorlige syke og døende (IS-2091). Oslo: Helsedirektoratet. Hentet fra https://helsedirektoratet.no/retningslinjer/veileder-for-beslutningsprosesser-ved-begrensning-av-livsforlengende-behandling
Helsedirektoratet. (2013). Nasjonale faglige retningslinjer for forebygging og behandling av underernæring (IS-1580). Oslo: Helsedirektoratet. Hentet fra https://helsedirektoratet.no/retningslinjer/nasjonal-faglig-retningslinje-for-forebygging-og-behandling-av-underernering
Helsedirektoratet. (2015). Rapport om tilbudet til personer med behov for lindrende behandling og omsorg mot livets slutt: å skape liv til dagene (IS-2278). Oslo: Helsedirektoratet. Hentet fra https://www.helsedirektoratet.no/tema/palliasjon/_/attachment/download/64b02e2c-9ec9-4709-b6fa-a156a79e9baf:3828cd931ca7996c7220dd12f25bb1a4876dda58/Rapport%20om%20tilbudet%20til%20personer%20med%20behov%20for%20lindrende%20behandling%20og%20omsorg%20ved%20livets%20slutt.pdf
Helsedirektoratet. (2018). Veileder om pårørende i helse- og omsorgstjenesten (IS-2587). Oslo: Helsedirektoratet. Hentet fra https://helsedirektoratet.no/retningslinjer/parorendeveileder
Hodel, J., Zins, M., Desmottes, L., Boulay-Coletta, I., Julles, M. C., Nakache, J. P., & Rodallec, M. (2009). Location of the transition zone in CT of small-bowel obstruction: added value of multiplanar reformations. Abdominal imaging, 34(1), 35-41. https://doi.org/10.1007/s00261-007-9348-4
Holtan, A., Aass, N., Nordoy, T., Haugen, D. F., Kaasa, S., Mohr, W., & Kongsgaard, U. E. (2007). Prevalence of pain in hospitalised cancer patients in Norway: a national survey. Palliative medicine, 21(1), 7-13. https://doi.org/10.1177/0269216306073127
Husband, D. J., Grant, K. A., & Romaniuk, C. S. (2001). MRI in the diagnosis and treatment of suspected malignant spinal cord compression. The British journal of radiology, 74(877), 15-23. https://doi.org/10.1259/bjr.74.877.740015
Haanpaa, M., Attal, N., Backonja, M., Baron, R., Bennett, M., Bouhassira, D., . . . Treede, R. D. (2011). NeuPSIG guidelines on neuropathic pain assessment. Pain, 152(1), 14-27. https://doi.org/10.1016/j.pain.2010.07.031
Individuell plan 2010 – veileder til forskrift om individuell plan. (2010). (IS-1253). Oslo: Helsedirektoratet. Hentet fra https://helsedirektoratet.no/retningslinjer/rehabilitering-habilitering-individuell-plan-og-koordinator/seksjon?Tittel=individuell-plan-og-koordinator-6935
Iversen, G. S. (2. august 2018). En plan for livets sluttfase. [Nettdokument]. Oslo: Sykepleien. Hentet 11. desember 2018, 2018, fra https://sykepleien.no/meninger/innspill/2016/09/en-plan-livets-sluttfase
Jackson, K. C. (2015). Kulturformuleringsintervjuet (CFI), DSM-5 : et klinisk verktøy i tverrkulturell kommunikasjon. Oslo: NAKMI, Nasjonal kompetanseenhet for minoritetshelse. Hentet fra https://www.fhi.no/publ/2015/kulturformuleringsintervjuet-cfi-dsm-5/
Jandhyala, R., Fullarton, J. R., & Bennett, M. I. (2013). Efficacy of rapid-onset oral fentanyl formulations vs. oral morphine for cancer-related breakthrough pain: a meta-analysis of comparative trials. Journal of pain and symptom management, 46(4), 573-580. https://doi.org/10.1016/j.jpainsymman.2012.09.009
Jeejeebhoy, K. N. (2012). Malnutrition, fatigue, frailty, vulnerability, sarcopenia and cachexia: overlap of clinical features. Current opinion in clinical nutrition and metabolic care, 15(3), 213-219. https://doi.org/10.1097/MCO.0b013e328352694f
Jennings, A. L., Davies, A. N., Higgins, J. P., & Broadley, K. (2001). Opioids for the palliation of breathlessness in terminal illness. The Cochrane database of systematic reviews, (4), CD002066. https://doi.org/10.1002/14651858.cd002066
Jeurnink, S. M., Steyerberg, E. W., Hof, G., van Eijck, C. H., Kuipers, E. J., & Siersema, P. D. (2007). Gastrojejunostomy versus stent placement in patients with malignant gastric outlet obstruction: a comparison in 95 patients. Journal of surgical oncology, 96(5), 389-396. https://doi.org/10.1002/jso.20828
Johnstone, C., & Lutz, S. T. (2014). External beam radiotherapy and bone metastases. Annals of palliative medicine, 3(2), 114-122. https://doi.org/10.3978/j.issn.2224-5820.2014.04.06
Jones, L. W., & Alfano, C. M. (2013). Exercise-oncology research: past, present, and future. Acta oncologica (Stockholm, Sweden), 52(2), 195-215. https://doi.org/10.3109/0284186x.2012.742564
Kakhki, V. R., Anvari, K., Sadeghi, R., Mahmoudian, A. S., & Torabian-Kakhki, M. (2013). Pattern and distribution of bone metastases in common malignant tumors. Nuclear medicine review. Central & Eastern Europe, 16(2), 66-69. https://doi.org/10.5603/nmr.2013.0037
Khan, S. Y., & O'Driscoll, B. R. (2004). Is nebulized saline a placebo in COPD? BMC pulmonary medicine, 4, 9. https://doi.org/10.1186/1471-2466-4-9
King, S., Forbes, K., Hanks, G. W., Ferro, C. J., & Chambers, E. J. (2011). A systematic review of the use of opioid medication for those with moderate to severe cancer pain and renal impairment: a European Palliative Care Research Collaborative opioid guidelines project. Palliative medicine, 25(5), 525-552. https://doi.org/10.1177/0269216311406313
Kissane, D. (2005). A challenge for palliative medicine: bereavement care. European Journal of Palliative Care, 12(2S), 19-23.
Kjørstad, O. J., & Haugen, D. F. (2013). Hjarte-lunge-redning til kreftpasientar i palliativ fase. Tidsskr Nor Legeforen, 133(4), 417-421. https://dx.doi.org/10.4045/tidsskr.12.0378
Kloke, M., & Cherny, N. (2015). Treatment of dyspnoea in advanced cancer patients: ESMO Clinical Practice Guidelines. Annals of oncology : official journal of the European Society for Medical Oncology, 26 Suppl 5, v169-173. https://doi.org/10.1093/annonc/mdv306
Knudsen, A. K., Brunelli, C., Klepstad, P., Aass, N., Apolone, G., Corli, O., . . . Kaasa, S. (2012). Which domains should be included in a cancer pain classification system? Analyses of longitudinal data. Pain, 153(3), 696-703. https://doi.org/10.1016/j.pain.2011.12.005
Kondrup, J., Rasmussen, H. H., Hamberg, O. L. E., & Stanga, Z. (2003). Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials. Clinical Nutrition, 22(3), 321-336. https://doi.org/10.1016/S0261-5614(02)00214-5
Kringlen, E., Finset, A., & Kringlen, E. (1999). Den kliniske samtalen : kommunikasjon og pasientbehandling. Oslo: Universitetsforlaget.
Kultur- og kirkedepartementet. Frivillighet for alle (St.meld. nr 39 (2006-2007)). Hentet fra https://www.regjeringen.no/no/dokumenter/Stmeld-nr-39-2007-/id477331/
Kumar, N., Malhotra, R., Maharajan, K., Zaw, A. S., Wu, P. H., Makandura, M. C., . . . Wong, H. K. (2017). Metastatic spine tumor surgery: A comparative study of minimally invasive approach using percutaneous pedicle screws fixation versus open approach. Clinical spine surgery, 30(8), E1015-e1021. https://doi.org/10.1097/bsd.0000000000000400
Kvale, P. A., Simoff, M., & Prakash, U. B. (2003). Lung cancer. Palliative care. Chest, 123(1 Suppl), 284s-311s.
Kaasa, S., Apolone, G., Klepstad, P., Loge, J. H., Hjermstad, M. J., Corli, O., . . . Caraceni, A. (2011). Expert conference on cancer pain assessment and classification--the need for international consensus: working proposals on international standards. BMJ supportive & palliative care, 1(3), 281-287. https://doi.org/10.1136/bmjspcare-2011-000078
Kaasa, S., Loge, J. H., Fayers, P., Caraceni, A., Strasser, F., Hjermstad, M. J., . . . Haugen, D. F. (2008). Symptom assessment in palliative care: a need for international collaboration. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 26(23), 3867-3873. https://doi.org/10.1200/jco.2007.15.8881
Kaasa, S., Loge, J. H., Aapro, M., Albreht, T., Anderson, R., Bruera, E., . . . Lundeby, T. (2018). Integration of oncology and palliative care: a Lancet Oncology Commission. The Lancet. Oncology, 19(11), e588-e653. https://doi.org/10.1016/s1470-2045(18)30415-7
Kaasa, T., & Wessel, J. (2001). The Edmonton Functional Assessment Tool: further development and validation for use in palliative care. Journal of palliative care, 17(1), 5-11.
Lacey, J. (2015). Management of the actively dying patient. I: N. I. Cherny (red.), Oxford textbook of palliative medicine (5. utg.). Oxford: Oxford University Press.
Laird, B. J., Boyd, A. C., Colvin, L. A., & Fallon, M. T. (2009). Are cancer pain and depression interdependent? A systematic review. Psycho-oncology, 18(5), 459-464. https://doi.org/10.1002/pon.1431
Laksantia. I. (2016). Norsk legemiddelhåndbok. Oslo: Foreningen for utgivelse av Norsk legemiddelhåndbok. Hentet fra https://www.legemiddelhandboka.no/L12.11/Laksantia
Langer, A. (2010). A systematic review of PET and PET/CT in oncology: a way to personalize cancer treatment in a cost-effective manner? BMC health services research, 10, 283. https://doi.org/10.1186/1472-6963-10-283
Larkin, P. J., Cherny, N. I., La Carpia, D., Guglielmo, M., Ostgathe, C., Scotté, F., . . . Committee, E. G. (2018). Diagnosis, assessment and management of constipation in advanced cancer: ESMO Clinical Practice Guidelines. Annals of oncology : official journal of the European Society for Medical Oncology, 29(Supplement_4), iv111-iv125. https://doi.org/10.1093/annonc/mdy148
Larkin, P. J., Sykes, N. P., Centeno, C., Ellershaw, J. E., Elsner, F., Eugene, B., . . . Zuurmond, W. W. (2008). The management of constipation in palliative care: clinical practice recommendations. Palliative medicine, 22(7), 796-807. https://doi.org/10.1177/0269216308096908
Larssen, L., Medhus, A. W., Hjermstad, M. J., Korner, H., Glomsaker, T., Soberg, T., . . . Hauge, T. (2011). Patient-reported outcomes in palliative gastrointestinal stenting: a Norwegian multicenter study. Surgical endoscopy, 25(10), 3162-3169. https://doi.org/10.1007/s00464-011-1680-7
Larssen, L., Medhus, A. W., Körner, H., Glomsaker, T., Søberg, T., Gleditsch, D., . . . Hauge, T. (2012). Long-term outcome of palliative treatment with self-expanding metal stents for malignant obstructions of the GI tract. Scand J Gastroenterol, 47(12), 1505-1514. https://doi.org/10.3109/00365521.2012.711854
Laugsand, E. A., Fladvad, T., Skorpen, F., Maltoni, M., Kaasa, S., Fayers, P., & Klepstad, P. (2011). Clinical and genetic factors associated with nausea and vomiting in cancer patients receiving opioids. European journal of cancer (Oxford, England : 1990), 47(11), 1682-1691. https://doi.org/10.1016/j.ejca.2011.04.014
Laugsand, T. S., Kaasa, S., Romundstad, P., Johannesen, T. B., & Lund, J. A. (2013). Radiotherapy for bone metastases: practice in Norway 1997-2007. A national registry-based study. Acta oncologica (Stockholm, Sweden), 52(6), 1129-1136. https://doi.org/10.3109/0284186x.2012.747697
Lederberg, M. (1998). The family of the cancer patient. I: J. Holland (red.), Psycho-oncology (s. 981-993). New York: Oxford University Press.
Lee, S. H., Grant, R., Kennedy, C., & Kilbride, L. (2015). Positioning and spinal bracing for pain relief in metastatic spinal cord compression in adults. The Cochrane database of systematic reviews, (9), CD007609. https://doi.org/10.1002/14651858.CD007609.pub3
Levack, P., Graham, J., Collie, D., Grant, R., Kidd, J., Kunkler, I., . . . Summers, D. (2002). Don't wait for a sensory level--listen to the symptoms: a prospective audit of the delays in diagnosis of malignant cord compression. Clinical oncology (Royal College of Radiologists (Great Britain)), 14(6), 472-480.
Leve med kreft. Nasjonal kreftstrategi (2018–2022). (2018). (I-1184 B). Oslo: Helse- og omsorgsdepartementet. Hentet fra https://www.regjeringen.no/contentassets/266bf1eec38940888a589ec86d79da20/regjeringens_kreftstrategi_180418.pdf
Levy, M. H. (1998). Doctor-patient communication: the lifeline to comprehensive cancer care. I: American Society of Clinical Oncology, Educational Book, 1998 (34th Annual Meeting) (s. 195-202)
Librach, S. L., Bouvette, M., De Angelis, C., Farley, J., Oneschuk, D., Pereira, J. L., & Syme, A. (2010). Consensus recommendations for the management of constipation in patients with advanced, progressive illness. Journal of pain and symptom management, 40(5), 761-773. https://doi.org/10.1016/j.jpainsymman.2010.03.026
Lichter, I. (1993). Which antiemetic? Journal of palliative care, 9(1), 42-50.
Lippert, F. K., Raffay, V., Georgiou, M., Steen, P. A., & Bossaert, L. (2010). European Resuscitation Council Guidelines for Resuscitation 2010 Section 10. The ethics of resuscitation and end-of-life decisions. Resuscitation, 81(10), 1445-1451. https://doi.org/10.1016/j.resuscitation.2010.08.013
Loblaw, D. A., Perry, J., Chambers, A., & Laperriere, N. J. (2005). Systematic review of the diagnosis and management of malignant extradural spinal cord compression: the Cancer Care Ontario Practice Guidelines Initiative's Neuro-Oncology Disease Site Group. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 23(9), 2028-2037. https://doi.org/10.1200/jco.2005.00.067
Locke, G. R., 3rd, Pemberton, J. H., & Phillips, S. F. (2000). American Gastroenterological Association Medical Position Statement: guidelines on constipation. Gastroenterology, 119(6), 1761-1766.
Loge, J. (2008). Angst og depresjon. I: S. Kaasa (red.), Palliasjon: nordisk lærebok (2. utg., s. 531-547). Oslo: Gyldendal akademisk.
Loughrey, G. J., Collins, C. D., Todd, S. M., Brown, N. M., & Johnson, R. J. (2000). Magnetic resonance imaging in the management of suspected spinal canal disease in patients with known malignancy. Clinical radiology, 55(11), 849-855. https://doi.org/10.1053/crad.2000.0547
Lov om arbeidsmiljø, arbeidstid og stillingsvern mv. (arbeidsmiljøloven). LOV-2005-06-17-62. Hentet fra https://lovdata.no/dokument/NL/lov/2005-06-17-62?q=LOV-2005-06-17-62
Lov om folketrygd (folketrygdloven). LOV-1997-02-28-19. Hentet fra https://lovdata.no/dokument/NL/lov/1997-02-28-19?q=LOV-1997-02-28-19
Lov om helsepersonell m.v. (helsepersonelloven). LOV-1999-07-02-64. Hentet fra https://lovdata.no/dokument/NL/lov/1999-07-02-64
Lov om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven). LOV-2011-06-24-30. Hentet fra https://lovdata.no/dokument/NL/lov/2011-06-24-30
Lov om pasient- og brukerrettigheter (pasient- og brukerrettighetsloven). LOV-1999-07-02-63. Hentet fra https://lovdata.no/dokument/NL/lov/1999-07-02-63
Lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven). LOV-1999-07-02-61. Hentet fra http://www.lovdata.no/all/hl-19990702-061.html
Lowenstein, O., Leyendecker, P., Hopp, M., Schutter, U., Rogers, P. D., Uhl, R., . . . Reimer, K. (2009). Combined prolonged-release oxycodone and naloxone improves bowel function in patients receiving opioids for moderate-to-severe non-malignant chronic pain: a randomised controlled trial. Expert opinion on pharmacotherapy, 10(4), 531-543. https://doi.org/10.1517/14656560902796798
Lutz, S., Balboni, T., Jones, J., Lo, S., Petit, J., Rich, S. E., . . . Hahn, C. (2017). Palliative radiation therapy for bone metastases: update of an ASTRO Evidence-Based Guideline. Practical radiation oncology, 7(1), 4-12. https://doi.org/10.1016/j.prro.2016.08.001
Mak, K. S., Lee, L. K., Mak, R. H., Wang, S., Pile-Spellman, J., Abrahm, J. L., . . . Balboni, T. A. (2011). Incidence and treatment patterns in hospitalizations for malignant spinal cord compression in the United States, 1998-2006. International journal of radiation oncology, biology, physics, 80(3), 824-831. https://doi.org/10.1016/j.ijrobp.2010.03.022
Malign medullakompresjon (MMK) - Standardisert pasientforløp. I: eHåndboken for Oslo universitetssykehus. (2018). [nettdokument]. Oslo: Oslo universitetssykehus. Avd. for kreftbehandling. Hentet 18. desember 2018, fra http://ehandboken.ous-hf.no/document/128350
Mancini, I., & Bruera, E. (1998). Constipation in advanced cancer patients. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer, 6(4), 356-364. https://doi.org/10.1007/s005200050177
Mancini, I. L., Hanson, J., Neumann, C. M., & Bruera, E. D. (2000). Opioid type and other clinical predictors of laxative dose in advanced cancer patients: a retrospective study. Journal of palliative medicine, 3(1), 49-56. https://doi.org/10.1089/jpm.2000.3.49
McClain, C. S., Rosenfeld, B., & Breitbart, W. (2003). Effect of spiritual well-being on end-of-life despair in terminally-ill cancer patients. Lancet (London, England), 361(9369), 1603-1607. https://doi.org/10.1016/s0140-6736(03)13310-7
McClement, S. E. (2015). Spiritual issues in palliative medicine. I: N. Cherny, M. Fallon, S. Kaasa, R. K. Portenoy, & D. C. Currow (red.), Oxford Textbook of Palliative Medicine (5. utg., s. 1059-1066). Oxford: Oxford University Press.
McCurdy, M. T., & Shanholtz, C. B. (2012). Oncologic emergencies. Critical care medicine, 40(7), 2212-2222. https://doi.org/10.1097/CCM.0b013e31824e1865
McMillan, S. C. (2004). Assessing and managing opiate-induced constipation in adults with cancer. Cancer control : journal of the Moffitt Cancer Center, 11(3 Suppl), 3-9. https://doi.org/10.1177/10732748040110s302
Meissner, W., Leyendecker, P., Mueller-Lissner, S., Nadstawek, J., Hopp, M., Ruckes, C., . . . Reimer, K. (2009). A randomised controlled trial with prolonged-release oral oxycodone and naloxone to prevent and reverse opioid-induced constipation. European journal of pain (London, England), 13(1), 56-64. https://doi.org/10.1016/j.ejpain.2008.06.012
Mendoza, J., Legido, J., Rubio, S., & Gisbert, J. P. (2007). Systematic review: the adverse effects of sodium phosphate enema. Alimentary pharmacology & therapeutics, 26(1), 9-20. https://doi.org/10.1111/j.1365-2036.2007.03354.x
Mercadante, S., Porzio, G., Valle, A., Fusco, F., Aielli, F., & Costanzo, V. (2011). Palliative sedation in patients with advanced cancer followed at home: a systematic review. Journal of pain and symptom management, 41(4), 754-760. https://doi.org/10.1016/j.jpainsymman.2010.07.013
Metastatic spinal cord compression in adults. (2014). (Quality standard QS56). London: National Institute for Health and Care Excellence. Hentet fra https://www.nice.org.uk/guidance/qs56
Metastatic spinal cord compression in adults: risk assessment, diagnosis and management. (2008). (Clinical guideline CG75). London: National Institute for Health and Care Excellence Hentet fra https://www.nice.org.uk/guidance/cg75
Metoder og verktøy [Nettdokument]. Oslo: Helsedirektoratet. Hentet 20. desember 2018, fra https://www.helsedirektoratet.no/veiledere/oppfolging-av-personer-med-store-og-sammensatte-behov/metoder-og-verktoy-for-systematisk-kvalitetsforbedring-for-helhetlige-og-koordinerte-tjenester
Meyer, L., & Pothuri, B. (2006). Decompressive percutaneous gastrostomy tube use in gynecologic malignancies. Current treatment options in oncology, 7(2), 111-120.
Miles, C. L., Fellowes, D., Goodman, M. L., & Wilkinson, S. (2006). Laxatives for the management of constipation in palliative care patients. The Cochrane database of systematic reviews, (4), CD003448. https://doi.org/10.1002/14651858.CD003448.pub2
Moksnes, K., Dale, O., Rosland, J. H., Paulsen, O., Klepstad, P., & Kaasa, S. (2011). How to switch from morphine or oxycodone to methadone in cancer patients? a randomised clinical phase II trial. European journal of cancer (Oxford, England : 1990), 47(16), 2463-2470. https://doi.org/10.1016/j.ejca.2011.06.047
Moss, A. C., Morris, E., & Mac Mathuna, P. (2006). Palliative biliary stents for obstructing pancreatic carcinoma. The Cochrane database of systematic reviews, (1), CD004200. https://doi.org/10.1002/14651858.CD004200.pub2
Müller, D., Wiedmann, M., Kluge, R., Berr, F., Mössner, J., Sabri, O., & Caca, K. (2005). Ist die 18F-FDG-PET zum Monitoring der palliativen photodynamischen Therapie von nichtresektablen Klatskin-Tumoren geeignet? Zeitschrift fur Gastroenterologie, 43(5), 439-443. https://doi.org/10.1055/s-2004-813935
Nabal, M., Librada, S., Redondo, M. J., Pigni, A., Brunelli, C., & Caraceni, A. (2012). The role of paracetamol and nonsteroidal anti-inflammatory drugs in addition to WHO Step III opioids in the control of pain in advanced cancer. A systematic review of the literature. Palliative medicine, 26(4), 305-312. https://doi.org/10.1177/0269216311428528
NHS. (20. juni 2018). End of life care. [Nettside]. England: NHS. Hentet 4. desember 2018, 2018, fra https://www.nhs.uk/conditions/end-of-life-care/
Nordoy, T., Thoresen, L., Kvikstad, A., & Svensen, R. (2006). Ernæring og væskebehandling til pasienter med ikke-kurabel kreftsykdom. Tidsskr Nor Legeforen, 126(5), 624-627.
Obling, S. R., Wilson, B. V., Pfeiffer, P., & Kjeldsen, J. (2017). Home parenteral nutrition increases fat free mass in patients with incurable gastrointestinal cancer. Results of a randomized controlled trial. Clinical nutrition (Edinburgh, Scotland). https://doi.org/10.1016/j.clnu.2017.12.011
Oldervoll, L., & Stene, G. (2016). Fysisk aktivitet og trening. I: S. Kaasa, J. H. Loge, & D. R. F. Haugen (red.), Palliasjon: nordisk lærebok (3. utg., s. 244-252). Oslo: Gyldendal akademisk.
Oldervoll, L. M., Loge, J. H., Lydersen, S., Paltiel, H., Asp, M. B., Nygaard, U. V., . . . Kaasa, S. (2011). Physical exercise for cancer patients with advanced disease: a randomized controlled trial. The oncologist, 16(11), 1649-1657. https://doi.org/10.1634/theoncologist.2011-0133
Oldervoll, L. M., Loge, J. H., Paltiel, H., Asp, M. B., Vidvei, U., Hjermstad, M. J., & Kaasa, S. (2005). Are palliative cancer patients willing and able to participate in a physical exercise program? Palliative & supportive care, 3(4), 281-287.
Ortner, M. E., Caca, K., Berr, F., Liebetruth, J., Mansmann, U., Huster, D., . . . Lochs, H. (2003). Successful photodynamic therapy for nonresectable cholangiocarcinoma: a randomized prospective study. Gastroenterology, 125(5), 1355-1363.
Paniagua-Collado, M., & Cauli, O. (2018). Non-pharmacological interventions in patients with spinal cord compression: a systematic review. Journal of neuro-oncology, 136(3), 423-434. https://doi.org/10.1007/s11060-017-2684-5
Patchell, R. A., Tibbs, P. A., Regine, W. F., Payne, R., Saris, S., Kryscio, R. J., . . . Young, B. (2005). Direct decompressive surgical resection in the treatment of spinal cord compression caused by metastatic cancer: a randomised trial. Lancet (London, England), 366(9486), 643-648. https://doi.org/10.1016/s0140-6736(05)66954-1
Paulsen, O., Klepstad, P., Rosland, J. H., Aass, N., Albert, E., Fayers, P., & Kaasa, S. (2014). Efficacy of methylprednisolone on pain, fatigue, and appetite loss in patients with advanced cancer using opioids: a randomized, placebo-controlled, double-blind trial. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 32(29), 3221-3228. https://doi.org/10.1200/jco.2013.54.3926
Plesner, I. T., & Døving, C. A. Livsfaseriter : religions- og livsynspolitiske utfordringer i Norge. Oslo: STL, Samarbeidsrådet for tros- og livssynsamfunn. fra https://stl.no/wp-content/uploads/2023/04/STL-rapport-Livsfaseriter.pdf
Pothuri, B., Montemarano, M., Gerardi, M., Shike, M., Ben-Porat, L., Sabbatini, P., & Barakat, R. R. (2005). Percutaneous endoscopic gastrostomy tube placement in patients with malignant bowel obstruction due to ovarian carcinoma. Gynecologic oncology, 96(2), 330-334. https://doi.org/10.1016/j.ygyno.2004.09.058
Prat, F., Chapat, O., Ducot, B., Ponchon, T., Pelletier, G., Fritsch, J., . . . Buffet, C. (1998). A randomized trial of endoscopic drainage methods for inoperable malignant strictures of the common bile duct. Gastrointestinal endoscopy, 47(1), 1-7.
Puchalski, C., Ferrell, B., Virani, R., Otis-Green, S., Baird, P., Bull, J., . . . Sulmasy, D. (2009). Improving the quality of spiritual care as a dimension of palliative care: the report of the Consensus Conference. Journal of palliative medicine, 12(10), 885-904. https://doi.org/10.1089/jpm.2009.0142
På liv og død: palliasjon til alvorlig syke og døende. (2017). (NOU 2017:16). Oslo: Departementenes sikkerhets- og serviceorganisasjon, Informasjonsforvaltning. Hentet fra https://www.regjeringen.no/no/dokumenter/nou-2017-16/id2582548/
Radbruch, L., Elsner, F., Trottenberg , P., Strasser, F., & Fearon, K. (2010). Clinical practice guidelines on Cancer Cachexia in advanced cancer patients. Aachen: Department of Palliative Medicinen / European Palliative Care Research Collaborative.
Radbruch, L., Sabatowski, R., Loick, G., Kulbe, C., Kasper, M., Grond, S., & Lehmann, K. A. (2000). Constipation and the use of laxatives: a comparison between transdermal fentanyl and oral morphine. Palliative medicine, 14(2), 111-119. https://doi.org/10.1191/026921600671594561
Rades, D., Segedin, B., Conde-Moreno, A., Gómez, R., Perpar, A., Metz, M., . . . Schild, S. (2016). Radiotherapy with 4 Gy x 5 versus 3 Gy x 10 for metastatic epidural spinal cord compression: Final results of the SCORE-2 trial (ARO 2009/01). Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 34(6), 597-602. https://doi.org/10.1200/JCO.2015.64.0862
Ramesh, P. R., Kumar, K. S., Rajagopal, M. R., Balachandran, P., & Warrier, P. K. (1998). Managing morphine-induced constipation: a controlled comparison of an Ayurvedic formulation and senna. Journal of pain and symptom management, 16(4), 240-244.
Rauws, E. A. (2006). Photodynamic therapy and Klatskin tumour: an overview. Scandinavian journal of gastroenterology. Supplement, (243), 135-138. https://doi.org/10.1080/00365520600664441
Ravasco, P. (2005). Aspects of taste and compliance in patients with cancer. European Journal of Oncology Nursing, 9, S84-S91. https://doi.org/10.1016/j.ejon.2005.09.003
Reid, J., McKenna, H. P., Fitzsimons, D., & McCance, T. V. (2010). An exploration of the experience of cancer cachexia: what patients and their families want from healthcare professionals. European journal of cancer care, 19(5), 682-689. https://doi.org/10.1111/j.1365-2354.2009.01124.x
Retningslinjer for lindrende sedering i livets sluttfase. (2014). Oslo: Den norske legeforening. Hentet fra https://www.helsebiblioteket.no/anestesiologi/retningslinjer/retningslinjer-for-lindrende-sedering-i-livets-sluttfase
Rett til egen tros- og livssynsutøvelse. (2009). (Rundskriv I - 6/2009). Oslo: Helse- og omsorgsdepartementet. Hentet fra https://www.regjeringen.no/globalassets/upload/hod/rundskriv/rundskriv-i---6-2009.pdf
Rich, S. E., Chow, R., Raman, S., Liang Zeng, K., Lutz, S., Lam, H., . . . Chow, E. (2018). Update of the systematic review of palliative radiation therapy fractionation for bone metastases. Radiotherapy and oncology : journal of the European Society for Therapeutic Radiology and Oncology, 126(3), 547-557. https://doi.org/10.1016/j.radonc.2018.01.003
Richmond, C. (2005). Dame Cicely Saunders. BMJ : British Medical Journal, 331(7510), 238-238.
Ringdal, G. I., Ringdal, K., Jordhoy, M. S., Ahlner-Elmqvist, M., Jannert, M., & Kaasa, S. (2004). Health-related quality of life (HRQOL) in family members of cancer victims: results from a longitudinal intervention study in Norway and Sweden. Palliative medicine, 18(2), 108-120. https://doi.org/10.1191/0269216304pm878oa
Ripamonti, C. (1994). Management of bowel obstruction in advanced cancer. Current opinion in oncology, 6(4), 351-357.
Ripamonti, C. (1999). Management of dyspnea in advanced cancer patients. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer, 7(4), 233-243.
Roberts, C. M. (2004). Short burst oxygen therapy for relief of breathlessness in COPD. Thorax, 59(8), 638-640. https://doi.org/10.1136/thx.2003.017301
Roodman, G. D. (2004). Mechanisms of bone metastasis. The New England journal of medicine, 350(16), 1655-1664. https://doi.org/10.1056/NEJMra030831
Ropper, A. E., & Ropper, A. H. (2017). Acute spinal cord compression. The New England journal of medicine, 376(14), 1358-1369. https://doi.org/10.1056/NEJMra1516539
Rosland, J. H., von Hofacker, S., & Paulsen, O. (2006). Den døende pasient. Tidsskr Nor Legeforen, 126(4), 467-470.
Ruiz Garcia, V., Lopez-Briz, E., Carbonell Sanchis, R., Gonzalvez Perales, J. L., & Bort-Marti, S. (2013). Megestrol acetate for treatment of anorexia-cachexia syndrome. The Cochrane database of systematic reviews, (3), CD004310. https://doi.org/10.1002/14651858.CD004310.pub3
Salt, S., Mulvaney, C. A., & Preston, N. J. (2017). Drug therapy for symptoms associated with anxiety in adult palliative care patients. The Cochrane database of systematic reviews, (5), CD004596. https://doi.org/10.1002/14651858.CD004596.pub3
Sarhill, N., Mahmoud, F., Walsh, D., Nelson, K. A., Komurcu, S., Davis, M., . . . Rybicki, L. (2003). Evaluation of nutritional status in advanced metastatic cancer. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer, 11(10), 652-659. https://doi.org/10.1007/s00520-003-0486-0
Saunders, C. (2003). Watch with me: inspiration for a life in hospice care. Sheffield: Mortal Press.
Saxby, C., Ackroyd, R., Callin, S., Mayland, C., & Kite, S. (2007). How should we measure emesis in palliative care? Palliative medicine, 21(5), 369-383. https://doi.org/10.1177/0269216307080173
Sebastian, S., Johnston, S., Geoghegan, T., Torreggiani, W., & Buckley, M. (2004). Pooled analysis of the efficacy and safety of self-expanding metal stenting in malignant colorectal obstruction. The American journal of gastroenterology, 99(10), 2051-2057. https://doi.org/10.1111/j.1572-0241.2004.40017.x
Segal, R., Zwaal, C., Green, E., Tomasone, J. R., Loblaw, A., Petrella, T., & Exercise for People with Cancer Guideline Development, G. (2017). Exercise for people with cancer: a systematic review. Current oncology (Toronto, Ont.), 24(4), e290-e315. https://doi.org/10.3747/co.24.3619
Selman, L. E., Brighton, L. J., Sinclair, S., Karvinen, I., Egan, R., Speck, P., . . . Hope, J. (2018). Patients' and caregivers' needs, experiences, preferences and research priorities in spiritual care: A focus group study across nine countries. Palliative medicine, 32(1), 216-230. https://doi.org/10.1177/0269216317734954
Seymour, J., & Clark, D. (2018). The Liverpool Care Pathway for the dying patient: a critical analysis of its rise, demise and legacy in England. Wellcome open research, 3, 15. https://doi.org/10.12688/wellcomeopenres.13940.2
Shin, E. S., Seo, K. H., Lee, S. H., Jang, J. E., Jung, Y. M., Kim, M. J., & Yeon, J. Y. (2016). Massage with or without aromatherapy for symptom relief in people with cancer. The Cochrane database of systematic reviews, (6), CD009873. https://doi.org/10.1002/14651858.CD009873.pub3
Sigurdardottir, K. R., Kaasa, S., Rosland, J. H., Bausewein, C., Radbruch, L., & Haugen, D. F. (2014). The European Association for Palliative Care basic dataset to describe a palliative care cancer population: results from an international Delphi process. Palliative medicine, 28(6), 463-473. https://doi.org/10.1177/0269216314521264
Singhal, D., van Gulik, T. M., & Gouma, D. J. (2005). Palliative management of hilar cholangiocarcinoma. Surgical oncology, 14(2), 59-74. https://doi.org/10.1016/j.suronc.2005.05.004
Smith, H. S., & Barkin, R. L. (2014). Painful boney metastases. American journal of therapeutics, 21(2), 106-130. https://doi.org/10.1097/MJT.0b013e3182456dff
Smith, S. (2001). Evidence-based management of constipation in the oncology patient. European Journal of Oncology Nursing, 5(1), 18-25. https://doi.org/10.1054/ejon.2000.0119
Solheim, T. S., & Laird, B. J. (2012). Evidence base for multimodal therapy in cachexia. Current opinion in supportive and palliative care, 6(4), 424-431. https://doi.org/10.1097/SPC.0b013e328359b668
Spiritual support services. I. (2004). Improving supportive and palliative care for adults with cancer: the manual (s. 95-104). London: National Institute for Clinical Excellence. Hentet fra https://www.nice.org.uk/guidance/csg4/resources/improving-supportive-and-palliative-care-for-adults-with-cancer-pdf-773375005
Stajduhar, K., Funk, L., Toye, C., Grande, G., Aoun, S., & Todd, C. (2010). Part 1: Home-based family caregiving at the end of life: a comprehensive review of published quantitative research (1998-2008). Palliative medicine, 24(6), 573-593. https://doi.org/10.1177/0269216310371412
Standardisert pasientforløp: Malign medullakompresjon. Trondheim: St. Olavs hospital. Kreftklinikken. fra http://data.stolav.no/eqspublic/pasientforlop/docs/doc_28412/index.html
Standish, L. J., Kozak, L., & Congdon, S. (2008). Acupuncture is underutilized in hospice and palliative medicine. The American journal of hospice & palliative care, 25(4), 298-308. https://doi.org/10.1177/1049909108315916
Stensheim, H., Hjermstad, M., & Loge, J. H. (2016). Ivaretakelse av pårørende. I: S. Kaasa, J. H. Loge, & D. R. F. Haugen (red.), Palliasjon: nordisk lærebok (3. utg., s. 274-285). Oslo: Gyldendal akademisk.
Stephenson, J., & Davies, A. (2006). An assessment of aetiology-based guidelines for the management of nausea and vomiting in patients with advanced cancer. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer, 14(4), 348-353. https://doi.org/10.1007/s00520-005-0897-1
Stone, C. A., Lawlor, P. G., & Kenny, R. A. (2011). How to identify patients with cancer at risk of falling: a review of the evidence. Journal of palliative medicine, 14(2), 221-230. https://doi.org/10.1089/jpm.2010.0326
Stratton, R. J., Hackston, A., Longmore, D., Dixon, R., Price, S., Stroud, M., . . . Elia, M. (2004). Malnutrition in hospital outpatients and inpatients: prevalence, concurrent validity and ease of use of the 'malnutrition universal screening tool' ('MUST') for adults. The British journal of nutrition, 92(5), 799-808.
Sudore, R. L., Lum, H. D., You, J. J., Hanson, L. C., Meier, D. E., Pantilat, S. Z., . . . Heyland, D. K. (2017). Defining advance care planning for adults: a consensus definition from a multidisciplinary Delphi Panel. Journal of pain and symptom management, 53(5), 821-832.e821. https://doi.org/10.1016/j.jpainsymman.2016.12.331
Sykmelderveileder. (2018). [nettdokument]. Oslo: Helsedirektoratet. Hentet 18. desember 2018, fra https://helsedirektoratet.no/retningslinjer/sykmelderveileder
Sze, W. M., Shelley, M., Held, I., & Mason, M. (2004). Palliation of metastatic bone pain: single fraction versus multifraction radiotherapy - a systematic review of the randomised trials. The Cochrane database of systematic reviews, (2), CD004721. https://doi.org/10.1002/14651858.cd004721
Sze, W. M., Shelley, M. D., Held, I., Wilt, T. J., & Mason, M. D. (2003). Palliation of metastatic bone pain: single fraction versus multifraction radiotherapy--a systematic review of randomised trials. Clinical oncology (Royal College of Radiologists (Great Britain)), 15(6), 345-352.
Szklaruk, J., Tamm, E., & Charnsangavej, C. (2002). Preoperative imaging of biliary tract cancers. Surgical oncology clinics of North America, 11(4), 865-876.
Tamayo, A. C., & Diaz-Zuluaga, P. A. (2004). Management of opioid-induced bowel dysfunction in cancer patients. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer, 12(9), 613-618. https://doi.org/10.1007/s00520-004-0649-7
Temel, J. S., Abernethy, A. P., Currow, D. C., Friend, J., Duus, E. M., Yan, Y., & Fearon, K. C. (2016). Anamorelin in patients with non-small-cell lung cancer and cachexia (ROMANA 1 and ROMANA 2): results from two randomised, double-blind, phase 3 trials. The Lancet. Oncology, 17(4), 519-531. https://doi.org/10.1016/s1470-2045(15)00558-6
Teunissen, S. C., Wesker, W., Kruitwagen, C., de Haes, H. C., Voest, E. E., & de Graeff, A. (2007). Symptom prevalence in patients with incurable cancer: a systematic review. Journal of pain and symptom management, 34(1), 94-104. https://doi.org/10.1016/j.jpainsymman.2006.10.015
Thoresen, L., Lillemoen, L., Sævareid, T. J. L., Gjerberg, E., Førde, R., & Pedersen, R. (2017). Forhåndssamtaler på sykehjem: felles planlegging for tiden framover og helsehjelp ved livets slutt for pasienter ved sykehjem (Veileder). Oslo: Universitet i Oslo. Institutt for helse og samfunn. Hentet fra https://www.med.uio.no/helsam/forskning/prosjekter/forberedende-samtaler-i-sykehjem/acp-veileder271117.pdf?utm_source=publikasjoner&utm_campaign=veileder-forhandssamtaler
Townsend, P. W., Rosenthal, H. G., Smalley, S. R., Cozad, S. C., & Hassanein, R. E. (1994). Impact of postoperative radiation therapy and other perioperative factors on outcome after orthopedic stabilization of impending or pathologic fractures due to metastatic disease. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 12(11), 2345-2350. https://doi.org/10.1200/jco.1994.12.11.2345
Townsend, P. W., Smalley, S. R., Cozad, S. C., Rosenthal, H. G., & Hassanein, R. E. (1995). Role of postoperative radiation therapy after stabilization of fractures caused by metastatic disease. International journal of radiation oncology, biology, physics, 31(1), 43-49. https://doi.org/10.1016/0360-3016(94)e0310-g
Traynor, O., Castaing, D., & Bismuth, H. (1987). Left intrahepatic cholangio-enteric anastomosis (round ligament approach): an effective palliative treatment for hilar cancers. The British journal of surgery, 74(10), 952-954.
Treatment for the dying patient: The Liverpool Care pathway. (2011). Best Practice Journal, (36), 6-13.
Treede, R. D., Jensen, T. S., Campbell, J. N., Cruccu, G., Dostrovsky, J. O., Griffin, J. W., . . . Serra, J. (2008). Neuropathic pain: redefinition and a grading system for clinical and research purposes. Neurology, 70(18), 1630-1635. https://doi.org/10.1212/01.wnl.0000282763.29778.59
van Delden, O. M., & Lameris, J. S. (2008). Percutaneous drainage and stenting for palliation of malignant bile duct obstruction. European radiology, 18(3), 448-456. https://doi.org/10.1007/s00330-007-0796-6
van den Beuken-van Everdingen, M. H., de Rijke, J. M., Kessels, A. G., Schouten, H. C., van Kleef, M., & Patijn, J. (2007). Prevalence of pain in patients with cancer: a systematic review of the past 40 years. Annals of oncology : official journal of the European Society for Medical Oncology, 18(9), 1437-1449. https://doi.org/10.1093/annonc/mdm056
van den Beuken-van Everdingen, M. H., Hochstenbach, L. M., Joosten, E. A., Tjan-Heijnen, V. C., & Janssen, D. J. (2016). Update on prevalence of pain in patients with cancer: systematic review and meta-analysis. Journal of pain and symptom management, 51(6), 1070-1090.e1079. https://doi.org/10.1016/j.jpainsymman.2015.12.340
Vigano, A. L., di Tomasso, J., Kilgour, R. D., Trutschnigg, B., Lucar, E., Morais, J. A., & Borod, M. (2014). The abridged patient-generated subjective global assessment is a useful tool for early detection and characterization of cancer cachexia. Journal of the Academy of Nutrition and Dietetics, 114(7), 1088-1098. https://doi.org/10.1016/j.jand.2013.09.027
Wang, C., Shen, Y., & Zhu, S. (2015). Distribution features of skeletal metastases: a comparative study between pulmonary and prostate cancers. PloS one, 10(11), e0143437. https://doi.org/10.1371/journal.pone.0143437
Wang, Y. C., & Lin, C. C. (2016). Spiritual well-being may reduce the negative impacts of cancer Symptoms on the quality of life and the desire for hastened death in terminally ill cancer patients. Cancer nursing, 39(4), E43-50. https://doi.org/10.1097/ncc.0000000000000298
WHO definition of palliative care. (2018). [nettdokument]. Geneve: World Health Organisation. Hentet 3. desember 2018, fra https://www.who.int/cancer/palliative/definition/en/
Wirz, S., Nadstawek, J., Elsen, C., Junker, U., & Wartenberg, H. C. (2012). Laxative management in ambulatory cancer patients on opioid therapy: a prospective, open-label investigation of polyethylene glycol, sodium picosulphate and lactulose. European journal of cancer care, 21(1), 131-140. https://doi.org/10.1111/j.1365-2354.2011.01286.x
Witzigmann, H., Berr, F., Ringel, U., Caca, K., Uhlmann, D., Schoppmeyer, K., . . . Wiedmann, M. (2006). Surgical and palliative management and outcome in 184 patients with hilar cholangiocarcinoma: palliative photodynamic therapy plus stenting is comparable to r1/r2 resection. Annals of surgery, 244(2), 230-239. https://doi.org/10.1097/01.sla.0000217639.10331.47
Wood, G. J., Shega, J. W., Lynch, B., & Von Roenn, J. H. (2007). Management of intractable nausea and vomiting in patients at the end of life: "I was feeling nauseous all of the time . . . nothing was working". Jama, 298(10), 1196-1207. https://doi.org/10.1001/jama.298.10.1196
Woolery, M., Bisanz, A., Lyons, H. F., Gaido, L., Yenulevich, M., Fulton, S., & McMillan, S. C. (2008). Putting evidence into practice: evidence-based interventions for the prevention and management of constipation in patients with cancer. Clinical journal of oncology nursing, 12(2), 317-337. https://doi.org/10.1188/08.cjon.317-337
Wu, J. S., Wong, R., Johnston, M., Bezjak, A., & Whelan, T. (2003). Meta-analysis of dose-fractionation radiotherapy trials for the palliation of painful bone metastases. International journal of radiation oncology, biology, physics, 55(3), 594-605.
Yavuzsen, T., Davis, M. P., Walsh, D., LeGrand, S., & Lagman, R. (2005). Systematic review of the treatment of cancer-associated anorexia and weight loss. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 23(33), 8500-8511. https://doi.org/10.1200/jco.2005.01.8010










