Nasjonalt handlingsprogram med retningslinjer for diagnostikk behandling og oppfølging av blærekreft
Forkortelser
Sist faglig oppdatert: 21.09.2023
| Forkortelse | Forklaring |
|---|---|
µm | Mikrometer |
5FU | 5-fluorouracil |
ACTH | Adrenokortikotropt hormon |
ALP | Alkalisk fosfatase |
AUC | Atypiske urotelceller |
BCG | Bacille Calmette Guérin (Intravesikalt blæreinstillasjonsregime med BCG) |
BSC | Beste symptomlindrende behandling |
BTA | Blæretumorantigen |
C65 | Ondartet svulst i nyrebekken (neoplasma malignum pelvis renalis) |
C66 | Ondartet svulst i urinleder (neoplasma malignum ureteris) |
C67 | Ondartet svulst i urinblære (neoplasma malignum vesicae urinariae) (Desimal etter punktum angir lokalisasjon) |
C68 | Ondartet svulst i andre og uspesifiserte urinveisorganer (neoplasma malignum organorum aliorum urinariorum et non specificatorum) |
CI | Konfidensintervall |
CIS | Carcinoma in situ |
cM0-sykdom | Klinisk (c) stadium uten fjernspredning (M=0) |
cN1-3 (blærekreft) | Klinisk stadium med regional lymfeknutespredning (Tall angir utbredelse) |
CNS | Sentralnervesystemet |
Cr-EDTA | Glomulær filtrasjonsrate av EDTA |
CRP | C-reaktivt protein |
CT | Computertomografi |
CTV bladder | Union av hele urinblærens ytterkontur og CTVp |
CTV urethra | Hele prostata/urethra hos kvinner |
CTVp | GTVp + utvidelse av CTV |
DNP | Den Norske Patologiforening |
EAU | European Association of Urology |
ECOG | Pasientens funksjonsstatus |
EDTA | Ethylene Diamine Tetraacetic Acid |
e-GFR | Estimert glomerulær filtrasjonsrate |
EORTC | European Organization for Research and Treatment of Cancer |
ESUR | European Society of Urogenital Radiology |
Evidensgrad A | Kunnskap som bygger på systematiske oversikter og meta-analyser av randomiserte kontrollerte studier (nivå 1a) Kunnskap som bygger på minst én randomisert kontrollert studie (nivå 1b) |
Evidensgrad B | Kunnskap som bygger på minst én godt utformet kontrollert studie uten randomisering (nivå 2a) Kunnskap som bygger på minst én annen godt utformet kvasi-eksperimentell studie uten randomisering (nivå 2b) |
Evidensgrad C | Kunnskap som bygger på godt utformede ikke eksperimentelle beskrivende studier, som sammenlignende studier, korrelasjonsstudier og case-studier (nivå 3) |
Evidensgrad D | Kunnskap som bygger på rapporter eller oppfatninger fra eksperter, komiteer og/eller klinisk ekspertise hos respekterte autoriteter (nivå 4) |
FDG | Radioaktiv isotop til bruk ved PET (fluoro-2-deoksyglukose) |
FGFR3 | Fibroblast growth factor receptor 3 |
FSH | Follikkelstimulerende hormon |
FT4 | Fritt tyroksin |
G1-3 | Histologisk grad 1-3 (etter WHO 1972) |
GC | Gemcitabin |
G-CSF | Granulocytt-stimulerende faktor |
GFR | Glomerulær filtrasjonsrate |
GTVp | Synlig tumor på CT (evt MR) |
Gy | Gray (Måleenhet for stråledose) |
HAL | Hexylaminolevulinat |
HELFO | Helseøkonomiforvaltningen |
HG | Høygradig |
Hgb | Hemoglobin |
HGUC | Høygradig urotelialt carcinom |
HNPCC | Hereditær ikke-polypøs kolorektalcancer |
HR | Hazard ratio |
I.v. | Intravenøs |
ICD-10 | Den tiende revisjonen av den internasjonale statistiske klassifikasjonen av sykdommer og beslektede helseproblemer |
ICUD 2012 | International Consensus of Urological Diseases |
IMRT | Intensitetsmodulert stråleterapi |
ITV bladder | CTV_bladder + margin for varierende blærevolum inter- og intrafraksjonelt |
ITV urethra | CTV_urethra + 5 mm isotrop margin |
K | Kalium |
KI | Konfidensintervall |
kRT | Kjemoradioterapi |
LG | Lavgradig |
LGUN | Lavgradig urotelial neoplasi |
LH | Luteiniserende hormon |
LND | Lymfeknutedisseksjon |
LNU | Laparoskopisk nefroureterektomi |
LRC | Tradisjonell laparoskopi |
(c)M+ sykdom | Sykdom med fjernspredning (M=1) |
MDT | Multidisiplinært team |
MIBC | Muskelinfiltrerende blærekreft (Muscle Invasive Bladder Cancer) |
Mitomycin-C | Type cellegift |
MR | Magnetresonansundersøkelse |
mTOR | Proteinkinase som spiller en viktig rolle i forskjellige celleprosesser |
M-VAC | Metotrexat, vinblastin og adriamycin |
N | Antall målinger |
cN0-3 | Klinisk stadium regionale lymfeknuter |
Na | Natrium |
NAC | Neoadjuvant kjemoterapi |
NaCl | Natriumklorid |
NBI | Narrow Band Imaging |
NFKC | Norsk Forening for Klinisk Cytologi |
NMIBC | Ikke-muskelinfiltrerende blærekreft (Non Muscle Invasive Bladder Cancer) |
NMP 22 | Biomarkør for blærekreft |
Non-UTC | Ikke-urotelial cancer |
NPV | Negativ prediktiv verdi |
NU | Nefroureterektomi |
NUCG | Norsk Urologisk Cancergruppe |
NX (blærekreft) | Lymfeknuter kan ikke vurderes |
ORC | Åpen cystektomi |
OS | Total overlevelse (Overall Survival) |
p53 | Gen med økt kreftrisiko |
Pasient-ID | Pasientidentifikasjon |
PD-1 hemmer | Medikament som hemmer PD1-reseptor |
PDD | Fotodynamisk diagnostikk |
PD-L1 hemmer | Medikament som hemmer PDL1-reseptor |
PET/CT | Positronemisjonstomografi/ Computertomografi |
pH | Pondus Hydrogenii (Måleenhet for surhetsgrad i vannløsninger) |
PSA | Prostata spesifikt antigen |
pT | Patologisk tumorstadium |
PTV | Union av ITV_bladder og ITV_urethra + forslagsvis 5 mm isotrop margin |
PUNLMP | Papillær urotelial neoplasme av lavt malignitetspotensiale |
p-verdi | Verdi for angivelse av sannsynlighet for statistisk signifikant forskjell (<0,05 oppfattes normalt som ikke tilfeldig – dvs. signifikant forskjell) |
PV-kur | Kombinasjonscellegiftkur bestående av cisplatin og etoposid |
RARC | Robotassistert laparoskopisk cystektomi |
RC | Radikal cystektomi |
RHF | Regionalt helseforetak |
RTC | Klinisk randomisert studie |
Rtg us | Røntgenundersøkelse |
SCBC | Småcellet kreft i urinblære (Small Cell Bladder Cancer) |
SR | Senkningsreaksjon («senken») |
SWOG S8710 | South Western Oncology Group studie 8710 |
(c)T0-4b | Klinisk stadium for tumor (Tall angir utbredelse lokalt) |
Ta (blærekreft) | Ikke-invasivt papillært carcinom |
Tis (blærekreft) | Urotelialt carcinom in situ (flat «tumor») |
TX (blærekreft) | Primærtumor kan ikke vurderes |
TKI | Tyrosin kinase inhibitor |
TNM | Klassifikasjonssystem for maligne svulster (T=svulst/tumor, N=lymfeknute, M= metastase) |
TSH | Thyreoideastimulerende hormon |
T-stadium | Tumors lokale stadium |
TURB | Transuretral reseksjon av blære |
TURP | Transuretral reseksjon av prostata |
UL | Ultralyd |
UTC | Urotelialt carcinom (Urothelial Carcinoma) |
UTUC | Urotelial neoplasi i øvre urinveier ( Upper Urinary Tract Urothelial Carcinoma) |
UVI | Urinveisinfeksjon |
Vit. B12 | Vitamin B12 |
WHO-systemet | Graderingssystem for uroteliale carcinomer |
|
|
Endringer i handlingsprogrammet 2023
Sist faglig oppdatert: 21.09.2023
Nye anbefalinger
Kapittel Utredning av makroskopisk hematuri (Makrohematuri)
- Ved makroskopisk hematuri skal alltid pasienten undersøkes i pakkeforløp med:
- Kontrastforsterket CT abdomen
- Cystoskopi
- Makrohematuri utløst av antikoagulasjon skal utredes.
Kapittel Utredning for mikroskopisk hematuri (Mikrohematuri)
- Det er ikke indikasjon for CT eller annen billeddiagnostikk ved utredning.
Kapittel Billeddiagnostikk
- Kontrastforsterket CT abdomen anbefales før cystoskopi. Èn-fase CT er som regel tilstrekkelig.
- CT abdomen tatt i forbindelse med primærutredning er tilstrekkelig for abdominal staging.
- Ved abdominal staging, er det viktig at CT gjøres før TURB.
- CT thorax anbefales ved påvist MIBC og ved høy-gradig NMIBC.
- Det anbefales MR blære for staging under forutsetning av lokal forankring og kvalitetssikring.
Kapittel Utredning og klassifikasjon av UTUC (Upper Tract Urothelial Carcinoma)
- Èn-fase CT abdomen skal alltid gjennomføres.
Kapittel Hyperterm og Device-assisted instillasjon av kjemoterapi ved NMIBC
- Instillasjonsbehandling med hyperterm kjemoterapi (DAIC) kan tilbys ved BCG-svikt til pasienter som ikke er kandidater for radikal cystektomi, primært innenfor en klinisk studie.
Kapittel Strålebehandling / Trimodal behandling
- Neoadjuvant cisplatinbasert kjemoterapi kan vurderes gitt før trimodal behandling.
- Elektiv lymfeknutebestråling anbefales ikke, men kan vurderes til pasienter med svært høy risiko/N1-2.
Kapittel Systemisk behandling i kurativ hensikt ved blærekreft
- Neoadjuvant immunterapi ved muskelinfiltrerende blærekreft skal ikke benyttes utenom studier.
- Adjuvant behandling med nivolumab etter cystektomi er under metodevurdering.
Kapitel Palliativ systemisk behandling
- Ved kontraindikasjon for platinumbasert kjemoterapi er monoterapi med atezolizumab godkjent som palliativ systemisk behandling. Evidensgrad A.
Kapittel Palliativ strålebehandling
- Ved symptomer fra svulst lokalt i blæren som smerter, hematuri og vannlatingsbesvær anbefales hypofraksjonert strålebehandling.
Utgåtte anbefalinger
Kapittel Billeddiagnostikk
- Nødvendigheten av flerfase CT urinveier og CT thorax i hematuriutredning bør bestemmes etter utført cystoskopi, dersom det ikke allerede er gjort på forhånd.
- Ved mistanke om høygradige eller infiltrerende svulster skal CT urinveier flerfaseinklusive CT thorax tilstrebes før TURB.
- Lavgradige Ta-svulster krever ikke radiologisk utredning, men dette kan gjøres etter klinisk vurdering.
Når blæresvulsten er muskelinfiltrerende og radikalbehandling er indisert, anbefales følgende undersøkelser:
- CT thorax med iv. kontrast, som er førstevalg for påvisning av metastaser.
- MR urinblære har noe høyere spesifisitet for lokal stadieinndeling enn CT, og benyttes oftere enn før som supplement ved lokal staging, særlig etter TURB, men er foreløpig ikke rutineundersøkelse. Endelig betydning av MR er ikke helt fastsatt, men vil trolig bli klarere i løpet av de nærmeste år.
- PET/CT har foreløpig ingen plass i utredning av primærtumor, men kan i spesielle tilfeller avklare tumor/metastaser i avstand fra urinveiene.
- Urografi anbefales ikke i primærutredningen av nyre/urinveiskreft av noe slag.
Kapittel Utredning og klassifikasjon av UTUC (Upper Tract Urothelial Carcinoma)
- Flerfase CT urinveier skal gjennomføres.
Kapittel Strålebehandling / Trimodal behandling
- Strålebehandling anbefales ikke til operable pasienter med tumor i blæredivertikkel.
Kapittel Palliativ strålebehandling
- Ved symptomer fra svulst lokalt i blæren som smerter, hematuri og vannlatingsbesvær anbefales et hypofraksjonert regime med 7 Gy gitt annenhver dag til totalt 21 Gy eller 3.5 Gy x 10 over 14 dager.
Kapitler som er vesentlig endret
- Kapittel Utredning av makroskopisk hematuri (Makrohematuri)
- Kapittel Utredning for mikroskopisk hematuri (Mikrohematuri)
- Kapittel Klinisk undersøkelse, cystoskopi og billeddiagnostikk
- Kapittel Utredning og klassifikasjon av UTUC (Upper Tract Urothelial Carcinoma), Klinisk undersøkelse og billeddiagnostikk
- Kapittel Strålebehandling / Trimodal behandling
- Kapittel Urachuscancer (urachalt carcinom)
- Kapittel Behandling av urethracancer
- Kapittel Palliativ strålebehandling
Nye delkapitler og avsnitt som har kommet inn
- Kapittel Utredning og klassifikasjon av UTUC (Upper Tract Urothelial Carcinoma) - Epidemiologi og Risikofaktorer
- Kapittel Postoperativ skylling av blære
- Kapittel BCG-toksisitet
- Kapittel Hypterterm og Device-assisted instillasjon av kjemoterapi ved NMIBC
- Kapittel Cystektomi, Prosedyren – En Bloc Radikal Cystektomi
- Kapittel Neoadjuvant kjemoterapi ved lokalavansert sykdom (Induksjon)
- Kapittel Neoadjuvant immunterapi
- Kapittel Adjuvant immunterapi
- Kapittel Immunterapi
- Kapittel Antistoff-behandling
- Appendiks, Planlegging av kurativt rettet strålebehandling – Risikoorganer og Dosekrav og fraksjonering
- Appendiks, Kontrollrutiner for pasientar behandla kirurgisk for UTUC.
Kapitler som har fått ny undernummerering
- Kapittel Billeddiagnostikk
- Kapittel Adjuvant behandling etter TURB
- Kapittel Instillasjonsbehandling av NMIBC
- Kapittel Cystektomi
- Kapittel Palliativ systemisk behandling
Sammendrag av anbefalingene
Sist faglig oppdatert: 21.09.2023
3 RISIKOFAKTORER OG FOREBYGGING
3.2 Genetiske risikofaktorer
- Medlemmer av familier med Lynch syndrom, og samtidig familieanamnese på urotelkreft bør vurderes testet med urinstix og cytologi årlig fra 35 års alder.
- Pasienter med urotelkreft i de øvre urinveier som er under 60 år og har familiemedlemmer med kolorektalkreft eller endometriekreft bør henvises til genetisk veiledning mhp. utredning for HNPCC (Metcalfe et al., 2018; Mork et al., 2015; Rouprêt et al., 2015).
3.3 Tidligere kreftbehandling
- Pasienter som har fått strålebehandling mot bekkenet bør undersøkes med urinstix årlig fra fem år etter avsluttet strålebehandling og resten av livet.
- Alle pasienter med mikrohematuri etter strålebehandling mot bekken bør utredes, men utenfor pakkeforløp (jf. kap. 6.1.2).
6 DIAGNOSTISERING
6.1 Symptomer og indikasjon for utredning
Utredning av makroskopisk hematuri (Makrohematuri)
- Ved makroskopisk hematuri skal alltid pasienten undersøkes i pakkeforløp med:
- Kontrastforsterket CT abdomen
- Cystoskopi
- Makrohematuri utløst av antikoagulasjon skal utredes.
- Unntak for utredning:
- Klinisk cystitt hos kvinner <50 år, der hematuri opphører innen 4 uker etter antibakteriell behandling.
- Klinisk steinsykdom der stein bekreftes radiologisk og hematurien opphører etter steinbehandling.
- Blødning i direkte tilslutning til manipulering av urinveiene.
Utredning for mikroskopisk hematuri (Mikrohematuri)
- Mikroskopisk hematuri defineres som minimum 2+ på urinstix på 3 prøver med 1 mnd. mellomrom eller funn av > 2 røde blodceller pr. synsfelt ved stor forstørrelse i mikroskop.
- Det er ikke indikasjon for CT eller annen billeddiagnostikk ved utredning.
- Asymptomatiske pasienter uten risikofaktorer trenger ikke urologisk utredning med cystoskopi.
- Symptomatiske pasienter >50 år, og pasienter med risikofaktorer skal utredes utenfor pakkeforløp med cystoskopi
- Unntak for aldersgrense er gjennomført strålebehandling og genetisk disposisjon for UTC.
- Pasienter <50 år med urinveissymptomer og mikroskopisk hematuri skal utredes i henhold til symptomene.
6.2 Klinisk undersøkelse, cystoskopi og billeddiagnostikk
Cystoskopi
- Cystoskopi skal ved blæresvulst beskrive følgende forhold ved tumor og blære: Størrelse, lokalisasjon, utseende, antall, urinjet fra ostier og ev. slimhinneforandringer utenom selve svulsten.
Billeddiagnostikk
Anbefalinger for radiologisk utredning av makrohematuri og staging av blærecancer:
- Kontrastforsterket CT abdomen anbefales før cystoskopi. Èn-fase CT er som regel tilstrekkelig.
- CT abdomen tatt i forbindelse med primærutredning er tilstrekkelig for abdominal staging.
- Ved abdominal staging, er det viktig at CT gjøres før TURB.
- CT thorax anbefales ved påvist MIBC og ved høy-gradig NMIBC.
- Forsiktighet i forhold til kontrast bør utvises ved GFR < 30 ml/min.
- Det anbefales MR blære for staging under forutsetning av lokal forankring og kvalitetssikring.
Urinundersøkelser
Molekylære urintester
- Urincytologi er indisert ved følgende tilfeller:
- Makroskopisk hematuri uten positive funn ved cystoskopi og bildeundersøkelse av øvre urinveier.
- Usikkert cystoskopifunn.
- Negativ cystoskopi hos pasient med suspekte urinveissymptomer.
- Negativ cystoskopi og mulig svulst i øvre urinveier ved bildeundersøkelse.
- Det anbefales at Paris-systemet for rapportering av urincytologi brukes.
- Urincytologi skal gjentas hvis den viser atypiske uroteliale celler i første prøve.
- Molekylære tester kan ikke erstatte cytologi grunnet lavere spesifisitet.
6.3 Klassifikasjon og risikogruppering
- Det anbefales at WHO-systemet fra 2004 anvendes for klassifisering av svulstene.
- Det anbefales at urologen gjennomgår den histologiske diagnosen sammen med patologen i MDT, særlig ved høygradig tumor.
- Den histologiske bedømmingen bør gjøres etter etablert mal.
6.4 Utredning og klassifikasjon av UTUC (Upper Tract Urothelial Carcinoma)
- Cystoskopi skal alltid gjøres.
- Cytologi skal alltid utføres.
- Èn-fase CT abdomen skal alltid gjennomføres.
- Diagnostisk ureterorenoskopi utføres når indisert.
6.5 Utredning og klassifikasjon av cancer i urethra
- Urethracancer utredes med cystoskopi, cytologi og eventuelt biopsi.
- Lokal tumorutbredelse og regionale lymfeknuter utredes med multiparametrisk MR penis/bekken.
- CT benyttes for kartlegging av metastaser i abdomen og thorax.
7 INITIAL BEHANDLING OG BEHANDLING AV NMIBC
7.1 TURB
- TURB er primærprosedyre ved alle blæresvulster. Samtidig bimanuell palpasjon bør gjennomføres ved mistenkt muskelinfiltrerende svulst (kan erstattes med MR).
- Små svulster reseseres i ett stykke med noe underliggende blæreveggsmuskulatur.
- Store overfladiske og alle åpenbart muskelinfiltrerende svulster reseseres fraksjonert (inkludert blærevegg) og med tilsvarende fraksjonert biopsiforsendelse.
- Biopsi gjøres av unormalt utseende blæreslimhinne, og av posteriore urethra ved svulst eller mistanke om CIS i blærehals.
- Ved usikre cystoskopifunn bør poliklinisk biopsering vurderes.
- Poliklinisk koagulering av små lavgradige residiver kan redusere antall TURB.
7.2 Re-TURB
- Re-TURB ved T1 eller mistanke om inkomplett primær-TUR.
7.3 Visualiseringsteknikker ved endoskopi av blære
- Vurder bruk av PDD, evt NBI ved TURB for å øke deteksjonsrate av små svulster og CIS, samt ved positiv cytologi men negativt cystoskopifunn.
Instillasjon av kjemoterapeutikum i blære
- Enkeltinstillasjon med kjemoterapi etter TUR (operasjonsdøgnet) hos alle med tilsynelatende ikke-muskelinfiltrerende svulst. Tillegg av vedlikeholdsbehandling er nødvendig ved risikosvulster.
- Ved kjent høygradige residiver og ved hyppige residiver er der ikke vist effekt av enkeltinstillasjon av cytostatika.
- Blæreskylling med steril 0.9 % NaCl til neste dag kan alltid vurderes fremfor singel shot mitomycin.
Instillasjonsbehandling med BCG i blære
Hyperterm og Device-assisted instillasjon av kjemoterapi ved NMIBC
- Kjemoterapi kan anvendes primært ved lavgradig, residiverende svulstsykdom med lav progresjonsrisiko, samt ved intolerable bivirkninger av eller svikt av BCG-behandling.
- Kjemoterapi må gis i en pH-optimalisert løsning, og væskerestriksjon anbefales for å holde konsentrasjonen av cellegiften i blæren høyest mulig.
- BCG gir bedre langtidsbeskyttelse mot residiv enn kjemoterapi, og bare BCG har evne til å redusere progresjonsrisiko.
- Den optimale varigheten av vedlikeholdsbehandlingen etter induksjons-behandlingen er ikke fastslått, men for BCG anbefales minst 1 år og for kjemoterapi 6–12 måneder.
- BCG er generelt førstevalget, fremfor alt ved høygradige svulster, og CIS, som har både residiv- og progresjonsrisiko
- Instillasjonsbehandling med hyperterm kjemoterapi (DAIC) kan tilbys ved BCG-svikt til pasienter som ikke er kandidater for radikal cystektomi, primært innenfor en klinisk studie.
7.6 Radikal behandling av NMIBC
- Ved svikt av instillasjonsbehandling bør radikalbehandling (cystektomi) sterkt overveies.
8 BEHANDLING AV MIBC, LOKOREGIONAL SYKDOM OG UTUC
- Pasienter hvor det planlegges radikal cystektomi eller radikal strålebehandling skal vurderes i multidisiplinært team for å skreddersy optimal behandling inkludert neo¬adjuvant behandling.
8.1 Cystektomi
- Radikal cystektomi anbefales ved T2-T4a N0-NX M0, residiverende T1HG/G3 og CIS og variant histologi.
- Preoperativ strålebehandling anbefales ikke.
- Lymfeknutedisseksjon skal utføres og som et minimum med kranial begrensning ved ureters kryssing av iliacakarene.
- Urethra fjernes primært eller sekundært etter individuell vurdering.
- Nervesparende cystektomi kan utføres hos selekterte pasienter, mens prostatabevarende operasjon bør som hovedregel unngås.
- Robotassistert cystektomi har vist sammenlignbare resultater med åpen prosedyre, men bør utføres ved sentra med mye erfaring.
8.2 Urinavledning
Pasienter som skal gjennomgå cystektomi må informeres om mulige alternativer for avledning/rekonstruksjon, og det endelige valg av metode må baseres på en konsensus mellom pasient og operatør.
8.3 Strålebehandling / Trimodal behandling
- Kurativt rettet strålebehandling (stadium T2-T4a N0 M0) skal vurderes som alternativ til pasienter som er uegnet for radikal kirurgi og tilbys til pasienter som ikke ønsker operasjon.
- Operable pasienter bør informeres om trimodal behandling som alternativ til cystektomi. Evidensgrad: B
- Kurativt rettet strålebehandling skal så sant mulig gis i form av trimodal behandling. Evidensgrad: A
- Pasienter som er best egnet for trimodal behandling har god blærefunksjon, begrenset, unifokal tumor i urinblæren (cT2) uten tumorbetinget hydronefrose eller CIS.
- Neoadjuvant cisplatinbasert kjemoterapi kan vurderes gitt før trimodal behandling. Evidensgrad: B
- Elektiv lymfeknutebestråling anbefales ikke, men kan vurderes til pasienter med svært høy risiko/N1-2. Evidensgrad: D
- Pasienter som er kandidater for strålebehandling bør undersøkes for CIS.
8.4 Systemisk behandling i kurativ hensikt ved blærekreft
- Preoperativ neoadjuvant cisplatin-basert kombinasjonsbehandling skal vurderes ved muskelinfiltrerende blærekreft uten påvisbare metastaser, stadium T2-T4a N0/NX M0. Evidensgrad: A
- Doseintensivert M-VAC er foretrukket regime i kurativ setting grunnet best dokumenta¬sjon. Det foreligger ikke data fra randomiserte studier for at GC-regimet eller andre kombinasjoner er effektive i kurativ setting. Evidensgrad: A
- Pasienter som ikke har fått neoadjuvant kjemoterapi, og som etter cystektomi har pT3 eller høyere og/eller regionale lymfeknutemetastaser bør vurderes for adjuvant cisplatin-basert kombinasjonskjemoterapi. Evidensgrad: B
- Neoadjuvant immunterapi ved muskelinfiltrerende blærekreft skal ikke benyttes utenom studier.
- Adjuvant behandling med nivolumab etter cystektomi er under metodevurdering.
8.5 Behandling av ikke-urotelial cancer og differensierte former av UTC
- Rene varianter av non-UTC og sjeldne differensieringer av UTC skal MIBC behandles med direkte cystektomi.
- De vanligste differensierte UTC-varianter av MIBC bør vurderes for neoadjuvant kjemoterapi.
- BCG er dårlig dokumentert ved differensierte varianter av NMIBC, og bør bare tilbys informerte pasienter med plateepitel-, adenocarcinom- eller nested differensiering uten resttumor.
- Småcellede carcinomer metastaserer tidlig og behandles uavhengig av infiltrasjon med kjemoterapi som ved småcellet lungecarcinom.
- Sarkomer og andre mesenkymale tumores behandles iht. egne protokoller.
8.6 Behandling av UTUC
Kirurgisk behandling for UTUC
- Tilby endoskopisk behandling for lavgradig tumor. Evidensgrad: C
- Tilby endoskopisk behandling ved høygradig tumor og singel nyre eller redusert nyrefunksjon når det ikke reduserer kreftspesifikk overlevelse i forhold til radikal nefroureterektomi. Evidensgrad: C
- Tilby ureterreseksjon av distal ureter hos de med høygradig tumor hvis redusert nyrefunk¬sjon eller singel nyre. Evidensgrad: C
- Radikal nefroureterekotomi er gullstandard ved høygradig sykdom, multifokalitet, og store svulster. Evidensgrad: B
- Gjør lymfeknutetoalett ved T2-sykdom. Evidensgrad: C
- Postoperativ singelshot kjemoinnstillasjon reduserer tilbakefall i blæren. Evidensgrad: B
Kjemoterapi og strålebehandling for urotelial kreft i øvre urinveier
- Alle pasienter med nyoppdaget, avansert urotelial kreft i øvre urinveier (nyrebekken eller ureter) uten fjernmetastaser, bør diskuteres på multidisiplinært tverrfaglig møte med tanke på kjemoterapi.
- Adjuvant platinumbasert behandling anbefales til pasienter i god allmenntilstand (ECOG 0-1) med UTUC, stadium pT2-T4 pN0-2 og alle pN1-2. Det gis 4 kurer gemcitabin og cisplatin hver 3. uke ved GFR ≥ 50 eller gemcitabin og karboplatin ved GFR 30-49. Behandlingen bør starte innen 90 dager postoperativt. Evidensgrad: A
- Neoadjuvant behandling kan vurderes til pasienter i god allmenntilstand (ECOG 0-1) og god nyrefunksjon (GFR ≥ 60) med radiologisk avansert sykdom cT3-T4 og/eller cN1-2 og/eller hvor nefrektomi sannsynlig vil svekke nyrefunksjonen slik at adjuvant cisplatin ikke kan gis. I denne situasjonen anbefales 3 doseintensiverte MVAC-kurer eller 3 kurer gemcitabin og cisplatin hver 3. uke. Evidensgrad: C
- Kurativt rettet strålebehandling anbefales ikke.
- For pasienter med fjernmetastaser anbefales systemisk behandling etter samme retningslinjer som for metastaserende urinblærekreft.
8.7 Behandling av urethracancer
- Urethracancer er sjeldne og skal diskuteres i tverrfaglig møte.
- Primær urethracancer uten annen lokalisasjon av UTC hos kvinner kan behandles med lokal reseksjon, men forutsetter sikker fri margin.
- Primær urethracancer uten annen lokalisasjon av UTC hos menn kan behandles med urethrectomi, men forutsetter sikker fri margin.
- Ikke-infiltrerende UTC og CIS i prostatisk urethra kan behandles med TURP og BCG.
- Ved ductal eller stromal infiltrasjon eller manglende effekt av BCG på UTC i prostata skal pasienten tilbys cystoprostatektomi med utvidet lymfeknutedisseksjon.
- Ved lokalavansert urethracancer bør cisplatin-basert neoadjuvant behandling vurderes.
9 PALLIATIV BEHANDLING
9.2 Palliativ systemisk behandling
Førstelinjes behandling
- Cisplatinbasert kjemoterapi i kombinasjon med metotrexat, vinblastin og adriamycin (M VAC) eller gemcitabin (GC) har best dokumentert effekt som 1.-linjes behandling ved metastatisk sykdom, og egner seg primært for pasienter med tilstrekkelig nyrefunksjon (GFR>60 ml/min) og relativt god ECOG-status. GC foretrekkes fremfor M VAC grunnet mindre bivirkninger. Evidensgrad: A
- Ved kontraindikasjoner mot cisplatin grunnet nedsatt nyrefunksjon, nedsatt allmenntilstand eller organsvikt kan kombinasjonen karboplatin/gemcitabin være aktuell. Evidensgrad: A
- Kombinasjonsbehandling med avelumab som vedlikeholdsbehandling anbefales til pasienter som ikke har progrediert på 1.-linjes behandling med platinumbasert kjemoterapi etter 4-6 sykluser. Evidensgrad: A
- Ved kontraindikasjon for platinumbasert kjemoterapi er monoterapi med atezolizumab godkjent som palliativ systemisk behandling. Evidensgrad: A
Andre-, tredje- og fjerdelinjes behandling
- Det anbefales immunterapi hvis dette ikke er gitt som vedlikeholdsbehandling.
- Immunterapi med PD-1 hemmeren pembrolizumab har høyest evidens med dokumentert effekt på overlevelse og anbefales som 2.-linjes behandling. Evidensgrad: A
- PD-L1-hemmeren atezolizumab anbefales som 2.-linjes behandling fremfor kjemoterapi. Evidensgrad: A
- PD1-hemmeren nivolumab anbefales som 2.-linjes behandling fremfor kjemoterapi. Evidensgrad: B
- Det er ikke indikasjon for PD-L1 analyse før behandling med PD1- eller PD-L1 hemmer for behandling i 2. linje.
- Kjemoterapi kan vurderes til pasienter i god allmenntilstand, ECOG ≤ 1.
- Vinflunin kan tilbys som 2.-linjes behandling når immunterapi ikke kan gis. Evidensgrad: A
- Taxan som monoterapi, kan være et alternativ. Evidensgrad: C
- Hvis immunterapi er gitt som vedlikeholdsbehandling, kan pasienter med initial respons på GC og lang progresjonsfri periode (minimum 6 mnd), vurderes for ny behandlingssyklus med GC. Evidensgrad: D
- 3.-linjes behandling kan vurderes til pasienter som fortsatt er i god allmenntilstand (ECOG ≤ 1).
- Vinflunin eller taxan kan gis som 3.-linjes behandling etter manglende effekt av eller progresjon under immunterapi. Evidensgrad: D
- Hvis immunterapi er gitt som 2.-linjes behandling, kan pasienter med initial respons på GC og lang progresjonsfri periode før 2.-linjes behandling (minimum 6 mnd), vurderes for ny behandlingssyklus med GC. Evidensgrad: D
- 4.-linjes behandling kan vurderes til pasienter som fortsatt er i god allmenn¬tilstand (ECOG ≤ 1).
- Vinflunin eller taxan kan gis som 4.-linjes behandling etter manglende effekt av eller progresjon under GC gitt som rebehandling i 3. linje. Evidensgrad: D
9.3 Palliativ strålebehandling
- Ved symptomer fra svulst lokalt i blæren som smerter, hematuri og vannlatings¬besvær anbefales hypofraksjonert strålebehandling. Evidensgrad: A
9.4 Palliativ kirurgi
- Palliativ cystektomi kan gi økt levetid, særlig i kombinasjon med palliativ kjemoterapi, men kan også være indisert i forbindelse ved oppståtte eller forventede intraktable tumorrelaterte symptomer. Evidensgrad: D
10 OPPFØLGING
10.2 Oppfølging av ikke-muskelinfiltrerende blærekreft
- Første cystoskopikontroll skal gjøres 3 måneder etter TUR hos alle, uavhengig av risikogruppe.
- Ved negativ 3 måneders kontroll cystoskoperes pasienter med lav risiko for residiv og progresjon ved måned 12 etter TURB og kontrolleres deretter årlig med cystoskopi i min. 5 år.
- Pasienter med intermediær risiko cystoskoperes etter den initiale 3 måneders kontroll hver 6. måned i 2 år og deretter årlig i minst 10 år.
- Ved høy risiko for residiv og progresjon, men uten svulst ved 3 måneders kontrollen, cystoskoperes med følgende intervaller: hver 3. måned i 2 år, hver 6. måned til 5 år og deretter årlig livet ut.
- Billeddiagnostikk av øvre urinveier med kontrastforsterket CT hos pasienter med høyrisiko bør vurderes utført hvert 2. år.
10.3 Kontroll etter strålebehandling
- Kontroll etter radikal strålebehandling hos operable pasienter (som er kandidat for salvage cystektomi):
- Pasienten kontrolleres hos onkolog 6 uker etter avsluttet strålebehandling for å vurdere akutte bivirkninger. Deretter årlige kontroller hos onkolog for å vurdere kroniske bivirkninger.
- Alle pasienter kontrolleres hos urolog med cystoskopi etter 3 mnd.
- Intervaller: cystoskopi hver 3. mnd. første år, videre hver 6. mnd i 2 år, deretter årlig så lenge de ansees operable.
- CT-thorax (lavdose), kontrastforsterket CT urinveier hver 6. mnd. i 2 år, deretter årlig i 3 år. Etter dette etter individuell vurdering.
- Pasientene bør anbefales livslang, årlig kontroll av nyrefunksjon hos fastlege.
- Kontroll etter radikal strålebehandling, inoperable pasienter:
- Pasienten kontrolleres hos onkolog 6 uker etter avsluttet strålebehandling for å vurdere akutte bivirkninger. Deretter årlige kontroller hos onkolog for å vurdere kroniske bivirkninger.
- Pasienter som ikke er kandidat for salvage cystektomi trenger ikke oppfølging med cystoskopi.
- CT-thorax, abdomen og bekken hver 6. mnd. i 2 år, deretter årlig i 3 år hvis pasienten er kandidat for intensiv palliativ systemisk behandling.
- Pasientene bør anbefales livslang, årlig kontroll av nyrefunksjon hos fastlege.
- Kontroll etter palliativ strålebehandling:
- Hyppigheten av kontroller og spesielt indikasjon for cystoskopi er avhengig av pasientens symptomer og nødvendighet av palliativ TURB.
10.4 Kontroll etter radikal kirurgi
- Kontroll etter cystektomi er rettet både mot oppfølging av kreftsykdommen og mot sikring av en velfungerende urinavledning.
- Isotoprenografi anbefales som kontroll av avløpsforhold etter 6–12 uker. Evidensgrad: D
- Bruk av CT thorax (lavdose) og CT urinveier kontrastforsterket må inngå i kontrollopplegget for å avdekke avløpsforhold, metakron tumor og metastaser de første 5 år.
- Pasienter som tilbakeføres for oppfølging hos fastlege skal medfølge en beskrivelse av undersøkelser og områder som skal observeres.
- Pasienter som utvikler nyresvikt, makroskopisk hematuri, residiverende urinveisinfeksjoner eller symptomer suspekt på tilbakefall av sykdom bør vurderes for henvisning til urolog.
11 PATOLOGI
- Det anbefales at WHO-systemet fra 2004 anvendes for klassifisering av svulstene. Evidensgrad: D
- Det anbefales at urologen gjennomgår den histologiske bedømmelsen sammen med patologen, i alle fall hos de pasientene der dette vil kunne få avgjørende betydning for valg av behandling. Evidensgrad: D
Fastlegens arbeid og ansvar ved blære- og urotelkreft
Fastlegens arbeid og ansvar ved blære- og urotelkreft
Sist faglig oppdatert: 21.09.2023
Forekomst og risikofaktorer
Blærekreft er den hyppigste urologiske kreftformen etter prostatakreft, og den fjerde hyppigste kreftformen hos skandinaviske menn.
Fastlegene må kjenne til forekomsten av og risikofaktorer for kreft i urinblære og urinveier og bruke kunnskapsbaserte metoder i arbeidet med disse.
Røyking er den viktigste risikofaktoren for blære- og urotelkreft. Risikoøkningen er doseavhengig. Røykeslutt vil ha effekt, både som primærprofylaktisk og sekundærprofylaktisk tiltak. Det er grunn til å anta at befolkningens kjennskap til sammenhengen mellom røyking og blærekreft er mindre enn sammenhengen mellom røyking og lungekreft. Fastlegenes viktigste innsats i forebygging av blære- og urinveiskreft er å informere og å hjelpe pasientene til røykeslutt.
Økt risiko for blære- og urotelkreft har også:
- Pasienter som har jobbet med kjemikalier, spesielt aromatiske aminer
- Familier med Lynch syndrom (hereditær non-polypøs kolonkreft -HNPCC).
- Pasienter som tidligere har fått stråling mot kreft i bekkenregionen.
- Pasienter med 1. grads familiemedlemmer som har hatt blærekreft.
Anbefalinger:
- Leger bør motivere pasienter til røykeslutt og arbeide med røyke-avvenning etter anbefalte metoder. Her har fastlegene et særskilt ansvar.
- Medlemmer av familier med Lynch syndrom, og samtidig familieanamnese på urotelkreft bør vurderes testet med urinstix og cytologi årlig fra 35 års alder.
Se også
Helsedirektoratets retningslinje om røykeavvenning
Handlingsprogrammets kapittel om Risikofaktorer
(Røyking/genetisk risiko/tidligere strålebehandling mot
bekkenet/yrkeseksponering for kjemiske stoffer/kosthold)
Handlingsprogrammets kapittel om Epidemiologi
(forekomst/kjønn/alder/mortalitet og overlevelse)
Fastlegens rolle i diagnostikk og henvisning
Sist faglig oppdatert: 21.09.2023
Fastlegens primæroppgave er å fange opp symptomer som kan være forenlig med blære- og urotelkreft, samt å identifisere pasienter med særlig risiko for å utvikle sykdommen.
De viktigste hjelpemidlene i primærhelsetjenesten er anamnese, urinstix og CT-urinveier.
Ved hematuri må fastlegen vurdere mulige årsaker før henvisning til urolog eller til pakkeforløp.
Asymptomatisk mikroskopisk hematuri er ganske hyppig forekommende i den voksne normalbefolkningen uten at det foreligger sykdom og er sjelden et symptom på kreft. Ved tilfeldig funn av mikrohematuri er det kun risikopasienter som skal henvises. Pasienter med mikroskopisk hematuri uten andre symptomer eller risikofaktorer trenger ikke urologisk utredning.
Definisjon
Mikroskopisk hematuri defineres som positiv urinstix med minst 2+ på blod ved tre gjentatte prøver med én måneds mellomrom eller funn av > 2 røde blodceller pr. synsfelt ved stor forstørrelse i mikroskop.
Anbefalinger:
- Mikroskopisk hematuri defineres som minimum 2+ på urinstix på 3 prøver med 1 mnd. mellomrom eller funn av > 2 røde blodceller pr. synsfelt ved stor forstørrelse i mikroskop.
- Det er ikke indikasjon for CT eller annen billeddiagnostikk ved utredning.
- Asymptomatiske pasienter uten risikofaktorer trenger ikke urologisk utredning med cystoskopi.
- Symptomatiske pasienter >50 år, og pasienter med risikofaktorer skal utredes utenfor pakkeforløp med cystoskopi.
- Unntak for aldersgrense er gjennomført strålebehandling og genetisk disposisjon for UTC.
- Pasienter <50 år med urinveissymptomer og mikroskopisk hematuri skal utredes i henhold til symptomene.
Anbefalinger:
- Ved makroskopisk hematuri skal alltid pasienten undersøkes i pakkeforløp med:
- Kontrastforsterket CT abdomen
- Cystoskopi
- Makrohematuri utløst av antikoagulasjon skal utredes.
- Unntak for utredning:
- Klinisk cystitt hos kvinner <50 år, der hematuri opphører innen 4 uker etter antibakteriell behandling.
- Klinisk steinsykdom der stein bekreftes radiologisk og hematurien opphører etter steinbehandling.
Se også
Handlingsprogrammets kapittel om Utredning
Fastlegens rolle for pasienter som er i aktiv behandling for blærekreft
Sist faglig oppdatert: 21.09.2023
Fastlegens rolle i denne fasen vil variere med pasientens kliniske situasjon, livssituasjon og avstand til sykehus. Fastlegen bør være tilgjengelig for å bistå i oppfølging av behandlingen der det er hensiktsmessig for pasienten.
Problemstillinger/oppgaver fastlegen kan møte
- Smerter og komplikasjoner etter kirurgi
- Vannlatingsproblemer
- Bivirkninger av cytostatisk behandling
- Hematologisk overvåkning mellom cytostatikakurer
- Behov for å justere smerte- og kvalmebehandling
- Gi råd om ernæring
- Håndtere lokale stråleskader i huden
- Avdekke eventuell tromboembolisk sykdom
- Komplikasjoner etter behandling, avhengig av hvilken behandling pasienten har mottatt.
Fastlegen kan bidra i behandling av angst, depresjon, psykiske plager og søvnvansker. Fastlegen kan også bidra til ivaretagelse av berørte familiemedlemmer, herunder eventuelle barn, og samarbeide med hjemmetjeneste der dette er aktuelt. Det bør avklares individuelt om sykehuset eller fastlegen skal sørge for eventuell sykemelding i denne fasen. Pasientens beste bør være førende for valgt løsning.
Fastlegens rolle for pasienter som er i kontrollopplegg etter blærekreftbehandling
Sist faglig oppdatert: 21.09.2023
Handlingsprogrammet anbefaler at kontroll etter blære- og urotelkreft skjer i regi av spesialisthelsetjenesten. Der det er dokumentasjon for gevinst av kontroller, vil disse foregå på sykehus.
Etter radikal strålebehandling hos både operable og inoperable pasienter er det anbefalt livslang, årlig kontroll av nyrefunksjonen, og at dette skjer hos fastlegen.
Fastlegene vil med stor sannsynlighet ha kontakt med pasienten etter behandling for blære- eller urotelkreft, dels på grunn av henvendelser for annen sykdom, dels på grunn av plager og spørsmål som angår kreftsykdommen.
For pasienter som har gjennomgått behandling for blære- eller urotelkreft, er fastlegen viktig i medisinsk oppfølging, blant annet ved å
- Motivere/opprettholde motivasjon for røykestopp
- Behandle smerter etter kirurgi
- Behandle infeksjoner
- Følge opp senskader etter cytostatikabehandling, som nevropati, asteni og andre senplager
- Bistå i rehabilitering og oppmuntre til egentrening
- Bistå med eventuell sykemelding/friskmeldingsprosess
- Fange opp symptom på tilbakefall og/eller spredning og henvises til pakkeforløp
Komplikasjoner som fastlegen bør være oppmerksom på
- Hydronefrose på grunn av ureterstriktur, sykdomsresidiv i ureter eller retroperitonealt
- Urinveisinfeksjoner
- Steindannelse i de øvre urinveier
- Steindannelse i kutant kontinent reservoar
- Funksjonelle problemer, som stomiproblemer, inkontinens og urinretensjon
- Metabolske forstyrrelser
- Nedsatt nyrefunksjon
Anbefaling:
- Pasientene bør anbefales livslang, årlig kontroll av nyrefunksjon hos fastlege.
Se også
Se Handlingsprogrammets kapitler om oppfølging av blærekreft:
Kontroll av ikke-muskelinfiltrerende blærekreft etter TURB
Kontroll etter behandling av muskel-infiltrerende blærekreft
Fastlegens rolle for pasienter som har avsluttet oppfølging for blære- og urotelkreft på sykehus
Sist faglig oppdatert: 21.09.2023
Fem år etter radikalkirurgi kan oppfølging foretas av fastlege i samsvar med veiledning i et poliklinisk avslutningsnotat med konkrete anbefalinger. Pasienter med avanserte urinavledninger vil ofte fortsette oppfølging hos spesialist også etter 5 år.
Mange pasienter som har gjennomgått behandling for blære- og urotelkreft vil, i likhet med normalbefolkningen, ha mikroskopisk hematuri. Det er ikke hensiktsmessig å rutinemessig undersøke urinprøve med urinstix ved symptomfrihet hos denne gruppen.
Årlig kontroll hos fastlege bør omfatte følgende prøver:
Blodprøver: Hemoglobin, natrium, kalium, kreatinin, GFR, Vitamin B12.
Urinprøver: Bakteriologisk undersøkelse og pH i blod (kapillær syre-base eller total Co2) ved blæresubstitutt.
Fastlegen må være oppmerksom på symptomer på residiv.
Pasienten skal re-henvises ved:
- makroskopisk hematuri
- smerter i bekkenet
- vannlatingsendringer
- gjentatte urinveisinfeksjoner hos pasienter med urinavledning
- synkende nyrefunksjon med mistanke om hydronefrose/avløpshinder
Pasienter med urinavledning som får gjentatte urinveisinfeksjoner, har ofte avløpshindring/anastomosestriktur eller resturin ved ortotop blære. Disse pasientene skal henvises til urolog og vil ofte gjennomgå bl.a. diureserenografi for kontroll av avløp.
Noen blære- og urotelkreftpasienter går ut av aktiv behandling og kontroll på sykehus fordi sykdommen har kommet over i palliativ fase. Se eget kapittel.
Anbefalinger:
- Pasienter som tilbakeføres for oppfølging hos fastlege skal medfølge en beskrivelse av undersøkelser og områder som skal observeres.
- Pasienten skal informeres om at årlig kontroll bør avtales hos fastlegen.
- Pasienter som utvikler nyresvikt, makroskopisk hematuri, residiverende urinveisinfeksjoner eller symptomer suspekt på tilbakefall av sykdom bør vurderes for henvisning til urolog.
Fastlegens arbeid med palliasjon og omsorg ved livets slutt for blærekreftpasienter
Sist faglig oppdatert: 21.09.2023
Enkelte pasienter med muskelinvasiv blærekreft kan ikke gjennomgå radikal kirurgisk behandling, enten fordi sykdommen er for avansert eller på grunn av pasientens høye alder, komorbiditet eller andre forhold. Også et betydelig antall av pasientene som har gjennomgått radikalkirurgi, vil få lokalt, regionalt eller metastatisk tilbakefall av kreftsykdommen. Disse pasientene vil ha ulike plager, avhengig av hvor tilbakefallet er lokalisert.
Ureterobstruksjon, fisteldannelse, lokale smerter og smerter fra metastaser vil være symptomer som kan oppstå hos pasienter i palliativ fase med blærekreft.
Palliasjon og omsorg ved livets slutt for blærekreftpasienter må tilpasses den enkeltes kliniske situasjon, livsfase og det som er den største utfordringen. Disse pasientene krever ofte tett oppfølging av fastlege i samarbeid med kommunal pleie- og omsorgstjeneste.
Fastlegens arbeid og ansvar ved blære- og urotelkreft
Sist faglig oppdatert: 21.09.2023
Forekomst og risikofaktorer
Blærekreft er den hyppigste urologiske kreftformen etter prostatakreft, og den fjerde hyppigste kreftformen hos skandinaviske menn.
Fastlegene må kjenne til forekomsten av og risikofaktorer for kreft i urinblære og urinveier og bruke kunnskapsbaserte metoder i arbeidet med disse.
Røyking er den viktigste risikofaktoren for blære- og urotelkreft. Risikoøkningen er doseavhengig. Røykeslutt vil ha effekt, både som primærprofylaktisk og sekundærprofylaktisk tiltak. Det er grunn til å anta at befolkningens kjennskap til sammenhengen mellom røyking og blærekreft er mindre enn sammenhengen mellom røyking og lungekreft. Fastlegenes viktigste innsats i forebygging av blære- og urinveiskreft er å informere og å hjelpe pasientene til røykeslutt.
Økt risiko for blære- og urotelkreft har også:
- Pasienter som har jobbet med kjemikalier, spesielt aromatiske aminer
- Familier med Lynch syndrom (hereditær non-polypøs kolonkreft -HNPCC).
- Pasienter som tidligere har fått stråling mot kreft i bekkenregionen.
- Pasienter med 1. grads familiemedlemmer som har hatt blærekreft.
Anbefalinger:
- Leger bør motivere pasienter til røykeslutt og arbeide med røyke-avvenning etter anbefalte metoder. Her har fastlegene et særskilt ansvar.
- Medlemmer av familier med Lynch syndrom, og samtidig familieanamnese på urotelkreft bør vurderes testet med urinstix og cytologi årlig fra 35 års alder.
Se også
Helsedirektoratets retningslinje om røykeavvenning
Handlingsprogrammets kapittel om Risikofaktorer
(Røyking/genetisk risiko/tidligere strålebehandling mot
bekkenet/yrkeseksponering for kjemiske stoffer/kosthold)
Handlingsprogrammets kapittel om Epidemiologi
(forekomst/kjønn/alder/mortalitet og overlevelse)
Fastlegens rolle i diagnostikk og henvisning
Sist faglig oppdatert: 21.09.2023
Fastlegens primæroppgave er å fange opp symptomer som kan være forenlig med blære- og urotelkreft, samt å identifisere pasienter med særlig risiko for å utvikle sykdommen.
De viktigste hjelpemidlene i primærhelsetjenesten er anamnese, urinstix og CT-urinveier.
Ved hematuri må fastlegen vurdere mulige årsaker før henvisning til urolog eller til pakkeforløp.
Asymptomatisk mikroskopisk hematuri er ganske hyppig forekommende i den voksne normalbefolkningen uten at det foreligger sykdom og er sjelden et symptom på kreft. Ved tilfeldig funn av mikrohematuri er det kun risikopasienter som skal henvises. Pasienter med mikroskopisk hematuri uten andre symptomer eller risikofaktorer trenger ikke urologisk utredning.
Definisjon
Mikroskopisk hematuri defineres som positiv urinstix med minst 2+ på blod ved tre gjentatte prøver med én måneds mellomrom eller funn av > 2 røde blodceller pr. synsfelt ved stor forstørrelse i mikroskop.
Anbefalinger:
- Mikroskopisk hematuri defineres som minimum 2+ på urinstix på 3 prøver med 1 mnd. mellomrom eller funn av > 2 røde blodceller pr. synsfelt ved stor forstørrelse i mikroskop.
- Det er ikke indikasjon for CT eller annen billeddiagnostikk ved utredning.
- Asymptomatiske pasienter uten risikofaktorer trenger ikke urologisk utredning med cystoskopi.
- Symptomatiske pasienter >50 år, og pasienter med risikofaktorer skal utredes utenfor pakkeforløp med cystoskopi.
- Unntak for aldersgrense er gjennomført strålebehandling og genetisk disposisjon for UTC.
- Pasienter <50 år med urinveissymptomer og mikroskopisk hematuri skal utredes i henhold til symptomene.
Anbefalinger:
- Ved makroskopisk hematuri skal alltid pasienten undersøkes i pakkeforløp med:
- Kontrastforsterket CT abdomen
- Cystoskopi
- Makrohematuri utløst av antikoagulasjon skal utredes.
- Unntak for utredning:
- Klinisk cystitt hos kvinner <50 år, der hematuri opphører innen 4 uker etter antibakteriell behandling.
- Klinisk steinsykdom der stein bekreftes radiologisk og hematurien opphører etter steinbehandling.
Se også
Handlingsprogrammets kapittel om Utredning
Fastlegens rolle for pasienter som er i aktiv behandling for blærekreft
Sist faglig oppdatert: 21.09.2023
Fastlegens rolle i denne fasen vil variere med pasientens kliniske situasjon, livssituasjon og avstand til sykehus. Fastlegen bør være tilgjengelig for å bistå i oppfølging av behandlingen der det er hensiktsmessig for pasienten.
Problemstillinger/oppgaver fastlegen kan møte
- Smerter og komplikasjoner etter kirurgi
- Vannlatingsproblemer
- Bivirkninger av cytostatisk behandling
- Hematologisk overvåkning mellom cytostatikakurer
- Behov for å justere smerte- og kvalmebehandling
- Gi råd om ernæring
- Håndtere lokale stråleskader i huden
- Avdekke eventuell tromboembolisk sykdom
- Komplikasjoner etter behandling, avhengig av hvilken behandling pasienten har mottatt.
Fastlegen kan bidra i behandling av angst, depresjon, psykiske plager og søvnvansker. Fastlegen kan også bidra til ivaretagelse av berørte familiemedlemmer, herunder eventuelle barn, og samarbeide med hjemmetjeneste der dette er aktuelt. Det bør avklares individuelt om sykehuset eller fastlegen skal sørge for eventuell sykemelding i denne fasen. Pasientens beste bør være førende for valgt løsning.
Fastlegens rolle for pasienter som er i kontrollopplegg etter blærekreftbehandling
Sist faglig oppdatert: 21.09.2023
Handlingsprogrammet anbefaler at kontroll etter blære- og urotelkreft skjer i regi av spesialisthelsetjenesten. Der det er dokumentasjon for gevinst av kontroller, vil disse foregå på sykehus.
Etter radikal strålebehandling hos både operable og inoperable pasienter er det anbefalt livslang, årlig kontroll av nyrefunksjonen, og at dette skjer hos fastlegen.
Fastlegene vil med stor sannsynlighet ha kontakt med pasienten etter behandling for blære- eller urotelkreft, dels på grunn av henvendelser for annen sykdom, dels på grunn av plager og spørsmål som angår kreftsykdommen.
For pasienter som har gjennomgått behandling for blære- eller urotelkreft, er fastlegen viktig i medisinsk oppfølging, blant annet ved å
- Motivere/opprettholde motivasjon for røykestopp
- Behandle smerter etter kirurgi
- Behandle infeksjoner
- Følge opp senskader etter cytostatikabehandling, som nevropati, asteni og andre senplager
- Bistå i rehabilitering og oppmuntre til egentrening
- Bistå med eventuell sykemelding/friskmeldingsprosess
- Fange opp symptom på tilbakefall og/eller spredning og henvises til pakkeforløp
Komplikasjoner som fastlegen bør være oppmerksom på
- Hydronefrose på grunn av ureterstriktur, sykdomsresidiv i ureter eller retroperitonealt
- Urinveisinfeksjoner
- Steindannelse i de øvre urinveier
- Steindannelse i kutant kontinent reservoar
- Funksjonelle problemer, som stomiproblemer, inkontinens og urinretensjon
- Metabolske forstyrrelser
- Nedsatt nyrefunksjon
Anbefaling:
- Pasientene bør anbefales livslang, årlig kontroll av nyrefunksjon hos fastlege.
Se også
Se Handlingsprogrammets kapitler om oppfølging av blærekreft:
Kontroll av ikke-muskelinfiltrerende blærekreft etter TURB
Kontroll etter behandling av muskel-infiltrerende blærekreft
Fastlegens rolle for pasienter som har avsluttet oppfølging for blære- og urotelkreft på sykehus
Sist faglig oppdatert: 21.09.2023
Fem år etter radikalkirurgi kan oppfølging foretas av fastlege i samsvar med veiledning i et poliklinisk avslutningsnotat med konkrete anbefalinger. Pasienter med avanserte urinavledninger vil ofte fortsette oppfølging hos spesialist også etter 5 år.
Mange pasienter som har gjennomgått behandling for blære- og urotelkreft vil, i likhet med normalbefolkningen, ha mikroskopisk hematuri. Det er ikke hensiktsmessig å rutinemessig undersøke urinprøve med urinstix ved symptomfrihet hos denne gruppen.
Årlig kontroll hos fastlege bør omfatte følgende prøver:
Blodprøver: Hemoglobin, natrium, kalium, kreatinin, GFR, Vitamin B12.
Urinprøver: Bakteriologisk undersøkelse og pH i blod (kapillær syre-base eller total Co2) ved blæresubstitutt.
Fastlegen må være oppmerksom på symptomer på residiv.
Pasienten skal re-henvises ved:
- makroskopisk hematuri
- smerter i bekkenet
- vannlatingsendringer
- gjentatte urinveisinfeksjoner hos pasienter med urinavledning
- synkende nyrefunksjon med mistanke om hydronefrose/avløpshinder
Pasienter med urinavledning som får gjentatte urinveisinfeksjoner, har ofte avløpshindring/anastomosestriktur eller resturin ved ortotop blære. Disse pasientene skal henvises til urolog og vil ofte gjennomgå bl.a. diureserenografi for kontroll av avløp.
Noen blære- og urotelkreftpasienter går ut av aktiv behandling og kontroll på sykehus fordi sykdommen har kommet over i palliativ fase. Se eget kapittel.
Anbefalinger:
- Pasienter som tilbakeføres for oppfølging hos fastlege skal medfølge en beskrivelse av undersøkelser og områder som skal observeres.
- Pasienten skal informeres om at årlig kontroll bør avtales hos fastlegen.
- Pasienter som utvikler nyresvikt, makroskopisk hematuri, residiverende urinveisinfeksjoner eller symptomer suspekt på tilbakefall av sykdom bør vurderes for henvisning til urolog.
Fastlegens arbeid med palliasjon og omsorg ved livets slutt for blærekreftpasienter
Sist faglig oppdatert: 21.09.2023
Enkelte pasienter med muskelinvasiv blærekreft kan ikke gjennomgå radikal kirurgisk behandling, enten fordi sykdommen er for avansert eller på grunn av pasientens høye alder, komorbiditet eller andre forhold. Også et betydelig antall av pasientene som har gjennomgått radikalkirurgi, vil få lokalt, regionalt eller metastatisk tilbakefall av kreftsykdommen. Disse pasientene vil ha ulike plager, avhengig av hvor tilbakefallet er lokalisert.
Ureterobstruksjon, fisteldannelse, lokale smerter og smerter fra metastaser vil være symptomer som kan oppstå hos pasienter i palliativ fase med blærekreft.
Palliasjon og omsorg ved livets slutt for blærekreftpasienter må tilpasses den enkeltes kliniske situasjon, livsfase og det som er den største utfordringen. Disse pasientene krever ofte tett oppfølging av fastlege i samarbeid med kommunal pleie- og omsorgstjeneste.
Innledning
Sist faglig oppdatert: 21.09.2023
Blærekreft er den hyppigste urologiske kreftform etter prostatacancer, samt den fjerde hyppigste kreftformen hos skandinaviske menn. For majoriteten av pasientene infiltrerer ikke tilstanden dypere vegglag av blæren og er en sykdom med gode muligheter for helbredelse og liten risiko for død. Lavgradig blærekreft er likevel en tilstand som kan gi stadig nye svulster og pasientene må derfor kontrolleres livet ut. For en mindre andel av pasientene er svulstene høygradige og infiltrerer dypere enn slimhinnen og blærekreft er da en alvorlig sykdom som kan bety begrensede leveutsikter. Mange av disse pasientene gjennomgår en ressurskrevende radikalbehandling med konsekvenser for vannlatingsfunksjonen og livskvaliteten. Behandlingen av nye svulster og kontrollopplegget kan være en belastning for pasientene og krever mye ressurser i den urologiske spesialisthelsetjenesten.
Alle disse forholdene gjør blærekreft til en svært kostbar sykdom for helsevesenet, særlig fordi tilstanden må håndteres i spesialisthelsetjenesten. Fordi behandling og oppfølging av denne forholdsvis store pasientpopulasjonen er så differensiert og stadie-avhengig, er det behov for nasjonale retningslinjer for utredning, behandling og oppfølging av sykdommen. De norske nasjonale retningslinjene bygger i stor grad på EAU’s (European Association of Urology), European Guidelines, men er forkortet og tilpasset norske forhold av en gruppe spesialister oppnevnt av Helsedirektoratet.
Utviklingen i faget er rivende, og det kommer kontinuerlig ny kunnskap som vil kunne endre retningslinjene. Noen vil derfor savne omtale av nyere studier som vil kunne ha konsekvenser for praksis. Handlingsprogramgruppen legger opp til årlige hovedoppdateringer, mens Helsedirektoratet i mellomtiden legger inn nye medikamenter etter hvert som de godkjennes av Beslutningsforum for nye metoder.
2023-Revisjonen kommer sent av flere grunner, men endringene fra 2021 er også relativt små. Dog har det kommet inn noen nye delkapitler og avsnitt. Gruppen er også i ferd med å ta opp nye tema for neste revisjon. Vi håper likevel årets utgave kommer til nytte for alle som jobber med denne store pasientgruppen, og er takknemlig for tilbakemeldinger om innhold og nye emner som bør dekkes.
Epidemiologi
Forekomst
Sist faglig oppdatert: 21.09.2023
1852 personer ble rammet at kreft i blære og urinveier i Norge i 2020. Dette omfatter hovedsakelig blærekreft (C67), men også kreft i nyrebekken (C65), urinleder (C66) og andre og uspesifiserte urinveisorganer (C68), som også omfatter urethra. Antall pasienter med de ulike diagnosene er vist i tabell 1.
| Totalt (C65-68) | Nyrebekken | Urinleder | Blære | Uspes. urinveier |
|---|---|---|---|---|---|
Antall (%) pasienter i 2020 | 1852 (100 %) | 128 (7 %) | 69 (4 %) | 1626 (88 %) | 29 (2 %) |
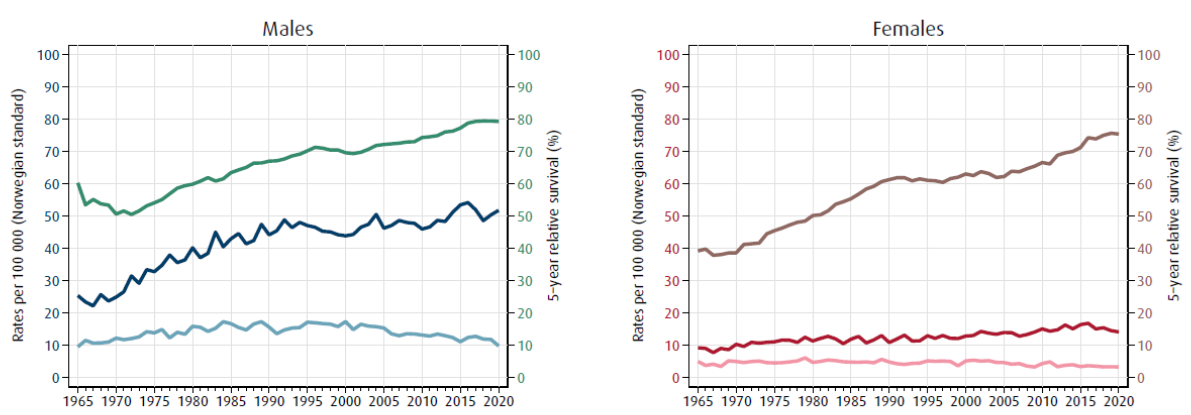
Frem til ca 2014 har kvinner hatt en jevn økning i forekomst av kreft i blære og urinveiene de siste 50 årene, mens hos menn var økningen i forekomst mest utpreget frem til rundt 1990 og stabilt deretter (Larsen, 2021). I de siste to femårsperiodene (2011-15 og 2016-20) har det vært høyere forekomst av kreft i blære og urinveiene (C65-C68) i Norge for både menn og kvinner enn i alle femårsperioder før det (se også figur 1).
Kjønn
Kreft i blære og urinveier var i 2020 den 5. vanligste kreftformen i Norge hos menn, etter prostata-, lunge- og tykktarmskreft og non-melanoma hudkreft. I 2020 ble 1410 menn diagnostisert med kreft i blære og urinveier, noe som til sammen utgjør 7.0 % av alle kreftformer hos menn. Kvinner blir rammet av denne sykdommen langt sjeldnere enn menn (M: F ratio 3.4 basert på tall fra 2016–20). 442 kvinner fikk samme diagnose i 2020. Dette utgjør 2.3% av alle kreftformer hos kvinner. Fordelingen mellom menn og kvinner varierer mellom de ulike lokalisasjonene i blære/urinveier.
Alder
For menn var median alder ved diagnose 73 år for en pasient diagnostisert i 2020 med kreft i blære eller urinveier. For menn var median alder for å få en blærekreftdiagnose (C67) 73 år, for kreft i nyrebekken (C65) 75 år og henholdsvis 75 år for kreft i urinleder (C66) og 73 år for kreft i andre og uspesifiserte urinveisorganer (C68). Den respektive aldersfordelingen for kvinner var median alder 76 for kreft i nyrebekken (C65), 74 for pasienter med kreft i andre og uspesifiserte urinveisorganer, 76 for kreft i urinleder (C66) og 73 for blærekreft (C67).
Mortalitet og overlevelse
Sist faglig oppdatert: 21.09.2023
Mortalitet
I 2020 døde 349 pasienter av kreft i blære og urinveier (C65–68) i Norge, noe som utgjør 3.2 % av alle dødsfall forårsaket av kreft i Norge. 241 (69 %) av dem var menn. Mortalitetsratene for kreft i blære og urinveier har vært avtagende de siste 20 årene for både menn og kvinner.
Overlevelse
Per 31.12.2020 var det 15 950 personer (C65: 751; C66: 402; C67: 14676; C68: 149) i live som på et eller annet tidspunkt i livet hadde fått en kreftdiagnose i blære eller urinveier, en fjerdedel av dem fikk diagnosen for mer enn 10 år siden. Siden mange blærekreftpasienter blir diagnostisert med ikke-infiltrerende tumorer hvor dødeligheten er lav, betyr det at det er mange kreftoverlevere med denne kreftformen. Totalt sett har det vært en jevn økning i overlevelsen av kreft i blære og urinveier i Norge de siste 50 årene. 5 års relativ overlevelse er henholdsvis 77.2 % (menn) og 71.2 % (kvinner) for pasienter diagnostisert i 2011–2015. Det er ingen forbedring i relativ overlevelse for pasienter med spredning (Andreassen et al., 2016).
Risikofaktorer og forebygging
Miljø og livsstilsfaktorer
Sist faglig oppdatert: 21.09.2023
Utvikling av urotelkreft er assosiert med mange kjente risikofaktorer (tabell 2). Røyking, både aktiv og passiv, disponerer og doseavhengigheten er veletablert (Rink et al., 2015). I studier fra USA og England er henholdsvis 50 % (USA) og 40 % (England) av blærekrefttilfellene røykerelatert (Freedman et al., 2011; Parkin et al., 2011). Listen av kjemikalier som øker risiko for urotelkreft inneholder diverse aromatisk aminer, benzenderivater og fargestoffer i stål som benyttes i aluminium-, olje-, verksted- og kjemikalieindustri (Brown et al., 2012). På verdensbasis kan ca. 25 % av urotelkrefttilfellene relateres til arbeidseksponering (Pashos et al., 2002). Kronisk inflammasjon i urotel, om det er sekundært til parasitter (bilharzia) eller kateter, øker også senere risiko for blærekreftutvikling.
Genetiske risikofaktorer
Sist faglig oppdatert: 21.09.2023
Risiko for utvikling av blærekreft er dobbelt så høy for førstegrads familiemedlemmer til blærekreftpasienter. Genetisk disposisjon påvirker det enkelte menneskes eksponering og følsomhet for og evne til nedbryting av karsinogener, og dermed risikoen for å utvikle blærekreft (Garcia-Closas et al., 2005; Grotenhuis et al., 2010; Kiemeney et al., 2010; Rothman et al., 2010).
Risiko for utvikling av blærekreft er økt i familier med Lynch syndrom (hereditær non-polypøs kolonkreft (HNPCC)). Flere kjente genmutasjoner gir opphav til HNPCC. Menn med MSH2 og MLH1 mutasjoner har en økt risiko (opptil 28 %) for utvikling av urotelkreft i de øvre urinveier. Det er enighet om at det er økt livstidsrisiko for urotelkreft i de øvre urinveier hos pasienter med HNPCC, og at de pasienter med MSH2 mutasjon i tillegg har økt risiko for utvikling av blærekreft (Barrow et al., 2013; van der Post et al., 2010). Der finnes ingen optimale screeningsmetoder for urotelkreft i de øvre urinveier, og CT anbefales ikke pga. stråledose. En senere internasjonal konsensus-rapport for oppfølgning av familier med Lynch syndrom sier at ved positiv familieanamnese på urotelkreft og MSH2 mutasjon, bør familiemedlemmer screenes med årlige urinstix og urincytologi fra 35 års alder (Bernstein et al., 2013; Vasen et al., 2007). Basert på studie av 95 Lynchfamilier anbefaler Post et al. screening med årlige urinstix av alle Lynch syndrom-familier med MSH2 mutasjon, selv om der ikke er familieanamnese på urotelkreft. Indikasjon for cystoskopi er kun ved positiv urinstix, positiv cytologi eller irritative vannlatingssymptomer.
Pasienter med urotelkreft i de øvre urinveier som er under 60 års alder og har familiemedlemmer med kolorektalkreft eller endometriekreft bør henvises til genetisk veiledning mhp. utredning for HNPCC (Metcalfe et al., 2018; Mork et al., 2015; Rouprêt et al., 2015).
Anbefalinger:
- Medlemmer av familier med Lynch syndrom, og samtidig familieanamnese på urotelkreft bør vurderes testet med urinstix og cytologi årlig fra 35 års alder.
- Pasienter med urotelkreft i de øvre urinveier som er under 60 år og har familiemedlemmer med kolorektalkreft eller endometriekreft bør henvises til genetisk veiledning mhp. utredning for HNPCC (Metcalfe et al., 2018; Mork et al., 2015; Rouprêt et al., 2015).
Tidligere kreftbehandling
Sist faglig oppdatert: 21.09.2023
Risiko for utvikling av urotelkreft sekundært til tidligere kreftbehandling er økt, men i hvilken grad er uavklart. Strålebehandling for prostatakreft synes å øke risiko for blærekreft og kolorektalkreft (Wallis et al., 2016). Insidensen av sekundær kreftutvikling har tidligere trolig vært underestimert grunnet relativ kort levetid for kreftpasienter. Med lengre levetid for kreftpasienter anslås nå at sekundær kreftutvikling kan bli så høyt som 1 % per år, dvs. 20 % etter 20 år. Pasienter som er tidligere strålebehandlet i bekkenregionen bør derfor utredes ved asymptomatisk hematuri uansett alder, men utenfor pakkeforløp. Videre bør pasienter som tidligere er strålebehandlet i bekkenregionen undersøkes med urinstix årlig fra og med 5 år etter avsluttet stråleterapi (Bartkowiak et al., 2012; Tubiana, 2009). Det finnes ingen publisert data om risiko for utvikling av urotelkreft sekundært til gjennomgått kjemoterapi.
Anbefalinger:
- Pasienter som har fått strålebehandling mot bekkenet bør undersøkes med urinstix årlig fra fem år etter avsluttet strålebehandling og resten av livet.
- Alle pasienter med mikrohematuri etter strålebehandling mot bekken bør utredes, men utenfor pakkeforløp (jf. kap. Utredning for mikroskopisk hematuri (Mikrohematuri)).
Røyking |
Yrkesmessig eller annen vedvarende eksponering for kjemikalier |
Tidligere kreftbehandling |
Kronisk urinveisinfeksjon/ bruk av kateter |
Lynch syndrom |
Førstegrads slektninger med blærekreft før 60 år |
(Mannlig kjønn) |
Forebygging
Sist faglig oppdatert: 21.09.2023
Ca. 1 av 40 personer født i dag vil utvikle blærekreft senere i livet. Per i dag skyldes 30–50 % av blærekrefttilfellene røyking, og ca. 25 % yrkesrelatert eksponering av kreftfremkallende stoffer (Colt et al., 2014; Rota et al., 2014). I tillegg til å begrense eksponering kan man forbygge kreftutvikling med livsstilsendringer som røykestopp (Crivelli et al., 2014; Lammers et al., 2011; Rink et al., 2013; Serretta et al., 2013; Sosnowski et al., 2014). Kosthold har også stor betydning for utvikling av kreftsykdommer og for immunsystemets kapasitet til å bekjempe kreftutvikling (Lamm et al., 2001). Kost med høyt innhold av N-nitrosostoffer, spesielt dibutylnitrosamine i kjøttprodukter, øker risikoen (Catsburg et al., 2014), mens diett med innhold av isothiocyanater og ezrin kan forbygge utvikling av blærekreft (Andersson et al., 2014; Bhattacharya et al., 2013; Bricker et al., 2014; Wennersten et al., 2014). Forbyggende tiltak bør prioriteres på nasjonalt plan med forbedring av arbeidsmiljø, tilgang på sunn mat, samt livsstilsundervisning under skolegang og i media.
Pakkeforløp for kreft
Sist faglig oppdatert: 21.09.2023
Fra 1. mai 2015 ble Pakkeforløp for blærekreft innført i helsetjenesten. Den 1. september 2016 kom alle pakkeforløpene i reviderte, oppdaterte utgaver.
Om Pakkeforløp for kreft
Sist faglig oppdatert: 21.09.2023
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er et standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Les mer om Pakkeforløp for blærekreft.
Det er egne Diagnoseveiledere for fastleger for inngang til pakkeforløp for kreft.
Pakkeforløp hjem for pasienter med kreft
Sist faglig oppdatert: 21.09.2023
Pakkeforløp hjem for pasienter med kreft skal bidra til å sikre god struktur og logistikk i helsetjenesten, samt sikre trygghet og forutsigbarhet for personer som lever med kreft eller etter endt kreftbehandling.
Om Pakkeforløp for kreft
Sist faglig oppdatert: 21.09.2023
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er et standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Les mer om Pakkeforløp for blærekreft.
Det er egne Diagnoseveiledere for fastleger for inngang til pakkeforløp for kreft.
Pakkeforløp hjem for pasienter med kreft
Sist faglig oppdatert: 21.09.2023
Pakkeforløp hjem for pasienter med kreft skal bidra til å sikre god struktur og logistikk i helsetjenesten, samt sikre trygghet og forutsigbarhet for personer som lever med kreft eller etter endt kreftbehandling.
Prioriteringsveilederen for urologi
Sist faglig oppdatert: 21.09.2023
Pasienter med tilstander som omfattes av pakkeforløpene for kreft, skal også rettighets-vurderes i samsvar med pasient- og brukerrettighetsloven og prioriteringsforskriften og få en juridisk bindende frist.
Pakkeforløpene og forløpstidene er ikke juridiske rettigheter, men bygger på faglige vurderinger. Det er bare manglende overholdelse av den juridisk bindende fristen, som er knyttet til varsling av HELFO. Dersom spesialisthelsetjenesten ikke kan starte helsehjelp før den juridiske fristen utløper, eller dersom oppstartstidspunktet må endres slik at den juridiske fristen ikke overholdes, skal spesialisthelsetjenesten kontakte HELFO. HELFO skal informere pasienten og gi alternativt sted for helsehjelp dersom pasienten ønsker det. Tilsvarende gjelder altså ikke hvis forløpstidene i pakkeforløpene ikke overholdes.
For pasienter med tilstander som skal følge Pakkeforløp for kreft, er den juridiske fristen en ekstra sikkerhet for at utredning og/eller behandling starter innen forsvarlig tid.
Frister i prioriteringsveilederne
Fristene helsetjenesten setter med bakgrunn i anbefalingene i prioriteringsveilederne er juridisk bindende, jf. pasient- og brukerrettighetslovens § 2‑1 b. Alle pasienter som får rett til nødvendig helsehjelp fra spesialisthelsetjenesten skal i løpet av vurderingsperioden, det vil si innen 10 virkedager, få en frist for når helsehjelpen senest skal starte. Fristen skal settes etter en vurdering av alvorlighet og hastegrad og den skal være medisinsk forsvarlig. Fristen uttrykker det som er siste frist for når de aktuelle helsehjelpstiltakene må starte for å få et forsvarlig forløp. Start av helsehjelp kan være både utredning og behandling.
Prioriteringsveilederen for urologi
Prioriteringsveilederen for urologi gir en veiledende frist for start utredning av sannsynlig blærekreft på 6 uker. Ved mistenkt muskelinfiltrerende sykdom kan rettighetsstatus endres (dvs forkortes), men det er ikke angitt konkret hvilken tidsfrist som da skal gjelde Den veiledende frist for start utredning av hematuri er 12 uker. Makrohematuri og pasienter med klare risikofaktorer bør prioriteres raskere enn gjennomsnittet. Anbefalt frist for denne gruppen er 4 uker. Videre er det anført at asymptomatiske pasienter under 50 år uten lang røykeanamnese med mikrohematuri ikke trenger urologisk utredning.
Diagnostisering
Sist faglig oppdatert: 21.09.2023
Symptomer og indikasjon for utredning
Sist faglig oppdatert: 21.09.2023
Diagnostisering av blærekreft baserer seg vanligvis på at sykehistorien med spesifikke symptomer gir mistanke om blæresvulst og at dette følges av diagnostiske tiltak. Det hyppigste symptomet er hematuri med eller uten ledsagende pollakisuri eller dysuri. Hast og omfang av diagnostikk avhenger av om hematurien er makroskopisk eller mikroskopisk hematuri når det også foreligger risikofaktorer for blærekreft. Risikofaktorer er definert i kapitlet "Risikofaktorer og forebygging", og i denne sammenheng vektlegges: røyking, arbeid med kjemikalier, tidligere strålebehandling mot bekken-regionen og familieanamnese på urotelkreft før 60 år. I tillegg øker risiko hvis du er mann og eldre.
Utredning av makroskopisk hematuri (Makrohematuri)
Makroskopisk hematuri er det hyppigste symptomet på blærekreft. Den er tilstede hos 80 % av pasientene, og skal derfor alltid utredes (Khadra et al., 2000). Ved makroskopisk hematuri, forekommer blærecancer hos 14-20 %, UTUC hos 0.4-1.2 %, og nyrecancer hos 1-2 % (Rai et al., 2022). Stein forkommer hos opptil 20 % (Galtung et al., 2023; Rai et al., 2022).
Blodfortynnende medisiner gir økt forekomst av hematuri (Wallis et al., 2017), og forekomsten av urotelcancer i denne gruppen er 4-6 %, hovedsakelig lokalisert i blæren (Moschini et al., 2016; Rasmussen et al., 2021). Forekomsten av UTUC ved makrohematuri utløst av antikoagulasjon er ukjent, men det anbefales foreløpig at denne gruppen utredes på vanlig måte med CT abdomen og cystoskopi. Behovet for repeterte undersøkelser ved persisterende hematuri, må vurderes individult. Utredning av hematuri hos pasienter på blodfortynnende medisin, men med nylig negativ hematuriutredning (cystoskopi og billeddiagnostikk), kan avventes dersom seponering av blodfortynnende medisin gir normalisering av urin kontrollert med urinstix.
Anbefalinger:
- Ved makroskopisk hematuri skal alltid pasienten undersøkes i pakkeforløp med:Kontrastforsterket CT abdomen
- Cystoskopi
- Makrohematuri utløst av antikoagulasjon skal utredes.
Unntak for utredning:
- Klinisk cystitt hos kvinner <50 år, der hematuri opphører innen 4 uker etter antibakteriell behandling.
- Klinisk steinsykdom der stein bekreftes radiologisk og hematurien opphører etter steinbehandling.
- Blødning i direkte tilslutning til manipulering av urinveiene.
Utredning for mikroskopisk hematuri (Mikrohematuri)
Mikroskopisk hematuri defineres som 2+ på urinstix på 3 prøver med 1 mnd. mellomrom eller funn av > 2 røde blodceller pr. synsfelt ved stor forstørrelse i mikroskop. Mikroskopisk hematuri kan forekomme i opptil 40,9 % av befolkningen (Loo et al., 2013; Mohr et al., 1987).
Pasienter med mikroskopisk hematuri har noe øket risiko for kreft i urinveiene, og risikoen øker betydelig ved uriveissymptomer og økende alder. Den observerte forekomsten av blærekreft er 1-6 % og UTUC 0.0-0.3 % (Elmussareh et al., 2017; Gonzalez et al., 2019; Malmström et al., 2019; Ordell Sundelin et al., 2017). I lys av ekstremt lav forekomst av UTUC ved mikroskopisk hematuri, anbefales ikke lenger billeddiagnostikk ved utredning, men cystoskopi anbefales fortsatt for pasienter > 50 år med symptomer eller risikofaktorer.
Anbefalinger:
- Mikroskopisk hematuri defineres som minimum 2+ på urinstix på 3 prøver med 1 mnd. mellomrom eller funn av > 2 røde blodceller pr. synsfelt ved stor forstørrelse i mikroskop.
- Det er ikke indikasjon for CT eller annen billeddiagnostikk ved utredning.
- Asymptomatiske pasienter uten risikofaktorer trenger ikke urologisk utredning med cystoskopi.
- Symptomatiske pasienter >50 år, og pasienter med risikofaktorer, skal utredes utenfor pakkeforløp med cystoskopi
- Unntak for aldersgrense er gjennomført strålebehandling og genetisk disposisjon for UTC.
- Pasienter <50 år med urinveissymptomer og mikroskopisk hematuri skal utredes i henhold til symptomene.
Klinisk undersøkelse, cystoskopi og billeddiagnostikk
Sist faglig oppdatert: 21.09.2023
I dag praktiseres rekkefølgen av klinisk undersøkelse, CT og cystoskopi forskjellig. Det har vært vanlig med klinisk undersøkelse og cystoskopi som første undersøkelser, og deretter CT for avklaring av de øvre urinveiene.
Dersom CT utføres før cystoskopi, vil man spare minimum èn konsultasjon fordi man unngår enda en kontakt for å informere om CT-svaret. Risikoen for falske negative cystoskopier og falske positive CT vil også trolig reduseres ved å utføre CT før cystoskopi, og man kan i noen tilfeller henvise direkte til TURB. For å redusere antal konsultasjoner og utredningstid, anbefales derfor CT abdomen som første undersøkelse.
Klinisk undersøkelse
Klinisk undersøkelse av bekkenet, inkludert rektal eksplorasjon og bimanuell palpasjon, anbefales generelt når man undersøker for hematuri. Imidlertid presenterer majoriteten av blærekreftpasientene seg med ikke-muskelinfiltrerende sykdom. Positive funn ved klinisk undersøkelse er sjeldne, og bare fremskredne tilfeller av blærekreft vil kunne påvises på denne måten. Klinisk undersøkelse gir derfor sjelden funn i diagnostikk ved hematuri, men kan påvise annen sykdom hos pasienten.
Cystoskopi
Den kliniske diagnosen blærekreft vil normalt bygge på cystoskopi, som er en obligatorisk undersøkelse ved mistanke om blæresvulst. Hvis billeddiagnostikk, ev. kombinert med positiv cytologi i urin, gir sterk mistanke om blæresvulst, vil man likevel kunne gå rett på initialbehandling (TURB) uten å forutgående cystoskopi.
Hos menn gir undersøkelse med fleksibelt cystoskop mindre ubehag og en bedre pasientopplevelse enn undersøkelse med stivt instrument og er derfor å foretrekke (Krajewski et al., 2017).
Cystoskopi-undersøkelsen skal som et minimum gi følgende beskrivelse av svulst-tilstanden: størrelse, lokalisering, antall, utseende (papillomatøs/solid, stilket/bredbaset), urinjet fra ostier og utseende av slimhinnen utenom svulsten
Svulst og annen slimhinnepatologi kan med fordel avmerkes på en standardtegning (figur 2). Status ved rektaleksplorasjon skal anføres.
For bruk av fluorescens-cystoskopi (PDD) og narrow band imaging (NBI), se under primærbehandling (kap. Visualiseringsteknikker ved endoskopi av blære).
Anbefalinger:
- Cystoskopi skal ved blæresvulst beskrive følgende forhold ved tumor og blære: størrelse, lokalisasjon, utseende, antall, urinjet fra ostier og ev. slimhinneforandringer utenom selve svulsten.
Billeddiagnostikk
Kontrastforsterket CT abdomen er førstevalg ved utredning av makrohematuri. Dersom CT av ulike grunner ikke er mulig å gjennomføre, kan man individuelt vurdere erstatning med MR eller ultralyd.
Primærhensikten med bildeutredning av makroskopisk hematuri er med henblikk på UTUC, men undersøkelsen må også ha fokus på blærecancer, spesielt hvis CT gjøres før cystoskopi. Andre årsaker til hematuri, som f.eks nyrecancer og stein må også vurderes med undersøkelsen.
Det er ingen absolutt nedre GFR-grense for kontrastundersøkelse av urinveier, men forsiktighet bør utvises ved redusert nyrefunksjon. Europeiske retningslinjer er utarbeidet og revidert i 2018 av ESUR (European Society of Urogenital Radiology) (van der Molen et al., 2018a, 2018b) (www.esur.org). Hovedregelen er at man kan gi intravenøs jodholdig kontrast til pasienter som normalt ved e-GFR 30 eller høyere. Ved e-GFR under 30 ml/min, skal pasienten normalt hydreres opp på forhånd. Dette skal skje med intravenøs infusjon av ringer eller bikarbonat, og skal starte noen timer før undersøkelsen, eventuelt også pågå i etterkant. Det må vurderes redusert kontrast eller alternative metoder på individuell basis.
Dersom pasienten bruker metformin eller analoge medikamenter, skal disse seponeres etter anbefalte retningslinjer før intravenøs jodholdig kontrast, dersom e-GFR er 30 eller lavere. Metforminbruk må ikke gjenopptas før e-GFR er målt etter 48 timer og nivå vurdert som akseptabel av ansvarlig lege.
Om indikasjonen for CT er sterk nok, og adekvate alternativer ikke finnes, kan man gi kontrast etter forbehandling med væske, helst i samråd med nefrolog.
For detaljer se www.esur.org.
Billeddiagnostikk ved primærutredning
CT abdomen
Ved makroskopisk hematuri anbefales kontrastforsterket CT abdomen. Hensikten er primært å utelukke UTUC, og studier har vist NPV >99% uavhengig av hvilken CT-protokol man velger (Cowan et al., 2007; Metser et al., 2012; Park et al., 2016). CT er også godt egnet for vurdering av blærecancer, men fortsatt regner man cystoskopi som den beste metoden (Blick et al., 2012; Helenius et al., 2015; Helenius et al., 2016). Tidligere har man som regel brukt tre- eller fire-fase CT, og den ekskretoriske fasen er ofte fremhevet som den mest sentrale for vurdering av urotelial cancer (Renard-Penna et al., 2020). Evidensen for at den ekskretorisk fasen forbedrer diagnostikken er mangelfull, og flere studier har vist at èn-fase CT er tilstrekkelig, og da foretrekkes sen urotelial/nefrografisk fase (Kim et al., 2014; Kupershmidt et al., 2011; Metser et al., 2012; Park et al., 2016; Takeuchi et al., 2015). Dette vil redusere stråledosen betraktelig, og korte ned undersøkelses- og granskningstiden slik at CT-kapasiten bedres. Behovet for supplerende kontrastfaser må individuelt vurderes ved usikre funn.
MR
MR er vanligvis ikke indisert primært ved utredning av makrohematuri.
Ultralyd
UL er vanligvis ikke indisert ved utredning av makrohematuri.
Billeddiagnostikk ved staging av blærecancer
CT abdomen og thorax
Kontrastforsterket CT abdomen i sen urotelial/ nefrografisk fase er førstevalg for staging av blærecancer.
CT kan ikke skille mellom NMIBC (<T2) og MIBC (T2), men kan påvise ekstravesikal tumorvekst (≥T3). CT er lite sensitivt (40-50%) for deteksjon av lymfeknutemetastaser, og kirurgisk glandeltoalett regnes derfor som gullstandard. Hovedhensikten med CT-staging er derfor påvisning av ekstravesikal tumorvekst, og fjernmetastaser.
Dersom CT er utført før TURB i forbindelse med utredning av makroskopis hematuri, vil denne være tilstrekkelig for abdominal staging. Det er viktig at CT utføres før TURB fordi TURB gir reaktive forandringer som feilaktig gir inntrykk av mer avansert sykdom.
Behovet for CT thorax vurderes individuelt før TURB, f.eks ved stor tumorvekst eller lokalavansert/metastatisk sykdom. Etter TURB, kan man supplere med CT thorax ved påvist MIBC og ved høy-gradig NMIBC.
MR blære
MR er bedre enn CT for påvisning av MIBC, men få sykehus har innført MR som rutine ved staging (Del Giudice et al., 2020). Noen studier ser nå på nytten av MR som erstatning til TURB før cystektomi, men konklusive resulater foreligger ikke (Bryan et al., 2021). Potensialet til MR er å selektere pasienter direkte til cystektomi uten TURB. Selv om man må avvente resultater fra kliniske studier, ansees det likevel som ønskelig at flere begynner med MR blære for lokal staging. Det vil da være viktig med lokal forankring og kvalitetssikring for å optimalisere kvaliteten. Det er viktig at MR blære utføres før TURB og rapporteres i henhold til VI-RADS. Foreløpig er multiparametrisk MR (med kontrast) vanligst for staging, men flere studier raporterer likeverdige resultater ved bruk av bi-parametrisk MR (uten kontrast) (Ye et al., 2022).
MR har bedre sensitivitet enn CT for deteksjon av lymfeknutemetastaser. Lymfeknutetoalett er er gullstandard for N-staging, men har terapeutisk gevinst ift øket overlevelse (Woo et al., 2018).
FDG-PET CT
Undersøkelsen anbefales foreløpig ikke i Norge ved utredning av blærecancer. FDG PET-CT er marginalt mer sensitivit enn vanlig CT for påvisning av lymfeknutemetastaser, men negativ undersøkelse erstatter ikke glandeltoalett ved cystektomi (Girard et al., 2019). Gevinsten av FDG PET-CT for deteksjon av fjernmetastaser i forhold til vanlig CT er usikker.
Anbefalinger:
- Kontrastforsterket CT abdomen anbefales før cystoskopi. Èn-fase CT er som regel tilstrekkelig.
- CT abdomen tatt i forbindelse med primærutredning er tilstrekkelig for abdominal staging.
- Ved abdominal staging, er det viktig at CT gjøres før TURB.
- CT thorax anbefales ved påvist MIBC og ved høy-gradig NMIBC.
- Forsiktighet i forhold til kontrast bør utvises ved GFR < 30 ml/min
- Det anbefales MR blære for staging under forutsetning av lokal forankring og kvalitetssikring
Urinundersøkelser
Bakteriologisk undersøkelse
Denne undersøkelsen er nødvendig bare hvis klinikken gir mistanke om assosiert infeksjon.
Urincytologi
Cytologisk undersøkelse av eksfolierte cancerceller i urin kan være nyttig i følgende tilfeller:
Hematuri uten positive funn ved cystoskopi og bildeundersøkelse av øvre urinveier
Usikkert cystoskopifunn
Negativ cystoskopi hos pasient med suspekte urinveissymptomer (CIS)
Negativ cystoskopi og mulig svulst i øvre urinveier ved bildeundersøkelse
Oppfølging av enkelte pasienter (for eksempel CIS – se kap. Oppfølging)
Undersøkelsen kan gjøres i spontanurin eller i væske fra blæreskylling. Prøvetype skal alltid angis på remissen da dette kan ha betydning for tolkningen av eventuelle funn. Det anbefales at spontanurinen ikke skal være den første morgenurinen. Urinprøven skal tas en tid på døgnet da pasienten er godt hydrert for å sikre flest mulig bevarte celler i urinen og slik unngå cytolyse. En prøve tatt under pågående makroskopisk hematuri kan være vanskelig å tolke.
Urincytologi er mest pålitelig for påvisning av svulster av høy malignitetsgrad og CIS (sensitivitet 28–100 %). Svulster med lav malignitetsgrad gir positiv urincytologi i langt færre tilfeller (ca. 16%). Tolkning av det cytologiske preparat kan være problematisk av flere grunner: Lavt celletall, degenerative/irritative forandringer (for eksempel stein) og terapiinduserte forandringer (BCG, stråleterapi). Det er derfor viktig at man anvender et laboratorium med erfaring i cytologisk vurdering og gir adekvate kliniske opplysninger til patologen (Raitanen et al., 2002) (evidensgrad C).
For å møte behovet for standardisering av terminologi og tolkning av funn er Paris-systemet for rapportering av urincytologi utviklet (Rosenthal et al., 2016), og dette anbefales brukt både av EAU (Babjuk et al., 2019) og av Norsk Forening for Klinisk Cytologi (NFKC). Systemet beskriver neoplastiske og enkelte ikke-neoplastiske tilstander i urin og gir forslag til terminologi (tabell 3) (figur 3).
Systemet deler inn svarrapportene i seks diagnosekategorier som kort beskrevet nedenfor.
1. Negativt for høygradig urotelialt carcinom (negativ)
Denne kategorien inkluderer alle entiteter som ikke medfører økt risiko for utvikling av høygradig urotelialt carcinom.
Kategorien inkluderer benigne og reaktive forandringer i urotel, kjertelepitel og plateepitel; benigne uroteliale vevsfragmenter og uroteliale flak og grupper; steinrelaterte forandringer; virusrelaterte forandringer og forandringer som kan tilskrives gjennomgått behandling inkludert epitelceller fra blæresubstitutt.
2. Atypiske urotelceller (AUC)
Kategorien omfatter prøver med urotelceller med lett til moderat cytologisk atypi. Vevsfragmenter og cellegrupper uten cytologisk atypi og tilfeller hvor det er kjent årsak til atypien (f.eks. virusrelaterte forandringer) kommer inn under normal-kategorien.
AUC inkluderer også prøver med uttalt degenerasjon/ dårlig bevarte prøver slik at atypiens natur ikke kan vurderes. Det bemerkes at kun degenerasjon ikke automatisk medfører AUC-diagnose.
3. Suspekt for høygradig urotelialt carcinom (suspekt)
Her inkluderes prøver med urotelceller med grov atypi som ikke helt møter kriteriene for høygradig urotelialt carcinom.
4. Høygradig urotelialt carcinom (HGUC)
Kategorien omfatter urotelceller med høygradig atypi, både høygradig urotelialt carcinom og CIS. Cytologisk kan man ikke skille mellom disse men det er rapportert at bakgrunnen i CIS er renere.
5. Lavgradig urotelial neoplasi (LGUN)
Denne kategorien inkluderer både papillomer, PUNLMP og lavgradige uroteliale carcinomer. Å skille lavgradige lesjoner fra normalt urotel kan være meget vanskelig, og diagnosen bør kun stilles når man har sikre holdepunkter for at det foreligger lavgradig neoplasi.
Negativ cytologi utelukker ikke denne kategorien.
6. Annen malign sykdom (primær eller metastatisk) og diverse lesjoner
For eksempel rene plateepitelcarcinomer, rene adenocarcinomer, nevroendokrine carcinomer og sarkomer kommer inn under denne kategorien.
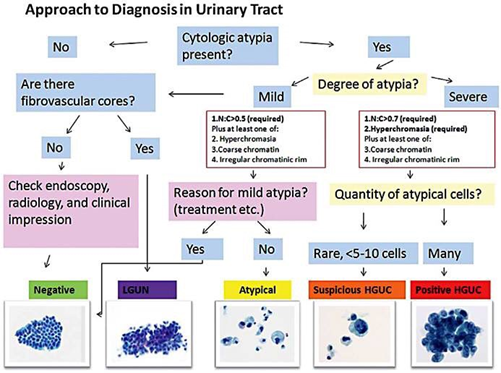
| Kategori | Risiko for malignitet | Anbefalt oppfølging |
|---|---|---|---|
1 | Ikke diagnostisk | <5-10% | Gjenta cytologi, cystoskopi om 3 måneder dersom økt klinisk mistanke |
2 | Negativ for høygradig urotelialt carcinom | 0-10% | Klinisk oppfølging etter behov |
3 | Atypiske uroteliale celler | 8-35% | Klinisk oppfølging etter behov |
4 | Suspekt for høygradig urotelialt carcinom | 50-90% | Cystoskopi, biopsi |
5 | Høygradig urotelialt carcinom | >90% | Cystoskopi, biopsi, stadieinndeling |
6 | Lavgradig urotelialt carcinom | 10% | Cystoskopi, biopsi nødvendig for vurdering av grad og stadium |
7 | Andre primære og sekundære maligne svulster | >90% | Cystoskopi, biopsi, stadieinndeling. Det som passer oppgitt diagnose. |
Molekylære urintester
For å kompensere for urincytologiens svakheter, er tester for blæresvulstmarkør i urin forsøkt utviklet (tabell 4). BTA/BTA Stat (blæretumorantigen), NMP 22 (spesifikt kjerneprotein), fibrin degradasjonsprodukter, Immunocyt og UroVision er kommersielt tilgjengelige. Disse og andre tester har, som cytologi, sine svakheter. De fleste av disse testene har bedre sensitivitet enn cytologi for oppdagelse av blærekreft, men spesifisiteten er lavere. Falsk positive prøver vil derfor lede til unødvendige undersøkelser, bl.a. blærebiopsier. Pr. i dag har ingen urintester vist tilstrekkelig pålitelighet til å kunne overta for cytologi i diagnostikk og oppfølging av blæresvulster (Glas et al., 2003; Lokeshwar et al., 2005; Lotan et al., 2003; van Rhijn et al., 2005) (evidensgrad B).
Test | Sensitivitet | Spesifisitet | Sensitivitet for høy grad svulster (%) | Evidensgrad |
|---|---|---|---|---|
UroVysion | 30–86 | 63–95 | 66–70 | 2b |
Mikrosattelite | 58–92 | 73–100 | 90–92 | 1b |
Immunocyt/uCYt+ | 52–100 | 63–79 | 62–92 | 2a |
Nukleær matrix protein 22 | 47–100 | 55–98 | 75–92 | 2a |
BTA stat | 29–83 | 56–86 | 62–91 | 3 |
BTA TRAK | 53–91 | 28–83 | 74–77 | 3 |
Cytokeratin | 12–88 | 73–95 | 33–100 | 3 |
Anbefalinger:
- Urincytologi er indisert ved følgende tilfeller
- Makroskopisk hematuri uten positive funn ved cystoskopi og bildeundersøkelse av øvre urinveier.
- Usikkert cystoskopifunn.
- Negativ cystoskopi hos pasient med suspekte urinveissymptomer.
- Negativ cystoskopi og mulig svulst i øvre urinveier ved bildeundersøkelse.
- Det anbefales at Paris-systemet for rapportering av urincytologi brukes.
- Urincytologi skal gjentas hvis den viser atypiske uroteliale celler i første prøve.
- Molekylære tester kan ikke erstatte cytologi grunnet lavere spesifisitet.
Klassifikasjon og risikogruppering
Sist faglig oppdatert: 21.09.2023
Urotelialt carcinom (tidligere kalt overgangsepitelcarcinom) er den vanligste formen for blærekreft. Andre typer inkluderer bl.a. plateepitelcarcinomer og adenocarcinomer. Det finnes en rekke histologiske varianter av uroteliale carcinomer. Å gjenkjenne disse kan ha betydning for prognose og/eller videre behandling. Ytterligere detaljer og mal for beskrivelse er beskrevet i kap. Patologi, mens kap. Behandling av ikke-urotelial cancer og differensierte former av UTC beskriver Behandling av ikke- urotelial cancer og differensierte former av UTC.
Behandling og oppfølging av NMIBC baseres på grunnlag av risikogruppering. De tradisjonelle EORTC’s tabellene baserer seg på 2696 Ta-T1 pasienter inkludert i EORTC studier, men som ikke fikk re-TURB eller vedlikeholds-instillasjonsbehandling. Scoring av seks kliniske og patologiske faktorer, gir risiko for rekurrens og progresjon ved 1 og 5 år ut fra tilhørende tabeller. EAU guidelines inneholder også en tilsvarende elektronisk kalkulator (uroweb.org).
EAU Guideline komite for NMIBC har senere utarbeidet en 3 delt samlet risikogruppering for rekurrens og spesielt progresjon med subgruppering av høyrisiko. Med høyrisiko blærekreft menes alle; T1, Høygradige og, CIS, men også Ta LG svulster som er multiple og rekurrente og store (> 3 cm i diameter) (Sylvester et al., 2016).
Risikogrupperingene har vist å kunne predikere rekurrens og progresjon (LE 2a) Stadie og grad har vist høyest prediktiv verdi for sykdomsspesifikk overlevelse og progresjon, mens alder og grad er viktigste prognostiske faktorer for total overlevelse (uroweb.org) (Cambier et al., 2016).
Anbefalinger:
- Det anbefales at WHO-systemet fra 2004 anvendes for klassifisering av svulstene.
- Det anbefales at urologen gjennomgår den histologiske diagnosen sammen med patologen i MDT, særlig ved høygradig tumor.
- Den histologiske bedømmingen bør gjøres etter etablert mal.
Utredning og klassifikasjon av UTUC (Upper Tract Urothelial Carcinoma)
Sist faglig oppdatert: 21.09.2023
Epidemiologi
I Norge oppstår 11.8 % av urotelial neoplasi i nyrebekken eller ureter, som benevnes øvre urinveier (Upper tract) (Almås et al., 2021). Insidensen har økt de siste årene, og gjennomsnittsalderen ved diagnose er 73,4 år. Fem års kreftspesifikk overlevelse har steget til 65,4 % fra 57,4% de siste 20 årene (Almås et al., 2021).
De fleste som blir diagnostisert er menn (61%-77%) (Raman et al., 2011a), og de fleste har kreft i nyrebekkenet (55-66%) (van Doeveren et al., 2021; Woodford et al., 2016). To tredjedeler av pasientene som blir diagnostisert med UTUC har invasiv svulst ved diagnosetidspunktet, sammenlignet med 15-25 % hos blærekreftpasienter (Margulis et al., 2009). Opptil 28 % av de som får påvist UTUC, har tidligere hatt blærekreft, og omtrent 10 % får blærekreft diagnostisert samtidig som UTUC (Milojevic et al., 2013).
Risikofaktorer
Røyking er den største risikofaktoren for kreft i øvre urinveier, som det er for blærekreft. Risikoen er større i øvre urinveier enn i blæren (OR 6.2 sammenlignet med 3.2 i blæren) (Pommer et al., 1999). Røykeslutt påvirker ikke kun risikoen, men også prognose etter radikal behandling med nefroureterektomi (Crivelli et al., 2014).
Aristolochic syre er naturlig syre som er brukt i urtemedisiner og er kjent risikofaktor for bl.a. UTUC, i tillegg til lever- og nyresykdommer. Bruk av den er relatert til høy insidens av UTUC i Kina og Balkan (Jelaković et al., 2012; Xiong et al., 2018).
Lynch syndrom er autosomal dominant syndrom som øker risikoen for tarmkreft, UTUC og andre kreftformer (se kapittel om risikofaktorer og forebygging av blærekreft). Pasienter med Lynch syndrom har økt risiko for utvikling av UTUC (2 % pr. 10 år med livstidsrisiko 4–10 %), og særlig blant dem som har mutasjon i MSH2 genet (Engel et al., 2012).
Patogenese og klassifisering
Patogenesen i de tilfeller der det ikke er samtidig blæretumor, er ofte molekylærgenetisk annerledes enn ved blærecancer. En populasjonsbasert studie indikerer at 6 % av tumores i øvre urinveier er mikrosatellitt instabile med bortfall av MMR proteiner (basert på immunhistokjemi) i 5 % av tilfellene (Ericson et al., 2005).
Tumores i øvre urinveier klassifiseres og graderes på samme måte som i urinblæren. Den anatomiske oppbyggingen i nyrebekkenet og ureteres er noe enklere enn i blæren, med færre cellelag i urotelet og kun ett muskellag (Cheng, 2008). Likevel følger stadieinndelingen de samme prinsippene som i urinblæren: pT1: invasjon i subepitelialt bindevev (lamina propria), pT2: invasjon i muskelvev, pT3: invasjon i fettvev, pT4: invasjon i nærliggende organer eller ut i perirenalt vev (TNM Classification of Malignant Tumours, 2017).
Symptomer
Det hyppigste symptomet for kreft i øvre urinveier er hematuri (70–80 %) (Inman et al., 2009; Raman et al., 2011b), men noen pasienter har flankesmerter eller palbabel tumor (10–20 %) (Ito et al., 2011; Raman et al., 2011b). De som har vekttap, trøtthet, feber, nattesvette eller andre generelle symptomer, må utredes med tanke på spredning (Ito et al., 2011; Raman et al., 2011b). Studier viser dårligere overlevelse hos de som har systemiske symptomer (Inman et al., 2009; Raman et al., 2011b).
Klinisk undersøkelse og billeddiagnostikk
Bildeutredning og staging er lik for blærecancer og UTUC.
Pasienter med UTUC har oftest makrohemturi, og utredes derfor i henhold til pakkeforløpet for blærecancer (se punkt Utredning av makroskopisk hematuri (Makrohematuri)). Alternativ har CT, utført på annen indikasjon, reist mistanke om UTUC. Denne undersøkelsen vil som regel være tilstrekkelig for deteksjon og abdominal staging. Supplerende CT abdomen er anbefalt dersom andre modaliteter enn CT har reist mistanke om UTUC.
CT thorax og abdomen anbefales for staging (se punkt Billeddiagnostikk ved staging av blærecancer)
Cystoskopi hører med i utredning av UTUC hvor det er viktig å utelukke blærekreft i tillegg.
Urinundersøkelse
Skal utføres som standard utredning for kreft i øvre urinveier (evidensgrad A). Se kapittel om urinundersøkelser for blærekreft.
Endoskopisk diagnostikk for kreft i øvre urinveier
Ureterorenskopi er et viktig hjelpemiddel i diagnostikk og behandling av kreft i øvre urinveier. Med fleksibelt skop kan man visualisere hele nyrebekkenet og se små lesjoner som ikke gir kontrastdefekt på CT urografi eller er tilgjengelige med semirigid skop. Fleksibelt skopi gir også muligheten for narrow band imaging (NBI) som kan være nyttig ved vurdering av flate lesjoner, men resultatene er foreløpig ikke entydige (Abouassaly et al., 2010; Brien et al., 2010). Ureterorenskopi er normalt en trygg og godt tolerert prosedyre som kan gjennomføres i spinalbedøvelse.
Indikasjoner for diagnostisk ureterorenoskopi:
- Mistanke om svulst i øvre urinveier på rtg us.
- Makroskopisk hematuri hvor CT ikke kan gjennomføres og cystoskopi er negativ
- Positiv cytologi og normal cystoskopi
- Makroskopisk hematuri og blod fra ostiet ved cystoskopi
- Avløpshinder, hydronefrosis og/eller hydroureter
Ved fleksibel ureterorenoskopi ser man omtrent 75 % av lesjonene. Lesjoner som ikke oppdages er oftest i ureter eller carcinoma in situ (Yamany et al., 2015). Biopsi kan gi tumorgrad i opptil 90 % av tilfellene uavhengig av biopsivolumet (Rojas et al., 2013), men undergradering kan forekomme. Rojas et al. viste god sammenheng mellom biopsi og endelig preparat etter nefroureterektomi for grad (92,3 % med 95 % CI 82,4–98,0). For stadium var sammenhengen dårligere (43 % med 95 % CI 28,7–55,9). Andre studier har ikke vist like gode resultater; Chitale et al. hadde 74 % samsvar mellom biopsi og endelig histologi (Chitale et al., 2008). Dette bør man ta hensyn til hvis man velger nyrebevarende behandling, se under behandling og oppfølging. Nyere studier viser at pasienter som får utført radikal nefroureterektomi og som har gjennomgått diagnostisk ureterorenskopi på forhånd har høyere residivrate i blæren (Baboudjian et al., 2020; Guo et al., 2018).
Anbefalinger:
- Diagnostikk for kreft i øvre urinveier
- Cystoskopi skal alltid gjøres.
- Cytologi skal alltid utføres.
- Èn-fase CT abdomen skal alltid gjennomføres.
- Diagnostisk ureterorenoskopi utføres når indisert.
Utredning og klassifikasjon av cancer i urethra
Sist faglig oppdatert: 21.09.2023
Innledning
Kreft med utgangspunkt i urethra (primær urethracancer) er sjelden, og står for under 1% av alle urologiske cancere. Hos menn er urotelialt carcinom vanligste histologi (53 %), etterfulgt av plateepitelcarcinom og adenocarcinom. Hos kvinner er adenocarcinom vanligst (46 %), etterfulgt av plateepitelcarcinom og urotelialt carcinom (Aleksic et al., 2018; Gatta et al., 2011). Kreft i urethra kan være sykdom som ledd i multifokal urotelial cancer (sekundær urethracancer), vanligvis med utgangspunkt i urinblæren.
Klassifisering
Cancer i urethra hos kvinner og menn klassifiseres i hht. 8. utgave av TNM-klassifiseringen (TNM Classification of Malignant Tumours, 2017). I tillegg finnes det et eget TNM-system for urotelialt carcinom med utgangspunkt i den prostatiske delen av urethra hos menn («prostatisk urotelial neoplasme»). Urotelialt carcinom i urethra ligner morfologisk/histopatologisk på kreft i urinblæren, og graderes på samme måte (G1-G3) og (PUNLMP, lowgrade, highgrade).
Cancer i urethra som antas å ha sitt opphav i urinblæren eller de øvre urinveiene, defineres som sekundær urethracancer, og klassifiseres ut fra hovedtumor. (F.eks: T1G3 i blære + CIS i pars prostatika urethra) (Liedberg et al., 2007). Når cancer i urethra påvises samtidig med urotelcancer/blærekreft på denne måten, er dette alltid høyrisiko blærekreft, og vil være en negativ prognostisk faktor.
Utredning og diagnose
Symptomer på cancer i urethra er ofte de samme som ved mistanke om cancer i urinblæren: dysuri, hematuri, nedsatt vannlatingstrykk, smerter, osv (Gheiler et al., 1998). Urethracystoskopi er dermed førstevalg ved primærutredning. Nøye skopi av urinblæren og utredning av de øvre urinveier med CT abomen er viktig for å utelukke samtidig/konkomitant sykdom.
Urincytologi har relativt lav sensitivitet ved kreft i urethra, men anbefales likevel som en del av utredningen (Touijer et al., 2004). Histologisk diagnose oppnås ved biopsi eller reseksjon i narkose. Biopsier bør inneholde underliggende muskulatur eller bindevev.
Multiparametrisk MR anbefales som en del av utredningen av primær urethracancer for å klassifisere primærtumor, og for å kartlegge lymfeknuter inguinalt og iliacalt (Del Gaizo et al., 2013; Itani et al., 2016). Ved påvist urethracancer, er CT abdomen - thorax indisert.
Urotelialn cancer i pars prostatika urethra
For å klargjøre de histopatologiske/morfologiske forskjellene mellom kvinner og menn, finnes det et eget TNM-klassifikasjonssystem for primær urethracancer som oppstår i uroteliale celler i urethras prostatiske del (TNM Classification of Malignant Tumours, 2017). Urotel som dekker den prostatiske delen av urethra har et tynt lamina propria (bindevevsdrag), mens de prostatiske utførselsgangene er uten lamina propria (Liedberg et al., 2007). Cancer i utførselsgangene vil dermed lettere kunne vokse inn i stromale prostataceller. Carcinoma in situ i den prostatiske delen av urethra hos menn kan oppstå i selve urethra (CIS pu), eller i utførselsganger/duktus (CIS pd).
Urotelial cancer som oppstår i pars prostatika urethra og som vokser inn i prostatas kjertelvev (stroma) er definert som T2 urethracancer. Cancer fra urinblæren som vokser gjennom prostatas lamina propria og inn i prostatas kjertelvev (stroma), defineres som T4a blærekreft.
Anbefalinger:
- Urethracancer utredes med cystoskopi, cytologi og eventuelt biopsi.
- Lokal tumorutbredelse og regionale lymfeknuter utredes med multiparametrisk MR penis/bekken.
- CT benyttes for kartlegging av metastaser i abdomen og thorax.
Initial behandling og behandling av NMIBC
Sist faglig oppdatert: 21.09.2023
Alle pasienter med påvist blæresvulst gjennomgår initialt transurethral reseksjon (TURB). Denne prosedyren vil gi materiale for diagnose og bestemmelse av T-stadiet. Ved NMIBC vil den i tillegg alene kunne behandle sykdommen ved å fjerne alt svulstvev.
Enkelte pasienter med NMIBC kan likevel ha behov for tilleggsbehandling med intravesikal instillasjonsbehandling (kap. Strålebehandling / Trimodal behandling). Pasienter som ikke responderer på denne behandlingen, kan være kandidater for radikalbehandling. Ved massiv utbredelse av NMIBC, som ikke kan saneres ved TURB, selv med flere prosedyrer, kan radikal cystektomi vurderes. Det samme gjelder for enkelte pasienter med T1HG med eller uten Tis (kap. Systemisk behandling i kurativ hensikt ved blærekreft).
TURB
Sist faglig oppdatert: 21.09.2023
Ved TURB-prosedyren skal følgende momenter vektlegges
Ved bimanuell palpasjon undersøkes det om en blæretumor er palpabel og om denne i så fall er bevegelig eller fiksert i forhold til bekkenveggen og videre om det er infiltrasjon i vagina, prostata eller rektum (Fossa et al., 1991; Wijkstrom et al., 1998). Bimanuell palpasjon kan gjøres både før og etter TURB. Palpabel svulst etter reseksjon øker sannsynligheten for at muskelinfiltrerende svulst foreligger (≥T2). Palpasjon gjøres ved mistanke om MIBC, men ved opplagt NMIBC er det ikke nødvendig. Palpasjon kan erstattes med MR av blæren. Reseksjonen skal utføres slik at svulstvevet bevares best mulig for histologisk undersøkelse og slik at svulstens horisontale utbredelse og dybdevekst i relasjon til blærens vegglag kan bedømmes. Varmeskade av representative svulstområder bør unngås ved å ta store nok biter. Bipolar strøm og minimalisert strømstyrke (unngå bruk av ”blandingsstrøm”) gir sannsynligvis mindre varmeskade på resektat (Hurle et al., 2016; Kramer et al., 2017; Teoh et al., 2017; Venkatramani et al., 2014). Overfladiske svulster (>2-3cm) kan reseseres i ett stykke med noe underliggende blærevegg - «En Bloc» (Yanagisawa et al., 2022). Ved større overfladiske og ved klinisk infiltrerende svulst reseseres den eksofytiske svulsten og den underliggende blæreveggen hver for seg. Disse sendes som separate prøver til histologisk undersøkelse. Ved slike svulster bør også vevet rundt kanten av reseksjonstomten reseseres og sendes som eget preparat. Har pasienten større mengder papillomatøst tumorvev, kan man vurdere å operere pasienten i to omganger, gitt at det ikke er indikasjon for radikal operasjon. Ved reseksjon på sidevegg og lateralt for ureterostiene er det risiko for stimulering av nervus obturatorius. Mht risiko for blæreperforasjon er forskjellen på mono- og bipolar strøm mer kontroversielt (Sugihara et al., 2014; Venkatramani et al., 2014). Også bipolart reseksjonsutstyr kan utløse obtoratorius spasme med risiko for blæreperforasjon.
Svulstene skal beskrives med antall, størrelse og lokalisasjon samt om de er solide eller papillomatøse, bredbasede eller stilkete, samt om de er ulcererende eller nekrotisk. Størrelse kan måles med bredden av reseksjonsslyngen. Den øvrige slimhinnen i blæren og urethra bør også beskrives. Man bør være særlig oppmerksom på svulster og annen slimhinnepatologi på blærens framveg innenfor blærehalsnivå. Disse kan være vanskelige å visualisere, spesielt hvis pasienten har en stor intravesikalt voksende prostata. En begrenset reseksjon av prostata i området kan da være nødvendig, selv om en fullstendig reseksjon av prostata (TURP) generelt frarådes samtidig med TURB. Det foreligger begrensede data mht samtidig TURB av svulster som påvises tilfeldig ved TURP. Disse sparsomme data viser ikke økt forekomst av rekurrens i blærehals eller prostatakavitet. Det synes derfor rimelig å fjerne små papillære svulster uten uttalt multiplisitet samtidig med TURP (Picozzi et al., 2012; Tsivian et al., 2003).
Biopsier i tillegg til svulstreseksjonen skal tas av visuelt suspekte slimhinneområder. Biopsi av pars prostatica urethrae helt ned til på hver side av colliculus (kl. 5 og 7), fortrinnsvis tatt med reseksjonsslynge, er indisert ved mistanke om CIS og ved klinisk infiltrerende svulst i blærehalsnivå (Matzkin et al., 1991; Mungan et al., 2005) (evidensgrad C). Slik biopsi ned til colliculusnivå skal prinsipielt også tas hvis cystektomi med ortotopt blæresubstitutt kan tenkes å bli den videre behandling, uansett hvor selve svulsten i blæren er beliggende. Tilfeldige blærebiopsier hos pasienter med solitære papillomatøse svulster er kontraindisert fordi det ikke gir noen tilleggsinformasjon, men også fordi biopsilesjoner av mucosa kan være lokalisasjon for implantasjon av celler fra selve svulsten.
For post-TURB intravesikal kjemoterapi, se kap. 7.2.
Preanalytisk håndtering av blærebiopsier og TURB-preparat
Preparatene bør legges i fikseringsvæske så raskt som mulig for å unngå tørkeartefakter. Dette er spesielt viktig for små eller tynne vevsbiter (Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av kreft i tykktarm og endetarm, 2017). Mengde vev/fikseringsvæske bør være minst 1:10. Preparater til frysesnittundersøkelse skal ikke legges i fikseringsvæske. Man bør tilstrebe så lav grad av traumatisering av preparatene som mulig, f.eks. med tanke på varmeskade ved bruk av strøm ved TURB. Prøveglass og remisse må merkes med fullstendig pasient-ID og gode kliniske opplysninger.
Poliklinisk behandling
Hos pasienter med tidligere små lavgradige Ta-svulster er det forsvarlig å foreta poliklinisk elektro- eller laserkoagulasjon av små rekurrente svulster fremfor innleggelse med TURB (Herr et al., 2007). Det bør tas en enkel biopsi før koagulasjon for å dokumentere tilbakefallet da dette har konsekvens for videre oppfølging.
Anbefalinger:
- TURB er primærprosedyre ved alle blæresvulster. Samtidig bimanuell palpasjon bør gjennomføres ved mistenkt muskelinfiltrerende svulst (kan erstattes med MR).
- Små svulster reseseres i ett stykke med noe underliggende blæreveggsmuskulatur.
- Store overfladiske og alle åpenbart muskelinfiltrerende svulster reseseres fraksjonert (inkludert blærevegg) og med tilsvarende fraksjonert biopsiforsendelse.
- Biopsi gjøres av unormalt utseende blæreslimhinne, og av posteriore urethra ved svulst eller mistanke om CIS i blærehals.
- Ved usikre cystoskopifunn bør poliklinisk biopsering vurderes.
- Poliklinisk koagulering av små lavgradige residiver kan redusere antall TURB.
Re-TURB
Sist faglig oppdatert: 21.09.2023
Hos en betydelig andel av pasientene med Ta-T1 svulster påviser en svulster ved 1. gangs kontroll etter TUR (Brausi et al., 2002; Miladi et al., 2003) (evidensgrad B). Det kan skyldes inkomplett reseksjon eller nyoppstått tumor (Jahnson et al., 2005), men førstnevnte årsak er klart den hyppigste (Cumberbatch et al., 2018). I tillegg er T1HG/G3 tumores likevel muskelinfiltrerende i ca. 10 % av tilfellene (Brauers et al., 2001; Jakse et al., 2004). Av disse grunner er re-TURB indisert, vanligvis innen 2-6 uker etter første TURB, særlig i følgende situasjoner:
- Usikkerhet om første TURB var komplett
- Manglende muskulatur i preparatet hos pasienter der mer avansert T-stadium vil få behandlingsmessige konsekvenser
- T1-tumor (prinsipielt alle)
Anbefalinger:
- Re-TURB ved T1 eller mistanke om inkomplett primær-TUR.
Visualiseringsteknikker ved endoskopi av blære
Sist faglig oppdatert: 21.09.2023
Fluorescensdiagnostikk (PDD)
Ved cystoskopi/TURB i hvitt lys vil enkelte maligne lesjoner ikke bli oppdaget, enten fordi de er små, eller fordi de i praksis er usynlige i hvitt lys. PDD anvender blått lys og et fotosensibiliserende porfyrinbasert stoff (hexylaminolevulinat, HAL), som instilleres i blæren hvor det akkumuleres særlig i maligne celler. Områdene med slik akkumulasjon vil gi rød fluorescens som kontrast til en blå bakgrunn når slimhinnen belyses med blått lys. Ved denne teknikken kan man hos ca. 20–30 % av pasientene oppdage tilleggslesjoner, særlig CIS, som ikke er synlige i hvitt lys (Hungerhuber et al., 2007; Jichlinski et al., 2003; Schmidbauer et al., 2004) (evidensgrad B). Dette gir mer komplett TURB og kan hos enkelte pasienter også avdekke behov for tilleggsbehandling hvis CIS påvises. PDD har på pasientnivå høyere sensitivitet enn hvitt lys (93 % vs. 71 %), men lavere spesifisitet (63 % vs. 81 %), dette siste pga. falsk-positive resultater (Mowatt et al., 2011). Disse ses gjerne ved inflammasjon av slimhinnen kort tid etter TURB og i løpet av de første 3 måneder etter BCG-instillasjon (Draga et al., 2010; Ray et al., 2010) (evidensgrad C)
Nytten av fluorescens-veiledet TURB for reduksjon av residiv på kort sikt (12 måneder) er vist i to større randomiserte multisenterstudier med litt ulik design og pasientpopulasjon. Absolutt reduksjon i kortsiktig residivfrekvens med HAL var i disse studiene i størrelsesorden 10 % (hhv. 9 % og 16 %) (Hermann et al., 2011; Stenzl et al., 2010) (evidensgrad A). Om PDD anvendt ved TURB gir lavere rekurrensforekomst enn TURB med umiddelbar endose-kjemoterapiinstillasjon ble ikke bekreftet i en randomisert studie. Nytten av PDD for reduksjon av progresjon av sykdommen eller for bedring av overlevelse er ennå ikke entydig dokumentert.
Metoden kan også anvendes rent diagnostisk ved poliklinikk, men har vært mest benyttet under operasjon (TURB) der man samtidig har mulighet for å biopsere/resesere de fluorescerende lesjonene. Poliklinisk anvendelse er aktuelt ved mindre rekurrente svulster i avdelinger med mulighet for samtidig behandling.
Teknikken er mest aktuell ved Ta/T1-svulster, men det er fortsatt uavklart om den bør anvendes rutinemessig hos absolutt alle som skal gjennomgå TURB for antatt ikke-muskelinfiltrerende svulst. Likevel bør anvendelse sterkt overveies ved; hyppig residiverende Ta/T1-svulstsykdom (høygradige svulster), multiple førstegangssvulster, mistenkelige lesjoner synlig i hvitt lys eller positiv cytologi uten endoskopiske funn i hvitt lys. Ved re-TURB for T1 HG/G3 bør PDD overveies hvis det ikke ble anvendt ved den initiale TURB. Hensikten er da å påvise CIS i andre områder av blæren enn der selve svulsten var beliggende.
Narrow band imaging (NBI)
NBI brukes til å øke kontrasten mellom normalt urotel og hypervaskulært svulstvev. Metoden ligger i utstyrets software og krever ikke instillasjon av et preparat i blæren. Preliminære studier har vist økt deteksjon av svulstvev i urinblære bekreftet ved biopsering og TURB (Drejer et al., 2017; Ye et al., 2015; Zheng et al., 2012). Reduksjon av rekurrens etter 3 og 12 måneder er vist bare for lavrisikosvulster (pTa LG, < 30 mm, ingen CIS) (Naito et al., 2016).
Anbefaling:
- Vurder bruk av PDD, evt NBI ved TURB for å øke deteksjonsrate av små svulster og CIS, samt ved positiv cytologi men negativt cystoskopifunn.
Adjuvant behandling etter TURB
Sist faglig oppdatert: 21.09.2023
Postoperativ skylling av blære
Postoperativ skylling av blære har i metaanalyser og systematisk review vist å kunne redusere tidlig rekurrens. Varighet av skylling er ikke fastsatt. Metoden bør først og fremst vurderes der instillasjon av kjemoterapeutikum i blære ikke er mulig.
Postoperativ Instillasjon av kjemoterapeutikum i blære
Intravesikale blæreinstillasjonsregimer har som formål å redusere risiko for residiv av lavgradige svulster. Engangsinstillasjon av 40 mg Mitomycin-C i blæren innen noen timer etter TURB reduserer residivfrekvens med opptil 35 % (Bouffioux et al., 1995; Gudjónsson et al., 2009; Oosterlinck et al., 1993; Solsona et al., 1999). Ved høyrisiko blærekreft er der ikke funnet effekt med enkel postoperativ blæreinstillasjon (Onishi et al., 2011; Onishi et al., 2017).
Anbefalinger:
- Enkeltinstillasjon med kjemoterapi etter TUR (operasjonsdøgnet) hos alle med tilsynelatende ikke-muskelinfiltrerende svulst. Tillegg av vedlikeholdsbehandling er nødvendig ved risikosvulster.
- Ved kjent høygradige residiver og ved hyppige residiver er det ikke vist effekt av enkeltinstillasjon av cytostatika.
- Blæreskylling med steril 0.9 % NaCl til neste dag kan alltid vurderes fremfor singel shot mitomycin.
Instillasjonsbehandling av NMIBC
Sist faglig oppdatert: 21.09.2023
Instillasjon av kjemoterapeutikum i blære
Ved stadig residiverende lavgradige svulster kan regelmessige instillasjoner av kjemotera¬peutikum etter fast protokoll redusere residiv-risikoen. Instillasjonene gis da som seks ukentlige instillasjoner etterfulgt av 1 månedlig instillasjon. Lengden av vedlikeholdsbehand¬lingen er ikke fastsatt, men det finnes liten dokumentasjon for effekt utover ett år. Ved manglende toleranse for eller tilgjengelighet av BCG, kan instillasjon av Mitomycin benyttes som erstatning under nøye overvåkning.
Instillasjonsbehandling med BCG i blære
BCG er førstevalget for både høy- og intermediærrisikopasienter da det både kan redusere risiko for residiv og forhindre eller utsette progresjon (Bohle et al., 2004; Sylvester et al., 2002) (evidensgrad A). BCG har også dokumentert en langsiktig effekt, opptil 15 år (Sylvester et al., 2002). Forskjell i overlevelse for kjemoterapi og BCG er imidlertid ikke sikkert dokumentert.
Instillasjonsregimet består av en induksjonskur (6 ukentlige instillasjoner) og en vedlikeholdskur (forskjellige opplegg over 1–3 år). For BCG er anvendelse av et slikt vedlikeholdsregime en forutsetning for å oppnå en fordelaktig effekt av BCG (Bohle et al., 2003; Han et al., 2006; Shelley et al., 2001; Shelley et al., 2004) (evidensgrad A).
Inntil 50 % av de som ikke responderer på induksjonskuren, responderer på en induksjonskur nummer 2, særlig gjeldende ved CIS. Den optimale varigheten av vedlikeholdsbehandlingen er uavklart, men min. 1 år anbefales. Gjennomføring av full vedlikeholdskur i 3 år må veies opp mot svulstens risikoprofil og mot tolerabilitet (bivirkninger). I en randomisert studie av EORTC var det ingen forskjell i forekomst av rekurrens i intermediærrisiko-gruppen ved vedlikeholdsbehandling i 1 og 3 år med BCG. For høyrisikogruppen var det en beskjeden forskjell til fordel for 3 år, mens mht progresjon og totaloverlevelse var det ingen forskjell (Oddens et al., 2013) (evidensgrad A). Generelt bør en ta sikte på at pasienter med høyrisikosvulster (T1HG/G3, CIS) får full vedlikeholdsbehandling, men fordelen med de to ekstra årene med vedlikeholdsbehandling må veies mot bivirkningsprofilen til pasienten.
BCG har mer toksisitet enn kjemoterapi, men alvorlig toksisitet forekommer hos mindre enn 5 % av pasientene og behandles effektivt praktisk talt hos alle (van der Meijden et al., 2003) (evidensgrad A). Dosereduksjon (dvs. at pasienten tømmer blæren før to timer) av BCG ser ut til å redusere forekomsten av moderate bivirkninger, men ikke av de alvorlige. Pga. faren for systemisk absorpsjon, skal BCG-instillasjon ikke gis i de første 2 uker etter TUR, ved makroskopisk hematuri eller rett etter traumatisk kateterisering/cystoskopi. Videre ser full BCG-dose ut til å være mer effektivt ved multifokal tumorsykdom enn redusert dosering (Martinez-Pineiro et al., 2002; Martinez-Pineiro et al., 2005) (evidensgrad A).
Eksempel på instillasjonsskjema med vedlikeholdsbehandling finnes i appendiks; Behandlingsskjema BCG og Behandlingsskjema Instillasjon av kjemoterapi i blære. Her finnes også praktiske forslag om behandlingstid, generelle forholdsregler og om bivirkninger og håndtering av disse.
Behandling av CIS med BCG
Behandlingsvalget ved CIS står mellom BCG eller cystektomi uten at det foreligger konsensus om hvilken av disse behandlingene som skal anbefales initialt. Tidlig cystektomi gir meget god sykdomsspesifikk overlevelse, men opptil 40–50 % av pasientene vil da bli overbehandlet (Sylvester et al., 2005).
Det er derfor grunnlag for å holde BCG som standard initialbehandlingen av primær carcinoma in situ. Etter induksjonskuren med 6 ukentlige behandlinger oppnår 83–93 % av pasientene komplett remisjon (negative urincytologier, ev. negativ histologi) (Jakse et al., 2001; Losa et al., 2000) (evidensgrad B). Hvis urincytologi og blærebiopsier (evt. PDD-veiledet) fortsatt viser CIS etter denne kuren, kan en ny 6-ukers kur forsøkes, og ytterligere noen pasienter vil da oppnå komplett remisjon. Vedlikeholdsbehandling i inntil 36 mnd. anbefales for å hindre residiv av denne svulsttypen som har spesielt høy risiko (Lamm et al., 2000).
Kjemoterapi har ikke dokumentert god nok effekt ved CIS, sammenlignet med BCG med hhv. 48 % og 72–93 % komplett respons (Jakse et al., 2001; Losa et al., 2000) (evidensgrad B).
Ved simultan CIS med papillær svulst, fjernes svulstene først og behandling gis deretter som ved primær CIS.
Ved primær CIS vil ca. 50 % av pasientene få progresjon til muskelinfiltrerende sykdom til tross for primær respons på BCG, og mellom 11 % og 21 % vil dø av sykdommen innen 5–7 år etter initialt komplett respons (de Reijke et al., 2005; Griffiths et al., 2002; Jakse et al., 2001; Lamm, 1992; Lamm et al., 2000; Losa et al., 2000; Takenaka et al., 2008) (evidensgrad B). Hvis remisjon ikke oppnås senest etter den andre induksjonskuren eller det kommer et tidlig residiv, er cystektomi ev. med urethrektomi indisert.
CIS i prostatiske del av urethra kan behandles med intravesikal BCG, men TUR av prostata på forhånd anbefales da dette vil bedre eksponeringen av BCG i aktuelle område av urethra (Palou et al., 2007) (evidensgrad C). Hvis det også foreligger CIS i det prostatiske gangsystemet, skal cystektomi vurderes (evidensgrad C)
Behandling av T1HG med BCG
T1HG blæresvulster har en tendens til progresjon (27–48 %), og noen vil derfor anbefale tidlig cystektomi (primært). Likevel er det vist at 50 % av pasientene vil kunne beholde blæren hvis man velger et blæreinstillasjonsregime med BCG. Særlig ved liten svulst (< 3 cm) og uten samtidig CIS, vil flertallet beholde blæren sin over en 10-årsperiode (Serretta et al., 2004) (evidensgrad B). BCG er standard primærbehandling av T1HG etter TURB
Instillasjonsbehandling ved BCG-mangel
I årene rundt 2014/-15 var det problemer med levering av BCG fra flere produsenter, noe som har gjentatt seg. Det ble den gang gitt råd fra norsk blærekreftgruppe (NUCG).
Hovedbudskapet var at BCG-vaksinen må prioriteres til undergrupper av blærekreft og deler av behandlingsforløpet der nytten av BCG er størst, sammenlignet med cellegiftinstillasjoner. Rådene var som følger:
Pasienter med høygradig malign T1-cancer (T1HG), bekreftet ved re-TURB, og pasienter med behandlingstrengende carcinoma in situ (CIS) bør ha høyeste prioritet. T1HG-cancer har særlig risiko for progresjon, som reduseres av BCG, men ikke av cellegift-instillasjon. Gevinsten av BCG i forhold til cellegift er større ved CIS enn ved eksofytisk voksende svulster.
Induksjonskurer bør prioriteres foran vedlikeholdskurer. Det er også god dokumentasjon for at vedlikeholdsbehandling kan avsluttes etter 1 år, uavhengig av leveranseproblemer for BCG.
Det er forsvarlig å redusere BCG-dosen til 1/3 uten å påvirke progresjonsrisiko, men tilbakefall (rekurrens) kan øke noe.
Pasienter med TaHG med hyppige rekurrens, kan behandles med instillasjoner av cellegift der Mitomycin 40 mg er mest anvendt. Alternativene til Mitomycin er epirubicin (50 mg) eller gemcitabin (2000 mg). Hos eldre pasienter (> ca 80 år), aktuelle for BCG, kan cellegiftinstillasjon vurderes, men langsiktig gevinst mot progresjon er da ikke dokumentert.
Alternativet til BCG for T1HG- og CIS-pasienter er i prinsippet radikal cystektomi (RC). Aktuelle leveringssituasjon vil bety at flere av disse pasientene må vurderes for RC og kanskje særlig yngre pasienter, selv om bare et mindretall av T1HG-svulstene bekreftet ved re-TURB, vil progrediere. Tumorstørrelse, dyp eller overfladisk infiltrasjon i submucosa og forekomst av CIS bør da vektlegges. RC er et omfattende inngrep, som må vurderes i samråd med pasienten, men pasienter som ikke får optimal BCG-behandling må følges særlig nøye.
For pasienter med svulster som ikke responderer på BCG og hvor cystektomi er kontraindisert pga. komorbiditet kan blærepreserverende strategier med intravesikal kjemoterapi, kjemohypertermi og intravesikal eller systemisk immunterapi vurderes. Slik behandling bør inngå i kliniske studier.
Det oppfordres til plenumsdiskusjoner/konsensusmøter i de urologiske avdelinger om aktuelle pasienter, slik at prioriteringer blir grundig diskutert.
BCG-toksisitet
BCG-installasjoner er assosiert med mer bivirkninger enn intravesikal kjemoterapi, men alvorlige bivirkninger opptrer hos mindre enn 5% av pasienter, og kan behandles vellykket i de fleste tilfeller (van der Meijden et al., 2003).
Alvorlige komplikasjoner kan oppstå etter systemisk absorpsjon av medikamentet, og viktigste forebyggende tiltak er å respektere kontraindikasjoner og forsiktighetsregler til BCG-installasjon:
- Oppstart tidligst 2-4 uker etter TUR-B
- Makroskopisk hematuri
- Symptomatisk urinveisinfeksjon
- Vanskelig eller traumatisk kateterisering
Asymptomatisk bakteriuri og mikrohematuri er ikke kontraindikasjoner mot behandling, og antibiotikaprofylakse er ikke nødvendig (Herr, 2012). Redusert immunforsvar ved for eksempel HIV-infeksjon eller immunosuppressiv behandling er relative kontraindikasjoner, og BCG skal brukes med forsiktighet hos slike pasienter.
Milde lokale (cystitt) og systemiske (sykdomsfølelse, feber < 38,5°C) symptomer er vanlige innen de første 2-3 dager etter behandling, og krever ingen tiltak utover NSAIDs og/eller paracetamol (Bohle et al., 1996).
Lokale bivirkninger
Cystitt:
- Hvis symptomer vedvarer utover 2-3 dager etter behandling, utsett behandling, urindyrkning, empirisk antibiotikabehandling som evt. justeres etter resistensbestemmelse.
- Hvis symptomer vedvarer tross antibiotika og dyrkning er negativ startes behandling med fluorokinolon (Rischmann et al., 2000).
- Hvis symptomene vedvarer må oppstart tuberkulostatika og steroider overveies, infeksjonsmedisiner bør kontaktes.
- Hvis ingen respons på behandling og/eller skrumpblære kan radikal cystektomi bli nødvendig
Hematuri:
Ta urindyrkning for å utelukke hemoragisk cystitt som årsak. Påvist infeksjon behandles. Behandling utsettes inntil makrohematuri har opphørt. Hvis makrohematuri vedvarer må det utføres cystoskopi for å utelukke residivtumor.
Symptomatisk granulomatøs prostatitt:
BCG-behandling forårsaker inflammasjon i prostata hos en stor andel av pasienter, men dette gir sjelden symptomer. Hvis symptomatisk prostatitt behandles dette i første omgang med fluorokinoloner. Hvis symptomer vedvarer må tuberkulostatika i 3 måneder (isoniazid+rifampicin) vurderes og BCG-behandling avsluttes. Infeksjonsmedisiner bør kontaktes.
Epididymoorkitt:
Hvis symptomer i tilslutning til installasjoner vanligvis forårsaket av gram negative bakterier ved kateterisering. Urindyrkning og antitiobikabehandling (fluorokinolon). Sene symptomer kan skyldes mykobakterier, og tuberkulostatika må vurderes. Infeksjonsmedisiner bør kontaktes. Ved behandlingssvikt eller abscedering er orkiektomi nødvendig.
Systemiske bivirkninger
Feber > 38,5°C som varer 12-24 timer:
Stopp BCG-behandling. Urin dyrkning, infeksjonsstatus, rtg.thorax. Kontakt infeksjonsmedisiner og gi evt.isoniazid 300 mg x 1 i tre måneder. BCG-behandling kan gjenopptas når pasienten er symptomfri.
Feber > 38,5°C som varer utover 24-48 timer og allmennsymptomer:
Mistenkt BCG-sepsis. Infeksjonsmedisiner kontaktes mtp.dobbel- eller trippelbehandling med isoniazid, rifampicin og etambutol. BCG-behandling stoppes permanent.
Artralgi og/eller artritt:
Sjelden bivirkning oppfattes som autoimmun reaksjon. Behandles i utgangspunktet med NSAIDs. Ved manglende/dårlig respons vurderes steroider, høydose fluorokinoloner eller tuberkulostatika (Tinazzi et al., 2006).
Hyperterm og Device-assisted instillasjon av kjemoterapi ved NMIBC
Intravesikal kjemohypertermi, device-assisted intravesical chemotherapy (DAIC), hvor enten selve blæreveggen eller installasjonsvæsken varmes opp til 42-43°C, har vist lovende resultater i flere mindre randomiserte studier, og er i en metaanalyse funnet å redusere risiko for residiv og progresjon ved intermediær og høyrisiko NMIBC tilsvarende BCG-behandling (Arends et al., 2016; Zhao et al., 2021). Foreløpig finnes det ingen klare indikasjoner i EAU guidelines, og DAIC må fortsatt anses som eksperimentell behandling.
Anbefalinger:
- Kjemoterapi kan anvendes primært ved lavgradig, residiverende svulstsykdom med lav progresjonsrisiko, samt ved intolerable bivirkninger av eller svikt av BCG-behandling.
- Kjemoterapi må gis i en pH-optimalisert løsning, og væskerestriksjon anbefales for å holde konsentrasjonen av cellegiften i blæren høyest mulig.
- BCG gir bedre langtidsbeskyttelse mot residiv enn kjemoterapi, og bare BCG har evne til å redusere progresjonsrisiko.
- Den optimale varigheten av vedlikeholdsbehandlingen etter induksjonsbehandlingen er ikke fastslått, men for BCG anbefales minst 1 år og for kjemoterapi 6–12 måneder.
- BCG er generelt førstevalget, fremfor alt ved høygradige svulster og CIS, som har både residiv- og progresjonsrisiko.
- Instillasjonsbehandling med hyperterm kjemoterapi (DAIC) kan tilbys ved BCG svikt til pasienter som ikke er kandidater for radikal cystektomi, primært innenfor en klinisk studie.
Radikal behandling av NMIBC
Sist faglig oppdatert: 21.09.2023
Ved NMIBC vil blæresparende behandling være standard hos de aller fleste. Et lite mindretall av disse pasientene vil likevel være aktuelle for radikalbehandling, enten primært eller ved svikt av blæresparende behandling. Dette vil stort sett være kategorier av pasienter med T1 HG-svulster med eller uten CIS.
Hvilke T1HG svulster som trenger tidlig cystektomi, er ikke entydig definert. Følgende faktorer kan imidlertid bidra til å velge cystektomi (Kulkarni et al., 2010) (evidensgrad C):
Alder > 70
Solid bredbaset svulst
Svulstdiameter >3 cm
Svulst i prostatadelen av urethra
Multiple papillomatøse svulster
Hydronefrose
Dyp submucosa-invasjon (gjennombrudd av muscularis mucosae)
Mikrovaskulær infiltrasjon
T1-svulst ved re-TURB
T1HG – residiv under BCG-behandling
Raskt innsettende, multiple høygradige Ta-residiv under BCG-behandling
Samtidig forekomst av CIS
I EAU er følgende faktorer angitt som særlige risikofaktorerAlder >70
Multiple papilomatøse tumores
Tumor > 3 cm
CIS
Very High Risk defineres som 2 av de tre første faktorene hvis det foreligger T1 G2 + CIS, mens ved T1 G3 + CIS kreves bare en. Ved Ta G3 + CIS og TiG3 uten CIS, kreves alle 3 risikofaktorer for å definere tilstanden som Very High Risk.
Behandlingssvikt ved BCG-behandling
Svikt av adjuvant intravesikal behandling er ikke entydig definert, men er omfattende omtalt i EAU guidelines. Likevel er det åpenbart at progresjon til muskelinfiltrerende sykdom er en behandlingssvikt, som indiserer radikalbehandling (cystektomi) i de fleste tilfellene.
Forekomst av høyere malignitetsgrad, høyere T-stadium (Ta → T1) og av CIS under behandlingen er også tegn på utilstrekkelig effekt av instillasjonsbehandlingen.
Et residiv, selv med samme grad og T-kategori, etter både 3 og 6 måneder vil svært sjelden respondere på videre intravesikal behandling (Herr et al., 2003) (evidensgrad C). Ved residiv allerede etter 3 måneder vil bare ca. 1/5 oppnå komplett remisjon på videre behandling. Ved terapisvikt kan skifte fra BCG til kjemoterapi da gi komplett remisjon.
Ved høygradige papillære svulster skal man imidlertid være forsiktig med å bruke tid på sekundære instillasjonsopplegg da progresjon og metastasering kan forekomme før man innser at radikal cystektomi er nødvendig. Det kan ta noe tid for å opparbeide immunrespons ved BCG-behandling, men det er uavklart hvor lenge man kan tillate seg å vente på slik respons i klinikken. Likevel anbefales radikal cystektomi hvis BCG ikke har hatt effekt 6 måneder etter behandlingsstart.
Cystektomi kan også vurderes ved residiv av overfladiske svulster hver 3. måned, selv med instillasjonsbehandling og særlig hvis behandlingen har medført redusert blærekapasitet med tilhørende symptomer.'
Anbefalinger:
- Ved svikt av instillasjonsbehandling bør radikalbehandling (cystektomi) sterkt overveies.
Behandlingsoversikt for NMIBC
Sist faglig oppdatert: 21.09.2023
Behandlingsoversikt for NMIBC er vist i tabell 5.
Risiko-kategori | Definisjon | Anbefalt behandling |
|---|---|---|
Lav-risiko svulster | Primære, solitære, Ta, lavgradig (LG) (inkl. PUNLP), < 3 cm, ingen CIS | Umiddelbar enkelt-instillasjon med kjemoterapi, evt. NaCL-irrigasjon |
Intermediær-risiko svulster | Ta LG svulster som er multiple, residivsvulst eller store (> 3 cm) | Umiddelbar enkelt-instillasjon med kjemoterapi/NaCL-irrigasjon etterfulgt av videre instillasjoner, enten kjemoterapi i maks. 1 år eller full dose BCG i 1 år |
Høy-risiko svulster | Minst ett av følgende forhold foreligger: T1-svulst Høygradig (HG) svulst CIS | Intravesikal full dose BCG-instillasjoner i 1–3 år eller cystektomi (ved særlig høy-risiko svulst) |
Undergruppe av svulster med særlig høy risiko (Very High Risk) | T1HG med CIS i blære T1HG, multiple, store og/eller rekurrente T1HG T1HG med CIS i urethra Særlig aggressiv histologisk type, lymfovaskulær infiltrasjonSvikt av BCG-behandling | Radikal cystektomi skal vurderes. Pas. som ikke ønsker eller er uegnet til dette gis full dose BCG-instillasjoner i 1–3 år Radikal cystektomi anbefales |
Behandling av MIBC, lokoregional sykdom og UTUC
Sist faglig oppdatert: 21.09.2023
Alle pasienter med muskelinfiltrerende sykdom og hvor det planlegges kurativ behandling skal vurderes i multidisiplinært team MDT for å skreddersy optimal behandling. Dette gjelder særskilt vurdering for kjemoterapi før cystektomi.
Anbefalinger:
- Pasienter hvor det planlegges radikal cystektomi eller radikal strålebehandling skal vurderes i multidisiplinært team for å skreddersy optimal behandling inkludert neoadjuvant behandling.
Cystektomi
Sist faglig oppdatert: 21.09.2023
Indikasjon og tidspunkt
Radikal cystektomi er standardbehandling av muskelinfiltrerende blærekreftsykdom, men er også aktuelt ved enkelte høyrisikogrupper av ikke-muskelinfiltrerende sykdom, se kap. 7.6. Misforhold mellom klinisk og patologisk staging ved cystektomi forekommer hos opptil 30 %, dette gjelder spesielt pasienter med T2-tumor (Herr et al., 1990; Sternberg et al., 2003). Cystektomi bør også vurderes ved cN1–3 sykdom (regional lymefeknutespredning under aortabifurcaturen), tross dårlig prognose, da operasjonen også kan forebygge senere palliative problemer.
Pasienter som ikke responderer på eller som får residiv etter kurativ stråleterapi/blærekonserverende behandling bør vurderes for salvage cystektomi. Operasjonsrisiko må da igjen vurderes mot risiko ved ingen kurativ behandling.
Cystektomi kan utføres trygt også hos eldre pasienter (>75–80 år) (Figueroa et al., 1998). Komplikasjonsfrekvens er mer avhengig av komorbiditet og allmenntilstand enn av alder i seg selv. Likevel har pasienter over 80 år økt morbiditet ved cystektomi, men ikke økt mortalitet
Tidspunktet for cystektomi synes å ha prognostisk betydning. En forsinkelse av radikaloperasjon utover 90 dager etter primærdiagnosen gir en høyere andel av pasienter med ekstravesikal svulstvekst (81 vs. 52 %) (Chang et al., 2003) og også redusert residivfri- og total overlevelse (Sanchez-Ortiz et al., 2003).
Vedr. neoadjuvant/adjuvant kjemoterapi vises til kap. 8.4. Preoperativ strålebehandling kan gi en «down-staging» av blæresvulsten evidensgrad A), men har ikke vist noen overlevelsesgevinst (Huncharek et al., 1998; Widmark et al., 2003) (evidensgrad B).
Prosedyren
Radikal cystektomi omfatter fjernelse av blæren, samt prostata og vesiculae seminales hos menn, og uterus og adnexae hos kvinner (Stenzl et al., 2005). Ved nervesparende cystektomi kan vesicula etterlates etter individuell vurdering av tumorlokalisasjon. Ved tumor knyttet til urachus og adenocarcinom i blæren bør hele urachus og evt navlen reseseres. Distale del av ureteres fjernes, og det anbefales frysesnitt av reseksjonskanten for å se om CIS foreligger i ureteres (Stenzl et al., 2002). I så fall reseseres ureteres så langt proksimalt man kan av hensyn til urinavledningen.
Indikasjonen for urethrektomi er kontroversiell og er blitt noe innskrenket, knyttet til økt morbiditet og mulighet for ortotopt blæresubstitutt (Nelles et al., 2008; Spiess et al., 2006). Urethrektomi anbefales dersom tumor er lokalisert til blærehals hos kvinner og til pars prostatica urethrae hos menn, særlig hvis tumor infiltrerer i det subepiteliale prostatiske stroma. Ved primær CIS (utbredt sykdom) anbefales også urethrektomi. Dersom urethrektomi må utføres i en senere seanse pga. residiv i urethra bør kombinert abdominal og perineal tilgang vurderes for å sikre radikalitet.
Handlingsprogrammet åpner for å gjennomføre operasjonen med fjerning av blæren og lymfeknutene som et preparat; En Bloc Radikal Cystektomi. Glandeltoalettet skal være like omfattende som beskrevet i avsnittet: Lymfeknutedisseksjon.
Nerve- og organsparende cystektomi
Cystektomi kan gjøres med nervesparende intensjon hos enkelte pasienter for å bedre postoperativ seksualfunksjon og redusere lekkasje ved ortotopt blæresubstitutt. Ulike teknikker med bevaring av 1. prostata, 2. prostatakapsel, 3. vesicula seminalis og 4. nervi errigentes, er forsøkt hos menn for å bedre postoperativ seksualfunksjon. Samtlige teknikker har vist seg fordelaktige, men ingen av teknikkene bedre. Ut fra hensyn til radikalitet bør derfor teknikk 3. og 4. foretrekkes (Hernandez et al., 2015).
Hos kvinner finnes foreløpig ikke dokumentasjon på at nerve- eller genitalia-sparende kirurgi bedrer seksualfunksjon (Veskimae et al., 2017). Bevaring av uterus for støtte og fiksering av neo-blære med bevarte ligamentum rotundum er dog beskrevet å kunne forebygge inkontinens og urinretensjon. Ekspertsentra på ortotop neo-blære vektlegger også betydningen av nervesparende teknikk for optimalt funksjonelt resultat ift. postoperativ kontinens (Furrer et al., 2018).
Lymfeknutedisseksjon
Forekomst av regional lymfeknutemetastasering varierer fra mindre enn 10 % ved T1 til vel 30 % ved T3–4, og gir generelt en dårligere prognose. Lymfeknutedisseksjon (LND) er tradisjonelt ansett som diagnostisk, men kan være terapeutisk (relativ bedring av prognosen), særlig hvis begrenset metastasering foreligger (Fleischmann et al., 2005; Ghoneim et al., 2004; Herr et al., 2002; Leissner et al., 2000; Poulsen et al., 1998; Studer et al., 2006). Betydningen av utvidet lymfeknutedisseksjon for prognosen synes å være størst ved organlokalisert sykdom (£ T2). Det er vist retrospektivt og prospektivt at det ikke foreligger lymfeknutespredning («skip lesions») utenfor bekkenet hvis bekkenlymfeknutene er frie for tumor (Roth et al., 2010) (evidensgrad C).
Det anatomiske templatet for LND har lenge vært omstridt; fra avgrenset til fossa obturatorius (begrenset) til å omfatte para-aortale lymfeknuter (super-/hyperextended), begrepsbruken og avgrensningene av de ulike templatene har variert. Templatet bør etter siste anbefalinger (Bruins et al., 2014) omfatte; fossa obturatorius, området langs iliaca arteriene lateralt begrenset av nervus genitofemoralis, medialt begrenset av ureter og kranialt av ureters krysning av iliaca communis, samt presakralt vev. En sammenlignende studie mellom 2 store cystektomi-sentra, som anvender disseksjon til hhv. ureterkryssingen og til kranialt for aortabifurkaturen viser samme total residivfrekvens (38 %) for de to disseksjonsfeltene (Zehnder et al., 2011).
Komplikasjoner, morbiditet og mortalitet
En omfattende beskrivelse av tidlig morbiditet etter cystektomi er en serie med 1142 pasienter fra New York som viste at 67 % opplevde komplikasjoner (alle grader) i løpet av sykehusoppholdet og 58 % etter utskriving. 13 % opplevde alvorlige komplikasjoner (Clavien grad 3–5), hvor av 29 % var gastrointestinale og 25 % infeksiøse (Shabsigh et al., 2009). Det er også vist at det ikke er forskjell i komplikasjonsrate for cystektomi for ikke-muskelinvasiv og muskelinvasiv cancer (Cookson et al., 2003). Langtidsmorbiditet er mest knyttet til forhold ved urinavledningen, og risiko for erektil dysfunksjon er høy og aldersavhengig. Den perioperative mortaliteten er på 1–3 % etter 30 dager og 2,3–5,7 % etter 90 dager (Hautmann et al., 2012; Hautmann et al., 2010; Porter et al., 2011a; Shabsigh et al., 2009)
Robotassistert versus åpen radikal cystektomi
Robotassistert laparoskopisk cystektomi (RARC) har vist seg mulig både hos menn og kvinner. Innledningsvis utførte de fleste urinavledningen ekstrakorporalt, men etter hvert utføres også urinavledning intrakorporalt ved mange sentra (Wilson et al., 2015). Det eksisterer også sentra som har gjort operasjonen med tradisjonell laparoskopi (LRC), men dette vil trolig forsvinne med utviklingen i antall robot-systemer (Haber et al., 2007).
Det har kommet flere review-artikler som sammenligner åpen (ORC) og RARC. De fleste bygger på en blanding av kliniske og randomiserte studier (RCT) mens i 2016 kom en som kun baserer seg på RCT-er (Fahmy et al., 2015; Novara et al., 2015; Tan et al., 2016; Wilson et al., 2015; Yuh et al., 2015). Av 5 publiserte RCT-er, randomiserte den største studien 118 pasienter (Bochner et al., 2015), men ble avsluttet på grunn av manglende påvisning av minimum 20 % gevinst av RARC.
I tråd med mange publiserte studier fant man ingen forskjell av alvorlige komplikasjoner eller onkologisk resultat mellom ORC og RARC, men langtidsdata mangler. RARC har i observasjonsstudier vist færre mindre alvorlige komplikasjoner, men også flere lymfeknuteresidiv utenfor bekken og mer peritoneal carcinomatose, uten at dette er vist i RCT-er (Nguyen et al., 2015; Son et al., 2017). Det er imidlertid vist signifikant mindre estimert peroperativ blødning på ca. 250 ml og 1,5 dager kortere liggetid. Operasjonstiden varer samtidig mer enn 1 time lenger og kostnadene er vurdert som høyere for RARC (Tan et al., 2016). De fleste studier er gjort med anleggelse av urinavledning ekstrakorporalt. Det er uavklart om gjennomføring av hele inngrepet intrakorporalt vil vise resultater i favør av RARC ift ORC.
Håndtering av preparater til patologi
Cystektomipreparater, preanalytisk håndtering
Preparatet sendes til patologiavdeling jf. lokale retningslinjer. Hvis preparatet sendes på formalin eller annen fikseringsvæske, er det viktig å sikre at denne kommer godt til i slimhinnen, enten ved oppklipping av preparatet eller innstillasjon av formalin via kateter. Mengde vev/fikseringsvæske bør være minst 1:10.
Trådmerking av reseksjonsrand i ureter anbefales. Man bør tilstrebe så lav grad av klemskade av reseksjonsrendene som mulig.
Prøveglass og remisse må merkes med fullstendig pasient-ID og gode kliniske opplysninger.
Ureterektomipreparater, preanalytisk håndtering
Preparatet sendes til patologiavdeling jf. lokale retningslinjer. Hvis preparatet sendes på formalin eller annen fikseringsvæske, bør ureter klippes opp til tumor fra begge sider. Preparatet bør merkes og orienteres mtp. angivelse av avstand til distale/proksimale reseksjonsrand. Mengde vev/fikseringsvæske bør være minst 1:10.
Man bør tilstrebe så lav grad av klemskade av reseksjonsrendene som mulig.
Prøveglass og remisse må merkes med fullstendig pasient-ID og gode kliniske opplysninger.
Anbefalinger:
- Radikal cystektomi anbefales ved T2-T4a N0-NX M0, residiverende T1HG/G3 og CIS og variant histologi.
- Preoperativ strålebehandling anbefales ikke.
- Lymfeknutedisseksjon skal utføres og som et minimum med kranial begrensning ved ureters kryssing av iliacakarene.
- Urethra fjernes primært eller sekundært etter individuell vurdering.
- Nervesparende cystektomi kan utføres hos selekterte pasienter, mens prostatabevarende operasjon bør som hovedregel unngås.
- Robotassistert cystektomi har vist sammenlignbare resultater med åpen prosedyre, men bør utføres ved sentra med mye erfaring.
Strålebehandling / Trimodal behandling
Sist faglig oppdatert: 21.09.2023
Kurativt rettet strålebehandling av blærekreft (stadium T2-T4a N0 M0) gis i form av trimodal behandling, hvis mulig. Trimodal behandling innebærer en mest mulig radikal TURB hvor alt makroskopisk tumorvev fjernes, etterfulgt av strålebehandling kombinert med cellegiftbehandling. Ved kontraindikasjon mot cellegiftbehandling (dårlig allmenntilstand/ komorbiditet) gis strålebehandling alene etter TURB.
Det er økende evidens for at trimodal blæresparende behandling hos selekterte pasienter, kan være et alternativ til cystektomi (Ploussard et al., 2014). Trimodal behandling har aldri blitt sammenlignet direkte med cystektomi i randomiserte forsøk. I en systematisk oversikt og metaanalyse er resultatene etter trimodal behandling sammenlignbare med resultatene etter radikal cystektomi (Fahmy et al., 2018).
Målet for behandlingen er å bevare en god urinblærefunksjon uten å forringe muligheten for kurasjon.
Pasienter som er medisinsk inoperable eller pasienter som ønsker å unngå operasjon, skal tilbys eller vurderes for trimodal behandling. Operable pasienter bør også få informasjon om trimodal behandling som alternativ til cystektomi. Pasientene bør diskuteres tverrfaglig av urolog og onkolog. I en randomisert fase 3 studie (BC2001) ble det vist at kombinert strålebehandling og cellegift gir bedre lokoregional kontroll enn strålebehandling alene (lokal kontroll etter 2 år var 67% versus 54% og 5-års overlevelse 48% versus 35%) (James et al., 2012). Komplett TURB er assosiert med økt sjanse for tumorkontroll sammenlignet med inkomplett TURB (Efstathiou et al., 2012). Neoadjuvant kjemoterapi (NAC) bedrer totaloverlevelsen med ca 5% uavhengig av lokal behandling, cystectomi eller strålebehandling (Advanced Bladder Cancer (ABC) Meta-analysis Collaboration, 2005; Yin et al., 2016). Imidlertid er dokumentasjonen for NAC før kjemoradioterapi (kRT) mangelfull. I BC2001-studien fikk 33% av pasientene (n=117) NAC, 48% av disse fikk kRT. NAC påvirket ikke gjennomførbarheten av kRT, det ble observert en ikke signifikant økt toksisitet, men ingen forskjell i livskvalitet (Hussain et al., 2021). Man bør tilstrebe å starte NAC 4-8 uker etter TURB og kRT 4-6 uker etter siste syklus kjemoterapi. Vi anbefaler at 3-4 neoadjuvante cisplatinbaserte kurer vurderes før kRT til egnede pasienter, spesielt ved inkomplett TURB og ved stadium cT3-T4a.
Pasienter som er best egnet for trimodal behandling har begrenset, unifokal tumor i blæreveggen (cT2) uten tumorbetinget hydronefrose eller CIS utenfor primærtumor. Det skal ikke være mistanke om lymfeknutespredning og pasientene må ha god blærekapasitet og funksjon. Blæredivertikler og spesielt tumor i blæredivertikkel er en relativ kontraindikasjon (Mirza et al., 2016). Riktig seleksjon av pasientene er trolig av stor betydning for resultatet av behandlingen. I en studie fra Massachusetts General Hospital hadde 75 % av pasientene normal blærefunksjon ved urodynamisk undersøkelse etter en median oppfølgingstid på 6 år (Zietman et al., 2003).
Responsraten ved trimodal behandling for medisinsk operable pasienter oppgis til ca 70 % (komplett respons definert som fravær av synlig tumor og negative kontrollbiopsier og urincytologi). Den kreftspesifikke 5-årsoverlevelsen varierer mellom 50 % og 82 % og 5-års totaloverlevelse mellom 36 % og 74 % (Ploussard et al., 2014). Den store spredningen kan forklares av stor variasjon i pasientseleksjon, staging og behandlingsopplegg. Langtidsdata (> 5 år) for senskader og livskvalitet er mangelfulle. Det vises til kap. Diagnoseelementer.
Pasienter som ikke ønsker å bli operert, må få grundig informasjon om trimodal behandling avhengig av tumorstadium. Velegnede pasienter (cT2 uten CIS og/eller hydronefrose) løper relativt lav risiko i forhold til pasienter med mer avansert cancer. Pasientene må informeres om ca. 25 % risiko for lokalt tilbakefall og at det anbefales hyppige kontroller (se kap. 11.3). Pasientene må forberedes på at ved salvage cystektomi vil man ikke anbefale anleggelse av ortopt blæresubstitutt da risiko for komplikasjoner og inkontinens er større etter strålebehandlingen.
Pasientene bør alltid vurderes for cystoskopi med tanke på re-TURB etter diagnostisk eller inkomplett TURB ved henvisende sykehus eller hvis det har gått over 6 uker før start av strålebehandling. Det bør undersøkes spesielt om det foreligger CIS.
Pasientene må vurderes nøye med hensyn til toleranse for kjemoterapi og strålebehandling. Pasienten bør være i god allmenntilstand (ECOG 0–1) (James et al., 2012) og ha begrenset komorbiditet ved behandling med kjemoterapi. Alternativt gis strålebehandling alene (ECOG 2) (Efstathiou et al., 2012).
(Kjemo)radioterapi startes 4–6 uker etter siste TURB. Strålebehandlingen gis med CT-planlagt ekstern teknikk. To aktuelle fraksjoneringsregimer er aktuelle, 2 Gy x 32 eller 2.75 Gy x 20 mot hele urinblæren. Fraksjoneringsregimene er ikke sammenlignet direkte i randomiserte forsøk. I en metaanalyse av BC2001 og BCON studiene, ble 2.75 Gy x 20 funnet å være non-inferior sammenlignet med 2 Gy x 32 for både lokoregional kontroll og toksisitet og superior når det gjaldt invasiv lokoregional kontroll alene (Choudhury et al., 2021). Imidlertid var det bare 17% (n=71) av pasientene i studien som fikk kjemoradioterapi. Vi anbefaler derfor foreløpig at begge fraksjoneringsregimer kan benyttes ved kjemoradioterapi, men at 2.75 Gy x 20 er primært valg ved strålebehandling alene. Forslagsvis gis Mitomycin C 12 mg/m2 dag 1 av strålebehandlingen og Fluorouracil 500 mg/ m2/24 timer dag 1–5 (uke 1) og dag 16–20 (uke 4) av strålebehandlingen (James et al., 2012) eller Cisplatin 35 mg/ m2 ukentlig under strålebehandlingen ved GFR > 60 ml/min (Ploussard et al., 2014). Se appendiks, Planlegging av kurativt rettet strålebehandling (s. 125).
Elektiv bestråling av lymfeknuteregionene i bekkenet anbefales ikke gitt rutinemessig. Datagrunnlaget er svakt. En randomisert fase III singel senter studie (n=230) mellom kjemoradioterapi mot urinblæren alene versus strålebehandling av elektive lymfeknuter i bekkenet i tillegg, viste ingen forskjell i 5-års totaloverlevelse, lokoregionalt tilbakefall eller toksisitet (Tunio et al., 2012).
Ved svært høy risiko/N1-2 sykdom kan strålebehandling vurderes til selekterte pasienter som ikke kan eller ønsker operasjon. Det anbefales at lymfeknuteområdene i bekkenet dekkes opp til promontoriet/mellomvirvelskivenivå L5-S1. Det anbefales konvensjonell fraksjonering, simultan integrert boost teknikk, 2 Gy per fraksjon til involverte knuter opp til 64 Gy og 1.64 Gy til elektive lymfeknuteområder til 52 Gy.
Ved muskelinvasivt residiv utføres salvage cystektomi hos egnede pasienter. Ikke-muskelinvasive residiver behandles etter standard retningslinjer.
Kontraindikasjoner | Mindre egnet | Godt egnet |
-tidligere strålebehandling mot bekkenet -inflammatorisk tarmsykdom -store vannlatingsplager* -tumor i blæredivertikkel* -utbredt CIS* -variant histologi* | -hydronefrose -multifokal tumor -T4 -CIS utenfor primærtumor -blæredivertikler | -unifokal tumor -cT2 < 6 cm -ingen hydronefrose -ingen CIS -ingen blæredivertikler -god blærefunksjon -komplett TUR-B |
*relative kontraindikasjoner for operable pasienter
Anbefalinger:
- Kurativt rettet strålebehandling (stadium T2-T4a N0 M0) skal vurderes som alternativ til pasienter som er uegnet for radikal kirurgi og tilbys til pasienter som ikke ønsker operasjon.
- Operable pasienter bør informeres om trimodal behandling som alternativ til cystektomi. Evidensgrad B.
- Kurativt rettet strålebehandling skal så sant mulig gis i form av trimodal behandling. Evidensgrad A.
- Pasienter som er best egnet for trimodal behandling har god blærefunksjon, begrenset, unifokal tumor i urinblæren (cT2) uten tumorbetinget hydronefrose eller CIS.
- Neoadjuvant cisplatinbasert kjemoterapi kan vurderes gitt før trimodal behandling. Evidensgrad B.
- Elektiv lymfeknutebestråling anbefales ikke, men kan vurderes til pasienter med svært høy risiko/N1-2. Evidensgrad D.
- Pasienter som er kandidater for strålebehandling bør undersøkes for CIS.
Systemisk behandling i kurativ hensikt ved blærekreft
Sist faglig oppdatert: 21.09.2023
Omtrent halvparten av cystektomerte pasienter med muskelinfiltrerende cancer (T2b-T4) vil få residiv av sykdommen innen fem år, de fleste residiverer innen to år (Sternberg et al., 2013). Mikrometastaser på operasjonstidspunktet er sannsynligvis bakgrunnen for dette.
Blærecancer er en kjemosensitiv svulst, og cisplatin er det mest effektive cytostatikum ved behandling av urotelialt carcinom. Cisplatin er oto-, nevro- og nefrotoksisk, og er kontraindisert ved nyresvikt. Ved hjertesvikt bør også cisplatin brukes med forsiktighet grunnet stor væskebelastning i forbindelse med kurene. Forøvrig vises til Cytostatikaboken (Medikamentell kreftbehandling, Cytostatikaboken, 2009).
En bør nøye vurdere indikasjonen for kjemoterapi som ledd i kurativ behandling hos pasienter over 75 år grunnet komorbiditet, allmenntilstand og forventet nytte av behandlingen. Videre bør uni- eller bilaterale nefrostomier vurderes ved avløpshinder for å sikre optimal nyrefunksjon under cisplatin-basert kjemoterapi.
Kjemoterapi som ledd i kurativ behandling kan enten gis før cystektomi til operable pasienter (neoadjuvant behandling) eller etter radikal kirurgi (adjuvant behandling) for å bedre overlevelsen. Det er så langt ingen randomiserte studier som har sammenlignet rene populasjoner med pasienter som har fått neoadjuvant vs. adjuvant kjemoterapi, og disse to ulike opsjonene diskuteres nedenfor.
Neoadjuvant kjemoterapi
Flere store randomiserte studier og tre meta-analyser gir god evidens for at neoadjuvant kjemoterapi før cystektomi gir en bedret overlevelse sammenlignet med cystektomi alene for pasienter med muskelinfiltrerende cancer (Advanced Bladder Cancer (ABC) Meta-analysis Collaboration, 2005; Grossman et al., 2003; International Collaboration of Trialists et al., 2011; Leow et al., 2013; Yin et al., 2016).
Totaloverlevelsen ved 5 år er økt fra i gjennomsnitt 45 % til 50 %, og gir en relativ bedring på opptil 8 % uavhengig av T-stadium (Advanced Bladder Cancer (ABC) Meta-analysis Collaboration, 2005; Yin et al., 2016). Den absolutte overlevelsesgevinsten er størst for pasienter med mest avansert T-stadium (Grossman et al., 2003; Sternberg et al., 2013).
Kjemoterapi før cystektomi er standardbehandling ved muskelinvasiv cancer hos pasienter uten sikre tegn til lymfeknutemetastaser (T2-T4a, N0/NX, M0). Hensikten med slik behandling er å behandle mikrometastaser som foreligger på diagnosetidspunktet (Grossman et al., 2003; International Collaboration of Trialists et al., 2011).
Pasienter som får kjemoterapi før cystektomi tolererer gjennomsnittlig flere kurer enn de som får kjemoterapi etter operasjonen (Sternberg et al., 2013). Videre kan man vurdere responsen på kjemoterapi som gir verdifull prognostisk informasjon. Pasienter som oppnår komplett remisjon på kjemoterapi har en betydelig økt overlevelse sammenlignet med de som ikke responderer (Grossman et al., 2003). Kjemoterapi før cystektomi ser ikke ut til å påvirke den kirurgiske komplikasjonsfrekvensen (Millikan et al., 2001). Ulempen med neoadjuvant behandling er en forsinkelse av operasjonen hos pasienter som ikke har effekt av kjemoterapi. En responsevaluering (CT/MR) etter 2 kurer kan muliggjøre at pasienter som ikke responderer går direkte videre til kirurgi. Dette krever tidlig planlegging og bestilling av bilder samt vurdering i MDT-møtet underveis, og det kan være vanskelig å skille inflammatorisk reaksjon på respons fra progresjon radiologisk.
Hos pasienter med kontraindikasjoner mot cisplatin-basert kjemoterapi er det foreløpig ikke dokumentert effekt på totaloverlevelse av kjemoterapiregimer som ikke inneholder cisplatin (Sternberg et al., 2013). Disse skal derfor opereres direkte uten neoadjuvant kjemoterapi. Videre er det ikke dokumentert at cisplatin administrert som monoterapi gir tilsvarende overlevelsesgevinst som kombinasjonsregimer (Advanced Bladder Cancer (ABC) Meta-analysis Collaboration, 2005).
Effektiviteten ved gemcitabin/cisplatin (GC) er vist å være sammenlignbar med metotrexat/vinblastin/doxorubicin/cisplatin (M-VAC) i metastatisk setting (se kap. 7.2). Imidlertid foreligger det ingen data fra randomiserte studier i neoadjuvant setting som støtter GC-kombinasjonen som det fortrukne alternativet. M-VAC har sterkest evidens i neoadjuvant setting og bør således være førstevalget (Sternberg et al., 2013). Flere fase II studier har evaluert dose-intensivert M-VAC med G-CSF støtte, hvor en gir totalt 3 kurer med 2 ukers intervaller, og de konkluderer med at dose-intensivert M-VAC er godt tolerert og gir en patologisk downstaging til <pT1 hos 38 %–49 % av pasientene (Choueiri et al., 2014; Plimack et al., 2014). I GETUG-AFU V05 VESPER studien ble pasienter med ikke-metastastisk muskelinfiltrerende blærecancer randomisert til enten 6 kurer doseintensivert MVAC eller 4 kurer GC 22 (hver 3. uke) (for lik behandlingslengde med kjemoterapi i begge grupper) som perioperativ behandling (enten neoadjuvant eller adjuvant). Ingen pasienter ≥ 70 år ble inkludert. I den neoadjuvante gruppen mottok 58% 6 kurer MVAC, og 66% 4 kurer GC (doseredusert i 18% av tilfellene). Cystektomi ble utført som planlagt i 90% av tilfellene. Komplett patologisk respons ble observert ihhv 42% og 36%, og en signifikant høyere lokalkontroll rate ble observert i MVAC gruppen (p=0,021). Anemi, asteni og kvalme/brekninger forekom hyppigere i MVAC-gruppen (Pfister et al., 2021). Primært endepunkt i studien var progresjonsfri overlevelse (PFS) etter 3 år. For gruppen som helhet var studien negativ, men det ble observert signifkant lengre tid til progresjon i MVAC-gruppen (69% versus 58% etter 3 år). Når man bare så på den neoadjuvante gruppen, ble PFS etter 3 år signigfikant bedre for de som fikk MVAC (66% versus 56%, HR 0.70, p = 0.025) (Pfister et al., 2022). Resultater for totaloverlevelse foreligger enda ikke. Studien støtter ddMVAC som det foretrukne regime, men gir ikke svar på antall kurer som bør gis. Vi anbefaler at det gis 4 kurer ddMVAC hvis tolerabelt som standard.
For å redde et liv med neoadjuvant behandling versus kirurgi alene må 20 pasienter behandles, og man mangler foreløpig prediktive markører for å forutsi hvem som vil profitere på neoadjuvant kjemoterapi. I påvente av gode prediktive markører bør derfor alle pasienter som ikke har kontraindikasjoner mot neoadjuvant terapi tilbys denne behandlingen. På tross av grad A evidens for effekten av neoadjuvant kjemoterapi blir det fortsatt brukt i for liten grad (Burger et al., 2012; Porter et al., 2011b). Det er viktig at pasienter som planlegges for radikal cystektomi blir diskutert i MDT for å skreddersy optimal behandling for den enkelte pasient.
Neoadjuvant kjemoterapi ved lokalavansert sykdom (Induksjon)
Pasienter i god allmenntilstand med lokalavansert cancer (T4b eller N+) bør diskuteres i MDT med tanke på kjemoterapi etterfulgt av cystektomi hvis klinisk «downstaging» oppnås (Ghadjar et al., 2011; Herr et al., 2001; Nieuwenhuijzen et al., 2005). Det foreligger imidlertid ingen data fra fase III studier som støtter denne strategien, som i andre Nordiske land omtales som Induksjonsbehandling. Pasienter med lymfeknutemetastaser i det lille bekken byr på en spesielt stor utfordring, da det ikke finnes god dokumentasjon for hvordan denne gruppen skal håndteres. Hos denne pasientgruppen kan en vurdere neoadjuvant kjemoterapi til spreke pasienter uten vesentlig komorbiditet. Vi anbefaler 4-6 kurer cisplatinbasert kjemoterapi avhengig av effekt og toleranse. Ved svekket nyrefunksjon, kan Gemcitabin og Karboplatin være et alternativ. Radikalt rettet behandling, må vurderes individuelt. Vi anbefaler kirurgi som førstevalg hos yngre pasienter, alternativt strålebehandling, se kapittel 8.3. Ved respons av kjemoterapi, kan vedlikeholdsbehandling med Avelumab vurderes.
Neoadjuvant immunterapi
Nytten av neoadjuvant immunterapi, både som monoterapi og som kombinasjonsbehandling med kjemoterapi, testes ut i flere studier. I PURE-1 studien, en åpen, en-armet fase II studie, fikk pasienter med muskeinvasiv blærekreft, klinisk T <3bN0 , tre kurer med PD-1 hemmerene Pembrolizumab 200 mg hver 3 . uke før cystektomi. Primært endepunkt var komplett patologisk respons. Resultatene var lovende med komplett respons (pT0) i 42% av pasientene og patologisk respons (<pT2) i 54% av pasientene (Necchi et al., 2018). I en annen en-armet åpen fase II studie fikk pasientene 2 kurer med PD-L1 hemmer atezolizumab før cystektomi, og hvor resultatene viste komplett respons i 31% av pasientene (Powles et al., 2019). En kombinasjonsbehandling av kjemoterapi med GC og immunterapi med pembrolizumab, 4 kurer, før cystektomi hos pasienter med muskelinvasiv blærekreft ble nylig testet ut i åpen fase II studie (Rose et al., 2021). Downstaging til <pT2 ble oppnådd i 56% av pasientene og komplett patologisk respons i 36% av pasientene. Resultatene har ledet til en pågående internasjonal multisenter placebo-kontrollert studie. Foreløpig er ikke immunterapi alene eller i kombinasjon med kjemoterapi godkjent som ledd i neoadjuvant behandling, og skal kun anvendes i studier.
Adjuvant kjemoterapi
Fordelen med å gi kjemoterapi etter cystektomi er at man da har sykdommens patologiske stadium (pTNM) tilgjengelig og kan gi behandlingen til risikogruppene som vil ha mest nytte av behandlingen (pT3–4 og/eller pN+M0). Ulempen er at inntil 30 % av pasientene ikke er i stand til å gjennomgå kjemoterapi med behandlingsstart innen 3 måneder etter cystektomi, oftest grunnet nedsatt nyrefunksjon (Donat et al., 2009).
Flere mindre randomiserte studier har antydet overlevelsesgevinst med adjuvant kjemoterapi etter radikal kirurgi for blærekreft (Freiha et al., 1996; Lehmann et al., 2006; Skinner et al., 1991; Stockle et al., 1995). Studiene som er publisert har imidlertid flere statistiske og metodologiske svakheter. En nylig gjennomført kohort-analyse som inkluderte 3947 pasienter viste signifikant økt overlevelse for pasienter som hadde mottatt adjuvant kjemoterapi versus kun cystektomi (HR 0.83, 95 % KI 0.72–0.97) (Svatek et al., 2010). Denne studien viste videre at overlevelsesgevinsten var størst for pasienter med stadium ≥T3 og/eller lymfeknutemetastaser. En nylig publisert meta-analyse viste også en statistisk signifikant redusert risiko for total dødelighet på 22 % for pasienter behandlet med adjuvant kjemoterapi versus cystektomi alene med en HR på 0,78 (95 % KI 0,61–0,99) (Leow et al., 2013). Gevinsten i sykdomsfri overlevelse var størst for de med lymfeknutemetastaser. En annen observasjonsstudie av 224 pasienter hentet fra en prospektivt innsamlet europeisk database viste at andelen som nådde 3 års OS blant pasientene som fikk adjuvant kjemoterapi etter cystektomi var 62 % vs. 40 % av pasientene som ikke fikk adjuvant behandling. Adjuvant kjemoterapi vs. observasjon var forbundet med signifikant redusert risiko for kreft-relatert død (HR 0,51; 95 %CI 0,26–0,98) (Vetterlein et al., 2018). Den siste og hittil største randomiserte studien som er publisert viste en signifikant forlenget progresjonsfri overlevelse hos pasienter som mottok umiddelbart adjuvant kjemoterapi sammenlignet med de som ikke fikk (HR 0,54; 95 % KI 0,4–0,73), dog uten å vise signifikant bedre OS (Sternberg et al., 2015).
Nytten av adjuvant kjemoterapi er fortsatt uklar, men det foreligger nå evidensgrad B for at pasienter som ikke har fått neoadjuvant kjemoterapi, og som etter cystektomi har pT3 eller høyere og/eller regionale lymfeknutemetastaser bør vurderes for adjuvant cisplatin-basert kjemoterapi. Det understrekes likevel at pasienter primært bør få kjemoterapi i neoadjuvant setting grunnet best evidens og fordeler fremfor adjuvant behandling som beskrevet ovenfor.
Adjuvant immunterapi
Nytten av adjuvant immunterapi er testet ut i tre randomiserte fase III studier, hvor atezolizumab, nivolumab eller pembrolizuamb er gitt som monoterapi til pasienter med muskelinvasiv urotelialt carcinom. Resultatene fra disse studiene er divergerende. I Check-Mate 274, en dobbel-blind fase III studie ble 709 pasienter randomisert (1:1 )til enten nivolumab 240 mg hver 2. uke vs placebo i inntil 1 år etter cystektomi. Neoadjuvant kjemoterapi var tillatt. I gruppen som fikk adjuvant nivolumab var det en signifikant bedre DFS (20.8 mnd (95% CI: 16.5–27.6) ) enn i placebogruppen (10.8 mnd (95% CI: 8.3–13.9). Etter 6 mnd var det 74.9% i gruppen som fikk nivolumab i live og sykdomsfri mot 60.3% placebogruppen (HR 0.70; 98.22% CI: 0.55–0.90; p < 0.001) (Bajorin et al., 2021). I IMVigor 010 studien, en åpen randomsiert fase III studie fikk pasientene enten atezolizumab 1200 mg i.v hver 3. uke eller observasjon opp mot et år etter cystektomi (Bellmunt et al., 2021). Primært endepunkt med DFS ble ikke nådd. Median DFS var 19.4 mnd (95% CI: 15.9–24.8) i atezolizumabgruppen og 16.6 mnd (11.2–24.8) i observasjonsgruppen (stratified HR: 0.89, 95% CI: 0.74–1.08, p = 0.24). En tilsvarende studiedesign med pembrolizumab adjuvant er nettopp avsluttet, og resultater fra denne avventes. Behandling med adjuvant nivolumab for pasienter med muskeinfiltrerende urotelial sykdom er sendt til Beslutningsforum, og er under metodevurdering.
Anbefalinger:
- Preoperativ neoadjuvant cisplatin-basert kombinasjonsbehandling skal vurderes ved muskelinfiltrerende blærekreft uten påvisbare metastaser, stadium T2-T4a N0/NX M0. Evidensgrad A.
- Doseintensivert M-VAC er foretrukket regime i kurativ setting grunnet best dokumentasjon. Det foreligger ikke data fra randomiserte studier for at GC-regimet eller andre kombinasjoner er effektive i kurativ setting. Evidensgrad A.
- Pasienter som ikke har fått neoadjuvant kjemoterapi, og som etter cystektomi har pT3 eller høyere og/eller regionale lymfeknutemetastaser bør vurderes for adjuvant cisplatin-basert kombinasjonskjemoterapi. Evidensgrad B.
- Neoadjuvant immunterapi ved muskelinfiltrerende blærekreft skal ikke benyttes utenom studier.
- Adjuvant behandling med nivolumab etter cystektomi er under metodevurdering.
Behandling av ikke-urotelial cancer og differensierte former av UTC
Sist faglig oppdatert: 21.09.2023
«Pure» og «Mixed» Variant histology
I engelsk litteratur skiller man mellom «mixed» og «pure» variant histology, som spiller på varianter av UTC og av blærekreft. Utviklingsmessig regner man mixed å være en videre differensiering fra UTC, men hvor det definisjonsmessig også skal foreligge elementer av UTC. Pure ansees i motsetning å ha oppstått via metaplasi av urotel og det foreligger ikke elementer av UTC (Se også tabell 1 i Willies 2015 (Willis et al., 2015a)). Sarkom i blære oppstår fra mesenkymale celler, og er således vesentlig forskjellig fra UTC med sarkomatoid differensiering, mens urachalt adenocarcinom (urachus cancer) oppstår fra enkelt embryonalt overgangsepitel. Det har vært publisert studier som viser at andelen av tumorvev som er differensiert til annen form er avgjørende for den prognostisk betydningen ved differensiering av UTC.
Selv om urotelialt carcinom (UTC) er den overveiende mest forekommende formen for blærekreft i den vestlige verden, forekommer også andre morfologiske typer. I et norsk materiale fra sykehuset i Vestfold var forekomsten av differensiering 35 %, mens 6 % var non-UTC (personlig meddelelse). Hos pasienter fra områder der parasitten Schistosoma hematobium er endemisk er andelen plateepitelcancere i blære betydelig. I Norge er platepitelcancer den vanligste formen for non-UTC med ca 3 % av alle blærecancere. Av mer sjeldne former er adenocarcinom og småcellet carcinom, men også sarkomer, karsinoid, melanom og lymfom beskrevet i blære (Kava et al., 2012). Handlingsprogrammet omtaler de vanligste formene for variant histologi og gir anbefalinger, basert på flere nyere gode oversiktsartikler (Alanee et al., 2019; Matulay et al., 2019; Moschini et al., 2017; Willis et al., 2015a). Se også Box 1 i Willies 2015 (Willis et al., 2015a).
Plateepitelcarcinom
I ikke-endemiske områder for Schistosomiasis er sannsynligvis kronisk UVI den viktigste årsak til utvikling av plateepitelkreft i urinblæren. Pasienter med ryggmargsskade har i noen studier vært overrepresentert, mens andelen kvinner er noe høyere enn ved UTC.
Plateepiteltumores i urinveier er generelt lite kjemosensitive og gevinst av neoadjuvant og adjuvant kjemoterapi er ikke vist, noe som må veies grundig mot risiko for utsettelse av radikal behandling for lokal kontroll. I publiserte studier har heller ikke stråling gitt oppløftende resultater og det anbefales direkte cystektomi ved cM0-sykdom for å oppnå lokal kontroll.
Forekomsten av lokalt residiv er hyppigere enn metastaser som årsak til sykdomsrelatert død, noe som i tillegg styrker indikasjon for direkte radikal cystektomi. Det er uklart om prognosen ved sammenlignbar sykdom er dårligere enn ved UTC, da avansert stadium (T2 –T4) forekommer i de fleste tilfellene.
Plateepitelcarcinom forårsaket av bilharzia skal behandles prinsipielt likeledes, med primær cystektomi, men det synes å komme dokumentasjon for neoadjuvant behandling i denne spesielle gruppen.
Adenocarcinom
Adenocarcinom er den 3. mest forekommende histologiske typen av blærekreft og utgjør 0,5-2,0 % av tilfellene i vestlige land. Adenocarcinomer i blære er enten primære, med en overopphopning ved tidligere blæreekstrofi, eller sekundær forårsaket av innvekst eller spredning fra annet adenocarcinom i bekken og abdomen. Adenocarcinomer med utgangspunkt i urachus er en egen entitet som omtales i 8.5.4. Sekundære er hyppigst og kartlegging av annet utgangspunkt enn blære bør vurderes, evt med koloskopi (Melicow, 1955).
Det finnes ingen robuste sammenligninger mellom behandlingsstrategier, men neoadjuvant kjemo anbefales ikke ved primært adenocarcinom som bør gå til direkte cystektomi, ved cM0. Ved sekundært adenocarcinom og utbredt sykdom skal pasienten behandles ut fra retningslinjer for primærtumor.
Uansett utgangspunkt har regimer med 5-FU vært hyppigst benyttet ved metastatisk sykdom ut fra erfaringer fra kolorektal onkologi, men med begrenset responsrate.
Urachuscancer (urachalt carcinom)
Urahuscancer er en sjelden tilstand og står for under 1% av blærekrefttilfellene årlig (Bruins et al., 2012), og en agressiv kreftform med 5 års kreftspesifikk overlevelse på 35%. Histologisk påvises vanligvis adenokarsinom. Gjennomsnittsalderen er mellom 52-59 år (Szarvas et al., 2016). Debuterer som oftest med hematuri (ca 70%), i noen tilfeller med abdominale smerter og dysuri (12-14%) eller med slim i urinen (10%) og en sjelden gang med sekresjon fra umbilicus (Loizzo et al., 2022). Mangel på data gjør at det ikke er konsensus i internasjonale retningslinjer om hvilken behandling som er den beste.
Diagnostiske kriterier (Paner et al., 2016):
- Tumor lokalisert i blæretaket eller i fremre vegg.
- Tumorvekst i blæreveggen.
- Fravær av atypisk intestinal metaplasi eller cystitis glandularis utenfor blæretaket eller fremre vegg.
- Fravær av urotelial neoplasi.
- Eksklusjon av adenokarsinom fra annet origo.
Funn av kalk i tumor (UL/CT) regnes som patognomonisk for urachuscancer. Histologisk diagnose stilles etter TUR-B eller eventuelt perkutan biopsi. TUR-B har lav negativ prediktiv verdi (50%) og biopsi kan være nødvending for å differensiere sikkert mellom carcinom og infisert urachal cyste (Loizzo et al., 2022).
Kirurgi
Reseksjon ved urachustumor skal omfatte urachus opp til navel. Hos eldre og skrøpelige pasienter hvor trigonum og meatus internus ikke er involvert og fri margin kan oppnås, er blærereseksjon et alternativ som kan gi god lokal kontroll. Fjerning av lymfeknuter i bekkenet gir bedre overlevelse (Duan et al., 2020; Jia et al., 2020; Yu et al., 2021).
Kjemoterapi
Retrospektive data har vist at kjemoterapi reduserer dødeligheten ved metastatisk urachuscancer, spesielt hos yngre (≤ 70 år) (Flammia et al., 2022).
Aktuelle regimer er Cisplatin og 5-Fu eller mFOLFOX6 (Loizzo et al., 2022). CEA og eventuelt CA19-9 eller CA 125 er ofte forhøyede og kan være til hjelp ved responsevaluering av kjemoterapi.
Perioperativt har kjemoterapi en begrenset rolle på grunn av manglende evidens. Anbefalingen baseres på effekt i metastatisk situasjon og ekspertuttalelse (Siefker-Radtke, 2012). Ved ufrie marginer, pN1 eller affeksjon av peritoneum, kan adjuvant kjemoterapi vurderes, 4-6 kurer av ovennevnte regimer avhengig av toleranse. Ved lokalavansert sykdom og/eller cN1, kan cytoreduktiv kirurgi vurderes etter effekt av neoadjuvant kjemoterapi. Det anbefales å tilstrebe 2 kurer etter at maksimal respons er oppnådd (Siefker-Radtke, 2012).
Strålebehandling
Det er ingen evidens for å anbefale radikalt rettet strålebehandling. Strålebehandling kan vurderes for palliasjon av symptomgivende, ikke operabel primærtumor eller metastaser.
Småcellet kreft i urinblære (SCBC)
SCBC utgjør <1% av nye tilfeller av blærekreft, men det har vært påvist en økning i amerikanske materialer (Koay et al., 2011). Pasientene har ofte utbredt sykdom på diagnosetidspunktet og prognosen er generelt dårlig. SCBC finnes både i ren og blandet form, der den siste har best prognose, selv om den generelt er dårligere enn ved UTC.
Behandlingsalgoritmer baserer seg på erfaring fra småcellet lungecancer, og skiller ikke på småcellet differensiering og ren form. Primærbehandling av SCBC er kjemoterapi, oftest basert på etoposid og cisplatin, da kjemoterapiregimer innrettet mot ren UTC-svulst (MVAC, GC) har gitt dårligere resultater. Komplett respons har vært rapportert opptil 70%, men effekten er ofte kortvarig.
Ved ikke metastatisk sykdom bør kjemoterapi kombineres med lokal behandling. Resultatene av stråling og kirurgi i de få og små seriene som er rapportert er sammenlignbare, men ikke korrigert for at noen strålede pasienter måtte opereres grunnet residiv.
Mikropapillær UTC
Den mikropapilære varianten regnes som en differensiering fra UTC, men har karakteristiske histologiske trekk (Willis et al., 2015b). Typen responderer dårlig på intravesikal BCG (Kamat et al., 2007). Svulsttypen er ofte avansert ved diagnose og har et aggressivt forløp. Effekten av neoadjuvant kjemoterapi er ofte dårlig, knyttet til predominant forekomst av luminal p53-lik subtype. Direkte cystektomi anbefales derfor som behandling både ved NMIBC og MIBC med elementer av mikropapillær vekst (Matulay et al., 2019).
Lymfom, sarkom og melanom
Skal håndteres av spesialavdeling for gitte diagnoser.
Kjemoterapi av non-UTC og blandet histologi ved MIBC
Ved rene non-UTC svulster i blære er det kun vist gevinst av neoadjuvant kjemoterapi ved småcellet carcinom, mens adjuvans ikke har dokumentert effekt (Berg et al., 2019; Vetterlein et al., 2017).
En subanalyse av SWOG S8710 har imidlertid vist at UTC med plateepitel- og glandulær (adenocarcinom-)differensiering, har effekt av neoadjuvant kjemoterapi, og antydningsvis bedre enn ved ren UTC (Scosyrev et al., 2011). Se også Figur 2 i Willies 2015 (Willis et al., 2015a).
Instillasjons-behandling av non-UTC og blandet histologi ved NMIBC
Ved rene non-UTC NMIBC-svulster finnes ingen dokumentasjon for gevinst av BCG- instillasjonsbehandling og tilgjengelige oversiktsartikler anbefaler direkte cystektomi (Moschini et al., 2017).
Ved NMIBC med variant-differensiering finnes det lite dokumentasjon for gevinst av BCG- instillasjon, men resultatene spriker. De publiserte retrospektive studiene viser høyere andel progresjon og metastaser, samt dårligere sykdomsspesifikk overlevelse enn ved ren UTC (Gofrit et al., 2016; Shapur et al., 2011). Plateepitel-differensiering kan også predikere dårlig effekt av intravesikal kjemoterapi (Li et al., 2018). Anerkjente sentra anbefaler derfor at BCG kun tilbys velinformerte pasienter med plateepitel-, adenocarcinom- eller nested differensiering uten mistanke om residual tumor etter TURB. For UTC-varianter med sarkomatoid, plasmocytoid eller mikropapillær differensiering, anbefales direkte cystektomi. Ren eller blandet småcellet NMIBC skal ha neoadjuvant kjemoterapi og cystektomi. Se også Figur 1 i Willies 2015 (Willis et al., 2015a).
Metaplasi
Plateepitelmetaplasi er relativt hyppig forekommende, og betydningen for utviklingen av carcinom er omdiskutert. Det har derfor vært hevdet at pasientene bør følges regelmessig med cystoskopi, og spesielt hvis det foreligger andre risikofaktorer for UTC, for å avdekke utvikling til carcinom.
I keratinisernde form kan det kliniske bildet fremstå urovekkende med meget grumset illeluktende urin, flassende slimhinne, og residiverende UVI er hyppig forekommende (Khan et al., 2002). Cystektomi kan derfor være indisert av palliative grunner, og det har vært anbefalt cystektomi dersom metaplasien inntar mer enn 50% av blæren.
Blærepapilomer utgjør en liten andel av neoplasier i blæren, og finnes også i en invertert form. Sannsynligheten for malign transformasjon er ikke sikkert vist, men en pragmatisk oppfølging som ved low risk NMIBC har vært foreslått (Sweeney et al., 2017).
Anbefalinger:
- Behandling av ikke-urotelial cancer:
- Rene varianter av non-UTC og og sjeldne differensieringer av UTC skal MIBC behandles med direkte cystektomi.
- De vanligste differensierte UTC-varianter av MIBC bør vurderes for neoadjuvant kjemoterapi.
- BCG er dårlig dokumentert ved differensierte varianter av NMIBC, og bør bare tilbys informerte pasienter med plateepitel-, adenocarcinom- eller nested differensiering uten resttumor.
- Småcellede carcinomer metastaserer tidlig og behandles uavhengig av infiltrasjon med kjemoterapi som ved småcellet lungecarcinom.
- Sarkomer og andre mesenkymale tumores behandles iht. egne protokoller.
Behandling av UTUC
Sist faglig oppdatert: 21.09.2023
Kirurgisk behandling for UTUC
Kirurgi er eneste kurative behandlingen ved påvist kreft i øvre urinveier. Gullstandard er nefroureterektomi (NU) med komplett eksisjon av ureterostiet uansett hvor tumor ligger. Endoskopisk behandling er imidlertid blitt vanligere siste år som alternativ ved svulster med lavere risiko.
Endoskopisk ureterorenoskopisk eller perkutan behandling med laserablasjon var i starten forbeholdt pasienter der NU var kontraindisert, men er nå akseptert som behandling av utvalgte tumores i elektiv setting. Overlevelsen etter endoskopisk behandling av lavgradige svulster er sammenlignbar med NU, med opptil 80 % bevaring av aktuelle nyre (Cutress et al., 2012; Hoffman et al., 2014; Margulis et al., 2009). Endoskopisk behandling bør derfor være første valg ved små, lavgradige svulster. Endoskopisk behandling av høygradige svulster er ikke anbefalt. Kriterier for endoskopisk behandling:
- Histologisk verifisert lavgradig tumor, gjentatte biopsier anbefales pga. risiko for undergradering (Wang et al., 2012)
- Svulsten må ha en størrelse og lokalisasjon som gjør endoskopisk behandling mulig (<2 cm)
- Mulighet for tett oppfølging med ureterorenoskopi pga. risiko for tilbakefall
- Behandling bør foregå på et senter med nødvendig volum og erfaring for slik behandling
Nefroureterektomi er anbefalt ved høygradig tumor og ved lavgradig tumor som ikke egner seg for endoskopisk behandling. Tilbakefall er relativt vanlig og det er generell konsensus om at komplett eksisjon av ureterostiet er obligat uten at viktigheten av dette er veldig godt dokumentert (Rouprët et al., 2013). Flere alternative metoder for eksisjon av ostiet både åpent, transuretralt og laparoskopisk har vært beskrevet, hvor alle metoder har vist akseptable resultat, med unntak for intussepsjon (Macejko et al., 2008). Radikal nefroureterektomi har komplikasjonsrate på 8-17 % hvor av major komplikasjoner på 4 %. Perioperativ mortalitet på ca.1 % (Hanna et al., 2012; Ni et al., 2012). Laparoskopisk NU (LNU) har i flere, større, retrospektive studier vist likeverdig onkologisk resultat som åpen NU, med mindre blødning og kortere liggetid (Capitanio et al., 2009; Fairey et al., 2013). En mindre, men prospektiv randomisert studie med 80 pasienter viste bedre kreftspesifikk overlevelse ved åpen NU sammenlignet med LNU ved T3/T4-sykdom (Simone et al., 2009). Robotassistert LNU er brukt i økt grad, og har samme kreftspesifikke overlevelse som åpen og LNU (Aboumohamed et al., 2015; Clements et al., 2018; Rodriguez et al., 2017).
Ureterreseksjon av distale ureter med reimplantasjon til urinblære kan brukes med gode resultater ved lavgradig tumor i distale ureter som ikke kan behandles endoskopisk. Dette kan også brukes ved høygradig tumor, dersom NU er kontraindisert på grunn av nyresvikt eller annen komorbiditet (Colin et al., 2012).
Lymfeknutedisseksjon
Det er en klar sammenheng mellom T-stadium og forekomst av lymfeknutemetastaser. Forekomsten er lav ved Ta/T1-svulst (2 %), men stiger til 6 % og 15 % ved T2- og T3/T4-sykdom (Lughezzani et al., 2010). En prospektiv studie har vist bedre overlevelse ved NU+LND hos pasienter med T2+ sykdom i nyrebekkenet sammenlignet med en lignende pasientgruppe behandlet med NU alene. Andre, større, retrospektive studier har ikke klart å vise bedre overlevelse, men har vist nytten av LND som staging prosedyre for å selektere pasienter med N+ sykdom til adjuvant kjemoterapi eller tettere kontrollopplegg. 5-årsoverlevelsen til pasienter med N+ sykdom er rundt 30 %, slik at den potensielle kurative effekten av lymfeknutetoalett hos denne gruppa er diskutert (Roscigno et al., 2011).Fordelingen av positive lymfeknuter er beskrevet i to artikler. Ved nyrebekkentumor på høyre side kan man få med opp mot 95 % av positive lymfeknuter ved å ta med hilus, para- og retrocavale samt interaortocavale knuter. På venstre side kan en få med opptil 90 % av positive lymfeknuter ved å ta hilus og paraaortale knuter (Kondo et al., 2007; Matin et al., 2015). Omfanget av lymfeknutetoalett ser ut til å ha betydning for overlevelse (Roscigno et al., 2009).
To, randomiserte studier har vist at en enkeltinstillasjon av mitomycin C eller pirarubicin postoperativt etter NU signifikant reduserer forekomst av blæreresidiv det første året (Ito et al., 2013; O'Brien et al., 2011).
Ureterektomipreparater, preanalytisk håndtering
Preparatet sendes til patologiavdeling jf. lokale retningslinjer. Hvis preparatet sendes på formalin eller annen fikseringsvæske, bør ureter klippes opp til eventuell tumor fra begge sider. Preparatet bør orienteres og merkes mtp. distale/proksimale reseksjonsrand. Man bør tilstrebe så lav grad av klemskade av reseksjonsrendene som mulig.
Mengde vev/fikseringsvæske bør være minst 1:10.
Prøveglass og remisse må merkes med fullstendig pasient-ID og gode kliniske opplysninger.
Anbefalinger:
- Tilby endoskopisk behandling for lavgradig tumor (evidensgrad C).
- Tilby endoskopisk behandling ved høygradig tumor og singel nyre eller redusert nyrefunksjon når det ikke reduserer kreftspesifikk overlevelse i forhold til radikal nefroureterektomi (evidensgrad C).
- Tilby ureterreseksjon av distal ureter hos de med høygradig tumor hvis redusert nyrefunksjon eller singel nyre (evidensgrad C).
- Radikal nefroureterekotomi er gullstandard ved høygradig sykdom, multifokalitet, og store svulster (evidensgrad B).
- Gjør lymfeknutetoalett ved T2-sykdom (evidensgrad C).
- Postoperativ singelshot kjemoinnstillasjon reduserer tilbakefall i blæren (evidensgrad B)
Kjemoterapi og strålebehandling for urotelial kreft i øvre urinveier
Det anbefales adjuvant gemctiabin og platinumbasert kjemoterapi til pasienter med kreft i øvre urinveier (UTUC), stadium pT2-T4 pN0-2 og alle pN1-2 på bakgrunn av en randomisert fase 3 studie (POUT-studien) (Birtle et al., 2020). Pasienter (n=261) i god allmenntilstand (ECOG 0-1) med histologisk bekreftet UTUC, pT2-pT4 pN0-3 ble randomisert til 4 x 21-dagers sykler gemcitabin og cisplatin eller gemcitabin og karboplatin ved GFR 30-49 ml/min (n=132) eller observasjon (n=129). Adjuvant kjemoterapi ga en signifikant bedret sykdomsfri overlevelse (hazard ratio 0.45, 95% KI 0.30-0.68; p=0.0001) etter en median oppfølging på 30.3 måneder. Estimert sykdomsfri overlevelse etter 3 år var 75% for kjemoterapi og 46% for observasjon. Kjemoterapien ble gitt innen 3 måneder etter operasjonen. Ved GFR ≥ 70 ml/min ble det gitt standard cisplatin og ved GFR 50-69 ml/min ble cisplatin gitt etter nyresparende regime med cisplatindosen fordelt over to døgn. Ved GFR 30-49 ml/min ble det i stedet gitt karboplatin (AUC 4.5-5.0). Andre årsaker enn nedsatt nyrefunksjon for at pasienten ikke kunne få cisplatin, var ikke tillatt. En systematisk oversikt og metaanalyse av perioperativ kjemoterapi, konkluderte med at det sannsynlig er en overlevelsesgevinst av platinumbasert kjemoterapi (Gregg et al., 2018). Det konkluderes med at det er holdepunkter for at karboplatin kan være et alternativ for pasienter som ikke tolererer cisplatin. I en amerikansk observasjonsstudie (n=3253) ble adjuvant kjemoterapi sammenlignet med observasjon hos pasienter med lokal-/lokoregional avansert sykdom, pT3-4 og /eller pN1 (Seisen et al., 2017). Totaloverlevelsen var signifikant høyre etter kjemoterapi (47 mnd. versus 36 mnd.). Redusert nyrefunksjon er vanlig hos pasienter med urotelial kreft i øvre urinveier. Det er vist at over halvparten av pasientene med adekvat nyrefunksjon før nefroureterektomi ikke lenger er kandidater for cisplatin etter operasjon på grunn av forverring av nyrefunksjonen (Yafi et al., 2014). Det anbefales at alle pasienter drøftes på multidisplinært tverrfaglig møte med tanke på perioperativ kjemoterapi. Neoadjuvant kjemoterapi kan vurderes til selekterte pasienter med radiologisk avansert sykdom og spesielt der nefrektomi sannsynlig vil svekke nyrefunksjonen slik at adjuvant cisplatinbasert kjemoterapi ikke kan gis.
Litteratur om systematiske undersøkelser av strålebehandling mot primærsvulster utgående fra urotelet i øvre urinveier mangler. Strålebehandling som ledd i kurativt rettet behandling av UTUC, anbefales primært ikke.
Behandling av pasienter med metastatisk sykdom baserer seg på erfaring med pasienter med blærekreft. Studiene har ofte inkludert pasienter med urotelial kreft generelt og ikke blærekreft spesielt.
Anbefalinger:
- Alle pasienter med nyoppdaget, avansert urotelial kreft i øvre urinveier (nyrebekken eller ureter) uten fjernmetastaser, bør diskuteres på multidisiplinært tverrfaglig møte med tanke på kjemoterapi.
- Adjuvant platinumbasert behandling anbefales til pasienter i god allmenntilstand (ECOG 0-1) med UTUC, stadium pT2-T4 pN0-2 og alle pN1-2. Det gis 4 kurer gemcitabin og cisplatin hver 3. uke ved GFR ≥ 50 eller gemcitabin og karboplatin ved GFR 30-49. Behandlingen bør starte innen 90 dager postoperativt. Evidensgrad A.
- Neoadjuvant behandling kan vurderes til pasienter i god allmenntilstand (ECOG 0-1) og god nyrefunksjon (GFR ≥ 60) med radiologisk avansert sykdom cT3-T4 og/eller cN1-2 og/eller hvor nefrektomi sannsynlig vil svekke nyrefunksjonen slik at adjuvant cisplatin ikke kan gis. I denne situasjonen anbefales 3 doseintensiverte M-VAC-kurer eller 3 kurer gemcitabin og cisplatin hver 3. uke. Evidensgrad C.
- Kurativt rettet strålebehandling anbefales ikke.
- For pasienter med fjernmetastaser anbefales systemisk behandling etter samme retningslinjer som for metastaserende urinblærekreft.
Behandling av urethracancer
Sist faglig oppdatert: 21.09.2023
Urethracancer er en sjelden sykdom som utgjør < 1 % av alle kreftsykdommer i urogenitaltraktus. Behandlingen er avhengig av TNM-stadium , lokalisasjon og histologisk subtype. Uroteliale carcinomer er hyppigst (54-65%) etterfulgt av plateepitelcarcinomer (16-22%) og adenocarcinomer (10-16%) i følge EAU. Urethracancere hos menn lokalisert i penile eller bulbære del av urethra, anbefales henvist til senter som behandler peniscancer.
Ved primærcancer i urethra anbefales reseksjon eller radikal kirurgi med urethrectomi (Karnes et al., 2010; Torbrand et al., 2017). Ved primær urethracancer uten påvist cancer i urinveiene for øvrig, er det i utgangspunktet ikke indikasjon for radikal cystektomi.
CIS i prostatiske del av urethra kan behandles med intravesikal BCG, men TUR av prostata på forhånd anbefales for å bedre eksponeringen av BCG i aktuelle område av urethra. Hvis det også foreligger CIS i det prostatiske gangsystemet, skal cystektomi vurderes.
Ved cancer vesica hos menn med innvekst av urotelialt carcinom i pars prostatika urethra (T4a blærekreft) anbefales radikal cystoprostatektomi med urethrectomi.
Hos kvinner er det ikke anbefalt å gjøre biopsier av urethra rutinemessig ved påvisning av blærekreft. Anbefalt behandling av urethracancer hos kvinner er total urethrectomi og urinavledning med eksempelvis appendico-vesikostomi (Dimarco et al., 2004; Karnes et al., 2010).
Det er ikke grunn til å gjøre samtidig cystektomi dersom man kan oppnå frie histologiske render mot blærehals. Lokal eksisjon av distale tumores er også forsvarlig dersom man kan oppnå frie histologiske render, men vil gi økt risiko for tilbakefall.
Alle uroteliale cancere, ≥ T2, bør vurderes for neoadjuvant kjemoterapi etter samme retningslinjer som ved blærecancer før radikal lokal behandling, primært kirurgi. Radio(-kjemo)terapi kan være et alternativ til pasienter som ikke er operable eller ikke ønsker operasjon.
Tekst og anbefaling bygger på EAU Guidelines på Primary Urethral Carcinoma (Gakis et al., 2020).
Anbefalinger:
- Urethracancer er sjeldne og skal diskuteres i tverrfaglig møte.
- Primær urethracancer uten annen lokalisasjon av UTC hos kvinner kan behandles med lokal reseksjon, men forutsetter sikker fri margin.
- Primær urethracancer uten annen lokalisasjon av UTC hos menn kan behandles med urethrectomi, men forutsetter sikker fri margin.
- Ikke-infiltrerende UTC og CIS i prostatisk urethra kan behandles med TURP og BCG.
- Ved ductal eller stromal infiltrasjon eller manglende effekt av BCG på UTC i prostata skal pasienten tilbys cystoprostatektomi med utvidet lymfeknutedisseksjon.
- Ved lokalavansert urethracancer bør cisplatin-basert neoadjuvant behandling vurderes.
Palliativ behandling
Sist faglig oppdatert: 21.09.2023
Noen pasienter med muskelinvasiv blærekreft kan ikke gjennomgå radikal behandling, enten fordi sykdommen er for avansert eller fordi pasienten er uegnet pga alder, komorbiditet eller andre forhold. Også et betydelig antall pasienter som har gjennomgått radikalkirurgi eller kurativt rettet strålebehandling vil få lokalt, regionalt eller metastatisk tilbakefall av kreftsykdommen. Disse pasientene vil ha ulike plager, alt etter hvor sykdomstilbakefallet er lokalisert. Det er behov for palliative tiltak mot disse plagene, men felles for disse tiltakene er at det er forholdsvis sparsomt med dokumentasjon, og randomiserte studier er praktisk talt fraværende. Mye er basert på erfaringer og publiserte mindre pasientserier. Oftest vil det bli en helt individuell vurdering av hvilket tiltak som er best for pasienten. En gjennomgang av litteratur for kirurgisk og miniinvasiv behandling for lindring av urologisk relatert symptomer ble publisert av Senter for medisinsk metodevurdering i 2003 (Giercksky et al., 2003).
Behandling av lokale og lokoregionale symptomer
Sist faglig oppdatert: 21.09.2023
Hematuri
Ved tumorindusert hematuri vil palliativ TURB/koagelevakuering ofte være aktuelt. Palliativ stråleterapi (se kap. Palliativ kirurgi) eller blæreskyllinger med adstringerende substanser (aluminiumhydroksyd, formalin) kan vurderes i tillegg. Blæreskylling med aluminiumkaliumsulfat 1 % kan gjøres uten anestesi og har beskjedne bivirkninger. Komplett respons på 66 % er rapportert i en mindre pasientserie (Arrizabalaga et al., 1987). Instillasjon av formalin 1–4 % er meget effektivt, men mer smertefullt og krever anestesi (Ghahestani et al., 2009). Denne behandlingen kan gi blærefibrose.
Radiologisk selektiv embolisering av grener fra arteria iliaca interna til blæren kan vurderes hvis ovennevnte metoder ikke fører frem. I en serie på 44 pasienter med kreftrelatert blødning fra urinblæren (24 av disse med blærekreft) ble det oppnådd umiddelbar blødningskontroll hos 82 %. Etter en median observasjonstid på 10,5 måneder var fortsatt 43 % uten blødning (Liguori et al., 2010).
Husk også alltid å vurdere om det kan være andre årsaker til hematuri, som at pasienten bruker blodfortynnende medikamenter. Ved stråleindusert cystitt som bakgrunn for hematuri kan hyperbar oksygenmetning vurderes (Oliai et al., 2012) ved Senter for hyperbar medisin, Haukeland Universitetssykehus i Bergen.
Ureterobstruksjon
Ved ureterobstruksjon som gir kreatinin-stigning bør en vurdere nefrostomi ved bilateral obstruksjon hos pasienter som har en viss forventet levetid og relativt god allmenntilstand. Lokale symptomer fra den hydonefotiske nyren som smerter og infeksjon gjør også nefrostomi aktuelt. For pasienter som skal ha kjemoterapi bør bilateral nefrostomi vurderes for å sikre optimal nyrefunksjon. For øvrige pasienter vil oftest ensidig nefrostomi være tilstrekkelig. Man velger da den nyren som radiologisk ser ut til å ha mest parenkym. Spørsmål om konvertering fra nefrostomi til intern ureterstent vil ofte komme. Ved blærekreft med lokal plager fra blæren, vil disse gjerne bli verre med intern stent, og pasienten bør frarådes dette. Dessuten må slike stenter skiftes under generell anestesi mens det ved skifting av nefrostomi normalt utføres med maksimalt lokalanalgesi. Hos pasienter som er aktuelle for palliativ cystektomi, vil ureterobstruksjonen oppheves med urinavledningen som da lages (se kap. Kontroll etter kjemoterapi for avansert kreft).
Tumor-indusert vesicovaginal fistel
Ved vesicovaginal fistel bør blærekateter, evt. bilateral nefrostomi vurderes, men nefrostomi har ofte begrenset effekt på urinlekkasjen gjennom fistelen dersom det ikke samtidig også foreligger noe ureterobstruksjon. Dette er derfor en situasjon der palliativ cystektomi kan vurderes hos egnede pasienter, som ikke har fjernmetastaser og med en viss forventet levetid.
Smerter
Smerter fra enten tumor lokalt i blære eller fra metastaser skal behandles med analgetika etter gjeldende behandlingsprinsipper (Aass et al., 2015). I tillegg vurderes pasientene for enten palliativ stråleterapi eller palliativ kjemoterapi avhengig av sykdomsutbredelse, forventet levetid og allmenntilstand.
Skjelettmetastaser
Ved skjelettmetastaser anbefales fraksjonering 8 Gy x 1 dersom kun smerter er indikasjonen, eller 3 Gy x 10 dersom kompresjon av nerver eller medulla. Ved skjelettmetastaser fra blærecancer er det dokumentert at administrering av Zoledronsyre (Zometa®) 4 mg iv en gang i måneden reduserer insidensen av skjelett-relaterte hendelser med 59 % sammenlignet med placebo (Zaghloul et al., 2010). Zometa er godkjent «hos voksne pasienter med utbredt sykdom som involverer skjelettet» (Felleskatalogen), og bør således benyttes også hos pasienter med skjelettmetastaser fra blærecancer. Denosumab (Xgeva®) er også godkjent ved skjelettmetastaser fra solide svulster, og har den fordelen av det kan anvendes også ved nedsatt nyrefunksjon (Saylor et al., 2013).
Palliativ systemisk behandling
Sist faglig oppdatert: 21.09.2023
Førstelinjes behandling
Kjemoterapi
Omtrent 10–15 % av pasienter med muskelinfiltrerende blærekreft har påvisbare metastaser ved diagnosetidspunkt (Rosenberg et al., 2005). Videre vil omtrent halvparten av cystektomerte pasienter få tilbakefall av sykdommen, ca. 30 % som lokale residiv i bekkenet, øvrige med fjernmetastaser. Median overlevelse uten kjemoterapi er samlet 3–6 måneder for pasienter med metastaser (Sternberg et al., 2003).
Blærekreft med metastaser er en kjemosensitiv sykdom, og cisplatin er det mest effektive cytostatikum ved behandling av urotelcarcinom (Stenzl et al., 2011). For at cisplatinbaserte regimer skal kunne anvendes, bør pasientene ha en rimelig god nyrefunksjon (GFR >60 ml/min) og relativt god allmenntilstand med ECOG-status ≤ 1. Cisplatin i kombinasjon med metotrexat, vinblastin og adriamycin (M-VAC) eller i kombinasjon med gemcitabin (GC) har best dokumentert effekt som førstelinjes behandling ved metastatisk sykdom. Begge regimer gir en responsrate på ca. 50 %, og forlenger median overlevelse til ca. 14 måneder. GC-kombinasjonen er mindre toksisk enn M-VAC med færre akutte dødsfall, samt en lavere forekomst neutropene infeksjoner, grad 3/4 mucositt og alopeci (von der Maase et al., 2000). Dermed er GC-kombinasjonen standard behandling ved avansert sykdom hos pasienter som egner seg for cisplatin. Total 5-års overlevelse er 7 % for M+-pasienter med viscerale metastaser, versus 21 % for pasienter uten viscerale metastaser etter behandling med cisplatinbasert kjemoterapi (von der Maase et al., 2005) Det å legge til nye stoffer til GC-regimet, f.eks. trippelbehandling med gemcitabin/cisplatin/paclitaxel har ikke vist økt overlevelse. Heller ikke doseintensivert behandling eller sekvensiell behandling har vist effekt utover standard cisplatinbasert behandling.
Omtrent 50 % av pasientene er uaktuelle for cisplatinbasert kjemoterapi i førstelinje grunnet nedsatt nyrefunksjon, nedsatt allmenntilstand eller annen organsykdom som f.eks. hjertesvikt. Ved kontraindikasjoner mot cisplatinbasert kjemoterapi er kombinasjonen karboplatin/gemcitabin best dokumentert (De Santis et al., 2012). En anvendte her karboplatin dosert på areal under kurven på 4.5. Denne kombinasjonen har gitt en responsrate på 41 %, og en totaloverlevelse på median på 9.3 måneder.
Immunterapi
Platinumbasert kombinasjonskjemoterapi er førstevalget ved behandling av urotelialt carcinom. Men opp til 2/3 av pasientene kan være uaktuelle for denne behandlingen grunnet nyre- eller hjertesvikt, annen komorbidet eller nedsatt allmenntilstand. To en-armede fase II studier har testet ut effekten av immunterapi i første linje for pasienter som ikke kan motta platinumbasert kjemoterapi (Balar et al., 2017a; Balar et al., 2017b). Pembrolizumab ble testet hos 370 pasienter med lokalavansert eller metastatisk urotelialt carcinom uegnet for cisplatin. Resultatene viste ORR på 29% og komplett respons hos 7% av patientene (Balar et al., 2017a). Atezolizumab ble evaluert i samme pasientpopulasjon i en fase II studie med 119 pasienter, hvor resultatene viste en ORR på 23% og komplett respons i 9% av pasientene (Balar et al., 2017b). Atezolizumab ble høsten 2022 godkjent av Beslutningforum som monoterapi til behandling av voksne med lokalavansert eller metastatisk urotelialt carcinom som ikke anses som egnet for cisplatin og hvor tumor har et PD-L1-uttrykk ≥5%. 9.2.1.3 Kombinasjonsbehandling platinumbasert kjemoterapi og immunterapi
Kjemoterapiresistens begrenser både totaloverlevelse og progresjonsfri overlevelse hos pasienter ved metastatisk blærekreft. De fleste pasienter har sykdomsprogresjon innen 9 måneder etter avsluttet førstelinjes behandling med platinumbasert kjemoterapi. Ved flere andre kreftsykdommer er det anbefalt å legge til vedlikeholdsbehandling med annet medikament etter standard behandling for å øke overlevelsen (Grivas et al., 2019).
I Javelin 100 studien ble 700 pasienter med inoperabel eller metastatisk urotelialt carcinom som ikke hadde progresjon etter 4-6 kurer platinumbasert kjemoterapi randomisert til vedlikeholdsbehandling med PD-L1 hemmereren avelumab pluss best supportive care versus best supportive care alene. Avelumab ble gitt i dose 10 mg/kg gitt hver 2. uke. Resultatene fra denne fase 3 studien viste 1 års overlevelse på 71% i avelumabgruppen vs 58% i kontrollgruppen (median overlevelse 21,4 vs 14,3 mnd; HR 0,69, P = 0,001). I den PD- L1 positive populasjonen i avelumabgruppen var det også en signifikant bedre 1 års overlevelse (79% vs 60% i kontrollgruppen). Progresjonsfri overlevelse var signifikant bedre med 3,7 mnd i avelumabgruppen vs 2,0 mnd i kontrollgruppen, og 5,7 mnd i PD-L1 positive populasjonen vs 2,1 mnd i kontrollgruppen. Den forbedrede totaloverlevelsen og progresjonsfri overlevelse mener man styrker indikasjon for å starte tidlig med immunsjekkpunkthemmere etter kjemoterapi i stedet for å vente til progresjon. Blant annet så man ingen hyperprogresjon hos pasienter i avelumabgruppen (Powles et al., 2020). Ingen andre studier har vist at kjemoterapi eller annen målrettet behandling som vedlikeholdsbehandling etter standard kjemoterapi for urotelialt carcinom har resultert i forlenget levetid.
Andre-, tredje- og fjerdelinjes behandling
Immunterapi
Til nå har man anbefalt at pasienter med god initial respons og med en lang progresjonsfri periode (minimum 6 måneder, og ikke har fått vedlikeholdsbehandling med immunsjekkpunkthemmere) bør vurderes for ny behandlingssyklus med GC eller M-VAC.
Ved svikt på cisplatin-basert kjemoterapi hos pasienter som fortsatt er i god allmenntilstand (ECOG ≤1), kan andrelinjes behandling vurderes.
I en randomisert fase 3 studie (Keynote 045) ble PD-1 hemmeren pembrolizumab sammenlignet med kjemoterapi (paclitaxel, docetaxel eller vinflunin) hos 542 pasienter med avansert urotelial kreft som hadde residivert eller progrediert etter cisplatinbasert kjemoterapi (Bellmunt et al., 2017). Pasientene behandlet med pembrolizumab hadde signifikant økt median totaloverlevelse (10.3 vs. 7.4 mnd.; p=0.002). Den objektive responsraten var signifikant høyere for pembrolizumab (21.1 % vs. 11.4 %; p=0.001) og behandlingen ga færre bivirkninger. Nytten av pembrolizumab syntes å være uavhengig av PD-L1 utrykk på tumorceller og immunceller. Pembrolizumab anbefales som andrelinjes behandling for pasienter i bra allmenntilstand (ECOG ≤ 2).Pembrolizumab gis i fast dosering, 200 mg iv hver 3. uke.
I en tilsvarende randomisert fase 3 studie (IMvigor211) ble PD-L1 hemmeren atezolizumab sammenlignet med kjemoterapi (paclitaxel, docetaxel eller vinflunin) hos 931 pasienter med avansert urotelial kreft som hadde residivert eller progrediert etter cisplatinbasert kjemoterapi (Powles et al., 2018). Det primære endepunktet var totaloverlevelse. Dette ble testet hierarkisk i predefinerte grupper avhengig av PD-L1 utrykk på tumorinfiltrerende immunceller, IC2/3 (≥5 % ekspresjon) etterfulgt av IC1/2/3 (1-<5 %), etterfulgt av «intention to treat» populasjonen. I gruppen med IC2/3 (n=234) var totaloverlevelsen ikke signifikant bedre enn i kjemoterapigruppen (median 11.1 vs 10.6 mnd). Den objektive responsraten var 23 % for atezolizumab og 22 % for kjemoterapi, og dette utelukket formelle statistiske analyser av de etterfølgende populasjonene. Median varighet av respons var tallmessig lengre for atezolizumab enn for kjemoterapi (15.9 mnd vs 8.3 mnd). I «intention to treat» populasjonen var det færre av de som fikk atezolizumab enn av de som fikk kjemoterapi som fikk grad 3–4 bivirkninger (20 % vs 43 %) og som måtte avbryte behandlingen på grunn av bivirkninger (7 % vs 18 %). Atezolizumab anbefales fremfor kjemoterapi som andrelinjes behandling til pasienter i bra allmenntilstand (ECOG ≤ 2). Atezolizumab gis i fast dosering 1200 mg iv hver 3. uke.
PD1-hemmeren nivolumab har blitt testet i en enarmet fase 2 studie (CheckMate275) hos pasienter som tidligere har progrediert eller residivert etter platinabasert kjemoterapi (n=270) (Sharma et al., 2017). Objektiv responsrate var 19.6 % og respons ble sett for alle nivåer av PL-L1 ekspresjon på tumorcellene. Etter 7 måneders oppfølging var median totaloverlevelse 8.7 mnd. For pasienter som responderte var median responstid ikke oppnådd (7.43 mnd – «not reached») og 77 % hadde fortsatt respons. Nivolumab anbefales som alternativ til kjemoterapi som andrelinjes behandling til pasienter i bra allmenntilstand (ECOG ≤ 2). Nivolumab doseres etter vekt, 3 mg/kg iv hver 2. uke. Ingen av PD1-/PD-L1 hemmerne er sammenlignet direkte mot hverandre.
Genetisk testing ved immunterapi
I forbindelse med immunterapi med PD1/PD-L1 hemmere for urotelkreft reises det tidvis spørsmål om testing av tumor for PD-L1. Slik testing tilbys pr. i dag ikke i Norge, og testing anbefales heller ikke av EAU ved andrelinjes behandling av urotelkreft (Grimm et al., 2019). Det er dessuten ingen internasjonal enighet om en standardisert metode for slik testing, i hovedsak begrunnet i at hvert enkelt av medikamentene kun er validert mot testing med hvert sitt tilhørende antistoff, med dertil tilhørende metode for vurdering/scoring av tumorvevet (ved immunhistokjemisk undersøkelse). Testing med én spesifikk metode vil såldes ikke nødvendigvis være til nytte dersom et av de andre medikamentene skal benyttes.Man avventer derfor undersøkelser med tanke på å finne frem til én enkelt test- og vurderingsmetode som kan benyttes for samtlige medikamenter.
Kjemoterapi
Dokumentasjon av overlevelsesgevinst av kjemoterapi i andre linje er svak. Det foreligger bare en randomisert fase III-studie. Vinflunin, et 3. generasjons vinkaalkaloid, ble testet mot «best supportive care (BSC)» hos pasienter tidligere behandlet med platinum-basert kjemoterapi (Bellmunt et al., 2013; Bellmunt et al., 2009). Denne studien gav en total responsrate på 8.6 % i vinflunin-armen, og ingen statistisk signifikant forskjell i totaloverlevelse versus BSC i «intention to treat»-populasjonen (n=370, 6.9 md vs.4.6 md, p=0.29). Imidlertid ble denne forskjellen signifikant etter eksklusjon av pasienter som ikke oppfylte inklusjonskriteriene (n=357, 6.9 md vs. 4.3 md, p=0.04) (Bellmunt et al., 2009). Vinflunin ga en del bivirkninger, med forstoppelse, anemi og neutropeni som de hyppigste grad 3–4 bivirkningene. Vinflunin kan vurderes ved svikt på førstelinjes behandling hos pasienter i god allmenntilstand (ECOG ≤1). Behandlingen kan gis så lenge pasienten responderer eller har stabil sykdom og toksisiteten er akseptabel ved dosering ned til 250 mg/m2.
Små fase II-studier med blant annet paclitaxel, nab-paclitaxel, docetaxel, topotecan, pemetrexed, gemcitabine og ifosfamid gitt som monoterapi har vist objektive responsrater på mellom 9 og 29 %, men overlevelsesgevinst er ikke vist i prospektive, randomiserte studier (Oing et al., 2016). Kombinasjonsbehandling, spesielt taxanbaserte regimer, har vist høyere responsrater i små enarmede fase II-studier. Dette gjelder spesielt kombinasjonen paclitaxel og gemcitabin (responsrater på mellom 30 og 70 %) og paclitaxel og karboplatin (responsrater på mellom 16 % og 33 %), men toksisiteten er høyere og overlevelsesgevinst er ikke vist i prospektive, randomiserte studier (Oing et al., 2016). I en metaanalyse hvor man sammenlignet ett stoffs regimer med to stoffs regimer var responsraten høyere og den progresjonsfrie overlevelsen lengre ved kombinasjonsbehandling, men totaloverlevelsen var ikke signifikant høyere. Når man sammenlignet med vinflunin eller et taxan som monoterapi, var forskjellen signifikant kun for responsraten (Raggi et al., 2016). Taxan som monoterapi, kan vurderes som alternativ til vinflunin ved svikt på førstelinjes behandling hos pasienter i god allmenntilstand (ECOG ≤ 1).
Målrettet terapi i form av tyrosin kinase inhibitorer (TKI), mammalian target of rapamycin (mTOR) hemmere og monoklonale antistoffer som bevacizumab har blitt testes ut hos pasienter med metastatisk blærecancer med progresjon på tidligere kjemoterapi. Ingen av disse stoffene gav noen effekt på overlevelse, og TKI i kombinasjon med kjemoterapi gav økt toksisitet (Vogelzang, 2013).
Antistoff-behandling
Pasienter som progredierer på platinumbasert kjemoterapi og immunterapi har svært dårlig prognose. Nectin-4 er et celleoverflateprotein som er høyt uttrykt ved urotelialt carcinom og bidrar mulig inn i tumorcellevekst og proliferasjon. Enfortumab vedotin er humant monoklonalt antistoff rettet spesifikt for nectin-4 og det mikrotubulinforstyrrende midlet monomethyl auristatin E (MMAE) (Challita-Eid et al., 2016). Frigjøring av MMAE forstyrrer mikrotubulinettverket i cellen, noe som fører til cellesyklusarrest og apoptotisk celledød. I en åpen randomisert fase III studie ble pasienter som hadde progrediert på platinumbasert kjemoterapi og sjekkpunkthemmere randomsiert til enten enfortumab vedotin (1.25 mg i.v. per kg kroppsvekt på dag 1, 8 og 15 i en 28-dagers syklus) eller kjemoterapi (taxan eller vinflunin) (Powles et al., 2021). Resulatene viste en signifikant forbedret overlevelse i enfortumab vedotin-armen med en gevinst på 4 mnd (12.88 mnds vs. 8.97 mnd; HR 0.7, 95% CI: 0.56–0.89 ). De vanligste rapporterte bivirkningen var alopecia (45%), perifer nevropati (34%), fatigue (31%, 7.4% > grad 3), nedsatt appetitt (31%), diarè (24%), kvalme (23%) og hudkløe (16%, 7.4% > grad 3).
Enfortumab vedotin som behandling av voksne med lokalavansert eller metastatisk urotelialt carcinom, som tidligere har blitt behandlet med platinumbasert kjemoterapi og PD-1-/PD-L1-hemmer er til metodevurdering i Beslutningsforum.
Se appendiks Cytostaticakurer for tabell med kurbeskrivelser
Anbefalinger:
- Første linje:
- Cisplatinbasert kjemoterapi i kombinasjon med metotrexat, vinblastin og adriamycin (M‑VAC) eller gemcitabin (GC) har best dokumentert effekt som 1.-linjes behandling ved metastatisk sykdom, og egner seg primært for pasienter med tilstrekkelig nyrefunksjon (GFR>60 ml/min) og relativt god ECOG-status. GC foretrekkes fremfor M‑VAC grunnet mindre bivirkninger. Evidensgrad A.
- Ved kontraindikasjoner mot cisplatin grunnet nedsatt nyrefunksjon, nedsatt allmenntilstand eller organsvikt kan kombinasjonen karboplatin/gemcitabin være aktuell. Evidensgrad A.
- Kombinasjonsbehandling med avelumab som vedlikeholdsbehandling anbefales til pasienter som ikke har progrediert på 1.-linjes behandling med platinumbasert kjemoterapi etter 4-6 sykluser. Evidensgrad A
- Ved kontraindikasjon for platinumbasert kjemoterapi er monoterapi med atezolizumab godkjent som palliativ systemisk behandling. Evidensgrad A.
- Andre linje:
- Det anbefales immunterapi hvis dette ikke er gitt som vedlikeholdsbehandling.
- Immunterapi med PD-1 hemmeren pembrolizumab har høyest evidens med dokumentert effekt på overlevelse og anbefales som 2.-linjes behandling. Evidensgrad A .
- PD-L1-hemmeren atezolizumab anbefales som 2.-linjes behandling fremfor kjemoterapi. Evidensgrad A .
- PD1-hemmeren nivolumab anbefales som 2.-linjes behandling fremfor kjemoterapi. Evidensgrad B .
- Det er ikke indikasjon for PD-L1 analyse før behandling med PD1- eller PD-L1 hemmer for behandling i 2. linje.
- Kjemoterapi kan vurderes til pasienter i god allmenntilstand, ECOG ≤ 1.
- Vinflunin kan tilbys som 2.-linjes behandling når immunterapi ikke kan gis. Evidensgrad A .
- Taxan som monoterapi, kan være et alternativ. Evidensgrad C.
- Hvis immunterapi er gitt som vedlikeholdsbehandling, kan pasienter med initial respons på GC og lang progresjonsfri periode (minimum 6 mnd), vurderes for ny behandlingssyklus med GC. Evidensgrad D.
- Tredje linje:
- 3.-linjes behandling kan vurderes til pasienter som fortsatt er i god allmenntilstand (ECOG ≤ 1).
- Vinflunin eller taxan kan gis som 3.-linjes behandling etter manglende effekt av eller progresjon under immunterapi. Evidensgrad D.
- Hvis immunterapi er gitt som 2.-linjes behandling, kan pasienter med initial respons på GC og lang progresjonsfri periode før 2.-linjes behandling (minimum 6 mnd), vurderes for ny behandlingssyklus med GC. Evidensgrad D.
- Fjerde linje:
- 4.-linjes behandling kan vurderes til pasienter som fortsatt er i god allmenntilstand (ECOG ≤ 1).
- Vinflunin eller taxan kan gis som 4.-linjes behandling etter manglende effekt av eller progresjon under GC gitt som rebehandling i 3. linje. Evidensgrad D.
Palliativ strålebehandling
Sist faglig oppdatert: 21.09.2023
Indikasjonen for palliativ stråleterapi er symptomgivende, avansert sykdom. Beslutningen om hvorvidt en skal starte stråleterapi eller kjemoterapi bør baseres på grad av sykdomsutbredelse, allmenntilstand og forventet levetid. Det vises til en oversiktsartikkel i Onkonytt nr 1, 2021 vedrørende palliativ strålebehandling av urinblæren (van Helvoirt, 2021). Symptomer som kan lindres av strålebehandling er 1) hematuri, 2) smerter ved vannlating (dysuri) eller bekkensmerter grunnet lokal innvekst i omkringliggende strukturer eller 3) nedre urinveissymptomer (LUTS). Effekten på hematuri kommer ofte raskt, allerede under eller like etter avsluttet strålebehandling, 80-90% er fri for hematuri etter 3 måneder og median varighet av respons varierer mellom 4 og 9 måneder avhengig av stråledose. Effekten på smerter og LUTS kommer senere, i løpet av ukene etter strålebehandlingen. Opp mot 90% opplever smertelindring og 50-70% opplever bedring av LUTS, median varighet av respons på 7-9 mnd.
I en randomisert studie var det ingen forskjell mellom 7 Gy gitt annenhver dag til totalt 21 Gy eller 3.5 Gy x 10 med 5 fraksjoner per uke (Duchesne et al., 2000), hvor tumor og hele urinblæren ble inkludert i strålefeltet. Da dette er pasienter med begrensede leveutsikter bør en bruke enkle behandlingsopplegg, og minst mulig av pasientens tid til planlegging og gjennomføring av stråleterapi. Ved tvil om prognose og toleranse for behandlingen, kan man velge et regime med en fraksjon per uke og revurdere underveis om man skal fullføre eller avslutte behandlingen. Veiledende for valg av fraksjonering (van Helvoirt, 2021):
Prognose/leveutsikter | Fraksjonering |
|---|---|
< 3 mnd | 8 Gy x 1 (kan gjentas ved behov) |
3 mnd + (tvilsituasjon) | 7 Gy x 3 (1 fraksjon annenhver dag) 5-6 Gy x 6 (1 fraksjon per uke) 8 Gy x 3 (dag 1, dag 8 og dag 22) |
> 4 mnd | 3.5 Gy x 10 (5 fraksjoner per uke) 7 Gy x 3 (1 fraksjon annenhver dag) 6 Gy x 6 (1 fraksjon per uke) |
Anbefalinger:
- Ved symptomer fra svulst lokalt i blæren som smerter, hematuri og vannlatingsbesvær anbefales hypofraksjonert strålebehandling. Evidensgrad A.
Palliativ kirurgi
Sist faglig oppdatert: 21.09.2023
Selv om ca. 70 % får fjernmetastaser kan de lokale problemene ved invasiv blærekreft gi betydelige palliative utfordringer i form av infeksjon, blødning og overvekst på bekkenvegg og nabo-organer med fisteldannelse til tarm, genitalia og perineum. Pollakisuri, smerter og dysuri kan også være meget vanskelig å håndtere konservativt eller medikamentelt, ved betydelig resttumor i blæren. Grundig og gjentatt TURB, vil derfor kunne forebygge en del symptomer, særlig der det ikke er omfattende perivesikal vekst.
Det fremkommer pr i dag ingen studier som vurderer palliativ gevinst av cystektomi ved M+ sykdom. En liten serie har vist gevinst av salvage cystektomi på overlevelse etter primært avbrutt cystektomi med videre kjemoterapi (Guzzo et al., 2008). Gevinst i forhold til senere palliative tiltak eller symptomer ved cystektomi er kun beskrevet for lokalavansert prostatacancer (Kamat et al., 2003; Leibovici et al., 2005). Kurativ eller palliativ indikasjon ved avansert sykdom der metastaser er forventet, men ennå ikke påvist, vil ofte være subjektiv. Indikasjon for lymfeknutedisseksjon må vurderes opp mot prosedyrerelatert morbiditet, men debulking må prinsipielt ansees som gunstig. Etter TNM 2014 er infiltrasjon i lymfeknuter langs arteria iliaca communis ikke lenger M1 men N3 sykdom, men gevinsten av lymfeknutedisseksjon overfor ureters krysning av bekkenkar er likevel diskutabel (Sweeney et al., 2003).
Palliativ cystektomi bør overveies ved stor primærtumor med gjennomvekst uten fiksering, hvor god kontroll med TUR ikke lar seg gjennomføre, men også der pasienten ikke er tilgjengelig for palliativ kjemoterapi. Indikasjonsstilling blir en avveiing mellom forventet levetid og sannsynlige lokale problemer i det enkelte tilfelle. Gjenværende metastase- eller tumorvolum etter operasjon bør være minimalt og pasienten ideelt tilgjengelig for palliativ kjemoterapi, da det ellers har vært observert eksplosiv vekst ved betydelig resttumor (Nieuwenhuijzen et al., 2004). Kort forventet levetid og risiko knyttet til tarmkirurgi, bør medføre vurdering av uretero-kutanostomi som avledning, da dette kan redusere perioperative komplikasjoner. Risiko for kutan ureterstriktur og stomiproblemer er dog betydelig og må vurderes ift risiko ved mer omfattende kirurgi. Pasienter med ureterokutanostomi vil som hovedregel trenge inneliggende stent i stomien.
Ved kirurgisk eksplorasjon som avdekker teknisk inoperabel tumor bør urinavledning med entero-kutanostomi eller cross-over med kutan ureterostomi vurderes av palliative hensyn. Ved tumormasser på bakre bukvegg bør imidlertid nefrostomi foretrekkes pga risiko for rask kompromittering av ureteres ved kutan urinavledning.
Anbefalinger:
- Palliativ cystektomi kan gi økt levetid, særlig i kombinasjon med palliativ kjemoterapi, men kan også være indisert i forbindelse ved oppståtte eller forventede intraktable tumorrelaterte symptomer (evidensgrad D).
Oppfølging
Generelt om oppfølging
Sist faglig oppdatert: 21.09.2023
Hyppigheten og type av kontroller for oppfølging av blærekreft retter seg etter:
- Svulsttype (NMIBC vs. MIBC)
- Målsetning med primærbehandling (kurativ vs. palliativ)
- Mulige konsekvenser av patologiske funn (f.eks salvage cystektomi, palliativ kjemoterapi og/eller behandling av komplikasjoner)
- Psykososiale faktorer
Oppfølging av ikke-muskelinfiltrerende blærekreft
Sist faglig oppdatert: 21.09.2023
Målsettingen med kontroll av ikke-muskelinfiltrerende blærekreft er å oppdage rekurrens av ny ikke-muskelinfiltrerende svulst eller oppdage progresjon til muskelinfiltrerende svulst. Tilbakefall som lavgradig Ta-svulst setter ikke pasienten i noen umiddelbar fare, mens forsinket påvisning og behandling av et tilbakefall med progresjon kan redusere leveutsiktene. Tilbakefall som T1HG bør i praksis vurderes som potensielt livstruende sykdom på linje med muskelinfiltrerende svulst. Med støtte fra EORTC-tabellene vil man kunne risikoklassifisere sykdommen for å se om den enkelte pasienten hovedsakelig er risikoutsatt for residiv eller for progresjon.
Cystoskopi
Cystoskopi er gullstandard i oppfølging etter TURB. Ufullstendig reseksjon, implantasjon av kreftceller i forløpet av TURB eller en svulstbiologi som gir raskt residiv av svulsten, er bakgrunnen for residiv av Ta/T1 blærekreft 3 måneder etter TURB. Resultatet av cystoskopi på dette tidspunkt er en viktig prognostisk faktor for senere residiv og for progresjon (Holmang et al., 2002; Mariappan et al., 2005; Solsona et al., 2000; Sylvester et al., 2006) (evidensgrad B). Derfor anbefales cystoskopikontroll 3 måneder etter TURB for alle pasienter med ikke-muskelinfiltrerende blærekreft.
Det mangler randomiserte studier som indikerer trygge intervaller mellom påfølgende cystoskopikontroller. Anbefalinger (tabell 7) er derfor basert på retrospektiv erfaring (evidensgrad D). I alle studier er antallet tilbakefall størst i de første 2 år av oppfølgingen. Deretter blir antall cystoskopier med positive funn stadig færre.
Ved lav-risiko svulster uten tilbakefall etter 3 måneder kan neste cystoskopi vente i 9 måneder og deretter utføres årlig i til sammen 5–10 år pga. den svært lave risiko for tilbakefall for disse svulstene. Ved residiv vil >95 % av svulstene ha samme histologi som primærtumor og forsinket oppdagelse av et slikt residiv vil normalt ikke være noen risiko for pasienten (Borhan et al., 2003; Fujii et al., 2003; Gofrit et al., 2006; Holmang et al., 2001; Leblanc et al., 1999; Oge et al., 2000; Soloway et al., 2003; Zieger et al., 2000) (evidensgrad B).
I høy-risikogruppen, som utgjør ca. 15 % av pasientene, er cystoskopi hver 3. måned de første 2 år et anbefalt opplegg. Deretter gjøres cystoskopi hver 4. måned i det 3. året, hver 6. måned de neste to årene (til 5 år) og deretter årlig. (Cancer i urinblåsa, njurbäcken, urin-ledare och urinrör: nationellt vårdprogram, 2015)
Oppfølgingen av svulster med intermediær risiko ligger noe imellom de to øvrige risikogrupper.
Ved påvist tilbakefall vil de aller fleste pasientene gjennomgå ny TURB. Ved små og få residivsvulster hos pasienter med tidligere bare lavgradige svulster kan poliklinisk koagulering (laser eller elektro) vurderes. Fortrinnsvis bør svulstene samtidig biopseres (Se kap 7.1 TURB - Poliklinisk behandling). For å redusere antall TURB/tumorkoaguleringer hos den samme pasientgruppen er det i utvalgte tilfelle funnet forsvarlig å utsette bestemmelse av tumordestruksjon til neste cystoskopikontroll (surveillance) (Pruthi et al., 2008).
Risikogruppe | Cystoskopi-intervall etter TURB (re-TURB) |
|---|---|
Lav-risiko svulster: Primære, solitære, Ta, lavgradig (LG) (inkl. PUNLP), < 3 cm, ingen CIS | Cystoskopi 3 mnd. etter TURB/re-TURB Cystoskopi 12 mnd. etter TURB Cystoskopi en gang årlig år tom år 5 Små residiv kan elektrokoaguleres poliklinisk |
Intermediær-risiko svulster: Ta LG svulster som er multiple, residivsvulst eller store (> 3 cm) | Cystoskopi 3 mnd. etter TURB/re-TURB Cystoskopi hver 6. måned i 2 år Cystoskopi årlig fra 3. til 10. år |
Høy-risiko svulster: Minst ett av følgende forhold foreligger: T1-svulst Høygradig (HG) svulst CIS | Cystoskopi + cytologi 3 mnd. Etter TURB/re-TURB Cystoskopi + cytologi hver 3. mnd. i 2 år Cystoskopi + cytologi hver 6. måned tom 5. året Cystoskopi + cytologi årlig livslangt etter 5 år |
Ved usikre funn kan mellomliggende kontroller utføres.
Ved residiv begynner oppfølgingen med cystoskopi etter 3 mnd. og deretter som intermediær- eller høy-risiko.
Ved høy-risiko svulster bør cystoskopi suppleres med cytologi
Kommersielt tilgjengelige urintester har ikke vist seg å kunne erstatte cystoskopi
Varighet av oppfølging NMIBC
Ved intermediær- eller høy-risiko svulst opptrer tilbakefall selv etter 10–12 års oppfølging. Pasienter med residiv i løpet av de 4 første årene etter TURB, vil kunne residivere livet ut.
De fleste eksperter mener det er rimelig å avslutte kontroll av lav-risiko svulster, som ikke har residivert i løpet av 5 år (Borhan et al., 2003; Fujii et al., 2003; Gofrit et al., 2006; Holmang et al., 2001; Leblanc et al., 1999; Oge et al., 2000; Soloway et al., 2003; Zieger et al., 2000) (evidensgrad B), evt. kan pasienten følges av fastlegen med cytologi og kontroll av hematuri. Ved alle de andre svulster anbefales oppfølging livet ut. Forhold som høy alder, dårlig allmenntilstand, komorbiditet og psykososiale forhold kan i praksis gjøre det nødvendig med et mer individuelt tilpasset oppfølgingsopplegg etter at de første kontrollene har indikert svulstens biologi.
Oppfølging av de øvre urinveier
Utvikling av urotelial svulst i de øvre urinveier under oppfølging av pasienter med ikke-muskelinvasiv blærekreft er generelt svært sjelden (2–4 %), og billeddiagnostikk skal derfor ikke rutinemessig utføres (Herr et al., 1996). Høyest frekvens (ca. 10 % etter 7 år) kan forventes ved høyrisikosvulster (T1HG og CIS), og kontrastforsterket CT hvert annet år anbefales hos disse pasientene (Choe et al., 2017; Hurle et al., 1999). Indikasjon for billeddiagnostikk av de øvre urinveier under oppfølgingen vil derfor være risikobasert, og følgende praktiske retningslinjer for indikasjon kan anbefales:
- Primær CIS
- Svulst i ureterostium
- Høyrisikosvulster (høygradig maligne), som residiverer hyppig
- Positiv cytologi – negativ cystoskopi
- Makroskopisk hematuri med negativ cystoskopi
- I forløpet av BCG-behandling, første gang ca. 1 år etter behandlingsstart, spesielt for å se etter utvikling av distal ureterstriktur
Anbefalinger for oppfølging av Ta-T1 blærekreft:
- Første cystoskopikontroll skal gjøres 3 måneder etter TUR hos alle, uavhengig av risikogruppe.
- Ved negativ 3 måneders kontroll cystoskoperes pasienter med lav risiko for residiv og progresjon ved måned 12 etter TURB og kontrolleres deretter årlig med cystoskopi i min. 5 år.
- Pasienter med intermediær risiko cystoskoperes etter den initiale 3 måneders kontroll hver 6. måned i 2 år og deretter årlig i minst 10 år.
- Ved høy risiko for residiv og progresjon, men uten svulst ved 3 måneders kontrollen, cystoskoperes med følgende intervaller: hver 3. måned i 2 år, hver 6. måned til 5 år og deretter årlig livet ut.
- Billeddiagnostikk av øvre urinveier med kontrastforsterket CT hos pasienter med høyrisiko bør vurderes utført hvert 2. år.
Kontroll etter strålebehandling
Sist faglig oppdatert: 21.09.2023
Pasientene bør primært kontrolleres ved behandlende sykehus. Pasienten kontrolleres hos onkolog 6 uker etter avsluttet strålebehandling for å vurdere de akutte bivirkninger, deretter årlig for å vurdere kroniske bivirkninger.
Første kontroll hos urolog anbefales 3 måneder etter avsluttet strålebehandling. Følgende forhold skal da evalueres i tillegg til at det utføres undersøkelser på grunnlag av pasientens symptomer:
- Respons på strålebehandling (cystoskopi: Ingen svulst vs. rest-svulst).
- Symptomer og bivirkninger (blære, tarm).
- Blodprøver: SR, Serum kreatinin, Hgb, Hvite, Trombocytter, Alkalisk fosfatase.
- Performance status.
Pasienter som kan være kandidater for salvage cystektomi følges videre systematisk med cystoskopi for tidlig å fange opp residiv. Hos disse pasientene bør kontrollene gjentas med 3 måneders intervaller i 1 år, med 6 måneders mellomrom i ytterligere 1 år, deretter årlige så lenge de ansees operable. Det gjøres da cystoskopi ved hver kontroll med henblikk på tumor residiv/progresjon av resttumor.
CT thorax og kontrastforsterket CT urinveier tas hver 6. mnd. I 2 år etter avsluttet kjemoradioterapi. Deretter etter individuell vurdering avhengig av hvilken konsekvens et positivt funn vil få. Pasienter som fortsatt er kandidater for kurativ eller palliativ systemisk behandling bør vurderes for årlig CT frem til 5 år.
Pasienter som ikke er kandidater for salvage cystektomi følges opp etter individuell vurdering. Cystoskopi gjøres ved de første kontrollene for å evaluere behandlingseffekt, men senere gjøres cystoskopi mer etter symptomer, som for eksempel ved hematuri. Selv om pasienten ikke er kandidat for cystektomi, kan overfladiske residiver behandles radikalt med TURB. CT-kontroller avgjøres etter individuell vurdering avhengig av hvilken konsekvens et positivt funn vil få.
Pasientene bør anbefales livslang, årlig kontroll av nyrefunksjon hos fastlege for å avdekke striktur og evt skade på øvre urinveier.
Etter palliativ strålebehandling er hyppigheten av kontroller og spesielt indikasjon for cystoskopi avhengig av pasientens symptomer og nødvendighet av palliativ TURB.
Anbefalinger:
- Kontroll etter radikal strålebehandling hos operable pasienter (som er kandidat for salvage cystektomi):
- Pasienten kontrolleres hos onkolog 6 uker etter avsluttet strålebehandling for å vurdere akutte bivirkninger. Deretter årlige kontroller hos onkolog for å vurdere kroniske bivirkninger.
- Alle pasienter kontrolleres hos urolog med cystoskopi etter 3 mnd.
- Intervaller: cystoskopi hver 3. mnd. første år, videre hver 6. mnd i 2 år, deretter årlig så lenge de ansees operable.
- CT-thorax (lavdose) og kontrastforsterket CT urinveier hver 6. mnd. i 2 år, deretter årlig i 3 år. Etter dette etter individuell vurdering.
- Pasientene bør anbefales livslang, årlig kontroll av nyrefunksjon hos fastlege.
- Kontroll etter radikal strålebehandling, inoperable pasienter:
- Pasienten kontrolleres hos onkolog 6 uker etter avsluttet strålebehandling for å vurdere akutte bivirkninger. Deretter årlige kontroller hos onkolog for å vurdere kroniske bivirkninger.
- Pasienter som ikke er kandidat for salvage cystektomi trenger ikke oppfølging med cystoskopi.
- CT-thorax, abdomen og bekken hver 6. mnd. i 2 år, deretter årlig i 3 år hvis pasienten er kandidat for intensiv palliativ systemisk behandling.
- Pasientene bør anbefales livslang, årlig kontroll av nyrefunksjon hos fastlege.
- Kontroll etter palliativ strålebehandling:
- Hyppigheten av kontroller og spesielt indikasjon for cystoskopi er avhengig av pasientens symptomer og nødvendighet av palliativ TURB.
Kontroll etter radikal kirurgi
Sist faglig oppdatert: 21.09.2023
Kontroll etter cystektomi er rettet både mot oppfølging av kreftsykdommen og mot sikring av en velfungerende urinavledning over tid. Pasienter som lever lenger enn 36 måneder uten residiv etter cystektomi, har forholdsvis lav risiko for senere tilbakefall av kreftsykdommen. Den potensielle nytten av regelmessig oppfølging med tanke på kreftsykdommen er størst i de første 24 måneder etter cystektomi. Til tross for systematisk oppfølging vil >50 % av tilbakefallene oppdages på bakgrunn av symptomer og ikke av selve oppfølgingen.
På lang sikt er det kontroll av urinsystemet som blir det viktigste. Viktige forhold relatert til urinsystemet vil være:
- Hydronefrose (ureterstriktur/sykdomsresidiv i ureter eller retroperitonealt)
- Steindannelse i øvre urinveier
- Steindannelse i kutant kontinent reservoar
- Funksjonelle problemer (eks: stomiproblemer, inkontinens, retensjon)
- Metabolske forstyrrelser.
- Nyrefunksjon
Oppfølgingsprotokoll
Intervaller:
- 6 uker postoperativt med fokus på urinveissystemet og evt. kliniske problemer hos pasienten.
- Hovedregel: Hver 6. måned etter operasjonen i 5 år.
- 3 mnd. postoperativt vurderes hos pasienter med særlige ugunstige faktorer mhp sykdomstilbakefall (eks. ≥pT3b, ufrie marginer, pN+) og hos pas. med hydronefrose ved 6‑ukers kontroll.
- Etter 5 år kan oppfølging foretas av fastlege i samsvar med veiledning av et poliklinisk avslutningsnotat med konkrete råd til fastlegen om oppfølgingen. Pasienter med de mer avanserte urinavledninger vil likevel ofte fortsette oppfølging hos spesialist også etter 5 år.
Spesifikke undersøkelser
Blodprøver:
- Hgb, Na, K, Kreatinin, GFR, ALP, venøs syre-base-bestemmelse (base excess), Vit. B12 (etter 2 år og deretter en gang årlig) og PSA hos pasienter med samtidig prostatakreft.
Urinprøver:
- Bakteriologisk undersøkelse ved blæresubstitutt.
- Urincytologi fra pasienter med særlig risiko for senere svulster i øvre urinveier (for eksempel ved utbredt CIS, positivt frysesnitt fra ureteres).
Radiologiske undersøkelser:
- Isotoprenografi etter 6 uker som utgangspunkt for senere vurdering av øvre urinveiers funksjon og arkitektur. Hydronefroseutvikling overvåkes senere med CT/ultralyd.
- CT thorax lavdose og kontrastforsterket CT urografi/ gjøres som hovedregel halvårlig i 2 år, deretter årlig frem til 5 år.
- Symptomer som hematuri, klinisk UVI, flankesmerter vil uansett indisere CT, evt mellom de planlagte intervallene.
Skopi av gjenværende urethra og av blæresubstitutt, evt. supplert med «vaskecytologi» gjøres på klinisk indikasjon (hematuri, blod fra urethra, blæretømningsproblemer og slimretensjon) og hos pasienter med utbredt CIS, som har størst risiko for å få senere urethratumor. Skopi bør hos slike risikopasienter som et minimum utføres årlig de første 3 årene. Ved ortotopt blæresubstitutt måles resturin, og urinen sjekkes for infeksjon.
Veiledende standardoppfølging er vist i tabell 8.
| 6u | 3m | 6m | 12m | 18m | 24m | 30m | 36m | 42m | 48m | 54m | 60m |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Alle | ||||||||||||
Hgb, Na, K, Kreatinin, GFR, ALP | X | x | x | x | x | X | x | x | x | x | X | x |
Vit. B12 |
|
|
|
|
| X |
| x |
| x |
| x |
Isotoprenografi, evt. miniurografi | X |
|
|
|
|
|
|
|
|
|
|
|
CT thorax lavdose og CT urinveier flerfase |
| (x) | x | x | x | X |
| x |
| x |
| x |
Urethroskopi + evt. vaskecytolog|i |
|
|
| x |
| X |
| x |
|
|
|
|
Venøs syre-base | X | x | x | x | x | X | x | x | x | x | X | x |
Ved blæresubstitutt | ||||||||||||
Skopi av blæresubstitutt |
|
|
| x |
| X |
| x |
|
|
|
|
Resturin | X | x | x | x | x | X | x | x | x | x | X | x |
Urinbakt. Us. | X | x | x | x | x | X | x | x | x | x | X | x |
Kontroll etter 3 måneder:
- (x): Hos risikopasienter (se tekst)
- x: Hos sykepleier/uroterapeut
Kontrollopplegget hos fastlegen (etter 5 år):
- Fem år etter radikalkirurgi vil de fleste pasientene, som har gjennomgått radikalkirurgi kunne fortsette kontrollene hos fastlegen. De fleste vil da ha en uretero-entero-kutan stomi. Etter dette tidspunktet er risiko for tilbakefall av selve blærekreftsykdommen betydelig redusert, men risiko for svulster i gjenværende øvre urinveier består i noen grad. Det viktigste i denne perioden blir likevel å fange opp problemer knyttet til urinavledningen.
Punktvis oppsummering relatert til fastlegens oppgaver:
- Kontroll 1-2 ganger årlig
- Årlig fornyelse av resept på stomiutstyr
- Henvisning til stomisykepleier ved praktiske problemer med stomien/stomiutstyret
- Urincytologi
- Minimum følgende blodpøver: kreatinin, venøs syre-basestatus, vit B12 og PSA hos pasienter med påvist cancer prostata i operasjonspreparatet.
- CT gjøres på indikasjon (generell mistanke om tilbakefall av sykdom, flankesmerter, stigende kreatinin, blodig urin, febril urinveisinfeksjon)
Hvis noen av de ovennevnte problemer mistenkes/påvises, skal pasienten henvises urologisk avdeling. Ved andre mer spesifikke problemer, som kan være knyttet til mer avanserte urinavledninger, skal pasienten også henvises urologisk avdeling.
Det skal også understrekes at pasienter med uretero-entero-kutan stomi ofte har bakteriuri. Dette skal ikke behandles med mindre pasienten har symptomer (feber, generell sykdomsfølelse, svært illeluktende urin).
Anbefalinger:
- Kontroll etter cystektomi er rettet både mot oppfølging av kreftsykdommen og mot sikring av en velfungerende urinavledning.
- Isotoprenografi anbefales som kontroll av avløpsforhold etter 6–12 uker. (Evidensgrad D)
- Bruk av CT thorax (lavdose) og kontrastforsterket CT urinveier må inngå i kontrollopplegget for å avdekke avløpsforhold, metakron tumor og metastaser de første 5 år.
- Pasienter som tilbakeføres for oppfølging hos fastlege skal medfølge en beskrivelse av undersøkelser og områder som skal observeres.
- Pasienter som utvikler nyresvikt, makroskopisk hematuri, residiverende urinveisinfeksjoner eller symptomer suspekt på tilbakefall av sykdom bør vurderes for henvisning til urolog.
Kontroll etter kjemoterapi for avansert kreft
Sist faglig oppdatert: 21.09.2023
Pasienter som er under aktiv behandling med palliativ kjemoterapi evalueres vanligvis etter hver 2. kur i henhold til gjeldende kur-skjema. Vi anbefaler at evalueringen inkluderer klinisk vurdering av respons, bivirkninger samt CT/MR av kjente metastaselokalisasjoner. MR og PET-CT har ingen rutinemessig plass her, men MR av columna anbefales dersom det foreligger symptomer forenlig med en truende tverrsnittslesjon. For pasienter som har pause fra kjemoterapi og som kan være aktuelle for oppstart av ny behandlingssyklus, anbefales klinisk kontroll samt CT/MR-undersøkelser hver 3.–4. måned. Etter avslutning av tumorrettet behandling anbefales ikke rutinemessige bildeundersøkelser, men radiologiske undersøkelser vurderes individuelt på bakgrunn av symptomer. Disse pasientene kan med fordel følges av fastlege i samarbeid med palliativt team eller lokalsykehus, og henvises til urolog eller onkolog ved behov.
Seneffekter etter gjennomgått onkologisk behandling
Sist faglig oppdatert: 21.09.2023
Seneffekter etter kreftbehandling er enten kroniske bivirkninger som vedvarer minst et år etter at behandlingen ble gitt, eller symptomer eller sykdommer som oppstår lang tid, opptil flere tiår, etter gjennomgått behandling (Aziz, 2007).
Seneffekter etter neoadjuvant kjemoterapi
Randomiserte studier utført på pasienter behandlet med neoadjuvant kjemoterapi beskriver kun den akutte toksisiteten og det finnes knapt studier som beskriver seneffekter etter neoadjuvant kjemoterapi. For enkelte av de stoffene som inngår i M-VAC er seneffekter beskrevet for andre pasientgrupper behandlet med andre medikamentkombinasjoner, og er dermed ikke direkte overførbare til blærekreft-overlevere. I mangel på dokumentasjon for denne pasientgruppen nevnes kort det som er kjent for noen av stoffene. Cisplatin-basert kjemoterapi er assosiert med økt risiko for nedsatt hørsel, tinnitus, perifere nevropatier, nyresvikt, hypogonadisme, og en moderat økt risiko for kardiovaskulær sykdom og sekundær cancer (Fung et al., 2013; Haugnes et al., 2012). Kardiotoksisiteten ved doxorubicin er doseavhengig og den kumulative dosen ved 3 neoadjuvante MVAC kurer er langt under anbefalt grense på 450 mg/m2 (Medikamentell kreftbehandling, Cytostatikaboken, 2009).
Seneffekter etter stråleterapi alene
Den største gruppen blærekreft-overlevere som er studert hittil, er en retrospektiv analyse av 487 pasienter strålebehandlet i perioden 1975–1995 med median dose til blære på 66.5 Gy og median oppfølging 76 måneder (Majewski et al., 2009). Studien rapporterte en 5 års prevalensrate på minimum grad 2 blæretoksisitet (moderat hyppighet, intermitterende hematuri) og grad 2 tarmtoksisitet (flere enn fem tømninger per dag, intermitterende blødning) på henholdsvis 35 % og 7 %. Andelen med minimum grad 3 toksisitet (blære: uttalt hyppighet/nocturi, hyppig hematuri, redusert blærevolum; tarm: obstruksjon eller blødning som krever kirurgi) var på 12 % og 3 % for blære- og tarmtoksisitet. Både blære- og tarmtoksisitet etter 5 år var assosiert med grad av akutt toksisitet.
En nylig publisert dansk studie har evaluert seneffekter etter konformal stråleterapi (n=66) versus intensitets-modulert stråleterapi (IMRT, n=50) hos pasienter behandlet 2007–2010 (Søndergaard et al., 2014). De fleste fikk stråleterapi både mot blære og elektivt bekkenfelt. De rapporterte overraskende høye prevalensrater for minimum grad 2 blæretoksisitet etter konformal stråleterapi og IMRT på henholdsvis 63 % og 48 % (p=0.4), og minimum grad 2 tarmtoksisitet på henholdsvis 17 % og 40 % (p=0.1). Tallene var imidlertid for små til å konkludere, og studien hadde betydelig kortere follow-up tid på median 14–16 måneder enn studien til Majewski et al. Frykten for seneffekter fra blære er dosebegrensende ved stråleterapi. En engelsk studie har vist signifikant lavere prevalens av grad 3–4 sen toksisitet for pasienter behandlet med boost mot tumor og lavere totaldose mot hele blæren versus konvensjonell hel-blære stråleterapi, uten at overlevelsen ble redusert (Mangar et al., 2006).
Seneffekter etter trimodal behandling
Flere studier har rapportert seneffekter etter trimodal blæresparende behandling (Efstathiou et al., 2009; Gogna et al., 2006; Ploussard et al., 2014; Weiss et al., 2007). Andelen pasienter med grad 1–2 blæretoksisitet etter inntil fem års oppfølging varierte fra 10 til 27 %, og andelen med grad 1–2 tarmtoksisitet var 5–6 %, mens grad 3 blæretoksisitet varierte fra 3 til 8 %. Flere studier har rapportert at ingen av pasientene trengte palliativ cystektomi på grunn av behandlingsrelatert toksisitet (Efstathiou et al., 2009; Gogna et al., 2006; Shipley et al., 2002). To prospektive serier har bekreftet en god blærefunksjon etter trimodal behandling (Herman et al., 2004; Lagrange et al., 2011). Det må presiseres at studiene som er utført er basert på stor grad av pasientseleksjon, og det foreligger så langt ingen studier med oppfølging lenger enn fem år.
For å oppsummere, så viser disse studiene at kurativ stråleterapi ved blærekreft er assosiert med en nokså høy forekomst av minimum grad 2 blæretoksisitet, mens en liten andel av kreftoverleverne har minimum grad 2 tarm toksisitet. De hyppigste lavgradige seneffektene var hyppig vannlatning, nochturi, dysuri, diare og proktitt.
Oppfølging av urotelkreft i øvre urinveier
Sist faglig oppdatert: 21.09.2023
Målsetning med oppfølging av pasienter som tidligere er behandlet for UTUC er å fange opp metastatisk sykdom og tilbakefall i gjenværende nyrebekken, urinleder og urinblære. To randomiserte studier har vist at 30 % av pasientene får tilbakefall i blæren etter radikal nefroureterektomi og mitomycin eller pirarubicin instillasjon, som er dagens standard behandling (Ito et al., 2013; O'Brien et al., 2011).
Det finnes lite data hvordan det er best å organisere oppfølgingen, og evidensen er svak og baserer seg stort sett på «expert opinion» (EAU, 2022). Det er derfor viktig å vurdere om kontrollene til pasientene, som ofte er eldre og multimorbide, vil ha behandlingsmessige konsekvenser før man bestemmer oppfølgingsregime. Ulike tilnærminger til behandling, vil også ha betydning for omfang og metoder for oppfølging.
Forslag til oppfølging som har vært brukt på Haukeland Universitetssykehus (laget av Bjarte Almås) ligger i tabell 12, 13 og 14 nedenfor.
Kontrollrutiner for pasienter behandla kirurgisk for UTUC
Risikogrupper for pasientar behandla med NU for UTUC. Sidan vi ikkje har så mange av desse pasientane gjer vi det så enkelt som mulig.
Høgrisigogruppe: T2+ eller N+ ved endelig histologi etter NU/ureterreseksjon
Lågrisikogruppe: Ta/T1 ved endelig histologi etter NU/ureterreseksjon
Angående CT som rutineundersøkelse:
Vurder om eit evt positivt funn vil ha konsekvens for pasienten. I praksis vil dette gjelde for pasientar <80 år med ECOG 0-1.
Undersøkelse | 6 uker | 4 mnd | 8 mnd | 12 mnd | 18 mnd | 24 mnd | 30 mnd | 36 mnd | 42 mnd | 48 mnd | 60 mnd |
|---|---|---|---|---|---|---|---|---|---|---|---|
Blodprøver som ved nyreca.ktr | x | X | X | X | X | X | X | X | X | X | X |
Cystoskopi | X | X | X | X | X | X | X | X | X | X | X |
CT Thorax/abdomen |
| X |
| X |
| X |
| X |
|
| x |
Undersøkelse | 6 uker | 4 mnd | 8 mnd | 12 mnd | 18 mnd | 24 mnd | 30 mnd | 36 mnd | 42 mnd | 48 mnd | 60 mnd |
|---|---|---|---|---|---|---|---|---|---|---|---|
Blodprøver som ved nyreca.ktr | x | X | X | X | X | X | X | X | X | X | X |
Cystoskopi | X | X | X | X | X | X | X | X | X | X | X |
CT Thorax/abdomen |
|
|
| X |
|
|
|
|
|
| x |
Undersøkelse | 3 mnd | 6 mnd | 9 mnd | 12 mnd | 18 mnd | 24 mnd | 36 mnd | 48 mnd | 60 mnd |
|---|---|---|---|---|---|---|---|---|---|
URS | x | X |
| X |
| X |
|
|
|
Cystoskopi |
|
| X |
| X |
|
|
|
|
CT urografi/thorax |
|
| x |
| x |
| x | x | x |
Patologi
Preanalytisk håndtering
Sist faglig oppdatert: 21.09.2023
Den preanalytiske preparathåndteringen er beskrevet under de respektive kapitlene for kirurgisk behandling.
Makrohåndtering og laboratoriearbeid
Sist faglig oppdatert: 21.09.2023
Blærebiopsier og TURB
Dersom det er mottatt flere enn 10 vevsbiter er telling ikke nødvendig. Vekt og/eller volum kan angis som et objektivt mål på mengde mottatt vev.
I utgangspunktet skal alt mottatt vev støpes inn, men ved store menger kan man støpe inn f.eks. åtte blokker og angi at det finnes restmateriale. Hvis man ikke påviser muscularis propria i det innstøpte materialet, må man støpe inn mer materiale eventuelt inntil alt materialet er innstøpt (Sharks et al., 2013).
Cystektomipreparater
Cystektomipreparater beskrives og beskjæres jf. anbefalinger i Veileder i biopsibesvarelse av maligne svulster (Veileder i biopsibesvarelse av maligne svulster, 2016).
Som et minimum skal det tas transmurale snitt fra tumor, snitt fra reseksjonsrender, lymfeknuter og vev utenom tumor.
Ved cystoprostatektomi skal også prostata undersøkes makro- og mikroskopisk.
Nefroureterektomipreparater
Nefroureterektomipreparatene beskrives og beskjæres jf. anbefalinger i Veileder i biopsibesvarelse av maligne svulster.
Som et minimum skal det tas snitt fra tumor med relasjon til omliggende vev, snitt fra reseksjonsrender, eventuelle lymfeknuter og vev utenom tumor.
Ureterektomipreparater
Preparatet beskrives og måles.
Tumor beskrives: Mål, utbredelse, vekstmåte og avstand til reseksjonsrender.
Øvrig ureterslimhinne beskrives.
Som et minimum skal det støpes inn snitt fra begge reseksjonsrender. 3 transmurale tumorsnitt og snitt fra upåfallende slimhinne.
Laboratoriearbeid
Materialet fremføres og støpes inn i parafin.
Det skjæres snitt med 3–5 µm tykkelse og snittene farges jf. laboratoriets protokoll for rutinefarging.
Klassifikasjon av blærekreft
Sist faglig oppdatert: 21.09.2023
Urotelialt carcinom (tidligere kalt overgangsepitelcarcinom) er den vanligste formen for blærekreft og utgjør minst 90 % av blærekrefttilfellene i vestlige land, men i områder hvor Schistosoma er endemisk kan andelen plateepitelcarcinomer bli opp mot 30–40 % (Cancer Incidence in Five Continents, 2007; El-Bolkainy et al., 1982; Kirkali et al., 2005).
Mindre vanlige typer blærekreft inkluderer adenocarcinomer og neuroendokrine carcinomer. Sarkomer og lymfomer kan også opptre i blære, men er svært sjeldne.
Det finnes en rekke histologiske varianter av uroteliale carcinomer. Å gjenkjenne disse kan ha betydning for prognose og/eller videre behandling. Den vanligste typen er urotelialt carcinom med avvikende differensiering, og vanligste undergruppe av denne typen er urotelialt carcinom med plateepiteldifferensiering, en type med økt risiko for lokalavansert sykdom (Kim et al., 2012; Lee et al., 2014; Wasco et al., 2007).
Videre finnes også urotelialt carcinom med glandulær differensiering, en type som må skilles fra urotelialt carcinom med pseudoglandulære hulrom, samt urotelialt carcinom med trofoblastdifferensiering.
Andre klinisk viktige varianter av uroteliale carcinomer inkluderer «nested urothelial carcinoma», mikrocystisk carcinom, mikropapillært carcinom, lymfoepiteliomlignende carcinom og plasmacytoid carcinom (Moch et al., 2016).
Gradering av uroteliale carcinomer
Sist faglig oppdatert: 21.09.2023
Pr. i dag er det, både nasjonalt og internasjonalt, i hovedsak brukt to graderingssystemer for uroteliale carcinomer; WHO1973 og WHO2004. Det finnes også et graderingssystem WHO1999 (Busch et al., 2002; Mostofi et al., 1999), men dette er mindre brukt.
Gradering av urotelialt carcinom er en subjektiv øvelse, og det vil alltid kunne forekomme diskrepanser mellom ulike patologer, uavhengig av hvilket graderingssystem som brukes.
WHO1973-graderingen er tredelt med økende grad av atypi (Mostofi et al., 1973). Vurderingen av de forskjellige gradene er meget sparsomt beskrevet, og en stor andel ender som grad II.
I et forsøk på å bedre reproduserbarheten ble det i 1998 publisert et nytt graderingssystem med bedre definerte kriterier for atypivurderingen, og disse kriteriene ble implementert i 2004-systemet (Eble et al., 2004; Epstein et al., 1998). Dette systemet deler svulstene i to grupper: lavgradig og høygradig urotelialt carcinom. I tillegg beskrives det papillære svulster med lavt malignitetspotensiale (PUN-LMP).
Graderingen i henhold til de to systemene er ikke direkte overførbar fra det ene systemet til det andre (Chen et al., 2012; Gönul et al., 2008; Oosterhuis et al., 2002). En del av WHO1973 grad 1-svulstene vil ende som PUN-LMP mens andre ender som WHO2004 lavgradige svulster. Grad 2-svulster fordeles i alle tre 2004-gruppene. Andelen grad 2-svulster som ender som høygradige carcinomer i 2004-systemet varierer fra 4 % til 22 %. De aller fleste grad 3-svulster ender som 2004 høygradige svulster.
Stadieinndeling
Sist faglig oppdatert: 21.09.2023
Stadium angis iht. TNM-systemet (tabellene 9–11, figur 4) (Renal pelvis and ureter, 2017; Urinary Bladder, 2010).
Patologisk tumorstadium (pT) angis etter lysmikroskopisk undersøkelse av svulsten. For TURB- preparater kan patologisk stadium kun angis opptil T2. Dersom muscularis propria mangler i TURB- materialet, kan stadium angis som pTx.
En papillært voksende svulst som er begrenset til mucosa, klassifiseres etter TNM-systemet som en Ta-svulst. Svulster som kun invaderer det subepiteliale bindevevet (med andre ord submucosa eller lamina propria, kan inkludere muscularis mucosae) betegnes T1. Videre inndeling («substaging») av pT1-svulster er ikke formelt innlemmet i TNM-systemet, og det er ingen internasjonal konsensus rundt hvordan eventuell inndeling skal gjøres (Moch et al., 2016).
Svulster med enda dypere vekst enn bindevevet, det vil si ned i muscularis propria (detrusor), kalles muskelinfiltrerende (T2). Man skiller her mellom svulster som infiltrerer overfladisk i muscularis propria (indre halvdel, pT2a) og i dype deler av muskulaturen (ytre halvdel, pT2b).
Svulster som vokser ut i bløtvevet omkring blæren betegnes som pT3 med undergrupper pT3a (mikroskopisk påvist) og pT3b (makroskopisk påvist).
Ved direkte innvekst i omkringliggende organer (pT4a) eller i bekken- eller bukvegg (pT4b) betegnes svulsten som pT4.
Diagnostisering av pT1 anses å være blant de vanskeligste områdene i patologiens rutinediagnostikk. Opptil 50 % av pT1 diagnoser viser seg ved regransking å være pTa, hvilket støtter bruk av dedikerte uropatologer i TURB-diagnostikk (Van Der Meijden et al., 2000).
Fordi Ta- og T1-svulster begge kan fjernes ved TURB, har disse i lang tid vært betegnet under ett som overfladiske svulster ut fra et behandlingsmessig synspunkt, selv om T1-svulstene rent patologisk-anatomisk er infiltrerende. I dag er det internasjonal enighet om at ikke-muskelinfiltrerende er en riktigere betegnelse for Ta/T1-svulster enn betegnelsen overfladisk. Flate, dvs. ikke-papillære svulster, som ikke infiltrerer kalles carcinoma in situ (Tis – heretter kalt CIS), hører også med til denne ikke-muskelinfiltrerende gruppen. Tilstedeværelse av CIS anses å være den sterkeste prognostiske parameteren for ikke-muskelinfiltrerende blærekreft (Sylvester et al., 2006).
Det er viktig å merke seg at molekylærbiologiske karakteristika og klinisk erfaring har vist at både CIS og T1-svulster generelt har et betydelig mer muskelinvasivt potensiale enn Ta-svulstene.
CIS kan klassifiseres i tre kliniske undergrupper:
- Primær: Isolert CIS uten tidligere eller samtidig eksofytisk voksende blæresvulst. Utgjør mindre enn 5 % av blærekrefttilfellene.
- Sekundær: CIS hos pasienter med tidligere annen blæresvulst.
- Concomitant (samtidig): CIS samtidig med annen blæresvulst.
Til tross for nytt system for histologisk klassifikasjon anvendes enkelte steder fortsatt betegnelsen T1G3 for T1-svulster med høy malignitetsgrad etter det nye systemet. Da både gammelt og nytt graderingssystem fortsatt anvendes, vil disse svulstene i disse retningslinjene bli betegnet T1HG/G3.
Diagnoseelementer
Sist faglig oppdatert: 21.09.2023
Diagnoseelementene med kommentar er beskrevet i DNPs Veileder i biopsibesvarelse av maligne svulster (Veileder i biopsibesvarelse av maligne svulster, 2016).
TURB
Preparattype.
Histologisk klassifikasjon.
Histologisk gradering.
Utbredelse inkludert kommentar vedrørende eventuell infiltrasjon, hvorvidt muscularis propria sees eller ikke og hvorvidt CIS er påvist eller ikke.
Det angis hvorvidt karinfiltrasjon er påvist eller ikke.
Cystektomi
Preparattype.
Tumors lokalisasjon.
Histologisk klassifikasjon.
Histologisk gradering.
Utbredelse.
CIS.
Reseksjonsrender.
Lymfeknuter (angis med lokalisasjon).
Vev utenom tumor.
Nefroureterektomipreparater og ureterektomipreparater
Preparattype.
Tumors lokalisasjon.
Histologisk klassifikasjon.
Histologisk gradering.
Utbredelse.
CIS.
Reseksjonsrender.
Lymfeknuter.
Vev utenom tumor.
Anbefalinger:
- Histologisk vurdering:
- Det anbefales at WHO-systemet fra 2004 anvendes for klassifisering av svulstene (D).
- Det anbefales at urologen gjennomgår den histologiske bedømmelsen sammen med patologen, i alle fall hos de pasientene der dette vil kunne få avgjørende betydning for valg av behandling. (D).
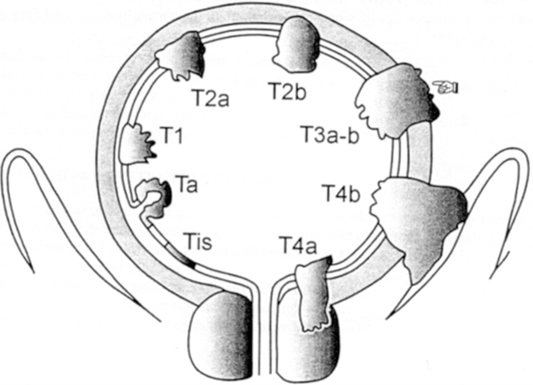
T3a mikroskopisk gjennomvekst
T3b makroskopisk gjennomvekst
TX | Primærtumor kan ikke vurderes. |
T0 | Tumor ikke påvist. |
Ta | Ikke-invasivt papillært carcinom. |
Tis | Urotelialt carcinom in situ (flat «tumor»). |
T1 | Tumor vokser inn i lamina propria (subepitelialt bindevev). |
T2 | Tumor vokser inn i muscularis propria. |
T2a | Tumor vokser inn i overfladiske muscularis propria (indre halvdel). |
T2b | Tumor vokser inn i dype muscularis propria (ytre halvdel). |
T3 | Tumor vokser inn i perivesikalt bløtvev. |
T3a | Mikroskopisk |
T3b | Makroskopisk |
T4 | Ekstravesikal tumor med direkte innvekst i en eller flere av de følgende: Prostatastroma, vesiculae seminalis, uterus, vagina, bekkenvegg, bukvegg. |
T4a | Ekstravesikal tumor med direkte innvekst i prostatastroma, uterus og/eller vagina. |
T4b | Ekstravesikal tumor med direkte innvekst i bekkenvegg og/eller bukvegg. |
NX | Lymfeknuter kan ikke vurderes. |
N0 | Ingen lymfeknutemetastaser. |
N1 | Metastase til enslig regional lymfeknute i bekkenet (perivesikalt, obturator, iliaca interna og externa eller sakralt). |
N2 | Metastase til multiple regionale lymfeknuter i bekkenet (perivesikalt, obturator, iliaca interna og externa eller sakralt). |
N3 | Metastase til iliaca communis lymfeknute (sekundær drenasje) |
M0 | Ingen fjernmetastase. |
M1 | Fjernmetastase påvist. |
M1a | Fjernmetastase begrenset til lymfeknuter utenfor iliaca communis. |
M1b | Fjernmetastaser til andre lokalisasjoner enn lymfeknuter. |
Molekylær subtyping
Sist faglig oppdatert: 21.09.2023
To hovedveier for urotelial tumorutvikling er tidligere identifisert. Mutasjoner i fibroblast growth factor receptor 3 (FGFR3) med aktivering av RAS-MAPK pathway er vist å være assosiert med lavgradige, ikke-muskelinvasive uroteliale carcinomer mens mutasjoner i TP53 og Rb1 assosieres med høygradige carcinomer med økt tendens til muskeinfiltrasjon (Dinney et al., 2004; van Rhijn et al., 2004).
Inspirerert av funn i andre tumortyper har flere grupper forsøkt å identifisere molekylære subtyper, og gruppene har identifisert varierende antall molekylære subtyper (Choi et al., 2017; Eriksson et al., 2015). Datasettene er imidlertid begrensede med kort oppfølgingstid. Molekylær subtyping kan vise seg å ha betydning for prognose og behandling (ved identifikasjon av svulster med økt sensitivitet for kjemoterapi), men molekylær subtyping er foreløpig ikke rutinepraksis i klinisk virksomhet eller anbefalt i retningslinjer.
Prosess og metode for utarbeiding av retningslinjene
Hva er nasjonale retningslinjer?
Sist faglig oppdatert: 21.09.2023
I henhold til Nasjonal helseplan (2007–2010) (2006a) har Helsedirektoratet en normerende rolle for helsetjenesten på tvers av helseregioner og tjenestenivå. Helsedirektoratet har en koordinerende rolle for å utvikle overordnede referanserammer for kreftomsorgen, sammen med de regionale helseforetakene, kommunene og andre relevante myndighetsorganer og tjenester.
Lov om kommunale helse- og omsorgstjenester § 12‑5 fastslår at Helsedirektoratet er eneste aktør med mandat til å utvikle, formidle og vedlikeholde nasjonale faglige retningslinjer og veiledere som understøtter de mål som er satt for helse- og omsorgstjenesten.
De nasjonale faglige retningslinjene inneholder systematisk utviklede faglige anbefalinger som etablerer en nasjonal standard for utredning, behandling og oppfølging av pasientgrupper, diagnosegrupper og brukergrupper. Nasjonale faglige retningslinjer er et virkemiddel for å bidra til at helse- og omsorgstjenestene:
- har god kvalitet
- gjør riktige prioriteringer
- ikke har uønsket variasjon i tjenestetilbudet
- løser samhandlingsutfordringer
- tilbyr helhetlige pasientforløp
Nasjonale faglige retningslinjer gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet. Sentrale fagmiljøer og tjenestemottakere er aktivt involvert i utarbeidelsen.
Helsepersonell og alle deler av helse- og omsorgstjenesten er forpliktet til å yte forsvarlig helsehjelp. Retningslinjer, anerkjent fagkunnskap og allmenngyldige samfunnsetiske normer inngår som aksepterte grunnlag for vurdering av hva som er faglig forsvarlig. Retningslinjer er ment som et hjelpemiddel ved avveiningene tjenesteyterne må gjøre for å oppnå forsvarlig og god kvalitet i tjenesten. De er ikke rettslig bindende, men faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet. Helsepersonell må likevel vise faglig skjønn i vurderingen av hver enkelt pasient for å ta hensyn til individuelle behov. Dersom helsepersonell eller institusjoner velger å fravike anbefalinger i en retningslinje, skal dette dokumenteres og begrunnes.
Helsetjenestens eiere og ledelse har ansvar for tilrettelegging av virksomheten slik at anbefalinger gitt i nasjonale faglige retningslinjer kan følges.
Kunnskapsbasert prosess
Sist faglig oppdatert: 21.09.2023
Helsedirektoratet legger til grunn at alle nasjonale retningslinjer skal være utarbeidet etter en metode med vekt på forskningsbasert kunnskap, tydelig og tilgjengelig dokumentasjon, brukermedvirkning, tverrfaglighet, fokus på praksis, implementering og oppdatering.
Det er en omfattende prosess å lage gode retningslinjer som tilfredsstiller krav til prosess, metode og transparens som er det nivå Helsedirektoratet og andre internasjonale organisasjoner har lagt til grunn for utforming av anbefalinger.
Helsedirektoratet ønsker i arbeidet med nasjonale retningslinjer for kreftbehandling å bygge på det arbeid faggruppene tilsluttet Onkologisk Forum i en årrekke har gjort med å lage behandlingsveiledere.
Gradering av kunnskapsgrunnlaget
Sist faglig oppdatert: 21.09.2023
Ved utarbeiding av nasjonale retningslinjer stilles det krav om at all relevant kunnskap på området hentes frem, beskrives og vurderes på en systematisk og åpen måte.
I dette handlingsprogrammet har man anvendt gradering av evidensnivå (A–D) for å vise hvilket vitenskapelig grunnlag kunnskapen er basert på.
Studietype | Evidensnivå | Gradering av evidensnivå |
|---|---|---|
Kunnskap som bygger på systematiske oversikter og meta-analyser av randomiserte kontrollerte studier | Nivå 1a | A |
Kunnskap som bygger på minst én randomisert kontrollert studie | Nivå 1b |
|
Kunnskap som bygger på minst én godt utformet kontrollert studie uten randomisering | Nivå 2a | B |
Kunnskap som bygger på minst én annen godt utformet kvasi-eksperimentell studie uten randomisering | Nivå 2b |
|
Kunnskap som bygger på godt utformede ikke eksperimentelle beskrivende studier, som sammenlignende studier, korrelasjonsstudier og case-studier | Nivå 3 | C |
Kunnskap som bygger på rapporter eller oppfatninger fra eksperter, komiteer og/eller klinisk ekspertise hos respekterte autoriteter | Nivå 4 | D |
Kunnskapsgrunnlaget i disse retningslinjene er gradert i henhold til tabellen over. I disse retningslinjene er kun kunnskapsgrunnlaget og ikke anbefalingene gradert.
For å indikere kunnskapsgrunnlaget for anbefalingene, er det brukt gradering A–D. En anbefaling som er anført med D behøver derfor ikke å være en svakere anbefaling enn en som er anført A, B eller C. Det henspeiler kun til kunnskapsgrunnlaget anbefalingen er basert på. I enkelte sammenhenger vil klinisk erfaring og gjeldende praksis være et godt grunnlag for anbefalingen. I andre sammenhenger er det uttrykk for at det ikke finnes tilstrekkelig vitenskapelig dokumentasjon for anbefalingen, selv om det hadde vært ønskelig.
Bakgrunn og arbeidsprosess
Sist faglig oppdatert: 21.09.2023
Utvikling av de nasjonale handlingsprogrammene for kreftbehandling var et viktig tiltak under Nasjonal strategi for kreftområdet 2006–2009 (2006b) (forlenget til 2011). Og videre utvikling av de nasjonale handlingsprogrammene er en kjerneoppgave i oppfølging av Sammen mot kreft- Nasjonal Kreftstrategi 2013–2017 (2013). Nasjonale handlingsprogrammer for kreftbehandling skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
De nasjonale onkologiske faggruppene tilsluttet Onkologisk Forum hadde tidligere utviklet behandlingsveiledere for ulike krefttyper. Da arbeidet med de nasjonale handlingsprogrammene på kreftområdet startet i 2006, tok Helsedirektoratet utgangspunkt i disse.
Bakgrunn og arbeidsprosess første utgave av handlingsprogrammet (2012)
Dette nasjonale handlingsprogrammet med retningslinjer for diagnostikk, behandling og oppfølging av blærekreft er utarbeidet på følgende måte:
Rolf Wahlqvist fikk i sin tid av Norsk Urologisk Cancer Gruppe (NUCG) oppgaven å lage et handlingsprogram for blærekreft. Dette ble utgitt i en trykket versjon i 2005, finansiert av Kreftforeningen (Wahlquist, 2005). Når Helsedirektoratet skulle lage et Nasjonalt handlingsprogram for blærekreft var det naturlig å bygge på det handlingsprogrammet som allerede var publisert. Foreliggende handlingsprogram er derfor en betydelig oppdatering av dette.
Handlingsprogrammet er ment som et hjelpemiddel ved de avveininger klinikerne (urologer og onkologer) som behandler disse pasientene, må gjøre for å oppnå forsvarlighet og god kvalitet i tjenesten. For enkelte forhold er det gitt detaljerte retningslinjer med anbefalinger, mens andre forhold er omtalt på en måte som skal gi klinikeren bakgrunnsinformasjon for å kunne gjøre egne kvalifiserte vurderinger hos enkeltpasienten. Allmennlegen har en svært viktig oppgave ved å fange opp symptomer og tegn som kan gi mistanke om blærekreft så tidlig som mulig, men har ellers begrensede oppgaver i forhold til denne sykdommen. Likevel vil programmet ha interesse for allmennlegen, som ønsker informasjon om spesialistbehandlingen av sine blærekreftpasienter.
I arbeidet med programmet har en for en stor del hatt retningslinjene til den europeiske urologiorganisasjonen (EAU) som modell (Babjuk et al., 2011a; Babjuk et al., 2011b; Stenzl et al., 2011a; Stenzl et al., 2011b). Handlingsprogrammet er på noen områder mer detaljerte enn disse retningslinjene, og innholdet er tilpasset de synspunkter som er rådende innenfor norske behandlingsmiljøer. Dette harmonerer imidlertid godt med nordiske og øvrige internasjonale holdninger.
Arbeidsgruppe – første utgave av handlingsprogrammet
Høstmark, Jens, Urolog
Mestad, Oddvar, Urolog
Fosså, Sophie, Onkolog
Langberg, Carl, Onkolog
Svindland, Aud, Patolog
Hovedforfatter Wahlqvist leverte våren 2012 utkast til Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av blærekreft. Helsedirektoratet ferdigstilte i samarbeid med forfatteren og Nasjonalt Kunnskapssenter for helsetjenesten våren 2012 arbeidet og utkast til retningslinjer ble sendt på høring til Kreftforeningen og dens pasientorganisasjoner, RHFene, Norsk Urologisk Cancer Gruppe (NUCG) og Den norske legeforening. Handlingsprogrammet ble etter dette ferdigstilt i løpet av 2012.
I den første utgaven av dette retningslinjearbeidet samarbeidet arbeidsgruppen og Kunnskapssenteret. Kunnskapssenteret har identifisert og formidlet kunnskapsbaserte internasjonale retningslinjer og systematiske oversikter til faggruppen, ved søk på følgende nettsteder:
Søk etter retningslinjer
Guidelines international network: http://www.g-i-n.net/
NICE, UK: http://www.nice.org.uk/page.aspx?o=home
SIGN, Scotland: http://www.sign.ac.uk/
AHRQ, US: http://www.guideline.gov/
Cancer care Ontario: http://www.cancercare.on.ca/
Søk etter systematiske oversikter
CRD-databasene: http://www.crd.york.ac.uk/crdweb/
Cochrane Library: http://www.mrw.interscience.wiley.com/cochrane/cochrane_search_fs.html
Clinical evidence: https://bestpractice.bmj.com/info/
Det er også gjort litteratursøk etter primærstudier i PubMed og Medline.
Arbeidsprosess andre utgave av handlingsprogrammet (2016)
Arbeidsgruppe – andre utgave av handlingsprogrammet
I 2013 startet den nyoppnevnte Fagruppe Blærekreft under NUCG på en ny revisjon av Handlingsprogrammet. Gruppen har bestått av
Haug, Erik Skaaheim, Urolog, Sykehuset i Vestfold HF | (Leder) |
Arum, Carl Jørgen, Urolog, St Olavs Hospital HF |
|
Bergan, Unni, Radiolog, Helse Møre og Romsdal HF | (inn vår 2015) |
Haugnes, Hege Sagstuen, Onkolog, UNN HF |
|
Isfoss, Bjørn, Patolog, Sykehuset Telemark HF | (inn vår 2015) |
Kvavik, Lene Ekern, Onkolog, AHUS HF | (ut vår 2015) |
Tafjord, Gunnar, Onkolog, Radiumhospitalet-OUS HF |
|
Wahlqvist, Rolf, Urolog, Aker sykehus OUS HF |
|
Gruppen har skrevet om deler av strukturen og føyd til kapitler og emner, mens noen delkapitler er i prinsippet uendret. Nytt er også en doseplan for cytostatika som ligger som et appendiks. Mens revisjonen har pågått, er det fra helsemyndighetene blitt innført pakkeforløp for blærekreft, som også omfatter urothelcancer utenfor blære. Ved innlevering av denne revisjonen er derfor allerede oppstart av neste revisjon planlagt, som vil bli gjort med støtte fra Kunnskapssenteret. Etter planen vil denne revisjon bli mer omfattende og dekke Blære- og urothelkreft, herunder i øvre urinveier som til nå ikke har hatt noe nasjonalt handlingsprogram.
Arbeidsprosess tredje utgave av handlingsprogrammet (2018)
Den 3. versjonen av handlingsprogrammet innbefatter for første gang også nyrebekken- og urinlederkreft, og har derfor fått nytt navn: Handlingsprogram for blære- og urotelkreft.
Utarbeidelse og redigering av de ulike kapitlene er fordelt mellom gruppens medlemmer etter faglige forutsetninger. Alle anbefalinger er imidlertid gjennomgått i plenum.
Gruppen er i det senere utvidet med representanter for fastleger, Kreftregisteret og Folkehelseinstituttet. Evidensgradering er ikke benyttet i hele programmet, og bruken vil bli gjennomgått til neste revisjon. Endring i anbefalingene rundt utredning av mikroskopisk hematuri vil muligens ha størst implikasjoner for klinisk praksis, ikke minst for henvisning for utredning.
Gruppen har etter beste evne forsøkt å gi klare anbefalinger der det er mulig, men er takknemlig for reaksjoner og innspill til rettelser og endringer. Det har også vært gjort endringer i kapittelinndeling som dessverre har medført forsinket ferdigstillelse. Gruppen håper dog at neste versjon, som allerede er påbegynt, kan følge samme mal og være klar før sommeren 2019.
Arbeidsgruppe – tredje utgave av handlingsprogrammet
Erik Skaaheim Haug (leder) | Urolog | Sykehuset i Vestfold HF | HSØ |
Carl Jørgen Arum | Urolog | St. Olavs hospital HF | HM |
Unni Bergan | Radiolog | HMR-Ålesund HF | HM |
Ole Jacob Greve | Radiolog | SUS HF | HV |
Gigja Gudbrandsdottir | Urolog | Helse Bergen HF | HV |
Heidi Knobel | Onkolog | St. Olavs Hospital HF | HM |
Målfrid Mangrud | Patolog | Innlandet-Lillehammer HF | HSØ |
Gunnar Tafjord | Onkolog | OUS-Radiumhospitalet HF | HSØ |
Rolf Wahlqvist | Urolog | OUS- Aker sykehus HF | HSØ |
Øystein Størkersen | Patolog | St. Olavs hospital HF | HM |
Eivind Bjerkaas | Urolog | UNN | HN |
Bettina Kulle Andreassen | Statistiker/forsker | Kreftregisteret |
|
Karsten Kehlet | Fastlege |
|
|
Tove Borgen | Fastlege |
|
|
Kjetil G. Brurberg | Seniorforsker, Ph.D. | Folkehelseinstituttet |
|
Arbeidsgruppe fjerde utgave av handlingsprogrammet (2020)
Erik Skaaheim Haug (leder) | Urolog | Sykehuset i Vestfold HF | HSØ |
Carl Jørgen Arum | Urolog | St. Olavs hospital HF | HM |
Unni Bergan | Radiolog | HMR-Ålesund HF | HM |
Ole Jacob Greve | Radiolog | SUS HF | HV |
Gigja Gudbrandsdottir | Urolog | Helse Bergen HF | HV |
Heidi Knobel | Onkolog | St. Olavs Hospital HF | HM |
Målfrid Mangrud | Patolog | Innlandet-Lillehammer HF | HSØ |
Gunnar Tafjord | Onkolog | OUS-Radiumhospitalet HF | HSØ |
Rolf Wahlqvist | Urolog | OUS- Aker sykehus HF | HSØ |
Øystein Størkersen | Patolog | St. Olavs hospital HF | HM |
Bettina Kulle Andreassen | Statistiker/forsker | Kreftregisteret |
|
Tove Borgen | Fastlege |
|
|
Eivind Bjerkaas | Urolog | UNN HF | HN |
Arbeidsgruppe femte utgave av handlingsprogrammet (2021)
Erik Skaaheim Haug (leder) | Urolog | Sykehuset i Vestfold HF | HSØ |
Carl Jørgen Arum | Urolog | St. Olavs hospital HF | HM |
Unni Bergan | Radiolog | HMR-Ålesund HF | HM |
Ole Jacob Greve | Radiolog | SUS HF | HV |
Gigja Gudbrandsdottir | Urolog | Helse Bergen HF | HV |
Heidi Knobel | Onkolog | St. Olavs Hospital HF | HM |
Målfrid Mangrud | Patolog | Innlandet-Lillehammer HF | HSØ |
Gunnar Tafjord | Onkolog | OUS-Radiumhospitalet HF | HSØ |
Rolf Wahlqvist | Urolog | OUS- Aker sykehus HF | HSØ |
Øystein Størkersen Magnus Larsen | Patolog Urolog | St. Olavs hospital HF UNN | HM HN |
Bettina Kulle Andreassen | Statistiker/forsker | Kreftregisteret |
|
Tove Borgen | Fastlege |
|
|
Arbeidsgruppe sjette utgave av handlingsprogrammet (2023)
Erik Skaaheim Haug (leder) | Urolog | Sykehuset i Vestfold HF | HSØ |
Ole Jacob Greve | Radiolog | SUS HF | HV |
Gigja Gudbrandsdottir | Urolog | Helse Bergen HF | HV |
Heidi Knobel | Onkolog | St. Olavs Hospital HF | HM |
Målfrid Mangrud | Patolog | Innlandet-Lillehammer HF | HSØ |
Gunnar Tafjord | Onkolog | OUS-Radiumhospitalet HF | HSØ |
Øystein Størkersen Magnus Larsen | Patolog Urolog | St. Olavs hospital HF UNN | HM HN |
Bettina Kulle Andreassen | Statistiker/forsker | Kreftregisteret |
|
Eirik Kjøbli Bjørn Brennhovd | Urolog Urolog | St. Olavs hospital OUS | HM HSØ |
Erik Rud | Radiolog | OUS | HSØ |
Habilitet
Sist faglig oppdatert: 21.09.2023
Arbeidsgruppenes medlemmer har i forbindelse med arbeidet bedt om å oppgi potensielle interessekonflikter. Medlemmene er vurdert til å være habile i forhold til å delta i arbeidet.
Oppdatering av retningslinjene
Sist faglig oppdatert: 21.09.2023
Utviklingen av ny behandling på kreftområdet går raskt. Handlingsprogrammet vil vurderes årlig og om nødvendig oppdateres. Oppdateringen utføres av en arbeidsgruppe oppnevnt av Helsedirektoratet med representanter utnevnt fra RHF-ene og Område for helsetjenester i Folkehelseinstituttet.
De oppdaterte retningslinjene vil publiseres på helsedirektoratet.no og helsebiblioteket.no
Appendiks
Bruk av CT ved blærekreft og urotelial kreft, samt utredning av hematuri
Sist faglig oppdatert: 21.09.2023
1. CT urinveier uten kontrast-lavdose (Stein-CT)
Ingen konsensus vedrørende terminologi. Dette er en undersøkelse som gjøres der det er mistanke om stein i nyrer/urinveier/blære. Den gjøres oftest med lav stråledose, og uten intravenøs kontrast, og der både et positivt og negativt funn er tilstrekkelig utredning. Man kan ikke regne med å se annen type patologi, spesielt ikke i parenkymatøse organer. Den er ikke tilstrekkelig som malignitetsutredning, heller ikke av nyrene og urinveiene. Man kan også tilfeldig påvise annen patologi, som for eksempel aortaaneurismer, appendicitt og divertikulitt, men dette er i første rekke en undersøkelse for å avkrefte eller bekrefte steinsykdom. Det finnes flere varianter av denne prosedyren som går på hvor stort område som undersøkes, hvordan pasienten leies, hvor stor strålebesparing, snitt-tykkelse, bildealgoritme, med mer.
2. CT urinveier med kontrast
CT urinveier med en eller flere kontrastfaser (CT urografi/ CT nyrer-urinveier-blære med kontrast/CT urinveier med kontrast)- er en undersøkelse med mange navn
Dette er den primært valgte billeddiagnostiske undersøkelsen i utredningen av hematuri og nyre-/urinveiskreft, og anbefales brukt der det ikke er gode grunner for å la være, for eksempel svært redusert nyrefunksjon (med tanke på intravenøs kontrast), graviditet eller fare for alvorlig kontrastmiddelreaksjon (Heller et al., 2014). Den brukes for å bekrefte om det foreligger kreft, for å stadieinndele kjent kreft, både lokalt og med tanke på metastaser, og for oppfølging av behandling/forløp (Maurer et al., 2013; Moloney et al., 2014; O'Connor et al., 2010). Tradisjonelt tas serier gjennom det aktuelle området både uten og med intravenøs kontrast i ulike faser av opptak og utskillelse:
Serien uten kontrast gjøres for å se etter konkrementer. Den er ikke obligat der man skal gjøre malignitetsutredning, da stein også vises på kontrastundersøkelsen. Den brukes også som utgangspunkt for å vurdere om en lesjon i nyrene lader kontrast eller ikke, dvs om den er perfundert, for å skille hyperdens cyste fra tumor og av og til annen ikke-neoplastisk prosess. Det varierer hvor stort område man undersøker (bare nyrene/komplett gjennom urinveiene), om det brukes lavdose, snitt-tykkelse med mer. Dersom man bare er ute etter urinveiene, kan denne serien sløyfes.
I arteriefasen fremstilles karanatomien. Prosesser i nyreparenkymet vurderes best i denne tidlige fase, f.eks som for eksempel nyreinfarkter. Flere studier antyder også at blæretumores vurderes best i denne fasen (Helenius et al., 2014). I den litt senere delen av denne fasen, ofte betegnet som nefrografisk, parenkymatøs eller portovenøs fase, ser man etter svulster i nyrene, lymfeknuter, levermetastaser etc. Denne/disse fasene omfatter som regel både nyrer, urinveier og blære og det benyttes ordinær stråledose. Noen foretrekker positiv peroral kontrast for markering av tarm, andre ikke. Der man spesifikt skal vurdere nyreparenkym eller karanatomi, kan området begrenses. Blæren bør ikke være tom og ikke så full at det er smertefullt for pasienten.
Siste fase betegnes gjerne som senfase, utskillelsesfase, ekskresjonsfase eller urografifase. Serie som tas når ekskresjonen av kontrast har nådd ureteres/blære. Denne gjøres for å vurdere urinveisanatomi, evt obstruksjon og lesjoner i øvre urinveier og kontrastdefekter i blæren, selv om blæresvulster vises vel så godt i den tidlige fasen. Man kan variere stråledose, leie av pasienten, hvilket område som undersøkes, og på hvilket tidspunkt etter kontrast serien skal tas. Bildene tas oftest etter 5–10 minutter, men ved obstruksjon kan denne fasen komme inntil timer senere.
Noen kombinerer serie b og c ved å benytte «split bolus», dvs å gi deler av kontrasten først, deretter resten av kontrasten etter en gitt tid: 5–10 min, og deretter fotografere pasienten slik at man får begge faser i ett. Fordelen er redusert stråledose, ulempen er mindre kontrast pr. fase for å vurdere parenkym (nyrer/lever) og dårligere framstilling av samlesystemet pga. mindre kontrast i rett fase. Altså et slags kompromiss. Den kan brukes der det er helt avgjørende å redusere stråledosen.
Kontrastforsterket CT gjøres i mange varianter og serier, og ofte har man skreddersydd fasene for den enkelte pasient avhengig av aktuelle problemstilling. Jo mer spesifikk problemstilling, jo bedre tilpasset undersøkelse (Takeuchi et al., 2015). Fra 2023 anbefales kun en serie i nefrografisk fase ved utredning av makroskopisk hematuri.
Der man benytter Dual energy-CT, kan man unngå serien uten kontrast, da man kan beregne en slik serie ut fra en kontrastundersøkelse. Vurderingen av om lesjoner har blodgjennomstrømning eller ikke, gjøres etter et annet prinsipp enn tetthetsmåling, og baserer seg på måling av jodforekomst (jodholdig kontrast).
Cytostaticakurer
Sist faglig oppdatert: 21.09.2023
Generelt: Før hver kur måles alltid hemoglobin, leukocytter med differensialtelling og trombocytter i blodet. For dosereduksjon, grenser for utsettelse av kur samt antiemetica se lokale retningslinjer (som f.eks. Cytodose) eller Nasjonalt Cytostatica-register. Merk spesielt at man ved kurer som inneholder cisplatin må evaluere pasientens nyrefunksjon før oppstart kur med beregnet kreatinin clearance. Dersom GFR er under normalområdet bør man utføre kreatinin EDTA-undersøkelse. Ved GFR 50–59 ml/min fordeles cisplatindosen over 2 dager (nyresparende protokoll). Ved vedvarende GFR <50 ml/min er cisplatinholdig kjemoterapi kontraindisert.
M-VAC doseintensivert | |||
Metotrexat | 30 mg/m2 | dag 1 | |
Vinblastin | 3 mg/m2 | dag 2 | |
Doksorubicin | 30 mg/m2 | dag 2 | |
Cisplatin | 70 mg/m2 | dag 2 | |
Pegfilgastrim | 6 mg | dag 4 | |
Oppstart ny kur dag 15 |
|
| |
Gemcitabin-cisplatin 21 | |||
Gemcitabin | 1000 mg/m2 | dag 1 og dag 8 | |
Cisplatin | 70 mg/m2 | dag 2 | |
Oppstart ny kur dag 22 |
|
| |
Gemcitabin-cisplatin 21 nyresparende protokoll | |||
Gemcitabin | 1000 mg/m2 | dag 1 og dag 8 | |
Cisplatin | 35 mg/m2 | dag 2 og dag 3 | |
Oppstart ny kur dag 22 |
|
| |
Gemcitabin-cisplatin 28 | |||
Gemcitabin | 1000 mg/m2 | dag 1, dag 8 og dag 15 | |
Cisplatin | 70 mg/m2 | dag 2 | |
Oppstart ny kur dag 28 |
|
| |
PV-kur | |||
Etoposid | 100 mg/m2 | dag 1, dag 2 og dag 3 | |
Cisplatin | 75 mg/m2 | dag 1 | |
Vepecid (etoposid) kapsler | 200 mg/m2 | dag 2–4 | |
Gemcitabin-carboplatin | |||
Gemcitabin | 1000 mg/m2 | dag 1 og dag 8 | |
Karboplatin beregnet etter AUC 4,5 (Calverts formel) |
| dag 1 | |
Oppstart ny kur dag 22 |
|
| |
Vinflunin | |||
Vinflunin | 320 mg/m2 dag 1; for pasienter < 75 år, eller ECOG performance status= 0) | ||
Vinflunin | 280 mg/m2 dag 1; for pasienter 75–80 år eller ECOG performance- status 1, eller ECOG performance- status 0/1 med moderat nedsatt nyrefunksjon (CrCl = 40 til = 60 mL/min), eller tidligere strålebehandling til bekken). | ||
Vinflunin | 250 mg/m2 dag 1; for pasienter > 80 år, eller alvorlig nedsatt nyrefunksjon (CrCl = 30 til = 40 mL/min). | ||
Ny kur dag 22 |
| ||
Immunterapi
Generelt: Pembrolizumab og nivolumab kan gi typiske immunrelaterte bivirkninger som diare (også 2 eller flere tømninger enn de de har til vanlig pr. dag, endret avføringsmønster, blod i avføring), hypofysitt (hypo/hyperthyreose lavt kortisol (kan gi infeksjonsliknende symptomer med tachycardi, hypotensjon, feber), diabetes, pneumonitt, hepatitt (sees vanligvis kun på labprøver, ved alvorlig hepatitt-kvalme, redusert matinntak, icterus), dermatitt og fatigue.
Viktigst er å utelukke diare som kan gi alvorlig kolitt. Vanligvis kommer bivirkningen først etter 2. og 3. kur.
Vanlige blodprøver som skal tas er:
hematologi, CRP, kreatinin, ALAT, Bilirubin, γGT, ALP, TSH, FT4, LH, FSH, ACTH, kortisol.
Prøvene må tas som morgenprøver.
Pembrolizumab |
|
|
Pembrolizumab | 200 mg fast dose | dag 1 |
Ny kur dag 22 |
|
|
Nivolumab |
|
|
Nivolumab | 3 mg/kg | dag 1 |
Ny kur dag 15 |
|
|
Atezolizumab |
|
|
Atezolizumab | 1200 mg fast dose | dag 1 |
Ny kur dag 22 |
|
|
Planlegging av kurativt rettet strålebehandling
Sist faglig oppdatert: 21.09.2023
Det tas utgangspunkt i BC2001-protokollen som grunnlag for anbefalte strålevolumer (James et al., 2012).
CT-simulering og behandling gjennomføres med tom urinblære. (Pasienten later vannet ca. 15 min før simulering og behandling). Ved treg avføring anbefales bruk av laksantia f.eks. flytende parafin 10 ml, 1–2 ganger daglig.
- GTVp = synlig tumor på CT (evt MR).
- CTVp = GTVp + utvidelse av CTV for mikroskopisk sykdom, vurderes individuelt f.eks. 5-10 mm margin utenfor tumoraffisert urinblærevegg (GTV) ved mistanke om T3 og ved T4.
- CTV_bladder = Union av hele urinblærens ytterkontur og CTVp.
- CTV_urethra = Hele prostata/proksimale 15 mm av urethra hos kvinner ved (Hindson et al., 2012):
- Makroskopisk innvekst i prostata eller i fremre vaginalvegg hos kvinner (T4a)
- CIS
- Tumor lokalisert i trigonum
- Multifokal tumor
- ITV_bladder = CTV_bladder + margin for varierende blærevolum inter- og intrafraksjonelt:
- Anteriort og kranielt: 15 mm
- Lateralt, posteriort og inferiort: 10 mm
- Modifiseres for ben og muskulatur
- ITV_urethra = CTV_urethra + 5 mm isotrop margin
- Modifiseres for ben og muskulatur
- PTV = Union av ITV_bladder og ITV_urethra + forslagsvis 5 mm isotrop margin. PTV-marginer bestemmes i utgangspunktet ved hver enkelt stråleavdeling. Det oppfordres til å utvikle protokoller for adaptiv strålebehandling med «plan of the day» som det mest lovende (kombinert bruk av conebeam CT og VMAT/IMRT) (Foroudi et al., 2012).
Risikoorganer
Rectum og tarmkavitet («intestinal cavity»), det peritoneale rom utenom CTV inkludert sigmoideum. (Kranielle begrensing: 1 cm kranielt for PTV). Ved 2.75 Gy x 20 anbefales inntegning av «Annen tarm» som inkluderer individuelle tarmslynger av tykk- og tynntarm til 1 cm kranielt for PTV.
Dosekrav og fraksjonering
Måldose til PTV: 2 Gy x 32 = 64 Gy (5 fraksjoner/uke) (Hvis det ikke er påvist makroskopisk innvekst i prostata/urethra, kan man vurdere å gi redusert dose til ITV_urethra, 2 Gy x 25 / EQD2 50 Gy) | |
PTV: | D98 = 95 % (tilstrebes) |
CTV: | D98 = 95 % (krav) |
Rectum: | V60 < 50 % |
| Maksdose til bakre rectumvegg = 51.2 Gy (BC2001) (Ikke mer en 51 Gy til hele sirkumferensen av rectum). |
Tarmkavitet: | V45 < 195cc (Quantec) |
Måldose til PTV: 2.75 Gy x 20 = 55 Gy (5 fraksjoner/uke) (Hvis det ikke er påvist makroskopisk innvekst i prostata/urethra, kan man vurdere å gi redusert dose til ITV_urethra, 2.3-2.5 Gy x 20 / EQD2 50 Gy*) | |
PTV: | D98 = 95 % (tilstrebes) |
CTV: | D98 = 95 % (krav) |
Rectum: | V50 < 50 % |
| Gjennomsnittsdose < 40 Gy |
Annen tarm: | V50 < 98cc |
* antatt α/β = 2 ved hypofraksjonert, akselerert behandling (Choudhury et al., 2021).
Dosekrav til risikoorganer ved 2.75 Gy x 20 (Portner et al., 2021).
Konkomitant kjemoterapi
1. MiFu
Medikament | Dosering | Administrasjon | Dager |
|---|---|---|---|
Mitomycin | 12 mg/m² iv | 100 ml NaCl 9 mg/ml infusjonstid 10 min | Dag 1 |
Fluorouracil | 500 mg/m² iv | 1000 ml NaCl 9 mg/ml Infusjonstid 24 timer | Dag 1–5 og Dag 16–20 av strålebehandlingen |
Ondansetron | 8 mg | 1 tabl x 2 | Dag 1–5 og 16–20 |
NB! Dag 1–5 og 16–20 av strålebehandlingen, dvs. uke 1 og 4.
Ved start utenom mandag tas det pause i kjemoterapien i helgen.
Kritiske parametre:
e-GFR > 25ml/min, Leucocytter > 4.0, Trombocytter > 100, ALAT < 105, bilirubin < 37.5.
Pasienter skal ikke foreskrives metronidazol under behandling med fluorouracil.
Dosejustering av Fluorouracil ved diare eller mukositt/stomatitt (CTCAE) (James et al., 2012).
Grad 1 | Grad 2 | Grad 3 | Grad 4 |
|---|---|---|---|
Ingen endring | Reduser dose med 125 mg/m²/døgn | Avslutt kjemoterapi | Avslutt kjemoterapi |
Ingen endring | Fortsett strålebehandlingen | Ta pause i strålebehandlingen til bedring til grad 1 diare. Ved mukositt kan strålebehandlingen kontinueres | Avslutt strålebehandling |
Eller:
2. Ukentlig Cisplatin (totalt 6 kurer)
Medikament | Dosering | Administrasjon | Dager |
|---|---|---|---|
Hydrering |
| 2000 ml NaCl 9 mg/ml Tilsetninger: 40 mmol KCl 10 mmol MgSO4 Infusjonstid: 4 timer | Dag 1 |
Hydrering |
| 2000 ml NaCl 9 mg/ml Tilsetning: 10 mmol MgSO4 Infusjonstid: 2 timer | Dag 2 |
Dexametason | 12 mg | 100 ml NaCl 9 mg/ml Infusjonstid: 10 min | Dag 2 |
Akynzeo (netupitant 300 mg Palonosetron 0.5 mg) | 1 tbl | 1 time før kur | Dag 2 |
Cisplatin | 35 mg/m² | 1000 ml NaCl 9 mg/ml Infusjonstid: 1 time | Dag 2 |
Hydrering |
| 1000 ml NaCl 9 mg/ml Infusjonstid: 1 time | Dag 2 |
Behovet for hydrering dag 1, kan vurderes individuelt, men pasienten bør være istand til å drikke rikelig (minimum 2.5 liter) dagen før kur.
Kritiske parametre:
GFR > 60 ml/min
Leucocytter (Lc) > 2.5, Trc > 50
Dersom Lc < 2.5 eller Trc < 50 gis dose = 0
Hvis det 2 uker etter hverandre gis dose = 0, reduseres dosen neste gang og ved påfølgende kurer til 75 %.
Dersom ikke tilfredsstillende prøver før dag 3 eller senere gis 75 % av dosen og maksimalt 50 mg, i denne og påfølgende kurer.
Ved febril leukopeni gis neste kur med 75 % dosering og maksimalt 50 mg.
Elektrolytter, kreatrinin og albumin kontrolleres ukentlig.
Behandlingsskjema BCG
Sist faglig oppdatert: 21.09.2023









