Nasjonal faglig retningslinje for diabetes
Diagnostikk av diabetes, risikovurdering og oppfølging av personer med høy risiko for å utvikle diabetes
Diagnostiske kriterier for diabetes
Diagnosen diabetes stilles ved:
- HbA1c ≥48 mmol/mol (≥6,5 %), eller
- fastende glukose i plasma ≥7,0 mmol/L, og/eller
- glukose ≥11,1 mmol/L to timer etter en glukosebelastningstest
HbA1c bør brukes som primært diagnostikum for diabetes.
Verdi over diagnostisk grense må bekreftes i ny prøve før diagnosen kan stilles. Hvis pasienten har tilfeldig glukose i plasma ≥ 11,1 mmol/L og symptomer på diabetes, er det ikke behov for ny prøve før diagnosen stilles.
For diagnostikk av svangerskapsdiabetes gjelder egne glukosebaserte kriterier.
Praktisk – slik kan anbefalingen følges
Måling og analyse av HbA1c
Blodprøve til analyse av HbA1c til diagnostikk av diabetes kan tas når som helst på døgnet og krever ingen spesielle forberedelser av pasienten. Resultatet er normalt et uttrykk for gjennomsnittlig plasma-glukosekonsentrasjon de siste 2-3 månedene. HbA1c er ratio mellom glykert Hb og totalt Hb, og resultatet gis i mmol glykert HbA1c per mol totalt Hb.
Analyseresultatet vil kunne påvirkes ved endret omsetning av de røde blodlegemene. Ved graviditet, anemi, nylig startet behandling for anemi, kronisk alvorlig nyresykdom (som ved estimert glomerulær filtrasjonsrate <30 mL/min), hemolyse, enkelte hemoglobinvarianter og transfusjoner vil ikke HbA1c-resultatet med sikkerhet kunne tolkes som uttrykk for gjennomsnittlig plasma-glukosekonsentrasjon (Vikøren et al., 2014).
HbA1c øker langsommere enn glukose og bør ikke brukes diagnostisk hvis det er mistanke om rask utvikling av diabetes. Typiske symptomer og funn som ved diabetes og tilfeldig glukose i plasma ≥ 11,1 mmol/L er diagnostisk for diabetes.
For å sikre korrekt diagnostikk og behandling av diabetes stilles det imidlertid krav til analysekvalitet til laboratorier i og utenfor sykehus som utfører HbA1c-analysen.
Les mer om anbefalt analysekvalitet for HbA1c på Noklus sin hjemmeside.
Måling og analyse av glukose fastende eller i forbindelse med glukosebelastning
HbA1c kan ikke brukes som diagnostikum hos alle pasienter. Når HbA1c ikke kan brukes, baserer diagnostikken seg på resultater fra måling av plasma- eller serum-konsentrasjon av fastende glukose eller ved glukosebelastningstest. Ved måling av glukose er den preanalytiske fasen helt sentral fordi glykolysen fortsetter ved henstand etter prøvetaking, noe som fører til at glukosekonsentrasjonen synker. For å sikre korrekt diagnose må nedbryting av glukose etter prøvetaking forhindres i størst mulig grad. Riktig valg av prøvetakingsrør og riktig prøvehåndtering er derfor viktig. NOKLUS anbefaler bruk av egnete prøvetakingsrør og standardisert gjennomføring av glukosebelastning.
Korrekt diagnostikk av diabetes forutsetter også bruk av analyseinstrumenter med god analysekvalitet. Tidligere ble bruk av pasientnære analyseinstrumenter (PNA) frarådet ved diagnostikk pga. for dårlig kvalitet. I de siste årene er PNA-instrumenter blitt videreutviklet og forbedret slik at noen instrumenter kan egne seg til diagnostisk bruk. NOKLUS overvåker kontinuerlig kvaliteten av analyseinstrumenter både ved større laboratorier og ved pasientnære instrumenter og gir anbefaling til analysekvalitet for at noen instrumenter kan brukes til diagnostiske formål.
Les mer om prøvetaking og analyse av fastende glukose eller glukose i forbindelse med glukosebelastning ved diagnostikk av diabetes på Noklus sin hjemmeside.
Bruk av de tre diagnostiske metodene/prosedyrene
De tre diagnostiske kriteriene kan slå forskjellig ut hos samme pasient. Hvis det måles både HbA1c, fastende glukose og glukose etter belastningstest, er det kun det analyseresultatet som er over diagnostisk grense for diabetes som skal kontrolleres med en ny test i løpet av et par uker.
Diagnosen svangerskapsdiabetes kan kun stilles ved glukosebelastning (ikke Hba1c) (se egne retningslinjer).
Måling av ikke-fastende blodglukose
Måling av blodglukose er en del av utredningen av alle med klassiske symptomer på hyperglykemi, slik som tørste, økt vannlating, vekttap, kløe nedentil, økt infeksjonstendens o.a. Også ved uklare tilstander med diffuse symptomer som slapphet og redusert allmenntilstand bør man måle glukose. Tilfeldig glukose i plasma ≥ 11,1 mmol/L og symptomer og funn som ved diabetes som beskrevet ovenfor er diagnostisk for diabetes.
Ulike diabetestyper og supplerende blodprøver
Diabetes deles inn i to hovedformer.
Diabetes type 1 karakteriseres av autoimmun destruksjon av de insulinproduserende betacellene i pankreas som igjen fører til insulinmangel.
Ved diabetes type 2 er det en progredierende nedsatt evne til å utskille insulin som vanligvis skyldes insulinresistens. Ca 75-85 % har diabetes type 2.
I tillegg kommer svangerskapsdiabetes (se egen retningslinje) og diabetes som skyldes spesifikke andre årsaker som monogen diabetes (neonatal diabetes og “maturity-onset diabetes of the young (MODY)), sykdommer i eksokrine pankreas (for eksempel cystisk fibrose og pankreatitt) og diabetes forårsaket av medikamenter eller kjemikalier (for eksempel ved bruk av glukokortikoider) (Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes-2018).
Diabetes type 1 og type 2 er ikke helt homogene ikke-overlappende grupper, men kan sees på som ytterpunkter av et spektrum med en gråsone mellom hvor vi finner «latent autoimmune diabetes of the adult» (LADA) som ved diagnosetidspunktet er positiv for autoimmune markører for betacelledestruksjon, men har høyere insulinproduksjon enn diabetes type 1. LADA vil som regel progrediere til å ligne diabetes type 1.
Det er foreslått en subgruppering av diabetes type 2 som kan bidra til en raskere og bedre tilpasning av behandlingen. Ved å måle fastende glukose, C-peptid, auto-antistoffer mot glutaminsyre dekarboksylase (anti-GAD) samt bruke BMI og alder ved diagnosetidspunkt var det mulig å identifisere fem subgrupper med ulike pasientkarakteristika og risiko for senkomplikasjoner. En gruppe med den mest uttalte insulinresistensen hadde signifikant høyere risiko for diabetisk nyresykdom enn to av de andre gruppene. Gruppen med mest uttalt insulinmangel hadde høyest risiko for å få retinopati. Formelen for å identifisere subgrupper av diabetes type 2 er ennå ikke allment tilgjengelig og resultatene er ikke validerte i studier utenom Sverige og Finland (Ahlqvist E et al, 2018).
Når diagnosen diabetes er stilt, basert på HbA1c eller glukosemålinger, vil en blodprøve med analyse av auto-antistoffer mot insulinproduserende betaceller i pankreas (vanligvis anti-GAD) og fastende C-peptid ved diagnosetidspunktet være nyttig for å klassifisere diabetes som type 1, LADA eller type 2. Diabetes type 1 kjennetegnes ved å være anti-GAD-positive og ha lavt fastende C-peptid (gjerne <0,3 nmol/L), LADA er også anti-GAD-positive, men har høyere C-peptid ved diagnosetidspunktet (som regel > 0,3 nmol/L), mens type 2 er anti-GAD-negative. I tillegg til anti-GAD finnes det auto-antistoffer mot IA2 (en intracellulær del av en proteinfosfatase; kalles også anti-ICA512), insulin (IAA) og sinktransportør T8 (anti-ZnT8) som markører for betacelledestruksjon. Blant barn og unge voksne som er negative for auto-antistoffer, kan videre utredning med hensyn til MODY være aktuelt.
Monogen diabetes og MODY
Ved monogen diabetes oppstår sykdommen på grunn av mutasjoner i ett enkelt gen. Monogen diabetes kan deles i en gruppe som oppstår før 6 måneders alder og en med sykdomsdebut etter 6 måneder. Ved sykdomsdebut av monogen diabetes etter 6 måneders alder, betegnes sykdommen Maturity Onset Diabetes of the Young (MODY). De klassiske kriteriene for mistanke om MODY er autosomalt dominant arvegang av diabetes i familien, debut av diabetes hos minst ett familiemedlem før 25 års alder og betacelledysfunksjon (Njølstad et al., 2010). MODY og andre former for monogen diabetes kan diagnostiseres ved hjelp av genetiske undersøkelser av DNA fra for eksempel en fullblodprøve. For mer informasjon, se genetikkportalen.no.
Begrunnelse – dette er anbefalingen basert på
I 2012 besluttet Helsedirektoratet at HbA1c skulle brukes som primært diagnostikum for diabetes. Utførlig begrunnelse for dette ligger i informasjonsdokument som ble sendt ut til alle landets fastleger, spesialister i indremedisin og spesialister i medisinsk biokjemi i september 2012: HbA1c som primært diagnostikum for diabetes (PDF)
Vurdering
Fordeler og ulemper
Fordeler: De diagnostiske kriteriene er i samsvar med WHOs diagnostiske kriterier for diabetes (WHO report, 2011). Kriteriene er basert på grenseverdier forbundet med økt risiko for å utvikle diabetisk retinopati.
Ulemper: Diagnosen kan stilles ved å benytte tre ulike kriterier. En og samme person kan være over diagnostisk grense med en av analysene, men under grensen med en av de andre analysene. Kriteriene fanger ikke opp de samme personene, og forekomsten av diabetes vil bli påvirket av hvilken diagnostisk test som fortrinnsvis brukes (Cowie et al., 2010).
Kvalitet på dokumentasjonen
Vi har høy tiltro til risikoestimater for assosiasjon mellom verdier over grenser og diabetesspesifikke komplikasjoner som nefropati og nevropati (WHO Report, 2011).
Verdier og preferanser
Referanser
1. Cowie CC, Rust KF, Byrd-Holt DD, Gregg EW, Ford ES, Geiss LS, Bainbridge KE, Fradkin JE. Prevalence of diabetes and high risk for diabetes using A1C criteria in the U.S. population in 1988-2006. Diabetes Care 2010;33(3):562-8 https://www.helsedirektoratet.no/referanse/0002-0013-231989
2. Njølstad PR, Hertel JK, Søvik O, Ræder H, Johansson S, Molven A. Fremskritt innen diabetesgenetikk. Tidsskr Nor Legeforen 2010;130:1145-9 https://www.helsedirektoratet.no/referanse/0002-0013-231990
3. Vikøren T, Berg JP, Berg TJ. Feilkilder ved bruk av HbA1c. Tidsskr Nor Legeforen 2014;134:417-21 https://www.helsedirektoratet.no/referanse/0002-0013-231991
4. ADA Report of the expert committee on the diagnosis and classification of diabetes mellitus https://www.helsedirektoratet.no/referanse/0002-0013-231992
5. Abbreviated report of a WHO consultation https://www.helsedirektoratet.no/referanse/0002-0013-231993
22. Novel subgroups of adult-onset diabetes and their association with outcomes: a data-driven cluster analysis of six variables. https://www.helsedirektoratet.no/referanse/0002-0013-232010
23. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes-2018. Diabetes Care. 2018;41(Suppl 1):S13-S27. https://www.helsedirektoratet.no/referanse/0002-0013-232011
Sist faglig oppdatert: 16.03.2021
Risikovurdering og påvisning av diabetes
Det foreslås at fastlegen vurderer risikoen for uoppdaget diabetes:
- hos personer med diabetes i nær familie
- ved overvekt og/eller fysisk inaktivitet
- hos personer med bakgrunn fra Asia eller Afrika
Personer med etnisk europeisk bakgrunn
Hos personer eldre enn 45 år, foreslås det å bruke Diabetesrisiko.no eller annet validert risikoskåringsskjema som første skritt i risikovurderingen. Hvis skår på Diabetesrisiko.no er 15 eller høyere, følges dette opp med måling av HbA1c. Risikokalkulatoren er ikke validert for personer yngre enn 45 år. For disse bør legen anbefale HbA1c-testing etter klinisk skjønn og avhengig av risikofaktorer.
Ved klinisk mistanke om diabetes eller ved visse kliniske tilstander som er sterkt assosiert med diabetes kan, HbA1c test, eller annen glukosebasert test, brukes i stedet for risikoskåringsskjema. Dette gjelder:
- PCOS
- hypertensjon
- hjerte- og karsykdom
- bruk av kortikosteroider og enkelte psykofarmaka
- tidligere svangerskapsdiabetes (se egen retningslinje)
Personer med etnisk bakgrunn fra Asia og Afrika har stor risiko for diabetes fra ung alder
Diabetesrisiko.no undervurderer risiko for diabetes i mange etniske minoritetsgrupper. Derfor foreslås det å bruke HbA1c-test (eller annen glukosebasert test, se under praktisk) for denne pasientgruppen, etter klinisk skjønn som alternativ til bruk av risikoskåringsskjema.
Praktisk – slik kan anbefalingen følges

Last ned flytdiagram: Risikovurdering og diagnostikk av diabetes (Utskriftsvennlig PDF)
Risikovurdering med bruk av validert risikokalkulator
Ved Diabetesrisiko.no-skår 15-20 vil 1 av 3 utvikle diabetes i løpet av en 10-årsperiode, mens den er økt til 1 av 2 ved skår >20. Diabetesrisiko.no (basert på FINDRISK) er utviklet spesielt som en brukervennlig nettbasert risikokalkulator for egenevaluering av risiko.
Personer med høy risiko for å ha uoppdaget diabetes som for eksempel ved overvekt, genetisk disposisjon, passiv livsstil, etnisitet og tidligere svangerskapsdiabetes anbefales å kontakte sin fastlege for videre kartlegging ved bruk av Diabetesrisiko.no eller annet risikoskåringsskjema og videre måling av HbA1c dersom risikoskåren er høy.
Intensiv livsstilsintervensjon og årlig oppfølgning med måling av HbA1c hos fastlege foreslås for alle personer som skårer 15 eller høyere på diabetesrisikotesten. Se også anbefalingene Diagnostiske kriterier for diabetes og Anbefalte analyser ved klinisk mistanke om diabetes eller klinisk høy risiko for diabetes type 2 i kapittelet Diagnostikk av diabetes, risikovurdering og oppfølging av personer med høy risiko for å utvikle diabetes.
Det anbefales ikke screening av utvalgte befolkningsgrupper, men det er viktig for helsetjenesten å være oppmerksom på økt diabetesrisiko i hos personer med opprinnelse i Sørøst-Asia og Midtøsten.
HbA1c ved klinisk mistanke om uoppdaget diabetes
Ved klinisk mistanke om diabetes eller ved visse kliniske tilstander som er sterkt assosiert med diabetes (PCOS, hypertensjon, hjerte- karsykdom, bruk av kortikosteroider og enkelte psykofarmaka, tidligere svangerskapsdiabetes (se egen retningslinje)), kan HbA1c test (eller annen glukosebasert test) brukes i stedet for risikoskåringsskjema.
HbA1c er den foretrukne diagnostiske testen for diabetes, men er kontraindisert ved graviditet, anemi, kronisk nyresvikt, hemolyse, enkelte hemoglobinvarianter og transfusjoner (se tabell nedenfor). I slike tilfeller bør det brukes en glukosebasert test (fastende blodglukose eller 2t glukosebelastning).
Risikovurdering av etniske minoriteter
Med mindre klinisk risiko fremstår som lav, bør HbA1c kontrolleres årlig hos personer med bakgrunn fra Asia og Afrika fra 25 års alder.
Risikokalkulatoren på diabetesrisiko.no kan ikke brukes hos etniske minoriteter med høy risiko for type 2 diabetes, der diabetes ofte debuterer 10–15 år tidligere og ved lavere grad av overvekt.
Når det gjelder vurdering av risikofaktorer hos etniske minoriteter, er det viktig å være oppmerksom på at det er et annet risikobilde knyttet til overvekt og abdominal fedme, da andre grenser gjelder for visse etniske grupper.
På bakgrunn av data fra risikovurdering av den Sør-asiatiske befolkningen, har WHO anbefalt at en BMI mellom 18.5 og 22.0 kg/m² er sunt for denne befolkningsgruppen, og følgende vil BMI < 23 kg/m² være forbundet med lav risiko for diabetes type 2 i denne befolkningsgruppen. Grensen for fedme vil likeledes bli lavere, og en konsensusgruppe i India (japi.org) har definert fedme hos denne populasjonen som større enn, eller lik BMI på 25 kg/m² (versus BMI > 30 kg/m² for europeere).
Siden abdominal-fett er særlig forbundet med økt risiko for kardiovaskulær sykdom og type 2 diabetes, er det i denne sammenhengen også viktig å måle midjeomkretsen. The International Diabetes Federation (IDF) har satt følgende grenseverdier for midjeomkrets for å definere metabolsk syndrom hos denne etniske gruppen:
- Kvinner > 80 cm
- Menn > 90 cm
(Tabell 2 er tidligere publisert i Tidsskrift for Den norske legeforening av Vikøren et al., (2012). Feilkilder ved bruk av hemoglobin A1c. http://tidsskriftet.no/article/3141580/).
Begrunnelse – dette er anbefalingen basert på
For at det skal være berettiget å innføre screening for diabetes i den generelle befolkningen, må det være god dokumentasjon på at fordelene er klart større enn ulempene, og problemstillingen må vurderes etter 16 kriterier beskrevet i Helsedirektoratets rapport Ny styringsstruktur og strategi for nasjonale screeningprogrammer.
Studiene som ligger til grunn for denne anbefalingen er av lav kvalitet, fordelene oppveier ikke ulempene, og intervensjonen er ressurskrevende. På grunn av dette er ikke problemstillingen vurdert i henhold til de 16 kriteriene i denne rapporten.
Det er derimot mange studier som viser god dokumentasjon for at man bør foreta aktiv risikovurdering (og videre testing med HbA1c av høyrisikoindivider ved score ≥ 15 eller annen klinisk høy risiko), såkalt case-finding. For personer med europeisk bakgrunn har Diabetesrisiko.no vist seg å være et validert instrument som bør brukes.
Forskningsgrunnlag
Populasjon (P): Hele befolkningen
Tiltak (I): Screening mht diabetes
Sammenligning (C): Ikke screening mht diabetes
Beskrivelse av inkluderte studier
Ved generell testing av befolkningen
Screening av befolkningen med etterfølgende intervensjon er undersøkt i to studier: Ely-kohorten (Simmons RK et al 2011) og ADDITION-Cambridge-studien (Simmons RK et al 2012). Studiene har mortalitet eller kardiovaskulær mortalitet som utfall.
I Ely-kohorten (4900 deltakere med 10 års oppfølging) fant man HR for død 0,79 (95 % CI 0,63-1,00) dvs AR 14 færre per 1000 (95 % CI 26 færre til 0 færre). Kohortstudien inkluderte kvinner og menn uten kjent diabetes. Alderen var 40 til 65 år og majoriteten av deltakerne var av kaukasisk opprinnelse. Studiepopulasjonen ble delt inn i tre grupper: 1) deltakere invitert til screening i 1990-1992; 2) deltakere invitert til screening i 2000-2003; og 3) deltakere uten screening i den ovennevnte perioden. I evidensprofilen har vi ekstrahert data fra analysen som sammenliknet deltakere med screening i første runde (1990-1992) med deltakere som ikke ble screenet i den samme perioden. Deretter har vi brukt data fra analysen som sammenliknet deltakere som ble screenet i den andre runden (2000-2002) med deltakere som ikke ble screenet i den samme perioden.
I ADDITION-Cambridge-studien (en klyngerandomisert RCT med 19226 deltakere og 9,6 års oppfølgning) fant man HR for kardiovaskulær død 1,02 (CI 0,75-1,38), AR 1 flere døde pr 1000 (CI 7 færre til 11 flere døde). Studien inkluderte deltakere med høy risiko for uoppdaget diabetes, alder 40-69 år og gjennomsnittlig BMI på 30 kg/m2. Trettitre til 45 % av deltakerne brukte antihypertensiv behandling ved baseline og majoriteten var av kaukasisk opprinnelse. Intervensjonsgruppen gjennomførte screening ved tilfeldig måling av kapillær glukosekonsentrasjon, HbA1c, fastende kapillær glukosemåling og deretter OGTT. Deltakere som fikk påvist diabetes, ble videre randomisert til enten intensiv behandling eller ingen behandling. Kontrollgruppen mottok ingen screening/ingen behandling.
I en metaanalyse (Sherifali et al 2013) er det også oppsummert resultater fra studier som har undersøkt mulige negative utfall av screening for diabetes. Enkeltstudiene er hentet fra ADDITION-Cambridge. Gjennomgangen konkluderte med at screening medfører noe økt angstnivå og kortvarig redusert selvrapportert helse hos dem som ble screenet sammenliknet med dem som ikke ble screenet, og hos dem som fikk påvist diabetes. Det økte angstnivået var av kort varighet.
Hyppighet av screening av høyrisikopersoner er undersøkt ved hjelp av modellberegninger.
Referanser
6. Simmons RK, Echouffo-Tcheugui JB, Sharp SJ, Sargeant LA, Williams KM, Prevost AT, Kinmonth AL, Wareham NJ, Griffin SJ.Screening for type 2 diabetes and population mortality over 10 years (ADDITION-Cambridge): a cluster-randomised controlled trial. Lancet 2012;380(9855):1741-8 https://www.helsedirektoratet.no/referanse/0002-0013-231994
7. Simmons RK, Rahman M, Jakes RW, Yuyun MF, Niggebrugge AR, Hennings SH, Williams DR, Wareham NJ, Griffin SJ. Effect of population screening for type 2 diabetes on mortality: long-term follow-up of the Ely cohort. Diabetologia 2011;54(2):312-9 https://www.helsedirektoratet.no/referanse/0002-0013-231995
Sist faglig oppdatert: 14.09.2016
Anbefalte analyser ved klinisk mistanke om diabetes eller klinisk høy risiko for diabetes type 2
Følgende grupper har forhøyet risiko for å utvikle diabetes type 2:
- Personer med skår > 15 poeng på diabetesrisiko.no
- Personer med klinisk høy risiko, se Praktisk
- Personer med etnisk bakgrunn fra Asia eller Afrika
Det foreslås at de som tilhører en av disse risikogruppene blir testet ved hjelp av en av følgende analyser:
- HbA1c
- Fastende glukose
- Glukose to timer etter en glukosebelastning
Følgende resultatintervaller innebærer høy risiko for utvikling av diabetes type 2:
- HbA1c 42–47 mmol/mol (6,0–6,4 %)
- Fastende glukosekonsentrasjon i plasma 6,1–6,9 mmol/L
- Glukosekonsentrasjon i plasma 7,8–11,0 mmol/L to timer etter en glukosebelastning
Praktisk – slik kan anbefalingen følges
Følgende symptomer gir klinisk mistanke om diabetes:
- hyperglykemi som økt tretthet, polidipsi, poliuri
- vekttap og infeksjoner (analyser plasma-glukose)
Forhold som er forbundet med klinisk høy risiko for diabetes:
- asiatisk eller afrikansk etnisk bakgrunn
- overvekt
- tidligere påvist nedsatt glukosetoleranse
- tidligere svangerskapsdiabetes
- behandling med kortikosteroider
- kardiovaskulær sykdom
- fysisk inaktivitet
- forhøyede blodlipider
- diabetes i nærmeste familie
- behandling med psykofarmaka
- obstruktivt søvnapnesyndrom
- polycystisk ovariesyndrom.
Se for øvrig tabell under praktisk i anbefalingen Risikovurdering og påvisning av diabetes for tilstander som kan påvirke måling og fortolkning av HbA1c.
Begrunnelse – dette er anbefalingen basert på
Sammendrag
Anbefalingen er basert på en meta-analyse (Morris et al., 2013) som konkluderer med at det ikke er statistisk signifikant forskjell mellom testene for å avdekke grad av risiko for å utvikle diabetes enten man måler med HbA1c, fastende glukose eller glukose 2-timer etter glukosebelastning.
Det er anerkjent at nedsatt glukosetoleranse (impaired glucose tolerance (IGT)), definert som plasma-glukose etter glukosebelastning mellom 7,8 og 11,0 mmol/L og/eller forhøyet fastende glukose i området 6,1 og 6,9 mmol/L (impaired fasting glucose (IFG)) indikerer en økt risiko for å utvikle diabetes, selv om studien viser at testene har liten overlapp med hvilken høyrisikogruppe de identifiserer. IGT er foreslått å være forårsaket av en forhøyet endogen glukoseproduksjon i kombinasjon med betacellesvikt, mens IFG er foreslått å skyldes defekt i insulinsekresjonen.
Glukose-målinger og HbA1c avdekker ulike pasientpopulasjoner. Det er gjennomført få studier med HbA1c som kriterium for diabetes type 2, og det er behov for mer forskning for å definere grad av risiko hos personer med HbA1c mellom 42 - 47 mmol/mol (6,0 - 6,4 %).
De diagnostiske grensene for diabetes (HbA1c ≥ 48 mmol/mol (≥ 6,5 %), fastende plasma-glukosekonsentrasjon (FPG) ≥7,0 mmol/L og plasma-glukosekonsentrasjon (PG) ≥11,1 mmol/L to timer etter glukosebelastning) er alle høyere enn de respektive øvre referansegrensene for analysene (HbA1c 42 mmol/mol (6,0 %), FPG 6,0 mmol/L, PG etter glukosebelastning 7,7 mmol/L). Verdier mellom øvre referansegrense og diagnostisk grense for diabetes representerer en gråsone.
Forskningsgrunnlag
Populasjon (P): Hele befolkningen
Tiltak (I): Påvist nedsatt glukosetoleranse
Sammenligning (C): Påvist normal glukosetoleranse
Beskrivelse av inkluderte studier
Risiko for diabetes ved påvisning av nedsatt glukosetoleranse (IGT; plasma-glukosekonsentrasjon 7,8-11,0 mmol/L) vs normal glukosetoleranse (plasma-glukosekonsentrasjon <7,8 mmol/L) to timer etter en glukosetoleransetest.
Vurdering
Fordeler og ulemper
HbA1c: Analysen er stabil og kan tas uten forberedelse av pasienten når som helst på døgnet. Den påvirkes i liten eller ingen grad av andre sykdommer og er stabil etter at prøven er tatt. Det er mulig å oppnå diagnostisk kvalitet på HbA1c-målingen med instrumenter som finnes på mange legekontorer. Ulemper ved bruk av HbA1c er at resultatet ikke gir et pålitelig uttrykk for gjennomsnittlig glukosekonsentrasjon de siste 2-3 månedene ved endringer i omsetningen av røde blodceller som ved graviditet, anemier, alvorlig nyresykdom og enkelte hemoglobinopatier.
Fastende glukose målt i plasma eller serum: Det er en enkel og billig analyse som er godt validert mht risiko for å utvikle diabetes. Pasientnære analyseinstrumenter kan brukes diagnostisk dersom de har god analysekvalitet. Pasienten må møte fastende, og nivået påvirkes av blant annet akutte inflammasjoner og fysisk aktivitet dagen før prøven tas. Glukose forbrukes av blodceller og prøven må tas på riktig prøvetakingsrør for å unngå nedbrytning av glukose.
Les mer om prøvetaking og analyse av fastende glukose eller glukose i forbindelse med glukosebelastning ved diagnostikk av diabetes på Noklus sin hjemmeside.
Glukosebelastning: Fordeler og ulemper er som for fastende plasma-glukose. I tillegg er pasienten bundet til å være i nærheten av undersøkelsesrommet i minst 2 timer. Glukosekonsentrasjonen etter belastningen har stor biologisk variasjon og vil variere ±30%. Mange opplever en lett og forbigående kvalme ved inntak av 75 g glukose.
Kvalitet på dokumentasjonen
Det er kun utført observasjonsstudier med tanke på grenseverdier av de diagnostiske markørene for diabetes og senere utvikling av diabetes. Det er ikke sannsynlig at det vil bli utført randomiserte studier for å dokumentere eventuelle sammenhenger.
Verdier og preferanser
Fastende plasma-glukose og glukosebelastning krever at personen må forberede seg før prøvetakningen i form av faste fra dagen før. Belastningstesten er tidkrevende for personen (minst to timer). HbA1c og glukose kan analyseres med "diagnostisk" kvalitet ved hjelp av pasientnære instrumenter på legekontoret forutsatt at instrumentene har god nok analysekvalitet.
Referanser
8. Morris DH, Khunti K, Achana F, Srinivasan B, Gray LJ, Davies MJ, Webb D. Progression rates from HbA1c 6.0-6.4% and other prediabetes definitions to type 2 diabetes: a meta-analysis. Diabetologia 2013;56(7):1489-93 https://www.helsedirektoratet.no/referanse/0002-0013-231996
Sist faglig oppdatert: 14.09.2016
Oppfølging av personer med høy risiko for å utvikle diabetes
Det foreslås at personer med høy risiko for å få diabetes tilbys strukturert, intensiv livsstilsintervensjon og får målt HbA1c hos fastlege en gang i året.
For mer informasjon om hvilke personer som har høy risiko for diabetes, se anbefalingen Anbefalte analyser ved klinisk mistanke om diabetes eller klinisk høy risiko for diabetes type 2.
Praktisk – slik kan anbefalingen følges
Intensiv livsstilsintervensjon
Fastlegen kan koordinere og samarbeide med andre fagpersoner for de ulike elementene i livsstilsintervensjonen og henvise til gruppebaserte tilbud gjennom for eksempel frisklivssentraler, lærings- og mestringstilbud i kommunene eller annet tilsvarende (Diabetesforbundets motivasjonsgrupper, frivillige gruppetilbud o.l.).
Intensiv livsstilsendring kjennetegnes av en multifaktoriell behandling, som oftest bestående av fysisk aktivitet og trening, kostholdsendring og adferdsterapi. Oppfølgingen har et klart mål, er prosessorientert og gir deltagerne tid til å ta ett steg av gangen. Behandlingstilbud ved lokale Frisklivssentraler kan være et godt alternativ for denne pasientgruppen.
Se anbefaling om oppfølging/endring av levevaner ved diabetes type 2 og overvekt/fedme i kapittelet Levevaner ved diabetes og behandling av overvekt og fedme, der det anbefales at personer med diabetes type 2 og overvekt får tilbud om et intensivt livsstilsbehandlingsprogram av minst 6 måneders varighet med fokus på kalorirestriksjon, fysisk aktivitet og hjelp til varig adferdsendring (Jensen MD 2014) der målet er > 5 % varig vektreduksjon.
Råd om kosthold og fysisk aktivitet til personer med etablert høy risiko for diabetes type 2
(Basert på Finnish Diabetes Prevention Study (FDPS) sine råd for kosthold og fysisk aktivitet)
Kostråd
- Reduser inntaket hardt fett til fordel for mykt fett
- Øk inntaket hele korn og fiber og reduser inntaket av raffinert korn og sukker
- Øk inntaket av grønnsaker og frukt
- Spis mindre energitett mat
Kostholdsrådene gitt i anbefalingen Kosthold og kostsammensetning ved alle former for diabetes kan også følges av dem med høy risiko for å utvikle diabetes type 2.
Fysisk aktivitet
Minimum 2 ½ timer fysisk aktivitet per uke
- All trening (aerob, styrke) er gunstig
- Mest effektiv risikoreduksjon er oppnådd med moderat anstrengende trening.
Se også Aktivitetshåndboken som beskriver hvordan fysisk aktivitet kan benyttes i forebygging og behandling av sykdom: «Det anbefales daglig fysisk aktivitet med middels intensitet i minst 30 minutter (rask spasertur, sykling, skigåing e.l.), tilpasset personens allmenne fysiske form og levevaner. Ytterligere helseeffekt kan oppnås ved å kombinere dette med noe mer intensiv trening 2–3 ganger per uke».
Generelt er fysisk inaktivitet en betydelig risikofaktor for diabetes type 2 fordi det fører til redusert insulinfølsomhet, og det er i flere studier påvist at utviklingen av diabetes kan forebygges ved fysisk trening i kombinasjon med kostholdsveiledning. Regelmessig fysisk trening har positiv virkning både på insulinfølsomheten og på andre risikofaktorer for hjerte-karsykdom, for eksempel blodfettprofil og blodtrykk.
Vektreduksjon (hvis overvektig)
På lik linje med anbefalingen om vektreduksjon ved diabetes type 2 (se over og i kapittelet Levevaner ved diabetes og behandling av overvekt og fedme), er det også viktig med vektreduksjon ved høy risiko for å utvikle diabetes type 2. FDPS (og andre tilsvarende oppfølgingsstudier) har vist at et vekttap på 5-10% av egen kroppsvekt reduserer risikoen for å utvikle diabetes type 2 betydelig.
Innvandrerperspektivet
I all diabetesbehandling er det viktig med individuell tilpasning, dette er uavhengig av kjønn, kultur, religion og tradisjon.
Tendensen er at færre innvandrere enn norskfødte oppgir å ha god helse. Forekomsten av psykiske plager og lidelser, samt enkelte kroniske sykdommer er høyere i enkelte innvandrergrupper, men det er store forskjeller mellom grupper og innad i ulike grupper, ifølge Folkehelserapporten 2014 fra Folkehelseinstituttet (Rapport 2014:4 Folkehelserapporten 2014: Helsetilstanden i Norge).
Innvandrere er klart overrepresentert i diabetes statistikken i flere helseundersøkelser gjort gjennom årene. Det er imidlertid svært viktig å differensiere innvandrer befolkningen i ulike etniske grupper.
De gruppene det i all hovedsak er fokusert på i retningslinjene er;
- Sør-Asia (India, Pakistan, Sri Lanka, Bangladesh)
- Øst-Asia (Vietnam og Kina)
- Midtøsten og Nord-Afrika (Tyrkia, Irak, Iran, Marokko)
- Afrikas horn og Afrika sør for Sahara (Somalia og Eritrea, Nigeria etc.)
Det er viktig å tilrettelegge for, og ta hensyn til religion, tradisjon og kultur, kjønn og alder. Hver for seg og samlet vil ovenfor nevnte faktorer kunne påvirke evnen og muligheten til å delta i og gjennomføre ulike intervensjoner, tester og undersøkelser, noe som igjen kan påvirke utfallet og eller resultatet. Ellers bør innvandrerbefolkningen bør følge anbefalingene for kost og fysisk aktivitet, se kapitlet Levevaner ved diabetes og behandling av overvekt og fedme, og særskilt anbefalingen Kostveiledning til personer med diabetes og innvandrerbakgrunn .
Det er nødvendig å sette av tilstrekkelig tid til å gjøre seg kjent med pasientens kultur og tradisjon knyttet til kost og fysisk aktivitet. Ved å få rede på, ikke bare hva de spiser pr nå, men hva pasienten faktisk kan og har med seg av kunnskap og erfaring, vil det være lettere å tilpasse og legge til rette for gunstig livsstilsendring som samsvarer med det pasienten opplever som håndterbart og mulig å mestre. For å nå dette, er det avgjørende med god kommunikasjon, tillit og anerkjennelse.
Søvnforstyrrelser og risiko for diabetes
For kort og for lang søvn, samt problemer med å initiere og opprettholde søvnen er forbundet med økt risiko for kardiovaskulær sykdom og total dødelighet (Gallicchio et al., 2009; Kalesan et al., 2009; Cappuccio et al., 2009). Kartlegging av søvnmønster kan være et nyttig hjelpemiddel.
Kortvarige, akutte, laboratorie- og tverrsnittsobservasjonsstudier (Spiegel et al., 2009 og Cappuccio et al., 2009) tyder på at forstyrret eller redusert søvn er forbundet med glukoseintoleranse, insulinresistens, redusert akutt insulinrespons til glukose, og dermed predisponerer individer til type 2 diabetes. Kausaliteten i sammenhengen og overføringen av resultatene til mer langsiktige effekter av vedvarende søvnforstyrrelser har blitt undersøkt i prospektive befolkningsstudier for å etablere en tidsmessig sammenheng mellom eksponering og utfall.
En systematisk gjennomgang og meta-analyse (Cappuccio et al., 2011) gjennomgikk publiserte prospektive populasjonsbaserte studier for å vurdere om den globale evidens støtter tilstedeværelsen av en sammenheng mellom kvantitative og kvalitative søvnforstyrrelser og utvikling av diabetes type 2 og for å oppnå et kvantitativt estimat av risikoen. Denne viste et entydig og konsistent mønster av økt risiko for å utvikle diabetes type 2 både ved redusert og økt søvnlengde og ved kvalitative forstyrrelser av søvn.
Røykeslutt og atferdsendring
For personer med forhøyet risiko for å utvikle diabetes er det særlig viktig å slutte å røyke. Se kapitlet Levevaner ved diabetes og behandling av overvekt og fedme.
Atferdsendring hos de som er i en høyrisikogruppe sammenlignet med den som allerede har fått diagnosen diabetes, er ikke vesentlig forskjellig, da begge grupper har mye å hente på å endre levevaner, men da effekten er størst hos dem som ennå ikke har fått diagnosen er det særskilt viktig at helsepersonell fokuserer på motivasjon og mestring overfor denne gruppen. En del av de aspekter som fremheves i kapittelet Kommunikasjon, mestring og motivasjon kan brukes, men i tillegg anbefales det å bruke Motiverende intervju som teknikk og samtalemetode.
Begrunnelse – dette er anbefalingen basert på
Flere studier har vist at T2DM kan forebygges med endringer i livsstil for enkeltpersoner med risiko, selv med beskjedne kliniske forsøk (Nilsen et al., 2011). WHO anslår at 90% av T2DM kan forebygges gjennom endringer i kosthold, fysisk aktivitet og røykevaner, og det er vist at risikoen for å utvikle T2DM i høyrisikopersoner kan bli redusert med over 50% med høyverdig livsstilsintervensjon blant personer med fedme (WHO Action Plan, 2008).
Intervensjoner som involverer og endrer deltakeres risikooppfatninger ser ut til å lykkes med å få personer til å bedre sin livsstil, uavhengig av alder (Ferrer og Klein, 2014).
Dette, sammenfattet med resultatene i Finnish Diabetes Prevention Study (FDPS), gir et betydelig kunnskapsgrunnlag til å vise at tidlig intervensjon hos personer med forhøyet risiko for type 2 diabetes kan gi mulig redusert insidens (på kort sikt) eller i beste fall utsettelse av tidspunkt for diagnosen diabetes.
Studiene har ikke vist sikkert at intervensjonen kan ha effekt på ugunstig utfall på lang sikt etter at behandlingen er avslutte. Det kan skyldes kort oppfølgingstid. Uavhengig av dette, vil redusert insidens på kort sikt og en utsettelse av diagnosetidspunkt ha en stor samfunnsøkonomisk betydning.
Forskningsgrunnlag
Populasjon (P): Personer med høy risiko for å utvikle diabetes
Tiltak (I): Endring av livsstil
Sammenligning (C): Ingen intervensjon
Beskrivelse av inkluderte studier
Den finske DPS-studien (Lindstrøm J, 2013) med livsstilintervensjon i 4 år (diett, fysisk aktivitet, vektreduksjon) og oppfølgning i totalt 13 år (median 9 år) viste en utsettelse av diabetesdiagnosen med 5 år.
Denne randomiserte kontrollerte studien inkluderte deltakere med høy risiko for å utvikle type 2 diabetes (prevalent IGT, overvekt og fedme), alder 40 til 64 år og med kaukasisk opprinnelse. Deltakerne ble randomisert til to grupper og fikk aktiv oppfølging i fire år: 1) intensiv livsstilsintervensjon med kostholdsveiledning og fysisk aktivitet; og 2) kontrollgruppe som mottok standard behandling.
For utfallet vektreduksjon har vi lagt til grunn en metaanalyse/systematisk oversikt (Dunkley AJ, 2014) med inklusjon av 25 studier (med deltakere med høy risiko for å utvikle diabetes type 2, gjennomsnittsalder var fra 38 til 65 år og BMI fra 25 til 37 kg/m2. Få studier oppga etnisitet blant deltakerne). Det ble gitt livsstilintervensjon over 12 mnd med mål om å forebygge diabetes. Studien ga signifikant reduksjon i risiko målt i form av vektreduksjon sammenlignet med en kontrollgruppe som fikk «usual care». Resultatene var best der hvor intervensjonene ble gjort strengest i henhold til retningslinjene.
Det finnes ingen litteratur som gir svar på effekter på morbiditet, mortalitet, livskvalitet, angst, depresjon og bivirkninger av intervensjonen, men flere andre studier bekrefter resultatene fra DPS:
En systematisk gjennomgang av studier gjort på personer med risiko for å utvikle T2DM, eller med andre kliniske risikofaktorer som overvekt og høyt blodtrykk, har presentert intervensjonskomponenter knyttet til økt endring i fysisk aktivitet (12 til 18 måneder) og kosthold ( 1 og 3 år). Resultatene viste kausalitet når både fysisk aktivitet og kosthold ble adressert. I tillegg er hyppig kontakt med en total mengde av ni konsultasjoner forbundet med en positiv effekt (Greaves CJ et al, 2011).
En studie fant at de som var i risiko for T2DM ikke hadde høyere bevissthet om viktigheten av kosthold og vektkontroll for å forebygge T2DM enn personer uten risiko (Guess ND et al, 2015). En annen studie fant at høyere alder på personer med risiko for T2DM var assosiert med lavere forventninger og lavere klarhet for livsstilsendring (Bouchard DR et al, 2012).
Vurdering
Fordeler og ulemper
Fastlegen har kontakt med 80 % av sine listepasienter i løpet av et år. De med høyest risiko for diabetes besøker nok kontoret hyppigere enn de med lavest risiko. Utfylling av risikokalkulator for diabetesrisiko kan gjøres under konsultasjonene for å fange opp flest mulig av personene med høy risiko. Måling av HbA1c, fastende blodglukose eller glukosebelastning vil i tillegg kunne fange opp flere personer med høy risiko. Med tanke på intervensjonen vil det nok kunne oppstå en ulempe ved at den fanger skjevt med i forhold til sosioøkonomisk status.
De fleste pasientene vil oppfatte tiltaket som forebyggende helsearbeid og vil neppe føle seg stigmatisert. Overdiagnostikk er neppe relevant når en holder seg til kriterier for undersøkelse og intervensjon og kun tester personer med definert forhøyet risiko. Anbefalingen vil føre til mindre «villscreening».
Oppnåelse av kliniske effekter av livsstilsintervensjoner er bl.a. avhengig av intervensjonens intensitet, valg av kommunikasjonsmetode, pasientenes motivasjon og hvilken oppfølging kontrollgruppen får. I Finnish Diabetes Prevention Study (FDPS) ble deltakerne fulgt i opptil ni år, med vedvarende effekt på insidens av diabetes (HR 0.614 95% CI 0.48 - 0.79; p < 0.001). Kontrollgruppen fikk generell muntlig og skriftlig livsstilsinformasjon ved baseline og deretter en gang i året. Deltakerne i intervensjonsgruppen fikk intensiv, individuell oppfølging i form av rådgiving, oppfølging og målsetting relatert til vekt, fysisk aktivitet og kosthold (redusert inntak av fett, økt inntak av fiber). Intervensjonsgruppen hadde syv konsultasjoner med ernæringsfysiolog i løpet av det første året, og deretter hver tredje måned. I tillegg fikk deltakerne gratis, veiledede treningstimer i helsestudio.
FDPS viste at minimum fire års oppfølging av personer med høy risiko for diabetes gir beskyttelse mot å utvikle diabetes på lang sikt.
Det er få kliniske ulemper ved livsstilsintervensjon. En potensiell trussel for effekten er at behandlingen i stor grad er avhengig av et velfungerende behandler-pasient-forhold. De potensielle kliniske fordelene ved livsstilsintervensjon er langt flere enn de utvalgte utfallene som er vurdert i evidensprofilen, blant annet reduksjon i kardiovaskulære risikofaktorer.
Kvalitet på dokumentasjonen
FDPS er vurdert å ha moderat høy kvalitet, mens den systematiske oversikten som ligger til grunn for effekten på vektreduksjon har lav kvalitet på grunn av store forskjeller i rapportert effekt blant studiene som er inkludert i analysen.
Verdier og preferanser
Risikovurdering for alle hos fastlegen vil trolig utjevne forskjeller fordi de med høyest risiko vil få oppfølging. Dette forutsetter imidlertid at tiltakene er tilpasset ulike sosioøkonomiske og etniske grupper.
Hvordan informasjon om risiko blir mottatt av pasienten kan avhenge av sosiale og psykologiske faktorer, inkludert både familiehistorie og nåværende livsstil (Sandman et al., 2001)
For pasientene som ønsker å gjøre endringer i livsstilen vil en tett oppfølging være til stor hjelp, både for å holde motivasjonen oppe og med å få hjelp til å ta de rette valgene. Intensiv livsstilsbehandling er mer intensive i starten og krever mye tid og forpliktelse fra deltakeren. Det kan være upraktisk å måtte reise flere ganger ukentlig til behandlingsstedet.
Referanser
9. Rui Li, PhD; Shuli Qu, MPH; Ping Zhang, PhD; Sajal Chattopadhyay, PhD; Edward W. Gregg, PhD; Ann Albright, PhD; David Hopkins, MD; and Nicolaas P. Pronk, PhD. Economic Evaluation of Combined Diet and Physical Activity Promotion Programs to Prevent Type 2 Diabetes Among Persons at Increased Risk: A Systematic Review for the Community Preventive Services Task Force Annals of Internal Medicine. Ann Intern Med. 2015 doi:10.7326/M15-0469 https://www.helsedirektoratet.no/referanse/0002-0013-231997
10. Sandman P. Risk communication: Evolution and Revolution. Wolbarst A, editor: John Hopkins University Press; 2001 https://www.helsedirektoratet.no/referanse/0002-0013-231998
11. Spiegel K, Tasali E, Leproult R, Van Cauter E. Effects of poor and short sleep on glucose metabolism and obesity risk. Nat Rev Endocrinol 2009; 5: 253– 261 https://www.helsedirektoratet.no/referanse/0002-0013-231999
12. Lindström J, Peltonen M, Eriksson JG, Ilanne-Parikka P, Aunola S, Keinänen-Kiukaanniemi S, Uusitupa M, Tuomilehto J; Finnish Diabetes Prevention Study (DPS). Improved lifestyle and decreased diabetes risk over 13 years: long-term follow-up of the randomised Finnish Diabetes Prevention Study (DPS). Diabetologia 2013;56(2)284-93 https://www.helsedirektoratet.no/referanse/0002-0013-232000
13. Guess ND, Caengprasath N, Dornhorst A, Frost GS. Adherence to NICE guidelines on diabetes prevention in the UK: Effect on patient knowledge and perceived risk. Prim Care Diabetes. 2015 https://www.helsedirektoratet.no/referanse/0002-0013-232001
14. Greaves CJ, Sheppard KE, Abraham C et al. Systematic review of reviews of intervention components associated with increased effectiveness in dietary and physical activity interventions. BMC Public Health 2011;11(119) https://www.helsedirektoratet.no/referanse/0002-0013-232002
15. Gallicchio L, Kalesan B. Sleep duration and mortality: a systematic review and meta-analysis. J Sleep Res. 2009 Jun;18(2):148-58. doi:10.1111/j.1365-2869.2008.00732.x. Review. PubMed PMID: 19645960. https://www.helsedirektoratet.no/referanse/0002-0013-232003
16. Ferrer R, Klein WM. Risk perceptions and health behavior. Curr Opin Psychol. 2015 1(5):85-9.Portnoy DB, Ferrer RA, Bergman HE, Klein WM. Changing deliberative and affective responses to health risk: a meta-analysis. Health Psychol Rev 2014;8(3):296-318 https://www.helsedirektoratet.no/referanse/0002-0013-232004
17. Dunkley AJ, Bodicoat DH, Greaves CJ, Russell C, Yates T, Davies MJ, Khunti K. Diabetes prevention in the real world: effectiveness of pragmatic lifestyle interventions for the prevention of type 2 diabetes and of the impact of adherence to guideline recommendations: a systematic review and meta-analysis. Diabetes Care 2014;37(4):922-33 https://www.helsedirektoratet.no/referanse/0002-0013-232005
18. Cappuccio FP, Cooper D, D'Elia L, Strazzullo P, Miller MA. Sleep duration predicts cardiovascular outcomes: a systematic review and meta-analysis of prospective studies. Eur Heart J. 2011 Jun;32(12):1484-92. doi: 10.1093/eurheartj/ehr007. Epub 2011 Feb 7. Review. PubMed PMID: 21300732 https://www.helsedirektoratet.no/referanse/0002-0013-232006
19. Cappuccio FP, D'Elia L, Strazzullo P, Miller MA. Quantity and quality of sleep and incidence of type 2 diabetes: a systematic review and meta-analysis. Diabetes Care. 2010 Feb;33(2):414-20. doi: 10.2337/dc09-1124. Epub 2009 Nov 12. Review https://www.helsedirektoratet.no/referanse/0002-0013-232007
20. Bouchard DR, Langlois MF, Domingue MÈ, Brown C, LeBrun V, Baillargeon JP. Age differences in expectations and readiness regarding lifestyle modifications in individuals at high risk of diabetes. Arch Phys Med Rehabil. 2012;93(6):1059-64 https://www.helsedirektoratet.no/referanse/0002-0013-232008
21. Else Karin Grøholt (leder av redaksjonen). Folkehelserapporten 2014: Helsetilstanden i Norge, Folkehelseinstituttet. Rapport Des. 2014. ISBN: 978-82-8082-635-0 , ISBN (elektronisk): 978-82-8082-636-7, ISSN: 1503-1403. Tilgjengelig på www.fhi.no https://www.helsedirektoratet.no/referanse/0002-0013-232009
Sist faglig oppdatert: 14.12.2016
Oppfølging, utredning og organisering av diabetesomsorgen
Behandlingsansvar og samhandling ved diabetes
- Pasienter med diabetes type 1 bør tilbys tverrfaglig oppfølging av i spesialisthelsetjenesten (ofte organisert som 'diabetesteam'). Oppfølging må tilpasses den enkeltes behov, men minst én konsultasjon per år.
- Oppfølging og behandling av pasienter med diabetes type 2 foregår som hovedregel hos fastlegen. Pasienter med dårlig blodglukosekontroll eller kompliserende tilleggs-sykdom bør henvises til det tverrfaglige kompetanseteamet (diabetesteam) i spesialisthelsetjenesten (jf. Prioriteringsveilederen i Endokrinologi og endokrinkirurgi).
- Barn og unge under 18 år med diabetes følges opp og behandles på barneavdelinger.
Praktisk – slik kan anbefalingen følges
Indremedisinske/endokrinologiske avdelinger og barneavdelinger bør ha egne tverrfaglige kompetanseteam med særskilt fokus på diabetes, med ansvaret for pasienter med diabetes type 1.
Pasienter med diabetes type 2 som har en dårlig regulering, har alvorlige diabetiske senkomplikasjoner og/eller andre kompliserende tilleggs-sykdommer, vil også følges av spesialisthelsetjenesten (i perioder eller fast), men ansvaret vil her deles mellom fastlege og sykehus, og det er viktig med god samhandling og kommunikasjon mellom disse.
Gravide kvinner med pregestasjonell diabetes bør henvises til fødeavdeling med ekspertise på behandling og oppfølging av diabetes i svangerskapet. Dette gjelder både dersom kvinnen tar perorale glukosesenkende medikamenter eller insulin. Se også anbefaling: Behandlingsmål og henvisningsrutiner ved kjent diabetes type 1 og 2 i svangerskapet.
Helsedirektoratets Prioriteringsveileder i Endokrinologi og endokrinkirurgi, 2015 har detaljerte anbefalinger for henholdsvis diabetes type 1 og type 2 for aktuelle problemstillinger med alvorlighetsgrad av sykdom, forverring, akutt sykdom mm som krever prioritert helsehjelp i spesialisthelsetjenesten.
Barn under 18 år med diabetes
Barn under 18 år med diabetes følges opp og behandles på barneavdelinger. Da denne retningslinjen gjelder kun voksne (< 18 år) med diabetes, vises det til Norsk Barnelegeforeningens egen retningslinje for diabetes i alderen 0-18 år.
Se også:
- Akuttveileder i Pediatri (helsebiblioteket.no)
- Generell veileder i Pediatri (helsebiblioteket.no)
- Barnediabetesregisteret (oslo-universitetssykehus.no)
Tverrfaglig kompetanseteam med særkilt fokus på diabetes i spesialisthelsetjenesten (ofte referert til som «diabetesteam»)
Tverrfaglig kompetanseteam bør bestå av :
- overlege med spesialkompetanse innen diabetes
- diabetessykepleier
- klinisk ernæringsfysiolog
Det er også aktuelt å ha tilknyttet en psykolog og en lege i utdanningsstilling. I tillegg anbefales egen fotsårklinikk med samarbeid med karkirurg, ortoped og ortopediingeniør (evt. fotterapeut), samt etablert samarbeid med sosionom for trygdesaker og sosiale problemstillinger. Rutiner for samarbeid med aktuelle spesialiteter som øyelege, nevrolog, eventuelt nevrofysiolog, kardiolog og nefrolog for behandling av diabeteskomplikasjoner, er viktig.
Det tverrfaglige kompetanseteamets oppgaver:
Pasientbehandling
- konsultasjoner
- formidle kontakt (henvisning) til andre behandlere, eks. fotterapeut, øyelege, ortopediingeniør, sårpoliklinikk og andre
- utarbeide individuelle behandlingsplaner for pasienter med spesielle behov
- teammøter for drøfting av problemkasus, faglige spørsmål og arbeidsrutiner
- kvalitetssikring av behandlingen gjennom deltakelse i de nasjonale kvalitetsregistre for diabetes
Opplæring av pasienter og pårørende (se egen anbefaling om Opplæring)
- gjennomføre opplæring, repetisjon og reopplæring av pasienter og deres pårørende
- arrangere ulike temakurs, f. eks. startkurs, pumpekurs, eller gjenoppfriskningskurs for tenåringer og deres pårørende, gjerne i samarbeid med Diabetesforbundet lokalt.
Opplæring av helsepersonell
- drive undervisning om diabetes for leger under spesialistutdannelse
- være ressursbase/konsulenter for annet helsepersonell ved sykehusets avdelinger og i kommunehelsetjenesten (leger, sykepleiere, sykehjem, skoler, institusjoner)
- tilby hospitering ved diabetesklinikken for leger, sykepleiere og annet helsepersonell fra primær- og institusjonshelsetjenesten
- være senter i et faglig nettverk for opplæring av fastleger og annet helsepersonell i nærområdet
- I tråd med Samhandlingsreformen, har spesialisthelsetjenesten en Veiledningsplikt overfor den kommunale helse- og omsorgstjenesten.
Samarbeid og samhandling
- teamene skal samarbeide med primærhelsetjenesten og kommunale helseinstitusjoner; det bør etableres faste rutiner for kommunikasjon og samarbeid
- samarbeid med bioingeniører om kvalitetssikring av laboratorieundersøkelser og med farmasøyter om medisinbruk/hjelpemidler
- i samarbeid med de regionale universitetssykehusene bør kompetanseteamene bidra til forskning om behandling og forebygging av diabetes og diabetesrelaterte komplikasjoner.
Et viktig element i Samhandlingsreformen, er etablering av en samarbeidsavtale mellom kommunen (primærhelse, pleie- og omsorg) og det regionale helseforetaket (spesialisthelsetjeneste) (Hjemmel i Lov om kommunale helse- og omsorgstjenester, §§6.1 og 6.2) Dette kan avhjelpe samhandlingen og kvalitetssikre behandlingen og oppfølgingen av pasienter som alternerer mellom primær- og spesialisthelsetjenesten. For diabetes, gjelder dette særlig pasienter med dårlig regulert diabetes type 2, der spesialisthelsetjenesten er tungt involvert i håndtering av komplikasjoner, så vel som at behandlingen av selve grunnsykdommen ofte krever endokrinolog-kompetanse.
Primærhelseteam
I Primærhelsetjenestemeldingen (Helse- og Omsorgsdepartementet St. Meld 26 (2014-2015)) lanseres behovet for å opprette Primærhelseteam i kommunale helse- og omsorgssektor. Der det opprettes slike team, vil fastlegen i større grad kunne fordele oppgaver som f.eks. forebyggende konsultasjoner og opplæring av pasienter med kroniske, ikke-smittsomme sykdommer til sykepleier eller annet helsepersonell.
Begrunnelse – dette er anbefalingen basert på
Anbefalt ansvarsfordeling mellom fastlegen og spesialisthelsetjenesten er omtalt i Helsedirektoratets Prioriteringsveileder i Endokrinologi og endokrinkirurgi, (2015).
I kapittelet Fagspesifikk innledning – endokrinologi og endokrinkirurgi er det nevnt at fastlegen har ansvar for pasienter med type 2:
«Allmennpraktiserende leger vil ha ansvaret for store pasientgrupper som tilhører endokrinologien, som diabetes type 2, hypotyreose og osteoporose.» Videre står det i Diabetes-kapitlet, at pasienter med «vanskelig regulerbar og/eller komplikasjoner» skal henvises til spesialisthelsetjenesten med veiledende frist på 12 uker.
Begrunnelse for etablering av tverrfaglige kompetanseteam med særskilt fokus på diabetes (i spesialisthelsetjenesten)
I oppdragsdokumentene fra Helse- og omsorgsdepartementet til de regionale helseforetakene for 2007 er etablering av tverrfaglige diabetesteam et av tiltakene som nevnes særskilt for å redusere senkomplikasjoner og dette er i tråd med å følge opp Nasjonal Strategi for Diabetesområdet (2006-2011), som videreføres i Helse- og omsorgsdepartementets NCD-strategi (2013-2017):
"Helse (Sør/Øst/Midt-Norge/Nord/Vest) skal følge opp Nasjonal strategi for diabetesområdet 2006-2010 på spesialisthelsetjenestens område, herunder etablere tverrfaglige diabetesteam og tiltak for å redusere senkomplikasjoner blant denne pasientgruppen" (s. 12 i hhv de ulike regionenes oppdragsdokument).
Helse Nord har fulgt opp Nasjonal strategi for diabetesområdet (2006-2010), og utviklet en Handlingsplan for Diabetesområdet (2008-2013). (Den ble evaluert og revidert i 2013). I arbeidet med utarbeidelse av planen ble det avdekket at det var store organisatoriske og ressursmessige svakheter i denne store og geografisk utfordrende regionen, og som en konsekvens av dette ble det etablert sentralteam i Bodø og UNN, i tillegg til å ha lokalteam på de enkelte mindre sykehusene.
I Helse- og omsorgsdepartementets NCD-strategi (2013-2017), står det særskilt at sykehusene i landet bør sikre god læring ved å utveksle erfaringer fra Helse Nords handlingsplan, og således kan inndelingen i Sentralteam og Lokalteam være til etterfølgelse i de andre helseregionene.
Spesialisthelsetjenestens veiledningsplikt er presisert i et rundskriv fra Helse- og Omsorgsdepartementet 1. juli 2013. Presiseringen tar utgangspunkt i Spesialisthelsetjenesteloven §6-3: «Helsepersonell som er ansatt i statlige helseinstitusjoner som omfattes av denne loven eller som mottar tilskudd fra regionale helseforetak til sin virksomhet, skal gi den kommunale helse- og omsorgstjeneste råd, veiledning og opplysninger om helsemessige forhold som er påkrevet for at den kommunale helse- og omsorgstjenesten skal kunne løse sine oppgaver etter lov og forskrift.»
Referanser
26. Helse - og Omsorgsdepartementet: Rundskriv I-3/2013: Spesialisthelsetjenestens veiledningsplikt overfor den kommunale helse- og omsorgstjenesten, 1. juli 2013 https://www.helsedirektoratet.no/referanse/0002-0013-232014
27. Helse- og Omsorgsdepartementet: Oppdragsdokument 2007 til de regionale helseforetak https://www.helsedirektoratet.no/referanse/0002-0013-232015
28. Helse- og Omsorgsdepartementet: Nasjonal Strategi for diabetesområdet (2006 - 2010) https://www.helsedirektoratet.no/referanse/0002-0013-232016
29. Helse- og omsorgsdepartementet: Meld. St. 26 (2014-2015): Fremtidens primærhelsetjeneste - nærhet og helhet (Primærhelsetjenestemeldingen) https://www.regjeringen.no/no/dokumenter/meld.-st.-26-2014-2015/id2409890/
30. Helse Nord: Handlingsplan for diabetes (2008 - 2013) https://www.helsedirektoratet.no/referanse/0002-0013-232018
31. Lov om Spesialisthelsetjenesten, § 3-8: Sykehusenes oppgaver https://www.helsedirektoratet.no/referanse/0002-0013-232019
32. Helse- og Omsorgsdepartementet: NCD-strategi 2013 - 2017 https://www.helsedirektoratet.no/referanse/0002-0013-232020
33. Prioriteringsveileder i Endokrinologi og endokrinkirurgi https://www.helsedirektoratet.no/referanse/0002-0013-232021
Sist faglig oppdatert: 14.09.2016
Nydiagnostisert diabetes: Utredning, behandlingsplan og opplæring i primærhelsetjenesten
Ved nydiagnostisert diabetes bør legen avklare
- hvilken type diabetes pasienten har
- eventuell komorbiditet, organskade og risiko for hjerte- og karsykdommer
- pasientens psykososiale situasjon
- Det anbefales at legen og pasienten i fellesskap lager en behandlingsplan og setter opp behandlingsmål
- Deler av utredningen kan med fordel gjøres i samarbeid med en medhjelper/sykepleier ved legekontoret som del av et lokalt diabetesteam.
- Bruk av strukturert elektronisk diabetesskjema (NOKLUS) forenkler og systematiserer oppfølgingen.
Praktisk – slik kan anbefalingen følges
Utredning
Anamnese
Legg spesiell vekt på:
- symptomer (tørste, vekttap, øyesymptomer, infeksjoner, nedsatt allmenntilstand) og deres varighet
- symptomer på eller kjent hjerte- og karsykdom
- sykdommer i familien (diabetes, hjerte- og karsykdom)
- livssituasjon (familie, arbeid, utdanning)
- kosthold, se anbefalingen Kosthold og kostsammensetning ved alle former for diabetes i kapittelet Levevaner ved diabetes og behandling av overvekt og fedme
- levevaner (fysisk aktivitet, røyking, vektendring, stressbelastning, søvn osv.), se kapittelet Levevaner ved diabetes og behandling av overvekt og fedme
- medikamentbruk
- psykisk helse og egne ressurser nødvendig for mestring av sykdommen, se kapittelet Kommunikasjon, mestring og motivasjon ved diabetes, og særlig anbefalingen Nyttige spørsmål når pasienten får diagnosen diabetes type 1 eller 2
- obstruktiv søvnapne (ca 70% av pasienter med diabetes (type 2) har OSA) - viktig med diagnostikk og behandling (henvisning til søvnregistrering og evt. CPAP)
- spørsmål om snorking (komparentopplysninger om pustestopp), slitenhet/søvnighet i løpet av dagen, morgenhodepine, munntørrhet
- ved diabetes type 1: andre autoimmune sykdommer som tyreoideasykdommer, cøliaki, binyrebarksvikt og vitamin B12-mangel
Klinisk undersøkelse
Det bør gjøres en vanlig klinisk undersøkelse. Undersøk spesielt:
- høyde/vekt og livmål
- blodtrykk, se kapittelet Legemidler til forebygging av makrovaskulære senkomplikasjoner, anbefalingen Blodtrykk – Intervensjonsgrense, behandlingsmål og valg av legemidler ved diabetes.
- tegn på arteriosklerotisk sykdom
- undersøkelse av føtter, se kapittelet Diabetisk fot og nevropati, anbefalingen Undersøkelse og diagnostikk av nevropati og identifisering av pasienter med risiko for fotsår.
- tilleggsundersøkelser ved mistanke om infeksjoner/annen bakenforliggende sykdom
Laboratorieundersøkelser
For diagnostisering av hvilken type diabetes, se kapittelet Diagnostikk av diabetes, risikovurdering og oppfølging av personer med høy risiko for å utvikle diabetes
- B-Hb A1c
- S-lipider (totalkolesterol, HDL- og LDL- kolesterol, fastende triglyserider)
- estimert GFR
- urinundersøkelse (glukose, teststrimler for nitrit og leukocytter og urin-albumin/kreatinin-ratio, U-AKR), se kapittelet Nyresykdom ved diabetes, anbefalingen Laboratorieprøver for kontroll av nyrefunksjon (eGFR og u-AKR), henvisning til spesialisthelsetjenesten og forsiktighetsregler ved lav GFR.
- EKG (Hos pasienter > 50 år eller ved høy risiko for hjerte- og karsykdom kan et baseline-EKG ved nyoppdaget diabetes være nyttig)
- ev. tilleggsundersøkelser med tanke på bakenforliggende sykdom
Henvisning til regelmessige netthinneundersøkelser i spesialisthelsetjenesten
Siden retinopati kan foreligge allerede ved diagnosetidspunktet (5-15 %), bør alle pasienter med nyoppdaget diabetes type 2 henvises til regelmessige netthinnefotografering (ved diagnosetidspunktet). Pasienter med diabetes type 1 bør henvises etter 5 års diabetesvarighet, barn henvises første gang ved 10 års alder. Se kapittel Retinopati og regelmessig netthinneundersøkelse ved diabetes.
Influensavaksine
Voksne og barn med diabetes type 1 og 2 er blant de som regnes å ha særskilt risiko for komplikasjoner ved en influensainfeksjon og Folkehelseinstituttet anbefaler at disse pasientene tilbys årlig influensa-vaksine, se fhi.no.
Behandlingsplan og opplæring
Henvisning til Startkurs
Pasienten har krav på opplæring og legen bør henvise til nærmeste sykehus for deltagelse på Startkurs (se anbefaling Opplæring av nydiagnostiserte pasienter med diabetes i spesialisthelsetjenesten) og eventuelle kommunale tilbud, altså Frisklivssentral og/eller kommunale lærings- og mestringstilbud. Se også Veileder for frisklivssentraler.
Endring av levevaner
For de fleste pasienter med nydiagnostisert diabetes type 2 er det aktuelt med livsstilsendringer, f.eks. røykeslutt for de som røyker, kostholdsendringer, tiltak for å øke fysisk aktivitet og for noen er vektnedgang viktig. Lege og pasienten bør sammen diskutere hva som er viktigst og hvilke målsettinger som er realistiske. For detaljer om endring av levevaner, se kapitlene Levevaner ved diabetes og behandling av overvekt og fedme og Kommunikasjon, mestring og motivasjon ved diabetes.
For mange er det også behov for å gjennomgå og sette målsettinger for HbA1c og blodtrykk. Se anbefalingene Blodsukkersenkende behandling og behandlingsmål ved diabetes type 2 og Blodtrykk – Intervensjonsgrense, behandlingsmål og valg av legemidler ved diabetes.
Egenmåling av blodsukker
Opplæring i egenmåling av blodsukker inngår som del av Startkurset. For pasienter med nydiagnostisert diabetes type 1, inngår dette som en sentral del av opplæringen i insulinbruk, men for de fleste med nydiagnostisert diabetes type 2, vil det være mindre viktig, da disse pasientene enten starter med kun endring i kosthold og fysisk aktivitet, eller eventuelt med metformin i tillegg. For disse pasientene kan også blodsukkermåling være nyttig i en kort periode for å prøve ut hvordan mat og fysisk aktivitet påvirker blodglukosenivået. Se anbefalingen Blodsukkersenkende behandling og behandlingsmål ved diabetes type 2.
Svangerskap og prevensjon
I utgangspunktet kan alle prevensjonsformer brukes, men sikkerheten vil veie ekstra tungt, da svangerskap som ikke er planlagt kan gi økt risiko for abort og misdannelser. Se kapittelet Svangerskap ved kjent diabetes.
For yngre kvinner som ikke har født, anbefales primært lavdose kombinasjonspille. Ved kjent diabetes type 2, er overvekt og/eller fedme ofte en tilleggsfaktor, og vanlig forsiktighetsregler ved hormonelle prevensjonsmidler og BMI > 30 er gjeldende.
Pasienten trenger grundig informasjon om sykdommen og om hvilken betydning egenbehandling har. Det er viktig å etablere en god behandlingsrelasjon som utgangspunkt for behandlingsplanen og etterfølgelse av behandlingsmål. Se kapittelet Kommunikasjon, mestring og motivasjon ved diabetes, og særlig anbefalingen Nyttige spørsmål når pasienten får diagnosen diabetes type 1 eller 2
Førerkort
Førerkortveilederen: Helsekrav til førerkort ved diabetes.
Tannhelse
Personer med diabetes er 2-4 ganger mer utsatt for periodontale sykdommer (= fellesbetegnelse på sykdommer i tennenes festeapparat i kjeven) sammenlignet med normalbefolkningen og når periodontitten oppstår vil dette kunne gi en dårlige regulert diabetes med økt HbA1c.
Det er derfor viktig at personer med diabetes har god tannhygiene og de bør også følges opp med regelmessige kontroller hos tannlege. Diabetes utløser ikke rett til dekning av utgifter til tannbehandling fra Helfo. Etter folketrygdloven § 5-6 ytes det stønad til dekning av utgifter til undersøkelse og behandling utført av tannlege ved opplistede tilstander/tilfeller. Dette vurderes for hver pasient.
Sist faglig oppdatert: 14.09.2016
Opplæring i spesialisthelsetjenesten for nydiagnostiserte pasienter med diabetes
- Alle nydiagnostiserte pasienter med diabetes har rett til god opplæring for eksempel gjennom et startkurs. Fastlegen skal informere pasienten og tilby henvisning til et slikt kurs på nærmeste sykehus.
- Spesialisthelsetjenesten har ansvar for å tilby opplæring i grupper. Opplæringen skjer som oftest i regi av Lærings- og mestringssentrene. Denne opplæringen kommer i tillegg til kontinuerlig individuell oppfølging i regi av det tverrfaglig kompetanseteamet (diabetesteam).
Praktisk – slik kan anbefalingen følges
Spesialisthelsetjenesten er hovedansvarlig for opplæring av pasienter og pårørende, men primærhelsetjenesten er også en viktig arena for opplæring, særlig den individuelle.
Etablering av lærings- og mestringssentra (LMS) er en oppfølging av sykehusenes satsing på lærings- og informasjonsformidling. Sentrene skal være et supplement til den pasientopplæringen som må pågå kontinuerlig på sykehusene og i primærhelsetjenesten. Planlegging, gjennomføring og evaluering bør skje i et samarbeid mellom fagpersoner og brukere. Gode læringstilbud krever både fagkompetanse og brukerkompetanse (likemannsarbeid) - sistnevnte er særskilt viktig i møte med personer med innvandrerbakgrunn der tilpasning til både annet språk og kultur er viktig for best mulig opplæring og mestring.
I tillegg til den kontinuerlige veiledningen som skjer individuelt bør personer med diabetes tilbys opplæring i grupper. De fleste lærings- og mestringssentre og/eller sykehusenes diabetesteam har startkurs for diabetes type 1 og type 2. Henvisning fra lege er nødvendig. Lærings- og mestringssentre har egne hjemmesider og mange har informasjon om kurstilbudene på nettet. Det nasjonale LMS ved Aker Universitetssykehus har lenker til alle LMS (mestring.no).
I tillegg til startkusene er det behov for organisering av ytterligere opplæringstiltak med ulikt fokus og for ulike målgrupper. Her kan nevnes røykeavvenningskurs, vektreduksjonskurs, trimgrupper, grupper for personer med cøliaki eller andre tilleggslidelser, kurs for ungdom, foreldre osv. Opplæring i grupper bør være både problemorientert (teoretisk og praktisk opplæring) og emosjonsorientert (fokus på psykososiale aspekter knyttet til det å leve med diabetes) (Peyrot M, 2007). Se også kapittelet Kommunikasjon, mestring og motivasjon ved diabetes.
Mål og målgruppe avgjør hva som skal tillegges størst vekt. All opplæring må tilpasses alder, type diabetes og behandlingsform. Man må huske at evnen til å lære kan være påvirket i en fase der personen er preget av sjokk etter å ha fått en kronisk sykdom. Faren for feillæring er også stor og det er derfor viktig at man hele tiden sjekker at budskapet er forstått. Mengden kunnskap bør begrenses til det helt nødvendige i startfasen.
Den teoretiske opplæringen bør omfatte:
Hva er diabetes?
- ulike typer diabetes
- risikofaktorer for hjerte- og karsykdom
- senkomplikasjoner (nefropati, nevropati, retinopati)
Behandling
- mål for behandlingen
- behandlingsformer
- behandlingsregimer
Egenomsorg
- egenkontroll av blodglukose. Hva påvirker blodglukose? Hvor ofte og når bør blodglukose måles?
- hypoglykemi (pasienter som bruker sulfonylurea/insulin) eller frykt for dette
- mat og diabetes og sosiale utfordringer
- vektreduksjon ved overvekt
- alkohol
- fysisk aktivitet
- når man er syk: feber, kvalme, oppkast, diaré
- forholdsregler ved reise
- føtter
- tannhelse
- dersom pasienten røyker, motivering til røykeslutt
- planlegging av svangerskap
- prevensjon
- menstruasjon
- overgangsalder
- ereksjonsproblemer
- senkomplikasjoner – forebygging og behandling
Sosiale rettigheter og ytelser
- trygderettigheter
- rett til opplæring i håndtering av sykdommen
- skattefradragsregler
Diabetes og velferdsrettigheter (diabetes.no)
Diabetesforbundet - informasjon om brukerorganisasjonen (diabetes.no)
Insulinbrukere
- injeksjonsteknikk
- vurdering av sammenhengen mellom fysisk aktivitet, karbohydratinnhold i kosten og insulindosering, og sammenhengen mellom følelsesmessige reaksjoner/stress og insulinbehov.
- forebygging og behandling av akutte komplikasjoner (føling, hypoglykemier og eventuelt ketoacidose)
- hvordan håndtere insulindoseringsfeil (atferds- og følelsesmessig)
Spesielt for barn
- barn med kronisk sykdom
- diabetes i barnehage og skole
- opplæringspenger
- hjelpestønad
Den praktiske opplæringen omfatter:
- egenmåling av blodglukose (og eventuelt urintesting på ketoner)
- injeksjonsteknikk ved insulinbehandling (se kapittel "Medikamentell blodsukkersenkende behandling" - Insulinbehandling og egenmåling)
Undervisningens intensitet og omfang må tilpasses pasientens alder, modenhet og mottakelighet. Man må gi omsorg og diskutere de psykologiske aspekter ved å ha fått en kronisk sykdom.
Begrunnelse – dette er anbefalingen basert på
Spesialisthelsetjenestens plikt til å drive opplæring av pasienter og pårørende er lovfestet i Lov om Spesialisthelsetjenesten, § 3-8; Sykehusenes oppgaver. Det vil i praksis si at alle pasienter med nyoppdaget diabetes har krav på grunnleggende opplæring om sykdommen, det vil si et Startkurs.
I tillegg til å være lovfestet, er det også veldokumentert at god og grunnleggende opplæring i egen sykdom (og særlig ved en kronisk, livslang sykdom) reduserer uheldige utfall som senkomplikasjoner, i tillegg til å bedre funksjon og styrke mestringsfølelsen (Rygg LØ, 2012)
Referanser
31. Lov om Spesialisthelsetjenesten, § 3-8: Sykehusenes oppgaver https://www.helsedirektoratet.no/referanse/0002-0013-232019
34. Peyrot M, Rubin R: "Behavioral and psychosocial interventions in diabetes: a conceptual review." Diabetes Care. 2007 Oct;30(10):2433-40 https://www.helsedirektoratet.no/referanse/0002-0013-232022
35. "Efficacy of ongoing group based diabetes selfmanagement education for patients with type 2 diabetes mellitus. A randomised controlled trial" https://www.helsedirektoratet.no/referanse/0002-0013-232023
Sist faglig oppdatert: 14.09.2016
Årskontroll og bruk av Noklus diabetesskjema
- Fastlegen bør gjennomføre en utvidet årlig kontroll (Årskontrollen), som er en utvidet konsultasjon for å:
- kartlegge risiko for og eventuelle tegn til makro- og mikrovaskulære komplikasjoner.
- vurdere, i samråd med pasienten, om de individuelle behandlingsmålene eller behandlingsplanen bør justeres.
- kartlegge psykisk helse og diabetesrelaterte psykososiale problemer
- Bruk av strukturert, elektronisk diabetesskjema / journalmal anbefales for å sikre at alle elementene som skal inngå i den årlige kontrollen blir gjennomgått. NOKLUS diabetesskjema er eksempel på et slikt skjema, se Praktisk.
Praktisk – slik kan anbefalingen følges
I allmennpraksis vil årskontrollen ofte være mer omfattende enn en vanlig konsultasjonstime gir tid til. Mulige løsninger er å sette opp en dobbelttime eller fordele kontrollen på flere enkeltkonsultasjoner. Noen legekontorer har god erfaring med egne diabetesdager. Man kan også bruke sykepleier eller annet hjelpepersonell på legekontoret til deler av årskontrollen, enten deler av rutinekontrollene (f.eks. fotkontroll, herunder monofilament m.m.) eller opplæring som er mer tidkrevende (bruk av insulin eller råd om endring av levevaner (konkrete kostråd, kostanamnese, konkrete råd om fysisk aktivitet og veiing/måling).
NOKLUS diabetesskjema (noklus.no) kan forenkle og systematisere oppfølgingen av personer med diabetes. Det gir også mulighet til å få en oversikt over kvaliteten på diabetesbehandlingen på henholdsvis lege- og legesenter og avdelingsnivå. Bruk av skjemaet er også viktig for å rapportere data til Norsk Diabetesregister for voksne. Bruk av skjemaet og innsending av data til Norsk diabetesregister for voksne utløser takst 100/105.
Viktige elementer i Årskontrollen:
Symptomer på:
- makrovaskulære komplikasjoner (iskemisk hjertesykdom, perifer karsykdom, atrieflimmer, hjertesvikt osv.)
- mikrovaskulære komplikasjoner (perifer nevropati og retinopati)
- erektil dysfunksjon
- kognitiv funksjon
Risiko for komplikasjoner:
- kartlegge røykevaner
- registrere vekt (BMI og midjemål)
- blodtrykk/hypertensjon
- S-lipider (totalkolesterol, HDL-, LDL-kolesterol, fastende triglyserider)
- S-kreatinin og eGFR
- metabolsk kontroll (HbA1c og vurdering av egenmålinger)
- undersøkelse av urin med tanke på albuminuri, U-AKR; moderat (tidligere kalt mikroalbuminuri, AKR 3 -30) og betydelig forhøyet (tidligere kalt makroalbuminuri, AKR > 30 (se egen anbefaling i kapittelet Nyresykdom ved diabetes)
Risiko for psykiske problemer inkludert spiseforstyrrelser (se kapittel Psykiske lidelser og diabetes)
- Kartlegging av psykisk helse og diabetesrelaterte psykososiale problemer kan gjøres ved bruk av spørsmålene i anbefalingen Kommunikasjon og pasientaktiverende intervensjoner ved diabetes type 1 og 2.
Føtter
- inspeksjon (trykkpunkter, hyperkeratoser, sår, sprekker, deformiteter)
- undersøkelse av puls (arteria tibialis posterior, arteria dorsalis pedis)
- undersøkelse av sensibilitet med monofilamenttest (eventuelt vibrasjonssans med gradert stemmegaffel) - se kapittel om Diabetisk fot og nevropati for praktisk gjennomføring av testen
- sjekk pasientens sko
- vurdér trykkavlastende fottøy til pasienter med nevropati
Se kapittelet Diabetisk fot og nevropati, anbefalingen Undersøkelse og diagnostikk av nevropati og identifisering av pasienter med risiko for fotsår.
Øyne
Kontrollér at pasienten har gjennomført regelmessig netthinneundersøkelser, se kapittelet Retinopati og regelmessig netthinneundersøkelse ved diabetes.
Alder
Ved alder over 75-80 år bør man vurdere indikasjon for analyse av lipider og U-AKR ut fra den kliniske situasjonen og relevans for forebygging av senkomplikasjoner.
Ved insulinbruk
- undersøkelse av injeksjonssteder
Sist faglig oppdatert: 14.09.2016
Oppfølging av diabetes utenom årskontrollen
- Intervallene mellom legekonsultasjonene bør tilpasses pasientens behov og kliniske situasjon, og avtales med pasienten som del av behandlingsplanen.
- I situasjoner med somatisk eller psykisk tilleggssykdom, vanskelig livssituasjon, endring av medikamenter (eller doser) eller like etter at diagnosen er stilt, kan det være behov for hyppige planlagte kontroller.
- Ved godt regulert diabetes foreslås det én kontroll mellom årskontrollen, se egen anbefaling for Årskontrollen.
Praktisk – slik kan anbefalingen følges
- Den kliniske situasjonen og den avtalte behandlingsplanen avgjør hva som tas opp på rutinekontrollene.
Organisering av kontrollrutiner
- Ved en del fastlegekontorer deltar én eller flere medarbeidere aktivt i diabetesomsorgen med opplæring i egenmåling, bruk av insulin og råd om endring av levevaner. De kan også gjennomføre noen av rutinekontrollene eller elementer i årskontrollen.
- Det er også viktig å ha et forfallssystem for å innkalle pasienter som ikke har møtt til kontroll. Noen legekontorer har egne diabetesdager, eventuelt med gruppeundervisning.
- Bruk av et diabetesskjema (for eksempel Noklus diabetesskjema i primærhelsetjenesten) eller tilsvarende papirjournal er nyttig for å sikre struktur og oversikt over egen diabetespopulasjon.
Pasienter med dårlig regulert diabetes type 2
- Selv om oppfølging og behandling av pasienter med diabetes type 2 foregår som hovedregel hos fastlegen, er det viktig med god samhandling med spesialisthelsetjenesten for diabetes type 2-pasienter med dårlig blodglukosekontroll eller kompliserende tilleggs-sykdom. Disse bør henvises til det tverrfaglige kompetanseteamet (ofte referert til som 'diabetesteam') i spesialisthelsetjenesten, jf. Prioriteringsveilederen i Endokrinologi og endokrinkirurgi.
- Som ledd i Samhandlingsreformen foreligger det avtalesystemer og samarbeidsavtaler som klargjør rollefordeling og samhandling mellom primær- og spesialisthelsetjenesten, og slike avtaler finnes også på lokalt nivå for den enkelte kommune i samhandling med sitt tilhørende HF. Se også anbefalingen Behandlingsansvar og samhandling ved diabetes.
Begrunnelse – dette er anbefalingen basert på
Referanser
36. Helsedirektoratets Prioriteringsveileder i Endokrinologi og endokrinkirurgi, IS-1709 (2009) https://www.helsedirektoratet.no/referanse/0002-0013-232024
Sist faglig oppdatert: 14.09.2016
Kommunikasjon, mestring og motivasjon ved diabetes
Nyttige spørsmål når pasienten får diagnosen diabetes type 1 eller 2
Følgende spørsmål kan brukes i konsultasjonen, for å få frem nødvendig informasjon for å kunne sette realistiske mål og øke sjansen for å nå behandlingsmålene:
- Hvilke tanker har du knyttet til at du har fått diabetes?
- Opplever du at du vanligvis mestrer situasjoner?
- Har du noen du kan snakke med når du har behov for det (om tanker og følelser)?
- Hva ser du for deg at du kan gjøre til neste gang?
- Er det noe mer jeg kan hjelpe deg med, som vi ikke har snakket om i dag?
Praktisk – slik kan anbefalingen følges
Nedenfor følger en beskrivelse av hvordan ulike utfall på spørsmålene kan tolkes, og hva dette betyr for behandlingen.
Den presise formuleringen av spørsmålene må selvsagt tilpasses et språk du føler deg komfortabel med. Det er viktig å være lydhør og åpen for å diskutere alle tema som berører pasientens egenbehandling av sin diabetes. På bakgrunn av informasjonen som nå er innhentet kan det dannes grunnlag for videre oppfølging og diskusjon om mulige behandlingsmål.
Under følger en utdypning av de foreslåtte spørsmålene, hvorfor de er adressert, målet og mulige tolkninger.
Spørsmål 1: Hvilke tanker har du knyttet til at du har fått diabetes?
- Hvis pasienten mottar beskjeden om diagnosen på en tilfredsstillende måte, vil måloppnåelse være mer sannsynlig.
- Hvis pasienten responderer negativt eller uhensiktsmessig på det å få diabetes, kreves det mer tid, grundigere samtale, tettere oppfølging, mer empati og kreativitet for å nå ønsket behandlingsmål.
Diabetes bør presenteres som en insulinmangelsykdom hvor medisiner og-/eller insulindoser skal reguleres. Insulinbehovet er avhengig av mange faktorer, blant annet; hvordan man har det (tanker + følelser), relasjoner (sosial støtte), mental og fysisk helse generelt, stress- og mestringsnivå, kosthold, fysisk aktivitet og søvn. Det er viktig at det ikke blir presentert anklager, påbud, krav, forventninger, rettledning, men at det avdramatiseres og realitetsorienteres. Sammen med pasienten kan legen finne gode løsninger og ha fokus på det som er mulig og ønskelig (Fisher et al, 2007).
Spørsmål 2: Opplever du at du vanligvis mestrer situasjoner?
- Hvis pasienten svarer ja, betyr det vanligvis at pasienten har gode mestringsressurser. Da er sjansen for å lykkes med behandlingsmål større.
- Hvis pasienten svarer nei, betyr det ofte at pasienten i liten grad opplever å være mestrende. Mennesker som opplever å være ikke-mestrende har oftere høyere psykologisk forsvar og er mindre mottakelig for ny kunnskap og informasjon. Å være ikke-mestrende vil gi utslag på fysiologiske variabler (bl.a. blodsukker, insulinfølsomhet og blodfett) som kan påvirke diabetesbehandlingen. Det er derfor viktig å bruke tid og ressurser på å finne frem til pasientens egne mestringsressurser, dempe forsvaret og legge til rette for medbestemmelse. Tettere oppføling vil være nødvendig for å oppnå god behandling og hjelpe pasienten til å få positiv responsforventning. Samlet vil dette øke sjansen for at behandlingsmål nås.
Pasienten må få mulighet til å si noe om sin egen følelsesmessig reaksjon, for eksempel følelser som avmakt, skyld, skam, overveldende ansvar. Å spørre, lytte og anerkjenne er en viktig intervensjon i seg selv (Fellitti et al., 2014). Meningen med å spørre er å skape tillitt, lytte og gi pasienten rom for å beskrive egen situasjon og komme med forslag til løsninger. Å anerkjenne gir opplevelse av trygghet og frihet. Lege- pasient forholdet bør baseres på støtte uten at legen skal ta ansvar for den andre personens atferd, samt aksept for den andres følelser og valg uten å være dømmende (Petursson et al., 2009). I tillegg til å behandle symptomene, må man legge til rette for, å skape positive rammer, og tillit for å oppnå gunstige endringer for helsen (Meier et al., 2005). Avmakt, skyld, skam og overveldende ansvar er følelser som kan ligge som hinder for måloppnåelse (McEwen et al., 2012).
Om en stressende opplevelse blir "god", "håndterbar" eller "ødeleggende" avhenger av:
- opplevelsen av kontroll over stressoren
- sosial støtte
- ressurser tilgjengelig for mestring
Belastning, sykdom og stress kan føre til vekst og utvikling, tilpasning, gunstig fleksibilitet, nødvendig læring og god helse, så lenge belastningen oppleves som håndterbar og pasienten har positiv responsforventning til egne mestringsressurser. Motsatt kan det føre til ugunstig endring av nervebaner både fysisk og psykisk. Atferds-, tanke- og følelsesmessige endringer i uheldig retning, gi dårlig helse og prematur død hvis pasienten opplever belastningen som uhåndterbar og ikke har positiv responsforventning til egne handlinger (Warnecke et al., 2014; McEwen et al., 2015).
Spørsmål 3: Har du noen du kan snakke med når du har behov for det (om tanker og følelser)?
- Hvis pasienten svarer ja betyr det at pasienten sannsynligvis har tilstrekkelig sosial støtte. Sosial støtte er helt sentralt for å oppnå god helse.
- Hvis pasienten svarer nei, kan dette bety at pasienten har liten/ingen sosial støtte. Legen kan hjelpe pasienten med å mobilisere eventuelle eksisterende sosiale ressurser eller være med på å finne de ressursene som pasienten har behov for. Tettere oppføling vil være nødvendig for å oppnå god behandling og hjelpe pasienten til å få positiv responsforventning. Samlet vil dette øke sjansen for at behandlingsmål nås.
Manglende sosial støtte er den mest signifikante risikofaktoren for mortalitet. Et menneskes relasjoner, nettverk og sosiale støtte bør tas like alvorlig som andre risikofaktorer (røyking, blodtrykk, fysisk aktivitet) (Holt-Lunstad et al., 2010).
Spørsmål 4 og 5: Hva ser du for deg at du kan gjøre til neste gang? Er det noe mer jeg kan hjelpe deg med fremover, noe vi ikke har snakket om i dag?
Involver pasienten, la pasienten få eierskap til sine eventuelle endringer og håndteringen av sin diabetes, legg til rette for aktiv deltagelse, prøv å være med på å myndiggjøre pasienten (empowerment) (Anderson RM, 2005).
Dersom det kommer frem informasjon som tilsier at pasienten trenger mer tid til temaet, kan man sette opp ny time ganske raskt eller dobbelttime neste gang (støttesamtale). Alternativt kan man anbefale pasienten å snakke med en av sine nærmeste om dette, man kan henvise pasienten enten til samtale med diabetessykepleier ved et sykehus/spesialisthelsetjeneste, psykiatrisk sykepleier eller henvise til psykolog på vanlig måte dersom man vurderer at det er behov for det. Generelt vil lege og/eller sykepleier kunne ta seg av behovet til pasienten for å dele erfaringer, tanker og følelser knyttet til det å ha diabetes, henvisning til psykolog er i de fleste tilfeller ikke nødvendig.
Helsedirektoratet har utarbeidet retningslinjer og øvelser som er høyst relevant i motivasjonsarbeid med personer som har diabetes.
Begrunnelse – dette er anbefalingen basert på
Omkring 45 % av pasientene med diabetes type 2 når ikke HbA1c-mål (Mouland et al., 2014) og kun 13 % med diabetes type 2 nådde alle tre nasjonale mål (HbA1c, blodtrykk og lipider/HDL-kolesterol) samtidig (Jenssen et al., 2008). En studie fra det nasjonale diabetesregisteret har vist at 82 % med diabetes type 1 ikke når HbA1c-mål (Cooper et al., 2013). Årsakene til manglende måloppnåelse kan være mange. Ofte er det personlige faktorer i pasientens liv som spiller inn, faktorer som i liten grad har vært vektlagt i medisinen (McEwen og Getz, 2013). Manglende måloppnåelse kan handle om at pasientene har andre prioriteringer i sitt liv, liten opplevelse av mening, manglende kapasitet i tillegg til lav mestringsopplevelse og manglende sosial støtte.
Behandler bør stille seg spørsmålet om behandlingsmålene er realistiske og lage individuelt tilpassede mål i samråd med pasienten. For å øke sannsynligheten for at anbefalingene blir fulgt bør det prioriteres å jobbe med å øke motivasjon, mestringsforventning, etablere en god kontakt (tillit og en trygg relasjon) med hver enkelt pasient og samarbeide om felles behandlingsmål, der pasienten er involvert i målbeskrivelsen. Det er større sannsynlighet for at de mål som settes blir nådd hvis pasienten selv opplever å ha det som skal til for å gjennomføre det (for eksempel kunnskap, evner, sosial støtte) kombinert med at han selv ønsker å nå målet.
Med referanse til McEwen (2010) og Felitti (2014), foreslås det å strukturere konsultasjonen med spørsmålene som er beskrevet ovenfor slik at svarene er med på å forme konsultasjonen og dermed vil påvirke behandlingsmålene over tid. Det er avgjørende for god diabetesbehandling at det settes av tilstrekkelig tid, slik at pasienter som trenger det kan snakke om viktige faktorer i livet sitt som kan påvirke diabetesbehandlingen. Svarene vil gi helsepersonell viktig informasjon, som det er avgjørende at det tas hensyn til i den videre behandlingen.
Diabetes er blant de diagnosene som ofte også har stort innslag av komorbiditet, som blant annet fedme og depresjon. Diagnosens og pasientgruppens kompleksitet betyr at det behøves god kommunikasjon for best mulig måloppnåelse og mestring (Violan et al., 2014).
Forskningsgrunnlag
Populasjon (P): Pasienter med diabetes (alle typer)
Tiltak (I): Helsekommunikasjon ved første konsultasjon, diagnosetidspunkt og ved årskontroller
Sammenligning (C): Vanlig praksis
Beskrivelse av inkluderte studier
Helsekommunikasjon er aktuelt for alle anbefalingene, men passer dessverre ikke inn i en evidensprofil, det er derimot prøvd vist til utstrakt bakgrunnslitteratur av god kvalitet.
God helsekommunikasjon er avgjørende for å bedre diabetes relaterte utfall. Formen på kommunikasjonen er ikke etnisk spesifikt. All diabetesbehandling skal være likeverdig og tilpasset hvert enkelt individ, uavhengig av kjønn, alder, religion og etnisk bakgrunn.
Pasienten bør bli bevisst at de følelsesmessige reaksjonene knyttet til dagliglivets opplevelser, så vel som kost og fysisk aktivitet, vil påvirke blodsukkernivå og dermed behov for insulin. Stress/aktivering, manglende sosial støtte og redusert mestringsevne vil påvirke blodsukkeret, og det er godt dokumentert at ca 50 % av svingningene i blodsukkeret er relatert til psykiske hendelser. God kommunikasjon mellom pasient og behandler ser ut til å være av avgjørende betydning for måloppnåelse.
Referanser
38. The art of empowerment: stories and strategies for diabetes educators https://www.helsedirektoratet.no/referanse/0002-0013-232026
39. Treatment of type 1 diabetes in the specialist health service--data from the Norwegian diabetes register for adults https://www.helsedirektoratet.no/referanse/0002-0013-232027
40. The lifelong effects of adverse childhood experiences.. Chadwick`s child maltreatment. Vol 2: Sexual abuse and psychological maltreatment https://www.helsedirektoratet.no/referanse/0002-0013-232028
41. Healthy coping, negative emotions, and diabetes management: a systematic review and appraisal https://www.helsedirektoratet.no/referanse/0002-0013-232029
42. Social relationships and mortality risk: a meta-analytic review https://www.helsedirektoratet.no/referanse/0002-0013-232030
43. The gap between guidelines and practice in the treatment of type 2 diabetes: a nationwide survey in Norway https://www.helsedirektoratet.no/referanse/0002-0013-232031
44. Multidisciplinary biopsychosocial rehabilitation for chronic low back pain: cochrane systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-232032
45. Lifetime experiences, the brain and personalized medicine: an integrative perspective https://www.helsedirektoratet.no/referanse/0002-0013-232033
46. Central role of the brain in stress and adaption: Links to socioeconomic status, health, and disease https://www.helsedirektoratet.no/referanse/0002-0013-232034
47. Biomarkers for assessing population and individual health and disease related to stress and adaptation https://www.helsedirektoratet.no/referanse/0002-0013-232035
48. Brain on stress: how the social environment gets under the skin https://www.helsedirektoratet.no/referanse/0002-0013-232036
49. The role of the therapeutic alliance in the treatment of substance misuse: a critical review of the literature https://www.helsedirektoratet.no/referanse/0002-0013-232037
50. Diabetes in general practice--were treatment goals reached? https://www.helsedirektoratet.no/referanse/0002-0013-232038
51. I.. Can individuals with a significant risk for cardiovascular disease be adequately identified by combination of several risk factors? Modelling study based on the Norwegian HUNT 2 population https://www.helsedirektoratet.no/referanse/0002-0013-232039
52. Prevalence, determinants and patterns of multimorbidity in primary care: a systematic review of observational studies https://www.helsedirektoratet.no/referanse/0002-0013-232040
53. The art of communication https://www.helsedirektoratet.no/referanse/0002-0013-232041
Sist faglig oppdatert: 14.09.2016
Kommunikasjon og pasientaktiverende intervensjoner ved diabetes type 1 og 2
Det foreslås at helsepersonell stiller noen av følgende spørsmål under konsultasjoner/årskontroll for å få nødvendig informasjon om pasienten, og kunne sette realistiske behandlingsmål:
- Hvordan har det gått siden sist?
- Hvordan synes du det er å ha diabetes?
- Få rede på hva som tynger, hva som gleder, hva som mestres og hva som oppleves vanskelig. Eksempel på spørsmål:
3a) Hva går greit?
3b) Når har du det bra?
3c) Er det noe som bekymrer deg?
3d) Hvordan tror du dette påvirker insulinbehovet ditt?
4. Hvilke tanker har du om behandlingsmålene, hvilke mål syntes du er vanskeligst å nå, hva kan jeg gjøre for at det skal bli enklere for deg?
Praktisk – slik kan anbefalingen følges
Den presise formuleringen av spørsmålene må selvsagt tilpasses et språk du føler deg komfortabel med.
Manglende måloppnåelse hos personer med diabetes er vanlig og årsakene er mange. Pasientene kan ha andre prioriteringer i sitt liv, liten opplevelse av mening med målene, manglende kapasitet, og/eller lav mestringsopplevelse og manglende sosial støtte. De diabetesspesifikke psykologiske utfordringene som for eksempel følingsangst (en type angst man ikke kan ha uten å ha diabetes), er bare en av mange utfordringer som må "løses" psykologisk for at det skal være mulig å nå behandlingsmålene for den enkelte som har diabetes. Denne spesifikke psykologien vektlegges i liten grad i diabetesomsorgen (Haug et al., 2010).
Å identifisere, forstå og jobbe med å redusere barrierer er viktig for å øke pasientens måloppnåelse. Dette krever at det er god kommunikasjon mellom behandler og pasient (Bolen et al., 2014).
Under følger en utdypning av de foreslåtte spørsmålene, hvorfor de er adressert, målet og mulige tolkninger.
Spørsmål 1 og 2. Hvordan har det gått siden sist? Hvordan synes du det er å ha diabetes?
Diabetes bør presenteres som en insulinmangelsykdom hvor medisiner og-/eller insulindoser skal reguleres. Insulinbehovet er avhengig av mange faktorer, blant annet; hvordan man har det (tanker + følelser), relasjoner (sosial støtte), mental og fysisk helse generelt, stress- og mestringsnivå, kosthold, fysisk aktivitet og søvn. Det er viktig at det ikke blir presentert anklager, påbud, krav, forventninger, rettledning, men at det avdramatiseres og realitetsorienteres. Sammen med pasienten kan legen finne gode løsninger og ha fokus på det som er mulig og ønskelig.
Spørsmål 3. Bruk egne ord, men sørg for at du får rede på hva som tynger, hva som gleder, hva som mestres og hva som oppleves vanskelig. Målet i denne delen av samtalen er at pasientens små og store bekymringer og gleder i hverdagen, både knyttet til diabetes spesielt og til livet generelt, skal komme frem (McEwen et al., 2013)
- 3a) Hva går greit?
Gi rom for mestring, sørg for å finne noe pasienten har mestret, fokuser på dette. Del det opp og gjør det mindre og let etter det som gikk bra, viktig at pasienten blir bevisstgjort hva hun/han faktisk har fått til/klart. Grip tak i det praktiske og fokuser på det, selv om det er meget smått. Målet er at pasientene skal bli bevisst på hva som faktisk har gått bra, for på den måten og få erfaring om mestring som kan generaliseres videre til andre små og store mål. Viktig å hele tiden hjelpe til med fokus på det som går bra, slik at motløshet og hjelpeløshet ikke får festet seg (Ursin et al., 2004).
- 3b) Når har du det bra?
Ved å stille åpne spørsmål om hvordan pasienten har det i hverdagen sin gir du rom for at pasienten kan fortelle om stort og smått, hva som går bra og hva som er vanskelig. Det er din oppgave som fagperson å relatere diabetesbehandlingen til det pasienten forteller med type spørsmål som; hvordan løser du reguleringsoppgavene i denne situasjonen som du nå har fortalt meg om? Hvordan kan du få mer av det som er bra? Sett fokus på pasientens mestringsressurser og gode erfaringer. Finn det som er bra og bygg videre på det, på sikt vil mestring redusere emosjonelt stress og derfor være gunstig for regulering av medisinering og blodsukker.
- 3c) Er det noe som bekymrer deg?
Sett fokus på pasientens mestringserfaringer. Finn det som er bra og bygg videre på dette, dette vil redusere emosjonelt stress, og vil derfor påvirke insulinbehovet/blodglukose gunstig (Ursin H, 2004).
- 3d og 4) Hvordan tror du dette påvirker insulinbehovet ditt? Hva har du behov for at vi skal jobbe videre med?
Interessen for pasientens livshistorie fra tidlig barndom har en klar medisinsk/helsemessig konsekvens (Getz et al., 2011). Høy grad av belastning i sårbare livsfaser, overveldende traumatiske påkjenninger og/eller kronisk stress over lang tid vil ha biologiske konsekvenser på sikt (McEwen et al., 1998). Å prioritere tid til å lytte og forklare sammenhengen mellom livshendelser og reaksjoner opp mot insulinbehov og blodglukose vil øke tilliten til deg som behandler og sannsynligheten for måloppnåelse.
5. Er det noe mer jeg kan hjelpe deg med i dag?
Gi åpning for at pasienten kan fortelle om store og små hendelser fra sitt liv. Pasientens biografi vil påvirke biologien i stor grad.
Dersom det kommer frem informasjon som tilsier at pasienten trenger mer tid til temaet, kan man sette opp ny time ganske raskt eller dobbelttime neste gang (støttesamtale). Alternativt kan man anbefale pasienten å snakke med en av sine nærmeste om dette, man kan henvise pasienten enten til samtale med diabetessykepleier ved et sykehus/spesialisthelsetjeneste, psykiatrisk sykepleier eller henvise til psykolog på vanlig måte dersom man vurderer at det er behov for det. Generelt vil lege og/eller sykepleier kunne ta seg av behovet til pasienten for å dele erfaringer, tanker og følelser knyttet til det å ha diabetes, henvisning til psykolog er i de fleste tilfeller ikke nødvendig.
Pasientaktiverende intervensjoner
Å engasjere voksne personer med diabetes type 2 som ikke når behandlingsmålene, aktivt i håndtering av sykdommen i helsevesenet og primærhelsetjenesten, har en sterk kumulativ effekt på både sykdom og død (Bolen SD, 2014). Følgende pasientaktiverende intervensjoner kan integreres i diabetesomsorgen:
- Problemløsning: for eksempel emosjonell og kognitiv orientering til problemløsning, fokus på å lære av erfaringer.
- Evaluering og tilbakemelding: all slags evaluering av behandling, samt dagbøker, loggbøker etc.
- Individuelle behandlingsplaner: deler av behandlingsregimet blir rettet mot den enkeltes behov, som for eksempel måltidsplan, plan for fysisk aktivitet, rådgivning knyttet til egenbehandling.
- Finansielle insentiver: gratis eller lavkostnadstilbud brukt for å motivere pasientene til å delta i intervensjonsstudier.
- Sosial støtte/familie: at noen i nettverket/familien er direkte involvert i pasientens diabetesbehandling.
- Likemannsarbeid: lønnet eller frivillig likemannsarbeid.
- Psykologisk rådgivning: formell psykologisk behandling hos psykolog/psykiater, for eksempel kognitiv atferdsterapi, se kognitiv.no.
- Teoribasert rådgivning: rådgivning direkte rettet mot adferdsendring.
- Ferdighetstrening: læringsaktiviteter/protokoller som er innholdsstyrt med fokus på å utvikle kjerne-evner og øke mestring. Ferdighetstrening kan også være intervensjoner rettet mot mer generelle livsmestringsstrategier som mindfulness, meditasjon etc.
Dessuten foreslår vi at slike intervensjoner kan være et supplement til allerede eksisterende tilbud som:
- Lærings- og mestringssentre (LMS)
- Tverrfaglige kurs i regi av diabetessykepleier sammen med ernæringsfysiolog og psykolog
- Motivasjonsgrupper i regi av Diabetesforbundet
Begrunnelse – dette er anbefalingen basert på
Det er viktig at helsepersonell utforsker barrierer for måloppnåelse og om det finnes eventuelle motivasjonskonflikter for å kunne veilede pasienten til god egenomsorg. Et godt samspill mellom pasient og helsepersonell er nødvendig for optimal oppfølging, behandlingen og etterlevelse av anbefalinger. Det finnes betydelige barrierer for å oppnå en god pasient-behandler relasjon (de fleste artiklene som danner basis for kunnskapsgrunnlaget har primært inkludert voksne med diabetes type 2).
De vanligste barrierene hos helsepersonell er:
- Holdninger og kunnskapsnivå
- Kommunikasjon mellom helsepersonell og pasient
De vanligste barrierene hos pasientene er:
- Vansker med å følge opp behandlingsregimet
- Pasientens holdning og innstilling til diabetes
- Pasientens kunnskapsnivå
- Kulturelle, etniske og språklige forhold
- Komorbititet
- Sosial støtte
- Økonomiske forhold
Barrierer hos helsepersonell
Holdninger og kunnskapsnivå hos helsepersonell:
I følge Nam et al., (2011) har helsepersonells holdninger til diabetes betydning for hvordan pasienten følger opp behandlingen. En del helsepersonell betrakter fortsatt type 2 diabetes som en ikke-alvorlig kronisk sykdom. Slike holdninger, spesielt ved diagnosetidspunktet, synes å spille en avgjørende rolle for hvordan pasienten oppfatter sykdommens alvorlighet og videre egenbehandling av denne. Ved diagnosetidspunktet opplever pasienter ofte følelser som frykt/angst, sjokk, panikk, sinne og resignasjon. Studier viser at hvis legen reagerte på disse følelsene med å nedskalere alvorligheten av sykdommen, ble den også oppfattet som mindre alvorlig av pasienten.
Det er også dokumentert at pasientens holdninger til oppstart av insulinbehandling er påvirket av de holdninger helsepersonell har til slik behandling (Nam et al., 2011). I følge en oversiktsartikkel (review) av Ross et al. (2013), ble intensivering av behandlingen utsatt i nesten 2 år etter at økt HbA1c nivå ble observert første gang. Dette var spesielt fremtredende i overgangen fra behandling med tabletter til insulin hos pasienter med diabetes type 2. Studier viser at en slik utsettelse av behandlingsintensivering kan forklares med manglende ressurser, manglende kunnskap/opplæring hos helsepersonell, dårlig kommunikasjon med pasienten, dårlig oppfølging av behandling fra pasientens side, forsøk på å tilfredsstille pasientens ønsker (Grant et al., 2007; Ross et al., 2010).
Manglende kunnskap blant helsepersonell om oppdaterte evidensbaserte retningslinjer antas å påvirke utfallet av diabeteshåndteringen (Nam et al., 2011; Ross et al., 2013). Til tross for at rundt 41 % av pasientene i en studie rapporterte psykososiale forhold som hadde innflytelse på deres evne til å håndtere sin diabetes, rapporterte mange klinikere at de ikke var trygge på å identifisere og vurdere psykiske aspekter/problemer og gi støtte til disse pasientene (Peyrot et al., 2005).
Kommunikasjon mellom helsepersonell og pasient
To enkeltstudier rapporterer at helsepersonell mangler kommunikasjonsferdigheter og verktøy i pasientveiledningen, og anser dette som en barriere for en effektiv diabetesbehandling (Hunt et al., 1997; Wens et al., 2005). Helsevesenets ressurser, spesielt tid og personell er ofte begrenset og kan derfor være en barriere med tanke på å utvikle individuelle behandlingsplaner for å gjennomføre god diabetesopplæring inkludert medikamentell oppfølging (Nam et al., 2011). Empiri og pasienterfaringer viser at det ikke er økt bruk av tid som er det viktigste, men at formen på kommunikasjonen som foregår, og innholdet, er det som utgjør en forskjell og som skaper nødvendig tillit og trygghet. Ved å lytte, være nysgjerrig og empatisk, opplever pasienten at kvaliteten kan være svært god uavhengig av tid.
Barrierer hos pasientene
Vansker med å følge opp behandlingsregimet
Nam et al., (2011) viser at manglende oppnåelse av mål for HbA1c, kan være påvirket av at mange pasienter med diabetes type 2 har vansker med å følge opp behandlingsregimet. En del klarer for eksempel ikke å holde timeavtaler og ta anbefalte medikamenter. Funn viser også at dosering av medikamenter én gang daglig var lettere å følge opp enn to ganger daglig. Å følge opp insulinbehandling synes å være vanskeligere enn oppfølgingen av perorale medikamenter. Dette kan reflektere pasientens manglende forståelse for alvorligheten av sykdommen og for hvorfor det er nødvendig å starte med insulin hos pasienter med diabetes type 2. I følge Ross SA (2013) må mange med diabetes type 2 også ta medikamenter for andre sykdommer/symptomer som for eksempel hypertensjon og depresjon, noe som kan føre til ytterligere økt medikamentbyrde. Kompleksiteten i behandlingsregimet kan derfor resultere i at pasientene glemmer eller er uvillige til å følge opp regimene. Dette kan igjen lede til ukorrekte, forsinkede og manglende medikamentdoser.
Pasientens holdning og innstilling til diabetes
Pasientens holdning og innstilling til diabetes og behandlingen ser ut til å påvirke hvordan pasienten følger opp diabetesbehandlingen (Nam et al., 2011). Flere studier har funnet en positiv sammenheng mellom positive holdninger og oppfølging av behandlingen. Troen på at medikamentene vil virke synes å være positivt assosiert med intensjonen om å ta medikamentene regelmessig. Motvillighet til å starte med insulin for diabetes type 2 kan på den andre siden også være knyttet til pasientens holdning til diabetes og behandlingen. Det å måtte starte på insulinbehandling oppleves for mange å være et personlig nederlag og som en straff for ikke å håndtere sykdommen. Mange føler skyld knyttet til oppstart av insulinbehandling (Nam et al., 2011; Ross et al., 2013). Andre negative holdninger til oppstart av insulin kan være at pasienten tror livet vil bli mer begrenset og at insulin ikke vil ha en positiv effekt, men heller forverre sykdommen og gi alvorlige komplikasjoner (Nam et al., 2011). I tillegg er det dokumentert at frykten for sprøyter og flauhet over å sette injeksjoner der andre er tilstede kan være en barriere for å starte insulinbehandling (Nam et al., 2011, Ross et al., 2013). Angst og frykt for smerte relatert til sprøyteinjeksjoner er estimert til å angå rundt 30 – 50 % av pasientene med diabetes type 2 (Kruger et al., 2015). Andre identifiserte barrierer knyttet til insulininjeksjoner indikerer at pasienter med både diabetes type 1 og type 2 har utfordringer med å tilpasse injeksjonene til deres daglige liv (Davies et al., 2013).
Pasientens kunnskapsnivå
I følge Nam S (2011) kan manglende kunnskap hos pasienten også være en barriere for måloppnåelse. Men kunnskap alene er ikke tilstrekkelig for en god håndtering av diabetes. Selv om foreskrevet behandling blir fulgt opp, er det mange som rapporterer at de ikke vet hvorfor de må følge denne og er usikker på gevinsten av denne. Misforståelser om diabetes og behandlingen ser ut til å være vanlig og i stort omfang selv om pasientene følges opp rutinemessig hos fastlegen.
Kulturelle, etniske og språklige forhold
Nasjonale retningslinjer skal dekke alle befolkningsgrupper, og målet er at de ulike etniske gruppene skal behandles på lik linje med etniske nordmenn. Det er behov for å ta hensyn til enkelte pasientgrupper hvor studier viser at spesielle hensyn må tas. Det overordnede målet er likeverdig behandling til alle. Kulturelle, etniske og språklige forhold har innflytelse på pasientens holdning, språklig forståelse og kunnskap om diabetes som igjen kan påvirke oppnåelse av behandlingsmål (Hacker et al., 2012) Kulturelle faktorer som kan ha betydning for slik oppnåelse omfatter blant annet livsstil, kunnskap, og helse- og sykdomsoppfatning. En enkeltstudie påpeker at det kan være vanskelig for pasienter fra andre kulturer å forstå og akseptere behandlingsregimet i Norge (Larsen et al., 2000).
Komorbititet
Komorbiditet er også identifisert som en aktuell barriere for måloppnåelse på grunn av konkurrerende behandlingsregimer (Nam S, 2011). Depresjon i særdeleshet er utbredt blant pasienter med diabetes type 2 og ser ut til å redusere evnen til å håndtere diabetes optimalt, se kapittelet Psykiske lidelser og diabetes. Vektøkning og hyperglykemi ses blant annet som bivirkninger av antidepressiva, noe som igjen kan forsterke barrierene for måloppnåelse i diabetesbehandlingen (Barnett et al., 2012)
Sosial støtte
En stor meta-analyse som inkluderte 148 enkeltstudier viser at mangel på sosial støtte kan være en svært sentral barriere for måloppnåelse (Holt-Lunstad et al.J, 2010).
Økonomiske forhold
Kostnader knyttet til diabetesbehandlingen kan være en betydelig barriere for måloppnåelse, spesielt for pasienter med lav sosioøkonomisk status (Nam et al., 2011, Davies et al., 2013).
Forskningsgrunnlag
Populasjon (P): Personer med diabetes type 2
Tiltak (I): Aktiviserende intervensjoner for å øke kunnskap, selvtillit og egenkontroll
Sammenligning (C): Standard behandling/minimal intervensjon i gjennomsnittlig 12 år
Beskrivelse av inkluderte studier
For å komme med konkrete anbefalinger i dette kapittelet, har vi gjort systematiske søk i forskningslitteraturen for å forsøke å finne dokumenterte og evidensbaserte svar på følgende spørsmål:
- Hvordan kan man styrke behandlingsrelasjonen i en medisinsk setting?
- Har pasientaktiverende intervensjoner effekt (på ulike utfallsmål)?
- Hvilke barrierer finnes for måloppnåelse og god mestring?
- Hvordan kan kommunikasjon med fremmedspråklige og bruk av tolk øke måloppnåelse og opplevelse av mestring for pasientene?
Utgangspunktet for den kliniske problemstillingen var å se om intervensjoner som øker kunnskap, selvtillit og grad av egenkontroll har effekt på: mortalitet (kort sikt, < 2 år), mortalitet (lang sikt, > 2 år), HbA1c og vekt (Bolen S, 2014). Vi fant ikke studier som kunne vise effekt på andre utfallsmål som komplikasjoner, hypoglykemi, HDL, LDL, triglyserider og systolisk blodtrykk.
Vi fant at pasientaktiviserende intervensjoner kan føre til en reduksjon i dødelighet over tid blant pasienter med diabetes type 2, men det er knyttet en del usikkerhet til disse resultatene. Evidensen var moderat for reduksjon i HbA1c. Reduksjon i vekt anses som liten og det er derfor usikkert om pasientaktiviserende intervensjoner har effekt på vekt. De resterende utfallsmålene fant vi ikke god nok dokumentasjon på.
Vurdering
Fordeler og ulemper
Resultatene var varierende med moderate endringer på HbA1c og vekt, ikke signifikant for mortalitet, men RR viste 30 % reduksjon i mortalitet på lang sikt. Det ble ikke rapportert om negative utfall (bivirkninger) av PAIs.
Kvalitet på dokumentasjonen
Kvalitet på evidensen vurderes som lav (på en skala fra høy, moderat, lav og veldig lav). Graderingen av kvaliteten på dokumentasjonen er lav da det ikke foreligger tilstrekkelige data for de ulike endepunktene og mange ulike intervensjoner med ulike tilnærmingsmåter er inkludert i studien.
Verdier og preferanser
Opplæring i hva diabetes er og hva behandlingen innebærer er både viktig og nødvendig. Det er vanskelig å oppnå god egenhåndtering av diabetes hvis ikke den enkelte selv inntar en aktiv rolle i dette. Derfor trenger pasientene hjelp og støtte til å øke kunnskap, selvtillit og egenkontroll slik at de bedre kan håndtere daglige diabetesrelaterte utfordringer og muligens bedre HbA1c-nivå og forhindre utvikling av diabetiske komplikasjoner.
Pasientaktiviserende intervensjoner for å stimulere til økt kunnskap, selvtillit og selvkontroll synes å være et krevende tiltak bestående av mange ulike tilnærmingsmåter. Dessuten kan deltakelse i en slik intervensjon kreve for mye av enkelte pasienter slik at de ikke klarer å følge opp forventningene.
Referanser
42. Social relationships and mortality risk: a meta-analytic review https://www.helsedirektoratet.no/referanse/0002-0013-232030
54. The brain on stress: toward an integrative approach to brain, body, and behavior https://www.helsedirektoratet.no/referanse/0002-0013-232042
55. Epidemiology of multimorbidity and implications for health care, research, and medical education: a cross-sectional study https://www.helsedirektoratet.no/referanse/0002-0013-232043
56. Effectiveness and safety of patient activation interventions for adults with type 2 diabetes: systematic review, meta-analysis, and meta-regression https://www.helsedirektoratet.no/referanse/0002-0013-232044
57. Real-world factors affecting adherence to insulin therapy in patients with type 1 or type 2 diabetes mellitus: a systematic revie https://www.helsedirektoratet.no/referanse/0002-0013-232045
58. Meta-analysis of randomized educational and behavioral interventions in type 2 diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232046
59. Relationship between patient medication adherence and subsequent clinical inertia in type 2 diabetes glycemic management https://www.helsedirektoratet.no/referanse/0002-0013-232047
60. Exploring the impact of language services on utilization and clinical outcomes for diabetics https://www.helsedirektoratet.no/referanse/0002-0013-232048
61. The cognitive activation theory of stress. Review https://www.helsedirektoratet.no/referanse/0002-0013-232049
62. NIDDM patients' fears and hopes about insulin therapy. The basis of patient reluctance https://www.helsedirektoratet.no/referanse/0002-0013-232050
63. Recognition of and steps to mitigate anxiety and fear of pain in injectable diabetes treatment https://www.helsedirektoratet.no/referanse/0002-0013-232051
64. Menneskets biologi – mettet med erfaring https://www.helsedirektoratet.no/referanse/0002-0013-232052
65. Diabetes hos ikke-vestlige innvandrere https://www.helsedirektoratet.no/referanse/0002-0013-232053
66. Barriers to diabetes management: patient and provider factors https://www.helsedirektoratet.no/referanse/0002-0013-232054
67. Effectiveness of self-management training in type 2 diabetes: a systematic review of randomized controlled trials https://www.helsedirektoratet.no/referanse/0002-0013-232055
68. Psychosocial problems and barriers to improved diabetes management: results of the cross-national diabetes attitudes, wishes and needs (DAWN) study https://www.helsedirektoratet.no/referanse/0002-0013-232056
69. Breaking down patient and physician barriers to optimize glycemic control in type 2 diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232057
70. Baseline Data from SOLVE (TM) imply initiation of insulin therapy remains delayed for many patients in Canadian primary care of type 2 diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232058
71. GPs' perspectives of type 2 diabetes patients' adherence to treatment: a qualitative analysis of barriers and solutions https://www.helsedirektoratet.no/referanse/0002-0013-232059
Sist faglig oppdatert: 14.09.2016
Kommunikasjon med fremmedspråklige og bruk av tolk
- God kommunikasjon er ikke etnisitet- eller kulturspesifikt (Zen et al., 2012).
- Det anbefales bruk av kvalifisert tolk som snakker pasientens foretrukne språk.
- Se Veileder om kommunikasjon via tolk for ledere og personell i helse- og omsorgstjenestene
Praktisk – slik kan anbefalingen følges
God kommunikasjon og gjensidig forståelse er grunnleggende i møtet mellom pasient og helsepersonell. God kommunikasjon i konsultasjoner er avgjørende for å bedre diabetesrelaterte utfall. All diabetesbehandling bør være likeverdig og tilpasset hvert enkelt individ, uavhengig av kjønn, alder, religion og etnisk bakgrunn. Formen på kommunikasjonen er ikke etnisk spesifikk (Zeh P, 2012). En viktig forutsetning for god diabetesbehandling er at helsepersonell har kjennskap til pasientens egenomsorg, kunnskap og kulturelle forståelse. Informasjon om sykdommen og viktige faktorer som riktig kosthold, fysisk aktivitet og mestring må tilegnes og læres ved god kommunikasjon på pasientens eget språk.
Det er betydelige helseforskjeller for pasienter med manglende norskkunnskap sammenlignet med pasienter som snakker godt norsk. Det vil si at pasienter som ikke snakker norsk, eller tilstrekkelig norsk, mest sannsynlig får dårligere forebyggende tjenester og helseopplysninger, manglende kontinuitet i behandlingen og mer problemer med å forstå medisinske anbefalinger enn pasienter som er norskkyndige. Språkbarriere kan føre til redusert medisinering, redusert opplevelse av tilhørighet, større sannsynlighet for innleggelser, lengre sykehusopphold og økt ressursutnyttelse (Hacker K, 2012)
Både nasjonalt (Telle-Hjellset V, 2012) og internasjonalt (Lindstrom J et al 2010), finnes det studier som viser god måloppnåelse ved bruk av en etnisk tilpasset modell.
For å sikre at fremmedspråklige får omsorg av høy kvalitet, er det flere aktuelle strategier for å øke tilgjengeligheten av språksamstemmige leverandører som å
- rekruttere og beholde flere tospråklige individer i helseyrker
- teste og trene personell for å utvikle språkkapasiteten til tospråklig helsepersonell i primærhelsetjenesten
Vi må vurdere de unike behovene til våre pasienter og sørge for at pasientene med høyest risiko mottar de mest hensiktsmessige språktjenestene. Pasientjournal krever at tilbydere dokumenterer hvordan de møtte pasientens språklige behov ved hvert besøk. Strategier som dette vil forbedre vår evne til å forstå når og hvordan språktjenester blir benyttet.
Tolketjenesten kan blant annet tilby telefontolk. Diabetesforbundet har informasjon på flere språk.
Begrunnelse – dette er anbefalingen basert på
Lovbestemt
Bruk av kvalifisert tolk en grunnpilar i likeverdige helsetjenester og anbefalingen er sterk med bakgrunn i en verdi om likeverdighet som vi blant annet finner i lovverket. Ut fra Lov om pasientrettigheter har pasienten rett til medvirkning og tilrettelagt informasjon, ut fra Lov om spesialisthelsetjenester har pasienten rett på informasjon: «Helseinstitusjoner som omfattes av denne lov, har plikt til å gi videre den informasjon som er nødvendig for at allmennheten skal kunne ivareta sine rettigheter» (informasjon som gis, skal altså være tilgjengelig for personer som ikke snakker norsk) og ut fra Lov om helsepersonell, heter det at «den som yter helsehjelp, skal gi informasjon til den som har krav på det».
Det er lite sannsynlig at helsevesenet noen gang vil være i stand til å tilby nok oversettere/tolker for å møte etterspørselen. Men, det er stor politisk velvilje til ressurser knyttet til bruk av tolk.
Klinisk effekt
I tillegg til at dette er lovbestemt er det også verdt å nevne at studier som har sett kliniske effekter av å bruke tolk hos personer med diabetes type 1 og type 2 med begrenset språkkompetanse på aktuelle språk, kan vise til en signifikant mindre sannsynlighet for besøk ved akuttmottak relatert til diabetes (Hacker et al., 2012 og Perez-Stable et al., 1997) og en bedret glykemisk kontroll (redusert antall pasienter med HbA12c ≥9.0%) (Hacker et al., 2012 og Fernandez et al., 2011).
Studien (Hacker et al., 2012) ble utført i et by-nært offentlig sykehussystem med en multietnisk og relativt liten befolkning. Funnene kan dermed ikke uten videre generaliseres til andre lignende populasjoner. Siden det i noen kulturer kan være skambelagt å snakke med andre om sykdom (Kohinor et al., 2011), er det mulig at antallet pasientbesøk er falskt lavt i kontroll- og intervensjonsgruppene i studien. Videre kan det av kulturmessige årsaker være en utfordring å få disse personen til å delta i egenbehandlingsprogrammer.
Likeverdige helsetjenester
Likeverdige tjenester til hele befolkningen er et uttalt mål for helse- og omsorgstjenesten. Lik tilgang til helse- og omsorgstjenester av god kvalitet forutsetter i mange tilfeller tilrettelagt informasjon og kommunikasjon ved hjelp av tolking. God kommunikasjon og gjensidig forståelse er grunnleggende i møtet mellom pasient og helsepersonell. En viktig forutsetning for god diabetesbehandling er pasientens egenomsorg, og kunnskap og informasjon om sykdommen og viktige faktorer som riktig kosthold, fysisk aktivitet og mestring må tilegnes og læres ved god kommunikasjon på pasientens eget språk. Det vil si at pasienter som ikke snakker norsk mest sannsynlig får dårligere forebyggende tjenester og helseopplysninger, manglende kontinuitet i behandlingen og mer problemer med å forstå medisinske anbefalinger enn pasienter som er norskkyndige. Språkbarrierer kan føre til redusert medisinering, redusert opplevelse av tilhørighet, større sannsynlighet for innleggelser, lengre sykehusopphold og økt ressursutnyttelse (Hacker et al., 2012).
Forskningsgrunnlag
Populasjon (P): Personer med diabetes type 1 og type 2 med begrenset språkkompetanse på aktuelle språk ("limited English proficient")
Tiltak (I): Bruk av tolk
Sammenligning (C): Ikke bruk av tolk
Beskrivelse av inkluderte studier
Kunnskapsgrunnlaget for anbefalingen (Hacker K, 2012) antyder at oversettere som snakker samme språk som pasienten (språksamstemmige tilbydere) kan bidra til å redusere bruk av helsetjenester for pasienter med manglende norskkunnskaper. De utfordringene som ligger i å levere helsetjenester til en etnisk sammensatt befolkning fortjener videre forskning for å fastslå den beste praksisen og de beste strategiene for å oppnå dette målet. Det er sannsynlig at språksamstemmighet kan forbedre kommunikasjonen mellom pasient og leverandør, og føre til bedre helseutfall.
Studien (Hacker K, 2012) ble utført i et by-nært offentlig sykehussystem med en multietnisk og relativt liten befolkning. Funnene kan dermed ikke uten videre generaliseres til andre lignende populasjoner. Siden det i noen kulturer kan være skambelagt å snakke med andre om sykdom (Kohinor MJ, 2011), er det mulig at antallet pasientbesøk er falskt lavt i kontroll- og intervensjonsgruppene i studien. Videre kan det av kulturmessige årsaker være en utfordring å få disse personen til å delta i egenbehandlingsprogrammer.
Referanser
72. . Language barriers, physician-patient language concordance, and glycemic control among insured Latinos with diabetes: the diabetes study of Northern California (DISTANCE) https://www.helsedirektoratet.no/referanse/0002-0013-232060
73. Exploring the impact of language services on utilization and clinical outcomes for diabetics https://www.helsedirektoratet.no/referanse/0002-0013-232061
74. Factors affecting the disclosure of diabetes by ethnic minority patients: a qualitative study among Surinamese in the Netherlands https://www.helsedirektoratet.no/referanse/0002-0013-232062
75. Take action to prevent diabetes--the IMAGE toolkit for the prevention of type 2 diabetes in Europe https://www.helsedirektoratet.no/referanse/0002-0013-232063
76. The effects of ethnicity and language on medical outcomes of patients with hypertension or diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232064
77. The InnvaDiab-DE-PLAN study: a randomised controlled trial with a culturally adapted education programme improved the risk profile for type 2 diabetes in Pakistani immigrant women https://www.helsedirektoratet.no/referanse/0002-0013-232065
78. The impact of culturally competent diabetes care interventions for improving diabetes-related outcomes in ethnic minority groups: a systematic review https://www.helsedirektoratet.no/referanse/0002-0013-232066
Sist faglig oppdatert: 14.09.2016
Levevaner ved diabetes og behandling av overvekt og fedme
Personer med diabetes type 1 bør tilbys individuell veiledning i bruk av tekniske hjelpemidler, justering av insulindoser og inntak av mat og drikke i forbindelse med fysisk aktivitet
Sist faglig oppdatert: 30.06.2023
Personer med diabetes type 1 bør følge de generelle anbefalingene for fysisk aktivitet for sin aldersgruppe.
Veiledningen bør individtilpasses og foregå over tid, da det ofte er nødvendig med justeringer basert på individuelle erfaringer med aktivitet og trening.
Foresatte til barn med diabetes type 1 bør få skriftlig informasjon og veiledning om tiltak som reduserer faren for hypoglykemi før, under og etter fysisk aktivitet og trening. Informasjonen kan med fordel deles med skole, barnehage, idrettsledere og andre omsorgspersoner.
Praktisk – slik kan rådet følges
Helhetlig vurdering, veiledning og individtilpasset fysisk aktivitet
Tilrettelegging, veiledning og råd om fysisk aktivitet og begrensning av tid i ro bør bygge på en helhetlig vurdering av helsetilstand, funksjon og kulturell bakgrunn. Motiverende intervju (samtale) er en effektiv og empatisk metode for samtaler om endring, motivasjon og mestring. Bruk tolk ved behov.
Tilby grunnleggende informasjon om
- betydningen av regelmessig fysisk aktivitet for sykdomsmestring og sykdomsutvikling (se lenker til selvhjelpsmateriell nedenfor)
- samspillet mellom fysisk aktivitet og behovet for insulin og karbohydrater
- hvordan teknisk utstyr kan tilpasses og utnyttes ved fysisk aktivitet
- at hva som fungerer godt er individuelt og kan variere med dagsform
Informer om hvilke tiltak som reduserer faren for hypoglykemi før, under og etter aktivitet (informer gjerne også pårørende etter samtykke). For personer med diabetes type 1 kan det være nyttig å
- teste ut ulike løsninger for insulindosering og når, hva og hvor mye man bør spise, ved ulike aktiviteter
- følge med på blodsukkeret før, eventuelt under og etter fysisk aktivitet (ved blodsukkermåling eller bruk av kontinuerlig glukosemåler (CGM)) – denne informasjonen er nødvendig for å få til optimal justering av mat og insulin under trening
- notere ned erfaringer med ulik type aktivitet og hvilke justeringer som gjøres
Veiledning av foresatte, barn og unge
Veiled foresatte, barn og unge i hvordan de kan følge de generelle rådene for fysisk aktivitet og tid i ro for barn og unge og hvilke tiltak som reduserer risikoen for hypoglykemi før, under og etter aktivitet.
Skriftlig tiltaksplan
Lag en skriftlig tiltaksplan som kan deles med skole/barnehage, trening-/idrettsledere og andre omsorgspersoner som inneholder råd om
- aktiviteter, intensitet, varighet og frekvens
- å kontrollere/måle glukosenivå før og etter fysisk aktivitet
- type og mengde karbohydrat som bør inntas før, under og etter fysisk aktivitet basert på aktivitetens type, intensitet og varighet
- hvordan insulindosene før og etter aktivitet kan tilpasses ulike former for aktivitet
- hvordan tidspunktet for aktiviteten kan påvirke risiko for hypoglykemi (morgen vs. kveld)
- eventuelle behov for tilrettelegging, hjelpemidler og oppfølging
Det vises til rundskriv om håndtering av legemidler i barnehage, skole og skolefritidsordning (regjeringen.no).
Konkurranseidrett
I spesielle situasjoner med konkurranseidrett som skaper en kraftig stressrespons, kan enkelte oppleve at behovet for næring og insulin øker i stedet for den vanlige responsen som er at insulinbehovet synker (Riddell et al., 2020). Utøvere som opplever dette bør få veiledning av helsepersonell med spesiell kompetanse på dette området (Adolfsson et al., 2022).
Tilrettelegging før fysisk aktivitet
Motiver personer med diabetes type 1 som er lite fysisk aktive til å starte med fysisk aktivitet 2–3 dager i uken. Frekvens, intensitet og varighet kan gjerne økes gradvis over tid. Aktive pauser som avbryter stillesitting og fysisk aktivitet gjennom daglige gjøremål er gunstig.
Blodsukkermål
Blodsukkermål før og under fysisk aktivitet må tilpasses den enkelte basert på tidligere erfaringer. Det kan være lurt at det siste måltidet spises 90–180 minutter før aktiviteten starter, og at dette inneholder langsomt absorberbare karbohydrater og protein.
Hvis dette av erfaring ikke er tilstrekkelig for å oppnå ønsket blodsukkernivå før langvarig aktivitet/trening (over 20–30 minutter), kan det for de som bruker penn/pumpe uten CGM være en løsning å spise mat med langsomt absorberbare karbohydrater 30–60 minutter før aktiviteten uten å sette ekstra insulin (Moser et al. 2020).
Gunstig blodsukker før og under aktivitet
For de fleste vil en blodsukkerverdi mellom 7 og 10 mmol/L rett før og under økten være gunstig. Å starte aktiviteten med et litt forhøyet blodsukker kan fungere som en buffer mot synkende blodsukker ved aktivitet som varer mer enn 30 minutter.
Hvis blodsukkeret er mellom 4–6 mmol/L rett før aktiviteten/treningen, kan det være behov for å spise/drikke raskt absorberbare karbohydrater, tilsvarende 10–30 g karbohydrater (Adolfsson et al., 2022). Dette kan for eksempel være en banan, et glass vanlig saft, brus eller juice, sportsdrikke, druesukker/gel eller en brødskive.
Måling av blod-ketoner ved blodsukker over 14–15 mmol/L
Ved blodsukker over 14–15 mmol/L av ukjent årsak før aktiviteten starter, bør blod-ketoner måles. Informer personer med diabetes type 1 om at ved blod-ketoner over 1,5 mmol/L skal insulin settes (for eksempel halvparten av en vanlig korreksjonsdose) og fysisk aktivitet/trening utsettes til blodsukkeret og ketonene er stabilisert (Moser et al., 2020).
Blod-ketoner er vanligvis et resultat av for lite insulin, og blodsukkeret kan fortsette å stige under aktiviteten dersom insulin ikke settes. Fysisk aktivitet eller trening med høyt blodsukker og ketoner til stede kan bidra til ketoacidose.
Nylig alvorlig hypoglyklemi
Ved en eller flere episoder av alvorlig hypoglykemi de siste 24 timer, bør fysisk aktivitet eller trening utsettes (Adolfsson et al., 2022).
Hybrid closed-loop (HCL)-system
I et hybrid closed-loop (HCL)-system sender en vevsglukosemåler glukoseverdier til pumpen, som justeres automatisk etter vevsglukosen. HCL-systemet kan forhåndsinnstilles til et midlertidig høyere mål under fysisk aktivitet. Innstillingen gjøres helst minst 60 minutter før aktivitets-/treningsstart. Pumpene har ulike systemer for dette. Endres ikke innstillingen før (eller når) aktiviteten starter, er det stor sannsynlighet for hypoglykemi.
Mange velger å koble pumpen fra under trening (som ved kontaktidrett og svømming). I slike tilfeller kobles pumpen fra og HCL-systemet skrus av ved start av aktiviteten eller treningen. Varer aktiviteten/treningen i mer enn 60–90 minutter bør man tilføre hurtigvirkende insulin (med pumpe eller penn) tilsvarende omkring 50 % av den utelatte basaldosen rundt én gang i timen (Adolfsson et al., 2022).
Justering av insulindose
Metode for å justere insulindosene i forbindelse med fysisk aktivitet vil være avhengig av om det benyttes mange-injeksjonsbehandling eller kontinuerlig vevsglukosemåling kombinert med insulinpumpe med eller uten et HCL-system.
Reduser dosen hurtigvirkende insulin til måltidet før fysisk aktivitet med 25–75 % avhengig av type aktivitet, intensitet og varighet (jo lenger tid fra aktivitetens start måltidet inntas, jo mindre er behovet for dosereduksjon). Insulin settes da 10–20 minutter før måltidet for å redusere risikoen for hypoglykemi under aktiviteten (spesielt ved måltider tett på aktiviteten), men dette må tilpasses mengde 'aktivt insulin' og glukoseverdi.
Å redusere dosen med hurtigvirkende insulin kan alternativt erstattes helt eller delvis med inntak av en banan, et glass saft/brus eller tilsvarende rett før aktiviteten.
Hvis det siste måltidet før trening er 2–3 timer i forkant vil det trolig fungere best å sette en normal dose insulin til måltidet.
Alle insulinpumper angir mengde 'aktivt insulin' (dette inkluderer ikke basalinsulin). Pumper med HCL-system har også trendpiler som viser om blodsukkeret er på vei opp eller ned, og hvor hurtig endringen skjer. 'Aktivt insulin' er ubrukt insulin fra tidligere doser hurtigvirkende insulin. Hurtigvirkende insulin virker i 3–5 timer, med en topp etter 60–100 min, og etter 2 timer er rundt 2/3 av insulinet brukt opp. Å vite mengden 'aktivt insulin' er nyttig for å kunne vurdere behovet for å innta karbohydrater før og under aktiviteten.
Tilrettelegging under fysisk aktivitet
Oppfordre personer med diabetes type 1 til å ha mat/drikke med raskt absorberbare karbohydrater tilgjengelig under trening/fysisk aktivitet. Mange kan trenge 10–30 gram eller mer karbohydrat hvert 20.–30. minutt under aktiviteter som varer mer enn 60 minutter, særlig hvis blodsukkeret er mellom 4–6 mmol/L.
Ved svært høy intensitet eller kun anaerob trening (eksempelvis sprint eller vektløfting) kan noen unntaksvis oppleve at blodsukkeret stiger kortvarig (30–60 minutter), særlig når det er lenge siden forrige måltid (Adolfsson et al., 2022). I slike tilfeller kan en korreksjonsdose settes eller intensiteten på aktiviteten kan justeres ned.
Forsinkelse ved vevsglukosemåling
Ved fysisk aktivitet, når blodsukkeret kan endre seg raskt, er det ekstra viktig å huske på «forsinkelsen» ved vevsglukosemåling (vevsglukosen måles av en liten sensor på huden) sammenliknet med kapillær måling («stikk i fingeren»).
Sensorsystemene (kontinuerlig blodsukkermåler og flash-måling) vil overestimere blodsukkeret når det er raskt fallende. Det er samme forsinkelse hvis det stiger raskt, som etter inntak av søt drikke, men da vil sensoren oppgi en lavere glukoseverdi enn den reelle. Forsinkelsen er omkring 12 + 11 minutter under aerobisk kondisjonstrening (Adolfsson et al., 2022).
Ved symptomer på hypoglykemi som ikke stemmer med sensorverdier bør blodsukkeret måles kapillært. Råd personer med diabetes type 1 til å stole på symptomene og drikke/spise karbohydrater hvis kapillær måler ikke er tilgjengelig.
Tilrettelegging etter fysisk aktivitet
Det er økt sannsynlighet for hypoglykemi i en periode opp til 24 timer etter fysisk aktivitet som følge av økt insulinsensitivitet (Adolfsson et al., 2022). Risikoen for nattlig hypoglykemi er størst etter trening på ettermiddag/kveld. Oppfordre personer med diabetes type 1 til å spise et måltid som inneholder karbohydrater og protein etter avsluttet aktivitet/trening, helst innen 90 minutter og til å redusere insulindosen til måltidet etter aktivitet/trening med opptil 50 %.
Høy temperatur vil øke absorbsjonen av insulin, og ytterligere dosereduksjoner enn vanlig kan være nødvendig ved aktivitet og trening i varme.
Ved bruk av mange-injeksjonsbehandling og vanlig insulinpumpe
For noen kan det være aktuelt å redusere morgen- eller kveldsdosen langtidsvirkende insulin (gjelder insulintypene glargin, detemir og NPH) i forkant/etterkant av fysisk aktivitet eller trening. En reduksjon på 20 % eller mer av vanlig dose kan være nødvendig. Behovet gjelder spesielt ved aerob aktivitet med varighet mer enn én time, hvis treningen er av høy intensitet og/eller ikke gjøres regelmessig. Noen kan også trenge å innta et lite måltid med langsomt absorberbare karbohydrater og noe protein før leggetid uten å sette insulin dersom blodsukkeret ved leggetid er lavere enn rundt 7,0 mmol/L (grensen er individuell) (Riddell, Gallen et al. 2017).
Personer som bruker langtidsvirkende insulin kan ha nytte av å redusere dosen med 30–50 % på dager/i perioder med langvarig og uvanlig hard aktivitet (som en hard fottur/fjelltur, lang skitur eller løp eller hard trening over flere timer o.l.) (Adolfsson et al., 2022). Tilsvarende kan personer som bruker pumpe uten HCL-system ha nytte av å redusere basaldosen på natten med for eksempel 20 % etter hard og/eller langvarig (> 45–60 min) fysisk aktivitet utført på kveldstid.
Ved bruk av HCL
I likhet med vanlig insulinpumpe der man reduserer basaldosen, kan noen trenge å beholde midlertidig mål i noe tid etter fysisk aktivitet. De fleste vil trenge å legge inn litt færre karbohydrater (for eksempel 25 % reduksjon) til måltider enn de faktisk inntar etter fysisk aktivitet.
Fysisk aktivitet/trening på ettermiddag/kveld eller trening med høy intensitet eller lang varighet, øker sannsynligheten for nattlig hypoglykemi. For personer med sensorsystem kan det i enkelttilfeller være nyttig å heve alarmgrensen gjennom natten, for eksempel til 4,4 mmol/L (grensen er individuell) hvis nattlig hypoglykemi ikke kan unngås på andre måter (Moser et al. 2020).
Tilpasninger ved diabetes type 1 og tilleggssykdom
- Personer med hypertensjon eller kardiovaskulær sykdom bør være tilfredsstillende behandlet ved oppstart av, eller vesentlig økning i, rutinemessig fysisk aktivitet/trening.
- Personer med etablert eller høy risiko for koronarsykdom, eller som har autonom nevropati, bør få informasjon om atypiske symptomer på koronarsykdom, som unormalt tung pust eller utmattelse ved anstrengelser/trening og om å kontakte lege for en vurdering ved nye/endrede symptomer.
- Personer med kjent kardiovaskulær autonom nevropati eller proliferativ retinopati vurderes av lege før vesentlig økning i fysisk aktivitet igangsettes.
- Ved diabetes nevropati bør trykkavlastende fottøy benyttes og føttene sjekkes regelmessig for sår.
- Ved diabetisk fotsår må såret trykkavlastes totalt. Pasienten rådes til å velge ikke-vektbærende aktiviteter som for eksempel styrketrening eller sykling på ergometersykkel, forutsatt at såret totalt trykkavlastes.
Mer informasjon om fysisk aktivitet
Aktuelle tilbud
- Kurs i fysisk aktivitet ved diabetes type 1 (diabetes.no)
- Kommunale frisklivssentraler tilbyr blant annet veiledning i fysisk aktivitet, snus- og røykeslutt, sunt kosthold, gode søvnvaner og psykiske plager, samt informasjon om lokale tilbud.
Verktøy og selvhjelpsmateriell
Begrunnelse – dette er rådet basert på
Sammendrag
Forskning på den langsiktige effekten av fysisk aktivitet hos personer med diabetes type 1 er begrenset. Det antas at personer med diabetes type 1 som er regelmessig fysisk aktive kan redusere risiko for død, kardiovaskulær sykdom og kardiovaskulær død betydelig, sammenlignet med inaktive (Sluik, Buijsse et al. 2012, Wu, Bredin et al. 2019). Effekten er størst ved moderat til høyt volum aerobisk aktivitet (Sluik, Buijsse et al. 2012, Tikkanen-Dolenc, Wadén et al. 2017). Regelmessig fysisk aktivitet/trening kan også forbedre blodsukkerkontrollen, kondisjonen, bidra til vekttap og gi bedre lipidprofil (Ostman, Jewiss et al. 2018).
Forskning på barn og unge med diabetes type 1 under 12 år er særlig begrenset (Tully, Aronow et al. 2016), men antyder at fysisk aktivitet kan gi bedre helse og helserelatert livskvalitet (Anderson, Laffel et al. 2017, (Adolfsson et al., 2022). Å redusere stillesitting/skjermtid er assosiert med bedre metabolsk kontroll blant barn og ungdom med diabetes type 1 (Galler, Lindau et al. 2011). Foresattes frykt for hypoglykemi hos barna kan reduseres ved god veiledning og planlegging og ved at de er tilkoblet sensordata fra barnet (Sallis, Prochaska et al. 2000, Burckhardt, Roberts et al. 2018).
Bruk av vevsglukose-monitorering kan bidra til å oppnå et gunstig blodsukkernivå før, under og etter fysisk aktivitet, og gjøre det enklere å være i aktivitet. Å kombinere CGM med insulinpumpe i et hybrid closed-loop system (HCL) kan bidra ytterligere til å oppnå et ønsket blodsukkernivå. Det finnes få studier som har vurdert effekten av høyintensitetstrening ved bruk av HCL, og rådene er basert på noen få studier, samt erfaring (Moser et al., 2020).
Fysisk aktivitet ved diabetes type 2
Personer med diabetes type 2 anbefales å være fysisk aktive med moderat til høy intensitet minimum 150 minutter per uke, fordelt over minst tre dager og ikke mer enn to påfølgende dager uten fysisk aktivitet.
Det er et dose-respons-forhold og økt aktivitet (varighet, frekvens og intensitet) gir økt gevinst. Både styrketrening og utholdenhetstrening påvirker blodsukkeret gunstig, og kombinasjonen gir best effekt. Styrketrening anbefales 2 til 3 ganger per uke og bør komme i tillegg til minimumsdosen på 150 minutter moderat fysisk aktivitet. Lange perioder hvor man sitter stille bør stykkes opp med korte perioder med lett aktivitet, f.eks. lett gange. Det foreslås at personer med diabetes type 2 tilbys et strukturert program bestående av både utholdenhets- og styrketrening.
Praktisk – slik kan anbefalingen følges
Verktøy til bruk for kartlegging og motivasjon
Å få til varig atferdsendring kan være krevende. Det finnes verktøy som kan øke suksessraten for etterlevelse av livsstilsråd (Nilsen et al., 2015), se kapittelet Kommunikasjon, mestring og motivasjon ved diabetes.
Høy intensitetstrening
I en av metaanalysene (Umpierre et al., 2011) som dannet grunnlaget for fysisk aktivitetsanbefalingene fra 2016 ble det ikke funnet en ytterligere effekt av intensiv trening utover moderat intensitetstrening. Andre har derimot vist at økt intensitet på treningen (ca. 75 % av maksimalt oksygenopptak) er assosiert med HbA1c-reduksjon (Boule et al., 2003). Dette er en intensitet som kan beskrives som høy, men som ikke må forveksles med begrepet "høyintensitetstrening".
Høyintensitetstrening uføres som intervalltrening og intensiteten er gjerne 90 % eller høyere av maksimal hjertefrekvens. Intervallene kan variere fra 30 sekunder til 4-5 minutter. Dette er en form for trening som er tidseffektiv og som vil gi god effekt på kondisjon. En intensitet på ca. 75 % av maksimalt oksygenopptak er dog en lavere intensitet, som man kan utøve i lang tid (1-2 timer) avhengig av treningstilstand.
I en meta-analyse fra 2016 (Liubaroerjijin et al., 2016) sammenlignet man effekten på HbA1c av utholdenhetstrening på høyere (>70 % av maksimalt oksygenopptak), moderat (50-70 % VO2max) og lavere (≤40 % VO2max) intensitet blant personer med diabetes type 2: Fysisk aktivitet på høyere intensitet gav større reduksjon på HbA1c enn aktiviteter på moderat og lavere intensitet (gjennomsnittlig differanse -0,22 %). Det var uklart hvorvidt fordelene med trening på høyere intensitet var begrenset til studier som benyttet høyintensitetstrening med intervall, eller også sammenhengende aktivitet på høy intensitet.
Enkelte studier med personer med diabetes type 2 har også vist at «Høyintensitetstrening» gir større effekt på kardiorespiratorisk form (Weston et al., 2014; Jelleyman et al., 2015) og bedrer glykemisk kontroll, sammenlignet med aktivitet/trening på sammenhengende moderat intensitet (Jelleyman et al., 2015, Francois og Little 2015).
Glykemisk kontroll forbedres jo høyere volum (varighet, frekvens og intensitet) av fysisk aktivitet/trening som utføres (aerob eller kombinert aerob og styrketrening). Det synes likevel som om det er frekvensen av treningsøktene (antall ganger per uke) som er viktigst (Umpierre et al., 2013).
Individualisering
I all diabetesbehandling er det viktig med individuell tilpasning, dette er uavhengig av kjønn, kultur, religion og tradisjon. Hva som kan forventes av effekt av fysisk aktivitetstiltak er også individuelt. Det er vist i flere studier at effekten på metabolsk kontroll er større når HbA1c før intervensjon er over 53 mmol/mol (7 %) sammenlignet med verdier på 53 mmol/mol (7 %) eller lavere (Umpierre et al., 2013).
Faggruppen anbefaler at det er fagpersoner med utdanning inne fysisk aktivitet og helse, eller tilsvarende utdanning med fokus på fysisk aktivitet, fysisk trening og treningslære (bachelor grad eller høyere), som er ansvarlig for veiledning og tilretteleggingen av ulike fysisk aktivitetstiltak for målgruppen.
Praktiske råd
- Kartlegg pasientens aktivitetsnivå (hverdagsaktiviteter og fritidsaktiviteter) og motivasjon til fysisk aktivitet (aktivitetsanamnese)
- Kartlegg hva pasienten liker å gjøre, eventuelt har gjort tidligere og har positive erfaringer med (aktivitetsanamnese) og ta utgangspunkt i dette, benytt kommunikasjonsmetoder som motiverer til mer av det som er bra
- Diskuter med pasienten hvilke eller foreslå aktiviteter som er realistiske og gjennomførbare og som pasienten liker eller ønsker å prøve
- Sammen med pasienten bør fastlege, annet helsepersonell sette realistiske delmål, identifisere hindringer, kartlegge mulighetene for å unngå disse, lage en konkret aktivitetsplan og gjennomføre regelmessige oppfølginger (se eget kapittel om mestring og motivasjon for hvilke spørsmål som kan stilles)
Følg opp - oppfølgingene kan gjøres per telefon eller på legekontoret (disse kan gjøres av andre enn fastlegen om dette er avtalt på forhånd), oppfølgingen kan tidsmessig deles i tre faser:
- hvordan fysisk aktivitet har vært planlagt og gjennomført i løpet av uken som var
- hvordan overgangen til et nytt nivå av fysisk aktivitet har fungert de siste f. eks. 6-12 uker, og
- om pasienten har nådd det langsiktige og overordnede mål
Ved overvekt/fedme og for den som er utrent kan ikke-vektbærende aktiviteter, for eksempel sykling (innendørs/utendørs/el-sykkel), bruk av romaskin, svømming, vanngymnastikk/trening og/eller styrketrening oppleves bedre/gi bedre mestringsopplevelse enn vektbærende aktiviteter eller aktiviteter som krever stor grad av koordinasjon. For personer som i utgangspunktet ikke er fysisk aktive; Start med 5-15 minutter aktivitet på en intensitet som oppleves komfortabel, og øk belastning (varighet, intensitet og frekvens) gradvis. Møt pasienten der han/hun er når det gjelder fysisk aktivitet.
En individuell vurdering og hjelp til å finne passende aktivitet(er) kan bidra til økt fysisk aktivitet (Basert på tidligere brosjyre fra Statens råd for ernæring og fysisk aktivitet, 2000:
- «Rører du på deg?):«Nei, jeg er ikke fysisk aktiv, og har ingen planer om å bli det de neste månedene.»: Det kan være mange hindringer for å være fysisk aktiv. Kartlegg pasientens grunner til å være fysisk inaktiv og hindringer for fysisk aktivitet. Er det flere fordeler enn ulemper? Å avbryte stillesittende aktivitet med 3 minutter lett aktivitet 2 ganger i timen er bra!
- «Vel… Jeg er ikke fysisk aktiv, men tenker å bli det i løpet av de neste månedene.»: Vær fysisk aktiv i hverdagen, velg aktive alternativer som å ta trappen, gå til/fra. Hva liker og hva er lett for pasienten å gjøre? Liker pasienten å være aktiv sammen med andre eller alene? Er pasienten interessert i å registrere egenaktivitet (se punkt under)?
- «Av og til. For tiden er jeg noe fysisk aktiv, men det er ikke regelmessig.»: Samtal med pasienten om hvordan han/hun kan få fysisk aktivitet til å bli en del av hverdagen. Hjelp pasienten med å sette mål som er realistiske og gjennomførbare. Følg opp på dette!
- «Ja. Jeg er regelmessig fysisk aktiv, og det er først i løpet av de siste måneder jeg har begynt med det.» Støtt opp og vis interesse om pasientens aktivitetsvaner. Registrering av aktivitet og aktiviteter sammen med andre kan bidra til at pasienten opprettholder motivasjonen.
- Javisst! Jeg er fysisk aktiv og har vært det i flere måneder (lengre enn de siste 6 månedene.» Det er fremdeles viktig med oppfølging og at pasienten setter seg mål. Kanskje ønsker pasienten å justere tidligere mål. Variasjon i aktivitetsform og/eller hvor mye man tar i på øktene kan bidra til å holde motivasjonen oppe.
- Bruk av hjelpemidler som f.eks. skritteller/pedometer, mobilapper, annet som registrerer fysisk aktivitet, fysisk aktivitetsdagbok (papir/elektronisk) i kombinasjon med registrering av blodsukker før, etter og timer etter aktivitet kan virke inspirerende og motiverende for enkelte.
- Effekter av tiltak på fysisk aktivitet kan evalueres ved gangtester/ kondisjonstester, styrketester (kan gjøres i regi av f.eks. Frisklivssentraler), HbA1c og/eller subjektive/objektive effekter som er viktige for pasienten.
- Lag deg en oversikt over lavterskeltilbud og andre tilbud som tilbys i din kommune. Eksempler på tilbydere kan være frisklivssentralene, frivilligsentralene, likepersonsgrupper (f.eks. Diabetesforbundets motivasjonsgrupper, Tjukkasgjengen), lokale idrettslag, LHL, Den Norske Turistforening, private aktører.
Diabetesforbundet har god informasjon om fysisk aktivitet og forslag til øvelser på sine nettsider og en egen styrketreningsapp. Diabetesforbundets motivasjonsgrupper er likepersonsgrupper som har fokus på fysisk aktivitet, kosthold og motivasjon. Se diabetes.no for informasjon om hvor og når disse gruppene møtes.
Forsiktighetsregler
Intensitet
Ved etablert hjertesykdom, mistanke om angina pectoris, eller ved ønske om å trene med høy intensitet (intensitet som oppleves som svært anstrengende) bør man vurdere hjerteundersøkelse, inkludert et arbeids-EKG. Personer med diabetes har økt forekomst av autonom nevropati og stum iskemi. Mulighetene for dette bør vurderes før man anbefaler trening med høy intensitet.
Retinopati (øyenbunnsforandringer): Ved proliferativ diabetesretinopati eller ved alvorlig ikke-proliferativ diabetesretinopati kan svært anstrengende kondisjon- og styrketrening være kontraindusert med tanke på økt risiko for blødninger i øyets glasslegeme eller netthinneavløsning (Fyss, 2015).
Lavt blodsukker: Fysisk aktivitet bedrer insulinfølsomheten. Denne kan vedvare i mange timer – opptil to døgn - avhengig av volumet (kombinasjon av varighet og intensitet) på aktiviteten. Hos personer med diabetes type 2 som behandles med blodsukkersenkende legemidler (insulin eller insulinstimulerende legemidler) kan det derfor være nødvendig å redusere legemiddeldosen og/eller tilføre raskt absorberbare karbohydrater før, under og/eller etter fysisk aktivitet for å unngå lavt blodsukker. Reduksjon i eventuell basalinsulindoser og/eller måltidsinsulindoser kan være 20-30 %. Det vil være individuelle forskjeller i dette.
Høyt blodsukker
En tilfeldig høy glukoseverdi er ikke en kontraindikasjon for fysisk aktivitet, med mindre samtidig forhøyet ketonnivå. Trening bør utsettes ved betydelig forhøyede plasmaglukosenivå (> 15 mmol / l), dette for å sikre intracellulær energi (Fyss, 2015).
Personer med perifer nevropati bør sjekke sine føtter daglig og være spesielt oppmerksomme på dager de er fysisk aktive. Gode sko anbefales.
Stølhet (DOMS)
Det er kjent at når man begynner et treningsprogram vil mange oppleve å bli støle. Dette gjelder særlig ved styrketrening, uvante aktiviteter og høy intensitet. Stølhet eller DOMS (delayed onset muscle soreness) er en treg reaksjon som kommer til uttrykk gjerne 24 timer etter aktiviteten. DOMS er en naturlig reaksjon, og den vil forsvinne når man er vant med regelmessig fysisk aktivitet/trening. Imidlertid vil noen – avhengig av mengden av fysisk aktivitet – oppleve lette muskel-skjelettplager. Se detaljer om Fysisk aktivitet og diabetes type 2 i Aktivitetshåndboken.
Etniske minoriteter
Studier fra Norge viser at fysisk aktivitet i ulike innvandrergrupper, øker insulinfølsomheten og bedrer blodsukkerreguleringen (Andersen, 2012). Svært rolig gange etter et karbohydratrikt måltid senker blodsukkeret gunstig (Lunde et al., 2012).
Det er viktig å tilrettelegge for, og ta hensyn til religion, tradisjon og kultur, kjønn og alder. Hver for seg og samlet vil ovenfor nevnte faktorer kunne påvirke evnen og muligheten til å delta i og gjennomføre fysisk aktivitet. Kulturell tilrettelegging, kommunikasjon og oppfølging øker sjansen for at ikke- vestlige innvandrere følger opp og mestrer sin diabetes (Sohal et al., 2015). Dette er også vist i en norsk studie (Hjellset et al., 2013).
I noen innvandrergrupper er det periodisk faste knyttet til religion. Det er ulik aksept i ulike kulturer for deltagelse i fysisk aktivitet og idrettslige aktiviteter. Fysisk aktivitet vil i noen kulturer utelukkende være knyttet til arbeid, noe som kan bety at det å være fysisk aktiv knyttet til helse er fremmed og ukjent. Mange kvinner kan foretrekke å være fysisk aktive utelukkende med andre kvinner. Det er derfor viktig å legge til rette for fysisk aktivitet for kjønn adskilt. Kvinner og menn vil ofte være fysisk aktive på ulike arenaer.
En kulturelt tilpasset livsstilsintervensjon (kost, fysisk aktivitet og atferdsendring) som tok sikte på å forebygge diabetes type 2, har også vist seg å ha gunstig effekt på psykisk helse i en svensk studie blant innvandrere fra Irak. Effekten var større ved 4 måneder enn ved 2 måneder (Siddiqui et al., 2019).
Begrunnelse – dette er anbefalingen basert på
Råd om fysisk aktivitet viste en signifikant større reduksjon i HbA1c på - 0.43% sammenlignet med ingen råd om fysisk aktivitet, men kun når dette ble gitt kombinert med kostråd (Umpierre et al., 2011). Meta-analysen (Umpierre et al., 2011) viste at strukturert trening har en effekt på HbA1c (-0.67 %) sammenlignet med ingen intervensjon eller kun råd om sunn livsstil/kostråd. Analysene viste også at strukturert trening på mer enn 150 minutter per uke er assosiert med bedre effekt på HbA1c (-0.89%) enn strukturert trening mindre enn 150 minutter (-0.36%). Det er med andre ord et dose-respons-forhold.
Av de 24 studiene (7025 deltakere) som er inkludert i analysen hvor strukturert trening er behandlet, er det ingen som viser en negativ effekt og presisjonen for estimatet er god.
Det er vist at treningsintensitet er assosiert med HbA1 reduksjon (Boule et al., 2003). I en nyere metaanalyse fant man at trening med høy intensitet hadde en ytterligere effekt på HbA1c sammenlignet med sammenhengende moderat fysisk aktivitet (Liubaoerjijin et al., 2016).
Med hensyn til hvilken type trening som har best effekt på de endepunktene av interesse, ble det funnet at (Schwingshackl et al., 2014):
- Utholdenhetstrening har en ytterligere reduserende effekt på HbA1c og fastende glukose sammenlignet med styrketrening. For øvrig var det ingen forskjeller med hensyn til lipider og blodtrykk.
- Kombinasjonstreningen viste en litt bedre effekt på HbA1c, men ingen på fastende glukose, lipider og blodtrykk sammenlignet med utholdenhetstrening alene.
- Kombinasjonstrening resulterte i en HbA1C reduksjon på -0.62% (p=0.0002) sammenlignet med styrketrening alene. I tillegg viste analysene en bedre effekt på fastende glukose, triglyserider og systolisk blodtrykk.
En nyere oversiktsartikkel og meta-analyse (Pan et al., 2018) hvor 37 studier med 2208 pasienter med diabetes type 2 ble inkludert bekrefter funnene fra Umpierre et al., (2011) og Schwingshackl (2014): Veiledet aerob trening og styrketrening ga større effekt på HbA1c enn ingen trening og ikke-veiledet aerob- og styrketrening. Kombinert trening (aerob- og styrketrening) ga bedre effekt enn hver av treningsmodalitetene alene både når det gjaldt Hba1c og enkelte kardiovaskulære risikofaktorer som blodtrykk og blodlipider.
Som beskrevet ovenfor har styrketrening en gunstig effekt på glykemisk kontroll (målt ved HbA1c). Det optimale styrketeningsprogrammet hva gjelder frekvens, intensitet, type og volum er imidlertid ikke kjent (Ishiguro et al., 2016). Den største effekten av styrketrening på HbA1c er sett i studier hvor personer med diabetes type 2 har gjennomført 3 eller flere økter per uke (Castenada et al., 2002; Dunstan et al., 2002; Durak et al., 1990; Cauza et al., 2005). Imidlertid er det oppnådd signifikant reduksjon i HbA1c med styrketrening 2 ganger i uken i kombinasjon med regelmessig aerob trening (Balducci et al., 2010; Church et al., 2010; Schwingshackl et al., 2014). Effektene av styrketrening og aerob trening på glykemisk kontroll er additive (Sohal et al., 2007).
Fysisk aktivitet/trening, både som en akutt treningsøkt og regelmessig fysisk aktivitet/trening kan modifisere insulineffekten i muskulatur og lever (Roberts et al., 2013). Aerob trening vil kunne øke muskelglukoseopptaket opptil fem ganger, og etter en treningsøkt vil glukoseopptaket i muskelen forbli forhøyet gjennom både insulinuavhengige (~2 timer) og insulinavhengige (opptil 48 timer) mekanismer (Magkos et al., 2008). Denne effekten er knyttet til refylling av glykogen i muskulaturen (Wang et al., 2013; Wojataszewski et al., 2002). Økt insulineffekt kan vare i ca. 24 timer etter aktiviteter med kortere varighet (ca. 20 min) og høy intensitet. Dette er bakgrunnen for at det anbefales at det ikke bør gå mer enn to dager mellom treningsøktene.
Det ble ikke funnet meta-analyser av randomiserte kontrollerte studier som viser effekt på de andre endepunktene av interesse. Det er likevel grunn til å tro at de som har diabetes har like god, om ikke bedre effekt av fysisk aktivitet, enn den øvrige befolkningen. Det er vist i flere store kohortstudier (15-20 års oppfølgning) at regelmessig fysisk aktivitet eller god fysisk form (kondisjon) er assosiert med 39-70 % reduksjon i kardiovaskulær og total dødelighet hos personer med diabetes type 2 (og diabetes type 1) (Gregg et al., 2003; Hu et al., 2005; Church et al 2005). Utholdenhetstrening kan dessuten bedre kondisjonen (Nielsen et al., 2006) og bremse utviklingen av perifer nevropati (Balducci et al., 2006).
I tillegg til å oppnå aktivitetsmålet på minimum 150 minutter per uke med moderat til hard fysisk aktivitet, bør personer med diabetes minimere tiden brukt til stillesittende aktiviteter (Glenn et al., 2015). Ved å bryte langvarig stillesittende tid med kortere perioder (3 minutter) lett gange eller lett styrketrening har man sett gunstig effekt på glykemisk kontroll og blodtrykkskontroll hos personer med diabetes type 2 (Dempsey et al., 2016).
Forskningsgrunnlag
Populasjon (P): Personer med type 2 diabetes
Tiltak (I): Utholdenhetstrening, styrketrening eller kombinasjon av både utholdenhets- og styrketrening
Sammenligning (C): 1. Utholdenhetstrening vs styrketrening 2.Kombinasjonstrening vs utholdenhetstrening 3.Kombinasjonstrening vs styrketrening
Beskrivelse av inkluderte studier
Flere RCT (Sigal et al., 2013; Church et al., 2005) har vist at både styrketrening og utholdenhetstrening kan ha en effekt på glykemisk kontroll. I en meta-analyse er det estimert at strukturert trening som både inkluderer utholdenhetstrening, styrketrening eller kombinasjonen av disse, kan redusere HbA1C nivået med 0,67% (Umpierre et al., 2011). Schwingshackl et al., (2014) meta-analyse vurderer den enkeltvise effekten av de ulike aktivitetsformene/modalitetene – utholdenhetstrening, styrketrening eller kombinasjonen av disse – på glykemisk kontroll og blodlipider hos personer med type 2-diabetes.
1. Meta-analysen (Schwingshackl et al., 2014) viste at utholdenhetstrening har en bedre effekt på HbA1c (-0.20%, p= 0.0007), og fastende glukose (-0.90 mmol/l, p=0.03) sammenlignet med styrketrening. For øvrig var det ingen forskjeller med hensyn til lipider og blodtrykk.
2. Kombinasjonstreningen (Kondisjons- + styrketrening) viste en bedre effekt på HbA1c (-0,17%), men det var ingen forskjell i effekt på fastende glukose, lipider og blodtrykk sammenlignet med utholdenhetstrening alene.
3. Kombinasjonstrening viste en bedre effekt på HbA1c (-0,62%, p=0,0002) sammenlignet med styrketrening alene. I tillegg viste analysene en signifikant bedre effekt på fastende glukose (-1,99 mol/l), triglyserider (-0,28 mmol/l) og systolisk blodtrykk (-4,4 mmHg).
Vurdering
Fordeler og ulemper
I studiene som er undersøkt, reduserer fysisk aktivitet HbA1c med - 0.67% (95% CI: - 0.84, - 0.49) (Umpierre et al., 2011).
Det er nødvendig å bruke surrogat endepunkt (HbA1c) og samtidig anta at de gunstige endringene gir langtidseffekter på kliniske endepunkt, siden det er svært krevende og kostbart å gjennomføre randomiserte kontrollerte studier som kan gi oss svar på hvorvidt fysisk aktivitet alene kan redusere dødelighet og sykelighet. Dette er selvsagt en svakhet, men for å sette effekten av fysisk aktivitet i en sammenheng: Metformin reduserer HbA1c med 1.12% (Hirst et al 2013). Data fra United Kingdom Prosepctive Diabetes Study viser at 1% økning i HbA1c medfører 21% økt risiko for diabetesrelaterte endepunkt.
Det er også vist i flere store kohortstudier (15-20 års oppfølgning) at regelmessig fysisk aktivitet eller god fysisk form (kondisjon) er assosiert med 39-70% reduksjon i kardiovaskulær og total dødelighet hos personer med DT2 (og DT1) (Gregg et al., 2003; Hu et al., 2005; Church et al., 2005). Utholdenhetstrening kan bedre kondisjonen (Nielsen et al., 2006) og bremse utviklingen av perifer nevropati (Balducci et al., 2006).
Samtidig er det få, om noen negative effekter av å drive fysisk aktivitet, så lenge man forholder seg til forsiktighetsregler nevnt under «Praktisk».
Kvalitet på dokumentasjonen
Kvaliteten på meta-analysen om rådgivning av fysisk aktivitet (Umpierre et al., 2011) er vurdert til moderat fordi intervensjonene er beheftet med manglende data på oppfølgning av fysisk aktivitet. Altså – hvor mye aktivitet utførte deltakerne egentlig? En god monitorering av aktivitetsnivået ville gitt betydelig bedre innsikt. Monitorering av strukturert trening er en lettere oppgave og dette estimatet er det stor tiltro til. Forhold som skaper heterogenitet kan delvis forklares ved baseline HbA1c, varighet og hyppighet på treningen, samt den totale ukentlige treningsmengden.
Kvaliteten på studiene som danner grunnlag for vurdering av de ulike modaliteter av fysisk aktivitet opp mot hverandre (Schwingshackl et al., 2014), er vurdert til moderat for effekt på HbA1c, mens estimatene for fastende blodsukker, lipider og blodtrykk er vurdert fra moderat til lav - blant annet på grunn av liten informasjonsstørrelse og vide konfidensintervaller.
Verdier og preferanser
Fysisk aktivitet er en viktig del av behandlingen. Å utøve fysisk aktivitet regelmessig som anbefalt er likevel en av de største utfordringene for mange. Pasienten må prioritere tid til å drive fysisk aktivitet. Manglende evne/lyst til å følge opp anbefalt aktivitet ev. strukturert trening, kan ha negativ effekt på livskvalitet og mestringsopplevelse. Det er derfor viktig at pasienten velger en aktivitetsform de liker; styrke-, utholdenhetsaktiviteter eller kombinasjoner av disse.
Referanser
85. Education and individualized support regarding exercise and diabetes improves glucose control and level of physical activity in type 1 diabetes individuals https://www.helsedirektoratet.no/referanse/0002-0013-232073
95. http://fyss.se/wp-content/uploads/2015/02/FYSS-kap
207. Relationship of walking to mortality among US adults with diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232195
208. Physical activity, cardiovascular risk factors, and mortality among Finnish adults with diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232196
209. Cardiorespiratory fitness and body mass index as predictors of cardiovascular disease mortality among men with diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232197
210. Meta-analysis of the effect of exercise interventions on fitness outcomes among adults with type 1 and type 2 diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232198
211. Education and individualized support regarding exercise and diabetes improves glucose control and level of physical activity in type 1 diabetes individuals https://www.helsedirektoratet.no/referanse/0002-0013-232199
212. Physical activity and diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232200
213. Physical activity advice only or structured exercise training and association with HbA1c levels in type 2 diabetes: a systematic review and meta-analysis. https://www.helsedirektoratet.no/referanse/0002-0013-232201
214. Quantifying the effect of metformin treatment and dose on glycemic control. https://www.helsedirektoratet.no/referanse/0002-0013-232202
215. Exercise training can modify the natural history of diabetic peripheral neuropathy. https://www.helsedirektoratet.no/referanse/0002-0013-232203
216. Impact of different training modalities on glycaemic control and blood lipids in patients with type 2 diabetes: a systematic review and network meta-analysis. https://www.helsedirektoratet.no/referanse/0002-0013-232204
217. Meta-analysis of the effect of structured exercise training on cardiorespiratory fitness in Type 2 diabetes mellitus. https://www.helsedirektoratet.no/referanse/0002-0013-232205
218. Volume of supervised exercise training impacts glycaemic control in patients with type 2 diabetes: a systematic review with meta-regression analysis. https://www.helsedirektoratet.no/referanse/0002-0013-232206
219. Effect of a physical activity intervention on the metabolic syndrome in Pakistani immigrant men: a randomized controlled trial. https://www.helsedirektoratet.no/referanse/0002-0013-232207
220. Slow post meal walking reduces the blood glucose response: an exploratory study in female Pakistani immigrants. https://www.helsedirektoratet.no/referanse/0002-0013-232208
221. Effects of a randomized, culturally adapted, lifestyle intervention on mental health among Middle-Eastern immigrants. https://www.helsedirektoratet.no/referanse/0002-0013-232209
222. Barriers and Facilitators for Type-2 Diabetes Management in South Asians: A Systematic Review. https://www.helsedirektoratet.no/referanse/0002-0013-232210
234. Effect of aerobic exercise intensity on glycemic control in type 2 diabetes: a meta-analysis of head-to-head randomized trials. https://www.helsedirektoratet.no/referanse/0002-0013-232222
235. The effects of high-intensity interval training on glucose regulation and insulin resistance: a meta-analysis. https://www.helsedirektoratet.no/referanse/0002-0013-232223
236. Effectiveness and safety of high-intensity interval training in patients with type 2 diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232224
237. Exercise training modalities in patients with type 2 diabetes mellitus: a systematic review and network meta-analysis. https://www.helsedirektoratet.no/referanse/0002-0013-232225
238. In Search of the Ideal Resistance Training Program to Improve Glycemic Control and its Indication for Patients with Type 2 Diabetes Mellitus: A Systematic Review and Meta-Analysis. https://www.helsedirektoratet.no/referanse/0002-0013-232226
239. A randomized controlled trial of resistance exercise training to improve glycemic control in older adults with type 2 diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232227
240. High-intensity resistance training improves glycemic control in older patients with type 2 diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232228
241. Physical and glycemic responses of women with gestational diabetes to a moderately intense exercise program. https://www.helsedirektoratet.no/referanse/0002-0013-232229
242. The InnvaDiab-DE-PLAN study: a randomised controlled trial with a culturally adapted education programme improved the risk profile for type 2 diabetes in Pakistani immigrant women. https://www.helsedirektoratet.no/referanse/0002-0013-232230
245. High-intensity interval training in patients with lifestyle-induced cardiometabolic disease: a systematic review and meta-analysis. https://www.helsedirektoratet.no/referanse/0002-0013-232233
246. The effect of low-volume, high-intensity interval training on blood glucose markers, anthropometric measurements, and cardiorespiratory fitness in patients with type 2 diabetes https://www.researchgate.net/publication/282206082_The_Effect_of_Low-Volume_High-Intensity_Interval_Training_on_Blood_Glucose_Markers_Anthropometric_Measurements_and_Cardiorespiratory_Fitness_in_Patients_with_Type_II_Diabet
247. Benefits for Type 2 Diabetes of Interrupting Prolonged Sitting With Brief Bouts of Light Walking or Simple Resistance Activities. https://www.helsedirektoratet.no/referanse/0002-0013-232235
248. Continuous glucose monitoring in diabetic long distance runners. https://www.helsedirektoratet.no/referanse/0002-0013-232236
250. Metabolic syndrome and insulin resistance: underlying causes and modification by exercise training. https://www.helsedirektoratet.no/referanse/0002-0013-232238
251. Improved insulin sensitivity after a single bout of exercise is curvilinearly related to exercise energy expenditure. https://www.helsedirektoratet.no/referanse/0002-0013-232239
252. Invited review: effect of acute exercise on insulin signaling and action in humans. https://www.helsedirektoratet.no/referanse/0002-0013-232240
253. A ~60-min brisk walk increases insulin-stimulated glucose disposal but has no effect on hepatic and adipose tissue insulin sensitivity in older women. https://www.helsedirektoratet.no/referanse/0002-0013-232241
Sist faglig oppdatert: 20.12.2019
Kosthold og kostsammensetning ved alle former for diabetes
Det anbefales at personer med diabetes har en kost i tråd med Helsedirektoratets kostråd, men matvarer med mye stivelse og sukker påvirker blodsukkeret, og derfor bør inntaket av slike matvarer tilpasses den enkelte. Ved bruk av måltidsinsulin tilpasses dosen inntaket. Kosten kjennetegnes av:
- rikelig med grønnsaker
- daglig inntak av bær og frukt
- rikelig med belgvekster (bønner, erter og linser)
- fullkornsprodukter med mye fiber, hele korn og kjerner
- fisk/sjømat og fugl i større grad enn rødt kjøtt, og rene råvare framfor farseprodukter
- magre meieriprodukter
- matoljer (som olivenolje og rapsolje), og myke/flytende margariner (med mye umettet fett), nøtter og kjerner som fettkilder
- begrenset inntak av alle typer tilsatt/fritt sukker, inkludert fruktose. Energifrie søtstoffer kan erstatte sukker.
- begrenset mengde salt
Ved diabetes type 2 dokumentasjonen lav–moderat for å anbefale kostmønstrene under. Alle kostmønstrene er også forenelig med kostrådene ovenfor:
- tradisjonell middelhavskost
- moderat karbohydratredusert kost
- kost med lav glykemisk indeks
- vegetarisk kosthold
Praktisk – slik kan anbefalingen følges
Beskrivelsen av norske kostråd tilpasset personer med diabetes
Kostrådene som er beskrevet i anbefalingen er generelle og kan tilpasses ulike individuelle behov og preferanser hos den enkelte som har diabetes. Kostrådene kan følges uavhengig av matkultur. Ved ønske om vektreduksjon vil man også kunne bruke de samme kostråd og kostmønster, men redusere det totale energiinntaket (se egen anbefaling for vektreduksjon ved diabetes type 2)
Se eksempler på hvilke matvarer og mengder som kan brukes for følge rådene:
Nasjonale matvarebaserte kostråd er først og fremst rettet mot friske voksne, men kostrådene kan også brukes av andre, eventuelt med noen tilpasninger. Anbefalingene er primært laget på grunnlag av rapporten «Kostråd for å fremme folkehelsen og forebygge kroniske sykdommer», utgitt av Nasjonalt råd for ernæring i 2011 og «Nordic Nutrition Recommendations 2012» utgitt av Nordisk ministerråd i 2014 (NNR 2012).
- De norske kostrådene samsvarer i stor grad med punktrekken i anbefalingen over, men følgende tilpasninger er gjort:
- Ved diabetes vil det være ekstra viktig å unngå mat og drikke med mye sukker.
- I de norske kostrådene anbefales 2-3 frukt/bær daglig og det kan være vanskelig forenelig med god blodsukkerregulering hos enkelte personer med diabetes, siden frukt og bær inneholder ca 10% sukker. Måltidets innhold av sukker og stivelse må tas med når den som har diabetes vurderer hvor mye som er passende menge i et måltid, ev. må dosen måltidsinsulin tilpasses inntaket.
- For den som har diabetes er det dessuten ekstra gunstig å øke inntaket av belgvekster og nøtter (se informasjon om dette under fanen «begrunnelse» lenger ned på siden).
- I de norske kostrådene anbefales det også at grove kornprodukter til sammen bør gi 70-90 gram sammalt mel eller fullkorn per dag. Den som har diabetes må ta hensyn til den totale karbohydratmengden i måltidet når han/hun skal følge dette rådet, da sammalt mel og fullkorn også vil gi økning i blodsukkeret.
Anbefalte kostmønstre
Kostrådene i anbefalingen er forenelig med alle kostmønstrene som er anbefalt, men de tre kostmønstrene vektlegger ulike sider ved kostholdet og andelen av de enkelte matvaregruppene kan være forskjellig. Under defineres de fire kostmønstrene og hva som kjennetegner dem.
I tillegg til de anbefalte kostmønstrene ble også helseeffekten av en sunn nordisk kost («healthy Nordic diet») undersøkt, men det er ikke gjort studier på dette blant personer med diabetes. Det er likevel god grunn til å tro at en sunn nordisk kost vil være helsemessig gunstig for personer med diabetes. Dette med bakgrunn i at man har sett positive effekter på kardiometabolske risikofaktorer og vekt i andre populasjoner. En sunn nordisk kost kjennetegnes dessuten av matvarer som har vist gunstige helseeffekter hos personer med diabetes som bær, grønnsaker (f.eks. kål og rotgrønnsaker), belgfrukter, fisk og annen sjømat, helkornprodukter av havre, rug og bygg, magert viltkjøtt og rapsolje. Videre vil dette også være et mer bærekraftig kosthold da det i større grad vil bestå av lokalt fremstilt mat.
Tradisjonell middelhavskost
Begrepet «middelhavskost» brukes for å beskrive en samling av matvaner tradisjonelt fulgt av folk i ulike regioner i middelhavsområdet. Kosten er preget av et høyt forbruk av grønnsaker, enumettede fettsyrer (primært fra olivenolje), nøtter og frø, frukt, korn og belgvekster, et lavt forbruk av rødt eller bearbeidet kjøtt og søtsaker, et moderat forbruk av fisk, sjømat, fjærkre, meieriprodukter og egg (Trichopoulou et al., 1997) og vin som drikke til måltider (Sofi et al., 2009). Det er viktig å merke seg at dette kostmønsteret ikke nødvendigvis følges av befolkningen i middelhavsområdet i dag, men innvandrergrupper fra middelhavslandene og midtøsten vil kunne dra nytte av større kjennskap til bruk av råvarer som inngår i middelhavskostholdet.
Mer praktisk informasjon og oppskrifter finner du blant annet hos Diabetesforbundet og organisasjonen Oldways.
Moderat karbohydratredusert kost
Et karbohydratredusert kosthold kjennetegnes ved restriksjon eller eliminasjon av karbohydratrike matvarer slik som: søtsaker, kjeks, kaker og andre matvarer med tilsatt sukker, brus og juice, stivelsesholdige snacksprodukter som potetgull, søte meieriprodukter, søtt pålegg, brød, knekkebrød, potet, ris og pasta, frukt og stivelsesrike grønnsaker. Restriksjon i karbohydratinntak vil medføre en økning i andel av energi fra protein- og/ eller fett, men ikke nødvendigvis til en økning i den absolutte mengden proteiner og fett. I noen tilfeller vil det imidlertid medføre økt inntak av proteiner og/eller fett. I slike tilfeller er det viktig å være bevisst på det totale energiinntaket. Det er uansett viktig at personer som ønsker å redusere karbohydratinnholdet i kosten får veiledning mht til fettkvalitet (spesielt mer -umettet fett og mindre mettet fett) og at de karbohydratholdige matvarene de velger, bidrar til et tilstrekkelig inntak av fiber, vitaminer og mineraler. Det er per i dag ingen faglig konsensus om hvilken grense som definerer en karbohydratredusert kost, men følgende inndeling kan være veiledende (Wheeler ML/ADA, 2012):
- Moderat karbohydratredusert kost: 30 - 40 % av det totale energiinntaket
- Veldig karbohydratredusert kost: 21 til 70 g/d fra karbohydrater
Tabell hentet fra Nutrition Therapy for Adults With Diabetes or Prediabetes: A Consensus Report av Evert AB et al (2019).
Det presiseres at de som ønsker å følge dette kostmønsteret anbefales en moderat karbohydratredusert kost og ikke en veldig karbohydratredusert kost.
Kost med lav glykemisk indeks
Glykemisk indeks (GI) er en måte å inndele karbohydratrike matvarer etter hvilken effekt de har på blodsukkeret. En GI på 0 betyr ingen effekt, mens 100 i GI vil si at matvaren har samme blodsukkerøkende effekt som glukose. Man finner matvarens GI ved å gi en mengde av en matvare (tilsvarende et karbohydratinntak på 50 g) til en gruppe testpersoner. Deretter måler man blodsukkeret med jevne mellomrom i 2 timer. Blodsukkerendringene fra testmatvaren sammenlignes med den blodsukkerstigningen samme testperson får ved å spise 50 g ren glukose. Areal under blodsukkerkurven (AUC) beregnes geometrisk og GI-verdien til en matvare er AUC for testmatvaren/AUC for glukose x 100 (Foster-Powell K, 2002).
Kost med lav GI blir satt sammen med matvarer som i hovedsak har GI-verdi under 55. Det er ikke det samme som en karbohydratredusert kost, der det legges vekt på å redusere MENGDEN karbohydrat. Kost med lav glykemisk indeks kan ha et høyt karbohydratinnhold, men KVALITETEN på karbohydratkildene er det viktige. Typisk vil en kost med lav GI kunne inneholde karbohydratrike matvarer som belgvekster, hele korn/sammalt mel, grove brød- og kornprodukter, fullkornspasta/-ris og det legges også vekt på matvarer og matretter som er minst mulig bearbeidet (f.eks. kornblandinger av hele valsede korn og nøtter framfor cornflakes og lignende frokostblandinger, rå grønnsaker framfor kokte etc.).
Glykemisk belastning (GB) er også en indeks som rangerer karbohydratholdige matvarer etter hvordan de påvirker blodsukkeret, men i utregning av GB tar man også hensyn til mengden matvare spist. Man tar GI-verdien og multipliserer med mengden karbohydrat.
glykemisk belastning (GB) = mengde karbohydrat (KH) i en serveringsporsjon x GI av matvaren
Mer praktisk informasjon og oppskrifter finner du blant annet hos Diabetesforbundet og den kanadiske diabetesforeningen.
Vegetarisk kosthold
Et vegetarisk kosthold betyr at hovedandelen av næringsstoffer, både karbohydrater, fett og protein, samt vitaminer og mineraler skal komme fra planteriket. Vegetarisk kost består av alle typer grønnsaker, fullkorn (havregryn, brød, pasta og ris), belgfrukter (bønner, linser, erter og soyaprodukter), frukt og en liten mengde sunne fettkilder som nøtter, frø, kjerner og flytende planteoljer. Et vegetarisk kosthold inkluderer som oftest også egg og meieriprodukter, mens et vegansk kosthold ikke vil inkludere noen matvarer med animalsk opprinnelse.
Mer praktisk informasjon og oppskrifter finner man blant annet på nettsidene til HePla, Helsepersonell for plantebasert kosthold og organisasjonen Oldways.
Frukt og bær
Et daglig inntak av to til tre porsjoner frukt og bær inngår i de generelle norske kostanbefalingene og i middelhavskostholdet. De fleste som har diabetes vil fint kunne spise en fruktporsjon tilsvarende en håndfull (et lite eple e.l.) om gangen og noen kan spise mer uten at blodsukkeret stiger for mye. For enkelte vil likevel en håndfull frukt kunne medføre stor økning i blodsukkeret. Bær inneholder mindre sukker enn frukt, mens enkelte typer frukt (som for eksempel banan, druer og mango) har et høyere innhold av sukker. Rene fruktjuicer og fruktbaserte smoothier vil imidlertid gi rask blodsukkerøkning og bør unngås eller begrenses ved diabetes.
Rotvekster og belgvekster
Rotvekster (gulrot, kålrot osv) og belgvekster (bønner, linser, erter) inneholder mer stivelse enn de fleste andre grønnsaker, men de vil vanligvis ikke gi stor blodsukkerstigning med mindre de spises kokt og/eller moset i større mengder. Rotvekster og belgvekster er dessuten rike på næringsstoffer og fiber og kan derfor gjerne inngå i kosten (spesielt rå og mindre bearbeidede rotvekster). Rotvekster og belgvekster kan også være et godt alternativ til de tradisjonelle stivelsesholdige matvarene som oftest inngår i et måltid som potet, ris, pasta og brød. Tips til belgvekstbaserte oppskrifter finnes på helsenorge.no, lhl.no og diabetes.no.
Både frukt, belgvekster og rotvekster er matvarer som inngår i mange av de anbefalte kostmønstrene men den som har diabetes må ta hensyn til eventuell blodsukkerstigende effekten av disse matvarene.
Fett og meieriprodukter
Anbefaling om inntak av fettkilder og meieriprodukter til personer med diabetes er fortsatt under revisjon. I påvente av en systematisk litteraturgjennomgang fra en europeisk ekspertgruppe på diabetes og ernæring (DNSG; The Diabetes and Nutrition Study Group of the EASD, European Association for the Study of Diabetes), anbefales det at personer med diabetes følger kostrådene til den generelle befolkningen vedrørende disse matvaregruppene. DNSG reviderer for tiden de europeiske anbefalingene for kost ved diabetes med bruk av samme GRADE-metodikk som er blitt brukt i disse anbefalingene.
På grunn av faglig uenigheten om kunnskapsgrunnlaget for sammenhengen mellom mettet fett og hjerte- og karsykdom, og ikke minst usikkerheten dette har skapt i befolkningen, ba Helsedirektoratet Nasjonalt råd for ernæring om å gjøre en ny faglig vurdering av kostrådene om fett. I 2017 kom rapporten fra ekspertgruppen basert på en omfattende litteraturgjennomgang: «Kostråd om fett - en oppdatering og vurdering av kunnskapsgrunnlaget IS-2625 Utgitt 05/17». Konklusjonen fra denne rapporten var at de norske kostrådene om fett fra 2011 ikke var svekket: Mengde fett er viktig i et energibalanseperspektiv. For hjerte- og karsykdom er balansen mellom ulike typer fett og kilder til fett viktigere enn prosentandelen av totalt fett i kostholdet, og et kostholdsmønster i tråd med anbefalingene vil inneholde relativt lite mettet fett. Se mer i helsedirektoratets kostråd.
Meieriprodukter inneholder mange viktige næringsstoffer men også mettet fett. Det er et uttalt mål å redusere inntaket av mettet fett i norsk kosthold, og meieriprodukter utgjør ca 40-45 % av inntaket av mettet fett i vårt kosthold. Magre meieriprodukter og spesielt fermenterte meieriprodukter (kefir, yoghurt o.l.) er assosiert med redusert risiko for både koronar hjertesykdom, hjerneslag og diabetes type 2. Noen epidemiologiske studier tyder på at den positive assosiasjonen mellom meieriprodukter og koronar hjertesykdom er uavhengig av fettinnhold og noen antyder også at fett fra meieriprodukter er spesielt gunstig. I slike epidemiologiske studier er det imidlertid vanskelig å skille ut effekten av inntak av meieriprodukter fra andre positive trekk i kosten og livsstilen hos de samme individene. Det er også viktig hva man erstatter meierifettet med: Hvis man bytter ut fett fra meieriprodukter med umettet fett og/eller helkornsprodukter, reduseres LDL-kolesterol og risikoen for hjerte- og karsykdom. Ved å anbefale magre meieriprodukter sikres tilstrekkelig inntak av næringsstoffene som finnes i meieriprodukter uten at inntaket av mettet fett i kosten øker.
Proteininntak
Det er ikke gitt spesifikke anbefalinger for inntak av protein i kosten ved diabetes. Dette skyldes at det mangler vitenskapelig studier som gir grunnlag for å anbefale en kost med spesielt høyt (>20 energiprosent) eller lavt proteininnhold (<10 energiprosent) til personer med diabetes som ikke har nyresykdom. Mennesker har et daglig proteinbehov på ca 0,8 g proteiner per kg kroppsvekt, tilsvarende ca 60 g protein hos en person på 70 kg. Gjennomsnittlig inntak i Norge er på 80 g per dag for kvinner og 112 g per dag for menn (ca 15-18 energiprosent for begge kjønn).
I forbindelse med vektreduksjon og redusert energiinntak kan en større andel av energien komme fra proteiner (opp til 32 energi%), da det ser ut til å gi et like bra eller bedre vektreduksjonsresultat sammenlignet med andre kostsammensetninger, uten å gi negative bivirkninger.Se anbefalingen om proteininntak ved nyresykdom i kapittelet Kosthold ved diabetes og nyresykdom.
Sukker og søtstoff
I likhet med det som anbefales for befolkningen for øvrig anbefales det å begrense inntak av alle typer tilsatt/fritt sukker inklusivt fruktose, til maksimalt 10 energiprosent. Dette tilsvarer for en voksen person ca 50-70 g eller 25-35 sukkerbiter per dag. Sukkerholdig drikke gir ekstra rask blodsukkerstigning samtidig som det ikke gir samme metthetsrespons som mat i fast form. Sukkerholdig drikke bør derfor unngås ved diabetes.
Energifrie søtstoffer kan brukes som erstatning for fritt/tilsatt sukker i mengder som ikke overstiger akseptabelt daglig inntak (ADI) fastsatt av europeiske helsemyndigheter (efsa.europa.eu). Se FHI Fakta om søtstoffene. I praksis vil moderat bruk av søtstoff være en mengde som erstatter tilsatt sukker < 10 energiprosent.
Alkohol
Alkohol har i seg selv en moderat blodsukkersenkende effekt. Større mengder alkohol kan medføre alvorlig hypoglykemi etter noen timer. For å redusere risiko for alkoholindusert hypoglykemi bør personer som bruker insulin eller perorale antidiabetika som øker insulinproduksjonen, vurdere behovet for å innta karbohydratholdig mat i forbindelse med alkoholinntak og/eller å redusere insulindosen/ legemiddeldosen. Ved overvekt, hypertensjon og forhøyede triglyserider er det også viktig at alkoholinntaket begrenses.
Begrunnelse – dette er anbefalingen basert på
Norske kostråd tilpasset personer med diabetes
Kunnskapsgrunnlaget for kostrådene til den generelle befolkningen er godt, men naturlig nok er det ikke gjort egne studier på effekten av de norske kostrådene på en diabetes-populasjon. Tilpasningene som er gjort bygger derfor i hovedsak på klinisk erfaring, og behov for å ta hensyn til inntaket av karbohydratrike matvarer for å ha tilfredsstillende blodsukkerkontroll.
Personer med diabetes har økt risiko for hjerte- og karsykdom og de fleste personer med diabetes type 2 har dessuten overvekt eller fedme. Kostholdets betydning i forebygging av hjerte- og karsykdom og overvekt er godt ivaretatt i de gjeldende norske kostrådene, da dette er helseproblem som rammer store deler av befolkningen, ikke bare personer med diabetes. Det har likevel vært ønskelig å gjøre en egen vurdering av rådene angående fett i kosten, for å se om det er forskjell på effekt hos personer med og uten diabetes. Dette fordi noen personer med diabetes velger å redusere karbohydratinntaket (pga blodsukker) og kompenserer dette med et økt inntak av fett. Personer med diabetes type 2 har dessuten en karakteristisk blodlipidprofil som kjennetegnes av lav HDL-kolesterol- og høye triglyseridnivå, men ganske normale LDL-kolesterolnivå, og dette kan ha betydning for hvilke kostråd vi skal vektlegge. Som det framgår under "Praktisk", er denne kunnskapsgjennomgangen overlatt til en europeisk ekspertgruppe og de norske kostrådene er beholdt inntil videre.
Det er blitt gjort en egen vurdering av effekten av noen av kostrådene hos personer med diabetes. Dette gjelder rådet om belgvekster, fullkornsprodukter, fiber, type fett i kosten (påvirker råd om matoljer, myke/flytende margariner og meieriprodukter), nøtter, rødt kjøtt, fisk, egg, sukker, fruktose og energifrie søtstoff. Mer utfyllende informasjon vedrørende enkelte kostråd finnes under forskningsgrunnlag og beskrivelse av hvert enkelt PICO-spørsmål. Det ble valgt å se spesielt på disse kostrådene enten fordi det (utfra klinisk erfaring) ofte er disse kostrådene personer med diabetes ønsker veiledning om, eller fordi effekten av kostendringen kan være forskjellig hos de som har diabetes sammenlignet med de som ikke har diabetes.
For flere av kostrådene fantes det ikke systematiske kunnskapsoppsummeringer blant personer med diabetes (f.eks. rødt kjøtt og fisk), og når det ble funnet slike kunnskapsoppsummeringer, var de oftest av lav kvalitet; hovedsakelig på grunn av at det var små studier med heterogen intervensjon og heterogen populasjon, som igjen ga upresise effektestimat med store konfidensintervall. Effektestimatene (der det fantes) gikk likevel i stor grad i samme retning som de nasjonale matvarebaserte kostrådene; altså de kostrådene hvor et økt inntak er anbefalt, ga overveiende positive effekter på metabolsk kontroll og risikofaktorer for hjerte- og karsykdom, og motsatt ga kostrådene som oppfordrer til begrenset inntak, en negativ effekt på de samme utfallsvariablene.
Det var kun to RCT-er som så på harde endepunkter. Det ble heller ikke funnet mange studier som så på livskvalitet, hvorvidt kostendringen var lett å få til i hverdagen, etterlevelse av kostråd og bivirkninger. Dette har man prøvd å ta høyde for ved å gjøre en vurdering av verdier og preferanser i samarbeid med brukerrepresentanter, og disse vurderingene er oppsummert under fanen "Vurderinger".
Anbefalte kostmønstre
Kostrådene i anbefalingen er forenelig med alle de fire kostmønstrene som er anbefalt, men kostmønstrene vektlegger ulike sider ved kostholdet og andelen av de enkelte matvaregruppene kan være forskjellig.
Helseeffekten av en sunn nordisk kost («Healthy Nordic diet») ble også undersøkt, men det er ikke gjort slike studier blant personer med diabetes. Det er likevel god grunn til å tro at en sunn nordisk kost vil være helsemessig gunstig for personer med diabetes. Dette med bakgrunn i at man har sett positive effekter på kardiometabolske risikofaktorer og vekt i andre populasjoner. En sunn nordisk kost kjennetegnes dessuten av matvarer som har vist gunstige helseeffekter hos personer med diabetes som: bær, grønnsaker (f.eks. kål og rotgrønnsaker), belgvekster, fisk og annen sjømat, helkornprodukter av havre, rug og bygg, magert viltkjøtt og rapsolje. Videre vil dette også være et mer bærekraftig kosthold da det i større grad vil bestå av lokalt fremstilt mat.
Tradisjonell middelhavskost
I følge en meta-analyse fra 2014 (Huo et al., 2014) kan et kosthold som følger den tradisjonelle middelhavskosten ha gunstige effekter på en rekke metabolske risikofaktorer hos personer med type 2 diabetes, sammenlignet med ulike andre antatt sunne kosthold, både HbA1c, fastende blodsukker, kroppsvekt, blodlipider og blodtrykk. Total kvalitet på evidensen varierte fra lav (HbA1c), moderat (livvidde, LDL kolesterol, HDL kolesterol, total kolesterol, triglyserider) til høy (vekt, BMI, systolisk og diastolisk blodtrykk).
Det har ikke blitt funnet meta-analyser av systematiske oversikter som har sett på andre kritiske eller viktige endepunkter av interesse, men resultatene av PREDIMED-studien, en randomisert klinisk studie hvor halvparten av deltagerne hadde diabetes type 2, viste at middelhavskost reduserte forekomsten av kardiovaskulære hendelser over en 6-årsperiode sammenlignet med en kost med lite olivenolje og nøtter (Estruch et al., 2013). Da det er andre studier blant personer som ikke har diabetes som viser lignende effekter, er det grunn til å mene at dette også er overførbart til personer med diabetes type 1.
Konklusjonen er at den samlede evidens er av moderat til høy kvalitet i meta-analysen, men det er kun positive effekter på alle undersøkte utfall, og lignende positive effekter på kardiovaskulær risiko og risikofaktorer er funnet i epidemiologiske studier og i randomiserte, kontrollerte studier i andre populasjoner. Dette er grunnlaget for å anbefale dette kostmønsteret som et av flere alternativer ved diabetes.
Moderat karbohydratredusert kost
Randomiserte kontrollerte studier har vist at et kosthold med redusert karbohydratinnhold kan ha en gunstig effekt på antropometri og metabolske endepunkter, i studier med varighet opp til 3 år, hos personer med diabetes type 2 med overvekt og fedme. Når lav-karbohydrat kostholdet ble sammenlignet med andre kosthold med høyere karbohydratinnhold, er det derimot ingen signifikant forskjell på vekt og kardiovaskulære risikofaktorer, med unntak av en moderat større triglyseridsenkende effekt av lav-karbokosten. Det er også en noe større reduksjon (gjennomsnittlig forskjell 1,0 mmol/mol) i HbA1c i lavkarbo-armen i de kortvarige studiene (3-6 måneders varighet), men forskjellen forsvinner i studier som varer mer enn 6 mnd.
Grunnen til at det anbefales en moderat karbohydratredusert kost for de som ønsker å følge dette kostmønsteret, og ikke en veldig karbohydratredusert kost, er flere: Jo mer ekstrem reduksjonen i karbohydrater er, jo dårligere blir langtids etterlevelse av kostrådene. Det er også mer utfordrende å få til et balansert og variert kosthold som dekker behov for fiber, vitaminer og mineraler ved en veldig karbohydratredusert kost. Det finnes dessuten mer og bedre dokumentasjon for sikkerhet og effektivitet ved moderat karbohydratredusert kost.
Kost med lav glykemisk indeks (GI)
Til tross for begrenset effektstørrelse på metabolsk kontroll, anbefales det kost med lav GI som en av flere kostholdsmønster som kan være gunstig ved diabetes, siden risikoen for ugunstige virkninger og økte utgifter er liten, og den potensielle positive helseeffekten sannsynligvis går utover det vi har undersøkt. Det trengs imidlertid opplæring og veiledning til de som ønsker å følge denne anbefalingen.
Det har ikke blitt funnet meta-analyser som har vurdert kost med lav glykemisk belastning (GB) mot andre former for kostintervensjon og det er derfor ikke gitt noen anbefaling hva gjelder denne typen kosthold.
Vegetarisk kosthold
Dette er et kostmønster som ikke var med i de opprinnelige kostanbefalingene for diabetes utgitt i 2016. Arbeidsgruppen har valgt å legge til dette som en av de anbefalte kostholdene på grunn av at det er kommet minst fire systematiske oversikter og meta-analyser som konkluderer med at et plantebasert eller vegetarisk kosthold er gunstig i forebygging og behandling av diabetes type 2 og har en positiv effekt på HbA1c.
Qian et al., (2019) gjorde en systematisk gjennomgang og meta-analyse av ni prospektive kohortstudier der de konkluderer med at et plantebasert kosthold (med mye frukt, grønnsaker, hele korn, belgfrukter og nøtter) var assosiert med redusert risiko for diabetes type 2 også etter justering for BMI. I denne systematiske oversiktsartikkelen var 307099 deltagere inkludert, og av disse fikk 23544 diabetes type 2.
En systematisk review fra 2018 av Viguiliouk E. et al., inkluderte ni RCT studier som sammenlignet effekten av et vegetarisk mot et ikke-vegetarisk kosthold på metabolske risikofaktorer blant personer med diabetes type 2. De fant at et vegetarisk kosthold bedret glykemisk kontroll (gjennomsnittlig forskjell i HbA1c -0.29% [95% CI: -0.45, -0.12%]), og andre etablerte kardiovaskulære risiko faktorer som LDL-kolesterol (-0.12 mmol/L), ikke-HDL-kolesterol (-0.13 mmol/L), vekt (-2.15 kg) og livvidde (-2,86 cm). Det var ingen signifikant forskjell i effekt på fastende insulin, HDL-kolesterol, triglyserider eller blodtrykk. Tillit til effektestimatene ble vurdert som lav til moderat.
I en annen systematisk oversiktsartikkel fra samme gruppe undersøkte man effekten av et vegetarisk kosthold på kardiovaskulær mortalitet og morbiditet blant personer med og uten diabetes type 2, sammenlignet med et ikke-vegetarisk kosthold (Glenn et al., 2019). De inkluderte sju prospektive kohortstudier med 197 737 deltagere og 8430 hendelser. Et vegetarisk kosthold var assosiert med redusert insidens [RR 0.72 (0.61, 0.85)] og dødelighet av koronar hjertesykdom [0.78 (CI, 0.69, 0.88)] men ikke kardiovaskulær dødelighet [0.92 (0.84, 1.02)] eller død pga hjerneslag [0.92 (0.77, 1.10)]. Tillit til effektestimatet var imidlertid vurdert til å være svært lavt på grunn av mangel på presisjon og overførbarhet.
Schwingshackl et al., (2018) fant også i sin network meta-analyse at et vegetarisk kosthold var ett av kostmønstrene som reduserte HbA1c og fastende blodsukker signifikant sammenlignet med kontrollkosten.
Forskningsgrunnlag
Populasjon (P): Personer med diabetes
Tiltak (I): Høyt inntak av egg (>7 egg per uke)
Sammenligning (C): Lavere inntak av egg (<7 egg per uke)
Beskrivelse av inkluderte studier
En systematisk gjennomgang og meta-analyse av prospektive kohortstudie (Shin et al., 2013) som undersøkte de generelle longitudinelle sammenhenger mellom kvantitativt inntak av egg og forekomst av CVD, diabetes type 2 hjertedødelighet, samt risiko for CVD og hjertedødelighet hos personer med diabetes type 2, ble vurdert.
Litteraturen vi fant viste at et kosthold som inkluderer inntak av ett eller flere egg per dag kan ha følgende effekter hos personer med type 2 diabetes, sammenlignet med et kosthold som ikke inneholder egg eller som inkluderer mindre enn ett egg per uke:
- Økt risiko for å utvikle kardiovaskulær sykdom med 69%
- Økt risiko for kardiovaskulær død med 27%
Estimatene bygger på henholdsvis 4 kohorter med 7549 deltakere og 9,5 års gjennomsnittlig observasjonstid og 3 kohorter med 1529 deltakere og 13,8 års gjennomsnittlig observasjonstid. Kvaliteten på kunnskapsgrunnlaget er imidlertid vurdert til veldig lav pga stor risiko for systematiske feil, lav presisjon og fare for publiseringsskjevhet. I tillegg festes det mindre lit til cohortestudier sammenlignet med randomiserte kotrollerte studier.
En ny prospektiv kohortestudie som bygger på seks ulike kohorter i USA bekrefter at inntaket av egg er assosiert med økt risiko for hjerte- og karsykdom og økt dødelighet, men assosiasjonen er ikke lenger signifikant når det korrigeres for inntak av kolesterol i kosten (Zong et al., 2019).
Vurdering
Fordeler og ulemper
Samlet for de overordnede kostrådene og de tre anbefalte kostmønstrene
Effekten av hver enkelt kostendring er vanskelig å forutsi: Det finnes studier som underbygger at enkelte kostintervensjoner (f.eks. økt inntak av nøtter, grønnsaker) eller sammensatte kostmønstre (f.eks. middelhavskost) har god effekt på viktige kliniske utfall, men effektestimatene er vanligvis ikke store og har store konfidensintervall. Dette skyldes delvis heterogene intervensjoner (f.eks. varierer karbohydratandelen i ulik karbohydratreduserte koster fra 5-40 % av energiinntaket), delvis at det er små studier og at effekten av kostintervensjonen er vanskelig å skille fra samtidig endring i fysisk aktivitet, vekt eller legemidler.
Ulike kostintervensjoner vil vanligvis gi en reduksjon på omtrent 11 mmol/mol (1 %-poeng) i HbA1c. Mange legemiddelstudier kan vise til en tilsvarende reduksjon (Bennett et al, 2011). Kostendring vil ofte føre til positiv effekt på mange risikofaktorer og helseutfall samtidig, og i motsetning til de fleste legemidler, gir kostendringer lite eller ingen negative bieffekter. For eksempel vil en kost med mye fiber kunne redusere blodsukker. Samtidig kan et økt fiberinntak bidra til bedring i blodlipider, økt metthet/ vektreduksjon, forebygge forstoppelse og bidra til sunn tarmflora.
Uavhengig av om du ønsker å følge en middelhavskost, moderat karbohydratredusert kost, en kost med lav GI eller vegetarkost, så gjelder de overordnede kostrådene som anbefales i kulepunktene. Det betyr i alle tilfeller at kostholdet vil være bygd opp av mye plantebasert mat som er lite bearbeidet og har et høyt fiberinnhold, lavt sukker- og saltinnhold og domineres av umettede fettkilder. Dette er mat som ikke bare er gunstig ved diabetes men som har vist seg gunstig i å forebygge mange av de store folkesykdommene.
Kvalitet på dokumentasjonen
Kvaliteten på det vitenskapelige grunnlaget for samtlige kostråd varierer fra lav til moderat for alle endepunkter. Nedgradering av kvalitet skyldes høy risiko for systematiske feil, heterogenitet både i intervensjonene og i effektestimat og upresise effektestimater for enkelte endepunkter. Gjennomgående er det en mangel på studier med harde endepunkter som kardiovaskulær sykdom og død. Det er dessuten vanskelig å etterprøve at deltagere i kostintervensjonsstudier faktisk har spist den maten/kostsammensetningen de er randomisert til.
Verdier og preferanser
I et brukerperspektiv er det viktig at den som har diabetes får ta sine egne valg med hensyn til hvordan han/hun ønsker å spise. Hvilket kosthold som er optimalt vil avgjøres av hva som er de medisinske problemstillingene, personlige preferanser og ressurser og evnen til å gjennomføre endringer. For å kunne gjøre gode valg og oppleve mestring av sykdommen i hverdagen, trengs mye kunnskap om hvordan ulik mat og kosthold påvirker blodsukker og andre relevante helseutfall.
Kosthold og kostendringer som fører til store endringer sammenlignet med tidligere kostvaner, oppleves av de fleste som vanskelig å gjennomføre på lang sikt. Gjentatte mislykkede forsøk på kostendring kan svekke mestringsfølelsen og bidra til at personen får et anstrengt forhold til mat. Det er et uttalt mål i kostanbefalinger å gi råd som for de fleste er gjennomførbare på kort og lang sikt. Samtidig vil effekten av kostendringer ofte være større, jo større endringer man gjennomfører. Det å oppleve store forbedringer i metabolsk kontroll vil for noen være motivasjon nok til å følge en kost som for andre oppleves for restriktiv.
Mange mennesker med diabetes er usikre på hvorvidt de kan følge ulike kostmønstre i henhold til egne preferanser eller kosttradisjoner. Retningslinjene omhandler derfor kostmønstrene arbeidsgruppen erfarer det stilles spørsmål ved. Beskrivelsen av kostmønstre kan brukes som inspirasjon for sammensetning av en sunn kost ved diabetes og bidra til at den enkeltes preferanser og kosttradisjoner kan ivaretas.
Eventuell ulemper ved å følge kostanbefalingene kan være at disse matvarene kan være litt dyrere og vanskeligere å få tak i, enn de mer vanlige variantene (f.eks. fullkornsprodukter vs raffinerte produkter). Mange har også en smakspreferanse for raffinerte, sukkerholdige og/eller fete matvarer og bearbeidede produkter. For disse vil en kostomlegging i følge anbefalingene begrense gleden og nytelsen ved å spise mat man liker. En økning i fiberrike matvarer vil også kunne medføre økt gassdannelse, og en stinn og oppblåst mage/tarm, noe som kan være sjenerende og ubehagelig, men som ikke er farlig. Noen vil kunne oppleve at ulempen ved en kostomlegging er større enn ev. fordeler med hensyn til blodsukkerregulering, blodtrykk og blodlipider.
Til sist vil også de fleste kostholdsendringer kreve at den enkelte tilegner seg ny kunnskap ikke bare om kostholdet, men også om hvordan man tilbereder måltid som er i tråd med anbefalingene. For eksempel hvis man ønsker å følge en kost med lav glykemisk indeks (GI), så trengs det kunnskap om hva GI er; hvordan man tolker GI verdier, begrensninger i metodikken og man må også kunne innhente info om GI på de matvarer man ønsker å spise (hvilket ikke alltid er tilgjengelig).
Referanser
96. Effects of Mediterranean-style diet on glycemic control, weight loss and cardiovascular risk factors among type 2 diabetes individuals: a meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-232084
97. Primary Prevention of Cardiovascular Disease with a Mediterranean Diet https://www.helsedirektoratet.no/referanse/0002-0013-232085
98. Dietary sugars and cardiometabolic risk: systematic review and meta-analyses of randomized controlled trials of the effects on blood pressure and lipids https://www.helsedirektoratet.no/referanse/0002-0013-232086
99. En landsomfattende kostholdsundersøkelse blant menn og kvinner i Norge i alderen 18-70 år https://www.helsedirektoratet.no/referanse/0002-0013-232087
100. Do Norwegians with diabetes have a healthier diet than the general poplation? https://www.helsedirektoratet.no/referanse/0002-0013-232088
101. Effect of fructose on glycemic control in diabetes: a systematic review and meta-analysis of controlled feeding trials https://www.helsedirektoratet.no/referanse/0002-0013-232089
102. Heterogeneous effects of fructose on blood lipids in individuals with type 2 diabetes: systematic review and meta-analysis of experimental trials in humans https://www.helsedirektoratet.no/referanse/0002-0013-232090
103. Fructose-containing sugars, blood pressure, and cardiometabolic risk: a critical review https://www.helsedirektoratet.no/referanse/0002-0013-232091
104. Effect of fructose on postprandial triglycerides: A systematic review and meta-analysis of controlled feeding trials https://www.helsedirektoratet.no/referanse/0002-0013-232092
105. The ecologic validity of fructose feeding trials: supraphysiological feeding of fructose in human trials requires careful consideration when drawing conclusions on cardiometabolic risk https://www.helsedirektoratet.no/referanse/0002-0013-232093
106. Low carbohydrate versus isoenergetic balanced diets for reducing weight and cardiovascular risk: a systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-232094
107. A critical review of low-carbohydrate diets in people with Type 2 diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232095
108. The use of low-glycaemic index diets in diabetes control https://www.helsedirektoratet.no/referanse/0002-0013-232096
109. Low glycaemic index, or low glycaemic load, diets for diabetes mellitus https://www.helsedirektoratet.no/referanse/0002-0013-232097
110. Low glycaemic index diets and blood lipids: a systematic review and meta-analysis of randomised controlled trials https://www.helsedirektoratet.no/referanse/0002-0013-232098
111. A systematic review on the effect of sweeteners on glycemic response and clinically relevant outcomes https://www.helsedirektoratet.no/referanse/0002-0013-232099
112. Fiber intake and glycemic control in patients with type 2 diabetes mellitus: a systematic review with meta-analysis of randomized controlled trials https://www.helsedirektoratet.no/referanse/0002-0013-232100
113. Effect of tree nuts on glycemic control in diabetes: a systematic review and meta-analysis of randomized controlled dietary trials https://www.helsedirektoratet.no/referanse/0002-0013-232101
114. Effect of non-oil-seed pulses on glycaemic control: a systematic review and meta-analysis of randomised controlled experimental trials in people with and without diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232102
115. Effect of Replacing Animal Protein with Plant Protein on Glycemic Control in Diabetes: A Systematic Review and Meta-Analysis of Randomized Controlled Trials https://www.helsedirektoratet.no/referanse/0002-0013-232103
116. Consumption of nuts and legumes and risk of incident ischemic heart disease, stroke, and diabetes: a systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-232104
117. Non-soy legume consumption lowers cholesterol levels: a meta-analysis of randomized controlled trials https://www.helsedirektoratet.no/referanse/0002-0013-232105
118. Effect of dietary pulses on blood pressure: a systematic review and meta-analysis of controlled feeding trials https://www.helsedirektoratet.no/referanse/0002-0013-232106
119. Effects of dietary pulse consumption on body weight: a systematic review and meta-analysis of randomized controlled trials https://www.helsedirektoratet.no/referanse/0002-0013-232107
120. Omega-3 polyunsaturated fatty acids (PUFA) for type 2 diabetes mellitus https://www.helsedirektoratet.no/referanse/0002-0013-232108
121. Egg consumption in relation to risk of cardiovascular disease and diabetes: a systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-232109
122. Healthy traditional Mediterranean diet: an expression of culture, history, and lifestyle https://www.helsedirektoratet.no/referanse/0002-0013-232110
123. The Mediterranean diet revisited: evidence of its effectiveness grows https://www.helsedirektoratet.no/referanse/0002-0013-232111
124. Macronutrients, food groups, and eating patterns in the management of diabetes: a systematic review of the literature, 2010 https://www.helsedirektoratet.no/referanse/0002-0013-232112
125. International table of glycemic index and glycemic load values: 2002. https://www.helsedirektoratet.no/referanse/0002-0013-232113
188. Carbohydrate quantity in the dietary management of type 2 diabetes: A systematic review and meta-analysis. https://www.helsedirektoratet.no/referanse/0002-0013-232176
189. Effects of low-carbohydrate- compared with low-fat-diet interventions on metabolic control in people with type 2 diabetes: a systematic review including GRADE assessments. https://www.helsedirektoratet.no/referanse/0002-0013-232177
190. Effect of dietary carbohydrate restriction on glycemic control in adults with diabetes: A systematic review and meta-analysis. https://www.helsedirektoratet.no/referanse/0002-0013-232178
191. Effects comparison between low glycemic index diets and high glycemic index diets on HbA1c and fructosamine for patients with diabetes: A systematic review and meta-analysis. https://www.helsedirektoratet.no/referanse/0002-0013-232179
192. Association between intake of non-sugar sweeteners and health outcomes: systematic review and meta-analyses of randomised and non-randomised controlled trials and observational studies. https://www.helsedirektoratet.no/referanse/0002-0013-232180
193. Associations of Dietary Cholesterol or Egg Consumption With Incident Cardiovascular Disease and Mortality. https://www.helsedirektoratet.no/referanse/0002-0013-232181
205. Systematic review and meta-analysis of dietary carbohydrate restriction in patients with type 2 diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232193
Sist faglig oppdatert: 20.12.2019
Kostveiledning ved bruk av måltidsinsulin
Det foreslås at alle som behandles med hurtigvirkende insulin, får grundig veiledning om hvordan de kan dosere måltidsinsulin ut fra måltidets innhold og sammensetning, og at slik veiledning gis av helsepersonell med spesialkompetanse på diabetes og ernæring.
Praktisk – slik kan anbefalingen følges
Kostveiledning og oppfølging av diabetes type 1 foregår i utgangspunktet i spesialisthelsetjenesten, men øvrig helsehjelp gis av andre deler av helsetjenesten. Det kan være nyttig for øvrig helsepersonell og ha kjennskap til prinsippene bak diabetesbehandlingen. Behandling med hurtigvirkende insulin gir en mye større fleksibilitet i hva og hvor mye den som har diabetes kan spise, sammenlignet med det å ikke bruke hurtigvirkende insulin til måltidene.
Å dosere måltidsinsulin utfra karbohydratinnhold i måltidet, populært kalt karbohydratvurdering, er en metode som har vært benyttet i Norge en stund. Prinsippet går ut på at man estimerer innholdet av karbohydrater i det måltidet man ønsker å spise og doserer måltidsinsulin på bakgrunn av dette, fordi karbohydrater i et måltid er det som øker blodsukkeret og dermed behovet for insulin. I tillegg tar man høyde for blodsukkernivå før måltidet og ev. fysisk aktivitet før og etter måltid. Hensyn til glykemisk indeks og mengde fett/protein gir mulighet til å få en mer nøyaktig måltidsdose og mer forutsigbarhet med tanke på post-prandiale blodsukker.
Det er utarbeidet brosjyre og app for smarttelefoner som kan brukes i estimering av karbohydratinnholdet i ulike matvarer: diabetessenter.no.
Norsk Diabetessenter har utarbeidet veiledningsmateriale for helsepersonell som skal drive veiledning i karbohydratvurdering (diabetikersenter.no). Bruk av veiledningsmaterialet forutsetter at helsepersonell selv har deltatt på opplæringskurs.
Det finnes også tilsvarende internasjonale brosjyrer/bøker, nettsteder og apper (Carbs&Cals, Figwee, Kullhydrat - dansk app,) som kan være nyttig å kjenne til, spesielt om pasientene man skal veilede har en matkultur som skiller seg vesentlig fra den norske.
Karbohydratvurdering kan også være nyttig kunnskap for andre som bruker hurtigvirkende insulin til måltidene eller for de som ønsker å begrense karbohydratmengden i måltidene, men på grunn av at det mangler systematiske kunnskapsoppsummeringer og man har begrenset klinisk erfaring, er det valgt å ikke gi noen anbefaling vedrørende dette.
Begrunnelse – dette er anbefalingen basert på
I den systematiske kunnskapsoppsummeringen og meta-analysen fra 2014 (Bell et al., 2014) fant man 7 studier som sammenlignet opplæring og bruk av karbohydratvurdering blant personer med diabetes type 1, med generell kostveiledning uten bruk av karbohydratvurdering. Karbohydratvurdering ga ikke signifikant bedre effekt på HbA1c når man inkluderte alle studiene (gjennomsnittlig forskjell på HbA1c 0,35%-poeng, -0,75 - 0,06). I fem av studiene som bare inkluderte voksne med diabetes type 1 og som hadde parallell design, så man imidlertid en signifikant større reduksjon i HbA1c på 0,64%-poeng (CI -0,91 til -0,37, p<0,0001).
Kvalitet på kunnskapsgrunnlaget var moderat med trekk for risiko for systematisk feil pga. at ingen av studiene 1) utførte skjult allokering og 2) hadde tilfredsstillende blinding av utfallsmålere. Det bemerkes også at alle studiene hadde en sammenfallende intensivering av insulin-behandling i intervensjonsgruppen og at dette kan ha redusert HbA1c uavhengig av kostråd som ble gitt.
Sekundære endepunkt som tilfeller av hypoglykemi og livskvalitet, var definert forskjellig og ufullstendig rapportert i originalstudiene, men seks av sju studier rapporterte en ikke-signifikant reduksjon i hypoglykemiske hendelser i karbohydratvurderings-gruppa. Fem studier hadde brukt et validert verktøy for å måle endring i livskvalitet, og alle fant en bedring i livskvalitet i karbohydrattellegruppa, men bare en studie (DAFNE, 2002) kunne vise en signifikant bedre effekt av karbohydratvurdering sammenlignet med kontrollgruppen.
I en systematisk oversiktsartikkel og meta-analyse fra 2016 inkluderte man 10 studier som sammenlignet opplæring i bruk av karbohydratvurdering blant barn/unge (4 studier) og voksne (6 studier) med diabetes type 1 med annen diabetesrelatert kostveiledning/opplæring (5 studier) eller generell kostveiledning (5 studier) (Fu et al., 2016) . Randomiserte, kontrollerte studier (RCT) av minst 3 måneders oppfølging ble inkludert. Sammenlignet med annen kostveiledning/opplæring eller generell kostveiledning fant man at bruk av karbohydratvurdering ga en signifikant reduksjon i HbA1c (gjennomsnittlig forskjell i HbA1c -0,35%-poeng -0,65, -0,05). Sammenlignet man karbohydratvurdering med generell kostveiledning så man imidlertid en større reduksjon i HbA1c (-0,68%-poeng (CI -0,96 til -0,05)). Karbohydratvurdering ga ikke bedre effekt på HbA1c når denne metoden ble sammenlignet med annen diabetesrelatert kostveiledning/opplæring. Sub-gruppe analyser viste også at karbohydratvurdering ikke ga signifikant bedre effekt på HbA1c blant barn og unge (-0,29 (-0,52 til 0,24)).
Sammenlignet med annen diabetesrelatert kostveiledning eller generell kostveiledning ga karbohydratvurdering ingen signifikant reduksjon i antall hendelser med hypoglykemi (-0,14 (CI -0,39 til 0,10)), forskjeller i insulindoser (0,04 (CI -0,24 til 0,31)) eller endringer i KMI (-0,06 (CI -0,39 til 0,28)).
En artikkel fra Bell et al., (2015) oppsummerte kunnskap om effekt av glykemisk indeks (GI) og fett og protein i kosten på akutt postprandial respons hos personer med diabetes type 1. De så også på ulike strategier for å dosere måltidsinsulin til kosthold som varierte med tanke på disse kostfaktorene. De så da at mye fett i kosten kunne gi forsinket hyperglykemi, antagelig pga. at fett forsinker magesekktømningen etter et måltid og bidrar til blodsukkerøkning via glukoneogensen. Sju av studiene så på ulike doseringstrategier for insulin ved måltid som enten inneholdt mye fett og/eller proteiner. Det viste at disse måltidene krevde mer insulin enn måltid med mindre fett og/eller proteiner selv om måltidene hadde identisk innhold av karbohydrater. Dette blir støttet i en nylig publisert artikkel fra samme forskningsgruppe (Bell KJ, et al, 2019).
Artiklene fra Bell KJ, et al. fra 2015 og 2019 er ikke kvalitetsvurdert av forfatterne av disse retningslinjene. De illustrerer imidlertid at dosering av insulin til måltider er komplekst og at det krever god ernæringsfysiologisk kunnskap og kunnskap om matvarer både hos bruker og veileder.
Forskningsgrunnlag
Populasjon (P): Personer med type1 diabetes
Tiltak (I): Opplæring og bruk av karbohydrattelling for dosering av måltidsinsulin
Sammenligning (C): Kostveiledning uten bruk av karbohydrattelling
Beskrivelse av inkluderte studier
I en systematisk kunnskapsoppsummering og meta-analyse fra 2014 (Bell, 2014) fant man 7 studier som sammenlignet opplæring og bruk av karbohydrattelling blant personer med type 1 diabetes, med generell kostveiledning uten bruk av karbotelling. Karbohydrattelling ga ikke signifikant bedre effekt på HbA1c når man inkluderte alle studiene (gjennomsnittlig forskjell på HbA1c 0,35%-poeng, -0,75 - 0,06). I fem av studiene som bare inkluderte voksne med type 1 diabetes og som hadde parallell design, så man imidlertid en signifikant større reduksjon i HbA1c på 0,64%-poeng (CI -0,91 til -0,37, p<0,0001).
Kvalitet på kunnskapsgrunnlaget var moderat med trekk for risiko for systematisk feil pga at ingen av studiene 1) utførte skjult allokering og 2) hadde tilfredsstillende blinding av utfallsmålere. Det bemerkes også at alle studiene hadde en sammenfallende intensivering av insulin-behandling i intervensjonsgruppen og at dette kan ha redusert HbA1c uavhengig av kostråd som ble gitt.
Sekundære endepunkt som tilfeller av hypoglykemi og livskvalitet, var definert forskjellig og ufullstendig rapportert i originalstudiene, men seks av sju studier rapporterte en ikke-signifikant reduksjon i hypoglykemiske hendelser i karbohydrattelle-gruppa. Fem studier hadde brukt et validert verktøy for å måle endring i livskvalitet, og alle fant en bedring i livskvalitet i karbohydrattellegruppen, men bare en studie (DAFNE 2002) kunne vise en signifikant bedre effekt av karbohydrattelling sammenlignet med kontrollgruppen.
Vurdering
Fordeler og ulemper
Sekundære endepunkt som tilfeller av hypoglykemi og livskvalitet, var definert forskjellig og ufullstendig rapportert i originalstudiene, men seks av sju studier rapporterte en ikke-signifikant reduksjon i hypoglykemiske hendelser i karbohydrattelle-gruppa. Fem studier hadde brukt et validert verktøy for å måle endring i livskvalitet, og alle fant en bedring i livskvalitet i karbohydrattellegruppa, men bare en studie (DAFNE 2002) kunne vise en signifikant bedre effekt av karbohydrattelling sammenlignet med kontrollgruppen.
Kvalitet på dokumentasjonen
Kvalitet på kunnskapsgrunnlaget var moderat med trekk for risiko for systematisk feil pga at ingen av studiene utførte skjult allokering og hadde tilfredsstillende blinding av utfallsmålere. Det bemerkes også at alle studiene hadde en sammenfallende intensivering av insulin-behandling i intervensjonsgruppen og at dette kan ha redusert HbA1c uavhengig av kostråd som ble gitt.
Verdier og preferanser
God kunnskap om hvordan maten påvirker insulinbehovet og gode verktøy for å vurdere insulinbehov er avgjørende for at den som har insulinbehandlet diabetes, skal kunne ta ansvar for egen behandling. Det er også en forutsetning for at den som har insulinbehandlet diabetes skal kunne utnytte den fleksibilitet og frihet som ligger i dagens insulinbehandling og oppleve mestring og ha god livskvalitet. Karbohydratvurdering kan være ett slikt verktøy, men det er krevende både å tilegne seg nødvendig kunnskap til å bruke dette verktøyet riktig, og å bruke det til daglig dosering av insulin (Lawton J, et al, 2011). For noen vil andre tilnærminger fungere bedre - både forenklede og mer avanserte metoder. For eksempel kan en slik "matematisk" tilnærming til all mat man spiser, kombinert med blodsukkermålinger, for noen bidra til at et allerede komplisert forhold til mat, egen kropp og diabetes, blir forverret.
Den som har diabetes får selv avgjøre hvilken type tilnærming hun/han ønsker å bruke og helsepersonell som veileder må derfor ha inngående kunnskap om diabetes og ernæring og om ulike metoder for å tilpasse insulindosering til matinntak. Helheten i kosten er det som er mest avgjørende for helsa og det er derfor vesentlig at det også veiledes om andre aspekter av et sunt kosthold enn kun det som påvirker insulinbehovet.
Ny teknologi krever at brukeren kan og bruker karbohydratvurdering ved insulindosering til måltider/mat. Det er derfor avgjørende at helsepersonell klarer å tilpasse opplæringen/veiledning i bruk av karbohydratvurdering slik at alle kan ha mulighet til å nyttiggjøre seg denne teknologien.
Referanser
126. Impact of Fat, Protein, and Glycemic Index on Postprandial Glucose Control in Type 1 Diabetes: Implications for Intensive Diabetes Management in the Continuous Glucose Monitoring Era https://www.helsedirektoratet.no/referanse/0002-0013-232114
127. Training in flexible, intensive insulin management to enable dietary freedom in people with type 1 diabetes: dose adjustment for normal eating (DAFNE) randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-232115
128. Dose Adjustment for Normal Eating: a qualitative longitudinal exploration of the food and eating practices of type 1 diabetes pasients converted to flexible intesive insulin therapy in the UK. https://www.helsedirektoratet.no/referanse/0002-0013-232116
254. Effectiveness of advanced carbohydrate counting in type 1 diabetes mellitus: a systematic review and meta-analysis. https://www.helsedirektoratet.no/referanse/0002-0013-232242
255. Amount and Type of Dietary Fat, Postprandial Glycemia, and Insulin Requirements in Type 1 Diabetes: A Randomized Within-Subject Trial. https://www.helsedirektoratet.no/referanse/0002-0013-232243
Sist faglig oppdatert: 20.12.2019
Måltidsmønster og -frekvens for personer med diabetes
Det foreslås at personer med diabetes har en regelmessig måltidsrytme. Dette kan gjøre det enklere å regulere blodsukkeret.
Praktisk – slik kan anbefalingen følges
- Måltidsmønsteret må tilpasses den enkeltes dagsrytme.
- Effekten av et måltid på økning i blodsukker vil i stor grad bestemmes av mengde mat som spises.
- Et regelmessig måltidsmønster (Øverby et al., 2007) med hyppige måltider er gunstig for blodsukkerkontrollen, og økt måltidsfrekvens synes å medvirke til gunstig postprandial lipidprofil (Nordic Nutrition Recommendations 2004).
- Matinntaket kan fordeles på 3-4 hovedmåltider og 0-3 mellommåltider.
- Hos noen kan tette måltider forhindre overspising, mens andre opplever at ethvert måltid innebærer risiko for overspising og tap av kontroll over matinntak (Fra nasjonale retningslinjer for diabetes, 2009).
Begrunnelse – dette er anbefalingen basert på
Referanser
129. The influence of dietary intake and meal pattern on blood glucose control in children and adolescents using intensive insulin treatment https://www.helsedirektoratet.no/referanse/0002-0013-232117
130. Integrating nutrition and physical activity https://www.helsedirektoratet.no/referanse/0002-0013-232118
200. The influence of dietary intake and meal pattern on blood glucose control in children and adolescents using intensive insulin treatment. https://www.helsedirektoratet.no/referanse/0002-0013-232188
Sist faglig oppdatert: 20.12.2019
Kostveiledning til personer med diabetes og innvandrerbakgrunn
Det foreslås at personer med diabetes og innvandrerbakgrunn får kostveiledning som er tilpasset pasientens religion, tradisjon og kultur.
Praktisk – slik kan anbefalingen følges
Anbefalingene for kost kan også følges av de ulike innvandrergruppene som finnes i Norge, men det er viktig å tilrettelegge for og ta hensyn til religion, tradisjon og kultur. Som regel er det kvinnene som har ansvar for mat og matlaging. Enkelte matvarer blir ikke brukt av religiøse grunner (f.eks. svin), og det må man ta hensyn til når kostholdsrådene skal diskuteres med pasienten. Mange innvandrergrupper har en rik tradisjon for å bruke mye og varierte grønnsaker i maten, og dette er det viktig å bygge videre på. Likeså har de ulike innvandrergruppene bred erfaring med bruk av belgfrukter, linser og bønner, noe som er gunstig ved diabetes og kan vektlegges i kostrådgivningen.
Praktisk råd: Ta utgangspunkt i det kostholdet som pasienten har. Understrek det som er bra og bygg videre på det de har med seg fra sin kultur og tradisjon. Dette forutsetter at helsepersonellet spør pasienten om kultur og tradisjon knyttet til mat og bygger videre på det.
Informasjon på forskjellige språk om diabetes generelt og levevaner spesielt (diabetesforbundet.no)
Ramadan er den muslimske fastemåneden hvor man ikke skal spise eller drikke mellom soloppgang og solnedgang. Ramadan kan være utfordrende for personer med diabetes. Diabetes er en kronisk sykdom som kan gi unntak fra fasten. Muslimske lærde og helsepersonell er enige om dette. Det er likevel mange som ønsker å gjennomføre Ramadan selv om de har diabetes. Ved velregulert diabetes type 2 er det mulig å gjennomføre ramadan selv om de bruker blodsukkersenkende tabletter for sin diabetes (Abudhady M.M. 2019, Abdessadek M 2019), men det krever planlegging og god kunnskap og råd fra lege om hvordan man tilpasser kost og medisiner. Det kreves også kunnskap om hvordan man forebygger og håndterer høye og lave blodsukkerverdier som følge av endring i levesett. Tilrettelagt undervisning og god oppfølging før, under og etter Ramadan ser ut til å ha positiv effekt både på glykemisk kontroll og HbA1c (Srulovici et all 2019). Abushady (2019), viste at Ramadan ga bedring i glykemisk kontroll hos kvinner og menn med diabetes type 2 og eGFR >60. De så en negativ utvikling i mål på nyrefunksjon (e-GFR, u-AKR), men ikke hos de som hadde lavest GFR og høyest AKR i utgangspunktet. Imidlertid ble det vektlagt at man særlig må informere i forkant om viktigheten av å få i seg nok væske.
Personer med diabetes type 1 bør ikke faste under ramadan, og det bør heller ikke personer med dårlig regulert diabetes, eller personer som har hatt alvorlig hypoglykemi eller syreforgiftning de siste tre månedene. Det samme gjelder personer som er gravide (Glazier 2018) , har hjerte- og karsykdom, nyresvikt eller personer som utfører hardt fysisk arbeid.
Se informasjon og råd om ramadan og diabetes på (helsenorge.no)
Begrunnelse – dette er anbefalingen basert på
Innvandrerbefolkningen bør følge anbefalingene for kost og fysisk aktivitet, men det er viktig å tilpasse og tilrettelegge for den enkelte slik at hensyn til religion, kultur og tradisjon ivaretas (Lindström et al., 2010). Kulturell tilrettelegging, kommunikasjon og oppfølging øker sjansen for at ikke-vestlige innvandrere følger opp og mestrer sin diabetes.
Studier viser at det kan være manglende kunnskap om hva som er sunn mat med tanke på diabetes type 2 (Raberg Kjollesdal et al., 2011), eller de har mye kunnskap om sunn mat, men hensynet til familiens ønsker veier tyngre når de lager mat og velger råvarer (Raberg Kjollesdal et.al., 2010). Studier viser at kulturell tilrettelegging kan bidra til en gunstig endring av kostholdet (Raberg Kjollesdal et al., 2011), også tre år etter at intervensjonen er avsluttet (Helland-Kigen et al., 2013).
Referanser
132. Intention to change dietary habits, and weight loss among Norwegian-Pakistani women participating in a culturally adapted intervention https://www.helsedirektoratet.no/referanse/0002-0013-232120
133. Barriers to healthy eating among Norwegian-Pakistani women participating in a culturally adapted intervention https://www.helsedirektoratet.no/referanse/0002-0013-232121
134. Maintenance of changes in food intake and motivation for healthy eating among Norwegian-Pakistani women participating in a culturally adapted intervention https://www.helsedirektoratet.no/referanse/0002-0013-232122
135. Take action to prevent diabetes--the IMAGE toolkit for the prevention of type 2 diabetes in Europe https://www.helsedirektoratet.no/referanse/0002-0013-232123
Sist faglig oppdatert: 20.12.2019
Vektreduksjon ved diabetes type 2 og overvekt/fedme
Personer med diabetes type 2 og overvekt eller fedme bør få tilbud om et strukturert livsstilsbehandlingsprogram som varer i minst seks måneder da dette har vist klinisk relevant vekttap med bedring i en rekke metabolske risikofaktorer og i noen tilfeller remisjon av diabetes type 2. Fokus bør være på kalorirestriksjon, fysisk aktivitet og hjelp til varig atferdsendring. Målet er 5-10 % varig vektreduksjon, men større vektreduksjon gir større effekt på metabolsk kontroll og remisjon av diabetes.
Praktisk – slik kan anbefalingen følges
Hvem bør rådes til vektreduksjon?
Helsepersonell som behandler pasienter med diabetes som har fedme eller overvekt (KMI ≥ 25,0 kg/m2), bør først aktivt identifisere disse gjennom observasjon, veiing av kroppsvekt, samt måling av høyde og midjeomkrets, og deretter gi råd om vektreduksjon. Er midjemålet høyere eller lik 80 cm (kvinner) eller 94 cm (menn), foreligger også abdominal overvekt som styrker behandlingsindikasjonen. Dersom pasienten er mottagelig og motivert for konkrete råd bør den første samtalen gjennomføres så raskt som mulig.
Personer med sykelig overvekt (KMI 35 og oppover) har ekstra høy helserisiko og bør identifiseres raskt for å sikre at disse får den oppfølgingen de har krav på. Sykelig overvektig innebærer visse rettigheter hva gjelder henvisning, strukturert oppfølging ved sykehus, intensiv rehabilitering ved ulike enheter eller fedmeoperasjon.
Råd som helsepersonell kan gi
1) Informere om betydelig helsegevinst av vektreduksjon.
Pasienter som har KMI ≥ 35 kg/m2, kan ha behov for > 10-15 % vektreduksjon for god helsegevinst. En del pasienter ønsker å bli normalvektige, men selv om noen oppnår det, er normalvekt en urealistisk målsetting for de fleste. I samarbeid med pasienten (samvalg; "shared decision") bør helsearbeideren så diskutere seg frem til et meningsfullt og realistisk vektreduksjonsmål som kan nås i løpet av en periode på 3- 6 måneder. Deretter er varig endring av de nye levevanene og vektstabilisering et fornuftig mål som imidlertid krever mye og hardt arbeid.
2) Intensiv livsstilsbehandling som kan gjennomføres i primærhelsetjenesten
- Kalorirestriksjon: (F.eks. minus 500-1000 kcal/dag eller totalinntak på 1200-1800 kcal/dag). Redusert energiinntak (karbohydrater og/eller fett) er den mest effektive metoden for å oppnå vekttap. Ulike diettprinsipper (lavfett-, lavkarbo-, høyprotein-, lav glykemisk indeks) har ikke vist forskjellige effekter på varig vekttap (≥ 2 år).
- Strukturerte intensive lavkaloridietter: (Såkalte LCD-forkortelse for low calrie diets og VLCD - forkortelse for very low calorie diets, ofte omtalt som «pulverdietter» selv om de består av mange ulike typer måltider eller knekkebrød-dietter) kan også brukes for å oppnå vekttap, men viktig at disse inngår i et helhetlig vektreduksjonsprogram med oppfølging, spesielt i overgangen til vanlig mat og vektstabilisering.
- Fysisk aktivitet: (Eks. rask gange 30 minutter 5 ganger/uke) gir økt mestring, bedre helse og forebygger vektøkning etter vekttap.
- Atferdsbehandling: For å sikre gjennomføring av kalorirestriksjon og aktivitetsnivå. Hyppig oppfølging (ukentlig 3-6 måneder, deretter månedlig) individuelt og/eller i gruppe. Motiverende samtale kan være et godt verktøy for gjennomføringen av atferdsbehandling. Råd pasienten til å sette konkrete mål for atferdsendring (eks gå en rask 30 minutters tur hver ukedag fra klokken 17.30 uavhengig av vær, eller konkret erstatning hvis uvær). Selvmonitorering er en viktig del av atferdsbehandlingen. Pasient og helsearbeider bør ha regelmessige samtaler om matinntak, fysisk aktivitet og kroppsvekt. Bruk gjerne andre elementer av atferdsterapi som stimuluskontroll, problemløsning, og forebygging av tilbakefall.
3) Hva bør fastlegen gjøre av utredning
-
Anamnese: Utvikling av overvekt og fedme skyldes en ubalanse mellom inntak og forbruk av energi, men det kan være flere bakenforliggende årsaker til denne ubalansen; et fedmedisponerende samfunn fører lett til overvekt hos genetisk disponerte personer, og ved økende grad av fedme spiller psykososiale faktorer en viktig rolle. Ved uttalt fedme bør familiær opphopning av overvekt og kardiovaskulære sykdommer kartlegges, og man bør tenke på legemidler som øker risikoen for overvekt som flere antidiabetika (inkludert insulin), nevroleptika, antidepressiva, glukokortikoider og betablokkere. Kartlegg psykososiale forhold(anamnese). Utred og kartlegg evt. overvektsrelaterte somatiske og psykiatriske følgesykdommer (vanligste først).
-
Klinisk undersøkelse: Det bør gjøres en målrettet klinisk undersøkelse med tanke på blodtrykk, hypotyreose, fettlever og hudforandringer (eks striae, acanthosis nigricans). Vekt, midjemål og høyde; kalkulering av kroppsmasseindeks (KMI).
-
Diagnostisk utredning: Ved klinisk mistanke om hypotyreose eller Cushings syndrom tas TSH og fritt-T4, evt. kortisol i spytt kl. 23.00. Kartlegg andre risikofaktorer (spesielt overvektsrelaterte) for kardiovaskulær sykdom (eks. LDLkolesterol, HDL-kolesterol og triglyserider), kreft, polycystisk ovariesyndrom (fri testosteronindeks) og obstruktiv søvnapné (OSA) (søvnutredning med spesialundersøkelser; eks. polysomnografi, eller med enklere portable screeningverktøy (eks. Embletta™, ApneaLink™).
4) Hvor kan fastlegen henvise?
Hvis pasient og fastlege sammen ikke når målet, kan pasienten henvises til lokale tilbud. Frisklivssentraler og tilsvarende i mange kommuner som kan supplere oppfølging hos fastlegen med et organisert oppfølgingsprogram for vektreduksjon. I tillegg finnes det private aktører som tilbyr hjelp til vektreduksjon som kan være et godt supplement for de som ønsker hjelp og støtte til vektreduksjon.helsetjenesten, gjerne til en overvektspoliklinikk eller diabetespoliklinikk på lokalsykehuset, eller til en regional overvektspoliklinikk der det er mer naturlig. Dersom man ikke når målet med dette, kan pasienten henvises videre til spesialisthelsetjenesten, gjerne til en overvektspoliklinikk eller diabetespoliklinikk på lokalsykehuset, eller til en regional overvektspoliklinikk der det er mer naturlig.
Kaloriregnskapet
Vektøkning oppstår når energiinntaket er høyere enn energiforbruket. Motsatt kan vektreduksjon oppnås ved å redusere inntaket av mat/drikke og/eller gjennom økt fysisk aktivitet. En tommelfingerregel sier at 500 kcal redusert daglig kaloriinntak kan gi omtrent 10 kg vekttap i løpet av 12 måneder, mest de første ukene (Hall et al., 2011).
Fysisk aktivitet er viktig, men det skal mye til for å oppnå tilvarende resultater (Hjelmesæth et al., 2013): Hvileforbrenningen er omtrent 1 kcal per kilo kroppsvekt per time (eks person 100 kg - 100 kcal). Ved meget rask gange kan forbrenningen omtrent 6-dobles (person 100 kg - 600 kcal/time; 500 kcal mer enn i hvile). Dette må gjennomføres hver dag året rundt for å matche en tilsvarende kalorirestriksjon, hvilket forståelig nok er vanskelig. Fysisk aktivitet er sannsynligvis mest viktig i vektstabiliseringsfasen, både av psykologiske årsaker, for å holde på motivasjonen og for å motvirke redusert forbrenning.
Grad av energiunderskudd er avgjørende for vekttapet. Sammensetningen av kostholdet (andel fett, karbohydrater og proteiner) har derimot vist seg å ha lite å si for vekttapet, så lenge energireduksjonen er den samme (Expert Panel Report: Guidelines (2013) for the management of overweight and obesity in adults). Det er heller ikke dokumentert at noen spesielle kostmønstere (tradisjonell middelhavskost, vegetarisk/vegan-kosthold etc) gir større varig vekttap enn andre. Ved vektreduksjon gjelder derfor de samme kostrådene som for øvrig ved diabetes type 2, og sammensetningen av kosten bør tilpasses personlige preferanser, mens inntatt energi må begrenses. Det beste kostholdet for vektreduksjon er det pasienten greier å gjennomføre og etablere som varig vane og som samtidig ivaretar inntak av alle essensielle næringsstoffer.
Lavkaloridietter, low-calorie diets (LCD; 800-1200 kcal/dag) eller very-low-calorie diets (VLCD; 450-800 kcal/dag) gir raskt vekttap (1-3 kg/uke). De kan brukes i 8-16 uker for raskere initial vektreduksjon og forberedelse til overgang til intensiv livsstilsbehandling. Det anbefales at slik behandling kun tilbys som en del av et helhetlig vektreduksjonsprogram med tett oppfølging. Man bør vurdere risikoen for utvikling av spiseforstyrrelser, og informere om mulige bivirkninger relatert til raskt vekttap som gallestein og urinsyregikt.
Siden det ikke er dokumentert forskjellige effekter på vektreduksjon av LCD og VLCD (Tsai et al., 2006), mens bivirkningsprofilen synes verre ved sistnevnte, kan det være fornuftig å foreslå LCD ved behov for rask vektreduksjon. Lavkaloridietter markedsføres ofte som spesielt utviklede måltidsløsninger. Vanligvis er det pulverprodukter som blandes til supper eller shaker som skal erstatte et måltid, men det kan også være ferdiglagde produkter slik som barer, snacks og kjeks. Det er krav til at en dagsdose av disse produktene skal gi tilstrekkelig mengder av næringsstoffer til å dekke anbefalt inntak. Lavkaloridietter kan også bestå av vanlige matvarer som er satt sammen slik at kostholdet dekker behovet for alle næringsstoffer, f.eks. knekkebrødkuren som også ofte brukes før en fedmeoperasjon. Se Lavkaloridiett ved siv.no.
Lavkaloridietter kan brukes av personer med diabetes og fedme, men krever god planlegging, inkludert dosereduksjon av blodsukkersenkende legemidler og samarbeid med kvalifisert helsepersonell. VLCD bør ikke brukes av barn, ungdom, gravide og ammende, eldre (over 65 år), personer med hjertesykdom, cerebrovaskulære sykdommer, gallestein, alvorlige nyre- eller leversykdommer eller psykiske sykdommer. Kliniske erfaringer og kliniske studier tyder på at tett oppfølging i overgangen til et vektstabiliserende sunt kosthold er en forutsetning for å få til god langsiktig vektkontroll etter rask initial vektreduksjon på LCD/ VLCD (Tsai et al., 2006; Lean et al., 2018).
Pasienter og helsepersonell bør gjøres kjent med at flere typer blodsukkersenkende legemidler, spesielt insulin, sulfonylureapreparater og thiazolidinedioner, er assosiert med uønsket vektøkning som også kan vanskeliggjøre frivillig vektreduksjon. Andre preparater er mer vektnøytrale (metformin, DPP-4-hemmere) eller assosiert med moderat vektreduksjon (GLP-1-analoger og SGLT2-hemmere) (Inzucchi et al., 2015).
Mål for vektreduksjon
Mål for vektreduksjon må individualiseres, men 5-10 % vektreduksjon vil gi en god helsegevinst hos de fleste. Det er realistisk å få til med livsstilsintervensjon alene og det er tilstrekkelig for å gi klinisk signifikante effekter på diabetesrelaterte risikofaktorer som HbA1c, blodtrykk og blodlipider. Pasienter som har KMI ≥ 35 kg/m² kan ha behov for > 10-15 % vektreduksjon for god helsegevinst (Expert Panel Report: Guidelines (2013) for the management of overweight and obesity in adults). Større vekttap gir større helsegevinst og øker sannsynligheten for remisjon av diabetes.
Vektstabilisering må ses på som en kronisk behandling for å forhindre ny vektoppgang etter et initialt vekttap. Blant de viktigste tiltakene for å opprettholde et tilsiktet vekttap er regelmessig fysisk aktivitet (Wadden et al., 2011; Thomas et al., 2014)
Den som skal følge anbefalingen bør være motivert og klar for et langvarig (livslangt) atferdsendringsprosjekt som krever stor egeninnsats. Se eget kapittel om betydning av motivasjon og hvordan man kan kartlegge grad av motivasjon hos den enkelte.
Klinisk erfaring og mindre intervensjonsstudier tilsier at andre typer livsstilsintervensjonsprogram hvor man deler opp intervensjonsperioden i mindre bolker over lenger tid også kan være vellykket. Det ser ut til at vektreduksjon bedrer livskvalitet uavhengig om man har diabetes eller ikke. Størst effekt oppnås det første året, men forskjellen mellom personer som har gått ned i vekt og de som ikke har det, opprettholdes også ved senere vektoppgang. Det er enda et argument for at veiledning bør opprettholdes.
Nasjonal faglig retningslinje for forebygging, utredning og behandling av overvekt og fedme hos voksne gir mer utfyllende informasjon og praktiske tips om vektreduksjon uavhengig av diabetes.
Begrunnelse – dette er anbefalingen basert på
Grunnlaget for den sterke anbefalingen finnes i kunnskapsoppsummeringen fra amerikanske retningslinjer for overvektsbehandling Obesity Expert Panel (2013) og Look AHEAD-studiene (Wing et al., 2013; Pi-Sunyer et al., 2014; Rubin et al., 2014). Litteraturen (hovedsakelig Look AHEAD) viser overbevisende og varig effekt av intensiv livsstilsintervensjon på vekttap, HbA1c, HDL-kolesterol, systolisk blodtrykk og nyoppstått alvorlig kronisk nyresykdom, sammenliknet med et godt offentlig behandlingsalternativ (Jensen et al., 2014; Wing et al., 2013; Pi-Sunyer et al., 2014). Jo større vektreduksjonen er, jo større er effekten på HbA1c, blodlipider og blodtrykk (dose-responseffekt).
I en britisk studie som er tilkommet etter at kunnskapsoppsummeringen ble gjort i 2016, så man at vektreduksjon ved hjelp av lavkaloridiett (825-853 kcal/d) i 3-5 måneder ga diabetesremisjon (definert som HbA1c under 6,5% uten bruk av blodsukkersenkende medisiner) hos 46 % ved 1 år og 36% ved 2 år etter studiestart (Lean et al., 2018 og 2019). Sannsynligheten for diabetesremisjon øker ved økende vektreduksjon, og vektstabilisering bedrer mulighet for å opprettholde remisjon. I den britiske studien deltok personer med diabetes type 2 som hadde hatt diabetes i mindre enn 6 år og som ikke brukte insulin, men i Look AHEAD som inkluderte personer med diabetes type 2 uavhengig av sykdomslengde og behandling, observerte man også diabetesremisjon hos 11,5% ved ett år og 7,3% ved fire år i livsstilsintervensjonsgruppa (Gregg et al., 2012).
En annen studie som inkluderte personer med nyoppdaget diabetes, sammenliknet effekten av en karbohydratredusert middelhavskost og lavfettdiett med samme kalorirestriksjon (1500-1800 kcal/day). Tid før behov for ved oppstart med diabetesmedisin var primært endepunkt. Remisjon av diabetes og vekttap var to av flere sekundære endepunkter. Middelhavsgruppen hadde noe større vekttap og andelene av pasienter med komplett eller delvis remisjon av diabetes i middelhavskost-gruppen sammenliknet med lavfettgruppen var 15% vs 4% etter ett år, 10% vs 4% etter tre år og 5% vs 0% etter seks år. (Espositoet al., 2014).
Intensiv livsstilsintervensjon ga også bedre resultater på helserelatert livskvalitet og funksjon, samt færre symptomer på depresjon (Rubin et al., 2014; Rejeski et al., 2015), bedre kondisjon (Wing et al., 2013), mindre inkontinens (Phelan et al., 2012; Breyer et al., 2014), bedring av obstruktiv søvnapné (Kuna et al., 2013) og samfunnsøkonomisk gevinst (kostnadsbesparelse) (Espeland et al., 2014).
Look AHEAD-studien viste ingen signifikant effekt av intensiv livsstilsintervensjon på nyoppståtte tilfeller (insidens) av kardiovaskulær sykdom og død. Dette kan ha flere mulige forklaringer. For det første var antall kardiovaskulære hendelser lavere enn forventet med fare for redusert statistisk styrke og falskt negative funn. Det primære endepunktet ble endret etter 2 år for å bøte på dette, og man la til hospitalisering for angina pectoris i det kombinerte primære endepunkt. Dernest fikk kontrollgruppen god behandling, flere fikk statinbehandling og LDL-kolesterol sank signifikant mer i kontrollgruppen enn i livsstilsgruppen. I tillegg hadde deltagerne i Look AHEAD-studien god blodsukkerregulering i utgangspunktet (gj.sn. HbA1c 7.3%), og potensialet til forbedring i blodsukkerregulering var dermed begrenset. Forekomsten av alvorlige bivirkninger var ikke signifikant forskjellig mellom gruppene.
Effekten av vektreduksjon på total dødelighet er usikker, selv om tidligere prospektive observasjonsstudier har vist at tilsiktet vektreduksjon på 9-13 kg var assosiert med 25 % lavere totaldødelighet hos personer med overvekt og type 2-diabetes, sammenlignet med vektstabile kontroller (Williamson et al., 2000; Guidelines for the management of overweight and obesity in adults (2013), Poobalan et al., (2007); Gregg et al., 2004). Tiltroen til effektestimatet er lav fordi det i hovedsak er basert på to amerikanske kohortstudier. Vektdata er selvrapportert hvilket betyr en viss risiko for rapporteringsskjevhet, og metode for vektendring ble heller ikke oppgitt. Likevel støtter funnene fra Look-AHEAD og observasjonsstudiene antakelsen om at frivillig vektreduksjon ikke øker dødeligheten hos personer med diabetes type 2 og overvekt. Det er lite trolig at det vil bli gjennomført randomiserte kontrollerte studier som kan gi oss sikkert svar på om tilsiktet vektreduksjon hos personer med diabetes type 2 kan redusere dødelighet, da slike studier vil være svært krevende og kostbare å gjennomføre.
Resultatene av en prospektiv kohortstudie som ble publisert i 2019 gir ytterligere støtte til anbefalingen om vektreduksjon ved diabetes type 2 og overvekt/fedme. Studien viste reduksjon i HbA1c, bedring i blodlipider og en lavere forekomst av kardiovaskulære hendelser over en 10-årsperiode blant personer med diabetes type 2 som gikk ned 5% eller mer det første året etter at diagnosen ble stilt, sammenlignet med de som holdt seg vektstabile (HR 0,52, 95% konfidensintervall 0,32-0,86) (Strelitz et al., 2019).
Alt i alt vil de mange positive effektene av vektreduksjon oppnådd ved livsstilsintervensjon hos denne pasientgruppen, oppveie for usikkerheten om hvorvidt den samme behandlingen vil kunne medføre redusert dødelighet og kardiovaskulær sykelighet. Risikoen for negative bieffekter er dessuten svært liten. Dette er grunnlaget for at denne er en sterk anbefaling.
Forskningsgrunnlag
Populasjon (P): Personer med diabetes type 2 og overvekt
Tiltak (I): Intensiv livsstilsbehandling av minst 6 måneders varighet med fokus på kalorirestriksjon, fysisk aktivitet og varig adferdsendring
Sammenligning (C): Standard god behandling
Beskrivelse av inkluderte studier
Ett års intensiv livsstilsbehandling i Look AHEAD-studien (1 sesjon/uke første halvår, deretter 3 sesjoner/mnd det første året, mindre hyppig de neste tre år og minst to sesjoner årlig deretter) med fokus på kalorirestriksjon, fysisk aktivitet og varig atferdsendring ga et klinisk betydningsfullt (≥ 5 %) og varig (8 år) vekttap hos halvparten av deltakerne. Omtrent 1 av 3 deltakere i kontrollgruppen, som mottok et godt standard amerikansk behandlingstilbud, hadde et tilsvarende vekttap (absolutt forskjell 14 %; NNT=7).
Jo større vekttap er, jo større er de positive effektene på HbA1c, lipider og blodtrykk. To studier fra Look AHEAD –gruppen (2014) tyder på at intensiv behandling kan forebygge nye tilfeller av alvorlig kronisk nyresykdom (NNR=47) (Look AHEAD Research Group 2014), og at intensiv behandling medfører færre døgn på sykehus og mindre bruk av reseptbelagte medikamenter (gjennomsnittlig besparing 600 dollar per år per behandlet pasient) (Espeland MA 2014). Likevel fant man ikke at intensiv behandling reduserer forekomsten av kardiovaskulær sykdom eller død i Look-AHEAD studien (Look AHEAD Research Group 2013). Det foreligger ingen informasjon som tyder på fare for alvorlige bivirkninger.
Vurdering
Fordeler og ulemper
Livsstilsbehandlingsprogrammet som anbefales er i tråd med det som ble gjennomført i Look-AHEAD-studien. Forskerne fant at ett års intensiv livsstilsbehandling med hyppige sesjoner (1 sesjon/uke første halvår, deretter 3 sesjoner/mnd det første året, mindre hyppig de neste tre år og minst to sesjoner årlig deretter), delvis gjennom individuelle konsultasjoner og delvis gjennom gruppesamlinger og fokus på kalorirestriksjon oppnådd gjennom ulike diettmetoder (f.eks. ferdigretter, shakes etc.) , 175 min fysisk aktivitet per uke og varig adferdsendring, ga et klinisk betydningsfullt (≥ 5 %) og varig (8 år) vekttap hos halvparten av deltakerne. Omtrent 1 av 3 deltakere i kontrollgruppen, som mottok et godt standard behandlingstilbud, hadde et tilsvarende vekttap (absolutt forskjell 14 %; NNT=7) (Wing et al., 2013).
Økende vekttap gir økende positive effekter på HbA1c, lipider og blodtrykk. To studier fra Look AHEAD–gruppen (2014) som ikke er inkludert i evidensprofilen, tyder på at intensiv livsstilsbehandling kan forebygge nye tilfeller av alvorlig kronisk nyresykdom (NNT=47) (Pi-Sunyer et al., 2014), og at intensiv behandling medfører færre døgn på sykehus og mindre bruk av reseptbelagte legemidler (Espeland et al., 2014). Det er ikke vist at intensiv livsstilsbehandling reduserer forekomsten av kardiovaskulær sykdom eller død , men gir mange andre positive helseeffekter utover de metabolske og renale, inklusiv mindre søvnapné, bedre insulinfølsomhet, mindre urininkontinens og bedre fysisk mobilitet (Dutton et al., 2015; Lewis et al., 2015). Det foreligger heller ingen informasjon om alvorlige bivirkninger av slik behandling. Look AHEAD-studien viste også at intensiv livsstilsbehandling både reduserte risikoen for utvikling av moderate til alvorlige symptomer på depresjon, samt aldersrelatert forverring av fysisk helserelatert livskvalitet (Rubin RR, et al., 2014).
Økende vekttap i DIRECT-studien økte sannsynligheten for remisjon diabetes type 2 (definert som HbA1c < 6,5 % eller 48 mmol/mol uten medisiner) hos personer som hadde hatt diabetes i opp til 6 år og som ikke brukte insulin. Vekttapet ble oppnådd ved hjelp av en lavkaloridiett (LCD) som erstatning for alle måltider, totalt 825-853 kcal/d i form av spesialmåltider (shaker og supper) som er laget for å dekke dagsbehov for næringsstoffer. Deltagerne ble bedt om å spise utelukkende dette i 3-5 mnd. De hadde deretter en gradvis overgang til et sunt sammensatt kosthold bestående av vanlig mat, energiberegnet for å opprettholde vekttapet de hadde oppnådd i første fase av vektreduksjonsprogrammet. De ble hele tiden fulgt opp av spesialtrenede sykepleiere og klinisk ernæringsfysiologer som var tilknyttet pasientens fastlegekontor og som hadde fått åtte timers opplæring i metoden.. Overgangen til vanlig mat og vedlikeholdelse-programmet var i følge studieledelsen den mest krevende delen av programmet og avgjørende for at pasientene i stor greide å opprettholde det initiale vekttapet. Tilsvarende organisert oppfølging tilbys ikke rutinemessig i Norge per dato. LCD-produkter er lett tilgjengelig og kan kjøpes reseptfritt, men erfaringer fra denne og flere andre studier, samt klinisk erfaring blant forfatterne av retningslinjene, tilsier at det bør legges en plan for oppfølging hvis personer med diabetes ønsker å gå ned i vekt ved hjelp av LCD-produkter, for å sikre overgangen til et sunt kosthold som i størst mulig grad opprettholder vekttapet. Det foreligger imidlertid god dokumentasjon på at kalorirestriksjon med bruk av vanlige matvarer, riktig sammensatt av kyndige fagpersoner, for eksempel en variant av knekkebrød-dietten, kan gi minst like god vektreduksjon (Johnson LK 2015).
Det er relativt stor risiko for at personer som har hatt remisjon av diabetes får tilbakefall av sykdommen i løpet av noen år. Dette skyldes oftest vektøkning, men også aldersindusert redusert betacellefunksjon, redusert muskelmasse, og redusert fysisk aktivitet. Likevel kan vektstabilisering og økt fysisk aktivitet bidra vesentlig til å forbygge eller utsette tilbakefall. Remisjon av diabetes kan bidra til reduserte legemiddelkostnader, redusert stigmatisering, høyere livskvalitet, samt reduksjon av diabetesrelaterte komplikasjoner, og remisjon kan derfor være et velbegrunnet og godt mål for en del pasienter med diabetes type 2.
Kvalitet på dokumentasjonen
Høy tiltro til effektestimatene for HbA1c, lipider og blodtrykk.
Lav til moderat tiltro til effektestimatet for kardiovaskulær sykdom, død eller hospitalisering for angina pectoris og effektestimatet for død uansett årsak.
Moderat tiltro til effektestimatet for alvorlig kronisk nyresykdom (ikke laget evidensprofil).
Verdier og preferanser
Vår erfaring fra ulike deler av helsetjenesten og fra Diabetesforbundet, er at brukerne setter stor pris på et godt konservativt behandlingstilbud som vektlegger både kost, fysisk aktivitet og veiledning til adferdsendring. Å gjennomføre livslange endringer i levevaner er krevende og avhengig av at den enkelte selv ønsker og har evne til å gjennomføre endringene, samt at pasienten får den støtte og oppfølging som trengs. Gjentatte mislykkede forsøk på vektreduksjon kan ha negative effekter på helse, livskvalitet og mestringsfølelse. Det er derfor viktig at de som ønsker det får et kvalitetssikret varig tilbud, og at de følges opp av helsepersonell med tilstrekkelig kompetanse.
Referanser
136. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232124
137. Effect of a long-term behavioural weight loss intervention on nephropathy in overweight or obese adults with type 2 diabetes: a secondary analysis of the Look AHEAD randomised clinical trial https://www.helsedirektoratet.no/referanse/0002-0013-232125
138. Impact of an intensive lifestyle intervention on use and cost of medical services among overweight and obese adults with type 2 diabetes: the action for health in diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232126
140. Impact of intensive lifestyle intervention on depression and health-related quality of life in type 2 diabetes: the Look AHEAD Trial https://www.helsedirektoratet.no/referanse/0002-0013-232128
141. The Look AHEAD Trial: A Review and Discussion Of Its Outcomes https://www.helsedirektoratet.no/referanse/0002-0013-232129
142. Aging and physical function in type 2 diabetes: 8 years of an intensive lifestyle intervention https://www.helsedirektoratet.no/referanse/0002-0013-232130
144. Intensive lifestyle intervention reduces urinary incontinence in overweight/obese men with type 2 diabetes: results from the Look AHEAD trial https://www.helsedirektoratet.no/referanse/0002-0013-232132
145. Long-term effect of weight loss on obstructive sleep apnea severity in obese patients with type 2 diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232133
146. Intentional weight loss and mortality among overweight individuals with diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232134
148. rying to lose weight, losing weight, and 9-year mortality in overweight U.S. adults with diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232136
149. Quantification of the effect of energy imbalance on bodyweight https://www.helsedirektoratet.no/referanse/0002-0013-232137
150. Exercise yourself thin--a myth? https://www.helsedirektoratet.no/referanse/0002-0013-232138
151. National Institute for Health and Clinical Excellence: Guidance. Obesity: Identification, Assessment and Management of Overweight and Obesity in Children, Young People and Adults: Partial Update of CG43. London: National Institute for Health and Care Excellence (UK) https://www.helsedirektoratet.no/referanse/0002-0013-232139
152. The evolution of very-low-calorie diets: an update and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-232140
153. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232141
154. Four-year weight losses in the Look AHEAD study: factors associated with long-term success https://www.helsedirektoratet.no/referanse/0002-0013-232142
155. Weight-loss maintenance for 10 years in the National Weight Control Registry https://www.helsedirektoratet.no/referanse/0002-0013-232143
156. Executive summary: Guidelines (2013) for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Obesity Society published by the Obesity Society and American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Based on a systematic review from the The Obesity Expert Panel, 2013 https://www.helsedirektoratet.no/referanse/0002-0013-232144
157. AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society https://www.helsedirektoratet.no/referanse/0002-0013-232145
228. Primary care-led weight management for remission of type 2 diabetes (DiRECT): an open-label, cluster-randomised trial. https://www.helsedirektoratet.no/referanse/0002-0013-232216
229. Durability of a primary care-led weight-management intervention for remission of type 2 diabetes: 2-year results of the DiRECT open-label, cluster-randomised trial. https://www.helsedirektoratet.no/referanse/0002-0013-232217
230. The effects of a Mediterranean diet on the need for diabetes drugs and remission of newly diagnosed type 2 diabetes: follow-up of a randomized trial. https://www.helsedirektoratet.no/referanse/0002-0013-232218
231. Association of an intensive lifestyle intervention with remission of type 2 diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232219
232. Moderate weight change following diabetes diagnosis and 10 year incidence of cardiovascular disease and mortality. https://www.helsedirektoratet.no/referanse/0002-0013-232220
233. Fructose content of low calorie diets: effect on cardiometabolic risk factors in obese women with polycystic ovarian syndrome: a randomized controlled trial. https://www.helsedirektoratet.no/referanse/0002-0013-232221
Sist faglig oppdatert: 20.12.2019
Vektreduserende kirurgi og diabetes type 2
Dersom intensiv livsstilsbehandling (atferdsbehandling, kalorirestriksjon, fysisk aktivitet og eventuelt vektreduserende legemidler) ikke har gitt tilfredsstillende effekt, foreslås det vektreduserende kirurgi som et behandlingsalternativ for personer med diabetes type 2 og fedme grad 2-3 (KMI ≥35 kg/m²), uavhengig av hvor lenge pasienten har hatt diabetes.
Vektreduserende kirurgi kan også være aktuelt hos enkelte pasienter med KMI <35 kg/m² etter en grundig utredning og vurdering av et tverrfaglig team med spesiell ekspertise på vektreduserende kirurgi (tredjelinjetjeneste/regionalt senter).
Praktisk – slik kan anbefalingen følges
- Fedme grad 1 = KMI 30,0–34,9 kg/m²
- Fedme grad 2 = KMI 35,0–39,9 kg/m²
- Fedme grad 3 = KMI ≥ 40,0 kg/m²
Vektreduserende kirurgi bør ikke tilbys ved:
- aktivt rusproblem
- alvorlig psykiatrisk sykdom
- hvis pasienten ikke er i stand til eller ikke vil følge tiltakene som er nødvendige etter inngrepet.
For øvrig er minimumskravet som før (for de med diabetes type 2, fedme grad 2-3).
- Pasienten skal ha gjennomført ett eller flere seriøse livsstilsendringsforsøk av minst 6 måneders varighet uten å ha nådd behandlingsmålet,
- Pasienten bør orienteres om mulighetene for tilleggsbehandling med vektreduserende kirurgi.
- Legen bør orientere pasienten om fordeler og ulemper ved kirurgisk behandling, før pasient og lege sammen bli enige om eventuell henvisning til en tverrfaglig overvektspoliklinikk for vurdering.
Siden det mangler dokumentasjon på om nytten er større enn kostnaden (effekt versus bivirkninger) bør pasienter med fedme grad 1 og diabetes som vurderer vektreduserende kirurgi utredes grundig av en tverrfaglig sammensatt ekspertgruppe med spesialkompetanse på diabetes og vektreduserende kirurgi (tredjelinjetjeneste/regionalt senter) (NICE, 2014; Giske et al., 2018). Minimumskravet for at en slik vurdering skal gjøres, er som ellers ved fedme grad 2-3.
Begrunnelse – dette er anbefalingen basert på
Kunnskapsgrunnlaget for den allerede etablerte behandlingen med vektreduserende kirurgi ved diabetes type 2 og KMI 35 og høyere, framkommer i en kunnskapsoppsummering utført av Kunnskapssenteret i 2014 (Giske et al., 2014). Senere er det kommet flere studier som styrker tilliten vår til effektestimatene som man kom fram til i Kunnskapssenterets rapport (Mingrone et al., 2015; Courcoulas et al., 2015; Ikramuddin et al., 2015): Det er god dokumentasjon for at vektreduserende kirurgi, med sleeve og gastrisk bypass, reduserer vekten i størrelsesorden 25-30% vektreduksjon med nadir etter 1-2 år. Deretter stiger vekten fra en halv (½) til to prosent årlig med stor individuelle variasjoner (Mingrone et al., 2015). Vektreduksjonen har en positiv effekt på HbA1c, blodlipider og blodtrykk, men det observeres også en bedring i HbA1c før vektreduksjon. I de amerikanske retningslinjene (Guidelines 2013 for the management of overweight and obesity in adults, 2014) vurderer de at det er en høyere sannsynlighet for diabetesremisjon 2-3 år etter vektreduserende kirurgi enn all annen konservativ behandling og at kvaliteten på kunnskapsgrunnlaget er høy.
Langtidseffekten av vektreduserende kirurgi er likevel usikker, selv om tre nyere studier av høy kvalitet som har sammenliknet effekten av gastrisk bypass og sleeve-gastrektomi 5 år etter inngrepet, viste relativt tilfredsstillende varig vektreduksjon og god metabolsk kontroll hos deltakere med diabetes type 2 (Schauer et al., 2017, Salminen et al., 2018, Peterli et al., 2018). Ingen av disse studiene var designet for å sammenlikne effekten av gastrisk bypass og sleeve-gastrektomi på remisjon av diabetes, men de rapporterte likevel at de ikke fant signifikante forskjeller mellom de kirurgiske metodene. En ny trippelblindet randomisert kontrollert studie fra Vestfold (Oseberg study; Hofsø et al., 2019) var designet for dette formålet og viste at gastrisk bypass ga signifikant høyere remisjonsrate 1 år etter operasjon, 75% versus 48%, samt at vekttapet var signifikant høyere etter gastrisk bypass enn sleeve-gastrektomi (29% versus 23%). Dette bør pasienter som ønsker remisjon informeres om før de velger operasjonstype. Det planlegges langtidsoppfølging av disse pasientene.
En norsk registerstudie av nærmere 2000 pasienter (500 med diabetes) behandlet ved Senter for sykelig overvekt i Helse Sør-Øst ved Sykehuset i Vestfold, med median oppfølging på 6,5 år, viste at de som hadde gjennomgått vektreduserende kirurgi hadde en betydelig bedring i følgesykdommer som høyt blodtrykk og diabetes, sammenliknet med de som ble behandlet med intensiv medisinsk behandling (Jakobsen et al., 2018). Kirurgigruppen hadde imidlertid også økt forekomst av kirurgirelaterte komplikasjoner og behandlingskrevende angst og depresjon, samt økt forbruk av sterke smertestillende medisiner.
Mulige langsiktige fordeler og ulemper med vektreduserende kirurgi hos personer med diabetesvarighet under 10 år og/eller med fedme grad 1 kan ikke estimeres ut fra de få foreliggende studiene. Prosentuell vektreduksjon er klart større etter vektreduserende kirurgi på kort sikt – også hos denne gruppen, men kunnskapsgrunnlaget kommer fra studier med høy grad av bias, ingen studier har forhåndsstratifisert på fedmegrad (1 - 3) eller diabetesvarighet, og overførbarheten er lav. Folkehelseinstituttet utarbeidet en ny metodevurdering i 2018 som konkluderte med at "Fedmekirurgi ved diabetes type 2 og KMI under 35 kan gi remisjon av diabetes og lavere konsentrasjon av HbA1c sammenliknet med behandling med legemidler. Tilliten til denne dokumentasjonen er middels. På grunn av kort oppfølgingstid i studiene er det vanskelig å forutsi hvordan fedmekirurgi påvirker framtidige helseeffekter og helsekostnader ved diabetes. Effekt og sikkerhet utover to år bør undersøkes i videre studier" (Giske et al., 2018). Det anbefales derfor at vektreduserende kirurgi ved diabetes type 2 og fedme grad 1 kun bør tilbys etter en grundig utredning og tverrfaglig vurdering i regionalt senter med ekspertise på diabetes og vektreduserende kirurgi.
Livskvalitet, målt som samleskårer for fysisk helse, kan trolig bedres ved vektreduserende kirurgi på kort sikt, mens resultatene for mental helse og sosial fungering er usikre og til dels sprikende (Giske et al., 2014). Vektreduserende kirurgi er ikke dokumentert å være mer effektiv enn ikke-operativ behandling på psykiske symptomer som angst og depresjon på lang sikt. En ny systematisk oversiktsartikkel som inkluderte sju observasjonsstudier og oppfølgingstid fra 5-10 år konkluderte med at pasienter som fikk vektreduserende kirurgi rapporterte lav helserelatert livskvalitet (HRQoL) før operasjon og en betydelig forbedring etter (Andersen et al., 2015). En stor del av forbedringen av HRQoL ble opprettholdt hele oppfølgingstiden.
Forskningsgrunnlag
Populasjon (P): Personer med diabetes type 2 og BMI <35 kg/m²
Tiltak (I): Fedmekirurgi
Sammenligning (C): Annen standard god behandling
Beskrivelse av inkluderte studier
Vurdering
Fordeler og ulemper
Fordeler
Effektiv behandling: Vektreduserende kirurgi øker muligheten for varig vektreduksjon, tilbakegang av diabetes (remisjon) og bedre diabeteskontroll. Kunnskapssenteret hadde middels tillit til den samlede effekten av tilbakegang av diabetes inntil studiene av Mingrone et al., 2015; Courcoulas AP 2015; Ikramuddin et al., 2015 kom (Giske et al., 2014 og 2018). Se side 73 i rapport til Kunnskapssenteret (Giske et al., 2014).
Langtidsresultatene fra en ublindet randomisert kontrollert singelsenterstudie fra Italia viste at 15 av 20 pasienter (75%) som ble operert med gastrisk bypass hadde remisjon av diabetes etter 2 år, mens bare 7 av 19 (37%) hadde remisjon etter 5 år (Mingrone et al., 2015). Liknende resultater ble rapportert i en substudie av diabetespasienter i en stor svensk prospektiv matchet kohortstudie (SOS-studien) av pasienter som viste at omtrent halvparten av de som hadde remisjon 2 år etter restriktiv kirurgi (få med gastrisk bypass) var frie for diabetes etter 10 år (72% vs 38%) (Sjöström et al., 2014). Økende alder og vektøkning er to mulige forklaringer på tilbakefall av diabetes. De fleste studier viser at vektreduserende kirurgi gir 25-30% (sleeve og gastrisk bypass) vektreduksjon med nadir etter 1-2 år. Deretter stiger vekten fra en halv (½) til to prosent årlig med stor individuelle variasjoner (Mingrone et al., 2015).
Få alvorlige komplikasjoner: De vanligste operasjonsmetodene (gastrisk bypass og sleeve-gastrektomi) utføres laparoskopisk, og internasjonale registerdata viser at faren for postoperative alvorlige komplikasjoner (blødning, infeksjon, lekkasje) og død er lav (komplikasjoner < 4% og død ≤ 1 promille) (Stenberg et al., 2014; Lazzati et al., 2016). Det foreligger ikke tilstrekkelig dokumentasjon om mulige fordeler og ulemper med vektreduserende kirurgi hos personer med diabetes type 2 og fedme grad 1. Likevel åpner de nylig oppdaterte NICE-retningslinjene for at pasienter med nyoppstått (< 10 år) diabetes og fedme grad 1 unntaksvis kan henvises til høyspesialiserte sentre (Norge: regionale sentre) for vurdering av vektreduserende kirurgi (NICE 2014; Schauer et al., 2014).
Bedring i livskvalitet: Fedme gir ofte redusert livskvalitet, sosial problemer og stigmatisering (WHO, 2000). Kunnskapssenterets rapport fra 2014 om Langtidseffekter etter vektreduserende kirurgi konkluderte med at livskvalitet, målt gjennom ulike spørreskjema som samleskårer for fysisk helse og for mental helse og sosial fungering, viste bedre fysisk helse i operasjonsgruppen enn i ikke-opererte grupper etter ett og to år (fem studier) (Giske et al., 2014). Rapporten oppgir ikke effektestimater og de anser kvaliteten på dokumentasjonen for effekten på fysisk helse til å være lav. For samleskårer på mental helse og sosial fungering oppgir de kvaliteten på dokumentasjonen til å være svært lav. En nyere (2015) oversiktsartikkel som inkluderte sju observasjonsstudier og oppfølgingstid fra 5-10 år konkluderte med at pasienter som fikk vektreduserende kirurgi rapporterte lav helserelatert livskvalitet (HRQoL) før operasjon og en betydelig forbedring etter (Andersen et al., 2015). En stor del av forbedringen av HRQoL ble opprettholdt hele oppfølgingstiden.
Ulemper
Tidlige komplikasjoner: Kirurgiske og medisinske postoperative komplikasjoner som blødning, infeksjon, skade på tarm, lekkasje fra tarm til bukhule, tarmslyng, blodpropp eller akutt hjerte- og karsykdom og lungesykdom forekommer hos < 4% av de som opereres for overvekt. Magesår kan oppstå i den nye koplingen mellom magesekk og tynntarm etter gastrisk bypass og i restmagesekken etter sleeve-gastrektomi.
Tidlige plager: De vanligste plagene etter gastrisk bypass og sleeve-gastrektomi er kvalme, oppkast, gulping, luftsmerter, sure oppstøt, forstoppelse og diaré.
Senere komplikasjoner og plager: Typiske plager etter vektreduserende kirurgi er at man fryser mer og mister hår. Dette er mest uttalt i vektreduksjonsfasen og normaliserer seg oftest etter som vekten stabiliseres.
Psykiske plager: Psykiske plager reduseres ofte etter vektreduserende kirurgi. Det er likevel viktig å være klar over at enkelte kan utvikle eller få tilbakefall av tidligere psykiske lidelser og spiseforstyrrelser, og at risikoen for selvskade (Bhatti et al., 2015) og selvmord (Adams et al., 2015) er noe høyere enn før operasjon, spesielt hos de som har hatt psykisk sykdom tidligere. Pasienter med alvorlig psykisk sykdom trenger tett oppfølging fra både lokale overvektssentre, fastlege og psykiatrisk spesialisthelsetjeneste.
Ernæringsmangler: Det er fare for mangler på flere viktige vitaminer og mineraler (vanligst er kalsium, vitamin D, jern og vitamin B12) etter begge typer operasjon, men spesielt etter gastrisk bypass.
Plager og komplikasjoner etter gastric bypass
Dumping, også kalt "tidlig dumping", er vanlig spesielt etter gastrisk bypass og skyldes blant annet at sukkerholdige drikker og matvarer trekker væske inn i tynntarmen. Dette fører til symptomer som; magesmerter, kvalme, oppkast, diaré, slapphet, hjertebank, kaldsvetting og svimmelhet. Disse symptomene oppstår som regel innen en halvtime etter måltidet.
Lavt blodsukker (hypoglykemi), også kalt "sen dumping", oppstår ikke så sjelden etter gastrisk bypass og skyldes trolig at bukspyttkjertelen skiller ut for mye insulin etter et måltid. Lavt blodsukker kan oppstå en til tre timer etter matinntak, symptomene kan minne om dumping. Denne bivirkningen kan oppstå både kort og lang tid etter gastrisk bypass.
Indre brokk og tarmslyng er en alvorlig komplikasjon som kan oppstå både kort og lang tid etter gastrisk bypass. Tilstanden kjennetegnes ved akutt innsettende, og i enkelte tilfeller varierende, kraftige magesmerter. Tilstanden er alvorlig og krever rask vurdering av lege (øyeblikkelig hjelp).
Enkelte pasienter får kroniske magesmerter etter vektreduserende kirurgi, og det er ikke alltid man finner årsaken til dette.
Plager og komplikasjoner som kan oppstå etter sleeve-gastrektomi.
Ved sleeve-gastrektomi fjernes en stor del av magesekken, men tarmen kuttes ikke som ved gastrisk bypass. Risikoen for indre brokk, vitamin- og mineralmangler, dumping og lavt blodsukker etter måltider er derfor sannsynligvis lavere etter sleeve-gastrektomi enn etter gastrisk bypass. Risikoen for sure oppstøt og halsbrann er derimot høyere etter sleeve-gastrektomi.
Plager på grunn av overflødig hud
Store vekttap etter vektreduserende kirurgi medfører gjerne overflødig hud, noe som kan gi et stigmatiserende utseende og uttalte fysiske og psykiske plager. Kroppsformende kirurgi kan bidra til økt livskvalitet og høyere funksjonsnivå. Mange plastikkirurger setter imidlertid grensen for kroppsformende kirurgi ved KMI < 28 kg/m2. De fleste overvektsopererte har KMI ≥ 30 kg/m2, og en søknad om kroppsformende kirurgi for disse pasientene blir dermed ofte avslått, med unntak av der det er tungtveiende medisinske årsaker (Gunnarson et al., 2015).
Kvalitet på dokumentasjonen
Det er ikke gjort en egen gjennomgang av kvalitet på kunnskapsgrunnlaget for diabetesremisjon ved vektreduserende kirurgi. Kunnskapssenteret hadde middels tillit til den samlede effekten av tilbakegang av diabetes med oppfølging inntil 10 år i sin rapport fra 2013. Senere er det kommet tre studier som styrker tilliten vår til estimatene (Mingrone et al., 2015; Courcoulas et al., 2015; Ikramuddin et al., 2015). I de amerikanske retningslinjene (Guidelines 2013 for the management of overweight and obesity in adults, 2014) vurderer de at det er en høyere sannsynlighet for diabetesremisjon 2-3 år etter vektreduserende kirurgi enn all annen konservativ behandling og at kvaliteten på kunnskapsgrunnlaget er høy.
Langtidseffekten av vektreduserende kirurgi er likevel usikker og i de amerikanske retningslinjene er styrken på kunnskapsgrunnlaget vurdert som lav.
Det er svært lav/lav tiltro til effektestimatene for prosentuell vektreduksjon og remisjon av diabetes for de med kortere diabetesvarighet og KMI under 35 (NICE, 2014).
Verdier og preferanser
Vektreduserende kirurgi kan fungere godt for noen, men ikke for alle. Det er vesentlig at det også gjøres en psykologisk vurdering som del av den tverrfaglige utredningen før ev. vektreduserende kirurgi. Her må forventninger til resultat av inngrepet kartlegges og diskuteres, også de psykologiske sidene ved dramatisk vektreduksjon: Endring i identitet, hvordan pasienten og omverden ser vedkommende, samt endring i relasjoner til andre. Relativt mange har et problematisk forhold til mat og kan ha overspist pga. av angst, depresjon eller andre psykiske plager.
Det er en overhyppighet av personer som har vært utsatt for overgrep i denne pasientgruppen. Pasienten må forberedes på at de fortsatt må gjøre en stor innsats selv, både for å gå ned i vekt og for å opprettholde den nye vekten. Ikke alle problemer blir løst ved at vekten går ned, selv om at de fleste opplever bedre livskvalitet etter vektreduserende kirurgi, men nye problemer kan også oppstå, som nevnt under «fordeler og ulemper».
Fedme gir ofte redusert livskvalitet, sosial problemer og stigmatisering (WHO, 2000). Kunnskapssenterets rapport fra 2014 om Langtidseffekter etter vektreduserende kirurgi konkluderte med at livskvalitet, målt gjennom ulike spørreskjema som samleskårer for fysisk helse og for mental helse og sosial fungering, viste bedre fysisk helse i operasjonsgruppen enn i ikke-opererte grupper etter ett og to år (fem studier) (Giske et al., 2014). Rapporten oppgir ikke effektestimater og de anser kvaliteten på dokumentasjonen for effekten på fysisk helse til å være lav. For samleskårer på mental helse og sosial fungering oppgir de kvaliteten på dokumentasjonen til å være svært lav.
Fysisk helse:
Etter seks og ti år viste resultatene endring til det bedre for fysisk helse i to studier (Dixon et al., 2012, O'Brien et al., 2006), men ingen forskjell i skåringsverdi ved oppfølgingstidspunkt ved metoden vertikal båndkirurgi (Sjöholm et al., 2013).
Mental helse og sosial fungering:
Resultatene for samleskårene på mental helse og sosial fungering var sprikende. To studier viste ingen forskjell mellom operasjonsgruppene og ikke-opererte grupper (Dixon et al., 2012; O'Brien et al., 2006), og tre studier viste bedre mental helse og sosial fungering i operasjonsgruppen etter to år (O'Brien et al., 2010: Adams et.al., 2010 og 2012). Etter seks år var det ingen forskjell mellom gruppene i Utah-studien (Adams et al., 2012), mens SOS-studien med ti års oppfølging viste endring til det bedre i operasjonsgruppen, men ingen forskjell mellom gruppene i skåringsverdi ved oppfølgingstidspunkt. (Metode: gastric bypass) (Sjöholm et al., 2013).
Psykiske symptomer:
Fire studier undersøkte effekt av vektreduserende kirurgi på psykiske symptomer (Dixon et al., 2012; Buddeberg-Fischer et al., 2006; Schowalter et al., 2008; Karlsson et al., 1998 og 2007).
Det var ingen påviselig forskjell mellom operasjonsgruppene og ikke-opererte grupper i symptomer på angst og depresjon rapportert i forskjellige spørreskjema, med unntak var SOS-studien, som fant mindre symptomer på angst og depresjon etter to år (Karlsson et al., 1998), men mer symptomer på angst i operasjonsgruppen og ingen forskjeller mellom gruppene i symptomer på depresjon etter ti år (Karlsson et al., 2007). Rapporten oppgir ikke effektestimater for utfallene, og vurderer kvaliteten på dokumentasjonen til å være svært lav.
En ny (2016) systematisk oversikt og metaanalyse konkluderer med at vektreduserende kirurgi er assosiert med en reduksjon i forekomsten av depresjon (7 studier; 8%-74% reduksjon) og reduksjon i alvorlighetsgraden av symptomer (Dawes et al., 2016). Kunnskapsgrunnlaget ble vurdert til å være av moderat kvalitet (GRADE).
Referanser
156. Executive summary: Guidelines (2013) for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Obesity Society published by the Obesity Society and American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Based on a systematic review from the The Obesity Expert Panel, 2013 https://www.helsedirektoratet.no/referanse/0002-0013-232144
158. Bariatric-metabolic surgery versus conventional medical treatment in obese patients with type 2 diabetes: 5 year follow-up of an open-label, single-centre, randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-232146
159. Three-Year Outcomes of Bariatric Surgery vs Lifestyle Intervention for Type 2 Diabetes Mellitus Treatment: A Randomized Clinical Trial https://www.helsedirektoratet.no/referanse/0002-0013-232147
160. Roux-en-Y gastric bypass for diabetes (the Diabetes Surgery Study): 2-year outcomes of a 5-year, randomised, controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-232148
161. Association of bariatric surgery with long-term remission of type 2 diabetes and with microvascular and macrovascular complications https://www.helsedirektoratet.no/referanse/0002-0013-232149
162. Early complications after laparoscopic gastric bypass surgery: results from the Scandinavian Obesity Surgery Registry https://www.helsedirektoratet.no/referanse/0002-0013-232150
163. Reduction in early mortality outcomes after bariatric surgery in France between 2007 and 2012: A nationwide study of 133,000 obese patients https://www.helsedirektoratet.no/referanse/0002-0013-232151
164. Bariatric surgery versus intensive medical therapy for diabetes--3-year outcomes https://www.helsedirektoratet.no/referanse/0002-0013-232152
165. Health-related quality of life after bariatric surgery: a systematic review of prospective long-term studies https://www.helsedirektoratet.no/referanse/0002-0013-232153
166. Plastic surgery after bariatric surgery https://www.helsedirektoratet.no/referanse/0002-0013-232154
167. Mental Health Conditions Among Patients Seeking and Undergoing Bariatric Surgery: A Meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-232155
168. Health care use during 20 years following bariatric surgery https://www.helsedirektoratet.no/referanse/0002-0013-232156
169. Self-harm Emergencies After Bariatric Surgery: A Population-Based Cohort Study. https://www.helsedirektoratet.no/referanse/0002-0013-232157
170. All-Cause and Cause-Specific Mortality Associated with Bariatric Surgery: A review. https://www.helsedirektoratet.no/referanse/0002-0013-232158
171. Evaluation of current eligibility criteria for bariatric surgery: diabetes prevention and risk factor changes in the Swedish obese subjects (SOS) study. https://www.helsedirektoratet.no/referanse/0002-0013-232159
172. Treatment of mild to moderate obesity with laparoscopic adjustable gastric banding or an intensive medical program: a randomized trial. https://www.helsedirektoratet.no/referanse/0002-0013-232160
173. Physical and psychosocial outcome in morbidly obese patients with and without bariatric surgery: a 4 1/2-year follow-up https://www.helsedirektoratet.no/referanse/0002-0013-232161
174. Changes in depression following gastric banding: a 5- to 7-year prospective study. https://www.helsedirektoratet.no/referanse/0002-0013-232162
175. Swedish obese subjects (SOS) - an intervention study of obesity. Two-year follow-up of health-related qualtiy of life (HRQL) and eating behavior after gastric surgery for severe obesity. https://www.helsedirektoratet.no/referanse/0002-0013-232163
176. Ten-year trends in health-related quality of life after surical and conventional treatment for severe obesity: The SOS intervention study. https://www.helsedirektoratet.no/referanse/0002-0013-232164
177. National Institute for Health and Clinical Excellence: Guidance. Obesity: Identification, Assessment and Management of Overweight and Obesity in Children, Young People and Adults: Partial Update of CG43. London: National Institute for Health and Care Excellence (UK) https://www.helsedirektoratet.no/referanse/0002-0013-232165
178. Giske L, Lauvrak V, Elvsaas I-K Ø, Hofmann B, Håvelsrud K, Vang V, Fure B. Langtidseffekter etter fedmekirurgi. Rapport fra Kunnskapssenteret nr. 1 – 2014. ISBN 978-82-8121-843-7 ISSN 1890-1298 https://www.helsedirektoratet.no/referanse/0002-0013-232166
201. Bariatric Surgery versus Intensive Medical Therapy for Diabetes - 5-Year Outcomes. https://www.helsedirektoratet.no/referanse/0002-0013-232189
202. Effect of Laparoscopic Sleeve Gastrectomy vs Laparoscopic Roux-en-Y Gastric Bypass on Weight Loss at 5 Years Among Patients With Morbid Obesity: The SLEEVEPASS Randomized Clinical Trial. https://www.helsedirektoratet.no/referanse/0002-0013-232190
203. Effect of Laparoscopic Sleeve Gastrectomy vs Laparoscopic Roux-en-Y Gastric Bypass on Weight Loss in Patients With Morbid Obesity: The SM-BOSS Randomized Clinical Trial. https://www.helsedirektoratet.no/referanse/0002-0013-232191
204. Association of Bariatric Surgery vs Medical Obesity Treatment With Long-term Medical Complications and Obesity-Related Comorbidities. https://www.helsedirektoratet.no/referanse/0002-0013-232192
243. Fedmekirurgi ved diabetes type 2 og kroppsmasseindeks under 35 - fullstendig metodevurdering https://www.fhi.no/publ/2018/fedmekirurgi-ved-diabetes-type-2-og-kroppsmasseindeks-under-35---fullstendi/
244. Obesity: preventing and managing the global epidemic Report of a WHO Consultation (WHO Technical Report Series 894) https://www.who.int/nutrition/publications/obesity/WHO_TRS_894/en/
249. Surgical vs conventional therapy for weight loss treatment of obstructive sleep apnea: a randomized controlled trial. https://www.helsedirektoratet.no/referanse/0002-0013-232237
Sist faglig oppdatert: 20.12.2019
Røykeslutt for personer med diabetes
- Helsepersonell bør kartlegge røykevaner hos alle diabetespasienter som røyker. Kartlegging ved bruk av Minimal intervensjon gjennomføres ved alle egnede konsultasjoner.
- Alle som ønsker å slutte å røyke, bør få tilbud om strukturert hjelp til avvenning.
- Alle som ønsker å slutte å røyke, bør vurderes med tanke på bruk av legemidler til røykeslutt.
Praktisk – slik kan anbefalingen følges
Korte motiverende samtaler (2-3 minutter, refereres til som Minimal Intervensjon) som fokuserer på røykvaner og røykeslutt har dokumentert effekt. Eksempel på tema i en slik samtale er:
- røyker du?
- hva tenker du om det?
- jeg vil anbefale deg å slutte, og jeg kan hjelpe deg
Dersom pasienten ønsker å slutte, bør legen sammen med pasienten vurdere behov for medikamentell støtte til røykeslutt. Det finnes nikotinlegemidler og to ulike reseptbelagte medikamenter, bupropion (Zyban) og vareniklin (Champix). Zyban bør, på grunn av reduksjon av krampeterskelen, benyttes med forsiktighet hos personer som behandles med insulin eller perorale midler som gir risiko for hypoglykemi.
Alle nikotinlegemidler selges uten resept (til dem over 18 år) og er tilgjengelige både på apotek og i dagligvarehandelen i Norge. Bupropion og vareniklin er reseptpliktige. Alle tre grupper legemidler har dokumentert effekt. Valg av medikament bør skje i samråd med pasienten. Det er ikke refusjonsordninger for noen av disse legemidlene.
Dersom pasienten ønsker ytterligere oppfølging, kan legen henvise til Helsedirektoratets informasjonssider for røykeslutt: Metoder og hjelpemidler for snus- og røykeslutt. På Helsenorge sin side slutta.no er det oversikt over ulike verktøy for å slutte med røyk eller snus. Det finnes også røykesluttkurs mange steder i landet som pasientene kan delta på, og de fleste kommunale Frisklivssentraler tilbyr snus- og røykesluttkurs og/-eller individuell veiledning i snus- og røykeslutt. Dersom helsepersonell selv ønsker å følge opp pasienten gjennom et røykesluttforsøk er dette beskrevet nærmere i Nasjonal faglig retningslinje for røykeavvenning (Helsedirektoratet), anbefaling "Bruk av legemidler til røykeslutt".
Begrunnelse – dette er anbefalingen basert på
Personer med diabetes røyker minst like mye som andre. I 2006 var andelen av dagligrøykere i Norge 24% (SSB), mens en studie fra allmennpraksis med representativt utvalg av pasienter med diabetes type 2 i tidsrommet 2006-7 viste at 27 % av menn røykte, mens for kvinner var andelen røykere 28 % (Jenssen et al., 2008). For diabetes type 1-pasienter viste tall fra Norsk diabetesregister for voksne i 2010-2011 (Cooper et al., 2013) at det var 19,6 % røykere blant denne pasientgruppen. Dette underbygger at prosentandelen røykere blant diabetespasienter og befolkningen for øvrig er jevnbyrdig, da det for den generelle befolkningen var henholdsvis 19 og 17 % dagligrøykere i 2010 og 2011 (SSB).
Både de makrovaskulære og mikrovaskulære komplikasjonene ved diabetes forverres av røyking, og ved etablert mikrovaskulær komplikasjon (retinopati, nevropati og nefropati), vil røyking medføre en betydelig økt risiko for kardiovaskulær sykdom, i tillegg til at de mikrovaskulære komplikasjonene i seg selv (som f.eks. risiko for å utvikle nyresvikt) er betydelig mer alvorlig ved røyking (Orth et al., 2002; Hallan et al., 2011).
I en amerikansk prospektiv epidemiologisk multisenterstudie publisert i 2015 (Carter et al., 2015), ble nær en million kvinner og menn over 55 års alder fulgt i 11 år (2000-2011). Studien viste at hele 17 % av overdødeligheten ved tobakksrøyking var forårsaket av en rekke tilstander som ikke tidligere har vært forbundet med røyking. Dette gjaldt bl.a. nyresvikt (relativ risiko 2,0; 95 % KI1,7 – 2,3), tarmiskemi (6,0; 95 % KI 4,5 – 8,1), hypertensiv hjertesykdom (2,4; 95 % KI 1,9 – 3,0) og en rekke ulike luftveissykdommer. I tillegg var det en antydning til sammenheng mellom røyking og prostatakreft og brystkreft. Blant tidligere røykere sank den relative risikoen for hver av disse sykdommene med antall år etter røykeslutt.
Mange leger kvier seg for å ta opp røyking av frykt for å ødelegge et godt lege/pasientforhold. Norske allmennleger oppgir at de viktigste hindringene for å ta opp røyking med pasientene er tidsbruk. Ca. 1/3 av pasientene som ikke har røykerelaterte symptomer blir spurt om røykevaner (Gallefoss et al., 2002). Dette er uheldig fordi det å ikke ta opp røyking som tema i en konsultasjon signaliserer at det ikke er viktig for pasientens helse. Siden røyking øker risiko for hjerte- og karsykdom betydelig, er det særdeles viktig at personer med diabetes som røyker får god hjelp til å slutte. Intervensjon i form av veiledning og medikamenter har dokumentert effekt. Effekten er best når begge kombineres.
Veiledning og legemidler er begge viktige deler av intervensjonen røykeavvenning. Det er viktig for effekten at legemidlene blir brukt riktig. Pasientene behøver derfor råd og informasjon om riktig legemiddelbruk.
Røykeavvenning kan gi abstinensplager som delvis overlapper med rapporterte bivirkninger fra de reseptpliktige legemidlene til røykeavvenning. For mer detaljer om bivirkninger, forsiktighetsregler og kontraindikasjoner henvises til Direktoratet for medisinske produkters preparatomtaler som kan finnes på dmp.no eller til tekst i Felleskatalogen.
Bupropion og vareniklin er trolig ikke forbundet med risiko for avhengighet. Studier viser at 6-9 % av brukere av nikotintyggegummi fortsatt er brukere etter 0,5-1 år. Dette er ikke sett på som uheldig siden det å slutte med nikotintyggegummi kan føre til tilbakefall til røyking. Det er ikke vist at bruk av nikotintyggegummi over lengre tid har uheldige konsekvenser (Hajek et al., 2007; Shiffman et al., 2003).
Flere studier har viste at både vareniklin og bupropion er trygt å bruke hos pasienter med hjerte- og karsykdom og det er ikke vitenskapelig grunnlag for at pasienter med hjerte- og karsykdom eller diabetes ikke skal kunne bruke nikotinlegemidler ved røykeavvenning.
(Nasjonal faglig retningslinje om røykeavvenning).
Anbefalingen om at pasienter med diabetes bør få råd til å endre røykevaner (slutte å røyke) er en sterk anbefaling, til tross for at vi ikke viser til annet kunnskapsgrunnlag enn den spesielle risiko forbundet med utvikling av nyre-senkomplikasjoner hos pasienter med diabetes som røyker. Risiko for andre uheldige utfall, som f.eks. en betydelig økt risiko for kreft og kardiovaskulær sykdom og død, er godt beskrevet i en rekke store epidemiologiske (prospektive kohort) studier som er blitt gjort i løpet av de siste 40-50 årene (deriblant British Doctors' Study, fra 1951 to 2001, som en av de største), men på grunn av overveiende bevisbyrde for sigarettrøykings helseskadelig virkning, blir det ikke lenger gjennomført noen flere slike observasjonsstudier, og det synes irrelevant for arbeidsgruppene å legge til grunn dette brede kunnskapsgrunnlaget for risiko forbundet med røyking - både med etablert diabetessykdom og uten.
Referanser
165. Health-related quality of life after bariatric surgery: a systematic review of prospective long-term studies https://www.helsedirektoratet.no/referanse/0002-0013-232153
177. National Institute for Health and Clinical Excellence: Guidance. Obesity: Identification, Assessment and Management of Overweight and Obesity in Children, Young People and Adults: Partial Update of CG43. London: National Institute for Health and Care Excellence (UK) https://www.helsedirektoratet.no/referanse/0002-0013-232165
179. The gap between guidelines and practice in the treatment of type 2 diabetes A nationwide survey in Norway https://www.helsedirektoratet.no/referanse/0002-0013-232167
180. Treatment of type 1 diabetes in the specialist health service--data from the Norwegian Diabetes Register for Adults https://www.helsedirektoratet.no/referanse/0002-0013-232168
181. "Smoking and the kidney", https://www.helsedirektoratet.no/referanse/0002-0013-232169
182. Smoking and mortality–beyond established causes https://www.helsedirektoratet.no/referanse/0002-0013-232170
183. "Røykeintervensjon og hindringer for dette blant fastleger i Vest- Agder" https://www.helsedirektoratet.no/referanse/0002-0013-232171
184. Dependence potential of nicotine replacement treatments: effects of product type, patient characteristics, and cost to user https://www.helsedirektoratet.no/referanse/0002-0013-232172
185. British Doctors' Study, fra 1951 to 2001 https://www.helsedirektoratet.no/referanse/0002-0013-232173
186. Smoking is a risk factor in the progression to kidney failure https://www.helsedirektoratet.no/referanse/0002-0013-232174
187. Patterns of over-the-counter nicotine gum use: persistent use and concurrent smoking https://www.helsedirektoratet.no/referanse/0002-0013-232175
Sist faglig oppdatert: 14.09.2016
Behandling med blodsukkersenkende legemidler ved diabetes
Insulinbehandling og behandlingsmål ved diabetes type 1
Behandlingsmål ved diabetes type 1
For de fleste pasienter bør behandlingsmålet for HbA1c være omkring 53 mmol/mol (7 %) når det kan oppnås med god livskvalitet og uten uakseptable hypoglykemiske episoder.
Praktisk – slik kan anbefalingen følges
Målet med behandlingen er at pasienten har tilfredsstillende blodsukker gjennom hele døgnet og god livskvalitet. Dette tilsvarer egenmålt blodglukose før måltid på 4-7 mmol/l og <10 mmol/l postprandialt (1,5-2 timer etter måltid) uten uakseptable hypoglykemier.
Intensivert insulinbehandling - på to måter:
- Hurtigvirkende insulin eller insulinanalog til måltider og middels langsomtvirkende insulin (NPH-insulin) eller langsomtvirkende insulinanalog ved sengetid eller to ganger i døgnet ("mangeinjeksjonsbehandling"). Insulinet settes subkutant, som oftest med insulinpenn.
- Behandling med insulinpumpe med hurtigvirkende insulin (i dag oftest hurtigvirkende insulinanalog) som gir kontinuerlig basaldose som subkutan infusjon hele døgnet, med tillegg av ekstra doser ved måltider eller måltid i situasjoner med behov for ekstra insulin.
Se også anbefalingen Oppstart og valg av insulin ved diabetes type 1.
Begrunnelse – dette er anbefalingen basert på
Det foreligger overbevisende vitenskapelig dokumentasjon for at intensivert behandling av diabetes type 1 gir betydelig redusert risiko for mikrovaskulære senkomplikasjoner (øye-, nyre-, og nervekomplikasjoner).
Risikoen for slike komplikasjoner ved mindre intensiv behandling er høy, og det kan være mye å vinne for den enkelte pasient dersom man lykkes med intensivert behandling.
Evidensen kommer hovedsakelig fra studier av yngre pasienter i tidlig fase av sykdommen. Fordeler må vurderes sammen med risiko for alvorlig hypoglykemi og pasientens preferanser. Effekten av intensivert insulinbehandling ser ut til å være noe mindre og tar lengre tid å manifestere seg når det gjelder forebygging av progresjon av komplikasjoner som allerede er til stede. Det mangler evidens fra randomiserte studier på effekter hos eldre pasienter og på risiko for makrovaskulær sykdom. Langtids postintervensjonsoppfølging av Diabetes Control and Complications Trial (DCCT/EDIC) tyder på at intensiv blodsukkerkontroll forebygger makrovaskulær sykdom, og det er usannsynlig at vi vil få nye randomiserte studier som belyser spørsmålet ytterligere. Behandlingsmål må individualiseres basert på alder, sykdomsprogresjon, makrovaskulær risiko, pasientpreferanser/livsstil og pasientens evne til å følge opp behandling.
For nyrekomplikasjoner, viser studiene tydelig at intensivert blodsukkerregulering kan forebygge diabetisk nefropati. Det er derimot ikke evidens for at intensivert blodsukkerregulering forebygger utvikling av terminal nyresvikt (ESRD) eller nyrerelatert død.
Forebygging av mikrovaskulære komplikasjoner som nefropati (enten definert som mikroalbuminuri og/ eller proteinuri), nevropati og retinopati, er et prioritert mål i behandlingen av diabetes type 1.
- Forebygging av nevropati vil, foruten forebygging av nevropatiske smerter, indirekte også kunne forebygge diabetiske fotsår og igjen amputasjoner grunnet dette. Se kapittelet Diabetisk fot og nevropati.
- Forebygging av nefropati vil på sikt kunne forhindre hypertensjon, fall i nyrefunksjon (GFR), og sekundært til fall i GFR også forebygging av kardiovaskulær sykdom. Se kapittelet Nyresykdom ved diabetes.
- Forebygging av retinopati vil forebygge synstap og blindhet. Se kapittelet Retinopati og regelmessig netthinneundersøkelse ved diabetes.
Fordelene med intensivert behandling må veies opp mot risikoen for hyppige eller alvorlige episoder med hypoglykemi. Hypoglykemi kan gi nedsatt evne til å registrere lave blodsukkerverdier/følingssymptomer og nedsatt livskvalitet. Studier tyder imidlertid på at denne reduserte evnen til å kjenne hypoglykemi (følingssymptomer), kan reverseres om intensiteten av blodsukkerkontrollen reduseres noe (HbA1c legges noe høyere, f.eks. i området 7-7,5%) i en periode (Dagogo-Jack et al., 1999).
Forebygging av mikrovaskulære komplikasjoner vil, i et samfunnsøkonomiske perspektiv, kunne spare helseutgifter. Først og fremst vil slik besparelse komme fra reduserte utgifter til behandling av, og sykelighet ved, alvorlig nyresvikt, redusert syn og amputasjoner.
På utgiftssiden ved intensivert blodsukkerregulering, kommer at pasienten ofte vil trenge tilgang til nye insulintyper, eventuelt insulinpumpe og kontinuerlig vevsglukosesensor (CGM), eller behov for hyppige daglige målinger av blodsukker (som vil kreve forbruksmateriell). Alt tyder imidlertid på at intensivert blodsukkerregulering med optimal forebygging av hypoglykemi-episoder vil være gunstig både for pasient og samfunn.
Mulige ulemper med intensivert behandling er ikke større enn at vi antar de fleste pasienter vil akseptere dette. Det skal dog nevnes faren for forverring av nevropati og retinopati ved for raskt fall i HbA1c (se under Nøkkelinformasjon), men individuell tilpasning, god dialog mellom behandler og pasient, samt mulighet for tilpasning av hjelpemidler og utprøving av behandlingsregimer vil redusere risikoen for dette.
Forskningsgrunnlag
Populasjon (P): Pasienter med diabetes type 1
Tiltak (I): Intensiv blodsukkersenkende behandling
Sammenligning (C): Mindre intensiv blodsukkersenkende behandling
Beskrivelse av inkluderte studier
Utfall gruppen opprinnelig interesserte seg for - og graderte mellom Kritisk, Viktig og Mindre viktig:
1. Død – KRITISK
2. Livskvalitet – KRITISK
3. Hjerteinfarkt/hjerneslag – KRITISK
4. Ketoacidose/annen alvorlig hyperglykemi – VIKTIG
5. HbA1c – VIKTIG
6. (Alvorlig) hypoglykemi – KRITISK
7. Bivirkninger – VIKTIG
8. Vektendring – MINDRE VIKTIG
9. Synstruende retinopati – KRITISK
10. Amputasjon – KRITISK
11. Manifestasjon av nevropati – KRITISK
Nefropati-arbeidsgruppen så i tillegg på følgende nyrespesifikke utfall:
12. ESRD – KRITISK
13. Makroalbuminuri – KRITISK
14. Mikroalbuminuri – VIKTIG
15. Dobling av plasma kreatinin – KRITISK
Nevropati-arbeidsgruppen så i tillegg på følgende utfall:
16. Insidens av nevropati (ved 5 år) - VIKTIG
17. Endring i peroneal nerveledningshastighet (årlig) - MINDRE VIKTIG (isolert sett)
18. Endret vibrasjonssans i bena (årlig) - MINDRE VIKTIG (isolert sett)
For besvarelse av dette PICO-spørsmålet tok vi utgangspunkt i: Fullerton B et al 2014
I denne systematiske oversiktsartikkelen fra Cochrane er 12 studier inkludert, men for de fleste utfallene er det DCCT-studien som gir mest bidrag (er vektet mest). Cochrane-rapporten hadde ikke data på kardiovaskulære endepunkter, men for disse utfallene brukte oppfølgingsstudien av DCCT-kohorten; EDIC, som var en postintervensjonsstudie (DCCT/EDIC Study Research Group 2005)
I tillegg hadde nefropati-arbeidsgruppen tilgjengelig en annen systematisk oversikt: Kähler P et al 2014
Nevropati-arbeidsgruppen la metaanalysen til Callaghan BC et al til grunn for vurdering av de tre nevropati-spesifikke utfallene. De randomiserte kontrollerte studiene i litteraturoversikten inkluderte pasienter med type 1 og type 2 diabetes, alder og etnisitet ikke oppgitt. Hensikten med litteraturoversikten var å undersøke effekten av intensivert blodsukkersenkende behandling på forebygging og behandling av distal symmetrisk polynevropati hos pasienter med diabetes mellitus. I evidensprofil er det kun ekstrahert data for deltakerne med type 1 diabetes.
Kunnskapsgrunnlaget for hvert enkelt utfallsmål:
1. Død - KRITISK - Få hendelser i randomisert kontrollerte studier, bortsett fra en studie, MDCCT 1994, i Cochranerapporten (Fullerton B, 2014) som så på pasienter med ESRD. DCCT/EDIC (2) finner en svak gunstig postintervensjonseffekt av intensiv insulin behandling vs ikke intensiv insulinbehandling hos pasienter med type 1 diabetes på død og kardiovaskulær død etter 11 års oppfølging. Kvaliteten på dokumentasjonen vurderes som moderat. (RR 0,34 – KI 0,09-1,26)
2. Livskvalitet - KRITISK - Kun DCCT i Cochranerapporten (Fullerton B, 2014) sier noe om dette. Her finner en ingen signifikante effekter.
3. Hjerteinfarkt/hjerneslag - KRITISK - Sjeldent forekommende i RCTene i Cochranerapporten (Fullerton B, 2014) og ikke håndtert som primærutkomme i noen av de inkluderte studiene i cochranerapporten. DCCT/EDIC tyder på effekt. 11 års postintervensjonsoppfølging viser redusert risiko for gruppen som ble intensivt behandlet. For kardiovaskulære hendelser er RR 0,48 – KI 0,34-0,67. For Ikke-fatal, akutt MI er RR 0,45 og KI 0,19-1,09. For Cerebrovaskulære hendelser er RR 0,21 – KI 0,02-1,75.
4. Ketoacidose/annen alvorlig hyperglykemi - VIKTIG - Kun økt risiko i studier hvor det ble brukt insulinpumpe i intensivterapi gruppen. Veldig lav kvalitet på evidens. (1)
5. HbA1c - VIKTIG - Definert som behandlingsmål, ikke utfallsmål.
6. (Alvorlig) hypoglykemi - KRITISK - Intensiv behandling ser ut til å øke risiko for alvorlig hypoglykemi, men resultatene varierer mellom studier. Det ble i Cochranerapporten gjort analyser hvor man skiller pasientene på bakgrunn av HbA1c ved oppstart. Disse tyder på at risikoen er økt kun for de som i utgangspunktet har relativt lav HbA1c (mindre enn 9%) (Fullerton B, 2014).
7. Bivirkninger - VIKTIG - ikke rapportert.
8. Vektendring - MINDRE VIKTIG - Flere studier rapporterer større vektøkning ved intensiv behandling (veldig lav kvalitet på evidens) (Fullerton B, 2014)
9. Synstruende retinopati - KRITISK - Cochranerapporten (Fullerton B, 2014) rapporterer henholdsvis manifestasjon og progresjon av retinopati. Kvaliteten på evidensen for at intensiv behandling gir redusert risiko for retinopati vurderes som høy. Endepunkt benyttet i Cochranerapporten er surrogatmål for synstruende retinopati og kvalitet på evidensen i forhold til vårt predefinerte utkomme settes derfor til moderat. For manifestasjon av retinopati er RR 0,24 - KI 0,15-0,38. For progresjon av retinopati er RR 0,61 – KI 0,49-0,76.
10. Amputasjon - KRITISK - ikke rapportert
11. Manifestasjon av nevropati - KRITISK. Kvaliteten på evidens for at intensiv behandling beskytter mot manifestasjon av nevropati vurderes som høy. RR 0,35 - KI 0,23-0,53. Når det gjelder progresjon av nevropati foreligger ikke grunnlag for å konkludere. (Fullerton B, 2014)
12. ESRD - KRITISK - ikke rapportert (mest sannsynlig pga ikke lang nok oppfølgingstid i Cochrane-rapporten)
13./15. Manifest nefropati (proteinuri/ kreatinin stigning)- KRITISK. Kvaliteten er bedømt i både Cochrane-rapporten og metaanalysen fra Kähler et al som moderat grad av evidens. Vi valgte Kähler fremfor Cochrane da sistenevnte viste mindre overførbarhet til norske forhold grunnet at studiene inkludert hadde mange deltagere < 18 år, i tillegg til å være utført >15 år siden (det vil si før utstrakt bruk av annen renal og kardiovaskulær beskyttelse). Metaanalysen fra Kähler hadde også et godt effektmål med presist konfidensintervall.
14. Utvikling av albuminuri - VIKTIG. Analysen inkluderte også studier med høygradig albuminuri. Studieresultatet ga god konsistens (lav heterogenitet). Dog var det for få studier til å kunne oppnå et pålitelig funnel plot (det er dermed umulig å bedømme publiseringsskjevhet). Evidensgraden bedømmes som moderat.
16. Insidens av nevropati (ved 5 år) - VIKTIG. Relativ effekt veldig god med en risikoforskjell på 93 færre per 1000 i intervensjonsgruppen, men NNT er 11 i løpet av 5 år.
17. Endring i peroneal nerveledningshastighet (årlig) - MINDRE VIKTIG (isolert sett). Høy kvalitet på evidensen og effekten viser at det er en gjennomsnittlig forskjell mellom gruppene på 0.61 m/s per år, som er klinisk signifikant.
18. Endret vibrasjonssans i bena (årlig) - MINDRE VIKTIG (isolert sett). Høy kvalitet på evidensen og effekten viser en årlig "mean standarized difference" (MSD) i endret vibrasjonsfølsomhet målt med Biotesiometer var på 0.32Hz, p= 0.04, som er klinisk signifikant.
De to sistnevnte nevropati-spesifikke utfallsmålene er intermediærutfall, og ble av arbeidsgruppen bedømt som mindre viktige utfall, når man ser på de isolert sett, men i og med at de fleste pasienter som har redusert nerveledningshastighet og/eller vibrasjonssans også oppfyller kriteriene for å ha nevropati, vil disse utfallsmålene indirekte være viktige.
Selv om harde endepunkter som død, kardiovaskulær sykdom, nyresvikt, amputasjon eller blindhet mangler, eller har moderat til lav kvalitet på evidens, beror dette på metodiske begrensninger og kort observasjonstid, men de klare fordelene som sees i forhold til forebygging av mikrovaskulære komplikasjoner er overbevisende og derfor vil tilsvarende eller bedre studier på harde endepunkter heller trolig aldri komme.
Vurdering
Fordeler og ulemper
Intensivert insulinbehandling som resulterer i lavere HbA1c, vil kunne gi pasienten lengre og bedre liv med færre senkomplikasjoner. Men intensivert behandling gir også høyere risiko for alvorlig hypoglykemi (bevisstløshet eller behov for assistanse fra annen person).
Intensivert blodsukkerregulering vil også kreve hyppigere glukosemålinger/ døgn, og noen pasienter kan oppleve behandlingen som belastende.
I henhold til Cochranerapporten som ligger til grunn (Fullerton et al., 2014) vil en reduksjon av HbA1c fra 75 til 53 mmol/mol (fra 9 til 7 %) kunne gi en reduksjon i forekomst av retinopati fra 232 til 63 per 1000 behandlede pasienter (5-6,5 års oppfølgingstid), av nefropati fra 284 til 159 per 1000 (3,5-6,5 års oppfølgingstid) og for nevropati fra 139 til 49 per 1000 (5-6,5 års oppfølgingstid). Den totale risikoreduksjonen for diabetiske senkomplikasjoner kan være opp mot 76 %.
Noen pasienter med diabetes type 1 og proteinuri vil utvikle dialysetrengende nyresvikt etter lang sykdomsvarighet (15-30 år). Ingen av de randomiserte studiene hadde observasjonstid tilstrekkelig til å kunne konkludere om effektene av intensivert behandling på risiko for for tidlig død, selv om dette er analysert i meta-analysen. Det er publisert en langtidsoppfølging av DCCT (Epidemiology of Diabetes Interventions and Complications Study; EDIC) som viser at pasienter i den intensiverte behandlede gruppen hadde redusert dødelighet i oppfølgingsperioden etter studien.
Intensivert blodsukkersenkende behandling har effekt på både klinisk nevropati og nervefunksjonsmålinger som nerveledningshastighet
og vibrasjonsfølsomhet i underekstremiteter. NNT for å unngå klinisk nevropati ila 5 år er 11.
Dersom blodglukosenivået har vært høy i lang tid, anbefales det å intensivere gradvis slik at HbA1c faller til ønsket nivå over en periode på 3-6 måneder. Ved et fall i HbA1c på 22 - 33 mmol/mol (2-3 %-poeng) i løpet av 3 måneder, kan mikrovaskulære komplikasjoner forverres og den absolutte risikoen for insulin nevropati (behandlingsindusert nevropati) være 20% (Gibbons CH, 2015). Risikoen for forverring av retinopati øker også ved en slik rask reduksjon av blodsukkeret, men er i de aller fleste tilfeller er forbigående (Dahl-Jørgensen et al., 1985; DCCT Research Group, 1998).
Kvalitet på dokumentasjonen
Cochranerapporten (Fullerton et al., 2014) inkluderer 12 relevante randomiserte studier med totalt 2230 pasienter. Det er stor variasjon i pasientpopulasjon mellom studiene når det gjelder alder, sykdomsvarighet og etablerte diabeteskomplikasjoner. Gjennomsnittlig oppfølgingstid varierer fra 1-6,5 år. De fleste studiene er gjort på 80-tallet i Europa eller Nord Amerika.
* For manifestasjon av mikrovaskulære komplikasjoner er kvaliteten på evidensen gjennomgående høy eller moderat vurdert ved GRADE-kriterier. Vi har stor tiltro til effektestimatene.
* For makrovaskulær sykdom vurderer Cochranerapporten evidensen som svak.
* For død vurderes kvaliteten som moderat, men her er få hendelser og tallene baserer seg på en studie av pasienter med ESRD og overføringsverdien til en vanlig norsk pasientpopulasjon er usikker.
Oversiktsartikkelen som har vurdert nevropati-spesifikke utfall, har høy kvalitet, men det skal nevnes at studiene inkludert er mer enn 20 år gamle og kontrollgruppene har høyere HbA1c enn dagens pasientgruppe.
Verdier og preferanser
Forebygging av mikrovaskulære komplikasjoner er et prioritert mål i behandlingen av diabetes type 1. Behandlingen må imidlertid ikke gå på bekostning av at pasienten utvikler hyppige episoder med hypoglykemi som over tid gir nedsatt evne til å kjenne insulinfølinger, nedsatt livskvalitet, og i verste fall kardiovaskulær sykdom og død. God opplæring og tett oppfølging av fra kvalifisert personale på diabetespoliklinikk/sykehuspoliklinikk antas å gi bedre sjanse til å oppnå behandlingsmålene med minst mulig risiko for alvorlige hypoglykemier.
Personer med diabetes type 1 styrer i stor grad egen behandling. Det er derfor viktig at behandlingsstrategi og behandlingsmål planlegges sammen med pasienten, og at pasienten er godt informert om ulike behandlingsmuligheter og teknologiske hjelpemidler som kan være til hjelp for å nå behandlingsmål, og redusere risiko for hypoglykemi, ketoacidose og andre komplikasjoner. Optimalt behandlingsregime og bruk av teknologiske hjelpemidler krever stor grad av individuell tilpasning.
Risiko for senkomplikasjoner må veies opp mot belastning ved intensivert behandling. Langtidseffektene på mikrovaskulære komplikasjoner er trolig størst hos pasienter som ennå ikke har utviklet slike komplikasjoner. Pasientens preferanser vil variere med livssituasjon,personlighet og ressurser. Intensivert insulinbehandling er kognitivt og psykologisk krevende og utfordrende, og det er derfor viktig å samtale med pasienten om hvordan han/hun håndterer insulindoseringsfeil tankemessig og følelsemessig, ikke bare atferdsmessig.
Referanser
257. Dagogo-Jack S, Fanelli CG, Cryer PE: Durabel reversal of hypoglycemia unawareness in type 1 diabetes. Diabetes Care. 1999 May; 22(5):866-7 https://www.helsedirektoratet.no/referanse/0002-0013-232245
258. Gibbons CH, Freeman R: Treatment-induced neuropathy of diabetes: an acute, iatrogenic complication of diabetes. Brain. 2015;138:43-52. PMID: 25392197 https://www.helsedirektoratet.no/referanse/0002-0013-232246
259. Dahl-Jørgensen K, Brinchmann-Hansen O, Hanssen KF, Sandvik L, Aagenaes O: Rapid tightening of blood glucose control leads to transient deterioration of retinopathy in insulin dependent diabetes mellitus: the Oslo study. Br Med J .1985 16;290:811-5 https://www.helsedirektoratet.no/referanse/0002-0013-232247
260. Diabetes Control and Complications Trial Research Group: Early worsening of diabetic retinopathy in the Diabetes Control and Complications Trial. Arch Ophthalmol. 1998;116:874–886 https://www.helsedirektoratet.no/referanse/0002-0013-232248
261. Enhanced glucose control for preventing and treating diabetic neuropathy https://www.helsedirektoratet.no/referanse/0002-0013-232249
262. Intensive glucose control versus conventional glucose control for type 1 diabetes mellitus https://www.helsedirektoratet.no/referanse/0002-0013-232250
263. Intensive Diabetes Treatment and Cardiovascular Disease in Patients with Type 1 Diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232251
264. Targeting intensive versus conventionalglycaemic control for type 1 diabetes mellitus: a systemiatic review with meta-analyses of randomised clinical trials https://www.helsedirektoratet.no/referanse/0002-0013-232252
Sist faglig oppdatert: 14.09.2016
Egenmåling av blodsukker og bruk av kontinuerlig vevsglukosemåling ved diabetes type 1
Det anbefales egenmåling av blodsukker hos alle som behandles med insulin. Mange pasienter kan ha nytte av å bruke kontinuerlig vevsglukosemåler.
Praktisk – slik kan anbefalingen følges
Egenmåling av blodsukker
God opplæring er en forutsetning for at måleresultatene er pålitelige.
Praktiske råd ved måling:
- rene hender
- stikk i sidene på fingertuppene (mindre følsomhet der)
- benytt stor nok bloddråpe; se informasjon om aktuelle blodglukosemåleapparat
- kode/kalibrer apparatet i henhold til strimlene som benyttes, dersom apparatet krever koding
- obs. holdbarhetsdato på strimlene, spesielt holdbarhet etter at boksen er åpnet
Eksempler på situasjoner der det er særlig viktig å måle blodsukker:
- justering av insulindosene ved multiinjeksjonsbehandling og insulinpumpebehandling (før og 2 timer etter måltid)
- uforståelig høy Hb A1c
- ved febersykdom
- ved uklare symptomer som kan skyldes blodsukkersvingninger (føling)
- ved uregelmessig livsførsel som for eksempel ved reiser
- ved graviditet
- ved fysisk aktivitet
- ved hypoglykemi
- før og ev. under bilkjøring
De fleste personer med langvarig diabetes type 1 må, med våre nåværende behandlingsformer, være forberedt på å måle blodsukkeret 3-6 ganger daglig for å få en tilfredsstillende blodsukkerkontroll.
Kontinuerlig vevsglukosemåling
Personer med diabetes type 1 bør vurderes for bruk av kontinuerlig vevsglukosemåler (continuous glucose monitoring, CGM), både ved mangeinjeksjonsbehandling og pumpebehandling. Dagens anbefalte CGM har god nøyaktighet og er for de fleste lette å bruke. De gir et mer komplett bilde av blodglukoseprofil over tid enn fingerstikk og gjør det lettere å ta fornuftige behandlingsvalg.
Følgende pasientgrupper kan eksempelvis ha særlig nytte av og behov for CGM:
- personer med sterkt svingende blodsukker og alvorlige hypoglykemier, særlig nattlige
- personer med nedsatt evne til å kjenne følinger
- visse utsatte yrkesgrupper der faren for hypoglykemi og følinger kan få store konsekvenser
- gravide med diabetes type 1
- personer som bor alene
- personer som opplever blodsukkersvingninger og hypoglykemier i forbindelse med fysisk aktivitet
Personer som har hatt én eller flere alvorlige hypoglykemiske episoder og som har vist at bruk av CGM i betydelig grad reduserer risikoen for alvorlige hypoglykemier, kan dispensasjon for å beholde førerkortet forutsette bruk av CGM.
Det finnes nå flere produkter som kombinerer CGM og styring av insulintilførselen via pumpe. Noen pumper stopper insulintilførselen midlertidig ved lave blodglukoseverdier. Dette kan være en stor hjelp for personer med nattlig følinger og særlig hos personer med hypoglycemia unawareness (manglende eller nedsatt evne til å merke følinger).
Det er betydelige kostnader knyttet til uavbrutt bruk av en kontinuerlig vevsglukosemåler, hovedsakelig knyttet til bytte av sensor. De forskjellige systemene krever noe ulik tid til opplæring av brukerne, og de oppleves av brukerne som å ha noe ulik brukervennlighet og pålitelighet. Innkjøp av insulinpumper, kontinuerlige vevsglukosemålere og tilhørende forbruksmateriell skjer etter anbud via Sykehusinnkjøp HF (tidligere Helseforetakenes Innkjøpsservice, HINAS), som også har rangert utstyret og lagt føringer for hvilket utstyr som primært skal velges.
For detaljer om hjelpemidler som insulinpumper og vevsglukosemålinger se Nasjonal veileder i endokrinologi, Insulinpumper, CGM og forbruksmateriell.
Begrunnelse – dette er anbefalingen basert på
Kunnskap og oppdaterte opplysninger om blodglukosenivået er en forutsetning for god blodsukkerregulering ved diabetes type 1, særlig etter at all egenproduksjon av insulin har opphørt. Målet om god blodsukkerregulering har både langsiktige (færre diabetiske senkomplikasjoner og mindre hjerte-/karsykdom) og kortsiktige (færre akutte komplikasjoner) mål. Kunnskap om blodglukose i ulike situasjoner er informasjon som kan gi grunnlag for hensiktsmessig adferd med hensyn til insulindosering, inntak av karbohydrater, trening, bilkjøring og andre gjøremål. Tradisjonell egenmåling av blodglukose med fingermålinger gir øyeblikksbilder av blodglukose, som ved systematisk bruk også kan gi brukeren opplysninger om typiske endringer i blodglukosenivå i situasjoner som etter måltider, i forbindelse med fysisk aktivitet, under bilkjøring og under søvn.
De siste årene har det kommet flere studier som styrker kunnskapsgrunnlaget for at mange pasienter kan ha særskilte fordeler av å bruke kontinuerlig vevsglukosemåler fremfor egenmåling basert på kapillære fingermålinger. Utviklingen av vevsglukosesensorer (CGM) har de siste årene frembrakt pålitelig og brukervennlig utstyr som er velegnet for mange pasienter med diabetes type 1. Bruken av slikt utstyr vil for mange pasienter lette diabetesbehandlingen og også for mange føre til bedre blodsukkerkontroll, færre hypoglykemier og mindre frykt for insulinføling (ADA, 2019 (Diabetes Care)). Fortsatt mangler store systematiske kunnskapsoppsummeringer med harde endepunktsdata for nytteeffekt på kort og lang sikt, og det er ikke fullt ut avklart hvilke pasienter som kan nytte av utstyret, men det er dokumentert i randomiserte kontrollerte studier en viss reduksjon av HbA1c og redusert tid med hyperglykemi.
Forskningsgrunnlag
Populasjon (P): Pasienter med diabetes type 1, alle aldre
Tiltak (I): Bruk av utstyr for kontinuerlig måling av vevsglukose i 12-52 uker
Sammenligning (C): Egenmåling av blodglukose med punktmålinger etter fingerstikk, utført minst 3 ganger daglig i 12-52 uker
Beskrivelse av inkluderte studier
Etter gjennomgang av forskningsgrunnlaget for bruk av CGM ved utarbeidelsen av retningslinjen i 2014-2016 er det tilkommet betydelig ny kunnskap om emnet. Se Smith MB et al (2019), Messer LH et al (2018), Danne T et al (2017) og Petrie JR (2017).
Arbeidsgruppen har ikke hatt mulighet til å foreta en fullstendig oppdatering av evidensgrunnlaget, men har etter en forenklet gjennomgang og diskusjon konkludert med en mindre revisjon av anbefalingen.
Vurdering
Fordeler og ulemper
Egenmåling
De aller fleste personer med diabetes type 1 bør måle blodglukose flere ganger daglig (vanligvis 4-8 ganger) for å kunne justere insulindosene i henhold til behovet. Det er en rekke situasjoner der enda hyppigere målinger vil være nødvendig i en periode - dette er beskrevet under Praktisk informasjon.
Kontinuerlig vevsglukosemåling (CGM)
Enkelte pasientgrupper kan ha særlig fordel av å bruke kontinuerlig vevsglukosemåling i tillegg til egenmålinger med kapillær blodprøve (fingerstikk).
Kvalitet på dokumentasjonen
Verdier og preferanser
For den som har diabetes er blodsukkermåling helt nødvendig verktøy for å kunne gjøre egenbehandlingen, regulere blodsukkeret og for å unngå uønskede hendelser. Det er viktig for å mestre skole, arbeid, fritidsaktiviteter, idrett og til bilkjøring. Det er også viktig for å kunne forstå hvordan mat, aktivitet, annen sykdom, og alt annet virker inn på blodsukkeret. Likevel er det noen som strever med motivasjon for å foreta de nødvendige målingene. Andre blir "avhengige" av hyppige målinger uten å kunne bruke resultatene til noe nyttig. Det er ikke vist noen sikker effekt av CGM på generell eller diabetesspesifikk livskvalitet (QoL) målt med validerte spørreskjemaer. Lavere blodsukker og HbA1c antas likevel å føre til en gunstig effekt på livskvaliteten. Samtidig vil bruk av kontinuerlig vevsglukosemåler kreve en del stell og pass, inkludert jevnlige kalibreringer, og CGM-systemene ofte vil «plage» brukeren med et antall alarmer som dels vil kunne være falske eller mindre viktige, noe som kan oppfattes negativt.
Klinisk erfaring forteller at ekstraarbeid og falske/uviktige alarmer oppfattes svært ulikt blant brukerne. Toleransen for negative opplevelser vil også måtte avveies mot opplevd nytteverdi. For kontinuerlig vevsglukosemålinger har andre studier (enn meta-analysen som danner kunnskapsgrunnlaget) vist at effekten av tiltaket på HbA1c i stor grad avhenger av hvor stor del av samlet tid utstyret faktisk blir brukt, med best effekt dersom utstyret brukes minst 70-80 % av tiden. Effekten kan også være forskjellig i ulike aldersgrupper. Pasientenes preferanser vil være avgjørende for effekten av tiltaket. Særlig blant brukere med angst eller frykt for nattlige hypoglykemiske episoder, finnes eksempler på sterkt positive erfaringer med CGM på livskvalitet. Også for de som har problemer med reguleringen, problemer med å kjenne lave blodsukkernivåer og har følinger som går utover arbeid og skole, kan CGM være et nyttig verktøy.
Referanser
267. Comparative effectiveness and safety of methods of insulin delivery and glucose monitoring for diabetes mellitus: a systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-232255
268. Best friend or spy: a qualitative meta-synthesis on the impact of continuous glucose monitoring on life with Type 1 diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232256
269. International Consensus on Use of Continuous Glucose Monitoring. https://www.helsedirektoratet.no/referanse/0002-0013-232257
270. Improving the Clinical Value and Utility of CGM Systems: Issues and Recommendations: A Joint Statement of the European Association for the Study of Diabetes and the American Diabetes Association Diabetes Technology Working Group. https://www.helsedirektoratet.no/referanse/0002-0013-232258
271. Human Factors Associated with Continuous Glucose Monitor Use in Patients with Diabetes: A Systematic Review. https://www.helsedirektoratet.no/referanse/0002-0013-232259
272. 7. Diabetes Technology: Standards of Medical Care in Diabetes-2019. https://www.helsedirektoratet.no/referanse/0002-0013-232260
Sist faglig oppdatert: 20.12.2019
Oppstart og valg av insulin ved diabetes type 1
Standard insulinbehandling ved diabetes type 1 er en kombinasjon av langtidsvirkende insulinanalog eller NPH-insulin og hurtigvirkende insulinanalog.
Det vises til gjeldende refusjonsvilkår fra Direktoratet for medisinske produkter.
Praktisk – slik kan anbefalingen følges
| Type insulin (ATC-kode) | Virkestoff | ATC-kode | Innsettende effekt/maks effekt (a) | Virkningsvarighet (etter preparatomtalen) |
| Hurtigvirkende insulinanalog (b) - A10AB | Insulin glulisin | A10AB06 | 10-20 min/0,5-2 timer | 3-5 timer |
| Insulin lispro | A10AB04 | 10-20 min/0,5-2 timer | 3-5 timer | |
| Insulin aspart | A10AB05 | 10-20 min/0,5-2 timer | 3-5 timer | |
| Hurtigvirkende humant insulin - A10AB01 | Insulin (human) | A10AB01 | 0,5 timer/1-3 timer | 7-9 timer |
Middels langtidsvirkende insulin (human, NPH) - A10AC | Insulin (human) | A10AC01 | ||
| Langtidsvirkende insulinanalog - A10AE | Insulin glargin | A10AE04 | (c) | 16-36 timer – varierer mellom de ulike preparatene |
| Insulin glargin (biosimilar) | A10AE04 | (c) | 16-24 timer | |
| Insulin detemir | A10AE05 | (c) | opptil 24 timer | |
| Insulin degludec | A10AE06 | (c) | opptil 48 timer | |
| Blanding av hurtigvirkende og middels langtidsvirkende insulinanalog - A10AD | Insulin lispro Insulin aspart | A10AD04 A10AD05 | 10-20 min/1-4 timer | Inntil 20 timer |
a) De angitte tidene er gjennomsnittstall. Virkningstiden avhenger av en rekke faktorer som injeksjonssted, muskelaktivitet ved injeksjonsstedet, temperatur osv. og kan variere med 25-30 % hos samme pasient fra dag til dag, og 50 % fra pasient til pasient
b) Insulin i oppløsning kan gis subkutant, intramuskulært og intravenøst
c) Preparatene har lenger virketid enn NPH-insulin og mindre uttalt virkningsmaksimum. Virketiden er doseavhengig og viser betydelig intra- og interindividuell variasjon
Middels langtidsvirkende insulin (human) og blandingsinsuliner må blandes godt før bruk. For fullstendig omtale, se Felleskatalogen og Norsk Legemiddelhåndbok.
ATC-kodene i tabellen er hyperlenker til Direktoratet for medisinske produkter.
Henvisning til spesialist/poliklinikk
Alle pasienter som får påvist diabetes type 1 (eller der det er sterk mistanke om diabetes type 1) bør henvises til spesialistpoliklinikk. For gravide, er det aktuelt å henvise også dem med HbA1c mellom 41 og 47 mmol/mol (5,9 % og 6,4 %). De bør henvises til poliklinikk som behandler kvinner med diabetes i svangerskap for individuell vurdering og oppfølging (se Nasjonalt retningslinje for svangerskapsdiabetes, kapittel 4.1).
For enkelte pasientkategorier er det særlig viktig at henvisning til spesialisthelsetjenesten skjer raskt, eventuelt som øyeblikkelig hjelp:
- ved nyoppdaget diabetes hos barn og unge (øyeblikkelig hjelp)
- ved mistanke om ketoacidose i alle aldre (innlegges som øyeblikkelig hjelp)
- ved svært høyt blodsukkernivå (> 25-30 mmol/l)
Oppstart av insulinbehandling ved diabetes type 1
Standardbehandling er mangeinjeksjonsbehandling med kombinasjon av basalinsulin og måltidsinsulin. Som basalinsulin har langtidsvirkende insulinanalog noen fordeler (mindre variasjon i absorbsjon, ofte færre injeksjoner, mindre hypoglykemi), men NPH-insulin kan også brukes. Per i dag foreligger ikke en oppdatert helseøkonomisk vurdering som understøtter bruk av langtidsvirkende insulinanalog til alle pasienter med diabetes type 1. Vilkår for forskrivning av disse legemidlene på blå resept vil fremkomme av gjeldende refusjonsvilkår. Som måltidsinsulin foretrekkes hurtigvirkende insulinanalog. Mange pasienter oppnår delvis remisjon av sykdommen etter oppstart av insulinbehandling og kan ofte klare seg med enklere insulinregimer med lave doser i noen måneder, av og til betydelig lenger. Enkelte pasienter har tilstrekkelig restproduksjon av insulin og/eller har et svært regelmessig levevaner som gjør at de kan klare seg med enklere regimer gjennom flere år.
Ved diabetes type 1 er nødvendig døgndose som regel 0,5-1 E per kg kroppsvekt, mens startdosen kan være lavere. Ved et mangeinjeksjonsregime gis ofte 1/3-1/2 av døgnbehovet som basalinsulin (insulin human) og resten som måltidsinsulin. Størstedelen av dosen med basalinsulin gis vanligvis om kvelden, men for å sikre tilstedeværelse av noe insulin hele dagen (mellom måltidene) anbefales ofte en liten morgendose insulin (human); ofte omkring halvparten av kveldsdosen. Måltidsinsulinet fordeles etter måltidenes innhold av karbohydrater.
Intensivert insulinbehandling - på to måter:
- Hurtigvirkende insulin eller insulinanalog til måltider og middels langtidsvirkende insulin (human) eller langtidsvirkende insulinanalog ved sengetid eller to ganger i døgnet ("mangeinjeksjonsbehandling"). Insulinet settes subkutant, som oftest med insulinpenn.
- Behandling med insulinpumpe med hurtigvirkende insulin (i dag oftest hurtigvirkende insulinanalog) som gir kontinuerlig basaldose som subkutan infusjon hele døgnet, med tillegg av ekstra doser ved måltider eller måltid i situasjoner med behov for ekstra insulin.
Opplæring
Opplæring i egenkontroll av blodsukker er nødvendig og som regel en forutsetning for å lykkes med behandlingen. Målinger kan også foretas av pårørende eller hjemmesykepleien. Det er viktig at pasienten får god opplæring og at det er lett å komme i kontakt med kvalifisert helsepersonell, særlig den første tiden etter oppstart av behandlingen.
Målglukose
Med målglukose menes glukoseverdien målt på det tidspunkt som er mest egnet for å justere den aktuelle insulindosen. Eksempel: kveldsdose med insulin (human) styres etter fastende glukose, og måltidsdosene for hurtigvirkende insulin justeres etter glukoseverdien to timer etter det aktuelle måltidet. Ved bruk av insulin (human) om morgenen er målglukose den verdien som måles før middag.
Begrunnelse – dette er anbefalingen basert på
Med intensivert insulinbehandling mener vi bruk av langtidsvirkende insulin 1-2 ganger daglig og hurtigvirkende insulin eller insulinanalog til måltidene og ved ekstra behov, i kombinasjon med hyppig og helst systematisk egenmåling av blodglukose eller vevsglukose, gjerne med tett oppfølging av trenet personell. Også bruk av insulinpumpe og hyppige egenmålinger regnes som intensiv eller intensivert insulinbehandling.
Som mindre intensiv insulinbehandling regnes enklere insulinregimer med færre daglige insulininjeksjoner, eventuelt bare middels langtidsvirkende insulin eller blandingsinsulin 1-2 ganger i døgnet, uten hyppig og systematisk egenmåling. Dette er likevel behandlingsopplegg som hos enkelte kan fungere godt i en periode etter debut av diabetes type 1, så lenge det fortsatt er en viss egenproduksjon av insulin. Det er gjort en lang rekke studier der intensive insulinbehandlingsopplegg er sammenlignet med mindre intensive opplegg, oppsummert i en Cochranerapport fra 2014 (Fullerton et al., 2014). Se anbefalingen Behandlingsmål ved diabetes type 1.
Referanser
262. Intensive glucose control versus conventional glucose control for type 1 diabetes mellitus https://www.helsedirektoratet.no/referanse/0002-0013-232250
Sist faglig oppdatert: 14.09.2016
Bruk av insulinpumpe ved diabetes type 1
- Behandling med insulinpumpe kan sidestilles med mangeinjeksjonsbehandling. Pasienter som har fått god informasjon, bør få anledning til å prøve insulinpumpe, hvis de ønsker det.
- Bruk av insulinpumpe kan særlig være aktuelt ved store svingninger i blodsukkernivå, nattlige hypoglykemier eller høy HbA1c, og hos pasienter som trenger stor grad av fleksibilitet i insulindoseringen på grunn av skiftarbeid, variabel fysisk aktivitet og lignende.
- Insulinpumpe kan gi pasienten større fleksibilitet i måltidsplanlegging og variasjon i fysisk aktivitetsnivå.
Praktisk – slik kan anbefalingen følges
Vurder behovet for insulinpumpe
Insulinpumpe gir kontinuerlig subkutan tilførsel av hurtigvirkende insulin eller insulinanalog. Pumpen programmeres til å gi en viss mengde insulin hver time i løpet av døgnet (basaldose). I tillegg setter pasienten insulin til hvert måltid ved hjelp av pumpen. Disse måltidsdosene må justeres i forhold til aktivitet og måltidsstørrelse som ved mangeinjeksjonsbehandling. Noen synes at bruk av insulinpumpe forenkler hverdagen med diabetes, mens andre opplever pumpebehandlingen som krevende. Fordi det ikke foreligger noe depot av langsomvirkende insulin, er pasienten mer utsatt for ketoacidose dersom insulintilførselen svikter (brudd i slangen, nålen glir ut, tekniske problemer med pumpen og lignende).
Indikasjoner for å vurdere insulinpumpe kan være:
- hyppige, alvorlige hypoglykemier, eventuelt med manglende evne til å merke følinger
- sterkt svingende blodglukosenivå med hyppige følinger, særlig om natten
- høy HbA1c
- dårlig blodglukoseregulering om natten, spesielt ved sterkt varierende fastende blodglukose
- pasienter som "glemmer" insulininjeksjonene
- pasienter som trenger stor grad av fleksibilitet i insulindoseringen (skiftarbeid, variabel fysisk aktivitet)
- pasienter som ønsker å prøve insulinpumpe
Krav til bruker
Man må kunne forvente en høy grad av samarbeidsevne og ansvarsfølelse, særlig når det gjelder evnen til å vurdere risiko for og tiltak ved eventuell utvikling av ketoacidose. Alkohol- og rusmisbruk er en kontraindikasjon mot pumpebehandling. Vellykket og trygg insulinpumpebruk krever nøye opplæring og aktiv medvirkning fra pasienten. En forutsetning er at pasienten lærer å bruke boluskalkulator.
Oppstart i spesialisthelsetjenesten
Oppstart av pumpebehandling vil som regel skje i spesialisthelsetjenesten. Det er vanlig å redusere total døgndose med insulin med 10-20 % avhengig av blodglukosekontrollen. Ca. 50 % av denne dosen gis som basaldose, resten fordeles til måltidene etter en vurdering av måltidenes karbohydratinnhold, etter samme prinsipper som ved mangeinjeksjonsbehandling. Ved oppstart av behandlingen velger de fleste å fordele basaldosen jevnt over døgnet, alternativt å gi litt lavere basaldose tidlig på natten og litt høyere fram mot morgenen. Både basal- og måltidsdosene må justeres etter resultatene av egenmålingene.
Helseforetakene har en felles, anbudsbasert innkjøpsordning for insulinpumper og kontinuerlige glukosemålere. Se utfyllende informasjon på Sykehusinnkjøp HF. For detaljer om hjelpemidler som insulinpumper og vevsglukosemålinger se Nasjonal veileder i endokrinologi, Insulinpumper, CGM og forbruksmateriell.
Begrunnelse – dette er anbefalingen basert på
Behandling med insulinpumpe er assosiert med lavere HbA1c, bedre pasienttilfredshet, høyere livskvalitet og færre hypoglykemier enn multiinjeksjonsbehandling. Fordelene kan økes ved å kombinere insulinpumpe med CGM. Pasientfaktorer er avgjørende for hvorvidt pumpebehandling blir vellykket (Giani et al., 2015).
Referanser
265. The effect of using the insulin pump bolus calculator compared to standard insulin dosage calculations in patients with type 1 diabetes mellitus - systematic review https://www.helsedirektoratet.no/referanse/0002-0013-232253
266. Impact of new technologies on diabetes care https://www.helsedirektoratet.no/referanse/0002-0013-232254
Sist faglig oppdatert: 20.12.2019
Blodsukkersenkende behandling og behandlingsmål ved diabetes type 2
Behandlingsmål for HbA1c ved diabetes type 2
Ved diabetes type 2 bør intensivert blodsukkersenkende behandling tilpasses til den enkelte pasient.
Behandlingsmål for de fleste pasienter vil være HbA1c omkring 53 mmol/mol (7 %).
Hos en del pasienter, særlig yngre og nydiagnostiserte, som forholdsvis lett når behandlingsmålet ved å endre livsstil og eventuelt bruke 1-2 legemidler, kan det være aktuelt med lavere behandlingsmål (for eksempel HbA1c omkring 48 mmol/mol (6,5%)).
HbA1c mellom 53 - 64 mmol/mol (7.0 - 8.0 %) kan være aktuelt for pasienter med:
- Lang sykdomsvarighet
- Betydelig komorbiditet (særlig ved redusert nyrefunksjon, eGFR < 45 ml/min/1.73 m²)
- Risiko for hypoglykemi
For personer på sykehjem og andre med betydelig reduserte leveutsikter er målet å unngå symptomatisk hyperglykemi. Det oppnås hos de fleste når blodsukkeret sjelden overstiger 12-14 mmol/l.
Praktisk – slik kan anbefalingen følges
God blodsukkerkontroll er fundamentalt i behandlingen av diabetes. Målet med den blodsukkersenkende behandlingen er:
- å redusere plager og ubehag som skyldes høyt blodsukker
- å hindre alvorlig hyperglykemi og diabeteskoma
- å redusere risiko for diabetisk øyesykdom, nyresykdom og nervesykdom, og på lengre sikt trolig også for makrovaskulær sykdom
Manglende måloppnåelse hos personer med diabetes er vanlig og årsakene mange. Dagens behandlingsalternativer virker ikke tilstrekkelig hos alle, pasientene har ofte andre prioriteringer i sitt liv, liten opplevelse av mening med målene, manglende kapasitet, og/eller lav mestringsopplevelse og manglende sosial støtte. Se anbefaling: Kommunikasjon og pasientaktiverende intervensjoner ved diabetes for hvordan man kan gå frem for å avdekke mulige barrierer for måloppnåelse og eksempler på pasientaktiverende intervensjoner som kan øke etterlevelse av behandlingen.
Intensivert blodsukkersenkende behandling
Intervallene mellom legekonsultasjonene bør tilpasses pasientens behov og kliniske situasjon, og avtales med pasienten som del av behandlingsplanen. For de fleste pasienter i stabil fase av sykdommen vil 2-4 konsultasjoner/år hos lege/sykepleier være passe. Minst en av disse bør være hos lege og inneholde en bred gjennomgang av pasientens diabetes (årskontroll).
Ved mangelfull måloppnåelse (f.eks. for høy HbA1c) anbefales behandlingsintensivering minst hver 3. mnd.
I situasjoner med somatisk eller psykisk tilleggssykdom, vanskelig livssituasjon, endring av medikamenter (eller doser) eller like etter at diagnosen er stilt, kan det være behov for hyppige planlagte kontroller.
Bruk av strukturert elektronisk diabetesskjema (NOKLUS) forenkler og systematiserer oppfølgingen.
Behandlingsmål
- Personer som har hatt diabetes type 2 i lang tid (mer enn 10 år), eller har kjent hjerte-kar sykdom, har betydelig økt risiko for nye kardiovaskulære hendelser og er ikke entydig vist at intensivert blodsukkersenkende behandling med målsetting om å oppnå lav HbA1c i denne gruppen reduserer denne risikoen.
- HbA1c 53 - 64 mmol/mol (7,0 - 8,0 %) anbefales som målsetting for den blodsukkersenkende behandlingen for personer med lang diabetesvarighet, som har kjent hjerte- og karsykdom, nyresvikt (eGFR < 45 ml/min/1,73 m²) eller er eldre.
- Ved bruk av insulin for å intensivere blodsukkernivået kan raskt fall i gjennomsnittlig blodsukker (fall i HbA1c på 2-3 % i løpet av 3 måneder), føre til forverring av nevropati (Gibbons et al., 2015) og øyekomplikasjoner.
Veiledende tabell for hvor behandlingsmålet kan settes i ulike situasjoner:
| Pasientgruppe | HbA1c-mål |
| For de fleste pasienter der målet er å forebygge senkomplikasjoner. Det kan likevel være riktig å sette lavere individuelle behandlingsmål (omkring 6,5 % (48 mmol/mol)) tidlig i forløpet, dersom det kan oppnås uten bruk av mange legemidler og uten å øke forekomsten av bivirkninger og hypoglykemier. | Omkring 53 mmol/mol (7 %) |
| For pasienter som har vanskelig for å oppnå god blodsukkerkontroll, som har svingende blodsukker, tendenser til hypoglykemi, lang sykdomsvarighet og andre kompliserende sykdommer (f.eks redusert nyrefunksjon, eGFR < 45 ml/min/1,73 m²). | 53 – 64 mmol/mol (7,0 – 8,0 %)* |
* For personer på sykehjem og andre med betydelig reduserte leveutsikter er målet å unngå symptomatisk hyperglykemi og symptomatisk alvorlig hypoglykemi. Det oppnås hos de fleste når blodsukkeret sjelden overstiger 12-14 mmol/l i løpet av dagen. Når det primære målet er symptomfrihet kan behandlingsmålet settes høyere (rundt 75 mmol/mol (9 %).
Hos utsatte grupper der det er problemer med etterlevelse av behandlingen (som hos personer med alkohol- og/eller rusmisbruk eller uttalt psykiatrisk sykdom) er det først og fremst viktig å unngå betydelig hyperglykemi /ketoacidose og alvorlig hypoglykemi.
For anbefalinger om blodsukkersenkende legemidler ved diabetes type 2, se Metformin som førstevalg ved diabetes type 2 og Valg av blodsukkersenkende legemiddel etter metformin ved diabetes type 2.
Begrunnelse – dette er anbefalingen basert på
Evidensgrunnlag for nytten av intensivert blodsukkersenkende behandling
Det er god evidens fra observasjonelle, epidemiologiske studier for at gjennomsnittlig blodsukkernivå er assosiert til diabetiske komplikasjoner (Klein et al., 1984; Chase et al., 1989). Sammenhengen er sterkest mellom gjennomsnittlig blodsukkernivå og mikrovaskulære komplikasjoner (retinopati, nefropati og nevropati).
Ved diabetes type 2 finnes det en rekke randomiserte, kontrollerte og ofte dobbel-blindede undersøkelser hvor ulike blodsukkersenkende legemidler er sammenliknet, oftest med HbA1c som utfallsmål. Disse studiene er oftest av kort varighet (de fleste fra 3-12 mnd), har ikke statistisk styrke til å vurdere effekter på harde endepunkter (diabeteskomplikasjoner og død) og bruker oftest HbA1c og andre intermediære utfallsmål.
Ved diabetes er det god evidens for at HbA1c er nært assosiert til gjennomsnittlig blodsukkerkonsentrasjon de siste 2-3 måneder. HbA1c er det beste intermediære parameter for å vurdere sammenhengen mellom blodsukkerkontroll og risiko for senkomplikasjoner.
Ved diabetes type 2 er det moderat god evidens for at enhver reduksjon av gjennomsnittlig blodsukker reduserer risiko for diabetisk øyesykdom (alvorlig retinopati og makulopati), nyresykdom og nervesykdom.
Det er mindre evidens for at redusert blodsukkernivå forebygger nevropati. Siden de fleste som har diabetes type 2 er eldre (prevalensen > 60 år er dobbelt som høy som de under 60 år) er nevropati en alvorlig diagnose pga risiko for ustøhet og fall. Det mangler dokumentasjon for at god blodsukkerkontroll kan beskytte mot slike hendelser.
God blodsukkerkontroll er assosiert med redusert progresjon av diabetisk nyresykdom, men dokumentasjonen (Coca SG, 2012) er mindre sterk ved diabetes type 2 enn ved diabetes type 1. En mulig årsak er at studiene (i metaanalysen) også inneholder pasienter med hypertensiv nefropati, som ikke er forventet å ha så stor effekt av blodsukkerregulering. Vi foreslår derfor at pasienter uten særskilt kardiovaskulær risiko behandles med målsetning HbA1c omkring 7%, mens personer med høy kardiovaskulær risiko har behandlingsmål HbA1c mellom 7.0% og 8.0%. Dette siste behandlingsmålet kan individualiseres ut fra om pasienter behandles med legemidler som ikke gir hypoglykemi (lav HbA1c kan være forsvarlig) eller med legemidler som gir hypoglykemi (høyere HbA1c er mer forsvarlig).
Ved diabetes type 2 er det svak evidens for at intensiv blodsukkersenkende behandling reduserer risikoen for hjerte- og karsykdom.
Forskningsgrunnlag
Populasjon (P): Pasienter med type 2 diabetes
Tiltak (I): Intensiv blodsukkersenkende behandling
Sammenligning (C): Ikke intensiv blodsukkersenkende behandling (standard behandling)
Beskrivelse av inkluderte studier
Følgende utfall ble vurdert som relevante for problemstillingen (gradert etter hvor viktige vi tror de er for pasienten) og er vist i vedlagte evidensprofil:
1. Død – KRITISK
2. Livskvalitet – KRITISK
3. Hjerteinfarkt/hjerneslag – KRITISK
4. Ketoacidose/annen alvorlig hyperglykemi – VIKTIG
5. HbA1c – VIKTIG
6. (Alvorlig) hypoglykemi – KRITISK
7. Bivirkninger – VIKTIG
8. Vektendring – MINDRE VIKTIG
9. Synstruende retinopati – KRITISK
10. Amputasjon – KRITISK
11. ESRD - KRITISK
12. Makroalbuminuri - KRITISK
13. Mikroalbuminuri - VIKTIG
14. Dobling av plasma kreatinin - KRITISK
15. Død fra renal sykdom - KRITISK
I tillegg til disse utfallene ble også insidens av autonom nevropati og insidens av perifer nevropati vurdert (Buehler AM, 2013), og kategorisert som kritiske Risikoreduksjon ved intervensjon for insidens av perifer nevropati var 6 %, dvs. 26 færre av 1000. Kvaliteten på evidensen er moderat og nedgradert pga fare for høy bias da deltagerne ikke var blindet for intervensjonen. Risikoforskjell med intervensjon for insidens av autonom nevropati var 26 flere per 1000. RR 1.15 (95% KI 0.72-1.86). Kvaliteten på evidensen anses som lav og er nedgradert pga høy risiko for bias og publiseringsskjevhet.
I en metaanalyse fra Coca et al. er data fra intensiv blodglukosebehandling hos 15.000 - 28.000 deltakere oppsummert for nyrespesifikke utfallsmål (nr. 11-15 i listen ovenfor) (Coca SG, 2012). Studiene er open label, som øker muligheten for bias. Funnel plot for flere av effektmålene reiser mistanke om publikasjonsskjevhet. Ingen studier tar høyde for hvorvidt pasientene har diabetes nefropati (som er den absolutt vanligste nyreskaden ved diabetes type 1) eller hypertensiv nyreskade/ nefrosklerose (som ved diabetes type 2 er en minst like vanlig nyreskade som diabetes nefropati). Ved sistnevnte diagnose er ikke intensivert glukoseregulering forventet å ha like stor effekt på effektmålene som ved diabetes nefropati. I følge litteraturen kan det også forekomme blandingsformer av diabetes nefropati og hypertensiv nyreskade hos pasienten med diabetes type 2.
I den systematiske oversikten som best besvarte PICO, og som danner grunnlaget for Evidensprofilen, var følgende utfallsmål IKKE inkludert: HbA1c, ketoacidose, bivirkninger og vektendring.
En Cochrane review fra 2013 konkluderer med at intensiv behandling reduserer risiko for mikrovaskulære senkomplikasjoner (manifestasjon av retinopati med 21 %, relativ risiko (RR) 0,79 med 95 % konfidensintervall (KI) 0,68-0,92, og manifestasjon av nefropati med 25 %, RR 0,75 med 95 % KI 0,59-0,95,) samt amputasjoner av underekstremiteter (RR 0,65 med 95 % KI 0,45-0,94) uten signifikant effekt på risiko for total eller kardiovaskulær dødelighet, ikke fatalt hjerteinfarkt eller ikke fatalt hjerneslag (Hemmingsen B, 2013).
Bare to studier hadde undersøkt effekten på helserelatert livskvalitet og fant ingen signifikant effekt (ADDITION Netherlands og ACCORD 2008).
ADDITION Netherlands: No negative effects of a multi-factorial, intensified treatment on self-reported health status, treatment satisfaction, and diabetes-related distress in screen-detected type 2 diabetes patients. The ADDITION-Netherlands study. van den Donk M, Gorter KJ, Rutten GE. Quality of Life Research, 2010
ACCORD 2008: Effects of Intensive Glucose Lowering in Type 2 Diabetes. The Action to Control Cardiovascular Risk in Diabetes Study Group*N Engl J Med 2008; 358:2545-2559June 12, 2008DOI: 10.1056/NEJMoa0802743
Ved diabetes type 2 finnes det en stor randomisert, kontrollert intervensjonsstudie (UKPDS 33, 1998) som har undersøkt effekten av intensiv mot mindre intensiv blodsukkerkontroll (snitt HbA1c 7,0 % mot 7,9 %) over lang tid (10 år) hos pasienter med nyoppdaget diabetes på risiko for enhver diabeteskomplikasjon, mikrovaskulære komplikasjoner, hjerte-/karsykdom og død. Studien fant at intensiv behandling basert på insulin eller sulfonylurea reduserte summen av diabetiske senkomplikasjoner med 12 %, mikrovaskulære senkomplikasjoner med 25 %, men påvirket ikke risiko for død eller hjerte-/karsykdom signifikant. I en undergruppe av overvektige reduserte intensivert behandling med metformin både dødelighet og risiko for hjerteinfarkt signifikant (UKPDS, 1998). I en epidemiologisk analyse av UKPDS-data undersøkte Stratton et al sammenhengen mellom blodsukkerkontroll og mikro- og makrovaskulære komplikasjoner, og fant en signifikant, tydelig sammenheng mellom HbA1c og risiko for komplikasjoner (UKPDS 35, 2000).
I en oppfølgingsundersøkelse 10 år etter at den randomiserte studien var avsluttet, er det rapportert at så vel risiko for hjerteinfarkt som for tidlig død var lavere i gruppen som ble intensivt behandlet de 10 år studien varte (Holmann RR, 2008). Det finnes i tillegg tre store, randomiserte, kontrollerte undersøkelser av intensiv versus ikke-intensiv behandling ved diabetes type 2. Inkludert var pasienter som ikke hadde nyoppdaget diabetes, hvor målet for blodsukkerkontroll var strengere enn i UKPDS og hvor varigheten av studiene var betydelig kortere: ACCORD (7) , ADVANCE (8) og VADT (9). De aktuelle studier er også oppsummert i flere metaanalyser, bla Turnbull et al fra 2009 (10). ACCORD-studien ble stoppet prematurt på grunn av økt total dødelighet i intensiv behandlet gruppe. Behandlingsmålet i denne gruppen var HbA1c <6 %. Tilsvarende økt dødelighet ble ikke observert i ADVANCE eller VADT. Ingen av studiene fant at intensiv behandling reduserte risiko for død eller kardiovaskulære hendelser, men den positive effekten på mikrovaskulære komplikasjoner som ble observert i UKPDS ble bekreftet.
Når det gjelder risiko for alvorlig hyperglykemi (ketotisk eller ikke ketotisk koma) har vi ikke funnet rapporter som har sammenliknet intensiv mot ikke-intensiv blodsukkersenkende behandling.
Risiko for hypoglykemi øker ved intensiv blodsukkersenkende behandling. Hemmingsen et al (2) rapporterer en relativ risiko for mild og moderat hypoglykemi på 1,54 (95% KI 1,35-1,75) og for alvorlig hypoglykemi relativ risiko 2,18 (95% KI 1,53-3,11). Risikoen for alvorlig hypoglykemi varierte i betydelig grad mellom de randomiserte studiene nevnt over.
Vektøkning er vanligvis sterkere ved intensiv blodsukkersenkende behandling, men varierer med de ulike medikamentene og vil omtales i relasjon til disse.
Referanser:
- Coca SG, Ismail-Beigi F, Haq N, Krumholz HM, & Parikh CR (2012). "Role of intensive glucose control in development of renal end points in type 2 diabetes mellitus: systematic review and meta-analysis intensive glucose control in type 2 diabetes". Arch Intern Med, 172(10), 761-769.
- Hemmmingsen B, Lund SS, Gluud C, Vaag A, Almdal TP, Hemmingsen C, Wetterslev W. Targeting intensive glycaemic control versus targeting conventional glycaemic control for type 2 diabetes (Review). The Cochrane Library 2013, Issue 11
- UK Prospective Diabetes Study (UKPDS) Group (1998) Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 352:837–853
- UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes(UKPDS 34). Lancet 1998;352(9131):854–65
- Stratton I, Adler A,NeilH et al (2000) Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ 321:405–412
- Holman RR, Paul SK, Bethel MA, Matthews DR, Neil HA. 10-year follow-up of intensive glucose control in type 2 diabetes. The New England Journal of Medicine 2008;359 (15):1577–89. [PUBMED: 18784090]
- The Action to Control Cardiovascular Risk in Diabetes Study Group (2008) Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 358:2545–2559
- The ADVANCE Collaborative Group (2008) Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 358:2560–2572
- Duckworth W, Abraira C, Moritz T et al (2009) Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 360:129–139
- Turnbull FM, Abraira C, Anderson RJ, et al. Intensive glucose control and macrovascular outcomes in type 2 diabetes. Diabetologia 2009; 52: 2288-98
- Kahn SE, Haffner SM, Heise MA, et al. Glycemic duarbillity of rosiglitazone, metformin or glyburide therapy. N Engl J Med 2006; 355: 2427-43
- Buehler, A. M., Cavalcanti, A. B., Berwanger, O. Et al.. Effect of tight blood glucose control versus conventional control in patients with type 2 diabetes mellitus: a systematic review with meta-analysis of randomized controlled trials. Cardiovasc Ther 2013, 31;147-160. doi: 10.1111/j.1755-5922.2011.00308.x PMID: 22212499
Vurdering
Fordeler og ulemper
Intensiv blodsukkersenkende behandling tidlig i behandlingsforløpet vil redusere risiko for utvikling av mikrovaskulære senkomplikasjoner og kanskje også hjerte- og karsykdom. Eksempelvis er det god dokumentasjon for at progresjon av nyresvikt forsinkes. Forebygging av kronisk nyresvikt (stadium 3 eller alvorligere), og i verste fall behov for dialyse eller behov for nyretransplantasjon vil være en betydelig gevinst for pasienten i form av bedret livskvalitet og økt arbeidsevne. Det vil også kunne være kostnadsbesparende for samfunnet.
Effekten er mindre hos eldre pasienter med lang diabetesvarighet. Intensiv behandling øker risiko for hypoglykemi og særlig hos utsatte pasienter med samtidig hjerte- og karsykdom kan dette medføre alvorlige komplikasjoner og muligens økt risiko for død. Intensiv behandling kan resultere i vektøkning, varierende med ulike medikamenter.
Kvalitet på dokumentasjonen
Kunnskapssoppsummeringen blir etter GRADE-kriteriene vurdert til å ha lav til moderat kvalitet, og dette beror først og fremst på utdaterte og unøyaktige diagnostiske kriterier for diabetes, som medfører nedsatt overførbarhet til dagens norske populasjon, samt at de fleste av effektestimatene er ikke-signifikante. Arbeidsgruppen anser denne dokumentasjonen for å være den beste til å besvare spørsmålet, og mener at det er mindre sannsynlig at anbefalingen vil endres med ny kunnskap i løpet av få år. Vi savner relevante, store nok kliniske studier med tilstrekkelig lang varighet til å undersøke effekten av intensiv blodsukkersenkende behandling på død og kardiovaskulære endepunkter.
Kunnskapsoppsummeringen (Coca et al., 2012) som så på de nyrespesifikke utfallene er også vurdert til å være å ha lav til moderat kvalitet, og årsakene er stort sett at effektestimatene er upresise eller Funnel plot viste publiseringsskjevhet, samt pga risiko for systematiske feil da ikke alle studiene som er inkludert, er dobbeltblindet. For mikroalbuminuri var det også en stor grad av heterogenitet (I² = 64%), men dette kan delvis forklares med at studiene ikke skilte på om pasientene hadde diabetisk nefropati eller hypertensiv nyreskade (ved diabetes). Sistnevnte har mindre uttalt albuminuri og reagerer trolig heller ikke særlig på blodsukkerendring.
Verdier og preferanser
Eldre pasienter, pasienter med hjerte- og karsykdom og pasienter med andre kroniske sykdommer forventes å ha mindre utbytte av intensiv behandling og større risiko for hypoglykemi og andre negative følger av behandling. Hos pasienter med betydelig overvekt som trenger insulinbehandling kan det være vanskelig å nå behandlingsmål med dagens medikamenter og uønsket vektoppgang i sammenheng med insulinbehandling kan være en hindring for god blodsukkerkontroll. Hyppigere glukosemålinger for å kontrollere graden av glykemi, vil være en konsekvens av intensivert blodsukkermål, og dette kan for mange pasienter oppleves som en ekstra stressbelastning.
Pasientpreferansene for medikamentbruk viser i en stor oversiktsstudie fra 2014 at bedre blodsukkerkontroll er viktigst. Videre sier pasientene at vektnedgang/kontroll, hjerte/karsykdom, livskvalitet, bedre leveutsikter, unngå komplikasjoner og beholde jobben og førerkort er viktig. Av bivirkninger viser brukerpreferansene i denne oversikten at vektnedgang/kontroll er viktigst. Deretter kommer hypoglykemier og magetrøbbel.
Studiene i denne oversikten er utført i USA, Sverige, Danmark og UK i perioden 2007 til 2012.
Fra brukerundersøkelser Diabetesforbundet har gjort i Norge, viser det at for en god del pasienter er jobb og førerkort avgjørende for medikamentvalg.
Referanser
273. Hemmmingsen B, Lund SS, Gluud C, Vaag A, Almdal TP, Hemmingsen C, Wetterslev W. Targeting intensive glycaemic control versus targeting conventional glycaemic control for type 2 diabetes (Review). The Cochrane Library 2013, Issue 11 https://www.helsedirektoratet.no/referanse/0002-0013-232261
274. Holman RR, Paul SK, Bethel MA, Matthews DR, Neil HA. 10-year follow-up of intensive glucose control in type 2 diabetes. The New England Journal of Medicine 2008;359 (15):1577–89. [PUBMED: 18784090] https://www.helsedirektoratet.no/referanse/0002-0013-232262
275. ADDITION Netherlands: No negative effects of a multi-factorial, intensified treatment on self-reported health status, treatment satisfaction, and diabetes-related distress in screen-detected type 2 diabetes patients. The ADDITION-Netherlands study. van den Donk M, Gorter KJ, Rutten GE. Quality of Life Research, 2010 https://www.helsedirektoratet.no/referanse/0002-0013-232263
276. UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes(UKPDS 34). Lancet 1998;352(9131):854–65 https://www.helsedirektoratet.no/referanse/0002-0013-232264
277. The Action to Control Cardiovascular Risk in Diabetes Study Group (2008) Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 358:2545–2559 https://www.helsedirektoratet.no/referanse/0002-0013-232265
278. Kahn SE, Haffner SM, Heise MA, et al. Glycemic duarbillity of rosiglitazone, metformin or glyburide therapy. N Engl J Med 2006; 355: 2427-43 https://www.helsedirektoratet.no/referanse/0002-0013-232266
279. Buehler, A. M., Cavalcanti, A. B., Berwanger, O. Et al.. Effect of tight blood glucose control versus conventional control in patients with type 2 diabetes mellitus: a systematic review with meta-analysis of randomized controlled trials. Cardiovasc Ther 2013, 31;147-160. doi: 10.1111/j.1755-5922.2011.00308.x PMID: 22212499 https://www.helsedirektoratet.no/referanse/0002-0013-232267
280. Turnbull FM, Abraira C, Anderson RJ, et al. Intensive glucose control and macrovascular outcomes in type 2 diabetes. Diabetologia 2009; 52: 2288-98 https://www.helsedirektoratet.no/referanse/0002-0013-232268
281. The Wisconsin epidemiologic study of diabetic retinopathy. III. Prevalence and risk of diabetic retinopathy when age at diagnosis is 30 or more years https://www.helsedirektoratet.no/referanse/0002-0013-232269
282. Glucose control and the renal and retinal complications of insulin-dependent diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232270
283. https://www.helsedirektoratet.no/referanse/0002-0013-232271
284. Role of intensive glucose control in development of renal end points in type 2 diabetes mellitus: systematic review and meta-analysis intensive glucose control in type 2 diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232272
285. Glucose control and vascular complications in veterans with type 2 diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232273
286. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33) https://www.helsedirektoratet.no/referanse/0002-0013-232274
287. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study https://www.helsedirektoratet.no/referanse/0002-0013-232275
Sist faglig oppdatert: 14.09.2016
Egenmåling av blodsukker ved diabetes type 2
De fleste personer med diabetes type 2 som ikke bruker insulin, trenger ikke å utføre hyppige egenmålinger av blodsukkeret.
Praktisk – slik kan anbefalingen følges
For personer med diabetes type 2 som ikke bruker insulin er det ikke holdepunkter for at egenmålinger bedrer blodsukkerkontrollen over tid. Mange pasienter opplever imidlertid at egenmåling av blodsukker, særlig i starten av sykdomsforløpet, gir økt trygghet og innsikt i sykdommen og hvordan levevaner påvirker blodsukkernivået. Helsepersonell bør derfor ta utgangspunkt i den enkelte pasients behov og diskutere både behov for måling og hvordan resultatet brukes målrettet for å bedre blodsukkerkontrollen.
I følgende situasjoner kan det være nyttig å måle blodsukkeret:
- Ved nyoppdaget diabetes type 2 kan blodsukkermåling være nyttig i en kort periode for å prøve ut hvordan mat og fysisk aktivitet påvirker blodsukkernivået
- Når det er vanskelig å nå behandlingsmålene
- Ved endring av legemiddelbehandlingen
- Ved oppstart av insulin og titrering av insulindoser
God opplæring er en forutsetning for at måleresultatene er pålitelige.
Praktiske råd ved måling:
Begrunnelse – dette er anbefalingen basert på
Egenkontroll av blodsukker har vist seg å være et effektivt verktøy i egenhåndtering av pasientenes blodsukkernivåer hos personer med diabetes type 2 som bruker insulinbehandling.
I en systematisk oversiktsartikkel (Malanda et al., 2012) med 2324 pasienter med diabetesvarighet mer enn ett år, fulgt over 6 måneder (og 493 pasienter over 12 måneder), ble det vist at egenkontroll/selv-monitorering versus ingen egenkontroll hadde minimal effekt på blodsukkerkontroll i løpet av seks måneder, og denne effekten forsvant etter 12 måneder.
Studien fant at egenmåling av blodsukker ikke hadde effekt på generell helserelatert livskvalitet, generell trivsel, pasienttilfredshet, eller på reduksjon av antallet av hypoglykemiske episoder.
Referanser
288. Malanda UL, Welschen LM et al: Self-monitoring of blood glucose in patients with type 2 diabetes mellitus who are not using insulin. Cochrane Syst review. 2012 Jan 18;1:CD005060. doi: 10.1002/14651858.CD005060.pub3 https://www.helsedirektoratet.no/referanse/0002-0013-232276
Sist faglig oppdatert: 14.09.2016
Metformin som førstevalg ved diabetes type 2
Metformin anbefales som førstevalg ved oppstart av blodsukkersenkende legemiddelbehandling av diabetes type 2.
Praktisk – slik kan anbefalingen følges
Det skal ikke startes med metformin ved nedsatt nyrefunksjon (eGFR < 45 ml/min/ 1.73 m²).
I følge SLVs preparatomtale er metformin (A10BA02) kontraindisert ved eGFR < 45 ml/min/ 1.73 m², men pasienter som allerede står på metformin kan fortsette med redusert dose ved synkende eGFR inntil eGFR = 30 ml/min/ 1.73 m², hvor metformin skal seponeres. Årsaken er først og fremst frykt for økt risiko for laktacidose. Tilleggsfaktorer som kan øke denne risikoen er: Dehydrering, samtidig bruk av diuretika, ACE-hemmer eller angiotensin-2 blokker.
Se også anbefalingen Oppfølging av pasienter med lav GFR for å redusere risiko for kardiovaskulær sykdom – «Vær varsom»-plakaten.
For å unngå gastrointestinale bivirkninger bør man begynne med en lav dose metformin og trappe dosen langsomt opp.
Nedenfor følger beskrivelse av fordeler og ulemper ved behandling med metformin (og kan sammenlignes med fordeler og ulemper for andrevalgslegemiddel (det vil si det man velger etter metformin, se egen anbefaling)).
Antatte fordeler med metformin:
- Lang erfaring
- Gir sjelden hypoglykemi
- Er i en randomisert klinisk studie vist å redusere kardiovaskulære hendelser (UKPDS 34, 1998). (Det må dog presiseres at overførbarhet av dette effektestimatet til dagnes diabetespopulasjon er forbundet med begrensninger, da den øvrige beskyttelse mot kardiovaskulære hendelser (som statiner og RAS-hemming) var fraværende på tiden UKPDS var utført)
- Godkjent for bruk hos pasienter med moderat redusert nyrefunksjon (eGFR > 45 ml/min/ 1.73 m²) og også ved stabil, kronisk hjertesvikt
Antatte ulemper med metformin:
- Gastrointestinale bivirkninger
- Vitamin B12-mangel
- Risiko for laktacidose (sjeldent)
- Kontraindisert ved sterkt nedsatt nyrefunksjon (eGFR< 30-45 ml/min/ 1.73 m²), acidose, hypoksi og dehydrering
Begrunnelse – dette er anbefalingen basert på
Omfattende vitenskapelig dokumentasjon og lang klinisk erfaring har vist at metformin senker blodsukkeret effektivt uten risiko for vektøkning eller hypoglykemi. Det er ikke vist at andre blodsukkersenkende legemidler gir bedre prognose enn metformin med hensyn på kliniske endepunkt som total dødelighet, hjerte- og karsykdom, nyresvikt, blindhet eller amputasjoner.
Forskningsgrunnlag
Populasjon (P): Pasienter med type 2 diabetes
Tiltak (I): Sulfonylurea i monoterapi
Sammenligning (C): Metformin i monoterapi
Beskrivelse av inkluderte studier
Følgende utfall ble ansett som de viktigste for målgruppen av behandlingen (grad av antatt viktighet er gitt som Kritisk, Viktig og Mindre viktig):
1. Død – KRITISK
2. Livskvalitet – KRITISK
3. ESRD – KRITISK (Nefropatigruppen ser på dette utfallet)
4. Hjerteinfarkt/hjerneslag – KRITISK
5. Ketoacidose/annen alvorlig hyperglykemi – VIKTIG
6. HbA1c – VIKTIG
7. (Alvorlig) hypoglykemi – KRITISK
8. Bivirkninger – VIKTIG
9. Vektendring – MINDRE VIKTIG
10.Synstruende retinopati – KRITISK
11.Amputasjon – KRITISK
Gjennom litteratursøk ble det funnet to store kunnskapsoppsummeringer som best besvarte den kliniske problemstillingen (PICO), og i disse er det effektestimater på følgende seks utfallsmål: Død, hjerteinfarkt/hjerneslag, HbA1c, hypoglykemi, bivirkninger og vektendring. Disse to oversiktsartiklene er en Cochrane-analyse fra 2014 (Hemmingsen B, 2014) og en metaanalyse fra 2011 (Bennett WL, 2011).
Evidensprofilen er basert på Cochrane-oversikten (Hemmingsen B, 2014) som sammenligner metformin mot SU i monoterapi - og i denne er metformin kontroll, mens SU er intervensjon. Kunnskapsgrunnlaget for DPP4-hemmere og GLP-1-analoger sammenlignet mot metformin i monoterapi er basert på funnene i Bennett et al. SGLT2-hemmere er utelatt i sammenligningen fordi det mangler langvarige studier som har studert metformin monoterapi mot SGLT2-hemmere i monoterapi. Også for GLP-1 analoger er dokumentasjonen mangelfull, men en studie over 52 uker har sammenlignet metformin monoterapi med GLP-1 analog i monoterapi (Umpierrez G, 2014).
Beskrivelse av hvert enkeltutfall basert på konklusjoner i de to utvalgte kunnskapsoppsummeringene
1. Død – KRITISK
Bennett et al konkluderer med at det vitenskapelige grunnlaget for å trekke konklusjoner om forskjeller i effekt på total dødelighet og kardiovaskulær dødelighet mellom metformin monoterapi og andre blodsukkersenkende legemidler brukt i monoterapi er svakt eller mangler (Bennett WL, 2011).
Cochrane-analysen fra 2014 (Hemmingsen B, 2014) fant ingen forskjell i total dødelighet mellom gruppene.
Det var en ikke signifikant økning i kardiovaskulær dødelighet hos dem som fikk SU i monoterapi sammenlignet med gruppen som fikk metformin (relativ risiko 1,47, konfidensintervall 0,61-6,66). Samtidig fant man at andre- og tredjegenerasjons SU ga redusert risiko for ikke-dødelige makrovaskulære hendelser sammenlignet med metformin (relativ risiko 0,67 (konfidensintervall 0,48 – 0,93). «Trial sequential analyser» viste imidlertid at metaanalysen bare inkluderte en brøkdel av det antall hendelser som var nødvendige for å detektere eller utelukke en 10 % reduksjon i relativ risiko død og for kardiovaskulær død. Ingen av studiene i rapporten hadde dødelighet eller kardiovaskulære hendelser som primære utfall; utfallene ble rapportert som adverse events (Hemmingsen B, 2014).
I Cochrane analysen (2) er ADOPT-studien (A Diabetes Outcome Progression Trial (ADOPT) Giancarlo Viberti et al 2002) den klart største enkeltstudien og påvirker derfor resultatene av metaanalysen i stor grad. Risikoen for sponsor bias er vurdert som stor i denne studien.
Konklusjonen fra de to metaanalysene er sammenfallende: Det er ikke grunnlag for å trekke sikre konklusjoner om forskjeller i effekt på total dødelighet og kardiovaskulær dødelighet mellom metformin monoterapi og andre blodsukkersenkende legemidler brukt i monoterapi (Bennet WL, 2011 og Hemmingsen, 2014).
2. Livskvalitet – KRITISK
Ikke data.
3. ESRD – KRITISK
Hverken Bennet (2011) eller Cochrane (Hemmingsen, 2014) fant data som kunne dokumentere effektforskjeller mellom ulike blodsukkersenkende legemidler (brukt i monoterapi) med hensyn på forekomst av endestadium nyresvikt.
4. Hjerteinfarkt/hjerneslag – KRITISK
Cochrane-analysen fra 2014 (Hemmingsen, 2014) fant at andre- og tredjegenerasjons SU ga redusert risiko for ikke-dødelige makrovaskulære hendelser sammenlignet med metformin (relativ risiko 0,67 (konfidensintervall 0,48 – 0,93). Samtidig fant man en ikke signifikant økning i kardiovaskulær dødelighet hos dem som fikk SU i monoterapi sammenlignet med gruppen som fikk metformin (relativ risiko 1,47, konfidensintervall 0,61-6,66). «Trial sequential analyser» viste imidlertid at metaanalysen bare inkluderte en brøkdel av det antall hendelser som var nødvendige for å detektere eller utelukke en 10 % reduksjon ikke fatale makrovaskulære hendelser. Ingen av studiene i rapporten hadde heller dødelighet eller kardiovaskulære hendelser som primære utfall, men utfallene ble rapportert som adverse events (2). I Cochrane analysen (Hemmingsen, 2014) er ADOPT-studien (Viberti, 2002) den klart største enkeltstudien og påvirker derfor resultatene av metaanalysen i stor grad. Risikoen for sponsor bias er vurdert som stor i denne studien.
Heller ikke Bennett et al fant sikre forskjeller i ikke-fatal makrovaskulær sykdom mellom metformin monoterapi og andre blodsukkersenkende legemidler brukt i monoterapi (Bennett WL, 2011).
5. Ketoacidose/annen alvorlig hyperglykemi – VIKTIG ¨
Hverken Bennett (2011) eller Cochrane (Hemmingsen, 2014) fant data som kunne dokumentere effektforskjeller mellom ulike blodsukkersenkende legemidler (brukt i monoterapi) med hensyn på forekomst av ketoacidose/annen alvorlig hyperglykemi
6. HbA1c – VIKTIG
Bennett (2011) fant at SU ga omtrent samme reduksjon i HbA1c som metformin (17 studier/6936 deltakere); høy evidens. Effekten av DPP-4-hemmer var mindre enn for metformin (3 studier/1908 deltakere); moderat evidens. Bennets analyse fra 2011 inkluderer ingen studier som har sammenlignet metformin og dapagliflozin eller metformin og GLP-1-analoger i monoterapi.
Også Cochrane (Hemmingsen, 2014) fant at SU og metformin i monoterapi ga samme reduksjon i HbA1C (13 studier/3632 deltakere).
ADOPT-studien fant at etter fem år klarte 79 % av pasientene som brukte metformin seg fortsatt med monoterapi - mot 66 % av dem som brukte (Viberti, 2002).
En ny randomisert studie over 52 uker som sammenlignet metformin monoterapi og dulaglutide (en GLP-1 agonist) i monoterapi, fant at GLP-1 agonist ga noe større fall i HbA1C enn metformin etter 26 uker (Umpierrez G, 2014).
7. (Alvorlig) hypoglykemi – KRITISK
I Bennetts analyse (2011) skilte ingen av behandlingsalternativene seg ut med høy forekomst av alvorlig hypoglykemi, men mild eller moderat hypoglykemi ble sett 4 ganger så ofte ved SU monoterapi (238 hendelser/1650 pasienter) sammenlignet med metformin i monoterapi (56 hendelser / 1631 pasienter) (Høy evidens).
Cochrane-analysen fant økt risiko for både mild hypoglykemi (relativ risiko 2,95 konfidensintervall 2,13 – 4,07; høy evidens ) og alvorlig hypoglykemi (relativ risiko 5,64 konfidensintervall 1,22- 26,00; lav evidens) ved bruk av SU monoterapi sammenlignet med metformin monoterapi (Hemmingsen, 2014). Sekvensielle analyser viste at metaanalysen ikke hadde nok hendelser for å påvise /avvise 10 % reduksjon i relativ risiko
Diskusjon: Begge metaanalysene fant økt risiko for mild og moderat hypoglykemi ved bruk av SU i monoterapi sammenlignet med metformin monoterapi. ADOPT-studiet inngår i begge analysene, likevel er det bare Cochrane som konkluderer med økt risiko for alvorlig hypoglykemi. Også i denne analysen forekommer alvorlig hypoglykemi sjelden; 11 hendelse /1861 pasienter på SU og 2 hendelser/1940 pasienter på metformin.
8. Bivirkninger (I tillegg til de som er omtalt for seg) VIKTIG
Bennett (2011) fant at metformin ga mer gastrointestinale bivirkninger enn SU; (11 RCT/5745 deltakere); moderat evidens og DPP-4-hemmere (2 RCT/1028 deltakere); moderat evidens.
Cochrane (Hemmingsen, 2014) fant ingen forskjell i total forekomst av bivirkninger (adverse events) mellom SU monoterapi og metformin monoterapi (5 studier/3138 deltakere); moderat evidens.
9. Vektendring – MINDRE VIKTIG
Bennett fant at SU ga økt vekt sammenlignet med metformin (12 studier/5067 deltakere); høy evidens, mens DPP-4-hemmere ga litt økt vekt sammenlignet med metformin (3 studier/1908 deltakere); moderat evidens (Bennett WL, 2011). Cochrane (Hemmingsen, 2014) fant at SU i monoterapi ga 3,8 kg økt vekt(konfidensintervall 3,06 – 4,47 kg) sammenlignet med metformin monoterapi (7 studier / 3497 deltakere); høy evidens.
En ny randomisert studie over 52 uker som sammenlignet metformin monoterapi og dulaglutide (en GLP-1 agonist) i monoterapi, fant at GLP-1 agonist ga samme vektreduksjon som metformin (Umpierrez G, 2014).
10. Synstruende retinopati – KRITISK
Hverken Bennett (2011) eller Cochrane (hemmingsen, 2014) fant data som kunne dokumentere effektforskjeller mellom ulike blodsukkersenkende legemidler (brukt i monoterapi) med hensyn på forekomst av synstruende retinopati.
11. Amputasjon – KRITISK
Hverken Bennett (2011) eller Cochrane (Hemmingsen, 2014) fant data som kunne dokumentere effektforskjeller mellom ulike blodsukkersenkende legemidler (brukt i monoterapi) med hensyn på forekomst av amputasjoner.
Vurdering
Fordeler og ulemper
Metformin anbefales som første valg når pasienter med diabetes type 2 trenger blodsukkersenkende medisin fordi:
- metformin i monoterapi gir robust reduksjon i HbA1c
- metformin ikke gir vektøkning
- metformin gir liten risiko for hypoglykemi
I tillegg er metformin et rimelig legemiddel og det er lang klinisk erfaring med legemidlet. En eldre studie (UKPDS 34, 1998) kan tale for at metformin reduserer risikoen for hjerte- og karsykdom hos overvektige, men det er ikke sterkt vitenskapelig grunnlag for å trekke sikre konklusjoner om forskjeller i effekt på kliniske endepunkt som total dødelighet og hjerte-karsykdom mellom metformin monoterapi og ande blodsukkersenkende legemidler brukt i monoterapi. Metformin gir oftere gastrointestinale plager enn de andre blodsukkersenkende legemidler.
Kvalitet på dokumentasjonen
En Cochrane-analyse fra 2014 (Hemmingsen et al., 2014) inkluderte 25 artikler som beskrev 14 randomiserte studier der metformin i monoterapi var sammenlignet med andre- og tredjegenerasjons sulfonylurea i monoterapi. Med søk og utvalg av studier fulgte man anbefalingene fra The Cochrane Collaboration og en publisert protokoll.
Forfatterne peker på følgende svakheter:
- Bare tre av de 14 studiene hadde lav risiko for bias med hensyn på randomisering, allokering og blinding.
- Metaanalysen inkluderte bare studier der mortalitet og vaskulære hendelser ikke var definerte endepunkt (og der disse hendelsene følgelig bare ble rapportert som adverse events).
- De fleste studiene i metaanalysene har for lite data for viktige utfall bortsett fra endringer i vekt.
- Pasienter med andre sykdommer var ekskludert fra de fleste studiene.
I en metaanalyse fra Bennett et al., (2011) inkluderte kun RCT'er for intermediære endepunkt som vekt, HbA1c og hypoglykemi, men inkluderte også observasjonsstudier for kliniske endepunkt og bivirkninger. Det er gjort godt rede for søk og utvalg av studier. Vurdering av resultatene ble det brukt GRADE-metodikk.
Forfatterne peker på følgende svakheter:
- Deltakerne i studiene avviker fra den gjennomsnittlige diabetes-2 pasienten (yngre, bedre helse, kort sykehistorie).
- De fleste studiene var kortvarige.
- Studier der «bakgrunnsmedisinering» var tillatt ble ekskludert, dette førte til at flere store studier ble ekskludert (som UKPDS, VADT)
- Mange av studiene var finansiert av legemiddelindustrien.
Vurdering:
Pasientpopulasjonen i begge de to metaanalysene som ligger til grunn for kunnskapsgrunnlaget hadde en gjennomsnittsalder på 56 år og var uten kardiovaskulær sykdom. Den gjennomsnittlige pasient med diabetes type 2 i norsk klinisk praksis er eldre og sykere og man kan forvente en større effekt av samme behandling.
Verdier og preferanser
Metformin har egenskaper som tilsier at de fleste pasienter vil akseptere legemidlet som første valg ved behov for blodsukkersenkende behandling med legemidler. Det er sannsynlig at en del overvektige pasienter vil ønske å starte med legemidler som kan gi noe vektreduksjon (GLP-1 agonister og SGLT2-hemmere). Pasienter som opplever betydelige bivirkninger (først og fremst mageplager), vil selvsagt ønske annen behandling.
En metaanalyse med pasienters verdier og preferanser har vist at pasientene legger stor vekt på vektreduksjon og liten risiko for hypoglykemi (Purnell et al., 2014)
Referanser
273. Hemmmingsen B, Lund SS, Gluud C, Vaag A, Almdal TP, Hemmingsen C, Wetterslev W. Targeting intensive glycaemic control versus targeting conventional glycaemic control for type 2 diabetes (Review). The Cochrane Library 2013, Issue 11 https://www.helsedirektoratet.no/referanse/0002-0013-232261
289. Bennett W L et. al. Comparative Effectiveness and Safety of Medications for Type 2 Diabetes: An Update Including New Drugs and 2-Drug Combinations. Annals of Internal Medicine 2011; 154(9): 602-613 (Pubmed: 2140 3054) https://www.helsedirektoratet.no/referanse/0002-0013-232277
290. Efficacy and Safety of Dulaglutide Monotherapy Versus Metformin in Type 2 Diabetes in a Randomized Controlled Trial (AWARD-3) https://www.helsedirektoratet.no/referanse/0002-0013-232278
291. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes(UKPDS 34) https://www.helsedirektoratet.no/referanse/0002-0013-232279
292. A Diabetes Outcome Progression Trial (ADOPT). An international multicenter study of the comparative efficacy of rosiglitazone, glyburide, and metformin in recently diagnosed type 2 diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232280
Sist faglig oppdatert: 14.09.2016
Valg av blodsukkersenkende legemiddel etter metformin ved diabetes type 2
Ved utilstrekkelig blodsukkersenkende effekt av metformin alene eller når metformin ikke kan brukes, foreslås individuelt tilpasset behandling med andre blodsukkersenkende legemidler *.
For de fleste pasienter med diabetes type 2 foreslås det som andrevalg (ikke i prioritert rekkefølge):
- Sulfonylurea
- DPP4-hemmer
- SGLT2-hemmer**
- GLP1-analog**
- Basalinsulin
Det anbefales å velge et legemiddel der sikkerheten er dokumentert gjennom lang erfaring eller i kontrollerte langtidsstudier.
* Se preparatomtale for de enkelte legemidler. Det vises til Direktoratet for medisinske produkters gjeldende refusjonsvilkår.
** For pasienter med etablert hjerte- og karsykdom har SGLT2-hemmerne dapagliflozin, empagliflozin og kanagliflozin og GLP1- analogene eksenatid i langtidsvirkende form, dulaglutid, semaglutid og liraglutid dokumentert positiv effekt på ett eller flere viktige utfall (total mortalitet, hjerte- og kardød, hjertesvikt, hjerteinfarkt eller hjerneslag. Hos pasienter med nyresykdom har empagliflozin, dapagliflozin og kanagliflozin dokumentert beskyttende effekt på nyrefunksjonen (eGFR) ) og andre viktige nyrerelaterte endepunkter (se kapittel 8).
Praktisk – slik kan anbefalingen følges
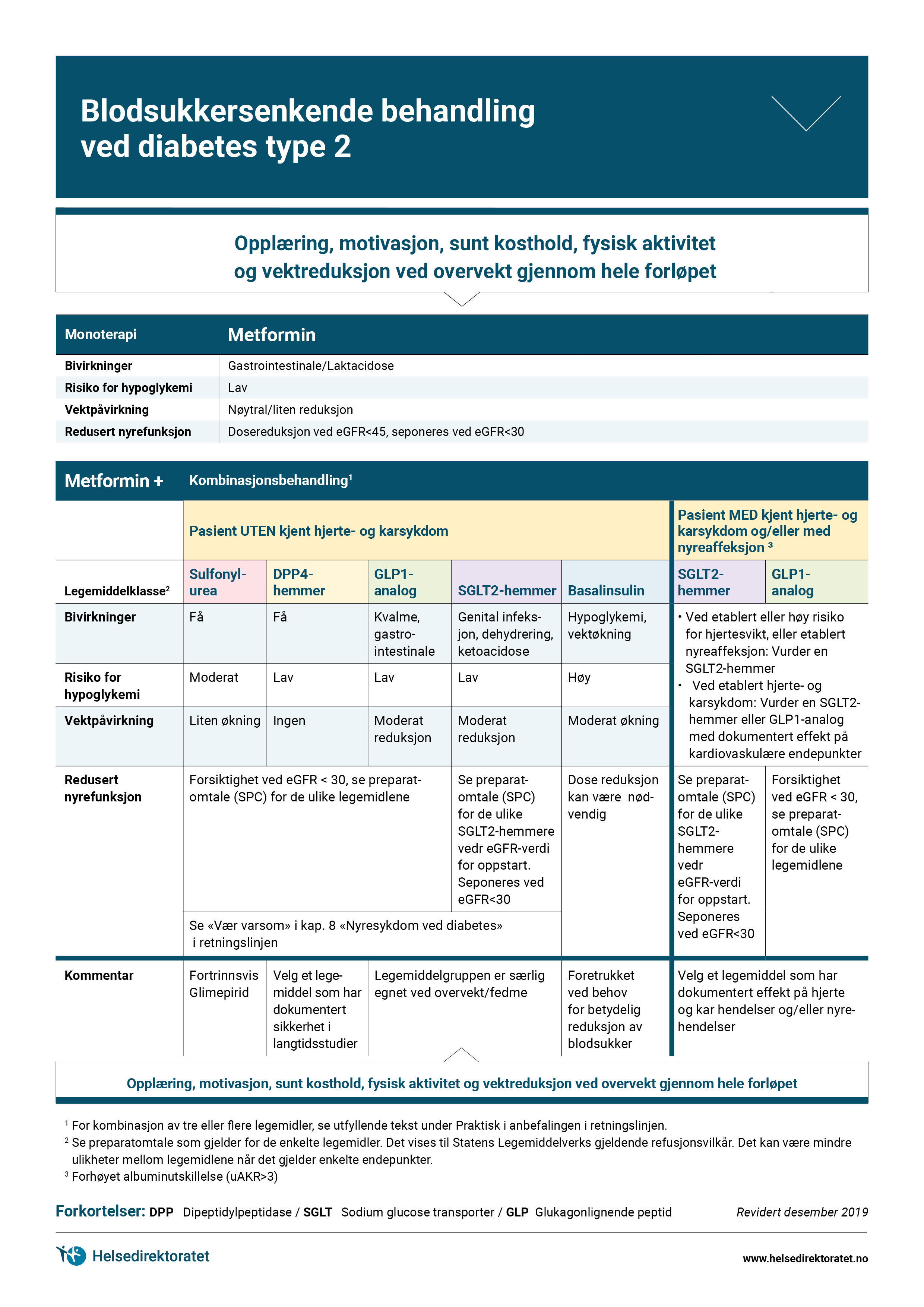
Last ned flytdiagram: Blodsukkersenkende behandling for diabetes type 2 (Utskriftsvennlig PDF)
Det anbefales at alle pasienter med diabetes type 2 får god basisbehandling med opplæring, motivasjon, veiledning i fysisk aktivitet og kostrådgivning. Se kapittelet Levevaner ved diabetes og behandling av overvekt og fedme.
De fleste pasienter med diabetes type 2 er overvektige og bør få informasjon om og hjelp til vektreduksjon. Selv et beskjedent vekttap (omkring 5 %) kan gi bedre glukosekontroll, lipidprofil og redusert blodtrykk. For pasienter med KMI over 35 er vektreduserende kirurgi et behandlingsalternativ som kan redusere blodsukker og kardiovaskulære risikofaktorer og sannsynligvis risiko for alvorlig sykdom og død. Mer om dette i kapittel 4 (i anbefalingen Vektreduksjon ved diabetes type 2 og overvekt/fedme).
Ved valg av blodsukkersenkende legemidler bør man ta hensyn til eventuelle effekter på kroppsvekt (se under for hvilke legemidler som kan føre til vektøkning/vektnedgang). Når behandling med blodsukkersenkende legemidler er indisert, anbefales metformin som førstevalg dersom det tolereres og ikke er kontraindisert. Se anbefaling Metformin som førstevalg ved diabetes type 2.
Ved behov for kombinasjonsterapi
Når metformin ikke er tilstrekkelig for å nå behandlingsmålet for blodsukker er det en rekke ulike legemidler å velge mellom, og det foreligger ikke tilstrekkelig vitenskapelig evidens til å gi kun en enkeltanbefaling. Det er i denne situasjonen mest aktuelt å legge til et legemiddel fra følgende farmakologiske grupper (2. valgs legemiddel): sulfonylurea, DPP4-hemmere, SGLT2-hemmere, GLP1-analoger eller langtidsvirkende insulin*.
Hvis nyrefunksjonen er normal og det ikke foreligger spesielle kontraindikasjoner eller intoleranser anbefales det å beholde metformindosen uendret og starte med ett av følgende legemidler i tillegg:
- glimepirid (A10BB12) 1 mg økende inntil 4(-6) mg/d i én morgendose over 2-6 uker
- linagliptin (A10BH05) 5mg eller sitagliptin (A10BH01) 100 mg (dosereduksjon ved nedsatt nyrefunksjon)
- dapagliflozin (A10BK01) 5 mg/d eller 10 mg/d, empagliflozin (A10BK03) 10 mg/d eller 25 mg/d, eller kanagliflozin (A10BK02) 100 mg/d
- dulaglutid (A10BJ05) 1,5 mg/uke, liraglutid (A10BJ02) 0,6 mg/d økende til 1,2 mg/d etter minst en uke (evt. videre økning til 1,8 mg/d) eller semaglutid (A10BJ06) 0,25 mg/uke økende til 0,5 mg/uke etter 4 uker (evt. videre økning til 1 mg/uke)
Vedrørende SGLT2-hemmere:
Tilfeller av diabetisk ketoacidose er rapportert ved bruk av SGLT2-hemmer, også ved diabetes type 2. I flere tilfeller var tilstanden atypisk med kun lett økte blodsukkerverdier. Pasienter skal umiddelbart undersøkes for ketoacidose dersom symptomer oppstår (f.eks. slapphet, tap av appetitt, kvalme, dehydrering, magesmerter), uavhengig av blodglukosenivået. Ved akutt, interkurrent sykdom eller dehydrering anbefales midlertidig seponering av SGLT2-hemmer (Se også «Vær varsom-plakaten» i kapittel 8). Det er meldt tilfeller av akutte infeksjoner som fører til skadet vev i området mellom kjønnsorgan og endetarm (nekrotiserende fascitt i perineum/Fourniers gangren) hos pasienter som bruker SGLT2-hemmere. I CANVAS-studiene (Neal B, et al, 2017) med kanagliflozin var det økt forekomst av amputasjoner og frakturer i canagliflozin-gruppen. Tilsvarende ble ikke sett i CREDENCE-studien (Perkovic V, et al, 2019) med samme legemiddel, men assosiasjon er også sett i observasjonelle studier med flere legemidler i gruppen og en klasse-effekt kan ikke utelukkes.
Hvis det er behov for å senke HbA1c mer enn 22 mmol/mol (2 %-poeng), anbefales det å velge insulin eller en GLP1-analog da de andre alternativene har mindre blodsukkersenkende virkning.
- basalinsulin (A10AC)
- Lær pasienten blodsukkermåling og riktig injeksjonsteknikk.
- Be pasienten måle fastende blodsukker daglig
- Start med 10 E til natten
- Øk insulindosen med 4 E hvis verdiene tre dager etter hverandre er over 10 mmol/l og 2 E ved fastende blodsukker 6-10 mmol/l
- Hvis føling eller flere målinger av fastende blodsukker under 4 mmol/l: Reduser med 2 (-4) E.
På denne måten økes insulindosen 2 ganger i uka inntil man når målet som er fastende blodsukker 4-6 mmol/l (tilsvarer oftest HbA1c omkring 7 % med et slikt behandlingsregime). Med optimal bruk av ovennevnte behandlingsregimer, vil rundt 40-60 % av pasientene kunne nå et behandlingsmål med HbA1c omkring 7 %.
*De fleste pasienter kan behandles med NPH-insulin. Utvalgte pasienter vil ha nytte av langtidsvirkende insulinanalog (glargin, glargin-300, detemir, degludec), særlig ved nattlig hypoglykemi eller åpenbart for kort virketid av NPH-insulin. For dosering og gjeldende refusjonsregler, se oppdatert tekst i Felleskatalogen.
Tredjevalgs-legemiddel
Dersom ovennevnte behandlingsregimer ikke fører til at man når ønsket behandlingsmål foreslås følgende tiltak:
- Vurdere om mer kan gjøres med opplæring, motivasjon og hjelp til endring av levevaner? Se detaljer om dette i kapitlene Kommunikasjon, mestring og motivasjon ved diabetes og Levevaner ved diabetes og behandling av overvekt og fedme.
- Egenmåling av blodglukose døgnprofil (før og to timer etter måltid) i 3-5 dager eller en tilsvarende periode med kontinuerlig vevsglukosemåling for å identifisere døgn-/måltidsmønstre i glukosesvingningene.
- Tillegg av ytterligere blodsukkersenkende legemidler. Det er en rekke legemidler å velge mellom og ikke sterk evidens for å foretrekke ett behandlingsregime fremfor et annet. Individuelt tilpasset behandling under hensyntagen til effekt og bivirkninger anbefales.
Følgende råd kan gis:
- Metformin kontinueres i samtlige kombinasjonsregimer, så sant det tolereres og nyrefunksjonen ikke er for dårlig.
- Insulin brukt på riktig måte har størst potensiale for å redusere blodsukkeret og anbefales til alle hvis HbA1c > 86 mmol/mol (10 %), fastende blodsukker > 15 mmol/l eller ved betydelige symptomer på hyperglykemi.
- Metformin i kombinasjon med en kveldsdose med langtidsvirkende insulin er et enkelt behandlingsregime som kan fungere godt for mange.
- Kombinasjon av sulfonylurea og insulin øker risikoen for hypoglykemi og bør oftest unngås.
- Kombinasjon av DPP4-hemmer og GLP1-analog gir liten mening, ettersom den blodsukkersenkende effekten via inkretinsystemet tas ut med GLP1-analog alene.
- Når overvekt/fedme er et vesentlig problem, bør man vurdere legemidler som bidrar til vektreduksjon (SGLT2-hemmere og GLP1-analoger). Vektreduserende kirurgi kan vurderes ved KMI > 35 kg/m². Se forøvrig kapittelet Levevaner ved diabetes og behandling av overvekt og fedme
- Noen GLP1-analoger ser ut til å redusere HbA1c mer enn det som vanligvis oppnås med perorale legemidler. Fast kombinasjon av GLP1-analog og langtidsvirkende insulin kan være et godt alternativ dersom ett av legemidlene ikke er tilstrekkelig.
- Pioglitazon (A10BG03) kan vurderes når det er uttalt insulinresistens (ikke tatt med i flytdiagrammet). OBS! forsiktighetsregler og kontraindikasjoner.
- Pasientpreferanser og pasientetterlevelse bør veie tungt opp mot injeksjonsbehandling og polyfarmasi.
- Etterlevelse av legemiddelforeskrivning av antidiabetika er ofte mangelfull og bør få fokus i pasientsamarbeidet.
Tillegg av hurtigvirkende insulin til måltid
Tillegg av hurtigvirkende insulin (analog). Kan gis som en dose (til hovedmåltid), to doser eller tre doser daglig. Merk at hurtigvirkende insulin gitt til overvektige personer med diabetes type 2 ikke virker like hurtig, sterkt og kortvarig som når vi bruker det til normalvektige personer med diabetes type 1. Ved særlig sterk blodsukkerstigning etter måltid (for eksempel etter frokost eller middag) kan det likevel være et godt valg å gi hurtigvirkende insulin til det aktuelle måltidet. Start gjerne med en liten dose (for eksempel 10 % av døgndose NPH-insulin) og mål blodsukkeret etter 2 timer. Øk med 2 E hver 3. dag inntil postprandialt blodsukker er under 10 (-12) mmol/L. OBS: Noen pasienter vil da trenge å redusere kveldsdosen av NPH-insulin tilsvarende for å unngå insulinføling om natten.
Spesielle situasjoner og mer komplekse regimer
I en del tilfeller er det ønskelig med rask kontroll over blodsukkeret og muligheter til raske endringer av den blodsukkersenkende behandlingen (nyoppdaget diabetes type 2 med høyt blodsukker, sykehusbehandling av interkurrent sykdom o.a.). Da anbefales insulinbehandling med to doser NPH-insulin eller mangeinjeksjonsbehandling som ved diabetes type 1 med 1-2 doser langtidsvirkende insulin og hurtigvirkende insulin(analog) til måltider.
Spesielle forholdsregler ved redusert eGFR
(Se detaljer i kapitlet Nyresykdom ved diabetes).
Ved redusert eGFR er det endret virkning og økt risiko for bivirkninger ved flere antidiabetika (se preparatomtaler/Felleskatalogtekst),
- Metformin kan brukes i reduserte doser og med forsiktighet og økt kontrollhyppighet ved eGFR ned mot 30 ml/min.
- SU har forlenget virketid og risikoen for hypoglykemi øker
- Dosen av noen DPP4-hemmere må reduseres
- SGLT2-hemmere har redusert blodsukkersenkende virkning
- GLP1-analoger anbefales ikke ved alvorlig nyresvikt
- Insulin har forlenget virketid og risikoen for hypoglykemier øker
Spesielle forholdsregler ved diabetes og hjertesvikt
Noen antidiabetika er assosiert med økt risiko for væskeretensjon som kan forverre eller utløse hjertesvikt. Det gjelder særlig pioglitazon, men kanskje også saxagliptin som i SAVOR-TIMI studien var assosiert med økt risiko for hospitalisering for hjertesvikt, og insulin særlig når blodsukkerkontrollen bedres raskt («insulinødemer»). SGLT2-hemmere ser ut til å redusere risiko for hjertesvikt hos pasienter med etablert hjerte- og karsykdom, og dapagliflozin til pasienter med etablert hjertesvikt har vist signifikant reduksjon av et kombinert endepunkt av forverret hjertesvikt og kardiovaskulær død.
Spesielle forholdsregler ved diabetes og overvekt/fedme
Hos pasienter med KMI over 35 kg/m² bør vektreduserende kirurgi vurderes. Ved valg av blodsukkersenkende legemidler er det viktig å drøfte med pasienten mulige effekter på vektutviklingen og ta hensyn til dette så vel i valg av legemiddel, som under oppfølgingen av pasienten. GLP1-analoger og SGLT2-hemmere er assosiert med i gjennomsnitt 2-4 kg vektreduksjon over 6 mnd, og kan være et godt alternativ. All behandling som reduserer blodsukkeret og glukosurien kan ledsages av vektøkning, dersom ikke kaloriinntaket reduseres/kaloriforbruket økes tilsvarende. Særlig viktig er god informasjon om dette når man starter insulinbehandling ved dårlig regulert diabetes (HbA1c over 75 mmol/mol (9 %)).
Hos pasienter med overvekt/fedme som bruker insulin, og som vil gjennomføre ketogent lavkarbokosthold for vektreduksjon, må man være spesielt oppmerksom på økt risiko for ketoacidose på grunn av lav endogen insulinreserve.
Fordeler og ulemper ved 2. og 3. valgs legemiddel
Nedenfor følger beskrivelse av noen fordeler og ulemper ved behandling med de ulike legemidlene som kan være aktuelle som tilleggsbehandling til metformin, eller som erstatning dersom metformin ikke kan brukes.
Sulfonylurea (A10BB)
Antatte fordeler:
- Lang erfaring
- Generelt godt tolerert
- Kan redusere risiko for diabetiske senkomplikasjoner (UKPDS)
Antatte ulemper:
- Ikke vist entydig positive effekter på kardiovaskulær sykelighet og dødelighet
- Kan indusere hypoglykemi
- Er assosiert med moderat vektøkning
DPP4-hemmere (A10BH)
Antatte fordeler:
- Gir sjelden hypoglykemi
- Gir ikke vektøkning
- Generelt godt tolerert
- Langtids sikkerhetsstudier med linagliptin, saxagliptin og sitagliptin viser nøytralitet i forhold til kardiovaskulære utfall sammenliknet med placebo og for linagliptin også sammenliknet med glimeperid (SU-preparat). OBS sikkerhetsinformasjon knyttet til mulig risiko for hjertesvikt for saxagliptin.
Antatte ulemper:
- Kan gi urticaria, angioødem (OBS! kombinasjon med A2-blokker og/eller ACE-hemmer) (sjeldent)
- Kan muligens (men sjelden!) forårsake akutt pankreatitt
Saksagliptin (A10BH03) assosiert med økt antall innleggelse for hjertesvikt
SGLT2-hemmere (A10BK)
Antatte fordeler:
- Kan gi tilleggsfordeler til blodsukkerreduksjon med redusert risiko for tidlig død og hjerte- og karsykdom hos pasienter med etablert hjerte- og karsykdom, samt gunstige langtidseffekter på nyrefunksjonen hos pasienter med etablert nyresykdom
- Kan ha gunstig effekt hos pasienter med hjertesvikt
- Gir sjelden hypoglykemi
- Kan redusere vekten (~2 kg over 3-6 mnd)
- Kan redusere blodtrykk (~2-4/~1-2 mmHg over 3-6 mnd)
- Har effekt også når insulinsekresjonen er betydelig redusert sent i sykdomsforløpet
Antatte ulemper:
- Kan forårsake genitale infeksjoner (2-5 ganger økt forekomst hos hhv. kvinner og menn, sammenlignet med placebo). Det er rapportert en sjelden form for alvorlig genital infeksjon (Fourniers gangren) assosiert med legemiddelklassen
- Er assosiert med økt risiko for urinveisinfeksjoner (varierende resultater i ulike studier)
- Har redusert/manglende effekt på HbA1c ved nedsatt nyrefunksjon
- Tilfeller av diabetisk ketoacidose er rapportert ved bruk av SGLT2-hemmer, også ved diabetes type 2. I flere tilfeller var tilstanden atypisk med kun lett økte blodsukkerverdier. Pasienter skal umiddelbart undersøkes for ketoacidose dersom symptomer oppstår (kan være f.eks. slapphet, tap av appetitt, kvalme, dehydrering, magesmerter), uavhengig av blodglukosenivået. Ved akutt, interkurrent sykdom eller dehydrering anbefales midlertidig seponering av SGLT2-hemmer (Se også «Vær varsom-plakaten» i kapittel 8).
- Gir en liten økning i LDL-kolesterol og HDL-kolesterol
- Gir en (forbigående) reduksjon i eGFR
Insulin og analoger (A10A)
Antatte fordeler:
- Reduksjon av senkomplikasjoner
- Størst blodsukkersenkende effekt
Antatte ulemper:
- Ikke vist entydig positive effekter på kardiovaskulær sykelighet og dødelighet
- Øker risikoen for hypoglykemi
- Kan gi vektøkning
- Kan være belastende for pasienten
- Krever dosejustering og hos noen hyppige egenmåling av blodsukker
GLP1 analoger (A10BJ)
Antatte fordeler:
- Kan gi tilleggsfordeler til blodsukkerreduksjon med redusert risiko for tidlig død og hjerte- og karsykdom hos pasienter med hjerte- og karsykdom
- Gir sjelden hypoglykemi
- Kan medvirke til vektreduksjon (gjennomsnittlig 2-4 kg over 3-6 mnd)
- Kan forhindre stor stigning i blodglukose etter måltid
- Kan gi liten reduksjon i blodtrykk
Antatte ulemper:
- Gastrointestinale bivirkninger (20-40 % initialt)
- Kan muligens (men sjelden!) forårsake akutt pankreatitt
- Kan forårsake C-celle hyperplasi og svulster i forsøksdyr
- Gir en liten økning i hjertefrekvensen
- Må injiseres, krever opplæring
Alfa-glukosidase hemmere (A10BF)
Antatte fordeler:
- Gir sjelden hypoglykemi
- Kan forhindre stor stigning i blodglukose etter måltid
Antatte ulemper:
- Ikke vist entydig positive effekter på kardiovaskulær sykelighet og dødelighet
- Ofte gastrointestinale bivirkninger
- Må tas ofte (opptrapping til dosering 2-3 ganger daglig)
- Begrenset blodsukkersenkende effekt
Thiazolidinedioner (A10BG)
Antatte fordeler:
- Lang erfaring, vist gunstig effekt på hjerte- og karsykdom i en langtidsstudie (sekundært endepunkt).
- Gir sjelden hypoglykemi
- Kan gi økt HDL-kolesterol
- Kan redusere triglyserider
Antatte ulemper:
- Ikke vist entydig positive effekter på kardiovaskulær sykelighet og dødelighet
- Kan føre til vektøkning
- Kan føre til væskeretensjon, ødem og hjertesvikt
- Assosiert med økning av risiko for frakturer, særlig postmenopausale kvinner
Repaglinid (A10BX02)
Antatte fordeler:
- Kan forhindre stor stigning i blodglukose etter måltid
- Fleksibel dosering
Antatte ulemper:
- Ikke vist entydig positive effekter på kardiovaskulær sykelighet og dødelighet
- Kan forårsake hypoglykemi
- Kan forårsake vektøkning
- Må doseres ofte (til hvert måltid)
- Ikke generell refusjon
Begrunnelse – dette er anbefalingen basert på
Valg av tilleggsbehandling når metformin ikke er tilstrekkelig, må baseres på en totalvurdering. Dokumentert sikkerhet og evt. effekt i randomiserte, kontrollerte langtidsstudier og i pasientbehandling over lang tid er tillagt betydelig vekt.
Nedenfor omtales kort de viktigste hensyn som er vektlagt i valget mellom de ulike legemidlene:
Sulfonylurea
Glimepirid viste i CAROLINA studien tilsvarende effekt og sikkerhet som linagliptin i forhold til viktige kardiovaskulære utfall (Rosenstock J, et al, 2019).
DPP4-hemmere
Linagliptin (Rosenstock J, et al (CARMELINA), 2019) og sitagliptin (Green JB, et al, 2015) har dokumentert tilsvarende sikkerhet som placebo i forhold til viktige kardiovaskulære utfall. Saxagliptin viste det samme i forhold til de primære utfall i studien, men det var en økning i hospitalisering for hjertesvikt (sekundært utfall) i saxagliptingruppen som er uforklart (Scirica BM, et al, 2012).
GLP1-analoger
Exenatid ukentlig (Holman RR, et al, 2017), liraglutid (Marso SP, Daniels GH, Brown-Frandsen K, et al, 2016) semaglutid (Marso SP, Bain SC, Consoli A, et al, 2016) og dulaglutid (Gerstein HC, et al, 2019) har dokumentert bedre effekt enn placebo i forhold til effekten på viktige kardiovaskulære utfall og tilfredsstillende sikkerhetsprofil, med noen ulikheter mellom preparatene. Lixisenatid har dokumentert tilsvarende sikkerhet som placebo, men ikke bedre effekt, i forhold til viktige kardiovaskulære utfall (Pfeffer MA, et al, 2015).
SGLT2-hemmere
Kanagliflozin (Neal B, et al, 2017), dapagliflozin (Wiviott SD, et al, 2019) og empagliflozin (Zinman B, et al, 2015) har dokumentert bedre effekt enn placebo i forhold til effekten på viktige kardiovaskulære utfall og tilfredsstillende sikkerhetsprofil, med noen ulikheter mellom preparatene.
Nytt i 2019 er at kanagliflozin har vist gunstige effekter på et sammensatt endepunkt av progresjon av nyresykdom eller kardiovaskulær død hos pasienter med diabetes type 2 og proteinuri (Perkovic V, et al, 2019) og at dapagliflozin har vist gunstige effekter på et sammensatt endpunkt av progresjon av hjertesvikt og kardiovaskulær død hos pasienter med hjertesvikt (uavhengig av diabetes eller ikke) (McMurray JJV, et al, 2019).
Akarbose, repaglinid og pioglitazon anbefales kun til utvalgte pasienter på grunn av avveiningen mellom effekt og bivirkningsprofil og mangelfull dokumentasjon av effekt på viktige kardiovaskulære utfall.
Forskningsgrunnlag
Populasjon (P): Pasienter med type 2 diabetes
Tiltak (I): Pasientpreferanser for medikament behandling (ikke-insulin)
Sammenligning (C): NOTSET!
Beskrivelse av inkluderte studier
HbA1c reduseres mer ved intensiv blodsukkersenkende behandling og forskjellen mellom behandlingsgruppene i undersøkelsene med harde endepunkter er varierte. Ved diabetes type 2 finnes det en rekke randomiserte, kontrollerte og dobbel-blindede undersøkelser hvor ulike blodsukkersenkende medikamenter er sammenliknet med placebo eller med hverandre med HbA1c som hovedutfallsmål. Disse studiene er oftest av kort varighet (de fleste fra 3-12 mnd), har ikke statistisk styrke til å vurdere effekter på harde endepunkter (diabeteskomplikasjoner og død), rapporterer sjelden effekt på livskvalitet, men rapporterer HbA1c, fastende blodsukker risiko for hypoglykemi og andre intermediære utfallsmål. Generelt gjelder at eldre studier gjerne inkluderte pasienter med høyere HbA1c enn nyere studier og derfor fant en noe sterkere reduksjon i HbA1c. Det er gjennomgående relativt liten forskjell i gjennomsnittlig reduksjon av HbA1c (oftest mellom 0,6 og 1,5 %-poeng) mellom de ulike medikamentene sammenliknet med placebo. Direkte sammenliknende studier mellom ulike medikamenter er det langt færre av. ADOPT-studien (Viberti G, 2002) inkluderte 4360 pasienter med nyoppdaget type 2 diabetes som ble behandlet I median 4 år, Den sammenliknet behandling med metformin, glibenkalmid og rosiglitazone og hovedenepunktet var tid til sviktende effekt av monoterapi (fastende blodsukker over 10 mmol/l). Kaplan-Meier estimater viste en kumulativ svikt av monoterapi etter 5 år på 15% ved rosiglitazone, 21% med metformin og 34 % med glibenklamid. (Kahn SE, 2006)
Referanser
292. A Diabetes Outcome Progression Trial (ADOPT). An international multicenter study of the comparative efficacy of rosiglitazone, glyburide, and metformin in recently diagnosed type 2 diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232280
293. Kahn SE, Haffner SM, Heise MA, et al. Glycemic duarbillity of rosiglitazone, metformin or glyburide therapy. N Engl J Med 2006; 355: 2427-43 https://www.helsedirektoratet.no/referanse/0002-0013-232281
294. Hospitalised hip fracture risk with rosiglitazone and pioglitazone use compared with other glucose-lowering drugs https://www.helsedirektoratet.no/referanse/0002-0013-232282
295. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus https://www.helsedirektoratet.no/referanse/0002-0013-232283
296. Oral Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232284
297. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. https://www.helsedirektoratet.no/referanse/0002-0013-232285
298. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232286
299. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. https://www.helsedirektoratet.no/referanse/0002-0013-232287
300. Effect of Linagliptin vs Placebo on Major Cardiovascular Events in Adults With Type 2 Diabetes and High Cardiovascular and Renal Risk: The CARMELINA Randomized Clinical Trial. https://www.helsedirektoratet.no/referanse/0002-0013-232288
301. Effect of Linagliptin vs Glimepiride on Major Adverse Cardiovascular Outcomes in Patients With Type 2 Diabetes: The CAROLINA Randomized Clinical Trial. https://www.helsedirektoratet.no/referanse/0002-0013-232289
302. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232290
303. Effects of Once-Weekly Exenatide on Cardiovascular Outcomes in Type 2 Diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232291
304. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232292
305. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232293
306. Lixisenatide in Patients with Type 2 Diabetes and Acute Coronary Syndrome. https://www.helsedirektoratet.no/referanse/0002-0013-232294
307. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. https://www.helsedirektoratet.no/referanse/0002-0013-232295
308. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. https://www.helsedirektoratet.no/referanse/0002-0013-232296
Sist faglig oppdatert: 12.09.2018
Blodsukkersenkende behandling ved interkurrent sykdom og steroidbehandling
Behov for intensivert blodsukkersenkende behandling ved interkurrent sykdom og steroidbehandling
- Ved interkurrent sykdom som alvorlig infeksjoner, hjerteinfarkt, hjerneslag osv eller ved bruk av kortikosteroider i doser som overstiger det fysiologiske behovet, kan det være behov for intensivering av den blodsukkersenkende behandlingen.
- Vanligvis vil det være aktuelt å starte insulinbehandling hos de pasienter som ellers er tilfredsstillende regulert med livsstilsråd og eventuelt orale antidiabetika - eller øke insulindosen hos pasienter som allerede er insulinbehandlet - se detaljer under Praktisk
Ved samtidig nyresvikt, er det spesielle forholdsregler, se anbefalingen Oppfølging av pasienter med lav GFR for å redusere risiko for kardiovaskulær sykdom – «Vær varsom»-plakaten.
Praktisk – slik kan anbefalingen følges
Blodsukkersenkende behandling ved interkurrent sykdom
Mange sykehus og andre helseinstitusjoners har lokale prosedyrer for dette. I tillegg finnes det gode tips i Nasjonal veileder i endokrinologi utarbeidet av Norsk forening for endokrinologi.
Mange pasienter vil oppleve forverret blodsukkerkontroll ved akutt sykdom eller kirurgiske inngrep på grunn av mindre fysisk aktivitet, aktivering av stressrespons, legemidler (for eksempel kortikosteroider), parenteral ernæring ol. For høyt blodsukker i slike situasjoner kan forverre prognosen (bla. redusere infeksjonsforsvaret). Ved lette/moderate tilfeller av kort varighet er store endringer i blodsukkerbehandlingen ikke påkrevd. I mer alvorlige tilfeller trengs justering av dosen av de blodsukkersenkende legemidlene. Oftest vil slike pasienter være innlagt i sykehus. Målet for behandlingen er mest mulig normalt blodsukker gjennom døgnet, det vil si stort sett <12 mmol/l gjennom døgnet (4-8 mmol/l før og 4-12 mmol/l etter måltid).
Ved stabilt blodsukker og moderat alvorlig sykdom kan evt. peroral blodsukkersenkende legemidler kontinueres.
- Ofte bør metformin seponeres pga. røntgenundersøkelser med kontrast eller (midlertidig) kompromittert nyrefunksjon/dehydrering.
- Ofte bør sulfonylurea seponeres fordi det har lang halveringstid og kan gi hypoglykemi ved redusert/manglende matinntak
I mange tilfeller er insulinbehandling aktuelt.
- Ved diabetes type 1 er det ofte aktuelt med dosejustering av insulin. Hvis pasienten er i stand til fortsatt å måle blodsukker og administrere insulin, er ofte det den beste løsningen og doseringen bestemmes i et samarbeid mellom pasient og behandler.
- Ved alvorlig sykdom, kirurgi eller om pasienten ikke kan spise er kontinuerlig insulininfusjon oftest å foretrekke. Gis best i egen infusjonspumpe slik at dosen kan tilpasses glukose/væske/næringstilførsel. Hvis blodsukkeret er normalt (5-8 mmol/l), start med 5 ml/t (50E hurtigvirkende insulinanalog i 500 ml NaCl 0.9%) og mål blodsukker 30 min etter start og deretter hver time, juster insulininfusjonshastighet etter målingene. Pass på å redusere infusjonshastigheten om natten for å unngå hypoglykemi.
- Mange pasienter, særlig med diabetes type 2, kan kontrolleres med 1-2 doser langsomtvirkende insulin subkutant. Start for eksempel med NPH-insulin 10E x 2 og juster i forhold til målte blodsukker pre- (evt. også og post-) prandialt.
- Det er vanlig (men ikke særlig god løsning) å gi hurtigvirkende insulin subkutant etter en glideskala basert på aktuelle målte blodsukker. Det er langt bedre å forsøke å planlegge behandlingen (med insulininfusjon eller langsomvirkende insulin evt. i kombinasjon med måltidsinsulin) slik at hyperglykemi og store svingninger unngås, og deretter intervenere med en ekstra dose hurtigvirkende insulin ved uttalt hyperglykemi (for eksempel >15-20 mmol/l).
Blodsukkersenkende behandling ved samtidig steroidbehandling
Behandling med kortikosteroider (for eksempel ved akutte betennelsestilstander, astma, revmatiske sykdommer, kreft o.a.) vil oftest gi økt insulinbehov. Kortikosteroider øker insulinresistens og hemmer evt. egenproduksjon av insulin. Derfor kan (midlertidig) intensivering av behandlingen med de blodsukkersenkende legemidlene være nødvendig. Hyppige egenmåling av blodsukker er oftest nødvendig for å justere behandlingen. Ved intensivering av den blodsukkersenkende behandlingen er det særlig viktig at insulinbehovet på dagtid dekkes. Ofte må pasienter med diabetes type 2 bruke insulin midlertidig.
- Ved diabetes type 1 er det ofte behov for økning av både måltidsinsulin og basalinsulin, gjerne 30-100% økt døgndose.
- Ved diabetes type 2 anbefales det å måle blodsukkeret hyppig før og etter måltid de første dagene av steroidkuren. Ved gjentatte målinger over 12 mmol/l er det oftest behov for å starte insulin. Start gjerne med NPH-insulin om morgenen for eksempel i dose 0,2 IE/kg. Noen pasienter vil også trenge hurtigvirkende insulin til måltid.
- Pass på å redusere og evt. seponere (gjelder diabetes type 2) insulin når bruken av kortikosteroider er redusert/stoppet.
Sist faglig oppdatert: 14.09.2016
Legemidler til forebygging av makrovaskulære senkomplikasjoner ved diabetes
Acetylsalisylsyre (ASA) som primærprofylakse ved diabetes
Det frarådes profylaktisk bruk av acetylsalisylsyre (ASA) til pasienter med diabetes uten kjent hjerte- og karsykdom
Praktisk – slik kan anbefalingen følges
En del pasienter med diabetes vil allerede stå på ASA-behandling som primærforebyggende behandling. Det er viktig å drøfte med disse pasientene at nyere data viser at ASA som primærprofylakse har liten eller ingen gevinst hos pasienter med diabetes med lav risiko for hjerte og karsykdom, og at mulig gevinst av behandling sannsynligvis oppveies av økt risiko for blødning.
Hos enkelte pasienter med spesielt høy risiko for hjerte- og karsykdom (nærslekt med debut av kardiovaskulær sykdom i ung alder, utilstrekkelig kontroll av andre risikofaktorer og/eller manglende toleranse for andre forebyggende tiltak som f.eks. statinbehandling) og antatt liten risiko for blødninger (ikke kjent ulcussykdom eller tidligere intrakraniell blødning, alder < 70 år og fravær av ukontrollert hypertensjon og blodsykdommer med forlenget blødningstid eller trombocytopeni) kan fordelene med behandling imidlertid være noe større enn ulempene. Det må likevel understrekes at vi mangler sikre metoder for å selektere slike pasienter hvor nytten overstiger ulempene.
Begrunnelse – dette er anbefalingen basert på
Bruk av acetylsalisylsyre (ASA) for primærforebygging av kardiovaskulær sykdom hos pasienter med diabetes er omdiskutert siden nyere data viser liten eller ingen netto gevinst hos pasienter med diabetes uten kjent hjerte- og karsykdom.
For å anbefale primærforebyggende medikamentell behandling hos antatt friske personer, må fordelene være klart større enn ulempene. Arbeidsgruppens konklusjon, ut fra nåværende kunnskap, er at gevinsten i form av en ikke-signifikant trend til mindre kardiovaskulære hendelser ikke er større en tilsvarende økning i blødningsrisiko. Det anbefales derfor ikke primærforebyggende behandling med ASA.
Forskningsgrunnlag
Populasjon (P): Pasienter med diabetes uten kjent kardiovaskulær sykdom.
Tiltak (I): Acetylsalisylsyre (ASA) behandling
Sammenligning (C): Ingen platehemmende behandling
Beskrivelse av inkluderte studier
Valgt metanalysen i denne evidensprofil (De Beradis, 2009) viser en ikke signifikant trend til færre store kardiovaskulære hendelser, dvs. over en periode fra 3,6 - 10,1 år vil 14 færre av 1000 pasienter oppleve en større kardiovaskulær hendelse (95% konfidensintervall 26 færre - 0 færre). For total-dødelighet og kardiovaskulær død er effekten heller ikke entydig positiv, selv om effektestimatet viser at 9 færre dør (totaldødelighet) og at 5 færre dør (kardiovaskulær dødelighet), så er dette ikke signifikant og konfidensintervallet krysser linjen for ingen effekt (fra 22 færre til 6 flere for totaldødelighet, og fra 21 færre til 18 flere for kardiovaskulær død). Behandling med acetylsalisyre (ASA) gir økt fare for blødning. Blødningsfaren er ikke rapportert systematisk i flere av studiene som inngår i De Beradis metaanalyse. Data fra 3 av studiene i metaanalysen viser en ikke-signifikant relativ risikoøkning på henholdsvis 2,5 og 2,11 for blødning og gastrointestinalblødning.
I perioden 2009-2014 er det publisert flere metaanalyser om primærprofylakse med ASA mot hjerte- og karsykdom hos pasienter med diabetes. (Butalia S, 2011, Pignone M, 2010, Stavrakis S, 2011, Younis N, 2010 og Xie M, 2014.) Metaanalysene inkluderer mange av de samme studiene (fra 1998 til 2010). En større metaanalyse (Berger JS, 2011) på den generelle befolkningen viser tilsvarende funn, dvs. en ikke signifikant trend til mindre kardiovaskulære hendelser som trolig oppveies av ulempene i form en økt risiko for blødning. Dvs. av 1000 pasienter behandlet med ASA i 5 år vil 2,9 færre oppleve en større kardiovaskulær hendelse, mens 2,8 flere vil oppleve en større blødning. En stor (14 464 pasienter) Japansk RCT med 5 års oppfølgingstid, hvor 33 % av deltakerne var personer med diabetes (Ikeda Y, 2014), viste at ASA 100 mg daglig gitt som primærprofylakse ga ingen signifikant reduksjon i alvorlige kardiovaskulære hendelser (kardiovaskulær død, ikke-dødelig hjerteinfarkt og hjerneslag) sammenlignet med placebo, men ga derimot signifikant økning i alvorlig blødning.
Totalt sett er det sparsomt med studier av ASA-behandling spesifikt hos personer med diabetes uten kjent kardiovaskulær sykdom. Resultatene av metaanalysene er nokså like: Fordelene ved ASA som primærprofylakse hos diabetespasienter er beskjeden, og de oppveies sannsynligvis av en økt risiko for blødning.
Vurdering
Fordeler og ulemper
De Berardis metaanalyse viser en ikke-signifikant trend til færre store kardiovaskulære hendelser, dvs. over en periode fra 3,6 - 10,1 år vil 14 færre av 1000 pasienter oppleve en større kardiovaskulær hendelse. For total-dødelighet og kardiovaskulær død er effekten heller ikke entydig positiv (De Beradis et al., 2009). Behandling med acetylsalisyre (ASA) gir økt fare for blødning. Blødningsfaren er ikke rapportert systematisk i flere av studiene som inngår i De Beradis metaanalyse. Data fra 3 av studiene i metaanalysen viser en ikke-signifikant relativ risikoøkning på 2,5 og 2,1 for henholdsvis blødning (inkludert hjerneslag) og gastrointestinalblødning.
Arbeidsgruppens konklusjon blir at en forventet fordel med beskjeden reduksjon i kardiovaskulære hendelser ikke er større enn ulempene med økt risiko for blødning.
Kvalitet på dokumentasjonen
Totalt sett er det sparsomt med gode studier på ASA-behandling spesifikt til personer med diabetes uten kjent kardiovaskulær sykdom og ingen studier skilte mellom type 1- og type 2-diabetes. ASA-dosene varierte mellom 100-650 mg daglig, og var derfor lite representativt for Norge, der 75 mg daglig er vanlig. Blødningshyppigheten er bare rapportert i noen av studiene, slik at det er usikkerhet knyttet til hvor mye blødningsfaren øker. En viss andel av deltakere i primærforebyggingsstudier hadde hatt hjertesykdom.
Kunnskapsgrunnlaget når det gjelder effekten av ASA som primærforebygging hos pasienter med diabetes må derfor anses som lav.
Verdier og preferanser
Pasienter med diabetes behandles ofte med flere medikamenter (blodsukkersenkende, blodtrykkssenkende og lipidsenkende). Det vil hos mange være en viss motstand mot å ta tabletter også mot blodpropp, spesielt når nettoeffekten er liten eller fraværende.
Referanser
309. Aspirin for primary prevention of cardiovascular events in people with diabetes: meta-analysis of randomised controlled trials https://www.helsedirektoratet.no/referanse/0002-0013-232297
310. Aspirin for Primary Prevention of Cardiovascular Events: Meta-Analysis of Randomized Controlled Trials and Subgroup Analysis by Sex and Diabetes Status. https://www.helsedirektoratet.no/referanse/0002-0013-232298
311. Younis N, Williams S, Ammori B, Soran H. Role of aspirin in the primary prevention of cardiovascular diasease in diabetes mellitus: a meta-analysis. Expert Opin Pharmaco ther. 2010 Jun;11(9):1459-66 https://www.helsedirektoratet.no/referanse/0002-0013-232299
312. Stavrakis S, Stoner JA, Azar M, Wayangankar S, Thadani U. Low-dose aspirin for primary prevention of cardiovascular events in patients with diabetes: a met-anaylsis. Am J Med Sci. 2011 Jan;341(1):1-9 https://www.helsedirektoratet.no/referanse/0002-0013-232300
313. Pignone M, Alberts MJ, Colwell JA, Cushman M, Inzucchi SE, Mukherjee D, Rosenson RS, Williams CD, Wilson PW, Kirkman MS; American Diabetes Association; American Heart Association; American College of Cardiology Foundation. Aspirin for primary prevention of cardiovascular events in people with diabetes. J Am Coll Cardiol. 2010 Jun 22;55(25):2878-86. doi: 10.1016/j.jacc.2010.04.003 https://www.helsedirektoratet.no/referanse/0002-0013-232301
314. Butalia S, Leung AA, Ghali WA, Rabi DM. Aspirin effect on the incidence of major adverse cardiovascular events in patients with diabetes mellitus: a systematic review and meta-analysis. Cardiovasc Diabetol. 2011 Apr 1;10:25. doi: 10.1186/1475-2840-10-25 https://www.helsedirektoratet.no/referanse/0002-0013-232302
315. Berger JS, Lala A, Krantz MJ, Baker GS, Hiatt WR. Aspirin for the prevention of cardiovascular events in patients without clinical cardiovascular disease: a meta-analysis of randomized trials. Am Heart J. 2011 Jul;162(1):115-24.e2. doi: 10.1016/j.ahj.2011.04.006 https://www.helsedirektoratet.no/referanse/0002-0013-232303
316. Ikeda Y, Shimada K, Teramoto T, Uchiyama S, Yamazaki T, Oikawa S, Sugawara M, Ando K, Murata M, Yokoyama K, Ishizuka N. Low-dose aspirin for primary prevention of cardiovascular events in Japanese patients 60 years or older with atherosclerotic risk factors: a randomized clinical trial. JAMA. 2014 Dec 17;312(23):2510-20. doi: 10.1001/jama.2014.15690 https://www.helsedirektoratet.no/referanse/0002-0013-232304
Sist faglig oppdatert: 14.09.2016
Acetylsalisylsyre (ASA) som sekundærprofylakse ved diabetes
Det anbefales at pasienter med diabetes og kjent hjerte- og karsykdom (definert som påvist koronarsykdom, iskemisk slag eller TIA samt perifer aterosklerose), får forebyggende behandling med acetylsalisylsyre (ASA) 75mg daglig.
For pasienter som ikke tåler behandling med acetylsalisylsyre, anbefales ADP-reseptorhemmere (75mg klopidogrel daglig) som alternativ.
Praktisk – slik kan anbefalingen følges
- Vurder blødningsrisikoen ved bruk av acetylsalisylsye (B01AC06) (ASA) eller klopidogrel (B01AC04) (ADP-reseptorhemmere). Risikoen er høyere hos pasienter med kjent ulcussykdom og hos pasienter > 70 år. Aktiv ulcussykdom, tidligere intrakraniell blødning og blodsykdommer med forlenget blødningstid eller trombocytopeni er kontraindikasjoner til bruk av ASA.
- ASA bør tas utenom måltid, men med rikelig drikke. Klopidogrel (ADP- reseptorhemmere) kan tas uavhengig av matinntak.
Begrunnelse – dette er anbefalingen basert på
Pasienter med diabetes rammes ofte av hjerte- og karsykdommer, og etter gjennomgått infarkt har pasienter med diabetes dårligere prognose enn andre infarktpasienter. Optimal sekundær forebygging er derfor viktig hos pasienter med diabetes. Den første oversikten fra Antiplatelet Trialists' Collaboration (Antiplatelet Trialists' Collaboration, 1994) fant at acetylsalisyre (ASA) behandling reduserte forekomst av ikke-dødelig hjerteinfarkt, ikke-dødelig hjerneslag og vaskulær død med cirka en fjerdedel, og behandlingen var like effektiv om pasienter hadde diabetes eller ikke. Senere metaanalyser på den generelle befolkningen (Antiplatelets Trialists' Collaboration 2002 og Vandvik PO, 2012) har bekreftet funnene fra den første oversikten og forfatterne vurderte at gevinsten med reduksjon i alvorlige vaskulære hendelser er større enn ulempen med en økning i alvorlige blødninger. Arbeidsgruppen mener at funnene fra senere metaanalyser er overførbar til pasienter med diabetes som har kjent hjerte- og karsykdom.
Gjennomsnittlig daglig dose med ASA i kliniske forsøk har variert fra 50 til 650 mg. Det har vært spekulert i om lav dose ASA kan gi ufullstendig platehemming hos pasienter med diabetes pga. "ASA-resistens" (Rocca, 2012). Ingen studier har imidlertid undersøkt hvordan ulike doser og doseringsintervall av ASA påvirker den platehemmende effekten hos pasienter med diabetes.
Arbeidsgruppen anser fordelene med ASA behandling som klart større enn ulempene hos pasienter med diabetes med kjent hjerte- og karsykdom. Det er grunn til å tro at det er fornuftig å bruke lavest mulig dose ASA for å redusere faren for bivirkninger, og anbefaler derfor samme dose og doseringsintervall (75 mg daglig) til pasienter med og uten diabetes.
Det er begrensede kunnskaper om virkningen av ADP-reseptorhemmere hos pasienter med diabetes. De fleste studiene har ikke data på pasienter med diabetes separat. Derfor er anbefalingen om bruk av ADP-reseptorhemmere for forebygging av hjerte- og karsykdom (som alternativ hos pasienter som ikke tåler ASA) basert på studier som inkluderer pasienter både med og uten diabetes.
Forskningsgrunnlag
Populasjon (P): Diabetespasienter med kjent hjerte- og karsykdom
Tiltak (I): Klopidogrel behandling
Sammenligning (C): Acetylsalisylsyre
Beskrivelse av inkluderte studier
CAPRIE-studien (CAPRIE, 1996) randomiserte 19.185 pasienter som hadde gjennomgått hjerneslag, hjerteinfarkt og symptomgivende perifer karsykdom til behandling med aspirin 325mg eller klopidogrel 75mg. 20% av pasientene i begge gruppene hadde diabetes. Klopidogrel viste signifikant bedre reduksjon av det primære endepunkt (et sammensatt utfall av slag,hjerteinfarkt eller vaskulær død) enn aspirin (5,3 vs 5,8% per år, relativ risiko-reduksjon 8,7 % (95%CI 0,3-16,5%). Den største effekten ble sett hos pasienter med perifer karsykdom og forskjellene mellom aspirin og clopidogrel var ikke signifikante når det gjaldt pasienter med slag eller hjerteinfarkt.
Dyspepsi/kvalme/oppkast og alvorlig gastrointestinal blødning forekom signifikant hyppigere i aspirin-gruppen (hhv 17,6% vs 15,0% og 0,71% vs 0,49%) , mens det ikke var signifikante forskjeller i intracerebral blødning (0,49% vs 0,35%). Utslett og diare var litt vanligere i klopidogrel-gruppen (ikke signifikant). Det var ingen forskjell i forekomsten av neutropeni og trombopeni i de to gruppene (0,1-0,25%).
Vurdering
Fordeler og ulemper
Den første oversikten fra Antiplatelet Trialists' Collaboration (Antiplatelet Trialists' Collaboration, 1994) fant at acetylsalisyre (ASA) behandling reduserte forekomst av ikke-dødelig hjerteinfarkt, ikke-dødelig hjerneslag og vaskulær død med cirka en fjerdedel, og behandlingen var like effektiv om pasienter hadde diabetes eller ikke.
Antithrombotic Trialists Collaboration (Antithrombotic Trialists Collaboration,2002) viste at ASA-behandling hos høyrisiko-pasienter i den generelle befolkningen reduserte alvorlige vaskulære hendelser med en fjerdedel, ikke-dødelig hjerteinfarkt med en tredjedel, ikke dødelig hjerneslag med en fjerdedel og kardiovaskulær dødelighet med en sjettedel (med ingen tilsynelatende økning i mortalitet av andre årsaker). Hos pasienter med gjennomgått hjerteinfarkt eller hjernesal/TIA var absolutt risikoreduksjon for en alvorlig kardiovaskulær hendelse 36 per 1000 pasienter behandlet i 2 år.
En nyere metaanalyse (Vandvik PO, 2013) som har studert effekten av sekundær profylakse hos 17 000 pasienter fra 16 RCT-er konkluderer med at dersom vi behandler 1000 pasienter med acetylsalisylsyre i 5 år, vil det føre til 13 færre dødsfall, 37 færre ikke-dødelig hjerteinfarkt og 26 færre hjerneslag sammenliknet med ingen behandling. Behandlingen vil imidlertid medføre en økning på 25 alvorlige ekstrakranielle blødninger per 1000 behandlede pasienter.
Fordelene ved ASA-behandling som sekundær profylakse anses som klart større enn ulempene.
ADP-reseptorhemmere: Sammenlignet med behandling med ASA har behandling med ADP-reseptorhemmere en relativ risikoreduksjon for hjerteinfarkt, ischemisk slag og vaskulær død på 8,7 %, CI 0.3, 16,5.
Kvalitet på dokumentasjonen
Vår tiltro til effekt-estimatene for hjerteinfarkt og hjerneslag i den generelle befolkningen er stor. For pasienter med diabetes er dokumentasjonsgrunnlaget mindre, men vi antar at effekten av ASA-behandling hos pasienter med diabetes tilsvarer effekten i den generelle befolkningen.
ADP-reseptorhemmere: Kvaliteten på dokumentasjon er vurdert som lav siden kun 20 % av pasientene i intervensjons- og kontrollgruppen hadde diabetes og det var signifikant heterogenitet mellom subgrupper i studiepopulasjonen.
Verdier og preferanser
Da behandling med acetylsalisylsyre som sekundærprofylakse gir betydelig redusert risiko for nytt hjerteinfarkt og hjerneslag, med kun en moderat økning i blødningsrisiko, antar vi at de fleste pasienter vil ønske denne behandlingen.
ADP-reseptorhemmere: For pasienter som trenger platehemmende behandling som ikke tåler ASA antar vi at klopidogrel er et akseptabelt alternativt til ASA siden effekten er omtrent lik, og gastrointestinale bivirkninger forekommer signifikant hyppigere med ASA behandling sammenlignet med klopidogrel.
Referanser
317. Antiplatelet Trialists' Collaboration.Collaborative overview of randomised trials of antiplatelet therapy - I: prevention of death, myocardial infarction, and stroke by prolonged antiplatelet therapy in various categories of patients.BMJ 1994;308:81–106 https://www.helsedirektoratet.no/referanse/0002-0013-232305
318. Vandvik PO, Lincoff AM, Gore JM, Gutterman DD, Sonnenberg FA, Alonso-Coello P, Akl EA, Lansberg MG, Guyatt GH, Spencer FA; American College of Chest Physicians. Chest. 2012 Feb;141(2 Suppl):e637S-68S. doi: 10.1378/chest.11-2306 https://www.helsedirektoratet.no/referanse/0002-0013-232306
319. Rocca B et al. The recovery of platelet cyclooxygenase activity explains interindividual variability in responsiveness to low-dose aspirin in patients with and without diabetes. J Thromb Haemost. 2012 Jul;10(7):1220-30. doi: 10.1111/j.1538-7836.2012.04723.x https://www.helsedirektoratet.no/referanse/0002-0013-232307
320. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE) Lancet 1996; 348: 1329–39 https://www.helsedirektoratet.no/referanse/0002-0013-232308
321. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients https://www.helsedirektoratet.no/referanse/0002-0013-232309
Sist faglig oppdatert: 14.09.2016
Blodtrykk – Intervensjonsgrense, behandlingsmål og valg av legemidler ved diabetes
Det anbefales at personer med diabetes og blodtrykk over 140/90 mm Hg behandles med blodtrykkssenkende legemidler.
Foreslått behandlingsmål er blodtrykk under 135/85 mm Hg (konsensus).
Praktisk – slik kan anbefalingen følges
Hvor lavt behandlingsmålet for blodtrykket bør være, er mer vanskelig å begrunne vitenskapelig. Følgende faktorer vil spille en rolle for valg av behandlingsintensitet:
- alder
- tilstedeværelse av retinopati og/eller nefropati
- risiko for framtidige hjerneslag
- behandlingskompleksitet
- bivirkninger
- pasientpreferanser
Det generelle behandlingsmålet er 135/85 mmHg som gjelder for de fleste pasienter. Lavere behandlingsmål (130/80) bør vurderes for yngre pasienter, pasienter med mikrovaskulær komplikasjoner (spesielt nefropati) og pasienter med øket risiko for hjerneslag. Høyere behandlingsmål (150/85) er hensiktsmessig for eldre pasienter (over 80 år), pasienter med isolert systolisk hypertensjon, pasienter med ortostatisme og pasienter med bivirkninger (ev. bør man forsøke bytte av legemiddel). Behandlingsmålet for friske pasienter over 80 år, i god allmenntilstand og som tåler behandling godt, kan likevel være 135/85.
Valg av blodtrykksenkende legemiddel
En nyere metaanalyse (Emdin, 2015) konkluderer med at valg av type blodtrykkssenkende legemiddel hos pasienter med diabetes type 2 har liten betydning for effekten på de fleste kardiovaskulære endepunkter. Unntaket er hjertesvikt der diuretika og A2-reseptorblokker er bedre og kalsiumblokker verre enn annen behandling. I samme metaanalysen (Emdin, 2015) var det noe evidens for at kalsiumblokker var assosiert med lavere, og betablokkere høyere risiko for hjerneslag.
Det er også etniske forskjeller i respons på blodtrykkssenkende medikasjon. Pasienter med afrikansk etnisk opprinnelse har høy forekomst av lav renin hypertensjon, og lav respons på hemming av renin-angiotensinsystemet. NICE (National Institute for Health and Clinical Excellence) har anbefalt (NICE CG66, oppdatert juli 2014) at pasienter med diabetes og afrikansk opprinnelse ikke bør tilbys monoterapi med ACE-hemmer, men en kombinasjon av ACE hemmer og kalsiumblokker eller ACE hemmer og tiazid. Betablokker bør unngås. Hos alle andre etniske grupperinger anbefaler NICE at en bør tilby monoterapi med ACE-hemmer, og først legge til en kalsiumblokker eller tiazid dersom behandlingsmål ikke nåes.
I praksis vil valg av blodtrykkssenkende legemiddel hos pasient med diabetes ofte bli styrt av tilleggsindikasjoner, kontraindikasjoner, bivirkninger og pasientpreferanser.
Tabellen oppsummerer viktige tilleggsindikasjoner og noen kontraindikasjoner eller tilstander der man bør utvise spesiell forsiktighet.
| Legemiddelgruppe | Tilleggsindikasjoner | Kontraindikasjoner | Spesiell forsiktighet ved: |
| Diuretika | |||
| Lavdose tiazider (C03A) | Isolert systolisk hypertensjon Hjertesvikt Afrikansk etnisk opprinnelse | Lavt K+ Urinsyregikt** | |
| Furosemid* (C03CA01) | Hjertesvikt Nyresvikt (eGFR < 30 mL/min/1,73m2) | Lavt K+ | |
| Kaliumsparende* (C03D) | Hjertesvikt, lavt K+ | Høyt K+, nyresvikt | |
| Betablokkere (C07A) | Koronarsykdom Angina pectoris Hjertesvikt Takyarytmi Migrene Glaukom | Hjerteblokk Dekompensert hjertesvikt | Obstruktiv lungesykdom (ikke-selektive betablokker) |
| Alfablokkere* (C02CA) | Prostatahypertrofi | Ortostatisk hypotensjon | |
| ACE-hemmere (C09AA) | Diabetetisk nefropati Hjertesvikt Koronarsykdom | Bilateral nyrearteriestenose | Høyt K+ |
| Angiotensin (C09CA) reseptor blokkere | Diabetetisk nefropati Hjertesvikt Venstre ventrikkelhypertrofi | Høyt K+ | |
| Kalsiumantagonister | |||
| Dihyropyridiner (C08DB01) | Isolert systolisk hypertensjon Afrikansk etnisk opprinnelse Angina pectoris | Systolisk hjertesvikt | |
| Verapamil (C08DA01) | Angina pectoris Takyarytmi | Hjerteblokk | Systolisk hjertesvikt |
*Anbefales ikke som førstevalg eller monoterapi på grunn av manglende dokumentasjon eller lavere effekt i primærforebygging
** Bruk av tiazid kan være avgjørende for å oppnå blodtrykkskontroll og kan gis etter behandling med allopurinol
Måling av blodtrykket
Bruk standard prosedyrer for måling av blodtrykket:
- bruk riktig mansjettstørrelse
- mål blodtrykket hos sittende, avslappede pasient med avslappet målearm
- mål etter 5 minutters hvile, tre målinger med ett minutts mellomrom, registrer gjennomsnitt av de to siste målingene
- ved mistanke om ortostatisme, mål også blodtrykk etter ett og tre minutter i stående stilling, dersom stående trykk faller med >15 mmHg sammenlignet med blodtrykk sittende, skal man behandle i henhold til stående blodtrykk.
Vurder 24 timers-blodtrykksmåling:
- hvis det er mistanke om "kontorblodtrykk"
- hvis BT-målingene viser uvanlig stor variasjon
- for å oppdage hypotensive episoder
- for å vurdere døgnvariasjon i blodtrykket
- ved behandlingsresistent hypertensjon
Tolkning av 24 timers blodtrykksmåling
Ved 24 timers blodtrykksmåling hos pasienter uten diabetes oppfattes en døgngjennomsnittsverdi >135/85 mmHg som behandlingstrengende hypertensjon (se helsedirektoratets generelle retningslinjer for forebygging av hjerte- og karsykdom). Hos pasienter med diabetes er det rimelig å sette lavere grenser slik at en døgngjennomsnittsverdi på >130/85 mmHg eller gjennomsnitt på dagtid >140/90 mmHg oppfattes som behandlingstrengende hypertensjon.
For mer detaljer rundt Prosedyre for blodtrykksmåling:
- se Nasjonal faglig retningslinje for forebygging av hjerte- og karsykdom, kapittel "Kartlegging av hypertensjon som forebygging av hjerte- og karsykdom", anbefaling "Utredning av høyt blodtrykk som forebygging av hjerte- og karsykdom" - under Praktisk
Blodtrykkssenkende behandling hos pasienter over 80 år
Det foreligger ingen studier på effekten av blodtrykkssenkende behandling hos pasienter med diabetes over 80 år. HYVET-studien (Beckett NS, 2008) randomiserte 3845 pasienter over 80 år med systolisk blodtrykk >160mmHg til behandling med en diuretika (og evt. tillegg av ACE- hemmer) eller placebo (6,8 % av de inkluderte deltakerne hadde diabetes). Behandlingsmålet var BT <150/80 mmHg) og studien viste signifikant reduksjon i mortalitet, kardiovaskulære hendelser og hjertesvikt. Færre bivirkninger var registrert hos de som fikk aktiv behandling. Resultatene er trolig overførbare til eldre pasienter med diabetes.
Isolert systolisk hypertensjon (ISH)
Isolert systolisk hypertensjon defineres som systolisk blodtrykk >160 mmHg og diastolisk blodtrykk <90 mmHg. Dette ses ofte hos pasienter med diabetes og stive kar og en diabetesrelatert autonom nevropati. Både forhøyet systolisk blodtrykk og forhøyet pulstrykk (forskjellen mellom systolisk og diastolisk trykk) er betydelige risikofaktorer for kardiovaskulær sykelighet og dødelighet. Pasienter med isolert systolisk hypertensjon er spesielt utsatt for ortostatisk hypotensjon ved blodtrykksbehandling. For å unngå dette må man derfor ofte akseptere høyere behandlingsmål ved ISH. Kontrollmåling av blodtrykk stående er viktig i denne pasientgruppen.
Ved symptomgivende ortostatisme der blodtrykk målt stående faller med mer enn 15 mmHg i forhold til blodtrykk sittende, bør en være forsiktig med for streng blodtrykksregulering.
Begrunnelse – dette er anbefalingen basert på
Det er godt vitenskapelig dokumentert at blodtrykk >140/90 mmHg er skadelig hos pasienter med diabetes, og at det er en betydelig gevinst (signifikant reduksjon i risikoen for død, hjerteinfarkt, hjerneslag og mikrovaskulære komplikasjoner) ved å senke blodtrykket når det ligger over dette nivået. Det anbefales derfor blodtrykkssenkende behandling til pasienter med diabetes som har blodtrykk >140/90 mmHg.
Det er begrenset evidens for lavere behandlingsmål enn 140/90 mmHg. En metaanalyse (McBrien K, 2012) som sammenlignet intensiv blodtrykksbehandling (BT <130/80 mmHg) med standard blodtrykksbehandling hos pasienter med diabetes type 2, var kun assosiert med en beskjeden, men signifikant reduksjon i risikoen for hjerneslag som kan oppveies av en økning i alvorlige bivirkninger. Kvaliteten på dokumentasjon i denne metaanalysen er imidlertid lav.
En nyere og mer omfattende metaanalyse (Emdin CA, 2015) som blant annet undersøkte assosiasjon mellom blodtrykkssenkende behandling hos pasienter med diabetes type 2 og endepunktene stratifisert etter oppnådde blodtrykksnivå fant signifikant reduksjon i mortalitet, kardiovaskulære hendelser, koronar hjertesykdom, hjerneslag, albuminuri og retinopati dersom man intervenerer ved blodtrykk > 140/90 mmHg og reduserer BT ned mot 130/80 mmHg. Denne metanalysen viste også at intervensjon på lavere blodtrykk enn 140/90 mmHg, eller ytterlige senkning av blodtrykk under 130/80 mmHg kun gir signifikant reduksjon i hjerneslag og mikrovaskulære komplikasjoner.
Dokumentasjonsgrunnlaget for effekten av hypertensjonsbehandling hos pasienter med diabetes type 1 er beskjedent. Sammenlignet med normalbefolkningen har imidlertid pasienter med type 1-diabetes økt forekomst av hypertensjon og høyere kardiovaskulær mortalitet slik at felles intervensjonsgrenser og behandlingsmål anbefales for pasienter med diabetes type 1- og type 2.
Basert på konsensus anbefaler arbeidsgruppen behandlingsmålet 135/85 mmHg for de fleste pasienter med diabetes. Høyere behandlingsmål bør vurderes for eldre pasienter, pasienter med isolert systolisk hypertensjon, pasienter med ortostatisme og pasienter med bivirkninger. Lavere behandlingsmål bør vurderes for yngre pasienter, pasienter med mikrovaskulær komplikasjoner (spesielt nefropati) og pasienter med øket risiko for hjerneslag.
Forskningsgrunnlag
Populasjon (P): Personer med diabetes
Tiltak (I): Intensiv blodtrykkssenkende behandling med behandlingsmål < 130/80
Sammenligning (C): Standard blodtrykkssenkende behandling med behandlingsmål 140 - 160/85-100
Beskrivelse av inkluderte studier
Intensiv blodtrykksbehandling (BT <130/80 mmHg) sammenlignet med standard blodtrykksbehandling i metaanalysen (varighet av inkluderte studier 1,9 - 5,3 år) var assosiert med en beskjeden, men signifikant reduksjon i risikoen for hjerneslag (absolutt risk reduksjon 1 %). Det var en ikke signifikant trend til reduksjon i totalmortalitet og hjerteinfarkt. Reduksjon i hjerneslag må vurderes opp mot en signifikant økning i alvorlige bivirkninger rapportert i ACCORD 3,3% i intensiv gruppen mot 1,7% i standard behandling (ref ACCORD).
Kvaliteten av dokumentasjon i den delen av metanalysen som sammenligner intensiv behandling mot standard behandling er lav. Vi har derfor også brukt resultatene av en nyere og mer omfattende metanalysen (Emdin CA,2015) som blant annet undersøkte assosiasjon mellom blodtrykkssenkende behandling og endepunktene stratifisert etter blodtrykksnivået før studiestart, og assosiasjon mellom blodtrykkssenkende behandling og endepunktene stratifisert etter oppnådde blodtrykksnivå.
Metanalysen til Emdin viste at hver 10 mmHg reduksjon i systolisk blodtrykk var assosiert med en signifikant lavere risiko for mortalitet (RR, 0.87; 95 % CI, 0.78-0.96); absolutt risiko reduksjon (ARR) i hendelser per 1000 pasientår (3.16; 95 % CI, 0.90-5.22), kardiovaskulære hendelser (RR, 0.89; (95 % CI, 0.83-0.95); ARR, 3.90 [95 % CI, 1.57-6.06]), koronar hjertesykdom (RR, 0.88 [95 % CI, 0.80-0.98]; ARR,
1.81 [95 % CI, 0.35-3.11]), hjerneslag (RR, 0.73 [95 % CI, 0.64-0.83]; ARR, 4.06 [95 % CI, 2.53-5.40]), albuminuri (RR, 0.83 [95 % CI, 0.79-0.87]; ARR, 9.33 [95 %CI, 7.13-11.37]), og retinopati (RR, 0.87 [95 % CI, 0.76-0.99]; ARR, 2.23 [95 % CI, 0.15-4.04]). Når studiene ble stratifisert etter gjennomsnittlig opprinnelig systolisk BT-verdi over eller under 140 mmHg, var RRs for dødelighet, kardiovaskulære hendelser og hjertesvikt lavere i studiene med større utgangspunkt systolisk BT (p interaksjon <0,1). Metaanalysen viste også at når studiene ble stratifisert etter oppnådde blodtrykk ble gruppen med oppnådde blodtrykk under 130/80 mmHg kun assosiert med lavere risiko for hjerneslag og albuminuri.
Oppsummert viser metaanalysen til Emdin at man får signifikant reduksjon i mortalitet, kardiovaskulære hendelser, koronar hjertesykdom, hjerneslag, albuminuri og retinopati dersom man intervenerer ved blodtrykk >140/90 mmHg og reduserer BT ned mot 130/80 mmHg. Intervensjon på lavere blodtrykk enn 140/90 mmHg eller ytterlige senkning av blodtrykk under 130/80 mmHg gir kun signifikant reduksjon i hjerneslag og mikrovaskulære komplikasjoner.
Vurdering
Fordeler og ulemper
Standard behandling sammenlignet med ingen behandling eller historisk behandling:
Meta-analysen av McBrien (McBrien K, 2012) inkluderte studier som varte fra 2 - 8,4 år og viste at standard behandling (BT-mål 140-160/80 -100 mmHg) sammenlignet med placebo eller historisk behandling (BT >160/100 mmHg) ga tydelig gevinst med signifikant absolutt risikoreduksjon for død (uansett årsak) 1,8 %, hjerteinfarkt 2,5 % og hjerneslag 3,9 %.
Bivirkninger var ikke rapportert systematisk i studiene som inngikk i metaanalysen, men hypokalemi forekom oftere hos behandlede pasienter i SHEP (Curb JD, 1996) (2,3 % vs. 0,4 %) og svimmelhet og synkope forekom oftere hos intensivt behandlede pasienter i UKPDS (UK Prospective Diabetes Study Group, 1998) (11 % vs 6 %).
Fordelene med standard blodtrykkssenkende behandling sammenlignet med ingen behandling eller historisk behandling er klart større enn ulempene.
Standard behandling sammenlignet med intensiv behandling:
McBrien metaanalysen (McBrien K, 2012) viste også at intensiv blodtrykksbehandling (BT <130/80 mmHg) sammenlignet med standard blodtrykksbehandling (varighet av inkluderte studier 1,9 - 5,3 år) var assosiert med en beskjeden, men signifikant reduksjon i risikoen for hjerneslag (absolutt risikoreduksjon 1 %). For totaldødelighet og hjerteinfarkt er effekten ikke entydig.
Selv om effektestimatene viser at det blir 15 mindre dødsfall og 7 færre hjerteinfarkt per 1000 pasienter, er konfidensintervallene vide (død: 29 mindre til 3 flere; hjerteinfarkt 17 mindre - 7 flere) og krysser linjen for ingen effekt. Reduksjon i hjerneslag må derfor vurderes opp mot en signifikant økning i alvorlige bivirkninger rapportert i ACCORD (3,3 % i intensiv gruppen mot 1,7 % i standard behandling) (ACCORD Study Group, 2010).
Basert på resultater av denne metaanalysen, vil fordelene med intensiv behandling sannsynligvis oppveies av ulempene.
Kvalitet på dokumentasjonen
Metaanalysen til McBrien er av moderat til god kvalitet når det gjelder sammenligning av standard behandling mot ingen behandling eller historisk behandling. Det foreligger imidlertid kun data for pasienter med diabetes type 2. Effektene samsvarer godt til de som er observert i store studier med mange deltakere i en generell populasjon.
Man har mindre tillit til effektestimatene i den delen av metaanalysen som omhandler intensiv blodtrykkssenkende behandling mot standard behandling grunnet mulig bias i noen av inkluderte studiene, redusert apliserbarhet til norske forhold og lav presisjon. I tillegg var hypertensjon definert kun på grunnlag av diastolisk blodtrykk i 4 av de 5 studiene. Det foreligger også her kun data for pasienter med diabetes type 2.
Verdier og preferanser
Kardiovaskulær sykdom, både hjerteinfarkt og kanskje særlig hjerneslag, er forbundet med betydelig dødelighet og dessuten risiko for alvorlige senfølger som utvikling av hjertesvikt, arytmier, lammelser og kognitive forstyrrelser.
En mulighet er å tolke resultatene fra metanalysene til McBrien slik at fordelene med intensiv behandling (BT <130/80 mmHg) er beskjedne og dermed anbefale mer konservative behandlingsmål for blodtrykket enn tidligere. Med mer konservative behandlingsmål vil man være sikker på at de fleste individer med diabetes vil ha en forventet egeninteresse av blodtrykkssenkende behandling siden den reduserer mortalitet, hjerteinfarkt og hjerneslag. Et mindre strengt behandlingsmål vil også redusere behandlingens kompleksitet og antall bivirkninger assosiert med behandlingen, noe som også vil være til fordel for pasienten.
En omfattende nyere metaanalyse (Emdin CA, 2015) tyder også på at de fleste pasienter får tydelig gevinst av oppnådde blodtrykk ned til 130/80 og taler for lavere grense for behandlingsmål enn 140/90 mmHg.
Referanser
322. ACCORD Study Group, Cushman WC, Evans GW, Byington RP, Goff DC Jr, Grimm RH Jr, Cutler JA, Simons-Morton DG, Basile JN, Corson MA, Probstfield JL, Katz L, Peterson KA, Friedewald WT, Buse JB, Bigger JT, Gerstein HC, Ismail-Beigi F. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med. 2010 Apr 29;362(17):1575-85 https://www.helsedirektoratet.no/referanse/0002-0013-232310
323. Beckett NS, Peters R, Fletcher AE, Staessen JA, Liu L, Dumitrascu D, Stoyanovsky V, Antikainen RL, Nikitin Y, Anderson C, Belhani A, Forette F, Rajkumar C, Thijs L, Banya W, Bulpitt CJ; HYVET Study Group. Treatment of hypertension in patients 80 years of age or older.N Engl J Med. 2008 May 1;358(18):1887-98 https://www.helsedirektoratet.no/referanse/0002-0013-232311
324. McBrien K, Rabi DM, Campbell N, Barnieh L, Clement F, Hemmelgarn BR, Tonelli M, Leiter LA. Intensive and Standard Blood Pressure Targets in Patients With Type 2 Diabetes Mellitus: Systematic Review and Meta-analysis. Arch Intern Med. 2012 Sep 24;172(17):1296-303 https://www.helsedirektoratet.no/referanse/0002-0013-232312
325. Emdin CA, Rahimi K, Neal B, Callender T, Perkovic V, Patel A. Blood Pressure Lowering in Type 2 Diabetes A Systematic Review and Meta-analysis. JAMA. 2015;313(6):603-615 https://www.helsedirektoratet.no/referanse/0002-0013-232313
326. UK Prospective Diabetes Study Group. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 38. BMJ.1998 Sep 12;317(7160):703-13 https://www.helsedirektoratet.no/referanse/0002-0013-232314
327. Curb JD, Pressel SL, Cutler JA, et al. Effect of diuretic‐based antihypertensive treatment on cardiovascular disease risk in older diabetic patients with isolated systolic hypertension. Systolic Hypertension in the Elderly Program Cooperative Research Group. JAMA. 1996;276:1886‐92 https://www.helsedirektoratet.no/referanse/0002-0013-232315
328. The CDC Diabetes Cost-effectiveness Group. Cost-effectiveness of Intensive Glycemic Control, Intensified Hypertension Control, and Serum Cholesterol Level Reduction for Type 2 Diabetes. JAMA. 2002;287(19):2542-2551 https://www.helsedirektoratet.no/referanse/0002-0013-232316
Sist faglig oppdatert: 05.12.2024
Kolesterolsenkende behandling som primærforebygging ved diabetes type 1 og 2
- Det anbefales å gi statinbehandling til alle personer med diabetes i alderen 40 - 80 år uten kjent kardiovaskulær sykdom hvis LDL-kolesterol overstiger 2,5 mmol/l eller når samlet risiko er høy.
- Det anbefales atorvastatin 20 mg som førstevalg eller eventuelt simvastatin 40 mg som startdose til personer med diabetes type 1 eller type 2.
- Statinbehandling bør også vurderes til pasienter <40 år med ekstra høy risiko (se risikogrupper under Praktisk)
Praktisk – slik kan anbefalingen følges
Følgende risikogrupper < 40 år som er særlig aktuelle å vurdere for statinbehandling:
- Diabetes type 1 med alder 10 - 40 år som har høy LDL-kolesterol og/eller mikrovaskulære komplikasjoner (se ISPAD kriterier)
- Enkelte etniske grupper (personer fra Sør-Asia)
- Ved etablert mikrovaskulær sykdom (type 1 og type 2)
- Ved diabetes type 2 med høy kardiovaskulær risiko
Dose og dosejustering
- Det anbefales atorvastatin (C10AA05) 20 mg som førstevalg eller eventuelt simvastatin (C10AA01) 40 mg som startdose til personer med diabetes type 1 eller type 2.
- Intensivert behandling bør imidlertid vurderes ved høy risiko dersom LDL-kolesterol blir værende over 2,5 - 3,0 mmol/l.
- Lavere startdose (10 mg) bør vurderes hos pasienter som bruker medikamenter som kan potensiere virkning av statiner (Ciklosporin, HIV-proteasehemmere, klaritromycin m.fl.) og ved kronisk nyresvikt med eGFR <30ml/min/1,73m2 (gjelder kun simvastatin) .
- Lavere startdose bør også vurderes for personer fra Sør-Asia.
- En utgangs lipidprofil og leverfunksjonstester bør kontrolleres før behandlingsstart, og verdiene anbefales kontrollert etter 3 og 12 måneder. Dersom levertransaminaser stiger over 3 ganger øvre referanseverdi og forblir på dette nivå, anbefales dosereduksjon eller seponering av statinbehandling.
Behandlingsmål er mindre viktig ved primærprofylakse, det viktigste er at pasientene får statinbehandling.
Bivirkninger
Bivirkninger med muskelplager er ikke uvanlig hos statinbehandlede pasienter, men randomiserte forsøk med statinbehandling viser at omtrent samme prosentandel av pasienter rapporterer muskelsmerter på placebo som på statinbehandling. CK bør måles hos pasienter som rapporterer muskelsmerter, og statinbehandling bør seponeneres dersom CK er over 5 ganger øvre referanseverdi. Mange pasienter er bekymret for demens ved statinbehandling, men resultater fra observasjonsstudier og randomiserte forsøk gir ikke holdepunkt for at statinbruk kan forårsake demens.
Dersom pasienter rapporterer uønskede bivirkning på statinbehandling, bør følgende strategier drøftes med pasienten:
- midlertidig seponering av statinbehandling, og nytt forsøk når symptomene har gitt seg for å sikre at symptomene er relatert til statinbehandling
- dosereduksjon (doser helt ned til atorvastatin 10 mg annen hver dag, ev. rosuvastatin 5 mg daglig har klar effekt på LDL-kolesterol nivå).
- bytte til annen statin
Dersom statiner overhodet ikke tolereres og pasienten har høy risiko for utvikling av hjerte- og karsykdom, bør behandling med ezetimib vurderes.
Begrunnelse – dette er anbefalingen basert på
Statinbehandling er omfattende testet ut hos pasienter både med og uten diabetes, og viser konsistente gevinster i de fleste studier og metaanalyser. Dataene for pasienter med diabetes uten kjent kardiovaskulær sykdom er oppsummert av de Vries metaanalyse (de Vries FM, 2012) et al og bekrefter dette bildet. Fordi pasientene har betydelig økt risiko for kardiovaskulær sykdom, anbefales på generelt grunnlag primærforebyggende behandling med statin når LDL-kolesterol er >2,5 mmol/l. Det er svært begrenset vitenskapelig dokumentasjon for statinbehandling hos pasienter under 40 år (nedre aldersgrense for inklusjon i CARDS og HPS (Collins R,2003) var 40 år), og vi har derfor valgt å sette 40 års grense i den generelle anbefalingen.
Arbeidsgruppen har kommet til at det er rimelig å ekstrapolere funnene gjort hos eldre pasienter til også å gjelde for pasienter under 40 år som har betydelig forhøyet risiko. Det finnes lite dokumentasjon på pasienter over 80 år, og primærforebygging vil sjelden være aktuelt i denne aldersgruppen.
Det er begrenset dokumentasjon for statinbehandling hos pasienter med diabetes type 1, men de henholdsvis 615 og 1466 pasienter med diabetes type 1 som var inkludert i HPS (Collins R, 2003) og CTT (Kearney PM, 2008) hadde tilsvarende reduksjon i kardiovaskulære hendelser som pasienter med diabetes type 2. Nyere epidemiologiske undersøkelser (Livingstone SJ, 2015 og Lind M, 2014) viser at pasienter med diabetes type 1 fortsatt har en betydelig overdødelighet sammenlignet med normalbefolkningen, og at kardiovaskulær død er den hyppigste årsak til overdødeligheten. Arbeidsgruppen mener derfor at det bør være felles anbefalinger for diabetes type 1 og type 2.
Forskningsgrunnlag
Populasjon (P): Pasienter med diabetes uten kjent kardiovaskulær sykdom
Tiltak (I): Statinbehandling
Sammenligning (C): Ingen kolesterolsenkende behandling/placebo
Beskrivelse av inkluderte studier
Denne metaanalysen (de Vries, 2012) viser at dersom 1000 pasienter mottar behandling med statin over en gjennomsnittlig periode på 3,8 år vil 28 færre oppleve en alvorlig kardiovaskulær hendelse (95% konfidensintervall 17 - 40 pasienter), og kvaliteten på evidensen er høy. For hvert enkeltutfall (hjerteinfarkt og slag, fatale og ikke-fatale), er den absolutte effekten mindre (12 færre hjerteinfarkt og 9 færre slag).
For total-dødelighet er effekten ikke entydig positiv, selv om effektestimatet viser at 8 færre dør, så er dette ikke signifikant og konfidensintervallet er vidt og krysser linjen for ingen effekt (fra 19 færre til 5 flere). Dette kan skyldes flere faktorer, herunder andre årsaker til død enn kardiovaskulære, og at studiene har for kort oppfølgingstid.
Vurdering
Fordeler og ulemper
Blant 1000 pasienter som mottar behandling med statin over en gjennomsnittlig periode på 3,8 år vil 28 færre oppleve en alvorlig kardiovaskulær hendelse. For hvert enkeltutfall (hjerteinfarkt og slag, fatale og ikke-fatale), er den absolutte effekten mindre (12 færre hjerteinfarkt og 9 færre slag).
For total-dødelighet er effekten ikke entydig positiv, selv om effektestimatet viser at 8 færre dør, så er dette ikke signifikant og konfidensintervallet er vidt og krysser linjen for ingen effekt. Dette kan skyldes flere faktorer, herunder andre årsaker til død enn kardiovaskulære, og at studiene har for kort oppfølgingstid.
Av alvorlige bivirkninger er rabdomyolyse rapportert så sjelden at man ikke kan gi et meningsfylt risikoanslag for dette, mens myopati opptrer hos rundt 3 flere per 1000, og økte leverprøver hos 4 flere per 1000.
Statinbehandling gir økt risiko for å utvikle diabetes hos personer uten diabetes, korresponderende til en forverret diabetesregulering hos personer med kjent diabetes. Hos personer med kjent diabetes har statinbehandling sammenlignet med placebo vist en beskjeden økning i HbA1c på 0,12 % etter 3,6 år (Erqou S, Diabetologia 2014). En nyere observasjonsstudie antyder økt risiko for katarakt ved statinbehandling.
Sett under ett, så oppveier fordelene ved dette tiltaket mulige ulemper.
Kvalitet på dokumentasjonen
For utfallene store kardiovaskulære hendelser og hjerteinfarkt har arbeidsgruppen tilstrekkelig tillit til effektestimatene til å gi en sterk anbefaling, fordi vi antar at de fleste pasienter vil ønske behandling dersom de var klar over de viktigste fordelene og ulempene. For total-dødeligheten er bevisgrunnlaget mindre sikkert siden effektestimatene krysser linjen for ingen effekt. Dette kan skyldes flere faktorer, herunder andre årsaker til død enn kardiovaskulære, og at studiene har for kort oppfølgingstid.
Kvaliteten på dokumentasjonen som ligger til grunn for effektestimatene for statinbehandling ved diabetes type 1 er lav. Tilgjengelige data gjør likevel at man må anta at også disse pasientene har tilsvarende effekt.
Effektene samsvarer meget godt til de som er observert i svært store materialer på den generelle populasjon.
Verdier og preferanser
Kardiovaskulær sykdom, både hjerteinfarkt og særlig hjerneslag, medfører økt dødelighet og dessuten risiko for alvorlige senfølger som utvikling av hjertesvikt, arytmier, lammelser og kognitive forstyrrelser. Sett under ett vil derfor personer med diabetes ha en forventet egeninteresse av forebyggende behandling, som fremstår som større jo større den absolutte risikoen er.
For personer med en velregulert diabetes uten komplikasjoner og ellers gunstig risikoprofil, kan nytteverdien synes liten, særlig dersom behandling er assosiert med bivirkninger. Motsatt vil enkelte utsatte grupper, selv i ung alder, ha stor nytte av å komme tidlig i gang med behandling. Disse må da informeres om fordelene ved behandlingen i relasjon til det som oftest er milde til moderate bivirkninger.
Referanser
329. de Vries FM, Denig P, Pouwels KB, Postma MJ, & Hak E.Primary prevention of major cardiovascular and cerebrovascular events with statins in diabetic patients: a meta-analysis. Drugs 2012, 72(18), 2365-2373. doi: 10.2165/11638240-000000000-00000 https://www.helsedirektoratet.no/referanse/0002-0013-232317
330. Collins R, Armitage J, Parish S, Sleigh P, Peto R; Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomised placebo-controlled trial. Lancet. 2003: Jun 14;361(9374):2005-16 https://www.helsedirektoratet.no/referanse/0002-0013-232318
331. Kearney PM, Blackwell L, Collins R, Keech A, Simes J, Peto R,Baigent C. Efficacy of cholesterol-lowering therapy in 18,686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet. 2008: 371(9607), 117-125. doi: 10.1016/s0140-6736(08)60104-x https://www.helsedirektoratet.no/referanse/0002-0013-232319
332. Livingstone SJ, Levin D, Looker HC, Lindsay RS, Wild SH, Joss N, Leese G, Leslie P, McCrimmon RJ, Metcalfe W, McKnight JA, Morris AD, Pearson DW, Petrie JR, Philip S, Sattar NA, Traynor JP, Colhoun HM; Scottish Diabetes Research Network epidemiology group; Scottish Renal Registry. Estimated life expectancy in a Scottish cohort with type 1 diabetes, 2008-2010. JAMA. 2015 Jan 6;313(1):37-44. doi: 10.1001/jama.2014.16425 https://www.helsedirektoratet.no/referanse/0002-0013-232320
333. Lind M, Svensson AM, Kosiborod M, Gudbjörnsdottir S, Pivodic A, Wedel H, Dahlqvist S, Clements M, Rosengren A. Glycemic control and excess mortality in type 1 diabetes. N Engl J Med. 2014 Nov 20;371(21):1972-82. doi: 10.1056/NEJMoa1408214 https://www.helsedirektoratet.no/referanse/0002-0013-232321
Sist faglig oppdatert: 14.09.2016
Kolesterolsenkende behandling som sekundærforebygging ved diabetes type 1 og 2
- Det anbefales å gi intensiv statinbehandling til pasienter med diabetes og kjent kardiovaskulær sykdom (definert som påvist koronarsykdom, iskemisk slag eller TIA samt perifer aterosklerose). Behandlingsmålet er LDL-kolesterol < 1,8 mmol/l.
- Hos pasienter med diabetes og kjent hjerte- og karsykdom (sekundærprofylakse) anbefales det atorvastatin 80 mg som startdose (se mer utfyllende under praktisk)
Praktisk – slik kan anbefalingen følges
Dose og dosejustering
- Hos pasienter med diabetes og kjent hjerte- og karsykdom (sekundærprofylakse) anbefales det atorvastatin (C10AA05) 80 mg som startdose.
- Lavere startdose (10 - 20 mg) bør brukes hos pasienter som bruker medikamenter som kan potensiere virkning av statiner (Ciklosporin, HIV-proteasehemmere, klaritromycin mm).
- Lipidprofil og leverfunksjonstester bør måles før behandlingsstart, og verdiene anbefales kontrollert etter 3 og 12 måneder, og deretter årlig. Dersom levertransaminaser stiger til over 3 ganger øvre referanseverdi og forblir på dette nivået, anbefales dosereduksjon eller seponering av statinbehandling.
Dersom pasienten ikke oppnår behandlingsmålet med største tolerert dose med statin anbefales tillegg av ezetimib (C10AX09) 10 mg daglig.
Bivirkninger
Randomiserte forsøk med statinbehandling viser at omtrent samme prosentandel av pasienter rapporterer muskelsmerter på placebo som på statinbehandling. Til tross for dette er bivirkninger med muskelplager ikke uvanlig hos statinbehandlede pasienter. CK bør måles hos pasienter som rapporterer muskelsmerter, og statinbehandling bør seponeneres dersom CK er over 5 ganger øvre referanseverdi.
Dersom pasienter rapporterer uønskede bivirkninger på høydose statinbehandling, bør følgende strategier drøftes med pasienten:
- midlertidig seponering av statinbehandling, og nytt forsøk når symptomene har gitt seg for å sikre at symptomene er relatert til statinbehandling
- dosereduksjon av atorvastatin (doser helt ned til 10 mg annen hver dag har klar effekt på LDL-kolesterol nivå).
Dersom statiner overhodet ikke tolereres må behandling med ezetimib vurderes (ev. gallesyrebindende medikamenter (C10AC) og fibrater)
Begrunnelse – dette er anbefalingen basert på
Pasienter med diabetes rammes ofte av hjerte- og kar sykdommer, og etter gjennomgått infarkt har pasienter med diabetes dårligere prognose enn andre infarktpasienter. Optimal sekundærprofylakse er derfor ekstra viktig hos diabetespasienter. Statinbehandling er omfattende testet ut hos pasienter både med og uten diabetes. Disse studiene viser konsistente funn med tydelig gevinst når det gjelder kardiovaskulære hendelser, dvs. hjerteinfarkt og hjerneslag, med en relativ risikoreduksjon på 20-30 %. Effekten på totaldød er mer usikker, mens en grensesignifikant effekt på kardiovaskulær død fremkommer i sekundærprofylakse.
De fleste statinstudier har testet spesifikke doser av statiner mot placebo, mindre intensiv statinbehandling, eller andre statiner, og bare noen få studier har hatt behandlingsmål for LDL-kolesterol. Vi vet derfor ennå ikke hvor langt ned LDL-kolesterol må senkes før det ikke lenger er noen effekt av ytterligere reduksjon. En oppdatering av CTT metaanalyse (Cholesterol Treatment Trialists' Collaboration, 2010) viste at for hver ytterlige 1,0 mmol/l reduksjon i LDL-kolesterol med intensiv behandling, var forekomst av hjerteinfarkt, revaskularisering og hjerneslag redusert med cirka 20 %. Metaanalysen fant ingen evidens for en terskelverdi i LDL-kolesterol der intensiv behandling ikke hadde ytterligere effekt. Enkelte studier har vist gevinst av å senke LDL-kolesterol til området 1,4 - 1,8 mmol/l.
I flere internasjonale retningslinjer har man frem til 2013/2014 ansett at LDL-kolesterol bør ligge under 1,8 mmol/l hos personer med diabetes og kjent hjerte- og karsykdom. Som det fremgår ovenfor har disse målene ikke noen klar medisinsk begrunnelse. I amerikanske retningslinjer fra 2013 har man unnlatt å definere behandlingsmål for LDL-kolesterol og i stedet valgt å skille mellom ulik intensitet av statinbehandlingen etter grad av utgangsrisiko. Dette kan synes som en korrekt vinkling så lenge kun statiner hadde dokumentert klinisk effekt.
Når man i 2015 har fått demonstrert at også LDL-reduksjon med ezetimib hos pasienter med diabetes og kjent hjerte- og karsykdom (Cannon CP, 2015) kan redusere antall kardiovaskulære hendelser, synes situasjonen noe endret. Det kan derfor synes ønskelig å beholde et mål for LDL i sekundærprofylakse, og at LDL-kolesterol < 1,8 mmol/l kan være veiledende.
Forskningsgrunnlag
Populasjon (P): Personer med diabetes type 1 eller 2 med etablert hjerte- og karsykdom som ikke oppnår behandlingsmål på ett medikament
Tiltak (I): Statin og Ezetrol kombinasjonsterapi
Sammenligning (C): Statin monoterapi
Beskrivelse av inkluderte studier
Denne RCT viser at dersom 1000 pasienter mottar behandling med Simvastatin og Ezetimibe over en gjennomsnittlig periode på 6 år vil 16 færre oppleve en store kardiovaskulær hendelse (95% konfidensintervall 28 færre - 3 færre) sammenlignet med behandling med Simvastatin alene. Det var ingen signifikant forskjell i forekomst av uønskede hendelser i de to behandlingsregimer. Kvaliteten på evidens er moderat.
Vurdering
Fordeler og ulemper
Blant 1000 pasienter med diabetes og kjent kardiovaskulær sykdom som mottar behandling med statin over en periode på 5 år, vil det være 42 færre pasienter som får alvorlige kardiovaskulære hendelser (95 % konfidensintervall 30-55 pasienter) per mmol/l senket LDL-kolesterol. Kvaliteten på denne evidensen er høy. For hvert enkeltutfall (koronar hendelse og slag), er den absolutte effekten mindre, men den relative gevinsten i samme størrelsesorden, tilsvarende litt over 20 % risikoreduksjon.
For total-dødelighet er effekten grensesignifikant, med 9 % relativ risikoreduksjon (p=0.02), og for kardiovaskulær død 13 % risikoreduksjon.
Av alvorlige bivirkninger er rabdomyolyse rapportert så sjelden at man ikke kan gi et meningsfylt risikoanslag for dette, mens myopati opptrer hos rundt 3 flere per 1000 (fra 2 til 8 flere), og økte leverprøver hos 4 flere per 1000 (fra 2 til 5 flere). Statinbehandling gir økt risiko for diabetesutvikling hos personer uten diabetes, korresponderende til en forverret diabetesregulering hos personer med kjent diabetes. Hos personer med kjent diabetes har statinbehandling sammenlignet med placebo vist en beskjeden økning i HbA1c på 0,12 % etter 3,6 år (Erqou S, Diabetologia 2014).
En nyere observasjonsstudie antyder økt risiko for katarakt ved statinbehandling.
Tillegg av ezetimib til statinbehandling i en nylig publisert stor RCT (Canon CP, 2015) førte til en signifikant 2 prosent reduksjon i kardiovaskulære hendelser (32,7% vs. 34.7%) sammenlignet med behandling med statin alene. Det var ingen signifikant forskjell i forekomst av uønskede hendelser i de to behandlingsregimer.
Sett under ett oppveier fordelene ved kolesterolsenkende behandling klart mulige ulemper.
Kvalitet på dokumentasjonen
Vi har stor tillit til effektestimatene for store kardiovaskulære hendelser, fordi bevisgrunnlaget er av høy kvalitet, men med mindre sikre data for diabetes type 1. Effektene samsvarer meget godt til de som er observert i svært store materialer på den generelle populasjon (uten og med diabetes). Dokumentasjonen på totaldød er imidlertid noe usikker, men med klar trend i positiv retning.
Verdier og preferanser
Kardiovaskulær sykdom, både hjerteinfarkt og særlig hjerneslag, er forbundet med betydelig økt risiko for ny kardiovaskulær hendelse i løpet av den nærmeste tiden, og prognosen kan forverres betydelig ved residiv. Optimal sekundærforebygging vil derfor ha klar verdi hos pasienter som allerede er rammet av en hendelse, og statinbehandling er et sentralt element i sekundærforebyggingen.
Personer med diabetes og etablert hjerte- og karsykdom vil dermed ha en forventet egeninteresse av statiner gitt sekundærforebyggende. Imidlertid kan stor medisineringsbyrde være et problem hos noen, og subjektive bivirkninger med muskelplager forekommer relativt hyppig (hos 5-10 %).
Referanser
334. Cholesterol Treatment Trialists' (CTT) Collaboration, Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, Peto R, Barnes EH, Keech A, Simes J, Collins R. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010 Nov 13;376(9753):1670-81. doi: 10.1016/S0140-6736(10)61350-5 https://www.helsedirektoratet.no/referanse/0002-0013-232322
335. Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, Darius H, Lewis BS, Ophuis TO, Jukema JW, De Ferrari GM, Ruzyllo W, De Lucca P, Im K, Bohula EA, Reist C, Wiviott SD, Tershakovec AM, Musliner TA, Braunwald E, Califf RM; IMPROVE-IT Investigators. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med. 2015 Jun 18;372(25):2387-97. doi: 10.1056/NEJMoa1410489 https://www.helsedirektoratet.no/referanse/0002-0013-232323
Sist faglig oppdatert: 14.09.2016
Omega-3-tilskudd som behandling av lipidforstyrrelser ved diabetes
Det er ikke vitenskapelig belegg for at omega-3-fettsyrer i tablettform reduserer risikoen for kardiovaskulær sykdom hos personer med diabetes. Dette gjelder både personer med og personer uten kjent kardiovaskulær sykdom.
Praktisk – slik kan anbefalingen følges
Studiene som er evaluert er ikke designet for å gi svar på nytteeffekten av omega-3 tilskudd hos pasienter med spesielt høye triglyserider. For slike pasienter må adekvat behandling vurderes ut fra lipidforstyrrelsen som klinisk problem og uavhengig av diabetessykdommen.
Det er også viktig å presisere at vi ikke har vurdert effekten av å innta omega-3 i matvarer.
Begrunnelse – dette er anbefalingen basert på
Studier har vist at høy dose omega-3 fettsyrer reduserer triglyserider med en doseavhengig respons. Det er imidlertid ingen effekt på HDL-kolesterol og muligens en økning av LDL-kolesterol. Det foreligger ingen overbevisende vitenskapelig dokumentasjon for gunstig effekt av omega-3 fettsyrer for primær- eller sekundærprevensjon av kardiovaskulær sykdom hverken hos pasienter med diabetes type 2 eller i den generelle befolkningen.
Generelt er kvaliteten på evidensen lav, men det foreligger en stor RCT med 6 års oppfølging (Origin Trial Investigators, 2012) på pasienter med diabetes type 2 (88 %) og pre-diabetes (12 %) som vi har brukt til å besvare vårt kliniske spørsmål. Denne studien viser heller ikke gunstig effekt på kardiovaskulære hendelser ved behandling med omega-3 fettsyrer. Bivirkninger av behandling med omega-3 fettsyrer forekommer sjelden, men behandlingen har likevel ulemper i form av økonomiske utgifter og økt medikalisering/tablettbelastning for pasientene.
Forskningsgrunnlag
Populasjon (P): Pasienter med diabetes med og uten kjent kardiovaskulær sykdom, ev med høye triglycerider
Tiltak (I): Omega-3 tilskudd
Sammenligning (C): Placebo / evt. tillegg til statinbehandling
Beskrivelse av inkluderte studier
Blant 1000 pasienter som mottar behandling med Omega-3 tilskudd tilsvarende 1g dgl, vil det per år ikke være signifikant lavere forekomst av kardiovaskulær død eller total død, med en estimert effekt svært nær 0 (0,3 færre tilfeller per 1000 personer per år). For hjerteinfarkt er det en tilsvarende ikke signifikant estimert effekt svært nær 0 (0,07 flere tilfeller per 1000 per år), og for hjerneslag tilsvarende (0,07 færre tilfeller per 1000 per år). Tallene er observert hos pasienter med ulike forstadier til diabetes ("IGT og IFG") og diabetes (88%), og hvor ca. 50% hadde kjent hjerte- og kar sykdom. Behandlingen er gitt uavhengig av nivået av triglycerider i utgangspunktet.
Vurdering
Fordeler og ulemper
Blant 1000 pasienter som mottar behandling med Omega-3 tilskudd tilsvarende 1g daglig, vil det per år ikke være signifikant lavere forekomst av kardiovaskulær død eller total død, med en estimert effekt svært nær 0 (0,3 færre tilfeller per 1000 personer per år). For hjerteinfarkt er det en tilsvarende ikke-signifikant estimert effekt svært nær 0 (0,07 flere tilfeller per 1000 per år), og for hjerneslag tilsvarende (0,07 færre tilfeller per 1000 per år). Tallene er observert hos pasienter med ulike forstadier til diabetes ("IGT og IFG") og diabetes, og hvor ca. 50 % hadde kjent hjerte- og kar sykdom.
Behandlingen er gitt uavhengig av nivået av triglyserider i utgangspunktet.Behandlingen hadde altså ingen målbar fordel/gevinst, men det ble heller ikke registrert bivirkninger av betydning. Behandlingen har likevel ulemper i form av økonomiske utgifter og økt medikalisering/tablettbelastning for pasientene. Det presiseres at omtalte studie ikke gir svar på hvor stor nytteeffekt omega-3 tilskudd kan ha hos pasienter med spesielt høye triglyserider. For slike pasienter må adekvat behandling vurderes ut fra lipidforstyrrelsen som klinisk problem og uavhengig av diabetessykdommen.
Kvalitet på dokumentasjonen
Vi har moderat tillit til de viktigste effektestimater, fordi studien på den positive siden er adekvat gjort når det gjelder randomisering og blinding og har et stort antall deltakere som er fulgt over 6 år. Imidlertid er det inkludert deltakere med nedsatt glukosetoleranse og fastende hyperglykemi slik at vi har nedgradert kvaliteten av dokumentasjon for appliserbarhet. Det er også relativt lav dødelighet og nokså få tilfeller av hjerteinfarkt og slag.
Verdier og preferanser
Ettersom studien ikke påviser noen signifikant gevinst på noe utfall, er det ikke aktuelt å anbefale tiltaket. Det vil da heller ikke være aktuelt å avveie verdier og preferanser.
Referanser
336. ORIGIN Trial Investigators, Bosch J, Gerstein HC, Dagenais GR, Díaz R, Dyal L, Jung H, Maggiono AP, Probstfield J, Ramachandran A, Riddle MC, Rydén LE, Yusuf S. n-3 fatty acids and cardiovascular outcomes in patients with dysglycemia. N Engl J Med. 2012 Jul 26;367(4):309-18. doi: 10.1056/NEJMoa1203859. Epub 2012 Jun 11 https://www.helsedirektoratet.no/referanse/0002-0013-232324
Sist faglig oppdatert: 14.09.2016
Undersøkelse for hjerte- og karsykdom hos pasienter med diabetes (uten kjent kardiovaskulær sykdom) - kun ved klinisk mistanke
- Undersøkelse (utredning) for å avdekke hjerte- og karsykdom hos pasienter med diabetes uten kjent kardiovaskulær sykdom bør kun gjøres ved klinisk mistanke om slik sykdom.
- Det foreslås at hvile-EKG tas når en pasient diagnostiseres med diabetes type 2 og når pasienter med diabetes type 1 kommer i voksen alder.
Praktisk – slik kan anbefalingen følges
Selv om allmenn screening hos personer med diabetes uten symptomer ikke anbefales, er det viktig å ha en lav terskel for å henvise pasienter til videre hjerteutredning ved klinisk mistanke om kardiovaskulær sykdom.
Hvile-EKG
Det foreligger ikke overbevisende studier som viser nytte av å screene pasienter med diabetes med vanlig hvile-EKG (selv om dette anbefales i noen av andre lands retningslinjer).
Hvile-EKG kan imidlertid være nyttig for å påvise tegn til venstre ventrikkel hypertrofi, tidligere gjennomgått infarkt og eventuelle rytmeforstyrrelser, og det kan anses som hensiktsmessig å ta dette når en pasient diagnostiseres med diabetes type 2 og når pasienter med diabetes type 1 når voksen alder. Undersøkelsen er smertefri, uten strålebelastning og lite ressurskrevende, og det bør være lav terskel for å gjenta undersøkelsen ved mistanke om kardiale symptomer.
Symptomer på hjertesykdom
Personer med diabetes og autonom nevropati kan ha få og atypiske symptomer på hjertesykdom (for eksempel utmattelse og redusert yteevne ved fysisk aktivitet). Relativ risikoøkning for kardiovaskulær sykdom sammenlignet med normalbefolkningen er størst for kvinner med diabetes.
Kardiovaskulær sykdom ved diabetes type 1 kan skille seg fra diabetes type 2 i at forekomsten av hjerte- og karsykdom kan forekomme i yngre alder og i enda større grad enn for diabetes type 2, debuterer med stille iskemi. Med stille (eller stum) iskemi menes koronarsykdom som gir mangelfull gjennomblødning av hjertemuskulaturen tilsvarende angina pectoris, men uten at pasienten har brystsmerter.
Begrunnelse – dette er anbefalingen basert på
Selv om allmenn screening hos personer med diabetes uten symptomer ikke anbefales, er det viktig å ha en lav terskel for å henvise pasienter til videre hjerteutredning ved klinisk mistanke om kardiovaskulær sykdom.
Hvile-EKG
Det foreligger ikke overbevisende studier som viser nytte av å screene pasienter med diabetes med vanlig hvile-EKG (selv om dette anbefales i noen av andre lands retningslinjer).
Hvile-EKG kan imidlertid være nyttig for å påvise tegn til venstre ventrikkel hypertrofi, tidligere gjennomgått infarkt og eventuelle rytmeforstyrrelser, og det kan anses som hensiktsmessig å ta dette når en pasient diagnostiseres med diabetes type 2 og når pasienter med diabetes type 1 når voksen alder. Undersøkelsen er smertefri, uten strålebelastning og lite ressurskrevende, og det bør være lav terskel for å gjenta undersøkelsen ved mistanke om kardiale symptomer.
Symptomer på hjertesykdom
Personer med diabetes og autonom nevropati kan ha få og atypiske symptomer på hjertesykdom (for eksempel utmattelse og redusert yteevne ved fysisk aktivitet). Relativ risikoøkning for kardiovaskulær sykdom sammenlignet med normalbefolkningen er størst for kvinner med diabetes.
Kardiovaskulær sykdom ved diabetes type 1 kan skille seg fra diabetes type 2 i at forekomsten av hjerte- og karsykdom kan forekomme i yngre alder og i enda større grad enn for diabetes type 2, debuterer med stille iskemi. Med stille (eller stum) iskemi menes koronarsykdom som gir mangelfull gjennomblødning av hjertemuskulaturen tilsvarende angina pectoris, men uten at pasienten har brystsmerter.
Forskningsgrunnlag
Populasjon (P): Pasienter med diabetes uten kjent kardiovaskulær sykdom
Tiltak (I): Screening for kardiovaskulær sykdom
Sammenligning (C): Ingen screening
Beskrivelse av inkluderte studier
Valgte metaanalyse i evidensprofilen (Lievre MM, 2011) viser ingen forskjell i risiko for død (uansett årsak) RR 1,18 (konfidensintervall 0,72 - 1,93); ikke-dødelig hjerteinfarkt (RR 0,61, konfidensintervall 0,29 - 1,29); hjerneslag (RR 2,21, konfidensintervall 0,96 - 4,64) eller hjertesvikt (RR 1,09, konfidensintervall 0,48 - 2,46) når screening med arbeids EKG og SPECT sammenlignes med ingen screening. Konfidensintervallene er vide, og studiene mangler statistisk styrke.
Studiene i metaanalysen ble gjennomført for over 10 år siden og resultatene kan ikke med sikkerhet overføres direkte til dagens pasientpopulasjon. Imidlertid støttes den negative konklusjonen i metaanalysen av en nyere RCT publisert i 2014 (Muhlestein JB 2014). Denne studien så på nytten av screening for å forebygge kardiovaskulær død og ikke-dødelig hjerteinfarkt og slag hos asymptomatiske pasienter med diabetes type 1 og 2 ved hjelp av CT angiografi. Denne studien viste ingen signifikant forskjell i hverken død, hjerteinfarkt eller slag mellom screeninggruppen eller kontroller (4.4 % [20 hendelser] vs 3.8 % [17 hendelser]; hasard ratio, 1.15 [95 %CI,
0.60-2.19]).
Vurdering
Fordeler og ulemper
Metaanalysen (Lievre MM, 2011) viste ingen signifikant fordel av screening for død, ikke-dødelig hjerteinfarkt, hjerneslag eller hjertesvikt. Studiene som inngikk i analysen hadde svak statistisk styrke (vide konfidensintervall). Imidlertid støttes den negative konklusjonen i metaanalysen av en nyere RCT publisert i 2014 (Muhlestein, 2014) som heller ikke fant signifikant fordel av screening.
Eventuell reduksjon i dødelighet ved bruk av screening må veies opp mot negative sider, slik som overdiagnostisering, bekymring for alvorlig diagnose, overbehandling, potensiell risiko forbundet med selve undersøkelsen og påfølgende behandling, samt falske positive og falske negative resultater.
Siden dagens kunnskapsgrunnlag ikke viser gevinst av screening, vil ulempene med screening framstå som større enn gevinsten.
Kvalitet på dokumentasjonen
Kvaliteten på evidensen er lav siden de to studiene som er inkludert i metanalysen er relativt små og inneholder få hendelser, noe som gjør at analysen mangler statistisk styrke og resultatene mer usikre. Studiene var kortvarige med maksimal oppfølgingstid på 4-5 år. Studiene inkluderte ikke personer med type 1-diabetes og det er mulighet for bias siden undersøkelsene ikke var blindet og den ene studien ble stoppet tidlig.
Verdier og preferanser
Som følge av screening vil noen asymptomatiske pasienter med diabetes få beskjed om at de har behandlingstrengende koronar hjertesykdom. I beste fall kan denne diagnostikken sørge for adekvat behandling (revaskularisering med PCI eller by-pass operasjon) før en alvorlig hjerte- og kar hendelse opptrer, hvilket mange ville oppfatte som verdifullt. Metaanalysen viser imidlertid at denne gevinsten kommer svært få til gode, og denne fordelen må veies mot effekten av at et større antall personer får påvist sykdom uten at dette fører til tiltak som bedrer prognosen. Dette kan tenkes å skape bekymringer og redusert livskvalitet.
Rutinebruk av screening vil eksponere personer med diabetes for stråling og muligens føre til unødvendig invasiv utredning og revaskulariseringsprosedyrer. Når den kliniske nytten av screening hos asymptomatiske personer med diabetes ikke er dokumentert å gi redusert forekomst av kardiovaskulære hendelser og død sammenliknet med standard optimal medikamentell behandling, er det usannsynlig at pasienter med diabetes vil ha egeninteresse av screening for hjerte- og karsykdom.
Referanser
337. Lièvre MM, Moulin P, Thivolet C, Rodier M, Rigalleau V, Penfornis A, Pradignac A, Ovize M; DYNAMIT investigators. Detection of silent myocardial ischemia in asymptomatic patients with diabetes: results of a randomized trial and meta-analysis assessing the effectiveness of systematic screening. Trials. 2011 Jan 26;12:23. doi: 10.1186/1745-6215-12-23 https://www.helsedirektoratet.no/referanse/0002-0013-232325
338. Muhlestein JB, Lappé DL, Lima JA, Rosen BD, May HT, Knight S, Bluemke DA, Towner SR, Le V, Bair TL, Vavere AL, Anderson JL. Effect of screening for coronary artery disease using CT angiography on mortality and cardiac events in high-risk patients with diabetes: the FACTOR-64 randomized clinical trial. JAMA. 2014 Dec 3;312(21):2234-43. doi: 10.1001/jama.2014.15825 https://www.helsedirektoratet.no/referanse/0002-0013-232326
Sist faglig oppdatert: 14.09.2016
Diabetisk fot og nevropati
Undersøkelse og diagnostikk av nevropati og identifisering av pasienter med risiko for fotsår
- Alle pasienter med diabetes bør undersøkes årlig med 10-g monofilament for å identifisere diabetisk polynevropati og for å identifisere personer med moderat eller økt risiko for utvikling av fotsår (se Praktisk).
- For å vurdere risiko for utvikling av fotsår anbefales i tillegg
- palpering av fotpulser
- vurdering av feilstilling og hard hud
- å skaffe informasjon om tidligere fotsår eller amputasjon, enten ved å spørre pasienten, eller på annen måte
Praktisk – slik kan anbefalingen følges

Brosjyrer: Informasjon og råd om diabetes – fotpleie og sårbehandling
Tilleggsundersøkelser for nevropati
Ved usikkerhet om funn av monofilamentundersøkelse bør det også utføres testing av vibrasjonsfølsomhet med stemmegaffel.
Vibrasjonsfølsomhetstesting
Det brukes en 128-Hz stemmegaffel som settes på den benete delen av stortåens ytterste ledd. Studier er ikke gjort med 256-Hz stemmegaffel som mange bruker. Det antas at 256-Hz stemmegaffel er adekvat. Spør pasienten om han kjenner vibrasjon med svarmulighet: "ja" eller "nei". Fire ganger på hver stortå. Totalt 8 stimuli.
- Pasienten kjenner 0-3 av 8 stimuli: tyder sterkt på nevropati
- Pasienten kjenner 4-6 av 8 punkter: mulig nevropati (må undersøkes videre)
- Pasienten kjenner 7-8 av 8 stimuli: nevropati er usannsynlig
For en mer presis diagnostisering bør følgende algoritme benyttes:
Diagnosen "Diabetisk polynevropati" stilles ut i fra (Tesfaye S, 2010):
- Symptomer: nedsatt følsomhet, nummenhet, prikking, stikking, brennende eller verkende smerte som starter i tær, deretter føtter og legger.
- Undersøkelse: Monofilament, vibrasjonsfølsomhet, ankelrefleks
Vurdering av symptomer og undersøkelse (Tesfaye S, 2010):
- Mulig diabetisk polynevropati: Ett symptom eller en nedsatt undersøkelse (f.eks. monofilament 6/8)
- Sannsynlig diabetisk polynevropati: Ett symptom og en nedsatt undersøkelse.
- Bekreftet diabetisk polynevropati: Abnormal nevrografiundersøkelse og ett symptom eller nedsatt monofilament, vibrasjonsfølsomhet, ankelrefleks.
Nevrografi behøves bare ved tvil om diagnosen. "Sannsynlig diabetisk nevropati" er et godt nok diagnostikum på diabetespoliklinikker og i primærhelsetjenesten.
Obs! Smertefull nevropati eller autonom nevropati fanges ikke nødvendigvis opp av definisjonen selv om de fleste med smerter og autonom nevropati også har typisk diabetisk polynevropati
Ikke sjeldne eksklusjonsdiagnoser er: Skiveprolaps (obs midtstilte), og nevropatier forårsaket av blant annet alkohol, vitamin B12-mangel og medikamenter
Det anbefales årlig undersøkelse for nevropati hos personer med diabetes. Ved type 2 fra diagnosetidspunkt, ved type 1 fra og med fem års varighet.
Pasienter med nevropati bør bruke trykkavlastende fottøy pga økt risiko for utvikling av fotsår. Pasienten bør få utdelt brosjyre i henhold til risikoklassifisering for fotsår: Lav risiko for diabetisk fotsår, Moderat risiko for diabetisk fotsår, Høy risiko for diabetisk fotsår, Pleie av diabetisk fotsår, Råd om fottøy.
Nevropatiscreening bør innarbeides i rutiner for årskontroll. Det anbefales å bruke fotdelen i NOKLUS diabetesjournal.
Henvisning til nevrografi eller nevrolog: Ved usikkerhet om diagnosen dvs. ingen sammenheng med diabetesvarighet, andre senkomplikasjoner eller HbA1c. Eller ved asymmetri, generell arefleksi eller mistanke om carpal tunnel syndrom.
Tilleggsundersøkelse for risikovurdering for utvikling av diabetisk fotsår
- Pulsundersøkelse: Palper over art. dorsalis pedis og art. tibialis posterior. Bruk ev. Doppler dersom puls ikke palperes. Et Dopplersignal med lav og/eller forlenget signal (amplitude) indikerer nedsatt sirkulasjon. Ved manglende puls og/eller Doppler-signal i en arterie bør pasienten henvises for karkirurgisk vurdering. Ankel/armindeks kan være falsk negativ på grunn av mediasklerose i leggarterier.
- Føttene undersøkes for sår, hard hud (hyperkeratose, kallus) særlig på trykkpunkter, feilstilling; særlig hammertær
- Vi anbefaler årlig fotundersøkelse for personer med diabetes type 2 fra diagnosetidspunkt og for de med diabetes type 1 fra og med fem års sykdomsvarighet
- Tidligere fotsår eller amputasjon er tilstrekkelig for å identifisere personer med høy risiko. Disse bør få undersøkt føtter ved hver konsultasjon
- Fotundersøkelse innarbeides i rutiner for årskontroll og andre rutinekontroller for personer med moderat eller høy risiko for fotsår. Det anbefales å bruke fotdelen i NOKLUS diabetesskjema.
- Personer med diabetes bør få utdelt brosjyre utarbeidet av Helsedirektoratet i henhold til risikoklassifisering for fotsår: Lav risiko for diabetisk fotsår, Moderat risiko for diabetisk fotsår, Høy risiko for diabetisk fotsår, Pleie av diabetisk fotsår, Råd om fottøy, Fotstell under ferie.
I en helhetlig risikovurdering av fotsår er det viktig å vurdere andre faktorer er assosiert med fotsår: høy alder, kjønn (mann), lengre varighet av diabetes, høyere BMI, røyking, alkohol, insulinbruk, nefropati, HbA1c, fotdeformiteter, aleneboende, nedsatt syn, nedsatt ankel/arm indeks og hjerte-karsykdom (Crawford F, 2015, Monteneiro-Soares M, 2012).
Risikostratifisering: Vi anbefaler bruk av "Scottish Intercollegiate Guideline Network, SIGN" sin risikostratifisering som er i ferd med å bli inkorporert i NOKLUS Diabetes (Monteiro-Soares M, 2012, Leese GP, 2011, 2006).
Ut ifra sårhistorie, fotpulser, monofilament og feilstilling deles pasientene årlig inn i å ha:
- Lav risiko for fotsår (minst en puls pr fot, og normal monofilament u.s., og ingen fotdeformitet)
- Moderat risiko for fotsår (ikke målbar pulser på en fot, eller nedsatt monofilament 6/8 eller færre eller fotdeformitet eller manglende evne til å se eller undersøke egen fot).
- Høy risiko for fotsår (tidligere sår eller amputasjon, eller fraværende pulser på en fot og nedsatt monofilament 6/8 eller færre eller en av de tidligere nevnte og hard hud (kallus) eller deformitet).
Det bør være en lav terskel blant allmennlegene for å konferere med spesialisthelsetjenesten angående fotproblemer hos pasienter med høy risiko for fotsår. De fleste av disse vil ha behov for trykkavlastende fottøy. Pasienter med høy risiko skal få undersøkt føtter ved hver diabeteskontroll. De med moderat og høy risiko anbefales å gå regelmessig til fotterapeut.
Begrunnelse – dette er anbefalingen basert på
Det er viktig å identifisere nevropati hos pasienter med diabetes fordi risiko for fall og fotsår er høy i denne gruppen og en ikke-diabetisk nevropati (som skiveprolaps, alkohol, vitamin B12 mangel, medikamenter, nyresvikt) kan behandles, smerter kan behandles og følelsesløse føtter kan identifiseres og sårforebygging iverksettes (Tesfaye S, 2010).
Monofilamenttest er tilstrekkelig for å undersøke pasienter for nevropati. Testen er enkel, rask billig og er ikke plagsom for pasienten (Crawford F, 2015). Vibrasjonsfølsomhet og symptomer er viktige i en videre diagnostiserering.
Diabetisk nevropati er en eksklusjonsdiagnose. De vanligste er diabetisk polynevropati og autonom nevropati (gastroparese, postural hypotensjon, urinblærekomplikasjoner, erektil dysfunksjon). Autonom nevropati er vanskelig å diagnostisere, og er en spesialistoppgave.
Bruk av en 10-g monofilament og palpering av fotpulser er tilstrekkelig for å identifisere personer med moderat økt risiko for utvikling av fotsår. Har pasienten hatt tidligere fotsår eller amputasjon er dette tilstrekkelig for å identifisere personer med høy risiko. Risikostratifiseringen er et viktig redskap i forebyggingen av (nye) fotsår.
Kvaliteten på artikkelen bak evidensprofilen er i utgangspunktet lav, da dette er en observasjonsstudie. Vi har valgt å oppgradere kvaliteten fordi vi har stor tiltro til effektestimatene fra studien som ligger til grunn for anbefalingen. Anbefalingen er heller ikke kostbar og vurderes til ikke å ha bivirkninger.
Forskningsgrunnlag
Populasjon (P): Pasienter med diabetes (type 1 og type 2) og kontrollpersoner uten diabetes
Tiltak (I): Undersøkelse med monofilament, vibrasjonsfølsomhet og overfladisk smerte med "Neurotip"
Sammenligning (C): Nerveledningshastighet og - amplituder
Beskrivelse av inkluderte studier
En stor tverrsnittsstudie har undersøkt sensitivitet, spesifisitet, ROC-kurve, positiv og negativ "likelihood ratio" av enkle screeningtester for perifer diabetisk nevropati med standardisert nevrografi som gullstandard. Monofilament og vibrasjonsfølsomhet er lett å bruke og implementere i klinisk praksis (Perkins BA, 2001).
Bruk av en 10-g monofilament er tilstrekkelig for å identifisere personer med nevropati med en sensitivitet og spesifisitet ved den optimale grense for screeningstest var på henholdsvis 77% og 96%; Positiv og negativ «likelihood ratio» ved optimal grense var 10.2 og 0.34 og ROC AUC 0.72. Sensitiviteten var 77% ved score større eller lik 7 og spesifisiteten 96% ved score 5 eller færre. Sensitivitet og spesifisitet for å kjenne vibrasjonsfølsomhet (ja/nei) ved de optimale grensene for screeningstesten var på henholdsvis 53% og 99%; Positiv og negativ «likelihood ratio» ved optimal grense var 26.6 og 0.51. Dette anses som gode resultater for enkle, kliniske tester.
Monofilament og vibrasjonsfølsomhet predikerer også risiko for utvikling av diabetisk nevropati ila 4 år med en ROC AUC på 0.71 for Monofilament og 0.59 for vibrasjonsfølsomhet (Perkins BA, 2010)
Vurdering
Fordeler og ulemper
Ved bruk av monofilament for identifisering av polynevropati
Identifisering av personer med diabetisk nevropati er et viktig redskap i forebyggingen av fotsår, kartlegging av fare for fall og kartlegging av smertefull nevropati.
Bruk av 10-g monofilament er tilstrekkelig for å identifisere personer med sannsynlig nevropati og har en sensitivitet på 77 % og spesifisitet på 96 % sammenlignet med gullstandard som var nevrografi. Dette anses som gode resultater for enkle, kliniske tester. På grunn av noe lav sensitivitet bør man ved symptomer vurdere tilleggsundersøkelser.
Monofilament og vibrasjonsfølsomhet predikerer også risiko for utvikling av diabetisk nevropati i løpet av 4 år (Perkins BA, 2010).
Ved bruk av monofilament for risikovurdering for utvikling av diabetisk fotsår:
Risikostratifiseringen er et viktig redskap i forebyggingen av (nye) fotsår (Crawford F, 2015).
Bruk av en 10-g monofilament eller palpering av fotpulser er tilstrekkelig for å identifisere personer med moderat økt risiko for utvikling av fotsår med OR hhv 3.44 (95% KI 2.77-4.26) og 2.60 (1.8,3.75) for pasienter uten tidligere fotsår eller amputasjon. Har pasienten hatt tidligere fotsår eller amputasjon er dette i seg selv tilstrekkelig for å identifisere personer med høy risiko.
Kvalitet på dokumentasjonen
For bruk av monofilament for identifisering av polynevropati
Vi har stor tiltro til estimatene for testene som er anbefalt for screening (test med 10-g monofilament og vibrasjonssans). Estimatene kommer fra en tverrsnittsstudie (Perkins BA, 2001). Pasientene i studien representerer ikke en kohort fra primærhelsetjenesten, men en blandet gruppe hovedsakelig fra spesialisthelsetjenesten. Man forventer derfor en lavere prevalens av nevropati blant pasientene i primærhelsetjenesten enn i kohorten.
For bruk av monofilament for risikovurdering for utvikling av diabetisk fotsår
Vi har stor tiltro til effektestimatene som ligger til grunn for anbefalingen (test med 10-g monofilament og palpering av fotpulser) blant personer som ikke tidligere har hatt fotsår. Estimatet kommer fra en stor systematisk review av høy kvalitet. Selv om den baserer seg på observasjonsstudier er størrelsen og kvaliteten av en slik art at den oppgraderes i GRADE. Vi har lavere tiltro til de resterende faktorenes prediktive verdi: høy alder, kjønn (mann), lengre varighet av diabetes, høyere BMI, røyking, alkohol, insulinbruk, nefropati, HbA1c, fotdeformiteter, aleneboende, depresjon, nedsatt syn, nedsatt ankel/arm indeks og hjerte-karsykdom.
Det er lite evidens på den mest optimale frekvens for screeningintervaller spesielt i grupper med lav/middels risiko.
Verdier og preferanser
Tiltaket anses som akseptabelt av pasienten. Undersøkelse for påvisning av nevropati er viktig for å utjevne helsemessige ulikheter da gruppen med nevropati har større risiko for fotsår som er assosiert med økt dødelighet (Iversen MM, 2009).
Når det gjelder risikovurdering for fotsår, antar vi at de fleste pasienter vil ønske dette, og den foreslåtte oppfølging som angitt i praktisk info.
Risikovurderingen kan mulig bidra til at pasienten blir engstelig, men gevinstene anses som større enn mulige ulemper.
Referanser
339. Crawford F, Cezard G, Chappell FM, Murray GD, Price JF, Sheikh A, et al. A systematic review and individual patient data meta-analysis of prognostic factors for foot ulceration in people with diabetes: the international research collaboration for the prediction of diabetic foot ulcerations (PODUS). Health Technol Assess 2015;19(57) https://www.helsedirektoratet.no/referanse/0002-0013-232327
340. Monteiro-Soares M, Boyko EJ, Ribeiro J, Ribeiro I, Dinis-Ribeiro M. Predictive factors for diabetic foot ulceration: a systematic review. Diabetes Metab Res Rev. 2012 Oct;28(7):574-600. doi: 10.1002/dmrr.2319 https://www.helsedirektoratet.no/referanse/0002-0013-232328
341. Tesfaye S, Boulton AJ, Dyck PJ, Freeman R, Horowitz M, Kempler P, Lauria G, Malik RA, Spallone V, Vinik A, Bernardi L, Valensi P; Toronto Diabetic Neuropathy Expert Group.Diabetic neuropathies: update on definitions, diagnostic criteria, estimation of severity, and treatments. Diabetes Care. 2010 Oct;33(10):2285-93 https://www.helsedirektoratet.no/referanse/0002-0013-232329
342. Perkins, B. A., Olaleye, D., Zinman, B., & Bril, V. (2001). Simple screening tests for peripheral neuropathy in the diabetes clinic. Diabetes Care, 24(2), 250-256 https://www.helsedirektoratet.no/referanse/0002-0013-232330
343. Perkins, B. A., Orszag, A., Ngo, M., Ng, E., New, P., & Bril, V. (2010). Prediction of incident diabetic neuropathy using the monofilament examination: a 4-year prospective study. Diabetes care, 33(7), 1549-1554. doi: 10.2337/dc09-1835 https://www.helsedirektoratet.no/referanse/0002-0013-232331
344. Measuring the accuracy of different ways to identify the 'at-risk' foot in routine clinical practice https://www.helsedirektoratet.no/referanse/0002-0013-232332
Sist faglig oppdatert: 14.09.2016
Opplæring i hvordan forebygge diabetiske fotsår
Det foreslås at pasienter med moderat og høy risiko for diabetisk fotsår får opplæring i daglig undersøkelse av føttene
Praktisk – slik kan anbefalingen følges
Opplæring og undersøkelse
Hos eldre og de med nedsatt bevegelighet eller nedsatt syn anbefales det at de får assistanse av andre til fotundersøkelse, for eksempel familie, venner, fotterapeut, hjemmesykepleier etc. Vi foreslår at pasienter med moderat og høy risiko for å utvikle fotsår går jevnlig til lege, sykepleier eller til autorisert fotterapeut med kompetanse på diabetesføtter. Vi foreslår at pasienter får utlevert informasjonsmateriell om egenomsorg og forebygging av fotsår (se lenker til brosjyrer om lav, moderat og høy risiko for fotsår).
For pasienter med moderat og høy risiko for fotsår innebærer forebyggende fotbehandling regelmessig/daglig undersøkelse av føttene for observasjon av:
- sprekker i huden
- tørr hud, kallus
- sår
- deformiteter
- områder som kan være utsatt for trykk, endring i farge
- fotsopp
- sko og fotsenger
Definisjoner
- Lav risiko: minst en puls pr fot, og normal Monofilament u.s., og ingen fotdeformitet
- Moderat risiko: ikke målbar pulser på en fot, eller nedsatt monofilament 6/8 eller færre eller fotdeformitet eller manglende evne til å se eller undersøke egen fot) eller fotdeformitet.
- Høy risiko: tidligere sår eller amputasjon, eller fraværende pulser og nedsatt monofilament 6/8 eller færre eller en av de tidligere nevnte og hard hud (kallus) eller deformitet).
Begrunnelse – dette er anbefalingen basert på
Undervisning om den diabetiske fot gjøres for at pasienten i best mulig grad skal passe på føttene selv for å forebygge fotsår. I tillegg skal pasienten bli i stand til å identifisere ev. deformiteter, hudsprekker, sår etc. slik at behandling og forebyggende tiltak kan iverksettes så raskt som mulig.
Personer med diabetiske fotsår og, eller amputerte, er en pasientgruppe som er alvorlig syke. Risikoen for utvikling av sår er sammensatt av flere risikofaktorer, og for den enkelte pasient er det mange faktorer å ta hensyn til. Undersøkelse av føttene bør gjøres daglig resten av livet. Depressive symptomer er assosiert med nedsatt tilheling og tilbakevendende fotsår, slik at det er ekstra viktig å motivere og oppmuntre denne sårbare gruppen til å prioritere egenomsorg (Iversen 2014).
Det foreligger ikke vitenskapelig evidens for at strukturert opplæring for forebygging av fotsår har effekt på gruppenivå (Lincoln NB, 2008). Når det i tillegg er svært ressurskrevende vil vi ikke anbefale å prioritere et slikt strukturert opplegg. Opplæring generelt er selvsagt viktig, men det vi har vurdert med base i kunnskapsgrunnlaget er om strukturert opplæring gir gevinst på utfallene fotsår og amputasjon.
Forskningsgrunnlag
Populasjon (P): Pasient med diabetes med nylig tilhelet fotsår
Tiltak (I): En time strukturert undervisning ved hjemmebesøk, informasjonsmateriell og oppfølging per telefon etter fire uker
Sammenligning (C): Kun informasjonsmateriell
Beskrivelse av inkluderte studier
Det mangler studier med statistisk styrke som vurderer effekten av intervensjonen, opplæring for forebygging sår. Til tross for få eller ingen studier som viser at opplæring til den enkelte pasient gir redusert forekomst av diabetiske fotsår og amputasjon på lang sikt, mener vi at individuell opplæring er viktig (Jeffcoate WJ, 2011). Opplæring for å unngå diabetisk fotsår og amputasjon anbefales selv om anbefalingene er vurdert ut fra en systematisk oversikt hvor det kun er én studie (Lincoln NB, 2008) som er av god nok kvalitet til å vurderes, og som også ligger til grunn for evidensprofilen. Intervensjon i denne studien ga ingen effekt på forebygging av sår og amputasjon på lengre sikt. Amputasjon RR 0.98 (95% KI 0.41, 2.43) og fotsår RR 1.00 (0.70, 1.44).
Grunnet statistisk, metodologisk og klinisk heterogenitet, ble det ikke utført en meta-analytisk oppsummering av effekten av strukturert opplæring av personer med diabetes i den systematiske litteraturoversikten av Dorresteijn JA, 2014. De 12 studiene som var inkludert i litteraturoversikten brukte ulike metoder for intervensjon med strukturert opplæring og ble sammenlignet med standard behandling, ingen behandling eller en mindre aktiv intervensjon/ opplæring. Kvaliteten på studiene, vurdert ved Cochrane Collaboration's risk og bias tool, var generelt lav og uklar, med unntak av for en studie som ligger til grunn for vår evidensprofil (Lincoln NB, 2008).
Totalt fem studier, med varighet fra 1 til 7 år, undersøkte effekten av strukturert opplæring på fotsår og/ eller amputasjon (Lincoln NB, 2008, Bloomgarden ZT, 1987, Cisneros LL, 2010, Malone JM, 1989, Hämäläinen H, 1998). Disse ble sammenlignet med standard behandling eller mindre intensiv intervensjon/ opplæring. Deltakerne hadde høy (Lincoln NB, 2008, Cisneros LL, 2010, Malone JM, 1989) og lav/moderat (Rice J, 2015, Hämäläinen H, 1998) risiko for fotsår.
Tre studier fant ingen signifikant effekt av strukturert opplæring på fotsår og/ eller amputasjon (Lincoln NB, 2008, Rice J, 2015, Cisneros LL, 2010); i en studie var det for få hendelser til å vurdere dette entydig (Hämäläinen H, 1998). Den siste studien fant der i mot en signifikant effekt av intervensjon på fotsår (RR 0.31, 95% KI 0.14, 0.66) og amputasjon (RR 0.33, 95% KI 0.15, 0.76), men endepunktene ble rapportert per ekstremitet og ikke per person, slik at resultatene fra studien trolig viser en overestimering av intervensjonseffekt (Malone JM, 1989).
Vurdering
Fordeler og ulemper
Siden diabetiske fotsår er en stor belastning for den enkelte pasient, er det viktig å identifisere pasienter med moderat til høy risiko for fotsår for å gi nødvendig opplæring og oppfølging. Klinisk erfaring tilsier nytte av undervisning på kort sikt, både når det gjelder kunnskap og pasienttilfredshet, selv om det ikke finnes god evidens på at det har effekt på lang sikt.
Kvalitet på dokumentasjonen
Det er lite evidens for at systematisk, strukturert opplæring har effekt. Kvaliteten på evidensen er moderat og anbefalingen er derfor svak. Vi foreslår at man ikke bør prioritere strukturert, systematisk opplæring, men foreslår likevel at generell opplæring bør inngå som en del av den eksisterende pasientkontakten. Generelt var de fleste studier små og av dårlig kvalitet, og besto av en kombinasjon av primær- og sekundærforebyggende tiltak. For eksempel hadde de aktuelle studier kun inkludert personer med tidligere diabetisk fotsår. Gevinsten av forebyggende tiltak i slike studier vil være vanskelig å påvise, da tidligere fotsår er den viktigste prediktor for nye fotsår, og dermed direkte assosiert med det primære utfallsmål, som er utsettelse eller forebygging av nye fotsår.
Verdier og preferanser
Det anses som viktig med individuell opplæring (Jeffcoate WJ, 2011). For den enkelte pasient er tiltaket daglig å undersøke føttene. For personer som er deprimert og/eller med redusert helserelatert livskvalitet kan det være en tilleggsbelastning siden egenbehandling og oppfølging krever mye av den enkelte pasient. Pasienter med høy risiko for fotsår er av erfaring en gruppe pasienter med lav etterlevelsesevne/compliance, og som det er ekstra viktig å motivere til egenomsorg. Det kan være nødvendig med tilrettelegging for personer med innvandrerbakgrunn, som bruk av tolk, gruppeundervisning, evt. kjønnsdelte grupper.
Referanser
345. Lincoln NB, Radford KA,Game FL, Jeffcoate WJ. Education for secondary prevention of foot ulcers in people with diabetes: a randomized controlled trial. Diabetologia 2008;51(11):1954-61 https://www.helsedirektoratet.no/referanse/0002-0013-232333
346. Jeffcoate WJ. Stratification of foot risk predicts the incidence of new foot disease, but do we yet know that the adoption of routine screening reduces it? Diabetologia 2011 May;54(5):991-3 https://www.helsedirektoratet.no/referanse/0002-0013-232334
347. Bloomgarden ZT, Karmally W, Metzger MJ, Brothers M, Nechemias C, Bookman J, et al. Randomized controlled trial of diabetic patient education: improved knowledge without improved metabolic status. Diabetes Care 1987;10 (3):263–72 https://www.helsedirektoratet.no/referanse/0002-0013-232335
348. Cisneros LL. Evaluation of a neuropathic ulcers prevention program for patients with diabetes [Avaliação de um programa para prevenção de úlceras neuropáticas em portadores de diabetes]. Revista brasileira de fisioterapia 2010;14(1):31–7 https://www.helsedirektoratet.no/referanse/0002-0013-232336
349. Malone JM, Snyder M, Anderson G, Bernhard VM, Holloway GA, Bunt TJ. Prevention of amputation by diabetic education. The American Journal of Surgery 1989; 158:520–4 https://www.helsedirektoratet.no/referanse/0002-0013-232337
350. Hämäläinen H, Rönnemaa T, Toikka T, Liukkonen I. Longterm effects of one year of intensified podiatric activities on foot-care knowledge and self-care habits in patients with diabetes. The Diabetes Educator 1998;24(6):734–40 https://www.helsedirektoratet.no/referanse/0002-0013-232338
Sist faglig oppdatert: 14.09.2016
Trykkavlastning og risiko for fotsår
Det foreslås at pasienter med moderat eller høy risiko for å utvikle fotsår får individuelt tilpassede fotsenger - eller sko i tilfeller der terapeutiske fotsenger ikke er tilstrekkelig
Praktisk – slik kan anbefalingen følges
- Pasientene må stratifiseres inn i risikogrupper for fotsår (lav, moderat, høy risiko, eksisterende fotsår) for eksempel ved bruk av "SIGN"-systemet . Se egen anbefaling.
- Pasienter med nevropati har moderat eller høy risiko for å utvikle fotsår og må bli informert om sine rettigheter til dekning av fotsenger
- En spesialist i indremedisin, ortopedi, nevrologi eller fysikalsk medisin må fylle ut rekvisisjon til slike fotsenger
- Pasientene og behandlere må informeres om at trykkavlastende fottøy ikke nødvendigvis vil passe perfekt etter første tilpasning. Noen ganger kreves det flere tilpasninger i starten for å oppnå perfekt fasong
- Prefabrikkerte terapeutiske sko er ikke en erstatning for spesialsydde ortopediske sko som er nødvendig ved uttalte deformiteter.
- Tradisjonelle vernesko er ikke trykkavlastende og må lages eller tilpasses av ortopeditekniker
- Trykkavlastning av fotsår er en spesialistoppgave
Fotsengene vil slites ut etter hvert og en forventer at fotsenger må fornyes to ganger årlig ved vanlig bruk.
Begrunnelse – dette er anbefalingen basert på
Trykkavlastende såler
Kvaliteten av de fleste studiene som undersøker effekten av fotsenger hos pasienter med diabetes er for det meste av svak kvalitet eller studiene har få deltakere. Noen av studiene bruker spesielle fotsenger som ikke er tilgjengelig overalt eller til og med er spesial laget for akkurat den ene studien.
Studien som vi fant mest representativ (Ulbrecht JS,2014) viste en over tre ganger øket risiko for fotsår i kontrollgruppen vs. de som fikk trykkavlastende såler. Studien inkluderer kun pasienter som allerede har hatt sår tidligere (altså ikke nødvendigvis en gruppe som er representativ for alle personer med diabetes med moderat til høy risiko for å utvikle sår. Vi kan derfor bare komme med en svak anbefaling for bruk av individuell tilpassete fotsenger for personer med diabetes med moderat til høy risiko for utvikling av fotsår.
Trykkavlastende sko
Det finnes få RCT studier av god kvalitet. Noen av studiene brukte spesielle terapeutiske sko som ikke er tilgjengelig overalt eller spesiallaget for studien. Det er stor forskjell i hvilke materialer som er brukt i skoene og type og fasonger av fotsengene og skosåler.
Den eneste RCTen med et høyt antall inkluderte pasienter og adekvat studiedesign (Reiber GE, 2002) viste ikke signifikant forskjell på utvikling av fotsår mellom personer med diabetes behandlet med terapeutiske sko og vanlige sko. Pasientene i denne studien hadde tidligere fotsår og representerte dermed en høyrisiko gruppe. Når vi allikevel svakt anbefaler bruk skyldes det klinisk inntrykk av effekt.
Forskningsgrunnlag
Populasjon (P): Personer med diabetes og tidligere fotsår eller økt risiko for å utvikle fotsår med fasongforandringer i foten der terapeutiske fotsenger alene ikke er tilstrekkelig
Tiltak (I): Prefabrikkerte ortopediske sko
Sammenligning (C): Vanlig skotøy
Beskrivelse av inkluderte studier
Den eneste RCT med et relativt høyt antall deltagere og adekvat studiedesign (Reiber GE, 2002) viste ikke signifikant forskjell i utvikling av fotsår mellom personer med diabetes behandlet med terapeutiske sko og vanlige sko. Pasientene i denne studien hadde en sykehistorie med tidligere fotsår og representerer dermed en høyrisiko gruppe. I løpet av to år var insidensen av nye fotsår i intervensjonsgruppene 14,5% og i kontrollgruppen 17%. I «intent-to-treat" analysen hadde pasientene i gruppen med terapeutiske sko ikke noen lavere risiko for utvikling av fotsår sammenlignet med kontrollgruppen RR for terapeutisk sko type1, 0.88; 95% konfidensinterval [CI], 0.51-1.52 og RR for terapeutisk sko type 2, 0.85; 95% CI, 0.48-1.48).
Maciejewski ML, 2004 viser til at RR i alle studier som evaluerte sammenheng mellom terapeutiske sko og residiv av fotsår var under 1.0, som tyder på en viss beskyttende effekt av terapeutiske sko. Dette gjelder imidlertid en spesielt utsatt pasient gruppe: Personer med diabetes med tidligere fotsår, og er ikke nødvendigvis representative for alle med moderat til høy risiko for fotsår.
Det finnes få RCT studier av god kvalitet. Noen av studiene brukte spesielle terapeutiske sko som ikke er tilgjengelige overalt eller var spesiallaget for studien. Det er stor forskjell i materialbruk i skoene og type og fasonger av fotsengene og skosåler. Dette vanskeliggjør generelle anbefalinger.
Utfra dagens kunnskapsnivå er evidensen svak for bruk av terapeutiske sko hos pasienter i høyrisikogruppen, med tidligere fotsår, med fotdeformiteter eller amputasjoner på fotnivå. Det finnes ikke evidens for bruk av terapeutiske sko hos pasienter med bare moderat risiko for utvikling av fotsår.
Som ved bruk av terapeutiske fotsenger finner man flere studier som beskriver lav compliance for bruk av terapeutiske sko. I en nederlandsk undersøkelse viste Waaijmann R, 2013 at compliance til bruk av individuelt tilpasset fottøy hos personer med diabetes med høy risiko for fotsår var 28-62%.
Vurdering
Fordeler og ulemper
Fordelen er at det sannsynligvis minsker risikoen for fotsår. Det er lite ulemper forbundet for pasienten med tilpasning av trykkavlastende såler eller sko. Først og fremst kan det være et logistisk problem. I Norge må rekvisisjon for slike ortopediske hjelpemidler fylles ut av spesialist i indremedisin, ortopedi, fysikalsk medisin eller nevrologi. Dette kan medføre ventetid for en poliklinisk konsultasjon hos tilsvarende spesialist. Pasienten må også reise til et ortopedisk teknisk verksted for å få tilpasset sålene eller skoene.
Kvalitet på dokumentasjonen
Trykkavlastende såler: Vi har moderat tiltro til kvaliteten på evidensen for bruk av individuelt tilpasset fotsenger hos pasienter med diabetes med tidligere fotsår.
Vi har mindre tiltro til effekten av individuelt tilpassete fotsenger hos pasienter med moderat risiko for fotsår og pasienter med høy risiko for fotsår, men som ikke har hatt sår tidligere (Ulbrecht JS, 2014).
Trykkavlastende sko: Vi har svak tiltro til kvalitet på evidensen for bruk av terapeutiske sko hos pasienter med diabetes med tidligere fotsår/høy risiko for utvikling av fotsår. Dette gjelder prefabrikkerte terapeutiske sko og ikke individuelt sydde ("custom-made") terapeutiske sko som ikke er vurdert.
Vi har mindre tiltro til effekten av terapeutiske sko hos pasienter med moderat risiko for fotsår og pasienter med høy risiko for fotsår (men som ikke har hatt sår tidligere, har vesentlig fot deformitet eller er tidligere amputert i fotnivå).
Verdier og preferanser
Trykkavlastende såler: Erfaringen fra den kliniske hverdagen viser at pasientene oftest er positivt innstilt til å få tilpasset slike fotsenger. Mange pasienter er opptatt av at fotsengene lett kan flyttes mellom forskjellige par sko. Compliance over tid er imidlertid sannsynligvis relativ dårlig.
Det er få ulemper. De må rekvireres av spesialist og ofte tilpasses underveis og fornyes. De har høy kostnad.
Trykkavlastende sko: Klinisk erfaring viser at pasientene som oftest er positivt innstilt til å få tilpasset terapeutiske sko. Kvinnelige pasienter er ofte opptatt av estetikken av slike sko og beskriver ofte at de opplever at skoene er brede å se på. Compliance over tid antas å være relativ lav.
Referanser
351. Reiber GE, Smith DG, Wallace C, Sullivan K, Hayes S, Vath C, Maciejewski ML, Yu O, Heagerty PJ, LeMaster J. Effect of therapeutic footwear on foot reulceration in patients with diabetes: a randomized controlled trial. JAMA. 2002 May 15;287(19):2552-8 https://www.helsedirektoratet.no/referanse/0002-0013-232339
352. Murray HJ, Young MJ, Hollis S, Boulton AJ. The association between callus formation, high pressures and neuropathy in diabetic foot ulceration. Diabet Med. 1996 Nov;13(11):979-82 https://www.helsedirektoratet.no/referanse/0002-0013-232340
353. Waaijman R, Keukenkamp R, de Haart M, Polomski WP, Nollet F, Bus SA. Adherence to wearing prescription custommade footwear in patients with diabetes at high risk for plantar footulceration. Diabetes Care. 2013 Jun;36(6):1613-8. doi: 10.2337/dc12-1330 https://www.helsedirektoratet.no/referanse/0002-0013-232341
Sist faglig oppdatert: 14.09.2016
Henvisning og oppfølging av diabetiske fotsår i multidisiplinært fotsårteam
En pasient med diabetes bør henvises raskt til spesialisthelsetjenesten dersom:
- pasienten har sår med infeksjon, eller sår kombinert med iskemi eller nevropati
- pasienten har hatt fotsår tidligere og har fått sår på nytt
Pasienter med diabetes, men uten disse risikofaktorene bør henvises til spesialisthelsetjenesten dersom de har hatt sår nedenfor ankelleddet med varighet mer enn 3 uker.
Det anbefales at behandlingen av diabetiske fotsår blir organisert i multidisiplinære team i spesialisthelsetjenesten.
Praktisk – slik kan anbefalingen følges
Det anbefales at behandlingen av diabetiske fotsår blir organisert i multidisiplinære team i spesialisthelsetjenesten.
Henvisningsrutine
Følgende kompliserende faktorer taler for en rask henvisning (for eksempel konfereres samme dag med spesialisthelsetjenesten når såret er oppdaget):
- Mistanke om infeksjon
- Mistanke om iskemi (ikke følbar puls i art. dors. pedis eller art. tibialis post. eller nekrose)
- Stort eller dypt sår
- Tidligere amputasjon eller fotsår
- Betydelig komorbiditet
- Nevropati
- Fotdeformiteter
Andre diabetiske fotproblemer (uten sår) som bør vurderes raskt i spesialisthelsetjenesten:
- Mistanke om Charcot fot (en varm, rød, hoven fot (ofte midtfot) med eller uten smerte).
- Ved alvorlig infeksjon eller infeksjon som sprer seg, samt ved kritisk iskemi i u.ex bør pasienten innlegges akutt.
Det bør være lav terskel blant allmennlegene for å konferere med spesialisthelsetjenesten angående fotproblemer hos høyrisikopasienter. Ved behov tilbys raskt time (i løpet av et par dager, raskere ved mistanke om infeksjon/iskemi). Det bør oppmuntres til telemedisinske løsninger for konferering.
Alvorlighetsgraden av fotsår kan ofte feiloppfattes/undervurderes.
Hos pasienter med nevropati er et sår ofte smertefritt. I en følelsesløs fot på grunn av nevropati kan et sår utvikle seg og bli alvorlig før pasienten identifiserer såret. Et sår som ser lite ut på overflaten kan være dypt eller underminert. En pasient med perifer karsykdom kan ha et infisert sår uten rødhet, og diabetespasienter vil sjelden ha CRP-stigning eller feber ved infeksjon i foten.
Bare halvparten av infeksjoner i diabetesfoten har klassiske infeksjonstegn (Edmonds M, 2006), da nevropati og iskemi begge kan hemme betennelsesprosessen som normalt oppstår i infiserte sår.
Infeksjon mistenkes når:
- Foten har minst to tegn/symptomer på betennelse (varme, rubor, hevelse, ømhet/smerte) eller purulent sekresjon.
- Underminerte sår, nekrose og vond lukt kan også være infeksjonstegn.
- Forverring av glykemisk kontroll.
- Man bør mistenke osteomyelitt i et sår som er infisert, dypt eller stort, spesielt hvis såret er kronisk eller det sonderes inn til ben.
For spesialisthelsetjenesten
Alle Helseforetak bør ha en plan/prosedyre for behandling av diabetiske fotsår og for organiseringen av denne behandlingen.
Behandlingsprinsippene ved diabetisk fotsår i spesialisthelsetjenesten:
- Revisjon av såret, fjern hard hud, rene sårkanter
- Antibiotika p.o. eller i.v. dekning rettet mot gule stafylokokker og/eller betahemolytiske streptokokker vil være tilstrekkelig. Se Helsedirektoratets "Retningslinje for antibiotikabehandling i sykehus".
- Re-etabler god blodsirkulasjon
- Trykkavlastning (såler, sko, filt, silikon, ortose, gips, krykker, rullestol)
- Oppnå blodsukkermål
- Røykestopp
- Vurder lipidsenkende behandling
Begrunnelse – dette er anbefalingen basert på
Livstidsprevalensen for fotsår er 15-25%. Ca 85 % av (ikke-traumatiske) amputasjoner hos diabetespasienter kommer som en følge av forutgående fotsår. I 2014 var det 413 amputasjoner hos personer med diabetes i Norge. Diabetiske fotsår er et komplekst og alvorlig problem som krever omfattende og koordinert behandling fra forskjellige faggrupper. Istedenfor konsultativ bistand, kan organisering i et team sikre bedre kommunikasjon, mindre forsinkelser og en mer strømlinjeformet og effektiv behandling. Behandlingen kan skje poliklinisk eller ved innleggelser avhengig av alvorlighetsgrad. Mange studier har vist stor effekt av strukturerte organiserte team bak fotsårbehandlingen, men disse studiene er alle av dårlig kvalitet. Til tross for at studiene er av dårlig kvalitet har de konsistent vist minsket frekvens av kritiske utfall som mortalitet og amputasjoner i land som er sammenlignbare med norske forhold.
Alvorlighetsgraden til diabetiske fotsår kan være vanskelig å vurdere. Flere studier antyder en assosiasjon mellom varighet av såret ved henvisning og det kliniske resultatet (Margolis DJ, 2002 og Ince P, 2007). Forsinkelser i henvisinger kan således være en risikofaktor for amputasjon (Jeffcoat WJ, 2004). Tidlig behandling i kompetent fotteam kan bedre prognosen betraktelig. Vi anbefaler derfor en lav terskel for å henvise/konferere med spesialisthelsetjenesten om nyoppdagede diabetiske fotsår.
Forskningsgrunnlag
Populasjon (P): Diabetespasienter med sår under ankelleddet
Tiltak (I): Behandling i multidisiplinære fotteam
Sammenligning (C): Vanlig behandling
Beskrivelse av inkluderte studier
Relevante internasjonale retningslinjer på området (NICE, svenske, danske, kanadiske retningslinjer, International Working Group on the Diabetic Foot 2011, ADA position statement 2016) anbefaler at behandling av diabetiske fotsår foregår i multidisiplinære team.
Evidensprofilen er basert på en observasjonsstudie fra Weck M, 2013 og utfallene mortalitet, major amputasjon, minor amputasjon, sårtilheling under sykehusopphold. Studien hadde 1192 pasienter. Det ble sammenlignet strukturert versus standard behandling av diabetisk fot. De fant en signifikant reduksjon i amputasjoner over ankelleddet på mer en 75 % sammenlignet med standard behandling. For dette utfallet og for mortalitet var det færre enn 300 hendelser, men p- verdien er for begge utfallene <0,00001 og konfidensintervallene smale. Vi har derfor tiltro til effektestimatene som er rapportert.
I tillegg har vi vurdert NICE sin anbefaling om multidisiplinær behandling av fotsår der fem studier inngikk fra 1995-2008 (se GRADE-profil nederst på siden). Denne anbefalingen bygger på studier fra litteratursøk fram til 2009 og vi gjorde et systematisk søk etter nyere studier som kun frambrakte Weck 2013.
De seks kohortstudiene vi tilsammen har vurdert har entydig positiv effekt av intervensjonen, og effektstørrelsene er gjennomgående (meget) høye på kritiske utfall. Vårt samlede kliniske inntrykk støtter opp om dette.
Mortalitet under sykehusopphold (Weck): RR: 0,26 (0,15 – 0,45) (kun 17 hendelser i intervensjonsgruppen og 48 i kontrollgruppen).
Major and minor amputasjon (Weck og NICE): Alle 6 studier viser gode effekter på reduksjon av amputasjoner. Effektstørrelsene ligger alle mellom en halvering til en femdeling av risikoen for amputasjon for pasientene som fikk behandling av et multidisiplinært team.
Sårresidiv (Dargis V, 1999): 30,4 % av pasientene behandlet i multidisiplinært team fikk residiv av sår, mot 58,4% av pasientene i kontrollgruppen.
Sårtilheling i løpet av sykehusopphold (Weck): RR: 1,23 (95% KI 1,01, 1,50).
Et problem med studiene sett under ett, er at det ikke er en entydig definisjon på hva slags intervensjon et multidisiplinært team er. Det er variasjoner både i nivå i helsetjenesten, i struktur og sammensetning av fagfolk, i vektlegging av forskjellige behandlingsmetoder, samt i algoritmer/protokoller for evaluering av såret og for selve behandlingen. Studiene er enten retrospektive eller prospektive kohortstudier. Randomisering ville trolig vært meget vanskelig og kanskje uetisk.
Fellestrekket mellom intervensjonene er likevel at de multidisiplinært teamene har medlemmer fra forskjellige profesjoner/spesialiteter og at de er tettere knyttet sammen enn ved et sårsenter. Likeledes at det i teamet finnes både medisinsk og kirurgisk kompetanse.
Henvisning til multidisiplinære sårteam: Vi fant ingen studier som undersøker om henvisning på et spesielt tidspunkt eller ved spesielle karakteristika ved såret, gir bedre resultater. Vi har således ingen egen GRADE-evaluert litteratur som belyser dette spørsmålet. I utarbeidelsen av anbefalingen har vi støttet oss til annen litteratur og retningslinjer. En rekke observasjonsstudier av veldig lav kvalitet viser stor effekt av behandling i multidisiplinære team. Mange observasjonsstudier har også kartlagt hvilke faktorer ved sår/pasient som predikerer dårligere utfall.
Forsinket henvisning: Relevante internasjonale retningslinjer som American Diabetes Association (ADA) (ADA, 2015) understreker at pasienter med diabetiske fotsår bør komme raskt til behandling. Studier (Prompers L, 2007 og Margolis DJ, 2002) tyder på at det er vanlig med forsinkelser i henvisning til fotteam. Ofte kan dette være pga undervurdering av sårets alvorlighetsgrad (infeksjon, iskemi), vanligvis pga fravær av smerte, at såret ikke er så stort (<1 cm2), eller fravær av klassiske infeksjonstegn. Gjennomgående i litteraturen (Prompers L, 2007, Margolis DJ, 2002, Ince P, 2007, Jeffcoat WJ, 2004) angis det at pasientene ofte ikke henvises til strukturert behandling før skaden forverres eller egen behandling (bandasjer og antibiotika) ikke gir resultater.
Det er ingen studier av henvisningsmønsteret i Norge. I en europeisk multisenterstudie (Prompers L, 2007) kom 27 % til fotteam med mer enn 3 mnd gammelt sår (store forskjeller internt). Den kliniske erfaringen i arbeidsgruppa samsvarer med internasjonale studier.
[Ca] = Canavan et al. (2008): key components = Organized Diabetes Foot Care compared to standard care (composition of the organised care not described).
[Cr] = Crane et al. (1999): key components = Critical pathway approach to diabetic foot infections compared to standard care (the pathway was initiated in the emergency department utilizing committee-approved standing physician's orders and clinical progress records to facilitate transitions between departments).
[D] = Dargis et al. (1999): key components = Multidisciplinary approach compared to standard care (the multidisciplinary team staffed by a diabetologist, a rehabilitation physician, a podiatrist, orthopaedic, surgeons, and shoemakers).
[Dr] = Driver et al. (2005): key components = Multidisciplinary Foot Care (Limb Preservation Service Model) compared to standard care (services included prevention and education, wound care, infection management, surgical and hospital management, research and grant development, community and regional education, and the creation of orthotics, prosthetics, and shoes).
[L] = Larsson et al. (1995): key components = Multidisciplinary Foot Care Team Approach compared to standard care (the team consisting of a diabetologist and an orthopaedic surgeon assisted by a diabetes nurse, a podiatrist, and an orthotist and working in close cooperation with the Department of vascular surgery and the Department of infectious diseases. A programme for patient and staff education was also started).
NK = not known
- Pre- and post- design with historical control
- Small sample
- Unable to assess as sample of historical control group unknown
- Actual number unknown, only reported participants treated prior to 1983
- Simple uncontrolled trend analysis over 5 years period
- Unable to assess
- Actual number unknown, not reported
Vurdering
Fordeler og ulemper
Multidisiplinære team har vist seg å redusere mortalitet og amputasjoner hos diabetespasienter med fotsår. I den nyeste (og største) studien (Weck M, 2013) var det en nesten fem ganger så høy amputasjonsrate i kontrollgruppen sammenlignet med de som ble behandlet i multidisiplinært team (RR 0,22, KI 0.15-0.31).
For mortalitet i løpet av sykehusoppholdet var det nesten fire ganger flere som døde i kontrollgruppen sammenlignet med de som fikk behandling i et multidisiplinært team (RR 0,26, KI 0.15-0.45).
I tillegg til effektene på tilheling og amputasjonsfrekvens, vil slike team gi bedre koordinering (medisinsk/kirurgisk) og for klinikerne god faglig støtte. Samtidig vil dette gi bedre ressursutnytting siden et stort antall nye/alternative behandlingsmetoder forutsetter erfaring og kompetanse.
For pasientene er det ingen klare ulemper slik vi ser det. Ved en eventuell sentralisering av teamene vil det imidlertid bli lengre reisevei for en del av pasientene.
Kvalitet på dokumentasjonen
For spørsmålet hvordan man bør organisere behandlingen av fotsår i spesialisthelsetjenesten har vi vurdert en observasjonsstudie (Weck M, 2013) og NICEs anbefaling for tverrfaglig oppfølging av diabetisk fot (NICE, 2015). Weck rapporterer stor effekt av multidisiplinær behandling av fotsår relatert til mortalitet og amputasjoner over ankelleddet. Resultatene er signifikante og konfidensintervallet smalt, til tross for at det er relativt få events (totalt 65 dødsfall og 142 store amputasjoner). Vi mener studien er godt gjennomført og appliserbar til norske forhold. NICE har vurdert kvaliteten på sine inkluderte studier som svært lav, hovedsakelig pga manglende data, men resultatene stemmer godt overens med hva Weck fant.
Vi fant ingen studier som undersøker om henvisning på et spesielt tidspunkt eller ved spesielle karakteristika ved såret, gir bedre resultater. Vi har således ingen egen GRADE-evaluert litteratur som belyser dette spørsmålet. Mange observasjonsstudier har derimot kartlagt hvilke faktorer ved sår/pasient som predikerer dårligere utfall. I utarbeidelsen av anbefalingen om henvisningsrutiner har vi støttet oss denne litteraturen og til andre retningslinjer.
Verdier og preferanser
Poliklinisk behandling er krevende for pasienter med lang reisevei. Vi antar at fordelen med spesialisert behandling oppveier mulige ulemper.
Referanser
354. Foot Care for People with Diabetes: The Economic Case for Change. https://www.helsedirektoratet.no/referanse/0002-0013-232342
355. NICE guidelines [CG119] Diabetic foot problems: Inpatient management of diabetic foot problems 2011 https://www.helsedirektoratet.no/referanse/0002-0013-232343
356. Edmonds M, Foster AVM. ABC of wound healing. Diabetic foot ulcers. Br Med J 2006;332: 407–10 https://www.helsedirektoratet.no/referanse/0002-0013-232344
357. The association between baseline characteristics and the outcome of foot lesions in a UK population with diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232345
358. Margolis DJ, Allen-Taylor L, Hoffstad O, Berlin JA. Diabetic neuropathic foot ulcers: the association of wound size, duration, and wound grade on healing. Diabetes Care 2002; 25: 1835–1839. PMID: 12351487 https://www.helsedirektoratet.no/referanse/0002-0013-232346
359. Jeffcoate WJ, van Houtum WH. Amputation as a marker of the quality of foot care in diabetes. Diabetologia 2004;47: 2051–2058. PMID:15662547 https://www.helsedirektoratet.no/referanse/0002-0013-232347
360. Prompers L, Huijberts M, Apelqvist J, Jude E, Piaggesi A, Bakker K et al. High prevalence of ischaemia, infection and serious comorbidity in patients with diabetic foot disease in Europe. Baseline results from the Eurodiale study. Diabetologia. 2007 Jan;50(1):18-25 https://www.helsedirektoratet.no/referanse/0002-0013-232348
361. Microvascular complications and foot care https://www.helsedirektoratet.no/referanse/0002-0013-232349
Sist faglig oppdatert: 14.09.2016
Legemidler til behandling av smertefull diabetisk nevropati
- Amitriptyline (trisyklisk antidepressivum, TCA) vurderes som førstevalg ved behandling av smertefull diabetisk nevropati.
- Ved kontraindikasjoner eller bivirkninger av amitriptylin kan duloksetin (selektiv noradrenalinreopptakshemmer, SNRI) forsøkes.
- Ved manglende effekt av amitriptylin og/eller duloksetin eller bivirkning av disse, vurderes (tillegg av) gabapentin, eventuelt pregabalin. Gabapentin og pregabalin bør ikke kombineres.
- Ved kombinasjon av legemidler bør det vurderes å redusere dosene på grunn av fare for bivirkninger
Praktisk – slik kan anbefalingen følges
- Smertefull nevropati og ingen kontraindikasjoner: Start med amitriptylin (N06AA09) (TCA) monoterapi
- Ved kontraindikasjoner eller manglende effekt: Start med duloksetin (N06AX21) (SNRI) monoterapi
- Ved manglende effekt: Legg til gabapentin (N03AX12)
- Ved manglende effekt av TCA+gabapentin eller SNRI+gabapentin kan man forsøksvis erstatte en av disse med kortvarig tramadol (N02AX02) retardbehandling. Pasienten bør da henvises til smerteteam.
Bivirkninger ved bruk av smertelindrende legemidler vil ofte kunne oppfattes som mer akseptable, fordi man samtidig merker effekt (mindre smerter).
Amitriptylin
- Det anbefales å starte med en lav dose amytriptylin f.eks 10 mg, og deretter øke denne etter behov for eksempel med 10 mg hver 3. dag og til smertelindring eller opp til høyeste tolerable dose oftest rundt 50 mg.
- Kveldsdosering en til to timer før leggetid er mest praktisk, da dette kan gi en gunstig effekt på søvn, og mindre tretthet på formiddag.
- Kontraindikasjoner er: Ortostatisme, hjerte-arytmier, gastroparese og prostatisme. Amitriptylin må brukes med forsiktighet hos eldre (pga kraftig sedativ og anti-kolinerg effekt, med fare for bla kognitiv svikt, delir og fall). Lavere doser og forsiktigere opptrapping anbefales derfor.
Duloksetin
- Kontraindikasjoner: Ukontrollert glaukom, alvorlig nyre – eller leversvikt, ukontrollert hypertensjon og blødningstendens.
- Hyppigste bivirkningene, ca 15 % opplever bivirkninger: tørr munn, svimmelhet, somnolens, kvalme og forstoppelse.
- Det er anbefalt å starte rett på vedlikeholdsdosen – 60 mg. Hos et fåtall, særlig deprimerte, kan den høyeste dosen (120 mg) forsøkes.
Gabapentin
Gabapentin titreres gradvis opp til effektiv smertelindring eller til høyeste tolerable dose. Dosen bør deles opp, slik at den gis 2-3 ganger daglig. For detaljert titreringsplan vises til Felleskatalogen. Pasienten bør følges opp regelmessig under opptitreringen. Ved nyresvikt må maksdosen reduseres. Forsiktighet må utvises i forbindelse med bilkjøring og betjening av maskiner. Bråseponering av gabapentin bør unngås, da dette kan utløse epileptisk anfall. Ved tidlige tegn til overfølsomhet, slik som feber, utslett og hovne lymfeknuter bør medikamentet seponeres, da utvikling av Stevens-Johnson og DRESS syndrom er beskrevet.
Pregabalin
Pregabalin (N03AX16) titreres gradvis opp til effektiv smertelindring eller til høyeste tolerable dose. Dosen bør deles opp, slik at den gis 2 (eventuelt 3) ganger daglig. For detaljert titreringsplan vises til Felleskatalogen. Ved nyresvikt må maksdosen reduseres. Forsiktighet må utvises i forbindelse med bilkjøring og betjening av maskiner. Bråseponering av pregabalin bør unngås, da det er beskrevet hjerneødem og encefalopati (Javed S et al). Hypersensitivitetsreaksjoner er beskrevet, inkludert angioødem. Kongestiv hjertesvikt er observert hos eldre pasienter med smertefull nevropati som har fått pregabalin, og medikamentet bør derfor brukes med forsiktighet hos denne pasientgruppen. Langtidsbruk er også assosiert med vektøkning hos enkelte pasienter. Justering av blodsukkersenkende behandling kan bli nødvendig. God informasjon i forkant, og kost- og livsstilstiltak kan muligens redusere risiko for slik vektøkning. Pregabalin bør gis med forsiktighet i kombinasjon med opiater, da det er en additiv øket risiko for forstoppelse og ileus.
Pregabalin er tilknyttet risiko for skadelig bruk. Særlig forsiktighet må utvises ved bruk hos personer med kjent avhengighetsproblematikk, eller dersom det fremkommer symptomer som kan tyde på misbruk.
Venlafaksin: Det finnes lite evidens som støtter bruk av venlafaksin mot nevropatiske smerter som vist i en Cochranestudie (Gallagher HC, 2015). Gruppen har derfor ikke foretatt en vurdering av dette medikamentet.
Begrunnelse – dette er anbefalingen basert på
Det er ikke stor forskjell i effekt mellom de ulike legemidlene, men det er en del forskjell i pris, anvendbarhet og bivirkninger. Vurderinger av dette ligger til grunn for anbefalingen.
Amitriptylin
Gruppen ender med en svak anbefaling for å bruke amitriptylin til behandling av smertefull nevropati. Evidensen for effekt er av lav kvalitet, men til gjengjeld foreligger det en utstrakt klinisk erfaring med bruk av legemiddelet gjennom mange år. Det foreligger ingen evidens på manglende effekt av amitriptylin, og heller ikke evidens som tyder på at amitriptylin har sterkere eller svakere effekt enn SNRI eller antikonvulsiva. Før oppstart er det viktig å være klar over de viktigste bivirkningene og kontraindikasjonene.
Duloksetin
Gruppen ender med en moderat til sterk anbefaling for å bruke SNRI (duloksetin) 60 mg til behandling av smertefull nevropati. Evidensen for effekt vs. placebo er av moderat kvalitet. Det finnes også en svak evidens for at SNRI er mer potent enn antikonvulsiva. Gruppen ser det som positivt at det også finnes studier som viser effekt på livskvalitet. Det er sjelden grunn til å bruke maksdosen, 120 mg. Ca 15 % av pasientene opplever bivirkninger grunnet SNRI, noe som er lavere enn for TCA, men vi mangler langtidserfaring med SNRI. Før oppstart er det viktig å være klar over kontraindikasjonene (ukontrollert glaukom, alvorlig nyre – eller leversvikt, ukontrollert hypertensjon og blødningstendens).
Gabapentin
Gruppen ender med en svak anbefaling for å bruke gabapentin til behandling av smertefull nevropati. Evidensen mtp. effekt er av moderat kvalitet, men det trekker ned at behandlingen er dyr og krever omfattende dosetitrering. Det foreligger ingen evidens for sterkere eller svakere effekt enn TCA, men mulig dårligere enn SNRI. Forholdet mellom effekt og bivirkninger er likevel i en meta-analyse anslått å være gunstigere enn andre aktuelle legemidler. Flertallet av pasientene opplevde minst én bivirkning, og det er viktig å være klar over bivirkningsprofilen før oppstart.
Pregabalin
Gruppen ender med en svak anbefaling for å bruke pregabalin til behandling av smertefull nevropati. Evidensen for effekt vs. placebo er god, men den høyeste dosen må ofte benyttes for effekt. Bivirkninger er hyppige, og det er i tillegg angitt et visst potensial for avhengighet. Det er vist i en meta-analyse at pregabalin har en mindre potent smertestillende effekt enn SNRI, men her er evidensen svak. I høyeste dose er legemiddelet det klart dyreste alternativet.
Se også Nasjonal faglig veileder for bruk av opioider – ved langvarige ikke-kreftrelaterte smerter
Forskningsgrunnlag
Populasjon (P): Diabetisk nevropati og smerter i føtter
Tiltak (I): TCA
Sammenligning (C): Placebo
Beskrivelse av inkluderte studier
Vurdering
Fordeler og ulemper
Amitritylin: Behandling med amitriptylin er vist å gi en signifikant sannsynlighet for minst 30 % smertereduksjon (NNT 5,9). Vi har dårlige data når det gjelder 50 % smertereduksjon, noe som ville være mer klinisk betydningsfullt for pasient. Amitriptylin er velkjent gjennom mange år, slik at vi har utstrakt klinisk erfaring og kjenner til hvordan effekt og bivirkninger arter seg. De fleste pasienter vil oppleve minst én bivirkning, hyppigst forekommer tørr munn, forstoppelse, somnolens, svimmelhet og palpitasjoner (NNH 4,1). Hos eldre kan amitriptylin gi en kraftig sedativ og anti-kolinerg effekt, med fare for bla kognitiv svikt, delir og fall. Ved bruk hos eldre bør dosen være lavere og trappes forsiktigere opp.
Duloksetin: Behandling med duloksetin 60 eller 120 mg er i relativt korte studier vist å gi en ca 1,5 ganger øket sannsynlighet for minst 50% smertereduksjon sammenlignet med placebo (NNT= 5 etter 12 uker). Dette er regnet for å være en klinisk betydningsfull smertereduksjon. Det er også vist positive effekter både på fysisk (begge doser) og psykisk livskvalitet (kun ved 120 mg). Medikamentet er relativt nytt, og vi har begrenset langtidserfaring. Ca 15 % opplever bivirkninger, hvorav hyppigst forekommende er tørr munn, svimmelhet, somnolens, kvalme og forstoppelse. Bivirkningene er til en viss grad doseavhengige.
Gabapentin: Behandling med ≥ 1200 mg gabapentin er vist å gi en signifikant sannsynlighet for 50 % smertereduksjon, NNT 5,9. Dette er regnet for å være en klinisk betydningsfull grad av smertereduksjon. Det tilsvarende tallet for enhver bivirkning (NNH) var 8,6. De hyppigst forekommende bivirkningene var somnolens (14 %), svimmelhet (19 %), perifere ødemer (7 %) og ataxi/gangvansker (9 %).
Pregabalin: Behandling med 300 og 600 mg pregabalin kan gi minst 50 % smertereduksjon hos enkelte pasienter med smertefull nevropati, NNT hhv. 7,5 og 5,0. Det tilsvarende tallet for enhver bivirkning (NNH) var hhv. 6,6 og 6,1. Det er altså en viss dose-respons mtp. smertelindring, men ikke for bivirkninger. Ved oppstart kreves en opptitreringsperiode, noe som kan være negativt for pasienter som har vansker med å følge en skriftlig titreringsplan. Det vil også kreve flere legebesøk enn medikamenter med en enklere dosering. De hyppigst forekommende bivirkningene var somnolens (5-40 %), svimmelhet (5-38 %), perifere ødemer (4-17 %) og hodepine (2-13 %).
Kvalitet på dokumentasjonen
Amitritylin: Samlet tiltro til effektestimatet er lav på bakgrunn av lav kvalitet på dokumentasjonen. Griebeler ML, 2014 inkluderer 5 RCTer (ukjent antall deltagere), mens Cochrane (Moore RA, 2012) med sine strengere seleksjonskrav ender opp med 2 RCTer og 253 deltagere. Flere studier rapporterer ikke i henhold til "intention to treat", så det er trekk for mulig seleksjonsbias. Videre er studiene kortvarige og av begrenset størrelse.
Duloksetin: Samlet tiltro til effektestimatet for duloksetin vs. placebo er moderat til høy. Cochrane (Lunn MP, 2014) konkluderer med at det ikke er behov for flere studier for å konkludere med effekt. De to meta-analysene (Lunn MP og Griebeler ML, 2014) kommer til et samsvarende resultat, noe som styrker vår tiltro til effektestimatet. Når det gjelder effekt vs TCA og antikonvulsiva er kvaliteten på dokumentasjonen svak, og vi har lav tiltro til effektestimatene. Alle RCT-ene er finansiert av produsenten, noe som kan svekke overordnet tiltro.
Gabapentin: Samlet tiltro til effektestimatet når det gjelder smertelindring vs. placebo er moderat. I negativ retning trekker at det er svært varierende dosering i studiene (600-3600 mg), og at det er flere små studier. Risiko for publikasjonsbias er ukjent/lar seg vanskelig avgjøre. Flere av studiene rapporterer kun på pasienter som fullførte studien og ikke på "intention to treat". Samlet tiltro til effektestimatet når det gjelder smertelindring og bivirkninger vs. annen aktiv behandling er svært lav.
Pregabalin: Samlet tiltro til effektestimatet når det gjelder smertelindring vs. placebo er moderat. I negativ retning trekker at det er
varierende varighet og dosering i studiene , det er suboptimal informasjonsstørrelse noe som gir et upresist konfidensintervall, og at alle
studiene er industrisponset. Én aktuell studie er trukket tilbake pga. forfalskede data (Reuben 2006), og data fra denne er ikke inkludert i
evidensoppsummeringen. I følge Cochrane-rapporten kan det også i inkluderte studier ha forekommet seleksjon av studiedeltagerer, slik at de med forutgående erkjent dårlig effekt av Pregabalin ikke ble inkluderte, og motsatt hos pasienter med kjent god effekt av medikamentet. Grad av seleksjonsbias lar seg vanskelig estimere. Samlet tiltro til effektestimatet når det gjelder smertelindring og bivirkninger vs. annen aktiv behandling er svært lav.
Verdier og preferanser
Amitriptylin: Utstrakt erfaring med medikamentgruppen er viktig for mange pasienter, og kan gjøre at mange vil foretrekke amitriptylin. For pasienter med dårlig søvn kan amitriptylin i tillegg gi bedret søvn. I tilfeller med betydelig komorbiditet vil man kanskje foretrekke andre medikamenter (særlig ortostatisme, hjerte-arytmier, gastroparese og prostatisme). Ved amitriptylin kreves opptrapping av dosen, dvs. flere kontroller hos lege enn f.eks ved bruk av SNRI. Bivirkninger ved bruk av smertelindrende medikamenter vil ofte kunne være mer akseptable, fordi man samtidig merker effekt (mindre smerter).
Duloksetin: Medikamentet har en del fordeler som kan øke brukerpreferansen: Det i liten grad nødvendig med dosejustering, og det er vist en gunstig effekt ikke bare på smerter men også livskvalitet ved 120 mg. En ønsket bivirkning kan hos noen pasienter være bedring av urgeinkontinens. Manglende langtidserfaring med medikamentet kan vurderes som negativt for enkelte. Det er færre forsiktighetsregler/kontraindikasjoner mtp. komorbiditeter, men man må være forsiktig hos pasienter med glaukom, alvorlig nyresvikt, ukontrollert hypertensjon og blødningstendens. Et krav for at medikamentet skrives på blå resept er at man har forsøkt amitirptylin uten adekvat effekt, eller at amitriptylin er kontraindisert.
Gabapentin: Omtrent 38 % av pasientene kan forvente minst 50 % smertereduksjon, forutsatt at de når 1200 mg uten for mye bivirkninger. Det tilsvarende tallet for placebobehandling var 21 %. For disse pasientene vil behandlingen være nyttig. Den individuelle balansen mellom effekt og bivirkninger vil være avgjørende for brukerpreferanse. Gabapentin er et velkjent medikament som vi har utstrakt klinisk erfaring med, dette vil kunne telle positivt. Oppstart med gabapentin krever aktiv og hyppig dosetitrering. Erfaringsmessig trenger mange pasienter oppfølging og støtte for å finne riktig balanse mellom virkning/bivirkning. Medikamentet kan gi svimmelhet og gangvansker. Pasienter med øket risiko for fall – eller hvor fall ville kunne få alvorlige konsekvenser – ville kanskje foretrekke annen behandling.
Pregabalin: Smertebehandling ved nevropati er langtidsbehandling. Hvis studier med mindre enn 8 ukers varighet ekskluderes var det kun 38 % av de som fikk 300 mg vs 29% på placebo som oppnådde minst 50% smertereduksjon. For den høyere dosen på 600 mg var det 46% av de med aktiv behandling og 30 % av de som fikk placebo som oppnådde slik smertelindring. I denne dosen var det 3 ganger så mange pasienter som avbrøt behandlingen på grunn av bivirkninger i den aktive gruppen sammenlignet med placebo. Det er liten grad av dose-respons når det gjelder bivirkninger. Bivirkningene viser seg derfor ofte relativt tidlig, slik at behandlingen kan avsluttes. Somnolens og svimmelhet er negativt for pasienter som på denne bakgrunn blir hemmet i sitt arbeide. Den individuelle balansen mellom effekt og bivirkninger vil være avgjørende for brukerpreferanse. Bivirkninger ved bruk av smertelindrende medikamenter vil ofte kunne oppfattes som mer akseptable, fordi man samtidig merker effekt (mindre smerter). Pregabalin er et velkjent medikament som vi har utstrakt klinisk erfaring med, dette vil kunne telle positivt. Oppstart med pregabalin krever aktiv og hyppig dosetitrering, noe som gjør at pasienter som ikke klarer å følge et dosetitreringsskjema på egen hånd vil måtte trenge gjentatte besøk hos behandlende lege. Pregabalin er ikke forhåndsgodkjent for forskrivning på blå resept, det må søkes individuell refusjon.
Referanser
362. Finnerup NB, Attal N, Haroutounian S et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol. 2015 Feb;14(2):162-73. doi: 10.1016/S1474-4422(14)70251-0 https://www.helsedirektoratet.no/referanse/0002-0013-232350
363. Gallagher HC1, Gallagher RM, Butler M, Buggy DJ, Henman MC. Venlafaxine for neuropathic pain in adults.Cochrane Database Syst Rev. 2015 Aug 23;8:CD011091. doi: 10.1002/14651858.CD011091.pub2 https://www.helsedirektoratet.no/referanse/0002-0013-232351
364. Annals of Internal Medicine https://www.helsedirektoratet.no/referanse/0002-0013-232352
365. https://www.helsedirektoratet.no/referanse/0002-0013-232353
366. https://www.helsedirektoratet.no/referanse/0002-0013-232354
Sist faglig oppdatert: 14.09.2016
Nyresykdom ved diabetes
Laboratorieprøver for kontroll av nyrefunksjon (eGFR og u-AKR), henvisning til spesialisthelsetjenesten og forsiktighetsregler ved lav GFR
Sist faglig oppdatert: 20.12.2019
Måling av albuminuri (u-AKR) hos personer med diabetes
- Albuminuri bør diagnostiseres ved å bestemme albumin/kreatinin-ratio (AKR) i urin. To positive analyseresultater er nødvendig for å bekrefte diagnosen.
- Pasienter med diabetes bør undersøkes med måling av u-AKR årlig eventuelt oftere ved mistanke om progressiv sykdom.
Praktisk – slik kan anbefalingen følges
Diabetisk nefropati defineres klinisk ved forekomst av urin albumin/kreatinin-ratio (U-AKR) > 30 mg/mmol). Mistanken forsterkes når pasienten samtidig har retinopati. GFR kan være normal eller nedsatt.
Gradering av albuminuri, målt ved u-AKR
| u-AKR | Albuminutskillelse |
| < 3mg/mmol | Normal albuminutskillelse |
| 3-29mg/mmol | Moderat albuminuri* |
| 30-299 mg/mmol | Betydelig albuminuri** |
| ≥ 300mg/mmol | Nefrotisk proteinuri |
* 3-29 mg/mmol er tidligere benevnt som mikroalbuminuri
** 30-299 mg/mmol er tidligere benevnt som makroalbuminuri
Prøvetakingsprosedyre for å oppfylle kravet til forhøyet albuminutskillelse
Dersom u-AKR måles forhøyet, tas ny prøve innen 3 måneder. Dersom denne også er forhøyet, har pasienten forhøyet u-AKR. Dersom prøve nr 2 har normal albuminutskillelse tas prøve nr 3. Hvis 2 av 3 prøver har forhøyet u-AKR, har pasienten forhøyet u-AKR. Akuttfase og urinveisinfeksjon må utelukkes og kraftig fysisk aktivitet må unngås 3 døgn før testing.
En systematisk oversiktsartikkel (McTaggart et al., 2014) viser at kvantitativ AKR måling vha POC instrument har sensitivitet og spesifisitet for albuminuri på 96 og 98% sammenlignet med AKR målinger gjort på sykehuslaboratorium. Sensitiviteten og spesifisiteten ved bruk av semikvantitative metoder var betydelig dårligere (hhv 76 og 93%) og slike metoder anbefales derfor ikke.
Utskillelsen av albumin i urin kan kvantiteres ved ulike prosedyrer. Tidligere ble ofte ulike urinsamlinger anbefalt (4-24 timer), mens i dag anbefaler de aller fleste retningslinjer at man skal kvantitere AKR i en spotprøve tatt om morgenen. Bruk av morgenurin kan være tungvint, og tilfeldig urin kan benyttes som alternativ.
Ved tolkning av resultater vil grensene variere noe mellom laboratorier pga bruk av ulike metoder, men som tommelfingerregel kan man si at AKR verdier ≥ 3 mg/mmol kreatinin regnes som moderat albuminuri mens verdier ≥ 30 mg/mmol kreatinin regnes som betydelig albuminuri. Enkelte pasientnære apparater på legekontor kvantiterer ikke AKR over en viss terskelverdi, de viser kun en verdi «større enn»: det vil si >. I slike tilfeller bør man sende inn prøven til et sentrallaboratorium for en nøyaktig verdibestemmelse.
Ved tolkning av flere påfølgende resultater bør man være klar over at utskillelse av albumin i urin viser stor biologisk variasjon. Dette medfører at påfølgende resultater hos et individ kan variere med 100–200 % uten at dette nødvendigvis betyr noen endring i pasientens kliniske tilstand. Denne naturlige variasjonen er typisk mest uttalt ved lave og lett forhøyede verdier. Denne naturlige variasjonen er bakgrunnen for at det anbefales å ta flere prøver på forskjellige dager, særlig dersom albuminutskillelsen bare er lett forhøyet.
Nærmere råd for oppfølging av pasienter med nyreskade er gitt i anbefalingene Henvisning av pasienter med nyreskade til nefrolog og Oppfølging av pasienter med lav GFR for å redusere risiko for kardiovaskulær sykdom - "Vær varsom"-plakaten
Begrunnelse – dette er anbefalingen basert på
Økt albuminutskillelse i urinen (albuminuri) er et tidlig tegn på nyreskade (nefropati) og en risikomarkør for hjerte- og kar sykdom. Kvantitering av AKR brukes derfor både som et diagnostikum (diabetisk nefropati eller annen nyresykdom) og som mål på progresjon av nyreskade (økende albuminuri).
Ved diabetes nefropati opptrer ofte økning i albuminutskillelse samtidig med utvikling av diabetisk retinopati eller andre tegn på mikrovaskulære komplikasjoner. Ved fravær av retinopati bør annen årsak til nyreskade vurderes, spesielt ved diabetes type 2. Nivået av albuminuri (høyt eller lavt) er et viktig prognostisk tegn på utvikling i nyreskaden.
Forskningsgrunnlag
Populasjon (P): Personer med diabetes
Tiltak (I): Måling av albumin-kreatinin ratio i urin
Sammenligning (C): 24-timers albumin-utskillelse i urin
Beskrivelse av inkluderte studier
Det er ikke utført randomiserte undersøkelser som direkte sammenligner ulike metoder å bestemme urin albuminutskillelse på (f.eks. bruk av spoturin vs. samleurin) for prediksjon av fremtidig sykdom (nyresykdom, hjerte-karsykdom).
En større systematisk oversiktsartikkel publisert i 2004 (Ewald et al 2004) har undersøkt samsvaret mellom urinsamlinger og spotprøver (AKR eller konsentrasjonsmåling av urin-albumin i morgenurin) for diabetespasienter i allmennpraksis; totalt 10 studier ble inkludert. Effektmålet var diagnostisk odds ratio (sanne positive x sanne negative / falske negative x falske positive). Man fant en høy DOR (ca. 90), noe som betyr at AKR i spotprøver er en effektiv metode sammenlignet med urinsamlinger. Sensitivitet og spesifisitet for diagnosen albuminuri var > 80% i de fleste studier, men poolede data for dette er ikke gitt.
En annen stor systematisk oversiktsartikkel (Wu et al 2014) har sammenlignet vanlige konsentrasjonsmålinger (mg/L) og AKR (mg/mmol kreatinin) i tilfeldige urinprøver mot 24 timers urinsamlinger (gullstandard) mtp effektivitet ved screening for albuminuri hos pasienter med diabetes. 14 studier (n=2078) ble inkludert, og gjennomsnittsprevalensen av albuminuri var 33 %. Pooled sensitivitet og spesifisitet var 0,85 / 0,88 og 0,87 / 0,88 for hhv konsentrasjonsmåling og AKR. DOR og AUC var høyest for AKR (46,4 vs 39,7 og 0,94 vs 0,91). Tidspunktet for prøvetakning ila dagen påvirket ikke påvist sensitivitet/spesifisitet.
Det ser derfor ut som disse testene er ganske likeverdige mtp screeningformål, og at prøvetakingstidspunkt er mindre vesentlig enn tidligere antatt. Forfatterne understreker likevel at et positivt resultat ved screening bør verifiseres enten med samleurinprøve eller repeterte målinger.
I tillegg vurderes en oversiktsartikkel publisert i 2009 (Miller et al., 2009). Artikkelen viser at biologisk variasjon (fysiologiske endringer hos stabile pasienter) er minst ved undersøkelse av urin albumin/kreatinin ratio i morgenprøver sammenlignet med andre metoder. Dette er bakgrunnen for at AKR og morgenurin anbefales, da redusert variabilitet er en fordel for analyseresultater som benyttes til monitorering.
Vurdering
Fordeler og ulemper
Måling av albumin/kreatinin-ratio (AKR) vil være et viktig hjelpemiddel for å kunne bedømme den enkelte pasient med hensyn til fare for utvikling av kronisk nyresykdom, også for fremtidig hjerte-karsykdom.
AKR må bedømmes kvantitativt, ikke kvalitativt (dvs. semikvantitativ metode for urin albumin bør ikke benyttes da disse ikke gir nøyaktig verdi og vanlig urinstix kan ikke brukes da disse ikke gir positivt utslag før albuminkonsentrasjonen er betydelig forhøyet). Urinstix har for lav sensitivitet (nedre deteksjonsgrense for albuminkonsentrasjon i urin målt ved urinstix er ca. 150 mg/L). Målingen inngår som en obligat del av diabetesjournalen og har behandlingsmessige konsekvenser. For pasienten vil det være en fordel å kunne levere spotprøve heller enn samleurin, noe som i seg selv også vil være kostnadsbesparende.
Kvalitet på dokumentasjonen
Det er ikke utført randomiserte undersøkelser som direkte sammenligner bruk av spoturin mot samleurin for prediksjon av fremtidig nyre- eller hjerte-karsykdom. Evidensgrunnlaget for anbefalingen om målemetode for albuminuri er derfor basert på korrelasjonsstudier og retrospektive samlekohorter. Disse gjengis i sammendraget.
Verdier og preferanser
Forebygging av nefropati, enten definert som moderat forhøyet albuminuri og/eller betydelig forhøyet albuminuri, er et prioritert mål i behandlingen av diabetes type 1. Dette vil på sikt kunne forhindre hypertensjon, fall i nyrefunksjon (glomerulær filtrasjonsrate, GFR), og sekundært til fall i GFR også forebygging av kardiovaskulær sykdom.
Referanser
371. Which test to detect microalbuminuria in diabetic patients? A systematic review https://www.helsedirektoratet.no/referanse/0002-0013-232359
372. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease https://www.helsedirektoratet.no/referanse/0002-0013-232360
373. Diagnostic accuracy of point-of-care tests for detecting albuminuria: a systematic review and meta-analysis. https://www.helsedirektoratet.no/referanse/0002-0013-232361
374. Current Issues in Measurement and Reporting of Urinary Albumin Excretion https://www.helsedirektoratet.no/referanse/0002-0013-232362
375. Age- and gender-specific reference values for urine albumin/creatinine ratio in children of southwest China https://www.helsedirektoratet.no/referanse/0002-0013-232363
Sist faglig oppdatert: 20.12.2019
Måling av estimert GFR (eGFR) og bruk av riktig formel
Til laboratoriet:
- Estimering av GFR utføres i Norge ved ved bruk av to alternative kreatinin-baserte formler; den klassiske MDRD-formelen og den nyere CKD-EPI-formelen. CKD-EPI-formelen ser ut til å gi en bedre prediksjon for nyresykdom og hjerte-kar dødelighet enn MDRD-formelen hos pasienter som har estimert GFR 45 - 90 ml/min/1.73 m².
- På bakgrunn av dette anbefales bruk av CKD-EPI-formel fremfor MDRD-formel, selv om begge formlene har rimelig grad av nøyaktighet ved GFR <60 ml/min/1.73 m².
- Enzymatisk kreatinin metode bør benyttes for analyse av kreatinin.
- Cystatin C baserte formler gir ikke bedre estimat av GFR, slik at vi anbefaler bruk av den kreatinin-baserte CKD-EPI-formelen.
Til fastlegen:
- Pasientens nyrefunksjon bør måles årlig ved hjelp av eGFR, og ikke ved hjelp av en målt kreatinin-konsentrasjon alene.
- Vær oppmerksom på at i tidlig fase av nyreskaden kan personer med diabetes gjerne ha en renal hyperfiltrasjon slik at eGFR kan være overestimert. Det gjelder spesielt personer med gjennomgående høye blodsukkerverdier og/eller personer som er overvektige.
Praktisk – slik kan anbefalingen følges
Ved raskt fallende eGFR eller stigende AKR-verdier bør eGFR bestemmes hyppigere. Se Algoritme for vurdering av eGFR og u-AKR ved diabetes.
CKD-EPI- og MDRD-kalkulator. Velg CKD-EPI CREATININE EQ (2009) for kalkulering av CKD-EPI.
Tolkning av resultater
Store proteinrike måltider <12 timer før prøvetaking kan gi falskt høye eGFR-verdier. Hos pasienter med unormal høy eller lav muskelmasse er eGFR verdiene usikre, stor muskelmasse gir falsk lave eGFR-verdier, mens lav muskelmasse gir falsk for høye verdier. Ved tolkning av påfølgende eGFR-resultater er det viktig å være klar over at disse hos enkeltindivider kan variere med inntil 10-15 % på grunn av biologisk og analytisk variasjon.
Gradering av eGFR
| GFR-kategori | Nyrefunksjon | Glomerulær filtrasjonshastighet (ml/min/1.73 m²) |
| G1 | Normal | >90 |
| G2 | Lett redusert* | 60-89 |
| G3a | Lett til moderat redusert | 45-59 |
| G3b | Moderat til betydelig redusert | 30-44 |
| G4 | Betydelig redusert | 15-29 |
| G5 | Terminal nyresvikt | <15 |
*Hos eldre reduseres nyrefunksjon årlig med 0,5-1 ml/min/1.73 m². eGFR i området 60-89 ml/min/1.73 m² anses normalt for eldre mennesker.
Begrunnelse – dette er anbefalingen basert på
Pasienter med diabetes utvikler hyppig komplikasjoner i form av redusert nyrefunksjon. Nyrefunksjon måles ved å bestemme glomerulær filtrasjonsrate (GFR). Gullstandard for GFR måling gjøres ved å injisere et inert stoff som man deretter måler nyrenes evne til å filtrere. Nøyaktig måling av GFR er omstendelig og krever flere timers undersøkelse ved nyrefysiologisk laboratorium eller nukleærmedisinsk avdeling (iohexol-clearance, EDTA-clearance, DTPA-clearance).
Den vanligste metoden er derfor å måle konsentrasjonen av ulike endogene stoffer som produseres med konstant rate, filtreres fritt over glomerulusmembranen og i liten grad absorberes eller sekreres i nyretubuli. Den klart vanligste av disse parameterne er kreatinin. Kreatinin er et nedbrytningsprodukt fra muskulatur som frigis kontinuerlig, og konsentrasjonen av kreatinin er derfor avhengig av pasientens muskelmasse og nyrefunksjon. Gjennomsnittlig muskelmasse varierer basert på alder og kjønn. Kvinner og eldre har som regel lavere kreatininkonsentrasjon enn menn ved samme grad av nyrefunksjon.
For å gjøre tolkningen av kreatinin-verdier lettere er det laget ulike formler der en estimerer GFR (eGFR) for ulike kreatininverdier hos pasienter med ulik alder og kjønn. Det fins flere ulike formler for å beregne eGFR basert på kreatininkonsentrasjonen. Formlene har for ulike populasjoner av pasienter varierende grad av overenstemmelse med gullstandard nyrefunksjonsmåling og varierende prognostisk informasjon. I Norge benyttes primært kreatinin-baserte estimat av GFR. Lave verdier av eGFR øker risikoen for raskere fall i nyrefunksjon, og kan også påvirkes av interkurrente ikke-renale tilstander. Derfor bør eGFR <60 ml/min/1.73 m2 kontrolleres innen 3 måneder (se algoritme). Vær oppmerksom på at eGFR spesielt hos eldre mennesker temporært kan være lavere på grunn av nedsatt væskeinntak eller interkurrent sykdom. Stabile verdier over tid kan kontrolleres sjeldnere. Ved påvisning av eGFR <60 ml/min/1.73 m2 hos ny pasient bør denne verdien kontrolleres inn 2 uker, og pasienter med raskt fall i eGRF (>20%) henvises til nyrespesialist (se algoritme).
Forskningsgrunnlag
Populasjon (P): Diabetespasienter i samlestudie fra generell populasjon og høyrisiko populasjon
Tiltak (I): CKD-EPI formel
Sammenligning (C): MDRD formel
Beskrivelse av inkluderte studier
Gruppen har vurdert følgende utfallsmål som kritisk eller viktig:
- Død - KRITISK
- CVD - KRITISK
- ESRD - KRITISK
- Betydelig albuminuri - KRITISK
- Moderat albuminuri - VIKTIG
- Dobling av plasma kreatinin - KRITISK
- Vektreduksjon - VIKTIG
Død, CVD og ESRD predikert med hhv. CKD-EPI- og MDRD-formelen lot seg vurdere i følgende arbeider:
1. (Matsushita, K et al, 2012)
PICO-analysen baserer seg på denne studien, som er en samleanalyse av 1.1 millioner mennesker rekruttert fra bakgrunnspopulasjonen og fra definerte høyrisikopopulasjoner. CKD-EPI-formelen viser bedre prediktivitet for ESRD og kardiovaskulær død sammenlignet med MDRD-formelen når eGFR er 45-90 ml/min/1.73 m2 (CKD stadium 3A og 2). Analysen omfatter personer med og uten diabetes.
2. (Targher ,G. et al, 2012)
Undersøkelsen følger 2.823 personer med diabetes type 2 i 6 år. CKD-EPI predikerte kardiovaskulær død og død uansett årsak bedre enn MDRD-formelen.
I tillegg ble nøyaktigheten ved bruk av hhv CKD-EPI- og MDRD-formelen og ulike kreatininmetoder analysert mot målt GFR i:
Undersøkelsen omfatter et samlet datasett på 3.896 personer fra tilsammen 16 studier. CKD-EPI-formelen ga mer nøyaktig estimat av GFR enn MDRD-formelen ved alle målte GFR >30 ml/min/1.73 m2 (lavere bias). Bias var lavere opp til målt GFR 119 ml/min/1.73 m2. Undersøkelsen omfattet vesentlig personer uten diabetes, kun 28% hadde diabetes (Stevens, L.A., et al, 2010).
Vedrørende bruk av kreatininmetode har flere studier vist at enzymatisk kreatininmetode gir best samsvar med referansemetoden for kreatinin (Greenberg et al 2012, Kuster et al 2014), og KDIGO guidelines angir at denne metoden er å foretrekke. Det er også vist at andre metoder ikke alltid oppfyller kravene til analytisk kvalitet, dette gjelder også IDMS sporbare Jaffe metoder (Kuster et al 2014).
Vurdering
Fordeler og ulemper
Bestemmelse av nyrefunksjon og klassifisering av ev. nyresykdom hos diabetespasienter er essensielt for å kunne gi en best mulig bedømmelse av risiko for kronisk nyresykdom og hjerte-karsykdom. Dette vil på sin side bestemme behandlingsvalgene for pasienten.
Estimering av GFR utføres Norge ved to alternative kreatinin-baserte formler, den klassiske MDRD-formelen og den nye CKD-EPI-formelen. CKD-EPI-formelen ser ut til å gi en bedre prediksjon for nyresykdom og hjerte-kar dødelighet enn MDRD-formelen hos pasienter som har estimert GFR 45-90 ml/min/1.73 m2. Mer utstrakt bruk av CKD-EPI-formelen vil kreve at flere norske laboratorier forandrer sine utregninger i henhold til denne metoden.
Kvalitet på dokumentasjonen
Målemetode for eGFR lar seg vanskelig evaluere ut fra GRADE metodikk. Vi har derfor vurdert retrospektive analyser på samlekohorter.
Evidensgrunnlaget for anbefalingen av CKD-EPI eller MDRD formel som egnet metode for å predikere fremtidig nyresykdom og hjerte- kardødelighet, er basert på retrospektive samlekohorter. Disse gjengis i sammendraget.
Ingen av de utvalgte studiene er spesifikke for pasienter med diabetes, men inngår som en subpopulasjon i totalanalysen. Siden antallet diabetespasienter i disse analysene er ganske få, har vi valgt å basere våre anbefalinger på data fra totalpopulasjonen, hvor de fleste ikke har diabetes. Dette gjør at våre anbefalinger på dette punkt har begrenset styrke for personer med diabetes.
Verdier og preferanser
Oppfølging av pasientens nyrefunksjon gjøres på en enkel måte med estimert GFR (eGFR). Dette er i klinikken en rimelig og praktisk metode og medfører ingen ekstra belastning for pasientene. Estimatet gir ikke bare et mål på utvikling av nyresvikt, men også risiko for fremtidig hjerte-karsykdom. Alternativet til eGFR er kvantitativ måling av GFR, som er en ressurskrevende og kostbar teknikk. Den gjøres kun i sykehus og spesialisthelsetjeneste, og utføres kun på spesiell indikasjon.
Referanser
372. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease https://www.helsedirektoratet.no/referanse/0002-0013-232360
376. Comparison of risk prediction using the ckd-epi equation and the mdrd study equation for estimated glomerular filtration rate https://www.helsedirektoratet.no/referanse/0002-0013-232364
377. Specificity characteristics of 7 commercial creatinine measurement procedures by enzymatic and Jaffe method principles. https://www.helsedirektoratet.no/referanse/0002-0013-232365
378. Enzymatic creatinine assays allow estimation of glomerular filtration rate in stages 1 and 2 chronic kidney disease using CKD-EPI equation https://www.helsedirektoratet.no/referanse/0002-0013-232366
379. Comparative performance of the CKD Epidemiology Collaboration (CKD-EPI) and the Modification of Diet in Renal Disease (MDRD) Study equations for estimating GFR levels above 60 mL/min/1.73 m2 https://www.helsedirektoratet.no/referanse/0002-0013-232367
380. Comparison of two creatinine-based estimating equations in predicting all-cause and cardiovascular mortality in patients with type 2 diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232368
381. Glomerular Hyperfiltration in Diabetes: Mechanisms, Clinical Significance, and Treatment. https://www.helsedirektoratet.no/referanse/0002-0013-232369
382. Obesity-related glomerulopathy: clinical and pathologic characteristics and pathogenesis. https://www.helsedirektoratet.no/referanse/0002-0013-232370
Sist faglig oppdatert: 20.12.2019
Henvisning av pasienter med nyreskade til nefrolog
Henvis til eller konferer med nefrolog ved:
- Vedvarende u-AKR >30 mg/mmol (se algoritme under "praktisk info")
- Utilfredsstillende blodtrykkskontroll med tre antihypertensiva, inklusiv et diuretikum.
- Akutt nyresvikt, reduksjon av eGFR > 20% i løpet av 2 uker (se "praktisk info")
- Fall i eGFR med mer enn 10 ml/min/1.73 m² i løpet av 2 år, uansett utgangsverdi.
- Mistanke om annen nyresykdom enn diabetes nefropati (se "praktisk info")
- Vedvarende hyperkalemi s-K+> 5,5 mmol/l (se "praktisk info")
- PTH > 3x øvre normalområde og/eller s-Kalsium under nedre normalområde (se anbefaling Nedsatt nyrefunksjon og kalsium-fosfat)
Praktisk – slik kan anbefalingen følges
Huskeliste ved henvisning til nefrolog:
- U-stiks
- U-AKR
- Blodtrykk
- Karbamid/Kreatinin / eGFR
- Natrium, kalium, kalsium, fosfat, albumin
- Hba1c
- Lipider
- Røykestatus
- BMI
- Legemiddeloversiktoversikt
- Vurdering av evt avløpshinder
Akutt nyresvikt. Hyppigste årsak er interkurent sykdom og dehydrering med forverring av nyrefunksjon på grunn av legemidler som Ikke-steroide antiinflammatoriske midler (NSAID (M01A)), diuretika, ACE-hemmere (ACE-i) (C09AA), eller Angiotensin II-reseptorantagonister (ARB) (C09CA) (se Oppfølging av pasienter med lav GFR for å redusere risiko for kardiovaskulær sykdom – «Vær varsom»-plakaten). Dårlig pasient som ikke skal behandles i allmennpraksis legges inn som øhj. Henvis urolog ved avløpshinder som ikke behandles i allmennpraksis.
Mistanke om annen nyresykdom enn diabetes nefropati dersom: Plutselig oppstått proteinuri (urin protein stiks 2-3+), hematuri, fravær av retinopati, kort varighet av diabetes (type 1).
Hyperkalemi. Ta blodprøve uten venestase, seponer eller reduser kaliumtilskudd, ACEi eller ARB, kaliumsparende diuretika, gi beskjed om kaliumredusert kost (unngå cola, kaffe, nøtter, tørkede frukter, kakao). Konferer eventuelt med nefrolog eller klinisk ernæringsfysiolog.
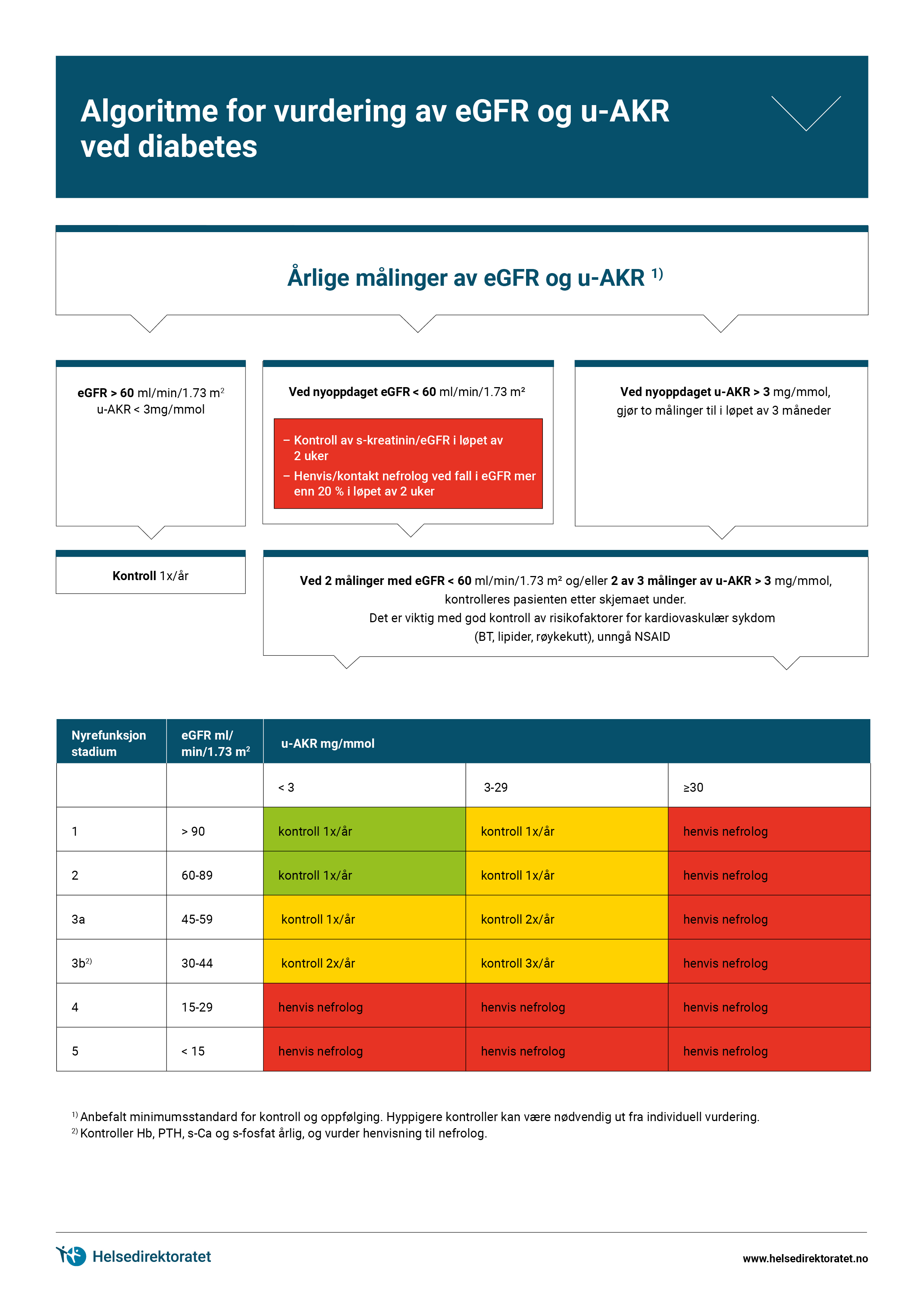
Begrunnelse – dette er anbefalingen basert på
Formål med henvisning av pasienter med diabetes og nyreskade til nefrolog er at man ved samarbeid kan:
- Følge opp pasienter med betydelig økt risiko for terminal nyresvikt.
- Behandle metabolske komplikasjoner ved nyresvikt.
- Oppdage og behandle andre alvorlige nyresykdommer enn diabetes nefropati.
20 % av alle med diabetes type 2 har GFR <60 ml/min/ 1.73 m² (Koro CE, 2009). Disse trenger spesiell oppfølging med hensyn på forverring av nyreskade, og også kardiovaskulær risiko. Ved god oppfølging og kontroll av pasientene kan utviklingen av nyresvikt bremses, hvilket vil kunne redusere komplikasjoner og mortalitet (Rayner HC, 2011 og 2014). Ved etablert nefropati er godt regulert blodtrykk viktigst for å bremse progresjon av nyresvikt. Hos pasienter med diabetes type 2 er nefrosklerose (hypertensiv nyreskade) en like hyppig årsak til nyresvikt som diabetes nefropati.
Referanser
367. Does community-wide chronic kidney disease management improve patient outcomes? https://www.helsedirektoratet.no/referanse/0002-0013-232355
368. Systematic kidney disease management in a population with diabetes mellitus: turning the tide of kidney failure https://www.helsedirektoratet.no/referanse/0002-0013-232356
369. Antidiabetic medication use and prevalence of chronic kidney disease among patients with type 2 diabetes mellitus in the United States https://www.helsedirektoratet.no/referanse/0002-0013-232357
372. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease https://www.helsedirektoratet.no/referanse/0002-0013-232360
383. Management of patients with diabetes and CKD: conclusions from a "Kidney Disease: Improving Global Outcomes" (KDIGO) Controversies Conference. https://www.helsedirektoratet.no/referanse/0002-0013-232371
Sist faglig oppdatert: 12.09.2018
Oppfølging av pasienter med lav estimert GFR (eGFR) for å redusere risiko for kardiovaskulær sykdom – «Vær varsom»-plakaten
- For pasienter med diabetes type 1 og type 2 og samtidig lav eGFR (lavere enn 60 ml/min/1.73 m²) bør man være særlig oppmerksom på en økt risiko for kardiovaskulær sykdom.
- Risikoen øker ytterligere når pasienten har økende albuminuri. Risikoen ved albuminuri og lav eGFR er additiv.
- Se «Vær varsom»-plakaten under Praktisk.
Praktisk – slik kan anbefalingen følges
- Når eGFR er blir lavere enn 60 ml/min/1.73 m² er blodtrykkskontroll viktig, og man må samtidig kvantitativt følge albumin-kreatinin ratio i urinen. Ratio bør ikke stige ytterligere, helst falle.
- Bruk av ACE-hemmere (ACE-i) (C09AA) eller Angiotensin II-reseptorantagonister (ARB) (C09CA) er spesielt å anbefale, dersom pasienten tåler det.
- Bruk av kolesterolsenkende legemidler/statiner (C10AA) anbefales.
- HbA1c bør holdes lavere enn 64 mmol/mol (8,0 %), men ikke lavere enn 53 mmol/mol (7,0 %) dersom pasienten bruker insulin eller
sulfonylurea. Hos eldre med lav eGFR (<45 ml/min/m2) kan man akseptere HbA1c <69 mmol/mol (<8,5%). - Aktivering av D-vitamin (A11CC) i nyrer er nedsatt. Dersom PTH stiger høyere enn 3 ganger øvre normalgrense bør substituering med aktivt D-vitamin igangsettes. Konferer med nefrolog.
«Vær varsom»-plakaten: Pasienter med nyresvikt, diabetes og kardiovaskulær sykdom
1. Dehydrering og interkurrent sykdom
Eldre skrøpelige pasienter med nyre- og hjertesykdom og diabetes har betydelig økt risiko for alvorlige legemiddelassosierte komplikasjoner. Dehydrering og interkurrent sykdom med manglende væskeinntak er en hyppig årsak til hospitalisering med akutt nyresvikt og hyperkalemi. De viktigste legemidlene som utløser dette er diuretika, ACEi/ARB, og kaliumtilskudd. Interkurrent sykdom kan utløse akutt nyresvikt som ved samtidig bruk av metformin kan utløse en livstruende laktacidose.
Enkle tiltak kan redusere risiko for slike komplikasjoner. Det anbefales at behandlende lege informerer pasienten om risiko og forebyggende tiltak:
- Skriftlig informasjon om å redusere dose, eventuelt stoppe helt med diuretika, ACEi/ARB, SGLT2-hemmer, metformin ved tegn til dehydrering.
- Skriftlig informasjon om å kontakte lege ved tegn på dehydrering eller lavt blodtrykk.
2. Pasienter med nyresvikt har økt risiko for hypoglykemi
- Velg legemidler som gir liten risiko for hypoglykemi (metformin (forutsatt eGFR > 45 ml/min/1.73 m²), gliptiner (DPP-4-hemmere))
- Dosering av metformin ved nyresvikt:
- eGFR 45-60 ml/min/1.73 m²: maks 1,5g pr dag
- eGFR 30-45 ml/min/1.73 m²: maks 1 g pr dag (metformin-behandling skal ikke startes med eGFR i dette området)
- eGFR < 30 ml/min/1.73 m²: kontraindisert
- HbA1c <64 mmol(mol (< 8,0%) anses tilfredsstillende for denne pasientgruppen
3. Forverring av nyrefunksjon (akutt eller kronisk), legemiddelliste
Kombinasjonsbehandling gir alltid økt risiko for interaksjoner. Vurder pasientens legemidler ved 20% rask reduksjon i eGFR (innenfor uker eller måneder). Dette kan spesielt skje etter oppstart av ACEi/ARB, diuretika eller SGLT2-hemmer. Vurder også pasientens legemidler ved overgang fra nyresvikt grad 3a (45-60ml/min/1.73 m²) til 3b (30-45 ml/min/1.73 m²) og overgang til grad 4 (15-30 ml/min/1.73 m²). Ved fall av eGFR til < 20 ml/min/1.73 m² vurder nytten av ACEi/ARB opp mot ulempe og risiko, søk råd hos nefrolog. De vanligste legemidlene som trenger dosereduksjon eller seponering er:
- sulfonylurea
- ACEi/ARB
- SGLT2-hemmer
- diuretika
- metformin
- Ikke-steroide antiinflammatoriske midler (NSAID)
- Inkretinmimetika (GLP1-analog)
Når man starter med SGLT2-hemmer hos personer som bruker ACE-hemmer eller angiotensin-2 blokker fra før, vil filtrasjonstrykket i karnøstene reduseres ytterligere. Pass på at eGFR ikke faller mer enn 20 %
de nærmeste ukene. SGLT2-hemmere forventes ikke å ha blodsukkersenkende effekt når eGFR<45 ml/min/ 1.73 m². SGLT2-hemmere forventes ikke å ha blodsukkersenkende effekt når eGFR<45 ml/min/ 1.73 m².
Begrunnelse – dette er anbefalingen basert på
Det å ha diabetes innebærer økt risiko for kardiovaskulær sykdom (hjertesykdom og slag). Risiko for mortalitet blant pasienter med og uten diabetes øker med 45 % når eGFR er 45 ml/min/1.73 m² sammenlignet med eGFR høyere enn 60 ml/min/1.73 m². Studier (van der Velde M, 2001) tyder på at denne risikoen kan være opptil 3 ganger økt ved diabetes og avansert nyresvikt (eGFR 15 ml/min/1.73 m²), sammenlignet med diabetes og normal nyrefunksjon. Pasienter med diabetes og nyreskade må følges og behandles spesielt nøye.
Forskningsgrunnlag
Populasjon (P): Personer med type 1 og type 2 diabetes
Tiltak (I): kardiovaskulær risiko lav eGFR
Sammenligning (C): kardiovaskulær risiko normal eGFR
Beskrivelse av inkluderte studier
Referanser
370. Lower estimated glomerular filtration rate and higher albuminuria are associated with all-cause and cardiovascular mortality. A collaborative meta-analysis of high-risk population cohorts https://www.helsedirektoratet.no/referanse/0002-0013-232358
372. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease https://www.helsedirektoratet.no/referanse/0002-0013-232360
384. A European Renal Best Practice (ERBP) position statement on the Kidney Disease: Improving Global Outcomes (KDIGO) clinical practice guideline for the management of blood pressure in non-dialysis-dependent chronic kidney disease: an endorsement with some caveats for real-life application. https://www.helsedirektoratet.no/referanse/0002-0013-232372
385. Risk of hypoglycemia after hospital discharge after acute kidney injury in patients with diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232373
386. The role of cystatin C in improving GFR estimation in the general population https://www.helsedirektoratet.no/referanse/0002-0013-232374
Sist faglig oppdatert: 20.12.2019
Nedsatt nyrefunksjon og kalsium-fosfat
Hos personer med nedsatt nyrefunksjon (eGFR < 45 ml/min/1.73 m²) bør behandling med aktivt D-vitamin (1,25-OH vitamin D3) startes hvis PTH overskrider det 3-dobbelte av øvre referanseverdi og s-Ca under referanseverdi. Før behandlingen starter må fastlegen konferere med nefrolog.
Praktisk – slik kan anbefalingen følges
Behandlingen er oftest aktuell når eGFR < 45 ml/min/1.73 m². Når nyrefunksjonen faller ytterligere vil fosfat-nivåene stige i blodet. Pasienten bør da henvises til nefrolog for vurdering.
Dosering
Som aktivt D-vitaminpreparat (A11CC) brukes i Norge Rocaltrol eller Etalpha. Pasienten må samtidig ikke bruke andre D-vitaminpreparat. Vanlig dose er 0.25-0.5 ug/ dag.
Oppfølging
Siden aktivt D-vitamin utgjør en forsvinnende liten del av total vitamin D kan ikke D-vitaminmålinger i blodet brukes til kontroll. Det er i stedet viktig å måle kalsium og fosfat for å unngå høyt kalsium-fosfat produkt. Stabilisering eller fall i PTH-verdien er også en indikasjon på adekvat behandling. Oppstart av D-vitaminbehandling ved samtidig høy s-fosfat er potensielt farlig, og behandlingen bør i så fall overlates nefrolog.
Begrunnelse – dette er anbefalingen basert på
D-vitamin
Nyrene omdanner inaktivt D-vitamin til aktivt 1-alfa hydroksy-vitamin D. Ved nyresvikt reduseres nyrenes kapasitet til denne omdannelsen med påfølgende fare for mangel av aktivt D-vitamin.
Kalsium-fosfat
Fosfat skilles kun ut gjennom nyrene. Hyperfosfatemi øker risiko for ekstraossøse forkalkninger i arterier og arterioler og derved økt fare for kardiovaskulær sykdom. Kombinasjon av hyperkalsemi og hyperfosfatemi er spesielt ugunstig.
Hyperparathyreoidisme
På grunn av redusert sensibilitet av kalsiumreseptorer øker PTH ved nyresvikt. Vi aksepterer derfor verdier av PTH 2-3x normalområdet. Hyperparathyreodisme øker benomsetningen og derved økes risikoen for benbrudd.
Referanser
372. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease https://www.helsedirektoratet.no/referanse/0002-0013-232360
Sist faglig oppdatert: 14.09.2016
Nedsatt nyrefunksjon og anemi
Når andre årsaker til anemi er utelukket, bør erytropoitin-behandling (epo-behandling) startes før Hb er lavere enn 10.0 g/dl. Som hovedregel bør Hb ikke overstige 12.0 g/dl.
Praktisk – slik kan anbefalingen følges
Problemstillingen er som regel aktuell når eGFR < 45 ml/min/1.73 m². Behandlingen kan startes i allmennpraksis, men i samråd med nefrolog. Reseptene skrives av spesialist (H-resept).
Dosering
For å få tilstrekkelig effekt av erytropoietin (B03XA01) bør jernlagrene fylles opp før oppstart med epo. Husk at hos en pasient med nyresvikt kan ferritin være falskt forhøyet (som akutt- fase reaktant). Bruk også øvrige jernparametre som for eksempel serumjern, transferin-metning og reticulocytt-Hb for å bedømme jerndepotene. Peroral jernbehandling kan være utilstrekkelig og erstattes med iv behandling. Dette er som regel en oppgave for nefrolog. Epo gis som sc injeksjon en eller flere ganger per måned, og doseres i forhold til anbefalingen for aktuell preparat.
Behandlingsmål
Anbefalt Hb-konsentrasjon 10-12 g/dl. Hb-verdier høyere enn normal-området (>13-14 g/dl) er forbundet med hypertensjon, samt økt tromboserisiko. Ved Hb over disse nivå er det også rapportert økt forekomst av kardiovaskulære hendelser, hvor røykere er spesielt disponert.
Begrunnelse – dette er anbefalingen basert på
Renal anemi skyldes redusert produksjon av erytropoietin (epo) i nyrer og redusert erytrocytt levetid. Ikke sjelden foreligger blødning fra gastrointestinaltraktus som i stedet er årsak til en blødningsanemi. Dette kan skyldes redusert trombocytt-funksjon, eventuelt betennelsesforandringer i GI-traktus. Før oppstart av epo-behandling skal det gjøres en vanlig utredning av anemi for å utelukke annen årsak enn til anemien.
Referanser
372. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease https://www.helsedirektoratet.no/referanse/0002-0013-232360
Sist faglig oppdatert: 20.12.2019
Blodtrykksbehandling ved albuminuri
Blodtrykksbehandling ved albuminuri, diabetes type 1
Det anbefales ACE-hemmer (ACEi) eller angiotensin II-reseptorantagonister (ARB) hos personer med diabetes type 1 og moderat albuminuri (U-AKR 3-30 mg/mmol) med eller uten hypertensjon. Bruk av ACEi forebygger videreutvikling til betydelig albuminuri (U-AKR >30 mg/mmol) og fall i eGFR på sikt, uavhengig av blodtrykk ved start av behandlingen.
Praktisk – slik kan anbefalingen følges
- Risiko og monitorering ved oppstart/pågående behandling med ACEi/ARB (C09AA):
- Sjekk s-kreatinin og s-K+(<4,5mmol/l) før oppstart og 1 uke etter, samt ved dosetitrering og interkurrent sykdom/dehydrering.
Oppstart av behandling er rapportert trygt inntil kreatinin-verdier på 250 umol/l (eGFR ned til 25 ml/min/1.73 m²), men ved eGFR <45 ml/min/1.73 m² anbefaler vi å starte med halverte doser. - Ved kreatininstigning >20% fra baseline 1 uke etter oppstart: Reduser da evt dosen.
Kontroll etter 1 uke igjen. Hvis stabilisering: Fortsett ACEi/ARB. - Kalium inntil 5,0 aksepteres (kontroll uten stase)
- Ved hyperkalemi (5,0-5,5mmol/l) etter kontroll: Unngå kaliumrik kost (obs: sjokolade, nøtter, tørkede frukter, kaffe, cola, jordbær)
Evt: gi loopdiuretika (f.eks. furosemid). Vurder dosereduksjon/seponering ACEi/ARB og kaliumsparende diuretika (C03DA01)(aldosteronantagonister og amilorid ). - Vedvarende S-K+ >5,0mmol/l : Reduser eller seponer ACEi/ARB/aldosteron-hemmer. Konferer nyrelege.
- Sjekk s-kreatinin og s-K+(<4,5mmol/l) før oppstart og 1 uke etter, samt ved dosetitrering og interkurrent sykdom/dehydrering.
- Anbefalingen har sterkest evidens for ACEi, men mest trolig oppnår man samme effekt ved bruk av ARB.
- Blodtrykket bør om mulig behandles til under 130/80 mmHg, men behandlingsmål er også en reduksjon eller stabilisering av AKR. Albuminuri (U-AKR) må kvantiteres. Dersom det er behov for nøyaktig kvantitering av AKR verdier i høyere nivå enn det som pasientnære instrumenter kan kvantitere, må prøven analyseres på sykehuslaboratorium.
- Man kan trenge høyere doser av legemiddelet for å redusere U-AKR enn for å redusere blodtrykket alene.
- Reduksjon av moderat albuminuri er en gunstig prognostisk faktor i seg selv. Behandlingen skal da ikke seponeres, men opprettholdes, og kontrollene fortsetter på ordinære måte,
- Vi fraråder å bruke ACEi i kombinasjon med ARB. Denne kombinasjonen øker sjansen for betydelig kreatinin-stigning med fare for akutt nyresvikt. I sjeldne tilfeller bruker nyrespesialister denne legemiddelkombinasjonen i behandlingen av nefrotisk syndrom.
- ACEi eller ARB er anbefalt til pasienter med moderat albuminuri, men har ingen kliniske fordeler hos pasienter med normal albuminuri.
- Risikoen for akutt nyresvikt øker når ACEi eller ARB kombineres med NSAID.
Begrunnelse – dette er anbefalingen basert på
Dokumentasjonen på den nyrebeskyttende effekten av ACEi, alternativt ARB er ganske entydig. Den sterkeste dokumentasjonen er på å forebygge progresjon av modeart albuminuri til betydelig albuminuri (Hirst, et al. 2012). Betydelig albuminuri (tidligere kalt makroalbuminuri eller proteinuri) er assosiert med fall i eGFR. Den beskyttende effekten mot dobling av kreatinin og ESRD er sannsynligvis også tilstede (Sarafidis, et al. 2008). Man ser denne trenden ganske konsistent i de fleste studier, men oppfølgingstid og påvist antall utfall er trolig ikke tilstrekkelig til at funnen når statistisk signifikans (konfidensintervallet krysser linjen for null-effekt).
Noen enkeltstudier av mindre størrelse har vist tilsvarende effekt med aldosteron-hemmer, men dette er ikke veldig godt undersøkt i litteraturen.
Forskningsgrunnlag
Populasjon (P): Diabetes type 1 med forhøyet albuminuri
Tiltak (I): ACEi/ARB
Sammenligning (C): Andre antihypertensiva
Beskrivelse av inkluderte studier
Gruppen har vurdert følgende utfallsmål som kritisk (9-7) eller viktig (6-4):
- Død-KRITISK (9)
- CVD-KRITISK (8)
- ESRD-KRITISK (8)
- Betydelig albuminuri (tidligere kalt makroalbuminuri)-KRITISK (7)
- Moderat albuminuri (tidligere kalt mikroalbuminuri)-VIKTIG (5)
- Dobling av plasma kreatinin-KRITISK (7)
- Vektreduksjon-VIKTIG (5)
For besvarelse av dette PICO-spørsmålet hentet vi data fra Sarafidis, P.A., et al, 2008, for følgende utfallsmål: (1.) Død - KRITISK, (3.) ESRD - KRITISK, (6.) Dobling av plasma kreatinin - KRITISK. Majoriteten av studiene i analysen brukte ACE-hemmer (20 studier), et mindretall brukte angiotensin-2 receptor blokkere (4 studier). For utfallsmålet (4.) Betydelig albuminuri - KRITISK hentet vi data fra Hirst, J.A., et al, 2012. Majoriteten av studiene i denne analysen brukte ACE-hemmere, et mindretall brukte angiotensin-2 receptor blokkere.
Ingen av studiene omfattet bruk av aldosteron-hemmere.
Utfall 1. Død-KRITISK (9). Det er ikke vist sikker forebyggende effekt av død (uansett årsak) siden konfidensintervallet krysser indentitetslinjen med p=0.55. Appliserbarheten er trukket ned fordi en stor andel av pasientene (n=5.021) har diabetes type 2, og kontrollgruppen er en blanding av placebo-behandling og annen antihypertensiv behandling Evidensgraden bedømmes som moderat.
Utfall 3. ESRD - KRITISK. Det er få utfall i analysen (10-15/ 1000 pasienter), i tillegg trekk for nedsatt appliserbarhet, i det hovedandelen av pasientene i analysen hadde diabetes type 2 (n=5.021), og kontrollgruppen er en blanding av placebo-behandling og annen antihypertensiv behandling. Trass i få utfall er konfidensintervallet nær signifikant effekt. Evidensgraden bedømmes som lav.
Utfall 4. Betydelig albuminuri - KRITISK: Analysen Hirst, J.A., et al., viser at intensivert blodsukkerregulering kan forebygge utvikling av makroalbuminuri. Kontrollgruppen brukte placebo eller ingenting, annen antihypertensiv behandling var ikke inne i bildet. Konfidensintervallet er forenelig med effekt, trass i lite utvalg. Evidensgraden bedømmes som moderat.
Utfall 6. Dobling av kreatinin - KRITISK: Intensivert blodsukkerregulering ser ut til å forebygge dobling av kreatinin over tid. Styrken av evidens trekkes dels på grunn av stor andel pasienter med diabetes type 2 i analysen (5.042 av 6.754 deltakere), i noen tilfeller bruk av placebo i kontrollgruppen, og relativt få utfall. Likefullt angir konfidensintervallet signifikant effekt. Evidensgraden bedømmes som moderat.
Vurdering
Fordeler og ulemper
Blodtrykksbehandling med ACEi eller ARB har til hensikt å forsinke utviklingen av nefropati hos en person med diabetes type 1 og moderat eller betydelig albuminuri. Når betydelig albuminuri (albumin/ kreatinin ratio >30 mg/mmol) inntrer, er blodtrykket alltid forhøyet og eGFR avtar. Ubehandlet faller eGFR med 5-6 ml/min/år ved diabetes nefropati. Riktig bruk av ACEi eller ARB i behandlingen kan forsinke utviklingen fra moderat albuminuri til betydelig albuminuri, og videre til fall i eGFR. I evidensprofilen fant vi at slik behandling forebygget dobling av kreatinin (som er et surrogat for fall i eGFR) og forebygget utvikling av betydelig albuminuri fra moderat albuminuri. Derimot fant vi ikke sikker forebygging av endestadie nyresvikt (ESRD) eller død. Det er heller ikke evidens for at primærprofylakse med ACEi eller ARB forebygger utvikling av moderat albuminuri. Alt i alt synes behandlingen viktig for å forebygge fremtidig fall i eGFR og nyresvikt. Denne gevinsten vil i de fleste tilfeller oppveie eventuelle bivirkninger ved behandlingen.
Kvalitet på dokumentasjonen
Vi tok utgangspunkt i 2 metaanalyser:
(Sarafidis, P.A., et al, 2008) og (Hirst, J.A., et al, 2012)
Endepunktene ESRD, dobling av kreatinin og død ble undersøkt i studien til Sarafidis et al., mens endepunktet betydelig albuminuri ble undersøkt i studien til Hirst et al. Appliserbarheten for diabetes type 1 i studien til Sarafidis et al. ble nedgradert ett nivå siden dette var en meta-analyse som både inkluderte diabetes type 1 og type 2. Ut fra resultater i enkeltstudier har vi imidlertid grunn til å tro at effekten av denne type behandling er lik ved de to diabetesformene, og uavhengig av om det foreligger diabetes nefropati (som ved diabetes type 1) eller nefrosklerose (som i mange tilfeller er årsak til nyresykdom ved diabetes type 2, i tillegg til diabetes nefropati). Appliserbarheten i begge studien ble dessuten nedgradert fordi kontrollgruppen ikke bare bestod av pasienter som fikk annen antihypertensiv behandling, men også pasienter som fikk placebo.
Verdier og preferanser
Det er et mål å holde diabetespasientens blodtrykk under god kontroll, fortrinnsvis ved at ACEi eller ARB er inne i bildet. Dette vil på sikt forsinke utvikling av kronisk nyresvikt og sannsynligvis også hjerte-karsykdom. Behandlingen må derimot ikke gå på bekostning av farlige bivirkninger, så som akselerert nyresvikt/ hyperkalemi initialt i behandlingsforløpet, spesielt hos eldre personer med uttalt arteriosklerose og saltmangel. Man må også unngå ortostatisk hypotensjon, dette er en vanlig bivirkning hos eldre pasienter.
Referanser
387. The impact of renin-angiotensin-aldosterone system inhibitors on Type 1 and Type 2 diabetic patients with and without early diabetic nephropathy https://www.helsedirektoratet.no/referanse/0002-0013-232375
388. Effects of renin-angiotensin system blockers on renal outcomes and all-cause mortality in patients with diabetic nephropathy: an updated meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-232376
Sist faglig oppdatert: 20.12.2019
Blodtrykksbehandling ved albuminuri, diabetes type 2
ACE-hemmer (ACEi) eller angiotensin II-reseptorantagonister (ARB) anbefales til pasienter med diabetes type 2 med hypertensjon og moderat albuminuri (U-AKR 3-30 mg/mmol) for å forebygge utvikling til betydelig albuminuri (U-AKR >30 mg/mmol) og fall i eGFR.
Praktisk – slik kan anbefalingen følges
- Risiko og monitorering ved oppstart/pågående behandling med ACEi/ARB (C09AA):
- Sjekk s-kreatinin og s-K+(<4,5mmol/l) før oppstart og 1 uke etter,-samt ved dosetitrering og interkurrent sykdom/dehydrering.
Oppstart av behandling er rapportert trygt inntil kreatinin-verdier på 250 umol/l (eGFR ned til 25 ml/min/1.73 m²), men ved eGFR <45 ml/min/1.73 m² anbefaler vi å starte med halverte doser.
- Sjekk s-kreatinin og s-K+(<4,5mmol/l) før oppstart og 1 uke etter,-samt ved dosetitrering og interkurrent sykdom/dehydrering.
- Spesielle forsiktighetsregler hos eldre:
- Hos eldre personer med diabetes type 2 bør ortostatisk blodtrykkfall utelukkes før man starter antihypertensiv behandling.
- Spesiell forsiktighet må utvises hos eldre med nedsatt allmenntilstand, hypovolemi og hyponatremi. Hos disse kan alvorlig kreatinin-stigning og hyperkalemi utvikle seg raskt.
- Hos eldre med nedsatt nyrefunksjon gir ACEi/ARB kombinert med metformin økt risiko for laktacidose ved interkurrent sykdom med volumtap (diare/oppkast). Midlertidig seponering av behandlingen (både metformin og ACE-hemmer) skal vurderes inntil tilstanden er klinget av og væskebalansen gjenopprettet.
- Ved kreatininstigning> 20% fra baseline 1 uke etter oppstart: Reduser da evt dosen.
Kontroll etter 1 uke igjen. Hvis stabilisering: Fortsett ACEi/ARB. - Kalium inntil 5,0 aksepteres (kontroll uten stase)
- Ved hyperkalemi (5,0-5,5mmol/l) etter kontroll: Unngå kaliumrik kost (obs: sjokolade, nøtter, tørkede frukter, kaffe, cola, jordbær)
Evt: gi loopdiuretika (f.eks. furosemid). Vurder dosereduksjon/seponering ACEi/ARB og kaliumsparende diuretika (C03DA01) (aldosteronantagonister og amilorid ). - Vedvarende S-K+ >5,0mmol/l : Reduser eller seponer ACEi/ARB hemmer/aldosteron-hemmer. Konferer nefrolog.
- Blodtrykket bør om mulig behandles til under 130/80 mmHg, men behandlingsmål er også en reduksjon eller stabilisering av AKR. Albuminuri (U-AKR) må kvantiteres. Dersom det er behov for nøyaktig kvantitering av AKR verdier i høyere nivå enn det som pasientnære instrumenter kan kvantitere, må prøven analyseres på sykehuslaboratorium.
- Man kan trenge høyere doser av legemiddelet for å redusere U-AKR enn for å redusere blodtrykket alene.
- Reduksjon av mikroalbuminuri er en gunstig prognostisk faktor i seg selv. Behandlingen skal da ikke seponeres, men opprettholdes, og kontrollene fortsetter på ordinære måte,
- Vi fraråder å bruke ACEi i kombinasjon med ARB. Denne kombinasjonen øker sjansen for betydelig kreatinin-stigning med fare for akutt nyresvikt. I sjeldne tilfeller bruker nyrespesialister denne legemiddelkombinasjonen i behandlingen av nefrotisk syndrom.
- ACEi eller ARB er anbefalt til pasienter med moderat albuminuri, men har ingen kliniske fordeler hos pasienter med normal albuminuri.
- Risikoen for akutt nyresvikt øker når ACEi eller ARB kombineres med NSAID (M01A).
- SGLT2-hemmere og GLP1-analoger. Hos personer med diabetes type 2 og spesielt høy risiko for hjerte- og karsykdom, har SGLT2-hemmerne vist seg å beskytte mot fall i eGFR, mens GLP1-analogene liraglutid og semaglutid har vist seg å beskytte mot utvikling av proteinuri. Legemidlene har foreløpig kun indikasjon som blodsukkersenkende legemidler, og ikke som nyrebeskyttende legemidler på linje med ACEi og ARB.
Begrunnelse – dette er anbefalingen basert på
Riktig bruk av ACEi eller ARB kan utsette behov for dialyse (Vejakama et al., 2012). Hemodialyse eller peritonealdialyse er stipulert å koste ca. kr 750.000/ år. Forebygging eller utsettelse av dialyse innebærer også en viktig livskvalitet for pasienten. Behandlingen må imidlertid monitoreres i tilfelle raskt fallende nyrefunksjon og/ eller utviklende hyperkalemi. Feildosering av medikamentene kan i seg selv føre til fremskutt dialysebehov med nedsatt livskvalitet hos pasienten og økte samfunnskostnader.
Forskningsgrunnlag
Populasjon (P): Diabetes type 2 med forhøyet albuminuri
Tiltak (I): ACEi/ARB/aldosteronhemmer
Sammenligning (C): Andre antihypertensiva
Beskrivelse av inkluderte studier
Gruppen har vurdert følgende utfallsmål som kritisk (9-7) eller viktig (6-4):
- Død-KRITISK (9)
- CVD-KRITISK (8)
- Endestadie nyresvikt (ESRD)-KRITISK (8)
- Betydelig albuminuri (tidligere kalt makroalbuminuri)-KRITISK (7)
- Dobling av plasma kreatinin-KRITISK (7)
- Vektreduksjon-VIKTIG (5)
For besvarelse av dette PICO-spørsmålet hentet vi data fra Vejakama, et al. 2012, for følgende utfallsmål l: (3.) ESRD - KRITISK, (4.) Betydelig albuminuri - KRITISK, (5.) Dobling av plasma kreatinin - KRITISK.
Utfall 1.
Utfall 3. ESRD - KRITISK. Det er få utfall i analysen (totalt 200 hendelser, men dog hos 10% av pasientene), Det er gitt trekk for nedsatt appliserbarhet ved at flere av studiene omfattet personer med normal albuminuri. Trass i få utfall er konfidensintervallet nær signifikant effekt. Evidensgraden bedømmes som moderat.
Utfall 4. Betydelig albuminuri - KRITISK: Nedgradert fordi flere av studiene inkluderer deltakere med normal albuminuri. Konfidensintervallet tilsier effekt, trass i lite utvalg. Evidensgraden bedømmes som moderat.
Utfall 5. Dobling av kreatinin - KRITISK: Nedgradert fordi flere av studiene inkluderer deltakere med normal albuminuri
Konfidensintervallet viser signifikant effekt på utfallet, men det er en svakhet at publiseringsskjevhet ikke er oppgitt. Antall hendelser er begrenset (250 blant 1.198 pasienter). Evidensgraden bedømmes som moderat.
Vurdering
Fordeler og ulemper
Blodtrykksbehandling med ACEi eller ARB har til hensikt å forsinke utviklingen av nefropati hos en person med diabetes type 2, hypertensjon, og moderat eller betydelig albuminuri. Mange personer har hatt diabetes type 2 i mer enn 10 år og har utviklet moderat eller betydelig albuminuri allerede på det tidspunkt diabetesdiagnosen stilles. Behandling med ACE-hemmer eller angiotensin-2 blokker er indisert allerede når moderat albuminuri påvises sammen med hypertensjon. Ubehandlet faller eGFR med 5-6 ml/min/år ved diabetes nefropati, langsommere ved nefrosklerose med lavgradig eller fraværende proteinuri. Riktig bruk av ACEi eller ARB i behandlingen kan forsinke utviklingen fra moderat albuminuri til betydelig albuminuri, og videre til fall i eGFR. I evidensprofilen fant vi at slik behandling forebygget utvikling av betydelig albuminuri fra moderat albuminuri, samt dobling av kreatinin (som er et surrogatmål for fall i eGFR). Derimot fant vi ikke at behandlingen forebygget ESRD eller død med signifikans. Alt i alt synes behandlingen viktig for å forebygge fremtidig fall i eGFR og nyresvikt. Denne gevinsten vil i de fleste tilfeller oppveie eventuelle bivirkninger ved behandlingen.
Kvalitet på dokumentasjonen
Vi tok utgangspunkt i en nylig publisert meta-analyse:
(Vejakama, et al. 2012)
Appliserbarheten ble nedgradert fordi flere av enkeltstudiene i meta-analysen inkluderte personer med normal albuminuri
Verdier og preferanser
Det er et mål å holde diabetespasientens blodtrykk under god kontroll, fortrinnsvis ved ved hjelp av ACEi eller ARB med eventuelt tillegg av andre blodtrykksmedikamenter. Dette vil på sikt forsinke utvikling av kronisk nyresvikt og sannsynligvis også hjerte-karsykdom. Behandlingen må derimot ikke gå på bekostning av farlige bivirkninger, såsom akselerert nyresvikt/ hyperkalemi initialt i behandlingsforløpet, spesielt hos eldre personer med uttalt arteriosklerose og saltmangel. Man må også unngå ortostatisk hypotensjon, dette er en vanlig bivirkning hos eldre pasienter.
Referanser
389. Reno-protective effects of renin-angiotensin system blockade in type 2 diabetic patients: a systematic review and network meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-232377
372. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease https://www.helsedirektoratet.no/referanse/0002-0013-232360
Sist faglig oppdatert: 20.12.2019
Kosthold ved diabetes og nyresykdom
Kosthold med lavt proteininnhold ved nyreskade hos pasienter med diabetes
Effekten av proteinreduksjon for å forebygge ytterligere nyreskade hos personer med diabetes, er usikker.
Helsepersonell kan foreslå redusert proteininntak, men dette bør kun gjennomføres av pasienter som er motivert.
Praktisk – slik kan anbefalingen følges
Proteinreduksjon i kosten innebærer reduksjon til 0.8 g protein/kg kroppsvekt/døgn, og behandlingen må følges av personell med spesiell kompetanse innen ernæring, fortrinnsvis klinisk ernæringsfysiolog.
Det er spesielt viktig at adekvat kaloriinntak opprettholdes, og at pasienten ikke utvikler en katabol tilstand med tap av muskelmasse. Insulin-krevende diabetes er i utgangspunktet en katabol tilstand, hvor underdosering av insulin i seg selv leder til katabole forandringer i kroppen, i tillegg til de effekter kostholdet måtte ha.
Begrunnelse – dette er anbefalingen basert på
Tilgjengelige studier omfatter fortrinnsvis personer med diabetes type 1, ikke personer med diabetes type 2 (Hansen et al., 2002; Nezu et al., 2013; Pan et al., 2008; Robertson et al., 2007). Studiene har lav statistisk styrke, og preges av stor spredning i konfidensintervall. Dårlig compliance er ofte et problem i studiene. De er også alle mer enn 15 år gamle, og de færreste er utført samtidig med bruk av medikamentell behandling som senker filtrasjonstrykket tilsvarende i nyrene (ACE-hemmer, angiotensin-2 hemmer). Vi har derfor lite kunnskap om effekten av behandlingene vil være additiv eller ikke.
Forskningsgrunnlag
Populasjon (P): Personer med diabetes og nyresykdom
Tiltak (I): Lavprotein kosthold
Sammenligning (C): Vanlig kosthold tilpasset diabetes
Beskrivelse av inkluderte studier
Utfall gruppen opprinnelig interesserte seg for - og graderte mellom Kritisk (9-7), Viktig (6-4) og Mindre viktig (3-1):
- Død-KRITISK (9)
- CVD-KRITISK (8)
- ESRD-KRITISK (8)
- Betydelig albuminuri (tidligere kalt makroalbuminuri)-KRITISK (7)
- Moderat albuminuri (tidligere kalt mikroalbuminuri)-VIKTIG (5)
- Dobling av plasma kreatinin-KRITISK (7)
- Vektreduksjon-VIKTIG (5)
For besvarelse av dette PICO-spørsmålet fant vi 3 systematiske oversikter:
(Robertson, L et al, 2007), (Pan, Y et al, 2008) og (Nezu, U et al, 2013)
Utfall 1. Død-KRITISK (9) og utfall 3. ESRD-KRITISK (8) ble rapportert én studie som var referert i alle disse samleoversiktene:
(Hansen HP et al, 2002)
Denne studien hadde få deltakere (88 personer fordelt på hhv lavprotein og normalprotein kosthold fulgt i 4 år, og hvor effektestimat død og ESRD kun er presentert som kombinert endepunkt). Det var få hendelser, og vi har presentert død og ESRD separat med absolutt tall i evidensprofilen.
De øvrige effektestimatene: Endring i eGFR, endring i albuminuri, endring i serum albumin og endring i HbA1c er hentet fra samleoversikten av nyere dato, (Nezu U et al. 2013). Denne samleoversikten omfattet 13 RCTs, 779 pasienter, oppfølgingstid 3-60 måneder, og involverte også arbeidene som er presentert i de to tidligere samleoversiktene. En bias i samtlige samleoversikter er at de vesentlig omfatter studier på type 1-diabetes, studier på type 2-diabetes er få. I meta-analysen til Nezu et al er det signifikant i GFR med lavprotein kost (5.82 ml/min/1.73 m2, 95% KI 2.30-9.33, n=624), men med høy grad av heterogenitet (I=92%). Utfallet var imidlertid konsistent uavhengig av type diabetes, stadium av nyresykdom og varighet av oppfølging. I denne og andre studien er utfallet avhengig av compliance med intervensjonen, som hos noen pasienter viser seg vanskelig.
Evidensgraden for samtlige effektmål regnes som lav-svært lav.
Vurdering
Fordeler og ulemper
Diabetisk nyreskade er forbundet med hyperfiltrasjon og økt trykk i karnøstene i begynnerstadiet, og etter hvert fallende nyrefunksjon. Høyt proteininntak er i seg selv forbundet med høyt filtrasjonstrykk i karnøstene, og kunne tenkes å bidra til progresjon i nyreskaden. Fra en teoretisk synsvinkel skulle kanskje redusert proteininntak i kosten kunne senke filtrasjonstrykket i nyrene, og forsinke progresjonen i nyreskaden.
De norske anbefalingene for kost og ernæring anbefaler at karbohydrat bør bidra med 45–60 E%, fett med 25–40 E% og protein med 10–20 E%. Dette tilsvarer et proteininntak på i gjennomsnitt 1.2 g protein/ kg kroppsvekt/ døgn. I intervensjonsforsøk på personer med nedsatt nyrefunksjon har man forsøkt reduksjon av proteininntaket til 0.8 g protein/ kg kroppsvekt/ døgn og sågar helt ned til 0.3 g protein/ kg kroppsvekt/ døgn.
Nytten av en slik kostomlegging må veies opp mot ulemper som ekstra kostnader i kostholdet, vanskelig compliance med så lavt proteininntak, dobbelt hushold i matlagingen, og også fare for ufullstendig proteintilførsel i forhold til det kroppslige behov. Det siste kan være et spesielt problem ved type 1-diabetes, som i utgangspunktet er en sterkt katabol tilstand som motvirkes etter beste evne ved dosering av insulin.
Kvalitet på dokumentasjonen
Dokumentasjonen preges av små studier, fortrinnsvis utført på personer med type-1 diabetes, ikke type 2-diabetes. Konfidensintervallene er vide, og evidensen usikker. Dertil kommer at etterlevelse av intervensjonen har vært et stort problem i studiene. Det foreskrevne protein-inntaket i studiene varierte fra 0.3-0.8 g protein/ kg kroppsvekt/ døgn, mens det virkelige proteininntaket var 0.6-1.1 g protein/ kg kroppsvekt/ døgn. Dette bidrar i seg selv til stor usikkerhet i fortolkningen av studiene.
Verdier og preferanser
Erfaringsmessig er det vanskelig for pasientene å opprettholde et kosthold med lavt proteininntak (<0.8 kg protein/ kg kroppsvekt/ døgn). Diabetes er i seg selv en sykdom som krever stor grad av kostholdstilpasning selv uten nyresykdom. Kosten tilpasses med langsomt absorberbare karbohydrater. Dertil opplever noen en bedret glukoseregulering ved å redusere energiinntaket av karbohydrater og å øke energiinntaket i form av proteiner. Sterke kutt i kostens proteininntak av noen, men neppe alle, oppleves som forringet livskvalitet. I mange tilfeller vil dette også i visse familier medføre dobbel matlaging. Dette må veies opp mot den gevinst, eller kanskje begrensede gevinst, kostomleggingen gir for fremtidig helse. Muligheten til å etterleve kostomleggingen vil være avhengig av personlig motivasjon, kunnskap, og personlige ressurser.
Referanser
390. Effect of low-protein diet on kidney function in diabetic nephropathy: meta-analysis of randomised controlled trials https://www.helsedirektoratet.no/referanse/0002-0013-232378
391. Protein restriction for diabetic renal disease https://www.helsedirektoratet.no/referanse/0002-0013-232379
392. Effect of dietary protein restriction on prognosis in patients with diabetic nephropathy https://www.helsedirektoratet.no/referanse/0002-0013-232380
393. Low-protein diet for diabetic nephropathy: a meta-analysis of randomized controlled trials https://www.helsedirektoratet.no/referanse/0002-0013-232381
372. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease https://www.helsedirektoratet.no/referanse/0002-0013-232360
Sist faglig oppdatert: 14.09.2016
Kosthold med høyt proteininnhold og lavt innhold av karbohydrater hos personer med diabetes type 2 og moderat albuminuri
- Det finnes ikke evidens som tilsier at helsepersonell bør fraråde høyprotein/lavkarbo-kosthold for en pasient med diabetes type 2 og moderat albuminuri og normal eGFR, dersom pasienten ønsker dette under vektreduksjon.
- Pasienter med diabetes type 2, overvekt, moderat albuminuri, men normal eGFR kan følge et høyprotein/lavkarbo-kosthold forutsatt at albumin/kreatinin-ratio og nyrefunksjonsprøver måles jevnlig.
Praktisk – slik kan anbefalingen følges
Høyprotein kosthold kan hos personer med permanent nyreskade lage hyperfiltrasjon i nyrene og forverre nyreskaden. Dette vil da arte seg som økende proteinuri og/ eller fall i eGFR. Det er derfor viktig at nyreparametrene følges nøye (kreatinin, AKR).
Begrunnelse – dette er anbefalingen basert på
Det har vært vanskelig å finne forskning av god kvalitet på dette området. I tillegg skårer de studiene som svarer best på problemstillingen lavt på evidensprofilen. Samtidig er det heller ikke noe som tyder på at dette er skadelig. Arbeidsgruppen vil derfor ikke fraråde at lavkarbo/høyprotein kosthold kan brukes i vektreduksjonsøyemed for overvektige personer med diabetes type 2 og moderat albuminuri, under forutsetning at albuminuri og nyrefunksjon kontrolleres jevnlig underveis.
Forskningsgrunnlag
Populasjon (P): Personer med type 2 diabetes og mild-moderat nyresykdom
Tiltak (I): Høyprotein/lavkarbo-kosthold
Sammenligning (C): Standard diabetes-kosthold
Beskrivelse av inkluderte studier
Utfall gruppen opprinnelig interesserte seg for - og graderte mellom Kritisk (9-7), Viktig (6-4) og Mindre viktig (3-1):
- Død-KRITISK (9)
- CVD-KRITISK (8)
- ESRD-KRITISK (8)
- Betydelig proteinuri (tidligere kalt makroalbuminuri)-KRITISK (7)
- Moderat albuminuri (tidligere kalt mikroalbuminuri)-VIKTIG (5)
- Dobling av plasma kreatinin-KRITISK (7)
- Vektreduksjon-VIKTIG (5)
For besvarelse av dette PICO-spørsmålet fant vi 2 RCT, ingen systematiske oversikter. Begge studiene hadde lav evidensgrad med få inkluderte pasienter, få hendelser, og statistikk-beregning uten konfidensintervall.
Utfall 1. Død-KRITISK (9) ble rapportert i 1 rapport (Facchini FS & Saylor KL, 2003). Evidensgraden er svak med 170 deltakere i 3.9 +/- 1.8 års oppfølging, intervensjonsdietten hadde et spesielt innslag av lavt jerninnhold og høyt polyfenol innhold. Antall hendelser var få, og konfidensintervall er ikke oppgitt. Ingen sikker forskjell i utfallmålet. Evidensgraden bedømmes som lav.
Utfall 2. ESRD-KRITISK (8) er bedømt i (Facchini FS & Saylor KL, 2003) samme betraktninger som ovenfor. Ingen sikker forskjell i utfallmålet. Evidensgraden bedømmes som lav.
Utfall 6. Dobling av plasma kreatinin-KRITISK (7) er bedømt i (Facchini FS & Saylor KL, 2003), samme betraktninger som ovenfor. Ingen sikker forskjell i utfallmålet. Evidensgraden bedømmes som lav.
I tillegg har vi bedømt utfall endring i eGFR, 1 rapport (Tirosh A, et al, 2013), lav evidens. Studien involverte kun 45 pasienter med diabetes type 2 ut fra et totalutvalg på 318 personer, fordelt på 3 dietter (høyprotein-lavkarbodiett, Middelhavsdiett, lavfettdiett). To års oppfølging hvor personene i høyproteindiett hadde et relativt lavt proteininntak ved studieslutt (22 E%), få hendelser og ingen konfidensintervall. Ingen sikker forskjell i utfallmålet. Evidensgraden bedømmes som lav.
Referanser
394. A low-iron-available, polyphenol-enriched, carbohydrate-restricted diet to slow progression of diabetic nephropathy https://www.helsedirektoratet.no/referanse/0002-0013-232382
395. Renal function following three distinct weight loss dietary strategies during 2 years of a randomized controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-232383
Sist faglig oppdatert: 14.09.2016
Retinopati og regelmessig netthinneundersøkelse ved diabetes
Hyppighet av netthinneundersøkelse ved diabetes
For netthinneundersøkelse (netthinnefoto + gradering av foto) med hensikt å diagnostisere eventuell diabetisk retinopati anbefales det at:
- Pasienter med diabetes type 2 henvises til regelmessig netthinnefotografering i spesialisthelsetjenesten ved diagnosetidspunkt
- Pasienter med diabetes type 1 henvises fem år etter diagnosetidspunkt
Resultatet av undersøkelsen (gradering av netthinnefoto) avgjør den videre oppfølgingen. Dersom det ikke er tegn til retinopati er det tilstrekkelig med kontroll med ny netthinneundersøkelse (netthinnefoto + gradering) hvert annet år.
Praktisk – slik kan anbefalingen følges
Avgjøre undersøkelses-intervall
Risikofaktorer som må tas med i vurderingen når man bestemmer undersøkelses-intervall:
- Diabetesvarighet
- HbA1c
- U-albumin
- Blodtrykk
Den som graderer netthinnefoto (øyelegen eller annet helsepersonell som tilfredsstiller kravet til tolkning/gradering) må også kjenne til forekomst eller fravær av disse risikofaktorene ved gradering av netthinnefotografi, og det er derfor viktig at disse opplysningene følger med i henvisningen.
Det er viktig at intervallene for de anbefalte undersøkelsene ikke overskrides. Man må presisere overfor pasientene at de ikke må tolke sjeldnere innkalling som signal om at faren er over. Det er viktig at de kontakter øyelege eller fastlege dersom de opplever synssvekkelse mellom de oppsatte avtalene, eller hvis diabetessykdommen eller blodtrykket har kommet ut av kontroll.
Regelmessige netthinneundersøkelser av barn og gravide med kjent diabetes
For barn og gravide vises det til egne retningslinjer. Gravide kvinner med kjent diabetes før svangerskapet bør undersøkes hos øyelege så tidlig som mulig i svangerskapet. Det anbefales stedlig kontroll hos øyelege, og ikke kun netthinnefoto og gradering. Fordi retinopati erfaringsmessig kan forverres i løpet av svangerskapet bør pasienter som planlegger å bli gravide, ha god kontroll på sin retinopati. Se kapitlet Svangerskap ved kjent diabetes og Norsk gynekologisk forenings Veileder i fødselshjelp fra 2014.
Pasienter med svangerskapsdiabetes trenger vanligvis ikke vurdering av øyelege eller netthinneundersøkelse (netthinnefoto + gradering).
Begrunnelse – dette er anbefalingen basert på
Mangelen på komparative undersøkelser svekker evidenskraften på den foreliggende forskningslitteraturen. Studiene preges av stor heterogenitet, seleksjonsbias og upresise effektestimater. Resultatene peker likevel i samme retning: Det er fornuftig ressursbruk og medisinsk forsvarlig å forlenge undersøkelses-intervallene for selekterte lavrisikogrupper uten påvist retinopati til hvert 2. år.
Systematisk øyeundersøkelse med tanke på diabetisk retinopati er kostnadseffektivt (Javitt, 1996). Laserbehandling kan redusere diabetesrelatert blindhet med minst 60 %. Nyere injeksjonsbehandling (intravitreale anti VEGF/dexametasonimplantater) vil kunne redusere dette ytterligere. Norske data tyder på at mange personer med diabetes ikke har blitt undersøkt regelmessig av øyelege og at behandlingen av øyekomplikasjoner av den grunn igangsettes for sent (Claudi 2008, Cooper 2013, Berthelsen 2013, Kilstad 2012, Bakke 2017). Dette kan føre til alvorlige øyekomplikasjoner og synsnedsettelse som kunne vært forhindret ved tidligere diagnostikk og behandling.
Forskningsgrunnlag
Populasjon (P): Personer med diabetes type 1 eller type 2 uten kjent retinopati
Tiltak (I): Screening hvert 2. år
Sammenligning (C): Screening hvert år
Beskrivelse av inkluderte studier
Misra, A et al 2009, er en kohortestudie, 20 788 deltagere med 17 års oppfølging og totalt 63 622 screeningepisoder. 4,9 % utviklet retinopati som krevde henvisning. Studien observerte en fallende insidens av synstruende retinopati, sannsynligvis fordi screeningprogrammet medførte tidligere diagnose. De konkluderte med at screeningintervall opp til 24 måneder kan vurderes for pasienter med lav risiko for utvikling av diabetisk retinopati. Pasienter som fikk insulinbehandling ble ekskludert, det samme ble pasienter som ble fulgt opp av øyelege. Studien ble derfor nedgradert pga. usikker appliserbarhet.
NB! Ordet 'screening' er brukt i PICO-spørsmålet da dette var søkerord, og er et ord som brukes for 'systematisk øyeundersøkelse' i internasjonal litteratur, selv om Helsedirektoratets bruk og definisjon av ordet 'screening' i øvrige sammenhenger er forbeholdt en systematisk undersøkelse av en frisk og symptomfri befolkningsgruppe.
Vurdering
Fordeler og ulemper
Diabetisk retinopati gir ofte få symptomer før synstap inntrer. Systematiske netthinneundersøkelser av personer med diabetes er derfor nødvendig for å påvise retinopati med tanke på igangsetting av tidlig behandling for å forhindre synstap. 25 - 40 % av personer med diabetes i Norge får ikke foretatt regelmessig undersøkelse hos øyelege med tanke på diagnostikk og evt. behandling av diabetiske øyekomplikasjoner (Kilstad 2012, Claudi 2008, Bakke 2017). Data fra 2013 fra Norsk diabetesregister for voksne viser at det er innrapportert data om øyelegeundersøkelse hos henholdsvis 50,8 % ved diabetes type 1 (Cooper 2013), og 32,5 % ved diabetes type 2 (Norsk diabetesregister for voksne Noklus).
Det finnes ingen nasjonale data om forekomst av alvorlig synssvekkelse eller blindhet pga. diabetes. Vi har få data om forekomst og behandling av diabetisk retinopati i Norge. En nyere undersøkelse fra Tromsø viste en forekomst av retinopati på 26,8 % og av makulaødem på 3,9 % (Bertelsen 2013, Kilstad 2012). Flere pasienter enn det som er tilfelle i dag ville derfor hatt fordel av behandlingen hvis den hadde blitt igangsatt tidlig nok (Javitt 1996).
Kvalitet på dokumentasjonen
Anbefalingen baserer seg i hovedsak på to studier. Den ene av Taylor-Philips et al i 2014 er en systematisk oversiktsartikkel som inkluderte totalt 262 541 pasienter. De konkluderer med at undersøkelses-intervallet trygt kan forlenges til to år eller mer hos personer med diabetes type 2 og lav risiko for utvikling av retinopati. Grunnet lav reliabilitet og validitet i studiene ble ikke evidensgrunnlaget vurdert som tilstrekkelig for å konkludere med økt eller redusert undersøkelses-intervall.
Den andre (Misra al 2009) er en kohortestudie, 20788 deltagere, hovedsakelig med diabetes type 2, 17 års oppfølging og totalt 63622 screeningepisoder. De påviste ikke signifikant forskjell mellom undersøkelse hvert annet år sammenlignet med årlig undersøkelse for å påvise henvisningskrevende retinopati (OR 0,93, CI 0,82-1,05) eller påvisning av synstruende retinopati (OR 1,05, CI 0,72-1,52). De konkluderte med at undersøkelses-intervall opp til 24 måneder kan vurderes for pasienter med lav risiko for utvikling av diabetisk retinopati. Studien ble nedgradert pga. usikker appliserbarhet.
De reviderte svenske Nationella riktlinjer för diabetesvård fra 2015 anbefaler øyebunnsfotografering hvert tredje år ved diabetes type 2 uten øyebunnsforandringer, og gir anbefalingen prioritet 1.
Porta et al. (Diabetologia 2013) undersøkte risiko for å utvikle henvisningskrevende retinopati over en seksårsperiode etter en negativ systematisk undersøkelse, i en populasjon på 4320 pasienter. De konkluderte med at man trygt kunne undersøke hvert 2. år og at lengre intervall kunne vurderes under forutsetning av at man hadde god kvalitet på undersøkelsesprosedyrene og at alle som ikke møtte etter innkalling ble fulgt opp.
Stratton et al (Diabetes Care 2013) fant i en prospektiv undersøkelse som inkluderte 14 554 pasienter (type diabetes er ikke angitt) en årlig progresjon til synstruende diabetisk retinopati på 0.7 % hos personer med diabetes og to negative netthinnefotografier med ett års intervall. Hos personer med kjent mild retinopati i ett øye utviklet 1,9 % synstruende retinopati årlig. Deres konklusjon er at undersøkelses-intervallet kan varieres ut fra om pasienten har kjent retinopati eller ikke.
En retrospektiv kohortestudie fra 2011 (basert på The Scottish Diabetic Retinopathy Screening Programme) som inkluderte 155 114 pasienter uten kjent retinopati eller makulopati fra perioden 2005 - 2011 (Looker HC, Diabetologia 2013), fant at utviklingen av diabetisk retinopati var høyere for pasienter som fikk påvist retinopati ved baseline (1,2 % vs. 8,1 % ved type 1, og 0,6 % vs. 5,1 % ved diabetes type 2). En økning av undersøkelses-intervallet fra ett til to år ville øke risiko for å utvikle henvisningskrevende retinopati fra <=0,02 % til <= 0,22 % ved diabetes type 2. Det ville også redusert antall netthinnefotografier (netthinneundersøkelser) med ca. 40 %.
Chalk D (Diabetes Care 2012) konkluderte i en simuleringsmodell at systematisk undersøkelse hvert annet år hos personer med diabetes type 2 og ingen kjent retinopati er trygt og kostnadseffektivt. De beregnet at det ville redusere kostnadene med ca. 25 % sammenliknet med årlig undersøkelse.
Aspelund T (Diabetologia 2011) har utviklet en individuell risikovurdering med tanke på hyppigheten av systematisk undersøkelse for retinopati. Eksempelvis anbefaler de intervall på 53 måneder hos en mann med diabetes type 2 uten retinopati og med et blodtrykk på 130/80 mmHg og en HbA1c på 7 %. Dersom HbA1c var 10 % ble tilsvarende intervall 17 måneder. Dette er pt. er en lite aktuell strategi i Norge.
En undersøkelse fra Diabetic Retinopathy Screening Service fra Wales omfattet 57 199 personer med diabetes type 2 som hadde sin første "retinascreening" (netthinneundersøkelse) i perioden 2005-2009. 40 % av disse hadde minst en ny undersøkelse og ble inkludert i studien. Konklusjonen var at personer med diabetes type 2 uten kjent retinopati kan undersøkes hvert 2. år. Personer med diabetesvarighet over 10 år og som bruker insulin bør undersøkes årlig.
SIGN konkluderte med at retinascreening hvert 2. år var trygt og kostnadseffektivt. http://www.nsd.scot.nhs.uk/services/screening/drs/...). Den canadiske diabetesforeningen anbefaler i sin "Clinical Practice Guideline Expert Comittee" at oppfølgende retinopatikontroller skreddersys den enkelte pasient, slik at de med ingen eller meget lett retinopati anbefales undersøkt hvert 1-2 år.(Can.J Diabetes 37(2013) S137-S141.
NICE anbefaler imidlertid i 2002 årlige screeninger. Grade D, basert på evidensnivå IV (expert opinion), (Diabetic Retinopathy: Early Management and Screening. NICE website, www.nice.org.uk og det gjentas i "UK National Screening Comittee. Diabetic Eye Screening: Commission and provide. NHS diabetic eye screening(DES) programme and Population programmes."Provide diabetic eye screening".2.jan.2015.
Britiske retningslinjer tar ikke hensyn til risikostratifisering ved "ingen retinopati". Det kan være årsaken til at de anbefaler årlig netthinnefotografering uansett utfall av undersøkelsen.
Til tross for svakheter ved flere av studiene, er konklusjonen at det er god evidens for å forlenge undersøkelses-intervallet til to år hos pasienter som ikke har kjent diabetisk retinopati.
Verdier og preferanser
Studier (Strain WD, 2014) viser at frykten for blindhet er en hovedbekymring for personer med diabetes. Helsedirektoratet mener derfor at flesteparten av pasientene vil støtte tiltak som har vist seg å redusere faren for blindhet og svaksynthet, og at de vil støtte innføring av regelmessige netthinneundersøkelser for diabetisk retinopati i Norge.
Som pasient vil man bli innkalt sjeldnere dersom man tilhører lav-risikogruppen. Samtidig vil undersøkelses-intervallet tilpasses etter risiko for utvikling av synstruende forandringer. På denne måten spares pasientene for unødvendige kontroller, samtidig som de som trenger det mest, får bedre mulighet for oppfølging. Data tyder på at antall besøk kan reduseres med 25 - 59 %.
Helsedirektoratet mener at personer med diabetes vil foretrekke å komme sjeldnere til netthinnefotografering når det er medisinsk forsvarlig, og når det gjøres for å styre ressursene til de som trenger det mest.
Ulempen kan være en dårligere compliance hos pasientene når undersøkelsen foretas sjeldnere. Hos noen pasienter vil man også påvise en nyoppstått retinopati på et noe senere tidspunkt enn ved årlige kontroller. De studier gruppen har vurdert tyder ikke på at dette er et alvorlig problem som vil føre til mer senkomplikasjoner og synstap.
Referanser
396. Predicted impact of extending the screening interval for diabeticretinopathy: the Scottish Diabetic Retinopathy Screening programme https://www.helsedirektoratet.no/referanse/0002-0013-232384
397. New blindness in diabetes reduced by more than one-third in Stockholm County https://www.helsedirektoratet.no/referanse/0002-0013-232385
398. Trends in yeld and effects of screening intervals during 17 years of a large UK community -based diabetic retinopathy screening programme https://www.helsedirektoratet.no/referanse/0002-0013-232386
399. Kvaliteten på diabetesbehandlingen i allmennpraksis https://www.helsedirektoratet.no/referanse/0002-0013-232387
400. Quality of care for patients with type 2 diabetes in primary care in Norway is improving https://www.helsedirektoratet.no/referanse/0002-0013-232388
401. The Norwegian Diabetes register for adults– an overview of the first years https://www.helsedirektoratet.no/referanse/0002-0013-232389
402. Behandling av type 1-diabetes i spesialisthelsetjenesten https://www.helsedirektoratet.no/referanse/0002-0013-232390
403. Årsrapport for 2013 med plan for forbedringstiltak http://www.noklus.no/Portals/2/Diabetesregisteret/Arsrapport%20Norsk%20diabetesregister%20for%20voksne%202013.pdf
404. prevalence and risk factors of diabetic retinopathy https://www.helsedirektoratet.no/referanse/0002-0013-232392
405. Prevalence of diabetic retinopathy in Norway: report fra a screening study https://www.helsedirektoratet.no/referanse/0002-0013-232393
406. Clinical Characteristics influence screening intervals for diabetic retinopathy https://www.helsedirektoratet.no/referanse/0002-0013-232394
407. A simple risk stratification for time to development of sight-threatening diabetic retinopathy https://www.helsedirektoratet.no/referanse/0002-0013-232395
408. Can the retinal screening interval be safely increased to 2 years for type 2 diabetic patients without retinopathy? https://www.helsedirektoratet.no/referanse/0002-0013-232396
409. Individual risk assessment and information tecnology to optimise screening frequency for diabetic retinopathy https://www.helsedirektoratet.no/referanse/0002-0013-232397
410. https://www.helsedirektoratet.no/referanse/0002-0013-232398
411. Socialstyrelsen Nationella riktlinjer for diabetesvård https://www.helsedirektoratet.no/referanse/0002-0013-232399
412. Time to do more: Addressing clinical inertia in the management of type 2 diabetes mellitus https://www.helsedirektoratet.no/referanse/0002-0013-232400
413. Cost-effectiveness of detecting and treating diabetic retinopathy https://www.helsedirektoratet.no/referanse/0002-0013-232401
414. Scottish Practic Retinopathy Screening (Service) Colloborative Website 2011.Training and accreditation standards og Training and Education, Roal College of Ophtalmology: igital Retinopathy Guidelines, des.2012. Royal College of Ophtalmologists: Preferred Practice Guidance.2010. Diabetic Retinopathy Screening and the Ophtalmology Clinic set up in England https://www.helsedirektoratet.no/referanse/0002-0013-232402
415. Diabetic retinopathy screening: a systematic review of the economic evidence https://www.helsedirektoratet.no/referanse/0002-0013-232403
416. Incidence of diabetic retinopathy in people with type 2 diabeters mellitus attending the Diabetic Retinopathy Screen Service for Wales: retrospective analysis https://www.helsedirektoratet.no/referanse/0002-0013-232404
417. Claudi T, Cooper JG, Midthjell K, Daae C, Furuseth K Hansen KF. NSAMs handlingsprogram for diabetes i allmennpraksis.Skriftserie for leger. Utdanning og kvalitetssikring. Norsk selskap for allmennmedisin, Den norske legeforening, Norges Diabetesforbund, Statens institutt for folkehelse. 2000 https://www.helsedirektoratet.no/referanse/0002-0013-232405
418. Kristinsson et al. Active Prevention in diabetic eye disease.14 year follow up. Acta Ophtalmol.Scand. 1997; 75:249-254. https://www.helsedirektoratet.no/referanse/0002-0013-232406
433. Type 2 diabetes in general practice in Norway 2005-2014: moderate improvements in risk factor control but still major gaps in complication screening. https://www.helsedirektoratet.no/referanse/0002-0013-232421
Sist faglig oppdatert: 12.09.2018
Netthinnefotografering av personer med diabetes: krav til kompetanse hos helsepersonell som tar netthinnefoto
Det anbefales at personell som tar netthinnefoto for diabetisk retinopati har dokumenterte kvalifikasjoner i digital netthinnefotografering.
Praktisk – slik kan anbefalingen følges
Hvordan sikre god kvalitet av netthinnefoto
Kvaliteten på netthinnefotograferingen er avgjørende for at man skal kunne påvise diabetiske øyekomplikasjoner hos de personene som undersøkes. Forutsetningen for høy kvalitet (høy sensitivitet og spesifisitet) på vurdering og gradering av diabetisk retinopati, er gode bilder. Dette krever oppdaterte digitale fotoløsninger, kvalifisert personell som sikrer riktig fremgangsmåte ved selve fotograferingen, adekvate IT-systemer for behandling og lagring av bilder, adekvat journalsystem for dokumentasjon av funn og en ensartet standard for gradering av funn. Et kvalitetskrav bør være at undersøkelse og vurdering av bildene har en sensitivitet på minst 80 % og en spesifisitet på minst 90 % for oppdagelse av diabetisk retinopati. (Royal College of Ophtalmology: Digital Retinopathy Guidelines, 2010).
Det er arbeidsgivers lovpålagte ansvar å sikre den nødvendige kompetanse hos helsepersonell som skal foreta øyeundersøkelsen. (Jamfør spesialisthelsetjenesteloven og helse- og omsorgstjenesteloven, som presiserer at arbeidsgiver er ansvarlig for å sikre at helsepersonellet har tilstrekkelig kompetanse tilpasset oppgavene de skal utføre, herunder sørge for opplæring, etter- og videreutdanning). I henhold til helsepersonelloven stilles det også krav til personellet om faglig forsvarlighet, så ved behov for bistand i utførelsen av øyeundersøkelsen, må dette innhentes.
Oppdatert informasjon med hensyn til kvalifikasjoner hos personell som skal foreta fundusfotografering og gradering, samt tekniske krav til fotograferingsutstyr er gitt i flere britiske databaser:
- Scottish Practic Retinopathy Screening (Service) Collaborative Website 2011. Training and accreditation standards og Training and Education
- Royal College of Ophtalmology: Digital Retinopathy Guidelines, 2012
- Royal College of Ophtalmologists: Preferred Practice Guidance, 2010
- UK National Screening Comittee. Diabetic Eye Screening: Commission and provide
- NHS diabetic eye screening (DES) programme and Population programmes
- UK National Screening Committee anbefaler i sitt Diabetic Eye Screening Programme at undersøkelsen skal foretas av akkrediterte undersøkere. (NHS september 2013).
Som del av Nasjonal diabetesplan (2017-2021) utarbeidet Helsedirektoratet i 2018 Anbefalt program for regelmessige netthinneundersøkelser for diabetisk retinopati som anbefaler hvordan organiseringen av regelmessige netthinneundersøeksler bør foregå og der de regionale helseforetak får ansvaret for å gjennomføre dette i sin region. Dette programmet inneholder krav til kompetanse for de aktører som skal foreta undersøkelsen/ta netthinnefoto, samt krav til kompetanse hos de aktører som graderer netthinnefoto.
Begrunnelse – dette er anbefalingen basert på
Der regelmessige netthinneundersøkelser for diabetisk retinopati er gjennomført av kvalifisert personell, har man vist at insidensen av blindhet og redusert synsstyrke går ned (Algardh 1993, Kristinsson 1997, Stephansson 2000, Liew 2014).
Øyeleger opplever at undersøkelser med dårlig spesifisitet fører til en rekke unødvendige henvisninger til spesialisthelsetjenesten. Opplært helsepersonell vil i større grad kunne ta bilder av høy kvalitet slik at spesifisiteten og sensitiviteten av screeningen blir høyest mulig. Det kreves også opplæring i håndtering av teknisk utstyr for å sikre god reproduserbarhet av bildene (viser til kapittel 5 i Helsedirektoratets rapport IS-2752: "Anbefalt program for regelmessige netthinneundersøkelser for diabetisk retinopati", april-2018).
Forskningsgrunnlag
Populasjon (P): Personer med diabetes
Tiltak (I): Screening med fundusfoto foretatt av kvalifisert helsepersonell
Sammenligning (C): Screening med fundusfoto foretatt av ikke kvalifisert personell
Beskrivelse av inkluderte studier
Anbefalingen baserer seg på en studie av Bragge 2011. Dette er en metaanalyse fra Nord-Amerika, Australia, India og Asia. 3 576 personer / 6 372 øyne. Ikke spesifisert diabetes type 1 eller type 2. Gjennomsnittsalder 58 år. Gjennomsnittlig diabetesvarighet 11 år, 45 % kvinner. Betydelig variasjon i diabetesprevalens i de inkluderte studiene, gjennomsnitt 46 %, variasjon 9 - 85 %.
Utfallet av de forskjellige undersøkelsessituasjoner angis som sensitivitet og spesifisitet for deteksjon av diabetisk retinopati. Utfallene sammenliknes på tvers av undersøkelsesgruppene (odds ratio). Referansestandard oppgis som 7 felts øyebunnsfoto eller oftalmoskopi i mydriasis av øyespesialist. Variasjon i medisinsk kvalifikasjon påvirket ikke i signifikant grad sensitivtet for deteksjon av diabetes retinopati. Odds ratio kvalifisert/ikke kvalifisert personell 1.25 (95 % CI, 0.31-5.12).
Variasjon i medisinsk kvalifikasjon påvirker i signifikant grad spesifisitet for deteksjon av diabetes retinopati. Odds ratio kvalifisert/ikke kvalifisert personell 3.86 (95% CI, 1.78-8.37). Utfallet er et gjennomsnitt vurdert for undersøkelsene uten mydriasis 5.65, (95% CI, 2.24-14.25) og med mydriasis 2.24, (95% CI, 0.86-6.84)
NB! Ordet 'screening' er brukt i PICO-spørsmålet da dette var søkerord, og er et ord som brukes for 'systematisk øyeundersøkelse' i internasjonal litteratur, selv om Helsedirektoratets bruk og definisjon av ordet 'screening' i øvrige sammenhenger er forbeholdt en systematisk undersøkelse av en frisk og symptomfri befolkningsgruppe.
Vurdering
Fordeler og ulemper
Regelmessig netthinnefoto utført av øyelege/spesialutdannet helsepersonell gir best sensitivitet og spesifisitet med tanke på påvisning av diabetisk retinopati. Særlig spesifisiteten er vesentlig høyere ved undersøkelse av spesialutdannet helsepersonell (OR 3.86, CI 1.78 – 8.37). Det samlede effektestimatet for spesifisitet viser en favør av utdannet personell for screening av retinopati (p=0.001) og tyder på at spesifisiteten øker med kunnskapsnivå hos undersøker.
Kvalitet på dokumentasjonen
Kvaliteten på den foreliggende dokumentasjon vurderes som relativt lav. Artikkelen til Bragge (2011, metaanalyse som inkluderte 2555 pasienter i syv kohortestudier) ble nedgradert på grunn av usikker appliserbarhet til norske forhold (høyere forekomst av retinopati, delvis foretatt i spesialklinikker), stor heretogenisitet i de inkluderte studiene og upresist effektestimat.
Verdier og preferanser
Kvaliteten på netthinnefoto påvirkes av undersøkelsesforhold og av kunnskapsnivå hos undersøker. Dette gjelder særlig spesifisitet, det vil si undersøkelsens evne til å skille mellom sanne positive og falske positive resultater.
Helsedirektoratet mener at brukerne vil være tjent med at det nå innføres et program for regelmessig netthinnefotografering for diabetisk retinopati med veldefinerte krav til personell som utfører undersøkelsen og krav til metode for undersøkelse.
Referanser
399. Kvaliteten på diabetesbehandlingen i allmennpraksis https://www.helsedirektoratet.no/referanse/0002-0013-232387
400. Quality of care for patients with type 2 diabetes in primary care in Norway is improving https://www.helsedirektoratet.no/referanse/0002-0013-232388
401. The Norwegian Diabetes register for adults– an overview of the first years https://www.helsedirektoratet.no/referanse/0002-0013-232389
419. Screening and prevention of diabetic blindness https://www.helsedirektoratet.no/referanse/0002-0013-232407
420. A 4-year follow-up https://www.helsedirektoratet.no/referanse/0002-0013-232408
421. A comparison of the causes of blindness certifications in England and Wales in working age aldults (16-64 years), 1999-2000 With 2009-2010 https://www.helsedirektoratet.no/referanse/0002-0013-232409
422. Diabetic Retinopathy Guidelines http://www.icoph.org/dynamic/attachments/taskforce_documents/2012-sci-267_diabetic_retinopathy_guidelines_december_2012.pdf
423. "Provide diabetic eye screening" https://www.helsedirektoratet.no/referanse/0002-0013-232411
424. Peter Bragge PhD et al. Screening for the presence or absence of diabetic rethinopathy: a metaanalysis. Arch Ophtalmol. 2011:129(4); 435-444 https://www.helsedirektoratet.no/referanse/0002-0013-232412
433. Type 2 diabetes in general practice in Norway 2005-2014: moderate improvements in risk factor control but still major gaps in complication screening. https://www.helsedirektoratet.no/referanse/0002-0013-232421
Sist faglig oppdatert: 12.09.2018
Tolking av netthinnefoto: krav til kompetanse hos helsepersonell som skal gradere resultatet av undersøkelsen
Øyelege eller annet kvalifisert helsepersonell bør gradere netthinnefoto tatt ved regelmessig netthinneundersøkelse for diabetisk retinopati. Graderingen kan deles i primærgradering og sekundærgradering.
Optiker, øyesykepleier eller annet kvalifisert helsepersonell med dokumenterte kvalifikasjoner kan primærgradere netthinnefoto. Øyelege med dokumenterte kvalifikasjoner kan sekundærgradere og stille endelig diagnose.
Viser til Helsedirektoratets rapport, IS-2752: "Anbefalt program for regelmessige netthinneundersøkelser for diabetisk retinopati" (lenke kommer)
Se Praktisk for klassifisering og henvisningsrutiner.
Praktisk – slik kan anbefalingen følges
Klassifikasjon av funn og epikrise
- Viser til Helsedirektoratets rapport; IS-2752: "Anbefalt program for regelmessige netthinneundersøkelser for diabetisk retinopati" (særkilt kapittel 5.5) (lenke kommer)
For klassifikasjon av funnene anbefaler vi at man benytter "International Classification of DR Scale".
Tabell for klassifisering av diabetes retinopati og makulaødem med henvisningsrutiner
Se også avsnitt 5.6.3 i "Anbefalt program for regelmessige netthinneundersøkelser" (lenke kommer)
DR = Diabetes retinopati
DMØ = Diabetisk makulaødem
| Diabetisk retinopati | Funn ved netthinnefoto | Konsekvens / videre håndtering |
| Primærgradering tilstrekkelig | ||
| Ingen synlig diabetisk retinopati (DR) | Ingen avvik | Ny netthinneundersøkelse; foto + tolkning innen 2 år |
| Mild, non-proliferativ DR | Under 10 mikroaneurismer | Ny netthinneundersøkelse; foto + tolkning innen 2 år |
| 10 eller flere mikroaneurismer og ingen andre tegn på diabetisk retinopati | Ny netthinneundersøkelse; foto + tolkning innen 1 år | |
| Sekundærgradering nødvendig | ||
| Moderat non-proliferativ DR | Mer enn kun mikroaneurismer, men ikke alvorlig non-proliferativ DR | Kontroll øyelege innen 6-12 måneder |
| Alvorlig non-proliferativ DR | Ett eller flere av følgende funn: • Intraretinal blødning (≥ 20 i hver kvadrant); • Sikker venøs beading ("perlekjededannelse") i 2 kvadranter; • Intraretinal mikrovaskulært avvik i minst 1 kvadrant; • og ingen tegn på proliferativ retinopati | Henvises straks til behandlende øyelege/øyeavdeling |
| Proliferativ DR | • Vekst av nye kar (neo-vaskularisering) og/eller • Blødning preretinalt/corpus vitreum | Henvises straks til behandlende øyelege/øyeavdeling |
| Diabetisk makulaødem (DMØ) | Funn ved dilatert oftalmoskopi* | Konsekvens / videre håndtering |
| DMØ sannsynligvis fraværende | Ingen fortykning av retina eller harde eksudater i bakre pol | Kontroll øyelege innen 2 år |
| DMØ sannsynligvis tilstede/kan ikke utelukkes | Fortykning av retina eller harde eksudater i bakre pol | Henvises straks til behandlende øyelege/øyeavdeling |
* Harde eksudater er et tegn på persisterende eller tidligere gjennomgått makulaødem. DMØ er definert som retinal fortykning, og krever en tredimensjonal undersøkelse for å kunne oppdages. Med stor grad av subjektivitet har dette vært vurdert ved å bruke kontaktglass i spaltelampe og/eller med stereo fundusfotografi etter pupilledilatasjon. I klinikken har nå OCT (optisk koherenstomografi) nesten fullstendig overtatt definisjons- og deteksjonsmessig, da ødemet med denne metoden visualiseres direkte og med større presisjon.
Begrunnelse – dette er anbefalingen basert på
Kvaliteten (høy sensitivitet og spesifisitet) på vurdering og gradering av funnene ved fundusfotograferingen er avgjørende for at man skal kunne påvise diabetiske øyekomplikasjoner ved regelmessige øyeundersøkelser. Sensitiviteten og spesifisiteten påvirkes av undersøkelsesmetode og av kvaliteten/utdanningen på det personell som utfører og vurderer resultatet av undersøkelsen (Hutchinson 2000). Der systematiske undersøkelser for påvisning av diabetisk retinopati er gjennomført, har man vist at blindhets- og svaksynsinsidensen går ned (Agardh 1993, Kristinsson 1997, Stephansson 2000, Liew 2014).
Forskjeller i sensitivitet og spesifisitet påvist mellom forskjellige yrkesgrupper i foreliggende dokumentasjon, er basert på vurdering av fundusfoto kombinert med oftalmoskopi, og ikke kun direkte oftalmoskopi.
Systematisk øyeundersøkelse med tanke på diabetisk retinopati er kostnadseffektivt (Javitt 1996). Laserbehandling kan redusere diabetesrelatert blindhet med minst 60 % (Cantril 1984, ETDRS Report number 9).
Norske data tyder på at mange personer med diabetes ikke undersøkes regelmessig av øyelege og at behandlingen av øyekomplikasjoner av den grunn igangsettes for sent (Claudi 2008, Cooper 2013, Bakke 2017). Dette kan medføre alvorlige øyekomplikasjoner og synsnedsettelse som kunne vært forhindret ved tidligere diagnostikk og behandling.
Forskningsgrunnlag
Populasjon (P): Personer med diabetes
Tiltak (I): vurdering av fundusfoto av øyelege
Sammenligning (C): vurdering av fundusfoto av "ikke sertifisert personell"-
Beskrivelse av inkluderte studier
Anbefalingen baserer seg i hovedsak på en systematisk oversiktsartikkel av Hutchinson (Hutchinson 2000). Studien inkluderte ca. 4700 pasienter fra ni observasjonsstudier. Den er nedgradert pga. stor variasjon i gradering av endepunkt på tvers av studiene. Hovedkonklusjonen var at retina-/fundus- foto vurdert av øyelege viste en sensitivitet på 88 til 99 % for å påvise proliferativ, synstruende eller henvisningskrevende retinopati. Dersom det ble benyttet fundusfoto i mydriasis var spesifisiteten like høy i de andre yrkesgruppene. Undersøkelsen viste at fundusfoto i mydriasis er den mest sensitive metode med tanke på å påvise diabetisk retinopati, spesifisitet fra 87 og 100%.
Det var stor variasjon i sensitivitet og spesifisitet når foto ble vurdert av annet personell (sensitivitet fra 25-100%, spesifisitet fra 47-100%)
Det samlede effektestimat for spesialister viser en klar fordel av av utdannet personell ved systematiske undersøkelser for retinopati (p=0.001). Dette kan tyde på at spesifisiteten øker med kunnskapsnivå, særlig gjør dette seg gjeldende når undersøkelsesforholdene ikke er optimale.
Hovedfunnet i studien er store forskjeller når det gjelder sensitivitet og spesifisitet relatert til kvalifikasjonene til helsepersonell som vurderte resultatet av fundusfotograferingen.
Vurdering
Fordeler og ulemper
Vurdering av netthinnefoto utført av spesialister i oftalmologi eller utdannet personell (herunder optiker, øyesykepleier eller annet kvalifisert personell), har gjennomgående den høyeste spesifisitet (86 - 98 %) og sensitivitet (89 - 96 %) for å påvise retinopati (Hutchinson 2000).
Dette medfører større sannsynlighet for rett diagnose, riktig vurdering av kontrollintervall og riktig tidspunkt for henvisning til videre medisinsk behandling når det er indikasjon for det.
Tolkning og vurdering av bilder utført av oftalmolog eller annet utdannet personell med klinisk erfaring, gir pga. høy spesifisitet og sensitivitet, redusert antall falske positive funn og redusert antall usikre bifunn som fører til unødvendige utredninger.
Kvalitet på dokumentasjonen
Det foreligger lite dokumentasjon som besvarer spørsmålet om i hvilken grad utdanningen til de som vurderer og graderer netthinnefoto betyr noe for sensitivitet og spesifisitet av undersøkelsen. Vi har ikke funnet kvantitative metaanalyser som besvarer vår problemstilling (studien til Evidensprofilen er bygget på en studie av Hutchinson (Diabetic Medicine 2000) som er en systematisk oversiktsartikkel basert på ni observasjonsstudier med ukjent antall pasienter totalt). Kontrollgruppen i studien bestod av allmennpraktikere, optikere, diabetologer og "trained independent graders", mens bildene i intervensjonsgruppen ble tolket av øyeleger eller kliniske assistenter.
Publiseringsskjevheter er ikke angitt, men forfattere har redegjort for en omfattende søkeprosess for å identifisere tilgjengelig og relevant litteratur.
Verdier og preferanser
Helsedirektoratet antar at de fleste pasienter vil foretrekke at billedfunnene blir vurdert av kvalifisert personell i en større klinisk sammenheng, og at også pasientene vil verdsette regelmessig netthinnefotografering hvor det settes faglige krav både til den som skal foreta undersøkelsen og til den som skal vurdere resultatet.
Referanser
419. Screening and prevention of diabetic blindness https://www.helsedirektoratet.no/referanse/0002-0013-232407
425. A comparison of the causes of blindness certifications in England and Wales in working age aldults (16-64 years), 1999-2000 With 2009-2010 https://www.helsedirektoratet.no/referanse/0002-0013-232413
426. The five year incidence of blindness after introducing a screening programmefor early detection of treatable diabetic retinopathy https://www.helsedirektoratet.no/referanse/0002-0013-232414
427. ETDRS-studien: The diabetic retinopathy study and the early treatment of diabetic retinopathy study http://www.ncbi.nlm.nih.gov/pubmed/6389409
428. Early photocoagulation for diabetic retinopathy. ETDRS report number 9. Early Treatment Diabetic Retinoptathy Study Research Group.Ophtalmology http://www.ncbi.nlm.nih.gov/pubmed/2062512/no
429. Effectiveness of screening and monitoring tests for diabetic retinopathy - a systematic review https://www.helsedirektoratet.no/referanse/0002-0013-232417
430. The diabetic retinopathy study and the early treatment of diabetic retinopathy study https://www.helsedirektoratet.no/referanse/0002-0013-232418
431. ICO Guidelines for Diabetic Eye Care http://www.icoph.org/downloads/ICOGuidelinesforDiabeticEyeCare.pdf
432. https://www.helsedirektoratet.no/referanse/0002-0013-232420
Sist faglig oppdatert: 12.09.2018
Psykiske lidelser og diabetes
Utredning av angst og depresjon hos personer med diabetes kun ved klinisk mistanke
Det er viktig med oppmerksomhet på økt forekomst av angst og depresjon hos personer med diabetes. Spørsmålene i kapittelet Kommunikasjon, mestring og motivasjon ved diabetes kan med fordel brukes som utgangspunkt for å undersøke dette.
På bakgrunn av kunnskapsgrunnlaget foreslås det likevel at personer med diabetes kun systematisk utredes for angst eller depresjon når det er klinisk indikasjon for det.
Praktisk – slik kan anbefalingen følges
Angst kjennetegnes av uro og grubling, mens kjernesymptomene ved depresjon er nedstemthet og manglende interesse og energi. Tegn på depresjon hos personer med diabetes kan være manglende etterlevelse av behandling og høyt langtidsblodsukker. Personer med diabetes som også har angst kan være overdrevent bekymret og overopptatt av av det å ha diabetes, samt ha et høyt kontrollbehov.
Følingsangst (redsel for hypoglykemi) er antageligvis vanlig, og kan føre til at personen intensjonelt tilstreber høyt blodsukker, eller måler blodsukkeret overdrevent ofte. Over tid kan denne adferden bidra til å utvikle eller opprettholde en mer generalisert angstlidelse, eller en tvangspreget måte å måle blodsukker eller sette insulin på. Det finnes ikke egne psykometriske verktøy for utredning av angst og depresjon hos personer med diabetes, og selvrapporteringsskjema og diagnostiske intervju for den generelle befolkningen må benyttes. Mye brukt i Norge er selvrapporteringsskjemaet Hospital Anxiety Depression Scale (HADS) for symptomer på angst og depresjon, og M.I.N.I Nevropsykiatrisk Intervju.
Begrunnelse – dette er anbefalingen basert på
Personer med diabetes har ca 40% økt forekomst av angst (Griegsby, journal of psychosomatic research 2002), men ingen studier har undersøkt om screening for angst hos personer med diabetes identifiserer flere personer med behandlingskrevende symptomer på angst.
Personer med diabetes har ca 50% økt forekomst av depresjon, og ca 25% økt risiko for å utvikle depresjon (ref 3 og 17 under), og det er godt dokumentert at depresjon komorbid til diabetes er assosiert med negative konsekvenser i form av redusert livskvalitet (Schram, current diabetes reviews 2009), økt risiko for komplikasjoner (Black Diabetes Care 2003) og død (Park, general hospital psychiatry 2013, van dooren plos one 2013 og hofmann plos one 2013). Flere internasjonale retningslinjer anbefaler derfor at personer med diabetes jevnlig screenes for angst og depresjon, for eksempel American Diabetes Association (ref ADA Clinical Practice Recomendations, Diabetes Care, 2014). Disse anbefalingene synes imidlertid ikke basert på studier som har undersøkt evt effekt av en slik intervensjon.
En studie fra allmennpraksis i England (McLintock K, 2014) har sett på effekt av screening for symptomer på depresjon. Denne studien viste at mange pasienter må screenes for å finne relativt få nye tilfeller (73 nye tilfeller pr 100 000 screenet pr måned).
En etnografisk studie (Alderson S, 2014) basert på direkte observasjon av konsultasjonene der screeningen ble utført, konkluderte med at screening:
- ikke passet naturlig inn i samtalen med pasienten
- førte til usikkerhet hos både pasient og helsepersonell
- skapte usikkerhet om validiteten av svarene
For at det skal være berettiget å innføre screening for angst og depresjon av pasienter med diabetes uten at det foreligger klinisk mistanke, må det være god dokumentasjon på at fordelene er klart større enn ulempene, og problemstillingen må vurderes etter 16 oppsatte kriterier beskrevet i Helsedirektoratets rapport Ny styringsstruktur og strategi for nasjonale screeningprogrammer.
Litteraturen gav ingen holdepunkter for at fordelene ved systematisk og rutinemessig undersøkelse for angst og depresjon var større enn ulempene, og følgelig har tiltaket ikke vært vurdert i henhold til Helsedirektoratets kriterier for screening.
Det er viktig med oppmerksomhet på økt forekomst av angst og depresjon hos personer med diabetes, samt konsekvensene av denne komorbiditeten. Kunnskapsgrunnlaget tilsier likevel at systematisk og rutinemessig utredning uten klinisk mistanke ikke er riktig intervensjon for å oppnå dette. Det foreslås at utredning av angst eller depresjon hos personer med diabetes iverksettes kun ved klinisk mistanke.
Forskningsgrunnlag
Populasjon (P): Alle personer med kjent diabetes type 1 og 2
Tiltak (I): Screening for angst og depresjon med validert instrument
Sammenligning (C): Ingen screening
Beskrivelse av inkluderte studier
Personer med diabetes har ca 40 til 50 prosent økt forekomst av angst (Grigsby, Journal of psychosomatic research 2002) og depresjon og ca 25 prosent økt risiko for å utvikle depresjon (Rotella F, Mannucci 2013). Samtidig gir depresjon hos personer med diabetes dårligere livskvalitet (Schram MT,et al 2009) og økt risiko for komplikasjoner (Black SA et al 2003) og (Lin EH et al 2010) og død (Park M 2013) og (Hofmann M et al 2013) og (Van Dooren FE 2013)
Få studier har undersøkt problemstillingene. Vi fant ingen studier som har undersøkt effekt av screening for angst hos personer med diabetes, ingen som undersøkte effekt av screening for depresjon på sykefravær og dødelighet, mens et par studier har undersøkt om screening for depresjon hos personer med diabetes øker sannsynligheten for utfallet identifikasjon av depresjon.
Evidensprofilen er basert på en studie med data fra allmennpraksis i England (McLintock K et al 2014)) der leger fikk økt refusjon hvis de stilte to standardiserte spørsmål om depresjon til personer med diabetes og/eller koronar hjertesykdom. Denne intervensjonen doblet oddsen for diagnose med depresjon eller forskrivninger med antidepressiva sammenlignet med før refusjon, og identifiserte 73 nye personer med depresjon pr 100 000 pr måned (Mc Lintock). En randomisert studie fra spesialisthelsetjenesten i Nederland sammenlignet «usual care» med effekten av screening for depresjon kombinert med tilbakemelding til fastlegen om resultatet hos personer med både depresjon og diabetes, både type 1 og 2. (Pouwer F et al 2011). Ved 6 måneders oppfølging hadde begge gruppene lavere depresjonsscore målt med CES-D (Centre for Epidemiologic Studies Depression Scale), men reduksjonen var like stor i begge gruppene. Videre var det ingen forskjell mellom gruppene i HbA1c eller «diabetes distress» målt ved PAID (Problem Areas in Diabetes Survey). Imidlertid økte andelen av personer som fikk hjelp fra psykisk helsevesen mer i intervensjonsgruppen (8% økning mot 3% økning i kontrollgruppen).
En cochrane review fra 2005 konkluderer med liten effekt av case finding og screening for depresjon i generell befolkning for utfallene identifikasjon av depresjon, behandling av depresjon og forløpet av depresjon (Gilbody S et al 2005). Forfatterne fraråder bruk av screening for depresjon som virkemiddel for å gi bedre helsetjenester til personer med depresjon (Gilbody S et al 2006) og (Jani BD et al 2013)
Alle utfallsmålene ble vurdert som viktige (på en skala fra kritisk-viktig-mindre viktig).
Vurdering
Fordeler og ulemper
Fordeler: økt fokus blant helsepersonell og pasienter på psykisk helse generelt og angst og depresjon spesielt. Depresjon hos personer med diabetes fører til hyppigere komplikasjoner og tidligere død, og dersom screening for depresjon hos personer med diabetes hadde redusert forekomsten av depresjon hos personer med diabetes, kunne risikoen for disse utfallene muligens blitt redusert.
Ulemper: Underminering av helsepersonell sin kliniske «teft» og kompetanse. Vanskelig å implementere i klinisk praksis (Jani BD, 2013 og Alderson S, 2014). Screening for depresjon gir generelt mange «falske» positive pr «sanne» positive (Roy T, 2012). Studien i evidensprofilen tyder på at mange må screenes for å finne relativt få nye tilfeller (73 nye tilfeller med depresjon pr 100 000 screenet pr måned) (Mc Lintock K, 2014).
Kvalitet på dokumentasjonen
Kun en studie ble inkludert i evidensprofilen (Mc Lintock K, 2014), kvalitet på evidens vurdert som lav. Nedgradert fordi studiepopulasjonen var personer med diabetes og/eller koronar hjertesykdom (og ikke bare personer med diabetes), og fordi responsraten var lav (58 %).
Verdier og preferanser
En kvalitativ, etnografisk studie basert på direkte observasjon av konsultasjoner og intervju med pasienter ble også utført ved noen av allmennpraksisene inkludert i studien i evidensprofilen (Alderson S, 2014). Forfatterne konkluderte at case finding ikke passet naturlig inn i konsultasjonene, og pasientenes reaksjon kunne langt på vei motvirke intensjonen om å finne nye tilfeller med depresjon. De mente at det å rutinemessig stille spørsmål om depresjon til alle pasientene med diabetes og koronar hjertesykdom ikke var hensiktsmessig fordi:
1) det kunne øke avstanden mellom pasienten og legens agenda
2) det førte til usikkerhet blant helsepersonell dersom de følte de ikke hadde redskaper til å følge opp eventuelt positivt svar
3) pasientene hadde vansker med å forstå hvorfor de ble spurt om symptomer på depresjon, og at det var usikkert om validiteten av svarene var god.
Referanser
434. Incentivised case finding for depression in patients with chronic heart disease and diabetes in primary care: an ethnographic study https://www.helsedirektoratet.no/referanse/0002-0013-232422
435. The effects of financial incentives for case finding for depression in patients with diabetes and coronary heart disease: interrupted time series analysis https://www.helsedirektoratet.no/referanse/0002-0013-232423
436. Challenges and implications of routine depression screening for depression in chronic disease and multimorbidity: a cross sectional study https://www.helsedirektoratet.no/referanse/0002-0013-232424
437. Screening tools used for measuring depression among people with Type 1 and Type 2 diabetes: a systematic review https://www.helsedirektoratet.no/referanse/0002-0013-232425
438. Rotella F, Mannucci. Diabetes mellitus as a risk factor for depression. A meta-analysis of longitudinal studies. Diabetes Research and Clinical Practice. 2013; 99 (2) : 98-104 https://www.helsedirektoratet.no/referanse/0002-0013-232426
439. Schram MT, Baan CA, Pouwer F. Depression and quality of life in patients with diabetes: a systematic review fro the European depression in diabetes (EDID) research consortium. Current Diabetes Revievs. 2009; 5(2):112-119 https://www.helsedirektoratet.no/referanse/0002-0013-232427
440. Black SA, Markides KS, Ray LA. Depression predicts increased incidence of adverse health outcomes in older Mexican Americans with type 2 diabetes. Diabetes Care. 2003;26(10):2822-2828 https://www.helsedirektoratet.no/referanse/0002-0013-232428
441. Lin EH, Rutter CM, Katon W, Heckbert SR, Ciechanowski P, Oliver MM et al. Depresion and advanced complications of diabetes: a prospective cohort study. Diabetes care. 2010;33 (2):264-269 https://www.helsedirektoratet.no/referanse/0002-0013-232429
442. Park M, Katon WJ, Wolf FM. Depression and risk of mortality in individuals with diabetes: a meta-analysis and systematic review. General Hospital Psychiatry. 2013; 35 (3):217-225 https://www.helsedirektoratet.no/referanse/0002-0013-232430
443. Hofmann M, Kohler B, Leichsenring F, Kruse J. Depression as a risk factor for mortality in indivudials with diabetes: a meta-analysis of prospective studies. Plos One. 2013;8 (11):e79809 https://www.helsedirektoratet.no/referanse/0002-0013-232431
444. Van Dooren FE, Nefs G, Schram MT, Verhey FR, Denollet J, Pouwer F. Depression and risk of mortality in people with diabetes mellitus: a systematic review and meta-analysis. Plos One. 2013;8 (3):e57058 https://www.helsedirektoratet.no/referanse/0002-0013-232432
445. Hermanns N1, Caputo S, Dzida G, Khunti K, Meneghini LF, Snoek F. Screening, evaluation and management of depression in people with diabetes in primary care. Prim Care Diabetes. 2013, 7(1):1-10 https://www.helsedirektoratet.no/referanse/0002-0013-232433
446. Pouwer F, Tack Cj, Geelhoed—Duijvestijn PHLM, Bazelmans E, Beekman AT, Heine RJ, Snoek FJ. Limited effect of screening for depression with written feedback in outpatients with diabetes mellitus: a randomized control trial. Diabetologia 2011, 54: 741-748 https://www.helsedirektoratet.no/referanse/0002-0013-232434
447. Gilbody S, House A, Sheldon T. Screening and case finding instruments for depression. Review. The Cochrane Collaboration. 2005, issue 4 https://www.helsedirektoratet.no/referanse/0002-0013-232435
448. Berge LI, Riise T, Fastmer OB, Lund A, Oedegaard KJ, Hundal Ø. Risk of depression in diabetes is highes for young persons using oral anti-diabetic agents. Diabetic Medicine 2012, 29; 509-514 https://www.helsedirektoratet.no/referanse/0002-0013-232436
449. Nice guidelines tilgjengelig fra http://www.nice.org.uk/guidance/cg15/chapter/1-recommendations#complications-and-associated-conditions https://www.helsedirektoratet.no/referanse/0002-0013-232437
450. American Diabetes Association. Clincial Practice Recommendations. Diabetes Care. 2014;37 (1):32 https://www.helsedirektoratet.no/referanse/0002-0013-232438
451. Canadian Diabetes Association. Clinical Practice Guidelines Expert Committee. Canadian Journal of Diabetes. 2013;37:90 https://www.helsedirektoratet.no/referanse/0002-0013-232439
452. Gilbody S, Sheldon T, Wessely S. Should we screen for depression? BMJ 2006;332:1027-1030 https://www.helsedirektoratet.no/referanse/0002-0013-232440
453. Holt RI, van der Feltz-Cornelis CM. Key concepts in screening for depression in people with diabetes. Journal of Affective Disorderes. 2012;142 supl: 72-79 https://www.helsedirektoratet.no/referanse/0002-0013-232441
Sist faglig oppdatert: 14.09.2016
Behandling av depresjon hos personer med diabetes
Depresjon hos personer med diabetes må behandles. Effekten av behandling med antidepressive legemidler og psykologisk behandling er like stor.
Praktisk – slik kan anbefalingen følges
Farmakologisk behandling
- Unngå bruk av antidepressiva som har vektøkning eller annen kjent negativ effekt på metabolske faktorer som hyppig bivirkning.
- Selektive serotonin reopptakshemmere (SSRI) (N06AB) bør forsøkes først. Denne gruppen medikamenter er førstevalg ved behandling av depresjon i generell befolkning, og er i liten grad assosiert med endring av metabolske faktorer. Vektøkning ved bruk av SSRI er mest uttalt for paroksetin (N06AB05).
- Trisykliske antidepressiva (N06AA) kan gi forverring av insulinresistens og vektøkning.
- Mirtazapin (N06AX11) gir ofte vektøknng.
Psykologisk behandling
Det er ikke grunnlag for å anbefale en type psykologisk behandling fremfor en annen. Anerkjente psykologiske behandlingsformer som kognitiv (adferds) terapi og interpersonlig psykoterapi, samt samt støtteterapi og psykoedukasjon antas å ha like god effekt på behandling av depresjon hos personer med diabetes sammenlignet med personer uten (ref Baumeister Cochrane review 2012)
Begrunnelse – dette er anbefalingen basert på
Valg av farmakologisk behandling: De randomiserte kliniske studiene i Cochrane reviewen har kun undersøkt behandling med SSRI, og funnet evidens for moderat effekt på remisjon og reduksjon av symptomer på depresjon målt ved avslutting av behandling. Det betyr ikke at andre antidepressive legemidler ikke har effekt ved depresjon hos personer med diabetes, men at dette ikke er systematisk undersøkt. Vi mener likevel at behandling med SSRI bør forsøkes først da SSRI er førstevalg ved behandling av depresjon i generell befolkning, og i liten grad assosiert med metabolske endringer.
Valg av psykologisk behandling: Det er ikke grunnlag for å anbefale en type psykologisk behandling framfor en annen. Det er ingen studier som sammenligner effekt av farmakologisk og psykologisk behandling for de ulike utfallene. Det er grunn til å tro at personer med diabetes vil kunne nyttiggjøre seg behandling for depresjon på lik linje med personer uten somatisk sykdom (van Straten 2010)
Forskningsgrunnlag
Populasjon (P): Personer med diabetes
Tiltak (I): Farmakologisk behandling av depresjon
Sammenligning (C): Standard behandling (usual care)
Beskrivelse av inkluderte studier
Vurdering av effekt av psykologisk og farmakologisk behandling ved diabetes type 1 og type 2 med depresjon bygger på en systematisk kunnskapsoppsummering fra 2012 utarbeidet av The Cochrane Collaboration; «Psychological and pharmacological interventions for depression in patients with diabetes mellitus and depression» (Baumeister, H., Hutter, N., & Bengel, J. (2012). Psychological and pharmacological interventions for depression in patients with diabetes mellitus and depression. Cochrane Database Syst Rev, 12, CD008381. PMID: 23235661). Tidligere metaananlyser på samme tema har tilsvarende konklusjoner (van der Feltz-Cornelis CM, Nuyen J, Stoop C, Chan J, Jacobson AM, Katon W, Snoek F, Sartorius N Effect of interventions for major depressive disorder and significant depressive symptoms in patients with diabetes mellitus: a systematic review and meta-analysis. Gen Hosp Psychiatry. 2010 Jul-Aug;32(4):380-95. PMID: 20633742 og Alam R, Sturt J, Lall R, et al. An updated meta-analysis to assess the effectiveness of psychological interventions delivered by psychological specialists and generalist clinicians on glycaemic control and on psychological status. Patient Educ Couns. 2009 Apr;75(1):25-36. PMID: 19084368 ). En tidligere Cochrane Review som undersøkte effekt av farmakologisk og psykologisk behandling hos personer med depresjon og hjerte-og karsykdom fant lignende resultat om om effekt av behandlingen (Baumeister H, Hutter N, Bengel J. Psychological and pharmacological interventions for depression in patients with coronary artery disease. Cochrane Database Syst Rev. 2011 Sep 7;(9):CD008012. PMID: 21901717)
Effekt av farmakologisk behandling sammenlignet med placebo på alvorlighetsgrad av depresjon ved avslutting av behandling ble undersøkt i 7 RCT (N=306); 5 med SSRI og 2 med andre antidepressiva. Remisjon av depresjon ved behandlingsslutt ble undersøkt i 3 RCT (N=136). Effekt på HbA1c ved behandlingsslutt ble undersøkt i 5 RCT (N=238). Det var ingen studier som undersøkte om effekten vedvarte etter avsluttet behandling for noen av de 3 utfallene.
Effekt av psykologisk behandling på alvorlighetsgrad av depresjon ved avslutting av behandling ( mellom 3 til 12 mnd), ble undersøkt i 7 RCT (N=1032). Effekt ved follow-up 1-6 mnd etter behandlingsslutt ble undersøkt i 3 RCT (N=514). Remisjon av depresjon ved behandlingsslutt ble undersøkt i 4 RCT (N=647), mens 2 RCT (N=296) undersøkte remisjon 1-6 mnd etter avsluttet behandling. Effekt på HbA1c ved behandlingsslutt ble undersøkt i 4 RCT (N=441), 3 RCT (N=346) undersøkte effekt 1-6 mnd etter avsluttet behandling.Psykologisk behandling var definert som psykoedukasjon, "minimal psykologisk intervensjon", kognitiv terapi, telefonbasert kognitiv terapi eller psykodynamisk behandling. Kontrollgruppene var usual care (TAU) eller venteliste.
1. Alvorlighet av depresjon
Farmakologisk behandling:
Behandling med antidepressiva gav moderat positiv effekt på grad av depresjon målt ved avslutting av behandling. Dette fant en også i subgruppeanalyser som undersøkte effekten hos personer som fikk SSRI og hos personer som fikk antidepressiva, inkluder SSRI.
Psykologisk behandling: Psykologisk behandling hadde moderat effekt på alvorlighetsgrad av depresjon både ved avsluttet behandling og ved oppfølging etter behandlingsslutt inntil 1-6 mnd.
2: Remisjon av depresjon
Farmakologisk behandling:Behandling med SSRI gav økt andel av remisjon av depresjon målt ved avslutting av behandlingsperioden. Effekten var moderat. Effekt av andre typer antidepressiva er ikke systematisk undersøkt.
Psykologisk behandling:Psykologisk behandling hadde moderat effekt på remisjon av depresjon både ved avsluttet behandling og ved oppfølging 1-6 måneder etter behandlingsslutt.
3. HbA1c
Farmakologisk behandling:Det var positiv effekt av behandling med SSRI på glykemisk kontroll målt ved avslutting av antidepressiv behandling. Effekten var liten til moderat.
Psykologisk behandling:Psykologisk behandling viste ikke bedring av glykemisk kontroll verken ved avslutting av behandling eller 6-12 mnd etter avsluttet behandling. Dette samsvarer også med en tidligere systematisk review som fant at ikke-farmakologisk behandling for depresjon hadde ingen/begrenset effekt på glykemisk kontroll ved diabetes type 2 (Wang MY, Tsai PS, Chou KR, et al. A systematic review of the efficacy of non-pharmacological treatments for depression on glycaemic control in type 2 diabetics. J Clin Nurs. 2008 Oct;17(19):2524-30. PMID: 18808619)
4. Diabeteskomplikasjoner
Det ble ikke funnet studier som undersøkte om psykologisk eller farmakologisk behandling av depresjon påvirker risiko for diabeteskomplikasjoner.
5. Mortalitet
Det ble ikke funnet studier som undersøkte om psykologisk eller farmakologisk behandling av depresjon påvirket mortalitet ved diabetes. En meta-analyse fra 2013 med 10 studier og til sammen 42 363 pasienter sammenlignet mortalitet mellom personer med diabetes og komorbid depresjo med personer med diabetes uten depresjon ( Park M, Katon WJ, Wolf FM. Depression and risk of mortality in individuals with diabetes: a meta-analysis and systematic review. Gen Hosp Psychiatry. 2013 May-Jun;35(3):217-25. PMID: 23415577)De fant at depresjon hos personer med diabetes var assosiert med 50% økt risiko for død (pooled HR 1.50 (1.35-1.66)). Det var lite heterogenitet i resultatene og ingen tegn til publikasjonsbias. De konkluderte med at tidlig oppdagelse og behandling av depresjon kan bedre leveutsiktene.
Vurdering
Fordeler og ulemper
Oppfølging av denne pasientgruppen gjennom en strukturert modell (L: bruke uttrykket individuell plan?) for tverrfaglig samarbeid (bruke uttrykket diabetesteam?) viser god effekt på behandling av depresjon (RR treatment response: 1.33 (95 % CI: 1.05, 1.68), RR depression remision: 1.53 (95% CI: 1.11, 2.12) og compliance til oral antidiabetisk (RR 2.18 (95% CI: 1.61, 2.96) og antidepressiv (RR 1.79 (95% CI: 1.19, 2.69) medikamentbruk.
Modellen viser mindre effekt på HbA1c (Mean difference:-0.13 (95% CI: -0.46, 0.19) ), og det finnes ikke data på effekt på mortalitet. Ikke alle fastlegekontor vil ha tilgang til annet helsepersonell som kan inngå i et tverrfaglig (diabetesteam) team.
Kvalitet på dokumentasjonen
Det er høy til moderat kvalitet på evidensen på at strukturert tverrfaglig behandling har god effekt for (de fleste utfallene) M: rams i stedet opp hvilke utfall som har god effekt L: enda en gang? Se under fordeler og ulemper.
En Cochrane review (Baumeister Cochrane Review 2012) fra 2012 som undersøkte effekt av psykologisk og farmakologisk behandling av depresjon hos personer med diabetes viste følgende kvalitet på dokumentasjonen for utfallene:
Alvorlighet av depresjon: Lav evidens for farmakologisk behandling for effekt målt ved avslutting av behandling. For psykologisk behandling var det lav evidens både for effekt målt ved avslutting av behandling, samt effekt målt 1-6 mnd og ≥ 6 mnd etter avsluttet behandling.
Remisjon av depresjon: Veldig lav evidens for effekt av farmakologisk behandling målt ved avsluttet behandling. For psykologisk behandling var evidensen lav for effekt målt både ved avslutting av behandling og 1-6 mnd etter endt behandling.
HbA1c: Moderat for effekt av farmakologisk behandling målt ved avsluttet behandling og lav for psykologisk behandling målt ved avsluttet behandling og ≥ 6mnd etter avsluttet behandling.
Diabeteskomplikasjoner og mortalitet: ikke undersøkt
Samlet sett vurderes kvaliteten på evidensen for psykologisk og farmakologisk behandling som lav fordi de inkluderte studiene er små, det er ingen differensiering av type eller alvorlighet av depresjon, det er flere feilkilder (bias) i enkeltstudiene og det er stor grad av heterogenitet mellom studiene.
Verdier og preferanser
En tverrfaglig, strukturert og forhåndsbestemt oppfølging vil sannsynligvis være en fordel, spesielt for mindre ressurssterke pasienter, og pasienter som krever tett oppfølging av behandler. Ulempen kan være at pasientene får flere behandlere å forholde seg til, og behandlerne seg i mellom må i større grad sørge for at oppfølgingen ikke blir fragmentert.
Psykologisk behandling kan oppleves krevende for personer med depresjon. Ved moderat til alvorlig depresjon kan både
hukommelse og konsentrasjon være redusert slik at kan være vanskelig for den enkelte å nyttiggjøre seg behandlingen. Ved manglende bedring av psykologisk behandling kan det utløse eller forsterke følelse av å mislykkes og dermed forverre de depressive symptomene.
Farmakologisk behandling med antidepressiva kan ha vektøkning som bivirkning (Blumenthal Jama Psychiatry 2014), og det er foreløpig uavklart i litteraturen om bruk av antidepressiva i seg selv kan gi redusert glukosetoleranse og økt risiko for type 2 diabetes. (Barnard Diabetes Care 2013). Denne litteraturen ble gjennomgått i en systematisk review fra 2013 (Barnard 2013 Diabetes Care), og en fant at redusert glykemisk kontroll var assosiert med bruk av antidepressiva med sterk noradrenerg virkning (desipramin (Sinequan)), og muligens også medikamenter med kombinert noradrenerg og serotonerg virkning (duloxetin (Cymbalta) og venlafaxin (Efexor)). SSRI var i enkelte studier assosiert med bedret glykemisk kontroll (Hennings jm, Curr pharm 2012). Den systematiske reviewen inkluderte en registerbasert cohortstudie som fulgte ca 150 000 yrkesaktive personer fra Finnland i ca 5 år. Denne viste at risiko for å utvikle diabetes type 2 var høyest for personer som brukte flest definerte døgndoser med antidepressiva (over el lik 400) sammenlignet med personer som brukte lavere antall definerte døgndoser (200-400) og som ikke brukte antidepressiva, justert for symptomer på depresjon (Kivimaki M, Diabetes Care 2010)
Disse mulige ulempene ved behandling med antidepressiva vil for de fleste veies opp av fordelene ved reduksjon i symptomer på depresjon. Tilstedeværelse av depressive symptomer pr se er sannsynligvis også assosiert med økt risiko for å utvikle type 2 diabetes (Knol Diabetologia 2006 og Rotella, Diabetes Research and Clinical Practice 2013), noe som taler i favør av behandling.
For mange med somatisk sykdom kan det oppleves stigmatiserende eller medføre en ekstra følelsesmessig påkjenning å bli diagnostisert med samtidig psykisk sykdom. I en studie fra Tyskland fant en at eldre personer hadde mer negative holdninger og avstand til psykiske lidelser som depresjon og schizofreni sammenlignet med yngre personer. (Schoumerus, Acta Psychiatria Scand 2015, PMID: 24676686) Vi tror disse funnene også er overførbare til norske forhold, og tror at diagnostisering og behandling av depresjon hos eldre med diabetes kan være spesielt utfordrende.
Referanser
454. Psychological and pharmacological interventions for depression in patients with coronary artery disease https://www.helsedirektoratet.no/referanse/0002-0013-232442
455. Baumeister, H., Hutter, N., & Bengel, J. (2012). Psychological and pharmacological interventions for depression in patients with diabetes mellitus and depression. Cochrane Database Syst Rev, 12, CD008381. PMID: 23235661 https://www.helsedirektoratet.no/referanse/0002-0013-232443
456. van Straten A, Geraedts A, Verdonck-de Leeuw I, Andersson G, Cuijpers P. Psychological treatment of depressive symptoms in patients with medical disorders: a metaanalysis. J Psychosom Res. 2010 Jul;69(1):23-32. PMID: 20630260 https://www.helsedirektoratet.no/referanse/0002-0013-232444
457. Moussavi S, Chatterji S, Verdes E, Tandon A, Patel V, Ustun B. Depression, chronic diseases, and decrements in health: results from the World Health Surveys. Lancet. 2007 Sep 8;370(9590):851-8. PMID: 17826170 https://www.helsedirektoratet.no/referanse/0002-0013-232445
458. Katon WJ. Epidemiology and treatment of depression in patients with chronic medical illness. Dialogues Clin Neurosci. 2011;13(1):7-23. PMID: 21485743 https://www.helsedirektoratet.no/referanse/0002-0013-232446
459. Hofmann M, Kohler B, Leichsenring F, Kruse J. Depression as a Risk Factor for Mortality in Individuals with Diabetes: A Meta-Analysis of Prospective Studies. PLoS One. 2013 Nov 21;8(11):e79809. PMID: 24278183 https://www.helsedirektoratet.no/referanse/0002-0013-232447
460. Katon WJ. Rutter C. G. Simon G. The association of comorbid depression with mortality in patients with type 2 diabetes. Diabetes Care 28, 2005:2668-2672. PMID: 16249537 https://www.helsedirektoratet.no/referanse/0002-0013-232448
461. X. Zhang S.L. Norris E.W. Gregg. Depressive symptoms and mortality among persons with and without diabetes. Am J Epidemiol 161, 2005: 652-660. PMID: 15781954 https://www.helsedirektoratet.no/referanse/0002-0013-232449
462. van der Feltz-Cornelis CM, Nuyen J, Stoop C, Chan J, Jacobson AM, Katon W, Snoek F, Sartorius N Effect of interventions for major depressive disorder and significant depressive symptoms in patients with diabetes mellitus: a systematic review and meta-analysis. Gen Hosp Psychiatry. 2010 Jul-Aug;32(4):380-95. PMID: 20633742 https://www.helsedirektoratet.no/referanse/0002-0013-232450
463. Alam R, Sturt J, Lall R, et al. An updated meta-analysis to assess the effectiveness of psychological interventions delivered by psychological specialists and generalist clinicians on glycaemic control and on psychological status. Patient Educ Couns. 2009 Apr;75(1):25-36. PMID: 19084368 https://www.helsedirektoratet.no/referanse/0002-0013-232451
464. Wang MY, Tsai PS, Chou KR, et al. A systematic review of the efficacy of non-pharmacological treatments for depression on glycaemic control in type 2 diabetics. J Clin Nurs. 2008 Oct;17(19):2524-30. PMID: 18808619 https://www.helsedirektoratet.no/referanse/0002-0013-232452
465. Park M, Katon WJ, Wolf FM. Depression and risk of mortality in individuals with diabetes: a meta-analysis and systematic review. Gen Hosp Psychiatry. 2013 May-Jun;35(3):217-25. PMID: 23415577 https://www.helsedirektoratet.no/referanse/0002-0013-232453
466. Bogner HR, Morales KH, de Vries HF, Cappola AR. Integrated management of type 2 diabetes mellitus and depression treatment to improve medication adherence: a randomized controlled trial. Ann Fam Med. 2012 Jan-Feb;10(1):15-22. PMID: 22230826 https://www.helsedirektoratet.no/referanse/0002-0013-232454
467. Schram MT, Baan CA, Pouwer F. Depression and Quality of Life in Patients with Diabetes: A Systematic Review from the European Depression in Diabetes (EDID) Research Consortium. Curr Diabetes Rev. 2009 May; 5(2): 112–119. PMID: 19442096 https://www.helsedirektoratet.no/referanse/0002-0013-232455
468. Leslie WS, Hankey CR, Lean MEJ. Weight gain as an adverse effect of some commonly prescribed drugs: a systematic review. Q J Med 2007; 100:395–404. PMID: 17566010 https://www.helsedirektoratet.no/referanse/0002-0013-232456
469. Vancampfort D, Correll CU, Wampers M, Sienaert P, Mitchell AJ, De Herdt A, Probst M, Scheewe TW, De Hert M. Metabolic syndrome and metabolic abnormalities in patients with major depressive disorder: a meta-analysis of prevalences and moderating variables. Psychol Med. 2013 Nov 21:1-12. PMID: 24262678 https://www.helsedirektoratet.no/referanse/0002-0013-232457
470. Schomerus G, Van der Auwera S, Matschinger H, Baumeister SE, Angermeyer MC. Do attitudes towards persons with mental illness worsen during the course of life? An age-period-cohort analysis. Acta Psychiatr Scand. 2015 Feb 10. PMID: 25676686 https://www.helsedirektoratet.no/referanse/0002-0013-232458
471. Molosankwe I, Patel A, José Gagliardino J, Knapp M, McDaid D. Economic aspects of the association between diabetes and depression: a systematic review. .J Affect Disord. 2012 Oct;142 Suppl:42-55. PMID: 23062857. https://www.helsedirektoratet.no/referanse/0002-0013-232459
472. Roy T, Lloyd CE. Epidemiology of depression and diabetes: a systematic review. J Affect Disord. 2012 Oct;142 Suppl:8-21. PMID: 23062861. https://www.helsedirektoratet.no/referanse/0002-0013-232460
Sist faglig oppdatert: 14.09.2016
Strukturert, tverrfaglig samarbeid ved behandling av personer med diabetes og depresjon
- Strukturert, tverrfaglig samarbeid foreslås som utgangspunkt for behandling av personer med både diabetes og depresjon.
- For pasienter med lett til moderat depresjon som følges i primærhelsetjenesten vil samarbeidende instanser inkludere aktører fra førstelinjetjenesten som fastlege, hjemmesykepleie og psykiatritjeneste.
- For mer alvorlig depresjon omfatter samarbeidet de somatiske (indremedisinsk) og psykiatriske enheter i spesialisthelsetjenesten, fortrinnsvis allmenpsykiatriske poliklinikker ved DPS.
Praktisk – slik kan anbefalingen følges
Kunnskapsgrunnlaget for denne anbefalingen er basert på en modell som kalles Collaborative care (Gilbody JAMA Internal Medicine 2006). Denne modellen danner et utgangspunkt for koordinering av tjenester for pasienter med kroniske sykdommer i førstelinjetjenesten, og inkluderer sykepleiere og annet helsepersonell i tillegg til fastleger (Gilbody JAMA Internal Medicine 2006).
Begrepet brukes om en rekke intervensjoner, men ofte omfatter det at en av aktørene, for eksempel en sykepleier med videreutdannelse, har ansvar for at en «stepped care» modell følges. Dette kan inkludere intensivering, skifte av behandling eller tettere oppfølging i henhold til forhåndsbestemt protokoll dersom ikke tilstrekkelig bedring av symptomer i løpet av en bestemt tid (Katon, Archives of General Psychiatry 2004).
Denne modellen for samarbeid har pr i dag ingen direkte overførbarhet til norsk helsevesen. Hovedpoenget med anbefalingen er å oppnå et samarbeid mellom de som har ansvar for pasientens somatisk sykdom (diabetes) - og de som behandler pasientens psykiske sykdom (depresjon) og at utgangspunktet for dette samarbeidet bør være en strukturert plan. Felles mål for alle aktørene bør være pasientens helhetlige helse.
I norsk klinisk praksis vil begrepet bety strukturert, flerfaglig samarbeid. Det er flere tverrfaglig samarbeidsrutiner i norsk helsevesen som kan fungere som modell for utvikling av et slikt strukturert samarbeid, herunder:
- Individuell plan og koordinator, se Veileder for rehabilitering, habilitering, individuell plan og koordinator
- Dialogmøter i primærhelsetjenesten
- Multidisiplinære team (diabetesteam) i spesialisthelsetjenesten
Begrunnelse – dette er anbefalingen basert på
Strukturert, flerfaglig samarbeid som utgangspunkt for behandling av personer med diabetes og komorbid depresjon viser god effekt på behandling av depresjon og compliance til antidiabetisk og antidepressiv medikamentbruk, men mindre effekt på HbA1c. Det finnes ikke data på om modellen har effekt på mortalitet. Kvaliteten på dokumentasjonen er god. Vi foreslår at denne typen modell for samarbeid tas i bruk i Norge, og at man tar utgangspunkt i samarbeidsrutiner som allerede er etablert (se Praktisk), og at man intensiverer behandlingen i henhold til behov og en forhåndsbestemt protokoll/plan. Hovedargumentet mot anbefalingen er at det er en ressurskrevende behandlingsform som ikke ennå er godt etablert i norsk praksis og som lett kan fremstå fragmentert.
Forskningsgrunnlag
Populasjon (P): Personer med diabetes og behandlingskrevende depresjon
Tiltak (I): Collabrative care
Sammenligning (C): Standard behandling (usual care)
Beskrivelse av inkluderte studier
Sammenlignet med personer uten diabetes har personer med diabetes høyere forekomst av, og risiko for, komorbid depresjon, og disse personene følges i hovedregelen opp i primærhelsetjenesten. Det kan være spesielt vanskelig å behandle depresjonen tilfredsstillende hos personer med diabetes, og det å ha depresjon samtidig med diabetes øker risiko for uønskede utfall. Derfor er behandlingsmodeller som bygger på collaborative care prinsipper for denne pasientgruppen mye studert.
Kunnskapsgrunnalget bygger i hovedsak på en systematisk review og meta-analyse fra Huang og medarbeidere publisert i BMC Psychiatry i 2013 (Huang BMC Psychiatry 2013), der data fra 8 RCTer med totalt 2238 personer ble utnyttet. Studiene som ble inkludert i denne meta-analysen fylte følgende 4 kriterier for collaborative care: 1) flere helseprofesjoner var involvert (multiprofessional care), 2) strukturert behandlingsplan, 3) forhåndsdefinert tidspunkt for oppfølging (scheduled patient follow up), 4) tverrprofesjonell kommunikasjon (enhanced inter-professional communication).
1) Reduksjon i symptomer på depresjon:
Både ved behandlingsslutt og ved 12 måneders oppfølging etter behandlingsslutt hadde personer som var randomisert til collaborative care bedret behandlingsrespons av depresjon (studieslutt: RR 1.33 (95% CI: 1.05, 1.68), 12 md: RR 1.42 (95% CI: 1.14, 1.76). En klarte ikke å vise forskjell i forekomst av remisjon av depresjon ved studieslutt og etter 12 måneders oppfølging mellom intervensjonsgruppene. Disse funnene er bekreftet i en annen meta-analyse fra 2014 som inkluderte noen flere deltakere, der en fant større positiv endring i depresjonsscore i intervensjonsgruppen med collaborative care (standard gjennomsnittlig forskjell i score -0.32 (95% CI: -0.53, -0.11) (Atlantis BMJ Open 2014).
2) HbA1c:
Det var ikke påvist signifikant forskjell i HbA1c ved behandlingsslutt eller 12 måneders oppfølging. Meta-analysen fra 2014 (Atlantis BMJ Open 2014), som for dette utfallsmålet inkluderte flere studier, fant imidlertid en signifikant reduksjon i nivå av HbA1c i intervensjonsgruppen (vektet gjennomsnittlig forskjell -0.33% (95% CI: -0.66% --0.00%). Dette kan tyde på at de resultatene fra meta-analysen i evidensprofilen om forskjell i HbA1c mellom gruppene ikke var signifikante grunnet lav styrke.
3) Diabeteskomplikasjoner
Vi fant ingen studier som har undersøkt om bruk av collaborative care påvirker risiko for utvikling av diabeteskomplikasjoner hos personer med diabetes og depresjon.
4) Compliance til medikamentell antidiabetisk og antidepressiv behandling
Studien i evidensprofilen viser klart bedre compliance, både for antidiabetisk og antidepressiv behandling, hos pasienter som ble randomisert til stepped care sammenlignet med standard behandling. Styrken på effekten er høy (RR 1.79 (95% CI: 1.19, 2.69) for antidepressiva og RR 2.18 (95% CI: 1.61, 2.96).
5) Mortalitet:
Vi fant ingen studier som har undersøkt om bruk av collaborative care påvirker mortalitet hos personer med diabetes og depresjon. Dette kan med stor sannsynlighet forklares av foreløpig for kort oppfølgingstid, og at død er et sjelden utfall.
Vurdering
Fordeler og ulemper
Studien viste en større reduksjon i depressive symptomer og bedre compliance til antidiabetika og antidepressiva hos dem som fikk collaborative care sammenlignet med dem som fikk standard behandling, mens det var ingen endring i HbA1c. Det er i studien ikke beskrevet noen ulemper, men i en balansering av fordeler og ulemper vil ressurshensyn tas inn som en ulempe da denne intervensjonen er svært ressurskrevende.
Kvalitet på dokumentasjonen
Høy til moderat kvalitet på evidens, dvs, godt dokumentert effekt. Effektestimatene viser god effekt for de fleste utfallene.
Verdier og preferanser
Fordel for mindre ressurssterke pasienter, helsevesenet tar generelt større ansvar. Ulempe at pasientene får flere behandlere å forholde seg til, må påse at behandlingen ikke blir fragmentert.
Referanser
473. The prevalence of comorbid depression in adults with diabetes: a meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-232461
474. Collaborative care for comorbid depression and diabetes: a systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-232462
475. Diabetes, depression, and death: a randomized controlled trial of a depression treatment program for older adults based in primary care (PROSPECT) https://www.helsedirektoratet.no/referanse/0002-0013-232463
476. Stepped care in psychological therapies: access, effectiveness and efficiency. Narrative literature review https://www.helsedirektoratet.no/referanse/0002-0013-232464
477. Collaborative care for patients with depression and diabetes mellitus: a systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-232465
478. Collaborative care for patients with depression and chronic illnesses https://www.helsedirektoratet.no/referanse/0002-0013-232466
479. The Pathways Study: a randomized trial of collaborative care in patients with diabetes and depression https://www.helsedirektoratet.no/referanse/0002-0013-232467
480. Improving depression care in patients with diabetes and multiple complications https://www.helsedirektoratet.no/referanse/0002-0013-232468
481. Depression and type 2 diabetes over the lifespan: a meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-232469
482. Depression as a risk factor for diabetes: a meta-analysis of longitudinal studies https://www.helsedirektoratet.no/referanse/0002-0013-232470
Sist faglig oppdatert: 14.09.2016
Behandling av spiseforstyrrelser hos personer med diabetes
Personer med diabetes og spiseforstyrrelser bør behandles i tråd med Nasjonal faglig retningslinje for tidlig oppdagelse, utredning og behandling av spiseforstyrrelser (helsedirektoratet.no).
Praktisk – slik kan anbefalingen følges
I forbindelse med utarbeidelse av den nye nasjonale retningslinjen for utredning og behandlingen av spiseforstyrrelser, bestilte Helsedirektoratet en litteraturgjennomgang fra Kunnskapssenteret om effekten av behandling for personer som har både diabetes og spiseforstyrrelser (Vist GE, Rapport fra Kunnskapssenteret, 2015)
Rapporten konkluderer med at få studier har undersøkt problemstillingen, og at disse er av dårlig kvalitet. Kort oppsummert omtales fire studier med totalt omtrent 150 personer. En studie viser at behandling av overspisningslidelse og diabetes type 2 med ukentlig kognitiv adferdsterapi var like effektiv som annen gruppebehandling. Andre studier viste at psykoedukasjon kunne ha effekt ved behandlingen av både subklinisk spiseforstyrrelse og bulimi hos personer med diabetes type 1.
Diabetes er både en risikofaktor og vedlikeholdende faktor for spiseforstyrrelser, fordi det å ha diabetes krever økt fokus på mat, kontroll og regelmessighet (Vist GE, Rapport fra Kunnskapssenteret, 2015). Sammenlignet med personer med diabetes uten spiseforstyrrelse har personer med spiseforstyrrelser komorbid til diabetes høyere HbA1c (Wisting, 2013). og økt risiko for å utvikle komplikasjoner (Rydall, 1997).
Spesielt alvorlig er underdosering av insulin (insulin purging), dvs å intensjonelt unnlate å sette insulin for å hindre vektoppgang/tape vekt. Data fra det norske barnediabetesregisteret tyder på at insulinrestriksjon forekommer hos omtrent 30 prosent av norsk ungdom med type 1 diabetes, mens 7 prosent unnlater å sette insulin etter episoder med overspisning (Wisting, 2013).
Begrunnelse – dette er anbefalingen basert på
Sammenlignet med generell befolkning har personer med diabetes en økt forekomst av spiseforstyrrelser. En metaanalyse fra 2005 fant omtrent to til tre ganger økt forekomst av bulimi hos personer med diabetes type 1 (Mannucci, 2005). Studier fra det norske barnediabetesregisteret viser at forekomsten av spiseproblemer hos unge med diabetes type 1 er i samme størrelsesorden (Wisting, Diabetes Care 2013). Høyest forekomst var for jenter 17-19 år, der halvparten angav spiseproblemer (Wisting, Diabetes Care 2013).
Spiseforstyrrelser ved diabetes er hyppig og assosiert med økt risiko for komplikasjoner, men kunnskapsgrunnlaget for effekt av ulike behandlingstilnærminger er dårlig. Inntil behandlingsstudier av personer med spiseforstyrrelser og diabetes foreligger, anbefales behandling som ved spiseforstyrrelser generelt, men med spesielt fokus på underdosering av insulin.
Referanser
483. Behandling av personer som både har spiseforstyrrelse og diabetes https://www.helsedirektoratet.no/referanse/0002-0013-232471
484. Wisting L, Frøisland DH, Skrivarhaug T, Dahl-Jørgensen K, Rø Ø, Disturbed Eating Behavior and Omission of Insulin in Adolescents Receiving Intensified Insulin Treatment, Diabetes Care. 2013 Nov; 36(11): 3382–3387 https://www.helsedirektoratet.no/referanse/0002-0013-232472
485. Mannucci E, Rotella F, Ricca V, Moretti S, Placidi GF, Rotella CM. Eating disorders in patients with type 1 diabetes: a meta-analysis. Journal of endocrinological investigation. 2005; 28(5): 417-9 https://www.helsedirektoratet.no/referanse/0002-0013-232473
486. Rydall AC, Rodin GM, Olmsted MP, Devenyi RG, Daneman D. Disordered eating behavior and microvascular complications in young women with insulin-dependent diabetes mellitus. The New England journal of medicine. 1997; 336(26): 1849-54 https://www.helsedirektoratet.no/referanse/0002-0013-232474
487. Statens helsetilsyn. Alvorlige spiseforstyrrelser. Retningslinjer for behandling i spesialisthelsetjenesten. 7-2000 https://www.helsedirektoratet.no/referanse/0002-0013-232475
Sist faglig oppdatert: 14.09.2016
Svangerskap ved kjent diabetes
Planlegging av svangerskapet ved kjent diabetes type 1 og 2 (før svangerskapet)
- Kvinnen bør få intensivert pasientundervisningen og blodglukosekontrollen bør optimaliseres før graviditet.
- Kvinner med diabetes bør få tilbud om veiledning før hun blir gravid ved den avdelingen der svangerskapskontrollen skal foregå eller ved den avdeling hun vanligvis blir fulgt opp for sin diabetessykdom.
Praktisk – slik kan anbefalingen følges
Ved planlegging av svangerskap hos en kvinne med diabetes bør følgende tiltak iverksettes:
- Motiver til optimal diabetesregulering og intensiver pasientundervisningen. Kvinnen bør få tilbud om oppfølging ved den avdeling svangerskapskontrollen skal foregå eller ved den avdeling hun vanligvis blir fulgt opp for sin diabetessykdom innen 1-2 uker etter kjent graviditet
- For å redusere forekomsten av misdannelser og spontanaborter er det viktig at kvinnens diabetes er godt regulert allerede før konsepsjonstidspunktet. Man bør tilstrebe HbA1c <53 mmol/mol (7,0 %) før konsepsjon og i første trimester. Gravide kvinner med pregetasjonell diabetes, som har en HbA1c ≥64 mmol/mol (8 %) ved siste måling umiddelbart før svangerskapet, eller ved første HbA1c-måling i svangerskapet, foreslås å tilbys ekstra «utvidet ultralyd» (det vil si av lege med fostermedisinsk kompetanse) i uke 15-16, i tillegg til den ordinære ultralydsscreeningen noen uker senere.
- Kvinner bør motiveres til å være så nær normalvektige som mulig før svangerskapet. Det er sannsynlig at en bør anbefale ulik vektøkning i svangerskapet stratifisert etter pre-gravid BMI (se tabell nederst på siden for forslag), både ved eksisterende diabetes og svangerskapsdiabetes. De fleste unge kvinner er ikke klar over at stor vektøkning i svangerskapet er en selvstendig risikofaktor for både mor og barn, særlig ved overvekt eller fedme hos mor før graviditeten (IOM, 2009).
- Motiver for røykeslutt.
- Optimaliser blodglukosekontrollen, henvis eventuelt til kostrådgiving/klinisk ernæringsfysiolog.
- Gi råd om folinsyre etter vanlige retningslinjer.
- Vurder henvisning til/oppfølging av øyelege.
- Ved alvorlige diabetiske senkomplikasjoner, særlig nefropati, bør pasienten alltid henvises til vurdering før et svangerskap påbegynnes.
- Kvinnen bør undersøkes hos øyelege ved planlegging og så tidlig som mulig i svangerskapet. Eventuell laserbehandling bør være ferdig før graviditet.
- Stopp eventuell behandling med perorale blodsukkersenkende (metformin kan kontinueres, vurder overgang til insulin - se anbefaling om behandlingsmål og henvisningsrutiner).
- Stopp eventuell behandling med statiner og ACE-hemmere (ACEi) (C09AA) / Angiotensin II-reseptorantagonister (ARB) (C09CA) og vurder annen antihypertensiv behandling (se anbefaling om behandling av hypertensjon i svangerskapet).
- Tyroideafunksjonen bør kontrolleres ideelt før svangerskapet. Ved påvist hypotyreose øk Levaxindosen (H03AA01) med 25-50 % allerede ved første kontroll i svangerskapet.
- Kursdag for kvinner med diabetes og hennes partner som planlegger å bli gravide, kan være svært nyttig, da en graviditet ved diabetes krever en betydelig egeninnsats. Tidspunktet for graviditet må derfor passe inn i familiens situasjon.
- For mer informasjon om bruk av legemidler i svangerskapet vises det til Tryggmammamedisin
Hvem bør ikke bli gravide?
Nesten ingen, men de med diabetisk nefropati og nedsatt eGFR krever oppfølging av helsepersonell med spesiell kompetanse. Mikroalbuminuri er også et signal for behov for særskilt oppfølging når det gjelder hypertensjon og pre-eklampsi.
Tabell 1. Forslag til anbefalt vektøkning under svangerskapet er kun basert på observasjonsstudier og tilsvarer anbefalingene fra Institute of Medicines (IOM).
| BMI ved svangerskapets start | Anbefalinger fra Institute of Medicine (IOM, 2009) | |
| Undervekt | <18,5 kg/m² | 12,5–8 kg |
| Normal vekt | 18,5–24,9 kg/m² | 11,5–16 kg |
| Overvekt | 25–29,9 kg/m² | 7–11 kg |
| Fedme* | 30–35 kg/m² | 5–9 kg |
* Ved BMI >30 kg/m² tyder nyere data på at svangerskapsutfallene blir bedre ved lavere vektøkning enn IOM siden anbefalinger.
Begrunnelse – dette er anbefalingen basert på
Referanser
488. Institute of Medicine (US) and National Research Council (US) Committee to Reexamine IOM Pregnancy Weight Guidelines; Rasmussen KM, Yaktine AL, editorsWeight Gain During Pregnancy: Reexamining the Guidelines. SourceWashington (DC): National Academies Press (US); 2009. https://www.helsedirektoratet.no/referanse/0002-0013-232476
Sist faglig oppdatert: 14.09.2016
Behandlingsmål og henvisningsrutiner ved kjent diabetes type 1 og 2 i svangerskapet
Gravide kvinner med kjent diabetes før svangerskapet bør henvises til en fødeavdeling med ekspertise på behandling og oppfølging av diabetes i svangerskapet. Dette gjelder både dersom kvinnen tar perorale glukosesenkende medikamenter, insulin eller regulerer sin diabetes gjennom kosthold.
Praktisk – slik kan anbefalingen følges
Henvisning, opplæring og kontrollrutiner
- Ved påvist graviditet bør kvinnen straks henvises til fødepoliklinikk med tilknyttet nødvendig endokrinologisk kompetanse (fortrinnsvis bestående av et team for gravide med diabetes der følgende profesjoner er representert: jordmor, diabetessykepleier, klinisk ernæringsfysiolog, fødselslege, endokrinolog.
- Det er en fordel om fastlegen alltid tar HbA1c på første kontroll slik at resultatet kan sendes med henvisningen siden oppfølging i spesialisthelsetjenesten ofte skjer først flere uker senere.
- Kvinnen bør på nytt få opplæring i selvmåling av blodsukker og kostveiledning. Det er nødvendig med hyppige selvmålinger; opp til 7-10 ganger daglig.
- Kvinnen bør få tilbud om kontroll på poliklinikk minimum hver 4. uke, gjerne hver 14. dag. Hyppigere kontroller er anbefalt ved følgende komplikasjoner:
- dårlig blodsukkerregulering
- hyppige eller kraftige hypoglykemier
- utilfredsstillende utvikling av svangerskapet
- annet som tilsier tett kontroll - Lang reisetid eller andre kompliserende forhold kan tilsi kontrollhyppighet på hver 4. uke, med ev. kontroller i mellom hos fastlege eller per telefon.
- Kvinnen bør få opplyst direktenummer til fødeavdeling og ha lav terskel for å ta kontakt ved behov.
- Vi viser for øvrig til anbefalt kontrollhyppighet i Veileder i fødselshjelp
Behandlingsmål
- Behandlingsmålene er strenge:
- fastende 3,4-5,5 mmol/l
- 1 ½ - 2 timer etter måltidene: <7.1 mmol/l.
Enkeltmålinger over dette er vanskelig å unngå og vil ikke påvirke svangerskapets forløp uheldig. Det er viktig å være varsom med måten en presenterer de ideelle mål på for ikke å belaste kvinnen med bekymring eller dårlig samvittighet dersom målene ikke alltid kan oppnås. - HbA1c bør måles minimum hver 4. uke, gjerne hver 14. dag, og bør fra 3. trimester ideelt være mellom 38-42 mmol/mol (5,6-6,0 %).
Kostveiledning
Den gravide som har kjent diabetes forut for svangerskapet vil som oftest ha god kjennskap til hvordan kostholdet virker inn på hennes blodsukkerregulering. Men når hun blir gravid er det særskilt viktig at blodsukkerreguleringen er godt kontrollert. Svangerskapet vil også kunne påvirke hennes blodsukkernivåer som gjør at hun særlig må tilpasse kostholdet på en annen måte enn før graviditeten, og dette må igjen tilpasses til om hun bruker insulin, perorale antidiabetika eller om blodsukkeret kun reguleres med kost.
Det er derfor viktig at kvinnen får individuelt tilpasset informasjon og veiledning om kostholdet under graviditeten.
For mer detaljerte kostholdsråd ved graviditet og diabetes vises det til Nasjonal faglig retningslinje om svangerskapsdiabetes
Svangerskap og diabetes type 2
- Diabetes type 2 i svangerskapet er en mer heterogen sykdom enn diabetes type 1, og øker i forekomst som følge av økende overvekt, eldre fødende, økende forekomst av diabetes type 2 blant innvandrere (særlig kvinner fra Midt-Østen og Sør-Øst Asia). Flere steder i Norge er diabetes type 2 like hyppig som type 1 i svangerskapet, samtidig er mørketallene store og forekomsten av uoppdaget diabetes type 2 ved svangerskapets start er høy (Jenum AK, 2012)
- Planlegging av svangerskapet er minst like viktig ved diabetes type 2 som ved type 1
- Målene for blodglukosekontroll før og under svangerskapet er identiske med målene for diabetes type 1 (fastende BG 3,4-5,5 mmol/l og
<7.1 mmol/l 1 ½ - 2 timer etter måltid) - Behandling: Metformin brukes i økende grad ved diabetes type 2, og med tanke på utfallet for barnet viser randomiserte studier at metformin og insulin kan sidestilles som behandling. I de fleste av disse studiene er Metformin-behandlingen startet mellom 24-28 uke. Det er utført en randomisert studie hos kvinner med PCOS hvor Metformin ble gitt tidlig i svangerskapet. Studien viste ikke uheldige bivirkninger. Det pågår en stor randomisert, kanadisk studie (MiTy) ved diabetes type 2 i svangerskapet som forventes å avsluttes i desember 2016
- Kvinner som allerede bruker Metformin når de blir gravide, bør fortsette med dette
- En stor andel av de som begynner med Metformin må senere i svangerskapet også ha insulinbehandling. Hvis HbA1c tidlig i svangerskapet er over 58-64 mmol/mol (7.5-8.0 %) er det sannsynligvis best å starte direkte med insulin
- Sulfonylurea frarådes i svangerskapet (Zeng YC, 2014)
- Insulinbehandling: Begynn med langsomtvirkende insulin morgen og/eller kveld. Bruk mangeinjeksjonsbehandling hvis ikke behandlingsmålene nås. Det er vanlig med en økning i insulinbehovet fra 18 uke som ved diabetes type 1, men det er store individuelle variasjoner i hvor mye insulindosen må økes. Mest økning er nødvendig hos overvektige og kvinner fra Sør-Asia (Pakistan, India, Bangladesh og Sri Lanka)
- PCOS (polycystisk ovarial syndrom) er en ikke sjelden tilstand hos unge kvinner, og en viss andel av disse har svangerskapsdiabetes eller diabetes type 2. Det er gunstig å fortsette å behandle disse med Metformin når de er blitt gravide. Behandlingsmål og oppfølging av levevaner er som ved diabetes type 2.
Begrunnelse – dette er anbefalingen basert på
- Blodglukoseregulering før og under svangerskapet er av helt avgjørende betydning for forløpet av svangerskapet og utfall som makrosomi, intrauterin død, pre-eklampsi og misdannelser (Wahabi HA, 2012)
- Det er en klar sammenheng mellom høy Hb A1c (>8 %) ved begynnelsen av svangerskapet og forekomsten av både misdannelser og spontanaborter (Tennant PW, 2014)
- Pregestasjonell diabetes med komplikasjoner har en særlig økt risiko for maternelle og føtale komplikasjoner. Alle disse komplikasjoner er vesentlig mindre med god blodglukosekontroll før og under svangerskapet
Referanser
489. Veileder i fødselshjelp http://legeforeningen.no/Fagmed/Norsk-gynekologisk-forening/Veiledere/Veileder-i-fodselshjelp-2014/Ultralydundersokelser-i-den-alminnelige-svangerskapsomsorgen/
490. Wahabi HA, Alzeidan RA, Esmaeil SA. Pre-pregnancy care for women with pre-gestational diabetes mellitus: a systematic review and meta-analysis. BMC Public Health. 2012 Sep 17;12:792. doi: 10.1186/1471-2458-12-792. https://www.helsedirektoratet.no/referanse/0002-0013-232478
491. Tennant PW, Glinianaia SV, Bilous RW, Rankin J, Bell R.Pre-existing diabetes, maternal glycated haemoglobin, and the risks of fetal and infant death: a population-based study.Diabetologia. 2014 ;57:285-94 https://www.helsedirektoratet.no/referanse/0002-0013-232479
492. Jenum AK1, Diep LM, Holmboe-Ottesen G, Holme IM, Kumar BN, Birkeland KI. Diabetes susceptibility in ethnic minority groups from Turkey, Vietnam, Sri Lanka and Pakistan compared with Norwegians - the association with adiposity is strongest for ethnic minority women. BMC Public Health. 2012 Mar 1;12:150. doi: 10.1186/1471-2458-12-150. https://www.helsedirektoratet.no/referanse/0002-0013-232480
493. Zeng YC1, Li MJ2, Chen Y1, Jiang L1, Wang SM1, Mo XL1, Li BY3. The use of glyburide in the management of gestational diabetes mellitus: a meta-analysis.Adv Med Sci. 2014 Mar;59(1):95-101. doi: 10.1016/j.advms.2014.03.001. Epub 2014 Mar 22. https://www.helsedirektoratet.no/referanse/0002-0013-232481
Sist faglig oppdatert: 14.09.2016
Insulinbehandling under graviditet ved diabetes type 1
Fordi det er stor variasjon i insulinbehovet gjennom svangerskapet og fra kvinne til kvinne, bør insulinbehandlingen følges nøye.
Det er særlig viktig å ha tett oppfølging med tilpassing av dosering i første trimester. Det er fordi faren for alvorlig hypoglykemi er betydelig økt i denne perioden. I 18.–20. svangerskapsuke derimot, øker behovet for insulin sterkt.
Praktisk – slik kan anbefalingen følges
Måling av HbA1c
- HbA1c bør måles minimum hver 4. uke, gjerne hver 14. dag
- HbA1c er i normale svangerskap fra og med 2. trimester ca. 11 mmol/mol (1 %-poeng) lavere enn hos ikke-gravide
- Det ideelle målet for blodglukosekontroll etter uke 16 er HbA1c mellom 38–42 mmol/mol (5,6-6,0 %)
Behandling med insulin i svangerskapet
- Generelt er det de samme insulintypene som brukes under graviditet som utenfor. Sjekk alltid gjeldende preparatomtale (Direktoratet for medisinske produkter) for oppdatert informasjon om virkning og anbefalt bruk.
- Mangeinjeksjonsbehandling er standardbehandling, og de få som ikke bruker dette før graviditeten bør begynne med dette helst før konsepsjon (Ringholm L, 2012)
- Behandling med insulinpumpe blir mer og mer vanlig og kan fortsettes under graviditet. Det er ikke vist at insulinpumpebehandling har spesielle fordeler under graviditet (Ranasinghe PD, 2015), og det er derfor sjeldent indikasjon for å starte insulinpumpebehandling ved inntrådt graviditet.
- Ketoacidose i graviditet er farlig og bør unngås. Risikoen for ketoacidose er noe økt ved insulinpumpebehandling sammenlignet med mangeinjeksjonsbehandling.
Insulinbehov og dosering:
- Insulinbehovet er vanligvis redusert mellom uke 8 og 16. Kvinnen har økt risiko for alvorlig hypoglykemi, særlig de som tidligere har hatt manglende evne til å merke lavt blodsukker før svangerskapet (hypoglycemia unawareness)
- Kvinner med tidligere alvorlig hypoglykemi, krever ekstra opplæring og oppfølging. Tiltak for å minske alvorlig hypoglykemi:
- Reduksjon av insulindosen med 10–20 % mellom ca. 8-16 svangerskapsuke, særlig aktuelt å redusere nattinsulin. Hvis blodsukker før leggetid er <6 mmol/l bør hun rådes til å spise et ekstra måltid før sengetid
- Ekstra hurtigvirkende insulin mellom måltidene må brukes med forsiktighet (deValk HW, 2011)
- Insulinbehovet øker vanligvis sterkt fra 18-20. svangerskapsuke pga økende insulinresistens. Man ser en økning både av fastende verdier og etter hvert også postprandiale verdier. Det er imidlertid store individuelle variasjoner og sterkest økning hos overvektige
- I 3. trimester ses oftest en stabilisering av insulinbehovet. Noen får et moderat fall i insulinbehovet etter 34-36. uke. Hvis reduksjonen er på over 15-20 % bør fosterets tilstand vurderes nøye.
- Justeringer av insulindose baseres på fastende og postprandiale glukoseverdier. Bolusdoser kan tas 15–30 minutter før måltider, særlig sent i svangerskapet
- Det er ikke unormalt med en firedoblet reduksjon i karbohydrat/insulin-ratio
- Behandlingsmål for fastende blodsukker bør være 4,8 mmol/l (Mathiesen JM, 2014)
Kontinuerlig vevsglukosemåling
Kontinuerlig vevsglukosemåling anbefales til kvinner med spesielle problemer, særlig de som har nedsatt evne til å kjenne følinger (impaired awareness of hypoglycaemia), men anbefales foreløpig ikke til alle. Bruk av boluskalkulator kan være aktuelt, men kan være vanskelig pga store endringer i insulinresistensen utover i svangerskapet.
Begrunnelse – dette er anbefalingen basert på
Pregestasjonell diabetes type 1 er assosiert med betydelig økt risiko for alvorlige svangerskapsutfall. Sammenlignet med kvinner uten diabetes har studier vist en 3-4 ganger så høy risiko for dødfødsel og opptil 3 ganger så høy risiko for perinatal død. Risikoen for for tidlig fødsel er nær 5-doblet, mens risikoen for pre-eklampsi er vist å være over 6 ganger så høy. Det gledelige er at risikoen reduseres betydelig ved god blodglukosekontroll (Eidem I, 2011; Tennant PW, 2014).
Referanser
491. Tennant PW, Glinianaia SV, Bilous RW, Rankin J, Bell R.Pre-existing diabetes, maternal glycated haemoglobin, and the risks of fetal and infant death: a population-based study.Diabetologia. 2014 ;57:285-94 https://www.helsedirektoratet.no/referanse/0002-0013-232479
494. Ranasinghe PD, Maruthur NM, Nicholson WK, Yeh HC, Brown T, Suh Y, et al. Comparative effectiveness of continuous subcutaneous insulin infusion using insulin analogs and multiple daily injections in pregnant women with diabetes mellitus: a systematic review and meta-analysis. J Womens Health (Larchmt). 2015 Mar;24(3):237-49. https://www.helsedirektoratet.no/referanse/0002-0013-232482
495. deValk HW, Visser GHA. Insulin during pregnancy, labour, and delivery. Best Practice & Research Clinical Obstetrics and Gynaecology. 2011; 25 :65-76. https://www.helsedirektoratet.no/referanse/0002-0013-232483
496. Ringholm L., Mathiesen E. R., Kelstrup L., Damm P. Managing type 1 diabetes mellitus in pregnancy—from planning to breastfeeding. Nature Reviews Endocrinology. 2012;8(11):659–667. doi: 10.1038/nrendo.2012.154 https://www.helsedirektoratet.no/referanse/0002-0013-232484
497. Eidem I, Vangen S, Hanssen KF, Vollset SE, Henriksen T, Joner G, Stene LC. Perinatal and infant mortality in term and preterm births among women with type 1 diabetes.Diabetologia. 2011 ;54:2771-8. https://www.helsedirektoratet.no/referanse/0002-0013-232485
498. Mathiesen JM, Secher AL, Ringholm L. Changes in basal rates and bolus calculator settings in insulin pumps during pregnancy in women with type 1 diabetes. J Matern Fetal Neonatal Med 2014;27:724–728. pmid:23981186 https://www.helsedirektoratet.no/referanse/0002-0013-232486
Sist faglig oppdatert: 14.09.2016
Igangsetting av fødsel og glukosekontroll under og etter fødsel hos gravide med kjent diabetes
Det anbefales at gravide med kjent diabetes vurderes indusert fra uke 38, hvis ikke forløsning er blitt vurdert før. Det frarådes som regel at gravide med kjent diabetes går over termin.
Det bør tilstrebes at blodglukosen reguleres mellom 4 og 7 mmol/l under fødselen for å redusere risikoen for neonatal hypoglykemi.
Praktisk – slik kan anbefalingen følges
Forløsning
Gravide med kjent diabetes før svangerskapet eller svangerskapsdiabetes som behandles med insulin bør vurderes individuelt for indusering av fødsel ved uke 38, med iverksetting av induksjon senest ved termin. Det frarådes som regel at gravide med pregestasjonell diabetes går over termin.
Den individuelle vurderingen vektlegger blant annet:
- fosterets tilvekst, trivsel og tilstand
- eventuelle forandringer i fostervannsmengde
- morens blodglukoseregulering (HbA1c) og evt. nytilkommet hypertoni
- keisersnitt anvendes etter vanlige obstetriske indikasjoner og anbefales ved alvorlige vaskulære, nyre- eller øyekomplikasjoner
Fødende med insulinkrevende diabetes setter selv insulin og spiser så lenge de kan i fødselsforløpet
Blodglukose måles vanligvis hver time i aktiv fødsel og lokale retningslinjer for tilførsel av insulin og glukose benyttes. Det bør tilstrebes at blodglukosen reguleres mellom 4 og 7 mmol/l under fødselen for å redusere risikoen for neonatal hypoglykemi. Dette kan gjøres ved å gi små doser hurtigvirkende insulin basert på BG-målinger. I aktiv fødsel faller BG og iv glukosetilførsel kan være nødvendig. Ved keisersnitt benyttes glukoseinfusjon tilsatt insulin
Så langt det lar seg gjøre bør kvinner med medikamentelt behandlet diabetes forløse på fødeavdeling med barnelege i vaktberedskap
Se Veileder i fødselshjelp for nærmere beskrivelse av rutiner under og etter fødsel
Etter fødsel
- Umiddelbart etter fødsel faller morens behov for insulin sterkt; til ca. 60 % av behovet før svangerskapet
- Når hun begynner å amme kan behovet falle ytterligere, men kommer etter noen måneder vanligvis opp på nivået før svangerskapet.
På etterkontroll hos fastlegen, er det viktig med rådgivning og informasjon om passende prevensjon. Se også Sjekkliste og informasjon til deg som forskriver p-piller (dmp.no).
Begrunnelse – dette er anbefalingen basert på
Norsk gynekologisk forening har revidert sin Veileder for fødselshjelp i 2014, og denne er førende på feltet. Arbeidsgruppen så derfor ingen grunn til å gjøre egne litteratursøk eller fravike fra anbefalingene i denne, og anbefalingen er derfor sterk, basert på konsensus.
Referanser
489. Veileder i fødselshjelp http://legeforeningen.no/Fagmed/Norsk-gynekologisk-forening/Veiledere/Veileder-i-fodselshjelp-2014/Ultralydundersokelser-i-den-alminnelige-svangerskapsomsorgen/
Sist faglig oppdatert: 20.12.2019
Behandling av hypertensjon ved svangerskap og kjent diabetes
For å unngå komplikasjoner i svangerskapet, bør gravide med kjent diabetes få behandling mot hypertensjon ved blodtrykk >150/100 mmHg.
Behandling av hypertensjon og preeklampsi i svangerskapet hos kvinner med kjent diabetes er en spesialistoppgave.
Praktisk – slik kan anbefalingen følges
Behandling av hypertensjon i svangerskapet er en spesialistoppgave. Kvinner med kjent diabetes og svangerskapsdiabetes har økt risiko for å utvikle preeklampsi under svangerskapet (Pre-eclampsia: Current perspectives and management, 2004).
Svangerskapshypertensjon defineres av vedvarende systolisk blodtrykk ≥140 og/eller >90 mmHg diastolisk som inntrer etter 20. svangerskapsuke uten proteinuri. Blodtrykket er tilbake til det normale igjen innen 12 uker etter fødselen.
Preeklampsi defineres av vedvarende systolisk blodtrykk ≥140 mmHg og/eller >90 mmHg diastolisk som inntrer etter 20. svangerskapsuke med proteinuri ≥0.3 gram per 24 timer eller totalprotein/kreatinin-ratio >0,3 (eller ≥ +1 på urin stix ved minst 2 målinger).
Kvinner med kronisk hypertensjon defineres ved at de har kjent hypertensjon før svangerskapet eller vedvarende blodtrykk ≥140 mmHg systolisk og/eller ≥90 mmHg før 20. svangerskapsuke. "Superimposed" preeklampsi diagnostiseres dersom pasienten i tillegg får proteinuri (uten kjent nyresykdom). Kvinnen bør behandles slik at blodtrykket er lavere enn 150/100 mmHg i svangerskapet. Seponer eventuelt bruk av angiotensin-converting enzyme (ACE) inhibitorer eller angiotensin II reseptor-blokkere i svangerskapet pga. risiko for føtale misdannelser. De samme legemidlene kan benyttes ved behandling av kjent hypertensjon som ved hypertensjon oppstått under svangerskapet/preeklampsi. Se avsnitt Valg av legemiddel lenger ned på siden.
For diagnostikk, behandling og differensialdiagnostikk av alvorlig preeklampsi og HELLP syndrom viser vi til Veileder i fødselshjelp fra Norsk Gynekologisk forening.
Diagnostikk og kliniske tegn på preeklampsi
Ved stigende blodtrykk (med eller uten proteinuri) skal en alltid vurdere kliniske symptomer som kan varsle om alvorlig preeklampsiutvikling, slik som "dårlig form", rask vektøkning/kliniske ødemer, (kraftig) hodepine, synsforstyrrelser, tungpust med trykk for brystet, kvalme, oppkast, epigastriesmerter eller irritabilitet/uro. Tilstanden er uforutsigbar og kan utvikles til en alvorlig, livstruende tilstand på kort tid, fra timer til dager. Tidlig innsettende preeklampsi er oftere assosiert med tilveksthemmet foster, men også sen preeklampsi kan ha alvorlige maternelle og føtale konsekvenser, for eksempel ved eklampsiutvikling.
Preeklampsi diagnostiseres ved forhøyet BT og proteinuri som beskrevet under definisjoner. Preeklampsi gir klinisk et maternelt syndrom (hypertensjon, proteinuri, ødem og aktivert koagulasjon) og i tillegg økt risiko for et føtalt syndrom (veksthemming, fosterhypoksi, placentaløsning, intrauterin fosterdød og prematuritet). Ved sent innsettende preeklampsi dominerer oftest de maternelle symptomer og funn, mens ved tidlig innsettende preeklampsi vil både de maternelle og føtal tegn sees i ulik grad. De føtale tegn vil preges av placentasvikt med tilveksthemning og føtoplacentære sirkulasjonsendringer (Pre-eclampsia: Current perspectives and management, 2004; Managing Obstetric Emergencies and Trauma-the MOET Course Manual, 2007; Hypertension in pregnancy.The management of hypertensive disorders during pregnancy. NICE clinical guideline 107, 2010).
Henvisning
Ved preeklampsi henvises pasienten til fødeavdelingen. Ved lette former for preeklampsi kan poliklinisk oppfølging i spesialisthelsetjenesten med få dagers kontrollintervall være aktuelt (Sibai BM, 2011).
Behandling
Kvinner med høy risiko for preeklampsi (tidligere gjennomgått preeklampsi med start før 34-36 uke) og gravide med diabetiske vaskulære komplikasjoner uten tidligere preeklampsi, bør behandles med 75 mg acetylsalisylsyre daglig fra 12. uke til fødsel.
Blodtrykk >150/100 mmHg bør behandles. Målet er å unngå maternelle komplikasjoner som hjerneblødning, hypertensiv encefalopati og kramper, og ikke en normalisering av blodtrykket (Abalos E, 2007).
Behandlingsmålet er diastolisk verdi rundt 80-100 mmHg og systolisk verdi <150 mmHg.
Postpartumoppfølging
Oppfølging etter svangerskap avhenger av alvorlighetsgrad av preeklampsi i dette svangerskapet og risiko for gjentakelse eller fremtidig hjerte- og karsykdom. Alle kvinner som har gjennomgått preeklampsi bør følges opp postpartum med blodtrykks- og urinkontroll etter utskriving fra sykehus, samt kliniske variabler relatert til andre eventuelle grunnsykdommer. Utvikling av kronisk hypertensjon må vurderes, og kvinnen informeres om økt risiko for hypertensjon ved en eventuelt senere graviditet.
Siden uteroplacentær sirkulasjon ikke er et problem postpartum, bør behandlingsmål for blodtrykk etter forløsning være lavere enn før forløsning, f.eks 140/90 mmHg. Ved behandling av hypertensjon postpartum bør metyldopa seponeres først grunnet bivirkninger. Behandling bør fortsette med labetalol eller nifedipin, evt. i kombinasjon.
Det anbefales at pasienten vurderes nevrologisk etter eklampsianfall med tanke på differensialdiagnoser.
Ny kontroll ved fødeavdelingens poliklinikk anbefales etter 2-3 måneder ved alvorlig preeklampsi, eklampsi og HELLP med ny gjennomgang av graviditeten, informasjon og planlegging av neste svangerskap. Det bør vurderes videre utredning (hypertensjon, nyrefunksjon, trombofili, antifosfolipidsyndrom). Ved senere svangerskap hos disse kvinnene bør kontrollene foregå i samarbeid med fødeavdelingene fra svangerskapsuke 23-24.
Tidligere preeklampsi og hypertensjon i svangerskap gir økt risiko for senere hjerte- og karsykdom. Generelt er risikoen for senere hjerte- og karsykdom sterkest assosiert med tidlig innsettende sykdom (og dermed tidlig forløsning) og alvorlige former for preeklampsi, spesielt der placentafunksjonen er affisert (med tilveksthemmet foster eller intrauterin fosterdød) (Bellamy L, 2007; MdDonald SD, 2008).
Kvinnene bør få informasjon om fordelaktig livsstil og kostholdsvaner for å forebygge hjerte- og karsykdommer etter avsluttet svangerskap og følges perimenopausalt med tanke på tidlig diagnostikk og behandling.
Valg av legemiddel
Antihypertensiva som virker på renin-angiotensin-systemet (ACE-hemmere/angiotensin-2-antagonister) skal ikke brukes av gravide. Disse legemidlene gir forhøyet risiko for nyreskade hos fosteret (renal dysplasi), vekstrestriksjon og fosterdød, spesielt ved eksponering i andre eller tredje trimester. Én studie har vist økt risiko for misdannelser ved bruk i første trimester, mens andre studier tyder på at risikoen ved bruk i første trimester ikke er større enn for andre antihypertensiva eller ved ubehandlet hypertensjon (Baker PN, 2004; Johanson R, 2003).
Kvinner som utenom svangerskap bruker antihypertensiva som virker på renin-angiotensin-systemet skal skifte medikament før de planlegger svangerskap, eventuelt ved påvist graviditet. I noen tilfeller kan de være uten medikamenter en periode midt i svangerskapet på grunn av fysiologiske endringer i svangerskapet. Behandlingsmål er blodtrykk lavere enn 150/100 mmHg gjennom svangerskapet.
De vanligst brukte antihypertensiva som brukes under graviditet i Norge er:
- Labetalol: Tabletter 100 mg x 2, stigende til 200 mg x 3-4. Legemidlet anses som veldokumentert til gravide og trygt for fosteret, og brukes som førstevalg. Adrenerge betareseptorantagonister kan være assosiert med vekstretardasjon, men størrelsen av denne risikoen er uklar. Ved bruk av betablokker mot slutten av svangerskapet bør barnet observeres for bradykardi eller andre tegn til legemiddelpåvirkning de første 1-2 døgnene etter fødselen.
- Nifedipin: Tabletter 10 mg x 2, økende til maks 40 mg x 2/døgn.
- Metyldopa: Tabletter 250 mg x 2-3. Kan økes til 500 mg x 3. Det er ingen holdepunkter for teratogene effekter av metyldopa og dette har tradisjonelt vært førstevalgsmiddel for behandling av hypertensjon hos gravide. Metyldopa ble imidlertid avregistrert i Norge i 2009 og bruken av dette legemidlet har derfor avtatt betydelig de seneste årene.
For doseveiledning, differensialdiagnostikk, vurdering av forløsningstidspunkt og andre spesialistoppgaver, se Veileder i fødselshjelp fra Norsk Gynekologisk forening.
Begrunnelse – dette er anbefalingen basert på
Hypertensive svangerskapskomplikasjoner sees hos 8-10 % av alle gravide i Norge. Kronisk hypertensjon forekommer hos 1-2 %, svangerskapshypertensjon hos 4-5 % og preeklampsi utvikles hos 3-4 %. Diabetes og høy BMI øker risikoen for preeklampsi (Klungsøyr K, 2012).
Tidlig innsettende preeklampsi er oftere assosiert med tilveksthemmet foster, men også sen preeklampsi kan ha alvorlige maternelle og føtale konsekvenser, som eklampsiutvikling.
Labetalol er ansett som førstevalg når det er indikasjon for blodtrykkssenkende behandling under graviditet. ACE-hemmere og AT2-antagonister er kontraindiserte under graviditet. Høyt blodtrykk under graviditet er en risikofaktor for utvikling av preeklampsi, men også for kardiovaskulær sykdom senere i livet. Det er derfor viktig at kvinner med blodtrykk >150/100 mmHg behandles.
Norsk gynekologisk forening har revidert sin Veileder for fødselshjelp i 2014, og denne er førende på feltet. Arbeidsgruppen så derfor ingen grunn til å gjøre egne litteratursøk eller fravike fra anbefalingene i denne, og anbefalingen er derfor sterk, basert på konsensus.
Referanser
489. Veileder i fødselshjelp http://legeforeningen.no/Fagmed/Norsk-gynekologisk-forening/Veiledere/Veileder-i-fodselshjelp-2014/Ultralydundersokelser-i-den-alminnelige-svangerskapsomsorgen/
499. Hypertension in pregnancy. The management of hypertensive disorders during pregnancy. NICE clinical guideline 107, 2010. https://www.helsedirektoratet.no/referanse/0002-0013-232487
500. Baker PN, Kingdom JCP. Preeclampsia. Current Perspectives and Management. The Partenon Publishing Group, USA 2004 https://www.helsedirektoratet.no/referanse/0002-0013-232488
501. Johanson R, Cox C, Grady K, Howell C. Pre-eclampsia and eclampsia. Managing Obstetric Emergencies and Trauma. The MOET Course Manual . M.O.E.T. RCOGPress 2003; 15: 135-47 https://www.helsedirektoratet.no/referanse/0002-0013-232489
502. Neilson JP. Pre-eclampsia and eclampsia. Why Mothers Die 2000-2002 - Report on confidential enquiries into maternal deaths in the United Kingdom (HTML version). https://www.helsedirektoratet.no/referanse/0002-0013-232490
503. Abalos E, Duley L, Steyn DW, Henderson-Smart DJ. Antihypertensive drug therapy for mild to moderate hypertension during pregnancy. The Cochrane Database of Systemic Reviews 2001, Issue 1 https://www.helsedirektoratet.no/referanse/0002-0013-232491
Sist faglig oppdatert: 14.09.2016
Henvisning av gravide kvinner med kjent diabetes til øyeundersøkelse
Gravide kvinner med kjent diabetes bør undersøkes hos øyelege før svangerskapet, og så tidlig som mulig i svangerskapet. Det anbefales stedlig kontroll hos øyelege, og ikke kun netthinnefoto og gradering.
Kvinner med retinopati bør være optimalt behandlet før de blir gravide.
Praktisk – slik kan anbefalingen følges
Gravide kvinner med kjent diabetes før svangerskapet bør undersøkes hos øyelege når de planlegger å bli gravide og så tidlig som mulig i svangerskapet. Fordi retinopatien erfaringsmessig kan forverres i løpet av svangerskapet, bør pasienter som planlegger å bli gravide være optimalt behandlet. Pasienter med svangerskapsdiabetes trenger vanligvis ikke en vurdering hos øyelege.
Kontrollhyppighet
- Retinopati bør vurderes av øyelege før graviditet og eventuell laserbehandling bør være ferdig før graviditet.
- Kvinner med kjent diabetes bør vurderes hos øyelege så tidlig som mulig i svangerskapet (også dersom de ble kontrollert rett før svangerskapet).
- Ved påvist retinopati tas avgjørelse om videre oppfølging av behandlende øyelege.
Begrunnelse – dette er anbefalingen basert på
Uoppdaget retinopati kan progrediere raskt som følge av hormonell forandring under graviditeten eller påvirkes av plutselig forbedring av glukosekontrollen. Som oftest vil forandringene regrediere etter fødsel, men vil i enkelte tilfeller gi varig synsnedsettelse selv om laserbehandling utføres. Gravide kvinner med kjent diabetes før svangerskapet bør derfor undersøkes hos øyelege når de planlegger å bli gravide og så tidlig som mulig i svangerskapet.
Sist faglig oppdatert: 14.09.2016
Helsekrav til førerkort ved diabetes
Sist faglig oppdatert: 27.09.2018
Metode og prosess
Sist faglig oppdatert: 20.12.2019
Nasjonal faglig retningslinje for diabetes, IS-2685, erstatter IS-1674: «Nasjonal faglig retningslinje for forebygging, diagnostikk og behandling av diabetes» fra 2009.
Bakgrunnen for revisjonen er endringer i folkehelselovgivningen, ny kommunehelselov, Føringer i samhandlingsreformen, og strategier for innvandrers helse og for ikke-smittsomme sykdommer. Disse har vært førende for revideringsarbeidet. Samtidig har det kommet ny kunnskap om etiologi, forebygging og behandling av diabetes.
Målgrupper
Hovedmålgruppen for retningslinjen er fastleger og annet helsepersonell ansatt i kommunale helse- og omsorgstjenester, og beslutningstakere i helse- og omsorgsadministrasjon både kommunalt og regionalt. Revisjonen har lagt vekt på å beskrive henvisnings- og samhandlingsrutiner med spesialisthelsetjenesten for å styrke fastlegers kompetanse og trygghet i å håndtere stadig flere pasienter med diabetes og annen kronisk sykdom. Denne avgrensningen fører også til at hovedvekten av anbefalingene gjelder personer med diabetes type 2 over 18 år.
For å understøtte Samhandlingsreformens mål om et sømløst tjenesteforløp, er spesialisthelsetjenesten også målgruppe for retningslinjen. Personer med diabetes vil ofte alternere mellom primær- og spesialisthelsetjenesten etter sykdommens forløp og grad av komplikasjoner, og retningslinjen inneholder derfor også informasjon om ansvarsfordeling mellom tjenestene og noen utvalgte prosedyrer for behandling på sykehus.
Arbeidsgrupper og habilitet
Rundt 60 klinikere og brukerrepresentanter har deltatt i revisjonsarbeidet. Valget av representanter ble basert på en invitasjon til alle regionale helseforetak, Legeforeningen, Norsk Sykepleierforbund, Kommunenes Sentralforbund og Diabetesforbundet. Kjønn, alder, klinisk erfaring, forskningserfaring, geografisk tilhørighet og om de arbeider i primær- eller spesialisthelsetjenesten ble tatt i betraktning ved utvelgelse., Det nasjonale fagrådet for diabetes ble oppfordret til å komme med forslag til representanter og fagområder som skulle prioriteres. Etter at fagområdene var bestemt, ble det gjort ytterligere søk etter representanter som har utpekt seg på sine felt gjennom forskning og foredragsvirksomhet.
Under følger en oversikt over arbeidsgruppene, klinikere og brukerrepresentanter som har vært involvert i arbeidet. Hver arbeidsgruppe har hatt en gruppeleder med overordnet ansvar for fremdrift og ledelse av gruppemøtene i samråd med Helsedirektoratet. Gruppelederen har også fungert som fagredaktør, og har i samarbeid med Helsedirektoratet hatt det redaksjonelle ansvaret med å formidle gruppens vurderinger over i et elektronisk format.
DF= Representant fra Diabetesforbundet
Diagnostikk av diabetes, risikovurdering og oppfølging av personer med høy risiko for å utvikle diabetes
- Berg, Jens Petter (gruppeleder) - Forskningsleder/Professor (Dr.Med.), Oslo Universitetssykehus, Avd for medisinsk biokjemi
- Furuseth, Kristian - Fastlege, Solli klinikk
- Gjelsvik, Bjørn - Førsteamanuensis/fastlege, Universitetet i Oslo, Institutt for Helse og Samfunn (HELSAM), Avd for allmennmedisin
- Høines, Kristian Jong - Fastlege/Spes. i allmennmedisin, Tananger Legesenter
- Jenum, Anne Karen – Professor, Avdeling for allmennmedisin, HELSAM, Universitetet i Oslo
- Markham, Linda (brukerrepresentant, DF)
- Svoen, Normund - Fastlege, Legegruppa Sunnfjord Medisinske Senter, Florø; Praksiskonsulent i Helse Førde
Oppfølging, utredning og organisering av diabetesomsorgen
- Alle arbeidsgruppene
Kommunikasjon, mestring og motivasjon ved diabetes
- Følling, Ingrid S. - Doktorgradsstipendiat, Nord Universitet og NTNU
- Hjellset, Victoria Telle - Postdoc, Universitetet for miljø og biovitenskap, Ås / Universitetet i Oslo, HELSAM
- Karlsen, Bjørg - Professor, Universitetet i Stavanger, Institutt for helsefag
- Lande, Marianne (og Vedvik, Stine) (brukerrepresentant, DF)
- Selle, Harriet - Klinisk spesialistsykepleier, Diabetesklinikken i Trondheim
- Wilhelmsen-Langeland, Ane (fagredaktør) - Psykolog/PhD, Institutt for psykologisk rådgivning
Levevaner ved diabetes og behandling av overvekt og fedme
- Anderssen, Sigmund - Seksjonsleder/professor, Norges Idrettshøgskole
- Bjerkan, Kirsti - Klinisk ernæringsfysiolog/treningspedagog, Oslo Universitetssykehus, Seksjon for klinisk ernæring og Avdeling for endokrinologi, sykelig overvekt og forebyggende medisin
- Følling, Ingrid S. - Doktorgradsstipendiat, Nord Universitet og NTNU
- Gjerstad, Trine Strømfjord, og Aulie, Margrethe (brukerrepresentant, DF)
- Hjellset, Victoria Telle - Postdoc, Universitetet for miljø og biovitenskap, Ås / Universitetet i Oslo, HELSAM
- Hjelmesæth, Jøran - Senterleder/Professor, Senter for sykelig overvekt i Helse Sør-Øst,Sykehuset i Vestfold / Universitetet i Oslo
- Kulseng, Bård Eirik, Overlege/professor, Leder regionalt senter for fedmeforskning og innovasjon, St. Olavs hospital/NTNU
- Lindberg, Fedon A. - Medisinsk direktør/Spesialist i Indremedisin, Dr. Lindbergs klinikk
- Selle, Harriet - Klinisk spesialistsykepleier, Diabetesklinikken i Trondheim
- Aas, Anne-Marie (gruppeleder) - Klinisk ernæringsfysiolog/Førsteamanuensis, Oslo Universitetssykehus (Aker) / Universitetet i Oslo
Behandling med blodsukkersenkende legemidler ved diabetes
- Allgot, Bjørnar (brukerrepresentant, DF)
- Birkeland, Kåre I. (gruppeleder) - Professor/Avd.overlege, Universitetet i Oslo / Oslo Universitetssykehus
- Chaudhary, Amir T. - spesialist i allmennmedisin/overlege, Stovner legesenter / Kommunale Akutt Døgnpost, Aker sykehus
- Claudi, Tor - overlege medisinsk avd., Nordlandssykehuset Bodø
- Cooper, John - Seksjonsoverlege, Stavanger Universitetssjukehus
- Fougner, Kristian J. - avdelingsoverlege, St. Olavs hospital, avdeling for endokrinologi
- Hanssen, Kristian F.- professor (emeritus)/Dr. Med, Oslo Universitetssykehus, Aker
- Hortemo, Sigurd - overlege, Statens legemiddelverk
- Lobben, Stian - fastlege, Nytorget Legesenter, Stavanger
Legemidler til forebygging av makrovaskulære senkomplikasjoner ved diabetes
- Cooper, John (gruppeleder) - Seksjonsoverlege, Stavanger Universitetssjukehus
- Hortemo, Sigurd - overlege, Statens Legemiddelverk
- Johansen, Hilde Ness - vernepleier med videreutdanning i diabetes/sårbehandling og palliasjon, Kommunelegen i Sørfold
- Klemsdal, Tor Ole - overlege, Oslo Universitetssykehus, seksjon for preventiv kardiologi
- Mouland, Gunnar - fastlege, Legegruppen Arendal
- Sveen, Kari Anne - lege, Oslo Universitetssykehus, Aker
- Aambø, Arild - seniorrådgiver, NAKMI
Diabetisk fot og nevropati
- Ayub, Shaista (brukerrepresentant, DF)
- Berg, Tore Julsrud (gruppeleder) - seksjonsoverlege/Dr.Med, Oslo Universitetssykehus, endokrinologisk avdeling, Aker
- Günther, Bodo - seksjonsoverlege, Stord sjukehus
- Iversen, Marjolein M. - førsteamanuensis, Høgskolen i Bergen / Stavanger Universitetssjukehus
- Nøkleby, Kjersti - fastlege, Østensjø legesenter
- Orvik, Elsa - diabetessykepleier, Vestre Viken HF, Bærum sykehus, endokrinologisk poliklinikk
- Søfteland, Eirik - overlege, Haukeland Universitetsjukehus, medisinsk avdeling og Hormonlaboratoriet
Nyresykdom ved diabetes
- Hernar, Ingvild - ass.avdelingssykepleier/diabetessykepleier, Haukeland Universitetssjukehus, medisinsk avdeling, medisinsk poliklinikk
- Jenssen, Trond Geir (gruppeleder) - overlege/professor II, Oslo Universitetssykehus, Rikshospitalet / Universitetet i Tromsø
- Nordahl, Hege (brukerrepresentant, DF)
- Paulsen, Dag - overlege, Sykehuset Innlandet, Lillehammer, medisinsk avdeling/nyreseksjon
- Rabe, Ragnar - fastlege/spesialist i allmennmedisin, Østerås legekontor
- Svarstad, Einar - seksjonsoverlege, Haukeland Universitetssjukehus, medisinsk avdeling
- Aakre, Kristin M. - avdelingsoverlege, Haukeland Universitetssjukehus
Retinopati og systematisk øyeundersøkelse ved diabetes
- Claudi, Tor (gruppeleder) - overlege, Nordlandssykehuset Bodø, medisinsk avdeling
- Fosmark, Dag S. - overlege/PhD, Oslo Universitetssykehus, Ullevål, øyeavdelingen
- Hapnes, Odd Rune - spesialist i øyesykdommer, pensjonist (tidligere avdelingsoverlege Stavanger Universitetssjukehus, øyeavdelingen)
- Henschien, Hans Jørgen - overlege, Sykehuset i Vestfold HF, øyeavdelingen
- (Holm, Mari Liavåg (brukerrepresentant, DF))
- Norveel, Kjetil Unger - øyelege (avtalespesialist), Bærum Øyelegesenter, Sandvika
- Schjelderup-Høye, Ingeborg - fastlege, Dr. Lerner og Dr. Schjelderup-Høyes legekontor, Grue
- Skau, Alexander - overlege/avtalespesialist, Nordlandssykehuset Bodø, øyeavdelingen / Bodø Synskirurgi
Psykisk lidelser og diabetes
- Asghar, Shaheen - overlege, Helse Bergen, Sandviken sykehus
- Berge, Line Iden (gruppeleder) - PhD/LIS-lege i psykiatri, Helse Bergen
- Engum, Anne - PhD/ overlege. St.Olavs Hospital, avd Østmarka og førsteamanuensis II ved Institutt for nevromedisin, Det medisinske fakultet, NTNU
- Karlsen, Bjørg - Professor, Universitetet i Stavanger, Institutt for helsefag
- Lande, Marianne (og Vedvik, Stine) (brukerrepresentant, DF)
- Qurashi, Samara A. - lege/forsker II, NAKMI (Kumar, Bernadette, lege/direktør, NAKMI)
- Wilhelmsen-Langeland, Ane - Psykolog/PhD, Institutt for psykologisk rådgivning
Svangerskap ved kjent diabetes
- Hanssen, Kristian F. (gruppeleder) - professor (emeritus)/Dr. Med, Oslo Universitetssykehus, Aker
- Henriksen, Tore - overlege/professor (emeritus) i gynekologi/obstetrikk, Oslo Universitetssykehus, Rikshospitalet, Fødeseksjonen
Svangerskapsdiabetes (egen retningslinje)
- Bjerkan, Kirsti - Klinisk ernæringsfysiolog/treningspedagog, Oslo Universitetssykehus, Seksjon for klinisk ernæring og Avdeling for endokrinologi, sykelig overvekt og forebyggende medisin
- Gudim, Hilde Beate - fastlege/spesialist i allmennmedisin, Skui legekontor; Praksiskonsulent Bærum sykehus
- Hanssen, Kristian F. (gruppeleder) - professor (emeritus)/Dr. Med, Oslo Universitetssykehus, Aker
- Henriksen, Tore - overlege/professor (emeritus) i gynekologi/obstetrikk, Oslo Universitetssykehus, Rikshospitalet, Fødeseksjonen
- Holm, Helene Oeding - diabetessykepleier/jordmor, Oslo Universitetssykehus, Svangerskapspoliklinikken (Ullevål)
- Jenum, Anne Karen (fagredaktør) – Professor, Avdeling for allmennmedisin, HELSAM, Universitetet i Oslo
- Thordarson, Hrafnkell B. - seksjonsoverlege, Haukeland Universitetssjukehus, endokrinologisk seksjon
Innvandrere og diabetes (referansegruppe, ikke eget kapittel)
- Ayub, Shaista (brukerrepresentant, DF)
- Chaudhary, Amir T. - spesialist i allmennmedisin/overlege, Stovner legesenter/Kommunale Akutt Døgnpost, Aker sykehus
- Hjellset, Victoria Telle (gruppeleder) - Postdoc, Universitetet for miljø og biovitenskap, Ås / Universitetet i Oslo, HELSAM
- Jenum, Anne Karen – Professor, Avdeling for allmennmedisin, HELSAM, Universitetet i Oslo
- Kumar, Bernadette, lege/direktør, NAKMI
- Aambø, Arild - seniorrådgiver, NAKMI
Alle deltakerne i arbeidsgruppene har avgitt skriftlig erklæring hvor de har redegjort for mulige faglige eller økonomiske interessekonflikter knyttet til dette arbeidet. Helsedirektoratet har vurdert alle deltakere i arbeidsgruppene med hensyn til habilitet.
En del av legene i de ulike arbeidsgruppene rapporterte at de hadde mottatt honorar fra ulike legemiddelfirmaer for foredragsvirksomhet, deltagelse i «Advisory Boards» ol, men alle de aktuelle legene kunne vise til en fordeling på flere ulike firmaer slik at dette ble vurdert til å ikke innvirke på dere habilitet, av verken økonomisk eller intellektuell karakter.
Fedon A. Lindberg rapporterer at han er medisinsk direktør i dr. Lindbergs klinikk, som har spesialisert seg på forebygging og behandling av livsstilssykdommer. Den kliniske praksisen baserer seg på Dr. Lindbergs kostholdfilosofi.
Dette ble vurdert til å være et spørsmål om habilitet for noen av de kliniske problemstillingene i arbeidsgruppen for «Levevaner ved diabetes og behandling av overvekt og fedme».
Dette spørsmålet ble håndtert i henhold til GRADE Working group (ved Gordon Guyatt) sitt råd om håndtering av «Conflict of Interest» (Guyatt G, 2010 ¹), som angir at arbeidsgruppemedlemmet i slike tilfeller er fri til å være med i diskusjonen, men ikke kan spille inn i den endelige avgjørelsen med ordlyd eller styrke i anbefalingen. Det ble vurdert i en åpen diskusjon i arbeidsgruppen hvilke kliniske problemstillinger (PICO-spørsmål) som dette var gjeldende for, og i dette tilfelle gjaldt det PICO om middelhavskosthold, kost med lav glykemisk indeks, karbohydratredusert kost og fruktose.
Ingen andre arbeidsgruppedeltakere ble funnet inhabile i forhold til å delta i arbeidet med retningslinjen.
Metodisk tilnærming
Kunnskapsbasert praksis
En nasjonal faglig retningslinje skal bygge på kunnskapsbasert praksis. Det innebærer at forskning, klinisk erfaring og brukererfaring skal vurderes samlet opp mot ønskede og uønskede konsekvenser av foreslåtte anbefalinger. Anbefalinger skal ses i lys av verdier, ressursbruk, prioriteringskriterier, lover og forskrifter.
Anbefalingene i denne retningslinjen står på disse tre tilnærmingene:
- innhentet og vurdert oppsummert forskningsbasert kunnskap
- klinisk kunnskap og erfaring
- brukerkunnskap og erfaring
I kunnskapsbasert praksis vil avgjørelsene på tema der man finner lite eller ingen forskningsbasert kunnskap, i større grad baseres på klinisk kunnskap og brukererfaringer. Et eksempel på dette er behandlingsmål for blodglukose eller blodtrykk, der avgjørelsen hovedsakelig har fremkommet gjennom diskusjoner i arbeidsgruppen og mellom arbeidsgruppedeltakere og andre brukere og klinikere.
Definere og prioritere problemstillinger
Prioriteringen av de kliniske problemstillingene ble gjort ut i fra følgende formål:
- å hindre uønsket variasjon i tjenesten
- å sikre god kvalitet
- å sikre riktige prioriteringer
- å løse samhandlingsutfordringer
- å sikre helhetlige pasientforløp
Videre ble det for hver problemstilling definert:
- Populasjonen spørsmålet omfatter og den aktuelle intervensjonen
- Eventuell sammenlignende behandling
- De viktigste utfallsmålene av intervensjonen
Innhenting av litteratur, prioritering og vurdering av kvalitet på evidens
Gruppemedlemmene ble gitt en grunnleggende opplæring i McMaster Plus Pyramidesøk for å lete etter oppsummert forskning og gå gjennom søkeresultater. Vi har i størst mulig grad basert våre anbefalinger på meta-analyser og systematiske oversikter. Randomiserte kontrollerte studier ligger til grunn for de fleste av disse, og kun unntaksvis er narrative oppsummeringer, observasjonsstudier eller kohortestudier benyttet i kunnskapsgrunnlaget. Vi har tilstrebet å finne den seneste publiserte vitenskapen med høyest kvalitet, og som er basert på en pasientpopulasjon og en intervensjon som er nærmest norske forhold.
Metoden for kvalitetsvurdering er basert på GRADE (Grading of Recommendations, Assessment, Development and Evaluation).
Utarbeide anbefalinger
Hver enkel klinisk problemstilling ble systematisk drøftet ved bruk av Evidence to Decision Framework (epistemonikos.org). Med utgangspunkt i forskningsgrunnlaget, ble klinisk erfaring og brukerpreferanser- og erfaringer vurdert for å komme frem til endelig anbefaling og dens styrke.
Spørsmålene som ble diskutert for å avgjøre styrken på anbefalingen var blant annet:
- Er det usikkerhet om nytten klart overgår potensiell skade/bivirkninger og ressursbruk?
- Er det lav kvalitet på dokumentasjonen eller lav tiltro til effektestimatene?
- Er det usikkerhet eller variasjon vedrørende verdier og preferanser hos aktuelle målgrupper?
- Er det usikkerhet om tiltaket vil føre til utilsiktet variasjon i tjenestene?
- Er det usikkerhet om netto gevinst for pasient og helsetjeneste er verdt kostnadene?
- Er tiltaket mulig å gjennomføre?
Mulige svakheter ved retningslinjen
I stor grad gjenspeiler anbefalingene de kliniske problemstillingene som gruppene ønsket svar på i utgangspunktet. For en del problemstillinger var det viktig å inkludere utfallsmål som stress, engstelse, livskvalitet, mestringsevne med mer, da disse utfallsmålene var spesielt viktige for brukerne. Det viste seg imidlertid at det var lite systematisert kunnskap som adresserte disse utfallsmålene. For noen problemstillinger hadde det vært ønskelig med studier som hadde lenger oppfølgingstid av intervensjoner og pasienter slik at langtidseffekter kunne belyses bedre. Dette gjelder også for harde utfallsmål, som død og hjerte- og karhendelser. Surrogate utfallsmål er i stor grad benyttet som erstatning der det er relevant.
Det finnes mange systematiske oversiktsartikler og meta-analyser på diabetesfagfeltet og pyramidesøk ble vurdert som tilstrekkelig for å innhente nødvendig forskningsgrunnlag. Enkeltstudier, kvalitativ forskning og grå litteratur er således i liten grad inkludert i forskningsgrunnlaget.
Evaluering og måling av retningslinjens effekt
Det er en svakhet at vi ikke har gode nok data på kvaliteten av dagens diabetesomsorg. Dermed kan vi heller ikke vite hvilken effekt de nye anbefalingene vil ha. Men det arbeides for at datakomplettheten i Norsk Diabetesregister for voksne (NDV (Noklus)) skal bedres, og dette vil være ett av flere elementer som vil inngå i utkast til Nasjonal diabetesplan, som skal utarbeides i løpet av første halvdel i 2017. I løpet av noen år, når det planlagte kommunale pasient- og brukerregister (KPR) blir etablert, vil også dette kunne gi data på kvaliteten i diabetesbehandlingen.
¹Guyatt G, Akl EA, Hirsh J, Kearon C, Crowther M, Gutterman D, Lewis SZ, Nathanson I, Jaeschke R, Schünemann H. The vexing problem of guidelines and conflict of interest: a potential solution. Ann Intern Med. 2010 Jun 1;152(11):738-41. doi: 10.7326/0003-4819-152-11-201006010-00254. Epub 2010 May 17.









