Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av diffuse gliomer hos voksne
Hva er nytt?
Sist faglig oppdatert: 17.04.2024
Hovedmomenter i oppdateringen av de nevroonkologiske handlingsprogrammene som ble publisert august 2023 og mindre oppdatering vår 2024:
- Handlingsprogrammene for diffuse høygradige og diffuse lavgradige gliomer ble slått sammen til ett handlingsprogram for diffuse gliomer
- Handlingsprogrammet for meningeomer ble strammet inn og det ble definert et tydelig MR kontrollopplegg
- I alle stråleappendixer er det lagt inn referanse til ny publikasjon fra KVIST vedrørende stråletoleransegrenser for viktige organer i og nær sentralnervesystemet (såkalte risikoorganer)
- Nasjonale insidenstall er oppdaterte i tråd med rapport fra det nyetablerte Hjernesvulstregisteret (kvalitetsregister i regi av Kreftregisteret)
- Hjernesvulstklassifiseringen er oppdatert og i tråd med WHOs klassifisering publisert november 2021
- Det er lagt inn egne kapitler skrevet av og for fastleger/primærleger
- Utvidet omtale av nukleærmedisinsk diagnostikk
- Den sannsynlige sammenhengen mellom oral hormonerstatningsterapi og meningeomer er omtalt
Sammendrag av anbefalingene
Sist faglig oppdatert: 17.08.2023
- Dette handlingsprogrammet omhandler diffust gliom CNS WHO grad 2-4 hos voksne
- I programmet skilles det mellom CNS WHO grad 2 og CNS WHO grad 3 og 4 diffust gliom, det vil si diffust lavgradig og diffust høygradig gliom. Dette skyldes at mange tidligere kliniske studier har brukt denne dikotomiseringen. Det prognostiske skillet mellom CNS WHO grad 2 og 3 er imidlertid mer utydelig etter WHO 2021-klassifikasjonen av CNS-svulster. Prognosen for CNS WHO grad 3 oligodendrogliom er dessuten bedre enn for CNS WHO grad 2 astrocytom
HENVISNINGSRUTINER
- Pasienter med radiologisk mistenkt diffust CNS WHO grad 2 gliom skal inkluderes i «Pakkeforløp for hjernekreft» for å utelukke diffust høygradig gliom, og henvises til nevrokirurgisk avdeling for vurdering med tanke på kirurgi (Evidens grad D). Om det blir sannsynliggjort med MR tumorprotokoll eller vevsprøve at det foreligger et diffust CNS WHO grad 2 gliom, skal pasienten ut av pakkeforløpet
- Pasienter hvor man mistenker høygradig diffust gliom (CNS WHO grad 3 eller 4), skal henvises til «Pakkeforløp for hjernekreft»
- Pasientene bør som hovedregel vurderes i multidisiplinært team (MDT) preoperativt og/eller postoperativt
DIAGNOSTIKK
- Alle pasienter hvor man mistenker diffust gliom skal utredes med MR tumorprotokoll, med mindre MR er kontraindisert
- MR-undersøkelsen skal omfatte hodet (hjernen) og utføres med tumorprotokoll som minimum må inneholde følgende sekvenser:
Sekvens | Bildeplan |
|---|---|
T1 før kontrast | 3D |
TSE/FSE T2 | Transversal |
FLAIR | 3D |
Diffusjon | Transversal |
T1 etter intravenøs kontrast | 3D |
- Diagnosen bør som hovedregel baseres på histopatologi i tillegg til MR (Evidens grad C)
- Diagnostiske molekylærbiologiske parametere som må utføres på pasienter med diffust gliom:
Diffust gliom | Karakteristika | Diagnose |
|---|---|---|
IDH-positiv (mutert)
| 1p/19q kodelesjon | Oligodendrogliom CNS WHO grad 2 eller 3 |
1p/19q kodelesjon ikke påvist (eller ATRX-positiv og/eller p53-positiv) | Diffust astrocytom CNS WHO grad 2, 3 eller 4 | |
1p/19q kodelesjon ikke påvist, men påvist mikrovaskulær proliferasjon, nekrose eller homozygot CDKN2A/B delesjon | Diffust astrocytom CNS WHO grad 4 | |
IDH-negativ (villtype) | Mikrovaskulær proliferasjon, nekrose, TERT-promotormutasjon, EGFR-amplifikasjon eller kromosomkombinasjonen +7 og -10 | Glioblastom CNS WHO grad 4 |
- MGMT metyleringsstatus bør bestemmes ved glioblastom. MGMT-status har prediktiv verdi for respons på alkylerende kjemoterapi (temozolomid) ved glioblastom (men ikke ved IDH-positivt astrocytom CNS WHO grad 4). MGMT status har også trolig prediktiv verdi for respons på alkylerende kjemoterapi ved oligodendrogliom.
BEHANDLING
CNS WHO grad 2 diffust gliom
- Tidlig kirurgisk reseksjon gir på gruppenivå stor overlevelsesgevinst sammenlignet med «watchful waiting” ved mistenkt diffust CNS WHO grad 2 gliom (Evidens grad B)
- Målet ved primær kirurgisk reseksjon av diffust CNS WHO grad 2 gliom er å gjennomføre maksimal reduksjon av svulstvev, uten å påføre pasienten nye permanente sekveler (Evidens grad C). Noen sekveler kan av og til være akseptable sett i lys av den store overlevelsesgevinsten ved kirurgi, ikke minst der vevsdiagnosen er kjent (Evidens grad D). Avgjørelser rundt dette diskuteres med pasienten
- Postoperativt bør det tas en tidlig MR (innen 48 timer) for å vurdere reseksjonsgrad og komplikasjoner. Dersom reseksjonsgrad er klart dårligere enn ønsket bør mulighet for rekirurgi vurderes, helst i MDT-møte (Evidens grad D)
- Mulighet for rekirurgi vurderes ved residiv (Evidens grad D)
- Pasienter operert for diffust CNS WHO grad 2 gliom skal diskuteres på MDT-møte for vurdering av indikasjon for strålebehandling og adjuvant kjemoterapi
- Adjuvant PCV etter strålebehandling til 54 Gy gir bedre overlevelse for selekterte pasienter med høyere risiko for malign transformasjon (Evidens grad A)
- Pasienter som ikke er egnet for primær kirurgisk eller ytterligere kirurgisk reseksjon ved rest/residiv, pasienter med kliniske/radiologiske tegn til rask tumorprogresjon og/eller flere negative prognostiske faktorer, samt pasienter med dårlig epilepsikontroll er ofte aktuelle for tumorrettet behandling med stråleterapi og kjemoterapi (Evidens grad B)
- Stråledose for pasienter med diffust CNS WHO grad 2 gliom bør være 50.4–54 Gy (Evidens grad B)
- Fordi strålebehandling kombinert med kjemoterapi i form av PCV gir bedre totaloverlevelse enn strålebehandling alene, bør man som standard gi kombinasjonsterapi og ikke bare kjemoterapi (Evidens grad A). Det er ikke gjennomført studier som viser at temozolomid har samme effekt som PCV adjuvant til strålebehandling
- Dersom pasienter av toksisitetshensyn ikke klarer å gjennomføre PCV-kurene, kan man vurdere å erstatte gjenværende behandlingstid med temozolomid
- Anbefalt kurskjema for temozolomid og PCV finnes i appendix 1
CNS WHO grad 3 og 4 diffust gliom
- Alle pasienter med høygradig diffust gliom (CNS WHO grad 3 og 4) skal vurderes for multimodal terapi inkludert kirurgi, strålebehandling og kjemoterapi
- Målet ved kirurgisk reseksjon av diffust CNS WHO grad 3 og 4 gliom er å sikre vevsdiagnose og å gjennomføre maksimal reduksjon av svulstvev uten å påføre pasienten nye sekveler (Evidens grad C)
- Postoperative nevrologiske utfall er assosiert med dårligere overlevelse ved glioblastom (Evidens grad C)
- Høy kirurgisk reseksjonsgrad bedrer overlevelse for pasienter med diffust CNS WHO grad 3 og 4 gliom (Evidens grad B). Reseksjon av alt kontrastladende tumorvev gir overlevelsesgevinst sammenlignet med kun partiell reseksjon eller biopsi (Evidens grad B). Reseksjon av ikke-kontrastadende tumorvev (FLAIR-forandringer) i tillegg til kontrastladende vev er assosiert med bedre overlelevelse hos pasienter <65 år (Evidens grad C)
- Postoperativt bør det tas en tidlig MR (<48 timer) for å vurdere reseksjonsgrad og eventuelle komplikasjoner. Dersom reseksjonsgrad er klart dårligere enn ønsket bør mulighet for tidlig rekirurgi vurderes, helst i MDT-møte (Evidens grad D)
- Strålebehandling av diffust CNS WHO grad 3 og 4 gliom forlenger pasientenes overlevelse (Evidens grad B). Vedrørende definering av målvolumer og risikoorganer henvises til appendix 2
- Pasienter med CNS WHO grad 3 oligodendrogliom (IDH-mutert, 1p19q-kodelesjon) anbefales postoperativ strålebehandling 1.8 Gy x 33 og 6 adjuvante PCV-kurer, forutsatt akseptabel toleranse (for kurskjema henvises til appendix 1. Evidens grad A)
- Pasienter med CNS WHO grad 3 diffust astrocytom (IDH-mutert) anbefales postoperativ strålebehandling 1.8 Gy x 33 og 6–12 adjuvante temozolomidkurer, forutsatt akseptabel toleranse (for kurskjema henvises til appendix 1. Evidens grad A)
- Pasienter under 70 år med glioblastom eller diffust astrocytom CNS WHO grad 4 og allmenntilstand svarende til ECOG 2 eller bedre, bør ha postoperativ strålebehandling 2 Gy x 30 med daglig konkomitant og 6 kurer adjuvant temozolomid, forutsatt akseptabel toleranse (for kurskjema henvises til appendix 1. Evidens grad A)
- Pasienter over 70 år med glioblastom eller diffust astrocytom CNS WHO grad 4 og allmenntilstand svarende til ECOG 2 eller bedre, anbefales postoperativ hypofraksjonert strålebehandling 2.67 Gy x 15 med konkomitant og adjuvant temozolomid, alternativt 3 Gy x 13 eller 3.4 Gy x 10 (for kurskjema henvises til appendix 1. Evidens grad A)
- Monoterapi temozolomid er et behandlingsalternativ for pasienter over 70 år med glioblastom som har metylert MGMT-promotor (for kurskjema henvises til appendix 1. Evidens grad A)
- Hos eldre pasienter og/eller pasienter med allmenntilstand svarende til ECOG 3–4 individualiseres behandlingen
- Oppstart strålebehandling bør skje innen 6 uker etter diagnostisk kirurgi (Evidens grad D)
- Oppstart adjuvant kjemoterapi bør skje ca 4–6 uker etter avsluttet strålebehandling (gjelder både for temozolomid og PCV)
- Behandling med alternerende elektriske felter (TTF) som supplement i den adjuvante fasen i Stupp-regimet er vist å gi forlenget overlevelse for pasienter med glioblastom (Evidens grad A). Beslutningsforum har imidlertid sagt nei til at denne behandlingen kan tilbys i det offentlige norske helsevesenet
OPPFØLGING
CNS WHO grad 2 diffust gliom
- Oppfølging ved MR gjøres helst med samme feltstyrke (Tesla) og fortrinnsvis samme skanner for å unngå teknologiavhengige variasjoner i T2/FLAIR-signaler og dermed antatt tumorvolum/behandlingsrespons. Volumetriske analyser er mest følsomt for å avdekke svulstvekst (Evidens grad C)
- Pasienter med diffust CNS WHO grad 2 gliom skal kontrolleres livslangt
- Kontrollene bør i tillegg til MR caput bestå av klinisk konsultasjon
- I oppfølging etter primærbehandling bør MR tas hver 6. måned. Dersom det ikke er tegn til progresjon første 10 år kan man vurdere å gå over til årlige kontroller
- Pasienter som får bekreftet malign transformasjon histologisk eller der det er overbevisende radiologiske tegn til sekundær malign transformasjon behandles som høygradige diffuse gliomer (Evidens grad C)
- For rehabiliteringsanbefalinger – se «Handlingsprogram for hjernesvulst»
CNS WHO grad 3 og 4 diffust gliom
- Pasienter med høygradig (CNS WHO grad 3 og 4) diffust gliom skal kontrolleres livslangt
- Kontrollintervallet bør initialt være hver 4. måned og kan etter hvert økes inntil hver 6. måned, men pasienter med oligodendrogliom CNS WHO grad 3 kan kontrolleres som diffust CNS WHO grad 2 gliom (Evidens grad D)
- Kontrollene bør bestå av MR caput (med samme tumorprotokoll hver gang) etterfulgt av klinisk konsultasjon (Evidens grad D)
- Det er viktig å være klar over muligheten for radiologisk pseudoprogresjon, spesielt ved høye stråledoser på opptil 60 Gy kombinert med kjemoterapi. MR perfusjon samt ekspektans kan være nyttig ved mistanke om pseudoprogresjon
- Symptomrettet behandling må vurderes og igangsettes gjennom hele forløpet etter behov. Rehabilitering må vurderes, men er aktuelt i varierende grad, ikke minst avhengig av diagnose og prognose (Evidens grad D)
RESIDIVBEHANDLING
- Behandling ved residiv vil være ulik avhengig av allmenntilstand, komorbiditet, funksjonsnivå, diagnose, tid siden primærbehandling og residivlokalisasjon. I prinsippet er alle tumorrettede behandlingsmodaliteter aktuelle. Evidensnivået for de fleste tumorrettede behandlingsopsjoner i residivfasen er imidlertid nokså svakt
- Recidivpasienter kan med fordel diskuteres i MDT-møter
Innledning
Sist faglig oppdatert: 17.08.2023
Diffuse gliomer vokser diffust infiltrerende inn i det som radiologisk ser ut som normalt hjernevev. Samtidig sprer gliomer seg nesten aldri til organer utenfor sentralnervesystemet (CNS). Uansett grad av kirurgisk reseksjon eller respons på primærbehandling vil det alltid gjenstå mikroskopisk sykdom som før eller senere vil gi opphav til residiv/progresjon. Gjenværende mikroskopisk tumorvev kan ikke visualiseres med bildediagnostikk. All behandling vil dermed være livsforlengende med formål lengst mulig levetid med best mulig livskvalitet.
Diffuse gliomer hos voksne inndeles i henhold til WHO i malignitetsgrad 2-4 og omfatter uhelbredelige hjernekreftsykdommer med svært stort spenn i prognose og behandling. De utgjør likevel et kontinuum der diffuse CNS WHO grad 2- og grad 3-svulster kan gjennomgå malign transformasjon til høyere CNS WHO-grad. Klassifikasjon av diffuse gliomer endret seg med både WHOs 2016- og 2021-klassifikasjoner og molekylærpatologiske karakteristika (spesielt IDH-status) trekker nå opp de viktigste diagnostiske skillelinjene (Louis et al., 2021). Man bør være oppmerksom på at begrepet lavgradig gliom er upresist og historisk inndeling der CNS WHO grad 1 og 2 blir omtalt som lavgradige og CNS WHO grad 3 og 4 blir omtalt som høygradige gir biologisk stadig mindre mening. Diffuse CNS WHO grad 2 gliomer har lite til felles med benigne CNS WHO grad 1 gliomer og med dagens molekylærbiologiske diagnostikk er skillelinjene mellom CNS WHO grad 2- og 3-gliomer også noe mer uvisket. CNS WHO grad 2 og 3 diffuse gliomer blir derfor nå av og til slått sammen som diffuse lavere grad gliomer (diffuse lower grade glioma), selv om det nok er ryddigst å unngå å slå sammen grupper. Dette handlingsprogrammet omhandler diffuse gliomer, CNS WHO grad 2-4. Siden mange kliniske studier har satt skillet mellom grad 2 og grad 3-4 har vi valgt å bruke den dikotomiseringen ved denne oppdateringen av handlingsprogrammet.
Epidemiologi
Forekomst
Sist faglig oppdatert: 17.08.2023
Hvert år diagnostiseres omkring 300 voksne personer med diffuse gliomer CNS WHO grad 4, ca 40-80 med diffuse grad 3 gliomer og ca 50 med diffuse grad 2 gliomer i Norge. Grunnet endring i klassifikasjon er fordelingen mellom gliomgruppene i noe endring. Det er en svak økning i insidens over tid, trolig grunnet bedre og mer bruk av følsom bildediagnostikk, ikke minst hos eldre.
Mens pasienter med glioblastomer oftest er eldre (median alder over 60 år), er pasienter med diffuse CNS WHO grad 3 gliomer gjennomsnittlig noe yngre. Diffuse grad 2 gliomer rammer hyppigst yngre voksne og median alder ved diagnose er omkring 40 år. Gliomer sees oftest supratentorielt og rammer menn noe hyppigere enn kvinner (mann/kvinne-ratio 1,3 – 1,4).
Prognose
Sist faglig oppdatert: 17.08.2023
Diffust CNS WHO grad 2 gliom
Diffuse CNS WHO grad 2 gliomer vokser gjerne langsomt (median 4.4 mm/år) inntil såkalt malign transformasjon (Mandonnet et al., 2003), hvoretter prognosen ofte er sammenlignbar med primære CNS WHO grad 3 eller 4 diffuse gliomer (Dropcho et al., 1996). Ubehandlet vokser diffuse lavgradige gliomer i prinsippet alltid (Rees et al., 2009), selv om veksten kan være så langsom at det ikke alltid fanges opp med ordinær bildediagnostikk uten volumetriske målinger og en viss observasjonstid. Veksten er typisk konstant og volumavhengig, også i klinisk/symptomatisk stabil fase, men veksthastighet øker etter malign transformasjon. Radiologisk bedømt progresjonsfri overlevelse er dermed et kontroversielt, men mye brukt endepunkt i kliniske studier da overlevelsesstudier krever svært lang oppfølgingstid. Prognosen avhenger sterkt av hvor tidlig det tilkommer malign transformasjon. Et hovedmål ved behandlingen er derfor å utsette/hindre malign transformasjon. Dette forutsetter tidlig behandling. Sykdomsforløpet er ofte uforutsigbart med median overlevelse 5–25 år avhengig av prognostiske faktorer og behandling.
Forekomst av nevrologiske utfall øker gjerne med alder og tumorutbredelse, mens epilepsi som debutsymptom er inverst assosiert med forekomst av nevrologiske utfall og dermed et prognostisk gunstig tegn. Prognosen blir dårligere med større tumorvolum, innvekst i midtlinjestrukturer eller følsomme (elokvente) områder, dårlig funksjonsnivå (målt ved WHO/ECOG-status eller Karnofsky performance status), diagnose astrocytom og lav kirurgisk reseksjonsgrad (Capelle et al., 2013; Pignatti et al., 2002; Wen et al., 2009). Veksthastigheten korrelerer også med risiko for malign transformasjon (Pallud et al., 2013).
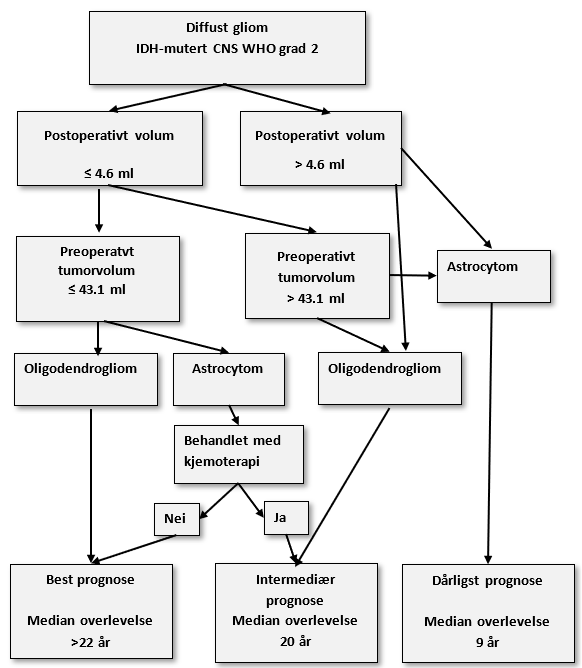
Prognostisering er viktig for hvor aktiv behandling man skal tilby tidlig hos pasienter med diffust CNS WHO grad 2 gliom; både for beslutninger omkring kirurgisk strategi (risko-nytte for operativ radikalitet) og indikasjon for postoperativ strålebehandling og kjemoterapi. Tidligere prognostiske scoringssystemer (som Pignatti risk score og UCSF/Chang-score) tok ikke hensyn til molekylær klassifikasjon eller postoperative tumorvolum, to svært viktige prognostiske faktorer. Det er etter hvert nokså klart at pre- og postoperative tumorvolum er de sterkeste prognostiske faktorene hos pasienter med diffuse lavgradige gliom (Hervey-Jumper et al., 2023; Wijnenga et al., 2018). For diffuse astrocytomer er reseksjonsgrad spesielt avgjørende og kun 1 ml resttumor er assosiert med dårligere overlevelse. For oligodendrogliom er den statistiske grenseverdien høyere (Kavouridis et al., 2019). Dette kan skyldes at veksthastighet ofte er lavere og respons på stråle- og kjemoterapi bedre ved oligodendrogliom. I en validert retrospektiv kohortstudie definerte man tre prognostiske grupper basert på preoperativt volum, postoperativt volum, diagnose (astrocytom vs. oligodendrogliom) og kjemoterapi (Hervey-Jumper et al., 2023):
Diffust CNS WHO grad 3 og 4 gliom
Alder og funksjonsnivå (ECOG-status) er viktige kliniske prognostiske faktorer ved høygradige diffuse gliomer. I tillegg kommer tumors størrelse, lokalisasjon, samt kirurgisk reseksjonsgrad og molekylærbiologiske karakteristika. Median overlevelse for helt uselekterte pasienter med glioblastom er kun 8–10 måneder (Rønning et al., 2012), mens det for undergruppen av pasienter som er under 70 år, har godt funksjonsnivå og som får standardbehandling er noe bedre med knappe 15 måneder (Stupp et al., 2005).
CNS WHO grad 3 diffuse astrocytomer har historisk sett en mer variabel og bedre prognose hvor median overlevelse varierer fra 2 til 8 år i ulike studier. Med endret klassifikasjon der diffuse gliomer med IDH villtype ikke kan være CNS WHO grad 3 vil prognosen for gruppen bli noe bedre og mindre variabel. CNS WHO grad 3 oligodendrogliom har langt bedre prognose med median overlevelse 14-20 år (Lassman et al., 2022).
Forebygging
Sist faglig oppdatert: 17.08.2023
Det vises til «Nasjonalt handlingsprogram for hjernesvulster generelt». Man vet at strålebehandling eller eksponering for ioniserende stråler kan gi sekundære svulster. Ved bestråling av normal hjerne hos hjernesvulstpasienter med lang forventet levetid etter stråle-behandling, bør dette tas hensyn til ved indikasjonsstilling. For øvrig er det ingen aktuelle forebyggende tiltak som er aktuelle med tanke på diffuse gliomer.
Pakkeforløp for kreft
Sist faglig oppdatert: 17.08.2023
I 2015 ble «Pakkeforløp for hjernekreft» innført i helsetjenesten, sammen med øvrige Pakkeforløp for kreft. «Pakkeforløp for hjernekreft» ble revidert i 2020. Pasienter med radiologisk mistenkt diffust gliom grad 2 skal inkluderes i «Pakkeforløp for hjernekreft» for å utelukke diffust høygradig gliom (CNS WHO grad 3 eller 4). Om det blir bekreftet med MR tumorprotokoll eller vevsprøve at det foreligger et diffust gliom CNS WHO grad 2, skal pasienten ut av pakkeforløpet.
Mistenker man en hjernesvulst av usikker type, så skal pasienten inn i «Pakkeforløp for hjernekreft» for å få avklart hvilken type svulst det dreier seg om. Tilsvarende gjøres dersom man har radiologiske funn hvor man er usikker på om det dreier seg om et høygradig eller lavgradig diffust gliom; pasienten inkluderes da i «Pakkeforløp for hjernekreft» inntil man har avklart endelig diagnose og om pasienten skal fortsette i pakkeforløpet eller ei.
Om Pakkeforløp for kreft
Sist faglig oppdatert: 17.08.2023
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Les mer om Pakkeforløp for hjernekreft
Det er egne Diagnoseveiledere for inngang til pakkeforløp for kreft.
Pakkeforløp hjem for pasienter med kreft
Sist faglig oppdatert: 17.08.2023
Pakkeforløp hjem for pasienter med kreft skal bidra til å sikre god struktur og logistikk i helsetjenesten, samt sikre trygghet og forutsigbarhet for personer som lever med kreft eller etter endt kreftbehandling. Les mer om Pakkeforløp hjem for pasienter med kreft.
Anbefalinger:
- Pasienter med radiologisk mistenkt diffust CNS WHO grad 2 gliom skal inkluderes i «Pakkeforløp for hjernekreft» for å utelukke diffust høygradig gliom, og henvises til nevrokirurgisk avdeling for vurdering med tanke på kirurgi (Evidens grad D). Om det blir bekreftet med MR tumorprotokoll eller vevsprøve at det foreligger et diffust CNS WHO grad 2 gliom, skal pasienten ut av pakkeforløpet
- Pasienter hvor man mistenker at det kan foreligge et høygradig diffust gliom (CNS WHO grad 3 eller 4) skal henvises til «Pakkeforløp for hjernekreft»
- Pasientene bør vurderes i multidisiplinært team (MDT) preoperativt og/eller postoperativt
Om Pakkeforløp for kreft
Sist faglig oppdatert: 17.08.2023
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Les mer om Pakkeforløp for hjernekreft
Det er egne Diagnoseveiledere for inngang til pakkeforløp for kreft.
Pakkeforløp hjem for pasienter med kreft
Sist faglig oppdatert: 17.08.2023
Pakkeforløp hjem for pasienter med kreft skal bidra til å sikre god struktur og logistikk i helsetjenesten, samt sikre trygghet og forutsigbarhet for personer som lever med kreft eller etter endt kreftbehandling. Les mer om Pakkeforløp hjem for pasienter med kreft.
Anbefalinger:
- Pasienter med radiologisk mistenkt diffust CNS WHO grad 2 gliom skal inkluderes i «Pakkeforløp for hjernekreft» for å utelukke diffust høygradig gliom, og henvises til nevrokirurgisk avdeling for vurdering med tanke på kirurgi (Evidens grad D). Om det blir bekreftet med MR tumorprotokoll eller vevsprøve at det foreligger et diffust CNS WHO grad 2 gliom, skal pasienten ut av pakkeforløpet
- Pasienter hvor man mistenker at det kan foreligge et høygradig diffust gliom (CNS WHO grad 3 eller 4) skal henvises til «Pakkeforløp for hjernekreft»
- Pasientene bør vurderes i multidisiplinært team (MDT) preoperativt og/eller postoperativt
Diagnostikk og utredning
Sist faglig oppdatert: 17.08.2023
Diagnostikk, utredning, behandling og oppfølging av pasienter med mistenkt diffust gliom skjer i samarbeid mellom fastlege/primærhelsetjenesten og spesialisthelsetjenesten. Tumorrettet behandling gis i spesialisthelsetjenesten. Oppfølging underveis i behandlingen og ikke minst i perioder uten tumorrettet behandling er viktig og her har fastlegen en særskilt viktig rolle. Dette gjelder for eksempel symptomkontroll for derigjennom å avdekke rehabiliteringsbehov, oppfølging av antiepileptisk medisinering, og kartlegging av eventuelt behov for psykososiale tiltak og vurderinger omkring arbeidsførhet. Helsedirektoratet har i samarbeid med en arbeidsgruppe av fastleger, utarbeidet et dokument som beskriver fastlegenes rolle ved kreft.
Det vises også til nasjonal veileder for pårørende.
Symptomer
Sist faglig oppdatert: 17.08.2023
Symptombildet ved diffuse høygradig gliomer er oftest relativt hurtig utviklende, spesielt for diffuse gliomer CNS WHO grad 4. Symptomer på økt intrakranielt trykk som hodepine, tretthet, kvalme og kognitive symptomer er vanlig og kan ledsages av fokale nevrologiske symptomer/utfall, avhengig av tumors lokalisasjon. Epileptiske anfall forekommer, men er et mindre vanlig debutsymptom enn ved diffuse CNS WHO grad 2 gliomer. For pasienter med diffust CNS WHO grad 2 gliom er epileptiske anfall vanligste debutsymptom. De fleste pasientene med CNS WHO grad 2 gliom har lite plager og har et nokså normalt funksjonsnivå på diagnosetidspunktet. Økt trettbarhet er vanlige restplager etter både kirurgi, strålebehandling og kjemoterapi.
Utredning
Sist faglig oppdatert: 17.08.2023
Utredning av pasienter med mistenkt diffust gliom skiller seg ikke fra utredning av andre pasienter hvor man har mistanke om hjernesvulst. Klinisk nevrologisk undersøkelse, generell somatisk undersøkelse og MR-undersøkelse av hjernen skal gjøres. Det bør klart fremgå av radiologihenvisningen at man mistenker hjernesvulst fordi det influerer hvilke MR-sekvenser som kjøres. I praksis bør det gjøres en MR tumorprotokoll (se punkt "Bildediagnostiske undersøkelser"). CT thorax/abdomen/bekken bør gjøres dersom det ved diagnostisk MR åpnes for metastase som differensialdiagnose til gliom.
Kliniske undersøkelser
Sist faglig oppdatert: 17.08.2023
Nevrologisk utredning innebærer anamnese og klinisk undersøkelse med vekt på nevrologiske utfall inkludert kognitive problemer, epileptiske anfall og trykksymptomer.
Bildediagnostiske undersøkelser
Sist faglig oppdatert: 17.08.2023
MR
Se også «Handlingsprogram for hjernesvulst generelt» hvor minimumskrav for MR tumorprotokoll er definert. MR er den mest sensitive bildemodaliteten for diagnostikk av diffuse gliomer. Cerebral CT er sjelden indisert, men på CT uten kontrast vises typisk en hypodens lesjon. Forkalkninger kan av og til sees, hyppigst ved oligodendrogliomer. Høygradige gliomer (CNS WHO grad 3 og 4) lader typisk kontrast på CT.
Sekvens | Bildeplan |
|---|---|
T1 før kontrast | 3D |
T2 | Transversal |
T2-FLAIR | 3D |
Diffusjon | Transversal |
T1 etter intravenøs kontrast | 3D |
MR-undersøkelser skreddersys til den kliniske problemstillingen for å øke sensitivitet og spesifisitet. Likevel er det ikke alltid man kan skille hjernesvulster fra andre tilstander med lignende radiologisk bilde. Ikke-kontrastladende lesjoner kan for eksempel representere lavgradige gliomer, inflammasjonsprosesser eller utviklingsanomalier som fokal kortikal dysplasi. Hjernemetastase, abscess, subakutt infarkt og aktiv MS-lesjon vil være aktuelle radiologiske differensialdiagnoser til høygradige gliom som lader kontrast perifert.
Selv om patologisk kontrastoppladning er assosiert med mer agressiv tumortype, er opptil en tredjedel av høygradige gliomer ikke-kontrastladende mens lavgradige gliomer kan lade kontrast (Scott et al., 2002). En svulst som bildemessig ikke lader kontrast og fremstår som lavgradig gliom kan likevel være CNS WHO grad 4 (IDH villtype) (Osborn et al., 2022). Svulster med inhomogen struktur og blanding av nekrotiske, hemorragiske og kontrastoppladende områder, omgitt med perifokalt ødem og med masseeffekt, taler likevel sterkt for tumor av høyere grad, som glioblastom.
Avanserte MR-metoder som spektroskopi, diffusjon og perfusjon kan være nyttige supplement for å skille mellom tumor / pseudotumor og behandlingsrelaterte forandringer. Økt perfusjon (økt blodvolum) er utrykk for blodperfusjon i tumorvev / rik vaskularisering og er assosiert med CNS WHO grad: Høygradige svulster har oftere økt perfusjon. MR spektroskopi er en utvidet undersøkelse av hjernesvulsten som analyserer sammensetningen av spesifikke metabolitter i et område med suspekt tumorvev. Generelt har hjernetumores forhøyet kolin (en membranmarkør / gliamarkør) og redusert mengde N-acetylaspartat (markør for nevronal integritet) sammenlignet med tilsvarende normalt vev. Påvisning av laktat, økende ratio mellom kolin og kreatinin og mellom kolin og N-acetylaspartat taler for høygradig gliom.
Funksjonell MR er en metode som benyttes til preoperativ kartlegging av viktige kortikale områder (språk, motorikk) før kirurgisk tumor reseksjon.
DTI er en MR avbildningsteknikk som gir fremstilling av den dominerende diffusjonsretningen i hjernens hvit substans (nervefiberretning) og benyttes til preoperativ lokalisering av nervebaner og planlegging av den kirurgiske korridoren.
PET
Se også «Handlingsprogram for hjernesvulst generelt» hvor bakgrunn for bruk av PET og tilgjengelige metoder er beskrevet.
Aminosyre-PET er blitt den mest etablerte PET-metoden for avbildning av gliomer og flere internasjonale avbildningsgrupperinger (EANM/EANO/RANO) har gått sammen om å lage retningslinjer (Law et al., 2019). Aminosyretracere gir nesten ikke bakgrunnsopptak i normalt vev inkludert hjerne, slik at gliomer kan fremstilles med høy kontrast - i motsetning til FDG-PET (Galldiks et al., 2017). Aminosyre-PET brukes i økende grad som supplerende diagnostisk metode og kan være av nytte ved ønsket tilleggsinformasjon om svulster (Albert et al., 2016; Law et al., 2019):
- Preoperativt: malignitetsgrad, avgrensning av svulster (se avsnitt Praktisk gjennomføring av strålebehandling) og valg av biopsisted
- Postoperativt: differensiering av residiv fra behandlingsindusert endring (se kapittel Kontroller og Strålebehandling)
- Sykdom- og terapikontroll: Tegn til malign transformasjon, behandlingsrespons
Det finnes flere aminosyretracere med noe variasjon i publisert sensitivitet (Albert et al., 2016). De best etablerte tracerne er 11C-MET ([11C-methyl]-methionine), 18F-FET (O-(2-[18F]fluoroethyl)-L-tyrosine) og 18F-DOPA (3,4- dihydroxy-6-[18F]fluoro-L-phenylalanine). En annen aktuell aminosyretracer er [18F]fluciclovine. Praktisk bruk av disse PET-metodene beskrives i retningslinje fra EANM (Law et al., 2019). Siden aminosyrene har kun meget lavt opptak i normale hjernestrukturer, bør undersøkelsen helst utføres som hybrid PET/MR-undersøkelse, gjerne med intravenøs MR-kontrast.
[18F]FDG PET er utbredt og lett tilgjengelig, men har en meget begrenset rolle i gliomavbildning på grunn av lavt opptak i lavgradige gliomer og høyt bakgrunnsopptak i hjernens grå substans. FDG-PET kan vurderes som supplerende undersøkelse i uklare situasjoner for å skille strålenekrose og/eller tumorrecidiv fra lymfom eller infeksjon.
Selv om diagnosen hjernesvulst i dag vanligvis stilles med MR-undersøkelse, bør gliomdiagnosen med få unntak baseres på vevsdiagnostikk for å hindre feildiagnostikk og feilbehandling (kapittel Patologi). Sjeldne unntak kan for eksempel gjelde optikusgliom samt tilfeller der biopsi er mindre aktuelt grunnet alvorlig komorbiditet, redusert samtykkekompetanse, lokalisasjon beheftet med svært høy biopsirisiko samt høy alder. 98% klinisk/radiologisk diagnostisk spesifisitet for høygradig gliom ble funnet i en norsk studie (Majewska et al., 2021). Presis vevsdiagnostikk inklusiv molekylærpatologiske spesialundersøkelser er imidlertid ofte viktig for valg av behandling (for eksempel IDH-status og MGMT-status). Samtidig er det viktig å huske at diffuse gliomer er heterogene og at CNS WHO grad i biopsier ikke alltid er representativt for hele svulsten. Biopsier fra metabolske «hot-spots» basert på MR-perfusjon/-spektroskopi eller PET med aminosyretracer reduserer sannsynlighet for diagnostisk undergradering.
Laboratorieprøver
Sist faglig oppdatert: 17.08.2023
Laboratorieprøver utover vevsdiagnostikk har liten plass i utredningen av diffuse gliomer. Det vises forøvrig til «Handlingsprogram for hjernesvulst generelt».
Utredningsforløp
Sist faglig oppdatert: 17.08.2023
Pasienter med mistanke om hjernesvulst av ukjent type skal henvises til «Pakkeforløp for hjernekreft», se kapittel Pakkeforløp for kreft. For alle praktiske formål betyr det umiddelbar henvisning til sykehus med nevrokirurgisk avdeling. Ved mistanke om diffust CNS WHO grad 2 gliom vil det avhengig av klinikk oftest være naturlig med elektiv, men rask henvisning til nærmeste nevrokirurgiske avdeling. Ved førstegangs epileptisk anfall, nedsatt funsjonsnivå eller nevrologiske utfall blir de fleste pasienter innlagt akutt i sykehus og bildediagnostikk foretatt der.
Dersom det ikke allerede er gjort bildediagnostikk med MR og adekvate sekvenser (tumorprotokoll), så skal det gjøres snarest. De fleste pasienter bør vurderes i MDT, før og/eller etter operasjon. Har man på bakgrunn av bildediagnostikk mistanke om diffust gliom vil det som regel være ønskelig med en vevsprøve, denne tas oftest i forbindelse med svulstreseksjon. Hos pasienter som gjennomgår tumorreseksjon bør MR-kontroll gjennomføres innen 48 timer postoperativt for å avdekke kirurgiske komplikasjoner (sirkulasjonsforstyrrelser, hematomer) og for å vurdere reseksjonsgrad.
Alle pasienter med diffust CNS WHO grad 3 og 4 gliom henvises kreftavdeling for vurdering med hensyn på adjuvant behandling etter vevsdiagnostikk. Etter at histopatologisk diagnose foreligger bør også pasienter med diffust CNS WHO grad 2 gliom vurderes med tanke på adjuvant behandling. Dette er en tverrfaglig vurdering som helst bør foregå i MDT, i det minste i diskusjon mellom onkolog og nevrokirurg. Man bør da legge vekt på resttumorstørrelse, re-operabilitet, molekylære markører og andre prognostiske faktorer. Pasienter med diffust gliom bør også oftest vurderes i MDT-møter ved senere sykdomsprogresjon.
Stadieinndeling
Sist faglig oppdatert: 17.08.2023
Stadieinndeling er ikke aktuelt for diffuse gliomer. Svulster i denne gruppen sprer seg i praksis nesten aldri til andre organer. Det bemerkes at både WHO-gradering og molekylærpatologisk subklassifikasjon er vesentlig.
Anbefalinger:
- Alle pasienter hvor man mistenker diffust gliom skal utredes med MR tumorprotokoll, med mindre MR er kontraindisert
- MR-undersøkelsen skal omfatte hodet (hjernen) og utføres med tumorprotokoll som minimum må inneholde følgende sekvenser:
Sekvens | Bildeplan |
|---|---|
T1 før kontrast | 3D |
TSE/FSE T2 | Transversal |
FLAIR | 3D |
Diffusjon | Transversal |
T1 etter intravenøs kontrast | 3D |
- Diagnosen bør som hovedregel baseres på histopatologi i tillegg til MR (Evidens grad C)
- Diagnostiske molekylærbiologiske parametere som må utføres på pasienter med diffust gliom:
Diffust gliom | Karakteristika | Diagnose |
|---|---|---|
IDH-positiv (mutert) | 1p/19q kodelesjon | Oligodendrogliom CNS WHO grad 2 eller 3 |
1p/19q kodelesjon ikke påvist (eller ATRX-positiv og/eller p53-positiv) | Diffust astrocytom CNS WHO grad 2, 3 eller 4 | |
1p/19q kodelesjon ikke påvist, men påvist mikrovaskulær proliferasjon, nekrose eller homozygot CDKN2A/B-delesjon | Diffust astrocytom CNS WHO grad 4 | |
IDH-negativ (villtype) | Mikrovaskulær proliferasjon, nekrose, TERT-promotormutasjon, EGFR-amplifikasjon eller kromosomkombinasjonen +7 og -10 | Glioblastom CNS WHO grad 4 |
- MGMT metyleringsstatus bør bestemmes ved glioblastom. MGMT-status har prediktiv verdi for respons på alkylerende kjemoterapi (temozolomid) ved glioblastom (men ikke ved IDH-positivt astrocytom CNS WHO grad 4). MGMT-status har også trolig prediktiv verdi ved bruk av alkylerende kjemoterapi for oligodendrogliom.
Genetikk
Sist faglig oppdatert: 17.08.2023
Hos pasienter med diffuse gliom vil det som oftest ikke være aktuelt med henvisning til medisinsk genetiker. Vi viser til «Handlingsprogram for hjernesvulst generelt» for kriterier for hvilke pasienter som bør henvises til medisinsk genetisk avdeling. Ved diffuse gliom vil det i hovedsak være ved mistanke om Li-Fraumeni eller konstitusjonelt mismatch repair-deficiency syndrom.
Li-Fraumeni syndrom
Sist faglig oppdatert: 17.08.2023
Li-Fraumeni er en autosomal dominant tilstand som skyldes mutasjon i tumorsuppressorgen TP53. Tilstanden medfører økt risiko for flere typer kreft inkludert brystkreft, sarkom, binyrekarsinom, leukemi, høygradig gliom, medulloblastom, med mer. Li-Fraumeni syndrom er sannsynligvis underdiagnostisert. Tilstanden mistenkes ved familiær opphopning av kreft i ung alder (<50 år). Tenk spesielt på tilstanden ved krefttyper som sarkom, brystkreft, gliom, plexus choroideus papillom, medulloblastom (Sonic Hedgehog type), nevroblastom, binyrekarsinom og akutt leukemi. Li-Fraumeni kan skyldes nyoppstått («de novo») mutasjon hos den affiserte, slik at fravær av kreft i slekta ikke nødvendigvis taler imot at en person kan ha Li-Fraumeni.
Ved mistanke om tilstanden skal genetisk utredning og veiledning tilbys. CT/røntgen unngås da tilstanden gir større risiko for kreft ved eksponering for ioniserende stråling. Hos pasienter med Li-Fraumeni er ulike screeningprogram i bruk internasjonalt og inkluderer årlig helkropps-MR, MR mamma, med mer. Oppfølging av pasientene bør koordineres av kreftavdeling med en standardisert oppfølgingsplan.
Konstitusjonelt mismatch repair-deficiency syndrom
Sist faglig oppdatert: 17.08.2023
Konstitusjonelt mismatch repair-deficiency syndrom (CMMRD, tidligere Turcot 1) er en autosomal recessiv tilstand der pasienten har arvet mutasjon i ett av de fire MMR-genene (MLH1, MSH2, PMS2, MSH6) fra både mor og far. Ved CMMRD er det høy risiko for tarmkreft, hematologisk kreft og høygradig gliom. Pasientene kan ha cafe au lait-flekker i huden. Pasient med foreldre bør henvises til genetisk veiledning. Foreldre vil være heterozygote for mutasjon, og dermed ha Lynch syndrom med risko for tarmkreft, livmorkreft, med mer. Pasientens søsken vil ha 25% sannsylighet for CMMRD. Det vil være behov for kontroller både for slektninger med Lynch syndrom, og for eventuelle slektninger (først og fremst søsken) med CMMRD.
Behandling ved primærdiagnose
Sist faglig oppdatert: 17.08.2023
Diffuse gliomer er prinsipielt sett ikke kurable og forløpet kan være svært heterogent, også innenfor den enkelte molekylærbiologiske og histopatologiske undergruppe.
Kirurgi
Sist faglig oppdatert: 17.08.2023
Henvisning til nevrokirurgisk avdeling for vurdering med tanke på kirurgi bør gjøres umiddelbart hos alle der man ut fra bildediagnostikk mistenker diffust gliom, og der det ikke foreligger klare kontraindikasjoner (for eksempel kort forventet levetid grunnet annen alvorlig sykdom). Pasienten må informeres om at han/hun henvises til nevrokirurgisk avdeling med spørsmål om mulig kreft i hjernen. Ved mistanke om diffust gliom CNS WHO grad 3 eller 4 skal pasientene inn i «Pakkeforløp for hjernekreft», mens pasienter med mistanke om diffust CNS WHO grad 2 gliom inkluderes i «Pakkeforløp for hjernekreft» til det er avklart at man ikke har grad 3 eller 4 svulst. Pasienter med bildemessig ødem skal stå på antiødembehandling med glukokortikoider frem til gjennomført kirurgisk reseksjon, uten preoperativ nedtrapping av dose.
Diffust CNS WHO grad 2 gliom
Selv om tilstanden ikke kan helbredes er det stor overlevelsesgevinst ved kirurgisk reseksjon av diffust CNS WHO grad 2 gliom. I en norsk studie fra 2012 utnyttet man de den gang divergerende behandlingstradisjonene ved to norske nevrokirurgiske avdelinger i en såkalt kvasi-kontrollert studie. Studien viser entydig at tidlig kirurgisk reseksjon gir lavere forekomst av malign transformasjon og en klar overlevelsesgevinst sammenlignet med «watchful waiting» med overlevelse 14.4 vs. 5.9 år i de to regionene (Jakola et al., 2012a; Jakola et al., 2022; Jakola et al., 2017). Funnene støttes av flere ikke-kontrollerte observasjonsstudier som rapporterer sammenheng mellom reseksjonsgrad, resttumorstørrelse, risiko for malignisering og overlevelse (Chaichana et al., 2010; Claus et al., 2005; McGirt et al., 2008; Shaw et al., 2008; Smith et al., 2008). De sterkeste prognostiske faktorene for pasienter med diffust lavgradig gliom er postoperativt tumorvolum i tillegg til preoperativt tumorvolum og histologisk subgruppe (Hervey-Jumper et al., 2023; Wijnenga et al., 2018). Nær komplett eller komplett tumorreseksjon er assosiert med klart bedre prognose enn selv nokså små resttumormasser (Smith et al., 2008; Wijnenga et al., 2018). For astrocytom er reseksjonsgrad spesielt avgjørende og kun 1 ml resttumor er assosiert med dårligere overlevelse. For oligodendrogliom er den statistiske grenseverdien høyere (Kavouridis et al., 2019). Dette kan skyldes at veksthastighet er lavere og kjemoterapi- og stråleresponsen ofte er bedre ved oligodendrogliom.
Kirurgisk behandling med reseksjon er derfor i dag vanligvis førstevalget hos de fleste med diffuse CNS WHO grad 2 gliomer. Operabilitet er imidlertid subjektivt og hvor mye man skal/kan fjerne kan være en vanskelig vurdering og må avveies opp mot risiko for permanente sekveler. Ved større resttumorvolum enn 25 ml er effekten av kirurgi trolig begrenset (Wijnenga et al., 2018). Tverrfaglige diskusjoner og second opinions kan derfor være nyttig i tvilstilfeller, samt at man selvfølgelig må diskutere med pasient og/eller pårørende. Majoriteten av pasienter med diffuse CNS WHO grad 2 gliomer har epilepsi preoperativt og omkring halvparten har ikke fullgod anfallskontroll med antiepileptika. De aller fleste (>90 %) rapporteres å bli anfallsfrie etter kirurgi og flere blir anfallsfrie med høyere reseksjonsgrad og kort varighet av epilepsi (Chang et al., 2008).
Målet ved kirurgisk reseksjon er i utgangspunktet å gjennomføre maksimal reduksjon av svulstvolum uten å påføre pasienten nye permanente sekveler. Risiko for nevrologiske utfall må vurderes og diskuteres med pasienten preoperativt. Noen ganger vil man kunne akseptere høyere risiko for nevrologiske utfall for å kunne tilby best mulig reseksjonsgrad og dermed best mulig prognose. Slike «planlagte» nevrologiske utfall vil oftest kun være aktuelt dersom man kjenner vevsdiagnosen. Forbigående utfall i tidlig postoperativ fase er ikke uvanlig, men med moderne teknikker kan kirurgi ofte gjennomføres med relativt lav permanent morbiditetsrisiko. Rehabiliterende behandling av pasienter med nevrologiske utfall postoperativt bør alltid vurderes. Selvrapportert livskvalitet hos pasienter som gjennomgår kirurgi er på sikt ofte nokså god (Jakola et al., 2012b; Jakola et al., 2014; Aaronson et al., 2011). Fatigue er imidlertid vanlig (Schei et al., 2020).
Postoperativt bør det tas en tidlig MR (<48 timer) for å vurdere reseksjonsgrad og komplikasjoner som sirkulasjonsforstyrrelser og hematomer. Resttumor kan imidlertid overvurderes på tidlige MR-bilder, spesielt på FLAIR-sekvenser (Belhawi et al., 2011). Dersom reseksjonsgrad er klart dårligere enn ønsket, bør reoperasjon vurderes. Postoperativt tilkommer gjerne kontrastlekkasje (i mange måneder) i områder med tidligere sirkulasjonsforstyrrelser. Dette kan mistolkes som tegn til malignisering ved senere MR-kontroller. Områder med senere kontrastopptak må derfor sammenholdes med eventuelle områder med peritumoral infarsering på tidlig postoperativ diffusjonsvektet MR.
Ulike kirurger benytter og foretrekker gjerne ulike hjelpemidler ved operasjon av diffuse CNS WHO grad 2 gliomer. Det er få gode sammenlignende studier av ulike hjelpemidler. Foruten MR-kartlegging av selve svulsten og utbredelsen, vil det som ledd i preoperativ planlegging hos mange bli foretatt kartlegging av funksjonelle områder med funksjonell MR, Diffusion Tensor Imaging (DTI, traktografi) og/eller transkranial magnetstimulering. Nevropsykologisk testing kan også være aktuelt hos noen. Nevronavigasjon basert på preoperative MR-bilder alene med eller uten funksjonelle data blir ofte unøyaktige utover i operasjonen på grunn av såkalt «brain shift». Derfor er det ofte, og særlig ved svulster i eller nær følsomme hjerneområder, nyttig å supplere med peroperativ avbilding (2D/3D ultralyd eller intraoperativ MR), og/eller peroperativ funksjonell kartlegging basert på direkte kortikal og/eller subkortikal elektrofysiologisk stimulering/mapping. Slike hjelpemidler kan være til nytte for å sikre maksimal reseksjon samtidig som man kan redusere risiko for nevrologiske utfall. Våken kirurgi for peroperativ monitorering av spesifikke funksjoner som for eksempel språk og/eller motorikk kan være aktuelt hos utvalgte pasienter.
Diffust CNS WHO grad 3 og 4 gliom
Målet med kirurgisk reseksjon av diffuse CNS WHO grad 3 og 4 gliomer er todelt; oppnå høy reseksjonsgrad uten å påføre pasienten (ytterligere) permanente skader og å fremskaffe vev for histologisk diagnose. Kirurgisk påførte nevrologiske utfall er assosiert med dårligere overlevelse (Aabedi et al., 2022) og bør unngås så langt som mulig, spesielt ved mistenkt diffust CNS WHO grad 4 gliom der overlevelsesgevinsten av reseksjon er nokså moderat. Kirurgisk reseksjon gir imidlertid også masseavlastning i tumorområdet og kan dermed bedre symptombildet og redusere behov for antiødembehandling med glukokortikoider. Det er ingen større randomiserte studier som har undersøkt effekt av kirurgisk reseksjon, men reseksjonsgrad er en prognostisk faktor i de aller fleste observasjonsstudier. Overlevelseseffekten er mest tydelig for høye reseksjonsgrader (Brown et al., 2016; Chaichana et al., 2014; Lacroix et al., 2001; Molinaro et al., 2020; Sanai et al., 2011; Stummer et al., 2008) og er mer usikker for subtotale reseksjoner. Subtotal reseksjon innebærer ofte at mye sentral nekrose fjernes mens det meste av den viable del av tumor står igjen i periferien. Dersom man ikke tror at man kan oppnå en kirurgisk reseksjonsgrad på mer enn 80% av kontrastladende tumorvolum, kan biopsi uten resektiv kirurgi være et like godt alternativ. I en metaanalyse fant man 61% større sannsynlighet for overlevelse ved 1 år ved komplett reseksjon av kontrastladende vev versus subtotal reseksjon, men kun 19% større sjanse for overlevelse ved 2 år ved komplett reseksjon (Brown et al., 2016). Betydningen av primær reseksjonsgrad er nok dermed størst tidlig mens tumorbiologi og respons på annen onkologisk behandling er viktigere for å oppnå lengre overlevelse. Hos yngre pasienter (<65 år) er det observasjonsdata som taler for at reseksjon av FLAIR-volum i tillegg til kontrastladende volum er assosiert med lengre overlevelse (Molinaro et al., 2020) og i en liten case-kontroll studie med 40 pasienter fant man at lobektomi (supratotal reseksjon) var assosiert med bedre overlevelse enn reseksjon av kun kontrastladende tumorvev (Roh et al., 2019). Hos eldre er prognosen ofte dårligere og effekten av kirurgi dermed også mindre. I en fransk randomisert studie med 101 pasienter som var 70 år eller eldre fant man ingen overlevelsgevinst av reseksjon sammenlignet med kun biopsi (9.4 mnd vs. 9 mnd) (Laigle-Donadey et al., 2022). De fleste pasientene i studien var riktignok nokså funksjonelt svekket ved inklusjon og individuelle vurderinger av indikasjon for kirurgi og omfanget av reseksjon må alltid gjøres.
Hos eldre pasienter med betydelig redusert funksjonsnivå (ECOG 3-4) og med kort forventet overlevelse vil det svært sjelden være nyttig for pasienten å gjennomgå tumorrettet behandling. Dersom bildediagnostikk ikke sannsynliggjør annen tumor med større behandlingspotensiale (for eksempel lymfom), vil det i disse tilfellene oftest ikke være aktuelt med biopsi da det kun utsetter pasienten for risiko og ubehag i forbindelse med inngrepet, uten at det har behandlingsmessig konsekvens.
Ulike kirurger benytter og foretrekker gjerne ulike hjelpemidler ved operasjon av diffuse høygradige gliomer. Foruten MR-kartlegging av selve svulsten og utbredelsen, vil det som ledd i preoperativ planlegging av og til være aktuelt med funksjonell MR, Diffusion Tensor Imaging (DTI, traktografi) og/eller transkranial magnetstimulering. Fluoresensveiledet kirurgi med Gliolan er mye brukt (Stummer et al., 2006). Nevronavigasjon basert på preoperative MR-bilder brukes typisk også rutinemessig. Intraoperativ avbilding (2D/3D ultralyd eller intraoperativ MR) og/eller peroperativ funksjonell kartlegging basert på direkte kortikal og/eller subkortikal elektrofysiologisk stimulering/mapping er også mulige hjelpemidler. Våken kirurgi for peroperativ monitorering av spesifikke funksjoner som for eksempel språk og/eller motorikk kan være aktuelt hos spesielt utvalgte pasienter.
Postoperativt vil pasienten ofte bruke glukokortikoider som trappes ned over 5–10 dager. Ved større resttumor og mye ødem vil man ikke alltid kunne seponere glukokortikoider og en individuell nedtrappingsplan hvor man tilstreber laveste effektive dose bør utarbeides.
Postoperativt bør det tas en tidlig MR (innen 48 timer) for å vurdere/objektivisere grad av tumorreseksjon og eventuelle komplikasjoner som sirkulasjonsforstyrrelser og hematomer. Videre vil denne MR være nyttig som utgangspunkt for senere bildekontroller og planlegging av strålebehandling. Dersom reseksjonsgraden er klart dårligere enn ønsket, bør mulighet for tidlig reoperasjon vurderes, dette kan med fordel diskuteres i MDT-møte.
Strålebehandling
Sist faglig oppdatert: 17.08.2023
Strålebehandling ved diffuse gliomer avhenger av flere faktorer inkludert CNS WHO grad. For detaljer om planlegging og gjennomføring av strålebehandling vises det til appendix 2.
Strålebehandling av glioblastom IDH villtype CNS WHO grad 4 og andre CNS WHO grad 4 diffuse gliomer (astrocytom IDH-mutert CNS WHO grad 4, diffust midtlinjegliom H3 K27M-mutert CNS WHO grad 4, samt diffust hemisfærisk gliom H3 G34-mutert CNS WHO grad 4)
Postoperativ strålebehandling etter biopsi eller reseksjon av diffuse høygradige gliomer ble undersøkt i flere studier på 1970-, –80- og –90-tallet og senere systematisk gjennomgått i en metaanalyse (Laperriere et al., 2002). Denne viste at postoperativ strålebehandling forlenget median overlevelse med 4-6 mnd, noe mindre for eldre pasienter.
Det er påvist en dose-respons-relasjon i en studie som sammenliknet 45 Gy mot 60 Gy (Bleehen et al., 1991), men det er ikke vist gevinst ved stråledoser over 60 Gy (Nelson et al., 1988). Andre forsøk på doseintensivering (for eksempel med stereotaktisk boost) har heller ikke vist overbevisende effekt i denne pasientgruppen. I to studier har man undersøkt effekten av strålebehandling mot hele hjernen sammenlignet med fokal strålebehandling mot tumor med margin, uten å kunne påvise forskjell i overlevelse (Phillips et al., 2003; Sharma et al., 2003). For å begrense bivirkningene tilstreber man derfor å begrense strålebehandling til tumorområdet. De fleste tilbakefall sees i eller i nærheten av opprinnelig tumorlokalisasjon.
Anbefalt dosering for pasienter opp til 70 år som er i god allmenntilstand er i dag 2 Gy x 30 til totalt 60 Gy, med konkomitant temozolomid (appendix 2). For pasienter med nye tumorentiteter som tilkom i WHO-klassifiseringene i 2016 og 2021 (IDH-mutert astrocytom CNS WHO grad 4 (inkludert IDH-mutert astrocytom som på bakgrunn av CDKN2A/B homozygot delesjon defineres som grad 4), diffust midtlinjegliom H3 K27-alterert CNS WHO grad 4, diffust hemisfærisk gliom H3 G34-mutert CNS WHO grad 4) foreligger det lite evidens for hvilken behandling som bør tilbys. Disse svulstene er oftest hurtigvoksende og prognosen dårlig, og oftest vil man tilby strålebehandling som ved glioblastom. Om man skal bruke konkomitant temozolomid er også uavklart; for pasienter med IDH-mutert astrocytom CNS WHO grad 4 er det naturlig å tilby det fordi flere pasienter i denne kategorien ble inkludert i studien som viste bedret overlevelse ved bruk av temozolomid konkomitant og adjuvant (Stupp et al., 2005).
Fordi glioblastom er diffust infilterende i hjerneparenkymet er stereotaktisk engangsstrålebehandling (med gammakniv eller lineærakselerator) ikke egnet i primærsituasjonen. Det kan iblant være aktuelt ved gjenvekst, men også her er dokumentasjonen svak.
Partikkelbestråling med protoner har med bakgrunn i prognose lite for seg og kan i prinsippet gi dårligere overlevelse i jakten på reduksjon av klart mindre relevant langtidstoksisitet. Karbonioner synes heller ikke aktuelt.
Oppsummert anbefales stålebehandling 2 Gy x 30, totalt 60 Gy gitt konkomitant med daglig Temozolomid til pasienten < 70 år og i akseptabel almentilstand. Vedr ev adjuvant kjemoterapi henvises til avsnitt Glioblastom, IDH villtype, CNS WHO grad 4 og andre CNS WHO grad 4 diffuse gliomer (astrocytom IDH-mutert CNS WHO grad 4, diffust midtlinjegliom H3 K27-alterert CNS WHO grad 4, samt diffust hemisfærisk gliom H3 G34-mutert CNS WHO grad 4).
Strålebehandling av diffust høygradig gliom (CNS WHO grad 3 eller 4) hos eldre og pasienter i redusert almentilstand
Alder og allmenntilstand/funksjonsnivå (ECOG-status) er viktige prognostiske faktorer ved høygradige diffuse gliomer, der eldre pasienter og pasienter med redusert allmenntilstand har dårligere prognose og redusert toleranse for strålebehandling med konvensjonell fraksjonering (Cao et al., 2012; Malmström et al., 2012). I Stupp-studien inkluderte man ikke pasienter over 70 år eller i redusert allmenntilstand (Stupp et al., 2005).
Det er vist overlevelsesgevinst av strålebehandling for eldre pasienter (> 70 år) i en randomisert kontrollert studie hvor moderne konformal strålebehandling ble sammenlignet med «best supportive care» uten svulstrettet behandling. Denne studien viste samtidig verken alvorlig stråletoksisitet eller negativ effekt på livskvalitet eller kognisjon (Keime-Guibert et al., 2007). Dette er bekreftet i en senere metaanalyse som undersøkte hvilken behandling som gav best effekt og minst bivirkning hos eldre pasienter (Hanna et al., 2020).
En nordisk studie for pasienter eldre enn 60 år randomiserte mellom standard strålebehandling (2 Gy x 30), hypofraksjonert strålebehandling (3,4 Gy x 10) og monoterapi med 6 temozolomid (TMZ)-kurer. For pasienter over 70 år gav hypofraksjonert strålebehandling en overlevelsesgevinst i forhold til konvensjonell strålebehandling til 60 Gy (Malmström et al., 2012). Studien viste samtidig en overlevelsesgevinst ved TMZ i forhold til konvensjonell strålebehandling, og resultatene ved TMZ var sammenliknbare som for hypofraksjonert strålebehandling. Tilsvarende viste NOA-08, en randomisert studie for eldre over 65 år med anaplastisk astrocytom eller glioblastom, at kjemoterapi med TMZ alene var «non-inferior» sammenliknet med strålebehandling (til 60 Gy) alene (Wick et al., 2012). MGMT-metyleringsstatus var prediktivt for effekt av TMZ i begge disse studiene.
En prospektiv fase II-studie der eldre pasienter i aldersgruppen 70–81 år ble behandlet med hypofraksjonert strålebehandling (2.67 Gy x 15) med tillegg av TMZ konkomitant og adjuvant fant at denne behandlingen var gjennomførbar. Median overlevelse var 12.4 mnd, 2-års progresjonsfri overlevelse og total overlevelse henholdsvis 5 % og 20 %, med opprettholdt livskvalitet inntil sykdomsprogresjon. MGMT-metyleringsstatus var en sterk prognostisk faktor (Minniti et al., 2013).
En fase III-studie har vist at eldre pasienter med glioblastom har nytte av konkomitant og opptil 12 kurer adjuvant temozolomid som tillegg til hypofraksjonert strålebehandling 2.67 Gy x 15 (Perry et al., 2017). Nytteverdien var størst hos dem med metylert MGMT-promotor. Dette er å betrakte som standardbehandling for eldre i god almenntilstand (appendix 2). Ved umetylert MGMT-promotor og/eller dårlig allmenntilstand kan man vurdere å utelate TMZ, evt gi færre kurer. For pasienter med MGMT-promotor hypermetylering kan man også vurdere TMZ monoterapi.
Det er ulike hypofraksjoneringsregimer som også kan benyttes og man har ikke evidens for at det ene er bedre enn det andre: 39 Gy i 13 fraksjoner eller 34 Gy i 10 fraksjoner. For eldre pasienter i dårlig allmentilstand (ECOG 3) har 5 Gy x 5 vist seg likeverdig 2,67 x 15 med tanke på overlevelse (Roa et al., 2015).
Hos pasienter med glioblastom som er yngre enn 70 år, men som er i redusert almenntilstand (ECOG > 2), er gevinst av postoperativ strålebehandling til totaldose 60 Gy med konkomitant og adjuvant TMZ usikker. Her bør hypofraksjonert strålebehandling vurderes som et alternativ (appendix 2). Det presiseres at dersom man har potensielt reversible postoperative nevrologiske utfall som medfører dårligere funksjonsstatus enn ECOG 2, kan det likevel vurderes å gi 2 Gy x 30.
Målvolum ved hypofraksjonert strålebehandling defineres i prinsippet som for pasienter som får fulldose strålebehandling.
Ved meget utbredt tumoraffeksjon, som for eksempel ved «gliomatosis cerebri» (egentlig utgått begrep) eller uttalt meningeal metastasering, bør man gjøre individuelle vurderinger. Man vil da måtte prioritere mellom målvolumets størrelse og total stråledose; jo større volum, jo mindre totaldose. Dersom tumor er veldig utbredt og målvolumet for strålebehandling blir svært stort, kan man vurdere å gi 3–4 kurer TMZ monoterapi etterfulgt av MR for responsevaluering. Ved stabil sykdom eller radiologisk respons bør man kontinuere med ytterligere 6–8 kurer dersom god toleranse.
Hos eldre pasienter med betydelig redusert performance status (ECOG 3-4) og med kort forventet overlevelse vil det svært sjelden være nyttig for pasienten å gjennomgå strålebehandling eller annen tumorrettet behandling. Disse pasientene bør tilbys god palliativ behandling. Dersom bildediagnostikk ikke sannsynliggjør annen tumor med større behandlingspotensiale slik som lymfom, vil det i disse tilfellene oftest ikke være aktuelt med biopsi da det kun utsetter pasienten for risiko og ubehag i forbindelse med inngrepet, uten at det har behandlingsmessig eller prognostisk konsekvens.
Oppsummert anbefales hypofraksjonert stålebehandling (som egel over 2-3 uker) til pasienter > 70 år og / eller redusert almentilstand. Hvorvidt det skal gis konkomitant Temozolomid må vurderes individuelt (gis primært ved 2.66 Gy x 15). Vedrørende eventuell adjuvant kjemoterapi henvises til avsnitt Glioblastom, IDH villtype, CNS WHO grad 4 og andre CNS WHO grad 4 diffuse gliomer (astrocytom IDH-mutert CNS WHO grad 4, diffust midtlinjegliom H3 K27-alterert CNS WHO grad 4, samt diffust hemisfærisk gliom H3 G34-mutert CNS WHO grad 4). Monoterapi med Temozolomid kan være et alternativ til strålebehandling, spesielt ved MGMT-metylering.
Strålebehandling av astrocytom, IDH-mutert, CNS WHO grad 3
Etter reseksjon bør pasienter med diffuse astrocytomer CNS WHO grad 3 (tidligere anaplastiske astrocytomer) tilbys postoperativ strålebehandling. Doseringen er her noe mindre evidensbasert, men gis med fraksjonering 1.8 Gy x 33 i stedet for 2 Gy x 30 (appendix 2). Begrunnelsen for å gi lavere fraksjonsdose er å unngå potensiell strålerelatert toksisitet for dem som blir relativt sett langtidsoverlevere. Basert på samme argumentasjon samt tumorbiologi gis strålingen mot et noe mindre område enn ved glioblastom. CATNON-studien som viste signifikant bedret overlevelse ved adjuvante temozolomidkurer etter strålebehandling benyttet også dosering 1.8 Gy x 33 til 59,4 Gy (van den Bent et al., 2021). Hos pasienter med astrocytom CNS WHO grad 3 som er eldre og/eller i dårlig allmenntilstand, må behandlingen individualiseres. Her vil forskjellige hypofraksjonerte strålebehandlingsregimer (3 Gy x 13; 3.4 Gy x 10; og 2.67 Gy x 15) være mest aktuelle (Stupp et al., 2007), med eller uten temozolomid adjuvant.
Pasienter med CNS WHO grad 3 diffuse astrocytomer og gunstige prognostiske faktorer kan teoretisk sett ha nytte av protonbehandling for å redusere risikoen for langtidstoksisitet. Det er imidlertid, med bakgrunn i svulstenes infiltrative natur, et åpent spørsmål om dette vil gå på bekostning av effekt.
Strålebehandling av oligodendrogliom, IDH-mutert og med 1p/19q kodelesjon, CNS WHO grad 3
Det foreligger godt evidensgrunnlag for bedret overlevelse ved strålebehandling kombinert med PCV ved CNS WHO grad 3 oligodendrogliom. Evidensgrunnlaget for valg av fraksjonering og totaldose er derimot ikke solid, men baserer seg på fase III-studier som sammenlignet strålebehandling alene med kombinasjonsbehandling med strålebehandling og PCV (Cairncross et al., 2013; van den Bent et al., 2013). Disse studiene benyttet 1,8 Gy x 33 til 59,4 Gy og det er å anse som standard (appendix 2). Det foreligger ikke studier som sammenligner forskjellige doser eller fraksjoneringsregimer. Siden 2016 har oligodendrogliom vært molekylærpatologisk definert av 1p/19q kodelesjon og fra 2021 også av IDH-mutasjon. Effekten av PCV er potensielt undervurdert i eldre studier med mindre robust vevsdiagnose.
Basert på at mange pasienter har lang forventet levetid, og da det er relativt begrenset forskjell i prognose for CNS WHO grad 2 og 3 oligodendrogliomer, diskuteres det hvorvidt man kan begrense bestrålt hjernevolum (CTV) ved CNS WHO grad 3 oligodendrogliom. Dette kan gjøres ved å redusere margin fra GTV til CTV slik at marginen tilsvarer det som benyttes ved grad 2 diffust gliom (Halasz et al., 2022).
Pasienter med CNS WHO grad 3 diffuse oligodendrogliomer kan teoretisk sett ha nytte av protonbehandling for å redusere risikoen for langtidstoksisitet. Det er imidlertid, med bakgrunn i svulstenes infiltrative natur, et åpent spørsmål om dette vil gå på bekostning av effekt.
Strålebehandling av oligodendrogliom, IDH-mutert og med 1p/19q kodelesjon, CNS WHO grad 2, og astrocytom, IDH-mutert, CNS WHO grad 2
Det er publisert tre fase III-studier på strålebehandling som eneste adjuvante tumorretterede behandling postoperativt og/eller med ulik stråledose hos pasienter med diffuse CNS WHO grad 2 gliomer:
Studie | Intervensjon | 5 års progresjonsfri overlevelse | 5 års total overlevelse | |
EORTC 2845 (van den Bent et al., 2005) | Kirurgi | Kirurgi + 54 Gy | 37 % vs 44 %* | 66 % vs. 63 % |
EORTC22844 (Karim et al., 1996) | Kirurgi + 45 Gy | Kirurgi + 59.4 Gy | 47 % vs. 50 % | 58 % vs. 59 % |
NCCTG (Shaw et al., 2002) | Kirurgi + 50.4 Gy | Kirurgi + 64.8 Gy | 55 % vs. 52 % | 72 % vs. 64 % |
* p<0.05
Tidlig strålebehandling alene forlenger altså ikke 5-års total overlevelse hos pasienter med diffuse CNS WHO grad 2gliomer, men rapporteres å bedre radiologisk progresjonsfri overlevelse i studien som sammenligner mot kirurgi alene (van den Bent et al., 2005). Radiologisk progresjonsfri overlevelse er imidlertid et utfordrende endepunkt som defineres ulikt og ofte subjektivt i publiserte studier. Ubehandlede CNS WHO grad 2 diffuse gliomer vokser dessuten alltid dersom målinger gjøres nøyaktig nok (volumetriske målinger), og det er ikke gjort valideringsstudier som bekrefter sammenheng mellom «radiologisk signifikant» progresjon (for eksempel RANO-kriterier) og symptombyrde eller total overlevelse. Det er videre begrenset kunnskap om optimale stråledoser. De to eldre dose-respons-studiene viste ikke økt effekt ved høyere stråledoser (Karim et al., 1996; Shaw et al., 2002). Risiko for bivirkninger er større ved høyere stråledoser opp til og over 60 Gy (Karim et al., 1996; Kiebert et al., 1998; Shaw et al., 2002). Stråleteknologien har imidlertid utviklet seg siden disse studiene ble utført, og studier som viser redusert kognitiv funksjon etter strålebehandling er gjort med eldre strålebehandlingsteknologi og høye stråledoser (gjennomsnitt 56 Gy og høyeste dose 69 Gy) (Douw et al., 2009). Valg av stråledoser kompliseres ytterligere av at nyere behandlingsstudier gjerne er gjennomført med høyere dosering enn 45 Gy (Shaw et al., 2012). Det er indikasjoner på at pasienter med større resttumor kan ha nytte av høyere dose enn 50 Gy (Leighton et al., 2007). I flere utenlandske retningslinjer anbefales doser på 45–50 Gy. Standard dosering i Norge har så langt stort sett vært 1.8 Gy x 30 til totalt 54 Gy (Shaw et al., 2002), basert på friskvevstoleranse og er i tillegg den dosen som er brukt i studien hvor kombinasjon med PCV viste bedret overlevelse enn strålebehandling alene (Buckner et al., 2016). På bakgrunn av ovenstående vil en dose mellom 50 og 54 Gy på rimelig vis balansere kunnskapen om effekt og bivirkninger. Dersom det ut fra risikoorganproblematikk og meget store tumorvolum er ønskelig med lavere doser, synes dette akseptabelt ned til 45 Gy (Appendix 2). Det synes også klart at man som hovedregel skal unngå postoperativ strålebehandling alene (uten etterfølgende PCV-kurer) hos pasienter med lavgradig diffust gliom (se avsnitt Oligodendrogliom, IDH-mutert med 1p/19q kodelesjon, CNS WHO grad 2; og astrocytom, IDH-mutert, CNS WHO grad 2) (Buckner et al., 2016).
Pasienter med terapiresistent epilepsi kan ha nytte av tidlig strålebehandling da dette kan bedre anfallskontroll. I en randomisert studie var forekomsten av epileptiske anfall 25 % vs. 41 % ett år etter postoperativ strålebehandling sammenlignet med kirurgi alene (van den Bent et al., 2005). Dersom indikasjonen for ikke-kirurgisk behandling er epilepsikontroll og ikke i utgangspunktet sykdomskontroll (ung pasient med liten eller ingen resttumor), vil det med bakgrunn i ovenstående være rimelig å gi PCV i etterkant av strålebehandlingen.
Praktisk gjennomføring av strålebehandling
Strålebehandling ved CNS WHO grad 3 og 4 gliom bør helst iverksettes innen 4 uker fra operasjonsdato, maksimalt opp til 6 uker (Blumenthal et al., 2009; Lawrence et al., 2011). I «Pakkeforløp for hjernekreft» har man satt 3 ukers frist fra operasjonsdato til oppstart strålebehandling dersom det er gjort resektiv kirurgi; 4 uker fra henvisning mottatt dersom man har radiologisk diagnose eller bioptisk kirurgisk prosedyre. Dersom det kun er utført stereotaktisk biopsi, kan strålebehandling startes tidligere, men ikke før 1–2 uker etter biopsiprosedyren.
For definering av målvolumer og risikoorganer henvises til appendix 2. ESTROs retningslinjer anbefaler at MR til bruk ved stråleplanlegging ikke bør være mer enn 2 uker gammel (Niyazi et al., 2016). Disse retningslinjene åpnet opp for å utføre doseplan-CT med intravenøs kontrast som et alternativ. De nye ESTRO-retningslinjene har ikke tatt med dette siste punktet, men erkjenner at retningslinjene er pragmatiske og ikke sterkt evidensbaserte (Niyazi et al., 2023). Aminosyre-PET kan potensielt også ha en rolle i målvolumdefinisjon. Foreløpig er ikke kunnskapsgrunnlaget det samme som ved MR, men trendene er oppsummert i rapport fra PET/RANO-gruppen om bidrag av PET-avbildning til stråleterapiplanlegging og kontroll fra 2021 (Galldiks et al., 2021). PET kan være nyttig som supplerende undersøkelse for avgrensning av stråleterapi målvolum samt vurdering av behandlingrespons inkludert å skille mellom residiv og stråleinduserte forandringer.
Oppsummert defineres målvolum (CTV) som reseksjonskavitet inkludert eventuell gjenstående kontrastladende (eller også eventuell ikke kontrastladende) tumor, med margin for mikroskopisk sykdom (Niyazi et al., 2016). Studier har vist at 80–90 % av residivene kommer innenfor 2 cm til (preoperativ) kontrastladende tumor (Wallner et al., 1989). Selv ved omfattende T2/FLAIR høysignalområde omkring kontrastladende tumor («ødemsone») synes kun 2 cm margin ikke å endre residivlokalisasjon eller -hyppighet, sammenlignet med mer omfattende målvolumer der hele T2/FLAIR høysignalområdet inkluderes (Buglione et al., 2016; Chang et al., 2007). En bør unngå svært store målvolumer da strålebehandling til 60 Gy mot store volumer medfører økt risiko for strålebetinget nevrotoksisk skade (Jansen et al., 2000). Studier av residivmønster ved glioblastom har vist at man trolig kan redusere marginene fra GTV til CTV (ned mot 1 cm), uten at man får flere kantresidiver eller recidiver utenfor målvolumet for strålebehandlingen. Dette vil redusere strålebelastning mot omliggende normalt hjernevev og dermed risiko for senbivirkninger (Buglione et al., 2016; Gebhardt et al., 2014). Dette er tatt til følge i de nye ESTRO-retningslinjene ved at man har redusert marginen fra GTV til CTV fra 2 til 1.5 cm (Niyazi et al., 2023).
Diffuse gliomer vokser som hovedregel ikke inn i/gjennom hjernehinner, ventrikler eller skjelettstrukturer. CTV bør dermed beskjæres mot slike naturlige anatomiske barrierer.
Nyere teknikker for strålebehandling som IMRT (intensity-modulated radiation therapy) inkludert VMAT (volumetric modulated arc therapy), muliggjør bedre tilpasning av stråledose til definert målvolum enn eldre stråleplanleggingsteknikker, samtidig som det gir mulighet for ytterligere reduksjon av dose til kritiske normalvevsstrukturer som synsnerver, synsnervekrysning og hjernestamme.
Under pågående strålebehandling kan det oppstå akutt strålereaksjon med tretthet, hodepine, kvalme og/eller forverring av nevrologiske symptomer. Pasienter som har epilepsi kan oppleve både bedring og forverring av anfallssituasjonen i perioden med strålebehandling, oftest bedring. Det vil hos de fleste tilkomme håravfall lokalt der stråledosen i huden er høyest. Avhengig av dose i huden vil man oftest, men ikke alltid, få gjenvekst av hår. Pasientene bør informeres om mulighet for strålereaksjon før oppstart. Symptomene ved akutt strålereaksjon responderer som regel godt på steroidbehandling, og man bør raskt starte gradvis steroidnedtrapping til seponering eller til laveste dosenivå som gir symptomkontroll.
En subakutt strålereaksjon, såkalt pseudoprogresjon, kan sees i tidsrommet 2–6 måneder etter endt strålebehandling, i en del tilfeller også senere. Pseudoprogresjon kan, men må ikke, medføre tretthet, økt søvnbehov og lette kognitive symptomer som oftest er forbigående. Det er både klinisk og radiologisk vanskelig å sikkert skille pseudoprogresjon fra reell sykdomsprogresjon (se punkt Kontroller)
Frekvensen av sene strålereaksjoner som ledd i nevrotoksisk skade øker med tiden og kan ledsages av redusert kognitiv funksjon. Videre kan det tilkomme katarakt, hypofysesvikt (ved stråledoser over 20–40 Gy til hypofyse) og fatigue (se også «Handlingsprogram for hjernesvulst»).
Strålenekrose er en alvorlig komplikasjon som kan inntreffe etter strålebehandling. Slik nekrose oppstår typisk ett til tre år etter gjennomført strålebehandling, men kan også komme tidligere enn ett år og mer enn 10 år etter behandling. Risikoen er høyere blant annet ved høyere fraksjonsdose og høy total stråledose. Diagnosen kan være utfordrende og krever ofte samarbeid mellom nevroradiolog og stråleonkolog.
Medikamentell behandling
Sist faglig oppdatert: 17.08.2023
I 2002 ble effekten av adjuvant CCNU-basert kjemoterapi ved diffuse høygradige gliomer oppsummert i en metaanalyse av 12 randomiserte studier som til sammen inkluderte 3000 pasienter (Stewart, 2002). Ved tillegg av kjemoterapi økte 1-års overlevelse fra 40 % til 46 %, med 2 mnd økt median overlevelse. Senere har temozolomid tatt over som førstelinjebehandling ved glioblastom og anaplastisk astrocytom. Det vises til eget appendix 1 for oppsummert informasjon.
Glioblastom, IDH villtype, CNS WHO grad 4 og andre CNS WHO grad 4 diffuse gliomer (astrocytom IDH-mutert CNS WHO grad 4, diffust midtlinjegliom H3 K27-alterert CNS WHO grad 4, samt diffust hemisfærisk gliom H3 G34-mutert CNS WHO grad 4)
Det perorale alkylerende stoffet temozolomid (TMZ), som passerer blod-hjerne-barrieren, har erstattet nitrosureabasert kjemoterapi ved primærbehandling av glioblastom. Resultatene fra Stupp-studien (EORTC/NCIC 26981/22981), en stor randomisert studie hvor en ga postoperativ strålebehandling til 60 Gy +/- konkomitant og 6 kurer adjuvant TMZ til pasienter opptil 70 år og med ECOG status 0–2 («Stupp-regimet»), medførte endring av standardbehandling ved glioblastom (Stupp et al., 2005). Studien viste median overlevelse for pasienter i kombinasjonsgruppen (strålebehandling med TMZ konkomitant og adjuvant) på 14.6 mnd mot 12.1 mnd i gruppen med strålebehandling alene. To-års overlevelse var på 26 % mot 10 %, mens 5-års overlevelse for kombinasjonen lå på 10 % mot 2 % ved strålebehandling alene (Stupp et al., 2009). Studien viste samtidig økt grad 3–4 hematologisk toksisitet med TMZ (7 % vs 0 %), men uendret livskvalitet. En metaanalyse bekreftet senere overlevelsesgevinsten ved strategien med konkomitant og adjuvant TMZ til postoperativ strålebehandling (Hart et al., 2013). Denne overlevelsesgevinsten var uavhengig av MGMT-metyleringsstatus (Stupp et al., 2009).
Ulike alternative doseringsregimer med adjuvant TMZ gitt som «dose-dense», for eksempel dag 1–21 av 28 dagers syklus, har ikke vist ytterligere gevinst sammenliknet med adjuvant TMZ gitt som 5-dagers kur hver fjerde uke (Gilbert et al., 2013).
Dagens standard er å gi 6 adjuvante kurer. I USA gis ofte 12 kurer, men per i dag foreligger ingen data fra randomiserte studier som viser gevinst av TMZ utover 6 kurer (Blumenthal et al., 2017; Gramatzki et al., 2017), selv om retrospektive analyser antyder at slik behandling er gjennomførbar (Darlix et al., 2013). For pasienter i spesielle situasjoner, for eksempel med utbredte forandringer med diffus vekst langs hvit substans i flere områder av hjernen og stabile forhold eller gradvis regress av tumorforandringer ved evaluering etter 6 kurer, kan forlenget kjemoterapi til 9 eller 12 kurer vurderes ved god toleranse.
I en post hoc analyse av CATNON-studien ser man at undergruppen som hadde glioblastom etter WHO 2021-klassifiseringen ikke hadde overlevelsesgevinst av temozolomid i tillegg til strålebehandling (HR, 1.19; 95% CI, 0.82-1.71). Dette gjaldt 159 av 751 inkluderte pasienter i CATNON, hvorav 47 fikk strålebehandling alene og 112 fikk kombinasjonsbehandling. I denne gruppen hadde MGMT-metylering prognostisk betydning for overlevelse, men predikerte ikke effekt av behandlingen (Tesileanu et al., 2022). Dette er en post hoc analyse med få inkluderte pasienter og resultatene må tolkes med forsiktighet og har ikke medført endring i behandlingsanbefalinger.
Ved meget utbredt sykdom, som for eksempel ved det man tidligere kalte gliomatosis cerebri eller uttalt meningeal metastasering, bør man gjøre individuelle vurderinger. Man vil da måtte prioritere mellom målvolumets størrelse og total stråledose; jo større volum, jo mindre totaldose. Dersom tumor er veldig utbredt og målvolumet for strålebehandling blir svært stort, kan man vurdere å gi 3–4 kurer TMZ monoterapi etterfulgt av MR for responsevaluering (se avsnitt "Diffust CNS WHO grad 2 gliom"). Ved stabil sykdom eller radiologisk respons bør man kontinuere med ytterligere 6–8 kurer dersom god toleranse.
To randomiserte placebokontrollerte fase-3 studier har undersøkt bruk av det angiogenesehemmende monoklonale anti-VEGF-A antistoffet bevacizumab (Avastin®) som tillegg til standardbehandling i primærsituasjonen ved glioblastom (Chinot et al., 2014; Gilbert et al., 2014). Bevacizumab gir en pseudorespons ved å lukke blod-hjerne-barrieren slik at kontrastopptaket i svulstene blir borte, men svulstveksten hemmes imidlertid ikke. Begge studiene viste forlenget progresjonsfri overlevelse ved tillegg av bevacizumab (som resultat av den lukkede blod-hjerne-barrieren), men ikke økt totaloverlevelse. Behandling med bevacizumab i kombinasjon med standardbehandling ga noe økt frekvens av potensielt alvorlige komplikasjoner som tromboemboliske hendelser og tarmperforasjon, samt at det i den ene studien ga reduksjon av kognitiv funksjon og lavere livskvalitet (Gilbert et al., 2014). Bruk av bevacizumab i primærsituasjon ved diffuse høygradige gliomer anbefales derfor ikke.
En studie som randomiserte glioblastom-pasienter etter primær radiokjemoterapi mellom adjuvante TMZ-kurer med tillegg av «tumor-treating fields» (TTF) og adjuvante TMZ-kurer alene, viste signifikant forlenget progresjonsfri og total overlevelse (20.5 versus 15.6 mnd) ved tillegg av TTF (Stupp et al., 2015). TTF-intervensjon ble gitt kontinuerlig (minst 18 timer/dag) ved en portabel batteridrevet generator og elektroder på hodet. Virkningsmekanismen ved alternerende elektriske felter er hemming av mitose og dermed redusert proliferasjon av svulstceller. Behandler må være opplært i bruk og sertifisert. Behandlingen er svært dyr og tilbys per i dag etter vurdering i Beslutningsforum ikke i det offentlige helsevesen i Norge.
I 2019 ble det publisert et arbeid basert på en mindre tysk fase 3-studie hvor resultatene tydet på noe bedre overlevelse for pasienter med MGMT-metylert glioblastom dersom man i primærbehandingen legger lomustin til Stupp-protokollen (Herrlinger et al., 2019). Studien var imidlertid for liten til å trekke sikre konklusjoner og har enn så lenge ikke medført praksisendring for behandlingen av norske glioblastompasienter.
Det ble i 2023 publisert en studie som undersøkte effekten av en dendrittcellebasert vaksine ved glioblastom hvor man konkluderte med overlevelsesgevinst sammenlignet med historiske kontroller (Liau et al., 2023). Denne studien har høstet betydelig metodisk kritikk (Preusser et al., 2022). Man har nok dermed ikke vist effekt av dendrittcellebasert vaksine hos pasienter med glioblastom, men man har heller ikke vist at det ikke har effekt. Basert på dette har studien ikke behandlingskonsekvens i Norge.
Ved nydiagnostisert glioblastom er det blitt gjennomført flere større radomiserte kontrollerte studier som har sett på anti-EGFRvIII-terapi med rindopeptimut (Weller et al., 2017), integrininhibisjon med cilengtid (Stupp et al., 2014), og immunterapi i form av nivolumab (Lim et al., 2022; Omuro et al., 2023) uten at overlevelsen har blitt bedre for pasientene. I studien hvor man testet nivolumab for MGMT-negativt glioblastom kom intervensjonsarmen signifikant dårligere ut. Dette viser hvor viktig det er å teste ut ny behandling i kontrollerte kliniske studier.
Praktisk gjennomføring av temozolomidbehandling er beskrevet i appendix 1. Bruk av profylakse mot Pneumocystis jirovecii (Trimetoprim-sulfa tabletter (Bactrim®)) fra uke 3 etter start til 4 uker etter avsluttet strålebehandling) kan vurderes for pasienter som står på høydose steroider over lenger tid og/eller som har målt lave lymfocytter (Climans et al., 2022a; Climans et al., 2022b).
Med mindre man klinisk har mistanke om sykdomsprogresjon tas første MR-kontroll før tredje eller fjerde adjuvante TMZ-kur. Det er viktig å være oppmerksom på muligheten for pseudoprogresjon (se punkt Kontroller) som kan forekomme i opptil 12 mnd etter avsluttet strålebehandling (Kruser et al., 2013). I forbindelse med 6. TMZ-kur tas det vanligvis ny MR-kontroll som danner utgangspunkt for sammenlikning ved senere evaluering.
Høygradige diffuse gliomer hos eldre og pasienter i redusert allmenntilstand
Se detaljer om strålebehandling hos eldre og pasienter i redusert almentilstand under strålebehandling (Strålebehandling av diffust høygradig gliom (CNS WHO grad 3 eller 4) hos eldre og pasienter i redusert almentilstand). Alder og almenntilstand (ECOG-status) er viktige prognostiske faktorer ved høygradige diffuse gliomer, der eldre pasienter og pasienter i redusert ECOG-status har dårligere prognose og redusert toleranse for konvensjonell behandling.
En fase III-studie har vist at eldre pasienter i god allmenntilstand med glioblastom har nytte av konkomitant og opptil 12 kurer adjuvant temozolomid som tillegg til hypofraksjonert strålebehandling (Perry et al., 2017). Nytteverdien var størst hos dem med metylert MGMT-promotor. Dette er å betrakte som standardbehandling for eldre i god almenntilstand. Ved umetylert MGMT-promotor og/eller dårlig allmenntilstand kan man vurdere å utelate TMZ, evt gi færre kurer. Median antall kurer gitt i studien var fem, og som tidligere beskrevet er det ikke funnet evidens for at det å øke antall kurer ved glioblastom fra 6 til 12 har vist bedret overlevelse. For pasienter med MGMT-promotor hypermetylering kan man også vurdere TMZ monoterapi (Malmström et al., 2012).
Astrocytom, IDH-mutert, CNS WHO grad 3
Astrocytomer CNS WHO grad 3 har per definisjon ikke 1p/19q-kodelesjon, har klart dårligere prognose og er mindre sensitive for kjemoterapi enn CNS WHO grad 3 oligodendrogliomer.
I CATNON-studien, en fase III-studie hvor en randomiserte 748 pasienter med anaplastisk diffust gliom uten 1p/19q kodelesjon til enten postoperativ strålebehandling (59.4 Gy i 33 fraksjoner) alene, strålebehandling gitt med konkomitant temozolomid (TMZ), strålebehandling etterfulgt av 12 adjuvante TMZ-kurer, eller strålebehandling med både konkomitant TMZ og 12 adjuvante TMZ-kurer, viste den første interimanalysen etter median oppfølgning på 27 måneder signifikant bedre overlevelse for de to gruppene som hadde fått adjuvant TMZ (van den Bent et al., 2017). 5-års total overlevelse var på 56 % i gruppene med adjuvant TMZ mot 44 % ved strålebehandling alene, og median progresjonsfri overlevelse på 43 måneder med adjuvant TMZ mot 19 måneder ved strålebehandling alene. Resultatene ved å gi konkomitant TMZ er også frigitt og viser noe overraskende at det ikke var nytte av konkomitant TMZ til hele gruppen sett under ett (Berghoff et al., 2019). Den andre interimanalysen kom i 2021 (van den Bent et al., 2021) og bekreftet at konkomitant TMZ ikke hadde effekt på overlevelse, men at adjuvant TMZ bedret overlevelse til 82·3 mnd [95% CI 67·2-116·6] vs 46·9 mnd [37·9-56·9] ved strålebehandling alene (HR 0·64 [95% CI 0·52-0·79], p<0·0001).
Disse data har endret behandlingspraksis slik at det nå anbefales 6–12 måneders adjuvant TMZ ved astrocytom CNS WHO grad 3.
Oligodendrogliom, IDH-mutert og med 1p/19q kodelesjon, CNS WHO grad 3
To randomiserte fase-III studier publisert i 2006 viste økt progresjonsfri overlevelse ved tillegg av adjuvant kjemoterapi etter PCV-regimet (appendix 1), sammenliknet med strålebehandling alene (Cairncross et al., 2006; van den Bent et al., 2006). I den ene studien ble det gitt 6 adjuvante PCV-kurer etter strålebehandling (van den Bent et al., 2006), mens det i den andre ble gitt 4 PCV-kurer før strålebehandling (Cairncross et al., 2006). Senere oppdatering av begge studiene har vist at også totaloverlevelse øker ved tillegg av PCV-kurer for pasientene som har svulster med 1p/19q-kodelesjon, altså for alle praktiske formål det som i dag defineres som oligodendrogliomer (Cairncross et al., 2013; van den Bent et al., 2013). På bakgrunn av disse studiene anbefales 6 adjuvante PCV-kurer, med oppstart 4–6 uker etter gjennomført strålebehandling. Et alternativ som benyttes noen steder i Norge er å gi to konkomitante PCV-kurer i henholdsvis første og siste uken av en 6-ukers strålebehandlingsperiode, etterfulgt av 2–4 adjuvante PCV-kurer (appendix 1).
Fase 3-studien CODEL undersøkte overlevelsesforskjeller hos pasienter med grad 3 oligodendrogliom randomisert mellom strålebehandling, strålebehandling + TMZ, eller TMZ alene. En interimanalyse gjort etter at 36 pasienter hadde blitt randomisert og fulgt i median 7.5 år viste at pasienter randomisert til TMZ alene hadde klart dårligere progresjonsfri overlevelse enn de som hadde fått strålebehandling (Jaeckle et al., 2021). På denne bakgrunn ble studien endret til å randomisere mellom strålebehandling fulgt av PCV og strålebehandling med konkomitant og adjuvant TMZ. Hvorvidt en kan oppnå samme effekt med TMZ gitt konkomitant og/eller adjuvant til strålebehandling som man gjør med adjuvante PCV-kurer er foreløpig uklart, dog har det internasjonalt vært flere som velger TMZ som et alternativ til PCV-kurer grunnet enklere gjennomføring og bedre toleranse, tross svak evidens (Weller et al., 2013). Det finnes imidlertid ikke evidens for at man vil oppnå lik overlevelseseffekt ved denne tilnærmingen. En pragmatisk tilnærming vil være at dersom man ikke klarer å gjennomføre mer enn 3–4 PCV-kurer, kan man vurdere å seponere videre adjuvant behandling eller alternativt erstatte manglende behandlingstid med TMZ-kurer (2 PCV-kurer tilsvarer 3 TMZ-kurer).
Oligodendrogliom, IDH-mutert med 1p/19q kodelesjon, CNS WHO grad 2; og astrocytom, IDH-mutert, CNS WHO grad 2
Det har ikke vært gjennomført større randomiserte studier der man ser på overlevelsesgevinst ved strålebehandling (altså strålebehandling vs. ingen strålebehandling) ved diffust CNS WHO grad 2 gliom. En EORTC-studie fant ikke bedre effekt av strålebehandling gitt tidlig sammenlignet med strålebehandling ved progresjon for denne pasientgruppen (van den Bent et al., 2005). Kun én fase III-studie har vist overlevelsesgevinst av adjuvant behandling hos pasienter med diffust CNS WHO grad 2 gliom (Buckner et al., 2016). Denne studien inkluderte 251 pasienter mellom 1998 og 2002 og randomiserte mellom strålebehandling etterfulgt av kjemoterapi (PCV-kurer) mot strålebehandling alene. Studien søkte å inkludere pasienter med antatt dårlig prognose og inklusjonskriteriene var alder >40 år og/eller signifikant restsvulst etter kirurgi (ikke-radiologisk vurdert). Det ble gitt 1.8 Gy x 30 til 54 Gy etterfulgt av kjemoterapi (PCV) i 6 sykluser med 8 ukers intervall. Grunnet toksisitet fulgte kun 56 % av pasientene protokollen for kjemoterapi (median antall kurer 3–4). Den initiale, protokollførte analysen viste ingen effekt på overlevelse, men økt progresjonsfri overlevelse ved tillegg av PCV postirradiært (Shaw et al., 2012). Langtidsdata viste imidlertid betydelig økt overlevelse, 13.3 vs. 7.8 år i favør av gruppen som fikk kombinasjonsbehandling med både stråleterapi og PCV-kurer (Buckner et al., 2016). Man fant overlevelsesforskjell i alle analyserte subgrupper, dog ikke statistisk signifikant hos astrocytompasienter. Det var imidlertid få pasienter med astrocytom i studien (65 totalt), slik at manglende statistisk signifikans nok kan være relatert til manglende statistisk styrke. Fordi studien inkluderte pasienter så langt tilbake som mellom 1998 til 2002 er molekylær klassifikasjon mangelfull. Det er kun 106 av de 251 pasientene der man i ettertid har kunnet hente ut data slik at pasientene kunne deles inn i WHO-definerte molekylære subgrupper (Bell et al., 2020). Denne subgruppeanalysen viser at PCV gitt etter strålebehandling bedrer overlevelse både i svulstgruppen med IDH-mutasjon og 1p/19q kodelesjon (HR 0.21, p=0,029), og i svulstgruppen med IDH-mutasjon uten 1p/19q kodelesjon (HR 0.38, p=0,013). I gruppen uten IDH-mutasjon (kun 26 stk), var det ingen gevinst med tillegg av PCV.
Selv om dette disse analysene er gjort i et lite utvalg av pasientene, støtter det vurderingene om å anbefale PCV-behandling hos IDH-muterte CNS WHO grad 2 gliomer, uavhengig av 1p/19q-status, det vil si både astrocytomer og oligodendrogliomer. Inklusjonskriteriene var alder over 40 år uavhengig av resttumor, og kirurgisk bedømt (altså ikke MR-messig bedømt) signifikant resttumor hos pasienter under 40 år. Subtotal reseksjon som utvalgskriterium kan problematiseres siden MR-data ikke er publisert for den aktuelle studien. Kun 28 av 251 inkluderte pasienter er angitt å ha gjennomgått komplett kirurgisk reseksjon. Det er velkjent at korrelasjon mellom radiologisk og kirurgisk bedømt resttumor er dårlig og signifikant resttumor bedømt kirurgisk innebærer nok ofte en nokså stor radiologisk tumorrest. Det ble dessverre ikke utført analyser av hvorvidt resttumorstørrelse etter kirurgi hadde betydning for overlevelsesgevinsten ved strålebehandling og PCV. I tillegg er den prognostiske betydningen av alder mer utydelig for diffust CNS WHO grad 2 gliom etter WHO 2021-klassifikasjonen. Til tross for dette var overlevelsesgevinsten ved strålebehandling og PCV stor og dette gir utvilsomt grunn til å overveie tidlig strålebehandling med adjuvant PCV hos mange pasienter med diffust CNS WHO grad 2 gliom. Hvorvidt dette skal tilbys alle pasienter med lavgradig diffust gliom, bare de pasientene som følger inklusjonskriteriene i studien, eller hos de som på bakgrunn av andre prognostiske skåringssystemer vurderes å ha dårligst prognose, er fremdeles usikkert. Hovedgrunnene til usikkerhet rundt dette er bekymring knyttet til langtidstoksisitet ved strålebehandling (Habets et al., 2014), i tillegg til at strålebehandling gjør at resultatene ved senere reoperasjoner kan bli dårligere. Enn så lenge er indikasjonen uklar for når adjuvant behandling av diffuse CNS WHO grad 2 gliomer skal gis og det er noe regionale behandlingsforskjeller (Munkvold et al., 2021). Pasientene bør involveres i vurderingene slik at behandlingsbeslutninger må tas på grunnlag av velinformert samtykke.
Hvilke seleksjonskriterier man skal bruke for strålebehandling + PCV er utfordrende da det ikke er full enighet om hvordan man skal definere høyrisikopasienter. Svulststørrelse, reseksjonsgrad og vevsdiagnose (astrocytom vs. oligodendrogliom) er imidlertid de sterkeste prognostiske faktorene og må tas med i betraktningen, i tillegg til reoperabilitet. Generelt er pasienter som ikke er kandidater for primær kirurgisk reseksjon og der det er tydelige kliniske/radiologiske tegn til rask tumorprogresjon og/eller opphopning av flere negative prognostiske faktorer, klare kandidater for strålebehandling etterfulgt av kjemoterapi i form av PCV. Pasienter med større tumorrester etter kirurgi som neppe er aktuelle for fremtidige reoperasjoner er også klare kandidater for strålebehandling og PCV.
Pasienter med gliomatosis cerebri (radiologisk begrep) og diffus CNS WHO grad 2 histologi bør tilbys adjuvant tumorrettet behandling etter diagnostisk biopsi. Noen få pasienter med betydelig respons på adjuvant behandling kan da bli aktuelle for kirurgi eller rekirurgi senere (Blonski et al., 2013). For noen av disse pasientene bør man av toksisitetsgrunner vurdere kjemoterapi alene, spesielt for dem der det på grunn av tumorstørrelse og –utbredelse blir store strålevolumer. Anbefalt kurskjema for PCV og eventuelt temozolomid finnes i appendix 1.
Medikamentell behandling uten strålebehandling
Diffust CNS WHO grad 2 gliom
Noen fase II-studier med temozolomid viste lovende resultater (Kesari et al., 2009; Pace et al., 2003; Quinn et al., 2003), og det ble beskrevet objektive responsrater på 20–60 %. EORTC 22033/26033-studien sammenlignet postoperativ strålebehandling alene mot temozolomid alene (Baumert et al., 2016). Man inkluderte det man på bakgrunn av minst ett av følgende kriterier definerte som høyrisikopasienter: alder over 40 år, progressiv sykdom, tumorstørrelse over 5 cm, tumor som krysset midtlinjen og/eller nevrologiske utfall. Hensikten med denne tilnærmingen var å utsette strålebehandling så lenge som mulig for å unngå langtidstoksisitet. Studien fant ingen signifikant forskjell i median progresjonsfri overlevelse for de to gruppene; 46 måneder for stråleterapi og 39 måneder for kjemoterapi, p = 0.22 (Baumert et al., 2016). For pasienter som hadde IDH-mutasjon og var 1p/19q-negative, det vil si diffuse astrocytomer CNS WHO grad 2, var progresjonsfri overlevelse lenger ved strålebehandling enn temozolomid (55 vs. 36 mnd). Totalt sett var progresjonsfri overlevelse i begge armer klart dårligere enn det som er rapportert for strålebehandling etterfulgt av PCV. Merk at det også i denne studien er progresjonsfri overlevelse som er rapportert og man må avvente modning av data før totaloverlevelse kan vurderes. Pasienter i stråleterapiarmen fikk 1.8 Gy x 28, mens pasienter i kjemoterapiarmen fikk såkalt dosedens temozolomid (75 mg TMZ/m2 kroppsoverflate en gang daglig dag 1–21 i en 28-dagers syklus) i opptil 12 kurer. 75 % av pasientene gjennomførte 12 kurer. Denne måten å administrere temozolomid på var vanligere for ca. 10-15 år siden, men den viste seg å ikke gi bedre resultater enn standardkurer med temozolomid gitt 5 av 28 dager i hver syklus (Gilbert et al., 2013). Det var lite alvorlig behandlingsrelatert toksisitet i begge armer og det var ingen forskjell i helserelatert livskvalitet (Baumert et al., 2016). Oppfølgingstiden var imidlertid kort (median 48 måneder) og resultatene kan derfor endre seg med lengre oppfølgingstid. Anbefalt kurskjema for temozolomid finnes i appendix 1.
Siden man vet at tidlig strålebehandling alene ikke gir sikker overlevelsesgevinst (van den Bent et al., 2005), bør førstevalg av kjemoterapi foreløpig være PCV. Ved dårlig toleranse for PCV bør temozolomid vurderes som erstatningsterapi. Det er også rimelig å gi temozolomid ved progresjon under behandling med PCV.
Dersom tumor er veldig utbredt og målvolumet for strålebehandling blir svært stort (det man tidligere kalte gliomatosis cerebri), kan man vurdere å gi 3–4 kurer TMZ monoterapi etterfulgt av MR for responsevaluering (se avsnitt "Glioblastom, IDH villtype, CNS WHO grad 4 og andre CNS WHO grad 4 diffuse gliomer (astrocytom IDH-mutert CNS WHO grad 4, diffust midtlinjegliom H3 K27-alterert CNS WHO grad 4, samt diffust hemisfærisk gliom H3 G34-mutert CNS WHO grad 4)"). Ved stabil sykdom eller radiologisk respons bør man kontinuere med ytterligere 6–8 kurer dersom god toleranse. Alternativt kan man bruke PCV; starte med 2 kurer og ved respons gi ytterligere 2-4.
En nylig publisert industridrevet fase III-studie randomiserte pasienter med IDH1- eller IDH2-mutert CNS WHO grad 2 diffust gliom mellom vorasidenib og placebo (Mellinghoff et al., 2023). Inklusjonskriteriet var pasienter primæroperert med resttumor eller residivoperert, men som ikke hadde mottatt annen tumorrettet behandling. Vorasidenib ga få radologiske responser (10,7%), men økte progresjonsfri overlevelse (median 11,1 måneder vs. 27,7 måneder) og toksisiteten var lav. Effekten på progresjonsfri overlevelse var imidlertid klart dårligere enn for strålebehandling og PCV, som for mange vil være alternativet i denne sykdomsfasen. Det er enda ikke vist effekt av vorasidenib på overlevelse eller malignfri overlevelse og grunnet planlagt cross-over vil data på dette neppe komme med det første. Hvilken plass vorasidenib får i behandling av norske pasienter med diffust IDH-mutert CNS WHO grad 2 gliom er enda usikkert, men behandlingen kan potensielt bidra til å usette behovet for annen og mer toksisk adjuvant behandling. Prosessen med FDA-godkjenning er iverksatt og EMA vil nok følge etter. Prisen er forventet å bli høy, noe som potensielt kan påvirke behandlingsindikasjonen i Norge.
Diffust CNS WHO grad 3-4 gliom
Det samme som er beskrevet i avsnitt "Diffust CNS WHO grad 2 gliom" om utbredt lavgradig tumor og kjemoterapi uten strålebehandling gjelder for diffuse grad 3-4 gliomer også. Spesielt gjelder det for utbredte glioblastomer hos eldre og/eller pasienter i redusert allmenntilstand hvor tumor har metylert MGMT promotor (Strålebehandling av glioblastom IDH villtype CNS WHO grad 4 og andre CNS WHO grad 4 diffuse gliomer (astrocytom IDH-mutert CNS WHO grad 4, diffust midtlinjegliom H3 K27M-mutert CNS WHO grad 4, samt diffust hemisfærisk gliom H3 G34-mutert CNS WHO grad 4)).
Supplerende behandling
Sist faglig oppdatert: 17.08.2023
Vedrørende symptomrettet behandling, inkludert behandling med steroider, henvises det til «Handlingsprogram for hjernesvulst generelt».
Majoriteten av pasienter med diffuse CNS WHO grad 2 gliomer og mange med høygradige diffuse gliomer har epilepsi preoperativt og omkring halvparten har ikke fullgod anfallskontroll med antiepileptika. De aller fleste med diffuse diffuse CNS WHO grad 2 gliomer (>90 %) rapporteres å bli anfallsfrie etter kirurgi og flere blir anfallsfrie med høyere reseksjonsgrad og kort varighet av epilepsi (Chang et al., 2008). Epileptiske anfall er typisk fokale med eller uten sekundær generalisering. Antiepileptika gis vanligvis etter første anfall. Primærprofylaktisk antiepileptisk behandling er ikke indisert. Ved valg av antiepileptika bør man ta hensyn til at mange skal ha kjemoterapi i sykdomsforløpet. Lave hematologiske verdier ved bruk av noen typer antiepileptika (for eksempel valproat) vil av og til kunne vanskeliggjøre gjennomføringen av slik kjemoterapi. Epilepsi ved gliom har som regel fokal start og valproat er dermed sjelden førstevalg. Levetirazetam er mye brukt, men man må være oppmerksom på bivirkninger i form av irritabilitet/aggresjon hos noen.
Hos pasienter med CNS WHO grad 2 gliomer bør det tilbys rehabiliteringsbehovsvurdering, spesielt for pasienter med nevrologiske utfall. Vurdering av kognitiv funksjon bør inngå i vurdering av rehabiliteringspotensiale. Det er ennå uklart om kognitiv rehabilitering har varig klinisk nytteverdi (Gehring et al., 2009), men det synes rimelig at man vurderer rehabilitering for de fleste pasienter på et eller annet tidspunkt i sykdomsforløpet. I kontrast til dette vil relativt få pasienter med diffuse CNS WHO grad 4 gliomer ha nytte av spesifikk rehabilitering grunnet relativt begrenset levetid, ofte høyere alder og lavere rehabiliteringspotensiale. Tilrettelegging med for eksempel hjelpemidler kan imidlertid bidra til at pasientene kan være mest mulig selvhjulpne så lenge som mulig.
Palliativt team kan med fordel tilknyttes pasienter med dårlig prognose og behov for tettere oppfølging.
Ernæring
Det vises til «Handlingsprogram for hjernesvulst generelt».
Fysisk aktivitet
Det vises til «Handlingsprogram for hjernesvulst generelt».
Psykososiale tiltak
Det vises til «Handlingsprogram for hjernesvulst generelt».
Amming, fertilitet, graviditet
Pasienter som mottar kjemoterapi bør unngå amming og bruke prevensjon under og i minst 6 måneder etter avsluttet kjemoterapi. Kjemoterapi som brukes ved hjernesvulster (PCV, temozolomid, lomustin/CCNU) kan påvirke fertiliteten hos både kvinner og menn, men sannsynligheten for å bli varig steril av behandlingen er liten. Det er likevel tilrådelig at yngre pasienter (< 40 - 45 år) i god allmenntilstand og med gode prognostiske markører får tilbud om samtale og evt fertiltetsbevarende tiltak, og da helst i forkant av igangsatt behandling.
Beslutninger om graviditet ved hjernekreft vil være påvirket av mange faktorer, blant dem prognose for grunnsykdommen, sannsynlig behov for behandling i nærmeste fremtid og eventuelle begrensninger et svangerskap vil legge på dette, og potensiell hormonell påvirkning på svulsten. Pasient og partner bør få best mulig grunnlag for å treffe et informert valg.
Epilepsi eller bruk av anfallsforebyggende medikamenter krever spesielle tiltak i forbindelse med graviditet og fødsel. Det er spesielt viktig med folsyretilskudd i adekvat dose, god anfallskontroll, planlagt svangerskap og oppfølging av nevrolog og epilepsisykepleier gjennom svangerskapet, i tillegg tilobstetriker og jordmor. Det er også viktig å unngå de mest teratogene anfallsforebyggende medikamenene der fremtidig graviditet kan bli aktuelt (spesielt valproat).
Organisering av behandling
Sist faglig oppdatert: 17.08.2023
Fastlege/primærlege har en viktig rolle frem til første kontakt med spesialisthelsetjenesten er tatt. Det vil deretter være aktuelle lokale sykehusavdeling, nevrologisk avdeling eller annen relevant avdeling som har ansvaret frem til første kontakt med neste ledd i behandlingskjeden. Nevrologisk avdeling eller annen avdeling ved sykehus uten nevrologisk avdeling (ofte medisinsk avdeling) igangsetter nødvendig støttebehandling som antiepileptika, antiødembehandling og eventuelt tromboseprofylakse. Ved epilepsi legges en plan for medisinering videre i forløpet. Kjøreegnethet bør vurderes for alle pasienter. Behov for hjemmesykepleie, vurdering og eventuelt behandling av fysioterapeut, ergoterapeut og/eller logoped vurderes individuelt. Sosionom bør ofte involveres for å vurdere behov for sosialmedisinske tiltak for pasient og pårørende.
Neste ledd vil som oftest enten være nevrokirurgisk avdeling og deretter kreftavdeling.
Leddet i behandlingskjeden som til enhver tid har ansvar for pasienten har også løpende ansvar for informasjon og dialog med pasienten. Dette omfatter medisinsk informasjon og hjelp med nødvendige sosialmedisinske tiltak. Dialog med pårørende er spesielt viktig ved kognitive symptomer som kan vanskeliggjøre forståelse, kommunikasjon og sykdomsinnsikt. Ved barn som pårørende må det tas spesielle hensyn.
Behandlingsbeslutninger gjøres oftest i MDT-møter hvor representanter fra relevante spesialiteter er til stede. Som minimum må MDT-møtet bestå av av nevrokirurg, onkolog, patolog og nevroradiolog, og ideelt sett også nevrolog. Beslutninger tas i samråd med pasient og helst også pårørende.
Anbefalinger:
CNS WHO grad 2 diffust gliom
- Tidlig kirurgisk reseksjon gir på gruppenivå stor overlevelsesgevinst sammenlignet med «watchful waiting” ved mistenkt diffust CNS WHO grad 2 gliom (Evidens grad B)
- Målet ved primær kirurgisk reseksjon av diffust CNS WHO grad 2 gliom er å gjennomføre maksimal reduksjon av svulstvev, uten å påføre pasienten nye permanente sekveler (Evidens grad C). Noen sekveler kan av og til være akseptable sett i lys av den store overlevelsesgevinsten ved kirurgi, ikke minst der vevsdiagnosen er kjent (Evidens grad D). Avgjørelser rundt dette diskuteres med pasienten
- Postoperativt bør det tas en tidlig MR (innen 48 timer) for å vurdere reseksjonsgrad og komplikasjoner. Dersom reseksjonsgrad er klart dårligere enn ønsket bør mulighet for rekirurgi vurderes, helst i MDT-møte (Evidens grad D)
- Mulighet for rekirurgi vurderes ved residiv (Evidens grad D)
- Pasienter operert for diffust CNS WHO grad 2 gliom skal diskuteres på MDT-møte for vurdering av indikasjon for strålebehandling og adjuvant kjemoterapi
- Adjuvant PCV etter strålebehandling til 54 Gy gir bedre overlevelse for selekterte pasienter med høyere risiko for malign transformasjon (Evidens grad A)
- Pasienter som ikke er egnet for primær kirurgisk eller ytterligere kirurgisk reseksjon ved rest/residiv, pasienter med kliniske/radiologiske tegn til rask tumorprogresjon og/eller flere negative prognostiske faktorer, samt pasienter med dårlig epilepsikontroll er ofte aktuelle for tumorrettet behandling med stråleterapi og kjemoterapi (Evidens grad B)
- Stråledose for pasienter med diffust CNS WHO grad 2 gliom bør være 50.4–54 Gy (Evidens grad B)
- Fordi strålebehandling kombinert med kjemoterapi i form av PCV gir bedre totaloverlevelse enn strålebehandling alene, bør man som standard gi kombinasjonsterapi og ikke bare kjemoterapi (Evidens grad A). Det er ikke gjennomført studier som viser at temozolomid har samme effekt som PCV adjuvant til strålebehandling
- Dersom pasienter av toksisitetshensyn ikke klarer å gjennomføre PCV-kurene, kan man vurdere å erstatte gjenværende behandlingstid med temozolomid
- Anbefalt kurskjema for temozolomid og PCV finnes i appendix 1
CNS WHO grad 3 og 4 diffust gliom
- Alle pasienter med høygradig diffust gliom (CNS WHO grad 3 og 4) skal vurderes for multimodal terapi inkludert kirurgi, strålebehandling og kjemoterapi
- Målet ved kirurgisk reseksjon av diffust CNS WHO grad 3 og 4 gliom er å sikre vevsdiagnose og å gjennomføre maksimal reduksjon av svulstvev uten å påføre pasienten nye permanente sekveler (Evidens grad C)
- Postoperative nevrologiske utfall er assosiert med dårligere overlevelse ved glioblastom (Evidens grad C)
- Høy kirurgisk reseksjonsgrad bedrer overlevelse for pasienter med diffust CNS WHO grad 3 og 4 gliom (Evidens grad B). Reseksjon av alt kontrastladende tumorvev gir overlevelsesgevinst sammenlignet med kun partiell reseksjon eller biopsi (Evidens grad B). Reseksjon av ikke-kontrastadende tumorvev (FLAIR-forandringer) i tillegg til kontrastladende vev er assosiert med bedre overlelevelse hos pasienter <65 år (Evidens grad C)
- Postoperativt bør det tas en tidlig MR (<48 timer) for å vurdere reseksjonsgrad og eventuelle komplikasjoner. Dersom reseksjonsgrad er klart dårligere enn ønsket bør mulighet for tidlig rekirurgi vurderes, helst i MDT-møte (Evidens grad D)
- Strålebehandling av diffust CNS WHO grad 3 og 4 gliom forlenger pasientenes overlevelse (Evidens grad A). Vedrørende definering av målvolumer og risikoorganer henvises til appendix 2
- Pasienter med CNS WHO grad 3 oligodendrogliom (IDH-mutert, 1p19q kodelesjon påvist) anbefales postoperativ strålebehandling 1.8 Gy x 33 og 6 adjuvante PCV-kurer, forutsatt akseptabel toleranse (for kurskjema henvises til appendix 1. Evidens grad A)
- Pasienter med diffust astrocytom CNS WHO grad 3 (IDH-mutert) anbefales postoperativ strålebehandling 1.8 Gy x 33 og 6–12 adjuvante temozolomidkurer, forutsatt akseptabel toleranse (for kurskjema henvises til appendix 1. Evidens grad A)
- Pasienter under 70 år med glioblastom eller diffust CNS WHO grad 4 gliom og allmenntilstand svarende til ECOG 2 eller bedre, bør ha postoperativ strålebehandling 2 Gy x 30 med daglig konkomitant og 6 kurer adjuvant temozolomid, forutsatt akseptabel toleranse (for kurskjema henvises til appendix 1. Evidens grad A)
- Pasienter over 70 år med glioblastom eller diffust CNS WHO grad 4 gliom og allmenntilstand svarende til ECOG 2 eller bedre, anbefales postoperativ hypofraksjonert strålebehandling 2.67 Gy x 15 med konkomitant og adjuvant temozolomid, alternativt 3 Gy x 13, 3.4 Gy x 10 eller 5 Gy x 5 (for kurskjema henvises til appendix 1. Evidens grad A)
- Monoterapi temozolomid er et behandlingsalternativ for pasienter over 70 år med glioblastom som har metylert MGMT-promotor (for kurskjema henvises til appendix 1, Evidens grad A)
- Hos eldre pasienter og/eller pasienter med allmenntilstand svarende til ECOG 3–4 individualiseres behandlingen
- Oppstart adjuvant kjemoterapi bør skje ca 4–6 uker etter avsluttet strålebehandling (gjelder både for temozolomid og PCV)
- Behandling med alternerende elektriske felter (TTF) som supplement i den adjuvante fasen i Stupp-regimet er vist å gi forlenget overlevelse for pasienter med glioblastom (Evidens grad A). Beslutningsforum har imidlertid sagt nei til at denne behandlingen kan tilbys i det offentlige norske helsevesenet
Oppfølging og kontroll etter avsluttet primærbehandling
Sist faglig oppdatert: 17.08.2023
Pasienter med diffust gliom CNS WHO grad 2-4 er prinsipielt uhelbredelig syke og skal kontrolleres livslangt. Prognosen varierer imidlertid betydelig, se kapittel Prognose. Evidensen for anbefalte kontrollintervaller baseres i stor grad på erfaring og skjønnsmessige vurderinger.
Kontroller
Sist faglig oppdatert: 17.08.2023
Diffust CNS WHO grad 2 gliom
Underveis i primærbehandling tar man oftest MR-kontroll hver 3.-4. måned. Etter gjennomført primær tumorrettet behandling (kirurgi og/eller strålebehandling etterfulgt av PCV) er halvårlige MR-kontroller tilstrekkelig hos pasienter med stabil sykdom, og for pasienter med stabil sykdom over mange år kan kontrollintervallet økes til 12 måneder.
Da progresjon oftest skjer langsomt skal man alltid sammenligne siste MR-undersøkelse med første MR etter siste tumorrettede intervensjon; dette må presiseres i henvisningen til MR-undersøkelse. Volumetriske analyser er langt mer følsomt for å avdekke vekst enn grove diametermål, og radiologiske kriterier for progresjon (RANO/MacDonald) og veksthastighet hos den enkelte pasient er av prognostisk betydning og assosiert med risiko for malign transformasjon (Pallud et al., 2013). Volumetrisk vekstmåling kan også fungere som beslutningsstøtte dersom man overveier å gi adjuvant behandling eller skal vurdere behandlingsrespons. Tidlig postoperativ MR (<48 timer) kan overvurdere resttumorvolum noe, spesielt FLAIR-sekvens (Belhawi et al., 2011).
Diffuse CNS WHO grad 2 gliomer er en sjelden kreftform som bør følges opp av leger med erfaring med sykdommen. Hos pasienter der mer tumorrettet behandling kan bli aktuelt er nevroradiologisk, nevroonkologisk, og nevrokirurgisk kompetanse viktig og oppfølgingen bør derfor fortrinnsvis skje på sykehus med tilgang på alle disse spesialitetene. Subsidiært kan pasientene følges på andre sykehus som har tilgang på videobaserte MDT-møter med nødvendige spesialister som deltagere. Mulighet for reoperasjon vurderes alltid ved mistanke om residiv/progresjon etter primærbehandling. Kandidater for senere rekirurgi følges opp poliklinisk ved nevrokirurgisk avdeling, eventuelt i tett dialog med nevrokirurg. Pasienter med inoperable svulster eller som på grunn av svulstlokalisasjon eller andre forhold neppe blir kandidater for rekirurgi følges oftest av onkolog eller nevrolog. Ved viktige terapeutiske beslutninger skal pasientene diskuteres i MDT-møte. Pasient og eventuelt pårørende skal involveres i alle beslutninger og det bør være avtalt klinisk konsultasjon i etterkant av hver MR caput. Resultat av MR-undersøkelser skal formidles til pasienten uten ugrunnet opphold.
Pasienter som i oppfølgingen får bekreftet malign transformasjon histologisk eller der det er overbevisende radiologiske tegn til sekundær malign transformasjon (rask tumorprogresjon, nytilkommet kontrastopptak, nekrose, ødem), inkluderes i «Pakkeforløp for hjernekreft» og behandles etter retningslinjer for høygradig diffust gliom. I tvilstilfeller kan gjentatt biopsitaking være nyttig for å sikre riktig adjuvant behandlingsregime.
En bør være spesielt oppmerksom på eventuelle senbivirkninger etter strålebehandling, som redusert synsfunksjon, hypofysesvikt (ved stråledoser over 20–40 Gy til hypofyse), fatigue eller kognitiv svikt (se Seneffekter og senbivirkninger i «Handlingsprogram for hjernesvulst generelt»).
Diffust CNS WHO grad 3 og 4 gliom
Oppfølging under pågående cytostatikabehandling skjer som regel hos onkolog eller nevrolog, i samarbeid med pasientens fastlege. MR-kontroller underveis i primærbehandling besørges av onkolog eller nevrolog og tas oftest hver 3.-4. måned. Etter gjennomført initial tumorrettet behandling (kirurgi og strålebehandling, samt kjemoterapi i form av TMZ eller PCV) observeres pasienten med kontroller hver 3.–4. måned. Kontrollene bør bestå av MR caput, med samme protokoll hver gang, etterfulgt av klinisk konsultasjon. Hensikten er å oppdage sykdomsprogresjon/residiv, vurdere eventuelle bivirkninger etter behandlingen, samt optimalisere eventuell støttebehandling som kortikosteroider og antiepileptika. Kontrollintervallene kan økes gradvis, avhengig av vevsdiagnose, prognose og klininisk bilde. Pasienter med diffust CNS WHO grad 4 gliom bør oftest fortsette med kontroller hver 3.–4. måned, mens kontrollintervall hos pasienter med diffust CNS WHO grad 3 gliom med mindre aggressiv histologi og fredelig klinisk bilde gradvis kan økes etter det første året. For både diffuse CNS WHO grad 3- og 4-svulster kan man vurdere å øke kontrollintervallet dersom pasientene blir relative langtidsoverlevere; for pasienter med glioblastom til hver 6. måned og for pasienter med diffust CNS WHO grad 3 gliom til hver 12. måned. Resultat av MR-undersøkelser skal formidles til pasienten uten ugrunnet opphold.
En bør være spesielt oppmerksom på eventuelle senbivirkninger etter strålebehandling, som redusert synsfunksjon, hypofysesvikt (ved stråledoser over 20–40 Gy til hypofyse), fatigue eller kognitiv svikt (se Seneffekter og senbivirkninger i «Handlingsprogram for hjernesvulst generelt»).
Hvem som skal følge pasienten må vurderes individuelt fra pasient til pasient, avhengig av lokal geografi og lokale/regionale avtaler. Mens noen pasienter, i hvert fall i starten, bør følges av nærmeste onkologiske avdeling, vil andre være best tjent med tett oppfølging av nevrolog og/eller fastlege. Etter hvert vil det for de fleste pasientene være aktuelt å koble inn palliativt team. Ved spørsmål/utfordringer kontaktes onkolog eller nevrokirurg.
Ved mistanke om progresjon og hvor ny tumorrettet behandling fortsatt ansees som aktuelt, skal pasienten på nytt henvises til nærmeste onkologiske, nevrologiske eller nevrokirurgiske avdeling (avhengig av hvilke tiltak man anser som mest aktuelt). Slike pasienter kan med fordel diskuteres på nytt i MDT-møte (når ny MR foreligger).
Pseudoprogresjon
Den multimodale behandlingen av høygradig diffust gliom, inkludert kirurgi, strålebehandling og kjemoterapi, kan medføre forandringer i karveggene i hjernevevet som gir kontrastopptak og ødem, som igjen kan gi bildefunn og kliniske symptomer som likner det som ses ved tumorvekst. Dette kalles pseudoprogresjon, opptrer typisk de første 1–6 måneder etter avsluttet radiokjemoterapi, og sees hos nær en tredjedel av pasientene. Pseudoprogresjon kan imidlertid også sees senere i behandlings- og kontrollforløpet og er vanligst hos pasienter med MGMT hypermetylert glioblastom.
Det vil ofte være vanskelig å sikkert skille mellom reell neoplastisk progresjon og pseudoprogresjon/terapirelaterte forandringer på MR-bilder. Pasienter med pseudoprogresjon er vist å ha lengre overlevelse enn gjennomsnittet i pasientgruppen. Hvis pseudoprogresjon feiltolkes som reell progresjon kan det medføre unødvendig reoperasjon og/eller at kjemoterapi avsluttes for tidlig. MR-perfusjon kan være nyttig for å skille mellom reell progresjon og pseudoprogresjon, men kan ikke gi et sikkert svar. Ofte vil kun observasjon over tid, og eventuelt kortikosteroidbehandling i gradvis nedtrapping, kunne gi en avklaring (Brandsma et al., 2009; Kruser et al., 2013). En skal på denne bakgrunn være varsom med å konkludere kun på bakgrunn av økende kontrastoppladning og ødem innenfor strålebehandlet område ved MR 3 eller 6 mnd etter avsluttet strålebehandling.
Er aminosyre-PET tilgjengelig kan dette også være nyttig som tilleggsundersøkelse for å skille residiv fra stråleinduserte endringer. En PET/RANO-rapport fra 2021 beskriver høyere diagnostisk verdi av aminosyre-PET enn konvensjonell MR for å skille residiv fra stråleinduserte endringer (Galldiks et al., 2021).
Fastlegens rolle
Sist faglig oppdatert: 17.04.2024
Fastlegens rolle i diagnostikk og henvisning til Pakkeforløp for hjernekreft
Fastlegene har en viktig rolle i primærdiagnostikk, både med å avkrefte mistanke om hjernekreft, utrede og eventuelt påvise hjernekreft bildediagnostisk, legge inn i sykehus ved alvorlige symptomer eller henvise til Pakkeforløp for hjernekreft ved begrunnet mistanke. Mistanke om kreft i hjernen oppstår når:
- CT- eller MR-skanning, ofte utført på andre indikasjoner, har påvist romoppfyllende prosess i hjernevevet og der man mistenker at det deier seg om en malign prosess.
- Nyoppståtte objektive fokale nevrologiske utfallssymptomer som for eksempel halvsidig parese, styringsproblemer eller språkforstyrrelser uten andre sannsynlige forklaringer som for eksempel hjerneslag. Slike pasienter legges ofte inn i sykehus for rask utredning.
- Nyoppstått epileptisk anfall hos voksne legges inn i sykehus for utredning
- Nyoppståtte, raskt progredierende endringer i adferd, personlighet eller kognisjon.
- Mindre endringer med langsom progresjon hvor mistanken om hjernesvulst er liten, kan utredes av fastlegen med poliklinisk MR
- MR bestilles også ved nyoppstått, konstant og progredierende hodepine eller alvorlig forverring av kronisk hodepine med trykkpreg. Episodisk hodepine eller mer klassiske hodepinetilstander i typisk alder (som migrene) trenger ikke utredning med bildediagnostikk.
Alle pasienter med billedmessig mistanke om gliom henvises «Pakkeforløp for hjernekreft». Det bør gjøres en generell somatisk undersøkelse og klinisk nevrologisk undersøkelse. Pasienten henvises til lokal nevrologisk eller nevrokirurgisk avdeling via telefonisk kontakt med vakthavende nevrolog eller nevrokirurg. Denne avgjør om pasienten skal legges inn eller tas imot til poliklinisk utredning. Henvisning sendes med pasienten ved akutt innleggelse, elektronisk er å foretrekke. Henvisende lege har ansvar for at eventuelle svar på radiologiske undersøkelser oversendes. Det er viktig med god kommunikasjon med pasient og pårørende om hva som er funnet og hva som skal skje av utredning videre. En kan gjerne diskutere dette med vakthavende nevrolog/nevrokirurg.
Symptomatisk behandling med kortikosteroider startes ved billedmessig ødem og bivirkninger (insomni, hyperglykemi, psykiske bivirkninger) følges opp i påvente av behandling i sykehus. Ulcusprofylakse gis hos alle der man gir kortikosteroider. Ved mistake om hjernekreft er det også kjøreforbud og fastlegen gir muntlig kjørekarantene inntil avklaring.
Fastlegens rolle for hjernesvulstpasienter i aktiv behandling
Fastlegens rolle i denne fasen vil variere alt etter pasientens kliniske situasjon, livssituasjon og avstand til sykehus. Fastlegen bør bidra etter pasientens ønsker og behov.
Diagnostisering, valg av behandling og initial oppfølging etter ferdigbehandlet sykdom er i stor grad sentralisert til universitetssykehus og større sykehus. Fastlegen skal få kopi av epikrise fra innleggelser og polikliniske notater med behandlingsplan. Oftest vil primærbehandling og kontroller foregå ved sykehus. Hvis epikrise med plan for aktuell behandling fra sykehus inkluderer oppgaver for fastlegen, skal pasienten informeres om å kontakte fastlege eller sykehusavdelingen hjelpe med dette dersom pasienten selv ikke er i stand til det. Fastlegen henviser til behandlende sykehusavdeling ved symptomatisk forverring som gir mistanke om tilbakefall.
Fastlegen skal bidra til å lindre smerter, kvalme og komplikasjoner etter behandling, og gi råd om ernæring. Legen må derfor vite om mulige bivirkninger av behandlingen som er gjort og henvise til sykehus for råd og håndtering ved mistanke om alvorlige, akutte komplikasjoner av behandling, ved infeksjon eller residiv.
Fastlegen kan bidra i behandling av angst, depresjon og andre psykiske plager, samt søvnvansker. Fastlegen kan også bidra til ivaretagelse av berørte familiemedlemmer, herunder eventuelle barn, og samarbeide med hjemmetjeneste der dette er aktuelt. Henvisning til lokalt vardesenter og rehabiliteringsinstanser kan også gjøres av fastlegen. Fastlegen kan også koordinere innsats i samarbeid med kommunal kreftsykepleier.
Sykemelding skal i aktiv behandlingsfase primært skrives av behandlende lege, med mindre fastlegen allerede har sykemeldt pasienten. Fastlege kan forlenge sykemeldinger og bistå i kontakten med NAV der dette er hensiktsmessig.
Fastlegens rolle for pasienter som går til kontroller etter behandling
Primærbehandling og kontroller ved gliom foregår som regel ved sykehus. Fastlege kan samarbeide med sykehus om kontroller ved langvarig sykdom der dette er hensiktsmessig. Sykehusspesialisten skal da i epikrise beskrive detaljert oppfølgingsplan. Bildekontroller fremskyndes ved symptomer som kan gi mistanke om tilbakefall.
Det vises for øvrig til følgende dokumenter fra Helsedirektoratet:
Fastlegens arbeid med palliasjon og omsorg ved livets slutt for pasienter med hjernekreft
I denne fasen mottar mange pasienter behandling på sykehus, dels for symptomlindring, dels for livsforlengelse. Parallelt følges pasientene av fastlege og øvrig primærhelsetjeneste. Mange pasienter har et ønske om å dø hjemme og kommunal innsats som legger til rette for dette kan fasiliteres av fastlege.
Palliasjon og omsorg ved livets slutt for kreftpasienter må tilpasses den enkeltes kliniske situasjon og behov. Det vises til Helsedirektoratets nettsider med mer informasjon om fastlegenes rolle ved kreft, herunder "Palliasjon" og "Omsorg ved livets slutt", og Fastlegens rolle hos pasienter med hjernesvulst.
Seneffekter og senbivirkninger
Sist faglig oppdatert: 17.08.2023
De fleste pasienter med diffust CNS WHO grad 2 gliom lever i mange år og et betydelig antall pasienter også i flere tiår. Derfor er fokus på seneffekter, relatert både til svulsten og behandlingen, vesentlig. Spesielt hos pasientene som har gjennomgått strålebehandling skal man være oppmerksom på dette, for eksempel økt trettbarhet og kognitiv svikt. I tillegg kan kognitive følgetilstander av onkologisk behandling og psykotrope bivirkninger av antiepileptika og annen medikasjon påvirke pasientens funksjonsnivå og rehabiliteringspotensiale. Fastlege og spesialisthelsetjenesten må være oppmerksom på mulige seneffekter. Ved nevrologiske eller andre utfall bør pasienten vurderes for henvisning til rehabilitering dersom man anser prognosen å være rimelig god.
På grunn av den alvorlige prognosen er seneffekter/-bivirkninger ofte mindre relevant for pasienter med høygradig diffust gliom. Noen pasienter, ikke minst de med CNS WHO grad 3 oligodendrogliom (og de med diffust CNS WHO grad 3 astrocytom) kan imidlertid leve i mange år og oppleve seneffekter. Det vises til «Handlingsprogram for hjernesvulst generelt».
Rehabilitering
Sist faglig oppdatert: 17.08.2023
Det vises til tilsvarende avsnitt om rehabilitering i «Handlingsprogram for hjernesvulst». Alle pasienter bør få vurdert sitt rehabiliteringsbehov og -potensiale og rehabilitering skal igangsettes etter behov. Spesielt de pasientene som forventes å bli langtidsoverlevere bør få tilbud om rehabilitering dersom man på individuelt grunnlag finner behov for det.
Anbefalinger:
CNS WHO grad 2 diffust gliom
- Oppfølging ved MR gjøres helst med samme feltstyrke (Tesla) og fortrinnsvis samme skanner for å unngå teknologiavhengige variasjoner i T2/FLAIR-signaler og dermed antatt tumorvolum/behandlingsrespons. Volumetriske analyser er mest følsomt for å avdekke svulstvekst (Evidens grad C)
- Pasienter med diffust CNS WHO grad 2 gliom skal kontrolleres livslangt
- Kontrollene bør i tillegg til MR caput bestå av klinisk konsultasjon
- I oppfølging etter primærbehandling bør MR tas hver 6. måned. Dersom det ikke er tegn til progresjon første 10 år kan man vurdere å gå over til årlige kontroller
- Pasienter som får bekreftet malign transformasjon histologisk eller der det er overbevisende radiologiske tegn til sekundær malign transformasjon behandles som høygradige diffuse gliomer (Evidens grad C)
- For rehabiliteringsanbefalinger – se «Handlingsprogram for hjernesvulst»
CNS WHO grad 3 og 4 diffust gliom
- Pasienter med høygradig (CNS WHO grad 3 og 4) diffust gliom skal kontrolleres livslangt
- Kontrollintervallet bør initialt være hver 4. måned og kan etter hvert økes inntil hver 6. måned, men pasienter med oligodendrogliom CNS WHO grad 3 kan kontrolleres som diffust CNS WHO grad 2 gliom (Evidens grad D)
- Kontrollene bør bestå av MR caput (med samme tumorprotokoll hver gang) etterfulgt av klinisk konsultasjon (Evidens grad D)
- Det er viktig å være klar over muligheten for radiologisk pseudoprogresjon, spesielt ved høye stråledoser på opptil 60 Gy kombinert med kjemoterapi. MR perfusjon samt ekspektans kan være nyttig ved mistanke om pseudoprogresjon
- Symptomrettet behandling må vurderes og igangsettes gjennom hele forløpet etter behov. Rehabilitering må vurderes, men er aktuelt i varierende grad, ikke minst avhengig av diagnose og prognose (Evidens grad D)
Behandling av residiverende sykdom
Sist faglig oppdatert: 17.08.2023
Diffuse gliomer metastaserer svært sjelden utenfor sentralnervesystemet, og at det er lokal gjenvekst som er den klart dominerende form for tilbakefall. 85–90 % av høygradige diffuse gliomer residiverer i tilslutning til reseksjonskaviteten (Jansen et al., 2000).
I residivsituasjonen er vevsdiagnose og funksjonsnivå viktige prognostiske faktorer, i tillegg til tumorstørrelse og –lokalisasjon og residivfritt intervall.
Det er ingen etablert standardbehandling ved residiv av diffust gliom. Pasienter bør vurderes individuelt og beslutninger diskuteres ofte i multidisiplinært team (MDT). Forutsatt rimelig god almenntilstand/funksjonsstatus bør mulighet for ny kirurgisk reseksjon vurderes. Ny reseksjon vil gi tumordebulking og sikre materiale for ny histologisk vurdering av malignitetsgrad og eventuell dedifferensiering, samt gi differensialdiagnostisk informasjon opp mot eventuell strålenekrose.
Kirurgi ved residiv
Sist faglig oppdatert: 17.08.2023
Dokumentasjonen for residivbehandling av diffust CNS WHO grad 2 gliom er mangelfull. Logisk sett burde reoperasjon for å redusere tumorvolum og dermed antall celler som kan gjennomgå senere malign transformasjon ha effekt som ved primærkirurgi. Ved tilbakefall vurderes derfor alltid mulighet for reoperasjon. I en del tilfeller kan man se at funksjonelle områder har flyttet på seg ved senere reoperasjon (på grunn av hjernens plastisitet), slik at risiko for nevrologiske sekveler ikke nødvendigvis blir større ved andre gangs operasjon i antatt følsomme områder.
Hvorvidt reseksjon ved residiv av høygradig diffust gliom kan være aktuelt må vurderes individuelt. Faktorer som har betydning er pasientens kliniske status (funksjonsstatus, komorbiditet, nevrologiske utfall, trykksymptomer) og alder, mulighet for radiologisk komplett reseksjon, samt residivets lokalisasjon og hva som ellers finnes av behandlingsalternativer. Subtotal kirurgisk reseksjon i en residivsituasjon har sannsynligvis svært begrenset effekt på overlevelse (Suchorska et al., 2016).
Se ellers Kirurgi.
Strålebehandling
Sist faglig oppdatert: 17.08.2023
Diffust CNS WHO grad 2 gliom
Dersom man ikke allerede har gitt strålebehandling, så bør det sterkt vurderes ved residiv og strålebehandlingen bør kombineres med PCV (Buckner et al., 2016). Hos pasienter med residiv etter tidligere strålebehandling av diffust lavgradig gliom var det tidligere sjelden aktuelt å rebestråle med konvensjonell strålebehandling i samme område som pasienten tidligere har fått 54 Gy. I de senere år har dette endret seg noe, dog uten at det foreligger klar evidens for effekt og uten at man har sikker oversikt over potensiell toksisitet. Spesielt hos pasienter hvor det har gått mange år siden primærbestråling og der pasienten er i god form kan fraksjonert rebestråling vurderes. Ved små svulstvolumer vil det oftest være mer aktuelt å gi stereotaktisk engangsbasert strålebehandling mot tumor enn fraksjonert strålebehandling (Combs et al., 2005). Se ellers Strålebehandling.
Diffust CNS WHO grad 3 og 4 gliom
Rebestråling ved progresjon av høygradig diffust gliom har de senere år blitt et behandlingsalternativ for selekterte pasienter med rimelig god funksjonsstatus. Det foreligger ikke randomiserte data for rebestråling av glioblastom i residivsituasjon, men en evidensbasert oversiktsartikkel konkluderer med at rebestråling i rett setting (primært ved rimelig lokaliserte residiver), i form av enten konvensjonell fraksjonert ekstern strålebehandling, hypofraksjonert stereotaktisk ekstern strålebehandling eller stereotaktisk gammaknivbehandling i form av en enkeltdose, gir økt lokal tumorkontroll (Ryu et al., 2014).
De vanligste fraksjoneringsregimene er 30–40 Gy i 2,67–3,5 Gy fraksjoner ved konvensjonell fraksjonert ekstern strålebehandling, eller 20–40 Gy i 5–6 Gy fraksjoner ved hypofraksjonert stereotaktisk ekstern strålebehandling. Ved små tumorvolumer er gammaknivbehandling eller stereotaktisk ekstern strålebehandling med enkeltdoser 12–20 Gy aktuelt (Ryu et al., 2014). En retrospektiv studie med 147 pasienter med residiv av høygradig diffust gliom viste at rebestråling (median dose 35 Gy i 3,5 Gy fraksjoner) ga god toleranse og en median overlevelse på 11 mnd etter rebestråling (Fogh et al., 2010). En randomisert fase-2-studie fant samme overlevelse ved bevacizumab og 3.5 Gy x 10 versus bevazizumab alene (10,1 vs. 9,7 mnd), men bedre progresjonsfri overlevelse (7,1 vs 3,8 mnd) med kombinasjonsbehandlingen (Tsien et al., 2023). Studien viste videre at rebestråling var godt tolerert. I Norge har man noe erfaring med ekstern rebestråling mot residivtumor til en totaldose på 45–54 Gy gitt i 1.8–2 Gy fraksjoner. Dette bør nok oftest forbeholdes pasienter som har hatt et intervall siden primærbestråling på 2–3 år. Toksisitet må antas å øke med økende størrelse av målvolum og økt kumulativ stråledose (Mayer et al., 2008). Eventuell gevinst må i hvert enkelt tilfelle vurderes opp mot mulige bivirkninger.
Inntegning av målvolum er utfordrende ved diffust høygradig gliom i residivfasen da tidligere gitt behandling kan gi behandlingsrelaterte MR-forandringer (T1-kontrastladning, T2-signalforandring) som illuderer residiv. Oftest er det et blandingsbilde med både residiv og behandlingsrelaterte MR-forandringer. Radiologisk erfaring er nødvendig, og nye teknikker som PET-diagnostikk kan bidra med supplerende informasjon (Galldiks et al., 2021).
Medikamentell behandling
Sist faglig oppdatert: 17.08.2023
Diffust CNS WHO grad 2 gliom
Kjemoterapi vil oftest være indisert ved gjenvekst av diffust CNS WHO grad 2 gliom, selv om kunnskapsgrunnlaget er relativt svakt. Temozolomid (TMZ), kombinasjonsregimet PCV og monoterapi med CCNU er de aktuelle valgene. Hva man velger avhenger først og fremst av om/hva pasienten fikk av kjemoterapi ved primærdiagnose, effekten dette hadde, bivirkningsprofil og hvor lang tid det har gått siden primærbehandling.
For de få pasienter med BRAF-mutasjon bør man overveie behandling med kombinasjon av BRAF- hemmer og MEK-hemmer (Wen et al., 2022). BRAF- og IDH-mutasjon er imidlertid oftest gjensidig ekskluderende.
Diffust CNS WHO grad 3 og 4 gliom
Kjemoterapi som residivbehandling ved glioblastom har generelt lave responsrater. Målet vil primært være stabilisering av sykdommen. For pasienter som har et progresjonsfritt intervall på mer enn 4–6 mnd etter avsluttet primærbehandling med TMZ, kan man vurdere en ny runde med TMZ (appendix 1). En publisert Cochrane-oversikt konkluderer med at TMZ i residivsituasjon ikke gir forlenget overlevelse sammenliknet med annen (CCNU-basert) kjemoterapi, men kan forlenge tid til progresjon uten å forringe livskvalitet (Hart et al., 2013).
Ved ny sykdomsutvikling av glioblastom etter TMZ i residivsituasjon, bør forsøk med tredjelinje kjemoterapi med CCNU-basert behandling (CCNU monoterapi eller PCV) forbeholdes pasienter som er i god funksjonsstatus og som har hatt nytte av tidligere kjemoterapi, da responsraten for andre grupper vil være svært lav. PCV-regimet er kjent for å gi mye benmargstoksisitet, og er samtidig logistisk krevende. CCNU monoterapi vil derfor oftest være foretrukket, og har de senere år blitt brukt som kontrollarm i intervensjonsstudier.
Ved residiv av diffus CNS WHO grad 3 gliom anbefales PCV-kurer, særlig for oligodendrogliomer. Alternativt vurderes TMZ, spesielt dersom residiv tilkommer relativt tidlig etter avsluttet PCV-basert primærbehandling. For pasienter med grad 3 diffust astrocytom vil førstevalget være TMZ, men også for disse pasientene kan PCV vurderes. Mens MGMT promotor hypermetylering er både prognostisk og prediktivt for effekt av TMZ ved glioblastom, er metyleringsstatus prognostisk men ikke prediktivt ved diffust CNS WHO grad 3 gliom (van den Bent et al., 2016; Weller et al., 2012). Også hos pasienter med diffust CNS WHO grad 3 gliom vil CCNU alene kunne benyttes dersom dårlig toleranse for PCV og/eller progresjon etter TMZ.
For pasienter med BRAF-mutasjon bør man overveie behandling med kombinasjon av BRAF- hemmer og MEK-hemmer (Wen et al., 2022). Det er imidlertid et mindretall av glioblastomer som er BRAF-muterte (ca. 3%).
Entrectinib eller larotrectinib har vist seg å kunne krysse blod hjernebarrieren, og er godkjent behandling for NTRK-fusjonspositive solide svulster basert på fase 1-2-studier. Denne behandlingen kan med fordel forsøkes hos det lille mindretallet pasienter med diffust gliom som har denne forandringen (vel 2%). Det er imidlertid få studier av gliom og NTRK-fusjon (Doz et al., 2022; Grogan et al., 2022).
Recidivsituasjonen for spesielt glioblastom kan ofte være preget av ødem og strålenekrose, og i den sammenheng benyttes ofte glukokortikoider. I Helse Vest har man i mange år benyttet bevacizumab og vinkristin i kombinasjon med lomustin.
Studier ved tilbakefall av glioblastom hvor man har sett på immunterapi med nivolumab (Reardon et al., 2020) og VEGF-hemmeren cediranib (Batchelor et al., 2013) har dessverre ikke vist bedret overlevelse.
Se ellers Strålebehandling og Medikamentell behandling.
Supplerende behandling (andre palliative tiltak, ernæring, fysisk aktivitet, psykososiale tiltak)
Sist faglig oppdatert: 17.08.2023
Se «Handlingsprogram for hjernesvulst generelt». Pasienter med diffust CNS WHO grad 2 gliom lever oftest i mange år, til tross for at de er uhelbredelig syke. Dette gjelder også i tilbakefallssituasjonen og man bør ha fokus på rehabilitering. Behovet for dette kan være stort og pasienten bør tilbys tverrfaglig rehabiliteringsvurdering. Kvalitativt vil rehabiliteringsbehovet oftest ikke skille seg vesentlig fra situasjonen ved primærdiagnose.
Utover i sykdomsforløpet vil det også for pasienter med diffust CNS WHO grad 2 gliom bli mer fokus på symptomrettet, ikke-svulstrettet behandling.
Organisering av behandling
Sist faglig oppdatert: 17.08.2023
MR skal tas så snart som mulig ved klinsk mistanke om residiv. De fleste residiver blir imidlertid diagnostisert ved rutinekontroller og ikke på grunn av symptomer. Etter bildemessig påvist residiv skal pasienten tilbys samtale med lege om resultatet av undersøkelsen. Mulighet for ytterligere tumorrettet behandling vurderes av spesialisthelsetjenesten etter henvisning. Beslutning om videre behandling/utredning gjøres primært i MDT-møte. Har man mistanke om malignisering av pasientens tidligere diffuse CNS WHO grad 2 gliom skal pasienten gå inn i «Pakkeforløp for hjernekreft». Ansvarsforhold vil være som i primærsituasjonen.
Primærlege eller den avdeling som har pasienten til kontroller og/eller som oppdager residiv, har behandlingsansvaret inntil pasienten er henvist til nevrokirurgisk, onkologisk eller nevrologisk avdeling. Nevrokirurgisk, onkologisk eller nevrologisk avdeling melder pasienten til MDT-møte. Enkelte steder vil det være nevrologisk avdeling som forestår den onkologiske behandlingen ved residiv og har da behandlingsansvar, men i tett samarbeid med nevrokirurgisk eller onkologisk avdeling. Nevrologiske avdelinger kan også være ansvarlig avdeling for pasienter der man har besluttet at det ikke skal gis ytterligere svulstrettet behandling.
Anbefalinger:
- Behandling ved residiv vil være ulik avhengig av allmenntilstand, komorbiditet, funksjonsnivå, diagnose, tid siden primærbehandling og residivlokalisasjon. I prinsippet er alle tumorrettede behandlingsmodaliteter aktuelle. Evidensnivået for de fleste tumorrettede behandlingsopsjoner i residivfasen er imidlertid nokså svakt
- Recidivpasienter kan med fordel diskuteres i MDT-møter
Patologi
Sist faglig oppdatert: 17.08.2023
Svulster i sentralnervesystemet (CNS; hjerne, hjernehinner og ryggmarg) diagnostiseres og klassifiseres etter «WHO Classification of Tumours of the Central Nervous System». Den gjeldende klassifikasjonen er den femte utgaven av denne klassifikasjonen, den er fra 2021 og benevnes CNS WHO 2021-klassifikasjonen i det følgende (Louis et al., 2021).
En betydelig endring i CNS WHO 2021-klassifikasjonen er at diffuse gliomer nå deles inn i voksen type (adult type) og pediatrisk type (pediatric type) gliomer. I gruppen pediatrisk type finner man svulster som også kan opptre hos unge voksne, mens voksen type gliomer svært sjelden affiserer barn og unge. Disse to gruppene skiller seg fra hverandre ved definerte molekylære markører, der voksen type gliomene fortsatt defineres ut fra molekylærgenetisk status (blant annet IDH- og 1p/19q-status), mens pediatrisk type gliom har helt andre molekylære markører som for eksempel MYB eller MYBL1 for lavgradige svulster, og H3 p.K28-alterasjoner for høygradige svulster. Biologisk er det også store ulikheter da voksen type gliomer som regel utvikler seg til høyere grad over tid og har et mer aggressivt forløp enn svulster av pediatrisk type. En annen betydelig endring innenfor voksen type svulstene, er at spesifikke molekylærgenetiske markører er bestemmende for CNS WHO-grad, uavhengig av histologisk grad.
Vi finner de fleste svulstene i voksen type gruppen, og disse vil nærmere defineres i det følgende. Selv om det er relativt få svulster innenfor pediatrisk type svulster vil de likevel kort beskrives, da klassifikasjonen for første gang gir kriterier for å definere disse nærmere som en egen gruppe, og slik skille dem fra voksen type gliomer.
Den siste WHO CNS-klassifikasjonen stiller således ytterligere krav til molekylærgenetiske undersøkelser i rutinediagnostikk av hjernekreft. Dette har ressursmessige og tidsmessige konsekvenser av betydning for den enkelte patologiavdeling og for utredende og behandlende avdeling.
Voksen type (adult type) diffuse gliomer
Sist faglig oppdatert: 17.08.2023
Denne gruppen består av diffuse infiltrerende gliomer som har CNS WHO grad 2, 3 eller 4 basert på histologiske og molekylærgenetiske egenskaper.
Inndelingen er som følger:
Astrocytom, IDH-mutert
Oligodendrogliom, IDH-mutert, 1p/19q kodeletert
Glioblastom, IDH-villtype
Astrocytom, IDH–mutert
Denne gruppen inneholder diffust infiltrerende astrocytomer med mutasjoner i IDH1 eller IDH 2 med hyppig ATRX- og/eller TP53-mutasjon, uten komplett 1p/19q delesjon. Generelt viser tumorcellene høy grad av differensiering i retning astrocytter.
Histologiske kriterier for gradsinndeling er de samme som tidligere, men i henhold til siste klassifikasjon settes disse kriteriene til side ved påvisning av en spesifikk molekylærgenetisk markør, nærmere bestemt homozygot delesjon av CDKN2A/B. Dette på bakrunn av multiple retrospektive studier som indikerer kortere overlevelse korresponderende til CNS WHO Grad 4 tumores blant pasienter med IDH muterte astrocytomer med denne markøren (Louis et al., 2021). Det er økt mitotisk aktivitet som definerer histologisk grad 3 og presens av karproliferasjon og /eller nekrose som definerer histologisk grad 4.
De graderes CNS WHO grad 2,3 og 4 etter histologiske og molekylærgenetiske markører som følger:
CNS WHO grad 2: Histologisk grad 2, uten homozygot delesjon av CDKN2A/B
CNS WHO grad 3. Histologisk grad 3, uten homozygot delesjon av CDKN2A/B
CNS WHO grad 4: Histologisk grad 4, eller tumores med påvist homozygot delesjon av CDKN2A/B, uavhengig av histologisk grad.
Inklusjon av homozygot tap av CDKN2A/B som egenstandig biomårkør for gradering av IDH-muterte astrocytomer impliserer behov for CDKN2A/B analyse i alle IDH-muterte astrocytomer med histologisk grad 2 eller 3. Med tanke på evidensgenerering bør vurderes samme analysen også i IDH-muterte astrocytomer med mikrovaskulær proliferasjon og / eller tumornekrose.
Som beskrevet i kapittel 9 bør man overveie behandling med kombinasjon av BRAF- hemmer og MEK-hemmer for pasienter med BRAF-mutasjon (Wen et al., 2022). Immunhistokjemisk analyse med BRAFVE1 antistoff (mot p.BRAFV600E-mutasjonen) eller annen egnet metode (PCR med Sangersekvensering eller ganpanelanalyse) bør vurderes i alle diffuse gliomer.
Oligodendrogliom, IDH-mutert og 1p/19q kodeletert
I likhet med astrocytomene vokser oligodendrogliomene diffust infiltrerende i hjernevev og kan i praksis så godt som aldri fjernes radikalt ved kirurgi. Som i forrige klassifikasjon er oligodendrogliom hos voksne per definisjon et diffust infiltrerende gliom med IDH-mutasjon og kodelesjon av kromosomarmene 1p og 19q. Ifølge WHO finnes ikke entydige histologiske parameter som skiller mellom grad 2 og grad 3 oligodendrogliomer. I praksis brukes ofte økt mitotisk aktivitet (≥2,5 mitoser /mm2; ≥6 mitoser per HPF) og tilstedeværelse av mikrovaskulær proliferasjon og / eller nekrose som indikator av histologisk grad 3. Homozygot delesjon av CDKN2A ble beskrevet i en undergruppe av CNS WHO grad 3 oligodendroliomer med dårlig klinisk forløp. Dvs homozygot delesjon av CDKN2A indikerer i oliogodendrogliomer en CNS WHO grad 3.
De graderes som tidligere i to grader basert på histopatologiske kriterier:
Oligodendrogliom, IDH mutert, 1p/19q kodeletert, CNS WHO grad 2
Oligodendrogliom, IDH mutert, 1p/19q kodeletert, CNS WHO grad 3
Glioblastom, IDH-villtype (wt)
Glioblastom er et diffust infiltrerende gliom som er IDH- og H3-villtype, med en eller flere av følgende histologiske eller genetiske egenskaper:
- mikrovaskulær proliferasjon
- tumornekrose
- TERT-promotormutasjon
- EGFR-amplifikasjon
- kromosomal kopitallsendring +7/-10
Glioblastom graderes som CNS WHO grad 4. Det finnes ulike histologiske subtyper som kjempecelleglioblastom, gliosarkom og epiteloid glioblastom. BRAFV600-mutasjoner, som kan ha terapeutiske implikasjoner, finnes i mange epiteloide glioblastomer. Immunhistokjemisk farging for den mest vanlige IDH-mutasjonen, IDH1 p.R132H, og H3 p.K28me3 gjøres på alle nydiagnostiserte diffust infiltrerende gliomer. Ved negativ IDH1R132H immunhistokjemi gjøres molekylærgenetisk analyse på IDH1 kodon 132 og IDH2 kodon 172. Ved histologiske glioblastomer hos pasienter eldre enn 54 år med immunhistokjemisk ATRX- og H3 p.K28me3-positivitet uten mistanke om tidligere diffust CNS WHO grad 2 gliom, kan man vurdere å utelate molekylærgenetisk analyse før diagnosestilling. MGMT metyleringsstatus har prediktiv verdi for respons på alkylerende kjemoterapi ved glioblastom og bør derfor analyseres og etterrapporteres ved alle nydiagnostiserte glioblastomer. På dette tidspunkt anbefales også molekylærgenetisk analyse på IDH1 kodon 132 og IDH2 kodon 172 ved pasienter eldre enn 54 år. Immunhistokjemisk påvist tap av enten H3 p.K28me3 eller ATRX er uforenlig med glioblastomdiagnose uten molekylærgenetisk analyse som omfatter minst IDH1/2 og alle histon H3-gener. Det finnes glioblastom med genfusjoner som kan ha terapeutiske implikasjoner (blant annet NTRK1-3 og FGFR3). Ved indikasjonen for molekylærgenetisk IDH- og/eller histon H3-analyse bør det derfor overveies utvidet molekylær analyse som omfatter flere genfusjoner.
Til forskjell fra forrige WHO-klassifikasjon eksisterer det nå ikke lenger diffuse IDH-wt astrocytomer CNS WHO grad 2 eller 3. Klassifikasjonen tar således ikke høyde for eventuelle diffust infiltrerende gliomer der man har histologisk grad 2 eller 3, IDH-wt, og fravær av TERT-promotormutasjon, EGFR-mutasjon, +7/-10 eller H3-mutasjon. I slike tilfeller anbefales på det sterkeste utvidet molekylær diagnostikk inklusive DNA-metyleringsanalyse for avgrensning mot pediatrisk type diffuse gliomer (se Pediatrisk type diffuse lavgradige gliomer).
Pediatrisk type diffuse lavgradige gliomer
Sist faglig oppdatert: 17.08.2023
I denne gruppen finner vi diffuse gliomer som opptrer hovedsakelig, men ikke bare, hos barn og unge. De kan også opptre hos yngre voksne. De har molekylærgenetiske egenskaper som klart skiller dem fra voksen type diffust infiltrerende gliomer, og biologisk oppfører de seg også distinkt fra voksen type gliomer, oftest med et mer benignt forløp. Til foskjell fra voksen type diffuse gliomer, så finnes det også grad 1 diffuse pediatrisk type gliomer.
De klassifiseres som følger:
- Diffust astrocytom med endringer i MYB eller MYBL1
- Angiosentrisk gliom
- Polymorf lavgradig nevroepitelial tumor hos unge (PLNTY)
- Diffust lavgradig gliom med endringer i MAPK signalveien
Diffust astrocytom med endring i MYB eller MYBL1, CNS WHO grad 1
Diffust infiltrerende astrocytom som er IDH- og H3-villtype med genetiske forandringer i MYB/MYBL1. Tumor er morfologisk lavgradig uten histologiske tegn til anaplasi og defineres som CNS WHO grad 1. Det er molekylærpatologisk påvist MYB/MYBL1-endring, eller definert DNA-metyleringsprofil som tillater diagnosestillingen.
Angiosentrisk gliom, CNS WHO grad 1
I denne gruppen finner vi svulster med et diffust og fokalt distinkt perivaskulært vekstmønster, og med lavgradig histologi, CNS WHO grad 1. Molekylærgenetisk har de fleste svulstene i denne gruppen en MYB::QKI fusjon, de resterende har som regel en annen MYB-alterasjon. Svulsten er sjelden forekommende; foreløpige data tyder på at den har benignt forløp.
Polymorf lavgradig nevroepitelial tumor hos unge (PLNTY), CNS WHO grad 1
Dette er et lavgradig neoplasme hos unge og yngre voksne med sterk assosiasjon til epilepsi. Tumor viser et diffust vekstmønster, lavgradig morfologi, ofte med et oligodendroglialt preg, kalsifikasjon, positivitet for immunmarkøren CD34, og aktiverende genetiske alterasjoner i MAPK-signalveien.
Diffust lavgradig gliom med endringer i MAPK signalveien
Et diffust lavgradig gliom med astrocytær og/eller oligodendroglial morfologi som oftest opptrer hos barn, og er karakterisert av endringer i gener som koder for MAPK signalveien. Ofte finner man en intern tandemduplikasjon eller mutasjon i tyrosin kinase-domenet i FGFR1, eller en BRAF p.V 600-mutasjon. Tumor er IDH- og H3-villtype, og har ikke homozygot delesjon av CDKN2A/B. CNS WHO grad ble ikke definert på grunn av begrenset klinisk erfaring med denne diagnosen.
Pediatrisk type diffuse høygradige gliomer
Sist faglig oppdatert: 17.08.2023
Også i denne gruppen finner vi diffuse gliomer som opptrer hovedsakelig, men ikke bare, hos barn og unge. De kan også opptre hos voksne. Svulstene i denne gruppen graderes helt overveiende som CNS WHO grad 4 og i denne gruppen finner vi følgende svulster:
- Diffust midtlinjegliom, H3 K 27-endret
- Diffust hemisfærisk gliom, H3 G 34-mutert
- Diffust pediatrisk type høygradig gliom, H3-villtype og IDH-villtype
- Infantil type hemisfærisk gliom
Sistnevtne finnes bare i unge barn og beskrives derfor ikke videre i dette handlingsprogrammet.
CNS WHO 2021-klassifikasjonen bruker nomenklatur utviklet av «human genome variation society» (HGVS) som er brukt som verdens standard i beskrivelse av genetiske endringer. Siden histonendringer tidligere ble beskrevet på en måte som er forskjellig fra HGVS-nomenklatur, er det nå noen forandringer i henhold til entitetsnavn og den proteinforandring som følger HGVS-nomenklatur. Den gamle histonnomenklaturen er beskrevet i parentes nedenfor.
Diffust midtlinjegliom, H3 K27M-endret, CNS WHO grad 4
Diffust midtlinjegliom, H3 K27M-mutert kom som ny entitet i CNS-WHO 2016. Det dreier seg om et diffust infiltrerende gliom lokalisert i midtlinjen av CNS (for eksempel ponsgliom). I siste klassifikasjon beskrives tumor som et infiltrerende midtlinjegliom med endringer i H3 p.K28 (K27) som gir tap av H3 p.K28me3 (K27me3), og vanligvis enten en H3 c.83A>T p.K28M (K27M)-substitusjon i en av H3 isoformene, aberrant overekspresjon av EZHIP, eller en EGFR-mutasjon. Den hyppigste H3 p.K28M-mutasjonen kan påvises ved immunhistokjemisk farging. Disse svulstene antas å ha dårlig prognose og defineres som CNS WHO grad 4. Selv om svulsten er hyppigere hos barn/unge og derfor defineres som pediatrisk type diffust høygradig gliom, finnes diffust midtlinjegliom H3 K27M-endret i alle aldersgrupper.
Diffust hemisfærisk gliom, H3 G34-mutert, CNS WHO grad 4
Diffust infiltrerende høygradig gliom i cerebrale hemisfærer som forekommer oftest hos unge og yngre voksne. Tumor har en missense-mutasjon i H3-3A-genet, som resulterer i en H3 p.G35R (G34R)- eller H3 p.G35V (G34V)-mutasjon. Mer enn 90% av rapporterte kasus har ATRX-alterasjon, som ofte medfører immunhistokjemisk negativitet for ATRX, og en TP53-mutasjon som fører til nukleær akkumulasjon av p53. I motsetning til voksen type diffust gliom er denne entiteten overveiende negativ for OLIG2. Immunhistokjemisk kombinasjon av negativitet for IDH1 p.R132H, ATRX og OLIG2 i en glial svulst gir derfor mistanke om hemisfærisk gliom, H3 G34-mutert. Endelig diagnose krever uansett påvist H3 p.G35R/V-mutasjon.
Diffust pediatrisk type høygradig gliom, H3- og IDH–villtype, CNS WHO grad 4
Disse svulstene er morfologisk diffust høygradig gliom hos barn, ungdom og unge voksne uten H3- eller IDH-mutasjoner. Molekylærgenetisk markør for denne entiteten omfatter enten spesifikk DNA-metyleringsprofil (pHHG RTK1, pHGG RTK2, pHHG MYC) eller typiske molekylære forandringer (PDGFRA-alterasjon, EGFR-alterasjon, MYCN-amplifikasjon) som alle kan brukes for å stille diagnosen.
Metode og prosess
Bakgrunn
Sist faglig oppdatert: 17.04.2024
Nasjonalt handlingsprogram med retningslinje for diagnostikk, behandling og oppfølging av diffuse gliomer er utarbeidet av en oppdateringsgruppe med representanter for alle de regionale helseforetakene, og i samarbeid med Helsedirektoratet.
Mange onkologiske faggrupper la i en årrekke ned et betydelig arbeid for å komme frem til konsensusbaserte faglige anbefalinger for diagnostikk og behandling av ulike typer kreft. Som ledd i Nasjonal strategi for kreftområdet (2006–2009) fikk Helsedirektoratet i oppdrag å videreutvikle og oppdatere faggruppenes anbefalinger til nasjonale handlingsprogrammer for kreftbehandling, i nært samarbeid med fagmiljøene, de regionale helseforetakene, Nasjonalt kunnskapssenter for helsetjenesten, og andre relevante myndigheter. De nasjonale handlingsprogrammene representerte en videreføring av faggruppenes anbefalinger.
Helsedirektoratet takker arbeidsgruppen for stor innsats i utarbeidelsen av handlingsprogrammet.
Formål med handlingsprogrammet
Sist faglig oppdatert: 17.04.2024
Nasjonale handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av kreft (Nasjonale handlingsprogram) skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
Rettslig betydning
Sist faglig oppdatert: 17.04.2024
Helsedirektoratet skal utvikle, formidle og vedlikeholde normerende produkter, det vil si nasjonale faglige retningslinjer, nasjonale veiledere, nasjonal faglige råd og pakkeforløp, som understøtter målene for helse- og omsorgstjenesten.
Nasjonale anbefalinger og råd skal baseres på kunnskap om god praksis, og skal bidra til kontinuerlig forbedring av virksomhet og tjenester, jf. spesialisthelsetjenesteloven § 7-3, helse- og omsorgstjenesteloven § 12-5 og folkehelseloven § 24.
Anbefalinger/råd utgitt av Helsedirektoratet er ikke rettslig bindende, men er faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet.
I situasjoner der helsepersonell velger løsninger som i vesentlig grad avviker fra gitte anbefalinger, skal dette dokumenteres, jf. journalforskriften § 6, bokstav g. Helsepersonell bør være forberedt på å begrunne sine valg i eventuelle klagesaker eller ved tilsyn.
Målgrupper
Sist faglig oppdatert: 17.04.2024
Målgrupper for de nasjonale handlingsprogrammene er spesialister innen medisin, kirurgi, onkologi, radiologi og patologi. De vil også være av interesse for allmennleger, pasienter, pårørende og andre aktører på kreftfeltet.
Handlingsprogram og Nye metoder
Sist faglig oppdatert: 17.04.2024
De regionale helseforetakene har ansvar for Nye metoder, et felles system for å beslutte hvilke metoder som kan tilbys i spesialisthelsetjenesten. Nye metoder er et prioriteringsverktøy. Beslutningene i Nye metoder gjelder nasjonalt, les mer her: Bakgrunn: Hvorfor har vi Nye metoder?
Handlingsprogram og andre normerende produkter kan ikke anbefale legemidler eller andre metoder som ikke har finansering i den offentlige helsetjenesten. Handlingsprogrammene oppdateres i overenstemmelse med beslutninger i Nye metoder.
Kunnskapsbasert metode
Sist faglig oppdatert: 17.04.2024
Kunnskapsbasert praksis innebærer at både forskningsbasert kunnskap, erfaringsbasert klinisk kunnskap og pasientenes/ brukernes ønsker og behov vurderes samlet. I utarbeidelsen og revidering av nasjonale handlingsprogram har det ikke vært med brukerrepresentanter i gruppene.
Innholdet i en retningslinje skal baseres på et oppdatert, gjennomarbeidet og dokumentert kunnskapsgrunnlag. Det innebærer at forskningslitteratur, klinisk erfaring og brukererfaring vurderes opp mot ønskede og uønskede konsekvenser av et tiltak. På områder der det er funnet mindre forskningsbasert kunnskap, og/eller overføringsverdien fra internasjonal til norsk helsetjeneste er lav, blir klinisk kunnskap og brukerkunnskap tillagt større vekt.
Dette nasjonale handlingsprogrammet inneholder svært mange anbefalinger. Det er ikke praktisk mulig, innenfor gitte ressursrammer, å samle all relevant forskningsbasert kunnskap for hver anbefaling. Den forskningsbaserte kunnskapen er hovedsakelig basert på forskning identifisert i anerkjente internasjonale retningslinjer og nyere studier. Det er heller ikke praktisk mulig å gjennomgående bruke GRADE eller SIGN-metodikken for gradering av kunnskapsgrunnlaget.
Handlingsprogram og andre normerende produkter skal også forholde seg til prioriteringskriteriene og ressursbruk. Med ressurser menes direkte kostnader, men også personell og tidsbruk.
Grad av normering
Sist faglig oppdatert: 17.04.2024
Grad av normering angis i teksten i hver enkelt anbefaling/råd:
- Når Helsedirektoratet skriver «skal», betyr det at anbefalingen/rådet er basert på lov eller forskrift, eller når det er så klart faglig forankret at det sjelden er forsvarlig å ikke gjøre som anbefalt
- Når det står bør» eller «anbefaler», er det en sterk anbefaling/råd som vil gjelde i de aller fleste tilfeller
- Når det står «kan» eller «foreslår» er det en svak anbefaling/råd der ulike valg kan være riktig for ulike pasienter
Tilhørende normerende publikasjoner
Sist faglig oppdatert: 17.04.2024
Arbeidsform og deltakere
Sist faglig oppdatert: 17.04.2024
Handlingsprogrammet revideres av en oppdateringsgruppe oppnevnt av Helsedirektoratet. Representantene i gruppen er utnevnt av de regionale helseforetakene. Helsedirektoratets bearbeidelse og gjennomgang av utkast til handlingsprogram, blir publisert på Helsedirektoratets nettside om kreft.
Referansegruppe – andre utgave av handlingsprogrammet
- Petter Brandal, Avdeling for kreftbehandling, Oslo universitetssykehus HF (leder)
- Kirsten Marienhagen, Kreftavdelingen, Universitetssykehuset Nord-Norge HF
- Line Bjorland, Avdeling for blod- og kreftsykdommer, Helse Stavanger HF, Stavanger universitetssjukehus
- Jorunn Brekke, Avdeling for kreftbehandling og medisinsk fysikk, Helse Bergen HF, Haukeland universitetssjukehus
- Tora Skeidsvoll Solheim, Kreftklinikken, St. Olavs Hospital HF
- Roar Kloster, Nevrokirurgi-, øre-nese-hals-, og øyeavdelingen, Universitetssykehuset Nord-Norge HF
- Ole Solheim, Nevrokirurgisk avdeling, St. Olavs Hospital HF
- Rupavathana Mahesparan, Nevrokirurgisk avdeling, Helse-Bergen HF, Haukeland universitetssjukehus
- Pål A. Rønning, Nevrokirurgisk avdeling, Oslo universitetssykehus HF
- Einar O. Vik-Mo, Nevrokirurgisk avdeling, Oslo universitetssykehus HF
- Anette Storstein, Nevrologisk avdeling, Helse-Bergen HF, Haukeland universitetssjukehus
- Kjell Arne Kvistad, Klinikk for bildediagnostikk, St. Olavs hospital HF
- Snezana Maric, Radiologisk avdeling, Helse-Bergen HF, Haukeland universitetssjukehus
- Anders Palmstrøm Jørgensen, Avdeling for endokrinologi, sykelig overvekt og forebyggende medisin, Oslo universitetssykehus HF
- Kristin Myrmel, Klinisk patologi, Universitetssykehuset Nord-Norge HF
- Pitt Niehusmann, Avdeling for patologi, Oslo universitetssykehus HF
- Anne J. Skjulsvik, Avdeling for patologi, St. Olavs hospital HF
- Urd Teresia Wangensteen, Avdeling for medisinsk genetikk, Oslo universitetssykehus HF
- James Connelly, Avdeling for nukleærmedisin, Oslo universitetssykehus HF
- Hanna Helgetun Krogh, fastlege, Kalvskinnet legesenter
Oppdateringsgruppe – andre utgave av handlingsprogrammet for diffuse gliomer
- Ole Solheim, Nevrokirurgisk avdeling, St. Olavs Hospital HF (leder)
- Einar O. Vik-Mo, Nevrokirurgisk avdeling, Oslo universitetssykehus HF
- Pitt Niehusmann, Avdeling for patologi, Oslo universitetssykehus HF
- Snezana Maric, Radiologisk avdeling, Helse-Bergen HF, Haukeland universitetssjukehus
- James Connelly, Avdeling for nukleærmedisin, Oslo universitetssykehus HF
- Urd Teresia Wangensteen, Avdeling for medisinsk genetikk, Oslo universitetssykehus HF
- Tora Skeidsvoll Solheim, Kreftklinikken, St. Olavs Hospital HF
- Petter Brandal, Avdeling for kreftbehandling, Oslo universitetssykehus HF
Kontaktpersoner i Helsedirektoratet
- Kontaktperson i Helsedirektoratet: Kaja Fjell Jørgensen, avdeling for fagutvikling i spesialisthelsetjenesten, kaja.fjell.jorgensen@helsedir.no.
- Fagansvarlig på kreftområdet er Sissi Espetvedt: sissi.leyell.espetvedt@helsedir.no
Habilitet
Sist faglig oppdatert: 17.04.2024
Representantene i oppdateringsgruppen har fylt ut Helsedirektoratets habilitetsskjema. Ingen interesser med konsekvenser for deltakelse i arbeidet er identifisert. Skjemaene er arkivert i Helsedirektoratet.
Referanser
Sist faglig oppdatert: 17.04.2024
Helsedirektoratet. (2012). Veileder for utvikling av kunnskapsbaserte retningslinjer (IS-1870). ISBN-nr. 978-82-8081-225-4. Hentet fra https://www.helsedirektoratet.no/
Appendix 1 – kjemoterapi
Sist faglig oppdatert: 17.08.2023
- Alle kjemoterapeutiske doser i dette dokumentet beregnes på grunnlag av kroppsoverflate i m2.
- På generell basis bør pasienter som mottar kjemoterapi unngå amming og bruke prevensjon under og i minst 6 måneder etter avsluttet kjemoterapi.
- Kjemoterapi som brukes ved hjernesvulster (PCV, temozolomid, lomustin) kan påvirke fertiliteten hos både kvinner og menn, men sannsynligheten for å bli varig steril av behandlingen er liten. Det er likevel tilrådelig at yngre pasienter (< 40 - 45 år) i god allmenntilstand og med gode prognostiske markører får tilbud om samtale og evt fertiltetsbevarende tiltak, og da helst i forkant av igangsatt behandling.
- Retningslinjene i dette dokumentet er veiledende. Man kan, dersom det av ulike grunner skulle være behov for/ønske om det, velge andre løsninger enn det som er skissert her.
- Dersom man får påvirkning av blodprøveparametere, må kontrollhyppigheten revurderes på individuell basis ut ifra graden av påvirkning.
Temozolomid konkomitant til strålebehandling
Sist faglig oppdatert: 17.08.2023
Indikasjon
Primærbehandling av glioblastom sammen med 2, 3 eller 6 ukers strålebehandling.
Medikament | Dose | Varighet |
|---|---|---|
Temozolomid kapsler | 75 mg/m2/dag | Fra første til siste dag av strålebehandling, inkludert lørdager, søndager og helligdager (maksimalt 49 dager) |
- Peroral behandling en gang daglig.
- Kapslene bør tas ca. 1 time før strålebehandling.
- Kapslene bør tas ved omtrent samme tidspunkt hver dag (også i helgene).
- Kapslene skal tas fastende, det vil si minst en time før og to timer etter matinntak.
- Kapslene skal svelges hele (må ikke åpnes eller tygges) med et glass vann.
- Dersom oppkast etter at dosen er tatt skal man ikke ta ny dose.
Mest vanlige bivirkninger
- Benmargssuppresjon: Oftest trombocytopeni og lymfopeni, men også nøytropeni og sjeldnere anemi.
- Infeksjonsrisiko: Pneumocystis jiroveci (ved lave lymfocytter og/eller langvarig behandling med høydose steroider).
- Leverpåvirkning, oftest ALAT-stigning.
- Gastrointestinale forstyrrelser: Spesielt kvalme, oppkast, anoreksi, smaksforandringer og obstipasjon.
- Andre: Utslett, kløe, tretthet/fatigue.
Antiemetisk behandling
Temozolomid er relativt lav-emetogen. Ondansetron eller metoklopramid kan gis før administrering av temozolomid, men mange pasienter klarer seg uten. Vær oppmerksom på obstipasjonsfare ved bruk av ondansetron.
Pneumocystis jiroveci-profylakse
Pasienter som får temozolomid samtidig med strålebehandling har noe økt risiko for å utvikle Pneumocystis jiroveci-pneumoni. Profylakse med trimetoprim-sulfa (for eksempel 2 tabletter x 2 to dager i uken, eller 1 tablett daglig) fra uke 3 av strålebehandling og frem inntil 4 uker etter avsluttet strålebehandling, kan overveies hos pasienter som står på høydose kotikosteroider over lengre tid og/eller har målt lave lymfocytter (< 0.5). Trimetoprim-sulfa har bivirkninger inkludert nøytropeni som må tas med i vurderingen dersom profylakse anses indisert.
Blodprøvekontroll
- Ved oppstart: Hemoglobin, trombocytter, leukocytter, nøytrofile granulocytter, lymfocytter, kreatinin, natrium, kalium, klorid, kalsium, magnesium, urea, albumin, ALAT, ASAT, LD, ALP, GT, bilirubin, blodglukose og CRP.
- Ukentlig gjennom hele (og i forbindelse med ferdigstilling av) strålebehandlingen: Hemoglobin, trombocytter, leukocytter, nøytrofile granulocytter, lymfocytter og ALAT.
- Lave og synkende hematologiske parametere bør følges til man ser en stigende tendens; høye og økende leverparametere til man ser en synkende tendens
Dosejustering
Nøytrofile granulocytter | Trombocytter | Dosejustering |
|---|---|---|
< 1.0 | 50–100 | Opphold i temozolomidbehandling |
< 0.5 | < 50 | Seponer temozolomid |
Temozolomid monoterapi
Sist faglig oppdatert: 17.08.2023
Indikasjon
- Adjuvant som ledd i primærbehandling av glioblastom IDH-villtype eller astrocytom, IDH-mutert grad CNS grad WHO 3-4 (med oppstart 4–6 uker etter siste strålefraksjon).
- Residivbehandling av diffuse gliomer.
Kuroppsett
- Kurintervall 4 uker.
- Evaluering med MR etter 3–4 og 6–8 kurer.
Behandlingstid
- Ved adjuvant behandling: 6–12 kurer avhengig av diagnose og alder.
- Ved residivbehandling: Ofte 6–8 kurer, blant annet avhengig av behandlingseffekt.
Medikament | Dose |
|---|---|
Temozolomid | (150*-)200 mg/m2/dag i 5 dager. Maksimal døgndose: 500 mg * Vanlig startdose for pasienter som tidligere har fått cytostatikabehandling. |
- Peroral behandling en gang daglig.
- Kapslene bør tas ved omtrent samme tidspunkt hver dag.
- Kapslene skal tas fastende, det vil si minst en time før og to timer etter matinntak.
- Kapslene skal svelges hele (må ikke åpnes eller tygges) med et glass vann.
- Dersom oppkast etter at dosen er tatt skal man ikke ta ny dose.
Oppstart ny kur dag 29
Mest vanlige bivirkninger
- Benmargssuppresjon: Oftest trombocytopeni og lymfopeni, men også nøytropeni og sjeldnere anemi.
- Infeksjonsrisiko: Pneumocystis jiroveci (ved lave lymfocytter og/eller langvarig behandling med høydose kortikosteroider).
- Leverpåvirkning, oftest ALAT-stigning.
- Gastrointestinale forstyrrelser: Spesielt kvalme, oppkast, anoreksi, smaksforandringer og obstipasjon.
- Andre: Utslett, kløe, tretthet/fatigue.
Antiemetisk behandling
Temozolomid er relativt lav-emetogen. Ondansetron eller metoklopramid kan gis før administrering av temozolomid, men mange pasienter klarer seg uten. Vær oppmerksom på obstipasjonsfare ved bruk av ondansetron.
Pneumocystis jiroveci-profylakse
Profylakse med trimetoprim-sulfa (2 tabletter x 2 hver lørdag og søndag, eller 1 tablett daglig) kan overveies hos pasienter som står på høydose kortikosteroider over lengre tid og/eller har målt lave lymfocytter (< 0.5). Trimetoprim-sulfa har bivirkninger inkludert kvalme og nøytropeni som må tas med i vurderingen dersom profylakse anses indisert.
Blodprøvekontroll
- Ved oppstart hver kur: Hemoglobin, trombocytter, leukocytter, nøytrofile granulocytter, lymfocytter, kreatinin, natrium, kalium, klorid, kalsium, magnesium, urea, albumin, ALAT, ASAT, LD, ALP, GT, bilirubin, blodglukose og CRP.
- Lave og synkende hematologiske parametere bør følges til man ser en stigende tendens; høye og økende leverparametere til man ser en synkende tendens.
Dosejustering
Nøytrofile granulocytter | Trombocytter | Dosejustering/kurutsettelse |
|---|---|---|
≥ 1.0-1.5 | ≥ 100 | Ingen endring i dose |
< 1.0 | < 100 | Utsett kur en uke |
Dersom vedvarende cytopenier må man vurdere ytterligere utsettelser, doseredusering og seponering av videre kurer. Det vises til felleskatalogteksten for temozolomid for detaljer. Man bør vurdere kostnad vs nytte for den enkelte pasient, for eksempel vil pasienter med IDH-mutasjon og/eller metylert MGMT-promotor ha større nytte av temozolomid enn pasienter uten.
PCV-kur
Sist faglig oppdatert: 17.08.2023
Indikasjon
- Adjuvant som ledd i primærbehandling av oligodendrogliom CNS WHO grad 2-3 og diffust astrocytom, IDH-mutert CNS WHO grad 2.
- Ved residiv av diffuse gliomer grad 2-3 og i sjeldne, utvalgte tilfeller av astrocytom, IDH-mutert CNS WHO grad 4 eller glioblastom, IDH-villtype.
Kuroppsett
- Kurintervall: 6-8 uker
- Kontroll/evaluering med MR etter hver andre kur.
Behandlingstid
- Som adjuvant behandling: (4-)6 kurer
- Ved residivbehandling: Ofte 4 kurer, blant annet avhengig av behandlingsrespons.
Medikament | Dose | Kurdag |
|---|---|---|
Vinkristin (Oncovin) | 1.4 mg/m2 (maksimalt 2 mg ved hver infusjon) Gis intravenøst over 10 minutter i 100 ml 0.9 % NaCl | 8 og 29 |
CCNU (Lomustin) | 110 mg/m2 (maksimalt 200 mg) som engangsdose
| 1 |
Prokarbazin (Natulan) | 60 mg/m2 fordelt på 2 daglige doser (morgen og kveld). Det totale antall kapsler kan beregnes slik: (60 x overflateareal i m2 x 14) ÷50, og avrundes til nærmeste hele tall.
| 8–21 |
Oppstart ny kur dag 43 (eller 57 hvis mye toksisitet).
Mest vanlige bivirkninger
- Lomustin:
- Sterkt benmargstoksisk. Opptrer forsinket, vanligvis mest uttalt etter 4–6 uker, og kumulativt med større utslag, raskere inntreden og lengre varighet etter gjentatte doser. Affiserer alle tre rekker (hemoglobin, hvite blodceller, trombocytter). Vær oppmerksom særlig etter tidligere cytostatika- og/eller strålebehandling.
- Lungefibrose og nyreskade ved langvarig bruk. Forsiktighet bør utvises ved kumulative doser over 1000–1200 mg/m2.
- Vinkristin:
- Sterkt vevstoksisk! Det finnes ikke antidot. Svak oppvarming og tilsyn av kirurg ved ekstravasering.
- Nevropati som kan variere fra lette parestesier til arefleksi, dropfot og nedsatt kraft. Oftest reversibelt, men man bør ha lav terskel for seponering ved tiltagende symptomatologi. Pasientene bør vise at de kan stå på hæl og tå før hver infusjon.
- Prokarbazin:
- Allergiske reaksjoner.
- Utlett og kløe.
- Reaksjon med varierende grad av hodepine, rødme, angst, svimmelhet, høyt blodtrykk, høy puls, kvalme og oppkast (Antabuslignende effekter) kan opptre. Dette skjer oftest i kombinasjon med inntak av tyraminholdig drikke eller matvarer, og derfor bør inntaket av disse begrenses. Tyramin finnes i alkoholholdige produkter (spesielt rødvin), banan, sure melkeprodukter (yoghurt, rømme, kefir, Cultura, Biola og lignende), modnet ost, ansjos, kaviar, lever, rosiner, avocado, sjokolade, soyasaus, gjær og kjøtt som er kunstig mørnet. Det anbefales også å unngå inntak av store mengder koffeinholdige drikker som kaffe, te og cola.
- Hårtap: Håravfall er sjelden uttalt, men håret kan bli tynnere.
- Gastrointestinale forstyrrelser: Spesielt kvalme og oppkast (lomustin), anoreksi, smaksforandringer og obstipasjon (vinkristin).
- Andre: Tretthet/fatigue, muskelatrofi.
Antiemetisk behandling
Ondansetron eller metoklopramid anbefales før lomustin og ellers ved behov.
Blodprøvekontroll
- Ved oppstart kur: Hemoglobin, trombocytter, leukocytter, nøytrofile granulocytter, lymfocytter, kreatinin, natrium, kalium, klorid, kalsium, magnesium, urea, albumin, ALAT, ASAT, LD, ALP, GT, bilirubin, blodglukose og CRP.
- Dag 29 av kur: Hemoglobin, trombocytter, leukocytter og nøytrofile granulocytter
Dosejustering
Nøytrofile granulocytter | Trombocytter | Kreatinin | Dosejustering/kurutsettelse |
|---|---|---|---|
< 1.0-1.5 | < 100 | > 110 | Utsett kur 1 uke Dosejustering etter individuell vurdering og i samråd med pasienten. Forslagsvis:
|
Ved overgang til temozolomid: 2 kurer PCV tilsvarer 3 kurer temozolomid.
CCNU (Lomustin) monoterapi
Sist faglig oppdatert: 17.08.2023
Indikasjon
Recidivbehandling av diffuse gliomer CNS WHO grad 2-4.
Kuroppsett
- Kurintervall 6–8 uker.
- Evaluering med MR etter 2 kurer.
Behandlingstid
- Ofte 4 kurer, blant annet avhengig av behandlingsrespons.
Medikament | Dose |
|---|---|
CCNU (lomustin) | 110 mg/m2 (maksimalt 200 mg) som engangsdose
|
Oppstart ny kur dag 43
Bivirkninger
- Sterkt benmargstoksisk. Opptrer forsinket, vanligvis mest uttalt etter 4–6 uker, og kumulativt med større utslag, raskere inntreden og lengre varighet etter gjentatte doser. Affiserer alle tre rekker (hemoglobin, hvite blodceller, trombocytter). Vær oppmerksom særlig etter tidligere cytostatika- og/eller strålebehandling.
- Lungefibrose og nyreskade ved langvarig bruk. Forsiktighet bør utvises ved kumulative doser over 1000–1200 mg/m2.
- Hårtap: Håravfall er sjelden uttalt, men håret kan bli tynnere.
- Gastrointestinale forstyrrelser: Spesielt kvalme, oppkast, anoreksi, smaksforandringer og obstipasjon.
- Andre: Tretthet/fatigue, muskelatrofi.
Antiemetisk behandling:
Ondansetron 8 mg x 2 (eller metoklopramid) anbefales samme dag som CCNU.
Blodprøvekontroll
- Ved oppstart kur: Hemoglobin, trombocytter, leukocytter, nøytrofile granulocytter, lymfocytter, kreatinin, natrium, kalium, klorid, kalsium, magnesium, urea, albumin, ALAT, ASAT, LD, ALP, GT, bilirubin, blodglukose og CRP.
- Dag 29 av kur: Hemoglobin, trombocytter, leukocytter og nøytrofile granulocytter
Dosejustering
Nøytrofile granulocytter | Trombocytter | Kreatinin | Dosejustering/kurutsettelse |
|---|---|---|---|
< 1.0-1.5 | < 100 | > 110 | Utsett kur 1 uke Dersom vedvarende cytopenier må man vurdere ytterligere utsettelser, doseredusering og seponering av videre kurer |
Alternativ PCV-kur
Sist faglig oppdatert: 17.08.2023
For indikasjon, bivirkninger og forholdsregler: Se anbefalt PCV-kur.
Medikament | Dose | Kurdag |
|---|---|---|
Vinkristin (Oncovin) | 1.4 mg/m2 (maksimalt 2 mg ved hver infusjon) Gis intravenøst over 10 minutter i 100 ml 0.9 % NaCl | 1 |
CCNU (lomustin) | 100 mg/m2 (maksimalt 200 mg) som engangsdose
| 1 |
Prokarbazin (Natulan) | 100 mg/m2 fordelt på 2 daglige doser (morgen og kveld)
| 2–7 |
Dexametason | 4 mg x 4 4 mg x 3 2 mg x 4 2 mg x 2 1 mg x 2
| 1–2 3–4 5–6 7–8 9–10
|
Oppstart ny kur dag 43
Appendix 2 – strålebehandling
Generelt
Sist faglig oppdatert: 17.08.2023
Ved strålebehandling av diffuse gliomer er konvensjonell ekstern lineærakseleratorbasert strålebehandling den mest brukte formen for strålebehandling. Behandlingen gis som fraksjonert behandling. Protonbestråling brukes ikke rutinemessig i denne pasientgruppen.
Anbefalt tidspunkt for oppstart av strålebehandling er avhengig av diagnose/veksthastighet og målsetning med behandlingen. Etter primæroperasjon for høygradige diffuse gliomer (CNS WHO grad 3 og 4) anbefales oppstart innen 4 uker (maksimalt opptil 6 uker), forutsatt at operasjonsarret har grodd fint. Dersom det kun er utført stereotaktisk biopsi, kan strålebehandling startes tidligere, men ikke før 1–2 uker etter biopsi.
For CNS WHO grad 2 diffuse gliomer med behandlingsindikasjon vil man oftest starte strålebehandling med samme tidsperspektiv som for høygradige diffuse gliomer, men siden veksthastigheten for lavgradige diffuse gliomer oftest er lavere kan man tillate seg mer tid før man starter.
Forberedelse av strålebehandling
Sist faglig oppdatert: 17.08.2023
Det tas CT for doseplanlegging med pasient i ryggleie, immobilisert i 3-pkt-maske. CT tas fra vertex til nedre begrensning av C3 og bør helst være volumserie med snittykkelse 1 mm, men for glioblastomer kan man ha snittykkelse inntil 3 mm. Intravenøs kontrast ved CT er ikke påkrevet men kan gi tilleggsopplysninger, spesielt dersom man ikke har tilstrekkelig ny MR for ko-registrering.
Relevante MR-serier bør ko-registreres med CT for doseplanlegging. For høygradige diffuse gliomer vil det oftest være preoperative og postoperative MR-serier, eventuelt en dedikert MR for stråleplanlegging. Behov for ny MR for målvolumsinntegning vurderes i hvert tilfelle. Ny MR er spesielt aktuelt ved høygradige svulster hvis tilgjengelig MR er eldre enn 2 uker og/eller der klinikk/biologi gir mistanke om progresjon eller det er mulighet for anatomisk skift i etterkant av operasjonen. Alternativet er CT med intravenøs kontrast. Tilsvarende vil gjelde for lavgradige diffuse gliomer (grad 2), men der er det ikke alltid pasienten nylig har vært operert. De mest aktuelle serier er T1-vektet serie uten kontrast, T1-vektet serie med kontrast, ordinær T2-vektet serie og FLAIR-serie, og disse bør helst være volumserier. Funksjonelle MR-serier (perfusjon, diffusjon og/eller spektroskopi) og PET med ulike tracere har per i dag ikke vist sikker tilleggsgevinst for målvolumdefinisjon.
Totaldose og fraksjonering
Sist faglig oppdatert: 17.08.2023
For indikasjonsstilling med tanke på stråleterapi samt valg av teknikk og fraksjonering henvises til handlingsprogramteksten for diffuse gliomer. Kort oppsummert gjelder følgende:
| Fraksjonering | Kommentar |
|---|---|---|
Glioblastom/astrocytom CNS WHO grad 4 | 60 Gy/30# | Konkomitant og adjuvant temozolomid x 6 |
Astrocytom CNS WHO grad 3 | 59.4 Gy/33# | Adjuvant temozolomid x 6–12 |
Oligodendrogliom CNS WHO grad 3 | 59.4 Gy/33# | Adjuvant PCV x 6 |
Diffust gliom (CNS WHO grad 2) hvor det foreligger behandlingsindikasjon* | 50.4 –54 Gy/28–30# | Adjuvant PCV x 6 |
| Fraksjonering | Kommentar |
|---|---|---|
Fraksjonering gjelder for alle diffuse gliomer
Konkomitant temozolomid bare aktuelt ved glioblastom og astrocytom CNS WHO grad 4
Adjuvant PCV aktuelt ved oligodendrogliom CNS WHO grad 2 og 3 og astrocytom CNS WHO grad 2, ellers gis temozolomid | 40 Gy/15# | Metylert MGMT: Alternativt temozolomid monoterapi |
30–39 Gy/10–13# | ||
34 Gy/10# | ||
25 Gy/5# |
* Se «Handlingsprogram for diffuse gliomer»
# Antall fraksjoner/behandlinger
Inntegning av risikoorganer (OAR)
Sist faglig oppdatert: 17.08.2023
Risikoorganene skal benevnes i henhold til strålevernrapport «Nomenklatur for volumer brukt i stråleterapi» (Levernes, 2019).
Hvilke risikoorganer som skal tegnes må vurderes individuelt avhengig av diagnose, målvolumets lokalisasjon, behandlingsintensjon, fraksjonering og totaldose. For serielle risikoorganer som synsnerver, synsnervekrysning, hjernestamme og ryggmarg bør det i tillegg genereres PRV (Planning Risk Volume). PRV-margin er institusjonsavhengig og varierer også med behandlingsteknikk og type posisjonskontroll under strålebehandlingen.
Det henvises for øvrig til strålevernrapporten «Anbefalinger for inntegning av risikoorgan i CNS» (Marienhagen et al., 2020).
Inntegning av målvolum
Sist faglig oppdatert: 17.08.2023
Volumdefinisjoner i dette dokumentet bygger på retningslinjer gitt i StrålevernRapport 2012:09 (Levernes, 2012), som følger ICRUs (International Commision on Radiation Units and Measurements) prinsipper og terminologi (Landberg et al., 1999; Landberg et al., 1993; Report 78: Prescribing, Recording, and Reporting Proton-Beam Therapy, 2007; Report 83: Prescribing, Recording, and Reporting Intensity-Modulated Photon-Beam Therapy (IMRT), 2010).
Det presiseres at retningslinjene er veiledende. Målvolumer og marginer må vurderes individuelt med henblikk på alder, tumorutbredelse inkludert vurdering av kontrastladende og ikke-kontrastladende tumorkomponenter, grad av reseksjon, histologi og nærhet til risikoorganer.
Mens man i Europa bruker et behandlingsopplegg med en fase, har man i Nord-Amerika tradisjonelt brukt to faser med innskrenkning av målvolum etter 46–50 Gy. I det videre presenteres det europeiske (EORTCs) behandlingsopplegg som er det som brukes i Norge.
Gross Tumour Volume (GTV)
Inntegning av GTV gjøres på bakgrunn av CT for doseplanlegging, med støtte i relevante MR-sekvenser (det viktig å sjekke at ko-registreringen er bra).
GTV består av reseksjonskavitet inkludert eventuell gjenstående tumor. Både kontrastladende (fremstilt på T1-vektede MR-bilder med kontrast) og ikke-kontrastladende tumorsuspekte komponenter (fremstilt på T2-vektede bilder inkludert FLAIR) skal inkluderes i GTV, mens peritumoralt ødem ikke skal inkluderes. Det er ofte vanskelig å skille ikke-kontrastladende tumorkomponenter fra peritumoralt ødem, og i tvilstilfeller bør man konsultere nevroradiolog). Hvor mye av FLAIR-forandringene som inkluderes i GTV vil ha betydning for størrelse på CTV-margin.
Clinical Target Volume (CTV)
CTV omfatter GTV og område med høyest sannsynlighet for mikroskopisk tumorinfiltrasjon.
Man genererer CTV som isotropisk margin til GTV, som så beskjæres mot naturlige barrierer som skjelett, falx, tentorium, nervus opticus og chiasma opticum (0 mm), hjernestamme (individuell beskjæring på 0-5 mm), og eventuelt ventrikler (0-5 mm). Beskjæring forutsetter at tumor ikke følger nervebaner som går inn i disse strukturene, og at en ikke mistenker infiltrasjon i noen av barrierene. Ved gliosarkom skal man være spesielt oppmerksom på muligheten for innvekst i skjelett og hjernehinner.
Marginstørrelse må vurderes individuelt avhengig av histologi/malignitetsgrad, grad av patologisk kontrastopptak på MR, utbredelse av patologiske høysignalforandringer på T2/FLAIR og hva som er inkludert i GTV (se over). Ved diffuse gliomer kommer de aller fleste residiver (80–90 %) i eller nær tumor/reseksjonskavitet. Det vil si at hele ødemsonen ikke nødvendigvis må inkluderes i CTV, og en bør derfor av toksisitetshensyn unngå urimelig stor CTV-margin.
- Ved glioblastom, IDH-villtype og astrocytom, IDH-mutert CNS WHO grad 4 anbefales 15 mm margin fra GTV til CTV.
- For diffust astrocytom, IDH-mutert CNS WHO grad 3 vil man oftest bruke samme margin, men kan vurdere å redusere marginen avhengig av hvor mye av FLAIR-forandringene som er inkludert i GTV.
- Ved oligodendrogliom CNS WHO grad 3 vil man ofte kunne redusere CTV-margin tilsvarende det som benyttes ved diffust CNS WHO grad 2 gliom.
- Ved diffust CNS WHO grad 2 gliom bør marginen fra GTV til CTV i utgangspunktet være (10–)15 mm. Også her er det viktig med individuelle vurderinger av marginstørrelse, på bakgrunn av blant annet GTV-definisjon, ødemsone og målvolumstørrelse.
Histologi etter CNS WHO 5 | CTV-margin |
|---|---|
Glioblastom, IDH-villtype Diffust astrocytom, IDH-mutert CNS WHO grad 4 | 15(-20) mm |
Diffust astrocytom, IDH-mutert CNS WHO grad 3 | 15 mm |
Oligodendrogliom CNS WHO grad 3 | (10-)15 mm |
Diffust CNS WHO grad 2 gliom | 10(-15) mm |
Internal Target Volume (ITV)
Ved intrakraniell bestråling er ITV = CTV (ingen intern bevegelse). Den inntegningsusikkerhet som ellers inngår i ITV er tatt med i marginen fra GTV til CTV.
Planning Target Volume (PTV)
PTV er en geometrisk margin (setup margin), som skal sikre at CTV/ITV får korrekt stråledose. PTV bestemmes lokalt av hvert enkelt strålesenter og er avhengig av fiksering, behandlingsteknikk og type posisjonskontroll under behandlingen, og er oftest 2–3 mm.
Kommentar vedrørende målvolum og fraksjonering
Ved meget stor tumorutredelse, som for eksempel ved gliomatosis cerebri og tilsynelatende multifokalt gliom, må man vurdere alle målvolumer, og spesielt hvor stor margin man bruker fra GTV til CTV, meget nøye.
Av toksisitetshensyn kan det for høygradige diffuse gliomer være aktuelt å redusere dosen til PTV til 54 Gy. Ved CNS WHO grad 2 diffuse gliomer med gunstige biologiske og kliniske parametere, kan det forsvares å redusere dosen til PTV til ned til 45 Gy ved meget store målvolumer.
Doseplanlegging
Sist faglig oppdatert: 17.08.2023
Tidligere ble planlegging av strålebehandling gjort konvensjonelt tredimensjonalt (3D-CRT). Nyere teknikker med invers doseplanlegging som IMRT (intensity modulated radiation therapy) og VMAT (volumetric modulated arc therapy) muliggjør mer konformal tilpasning av stråledose til ønsket målvolum, og gir samtidig større mulighet for å begrense dose til risikoorganer. IMRT/VMAT eller tilsvarende bør velges, særlig ved komplekse målvolumer og/eller målvolumer nær OAR.
Prinsipielt tilstrebes mest mulig homogen og konformal dosefordeling. PTV bør tilstrebes dekket med 95 % av forskrevet stråledose (D98%,PTV >95 %). Maksimumsdose (Dmax eller D0.01cc) bør holdes <107 %. Underdosering av PTV kan aksepteres etter individuell vurdering, særlig ved nærliggende risikoorganer som ikke tåler rekvirert dose.
Toleransegrenser for risikoorganer og prioritering
Sist faglig oppdatert: 17.08.2023
For toleransegrenser henvises til rapporten Toleransedoser til risikoorganer ved strålebehandling av sentralnervesystemet (CNS) fra Direktoratet for strålevern og atomsikkerhet (Brandal et al., 2023). Toleransegrensene er angitt i EQD2, gjelder konvensjonelt fraksjonert strålebehandling og er veiledende.
Risikoorganer bør spares så godt som mulig (ALARA-prinsipp: As Low As Reasonably Achievable). Høyest prioritet har serielle risikoorganer som synsnerver, synsnervekrysning, hjernestamme og ryggmarg, og disse vil som regel prioriteres fremfor målvolum. Øvrige risikoorganer har lavere prioritet og prioriteringen vil være avhengig av diagnose, målvolumets lokalisasjon, behandlingsintensjon, fraksjonering og totaldose. Hos pasienter med lang forventet overlevelse og potensielt stor risiko for seneffekter som vil kunne gå ut over livskvalitet på sikt, må en vurdere å akseptere suboptimal dekning av målvolum av hensyn til dose til risikoorgan. I slike situasjoner må behandlende lege på individuelt grunnlag gjøre prioriteringer og disse må diskuteres med pasienten, hvoretter beslutningen bør journalføres.
Det finnes så langt ingen data som tyder på at konkomitant temozolomid øker risikoen for varig stråleskade hos pasienter med høygradige diffuse gliomer.
Gjennomføring av behandlingen
Sist faglig oppdatert: 17.08.2023
Daglig posisjonskontroll (Image Guided RadioTherapy, IGRT) med røntgen- eller CT-bilder bør gjennomføres og bruk av CT (CBCT) anbefales.
Pauser i behandlingen skal i størst mulig grad unngås. Ved opphold i behandlingen skal som regel opprinnelig behandlingsplan (inkludert totaldose) opprettholdes.
Bivirkninger under og etter strålebehandling
Sist faglig oppdatert: 17.08.2023
All strålebehandling er i større eller mindre grad forbundet med bivirkninger, som varierer fra person til person. Bivirkningene er avhengig av bestrålt volum og stråledose (fraksjons- og totaldose). Det er ikke alltid lett å fastslå hvor stor del av bivirkningene som skyldes grunnsykdom, kirurgi, strålebehandling eller annen behandling (kjemoterapi, antiepileptisk medikasjon og glukokortikoidbehandling). Generelt skilles det mellom akutte bivirkninger og seneffekter etter strålebehandling.
Akutte strålereaksjoner
Strålebehandling er oftest godt tolerert. De mest vanlige akutte strålereaksjonene er tretthet, hodepine, kvalme (behandles med antiemetika ved behov), hudrødme og svie i stråleområdet, forverring av nevrologiske symptomer og håravfall (ikke alltid forbigående, avhengig av tumorlokalisasjon, stråledose og eventuell samtidig bruk av kjemoterapi). Noen av symptomene kan skyldes økt intrakranielt trykk på grunn av strålerelatert ødemdannelse i og rundt målvolumet; dette behandles med kortikosteroider. Avhengig av lokalisasjon for strålebehandling kan man også få sekretorisk otitt og konjunktivitt. De akutte bivirkningene er oftest forbigående.
Seneffekter
Seneffekter inntreffer oftest flere år etter strålebehandling. Type og grad av seneffekter avhenger av lokalisasjon for strålebehandlingen, total stråledose og fraksjonering. Disse vil være mest aktuelle for pasienter med relativt sett god prognose, for eksempel oligodendrogliom CNS WHO grad 2-3 og diffust astrocytom, IDH-mutert CNS WHO grad 2-3.
Pasienter som har fått høy stråledose til hypofysen kan få hormonforstyrrelser med ulik grad av hypofysesvikt, og bør derfor få kontrollert hormonstatus årlig. Skade på blodkar kan føre til økt risiko for cerebrovaskulære hendelser. Videre kan man se kognitive utfall inkludert hukommelsessvikt og konsentrasjonsvansker, fatigue, grå stær, nevrogent hørselstap og varig endring av hårstruktur. Sekundære svulster kan oppstå, oftest mange år etter strålebehandling. Langvarig oppfølging er viktig hos langtidsoverlevere for å fange opp senbivirkninger.









