Nasjonal faglig retningslinje for forebygging av hjerte- og karsykdom
Risikovurdering og grense for legemiddelbehandling ved forebygging av hjerte- og karsykdom
Risikovurdering og grense for legemiddelbehandling ved forebygging av hjerte- og karsykdom
- Bruk NORRISK 2 til å beregne 10-års risiko for kardiovaskulære hendelser og for å vurdere behovet for primærforebygging av hjerte- og karsykdommer med legemidler.
- Legemiddelbehandling bør vurderes ved beregnet risiko ≥ 5 % for aldersgruppen 45-54 år, risiko ≥ 10 % ved alder 55-64 år og ved risiko ≥15 % ved alder 65-74 år, når råd om endring av levevaner ikke har gitt tilstrekkelig effekt etter 3-12 måneder.
- Tiltaksgrenser ved alder < 45 år og ≥75 år må vurderes individuelt.
- Ved totalkolesterol ≥ 7,0 mmol/l (unntatt hos kvinner over 50 år) eller systolisk blodtrykk ≥ 160 mmHg må medikamentelle tiltak vurderes uavhengig av risikoberegning.
- Ved familiære hyperlipidemier må medikamentelle tiltak vurderes uavhengig av risikoberegning.
- Ved diabetes (se egne retningslinjer) eller påvist endeorganskade som asymptomatisk aterosklerose, nyreskade eller venstre ventrikkelhypertrofi, vurderes behandling uavhengig av ovennevnte risikoberegning.
Praktisk – slik kan anbefalingen følges
En rutinemessig screening av befolkningen har ikke dokumentert nytte. Kartlegging av risiko for hjerte- og karsykdom tilbys bare når visse forutsetninger er tilstede. En slik situasjon kan foreligge når:
- Pasienten ber om en slik vurdering.
- Symptomer eller funn indikerer en klart økt risiko.
- Det foreligger kjent høyt nivå av en enkelt risikofaktor (f. eks. høyt blodsukker, kolesterol eller blodtrykk).
- Tidlig hjerte- og karsykdom har forekommet hos nære slektninger.
For at et tiltak med bakgrunn i forhøyet risiko skal bli vellykket, er det en grunnleggende forutsetning at personen det gjelder er interessert i at en kartlegging skal gjøres og er innstilt på å følge de rådene som blir gitt.
Ny vurdering etter råd om endring av levevaner.
Etter en første risikovurdering bør man vanligvis forsøke å redusere risikoen for sykdom gjennom røykeslutt, kostendringer, økt fysisk aktivitet og, ved behov, vektnedgang. Ny risikovurdering bør gjøres etter 3-12 måneder, avhengig av risikonivå. Ved fortsatt risiko over tiltaksgrensene bør legemiddelbehandling vurderes. For nærmere detaljer om utredning av lipidforstyrrelser og hypertensjon vises til egne anbefalinger i denne retningslinjen.
Som basis for en orienterende risikovurdering trenger man opplysninger om alder, kjønn, røykevaner, systolisk blodtrykk og totalkolesterol, samt tilleggsfaktorene lavt HDL-kolesterol, hjerteinfarkt før 60 år hos nære slektninger og legemiddelbehandlet hypertensjon. Bruk av snus eller e-sigarett regnes ikke som røyking i tabellen. Ett år etter røykeslutt regnes man som ikke-røyker. Risikomodellen omfatter også tilleggsfaktorene lavt HDL, hjerteinfarkt før 60 år hos førstegradsslektninger og legemiddelbehandlet hypertensjon. Risikodiagrammet viser risiko for individer som ikke har noen av disse tilleggsfaktorene. Bakgrunnen og metodene for den nye risikoberegningen er publisert internasjonalt (Selmer R m.fl. 2017). Diagrammet viser risikoen for gjennomsnittsalder i hver aldersgruppe mens risikokalkulatoren på Helsedirektoratets hjemmeside beregner risiko for nøyaktig alder.
Tabell 1. NORRISK 2: 10-års risiko for ikke-dødelig eller dødelig hjerteinfarkt eller hjerneslag eller død av koronar hjertesykdom, gitt fravær av familiær belastning, lavt HDL-kolesterol og medikamentell hypertensjonsbehandling. Risikoestimatene i tabellen er basert på gjennomsnittsalder innen hver aldersgruppe
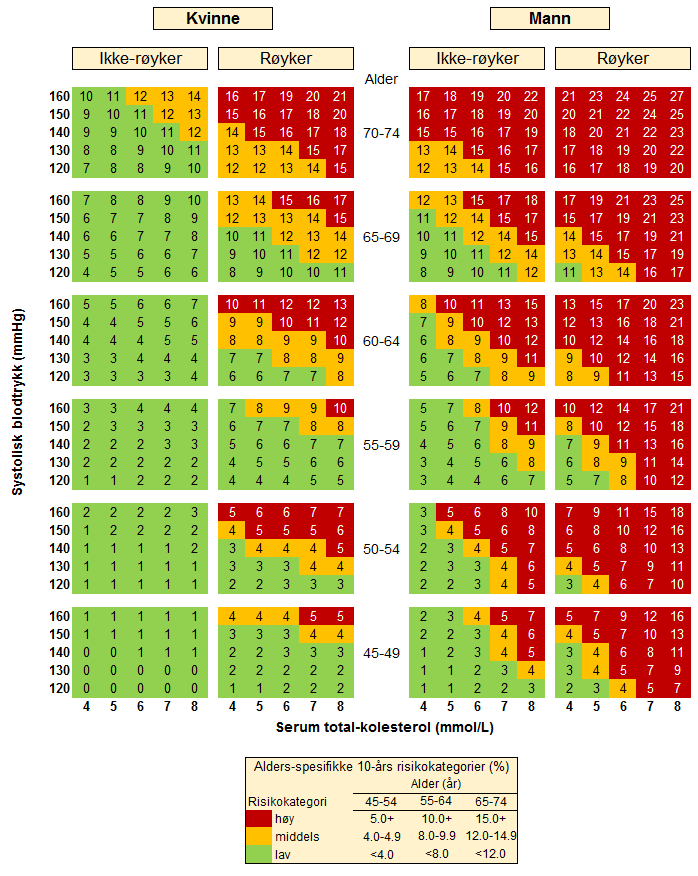
Etter at en orienterende risikoberegning er gjort ved hjelp av NORRISK 2-tabellen, er det nødvendig å kartlegge en del andre risikofaktorer utover de som tabellen inkluderer. Dette kan gjøres ved å multiplisere grunnrisikoen fra tabellen med en faktor som anslår betydningen av de ulike tilleggsfaktorer. Noen viktige tilleggsfaktorer med tilhørende estimater for risikoøkning er listet opp i tabellen nedenfor.
Hjerteinfarkt hos førstegrads slektninger, legemiddelbehandlet hypertensjon og lavt HDL er tilleggsfaktorer som inngår i modellen og i risikokalkulatoren som er tilgengelig på Helsedirektoratets nettsider, slik at man kan få ut den totale risiko direkte. Sørasiatisk etnisitet (Rabanal KS m. fl. 2015) og revmatoid artritt inngår ikke i modellen, men de foreslåtte multiplikasjonsfaktorene antyder risikoøkningen assosiert med disse faktorene. Abdominal fedme og psykososial belastning og stress vurderes skjønnsmessig.
Tabell 2. Noen viktige faktorer som bør kartlegges for komplett risikovurdering.
| Tilleggsfaktorer | Anbefalt multiplikasjonsfaktor |
| Inngår i risikokalkulatoren: | |
| Hjerteinfarkt før 60 år hos en 1. gradslektning | 1,3 |
| Hjerteinfarkt før 60 år hos to eller flere 1. grads slektninger | 1,7 |
| legemiddelbehandlet hypertensjon | 1,3 |
| Lavt HDL kolesterol (<1,0 mmol/l for menn, < 1,3 mmol/l for kvinner) | 1,4 |
| Andre tilleggsfaktorer: | |
| Sørasiatisk etnisitet | 1,5 |
| Revmatoid artritt | 1,4 |
| Abdominal fedme (>88cm for kvinner, >100 cm for menn) | Skjønnsmessig |
| Psykososial belastning og stress | Skjønnsmessig |
| Depresjon, psykotisk lidelse med medikasjon | Skjønnsmessig |
Multiplikasjonsfaktorene er basert på Helsedirektoratets nasjonale retningslinjer fra 2009 (Norheim OF m.fl. 2009) og på Joint British Societies' consensus recommendations (JBS3 Board 2014) samt beregninger i CONOR-databasen.
Det er imidlertid mange andre sykdommer og sykdomsgrupper som også har dokumentert økt risiko for hjerte- og karsykdom, men som ikke inngår i overnevnte tabell (Piepoli MF m.fl. 2016). Dette inkluderer pasienter med andre revmatiske og autoimmune sykdommer som for eksempel spondyloartritt, pasienter med nyresykdom, diabetes, pasienter med immunsvikt og antiviral behandling, pasienter med depresjon og de som får antipsykotisk behandling, pasienter som har hatt svangerskapsforgiftning, pasienter med erektil dysfunksjon og pasienter med sykelig overvekt, for å nevne noen av de vanligste. Det er også kjent økt risiko for personer som har rus- og misbruksproblemer, særlig ved bruk av metadon og anabole androgene steroider.
I denne retningslinjen synes det ikke hensiktsmessig å gi spesifikke anbefalinger vedrørende vurdering og håndtering av alle de spesielle forhold som gjelder slike pasientgrupper, men det er viktig at allmennleger og spesialister innen de ulike felt er oppmerksomme på den økte risikoen. Det vises også til respektive egne retningslinjer for disse tilstandene.
En rekke andre "nyere" risikomarkører har vært studert med tanke på å forutsi hvem som vil bli rammet av kardiovaskulær sykdom, deriblant høysensitivt C-reaktivt protein (Hs-CRP), subfraksjoner av lipider og lipoproteiner (APO B, APO A1, oksydert LDL, LDL partikkelstørrelse), og andre metabolske parametere som homocystein og urinsyre. Videre anbefaler noen målinger av intima media tykkelse (IMT) ved ultralyd av a. carotis, CT-angiografi eller koronar kalsium score ved CT-undersøkelse, uten at det er dokumentert at rutinemessig bruk av slike ekstra undersøkelser gir vesentlig tilleggsinformasjon og dermed grunnlag for klinisk gevinst (Helfand M m.fl. 2009). Rutinemessig bruk av bildediagnostikk som screeningmetode for hjerte- og karrisiko innebærer stor ressursbruk og (ved koronar kalsium score) en viss strålebelastning, og kan derfor ikke forsvares uten at kostnad/nytte effekt er bedre dokumentert. Heller ikke rutinemessig måling av lp(a) anbefales. Dersom det likevel foreligger opplysninger om forhøyet nivå av sistnevnte lipoprotein, viser studier at risikoanslaget må justeres opp med en faktor tilsvarende 1,5.
Nytteverdien av de ulike metoder for ekstra risikovurdering er også vurdert som ganske beskjeden både i de nyeste Prevention Guidelines fra European Society of Cardiology fra 2012/2016 og de siste amerikanske retningslinjer fra American Heart Association/American College for Cardiology fra 2013. Bruk av slike metoder fører sjelden til reklassifisering av personens risikonivå, og har ingen hensikt når risikoen fremstår som klart under eller over tiltaksgrensen ut fra en standard vurdering i NORRISK 2 og de ovennevnte tilleggsfaktorer. Ekstra undersøkelser kan imidlertid være berettiget hvis man etter en standard vurdering er sterkt i tvil om forebygging med legemidler bør anbefales.
Begrunnelse – dette er anbefalingen basert på
Forebygging av hjerte- og karsykdom er en sentral oppgave i et folkehelseperspektiv, men krever samlet sett betydelige ressurser. For at denne ressursbruken skal være hensiktsmessig og for å unngå mangeårig legemiddelbehandling av personer med svært lav sannsynlighet for å rammes av sykdom, er det nødvendig å gjøre en kvalifisert risikovurdering av de aktuelle personene. En slik vurdering vil innebære at de viktigste risikofaktorer som blodtrykk, lipidnivåer og røykevaner kartlegges og vurderes på bakgrunn av underliggende faktorer som alder og kjønn. Flere tilleggsfaktorer utover de ovennevnte er også dokumentert å ha betydning, og det er vanskelig å integrere informasjonen fra alle disse faktorene uten bruk av definerte risikoverktøy, enten i form av risikotabeller eller databaserte risikokalkulatorer. Ut fra en slik risikotabell/kalkulator vil man få et anslag som prosent risiko for hjerte- og karsykdom eller død av slik sykdom de neste 10 år. Det er ønskelig at et slikt risikoverktøy er basert på samme populasjon som den skal anvendes på, og med så oppdaterte data som mulig. Det er også ønskelig at risikoverktøyet kan angi risiko ikke bare for dødelighet av hjerte- og karsykdommer, men også risiko for ikke-dødelige hendelser som hjerteinfarkt og hjerneslag. På denne bakgrunn har faggruppen fått Randi Selmer m.fl. fra Folkehelseinstituttet til å utarbeide et nytt risikoverktøy (NORRISK 2), for beregning av et best mulig risikoestimat for personer bosatt i Norge. For optimal risikobedømming anbefales nå denne NORRISK 2 tabellen/kalkulatoren med aldersspesifikke grenser for intervensjon med legemidler tilpasset denne risikovurderingen.
Vurdering
Fordeler og ulemper
Det er et overordnet mål å sikre at personer med betydelig økt hjerte- og karrisiko får mulighet for effektiv forebygging, samtidig som man unngår medisinering av store deler av befolkningen. Høy kardiovaskulær risiko kan foreligge når én viktig risikofaktor (blodtrykk, kolesterol) er klart over anbefalt nivå, men også når flere risikofaktorer er moderat forhøyet. For å kunne gjøre en kvalifisert risikovurdering når en eller flere risikofaktorer bare er moderat forhøyet, bør risikoen for sykdom vurderes ved hjelp av en oppdatert nasjonal risikotabell eller tilsvarende databasert beregning. Vi anbefaler bruk av slik risikotabell/algoritme, fordi det ellers er vanskelig å integrere betydningen av alder, kjønn, røykevaner, kolesterol og blodtrykk.
Ny risikotabell
I den norske retningslinjen fra 2009 ble det anbefalt å bruke NORRISK-tabellen/kalkulatoren, som var en nasjonalt tilpasset variant av den europeiske SCORE-algoritmen (Norheim OF m.fl. 2009, Perk J m.fl. 2012). Denne anga 10-års risiko for kardiovaskulær død. Ved revisjon av retningslinjen i 2016 er det behov for å oppdatere risikoberegningene (NORRISK 2) bl.a. fordi risikofaktorer, dødelighet og sykdomsforekomst har endret seg betydelig (Folkehelseinstituttet 2015, Mannsverk J m.fl. 2016). Oppdatert informasjon om forekomst og årsaksforhold for hjerte- og karsykdommer er nærmere beskrevet på Folkehelseinstituttets sider og i Folkehelserapporten https://www.fhi.no/he/folkehelserapporten/?term=.
NORRISK 2 (Tabell 1) har muliggjort beregning av risiko for kardiovaskulære hendelser og ikke bare kardiovaskulær død. NORRISK 2-tabeller for menn og kvinner er vist under "Praktisk informasjon", og en databasert risikoberegning er tilgjengelig på Helsedirektoratets nettsider: https://hjerterisiko.helsedirektoratet.no/
Datamaterialet som ligger til grunn for den nye risikofunksjonen er «Cohort of Norway» (CONOR) (Næss Ø m.fl. 2008) koblet mot utskrivningsdiagnoser fra de pasientadministrative systemene ved alle landets sykehus (CVD-NOR) og Dødsårsaksregisteret (Igland J m.fl. 2013). Risikofunksjonen angir risiko for å få et akutt ikke-dødelig eller dødelig hjerneslag eller ikke-dødelig akutt hjerteinfarkt eller død av koronar hjertesykdom i løpet av de neste 10 år. Faktorer som inngår i modellen er kjønn, alder, røykevaner, systolisk blodtrykk, totalkolesterol, lavt HDL-kolesterol, hjerteinfarkt hos førstegradsslektninger før 60 års alder og legemiddelbehandlet hypertensjon.
I motsetning til tidligere modeller, tar denne modellen hensyn til konkurrerende risiko. Det betyr at hvis en kombinasjon av risikofaktorer gir høy risiko for å dø av andre årsaker, vil det redusere sannsynligheten for de akutte hjerte-/karhendelsene.
Ideelt sett burde en risikofunksjon baseres på en oppfølging av ubehandlede pasienter. Dette er ikke mulig i nyere undersøkelser, heller ikke for den nye norske risikomodellen. Mange av CONOR-deltakerne vil ha fått behandling eller sluttet å røyke i løpet av oppfølgingstiden. Det betyr at røykere og personer med særlig høye verdier for blodtrykk og kolesterol kan ha høyere risiko enn det tabellen viser. Risikomodellen er dokumentert i en egen publikasjon (Selmer m.fl.2017).
Nye alderskategorier
Legg merke til at alder er kategorisert i 10-års intervaller fra 45 til 75 år. Dette er begrunnet i at svært få under 45 år har risiko over tiltaksgrensen, samtidig som risikovurdering etter fylte 70 år har vært etterspurt. Hos personer som er < 45 år eller ≥ 75 år er individuell vurdering av tiltaksgrensen nødvendig.
Valg av Intervensjonsgrenser
Både internasjonale og nasjonale retningslinjer omfatter råd om hva som bør betraktes som "høyrisiko», og hvilken grense man skal sette for medisinske tiltak. Risikoen for hjerte- og karsykdommer er et kontinuum, og de fleste tilfeller i befolkningen skjer blant dem med middels risiko. Dermed er det et kompromiss mellom sensitivitet og spesifisitet når grenseverdier for intervensjon skal bestemmes. Sensitivitet er i denne sammenheng andel med beregnet risiko over grense blant personer som senere fikk et akutt hjerteinfarkt eller hjerneslag i løpet av 10 år. Spesifisitet er andel med beregnet risiko under grense blant personer som senere ikke fikk et akutt hjerteinfarkt eller hjerneslag i løpet av 10 år. De valgte intervensjonsgrensene er de som er funnet å ivareta en balansert avveining av hensyn til både sensitivitet og spesifisitet for de tre aldersgruppene, som fremkommer ved at summert spesifisitet og spesifisitet når høyest mulig verdi. De beregnede verdiene for sensitivitet og spesifisitet fremkommer i tabell I:
Tabell I: Sensitivitet og spesifisitet ved ulike intervensjonsgrenser i modell-populasjonen (HUNT 2, Tromsø 4 og HUSK). Optimal samlet sensitivitet og spesifisitet foreligger ved de valgte intervensjonsgrenser (5,10 og 15%).
[tabell mangler]
Sensitivitet: Andel med beregnet risiko over grense blant personer som senere fikk et akutt hjerteinfarkt eller hjerneslag i løpet av 10 år. Spesifisitet: Andel med beregnet risiko under grense blant personer som senere ikke fikk et akutt hjerteinfarkt eller hjerneslag i løpet av 10 år.
Fortsatt aldersspesifikke tiltaksgrenser
De nye retningslinjene har beholdt prinsippet om aldersspesifikke intervensjonsgrenser, som også ble benyttet i retningslinjene fra 2009 (Norheim OF m.fl. 2009). En publikasjon fra 2015 støtter også dette prinsippet, for å bedre sensitivitet og spesifisitet (Navar-Boggan AM m.fl. 2015). Her argumenteres det også for å ha separate og lavere intervensjonsgrenser for kvinner. Faggruppen har vurdert dette, men kommet til at prinsippet med kjønnsspesifikke grenseverdier gir begrenset gevinst og for mange ulike intervensjonsgrenser å forholde seg til.
Bruk av risikotabeller eller tilsvarende databaserte beregninger for å bedømme behov for forebygging med legemidler, har de siste 20 år vært anbefalt i et flertall av europeiske og amerikanske retningslinjer. Det må likevel sies at en slik metode for å selektere personer for primærforebygging med legemidler ikke er dokumentert effektiv for kliniske endepunkter. Studiene som har dokumentert klinisk gevinst av de aktuelle intervensjoner er derimot hovedsakelig utført med deltakere som er inkludert på grunnlag av høyt blodtrykk, høyt kolesterolnivå eller diabetes. Analyser fra slike studier viser likevel at studiedeltakerne med høyest samlet risiko har størst absolutt gevinst av intervensjon (The West of Scotland Coronary Prevention Study Group 1997). En nyere metaanalyse har også vist at behandling basert på blodtrykk og samlet kardiovaskulær risiko er mer kostnadseffektiv enn behandling styrt av blodtrykket alene (Blood Pressure Lowering Treatment Trialists' Collaboration 2014). På bakgrunn av slike analyser anbefaler de fleste retningslinjer å kartlegge samlet kardiovaskulær risiko i tillegg til å vurdere enkeltfaktorer. En slik strategi er nylig også rapportert mest hensiktsmessig i en stor analyse fra den danske befolkningen (Mortensen MB m.fl. 2015).
Når det gjelder enkeltfaktorer, vil det oftest foreligge behandlingsindikasjon ved:
- Systolisk blodtrykk ≥ 160 mmHg eller diastolisk blodtrykk ≥ 100 mmHg (bekreftet ved gjentatte målinger) eller hypertensjon bekreftet ved ambulatorisk 24-timers registrering.
- Totalkolesterol ≥ 7,0 mmol/L (LDL ≥ 5,0 mmol/L), unntatt når slike lipidverdier forekommer etter menopausen hos kvinner som ikke har andre risikofaktorer av betydning.
Det vises til egne anbefalinger om utredning av lipidverdiene.
Ved organskade knyttet til kardiovaskulære risikofaktorer ("endeorganskade"), anbefales behandling med legemidler uavhengig av risikoberegning.
De viktigste endeorganskadene er asymptomatisk aterosklerose, f. eks. karforandringer påvist med ultralyd eller andre radiologiske teknikker, redusert ankel-brakial indeks, øyenbunnsforandringer, venstre ventrikkel hypertrofi påvist ved EKG eller ekko-doppler, og tegn til nyreskade, både i form av lett til moderat nedsatt nyrefunksjon (GFR 30-59 mL/min/ 1.73 m2) eller albuminuri (f. eks. 30-300mg/ 24h) eller økt albumin/kreatinin ratio (> 1,8 hos menn, >2,5 hos kvinner).
Kvalitet på dokumentasjonen
Det er klart dokumentert i mange epidemiologiske studier at årsaksforholdene ved hjerte- og karsykdom er multifaktorielle, og at risiko for hjerteinfarkt og hjerneslag er et resultat av flere risikofaktorer som virker sammen. Det er også godt dokumentert at individer med høyest risiko har størst gevinst av forebyggende tiltak. Det er imidlertid ikke gjort randomiserte kliniske studier på effekt av intervensjon basert på seleksjon av individer ut fra deres totale kardiovaskulære risiko. Effekt av aldersspesifikke grenser er heller ikke dokumentert i kliniske studier.
Verdier og preferanser
Overdreven bruk av legemidler gir svært liten tilleggsgevinst i form av redusert antall hjerte- og karhendelser og har ulemper i form av kostnader til legemidler og kontroll, risiko for bivirkninger samt unødig sykdomsfokus og engstelse. Motsatt vil manglende tilbud om effektiv forebygging hos høyrisikoindivider kunne medføre unødig høy forekomst av hjerteinfarkt, hjerneslag, perifer karsykdom og tilhørende komplikasjoner med stort helsetap og tap av leveår. Selv om det internasjonalt er stor enighet om at man først bør gjøre en individuell risikovurdering og deretter gi anbefaling om tiltak, er det store forskjeller mellom fagmiljøer og land i hvordan man mener en slik avveining skal gjøres. Uenigheten gjelder i noen grad vurderingen av hvor effektiv og trygg primærforebygging med legemidler faktisk er, men i større grad hvor og hvordan man i et samfunnsmedisinsk og etisk perspektiv skal sette en anbefalt grense for å behandle med legemidler.
I siste utgave av britiske (NICE) og amerikanske retningslinjer (felles for American Heart Association, American College of Cardiology og National Heart Lung and Blood Institute), publisert hhv. i 2014 og 2013, har man valgt å redusere risikonivået som tilsier anbefaling av primærforebygging med et statin til halvparten av tidligere anbefalt nivå (Editors. National Clinical Guideline Centre (UK) 2014, Stone NJ m.fl. 2014). Det vil si at forebygging med legemidler blir anbefalt ved en 10 års risiko for kardiovaskulær hendelse som overstiger 10% i Storbritannia og 7,5% i USA. Endringen er begrunnet i nyere forskning som viser at statinbehandling er trygt og gir klar helsegevinst også ved lavere risikonivå enn tidligere anbefalt, samt at legemiddelkostnadene er blitt ganske små grunnet bruk av generiske preparater. Tilsvarende gevinst hos personer med moderat forhøyet risiko er nylig vist i HOPE3 (Yusuf S m.fl. 2016). Endringen har likevel vært kontroversiell i begge land fordi mange millioner flere symptomfrie personer vil bli kandidater for legemiddelbehandling samtidig som det ikke fins data som direkte måler effekten av en slik endret praksis.
Referanser
1. Andrew E, Moran AE, Odden MC, Thanataveerat, A, et al. Cost-Effectiveness of Hypertension Therapy According to 2014 Guidelines. N Engl J Med 2015; 372: 447-55 https://www.helsedirektoratet.no/referanse/0002-0013-177664
2. Editors. National Clinical Guideline Centre (UK). Lipid Modification: Cardiovascular Risk Assessment and the Modification of Blood Lipids for the Primary and Secondary Prevention of Cardiovascular Disease. London: National Institute for Health and Care Excellence (UK); 2014 Jul https://www.helsedirektoratet.no/referanse/0002-0013-177665
3. Folkehelseinstituttet: Færre nordmenn dør av hjerte- og karsykdommer. FHI 2015, 13:17 http://www.fhi.no/artikler/?id=116619
4. Helfand M, Buckley DI, Freeman M, Fu R, Rogers K, Fleming C, Humphrey LL. Emerging risk factors for coronary heart disease: a summary of systematic reviews conducted for the U.S. Preventive Services Task Force. Ann Intern Med. 2009;151: 496–507 https://www.helsedirektoratet.no/referanse/0002-0013-177667
5. Igland J, Tell S, Ebbing M, Nygård O, Vollset S, Dimoski T. CVDNOR data and quality report: the CVDNOR project: cardiovascular disease in Norway 1994–2009. 2013. Description of data and data quality www.cvdnor.no
6. JBS3 Board. Joint British Societies' consensus recommendations for the prevention of cardiovascular disease ( JBS3). JBS3 Heart 2014; 100: ii1–ii67 https://www.helsedirektoratet.no/referanse/0002-0013-177669
7. Mannsverk J, Wilsgaard T, Mathiesen EB, Løchen ML, Rasmussen K, Thelle DS, Njølstad I, Hopstock LA, Bønaa KH. Trends in Modifiable Risk Factors are Associated With Declining Incidence of Hospitalized and Non-Hospitalized Acute Coronary Heart Disease in a Population. Circulation. 2016;133:74-81. pii: CIRCULATIONAHA.115.016960 https://www.helsedirektoratet.no/referanse/0002-0013-177670
8. McConnachie A, Walker A, Robertson M, et al.1. Long-term impact on healthcare resource utilization of statin treatment, and its cost effectiveness in the primary prevention of cardiovascular disease: a record linkage study. European Heart Journal (2014) 35, 290–298 https://www.helsedirektoratet.no/referanse/0002-0013-177671
9. Mortensen MB, Afzal S, Nordestgaard BG, et al. Primary Prevention With Statins: ACC/AHA Risk-Based Approach Versus Trial-Based Approaches to Guide Statin Therapy. J Am Coll Cardiol 2015;66:2699-2709 https://doi.org/10.1016/j.jacc.2015.09.089
10. Navar-Boggan AM, Peterson ED, D'Agostino RB Sr, al. Using age- and sex-specific risk thresholds to guide statin therapy: one size may not fit all. J Am Coll Cardiol. 2015 Apr 28;65(16):1633-9. doi: 10.1016/j.jacc.2015.02.025. Epub 2015 Mar 2 https://www.helsedirektoratet.no/referanse/0002-0013-177673
11. Norheim OF, Gjelsvik B, Kjeldsen SE, Klemsdal TO, Madsen S, Meland E, et al. Retningslinjer for individuell primærforebygging av hjerte- og karsykdommer. Oslo: Helsedirektoratet 2009 https://www.helsedirektoratet.no/referanse/0002-0013-177674
12. Næss Ø, Søgaard AJ, Arnesen E, et al. Cohort profile: Cohort of Norway (CONOR). Int J Epidemiol 2008;37:481-485 https://doi.org/10.1093/ije/dym217
13. Pandya A, Sy S Cho S, et al. Cost-effectiveness of 10-Year Risk Thresholds for Initiation of Statin Therapy for Primary Prevention of Cardiovascular Disease. JAMA. 2015; 314(2): 142-150 https://www.helsedirektoratet.no/referanse/0002-0013-177676
14. Perk J. et al, for European Association for Cardiovascular Prevention & Rehabilitation (EACPR); ESC Committee for Practice Guidelines (CPG). European Guidelines on cardiovascular disease prevention in clinical practice (version 2012.Eur Heart J. 2012 Jul; 33(13): 1635-701. Erratum in: Eur Heart J. 2012 Sep; 33(17):2126 https://www.helsedirektoratet.no/referanse/0002-0013-177677
15. Stone NJ, et al. American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2014 Jul 1;63(25 Pt B):2889-934. doi: . Epub 2013 Nov 12. doi:10.1001/jama.2015.6822. Corrected on August 10, 2015 https://www.helsedirektoratet.no/referanse/0002-0013-177678
16. The West of Scotland Coronary Prevention Study Group. [No authors listed] Baseline risk factors and their association with outcome in the West of Scotland Coronary Prevention Study. Am J Cardiol. 1997 Mar 15;79(6):756-62 https://www.helsedirektoratet.no/referanse/0002-0013-177679
17. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts): Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR) https://www.helsedirektoratet.no/referanse/0002-0013-177680
18. NORRISK 2: A Norwegian risk model for acute cerebral stroke and myocardial infarction Eur J Prev Cardiol 2017;773-783. https://www.helsedirektoratet.no/referanse/0002-0013-177681
Sist faglig oppdatert: 05.03.2018
Kartlegging av hypertensjon ved forebygging av hjerte- og karsykdom
Utredning av høyt blodtrykk ved forebygging av hjerte- og karsydom
- Personer med gjentatte blodtrykksmålinger ≥ 140/90 mmHg anbefales å få kartlagt nøyaktig blodtrykksnivå (ofte ved hjelp av 24-timers registrering eller hjemmemålinger), andre risikofaktorer, eventuelle underliggende årsaksfaktorer og/eller organskade for å avklare behandlingsbehov.
- Utredning av mild hypertensjon kan gjøres over flere måneder, mens mer alvorlig forhøyet blodtrykk (≥160/100 mmHg) vil kreve raskere inngripen, og kan i spesielle tilfeller (malign hypertensjon) kreve umiddelbar behandling og sykehusinnleggelse.
Praktisk – slik kan anbefalingen følges
Observasjon over flere måneder kan være hensiktsmessig for å etablere et diagnoseblodtrykk og bestemme samlet risiko for hjerte- og karsykdom. Ved markert forhøyet blodtrykk (>160/100 mm Hg), eller når det foreligger samlet høy risiko eller målorganskade, bør beslutning om medikamentell behandling tas raskere.
Blodtrykket kan normaliseres hos pasienter etter endringer i livssituasjon, f.eks. i jobb eller privatliv, ved vekttap eller interkurrent sykdom. Disse pasientene bør likevel følges senere med blodtrykkskontroll ettersom de vil ha økt risiko for å utvikle høyt blodtrykk senere i livet.
Når blodtrykket måles på legekontoret
- Be pasienten møte i god tid før timen, og la pasienten sitte rolig i flere minutter uten å prate før målingen.
- Bruk automatisk oscillometrisk apparat, eventuelt kalibrert aneroid måleapparat, se nedenfor.
- Det bør brukes utstyr som måler trykket i overarmen. Bruk av utstyr som måler blodtrykk i håndledd eller finger har lavere presisjonsnivå.
- Foreta minst to, og helst tre, målinger med ett minutts mellomrom, og registrer gjennomsnittet av de to siste.
- Bruk en standardmansjett (12–13 x 35 cm) for vanlig armtykkelse, større mansjett for tykkere arm og eventuelt barnemansjett for tynne armer.
- Mansjetten skal være i hjertehøyde.
- Slipp luften langsomt ut av mansjetten (2 mmHg/sekund).
- Mål blodtrykket også i stående stilling (etter 1 og 3 minutter) hos eldre og personer med diabetes (vær oppmerksom på risiko for ortostatisk hypotensjon).
- Diagnostikk er vanligvis basert på måling ved 3 uavhengige besøk og diagnoseblodtrykket er gjennomsnittet av trykket ved de to siste konsultasjonene. Ved første gangs besøk anbefales måling på begge armer for å avdekke eventuell forskjell.
Blodtrykksapparat
Det finnes tre typer apparater i bruk:
- Kvikksølvmanometer (utfases på grunn av kvikksølvets toksisitet).
- Aneroide apparater.
- Automatiske oscillometriske apparater.
De aneroide apparatene er manuelle, og krever regelmessig kalibrering og kontroll for å forsikre seg mot lekkasje og feilmålinger. Undersøkelser viser at slik kalibrering foregår sjelden og usystematisk på mange legekontorer. Automatiske oscillometriske apparater (vanlig i 24 timers apparater) trenger ikke kalibrering, men kan vise uriktige verdier ved arytmier, for eksempel atrieflimmer (Moe m.fl. 2010).
Bruk av 24-timers ambulatorisk blodtrykk eller hjemmeblodtrykk
24-timers blodtrykksmåling eller måling av blodtrykk hjemme gir verdifull tilleggsinformasjon og bør benyttes ofte) (Piper MA m.fl. 2015, Gelfer M m.fl. 2015, 2013 ESH/ESC Guidelines).
Slike målinger er særlig aktuelt ved utredning av mild hypertensjon, og/eller ved:
- Mistenkt høyt «white-coat»-kontorblodtrykk.
- Uvanlig variabilitet av kontorblodtrykk.
- Markert forskjell mellom kontor- og hjemmeblodtrykk.
- Manglende eller dårlig effekt av blodtrykksmedisiner.
- Mistenkt «maskert» hypertensjon – høyt ambulatorisk og lavt blodtrykk på legekontoret (utredning av venstre ventrikkel hypertrofi, atrieflimmer eller hjertesvikt av ukjent årsak).
- Mistanke om medikamentelt utløst ortostatisk hypotensjon (blodtrykksfall når man reiser seg, særlig viktig hos eldre og ved diabetes).
Gjennomsnittlig 24 timers blodtrykk (døgnmåling) vil i store befolkningsstudier ligge ca. 10 mm Hg lavere enn tilsvarende kontormålt blodtrykk (2013 ESH/ESC Guidelines) og hjemmemålinger ca 5 mmHg lavere, mens en større differanse indikerer "kontorblodtrykk" eller "white coat" effekt.
Ved hjemmemåling av blodtrykk anbefales måling av blodtrykket daglig i 3-4 dager og helst 7 dager på rad, både morgen og kveld. Målingen gjøres sittende etter 5 minutters hvile, og med 2 målinger med 1-2 minutters mellomrom.
Fordeler
- Gir økt informasjonsmengde før det tas beslutning om behandling.
- Øker pasientens interesse for egen sykdomssituasjon.
- Kan gi bedre etterlevelse av livsstilsendringer og medikamentell behandling.
- Gir viktig informasjon om oppnådd blodtrykk under behandling.
Ulemper
- 24-timers måling kan av enkelte oppfattes som ubehagelig og plagsomt.
- Kan gi økt angstnivå og endog være uegnet hos enkelte.
- Kan medføre ukvalifisert selvmodifisering av behandlingen.
- Kan medføre uhensiktsmessig fokusering på én risikofaktor.
Bedømming av 24 timers blodtrykk og hjemmeblodtrykk
Ettersom risikoestimater og behandlingsanbefalinger baserer seg på standardiserte blodtrykksmålinger (kontorblodtrykk), kan ikke gjennomsnittsverdier fra døgnmålinger eller hjemmemålinger uten videre overføres til NORRISK 2 eller andre risikoinstrumenter. Som en tommelfingerregel kan gjennomsnittlig 24-timers blodtrykk påplusses 10 mm Hg for sammenlikning med kontormålt blodtrykk, men også mangel av nattlig «dip» (reduksjon i blodtrykket på minst 10% i forhold til dagblodtrykk) eller andre risikofaktorer bør vektlegges. Påvist høyt 24-timers blodtrykk sikrer diagnosen og er klarere forbundet med risiko for endeorganskade. Grensen for hypertensjon med kontorblodtrykk, hjemmeblodtrykk og 24-timers blodtrykk er sammenliknet i følgende tabell (2013 ESH/ESC Guidelines).
Definisjoner av hypertensjon
Høyt blodtrykk foreligger når et av de følgende vilkår er til stede:
- Kontorblodtrykk systolisk ≥140 og/eller diastolisk ≥90 mmHg
- 24-timers blodtrykk (gjennomsnitt):
- Døgn ≥130 og/eller ≥80 mmHg.
- Dagtid (våken) ≥135 og/eller ≥85 mmHg.
- Natt (sovende) ≥120 og/eller ≥70 mmHg.
- Hjemmeblodtrykk ≥135 og/eller ≥85 mmHg.
Isolert kontorhypertensjon («white coat»-hypertensjon)
- Kontorblodtrykk som er vedvarende for høyt (≥ 140/90 mmHg).
- 24-timers ambulatorisk- eller hjemmeblodtrykksverdier er normale (dvs. 24-timers ambulatorisk blodtrykk < 130/80 mmHg, dagblodtrykk og hjemmeblodtrykk <135/85 mmHg, nattblodtrykk < 120/70 mmHg.
Maskert kontorhypertensjon
- Kontorblodtrykk <140/90 mmHg, men 24-timers blodtrykk >130/80 mmHg (eventuelt ≥135/85 mmHg på dagtid) eller hjemmemålt blodtrykk ≥135/85 mmHg.
Hos personer med isolert kontorhypertensjon er kardiovaskulær risiko betydelig lavere enn hos personer med etablert hypertensjon. Likevel er kontorhypertensjon en tilstand med noe økt risiko. Personer med dette bør derfor følges og tilbys behandling dersom ambulatorisk eller hjemmemålt blodtrykk stiger, og den samlede kardiovaskulære risiko er over intervensjonsgrensen. Personer med maskert hypertensjon har risiko som ligger klart over normotensive og maskert hypertensjon gir også høyere risiko enn kontorhypertensjon. Utstrakt bruk av 24 timers-registreringer hos personer med grensehøyt blodtrykk vil trolig avdekke flere personer med denne tilstanden, som derfor vil kreve spesiell oppfølging og behandling (Stergiou GS m.fl. 2014).
Klinisk undersøkelse
Se spesielt etter:
- Tegn som kan tyde på sekundær hypertensjon (nyresykdom, Cushing tilstand, akromegali, hypertyreose, nyrearterie stenose, coarctatio aorta).
- Tegn på målorganskade (for eksempel følgetilstander etter hjerneslag, kliniske tegn til hjerte- eller perifer karsykdom).
- Annen interkurrent eller samtidig sykdom av betydning for valg av medikamenter eller intensitet i blodtrykksbehandlingen (som for eksempel diabetes).
Laboratorieundersøkelser
- Urin strimmeltest (hematuri, proteinuri, mikroalbuminuri, eventuelt Urin-Albumin/Kreatinin-ratio).
- HbA1c, ev. glukosebelastningstest hos gravide.
- Total-, LDL- og HDL-kolesterol; fastende serumtriglyserider.
- Kreatinin (med beregning av glomerulær filtrasjonsrate, GFR).
- Urinsyre.
- Natrium, kalium.
- Hemoglobin og hematokrit (avvik ved sekundær hypertensjon, astma/KOLS, røyking, alkohol).
- Thyroidea stimulerende hormon (TSH), fritt T4 (FT4).
- Elektrokardiogram, med tanke på følgende tilstander som har konsekvenser for behandlingen:
- venstre ventrikkel hypertrofi (VVH) (overutviklet hjertemuskulatur, synlig ved Cornell kriterier ((RaVL + SV3) x QRS bredde, + 6 mm for kvinner) > 2440 mm x msek) og/eller Sokolow-Lyon kriterier (SV1 + RV5 > 38 mm) med 96 % spesifisitet og 50 % sensitivitet hos folk > 50 år)
- arytmi (unormal rytme, særlig atrieflimmer)
- tidligere infarkt
Når mistenke sekundær hypertensjon?
- Alder under 40 år (mer sannsynlig jo yngre pasienten er).
- Manglende nattlig dip ved 24-timers registrering.
- Vedvarende svært høye blodtrykksverdier (blodtrykk ≥180/110 mmHg).
- Manglende effekt av tre eller flere legemidler.
Supplerende undersøkelser på indikasjon
- Ekkokardiografi ved mistanke om hjertesvikt, (redusert venstre ventrikkelfunksjon kan være avgjørende for riktig valg av blodtrykksmedikamenter), og ved utredning av bilyd (hypertensjon disponerer for aortastenose).
- Kvantitativ måling av proteinuri (ved positiv strimmeltest).
- Oftalmoskopi (viktigst for å vurdere malign hypertensjon).
Spesialistvurdering
- Komplisert hypertensjon (påvist alvorlig målorganskade eller manglende terapirespons).
- Manglende effekt av behandling (≥3 legemidler inkludert et diuretikum).
- Mistanke om sekundær hypertensjon.
Begrunnelse – dette er anbefalingen basert på
Nøyaktig bestemmelse av blodtrykksnivå og kartlegging av øvrige risikofaktorer med etterfølgende råd og behandling reduserer sykelighet og dødelighet av hjerte- og karsykdom, først og fremst hjerneslag, hjerteinfarkt, hjertesvikt og nyresvikt. (Moran AE m.fl. 2015, Booth N m.fl. 2007, Kaczorowski J m.fl. 2011). Generelt er gevinsten ved behandling større dess høyere blodtrykket er, men også større når andre risikofaktorer er til stede. Som ved all annen legemiddelbehandling forekommer bivirkninger hos noen, og behandling bør derfor bare tilbys når adekvat blodtrykkskartlegging og risikovurdering er utført. Ved mildere grader av hypertensjon skal forsøk på endring av levevaner (kostendringer, fysisk aktivitet, vektreduksjon) forsøkes i 3-12 måneder før ny risikovurdering og blodtrykksmåling utføres, mens behandling bør startes raskt ved høyere blodtrykksnivåer og ved tegn til organskade. Adekvat håndtering av høyt blodtrykk forutsetter derfor at utredning og kartlegging gjøres i henhold til de omtalte prinsipper.
Vurdering
Fordeler og ulemper
Fordeler
Påvisning av høyt blodtrykk og kartlegging av risikofaktorer med etterfølgende råd og behandling, reduserer sykelighet og dødelighet av hjerte- og karsykdom, først og fremst hjerneslag, hjerteinfarkt, hjertesvikt og nyresvikt. (Moran AE m.fl. 2015, Booth N m.fl. 2007, Kaczorowski J m.fl. 2011). Generelt er gevinsten ved behandling større dess høyere blodtrykket er, men også større når den øvrige risiko for hjerte- og karsykdom er høyere (Blood Pressure Lowering Treatment Trialists' Collaboration 2014). Dette viser nødvendigheten av en bred risikokartlegging når blodtrykket er forhøyet.
Ulemper
Personer som får påvist en risikofaktor kan oppleve økt engstelse og uro. Det er usikkert hvor stor andel som opplever dette, men eventuell uro vil for de fleste avta i løpet av noen måneder (Piper MA m.fl. 2015).
I en samleanalyse fant man at informasjon om risiko bedret pasientens forståelse av egen risiko uten å redusere livskvalitet eller gi økt engstelse (Usher-Smith JA m.fl. 2015).
Det er risiko for overdiagnostikk og overbehandling ved at personer med lav samlet risiko tilbys omfattende utredning, oppfølging og kanskje medikamentell behandling. Ved usikker behandlingsindikasjon er det viktig å utrede videre ved hjelp av ambulatorisk 24-timers måling og eventuelt hjemmemålinger. (Piper MA m.fl. 2015, Gelfer M m.fl. 2015, Clark CE m.fl. 2014 )
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen vurderes som god.
Nytten av å kartlegge blodtrykk og risiko for hjerte- og karsykdom er hovedsakelig studert indirekte i undersøkelser der påvist høyt blodtrykk har blitt medikamentelt behandlet. Det finnes få randomiserte studier av selve blodtrykksmålingen og kartlegging av samlet kardiovaskulær risiko, slik at denne dokumentasjonen anses som svak. En nyere metaanalyse viser imidlertid at behandling som er styrt ut fra både blodtrykk og samlet kardiovaskulær risiko er mer kostnadseffektiv enn når behandlingen er styrt ut fra blodtrykket alene (Blood Pressure Lowering Treatment Trialists' Collaboration 2014).
Sammenhengen mellom høyt blodtrykk og hjerte- og karsykdom/for tidlig død er godt dokumentert i store prospektive befolkningsundersøkelser (Lewington S m.fl. 2002). Grunnlaget for disse studiene er blodtrykk som er målt under standardiserte betingelser av helsepersonell med auskultatorisk eller automatisk oscillometrisk apparat. Dokumentasjonen av sammenhengen mellom målinger i vanlig klinisk praksis og kardiovaskulær sykdom er svakere. Dette gjelder også diagnostikk basert på hjemmeblodtrykksmålinger eller ambulatorisk 24-timers måling (Bonafini S m.fl. 2015).
Verdier og preferanser
Kartlegging av blodtrykk gir mulighet for å redusere risiko for framtidig hjerte- og karsykdom gjennom målrettede livsstilsendringer og eventuelt behandling med legemidler. Samtidig kan rådgivning og behandling komme i konflikt med enkeltmenneskets behov for selv å bestemme hvordan man vil leve. Endring av livsstil og daglig bruk av legemidler forutsetter personlig motivasjon, og pasientens preferanser må undersøkes og vektlegges i kartleggingen. Kartleggingen kan medføre flere legebesøk, prøvetaking og undersøkelser som kan oppleves som en belastning, for eksempel ambulatorisk måling av blodtrykk. En studie tyder på at pasienter foretrekker hjemmemålinger av blodtrykket fremfor 24-timers ambulatorisk måling (Nasothimiou EG m.fl. 2014). Det er en selvfølge at et ønske om ikke å foreta kartlegging av blodtrykket blir respektert, men pasienten må informeres om mulige uheldige konsekvenser av manglende diagnose og behandling.
Referanser
19. Blood Pressure Lowering Treatment Trialists' Collaboration, Sundström J, Arima H, Woodward M, et al. Blood pressure-lowering treatment based on cardiovascular risk: a meta-analysis of individual patient data. Lancet. 2014 Aug 16;384(9943):591-8. doi: 10.1016/S0140-6736(14)61212-5 https://www.helsedirektoratet.no/referanse/0002-0013-177682
20. Booth N, Jula A, Aronen P, Kaila M, Klaukka T, Kukkonen-Harjula K, Reunanen A, Rissanen P, Sintonen H, Mäkelä M. Cost-effectiveness analysis of guidelines for antihypertensive care in Finland. BMC Health Serv Res 2007 7:172 https://bmchealthservres.biomedcentral.com/articles/10.1186/1472-6963-7-172
21. Bonafini S, Fava C1. Home blood pressure measurements: advantages and disadvantages compared to office and ambulatory monitoring. Blood Press. 2015;24(6):325-32. doi: 10.3109/08037051.2015.1070599. Epub 2015 Sep 12.analysis of guidelines for antihypertensive care in Finland.BMC Health Serv Res. 2007 Oct 24;7:172 https://www.helsedirektoratet.no/referanse/0002-0013-177684
22. Clark CE, Horvath IA, Taylor RS, Campbell JL. Doctors record higher blood pressures than nurses: systematic review and meta-analysis. Br J Gen Pract. 2014 Apr;64(621):e223-32. doi: 10.3399/bjgp14X677851 https://www.helsedirektoratet.no/referanse/0002-0013-177685
23. Gelfer M, Dawes M, Kaczorowski J, Padwal R, Cloutier L. Diagnosing hypertension: Evidence supporting the 2015 recommendations of the Canadian Hypertension Education Program. Can Fam Physician. 2015 Nov;61(11):957-61 https://www.helsedirektoratet.no/referanse/0002-0013-177686
24. Kaczorowski J, Chambers LW, Dolovich L, et al. Improving cardiovascular health at population level: 39 community cluster randomised trial of Cardiovascular Health Awareness Program (CHAP). BMJ. 2011 Feb 7;342:d442. doi: 10.1136/bmj.d442 https://www.helsedirektoratet.no/referanse/0002-0013-177687
25. Lewington S et al. Age-spesific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet 2002;360:1903-1913 https://www.helsedirektoratet.no/referanse/0002-0013-177688
26. Moe N, Getz L, Dahl K, Hetlevik I. Blodtrykksapparater på legekontorer. Tidsskr Nor Legeforen 2010; 130: 1233-5. https://www.helsedirektoratet.no/referanse/0002-0013-177689
27. Moran AE, Odden MC, Thanataveerat A, Tzong KY, Rasmussen PW, Guzman D, Williams L, Bibbins-Domingo K, Coxson PG, Goldman L. Cost-effectiveness of hypertension therapy according to 2014 guidelines. N Engl J Med. 2015 Jan 29;372(5):447-55. doi: 10.1056/NEJMsa1406751 https://www.helsedirektoratet.no/referanse/0002-0013-177690
28. Nasothimiou EG, Karpettas N, Dafni MG, Stergiou GS. Patients' preference for ambulatory versus home blood pressure monitoring. J Hum Hypertens. 2014 Apr;28(4):224-9. doi: 10.1038/jhh.2013.104. Epub 2013 Oct 24 https://www.helsedirektoratet.no/referanse/0002-0013-177691
29. Piper MA, Evans CV, Burda BU, Margolis KL, O'Connor E, Whitlock EP. Diagnostic and predictive accuracy of blood pressure screening methods with consideration of rescreening intervals: a systematic review for the U.S. Preventive Services Task Force https://www.helsedirektoratet.no/referanse/0002-0013-177692
30. Stergiou GS, Asayama K, Thijs L, et al; International Database on HOme blood pressure in relation to Cardiovascular Outcome (IDHOCO) Investigators. Prognosis of white-coat and masked hypertension: International Database of Home blood pressure in relation to Cardiovascular Outcome. Hypertension. 2014 Apr;63(4):675-82. doi: 10.1161/HYPERTENSIONAHA.113.02741. Epub 2014 Jan 13 https://www.helsedirektoratet.no/referanse/0002-0013-177693
31. Usher-Smith JA, Silarova B, Schuit E, Moons KG, Griffin SJ. Impact of provision of cardiovascular disease risk estimates to healthcare professionals and patients: a systematic review. BMJ Open. 2015 Oct 26;5(10):e008717. doi: 10.1136/bmjopen-2015-008717 https://www.helsedirektoratet.no/referanse/0002-0013-177694
32. 2013 ESH/ESC Guidelines for the management of arterial hypertension. Eur Heart J. 2013; 34: 2159-219 https://www.helsedirektoratet.no/referanse/0002-0013-177695
Sist faglig oppdatert: 05.03.2018
Utredning av lipidverdiene ved primær- og sekundærforebygging av hjerte- og karsykdom
Utredning av lipidverdiene ved primær- og sekundærforebygging av hjerte- og karsykdom
- Mål lipidprofil (totalkolesterol, LDL-kolesterol, HDL-kolesterol og triglyserider) som ledd i risikovurdering, eller når unormal lipidverdi er oppdaget tilfeldig eller mistenkes, for eksempel grunnet familiehistorien. Dette gjelder også i alder under 40 år.
- Risikovurdering bør gjøres når en person ber om en slik vurdering eller når økt risiko mistenkes på grunn av familieanamnesen eller risikofaktorer for øvrig.
- Dersom en person er ukjent med sitt lipidnivå, bør en orienterende lipidprofil vurderes fra 40-års alder.
Praktisk – slik kan anbefalingen følges
Målinger og risikogrenser
- Måling av lipidprofil (totalkolesterol, HDL-kolesterol, og direktemålt LDL-kolesterol) kan foretas i ikke-fastende prøve. Ved måling av fullstendig lipidprofil med triglyserider eller ved bruk av estimert LDL-kolesterol, er faste i 8-10 timer nødvendig for å få en standardisert måling. Dersom prøveresultatet ved måling av ikke-fastende triglyserider er over 4,0 mmol/l må det tas fastende verdier. Matinntak øker vanligvis triglyseridnivået med kun 0,2-0,4 mmol/l – en økning som er uten stor klinisk betydning.
- Måling av lipoprotein(a) (forkortes Lp(a)) kan gjøres hos pasienter med økt forekomst av hjerte- og karsykdom i familien, der indikasjonen for bruk av legemiddel behandling er usikker.
- Måling av apolipoprotein B (apo B) anbefales ikke rutinemessig, men kan gi tilleggsinformasjon hos pasienter med metabolsk syndrom og normalt LDL-kolesterolnivå og ved mistanke om familiær kombinert hyperlipidemi. Måling av apo A1 gir sjelden tilleggsinformasjon og anbefales heller ikke ruinemessig. Ved økt apo B/apo A1 ratio øker risikoen gradvis (hos menn ved ratioer > 0,7 og hos kvinner > 0,6). Faste er ikke nødvendig ved måling av apo A1, apo B og Lp(a).
- Lipidpartikler (lipoproteiner) som er rike på apo B fremmer aterosklerose (er aterogene). HDL inneholder derimot apo A1, og lav verdi for HDL-kolesterol er assosiert med økt risiko. LDL er den viktigste aterogene partikkelen. Andre apo B-holdige partikler er IDL (Intermediate Density Lipoprotein), VLDL og Lp(a).
- Et høyt nivå av HDL-kolesterol beskytter ikke alltid mot hjerte- og karsykdom. Risikovurderingen må da gjøres primært ut fra LDL-kolesterolverdien.
- Hyperlipidemi kan oppstå sekundært til diabetes, thyreoidealidelser, nyre- og leversykdommer og overvekt, samt bruk av visse legemidler. De viktigste prøver for å utelukke sekundære årsaker til hyperlipidemi er TSH, fritt T4, kreatinin, leverprøver, glukose og HbA1c.
- Total- og LDL-kolesterolnivåene følges som mål for effekten av kostholdsendringer og medikamentell behandling.
- Høye triglyserider (optimalt <1,7 mmol/l) og lavt HDL-kolesterol (optimalt > 1,0 mmol/l for menn og > 1,2 mmol/l for kvinner) markerer at personen har en lipidprofil som gir økt risiko, og kan brukes til å følge effekten av vektreduksjon og endret livsstil.
Lipiddiagnoser
Familiær hyperkolesterolemi (FH) er en autosomal dominant arvelig tilstand som oftest forårsakes av mutasjoner i genet som koder for LDL-reseptoren. Nedsatt konsentrasjon eller funksjon av LDL-reseptorer på celleoverflatene medfører at mye LDL sirkulerer i blodet fra fødselen av, noe som disponerer for tidlig aterosklerotisk sykdom utover det en ordinær risikotabell angir (NORRISK 2). Lipidsenkende behandling bør derfor vurderes fra barneårene. Antatt prevalens er 1 per 300, men kan være 1 per 200.
Kartlegging av mutasjon gjøres ved mistanke om FH. I slekter med kjent mutasjon bør familiemedlemmer tilbys gentest som kan bekrefte eller avkrefte diagnosen på en sikker måte. EDTA-blod (5 ml) sendes per post til Enhet for hjertegenetikk, Oslo universitetssykehus for analyse. Gentesten tas kun en gang. Bioteknologiloven hindrer oppsøkende kontakt fra helsevesenet til slektninger som bør teste seg. Det er derfor pasienten selv som må informere slektningene sine om anbefalt testing.
I slekter uten kjent mutasjon bør FH og gentest vurderes ved totalkolesterol hos barn ≥ 6,0 mmol/l, i alderen 20-40 år ved verdier ≥ 7,0 mmol/l og i alderen over 40 år ved verdier ≥ 8,0 mmol/l. Disse kriteriene alene er imidlertid så uspesifikke at kun en mindre andel av disse vil ha FH. Indikasjonen for gentest øker ved tilstedeværelse av høyt kolesterol og tidlig hjerte- og karsykdom i slekten (før 55 år hos menn og før 65 år hos kvinner) og særlig dersom høyt kolesterol følger en autosomal dominant arvegang (finnes bare på mors eller bare fars side, og uten å hoppe over generasjoner) eller vedkommende med høy verdi har barn med totalkolesterol ≥ 6,0 mmol/l. Xantomknuter kan påvises hos et mindretall av pasienter med FH, men dersom xantomknuter påvises, gir det stor diagnostisk sikkerhet. Sannsynligheten for FH kan estimeres mer nøyaktig ved hjelp av scoringssystemer (for eksempel Dutch Lipid Clinic Network kriteriene) (Nordestgaard BG m.fl. 2013). Nasjonal kompetansetjeneste for FH tilbyr informasjon og veiledning (www.nktforfh.no).
Familiær kombinert hyperlipidemi (FKH) er mindre entydig definert og vanligere enn FH (antatt prevalens 2-3 %). FKH debuterer oftest i tidlig voksen alder med høyt nivå av både total- og LDL-kolesterol og triglyserider. Gentester for denne diagnosen er ikke utviklet da tilstanden skyldes polygenetiske endringer og ikke monogener. FKH mistenkes ved kolesterolverdier hos voksne i størrelsesorden ≥ 6,0-7,0 mmol/l som har familiemedlemmer (ofte flere) med høyt kolesterol og/eller høye triglyserider og/eller tidlig hjerte- og karsykdom. Følgende verdier er foreslått for å fastsette diagnosen: apo B >1,2 mmol/l og triglyserider >1,5 mmol/l hos pasienten og minst 1 familiemedlem, samt minst 1 familiemedlem med tidlig hjerte- og karsykdom (Veerkamp MJ m.fl. 2004). Mange i denne gruppen vil fylle indikasjonen for gentest for FH, men uten at relevant mutasjon påvises. Det er viktig at manglende påvisning av mutasjon ikke mistolkes dit hen at lipidforstyrrelsen ikke har arvelig komponent eller er ufarlig. Grunnet tidlig belastning med høye lipidverdier, må disse personene starte behandling tidligere enn vurdert ut fra NORRISK 2-tabellen (ofte fra 30-40 års alder). Gevinsten ved livsstilsendringer er stor hos denne gruppen.
Polygen hyperkolesterolemi eller hyperlipidemi: Øvrige hyperlipidemier enn FH og FKH benevnes ofte som polygen eller postmenopausal hyperlipidemi. Tilstanden skyldes en kombinasjon av gener og forhold knyttet til livsstil og debuterer oftest etter 40 år hos menn og etter 50 år hos kvinner. Risikovurderingen blir som ordinært (NORRISK 2).
Metabolsk syndrom: Kombinasjonen høye triglyserider/lavt HDL kolesterol omtales som dyslipidemi og utgjør en del av metabolsk syndrom når observert med høyt livvidde, blodtrykk 130/85 mmHg (eller bruk av blodtrykksreduserende medikament) og/eller høyt fastende glukose (Alberti KG m.fl. 2009). Dyslipidemi er assosiert med små og tette LDL-partikler, noe som gjør partiklene særlig aterogene (økt avleiring i åreveggen). Tetthet av LDL-partikkelen måles kun i forskningssammenheng.
Type III hyperlipidemi: Ved kolesterolverdier > 8–10 mmol/l samt triglyserider > 8-10 mmol/l, må man mistenke den sjeldne type III hyperlipidemien. Tilstanden skyldes oftest en isoform av apo E (E-2) i begge alleler og er forbundet med betydelig økt risiko for prematur aterosklerotisk sykdom.
Isolert hypertriglyseridemi kan skyldes genetiske tilstander og/eller økt alkoholinntak, ukontrollert diabetes, eller bruk av visse medikamenter. Triglyserider ≥10 mmol/l er en risikofaktor for pankreatitt og skal fortrinnsvis henvises til spesialist for diagnostisk utredning og behandling. Høyt alkoholforbruk øker triglyseridnivået i uttalt grad hos enkelte, og normaliseres ofte ved redusert forbruk.
Begrunnelse – dette er anbefalingen basert på
Lipidforstyrrelser, og da først og fremst høyt nivå av LDL-kolesterol, forekommer hos en stor andel av befolkningen og utgjør sammen med røyking og høyt blodtrykk de viktigste risikofaktorer for hjerte- og karsykdom. Lipidforstyrrelser er i stor grad påvirkelige, både ved endringer i levevaner og kosthold og ved legemiddelbehandling. Det foreligger omfattende dokumentasjon som viser at behandling med legemidler kan gi redusert forekomst av hjerte- og karsykdom og redusere dødeligheten av disse sykdommene. Det er noe svakere dokumentasjon for at kostendringer kan ha tilsvarende effekt. Behandling med legemidler har lave kostnader og medfører liten risiko for alvorlige bivirkninger, og bør derfor tilbys når nivået av lipidverdier og/eller andre risikofaktorer øker risikoen for hjerte- og karsykdom til over aldersspesifikke behandlingsgrenser. For å kunne vurdere hvorvidt en person har lipidforstyrrelser og/eller en samlet risiko for hjerte- og karsykdom som nødvendiggjør intervensjon med livsstilsendringer og eventuelt legemidler, må det gjøres en adekvat kartlegging av lipidnivåene og andre viktige risikofaktorer. Tilsvarende gjelder i stor grad ved kjent hjerte- og karsykdom, der særlig tilstrekkelig lavt nivå av LDL-kolesterol må tilstrebes for å sikre optimal prognose.
Vurdering
Fordeler og ulemper
Fordeler
Måling av lipidprofil vil avdekke hyperlipidemi, som er en av de viktigste modifiserbare risikofaktorene for hjerte- og karsykdom sammen med tobakk, hypertensjon og diabetes (Berry JD m.fl. 2012). Måling av lipidverdier gir grunnlag for intervensjon med endring av levevaner og behandling med legemidler som har vist seg effektive i forebygging av hjerte- og karsykdommer (se kapittel Legemidler ved forebygging av hjerte- og karsykdom; Bruk av statiner og andre lipidsenkende legemidler).
Bestemmelse av totalkolesterol er nødvendig for å kunne gjøre en adekvat risikoberegning, og inngår i NORRISK 2. LDL-kolesterol vil være den viktigste verdien for å vurdere behandlingseffekt og oppnåelse av behandlingsmål (Ridker PM 2014). Måling av HDL-kolesterol og triglyserider gir informasjon om risikoprofil og behov for livsstilstiltak, men er i seg selv ikke mål for behandling (Nordestgaard BG m.fl. 2014, Rader DJ m.fl. 2014). Unntaket er tilfeller med svært høye triglyserider (≥ 10 mmol/l) som kan forårsake akutt pankreatitt.
Ulemper
Måling av lipidprofil krever ressurser til prøvetaking, analyser og vurdering. Høyt kolesterol uten samlet høy risiko kan gi grunnlag for engstelse hos noen personer og medføre gjentatte unødige kontroller og i noen tilfeller overbehandling (Tonstad S m.fl. 2004).
Kvalitet på dokumentasjonen
Kvalitet på dokumentasjonen vurderes som lav
Verdier og preferanser
Kartlegging av lipidnivåer er en sentral del av vurderingen når en person skal få bedømt sin risiko for hjerte- og karsykdom og er en sentral del av oppfølgingen hos personer som allerede har fått påvist dette. Fordi det finnes effektive tiltak rettet mot høyt kolesterolinnhold i blodet, vil personer med økt risiko eller kjent sykdom ha forventet egennytte av slik kartlegging. Hos personer uten hjerte- og karsykdom kan likevel hyppige målinger fortone seg som belastende, og særlig dersom det måles lett forhøyede verdier som likevel ikke tilsier at personen har høy risiko eller bør behandles. Kartlegging av risiko og lipidnivåer skal bare gjøres når personer ber om dette, når symptomer og funn indikerer at det kan foreligge viktige forstyrrelser, eller når økt risiko mistenkes på grunn av familieanamnesen eller risikofaktorer for øvrig.
Referanser
33. Undertreatment and overtreatment with statins: the Oslo Health Study 2000-2001 https://www.helsedirektoratet.no/referanse/0002-0013-177696
34. Berry JD, Dyer A, Cai Xet al. Lifetime risks of cardiovascular disease. N Engl J Med 2012; 366: 321-29 https://www.helsedirektoratet.no/referanse/0002-0013-177697
35. Ridker PM. LDL cholesterol: controversies and future therapeutic directions. Lancet 2014; 384: 607-17 https://www.helsedirektoratet.no/referanse/0002-0013-177698
36. Nordestgaard BG, Varbo A. Triglycerides and cardiovascular disease. Lancet 2014; 384: 626-35 https://www.helsedirektoratet.no/referanse/0002-0013-177699
37. Rader DJ, Hovingh GK. HDL and cardiovascular disease. Lancet 2014; 384: 618-25 https://www.helsedirektoratet.no/referanse/0002-0013-177700
38. Nordestgaard BG, Chapman MJ, Humphries SEet al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease. Consensus Statement of the European Atherosclerosis Society. Eur Heart J 2013; 34: 3478-90 https://www.helsedirektoratet.no/referanse/0002-0013-177701
39. Veerkamp MJ, de Graaf J, Hendriks JCM, Dermacker PNM, Stalenhoef AFH. Nomogram to diagnose familial combined hyperlipidemia on the basis of results of a 5-year follow-up study. Circulation 2004; 109: 2980-5 https://www.helsedirektoratet.no/referanse/0002-0013-177702
40. Alberti KG, Eckel RH, Grundy SM et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009; 120: 1640-5 https://www.helsedirektoratet.no/referanse/0002-0013-177703
Kartlegging av levevaner og råd om livsstilstiltak som forebygging av hjerte- og karsykdom
Anbefaling angående inntak av alkohol ved forebygging av hjerte- og karsykdom
Alkoholinntaket hos kvinner bør ikke overstige 10 g alkohol per dag.
Alkoholinntaket hos menn bør ikke overstige 20 g alkohol per dag.
Praktisk – slik kan anbefalingen følges
Tilgjengelige data støtter opp om at gjennomsnittlig forbruk bør være begrenset til 10 g per dag for kvinner og 20 g for menn. Personer med økt hjerte- og karrisiko bør informeres om at såpass lavt konsum betyr at alkohol bare bør serveres og nytes ved begrensede anledninger og i moderate mengder. Sterkere former for alkohol (hetvin, brennevin) vil lett kunne medføre at de anbefalte mengder overskrides, og bør derfor særlig begrenses. Attraktive alkoholfrie alternativer til vin og øl kan ofte mangle, men kan være nyttig for å kunne begrense alkoholbruk i sosiale sammenhenger.
Alkohol inneholder, på linje med sukker, såkalte «tomme kalorier». Alkoholinntaket bør ikke overstige 5 prosent av energiinntaket blant voksne (Klatsky AL 2015).
1 alkoholenhet inneholder ca. 12 g alkohol som tilsvarer 33 cl pils/12 cl vin/4 cl sprit.
Begrunnelse – dette er anbefalingen basert på
Kunnskapsoppsummeringen «Sammenhengen mellom alkohol og hjerte- og karsykdommer» fant at det er begrenset kunnskap om eventuelle helsefordeler av alkohol (Lidal IB m.fl. 2013). Internasjonale oversiktsartikler rapporterer ofte en svak beskyttende effekt av lavt alkoholkonsum (1-2 enheter per dag) på noen typer hjerte- og karsykdom, primært hjerteinfarkt og hjertesvikt, mens risikoen for hjerneslag synes å øke selv ved svært lavt inntak (Ronksley PE m.fl. 2011, Gonçalves A m.fl. 2015, Gémes K m.fl. 2015, Klatsky AL 2015). Mekanismene for en eventuell beskyttende effekt er ikke klarlagt (Gepner Y m.fl. 2015).
En epidemiologisk studie (mendeliansk randomisering) av genetisk variasjon i alkoholmetabolisme og forbruk, tyder på at lavere forbruk er gunstig også for hjerte- og karrisiko (Holmes M m.fl. 2014). Det er godt dokumentert at både akutte og kroniske alkoholskader bidrar betydelig til sykelighet, dødelighet og sosiale problemer (Diet, nutrition and the prevention of chronic diseases: report of a Joint WHO/FAO Expert. Consultation (2003) World Health Organization, Balakrishnan R m.fl. 2009, Babor T m.fl. 2010). WHO konkluderer med at det er overbevisende dokumentasjon for at høyt inntak av alkohol øker risiko for hjerneslag. (Diet, nutrition and the prevention of chronic diseases: report of a Joint WHO/FAO Expert. Consultation (2003) World Health Organization).
Den norske kunnskapsoppsummeringen fant økt risiko for hjerneslag, hypertensjon og atrieflimmer ved inntak av alkohol, og risikoen økte med økende inntak (Lidal IB m.fl. 2013). Høyt alkoholkonsum er også assosiert med økt risiko for en rekke kreftsykdommer (Bagnardi V m.fl. 2015).
Forskningsgrunnlag
Populasjon (P): Personer med økt risiko for hjerte- og karsykdom, eller med kjent slik sykdom
Tiltak (I): Begrenset alkoholinntak tilsvarende maksimalt 2 enheter daglig for menn og 1 enhet daglig for kvinner
Sammenligning (C): Ingen begrensning i alkoholinntak
Beskrivelse av inkluderte studier
Sammenhengen mellom alkoholbruk og hjerte- og karsykdom er av metodologiske grunner vanskelig å slå fast eksakt, men et forsiktig inntak kan være assosiert med en beskjeden fordelaktig effekt for koronarsykdom og hjertesvikt, men ikke for hjerneslag. Høyere inntak av alkohol er klart forbundet med økt risiko, særlig for hjerneslag. Høyere alkoholbruk har også en rekke andre negative helseeffekter. Det er ikke vitenskapelig grunnlag for å anbefale alkoholbruk for å oppnå eller bevare god helse (Rapport fra Helsedirektoratet 2014, hoveddokumentasjon).
Vurdering
Fordeler og ulemper
Fordeler
Høyt alkoholinntak er forbundet med økt risiko for hjerte- og karsykdom, særlig hjerneslag. Høyt alkoholkonsum bidrar til utvikling av hypertensjon og dermed til hypertensjonsrelaterte organskader på hjerte, hjerne, og nyrer (Lidal IB m.fl. 2013)
Tiltak som begrenser for høyt inntak av alkohol vil derfor kunne redusere denne type helseskade. Høyt alkoholkonsum er også forbundet med andre negative helseeffekter, som for eksempel økt risiko for visse kreftsykdommer, ulykker og vold. Det mangler likevel kontrollerte studier med tiltak mot høyt alkoholkonsum og effekt på kardiovaskulær sykdom.
Ulemper
Moderat bruk av alkohol er i en del observasjonsstudier assosiert med en beskyttende effekt mot visse typer hjertesykdom (Ronksley m.fl.2011, Holmes m.fl.2014), og tiltak som reduserer alkoholbruk vil da kunne tenkes å redusere en eventuell positiv effekt. Den mulig beskyttende effekt kan imidlertid ikke anses godt nok dokumentert til at dette representerer noen innvending mot tiltaket (Helsedirektoratet 2014).
Kvalitet på dokumentasjonen
Forskningen på alkoholbruk er beheftet med både metodiske svakheter og usikkerhet og mangel på kontrollerte studier (Lidal IB m.fl. 2013).
Verdier og preferanser
Moderat bruk av alkohol regnes som en del av middelhavskostholdet (Widmer RJ m.fl. 2015), og alkoholbruk har også tradisjoner i norsk kultur. For mange mennesker oppfattes alkoholinntak som en naturligdel av selskapsliv og sosialt samvær. Alkoholens negative sider i forhold til ulykker, misbruk/avhengighet, vold og kriminalitet er imidlertid også velkjente, men oppfattes vanligvis mest knyttet til inntak av store mengder alkohol.
For personer uten alkoholavhengighet eller rusproblemer vil spørsmålet om hvorvidt alkohol kan nytes i moderate mengder uten negative helseeffekter være relevant. Ettersom det ikke foreligger klare negative effekter av et forsiktig alkoholkonsum i forhold til hjerte- og karsykdom, vil personer med økt risiko for hjerte- og karsykdom trolig velge å bruke alkohol ut fra sine generelle vaner og tradisjoner.
Referanser
41. Sammenhengen mellom inntak av alkoholholdige drikker og risiko for hjerte- og karsykdom. Rapport fra Kunnskapssenteret - Systematisk oversikt nr. 13 - 2013 https://www.helsedirektoratet.no/referanse/0002-0013-177704
42. Association of alcohol consumption with selected cardiovascular disease outcomes: a systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-177705
43. Alcohol consumption and risk of heart failure: the Atherosclerosis Risk in Communities Study https://www.helsedirektoratet.no/referanse/0002-0013-177706
44. Light-to-moderate drinking and incident heart failure - the Norwegian HUNT study https://www.helsedirektoratet.no/referanse/0002-0013-177707
45. Alcohol and cardiovascular diseases: where do we stand today? https://www.helsedirektoratet.no/referanse/0002-0013-177708
46. Effects of Initiating Moderate Alcohol Intake on Cardiometabolic Risk in Adults With Type 2 Diabetes: A 2-Year Randomized, Controlled Trial https://www.helsedirektoratet.no/referanse/0002-0013-177709
47. Association between alcohol and cardiovascular disease: Mendelian randomisation analysis based on individual participant data https://www.helsedirektoratet.no/referanse/0002-0013-177710
48. Diet, nutrition and the prevention of chronic diseases: report of a Joint WHO/FAO Expert. Consultation (2003) World Health Organization. WHO technical report series ISSN/ISBN: 92-4-120916-x https://www.helsedirektoratet.no/referanse/0002-0013-177711
49. Alcohol: no ordinary commodity: research and public policy (2003) https://www.helsedirektoratet.no/referanse/0002-0013-177712
50. Alcohol consumption and site-specific cancer risk: a comprehensive dose-response meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-177713
51. The Mediterranean diet, its components, and cardiovascular disease https://www.helsedirektoratet.no/referanse/0002-0013-177714
52. Rapport fra Helsedirektoratet 2014, Anbefalinger om kosthold, ernæring og fysisk aktivitet, IS-2170 https://www.helsedirektoratet.no/referanse/0002-0013-177715
53. Gémes K, Janszky I, Ahnve S, et al. Light-to-moderate drinking and incident heart failure - the Norwegian HUNT study. Int J Cardiol. 2016; 203:553-560. doi: 10.1016/j.ijcard.2015.10.179 https://www.helsedirektoratet.no/referanse/0002-0013-177716
54. Balakrishnan R, Allender S., Scarborough P, Webster P, Rayner, M. The burden of alcohol-related ill health in the United Kingdom. J Public Health 2009; 31: 366-73. :366-373 https://www.helsedirektoratet.no/referanse/0002-0013-177717
Sist faglig oppdatert: 05.03.2018
Fysisk aktivitet ved primærforebygging av hjerte- og karsykdommer
For forebygging av hjerte- og karsykdom bør voksne følge hovedprinsippene i de generelle befolkningsråd om fysisk aktivitet som er beskrevet i Helsedirektoratets Anbefalinger om fysisk aktivitet. Se også Aktivitetshåndboken for nærmere beskrivelse.
For å redusere risiko for hjerte- og karsykdom er de viktigste punktene som følger:
- Voksne og eldre bør være fysisk aktive i minst 150 minutter med moderat intensitet per uke eller minst 75 minutter med høy intensitet per uke. Anbefalingen kan også oppfylles med kombinasjon av moderat og høy intensitet, for eksempel 90 minutter med moderat intensitet og 30 minutter med høy intensitet. Aktiviteten kan deles opp i bolker på minst 10 minutters varighet.
- Økt dose gir større gevinst. For å oppnå ytterligere helsegevinster bør voksne og eldre utøve inntil 300 minutter øke med moderat fysisk aktivitet i uken, eller utføre inntil 150 minutter med høy intensitet, eller en tilsvarende kombinasjon av moderat og høy intensitet.
- Øvelser som gir økt muskelstyrke til store muskelgrupper bør utføres to eller flere dager i uken.
- Reduser stillesitting.
Praktisk – slik kan anbefalingen følges
Generelt vil fysisk aktivitet innebære å bevege seg, eller å bruke kroppen. Det kan innbefatte fysisk arbeid, hverdagsaktivitet, mosjon, lek, lett og intens trening og idrett.
Fysisk aktivitet defineres ofte slik: Enhver kroppslig bevegelse som resulterer i en vesentlig økning i energiforbruket utover stillesitting.
Mosjon beskrives som en aktivitet som skal styrke ens helsetilstand. Mosjon brukes ofte synonymt med ordet trim, å mosjonere eller å trimme.
Trening er fysisk aktivitet som er planlagt, strukturert og som gjentas med mål å bedre eller vedlikeholde fysisk form.
- Lett intensitet tilsvarer aktiviteter som i liten grad påvirker pust og puls, for eksempel rolig gange.
- Moderat intensitet tilsvarer aktiviteter som øker pust og puls, men ikke mer enn at du fortsatt er i stand til å føre en samtale. Eksempler er hurtig gange eller lett jogging.
- Høy intensitet tilsvarer aktiviteter som øker pust og puls slik at du ikke er i stand til å føre en samtale. Eksempler er løping, gange og sykling i motbakke/med høy motstand.
- Være fysisk aktiv omtrent 30 minutter daglig med moderat til høy intensitet.
- Drive styrketrening av store muskelgrupper (rygg, setemuskulatur og ben) bør utføres to eller flere dager i uken og kan inngå i den totale aktiviteten. Styrkeøvelser bør tilpasses den enkelte med hensyn til type øvelser, antall sett, antall repetisjoner.
- Huske hverdagsaktivitet - all aktivitet er bedre enn ingen aktivitet.
- Redusere stillesitting.
Hverdagsaktiviteter vil gi vesentlige helseeffekter såframt slike aktiviteter kan videreføres på permanent basis. Aktuelle eksempler er å gå i trapper, gå eller sykle til og fra jobb, skole, barnehage og butikk, gjøre husarbeid og hagearbeid, leke med barn og barnebarn og gå tur med hunden.
Se også Aktivitetshåndboken og Nasjonalt kompetansesenter for trening som medisin for flere forslag til hverdagsaktiviteter.
Den største reduksjonen i risiko for tidlig død ser man mellom de som er inaktive og de som er litt aktive (Grimsmo J m.fl. 2010). Det vil si at det er viktig å stimulere de som ikke driver med noen form for aktivitet til å begynne. For de fleste vil økning av aktivitet gi ytterligere helsegevinst, men på høyeste nivå er det beskjeden nytte.
Personer som ikke kan følge rådene på grunn av nedsatt funksjonsnivå eller en sviktende helse, anbefales å være så fysisk aktive som evne og helsetilstand tillater.
Begrunnelse – dette er anbefalingen basert på
Det foreligger overbevisende dokumentasjon med konsistente funn som bekrefter at lavt nivå av fysisk aktivitet er forbundet med økt risiko for hjerte- og karsykdom, og at selv en liten økning i aktivitetsnivå vil bedre leveutsikter. Økt fysisk aktivitet har også en rekke andre positive helseeffekter og innebærer svært få ulemper når aktiviteten tilpasses individuelle hensyn. Det er viktig at leger og annet helsepersonell fremmer betydningen av fysisk aktivitet som et virkemiddel for bedre helse og redusert risiko, slik at personene selv kan få et godt virkemiddel for å ivareta egen helse.
Forskningsgrunnlag
Populasjon (P): Personer med økt risiko for hjerte- og karsykdom
Tiltak (I): Råd og tiltak for økt fysisk aktivitet
Sammenligning (C): Ingen tiltak
Beskrivelse av inkluderte studier
En rekke epidemiologiske studier bekrefter at lavt nivå av fysisk aktivitet er forbundet med økt sykelighet og dødelighet av hjerte- og karsykdom. Gevinsten ved økt fysisk aktivitet synes særlig å være stor ved en økning fra ingen aktivitet til noe aktivitet, men for de fleste vil enhver økning av aktiviteten innebære helsemessige fordeler. Dette gjelder likevel ikke for de som allerede driver svært intens trening de fleste dager i uken. En norsk analyse viser at de som er fysisk aktive vinner i gjennomsnitt åtte leveår med god helse sammenlignet med personer som er inaktive.
Dette innefatter både økt levetid og økt livskvalitet (Helsedirektoratet. Rapport IS-1794 2010, hoveddokumentasjon).
Vurdering
Fordeler og ulemper
Fordeler
Det foreligger overbevisende dokumentasjon om betydelig helsegevinster ved regelmessig fysisk aktivitet i alle aldersgrupper (1 – 8), og samtidig viser undersøkelser at kun 32 % av voksne når opp til Helsedirektoratets minimumsanbefaling for fysisk aktivitet (Helsedirektoratet. Nasjonal kartlegging 2014-2015. Rapport IS-2367).
Effektene av fysisk aktivitet er mange og sammensatte, men inkluderer gunstige endringer av en rekke metabolske faktorer inkludert økning av HDL-kolesterol, reduksjon i triglyserider, lavere kroppsmasseindeks, livvidde og lavere kardiovaskulær risikoskår (Framingham risiko skår) (Nicole L m.fl. 2013). I tillegg kommer effekter på hjertets struktur og funksjon, samt egenskaper ved pulsårene (karstivhet). Trening gir lavere puls både i hvile og aktivitet, lavere blodtrykk, økt slagvolum og bedring av hjertets sammentrekning.
Per i dag foreligger det ikke randomiserte kontrollerte studier som viser overlevelsesgevinst ved tiltak for økt fysisk aktivitet, men konsistente og overbevisende funn fra en rekke store observasjonsstudier (Eijsvogels TMH m.fl. 2016, Chomistek AK m.fl. 2013, Sattelmair J m.fl. 2011, Nocon M m.fl. 2008).
I en oversiktsanalyse er det vist til at helsegevinster er sett på ulike nivåer av fysisk aktivitet, med større effekter med høyere aktivitet (Eijsvogels TMH m.fl. 2016). Personer i en amerikansk undersøkelse som løp ca. 50 minutter per uke hadde f. eks. reduksjon i kardiovaskulær død tilsvarende en hasard ratio (HR) på 0,45, (95% CI 0,31-0,66) og tilsvarende reduksjon i total dødelighet med HR 0,70 (95% CI 0,58-0,85). I en undersøkelse fra Taiwan ga moderat intens trening med varighet 90 minutter per uke en reduksjon i kardiovaskulær død tilsvarende HR 0,81 (95% CI 0,71-0,93) sammenliknet med inaktive personer. En stor europeisk og amerikansk analyse med over 600.000 personer fant også at aktivitet som var mindre enn de anbefalte minutter per uke var assosiert med reduksjon i kardiovaskulær død tilsvarende HR 0,80 (95% CI 0,77-0,84) og også reduksjon i total dødelighet tilsvarende HR 0,80 (95% CI 0,78-0,82), sammenliknet med helt inaktive personer.
Ulemper
Oppstart av fysisk aktivitet eller økning av aktivitetsnivået kan føre til belastningsskader, kroppslig ubehag i form av stivhet, stølhet, eller lette smerter i ledd og muskulatur. Plagene er vanligvis forbigående. Langvarig og intensiv utholdenhetstrening på konkurransenivå er assosiert med økt risiko for atrieflimmer (Myrstad M m.fl. 2013., Andersen K m.fl. 2013, Grimsmo J m.fl. 2010, Gjesdal K m.fl. 2015, U.S.Department of Health and Human Services 2008).
Fordelene ved økt fysisk aktivitet anses som klart større enn ulempene.
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen vurderes som lav
Verdier og preferanser
Anbefalt nivå av fysisk aktivitet innebærer redusert risiko for alvorlig hjerte- og karsykdom og diabetes.
Råd om endring av levevaner kan komme i konflikt med enkeltmenneskers behov for selv å bestemme hvordan man vil leve. Følgende grunner oppgis oftest på hvorfor de ikke er nok fysisk aktive: «har ikke tid», «orker ikke» og «vil bruke tiden på andre ting» (Helsedirektoratet. Nasjonal kartlegging 2014-2015. Rapport IS-2367).
Det tidkrevende å legge inn i timeplanen fysisk aktivitet, særlig i starten. Mange har travle liv fra før, og det kan komme som en ekstra belastning. Det kan også føre til en del dårlig samvittighet dersom man ikke klarer å trene som det er anbefalt. For noen er det bare er aktuelt å trene inne, da kan avgift på treningssenter være en belastning for økonomien.
For mange gir trening økt velvære og økt mestringsfølelse, man føler seg sterkere fysisk og mentalt. Det kan oppleves som om man får mere energi av trening. Flere oppgir at de er fysisk aktiv for å forebygge helseplager, komme i bedre form, få økt fysisk og psykisk velvære, få frisk luft og holde vekten nede (Helsedirektoratet. Nasjonal kartlegging 2014-2015. Rapport IS-2367).
Beregninger viser at de som er fysisk aktive vinner i gjennomsnitt åtte leveår med god helse sammenlignet med personer som er inaktive.
Dette innefatter både økt levetid og økt livskvalitet ( Helsedirektoratet. Rapport IS-1794 2010).
Undersøkelser viser at en stor del av den norske befolkning ligger under anbefalt nivå for fysisk aktivitet (Helsedirektoratet. Rapport IS-2367).
Referanser
55. Helsedirektoratet. Fysisk aktivitet og sedat tid blant voksne og eldre i Norge. Nasjonal kartlegging 2014-2015. Rapport IS-2367. https://helsedirektoratet.no/publikasjoner/fysisk- https://www.helsedirektoratet.no/referanse/0002-0013-177718
56. Helsedirektoratet. Vunne kvalitetsjusterte leveår (QALYs) ved fysisk aktivitet. Rapport IS-1794. 08/2010 https://www.helsedirektoratet.no/referanse/0002-0013-177719
57. Nicole L. Glazer, NL, Asya Lyass, A 3, Dale W. Et al. Sustained and Shorter Bouts of Physical Activity are Related toCardiovascular Health. Med Sci Sports Exerc. 2013 January ; 45(1): 109–115. doi:10.1249/MSS.0b013e31826beae5 https://www.helsedirektoratet.no/referanse/0002-0013-177720
58. Nordic Nutrition Recommendations 2012 - Integrating nutrition and physical activity. Nord 2014:002, Nordic Council of Ministers, Copenhagen 2014. http://dx.doi.org/10.6027/Nord2014-002 https://www.helsedirektoratet.no/referanse/0002-0013-177721
59. Warburton DE, Charlesworth S, Ivey A, Nettlefold L, Bredin SS. A systematic review of the evidence for Canada's Physical Activity Guidelines for Adults. Int J Behav Nutr Phys Act2010;7:39 https://www.helsedirektoratet.no/referanse/0002-0013-177722
60. Blair S, Kohl III H, Paffenbarger R et al. Physical Fitness and All-Cause Mortality. A Prospective Study of Healthy Men and Women. JAMA 1989; 262: 2395-401 https://www.helsedirektoratet.no/referanse/0002-0013-177723
61. Chomistek AK, Manson JE, Stefanick ML et al. Relationship of sedentary behavior and physical activity to incident cardiovascular disease: results from the Women's Health Initiative. J Am Coll Cardiol 2013; 61: 2346-54 https://www.helsedirektoratet.no/referanse/0002-0013-177724
62. Eijsvogels TMH, Molossi S, Lee DC et al. Exercise at the Extremes: The Amount of Exercise to Reduce Cardiovascular Events. J Am Coll Cardiol 2016; 67: 316-29. doi: 10.1016/j.jacc.2015.11.034 https://www.helsedirektoratet.no/referanse/0002-0013-177725
63. Ekelund U, Ward HA, Norat T et al. Activity and all-cause mortality across levels of overall and abdominal adiposity in European men and women: the European Prospective Investigation into Cancer and Nutrition Study (EPIC). AmJ Clin Nutr; 2015; 101:613-21 https://www.helsedirektoratet.no/referanse/0002-0013-177726
64. Gjesdal K, Grundvold I. Atrial fibrillation and exercise in women: some answers given, some questions remain. Heart 2015; 101; 1605-6 https://www.helsedirektoratet.no/referanse/0002-0013-177727
65. Grimsmo J, Grundvold I, Maehlum S, Arnesen H. High prevalence of atrial fibrillation in long-term endurance cross-country skiers: echocardiographic findings and possible predictors--a 28-30 years follow-up study. Eur J Cardiovasc Prev Rehab 2010; 17: 100-5 https://www.helsedirektoratet.no/referanse/0002-0013-177728
66. Helsedirektoratet. Anbefalinger om kosthold, ernæring og fysisk aktivitet. Rapport IS-2170. Oslo: Helsedirektoratet, 2014. https:helsedirektoratet.no/Lists/Publikasjoner/ Attachments/806/Anbefalinger-om-kostholdernering-og-fysisk-aktivitet-IS-2170.pdf (6.7.2015) https://www.helsedirektoratet.no/referanse/0002-0013-177729
67. Kriemler S, Meyer U, Martin E, van Sluijs EM, Andersen LB, Martin BW. Effect of school basedinterventions on physical activity and fitness in children and adolescents: a review of reviews and systematic update. Br J Sports Med 2011; 45:923-30 https://www.helsedirektoratet.no/referanse/0002-0013-177730
68. Myrstad M, Løchen ML, Graff-Iversen S et al. Increased risk of atrial fibrillation among elderly Norwegian men with a history of long term endurance sport practice. Scand J Med Sci Sports 2014;24;e238-44Doi: 10.111/sms.12150 https://www.helsedirektoratet.no/referanse/0002-0013-177731
69. Glazer NL LyassA, Esliger DW et al. Sustained and Shorter Bouts of Physical Activity are Related to Cardiovascular Health. Med Sci Sports Exerc 2013; 45: 109–15. doi:10.1249/MSS.0b013e31826beae5 https://www.helsedirektoratet.no/referanse/0002-0013-177732
70. Nocon M, Hiemann T, Müller-Riemenschneider F, Thalau F, Roll S, Willich SN. Association of physical activity with all-cause and cardiovascular mortality: a systematic review and meta-analysis. Eur J Cardiovasc Prev Rehabil 2008; 15:239-46 https://www.helsedirektoratet.no/referanse/0002-0013-177733
71. Sandvik L, Erikssen J, Thaulow E et al. Physical fitness as a predictor of mortality among healthy, middle-aged Norwegian men. N Engl J Med1993; 328: 533-7 https://www.helsedirektoratet.no/referanse/0002-0013-177734
72. Sattelmair J, Pertman J, Ding EL, Kohl HW 3rd, Haskell W, Lee IM. Dose response between physical activity and risk of coronary heart disease: a meta-analysis. Circulation 2011; 124: 789-95 https://www.helsedirektoratet.no/referanse/0002-0013-177735
73. World Health Organization (WHO). Global recommendations on physical activity for health. Switzerland: World Health Organization, 2010 https://www.helsedirektoratet.no/referanse/0002-0013-177736
74. Andersen K, Farahmand B, Ahlbom A et al. Risk of arrhythmias in 52 755 long-distance cross-country skiers: a cohort study. Eur Heart J 2013; 34: 3624-31 https://www.helsedirektoratet.no/referanse/0002-0013-177737
75. U.S.Department of Health and Human Services. 2008 Physical Activity Guidelines for Americans. Atlanta, GA: National Center for Chronic Disease Prevention and Health Promotion, 2008 https://www.helsedirektoratet.no/referanse/0002-0013-177738
Sist faglig oppdatert: 05.03.2018
Røykeslutt ved primær- og sekundærforebygging av hjerte- og karsykdom
Hos personer med påvist hjerte- og karsykdom eller ekstra høy risiko for slik sykdom er hjelp til røykeslutt et av de aller viktigste helsebringende tiltak vi kjenner. Prinsippene er utførlig beskrevet i Nasjonal faglig retningslinje om røykeavvenning , og en ekstra aktiv innsats er berettiget når det foreligger manifest sykdom eller ekstra høy risiko. Hovedpunkter i tilnærmingen i denne situasjonen er som følger:
- Kartlegg røykevaner ved alle egnede konsultasjoner og gi konkret tilbud om hjelp til røykeslutt med både legemiddelbehandling og strukturert (planlagt) motivasjonsstøtte.
- Av og til-røyking medfører økning av risiko for hjerte- og karsykdom, og bør frarådes.
.
Praktisk – slik kan anbefalingen følges
På grunn av den ekstra høye risikoen som fortsatt røyking medfører for personer med hjerte- og karsykdom (eller særlig høy risiko for slik sykdom), bør man ikke avvente at personen uttrykker motivasjon for å slutte, men som hovedregel alltid tilby hjelp til røykeslutt inkludert legemiddelbehandling. Prinsippene for røykeavvenning er for øvrig de samme for denne gruppen som de som angår den generelle befolkning (se Nasjonal faglig retningslinje om røykeavvenning) . Dette inkluderer prinsippene for strukturert hjelp og motivasjonsstøtte og motiverende samtale (Lee WW m.fl. 2016). Se Motiverende intervju.
De fleste røykere med hjerte- og karsykdom eller risiko for hjerte- og karsykdom ønsker å slutte, men mange stoppes av fysisk og psykisk avhengighet og det faktum at å ta et trekk av en sigarett er en sterkt innarbeidet vane. Nikotin blir tatt opp i kapillært blod i alveolene og passerer gjennom hjernen innen 10-19 sekunder fra inhalasjon. Nikotin fester seg så til acetylkolinreseptorer i belønningssystemet i hjernen og dopaminproduksjon stimuleres (Benowitz NL 2010). Når røykingen er etablert, øker tettheten av reseptorene i hjernen og tilbakefall til røyking etter et sluttforsøk er vanlig. De vanligste symptomene på abstinens er sug, økt matlyst og vektoppgang, irritabilitet, rastløshet og nedsatt konsentrasjonsevne. De fleste symptomene avtar i løpet av 2-4 uker, mens sug og økt matlyst kan vedvare mye lengre. Legemiddelbehandling kan motvirke flere av de nevnte ubehag knyttet til røykeslutt og øker sjansene for vedvarende røykfrihet. Det er derfor nyttig at man har praktisk kjennskap til de ulike alternativer.
Praktiske råd ved bruk av nikotinlegemidler
- Informer om at nikotinlegemidler gir lavere nikotinnivå enn røyking og nivået oppnås saktere, dermed er faren for avhengighet liten.
- Hjerte- og kar og andre sykdommer knyttes i ubetydelig grad til nikotin, men i stor grad til karbonoksid, tjære og andre av flere tusen toksiske stoffer i sigarettrøyk.
- Best resultat oppnås ved å kombinere et langtidsvirkende nikotinlegemiddel (for eksempel plaster) med et kortidsvirkende nikotinlegemiddel (for eksempel tyggegummi, sugetabletter, munnspray og inhalator).
- Bruk middels eller høy dose av depotplaster for de fleste røykere.
- Både depotplaster som avgir dosen over 16 timer og depotplaster som avgir dosen over 24 timer er effektive.
- Mengdene som brukes må være tilstrekkelige for å stoppe suget etter nikotin.
- I tillegg til nikotinplaster brukes de andre typer nikotinpreparater etter behov, anslagsvis 4-6 ganger daglig.
- Vanlig varighet av behandlingen er 3 måneder, men lengre bruk medfører ikke ulemper sammenliknet med tilbakefall til sigarettrøyking.
- Nikotinlegemidler brukes som hjelp til total røykestopp eller for å redusere røykingen.
- Nikotinlegemidler i adekvate doser kan redusere vektøkning i behandlingsperioden.
Praktiske råd ved bruk av vareniklin
- Informer om at vareniklin hindrer nikotin i å binde seg til nikotinreseptorene i hjernen samt demper sug
- Vareniklin startes 8-35 dager før sluttdagen og brukes i 3-6 måneder.
- Doseringen er 0,5 mg i 3 dager, deretter 0,5 mg x 2 i 4 dager, så 1 mg x 2.
- De vanligste bivirkninger er kvalme, søvnproblemer og unormale drømmer.
- Nevropsykiatriske bivirkninger annet enn søvnproblemer er ikke påvist i meta-analyse av randomiserte studier (Thomas KH m.fl. 2015).
- For røykere som har sluttet etter 12 uker kan behandling i ytterligere 12 uker vurderes for å redusere risikoen for tilbakefall.
- Vareniklin øker sluttraten hos røykere som vil prøve å slutte totalt og til de som ønsker å redusere i første omgang, samt hos røykere som har begynt å røyke igjen etter tidligere sluttforsøk ved hjelp av vareniklin.
- Vareniklin har kun minimal effekt for å redusere vektøkning i behandlingsperioden.
Praktiske råd ved bruk av bupropion
- Bupropion er et antidepressivt legemiddel som hemmer nedbrytning av noradrenalin og dopamin i hjernen.
- Doseringen er 150 mg de første 6 dagene, så 150 mg x 2 i 2 måneder, med røykesluttdag i den andre uken.
- Bupropion kan redusere vektøkning i behandlingsperioden.
Andre former for tobakksbruk enn daglig røyking
Bruk av snus og e-sigarett er ikke helsemessig gunstig og bør generelt frarådes. De overnevnte medikamentelle hjelpemidler er derfor førstevalg ved røykeavvenning. Snus er likevel assosiert med betydelig mindre risiko for hjerte- og karsykdom enn sigaretter (Morris PB m.fl. 2015). Hvis behandlinger med legemidler ikke fører frem, bør ikke snus eller e-sigaretter frarådes som hjelpemiddel for å oppnå røykeslutt. Slik behandling har likevel mangelfull dokumentasjon sammenliknet med støttebehandling med legemidler. Se også rapporten E-sigaretter (elektroniske sigaretter) og regelverk.
Fest-røykere og andre ikke daglig-røykere anbefales sterkt å slutte. Støttebehandling med legemidler er ikke dokumentert hos disse gruppene, men erfaringsmessig kan nikotinlegemidler være nyttig.
Også passiv røyking har skadelige effekter, og dette bør unngås hos personer med høy risiko eller manifest hjerte- og karsykdom. Det vil derfor være nyttig at det ytes hjelp til røykeslutt også hos familiemedlemmer der dette er mulig.
Begrunnelse – dette er anbefalingen basert på
Tallrike epidemiologiske studier og noen intervensjonsstudier viser stor og rask effekt av røykeslutt for å redusere risikoen for hjerte- og karsykdom, med betydelige effekter både på sykelighet og dødelighet (Critchley JA m.fl. 2003). Også av og til røyking forbundet med merkbart økt risiko (Schane RE m.fl.2010), slik at dette bør klar frarådes. I den generelle befolkningen slutter bare ca 1 % årlig å røyke, men målrettede tiltak kan øke den spontane sluttraten betydelig. Legeråd alene (minimal intervensjon) har klar effekt, men ved samtidig bruk av nikotinerstatning eller bupropion og motivasjonsstøtte vil prosenten som lykkes bli doblet sammenliknet med motivasjonsstøtte alene. Behandling med vareniklin og motivasjonsstøtte øker suksessraten ytterligere. Aktiv innsats for å hjelpe personer med røykeslutt, inkludert tilbud om medikamentell støtte, er derfor et svært viktig og kostnadseffektivt tiltak for forebygging av hjerte- og karsykdom.
Forskningsgrunnlag
Populasjon (P): Personer med økt risiko for hjerte- og karsykdom, eller med kjent slik sykdom
Tiltak (I): Tiltak for å fremme røykeslutt
Sammenligning (C): Ingen tiltak for røykeslutt
Beskrivelse av inkluderte studier
Røykeslutt er det mest effektive tiltaket for å redusere risiko for hjerte- og karsykdom blant røykere, og gir raskere effekt enn behandling med statiner og andre forebyggende medikamenter (Critchley JA m.fl. 2003). Risikoen for hjerte- og karsykdom reduseres med 50 % innen ett år etter røykeslutt (Ockene IS m.fl. 1997). Hos pasienter med hjerte- og karsykdom reduseres risiko for nytt infarkt med 32 % og dødelighet med 36 % (Critchley JA m.fl. 2003). Forholdet mellom røyking og risiko for sykdom og død er ikke lineært (Ockene IS m.fl. 1997), og også festrøyking eller av og til røyking er forbundet med merkbart økt risiko (Schane RE m.fl.2010).
I den generelle populasjonen slutter ca 1 % å røyke årlig. Tiltak for å fremme røykeslutt kan øke den spontane sluttraten betydelig. Med legeråd (minimal intervensjon) uten medikamentell støtte vil prosenten som oppnår vellykket røykeslutt økes med 1-3 % etter ett år (Stead LF m.fl. 2013). Med nikotinerstatning eller bupropion og motivasjonsstøtte vil prosenten som lykkes dobles i forhold til motivasjonsstøtte og placebo (Cahill K m.fl. 2013, hoveddokumentasjon). Behandling med vareniklin og motivasjonsstøtte øker suksessraten med det tredobbelte (Cahill K m.fl. 2013). Vanlige sluttrater etter 1 år ved behandling med nikotinerstatning eller bupropion er ca. 10-15 % og med vareniklin ca. 20-22 %.
Vurdering
Fordeler og ulemper
Fordeler
Risikoen for hjerte- og karsykdom reduseres med 50 % innen ett år etter røykeslutt (Ockene IS m.fl. 1997). Hos pasienter med hjerte- og karsykdom reduseres risiko for nytt infarkt med 32 % og dødelighet med 36 % (Critchley JA m.fl. 2003). Røykeslutt er dermed det mest effektive livsstilstiltak for å redusere risiko og gir raskere effekt enn behandling med statiner og andre forebyggende legemidler (Critchley JA m.fl. 2003). Forholdet mellom røyking og risiko for sykdom og død er ikke-lineært (Ockene IS m.fl. 1997). Dermed er festrøyking eller av-og-til røyking forbundet med merkbart økt risiko (Schane RE m.fl.2010). Total røykeslutt er målet for å oppnå de største helsegevinstene.
I den generelle populasjonen slutter ca. 1 % årlig å røyke. Med legeråd (minimal intervensjon) uten legemiddelstøtte vil prosentandelen som oppnår vellykket røykeslutt økes med 1-3 prosentpoeng etter ett år (Stead LF m.fl. 2013). Med nikotinlegemidler eller bupropion kombinert med motivasjonsstøtte vil prosenten som lykkes dobles i forhold til placebo og motivasjonsstøtte (Cahill K m.fl. 2013).
Behandling med vareniklin og motivasjonsstøtte øker suksessraten med det tredobbelte (Cahill K m.fl. 2013). Vanlige sluttrater etter 1 år ved behandling med nikotinlegemidler eller bupropion er ca. 10-15 % og med vareniklin ca. 20-22 %. Effekten av vareniklin, buproprion og nikotinplaster ble sammenliknet med placebo for hvert medikament hos 8144 røykere (Anthenelli RM m.fl. 2016). Behandling med vareniklin viste størst effekt på sluttrater etter 12 uker sammenliknet med placebo (odds ratio 3,61; 95 % KI 3,07-4,24), og var også mer effektivt enn nikotinplaster (odds ratio 1,68; 95 % KI 1,46-1,93) og bupropion (odds ratio 1,75; 95 % KI 1,52-2,01).
Ulemper
Røykeslutt fører til vektøkning hos over 80 % av personene som prøver å slutte. Mens en vektoppgang på 2-3 kg er "til å leve med", kan personer med anlegg for overvekt gå opp mer. Allikevel er røyking mer skadelig enn vektøkningen (Siahpush M m.fl. 2014).
Det ha vært usikkerhet rundt mulige nevropsykiatriske bivirkninger av medikamenter for røykavvenning, men studien nevnt ovenfor fant ingen sikker økning i disse bivirkninger hos røykere behandlet med vareniklin eller bupropion sammenliknet med nikotinplaster eller placebo, heller ikke blant 4116 med psykiatrisk diagnose som var inkludert i denne undersøkelsen (Anthenelli RM m.fl. 2016). Ut fra konfidensintervallene ble det vurdert som svært usannsynlig at varineklin eller bupropion øker moderat til alvorlige nevropsykiatriske bivirkninger mer enn 1,5 prosentpoeng hos røykere uten psykiatrisk sykdom, og tilsvarende ikke mer enn 4 prosentpoeng hos røykere med psykiatriske tilstander. Dataene er ellers forenelige med at disse preparatene ikke gir noen signifikant økning i nevropsykiatriske ugunstige hendelser.
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen vurderes som lav.
Verdier og preferanser
Tiltak mot røykeslutt vil representere svært stor helsegevinst for personer som lykkes med dette, og vil i tillegg gi mange fordeler både økonomisk, i form av respons fra omgivelsene og med tanke på egen mestringsopplevelse.
Når personen ikke lykkes, kan det derimot oppleves belastende, og det er viktig at leger og helsepersonell ikke viser seg fordømmende i en slik situasjon. I stedet bør man informere om at vellykket røykeslutt hos de fleste vil kreve mer enn ett sluttforsøk, og at man vil hjelpe pasienten videre.
For noen pasienter kan gjentatt påpeking av ugunstige røykevaner oppleves som en belastning, og som et inngrep i personens rett til å bestemme over seg selv og gjøre sine egne valg. Teknikken med motiverende intervju kan da med fordel benyttes, slik at personen selv blir spurt om han eller hun ser noen fordeler dersom man klarte å slutte å røyke.
Referanser
76. Baker TB, Piper ME, McCarthy DE et al. Time to first cigarette in the morning as an index of ability to quit smoking: implications for nicotine dependence. Nicotine Tob Res 2007; 9(suppl 4): S555-S70 https://www.helsedirektoratet.no/referanse/0002-0013-177739
77. Benowitz NL. Nicotine addiction. N Engl J Med 2010; 362: 2295-303 https://www.helsedirektoratet.no/referanse/0002-0013-177740
78. Cahill K, Stevens S, Perera R, Lancaster T. Pharmacological interventions for smoking cessation: an overview and network meta-analysis. Cochrane Database Syst Rev 2013; 31:5:CD009329 https://www.helsedirektoratet.no/referanse/0002-0013-177741
79. Critchley JA, Capewell S. Mortality risk reduction associated with smoking cessation in patients with coronary heart disease: a systematic review. JAMA 2003; 290:86-97 https://www.helsedirektoratet.no/referanse/0002-0013-177742
80. Ockene IS, Miller NH. Cigarette smoking, cardiovascular disease, and stroke: a statement for healthcare professionals from the American Heart Association. Circulation 1997; 96: 3243-7 https://www.helsedirektoratet.no/referanse/0002-0013-177743
81. Mills EJ, Thorlund K, Eapen S, Wu P, Prochaska JJ. Cardiovascular events associated with smoking cessation pharmacotherapies: a network meta-analysis. Circulation 2014; 129: 28-41 https://www.helsedirektoratet.no/referanse/0002-0013-177744
82. Morris PB, Ference BA Jahangir E, et al. Cardiovascular effects of exposure to cigarette smoke and electronic cigarettes. J Am Coll Cardiol 2015; 66: 1378-91 https://www.helsedirektoratet.no/referanse/0002-0013-177745
83. Schane RE, Ling PM, Glantz SA. Health effects of light and intermittent smoking: a review. Circulation 2010; 121: 1518-22 https://www.helsedirektoratet.no/referanse/0002-0013-177746
84. Siahpush M, Singh GK, Tibbits M, Pinard CA, Shaikh RA, Yaroch A. It is better to be a fat ex-smoker than a thin smoker: findings from the 1997-2004 National Health Interview Survey-National Death Index linkage study. Tob Control 2014; 23: 395-402 https://www.helsedirektoratet.no/referanse/0002-0013-177747
85. Stead LF, Buitrago D, Preciado N, Sanchez G, Hartmann-Boyce J, Lancaster T. Physician advice for smoking cessation. Cochrane Database of Systematic Reviews. 2013;5:CD000165 https://www.helsedirektoratet.no/referanse/0002-0013-177748
86. Thomas KH, Martin RM, Knipe DW, Higgins JPT, Gunnell D. Risk of neuropsychiatric adverse events associated with varenicline: systematic review and meta-analysis. BMJ 2015; 350: h1109 https://www.helsedirektoratet.no/referanse/0002-0013-177749
87. Anthenelli RM, Benowitz NL, West R et al. Neuropsychiatric safety and efficacy of varenicline, bupropion, and nicotine patch in smokers with and without psychiatric disorders (EAGLES): a double-blind, randomised, placebo-controlled clinical trials Lancet 2016; published online April 22, 2016 https://www.helsedirektoratet.no/referanse/0002-0013-177750
88. Lee WW, Choi KC, Yum RW, Yu DS, Chair SY. Effectiveness of motivational interviewing on lifestyle modification and health outcomes of clients at risk or diagnosed with cardiovascular diseases: a systematic review. Int? J Nurs Stud 2016; 53: 331-41 https://www.helsedirektoratet.no/referanse/0002-0013-177751
Sist faglig oppdatert: 05.03.2018
Kostråd ved primær- og sekundærforebygging av hjerte- og karsykdommer
Personer med kjent hjerte- og karsykdom eller økt risiko bør tilbys råd om kosthold i henhold til Helsedirektoratets kostråd
Dette foreligger særlig vitenskapelig grunnlag for følgende hovedanbefalinger:
- Økt andel plantebaserte matvarer som inneholder umettet fett, inkludert planteoljer som olivenolje og rapsolje og nøtter, med reduksjon i matvarer med mettet fett fra kjøttvarer.
- Økt andel grønnsaker, salat, belgfrukter og frukt, samt grove kornprodukter, med reduksjon i finere kornprodukter som bakevarer av hvitt mel og søte frokostblandinger.
- Hvitt kjøtt (kylling, kalkun), fisk og skalldyr i stedet for rødt kjøtt.
- Begrenset inntak av salt, smør, sukker, mat og drikke med høyt sukkerinnhold, samt bearbeidede kjøttvarer.
- Et vegetarbasert kosthold kan være gunstig i forhold til hjerte- og karrisiko.
- Friske personer med et variert kosthold har ingen dokumentert nytte av kosttilskudd (vitaminer, antioksidanter og lignende).
Praktisk – slik kan anbefalingen følges
Kostråd bør fortrinnsvis gis ut fra matvarer istedenfor næringsstoffer og må i noen grad tilpasses pasientenes ulike tilstander (hyperlipidemier, hypertensjon, overvekt og diabetes). Hovedtrekkene i et anbefalt kosthold er likevel felles for alle personer med økt kardiovaskulær risiko (Mozaffarian D 2016). Utover disse kjerneråd vil det være noen nyanser for de ulike risikotilstander, men disse er totalt sett av mindre betydning.
Å få til vedvarende endringer av kostvaner er krevende, og forutsetter oppfølging over tid. Det er viktig å utnytte ressurser som er tilgjengelig lokalt, og tilbud om kostråd/kurs ved frisklivssentraler kan være nyttig for mange.
Kartlegging: Spør om kostvaner
- La gjerne pasienten fortelle om matinntaket dagen før konsultasjonen og spør hvordan denne dagen skiller seg fra helgedager eller andre hverdager. Selv om en dag er tilfeldig og ikke gir en fullstendig oversikt, kan det gi verdifull informasjon om matvarevalg og variasjon i kostholdet.
- Få frem inntaket av frukt og grønt.
- Kartlegg saltinntaket hvis personen har høyt blodtrykk.
- Forsøk å få et inntrykk av måltidsrytmer og inntaket av snacks og sjokolade/søtsaker på ukebasis eller i perioder.
- Kartlegg situasjonen i forhold til vektutvikling og eventuelle forsøk på å gå ned i vekt.
Råd om kosthold ved økt kardiovaskulær risiko, hyperlipidemier og høyt blodtrykk
Anbefal økt andel plantebaserte matvarer som inneholder umettet fett
- Kaldpresset (Extra virgin) olivenolje – opptil 4 ss daglig istedenfor annen fett i matlaging, sauser og salater. Personer som ikke liker olivenolje, kan velge rapsolje eller rapsoljebasert margarin eller -majones.
- Usaltede nøtter og frø – 30 gram daglig (1 håndfull nøtter).
- Avocado.
Anbefal økt andel grønnsaker, belgfrukter og frukt som inneholder løselige fibertyper og andre gunstige næringsstoffer
- Grønnsaker: 2-3 ganger daglig;
- Friske og fargerike som tomat, paprika, spinat, salat.
- Brokkoli, hodekål, rødkål, rosenkål, kålrot, gulrot, erter, asparges, rødbet, søtpotet.
- Frukt eller bær: 2-3 ganger daglig;
- Appelsin, pære, eple, nektarin, fersken, mango, banan.
- Tørket frukt som dadler, svisker, aprikos.
- Belgfrukter; bønner (svarte, brune, hvite), kikerter og linser: 2 porsjoner (á 150 g) i uken.
Anbefal meieriprodukter (helst fettreduserte for personer med høyt kolesterol eller høyt blodtrykk)
- Melk, ost, cottage-cheese, kesam, yogurt, skyr.
Anbefal hvitt kjøtt (kylling, kalkun), fisk og skalldyr i stedet for rødt kjøtt
Anbefal matvarer som inneholder omega-3 fettsyrer
- Fet fisk som makrell, laks, ørret, sardiner, sild eller tran (ev. omega-3 tilskudd).
- Planteoljer fra linfrø og raps – evt. istedenfor deler av olivenoljeporsjonen.
- Valnøtter.
Anbefal grove kornprodukter med høy andel løselige fibertyper
- Grovt brød og knekkebrød med havre, bygg, rug, nøtter og frø.
- Havre og bygg – som grøt og som grovbakst i brød, pizzabunn og rundstykker.
Som avslutning til et måltid eller ved søtsug
- Mørk sjokolade, frukt/bær eller ost er å foretrekke fremfor kaker og søte desserter
Anbefal lite eller kun av og til
- Søtsaker.
- Kaker, kjeks, boller, annen søtbakst, vanlige pannekaker og vafler.
- Oppblandede kjøttprodukter (pølse, kjøttdeig, farse, salami).
- Fete kjøttslag (kotelett med fettrand, bacon, flesk).
- Pommes frites, potetgull og annen salt snacks.
- Smør og hard margarin.
- Iskrem, seterrømme, Creme-Fraiche og kremfløte.
- Fruktjuice, søt smoothie.
- Ufiltrert kaffe
Anbefal ingen eller sjelden bruk
- Sukkerholdig drikke – brus, saft, sportsdrikk (pasienter med overvekt eller fedme bør unngå også fruktjuice, søt smoothie og redusere melkeinntaket)
I tillegg til å begrense sukkerinntaket kan personer med type 2 diabetes/insulinresistens eller høye triglycerider anbefales å følge de alternative kostmønstre i Nasjonal faglig retningslinje for diabetes.
Kostråd for å senke saltinntaket (særlig aktuelt ved høyt blodtrykk)
Kostrådene bør være individuelt tilpassede. De matvarene som inntas daglig og i store porsjoner har størst betydning.
- Hvis man spiser flere brødmåltider daglig, bak brødet selv, velg brød med nøkkelhull eller varier med havregrøt eller havregrynsbaserte kornblandinger.
- Velg pålegg med lite salt, se etter nøkkelhull og varier med mindre salte alternativer.
- Bruk mindre ferdigretter til middag og lag mer mat basert på rene råvarer.
- Hvis du spiser ferdigretter, spis mindre mengde og øk inntaket av grønnsaker.
- Reduser tilsatt salt i matlagningen ved å bruke hvitløk, urter og annet krydder som smakstilsetning.
- Velg usaltede nøtter som snacks.
- Velg vann i stedet for saltet mineralvann.
Begrunnelse – dette er anbefalingen basert på
Tallrike epidemiologiske studier og – i noe mindre grad – kontrollerte kliniske studier viser klar sammenheng mellom kosthold og risiko for hjerte- og karsykdom. Kontrollerte studier viser også signifikant reduksjon i så vel nivåer av risikofaktorer som kardiovaskulære hendelser når adekvate kostråd gis, primært basert på «middelhavskostholdet». Den epidemiologiske utviklingen av hjerte- og karsykdommer og risikofaktorer som blodtrykk og kolesterol i Norge, viser at kosthold og andre levevaner har avgjørende betydning, og derfor også stort potensial i forebyggingsarbeidet. Til tross for dette har kostråd i den senere tid vært omstridte, mye på bakgrunn av økende hyppighet av overvekt og tallrike alternative diettråd som har vært fremmet for å oppnå vektreduksjon. Det er derfor viktig at veldokumenterte sammenhenger mellom kosthold og hjerte- og karsykdom blir tydeliggjort, og at leger og annet helsepersonell er kjent med de viktigste elementer i et anbefalt kosthold.
Forskningsgrunnlag
Populasjon (P): Personer med økt risiko for hjerte- og karsykdom, eller med kjent slik sykdom
Tiltak (I): Kostråd basert på middelhavskostholdet
Sammenligning (C): Ingen kostrådgivning
Beskrivelse av inkluderte studier
Sammenhengen mellom kosthold og hjerte- og karsykdom er omfattende studert, både direkte i forhold til forekomst av hjerte- og karsykdom og død, men også indirekte ved sammenhengen mellom kosthold og nivåer av risikofaktorer som blodtrykk, lipidverdier m.m.. Mye av den epidemiologiske forskningen har likevel vært omdiskutert, og det har dessuten vært store endringer i befolkningens kostvaner og i kvaliteten på matvarer som har gjort tolkningen av tidligere resultater komplisert. Mens tidligere studier har hatt mye fokus på inntaket av mettet fett, har senere studier i større grad dokumentert viktigheten av at andre elementer i kosten. En oppdatert gjennomgang (Mozaffarian D, 2016, hoveddokumentasjon) viser at høyt inntak av frukt, grønnsaker, fullkornprodukter og nøtter gir redusert sykdomsforekomst, mens rødt kjøtt og særlig bearbeidet rødt kjøtt og sukkerholdig drikke gir økt risiko for hjerte- og karsykdom. Tilsvarende gir transfett, høyt salt-inntak og matvarer med høy glykemisk belastning (stor andel lett absorberbare karbohydrater) økt risiko for hjerte- og kar sykdom, mens umettet fett fra planter og sjømat tenderer mot beskyttende effekt. Et middelhavskosthold med ekstra olivenolje eller nøtter er nylig vist å redusere hjerte- og kar hendelser, særlig hjerneslag, i en større randomisert studie (Estruch R m.fl. 2013).
Vurdering
Fordeler og ulemper
Fordeler
Hjerte- og karsykdom
Et riktig sammensatt kosthold er sentralt i all kardiovaskulær forebygging, og en viktig del av håndtering av hyperlipidemier, hypertensjon, overvekt og diabetes. Kostrådene som særlig har dokumentasjon for forebygging av hjerte- og karsykdommer tar utgangspunkt i den tradisjonelle middelhavskosten. Positive effekter av denne type diett er beskrevet i en metaanalyse av randomiserte kontrollerte studier (Liyanage T m.fl. 2016), men forfatterne peker på at både kvantitet og kvalitet på dataene er begrenset og resultatene usikre. Selv om det mangler endepunktsstudier for detaljer i kostholdet har to randomiserte, kontrollerte studier vist reduksjon i hjerte- og karsykdom ved dette kosthold (de Lorgeril M m.fl. 1994, Estruch R m.fl. 2013). I PREDIMED studien fant man at middelhavskost beriket med kaldpresset olivenolje eller nøtter reduserte insidensen av hjerte- og karsykdom med ca. 30 % sammenlignet med et mer fettredusert kosthold hos høyrisiko personer (Estruch R m.fl. 2013). Her var risikoreduksjonen først og fremst knyttet til færre hjerneslag. Det har imidlertid vært påpekt at kostholdsintervensjonene i denne studien ikke var en ren middelhavsdiett, og at fettinntaket også i kontrollgruppen var høyt (37%) (Appel LJ m. fl. 2013). I Lyon Heart Study fant man 37 % risikoreduksjon for kardiovaskulære hendelser i sekundærprevensjon blant deltakere som ble fordelt til middelhavskost med tillegg av rapsoljebasert margarin (de Lorgeril M m.fl. 1994). Også et rent vegetarkosthold synes gunstig for å forebygge hjerte- og karsykdom (Dinu M m.fl. 2016).
Lipider
Kontrollerte undersøkelser viser at inntak av mettet fett og transfett øker LDL-kolesterol, mens umettet fett senker LDL-kolesterol i blodet (Micha R m.fl. 2010). Sammenhengen mellom mettet fett og hjerte- og karsykdom er likevel ikke entydig, ettersom også HDL-kolesterol og triglyserider påvirkes. De ulike mettede fettsyrer har noe forskjellige egenskaper slik at for eksempel mettet fett fra kjøttvarer synes klarere assosiert med hjerte- og karsykdom enn mettet fett fra ost og meierivarer (Mozaffarian D 2016).
I en nylig meta analyse basert på randomiserte, kontrollerte studier fant man at redusert inntak av mettet fett reduserte risiko for hjerte- og karsykdom med ca. 17 % (Hooper L m.fl. 2015), men effekten fremkom primært i studier der mettet fett ble erstattet med flerumettet fett. En større andel protein fra magre meieriprodukter og fett fra mandler på bekostning av karbohydrater, har gunstige effekter på både lipider og blodtrykk (Appel LJ m.fl. 2005). Å inkludere én avocado i det daglige kostholdet, har vist gunstig effekt på lipidprofil og konsentrasjonen av små, tette LDL-partikler (Wang L m.fl. 2015). Videre kan økt inntak av plantesterolberiket margarin (AbuMweis SS m.fl 2014), løselige fiber (Whitehead A m.fl. 2014) og soyaprodukter (Anderson JW m.fl. 2011), senke LDL-kolesterol. Et nordisk kosthold med rugbrød, kål- og rotgrønnsaker, epler, pærer, bær, fisk og rapsolje, har vist gunstig reduksjon i LDL-kolesterol og lavgradig inflammasjon (Uusitupa M m.fl. 2013, Adamsson V m.fl. 2011). Det ser ut som kolesterolinnholdet i kosten for eksempel fra egg, har mindre betydning for de fleste, men her kan det være individuelle variasjoner. Kolesterol i kosten øker både LDL- og HDL-kolesterol, slik at ratioen viser liten forskjell (Berger S m.fl. 2015). Når det gjelder kaffe, er det kokekaffe og tilsvarende ufiltrert kaffe fra maskiner som baserer seg på hele kaffebønner, som øker total- og LDL-kolesterol (Cai L m.fl. 2012). Hos pasienter med høyt nivå av blodglukose eller triglyserider har reduksjon i inntaket av sukker og andre raffinerte karbohydrater størst betydning for å oppnå normalisering av blodverdiene. I tillegg må reduksjon i alkoholbruk tilrås når dette er høyt.
Hypertensjon
Hovedelementet i anbefalt kosthold er som for den generelle befolkningen basert på middelhavskostholdet, ettersom det avgjørende målet for dietten i alle tilfeller er lavere forekomst av hjertesykdom og hjerneslag. Ved hypertensjon er det utover dette dokumentert blodtrykkssenkende effekt ved den såkalte "DASH" dietten, som innebærer blant annet redusert mengde mettet fett, redusert inntak av salt, økt inntak av frukt og grønt og en passe mengde magre meieriprodukter (Appel LJ m.fl. 1997). Anbefalt mengde av grønnsaker og frukt tilsvarer 2-3 enheter frukt og ca. 500 g grønnsaker daglig. For å få til saltreduksjon er det nødvendig å kjenne til de viktigste kildene til natrium i våre matvarer (se praktisk informasjon).
Overvekt
For personer med overvekt eller fedme gjelder de samme kostprinsippene som ved generell forebygging av hjerte- og karsykdom. Samtidig vil man motivere pasienten til å tilstrebe en moderat vektreduksjon (5-10%) over en tidsperiode på 3-6 måneder som deretter vedlikeholdes i størst mulig grad. Man skal ta hensyn til pasientens metabolske risikofaktorer (lipider, glukose) og diskutere matvare- og drikkevalg, mengder og porsjonsstørrelser samt måltidsrytmen og fysisk aktivitet.
Når vektreduksjon er ønskelig, vil en tilpasset diett som gir reduksjon på 500-700 kcal per dag i forhold til personens utgangsinntak oftest være hensiktsmessig, men vekten øker imidlertid etter endt behandling. Det er vist at en vektreduksjon på 3-5 % som er vedlikeholdt over flere år reduserer risikofaktorer for hjerte- og karsykdom og forebygger type 2 diabetes (Jensen MD m.fl.2014, American College of Cardiology/American Heart Association Task Force on Practice Guidelines, Obesity Expert Panel, 2013). Norske retningslinjer for behandling av overvekt og fedme i primærhelsetjenesten ble publisert i 2011 (Helsedirektoratet, Nasjonal faglig retningslinje for forebygging, utredning og behandling av overvekt og fedme hos voksne 2011).
Ulemper
Å fremme et kosthold med begrensninger i matvarer som søtsaker, salt og bearbeidede kjøttvarer, vil av enkelte kunne oppleves som en innskrenking i frihet og livsutfoldelse. For noen vil mindre sunne matvarer kunne oppfattes som bedre på smak. Tilsvarende kan matinntak på tvers av kostrådene utløse dårlig samvittighet, eventuelt skam og skyldfølelse. Sunne matvarer kan være dyrere og mer krevende å tilberede. De største hindringene for å gjennomføre et gunstig kosthold er mindre knyttet til kunnskap om hva som er bra og i større grad knyttet til faktorer som prioriteringer, tid, overskudd til å tilberede mat, planlegging av måltider, sosialt press og verdi for pengene (Macdiarmid JI m.fl. 2013).
For personer med ulike former for matintoleranse eller irritabel tykktarm kan en del av de anbefalte matvarene føre til økte plager fra fordøyelsessystemet. Slike plager kan imidlertid oftest unngås ved individuell tilpasning av kostrådene.
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen vurderes som svak
Verdier og preferanser
Inntak av mat og drikke fyller mange behov og inngår som en viktig del av sosialt samvær. Valg av matvarer vil derfor ikke bare styres av forventede effekter på helse, men påvirkes av individuelle smakspreferanser, kulturelle faktorer og sosioøkonomisk status. Valgene kan forstås i lys av en plassering i forhold til en behovspyramide (Maslovs 'hierarchy of needs') (van Lenthe FJ m.fl. 2015)
Kostrådenes effekt på sykdomsrisiko begrenses av praktiske problemer med å etterleve rådene. Derfor er det viktig at de rådene som blir gitt er tilpasset pasientens smak og kultur, og at pasientene selv bestemmer hvilke endringer de vil starte med. Gi gjerne positive anbefalinger (øke olje, nøtter, grønnsaker, frukt, bønner, linser, kylling, fisk) før begrensninger (opplaget kjøttmat, fete meieriprodukter, raffinerte karbohydrater, sukker og salt snacks). Det kan være vanskelig å opprettholde store forandringer over lengre tid. Effekten av mindre endringer i levevaner er likevel betydelig.
Referanser
89. Primary prevention of cardiovascular disease with a Mediterranean diet. N Engl J Med. 2013; 368: 1279-1290 https://www.helsedirektoratet.no/referanse/0002-0013-177752
90. Saturated fat and cardiometabolic risk factors, coronary heart disease, stroke and diabetes: a fresh look at the evidence. Lipids 2010; 45: 893-910 https://www.helsedirektoratet.no/referanse/0002-0013-177753
91. Reduction in saturated fat intake for cardiovascular disease https://www.helsedirektoratet.no/referanse/0002-0013-177754
92. Dietary and policy priorities for cardiovascular disease, diabetes, and obesity. A comprehensive review. Circulation 2016; 133: 187-225 https://www.helsedirektoratet.no/referanse/0002-0013-177755
93. Appel LJ, Sacks FM, Carey V, Obarzaneck E, Swain JF, Miller ER: Effects of protein, monounsaturated fat and carbohydrate intake on blood pressure and serum lipids. Results of the OmniHeart Randomized trial. JAMA 2005; 294: 2455-64 https://www.helsedirektoratet.no/referanse/0002-0013-177756
94. Effects of a moderate fat diet with and without avocados on lipoprotein particle number, size and subclasses in overweight and obese adults: a randomized, controlled trial. https://www.helsedirektoratet.no/referanse/0002-0013-177757
95. Cholesterol-lowering effects of oat β-glucan: a meta-analysis of randomized controlled trials https://www.helsedirektoratet.no/referanse/0002-0013-177758
96. Soy protein effects on serum lipoproteins: a quality assessment and meta-analysis of randomized, controlled studies https://www.ncbi.nlm.nih.gov/pubmed/21730216
97. Effects of a healthy Nordic diet on cardiovascular risk factors in hypercholesterolaemic subjects: a randomized controlled trial (NORDIET) https://www.helsedirektoratet.no/referanse/0002-0013-177760
98. Dietary cholesterol and cardiovascular disease: a systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-177761
99. The effect of coffee consumption on serum lipids: a meta-analysis of randomized controlled trials https://www.helsedirektoratet.no/referanse/0002-0013-177762
100. Appel LJ, Moore TJ, Obarzanek E, Vollmer WM, Svetkey LP, Sacks FM, et al. A clinical trial of the effects of dietary patterns on blood pressure. N Engl J Med 1997; 336: 1117-24 https://www.helsedirektoratet.no/referanse/0002-0013-177763
101. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults; a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society https://www.helsedirektoratet.no/referanse/0002-0013-177764
102. Helsedirektoratet. Nasjonal faglig retningslinje for forebygging, utredning og behandling av overvekt og fedme hos voksne https://helsedirektoratet.no/retningslinjer/nasjonal-faglig-retningslinje-for-forebygging-utredning-og-behandling-av-overvekt-og-fedme-hos-voksne
103. "It was an education in portion size". Experience of eating a healthy diet and barriers to long term dietary change https://www.helsedirektoratet.no/referanse/0002-0013-177766
104. van Lenthe FJ, Jansen T, Kamphuis CB. Understanding socio-economic inequalities in food choice behaviour: can Maslow's pyramid help? Br J Nutr. 2015; 113: 1139-47. https://www.helsedirektoratet.no/referanse/0002-0013-177767
105. de Lorgeril M, Renaud S, Mamelle N, Salen P, Martin JL, Monjaud I, et al. Mediterranean alpha-linolenic acid-rich diet in secondary prevention of coronary heart disease. Lancet. 1994; 343: 1454-59 https://www.helsedirektoratet.no/referanse/0002-0013-177768
106. AbuMweis SS, Marinangeli CP, Frohlich J, Jones PJ. Implementing phytosterols into medical practice as a cholesterol-lowering strategy: overview of efficacy, effectiveness, and safety. Can J Cardiol. 2014; 30:1225-32 https://www.helsedirektoratet.no/referanse/0002-0013-177769
107. Liyanage T, Ninomiya T, Wang A,et al. Effects of the Mediterranean Diet on Cardiovascular Outcomes-A Systematic Review and Meta-Analysis. PLoS One. 2016; 11: e0159252. https://www.helsedirektoratet.no/referanse/0002-0013-177770
108. Appel LJ, Van Horn L. Did the PREDIMED Trial Test a Mediterranean Diet? N Engl J Med 2013; 368:1353-1354. https://www.helsedirektoratet.no/referanse/0002-0013-177771
109. Guidelines (2013) for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Obesity Society published by the Obesity Society and American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Based on a systematic review from the The Obesity Expert Panel, 2013 https://www.helsedirektoratet.no/referanse/0002-0013-177772
110. Vegetarian, vegan diets and multiple health outcomes: a systematic review with meta-analysis of observational studies http://dx.doi.org/10.1080/10408398.2016.1138447
Sist faglig oppdatert: 05.03.2018
Redusere stillesitting for å forebygge hjerte- og karsykdom
Motiver personer med økt risiko til å redusere stillesitting for å forebygge hjerte- og karsykdom. Prinsippene for dette gjelder på samme måte som for den generelle befolkningen.
Se Helsedirektoratets anbefalinger for å redusere stillesitting
Sist faglig oppdatert: 05.03.2018
Fysisk aktivitet ved sekundærforebygging av hjerte- og karsykdommer
Personer med kjent hjerte- og karsykdom kan som oftest følge hovedprinsippene i de generelle befolkningsråd om fysisk aktivitet som er beskrevet i Helsedirektoratets anbefalinger, se Aktivitetshåndboken. Noen individuelle tilpasninger bør gjøres, særlig ved tilstander som hjertesvikt og hjertearytmi. Dette er nærmere beskrevet i aktivitetshåndboken vedrørende hjertesvikt, rytmeforstyrrelser, hypertensjon og koronarsykdom. Nasjonalt kompetansesenter for trening som medisin gir også anbefalinger angående fysisk aktivitet ved hjertesykdom.
- Personer med etablert hjerte- og karsykdom bør drive med regelmessig fysisk aktivitet for å forebygge nye hendelser og alvorlige komplikasjoner. Treningen bør inkludere både kondisjonstrening og styrketrening, og gjennomføres 3-5 ganger i uken.
- Den første uken etter et hjerteinfarkt og de to første ukene etter en hjerteoperasjon anbefales det mosjon ved å gå turer.
- Alle personer som har gjennomgått hjertesykdom anbefales å delta på et strukturert hjerterehabiliteringsprogram.
- Oppstår brystsmerter eller andre symptomer på aterosklerotisk hjertesykdom ved trening, anbefales utredning med belastningstest (arbeids-EKG) før videre trening fortsettes.
Praktisk – slik kan anbefalingen følges
Ved etablert hjerte- og karsykdom kreves regelmessig fysisk trening for å oppnå redusert kardiovaskulær mortalitet. Den generelle målsettingen med fysisk trening ved hjerte- og karsykdommer er å forbedre kondisjonen gjennom arbeid som innebærer bruk av de store muskelgruppene (Helsedirektoratet 2009).
Verdien av hverdagsaktivitet, helst i minst 30 minutter daglig, bør fremheves. Aktiviteten behøver ikke å være anstrengende eller skje sammenhengende, og kan være alt fra rutinemessig forflytning til spaserturer og gang i trapper.
Når starte med fysisk aktivitet?
Fysisk aktivitet kan starte allerede ved hjemkomst, med utgangspunkt i den formen personen var i før han/hun ble syk og hvor aktiv han/hun klarte å være på sykehuset. Det er viktig å starte rolig, gjerne med korte gåturer daglig, for deretter gradvis å øke både varighet, tempo og intensitet. Pasienten kan bli andpusten og svett, men bør ta hensyn til de signalene kroppen gir og ta pauser ved behov. Dersom han/hun føler seg utslitt resten av dagen etter en tur, er det et signal om at man har startet for hardt. Etter en hjerteoperasjon (med torakotomi) bør en vente med sykling ute, svømming, skigåing, jakt, fiske og lignende til brystbenet er grodd (6 - 8 uker), og til en har trent seg opp til å tåle større belastninger.
Hjerterehabilitering
Personer med hjertesykdom anbefales å delta i et strukturert hjerterehabiliteringsprogram den første tiden etter en hendelse. Deltakelse i hjerterehabiliteringsprogram reduserer risiko for død uansett årsak, død av kardiovaskulær sykdom, og tilbakefall av sykdom (Anderson L m.fl. 2016, Lawler m.fl. 2011, Taylor RS m.fl. 2014). Til tross for dokumentert effekt av deltakelse i hjerterehabiliteringsprogram viser studier at bare 62 % av pasientene blir henvist, bare 23 % møter opp og kun 5 % fullfører programmet (Doll JA m.fl. 2015). Det er derfor ekstra viktig at personer med hjertesykdom henvises og oppmuntres til å delta i strukturerte hjerterehabiliteringsprogram.
Personer med hjertesykdom kan også ha stor nytte av henvisning til en Frisklivssentral i kommunen. Alle frisklivssentraler skal gi kunnskapsbasert hjelp til fysisk aktivitet, kosthold og snus- og røykeslutt gjennom et strukturert oppfølgingstilbud. Frisklivssentralen kan også hjelpe til å finne frem til lokale tilbud og aktiviteter som passer den enkelte. Personer kan bli henvist av lege, annet helse personell eller selv ta kontakt med en frisklivssentral.
Anbefalt trening ved koronarsykdom
Både kondisjons- og styrketrening kan anbefales til personer med koronarsykdom (Helsedirektoratet 2009, Marzolini S m.fl. 2012). Kondisjonstrening kan gjennomføres som intervalltrening eller langkjøring med moderat til høy intensitet 3–5 ganger pr. uke, 10–60 minutter per gang. Styrketrening: 40–80 % av maksimal kapasitet (RM = repetisjonsmaksimum, det vil si den vekten som kan løftes gjennom hele bevegelsesbanen bare én gang) 1–3 ganger pr. uke. (Helsedirektoratet 2009, Marzolini S m.fl. 2012).
4 x 4
Intervalltrening, det vil si trening der man veksler mellom høy og lav intensitet, anbefales også til personer med hjertesykdom. En av de mest kjente formene for langintervall er 4 x 4 minutters intervall. Denne bestemte typen langintervall har vist seg å være forbundet med lav risiko også hos personer med hjertesykdom (Rognmo O m.fl. 2012). Treningen skal ha høy intensitet i 4 minutter, etterfulgt av en periode på 3 minutter med moderat intensitet. Disse to periodene gjentas fire ganger.
All trening bør innledes med en gradvis oppvarming på 6–10 minutter med lett til moderat intensitet og avsluttes med gradvis nedtrapping av intensiteten. Se også om nærmere informasjon fra Nasjonalt kompetansesenter for trening som medisin.
Anbefalt trening ved arytmier
Personer med arytmi kan vanligvis følge de samme prinsippene for fysisk trening som andre personer med hjertesykdom, se rytmeforstyrrelser i aktivitetshåndboken. Styrketrening for personer med arytmi har i flere studier vist seg å være en både sikker og effektiv treningsmetode. Forutsetningen er at belastningen ikke overstiger 60 prosent av 1 RM (RM = repetisjonsmaksimum, altså maksimal belastning for en repetisjon) og at det er noen flere repetisjoner per gang (12–15) enn ved tradisjonell styrketrening. Nedtrapping av treningsintensiteten er ekstra viktig for personer med arytmiproblemer siden arytmier har en tendens til å komme dersom trening avsluttes uten nedtrapping (Pashkow FJ m.fl. 1997). Ved alvorlige hjerterytmeforstyrrelser er det ikke tilrådelig å drive med anstrengende fysisk aktivitet.
Trening ved hjertesvikt
Trening ved hjertesvikt skal gi økt aerob kapasitet og økt muskelstyrke uten å belaste hjerte- og karsystemet i for stor grad. Det anbefales trening 3–5 ganger i uken (Helsedirektoratet 2009, O'connor CM m.fl. 2009, Balardinelli R m.fl. 2012) i form av kondisjonstrening av 15–60 minutters varighet og styrketrening 2–3 ganger per uke. Utholdenhetstrening kan gjennomføres enten med kontinuerlig intensitet eller i intervaller der intensiteten varierer i løpet av treningen. For å få intensiteten opp på anbefalt nivå, må man bruke store muskelgrupper. Egnede aktiviteter er spaserturer m/u staver, sykkeltrening, gå på tredemølle, gymnastikk på land eller i vann samt styrketrening. Det er også viktig å finne en aktivitet som personer med hjertesvikt synes er greit å drive med. Personer med stabil hjertesvikt med dominerende systolisk dysfunksjon i NYHA-klasse I–IV (New York Heart Associations klassifisering) er best egnet for fysisk trening (O'connor CM m.fl. 2009). Det finnes liten dokumentasjon for trening av personer med utelukkende diastolisk dysfunksjon. All trening bør starte med en god oppvarming og avsluttes med nedtrapping i noen minutter. Ved økende hjertesvikt er det ikke tilrådelig å drive med fysisk aktivitet. Se også informasjon om trening ved hjertesvikt fra Nasjonalt kompetansesenter for medisin.
Trening ved hypertensjon
Ved hypertensjon anbefales kondisjonstrening 5–7 ganger i uken, minst 30 minutters varighet med moderat intensitet (Helsedirektoratet 2009, Ruivo A m.fl. 2012). Det kan være like effektivt å dele opp aktiviteten i for eksempel økter på ti minutter og gjenta disse tre ganger som å trene sammenhengende i 30 minutter én gang om dagen. Ved styrketrening anbefales lav belastning og mange repetisjoner, kanskje 40–50 % av maksimal kapasitet (RM = repetisjonsmaksimum). Denne anbefalingen er imidlertid usikkert dokumentert og ikke bekreftet i en nyere studie. Ved alvorlig ukontrollert hypertensjon anbefales ikke trening før man har oppnådd tilfredsstillende blodtrykkskontroll.
Trening ved perifer karsykdom
For å få best mulig effekt bør treningen drives som gangtrening, gjerne intermitterende, minst 3 ganger per uke, i minst 30 minutter hver gang og over en periode på minst 6 måneder, se også perifer karsykdom i aktivitetshåndboken.
Trening ved hjerneslag
Også etter hjerneslag vil mange ha fordel av fysisk aktivitet, som imidlertid må individualiseres ut fra personens tilstand, se slag(hjerneslag). For ytterligere informasjon, se også nasjonal faglig retningslinje for behandling og rehabilitering ved hjerneslag.
Kontraindikasjoner
Ved enkelte tilstander er det ikke tilrådelig å drive med fysisk aktivitet. Høyt ukontrollert blodtrykk, alvorlige hjerterytmeforstyrrelser og symptomgivende hjertesvikt er eksempler på dette.
Begrunnelse – dette er anbefalingen basert på
Personer med kjent hjerte- og karsykdom er gjerne forsiktige med fysisk aktivitet, ofte av frykt for at dette skal utløse nye hendelser. Nyere forskning viser at fysisk aktivitet tvert i mot vil bedre prognosen for svært mange, med flest studier gjort på pasienter med koronarsykdom, men også flere ved hjertesvikt. Slike studier og oppdaterte metaanalyser viser at pasienter med koronarsykdom vil ha signifikant redusert risiko for nye kardiovaskulære hendelser når de deltar i treningsbasert rehabilitering. Gunstige effekter er også vist hos pasienter med hjertesvikt når de får spesielt tilpassede treningsråd. For pasienter med arytmier gjelder noe mer restriktive treningsråd.
Pasienter med kjent hjerte- og karsykdom bør oppmuntres til fysisk aktivitet både for å sikre optimalisering av prognose og for bedret livskvalitet og livsutfoldelse. Tilpassede treningsråd er mer detaljert omtalt i aktivitetshåndboken, slik at fastleger og andre kan gi adekvate treningsråd ut fra den enkeltes tilstand og behov.
Forskningsgrunnlag
Populasjon (P): Personer med kjent koronar hjertesykdom
Tiltak (I): Trening og treningsbasert rehabilitering
Sammenligning (C): Ingen tiltak for økt fysisk trening
Beskrivelse av inkluderte studier
Personer med kjent hjerte- og karsykdom ble tidligere ofte rådet forsiktighet med fysisk aktivitet, uten at dette hadde noen dokumentert begrunnelse. De senere år har imidlertid dokumentasjon vist at de fleste pasienter med kjent hjerte- og karsykdom vil ha helsegevinst ved trening. Dette er primært vist for pasienter med koronar hjertesykdom. I en oppdatering fra Cochrane i 2016 (Anderson L, m.fl. 2016, hoveddokumentasjon) summerte man resultater i 63 studier på pasienter med koronarsykdom randomisert til trening eller vanlig oppfølging (kontroll). Etter 6-12 måneders treningsbasert rehabilitering fant man en reduksjon i kardiovaskulær dødelighet svarende til en relativ risiko (RR) på 0,74, 95 %,CI 0,64 til 0,86. Man fant også en redusert risiko for nye sykehusinnleggelser svarende til RR 0,82, 95 %,CI 0,70 til 0,96, men ingen sikker reduksjon i total dødelighet med RR 0,96, 95 %,CI 0.88 til 1.04.
Vurdering
Fordeler og ulemper
Fordeler
Trening gir lavere puls både i hvile og aktivitet, lavere blodtrykk, økt slagvolum og bedring av hjertets sammentrekning. Videre gir trening bedre lipidprofil, mindre bukfedme og økt insulinfølsomhet (Helsedirektoratet 2009).
Effekten av trening og treningsbasert rehabilitering hos personer med kjent hjerte - og karsykdom er studert i en rekke kontrollerte studier og metaanalyser (Anderson L m.fl. 2016, Lawler PR m.fl. 2011, Taylor RS m.fl. 2014).
En Cochrane-oppsummering fra 2016 inkluderte 63 studier med til sammen 14486 personer med koronarsykdom randomisert til trening eller vanlig oppfølging (kontroll). Etter 6-12 måneders treningsbasert rehabilitering fant man 26 % reduksjon i kardiovaskulær dødelighet (relativ risiko; RR 0,74;95 % KI 0,64 - 0,86). Man fant også redusert risiko for nye sykehusinnleggelser svarende til RR 0,82 (95 % KI 0,70 - 0,96), men ingen sikker reduksjon i total dødelighet (RR 0,96; 95 % KI 0,88- 1,04).
En metaanalyse av 33 studier med 4740 personer med hjertesvikt hovedsakelig i NYHA klasse II-III (Taylor RS m.fl. 2014) viste ingen endring i mortalitet ved treningsbasert rehabilitering (RR 0,93; 95 % KI 0,69 -1,27). I studier med varighet på ett år eller mer (6 studier med 2845 deltakere) ble det sett en effekt tilsvarende RR 0,88; 95 % KI 0,75 - 1,02. Videre ble det påvist en signifikant reduksjon i risiko for sykehusinnleggelse (15 studier med 1328 deltakere) svarende til RR 0,75 (95 % KI 0,62 - 0,92). Trening ga også en klinisk viktig bedring av livskvalitet bedømt ut fra et spesialisert spørreskjema (Minnesota Living with Heart Failure questionnaire), dette var data fra 13 studier med 1270 deltakere, med en gjennomsnittlig forskjell versus kontrollgruppen på -5.8 poeng (95 % KI -9.2 - -2.4).
Ulemper
Oppstart av fysisk aktivitet eller økning av aktivitetsnivået kan føre til belastningsskader, kroppslig ubehag i form av stivhet, stølhet, eller lette smerter i ledd og muskulatur. Plagene er vanligvis forbigående og kan langt på vei unngås ved forsiktig opptrapping av treningen. Langvarig og intensiv utholdenhetstrening på konkurransenivå er assosiert med økt risiko for atrieflimmer (Myrstad M m.fl. 2013, Andersen K m.fl. 2013, Gjesdal K m.fl. 2015).
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen vurderes som svak
Verdier og preferanser
Kardiovaskulær sykdom, både hjerteinfarkt og kanskje særlig hjerneslag, er forbundet med økt dødelighet og dessuten økt risiko for alvorlige hendelser som utvikling av hjertesvikt, arytmier, lammelser og kognitive forstyrrelser (Smolina K m.fl. 2012, Mathisen S m.fl. 2015). Anbefalt nivå av fysisk aktivitet innebærer redusert risiko for alvorlig hjerte- og karsykdom.
Sett under ett vil derfor personer med kjent hjerte- og karsykdom ha en forventet egeninteresse av forebyggende behandling. Frykt for tilbakefall eller å belaste hjertet for mye kan føre til at anbefalingene om fysisk aktivitet ikke etterleves.
Råd om endring av levevaner kan også komme i konflikt med enkeltmenneskers behov for selv å bestemme hvordan man vil leve. Det kan være tidkrevende for mange å få til fysisk aktivitet i en travel hverdag. Det kan også føre til dårlig samvittighet dersom man ikke klarer å trene det som anbefales. For noen kan trening være en belastning for økonomien gjennom dyrt treningsutstyr eller medlemskap på treningssenter.
For mange gir trening økt velvære og økt mestringsfølelse, man føler seg sterkere fysisk og mentalt. Personer med hjertesykdom som trener rapporterer en tidligere og større bedring i selvrapportert helsestatus og økt livskvalitet (Marzolini S m.fl. 2012, Flynn KE m.fl. 2009).
De fleste pasienter med kjent hjerte- og karsykdom vil trolig anse fordelene ved økt fysisk aktivitet som klart større enn ulempene.
Referanser
111. Lawler PR, Filion KB, Eisenberg MJ. Efficacy of exercise-based cardiac rehabilitation postmyocardial infarction: a systematic review and meta-analysis of randomized controlled trials. Am Heart J 2011;162:571–84.e2 https://www.helsedirektoratet.no/referanse/0002-0013-177774
112. Andersen K, Farahmand B, Ahlbom A et al. Risk of arrhythmias in 52 755 long-distance cross-country skiers: a cohort study. Eur Heart J 2013; 34:3624-31 https://www.helsedirektoratet.no/referanse/0002-0013-177775
113. Andersen K, Farahmand B, Ahlbom A et al. Risk of arrhythmias in 52 755 long-distance cross-country skiers: a cohort study. Eur Heart J 2013; 34: 3624-31 https://www.helsedirektoratet.no/referanse/0002-0013-177776
114. Anderson L, Thompson DR, Oldridge N et al.. Exercise-based cardiac rehabilitation for coronary heart disease. Cochrane Database Syst Rev. 2016 Jan 5;1:CD001800. doi: 10.1002/14651858.CD001800.pub3 https://www.helsedirektoratet.no/referanse/0002-0013-177777
115. Belardinelli R, Georgiou D, Cianci G, Purcaro A. 10-year exercise training in chronic heart failure: a randomized controlled trial. J Am Coll Cardiol. 2012; 60: 1521–8 https://www.helsedirektoratet.no/referanse/0002-0013-177778
116. Doll JA, Hellkamp A, Ho PM et al. Participation in cardiac rehabilitation programs among older patients after acute myocardial infarction. JAMA Intern Med 2015; 175: 1700–2 https://www.helsedirektoratet.no/referanse/0002-0013-177779
117. Flynn KE, Pina IL, Whellan DJ et al. Effects of exercise training on health status in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA 2009; 301: 1451–9 https://www.helsedirektoratet.no/referanse/0002-0013-177780
118. Gjesdal K, Grundvold I. Atrial fibrillation and exercise in women: some answers given, some questions remain. Heart 2015; 101: 1605-6 https://www.helsedirektoratet.no/referanse/0002-0013-177781
119. Helsedirektoratet. Aktivitetshåndboken – Fysisk aktivitet i forebygging og behandling. Rapport IS-1592. Oslo: Helsedirektoratet, 2009. https://helsedirektoratet.no/ retningslinjer/aktivitetshandboken-fysisk-aktivitet-i-forebygging-og-behandling https://www.helsedirektoratet.no/referanse/0002-0013-177782
120. Marzolini S, Oh PI, Brooks D. Effect of combined aerobic and resistance training versus aerobic training alone in individuals with coronary artery disease: a meta-analysis. Eur J Prev Cardiol 2012; 19: 81–94 https://www.helsedirektoratet.no/referanse/0002-0013-177783
121. Mathisen S, Dalen I, Larsen JP, Kurz M. Long-term mortality and its risk factors in stroke survivors. J Stroke Cerebrovasc Dis 2016; 25: 635-41. http://dx.doi.org/10.1016/j.jstrokecerebrovasdis.2 https://www.helsedirektoratet.no/referanse/0002-0013-177784
122. Myrstad M, Løchen ML, Graff-Iversen S et al. Increased risk of atrial fibrillation among elderly Norwegian men with a history of long term endurance sport practice. Scand J Med Sci Sports 2014; 24: e238-44. Doi: 10.111/sms.12150 https://www.helsedirektoratet.no/referanse/0002-0013-177785
123. O'Connor CM, Whellan DJ, Lee KL et al. Efficacy and safety of exercise training in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA 2009; 301:1439-50 https://www.helsedirektoratet.no/referanse/0002-0013-177786
124. Pashkow FJ, Schweikert RA, Wilkoff BL. Exercise testing and training in patients with malignant arrhythmias. Exerc Sport Sci Rev 1997; 25: 235-69 https://www.helsedirektoratet.no/referanse/0002-0013-177787
125. Rognmo O, Moholdt T, Bakken H et al. Cardiovascular risk of high- versus moderate-intensity aerobic exercise in coronary heart disease patients. Circulation 2012; 126: 1436-40. doi: 10.1161/CIRCULATIONAHA.112.123117 https://www.helsedirektoratet.no/referanse/0002-0013-177788
126. Ruivo JA, Alcântara P. Hypertension and exercise.Rev Port Cardiol 2012; 31: 151-8 https://www.helsedirektoratet.no/referanse/0002-0013-177789
127. Smolina K, Wright FL, Rayner M, Goldacre MJ. Long-term survival and recurrence after acute myocardial infarction in England, 2004 to 2010. Circ Cardiovasc Qual Outcomes 2012; 5: 532-40 https://www.helsedirektoratet.no/referanse/0002-0013-177790
128. Taylor RS, Sagar VA, Davies EJ et al. Exercise based rehabilitation for heart failure. Cochrane Database Syst Rev 2014; 4: CD003331 https://www.helsedirektoratet.no/referanse/0002-0013-177791
Sist faglig oppdatert: 05.03.2018
Legemidler ved primærforebygging av hjerte- og karsykdom
Legemiddelbehandling av høyt blodtrykk
- Personer med behandlingstrengende hypertensjon i alle aldre opp til 80 år anbefales livsstilstiltak og legemiddelbehandling for å oppnå et stabilt blodtrykk <140/90 mmHg.
- Legemiddelbehandling anbefales hos alle med systolisk BT≥160 mmHg og/eller diastolisk BT≥100, samt ved BT ≥140/90 mmHg når det foreligger påvist organskade og/eller diabetes.
- For å forebygge komplikasjoner anbefales snarlig og stabil blodtrykkskontroll til <140/90 mmHg, mens gevinsten ved å ha lavere blodtrykksmål synes begrenset og ennå uavklart. Behandlingen må tilpasses for å minimalisere bivirkninger.
- Hos eldre over 80 år anbefales et behandlingsmål på <150 mmHg (målområde 140-150 mmHg) for systolisk blodtrykk.
Praktisk – slik kan anbefalingen følges
Når anbefales antihypertensiv behandling?
Behandling av høyt blodtrykk med legemidler vurderes både ut fra blodtrykket, øvrige risikotilstander og total risiko bedømt med NORRISK 2 (se anbefaling om risikovurdering). Ved mild hypertensjon (systolisk BT 140-159 mmHg og diastolisk BT fra 90-99 mmHg) og risiko over den aldersspesifikke tiltaksgrensen, bør endring av levevaner forsøkes først, og effekten bør evalueres i løpet av 3-12 måneder. Individuelt tilpassede råd om livsstilsendringer og evaluering av dette vil ofte øke pasientens mestringsfølelse, motivasjon og deltakelse i behandlingen.
Hovedpunkter i medikamentell blodtrykksbehandling
Det viktigste i blodtrykksbehandlingen er å senke blodtrykket til <140/90 mmHg uten å påføre pasienten bivirkninger. Den forebyggende effekten synes mest relatert til den blodtrykkssenkende effekten per se, og i mindre og usikker grad relatert til valg av legemiddel. De fleste pasienter trenger mer enn ett legemiddel, og man bør derfor gradvis kombinere moderate doser av to (eller tre hvis nødvendig) godt tolererte men ulike legemidler, som tilslutt bør gis i samme kombinasjonspreparat for å øke etterlevelse av behandlingen. Hvis tre legemidler er nødvendig, bør som hovedregel et tiazid-diuretikum inngå som ett av disse, ettersom volumavlastning gjennom økt utskilling av natrium og vann er vesentlig for å oppnå tilstrekkelig blodtrykksreduksjon.
Anbefalte kombinasjoner er beskrevet nedenfor og vist i figur 1 der heltrukne grønne linjer angir anbefalte kombinasjoner.
Kombinasjonen av betablokkere og diuretika anses ikke optimal i primærforebygging, bl.a. grunnet diabetogen effekt, mer bivirkninger og redusert etterlevelse. For personer med afrikansk herkomst ses ofte noe mindre blodtrykkssenkende effekt ved midler som hemmer renin-angiotensinsystemet, slik at kalsiumantagonister og diuretika kan anses som mer naturlige førstevalg.
Dersom en kombinasjon av ovennevnte legemidler ikke gir tilstrekkelig effekt, kan også andre registrerte antihypertensiva brukes. Det gjelder alfa-blokkere (spesielt doxazosin som typisk gis mot benign prostatahyperplasi (prostatisme), aldosteron antagonister (mineral reseptor antagonister, spironolakton, eplerenon), andre kaliumsparende diuretika som amilorid og triamteren samt, direkte vasodilaternde medikamenter (hydralazin, monoxidin) og sentraltvirkende midler (minoxidil, og unntaksvis også avregistrerte, men effektive legemidler som alfa-metyldopa og klonidin, da fortrinnsvis etter vurdering hos spesialist).
Ved oppstart av legemiddelbehandling må man vurdere både blodtrykksnivået, samlet risikostatus, grad av organskade og eventuell annen sykdom inkludert diabetes. Høyt normalt blodtrykk (blodtrykk 130-139/80-89 mmHg) medfører betydelig høyere risiko enn lavere blodtrykk, men det er aldri gjort intervensjonsforsøk hos personer med slike blodtrykk og legemiddelbehandling kan derfor ikke uten videre anbefales. Ved høyt normalt blodtrykk og samtidig organskade, som venstre ventrikkelhypertrofi eller begynnende hjertesvikt, gis behandling ut fra organskaden, i dette tilfelle med ACE-hemmer eller angiotensin reseptor antagonist, som gitt slik organskade har dokumentert effekt på kliniske endepunkter. Påvises typisk kontorhypertensjon («white coat») eller maskert hypertensjon, så bør man forholde seg til det ambulatoriske blodtrykket. Med maskert hypertensjon menes BT <140/90 mm Hg ved kontormåling, men påvist BT>130/80 mmHg ved 24-timers registrering (hele døgnet), eller BT >135/85 mmHg ved hjemmemåling. Både kontorhypertensjon og maskert hypertensjon er vanlige tilstander, som forekommer hos om lag 10% og 15% av den voksne befolkningen, henholdsvis.
I de fleste tilfeller anbefales det å begynne med ett legemiddel i lav dose. I de tilfellene der effekt av lav dose ikke er tilfredsstillende, vurderes bruk av egnede kombinasjoner fremfor maksimal dose av ett enkelt legemiddel for å effektivisere blodtrykksreduksjonen og minimere bivirkningene. Bytt til annet legemiddel eller kombinasjon ved svak respons eller dårlig toleranse. Bruk av langtidsvirkende midler sikrer 24 timers effekt ved éngangsdosering og gjør det samtidig lettere for pasienten å etterleve behandlingen. Ved betydelig forhøyet risiko (og blodtrykk >160/100 mmHg) anbefales å starte med kombinasjonspreparat med lave doser av 2 eller 3 komponenter og gradvis øke doseringen inntil blodtrykket er velkontrollert (2013 Clinical practice guidelines for the management of hypertension in the community. J Hypertens. 2014).
De ulike medikamentgruppene
For detaljert omtale av de spesifikke legemidler vises til preparatomtalen. Følgende betraktninger er ment som generell veiledning.
Angiotensin-konverterende-enzymhemmere (ACE-hemmere) (ATC: C09AA)
Gruppen omfatter korttidsvirkende (kaptopril) og mer langtidsvirkende (enalapril, lisinopril, trandolapril, ramipril) hemmere av angiotensinkonverterende enzym, dvs. omdannelsen av angiotensin I til II. Blodtrykksreduksjonen skyldes dilatasjon av motstandskar på grunn av mindre angiotensin II effekter, mindre aldosteron utslipp og redusert sympatisk tonus. På samme måten som beta-blokkere brukes ACE-hemmere ved flere indikasjoner innen hjertesykdommer. Legemidlene er i blodtrykksbehandlingen særlig effektive i kombinasjon med lavdose tiazid og kalsiumblokker. Enkelte bivirkninger skyldes antakelig samtidig redusert nedbrytning av bradykinin. Irriterende tørrhoste er hyppigste bivirkning og forekommer hos 10-30 % av personer i kontrollerte hypertensjonsstudier. En sjelden bivirkning er angioneurotisk ødem (ansikt, svelg). Nyrefunksjonen bør kontrolleres; 10-20 % stigning i serum kreatinin regnes som fysiologisk, mens pasienten bør utredes mht. nyrearteriestenose eller annen nyreskade/sykdom ved mer betydelig stigning i kreatinin. ACE-hemmer må ikke gis ved planlagt graviditet.
Angiotensin-reseptor-II-antagonister (ATC: C09CA)
Denne legemiddelgruppen har lite bivirkninger og er bedre tolerert enn placebo i mange store studier. I likhet med ACE-hemmere er angiotensin reseptor antagonister spesielt effektive i kombinasjon med lavdose tiazid og er også registrert i kombinasjon med kalsiumantagonist. Blodtrykksreduksjonen skyldes dilatasjon av motstandskar, mindre aldosteron utslipp og redusert sympatisk tonus. Behandling med denne gruppen legemidler forebygger hypertensjonskomplikasjoner, særlig hjerneslag, hos personer med venstre ventrikkel hypertrofi (losartan) og bevarer nyrefunksjonen hos pasienter med diabetisk nefropati (losartan, irbesartan). Reduksjon av kardiovaskulær morbiditet er også vist for pasienter med kjent aterotrombotisk kardiovaskulær sykdom (telmisartan). Angiotensin reseptor antagonister er i studier vist å like effektive som kalsium antagonisten amlodipin hos personer med høy risiko (valsartan), og like effektiv som tiazid diuretika hos eldre (kandesartan). Angiotensin reseptor antagonister synes å gi lavere risiko for utvikling av nye tilfeller med diabetes sammenliknet med ACE-hemmere (Hasvold LP1 m.fl. 2014), og tolereres bedre av personer som får bivirkninger av de sistnevnte. Nyrefunksjonen bør kontrolleres som ved bruk av ACE-hemmer. Angiotensin reseptor antagonister må ikke gis ved planlagt graviditet.
Kalsiumantagonister, som inkluderer Dihydropyridiner (ATC: C08CA) og Verapamil (ATC: C08DA01)
Gruppen består av dihydropyridin-derivater med dokumentasjon på harde endepunkter (amlodipin, nifedipin, felodipin, isradipin) og uten slik dokumentasjon (lerkanidipin), samt verapamil som også har dokumentasjon. Blodtrykksreduksjonen skyldes dilatasjon av motstandskar pga. blokade av kalsium kanaler i glatte muskelceller. Verapamil hemmer overledningen i AV-knuten like mye som betablokkerbehandling og bør derfor ikke kombineres med betablokker pga. faren for AV- blokk og alvorlig synkope. Midlene brukes ofte ved hypertensjon kombinert med takyarytmi (inklusive atrieflimmer). Kalsiumantagonistene oppfattes som nøytrale i forhold til metabolisme, nyrefunksjon og elektrolyttbalansen. Disse egenskapene kan være fordelaktige i varmt klima og ved fare for dehydrering. Dihydropyridin-derivater dilaterer prekapillære arterioler og gir ankelødemer hos 10-30% av pasientene og særlig i høye doser. Verapamil kan medføre obstipasjon. Kalsiumantagonister er effektive mot angina pectoris, men er uegnet ved hjertesvikt og kan forverre systolisk hjertesvikt med lav ejeksjonsfraksjon (med unntak av der det brukes som tilleggsbehandling ved meget alvorlig hypertensjon).
Bruk av kalsiumantagonister som frekvensreduserende middel ved atrieflimmer
Ved venstre ventrikkel hypertrofi av konsentrisk type (tykk hjertemuskel med liten kavitet) komplisert med rask atrieflimmer kan verapamil (Isoptin Retard) være et bedre alternativ enn å bruke Cordarone (amiodarone) ettersom sistnevnte har alvorlige bivirkninger. Slik behandling bør imidlertid kun gis etter vurdering hos spesialist (kardiolog, hypertensjonsspesialist og oftest på sykehus) og EKG må tas regelmessig eller initialt overvåkes kontinuerlig (telemetriovervåkning på sykehus).
Diuretika, som inkluderer Tiazider (ATC: C03A), Furosemid (ATC: C03CA01), Kaliumsparende midler (ATC: C03D)
Gruppen omfatter hydroklortiazid (HCTZ) og andre tiazider, furosemid og kaliumsparende diuretika som amilorid, triamteren og aldosteronantagonister (spironolakton, eplerenon). Furosemid brukes ved alvorlig hjertesvikt med ødemer og ved nyresvikt, men ellers ikke i behandlingen av høyt blodtrykk. HCTZ eller andre tiazider i "lav dose" bør ellers velges som diuretikum i det blodtrykkssenkende regimet; vanlig dose er 12,5 mg eller 25 mg HCTZ, eventuelt i kombinasjon med amilorid, ACE-hemmer, angiotensin reseptor blokker eller kalsiumantagonist. Blodtrykksreduksjonen skyldes initialt natrium- og vannutskillelse, dvs. volumavlastning, men tiazider virker også noe vasodilaterende etter en tid. Større dose tiazider skal ikke brukes rutinemessig på grunn av diabetogen effekt og stor risiko for hypokalemi. Tiazider forebygger først og fremst hjerneslag og hjertesvikt. Forebyggende effekt på koronarsykdom er vist hos eldre og hos personer med type 2-diabetes. Aldosteronantagonist kan være særlig effektivt ved både primær og sekundær hyperaldosteronisme og ved annen alvorlig hypertensjon. Denne medikamentgruppen er veldokumentert ved hjertesvikt, men mangler tilsvarende dokumentasjon på forebygging av komplikasjoner og død ved ordinær hypertensjon. Man må være spesielt forsiktig med aldosteronantagonister hos eldre pasienter, serum-K+ må følges nøye, og redusert nyrefunksjon er relativ kontraindikasjon.
Betablokkere (ATC: C07A)
Gruppen omfatter beta-1 selektive (atenolol, metoprolol, bisoprolol) og ikke-selektive (propranolol, oxprenolol, timolol) blokkere, samt noen substanser som også har alfa-1 blokkerende egenskaper (labetalol, karvedilol). Betablokkere har utstrakt bruk i kardiologien i behandling av pasienter med angina pectoris, takyarytmier, etter gjennomgått hjerteinfarkt og ved hjertesvikt. I meta-analyser for blodtrykksbehandling har beta-blokkere likevel vist noe lavere effekt enn andre dokumenterte legemidler i direkte sammenlikninger, spesielt i forebyggelse av hjerneslag (se ovenfor). Betablokkerne bisoprolol, timolol og karvedilol er ikke undersøkt i hypertensjonsstudier med "harde" kliniske endepunkter. Blodtrykksreduksjonen skyldes redusert hjertearbeid (cardiac output), reninhemming og noe vasodilatasjon særlig ved midler med ledsagende alfa-1 blokade. Betablokkere anbefales ikke som førstevalgspreparat i blodtrykksbehandlingen hos ellers friske personer, men er ofte aktuelt ved samtidig hjertesykdom.
Alfablokkere (ATC: C02CA)
Kun doxazosin er registrert til behandling mot høyt blodtrykk i Norge, men denne og andre alfablokkere er godkjent for behandling av benign prostatahyperplasi (prostatisme). Blodtrykksreduksjonen skyldes dilatasjon av motstandskar pga. blokade av alfa-1 reseptorer som formidler noradrenalins effekter på glatte muskelceller. Forebyggende effekt av doxazosin på harde endepunkter (hjerteinfarkt eller død av koronarsykdom) er dokumentert likeverdig med andre blodtrykksmidler i én studie. I denne studien var legemiddelet imidlertid noe oftere assosiert med forverrelse av hjertesvikt og angina pectoris enn klortalidon, et tiazid-liknende diuretikum (ALLHAT Collaborative Research Group 2000). Doxazosin anbefales derfor ikke brukt som førstevalg eller monoterapi i behandling av personer med høyt blodtrykk. Hos personer med høyt blodtrykk og prostatabesvær kan alfablokkere likevel være et godt valg ved behov for mer enn et legemiddel, men alfablokkere kan relativt ofte gi ortostatisk besvær. Man må være oppmerksom på de vasodilaterende og blodtrykkssenkende effektene ved behandling av benign prostatahyperplasi.
Sentralt virkende antihypertensiva og perifere vasodilatatorer (ATC: C02A, C02DB)
Flere legemidler som egner seg i kombinasjonsbehandling er tilgjengelige og kan brukes ved terapiresistent hypertensjon eller hos personer som ikke tolerer legemiddelgruppene omtalt ovenfor. Slike legemidler har i mindre grad dokumentert effekt på harde endepunkter. Hvis de skal brukes, må det være som supplement til dokumenterte legemidler, som skal brukes som primær- og sekundærvalg. Vurder henvisning til spesialist ved behov for denne type midler.
Viktige tilleggsindikasjoner og noen kontraindikasjoner eller tilstander der man bør vise spesiell forsiktighet
De forskjellige blodtrykkssenkende legemidlene har en rekke tilleggsindikasjoner eller kontraindikasjoner (tabell 1 nedenfor).
| Legemiddelgruppe: | Tilleggsindikasjoner: | Kontraindikasjoner: | Spesiell forsiktighet ved: |
| Diuretika | |||
| – Tiazider | Isolert systolisk hypertensjon Hjertesvikt | Lavt K + Urinsyregikt** | |
| – Furosemid* | Hjertesvikt Nyresvikt (kreatinin >150 µmol/l) | Lavt K + | |
| – Kaliumsparende* | Hjertesvikt, lavt K + | Høyt K +, nyresvikt | |
| Betablokkere | Koronarsykdom Angina pectoris Hjertesvikt Takyarytmi Migrene Glaukom (grønn stær) | Hjerteblokk Dekompensert hjertesvikt | Obstruktiv lungesykdom (ikke-selektiv betablokker) |
| Alfablokkere* | Benign prostatahyperplasi | Ortostatisk hypotensjon | |
| ACE-hemmere | Hjertesvikt Koronarsykdom Diabetisk nefropati | Bilateral nyrearteriestenose Graviditet | Høyt K + |
| Angiotensin reseptor antagonister | Hjertesvikt Diabetes nefropati Venstre ventrikkelhypertrofi | Bilateral nyrearteriestenose Graviditet | Høyt K + |
| Kalsiumantagonister | |||
| – Dihydropyridiner | Isolert systolisk hypertensjon Angina pectoris | Systolisk hjertesvikt | |
| – Verapamil | Angina pectoris Takyarytmi | Hjerteblokk | Systolisk hjertesvikt |
* Anbefales ikke som førstevalg eller monoterapi på grunn av manglende dokumentasjon eller lavere effekt i primærforebygging.
** Bruk av tiazid kan være avgjørende for å oppnå blodtrykkskontroll og kan ev. gis - ved samtidig bruk av tilstrekkelig dosert allopurinol.
Behandling av hypertensjon ved type 2-diabetes
Hypertensjon ved type 2-diabetes bør behandles ved selv lett forhøyede verdier og med noe strengere krav til blodtrykksreduksjon (optimalt < 135/85 mmHg) enn hos personer uten diabetes. Dette er nærmere omtalt i Nasjonal faglig retningslinje for diabetes.
Monoterapi og kombinasjonsbehandling
Behandling kan startes som monoterapi i lav eller moderat dose med påfølgende økning i antall antihypertensiva eller doser, hvis nødvendig. Monoterapi kan være startbehandling ved lav eller moderat samlet kardiovaskulær risiko. Når blodtrykket er ≥160/100 mmHg og samlet risiko høy, anbefales kombinasjon av to antihypertensiva i lav dose som startbehandling. Bruk av kombinasjonsterapi for å oppnå adekvat blodtrykksreduksjon er nødvendig hos mange personer, uavhengig av blodtrykksnivå og av legemiddelklasse. En kombinasjon av tre eller flere legemidler kan være nødvendig. Ved ukomplisert hypertensjon, og hos eldre personer, bør legemiddelbehandlingen normalt trappes opp langsomt. Hos høyrisikopersoner bør opptrapping av behandlingen gjennomføres hurtigere.
Figur 1. Anbefalte legemiddelkombinasjoner ved behandling av hypertensjon etter 2013 ESH/ESC-retningslinjer og i henhold til dokumentasjon i å forebygge hjerte-karsykdom i store, prospektive, randomiserte, kliniske studier. Heltrukne grønne linjer representerer anbefalte kombinasjoner. Stiplede linjer representerer alternative kombinasjoner. Grønn stiplet linje er i en mellomstilling. Heltrukken rød linje frarådes.
Blodtrykkssenkende legemidler i forskjellige klasser kan kombineres hvis:
- de har forskjellig og supplerende virkningsmekanisme,
- det foreligger dokumentasjon for at den antihypertensive effekten av kombinasjonen er likeverdig eller større enn effekten av det enkelte legemiddel, og
- kombinasjonen har gunstig bivirkningsprofil. Følgende kombinasjoner er funnet å være effektive og vel tolererte:
- Tiazid diuretikum og amilorid (ATC-kode: C03EA01)
- Tiazid diuretikum og ACE-hemmer ( ATC-kode: C09BA)
- Tiazid diuretikum og angiotensin reseptor antagonist ( ATC-kode: C09DA)
- Kalsiumantagonist og ACE-hemmer ( ATC-kode: C09BB)
- Kalsiumantagonist og angiotensin reseptor antagonist ( ATC-kode: C09DB)
- Kalsiumantagonist og tiazid diuretikum ( ATC-kode: C09DX)
Uheldige kombinasjoner kan være betablokkere sammen med kalsiumantagonist av ikke-dihydropyridin-type (verapamil) som sporadisk kan medføre alvorlig atrioventrikulært blokk (hjerteblokk). Kaliumsparende diuretika (amilorid, triamteren, spironolakton, eplerenon) i kombinasjon med ACE-hemmer eller angiotensin reseptor antagonist kan medføre hyperkalemi (kaliumforgiftning), spesielt hos eldre med redusert nyrefunksjon. Kombinasjonen ACE-hemmer og angiotensin reseptor antagonist («dual RAAS blockade») anbefales ikke pga. økt risiko for særlig akutt nyresvikt og hjerneslag, henholdsvis, sammenliknet med placebo i to store studier av pasienter med svært høy risiko (Tobe SW m.fl. 2011).
Hvordan bedre etterlevelsen av behandlingen?
All blodtrykksbehandling må ta utgangspunkt i pasientens egne forventninger, forestillinger og verdivalg. Legen skal imidlertid informere pasienten om risikoen ved hypertensjon og fordelen ved en effektiv behandling. Forskrivende lege bør gjøre seg kjent med pasientens opplevelse av situasjonen før man gir skriftlige og muntlige instruksjoner om behandlingen. Behandlingen må ta hensyn til pasientens behov og livssituasjon. Bruk av kombinasjonspreparater kan forenkle medisineringen for pasienten. I mange tilfeller kan hjemmemåling av blodtrykk være hensiktsmessig, og det er vist at dette øker interessen og bedrer etterlevelsen av behandlingen. Man bør oppfordre pasienten til å leve et normalt og aktivt liv. Legen bør ha stor oppmerksomhet på mulige bivirkninger, og derved kan pasientens tillit til behandlingen bedres.
Det har liten hensikt å forskrive legemidler som ikke blir tatt, og man kan i særlige tilfeller gjøre avtaler om bruk av monitorerings skjema (Morinsky), elektronisk pilleboks, medikamentmålinger i blod eller urin, eller direkte observert legemiddelinntak med etterfølgende 24-timers BT måling. Disse metodene bedrer etterlevelse i studier og kan være hensiktsmessig også i klinisk praksis spesielt ved alvorlig blodtrykksforhøyelse og tilsynelatende manglende effekt av legemidlene.
Blodtrykksmål og reduksjon av totalrisiko
Målet med den antihypertensive behandlingen er å hindre utvikling av hjerte- og karsykdom og endeorganskade. For å oppnå dette, bør blodtrykket senkes <140/90 mmHg. Flere store studer har vist at jo oftere pasienter har slike blodtrykksverdier ved kontroll, eller tilsvarende normalt ambulatorisk blodtrykk, jo mer effektivt forebygges komplikasjonene. I tillegg til adekvat blodtrykksbehandling vil god pasientbehandling også inkludere vurdering av andre risikoreduserende tiltak som statiner og i sjeldnere tilfeller acetylsalicylsyre. Denne vurderingen må gjøres ut fra en totalrisikovurdering (NORRISK2), slik beskrevet i egen anbefaling om risikovurdering. Blodtrykket bør om mulig reduseres til under 140/90 mmHg (systolisk/diastolisk) eller tilsvarende for dagblodtrykk (ambulatorisk, hjemme måling) <135/85mmHg, 24 timers døgnblodtrykk <130/80 mmHg og nattblodtrykk <120/70 mmHg.
Disse måltrykk gjelder for alle hypertensive personer opp til 80 år, men hos de aller eldste kan et systolisk blodtrykk < 150 mmHg være veiledende (i tråd med HYVET studien (Beckett NS m.fl. 2008). Husk kontroll av stående blodtrykk hos eldre og ved diabetes.
Til tross for kombinasjonsbehandling kan det være vanskelig å redusere systolisk blodtrykk til <140 mmHg og enda vanskeligere dersom målet er reduksjon til <130 mmHg. Målblodtrykk <130/80 mmHg er fortsatt et uavklart spørsmål for visse grupper av pasienter med diabetes, nyresykdom, venstre ventrikkel hypertrofi og spesiell risiko for å få hjerneslag. Følgelig er det enklere å oppnå behandlingsmålet dersom blodtrykksbehandlingen initieres før utvikling av betydelig organskade finner sted. Den amerikanske SPRINT studien (SPRINT Research Group, Wright JT Jr m.fl. 2015) viste fordel av blodtrykksmål <120 mmHg, men teknikken for blodtrykksmåling (ikke-observert automatisk kontor måling) er ikke direkte sammenliknbar med vanlige kontormålinger, og resultatene svarer trolig mer til et behandlingsmål på <140 mmHg ved vanlig kontormåling.
På tross av at flere retningslinjedokumenter stiller strenge krav til målblodtrykk for behandling, viser befolkningsstudier at et stort antall personer ikke oppnår slike blodtrykk, selv ikke med bruk av flere blodtrykksmidler. Det kan være flere årsaker til dette. Høyt utgangsblodtrykk og høy alder med isolert systolisk hypertensjon er to vanlige årsaker. Manglende opptitrering av legemidler er en annen viktig årsak. Høyt kontorblodtrykk med normalt ambulatorisk (eller hjemme målt) blodtrykk kan også være en forklaring. Bivirkninger og motvilje mot å bruke mange legemidler kan være medvirkende til at en del pasienter ikke får tilstrekkelig dosert behandling. Klinikeren bør ha målsettinger om å oppnå behandlingsmål hos så mange personer som mulig, men kan likevel formidle til pasienten at betydelig forebyggende effekt kan oppnås selv om man ikke når det tallmessige behandlingsmålet. Andre tiltak, så vel bedring av levevaner som andre typer legemiddelbehandling, kan ha avgjørende betydning for en god håndtering av pasientens risiko.
Store studier med lang oppfølgning av personer behandlet for hypertensjon, har vist at det er viktigere med god kontroll av ambulatorisk blodtrykk enn selve kontorblodtrykket som måles under legekonsultasjonen. Hjemmemåling eller bruk av 24-timers ambulatorisk blodtrykksmåling anbefales spesielt hos personer med svært varierende blodtrykk i kontorsituasjonen, ved bivirkninger eller om det er tvil om målblodtrykk er nådd (vær oppmerksom på at andre grenser gjelder for disse målingene - se egen anbefaling om utredning/kartlegging av hypertensjon).
I startfasen av blodtrykksbehandlingen bør kontrollene være relativt hyppige. Etter stabilisering kan antall kontroller reduseres til 1–2 per år. Personer med høy risiko bør ha hyppigere kontroller. Behandling av hypertensjon bør som oftest være livsvarig. Opphør av behandling fører vanligvis tilbake til en hypertensiv tilstand. Etter langvarig blodtrykkskontroll hos personer med lav risiko kan behandlingen forsøksvis reduseres, spesielt dersom tilfredsstillende livstilstiltak er gjennomført. I noen tilfeller kan også blodtrykknivået være betydelig påvirket av forbigående stressfaktorer. Seponering kan da forsøkes når livssituasjonen er normalisert.
Begrunnelse – dette er anbefalingen basert på
Høyt blodtrykk opptrer hos en stor andel av befolkningen, og utgjør sammen med røyking og høyt kolesterol de viktigste påvirkelige risikofaktorer for hjerte- og karsykdom. Hypertensjon er en særlig viktig årsak til hjerneslag, og er også assosiert med økt risiko for demens. Blodtrykksbehandling med legemidler bidrar sterkt til å redusere insidens av hjerte- og karsykdom og nyresykdom, redusere dødelighet av disse sykdommer og forlenge liv. Dette reduserer behov for legehjelp, sykehus, sykehjem og annen omsorgs- og pleietjeneste. Behandling som igangsettes tidligere i livsløpet har størst relativ effekt (dokumentert for 50-åringer vs. 60 og 70-åringer) mens behandling i høy alder har størst absolutt effekt. De anbefalte blodtrykkssenkende legemidler vil i hovedsak ha lik forebyggende effekt, og valg av legemiddel kan tilpasses individuelt for å minimalisere bivirkninger og for å ta hensyn til andre tilstander som måtte foreligge.
Tallrike kliniske studier og metaanalyser bekrefter at når blodtrykksbehandling igangsettes etter adekvat vurdering av blodtrykksnivå (eventuelt med 24-timers registrering) og øvrige risikofaktorer, vil slik behandling være effektiv og også kostnadseffektiv i et samfunnsperspektiv (Moran AE m.fl. 2014). Internasjonale retningslinjer (2013 ESH/ESC, National Institute for Health and Clinical Excellence 2011, 2013 Clinical practice guidelines for the management of hypertension in the community, An effective approach to high blood pressure control 2014, 2014 Evidence-based guideline for the management of high blood pressure in adults) gir ganske konsistente råd (Kjeldsen S m.fl. 2014) om blodtrykksbehandling, og danner basis for anbefalingene.
Forskningsgrunnlag
Populasjon (P): Personer med påvist for høyt blodtrykk
Tiltak (I): Medikamentell blodtrykksbehandling
Sammenligning (C): Ingen behandling/placebo
Beskrivelse av inkluderte studier
Medikamentell blodtrykksbehandling bidrar sterkt til å redusere insidens og dødelighet av hjerte- og karsykdom og nyresykdom.
En serie omfattende meta-analyser er publisert om blodtrykksbehandling de siste årene (Sundström J m.fl. 2015, Xie X m.fl. 2015, Ettehad D m.fl. 2015, Thomopoulos C m.fl. 2014; 32: 2285-95, Thomopoulos C m.fl. 2014; 32: 2296-304, Thomopoulos C m.fl. 2014; 32: 2304-14, Thomopoulos C m.fl. 2015; 33: 195-211, Thomopoulos C m.fl. 2015; 33: 1321-41).
I placebokontrollerte studier (Thomopoulos C m.fl. 2014) finner man at alle de viktigste hypertensjonsrelaterte komplikasjoner forebygges med følgende relative (%) og absolutte (hendelser per 1000 behandlede) risikoreduksjoner, for 10/5 mmHg reduksjon i blodtrykket og «numbers needed to treat» (NNT) for behandling i 5 år:
Komplikasjon; Relativ Risikoreduksjon; Absolutt Risikoreduksjon; NNT 5 år
- Hjerneslag: 33% relativ risikoreduksjon, 17 tilfeller unngått, NNT 59
- Hjerteinfarkt: 16% relativ risikoreduksjon, 7 tilfeller unngått, NNT 138
- Hjertesvikt: 48% relativ risikoreduksjon, 16 tilfeller unngått, NNT 63
- Hjerneslag, hjerteinfarkt og hjertesvikt samlet: 26% relativ risikoreduksjon, 29 tilfeller unngått, NNT 35
- Død: 11% risikoreduksjon, 9 tilfeller unngått, NNT 108
Legemiddelbehandling av høyt blodtrykk reduserer behov for legehjelp, sykehus, sykehjem og annen omsorgs- og pleietjeneste. Behandling som igangsettes tidligere i livsløpet har størst relativ effekt (dokumentert for 50-åringer vs. 60 og 70-åringer) mens behandling i høy alder har størst absolutt effekt. De ulike aspekter ved og effekter av behandlingen er omtalt i tallrike internasjonale retningslinjer, som 2013 ESH/ESC Guidelines for the management of arterial hypertension (2013 ESH/ESC Guidelines, 2013, hoveddokumentasjon).
Vurdering
Fordeler og ulemper
Fordeler
Blodtrykkskontroll med legemidler forebygger alvorlige komplikasjoner fra hjerne, hjerte, kar- og nyrer, og reduserer dødeligheten. Tilfredsstillende kontroll foreligger ved kontorblodtrykk <140/90 mmHg, tilsvarende dagblodtrykk (ambulatorisk, hjemmemåling) <135/85 mmHg, for 24 timers døgnblodtrykk ved verdier <130/80 mmHg og for nattblodtrykk ved verdier <120/70 mmHg.
Høyt blodtrykk og røyking er de ledende risikofaktorer for global sykdom og død i alle aldre (Turnbull F 2003, Kearney PM m.fl. 2005, Danaei G m.fl. 2009, Sundström J m.fl. 2011, The Global Burden of Disease Study (WHO) 2013 2015). Dette tilsier at en befolkningsrettet strategi er nødvendig for å redusere disse risikofaktorenes betydning for folkehelsen. Blodtrykkets epidemiologi har vært vurdert i en samleanalyse som inkluderte individuelle data på ca. 1 million i utgangspunktet friske personer fulgt i 10-15 år (Turnbull F 2003). Senere analyse av 464.000 pasienter som har vært inkludert i 147 prospektive og randomiserte intervensjonsstudier viste at 55-80 % av hjerteinfarkt og hjerneslag som kan forklares av den foreliggende epidemiologi (Turnbull F 2003), kan forebygges ved blodtrykksbehandling av relativt moderat intensitet (30/15 mmHg reduksjon i blodtrykk) (Law MR m.fl. 2009). Effekten er sterkest med hensyn til å forebygge hjerneslag og relativt sterkest hos middelaldrende (50 åringer) sammenliknet med eldre (70 åringer).
En serie omfattende meta-analyser er publisert om blodtrykksbehandling de siste årene (Sundström J m.fl. 2015, Xie X m.fl. 2015, Ettehad D m.fl. 2015, Thomopoulos C m.fl. 2014; 32: 2285-95, Thomopoulos C m.fl. 2014; 32: 2296-304, Thomopoulos C m.fl. 2014; 32: 2304-14, Thomopoulos C m.fl. 2015; 33: 195-211, Thomopoulos C m.fl. 2015; 33: 1321-41). Noen hovedresultater i disse er som følger:
I placebokontrollerte studier (Thomopoulos C m.fl. 2014) finner man at alle de viktigste hypertensjonsrelaterte komplikasjoner forebygges med følgende relative (%) og absolutte (hendelser per 1000 behandlede) risikoreduksjoner, for 10/5 mmHg reduksjon i blodtrykket og «numbers needed to treat» (NNT) for behandling i 5 år:
- Komplikasjon: Hjerneslag. Relativ risikoreduksjon: 33 %. Absolutt risikoreduksjon: 17. NNT 5 år: 59.
- Komplikasjon: Hjerteinfarkt. Relativ risikoreduksjon: 16 %. Absolutt risikoreduksjon: 7. NNT 5 år: 138.
- Komplikasjon: Hjertesvikt. Relativ risikoreduksjon: 48 %. Absolutt risikoreduksjon: 16. NNT 5 år: 63.
- Komplikasjon: Slag, infarkt og svikt. Relativ risikoreduksjon: 26 %. Absolutt risikoreduksjon: 29. NNT 5 år: 35.
En egen analyse av studier der pasienter ble randomisert til mer intens versus mindre intens blodtrykkssenkende behandling viste først og fremst reduksjon i hjerneslag (-34% og -10 hendelser per 1000, 5-års NNT 98).
Mild hypertensjon
Behandling ved mild hypertensjon og ellers lav kardiovaskulær risiko har beskjeden nytte og har vært rapportert uten effekt én metaanalyser (Diao D m.fl. 2012). I en nyere metaanalyse med større antall pasienter fremkommer imidlertid gunstig effekt (Sundström J m.fl. 2015), slik at behandling med legemidler også må vurderes ved mild hypertensjon, men ut fra at det er økende nytteverdi (lavere NNT) ved økende samlet risiko hos pasienten (Blood Pressure Lowering Treatment Trialists' Collaboration, Sundström J m.fl.2014).
Behandling av pasienter i alle kategorier (Thomopoulos C m.fl. 2014;32: 2296-304), mild hypertensjon (140-159/90-99 mmHg), moderat hypertensjon (160-179/100-109 mmHg) og alvorlig hypertensjon (>180/110 mmHg) forebygger alle komplikasjonene nevnt ovenfor. For pasienter i kategorien mild hypertensjon med generelt lett forhøyet risiko viser en meta-analyse følgende relative (%) og absolutte (1000/5 år) risikoreduksjoner for 10/5 mmHg reduksjon i blodtrykket og NNT for hver enkelt av komplikasjonen for 5 års behandling:
- Komplikasjon: Hjerneslag. Relativ risikoreduksjon: 67 %. Absolutt risikoreduksjon: 21. NNT 5 år: 47.
- Komplikasjon: Hjerteinfarkt. Relativ risikoreduksjon: 32 %. Absolutt risikoreduksjon: 12. NNT 5 år: 86.
- Komplikasjon: Slag eller infarkt. Relativ risikoreduksjon: 49 %. Absolutt risikoreduksjon: 34. NNT 5 år: 29.
- Komplikasjon: Død. Relativ risikoreduksjon: 47 %. Absolutt risikoreduksjon: 19. NNT 5 år: 54.
Meta-analysen viser en fordel av å senke blodtrykket til <130/80 mmHg når det gjelder forebygging av hjerneslag, men ikke for andre endepunkter eller kardiovaskulær død.
Faktisk risikonivå
Når studiene vurderes etter faktisk risikonivå (Thomopoulos C m.fl. 2014; 32: 2304-14) bedømt ut i fra hendelsesrater i kontrollgruppene, lav til moderat, høy, meget høy og svært høy, så er de relative risikoreduksjoner for hendelsene hjerneslag, hjerteinfarkt, hjertesvikt og død ganske like. Dermed vil den absolutte behandlingseffekten (målt ved for eksempel antall reduserte hendelser per 1000 per år) bli høyest i gruppene med høyt risikonivå. Det er derfor grunn til å ha størst oppmerksomhet rettet mot personer med høyest risiko og anbefale flere intervensjoner til denne gruppen. Residualrisiko (gjenværende risiko etter behandling) øker for alle hendelser med økende absolutt risikonivå og med økende alder. Av dette følger at behandling startet i yngre alder vil være gunstigst i forhold til å begrense residualrisiko.
Valg av legemiddel
Alle vanlig brukte blodtrykksenkende legemidler, det vil si forskjellige typer diuretika, beta-blokkere, kalsium antagonister, angiotensin konverterende enzym hemmere, angiotensin reseptor antagonister og sentralt virkende blodtrykkssenkende legemidler, forebygger de forskjellige komplikasjonene og død (Thomopoulos C m.fl. 2015; 33: 195-211). Legemiddel med virkestoffet diltiazem er avregistrert i Norge og tatt ut av anbefalingene. Den forebyggende effekten synes mer relatert til graden av blodtrykksreduksjon enn til type legemiddel.
Sammenlikning av legemidler
En meta-analyse av 50 «head-to-head» (direkte sammenlikning) endepunktstudier viser at de forskjellige legemiddelklassene har nokså lik forebyggende effekt på de forskjellige typer hendelser (Thomopoulos C m.fl. 2015; 33: 1321-41). Dog synes beta-blokkere mindre effektive og kalsium-antagonister mer effektive i å forebygge hjerneslag, og hemmere av renin-angiotensin systemet mest effektive i å forebygge hjertesvikt. Disse effektene er uavhengig av totalt risikonivå, men vurderes å ha betydning for pasienter med spesielt høy risiko for de nevnte enkelthendelser og pasienter med høyt blodtrykk som samtidig lider av disse tilstander.
Ulemper
Blodtrykksbehandling med legemidler kan bidra til sykeliggjøring av personer uten symptomer og er ressurskrevende med tanke på utredning, igangsetting og oppfølging. Behandlingen kan gi både mindre plagsomme bivirkninger og mer alvorlige hendelser som ortostatisk blodtrykksfall med synkope og fall, dessuten kan det ses utløsing eller forverring av nyresvikt.
Uheldig valg av legemidler, kombinasjoner og doser øker risikoen for bivirkninger, og kan resultere i overbehandling. Bivirkninger vil variere betydelig individuelt og i forhold til de ulike legemidlene. Dette er nærmere omtalt i avsnittet praktisk informasjon. Slike ulemper unngås i stor grad ved omsorgsfull oppfølging som tar hensyn til 24-timers blodtrykk, etterlevelse av behandlingen og kjente spesifikke bivirkninger.
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen vurderes som god. Blodtrykksbehandling med legemidler er klart dokumentert i tallrike randomiserte, kontrollerte kliniske forsøk og metaanalyser. Studiene omfatter aktiv behandling versus ingen eller placebobehandling ved mild, moderat og alvorlig hypertensjon, videre sammenlikning av behandling mot ulike målblodtrykk, aktive behandlinger i monoterapi mot kombinasjonsbehandling, samt ulike kombinasjonsbehandlinger mot hverandre.
Verdier og preferanser
Blodtrykksbehandling med legemidler forebygger alvorlige hjerte-, hjerne- og nyresykdommer og forlenger liv. De aktuelle legemidler har generelt lite bivirkninger og kan nesten alltid tilpasses uten vesentlige ulemper.
Det er viktig at leger og annet helsepersonell skaper forståelse for viktigheten av blodtrykksbehandling hos personer som har høy risiko, men som helst vil unngå legemidler. Noen studier indikerer at pasienter ikke ønsker legemidler fordi deres oppfatning om hva som forårsaker det høye blodtrykket ("stress") tilsier at legemiddelbehandling bare skulle være nødvendig for en begrenset periode (Marshall IJ m.fl. 2012).
Observasjoner i store intervensjonsstudier viser imidlertid at pasienter som slutter med legemiddelbehandling av blodtrykk på egen hånd har dårligere prognose. Hos pasienter med lett eller moderat forhøyet risiko for komplikasjoner anbefales imidlertid ikke-farmakologisk behandling som 1. linjebehandling, og ikke-farmakologiske tiltak bør alltid inngå i behandlingen også hos de som trenger legemidler. Nedtrapping og seponering av legemidler kan eventuelt gjøres hvis blodtrykket reduseres klart under behandlingsmålet på stabil dose legemidler, for eksempel gjennom endring av levevaner.
Referanser
129. Blood Pressure Lowering Treatment Trialists' Collaboration. Effects of different blood-pressure-lowering regimens on major cardiovascular events: results of prospectively-designed overviews of randomised trials https://www.ncbi.nlm.nih.gov/pubmed/14615107
130. Global burden of hypertension: analysis of worldwide data https://www.helsedirektoratet.no/referanse/0002-0013-177793
131. The preventable causes of death in the United States: comparative risk assessment of dietary, lifestyle, and metabolic risk factors https://www.helsedirektoratet.no/referanse/0002-0013-177794
132. Association of blood pressure in late adolescence with subsequent mortality: cohort study of Swedish male conscripts https://doi.org/10.1136/bmj.d643
133. Use of blood pressure lowering drugs in the prevention of cardiovascular disease: meta-analysis of 147 randomized trials in the context of expectations from prospective epidemiological studies https://www.helsedirektoratet.no/referanse/0002-0013-177796
134. Effect of blood pressure reduction in mild hypertension. A systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-177797
135. Effects of intensive blood pressure lowering on cardiovascular and renal outcomes: updated systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-177798
136. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-177799
137. Effects of blood pressure lowering on outcome incidence in hypertension. 1. Overview, meta-analyses, and meta-regression analyses of randomized trials https://www.helsedirektoratet.no/referanse/0002-0013-177800
138. Effects of blood pressure lowering on outcome incidence in hypertension: 2. Effects at different baseline and achieved blood pressure levels-overview and meta-analyses of randomized trials https://www.helsedirektoratet.no/referanse/0002-0013-177801
139. Effects of blood pressure lowering on outcome incidence in hypertension: 3. Effects in patients at different levels of cardiovascular risk-overview and meta-analyses of randomized trials https://www.helsedirektoratet.no/referanse/0002-0013-177802
140. Effects of blood pressure lowering on outcome incidence in hypertension: 4. Effects of various classes of antihypertensive drugs-overview and meta-analyses https://www.helsedirektoratet.no/referanse/0002-0013-177803
141. Effects of blood pressure-lowering on outcome incidence in hypertension: 5. Head-to-head comparisons of various classes of antihypertensive drugs - overview and meta-analyses https://www.helsedirektoratet.no/referanse/0002-0013-177804
142. Lay perspectives on hypertension and drug adherence: systematic review of qualitative research https://www.helsedirektoratet.no/referanse/0002-0013-177805
143. Cost-effectiveness of hypertension therapy according to 2014 guidelines https://www.helsedirektoratet.no/referanse/0002-0013-177806
144. Pharmacotherapy for mild hypertension https://www.helsedirektoratet.no/referanse/0002-0013-177807
145. Blood pressure-lowering treatment based on cardiovascular risk: a meta-analysis of individual patient data https://www.helsedirektoratet.no/referanse/0002-0013-177808
146. 2013 ESH/ESC Guidelines for the management of arterial hypertension https://www.helsedirektoratet.no/referanse/0002-0013-177809
147. National Institute for Health and Clinical Excellence (NICE) 2011 Hypertension guidelines http://guidance.nice.org.uk/CG127
148. 2013 Clinical practice guidelines for the management of hypertension in the community: A statement by the American Society of Hypertension and the International Society of Hypertension (ASH/ISH) https://www.helsedirektoratet.no/referanse/0002-0013-177811
149. https://www.helsedirektoratet.no/referanse/0002-0013-177812
150. https://www.helsedirektoratet.no/referanse/0002-0013-177813
151. Updated national and international hypertension guidelines: A review of current recommendations https://www.helsedirektoratet.no/referanse/0002-0013-177814
152. Diabetes and CVD risk during angiotensin-converting enzyme inhibitor or angiotensin II receptor blocker treatment in hypertension: a study of 15,990 patients https://www.helsedirektoratet.no/referanse/0002-0013-177815
153. ; ONTARGET and TRANSCEND Investigators. Cardiovascular and renal outcomes with telmisartan, ramipril, or both in people at high renal risk: results from the ONTARGET and TRANSCEND studies https://www.helsedirektoratet.no/referanse/0002-0013-177816
154. A Randomized Trial of Intensive versus Standard Blood-Pressure Control https://www.helsedirektoratet.no/referanse/0002-0013-177817
155. Treatment of hypertension in patients 80 years of age or older https://www.helsedirektoratet.no/referanse/0002-0013-177818
Sist faglig oppdatert: 05.12.2024
Acetylsalisylsyre og andre platehemmere ved primærforebygging av hjerte- og karsykdom
Acetylsalisylsyre (ASA) (eventuelt andre platehemmere ved intoleranse) bør sjelden benyttes i primærforebygging av hjerte- og karsykdommer.
Ved særlig høy risiko og begrensede muligheter for andre forebyggende tiltak, kan slik primærforebygging likevel vurderes etter individuell vurdering av den forventede risikoreduksjon for hjerteinfarkt og hjerneslag, veid opp mot økt blødningsrisiko.
Praktisk – slik kan anbefalingen følges
Dersom det unntaksvis anses hensiktsmessig å starte primærforebygging med platehemmer, vil standard behandling med acetylsalisylsyre (ASA) 75 mg daglig (ATC-kode B01A C06) være velegnet (Vandvik PO m.fl. 2012, Lotrionte M m.fl. 2016).
Det er få kontraindikasjoner, bortsett fra allergi.
Ved gastrointestinal sykdom/ulcus sykdom/dyspepsi vil primærforebygging sjelden være aktuelt, men vil unntaksvis kunne brukes forutsatt samtidig behandling med syredempende medikasjon.
Ved intoleranse kan alternativ behandling med klopidogrel 75 mg x 1 (ATC-kode B01A C04) regnes å ha tilsvarende forebyggende effekt og samme blødningsrisiko som ASA.
Begrunnelse – dette er anbefalingen basert på
Bruk av acetylsalicylsyre for primærforebygging av hjerte- og karsykdom har vært anbefalt i mange land tidligere som et rimelig legemiddel med moderat effekt. Nyere studier og metaanalyser viser imidlertid at reduksjonen i kardiovaskulære hendelser er ganske liten, og det ses ingen effekt på dødelighet. Videre vil behandlingen gi økt forekomst av både mindre alvorlige og alvorlige blødninger, og denne uheldige effekten vil være av omtrent samme størrelse som nytte-effekten hos de fleste personer som ikke har manifest hjerte- og karsykdom. Acetylsalicylsyre eller annet tilsvarende platehemmende legemiddel anbefales som hovedregel derfor ikke brukt i primærforebygging, men kan unntaksvis vurderes ved ekstra høy risiko og særlig når ikke andre forebyggende tiltak lar seg gjennomføre på en tilfredsstillende måte.
Forskningsgrunnlag
Populasjon (P): Pasienter med økt risiko for hjerte- og karsykdom grunnet f. eks. røyking, lipidforstyrrelser, høyt blodtrykk og familiær belastning, men uten manifest hjerte- og karsykdom
Tiltak (I): Acetylsalicylsyre 75 mg daglig, subsidiært annen platehemmer (klopidogrel 75 mg daglig)
Sammenligning (C): Ingen behandling (placebo)
Beskrivelse av inkluderte studier
Det foreligger flere store metaanalyser som viser i hovedsak sammenfallende funn. Primærforebygging med ASA har en beskjeden forebyggende effekt på kardiovaskulære hendelser tilsvarende en relativ risikoreduksjon på ca. 10 %.
Gevinsten beror vesentlig på en reduksjon av ikke-fatale hjerteinfarkt, mens det ikke er sikker effekt vedrørende hjerneslag eller kardiovaskulær dødelighet. Den gunstige effekten må veies mot en liten, men signifikant økt risiko for blødninger.
Vurderingen av den samlede nytten varierer i ulike retningslinjer. Europeiske retningslinjer anbefaler som hovedregel ikke å bruke ASA i primærforebygging (Perk J m.fl. 2012), mens amerikanske retningslinjer har vært mer positive (Guirguis-Blake JM m.fl. 2015, Vandvik PO m.fl. 2012).
Vår anbefaling er at ASA bare unntaksvis bør benyttes for primærforebygging, på linje med de europeiske retningslinjer. I noen tilfeller kan slik primærforebygging likevel synes riktig, særlig når risikoen er ekstra høy, og hvor man har begrenset mulighet til andre forebyggende tiltak. Det anbefales da å gjøre en individuell vurdering av personens risiko, både hva gjelder kardiovaskulære hendelser og blødningsfaren (Nansseu JR m.fl. 2015).
Flere store pågående studier med acetylsalicylsyre i primærforebygging som ventes ferdigstilt innen 2020, og resultatene fra disse kan derfor føre til justering av de nåværende anbefalinger.
Vurdering
Fordeler og ulemper
Fordeler
En metaanalyse fra 2015 med 10 randomiserte kontrollerte studier bedømt til å ha moderat til god kvalitet og som til sammen inkluderte 103787 personer, viste at behandling med acetylsalisylsyre (ASA) ga 11 % reduksjon i kardiovaskulære hendelser (hjerteinfarkt, hjerneslag og kardiovaskulær død (relativ risiko (RR) 0,89; 95 % konfidensintervall (KI) 0,84 - 0,95). (Guirguis-Blake JM m.fl. 2015). Effekten skyldtes hovedsakelig en reduksjon av ikke-fatale hjerteinfarkt og koronare hendelser (RR 0,80; 95 % KI 0,72-0,88). Effekt på hjerneslag ble bare sett ved doser <100 mg per dag (RR 0,85; 95 % KI 0,76 - 0,96). Det ble ikke observert noen sikker effekt på kardiovaskulær død eller total dødelighet.
En tidligere metaanalyse fra Antithrombotic Trialists' (ATT) Collaboration (2009) rapporterte om redusert forekomst av kardiovaskulære hendelser (0,51 % per år på ASA mot 0,57% per år på placebo/kontroll, dvs en relativ risikoreduksjon på 12 % (p=0,0001)), men ingen effekt på kardiovaskulær død ((ATT) Collaboration 2009).I en metaanalyse fra 2012 (Vandvik PO m.fl. 2012) ble det påvist noe bedre effekt på hjerteinfarkt (RR 0,77; 95 % KI 0,69-0,86). Det var ingen signifikant effekt på hjerneslag (RR 0,95; 95 % KI 0,85-1,06. Effekten på total dødelighet var grensesignifikant (RR 0,94; 95 % KI 0,88-1,00). Effekten av alternativ platehemmende behandling er langt mindre undersøkt, men synes for klopidogrel å tilsvare ASA (CAPRIE Steering Committee 1996), mens det mangler data for andre platehemmere i primærforebygging.
Ulemper
Behandling med ASA gir økt risiko for blødninger som vil variere med pasientkarakteristika, alder og komorbiditet, og ulike studier har rapportert varierende anslag for blødningsrisikoen.
I førstnevnte metaanalyse rapporterte 9 av de 10 studiene tall for gastrointestinale blødninger, slik at relativ risiko (RR) varierte fra 0,50 til 8,10. En analyse av individuelle data fra denne studien rapporterte en risikoøkning for større gastrointestinale og ekstrakranielle blødninger (RR 1.54; 95 % KI 1.30-1.82) for ASA mot kontroll/placebo (Guirguis-Blake JM m.fl. 2015). Økt risiko for intrakranielle blødninger ble også sett, men med såpass få tilfeller at presise risikoanslag ikke kunne beregnes.
I analysen fra Antithrombotic Trialists' (ATT) Collaboration fant man en økning av gastrointestinale og ekstrakranielle blødninger ved ASA tilsvarende 0,10% per år versus 0,07% per år ved placebo/kontroll, og for hjerneblødning en ikke-signifikant økning tilsvarende 0,04% per år versus 0,03% per år ((ATT) Collaboration 2009). I den sistnevnte analysen medførte ASA-behandling økt risiko for større ekstrakranielle blødninger (RR 1,54; 95 % KI 1,30-1,82) (Vandvik PO m.fl. 2012).
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen vurderes som lav. Flere av studiene er gjort på spesielle grupper personer (kun helsepersonell) og ulike doser og preparater har vært benyttet.
Verdier og preferanser
Behandling med ASA tolereres vanligvis godt. Behandlingen gir likevel en viss økning av alle typer blødninger, inkludert alvorlige gastrointestinale og intrakranielle blødninger. Den økte blødningsrisikoen er i primærforebyggende sammenheng av omtrent samme størrelse som reduksjonen i kardiovaskulære hendelser.
De fleste blødninger vil ha mindre alvorlige langtidskonsekvenser enn tilsvarende tromboemboliske komplikasjoner som f. eks. hjerneslag, men sjeldne tilfeller av fatale hjerneblødninger må også påregnes. Samlet sett vil det vanligvis ikke være hensiktsmessig å bruke ASA i primærforebygging.
Referanser
156. Antithrombotic Trialists (ATT) Collaboration. Baigent C, Blackwell L, Collins R, et al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009 May 30;373(9678):1849-1860 https://www.helsedirektoratet.no/referanse/0002-0013-177819
157. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet. https://www.helsedirektoratet.no/referanse/0002-0013-177820
158. Guirguis-Blake JM, Evans CV, Senger CA et al. Aspirin for the Primary Prevention of Cardiovascular Events: A Systematic Evidence Review for the U.S. Preventive Services Task Force [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2015 Sep. Report No.: 13-05195-EF-1. U.S. Preventive Services Task Force Evidence Syntheses, formerly Systematic Evidence Reviews https://www.helsedirektoratet.no/referanse/0002-0013-177821
159. Lotrionte M, Biasucci LM, Peruzzi M, et al. Which Aspirin Dose and Preparation Is Best for the Long-Term Prevention of Cardiovascular Disease and Cancer? Evidence From a Systematic Review and Network Meta-Analysis. Prog Cardiovasc Dis. 2016 Feb 4. pii: S0033-0620(16)30009-3. doi: 10.1016/j.pcad.2016.02.001. [Epub ahead of print] https://www.helsedirektoratet.no/referanse/0002-0013-177822
160. Nansseu JR, Noubiap JJ. Aspirin for primary prevention of cardiovascular disease. Thromb J. 2015 Dec 4;13:38. doi: 10.1186/s12959-015-0068-7. eCollection 2015 https://www.helsedirektoratet.no/referanse/0002-0013-177823
161. Perk J, De Backer G, Gohlke H, et al. European guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Eur Heart J 2012 Jul;33(13):1635-1701. Erratum in: Eur Heart J 2012 Sep;33(17):2126 https://www.helsedirektoratet.no/referanse/0002-0013-177824
162. Vandvik PO, Lincoff AM, Gore JM, Gutterman DD, Sonnenberg FA, Alonso-Coello P, Akl EA, Lansberg MG, Guyatt GH, Spencer FA; American College of Chest Physicians. Primary and secondary prevention of cardiovascular disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012 Feb;141(2 Suppl):e637S-68S. doi: 10.1378/chest.11-2306 https://www.helsedirektoratet.no/referanse/0002-0013-177825
Sist faglig oppdatert: 05.03.2018
Bruk av statiner og andre lipidsenkende legemidler ved primærforebygging av hjerte- og karsykdom
Tilby primærforebygging med statiner til personer <75 år med totalkolesterol > 7,0 mmol/l og LDL-kolesterol > 5,0 mmol/l, (eller LDL-kolesterol > 5 mmol ved lavere totalkolesterol). Dette gjelder ikke kvinner som utvikler slike kolesterolverdier etter overgangsalderen og som ikke har andre risikofaktorer.
Tilby primærforebygging også til personer 45-74 år med totalkolesterol 5,0-7,0 mmol/l (og LDL-kolesterol 3,0-5,0 mmol/l) dersom samlet risiko overstiger de aldersspesifikke risikogrenser.
Praktisk – slik kan anbefalingen følges
Statinbehandling bør tilbys personer med høy livstidsrisiko for hjerte- og karsykdom, når kolesterol- og risikonivået er over optimalt nivå. Slik behandling er aktuelt for følgende hovedgrupper:
- Voksne personer med familiær hyperkolesterolemi eller familiær kombinert hyperlipidemi – se eget kapittel om diagnostikk. Behandling av barn med familiær hyperkolesterolemi er en spesialistoppgave.
- Personer ≥ 40 år med diabetes og LDL-kolesterol ≥ 2,5 mmol/l (og yngre pasienter hvis risikoprofilen tilsier det) – se retningslinjer for diabetes.
- Personer < 75 år med totalkolesterol > 7,0 mmol/l og LDL-kolesterol > 5,0 mmol/l, (eller LDL-kolesterol > 5 mmol ved lavere totalkolesterol). Dette gjelder ikke kvinner som utvikler slike kolesterolverdier etter overgangsalderen og med lav samlet risiko (bruk risikoberegning som beskrevet i punktet nedenfor).
- Personer mellom 45-74 år og totalkolesterol 5,0-7,0 mmol/l (tilsvarende LDL-kolesterol på 3,0-5,0 mmol/l) med forhøyet risikoskår for hjerte- og karsykdom. Risikoskår beregnes basert på NORRISK 2 med eventuell justering for tilleggsfaktorer, slik nærmere beskrevet i anbefalingen om Risikovurdering. Som forhøyet risikoskår regnes en estimert risiko tilsvarende:
- ≥ 5 % (45-54 år)
- ≥ 10 % (55-64 år)
- ≥15 % (65-74 år)
- Individuell vurdering foretas hos personer ≥ 75 år (se egen anbefaling).
- Statinbehandling anbefales personer ≥ 45 år med kronisk nyresykdom uansett lipidverdiene (se KDIGO 2013).
- Hos personer < 45 år med betydelig forhøyet risiko sammenliknet med jevnaldrende pga. multiple eller alvorlig risikofaktorer, kan behandling med statiner vurderes også om beregnet 10 års risiko (NORRISK2) er lav. Individuell vurdering foretas og statinbehandling startes der relativ risiko er høy, eksempelvis hos personer med tre eller flere risikofaktorer.
Kolesterolnivå og risikovurdering
Legemiddelbehandling av hyperlipidemi fokuserer på nivået av totalrisiko for hjerte- og karsykdom mer enn på nivået av blodlipider. Enkelte personer med høyt kolesterol har lav absolutt risiko grunnet fravær av andre risikofaktorer for hjerte- og karsykdom, f.eks. postmenopausale kvinner som ikke har påvist høyt kolesterol før menopausen. På den annen side vil personer med gjennomsnittlig eller lavere kolesterolverdi kunne ha klar klinisk gevinst av å benytte lipidsenkende legemidler, eksempelvis personer med sterk familieanamnese, diabetes, inflammatorisk sykdom og kronisk nyresvikt.
Risikotabellene tar hensyn til de viktigste risikofaktorene dvs. alder, kjønn, røykestatus, kolesterolverdi og blodtrykk. Behandleren bør foreta en klinisk vurdering som rommer muligheten for en mer nyansert vurdering, særlig i forhold til betydningen av en persons livsstil og familieanamnese. Mange røykere vil redusere risikoen tilstrekkelig ved røykeslutt uten å trenge lipidsenkende behandling. Ved tidlig hjerte- og karsykdom i slekten (< 60 år hos menn og < 70 år hos kvinner) er det viktig å få frem i hvilken grad dette var forbundet med røyking og uheldig livsstil for å forstå betydningen av de arvelige faktorene i slekten.
Valg av statinpreparat og dose
Det anbefales å starte med 20 mg atorvastatin (ATC-kode, C10A A05) som reduserer LDL-kolesterol anslagsvis med 42 % (Adams SP m.fl. 2015). Dette er i samme effektgruppe (reduksjon 30 - 50 %) som simvastatin 40 mg (ATC-kode, C10A A01), rosuvastatin 10 mg (ATC-kode, C10A A07) , lovastatin 40 mg (ATC-kode, C10A A02) eller fluvastatin depot 80 mg (ATC-kode, C10A A04) . Til sammenlikning gir 10 mg atorvastatin om lag 37 % reduksjon i LDL-kolesterol, mens 40 mg gir om lag 47 % reduksjon. Disse tallene illustrerer at det er lite å hente ved dobling av statindosen når man først har startet med en moderat dose. Ved gjennomsnittlig utgangspunkt av LDL-kolesterol på ca. 4 mmol/l vil en moderat statindose som ovenfor gi en reduksjon i LDL-kolesterol på ca. 1,5 mmol/l.
Hos pasienter med kronisk nyresykdom og GFR < 60 ml/min/1,73 m2, anbefales bruk av preparater og doseringer med lav risiko for interaksjoner (fluvastatin 80 mg, atorvastatin 20 mg, rosuvastatin 10 mg, simvastatin 20 mg, eventuelt i kombinasjon med ezetimib 10 mg (ATC-kode, C10A X09) ). Disse lavere doseringer kan også gjelde ved samtidig bruk av en del antivirale midler. Man bør også være oppmerksom på interaksjoner med flere statiner og andre vanlige legemidler som for eksempel kalsiumantagonister (verapamil) og en rekke antibiotika. Se interaksjoner.no
Behandlingsmål
I primærforebygging mangler det data som gir grunnlag for å anbefale behandling mot en klart definert LDL-kolesterol målverdi. Den absolutte gevinsten ved å tilstrebe lavere verdier er begrenset. Risikoen for utvikling av diabetes øker ved bruk av høye statindoser (Preiss D m.fl. 2011) og nytte-risikobalansen kan tenkes å bli uheldig. Likevel er det grunn til å følge opp effekten av behandlingen for å sikre at tilstrekkelige reduksjoner i LDL-kolesterolnivå oppnås. En reduksjon i LDL-kolesterol på 30-40 % eller en LDL-kolesterol <3,0 mmol/l indikerer betydelig redusert risiko.
Behandlingsmål (LDL-kolesterol < 2,5 mmol/l) anbefales hos pasienter med diabetes på grunn av høy risiko. Hos personer med familiære hyperlipidemier medfører et høyt LDL-kolesterol fra fødselen eller fra ung alder betydelig økning i risiko. Dermed anbefales LDL-kolesterol <2,5 mmol/l generelt hos disse pasientene. Et lavere mål for LDL-kolesterol på < 1,8 mmol/l anbefales ved familiære hyperlipidemier når statinbehandlingen startet først etter 40 år (Nordestgaard BG m.fl. 2013), samt hos slike personer med samtidig påvist hjerte- og karsykdom eller diabetes.
Oppfølging
Ved oppstart av behandling med statiner bør det tas kontrollblodprøver etter 6-12 uker (lipider, transaminaser, eventuelt kreatinin kinase [CK] ved symptomer), og tilsvarende etter 1 år. Dette gjøres for å sikre etterlevelse og kontrollere leverstatus. Det er senere ikke nødvendig å kontrollere lipidene og leverstatus med hyppige rutinekontroller, men dette bør gjøres om pasienten har bivirkninger, man vil følge opp etterlevelsen eller ved endringer i medisineringen.
Hos personer med høy risiko for diabetes bør HbA1C og/eller fastende glukose sjekkes årlig. Risikofaktorer for diabetes inkluderer alder, familiær forekomst av diabetes, metabolsk syndrom (abdominal fedme, hypertriglyseridemi, hypertensjon, økt fastende glukose), visse etnisiteter og bruk av antipsykotika. Vurdering av diabetesrisiko er nærmere beskrevet i Diabetesretningslinjene.
Bivirkninger og toleranse
Økning i leververdier kan forekomme ved statinbehandling spesielt ved høye doser (Desai CS m.fl.2014). Ved økning i transaminaser > 3 ganger øvre normalområdet bør statin stoppes inntil verdiene er tilbake på startnivå. Man kan da prøve en lavere eller annenhver dag dosering, og en gradvis opptitrering. Alkoholinntak øker risikoen for økning i leververdier. En periode på 6-8 uker uten alkohol kan bidra til å normalisere verdiene. Personer med fedme og ikke-alkoholisk fettlever kan også ha økte leververdier som ikke skyldes statinbehandling, og som ikke bør føre til seponering av statin.
Mer vanlig er subjektive plager som gastrointestinalt besvær og stivhet og smerter i muskler og ledd. Muskel- og leddplager rapporteres hos 1-8 % av deltakere i kliniske studier, men forskjellen mellom statin-behandlede og placebo-behandlede deltakere er svært liten (Newman CB m.fl. 2015). I klinisk praksis rapporterer mange flere muskel- og leddsmerter, muskelsvakhet og kramper, stivhet, nedsatt arbeidskapasitet og/eller tretthet enn i randomiserte studier. En betydelig andel av personer med plager tolererer statiner når de tror at de får placebo. Noen personer er bekymret for endringer i hjernefunksjon ved bruk av statiner. Meta-analyser finner ingen sammenheng mellom bruk av statiner og nedsatt kognisjon (Desai CS m.fl.2014). Risikofaktorer for muskel- og leddplager er høy alder, liten kroppsmasse, systemsykdom, polyfarmasi og alkoholmisbruk. Ved slike plager, bør man tenke på underliggende årsaker som viral sykdom, hypotyreose, annen muskelsykdom som polymylagia revmatika og bruk av medikamenter som øker risikoen for muskelplager.
CK måles hos pasienter som rapporterer nye muskelsmerter eller forverring av smerter (Stroes ES m.fl. 2015). Et økt CK-nivå har usikker klinisk betydning i fravær av slike symptomer og bør ikke måles rutinemessig. Statinbehandling bør seponeres dersom CK er 5 ganger eller mer over øvre referanseverdi, og symptomer/verdier vurderes igjen etter noen ukers stopp i behandlingen.
Andre statiner enn atorvastatin kan brukes som alternativer ved bivirkninger, utilstrekkelig effekt eller intoleranse. Ved plagsomme bivirkninger eller utilstrekkelig effekt:
- Midlertidig seponering av statinbehandling, og nytt forsøk når symptomene har gitt seg for å sikre at symptomene er relatert til statinbehandling.
- Dosereduksjon av atorvastatin (doser helt ned til 10 mg eller rosuvastatin 5 mg annen hver dag reduserer LDL-kolesterol nivå effektivt) (Keating AJ m.fl. 2013).
- Bytte til annet statin.
Dersom statiner overhodet ikke tolereres eller lipidnivående på høyeste dose blir liggende vesentlig over behandlingsmål, må tilleggsbehandling med ezetimib vurderes. Ezetimib 10 mg er vist å redusere hendelser hos pasienter med etablert koronarsykdom (Cannon CP m.fl. 2015) og i meta-analyse (Savarese G m.fl. 2015), og kan benyttes i primærprevensjon ved statinintoleranse, eller hos pasienter der man ikke kommer til LDL-kolesterolmål (diabetes, familiære hyperlipidemier). I spesielle tilfeller kan også colesevalam og gallesyrebindende medikamenter (kolestyramin, kolestipol) vurderes.
Nylig er antistoffer mot proprotein-konvertase-subtilisin/kexin-type 9 (PCSK-9-hemmere) registrert i Norge (alirocumab - ATC-kode C10A X14, evolocumab - ATC-kode C10A X13). Ved familiære hyperlipidemier kan slike medikamenter være aktuelle ved manglende lipidkontroll på høyeste tolererte dose statin og ezetimib. Grunnet høye kostnader vil det være begrensninger i forhold til refusjon.
Begrunnelse – dette er anbefalingen basert på
Primærforebygging med statiner har omfattende dokumentasjon på å kunne redusere forekomsten av hjerte- og karsykdom ved ulike nivåer av risiko, samt ved hyperlipidemi, hypertensjon, diabetes og nyresykdom. Gevinsten av behandlingen må likevel veies opp mot risiko for bivirkninger og overbehandling, og i en slik avveining må man både se på lipidverdiene og andre risikofaktorer. Behandlingen har lave kostnader og lav risiko for alvorlige bivirkninger, og vil være kostnadseffektiv når forskrivning gjøres etter en grundig totalvurdering. Behandling er derfor å anbefale når kolesterolnivået overstiger de anbefalte grenser, og bør startes i ung alder ved familiære hyperlipidemier.
Tilsvarende anbefales statiner som primærforebygging til personer mellom 40 og 75 år når risikoen overstiger spesifikke alderjusterte intervensjonsgrenser, samt ved diabetes og nedsatt nyrefunksjon. Slik intervensjon er viktig for å motvirke den betydelige ekstra hjerte- og karrisiko som de sistnevnte tilstander innebærer.
Forskningsgrunnlag
Populasjon (P): Personer med økt risiko for hjerte- og karsykdom
Tiltak (I): Behandling med statin
Sammenligning (C): Ingen behandling/placebo
Beskrivelse av inkluderte studier
Bruk av statiner i primærforebygging er kartlagt i en rekke randomiserte kontrollerte studier og metaanalyser. Vi har vektlagt en Cochrane metaanalyse fra 2013 (Taylor F m.fl. 2013, hoveddokumentasjon). Statinbehandling reduserte totalmortalitet (odds ratio [OR] 0,86, 95 % KI 0,79 - 0,94); kombinert fatal og ikke-fatal hjerte- og karsykdom (RR 0,75, 95 % KI 0,70 – 0,81), kombinert fatal og ikke-fatal koronarsykdom (RR 0,73 (95 % KI 0,67 – 0,80) og fatal- og ikke-fatal hjerneslag (RR 0,78, 95 % KI 0,68 – 0,89). Det var også mindre behov for revaskularisering. Som en helhet reduserte statiner risikoen for hjerte- og karsykdom med 27 % over 5 år (Taylor F m.fl. 2013). For grupper med median risiko for hjerte-karsykdom på 15 % tilsvarer dette at 50 personer må behandles i 5 år for å spare ett sykdomstilfelle. Cochrane meta-analysen fant ingen signifikant økning av alvorlige bivirkninger (Taylor F m.fl. 2013). Statinbehandling kan likevel medføre en meget lav risiko for rabdomyolyse. I en stor metaanalyse var statinbehandling assosiert med ca. 9 % økning i risiko for diabetes (Sattar N m.fl. 2010). Muskelplager av behandlingen er vanlig i klinisk praksis, og dette ses hyppigere ved lav kroppsvekt, høy alder, hos kvinner og ved multifarmasi. Bruk av statiner i primærforebygging bør derfor reserveres for personer med økt risiko og klar gevinst av behandlingen.
Vurdering
Fordeler og ulemper
Fordeler
Hos personer uten tidligere kardiovaskulær sykdom reduseres vaskulære hendelser (ikke fatalt hjerteinfarkt, koronardød, hjerneslag og revaskularisering) med 25 % per 1,0 mmol/l reduksjon i LDL-kolesterol over 5 år (relativ risiko [RR] 0,75, 95 % konfidensintervall (KI) 0,70-0,80) (Cholesterol Treatment Trialists (CTT) Collaboration 2012). Kardiovaskulær død reduseres med 15 % per 1,0 mmol/l reduksjon LDL-kolesterol over 5 år (RR 0,85, 95 % KI 0,77-0,95) ( CTT Collaboration 2012). Disse effektene er bekreftet i metaanalysen utført av Cochrane-gruppen (Taylor F m.fl. 2013). Relativ-risikoreduksjonen er ikke avhengig av nivået av utgangsrisikoen (CTT Collaboration 2012). Med større reduksjon i LDL-kolesterol oppnås større gevinster (CTT Collaboration 2010). Hos menn og kvinner med lik risiko, er gevinsten ved lipidreduksjon ganske tilsvarende (CTT Collaboration 2015).
Cochrane metaanalysen analyserte data fra 18 studier av statiner i primærforebygging (Taylor F m.fl. 2013). Av disse studiene rekrutterte 14 studier pasienter med risikofaktorer (økning i lipider, diabetes, hypertensjon, mikroalbuminuri). Statinbehandling reduserte totalmortalitet (odds ratio [OR] 0,86, 95 % KI 0,79 - 0,94); kombinert fatal og ikke-fatal hjerte- og karsykdom (RR 0,75, 95 % KI 0,70 – 0,81), kombinert fatal og ikke-fatal koronarsykdom (RR 0,73 (95 % KI 0,67 – 0,80) og fatal- og ikke-fatal hjerneslag (RR 0,78, 95 % KI 0,68 – 0,89). Det var også mindre behov for revaskularisering.
Som en helhet reduserte statiner risikoen for hjerte- og karsykdom med 27 % over 5 år (Taylor F m.fl. 2013). For grupper med median risiko for hjerte-karsykdom på 15 % tilsvarer dette at 50 personer må behandles i 5 år for å spare ett sykdomstilfelle.
Ulemper
Cochrane meta-analysen fant ingen dokumentasjon på at statinbehandling medførte risiko for alvorlige bivirkninger (Taylor F m.fl. 2013). Statinbehandling medfører økt risiko for rabdomyolyse, men dette er såpass sjelden at presise anslag for risikoøkningen ikke kan beregnes. I en stor metaanalyse var statinbehandling assosiert med ca. 9 % økning i risiko for diabetes (Sattar N m.fl. 2010). Statinbehandling av 255 pasienter over 4 år resulterte i 1 ekstra tilfelle med diabetes (Sattar N m.fl. 2010). Høye doser gir større risiko enn lave og moderate doser (Preiss D m.fl. 2011). Blant pasienter med etablert diabetes er det observert en liten økning i HbA1C på 0,12 % (Ergou S m.fl. 2014).
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen vurderes som god, med flere store randomiserte kliniske studier og metaanalyser
Verdier og preferanser
Ut fra dokumentert effekt mot sykelighet og død vil personer med høy risiko for hjerte- og karsykdom ha en forventet egeninteresse av forebyggende behandling, som fremstår som større jo høyere den absolutte risikoen er. For personer som føler seg helt friske og er lite opptatt av fremtidig risiko, kan nytteverdien likevel synes liten, særlig dersom behandling er assosiert med bivirkninger. Det kan være problematisk å gjøre en god avveiing både fordi all risikovurdering er beheftet med usikkerhet, og fordi mange av de vanligste bivirkningene, som muskelsmerter og lette forstyrrelser i mage- og tarmsystemet, er utbredt i befolkningen generelt slik at relasjonen til legemiddelbehandlingen ofte er uklar. Det er viktig at forskrivende lege forsøker å gi balansert og nøktern informasjon om gevinst av behandlingen og hva slags bivirkningsproblemer som er dokumentert, slik at pasienten kan ta stilling til tilbud om forebygging med legemidler på bredest mulig grunnlag.
Referanser
163. Adams SP, Tsang M, Wright JM. Lipid-lowering efficacy of atorvastatin. Cochrane Database Syst Rev 2015; 3: CD008226 https://www.helsedirektoratet.no/referanse/0002-0013-177826
164. Cannon CP, Blazing MA, Guigliano RP, et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372: 2387-2397 https://www.helsedirektoratet.no/referanse/0002-0013-177827
165. Cholesterol Treatment Trialists (CTT) Collaboration. Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, Peto R, Barnes EH, Keech A, Simes J, Collins R. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376: 1670-1681 https://www.helsedirektoratet.no/referanse/0002-0013-177828
166. Cholesterol Treatment Trialists (CTT) Collaboration. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet 2012; 380: 581-590 https://www.helsedirektoratet.no/referanse/0002-0013-177829
167. Cholesterol Treatment Trialists (CTT) Collaboration. Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174 000 participants in 27 randomised trials. Lancet 2015; 385: 1397-1340 https://www.helsedirektoratet.no/referanse/0002-0013-177830
168. Desai CS, Martin SS, Blumenthal RS. Non-cardiovascular effects associated with statins. BMJ 2014; 349:g3743 https://www.helsedirektoratet.no/referanse/0002-0013-177831
169. Ergou S, Lee CC, Adler AI. Statins and glycaemic control in indivdiuals with diabetes: a systematic review and meta-analysis. Diabetologia 2014; 57: 2444-2452 https://www.helsedirektoratet.no/referanse/0002-0013-177832
170. KDIGO Clinical Practice Guidelines for lipid management in chronic kidney disease. Kidney Int Suppl 2013; 3 https://www.helsedirektoratet.no/referanse/0002-0013-177833
171. Keating AJ, Campbell KB, Guyton JR. Intermittent nondaily dosing strategies in patients with previous statin-induced myopathy. Ann Pharmacother 2013; 47: 398-404 https://www.helsedirektoratet.no/referanse/0002-0013-177834
172. Newman CB, Tobert JA. Statin intolerance. Reconciling clinical trials and clinical experience. JAMA 2015; 313: 1011-1012 https://www.helsedirektoratet.no/referanse/0002-0013-177835
173. Nordestgaard BG, Chapman MJ, Humphries SE, et al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease. Consensus statement of the European Atherosclerosis Society. Eur Heart J 2013; 34: 3478-90 https://www.helsedirektoratet.no/referanse/0002-0013-177836
174. Preiss D, Seshasai ST, WelshP, et al. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy: a meta-analysis. JAMA 2011; 305: 2556-2564 https://www.helsedirektoratet.no/referanse/0002-0013-177837
175. Sattar N, Preiss D, Murray HM, et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet 2010; 375: 735-742 https://www.helsedirektoratet.no/referanse/0002-0013-177838
176. Savarese G, De Ferrari GJ, Rosano GM, et al. Safety and efficacy of ezetimibe: a meta-analysis. Int J Cardiol 2015; 201: 247-252 https://www.helsedirektoratet.no/referanse/0002-0013-177839
177. Stroes ES, Thompson PD, Corsini A, et al. Statin-associated muscle symptoms: impact on statin therapy – European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. Eur Heart J 2015; 36: 1012-1022 https://www.helsedirektoratet.no/referanse/0002-0013-177840
178. Taylor F, Huffman MD, Maceo AF, et al. Statins for the primary prevention of cardiovascular disease. Cochrane Database Syst Rev 2013; 1: CD004816 https://www.helsedirektoratet.no/referanse/0002-0013-177841
Sist faglig oppdatert: 05.12.2024
Legemidler ved sekundærforebygging etter påvist hjertesykdom, aterosklerose og iskemisk hjerneslag
Bruk av acetylsalicylsyre (ASA) og andre platehemmere ved kjent aterosklerotisk hjerte- og karsykdom
Antitrombotisk behandling inngår som en sentral del av sekundærforebyggingen både ved koronarsykdom, iskemisk hjerneslag og ved perifer karsykdom. Se også Nasjonal faglig retningslinje for behandling og rehabilitering ved hjerneslag
- Tilby alle personer med kjent aterosklerotisk hjerte- og karsykdom behandling med acetylsalicylsyre (ASA), eller som 2. valg annen platehemmer (klopidogrel).
- Etter iskemisk hjerneslag (ikke-embolisk), bør kombinasjonsbehandling med acetylsalicylsyre og Dipyramidol vurderes, alternativt monoterapi med klopidogrel.
Praktisk – slik kan anbefalingen følges
Ved påvist aterosklerotisk hjerte- og karsykdom vil standard behandling med acetylsalicylsyre 75 mg daglig (ATC-kode B01A C06) kunne startes så snart diagnosen og akuttbehandlingen er gjort. Det er få kontraindikasjoner, bortsett fra allergi. Behandlingen er i utgangspunktet livslang.
Langtidsbehandling (inntil 3 år) med tikagrelor (ATC kode B01A C24) 60 mg x 2, kan også vurderes etter akutt koronarsykdom, og er særlig aktuelt ved økt residivtendens eller risiko.
Ved gastrointestinal sykdom/ulcus sykdom/dyspepsi kan samtidig behandling med syredempende medikasjon vurderes. Ved intoleranse kan alternativ behandling med klopidogrel (Plavix) 75 mg x 1 (ATC-kode B01A C04) regnes å ha tilsvarende effekt. Dipyramidol (ATC-kode B01A C07) gis i depotformulering (Persantin retard) og i doser på 200 mg to ganger daglig (etter trombotisk hjerneslag). Se også egen retningslinje om behandling av hjerneslag.
Begrunnelse – dette er anbefalingen basert på
Pasienter med etablert aterosklerotisk hjerte- og karsykdom har en klart høyere risiko enn jevnaldrende uten slik sykdom for ny kardiovaskulær sykdom og død. Det er derfor viktig med tiltak som kan redusere denne risikoen. Sekundærprofylakse med ASA og andre platehemmere har for denne typen pasienter vist seg effektivt i å redusere kardiovaskulære hendelser, med et akseptabelt nivå av bivirkninger - primært blødninger. Behandlingen er lite ressurskrevende og godt etablert både blant spesialister, allmennleger og pasienter.
Forskningsgrunnlag
Populasjon (P): Pasienter med påvist koronarsykdom, hjerneinfarkt/TIA og perifer aterosklerose
Tiltak (I): Acetylsalicylsyre 75 mg daglig, subsidiært annen platehemmer (klopidogrel 75 mg daglig.)
Sammenligning (C): Ingen behandling (placebo)
Beskrivelse av inkluderte studier
Pasienter med etablert aterosklerotisk hjerte- og kar sykdom har en klart høyere risiko enn jevnaldrende uten slik sykdom for ny kardiovaskulær sykdom og død. Sekundærprofylakse med Asetylsalicylsyre (ASA) har for denne typen pasienter vist seg effektivt i å redusere kardiovaskulære hendelser, med et akseptabelt nivå av bivirkninger - primært blødninger. Basert på en omfattende metaanalyse ved Antithrombotic Trialists (ATT) Collaboration (Lancet 2009) (hoveddokumentasjon) gir ASA knapt 20% reduksjon i vaskulære hendelser i sekundærprofylakse, noe som tilsvarer en absolutt risikoreduksjon i alvorlige kardiovaskulære hendelsr på 1,5% per år.
Behandlingen vil imidlertid medføre en økning av alvorlige ekstrakranielle blødninger som tilsvarer 25 tilfeller (95% K.I. 4-71 tilfeller) per tusen behandlede personer over 5 år (tilsvarende 0,5% per år), hovedsakelig gastrointestinale. ASA i sekundærprofylakse gir videre en svært liten økning i antall hemorragiske slag (hjerneblødninger) tilsvarende knapt 1 per tusen behandlede per år. Blødningsrisikoen ved andre platehemmere som klopidogrel er på linje med det som observeres ved ASA.
Ved iskemisk hjerneslag og transitorsik ischemiske attaker (TIA), anbefales også kombinasjonsbehandling med ASA og dipyramidol, alternativt klopidogrel alene (Kernan WN, et al Stroke 2014).
Gevinsten i form av reduksjon i alvorlige kardiovaskulære hendelser anses som klart større enn ulempene med blødninger, og tiltaket anbefales som standard behandling ved så vel kjent koronarsykdom, perifer aterosklerose og etter trombotiske hjerneslag/TIA.
Vurdering
Fordeler og ulemper
Metaanalyser viser at acetylsalicylsyre (ASA) i doser fra 75 til 300 mg gir knapt 20% reduksjon i vaskulære hendelser i sekundærforebygging, med en absolutt risikoreduksjon i alvorlige kardiovaskulære hendelser på 1,5% per år (67% versus 82% , p<0.0001) (Antithrombotic Trialists (ATT) Collaboration 2009). Effekten er består i en reduksjon i hjerneslag på 0,5% per år (2,08% vs 2,54%, p=0.002) og en reduksjon i koronare hendelser på 1% per år (4,3% versus 5,3%, p<0.0001).
En tilsvarende metaanalyse på effekten av sekundær profylakse hos 17000 pasienter fra 16 randomiserte studier konkluderer med at behandling av 1000 pasienter i 5 år med acetylsalisylsyre, vil gi 13 færre dødsfall (95% konfidens interval (CI) 24 til -1), 37 færre ikke-dødelig hjerteinfarkt (95% CI 47 - 23) og 26 færre hjerneslag (95% CI 39 - 11) sammenliknet med ingen behandling (Vandvik PO1 m.fl. 2012).
Behandlingen vil imidlertid medføre en økning på 25 tilfeller (95% CI 4-71 tilfeller) av alvorlige ekstrakranielle blødninger, hovedsakelig gastrointestinale (Vandvik PO1 m.fl. 2012). ASA i sekundærprofylakse ga videre en økning versus placebo i antall hemorragiske slag (hjerneblødninger) tilsvarende 36 versus 19 per 43000 personår, det vil si knapt 1 per tusen behandlede per år (0,079%) (ATT 2009). Antall dødsfall pga hjerneblødning var 24 tilfeller mot 12 på placebo, tilsvarende 0,5 tilfeller per 1000 per år (ATT 2009). Blødningsrisikoen ved andre platehemmere er også på linje med det som observeres ved ASA.
Fordelene anses som klart større enn ulempene ved sekundærprofylakse, og slik behandling er anbefalt rutinemessig i internasjonale retningslinjer, både når det gjelder koronar hjertesykdom, trombotiske hjerneslag, og perifer karsykdom (3-7).
Alternativ platehemmende behandling er mindre studert, men mest dokumentasjon foreligger for klopidogrel, primært fra CAPRIE-studien (CAPRIE Steering Committee 1996). Effekten er også rapportert i en metaanalyse, og klopidogrel anbefales som alternativ til ASA i flere retningslinjer (Vandvik PO1 m.fl. 2012).
Tilleggsbehandling med Tikagrelor 60 mg x 2 kan vurderes i inntil 3 år etter en akutt koronar hendelse, ut fra resultater i en randomisert studie der man fant reduksjon i primære endepunkt (summen av tilfeller med kardiovaskulær død, hjerteinfarkt og slag) tilsvarende en hasard ratio på 0.84; (95% c.i. 0.74 to 0.95) (Bonaca MP m. fl. 2015). Risikoen for større blødninger var imidlertid også økt (2.30% versus1,06% på placebo), og slik behandling er derfor mest aktuelt der det foreligger særlig stor residivtendens eller risiko.
For detaljert omtale av sekundærprofylakse etter hjerneslag vises til egne retningslinjer fra 2010, som nå er under revisjon (Nasjonal faglig retningslinje for behandling og rehabilitering ved hjerneslag 2009). Etter ikke-emboliske iskemisk hjerneslag og TIA anbefales både ASA alene og kombinasjonen ASA og Dipyramidol som sekundærprofylakse (Kernan WN m.fl. 2014). Denne kombinasjonen har vist seg noe mer effektiv enn ASA alene i flere studier, men ikke mer effektiv enn klopidogrel alene (Ralph L m.fl. 2008). Dipyramidol er også noe dårligere tolerert enn annen platehemmende behandling, særlig grunnet hodepine, og må doseres 2 ganger i døgnet.
For emboliske hjerneslag ved atrieflimmer og andre kardiale tilstander, vises også til egne retningslinjer fra 2017: https://helsedirektoratet.no/retningslinjer/hjerneslag.
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen for behandling med acetylsalicylsyre vurderes som god, med flere randomiserte studier og metaanalyser. Det er svakere dokumentasjon på andre platehemmere.
Verdier og preferanser
Behandling med ASA tolereres vanligvis godt. Behandlingen gir likevel en viss økning av alle typer blødninger, inkludert alvorlige gastrointestinale og intrakranielle blødninger. Den økte blødningsrisikoen er likevel klart mindre enn reduksjonen i kardiovaskulære hendelser.
De fleste blødninger vil ha mindre alvorlige langtidskonsekvenser enn tilsvarende tromboemboliske komplikasjoner som f. eks. hjerneslag, men sjeldne tilfeller av fatale hjerneblødninger må også påregnes. Personer med hjerte- og karsykdom vil man derfor generelt anta foretrekker behandling med ASA ut fra en gunstig totaleffekt og lite bivirkninger.
I en amerikansk studie for bruk av ASA ved akutt koronarsykdom fant man at pasienter og leger hadde lik vurdering når det gjaldt viktigheten av å unngå dødsfall og alvorlig hjerneslag (svært alvorlig) og tilsvarende for betydningen av blødninger uten behov for transfusjon (lite viktig) (Yuan Z1 m.fl. 2014). Derimot var det noen forskjeller i synet på betydningen av stort hjerteinfarkt og moderat alvorlig slag, som ble vurdert som mer alvorlig av legene. Blødninger, med unntak av de mest alvorlige, ble generelt ansett som mindre alvorlig av pasientene enn av legene. Forskjellen i hvordan lege og pasient verdisetter mulige konsekvenser av behandling med ASA understreker behovet for en åpen dialog og grundig informasjon når pasienten skal tas med på råd om sin behandling.
Referanser
179. AHA/ACCF secondary prevention and risk reduction therapy for patients with coronary and other atherosclerotic vascular disease: 2011 update: a guideline from the American Heart Association and American College of Cardiology Foundation https://www.helsedirektoratet.no/referanse/0002-0013-177842
180. European guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts) Eur Heart J 2012; 33(17): 2126 https://www.helsedirektoratet.no/referanse/0002-0013-177843
181. Antithrombotic Trialists (ATT) Collaboration. Baigent C, Blackwell L, Collins R, et al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009 May 30;373(9678):1849-1860 https://www.helsedirektoratet.no/referanse/0002-0013-177844
182. Vandvik PO, Lincoff AM, Gore JM et al. American College of Chest Physicians. Primary and secondary prevention of cardiovascular disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest https://www.helsedirektoratet.no/referanse/0002-0013-177845
183. Yuan Z1, Levitan B, Burton P, Poulos C, Brett Hauber A, Berlin JA. Relative importance of benefits and risks associated with antithrombotic therapies for acute coronary syndrome: patient and physician perspectives. Curr Med Res Opin. 2014 Sep;30(9):1733-41. doi: 10.1185/03007995.2014.921611. Epub 2014 Jun 2 https://www.helsedirektoratet.no/referanse/0002-0013-177846
184. Ralph L. Sacco, M.D., Hans-Christoph Diener, M.D., Ph.D., Salim Yusuf, M.B., for the PRoFESS Study Group. Aspirin and Extended-Release Dipyridamole versus Clopidogrel for Recurrent Stroke. N Engl J Med. 2008 Sep 18; 359(12): 1238–1251. Published online 2008 Aug 27. doi: 10.1056/NEJMoa0805002 https://www.helsedirektoratet.no/referanse/0002-0013-177847
185. Anderson JL, Halperin JL, Albert NM et al. Management of patients with peripheral artery disease (Compilation of 2005 and 2011 ACCF/AHA guideline recommendations). A report from the American Collegeof Cardiology Foundation/American Heart Association Task Force on practise guidelines. Circulation 2013;127:1425-1443 https://www.helsedirektoratet.no/referanse/0002-0013-177848
186. Kernan WN, Ovbiagele B, Black HR et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack. Stroke 2014;45:2160-2236 https://www.helsedirektoratet.no/referanse/0002-0013-177849
187. Task Force Members, Montalescot G, Sechtem U, Achenbach S, et al. 2013 ESC guidelines on the management of stable coronary artery disease: The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013 doi: 10.1093/eurheartj/eht296 First published online: August 30, 2013 https://www.helsedirektoratet.no/referanse/0002-0013-177850
188. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet. 1996 Nov 16;348(9038):1329-39 https://www.helsedirektoratet.no/referanse/0002-0013-177851
189. Nasjonal faglig retningslinje for behandling og rehabilitering ved hjerneslag. HDIR 2009. IS-1688 https://www.helsedirektoratet.no/referanse/0002-0013-177852
190. Long-Term Use of Ticagrelor in Patients with Prior Myocardial Infarction https://www.helsedirektoratet.no/referanse/0002-0013-177853
Sist faglig oppdatert: 05.03.2018
Bruk av statiner og andre lipidsenkende medikamenter ved sekundærforebygging av aterosklerotisk hjerte- og karsykdom
Lipidsenkende behandling inngår som en sentral del av sekundærforebyggingen både ved koronarsykdom, iskemisk hjerneslag og ved perifer karsykdom. Se også Nasjonal faglig retningslinje for behandling og rehabilitering ved hjerneslag
- Alle personer med kjent aterosklerotisk hjerte- og karsykdom bør tilbys behandling med statiner. Behandlingsmålet er LDL-kolesterol < 1,8 mmol/l.
- Vurder kolesterolabsorpsjonshemmer (ezetimib) ved statinintoleranse, eller når behandlingsmålet ikke nås.
- Behandling med PCSK-9 hemmere (alirokumab, evolokumab) kan være aktuelt ved utilstrekkelig lipidkontroll.
- Det er ikke grunnlag for rutinemessig tilskudd med omega-3 fettsyrepreparater, men slik behandling kan være aktuell ved særlig høye triglyserider.
Praktisk – slik kan anbefalingen følges
Hos personer med kjent aterosklerotisk hjerte- og karsykdom (sekundærforebygging) anbefaler vi høydose behandling med atorvastatin 40-80 mg, eventuelt rosuvastatin 20-40 mg dersom atorvastatin ikke tolereres. Andre statiner kan forsøkes ved bivirkninger, men grunnet mindre kolesterolsenkende effekt bør da ofte tilleggsbehandling, primært med ezetimib, legges til. Behandlingen er i utgangspunktet livslang (se også anbefaling om Legemiddelbehandling hos eldre ved forebygging av hjerte- og karsykdom).
Aktuelle legemidler
- Atorvastatin (ATC-kode C10A A05)
- Rosuvastatin (ATC-kode C10A A07)
- Fluvastatin (ATC-kode C10A A04)
- Lovastatin (ATC-kode C10A A02)
- Pravastatin (ATC-kode C10A A03)
- Simvastatin (ATC-kode C10A A01)
- Ezetimib (ATC-kode C10A X09)
- Alirokumab (ATC-kode C10A X14)
- Evolokumab (ATC-kode C10A X13)
Lenken i virkestoffet gir oversikt over tilgjengelige legemidler i Norge, preparatomtaler, pakningsvedlegg og refusjonsregler hos Statens legemiddelverk.
Lavere startdose (10-20 mg atorvastatin) bør brukes ved kronisk nyresvikt (eGFR < 30ml/min/1,73m2), mens rosuvastatin er kontraindisert ved alvorlig nedsatt nyrefunksjon. Dosereduksjon eller behandlingsavbrudd må vurderes for pasienter som bruker eller har kur med legemidler som kan potensiere virkning av statiner (kalsiumantagonister, antibiotika som makrolider og ciproxin, cyklosporin, proteasehemmere mm). Statiner kan interagere farmakokinetisk med en rekke andre legemidler som brukes samtidig, også ved intermitterende behandling. Se interaksjoner.no
Dersom LDL-kolesterol blir liggende vesentlig over behandlingsmål når maksimalt tolererte statinbehandling er gitt i kombinasjon med ezetimib, kan behandling med PCSK-9 hemmer (alirocumab, evolocumab) vurderes. Behandling krever søknad om individuell refusjon. PCSK-9 hemmer kan også vurderes hos pasienter med gjentatte koronare hendelser tross maksimal øvrig lipidsenkende behandling.
Oppfølging og kontroll
Lipidprofil og leverfunksjonstester bør kontrolleres før behandlingsstart, ved 3 og 12 måneder etter behandlingsstart, og deretter årlig eller ved doseendring. Dersom levertransaminaser stiger til over tre ganger øvre referanseverdi og forblir like høye, anbefales dosereduksjon eller seponering av legemidlet.
Randomisert forsøk med statiner viser at omtrent samme prosentandel personer rapporterer muskelsmerter på placebo som på statinbehandling (Finegold JA m.fl. 2014). Til tross for dette vil subjektive bivirkninger med muskelplager forekommer relativt hyppig hos statinbehandlede pasienter. CK bør måles hos personer som rapporterer muskelsmerter og statinbehandling bør seponeres dersom CK er over fem ganger øvre referanseverdi.
Dersom personer rapporterer uønskede bivirkning på behandling med høydose statin, bør følgende strategier vurderes:- Midlertidig seponering av statinbehandling, og nytt forsøk når symptomene har gitt seg for å sikre at symptomene er relatert til statinbehandlingen.
- Dosereduksjon (doser helt ned til 10 mg atorvastatin annen hver dag, ev. rosuvastatin 5 mg dgl. har effekt på LDL-kolesterol nivå). Tillegg av ezetimib må vurderes dersom dosereduksjonen gir LDL-kolesterol over behandlingsmålet.
- Bytte til annet statin.
- Behandling med PCSK-9 hemmere (alirokumab, evolokumab) kan være aktuelt dersom nødvendig dosereduksjon grunnet bivirkninger har resultert i LDL-kolesterol betydelig over behandlingsmål (individuell søknad om refusjon).
- I spesielle tilfeller kan også gallesyrebindende medikamenter (kolestyramin, kolestipol, colesevelam) vurderes.
Begrunnelse – dette er anbefalingen basert på
Personer med etablert aterosklerotisk hjerte - og karsykdom har en klart høyere risiko for en ny sykdomshendelse sammenliknet med friske jevnaldrende. Dette gjelder såvel ved koronar hjertesykdom, gjennomgått iskemisk hjerneslag og ved perifer aterosklerose (men ikke ved hjerneblødning). Behandling med statiner er omfattende studert hos slike pasienter, og har godt dokumentert effekt i en rekke randomiserte studier og metaanalyser. Gevinsten tilsvarer en relativ risikoreduksjon for nye kardiovaskulære hendelser på i overkant av 20 % per mmol/l redusert nivå av LDL-kolesterol, gitt behandling over ca. 5 år. (Cholesterol Treatment Trialists' (CTT) Collaboration, Fulcher J, m.fl. 2015). Behandlingen gir lite alvorlige bivirkninger, men muskelsmerter og gastrointestinalt ubehag forekommer likevel ganske hyppig i klinisk praksis. Slike problemer bør håndteres med dosejusteringer, bytte av medikament og eventuelt tillegg av kolesterolabsorpsjonshemmer (ezetimib), for å sikre at lipidsenkende behandling blir kontinuert. Dersom lipidverdiene blir liggende betydelig over behandlingsmål etter at overnevnte tiltak er forsøkt, bør også behandling med PCSK-9 hemmere vurderes.
Forskningsgrunnlag
Populasjon (P): Individer med hjerte- og karsykdom
Tiltak (I): Legemiddelbehandling med statiner
Sammenligning (C): Ingen behandling
Beskrivelse av inkluderte studier
Effekten av behandling med statiner er undersøkt i flere metaanalyser på ulike grupper pasienter med kjent hjerte- og karsykdom. I en analyse av effekten ved kjent koronarsykdom fant man at statiner reduserte koronar død og ikke-fatalt hjerteinfarkt med 25 % (relativ risiko [RR], 0,75; 95 % CI, 0,71-0,79), total dødelighet med 16 % (RR, 0,84; 95% CI, 0,79-0,89), og koronar dødelighet med 23 % (RR, 0,77; 95% CI, 0,71-0,83). En annen analyse som også inkluderte personer med andre typer vaskulær sykdom, fant at statinbehandling reduserte total dødelighet tilsvarende en odds ratio på 0,82, 95% (CI 0,75–0,90) og reduserte risikoen for større kardiovaskulære hendelser tilsvarende odds ratio på 0,69, (95% CI 0,62–0,77)(Naci H m.fl. 2013). En analyse fra Cholesterol Treatment Trialists med fokus på effekter hos kvinner og menn, rapporterte en effekt tilsvarende 21% reduksjon i kardiovaskulære hendelser (RR 0,79) per mmol/l reduksjon i LDL-kolesterol hos personer med kjent kardiovaskulær sykdom, uten signifikant forskjell mellom kjønnene. Median behandlingstid var ca. 5 år (Cholesterol Treatment Trialists' (CTT) Collaboration 2015). Kvaliteten på evidensen ble vurdert som høy. Behandlingen gir lite alvorlige bivirkninger.
Vurdering
Fordeler og ulemper
Sekundærforebygging med statiner ved påvist aterosklerotisk hjerte- og karsykdom er undersøkt i en rekke studier og det finnes tallrike metaanalyser.
I en analyse som begrenset seg til pasienter med kjent koronarsykdom ble det identifisert 25 studier med 69 511 individer inkludert, gjennomsnittsalder var 63 år og ubehandlet LDL-kolesterol 3,85 mmol/L; 23 % var kvinner (Wilt TJ m.fl. 2004). Statinbehandling reduserte koronar død og ikke-fatalt hjerteinfarkt med 25 % (relativ risiko [RR], 0,75; 95 % CI, 0,71-0,79), total dødelighet 16 % (RR, 0,84; 95% CI, 0,79-0,89), og koronar dødelighet med 23 % (RR, 0,77; 95% CI, 0,71-0,83).
I en nyere analyse for pasienter med kjent kardiovaskulær sykdom, fant man at statinbehandling reduserte total dødelighet tilsvarende en odds ratio på 0,82, 95% (CI 0,75–0,90) og reduserte risikoen for større kardiovaskulære hendelser tilsvarende odds ratio på 0,69, (95% CI 0,62–0,77)(Naci H m.fl. 2013). Flertallet av pasientene som har inngått i disse studiene og metaanalysene har hatt koronarsykdom, men også pasienter med hjerneslag og perifer aterosklerose er studert.
I en metaanalyse på bruk av statiner perioperativt ved vaskulære (ikke-kardiale) inngrep, er det også funnet betydelige og konsistente gevinster tilsvarende en odds ratio på 0,45 (95% C.I 0,29-0,70) for et sammensatt endepunkt som inkluderte hjerteinfarkt, slag og død (Antoniou GA m.fl. 2015).
En nyere analyse fra Cholesterol Treatment Trialists med fokus på effekter hos kvinner og menn, rapporterte en effekt tilsvarende 21% reduksjon i kardiovaskulære hendelser (RR 0,79) per mmol/l reduksjon i LDL-kolesterol hos personer med kjent kardiovaskulær sykdom, uten signifikant forskjell mellom kjønnene. Median behandlingstid var ca. 5 år (Cholesterol Treatment Trialists' (CTT) Collaboration 2015). Kvaliteten på evidensen vurderes som høy.
Behandlingsgevinsten synes klart relatert til senkningen av LDL-kolesterol, og uten at en klar nedre grense for optimalt LDL-kolesterolnivå er fastslått. I IMPROVE-it studien (Cannon CP m.fl. 2015) ble det vist at oppnådd LDL-kolesterol på 1,4 mmol/l ga lavere risiko for nye kardiovaskulære endepunkter enn LDL-kolesterol på 1,8 mmol/l, men uten synlig effekt på dødelighet.
Nyere studier på tilleggsbehandling med PCSK-9 hemmere viser lavere kardiovaskulære hendelser ved oppnådd LDL-kolesterol på 1,3 mmol/l sammenliknet med 3,0 mmol/l (placebo) (Sabatine MS m.fl. 2015, Robinson JG m.fl 2015). En større randomisert studie på pasienter med kjent hjerte- og karsykdom viste signifikant reduksjon tilsvarende hasard ratio på 0,80 (95% c.i. 0,73-0,88) for et samlet endepunkt bestående av hjerteinfarkt, hjerneslag og kardiovaskulær død, når behandling med evolokumab ble gitt versus placebo på toppen av ordinær lipidsenkende behandling (Sabatine MS m.fl. 2017).
For praktiske formål kan målet for den lipidsenkende behandling være å senke LDL-kolesterol til et nivå under 1,8 mmol/l og ytterligere gevinst er sannsynliggjort ved lavere verdier.
Behandling med omega-3 fettsyrepreparater har usikker effekt hos pasienter med kjent hjerte- og karsykdommer og anbefales ikke brukt rutinemessig, på linje med de europeiske anbefalinger (Piepoli MF m. fl. 2016). Ved særlig høye triglyseridnivåer må slik behandling likevel vurderes slik omtalt i anbefalingen om lipidforstyrrelser.
Bivirkninger
Av alvorlige, sjeldne bivirkninger forekommer rhabdomyolyse. Imidlertid kan det ikke gis et meningsfylt risikoanslag for dette da det er svært sjeldent. I randomiserte studier opptrer ulike muskelplager og CK-stigning ikke signifikant hyppigere enn på placebo (Finegold JA m.fl. 2014), mens økte leverprøver observeres hos 4 (2-7) flere per 1000. I klinisk praksis ses bivirkninger likevel relativt hyppig, og 7-29% av pasientene rapporterer om muskelplager (Erik S. Stroes m.fl. 2015).
Håndtering av statinbivirkninger er nylig omfattende beskrevet i en publikasjon fra den europeiske aterosklerose foreningen (European Atherosclerosis Society) (Erik S. Stroes m.fl. 2015). Statinbehandling gir økt risiko for diabetesutvikling, estimert til en faktor på 1,13 (95 % C.I. 1,03-1,23), ut fra en metaanalyse publisert i 2009 (Rajpathak Swapnil N m.fl. 2009), men varierende fra 9 % til 12 % i andre analyser og noe mer med høydosert behandling (Preiss D m.fl. 2011).
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen vurderes som god, med flere randomiserte studier og store metaanalyser.
Verdier og preferanser
Ut fra dokumentert effekt mot ny sykelighet og død vil personer med kjent hjerte- og karsykdom ha en forventet egeninteresse av forebyggende behandling, som fremstår som større jo høyere den absolutte risikoen er. For personer som har vært symptomfrie i mange år etter en mindre kardiovaskulær episode, kan nytteverdien likevel synes liten, særlig dersom behandling er assosiert med bivirkninger.
Studier har vist at det er stort frafall i statinbehandlingen hos pasienter med kardiovaskulær sykdom, slik at anslagsvis bare 60-75 % tar dette noen år etter en akutt kardiovaskulære hendelse (Erik S. Stroes m.fl. 2015, Chodick G1 2008, Naderi SH m.fl. 2012).
Vi mangler nyere norske data på legemiddeletterlevelse, men i data samlet inn fra allmennpraksis i 2005 ble det funnet at 69,7 % av pasienter med diabetes og kjent hjerte- og kar sykdom var under pågående behandling med statin (Claudi T m.fl. 2008). Årsakene til at 30% var uten statinbehandling kan være sammensatte, men det kan være krevende å formidle informasjon om risiko og gevinst av behandlingen til pasienter.
Mange pasienter ville velge å avstå fra behandling, dersom det var slik at denne ga betydelige bivirkninger (Wouters H m.fl. 2014). Det kan da være problematisk at pasienter kan tilskrive statiner en rekke kroppslige symptomer som ikke nødvendigvis er relatert til behandlingen, slik at legemiddeletterlevelsen blir unødig lav.
Det er viktig at behandlende lege tar bivirkningsproblemer på alvor, og diskuterer dette med pasienten. Pasienten bør få mulighet til å forsøke ulike statiner i ulike doser, gjerne da kombinert med ezetimib dersom kun lavdosert statin tolereres.
Referanser
187. Task Force Members, Montalescot G, Sechtem U, Achenbach S, et al. 2013 ESC guidelines on the management of stable coronary artery disease: The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013 doi: 10.1093/eurheartj/eht296 First published online: August 30, 2013 https://www.helsedirektoratet.no/referanse/0002-0013-177850
191. Wilt TJ, Bloomfield HE, MacDonald R, et al. Effectiveness of statin therapy in adults with coronary heart disease. Arch Intern Med 2004 Jul 12;164(13):1427-1436 https://www.helsedirektoratet.no/referanse/0002-0013-177854
192. Naci H, Brugts JJ, Fleurence R, Tsoi B, Toor H, Ades AE. Comparative benefits of statins in the primary and secondary prevention of major coronary events and all-cause mortality: a network meta-analysis of placebo-controlled and active-comparator trials. Eur J Prev Cardiol. 2013; 20(4): 641-57 https://www.helsedirektoratet.no/referanse/0002-0013-177855
193. Antoniou GA, Hajibandeh S, Hajibandeh S, Vallabhaneni SR, Brennan JA, Torella F. Meta-analysis of the effects of statins on perioperative outcomes in vascular and endovascular surgery.J Vasc Surg. 2015; 61(2): 519-532 https://www.helsedirektoratet.no/referanse/0002-0013-177856
194. Cholesterol Treatment Trialists' (CTT) Collaboration, Fulcher J, O'Connell R, Voysey M, et al. Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174,000 participants in 27 randomised trials. Lancet. 2015 Apr 11;385(9976):1397-405. doi: 10.1016/S0140-6736(14)61368-4. Epub 2015 Jan https://www.helsedirektoratet.no/referanse/0002-0013-177857
17. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts): Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR) https://www.helsedirektoratet.no/referanse/0002-0013-177680
195. Cannon CP, Blazing MA, Giugliano RP, et al; IMPROVE-IT Investigators. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med. 2015 Jun 18;372(25):2387-97. doi: 10.1056/NEJMoa1410489. Epub 2015 Jun 3 https://www.helsedirektoratet.no/referanse/0002-0013-177858
196. Sabatine MS1, Giugliano RP, Wiviott SD, et al.; Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. Open-Label Study of Long-Term Evaluation against LDL Cholesterol (OSLER) Investigators. N Engl J Med. 2015 Apr 16;372(16):1500-9. doi: 10.1056/NEJMoa1500858. Epub 2015 Mar 15 https://www.helsedirektoratet.no/referanse/0002-0013-177859
197. Robinson JG, Farnier M, Krempf M, et al; ODYSSEY LONG TERM Investigators. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015 Apr 16;372(16):1489-99. doi: 10.1056/NEJMoa1501031. Epub 2015 Mar 15 https://www.helsedirektoratet.no/referanse/0002-0013-177860
198. Finegold JA, Manisty CH, Goldacre B, Barron AJ, Francis DP. What proportion of symptomatic side effects in patients taking statins are genuinly caused by the drug? Systematic review of randomized placebocontrolled trials to aid individual patient choice. European Journal of Preventive Cardiology https://www.helsedirektoratet.no/referanse/0002-0013-177861
199. Erik S. Stroes,1,* Paul D. Thompson, Alberto Corsini, Georgirene D. et al European Atherosclerosis Society Consensus Panel. Statin-associated muscle symptoms: impact on statin therapy—European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management Eur Heart J. 2015 May 1; 36(17): 1012–1022. Published online 2015 Feb 18. doi: 10.1093/eurheartj/ehv043 https://www.helsedirektoratet.no/referanse/0002-0013-177862
200. Rajpathak, Swapnil N, MD, DRPH;Kumbhani, Dharam J, MD, SM;Crandall, Jill, MD;Barzilai, Nir, MD;Al. Statin Therapy and Risk of Developing Type 2 Diabetes: A Meta-Analysis https://www.helsedirektoratet.no/referanse/0002-0013-177863
201. Preiss D, Seshasai SR, Welsh P, et al. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy: a meta-analysis. JAMA. 2011; 305(24): 2556-64 https://www.helsedirektoratet.no/referanse/0002-0013-177864
202. Chodick G, Shalev V, Gerber Y, Heymann AD, Silber H, Simah V, Kokia E. Long-term persistence with statin treatment in a not-for-profit health maintenance organization: a population-based retrospective cohort study in Israel. Clin Ther. 2008; 30(11): 2167-79 https://www.helsedirektoratet.no/referanse/0002-0013-177865
203. Naderi SH, Bestwick JP, Wald DS. Adherence to drugs that prevent cardiovascular disease: meta-analysis on 376,162 patients. Am J Med 2012 Sep;125(9):882-887 https://www.helsedirektoratet.no/referanse/0002-0013-177866
204. Claudi T, Ingskog W, Cooper JG, Jenum AK, Hausken MF. Kvaliteten på diabetesbehandlingen i allmennpraksis. Tidsskr Nor Laegeforen. 2008 Nov 20;128(22):2570-4 https://www.helsedirektoratet.no/referanse/0002-0013-177867
205. Goodyear-Smith F, Kenealy T, Wells S, Arroll B, Horsburgh M. Patients' preferences for ways to communicate benefits of cardiovascular medication. Ann Fam Med. 2011; 9(2): 121-7 https://www.helsedirektoratet.no/referanse/0002-0013-177868
206. Institute for Clinical and Economic Review. PCSK9 inhibitors for treatment of high cholesterol: effectiveness, value, and value-based price benchmarks draft report. Published September 8, 2015 https://www.helsedirektoratet.no/referanse/0002-0013-177869
207. Perk J, De Backer G, Gohlke H, et al. European guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Eur Heart J 2012 Jul;33(13):1635-1701. Erratum in: Eur Heart J 2012 Sep;33(17):2126 https://www.helsedirektoratet.no/referanse/0002-0013-177870
208. Smith SC Jr, Benjamin EJ, Bonow RO, et al. AHA/ACCF secondary prevention and risk reduction therapy for patients with coronary and other atherosclerotic vascular disease: 2011 update: a guideline from the American Heart Association and American College of Cardiology Foundation. Circulation 2011 Nov 29;124(22):2458-2473. 10.1016/j.ijcard.2014.07.219. Epub 2014 Aug 5 https://www.helsedirektoratet.no/referanse/0002-0013-177871
209. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease https://www.helsedirektoratet.no/referanse/0002-0013-177872
210. Do the benefits of statins outweigh their drawbacks? Assessing patients' trade-off preferences with conjoint analysis https://www.helsedirektoratet.no/referanse/0002-0013-177873
Sist faglig oppdatert: 05.03.2018
Bruk av ACE-hemmer (eventuelt angiotensin II-antagonist) ved kjent aterosklerotisk hjerte- og karsykdom
- Ved koronarsykdom med klinisk hjertesvikt under infarktforløpet og/eller ved påvist skade på venstre ventrikkel (ved EF <40%), bør vedvarende behandling med ACE-hemmer tilbys (andrevalg: Angiotensin II-antagonister).
- Ved koronarsykdom uten større skade på venstre ventrikkel bør ACE-hemmer (evt. Angiotensin II-antagonister) vurderes, men gevinsten er mindre klar og må veies mot ulemper knyttet til bivirkninger og polyfarmasi. Slik behandling er mer aktuell jo større grad av risiko, som ved diabetes og hypertensjon.
- Etter påvist iskemisk hjerneslag og ved perifer karsykdom har ACE-hemmer (evt. Angiotensin II-antagonister) usikkert dokumentert effekt, og kan derfor ikke anbefales som generell behandling. Ved perifer karsykdom kan ACE-hemmer likevel vurderes, særlig når det foreligger symptomer.
Se også: Nasjonal faglig retningslinje for behandling og rehabilitering ved hjerneslag (helsedirektoratet)
Praktisk – slik kan anbefalingen følges
ACE-hemmer bør startes når pasienten er hemodynamisk stabil etter et hjerteinfarkt og gis per oralt. Behandling kan også startes i stabil fase senere i forløpet og ved stabil aterosklerotisk hjerte- og kar sykdom. Forsiktig opptrapping over 6 uker anbefales ved pga økt risiko for hypotensjon.
Både blodtrykk, nyrefunksjonsprøver (kreatinin og urinstoff) og elektrolytter bør følges ved oppstart og ved doseøkning. På grunn av dilatasjon av efferente arteriole og redusert filtrasjonstrykk, kan man se opp til 30% stigning i kreatinin etter oppstart av behandling uten at dette tilsier behov for dosereduksjon eller seponering, men dosereduksjon anbefales ved større kreatininstigning eller hyperkalemi. På lang sikt (over år) bevares nyrefunksjonen bedre med ACE-hemmer /Angiotensin II-antagonister selv om man får en initial stigning i kreatinin.
ACE-hemmere
- Ramipril startdose 2,5 mg x 1 i 1 uke, deretter 5 mg i 3 uker før økning til måldose på 10 mg daglig. Indisert for generell kardiovaskulær forebygging etter infarkt og ved stabil koronarsykdom, ved hjertesvikt og ved hypertensjon. (Ramipril ATC-kode C09A A05)
- Perindopril startdose 2-4 mg x 1, titrert opp til 8 mg daglig. Indisert for generell kardiovaskulær forebygging etter infarkt og stabil koronarsykdom, og ved hypertensjon. (Perindopril ATC-kode C09A A04)
- Enalapril startdose 2,5 mg x 2, titrert opp til 10 mg x 2 eller 20 mg x 1. Indisert ved hjertesvikt, hypertensjon og til forebygging ved nedsatt venstre ventrikkelfunksjon, men ikke for generell kardiovaskulær forebygging etter infarkt. (Enalapril ATC-kode C09A A02)
- Kaptopril startdose 6,25-12,5 mg x 3, titrert opp til 50 mg x 3. Indisert ved hjertesvikt, hypertensjon og til forebygging ved nedsatt venstre ventrikkelfunksjon, men ikke for generell kardiovaskulær forebygging etter infarkt. Grunnet tungvint administrasjon tre ganger daglig brukes dette lite i langtidsbehandling. (Kaptopriil ATC-kode C09A A01)
Ikke indisert for generell kardiovaskulær forebygging etter infarkt - kun kort tids behandling:
- Lisinopril startdose 2,5 mg-5mg x 1, titrert opp til 20-35 mg dgl.. Kan være aktuell i lav dose ved hjertesvikt hos eldre og ved nedsatt nyrefunksjon. (Lisinopril ATC-kode C09A A03)
- Zofenopril startdose 7,5 mg x 2, titrert opp til 30 mg x 2. Indisert ved hypertensjon og tidlig behandling etter hjerteinfarkt. (Zofenoprill ATC-kode C09A A15)
Angiotensin II-antagonister
- Telmisartan startdose 40 mg x1, titrert opp til 80 mg daglig. Indisert for generell kardiovaskulær forebygging ved kjent kardiovaskulær sykdom og hypertensjon. (Telmisartan ATC-kode C09C A07)
- Kandesartan startdose 4-8 mg x 1, titrert opp til 32 mg daglig. Indisert ved hypertensjon og hjertesvikt med nedsatt venstre ventrikkelfunksjon, men ikke for generell kardiovaskulær forebygging etter infarkt. (Kandesartan ATC-kode C09C A06)
- Valsartan startdose 20-80 mg x 1, titrert opp til 160 mg x 2 (alternativt 320 mg x 1). Indisert ved hypertensjon og hjertesvikt med nedsatt venstre ventrikkelfunksjon, men ikke for generell kardiovaskulær forebygging etter infarkt.(Valsartan ATC-kode C09C A03)
- Losartan startdose 12,5- 50 mg x 1, titrert opp til 100-150 mg daglig. Indisert ved hjertesvikt, hypertensjon og til forebygging ved nedsatt venstre ventrikkelfunksjon, men ikke for generell kardiovaskulær forebygging etter infarkt.(Losartan ATC-kode C09C A01)
Kun indisert ved hypertensjon eller ved hypertensjon og nyresykdom/diabetes:
- Olmesartan startdose 10 mg, titrert opp til 40 mg daglig. Kun indisert ved hypertensjon.(Olmesartan ATC-kode C09C A08)
- Irbesartan startdose 75 mg, titrert opp til 300 mg daglig. Kun indisert ved hypertensjon og nyresykdom/diabetes.(Irbesartan ATC-kode C09C A04)
- Eprosartan 600 mg. Kun indisert ved hypertensjon.(Eprosartan ATC-kode C09C A02)
Begrunnelse – dette er anbefalingen basert på
Risikoen for nye kardiovaskulære hendelser, hjertesvikt og arytmi er klart høyere for pasienter som har gjennomgått hjerteinfarkt, og særlig ved større skade på myokard (hjertemuskelen). Økt risiko for alle typer kardiovaskulære hendelser foreligger også etter iskemisk hjerneslag og ved påvist perifer aterosklerose. For slike pasienter er optimal sekundærforebygging svært viktig for prognosen. Behandling med ACE-hemmer og i noe mindre grad Angiotensin II-antagonister er undersøkt både etter gjennomgått hjerteinfarkt, ved hjerneslag og ved perifer aterosklerose. Ved gjennomgått hjerteinfarkt med skade på venstre ventrikkel og/eller klinisk tegn på hjertesvikt viser studier klart gunstig effekt av behandling med slike legemidler, både på risikoen for kardiovaskulær død og andre kardiovaskulære hendelser (NICE 2013). Etter mindre og ukompliserte hjerteinfarkt (uten tegn til skadet venstre ventrikkel) er effekten mindre tydelig og ikke signifikant når det gjelder total dødelighet, men behandlingen gir en signifikant reduksjon i størrelsesorden 20% for en sum av kardiovaskulære hendelser inkludert kardial død, og lignende effekt ses ved stabil hjerte- og kar sykdom. Behandling med ACE-hemmer må derfor vurderes hos alle med kjent koronarsykdom og er et viktig tiltak etter større hjerteinfarkter og tilfeller komplisert med hjertesvikt. Slik behandling er mer aktuell jo større grad av risiko, som ved diabetes og hypertensjon.
Det er mindre dokumentasjon for å anbefale ACE-hemmer ved perifer aterosklerose, men noen retningslinjer gir likevel slik behandling en svak anbefaling, og mer begrunnet ved symptomatisk perifer karsykdom (klaudikasjon) (Anderson JL m.fl. Circulation 2013).
Etter påvist iskemisk hjerneslag har ACE-hemmere (evt. Angiotensin II-antagonister) usikkert dokumentert effekt, og bruk vil da oftest være aktuell dersom det foreligger en tilleggsindikasjon som diabetes, nyreskade eller hypertensjon.(Se helsedirektoratets egne retningslinjer for behandling av hjerneslag).
Behandling med ACE-hemmere og Angiotensin II-antagonister kan gi bivirkninger som tørrhoste (kun ACE-hemmere), hypotensjon, nyresvikt, hypokalemi og svært sjelden angioødem, men de gunstige effekter vurderes som klart større enn ulempene. Dette kostnad-nytte forholdet er likevel mest gunstig jo mer alvorlig pasientens tilstand og prognose er.
Forskningsgrunnlag
Populasjon (P): Personer med kjent aterosklerotisk hjerte- og karsykdom
Tiltak (I): Behandling med ACE-hemmer eller som 2. valg Angiotensin II-antagonist
Sammenligning (C): Ingen behandling/placebo
Beskrivelse av inkluderte studier
Behandling med ACE-hemmer og i noe mindre grad Angiotensin II-antagonister er undersøkt både etter gjennomgått hjerteinfarkt, ved iskemisk hjerneslag og ved perifer aterosklerose. Ved gjennomgått hjerteinfarkt med skade på venstre ventrikkel og/eller klinisk tegn på hjertesvikt viser oppsummert forskning (NICE 2013, hoveddokumentasjon) klar gunstig effekt på total dødelighet med 16 % (relativ risiko (RR) 0,84;95 % konfidensintervall (KI) 0,78-0,90, og en 16 % reduksjon i antall nye hjerteinfarkt (RR 0,84;95 % KI 0,73-0,95). Etter mindre og ukompliserte hjerteinfarkt (uten tegn til skadet venstre ventrikkel) fant man derimot ingen effekt på totaldødeligheten, men en effekt på et samlet endepunkt bestående av hjertedød, hjertestans og ikke-dødelig hjerteinfarkt sett under ett (RR 0,79;95 % KI 0,69-0,90).
Ved stabil hjerte- og kar sykdom rapporteres i NICE-gjennomgangen en 21 % lavere forekomst av død av hjertesykdeom (RR 0,79; 95 % KI 0,71-0,89). Etter gjennomgått iskemisk hjerneslag er effekt av behandling med ACE-hemmer eller Angiotensin-II antagonist ikke sikkert dokumentert.
Det er sparsom dokumentasjon for bruk av ACE-hemmer ved perifer aterosklerose, men amerikanske retningslinjer gir likevel slik behandling en svak anbefaling. Behandling anses mer begrunnet ved symptomatisk perifer karsykdom (klaudikasjon) (Anderson JL m.fl. Circulation 2013).
Ifølge NICE-retningslinjen øker ACE- hemmere risikoen for nyresvikt (RR 1,27 ;95 % KI 1,0-1,61) og risikoen for hypotensjon (RR 1,45; 95 % KI 1,24-1,69). Det ble også funnet økt risiko for svimmelhet/synkope (RR 1,17; 95 % KI 1,09-1,26) (NICE 2013). ACE-hemmere kan gi tørrhoste og annen intoleranse hos 5-20% av pasientene (Caldeira D m.fl. 2012), og kan da ofte erstattes av Angiotensin II-antagonist.
Vi anbefaler behandling med ACE-hemmer, eventuelt (som 2. valg) Angiotensin-II antagonist, til alle pasienter med hjerteinfarkt og tegn til skade på venstre ventrikkel eller klinisk svikt. Ved koronarsykdom uten større skade på venstre ventrikkel bør slik behandling også vurderes, men gevinsten er mindre klar og må veies mot ulemper knyttet til bivirkninger og polyfarmasi. Slik behandling er mer aktuell ved større grad av risiko, som ved diabetes og hypertensjon. Etter påvist hjerneslag og ved perifer karsykdom har ACE-hemmer (evt. Angiotensin II-antagonister) usikkert dokumentert effekt, men bør likevel vurderes, særlig ved symptomatisk perifer aterosklerose.
Vurdering
Fordeler og ulemper
Fordeler
Bruk av ACE-hemmer (og i mindre grad Angiotensin-II antagonister), er undersøkt i en rekke studier etter akutt hjerteinfarkt. Resultatene synes å avhenge av hvorvidt det er et ukomplisert forløp uten tegn til skade på hjertets pumpefunksjon, eller om det er klinisk hjertesvikt i forløpet, eventuelt tegn til skadet venstre ventrikkel (redusert ejeksjonsfraksjon (EF)).
Etter hjerteinfarkt med tegn til skadet venstre ventrikkel eller hjertesvikt: De britiske NICE-retningslinjer (NICE 2013) har i en metaanalyse inkludert 9 randomiserte studier med 10458 personer med hjerteinfarkt og redusert venstre ventrikkelfunksjon og konkludert med at behandling med ACE-hemmer reduserte total dødelighet med 16 % (relativ risiko (RR) 0,84;95 % konfidensintervall (KI) 0,78-0,90. I en tilsvarende analyse av 7 studier med 10392 personer var det 16 % reduksjon i antall nye hjerteinfarkt (RR 0,84;95 % KI 0,73-0,95).
Etter hjerteinfarkt uten tegn til skadet venstre ventrikkel eller hjertesvikt: Analysen utført av NICE-retningslinjer fant ingen effekt på totaldødeligheten, mens en analyse av 2 studier med til sammen 7910 personer fant 21 % reduksjon for i hjertedød, hjertestans og ikke-dødelig hjerteinfarkt sett under ett (RR 0,79;95 % KI 0,69-0,90).
Ved stabil aterosklerotisk hjerte- og karsykdom: NICE-gjennomgangen summerte resultatene i de to viktigste studiene med behandling i mer enn 12 måneder (Yusuf S m.fl. 2000, Fox KM m.fl. 2003), og fant at ACE-hemmer ga 21 % lavere forekomst av død av hjertesykdom (RR 0,79; 95 % KI 0,71-0,89).
Etter gjennomgått iskemisk hjerneslag: Effekt av behandling med ACE-hemmer eller Angiotensin II-antagonist ikke sikkert dokumentert (Kernan WN 2014), og en studie på Angiotensin-II antagonisten telmisartan etter hjerneslag viste ingen sikker gevinst (Yusuf S m.fl.2008).
Ved perifer karsykdom: Det er sparsom dokumentasjon for bruk av ACE-hemmer, men amerikanske retningslinjer gir likevel slik behandling en svak anbefaling. Behandling anses mer begrunnet ved symptomatisk perifer karsykdom (klaudikasjon) (Anderson JL m.fl. 2013).
Ulemper
Ifølge NICE-retningslinjen øker ACE-hemmere risikoen for nyresvikt (RR 1,27 ;95 % KI 1,0-1,61) og risikoen for hypotensjon (RR 1,45; 95 % KI 1,24-1,69). Det ble også funnet økt risiko for svimmelhet/synkope (RR 1,17; 95 % KI 1,09-1,26) (NICE 2013). I to randomiserte kliniske studier med tilsammen 19989 personer med alle grader av redusert venstre ventrikkelfunksjon ble det ikke funnet sikker økning av risiko for hyperkalemi (NICE 2013).
ACE-hemmere kan gi tørrhoste og annen intoleranse hos 5-20% av pasientene (Caldeira D m.fl. 2012) og førte til seponering av medikamentet hos 3,9% av pasientene i en større analyse (Brugts JJ m.fl. 2014).
Risikoen for intoleranse for Angiotensin II-antagonister er derimot ikke signifikant forskjellig fra placebo (Caldeira D m.fl. 2012).
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen varierer for de ulike grupper av pasienter, men er av NICE-gjennomgangen oftest vurdert som lav til moderat.
Verdier og preferanser
ACE-hemmere tolereres som regel godt, og har vanligvis lite subjektive bivirkninger bortsett fra tørrhoste. Grunnet gunstig effekt på viktige endepunkter som dødelighet, nytt hjerteinfarkt og hjerneslag, vil pasienter forventes å ønske behandling, tross noe økt risiko for nyresvikt, hypotensjon, svimmelhet og besvimelser. Ved små hjerteinfarkt og ukomplisert forløp kan fordelene imidlertid fortone seg som små. For pasienter som er uten plager fra sin hjertesykdom og som opplever subjektive bivirkninger, vil fordelene kunne oppleves som mindre viktige enn ulempene.
Referanser
211. Anderson JL, Halperin JL, Albert NM et al. Management of patients with peripheral artery disease (Compilation of 2005 and 2011 ACCF/AHA guideline recommendations). A report from the American Collegeof Cardiology Foundation/American Heart Association Task Force on practise guidelines. Circulation 2013; 127: 1425-1443 https://www.helsedirektoratet.no/referanse/0002-0013-177874
212. Brugts JJ, Arima H, Remme W, et al. The incidence and clinical predictors of ACE-inhibitor induced dry cough by perindopril in 27,492 patients with vascular disease. Int J Cardiol. 2014 Oct 20; 176: 718-23 https://www.helsedirektoratet.no/referanse/0002-0013-177875
213. Caldeira D, David C, Sampaio C. Tolerability of angiotensin-receptor blockers in patients with intolerance to angiotensin-converting enzyme 8.inhibitors: a systematic review and meta-analysis. Am J Cardiovasc Drugs. 2012; 12: 263-77 https://www.helsedirektoratet.no/referanse/0002-0013-177876
214. Fox KM; EURopean trial On reduction of cardiac events with Perindopril in stable coronary Artery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet. 2003; 362: 782-8 https://www.helsedirektoratet.no/referanse/0002-0013-177877
215. National Institute for Health and Care Excellence: Clinical Guidelines . MI - secondary prevention-Secondary prevention in primary and secondary care for patients following a myocardial infarction Partial update of NICE CG48. Methods, evidence and recommendations. November 2013 London: Royal College of Physicians (UK); 2013 Nov.2014; 45:2160-2236 https://www.helsedirektoratet.no/referanse/0002-0013-177878
216. Savarese et al. Meta-Analysis Reporting Effects of Angiotensin-Converting Enzyme Inhibitors and Angiotensin Receptor Blockers in Patients Without Heart Failure. J Am Coll Cardiol 2013;61:131–42 https://www.helsedirektoratet.no/referanse/0002-0013-177879
217. Smith SC Jr, Benjamin EJ, Bonow RO, et al. AHA/ACCF secondary prevention and risk reduction therapy for patients with coronary and other atherosclerotic vascular disease: 2011 update: a guideline from the American Heart Association and American College of Cardiology Foundation. Circulation 2011 Nov 29;124(22):2458-2473 https://www.helsedirektoratet.no/referanse/0002-0013-177880
218. Task Force Members, Montalescot G, Sechtem U, Achenbach S, et al. 2013 ESC guidelines on the management of stable coronary artery disease: The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013 doi: 10.1093/eurheartj/eht296 First published online: August 30, 2013 https://www.helsedirektoratet.no/referanse/0002-0013-177881
219. Yusuf S, Sleight P, Pogue J, Bosch J, Davies R, Dagenais G. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med. 2000; 342(3): 145-53 https://www.helsedirektoratet.no/referanse/0002-0013-177882
220. Yusuf S, Diener HC, Sacco RL, et al.; PRoFESS Study Group. Telmisartan to prevent recurrent stroke and cardiovascular events. N Engl J Med. 2008;359:1225-37 https://www.helsedirektoratet.no/referanse/0002-0013-177883
221. Kernan WN, Ovbiagele B, Black HR et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack. Stroke 2014; 45: 2160-2236 https://www.helsedirektoratet.no/referanse/0002-0013-177884
Sist faglig oppdatert: 05.03.2018
Bruk av betablokker ved kjent aterosklerotisk hjerte- og karsykdom
- Ved akutt koronarsykdom bør behandling med betablokker startes når pasienten er hemodynamisk stabil og fortsettes i 1-3 år ved ukompliserte tilfeller.
- Livslang eller langvarig behandling bør tilbys ved større infarktskader og ved anginasymptomer eller systolisk hjertesvikt.
- Betablokker har ingen rutinemessig plass etter påvist iskemisk hjerneslag eller ved perifer karsykdom, men kan benyttes som en del av behandlingsopplegget ved hypertensjon.
Se også Nasjonal faglig retningslinje for behandling og rehabilitering ved hjerneslag
Praktisk – slik kan anbefalingen følges
Betablokkerbehandling bør startes når pasienten er hemodynamisk stabil, med lav startdose som titreres opp gradvis ut fra toleranse. Ofte vil hjertefrekvensen være veiledende for titreringen, og puls under 70 slag per minutt har vært anbefalt (Rosenson RS m.fl. 2016). Titreringen bør ellers ha som mål å komme opp til doser tilsvarende de som er brukt i studiene av betablokker etter hjerteinfarkt.
- Metoprolol depot (Selo-Zok) 12,5-50 mg x 1-2 som titreres opp mot 200 mg per døgn. (Metoprolol ATC-kode C07A B02)
- Atenolol 25-50 mg x 1-2, titreres opp mot 100 mg per døgn.(Atenolol ATC-kode C07A B03)
- Karvedilol 12,5 x 1-2, titreres opp mot 50 mg per døgn. (Karvedilol ATC-kode C07A G02)
- Bisoprolol 1,25-2,5 mg x 1, titreres opp mot 10 mg per døgn. (Bisoprolol ATC-kode C07A B07)
- (Propanolol 20-40 mg 3-4 ganger daglig, titreres mot 160 mg per døgn - anbefales i liten grad grunnet tungvinn administrering) (Propanolol ATC-kode C07A A05)
- (Metoprolol 50 mg x 1-2. Mest aktuelt som startbehandling på sykehus Titreres opp mot 200 mg /døgn, brukes i liten grad for vedlikeholdsbehandling) (Metoprolol ATC-kode C07A B02)
Ved nedsatt venstre ventrikkelfunksjon og hjertesvikt er lavere startdose og forsiktig opptrapping nødvendig for å unngå forverring av hjertesvikt, men måldosene er de samme.
Som absolutte kontraindikasjoner regnes kardiogent sjokk, tilstedeværende bronkospasme, alvorlig bradykardi og AV-blokk grad 2 eller 3 (med mindre pasienten har pacemaker) og dekompensert (ukontrollert) hjertesvikt (Rosenson RS m.fl. 2016).
Ved avslutning av behandling bør dosen betablokker trappes ned gradvis før seponering for å redusere risikoen for refleks-takykardi og økt angina.
Begrunnelse – dette er anbefalingen basert på
Risikoen for nye kardiovaskulære hendelser, hjertesvikt og arytmi er klart høyere for pasienter som har gjennomgått hjerteinfarkt, og særlig ved større skade på myokard (hjertemuskelen). Økt risiko for alle typer kardiovaskulære hendelser foreligger også etter iskemisk hjerneslag og ved påvist perifer aterosklerose. Optimal sekundærforebygging har stor betydning for prognosen etter en kardiovaskulær hendelse, men er noe ulik for de forskjellige typer hjerte- og karsykdom. Betablokkere er hovedsakelig dokumentert ved gjennomgått hjerteinfarkt og stabil koronarsykdom. Oppsummert forskning (NICE 2013) viser at behandling med betablokker trolig gir en viss reduksjon av totalmortalitet, og en signifikant reduksjon i død av hjertesykdom og plutselig død. Behandlingen gir videre redusert risiko for re-infarkt (nytt hjerteinfarkt), mens det ikke kan påvises reduksjon i hjerneslag.
De gunstige effekter synes å være størst ved stor hjertemuskelskade og ved kliniske tegn til hjertesvikt, og livslang behandling er da svært viktig for prognosen. Ved mindre infarktskade synes effekten hovedsakelig tilstede den første tiden etter infarktet, og det ikke funnet overbevisende data for behandling utover 3 år etter et hjerteinfarkt. Det er heller ikke dokumentert gunstig effekt av rutinemessig behandling med betablokkere hos pasienter med perifer aterosklerose eller gjennomgått hjerneslag (se også egen retningslinje for behandling av hjerneslag).
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt og kronisk koronarsykdom
Tiltak (I): Behandling med betablokker
Sammenligning (C): Ingen behandling/placebo
Beskrivelse av inkluderte studier
Betablokkerbehandling ved akutt og kronisk koronarsykdom har vært studert i over 35 år, og en del studier tar for seg intravenøs behandling gitt umiddelbart etter sykehusinnleggelse for hjerteinfarkt. Denne anbefalingen omtaler ikke slik behandling, men gjelder den vedvarende tablettbehandling som startes når pasienten er hemodynamisk stabil, samt behandling i etterfølgende år. I metaanalyser på behandling i stabil fase etter akutt infarkt synes effekten i eldre studier mer uttalt enn i de nyere, noe som antas å henge sammen med at øvrig behandling, kanskje særlig akutt revaskularisering og lipidsenkende behandling, har bidratt til betydelig bedret prognose for infarktpasienter.
De britiske NICE retningslinjene har i 2013 studert effekten av betablokker etter akutt koronarsykdom med 14 inkluderte studier hvor behandlingen var startet etter 72 timer (NICE guidelines 2013). Oppsummeringen viste at behandling med betablokker trolig gir en viss reduksjon av totalmortalitet. I samme oppsummering fra 12 studier, fant man en reduksjon i død av hjertesykdom og plutselig død. Videre ble det i 13 av studiene som inkluderte 17089 personer funnet redusert risiko for re-infarkt, mens det ikke var tegn til reduksjon i hjerneslag. Det er i øvrig litteratur ikke funnet overbevisende data for behandling utover 3 år etter et hjerteinfarkt, og ikke evidens for effekt hos pasienter med perifer aterosklerose eller gjennomgått iskemisk hjerneslag.
I akuttfasen av hjerteinfarkt kan behandling med betablokker gi økt risiko for bradykardi og AV-blokk, forverret hjertesvikt og bronkospasme (Rosenson RS m.fl. 2016), hvilket imidlertid som regel opptrer under sykehusoppholdet. Den britiske oppsummeringen fra 2013 (NICE guidelines) viste at betablokker kan gi økt forekomst av svimmelhet og bradykardi, mens det ikke var sikre holdepunkter for økt forekomst av muskelsvakhet, drømmer/mareritt eller nedsatt seksuallyst, selv om dette rapporteres jevnlig i klinisk praksis.
Vurdering
Fordeler og ulemper
Fordeler
Betablokkerbehandling ved akutt koronarsykdom (hjerteinfarkt) har vært undersøkt i studier helt siden 1970-tallet. Behandlingen starter som regel noen dager etter hjerteinfarktet, men i noen tilfeller i akuttfasen, til dels med intravenøs administrasjon. Intravenøs behandling må anses som sykehusbehandling og er ikke nærmere omtalt i denne anbefalingen. Anbefalingen gjelder altså vedvarende behandling som er startet når pasienten er hemodynamisk stabil, det vil si dager etter den akutte hendelsen, ofte definert som fra 72 timer og senere.
I en metaanalyse fra 2014 ble 60 studier med tilsammen 102.003 pasienter vurdert (Bangalore S m.fl. 2014). Forfatterne delte resultatene inn i henhold til hvorvidt studien var gjennomført før eller etter reperfusjonsbehandling ble vanlig. I de eldre studiene reduserte betablokker total dødelighet med 14 % (relativ risiko(RR) 0,86; (95% konfidensintervall (KI) 0,79-0,94), og kardiovaskulær dødelighet med 13 % (RR 0,87; (95% KI 0,78-0,98), mens det ikke var noen effekt på total dødelighet i nyere studier (RR 0,98; (95% KI 0,92-1,05).
Behandling med betablokker ga imidlertid både i eldre og nyere studier en reduksjon i anginaplager samt redusert risiko for nytt infarkt på omkring 15%, med RR 0,78; 95% KI, 0,62-0,97 i de eldre studier og RR 0,72; 95% KI 0,62-0,83 i de nyere. I de nyere studiene ble disse effektene hovedsakelig sett de første 30 dager etter akutt koronarsykdom (Bangalore S m.fl. 2014).
De britiske NICE retningslinjene har i 2013 studert effekten av betablokker etter akutt koronarsykdom og inkluderte 14 studier med 17642 pasienter hvor behandlingen var startet etter 72 timer (NICE guidelines 2013). Oppsummeringen viste at behandling med betablokker trolig gir en viss reduksjon av totalmortalitet. I samme oppsummering (NICE guidelines 2013) fant man i 12 studier med 16394 pasienter en reduksjon i død av hjertesykdom og plutselig død. Videre ble det i 13 av studiene som inkluderte 17089 personer funnet redusert risiko for re-infarkt, mens det ikke var tegn til reduksjon i hjerneslag. Kvaliteten på dokumentasjonen ble generelt vurdert som lav.
Bruk av betablokker til pasienter med hjerte- og karsykdom er mangelfullt studert ved andre tilstander enn akutt koronarsykdom. Det finnes ingen dokumentert gevinst på kardiovaskulær dødelighet ved stabil angina (Henneken CH m.fl. 2016, Bangalore S m.fl. 2012, Ferrari R 2013). I mangel av dokumentasjon ved stabil angina, hjerneslag og perifer karsykdom (Kernan KW m.fl. 2014, Andersson JL m.fl 2013), er det ikke grunnlag for anbefaling om rutinemessig sekundærforebyggende bruk ved andre hjerte- og kartilstander enn akutt koronarsykdom.
Ulemper
I akuttfasen av hjerteinfarkt kan behandling med betablokker gi økt risiko for bradykardi og AV-blokk, forverret hjertesvikt og bronkospasme (Rosenson RS m.fl. 2016), hvilket som oftest vil opptre under sykehusopphold.
Den britiske oppsummeringen fra 2013 (NICE guidelines) viste at betablokker kan gi økt forekomst av svimmelhet og bradykardi, mens det ikke var sikre holdepunkter for økt forekomst av muskelsvakhet, drømmer/mareritt eller nedsatt seksuallyst.
En metaanalyse av betablokker i hypertensjonsbehandling viste svært beskjeden økning av bivirkninger svarende til 18 flere tilfeller med muskelsvakhet per 1000 behandlede (1 tilfelle per 57 behandlede per år), 5 per 1000 tilfeller av seksual dysfunksjon (1 tilfelle per 199 behandlede per år), mens det ikke ble funnet økt tendens til depressive symptomer (Ko DT m.fl. 2002).
Kliniske erfaringer fra betablokkerbehandling hos pasienter med koronarsykdom og høyt blodtrykk tilsier likevel at mange pasienter opplever bivirkninger som følelse av nedsatt fysisk kapasitet, kalde hender og føtter, søvnforstyrrelser, nedsatt seksualfunksjon og noen ganger vektøkning.
Kvalitet på dokumentasjonen
Vurdert som svak, basert på vurderingen i fra NICE 2013
Verdier og preferanser
Betablokkerbehandling gitt i forbindelse med hjerteinfarkt tolereres som regel godt, og kan gi pasienten mindre plager med hjertebank og angina. Redusert risiko for nytt hjerteinfarkt og redusert dødelighet den første tiden etter akutt koronarsykdom vil trolig være viktige fordeler for pasienten. Ved små hjerteinfarkt og ukomplisert forløp kan fordelene imidlertid fortone seg som små. For pasienter som er uten plager fra sin hjertesykdom og opplever subjektive bivirkninger, vil fordelene kunne oppleves som mindre viktige enn ulempene.
Referanser
221. Kernan WN, Ovbiagele B, Black HR et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack. Stroke 2014; 45: 2160-2236 https://www.helsedirektoratet.no/referanse/0002-0013-177884
222. Anderson JL, Halperin JL, Albert NM et al. Management of patients with peripheral artery disease (Compilation of 2005 and 2011 ACCF/AHA guideline recommendations). A report from the American Collegeof Cardiology Foundation/American Heart Association Task Force on practise guidelines. Circulation 2013; 127: 1425-1443 https://www.helsedirektoratet.no/referanse/0002-0013-177885
223. Bangalore S, Steg G, Deedwania P, et al. β-blocker use and clinical outcomes in stable outpatients with and without coronary artery disease. JAMA 2012 Oct 3;308(13):1340-1349 https://www.helsedirektoratet.no/referanse/0002-0013-177886
224. Bangalore S, Makani H, Radford M, et al. Clinical outcomes with β-blockers for myocardial infarction: a meta-analysis of randomized trials. Am J Med. 2014 Oct; 127(10): 939-53 https://www.helsedirektoratet.no/referanse/0002-0013-177887
225. Ferrari R. Revising common beliefs in the management of stable CAD. Nat Rev Cardiol 2013 Feb;10(2):65-66 https://www.helsedirektoratet.no/referanse/0002-0013-177888
226. Hennekens CH, Lopez-Sendon J, et al. UpToDate. Prevention of cardiovascular disease events in those with established disease or at high risk. Literature review current through: Feb 2016. | This topic last updated: Mar 10, 2016 https://www.helsedirektoratet.no/referanse/0002-0013-177889
227. Rosenson RS, Reeder GS, Kennedy HL, et al. UpToDate. Acute myocardial infarction: Role of beta blocker therapy Literature review current through: Feb 2016. | This topic last updated: Jan 04, 2016 https://www.helsedirektoratet.no/referanse/0002-0013-177890
228. Smith SC Jr, Benjamin EJ, Bonow RO, et al. AHA/ACCF secondary prevention and risk reduction therapy for patients with coronary and other atherosclerotic vascular disease: 2011 update: a guideline from the American Heart Association and American College of Cardiology Foundation. Circulation 2011 Nov 29;124(22):2458-2473. https://www.helsedirektoratet.no/referanse/0002-0013-177891
229. Task Force Members, Montalescot G, Sechtem U, Achenbach S, et al. 2013 ESC guidelines on the management of stable coronary artery disease: The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013 https://www.helsedirektoratet.no/referanse/0002-0013-177892
230. The Norwegian Multicenter Study Group. Timolol-induced reduction in mortality and reinfarction in patients surviving acute myocardial infarction. N Engl J Med 1981; 304: 801-807 https://www.helsedirektoratet.no/referanse/0002-0013-177893
231. Beta-blocker therapy and symptoms of depression, fatigue, and sexual dysfunction https://www.helsedirektoratet.no/referanse/0002-0013-177894
232. Myocardial infarction: cardiac rehabilitation and prevention of further cardiovascular disease https://www.nice.org.uk/guidance/cg172/resources
Sist faglig oppdatert: 05.03.2018
Blodtrykksbehandling ved kjent hjerte- og karsykdom
- Tilby medikamentell blodtrykksbehandling ved påvist hjerte- og karsykdom som koronarsykdom, hjerneslag, hjertesvikt, arytmi, klaffefeil og aortaaneurismer når blodtrykket er ≥140/90 mmHg.
- Valg av medikament og intensitet av behandlingen må tilpasses den underliggende sykdomstilstand, men det generelle behandlingsmål er blodtrykk <140/90 mmHg.
Praktisk – slik kan anbefalingen følges
Ved mange (men ikke alle) kardiovaskulære tilstander vil medikamenter med blodtrykksregulerende virkning være indisert på grunn av den underliggende sykdommen, uavhengig av blodtrykket. Dette gjelder bl.a. betablokkere og ACE-hemmere (alternativt Angiotensin II antagonister) ved gjennomgått infarkt og ved hjertesvikt, og ved alvorlig svikt med nedsatt venstre ventrikkelfunksjon vil også aldosteronantagonister og loop-diuretika oftest inngå. For noen pasienter med angina eller rytmeforstyrrelser vil også kalsiumblokkere inngå i behandlingen, uavhengig av blodtrykket.
Det vil derfor være hensiktsmessig å avvente vurdering av spesifikk ytterligere blodtrykkssenkende medikasjon til slik øvrig behandlingen er ferdig opptitrert og tilpasset.
Selve blodtrykksnivået kan ofte være betydelig forskjellig under en sykehusinnleggelse sammenliknet med det som etablerer seg når pasienten kommer i vanlig funksjon etter utskrivelsen. Det vil derfor være viktig å gjennomføre nøyaktig blodtrykkskontroll etter noen uker til måneder. Europeiske data viser at en stor andel av pasienter med gjennomgått hjerte- og karsykdom ikke har adekvat blodtrykkskontroll (Kotseva K m.fl 2015).
Ved gjentatt blodtrykk ≥140/90 mmHg bør spesifikk blodtrykksbehandling startes. Valg av preparat og dose må tilpasses underliggende tilstand og allerede igangsatt medikasjon. Nærmere veiledning om valg av preparat, ekstra indikasjon og kontraindikasjoner fremkommer i tabell 1 i anbefalingen om medikamentell blodtrykksbehandling som primærforebygging. Ved hjertesvikt med bevart ejeksjons fraksjon (HFpEF) finnes det foreløpig lite dokumentasjon på spesifikk behandling, men adekvat kontroll av blodtrykket anses som svært viktig (Kanwar M m.fl. 2016).
Det generelle behandlingsmål er BT < 140/90 mmHg, men flere internasjonale retningslinjer angir at noe lavere blodtrykksmål, tilsvarende 130/80 kan være fordelaktig for noen pasientgrupper, f. eks. etter hjerneslag (Mancia G m. fl. 2013, Rosendorff C m. fl. 2015).
Begrunnelse – dette er anbefalingen basert på
Høyt blodtrykk representerer en av de viktigste årsaker til hjerte- og karsykdom. Hypertensjon gir ikke bare økt risiko for hjerneslag og hjerteinfarkt, men er en hovedårsak til utvikling av hjertesvikt, arytmi, inkludert atrieflimmer, og medvirker til utvikling av klaffefeil, samt annen karsykdom. Når hjerte- og karsykdom allerede foreligger, gir det også økt risiko for nye komplikasjoner. Adekvat blodtrykkskontroll inngår som en sentral faktor i håndteringen for å unngå nye komplikasjoner med mer spesifikk rettet behandling og valg av preparat ut fra de gitte tilstander som foreligger.
Vurdering
Fordeler og ulemper
Fordeler
Medikamentell blodtrykksbehandling er en sentral del av håndteringen hos pasienter med ulike former for hjerte- og karsykdom, og et viktig bidrag til å forhindre forverring av den underliggende tilstand og andre kardiovaskulære komplikasjoner (Mancia G m.fl. 2013, Rosendorff C m.fl. 2015, Katsanos AH m.fl. 2017). Blodtrykksbehandling gir tilsvarende relativ risikoreduksjon hos personer med kjent hjerte- og karsykdom som ved primærforebygging, men grunnet høyere absolutt risiko blir den absolutte gevinsten større.
I en stor metaanalyse ble det hos personer med kjent koronarsykdom funnet at en reduksjon i blodtrykk på 10/5 mmHg (systolisk/diastolisk) ga en relativ risikoreduksjon (RR) på 0,76 (95 % c.i. 0,68-0,86) for nye koronare hendelser og en RR på 0,65 (0,53-0,80) for hjerneslag (Law MR m.fl. 2009). Tilsvarende ble det hos personer med kjent hjerneslag sett RR på 0,79 (0,73-1,00) for koronare hendelser og RR på 0,66 (0,56-0,79) for hjerneslag. Risikoen for total død ble i denne analysen redusert med RR 0,86 (0,89-0,90) hos personer med kjent koronarsykdom og ikke-signifikant med RR 0,91 (0,83-1,01) hos personer med gjennomgått hjerneslag.
Ulemper
Ulike blodtrykksmidler har spesifikke bivirkninger og kontraindikasjoner som er nærmere beskrevet i denne retningslinjen under anbefalingen om primærforebyggende blodtrykksbehandling. Behandlingen må derfor tilpasses underliggende tilstander, komorbiditet, bivirkninger og kontraindikasjoner slik dette er anført i egen tabell.
Viktige bivirkninger av blodtrykksbehandlinger ortostatisk svimmelhet, påvirkning av hjerteledning (AV-blokk), endringer i nyrefunksjon, væske- og elektrolyttbalanse og glukoseregulering, påvirkning av seksualfunksjon, vekt, hoste, kalde hender og føtter, og tretthet/muskelsvakhet (fatigue).
Kvalitet på dokumentasjonen
Kvaliteten vurderes som god når det gjelder sekundærforebygging etter hjerteinfarkt og slag, men mer mangelfull for andre kardiovaskulære tilstander.
Verdier og preferanser
Pasienter som allerede har opplevd hjerte- og kar sykdom vil ønske størst mulig reduksjon av risikoen for nye hendelser, men mange har likevel motforestillinger mot å måtte ta tallrike legemidler daglig. For pasienter som er uten plager fra sin hjerte- og karsykdom og opplever subjektive bivirkninger av behandlingen, vil fordelene kunne oppleves som mindre viktige enn ulempene. Studier viser at 30-40% av pasienter med kjent hjerte- og karsykdom ikke tar forskrevne legemidler (Chowdury R m.fl. 2013). Å ta pasienten med på råd er som alltid en forutsetning (Barry MJ m.fl. 2012), og forutsetter adekvat informasjon om risiko og ulemper med og uten behandling (Martin SS m.fl. 2013).
Blodtrykksbehandling er viktig med tanke på reduksjon av senere hjerneslag, og risikoen ved manglende blodtrykkskontroll må derfor forklares. En del opplever ulike kroppslige symptomer etter en kardiovaskulær hendelse, som da på usikkert grunnlag tilskrives medisineringen. Med en nøyaktig gjennomgang og tilpasning av behandlingen, vil man oftest kunne gi pasienten et behandlingsregime som både gir tilstrekkelig beskyttelse og lite plager i det daglige.
Referanser
133. Use of blood pressure lowering drugs in the prevention of cardiovascular disease: meta-analysis of 147 randomized trials in the context of expectations from prospective epidemiological studies https://www.helsedirektoratet.no/referanse/0002-0013-177796
233. Chowdhury R, Khan H, Heydon E, et al. Adherence to cardiovascular therapy: a meta-analysis of prevalence and clinical consequences. Eur Heart J. 2013 Oct; 34(38): 2940-8 https://www.helsedirektoratet.no/referanse/0002-0013-177896
234. Kotseva K, Woods D, DeBacquer D et al. EUROASPIRE IV: A European Society of Cardiology survey on the lifestyle, risk factor and therapeutic management of coronary patients from 24 European countries. Eur JPrev Cardiol; 2016 Apr 23 (&); 636-438 https://www.helsedirektoratet.no/referanse/0002-0013-177897
235. Blood Pressure Reduction and Secondary Stroke Prevention: A Systematic Review and Metaregression Analysis of Randomized Clinical Trials https://www.helsedirektoratet.no/referanse/0002-0013-177898
236. Treatment of hypertension in patients with coronary artery disease: a scientific statement from the American Heart Association, American College of Cardiology, and American Society of Hypertension https://www.helsedirektoratet.no/referanse/0002-0013-177899
237. Shared decision making--pinnacle of patient-centered care https://www.helsedirektoratet.no/referanse/0002-0013-177900
238. Clinician-patient risk discussion for atherosclerotic cardiovascular disease prevention: importance to implementation of the 2013 ACC/AHA Guidelines https://www.helsedirektoratet.no/referanse/0002-0013-177901
239. 2013 ESH/ESC Guidelines for the management of arterial hypertension https://www.helsedirektoratet.no/referanse/0002-0013-177902
240. Targeting heart failure with preserved ejection fraction: current status and future prospects https://www.helsedirektoratet.no/referanse/0002-0013-177903
Sist faglig oppdatert: 05.03.2018
Legemiddelbehandling hos eldre ved forebygging av hjerte- og karsykdom
Statinbehandling hos eldre > 75 år
- Start eller fortsett statinbehandling hos eldre (> 75 år) med etablert hjerte- og karsykdom eller diabetes, med mindre helsetilstanden eller leveutsikter er betydelig svekket.
- Hos eldre (> 75 år) uten etablert hjerte- og karsykdom eller diabetes (primærforebygging) bør statinbehandling bare gis basert på en individuell klinisk vurdering av nytte og risiko, der man særlig vektlegger hvorvidt det foreligger andre vesentlige sykdommer og stor grad av polyfarmasi.
- Pågående statinbehandling bør avsluttes ved sykdom som reduserer forventet nytte av statinbehandling, f.eks. kreftsykdom, underernæring, alvorlig organsvikt eller alvorlig demens.
Praktisk – slik kan anbefalingen følges
Primærforebygging
Vi anbefaler atorvastatin 10-20 mg daglig (ATC-kode C10A A05), uten klart definerte behandlingsmål.
Sekundærforebygging
Vi anbefaler atorvastatin 20-40 mg daglig ved behandlingsstart hos personer > 75 år som har påvist hjerte- og karsykdom. LDL-kolesterol mål er <1,8 mmol/l.
Ved diabetes uten hjerte- og karsykdom bør behandling med statiner vurderes, f. eks. atorvastatin 20 mg, med behandlingsmål 2,5 mmol/l (se Nasjonal faglig retningslinje for diabetes). Ved manglende oppnåelse av LDL-kolesterolmål kan man vurdere å legge til ezetimib 10 mg, men ta hensyn til pasientens biologiske alder, komorbiditeter, legemidler for øvrig og eventuelle muskelskjelettplager. Forekomsten av plagene er større ved høye statindoseringer og ved kombinasjonen statin/ezetimib.
Livskvalitet og personlige preferanser må tas i betraktning både ved start og fortsettelse av behandling. Vær på vakt når det gjelder mer klassiske symptomer på intoleranse som myalgier, myositter og kramper samt andre plager som nevropatier, bløtdelsskader, og svakhet i muskulatur.
Personer som kan ha stått på legemidler i en lengre periode kan utvikle bivirkninger uten at man setter de i sammenheng med pågående statinbehandling. Et seponeringsforsøk kan være avklarende.
Ved alvorlig kreftsykdom, underernæring, alvorlig infeksjon eller demens og i livets siste fase bør statiner seponeres.
Risikofaktorer for myopatier med statiner
- Alder over 80 år
- Kvinne
- Lav BMI og skjørhet
- Multisystem sykdom (kronisk nyresykdom, diabetes)
- Ubehandlet hypothyreose
- Intens fysisk aktivitet
- Etter operasjoner
- Polyfarmasi – se interaksjonsanalyse
- Stort alkoholinntak
- Grapefrukt-/tyttebærjuice
- Genetiske polymorfismer
Begrunnelse – dette er anbefalingen basert på
Behandling med statiner for å forebygge hjerte- og karsykdom hos eldre > 75 år krever spesielle avveininger både fordi denne gruppen er mer utsatt for bivirkninger og problemer knyttet til polyfarmasi, og fordi forekomsten av andre sykdommer er høy og leveutsiktene gradvis mer begrensede.
Statinbehandling er i studier likevel vist å gi tilvarende reduksjon i kardiovaskulær sykelighet som hos yngre, og i sekundærforebygging er det både vist reduksjon i kardiovaskulære hendelser og dødelighet. I primærforebygging er det få studier på denne aldersgruppen, og eksisterende data viser tilsvarende reduksjon i hendelser, men ikke sikker effekt på dødelighet.
Personer med alder >75 år bør derfor tilbys sekundærforbygging med statiner på ganske lik linje med yngre personer, så fremt det ikke foreligger forhold som klart reduserer nytten av behandlingen, for eksempel alvorlig kreftsykdom, underernæring, organsvikt og demens.
I primærforebygging bør statinbehandling derimot bare gis til personer > 75 år når det foreligger særlig høy risiko, samtidig som den generelle helsetilstand er god med fravær av andre vesentlige sykdommer og stor grad av polyfarmasi.
Vurdering
Fordeler og ulemper
Fordeler
Sekundærforebygging
Randomiserte kontrollerte kliniske forsøk har påvist effekt av lipidsenkende behandling hos eldre pasienter med etablert hjerte- og karsykdom. Flest data er tilgjengelig for aldersgruppen 65-74 år, mens mindre data finnes for aldersgruppen > 75 år. Relativ risikoreduksjon er omtrent lik hos eldre som hos yngre, men på grunn av økt absolutt risiko er "number needed to treat" betydelig lavere hos de eldre (Afilalo J m.fl. 2008). En meta-analyse av 9 studier der deltakerne var fra 65 til 82 år gamle, fant man 22 % reduksjon i totaldødelighet over 5 år (relativ risiko (RR) 0,78; 95 % konfidensintervall (KI) 0,65-0,89). Risiko for ikke-dødelig hjerteinfarkt ble redusert med 26 % og risiko for hjerneslag med 25 %. Tre studier inkluderte pasienter over 75 år i denne metaanalysen (Heart Protection Study Collaborative Group 2005, Shepherd J m.fl. 2002, Deedwania P m.fl. 2007).
En meta-analyse utført av Cholesterol Treatment Trialists viste at med større reduksjon i LDL-kolesterol oppnås større gevinster også hos personer ≥ (CTT Collaboration 2010).
I en senere meta-analyse som undersøkte effekten av intensiv statinbehandling mot mindre intensiv behandling hos pasienter ≥ 65 år med akutt koronarsykdom, var det reduksjon i ikke-dødelig hjerteinfarkt, hjerneslag og revaskularisering, men ikke i totaldødelighet (Yan YL 2013). To av studiene inkluderte pasienter over 80 år (Deedwania P m.fl. 2007, Olsson AG m.fl. 2007).
På bakgrunn av disse studiene og meta-analysene sett under ett, bør LDL-kolesterolmål under 1,8 mmol/l tilstrebes også hos de eldre, hvis behandlingen tolereres godt og pasienten har normale leveutsikter for alderen.
Primærforebygging
Høy alder er den mest dominerende risikofaktor for hjerte- og karsykdom. I aldersgruppen > 75 år vil de fleste ha mer enn 15 % risiko for hjerte- og karhendelser i de neste 10 år. Gevinsten av lipidsenkende behandling hos personer over 75 år uten kjent hjerte- og karsykdom er lite undersøkt. I PROSPER-studien reduserte behandling med pravastatin 40 mg/dag forekomsten av vaskulære hendelser med 15 % i aldersgruppen 70-82 år, men effekten var ikke statistisk signifikant hos deltakere uten tidligere hjerte- og karsykdom (hasard ratio (HR) 0,94; 95 % KI 0,77 – 1,15) (Shepherd J m.fl. 2002). JUPITER studien randomiserte menn > 50 år og kvinner > 60 år med høy CRP men uten hjerte- og karsykdom eller hyperkolesterolemi til behandling med rosuvastatin 20 mg/dag eller placebo (Glynn RJ m.fl. 2010). I gruppen > 75 år reduserte statinbehandling den samlede forekomsten av hjerteinfarkt, hjerneslag, revaskularisering, ustabil angina og hjerte- og kardød med 20 % (HR 0,80; 95 % KI 0,46-0,82), men det var ingen effekt på totaldødeligheten.
I en meta-analyse av 8 studier med 24,674 personer > 65 år (gjennomsnittlig alder 73 år), reduserte statinbehandling risikoen for hjerteinfarkt (RR 0,61;95 % KI 0,43-0,85) og hjerneslag (RR 0,76; 95 % KI 0,63-0,93), men det var ikke redusert total- eller kardiovaskulær dødelighet (Savarese G m.fl. 2013). Number needed to treat var 83 for hjerteinfarkt og 142 for hjerneslag over perioden på 3,5 år (Savarese G m.fl. 2014). Fem av studiene inkluderte deltakere med mer enn én risikofaktor (AFCAPS, ALLHAT, ASCOT-LLA, CARDS, PROSPER); i 2 studier hadde deltakere hyperkolesterolemi (MEGA, Elderly FLUVA) og i én studie hadde deltakerne høy CRP (JUPITER). Gruppen > 75 år ble ikke analysert separat.
I en nyere meta-analyse som inkluderte data fra Heart Protection Study, men ikke fra AFCAPS-TexCAPS, fant man reduksjon i forekomsten av hjerteinfarkt, men ikke hjerneslag og totaldødelighet (Teng M m.fl. 2015). Gruppen > 75 år ble ikke analysert separat.
På bakgrunn av disse enkeltstudiene og meta-analysene anbefaler vi ikke generell bruk av statiner i primærforebygging hos personer > 75 år, da man har for lite informasjon om fordeler og ulemper ved behandling i denne aldersgruppen. Hos personer i denne aldersgruppen som har flere risikofaktorer og som ikke tidligere har vært behandlet, kan likevel statiner vurderes individuelt. Personer som allerede behandles med statiner bør fortsette med det så lenge toleransen er god og i fravær av andre faktorer som reduserer forventede gevinster.
Ulemper
Studiene viser ingen betydelige forskjeller i statin-relaterte bivirkninger hos eldre sammenliknet med yngre personer (Afilalo J m.fl. 2008, CTT 2010, Roberts CG m.fl. 2007). Gastrointestinale symptomer er vanligste bivirkning hos eldre og er observert hos 49 % på statin mot 40 % på placebo i studiene (p-verdi <0,01), mens muskel-/skjelettplager er observert hos 27 % på statin mot 26 % på placebo (p-verdi <0,01) (Roberts CG m.fl. 2007).
Selv om forskjellen i forekomsten av muskelskjelettplager mellom statin og placebo synes å være liten i randomiserte studier, kan forekomsten av muskel/skjelettplager ved statinbehandling i klinisk praksis være større enn i de kliniske studiene. Observasjoner hos deltakere i studier kan ikke overføres i sin helhet til eldre pasienter i befolkningen. Studiene har ikke inkludert skrøpelige eldre eller pasienter med flere sykdommer (Guyton JR m.fl. 2014). I denne aldersgruppen er risikoen for bivirkninger større og kroppens evne til å omsette legemidler dårligere enn hos yngre. Statiner kan ha sammenheng med en rekke muskelplager som er vanlige hos eldre personer, som myalgier, rhabdomyolyse, nevropatier, problemer med balansen, bløtdelsskader, svakhet og kramper i underekstremiteter (Fleg JL m.fl. 2013, Mansi I m.fl. 2013).
I en randomisert studie blant pasienter med forventet levealder mellom 1 måned og 1 år og nylig funksjonsforverrelse, førte statinseponering til bedre livskvalitet uten økning i hjerte- og karsykdom (Kutner JS m.fl. 2015).
Til tross for uklar etiologi, er statin-relaterte muskel- og nevrologiske plager vanligere ved bruk av høyere doser av statiner hos kvinner og hos personer med lav BMI (Fleg JL m.fl. 2013). I tillegg vil kirurgiske inngrep, redusert lever- eller nyrefunksjon, fettlever, ubehandlet hypothyreose, diabetes og et stort alkoholforbruk øke risikoen (Fleg JL m.fl. 2013).
Personer i høyere aldersgrupper kan være mer følsomme for høye doser statiner enn i de yngre aldersgruppene. I Treat to New Targets studien hadde pasienter > 65 år høyere risiko for uønskede hendelser med atorvastatin 80 mg (8,3 %) enn med 10 mg (5,2 %), en forskjell som ikke ble observert hos yngre pasienter (Wenger NK m.fl. 2007).
Risikoen for utvikling av diabetes med bruk av statiner er omtalt i tidligere kapittel. Hos de eldre må fordelene ved statinbehandling veies opp mot økningen i risiko for diabetes. Sjeldne tilfeller av kognitiv svekkelse ved bruk av statiner er rapportert. Det finnes ikke evidens fra randomiserte studier på at statiner fører til økt risiko for demens eller gir permanent reduksjon i kognitiv funksjon (Guyton JR m.fl. 2014, Richardson K m.fl. 2013). En ny oppsummering fra Cochrane er vurdert av Kunnskapssenteret og konkluderer med at statinbehandling verken forebygger demens eller har noen sikker negativ innvirkning på kognitiv funksjon (McGuinness B m.fl. 2016).
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen vurderes som lav, da få studier rapporterer spesifikke data for personer over 75 år
Verdier og preferanser
Ut fra dokumentert effekt mot sykelighet og død vil personer med kjent hjerte- og karsykdom eller økt risiko for slik sykdom ha en forventet egeninteresse av forebyggende behandling, som fremstår som større jo høyere den absolutte risikoen er. For personer som føler seg helt friske og er lite opptatt av fremtidig risiko, kan nytteverdien likevel synes liten, særlig dersom behandlingen er assosiert med bivirkninger. Hos eldre over 75 år vil nivået av risiko som regel være såpass høyt at den absolutte risikoreduksjon blir god, men samtidig er forekomsten av bivirkninger, også de mer alvorlige, høyere. Effekten på vunne leveår er også mer begrenset i høy alder, til dels grunnet høy forekomst av andre sykdommer og dødsårsaker. For mange vil redusert risiko for hjerneslag, symptomgivende koronarsykdom og eventuell sekundær utvikling av symptomatisk hjertesvikt likevel representere viktige helsegevinster som også eldre personer bør ha tilgang til. For personer med nedsatt helsetilstand, reduserte leveutsikter og uttalt polyfarmasi kan likevel statinbehandling fortone seg som en belastning med beskjeden nytte. Det anbefales da at det hos eldre gjøres en løpende vurdering av pasientens generelle helsetilstand, av forventet nytte og mulige ulemper ved behandlingen, og hvor pasientens preferanser i størst mulig grad tas hensyn til.
Referanser
241. Afilalo J, Duque G, Steele R, et al. Statins for secondary prevention in elderly patients. J Am Coll Cardiol 2008; 51: 37-45 https://www.helsedirektoratet.no/referanse/0002-0013-177904
242. Bhardwaj S, Selvarajah S, Schneider EB. Muscular effects of statins in the elderly female: a review. Clinical Interventions in Aging 2013; 8: 47-59 https://www.helsedirektoratet.no/referanse/0002-0013-177905
243. Cholesterol Treatment Trialists (CTT) Collaboration. Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, Peto R, Barnes EH, Keech A, Simes J, Collins R. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376: 1670-1681 https://www.helsedirektoratet.no/referanse/0002-0013-177906
244. Deedwania P, Stone PH, Merz NB et al. Effects of intensive versus moderate lipid-lowering therapy on myocardial ischemia in older patients with coronary heart disease. Circulation 2007; 115: 700-7 https://www.helsedirektoratet.no/referanse/0002-0013-177907
245. Fleg JL, Forman DE, Berra K, et al. Secondary prevention of atherosclerotic cardiovascular disease in older adults. Circulation 2013; 128: 2422-46 https://www.helsedirektoratet.no/referanse/0002-0013-177908
246. Glynn RJ, Koenig W, Nordestgaard BG, et al. Rosuvastatin for primary prevention in older persons with elevated C-reative protein and low to average low-density lipoprotien cholesterol levels: exploratory analysis of a randomized trial. Ann Intern Med 2010; 152: 488-96 https://www.helsedirektoratet.no/referanse/0002-0013-177909
247. Guyton JR, Bays HE, Grundy SM, Jacobson TA. An assessment by the Statin Intolerance Panel: 2014 update. J Clin Lipidol 2014; 8: S72-S81 https://www.helsedirektoratet.no/referanse/0002-0013-177910
248. Heart Protection Study Collaborative Group. The effects of cholesterol lowering with simvastatin on cause-specific mortality and on cancer incidence in 20,536 high-risk people: a randomised placebo-controlled trial. BMC Med 2005; 3: 6 https://www.helsedirektoratet.no/referanse/0002-0013-177911
249. Kutner JS, Blatchford PJ, Taylor DH Jr, et al. Safety and benefit of discontinuing statin therapy in the setting of advanced, life-limiting illness: a randomized clinial trial. JAMA Intern Med 2015; 175: 691-700 https://www.helsedirektoratet.no/referanse/0002-0013-177912
250. Mansi I, Frei CR, Pugh MJ et al. Statins and musculoskeletal conditions, arthropathies, and injuries. JAMA Intern Med 2013; 173: 1-10 https://www.helsedirektoratet.no/referanse/0002-0013-177913
251. McGuinness B, Craig D, Bullock R, Passmore P. Statins for the McGuinness B, Craig D, Bullock R, Passmore P. Statins for the prevention of dementia. Cochrane Database of Systematic Reviews 2016, Issue 1. Art. No.: CD003160 https://www.helsedirektoratet.no/referanse/0002-0013-177914
252. Odden MC, Pletcher MJ, Coxson PG, et al. Cost-effectiveness and population impact of statins for primary prevention in adults aged 75 years of older in the United States. Ann Intern Med 2015; 162: 533-41 https://www.helsedirektoratet.no/referanse/0002-0013-177915
253. Olsson AG, Schwartz GG, Szarek M et al. Effects of high-dose atorvastatin in patients >65 years of age with acute coronary syndrome (from the Myocardial Ischemia Reduction with Aggressive Cholesterol lowering (MIRACL) Study. Am J Cardiol 2007; 99: 632-5 https://www.helsedirektoratet.no/referanse/0002-0013-177916
254. Richardson K, Schoen M, French B et al. Statins and cognitive function: a systematic review. Ann Intern Med 2013; 159: 688-97 https://www.helsedirektoratet.no/referanse/0002-0013-177917
255. Roberts CG, Gaullar E, Rodriquez A. Efficacy and safety of statin monotherapy in older adults: a meta-analysis. J Gerontol A Biol Sci Med Sci 2007; 62: 879-87 https://www.helsedirektoratet.no/referanse/0002-0013-177918
256. Savarese G, Gotto AM, Jr., Paolillo S, et al. Benefits of statins in elderly subjects without established cardiovascular disease. J Am Coll Cardiol 2013; 62: 2090-9 https://www.helsedirektoratet.no/referanse/0002-0013-177919
257. Savarese G, Perrone-Filardi P. Reply: benefits of statins in healthy elderly subjects: what is the number needed to treat? J Am Coll Cardiol 2014; 63: 2303 https://www.helsedirektoratet.no/referanse/0002-0013-177920
258. Shepherd J, Blauw GJ, Murphy MB et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet 2002; 360: 1623-30 https://www.helsedirektoratet.no/referanse/0002-0013-177921
259. Teng M, Lin L, Zhao YJ, et al. Statins for Primary Prevention of Cardiovascular Disease in Elderly Patients: Systematic Review and Meta-Analysis. Drugs Aging. 2015; 32(8): 649-61 https://www.helsedirektoratet.no/referanse/0002-0013-177922
260. Wenger NK, Lewis SJ, Herrington DM et al. Outcome of using high- or low-dose atorvastatin in patients 65 years of age or older with stable coronary heart disease. Ann Intern Med 2007; 147: 1-9 https://www.helsedirektoratet.no/referanse/0002-0013-177923
261. Yan YL, Qui B, Hu LJ et al. Efficacy and safety evaluation of intensive statin therapy in older patients with coronary heart disease. A systematic review and meta-analysis. Eur J Clin Pharmacol 2013; 69: 2001-9 https://www.helsedirektoratet.no/referanse/0002-0013-177924
Blodtrykksbehandling med legemidler hos eldre > 75 år
- Blodtrykksbehandling hos eldre (>75 år) må baseres på en individuell klinisk vurdering av nytte og risiko, der særskilt hensyn tas til risiko for alvorlige bivirkninger, ortostatisk hypotensjon og fall.
- Reduksjon eller avslutning av pågående blodtrykksbehandling bør vurderes når det foreligger annen sykdom som reduserer forventet nytte av behandlingen, f.eks. kreftsykdom, underernæring, alvorlig organsvikt eller alvorlig demens.
- Behandlingsmål for personer >80 år er blodtrykk < 150/90 mmHg. Vær oppmerksom på at forekomst av stive kar hos eldre kan gi en form for pseudohypertensjon, som ikke krever blodtrykksbehandling. Grundig kartlegging og fravær av organskade kan vise at behandling er unødvendig.
Praktisk – slik kan anbefalingen følges
Blodtrykksbehandling hos eldre bør igangsettes etter tilsvarende utredning som hos yngre, og med utstrakt bruk av 24-timers målinger for å sikre diagnosen. I høyere alder er systolisk blodtrykk dominerende som risikofaktor og som mål for behandlingen. Hos de eldre er det spesielt viktig med legekontroll minimum én gang i året. Legemiddelgjennomgang er viktig. Hvert enkelt medikament må vurderes i forhold til mulige bivirkninger og interaksjoner, og om det fortsatt er medisinsk grunn til å bruke legemiddelet. Dersom pasienten er bruker av hjemmetjenesten, kan mulige bivirkninger, funksjonsnivå (ADL) og naturlige funksjoner med fordel kartlegges av hjemmetjenesten før legetimen. Blodprøver inkludert nyrefunksjonsprøver og elektrolytter samt vekt bør være tatt i forkant av legemiddelgjennomgangen.
Det er viktig at blodtrykket måles både sittende og stående etter 1 minutt og etter 3 minutter for å avdekke ortostatisk hypotensjon.
Spesielle forhold vedrørende blodtrykksmedisiner hos eldre
- ACE-hemmer og Angiotensin II antagonister medfører økt risiko for nedsatt nyrefunksjon og hyperkalemi.
- Betablokkere kan gi nedsatt kontraktilitet, nedsatt kardial ledningsevne, mild sedasjon og ortostatisk hypotensjon. Betablokkere kan også medføre bradykardi, hjertesvikt, forvirring og fall.
- Diuretika i for høye doser kan medføre betydelig dehydrering, forstoppelse, hypotensjon og fall.
Begrunnelse – dette er anbefalingen basert på
Med eldre menes i denne sammenheng personer som er 75 år eller eldre. Mange i denne aldersgruppen er friske og klarer seg selv uten hjelp fra andre. Likevel er forekomst av alvorlig sykdom og funksjonsnedsettelse vesentlig høyere enn i befolkningen ellers. Særlig gjelder dette i aldersgruppen over 80 år. Forebyggende behandling må ta hensyn til at pasienten ofte har andre sykdommer(komorbiditet) og annen medikamentell behandling (polyfarmasi). Hos eldre over 80 år er kroppens evne til å omsette legemidler dårligere og risikoen for bivirkninger større. Dosering av medikamenter må derfor avpasses nøye. Forkalkning og stivhet i arteriene er vanlig hos eldre, og utredning og vurdering av behandlingsindikasjon må ta hensyn til dette. På bakgrunn av de spesielle forholdene hos eldre, har vi derfor egen anbefaling om vurderinger av slik blodtrykksbehandling.
Vurdering
Fordeler og ulemper
Blodtrykksbehandling hos friske eldre
Den eneste større studien som omfatter eldre over 80 år, er HYVET-studien (Beckett NS m.fl. 2008 ). Dette var en placebokontrollert randomisert studie som omfattet 3845 pasienter 80 år eller eldre og hadde systolisk blodtrykk (SBT) > 160 mmHg. Bare 12% hadde kardiovaskulær sykdom ved oppstart. Studiemedikamentene var indapamid, et tiazid-liknende diuretikum, med eventuelt tillegg av ACE-hemmer som ble gitt til om lag halvparten av pasientene. Gjennomsnittlig blodtrykksreduksjon i intervensjonsgruppen var 15/6 mmHg sammenliknet med placebogruppen. Observasjonstiden var 1,8 år, og ble avbrutt etter den 2. planlagte interimanalysen grunnet klar gunstig effekt av behandlingen med reduksjon av total død og tegn til reduksjon av det primære endepunktet som var alle typer hjerneslag. Resultatene for de ulike endepunkter (Hazard ratio (HR) med 95 % konfidensintervall (KI) for aktiv behandling versus placebo var: for total dødelighet: HR 0,79 (95 % KI 0,65-0,95); død av hjertesykdom: HR 0,77 (95 % KI 0,60-1,01); hjerneslag HR 0,70 (95 % KI 0,49-1,01); hjertesvikt HR 0,36 (95 % KI 0,22-58).
Blodtrykksvurdering hos eldre med annen sykdom
Blodtrykksbehandling må ses i sammenheng med samtidig behandling for hjerte- og karsykdommer som hjertesvikt, atrieflimmer og klaffefeil, og ta hensyn til faktorer som nyresykdom, lungesykdom etc. Blodtrykksbehandlingen bør gis som vanlig, men hensyntaking til relevante interaksjoner og prognose.
Behandling hos skrøpelige eldre med alvorlig nedsatt helse og begrensede leveutsikter
Epidemiologiske observasjonsstudier har vist svakere sammenheng mellom blodtrykk og død av hjerneslag hos personer over 80 år (Lawes CMM m.fl. 2004). Funnene tyder på at selv om hyppigheten av hjerneslag synker med lavere blodtrykk, øker dødsfall av andre årsaker. Dette kan skyldes at det hos skrøpelig eldre er økt risiko for bivirkninger av behandlingen eller at andre sykdommer (kreft, infeksjoner, demens, hjertesvikt) er assosiert med lavere blodtrykk (Rastas S m.fl. 2006).
En nylig meta-analyse av blodtrykksbehandling hos eldre viste signifikant reduksjon av total dødelighet, hjerte- og kardødelighet, hjerneslag og hjertesvikt, men de fleste av studiene i meta-analysen omfattet personer i aldersgruppen 65-79 år, og resultatene kan derfor ikke uten videre overføres til personer over 80 år (Briasoulis A m.fl. 2014). Denne meta-analysen viste også at det ikke gir redusert dødelighet eller sykelighet å senke systolisk blodtrykk til lavere enn 150 mm Hg.
Kvalitet på dokumentasjonen
Kvalitet på dokumentasjon vurderes som lav.
Verdier og preferanser
Personer med kjent hjerte- og karsykdom eller økt risiko for slik sykdom forventes å ha egeninteresse av forebyggende behandling. Hos friske eldre kan nytteverdien likevel synes liten, særlig dersom behandlingen er assosiert med bivirkninger. Hos eldre over 75 år vil nivået av risiko som regel være såpass høyt at den absolutte risikoreduksjon blir god, men samtidig er forekomsten av bivirkninger høyere. Dette gjelder særlig ortostatisk hypotensjon og falltendens. For mange vil redusert risiko for hjerneslag, symptomgivende koronarsykdom og eventuell sekundær utvikling av symptomatisk hjertesvikt likevel representere viktige helsegevinster. For personer med nedsatt helsetilstand, reduserte leveutsikter og uttalt polyfarmasi kan likevel blodtrykksbehandling fortone seg som en belastning med beskjeden nytte. Det anbefales da at det hos eldre gjøres en løpende vurdering av pasientens generelle helsetilstand av forventet nytte og mulige ulemper ved behandlingen.
Referanser
262. Beckett NS, Peters R, Fletcher AE, Staessen JA, Liu L, Dumitrascu D, et al. Treatment of Hypertension in Patients 80 Years of Age or Older. N Engl J Med. 2008 May 1;358(18):1887-98 https://www.helsedirektoratet.no/referanse/0002-0013-177925
263. Briasoulis A, Agarwal V, Tousoulis D, Stefanadis C. Effects of antihypertensive treatment in patients over 65 years of age: a meta-analysis of randomised controlled studies. Heart 2014 Feb;100(4):317-23.New England Journal of Medicine 2008 May 1;358(18):1887-98 https://www.helsedirektoratet.no/referanse/0002-0013-177926
264. Lawes CMM, Bennett DA, Feigin VL, Rodgers A. Blood Pressure and Stroke: An Overview of Published Reviews. Stroke 2004 Mar 1;35(3):776-85 https://www.helsedirektoratet.no/referanse/0002-0013-177927
265. Rastas S, Pirttil T, Viramo P, Verkkoniemi A, Halonen P, Juva K, et al. Association Between Blood Pressure and Survival over 9 Years in a General Population Aged 85 and Older. Journal of the American Geriatrics Society 2006 Jun 1;54(6):912-8 https://www.helsedirektoratet.no/referanse/0002-0013-177928
Sist faglig oppdatert: 05.03.2018
Oppfølging og mål for kontroll ved forebygging av hjerte- og karsykdom
Oppfølgning og mål for kontroll ved forebygging av hjerte- og karsykdom
- Fastlegen bør tilby oppfølging til pasienter hvor utredning har avdekket indikasjon for tiltak på grunn av hypertensjon, forhøyet kolesterol, forhøyet NORRISK 2 score, og ved kjent hjerte- og karsykdom.
- Livsstilsendring er sentralt både ved primær og sekundærforebygging, og bør følges opp med fornyet vurdering etter 3-12 måneder med tanke på mulig behov for forsterkede tiltak inkludert intervensjon med legemidler.
- Ved behandling med legemidler anbefales legekontroll minimum én gang i året.
- Kontroller bør inkludere gjennomgang av de viktigste kardiovaskulære risikofaktorer og evaluere i hvilken grad behandlingsmål er oppnådd. Tilbud om influensavaksine er også aktuelt for flere pasientgrupper.
- Behandlingsmålene bør tilstrebes dersom de kan oppnås uten plagsomme bivirkninger og med pasientens medvirkning og aksept.
Praktisk – slik kan anbefalingen følges
Forslag til årskontroll:
Anamnese: Spør om symptomer på hjerte- og karsykdom, eventuelt forverring av kjent hjerte- og karsykdom så som brystsmerter, ødemer eller tung pust, og om pasienten har merket endring i fysisk yteevne. Undersøk om pasienten tar medisinene som foreskrevet og om det er subjektive bivirkninger (spør spesifikt avhengig av de legemidler som gis).- Kartlegging av livsstil bør inkludere røykestatus, bruk av alkohol, kosthold og fysisk aktivitet.
- Klinisk undersøkelse: Måling av blodtrykk og puls (vurder tegn til uregelmessighet, ev. nyoppstått atrieflimmer), vekt, evt. livvidde. Undersøkelse av bena og føttene (ødemer, blodsirkulasjon) og hjerte-/lunge auskultasjon ut fra klinikk og anamnese.
Blodprøver: Bør helst tas en uke før legetimen slik at svarene foreligger under konsultasjonen.
Alle: Totalkolesterol, LDL-kolesterol, kreatinin, elektrolytter, hemoglobin, og HDL-kolesterol og triglyserider ved dyslipidemier.
Avhengig av behandling og indikasjon anbefales i tillegg følgende prøver:
- Alat; ved muskelsymptomer også kreatin kinase (CK), ved statinbehandling.
- Urinsyre; ved diuretikabehandling, arthrittsymptomer.
- HbA1c, u-acr/mikroalbumin, TSH, EKG; ut fra tilstand og symptomer. Se ellers egne retningslinjer om rutineprøver ved diabetes (Nasjonal faglig retningslinje for diabetes)
Vurdering og tiltak: Diskuter behandlingsmålene og eventuelle nye tiltak med pasienten.
- Er pasienten tilfredsstillende behandlet i forhold til relevante behandlingsmål?
- Er det behov for andre eller intensiverte livsstilsendringer?
- Er det behov for endring av legemiddelbehandlingen?
- Har pasienten symptomer eller funn som tilsier nye utredninger? Vurder for eksempel behov for måling av 24-timers blodtrykk.
Blodtrykk:
Behandlingsmål for blodtrykk : kontortrykk BT <140/90 mmHg, ved hjemmemåling <135/85 mmHg, og ved 24 t BT døgnverdi <130/80 mmHg og nattverdi <120/70 mmHg.
For eldre pasienter (> 80 år) er behandlingsmålet < 150 mmHg for systolisk blodtrykk, med anbefalt intervall 140-150.
Lipider:
I primærforebygging er det ikke definert klare behandlingsmål for totalkolesterol eller LDL-kolesterol, men atorvastatin 20 mg x 1 er anbefalt som startdose og vil som regel gi tilfredsstillende effekt. En reduksjon i LDL-kolesterol på 30-40 % eller til under 3,0 mmol/l vil ellers være tilstrekkelig til å gi god risikoreduksjon hos de fleste.
Ved diabetes anbefales imidlertid et behandlingsmål < 2,5 mmol/l for LDL-kolesterol. Ved etablert hjerte- og karsykdom vil LDL-kolesterol < 1,8 mmol/l være veiledende behandlingsmål.
Resepter skrives fram til neste avtalte kontroll. Tilby pasienten innkalling eller timeavtale. En tverrfaglig medisingjennomgang i kommunehelsetjenesten med bl.a. farmasøyt og hjemmesykepleier kan være nyttig når pasienten har flere tilstander og omfattende legemiddelbruk.
Begrunnelse – dette er anbefalingen basert på
Effekten av forebygging av hjerte- og karsykdom er godt dokumentert både i primær- og sekundærforebygging, men forutsetter oppfølging og kontroll. Både livsstilsendringer som røykeslutt, kostendringer, fysisk aktivitet og behandlingsetterlevelse vil kunne bedres ved adekvat oppfølging. Manglende legemiddeletterlevelse er dokumentert assosiert med betydelig dårligere prognose. Oppfølging som tar hensyn til pasientens totalsituasjon, bivirkninger og forståelse av behandlingsnytten, vil kunne bedre etterlevelse og egeninnsats slik at det oppnås redusert sykdomsbelastning.
Vurdering
Fordeler og ulemper
Fordeler
Hjerte- og karsykdom forebygges når risikofaktorene reduseres, og oppfølging og kontroll vil optimalisere risikonivåene. Aktiv oppfølgning hos fastlegen er viktig for å få til røykeslutt og oppnå blodtrykkskontroll og kolesterolreduksjon, slik dette er vist ved definerte oppfølgingsprogrammer (Avanzini F m.fl. 2015). Såkalt minimal intervensjon fra allmennlege kan doble muligheten for røykeslutt (Stead LF m.fl. 2013). Se også Nasjonal faglig retningslinje for røykeavvenning. Mer intensivert behandling og oppfølging øker sjansen for røykeslutt ytterligere.
I primærforebygging er det viktig at pasientene får nok informasjon til å ta gode beslutninger sammen med fastlegen om blant annet legemiddelbehandling (WHO-2003). Det er behov for faste avtaler for oppfølging og kontroll fordi mange ellers slutter med legemidler eller bruker legemidler på feil måte (Chowdry R m.fl. 2013). Det er også behov for jevnlige kontroller for å fange opp symptomer på utvikling av hjerte- og karsykdom eller bivirkninger av behandlingen. Personer som avbryter blodtrykksenkende behandling og/eller forebyggende behandling med statiner, har dårligere prognose sammenliknet med de som kontinuerer behandlingen.
I en metaanalyse av 44 studier mednær 2 millioner deltakere, 135627 kardiovaskulære hendelser og 94126 dødsfall, fant man at kun ca. 60 % av deltakerne hadde god legemiddeletterlevelse, definert som å ta mer enn 80 % av foreskrevet medikasjon (Chowdry R m.fl. 2013). Den relative risiko (RR) for kardiovaskulær sykdom (hendelse) ved god etterlevelse versus dårlig etterlevelse var 0,85 (95 % konfidensintervall (KI) 0,81-0,89) vedrørende statiner og 0,81 (95 % KI 0,76-0,86) for blodtrykksregulerende midler. Tilsvarende risiko for total dødelighet var 0,55 (95 % KI 0,46-0,67) for statiner og 0,71 (95 % KI 0,64-0,78) for blodtrykksbehandling. Effekten var lik for de ulike pasientgruppene som ble studert, og beregninger tyder på at 9 % av alle kardiovaskulære hendelser i Europa kan tilskrives dårlig etterlevelse av legemiddelbehandling.
Studier har vist at personer som i liten grad tar blodtrykksreduserende legemidler regelmessig, også har mindre regelmessig bruk av statiner (Muntner P m.fl. 2014), hvilket gjør denne gruppen spesielt utsatt for kardiovaskulære hendelser.
I følge en WHO-rapport er etterlevelse for blodtrykkssenkende legemidler avhengig bl.a. av en rekke faktorer:
- sosioøkonomiske faktorer,
- faktorer knyttet til forholdet mellom pasient og helsearbeidere (legen),
- faktorer ved selve tilstanden, terapirelaterte faktorer (doseringsregime, bivirkninger),
- pasientrelaterte faktorer som inkluderer forståelsen av egen tilstand og risiko og egen deltakelse behandling og oppfølging av tilstanden (WHO report 2003).
Ved å justere eller endre legemidler som er dårlig tolerert, har legen muligheter til å bedre etterlevelse av behandlingen.
I en nylig publisert norsk studie fra tredjelinje helsetjeneste var manglende etterlevelse av legemiddelbehandlingen årsak til terapiresistent hypertensjon i 1/3 av tilfellene (Heimark S m.fl 2016). Måling av legemiddelkonsentrasjon i blodet er en av metodene som kan benyttes for å bedre etterlevelsen (Eskås m.fl. 2016).
Ulemper
Ulempen med oppfølging og kontroll av kan være at personer med få eller ingen symptomer føler seg sykeliggjort, og de kan føle mindre ansvar for egne valg. Behandlingen og oppfølgingen vil ha noen kostnader for pasienten, både i forhold til kjøp av legemidler, betaling for konsultasjoner og med tanke på avsatt tid til undersøkelser og kontroll. Bivirkninger av behandlingen kan være betydelige, men varierer både individuelt og i henhold til klasse av legemidler (Elliot WJ 2009).
For pasienter som ikke når behandlingsmål, kan det være belastende å konfronteres med dette og det er viktig å ha et balansert forhold til enkeltmål i oppfølgingen (Muth C m.fl. 2016).
Strenge behandlingsmål har kostnader også i primærhelsetjenesten i form av hyppigere kontroller, mer ressursbruk og høyere andel som dropper ut av behandlingen (Mant J m.fl. 2016).
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen vurderes som svak.
Det finnes flere studier som viser effekt av oppfølging på intermediære endepunkter som blodtrykk, lipidverdier og røykeslutt, men resultatene er ofte moderate og mange pasienter når ikke behandlingsmålene (Avanzini Eur J Prev Cardiol 2015, Kotzeva Eur J Prev Cardiol 2015).
Det mangler store randomiserte studier på f. eks. tett oppfølging versus mindre tett oppfølging.
Anbefalinger vedrørende hyppighet og innhold i kontroller er derfor også basert på erfaring og konsensus.
Verdier og preferanser
Oppfølgning og kontroll av behandling vurderes å forbedre kvaliteten på behandlingen og redusere risiko for hjerte/kar sykdom. Hjelp til livsstilsendring som røykeslutt, økt fysisk aktivitet og forbedret kosthold vurderes å ha helsefremmende effekter generelt og redusere risiko også for andre alvorlige sykdommer.
Oppfølgingen kan tilpasses individuelle behov og preferanser, og bedre grunnlaget for felles beslutninger i lege-pasientforholdet (samvalg).
Referanser
266. ADHERENCE TO LONG-TERM THERAPIES Evidence for action- World Health Organization 2003 WHO Library Cataloguing-in-Publication. ISBN 92 4 154599 2 (NLM classification:W 85) © World Health Organization 2003 https://www.helsedirektoratet.no/referanse/0002-0013-177929
267. Avanzini F, Marzona I, Baviera M, et al. Improving cardiovascular prevention in general practice: Results of a comprehensive personalized strategy in subjects at high risk. Eur J Prev Cardiol. 2015 Nov 2. pii: 2047487315613664. [Epub ahead of print] https://www.helsedirektoratet.no/referanse/0002-0013-177930
268. Barfoed BL, Jarbøl DE, Paulsen, MS, et al. GPs' Perceptions of Cardiovascular Risk and Views on Patient Compliance: A Qualitative Interview Study. Int J Family Med. 2015; 2015: 214146. Published online https://www.helsedirektoratet.no/referanse/0002-0013-177931
269. Elliott WJ. Improving outcomes in hypertensive patients: focus on adherence and persistence with antihypertensive therapy. J Clin Hypertens (Greenwich). 2009; 11(7): 376-82 https://www.helsedirektoratet.no/referanse/0002-0013-177932
270. Eskås PA, Heimark S, Eek Mariampillai J, Larstorp AC, Fadl Elmula FE, Høieggen A. Adherence to medication and drug monitoring in apparent treatment-resistant hypertension. Blood Press. 2016 Jan 5:1-7. [Epub ahead of print] https://www.helsedirektoratet.no/referanse/0002-0013-177933
271. Heimark S, Eskås PA, Mariampillai JE, Larstorp AC, Høieggen A, Fadl Elmula FE. Tertiary work-up of apparent treatment-resistant hypertension. Blood Press. 2016 Apr 28:1-7. [Epub ahead of print] https://www.helsedirektoratet.no/referanse/0002-0013-177934
272. Stead LF, Buitrago D, Preciado N, Sanchez G, Hartmann-Boyce J, Lancaster T. Physician advice for smoking cessation. Cochrane Database of Systematic Reviews. 2013;5:CD000165 https://www.helsedirektoratet.no/referanse/0002-0013-177935
273. Mant J, McManus RJ, Roalfe A et al. Different systolic blood pressure targets for people with history of stroke or transient ischaemic attack: PAST-BP (Prevention After Stroke-Blood Pressure) randomised controlled trial. BMJ. 2016; 352: i708 https://www.helsedirektoratet.no/referanse/0002-0013-177936
274. McConnachie A, Walker A, Robertson M et al. Long-term impact on healthcare Resource utilization of statin treatment, and its cost effectiveness in the primary prevention of cardiovascular disease: a record linkage study. Eur Heart J 2014; 35: 290–298 https://www.helsedirektoratet.no/referanse/0002-0013-177937
275. Moran AE, Odden MC, Thanataveerat A et al. Cost-effectiveness of hypertension therapy according to 2014 guidelines. N Engl J Med 2015; 372: 447-55 https://www.helsedirektoratet.no/referanse/0002-0013-177938
276. Muntner P, Yun H, Sharma P, et al. Ability of low antihypertensive medication adherence to predict statin discontinuation and low statin adherence in patients initiating treatment after a coronary event. Am J Cardiol. 2014; 114: 826-31 https://www.helsedirektoratet.no/referanse/0002-0013-177939
277. Muth C, van den Akker M, Glasziou PP. Blood pressure targets in primary care. BMJ. 2016; 352: i813 https://www.helsedirektoratet.no/referanse/0002-0013-177940
278. Naderi SH1, Bestwick JP, Wald DS. Adherence to drugs that prevent cardiovascular disease: meta-analysis on 376,162 patients. Am J Med. 2012; 125: 882-7.e1 https://www.helsedirektoratet.no/referanse/0002-0013-177941
279. Sheppard JP, Fletcher K, McManus RJ, Mant J. Missed opportunities in prevention of cardiovascular disease in primary care: a cross-sectional study.Br J Gen Pract. 2014; 64(618): e38-46 https://www.helsedirektoratet.no/referanse/0002-0013-177942
233. Chowdhury R, Khan H, Heydon E, et al. Adherence to cardiovascular therapy: a meta-analysis of prevalence and clinical consequences. Eur Heart J. 2013 Oct; 34(38): 2940-8 https://www.helsedirektoratet.no/referanse/0002-0013-177896
234. Kotseva K, Woods D, DeBacquer D et al. EUROASPIRE IV: A European Society of Cardiology survey on the lifestyle, risk factor and therapeutic management of coronary patients from 24 European countries. Eur JPrev Cardiol; 2016 Apr 23 (&); 636-438 https://www.helsedirektoratet.no/referanse/0002-0013-177897
Sist faglig oppdatert: 05.03.2018
Metode og prosess
Sist faglig oppdatert: 05.03.2018
Mandatet for dette retningslinjeprosjektet er del av et større oppdrag fra Helse- og omsorgsdepartementet som omhandler NCD (non-communicable diseases)-strategien 2013-2017 (forebygging, diagnostisering, behandling og rehabilitering av fire ikke-smittsomme folkesykdommer; hjerte- og karsykdommer, diabetes, kols og kreft).
Strategien har et overordnet mål om at man i Norge skal redusere for tidlig død av hjerte- og karsykdommer, diabetes, kroniske lungesykdommer og kreft med 25 prosent innen 2025. Oppdaterte retningslinjer for forebygging av hjerte- og karsykdom inngår som en del av dette arbeidet.
I 2009 ble Nasjonal faglig retningslinje for individuell primærforebygging av hjerte- og karsykdommer utgitt av Helsedirektoratet. Det har tilkommet ny og vesentlig kunnskap på området, og den reviderte versjonen foreligger nå. Denne gangen er også anbefalinger om hovedelementer i sekundærforebygging inkludert.
Omfang og målgrupper
Retningslinjen gir kliniske, praktiske anbefalinger/råd om utredning, behandling og veiledning for de vanligste tilstandene innen forebygging av hjerte- og karsykdom. Når det gjelder sekundærforebygging, omtales de viktigste generelle tiltak som anbefales etter påvist koronarsykdom, perifer aterosklerose eller hjerneslag. Omtalen er imidlertid begrenset til de generelle sekundærforebyggende tiltak i stabil fase som har til hensikt å bremse videre ateroskleroseutvikling og komplikasjoner. Mer spesifikk behandling av hjerneslag, hjerteinfarkt eller perifer karsykdom omtales ikke. Forebyggende tiltak ved hjerteklaffefeil, hjertearytmier eller tromboembolisk sykdom er heller ikke omtalt. Man viser da til egne retningslinjer og veiledere for disse tilstandene.
Målgruppen er fastleger, andre leger, sykepleiere, fysioterapeuter og annet autorisert helsepersonell som arbeider med forebygging og rehabilitering, samt personer med økt risiko for hjerte- og karsykdom. Retningslinjen kan også være nyttig for pasienter og deres pårørende.
Anbefalingenes rettslige betydning
Helsedirektoratet skal utvikle, formidle og vedlikeholde nasjonale faglige retningslinjer og veiledere som understøtter de mål som er satt for helse- og omsorgstjenesten. Retningslinjer og veiledere skal baseres på kunnskap om god praksis og skal bidra til kontinuerlig forbedring av virksomhet og tjenester jf. spesialisthelsetjenesteloven § 7-3 og helse- og omsorgstjenesteloven § 12-5.
Det er viktig å påpeke at retningslinjer er normerende dokumenter og at helsepersonell må vise faglig skjønn i vurderingen av hver enkelt pasient for å ta hensyn til individuelle behov. Helsepersonelloven er overordnet retningslinjen hvis det oppstår konflikt i en konkret situasjon. I situasjoner der helsepersonell velger løsninger som i vesentlig grad avviker fra gitte anbefalinger skal dette dokumenteres (jf. journalforskriften § 8, bokstav h.) En bør være forberedt på å begrunne sine valg i eventuelle klagesaker eller ved tilsyn.
Metode og kunnskapsgrunnlag
Det ble besluttet å revidere retningslinjen høsten 2014, og den nedsatte arbeidsgruppen startet da arbeidet med revisjon. Gruppen har hatt arbeidsmøter 5 ganger høsten 2014, 11 møter i 2015 , 5 møter våren 2016.og 4 møter i 2017.
Helsedirektoratet har basert seg på å revidere retningslinjene på basis av
1) Tidligere litteraturgjennomgang som ble gjort av nasjonalt kunnskapssenter for helsetjenesten for tilsvarende nasjonal faglig retningslinje i 2009. Denne kunnskapsoppsummeringen frembrakte gode estimater for effekter av så vel blodtrykksbehandling, behandling med lipidsenkende legemidler (statiner) og platehemmere (acetylsalicylsyre) anvendt i primærforebyggende øyemed, og det har kommet få nye og viktige studier på disse feltene i perioden som har gått. Fremfor en total gjennomgang av tidligere og nytilkommet litteratur, har arbeidsgruppen tatt utgangspunkt i anbefalingene fra 2009-retningslinjen, og gjort oppdatering og justering av disse på basis av rettede litteratursøk for nyere studier på disse områdene.
2) Oppdatering og utvidelse av faglig innhold basert på nyere internasjonale retningslinjer innen primær- og sekundærforebygging av hjerte- og karsykdom. Vi har først og fremst støttet oss på europeiske retningslinjer (ESC/ESH), britiske retningslinjer (NICE og Joint British Societies' Consensus Recommendations) og amerikanske retningslinjer (AHA/ACC/ACCF/NHLBLI). De viktigste referansene er nevnt nedenfor.
3) Ikke-systematiske litteratursøk, vesentlig gjennom PubMed, er brukt for å fange opp nyere relevante studier og metaanalyser. Innhentingen av de viktigste aktuelle arbeider har også i noen grad vært sikret av arbeidsgruppens samlede kompetanse innen fagområdene. Tilsvarende litteratursøk er utført for dokumentasjon vedrørende områder som er mindre dekket i øvrige retningslinjer, som verdier og preferanser.
4) For temaet forebygging med legemidler hos eldre (lipidsenkende, blodplatehemmende og blodtrykksenkende legemidler), er det ved hjelp av biblioteket i Helsedirektoratet utført systematiske litteratursøk. Disse ble utført februar 2015. Det ble definert 3 ulike søk, alle for populasjonen eldre over 70 år, men separat for acetylsalicylsyre, blodtrykksbehandling og statiner, og med ingen behandling som sammenlikning.
5) Anbefalingene vedrørende kosthold, fysisk aktivitet og røykeslutt er i stor grad basert på tidligere utgitte retningslinjer fra Helsedirektoratet, og mer utfyllende informasjon kan da oftest finnes i disse publikasjonene. Omtalen nå har hatt som mål å formidle kortfattet og oppdatert viten, særlig der eksisterende veiledere har blitt noen år gamle. Videre har vi søkt å fokusere på viten som er relevant spesifikt for forebygging av hjerte- og karsykdom, noe som betyr mest i sammenheng med sekundærforebygging.
Viktigste referanser
1. Norheim OF, Gjelsvik B, Kjeldsen SE, et al. Retningslinjer for individuell primærforebygging av hjerte- og karsykdommer. Oslo: Helsedirektoratet, 2009. IS-1550
2..Editors. National Clinical Guideline Centre (UK). Lipid Modification: Cardiovascular Risk Assessment and the Modification of Blood Lipids for the Primary and Secondary Prevention of Cardiovascular Disease. London (UK): National Institute for Health and Care Excellence, 2014.
3. Stone NJ, Robinson JG, Lichtenstein AH et al. American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014; 63 (25 Pt B): 2889-934.
4. NICE guidelines [CG172] Published date: November 2013. Myocardial infarction: cardiac rehabilitation and prevention of further MI ISBN: 978-1-4731-0354-2
5. Kernan WN, Ovbiagele B, Black HR et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack. Stroke 2014; 45: 2160-236.
6. Anderson JL, Halperin JL, Albert NM et al. Management of patients with peripheral artery disease (Compilation of 2005 and 2011 ACCF/AHA guideline recommendations). A report from the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. Circulation 2013; 127: 1425-43.
7. Smith SC Jr, Benjamin EJ, Bonow RO et al. AHA/ACCF secondary prevention and risk reduction therapy for patients with coronary and other atherosclerotic vascular disease: 2011 update: a guideline from the American Heart Association and American College of Cardiology Foundation. Circulation 2011; 124: 2458-73.
8. Perk J, De Backer G, Gohlke H et al. European guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Eur Heart J 2012; 33: 1635-1701. Erratum in: Eur Heart J 2012; 33: 2126.
9. Piepoli MF, Hoes AW, Agewall S, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts): Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J. 2016 May 23. pii: ehw106. [Epub ahead of print)
10.Task Force Members, Montalescot G, Sechtem U, Achenbach S et al. 2013 ESC guidelines on the management of stable coronary artery disease: The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013; 34: 2949-3003
11. 2013 ESH/ESC Guidelines for the management of arterial hypertension. Eur Heart J 2013; 34: 2159-219.
12. National Institute for Health and Clinical Excellence 2011 Hypertension guidelines: http://guidance.nice.org.uk/CG127.
13. 2013 Clinical practice guidelines for the management of hypertension in the community: A statement by the American Society of Hypertension and the International Society of Hypertension (ASH/ISH). J Hypertens 2014; 32: 3-15.
14. An effective approach to high blood pressure control: A science advisory from the American Heart Association, American College of Cardiology and the Centers for Disease Control and Prevention (AHA/ACC/CDC). Hypertension 2014; 63: 878-85.
15. 2014 Evidence-based guideline for the management of high blood pressure in adults. Report from the panel members appointed to the Eighth Joint National Committee (JNC 8). JAMA 2014; 311: 507-11.
Arbeidsgruppens sammensetning
Sammensetning av arbeidsgruppen ble gjort med utgangspunkt i gruppen som utarbeidet den tidligere utgaven, slik at disse forespurt ny medvirkning. I tillegg til de av disse som fortsatt ønsket å medvirke, ble det forespurt flere kandidater for å sikre en balansert sammensetning med tanke på kjønn, klinisk erfaring, forskningserfaring, geografisk tilhørighet og hvorvidt man arbeidet i primær- eller spesialisthelsetjenesten. Som brukerrepresentanter ble Nasjonalforeningen for folkehelsen og LHL forespurt å stille med kandidater. Gruppens endelige sammensetning ble som følger.
- Bjørn Gjelsvik, PhD, spesialist i allmenn- og samfunnsmedisin, førsteamanuensis Avdeling for allmennmedisin, Universitetet i Oslo og fastlege ved Tanum Legekontor, Bærum Kommune.
- Inger Elling, brukerrepresentant, LHL.
- Sirin Johansen, fastlege Nordbyen legesenter, Tromsø. Styremedlem i NFA.
- Steinar Madsen, medisinsk fagdirektør ved Statens Legemiddelverk og privatpraktiserende spesialist i indremedisin og hjertesykdommer.
- Sverre E. Kjeldsen, indremedisiner og kardiolog, professor 2 ved hjertemedisinsk avdeling OUS, Ullevål. Forsker på hypertensjon og hypertensiv hjertesykdom.
- Tor Ole Klemsdal, arbeidsgruppeleder, avdelingsoverlege ved preventiv kardiologi, OUS, avdeling for endokrinologi, sykelig overvekt og forebyggende medisin.
- Øivind Kristensen, brukerrepresentant, Nasjonalforeningen.
- Inger Njølstad, lege, professor i epidemiologi og statistikk, Institutt for samfunnsmedisin, UiT Norges arktiske universitet. Leder for Tromsøundersøkelsen.
- Randi Selmer, statistiker, seniorforsker, avdeling for farmakoepidemiologi, FHI. Utviklet risikokalkulator for retningslinjen i 2009.
- Serena Tonstad, professor og overlege ved preventiv kardiologi, OUS, avdeling for endokrinologi, sykelig overvekt og forebyggende medisin.
- Hilde Voie, seniorrådgiver, Helsedirektoratet.
Alle deltakerne i arbeidsgruppene har avgitt skriftlig erklæring hvor de har redegjort for mulige faglige eller økonomiske interessekonflikter knyttet til dette arbeidet. Helsedirektoratet har vurdert alle deltakere i arbeidsgruppene med hensyn til habilitet.
En del av legene i de ulike arbeidsgruppene rapporterte at de hadde mottatt honorar fra ulike legemiddelfirmaer for foredragsvirksomhet, deltagelse i "Advisory Boards" ol, men alle de aktuelle legene kunne vise til en fordeling på flere ulike firmaer slik at dette ble vurdert til å ikke innvirke på dere habilitet, av verken økonomisk eller intellektuell karakter.









