Nasjonal faglig retningslinje for behandling og rehabilitering ved hjerneslag
Behandlingskjeden ved hjerneslag
Sist faglig oppdatert: 21.12.2017
Behandlingkjeden ved hjerneslag
Hjerneslag er både en akuttmedisinsk tilstand og kronisk tilstand og derfor trengs en bred tilnærming og en helhetlig behandlingskjede for å ivareta de behov slagrammede trenger i de ulike faser i behandlingsforløpet. I dette kapitlet presenteres Helsedirektoratets anbefalinger for å sikre en effektiv behandling til riktig tid i alle faser av behandlingsforløpet.
Organisering av behandlingskjeden ved hjerneslag
Behandlingstilbudet til pasienter som rammes av hjerneslag bør organiseres som en behandlingskjede der pasienten får diagnostikk, utredning og veldokumentert, effektiv, koordinert behandling og rehabilitering til riktig tid i alle faser i sykdomsforløpet.
SIGN: A 1a
Praktisk – slik kan anbefalingen følges
Organisering av en helhetlig behandlingskjede for pasienter med hjerneslag fordrer nært samarbeid og god kommunikasjon og informasjonsutveksling mellom prehospitale akuttmedisinske tjenester (AMK, legevakt, ambulansetjenesten), akuttmottaket og slagenheten i sykehus med ledsagende serviceavdelinger, rehabiliteringsavdelinger og helse- og omsorgstjenestene i kommunene. I tillegg er det nødvendig med nært samarbeid mellom slagenhetene og regionalt spesialisert slagsenter.
Øyeblikkelig hjelp innleggelse bør som hovedregel også iverksettes dersom konsultasjon med helsetjenesten først skjer flere døgn etter debut. I slike tilfeller kan det imidlertid også være nyttig med direkte kontakt med sykehus/slagenhet for å avklare hastegrad.
Samtidig med revidert retningslinje for hjerneslag, vil pakkeforløp hjerneslag bli publisert og gi viktige innspill til logistikken i behandlingskjeden.
Begrunnelse – dette er anbefalingen basert på
Pasienter har rett til nødvendig helsehjelp.
Det overordnede målet for organiseringen av tilbudet er å gi personer som rammes av hjerneslag et effektivt og helhetlig behandlingstilbud som ivaretar de ulike behov gjennom ulike faser fra debut av slagsymptomer, via akutt behandling, rehabilitering, forebygging av nye hjerneslag, og videre oppfølging tilbake til et meningsfylt liv.
Standardiserte pasientforløp kan være en god basis for slike behandlingskjeder både med hensyn til ressursbruk, kvalitet og effekt, men hvor nyttig dette er ved hjerneslag er foreløpig ikke avklart [109] (SIGN: 1a). Pasienter med hjerneslag er en heterogen gruppe, og det er nødvendig å ivareta en individuell tilpasning og fleksibilitet i behandlingskjeden tilpasset den enkeltes behov.
Helsetjenesten skal tilby forsvarlige helsetjenester til pasienter som rammes av hjerneslag ihht HOL § 4-1 og Spestjl § 2-2. Initialt trengs en rask identifisering av symptomer som kan indikere hjerneslag, og rask reaksjon når helsetjenesten blir varslet slik at innleggelse i sykehus kan finne sted uten unødig tidstap. I sykehuset er det nødvendig med effektive rutiner for diagnostikk, utredning, akuttbehandling og tidlig innsettende rehabilitering. Det er meget godt dokumentert at denne sykehusbehandlingen bør organiseres i egne sengeenheter/slagenheter [1] (SIGN:1a).
Etter behandling i en slagenhet er det nødvendig med organisert oppfølging i samarbeid/samhandling med kommunehelsetjenesten. Der skal pasientens behov for sekundærforebygging og rehabilitering, tilpasning til hjemmesituasjonen og ev. arbeidsliv ivaretas [7](SIGN: 1a). Virksomhetenes styringssystem er avgjørende for å sikre at personer som rammes av hjerneslag gis et effektivt og helhetlig behandlingstilbud gjennom hele forløpet.
En del pasienter vil ha behov for spesialisert døgnbasert rehabilitering i spesialisthelsetjenesten som bør organiseres på samme måten som rehabiliteringsslagenhetene i de randomiserte studier [1].
Mange pasienter vil ha en eller annen form for varig funksjonsforstyrrelse etter hjerneslaget, og derfor er det behov også for oppfølging som ivaretar både pasient og pårørende på lengre sikt. Oppfølgingen bør bidra til at alle pasienter kan oppleve mestring og en best mulig livskvalitet. For noen pasienter med de alvorligste sekveler etter hjerneslaget må tilbudet og langtidsoppfølgingen ofte skje med basis i et sykehjem.
En organisering av behandlingstilbudet til slagpasienter basert på den kunnskapen som finnes om de ulike ledd i behandlingskjeden, har stor betydning for den enkelte pasients mulighet til å overleve og til å oppnå et godt funksjonsnivå og god livskvalitet[1] [7].(SIGN:1a).
For helsetjenesten og samfunnet kan god organisering redusere kostnader og effektivisere ressursbruken [309] [4]
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag
Tiltak (I): En standardisert organisering av behandlingskjeden
Sammenligning (C): Ingen standardisert behandlingskjede
Beskrivelse av inkluderte studier
Referanser
1. Organised inpatient (stroke unit) care for stroke. https://www.helsedirektoratet.no/referanse/0002-0013-195346
306. Services for reducing duration of hospital care for acute stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195651
2. Early supported discharge services for stroke patients: a meta-analysis of individual patients' data. https://www.helsedirektoratet.no/referanse/0002-0013-195347
309. Services for reducing duration of hospital care for acute stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195654
4. Early Supported Discharge for Stroke Patients Improves Clinical Outcome. Does It Also Reduce Use of Health Services and Costs? https://www.helsedirektoratet.no/referanse/0002-0013-195349
109. In‐hospital care pathways for stroke https://www.helsedirektoratet.no/referanse/0002-0013-195454
7. Early supported discharge services for stroke patients: a meta-analysis of individual patients' data https://www.helsedirektoratet.no/referanse/0002-0013-195352
Sist faglig oppdatert: 21.12.2017
Organisering av prehospitale tjenester
Henvendelse/varsling om pasient med mistenkt akutt hjerneslag skal gå direkte til AMK og medisinsk nødtelefon 113. SIGN: B 2a
Det skal øyeblikkelig settes igang tiltak som sikrer at pasienter med symptomer på akutt hjerneslag raskt blir transportert til sykehus. SIGN: B 2a
Praktisk – slik kan anbefalingen følges
God prehospital organisering innebærer at pasienter med symptomer på hjerneslag prioriteres høyt for rask service fra ambulanse, inkludert helikopter eller ambulansefly, der dette er tilgjengelig og nødvendig for å oppnå en vesentlig reduksjon i transporttid.
Det kan være aktuelt å vurdere å bruke helikopter hvis slik transport er nødvendig for å nå sykehuset innen 4 timer fra debut eller hvis transporttid kan reduseres med > 30 minutter hos pasienter som kan nå fram innen 4 timer. Et slikt tiltak kan øke andelen av pasienter som får effektiv behandling med trombolyse da effekten av trombolyse reduseres betydelig hvis det går lang tid mellom symptomdebut og start av behandling. Start senere enn 4,5 timer etter symptomdebut anbefales ikke trombolytisk behandling. Se anbefaling om Trombolytisk behandling av pasienter med akutt hjerneinfarkt .
Norsk medisinsk indeks gir en oversikt over kriterier for hvilke symptomer som gir grunnlag for å mistenke akutt hjerneslag og eventuell utløse akuttrespons - rød respons. Lenke til Norsk medisinsk indeks. En viktig oppgave i den prehospitale fase, er å etablere et system for varsling til det aktuelle sykehus der innleggelse skal finne sted ( trombolyse-alarm). Se anbefaling om prehospital varsling.
Dersom fastlege / legevakt eller andre instanser i helsetjenesten kontaktes først ved mistenkt hjerneslag, skal disse medvirke til rask innleggelse, ev. uten forutgående undersøkelse som kan medføre unødvendig tidstap.
De vanligste symptomer ved akutt hjerneslag er ansiktsskjevhet, lammelse i arm og språk/tale forstyrrelser jf. Helsedirektoratets informasjonskampanje "Prate, smile, løfte". Ett eller flere av disse symptomer er tilstede hos 4 av 5 pasienter med akutt hjerneslag.
Pasienter med transitorisk iskemisk anfall (TIA) bør også tilbys rask vurdering og hovedanbefalingen er innleggelse som ø-hjelp. Rask poliklinisk vurdering etter en risikovurdering av fastlege/legevakt kan være et alternativ hvis sykehuset har etablert en slik rask poliklinisk service. Acetylsalisylsyre kan gis prehospitalt ved TIA og bør gis hvis pasienten henvises til poliklinisk vurdering. Se anbefaling om behandling av pasienter med TIA.
Begrunnelse – dette er anbefalingen basert på
Akutt hjerneslag er en akuttmedisinsk tilstand. Ved mistanke om hjerneslag har helsepersonell etter helsepersonelloven § 7 plikt til straks å gi pasienten øyeblikkelig hjelp. Hjelpeplikten er en personlig plikt for alt helsepersonell og gjelder uansett arbeidssted og arbeidstid/fritid. Dersom fastlege/legevakt/andre kontaktes først ved symptomer på hjerneslag, skal som hovedregel varsling til AMK gå direkte fra helsepersonellet uten forutgående undersøkelser. En slik varslingsprosedyre sparer tid og vil medføre raskere innleggelse.
Rask innleggelse av pasienter med symptomer på hjerneslag er nødvendig for å kunne tilby trombolytisk behandling (16). Også pasienter som ikke er aktuelle for trombolyse har gevinst av akutt innleggelse i sykehus med observasjon, behandling og tidlig rehabilitering i en slagenhet [8]. Hjerneslag er en tilstand som pålegger det sykehus som varsles en plikt til straks ta imot pasienten jf speshtjl. § 3-1. Helseforetakene har derfor plikt til å sikre at dette behovet til enhver tid er dekket på de enkelte sykehus.
Studier av prehospital organisering har funnet at befolkningsopplysning om slagsymptomer og informasjon om hvordan pasienter og/eller pårørende skal reagere ved symptomer på hjerneslag, reduserer tidsforsinkelser [10] [11] (SIGN: 2a). Det samme gjør utdanning av ambulansepersonell og personell ved AMK-sentraler[9] (SIGN: 3). Kommunens ansvar i en slik situasjon fremgår av hol §§ 3-2 første ledd pkt 3 jf. § 3-1. For å oppfylle ansvaret for å tilby hjelp i akutte situasjoner, skal kommunen tilby legevakt, heldøgns medisinsk akuttberedskap og medisinsk nødmeldetjeneste.
God prehospital organisering innebærer at pasienter med symptomer på hjerneslag prioriteres høyt for rask service fra ambulanse, inkludert helikopter eller ambulansefly, der dette er tilgjengelig og nødvendig for å oppnå en vesentlig reduksjon i transporttid (se også praktisk info).
Selve organiseringen mellom kommunal legevakt, ambulansetjeneste og AMK er nærmere regulert i akuttforskriften. Tjenestene skal organiseres i tråd med bestemmelsene i denne. Både helse- og omsorgstjenesten i kommunen og spesialisthelsetjenesten har ansvar for å etablere et styringssystem og en internkontroll som sikrer at organiseringen er i samsvar med forskriftens bestemmelser og øvrige lovkrav, jf. helsetilsynsloven § 3. Pasienter med transitorisk iskemisk anfall (TIA) bør også tilbys rask vurdering, og hovedanbefalingen er innleggelse som ø-hjelp. Rask poliklinisk vurdering etter en risikovurdering av fastlege/legevakt kan være et alternativ hvis sykehuset har etablert en slik service. Acetylsalisylsyre kan gis prehospitalt ved TIA og bør gis hvis alternativet er poliklinisk vurdering. Se også anbefaling behandling av TIA.
Studier har vist at akutt varsling av helsetjenesten ved symptomer på hjerneslag bør skje via medisinsk nødtelefon 113, da varsling til legevakt, fastlege, hjemmesykepleie eller andre instanser i helsetjenesten tar lengre tid [10] [11] (SIGN: 3). Dersom fastlege/legevakt eller andre instanser i helsetjenesten er de som først blir kontaktet ved et mistenkt tilfelle av akutt hjerneslag er den viktigste oppgaven å medvirke til rask innleggelse, ev. uten forutgående undersøkelse, da en slik undersøkelse ofte vil kunne forsinke innleggelse.
For detaljer vises til anbefaling om prehospital behandling under transport i akutt kapittel.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneslag
Tiltak (I): Direkte kontakt med AMK (med nødtelefon 113)
Sammenligning (C): Ingen standardisering
Beskrivelse av inkluderte studier
Referanser
8. What are the components of effective stroke unit care? https://www.helsedirektoratet.no/referanse/0002-0013-195353
9. Stroke symptoms and the decision to call for an ambulance https://www.helsedirektoratet.no/referanse/0002-0013-195354
10. Factors Associated With Delayed Admission to Hospital and In-Hospital Delays> in Acute Stroke and TIA https://www.helsedirektoratet.no/referanse/0002-0013-195355
11. A systematic review of barriers to delivery of thrombolysis for acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195356
Sist faglig oppdatert: 21.12.2017
Prehospital varsling- trombolyse-alarm, trombolyseteam
Alle sykehus som tilbyr trombolysebehandling bør, i samarbeid med AMK etablere prehospital varsling og trombolyse-alarm, og et trombolyseteam bør stå klart når pasienten ankommer akuttmottaket. SIGN: C 3
Praktisk – slik kan anbefalingen følges
Prehospital varsling av pasienter som kan være aktuelle for trombolyse bidrar til at utredningstid i sykehus reduseres og tid fra symptomdebut og til eventuell trombolytisk behandling igangsettes blir kortest mulig.
Alle sykehus bør derfor innføre prehospital varsling, trombolysealarm og et trombolyseteam som står klart når pasienten ankommer sykehuset.
Spesielt er det viktig med prehospital varsling for å unngå ventetid på bildediagnostikk.
Hvordan dette i praksis organiseres, må tilpasses i det enkelte sykehus.
Begrunnelse – dette er anbefalingen basert på
Akutt slagbehandling bør organiseres slik at pasienter med symptomer på akutt hjerneslag øyeblikkelig undersøkes ved ankomst i akuttmottak, og at de har høy prioritet med henblikk på nødvendige supplerende undersøkelser som bildediagnostikk og blodprøver. Klare prosedyrer for hvem som skal varsles og hvordan, hvilke undersøkelser og prøver som skal utføres og på hvilke tidspunkt, bidrar til en effektiv organisering ved akutt hjerneslag [10] [12]. Slik organisering som kan betegnes som en "fast track" bedrer også mulighetene for akutte tiltak som trombolytisk behandling [13].
En organisering med prehospital varsling og trombolysealarm samt trombolyseteam sikrer rask logistikk ved ankomst til akuttmottaket og er den organisering som er best dokumentert [14] [52] og kan bidra til raskere start av trombolysebehandling. Rask start av trombolyse ved ankomst sykehuset (door to needle time) er en nasjonal kvalitetsindikator for helsetjenesten. Trombolysealarm og trombolyseteam er et nødvendig tiltak for høy måloppnåelse for denne indikatoren.
De fleste sykehus i Norge har nå etablert en eller annen form for trombolysevarsling og trombolysealarm.
Forskningsgrunnlag
Populasjon (P): Pasienter med symptomer på akutt hjerneslag
Tiltak (I): Organisering av mottak av pasienter med prehospital varsling og etablering av akutt slagteam-trombolyseteam etter fulgt av behandling i slagenhet
Sammenligning (C): Andre modeller for organisering eller ingen fast organisering
Beskrivelse av inkluderte studier
Referanser
10. Factors Associated With Delayed Admission to Hospital and In-Hospital Delays> in Acute Stroke and TIA https://www.helsedirektoratet.no/referanse/0002-0013-195355
12. Delay in presentation and evaluation for acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195357
13. Reduction in IV t-PA door to needle times using an Acute Stroke Triage Pathway https://www.helsedirektoratet.no/referanse/0002-0013-195358
14. Translation of the ‘time is brain’concept into clinical practice: focus on prehospital stroke management https://www.helsedirektoratet.no/referanse/0002-0013-195359
52. Hospital prenotification of stroke patients by emergency medical services improves stroke time targets https://www.helsedirektoratet.no/referanse/0002-0013-195397
Sist faglig oppdatert: 21.12.2017
Organisering av sykehusbehandlingen ved akutt hjerneslag
For pasienter som innlegges med mistanke om akutt hjerneslag, bør det foreligge klare prosedyrer i akuttmottaket for rask diagnostikk.SIGN: C3.
Tilbudet til pasienter med akutt hjerneslag bør organiseres slik at alle får diagnostikk, utredning og behandling i slagenheter.SIGN: A1a.
Praktisk – slik kan anbefalingen følges
Organisering av behandlingen i Akuttmottak:
I akutt mottaket bør det foreligge gode prosedyrer for god kommunikasjon med vakthavende lege og avtaler med akuttmottak, røntgenavdelingen, laboratorietjenester og slagenhet for å redusere tidsbruk. (SIGN: C3)
Ved ankomst akuttmottaket anbefales at man omgående fastslår symptomdebut og raskt tar stilling til om pasienten er en potensiell kandidat for trombolyse (innen 4 ½ timer fra debut) og (37-41). [60] [59] og/eller trombektomi [51]. For å sikre rask vurdering og behandling for pasienter som kan være aktuelle for trombolyse bør prehospital varsling og trombolyseteam etableres. Se anbefaling om prehospital varsling.
For videre detaljer om organisering og behandling i akuttmottaket, se kapittel diagnostikk og behandling ved symptomer på akutt hjerneslag i akuttmottak .
Videre organisering av akuttbehandlingen: Behandling i slagenhet:
Pasientene bør etter akutt diagnostikk og eventuell behandling i akutt mottaket, raskt overføres til slagenhet.
En slagenhet kan defineres som "en organisert behandling av slagpasienter i en geografisk avgrenset enhet med faste senger, bemannet med et tverrfaglig spesialopplært personale og med et standardisert program for diagnostikk, observasjon, akutt behandling og tidlig rehabilitering". Denne modellen har vist seg å fungere godt både i nevrologiske, indremedisinske og geriatriske avdelinger [1].
For pasienter med hjerneslag har gjennomsnittlig liggetid i slagenhet mellom 7 og 14 dager vist best effekt. Gjennomsnittlig liggetid <7 dager er lite evaluert, og dokumentasjonen når det gjelder effekten av slagenhetsbehandling bygger på studier der gjennomsnittlig liggetid har vært > 7 dager [1]. Slagenheter med gjennomsnittlig liggetid < 7 dager for pasienter med hjerneslag bør derfor nøye vurdere sine behandlingsresultater.
Pasienter som kan utskrives til hjemmet innen 2 uker bør som hovedregel ikke flyttes til annen enhet eller avdeling i sykehuset.
En oppsummering om de mest sentrale aspektene ved organisering, struktur og bemanning i en effektiv slagenhet basert på kunnskapen fra de randomiserte studier er presentert i kapittel om slagenheter.
Nye behandlingstilbud innenfor akuttilbudet til pasienter med hjerneslag vil kreve økt faglig kunnskap og ressurser, med tanke på tidlig overvåking, administrering av medikamenter og oppfølging første timer etter sykdomsdebut. Jfr. kpt.3.6 Av denne grunn bør det ved en slagenhet legges til rette for overvåking av fysiologisk homøostase og nevrologisk utvikling.
Det er uklart om alle slagenheter i Norge tilbyr et fullt ut tilfredsstillende behandlingsopplegg. Basert på de vitenskapelige studiene er det utarbeidet klare forslag om hvordan organisering, struktur og bemanning i slike enheter bør være for å sikre effektiv slagenhetsbehandling [1][8][17]. Anbefalingene i denne retningslinjen bygger på denne dokumentasjonen, og de konkrete forslagene om organisering og rammevilkår for en forskningsbasert effektiv slagenhet er presentert i . Se anbefaling om slagenhet.
Når det gjelder diagnostikk, utredning, behandling og rehabilitering som skal foregå innenfor rammen av en slagenhet, se anbefaling om slagenhet .
Begrunnelse – dette er anbefalingen basert på
Rask logistikk i akuttmottaket sikrer rask vurdering av pasienter med mistenk hjerneslag og er spesielt viktig for å kunne starte eventuell trombolysebehandling så tidlig som mulig etter innkomst. Rask logistikk bør derfor høyprioriteres for alle potensielle trombolysekandidater.
Etablering av prehospital trombolysevarsling og trombolyse-alarm er viktig for å oppnå rask og effektiv logistikk i akuttmottaket.
Spesialisthelsetjenesten har plikt til å straks ta imot en pasient med symptomer på hjerneslag jf spestjl § 3-1.
Når det gjelder den videre behandlingen, er et hovedmål for behandling av personer med akutt hjerneslag å redusere dødelighet og funksjonshemning. Rask innleggelse i slagenhet er derfor den viktigste enkeltkomponenten i organiseringen av behandlingskjeden for slagpasienter fordi slagenhetsbehandling er det eneste behandlingstilbudet som reduserer dødelighet for en uselektert slagpopulasjon [1] (SIGN: 1a). Behandlingen reduserer også funksjonshemning både på kort og lengre sikt [1] (SIGN:1a). Sykehus uten slagenhet bør derfor ikke behandle pasienter med akutt hjerneslag, fordi mulighetene for overlevelse og/eller vesentlig funksjonsbedring er klart svekket for pasienter som ikke får et slagenhetstilbud [1] (SIGN:1a).
Meta-analyser fra randomiserte slagenhetsstudier viser at alle akutte pasienter med hjerneslag har nytte av slagenhetsbehandling [1] (SIGN:1a). Odds ratio (OR) for død er 0.81, KI 0.69-0.94, for død og alvorlig funksjonshemning er OR 0.78 KI 0.68-0.89 og for død og sykehjemsbehov er OR 0.79 KI 0.68-0.90 (12) (SIGN:1a). En del studier der en har hatt meget sterkt fokus på å kombinerer akutt behandling og tidlig rehabilitering har vist enda større effekt [1] [17] (SIGN:1b). Det er også vist at de positive resultatene av behandling i slagenhet vedvarer, og reduksjon i død og alvorlig funksjonshemning er til stede også ved etterundersøkelser 5-10 år etter slaget [1] [15] (SIGN:1a). Det finnes ulike modeller for slagenhetsbehandling. Den modellen som kombinerer akuttbehandling og tidlig rehabilitering er mest studert og best dokumentert. Dette er også den modellen som er mest utprøvd i de nordiske land inkludert Norge [1] [17]. Det er derfor denne kombinerte slagenhetsmodellen som anbefales i denne retningslinjen.
Det styrker også dokumentasjonen at en systematisk oversikt over slagenhetsbehandling i vanlig klinisk praksis viser de samme positive
resultater som i de vitenskapelige forsøk [16] (SIGN: 3).
Når det gjelder diagnostikk, utredning, behandling og rehabilitering som skal foregå innenfor rammen av en slagenhet for å tilby dokumentert slagenhetsbehandling, henvises til de respektive kapitlene i denne retningslinjen.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneslag
Tiltak (I): Organisering og behandling i egne enheter- slagenheter
Sammenligning (C): Organisering av sykehusbehandlingen i vanlige sengeposter
Beskrivelse av inkluderte studier
Referanser
1. Organised inpatient (stroke unit) care for stroke. https://www.helsedirektoratet.no/referanse/0002-0013-195346
59. Thrombolysis for acute ischaemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195404
60. Effekt av trombolytisk behandling i http://www.kunnskapssenteret.no/publikasjoner/effekt-av-trombolytisk-behandling-i-intervallet-3-til-4-5-timer-etter-hjerneslag
8. What are the components of effective stroke unit care? https://www.helsedirektoratet.no/referanse/0002-0013-195353
15. Stroke unit treatment. 10-year follow-up https://www.helsedirektoratet.no/referanse/0002-0013-195360
16. Stroke units in their natural habitat https://www.helsedirektoratet.no/referanse/0002-0013-195361
17. MEDISIN OG VITENSKAP-Tema: Hjerneslag-En effektiv slagenhet--hva er det? https://www.helsedirektoratet.no/referanse/0002-0013-195362
51. Mekanisk trombektomi ved akutt hjerneinfarkt. Mechanical https://www.fhi.no/publ/2016/mekanisk-trombektomi-ved-akutt-hjerneinfarkt-del-2.-helseokonomisk-evalueri/
Sist faglig oppdatert: 21.12.2017
Organisering av oppfølging med tidlig støttet utskrivning
Ved utskrivning fra slagenhet bør aktuelle pasienter tilbys en støttet og koordinert oppfølging hvor slagenhet, ambulerende team, eventuelt rehabiliteringsavdeling og helse- og omsorgstjenesten i kommunen samarbeider nært.
Praktisk – slik kan anbefalingen følges
Hovedpoenget ved tidlig støttet utskrivning er at et tverrfaglig slagteam følger opp pasientens rehabilitering i hjemmet istedenfor at pasienten er innlagt for rehabilitering i enten slagenhet eller rehabiliteringsavdeling.
Teamet bør ha spesiell kompetanse på hjerneslag, det bør være nær samhandling mellom sykehus og helse- og omsorgstjenestene i kommunen, inkludert fastlege, og et rehabiliteringstilbud i hjemmet, eventuelt kombinert med rehabilitering i dagavdeling, bør tilstrebes.
Tiltaket må inkludere:
- å kartlegge utfordringer i pasientens hjemmemiljø
- å utforme en individuelt tilpasset rehabiliteringsplan basert på kartleggingen
- å bruke hjemmemiljøet aktivt i rehabiliteringen
- at helsepersonell med spesialkompetanse på hjerneslag – tverrfaglig sammensatt for å imøtekomme pasientens individuelle behov – fortløpende evaluerer utviklingen og tilpasser tiltak
Rehabiliteringen planlegges og gjennomføres i samråd med pasienten og pårørende og har som hovedmål å øke pasientens funksjonsnivå når det gjelder aktivitet og deltakelse.
Varigheten av tilbudet vil vanligvis være minst en måned, og det kan fortsette frem til den polikliniske kontrollen i spesialisthelsetjenesten. Ytterligere rehabiliteringstiltak vurderes individuelt.
Hva som er «tidlig utskrivning» kan variere ut fra individuelle forhold. Hovedfokus med tiltaket er ikke spesielt tidlig utskrivning, fordi liggetiden i slagenhet i Norge allerede er kort. Derimot må støtten som gis når pasienten utskrives noe tidligere enn uten tiltaket vektlegges.
Med «tett oppfølging» menes minimum ukentlig kontakt, men som regel flere ganger per uke og opp til daglig.
Med «tverrfaglig ambulerende slagteam» menes tre til fire faggrupper med spesialkompetanse på hjerneslag, vanligvis ergoterapeut, fysioterapeut og sykepleier, samt tilgang på logoped, lege og sosiale tjenester. Et slikt team vil ofte ha en fast sammensetning av faggrupper, der andre må dras inn i rehabiliteringen ved behov. Rehabiliteringstilbudet foregår som regel i hjemmet, men kan være supplert med rehabilitering i dagavdeling e.l. Det ambulerende teamet må ha en koordinerende og veiledende funksjon, og det fungerer således som et sikkerhetsnett og koordinerer også nødvendige tilbud fra andre aktører. I dette inngår arbeid med individuell plan der aktuelt. Teamet kan i tillegg også ha en behandlingsfunksjon – dette vil variere ut fra praktiske og lokalse forhold.
Et sentralt aspekt ved tidlig støttet utskrivning er tett samhandling mellom spesialisthelsetjenesten og helse- og omsorgstjenestene i kommunen der begge oppfyller sitt oppfølgingsansvar med pasienten i sentrum, uavhengig av om tilbudet formelt utgår fra kommune- eller spesialisthelsetjenesten. Dette sikrer kontinuitet og inkluderer bl.a. direkte kontakt mellom involvert helsepersonell om faglige forhold hos den individuelle pasienten. Det vises til veiledningsplikten.
Det forutsettes en poliklinisk kontroll i spesialisthelsetjenesten der både medisinske aspekter (sekundærforebygging) og videre rehabiliteringsbehov blir adressert. Se anbefaling om kontroll etter gjennomgått hjerneslag.
For nærmere detaljer om tidlig støttet utskriving vises det også til en internasjonal konsensus [310] .
(A Consensus on Stroke; Early Supported Discharge.)
Se også veileder om habilitering og rehabilitering, individuell plan og koordinator, og pasient- og brukerrettighetsloven
Begrunnelse – dette er anbefalingen basert på
Rehabilitering etter hjerneslag foregår tradisjonelt i sykehus og da som oftest ved egne slagenheter og spesialiserte rehabiliteringsavdelinger. De fleste pasienter kan utskrives til hjemmet etter behandling i en slagenhet. En del av disse vil ha behov for fortsatt rehabilitering i regi av helse- og omsorgstjenesten i kommunen eller i samarbeid mellom spesialisthelsetjenesten og helse- og omsorgstjenesten i kommunen. For mange av disse pasientene vil tidlig støttet utskrivning være det mest nyttige tiltak
Mange pasienter med mer alvorlig eller komplekse utfall og funksjonssvikt etter hjerneslaget vil trenge videre rehabilitering i spesialisthelsetjenesten. Noen vil ha behov for pleie, omsorg og ev. rehabilitering i sykehjem.
Det er derfor i denne fasen behov for fleksible løsninger som spenner fra enkel poliklinisk rådgivning, hjemmebesøk med stimulering til egen aktivitet i hjemmet, via mer systematisk hjemmerehabilitering – til kombinasjonen hjemmerehabilitering og dagrehabilitering utenfor hjemmet, og mer spesialisert rehabilitering i heldøgnsinstitusjon i spesialisthelsetjenesten eller i kommunen. Fastlegen bør være en viktig samarbeidspartneri de ulike pasientforløp som velges.
Det best dokumenterte konseptet etter slagenhetsbehandling for pasienter med mild og moderat nedsatt funksjonsevne etter hjerneslag er "early supported discharge service" (ESD-service). Dette innebærer en tidlig støttet utskriving fra sykehus og rehabilitering i hjemmet med støtte fra et tverrfaglig team og i samarbeid og samhandling med helse- og omsorgstjenesten i kommunen. Se rehabiliteringskapittel og anbefaling om ESD. En slik organisering vil kunne bidra til bedre funksjonsnivå , redusert sykehjemsbehov og kortere ligge tid i institusjon [1];[310]. Ved en ESD service vektlegges tett oppfølging av pasienten der stimulerende aktiviteter i hjemlige omgivelser står sentralt [7][3][153] (SIGN:1a). Dokumentasjonen tilsier at denne oppfølgingen bør koordineres av et tverrfaglig team og i nært samarbeid mellom slagenhet, rehabiliteringsavdeling og helse- og omsorgstjenesten i kommunen.[7] [3] (SIGN:1a). Det ambulerende tverrfaglige teamet kan ha sin base enten i sykehuset eller i kommunen og begge organisasjonsmodeller har vist likeverdige positive.effekter. Per i dag har ca. 20 % av alle pasienter med hjerneslag tilbud om tidlig støttet utskrivning. Lenke til Forskrift om habilitering og rehabilitering, individuell plan og koordinator .
Evidensen som foreligger er basert på studier på tidlig støttet utskrivining i byer og bynære strøk. Om det gjennomføres på samme måte, er det grunn til å anta at de positive effektene også gjelder distriktskommuner. Anbefalingen er basert på «oppsummert forskning»/vurdering av kunnskapsgrunnlaget og arbeidsgruppens samlede erfaring og kunnskap.
Pasienten har etter pasient- og brukerrettighetsloven §§ 2-1 a og 2-1 b rett på nødvendig helsehjelp fra spesialisthelsetjenesten og kommune etter et hjerneslag.
Denne retten korresponderer med «sørge-for» ansvaret etter sphtjl § 2-1a og hol § 3-1.
Behandlingen skal være i tråd med kravet til forsvarlig virksomhet i spestjl. § 2-2 og hol § 4-1.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneslag som er behandlet i slagenhet
Tiltak (I): Organisering av oppfølging med tidlig støttet utskrivning
Sammenligning (C): Andre modeller for organisering eller ingen fast organisering
Beskrivelse av inkluderte studier
Flytskjema (PDF)
Søkestrategi (PDF)
Tidlig støttet utskrivning er et tiltak der pasienter med hjerneslag reiser hjem fra sykehuset tidligere enn vanlig og mottar rehabilitering i hjemmemiljøet. En systematisk oversikt av 14 studier med 1957 deltakere (Fearon et al., 2012) viser at pasienter med hjerneslag som fikk tidlig støttet utskrivning var mer sannsynlige til å gjenvinne uavhengighet i daglig aktiviteter og å bli hjemmeboende på sikt enn de som fikk tradisjonell rehabilitering i sykehus. De beste resultatene ble sett med godt organiserte støtteteam og hos pasienter med mindre alvorlige slag.
Det var liten forskjell mi selvopplevd fysisk helse mellom pasienter med tidlig støttet utskrivning og de med standard behandling. Tilsvarende var det liten forskjell i pasientenes sinnsstemning, men en studie viste tendens til at de med tidlig støttet utskrivning opplevde mer angst. Tidlig støttet utskrivning gir færre liggedøgn på sykehus etter hjerneslag, mens antall reinnleggelser kan øke noe.
Tidlig støttet utskriving av slagpasienter er estimert til i snitt å gi åtte færre dødsfall per 1000 slagpasienter (fra 30 færre til 23 flere dødsfall) per år. Effektestimatet (dvs. død) er basert på data fra 1957 deltakere i 14 randomiserte kontrollerte studier som varte fra 3 til 12 måneder. Fordi det totalt sett var få hendelser (liten informasjonsstørrelse) og konfidensintervallet krysser grensen for ingen forskjell i effekt (dvs. null), er det noe tvil om hvor sikkert effektestimatet er. Tiltroen til estimatet er derfor moderat.
Tidlig støttet utskrivning av slagpasienter er estimert til i snitt å gi 55 færre pasienter som dør eller blir avhengige av fysisk hjelp til basale daglige gjøremål per 1000 slagpasienter (fra 97 færre til 8 flere) per år. Basale daglige gjøremål er definert som hjelp til forflytning, mobilitet, vasking/stell, påkledning eller toalettbesøk (engelsk: basic ADL). Estimatet er basert på data fra 1957 deltakere i 14 randomiserte kontrollerte studier som varte fra 3 til 12 måneder. Tiltroen til dette estimatet er høy. Hvis man tar i betraktning at det er åtte færre som dør (se avsnittet over), er det 47 flere pasienter (55-8=47) som blir selvhjulpne med tidlig støttet utskrivning.
Tidlig støttet utskrivning av slagpasienter er estimert til i snitt å gi 38 færre (fra 71 færre til 0 flere) som dør eller får behov for behandling/omsorg i institusjon per 1000 slagpasienter per år. Estimatet er basert på data fra 1758 deltakere i 12 randomiserte kontrollerte studier som varte fra 3 til 12 måneder. Tiltroen til dette estimatet er høy. Hvis man tar i betraktning at det er åtte færre som dør per år (se første avsnitt), er det 30 færre pasienter (38-8=30) som trenger sykehjemsplass med tidlig støttet utskriving per år.
Det er estimert lite forskjell i hverdagsaktivitet mellom pasienter med tidlig støttet utskrivning og de med standard behandling/oppfølging målt på Barthel skala (ADL). Måten dette er regnet ut på (standardisert gjennomsnitt) viser bare eventuelle forskjeller på gruppenivå og ikke antall pasienter som skårer/ikke skårer på daglig aktivitet. Tiltroen til estimatet er høy.
Pasienter med tidlig støttet utskrivning lå i snitt syv dager mindre (fra 4 til 10 dager mindre) på sykehus enn de som fulgte standard behandling og oppfølging. Estimatet (dager på sykehus) er basert på 1695 deltakere i 13 randomiserte-kontrollerte studier som varte fra 3 til 12 måneder. Fordi det var uforklarlige forskjeller mellom studiene, er det noe tvil om hvor sikkert effektestimatet er. Tiltroen til estimatet er derfor moderat.
Tidlig støttet utskrivning av pasienter med hjerneslag er estimert til i snitt å gi 49 flere (fra 12 færre til 115 flere) reinnleggelser per 1000 pasienter per år. Estimatet er basert på data fra 918 deltakere i 7 randomiserte kontrollerte studier som varte fra 3 til 12 måneder. Fordi konfidensintervallet er veldig vidt (fra 12 færre til 115 flere), er det noe tvil om hvor sikkert effektestimatet er. Tiltroen til estimatet er derfor moderat.
Andre opplysninger i denne reviewen:
Når hverdagsaktivitet ble målt på en utvidet skala (E-ADL), viste pasientene som hadde fått støtte og hjelp av et team etter tidlig utskrivning, en tendens til høyere skåre.
Det var liten forskjell i hvordan pasienter med tidlig støttet utskrivning og de med standard behandling oppga at de opplevde den fysiske helsen sin. Tilsvarende var det liten forskjell i pasientenes sinnsstemning, men en studie viste tendens til at de med tidlig støttet utskrivning opplevde mer angst.
Vurdering
Fordeler og ulemper
Fordeler
Færre innleggelser ved sykehjem og økt selvhjulpenhet (lav institusjonaliseringsgrad) vurderes som svært vesentlige ønskede forventede effekter av tidlig støttet utskriving sammenlignet med vanlig oppfølging.
Ulemper
Det er mulig noen flere reinnleggelser per år ved tidlig støttet utskrivning.
Konklusjon
Fordelene oppveier ulempen
Kvalitet på dokumentasjonen
Verdier og preferanser
Referanser
1. Organised inpatient (stroke unit) care for stroke. https://www.helsedirektoratet.no/referanse/0002-0013-195346
3. Early Supported Discharge Trialists. Services for reducing duration of hospital care for acute stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195348
7. Early supported discharge services for stroke patients: a meta-analysis of individual patients' data https://www.helsedirektoratet.no/referanse/0002-0013-195352
153. Therapy-based rehabilitation services for stroke patients at home https://www.helsedirektoratet.no/referanse/0002-0013-195498
Sist faglig oppdatert: 21.12.2017
Spesialiserte slagsentra
Det bør være minst ett spesialisert slagsenter i hver helseregion.
SIGN: D4
Praktisk – slik kan anbefalingen følges
Det bør sannsynligvis være minst ett spesialisert slagsenter i hver helseregion. Hovedformålet vil være å ta hand om kompliserte og avanserte akuttbehandlingstiltak.
Dette har blitt særlig aktualisert i forbindelse med innføringen av trombektomi som et aktuelt behandlingsalternativ ved store hjerneinfarkter med samtidig okklusjon av en stor hjernearterie. Det bør etableres et nært samarbeid mellom slagenhetene i en region og et spesialisert slagsenter slik at aktuelle pasienter kan vurderes og eventuelt raskt overføres til det spesialiserte slagsenter for trombektomi. Det vises ellers til anbefaling om trombektomi.
De spesialiserte slagsentrene bør ha som oppgave å være ressursbase for slagenhetene i sitt område, og bidra til forskning, utvikling og behandling når det gjelder nye og avanserte behandlingstiltak. SIGN: D4
For behandling av pasienter med andre kompliserte tilstander som medfører behov for avanserte behandlingstilbud, er samarbeid mellom slagenhetene og et spesialisert slagsenter nyttig.
Det bør utvikles systemer som sikre god og rask kommunikasjon og informasjonsutveksling mellom slagsenteret og de ulike slagenheter i regionen. SIGN: B2b
Telemedisinsk kommunikasjon kan omfatte ulike kommunikasjonsmetoder.
Telefon er mest benyttet og raskest og kan av og til være tilstrekkelig for informasjonsutveksling og rådgivning.
Hvis telefonkommunikasjon kan suppleres med online radiologisk bildeoverføring, øker nytteverdien betydelig og slike løsninger bør forsøkes etablert.
Videokonferanser der pasienten også kan "sees" vil i en del tilfeller ytterligere øke nytteverdien og er vanligvis det som oppfattes som teleslag. Svakheten er at etablering av videokommunikasjon ofte er noe mer tidkrevende og at den som oftest ikke kan erstatte online radiologisk bilde overføring. Bildetolkning er ofte den viktigste informasjon som trengs å overføre.
Begrunnelse – dette er anbefalingen basert på
Må ses i sammenheng med konklusjonen vedr. trombektomi [51].
Et spesialisert slagsenter bør ha som basis en slagenhet med den standard, struktur og funksjon som er beskrevet og definert i denne retningslinjen. Se anbefaling om behandling i slagenhet. I tillegg må et spesialisert slagsenter ha infrastruktur, ekspertise, bemanning og rutiner for å håndtere slagpasienter som har behov for mer avansert diagnostikk og behandling [53]. De bør kunne tilby:
- avansert diagnostikk som vanligvis ikke er tilgjengelig i en slagenhet. Dette kan være mer spesialiserte CT- og MR-undersøkelser som perfusjons-CT og MR, diagnostikk av høyre- venstre-shunt, og embolimonitorering.
- avansert behandling inkludert intervensjonsbehandling med mekanisk trombektomi og intrakranial stenting, karkirurgi samt hemikraniektomi og andre nevrokirurgiske inngrep.
Spesialiserte slagsentra bør ha kompetanse i å håndtere pasienter med komplekse nevrovaskulære tilstander og etableres i sykehus med avanserte intensivavdelinger, nevroradiologisk intervensjonstilbud og spisskompetanse innen nevrologi [307] [308], nevrokirurgi, karkirurgi, ulike indremedisinske spesialiteter, kardiologi, ev. også geriatri og rehabilitering. Det bør etableres et nært og formalisert samarbeid mellom en rekke spesialister og profesjoner for å kunne ivareta de avanserte oppgavene som er tiltenkt et slikt senter. Detaljer om hvilke spesialister og fagkunnskap som bør inngå i disse sentra vil måtte avklares etter hvert som erfaring vinnes og er også avhengig av hvilke behandlingstilbud som vil vise seg å være til mest nytte.
Sentrene må ha et så stort pasientgrunnlag at de kan utvikle den nødvendige spisskompetanse, men de geografiske forhold i Norge gjør at det sannsynligvis bør etableres minst ett slikt senter i hver helseregion, og i noen regioner med store geografiske avstander muligens flere. Hvilke kriterier som bør legges til grunn for etablering av slike slagsentre, bør vurderes av de ulike RHF. Slagsentrene bør ha forskning på avanserte og invasive behandlingsmetoder som en av sine hovedoppgaver.
Etablering av slike sentra vil kunne gi bedre behandling til en del yngre slagrammede og til pasienter med kompliserte nevrovaskulære tilstander, store hjerneinfarkt hvor hemikraniektomi eller nevrointensiv behandling kan være aktuelt, eller okklusjoner i større kar hvor intra-arteriell intervensjon, ev. akutt karkirurgi, kan være aktuelt å vurdere for behandling og/eller forskning. I tillegg vil de kunne bidra med rådgivning til slagenheter i sin region slik at kompetanse og kvalitet på behandlingen kan opprettholdes på høyt nivå i alle slagenheter.
En potensiell gevinst er økt bruk av trombolytisk behandling når slagenhetene kan få veiledning fra et spesialisert senter. En annen viktig konsekvens ved etablering av slike spesialiserte sentra er at det muliggjør utvikling og forskning på nye og mer avanserte metoder for utredning og behandling av hjerneslag. Dette er vanligvis ressurskrevende og kostbare behandlingstiltak. Her trengs mye forskning for å evaluere nytten av behandlingstiltakene, og slik forskning er vanskelig å gjennomføre uten at det etableres en del spesialiserte slagsentra.
Telemedisinske nettverk kan knytte slagenhetene opp mot spesialiserte slagsentra i et tett klinisk samarbeid.
Et telemedisinsk nettverk kan medføre at bruken av trombolytisk behandling kan økes ved de tilknyttede mindre sykehusene. Trombolyse via et telemedisinsk nettverk er kostnadseffektivt. Det kan være en fordel om nettverket bør ha mulighet for toveis audio-videokonferanse, men on line radiologisk bildeinformasjon er viktigst, og sammen med vanlig telefonkommunikasjon fungerer dette godt og som oftest raskere. Nettverk basert kun på telefonkonsultasjon er nyttig, men supplement med radiologisk bildeinformasjon eller video-kommunikasjon vil kunne øke nytteverdien.
Forskningsgrunnlag
Populasjon (P): Pasienter med kompleks nevrovaskulær sykdom
Tiltak (I): Overflytting til spesialisert slagsenter
Sammenligning (C): Pasienter med kompleks nevrovaskulær sykdom, som ikke overflyttes
Beskrivelse av inkluderte studier
Referanser
307. VA Stroke Study Neurologist care is associated with increased testing but improved outcomes https://www.helsedirektoratet.no/referanse/0002-0013-195652
308. What role do neurologists play in determining the costs and outcomes of stroke patients? https://www.helsedirektoratet.no/referanse/0002-0013-195653
28. Telestroke: effective networking https://www.helsedirektoratet.no/referanse/0002-0013-195373
29. Effects of the implementation of a telemedical stroke network: the Telemedic Pilot Project for Integrative Stroke Care (TEMPiS) in Bavaria, Germany https://www.helsedirektoratet.no/referanse/0002-0013-195374
30. Can telemedicine contribute to fulfill WHO Helsingborg Declaration of specialized stroke care? https://www.helsedirektoratet.no/referanse/0002-0013-195375
31. Effect of telestroke on emergent stroke care and stroke outcomes https://www.helsedirektoratet.no/referanse/0002-0013-195376
32. Efficacy of telemedicine for stroke: pooled analysis of the Stroke Team Remote Evaluation Using a Digital Observation Camera (STRokE DOC) and STRokE DOC Arizona telestroke trials https://www.helsedirektoratet.no/referanse/0002-0013-195377
33. National use of thrombolysis with alteplase for acute ischaemic stroke via telemedicine in Denmark https://www.helsedirektoratet.no/referanse/0002-0013-195378
34. tPA by telephone: extending the benefits of a comprehensive stroke center https://www.helsedirektoratet.no/referanse/0002-0013-195379
35. Telestroke: extending stroke expertise into underserved areas https://www.helsedirektoratet.no/referanse/0002-0013-195380
36. The use of telemedicine in combination with a new stroke-code-box significantly increases t-PA use in rural communities https://www.helsedirektoratet.no/referanse/0002-0013-195381
37. Safety and efficacy of thrombolysis in telestroke A systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195382
38. Outcomes from a comprehensive stroke telemedicine program https://www.helsedirektoratet.no/referanse/0002-0013-195383
39. Telemedicine for acute stroke When virtual is as good as reality https://www.helsedirektoratet.no/referanse/0002-0013-195384
40. Extending the potential of perfusion imaging with MRI to prevent major stroke https://www.helsedirektoratet.no/referanse/0002-0013-195385
42. Advantages and limitations of teleneurology https://www.helsedirektoratet.no/referanse/0002-0013-195387
51. Mekanisk trombektomi ved akutt hjerneinfarkt. Mechanical https://www.fhi.no/publ/2016/mekanisk-trombektomi-ved-akutt-hjerneinfarkt-del-2.-helseokonomisk-evalueri/
53. Recommendations for comprehensive stroke centers https://www.helsedirektoratet.no/referanse/0002-0013-195398
Sist faglig oppdatert: 21.12.2017
Organisering av behandlingen for pasienter med transitorisk iskemisk anfall (TIA)
Pasienter med symptomer på TIA bør utredes og behandles raskt. SIGN: B2a.
Det foreslås at pasienter med symptomer på TIA innlegges akutt for utredning og behandling.
Praktisk – slik kan anbefalingen følges
Organisering av tilbudet til pasienter med symptomer på TIA bør sikre rask utredning og behandling. Se anbefaling om behandling av pasienter med TIA. Det viktigste akutte behandlingstilbud er rask behandling med acetylsalisylsyre som reduserer risiko for manifest hjerneslag de første dager og kan gis før bildediagnostikk.
Organisering både med akutt innleggelse og rask poliklinisk behandling har gitt gode resultater. I revideringen av denne retningslinjen foreslår vi som hovedregel innleggelse som ø-hjelp da det for de fleste sykehus vil være krevende å etablere en rask poliklinikkservice. Denne anbefalingen vil sannsynligvis redusere uønsket praksis. For sykehus som har etablert en rask «TIA-poliklinikk» og et godt samarbeid med fastleger og legevakt gir ikke den eksisterende dokumentasjonen grunnlag for å anbefale at poliklinikorganiseringen bør opphøre.
For å identifisere hvilke pasienter som har så høy risiko for å få hjerneslag kort tid etter TIA at innleggelse er å foretrekke og hvilke som like gjerne kan behandles poliklinisk, kan ulike screeningsverktøy benyttes. Risiko skåren ABCD2 gir fortsatt god informasjon om prognose og kan dermed være et hjelpemiddel for å vurdere hvilke pasienter som har størst behov for meget rask utredning [46] [49] [43].
Pasienter med TIA bør utredes på samme måte som pasienter med hjerneslag. Se anbefaling om behandling av pasienter med TIA
Begrunnelse – dette er anbefalingen basert på
Det finnes ulike modeller for hvordan helsetjenesten kan organisere behandlingstilbudet til TIA-pasienter.
Rask utredning og start av forebyggende behandling er viktig for å redusere risiko for hjerneslag.
Risikoen for å få etterfølgende hjerneslag var tidligere høy [44][48], men har blitt redusert betydelig i de senere år. I dag er risikoen for hjerneslag innen 1 uke på omlag 2 % og etter 3 md. 3 % [43].
Tidlig innsettende antitrombotisk behandling med ASA er det viktigste tiltak for å redusere den tidlige risiko for hjerneslag (2). Ved TIA kan ASA gis før bildediagnostikk, og tidlig ASA behandling har så god effekt at slik tidlig ASA behandling anbefales [44];[48] (SIGN: 2a).
ABCD2 skår som er et skåringssystem for å vurdere risiko for manifest hjerneslag tidlig etter TIA, har en sterk prognostisk verdi. Lavt skår 0-3 gir liten risiko for hjerneslag kort tid etter TIA, men fanger ikke opp alle som har risiko for hjerneslag etter et TIA [46] [49] [43].
Både akutt innleggelse som ø-hjelp og rask poliklinisk behandling har gitt gode resultater, men en hovedregel om innleggelse vil sannsynligvis redusere uønsket praksis og er hovedanbefalingen for pasienter med TIA. Se praktiske tips i anbefaling om behandling av pasienter med TIA.
Forskningsgrunnlag
Populasjon (P): Pasienter med TIA
Tiltak (I): Innleggelse akutt i sykehus på lik linje med hjerneslag
Sammenligning (C): Poliklinisk vurdering
Beskrivelse av inkluderte studier
Flytskjema (PDF)
Søkestrategi (PDF)
Det er søkt etter systematiske oversikter i et søk utført ved biblioteket ved Helsedirektoratet i juni 2016, men ingen systematiske oversiktsartikler kunne svare på om innleggelse av alle TIA-pasienter vil gi bedre behandlingsresultat.
Anbefalingen bygger på arbeidsgruppens erfaring og oppfattelse av at slik organisering vil sikre mest mulig likhet i behandlingstilbudet.
Vurdering
Fordeler og ulemper
Alle pasienter med TIA bør ha samme utredning som ved hjerneslag. Rask utredning og behandling kan forebygge tidlige residivslag. Innleggelse gir mulighet for bedre overvåkning, rask oppstart av sekundærprofylakse (medikamenter, karotiskirurgi) og eventuelt reperfusjonsbehandling ved residiv og dermed redusert risiko for manifest hjerneinfarkt, vaskulære hendelser og kanskje også død.
Ulemper:
Innleggelse kan medføre økt ressursbruk (behov for sengeplasser). Noen pasienter vil kunne oppleve innleggelse som belastende.
Fordelene med tiltaket veier opp for ulempene.
Kvalitet på dokumentasjonen
Verdier og preferanser
Referanser
43. One-year risk of stroke after transient ischemic attack or minor stroke https://www.helsedirektoratet.no/referanse/0002-0013-195388
44. Population based study of early risk of stroke after transient ischaemic attack or minor stroke: implications for public education and organisation of services https://www.helsedirektoratet.no/referanse/0002-0013-195389
45. Risk of stroke early after transient ischaemic attack: a systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195390
46. Validation and refinement of scores to predict very early stroke risk after transient ischaemic attack https://www.helsedirektoratet.no/referanse/0002-0013-195391
47. Effects of aspirin on risk and severity of early recurrent stroke after transient ischaemic attack and ischaemic stroke: time-course analysis of randomised trials https://www.helsedirektoratet.no/referanse/0002-0013-195392
48. Effect of urgent treatment of transient ischaemic attack and minor stroke on early recurrent stroke (EXPRESS study): a prospective population-based sequential comparison https://www.helsedirektoratet.no/referanse/0002-0013-195393
49. Rapid identification of high-risk transient ischemic attacks https://www.helsedirektoratet.no/referanse/0002-0013-195394
Kontroll etter gjennomgått hjerneslag
Det anbefales som hovedregel en poliklinisk kontroll i spesialisttjenesten 1-3 md. etter hjerneslaget, alternativt i samarbeid mellom fastlege og spesialisthelsetjenesten.
SIGN D4.
Fastlegen bør ha hovedansvaret i oppfølgingen av sekundærforebygging og koordinering av ev. rehabilitering etter hjerneslag.
SIGN: D4.
Praktisk – slik kan anbefalingen følges
Det anbefales som hovedregel en poliklinisk kontroll etter gjennomgått hjerneslag. Kontrollen bør bestrebe seg på en tverrfaglig tilnærming, bør gjennomføres av helsepersonell med spesialkompetanse på hjerneslag og bør inkludere sekundærforebygging og rehabiliteringsbehov.
Der geografiske eller andre særlige forhold gjør kontroll i spesialisthelsetjenesten vanskelig, kan etterkontrollen skje hos fastlegen i samarbeid med spesialisthelsetjenesten via et ambulerende team eller telemedisinsk nettverk.
For pasienter med lavt funksjonsnivå og stort omsorgsnivå (sykehjemsbehov) er nytten av en poliklinisk etterkontroll usikker, og ofte vil en rådgivning fra spesialisthelsetjenesten til sykehjemmet være mer hensiktsmessig for slike pasienter.
Kontrollen bør omfatte:
1. Årsaker til og alvorlighetsgraden av hjerneslaget
2. Forebyggende behandling
a. Vurdering av indikasjon for platehemmere/antikoagulasjon
b. Legemidler og behandlingsmål vedrørende blodtrykk, lipidprofil og diabetes
c. Eventuelle bivirkninger og kontroll av Hb, kreatinin, leverprøver, CK, INR og elektrolytter
d. Sunne levevaner med regelmessig fysisk aktivitet, røykekutt, vektkontroll, alkoholmoderasjon og sunn kost
e. Etterlevelse av forebyggende behandling og plan for videre oppfølging av denne
3. Rehabilitering – er det behov for tiltak vedrørende:
a. ADL-funksjon
b. Mobilitet/gangfunksjon
c. Spastisitet
d. Smerter
e. Inkontinens
f. Seksualitet og samliv
g. Kommunikasjon/språk
h. Synsfunksjon
i. Angst/depresjon
j. Kognisjon
k. Fatigue
l. Aktiviteter og deltakelse: arbeid, bilkjøring, fritid/hobby
m. Sosiale og familierelasjoner, mestringsstrategier
4. Plan videre
a. Plan for videre evaluering og oppfølging av sekundærprofylakse
b. Plan for videre rehabilitering, inkl. behov for individuell plan
Ut fra den enkeltes behov, bør konsultasjonen ved den polikliniske kontrollen bestrebe seg på å ha en tverrfaglig tilnærming med deltagelse fra aktuelle faggrupper.
Det bør sendes en detaljert rapport til fastlegen og de instanser i helse- og omsorgstjenesten i kommunen som vil være involvert i den videre oppfølging. Informasjon ved 3 md. kontroll kan også benyttes til den meldepliktige innrapportering om status 3 md. etter hjerneslaget til Norsk hjerneslagsregister.
Pasientorganisasjonene angir at der det ikke er spesielle forhold som tilsier raskt etterkontroll, så bør ikke denne kontrollen skje før etter ca. 3 md. for da har den slagrammede fått tid til å vurdere sin situasjon og hvilke utfordringer som eventuelt finnes både når det gjelder funksjonsnivå, komplikasjoner og gjennomføring av sekundær forebyggende tiltak.
Ved en etterkontroll etter ca 3 md. fanges også opp mye av den informasjon og de data som det er pliktig å melde til Norsk hjerneslagregister.
Begrunnelse – dette er anbefalingen basert på
Poliklinisk kontroll i spesialisthelsetjenesten etter 1-3 md. har bidratt til de gode behandlingsresultatene i studiene om støttet utskriving [7][3][50].
Studiene indikerer at en slik poliklinisk kontroll i spesialisthelsetjenesten er viktig og nyttig for pasienten, for samhandling mellom spesialisthelsetjenesten og helse- og omsorgstjenesten i kommunen og for videre optimal oppfølging i helse- og omsorgstjenesten i kommunen. En slik etterkontroll er også sterkt anbefalt av alle de aktuelle pasientorganisasjoner.
Nytten av poliklinisk etterkontroll for TIA-pasienter er ikke avklart, men hos pasienter hvor det vurderes som spesielt stor risiko for etterfølgende hjerneslag, kan en slik etterkontroll i spesialisthelsetjenesten være hensiktsmessig.
Referanser
3. Early Supported Discharge Trialists. Services for reducing duration of hospital care for acute stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195348
7. Early supported discharge services for stroke patients: a meta-analysis of individual patients' data https://www.helsedirektoratet.no/referanse/0002-0013-195352
50. Stroke unit care combined with early supported discharge https://www.helsedirektoratet.no/referanse/0002-0013-195395
Sist faglig oppdatert: 21.12.2017
Organisering av langtidsoppfølging etter hjerneslag
Helse- og omsorgstjenesten i kommunen bør organisere en oppfølging for pasienter etter hjerneslag som sikrer optimal sekundærforebygging, identifikasjon og behandling av komplikasjoner og rehabilitering tilpasset den enkelte pasients behov.
SIGN: D 4
Alle helseforetak bør i samarbeid med helse- og omsorgstjenesten i kommunen utarbeide standardiserte pasientforløp/behandlingslinjer for pasienter med hjerneslag/TIA med basis i anbefalingene i denne retningslinjen.
SIGN: D 4
Praktisk – slik kan anbefalingen følges
Akutt behandling og tidlig rehabilitering bør i spesialisthelsetjenesten organiseres i slagenheter [1]. For en del pasienter er det etter akutt fasen behov for døgnbasert rehabilitering i spesialisthelsetjenesten [1], mens det for pasienter med lett til moderat funksjonsreduksjon etter slaget ofte vil gi det beste behandlingsresultatet hvis utskrivningen fra slagenheten organiseres som tidlig støttet utskrivning.
Når det gjelder den videre oppfølgning bør denne organiseres i helse- og omsorgstjenesten i kommunen, men med mulighet for rask henvendelse til spesialisthelsetjenesten ved behov. (SIGN: D4).
Viser til spesialisthelsetjenestens plikt til å gi veiledning til kommunene. Speshjtl § 6-3 – Se Rundskriv fra HOD I-2013-3 (https://lovdata.no/dokument/NL/lov/1999-07-02-61)
Begrunnelse – dette er anbefalingen basert på
Det er helse- og omsorgstjenesten i kommunen som er den sentrale aktøren i denne fasen og som er ansvarlig for å organisere et tilbud for tilpasning i hjemmesituasjonen jamfør helse- og omsorgsloven § 3-1 og § 3-2 pkt 5. Det er behov for kompetanseoppbygging og forskning for å finne fram til gode modeller for helsetjenestens rolle i denne fasen, da det er lite dokumentasjon om hva som er optimal organisering av langtidsoppfølgingen. Nye strukturer som distriktsmedisinske sentre kan spille en viktig rolle i denne oppfølgingen. Organiseringen bør sikre at den enkelte pasients individuelle behov ivaretas og at bred tverrfaglig kompetanse kan tilbys når det er behov for det.
Private rehabiliteringsinstitusjoner/helsesportssentre, egne kommunale eller interkommunale enheter/avdelinger, sykehjem, opplæringsetaten, NAV og hjelpemiddelsentraler er alle aktører som kan være aktuelle å trekke inn for å kunne dekke de ulike behovene som slagpasienter kan ha.
Se kapittel "organisering av slagrehabilitering".
Det skal utarbeides pakkeforløp for hjerneslag som vil være et standardisert pasientforløp supplert med estimater vedrørende optimale tidsangivelser.
Både spesialisthelsetjenesten og helse- og omsorgstjenesten i kommunen vil være viktige aktører for å sikre gode pasientforløp slik at det sikrer effektiv og koordinert behandling og rehabilitering til riktig tid i alle faser av sykdomsforløpet.
Lenke til Forskrift om habilitering og rehabilitering (lovdata)
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag med oppfølgingsbehov
Tiltak (I): Sytematisk organisering i kommunehelsetjenesten
Sammenligning (C): Ingen systematisk organisering i kommunehelsetjenesten
Beskrivelse av inkluderte studier
Referanser
22. Shared responsibility for ongoing rehabilitation: a new approach to home-based therapy after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195367
23. Home rehabilitation after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195368
24. Medical day hospital care for the elderly versus alternative forms of care https://www.helsedirektoratet.no/referanse/0002-0013-195369
25. Evaluation of a multiprofessional community stroke team: a randomized controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195370
26. Stroke rehabilitation after hospital discharge: a randomized trial comparing domiciliary and day‐hospital care https://www.helsedirektoratet.no/referanse/0002-0013-195371
27. Individual patient data meta-analysis of randomized controlled trials of community occupational therapy for stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195372
Sist faglig oppdatert: 21.12.2017
Rehabilitering i spesialisthelsetjenesten
Pasienter med hjerneslag som har behov for spesialisert døgnbasert rehabilitering i forlengelse av akuttoppholdet, bør få tilbud om innleggelse i rehabiliteringsenhet i spesialisthelsetjenesten.
SIGN: A1a
Praktisk – slik kan anbefalingen følges
Rehabiliteringsenheten som bør ha spesiell kompetanse på rehabilitering ved hjerneslag har som oppgaver:
• å gi et tilbud til de pasientene som trenger spesialisert rehabilitering etter behandling i slagenhet
• å gi tilbud for pasienter i senfase, både utredning, eksempelvis førerkortvurdering, og for spesifikk trening for å nå konkrete mål
• å gi veiledning til pasienter og pårørende samt samarbeidspartnere i helse- og omsorgstjenesten i kommunen og andre instanser [21]
• å utrede henviste pasienter fra allmennleger ev. fra andre sykehus- /sykehjems avdelinger
• å initiere utarbeidelse av individuell plan for pasienter med behov for langvarige og koordinerte tjenester
De fleste pasienter med behov for spesialisert rehabilitering vil pga. funksjonsutfall ha behov for et døgntilbud initialt. Dersom pasienten har mulighet til å bo hjemme, bør pasienten lenger ut i rehabiliteringsforløpet få et dagtilbud eller et poliklinisk tilbud.
Tilbud i spesialisthelsetjenesten gis både i sykehus/sykehusavdelinger og i rehabiliteringsinstitusjoner med avtale med de regionale helseforetak. Hver region har en regional koordinerende enhet som gir nærmere informasjon om tilbudet i regionen, se deres respektive nettsider eller ring grønt nummer 800 300 61.
Se kapittel:
- Organisering av slagrehabilitering, anbefaling om høyspesialisert, døgnbasert rehabilitering
Begrunnelse – dette er anbefalingen basert på
Pasienter med alvorlige utfall eller funksjonssvikt etter hjerneslag vil ofte trenge videre rehabilitering i sykehus i en rehabiliteringsenhet i. Effekten av spesialisert tverrfaglig rehabilitering i sykehus er godt dokumentert hvis pasientene samles i en egen enhet i rehabiliteringsavdelingen. [1] [20]
Organiseringen av et slikt rehabiliteringstilbud bør derfor være tilsvarende det som i de randomiserte slagenhetsstudier er betegnet som rehabiliteringsslagenhet ([1] [20] (SIGN:1a). I de randomiserte studier har personalet vært spesialopplært, og det synes å være av betydning for å oppnå de beste resultatene. Det er derfor viktig at personalet i slike rehabiliteringsavdelinger har kompetanse om slag og slagrehabilitering. [1] [20] [18] [19]. Se kapittel "Organisering av slagrehabilitering.
Pasienten har etter pasient- og brukerrettighetsloven §§ 2-1 a og 2-1 b rett på nødvendig helsehjelp fra spesialisthtjenesten og kommune etter et hjerneslag.
Denne retten korresponderer med «sørge-for» ansvaret etter sphtjl § 2-1a og hol § 3-1.
Behandlingen skal være i tråd med kravet til forsvarlig virksomhet i spestjl. § 2-2 og hol § 4-1.
Lenke til Forskrift om habilitering og rehabilitering, individuell plan og koordinator (lovdata.no). Forskriftens § 2 viser til bestemmelsene i spesialisthelsetjenesteloven og helse- og omsorgstjenesteloven vedrørende individuell plan, koordinering og kontaktlege.[21]
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag som trenger rehabilitering i spesilalisthelsetjenesten
Tiltak (I): Døgnbasert behandling i spesialisthelsetjenesten organisert som rehabiliteringsslagenheter
Sammenligning (C): Andre former for døgnbasert organisering av slagrehabiliteringen
Beskrivelse av inkluderte studier
Referanser
1. Organised inpatient (stroke unit) care for stroke. https://www.helsedirektoratet.no/referanse/0002-0013-195346
18. Epidemiology of stroke in Innherred, Norway, 1994 to 1996 https://www.helsedirektoratet.no/referanse/0002-0013-195363
19. Scenario 2030: Sykdomsutviklingen for eldre fram til 2030 https://www.helsedirektoratet.no/referanse/0002-0013-195364
20. Does the organization of postacute stroke care really matter? https://www.helsedirektoratet.no/referanse/0002-0013-195365
21. Forskrift om habilitering og rehabilitering https://www.helsedirektoratet.no/referanse/0002-0013-195366
Sist faglig oppdatert: 21.12.2017
Rehabilitering i den kommunale helse- og omsorgstjenesten
Alle kommuner bør tilby tverrfaglig døgn-, dag- og hjemmerehabilitering ut fra den slagrammedes individuelle behov, eventuelt i samarbeid med andre kommuner.
SIGN: D4.
Praktisk – slik kan anbefalingen følges
Rehabiliteringstjenestene bør være organisert i egne enheter med eget tverrfaglig personale. Frisklivssentralene bør være en del av det totale rehabiliteringstilbudet, gjerne samorganisert med dette. Uavhengig av arena gjennomføres rehabiliteringen i tråd med faglige anbefalinger - samordnet, tverrfaglig og planmessig, med tilstrekkelig intensitet og ut ifra et pasient- og brukerperspektiv. Fokus bør være målrettet, oppgaverelatert trening, som gis i motiverende og stimulerende omgivelser. Informasjon om levevaner og ernæring bør inngå i tilbudet.
Det bør være regelmessig kontakt med fastlegen som er ansvarlig for den medisinske rehabiliteringen.
Hjemme- og dagrehabilitering
Forutsatt tilstrekkelig funksjonsnivå bør hjemmet være foretrukket arena for rehabilitering. Likevel kan bygningsmessige forhold, pårørendes mulighet til støtte og oppfølging, samt rehabiliteringsteamets ressurser til oppfølging i hjemmet være hindringer for optimal effekt. Hver kommune, eventuelle samarbeidende kommuner, bør ha ett eller flere rehabiliteringsteam med ansvar for hjemmebasert rehabilitering. Dette teamet bør bestå av lege, fysioterapeut, ergoterapeut og sykepleier, samt tilgang til logoped og sosionom ved behov. Det kan være hensiktsmessig med tett samarbeid med sykehusets rehabiliteringsteam om enkeltpersoner, både den første tiden etter utskrivning fra sykehus/rehabiliteringsinstitusjon og ved behov for veiledning senere i rehabiliteringsforløpet.
Hjemmebasert rehabilitering kan også gis som, eller i kombinasjon med, et dagtilbud. Det kan være lettere å gi rehabilitering av god kvalitet når flere personer rammet av hjerneslag er samlet i en dagavdeling. Sosiale aspekter kan øke trivsel og motivasjon. Daggrupper kan også egne seg som et vedlikeholdstilbud til slagrammede. Det kan være rom for individuell behandling i gruppene. Dagtilbud krever en tilfredsstillende transportordning og forutsetter akseptable avstander fra hjemmet til dagavdelingen slik at ikke selve transporten blir en for stor belastning.
Institusjonsbasert rehabilitering
Institusjonsbasert rehabilitering bør skje i egne kommunale rehabiliteringsavdelinger/-sentre. Hensikten er å sikre tilstrekkelig kompetanse og fokus på rehabilitering. Interkommunalt samarbeid kan være nødvendig for å skape et godt nok rehabiliteringstilbud. Det bør samarbeides med andre aktuelle kommunale aktører etter behov (fastlege, faggrupper utenfor kommunal rehabiliteringsavdeling/-senter, koordinerende enhet for habilitering og rehabilitering, søknadskontor/forvalterkontor, ambulerende rehabiliteringsteam, opplæringsetat, pleie- og omsorgstjenesten, NAV, senter for attføring m.fl.).
Sykehjem
Vurderingen av hvilke personer som skal tilbys opphold i sykehjem, må baseres på en faglig vurdering og personens og pårørendes ønsker. Vedvarende store utfall med komplette lammelser, store kognitive utfall, manglende evne til å motta instruksjon og uttalt blære-/og eller tarminkontinens er faktorer som ofte medfører at en person ikke kan nyttiggjøre seg intensiv eller spesialisert rehabilitering. Sykehjem bør også tilby fysio-/ergoterapi i form av funksjonstrening og kompenserende tiltak, et stimulerende miljø og kompetent pleiepersonale, slik at funksjoner kan vedlikeholdes og om mulig bedres.
Se også veileder om habilitering og rehabilitering, individuell plan og koordinator, forskrift om habilitering og rehabilitering kap.3, forskriften §4 om brukermedvirkning og pasient- og brukerrettighetsloven
Begrunnelse – dette er anbefalingen basert på
På bakgrunn av funksjon og behov vil personer rammet av hjerneslag ha ulike behov for rehabilitering. Kommunene, eventuelt i et samarbeid mellom flere kommuner, bør derfor ha tilbud om både døgn-, dag- og hjemmerehabilitering.
Hjemme- og dagrehabilitering
Rehabilitering i hjemmet fremmer autonomi, uavhengighet og reintegrering i samfunnet [153] (SIGN:1a) og kan sies å være den optimale rehabiliteringsarena for personer med lettere til moderat funksjonssvikt. I tillegg til den slagrammede blir også pårørende aktive medlemmer i rehabiliteringsteamet. Det finnes god dokumentasjon for effekten av trening rettet mot ADL hos hjemmeboende slagpasienter utført av fysioterapeut, ergoterapeut og tverrfaglige team [153] [172] [27] (SIGN:1a).
Ved hjemmebasert rehabilitering skjer rehabiliteringen i hjemmet og/eller i form av et dagtilbud. Studier har ikke vist noen forskjell i effekt på de to modellene [23] [22] [26] [24] [25] (SIGN: 1a-1b). Muligens er en kombinasjon av metodene mest effektiv, men her trengs mer forskning før sikre konklusjoner kan trekkes.
Studiene som er gjort på dagrehabilitering har vært sprikende og har ikke gitt grunnlag for konklusjoner om effekt sammenlignet med andre rehabiliteringstilbud [312] (SIGN: 1a). ESD-studiene tyder på bedre effekt av dagrehabilitering enn av institusjonsrehabilitering på døgnbasis [50] (SIGN:1b).
Institusjonsbasert rehabilitering: For personer med alvorlige utfall/funksjonssvikt, stort omsorgsbehov og/eller når hjemmet av andre grunner er uegnet som rehabiliteringsarena, kan institusjonsbasert rehabilitering være nødvendig for å kunne heve funksjonsnivået.
Sykehjem: Sykehjem kan være et tilbud til personer rammet av slag der funksjonssvikten er så stor at utskrivning til hjemmet ikke lar seg gjennomføre. Rehabilitering kan være forsøkt eller personen kan være vurdert til å ikke kunne nyttiggjøre seg intensiv eller spesialisert rehabilitering.
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag med behov for kommunal rehabilitering
Tiltak (I): Døgn-, dag- og hjemmerehabilitering organisert i egen avdeling med eget tverrfaglig personale
Sammenligning (C): Standard kommunal rehabilitering
Beskrivelse av inkluderte studier
Referanser
172. Occupational therapy for patients with problems in personal activities of daily living after stroke: systematic review of randomised trials https://www.helsedirektoratet.no/referanse/0002-0013-195517
312. Effects of day-hospital rehabilitation in stroke patients: a review of randomized clinical trials https://www.helsedirektoratet.no/referanse/0002-0013-195657
153. Therapy-based rehabilitation services for stroke patients at home https://www.helsedirektoratet.no/referanse/0002-0013-195498
22. Shared responsibility for ongoing rehabilitation: a new approach to home-based therapy after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195367
23. Home rehabilitation after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195368
24. Medical day hospital care for the elderly versus alternative forms of care https://www.helsedirektoratet.no/referanse/0002-0013-195369
25. Evaluation of a multiprofessional community stroke team: a randomized controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195370
26. Stroke rehabilitation after hospital discharge: a randomized trial comparing domiciliary and day‐hospital care https://www.helsedirektoratet.no/referanse/0002-0013-195371
27. Individual patient data meta-analysis of randomized controlled trials of community occupational therapy for stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195372
50. Stroke unit care combined with early supported discharge https://www.helsedirektoratet.no/referanse/0002-0013-195395
Sist faglig oppdatert: 21.12.2017
Akuttfasen – undersøkelse og behandling ved hjerneslag
Sist faglig oppdatert: 21.12.2017
Akuttfasen er her definert som den første uken etter debut av symptomer på akutt hjerneslag. Gjennomsnittlig liggetid i den slagenhetsmodellen som kombinerer akutt behandling og tidlig rehabilitering og som anbefales i denne retningslinjen, er 7-14 dager [17]. Akuttfasen dekker således en vesentlig del av slagenhetsbehandlingen.
Prehospital fase, behandling under transport
Sist faglig oppdatert: 21.12.2017
Anbefalinger for organisering i den prehospitale fase, se kapittel om organisering av behandlingskjeden.
Overvåkning under transport
Under transport skal pasienten ha kontinuerlig tilsyn, og vitale funksjoner og fysiologisk homøstase bør ivaretas.
SIGN: D4.
Praktisk – slik kan anbefalingen følges
Tiltak under transport til sykehuset:
- Sikre ABC (airway, breathing, circulation)
- Gi oksygen ved oksygenmetning < 95 %
- Heve hodeleie til 15-30 grader
- Ved nedsatt bevissthet legges pas i sideleie med frisk side ned
- Monitorer blodtrykk, puls, hjerterytme og oksygenmetning
- (Eventuelt ta utskrift av 12-kanalers EKG da dette sparer mye tid i mottak).
- Ved BT<120 mm Hg konferer med vakthavende lege ved slagenheten
- Mål blodsukker
- Etabler minst en venevei og gi infusjon med Ringer acetat/ NaCl 0,9 %
- (Med tanke på senere behov for iv tilgang for kontrast i forbindelse med CT med angiografi, prioriteres venevei, grønn eller større, i venstre albueøy).
- Sjekk urinretensjon. Urinkateter ved bevisstløshet
- Behandle kvalme ved behov
- Behandle kramper ved behov
- Gi Paracetamol 1 g ved temperatur >37.5. Mest aktuelt ved lang transporttid til sykehuset.
- Noter mobilnummer til nærmeste pårørende
- Innhent informasjon om debuttidspunkt og nødvendige komparentopplysninger
- Gi ikke noe per os under transport
En del tiltak kan vurderes utsatt dersom det medfører tidstap med tanke på rask inntransport.
Sist faglig oppdatert: 21.12.2017
Diagnostikk og behandling i akuttmottak
Diagnostikk og behandling i akuttmottak ved symptomer på akutt hjerneslag
For pasienter som innlegges med mistanke om akutt hjerneslag, bør det foreligge klare prosedyrer i akuttmottaket for rask diagnostikk.
SIGN: C3.
Praktisk – slik kan anbefalingen følges
Ved ankomst akuttmottaket bør tidspunkt for symptomdebut avklares, og det bør raskt tas stilling til om pasienten er en potensiell kandidat for trombolyse (innen 4 ½ timer fra debut) og/eller trombektomi [55] [58] [56] [57] [54].
Følgende vurderinger er viktige ved ankomst:
For pasienter aktuelle for trombolyse bør det være prosedyrer for prehospital varsling, slik at et team står klart når pasienten ankommer akuttmottaket og kan tilrettelegge for raskest mulig reperfusjons-behandling, som inkluderer:
• Akutt bildeundersøkelse: CT caput med CT angiografi - om ikke det foreligger kontraindikasjoner, dvs. kjent nyresvikt eller kontrastallergi (alternativt MR caput).
• Sjekk av glukosenivå og INR på hurtigste måte. Hvis pasienten ikke er antikoagulert med warfarin, er det bare nødvendig å sjekke glukose stix før trombolyse. Dersom pasienten ikke kan gjøre rede for sin legemiddelbruk, og det er uklart hvilke legemidler pasienten bruker, bør dette sjekkes i reseptformidler og kjernejournal.
• Klinisk og nevrologisk vurdering som bør gjennomføres i løpet av få minutter inklusive NIHSS.
• Innleggelse av 2 perifere venekanyler hvis det ikke er gjort tidligere. Infusjon av Ringer eller NaCl startes.
Andre viktige vurderinger:
• Luftveier og respirasjon sikres (frekvens og dybde, oksygenmetning > 95 %). Hodeelevasjon til 30 grader.
• Sirkulasjon (BT, hjertefrekvens, rytme). Systolisk BT bør holdes >120 og < 220 mm Hg (obs spesielle BT-grenser for trombolyse. Se anbefaling om blodtrykkskontroll i akuttfasen ved hjerneinfarkt.
• Svelgevansker: Null per os inntil svelgetest er gjennomført.
• Urolig pasient: Urinretensjon vurderes.
Etter oppstart av trombolyse og evt. trombektomi vurderes pasienten nærmere for differensialdiagnostikk og ledsagende tilstander, særlig hjerteinfarkt og infeksjon.
• Blodprøver: Glukose, Hemoglobin,hvite blodlegemer, trombocytter, INR, CRP, Na, K, kreatinin, Troponin.
• EKG tas med spørsmål om iskemi og atrieflimmer.
Ny vurdering av pasienten med vitale funksjoner, kardiovaskulær status og NIHSS bør gjennomføres når pasienten overtas av slagenheten.
Begrunnelse – dette er anbefalingen basert på
For pasienter som innlegges med mistanke om akutt hjerneslag, bør det foreligge klare prosedyrer i akuttmottaket for rask diagnostikk og god kommunikasjon med vakthavende lege og avtaler med akuttmottak, røntgenavdeling, laboratorietjenester og slagenhet for å redusere tidsbruk.
Forskningsgrunnlag
Populasjon (P): Pasienter med symptomer på akutt hjerneslag
Tiltak (I): Diagnostikk og behandling i akuttmottak
Sammenligning (C): NOTSET!
Beskrivelse av inkluderte studier
Referanser
54. Reliability of the national institutes of health stroke scale https://www.helsedirektoratet.no/referanse/0002-0013-195399
55. Tissue plasminogen activator for acute ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195400
56. Door to thrombolysis: ER reorganization and reduced delays to acute stroke treatment https://www.helsedirektoratet.no/referanse/0002-0013-195401
57. The Recognition of Stroke in the Emergency Room (ROSIER) scale: development and validation of a stroke recognition instrument https://www.helsedirektoratet.no/referanse/0002-0013-195402
58. The ECASS 3-hour cohort https://www.helsedirektoratet.no/referanse/0002-0013-195403
59. Thrombolysis for acute ischaemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195404
60. Effekt av trombolytisk behandling i http://www.kunnskapssenteret.no/publikasjoner/effekt-av-trombolytisk-behandling-i-intervallet-3-til-4-5-timer-etter-hjerneslag
51. Mekanisk trombektomi ved akutt hjerneinfarkt. Mechanical https://www.fhi.no/publ/2016/mekanisk-trombektomi-ved-akutt-hjerneinfarkt-del-2.-helseokonomisk-evalueri/
Sist faglig oppdatert: 21.12.2017
Bildediagnostikk
Øyeblikkelig bildediagnostikk ved akutt hjerneslag
Pasienter med symptomer på akutt hjerneslag bør umiddelbart undersøkes med CT eller MR.**
Pasienter med akutt hjerneinfarkt bør undersøkes med CT-angiografi. **
Pasienter med akutt hjerneblødning bør undersøkes med CT angiografi av intrakraniale kar. **
Praktisk – slik kan anbefalingen følges
Rask bildeundersøkelse er nødvendig for å avklare om det foreligger hjerneblødning.
Det er spesielt viktig med CT umiddelbart for pasienter som er aktuelle for trombolyse. CT bør hos slike pasienter som regel gjennomføres innen 15 minutter fra ankomst til akuttmottaket.
Trombolysebehandling bør startes så raskt som mulig etter bildediagnostikk som utelukker blødning, og kan starte før CT angio hvis denne undersøkelsen forsinker oppstart i betydelig grad. Se anbefaling om trombolyse.
Pasienter med akutt hjerneinfarkt bør undersøkes med CT angiografi (CTA) som omfatter karavgangene fra aortabuen, halskar og intrakraniale kar til vertex. Det kan være nyttig å bruke kildebilder i tolkningen. CTA med iv kontrast gir en rask og god oversikt over ekstrakraniale og intrakraniale arterier [65] [66]. MR angiografi kan være et godt alternativ som enkelte ganger kan gi noe tilleggsinformasjon, men det er betydelig mer tidkrevende, og inngår vanligvis ikke i den akutte utredningen.
CTA kan i tillegg vise aneurismer, andre karmalformasjoner, pågående blødning («spot sign»), og av og til arteritter. CTA kan hos de fleste pasienter utføres i forløpet av en standard CT med liten ekstra tidsbruk.
MR-angiografi's (MRA) sensitivitet og spesifisitet for større okklusjoner er 70 til 100 %. MRA uten bruk av kontrast kan overestimere høygradige stenoser på halsen. Kontrastforsterket MRA gir en meget god framstilling av precerebrale stenoser og okklusjoner [69], men gir ingen fremstilling av kalk i åreveggen, slik CTA gjør. MRA kan ikke med tilfredsstillende sikkerhet påvise distale okklusjoner [65].
For påvisning av distale okklusjoner er konvensjonell cerebral angiografi og CTA bedre. Ved mistanke om disseksjon vil kontrastforsterket CT eller MR med aksiale snitt være nyttig.
Angio er særlig viktig hos pasienter med alvorlige slagsymptomer som kan være aktuell for trombektomi. Som et supplement til CT- eller MR- angiografi, kan det gjøres en CT- eller MR-perfusjon hos pasienter med akutt hjerneinfarkt.
CT- perfusjon kan gi en mer sikker vurdering av infarktet enn ikke kontrast CT. [84].
Perfusjonsundersøkelser kan vise forandringer som kan bidra til bedret diagnostikk samt belyse årsak og alvorlighetsgrad. Samlet kan denne informasjonen gi støtte til kliniske vurderinger.
Det er ikke funnet grunnlag for anbefalinger vedrørende perfusjonsundersøkelser. Men CT-perfusjon med iv kontrast kan være til hjelp for å differensiere mellom reversibel og irreversibel iskemi, dvs. kartlegge penumbrasonen eller det området i hjernen som fortsatt kan reddes ved reperfusjonsbehandling [70]. Perfusjonsundersøkelse kan også avklare om det foreligger hypo- eller hyperperfusjon, som begge kan gi de samme symptomene. MR-perfusjon med iv kontrast sammen med diffusjonsvektet MR kan definere penumbrasonen som den sonen som har kritisk nedsatt perfusjon, men ennå ikke diffusjonsavvik (diffusjon-perfusjon-"mismatch") [62], og kan være nyttig også ved vurdering av «wake-up stroke». Hvilke behandlingsmessige konsekvenser en slik "mismatch" bør få, er ikke avklart. Det finnes også andre metoder for bildeundersøkelser som kan gi noe av den samme tilleggsinformasjon, for eksempel multifaseangio som kanskje er enklere å implementere ved mange av våre sykehus. Men om dette er et aktuelt alternativ i forhold til CT-perfusjon er foreløpig ikke godt nok klarlagt.
Begrunnelse – dette er anbefalingen basert på
Initial bildediagnostikk av hjernen bør skje umiddelbart, primært for å avklare om det foreligger et hjerneinfarkt eller en hjerneblødning. CT caput har høy sensitivitet og spesifisitet for å oppdage fersk blødning både i hjernen og i hjernens hinner.
Ved infarkt kan tidlige iskemiske forandringer ses i løpet av de første 6 timene etter debut, særlig ved store infarkter [67] [68]).Utbredte tidlige iskemiske forandringer taler for en større arterieokklusjon, dårlig kollateralsirkulasjon og en dårlig prognose.
CT har lav sensitivitet både for svært tidlige vevsforandringer ved infarkt og ved små infarkter. ASPECT-score kan benyttes [64]. CT er spesielt dårlig til å påvise iskemi i hjernestamme og bakre skallegrop [63].
Diffusjonsvektet MR er mer sensitiv enn CT og viser infarkt nærmest umiddelbart (ref Brazelli). MR er særlig nyttig ved usikker diagnose og ved infarkter i bakre kretsløp.
CT- og MR- perfusjon kan gi informasjon om hemodynamikk og vevsperfusjon. For mer informasjon om dette, se praktisk informasjon.
Påvisning av en ekstrakranial eller intrakranial okklusjon ved CT angiografi kan ha betydning for valg av behandling (i.v trombolyse og/eller trombektomi). Kollateraler kan vurderes og kan ha betydning for den generelle behandlingen (perfusjonstrykk), og har også en prognostisk verdi [66].
Ved hjerneblødning gir CT informasjon om lokalisasjon, blødningsvolum, grad av ødem rundt hematomet og ev. gjennombrudd til ventrikkelsystemet. Ved blødninger kan CT-angiografi med kontrast vise «spot sign» som er assosiert med hematomvekst. Rask diagnose av en akutt hjerneblødning er nødvendig, bl.a. fordi blødninger kan gi klinisk forverring i løpet av få timer [71];[72], og nye blødninger kan oppstå.
MR med SWI (sekvenser for å påvise hemosiderin) kan bidra til å bestemme årsaken til hjerneblødningen. Lokalisasjon, MR- og CT-funn kan sannsynliggjøre om det foreligger en hypertensiv blødning, blødning på bakgrunn av amyloid angiopati, aneurisme/karmalformasjon eller annen årsak. MR kan vise om årsaken er aneurisme eller annen karmalformasjon. MR SWI avdekker mikroangiopatier som både kan være årsak til aktuell blødning, men også er en risikofaktor for nye blødninger.
CT-angiografi kan i tillegg vise aneurismer, andre karmalformasjoner, pågående blødning («spot sign») og artritter.
Det kan være en fordel å bruke kildebilder ved tolkning av denne undersøkelsen.
Ved klinisk forverring bør CT-/MR gjentas med spørsmål om hematomvekst, gjennombrudd til ventrikkelsystemet, utvikling av hydrocephalus eller herniering. Pasienter med gjennombrudd til ventrikkelsystemet bør, også uavhengig av klinikken, følges opp med flere CT-/MR-undersøkelser. Pasienter med hjerneblødning bør tidlig undersøkes med CT-/MR-angiografi. Er det mistanke om aneurismeblødning, bør angiografi tas med en gang
Referanser
61. Magnetic resonance imaging versus computed tomography for detection of acute vascular lesions in patients presenting with stroke symptoms https://www.helsedirektoratet.no/referanse/0002-0013-195406
62. EFNS guideline on neuroimaging in acute stroke. Report of an EFNS task force https://www.helsedirektoratet.no/referanse/0002-0013-195407
63. CT and Conventional and Diffusion-weighted MR Imaging in Acute Stroke: Study in 691 Patients at Presentation to the Emergency Department 1 https://www.helsedirektoratet.no/referanse/0002-0013-195408
64. Use of the Alberta Stroke Program Early CT Score (ASPECTS) for assessing CT scans in patients with acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195409
65. Noninvasive angiography (magnetic resonance and computed tomography) in the diagnosis of ischemic cerebrovascular disease https://www.helsedirektoratet.no/referanse/0002-0013-195410
66. Clinical application of CT angiography in acute ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195411
67. Early Prediction of Irreversible Brain Damage after Ischemic Stroke at CT 1 https://www.helsedirektoratet.no/referanse/0002-0013-195412
68. Detectability of cerebral hemisphere ischaemic infarcts by CT within 6 h of stroke https://www.helsedirektoratet.no/referanse/0002-0013-195413
69. Non-invasive imaging compared with intra-arterial angiography in the diagnosis of symptomatic carotid stenosis: a meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195414
70. Prognostic accuracy of cerebral blood flow measurement by perfusion computed tomography, at the time of emergency room admission, in acute stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195415
71. Early hemorrhage growth in patients with intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195416
72. Lack of evidence for an association between hemodynamic variables and hematoma growth in spontaneous intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195417
84. Referenceprogram for behandling af patienter med apopleksi www.dsfa.dk/referenceprogram
Sist faglig oppdatert: 21.12.2017
Ultralydundersøkelse av karsystemet
Ultralyd halskar bør gjøres hos pasienter med hjerneslag/TIA.**
Transkranial ultralydundersøkelse kan utføres hos pasienter med akutt hjerneinfarkt/TIA.**
Praktisk – slik kan anbefalingen følges
Pasienter med akutt hjerneinfarkt eller TIA bør undersøkes med ultralyd av halskar i løpet av de første 1-2 døgn.
For en del pasienter kan det gi nyttig tilleggsinformasjon med ultralyddiagnostikk selv hvor det er utført CT angiografi. For pasienter som vil være aktuelle kandidater for operasjon, viss det påvises signifikante symptomatiske stenoser, er det ønskelig at undersøkelsen utføres så tidlig som mulig.
Hos pasienter der en vurderer at undersøkelsen ikke har diagnostiske eller behandlingsmessige konsekvenser, kan undersøkelsen utelates. Dette vil blant annet gjelde pasienter med alvorlige hjerneslag eller stor komorbiditet, samt hos pasienter der det er utført CT angiografi som har gitt tilstrekkelig informasjon om karstatus.
Transkranial ultralydundersøkelse kan suppleres med embolimonitorering ved usikker embolikilde og kan av og til understøtte terapeutiske avgjørelser hos enkelte pasienter.
Begrunnelse – dette er anbefalingen basert på
Duplex-/Triplex-ultralydundersøkelse av halskar kan med høy sensitivitet og spesifisitet påvise okklusjoner og høygradige stenoser nesten på nivå med kontrastforsterket MRA [69]. Påvisning av grad av stenose er viktigste behandlingsmessige konsekvens av denne ultralydundersøkelsen.
Ultralydundersøkelse kan imidlertid også gi et bedre bilde av graden av aterosklerose enn andre modaliteter [82]. Kontrastforsterket ultralyd kan gi tilleggsinformasjon ved mistanke om ustabile plakk. Ultralyd av halspulsårer gir også hemodynamisk informasjon som CTA og MRA ikke gir. Undersøkelsen bør utføres hos alle pasienter som kan være aktuell for karotis endarterektomi, men bør også utføres hos pasienter hvor undersøkelsen antas å kunne være til nytte for vurdering av andre behandlingstiltak. Halskarundersøkelsen kan også kombineres med transkranial ultralydundersøkelse [78].
Transkranial duplex-undersøkelse kan utføres på pasienter med særlig risiko for hypoperfusjon eller mistanke om intrakraniale stenoser [76] [80]. Transkranial doppler (TCD) kan enkelt gjentas og gir mulighet for tett oppfølgning av CT- eller MR-påviste okklusjoner.
TCD kan benyttes til kontinuerlig monitorering av rekanalisering under og etter trombolytisk behandling og har prognostisk verdi [77] [79] [81]. TCD kan også benyttes for å vurdere vasoreaktivitet ved redusert cerebral perfusjon. Fordeler med ultralyd er muligheten for kontinuerlige eller repeterte undersøkelser i akuttstadiet. Ulempen er mangel på temporalt beinvindu hos 10-15 % av pasientene og at resultatet i større grad enn for andre undersøkelser av karsystemet er avhengig av undersøkers kompetanse.
Referanser
69. Non-invasive imaging compared with intra-arterial angiography in the diagnosis of symptomatic carotid stenosis: a meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195414
76. Yield of transcranial Doppler in acute cerebral ischemia https://www.helsedirektoratet.no/referanse/0002-0013-195421
77. CLOTBUST: Design of a Randomized Trial of Ultrasound‐Enhanced Thrombolysis for Acute Ischemic Stroke https://www.helsedirektoratet.no/referanse/0002-0013-195422
78. Yield and accuracy of urgent combined carotid/transcranial ultrasound testing in acute cerebral ischemia https://www.helsedirektoratet.no/referanse/0002-0013-195423
79. Timing of recanalization after tissue plasminogen activator therapy determined by transcranial Doppler correlates with clinical recovery from ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195424
80. Contrast-enhanced transcranial color-coded sonography in acute hemispheric brain infarction https://www.helsedirektoratet.no/referanse/0002-0013-195426
81. Doppler ultrasound and clinical findings in patients with acute ischemic stroke treated with intravenous thrombolysis https://www.helsedirektoratet.no/referanse/0002-0013-195427
82. Ultrasound and arterial wall disease https://www.helsedirektoratet.no/referanse/0002-0013-195425
Sist faglig oppdatert: 21.12.2017
Ultralydundersøkelse av hjertet ved akutt hjerneinfarkt og TIA
Pasienter med akutt hjerneinfarkt og med mistanke om kardial emboli som årsak bør bli undersøkt med ultralyd av hjertet. **
Se også anbefaling om utredning for sekundærforebygging ved hjerneslag.
Praktisk – slik kan anbefalingen følges
Ekkokardiografi bør utføres i de tilfeller hvor det foreligger mistanke om kardial emboli som årsak til hjerneinfarkt og TIA uten kjent atrieflimmer og hvor funn ved ekkokardiografi vil kunne ha behandlingsmessige konsekvenser.
Pasienter med hjerneinfarkter i flere karområder, tidligere eller akutt hjerteinfarkt, hjertesvikt eller kunstig hjerteventil, samt pasienter (særlig yngre <60 år) uten kjent årsak til hjerneinfarktet bør prioriteres for ekkokardiografi.
Begrunnelse – dette er anbefalingen basert på
Transtorakal ekkokardiografi (TTE) kan avdekke potensielle kardiale embolikilder [83]. Transøsofagal ekkokardiografi (TØE) gir bedre informasjon enn TTE i de tilfeller hvor det er særlig grunn til å mistenke kardiale embolikilder som hos yngre pasienter og ved åpentstående foramen ovale eller atrieseptum-aneurysme eller emboli fra mekanisk hjerteventil. TØE vil også ofte kunne avdekke aterosklerotiske plakk i aortabuen, men det er ennå uklart om et slikt funn bør føre til endringer i behandlingsopplegget. Pasienter med ikke-valvulær atrieflimmer skal i utgangspunktet gis antikoagulasjonsbehandling, og ekkokardiografi gir som regel ikke tilleggsinformasjon som endrer dette.
Referanser
83. ACC/AHA/ASE 2003 guideline update for the clinical application of echocardiography: summary article https://www.helsedirektoratet.no/referanse/0002-0013-195428
Sist faglig oppdatert: 21.12.2017
Kontroll bildeundersøkelse hos pasienter med akutt hjerneinfarkt og hjerneblødning
Ved hjerneinfarkt bør kontrollundersøkelse av hjernen med MR eller CT utføres minst én gang for vurdering av skadeomfang.**
Ved hjerneblødning bør kontrollundersøkelse av hjernen med CT caput tas innen 24 -36 timer for å oppdage eventuell ekspansjon av hematomet. **
Praktisk – slik kan anbefalingen følges
Ved hjerneinfarkt bør kontrollundersøkelse av hjernen med MR eller CT utføres minst én gang for vurdering av skadeomfang. MR gir oftest mer informasjon enn CT. Ved usikker diagnose anbefales MR. Ved utredning av pasienter med transitorisk iskemisk anfall er MR å foretrekke framfor CT. Det er som oftest tilstrekkelig med kun 2 MR-sekvenser for å besvare de aktuelle spørsmål for denne pasientgruppen (Diffusjon og FLAIR). Undersøkelsen er derfor lite tidkrevende.
MR er vanligvis å foretrekke ved kontrollundersøkelse og hvis ikke behov for øyeblikkelig bildediagnostikk, kan CT her utgå. I praksis vil dette bety at ved akutt hjerneinfarkt vil CT utføres akutt, men MR anbefales ved kontrollundersøkelse spesielt ved usikker diagnose, jfr. anbefaling og begrunnelse.
Begrunnelse – dette er anbefalingen basert på
Cerebral MR skiller godt mellom mange differensialdiagnoser, inklusive infarkt og blødning [75]. MR skiller bedre enn CT mellom akutte og eldre iskemiske forandringer og kan benyttes for å sikre diagnosen og sannsynliggjøre mekanismene bak infarktet.
MR med diffusjonsserie (DWI) kan vise et akutt iskemisk område allerede etter få minutter og i tillegg vise svært små lesjoner. Ulike MR-sekvenser kan samlet gi mulighet for å bestemme alder på den iskemiske skaden [73].
MR påviser i tillegg til små akutte infarkter også infarktstørrelse og asymptomatiske multiple infarkter som kan være av betydning ved vurdering av sannsynlige årsaker og valg av sekundærprofylakse [74]. MR er foretrukket undersøkelse for å påvise lesjoner i bakre kretsløp [63].
Særlig hos pasienter med usikker diagnose, ved små hjerneinfarkter og ved TIA, er MR å foretrekke fremfor CT for å øke den diagnostiske presisjon. MR er mer nyttig enn CT til å utelukke infarkt hos pasienter med slaglignende symptomer .
MR kan bidra til en mer målrettet utredning og sikrere svar. Dette kan redusere risiko for unødvendig utredning og behandling.
MR gir mindre eksponering for ioniserende stråling enn repeterte CT-undersøkelser .
Begrensninger ved bruk av MR er tilgjengeligheten av MR og pasientens evne til å gjennomføre undersøkelsen pga. f.eks. uro, klaustrofobi eller kontraindikasjon mot undersøkelse i magnet. Økt bruk av MR kan føre til behov for flere folk til å ta og tolke bildene og kompetanse/opplæring av fagpersoner. Dette kan kreve en omprioritering.
Det er også viktig å være klar over at en MR undersøkelse ikke alltid er i stand til å fange opp et akutt hjerneinfarkt, og en pasient kan ha et hjerneinfarkt selv om MR undersøkelsen er negativ [85] .
Temaet har ikke vært gjenstand for PICO og GRADE-prosessen, men det har i arbeidet med revisjon retningslinje hjerneslag vært avholdt møte med det radiologiske fagmiljøet, og arbeidsgruppen ser nå behov for en utvidet bruk av MR i utredningen av pasienter med hjerneinfarkter og transitoriske iskemiske anfall (TIA), som er en endring fra 2010-anbefalingen. Særlig hos pasienter med usikker diagnose, ved små hjerneinfarkter og ved TIA og negativ CT er MR spesielt nyttig.
Ved hjerneblødninger anbefales en kontrollundersøkelse. Kontrollen ved hjerneblødning tar sikte på å oppdage evt ekspansjon av hematomet. Vanligvis vil en slik ekspansjon finne sted etter 24 t og en kontrollundersøkelse mellom 24-36 timer anbefales for å oppdage dette. Ved klinisk forverring i løpet av første døgn, bør CT caput gjennomføres øyeblikkelig
Referanser
63. CT and Conventional and Diffusion-weighted MR Imaging in Acute Stroke: Study in 691 Patients at Presentation to the Emergency Department 1 https://www.helsedirektoratet.no/referanse/0002-0013-195408
73. Guidelines for the early management of adults with ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195418
74. Significance of early CT signs in acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195419
75. Effect of Incomplete (Spontaneous and Postthrombolytic) Recanalization After Middle Cerebral Artery Occlusion https://www.helsedirektoratet.no/referanse/0002-0013-195420
Sist faglig oppdatert: 21.12.2017
Reperfusjonsbehandling og antitrombotisk behandling ved akutt hjerneinfarkt
Antitrombotisk kombinasjonsbehandling med platehemmerene klopidogrel og acetylsalisylsyre ved små hjerneinfarkter og høyrisiko TIA
Pasienter med små hjerneinfarkt eller høy risiko TIA bør behandles med dobbel platehemming med acetylsalisylsyre (ASA) og klopidogrel med oppstart innen 24 timer etter debut av symptomer og med behandlingsvarighet 21 dager.
Denne anbefalingen gjelder for pasienter med:
- små hjerneinfarkter definert som hjerneinfarkt som gir National Institutes of Health Stroke Scale skår 0-3 poeng
- høyrisiko TIA definert som TIA med ABCD2 skår 4-7 poeng (se ABCD2 skår under)
Behandlingen bør starte tidligst mulig etter diagnostisk avklaring og innen 24 timer.
Praktisk – slik kan anbefalingen følges
Seleksjon:
I klinisk praksis bør dobbel platehemming benyttes til pasienter hvor det er god dokumentasjon for effekt.
Studiene som dokumenterer effekt av dobbel platehemming, har inkludert pasienter med
- små hjerneinfarkter definert som lette slagsymptomer med National Institutes of Health Stroke Scale skår 0-3 poeng
- alvorlige TIA med høy risiko for etterfølgende hjerneinfarkter definert som TIA med ABCD2 skår 4-7 poeng
Det er hensiktsmessig å benytte NIHSS og ABCD2 skår for utvelgelse av pasienter for de studier som utgjør forskningsgrunnlaget har benyttet disse kriteriene.
| Risikofaktor | Kategori | Poeng | |
|---|---|---|---|
| A | Alder | Alder > 60 å Alder < 60 år | 1 0 |
| B | Blodtrykk | Systolisk BT>140 mmHg eller diastolisk BT>90 mmHG Lavere BT | 1 0 |
| C | Kliniske kjennetegn | Halvsidig lammelse Språk/taleforstyrrelser uten lammelser Ingen lammelser eller språkforstyrrelser | 2 1 0 |
| D | Varighet av symptomutfall | >60 min 10- 59 min <10 min | 2 1 0 |
| D | Diabetes | Diabetes tilstede Ingen diabetes | 1 0 |
| Total skår | /7 |
Pasienter som har atrieflimmer og hjerneinfarkt med NIHSS 0-3 eller alvorlige TIA har vært ekskludert fra studiene. Det samme gjelder for pasienter som behandles med antikoagulasjon før slaget/TIA eller har behov for antikoagulasjon i sekundær profylakse. Disse pasientgrupper er ikke aktuelle for dobbel platehemming, men skal behandles iht. eksisterende anbefalinger om antitrombotisk behandling i akuttfasen og den videre sekundær profylakse.
Studiene har ikke inkludert pasienter som har fått intravenøs trombolyse, så dokumentasjon for dette mangler. Etter individuell vurdering, kan det hos pasienter uten stor blødningsrisiko være aktuelt å vurdere dobbel platehemming 24 timer etter trombolyse hvis NIHSS er 0-3 og det ikke er påvist blødning. Se anbefaling om "antitrombotisk behandling etter trombolyse":
Omfang:
I Norge har halvparten av pasienter som innlegges med akutt hjerneinfarkt NIHSS 0-3 (Årsrapport 2020 Norsk hjerneslagregister, PDF) og over 60 % av pasienter med TIA har ABCD2 skår 4-7 (Ildstad et al.19). Selv om det i disse tallene også inngår de som har behov for antikoagulasjon, så betyr dette at et stort antall pasienter med akutt hjerneinfarkt og TIA vil være aktuelle for slik dobbel platehemming.
Oppstart av behandling:
Det anbefales at behandlingen starter tidligst mulig etter diagnostisk avklaring og helst innen 24 timer etter debut av symptomer, men oppstart innen 48 - 72 timer gir sannsynligvis også en positiv effekt. For pasienter med symptomer forenlig med hjerneinfarkt (vedvarende slagsymptomer med NIHSS 0-3 ) utføres bildediagnostikk før oppstart av platehemming for å utelukke blødning (Johnston et al 2019: A Secondary Analysis from the POINT Randomized Trial).
For pasienter med høyrisiko TIA (ABCD 2 skår 4-7) kan initialt platehemmende behandling med acetylsalisylsyre (ASA) starte før bildediagnostikk. Se under praktiske råd i anbefaling om behandling av TIA. Tilleggsbehandling med klopidogrel foreslås etter at bildediagnostikk har utelukket blødning da de aktuelle studier når det gjelder dobbel platehemming har gjennomført bildediagnostikk før behandlingsstart.
Dosering:
Som praktisk råd anbefales til de fleste pasienter i denne anbefalingen ladningsdose ASA 300 mg og klopidogrel 300 mg, etterfulgt av 75 mg x1 for begge legemidler. I studiene er det brukt ladningsdose for klopidogrel 300-600 mg, ASA varierende fra 75 – 300 mg, så noe entydig dokumentasjon når det gjelder optimal dosering foreligger ikke. Med det aktuelle doseringsrådet antas at det meste av effekten av dobbel platehemming tas ut og uten noen klinisk betydningsfull økning av blødningsrisiko.
Ved økt blødningsrisiko, bør det i stedet for dobbel platehemming med ASA og klopidogrel gis ASA monoterapi i dose 150 mg - 300mg initialt etterfulgt av videre sekundærprofylakse med klopidogrel i monoterapi eller kombinasjon ASA/DP (lenke til anbefaling: antitrombotisk sekundær profylakse)
Hvis pasienten etter reperfusjonsbehandling med trombolyse/trombektomi har NIHSS 0-3 og bildediagnostikk 24 timer etter behandling ikke viser tegn til blødning eller stort infarkt, kan pasienten vurderes for dobbel platehemming, Men det finnes ikke informasjon om at slike pasienter er inkludert i de randomiserte studier så kunnskapsgrunnlaget er mangelfullt og noen sterke anbefalinger for denne pasientgruppen kan ikke gis
Behandlingsvarighet:
Det anbefales at behandlingen med kombinasjonen av ASA og klopidogrel gis 21 dager. Studiene definerer minimum 10 dager og 21 dager eventuelt opp til 30 dager som de sannsynlig mest optimale behandlingsperioder. Risiko for blødninger øker jo lengre behandlingen foregår, mens det meste av effekten når det gjelder å forhindre hjerneslag synes å bli tatt ut i løpet av de første 21 dager. Unntaksvis ved høy blødningsrisiko kan behandling i 10 dager vurderes framfor 21 dager.
Videre sekundærprofylakse etter 21 dager når det gjelder platehemming, bør følge de generelle anbefalinger der klopidogrel monoterapi eller kombinasjon ASA og dipyridamol anbefales.
Begrunnelse – dette er anbefalingen basert på
Revidert Nasjonal faglig retningslinje for behandling og rehabilitering ved hjerneslag ble publisert 18. desember 2017. Anbefalingen var da:
"Det foreslås at det etter individuell vurdering kan tilbys dobbel platehemmende behandling med acetylsalicylsyre (ASA), og klopidogrel i en tidsavgrenset periode:
- Til pasienter som fra før behandles med ASA når de får akutt TIA/hjerneinfarkt.
- Til pasienter med TIA/hjerneinfarkt med fluktuerende utfall eller forverring av utfall
Med grundig individuell vurdering og kort behandlingstid, kan disse anbefalingene fortsatt være aktuelle.
Pga ny kunnskap om dobbel platehemming vs enkel platehemming til pasienter med høyrisiko TIA og små hjerneinfarkt, ble arbeidet med utarbeidelse av ny anbefaling om dobbel platehemming satt i gang i 2020.
En ny anbefaling er basert på følgende kunnskapsgrunnlag:
- Meta-analyse ved Hao et al 2018 med tre RCT (FASTER, CHANCE, POINT) .
- Arbeidsgruppens samlede erfaring og kunnskap
Anbefalingen er i tråd med anbefalingene i ESO (Catarina Fonseca, A. et al.) og AHA/ASA guidelines (Kleindorfer, D. O. et al. 2021, Stroke (2021).
Det er blitt benyttet følgende støttelitteratur - som også støtter seg til og bruker Hao 2018 som primærartikkel:
Prasad et.al., 2018 er både en samleanalyse av de tre studiene med til sammen 10447 pasienter og påfølgende GRADE- basert anbefaling. Denne viser nøyaktig det samme som Hao et al. 2018, men den eneste vesentlige forskjell i de to oversiktene er at Hao i tillegg har med utfall som «Myocardial infarction» og «Nonfatal and fatal recurrent stroke»
Studiene det refereres til har valgt å begrense dobbel platehemming til små hjerneinfarkt fordi tidligere studier (MATCH studien, 2004) har vist vesentlig blødningsrisiko med dobbel platehemming ved større /alvorligere hjerneinfarkt
- Små hjerneinfarkt er definert som NIHSS < 3
- TIA med høy risiko for påfølgende hjerneinfarkt er definert som pasienter med TIA med ABCD2 skår 4 - 7.
Begrunnelse for begrensninger til små hjerneinfarkter:
Dobbel platehemming er begrenset til hjerneinfarkter med NIHSS skår 0-3 poeng, fordi studier med dobbelt platehemming for pasienter med moderate og store hjerneinfarkt (MATCH studien 2004) har gitt større risiko for blødning enn for pasienter med mindre hjerneinfarkt. Blødningsrisikoen har vært så stor at dobbelt platehemming ikke har gitt noen positiv effekt ved moderate og store hjerneinfarkter.
Begrunnelse for begrensninger til høyrisiko TIA:
I studiene som har undersøkt effekten av dobbel platehemming ved TIA er ABCD2 skår benyttet for å definere TIA med størst risiko for å få etterfølgende hjerneinfarkt. Høy ABCD2 skår øker også sannsynligheten for at den forbigående hendelsen har vært et TIA og det er sikker/sannsynlig TIA med ABCD2 skår 4-7 som kan være aktuelle for dobbel platehemming. ABCD2 skår er ikke alene egnet til å vurdere risiko for hjerneslag etter TIA, og alle pasienter med TIA har behov for rask utredning. Alle studier som har benyttet ABCD2 skår har imidlertid vist at gruppen som har skår 4-7 har dobbel risiko for etterfølgende hjerneslag sammenlignet med gruppen som har skår 0-3. I de studier som danner kunnskapsgrunnlaget for denne anbefalingen, er høyrisiko TIA definert som pasienter med ABCD2 skår 4-7. Anbefalingene om dobbel platehemming har derfor begrenset indikasjonen for slik behandling til ABCD2 skår 4-7.
For gruppen av pasienter med ABCD2 skår 0-3 er nå risiko for etterfølgende hjerneinfarkt så liten at dobbel platehemming ikke er indisert, og det foreligger heller ingen dokumentasjon for bruk av dobbel platehemming ved slike lavrisiko TIA.
Begrunnelse for behandlingsvarighet 21 dager
Kaplan-Meier kurve for nye hendelser viser:
Risiko for å få nytt hjerneinfarkt ved dobbel platehemming sammenlignet med monoterapi, reduseres allerede fra første døgn, og den største effekten tas ut allerede de første 10 dager, men med en ytterligere ekstra effekt fram til 21 dager. Vår anbefaling har derfor på samme måte som anbefalingene fra European Stroke Organisation valgt 21 dager som den foretrukne behandlingstid. (Johnston et al 2019: A Secondary Analysis from the POINT Randomized Trial)
Studiene viser at den positive effekten av behandlingen oppnås ved behandling i 21 dager, mens den negative effekten (blødninger) fortsetter ved behandling i mer enn 21 dager.
I tilknytning til utarbeidelsen av denne anbefalingen er det ikke søkt etter ny kunnskap om dobbel platehemming ved moderate til alvorlige hjerneslag, andre kombinasjoner av platehemmere enn ASA og klopidogrel eller sammenligning av ASA og klopidogrel med andre platehemmere enn ASA i monoterapi.
Forskningsgrunnlag
Populasjon (P): Pasienter med små hjerneinfarkter og høyrisiko TIA .
Tiltak (I): dobbelt platehemming med ASA og klopidogrel
Sammenligning (C): ASA
Beskrivelse av inkluderte studier
SOF tabell 1: ASA + klopidogrel versus ASA
En kort oversikt/sammendrag over det forskningsbaserte kunnskapsgrunnlaget og effekter av dobbel platehemming med klopidogrel og ASA ved små hjerneinfarkt og høyrisiko TIA.
Den systematiske oversikt som er valgt ut som forskningsgrunnlag om dobbel platehemming er en oversikt publisert av Hao og medarbeidere i British Medical Journal Open i 2018.
Oversikten inneholder 3 studier som presenterer resultatene av sammenligningen av effekt og risiko med klopidogrel og ASA mot ASA som monoterapi for pasienter med høyrisiko TIA og milde iskemiske hjerneslag:
- Kennedy J, et al. Fast assessment of stroke and transient ischaemic attack to prevent early recurrence (FASTER): a randomised controlled pilot trial. Lancet Neurol 2007;6:961-9.
- Wang Y, et al. Clopidogrel with aspirin in acute minor stroke or transient ischemic attack (CHANCE). N Engl J Med 2013;369(1):11-9.
- Johnston SC, et al. Johnston SC, et al. Clinical Research Collaboration, Neurological Emergencies Treatment Trials Network, and the POINT Investigators. Clopidogrel and Aspirin in Acute Ischemic Stroke and High-Risk TIA. N Engl J Med 2018;379(3):215-25
Den systematiske litteraturoversikten vist i samleanalysen (Hao Q) inkluderte 10447 pasienter fordelt på en gruppe som fikk dobbel platehemming med ASA og klopidogrel og en gruppe som fikk ASA. Behandlingen ble startet innen 24 timer etter symptomstart.
For pasienter med små hjerneinfarkt eller TIA med høy risiko for etterfølgende hjerneinfarkt, vil behandling med klopidogrel og ASA redusere risiko for nytt hjerneslag sammenlignet med behandling med ASA alene. Forskjellen er tydelig og det anses derfor som sikre behandlingseffekter.
Det er ingen sikre forskjeller mellom de to behandlingsalternativene i risiko for død og risiko for hjerneblødning
Det er litt økt risiko for mindre alvorlige blødninger (utenfor hjernen).
Dobbel platehemming gir en mulig liten økning i risiko for moderate til alvorlige blødninger utenfor hjernen, men forskjellene mellom dobbel platehemming og ASA er små og er derfor usikre.
Dobbel platehemming gir litt økt sjanse for bedre funksjonsnivå og livskvalitet, men forskjellene mellom dobbel platehemming og ASA er små og er derfor usikre.
Samleanalysen viste at det for nytt ikke fatalt hjerneslag (både iskemiske og hemoragiske slag) var 19 færre per 1000 og for mindre alvorlige ekstrakraniale blødninger 7 flere ved kombinasjonsbehandlingen med ASA og klopidogrel. Disse forskjellene er sannsynligvis sikre behandlingseffekter.
Vurdering
Fordeler og ulemper
Fordeler med tiltaket:
Dobbel platehemmende behandling med ASA og klopidogrel vs ASA alene, reduserer risiko for nye hjerneslag, men påvirker ikke dødelighet. Ved redusert risiko for nye hjerneinfarkt, vil erfaringsbasert kunnskap tilsi at man oppnår økt selvhjulpenhet i daglige gjøremål målt med modified Rankin Scale (mRS) og økt livskvalitet.
Ulemper med tiltaket:
Dobbel platehemmende behandling med ASA og klopidogrel øker risiko for milde og moderate blødninger utenfor hjernen.
Konklusjon:
De ønskede effekter veier opp for de uønskede effekter.
Kvalitet på dokumentasjonen
Kvaliteten på oversiktsartikkelen (Hao et al., 2018) er vurdert til å være moderat/høy.
Verdier og preferanser
Antitrombotisk kombinasjonsbehandling med klopidogrel og acetylsalisylsyre ved akutt TIA/hjerneinfarkt med fluktuerende symptomer.
Det foreslås at det etter individuell vurdering kan tilbys dobbel platehemmende behandling med acetylsalicylsyre (ASA), og klopidogrel i en tidsavgrenset periode:
Til pasienter som fra før behandles med ASA når de får akutt TIA/hjerneinfarkt.
Til pasienter med TIA/hjerneinfarkt med fluktuerende utfall eller forverring av utfall.
Praktisk – slik kan anbefalingen følges
Oppstart av dobbel platehemming med ASA og klopidogrel hos pasienter som står på ASA før akutt TIA/hjerneinfarkt, og hos subgruppen av pasienter med fluktuerende utfall, er avhengig av individuell vurdering der det bør vektlegges om det foreligger:
• Høygradige stenoser i precerebrale eller cerebrale kar
• Residiverende TIA eller hjerneinfarkter
• Høy ABCD2 skår ved TIA. Se anbefaling om behandling av pasienter med TIA.
• Kliniske og/eller bildemessige holdepunkter for flere iskemiske hendelser (hjerneinfarkter)
• Fluktuerende eller økende symptomer selv om det er gitt ASA behandling initialt
Det er viktig at oppstart av dobbel platehemming med ASA og klopidogrel er tidsavgrenset til 1-3 måneder, da risiko for blødninger øker ved lengre behandlingsløp [96] [97]. Vanlig dosering er ASA 75 mg daglig og klopidogrel 75 mg daglig.
Begrunnelse – dette er anbefalingen basert på
Arbeidsgruppen ønsket å undersøke om det var tilkommet ny forskning som kunne danne grunnlag for en nasjonal anbefaling for behandlingen av pasienter med akutt TIA/hjerneinfarkt og for pasienter med flukterende utfall:
PICO 1: Har pasienter med akutt TIA/hjerneinfarkt effekt av klopidogrel i tillegg til ASA som akutt antitrombotisk behandling i inntil 3 måneder?
PICO 2: Hos pasienter med akutt TIA/hjerneinfarkt som har fluktuerende utfall eller er i bedring: er dobbel platehemming med ASA og klopidogrel forbundet med bedre outcome enn uendret platehemming?
Etter gjennomgang av kunnskapsgrunnlaget ble det besluttet å gi en felles anbefaling for disse to PICO-spørsmålene, og den landet på en svak anbefaling om at det etter individuell vurdering kan tilbys dobbel platehemming med ASA og klopidogrel i en tidsavgrenset periode hos pasienter som står på ASA før akutt TIA/hjerneinfarkt. Pasienter med ustabilt hjerneinfarkt, som har fluktuerende utfall eller forverring av utfall, kan på individuelt grunnlag tilbys platehemming med ASA og klopidogrel. Det finnes studier på pasienter fra Asia som indikerer nytte av dobbel platehemming i den første fase etter akutt hjerneinfarkt og TIA [97]. Men vi har ikke studier som indikerer effekt på den kaukasiske rase. Holdbar forskningsbasert kunnskap for nasjonale retningslinjer mangler. Derfor er denne anbefalingen utarbeidet på bakgrunn av arbeidsgruppens samlede erfaring; klinisk kunnskap og brukerkunnskap.
Kunnskapsgrunnlag: Konsensus.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt TIA/hjerneinfarkt som har fluktuerende utfall eller er i bedring
Tiltak (I): Dobbel platehemming med ASA + klopidogrel
Sammenligning (C): Uendret platehemming
Beskrivelse av inkluderte studier
Flytskjema (PDF)
Søkestrategi (PDF)
Arbeidsgruppen ønsket å finne ut hvorvidt dobbel platehemming med ASA og klopidogrel hadde bedre effekt enn andre alternativer hos pasienter som står på ASA før akutt TIA/hjerneinfarkt og hos gruppen av pasienter med fluktuerende utfall.
Det ble utført separate litteratursøk for å finne systematiske litteraturoversikter for de to spørsmålene som ligger til grunn for anbefalingen. Oversiktsartikler ble gjennomgått, men det ble ikke funnet aktuell forskningsdokumentasjon som oppfylte arbeidsgruppens/Helsedirektoratets kriterier. Annen litteratur er trukket inn i utarbeidelse av anbefalingen, men ikke vektlagt grunnet mangelfull overførbarhet.
Kunnskapsgrunnlaget er dermed basert på konsensus og utarbeidet på bakgrunn av klinisk erfaring, brukerkunnskap, samt diskusjoner med fagfeltet.
Vurdering
Fordeler og ulemper
Fordeler: Mulig mindre risiko for residiv hjerneslag.
Ulemper: Økt blødningsrisiko ved dobbel platehemming [96].
Det foreligger ikke vesentlige forventede uønskede effekter med tiltaket.
Det er uvisst om de ønskede effektene veier opp for de uønskede.
Kvalitet på dokumentasjonen
Verdier og preferanser
Alvorlighetsgraden av utfallsmålene (hjerneinfarkt, hjerneslag, vaskulære hendelser, død innen 3 måneder) ble vektlagt i utformingen av anbefalingen. Både helsefaglige og bruker-representanter mente at hjerneinfarkt, hjerneslag, vaskulære hendelser og død innen 3 måneder er svært vesentlige utfall for å utforme forslag til en anbefaling
Referanser
96. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients (MATCH): randomised, double-blind, placebo-controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195441
97. Clopidogrel with aspirin in acute minor stroke or transient ischemic attack https://www.helsedirektoratet.no/referanse/0002-0013-195442
Antitrombotisk behandling ved akutt hjerneinfarkt og atrieflimmer
Pasienter med akutt hjerneinfarkt og atrieflimmer bør behandles med acetylsalisylsyre (ASA) initialt og senere gå over til antikoagulasjonsbehandling.
SIGN: A 1a
Praktisk – slik kan anbefalingen følges
Pasienter med hjerneinfarkt og atrieflimmer behandles med platehemming initialt. Pasienter med store infarkter kan starte peroral antikoagulasjonsbehandling etter om lag 1 uke (når risikoen for hemorragisk transformering er mindre). Hos pasienter med små hjerneinfarkt og atrieflimmer kan antikoagulasjonsbehandling startes etter 1- 3 dager. Pasienter som får hjerneinfarkt under pågående peroral antikoagulasjonsbehandling, bør kontinuere behandlingen hvis det foreligger indikasjon for fortsatt antikoagulasjonsbehandling.
Ved oppstart av antikoagulasjon kan DOAK eller warfarin benyttes. Se anbefalinger om antitrombotisk behandling under sekundærforebygging.
Hvis warfarin velges, seponeres ASA når INR er >2, ved bruk av DOAK seponeres ASA ved oppstart. Den antitrombotiske effekt, og dermed også mulig blødningstendens av DOAK kommer raskt, mens warfarin først virker etter noen dager. Dette bør det tas hensyn til når tidspunkt for oppstart vurderes.
Begrunnelse – dette er anbefalingen basert på
Umiddelbar antikoagulasjonsbehandling ved atrieflimmer reduserer risikoen for nye emboliske infarkt, men øker samtidig risikoen for blødninger, overlevelsen er derfor ikke bedret. Resultatene fra HAEST-studien [93] og IST-studien [94] tilsier at pasienter med hjerneinfarkt og atrieflimmer bør starte med ASA umiddelbart og så gå over til antikoagulasjonsbehandling når risiko for blødninger er redusert (se fanen praktisk info).
Særlig ved store hjerneinfarkter bør platehemmende behandling foretrekkes første uka for å unngå risiko for hemorragisk transformering.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneinfarkt og samtidig atrieflimmer
Tiltak (I): Akutt oppstart av antitrombotisk behandling
Sammenligning (C): Ingen behandling
Beskrivelse av inkluderte studier
Referanser
93. Low molecular-weight heparin versus aspirin in patients with acute ischaemic stroke and atrial fibrillation: a double-blind randomised study https://www.helsedirektoratet.no/referanse/0002-0013-195438
94. The International Stroke Trial (IST): a randomised trial of aspirin, subcutaneous heparin, both, or neither among 19 435 patients with acute ischaemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195439
Sist faglig oppdatert: 21.12.2017
Pasienter med akutt hjerneinfarkt og atrieflimmer bør behandles med antikoagulasjon etter initial behandling med acetylsalisylsyre (ASA)
Tidspunkt for start av DOAK kan avgjøres etter vurdering av infarktets størrelse:
- Ved små/moderate hjerneinfarkt/TIA og atrieflimmer: Start med DOAK innen 48 timer etter symptomdebut
- Ved store hjerneinfarkt og atrieflimmer: Start med DOAK fra dag 6-7 etter symptomdebut
Størrelsen på hjerneinfarkter kan defineres ved bildediagnostikk, og størrelsen kan best bedømmes ved CT eller MR utført 1- 2 dager etter innleggelse, og etter evt reperfusjonsbehandling (se bilde under praktisk).
Ved tvil om den bildemessige vurderingen av størrelsen av hjerneinfarktet ved CT/MR kan NIHSS benyttes som et supplement for å skille mellom små/moderate hjerneinfarkt og store hjerneinfarkt. Ved NIHSS >10 anbefales behandlingsstart 6-7 dager etter symptomdebut. Denne NIHSS undersøkelsen foreslås gjennomført 1-2 dager etter innleggelsen.
For pasienter med trombolyse se anbefalingen Antitrombotisk behandling etter trombolysebehandling.
Direktevirkende perorale antikoagulasjonsmidler (DOAK) anbefales fremfor warfarin ved hjerneinfarkt/TIA og atrieflimmer.
Se også anbefaling under sekundær forebygging: Antikoagulasjon hos pasienter med hjerneinfarkt/ TIA og atrieflimmer.
Praktisk – slik kan anbefalingen følges
Initial ASA dose: 300 mg og deretter 75mg daglig fram til antikoagulasjon starter.
Vurder størrelsen på infarktet før oppstart av antikoagulasjonsbehandling. Størrelsen på infarktet kan sikrest bedømmes med bildeundersøkelse 1-2 dager etter innkomst.
Benytt tilgjengelig bildediagnostikk (CT eller MR). Ny bildeundersøkelse tas ofte etter 1-2 dager ved negativ CT ved innkomst. MR kan eventuelt erstatte en kontroll-CT. Bruk kontrollundersøkelsen til å vurdere størrelsen på infarktet og eventuelt tilkommet blødning i infarktet. Ved usikkerhet om størrelsen på infarktet, start antikoagulasjon først etter denne undersøkelsen. I praksis betyr det at oppstart av antikoagulasjon sjelden er aktuelt før 24 timer etter debut ved små/moderate infarkter, men anbefales å starte innen 48 timer. Ved reperfusjonsbehandling vil også kontrollbilder etter 24 timer være nødvendig før eventuell antikoagulasjon.
TIA pasienter kan følge samme tidsplan for oppstart av antikoagulasjon som små hjerneinfarkt, men kontrollbilder er ikke nødvendig.
I tilfeller der initial bildediagnostikk viser små infarkter (diameter < 1,5 cm) og pasientene har lette slagsymptomer (NIHSS 0-3) som er stabile eller avtagende første 24 timer, kan også antikoagulasjon startes innen 48 timer etter symptomdebut uten ny bildeundersøkelse.
Pasienter som står på antikoagulasjon ved debut av hjerneinfarktet følger de samme praktiske råd med kontrollbilder etter 1-2 dager og deretter eventuelt ny oppstart av antikoagulasjon innen 48 timer ved små/moderate infarkter og etter 6-7 dager ved store infarkter.
llustrasjonen viser hvordan de ulike størrelser av hjerneinfarkter kan klassifiseres (U Fischer et al suppl).
Bilde brukt med tilltelse fra Prof. Urs Fischer, MD, Professor of Neurology
Kriterier som er blitt brukt i ELAN-studien:
- små hjerneinfarkt: diameter < 1,5 cm
- moderate hjerneinfarkter: infarkter i mindre arteriegrener i fremre, midtre eller bakre hjernearterie
- store hjerneinfarkter: alle øvrige infarkter inkludert infarkter i bakre sirkulasjon (hjernestamme og lillehjerne) ved diameter >1,5 cm.
Hvis NIHSS skår benyttes som supplement når det gjelder å vurdere infarktstørrelse så vil NIHSS > 10 ofte være utrykk for et stort infarkt.
Ut fra subgruppeanalyser i Timing studien, bør start av antikoagulasjon vente til dag 6-7 hos slike pasienter. Subgruppenalyser i TiMING studien tyder også på at det bør utvises en forsiktighetnår det gjelder tidlig oppstart av antikoagulasjon etter trombektomi da trombektomi pasienter hadde en tendens til noe dårligere behandlingsresultat ved tidlig oppstart med antikoagulasjon.
Vurder også risiko for blødning ved for eksempel høyt blodtrykk, høy alder og nyresvikt.
I Figur 1 er et flytskjema som viser framgangsmåten ved antitrombotisk akuttbehandling av pasienter med akutt hjenreinfarkt og atrieflimmer.
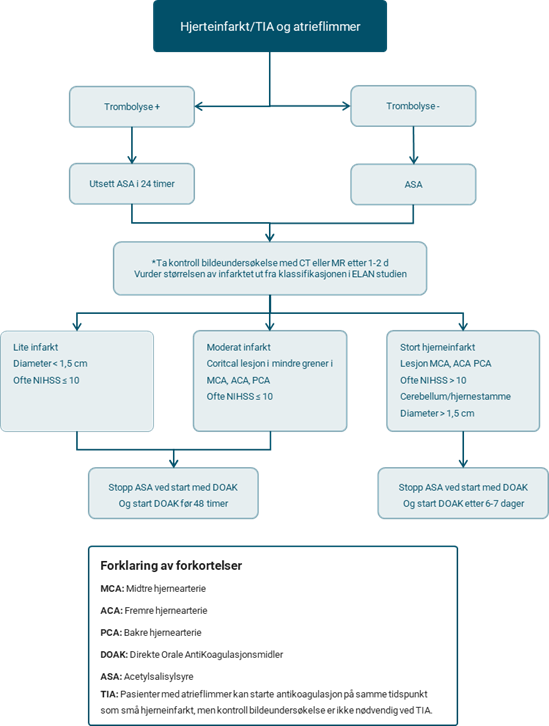
Se større versjon
Begrunnelse – dette er anbefalingen basert på
Antikoagulasjon gir svært god beskyttelse mot nye hjerneinfarkt hos pasienter med hjerneinfarkt/TIA og samtidig atrieflimmer (lenke til anbefaling). En rekke studier har vist at de nyere Direkte Orale AntiKoagulerende midler (DOAK) anbefales framfor warfarin (Marevan) fordi DOAK gir mindre risiko for blødninger (6,7,8,9).
Forskningsdokumentasjonen (1) viser en reduksjon i antall nye hjerneslag ved tidlig oppstart av antikoagulasjon, men effekten er liten med en statistisk ikke-signifikant absolutt risikoreduksjon på 1,1%. Det er få nye hjerneslag som unngås ved tidlig oppstart av antikoagulasjon, men hjerneslag er en alvorlig hendelse og har mulige store konskvenser for den enkelte. Tidlig oppstart av antikoagulasjon er dessuten et enkelt gjennomførbart og lite kostbart tiltak.
En fordel med å starte antikoagulasjonsbehandling tidlig, er økt etterlevelse fordi behandlingen oftere blir igangsatt før utskrivning fra slagenheten, pga korte liggetider i slagenhetene (median liggetid 5 dager- jfr Norsk hjerneslagregister).
Kunnskapsgrunnlaget gir ikke sikre holdepunkter for flere blødninger eller økt blødningsrisiko ved tidlig oppstart av antikoagulasjon. Blødningsrisikoen er lav både ved tidlig og sen oppstart. I studiene var det en overvekt av små og moderate infarkter og knapt hver 4. pasient hadde et stort infarkt. Det er noe blødningsrisiko ved store hjerneinfarkter, men ved å utsette oppstart av antikoagualsjon til dag 6 eller 7 etter symptomdebut, vurderes risikoen for blødninger å være lav. Ved å inkludere NIHSS skår i vuderingen av store hjerneinfarkter, kan risiko for blødning ytterligere reduseres.
Risikoen ved behandling med antikoagulasjon er økt fare for blødninger som trolig er størst i den første tiden etter et hjerneinfarkt.
Subgruppeanalyser i TIMING studien (REF), viste at ved NIHSS >10 var det ingen tendenser i effekt eller risiko i favør av tidlig behandling. NIHSS >15 viste en tendens til økt risiko for blødning ved tidlig start av antikoagulasjonsbehandling (2). Det er lite evidens om blødningsrisiko ved store infarkter ettersom det var få pasienter med store hjerneinfarkter i ELAN studien (1). Forsinket oppstart av antikoagualsjon hos pasienter med NIHSS >10 anbefales derfor for å redusere risiko for blødninger.
Det er liten effekt av tidlig antikoagulasjon ved svært lette slagsymptomer (NIHSS 0-3) (2). Dette kan skyldes at mange pasienter med lette symptomer har lakunære hjerneinfarkter. Sammenhengen mellom atrieflimmer og lakunære infarkter er ikke så tydelig som ved andre og større infarkter. Risiko for blødninger vurderes som liten ved små infarkter og tidlig oppstart innen 48 timer kan anbefales for denne gruppen
Metode for vurdering av infarktstørrelse
Oppstart av behandling vil for de fleste basere seg på bildeundersøkelser som allerede er en del av anbefalingene for bildeundersøkelse ved akutt hjerneslag. I ELAN studien var det ikke krav om at MR måtte benyttes for klassifisering av størrelsen på hjerneinfarktene. MR gir et bedre grunnlag for klassifisering, men det gjelder i praksis bare de små hjerneinfarktene da disse pasientene ofte ikke vil ha funn på CT når det foreligger små og mellomstore infarkter (Fischer et al, ). I tillegg vil pasienter med store hjerneinfarkter oftere ha høy NIHSS slik at anbefalingen ikke vil gi noen vesentlig økt bruk av MR for å avgjøre om tidlig eller sein oppstart av antikoagulasjon. Den sikreste metode for å vurdere størrelse på infarktet, vil være en bildeundersøkelse 24-48 timer etter innleggelse.
Klinikere som behandler hjerneslag er som oftest mer trenet i å bedømme alvorligheten av et hjerneslag ved NIHSS enn ved størrelsen på infarktet ved bildediagnostikk, og derfor foreslås NIHSS som et supplement i indikasjonsstillingen.
Inntil antikoagulasjon startes, anbefales at at alle pasienter får ASA som monoteterapi. Det vil for pasienter som denne anbefalingen gjelder for ikke være nødvendig å starte med dobbel platehemming. Anbefaling om dobbel platehemming ved akutt hjerneinfrakt gjelder for pasienter med NIHSS 0-3, men pasienter med atrieflimmer var ikke inkludert i de studier som danner kunnskapsgrunnlaget for dobbelt platehemming og det er også usikkert om dobbel platehemming i så kort tid som 24- 48 timer gir noen tilleggs effekt.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneinfarkt og atrieflimmer.
Tiltak (I): Oppstart av antikoagulasjon < 1 uke.
Sammenligning (C): Oppstart av antikoagulasjon < 2 uker.
Beskrivelse av inkluderte studier
Kunnskapsgrunnlaget fra de australske retningslinjene (1,2) om tidspunkt for oppstart av antikoagulasjon hos pasienter med akutt hjerneinfarkt og atrieflimmer er benyttet som grunnlag for anbefalingen. Kvaliteten på forskningsgrunnlaget er vurdert til å være høy på begge utfallsmål, se SOF tabell (lenke til retningslinjen). Retningslinjen er vurdert med FHIs sjekkliste til å være av moderat/høy metodisk kvalitet.
Kort informasjon om hovedstudien
ELAN-studien (1), randomisert kontrollert studie, inkluderte i alt 2013 pasienter med akutt hjerneinfarkt og atrieflimmer. Størrelsen på hjerneinfarktet ble klassifisert med bildediagnostikk (CT eller MR). Et hjerneinfarkt med diameter < 1,5 cm ble definert som et lite hjerneinfarkt, et overfladisk infarkt i mindre arteriegrener i fremre, midtre eller bakre hjernearterie (som forsyner overflaten av storhjernen), ble klassifisert som moderat stort infarkt og alle øvrige infarkter ble klassifisert som store infarkter. Tidlig start av antikoagulasjon ble definert som oppstart innen 48 timer for små og moderate infarkter og på dag 6 eller 7 for store infarkter. Sen oppstart av antikoagulasjon ble definert som hennholdvis oppstart på dag 3 eller 4 for små, dag 6 eller 7 for moderate og dag 12,13 eller 14 for store infarkter. Behandlingsresultatene ble vurdert ved 30 dager med hovedfokus på nye hjerneslag (hjerneinfarkt eller hjerneblødning) og større ekstrakraniale blødninger.
Hvis 1000 pasienter med akutt hjerneinfarkt og atrieflimmer behandles med tidlig oppstart av antikoagualsjon i henhold til denne anbefalingen så vil i løpet av de første 2 uker:
| Tidlig start med DOAK | Sein start med DOAK | Forskjell
|
|---|---|---|---|
Hjerneblødning (symptomgivende)
| 2 pas | 2 pas | Likt antall tidlig og sen start (men usikkerheten i resultatene gjør at det kan være 2 færre eller 11 flere)
|
Nytt hjerneinfarkt | 25 pas | 14 pas | 11 færre tidlig start (men usikkerheten I resultatene gjør at det kan være 18 færre eller 2 flere)
|
Vurdering: Tidlig oppstart av antikoagulasjon reduserer sannsynligvis risiko for hjerneinfarkt de første 2 uker etter det initaile hjerneslaget. Tidlig oppstart av antikoagulasjon gir sannsynligvis ingen økt risiko for hjerneblødning de første 2 uker etter det initaile hjerneinfarktet
Kort informasjon om Timing studien
Timing-studien (2) er en randomisert kontrollert studie der pasienter med med akutt hjerneinfarkt og atrieflimmer ble inkludert og randomisert til tidlig oppstart av antikoagulasjon < 4 dager etter symptomdebut eller sein oppstart mellom 5 og 10 dager etter symptomdebut. 888 pasienter ble inkludert - 450 til tidlig start og 438 til sein start av antikoagulasjon. DOAK ble benyttet som antikoagulasjonsmiddel.
I gruppen som fikk tidlig oppstart ble antikoagulasjon startet dag 3 (gjennomsnitt) og i sein gruppe i løpet av dag 5.
Det primære endepunkt var et kombinert endepunkt som inkluderte, nytt hjerneinfarkt, symptomatisk hjerneblødning eller død I løpet av de første 90 dager etter det initale hjerneinfarktet.
| Tidlig start med DOAK | Sein start med DOAK | Forskjell
|
|---|---|---|---|
Kombinert endepunkt
| 69 pas | 87 pas | 18 færre tidlig start (men usikkerheten i resultatene gjør at det kan være 53 færre eller 17 flere)
|
Nytt hjerneinfarkt | 31 pas | 46 pas | 15 færre tidlig start (men usikkerheten I resultatene gjør at det kan være 40 færre eller 11 flere)
|
- Det var ingen symptomatiske hjerneblødninger i noen av gruppene
- Ingen av resultatene var statistisk signifikant, men en trend I favør av tidlig start av antikoagulasjon
Studien viste at oppstart av antikoagulasjon 4 dager etter hjerneinfarktet ikke resulterte i flere iskemiske hendelser inkludert hjerneinfarkt ( sammenlignet med oppstart mellom 5 og 10 dager etter hjerneinfarktet. I denne studien var det ingen som fikk symptomgivende hjerneblødning, hverken i gruppen for tidlig eller sen oppstart. Flere observasjonsstudier som har inngått i systematiske oversikter har også vist at tidlig oppstart av antikoagulasjon synes å være trygt og uten økt risiko for blødninger og dette styrker kunnskapsgrunnlaget. (3,4,5).
Subgruppe-analyser viste at pasienter med alvorlige slagsymptomer NIHSS > 15 hadde økt risiko (odds ratio 2,3) for det kombinerte endepunktet ” Hjermeinfarkt, symptomatisk hjerneblødning eller død” og det var nær 0 effekt ved NIHSS 11-15.
Slike subgruppeanalyser må tolkes med forsiktighet, men analysene kan indikere at pasienter med alvorlig slagsymptomer muligens kan ha negative effekter av tidlig start av antikoagulasjon. For å minimalisere risiko for negative effekter av tidlig antikoagualsjon har vi derfor anført som råd at ved NIHSS > 10 kan start av antikoagulasjon med fordel utsettes. Da pasienter med NIHSS > 10 ofte vil falle I den gruppen som har store hjerneinfarkter i henhold til klassifiseringen i ELAN studien kan pasienter med NIHS> 10 med fordel utsette oppstart av antikoagualsjon til dag 6-7.
Trombolytisk behandling av pasienter med akutt hjerneinfarkt
Det anbefales at aktuelle pasienter med akutt hjerneinfarkt uten øvre aldersgrense behandles med IV- trombolyse.
Behandlingen bør starte tidligst mulig, fortrinnsvis innen 3 timer, men kan gis inntil 4,5 time fra symptomdebut
Praktisk – slik kan anbefalingen følges
Det er ikke gjennomført studier for trombolytisk behandling når det gjelder barn under 18 år. Anbefalingen gjelder derfor for voksne og uten øvre aldersgrense.
Trombolyse bør ikke gis til bevisstløse pasienter, pasienter med ukjent debut, intrakranial blødning eller tumor, tidligere hjerneblødning, blødningstendens, warfarinbehandling med INR over 1.7, fulldose heparin behandling siste 48 timer, behandling med DOAK siste 48 timer* (American Heart Association/American Stroke Association anbefaler 48 timer [99]), glukose <3 eller > 22 mmol/l, større kirurgi eller traume <21 dager, traumatisk hjertemassasje < 10 dager, punksjon ikke komprimerbart kar <10 dager, bakteriell endokarditt/perikarditt.
Systolisk BT over 185 eller diastolisk BT over 110 mmHg er kontraindikasjon, men IV-behandling kan gis for å redusere BT under dette nivå, og da kan trombolyse gis (labetolol infusjon er vanligste metode for akutt senking av blodtrykk).
Epileptiske anfall ved debut, CT av hjernen som viser utbredte infarkt forandringer og hjerneslag de siste tre mnd, og tidligere kirurgi i hjernen er også kontraindikasjoner for trombolytisk behandling.
Denne listen med kontraindikasjoner er ikke fullstendig, og i internasjonale retningslinjer er det ulike meninger om hva som er absolutte kontraindikasjoner og hva som er relative kontraindikasjoner for trombolytisk behandling. I de tilfeller der det etter individuell vurdering blir funnet indikasjon for trombolytisk behandling hos pasienter som har kontraindikasjoner som har ført til eksklusjon i de randomiserte studier, bør effekter og eventuell bivirkninger av behandlingen følges spesielt nøye. I en rapport fra American Heart Association/American Stroke Association er redegjort for grunnlaget for de ulike eksklusjons og inklusjonskriterier ved trombolyse som kan være til nytte ved vurdering av indikasjonsstilling for trombolyse [99].
Det er foreløpig kun alteplase som er godkjent for rutinemessig klinisk bruk ved IV trombolyse. Standard dosering er 0,9mg/kg, men med maks dose 90 mg. 10% av dosen gis i støt og 90 % som infusjon over 60 minutter.
Det er gjennomført en studie som viser at redusert dose ( 0,6 mg/ kg) reduserer blødningsrisiko og kan vurderes hos pasienter der blødningsrisiko er spesielt stor (1), men dokumentasjonen for anbefalingene om trombolyse bygger på doseringen 0.9mg/kg og er den best dokumenterte doseringen [98][60].
For trombolyse ved ukjent debut eller ved oppvåkningsslag, sonotrombolyse eller ved fluktuerende utfall, er det ikke funnet tilstrekkelig kunnskapsgrunnlag for å gi en anbefaling. Se under forskningsgrunnlag og sammendrag av studie.
*Hvilke konsekvenser for trombolyse som antidot mot DOAK kan få, er foreløpig ikke vurdert.
Begrunnelse – dette er anbefalingen basert på
Kunnskapssenteret har på bestilling fra Helsedirektoratet utført rapport på trombolytisk behandling innen 3 timer etter symptomdebut hos alle aldersgrupper (se PICO 1) og trombolytisk behandling med alteplase mellom 3 og 4.5 timer etter debut (PICO 2). Det oppsummerte kunnskapsgrunnlaget viser at trombolytisk behandling innen tre timer fra symptomdebut reduserer funksjonshemming betydelig. Det er også en positiv effekt av trombolyse mellom 3 og 4.5 time, men denne er mindre. Trombolytisk behandling bør derfor skje så raskt som mulig etter symptomdebut [60].
Forskningsdokumentasjonen viser at trombolyse i tidsvinduet 0-3 timer har samme effekt for pasienter over 80 år som for pasienter under 80 år [98]. Den oppsummerte forskningen viser også at trombolyse for pasienter over 80 år har positiv effekt også etter tre timer. Dette betyr at trombolyse kan tilbys pasienter med akutt hjerneinfarkt innen 4,5 time uten øvre aldersgrense.
I Norge behandles i dag ca. 17 % av alle pasienter med akutt hjerneslag med trombolyse. Trombolyse har effekt på sammensatte utfallsmål som omfatter død og uavhengighet, samt på å være i live og uavhengig av hjelp etter akutt hjerneslag. De første timene etter hjerneslaget er kritiske. Eldre over 80 år kan ha like stor effekt av trombolyse som pasienter under 80 år [98].
For følgende problemstillinger (PICO-spørsmål) ble det ikke funnet relevant forskningsdokumentasjon:
- PICO 3 (sonotrombolyse): Det ble inngått et samarbeid mellom Helsedirektoratet og Socialstyrelsen om å utveksle kunnskapsgrunnlag for PICO-spørsmål om effekten av kontrastforsterket sonotrombolyse hos pasienter med akutt hjerneinfarkt, men det ble ikke funnet tilstrekkelig dokumentasjon til å komme med generell anbefaling for denne problemstillingen.
- PICO 4 (bildebasert trombolyse): Det ble søkt etter systematiske litteraturoversikter for å undersøke virkning av IV-trombolyse etter bildebasert seleksjon hos pasienter med akutt hjerneinfarkt med ukjent debut, herunder oppvåkningsslag, eller debut for mer enn 4.5 t siden. Tilstrekkelig forskningsdokumentasjon ble ikke funnet.
- PICO 5 (trombolyse ved fluktuerende utfall): Systematisk søk ble gjennomført for trombolyse hos pasienter med hjerneinfarkt med fluktuerende utfall. Det ble ikke funnet sikker dokumentasjon som gjør det mulig å bedømme verken risiko eller nytteeffekt. Eventuell trombolyse ved fluktuerende utfall må derfor gjøres etter individuell vurdering.
Anbefalingen om trombolytisk behandling er basert på «oppsummert forskning» vurdering av kunnskapsgrunnlaget og arbeidsgruppens samlede erfaring og kunnskap. Anbefalingen er begrenset til standard IV-trombolyse innen 0-3 og 3-4,5 t.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneinfarkt som har fluktuerende utfall eller er i bedring
Tiltak (I): Intravenøs trombolytisk behandling
Sammenligning (C): Ingen trombolyse
Beskrivelse av inkluderte studier
Det ble utført søk etter systematiske litteraturoversikter som kunne forme grunnlag for anbefaling om trombolytisk behandling hos pasienter med akutt hjerneinfarkt og fluktuerende utfall. Etter gjennomgang av litteratursøk, ble det funnet en relevant systematisk litteraturoversikt, men denne ble ekskludert som forskningsgrunnlag grunnet lav metodisk kvalitet.
Vurdering
Fordeler og ulemper
Fordeler:
Trombolysebehandling gitt innen 3 timer fra symptomdebut, reduserer død og hjelpeavhengighet og bedrer funksjonsnivået for pasienter med akutt hjerneinfarkt i alle aldersgrupper (ikke undersøkt for pasienter under 18 år). Jo tidligere behandlingen gis, jo større effekt.
Når det gjelder trombolyse i tidsvindu 3-4,5 timer etter symptomdebut, er effekten mindre enn i tidsrommet 0-3 timer, men ved behandling i dette tidsrom (3-4,5 timer) medfører trombolysebehandling trolig at flere er i live og uten nedsatt funksjon (mRS 0-1). Det påvirker trolig ikke andelen som er i live og selvhjulpne (mRS 0-2) (NB: meget usikkert estimat).
Det er også en positiv effekt ved trombolysebehandling mellom 3-4,5 time fra symptomdebut. Se Sof tabeller.
Vurdering av trombolysebehandling for pasienter over 80 år.
Ulemper:
Blødninger hos pasienter over 80 år: Det er i Kunnskapssenterets analyser for trombolyse over 80 år ikke rapportert på hjerneblødninger, men det er i en annen metaanalyse (5) rapportert at ved trombolyse innen 3 timer, uavhengig av alder, så får 68 flere (49-87) per 1000 symptomgivende hjerneblødninger. Definisjon av symptomatisk blødning har variert noe fra studie til studie, og i meta-analysen fra Cochranedatabasen som Kunnskapssenteret bygger på (1) er tallet på symptomgivende blødninger angitt til 60 flere (50-70) per 1000. I metaanalysen på individuelle pasientdata er det angitt at 55 flere per 1000 fikk symptomatisk blødning (6). Det er altså ikke spesifikt rapportert på blødninger for pasienter > 80 år i noen av disse analysene, men blødninger er ikke signifikant økt i de studier som har inkludert mange pasienter > 80 år (4) i forhold til de som ikke har inkludert pasienter > 80 år. I den individuelle data-analysen er det anført at risiko for blødning er uavhengig av alder (6).
Blødninger vs. tid til start av trombolyse: Ut fra Kunnskapssenterets rapport (2) viser det økt risiko for symptomatisk intrakraniell blødning ved trombolyse både gitt innen 3 timer og gitt mellom 3-4,5 t. Det er usikkert om blødningsrisiko øker ved økt tid før trombolyse, men her foreligger usikre estimater (se Sof tabell). Det er verdt å merke seg at til tross for den blødningsrisiko som foreligger, så oppnås en signifikant reduksjon i andel pasienter som dør eller blir hjelpetrengende i daglige aktiviteter og flere som blir selvhjulpne.
Død: Det foreligger ingen separate analyser i Kunnskapssenterets rapport på kun død ved trombolyse > 80 år. Det er bare anført at risiko for død i alder 80 år samsvarer med risikoen i alder < 80 år. I metaanalyse (6) med individuelle pasientdata, framgår det at når det gjelder død etter 90 dager basert for alle pasienter i metaanalysene (6756) og alle aldersgrupper, er andelen døde 17,9 % i trombolysegruppen og 16,5 % i kontrollgruppen; ingen signifikante forskjeller. Det er derfor rimelig å anta at dødelighet ved 90 dager ikke påvirkes ved trombolyse verken i gruppen under eller over 80 år.
Kunnskapssenterets rapport tyder på at trombolyse både i tidsrommet 0-3 timer og 3-6 timer ikke påvirker dødelighet.
Det er vurdert at fordelene veier opp for ulempene.
Kvalitet på dokumentasjonen
Kunnskapssenteret har vurdert middels tillit til effektestimatene. Det er trukket ned i tilliten til resultatet i hovedsak på grunn av at det er subgruppeanalyser, med relativt sett noen færre personer med enn i hoved analysen. Men tilliten til dokumentasjonsgrunnlaget oppfattes som høy i arbeidsgruppen fordi dette var en forhåndsdefinert gruppe med > 700 inkluderte pasienter.
Verdier og preferanser
Forskningsdokumentasjonen viser at eldre over 80 år kan ha like stor effekt av trombolyse som pasienter under 80 år. Det antas at de aller fleste pasienter med akutt hjerneinfarkt vil ønske denne behandlingen.
Ulikhet i helsetilbud:
Det kan være en risiko for økte forskjeller i helsetilbudet fordi det er en tidsfølsom behandling og geografi og organisering kan avgjøre tilgjengeligheten til dette tilbudet. Men på sikt vil trolig en standardisering av tilbudet redusere denne ulikheten. Arbeidsgruppen var delt i synet på dette.
Referanser
86. Low-dose versus standard-dose intravenous alteplase in acute ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195431
87. Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: a meta-analysis of individual patient data from randomised trials https://www.helsedirektoratet.no/referanse/0002-0013-195432
88. The benefits and harms of intravenous thrombolysis with recombinant tissue plasminogen activator within 6 h of acute ischaemic stroke (the third international stroke trial [IST-3]): a randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195433
89. Recombinant tissue plasminogen activator for acute ischaemic stroke: an updated systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195434
60. Effekt av trombolytisk behandling i http://www.kunnskapssenteret.no/publikasjoner/effekt-av-trombolytisk-behandling-i-intervallet-3-til-4-5-timer-etter-hjerneslag
98. Hos personer over 80 år har trolig trombolyse effekt ved akutt hjerneslag http://www.kunnskapssenteret.no/publikasjoner/hos-personer-over-80-ar-har-trolig-trombolyse-effekt-ved-akutt-hjerneslag
99. Scientific Rationale for the Inclusion and Exclusion Criteria for Intravenous Alteplase in Acute Ischemic Stroke https://www.helsedirektoratet.no/referanse/0002-0013-195444
Pasienter med akutt hjerneinfarkt som sannsynligvis vil føre til en funksjonsnedsettelse, bør behandles tidligst mulig etter symptomdebut med IV- trombolyse. Både alteplase og tenekteplase kan benyttes. (HØRINGSUTKAST)
Trombolyse innen 4,5 timer etter symptomdebut har størst effekt. Trombolyse i utvidet tidsvindu (4,5 -9 timer etter symptomdebut eller innen 9 timer etter midtpunkt søvn ved oppvåkningsslag), anbefales for pasienter med akutt hjerneslag hvor CT- eller MR-bilder viser mismatch og der umiddelbar trombektomi ikke er indisert eller planlagt. Tenekteplase kan være et alternativ til alteplase også i utvidet tidsvindu.
For pasienter med milde slag som ikke medfører sannsynlig funksjonsnedsettelse, anbefales ikke trombolytisk behandling.
Både anbefalingen om trombolyse innen 4,5 timer og utvidet anbefaling gjelder alle pasienter med akutt hjerneslag uten øvre aldersgrense.
For anbefaling om trombolyse før trombektomi, se anbefaling om trombektomi innen 6 timer (lenke)
Praktisk – slik kan anbefalingen følges
For å avgjøre om det er indikasjon for trombolyse er det viktig å vurdere om pasienten har et akutt hjerneinfarkt som det er sannsynlig at vil medføre funksjonsnedsettelse. Milde slagsymptomer (for eksempel NIHSS 0-2) medfører ofte ikke funksjonsnedsettelse, og i slike tilfeller er det ikke indikasjon for trombolyse.
Ved milde hjerneslag (NIHSS 0-2), kan dobbel platehemming være et like godt eller bedre alternativ enn trombolyse (ref:22) .
CT caput er eneste bildeundersøkelse som er nødvendig for å avgjøre om en kan gi IV trombolyse innen 4,5 timer.
Trombolyse i utvidet tidsvindu
Indikasjon for trombolyse i utvidet tidsvindu (4,5 -9 t eller innen 9 t etter midtpunkt søvn) vurderes nøye da effekten er mindre enn ved trombolyse innen 4,5 time. Aktuelle pasienter selekteres med hjelp av CT eller MRI core/ perfusjon mismatch for å sikre at pasienter med sannsynlig effekt av trombolyse i det utvidede tidsrommet gis denne behandlingen.
Tolkning av CT eller MRI core/ perfusjon mismatch kan være en utfordring ved noen lokale sykehus. Dette kan løses ved at det etableres et samarbeid med større sykehus for akutt tolking av CT eller MRI core/ perfusjon mismatch. Både CT og MR kan benyttes for å selektere pasienter til trombolyse i utvidet vindu, men CT perfusjon er den mest aktuelle undersøkelse ved en akutt utredning av trombolyseindikasjon ved de fleste norske sykehus da MR kan ta vesentlig lenger tid å få gjennomført eller MR ikke er tilgjengelig.
Trombolyse kan gis både ved okklusjon i fremre og bakre kretsløp, men dokumentasjonen er best ved okklusjon i fremre kretsløp.
Valg av legemiddel
Alteplase og tenekteplase er to aktuelle legemidler både innen 4,5 time og utvidet tidsvindu. Ny kunnskap viser at tenekteplase ved trombolyse < 4,5 timer er minst like effektivt og like trygt som alteplase (Ref:18,19, 20,21, 23) (PICO 3). I utvidet tidsvindu har behandling med alteplase vist effekt (ref: 20) , og det foreligger også studier som viser at tenekteplase har effekt (Ref: 24). Det er foreløpig ikke gjennomført studier i utvidet tidsvindu som direkte sammenligner effekten av alteplase og tenekteplase, men ut fra effekten av tenekteplase < 4,5 timer vurderes bruk av tenekteplase også som et adekvat og sikkert alternativ til alteplase i utvidet tidsvindu (se PICO 4 med kommentarer).
En fordel med tenekteplase er at det kan gis som en injeksjon og er derfor enklere å bruke enn alteplase som må gis som en initial bolusdose, og deretter resterende dose som infusjon over en time.
Standard dosering ved alteplase er 0,9mg/kg, med maks dose 90 mg. 10% av dosen gis i støt og 90 % som infusjon over 60 minutter. Anbefalt dosering for tenekteplase er 0,25mg/kg med maks dose 25 mg.
Trombolyse hos barn
Det er ikke gjennomført randomiserte studier for trombolytisk behandling når det gjelder barn under 18 år, og denne retningslinjen gjelder ikke for barn.
Kontraindikasjoner
For å redusere risikoen for blødninger ved trombolyse, er det kontraindikasjoner, både ved bruk av alteplase og tenekteplase.
Alvorlige kontraindikasjoner avklares før behandling med trombolyse.
Se veiledende oversikt bakerst i anbefalingen over hva som kan oppfattes som absolutte og relative kontraindikasjoner. Listen er i stor grad basert på de eksklusjonskriterier som har vært benyttet i trombolysestudier slik det framgår fra American Heart/Stroke Association i artikkelen: (ref 8, samt liste over kontraindikasjoner ved trombolyse ved akutt hjerneinfarkt i Norsk Legemiddelhåndbok (ref 9Den australske retningslinjen om hjerneslagbehandling har også en tilsvarende liste over kontraindikasjoner når det gjelder trombolyse (ref: 5).
Listen må oppfattes som veiledende og ikke som en fullstendig oversikt over alle kontraindikasjoner
Dersom det etter individuell vurdering blir funnet indikasjon for trombolytisk behandling hos pasienter som har kontraindikasjoner som har ført til eksklusjon i de randomiserte studier, bør aktuelle pasienter som hovedregel informeres og effekter og eventuell bivirkninger av behandlingen følges spesielt nøye.
For sonotrombolyse er det ikke funnet tilstrekkelig kunnskapsgrunnlag for å gi en anbefaling. Se under forskningsgrunnlag og sammendrag av studie og PICO 5.
Begrunnelse – dette er anbefalingen basert på
Trombolytisk behandling innen tre timer fra symptomdebut reduserer funksjonsnedsettelse betydelig (Ref 10 og 11).(PICO 1) Det er også en positiv effekt av trombolyse mellom 3 og 4.5 time (PICO 2), men denne er mindre og særlig hos pasienter over 80 år. Trombolytisk behandling har imidlertid en positiv effekt i alle aldre og bør skje så raskt som mulig etter symptomdebut (ref 10, 11).
Studiene som danner kunnskapsgrunnlaget for trombolyse inkluderer hovedsakelig pasienter med hjerneinfarkt som medfører sannsynlig funksjonsnedsettelse. Derfor anbefaler internasjonale retningslinjer at trombolyse begrenses til pasienter med sannsynlig funksjonsnedsettende (disabling stroke) hjerneslag (hjerneinfarkt) (ref 5). En ny metaanalyse gir også grunnlag for å opprettholde en slik begrensning når det gjelder trombolyse av små (milde) hjerneinfarkter (ref 6).
I Norge behandles i dag ca. 20% av alle pasienter med akutt hjerneinfarkt med trombolyse (ref 12). Trombolyse har ikke effekt på død, men på det sammensatte utfallsmål som omfatter død og avhengighet (mRS 3-6), samt på å være uavhengig av hjelp (selvhjulpen i basale daglige gjøremål, mRS 0-2) etter akutt hjerneslag. (ref 1-5,10,11)
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneinfarkt
Tiltak (I): Kontrastforsterket sonotrombolyse (intravenøs trombolyse + mikrobobler + ultralyd)
Sammenligning (C): IV-trombolyse alene
Beskrivelse av inkluderte studier
Antitrombotisk behandling etter trombolysebehandling
Acetylsalisylsyre (ASA) eller antikoagulasjonsbehandling anbefales ikke de første 24 timene etter trombolytisk behandling.
SIGN: B2a
Praktisk – slik kan anbefalingen følges
Etter trombolytisk behandling skal det tas kontroll med bildeundersøkelse av hjernen med CT eller MR etter ca 24 timer. Antitrombotisk behandling skal ikke gis før denne undersøkelse er gjennomført og ikke viser blødning.
Begrunnelse – dette er anbefalingen basert på
ASA kan sannsynligvis øke risikoen for hemoragisk transformering etter trombolytisk behandling [95] (SIGN: 2a). Ved trombolytisk behandling gis derfor ikke ASA de første 24 t etter behandlingsstart. Antikoagulasjon øker risikoen for hemoragisk transformasjon også hos ikke trombolyserte og anbefales derfor heller ikke gitt i akuttfasen etter trombolyse.
Forskningsgrunnlag
Populasjon (P): Akutt hjerneinfarkt behandlet med IV-trombolyse
Tiltak (I): Umiddelbar ASA
Sammenligning (C): Avvente ASA
Beskrivelse av inkluderte studier
Referanser
95. Association of outcome with early stroke treatment: pooled analysis of ATLANTIS, ECASS, and NINDS rt-PA stroke trials https://www.helsedirektoratet.no/referanse/0002-0013-195440
Sist faglig oppdatert: 21.12.2017
Trombektomi innen 6 timer etter symptomdebut
Trombektomi anbefales utført så raskt som mulig og senest innen 6 timer etter debut av symptomer hos pasienter med hjerneinfarkt som skyldes okklusjon av store hjernearterier i fremre kretsløp (Karotis-kretsløpet).
Praktisk – slik kan anbefalingen følges
Mekanisk trombektomi er en akuttbehandling ved hjerneinfarkter som er forårsaket av tilstopping av store arterier som forsyner hjernen. Et kateter føres inn fra arterien i lysken og opp gjennom karsystemet til hjernen, der blodproppen fjernes («fiskes ut»).
I dag utføres trombektomi ved fem intervensjonssentra i landet. Siden tidsfaktoren er svært avgjørende, vil videre etablering av metoden som rutinemessig tilbud medføre behov for en del organisatoriske endringer som tar hensyn til Norges befolkningsmønster, topografi og værforhold.
Seleksjon for trombektomi
Funksjonsnivå: I de studier som danner det forskningsmessige kunnskapsgrunnlaget for trombektomi hadde pasientene god funksjon (mRS 0-2) før det aktuelle slaget. Denne seleksjonen av pasienter bør inntil annen dokumentasjon eventuelt foreligger være retningsgivende for trombektomi i klinisk praksis.
Alder: Det er ikke grunnlag for å anbefale noen øvre aldersgrense. Effekten av trombektomi var ikke forskjellig mellom aldersgruppene i de randomiserte studiene. Det finnes ingen randomiserte studier med pasienter under 18 år.
Fremre sirkulasjon: Dokumentasjonen fra de randomiserte studiene er knyttet til okklusjon av store arterier i fremre kretsløp med ledsagende uttalte/alvorlige slagsymptomer, og den sterke anbefalingen for trombektomi gjelder slike pasienter.
For okklusjon av arteria basilaris finnes det ingen randomiserte kontrollerte studier. Trombektomi er forbundet med større sjanse for rekanalisering enn trombolyse, men pasientseleksjon, tidsvindu og effekt er ikke klarlagt i bakre sirkulasjon.
Organisering av tilbud i Norge
Overordnet mål
Målsetting bør være å kunne tilby trombektomi til aktuelle pasienter i alle deler av landet. Det er behov for en del felles nasjonale føringer når det gjelder krav til fagligkompetanse og aktiviteten bør monitoreres. Men grunnet geografi og demografi vil det ikke være mulig med helt identisk tilbud i hele landet og tilbudet må tilpasses til forholdene i de ulike helseregioner.
Beslutningsforum som har besluttet trombektomi som et klinisk behandlingstilbud i møte 24.04 17 har anført at regionale planer bør utarbeides først og deretter samordnes i felles førende prinsipper. Denne framgangsmåten virker fornuftig.
Hele beslutningen:
1.Mekanisk trombektomi kan videreføres til behandling ved truende eller manifest hjerneslag.
2.Hver helseregion skal som følge av dette utrede organiseringen av hjerneslagbehandlingen og den prehospitale tjenesten for å ivareta sitt «sørge for»-ansvar.
3.Helseregionene skal etter en slik gjennomgang, som er anbefalt i punkt 2, samordne føringer for tilbud om mekanisk trombektomi slik at det er felles førende prinsipper på tvers av regionene.
De anbefalinger og råd som er anført om trombektomi her kan forhåpentligvis være nyttige i arbeidet med de regionale planer og også kunne danne et grunnlag for nasjonale føringer.
Hvor mange pasienter per år er aktuelle for trombektomi?
Det finnes ulike anslag på hvor mange pasienter som kan være aktuelle for trombektomi. Norsk Hjerneslagregister viser at omlag 15 % av pasienter med hjerneinfarkt per i dag behandles med trombolyse. Av disse har om lag 30 % NIHSS > 10 poeng som er den alvorlighetsgrad der trombektomi er best dokumentert. Med en antakelse om at logistikken kan forbedres og trombolysefrekvensen fordobles hos pasienter med NIHSS > 10 poeng, vil en trombektomi-frekvens på 5 % være mulig. I en studie fra Australia, fant man ved å bruke de samme kriterier som i de nyere RCT’ene, at 7 % kunne være aktuelle for trombektomi med restriktive kriterier og 13 % med mer liberale kriterier enn i de randomiserte studiene. Settingen var nokså lik et mellomstort norsk sykehus, med 258 hjerneinfarkt per 148 000 innbyggere per år. Dette er i overensstemmelse med en studie fra England, som estimerte at ca. 15 % av pasientene innen 6 timer kan være kandidater for trombektomi .
Framtidig utvikling og forskning vil avklare om andelen på lengre sikt kan økes ytterligere.
Samlet vurderes det som realistisk at 5-7 % kan være aktuelle for trombektomi per i dag og at andelen trolig vil øke med forbedret logistikk, diagnostikk og tekniske behandlingsløsninger. Dette betyr at 500-700 pasienter i Norge kan være aktuelle for trombektomi per i dag..
Det er et stort gap mellom andelen som kan være aktuell for behandling og de som faktisk får behandling. Dette nødvendiggjør tiltak for å bedre tilgangen til behandling.
Balanse mellom tilgjengelighet og krav til erfaring/kompetanse og pasientvolum
I utgangspunktet kan det være et motsetningsforhold mellom målsetting om høyt volum og høy spesialiseringsgrad på den ene siden og reell tilgang til rask behandling på den andre siden. I Norge må det derfor søkes løsninger som balanserer tilgjengelighet og krav til erfaring/kompetanse og pasientvolum. Kvaliteten kan bli redusert ved mindre erfaring og lavt pasientvolum og derfor er monitorering av aktiviteten viktig.
Det må lages praktiske løsninger tilpasset befolkningsstruktur og geografi i de ulike regioner og videre utarbeides noen felles nasjonale føringer med hensyn til basale krav til faglige forutsetninger, pasientvolum og monitorering av aktivitet. Til grunn for disse løsninger må ligge hensynet til at tidsfaktoren er den viktigste enkeltfaktor for godt resultat og derfor er regionale planer for å oppfylle dette viktig ( se også «Organisering for å redusere tidsbruk» nedenfor)
Faglige forutsetninger
I august 2016 ble det publisert Europeiske anbefalinger om organisering av trombektomi, utarbeidet av en tverrfaglig gruppe (nevrologi, nevrokirurgi, nevroradiologi, nevrointensiv medisin og akuttmedisin) fra syv europeiske land, som representerte seks faglige organisasjoner (i alfabetisk rekkefølge): European Academy of Neurology (EAN), European Association of Neurosurgical Societies (EANS), European Society of Emergency Medicine (EuSEM), European Society of Minimally Invasive Neurological Therapy (ESMINT), European Society of Neuroradiology (ESNR), European Stroke Organisation (ESO) [3]. Rapporten inneholder en gjennomgang av eksisterende evidens for faglige rammer, aktører, opplæring og monitorering av aktivitet.
Med grunnlag i Kunnskapssenterets rapport, europeiske anbefalinger, etablert praksis i Norge samt egen erfaring og kunnskap i arbeidsgruppen, gis følgende råd vedrørende organisering og som de ulike regioner kan vurdere og tilpasse i sitt arbeid med regionale planer:
Intervensjonister
- Trombektomi bør utføres av intervensjonsnevroradiologer eller intervensjonsradiologer med tilstrekkelig opplæring i metoden.
- Det bør utvikles en standard for teoretisk og praktisk opplæring. Opplæringens innhold og omfang kan sikres ved hospitering ved sentra med høyt volum. Rotasjonsordninger kan bidra til å opprettholde og videreutvikle kunnskap og ferdigheter.
Tverrfaglig slagteam (behandlingskjeden)
- Trombektomi bør være basert på et effektivt tverrfaglig slagteam.
- Slagteamet bør bestå av nevrologisk vakt / lege fra slagavdeling (teamleder), radiologisk vakt, intervensjonsradiolog og anestesilege. Involverte aktører må ha fått opplæring og ha god kunnskap om metoden. Regelmessige øvelser for slagteamet bør gjennomføres.
Slagenhet
- Senteret bør ha en velfungerende slagenhet med tilstrekkelig kapasitet til overvåking.
Pasientvolum
Det kan ikke anbefales et spesifikt krav til behandlingsvolum for trombektomisentra i Norge.
- På grunn av Norges geografi og demografi kan det ikke anbefales et spesifikt volumkrav til sentre som skal tilby trombektomi, men det må vektlegges at faglige forutsetninger og kvalifikasjoner er tiltede. Dette er i tråd med Kunnskapssenterets metodevurdering og de Europeiske anbefalingene.
- Lavt volum kan være en utfordring i forhold til kvalitet, men lang avstand som medfører sterkt forsinket behandling eller ingen behandling, vil være mer alvorlig for pasienten.
Organisering for å redusere tidsbruk:
Pasienter som er aktuelle for trombektomi må raskest mulig til behandling.
- Sannsynligheten for et godt klinisk resultat faller raskt med lengre tid til trombektomi.
- Direktetransport til trombektomisenter bør vurderes for pasienter som kan være aktuelle for trombektomi, hvis det ikke er vesentlig forskjellig avstand mellom trombektomisenter og sykehus som gi trombolyse.
- Det finnes flere kliniske skalaer som er utviklet for at prehospitalt personell skal kunne gradere slagets alvorlighet. Fellesnevneren er at høy alvorlighetsgrad indikerer høy sannsynlighet for okklusjon av stor hjernearterie og høy sannsynlighet for at pasienten er aktuell for trombektomi. Slike skalaer kan brukes for å triagere pasienter som kan være aktuelle for trombektomi direkte til trombektomisenter. Imidlertid vil man med slike skalaer miste mange som kan være aktuelle for trombektomi [4, 5]. Hva som samlet gir best nytte for pasienten, triagering eller mer uselektert direktetransport til trombektomisenter, må vurderes basert på tidsbruk til forskjellige behandlingstilbud.
- Det kan være et motsetningsforhold mellom målsetting om rask intravenøs trombolyse på den ene siden og raskt trombektomi på den andre siden. Tilbud om trombolyse finnes på nesten alle sykehus som behandler akutt slag og trombektomi er eller vil bare være mulig å etablere på et begrenset antall sykehus Det må gjøres en avveining av om pasienten er best tjent med transport til nærmeste sykehus som tilbyr trombolyse eller best tjent med transport direkte til nærmeste senter som tilbyr trombektomi. Trombolyse er aktuelt for langt flere enn det trombektomi er, så hvis transport til trombektomisenter forsinker trombolyse kan effekten for en god del pasienter bli negativ, Dette kan i noen grad imøtekommes ved å kombinere rask trombolyse på ett senter (lokalsykehus) med påfølgende rask videretransport til trombektomisenter hvis CT angiografi viser okklusjon i en stor arterie. Transport til trombektomisenter kan da skje mens trombolyseinfusjon pågår (Drip and Ship). Geografi, bosetting og sykehusstruktur i de ulike helseregioner vil være faktorer av betydning når fordeler og ulemper med de ulike alternativer vurderes. Noen steder og regioner vil trolig en sentralisering kunne være fordelaktig, Andre steder vil desentralisert initialbehandling være å foretrekke.
- De ulike RHF bør derfor utarbeide planer for hvordan trombolyse og trombektomi-tilbudet bør organiseres i deres region. Noen steder kan samarbeid over regiongrenser også være aktuelt å vurdere. Utarbeidelse av regionale planer er også i samsvar med Beslutningsforums beslutning om innføring av trombektomi som et klinisk behandlingstilbud i møte 24.04 17.
Prehospital behandlingskjede
Det bør etableres effektive rutiner for kommunikasjon mellom prehospitale tjenester og sykehus.
- Informasjonen bør omfatte tidligere funksjonsnivå (hvis tilgjengelig), debuttidspunkt (hvis kjent) og klinisk status.
- Prehospital nevrologisk undersøkelse bør standardiseres.
- For spørsmål om hvor pasienten skal transporteres, bør det prehospitale personell ha èn kommunikasjonslinje linje å forholde seg til (innenfor et nettverk av sykehus).
Sykehus i nettverk
Sykehus bør organiseres i nettverk for å maksimere tilgang til behandling og minimere forsinkelsene.
- Europeiske retningslinjer anbefaler at sykehus organiseres i nettverk for å maksimere tilgang til behandling og minimere forsinkelsene. Dette er i tråd med Nasjonal Helse- og Sykehusplan der det skisseres behov for at sykehusene i større grad enn nå utfyller hverandre i oppgaveløsning som ”sykehus i nettverk”.
Monitorering av aktiviteten ved trombektomisentra
- Aktiviteten ved trombektomisentra i Norge bør monitoreres i et felles kvalitetsregister. Det bør registreres viktige tider som mål for logistikk, mål for behandlingsresultat og komplikasjoner. Registreringen bør omfatte:
- Andel vurderte og behandlede pasienter
- Tid fra symptom til oppnådd reperfusjon samt ulike mellomtider (sykehus, intravenøs trombolyse, ankomst trombektomisenter, lyskepunksjon, reperfusjon)
- Grad av oppnådd reperfusjon
- Komplikasjoner – symptomgivende blødninger
- Nevrologisk funksjon etter 24-36 timer målt med NIHSS skår.
- Funksjon etter 3 måneder målt med modified Rankin Scale (mRS)
Det bør rapporteres jevnlig fra kvalitetsregisteret med bruk av definerte kvalitetsindikatorer
Lokalisering av trombektomisentra
Per 2016 tilbys trombektomi fem steder i Norge; Oslo Stavanger, Bergen, Trondheim og Tromsø. Sentrene har ulik profil vedrørende intervenjonistenes bakgrunn og opplæring, pasientvolum, seleksjonsmetoder- og kriterier og monitorering av aktiviteten. Det har frem til 2016 ikke vært noen koordinert implementering av trombektomi i Norge. De aktuelle sentra per i dag har utviklet tilbud basert på de ressurser som har vært tilgjengelig. Andre sentre har avventet oppstart i påvente av regionale eller nasjonale føringer. Det bør vurderes om det er behov for opprettelse av flere sentra for å kunne gi et godt landsdekkende tilbud.
Både sentra som har startet og eventuelt nye sentra bør legge til grunn felles føringer for intervensjonistenes bakgrunn og opplæring, sentrenes tverrfaglige tilbud samt monitorering av aktivitet.
Hvis det skal etableres nye trombektomitilbud, bør det tas hensyn til geografi og pasientvolum og til at senterets strukturelle og faglige forutsetninger for etablering av et tilbud vil kunne tilfredsstille nasjonale føringer og de viktigste internasjonale føringer for kvalitet.
Metoden er en høyspesialisert tjeneste, og det er per i dag ikke aktuelt å etablere dette ved samtlige sykehus som behandler hjerneslag. Det vil derfor være krevende å organisere tjenesten med et tilbud med mekanisk trombektomi så nær pasientene som mulig. Beslutningsforum for nye metoder har bestemt at hver helseregion først skal gjennomgå sin organisering. Deretter skal tilbudet samordnes nasjonalt slik at det følger felles prinsipper.
Med den geografi og befolkningsstruktur vi har i Norge kan det noen steder være aktuelt å vurdere om andre spesialister kan utføre trombektomi for å øke tilgjengeligheten og sikre robuste vaktordninger. Disse må da ha gjennomgått tilstrekkelig opplæring i metoden og nevroradiologiske aspekter av slagbehandling. I USA er det praksis at nevrologer og nevrokirurger kan få slik opplæring. Et aktuelt alternativ som diskuteres i flere land er å benytte spesialopplærte intervensjonskardiologer. Uansett spesialistenes bakgrunn blir det svært viktig med en nøye monitoring av aktivitet og behandlingsresultater
Begrunnelse – dette er anbefalingen basert på
- Mekanisk trombektomi gir for selekterte pasienter rammet av hjerneinfarkt på grunn av okklusjon i de store hjernearterier klart bedret funksjon og helserelatert livskvalitet.
- Dokumentasjonen bygger i all hovedsak på bruk av «stent retrievers»
- Behandlingen er kostnadseffektiv. Det gjelder også i scenarioanalyse med etablering av nye sentra i Norge.
Funksjon og dødelighet
Kunnskapssenterets rapport er bygd på fem randomiserte kontrollerte studier (RCT) publisert i 2014-2015, viste alle at trombektomi med «stent retriever» er effektiv behandling for pasienter med akutt hjerneinfarkt på grunn av okklusjon i store arterier i fremre kretsløp [51] . I hver av de fem studiene var trombektomi forbundet med økt sjanse for uavhengighet (mRS 0-2). De fleste pasientene fikk først intravenøs trombolyse og ble deretter randomisert til trombektomi eller kontroll.
En metaanalyse av de fem randomiserte studiene (1287 pasienter) viste at andelen uavhengige pasienter (mRS 0-2) var signifikant høyere i trombektomigruppen enn kontrollgruppen (46 % versus 27 %, odds ratio [OR] 2.35, 95% CI 1.85-2.98). Kun 2,6 pasienter må behandles for at èn skal få redusert funksjonshemming ≥1poeng på modified Rankin Scale (mRS). Trombektomi var effektivt i en rekke subgrupper av pasienter inkludert pasienter over 80 år, pasienter med store nevrologiske utfall og pasienter som ikke var behandlet med intravenøs trombolyse først. Det er få pasienter med lette og moderat alvorlige slagsymptomer (NIHSS< 10) som er inkludert i de randomiserte studier og nytten av trombektomi for denne gruppen pasienter er usikker. Det var ikke økt forekomst av alvorlige symptomgivende intrakranielle blødninger ved 90 dager i trombektomigruppen sammenlignet med kontrollgruppen.
Dødelighet
En metaanalyse av de fem randomiserte studiene, viste ingen sikker forskjell i dødelighet etter 90 dager. Imidlertid var det signifikant redusert mortalitet i trombektomigruppen etter 90 dager i ESCAPE (10,4% versus 19%).
Tidsavhengighet
Effekten av trombektomi er meget tidsavhengig. I MR CLEAN studien var den absolutte forskjellen i risiko for funksjonshemming mellom trombektomigruppen og kontrollgruppen 26 % dersom arterien ble åpnet innen 3 timer og 7 % dersom arterien ble åpnet innen 6 timer. Dette tilsvarer at antall pasienter som må behandles for at 1 ekstra pasient skal unngå skade (Number needed to treat; NNT) er <4 dersom arterien åpnes innen 3 timer, men er 15 dersom arterien åpnes innen 6 timer [100].
Kan resultatene overføres til klinisk praksis i Norge?
I de fem randomiserte studiene var pasientene selekterte – godt fungerende pasienter før slaget med alvorlige slagsymptomer - de aller fleste med NIHSS >10 poeng. De deltakende sentrene og intervensjonistene var erfarne. Både pasientseleksjonen og kompetansen ved sentraene kan ha bidradd til de gode resultatene. Det er nødvendig at norsk praksis søker å legge seg opp mot standarder fra studiene og at aktiviteten monitoreres.
Arteria basilaris
For okklusjon av arteria basilaris finnes det ingen randomiserte kontrollerte studier. I en systematisk analyse av femten publikasjoner konkluderes det med at trombektomi er forbundet med større sjanse for rekanalisering enn trombolyse, men pasientseleksjon tidsvindu og behandlingseffekt er ikke klarlagt.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneinfarkt
Tiltak (I): Trombektomi
Sammenligning (C): Ikke trombektomi
Beskrivelse av inkluderte studier
Kunnskapssenteret i Folkehelseinstituttet har gjennomført en fullstendig metodevurdering av kateterbasert fjerning av blodpropper i store blodårer som forsyner hjernen (mekanisk trombektomi). Vurderingen er gjort etter oppdrag fra de regionale helseforetakenes Bestillerforum.
Hovedfunn oppsummert av Kunnskapssenteret.
Tilgjengelig forskingsdokumentasjon om bruk av trombektomi i tillegg til standard behandling sammenlignet med standard behandling alene viser at:
• Sannsynligheten for funksjonstap etter 90 dager er mindre etter trombektomi
• Helserelatert livskvalitet etter 65-90 dager er bedre etter trombektomi, men det er usikkerhet knyttet til resultatene
• Det er ingen sikker forskjell i dødelighet etter 90 dager etter trombektomi
• Det ingen sikker forskjell på symptomgivende hjerneblødninger 24-30 timer etter trombektom
• Det er mulig økt risiko for hjerneblødning dersom symptomgivende og ikke-symptomgivende blødninger betraktes under ett
• Det er mulig høyere risiko for nytt hjerneinfarkt innen 90 dager etter trombektomi, men det er usikkerhet knyttet til resultatene
• Det er ikke mulig å trekke klare konklusjoner vedrørende uønskede hendelser knyttet til trombektomi
Vurdering
Fordeler og ulemper
Fordeler:
Sannsynligheten for funksjonstap er mindre etter trombektomi målt etter 90 dager
Ulemper:
Isolert sett er nye hjerneslag en moderat vesentlig uønsket effekt. Ikke symptomatiske hjerneslag ble gradert til «litt» som uønsket forventede effekter.
Fordelene med tiltaket veier opp for ulempene.
- Nye metoder kan utfordre moralske normer og verdier, og innføringen kan gi implikasjoner for fordeling av ressurser i helsevesenet. De etiske problemstillingene knyttet til innføring av trombektomi som rutinemessig tilbud i Norge er først og fremst knyttet til målet om å gi lik tilgang til behandlingen uavhengig av bosted.
- Sentralt er også spørsmålet om hvilke pasienter som bør få tilbud om trombektomi ut fra hensyn til alder, komorbiditet osv.
Kvalitet på dokumentasjonen
Verdier og preferanser
Referanser
3. Early Supported Discharge Trialists. Services for reducing duration of hospital care for acute stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195348
4. Early Supported Discharge for Stroke Patients Improves Clinical Outcome. Does It Also Reduce Use of Health Services and Costs? https://www.helsedirektoratet.no/referanse/0002-0013-195349
5. Organised inpatient (stroke unit) care for stroke https://www.helsedirektoratet.no/referanse/0002-0013-195350
100. Time to reperfusion and treatment effect for acute ischemic stroke: a randomized clinical trial https://www.helsedirektoratet.no/referanse/0002-0013-195445
51. Mekanisk trombektomi ved akutt hjerneinfarkt. Mechanical https://www.fhi.no/publ/2016/mekanisk-trombektomi-ved-akutt-hjerneinfarkt-del-2.-helseokonomisk-evalueri/
Sist faglig oppdatert: 21.12.2017
Hos pasienter med akutt hjerneinfarkt som sannsynligvis vil føre til betydelig funksjonsnedsettelse og som skyldes okklusjon i store arterier i fremre eller bakre kretsløp anbefales trombektomi tidligst mulig innen 6 timer fra symptomdebut (HØRINGSUTKAST).
Trombolyse, fortrinnsvis tenekteplase fremfor alteplase foreslås gitt før trombektomi og tidligst mulig i tidsvinduet 0-4,5 timer etter debut, både ved okklusjon i fremre og bakre kretsløp hvis ikke kontraindikasjoner og det ikke forsinker start av trombektomi.
Se egen anbefaling for trombektomi i utvidet tidsvindu (start av prosedyre 6-24 timer etter debut)
Praktisk – slik kan anbefalingen følges
Mekanisk trombektomi er en akuttbehandling som har effekt og bør vurderes ved hjerneinfarkter som sannsynligvis vil føre til betydelig funksjonsnedsettelse og som skyldes okklusjon i store arterier i hjernen (storkarokklusjon). Et kateter føres inn fra arterien i lysken og opp gjennom karsystemet til hjernen, der blodproppen fjernes («fiskes ut»). Denne behandlingen er nå å regne som standard behandling for pasienter med alvorlige slagsymptomer pga storkarokklusjon i hjernen sammen med anbefalt medikamentell behandling
Praktisk informasjon vedr trombolyse før trombektomi
Det finnes dokumentasjon for at trombolyse før trombektomi gir bedre resultat enn trombektomi alene. Effekten av trombolyse før trombektomi avtar med tiden fra symptomdebut til trombolyse så trombolyse bør gis så raskt som mulig etter symptomdebut og bør ikke forsinke oppstart av trombektomi. (ref: 8). For alle pasienter som kommer inn på lokalsykehus innen 4,5 t etter symptom debut og som er aktuelle for trombektomi, bør man starte trombolytisk behandling dersom det ikke er kontraindikasjoner mot trombolyse. Trombolyse før trombektomi er aktuelt både ved initial innleggelse i lokalsykehus og ved direkte innleggelse i trombektomisenter.
Begge de to trombolytiske virkestoffene alteplase og tenekteplase kan benyttes. Tenekteplase er minst like effektivt som alteplase og er lettere å administrere da medikamentet bare gis som en enkelt injeksjon. (ref:9). Tenekteplase er derfor spesielt egnet som trombolytisk behandling når det er aktuelt med trombektomi, da det med tenekteplase ikke er nødvendig å ta hensyn til pågående trombolyseinfusjon ved overflytting fra lokalsykehus til trombektomisykehus.
Seleksjon for trombektomi i tidsvinduet 0-6 timer etter debut
Alvorlighet av slagsymptomer
Trombektomi i fremre kretsløp er bare dokumentert ved hjerneslagsymptomer som gir NIHSS > 5 (ref 11) og i bakre sirkulasjon bare ved hjerneslagsymptomer som gir NIHSS >10. (ref 12,13) Disse grenser for alvorlighet av hjerneslagsymptomer bør som hovedregel følges og der det eventuelt etter individuell vurdering tilbys trombektomi ved lettere symptomer bør dette særskilt begrunnes.
Funksjonsnivå
I de studier som danner det forskningsmessige kunnskapsgrunnlaget for trombektomi hadde pasientene god funksjon (mRS 0-2) før det aktuelle slaget. Denne seleksjonen av pasienter bør inntil annen dokumentasjon eventuelt foreligger være retningsgivende for trombektomi i klinisk praksis. Der det eventuelt etter individuell vurdering tilbys trombektomi ved alvorligere funksjonssvikt før debut av slaget bør dette særskilt begrunnes.
Alder
Det er ikke grunnlag for å anbefale noen øvre aldersgrense. Effekten av trombektomi var ikke forskjellig mellom aldersgruppene i de randomiserte studiene. Det finnes ingen randomiserte studier med pasienter under 18 år.
Fremre sirkulasjon
Dokumentasjonen fra de randomiserte studiene er knyttet til okklusjon av store arterier i fremre kretsløp med ledsagende uttalte/alvorlige slagsymptomer. Sterkest dokumentasjon er det for okklusjon i karotis og M1 segmentet av midtre hjernearterie , men det har i studiene også inngått en liten andel pasienter med okklusjon i M2 segmentet som indikerer en effekt også i dette segmentet.
Bakre sirkulasjon
For okklusjon av arteria basilaris finnes det nå 3 randomiserte studier som alle har metodologiske svakheter som gjør tolkning vanskelig. Trombektomi sammen med trombolyse synes å være forbundet med en non signifikant større sjanse for mRS 0-2 og 0-3., men pasientseleksjon, tidsvindu og effekt er ikke klarlagt godt i bakre sirkulasjon.
Organisering av tilbud i Norge
Overordnet mål
Beslutningsforum som vedtok at trombektomi skulle bli et klinisk behandlingstilbud i 2017 anførte at regionale planer burde utarbeides og samordnet i felles førende prinsipper. Dette er nå i ganske stor grad gjennomført. Anbefalingen om trombektomi som ble tatt inn i nasjonal retningslinje for behandling og rehabilitering ved oppdateringen i 2017 har også bidratt til et felles grunnlag for klinisk praksis ved de ulike trombektomisentrene.
Målsetting har vært og er å tilby trombektomi til aktuelle pasienter i alle deler av landet. Det ble i anbefalingene fra 2017 tatt inn en del felles nasjonale føringer når det gjelder krav til fagligkompetanse og at aktiviteten bør monitoreres. Dette videreføres ved denne oppdateringen. Grunnet geografi og bosetting er det imidlertid ikke mulig med helt identisk tilbud i hele landet og tilbudet må tilpasses til forholdene i de ulike helseregioner.
Hvor mange pasienter per år er aktuelle for trombektomi?
I 2023 ble 500 ( 6.4 %) av pasienter med hjerneinfarkt behandlet med trombektomi . Det finnes ulike anslag på hvor mange pasienter som kan være aktuelle for trombektomi i årene framover. Det er i dag om lag 15 % av pasienter med akutt hjerneinfarkt som har NIHSS > 10 poeng som er den alvorlighetsgrad der trombektomi er best dokumentert. Andelen som er aktuell for trombektomi vil trolig ikke overstige 10 % av alle hjerneinfarkter de nærmeste årene.
Balanse mellom tilgjengelighet og krav til erfaring/kompetanse og pasientvolum
Faglige forutsetninger
I 2016 ble det publisert Europeiske anbefalinger om organisering av trombektomi, utarbeidet av en tverrfaglig gruppe (nevrologi, nevrokirurgi, nevroradiologi, nevrointensiv medisin og akuttmedisin) fra syv europeiske land, som representerte seks faglige organisasjoner (i alfabetisk rekkefølge): European Academy of Neurology (EAN), European Association of Neurosurgical Societies (EANS), European Society of Emergency Medicine (EuSEM), European Society of Minimally Invasive Neurological Therapy (ESMINT), European Society of Neuroradiology (ESNR), European Stroke Organisation (ESO) [3]. Rapporten inneholder en gjennomgang av eksisterende evidens for faglige rammer, aktører, opplæring og monitorering av aktivitet. En oppdatering med anbefalinger om trombektomi ble publisert i 2018. I tillegg publiserte Kunnskapssenteret en rapport i 2017 ( ref 14, 15)
Med grunnlag i Kunnskapssenterets rapport, oppdaterte europeiske og australske retningslinjeretablert praksis i Norge gjennom de årene trombektomi har vært godkjent behandling, samt egen erfaring og kunnskap i arbeidsgruppen, gis følgende råd vedrørende organisering som de ulike regioner bør ta hensyn til i sine regionale planer:
Intervensjonister
- Trombektomi bør utføres av intervensjonsnevroradiologer eller intervensjonsradiologer med tilstrekkelig opplæring i metoden.
- Det bør utvikles en standard for teoretisk og praktisk opplæring. Opplæringens innhold og omfang kan sikres ved hospitering ved sentra med høyt volum. Rotasjonsordninger kan bidra til å opprettholde og videreutvikle kunnskap og ferdigheter.
Tverrfaglig slagteam (behandlingskjeden)
- Trombektomi bør være basert på et effektivt tverrfaglig slagteam.
- Slagteamet bør bestå av nevrologisk vakt / slaglege fra slagavdeling (teamleder), radiologisk vakt, intervensjonsradiolog og anestesilege samt sykepleiere med erfaring med trombektomipasienter . Involverte aktører må få opplæring og ha god kunnskap om metoden. Regelmessige øvelser for slagteamet bør gjennomføres.
Slagenhet
- Senteret bør ha en velfungerende slagenhet med tilstrekkelig kapasitet til overvåking eller ha etablert nært samarbeid med en intensiv avdeling (ref: 16).
Pasientvolum
Det kan ikke anbefales et spesifikt krav til behandlingsvolum for trombektomisentra i Norge.
I utgangspunktet kan det være et motsetningsforhold mellom målsetting om høyt volum og høy spesialiseringsgrad på den ene siden og reell tilgang til rask behandling pga geografi og bosetting i Norge. Det må derfor søkes løsninger som balanserer tilgjengelighet og krav til erfaring/kompetanse og pasientvolum. Kvaliteten kan bli redusert ved mindre erfaring og lavt pasientvolum og derfor er monitorering av aktiviteten viktig. Norsk hjerneslagregister (NHR) monitorerer trombektomivirksomheten ved alle trombektomisentrene og sentrene har plikt til å innregistrere alle pasienter som behandles med trombektomi til trombektomi modulen i NHR (se under).
Organisering for å redusere tidsbruk
Pasienter som er aktuelle for trombektomi bør raskest mulig til behandling.
- Sannsynligheten for et godt klinisk resultat reduseres ved økt tid fra symptomdebut til trombektomi.
- Direktetransport til trombektomisenter bør vurderes for pasienter som kan være aktuelle for trombektomi, hvis det ikke er vesentlig forskjell i avstand og/eller transporttid ved innleggelse i trombektomisenter enn ved innleggelse i lokalsykehus som kan gi trombolyse.
- Initial innleggelse i lokalsykehus kan ofte være det beste alternativet i Norge fordi det sikrer rask innleggelse og mulighet for tidlig trombolyse. Det er langt flere pasienter som er aktuelle for trombolyse enn for trombektomi, så hvis transport til trombektomisenter forsinker trombolyse, kan effekten for en god del pasienter bli negativ. Rask trombolyse ved lokalsykehus, fortrinnsvis med tenekteplase som kan gis i injeksjon, kombinert med påfølgende rask videretransport til trombektomisenter hvis CT angiografi viser okklusjon i en stor arterie, vil derfor ofte være et godt alternativ. Initial bruk av lokalsykehus kan også være ressursbesparende både fordi mange pasienter vil være uaktuelle for trombektomi og fordi det ved trombolyse kan oppnås reperfusjon som gjør at det ikke blir behov for trombektomi. Initial innleggelse i lokalsykehus sikrer også at slagenhetene i disse sykehusene opprettholder sin kompetanse på akutt slagbehandling.
- Det finnes flere kliniske skalaer som er utviklet for at prehospitalt personell skal kunne gradere slagets alvorlighet og dette kan være et hjelpemiddel i valget mellom innleggelse i lokalsykehus eller trombektomisenter. Fellesnevneren for slike skalaer er at høy alvorlighetsgrad indikerer høy sannsynlighet for okklusjon av stor hjernearterie og dermed høyere sannsynlighet for at pasienten kan være aktuell for trombektomi, men det er fortsatt uavklart hvor gode slike skalaer er når det gjelder å identifisere storkar okklusjon og trombektomikandidater. [17,18,19
- Geografi, bosetting og sykehusstruktur i de ulike helseregioner vil være faktorer av betydning ved vurdering av fordeler og ulemper når det gjelder valg av innleggelse i lokalsykehus eller direkte til trombektomisenter. Enkelte steder og regioner vil trolig en sentralisering kunne være fordelaktig, Andre steder vil desentralisert initialbehandling være å foretrekke.
- De ulike RHF har utarbeidet en del planer for hvordan trombolyse og trombektomi-tilbudet bør organiseres i deres region., men det er viktig at slike planerer jevnlig evalueres. [17,18,19].
Prehospital behandlingskjede
Det er i stor grad etablert rutiner for kommunikasjon mellom prehospitale tjenester og sykehus inkludert direkte kontakt mellom ambulanse, AMK og vakthavende slaglege samt også mellom lokalsykehus og trombektomisykehus . Det er imidlertid fortsatt forbedringsområder.
Sykehus i nettverk
Sykehus bør organiseres i nettverk for å maksimere tilgang til behandling og minimere forsinkelsene.
- Europeiske retningslinjer anbefaler at sykehus organiseres i nettverk for å maksimere tilgang til behandling og minimere forsinkelsene. Dette er i tråd med Nasjonal Helse- og Sykehusplan der det skisseres behov for at sykehusene i større grad enn nå utfyller hverandre i oppgaveløsning som "sykehus i nettverk”. Ved akuttbehandling av hjerneslag er samarbeid som sikrer god tolkning av avansert bildediagnostikk med CT eller MR et meget aktuelt samarbeidsområde.
Meldeplikt til Norsk hjerneslagregister og monitorering av aktiviteten i trombektomisentrene
Aktiviteten ved trombektomisentre i Norge monitoreres av Norsk hjerneslagregister (NHR) i en egen trombektomimodul og alle trombektomisentre har plikt til å innrapportere sine pasienter til NHR. Det registreres i NHR viktige tider som mål for logistikk, mål for behandlingsresultat og komplikasjoner. Registreringen omfatter:
- Andel behandlede pasienter
- Hvem som behandles med trombektomi
- Tid fra symptom til oppnådd reperfusjon samt ulike mellomtider (sykehus, intravenøs trombolyse, ankomst trombektomisenter, lyskepunksjon, reperfusjon)
- Grad av oppnådd reperfusjon
- Komplikasjoner – symptomgivende blødninger
- Nevrologisk funksjon før trombektomi og etter 24-36 timer målt med NIHSS skår.
- Funksjon etter 3 måneder målt med modified Rankin Scale (mRS)
- Helserelatert livskvalitet ved 3 måneder
Lokalisering av trombektomisentra
Per 2024 tilbys trombektomi ved 8 sykehus i Norge: Ullevål, Rikshospitalet, A hus, Kristiansand , Stavanger, Bergen, Trondheim og Tromsø. Sentrene har noe ulik profil vedrørende intervenjonistenes bakgrunn og opplæring, og det er også en del forskjeller når det gjelder pasientvolum, seleksjonsmetoder- og kriterier, men sentrene følger i stor grad de nasjonale anbefalinger. Det bør fortløpende vurderes om det er behov for opprettelse av flere sentre for å kunne gi et godt landsdekkende tilbud, men med det begrensede antall pasienter som i overskuelig framtid trolig vil være aktuelle for trombektomi, så bør behovet for opprettelse av nye sentre vurderes nøye.
Hvis det skal etableres nye trombektomitilbud, bør det tas hensyn til geografi og pasientvolum og til at senterets strukturelle og faglige forutsetninger for å kunne etablere et tilbud som kan tilfredsstille nasjonale føringer og kvalitetsmål.
Med den geografi og befolkningsstruktur vi har i Norge kan det noen steder være aktuelt å vurdere om andre spesialister kan utføre trombektomi for å øke tilgjengeligheten og sikre robuste vaktordninger. Disse må da ha gjennomgått tilstrekkelig opplæring i metoden og nevroradiologiske aspekter av slagbehandling. I USA er det praksis at nevrologer og nevrokirurger kan få slik opplæring. Et aktuelt alternativ som diskuteres i flere land er å benytte spesialopplærte intervensjonskardiologer. Uansett spesialistenes bakgrunn blir det svært viktig med en nøye monitoring av aktivitet og behandlingsresultater. I Norge er det som anført Norsk hjerneslagregister som monitorerer trombektomivirksomheten ved de 8 sentra som er i drift.
Begrunnelse – dette er anbefalingen basert på
Anbefalingen er basert på rapport fra Kunnskapssenteret fra 2016, en del ny dokumentasjon som har kommet seinere, inkludert den dokumentasjon som retningslinjene fra Australian Stroke Foundation og European Stroke Organisation bygger på (ref) , arbeidsgruppens samlede erfaring og kunnskap.samt beslutning om videreføring av tiltaket fra Beslutningsforum RHF.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneinfarkt
Tiltak (I): Trombektomi
Sammenligning (C): Ikke trombektomi
Beskrivelse av inkluderte studier
Kunnskapssenteret i Folkehelseinstituttet har gjennomført en fullstendig metodevurdering av kateterbasert fjerning av blodpropper i store blodårer som forsyner hjernen (mekanisk trombektomi). Vurderingen er gjort etter oppdrag fra de regionale helseforetakenes Bestillerforum.
Kvalitet på dokumentasjonen for trombektomi
Oppsummering av oversiktsartiklene fra Kunnskapssenteret er vurdert til moderat kvalitet
Ressurshensyn
Trombektomi er en ressurskrevende behandling men også en meget effektiv behandling. Det er viktig at de «riktige pasienter» selekteres til denne behandlingen slik at unødig ressursbruk uten nevneverdig effekt kan unngås. Tiltaket kan da begrunnes med klar effekt og store fordeler fremfor ulemper.
Antagelig vil tiltaket kunne føre til økt ulikhet i helsetilbudet, men økt forskjell kan modifiseres noe ved de organisatoriske tiltak som erv foreslått.
Gradering av effektestimatene - fra Kunnskapssenterets rapport
Hovedfunn oppsummert av Kunnskapssenteret
Tilgjengelig forskingsdokumentasjon om bruk av trombektomi i tillegg til standard behandling sammenlignet med standard behandling alene viser at:
- Sannsynligheten for funksjonstap etter 90 dager er mindre etter trombektomi
- Helserelatert livskvalitet etter 65-90 dager er bedre etter trombektomi, men det er usikkerhet knyttet til resultatene
- Det er ingen sikker forskjell i dødelighet etter 90 dager etter trombektomi
- Det ingen sikker forskjell på symptomgivende hjerneblødninger 24-30 timer etter trombektom
- Det er mulig økt risiko for hjerneblødning dersom symptomgivende og ikke-symptomgivende blødninger betraktes under ett
- Det er mulig høyere risiko for nytt hjerneinfarkt innen 90 dager etter trombektomi, men det er usikkerhet knyttet til resultatene
- Det er ikke mulig å trekke klare konklusjoner vedrørende uønskede hendelser knyttet til trombektomi
Trombektomi mellom 6 og 24 timer etter symptomdebut
Trombektomi mellom 6 og 24 timer etter symptomdebut anbefales utført hos selekterte pasienter med alvorlige slagsymptomer som oppfyller de tre følgende seleksjonskriterier:
- Påvist okklusjon i karotis-kretsløpet (okklusjon i karotis interna eller midtre hjernearteries første del (M1)*
- Alvorlige hjerneslagsymptomer målt med National Institute of Health Stroke Scale, NIHSS med skår > 6.
- Ingen tidligere alvorlig funksjonssvikt målt med modified Rankin scale, mRS 0-2**
I tillegg kreves penumbra diagnostikk for den endelige seleksjon, dvs. avanserte bilde undersøkelser som kartlegger i hvilken grad det er områder med sirkulasjonssvikt som fortsatt kan «reddes» ved re-etablering av sirkulasjonen.
*Pasienter med okklusjon i M2 som oppfyller de øvrige kriterier, kan etter individuell vurdering være kandidater for trombektomi i utvidet tidsvindu.
**Pasienter med mRS>2 pga tidligere traume eller sykdom, som ellers er velfungerende, kan etter individuell vurdering være kandidater for trombektomi i utvidet tidsvindu.
Praktisk – slik kan anbefalingen følges
Mekanisk trombektomi kan være en aktuell akuttbehandling ved hjerneinfarkter som er forårsaket av tilstopping av store arterier som fører blod til hjernen. Et kateter føres inn fra arterien i lysken og opp gjennom karsystemet til hjernen, der blodproppen fjernes («fiskes ut»).
I dag utføres trombektomi ved syv intervensjonssentra i landet.
Anbefaling om trombektomi innen 6 timer fra symptomdebut, ble publisert i 2017. Den aktuelle anbefaling omhandler trombektomi i utvidet tidsvindu fra 6 - 24 timer etter debut.
Tidsfaktoren er fortsatt viktig ved mekanisk trombektomi også i tidsvinduet etter 6 timer, og derfor bør rask logistikk også etterstrebes for pasienter som er aktuelle for trombektomi i tidsrommet 6 timer - 24 timer etter symptom debut.
Seleksjon for trombektomi
Dokumentasjonen fra de randomiserte studiene DAWN og DEFUSE 3, begge publisert i "The New England Journal of Medicine" i 2018, benyttes ved seleksjon av aktuelle pasienter for trombektomi mellom 6 – 24 timer. Den sterke anbefalingen for trombektomi mellom 6 og 24 timer gjelder slike pasienter.
Seleksjonskriterier:
- Ingen tidligere alvorlig funksjonssvikt (mRS 0-2)
- Alvorlige hjerneslagsymptomer målt med NIHSS skår > 6. (Defuse: NHISS ≥ 6 – DAWN ≥ 10).
- Påvist okklusjon i karotis-kretsløpet (okklusjon i karotis interna eller midtre hjernearteries første del (M1)
Denne seleksjonen av pasienter basert på tidligere funksjonsnivå, NIHSS skår og angiografi funn bør inntil annen dokumentasjon eventuelt foreligger, være retningsgivende for den kliniske praksis når det gjelder den initiale seleksjon for trombektomi i utvidet tidsvindu. Det er viktig at sykehus sammen med AMK og ambulansetjenesten finner fram til prosedyrer som identifisere de relativt få pasienter med alvorlige slagsymptomer som kan være aktuelle for trombektomi i utvidet tidsvindu, og prioriterer disse for rask innleggelse. Ved alle lokalsykehus bør det kunne utføres seleksjon av pasienter basert på tidligere funksjonsnivå, NIHSS skår og angiografi.
I tillegg kreves for den endelige seleksjon, penumbra diagnostikk dvs. avanserte bilde undersøkelser som kartlegger i hvilken grad det er områder med sirkulasjonssvikt som fortsatt kan «reddes» ved re-etablering av sirkulasjonen.
Vurdering av seleksjonskriteriene:
- Ingen tidligere alvorlig funksjonssvikt (mRS 0-2)
I de randomiserte studier er det ikke inkludert pasienter som har alvorligere funksjonssvikt enn mRS 2. I tidsvindu 0-6 timer er det lite dokumentasjon for nytte av trombektomi for pasienter med alvorlig funksjonssvikt før hjerneslaget, og i studiene som har undersøkt trombktomi i utvidet tidsvindu er pasienter med alvorlig funksjonshemming ekskludert. Ut fra den eksisterende dokumentasjon, anbefales derfor å begrense trombektomi i utvidet tidsvindu for pasienter med mRS 0-2. Pasienter med mRS>2 pga tidligere traume eller sykdom, som ellers er velfungerende, kan etter individuell vurdering være kandidater for trombektomi i utvidet tidsvindu.
- Det er ikke grunnlag for å anbefale øvre aldersgrense.
Under forutsetning av god funksjonsevne før slaget, er ikke effekten av trombektomi forskjellig mellom aldersgruppene. Det finnes ingen randomiserte studier for de under 18 år. For de få pasienter dette måtte gjelde, må det foretas individuell vurdering i hvert enkelt tilfelle.
- Alvorlig hjerneslagsymptomer målt med NIHSS (NIHSS >6)
Grensen for NIHSS >6 er valgt fordi det ikke finnes dokumentasjon av nytteverdi for trombektomi hos pasienter ved lettere symptomer. Se metaanalyse og subgruppeanalyse i JAMA neurology.
I de studier som danner det forskningsmessige grunnlag for anbefalingen, så hadde nesten alle pasienter NIHSS<10 og median NIHSS var 17. Dvs de fleste aktuelle pasienter har meget alvorlige slagsymptomer.
De fleste pasienter som har dokumentert nytte av trombektomi i utvidet tidsvindu vil ha alvorlige lammelser og eller alvorlig afasi.
Alvorlige lammelser vil være lammelser som er så uttalt at pasienten har vansker med å bevege arm og/eller bein mot tyngdekraften eller hvis de klarer å bevege mot tyngdekraften at arm og eller bein drifter ned mot underlaget innen 5 -10 sekunder. Dette vil gi NIHSS > 6 , og ofte >10 som er den alvorlighetsgrad der nytte av trombektomi i utvidet tidsvindu er best dokumentert.
Alvorlig afasi/global afasi vil føre til at kommunikasjon er vanskelig eler umulig. Som regel vil alvorlig afasi gi NIHSS >6, slik at disse pasienter også vil oppfylle den grensen som retningslinjen anbefaler.
Mange kommunikasjonsproblemer hos akutt syke kan oppfattes som afasi uten at det foreligger hjerneslag, og det vil derfor være krevende prehospitalt å selektere ut pasienter som bør innlegges raskest mulig inkludert med helikoptertransport. Når det heller ikke finnes dokumentasjon for nytte av trombektomi ved NIHSS <6, så er denne NIHSS grensen beholdt. Det trengs mer forskning på trombektomi for lette slagsymptomer før det kan gis nasjonale normative anbefalinger ved hjerneslag med NIHSS <6.
Dersom afasi er kombinert med ett eller flere andre akutte hjerneslagsymptomer er diagnosen akutt hjerneslag sannsynlig og slike pasienter er aktuelle å vurdere for trombektomi i utvidet tidsvindu, men disse pasientene vil også ha NIHSS>6.
Det er grunn til å understreke at i de studier som danner det forskningsmessige grunnlag for anbefalingen, så hadde nesten alle pasienter NIHSS > 10, og median NIHSS var 17. Det vil si de fleste aktuelle pasienter har meget alvorlige slagsymptomer.
- Påvist okklusjon i karotis-kretsløpet (okklusjon i karotis interna eller midtre hjernearteries første del (M1)*
Seleksjon med penumbra diagnostikk er nødvendig for den avsluttende identifisering av pasienter som kan ha nytte av trombektomi i utvidet tidsvindu. Denne penumbra diagnostikk bør skje med avanserte bilde undersøkelser som kartlegger i hvilken grad det er områder med sirkulasjonssvikt som fortsatt kan «reddes» ved re-etablering av sirkulasjonen..
Å få etablert gode kriterier for når en penumbra er så stor og god at pasienten kan ha god nytte av trombektomi i utvidet tidsvindu vil være en betydelig utfordring for trombektomi sentrene. Årsaken er at RAPID software som ble benyttet i DAWN og DEFUSE, og som gir et automatisk svar vedr størrelse på penumbra, har en meget kostnadskrevende lisens og er ikke alminnelig tilgjengelig i norske sykehus foreløpig.
Den avsluttende seleksjon og prioritering av pasienter til trombektomi i utvidet tidsvindu bør gjøres av erfaren slaglege i samråd med nevroradiolog eller erfaren intervensjonsradiolog ut fra ovenstående kriterier og utfra forventet risiko ved inngrepet.
Organisering av tilbud i Norge
Overordnet mål
I 2016: Beslutningsforum for nye metoder bestemte at hver helseregion først skulle gjennomgå sin organisering for å finne ut hvordan regionen kunne tilby trombektomi 0-6 timer etter symptomdebut. Deretter skulle tilbudet samordnes nasjonalt slik at det følger felles prinsipper.
Utdrag av beslutningen fra 2016 (nyemetoder.no):
- Mekanisk trombektomi kan videreføres til behandling ved manifest hjerneslag(hjerneinfarkt).
- Hver helseregion skal som følge av dette utrede organiseringen av hjerneslagbehandlingen og den prehospitale tjenesten for å ivareta sitt «sørge for»-ansvar.
- Helseregionene skal etter en slik gjennomgang, som er anbefalt i punkt 2, samordne føringer for tilbud om mekanisk trombektomi slik at det er felles førende prinsipper på tvers av regionene.
Trombektomi i utvidet tidsvindu vil følge de samme prinsipper, men med regionale tilpasninger som tar hensyn til befolkning, geografi og sykehusstruktur.
Hvor mange pasienter per år er aktuelle for trombektomi i utvidet tidsvindu?
I flytskjemaet under presenteres en oversikt over hvor mange pasienter pr 1000 pasienter med hjerneslag, som kan være aktuell for trombektomi ut fra dagens kunnskapsgrunnlag (ref: DAWN, DEFUSE 3 og Norsk hjerneslagregister (stolav.no).
Studiene (DAWN og DEFUSE 3) gir ikke direkte informasjon om hvor mange pasienter som kan være aktuelle for trombektomi i utvidet tidsvindu, men ved å data fra et av sentrene sammen med data fra Norsk hjerneslagregister og HTA fra Sverige, er det mulig å komme frem til relativt gode estimater (ref: DAWN, DEFUSE 3, HTA fra Sverige. Jadhav mfl. 2018 og Norsk hjerneslagregister).Flytskjema viser at ca 2% vil ende opp som sannsynlige kandidater for trombektomi i utvidet tidsvindu. Dersom en benytter data fra Norsk hjerneslagregister som viser at ca 10 000 pasienter blir innlagt i sykehus med akutt hjerneslag pr år, så vil 2% utgjøre ca 200 pasienter. Slike estimater kan være usikre og må tolkes med forsiktighet, men ca 200 trombektomier i utvidet tidsvindu er sannsynligvis et omfang som det initialt bør planlegges ut fra. Dersom videre forskning finner at indikasjonene kan utvides, vil antall pasienter øke.
Det er få pasienter som er aktuelle for trombektomi i utvidet tidsvindu (se nedenfor) og den prehospitale vurdering og vurdering ved lokalsykehus er viktig for seleksjon av pasienter. Hovedregel vil derfor være at pasienter som kan være aktuell for trombektomi i utvidet tidsvindu, innlegges på lokalsykehus for avklaring av det videre behandlingstilbud
Flytskjema med tekst
Flytskjemaet viser at ca 20 pasienter (2 %) vil ende opp som aktuelle for trombektomi per 1000 pasienter med akutt hjerneslag. I tillegg vil en del «slag mimics» ytterligere «utvanne» sluttresultatet, men ved å bruke strenge kriterier for alvorlighet av slagsymptomer ( NIHSS> 6) vil andelen mimics sannsynligvis bli noe redusert.
Flytskjema "Aktuelle pasienter" for trombektomi i utvidet tidsvindu per år i Norge:
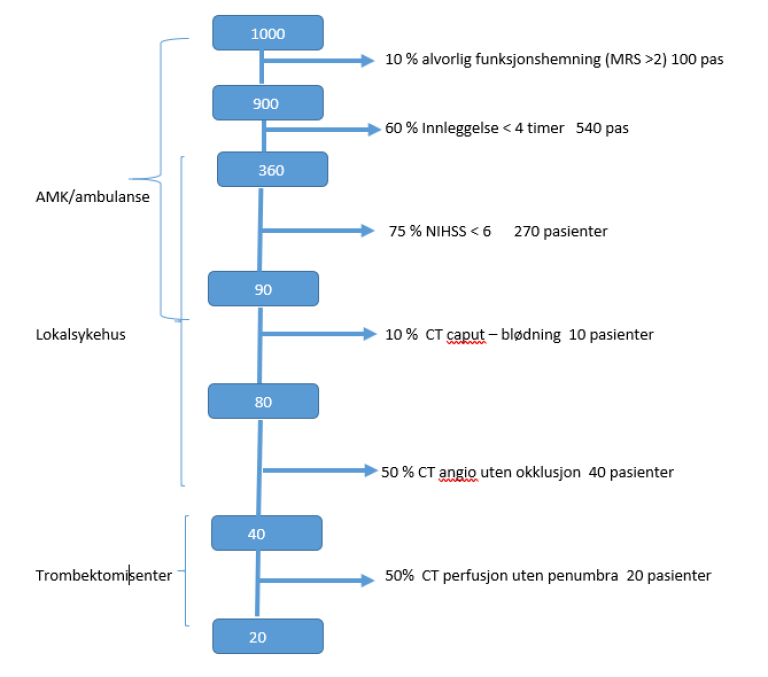
Alle tall i flytskjemaet representerer antall pasienter per 1000 pasienter med hjerneslag i Norge. Til venstre er anført hvilke aktører som bør ha hovedansvar for de ulike trinn i seleksjonen. Estimatene er fra Dawnog Defuse 3 studiene, og hentet fra Jadhav et al . Stroke 2018, kombinert med data fra Norsk hjerneslagregister. I region Skåne i Sverige er gjort tilsvarende estimater som viser tilnærmet de samme andeler som er aktuell for trombektomi i utvidet tidsvindu (HTA)
Forklaring til de ulike seleksjonstrinn i flytskjemaet
1. seleksjon (kan avklares av prehospitale tjenester): Ca 10 % har alvorlig funksjonshemning før slaget og kan identifiseres ved at de er på sykehjem eller har hjemmesykepleie mange ganger daglig. Seleksjon 1
2. Seleksjon (kan avklares av prehospitale tjenester): Ca 60 % av pasienter innlegges innen 4 timer og vil da hvis indisert i de fleste tilfeller kunne få trombektomi innen 6 timer eller like etter 6 timer ved rask overføring til trombektomisenter. Dvs de vil være kandidater for trombektomi innenfor det ordinære tidsvinduet på 6 timer
3. Seleksjon (kan i noen grad avklares av prehopsitale tjenester i samråd med vakthavende slaglege. Ytterligere avklaring/seleksjon av pasienter med NIHSS < 6 kan skje i lokalsykehuset): Ca 75 % av pasienter som innlegges etter 4 timer har lette slagsymptomer.
4. Bildeseleksjon 1 (kan avklares i lokalsykehuset): ca 10 % vil ha hjerneblødning som påvises ved CT caput.
5. Bildeseleksjon 2 (kan avklares i lokalsykehuset: Ca 50 % (40-50 %) av pasientene vil kunne påvise ved CT angio okklusjon i carotis/media. Det er varierende angivelser i ulike studier om andel pasienter hvor det kan påvises en okklusjon i carotis/media, men andelen er i de fleste studier angitt til 30 – 50% og aldri over 50%.
6. Bildeseleksjon 3 - Seleksjon ved avansert bildediagnostikk (kan avklares i trombektomi senter – og i enkelte lokalsykehus): Ca 50 % ( 30-50 %) vil ved avsluttende seleksjon med CT perfusjon ha funn som indikerer at et signifikant område med hjernevev kan reddes ved reperfusjon-trombektomi.
Balanse mellom tilgjengelighet og krav til erfaring/kompetanse og pasientvolum
For at trombektomi skal være tilgjengelig både innen 6 timer og i utvidet tidsvindu opptil 24 timer, må det søkes løsninger som balanserer tilgjengelighet og krav til erfaring/kompetanse og pasientvolum. Da trombektomi i tidsvindu 0 – 6 timer ble godkjent, var det etablert 5 trombektomisentre i Norge. Antallet er nå utvidet til 7 trombektomisentre.
Det må lages praktiske løsninger tilpasset befolkningsstruktur og geografi i de ulike regioner og videre utarbeides noen felles nasjonale føringer med hensyn til basale krav til faglige forutsetninger, pasientvolum og monitorering av aktivitet (Se anbefaling om trombektomi innen 6 timer).
Faglige forutsetninger
Å selektere de aktuelle pasienter til trombektomi i utvidet tidsvindu, vil være mer utfordrende i de prehospitale tjenester og lokalsykehus, og faglig oppdatering om seleksjonskriterier er viktig. Ellers er de faglige forutsetninger for trombektomi i utvidet tidsvindu de samme som for trombektomi innen 6 timer.
Intervensjonister
Når det gjelder krav til intervensjonister, slagteam og slagenhet, er det de samme som for trombektomi innen 6 timer.
Organisering for å redusere tidsbruk:
Pasienter som er aktuelle for trombektomi bør raskest mulig til behandling.
- Sannsynligheten for et godt klinisk resultat reduseres med lengre tid til trombektomi slik at tidsfaktoren er også av betydning ved trombektomi i utvidet tidsvindu.
- Andel pasienter som har nytte av trombektomi i utvidet tidsvindu er lavt bedømt ut fra analyser av data fra DAWN og DEFUSE 3. HTA fra Lund i Sverige viser også at andelen aktuelle pasienter ut fra dagens kunnskapsgrunnlag er lavt ca 2,7 %. Dette samsvarer med de andeler som fremgår av flytskjema som er laget basert på data fra Norsk hjerneslagregister som har kommet frem til ca 2%, men denne beregningen har tatt med alle hjerneslag og ikke kun hjerneinfarkt som i HTA fra Sverige. Estimatene fra Norge og Sverige er derfor tilnærmet identiske. 4 timer er valgt som grense fordi pasienter som innlegges etter 4 timer, som oftest ikke vil være aktuelle for trombektomi innen 6 timer.
- De ulike trombektomisentre bør finne fram til den mest hensiktsmessige organisering av trombektomi i sin region i samråd med sine lokalsykehus.
- Planene i de ulike RHF for trombektomi bør derfor inneholde informasjon om hvordan logistikken for pasienter som er aktuelle for trombektomi i utvidet tidsvindu bør organiseres.
Noen steder kan samarbeid over regiongrenser også være aktuelt å vurdere. Utarbeidelse av regionale planer er også i samsvar med Beslutningsforums beslutning om innføring av trombektomi som et klinisk behandlingstilbud i møte 24.04 17.
Organisering og oppgaver for de ulike ledd i behandlingskjeden ved trombektomi i utvidet tidsvindu
I flytskjema er anført de seleksjonsoppgaver som de ulike ledd i behandlingskjeden bør ha som mål å avklare.
AMK og ambulansetjenestens oppgaver for seleksjon av pasienter til trombektomi i utvidet tidsvindu.
AMK og ambulansetjenestens oppgaver er den prehospital vurdering for å identifisere pasienter som er aktuell for trombektomi i utvidet tidsvindu.
Det finnes ingen gode valide verktøy for denne seleksjon og identifisering. Men det kan være nyttig å avklare følgende spørsmål for å vurdere om en pasient kan være aktuell for trombektomi i utvidet tidsvindu:
- Har pasienten slagsymptomer i form av alvorlige lammelser i arm og/eller bein? Alvorlige lammelser vil være lammelser som er så uttalt at pasienten har vansker med å bevege arm og/eller bein mot tyngdekraften eller hvis de klarer å bevege mot tyngdekraften at arm og eller bein drifter ned mot underlaget innen 5 -10 sekunder
- Har pasienten afasi kombinert med andre fokale slagsymptomer som for eksempel fascialisparese, arm og/eller bein parese eller dysartri?
- Har pasienten vært selvhjulpen før hjerneslaget?
- Er pasienten våken eller lett vekkbar?
- Har 113 (AMK) fått henvendelse om pasienten over 4 timer etter debut, eller om pasienten har våknet med symptomer ?
- Har 113 (AMK) fått henvendelse om pasienten tidsnok til at pasienten kan nå sykehus innen 20-22 timer etter debut?
- Tidsangivelsen på 20-22 timer er angitt fordi de fleste aktuelle pasienter da vil kunne bli overført til trombektomisenter innen 24 timer fra symptomdebut..
- Pasienter hvor spm. 1 og/eller 2 kan besvares med ja, og spørsmål 3-6 kan besvares med ja, kan være aktuelle for trombektomi i utvidet tidsvindu, og AMK/ambulansetjenesten bør ta kontakt med vakthavende lege på slagavdelingen på aktuelle lokalsykehus for å avklare det videre forløp inkludert hastegrad på innleggelse.
Prehospital behandlingskjede ved trombektomi for pasienter i utvidet tidsvindu vil i hovedtrekk følge de anbefalinger som er gitt for trombektomi innen 6 timer, men lokalsykehusene vil i enda større grad være det mest aktuelle og riktige initiale innleggelsessted. 3 av 4 pasienter som henvender seg til helsetjenesten mer enn 4 timer etter symptomdebut har lette slagsymptomer (NIHSS skår 0-5 poeng) og er i henhold til denne anbefalingen ikke aktuelle for trombektomi. Det er derfor bare et mindretall som bør innlegges med stor hastegrad og alarm slik som anbefalt for pasienter som er aktuelle for trombolyse innen 4,5 timer og trombektomi innen 6 timer.
Det er viktig at sykehus sammen med AMK og ambulansetjenesten finner fram til prosedyrer som identifisere de relativt få pasienter med alvorlige slagsymptomer som kan være aktuelle for trombektomi i utvidet tidsvindu og prioriterer disse for rask innleggelse. De anførte spørsmål ovenfor kan være et hjelpemiddel for å identifisere aktuelle pasienter.
Lokalsykehusenes Oppgaver for seleksjon av pasienter til trombektomi i utvidet tidsvindu:
Lokalsykehus skal utrede pasienter som innkommer sykehuset mellom 4 – 20-22 timer etter symptomdebut, og som etter utredningen kan utføres til trombektomisenter innen 24 timer etter debut. Lokalsykehuset skal utføre seleksjon av pasienter basert på:
- CT caput som ikke viser blødning
- CT angiografi som viser okklusjon av karotis og M1*
- selvhjulpenhet før slaget (mRS 0-2**)
- NIHSS skår > 6
- Ingen uttalte forandringer på CT som indikerer et stort etablert infarkt.
Dersom seleksjonskriteriene for trombektomi i utvidet tidsvindu er oppfylt bør lokalsykehus og intervensjonssykehus ha en dialog vedrørende overflytting av pasient for videre utredning med henblikk på eventuell trombektomi i utvidet tidsvindu.
Det bør iverksette tiltak for raskest mulig overflytting til intervensjonssenter dersom trombektomi fortsatt anses indisert.
*) Hvis det påvises M2 okklusjon sammen med alvorlige slagsymptomer, (NIHSS > 6) åpner anbefalingen for individuell vurdering om trombektomi kan være aktuelt. Dersom det påvises okklusjon i bakre kretsløp (arteria basilaris), kan pasienter etter individuell vurdering, være kandidater for trombektomi i utvidet tidsvindu på samme måte som for trombektomi i tidsvindu 0-6 timer. (lim inn anbefalingen evt lenke dette til den aktuelle teksten)
**) Pasienter med mRS>2 pga tidligere traume eller sykdom, som ellers er velfungerende, kan etter individuell vurdering være kandidater for trombektomi i utvidet tidsvindu.
Intervensjonssenterets oppgaver ved seleksjon:
Ved beslutning om overflytting fra lokalsykehus til intervensjonssenter, utløses slagalarm. Ved ankomst verifiseres seleksjon basert på tidligere informasjon fra lokalsykehus om pasienten oppfyller de anførte seleksjonskriterier for trombektomi i utvidet tidsvindu og CT perfusjon utføres. Hvis CT perfusjon indikerer en stor og gjenværende penumbra så er pasienten en aktuell trombektomi kandidat og bør raskest mulig overføres til angiolab for start av trombektomi.
Sykehus i nettverk
Europeiske retningslinjer anbefaler at sykehus organiseres i nettverk for å maksimere tilgang til behandling og minimere forsinkelsene. Dette er også i tråd med Nasjonal Helse- og Sykehusplan der det skisseres behov for at sykehusene i større grad enn nå utfyller hverandre i oppgaveløsning som ”sykehus i nettverk”.
I de praktiske råd i denne anbefalingen, er forsøkt vektlagt oppgavene til de ulike sykehus i slike nettverk.
Monitorering av aktiviteten ved trombektomisentra
- Monitorering av trombektomi i utvidet tidsvindu skal i hovedtrekk følge anbefalingen for monitorering av trombektomi innen 6 timer.
- Aktiviteten ved trombektomisentra i Norge bør monitoreres i et felles kvalitetsregister. Norsk hjerneslagsregister har modul for innregistrering av aktuelle data i en elektronisk versjon fra 1. januar 2020.
Begrunnelse – dette er anbefalingen basert på
Revidert nasjonal faglig retningslinje for behandling og rehabilitering ved hjerneslag ble publisert 18. desember 2017. I dette arbeidet var trombektomi en sentral problemstilling, og kunnskapssenteret i Folkehelseinstituttet gjennomførte en fullstendig metodevurdering som dannet grunnlag for en nasjonal anbefaling:
Beslutningsforum ga sin tilslutning til metoden.
På bakgrunn av kunnskapsgrunnlaget ble tidsvinduet fra symptomdebut av hjerneslaget til start av denne typen behandling begrenset til maksimalt 6 timer etter symptomdebut.
Helsedirektoratet igangsatte en prosess høsten 2018 for å revidere/vurdere en tilleggsanbefaling om trombektomi på bakgrunn av to nye studier som viser effekt av trombektomi utover 6 timer og opptil 24 timer etter debut av symptomer.
Anbefalingen om trombektomi i utvidet tidsvindu er basert på følgende kunnskapsgrunnlag:
• to studier (DAWNog DEFUSE 3)
• arbeidsgruppens samlede erfaring og kunnskap
• HTA gjennomført i Sverige/Skåne ("Trombektomi 6 till 24 timmar efter stroke")
Funksjon og dødelighet
Resultatet fra to studier (RCT) publisert i 2018, viste at trombektomi mellom 6 og 16 timer (DEFUSE) og mellom 6 – 24 timer (DAWN) (med stent retriever) er en effektiv behandling for pasienter med akutt hjerneinfarkt på grunn av okklusjon i karotis og den første del av midtre hjernearterie (M1) sammenlignet med standard medisinsk behandling. De forventede effekter av trombektomi i utvidet tidsvindu er:
- Redusert dødelighet: Resultatene viste at 51 færre per 1000 pasienter døde i løpet av de første 3 måneder. Den statistiske usikkerhet (konfidensintervallet) viste at det sanne resultatet sannsynlig ligger mellom111 færre til 31 flere døde per 1000). Det var altså en trend til (men ikke helt sikkert) at færre dør ved trombektomi
- Selvhjulpen i daglige gjøremål målt med mRS: Det var en sikker økning i antall som blir selvhjulpne bedømt ved andel som oppnår mRS 0-2 ved 3 måneder, og økningen var sikker også når det tas hensyn til den statistiske usikkerheten. Resultatene viste at 319 flere per 1000 pasienter ble selvhjulpne. Den statistiske usikkerhet (konfidensintervallet) viste at det sanne resultatet sannsynlig ligger mellom 202 og 440 flere selvhjulpne per 1000.
- Reduksjon i grad av funksjonshemning målt med mRS ved 3 mnd: Resultatene viser en sikker reduksjon i grad av funksjonshemning målt med mRS. (forskyvning mot mindre funksjonshemning)
- Økt livskvalitet: Reduksjon av funksjonshemming vurderes til å gi økt livskvalitet selv om studiene ikke har undersøkt livskvalitet spesifikt
- Mindre variasjon i tilbudet: Anbefalinger om trombektomi i utvidet tidsvindu vil sannsynligvis gi mindre variasjon i tilbudet da en nasjonal føring vil modifisere uønskede lokale tilpasninger/variasjoner. Det er noen geografiske forskjeller per i dag. En systematisk tilnærming i et så stort tidsintervall som opptil 24 timer vil føre til at en større del av pasientene er aktuelle. Det er imidlertid et lite mindretall som vil ha nytte av trombektomi i utvidet tidsvindu. Dette setter krav til god seleksjon av pasienter så unødvendig transport til trombektomisenter kan unngås, men rask og effektiv transporttjeneste når indikasjon for trombektomi foreligger. Hvordan logistikken bør etableres vil variere ut fra lokale forhold, befolkning, geografi og sykehusstruktur. Her er variasjon i organisering nødvendig, men målet er minst mulig variasjon i mulighetene for å få trombektomi behandling når dette er indisert. Det målet vil lettere nås ved en nasjonal anbefaling.
Kan resultatene overføres til klinisk praksis i Norge?
I de to studier (RCT) publisert i 2018 var pasientene selekterte, populasjon var ca 5 år yngre enn den norske slagpopulasjon, men alder hadde ingen avgjørende betydning for behandlingsresultatet. De viktige seleksjonskriterier var godt fungerende pasienter før slaget, og med alvorlige slagsymptomer (NIHSS >6 poeng- median NIHSS skår 17), okklusjon i karotis eller midtre hjernearteries første del (M1) samt avansert penumbra diagnostikk. Hvis de samme kriterier for seleksjon av pasienter følges, er det sannsynlig at resultatene kan overføres til norske forhold.
God implementering i klinisk praksis forutsetter at AMK/ambulansetjenesten og sykehus er i stand til å gjennomføre en god seleksjon av pasientene inkludert avansert bildeseleksjon. Det anførte flytskjema med kommentarer om hvilke oppgaver som bør løses av de ulike ledd i behandlingskjeden, vil kunne bidra til en god implementering.
Arteria basilaris
I nåværende anbefaling for trombektomi innen 6 timer fra debut står:
"For okklusjon av arteria basilaris finnes det ingen randomiserte kontrollerte studier. I en systematisk analyse av femten publikasjoner konkluderes det med at trombektomi er forbundet med større sjanse for rekanalisering enn trombolyse, men pasientseleksjon tidsvindu og behandlingseffekt er ikke klarlagt".
Det er derfor rimelig etter individuell vurdering, å tilby trombektomi ved basilaris okklusjon med NIHSS >6 også i utvidet tidsvindu da prognosen ved denne tilstand, er svært alvorlig.
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneinfarkt som skyldes okklusjon av store hjernearterier i fremre kretsløp (Karotis-kretsløpet).
Tiltak (I): Trombektomi etter 6 timer fra symptomdebut.
Sammenligning (C): Standard care uten trombektomi > 6 timer
Beskrivelse av inkluderte studier
Det er foretatt et oppdatert litteratursøk etter «Mekanisk trombektomi ved akutt hjerneinfarkt» (metodevurdering, FHI 2016). Søket er avgrenset til systematiske oversikter og randomiserte kontrollerte studier og det er funnet 2 aktuelle studier (DAWN og DEFUSE 3), samt noen subgruppestudier av disse. (se eget flytdiagram). Kvaliteten på de to studiene er vurdert i artikkel fra ESO til å være moderat, selv om Risk of Bias er vurdert til å være lav i begge studier. Totalt sett er det et svært lavt antall pasienter som inngår i studiene ( kun 199 pasienter har fått trombektom)i. Dette kan reise spørsmål om generaliserbarhet og bidrar til at kvaliteten på dokumentasjonen vurderes som moderat. Over halvparten var oppvåkningsslag der tidspunkt fra debut til start trombektomi var ukjent og mange av disse pasienter kan ha blitt behandlet før 6 timer fra debut. (Og Sverige sin HTA vurderer kvaliteten som moderat)
Tabellen under oppsummerer resultatene fra de 2 randomiserte hovedstudier DEFUSE 3 og DAWN som har undersøkt effekten av trombektomi etter 6 timer fra debut. Det er ytterligere 2 studier som har inkludert pasienter etter 6 timer, men antall pasienter er så lavt at det ikke påvirker resultatene. De resultater som skal vurderes bygger derfor bare på disse 2 hovedstudier. Studiene med lav risiko for bias, er vurdert til middels høy kvalitet (Vurderingen er gjort med HTA metodikk i TBY rapport fra Sverige. I arbeidet har vi også sett til retningslinjen i Australia som også har inkludert de samme to studier som grunnlag for deres anbefaling om trombektomi etter 6 timer og opp til 24 timer.
Informasjon om studiene og pasientene som ble inkludert
| DEFUSE | DAWN | Kommentar | |
|
Antall pasienter |
182 | 206 | Trombektomi: 92+ 107 pas |
| Alder | 70 slagpasienter | 70 | 5 år yngre enn norske |
| Antall sykehus | 38 | bel26 | Deltagende sentra > 40 trombektomi/år |
| Inklusjonstid | 12 måneder | 31 måneder | |
| Inklusjoner per senter | 5 pas/år | 3 pas/år | |
| Alvorlighet (NIHSS) median | 17 (alv slag) Dawn >10 | 17 ( alv slag) Defuse: NIHSS > 6 | |
| Tid fra debut/sist sett frisk | 6-16 t | 6-24 t | |
| Oppvåkningsslag | 53 % | 63 % | DVS: >50% mulig behandlet < 6t |
| Hvor var blodproppen? hjernearterie | Carotis/ M1 |
Carotis/ M 1 M1: 1. deling midtre |
|
| Avansert bildeseleksjon | MR eller CT | MR eller CT | Litt ulike metoder for å definere «mismatch» og «penumbra» som indikerer at deler av det området som har nedsatt sirkulasjon kan «reddes» |
Hovedfunn, effekter av behandling med trombektomi versus standard medisinsk behandling. Samleresultater begge studier.
Som "Summary of findings" tabell under viser, er resultat som følger:
Effekt på funksjon: Selvstendighet i daglige gjøremål 3 måneder etter slaget (modfied Rankin Scale (mRS) 0-2):
Hvis 1000 pasienter behandles med trombektomi, vil 467 være selvhjulpen mot 148 uten trombektomi Det vil si: 319 flere per 1000 pasienter.
Usikkerhet knyttet til resultatet: (konfidensintervall)
Resultatet ligger mellom 202 og 440 flere selvhjulpne per 1000 Tolkning: En sikker økning i antall som blir selvhjulpne
Effekt på dødelighet ved 3 måneder:
Hvis 1000 pasienter behandles med trombektomi vil : 166 være døde mot 217 uten trombektomi
Det vil si: 51 færre døde per 1000 pasienter
Resultatet ligger mellom 111 færre døde og 31 flere døde per 1000 Tolkning: Sannsynlig noe redusert dødelighet, men ikke helt sikkert.
Effekt på symptomgivende hjerneblødninger:
Hvis 1000 pasienter behandles med trombektomi vil:
60 få symptomgivende hjerneblødning mot 37 uten trombektomi.
Det vil si: 23 flere symptomgivende hjerneblødninger per 1000 pasienter (Resultatet ligger mellom 106 flere og 13 færre per 1000):
Tolkning: Sannsynlig flere hjerneblødninger, men ikke helt sikkert.
Merknad:
Det er ikke informasjon om andre konsekvenser trombektomi (positive eller negative i de 2 studier som er gjennomført
Hvem har størst effekt?
Det er totalt sett relativt få pasienter som har fått trombektomi: 199 pasienter
Dette gjør det vanskelig å finne fram til undergrupper av pasienter som ev har særlig stor effekt av trombektomi eller meget liten effekt.
Uavklart spørsmål
Studiene gir ikke informasjon om hvor stor andel av pasienter i tidsvinduet > 6 timer som potensielt kan ha effekt av trombektomi. Våre estimater om andel aktuelle pasienter bygger på data fra Sverige samt data fra Norsk hjerneslagregister kombinert med data fra DAWN og DEFUSE.
Vurdering
Fordeler og ulemper
Fordeler:
- Redusert sannsynlighet for funksjonshemming ved tre mnd. med trombektomi i utvidet tidsvindu.
- Mulig noe bedret overlevelse.
- Reduksjon av funksjonshemming vurderes til å gi økt livskvalitet
Ulemper:
- Symptomatiske blødninger i hjernen innen 36 t ble gradert til "viktig", men ikke kritisk for beslutningstaking". Det er en økning på 23 hjerneblødninger per 1000 pasienter. Økningen er ikke helt sikker da den statistiske usikkerhet viser at resultatet ligger mellom 106 flere til 13 færre blødninger per 1000.
Andre potensielle ulemper:
- Forsinket slagenhet behandling for pasienter som ikke er aktuelle for trombektomi:
For slagpasienter i utvidet tidsvindu vil primærinnleggelse være i lokalsykehus med slagenhet for de fleste pasienter. For noen pasienter kan det være en ulempe å ikke bli direkte innlagt i trombektomisenter. Her må de ulike regioner finne frem til kriterier som er hensiktsmessige ift. geografi, befolkning og sykehusstruktur.
Med en slik organisering vil det ikke oppstå noen forsinkelse når det gjelder slagenhetsbehandling. Det vil være slagenhetens oppgave å utrede om kriteriene for trombektomi er tilstede. Og i så fall ta kontakt med trombektomisenter og eventuell sørge for raskest mulig overføring.
Raskest mulig tid til trombektomi er fortsatt viktig, og organiseringen må sikre at unødvendige forsinkelser unngås.
Arbeidsgruppen konkluderte med at de ønskede effekter veier opp for de uønskede effektene
Andre effekter ved innføring av tiltaket:
- Behov for god bildediagnostikk på lokalsykehus
Basis ved alle lokalsykehus må være 24-7 CT og CT-angio. CT-angio bør gjøres på alle med klare slagsymptomer basert på NHISS ≥ 6 opp til 24 t etter symptomdebut. Valg av ytterligere bilde-diagnostikk for seleksjon av trombektomi-pasienter må skje på regionalt nivå og i samarbeid med trombektomisenter. Ved noen lokalsykehus er det utviklet god kompetanse på CT perfusjon som kan benyttes.
- God bildeseleksjon ved intervensjonssentre:
Utstyr og kompetanse til penumbravurdering med CT - perfusjon eller MR for å identifisere pasienter som kan ha nytte av trombektomi opp til 24 t etter symptomdebut.
- Behov for økt kunnskap om seleksjon av pasienter:
Det er et regionalt ansvar å legge til rette for kompetanseheving når det gjelder klinisk seleksjon og bildeseleksjon både ved trombektomisenteret og ved lokale sykehus og ved de prehospitale tjenester, gjennom å sikre samarbeid, god kommunikasjon og informasjonsutveksling.
Kvalitet på dokumentasjonen
Verdier og preferanser
Ulikhet i helsetilbud
Utfordringer på grunn av geografi og avstander kan gi utfordringer ved alle tidskritiske tilbud som må sentraliseres (pga. høyteknologi). Men i tidsvinduet 6-24 timer vil de tidskritiske utfordringer være mindre enn for trombektomi innen 6 timer.
Akseptabilitet
Faggruppen og brukerorganisasjonene var enstemmige om at det er et akseptabelt tiltak.
Gjennomførbarhet
Kompetansebygging og organisatoriske tiltak foreslått for trombektomi innen 6 timer vil også være nyttig for gjennomføring av trombektomi i tidsvindu 6 – 24 timer.
Utfordringer:
Nært samarbeid
For å kunne implementere trombektomi utvidet tidsvindu slik at det blir et reelt tilbud i alle deler av landet, trengs et nært samarbeid mellom prehospitale tjenester, lokalsykehus og trombektomisentrene.
Implementering av seleksjonskriterier
Det er viktig at de anbefalte seleksjonskriterier følges. Disse seleksjonskriterier bygger på et godt kunnskapsgrunnlag og hvis de følges så skulle seleksjon for trombektomi i utvidet tidsvindu være gjennomførbart både for prehospitale tjenester, på lokalsykehus og trombektomisenter. Andre kriterier for seleksjon bør ikke benyttes før eventuelt ny dokumentasjon/kunnskap foreligger.
- Den største utfordringen er seleksjon prehospitalt. Her trengs opplæring og kompetanseheving hos prehospitale tjenester for å identifisere pasienter som kan være aktuelle for trombektomi i utvidet tidsvindu.
- Det finnes ingen gode valide verktøy for seleksjon, og her trengs systematisk kartlegging og forskning
Sist faglig oppdatert: 27.04.2020
Transitorisk iskemisk anfall (TIA)
Behandling av pasienter med TIA
Pasienter med symptomer på TIA bør utredes og behandles raskt. SIGN: B2a
Det foreslås at pasienter med symptomer på TIA innlegges akutt for utredning og behandling.
Praktisk – slik kan anbefalingen følges
Acetylsalisylsyre, ASA, bør gis så tidlig som mulig og kan gjerne, og spesielt ved lang reisetid, gis prehospitalt før bildediagnostikk (dose 300 mg brusetablett). ASA bør alltid gis initialt dersom poliklinisk utredning er aktuelt.
Pasienter som allerede får antikoagulasjonsbehandling, fortsetter med dette, men det bør kontrolleres at de tar sine medisiner som anført.
Polikliniske tilbud som gir like god og sikker behandling ved TIA er antakelig bare gjennomførbart på steder med stort volum. Der et slikt tilbud er etablert og fungerer godt, kan det kontinueres.
Risikoen for å få etterfølgende hjerneslag var tidligere høy [43][44], men har blitt redusert betydelig i de senere år. I dag er risikoen for hjerneslag innen 1 uke på omlag 2 % og etter 3 md. 3 % [43].
ABCD2 skår kan brukes som prognosevurdering ved mistanke om TIA og kan gi nyttig informasjon om hvem som har spesielt høy risiko for å få hjerneslag i tidlig fase etter et TIA [43][44][48]. Ved ABCD skår 0-3 er risiko for hjerneslag første uke under 1 % , men enkelte pasienter får hjerneslag tross lav skår, så det er en av grunnene til at innleggelse foreslås. Den viktigste grunnen til å foreslå innleggelse, er at det kan være krevende for sykehus å etablere en rask poliklinisk service. For sykehus som har et raskt poliklinisk tilbud eller dagtilbud for TIA-pasienter, kan utredning av pasienter med lav ABCD2 skår være et adekvat alternativ, men det forutsetter at det etableres gode samarbeidsavtaler med fastlege og legevakt som blant annet sikrer tidlig start av ASA-behandling.
Risiko for hjerneslag ved TIA - ABCD2 skår:
| Risikofaktor | Kategori | Poeng | |
| A | Age | Alder > 60 år Alder < 60 år | 1 |
| B | Blood pressure | Systolisk BT >140 mmHg eller diastolisk BT >90 mmHg Lavere BT | 1 0 |
| C | Clinical features | Halvsidig lammelse Språk/taleforstyrrelse uten lammelser Ingen lammelser eller språkforstyrrelser | 2 1 0 |
| D | Duration of symptoms | >60 min 10-59 min <10 min | 2 1 0 |
| D | Diabetes | Diabetes tilstede Ingen diabetes | 1 0 |
| Total skår | /7 |
Tid fra symptomdebut:
Akutt innleggelse er særlig aktuelt for pasienter som tar kontakt kort tid etter symptomdebut. Dersom det er mer enn 7 dager siden symptomene, kan man vurdere ut fra lokale forhold i spesialisthelsetjenesten hvordan utredningen organiseres (poliklinisk, dagutredning eller innleggelse). Ved sykehus der det er etablert et fast poliklinisk tilbud for rask TIA-utredning, kan et slikt tilbud gi like gode behandlingsresultater som innleggelse. Pasienter med kort sykehistorie som utredes poliklinisk, bør akutt behandles med ASA og få utredning raskt, anbefales innen 1-2 dager og med samme innhold som ved innleggelse.
Alle pasienter med TIA bør utredes med bildediagnostikk av hjernen. Se anbefaling om bildediagnostikk ved akutt hjerneslag.
For pasienter med TIA er MR-undersøkelse å foretrekke fremfor CT fordi det bedrer den diagnostiske presisjon.
Det foreslås MR-undersøkelse innen 24-36 timer på pasienter med gjennomgått TIA. ASA bør alltid gis i ventetiden.
Akutt MR kan vise reversible iskemiske lesjoner. Dette kan øke den diagnostisk presisjonen ved usikre TIA-symptomer, da MR DWI kan vise forandringer som ved iskemi. I tillegg vil tidlig MR fange opp evt. multiple reversible lesjoner som kan gi en indikasjon om etiologi. Negative funn utelukker imidlertid ikke TIA da de fleste TIA har normale funn ved MR-undersøkelse (1). Hvis MR ikke er tilgjengelig, bør det tas CT.
Utredningen ved TIA gjennomføres etter de samme prinsipper som ved akutt hjerneinfarkt.
Begrunnelse – dette er anbefalingen basert på
Pasienter med TIA har risiko for å få hjerneslag kort tid etter TIA. Rask utredning og behandling reduserer risikoen.
Risikoen for å få etterfølgende hjerneslag var tidligere høy [44][48], men har blitt redusert betydelig i de senere år. I dag er risikoen for hjerneslag innen 1 uke på omlag 2 % og etter 3 md. 3 %[43].
Tidlig innsettende antitrombotisk behandling med ASA er det viktigste tiltak for å redusere den tidlige risiko for hjerneslag [47]. Ved TIA kan ASA gis før bildediagnostikk, og tidlig ASA-behandling har så god effekt at det anbefales [44];[48] (SIGN: 2a).
I de fleste tilfeller vil innleggelse som øyeblikkelig hjelp være det tiltak som best sikrer rask utredning og start av behandling.
En anbefaling om innleggelse for utredning og behandling vil også sikre en mer ensartet praksis. Alle pasienter med hjerneslag, inkludert de fleste pasienter med TIA, innlegges allerede i slagenheter de fleste steder. Det kan være vanskelig å skille pasienter med TIA fra pasienter med hjerneslag med små utfall. Det er derfor mest hensiktsmessig å håndtere TIA på samme måte som hjerneslag. Innleggelse vil også gjøre det lettere å gjennomføre systematiske observasjoner.
Polikliniske tilbud eller dagtilbud som gir like god og sikker behandling ved TIA, er antakelig bare gjennomførbart på steder med stort volum. Der et slikt tilbud er etablert og fungerer godt, kan det kontinueres da rask poliklinisk tilbud eller dagtilbud gir de samme gunstige behandlingsresultater som innleggelse. Polikliniske tilbud er særlig aktuelt for pasienter med lav risiko for etterfølgende hjerneslag i den første uken. ABCD skår kan benyttes for en slik risikovurdering da pasienter med ABCD skår 0-3 har en risiko for hjerneslag første uken som er under 1%. Se praktisk informasjon.
Anbefalingen baserer seg på erfaringer i tjenestene samt arbeidsgruppens samlede erfaring og kunnskap.
Forskningsgrunnlag
Populasjon (P): Pasienter med TIA
Tiltak (I): Innleggelse akutt i sykehus på lik linje med hjerneslag
Sammenligning (C): Poliklinisk vurdering
Beskrivelse av inkluderte studier
Flytskjema (PDF)
Søkestrategi (PDF)
Det er søkt etter systematiske oversikter i et søk utført ved biblioteket ved Helsedirektoratet i juni 2016, men ingen systematiske oversiktsartikler kunne svare på om innleggelse av alle TIA-pasienter vil gi bedre behandlingsresultat.
Anbefalingen bygger på arbeidsgruppens erfaring og oppfattelse av at slik organisering vil sikre mest mulig likhet i behandlingstilbudet.
Vurdering
Fordeler og ulemper
Fordeler:
Alle pasienter med TIA bør ha samme utredning som ved hjerneslag. Rask utredning og behandling kan forebygge tidlige residivslag. Innleggelse gir mulighet for bedre overvåkning, rask oppstart av sekundærprofylakse (medikamenter, karotiskirurgi) og eventuelt reperfusjonsbehandling ved residiv og dermed redusert risiko for manifest hjerneinfarkt, vaskulære hendelser og kanskje også død.
Ulemper:
Innleggelse kan medføre økt ressursbruk (behov for sengeplasser). Noen pasienter vil kunne oppleve innleggelse som belastende.
Fordelene med tiltaket veier opp for ulempene.
Kvalitet på dokumentasjonen
Verdier og preferanser
Det er varierende oppfatninger om effekten av tiltaket. Denne variasjonen kan antyde at det ikke er alle pasienter som vil ønske å bli innlagt.
Referanser
43. One-year risk of stroke after transient ischemic attack or minor stroke https://www.helsedirektoratet.no/referanse/0002-0013-195388
44. Population based study of early risk of stroke after transient ischaemic attack or minor stroke: implications for public education and organisation of services https://www.helsedirektoratet.no/referanse/0002-0013-195389
47. Effects of aspirin on risk and severity of early recurrent stroke after transient ischaemic attack and ischaemic stroke: time-course analysis of randomised trials https://www.helsedirektoratet.no/referanse/0002-0013-195392
48. Effect of urgent treatment of transient ischaemic attack and minor stroke on early recurrent stroke (EXPRESS study): a prospective population-based sequential comparison https://www.helsedirektoratet.no/referanse/0002-0013-195393
Overvåking og kontroll ved akutt hjerneinfarkt
Hjerterytmemonitorering hos pasienter med akutt hjerneinfarkt
Rytmemonitorering bør gjennomføres hos pasienter med akutt hjerneslag i minst 24 timer.**
Praktisk – slik kan anbefalingen følges
Varighet av monitorering bør være minst 24 timer. Ved mistanke om paroksysmal atrieflimmer kan monitoreringstiden med fordel utvides.
Det finnes retningslinjer som anbefaler monitorering i minst 72 t (ESC retningslinjen 2016 [140]).
Begrunnelse – dette er anbefalingen basert på
Overvåkning av hjerterytme og måling av hjerteinfarktmarkører er nyttig hos pasienter med hjerneinfarkt eller TIA for å avdekke arytmier eller akutt koronar sykdom.
EKG-forandringer som ST-segmentforandringer, QT-tidforlengelse, T-bølgeinversjoner og prominente U-bølger sees ofte ved akutt hjerneslag. Lett troponinstigning og hjertearytmier kan forekomme uten at det foreligger primær hjertesykdom. Livstruende arytmier er sjeldne, men arytmier kan påvirke BT og cerebral sirkulasjon, og initialt bør derfor hjerterytmen overvåkes. Paroksystisk atrieflimmer som årsak til embolisk hjerneinfarkt kan også avdekkes ved slik monitorering som vil kunne ha konsekvenser for valg av videre antitrombotisk behandling.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneslag
Tiltak (I): Monitorering av hjerterytme
Sammenligning (C): Ingen monitorering
Beskrivelse av inkluderte studier
Referanser
140. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS https://www.helsedirektoratet.no/referanse/0002-0013-195485
Sist faglig oppdatert: 21.12.2017
Væskebehandling ved akutt hjerneinfarkt
Alle pasienter med akutt hjerneinfarkt bør få 1-2 liter Ringer acetat eller natriumklorid i.v. innleggelsesdagen.
SIGN: B2a
Praktisk – slik kan anbefalingen følges
Hos pasienter med hjertesvikt må væskebehandlingen ta hensyn til risikoen for overhydrering og lungestuvning.
For øvrige pasienter anbefales 1- 2 liter Ringer acetat eller 0,9 % NaCl innleggelsesdagen[8].
Begrunnelse – dette er anbefalingen basert på
Om lag halvparten av pasienter med hjerneslag er dehydrerte ved eller kort tid etter innleggelse i sykehus [108]. Dehydrering øker dødeligheten etter hjerneslag [108] (SIGN: 2a). Væskebehandling oppfattes å være gunstig og bidrar sannsynligvis til de positive effekter av slagenhetsbehandling [109][5].
I randomiserte slagstudier har det vært vanlig med 1-2 l. intravenøs saltvannsoppløsning, og dette er derfor et tiltak som anbefales [8].
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneinfarkt
Tiltak (I): Rutinemessig væskebehandling
Sammenligning (C): NOTSET!
Beskrivelse av inkluderte studier
Referanser
108. Influence of raised plasma osmolality on clinical outcome after acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195453
109. In‐hospital care pathways for stroke https://www.helsedirektoratet.no/referanse/0002-0013-195454
5. Organised inpatient (stroke unit) care for stroke https://www.helsedirektoratet.no/referanse/0002-0013-195350
8. What are the components of effective stroke unit care? https://www.helsedirektoratet.no/referanse/0002-0013-195353
Sist faglig oppdatert: 21.12.2017
Oksygentilførsel ved akutt hjerneinfarkt
Oksygenbehandling anbefales til pasienter med akutt hjerneinfarkt med oksygenmetning <95 % med mål 97-99 %.
SIGN: B2b.
Begrunnelse – dette er anbefalingen basert på
Respirasjonsproblemer er vanlig ved akutt hjerneslag. Øvre luftveisobstruksjoner forekommer hyppigst de første 24 timer, særlig hvis pasienten ligger på rygg og har høy BMI.
Ca. 60 % av pasienter med hjerneslag utvikler hypoksi (oksygenmetning < 95 %) i løpet av de første 24 timene [107]. Årsaken kan være hypoventilasjon, atelektase og aspirasjonspneumoni, arytmier og sviktende hjertefunksjon. En del pasienter har også kroniske respirasjonsforstyrrelser som KOLS.
Det er ikke vist at behandling med hyperbart oksygen i akuttfasen bedrer klinisk resultat [104] (SIGN:1a). Oksygen via nesekateter er assosiert med bedret funksjon ved større hjerneinfarkt, men ikke ved mindre hjerneinfarkt [105][106] (SIGN: 2b).
Oksygentilførsel hos pasienter som har tilfredsstillende oksygenmetning hjelper ikke og kan muligens være assosiert med forverret prognose.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneinfarkt
Tiltak (I): Oksygentilførsel
Sammenligning (C): Ingen oksygentilførsel
Beskrivelse av inkluderte studier
Referanser
104. Hyperbaric oxygen therapy for acute ischaemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195449
105. Venturi mask adjuvant oxygen therapy in severe acute ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195450
106. Should stroke victims routinely receive supplemental oxygen? https://www.helsedirektoratet.no/referanse/0002-0013-195451
107. Continuous pulse oximetry in acute hemiparetic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195452
Sist faglig oppdatert: 21.12.2017
Monitorering av fysiologiske parametre ved akutt hjerneinfarkt
Det foreslås at pasienter med akutt hjerneinfarkt får kontinuerlig monitorering av hjerterytme, blodtrykk og oksygenmetning i en slagenhet i minst 24-48 timer, og lengre hos ustabile pasienter.
Praktisk – slik kan anbefalingen følges
Respirasjon (i praksis oksygenmetning), sirkulasjon (BT og hjerterytme), væskebalanse, blodsukkerkonsentrasjon og temperatur er de viktigste faktorene som bør overvåkes og ev korrigeres, og dette er viktige elementer i akutt slagenhetsbehandling [103] .
Overvåkningen bør skje i en slagenhet [1][8][103][102]. Det optimale er å ha egne overvåkningssenger med sykepleier nært tilgjengelig. Automatiske målinger som kan avleses i en overvåkningssentral vil være alternativ der ikke slagenheten disponerer egne overvåkningssenger. Pasienter som får trombolyse trenger særlig nøye overvåkning det første døgnet (se trombolytisk behandling).
Overvåkning bør ikke gå på bekostning av mulighet for mobilisering, og overvåkning utover 2-3 døgn bør bare skje når det er sterk indikasjon for videre kontroll av den fysiologiske homøostase.
Begrunnelse – dette er anbefalingen basert på
Forstyrrelser i den fysiologiske balanse/homøostase med hyperglykemi, feber, hypoksi, hypertensjon eller hypotensjon, er assosiert med dårlig prognose. Den generelle overvåkning og behandling i akuttfasen har som mål å optimalisere den fysiologiske homøostase.
Det er få studier som har undersøkt effekten av kontinuerlig monitorering versus intermitterende monitorering, og studiene er av varierende kvalitet [1]. Overvåkning av de fysiologiske homøostaser er vurdert til å være et viktig element i akutt slagenhetsbehandling, men fordelene med kontinuerlig monitorering vs intermitterende er ikke godt dokumentert [8][103]. Vi mangler derfor store og gode studier om nytten av kontinuerlig monitorering. Den kliniske erfaringen fra de senere år med blant annet økt grad av trombolytisk behandling tyder på at kontinuerlig behandling er et nyttig tiltak. Ettersom god forskningsdokumentasjon mangler er det derfor ikke grunnlag for noe mer enn en svak anbefaling.
Det er også usikkerhet om hvor lenge monitorering bør gjennomføres ved akutt hjerneslag. I de aktuelle studier har monotoreringen vært begrenset til de første dagene, men i praksis bør lengden tilpasses alvorlighetsgraden av utfallene og om pasienten er stabil når det gjelder nevrologiske utfall og de fysiologiske parametre.
Anbefalingen er basert på «oppsummert forskning», vurdering av kunnskapsgrunnlaget og arbeidsgruppens samlede erfaring og kunnskap.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneslag
Tiltak (I): Kontinuerlig monitorering
Sammenligning (C): Intermitterende observasjon i tradisjonell slagenhet
Beskrivelse av inkluderte studier
Resultattabell (PDF)
Flytskjema (PDF)
Søkestrategi (PDF)
Definisjoner:
• mRS er forkortelse for modified Rankin Scale som uttrykker grad av selvhjulpenhet/funksjonshemming. Skalaen går fra 0 (intet symptom) til 6 (død)
• NIHSS er forkortelse for National Institute of Health Stroke scale, som er en klinisk vurderingsskala for nevrologiske symptom ved hjerneslag
• Atrieflimmer er en hjerterytmeforstyrrelse som involverer de to forkamrene (atriene) i hjertet
• Konfidensintervall gir informasjon om den statistiske usikkerhet når det gjelder resultatet.
o Smalt konfidensintervall: liten usikkerhet
o Bredt konfidensintervall: stor usikkerhet
Ciccone et al., 2013 er en metaanalyse med tre randomiserte kontrollerte studier med åpent design (enkel blinding) og med til sammen 354 deltakere. Studien som dominerer i metaanalysen omtales av Ciccone et al., 2013 som kvasi-randomisert fordi sekvensgenereringen ikke var tilfeldig (dvs. randomisert), men systematisk basert på ledig sengekapasitet. Denne studien har høy risiko for systematiske feil.
- Metaanalysen har relativt få deltakere totalt (354 stk.). Det er relativt få hendelser per utfall. Presisjon er nedgradert grunnet liten informasjonsstørrelse (total studiepopulasjon < 400; få hendelser < 300)
- Alle effektestimatene (unntatt ett) inkluderer studien med høy risiko for systematiske feil, og er derfor nedgradert
Flere av utfallene er ytterligere nedgradert pga. heterogenitet og vide konfidensintervall. For mange utfall har vi derfor veldig lav tiltro til at effektestimatene ligger nær den sanne effekten.
Død eller funksjonshemming (mRS ≥3, mRS ≥4): Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 276 færre tilfeller per 1000 pasient med slag (fra 138 færre til 366 færre). Effektestimatet (dvs. død eller funksjonshemming) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. Død eller funksjonshemming ble målt ved utskriving fra sykehus i den ene studien og etter tre måneder i de to andre studiene. Tiltroen til effektestimatet er veldig lav.
Død (alle årsaker) ved utskriving: Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 17 færre dødsfall per 1000 pasient med slag (fra 44 færre til 47 flere). Konfidensintervallet krysser linjen for ingen forskjell i effekt mellom gruppene. Effektestimatet (dvs. død, alle årsaker) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. Tiltroen til effektestimatet er lav.
Funksjonshemming ved 3 måneder: Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 47 færre tilfeller med funksjonshemming per 1000 pasient med slag (fra 187 færre til 169 flere). Konfidensintervallet krysser linjen for ingen forskjell i effekt mellom gruppene. Effektestimatet (dvs. funksjonshemming ved 3 mnd) er basert på data fra 86 pasienter i to randomiserte-kontrollerte studier. Tiltroen til effektestimatet er veldig lav.
Død av vaskulære årsaker: Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 14 færre dødsfall av vaskulære årsaker per 1000 pasient med slag (fra 25 færre til 37 flere). Konfidensintervallet krysser linjen for ingen forskjell i effekt mellom gruppene. Effektestimatet (dvs. død, vaskulære årsaker) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. Død ble målt ved utskriving fra sykehus i den ene studien og etter tre måneder i de to andre studiene. Tiltroen til effektestimatet er veldig lav.
Liggedøgn: Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag i snitt gi ca. 5 færre liggedøgn på sykehus per 1000 pasient med slag (fra 10 færre til 0,03 flere). Effektestimatet (dvs. liggedøgn) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier, men det var stor og uforklarlig forskjell mellom studiene. Den ene av de tre studiene hadde også høy risiko for systematiske feil. Tiltroen til effektestimatet er veldig lav.
Nevrologiske komplikasjoner (forverring av slag, nytt slag og krampeanfall): Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 29 færre nevrologiske komplikasjoner per 1000 pasient med slag (fra 89 færre til 59 flere). Konfidensintervallet krysser linjen for ingen forskjell i effekt mellom gruppene. Effektestimatet (dvs. nevrologiske komplikasjoner) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. Tiltroen til effektestimatet er lav.
Kardiologiske komplikasjoner (atrieflimmer, arytmier, hjertesvikt, hjerteinfarkt): Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 113 flere kardiologiske komplikasjoner per 1000 pasient med slag (fra 25 flere til 321 flere). Effektestimatet (dvs. kardiologiske komplikasjoner) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. Tiltroen til effektestimatet er veldig lav.
Komplikasjoner til immobilitet
Lungebetennelse: Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 18 flere lungebetennelser per 1000 pasient med slag (fra 23 færre til 109 flere). Konfidensintervallet krysser linjen for ingen forskjell i effekt mellom gruppene. Effektestimatet (dvs. lungebetennelser) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. I de tre studiene ble antall lungebetennelser (inkludert aspirasjonsrelatert) målt på forskjellig tidspunkt: i løpet av innleggelsestiden, i løpet av de første 48 timene, i løpet av de første fem dagene. Tiltroen til effektestimatet er veldig lav.
Andre infeksjoner (urinveisinfeksjoner og «andre infeksjoner»): Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 56 flere infeksjoner per 1000 pasient med slag (fra 3 færre til 162 flere). Konfidensintervallet krysser linjen for ingen forskjell i effekt mellom gruppene. Effektestimatet (dvs. infeksjoner) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. Tiltroen til effektestimatet er veldig lav.
Dyp venetrombose: Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 5 flere dype venetromboser per 1000 pasient med slag (fra 18 færre til 80 flere). Konfidensintervallet krysser linjen for ingen forskjell i effekt mellom gruppene. Effektestimatet (dvs. dyp venetrombose) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. Tiltroen til effektestimatet er veldig lav.
Vurdering
Fordeler og ulemper
Ved all akutt slagbehandling i Norge utføres det monitorering, men spørsmålet er om kontinuerlig monitorering bedrer behandlingsresultatet sammenlignet med intermitterende monitorering. Forskningsdokumentasjonen er sparsom og av lav kvalitet og gir ikke entydig og klart svar på dette spørsmålet. De få studier som er utført, viser imidlertid en trend mot positive resultater (se resultat i tabeller).
Kontinuerlig monitorering kan gi verdifull informasjon om eventuelle farer for en hjerne som nettopp har blitt rammet av en sirkulasjonsforstyrrelse pga blodpropp eller blødning. Tiltak for å korrigere ugunstige forhold når det gjelder den fysiologiske balanse kan trolig iverksettes tidligere hvis kontinuerlig monitorering finner sted og dette kan ha en positiv effekt for behandlingsresultatet.
En ulempe med kontinuerlig monitorering er at det kan gå på bekostning av tidlig mobilisering. Dersom kontinuerlig monitorering må foregå et annet sted utenfor slagenhet og dermed fører til at det tar lengre tid før pasienten kommer til en slagenhet, er det ikke sikkert at helsegevinsten er så stor. Muligheten for negative effekter er også tilstede hvis pasienten tas hånd om utenfor en slagenhet med spesialopplært personale. Det er også en usikkerhet om hvilket enkeltelement i den kontinuerlig monitorering (oksygen, puls, BT etc.) som er viktigst.
De ønskede effektene ble vurdert til å veie opp for de uønskede effektene, men kontinuerlig overvåkning/monitorering bør helst skje i slagenhet da vi mangler dokumentasjon på effekt av monitorering utenfor slagenhet. Overvåkning i tilknytning til trombolyse er den mest aktuelle situasjon der det er indikasjon for overvåkning utenfor slagenhet hvis slagenheten ikke har tilgang på kontinuerlig monitorering . Ved monitorering utenfor slagenhet bør lengden på monotoreringen begrenses, da tidlig slagenhetsbehandling for de aller fleste pasienter er viktigere enn langvarig monitorering.
Kvalitet på dokumentasjonen
Forskningsgrunnlaget er GRADEt til svært lav. Dokumentasjonen er svak og det er derfor ikke mulig å konkludere noe helt sikkert om kontinuerlig monitorering gir bedre behandlingsresultater enn intermitterende monitorering.
Verdier og preferanser
Verdien av muligheten for økt overlevelse og reduksjon av funksjonshemming er særlig vektlagt, og det ble konkludert med at kontinuerlig monitorering er et viktig og nødvendig tiltak uten at det har nok støtte i forskningsgrunnlaget.
Referanser
1. Organised inpatient (stroke unit) care for stroke. https://www.helsedirektoratet.no/referanse/0002-0013-195346
102. Continuous versus intermittent physiological monitoring for acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195447
103. Homeostasis as basis of acute stroke treatment: stroke units are the key https://www.helsedirektoratet.no/referanse/0002-0013-195448
8. What are the components of effective stroke unit care? https://www.helsedirektoratet.no/referanse/0002-0013-195353
Blodtrykkskontroll i akuttfasen ved hjerneinfarkt
Blodtrykksenkende behandling bør ikke startes ved akutt hjerneinfarkt hvis ikke verdiene er meget høye eller det foreligger andre tilstander som gir sterk indikasjon for blodtrykksenking.
SIGN: A1b.
Det foreslås individuell vurdering om hvorvidt BT-behandling skal stoppes eller fortsette hos pasienter med akutt hjerneslag som bruker BT-senkende legemidler ved innkomst.
Praktisk – slik kan anbefalingen følges
Labetalol er det medikamentet som er mest brukt ved akutt BT-behandling ved hjerneslag. Ved infusjonsbehandling oppnås en rask effekt og det er som oftest lett å styre BT-reduksjonen. Ved hjertesvikt, koronarsykdom eller bradycardi pga. labetalol, kan nitroglyserin-infusjon være et bedre alternativ.
I klinisk praksis er det vanlig å starte behandle BT over 220/120 mm Hg. Det tilstrebes en kontrollert reduksjon på 10-20 %. Ved samtidig symptomgivende hjertesvikt eller koronar-sykdom bør det interveneres på lavere verdier for å optimalisere kardial funksjon.
Når det gjelder individuelle vurderinger for pasienter som alt bruker BT-legemidler når de får sitt hjerneslag, bør disse baseres på pasientens alder, komorbiditet, type hjerneslag og blodtrykksnivå. For pasienter med BT-nivåer > 160/100 mm Hg er det vanlig praksis ved mange sykehus å kontinuere pågående BT-behandling , mens ved BT < 140/90 mm Hg er det vanlig å seponere i akuttfasen.
For pasienter med forhøyet BT som er aktuelle for trombolyse er målet med den BT-senkende behandlingen å komme under 185/110 mm Hg. Se anbefaling om trombolytisk behandling av pasienter med akutt hjerneinfarkt
Begrunnelse – dette er anbefalingen basert på
Forbigående økning av blodtrykket er vanlig ved hjerneinfarkt.
Blant pasienter som blir innlagt med akutt hjerneslag er det vist at opptil 50% står på blodtrykksbehandling ved innkomst [112]. I norske sykehus er det 60% av pasienter med hjerneslag som står på BT-behandling ved innleggelse [141]. Forskningsdokumentasjonen viser at midlertidig stopp av blodtrykksbehandling ved akutt hjerneslag kan ha en gunstig effekt på livskvalitet og dagliglivets gjøremål på kort sikt (innen 90 dager). Seponering av blodtrykksbehandling viser ingen sikker effekt på harde endepunkter/utfall som død og funksjonshemning, tidlig død (< 1 måned) og død innen 90 dager. Tilsvarende var det heller ingen sikker effekt på død og funksjonshemning, tidlige død og død ved 90 dager for subgrupper av pasienter med iskemisk hjerneslag og intracerebral blødning, eller ved ulike tidspunkt for oppstart av behandling (< 48 og < 4 timer).
Kunnskapsgrunnlaget tillater derfor ikke å komme med noen klare anbefalinger vedr stopp eller kontinuering av pågående BT-behandling, og må basere seg på individuelle vurderinger (se praktisk info).
Det er usikkerhet om indikasjon for BT-behandling i akuttfasen ved hjerneinfarkt [111]. En Cochrane-analyse fra 2014 fant ikke grunnlag for å anbefale behandling av høyt BT i akuttfasen [114]. Både for høyt og for lavt trykk er assosiert med reduksjon i funksjonsnivå [118]:[117];[115]. Verken kalsiumblokkere [116], transdermalt nitroglyserin [113] eller betablokker [110] har i akuttfasen hatt gunstig effekt på forløpet, snarere tvert imot.
En liten studie med candesartan (angiotensin reseptorblokker) reduserte vaskulære hendelser og død [120]. Men store studier som SCAST-studien [119] og ENOS viste ikke effekt, til dels negativ tendens av senkning av BT i akuttfasen. Samlet sett gir ikke de anførte studier grunnlag for rutinemessig BT-senkende behandling ved hjerneinfarkt i den akutte fasen.
I klinisk praksis er det likevel vanlig å behandle BT over 220/120 mm Hg. Det tilstrebes en kontrollert reduksjon på 10-20 %. Ved samtidig symptomgivende hjertesvikt eller koronar-sykdom bør det interveneres på lavere verdier for å optimalisere kardial funksjon.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneinfarkt
Tiltak (I): Behandle forhøyet blodtrykk i akuttfasen
Sammenligning (C): Ikke behandle forhøyet blodtrykk i akuttfasen
Beskrivelse av inkluderte studier
Resultattabell (PDF)
Flytskjema (PDF)
Søkestrategi (PDF)
Forskningsgrunnlaget er basert på den systematiske oversikten av Bath, P. M., & Krishnan et al. (2014). Denne oversikten inkluderte 26 studier med 17 011 deltakere. Kun to av studiene (ENOS 2014 og COSSACS 2010) undersøkte virkning av å fortsette blodtrykksbehandling i akuttfasen versus å seponere blodtrykksbehandlingen. Disse studiene er brukt gjennomgående for alle utfallsmål. Merk at intervensjon og kontroll er motsatt i studien i forhold til hvordan det er definert i arbeidsgruppens PICO. Tid for behandling i de to studiene var respektive 7 og 14 dager (ENOS 2014, COSSACS 2010).
I evidensgrunnlaget var det en tendens til at studiepopulasjonen var yngre og hadde færre komorbiditeter enn hva som er representativt for en «vanlig» slagpopulasjon. I studiene er det dessuten effekt på kort sikt (<90 dager ) som er undersøkt, slik at det er vanskelig å si noe om virkning over tid.
Merk (1): Begge de inkluderte studiene har som intervensjon å senke systolisk blodtrykk, og kontroll er midlertidig stoppe blodtrykksbehandlingen, med andre ord er intervensjon og kontroll motsatt av hva som er definert i PICO 1.8.
Merk (2): Den ene studien (COSSACS 2010) hadde ikke noe kriterium hvilket blodtrykk deltakerne skulle ha ved inklusjon.
Merk (3): Studiepopulasjonen hadde en tendens til å være yngre og ha færre komorbiditeter enn hva som er representativt for en «vanlig» slagpopulasjon.
Utfall 1: Død eller funksjonshemning
Funksjonshemning ble definert ved mRS skår > 2 (eller >3).
Sammenlignet med kontrollgruppen (seponering), gir blodtrykksbehandling i akuttfasen høyere sannsynlighet (odds), for at pasienten dør eller blir funksjonshemmet i løpet av oppfølgingsperioden (14-90 dager) med 14 fler tilfeller per 1000 pasient (fra 23 færre til 52 flere). Effektestimatet (dvs. antall dødsfall og tilfeller av funksjonshemning) er basert på 2860 pasienter i 2 randomiserte-kontrollerte studier. Blant pasientene fikk 1432 fortsatt blodtrykksbehandling, mens 1428 seponerte denne. Kvaliteten på evidensgrunnlaget er høyt. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt. Det er stor tillit til resultatet.
Utfall 2: Tidlig død
Tidlig død ble målt ved < 1 mnd.
Sammenlignet med kontrollgruppen (seponering), gir trolig blodtrykksbehandling i akuttfasen høyere sannsynlighet (odds), for at pasienten dør i løpet av 1 måned med 16 flere pasienter per 1000 (fra 9 færre til 44 fler). Effektestimatet (dvs. antall dødsfall) er basert på 2860 pasienter i 2 kontrollerte-randomiserte studier. Blant pasientene fikk 1432 fortsatt blodtrykksbehandling, mens 1428 seponerte denne. Kvaliteten på evidensgrunnlaget er moderat grunnet upresist effektestimat. Dette kan skyldes få hendelser. Det er middels tillit til resultatet.
Utfall 3: Død ved studieslutt
Sammenlignet med kontrollgruppen (seponering), gir blodtrykksbehandling i akuttfasen høyere sannsynlighet (odds), for at pasienten dør i løpet av oppfølgingsperioden (14-90 dager) med 16 fler tilfeller per 1000 pasient (fra 9 færre til 44 flere). Effektestimatet (dvs. antall dødsfall) er basert på 2860 pasienter i 2 randomiserte-kontrollerte studier. Blant pasientene fikk 1432 fortsatt blodtrykksbehandling, mens 1428 seponerte denne. Kvaliteten på evidensgrunnlaget er høy. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt. Det er stor tillit til resultatet.
Utfall 4: Barthel Index ved studieslutt (verre er indikert ved lavere skår).
Sammenlignet med kontrollgruppen (seponering), skåret deltakerne som fortsatte blodtrykksbehandling i gjennomsnitt 3.18 lavere (5.8 lavere til 0.55 lavere) på Barthel Index ved studieslutt. Effektestimatet er basert på 2860 pasienter i 2 kontrollerte-randomiserte studier. Blant pasientene fikk 1432 fortsatt blodtrykksbehandling, mens 1428 seponerte denne. Kvaliteten på evidensgrunnlaget er moderat grunnet et vidt/upresist konfidensintervall. Det er middels tillit til resultatet.
Utfall 5: Livskvalitet ved studieslutt – målt ved EQ-5D (verre er indikert ved lavere skår).
Sammenlignet med kontrollgruppen (seponering), skåret deltakerne som fortsatte blodtrykksbehandling i gjennomsnitt 0.03 lavere (0.05 lavere til 0.01 lavere) på EQ-5D ved studieslutt. Effektestimatet er basert på 2860 pasienter i 2 kontrollerte-randomiserte studier. Blant pasientene fikk 1432 fortsatt blodtrykksbehandling, mens 1428 seponerte denne. Kvaliteten på evidensgrunnlaget er moderat grunnet risiko for systematiske feil i forbindelse med manglende blinding av deltakere og klinikere (subjektivt utfallsmål). Det er middels tillit til resultatet.
Vurdering
Fordeler og ulemper
Fordeler: Forskningsdokumentasjonen viser at seponering av blodtrykksbehandling ved akutt hjerneslag muligens kan gi bedre livskvalitet og noe bedre ADL funksjon vurdert med Barthel index enn dersom man fortsetter behandling.
Ulemper: Effektestimatene for «død eller funksjonshemming», «tidlig død» og «død innen 90-dager» viser også at det kan være en risiko forbundet med å seponere blodtrykksbehandling, men at denne ikke er sikker.
Konklusjon: Det er usikkert om fordelene veier opp for ulempene ved å følge denne anbefalingen.
Kvalitet på dokumentasjonen
Kvaliteten på forskningsdokumentasjonen er av moderat til høy kvalitet.
Verdier og preferanser
Usikkerheten knyttet til effekt av dette tiltaket, antyder at det ikke er å vente at alle vil ønske å få denne behandlingen.
Referanser
110. Low dose β blockade in acute stroke (“BEST” trial): an evaluation https://www.helsedirektoratet.no/referanse/0002-0013-195455
111. International Society of Hypertension (ISH): statement on the management of blood pressure in acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195456
112. Interventions for deliberately altering blood pressure in acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195457
113. Nitric oxide donors (nitrates), L‐arginine, or nitric oxide synthase inhibitors for acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195458
114. Interventions for deliberately altering blood pressure in acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195459
115. General care in stroke: relevance of glycemia and blood pressure levels https://www.helsedirektoratet.no/referanse/0002-0013-195460
116. Calcium antagonists for acute ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195461
117. Blood pressure and antihypertensive therapy as predictors of early outcome in acute ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195462
118. Pressor therapy in acute ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195463
119. The angiotensin-receptor blocker candesartan for treatment of acute stroke (SCAST): a randomised, placebo-controlled, double-blind trial https://www.helsedirektoratet.no/referanse/0002-0013-195464
120. The ACCESS study https://www.helsedirektoratet.no/referanse/0002-0013-195465
141. Årsrapport 2015. Med plan for forbedringstiltak https://www.helsedirektoratet.no/referanse/0002-0013-195486
Sist faglig oppdatert: 21.12.2017
Behandling av feber ved akutt hjerneinfarkt
Pasienter med temperatur >37,5 grader de første 24-48 t etter debut av hjerneinfarkt bør få behandling med paracetamol.
SIGN: B1b
Praktisk – slik kan anbefalingen følges
Det finnes ulike metoder for å senke feber ved akutt hjerneslag, men i praksis er parcatamol den enkleste og mest benyttede metoden selv om temperaturreduksjonen som oppnås er moderat.
Behandling med paracetamol (4-6 g/døgn) senker kroppstemperaturen med 0,2-0,4 grader og kan medføre bedring i funksjonsnivå. [125];[122];[121].
Begrunnelse – dette er anbefalingen basert på
Feber (>37,5 grader C) innen 24-48 t etter symptomdebut er assosiert med økt dødelighet [123];[124] og nedsatt funksjonsnivå [123];[126].
Behandling med paracetamol (4-6 g/døgn) senker kroppstemperaturen med 0,2-0,4 grader og kan medføre bedring i funksjonsnivå [125];[122];[121].
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneinfarkt
Tiltak (I): Medikamentell behandling av feber
Sammenligning (C): Ikke behandling av feber
Beskrivelse av inkluderte studier
Referanser
121. Cooling therapy for acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195466
122. Effect of paracetamol (acetaminophen) on body temperature in acute ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195467
123. Effects of poststroke pyrexia on stroke outcome https://www.helsedirektoratet.no/referanse/0002-0013-195468
124. Admission body temperature predicts long-term mortality after acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195469
125. Acetaminophen for altering body temperature in acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195470
126. Hyperthermia is a surrogate marker of inflammation‐mediated cause of brain damage in acute ischaemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195471
Sist faglig oppdatert: 21.12.2017
Behandling av hyperglykemi ved akutt hjerneinfarkt
Pasienter med akutt hjerneinfarkt bør behandles med subkutant insulin ved blodglukose >10 mmol/l med mål blodglukose 6-8 SIGN: B1b
Pasienter med hyperglykemi de første 24 t etter debut av hjerneslag bør få kontrollert blodsukkernivået regelmessig, dvs. minst 4 ganger første døgnet og hyppigere hos pasienter med betydelig hyperglykemi eller hypoglykemi.**
Praktisk – slik kan anbefalingen følges
Hvis en pasient med akutt hjerneslag har forhøyet blodglukose, bør glukosenivåene kontrolleres nøye. De første 24 t etter debut av hjerneslag bør blodsukkernivået kontrolleres regelmessig, dvs. minst 4 ganger første døgnet og hyppigere hos pasienter med betydelig hyperglykemi eller hypoglykemi.
Hvis det besluttes å senke glukosenivået med insulin, bør hurtigvirkende insulin benyttes, og vanligvis gir subcutan administrering hurtig og tilstrekkelig effekt. **
Begrunnelse – dette er anbefalingen basert på
Hyperglykemi (>7.0 mmol/l) forekommer ofte hos pasienter med akutte hjerneslag [128], både blant diabetikere (70-100 %) og ikke-diabetikere (30-50 %). Hyperglykemi er assosiert med større hjerneskade, og redusert overlevelse og funksjonsnivå [132];[130]. Særlig sårbare er pasienter behandlet med trombolyse, hvor hyperglykemien synes å øke både den iskemiske skaden og risikoen for hemorrhagisk transformasjon [127].
Glukose-insulin-infusjon kan redusere mortalitet og morbiditet hos pasienter innlagt ved intensivavdelinger [133]. Tilsvarende studier hos pasienter med hjerneslag viser ikke nytte av et like strengt behandlingsregime [131];[134] Det er likevel grunn til å tro at god kontroll har betydning i den akutte fasen[129]. Da vil vanligvis et subcutant regime med hurtigvirkende insulin benyttes.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneinfarkt
Tiltak (I): Behandling av moderat hyperglykemi
Sammenligning (C): Ikke behandling av moderat hyperglykemi
Beskrivelse av inkluderte studier
Referanser
127. Impact of admission hyperglycemia on stroke outcome after thrombolysis https://www.helsedirektoratet.no/referanse/0002-0013-195472
128. Report of the expert committee on the diagnosis and classification of diabetes mellitus https://www.helsedirektoratet.no/referanse/0002-0013-195473
129. Treatment of hyperglycemia in ischemic stroke (THIS) https://www.helsedirektoratet.no/referanse/0002-0013-195474
130. Stress hyperglycemia and prognosis of stroke in nondiabetic and diabetic patients https://www.helsedirektoratet.no/referanse/0002-0013-195475
131. Glucose-potassium-insulin infusions in the management of post-stroke hyperglycaemia: the UK Glucose Insulin in Stroke Trial (GIST-UK) https://www.helsedirektoratet.no/referanse/0002-0013-195476
132. Increased damage after ischemic stroke in patients with hyperglycemia with or without established diabetes mellitus https://www.helsedirektoratet.no/referanse/0002-0013-195477
133. Intensive insulin therapy in the medical ICU https://www.helsedirektoratet.no/referanse/0002-0013-195478
134. A randomised, controlled pilot study to investigate the potential benefit of intervention with insulin in hyperglycaemic acute ischaemic stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195479
Sist faglig oppdatert: 21.12.2017
Svelgetesting ved akutt hjerneslag
Standardisert vurdering av svelgefunksjon bør gjøres av alle pasienter med akutt hjerneslag.**
Praktisk – slik kan anbefalingen følges
Begrunnelse – dette er anbefalingen basert på
Svelgevansker er svært vanlig i akuttfasen av hjerneslag, det forekommer hos 27-64% av pasientene. Aspirasjon er en viktig årsak til pneumoni, som er en av hovedårsakene til forverret prognose og død ved hjerneslag. Standardisert vurdering av svelgefunksjon vil avdekke de fleste med svelgevansker og kan sørge for trygg administrasjon av medikamenter og næring. Det bør derfor gjøres hos alle pasienter med hjerneslag før de får noe administrert per os.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneslag
Tiltak (I): Rutinemessig svelgkartlegging akutt
Sammenligning (C): Annen observasjon
Beskrivelse av inkluderte studier
Referanser
135. Interventions for dysphagia in acute stroke. Cochrane Library. Issue 2 https://www.helsedirektoratet.no/referanse/0002-0013-195480
136. Interventions for dysphagia and nutritional support in acute and subacute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195481
137. Screening swallowing function of patients with acute stroke. Part one: Identification, implementation and initial evaluation of a screening tool for use by nurses https://www.helsedirektoratet.no/referanse/0002-0013-195482
138. Svelgetesting hindrer dødsfall https://www.helsedirektoratet.no/referanse/0002-0013-195483
139. Dysphagia bedside screening for acute-stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195484
Sist faglig oppdatert: 21.12.2017
Overvåkning og behandling ved akutt hjerneblødning
Akutt blodtrykksreduksjon ved akutt hjerneblødning
Det foreslås å redusere forhøyet blodtrykk til 140 mm Hg systolisk hos pasienter med akutt hjerneblødning med symptomvarighet < 6 timer.
Praktisk – slik kan anbefalingen følges
Vanligvis vil blodtrykksenkingen gjøres med intravenøse midler. Vanlige strategier er labetotol i repeterte støtdoser eller nitroprussid-infusjon under monitorering av hjerterytme og blodtrykk.
Ytterligere intensiv blodtrykkssenkning til lavere nivåer, 120 mm Hg systolisk eller lavere, har usikker klinisk effekt og foreslås ikke i akuttfasen for de fleste pasienter med hjerneblødning.
Begrunnelse – dette er anbefalingen basert på
Forhøyet BT er svært vanlig ved akutt hjerneblødning og er forbundet med hematomvekst, nevrologisk forverrelse, økt dødelighet og avhengighet. [151];[155];[153].
Reduksjon av blodtrykk til under 140 mm Hg systolisk hos pasienter med akutt hjerneblødning med symptomvarighet < 6 timer er trygt og kan være effektivt med trend i retning redusert risiko for død eller alvorlig handicap. Dette foreslås som behandlingsmål for de fleste pasienter med hjerneblødning som kommer til behandling innen 6 timer. Dokumentasjonen av effekt er ikke tilstrekkelig til å gi grunnlag for en sterk anbefaling.
Ytterligere intensiv blodtrykkssenkning til lavere nivåer, 120 mm Hg systolisk eller lavere, har usikker klinisk effekt og foreslås ikke i akuttfasen for de fleste pasienter med hjerneblødning.
Forskningsgrunnlag
Populasjon (P): Voksne med hjerneblødning
Tiltak (I): Senke BT >140 mm Hg til et lavere nivå
Sammenligning (C): Observere BT som er under 180 mm Hg uten behandling
Beskrivelse av inkluderte studier
Resultattabell (PDF)
Flytskjema (PDF)
Søkestrategi (PDF)
Anbefalingen tar utgangspunkt i en systematisk litteraturoversikt som ble funnet ved gjennomgang av treffliste fra litteratursøk: Bath, P. M., & Krishnan, K. (2014). Interventions for deliberately altering blood pressure in acute stroke. Cochrane Database of Systematic Reviews, 10, CD000039. doi: 10.1002/14651858.CD000039.pub3
Bath, P. M., & Krishnan, K. (2014) er en oppdatert Cochrane-oversikt som hadde til hensikt å undersøke den kliniske effekten av blodtrykksregulering, samt effekt av forskjellige vasoaktive medikamenter, hos pasienter med akutt hjerneslag. Studiene inkludert i litteraturoversikten hadde stor variasjon vedr. oppstartstidspunkt for blodtrykkssenkende behandling (fra < 168 til < 4 timer) og studiepopulasjonen inkluderte både pasienter med iskemisk hjerneslag og hjerneblødning. Arbeidsgruppen besluttet derfor å trekke ut informasjon og oppsummere samlet effekt (meta-analyse) fra de studiene som utelukkende inkluderte pasienter med akutt hjerneblødning og som hadde oppstart av blodtrykksenkende behandling innen 6 timer etter debut (INTERACT 1 og INTERACT 2, se forest plot vist i figur 1).
De to randomiserte kontrollerte studiene INTERACT 1 (pilot) og INTERACT 2 undersøkte nytteverdi av blodtrykkssenking til under 140 mm Hg systolisk hos totalt 3 243 pasienter med akutt hjerneblødning og symptomvarighet under 6 timer (REF INTERACT 1 og INTERACT 2. ). Sammenligningsgrunnlaget i studiene var pasienter som fikk standard behandling med systolisk blodtrykksmål satt til under 180 mm Hg. Figur 1 viser oppsummert effekt på tvers av studiene for utfallet død og funksjonshemning. Det samlede effektestimatet (her vist ved Odds Ratio (OR) viste en trend mot redusert risiko for død og funksjonshemning ved systolisk blodtrykkssenking til under 140 mm Hg sammenlignet med standard behandling (ikke statistisk signifikant). Det ble funnet at blodtrykkssenking var trygt i både INTERACT 1 og INTERACT 2, samt i en annen tidligere, mindre studie.
Arbeidsgruppen avventet ATACH2-studien før utforming av anbefalingen.
ATACH-2 studien undersøkte sikkerhet og effekt av mer intensiv BT senking til 110-139 mm Hg systolisk innen 3 timer fra symptomdebut sammenlignet med standard behandling. Det var ingen signifikant forskjell i effekt mellom gruppene. En post hoc analyse viste flere uønskede renale hendelser de første 7 dager i den intensive gruppen (9% vs 4%), men ingen forskjell i alvorlige uønskede renale hendelser (0,8% vs 0,2%) eller uønskede hendelser fra andre organsystemer(1).
ATACH-2 og INTERACT 2 var forskjellige på flere punkter. I ATACH 2 ble pasientene behandlet mer aggressivt i både den intensive gruppen og kontrollgruppen. I ATACH-2 var gjennomsnittlig minimums systolisk BT de først to timer 128,9 mm Hg i den intensive gruppen og 141 mm Hg i kontrollgruppen. I INTERACT 2 var gjennomsnittlig systolisk BT den første timen 150 mm Hg i den intensive gruppen og 164 mm Hg i kontrollgruppen.
Kontrollgruppen i ATACH2 og intensivgruppen i INTERACT 2 hadde svært like blodtrykksprofiler de første timene etter randomisering. En svakhet i forhold til generalisering av resultatene i studiene er at Studiene er utført på pasienter med gjennomsnittsalder 61 – 63 år. Om en skal ha like ambisiøse mål for BT senkning for de i de eldre årsklasser er ikke godt kartlagt.
I ENOS-studien ble pasienter med hjerneinfarkt eller hjerneblødning randomisert innen 48 timer til glyceryltrinitratplaster (GTN) 5 mg/dag eller kontroll. I en subgruppe med 61 pasienter med hjerneblødning randomisert innen 6 timer var modified Rankin Score i gruppen med GTN signifikant bedre) (38).
Anbefalingen er vurdert på bakgrunn av «oppsummert forskning»/ vurdering av kunnskapsgrunnlaget og arbeidsgruppens samlede erfaring og kunnskap.
Oppsummering og vurdering
Forhøyet BT er svært vanlig ved akutt hjerneblødning og er forbundet med hematomvekst, nevrologisk forverrelse, økt dødelighet og avhengighet.[29-31]
Reduksjon av blodtrykk til under 140 mm Hg systolisk hos pasienter med akutt hjerneblødning med symptomvarighet < 6 timer er trygt og kan være effektivt med trend i retning redusert risiko for død eller alvorlig handicap. Det foreslås som behandlingsmål for de fleste pasienter med hjerneblødning som kommer til behandling innen 6 timer.
Ytterligere intensiv blodtrykkssenkning til lavere nivåer, 120 mm Hg systolisk eller lavere, har usikker klinisk effekt og foreslås ikke i akuttfasen for de fleste pasienter med hjerneblødning.
Vurdering
Fordeler og ulemper
Fordeler: Studier har vist sammenheng mellom blodtrykk og hematomvekst. Ettersom hematomstørrelse er en viktig prognostisk faktor for funksjonelt utkomme, vil en blodtrykkssenkning i akuttfasen teoretisk være riktig. INTERACT 2-studien viste også at de med høyest utgangstrykk hadde tendens til best effekt.
Ulemper: En motforestilling mot intensiv blodtrykkssenking hos pasienter med hjerneblødning er muligheten for negativ påvirkning av en iskemisk penumbra rundt hematomet. Imidlertid har man ikke kunnet påvise slik penumbra i studier med avansert billeddiagnostikk og heller ikke redusert blodstrøm i vevet rundt hematomet ved blodtrykksenking (35-37) ATACH 2 studien viste imidlertid ikke økt behandlingseffekt av svært aggressiv blodtrykkssenkning i akuttfasen, noe som kan tyde på at det skal vises en viss forsiktighet i hvor mye man senker blodtrykket.
Tiltaket fordrer en viss overvåking. Det er prinsipielt ikke ønskelig at pasienter blir flyttet ut av slagenheten til andre enheter med overvåking uten slagenhetskompetanse kun for blodtrykkssenking. I tilfelle bør et slik opphold utenfor slagenhet være så kort som mulig. Det er imidlertid ønskelig med overvåkingsmulighet i slagenhet. Lokale forhold må hensyntas. Det er vurdert at fordelene veier opp for ulempene.
Kvalitet på dokumentasjonen
Det er gjort et uttrekk av Sof-tabellen av studier som omhandler BT-reduksjon innen de første 6 timer. Det er ikke utført kvalitetsvurdering av dette uttrekket. For studier funnet ved systematisk litteratursøk, er kvaliteten vurdert til å være lav til moderat.
Verdier og preferanser
Effekten av blodtrykkssenkning av forhøyet blodtrykk hos voksne med hjerneblødning kan blant annet måles som mRS, død, livskvalitet og NIHSS. Dette tiltaket er forbundet med bedre utfallsmål, og det er trolig at de fleste pasienter ville velge denne behandlingen.
Referanser
149. Rapid blood-pressure lowering in patients with acute intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195494
150. Interventions for deliberately altering blood pressure in acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195495
151. Risk of stroke early after transient ischaemic attack: a systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195496
152. Efficacy of nitric oxide, with or without continuing antihypertensive treatment, for management of high blood pressure in acute stroke (ENOS): a partial-factorial randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195497
153. Therapy-based rehabilitation services for stroke patients at home https://www.helsedirektoratet.no/referanse/0002-0013-195498
154. Interpretation and implementation of intensive blood pressure reduction in acute cerebral hemorrhage trial (INTERACT II) https://www.helsedirektoratet.no/referanse/0002-0013-195499
155. Effect of urgent treatment of transient ischaemic attack and minor stroke on early recurrent stroke (EXPRESS study): a prospective population-based sequential comparison https://www.helsedirektoratet.no/referanse/0002-0013-195500
156. The ECASS 3-hour cohort https://www.helsedirektoratet.no/referanse/0002-0013-195501
167. Intensive Blood-Pressure Lowering in Patients with Acute Cerebral Hemorrhage http://www.nejm.org/doi/full/10.1056/NEJMoa1603460
Monitorering av fysiologiske parametre ved akutt hjerneblødning
Det foreslås at pasienter med akutt hjerneblødning får kontinuerlig monitorering av hjerterytme, blodtrykk og oksygenmetning i en slagenhet i minst 24-48 timer, og lengre hos ustabile pasienter.
Praktisk – slik kan anbefalingen følges
Overvåkningen bør skje i en slagenhet, helst i egne overvåkningssenger med sykepleier lett tilgjengelig. Automatiske målinger som kan avleses i en overvåkningssentral vil være et alternativ der ikke slagenheten disponerer egne overvåkningssenger. Hos ustabile pasienter og pasienter som har redusert bevissthet eller er truet av respirasjons- eller sirkulasjonssvikt, bør overvåkning skje i en semi-intensiv eller intensiv avdeling.
Respirasjon (i praksis oksygenmetning), sirkulasjon (BT og hjerterytme), væskebalanse, blodsukkerkonsentrasjon og temperatur er de viktigste faktorene som bør overvåkes og ev korrigeres, og dette er viktige elementer i akutt slagenhetsbehandling [103].
Overvåkning bør ikke gå på bekostning av mulighet for mobilisering, og overvåkning utover 2-3 døgn bør bare skje når det er sterk indikasjon for videre kontroll av den fysiologiske homøostase.
Begrunnelse – dette er anbefalingen basert på
Forstyrrelser i den fysiologiske balanse/homøostase med hyperglykemi, feber, hypoksi, hypertensjon eller hypotensjon er assosiert med dårlig prognose. Den generelle overvåkning og behandling i akuttfasen har som mål å optimalisere den fysiologiske homøostase.
Det er få studier som har undersøkt effekten av kontinuerlig monitorering versus intermitterende monitorering, og studiene er av varierende kvalitet [102]. Overvåkning av fysiologisk homøostase er et viktig element i akutt slagenhetsbehandling [8];[103]. Vi mangler store og gode studier som klart dokumenterer den kliniske erfaringen og erfaringen fra slagenhetsstudiene at dette er et viktig tiltak i slagenhetene. Det er derfor ikke grunnlag for noe mer enn en svak anbefaling.
Det er også usikkerhet om hvor lenge monitorering bør gjennomføres ved akutt hjerneslag. I de aktuelle studier har monotoreringen vært begrenset til de første dagene, men i praksis bør lengden tilpasses alvorlighetsgraden av utfallene og om pasienten er stabil når det gjelder nevrologiske utfall og de fysiologiske parametre.
Anbefalingen er basert på vurdering av kunnskapsgrunnlaget og arbeidsgruppens samlede erfaring og kunnskap.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneslag
Tiltak (I): Kontinuerlig monitorering
Sammenligning (C): Intermitterende observasjon i tradisjonell slagenhet
Beskrivelse av inkluderte studier
Resultattabell (PDF)
Flytskjema (PDF)
Søkestrategi (PDF)
Definisjoner:
• mRS er forkortelse for modified Rankin Scale som uttrykker grad av selvhjulpenhet/funksjonshemming. Skalaen går fra 0 (intet symptom) til 6 (død)
• NIHSS er forkortelse for National Institute of Health Stroke scale, som er en klinisk vurderingsskala for nevrologiske symptom ved hjerneslag
• Atrieflimmer er en hjerterytmeforstyrrelse som involverer de to forkamrene (atriene) i hjertet
• Konfidensintervall gir informasjon om den statistiske usikkerhet når det gjelder resultatet.
o Smalt konfidensintervall: liten usikkerhet
o Bredt konfidensintervall: stor usikkerhet
Ciccone et al., 2013 er en metaanalyse med tre randomiserte kontrollerte studier med åpent design (enkel blinding) og med til sammen 354 deltakere. Studien som dominerer i metaanalysen omtales av Ciccone et al., 2013 som kvasi-randomisert fordi sekvensgenereringen ikke var tilfeldig (dvs. randomisert), men systematisk basert på ledig sengekapasitet. Denne studien har høy risiko for systematiske feil.
- Metaanalysen har relativt få deltakere totalt (354 stk.). Det er relativt få hendelser per utfall. Presisjon er nedgradert grunnet liten informasjonsstørrelse (total studiepopulasjon < 400; få hendelser < 300)
- Alle effektestimatene (unntatt ett) inkluderer studien med høy risiko for systematiske feil, og er derfor nedgradert
Flere av utfallene er ytterligere nedgradert pga. heterogenitet og vide konfidensintervall. For mange utfall har vi derfor veldig lav tiltro til at effektestimatene ligger nær den sanne effekten.
Død eller funksjonshemming (mRS ≥3, mRS ≥4): Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 276 færre tilfeller per 1000 pasient med slag (fra 138 færre til 366 færre). Effektestimatet (dvs. død eller funksjonshemming) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. Død eller funksjonshemming ble målt ved utskriving fra sykehus i den ene studien og etter tre måneder i de to andre studiene. Tiltroen til effektestimatet er veldig lav.
Død (alle årsaker) ved utskriving: Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 17 færre dødsfall per 1000 pasient med slag (fra 44 færre til 47 flere). Konfidensintervallet krysser linjen for ingen forskjell i effekt mellom gruppene. Effektestimatet (dvs. død, alle årsaker) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. Tiltroen til effektestimatet er lav.
Funksjonshemming ved 3 måneder: Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 47 færre tilfeller med funksjonshemming per 1000 pasient med slag (fra 187 færre til 169 flere). Konfidensintervallet krysser linjen for ingen forskjell i effekt mellom gruppene. Effektestimatet (dvs. funksjonshemming ved 3 mnd) er basert på data fra 86 pasienter i to randomiserte-kontrollerte studier. Tiltroen til effektestimatet er veldig lav.
Død av vaskulære årsaker: Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 14 færre dødsfall av vaskulære årsaker per 1000 pasient med slag (fra 25 færre til 37 flere). Konfidensintervallet krysser linjen for ingen forskjell i effekt mellom gruppene. Effektestimatet (dvs. død, vaskulære årsaker) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. Død ble målt ved utskriving fra sykehus i den ene studien og etter tre måneder i de to andre studiene. Tiltroen til effektestimatet er veldig lav.
Liggedøgn: Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag i snitt gi ca. 5 færre liggedøgn på sykehus per 1000 pasient med slag (fra 10 færre til 0,03 flere). Effektestimatet (dvs. liggedøgn) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier, men det var stor og uforklarlig forskjell mellom studiene. Den ene av de tre studiene hadde også høy risiko for systematiske feil. Tiltroen til effektestimatet er veldig lav.
Nevrologiske komplikasjoner (forverring av slag, nytt slag og krampeanfall): Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 29 færre nevrologiske komplikasjoner per 1000 pasient med slag (fra 89 færre til 59 flere). Konfidensintervallet krysser linjen for ingen forskjell i effekt mellom gruppene. Effektestimatet (dvs. nevrologiske komplikasjoner) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. Tiltroen til effektestimatet er lav.
Kardiologiske komplikasjoner (atrieflimmer, arytmier, hjertesvikt, hjerteinfarkt): Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 113 flere kardiologiske komplikasjoner per 1000 pasient med slag (fra 25 flere til 321 flere). Effektestimatet (dvs. kardiologiske komplikasjoner) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. Tiltroen til effektestimatet er veldig lav.
Komplikasjoner til immobilitet
Lungebetennelse: Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 18 flere lungebetennelser per 1000 pasient med slag (fra 23 færre til 109 flere). Konfidensintervallet krysser linjen for ingen forskjell i effekt mellom gruppene. Effektestimatet (dvs. lungebetennelser) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. I de tre studiene ble antall lungebetennelser (inkludert aspirasjonsrelatert) målt på forskjellig tidspunkt: i løpet av innleggelsestiden, i løpet av de første 48 timene, i løpet av de første fem dagene. Tiltroen til effektestimatet er veldig lav.
Andre infeksjoner (urinveisinfeksjoner og «andre infeksjoner»): Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 56 flere infeksjoner per 1000 pasient med slag (fra 3 færre til 162 flere). Konfidensintervallet krysser linjen for ingen forskjell i effekt mellom gruppene. Effektestimatet (dvs. infeksjoner) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. Tiltroen til effektestimatet er veldig lav.
Dyp venetrombose: Sammenlignet med intermitterende overvåking kan kontinuerlig overvåking i 24-72 timer etter hjerneslag gi 5 flere dype venetromboser per 1000 pasient med slag (fra 18 færre til 80 flere). Konfidensintervallet krysser linjen for ingen forskjell i effekt mellom gruppene. Effektestimatet (dvs. dyp venetrombose) er basert på data fra 354 pasienter i tre randomiserte-kontrollerte studier. Den ene av de tre studiene hadde høy risiko for systematiske feil. Tiltroen til effektestimatet er veldig lav.
Vurdering
Fordeler og ulemper
Fordeler:
Forskningsdokumentasjonen er sparsom og av lav kvalitet og gir ikke entydig og klart svar på dette spørsmålet. De få studier som er utført, viser imidlertid en trend mot positive resultater (se tabeller).
Kontinuerlig monitorering kan gi verdifull informasjon om eventuelle farer for en hjerne som nettopp har blitt rammet av en sirkulasjonsforstyrrelse pga blodpropp eller blødning. Tiltak for å korrigere ugunstige forhold når det gjelder den fysiologiske balanse, kan trolig iverksettes tidligere hvis kontinuerlig monitorering finner sted og dette kan ha en positiv effekt for behandlingsresultatet.
Ulempe:
Kontinuerlig monitorering kan gå på bekostning av tidlig mobilisering, og særlig dersom kontinuerlig monitorering fører til at det tar lenger tid før pasienten kommer til en slagenhet hvor pasienten tas hånd om av spesialopplært personale. Det er også en usikkerhet om hvilket enkeltelement i den kontinuerlige monitorering (oksygen, puls, BT etc.) som er viktigst.
Konklusjon:
De ønskede effektene veier antagelig opp for de uønskede effektene dersom slagenheten utfører tiltaket.
Kvalitet på dokumentasjonen
Kunnskapsgrunnlaget gir oss svar på kontinuerlig monitorering innen 24-36 timer.
Kunnskapsgrunnlaget er GRADEt til svært lav av metodikere, men arbeidsgruppen vurderte/oppgraderte denne til lav kvalitet begrunnet i klinisk erfaring som tyder på at slik monitorering kan være nyttig.
Dokumentasjonen er imidlertid svak, og det er derfor ikke mulig å konkludere noe helt sikkert om kontinuerlig monitorering gir bedre behandlingsresultater enn intermitterende monitorering.
Verdier og preferanser
Verdien av økt overlevelse og reduksjon av funksjonshemming er særlig vektlagt i utforming av anbefaling. Kontinuerlig monitorering er et viktig og nødvendig tiltak også uten at det har nok støtte i forskningsgrunnlaget.
Referanser
1. Organised inpatient (stroke unit) care for stroke. https://www.helsedirektoratet.no/referanse/0002-0013-195346
102. Continuous versus intermittent physiological monitoring for acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195447
103. Homeostasis as basis of acute stroke treatment: stroke units are the key https://www.helsedirektoratet.no/referanse/0002-0013-195448
8. What are the components of effective stroke unit care? https://www.helsedirektoratet.no/referanse/0002-0013-195353
Hemostatisk behandling ved akutt hjerneblødning
Ved akutt hjerneblødning anbefales ikke aktivert faktor VII utenfor kliniske studier.
SIGN: B1b
Ved akutt hjerneblødning hos pasienter på oral antikoagulasjonsbehandling bør rask reversering av antikoagulasjon vurderes.
SIGN: C3
Praktisk – slik kan anbefalingen følges
Det er utarbeidet et informasjonshefte fra Helsedirektoratet som inneholder spesifikke råd om tiltak ved hjerneblødning under pågående behandling med warfarin eller DOAK. Imidlertid ble denne publisert før spesifikk antidot for dabigatran, idarucizumab (Praxbind®) ble godkjent.
Informasjon om warfarin og de perorale antikoagulasjonsmidlene dabigatran, rivaroksaban og apixaban (Utgitt: 28.04.2015, IS-nummer: IS-2050)
Begrunnelse – dette er anbefalingen basert på
Hjerneblødning hos pasienter som ikke står på oral antikoagulasjon
Behandling med rekombinant aktivert faktor VII (FVIIa) er vist å kunne redusere hematomvekst, men ikke gi bedre klinisk resultat sammenlignet med placebo. En pilotstudie viste redusert hematomvekst og bedret klinisk resultat (21). Imidlertid viste en påfølgende større fase 3 studie ikke bedret klinisk resultat, hvilket delvis kunne skyldes økt risiko for tromboemboliske episoder (22, 23). Behandling med FVIIa ved akutt hjerneblødning anbefales derfor ikke brukt utenfor kontrollerte studier.Det pågår studier av effekten av behandling med tranexamsyre ved akutt hjerneblødning.
Warfarin-assosiert hjerneblødning
Prognosen ved akutt hjerneblødning er mer alvorlig for pasienter som er under behandling med warfarin (24-26).Ved akutt warfarin-assosiert hjerneblødning anbefales rask korrigering av INR. Protrombinkompleks (PPC) anbefales fremfor ferskfrosset plasma (FFP). Vitamin-K anbefales gitt i tillegg (ikke tilstrekkelig alene).
Det finnes ingen randomiserte kontrollerte studier av nytten av å reversere warfarin-effekten. Likevel har dette blitt standard behandling ut fra observasjonsdata og farmakologiske data. Det er vanlig å gi Vitamin-K 5-10 mg intravenøst samt fersk frosset plasma (FFP) eller, Protrombinkompleks (PPC). PPC er vist å kunne reversere warfarin-effekten raskere enn FPP (27) og er derfor å foretrekke. Målet bør være å nå INR nivå<1.5 så raskt som mulig. INR bør kontrolleres flere ganger i forløpet. Vitamin K tilførsel alene har ikke tilstrekkelig effekt.
DOAK (direktevirkende orale antikoagulantia)-assosiert hjerneblødning
Det finnes mindre/lite data på prognosen ved hjerneblødning hos pasienter som er under behandling med direktevirkende orale antikoagulantia (DOAK).I en liten prospektiv observasjonsstudie som inkluderte 11 pasienter med DOAK-assosiert ICH og 52 pasienter med warfarin-assosiert ICH, var hjerneblødninger ved behandling med
DOAK assosiert med mindre hematom-volum og bedre prognose sammenlignet med hjerneblødninger ved behandling med warfarin (Marevan). (28)
Ved akutt hjerneblødning under behandling med dabigatran bør behandling med spesifikk antidot, idarucizumab (Praxbind®), vurderes. Når antidoter for de øvrige DOAK blir godkjent (2018), bør også de spesifikke antidoter for disse midler vurderes ved hjerneblødning.
Ved akutt hjerneblødning under behandling med øvrige DOAK kan behandling med protrombinkompleks (PPC) vurderes.
Det finnes ingen data fra randomiserte kontrollerte studier av nytteeffekten av å reversere effekten av DOAK ved hjerneblødning.
For dabigatran foreligger det nå en antidot, idarucizumab- (Praxbind®). Det forventes det vil komme antidot for flere andre DOAK.
Nytten av FPP er usikker, og Vitamin K er ikke virksomt. Det har vært foreslått at FEIBA eller rFVIIa kan virke bedre på den direkte trombinhemmeren dabigatran, mens andre PPC kan virke bedre på faktor Xa-hemmerne rivaroxaban og apixaban, (Hemphill ASA Guidelines ref 96–99).
Referanser
142. Thromboembolic events with recombinant activated factor VII in spontaneous intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195487
143. Location and outcome of anticoagulant-associated intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195488
144. Intracerebral hematomas during anticoagulant treatment https://www.helsedirektoratet.no/referanse/0002-0013-195489
145. Oral anticoagulants and intracranial hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195490
146. Recombinant activated factor VII for acute intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195491
147. Efficacy and safety of recombinant activated factor VII for acute intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195492
148. Efficacy and safety of a four-factor prothrombin complex concentrate (4F-PCC) in patients on vitamin K antagonists presenting with major bleeding: a randomized, plasma-controlled, phase IIIb study https://www.helsedirektoratet.no/referanse/0002-0013-195493
Sist faglig oppdatert: 21.12.2017
Kirurgisk behandling ved akutt hjerneblødning
Pasienter med blødning i storhjernen bør som hovedregel ikke opereres.
SIGN: A1b.
Pasienter med blødning i lillehjernen med klinisk forverring bør behandles med kirurgisk fjerning av hematomet.
SIGN: C3.
Hos pasienter med overfladisk lobær blødning kan kraniotomi vurderes.
SIGN: B2b.
Praktisk – slik kan anbefalingen følges
Pasienter med svært redusert bevissthetsnivå initialt bør vanligvis ikke opereres på grunn av liten effekt. Pasienter med lette nevrologiske utfall og små hematomer (<10 ml) bør ikke opereres pga. godt resultat av ikke-kirurgisk behandling [165].
Pasienter med intraventrikulær blødning har dårligere prognose, både pga. en vanligvis større sentral blødning og pga. risiko for utvikling av hydrocephalus. Ekstern drenasje av cerebrospinalvæske med ventrikkelkateter kan være aktuelt, og disse pasientene bør også følges med gjentatt bildediagnostikk [165].
Det bør etableres nært samarbeid mellom slagenhet og nevrokirurgisk avdeling med klare avtaler om hvilke pasienter med intracerebral blødning som bør overflyttes for nevrokirurgisk vurdering og når dette evt bør skje.
Begrunnelse – dette er anbefalingen basert på
Nytten av kirurgisk evakuering av lobære blødninger i storhjernen er ikke dokumentert [160];[166];[165];[161];[162] (SIGN:1b). Kirurgisk intervensjon kan i noen tilfeller være livreddende, men muligheten for å redusere alvorlig funksjonshemning er uavklart og omdiskutert.
Kraniotomi kan være nyttig ved hematomer nær hjernens overflate [158] (SIGN: 2b). Effekten av dekompressiv hemikraniektomi er uavklart og kan ikke anbefales [161]. Pasienter med store (>3 cm) cerebellære blødninger og cerebellære blødninger med hjernestammekompresjon eller hydrocephalus bør som hovedregel opereres [159] (SIGN: 3).
Intraventrikulær trombolyse med urokinase[164] og lav dose alteplase (ref*) har vært utprøvd i små serier og fører til raskere fjerning av blodansamlingen/koaglet i ventriklene [164]. Den kliniske effekten er usikker, og behandlingsanbefalinger kan foreløpig ikke gis. Pasienter med intracerebrale blødninger på grunn av aneurysmer og karmalformasjoner bør utredes og behandles i nært samarbeid med nevrokirurg.
Referanser
158. Reprint https://www.helsedirektoratet.no/referanse/0002-0013-195503
159. Neurosurgical management of cerebellar haematoma and infarct https://www.helsedirektoratet.no/referanse/0002-0013-195504
160. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial intracerebral haematomas in the International Surgical Trial in Intracerebral Haemorrhage (STICH): a randomised trial https://www.helsedirektoratet.no/referanse/0002-0013-195505
161. Surgical options in ICH including decompressive craniectomy https://www.helsedirektoratet.no/referanse/0002-0013-195506
162. Rebleeding leads to poor outcome in ultra-early craniotomy for intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195507
163. Low-dose recombinant tissue-type plasminogen activator enhances clot resolution in brain hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195508
164. Intraventricular thrombolysis speeds blood clot resolution: results of a pilot, prospective, randomized, double-blind, controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195509
165. Spontaneous intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195510
166. Meta analyses in treatment of spontaneous supratentorial intracerebral haematoma https://www.helsedirektoratet.no/referanse/0002-0013-195511
Sist faglig oppdatert: 21.12.2017
Svelgetesting ved akutt hjerneslag
Standardisert vurdering av svelgefunksjon bør gjøres av alle pasienter med akutt hjerneslag. **
Praktisk – slik kan anbefalingen følges
Begrunnelse – dette er anbefalingen basert på
Svelgevansker er svært vanlig i akuttfasen av hjerneslag, det forekommer hos 27-64% av pasientene. Aspirasjon er en viktig årsak til pneumoni, som er en av hovedårsakene til forverret prognose og død ved hjerneslag. Standardisert vurdering av svelgefunksjon vil avdekke de fleste med svelgevansker og kan sørge for trygg administrasjon av medikamenter og næring. Det bør derfor gjøres hos alle pasienter med hjerneslag før de får noe administrert per os.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneslag
Tiltak (I): Rutinemessig svelgkartlegging akutt
Sammenligning (C): Annen observasjon
Beskrivelse av inkluderte studier
Referanser
135. Interventions for dysphagia in acute stroke. Cochrane Library. Issue 2 https://www.helsedirektoratet.no/referanse/0002-0013-195480
136. Interventions for dysphagia and nutritional support in acute and subacute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195481
137. Screening swallowing function of patients with acute stroke. Part one: Identification, implementation and initial evaluation of a screening tool for use by nurses https://www.helsedirektoratet.no/referanse/0002-0013-195482
138. Svelgetesting hindrer dødsfall https://www.helsedirektoratet.no/referanse/0002-0013-195483
139. Dysphagia bedside screening for acute-stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195484
Sist faglig oppdatert: 21.12.2017
Behandling av feber ved akutt hjerneblødning
Pasienter med temperatur >37,5 grader de første 24-48 timene etter debut av hjerneblødning bør få behandling med paracetamol.
SIGN: B1b
Praktisk – slik kan anbefalingen følges
Det finnes ulike metoder for å redusere feber, men paracetamol er enklest og mest benyttet, selv om den reduksjon i temperatur som oppnås er moderat.
Behandling med paracetamol (4-6 g/døgn) senker kroppstemperaturen med 0,2-0,4 grader og kan medføre bedring i funksjonsnivå [125];[122];[121].
Begrunnelse – dette er anbefalingen basert på
Behandling med paracetamol (4-6 g/døgn) senker kroppstemperaturen med 0,2-0,4 grader og kan medføre bedring i funksjonsnivå [125];[122];[121].
Feber (>37,5 grader C) innen 24-48 t etter symptomdebut er assosiert med økt dødelighet (160;161) og nedsatt funksjonsnivå [123];[124].
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneblødning
Tiltak (I): Medikamentell behandling av feber
Sammenligning (C): Ikke behandling av feber
Beskrivelse av inkluderte studier
Referanser
121. Cooling therapy for acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195466
122. Effect of paracetamol (acetaminophen) on body temperature in acute ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195467
123. Effects of poststroke pyrexia on stroke outcome https://www.helsedirektoratet.no/referanse/0002-0013-195468
124. Admission body temperature predicts long-term mortality after acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195469
125. Acetaminophen for altering body temperature in acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195470
126. Hyperthermia is a surrogate marker of inflammation‐mediated cause of brain damage in acute ischaemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195471
Sist faglig oppdatert: 21.12.2017
Behandling av hyperglykemi ved akutt hjerneblødning
Pasienter med hjerneblødning bør behandles med subkutant insulin ved blodglukose >10 mmol/l med mål blodglukose 6-8 mmol/l.
SIGN: B1b
Pasienter med hyperglykemi de første 24 t etter debut av hjerneslag bør få kontrollert blodsukkernivået regelmessig, dvs. minst 4 ganger første døgnet og hyppigere hos pasienter med betydelig hyperglykemi eller hypoglykemi. **
Praktisk – slik kan anbefalingen følges
Pasienter med hyperglykemi de første 24 t etter debut av hjerneslag bør få kontrollert blodsukkernivået regelmessig, dvs. minst 4 ganger første døgnet og hyppigere hos pasienter med betydelig hyperglykemi eller hypoglykemi.
Vanligvis vil et subcutant regime med hurtigvirkende insulin benyttes.
Begrunnelse – dette er anbefalingen basert på
Hyperglykemi (>7.0 mmol/l) forekommer ofte hos pasienter med akutte hjerneslag [128], både blant diabetikere (70-100 %) og ikke-diabetikere (30-50 %). Hyperglykemi er assosiert med større hjerneskade, og redusert overlevelse og funksjonsnivå [132];[130]. Glukose-insulin-infusjon kan redusere mortalitet og morbiditet hos pasienter innlagt ved intensivavdelinger [133]. Tilsvarende studier hos pasienter med hjerneslag viser ikke nytte av et like strengt behandlingsregime [131];[134]. Det er likevel grunn til å tro at god kontroll har betydning i den akutte fasen [129].
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneblødning
Tiltak (I): Behandling av moderat hyperglykemi
Sammenligning (C): Ikke behandling av moderat hyperglykemi
Beskrivelse av inkluderte studier
Referanser
128. Report of the expert committee on the diagnosis and classification of diabetes mellitus https://www.helsedirektoratet.no/referanse/0002-0013-195473
129. Treatment of hyperglycemia in ischemic stroke (THIS) https://www.helsedirektoratet.no/referanse/0002-0013-195474
130. Stress hyperglycemia and prognosis of stroke in nondiabetic and diabetic patients https://www.helsedirektoratet.no/referanse/0002-0013-195475
131. Glucose-potassium-insulin infusions in the management of post-stroke hyperglycaemia: the UK Glucose Insulin in Stroke Trial (GIST-UK) https://www.helsedirektoratet.no/referanse/0002-0013-195476
132. Increased damage after ischemic stroke in patients with hyperglycemia with or without established diabetes mellitus https://www.helsedirektoratet.no/referanse/0002-0013-195477
133. Intensive insulin therapy in the medical ICU https://www.helsedirektoratet.no/referanse/0002-0013-195478
134. A randomised, controlled pilot study to investigate the potential benefit of intervention with insulin in hyperglycaemic acute ischaemic stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195479
Sist faglig oppdatert: 21.12.2017
Hjerterytmemoniterering ved akutt hjerneblødning
Kontinuerlig monitorering av hjerterytmen gjennomføres i akuttfasen hos pasienter med hjerneblødning. **
Begrunnelse – dette er anbefalingen basert på
EKG og måling av hjerteinfarktmarkører er nyttig hos pasienter med hjerneblødning for å avdekke arytmier eller akutt koronar sykdom.
EKG-forandringer som ST-segmentforandringer, QT-tidforlengelse, T-bølgeinversjoner og prominente U-bølger sees ofte ved akutt hjerneslag. Lett troponinstigning og hjertearytmier kan forekomme uten at det foreligger primær hjertesykdom. Livstruende arytmier er sjeldne, men arytmier kan påvirke BT og cerebral sirkulasjon, og initialt bør derfor hjerterytmen overvåkes.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneblødning
Tiltak (I): Kontinuerlig hjerterytmemonitorering i akuttfasen
Sammenligning (C): Kun klinisk observasjon
Beskrivelse av inkluderte studier
Sist faglig oppdatert: 21.12.2017
Oksygentilførsel ved akutt hjerneblødning
Oksygenbehandling anbefales til pasienter med akutt hjerneblødning med oksygenmetning <95 % med mål 97-99 %.
SIGN: B2b
Begrunnelse – dette er anbefalingen basert på
Respirasjonsproblemer er vanlig ved akutt hjerneslag. Øvre luftveisobstruksjoner forekommer hyppigst de første 24 t, særlig hvis pasienten ligger på rygg og har høy BMI.
Ca. 60 % av pasientene med hjerneslag utvikler hypoksi (oksygenmetning < 95 %) i løpet av de første 24 timene [107]. Årsaken kan være hypoventilasjon, atelektase og aspirasjonspneumoni, arytmier og sviktende hjertefunksjon. En del pasienter har også kroniske respirasjonsforstyrrelser som KOLS.
Det er ikke vist at behandling med hyperbart oksygen i akuttfasen bedrer klinisk resultat [104] (SIGN:1a). Oksygen via nesekateter er assosiert med bedret funksjon ved større hjerneinfarkt, men ikke ved mindre hjerneinfarkt [105];[106]
(SIGN: 2b). Oksygentilførsel hos pasienter som har tilfredsstillende oksygenmetning hjelper ikke og kan være assosiert med forverret prognose.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneblødning
Tiltak (I): Oksygentilførsel
Sammenligning (C): Ingen oksygentilførsel
Beskrivelse av inkluderte studier
Referanser
104. Hyperbaric oxygen therapy for acute ischaemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195449
105. Venturi mask adjuvant oxygen therapy in severe acute ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195450
106. Should stroke victims routinely receive supplemental oxygen? https://www.helsedirektoratet.no/referanse/0002-0013-195451
107. Continuous pulse oximetry in acute hemiparetic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195452
Sist faglig oppdatert: 21.12.2017
Væsketilførsel ved akutt hjerneblødning
Alle pasienter med akutt hjerneblødning bør få 1-2 liter Ringer/NaCl i.v. innleggelsesdagen.
SIGN: B2a
Praktisk – slik kan anbefalingen følges
Det anbefales behandling med 1-2 liter i.v. Ringer acetat eller 0,9 % NaCl innleggelsesdagen [8].
Behandling med hyperosmolar væske (hydroksyethyl stivelse, lavmolekylært dextran) gir ingen gevinst og har ingen plass i akuttbehandlingen [157].
Hos pasienter med hjertesvikt må væskebehandlingen ta hensyn til risikoen for overhydrering og lungestuvning. Forsiktighet bør også utvises ved tegn til økt intracerebralt trykk.
Begrunnelse – dette er anbefalingen basert på
Om lag halvparten av pasientene med hjerneslag er dehydrerte ved eller kort tid etter innleggelse i sykehus [108]. Dehydrering øker dødeligheten etter hjerneslag [108].
Væskebehandling oppfattes å være gunstig og utgjør sannsynligvis en del av "slagenhetseffekten" [5];[8].
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneblødning
Tiltak (I): Rutinemessig væsketilførsel
Sammenligning (C): Ikke væsketilførsel
Beskrivelse av inkluderte studier
Referanser
108. Influence of raised plasma osmolality on clinical outcome after acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195453
109. In‐hospital care pathways for stroke https://www.helsedirektoratet.no/referanse/0002-0013-195454
5. Organised inpatient (stroke unit) care for stroke https://www.helsedirektoratet.no/referanse/0002-0013-195350
8. What are the components of effective stroke unit care? https://www.helsedirektoratet.no/referanse/0002-0013-195353
157. Haemodilution for acute ischaemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195502
Sist faglig oppdatert: 21.12.2017
Komplikasjoner – Forebygging og behandling
Utredning og behandling ved svelgevansker etter akutt hjerneslag
En standardisert screeningundersøkelse for svelgevansker bør skje tidlig etter innleggelse og før peroral ernæring blir gitt. **
Hvis svelgevanskene påvises og vedvarer utover 24 timer, bør pasienten primært ernæres via nasogastrisk sonde.
SIGN: A1b
PEG-sonde anbefales tilbudt ved vedvarende svelgevansker utover 3-4 uker eller hvis nasogastrisk sonde ikke tolereres.
SIGN: A1b
Praktisk – slik kan anbefalingen følges
Vanntest ved svelgevansker
For å avdekke svelgevansker kan en enkel vanntest benyttes:
- Tilby pasienten 1 teskje vann 3 ganger.
- Observer og kjenn med 4-fingertest.
- Hvis pasienten hoster: tilby pasienten en teskje fortykket vann (kefirkonsistens).
- Hvis pasienten fortsatt hoster med fortykket vann, avbryt testen og kontakt logoped eller annet kyndig personell.
- Hvis svelgingen går greit: La pasienten drikke 1/3 av fullt vannglass (ca 50 ml) med eller uten fortykning.
Det anbefales at svelgevansker følges opp tverrfaglig med tanke på komplikasjoner, ernæring og trening. (SIGN:D4)
Hvis testen avdekker problemer, anbefales pasienten henvist til logoped eller annen person med kompetanse på svelgevansker for utredning og trening. Pasienter med lette svelgevansker bør få fortykningsmidler i tynne drikker, tilpasset mat og bør ha tilsyn ved måltider. Pasienter med større svelgevansker eller mistanke om aspirasjon bør ikke få peroral tilførsel [138];[209].
Bruk av nasogastrisk sonde
Pasienter med større svelgevansker eller mistanke om aspirasjon bør ikke få peroral tilførsel. Hvis svelgevanskene vedvarer utover 24 timer, bør pasienten primært ernæres via nasogastrisk sonde [174] (SIGN: A1b).
Bruk av PEG-sonde
PEG-sonde anbefales tilbudt ved vedvarende svelgevansker utover 3-4 uker eller hvis nasogastrisk sonde ikke tolereres (se pkt. 5.4.5).
(SIGN: A1b)
Nasogastrisk sonde gir samme overlevelse som PEG-sonde. PEG-sonde brukes derfor kun når pasientens langsiktige behov tilsier dette eller når pasienten ikke tolererer nasogastrisk sonde.
Observasjon ved svelgevansker
Pasienter med mulige svelgevansker anbefales vurdert daglig med henblikk på eventuell aspirasjon inkludert daglig måling av temperatur og eventuelle blodprøver.
Aspirasjonspneumoni oppstår gjerne de første 4 dagene etter slaget, oftest hos eldre (alder >75 år), pasienter med alvorlige slag, eller slagrammede med ledsagende KOLS, lav albumin eller hyperglykemi. Immobilisering/sengeleie og svelgevansker er viktige predisponerende faktorer.
Se også anbefaling om svelgvansker i rehabiliterings kapittel
Begrunnelse – dette er anbefalingen basert på
Svelgevansker er svært vanlig i akuttfasen av hjerneslag, det forekommer hos 27-64% av pasientene. Aspirasjon er en viktig årsak til pneumoni, som er en av hovedårsakene til forverret prognose og død ved hjerneslag.
Standardisert vurdering av svelgefunksjon vil avdekke de fleste med svelgevansker og kan sørge for trygg administrasjon av medikamenter og næring.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneslag
Tiltak (I): Rutinemessig svelgekartlegging akutt
Sammenligning (C): Annen observasjon
Beskrivelse av inkluderte studier
Referanser
170. Does the prevention of complications explain the survival benefit of organized inpatient (stroke unit) care? https://www.helsedirektoratet.no/referanse/0002-0013-195515
209. Lærebok i rehabilitering https://www.helsedirektoratet.no/referanse/0002-0013-195554
174. Effect of timing and method of enteral tube feeding for dysphagic stroke patients (FOOD): a multicentre randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195519
176. Complications after acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195521
178. Medical complications in a comprehensive stroke unit and an early supported discharge service https://www.helsedirektoratet.no/referanse/0002-0013-195523
179. The effect of pneumonia on mortality among patients hospitalized for acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195524
180. Medical complications after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195525
225. Admission to a neurologic/neurosurgical intensive care unit is associated with reduced mortality rate after intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195570
181. Dysphagia after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195526
182. Risk factors for chest infection in acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195527
183. Complications following acute ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195528
228. Acute stroke treatment in Europe: a questionnaire‐based survey on behalf of the EFNS Task Force on acute neurological stroke care https://www.helsedirektoratet.no/referanse/0002-0013-195573
184. Epileptic seizures after a first stroke: the Oxfordshire Community Stroke Project https://www.helsedirektoratet.no/referanse/0002-0013-195529
185. Seizures and epilepsy after ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195530
135. Interventions for dysphagia in acute stroke. Cochrane Library. Issue 2 https://www.helsedirektoratet.no/referanse/0002-0013-195480
137. Screening swallowing function of patients with acute stroke. Part one: Identification, implementation and initial evaluation of a screening tool for use by nurses https://www.helsedirektoratet.no/referanse/0002-0013-195482
138. Svelgetesting hindrer dødsfall https://www.helsedirektoratet.no/referanse/0002-0013-195483
139. Dysphagia bedside screening for acute-stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195484
206. Stroke-induced immunodeficiency promotes spontaneous bacterial infections and is mediated by sympathetic activation reversal by poststroke T helper cell type 1–like immunostimulation https://www.helsedirektoratet.no/referanse/0002-0013-195551
Sist faglig oppdatert: 21.12.2017
Tidlig mobilisering etter hjerneslag
For pasienter med hjerneslag anbefales tidlig mobilisering.
SIGN B 2a.
Det foreslås hyppig mobilisering med kort varighet i den tidlige fasen.
Praktisk – slik kan anbefalingen følges
Sengeleie disponerer for immobiliseringsrelaterte komplikasjoner og tidlig mobilisering i slagenhet synes å redusere slike komplikasjon, og tidlig mobilisering anbefales derfor for de fleste pasienter med akutt hjerneslag.[170];[171].
Meget tidlig mobilisering <24 timer kombinert med intensiv trening kan imidlertid ha negative effekter [169].
Tidlig mobilisering bør derfor individualiseres og tilpasses den enkelte pasient.
Tidspunkt for mobilisering
De fleste pasienter med lette slag (National Institute of Health Stroke Scale (NIHSS) 0-5)) som har stabile eller avtagende symptomer og stabilt BT, kan mobiliseres i løpet av de første 24 timer etter debut.
For pasienter med moderate til alvorlige symptomer (NIHSS >5) og stabilt BT bør første mobilisering gjennomføres mellom 24-48 timer etter debut.
Hos ustabile pasienter med fluktuerende eller økende symptomer og ustabilt BT bør mobilisering vanligvis utsettes til pasienten er stabil.
Første mobilisering
Før første mobilisering bør pasienten være godt hydrert (ev fått saltvannsløsning 500-1000 ml intravenøst).
Ved første mobilisering bør også BT måles før start og etter 15 minutter. Ved BT fall > 20mmHg eller økende symptomer inkludert svimmelhet bør mobiliseringen avbrytes.
Pasientene bør følge en «ut-av-sengenprotokoll» tilpasset den enkelte, men med formål å gjenvinne stå- og gangfunksjon og ADL- funksjon.
De første 24-48 timer bør mobilisering bestå av korte perioder flere ganger daglig (4-6) ut av seng - initialt av varighet 15-20 minutter og gradvis økende hvis pasientens tilstand, inkludert BT, er stabilt.
Innhold i tidlig mobilisering
Mobiliseringen består av at pasienten kommer opp i sittende, stående eller gående stilling, alt etter funksjonsnivå. Treningen bør være oppgaverelatert og omfatte daglige aktiviteter som forflytning, personlig stell, spising, på-og- avkledning og toalettbesøk. Pasientene trenger motivasjon til egenaktivitet, og hensiktsmessig veiledning og hjelp ved behov. Alle i det tverrfaglige teamet bør bidra til at pasienten mobiliseres tidlig, initialt med korte perioder ut av seng, og under observasjon.
Mengden av trening og varighet av treningsperiodene ut av seng synes å være av større betydning enn tidspunktet for start av mobilisering, i alle fall i tidsperioden opp til 48 timer etter debut. Ved utformingen av anbefalingen og de praktiske råd har en derfor valgt å legge betydelig vekt på dose; frekvens og varighet basert på klinisk erfaring og analyser fra AVERT-studien [168].
I tillegg er vektlagt den dokumentasjonen som foreligger fra slagenhetsstudier og som indikerer at langvarig sengeleie er negativt [1].
Begrunnelse – dette er anbefalingen basert på
Sengeleie disponerer for immobiliseringsrelaterte komplikasjoner, og tidlig mobilisering i slagenhet synes å redusere slike komplikasjoner [170]. Tidlig mobilisering og trening er en av de sentrale faktorene i forskningsbasert slagenhetsbehandling, og alle slagpasienter bør mobiliseres tidlig [171];[1]. Flere komplikasjoner (DVT, lungeemboli, pneumoni, kontrakturer, trykksår) er forbundet med immobilitet etter hjerneslag, og det er en sammenheng mellom tidlig mobilisering og overlevelse [1];[172] (SIGN: B 2a). Tidlig mobilisering anbefales derfor for de fleste pasienter med akutt hjerneslag.
Meget tidlig mobilisering < 24 timer kombinert med intensiv trening kan imidlertid ha negative effekter [169]. I AVERT-studien ble svært tidlig og svært hyppig mobilisering sammenliknet med «vanlig» mobilisering. «Vanlig» mobilisering ble definert ut fra gjeldende retningslinjer, og det viste seg at tidlig mobilisering ble praktisert i stor grad, og 59 % av pasientene i kontrollgruppen ble mobilisert innen 24 timer. Dette ga små forskjeller i tidspunkt for mobilisering da pasienter i intervensjonsgruppen ble mobilisert i gjennomsnitt 18,5 timer etter symptomdebut og i kontrollgruppen etter 22.4 timer. Studien viste tendens til dårligere funksjon tre måneder etter slaget i gruppen som ble mobilisert svært tidlig og fikk intensiv trening. Ved nærmere analyser framkommer at tid til mobilisering betyr lite for behandlingsresultatet så lenge mobilisering skjer innen 48 timer [168]. Lang varighet av treningsøktene synes negativt, mens hyppige treningsperioder med kort varighet er assosiert med bedre funksjon [168]. Det foreslås derfor tidlig mobilisering, framfor veldig tidlig, men ettersom nesten alle pasienter også i kontrollgruppen var mobilisert innen 48 timer, anbefales som hovedregel mobilisering innen 48 timer fra debut. Videre foreslås at treningsperiodene er korte, men kan repeteres hyppig. Lange treningsøkter bør unngås i de første dagene. Resultatene fra studien kan også tyde på at de eldste pasientene og pasienter med de største hjerneslagene hadde størst tendens til negative effekter [168].
En liten norsk studie viser resultater som går i samme retningen som AVERT-studien [173].
Ved utformingen av anbefalingen og de praktiske råd har vi derfor valgt å legge betydelig vekt på dose; frekvens og varighet [168].
I tillegg er vektlagt den dokumentasjonen som foreligger fra slagenhetsstudier og som indikerer at langvarig sengeleie er negativt [170];[171];[1], samt den oppsummering som Kunnskapssenteret har utført og rapportert i "Veldig tidlig mobilisering av pasienter med hjerneslag, en systematisk oversikt". LENKE.
Anbefalingen er basert på oppsummert forskning samt arbeidsgruppens samlede erfaring og kunnskap.
Trening av pasienter med hjerneslag er beskrevet i anbefaling om behandling i slagenhet ved akutt hjerneslag.
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag
Tiltak (I): Veldig tidlig mobilisering med oppstart innen 24 timer etter symptomdebut
Sammenligning (C): Tidlig mobilisering, med oppstart 24-48 timer etter symptomdebut
Beskrivelse av inkluderte studier
Kunnskapssenteret har på oppdrag av Helsedirektoratet gjort et oppdatert litteratursøk gjennomført i Cochrane-oversikten til Bernhardt og medarbeidere, fra 2009, og presentert, evaluert og sammenstilt de identifiserte studiene. Søket ble gjennomført 7. og 20. oktober 2016 i MEDLINE, EMBASE og Centra, og det ble identifisert to studier; en internasjonal studie med 2104 pasienter(AVERT), og en norsk studie med 56 pasienter(Sundseth med flere). Begge de inkluderte studiene hadde som formål å belyse forskjellen mellom mobilisering før 24 timer og mellom 24 - 48 timer etter symptomdebut/innleggelse. Kun den minste studien har fulgt protokoll i henhold til tidsrammene. I den store multi-senter studien (AVERT) var gjennomsnittlig tidspunkt for mobilisering i gruppen som fikk veldig tidlig mobilisering 18,5 timer, mens det i gruppen som var planlagt mobilisert mellom 24 og 48 timer i gjennomsnitt var 22,4 timer til mobilisering.
AVERT-studien har i tillegg presisert hvilke andre elementer som var planlagt som del av intervensjonen 'veldig tidlig mobilisering' og kan oppfattes som parallelle intervensjoner. Pasienter som var planlagt mobilisert før 24 timer, ble mobilisert hyppigere og mer intensivt enn pasienter planlagt mobilisert etter 24-48 timer.
Sundseth med flere (2012) hadde ikke en like omfattende beskrivelse av mobiliseringen, og de hadde ikke rapportert en plan for hvordan mobiliseringen skulle gjennomføres og heller ikke dokumentert slike elementer. Sundseth med flere (2012) har gått ut i fra at hyppighet og varighet av mobiliseringen var sammenliknbar i intervensjons- og kontrollgruppen.
Blant dem som fikk veldig tidlig mobilisering, døde 95 av i alt 1081 pasienter, mens det døde 74 av i alt 1079 blant dem som fikk tidlig mobilisering (RR=1,74, 95 % KI = 0,60-4,96). Antallet pasienter som var avhengige av hjelp til dagligdagse gjøremål (mRS 3-6) var 573 av 1063 i gruppen som fikk veldig tidlig mobilisering, og 531 av 1073 i gruppen med tidlig mobilisering (RR=1,14, 95 % KI 0,89-1,47). Antallet som ikke fikk dødelige/alvorlige seinfølger etter tre måneder, var 853 av 1053 i gruppen som fikk veldig tidlig mobilisering, og 842 av 1050 i gruppen som fikk tidlig mobilisering (RR 1,01 95 % KI 0,97 – 1.05).
I gruppen som fikk veldig tidlig mobilisering, fikk pasientene intensiv aktivitet oftere, og mobiliseringen begynte i gjennomsnitt 18,5 timer etter symptomdebut. I gruppen som fikk tidlig mobilisering, startet dette i gjennomsnitt 22,4 timer etter symptomdebut, selv om dette ikke var i tråd med protokoll for undersøkelsen, og pasientene fikk mindre intensiv aktivitet sjeldnere enn gruppen som ble mobilisert veldig tidlig.
Vurdering
Fordeler og ulemper
Fordeler: Tidlig mobilisering forebygger fare for komplikasjoner som sengeleie medfører og kan gi gunstige psykologiske effekter og mestringsfølelse samt bidra til at opptrening av funksjoner kommer tidlig i gang.
Ulemper: Mobilisering kan gi blodtrykksfall – og med det, dårligere blodtilførsel til hjernen og økt risiko for større hjerneskade.
Konklusjon: Ved tidlig mobilisering under kontroll av symptomer og blodtrykk, og der mobiliseringsperiodene er hyppige og kortvarige, vil antagelig de ønskede effekter av tiltaket veie opp for ulempene.
Det optimale tidspunktet for oppstart av mobilisering er imidlertid fremdeles usikkert fordi tidsforskjellen mellom mobiliseringen i intervensjonsgruppen og kontrollgruppen i de aktuelle studiene er så liten.
Vi er usikre på om effekten av svært tidlig mobilisering (før 24 timer) sammenlignet med tidlig mobilisering (24-48 timer) påvirker forekomst av død, og andel pasienter avhengig av andre i hverdagen, målt ved mRS 3-5.
Kvalitet på dokumentasjonen
Kunnskapssenteret har vurdert kvaliteten på dokumentasjonen til svært lav. Kunnskapssenteret identifiserte fem studier og inkluderte to av disse: Bernhardt med flere 2015 omtalt som AVERT-studien (A Very Early Rehabilitation Trial) og Sundseth med flere 2012.
På grunnlag av svært lav tillit til at effektestimatene faktisk belyser en forskjell i intervensjonsgruppe og kontrollgruppen med hensyn til tidspunktet for å starte mobilisering, kan det ikke trekkes noen sikker konklusjon. Når hyppigheten av mobilisering er over dobbelt så stor (6,5 sammenlignet med 3 ganger pr dag), og varigheten er tre ganger så lang, (31 minutter sammenlignet med 10 minutter pr dag), så kan hver av disse faktorene være minst like viktige for resultatet som tidspunktet pasientene ble mobilisert.
På bakgrunn av svært lav tillit til effektestimatene, kan det ikke konkluderes med om de effektestimatene som er publisert vil påvirkes av senere forskning.
Verdier og preferanser
Det antas at de fleste pasienter som har fått et hjerneslag, ville valgt å få denne behandlingen (tidlig mobilisering). Dødelighet, avhengighet av andre i hverdagen målt ved modified Rankin Scale (mRS) og uønskede hendelser er vurdert som viktige utfallsmål å vurdere for utforming av denne anbefalingen.
Referanser
168. Prespecified dose-response analysis for A Very Early Rehabilitation Trial (AVERT) https://www.helsedirektoratet.no/referanse/0002-0013-195513
169. Efficacy and safety of very early mobilisation within 24 h of stroke onset (AVERT): a randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195514
170. Does the prevention of complications explain the survival benefit of organized inpatient (stroke unit) care? https://www.helsedirektoratet.no/referanse/0002-0013-195515
171. Treatment in a combined acute and rehabilitation stroke unit https://www.helsedirektoratet.no/referanse/0002-0013-195516
172. Occupational therapy for patients with problems in personal activities of daily living after stroke: systematic review of randomised trials https://www.helsedirektoratet.no/referanse/0002-0013-195517
173. Outcome After Mobilization Within 24 Hours of Acute Stroke https://www.helsedirektoratet.no/referanse/0002-0013-195518
5. Organised inpatient (stroke unit) care for stroke https://www.helsedirektoratet.no/referanse/0002-0013-195350
202. Veldig tidlig mobilisering av pasienter med hjerneslag, en systematisk oversikt". [Very early mobilisation of patients with stroke, a systematic review. https://www.helsedirektoratet.no/referanse/0002-0013-195547
Utredning og behandling av lungeinfeksjoner ved akutt hjerneslag
Det bør gjennomføres tidlig og rask utredning ved kliniske tegn til lungeinfeksjon med CRP/leukocytter, blodkulturer ved temp >38.5 og røntgen thorax. **
Ved lungeinfeksjon anbefales rask oppstart av behandling med antibiotika IV samt febernedsettende behandling.
SIGN: D4.
Praktisk – slik kan anbefalingen følges
Antibiotikabehandlingen bør følge de rutiner sykehuset har, men vanlig behandlingstid 7-10 dager og med varighet minst ett døgn etter normalisering av feber og infeksjonsparametere. Febersenkende behandling med paracetamol anbefales. Det bør vurderes å gi ekstratilførsel av væske for å unngå dehydrering. (SIGN: D4)
Tiltak mot aspirasjonspneumoni består av tidlig mobilisering samt tidlig intervensjon med antibiotika. Det er ikke grunnlag for profylaktisk behandling med antibiotika.Lenke til Nasjonal faglig retningslinje for antibiotika i sykehus.
Screening for svelgevansker reduserer aspirasjonsfaren (lenke til anbefaling om svelgetesting ved akutt hjerneslag) [177] (SIGN; 2a). Ved tegn til infeksjon, dvs. temp >38, vurderes pasientens lungefunksjon klinisk og røntgenologisk, samt infeksjonsparametere i blodet. Ved positive funn anbefales rask start med antibiotika IV.
Begrunnelse – dette er anbefalingen basert på
Pneumoni er ansvarlig for 1/3 av dødeligheten i akuttfasen, og tredobler risikoen for død innen 30 dager [179]. Tiltak mot aspirasjonspneumoni består av tidlig mobilisering, varsomhet samt tidlig intervensjon med antibiotika. Det er ikke grunnlag for profylaktisk behandling med antibiotika. Aspirasjonspneumoni oppstår gjerne de første 4 dagene etter slaget, oftest hos eldre (alder >75 år)[178]; [179], pasienter med alvorlige slag,[180];[178];[179];[183];[176] eller intrakranial blødning [179];[176], pasienter med KOLS [179];[182] og med lav albumin eller hyperglykemi [179].
Immobilisering/sengeleie og svelgevansker er viktige predisponerende faktorer [170];[181] (SIGN: 2a). Det er også den hyppigste årsaken til reinnleggelse i sykehus [175].
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag og tegn til luftveisinfeksjon
Tiltak (I): Behandling mot lungeinfeksjon
Sammenligning (C): -
Beskrivelse av inkluderte studier
Referanser
175. Readmission and death after hospitalization for acute ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195520
176. Complications after acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195521
177. Formal dysphagia screening protocols prevent pneumonia https://www.helsedirektoratet.no/referanse/0002-0013-195522
178. Medical complications in a comprehensive stroke unit and an early supported discharge service https://www.helsedirektoratet.no/referanse/0002-0013-195523
179. The effect of pneumonia on mortality among patients hospitalized for acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195524
180. Medical complications after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195525
181. Dysphagia after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195526
182. Risk factors for chest infection in acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195527
183. Complications following acute ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195528
Sist faglig oppdatert: 21.12.2017
Utredning og behandling av urinveisinfeksjoner ved akutt hjerneslag
Ved urinveisinfeksjon (UVI) anbefales utredning inkludert blærescanning for å avklare om det foreligger retensjon, samt bakteriologisk undersøkelse før eventuell oppstart av antibiotika. **
Ved urinretensjon anbefales intermitterende kateterisering.
SIGN:D4
Permanent blærekateter bør unngås.
SIGN: B2a
Profylakse for urinveisinfeksjon bør bestå i rutinemessig ultralydscanning av blære og intermitterende kateterisering ved retensjon.
SIGN: 2a
Praktisk – slik kan anbefalingen følges
Urinveisinfeksjon (UVI) kan oppstå hos alle pasienter med hjerneslag, men sjelden ved lette slag. Urinretensjon og inneliggende blærekateter er predisponerende for urinveisinfeksjon og bør unngås. Ved symptomer eller feber anbefales utredning med Curinstix. Dyrking av bakterier gjennomføres. Behandling med antibiotika (vanligvis perorale) gis ved positive funn [176];[178];[180]. Lenke til Nasjonal faglig retningslinje for antibiotika i sykehus.
Begrunnelse – dette er anbefalingen basert på
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneslag og urinveisinfeksjon
Tiltak (I): Utredning og behandling
Sammenligning (C): -
Beskrivelse av inkluderte studier
Referanser
176. Complications after acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195521
178. Medical complications in a comprehensive stroke unit and an early supported discharge service https://www.helsedirektoratet.no/referanse/0002-0013-195523
180. Medical complications after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195525
Sist faglig oppdatert: 21.12.2017
Behandling av krampeanfall ved akutt hjerneslag
Hos pasienter med kun ett isolert krampeanfall i tilknytning til debut av hjerneslaget, er profylakse med antiepileptika vanligvis ikke indisert. Pasienter med flere epileptiske anfall, eller anfall etter akuttfasen, anbefales som hovedregel profylaktisk behandlet med antiepileptika.
SIGN: C3
Begrunnelse – dette er anbefalingen basert på
Epileptiske anfall opptrer hos 2-5 % av pasienter med hjerneslag. Slike anfall er vanligst ved store hjerneinfarkt, ved blødninger og ved lesjoner som involverer hjernebarken. Om lag 50 % av de som har et krampeanfall ved debut av slaget vil oppleve nye epileptiske anfall i det videre forløpet, og da bør antiepileptisk medikasjon vurderes.
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneslag og krampeanfall
Tiltak (I): Behandling med antiepileptika
Sammenligning (C): -
Beskrivelse av inkluderte studier
Referanser
184. Epileptic seizures after a first stroke: the Oxfordshire Community Stroke Project https://www.helsedirektoratet.no/referanse/0002-0013-195529
185. Seizures and epilepsy after ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195530
Sist faglig oppdatert: 21.12.2017
Forebygging og behandling ved delir hos hjerneslagpasienter
Det bør gjennomføres systematisk undersøkelse for eventuelt å identifisere utløsende faktorer ved akutt delir i tilknytning til hjerneslaget. **
Ved akutt delir bør det etableres et trygt og forutsigbart miljø rundt pasienten, og behandling med legemidler bør begrenses.
SIGN: C3.
Praktisk – slik kan anbefalingen følges
Avdelingen bør ha rutiner og kunnskap omkring delir, slik at pasienter blir kartlagt for risikofaktorer for om mulig hindre utvikling av delir.
Utløsende faktorer for utvikling av delir hos hjerneslagpasienten kan være selve hjerneslaget, infeksjoner, urinretensjon, obstipasjon, legemidler, høy alder og psykiske faktorer [186];[190]; [189]. Relevante blodprøver knyttet til problemstillingen må tas [189].
Det bør skilles mellom hyperaktivt og hypoaktivt delir. Det hyperaktive delir er preget av psykomotorisk uro, ofte med hallusinasjoner. Ved hypoaktivt delirium ser en forstyrret konsentrasjon og oppmerksomhet [187]. I begge tilfeller foreligger desorientering for tid, rom og situasjon [190];[189].
Ved akutt delir bør det etableres et trygt og forutsigbart miljø rundt pasienten hvor en prøver å unngå fysiske hindre i størst mulig grad og hvor normal døgnrytme tilstrebes. (SIGN: C3)
Medikamentell behandling bør begrenses, men kan benyttes ved stor uro, aggresjon og utagering med psykotiske symptomer. (SIGN: C3)
Begrunnelse – dette er anbefalingen basert på
Hjerneslag innebærer risiko for utvikling av delir [186][188][190][189]). Det er viktig å forebygge at delir oppstår i forbindelse med hjerneslaget.
Forvirringstilstander kan medføre lengre sykehusopphold, nedsatt funksjon i dagliglivets aktiviteter og økt dødelighet [188];[190];[186]. Ved behandling og god oppfølging har delir vanligvis kort varighet [188]).
Forskningsgrunnlag
Populasjon (P): Pasient med hjerneslag og med delir
Tiltak (I): Tilrettelagt miljø og behandling
Sammenligning (C): Ingen tiltak
Beskrivelse av inkluderte studier
Referanser
186. Delirium in acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195531
187. Delirium hos äldre kan förebyggas och behandlas https://www.helsedirektoratet.no/referanse/0002-0013-195532
188. Delirium post-stroke https://www.helsedirektoratet.no/referanse/0002-0013-195533
189. MEDISIN OG VITENSKAP-Legemidler i praksis-Medikamentell behandling av delirium hos eldre https://www.helsedirektoratet.no/referanse/0002-0013-195534
190. Delirium within three days of stroke in a cohort of elderly patients https://www.helsedirektoratet.no/referanse/0002-0013-195535
Sist faglig oppdatert: 21.12.2017
Forebygging og behandling av DVT hos pasienter med akutt hjerneslag
Tidlig mobilisering anbefales hos pasienter med akutt hjerneslag for å redusere risiko for dyp venetrombose (DVT).
SIGN: B2a.
Lavdose heparin kan vurderes hos pasienter med akutt hjerneinfarkt med høy risiko for DVT.
Behandling ved påvist DVT og/eller lungeemboli hos pasienter med hjerneinfarkt, bør følge de generelle behandlingsanbefalinger for disse tilstander.
Antikoagulasjonsbehandling ved DVT hos pasienter med akutt hjerneblødning bør skje etter individuell vurdering.
Praktisk – slik kan anbefalingen følges
Forebygging ved hjerneinfarkt: Tidlig mobilisering anbefales hos pasienter med akutt hjerneslag for å redusere risiko for dyp venetrombose (DVT)[170]. (SIGN: B2a).
Antikoagulasjonsbehandling med heparin er i flere studier vist å ha en forebyggende effekt mot DVT, men også en økt risiko for blødninger [192]. Rutinemessig bruk av antikoagulasjon i profylakse er derfor ikke indisert.
Lavdose heparin bør vurderes til pasienter med stor risiko for venøs tromboembolisme, dvs. immobiliserte pasienter, pasienter med uttalte pareser og pasienter med samtidig kreftsykdom, trombofili eller tidligere venøs tromboembolisme[192] . Lavdose heparin kan gis i kombinasjon med acetylsalisylsyre, ASA.
Kompresjonsstrømper har ikke vist noen dokumentert effekt for å forebygge DVT ved hjerneslag [191] (SIGN: 1b).
ASA har en liten, men svakt forebyggende effekt mot venøs tromboembolisme. Men ettersom ASA forhindrer arterielle komplikasjoner, bør det gis til de fleste pasienter med hjerneinfarkt [92] (SIGN:1a).
Intermitterende pneumatisk kompresjon har i nyere studier vist en effekt, men er foreløpig ikke brukt i Norge. I en nylig utgitt oppsummering av kunnskapsgrunnlaget fra Kunnskapssenteret konkluderes det med at pneumatisk kompresjon ved akutt hjerneslag kan redusere venøs tromboembolisme og føre til bedret overlevelse, men kan være assosiert med en del hudproblemer og muligens tendens til noe redusert funksjonsnivå [203]. Det har ikke vært ressurser til å evaluere metoden i tilknytning til denne revisjonen av retningslinjene, og det er derfor ikke utarbeidet noen anbefalinger om pneumatisk kompresjon som profylakse mot venøs tromboembolisme. Det ville være av interesse å skaffe seg erfaring med metoden også i Norge, for det finnes retningslinjer av høy kvalitet som anbefaler bruk hos immobiliserte slagpasienter [204].
Behandling ved hjerneinfarkt: Behandling ved påvist DVT og/eller lungeemboli hos pasienter med hjerneinfarkt, bør følge de generelle behandlingsanbefalinger for disse tilstander.
Forebygging ved hjerneblødning: Tidlig mobilisering er viktigste forebyggende tiltak for å redusere risiko for DVT. Kompresjonsstrømper har ikke vist noen dokumentert effekt for å forebygge DVT ved hjerneslag, men kan vurderes ved hjerneblødning [191] (SIGN:1b).
Lavdose heparin kan vurderes hos pasienter med spesielt høy risiko for DVT, men individuell vurdering når det gjelder oppstart med behandling. Det er vanlig å vente 1 uke etter debut av hjerneblødningen.
Behandling ved hjerneblødning: Ved påvist dyp venetrombose og/eller lungeemboli hos pasienter med hjerneblødning må individuell vurdering gjøres med henblikk på når antikoagulasjon bør starte.
Begrunnelse – dette er anbefalingen basert på
Det er signifikant økt risiko for dyp venetrombose (DVT) og ev. ledsagende lungeemboli spesielt i de første ukene etter et hjerneslag. Lungeemboli kan være årsak til dødsfall hos pasienter med akutt hjerneslag og skyldes vanligvis venøse tromber i en paretisk ekstremitet. Trolig er lungeemboli ansvarlig for minst 5 % av alle dødsfall etter hjerneslag [193].
Antikoagulasjonsbehandling i profylakse og ved behandling av DVT er dårlig dokumentert både når det gjelder effekter og risiko. De praktiske råd i denne anbefalingen bygger på den kliniske praksis som er vanlig å følge.
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneinfarkt
Tiltak (I): Behandling med lavdose heparin
Sammenligning (C): Ingen behandling med lavdose heparin
Beskrivelse av inkluderte studier
Referanser
170. Does the prevention of complications explain the survival benefit of organized inpatient (stroke unit) care? https://www.helsedirektoratet.no/referanse/0002-0013-195515
92. Antiplatelet therapy for acute ischaemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195437
191. Effectiveness of thigh-length graduated compression stockings to reduce the risk of deep vein thrombosis after stroke (CLOTS trial 1): a multicentre, randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195536
192. Anticoagulants for acute ischaemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195537
193. Prevention of venous thromboembolism, recurrent stroke, and other vascular events after acute ischemic stroke: the role of low-molecular-weight heparin and antiplatelet therapy https://www.helsedirektoratet.no/referanse/0002-0013-195538
203. Intermitterende pneumatisk kompresjon for å forebygge venøs tromboembolisme hos pasienter innlagt i sykehus https://www.helsedirektoratet.no/referanse/0002-0013-195548
204. National Institute for Health and Care Excellence. Venous thromboembolismin adults admitted to hospital: reducing the risk https://www.nice.org.uk/guidance/cg92
Sist faglig oppdatert: 21.12.2017
Håndtering av paretisk arm hos slagpasienter forebygger smerter og skade
Alle som pleier/hjelper/trener pasienter med armparese bør få opplæring i varsom håndtering av armen for å unngå skade på skulderleddet. SIGN: C3
Praktisk – slik kan anbefalingen følges
Drag i armen eller vridning av armen bør unngås. Passive bevegelser bør utføres med forsiktighet, og abduksjon over 90 grader i skulderleddet bør unngås.
Flere mindre kontrollerte studier tyder på at behandling med botulinumtoksin A kan redusere smerte i hemiplegisk skulder [198];[199], men ikke alle studier har vist positiv effekt [196] (SIGN:1b).
Begrunnelse – dette er anbefalingen basert på
Pareser i den stabiliserende muskulaturen rundt skulderleddet kan forårsake luksasjon, subluksasjon, kapsel-eller ligamentskade og føre til smerter, tendinitt og kapsulitt. Subluksasjon forekommer hos over 80 % av slagpasienter med pareser i armen [194].
Skuldersmerter forekommer hyppig, og i en studie hadde 1/3 av slagpasientene smerter i affisert skulder ett år etter slaget. Hos halvparten av disse starter smerten de første 2 ukene [197].
Risikoen øker ved alvorlig parese og ved høy NIHSS-skår. Skuldersmerter som etableres tidlig, blir ofte kroniske og reduserer livskvaliteten [195]. En studie har vist at hos pasienter behandlet av et spesialopplært personale i en slagenhet, var det kun 10 % som opplevde skuldersmerter i løpet av de første 3 md. og kun 2 % den første uken. Dette tyder på at kompetanse hos personalet er viktig [178] (C3).
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag og parese i arm
Tiltak (I): Kunnskap hos personale om håndtering av affisert arm
Sammenligning (C): Ingen spesiell kunnskap hos personale om håndtering av affisert arm
Beskrivelse av inkluderte studier
Referanser
178. Medical complications in a comprehensive stroke unit and an early supported discharge service https://www.helsedirektoratet.no/referanse/0002-0013-195523
194. Efficacy of electrical stimulation in preventing or reducing subluxation of the shoulder after stroke: a meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195539
195. Poststroke shoulder pain: its relationship to motor impairment, activity limitation, and quality of life https://www.helsedirektoratet.no/referanse/0002-0013-195540
196. A randomized controlled study of botulinum toxin A in the treatment of hemiplegic shoulder pain associated with spasticity https://www.helsedirektoratet.no/referanse/0002-0013-195541
197. Shoulder pain after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195542
198. Is botulinum toxin type A effective in the treatment of spastic shoulder pain in patients after stroke? A double-blind randomized clinical trial https://www.helsedirektoratet.no/referanse/0002-0013-195543
199. Treatment of shoulder pain in spastic hemiplegia by reducing spasticity of the subscapular muscle: a randomised, double blind, placebo controlled study of botulinum toxin A https://www.helsedirektoratet.no/referanse/0002-0013-195544
Sist faglig oppdatert: 21.12.2017
Slagenheter
Behandling i slagenhet ved akutt hjerneslag
Alle pasienter med akutt hjerneslag bør behandles i slagenheter.
SIGN A1a.
Praktisk – slik kan anbefalingen følges
Definisjon -Dimensjonering – Liggetid
Alle pasienter med akutt hjerneslag bør behandles i slagenheter som har ressurser, kompetanse og rutiner for å ivareta behandling, overvåking og tidlig rehabilitering
Definisjon av slagenhet:
En slagenhet kan defineres som en organisert behandling av slagpasienter i en geografisk avgrenset enhet med faste senger, bemannet med tverrfaglig spesialopplært personale og med et standardisert program for diagnostikk, observasjon, akutt behandling, tidlig mobilisering og rehabilitering.
En slagenhet som oppfyller denne definisjonen vil ha et godt grunnlag for å kunne tilby effektiv forskningsbasert behandling ved akutt hjerneslag. Akuttbehandlingen har fått økende betydning, men det er grunn til å minne om at slagenheter uten fokus på rehabilitering ikke har dokumentert sikker positiv effekt. De slagenhetsstudier som har vist best effekt, har hatt sterkt fokus på tidlig mobilisering (Se anbefaling om behandling i slagenhet ved akutt hjerneslag, og anbefaling om tidlig mobilisering ved akutt hjerneslag. og tidlig oppstart av oppgaverelatert trening.)
Alle pasienter med akutt hjerneslag bør behandles i slagenheter som har ressurser, kompetanse og rutiner for å ivareta behandling, overvåking og tidlig rehabilitering.
Dimensjonering:
Det er vanskelig å gi et eksakt anslag for hvor stor en slagenhet bør være, men sengetallet bør være på et nivå som sikrer at alle pasienter med akutt hjerneslag kan innlegges og behandles i slagenheten. Sykehusene har i dag mulighet for å kartlegge hvor stor andel av pasientene som innlegges og behandles i slagenhet via data fra Norsk hjerneslagregister. (www. norskhjerneslagregister.no)
Forhold som påvirker beregningen av nødvendig antall senger er:
- insidens av hjerneslag i opptaksområdet
- slagenhetens muligheter til å håndtere fluktuasjoner i antall innleggelser
- andel pasienter med alvorlige hjerneslag
- liggetid i slagenheten
- tilgjengelighet av videre spesialisert rehabilitering både i spesialisthelsetjenesten og kommunehelsetjenesten
- effektive behandlingskjeder ved utskrivning inkludert tilbud om tidlig støttet utskriving (LINK)
- fremtidige endringer i behandlingstilbud ved hjerneslag
Liggetid: Liggetid er av de viktigste faktorer som påvirker sengebehov. I Norge har det vært en betydelig reduksjon i liggetid i de senere årene, og i 2015 var liggetiden ved akutt hjerneslag i gjennomsnitt 7.3 dager (www.norskhjerneslagregister.no). Noe av liggetidreduksjonen kan forklares gjennom at en høyere andel av pasientene nå synes å ha relativt milde slag sammenlignet med tidligere. Det er imidlertid også en tendens til at færre utskrives direkte hjem, og bare halvparten så mange utskrives direkte til hjemmet i Norge sammenlignet med Sverige som har lengre liggetid i slagenhet. Det kan tyde på at liggetiden i Norge er i ferd med å bli så kort at maksimal effekt av slagenhetsbehandling ikke tas ut. Resultatene fra de randomiserte slagenhetsstudier viser at det ikke er noe dokumentasjon for god behandlingseffekt ved gjennomsnittlig liggetid under 7 dager. Den sterkeste dokumentasjonen på god effekt av slagenhetsbehandling er fra slagenheter med liggetid 10-20 dager. (TIA-pasienter ikke medregnet). Det er også grunn til å anbefale at pasienter som har mulighet til utskrivning til hjemmet innen 2 uker som hovedregel ikke bør flyttes til annen enhet/avdeling på sykehuset eller til samarbeidende rehabiliteringsinstitusjon.
Når behovet for slagenhetssenger skal kartlegges, må det også tas høyde for at det innkommer en god del pasienter med slaglignende symptomer (stroke mimics) som initialt ofte har behov for observasjon og utredning i slagenheten. Tidligere beregninger om behov for slagenhetssenger er nok for høye i dag [17];[205], men under forutsetning av en gjennomsnittlig liggetid på 7 -10 dager og en veletablert behandlingskjede etter utskrivning bør det være 7-10 slagenhetssenger per 100 000 innbyggere. Ut fra andelen pasienter som innlegges og behandles i slagenhet, kan dette tallet justeres opp eller ned. Behandling i slagenhet er også en nasjonal kvalitetsindikator som regelmessig publiseres og kan følges nøye for det enkelte sykehus.
Overvåkning: Det foreslås nå at pasienter med akutt hjerneslag bør tilbys kontinuerlig monitorering i den initiale fase. Se anbefaling om monitorering av fysiologiske parametre ved akutt hjerneinfarkt og anbefaling om monitorering av fysiologiske parametre ved akutt hjerneblødning.
Denne overvåkningen/monitoreringen bør skje i slagenhet. Erfaringer tyder på at om lag 1/3 av sengene i en slagenhet bør ha muligheter for monitorering.
Bemanning ved slagenheter
Personalet i en slagenhet bør ha spesialkompetanse.
Det bør legges til rette for en strukturert og systematisk plan for utdanning og internopplæring, så vel særfaglig som tverrfaglig.
Personalressursene ved en slagenhet bør være organisert slik at de imøtekommer kravet til tverrfaglig oppfølging/trening som samsvarer med tilbud om 24 timers rehabiliteringstilbud 7 dager i uken.
I en slagenhet bør ca, 1/3 av sengene være for tidlig overvåking med bemanning som intermediær enhet; 1 sykepleier fast tilstede per 2 senger.
Sykepleierbemanning bør i en slagenhet være styrket i forhold til "vanlige" sengeposter fordi sykepleier i en slagenhet har ressurskrevende oppgaver både i forhold til overvåkning, kartlegging, krevende pleie, forebygging av komplikasjoner og tidlig mobilisering og rehabilitering. Økt krav til akuttbehandling, mer fokus på kontinuerlig monitorering og økte krav til koordinering og dokumentasjon vil også kunne medføre behov for økt personell.
Som et minimum bør en slagenhet ha
- faste overleger med hjerneslag som hovedarbeidsområde
- slagsykepleier som har et ansvar for koordinering av og kompetanse hos personalet.
Bemanning per. 5 senger er estimert til :
- 1 fast overlege
- 7.5-10 sykepleiere per. døgn
- 1 fysioterapeut
- 0,5 ergoterapeut
- 0.3 logoped
For å drive en slagenhet i henhold til den forskningsbaserte kunnskap, bør det anførte personell være spesialopplært og fast tilknyttet slagenheten.
Annet spesialisert personale:
Alle slagenheter bør ha tilgang på sosionomtjeneste og klinisk ernæringsfysiolog og mulighet for henvisning til nevropsykolog, samt ha etablert samarbeid med karkirurg, øyelege, synspedagog, kardiolog, nevrokirurg og rehabiliteringsmedisiner. Der en eller flere spesialiteter ikke finnes i eget sykehus, bør det etableres kontakt med samarbeidende sykehus.
Slagenheter fungerer godt både i avdelinger for nevrologi, indremedisin og geriatri forutsatt at de elementer som inngår i forskningsbasert slagenhetsbehandling ivaretas. Samarbeid mellom nevnte spesialiteter bør etableres. Slagenheter synes også å kunne fungere godt både i lokalsykehus og større sykehus [207].
Tverrfaglig samarbeid
Det er viktig med tidlig kartlegging av kliniske utfall, start av behandling og planlegging av videre behandling og rehabilitering. Valide, reliable målemetoder bør bukes når det gjelder nevrologiske utfall og funksjonsnivå. Eksempelvis NIHSS, Barthel index (BI), modified Rankin Scale (mRS).
Det tverrfaglige teamet bør ha ukentlige tverrfaglige samarbeidsmøter med fast struktur i tillegg til daglige mer uformelle møter. Teamet skal samarbeide om mål for behandling og rehabilitering, samt planlegging av videre oppfølging og utskrivning sammen med pasient, eventuelt pårørende og ansvarlig personell for rehabilitering og/eller videre oppfølging etter akuttfasen [8];[208]. Når det planlagte pakkeforløp for hjerneslag blir etablert, vil det kunne være retningsgivende for hvordan logistikken bør være i samspillet mellom slagenheten og de øvrige instanser som skal sikre et optimalt pasientforløp.
Tidlig planlegging av utskrivning
Tidlig i behandlingsforløpet bør personalet i slagenheten innhente nøyaktige opplysninger om pasientens situasjon før hjerneslaget, vedkommendes fysiske og psykiske helse, boligforhold, sosialt nettverk, og eventuelle hjelpetiltak [210]. Opplysningene sammenholdes med nåværende tilstand. På bakgrunn av disse opplysningene kan det tverrfaglige teamet tidlig planlegge et individuelt pasientforløp i samarbeid med pasient, pårørende og helse og omsorgstjenestene i kommunene [210]. Fastlegen vil ofte ha en koordinerende oppgave.
Pasienter som har et langvarig rehabiliteringsbehov eller behov for tjenester fra mange instanser, kan allerede i akuttfasen ha behov og ønske om at en utarbeider en individuell plan som kan systematisere rehabiliteringsprosessen [209].
For å sikre informasjon til neste ledd i behandlingskjeden, er gode dokumentasjonsrutiner viktige og et godt verktøy for effektivt tverrfaglig samarbeid [1];[212]). Felles tverrfaglig epikrise kan være nyttig.
Pasienter som har mulighet til utskrivning til hjemmet innen 2 uker, bør som hovedregel ikke flyttes til annen enhet/avdeling på sykehuset eller til samarbeidende rehabiliteringsinstitusjon.
Begrunnelse – dette er anbefalingen basert på
Slagenhetsbehandling er den viktigste enkeltkomponenten i forskningsbasert slagbehandling fordi det er eneste tiltak som kan redusere dødelighet og samtidig redusere alvorlig funksjonshemning hos en stor andel pasienter med hjerneslag [1].
Meta-analyser fra randomiserte slagenhetsstudier viser at alle pasienter med akutte hjerneslag har nytte av slagenhetsbehandling [1] (SIGN:1a). Odds ratio (OR) for død er 0.81, KI 0.69-0.94, for død og alvorlig funksjonshemning er OR 0.78 KI 0.68-0.89 og for død og sykehjemsbehov er OR 0.79 KI 0.68-0.90 [1] (SIGN:1a). En del studier der en har hatt meget sterkt fokus på å kombinerer akutt behandling og tidlig rehabilitering har vist enda større effekt [1];[17] (SIGN: 1b). Det er også vist at de positive resultatene av behandling i slagenhet vedvarer, og reduksjon i død og alvorlig funksjonshemning er til stede også ved etterundersøkelser 5-10 år etter slaget [1];[15] (SIGN: 1a).
Det finnes ulike modeller for slagenhetsbehandling. Den modellen som kombinerer akuttbehandling og tidlig rehabilitering er mest studert, og best dokumentert. Dette er også den modellen som er mest utprøvd i de nordiske land inkludert Norge [1];[17]. Det er derfor denne kombinerte slagenhetsmodellen som anbefales i denne retningslinjen.
Slagenhetsbehandling vurderes som så viktig at det er en nasjonal kvalitetsindikator.
En slagenhet kan defineres som en organisert behandling av slagpasienter i en geografisk avgrenset enhet med faste senger, bemannet med tverrfaglig spesialopplært personale og med et standardisert program for diagnostikk, observasjon, akutt behandling, tidlig mobilisering og rehabilitering
En slagenhet som oppfyller denne definisjonen vil ha et godt grunnlag for å kunne tilby effektiv forskningsbasert behandling ved akutt hjerneslag Akutt behandlingen har fått økende betydning , men det er grunn til å minne om at slagenheter uten også fokus på rehabilitering ikke har dokumentert noen sikker positiv effekt. De slagenhets studier som har vist best effekt, har hatt sterkt fokus på tidlig mobilisering 8LINK) og tidlig oppstart av oppgaverelatert trening ( LINK til rehab)
Alle sykehus som skal behandle slagpasienter i akuttfase bør tilby slagenhetsbehandling. Sykehus uten slagenhet bør ikke behandle pasienter med akutt hjerneslag fordi mulighetene for overlevelse og/eller vesentlig funksjonsbedring er klart svekket for pasienter som ikke får slagenhetsbehandling [1];[17][170][205]. Slagenheten må kunne gi struktur, organisering og et behandlingstilbud på samme nivå som ved de slagenhetene som har vist god effekt i vitenskapelige studier. Oppsummering om de mest sentrale aspekter ved organisering, struktur og bemanning i en effektiv slagenhet er presentert under praktiske råd.
Nye behandlingstilbud innenfor akuttilbudet til pasienten med hjerneslag krever økt faglig kunnskap og ressurser med tanke på tidlig overvåking, administrering av medikamenter og oppfølging de første timer/døgn.
Samhandling i tverrfaglig team er viktig for å oppnå gode resultater [1];[8]. Teamsamarbeidet påvirker både grad av fremgang og liggetid [209].
Forskningsgrunnlag
Populasjon (P): Pasient med hjerneslag
Tiltak (I): Behandling i slagenhet
Sammenligning (C): Vanlig sengeavdeling
Beskrivelse av inkluderte studier
Referanser
1. Organised inpatient (stroke unit) care for stroke. https://www.helsedirektoratet.no/referanse/0002-0013-195346
207. Diagnostic procedures, treatments, and outcomes in stroke patients admitted to different types of hospitals https://www.helsedirektoratet.no/referanse/0002-0013-195552
170. Does the prevention of complications explain the survival benefit of organized inpatient (stroke unit) care? https://www.helsedirektoratet.no/referanse/0002-0013-195515
208. How should stroke services be organised? https://www.helsedirektoratet.no/referanse/0002-0013-195553
209. Lærebok i rehabilitering https://www.helsedirektoratet.no/referanse/0002-0013-195554
212. Risk of stroke and recurrent dissection after a cervical artery dissection A multicenter study https://www.helsedirektoratet.no/referanse/0002-0013-195557
8. What are the components of effective stroke unit care? https://www.helsedirektoratet.no/referanse/0002-0013-195353
15. Stroke unit treatment. 10-year follow-up https://www.helsedirektoratet.no/referanse/0002-0013-195360
17. MEDISIN OG VITENSKAP-Tema: Hjerneslag-En effektiv slagenhet--hva er det? https://www.helsedirektoratet.no/referanse/0002-0013-195362
205. Nationella riktlinjer for strokesjukvård: medicinskt och hälsoekonomiskt faktadokument http://www.socialstyrelsen.se/nationellariktlinjerforstrokesjukvard
Sist faglig oppdatert: 21.12.2017
Spesielle tilstander; disseksjoner og sinusvenetrombose
Disseksjoner – antitrombotisk profylakse etter akutt hjerneinfarkt
Platehemmer foretrekkes vanligvis fremfor antikoagulasjon som profylakse mot hjerneinfarkt de første tre måneder etter carotis- eller vertebralisdisseksjon.
SIGN: B2b
Praktisk – slik kan anbefalingen følges
Hvis det er mistanke om disseksjon i precerebrale eller cerebrale arterier, vil CT-angio, CTA, eller MR og MR-angio vanligvis påvise disseksjonen. De fleste pasienter med hjerneinfarkt/TIA vil bli undersøkt med angiografi, og disseksjoner vil derfor kunne bli oppdaget ved vanlig rutineutredning.
CTA- og MR- serier kan utfylle hverandre [219]. Viktige momenter i bildefremstilling av disseksjon er typisk utseende innsnevring av lumen i noen tilfeller (string sign, CTA), og direkte fremstilling av hematom i karveggen (MR). Det enkelte sykehus kan velge den undersøkelse som er mest hensiktmessig, og ved diagnostisk tvil eventuelt begge. Konvensjonell angiografi er sjelden aktuelt.
.
Begrunnelse – dette er anbefalingen basert på
I en Cochraneanalyse fra 2010 fant man ingen randomiserte kontrollerte studier som sammenlignet platehemmer og antikoagulasjon som profylakse etter disseksjon etter karotis- eller vertebralisdisseksjon [218].
I en randomisert kontrollert studie fra 2015 som sammenlignet platehemmer og antikoagulasjon som profylakse etter disseksjon etter karotis- eller vertebralisdisseksjon hos 250 pasienter, var det ingen forskjell mellom gruppene. Forekomsten av residivt slag eller død var 1-2%. Det ble anslått at det ville kreve en ny studie med 10.000 pasienter for å påvise en forskjell [217]. Det er svært lite trolig at en slik studie vil bli gjennomført.
Det er derfor ikke evidensgrunnlag for å anbefale antikoagulasjon fremfor platehemmer. Platehemmende behandling er enklere og har færre bivirkninger og vil derfor da som oftest være et naturlig førstevalg.
Det er ikke evidensgrunnlag for å gi generell anbefaling om nytte av profylakse etter de tre første måneder.
Forskningsgrunnlag
Populasjon (P): Pasienter med påvist disseksjon i arteria karotis eller -vertebralis
Tiltak (I): Antikoagulasjon som profylakse mot hjerneinfarkt de første tre måneder etter disseksjon
Sammenligning (C): Platehemmer
Beskrivelse av inkluderte studier
Referanser
217. Antiplatelet treatment compared with anticoagulation treatment for cervical artery dissection (CADISS): a randomised trial https://www.helsedirektoratet.no/referanse/0002-0013-195562
218. Antithrombotic drugs for carotid artery dissection https://www.helsedirektoratet.no/referanse/0002-0013-195563
219. Comparison of test performance characteristics of MRI, MR angiography, and CT angiography in the diagnosis of carotid and vertebral artery dissection: a review of the medical literature https://www.helsedirektoratet.no/referanse/0002-0013-195564
Sist faglig oppdatert: 21.12.2017
Antikoagulasjonsbehandling ved sinusvenetrombose (SVT)
Pasienter med sinusvenetrombose (SVT) og kjent temporær risikofaktor bør behandles med antikoagulasjon i 3-6 md.
SIGN: B1b
Pasienter med vedvarende spesielt høy risiko for SVT bør få antikoagulasjon i mer enn 6 måneder.
SIGN: D4.
Praktisk – slik kan anbefalingen følges
Pasienter med mistenkt sinusvenetrombose (SVT) bør utredes med noninvasiv angiografi (MR-angiografi eller CT-angiografi) med venesekvenser.
Sinusvenetrombose (SVT) er en sjelden tilstand, men er viktig å oppdage. SVT forekommer hyppigst postpartum, ved bruk av P-piller, ved dehydrering eller maligne sykdommer [229];[230]. De vanligste symptomene er hodepine, fokale sensorimotoriske utfall og krampeanfall, ev. subakutt encephalopati med fallende bevissthet uten fokalnevrologiske utfall [229];[230].
Ved mistanke om SVT bør pasienten undersøkes med MR-angiografi med venøs fase. Cerebral CT har for lav sensitivitet.
Spinalvæskeundersøkelse er vanligvis ikke indisert, men vil ofte vise økt lumbalt trykk, forhøyet protein og røde og hvite blodlegemer [229];[230].
Dersom pasienten utvikler symptomer på alvorlig intrakranialt høyt trykk kan antiødem behandling og hemikraniektomi vurderes.(Lenke til denne anbefalingen)
Begrunnelse – dette er anbefalingen basert på
Det er vanlig å behandle med antikoagulasjon i 3-6 md. ved SVT og kjent temporær risikofaktor, i 6-12 md. uten temporær risikofaktor eller ved mild hereditær trombofili, og livslang behandling ved residiverende SVT eller ved alvorlig trombofili [221];[223];[222] (SIGN:1b). Nytten av trombolyse ved SVT er ikke avklart [220].
Forskningsgrunnlag
Populasjon (P): Pasienter med sinusvenetrombose
Tiltak (I): Antikoagulasjonsbehandling
Sammenligning (C): Ingen antikoagulasjonsbehandling
Beskrivelse av inkluderte studier
Referanser
220. Thrombolysis for cerebral vein and dural sinus thrombosis https://www.helsedirektoratet.no/referanse/0002-0013-195565
221. Randomized, placebo-controlled trial of anticoagulant treatment with low-molecular-weight heparin for cerebral sinus thrombosis https://www.helsedirektoratet.no/referanse/0002-0013-195566
222. Heparin treatment in sinus venous thrombosis https://www.helsedirektoratet.no/referanse/0002-0013-195567
223. de Brujin SFTM, DeVEber G. Anticoagulation for cerebral sinus thrombosis https://www.helsedirektoratet.no/referanse/0002-0013-195568
229. Cerebral venous thrombosis https://www.helsedirektoratet.no/referanse/0002-0013-195574
230. Critical care of the patient with acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195575
Sist faglig oppdatert: 21.12.2017
Behandling av økt intrakranialt trykk og hemikraniektomi
Pasienter med akutt hjerneinfarkt med store nevrologiske utfall og fare for utvikling av malignt ødem bør få tilbud om hemikraniektomi innen 48 timer etter symptomdebut.
Hos pasienter med akutt hjerneinfarkt og tegn til økt intrakranialt trykk kan osmoterapi gis som støtteterapi før eventuell kirurgisk behandling.
SIGN: B1a
Praktisk – slik kan anbefalingen følges
Dokumentasjonen for dette tilbudet omhandler pasienter som var selvhjulpne med lav komorbiditet.
I tillegg til osmoterapi bør hode og overkropp heves, (SIGN: D4) feber (SIGN: C3) og hyperglykemi behandles aktivt (SIGN: C2b), blodtrykk bør ikke senkes til under 160 mmHg; (SIGN:C2b).
For pasienter med høy risiko for å utvikle malignt ødem i mediagebetet bør nevrokirurg konsulteres tidlig i forløpet med tanke på overflytting for nevrokirurgisk behandling.
For pasienter med risiko for å utvikle ødem i tilknytning til infarkter i lillehjernen bør også nevrokirurg konsulteres tidlig i forløpet med tanke på overflytting for nevrokirurgisk behandling.
Pasienter med tegn til utvikling av malignt ødem (gradvis reduksjon i bevissthetsnivå) må overvåkes nøye med gjentatte kliniske undersøkelser (gjerne monitorert med Glascow coma scale) og CT-undersøkelser. Ved kliniske eller radiologiske tegn til malignt ødem skal pasienten ha ca. 30° løftet hodeende, smertelindring, febersenkning og adekvat oksygenering. Blodtrykket bør sannsynligvis ikke reduseres til under 160/90 mm Hg. Middeltrykket kan sannsynligvis reduseres 15 % uten at sirkulasjonen i hjernen reduseres.
Osmoterapi med mannitol eller glyserol er av usikker verdi i behandling av forhøyet intrakranialt trykk. Osmoterapi bør benyttes ved truende herniering for å vinne tid i påvente av nevrokirurgisk behandling. Intensivbehandling med sedasjon, intubering og hyperventilering kan være indisert i denne situasjonen.
Osmoterapi alene har vanligvis liten effekt på det kliniske forløpet.
Begrunnelse – dette er anbefalingen basert på
Dokumentasjonen for dette tilbudet omhandler pasienter som var selvhjulpne med lav komorbiditet.
Osmoterapi med mannitol eller glyserol er av usikker verdi i behandling av forhøyet intrakranialt trykk [224];[227];[232] (SIGN: 1a). Osmoterapi bør benyttes ved truende transtentoriell herniering som et tiltak for å vinne tid i påvente av nevrokirurgisk behandling. Intensivbehandling med sedasjon, intubering og hyperventilering kan være indisert i denne situasjonen. Behandling i nevro-intensivenhet synes å kunne redusere dødelighet hos pasienter med hjerneblødning med tegn til økt hjernetrykk[225] (SIGN:2b). Behandling i intensivenhet benyttes mindre i Norge enn i de fleste andre europeiske land [228].
Økt intrakranialt trykk («malignt hjerneødem») kan utvikle seg i løpet av 24 timer[226] og kan innebære dødelighet opp mot 80 % [226]. Risikofaktorer er ung alder og store nevrologiske utfall (stort infarkt, spesielt carotis-T-okklusjon). Osmoterapi alene har vanligvis liten effekt på det kliniske forløpet [224];[227].
Forskningsgrunnlag
Populasjon (P): Akutt hjerneinfarkt, alle aldersgrupper
Tiltak (I): Hemikraniektomi
Sammenligning (C): Ikke hemikraniektomi
Beskrivelse av inkluderte studier
Resultattabell (PDF)
Flytskjema (PDF)
Søkestrategi (PDF)
Tre systematiske oversiktsartikler ble inkludert i kunnskapsgrunnlaget:
Studi1: Back, L., Nagaraja, V., Kapur, A., & Eslick, G. D. (2015). Role of decompressive hemicraniectomy in extensive middle cerebral artery strokes: a meta-analysis of randomised trials. Intern Med J, 45(7), 711-717. doi: 10.1111/imj.12724
Studie 2: Yang, M. H., Lin, H. Y., Fu, J., Roodrajeetsing, G., Shi, S. L., & Xiao, S. W. (2015). Decompressive hemicraniectomy in patients with malignant middle cerebral artery infarction: A systematic review and meta-analysis. Surgeon, 13(4), 230-240. doi: 10.1016/j.surge.2014.12.002
Studie 3: van Middelaar, T., Nederkoorn, P. J., van der Worp, H. B., Stam, J., & Richard, E. (2015). Quality of life after surgical decompression for space-occupying middle cerebral artery infarction: systematic review. Int J Stroke, 10(2), 170-176. doi: 10.1111/ijs.12329. doi: 10.1111/ijs.12329
Forskningsgrunnlaget er flere randomiserte studier, riktignok med lave antall pasienter, men med overbevisende forskjeller i resultat av behandlingen.
Forskingsdokumentasjonen viser at hemikraniektomi er en operasjon med få komplikasjoner som de fleste overlever, men med en tendens til funksjonshemming hos de som overlever.
Alderen på pasientene i begge studiene varierte fra 18-90 år.
Det ble også inkludert en studie som så på utfallsmålet QoL. Forfatterne har inkludert både RCT- og observasjonsstudier og bruker narrativ oppsummering.
Død ved 6 måneder (mRS 6) (studie 1): Ved akutt hjerneinfarkt gir hemikraniektomi lavere sannsynligheten (odds) for at slagpasienten dør i løpet av seks måneder sammenlignet med konvensjonell behandling. Effektestimatet (dvs. antall dødsfall) er basert på data fra 317 pasienter i seks randomiserte-kontrollerte studier. Blant de 317 pasientene gjennomgikk 156 hemikraniektomi og 161 konvensjonell behandling. Hvor mange som døde i hver gruppe er ikke oppgitt, bare at oddsen for å dø innen seks måneder var lavere hos de som gjennomgikk hemikraniektomi. Tiltroen til estimatet er likevel høy.
Død ved 12 måneder (studie 2): Av 1000 slagpasienter som får konvensjonell behandling etter akutt hjerneinfarkt per år, er det estimert 712 dødsfall. Sammenliknet med konvensjonell behandling er hemikraniektomi estimert til i snitt å gi 392 færre dødsfall per 1000 slagpasienter (fra 286 færre til 483 færre) i løpet av 12 mnd. Effektestimatet (dvs. antall dødsfall) er basert på data fra 314 pasienter i seks randomiserte-kontrollerte studier som varte 12 måneder. Tiltroen til dette estimatet er høy.
Selvhjulpne (mRS 0-2) ved 6 måneder (studie 1): Enten det ble gjort hemikraniektomi eller ikke ga dette ikke vesentlig utslag i andel selvhjulpne pasienter (mRS 0-2) etter seks måneder. Estimatet (dvs. antall personer med mRS 0-2) er basert på data fra 317 deltakere i seks randomiserte-kontrollerte studier. Hvor mange som skåret i hver gruppe er ikke oppgitt, bare oddsen for skåre innen seks måneder. Fordi konfidensintervallet er veldig vidt (fra 0,53 til 11,16), er det tvil om hvor sikkert effektestimatet er. Tiltroen til estimatet er derfor lav.
Funksjonshemming (mRS 0-3) ved 6 måneder (studie 1): Tilsvarende studie som over gjelder for andel pasienter med funksjonshemming (mRS 0-3) målt etter seks måneder, men konfidensintervallet er noe smalere (0,78 til 4,48), slik at tiltroen til dette estimatet er moderat.
Død og alvorlig funksjonshemming ved 12 måneder (mRS >3) (studie 2): Hemikraniektomi er estimert til i snitt å gi 132 færre dødsfall og alvorlige funksjonshemminger per 1000 pasienter sammenlignet med konvensjonell behandling etter 12 måneder (fra 34 færre til 252 færre). Estimatet (dvs. antall personer med mRS høyere enn 3) er basert på 314 pasienter i seks randomiserte-kontrollerte studier. Fordi konfidensintervallet er veldig vidt (fra 34 færre til 252 færre), er det noe tvil om hvor sikkert effektestimatet er. Tiltroen til estimatet er derfor moderat.
Død og svært alvorlig funksjonshemming ved 12 måneder (mRS >4) (studie 2): Hemikraniektomi er estimert til i snitt å gi 399 færre dødsfall og alvorlige funksjonshemminger per 1000 pasienter sammenlignet med konvensjonell behandling etter 12 måneder (fra 282 færre til 519 færre). Estimatet (dvs. antall personer med mRS-grad 4-5) er basert på 314 pasienter i seks randomiserte-kontrollerte studier. Selv om konfidensintervallet er relativt vidt og informasjonsstørrelse er liten (få antall hendelser), er den absolutte effekten stor og KI inkluderer ingen skade ved intervensjon. Tiltroen til dette estimatet er derfor høy.
Alvorlig funksjonshemming ved 12 måneder (mRS 4-5) (studie 2): Hemikraniektomi er estimert til i snitt å gi 126 flere dødsfall og alvorlig funksjonshemminger per 1000 pasienter sammenlignet med konvensjonell behandling etter 12 måneder (fra 62 færre til 269 flere). Estimatet (dvs. antall personer med mRS 4-5) er basert på 153 pasienter i seks randomiserte-kontrollerte studier. Fordi konfidensintervallet (fra 62 færre til 269 flere) krysser linjen for ingen effekt og informasjonsstørrelsen er liten (få antall hendelser), er det noe tvil om hvor sikkert effektestimatet er. Tiltroen til estimatet er derfor moderat.
Livskvalitet (studie 3) hos pasienter som hadde gjennomgått hemikraniektomi, varierte i snitt fra 46 % til 67 % når det ble målt ved spørreskjema og visuell analog skala (VAS). Pasienter over 60 år hadde generelt lavere livskvalitet enn yngre. Effektestimatet (dvs. livskvalitet) er basert data fra 114 deltakere i seks studier (fire observasjonsstudier og to randomiserte-kontrollerte studier) og ble målt 12 til 37.2 måneder etter operasjonen. Alle studiene var svært små og målte livskvaliteten ved bruk av ulike metoder. Alle studiene var svært små og målte livskvaliteten ved bruk av ulike metoder. Grunnet mangelfull sammenligningsgrunnlag i studien (dvs. kontrollpopulasjon) er det også usikkerhet knyttet til overførbarhet til norske forhold. Tiltroen til effektestimatet er derfor lav.
Vurdering
Fordeler og ulemper
Fordeler: Kirurgisk hemikraniektomi innen 48 timer etter debut øker sannsynligheten for overlevelse signifikant, uten at risikoen for overlevelse med alvorlig funksjonshemning øker tilsvarende.
Ulempe: kan være at noen pasienter som ellers ville ha dødd, overlever med meget betydelige nevrologiske utfall og stor grad av avhengighet av hjelp.
Kvalitet på dokumentasjonen
Man har høy tiltro til at intervensjonen har signifikant positiv effekt på overlevelse. Lav tiltro til effekt på selvhjulpenhet.
Verdier og preferanser
Økt overlevelse i seg selv er lagt vekt på som verdi. Flere klinikere i DECIDE-gruppene var noe usikre på om verdien av større sannsynlighet for overlevelse oppveier risikoen for å bli alvorlig funksjonshemmet og avhengig av hjelp. Brukerrepresentantene anså fordelene klart større enn ulempene, fordi høy skår på funksjonshemning ikke nødvendigvis gjenspeiler opplevelse av nedsatt egen livskvalitet.
Referanser
213. Role of decompressive hemicraniectomy in extensive middle cerebral artery strokes: a meta-analysis of randomised trials http://ovidsp.ovid.com/ovidweb.cgi?T=JS&CSC=Y&NEWS=N&PAGE=fulltext&D=prem&AN=25684396
214. Quality of life after surgical decompression for space-occupying middle cerebral artery infarction: systematic review http://ovidsp.ovid.com/ovidweb.cgi?T=JS&CSC=Y&NEWS=N&PAGE=fulltext&D=prem&AN=25042345
215. Decompressive hemicraniectomy in patients with malignant middle cerebral artery infarction: A systematic review and meta-analysis http://ovidsp.ovid.com/ovidweb.cgi?T=JS&CSC=Y&NEWS=N&PAGE=fulltext&D=prem&AN=25661677
216. Critical care for patients with massive ischemic stroke http://ovidsp.ovid.com/ovidweb.cgi?T=JS&CSC=Y&NEWS=N&PAGE=fulltext&D=prem&AN=25328873
224. Mannitol for acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195569
225. Admission to a neurologic/neurosurgical intensive care unit is associated with reduced mortality rate after intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195570
226. Timing of neurologic deterioration in massive middle cerebral artery infarction: a multicenter review https://www.helsedirektoratet.no/referanse/0002-0013-195571
227. Glycerol for acute stroke: a Cochrane systematic review https://www.helsedirektoratet.no/referanse/0002-0013-195572
228. Acute stroke treatment in Europe: a questionnaire‐based survey on behalf of the EFNS Task Force on acute neurological stroke care https://www.helsedirektoratet.no/referanse/0002-0013-195573
Sekundærforebygging – undersøkelse og behandling ved hjerneslag
Antitrombotisk behandling
Platehemmende behandling etter hjerneinfarkt/TIA
Pasienter med hjerneinfarkt/TIA uten en kardial årsak som gir indikasjon for antikoagulasjonsbehandling, bør få platehemmende behandling. SIGN: A,1a
Klopidogrel eller kombinasjonsbehandlingen acetylsalisylsyre (ASA)/dipyridamol foreslås fremfor monoterapi med acetylsalisylsyre.
Praktisk – slik kan anbefalingen følges
Monoterapi med acetylsalisylsyre er et adekvat alternativ for noen pasienter grunnet bivirkninger og etterlevelse når det gjelder kombinasjonen ASA/dipyridamol samt at de absolutte forskjeller i effekt ikke er meget store. For dosering av ASA med 75 mg er det ingen signifikant forskjell i forhold til kombinasjonen ASA/dipyridamol. Se SOF tabell. I tillegg er de fleste pasientene som har inngått i studiene 10 -15 år yngre enn den vanlige slagpopulasjonen i Norge så effekten av de ulike alternativer hos eldre slagpasienter er også noe usikker.
Forskjellene i effekt mellom klopidogrel og ASA er også marginale [238].For en god del pasienter vil derfor ASA monoterapi være et aktuelt og adekvat behandlingsalternativ.
Effekten av klopidogrel er på samme nivå som kombinasjonen ASA/dipyridamol [263].
Bivirkninger som hodepine, svimmelhet og gastrointestinale plager forekommende ofte ved kombinasjonen ASA/dipyridamol. Når ASA/dipyridamol må doseres to ganger om dagen, er det noen retningslinjer som anbefaler klopidogrel framfor kombinasjonen ASA/dipyridamol. Sett ut fra effekt, er alternativene likeverdige.
For å redusere risiko for bivirkninger er det ved kombinasjonsbehandling med ASA/dipyridamol, vanlig med opptrappende dosering med en tablett om kvelden første 1-2 uker og deretter en tablett to ganger daglig.
Hos eldre over 80 år er både kombinasjonsbehandlingen og klopidogrel i begrenset grad utprøvd, og individuelle vurderinger bør gjøres. ASA som monoterapi kan særlig i denne aldersgruppen være et adekvat alternativ.
Det er ikke vist noe tilleggseffekt av kombinasjonen ASA/dipyridamol versus ASA som monoterapi i akuttfasen og de første 3 md. etter hjerneslaget [47].
Begrunnelse – dette er anbefalingen basert på
Det er godt dokumentert at platehemmende behandling reduserer risiko for residiv etter hjerneinfarkt/ TIA [238].
I denne revisjonen ble det søkt etter ny kunnskap om hvorvidt ASA som monoterapi er like effektivt som ASA/dipyridamol (eller klopidogrel alene) hos pasienter med hjerneinfarkt/TIA.
Kunnskapsgrunnlaget for videreføringen av anbefalingen om ASA/dipyridamol og klopidogrel som likeverdig platehemmende behandling for pasienter med hjerneinfarkt/TIA, er basert på National clinical guidelines for stroke 2016 (Royal college of physicians – accr. av NICE). Anbefalingene bygger på studiene CAPRIE [261], ESPRIT [262] og PRoFESS [263]. Disse viser at ASA/dipyridamol og klopidogrel monoterapi er like effective. Begge behandlingsalternativene gir noe bedre sekundærforebygging enn ASA monoterapi.
For kombinasjonsbehandlingen ASA/dipyridamol vs ASA er det gjennomført en GRADE-prosess. Resultatet viser at kombinasjonsbehandling med acetylsalicylsyre/dipyridamol viser gjennomgang av forskningsdokumentasjonen redusert risiko for residiv av hjerneinfarkt ved oppfølging over 3,5 år sammenlignet med monoterapi med acetylsalicylsyre. Effekten var tydeligst ved sammenligning mellom kombinasjonsbehandling (acetylsalicyl 50 + dipyridamol 400 mg/d) og monoterapi acetylsalicyl i dosen 30-50 mg. Det var ingen signifikant forskjell i effekt på residiv hjerneinfarkt mellom kombinasjonsbehandling med acetylsalicylsyre/dipyridamol og monoterapi acetylsalicylsyre i dose 75-162 mg/d eller 500-1500 mg/d. Det ble ikke funnet signifikant forskjell i risiko for død og blødningsfare mellom kombinasjonsbehandling med acetylsalicylsyre/dipyridamol og acetylsalicylsyre monoterapi, men en tendens til bedre effekt med acetylsalicylsyre og dipyridamol. Anbefalingen er basert på arbeidsgruppens samlede kunnskap, brukererfaring og forskingsdokumentasjon.
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneinfarkt eller TIA uten indikasjon for antikoagulasjon
Tiltak (I): Antiplatebehandling
Sammenligning (C): ASA/dipyridamol eller clopidogrel versus ASA alene
Beskrivelse av inkluderte studier
Resultattabell (PDF)
Flytskjema (PDF)
Søkestrategi (PDF)
Forskningsgrunnlaget som ligger til grunn for anbefalingen er basert på to systematiske litteraturoversikter: Li et al. (2013) og Niu et al. (2016). Ved utforming av anbefalingen er det er også tatt hensyn til arbeidsgruppens samlede kompetanse, samt brukererfaring.
Den systematiske litteraturoversikten av Li et al. (2013) inkluderte fem randomiserte kontrollerte studier med totalt 8 622 deltakere. Litteraturoversikten hadde til hensikt å undersøke effekt og sikkerhet ved dobbel platehemming med acetylsalisylsyre (ASA) og dipyridamol sammenlignet mot ASA som monoterapi ved sekundærforebygging hos pasienter med tidligere TIA eller hjerneslag. (Utfall 1a, 2-5)
Den systematiske nettverk meta-analysen av Niu et al. (2016) inkluderte totalt 36 randomiserte kontrollerte studier med 82 144 deltakere. Litteraturoversikten undersøkte effekt og sikkerhet av diverse platehemmende regimer, herunder dobbel platehemming med ASA og dipyridamol sammenlignet med ASA som monoterapi. Seks av de randomiserte kontrollerte studiene som var inkludert i meta-analysen var aktuelle for arbeidsgruppens PICO-spørsmål. (Utfall 1b-1d, 6-8)
NB! I de to systematiske litteraturoversiktene er dobbelplatehemming med ASA + dipyridamol satt som intervensjon og monoterapi med ASA som kontroll (omvendt av arbeidsgruppens PICO). Dette gjelder alle utfall.
Utfall 1a: Gjentatt hjerneslag med ASA + dipyridamol vs. ASA
Sammenlignet med kontrollgruppen, gir ASA + dipyridamol etter hjerneslag trolig lavere sannsynlighet (odds) for at pasienten får nytt hjerneslag med 15 færre tilfeller per 1000 pasient (fra 4 færre til 26 færre). Effektestimatet (dvs. antall hjerneslag) er basert på 8 619 deltakere i fem randomiserte kontrollerte studier. Blant pasientene fikk 4 315 kombinasjonsbehandling med ASA og dipyridamol, mens 4 304 fikk ASA som monoterapi. Kvaliteten på evidensgrunnlaget er moderat grunnet usikkerhet vedr. presisjon rundt absolutt forskjell i effekt (utfallet er estimert ved bruk av to forskjellige statistiske metoder hvorav den kliniske forskjellen - gjenspeilet i absolutt effekt - er svært usikker). Det er moderat tillit til resultatet.
Utfall 1b: Gjentatt hjerneslag med ASA + dipyridamol (50 + 400 mg/d) vs. ASA (30-50 mg/d)
Sammenlignet med kontrollgruppen, gir ASA + dipyridamol etter hjerneslag/TIA lavere sannsynlighet (odds) for at pasienten får nytt hjerneslag med 29 færre tilfeller per 1000 pasient (fra 9 færre til 47 færre). Effektestimatet (dvs. antall hjerneslag) er basert på 3 299 deltakere i 1 randomisert kontrollert studie. Blant pasientene fikk 1 649 ASA som monoterapi mens 1 650 fikk kombinasjonsbehandlingen ASA og dipyridamol. Kvaliteten på evidensgrunnlaget er høy, og det er stor tillit til resultatet, men metodikerne har her ikke tatt hensyn til at det er en betydelig forskjell i alder mellom de pasienter som er studert og norske slagpasienter. Arbeidsgruppen mener derfor overførbarheten til norske forhold tilsier lavere tillit til estimatet.
Utfall 1c: Gjentatt hjerneslag med ASA + dipyridamol (50 + 400 mg/d) vs. ASA (75-162 mg/d)
Sammenlignet med kontrollgruppen, er det usikkert hvorvidt ASA + dipyridamol etter hjerneslag/TIA gir lavere sannsynlighet (odds) for at pasienten får nytt hjerneslag, med 4 flere tilfeller per 1000 pasient (fra 36 færre til 71 flere). Effektestimatet (dvs. antall hjerneslag) er basert på 4 030 deltakere i 2 randomiserte kontrollerte studier. Blant pasientene fikk 2 015 ASA som monoterapi mens 2 015 fikk kombinasjonsbehandlingen ASA og dipyridamol. Kvaliteten på evidensgrunnlaget er veldig lav grunnet risiko for systematiske feil, redusert overførbarhet og vidt konfidensintervall. Det er svært liten tillit til resultatet. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt.
Utfall 1d: Gjentatt hjerneslag med ASA + dipyridamol (990-1300 + 150-300 mg/d) vs. ASA (500-1500 mg/d)
Sammenlignet med kontrollgruppen, gir trolig ASA + dipyridamol etter hjerneslag/TIA lavere sannsynlighet (odds) for at pasienten får nytt hjerneslag, med 15 færre tilfeller per 1000 pasient (fra 17 flere til 40 færre). Effektestimatet (dvs. antall hjerneslag) er basert på 1 574 deltakere i 3 randomiserte kontrollerte studier. Blant pasientene fikk 787 ASA som monoterapi, mens 787 fikk kombinasjonsbehandlingen ASA og dipyridamol. Kvaliteten på evidensgrunnlaget er moderat grunnet et vidt konfidensintervall og få hendelser. Det er moderat tillit til resultatet. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt.
Utfall 2: Død, uansett årsak med ASA + dipyridamol vs. ASA
Sammenlignet med kontrollgruppen, gir ASA + dipyridamol etter hjerneslag lavere sannsynlighet (odds) for at pasienten dør, med 3 færre tilfeller per 1000 pasient (fra 10 flere til 13 færre). Effektestimatet (dvs. antall hendelser død) er basert på 8 622 deltakere i 5 randomiserte kontrollerte studier. Blant pasientene fikk 4 318 kombinasjonsbehandlingen ASA og dipyridamol, mens 4 304 fikk ASA som monoterapi. Kvaliteten på evidensgrunnlaget er høyt og det er stor tillit til resultatet. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt.
Utfall 3: Intrakranielle blødninger med ASA + dipyridamol vs. ASA
Sammenlignet med kontrollgruppen, gir trolig ASA + dipyridamol etter hjerneslag/TIA lavere sannsynlighet (odds) for at pasienten får intrakranielle blødninger med 5 færre tilfeller per 1000 pasient (fra 2 flere til 9 færre). Effektestimatet (dvs. antall intrakranielle blødninger) er basert på 5 320 deltakere i 4 randomiserte kontrollerte studier. Blant pasientene fikk 2 655 kombinasjonsbehandlingen ASA og dipyridamol, mens 2 665 fikk ASA som monoterapi. Kvaliteten på evidensgrunnlaget er moderat grunnet et vidt/upresist konfidensintervall og meget få antall hendelser. Det er middels tillit til resultatet. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt.
Utfall 4: Store blødninger med ASA + dipyridamol vs. ASA
Sammenlignet med kontrollgruppen, gir trolig ASA + dipyridamol etter hjerneslag lavere sannsynlighet (odds) for at pasienten får store blødninger med 3 færre tilfeller per 1000 pasient (fra 4 flere til 8 færre). Effektestimatet (dvs. antall store blødninger) er basert på 8 619 deltakere i 5 randomiserte kontrollerte studier. Blant pasientene fikk 4 315 kombinasjonsbehandlingen ASA og dipyridamol, mens 4 304 fikk ASA som monoterapi. Kvaliteten på evidensgrunnlaget er moderat grunnet et vidt/upresist konfidensintervall og få antall hendelser. Det er middels tillit til resultatet. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt.
Utfall 5: Alle typer blødninger med ASA + dipyridamol vs. ASA
Sammenlignet med kontrollgruppen, gir ASA + dipyridamol etter hjerneslag lavere sannsynlighet (odds) for at pasienten får blødninger (alle typer) med 22 færre tilfeller per 1000 pasient (fra 10 flere til 58 færre). Effektestimatet (dvs. antall blødninger) er basert på 8 619 deltakere i 5 randomiserte kontrollerte studier. Blant pasientene fikk 4 315 kombinasjonsbehandlingen ASA og dipyridamol, mens 4 304 fikk ASA som monoterapi. Kvaliteten på evidensgrunnlaget er høyt og det er stor tillit til resultatet. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt.
Utfall 6: Alle typer blødninger med ASA + dipyridamol (50 + 400 mg/d) vs. ASA (30-50 mg/d)
Sammenlignet med kontrollgruppen, gir trolig ASA + dipyridamol etter hjerneslag/TIA større sannsynlighet (odds) for at pasienten får blødninger med 5 flere tilfeller per 1000 pasient (fra 12 færre til 27 flere). Effektestimatet (dvs. antall blødninger) er basert på 3 299 deltakere i 1 randomisert kontrollert studie. Blant pasientene fikk 1 649 ASA som monoterapi, mens 1 650 fikk kombinasjonsbehandlingen ASA og dipyridamol. Kvaliteten på evidensgrunnlaget er moderat grunnet et vidt konfidensintervall og liten informasjonsstørrelse. Det er middels tillit til resultatet. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt.
Utfall 7: Alle typer blødninger med ASA + dipyridamol (50 + 400 mg/d) vs. ASA (75-162 mg/d)
Sammenlignet med kontrollgruppen, gir muligens ASA + dipyridamol etter hjerneslag/TIA lavere sannsynlighet (odds) for at pasienten får blødninger med 16 færre tilfeller per 1000 pasient (fra 28 flere til 49 færre). Effektestimatet (dvs. antall blødninger) er basert på 4 030 deltakere i 2 randomiserte kontrollerte studier. Blant pasientene fikk 2 015 ASA som monoterapi mens 2 015 fikk kombinasjonsbehandlingen ASA og dipyridamol. Kvaliteten på evidensgrunnlaget er lav grunnet risiko for systematiske feil og et vidt/upresist konfidensintervall. Det er liten tillit til resultatet. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt.
Utfall 8: Alle typer blødninger med ASA + dipyridamol (990-1300 + 150-300 mg/d) vs. ASA (500-1500 mg/d)
Sammenlignet med kontrollgruppen, gir trolig ASA + dipyridamol etter hjerneslag/TIA lavere sannsynlighet (odds) for at pasienten får blødninger med 7 færre tilfeller per 1000 pasient (fra 18 flere til 24 færre). Effektestimatet (dvs. antall blødninger) er basert på 1 574 deltakere i 3 randomiserte kontrollerte studier. Blant pasientene fikk 787 ASA som monoterapi, mens 787 fikk kombinasjonsbehandlingen ASA og dipyridamol. Kvaliteten på evidensgrunnlaget er moderat grunnet et vidt/upresist konfidensintervall og meget få hendelser. Det er middels tillit til resultatet. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt.
Vurdering
Fordeler og ulemper
Fordeler:
Forskningsdokumentasjonen tyder på at dobbelplatehemning med ASA og dipyridamol kan gi redusert risiko for gjentagende hjerneinfarkt, men når effektmålene er estimert basert på ulike doser av ASA, så ble det ikke funnet noen signifikant effekt mellom dobbelt platehemning (ASA/dipyridamol) og kontrollbehandlingen med ASA. For «død» og «alle typer blødninger», så er effekten av dobbelt platehemning ikke entydig positiv da
konfidensintervallet krysser linjen for ingen forskjell i effekt, men det er en trend mot positiv effekt.
Ulemper:
ASA/dipyridamol er assosiert med mer bivirkninger enn alternativene monoterapi med ASA eller klopidogrelASA/dipyridamol og forutsetter dosering 2 ganger daglig som en del pasienter synes er vanskeligere å følge opp enn tablettinntak en gang daglig.
Konklusjon:
Det er usikkert hvorvidt de ønskede effektene veier opp for de uønskede (e.g. bivirkninger), men det er vurdert at de antakelig gjør det.
Kvalitet på dokumentasjonen
Samlet sett er tilliten til effektestimatene lav på bakgrunn av at aldersgruppen i studien er 10 år yngre enn pasienter med hjerneslag i Norge.
Verdier og preferanser
Utfallsmålene (død, residiv hjerneinfarkt og blødningskomplikasjoner) er vesentlige for å utforme forslag til en anbefaling.
Referanser
235. The efficacy and safety of aspirin plus dipyridamole versus aspirin in secondary prevention following TIA or stroke: a meta-analysis of randomized controlled trials https://www.helsedirektoratet.no/referanse/0002-0013-195580
236. Low-intensity oral anticoagulation plus low-dose aspirin versus high-intensity oral anticoagulation alone: a randomized trial in patients with mechanical prosthetic heart valves https://www.helsedirektoratet.no/referanse/0002-0013-195581
237. Antiplatelet regimens in the long-term secondary prevention of transient ischaemic attack and ischaemic stroke: an updated network meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195582
238. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients https://www.helsedirektoratet.no/referanse/0002-0013-195583
239. Effects of aspirin on risk and severity of early recurrent stroke after transient ischaemic attack and ischaemic stroke: time-course analysis of randomised trials https://www.helsedirektoratet.no/referanse/0002-0013-195584
261. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE) https://www.helsedirektoratet.no/referanse/0002-0013-195606
262. Aspirin plus dipyridamole versus aspirin alone after cerebral ischaemia of arterial origin (ESPRIT): randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195607
263. Aspirin and extended-release dipyridamole versus clopidogrel for recurrent stroke https://www.helsedirektoratet.no/referanse/0002-0013-195608
Antitrombotisk behandling etter hjerneinfarkt/TIA i tilknytning til et hjerteinfarkt
Pasienter med hjerneinfarkt/TIA i forbindelse med akutt hjerteinfarkt bør initialt få antikoagulasjon med lavmolekylært heparin eventuelt i kombinasjon med acetylsalisylsyre og klopidogrel.
SIGN: C3
Pasienter med sannsynlig kardial emboli ved akutt hjerteinfarkt bør behandles med antikoagulasjon kombinert med platehemming i minimum 3 måneder.
SIGN: C3
Praktisk – slik kan anbefalingen følges
Behandlingen bør skje i samråd med kardiolog.
Begrunnelse – dette er anbefalingen basert på
Antitrombotisk behandling hos pasienter med hjerneinfarkt/TIA i forbindelse med et hjerteinfarkt bør vurderes med tanke på kombinasjonsbehandling med platehemmere og antikoagulasjon.
Store fremreveggsinfarkt, eventuelt med intramural trombedannelse eller venstreventrikkel dysfunksjon, med nedsatt ejeksjonsfraksjon EF, <30 %, styrker indikasjon for overgang til warfarin i kombinasjon med ASA [240] [241] [242]. Hvor lenge warfarin skal gis, er avhengig av indikasjonen. For noen pasienter kan det være indikasjon for å fortsette med platehemming og warfarin på ubestemt tid. Ved trippelbehandling (acetylsalisylsyre, klopidogrel og warfarin) anbefales et litt lavere INR nivå (2,0-2,5).
Forskningsgrunnlag
Populasjon (P): Pasienter med akutt hjerneinfarkt eller TIA i forbindelse med et akutt hjerteinfarkt
Tiltak (I): Antitrombotisk behandling; antikoagulasjon og eller platehemming (acetylsalisylsyre)
Sammenligning (C): Platehemming med acetylsalicylsyre versus høyintensitets antikoagulasjon med warfarin eller kombinasjon acetylsalisylsyre og lavintensitets antikoagulasjon med warfarin
Beskrivelse av inkluderte studier
Referanser
240. Left ventricular thrombosis and cerebrovascular accident in acute myocardial infarction https://www.helsedirektoratet.no/referanse/0002-0013-195585
241. Ventricular dysfunction and the risk of stroke after myocardial infarction https://www.helsedirektoratet.no/referanse/0002-0013-195586
242. Aspirin and coumadin after acute coronary syndromes (the ASPECT-2 study): a randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195587
Sist faglig oppdatert: 21.12.2017
Antitrombotisk behandling etter hjerneinfarkt/TIA og hjertesvikt
Pasienter med hjerneinfarkt eller TIA som også har hjertesvikt, bør som førstevalg behandles med klopidogrel eller kombinasjonen acetylsalisylsyre (ASA) og dipyridamol framfor antikoagulasjon.
SIGN: B1b
Hos pasienter med hjertesvikt kan antikoagulasjon vurderes hvis det foreligger tilleggsfaktorer som alvorlig dyskinesi (ejeksjonsfraksjon < 30%), trombe i venstre ventrikkel eller nye hjerneinfarkter under pågående platehemmende behandling.
SIGN: C3
Begrunnelse – dette er anbefalingen basert på
Observasjonsstudier viser at redusert ejeksjonsfraksjon øker risikoen for hjerneinfarkt og TIA [243] [244] [245].
Antikoagulasjon av hjertesviktpasienter med eller uten cerebrovaskulær sykdom er dårlig dokumentert i randomiserte studier, men det finnes en stor randomisert studie som sammenlignet behandling med warfarin, acetylsalisylsyre og klopidogrel [246]. Studien viste at warfarin ikke bedret overlevelse eller reduserte det totale antall vaskulære hendelser sammenlignet med ASA og klopidogrel. Det var få pasienter med tidligere hjerneslag i studien, slik at resultatene i begrenset grad tillater overføring til sekundærforebygging. Det var en liten reduksjon i hjerneslag i warfaringruppen som kan tyde på at warfarin også kan ha en plass i antitrombotisk behandling hos noen pasienter med hjerneinfarkt med hjertesvikt [246].
Warfarin kan være aktuelt å vurdere ved alvorlig dyskinesi (EF <30 % eller påvisning av trombe i venstre ventrikkel eller ved residiverende hjerneinfarkt hos pasienter på platehemmende behandling [246] (SIGN:3).
Som standard sekundærforebygging ved hjertesvikt, er ASA og dipyridamol alternativt klopidogrel fortsatt førstevalget da det er en enklere behandling og har færre bivirkninger [246].
Forskningsgrunnlag
Populasjon (P): Pasienter som får TIA eller hjerneinfarkt i forbindelse med hjertesvikt
Tiltak (I): Antitrombotisk behandling med acetylsalisylsyre (ASA) eller klopidogrel eller warfarin
Sammenligning (C): ASA vs warfarin, klopiogrel vs warfarin og klopidogrel vs ASA
Beskrivelse av inkluderte studier
Referanser
243. Left ventricular systolic dysfunction and the risk of ischemic stroke in a multiethnic population https://www.helsedirektoratet.no/referanse/0002-0013-195588
244. Ventricular dysfunction and the risk of stroke after myocardial infarction https://www.helsedirektoratet.no/referanse/0002-0013-195589
245. Randomized trial of warfarin, aspirin, and clopidogrel in patients with chronic heart failure https://www.helsedirektoratet.no/referanse/0002-0013-195590
246. Symptomatic and asymptomatic left-ventricular systolic dysfunction in an urban population https://www.helsedirektoratet.no/referanse/0002-0013-195591
Sist faglig oppdatert: 21.12.2017
Antitrombotisk behandling ved hjerneinfarkt/TIA og mekaniske hjerteklaffproteser
Pasienter med hjerneinfarkt/TIA og mekaniske klaffproteser bør får kombinasjonsbehandling med warfarin og acetylsalisylsyre (ASA) hvis hjerneinfarktet har oppstått på adekvat INR.
SIGN: C3
Praktisk – slik kan anbefalingen følges
Pasienter med akutt hjerneinfarkt eller TIA og som har mekaniske hjerteklaffproteser skal umiddelbart undersøkes med ekkokardiografi, og helst transøsofagal ekkokardiografi. Behandlingen bør gjennomføres i samarbeid med kardiolog.
Begrunnelse – dette er anbefalingen basert på
Hos pasienter med mekaniske hjerteklaffproteser som gjennomgår et hjerneinfarkt eller TIA til tross for tilfredsstillende antikoagulasjon med warfarin, kan tilleggsbehandling med ASA i 3 mnd. være nyttig [247]. Økning i INR nivået kan også vurderes.
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneinfarkt eller TIA som har mekaniske hjerteklaffproteser
Tiltak (I): Lavintensitet antikoagulasjon (INR 2,5-3,5)+ acetylsalisylsyre (100 mg x 1)
Sammenligning (C): Høyintensitet antikoagulasjon (INR 3,5-4,5).
Beskrivelse av inkluderte studier
Referanser
247. Low-intensity oral anticoagulation plus low-dose aspirin versus high-intensity oral anticoagulation alone: a randomized trial in patients with mechanical prosthetic heart valves https://www.helsedirektoratet.no/referanse/0002-0013-195592
Sist faglig oppdatert: 21.12.2017
Antitrombotisk behandling ved hjerneinfarkt/TIA og strukturell hjertesykdom som PFO, biologiske klaffeproteser, aorta- eller mitralklaffefeil
Ved hjerneinfarkt/TIA og samtidig:
- PFO (Patent foramen ovale), SIGN: C3,
- biologiske klaffproteser SIGN: D4,
- aortaklaffefeil SIGN: C3,
- mitralklaffefeil (inkludert mitralprolaps ) SIGN: C3,
- uten atrieflimmer SIGN: C3,
bør pasienten behandles med klopidogrel eller kombinasjonen ASA/dipyridamol framfor antikoagulasjon.
Pasienter med hjerneinfarkt/TIA som har mitralklaffefeil kombinert med dilaterte atrier eller trombemasser i atriene, bør vurderes for antikoagulasjonsbehandling. SIGN: C3
Kateterbasert lukning av PFO kan vurderes hos pasienter som får gjentatt hjerneinfarkt uten annen forklaring til tross for antitrombotisk behandling. SIGN: C3
Begrunnelse – dette er anbefalingen basert på
Det foreligger ikke randomiserte studier som har vist at antikoagulasjonsbehandling reduserer risikoen for systemiske embolier hos pasienter med isolert mitralklaffefeil [254][248]. Pasienter med hjerneinfarkt eller TIA som har mitralklaffefeil, bør primært få platehemmende behandling, men warfarinbehandling kan vurderes dersom det i tillegg foreligger dilaterte atrier eller trombemasser i atriene [255][253] (SIGN: 3).
Observasjonsstudier har ikke vist at forkalkede aortaklaffer eller aortasklerose øker risikoen for kliniske hjerneinfarkt dersom det ikke samtidig foreligger mitralklaffefeil eller atrieflimmer [249] [252]. Mikroembolisering fra forkalkede aortaklaffer forekommer trolig ganske ofte subklinisk. Det foreligger ikke dokumentasjon som favoriserer warfarin versus ASA/dipyridamol eller klopidogrel hos pasienter med hjerneinfarkt som har aortaklaffefeil (SIGN:3).
Det er usikkert om mitralprolaps eller excressenser, som er et vanlig funn ved ekkokardiografi, øker risikoen for hjerneinfarkt eller TIA. Det foreligger ingen randomiserte studier, og anti trombotisk behandling med ASA og dipyridamol er den vanligste behandlingen, alternativt klopidogrel (SIGN:3).
Pasienter med akutt hjerneinfarkt eller TIA og som har biologiske hjerteklaffeproteser skal umiddelbart undersøkes med ekkokardiografi, og helst transøsofagal ekkokardiografi.
Patent foramen ovale (PFO) forekommer hyppig og er påvist hos 20 % i normalbefolkningen. Hos unge pasienter med hjerneinfarkt er prevalensen høyere. Risikoen for gjentatt slag hos pasienter med hjerneinfarkt og patent foramen ovale er beregnet til 1-2 % per år. Dersom det foreligger PFO i kombinasjon med atrie-septum aneurisme, atrieflimmer eller flutter, øker risikoen for tromboemboli. Warfarin forebygger ikke gjentatte hjerneinfarkt mer effektivt enn ASA hos pasienter med hjerneinfarkt og PFO [250] (SIGN: 3). Kirurgisk behandling eller kateterbasert lukning av PFO har så langt ikke vist overbevisende forebyggende effekt, men er aktuelt å vurdere spesielt ved repeterende hjerneinfarkter eller TIA der annen sannsynlig årsak ikke kan påvises [251] (SIGN:3).
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneinfarkt eller TIA og samtidig patent foramen ovale (PFO)
Tiltak (I): Antikoagulasjon eller platehemming
Sammenligning (C): Kateterbaser lukning av PFO
Beskrivelse av inkluderte studier
Referanser
247. Low-intensity oral anticoagulation plus low-dose aspirin versus high-intensity oral anticoagulation alone: a randomized trial in patients with mechanical prosthetic heart valves https://www.helsedirektoratet.no/referanse/0002-0013-195592
248. Cerebral embolism and mitral stenosis: survival with and without anticoagulants https://www.helsedirektoratet.no/referanse/0002-0013-195593
249. Risk of stroke in a cohort of 815 patients with calcification of the aortic valve with or without stenosis https://www.helsedirektoratet.no/referanse/0002-0013-195594
250. Effect of medical treatment in stroke patients with patent foramen ovale https://www.helsedirektoratet.no/referanse/0002-0013-195595
251. Transcatheter closure versus medical therapy of patent foramen ovale and presumed paradoxical thromboembolia systematic review https://www.helsedirektoratet.no/referanse/0002-0013-195596
252. Association of aortic-valve sclerosis with cardiovascular mortality and morbidity in the elderly https://www.helsedirektoratet.no/referanse/0002-0013-195597
253. A prognostic model for predicting the disappearance of left atrial thrombi among candidates for percutaneous transvenous mitral commissurotomy https://www.helsedirektoratet.no/referanse/0002-0013-195598
254. Systemic embolism and anticoagulant prophylaxis in rheumatic heart disease https://www.helsedirektoratet.no/referanse/0002-0013-195599
255. Oral anticoagulants vs aspirin in nonvalvular atrial fibrillation: an individual patient meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195600
Sist faglig oppdatert: 21.12.2017
Antikoagulasjon hos pasienter med hjerneinfarkt/ TIA og atrieflimmer
Antikoagulasjonsbehandling anbefales til pasienter med hjerneinfarkt/TIA og atrieflimmer.
SIGN:1A
Ved hjerneinfarkt/TIA og atrieflimmer foreslås direktevirkende perorale antikoagulasjonsmidler (DOAK) fremfor warfarin.
Praktisk – slik kan anbefalingen følges
Behandling med warfarin krever regelmessig oppfølging av INR, som regel hver 3-6 uke.
Ved innsetting av DOAK anbefales også oppfølging av etterlevelse og blodprøver (Hb og kreatinin) etter 4 uker og senere 2 x årlig. Så langt foreligger det ikke anbefalinger om monitorering av antikoagulasjonseffekten ved bruk av DOAK.
Medikamentetterlevelse er svært viktig for å oppnå ønske effekt av både warfarin og DOAK. DOAK har kort halveringstid, og manglende etterlevelse medfører derfor raskt tap av den forbyggende effekten.
Ved oppstart av DOAK må pasienten informeres om at at eventuell samtidig bruk av warfarin må opphøre.
Tidspunkt for innsetting av antikoagulasjon etter et akutt hjerneinfarkt vil være avhengig av størrelsen på hjerneinfarktet . Se også anbefalinger i kapittelet Reperfusjonsbehandling og antitrombotisk behandling ved akutt hjerneinfarkt.
Forskjellene i effekt og bivirkninger av warfarin og DOAK er ikke større enn at pasientens preferanse når det gjelder valg av type antikoagulerende legemiddel, bør vektlegges.
Pasientgrupper med høy komorbiditet som har eller er i risiko for å utvikle alvorlig nyresvikt, bør foreskrives warfarin. Ved mekaniske hjerteventiler skal warfarin benyttes.
Ved behov forkombinasjonsbehandling med antikoagulasjon og platehemming må den forebyggende effekten veies mot økt blødningsrisiko.
Begrunnelse – dette er anbefalingen basert på
Atrieflimmer er en av de hyppigste årsakene til hjerneslag [256] .
Omlag 25 % av pasienter som får hjerneslag i Norge, har atrieflimmer (ref. Norsk hjerneslagregister- Årsrapport 2015, ref:informasjon om warfarin og de perorale antikoagulasjonsmidlene dabigatran, rivaroksaban og apixaban fra Helsedirektoratet). Antikoagulasjon gir svært god beskyttelse mot nye hjerneinfarkt hos pasienter med hjerneinfarkt/TIA og samtidig atrieflimmer. Forskningsdokumentasjonen som sammenligner warfarin med direktevirkende perorale antikoagulasjonsmidler (DOAK), tyder på at DOAK gir noe lavere risiko for nytt iskemisk hjerneslag, hjerneblødning og systemisk embolisme enn warfarin.
Det er også en trend i retning av færre blødningskomplikasjoner ved DOAK sammenlignet med warfarin.
Oppsummert taler dokumentasjonen for at at antikoagulasjon er et viktig sekundær forebyggende tiltak etter hjerneinfarkt/TIA og atrieflimmer. DOAK kan være å foretrekke framfor warfarin.
Anbefalingen er basert på forskningsdokumentasjon og arbeidsgruppens samlede kunnskap og brukererfaring.
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneinfarkt, TIA og atrieflimmer
Tiltak (I): NOAK
Sammenligning (C): Warfarin
Beskrivelse av inkluderte studier
Resultattabell (PDF)
Flytskjema (PDF)
Søkestrategi (PDF)
Begreper og forkortelser
DOAK(NOAK) = direkte virkende perorale antikoagulasjonsmidler.
Type DOAK brukt i de inkluderte studien: apixaban, rivaroxaban og dabigatran.
Det er tilkommet en nytt DOAK (edoxaban) etter at GRADE prosessen var gjennomført. Denne inngår ikke i analysene, men er godkjent som et antikoagulasjonsmiddel på lik linje med de andre og med tilsvarende dokumentasjon [264].
Ved gjennomgang av litteratursøk, ble det funnet en relevant systematisk litteraturoversikt som ligger til grunn for denne anbefalingen [256] Liu et al. (2014). Oversiktsartikkelen inkluderte totalt 23 randomiserte kontrollerte studier hvorav 4 av studiene undersøkte effekten av NOAK sammenlignet mot warfarin hos pasienter med tidligere hjerneslag/TIA og atrieflimmer. Den systematiske oversikten som anbefalingen bygger på er basert på legemiddelfinansierte studier hvor det er kort oppfølgingstid mens antikoagulasjon ved atrieflimmer som oftest er en livslang behandling. I slike studier er det også en seleksjon i pasientgruppen- som oftest mindre sykelighet enn i vanlig klinisk praksis. Det er derfor grunn til å være noe forsiktig ved behandling av pasienter med andre karakteristika og høyere sykelighet enn de som har vært inkludert i de randomiserte studier.
Det er også påvist ganske store variasjoner i medikamentkonsentrasjoner. Om dette har noen klinisk betydning er foreløpig ikke avklart.
I tillegg til utfallsmålene som er vist i Summary of Findings-tabell, så ønsket arbeidsgruppen å se på virkning av NOAK på iskemisk hjerneslag alene, hjerneblødning alene og død. Disse utfallene ble det ikke funnet oppsummert forskingsdokumentasjon på.
Merk (1): alle endepunktene under er basert på subgruppe-analyser. Man bør utvise varsomhet når man tolker disse, da kredibiliteten til subgruppe-effekter ofte er lav (Sun et. al 2012). I disse subgruppe-analysene var hypotesen formulert a priori og det er testet for statistisk signifikans gjennom en interaksjonstest, hvilket gjør at man kan ha større tiltro til resultatene.
Merk (2): I en av de inkluderte studiene (AVERROES) fikk kontrollgruppen Aspirin.
Utfall 1: Hjerneslag eller systemisk embolisme
Hjerneslag ble definert som iskemisk slag, hjerneblødning og TIA.
Systemisk embolisme ble definert som akutt arteriell vaskulær okklusjon i ekstremiteter eller organer.
Sammenlignet med kontrollgruppen, så gir trolig NOAK lavere sannsynlighet (odds) for hjerneslag og systemisk embolisme hos pasienter med atrieflimmer og tidligere hjerneslag/TIA med en OR på 0.72 (95% KI 0.52, 0.99). Effektestimatet (dvs. antall hendelser av hjerneslag og systemisk embolisme) er basert på 15 294 deltakere i 4 randomiserte-kontrollerte studier. Det var totalt 751 hendelser av hjerneslag eller systemisk embolisme. Kvaliteten på evidensgrunnlaget er moderat grunnet høy heterogenitet mellom studiene. Det er noe redusert overførbarhet, men det er valgt og ikke redusere den totale kvaliteten ytterligere. Det er middels tillit til resultatene.
Utfall 2: Alvorlige blødninger (major bleedings)
Store blødninger ble definert ved fall ≥2 g/dL hemoglobin innen 24 timer, behov for ≥2 enheter med blod/rød celle overføring eller intrakraniell blødning, «hematorrhacis», intra-okkulær blødning (ekskludert konjunktival blødning), perikard blødning, intra-«joint» blødning, retroperitoneal blødning eller «osteofascial compartment» syndrom ved injeksjonssted eller fatale blødninger.
Sammenlignet med kontrollgruppen, så gir trolig NOAK lavere sannsynlighet (odds) for hjerneslag og systemisk embolisme hos pasienter med atrieflimmer og tidligere hjerneslag/TIA med en OR på 0.88 (95% KI 0.76, 1.01). Effektestimatet (dvs. antall hendelser av hjerneslag og systemisk embolisme) er basert på 15 277 deltakere i 4 randomiserte-kontrollerte studier. Det var totalt 833 hendelser av alvorlige blødninger. Kvaliteten på evidensgrunnlaget er moderat grunnet noe redusert overførbarhet samt flere usikkerheter vedrørende risiko for systematiske feil. Det er middels tillit til resultatene. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt.
Vurdering
Fordeler og ulemper
Fordeler:
Kunnskapsoppsummeringen gir ikke informasjon om effekt på hjerneinfarkt eller hjerneblødning som separate utfallsmål. Effekten på disse utfallsmål er derfor noe usikker.
- For noen pasienter vil bortfall av regelmessig monitorering favorisere DOAK.
- Behandling med DOAK er ikke like avhengig av så tett oppfølging fra helsetjenesten som behandling med warfarin.
- DOAK har færre interaksjoner med fødemidler og medikamenter enn warfarin.
Ulemper:
- All antikoagulasjonsbehandling gir økt blødningstendens og dermed også økt risiko for hjerneblødninger.
- Manglende monitorering av antikoagulasjonseffekten av DOAK kan medføre både terapisvikt grunnet manglende etterlevelse og dosejustering samt uønskede bivirkninger som økt blødningsrisiko, særlig hos eldre med høy sykelighet som f. eks nyresvikt.
- Den korte halveringstid av DOAK forutsetter god etterlevelse for å gi tilstrekkelig beskyttelse.
- Flere av de nye direktevirkende perorale antikoagulerende midlene mangler antidot.
Konklusjon: De ønskede forventede effektene er vurdert til å veie opp for de uønskede effektene.
Kvalitet på dokumentasjonen
Vi har middels tillit til effektestimatene basert på metaanalysen (ref) for utfallene hjerneslag/systemisk embolisme og alvorlige blødninger grunnet henholdsvis høy heterogenitet mellom studiene og mulig redusert overførbarhet til klinisk praksis i Norge.
Verdier og preferanser
Utfallsmålene dødelighet, hjerneblødning og residiv hjerneinfarkt ble verdsatt som svært vesentlige i begrunnelsen for anbefalingen.
Andre store blødninger, definert som spontane blødninger som kan reverseres, ble ikke vektlagt like stor betydning.
Referanser
256. The efficacy and safety of novel oral anticoagulants for the preventive treatment in atrial fibrillation patients: a systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195601
264. Edoxaban vs. warfarin in vitamin K antagonist experienced and naive patients with atrial fibrillationdagger https://www.helsedirektoratet.no/referanse/0002-0013-195609
Platehemmende behandling etter hjerneblødning
Platehemmende behandling etter hjerneblødning kan verken anbefales eller frarådes.
Praktisk – slik kan anbefalingen følges
Platehemmende behandling bør bygge på en individuell vurdering av indikasjoner og risiko.
Platehemmende behandling kan være aktuell dersom det er høy risiko for hjerteinfarkt, hjerneinfarkt eller annen indikasjon for platehemmende behandling.
Faktorer som bør tas med i vurdering for platehemmende behandling, omfatter lokalisasjon av hjerneblødning, blodtrykk, alder, mikroblødninger, komorbiditet og levevaner.
Begrunnelse – dette er anbefalingen basert på
Det finnes ikke randomiserte studier som har studert platehemmende behandling hos pasienter med hjerneblødning og økt tromboembolisk risiko. Forskningsdokumentasjonen er basert på to kohortstudier.
Forskningsdokumentasjonen er av lav kvalitet og gir liten veiledning mht. anbefaling, og derfor er brukererfaring og klinisk erfaring vektlagt i større grad. Men heller ikke ut fra brukererfaring og klinisk erfaring kan det konkluderes om platehemming bør anbefales eller bør frarådes etter hjerneblødning.
Anbefalingen er basert på oppsummert forskning og arbeidsgruppens samlede erfaring og kunnskap.
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneblødning
Tiltak (I): Platehemming
Sammenligning (C): Ingen behandling
Beskrivelse av inkluderte studier
Det ble ikke funnet noen relevant systematisk litteraturoversikt ved litteratursøk for denne anbefalingen. Det ble funnet to observasjonsstudier som ble inkludert i kunnskapsgrunnlaget.
Viswanathan et al. (2006) er en prospektiv kohortestudie som hadde til hensikt å undersøke om platehemmende behandling økte risiko for gjentagende hjerneblødning. Studiepopulasjonen inkluderte 207 pasienter med primær hjerneblødning, alder ≥55 år fra USA.
Flynn et al. (2010) er en prospektiv registerstudie (observasjonsstudie) fra Skottland som bl.a. undersøkte sammenhengen mellom platehemmende behandling og gjentagende hjerneblødning. Studiepopulasjonen inkluderte 417 pasienter med tidligere hjerneblødning, gjennomsnittsalder 69.9 år.
Utfall 1: Ny hjerneblødning
Risiko for ny hjerneblødning ble utforsket i begge studier.
Viswanathan et al. (2006) oppga separate resultater for pasienter med tidligere lobar- og tidligere dyp hjerneblødning. Det ble ikke funnet noen forskjell i relativ effekt (vist ved hasard ratio, HR) på ny hjerneblødning ved oppstart med platehemmende behandling sammenlignet med kontroll (ingen platehemmer). Absolutt forskjell i effekt er ikke tilgjengelig fra denne studien, da antall hendelser (ny hjerneblødning) i hver gruppe ikke ble oppgitt. Kvaliteten på evidensgrunnlaget er veldig lav. Dette grunnet høy risiko for systematiske feil (analysen var ikke justert for konfoundere og prognostiske faktorer) og fordi det foreligger usikkerhet knyttet til presisjon (svært få deltakere og vidt konfidensintervall som krysser linjen for ingen forskjell i effekt).
Resultatet fra studien av Flynn et al. (2010) samsvarer med resultatet fra Viswanathan et al. (2006). Informasjon om absolutt effekt er ikke tilgjengelig, men det ble ikke funnet noen forskjell i relativ effekt (vist ved HR) på ny hjerneblødning ved oppstart med platehemmende behandling. Kvaliteten på evidensgrunnlaget er veldig lav grunnet svært høy risiko for systematiske feil (analysen var ikke justert for konfoundere og prognostiske faktorer, m.m.) og usikkerhet knyttet til presisjon (svært få hendelser (ny hjerneblødning) og vidt konfidensintervall som krysser linjen for ingen forskjell i effekt).
Utfall 2-5: (Utfall 2: Hjerneinfarkt. Utfall 3: Hjerteinfarkt. Utfall 4: Hjerneinfarkt og hjerteinfarkt (sammensatt endepunkt). Utfall 5: Hjerteinfarkt, alle typer hjerneslag og vaskulær død (sammensatt endepunkt).
Sammenlignet med kontrollgruppen (ingen platehemmer), antyder resultatene fra Flynn et al. (2010) at det ikke foreligger forskjell i relativ effekt på følgende utfall ved oppstart med platehemmende behandling etter hjerneblødning: Hjerneinfarkt; Hjerteinfarkt; Hjerneinfarkt og hjerteinfarkt (sammensatt endepunkt); Hjerteinfarkt, alle typer hjerneslag og vaskulær død (sammensatt endepunkt).
Absolutt forskjell i effekt er ikke tilgjengelig for noen av disse utfallsmålene. Evidensgrunnlaget er vurdert å være av veldig lav kvalitet grunnet svært høy risiko for systematiske feil (analysen var ikke justert for konfoundere og prognostiske faktorer, m.m.) og fordi det foreligger usikkerhet knyttet til presisjon (ukjent antall hendelser av de overnevnte utfallsmålene, og vidt konfidensintervall som krysser linjen for ingen forskjell i effekt).
Vurdering
Fordeler og ulemper
Fordeler:
Det er dokumentert at platehemming kan forebygge hjerneinfarkt og hjerteinfarkt [258].
Ut fra dette kan grupper med særlig risiko for hjerne- og hjerteinfarkt ha nytte av platehemmere også etter hjerneblødning.
Ulemper:
Økt risiko for ny hjerneblødning som følge av bruk av platehemmere.
Konklusjon:
Det er usikkert om de ønskede effekter veier opp for de uønskede effekter.
Kvalitet på dokumentasjonen
Forskningsdokumentasjonen er av svak kvalitet og gir liten veiledning mht. en nasjonalt normerende anbefaling (se Sof-tabell).
Verdier og preferanser
På grunn av usikkerhet omkring effekt av tiltaket, kvalitet på dokumentasjon og om fordeler vil veie opp for ulemper med tiltaket, er det usikkerhet om de fleste pasienter ville ønske dette tiltaket.
Referanser
257. Prescribing antiplatelet medicine and subsequent events after intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195602
258. Antiplatelet use after intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195603
Sist faglig oppdatert: 21.12.2017
Antikoagulasjonsbehandling hos pasienter med hjerneblødning og atrieflimmer
Antikoagulasjonsbehandling hos pasienter med hjerneblødning og atrieflimmer kan verken anbefales eller frarådes.
Praktisk – slik kan anbefalingen følges
Antikoagulasjonsbehandling bør bygge på en individuell vurdering av indikasjoner og risiko.
Faktorer som bør tas med i vurdering for antikoagulasjonsbehandling omfatter CHA2DS2 VASc skår hos pasienter med atrieflimmer, lokalisasjon av hjerneblødning, mikroblødninger, komorbiditet og levevaner.
Optimalt tidspunkt for eventuell start av antikoagulasjonsbehandling er ikke kjent, men erfaringsmessig er det vanlig å vente til etter akuttfasen. Kontrollbilde med CT eller MR bør tas før oppstart.
Begrunnelse – dette er anbefalingen basert på
Det finnes ikke randomiserte studier hvor antikoagulasjon er startet etter hjerneblødning.
I en retrospektiv kohortstudie av Kuramatsu et al. (2015) [259] var det færre dødsfall i gruppen som fikk gjeninnsatt antikoagulasjon enn i kontrollgruppen, men tiltroen til estimatene er veldig lav.
Anbefalingen er basert på oppsummert forskning og arbeidsgruppens samlede erfaring og kunnskap.
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneblødning
Tiltak (I): Per oral antikoagulasjon
Sammenligning (C): Ingen behandling
Beskrivelse av inkluderte studier
Det ble ikke funnet noen relevant systematisk litteraturoversikt ved litteratursøk for denne anbefalingen. Det ble derfor sett til enkeltstudier hvorav en retrospektiv kohortstudie av Kuramatsu et al. (2015) [259] ble valgt ut som forskningsgrunnlag. Den nevnte studien inkluderte 1 176 pasienter ved 19 tredjelinjetjeneste-sentere i Tyskland. Av disse var det 566 pasienter med hjerneblødning og samtidig atrieflimmer som former basis forskningsgrunnlaget (se Summary of Findings-tabell). I tillegg til Kuramatsu et al. (2015), er også kunnskapselementer som klinisk erfaring og brukerkunnskap trukket inn i utarbeidelse av anbefalingen.
Utfall 1: Død
Sammenlignet med kontrollgruppen (ingen antikoagulasjonsbehandling), antyder resultatene fra studien at oppstart av antikoagulasjonsbehandling gir lavere risiko for død med 217 færre tilfeller per 1000 pasient med hjerneblødning (fra 129 færre til 262 færre tilfeller). Kvaliteten på evidensgrunnlaget for utfallet «død» er veldig lav grunnet usikkerhet knyttet til effektestimatet. Dette skyldes liten informasjonsstørrelse med svært få hendelser (død).
Utfall 2: Alvorlig funksjonshemming (mRS 4-6)
Alvorlig funksjonshemming ble vurdert ved bruk av modified Rankin Scale (mRS). Skalaen går fra 0 (ingen symptom) til 6 (død). Den relative (RR) og absolutte effekten som er oppgitt i studien, antyder redusert risiko for alvorlig funksjonshemming ved oppstart av antikoagulasjonsbehandling. I løpet av studien (oppfølging ett år) var det 266 færre tilfeller per 1000 pasient med hjerneblødning av alvorlig funksjonshemming blant deltakere som fikk antikoagulantia (fra 134 færre til 360 færre tilfeller). Kvaliteten på evidensgrunnlaget er veldig lav grunnet: 1) høy risiko for systematiske feil under utførelse av studien (dvs. effektestimatet er hentet fra analyser hvor det ikke er justert for statistisk signifikante forskjeller mellom de som fikk og de som ikke fikk, antikoagulasjonsbehandling); og 2) usikkerhet knyttet til presisjon grunnet liten informasjonsstørrelse (få deltakere og hendelser med alvorlig funksjonshemming)).
Utfall 3: Cerebralt infarkt (hjerne)
Cerebralt infarkt ble definert som iskemisk hjerneslag og transitorisk iskemisk anfall (TIA). Det ble ikke oppgitt relativ risiko for dette utfallet, men i stedet hyppighet av hendelser (event rate) av cerebralt infarkt for hver gruppe. Event rate er et mål på hvor mange hendelser - i dette tilfellet cerebralt infarkt – som skjer innad i hver gruppe. Funnene fra studien viste at det var en statistisk signifikant forskjell i hendelser av cerebralt infarkt mellom gruppene, og at risikoen var lavere for pasienter med antikoagulasjonsbehandling (3.9 hendelser per 100 pasient-år oppfølging) sammenlignet med pasienter uten antikoagulantia (12.7 hendelser per 100 pasient-år oppfølging). Kvaliteten på evidensgrunnlaget er veldig lav grunnet usikkerhet knyttet til effektestimatet. Dette skyldes liten informasjonsstørrelse med svært få hendelser med cerebralt infarkt.
Utfall 4: Iskemiske komplikasjoner
Iskemiske komplikasjoner ble definert som cerebrale (iskemisk hjerneslag og TIA) eller ikke-cerebrale (blodpropp i lunger, mave/tarm, ekstremiteter eller hjerteinfarkt). Den absolutte effekten antyder fordel ved behandling med antikoagulasjon med 94 færre tilfeller per 1000 pasient med hjerneblødning (fra 27 færre til 125 færre hendelser). Kvaliteten på evidensgrunnlaget er veldig lav grunnet: 1) høy risiko for systematiske feil i utførelse av studien (dvs. effektestimatet er hentet fra analyser hvor det ikke er justert for statistisk signifikante forskjeller mellom de som fikk og de som ikke fikk, antikoagulasjonsbehandling); og 2) usikkerhet knyttet til presisjon grunnet liten informasjonsstørrelse (få hendelser med iskemiske komplikasjoner).
Utfall 5: Hemorragiske (blødningsrelaterte) komplikasjoner
Hemorragiske (blødningsrelaterte) komplikasjoner ble definert som ny hjerneblødning ved cerebral-parenkymatøse eller ekstrakraniale blødninger (blødning i mave/tarm, øyet, blødning i muskulatur eller blod i urinen). Funn fra analysen antyder at det ikke foreligger forskjell i effekt på hemorragiske komplikasjoner ved behandling med antikoagulantia sammenlignet med ingen behandling. Den absolutte forskjellen i effekt viste 16 flere hendelser per 1000 pasient med hjerneblødning for pasienter med antikoagulasjonsbehandling, men det kunne være 23 færre- til 99 flere hendelser (hemorragiske komplikasjoner). Kvaliteten på dette utfallet er også vurdert som veldig lav grunnet: 1) høy risiko for systematiske feil i utførelse av studien (i.e. effektestimatet er ikke justert for statisk signifikante forskjeller mellom de som fikk- og de som ikke fikk, antikoagulasjonsbehandling); og 2) usikkerhet knyttet til presisjon grunnet liten informasjonsstørrelse (få hendelser med hemorragiske komplikasjoner).
Utfall 6: Ny hjerneblødning
Sammenlignet med kontrollgruppen (ingen antikoagulasjonsbehandling), så antyder resultatene fra studien at det ikke foreligger forskjell i effekt på ny hjerneblødning ved oppstart av antikoagulasjonsbehandling. Det ble ikke oppgitt relativ risiko for dette utfallet, men i stedet hyppighet av hendelser (event rate) for hver gruppe. Hyppighet av hendelser var lik for begge grupper med 3.9 hendelser (ny hjerneblødning) per 100 pasient-år. Kvaliteten på evidensgrunnlaget er svært lav grunnet usikkerhet knyttet til effektestimatet. Dette skyldes liten informasjonsstørrelse med veldig få hendelser (ny hjerneblødning).
Vurdering
Fordeler og ulemper
Fordeler: Fordel med antikoagulasjon er redusert risiko for hjerneinfarkt og systemiske embolier hos pasienter med atrieflimmer. Fordelen øker med økende CHA2DS2VASc skår.
Ulemper: Ulempen med antikoagulasjon etter hjerneblødning er økt risiko for blødning.
Konklusjon: Det er usikkerhet vedrørende hvorvidt de ønskede effektene veier opp for de uønskede effektene av antikoagulasjon til pasienter med hjerneblødning og atrieflimmer.
Kvalitet på dokumentasjonen
Kvaliteten på forskningsdokumentasjonen er av svak kvalitet og gir liten veiledning mht. en anbefaling. Arbeidsgruppen har lav tiltro til de dokumenterte effektene av tiltakene, og ved diskusjon av DECIDE-rammeverket var gruppen delt - på grunn av det svake kunnskapsgrunnlaget - mht. å foreslå en nasjonalt normerende anbefaling.
Verdier og preferanser
Ut fra klinisk erfaring vil pasienters ønske om oppstart av antikoagulantia variere.
Referanser
259. Anticoagulant reversal, blood pressure levels, and anticoagulant resumption in patients with anticoagulation-related intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195604
Sist faglig oppdatert: 21.12.2017
Blodtrykkssenkende behandling
Legemiddelbehandling av høyt blodtrykk etter hjerneslag/TIA.
Pasienter med hjerneslag/TIA med blodtrykk > 140/90 mmHg bør få behandling med blodtrykksenkende legemidler hvis slik behandling ikke gir alvorlige bivirkninger.
SIGN: A1a
Praktisk – slik kan anbefalingen følges
Behandlingsmål
Blodtrykk-senkende behandling etter hjerneslag /TIA bør ha som mål BT <140/90 mmHg. Hos yngre pasienter og pasienter med stor vaskulær risiko som f.eks. ved diabetes og/eller nyresvikt, mikroalbuminuri eller venstre ventrikkelhypertrofi, bør behandlingsmålet være <130/80 mmHg [269].
BT- senkende behandling er det viktigste sekundærforebyggende tiltak ved hjerneblødning.
Spesielle forhold hos eldre
Antihypertensive bivirkninger er vanlige hos eldre pga. polyfarmasi og legemiddel-interaksjoner kombinert med økt sårbarhet pga. endret fysiologi, farmakokinetikk og farmakodynamikk.
Det er klar indikasjon for BT-behandling også hos eldre pasienter med hjerneslag eller TIA [265] .
Valg av legemiddel
Eksisterende dokumentasjon gir ikke grunnlag for å gi anbefalinger om valg av legemidler. Som regel er en kombinasjon av flere typer legemidler nødvendig for å nå behandlingsmålet. Betablokkere har den svakeste dokumentasjonen i sekundærforebygging etter hjerneslag og TIA, og de bør bare benyttes hvis det foreligger andre indikasjoner for betablokkerbehandling, eller hvis tilleggsbehandling med betablokkade er nødvendig for å nå behandlingsmålet. Hos pasienter med diabetes er ACE-hemmere og angiotensin- reseptorblokker (ARB) best dokumentert.
Begrunnelse – dette er anbefalingen basert på
Hypertensjon er den viktigste modifiserbare risikofaktoren for hjerneslag/TIA, både for første gangs slag og for residiv. Å senke blodtrykket (BT) beskytter mot nye hjerneinfarkt og hjerneblødning samt andre vaskulære hendelser [268] .
Hos pasienter med hjerneslag uten tilleggsrisiko er det vanlig å definere systolisk blodtrykk (SBT) <140 mmHg og diastolisk blodtrykk (DBT) <90 mmHg som normalt eller normotensivt [267] .
Det er bred enighet om at pasienter med hjerneslag med BT >140/90 mmHg bør tilbys BT-senkende behandling. Basert på BT-studier har denne behandlingsgrensen blitt utfordret, og behandlingsmål på 120/80 mmHg er foreslått [266]. Det er ingen god dokumentasjon som gir spesifikk informasjon om effekten av BT-senkende behandling i BT-området under SBT 130 mmHg, som særlig er det område hvor det kan forventes bivirkninger i form av ortostasefenomener.
Det er uklart hvilket BT som er viktigst; det systoliske, diastoliske eller pulstrykket, men alle er assosiert med økt risiko for hjerneslag og TIA.
Forskningsgrunnlag
Populasjon (P): Pasienter med gjennomgått hjerneslag eller TIA, og med blodtrykk > 140/90 mmHg
Tiltak (I): Medikamentell blodtrykkssenkende behandling
Sammenligning (C): Ingen medikamentell behandling
Beskrivelse av inkluderte studier
Referanser
265. Treatment of hypertension in patients 80 years of age or older https://www.helsedirektoratet.no/referanse/0002-0013-195610
266. The seventh report of the joint national committee on prevention, detection, evaluation, and treatment of high blood pressure: the JNC 7 report https://www.helsedirektoratet.no/referanse/0002-0013-195611
267. Helsingborg Declaration 2006 on European stroke strategies https://www.helsedirektoratet.no/referanse/0002-0013-195612
268. Blood pressure reduction and secondary prevention of stroke and other vascular events https://www.helsedirektoratet.no/referanse/0002-0013-195613
269. Antihypertensive agents for preventing diabetic kidney disease https://www.helsedirektoratet.no/referanse/0002-0013-195614
Sist faglig oppdatert: 21.12.2017
Råd og veiledning om levevaner som optimaliserer blodtrykket etter hjerneslag eller TIA
Etter hjerneslag eller TIA bør alle få råd og veiledning om endringer i levevaner som kan redusere blodtrykket; som økt fysisk aktivitet, vektreduksjon ved overvekt og redusert saltinntak.
SIGN: C3
Praktisk – slik kan anbefalingen følges
For fysisk aktivitet er det anbefalt utholdenhetstrening 1-3 ganger per uke, og helst minimum 30 minutter hver gang. Indikator for riktig aktivitetsnivå er at pasienten føler seg andpusten, men kan føre en samtale.
Se nasjonal faglig retningslinje for forebygging av hjerte - kar sykdommer.
Begrunnelse – dette er anbefalingen basert på
Hypertensjon er den viktigste modifiserbare risikofaktoren for hjerneslag/TIA og er en prediktor for vaskulære hendelser og død. Å senke blodtrykket beskytter mot både hjerneinfarkt og hjerneblødning [268] .
Hos personer uten spesiell tilleggsrisiko utover det å ha gjennomgått hjerneslag, er det vanlig å definere systolisk blodtrykk <140 mmHg og diastolisk blodtrykk <90 mmHg som normalt [267].
Ved primærforebygging av hjerte-karsykdommer er det vist at fysisk aktivitet senker blodtrykket [273] .
Det er vist at reduksjon av saltinntak i kombinasjon med høyt inntak av frukt og grønnsaker reduserer blodtrykket . Se nasjonale anbefalinger om kosthold og ernæring 2016) og nasjonal tiltaksplan for bedre kosthold 2017 - 2021
En metaanalyse har vist at inntak av minst 5 enheter frukt eller grønnsaker daglig reduserer risikoen for hjerneslag.
Vektreduksjon fører til bedring av risikofaktorprofilen for hjerneslag (lavere blodtrykk, lavere blodsukker og lavere lipider).
Se for øvrig også kapittel Levevaner
Forskningsgrunnlag
Populasjon (P): Pasienter som har gjennomgått hjerneslag eller TIA med blodtrykk >140 /90
Tiltak (I): Råd og veiledning om endring av levevaner (økt fysisk aktivitet, vektreduksjon, saltreduksjon) som kan senke blodtrykket
Sammenligning (C): Ingen råd eller veiledning
Beskrivelse av inkluderte studier
Sist faglig oppdatert: 21.12.2017
Lipidsenkende behandling
Råd og veiledning om levevaner som bedrer lipidprofilen etter hjerneinfarkt/TIA
Etter hjerneinfarkt/TIA bør det gis råd om hvordan levevaner som økt fysisk aktivitet, kostendring og vektreduksjon ved overvekt kan bedre lipidprofilen.
SIGN: C3
Praktisk – slik kan anbefalingen følges
LENKE til anbefaling om fysisk aktivitet
Begrunnelse – dette er anbefalingen basert på
Kolesterol er en av de mest sentrale risikofaktorer for aterosklerotisk sykdom [271][274].
Endringer av levevaner vil kunne bedre lipidprofilen og ha forebyggende effekt [270].
[273] [272]
Forskningsgrunnlag
Populasjon (P): Pasienter med gjennomgått hjerneinfarkt eller TIA
Tiltak (I): Råd og veiledning om levevaner som kan påvirke lipidprofilen i gunstig retning (økt fysisk aktivitet, kostendring, vektreduksjon).
Sammenligning (C): Ingen råd og veiledning
Beskrivelse av inkluderte studier
Referanser
270. Adherence to Mediterranean diet and health status: meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195615
271. Evidence mandating earlier and more aggressive treatment of hypercholesterolemia https://www.helsedirektoratet.no/referanse/0002-0013-195616
272. Exercise for type 2 diabetes mellitus https://www.helsedirektoratet.no/referanse/0002-0013-195617
273. Effect of aerobic exercise on blood pressurea meta-analysis of randomized, controlled trials https://www.helsedirektoratet.no/referanse/0002-0013-195618
274. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study https://www.helsedirektoratet.no/referanse/0002-0013-195619
Sist faglig oppdatert: 21.12.2017
Behandling med lipidsenkende legemidler etter hjerneinfarkt/TIA
Pasienter med hjerneinfarkt/TIA og LDL > 2,0 mmol/l bør tilbys statinbehandling.
SIGN: A1a
Praktisk – slik kan anbefalingen følges
Hos pasienter med bivirkning av statinbehandling kan doseringen reduseres til den dosen som tolereres for å unngå seponering.
Det er vanskelig å sette klare behandlingsgrenser for legemiddelbehandling, men behandling bør vurderes ved LDL-nivå >2.0mmol/l.
Ved statinbehandling bør målet være LDL <2,0 mmol/l hvis dette kan oppnås uten bivirkninger.
Ved høy alder, polyfarmasi og liten kroppsmasse bør dosen titreres med hensyn til pasientens toleranse og bivirkninger.
Hos pasienter med meget høy samlet kardiovaskulær risiko (for eksempel diabetes mellitus, perifer karsykdom eller koronarsykdom), kan statinbehandling titreres mot LDL nivået 1,8 mmol/l.
[285] [279]
Begrunnelse – dette er anbefalingen basert på
Kolesterol er en av de mest sentrale risikofaktorer for aterosklerotisk sykdom [271][274]. Analyser viser at lipider er uavhengige risikofaktorer for hjerneinfarkt/TIA, og at statinbehandling har sekundærforebyggende effekt [274] [285] [284] [282] [275].
Intensiv lipidsenkende behandling medfører 5 års absolutt risikoreduksjon på 2,2 % for fatalt og ikke fatalt residivslag, og antall pasienter som må behandles i 5 år for å unngå et residivslag er 46 [288];[280]. Det oppnås i tillegg en 5 års absolutt risikoreduksjon på 3,5 % for nye kardiovaskulære hendelser.
Statinbehandling kan ha gunstige kardio- og cerebrovaskulære effekter også hos eldre mennesker, men dokumentasjonen som omtaler pasienter med hjerneinfarkt i de høyeste aldersgrupper > 80 år er relativt svak, og individuell vurdering bør foretas [277];[281].
Nyere lipidsenkende midler er ikke vurdert i denne revisjonen.
For en oppdatering om generell informasjon om lipidsenkende behandling vises til retningslinje for forebygging av hjerte- og karsykdommer og retningslinje for diabetes.
Forskningsgrunnlag
Populasjon (P): Pasienter med gjennomgått hjerneinfarkt eller TIA
Tiltak (I): Lipidsenkende behandling med statin
Sammenligning (C): Placebo
Beskrivelse av inkluderte studier
Referanser
271. Evidence mandating earlier and more aggressive treatment of hypercholesterolemia https://www.helsedirektoratet.no/referanse/0002-0013-195616
274. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study https://www.helsedirektoratet.no/referanse/0002-0013-195619
275. Lipid management in the prevention of stroke: review and updated meta-analysis of statins for stroke prevention https://www.helsedirektoratet.no/referanse/0002-0013-195620
276. Incidence of new coronary events in older persons with prior myocardial infarction and serum low-density lipoprotein cholesterol > or = 125 mg/dl treated with statins versus no lipid-lowering drug https://www.helsedirektoratet.no/referanse/0002-0013-195621
277. Reduction of new coronary events and new atherothrombotic brain infarction in older persons with diabetes mellitus, prior myocardial infarction, and serum low-density lipoprotein cholesterol≥ 125 mg/dl treated with statins https://www.helsedirektoratet.no/referanse/0002-0013-195622
278. Effect of atorvastatin in elderly patients with a recent stroke or transient ischemic attack https://www.helsedirektoratet.no/referanse/0002-0013-195623
279. Discontinuation of statin therapy and clinical outcome after ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195624
280. Atorvastatin: its clinical role in cerebrovascular prevention https://www.helsedirektoratet.no/referanse/0002-0013-195625
281. Hemorrhagic stroke in the stroke prevention by aggressive reduction in cholesterol levels study https://www.helsedirektoratet.no/referanse/0002-0013-195626
282. Relationships between lipoprotein components and risk of ischaemic and haemorrhagic stroke in the Apolipoprotein MOrtality RISk study (AMORIS) https://www.helsedirektoratet.no/referanse/0002-0013-195627
283. High-dose atorvastatin after stroke or transient ischemic attack https://www.helsedirektoratet.no/referanse/0002-0013-195628
284. The role of cholesterol and statins in stroke https://www.helsedirektoratet.no/referanse/0002-0013-195629
285. Stroke mortality and the apoB/apoA‐I ratio: results of the AMORIS prospective study https://www.helsedirektoratet.no/referanse/0002-0013-195630
286. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study https://www.helsedirektoratet.no/referanse/0002-0013-195631
288. High-dose atorvastatin after stroke or transient ischemic attack https://www.helsedirektoratet.no/referanse/0002-0013-195633
Sist faglig oppdatert: 21.12.2017
Lipidsenkende behandling etter hjerneblødning
Behandling med lipidsenkende legemidler etter hjerneblødning kan verken anbefales eller frarådes.
Praktisk – slik kan anbefalingen følges
- Dersom det etter gjennomgått hjerneblødning foreligger sterk indikasjon for lipidsenkende behandling som tidligere hjerneinfarkt, hjerteinfarkt eller annen aterosklerotisk sykdom kan oppstart eller kontinuering av lipidsenkende behandling være akseptabelt.
- Dersom indikasjonen for lipidsenkende behandling er svak eller usikker, kan seponering av lipidsenkende være akseptabelt.
- Det finnes ingen god dokumentasjon for når eventuell lipidsenkende behandling eventuelt bør starte eller gjenopptas.
Begrunnelse – dette er anbefalingen basert på
Kolesterol er en av de mest sentrale risikofaktorer for aterosklerotisk sykdom. Noen studier har gitt indikasjoner på at statiner er assosiert med økt risiko for hjerneblødning.
Forskningsgrunnlaget for pasienter etter hjerneblødning er tre observasjonsstudier av meget lav kvalitet [287]. Resultatene må derfor vurderes med meget stor forsiktighet, men indikerer at kontinuering av lipidsenkende behandling gir lavere sannsynlighet for død sammenlignet med seponering.
Anbefalingen er basert på arbeidsgruppens samlede kunnskap, brukererfaring og forskningsdokumentasjon.
Forskningsgrunnlag
Populasjon (P): Pasienter med gjennomgått hjerneblødning
Tiltak (I): Lipidsenkende legemidler
Sammenligning (C): Ingen lipidsenkende legemidler
Beskrivelse av inkluderte studier
Resultattabell (PDF)
Flytskjema (PDF)
Søkestrategi (PDF)
Forskningsgrunnlaget som ligger til grunn for anbefalingen er basert på en systematisk litteraturoversikt av moderat kvalitet: Tapia Perez et al. (2015). Oversiktsartikkelen inkluderte 17 studier med totalt 15 276 deltakere. Tre observasjonsstudier sammenlignet kontinuering av lipidsenkende legemidler vs. seponering av lipidsenkende legemidler hos pasienter med gjennomgått intracerebral blødning. Varighet på behandlingen er ukjent. Det ble ikke funnet forskingsdokumentasjon på utfallene «hjerneslag» (iskemisk og hemorrhagisk) og «hjerteinfarkt».
Merk 1: Utfallet død er kun målt 30 dager etter intracerebral blødning i Flint et al. (2014). Hos Dowlatshahi et al. (2012) og Tapia Perez et al. (2014) er død målt ved flere ulike tidspunkter (under sykehusopphold, ved 30 dager, 180 dager, 90 dager, 6 måneder og 1 år), men det er ikke oppgitt hvilke tidspunkt for måling som er brukt i analysen.
Merk 2: Tapia Parez et al. (2015) starter i utgangspunktet som lav kvalitet ettersom den tar utgangspunkt i observasjonsstudier.
Utfall 1: Død
Grunnet svært lav tillit til resultatet, er det uklart hvorvidt lipidsenkende legemidler gir lavere sannsynlighet (odds) for at pasienten dør i løpet av oppfølgingsperioden (30 dager til 1 år) med 430 færre tilfeller per 1000 pasient (fra 370 færre til 479 færre). Effektestimatet (antall dødsfall) er basert på 1 755 deltakere i tre observasjonsstudier. Blant deltakerne var det 1 190 som fikk lipidsenkende legemidler og 565 med opphør (seponering) av lipidsenkende legemidler. Ettersom effektestimatet er basert på observasjonsstudier, starter kvaliteten på evidensgrunnlaget som «lav». Den totale kvaliteten er vurdert til å være svært lavt grunnet metodologiske svakheter (risiko for systematiske feil) i de inkluderte studiene.
Vurdering
Fordeler og ulemper
Fordeler:
Forskningsdokumentasjon med lav kvalitet indikerer at sannsynligheten for dødsfall er lavere ved fortsatt behandling med lipidsenkende medikamenter etter hjerneblødning, men det er betydelig usikkerhet, og tiltroen til dette resultatet er lav/usikker.
Ulemper:
Noen studier har funnet en sammenheng mellom statinbehandling og hjerneblødning, men det kunne ikke bekreftes i vårt kunnskapsgrunnlag .
Statinbehandling kan ha bivirkninger som kan være plagsomme, men disse er som regel ufarlige og reversible (lINK).
Konklusjon:
Det er ukjent hvor vesentlige de forventede ønskede og uønskede effektene er. Det er dermed usikkert om de ønskede effektene veier opp for de uønskede (dette kan trolig variere).
Kvalitet på dokumentasjonen
Det er veldig lav tillit til kvaliteten på forskningsdokumentasjonen.
Verdier og preferanser
Dokumentasjonen mangler effekt på utfallsmål som er vesentlige for å utforme forslag til anbefaling.
Referanser
287. Meta-analysis of statin use for the acute therapy of spontaneous intracerebral hemorrhage https://www.helsedirektoratet.no/referanse/0002-0013-195632
Sist faglig oppdatert: 21.12.2017
Behandling av patent foramen ovale
Patent foramen ovale (PFO) lukning hos pasienter mellom 18-60 år med hjerneinfarkt uten kjent årsak og påvist PFO
Pasienter mellom 18-60 år med hjerneinfarkt uten kjent årsak og påvist PFO som vurderes som mest sannsynlig årsak til hjerneinfarktet, bør tilbys lukking av PFO med etterfølgende platehemmende behandling fremfor platehemmende behandling alene.
Det er usikkert om PFO lukning beskytter bedre mot nye hjerneinfarkter enn antikoagulasjon, men en del pasienter oppfatter langvarig antikoagulasjonsbehandling som en ulempe. Det foreslås derfor PFO lukning framfor antikoagulasjonsbehandling, selv om dette har et svakere kunnskapsgrunnlag.
PFO lukning er ut fra dagens kunnskapsgrunnlag ikke indisert ved:
- Tilstander som oppfattes som mer sannsynlige årsaker til hjerneinfarktet enn PFO:
- Atrieflimmer
- Hjertesvikt med ejeksjonsfraksjon < 30 %
- Tidligere aterosklerotisk hjerte/kar sykdom i form av kjent koronarsykdom eller perifer karsykdom som claudicatio intermittens, tydelige tegn til aterosklerose i halskar eller intracerebralt ( >50 % stenoser) eller i aortabuen (plakk > 4 mm).
- Lakunære infarkter
- Tilstander med indikasjon for langtids antikoagulasjonsbehandling.
- Sterkt redusert funksjonsnivå: modified Rankin Scale (mRS) 4-5
Indikasjon for PFO lukning er usikker og bør vurderes nøye ved andre risikofaktorer som kan være årsak til hjerneinfarkt som:
- Hypertensjon og særlig hvis det aktuelle hjerneinfarkt er av lakunær type.
- Diabetes – særlig hvis dårlig regulert diabetes.
- Pasienter som røyker eller behandles med statiner har vært inkludert i studiene og kan etter nøye vurdering være aktuelle for PFO lukning hvis de ikke samtidig har noen av de ovenstående eksklusjonstilstander.
Hvis PFO lukning besluttes, bør denne skje innen 3-6 mnd fra debut av hjerneinfarktet og i ventetiden foreslås ut fra eksisterende dokumentasjon at pasienten behandles med antitrombotisk sekundærprofylakse i form av antikoagulasjon.
Se ellers «Praktisk - slik kan anbefalingen følges» vedrørende antikoagulasjonsbehandling. For pasienter >60 år se anbefaling om antitrombotisk behandling ved PFO.
Når det gjelder indikasjon for PFO lukning ved TIA, se under "praktiske råd -slik kan anbefalingen følges".
Praktisk – slik kan anbefalingen følges
Anbefalingene om eventuell lukning av en PFO, gjelder for pasienter mellom 18- 60 år med et hjerneinfarkt av ukjent årsak (kryptogent hjerneslag) og der PFO vurderes som den mest sannsynlige årsak.
Effekten av PFO lukning ift. kun platehemmende behandling, er vist i SOF tabell 1.
Effekten av PFO lukning ift. antikoagulasjon er vist i SOF tabell 2.
Hos 10 -30 % av pasienter med hjerneinfarkt, og opp mot 40% hos de yngste pasienter med hjerneinfarkt er det vanskelig å påvise noen «sikker» sannsynlig årsak. Hvis ingen eller i meget liten grad de vanligste risikofaktorer for hjerneslag er tilstede, styrker dette at hjerneinfarktet kan være av ukjent årsak. Det er i slike tilfeller pasientene bør undersøkes med henblikk på om PFO kan være en sannsynlig årsak..
En utfordring ved indikasjonsstilling for PFO lukning er at det ikke finnes noen universell konsensus når det gjelder definisjonen av «kryptogent slag», slik at diagnosen må i noen grad basere seg på et godt klinisk skjønn. Den manglende universelle konsensus avspeiler seg også i de randomiserte studier som har undersøkt effekten av PFO lukning ettersom ulike inklusjonskriterier er benyttet for å identifisere pasienter med sannsynlig slag av ukjent årsak.
De kriterier for PFO lukning som er anført under utvidet anbefaling, bør følges i klinisk praksis. Der framgår også hvilke tilstander som ikke er aktuelle for PFO lukning.
Når det gjelder antikoagulasjonsbehandling som alternativ til PFO lukning, tyder kunnskapsgrunnlaget som anbefalingen bygger på at antikoagulasjon beskytter like godt mot nye hjerneslag som PFO lukning, men kunnskapsgrunnlaget er svakt (Mir et.al. 2018). Det finnes kunnskapsoppsummering som angir at det er behov for ytterligere forskning for å konkludere om antikoagulasjon er bedre enn platehemming for å forhindre nye hjerneslag. Brukerrepresentantene har imidlertid lagt vekt på den opplevde ulempen ved å stå på langvarig antikoagulasjon.
Det er i hovedsak warfarin som er benyttet som antikoagulerende legemiddel i den forskningsdokumentasjon som foreligger. Det er holdepunkter for at DOAK vil ha tilsvarende effekt da de blodpropper som her er aktuelle å forebygge oppstår i lavtrykk systemer og tilsvarer i stor grad forholdene ved atrieflimmer og dype venetromboser. Ved disse tilstander er DOAK like effektivt som warfarin og har tendens til noe mindre bivirkninger i form av blødning. DOAK behandling oppfattes derfor som likeverdig med warfarin ved PFO.
Følgende tilnærming foreslås når det gjelder utredning for å vurdere pasienter som kan være aktuelle for lukning av PFO:
- Alder: mellom 18 -60 år
- Klinisk undersøkelse: Symptomer og/eller funn forenlig med fokal cerebral iskemi (hjerneinfarkt eller TIA)
- Funksjonsnivå: Pasienten har et funksjonsnivå tilsvarende modified Rankin Scale (mRS) 0-3 før eventuell PFO lukning. PFO lukning er ikke aktuelt ved sterkt redusert funksjonsnivå: modified Rankin Scale (mRS) 4-5
- Bildediagnostikk av hjernen: MR, eller der MR ikke kan gjennomføres; CT viser et eller flere sannsynlig embolisk hjerneinfarkt (kortikal lokalisasjon eller subcortical lokalisasjon med infarktstørrelse (diameter > 1,5 cm) forsterker indikasjonen for utredning. Mindre (lakunære) infarkter (diameter < 1,5 cm) utelukker ikke absolutt PFO som en årsak, men lakunære infarkter er ekskludert i de fleste PFO studier. Lakunære infarkter skyldes som oftest småkar sykdom og er vanligvis ikke definert som kryptogent slag og er sjeldent aktuelle for PFO lukning.
- Risikofaktorer: Pasienten har få eller ingen risikofaktorer som kan forklare hjerneinfarktet. Tilstander som oppfattes som sannsynlige årsaker til hjerneinfarkt og der PFO lukning ikke er aktuelt er:
- Atrieflimmer (se punkt 6)
- Tidligere aterosklerotisk hjerte/kar sykdom i form av kjent koronarsykdom eller perifer karsykdom, tydelige tegn til aterosklerose i halskar eller intracerebralt ( > 50 % stenoser) eller i aortabuen (plakk > 4 mm). (Se punkt 7).
- Hjertesvikt med ejeksjonsfraksjon < 30 % (se punkt 8).
Indikasjon for PFO lukning er usikker og bør vurderes nøye ved andre risikofaktorer som kan være årsak til hjerneinfarkt som:
- Hypertensjon og særlig hvis det aktuelle hjerneinfarkt er av lakunær type.
- Diabetes – særlig hvis dårlig regulert diabetes.
- Røyking
- Kolesterolsenkende behandling med statiner.
Pasienter med de to sistnevnte tilstander (røyking og behandling med statiner) har vært inkludert i studiene og kan etter nøye vurdering være aktuelle for PFO lukning hvis de ikke samtidig har noen av de ovenstående eksklusjonstilstander.
6. Atrieflimmer(AF): Hvis AF påvises, er det ingen indikasjon for PFO, men optimal lengde på monitoring for å identifisere AF i denne pasientgruppen er ikke avklart. I studiene er det i liten grad gjennomført monitorering over 24 timer, men dette oppfattes som et minimum. Hos pasienter uten risikofaktorer anbefales 3 døgns Holter. I tråd med internasjonale retningslinjer foreslås forlenget rytmemonitorering i 1 uke for pasienter med økt risiko for atrieflimmer: Alder > 55 år, hypertensjon, diabetes mellitus, strukturell hjertesykdom (f.eks venstre ventrikkelhypertrofi og dilatert atrium), og hjertesvikt (ref: Pristipino 2021). Sjansen for å påvise AF ved forlenget rytmeregistrering øker med økende alder.
7. Kardiagnostikk: CT angiografi av aortabuen, precerebrale og cerebrale kar og ultralyd av precerebrale kar viser ingen uttalt aterosklerose, stenoser eller annen karpatologi som disseksjoner eller vaskulittforandringer. Carotisstense over 50 % på den aktuell siden taler mot PFO lukking. Artereosklerose med plakk eller stenose, under 50% kan også være embolikilde og i slike tilfeller må det gjøres individuell vurdering av sannsynlig årsak og nytteverdi av PFO lukking.
8. Hjerteundersøkelse - transthorakal ekkokardiografi: Undersøkelsen viser ingen klare embolikilder (ventrikkel tromber, ventrikkel aneurismer, store infarktsekveler eller hjertesvikt med EF < 30 og myksom, septiske vegetasjoner).
For pasienter hvor den trinnvise utredningen 1- 8 ikke har påvist noen sannsynlig årsak til hjerneinfarktet er det indikasjon for å gå videre til pkt. 9.
9. Supplerende undersøkelser: Transøsofagal ekkokardiografi (TØE)
Resultatet av transøsofagal kan være:
A: Ingen PFO påvises: Pasienten tilbys sekundærprofylakse ut fra de risikofaktorer og sannsynlige årsaker som eventuelt er avdekket i utredningen.
B: Påvises PFO: Det vurderes om denne PFO kan være årsaken til hjerneinfarktet. Det som styrker en årsakssammenheng er:
- PFO sammen med atrie aneurisme.
- PFO med moderat til stor shunt. (f.eks. overgang av mange bobler i løpet av 3 hjerteslag).
Ved overgang av få bobler er en mulig årsakssammenheng svakere og særlig hvis bobleovergang ikke øker ved Vasalvamanøver. Det er imidlertid i de studier som inngår i meta-analysen disse anbefalinger bygger på (Mir et al 2018) anført at en nøyaktig klassifisering av størrelsen på shunten ofte kan være vanskelig. En kommer heller ikke her utenom et visst klinisk skjønn, så ved påvisning av svært små eller små PFO, bør derfor andre mulige årsaker til hjerneinfarktet vurderes spesielt nøye.
Andre supplerende undersøkelser: Transkranial doppler (TCD) undersøkelse med bobletest kan avdekke høyre-venstre-shunt (PFO hyppigst, men shunt på lungenivå forekommer) og kan være nyttig screening for diagnostikk av PFO som et supplement til TØE, særlig ved mindre shunt.
I de aktuelle studier er ikke TCD benyttet, så gode indikasjonsstillinger kan ut fra dagens forskningsgrunnlag skje uten bruk av TCD.
The Risk of Paradoxical Embolism (RoPE)-skår kan være et nyttig redskap i beslutningsprosessen til seleksjon av pasienter for PFO-lukking, men bør ikke benyttes alene som beslutningsgrunnlag (Pristipino, 2021).
Hvis utredningen i lokalsykehus oppfatter PFO som sannsynlig årsak, henvises pasienten til det sykehus som utfører PFO lukning.
10. Konklusjon om videre behandling: Utredningen pkt 1-8 bør skje i slagenhet/ slagpoliklinikk av leger-(slagleger/nevrologer) med erfaring i utredning av pasienter med hjerneslagsykdommer. Konklusjon om hvilken behandling som anbefales, foreslås avklart i et PFO møte. En endelig konklusjon om en PFO er den mest sannsynlig årsak til hjerneinfarktet, kan fortrinnsvis skje i et fast «PFO møte». Dette kan f eks skje en gang per måned på det sykehus som evt. skal utføre prosedyren hvor både hjerteleger og slagleger deltar, eventuelt også leger fra det lokale henvisende sykehus. På dette møtet sjekkes systematisk at:
- Pasienter har en PFO som er den sannsynlige årsak til hjerneinfarktet.
- Pasienten oppfyller de dokumenterte kriterier for PFO lukning
- Forholdene ligger til rette for en lukning
Hvis alle kriterier er oppfylt, journalføres dette med konklusjon om at PFO lukning anbefales.
Grundig informasjon gis til pasienten om den dokumentasjon som foreligger når det gjelder de ulike behandlingsalternativer, og de fordeler, ulemper og bivirkninger som de ulike behandlingsalternativer kan medføre.
Hvis pasienten ønsker å følge rådet om PFO lukning er det i de studier som danner forskningsgrunnlaget, gjennomført en slik lukning innen 3 -6 måneder fra debut av hjerneinfarktet. I ventetiden foreslås ut fra eksisterende dokumentasjon at pasienten behandles med antitrombotisk sekundærprofylakse i form av antikoagulasjon. Det er mest dokumentasjon for bruk av warfarin, men DOAK antas å ha tilsvarende effekt og muligens mindre bivirkninger og vil være det foretrukne alternativ for de fleste pasienter. Platehemning kan være et alternativ for pasienter som vurderes å ha betydelig økt blødningsrisiko på antikoagulasjon.
Hvilken device som bør benyttes ved lukning, er ikke systematisk vurdert i forbindelse med utarbeidelsen av disse anbefalinger.
11. Oppfølging etter PFO lukning: Når lukning er gjennomført, er det i de studier disse anbefalinger bygger på, benyttet platehemmende behandling. I studiene er ikke angitt noen definert tidsperiode for behandling med platehemmer. Platehemmende behandling anbefales derfor etter PFO lukning og som oftest vil slik behandling være livslang. ASA er mest benyttet i studiene, men de andre anbefalte platehemmende alternativer for sekundærprofylakse (Klopidogrel eller ASA/dipyridamol) antas å være like gode. I tillegg bør alle pasienter følges opp med henblikk på kontroll eller oppdagelse av andre risikofaktorer, da vurderingen av årsaker når det gjelder hjerneinfarkter alltid bygger på sannsynlighetsvurderinger og ikke er «absolutte sannheter». Det anbefales endokardittprofylakse de første 6 månedene etter PFO-lukning.
Spesielt er det viktig å følge opp om det har tilkommet atrieflimmer som det er en økt risiko for etter PFO lukning. I slike tilfeller antikoaguleres pasienten og platehemmende behandling seponeres.
Det foreslås en kontroll 3-6 måneder etter lukking av PFO med transtorakal ekkokardiografi for å undersøke om device er på plass samt en undersøkelse/samtale for å høre om det har vært noen nye suspekte hendelser siden sist, inkludert atrieflimmersymptomer, eller om komplikasjoner er oppstått. Et standard EKG tas. Videre planlegging av legemiddel-/antitrombotisk behandling. Kontrollen bør være ved både kardiolog og slaglege.
Rutinemessig videre oppfølging anses ikke indisert, men individuell videre oppfølging kan være aktuelt hos enkelte pasienter der det er oppstått nye hendelser eller andre komplikasjoner.
Hva med pasienter med TIA og PFO?
Pasienter med klinisk hjerneinfarkt er inkludert i alle de aktuelle PFO studier som danner det forskningsmessige grunnlag for PFO lukning. Noen studier har inkludert kliniske TIA når det ved MR foreligger forandringer forenlig med iskemi/infarktutvikling. TIA bør som hovedregel verifiseres med MR som viser iskemisk Infarkt for at man skal velge PFO lukking. Pasienter med TIA utgjør 10% av pasientene i studiene, og kunnskapsgrunnlaget i denne gruppen er derfor svakere enn for gruppen med manifest hjerneinfarkt. Det foreslås derfor at for pasienter med klinisk TIA hvor MR caput viser korresponderende iskemi følger de samme anbefalingene som for manifeste hjerneinfarkt. TIA uten bildeverifisering av iskemi er også inkludert, men i liten grad. TIA er en vanskelig diagnose, og TIA uten tegn til iskemi oppfattes som en tilstand hvor det foreløpig ikke er godt nok kunnskapsgrunnlag til å anbefale PFO lukning. Det samme gjelder for retinal iskemi.
Hva kan tilbys de pasienter som har PFO, men der det av ulike grunner ikke blir gjennomført PFO lukning?
I denne revisjon av anbefaling om PFO lukning er det ikke utarbeidet nasjonale anbefalinger om hvordan pasienter mellom 18- 60 år med hjerneinfarkt av ukjent årsak og PFO som ikke blir lukket, bør behandles. Dette fordi kunnskapsgrunnlaget her er så svakt at en klar normerende nasjonal anbefaling er vanskelig å utarbeide
Effektene av antikoagulasjon sammenlignet med platehemmende behandling ut fra kunnskapsgrunnlaget i FHI sin HTA (Hagen et.al., 2019) og de studier som er lagt til grunn, er oppsummert i resultat tabell (SOF tabell 3 lenke).
Resultatene i tabell 3 kan tolkes i retning av at at antikoagulasjon beskytter noe bedre mot nye hjerneinfarkter enn platehemmende behandling. Kostnaden er økt blødningsrisiko. For pasienter som er i den situasjonen at PFO ikke lukkes, bør de ulike antitrombotiske behandlingsalternativer drøftes med pasienten. For mange pasienter vil sannsynligvis den mulige reduksjonen i risiko for nye hjerneinfarkter gjøre at de velger behandling med antikoagulasjon, men for noen vil økt blødningsrisiko vektlegges så mye at de vil foretrekke platehemmende behandling. Her tas også eventuelt andre risikofaktorer med inn i vurderingen når antitrombotisk behandling skal velges.
NB: Det er viktig i denne diskusjonen med pasienten å få fram at det forskningsmessige kunnskapsgrunnlaget er begrenset og at begge behandlingsalternativer er aktuelle og at det store flertall av pasienter ikke vil oppleve nye hjerneinfarkter eller blødninger samme hvilken behandling de velger.
For pasienter over 60 år der det eventuelt er påvist PFO, opprettholdes de tidligere anbefalingene (se denne) om at platehemming er førstevalg hvis pasienten ikke har tilstander som gir indikasjon for antikoagulasjon (f.eks atrieflimmer). Anbefalingen opprettholdes fordi det i denne aldersgruppen for de fleste pasienter er mer sannsynlig at det er andre årsaker til hjerneinfarktet enn en PFO. Her eksisterer ikke studier som dokumenterer effekt av PFO lukning og heller ikke studier som gir holdepunkter for at antikoagulasjon er bedre enn platehemming.
Begrunnelse – dette er anbefalingen basert på
Hva er patent forum ovale (PFO)
Vanligvis er det en skillevegg mellom høyre og venstre forkammer i hjertet. Hos ca 25 % er det en åpning mellom høyre og venstre forkammer, kalt patent foramen ovale (PFO). Alle har en slik åpning i fosterstadiet, men hos omlag 1 av 4 lukker den seg ikke etter fødsel.
Hos noen kan en slik åpning mellom høyre og venstre forkammer føre til at eventuelle blodpropper i vener i beina eller i høyre forkammer kommer over til venstre side av hjertet og kan følge blod-strømmen til hjernen og gi hjerneinfarkt.
Anbefalinger om hvordan pasienter som får kryptogent hjerneinfarkt og som samtidig har PFO bør behandles, ble utarbeidet i 2017.
Kunnskapsgrunnlaget har endret seg, slik at anbefalingen fra 2017 om PFO ikke lenger er gjeldende for pasienter under 60 år.
RHF-ene fikk i oppdrag av Helsedirektoratet til å utnevne medlemmer (slagleger og hjerteleger) til å delta i arbeidet med å utarbeide ny anbefaling om PFO lukning for pasienter med kryptogent hjerneslag < 60 år.
Følgende problemstillinger er lagt til grunn:
PICO 1: Har pasienter <60 år med kryptogent hjerneslag effekt av PFO lukning fremfor kun platehemmende behandling.
PICO 2: Har pasienter <60 år med kryptogent hjerneslag effekt av PFO lukning fremfor kun antikoagulasjonsbehandling
Det er gjort en metodevurdering i "Nye metoder" (Hagen G, et al. 2019). Den nye forskningsdokumentasjon for pasienter under 60 år tyder på at PFO lukking i kombinasjon med påfølgende platehemming, reduserer risiko for hjerneinfarkt, men øker risiko for atrieflimmer og prosedyrerelaterte komplikasjoner (lenke SOF tabell 1). Sammenlignet med antikoagulasjon er det i den forskningsdokumentasjon som er lagt til grunn, ingen sikker forskjell mellom PFO lukking og antikoagulasjon når det gjelder risiko for hjerneinfarkt, men det er økt risiko for blødninger ved antikoagulasjon (lenke SOF tabell 2).
Den nye anbefalingen er basert på følgende kunnskapsgrunnlag:
- HTA av Folkehelseinstituttet: Hagen G, et.al.2019
- Mir H. et al. Patent foramen ovale closure, antiplatelet therapy or anticoagulation in patients with patent foramen ovale and cryptogenic stroke: A systematic review and network meta 57 analysis incorporating complementary external evidence. BMJ Open 2018;8 (7), som har inkludert følgende studier:
- PICCS (Homma et al 2002)
- CLOSURE 1 (Furlan et al 2012)
- Shariat et al 2013
- PC (Meier et al 2013)
- RESPECT (Saver et al 2013)
- CLOSE (Mas et al 2017)
- REDUCE (Søndergaard et al 2017)
- DEFENSE PFO (Lee et al 2018)
- Arbeidsgruppens samlede erfaring og kunnskap
Etter avsluttet litteratursøk ble det identifisert en systematisk oversikt av Diener et al., 2021 Denne metaanalysen og studiene den bygger på, endrer ikke forskningsgrunnlaget som anbefalingene bygger på. Denne metaanalysen konkluderer med at det fortsatt er usikkerhet om antikoagulasjon er bedre enn platehemming ved PFO. Selv om dokumentasjonen som er benyttet i utarbeidelsen av anbefalingene, indikerer at antikoagulasjon er bedre enn platehemming, er det i anbefalingen understreket at forskningsdokumentasjonen vedrørende antikoagulasjon er svakere.
Omfang:
I HTA (2019) fra Folkehelseinstituttet er det gjort estimater som indikerer at det, vil være behov for ca 300 PFO lukninger per år i aldersgruppen under 60 år. Ved en mer detaljert bruk av data fra Norsk hjerneslagregister kan følgende estimater settes opp:
| Antall pasienter under 60 år innlagt med akutt hjerneinfarkt i norske sykehus per år | 1500 |
| Antall pasienter med hjerneinfarkt av ukjent årsak 30 % * | 500 |
| Antall pasienter med påvist PFO ( 50 %)** | 250 |
Ut fra disse beregninger er rimelig å estimere at 500 pasienter per år må utredes for å identifisere en eventuell PFO og ca 250 pasienter per år kan være aktuelle for PFO lukning.
* Vanligvis er det angitt at andel hjerneinfarkt av ukjent årsak ligger mellom 10-30 %, men muligens i den høyere del av denne % angivelsen i yngre aldersgrupper og derfor er her estimert 30%
** Andelen personer med PFO i den vanlige befolkning er kartlagt i mange studier og det er funnet andeler på 20-25 %. Hos pasienter med hjerneinfarkt i aldergruppen < 60 år er andelen høyere og det er her estimert 50%
Hvis det åpnes for PFO lukning for pasienter med TIA vil dette medføre følgende:
Antall pasienter med TIA er i følge det svenske TIA register i Riksstroke ca 40 % av de som får manifest hjerneinfarkt.
Det betyr at:
| Antall pasienter med TIA i Norge per år | 4000 |
| 25 % er under 60 år | 1000 |
| 30 % har ukjent årsak til TIA | 300 |
| 33% har positiv bildediagnostikk | 100 |
| 50 % har PFO | 50 |
Det betyr at hvis de klare indikasjoner følges vil inklusjon av pasienter med bildeverifisert iskemi ved TIA medføre utredning av ytterligere 100 pasienter og mulig lukning av 50 av disse.
Oppsummert
Antall som vil være aktuell for utredning med henblikk på PFO per år vil være 500 + 100= 600
Antall som vil kunne være aktuelle for PFO lukning vil være 250 + 50 = 300
Disse estimater forutsetter at det er pasienter som er under 60 år og uten andre mer sannsynlige årsaker til hjerneinfarkt som utredes og tilbys PFO lukning.
Organisering
Et senter som utfører PFO lukning bør ha minimum 50 pasienter årlig ifølge de vurderinger som ble gjort av de kardiologiske medlemmer av arbeidsgruppen. Det betyr i Norge at de sentra som er aktive per i dag bør fortsette med dette tilbudet (Haukeland universitetssjukehus, Oslo universitetssykehus og St. Olavs hospital). Sentrene kan med fordel samarbeide om prosedyrer og evalueringer, da det er relativt få pasienter ved hvert senter.
Under forutsetning at man bruker dagens kunnskapsgrunnlag og indikasjoner vil dette tiltaket ifølge de kardiologiske medlemmer i arbeidsgruppen kunne innføres uten store ekstra kostnader.
Det ressursbehov og de kostnadsestimater som er anført i HTA fra Folkehelseinstituttet anses tilstrekkelig.
Prosedyren med PFO lukning anses å være en relativ enkel prosedyre, og opplæring og nødvendig opplæring av leger vil kunne gjennomføres ved de aktuelle sentra .
Forskningsgrunnlag
Populasjon (P): Pasienter <60 år med hjerneinfarkt uten kjent årsak og påvist PFO
Tiltak (I): PFO lukning
Sammenligning (C): platehemmende behandling
Beskrivelse av inkluderte studier
Summary of findings (resultat-) tabell 1: PFO lukning vs platehemming
Summary of findings (resultat-) tabell 2: PFO lukning vs antikoagulasjon
Summary of findings (resultat-) tabell 3: platehemming vs antikoagulasjon
Den systematiske oversikt som er valgt ut som forskningsgrunnlag om lukking av patent foramen ovale er en oversikt publisert av Hassan Mir og medarbeidere i British Medical Journal Open i 2018.
Oversikten inneholder 10 studier som presenterer resultatene av følgende sammenligninger for pasienter under 60 år med hjerneinfarkt av ukjent årsak som har fått påvist patent foramen ovale:
1. Seks studier som inkluderte 3560 pasienter har sammenlignet effekten av PFO lukking + platehemmende behandling versus platehemmende behandling (e.g. over 80 % av pasientene i kontrollgruppen ble behandlet med platehemmer – resten med antikoagulasjon).
2. En studie som inkluderte 353 pasienter har sammenlignet effekten av PFO lukking + platehemmende behandling versus antikoagulasjon.
3. Tre studier som inkluderte 503 pasienter har sammenlignet effekten av antikoagulasjon versus platehemmende behandling der ingen av gruppene fikk lukket PFO.
Summary of findings (sof) tabell 1:
Effekter av PFO lukking + platehemmer versus platehemmer (3560 pasienter)
Informasjon om sammenligning PFO lukking + platehemmende behandling versus platehemmende behandling (e.g. over 80 % av pasientene i kontrollgruppen ble behandlet med platehemmer – resten med antikoagulasjon):
PFO lukking reduserer risiko for hjerneinfarkt og øker risiko for atrieflimmer og prosedyrerelaterte komplikasjoner.
Det er små eller ingen sikre forskjeller mellom de 2 behandlingsalternativer i risiko for død, alvorlige blødninger, TIA og blodpropper til lunger og andre organer (utenom hjernen).
Det finnes ingen opplysninger i de aktuelle studier om funksjonsnivå eller helserelatert livskvalitet
Summary of findings (sof) tabell 2:
Effekter av PFO lukking + platehemmer versus antikoagulasjonsbehandling (353 pasienter).
Informasjon om sammenligning av PFO lukking + platehemmende behandling versus antikoagulasjons behandling.
PFO lukking reduserer risiko for alvorlige blødninger og øker risiko for atrieflimmer og prosedyrerelaterte komplikasjoner.
Det er små eller ingen sikre forskjeller mellom de 2 behandlingsalternativer i risiko for død, hjerneinfarkt, TIA og blodpropper til lunger og andre organer (utenom hjernen).
NB: Alle behandlingseffektene her har noe usikkerhet pga relativt få pasienter som er studert og altså kun en studie.
Det finnes ingen opplysninger i den aktuelle studie om funksjonsnivå eller helserelatert livskvalitet.
Summary of findings (sof) tabell 3:
Effekter av antikoagulasjon versus platehemmende behandling uten PFO lukking: (503 pasienter).
Informasjon om sammenligning av antikoagulasjons behandling versus platehemmende behandling der ingen har blitt behandlet med PFO lukking
Dokumentasjonen er ikke innført som nasjonal anbefaling men som praktisk råd.
Antikoagulasjon reduserer risiko for hjerneinfarkt og øker risiko for alvorlige blødninger sammenlignet med platehemmer.
Det er små eller ingen sikre forskjeller mellom de 2 behandlingsalternativer i risiko for død, atrieflimmer, TIA og blodpropper til lunger og andre organer (utenom hjernen).
Alle behandlingseffektene her har noe usikkerhet pga relativt få pasienter som er studert. Det er derfor fortsatt noe usikkerhet om, og i hvor stor grad, antikoagulasjon beskytter mot nye hjerneslag sammenlignet med platehemming. Det finnes ingen opplysninger i de aktuelle studier om funksjonsnivå eller helserelatert livskvalitet. Det finnes noe informasjon fra studier som sammenligner antikoagulasjon med platehemming, og på bakgrunn av dette er det foreslått at antikoagulasjon foretrekkes fremfor platehemming hos pasienter <60 år hvor PFO ikke lukkes'.
Vurdering
Fordeler og ulemper
Problemstilling 1
Fordeler: PFO lukking vs platehemming, reduserer risiko for hjerneinfarkt.
Ved sannsynlig reduksjon av nye hjerneinfarkt, er den erfaringsbaserte forventningen at det vil kunne påvirke både livskvalitet og funksjonsnivå positivt. Men det finnes ikke studier som har kartlagt livskvalitet og funksjonsnivå etter PFO lukning så forskningsdokumentasjon mangler.
Noe av usikkerheten skyldes at to av studiene Close og Respect ikke viste at PFO lukning reduserte alvorlige slag
Men når samleanalyser tyder på at nye hjerneinfarkt kan forhindres, er det grunn til å tro at dette kan redusere funksjonshemming selv om det eventuelt er små hjerneinfarkter som reduseres mest .
Ulemper: Følgende prosedyrerelaterte komplikasjoner ble rapportert i den aktuelle metaanalyse (Mir et al., 2018): vaskulære hendelser 1.0 %, ledningsforstyrrelser 1.0 %, trombe på device 0.7 %, dislokasjon av device 0.5 % . De mest alvorlige komplikasjon (luftemboli, tamponade og perforasjon) utgjorde til sammen 1%. Ingen prosedyrerelaterte dødsfall ble rapportert. Til sammen 3.5 % komplikasjoner - med statistisk usikker fra 2.3 % til 5.0% (Mir et.al., 2018)). Videre synes PFO lukning å gi noe økt forekomst av AF. En usikkerhet knyttet til PFO lukning er begrenset kunnskap om langtidseffekter eller langtids bivirkninger ( 10-20 år etc) av PFO lukning er det begrenset kunnskap om.
Konklusjon: De ønskede effekter veier opp for de uønskede effekter.
Problemstilling 2
Fordeler: PFO lukking + platehemmer reduserer risiko for alvorlige blødninger vs antikoagulanter.
Det å stå på livslang antikoagulasjon kan oppleves som ugunstig og hemmende i livsutfoldelsen med frykt for alvorlige blødningshendelser og engstelse for fysisk aktivitet som kan medføre skade/blødning. Spesielt brukerrepresentanter ga uttrykk for at de opplevde at dette var ugunstig og hemmende (psykisk belastende) og kunne påvirke livskvalitet. Forskningsdokumentasjon er mangelfull på dette området
Redusert risiko for bløding vurderes derfor til å være en fordel i favør av PFO lukning .
Ulemper: PFO lukning har de samme ulemper som er anført under Problemstilling1.
Konklusjon: de ønskede effekter veier antagelig opp for de uønskede effekter.
Kvalitet på dokumentasjonen
Dokumentasjonen er vurdert til å være av moderat kvalitet.
Verdier og preferanser
Det var ingen uenigheter i valg av utfallsmål og faggruppen og brukerorganisasjonene var enstemmige om at det er et akseptabelt tiltak.
Behandling av karotisstenose
Behandling av symptomatisk carotisstenose etter hjerneslag/TIA
Endarterektomi (åpen kirurgi) anbefales framfor endovaskulær behandling ved moderat og høygradige symptomgivende carotisstenoser.
Ved stenosegrad 50-69% kan endarterektomi anbefales etter individuell vurdering. SIGN 1a.
Endarterektomi (åpen kirurgi) SIGN 1a og endovaskulær behandling (angioplastikk/stenting) frarådes ved stenosegrad <50 %.
Praktisk – slik kan anbefalingen følges
• Stenosegrad kan måles på ulike måter. Her er målemetoden brukt i The North American Symptomatic Carotid Endarterectomy Trial (NASCET) lagt til grunn [294]:
o Høygradig stenose: stenosegrad ≥70%
o Moderat stenose: stenosegrad 50-69%
o Lavgradig stenose: stenosegrad <50%
- Gevinsten er størst hos menn, ved økende alder og når inngrepet gjøres tidlig (innen 2 uker etter at pasienten er i stabil fase) [293] [292].
- Behandlingseffekten er avhengig av at komplikasjonsraten ikke overstiger 6 % ved stenosegrad 70-99 % eller 3 % ved stenosegrad 50-69 % [293].
- Endovaskulær intervensjon kan vurderes hos pasienter med høygradig symptomgivende stenose hvor det er klare kontraindikasjoner mot kirurgi. Det mangler imidlertid dokumentasjon på nytteeffekten av dette.
- Sykehus som utfører endarterektomi eller endovaskulær behandling bør systematisk registrere peri- og postoperative komplikasjoner for å sikre at komplikasjonsfrekvensen ligger på et lavt nivå.
- Endarterektomi eller endovaskulær behandling, anbefales ikke hos personer med karotisstenose som ikke har hatt symptomer på hjerneinfarkt eller TIA (primærforebygging), men kan vurderes på individuell basis hos selekterte personer med stenosegrad 60-99 % og høy risiko for hjerneinfarkt, forutsatt komplikasjonsrate <3 % [290] (SIGN:1a).
- Effekt av endovaskulær behandling er ikke dokumentert og anbefales derfor ikke hos personer med carotisstenose som ikke har hatt symptomer på hjerneinfarkt eller TIA (primærforebygging).
Begrunnelse – dette er anbefalingen basert på
Store randomiserte, kontrollerte studier har vist gunstig effekt av endarterektomi hos pasienter med carotisstenose og gjennomgått ipsilateralt hjerneinfarkt/TIA i fremre kretsløp uten invalidiserende sekvele [294];[295];[292]. Effekten var høyest ved stenosegrad ≥70 %. For død eller slag med betydelig sekvele er RRR 48 %, KI 27-73 %, mens det er lavere/moderat gevinst ved stenosegrad 50-69 %, RRR 27 %, KI 15-44 %.
Gevinsten ved endarterektomi er størst hos menn, ved økende alder og når inngrepet gjøres tidlig (innen 14 dager etter at pasienten er i stabil fase) [293] [292]. Behandlingseffekten er avhengig av at komplikasjonsraten ikke overstiger 6 % ved stenosegrad 70-99 % og er lavere enn 3 % ved stenosegrad 50-69 % [293]. Pasienter med stenosegrad <50 % har ikke nytte av endarterektomi [291] (SIGN: 1a).
Endarterktomi ved asymptomatisk stenose med stenosegrad >60 % reduserer risiko for ipsilateralt hjerneinfarkt [290] (SIGN: 1a). Den absolutte nytten er beskjeden (ca. 1 % per år) og forutsetter lav perioperativ komplikasjonsrate (<3 %), og dette gjør at det ikke er grunnlag for noen generell anbefaling om endarterektomi i primærforebygging.
Forskningsdokumentasjonen vedrørende endarterektomi versus endovaskulær behandling viser at endovaskulær behandling hos pasienter med symptomatisk carotisstenose gir økt risiko for en rekke sammensatte utfall deriblant død, alle typer hjerneslag og invalidiserende hjerneslag innen 30 dager. Risiko for død eller alle typer hjerneslag (sammensatt utfall) var høyere med endovaskulær behandling på lang sikt (opptil 4 år). Det ble derimot ikke funnet noen forskjell mellom endovaskulær behandling og endarterektomi på alle typer hjerneslag (alene) eller ipsilaterlat hjerneslag (alene) ved 4 års oppfølging.
Anbefalingen ble utarbeidet med utgangspunkt i den oppsummerte forskningen, klinisk erfaring og brukererfaring.
Forskningsgrunnlag
Populasjon (P): Pasienter med symptomatisk karotisstenose (hjerneslag og/eller TIA)
Tiltak (I): Endovaskulær behandling (angioplastikk/stenting)
Sammenligning (C): Endarterektomi (åpen kirurgi)
Beskrivelse av inkluderte studier
Resultattabell (PDF)
Flytskjema (PDF)
Søkestrategi (PDF)
Ved gjennomgang av litteratursøk ble det funnet én relevant systematisk litteraturoversikt for denne anbefalingen: Bonati et al. (2012). Oversiktsartikkelen inkluderte totalt 16 randomiserte kontrollerte studier som undersøkte nytte og risiko ved endovaskulær behandling sammenlignet med endarterektomi hos 7 572 pasienter. To av studiene som bidrar med informasjon til arbeidsgruppens utfallsmål (nytt hjerneinfarkt, hjerneslag (alle), død) inkluderte pasienter med symptomatisk og ikke-symptomatisk karotisstenose.
Forkortelser: TIA, transitorisk iskemisk anfall; mRs, modified Rankin Scale
mRS uttrykker grad av selvhjulpenhet/funksjonshemming. Skalaen går fra 0 (intet symptom) til 6 (død); Oxfordshire Handicap Stroke scale uttrykker grad av selvhjulpenhet/funksjonshemming. Skalaen går fra 0 (intet symptom) til 5 (totalt avhengig, trenger konstant overvåkning, dag og natt).
Utfall 1: Død eller alle typer hjerneslag
Sammenlignet med kontrollgruppen (endarterektomi) gir endovaskulær behandling høyere sannsynlighet (odds) for at pasienten dør eller får et nytt slag i løpet av de 30 første dagene etter behandling med 33 flere tilfeller per 1000 pasient (fra 14 flere til 58 flere). Effektestimatet (dvs. antall dødsfall og slag) er basert på 5778 pasienter i 11 randomiserte kontrollerte studier. Blant de 5778 pasientene gjennomgikk 2896 endovaskulær behandling og 2882 endarterektomi. To av studiene har ikke separert hendelsene mellom symptomatiske/ikke symptomatiske pasienter (TESCAS-C 2006 og Beijing 2009), og disse er vektet henholdsvis 2.4% og 1.3% i analysen, med 166 deltakere i TESCAS-C (2006) og 40 deltakere i Bejiing (2009). Kvaliteten på evidensgrunnlaget er høy, og det er stor tillit til resultatet.
Utfall 2: Død eller alvorlige eller invalidiserende hjerneslag
Alvorlige og invalidiserende hjerneslag ble vurdert ved bruk av modified Rankin Scale (mRs) eller the Oxfordshire Handicap Stroke scale.
Sammenlignet med kontrollgruppen (endarterektomi) gir trolig endovaskulær behandling høyere sannsynlighet (odds) for at pasienten dør eller får et alvorlig/invalidiserende hjerneslag i løpet av de 30 første dagene etter behandling med 9 flere tilfeller per 1000 pasient (fra 2 færre til 25 flere). Effektestimatet (dvs. antall dødsfall og alvorlige/invalidiserende slag) er basert på 4044 pasienter i 7 randomiserte kontrollerte studier. Blant de 4044 pasientene gjennomgikk 2016 endovaskulær behandling og 2028 endarterektomi. Kvaliteten på evidensgrunnlaget er moderat grunnet usikkerhet knyttet til presisjon grunnet få hendelser og at konfidensintervallet krysser linjen for ingen forskjell i effekt. Det er middels tillit til resultatet.
Utfall 3: Død eller alle typer hjerneslag (fra randomisering og 30 dager etter behandling) eller ipsilaterale slag (fra 30 dager etter behandling til slutten av oppfølgingen).
Oppfølgingsperioden rangerte fra 18 mnd til 4 år.
Sammenlignet med kontrollgruppen (endarterektomi) gir endovaskulær behandling høyere sannsynlighet (odds) for at pasienten dør eller får et nytt hjerneslag (alle typer) i løpet av de første 30 dagene etter behandling, eller et ipsilateralt slag fra 30 dager etter behandling til slutten av oppfølgingsperioden med 27 flere tilfeller per 1000 pasient (fra 7 flere til 50 flere). Effektestimatet (dvs. antall dødsfall, hjerneslag og ipsilaterale hjerneslag) er basert på 3753 pasienter i 8 randomiserte-kontrollerte studier. Blant de 3753 pasientene gjennomgikk 1890 endovaskulær behandling og 1863 endarterektomi. Kvaliteten på evidensgrunnlaget er høy, og det er stor tillit til resultatet.
Utfall 4: Død eller alle typer hjerneslag (fra randomisering til slutten av oppfølgingen)
Oppfølgingsperioden rangerte fra 6 mnd til 4 år.
Sammenlignet med kontrollgruppen (endarterektomi) gir endovaskulær behandling høyere sannsynlighet (odds) for at pasienten dør eller får et nytt hjerneslag i løpet av oppfølgingsperioden med 62 flere tilfeller per 1000 pasient (fra 11 flere til 118 flere). Effektestimatet (dvs. antall dødsfall og hjerneslag) er basert på 1621 pasienter i 8 randomiserte kontrollerte studier. Blant de 1621 pasientene gjennomgikk 804 endovaskulær behandling og 817 endarterektomi. Den absolutte effekten av konfidensintervallet er noe vid med 11 til 118 fler, men vi har ikke nedgradert for dette. Kvaliteten på evidensgrunnlaget er høy, og det er stor tillit til resultatet.
Utfall 5: Alle typer hjerneslag i løpet av oppfølgningsperioden
Oppfølgingsperioden rangerte fra 18 mnd til 4 år.
Hendelser (død og hjerneslag) mellom randomisering og 30 dager etter behandling er ekskludert.
Sammenlignet med kontrollgruppen (endarterektomi) gir trolig endovaskulær behandling høyere sannsynlighet (odds) for at pasienten får et nytt hjerneslag i løpet av oppfølgingsperioden med 11 flere tilfeller per 1000 pasient (fra 10 færre til 43 flere). Effektestimatet (dvs. antall hjerneslag) er basert på 2319 pasienter i 6 randomiserte kontrollerte studier. Blant de 1621 pasientene gjennomgikk 1163 endovaskulær behandling og 1156 endarterektomi. Kvaliteten på evidensgrunnlaget er moderat med usikkerhet knyttet til presisjon grunnet få hendelser (hjerneslag) og at konfidensintervallet krysser linjen for ingen forskjell i effekt. Det er middels tillit til resultatet.
Utfall 6: Ipsilateralt hjerneslag i løpet av oppfølgingsperioden
Oppfølgingsperioden rangerte fra 18 mnd til 4 år.
Hendelser (død og ipsilaterale hjerneslag) mellom randomisering og 30 dager etter behandling er ekskludert.
Sammenlignet med kontrollgruppen (endarterektomi) fører trolig endovaskulær behandling til litt færre tilfeller av ipsilaterale slag, men det er usikkerhet rundt dette resultatet fordi konfidensintervallet spenner fra 9 færre til 10 flere per 1000. Effektestimatet (dvs. antall ipsilaterale hjerneslag) er basert på 3640 pasienter i 7 randomiserte kontrollerte studier. Blant de 3640 pasientene gjennomgikk 1831 endovaskulær behandling og 1809 endarterektomi. Kvaliteten på evidensgrunnlaget er moderat med usikkerhet knyttet til presisjon grunnet få hendelser (ipsilateralt hjerneslag) og at konfidensintervallet krysser linjen for ingen forskjell i effekt. Det er middels tillit til resultatet.
Vurdering
Fordeler og ulemper
Fordeler med endovaskulær behandling:
- Endovaskulær behandling er mindre invasiv enn endarterektomi.
- Hjerteinfarkt er ikke vurdert som utfallsmål med GRADE, men i noen av studiene viste posthoc-analyser lavere risiko for hjerteinfarkt sammenlignet med endarterektomi.
Ulempe med endovaskulær behandling: Flere dødsfall og hendelser av alle typer hjerneslag anses som svært vesentlige uønskede forventede effekter ved endovaskulær behandling.
- Høyere risiko for uønskede utfall som død, nye hjerneslag og funksjonshemming enn ved endarterektomi.
- Det er høyere kostnader ved angioplastikk enn ved endarterektomi.
Konklusjon: Fordelene ved endovaskulær behandling veier ikke opp for ulempene.
Kvalitet på dokumentasjonen
Det er moderat til høy tillit til effektestimatene.
Verdier og preferanser
Alvorlighetsgraden av utfallsmålene (død, hjerneslag, funksjonshemming) ble vektlagt i utformingen av anbefalingen. Utfallene død, hjerneslag og funksjonshemming ble vurdert til å være svært vesentlige utfallsmål for å utforme forslag til en anbefaling.
Referanser
289. Percutaneous transluminal balloon angioplasty and stenting for carotid artery stenosis https://www.helsedirektoratet.no/referanse/0002-0013-195634
290. Carotid endarterectomy for asymptomatic carotid stenosis https://www.helsedirektoratet.no/referanse/0002-0013-195635
291. Carotid endarterectomy for symptomatic carotid stenosis https://www.helsedirektoratet.no/referanse/0002-0013-195636
292. Analysis of pooled data from the randomised controlled trials of endarterectomy for symptomatic carotid stenosis https://www.helsedirektoratet.no/referanse/0002-0013-195637
293. Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery https://www.helsedirektoratet.no/referanse/0002-0013-195638
296. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis https://www.helsedirektoratet.no/referanse/0002-0013-195641
297. Randomised trial of endarterectomy for recently symptomatic carotid stenosis: final results of the MRC European Carotid Surgery Trial (ECST) https://www.helsedirektoratet.no/referanse/0002-0013-195642
Sist faglig oppdatert: 21.12.2017
Levevaner
Alkoholforbruk etter hjerneslag/TIA
Høyt alkoholforbruk frarådes.
SIGN: B2a
Praktisk – slik kan anbefalingen følges
Begrunnelse – dette er anbefalingen basert på
Stort inntak av alkohol øker risikoen for alle typer av hjerneslag og særlig blødninger. Det er kontroversielt om moderat forbruk beskytter. En metaanalyse indikerer at et moderat alkohol forbruk (1-2 enheter alkohol per døgn for menn og 1 enhet alkohol per døgn for kvinner) kan redusere risiko for hjerneinfarkter sammenlignet med total avholdenhet, men effekten er liten og usikker om en korrigerer for andre faktorer. [298]
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneinfarkt eller hjerneblødning som drikker alkohol
Tiltak (I): moderat alkoholforbruk
Sammenligning (C): stort alkoholforbruk
Beskrivelse av inkluderte studier
Referanser
298. Alcohol consumption and risk of stroke: a meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195643
Sist faglig oppdatert: 21.12.2017
Røyking etter hjerneslag/TIA
Alle pasienter med hjerneslag/TIA som røyker, bør sterkt anbefales å slutte. SIGN: B 2a
Praktisk – slik kan anbefalingen følges
Det fins flere metoder som har dokumentert effekt for å oppnå røykeslutt, og hovedprinsippene er veiledning og legemiddelbehandling.
Prinsipper og praktiske tips om hjelp til røykeslutt er beskrevet i Nasjonal faglig retningslinje for Røykeavvenning.
Kort rådgivning eller "minimal intervensjon" kan enkelt integreres ved legebesøk eller sykehusinnleggelse. Ved å spørre om pasienten røyker markerer man at det er et viktig tema.
Se ellers kapittelet om levevaner i Nasjonal faglig retningslinje for forebygging av hjerte- og karsykdom fra Helsedirektoratet.
Begrunnelse – dette er anbefalingen basert på
Røyking dobler risikoen for hjerneslag [300]. Røykeslutt reduserer risikoen for hjerneslag [303] [299] (SIGN:2a).
Nikotinerstatningspreparater og oppfølging øker sjansen for vellykket røykeslutt [301] [302] (SIGN:1a).
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneinfarkt eller TIA som røyker
Tiltak (I): Røykeslutt
Sammenligning (C): Pasienter med hjerneslag eller TIA som fortsetter å røyke
Beskrivelse av inkluderte studier
Referanser
299. Smoking cessation and decreased risk of stroke in women https://www.helsedirektoratet.no/referanse/0002-0013-195644
300. Meta-analysis of relation between cigarette smoking and stroke https://www.helsedirektoratet.no/referanse/0002-0013-195645
301. Nicotine replacement therapy for smoking cessation https://www.helsedirektoratet.no/referanse/0002-0013-195646
302. Telephone counselling for smoking cessation https://www.helsedirektoratet.no/referanse/0002-0013-195647
Sist faglig oppdatert: 21.12.2017
Fysisk trening for forebygging av nye hjerneslag hos pasienter etter gjennomgått hjerneslag/TIA
Tilpasset og regelmessig fysisk trening foreslås etter hjerneslag/TIA .
Praktisk – slik kan anbefalingen følges
Det er lite forskningsbasert dokumentasjon om hva som er optimal intensitet, mengde og type fysisk trening som ledd i sekundærforebygging etter hjerneslag/TIA.
Det er ikke gjennomført gode studier som kan gi velbegrunnede råd om hvor raskt kondisjonstrening bør starte etter et hjerneslag [305]. Erfaringsmessig tilrår vi å starte fysisk trening i løpet av første uke etter et hjerneslag for deretter gradvis å øke intensitet og mengde tilpasset den enkeltes kondisjonsnivå, alvorlighet av hjerneslaget og respons på aktiviteten. Mer systematisk og intens fysisk trening med målsetting om å bedre kondisjonsnivå kan vanligvis starte i løpet av 4-6 uker. Høy intensitetstrening med intervalltrening er i begrenset grad studert, men tolereres vanligvis godt 2-3 måneder etter et hjerneslag.
Utholdenhetstrening er den treningsformen som har antatt størst potensial for å kunne gi sekundære profylaktiske effekter. Styrketrening kan være aktuelt i kombinasjon med utholdenhetstrening, men det er færre holdepunkter for at slik trening alene vil ha effekt i forhold til sekundær forebygging
Se også anbefaling om fysisk aktivitet ved primærforebygging av hjerte- og karsykdommer i nasjonal faglig retningslinje for forebygging av hjerte og karsykdom.
Begrunnelse – dette er anbefalingen basert på
Dokumentasjonen for anbefalingen er basert på studier som har undersøkt relativt unge mennesker med lite utfall og med lav til moderat grad av fysisk trening og kort oppfølgingstid. Det ble ikke funnet forskning med utfallsmålene hjerneslag eller hjerteinfarkt, og anbefalingen bygger derfor også på generell kunnskap om betydning av fysisk trening for å forebygge hjerte-/karsykdom og arbeidsgruppens samlede kunnskap og erfaring .
Anbefalingen er basert på oppsummert forskning og arbeidsgruppens samlede erfaring og kunnskap [304].
Forskningsgrunnlag
Populasjon (P): Alle med gjennomgått hjerneslag
Tiltak (I): Fysisk aktivitet
Sammenligning (C): Ingen intervensjon, ulik grad av fysisk aktivitet
Beskrivelse av inkluderte studier
Resultattabell (PDF)
Flytskjema (PDF)
Søkestrategi (PDF)
I forbindelse med revisjon av nasjonal retningslinje for behandling og rehabilitering ved hjerneslag, ønsket arbeidsgruppen å undersøke kunnskapsgrunnlaget vedr. effekten av fysisk aktivitet for å forebygge nye hjerneslag hos pasienter med gjennomgått hjerneslag. Ved litteratursøk ble det funnet en systematisk litteraturoversikt som var overførbar til arbeidsgruppens problemstilling (Saunders et al. (2016)). Denne systematiske oversikten inkluderte totalt 58 randomiserte kontrollerte studier med 2797 deltakere. Intervensjon med fysisk aktivitet bestod av kardiorespiratorisk trening (utholdenhetstrening), styrketrening og kombinasjonstrening (kardiorespiratorisk- og styrketrening). Statistisk oppsummering av tiltakseffekt (ulike former for fysisk aktivitet) var begrenset i oversiktsartikkelen grunnet enkeltstudienes ulike definisjoner av utfallsmål. Dermed er det kun utfallet «død» som er inkludert i forskningsgrunnlaget (det er ikke funnet oppsummert forskning på effekten av fysisk aktivitet på residiv hjerneinfarkt og hjerteinfarkt i sekundærforebygging av hjerneslag).
Merknad gjeldende for alle sammenligningene: Det er gjennomgående få hendelser av død i analysene. Dette kan skyldes at de fleste deltakerne hadde milde hjerneslag, samt en utvalgsskjevhet med tanke på deltakere som i utgangspunktet var fysisk aktive. Gjennomsnittlig alder var 62. Dette gjør at overførbarheten er redusert, men det er ikke trukket ned for dette i evidensprofilen da vi har valgt å ikke nedgradere kvaliteten på utfallsmålene ytterligere.
Utfall 1: Død ved studieslutt (kardiorespiratorisk trening versus kontroll)
Sammenlignet med kontrollgruppen, gir muligens kardiorespiratorisk trening etter hjerneslag lik sannsynlighet (odds) for at pasienten dør i løpet av studieperioden (10 uker - 12 mnd) med ingen fler tilfeller per 1000 pasient (fra 3 færre til 18 flere). Effektestimatet (dvs. antall dødsfall) er basert på 1437 deltakere i 28 randomiserte kontrollerte studier. Blant pasientene fikk 750 kardiorespiratorisk trening, mens 687 fikk vanlig behandling. Kvaliteten på evidensgrunnlaget er lavt grunnet stor risiko for systematiske feil i de studiene som bidrar til analysen samt et vidt/upresist konfidensintervall som kan skyldes meget få hendelser av død. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt. Det er liten tillit til resultatet.
Utfall 2: Død ved endt oppfølging (kardiorespiratorisk trening versus kontroll)
Sammenlignet med kontrollgruppen, gir muligens kardiorespiratorisk trening etter hjerneslag lik sannsynlighet (odds) for at pasienten dør i løpet av oppfølgingsperioden (10 uker – 6 mnd) med ingen fler tilfeller per 1000 pasient (fra 6 færre til 92 flere). Effektestimatet (dvs. antall dødsfall) er basert på 304 deltakere i 5 randomiserte kontrollerte studier. Blant pasientene fikk 152 kardiorespiratorisk trening, og 152 fikk vanlig behandling. Kvaliteten på evidensgrunnlaget er svært lavt grunnet stor risiko for systematiske feil i de studiene som bidrar til analysen, liten informasjonsstørrelse samt et svært vidt/upresist konfidensintervall. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt. Det er svært liten tillit til resultatet.
Utfall 3: Død ved studieslutt (styrketrening versus kontroll)
I denne sammenligningen var det ingen hendelser av død i hverken kontrollgruppen eller i intervensjonsgruppen. Da det ikke er noen hendelser, er det heller ikke oppgitt noe samlet mål på relativ og absolutt effekt, men det er nedgradert for presisjon da informasjonsstørrelsen er liten (436 deltakere). Kvaliteten på evidensgrunnlaget er svært lav grunnet høy og/eller uklar risiko for systematiske feil i de inkluderte studiene, liten informasjonsstørrelse og ingen hendelser av død. Det er svært liten tillit til resultatet.
Utfall 4: Død ved endt oppfølging (styrketrening versus kontroll)
I denne sammenligningen var det ingen hendelser av død i hverken kontrollgruppen eller i intervensjonsgruppen. Da det ikke er noen hendelser, er det heller ikke oppgitt noe samlet mål på relativ og absolutt effekt, men det er nedgradert (-2) for presisjon da informasjonsstørrelsen er svært liten (138 deltakere). Kvaliteten på evidensgrunnlaget er svært lavt grunnet høy og/eller uklar risiko for systematiske feil i de inkluderte studiene samt en svært liten informasjonsstørrelse. Det er svært liten tillit til resultatet.
Utfall 5: Død ved studieslutt (kombinasjonstrening versus kontroll)
Kombinasjonstrening besto av kardiorespiratorisk trening og styrketrening.
Sammenlignet med kontrollgruppen, gir muligens kombinasjonstrening etter hjerneslag lavere sannsynlighet (odds) for at pasienten dør i løpet av studieperioden (12 uker - 6 mnd) med 14 færre tilfeller per 1000 pasient (fra 0 færre til 16 færre). Effektestimatet (dvs. antall dødsfall) er basert på 957 deltakere i 17 randomiserte-kontrollerte studier. Blant deltakerne fikk 473 kombinasjonstrening, mens 484 fikk vanlig behandling. Kvaliteten på evidensgrunnlaget er lavt grunnet stor risiko for systematiske feil i de studiene som bidrar til analysen samt et vidt/upresist konfidensintervall som kan skyldes meget få hendelser av død. I studien som er mest vektet i analysen (Langhammer 2007) inntraff tre av seks dødsfall i kontrollgruppen, samt det ene dødsfallet i intervensjonsgruppen, før intervensjonen begynte. Justert for dette var OR 0.19 (KI 0.01 - 4.08). Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt. Det er liten tillit til resultatet.
Utfall 6: Død ved endt oppfølging (kombinasjonstrening versus kontroll)
Kombinasjonstrening besto av kardiorespiratorisk trening og styrketrening.
Sammenlignet med kontrollgruppen, gir muligens kombinasjonstrening etter hjerneslag lavere sannsynlighet (odds) for at pasienten dør i løpet av studieperioden (12 uker - 6 mnd) med 15 færre tilfeller per 1000 pasient (fra 2 flere til 20 færre). Effektestimatet (dvs. antall dødsfall) er basert på 762 deltakere i 11 randomiserte kontrollerte studier. Blant deltakerne fikk 473 kombinasjonstrening, mens 484 fikk vanlig behandling. Kvaliteten på evidensgrunnlaget er lavt grunnet stor risiko for systematiske feil i de inkluderte studiene samt et vidt/upresist konfidensintervall som kan skyldes meget få hendelser av død. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt. Det er liten tillit til resultatet.
Vurdering
Fordeler og ulemper
Dokumentasjonen tyder på at det er trygt å anbefale fysisk aktivitet og trening etter hjerneslag.
Konklusjon:
Basert på erfaring vurderer arbeidsgruppen at de ønskede effekter sannsynligvis veier opp for de uønskede effekter.
Kvalitet på dokumentasjonen
Det er svært lav til lav tillit til effektestimatene. Det er ikke funnet forskningsdokumentasjon for utfallsmålene «hjerneslag» og «hjerteinfarkt».
Verdier og preferanser
Alvorlighetsgraden av utfallsmålene (hjerneslag, død, hjerteinfarkt) ble vektlagt i utformingen av anbefalingen. Både helsefaglige representanter og bruker representanter mente at hjerneslag, død og hjerteinfarkt er svært vesentlige utfall for å utforme forslag til en anbefaling.
Tiltaket er gjennomførbart, men compliance vil være avhengig av den enkelte pasients motivasjon og evne til å finne fram til regelmessige aktiviteter og treningsformer.
Referanser
304. Physical fitness training for stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195649
305. Physical activity and exercise recommendations for stroke survivors https://www.helsedirektoratet.no/referanse/0002-0013-195650
Sist faglig oppdatert: 21.12.2017
Utredning for sekundærforebygging
Utredningen etter hjerneslag/TIA bør avklare årsak og risikofaktorer for å sikre optimal sekundærforebygging.**
Se anbefalinger i akuttkapittel om bildediagnostikk
Se anbefaling om hjerterytmemonitorering ved akutt hjerneinfarkt og anbefaling om hjerterytmemonitorering ved akutt hjerneblødning
Se anbefaling om behandling av carotisstenoser
Se anbefaling om antikoagulasjon og anbefaling om platehemming
Se anbefaling om levevaner
Se også anbefalinger i Nasjonal faglig retningslinje for forebygging av hjerte- og karsykdom
Praktisk – slik kan anbefalingen følges
God sekundærprofylakse bygger på kunnskap om de aktuelle risikofaktorer hos pasienten og hvordan disse eventuelt kan reduseres og modifiseres. Omfanget av den kliniske utredningen må individualiseres avhengig av det kliniske bildet, alder og eventuelle andre sykdommer. Sykehistorie, kliniske funn og resultater av bildeframstilling av hjernen og eventuelle undersøkelser av karsystem og hjerte, samt funn ved blodprøver, vil som regel klarlegge den sannsynlige årsaken til hjerneslag og TIA. Noen ganger må mer omfattende utredning gjennomføres.
Vurdering av risiko for framtidige episoder bør gjøres, da dette kan ha betydning for hvor intensiv den sekundærforebyggende behandlingen bør være. Det er viktig å identifisere på et tidlig tidspunkt pasienter med særlig høy risiko slik som multiple risikofaktorer, metabolsk syndrom og familiære hyperlipidemier.
Den anbefalte kontroll etter tre måneder av alle slagrammede er en kontroll som bør ha som et av sine hovedformål å sikre at adekvat utredning er gjennomført og at optimal sekundærprofylakse er implementert
Se anbefaling i behandlingskjeden; kontroll etter gjennomgått hjerneslag.
Se nasjonal faglig retningslinje for diabetes
Begrunnelse – dette er anbefalingen basert på
De viktigste faktorer som bør avklares, er høyt BT, røyking, lite fysisk aktivitet, diabetes, atrieflimmer, høyt kolesterol og symptomgivende høygradige karotisstenoser,da disse faktorer bidrar helt eller delvis til omlag 85 % av alle hjerneslag [233];[234]
Referanser
233. Stroke–riskfaktorer och primärprevention https://www.helsedirektoratet.no/referanse/0002-0013-195578
234. Medical treatment in acute and long-term secondary prevention after transient ischaemic attack and ischaemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195579
Sist faglig oppdatert: 21.12.2017
Rytmemonitorering hos pasienter med hjerneinfarkt/TIA
Rytmemonitorering bør gjennomføres på alle pasienter, spesielt med tanke på paroksysmal atrieflimmer/flutter, men kan unnlates der dette ikke vil få behandlingsmessige konsekvenser. Ved mistanke om paroksysmal atrieflimmer bør varighet av monitorering være minst 24 timer. **
Praktisk – slik kan anbefalingen følges
Ved mistanke om paroksysmal atrieflimmer bør varighet av monitorering være minst 24 timer. Ved spesielt stor mistanke om paroksystisk atrieflimmer kan monitoreringstiden med fordel utvides (ESC retningslinjen 2016).
Det foreligger ulike metoder for monitorering av hjerterytme for å påvise parosyksmal atrieflimmer. Foreløpig er Holter monitorering mest benyttet. Men andre metoder for monitorering, har vist lovende resultater og kan i fremtiden bli foretrukne alternativer.
Begrunnelse – dette er anbefalingen basert på
EKG-forandringer som ST-segment-forandringer, QT-tid-forlengelse, T-bølgeinversjoner og prominente U-bølger sees ofte ved akutt hjerneslag. Lett troponinstigning og hjertearytmier kan forekomme uten at det foreligger primær hjertesykdom. Livstruende arytmier er sjeldne, men arytmier kan påvirke BT og cerebral sirkulasjon, og initialt bør derfor hjerterytmen overvåkes. Paroksystisk atrieflimmer som årsak til embolisk hjerneinfarkt kan også avdekkes ved slik monitorering som vil kunne ha konsekvenser for valg av videre antitrombotisk behandling.
Ved sterk mistanke om paroksystisk atrieflimmer, anbefaler en del retningslinjer monitorering i mer enn 24 timer [140] (ESC retningslinjen 2016).
Referanser
140. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS https://www.helsedirektoratet.no/referanse/0002-0013-195485
Sist faglig oppdatert: 21.12.2017
Rehabilitering etter hjerneslag
Sist faglig oppdatert: 21.12.2017
Om slagrehabilitering
Av de om lag 12 000 personene i Norge som hvert år innlegges for hjerneslag (1), vil i løpet av det første året omlag en tredjedel gjenvinne full eller tilnærmet full funksjon og en tredjedel vil dø. Dødeligheten er nedadgående og tall i den senere tid, tyder på under 25% dødelighet det første året (Riksstroke årsrapport 2015). Den siste tredjedelen vil ha en varig funksjonshemning som påvirker dagliglivets aktiviteter og kan medføre avhengighet av andre. Mange av de som overlever et hjerneslag, vil derfor trenge rehabilitering, og mange vil være avhengige av hjelp og støtte av andre mennesker og av samfunnet.
Et hjerneslag kan gi forskjellige funksjonsutfall avhengig av hvor i hjernen skaden inntreffer og hvor omfattende blødningen eller infarktet er. De mest typiske funksjonsutfall er halvsidige lammelser, følelsestap, svelgevansker, språkvansker, talevansker, synsfeltutfall, svekket balanse, uoppmerksomhet til en side, reduserte mentale funksjoner, psykiske plager, smerter, blære- og tarmforstyrrelser. Funksjonsutfallene påvirker i varierende grad den slagrammedes evne til å utføre daglige aktiviteter og evnen til å fungere i hjem og samfunn.
De siste tiårene har gitt ny kunnskap om hjernens plastisitet, og denne kunnskapen åpner nye perspektiver for slagrehabilitering. Forskning viser at tidlig og aktiv rehabilitering øker sjansene for å gjenvinne tapte funksjoner. Hva som er den mest ideelle form for slagrehabilitering er ikke avklart, men det er behov for god motivasjon kombinert med tilstrekkelig mengde, intensitet og varighet av treningen (410). Samtidig er det viktig at rehabiliteringen forankres i den slagrammedes livssituasjon og det livet som skal leves videre, enten det dreier seg om rehabilitering i sykehus, rehabilitering i annen institusjon eller rehabilitering i hjemmet.
Hva er rehabilitering?
Rehabilitering betyr "å gjeninnsette i verdighet". Ifølge «Forskrift om habilitering og rehabilitering, individuell plan og koordinator» (https://lovdata.no/dokument/SF/forskrift/2011-12-1...§3) er rehabilitering definert som «tidsavgrensede, planlagte prosesser med klare mål og virkemidler, hvor flere aktører samarbeider om å gi nødvendig bistand til pasientens og brukerens egen innsats for å oppnå best mulig funksjons- og mestringsevne, selvstendighet og deltakelse sosialt og i samfunnet.»
For slagpasienten betyr dette en personsentrert, målrettet prosess som begynner første dag etter slaget. Målet er å forbedre funksjon og/eller hindre tap av funksjon og å oppnå høyest mulig grad av uavhengighet, fysisk, psykisk, sosialt og ervervsmessig. Rehabilitering handler ikke alene om trening og gjenvinning av fysisk funksjon, men også om å venne seg til en ny livssituasjon samt å reintegreres i samfunnet.
Helsedirektoratets «Veileder om rehabilitering, habilitering, individuell plan og koordinator» gir mye nyttig informasjon og veiledning om rehabilitering generelt, samt generelle føringer på hva som er god praksis på dette området. Nasjonal faglig retningslinje for hjerneslag beskriver konkret hvordan rehabilitering av hjerneslagrammede pasienter bør være. Det er viktig å dokumentere årsak eller begrunnelse dersom man avviker fra anbefalingene.
Organisering av rehabilitering
Ulikheter i behov tilsier at rehabiliteringstilbudet må være bredt og fleksibelt. Tilbudet må bygge på tverrfaglighet og være tilgjengelig i alle faser av sykdomsforløpet, både i sykehus (slagenhet og rehabiliteringsavdeling), i ulike rehabiliteringsinstitusjoner og i helse- og omsorgstjenestene i kommunene. Organiseringen av rehabiliteringskjeden blir derfor viktig. Mange profesjoner og instanser er involvert i rehabilitering generelt og slagrehabilitering spesielt.
Norge har en variert geografi og befolkningstetthet og ulik organisering av helsetjenesten. Organisering av rehabilitering av slagrammede må derfor tilpasses lokale forhold, men innhold og kvalitet på enkeltelementene må være i samsvar med kunnskapsbaserte retningslinjer.
Slagrehabilitering involverer mange aktører og ulike forvaltningsnivåer. En god organisering av rehabiliteringstilbudet i de ulike faser er viktig for både optimal rehabilitering av den enkelte pasient og for effektiv ressursbruk.
Prinsipper og føringer for rehabilitering av hjerneslagpasienter bør tas inn i virksomhetenes styringssystemer. Plikten til å planlegge, gjennomføre, evaluere og korrigere virksomheten gjennom styringssystemet følger av helse- og omsorgstjenesteloven § 3-1 tredje ledd, jf. § 4-2, jf. § 4-1 og spesialisthelsetjenesteloven § 3-4a, jf. § 2-2. Forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten gir nærmere bestemmelser på hvordan et slikt systematisk arbeidet kan gjennomføres (se lenke: https://lovdata.no/pro/SF/forskrift/2016-10-28-1250). Helsedirektoratets veileder om ledelse og kvalitetsforbedring (lenke) gir ytterligere føringer på gjennomføringen.
Et viktig punkt er å sikre pasientens medvirkning til rehabiliteringen da dette bidrar til å sikre en best mulig gjennomføring, jf. forskrift om habilitering og rehabilitering § 4 (se lenke: https://lovdata.no/pro/SF/forskrift/2011-12-16-1256 ) og pasient- og brukerrettighetsloven kapittel 3 (se lenke: https://lovdata.no/pro/NL/lov/1999-07-02-63 ). Kapittel 4 i samme lov gjelder samtykke ved helsehjelp, og utdyping av hvordan lovens bestemmelser skal forstås fremgår av Helsedirektoratets rundskriv til pasient- og brukerrettighetsloven (IS-8/2015). Kjennetegn ved tjenester av god kvalitet er at de «involverer brukere og gir dem innflytelse, jf. Nasjonal strategi for kvalitetsforbedring i helse- og sosialtjenesten (Helsedirektoratet 2005). Det skal legges stor vekt på hva pasient og bruker mener. For rehabilitering av hjerneslagpasienter er det helt vesentlig å involvere pasienten for å sikre god oppfølging videre.
En viktig faktor for god rehabilitering er at den slagrammede får tilgang til et koordinert opplegg hvor et spesialisert tverrfaglig team deltar sammen med pasient og pårørende. Sammensetningen av dette teamet vil variere avhengig av om brukeren befinner seg i institusjon eller i hjemmet. Pasientens funksjonsutfall og målsettingen for rehabiliteringen vil også ha betydning for hvilket tverrfaglig tilbud det er behov for. Aktuelle fagpersoner er lege, sykepleier, hjelpepleier, fysioterapeut, ergoterapeut, sosionom, psykolog, logoped, synspedagog og klinisk ernæringsfysiolog. Fagpersonene som inngår i teamet, bør ha spesiell kompetanse i rehabilitering av slagrammede.
Referanse:
Norsk hjerneslagsregister, Årsrapport for 2015
Organisering av slagrehabilitering
Informasjon og koordinering ved utskrivning fra spesialisthelsetjenesten etter hjerneslag
Ved utskrivning fra spesialisthelsetjenesten skal det sikres overføring av nødvendig informasjon og koordinering av det videre forløpet.
SIGN: A1a.
Praktisk – slik kan anbefalingen følges
Utskrivning av pasient fra sykehuset må planlegges godt og bør skje i form av en utskrivningssamtale mellom pasient, lege og annen relevant helsepersonell. Det bør sikres at nøkkelpersonell som skal overta ansvaret for pasienten i den første tiden etter utskrivning er til stede, slik at det ikke blir avbrekk i rehabiliteringsprosessen. Det kan være ambulerende team fra spesialisthelsetjenesten eller rehabiliteringspersonell fra kommunen. Ved behov bør pårørende delta. Det viktige er at det foreligger en plan for videre rehabilitering og oppfølging, inkludert en oversikt over sikkerhetsrisikoer knyttet til eventuelle vedvarende fysiske og kognitive vansker. Se også veileder om habilitering og rehabilitering, individuell plan og koordinator for veiledningsplikten
Senest samtidig med utskrivning bør alle pasientrelaterte journaldata være ankommet til de som overtar ansvaret for pasienten. Dette bør bl.a. inkludere en oppdatert legemiddelliste og en tverrfaglig rapport/epikrise.
Rehabiliteringsstudier som har vist gode resultater på dette området [309] [311] (SIGN:1a), har en del fellestrekk som fremmer god samhandling:
• Kontinuerlig og godt samarbeid mellom sykehus og helse- og omsorgstjenestene i kommunene
• Konkretisering av ansvar hos helsepersonell
• Kompetanseoverføring og tverrsektorielle møter
• Grundig overføring av informasjon til neste ledd i tiltakskjeden
• Innsetting av ressurser til riktig tid på riktig sted
• Rehabilitering i stimulerende omgivelser
• Fleksibilitet i rehabiliteringstilbudet
• Lojalitet til de bestemmelser som er tatt
• Etablere samarbeid med pårørende slik at de er og forblir en ressurs
De overordnede samhandlingsavtalene mellom kommuner og helseforetak/sykehus bør vektlegge at samarbeidet bør ha et pasientnært fokus og involvere fagpersonell som arbeider nær brukerne.
Det bør etableres rutiner for rask (elektronisk) utveksling mellom alle involverte parter.
Kommunens koordinerende enhet for rehabilitering [21] eller rehabiliteringsteamet/-enheten bør være de som har ansvaret for å koordinere rehabiliteringsplaner og ev. individuelle planer i kommunen. For å sikre et hensiktsmessig rehabiliteringstilbud, bør alle som er blitt rammet av hjerneslag få tilbud om kontakt med kommunens rehabiliteringstjeneste. Det bør vurderes om pasienten har behov for/ønsker koordinator og Individuell plan.
Se også Veileder om rehabilitering, habilitering, individuell plan og koordinator
Fastleger og/eller legene på kommunens rehabiliteringsinstitusjoner bør delta i tverrfaglig samarbeid sammen med andre relevante aktører, både i tverrfaglige team, ansvarsgrupper, møter rundt individuell plan og nettverksmøter med pasient og pårørende. Også innad i kommunene bør det sikres (elektronisk) meldingsutveksling av relevant informasjon, slik at den til enhver tid er oppdatert hos alle aktørene i samarbeidet om pasienten. Det bør være definert hvem skal ha ansvaret for det tverrfaglige samarbeidet.
Når den slagrammede har fullført den initiale rehabiliteringsfase bør det sikres at alle aktører er inneforstått med planer for videre oppfølging og vedlikeholdsbehandling, kontroller hos fastlege, kontroller på sykehus, ev. nye opphold på rehabiliteringsinstitusjon m.m. Individuell plan er et godt verktøy for å sikre god planlegging.
Se også Veileder om rehabilitering, habilitering, individuell plan og koordinator
Begrunnelse – dette er anbefalingen basert på
God samhandling på tvers av forvaltningsnivåene ser ut til å være av særlig stor betydning for å lykkes i rehabilitering av slagpasienter [309] (SIGN: 1a).
Forskningsgrunnlag
Populasjon (P): Alle hjerneslagsrammede
Tiltak (I): Ved utskrivning fra sykehus foreligger relevant informasjon om pasienten og plan for videre rehabilitering og oppfølging, og neste ledd i behandlingskjeden er klar til å overta
Sammenligning (C): Standard utskrivning fra sykehus
Beskrivelse av inkluderte studier
Referanser
309. Services for reducing duration of hospital care for acute stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195654
311. Specialized stroke services: a meta-analysis comparing three models of care https://www.helsedirektoratet.no/referanse/0002-0013-195656
21. Forskrift om habilitering og rehabilitering https://www.helsedirektoratet.no/referanse/0002-0013-195366
Sist faglig oppdatert: 21.12.2017
Tidlig støttet utskriving hos pasienter med mild til moderat nedsatt funksjonsevne etter hjerneslag
Det anbefales at pasienter med mild til moderat funksjonssvikt utskrives tidlig direkte til hjemmet. Dette forutsetter tett oppfølging av et tverrfaglig ambulerende team med spesialkompetanse på hjerneslag, nær samhandling mellom sykehus og helse- og omsorgstjenestene i kommunene, og rehabiliteringstilbud i hjemmet eventuelt kombinert med rehabilitering i dagavdeling.
Praktisk – slik kan anbefalingen følges
Hovedpoenget ved tidlig støttet utskrivning er at et tverrfaglig slagteam følger opp pasientens rehabilitering i hjemmet istedenfor at pasienten er innlagt for rehabilitering i enten slagenhet eller rehabiliteringsavdeling.
Teamet bør ha spesiell kompetanse på hjerneslag, det bør være nær samhandling mellom sykehus og helse- og omsorgstjenestene i kommunen, inkludert fastlege, og et rehabiliteringstilbud i hjemmet, eventuelt kombinert med rehabilitering i dagavdeling, bør tilstrebes.
Tiltaket må inkludere:
- å kartlegge utfordringer i pasientens hjemmemiljø
- å utforme en individuelt tilpasset rehabiliteringsplan basert på kartleggingen
- å bruke hjemmemiljøet aktivt i rehabiliteringen
- at helsepersonell med spesialkompetanse på hjerneslag – tverrfaglig sammensatt for å imøtekomme pasientens individuelle behov – fortløpende evaluerer utviklingen og tilpasser tiltak
Rehabiliteringen planlegges og gjennomføres i samråd med pasienten og pårørende og har som hovedmål å øke pasientens funksjonsnivå når det gjelder aktivitet og deltakelse.
Varigheten av tilbudet vil vanligvis være minst en måned, og det kan fortsette frem til den polikliniske kontrollen i spesialisthelsetjenesten. Ytterligere rehabiliteringstiltak vurderes individuelt.
Hva som er «tidlig utskrivning» kan variere ut fra individuelle forhold. Hovedfokus med tiltaket er ikke spesielt tidlig utskrivning, fordi liggetiden i slagenhet i Norge allerede er kort. Derimot må støtten som gis når pasienten utskrives noe tidligere enn uten tiltaket vektlegges.
Med «tett oppfølging» menes minimum ukentlig kontakt, men som regel flere ganger per uke og opp til daglig.
Med «tverrfaglig ambulerende slagteam» menes tre til fire faggrupper med spesialkompetanse på hjerneslag, vanligvis ergoterapeut, fysioterapeut og sykepleier, samt tilgang på logoped, lege og sosiale tjenester. Et slikt team vil ofte ha en fast sammensetning av faggrupper, der andre må dras inn i rehabiliteringen ved behov. Rehabiliteringstilbudet foregår som regel i hjemmet, men kan være supplert med rehabilitering i dagavdeling e.l. Det ambulerende teamet må ha en koordinerende og veiledende funksjon, og det fungerer således som et sikkerhetsnett og koordinerer også nødvendige tilbud fra andre aktører. I dette inngår arbeid med individuell plan der aktuelt. Teamet kan i tillegg også ha en behandlingsfunksjon – dette vil variere ut fra praktiske og lokalse forhold.
Et sentralt aspekt ved tidlig støttet utskrivning er tett samhandling mellom spesialisthelsetjenesten og helse- og omsorgstjenestene i kommunen der begge oppfyller sitt oppfølgingsansvar med pasienten i sentrum, uavhengig av om tilbudet formelt utgår fra kommune- eller spesialisthelsetjenesten. Dette sikrer kontinuitet og inkluderer bl.a. direkte kontakt mellom involvert helsepersonell om faglige forhold hos den individuelle pasienten. Det vises til veiledningsplikten.
Det forutsettes en poliklinisk kontroll i spesialisthelsetjenesten der både medisinske aspekter (sekundærforebygging) og videre rehabiliteringsbehov blir adressert. Se også anbefaling om kontroll etter gjennomgått hjerneslag i i behandlingskjeden.
For nærmere detaljer om tidlig støttet utskriving vises det også til en internasjonal konsensus[310] .
Se også: http://stroke.ahajournals.org/content/42/5/1392.sh...)
Se også veileder om habilitering og rehabilitering, individuell plan og koordinator, og pasient- og brukerrettighetsloven
Begrunnelse – dette er anbefalingen basert på
Rehabilitering etter hjerneslag foregår tradisjonelt i sykehus og da som oftest ved egne slagenheter og spesialiserte rehabiliteringsavdelinger. Evidensgrunnlaget viser at tidligere utskrivning fra sykehus og rehabilitering i hjemmet med støtte fra et tverrfaglig team er et tiltak som kan være til nytte for pasienter med mild og moderat nedsatt funksjonsevne etter hjerneslag. Tidlig støttet utskrivning kan redusere andelen pasienter som er fysisk avhengig av hjelp og redusere andelen pasienter som har behov for sykehjem [310].
Per i dag har ca. 20 % av alle pasienter med hjerneslag tilbud om tidlig støttet utskrivning.
Evidensen som foreligger er basert på studier på tidlig støttet utskrivining i byer og bynære strøk. Om det gjennomføres på samme måte, er det grunn til å anta at de positive effektene også gjelder distriktskommuner. Anbefalingen er basert på «oppsummert forskning»/vurdering av kunnskapsgrunnlaget og arbeidsgruppens samlede erfaring og kunnskap.
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag
Tiltak (I): Tidlig støttet utskrivning
Sammenligning (C): Standard oppfølging/behandling
Beskrivelse av inkluderte studier
Tidlig støttet utskrivning er et tiltak der pasienter med hjerneslag reiser hjem fra sykehuset tidligere enn vanlig og mottar rehabilitering i hjemmemiljøet. En systematisk oversikt av 14 studier med 1957 deltakere (Fearon et al., 2012) viser at pasienter med hjerneslag som fikk tidlig støttet utskrivning var mer sannsynlige til å gjenvinne uavhengighet i daglig aktiviteter og å bli hjemmeboende på sikt enn de som fikk tradisjonell rehabilitering i sykehus. De beste resultatene ble sett med godt organiserte støtteteam og hos pasienter med mindre alvorlige slag.
Det var liten forskjell mi selvopplevd fysisk helse mellom pasienter med tidlig støttet utskrivning og de med standard behandling. Tilsvarende var det liten forskjell i pasientenes sinnsstemning, men en studie viste tendens til at de med tidlig støttet utskrivning opplevde mer angst. Tidlig støttet utskrivning gir færre liggedøgn på sykehus etter hjerneslag, mens antall reinnleggelser kan øke noe.
Tidlig støttet utskriving av slagpasienter er estimert til i snitt å gi åtte færre dødsfall per 1000 slagpasienter (fra 30 færre til 23 flere dødsfall) per år. Effektestimatet (dvs. død) er basert på data fra 1957 deltakere i 14 randomiserte kontrollerte studier som varte fra 3 til 12 måneder. Fordi det totalt sett var få hendelser (liten informasjonsstørrelse) og konfidensintervallet krysser grensen for ingen forskjell i effekt (dvs. null), er det noe tvil om hvor sikkert effektestimatet er. Tiltroen til estimatet er derfor moderat.
Tidlig støttet utskrivning av slagpasienter er estimert til i snitt å gi 55 færre pasienter som dør eller blir avhengige av fysisk hjelp til basale daglige gjøremål per 1000 slagpasienter (fra 97 færre til 8 flere) per år. Basale daglige gjøremål er definert som hjelp til forflytning, mobilitet, vasking/stell, påkledning eller toalettbesøk (engelsk: basic ADL). Estimatet er basert på data fra 1957 deltakere i 14 randomiserte kontrollerte studier som varte fra 3 til 12 måneder. Tiltroen til dette estimatet er høy. Hvis man tar i betraktning at det er åtte færre som dør (se avsnittet over), er det 47 flere pasienter (55-8=47) som blir selvhjulpne med tidlig støttet utskrivning.
Tidlig støttet utskrivning av slagpasienter er estimert til i snitt å gi 38 færre (fra 71 færre til 0 flere) som dør eller får behov for behandling/omsorg i institusjon per 1000 slagpasienter per år. Estimatet er basert på data fra 1758 deltakere i 12 randomiserte kontrollerte studier som varte fra 3 til 12 måneder. Tiltroen til dette estimatet er høy. Hvis man tar i betraktning at det er åtte færre som dør per år (se første avsnitt), er det 30 færre pasienter (38-8=30) som trenger sykehjemsplass med tidlig støttet utskriving per år.
Det er estimert lite forskjell i hverdagsaktivitet mellom pasienter med tidlig støttet utskrivning og de med standard behandling/oppfølging målt på Barthel skala (ADL). Måten dette er regnet ut på (standardisert gjennomsnitt) viser bare eventuelle forskjeller på gruppenivå og ikke antall pasienter som skårer/ikke skårer på daglig aktivitet. Tiltroen til estimatet er høy.
Pasienter med tidlig støttet utskrivning lå i snitt syv dager mindre (fra 4 til 10 dager mindre) på sykehus enn de som fulgte standard behandling og oppfølging. Estimatet (dager på sykehus) er basert på 1695 deltakere i 13 randomiserte-kontrollerte studier som varte fra 3 til 12 måneder. Fordi det var uforklarlige forskjeller mellom studiene, er det noe tvil om hvor sikkert effektestimatet er. Tiltroen til estimatet er derfor moderat.
Tidlig støttet utskrivning av pasienter med hjerneslag er estimert til i snitt å gi 49 flere (fra 12 færre til 115 flere) reinnleggelser per 1000 pasienter per år. Estimatet er basert på data fra 918 deltakere i 7 randomiserte kontrollerte studier som varte fra 3 til 12 måneder. Fordi konfidensintervallet er veldig vidt (fra 12 færre til 115 flere), er det noe tvil om hvor sikkert effektestimatet er. Tiltroen til estimatet er derfor moderat.
Andre opplysninger i denne reviewen:
Når hverdagsaktivitet ble målt på en utvidet skala (E-ADL), viste pasientene som hadde fått støtte og hjelp av et team etter tidlig utskrivning, en tendens til høyere skåre.
Det var liten forskjell i hvordan pasienter med tidlig støttet utskrivning og de med standard behandling oppga at de opplevde den fysiske helsen sin. Tilsvarende var det liten forskjell i pasientenes sinnsstemning, men en studie viste tendens til at de med tidlig støttet utskrivning opplevde mer angst.
Vurdering
Fordeler og ulemper
Fordeler
Færre innleggelser ved sykehjem og økt selvhjulpenhet (lav institusjonaliseringsgrad) vurderes som svært vesentlige ønskede forventede effekter av tidlig støttet utskriving sammenlignet med vanlig oppfølging.
Ulemper
Det er mulig noen flere reinnleggelser per år ved tidlig støttet utskrivning.
Konklusjon:
Fordelene oppveier ulempen
Kvalitet på dokumentasjonen
Tilliten til effektestimatene er samlet sett moderat. Det er høy tiltro til estimatene for død eller fysisk avhengighet; død eller behov for behandling ved institusjon, samt aktiviteter i dagliglivet. Tiltro til estimatene for død, lengde på sykehusopphold og antall reinnleggelser er moderat.
Verdier og preferanser
Effekten av tidlig støttet utskrivning i forhold til vanlig rehabilitering kan måles som bl.a. dødelighet, fysisk avhengighet av hjelp, aktivitet i dagliglivet, lengden på første sykehusinnleggelse og antall reinnleggelser. Dødelighet, grad av institusjonalisering og aktivitet i dagliglivet er viktige utfallsmål ved tidlig støttet utskrivning. Reinnleggelser kan oppleves traumatiserende for en del pasienter og antall reinnleggelser derfor også er et viktig utfallsmål. For noen pasienter kan lengden på første sykehusopphold som følge av hjerneslaget, være av mindre betydning i forhold til utfallsmålene institusjonaliseringsgrad og aktivitet i dagliglivet. Det er ikke holdepunkter for at tiltaket medfører økt belastning for pårørende. Støtten kan kompensere for at noen pasienter med hjerneslag kan utskrives fra sykehus for tidlig. Tiltaket forutsetter god dialog mellom spesialist- og helse- og omsorgstjenestene i kommunene.
Referanser
309. Services for reducing duration of hospital care for acute stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195654
3. Early Supported Discharge Trialists. Services for reducing duration of hospital care for acute stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195348
310. A Consensus on Stroke https://www.helsedirektoratet.no/referanse/0002-0013-195655
Sist faglig oppdatert: 21.12.2017
Spesialisert, døgnbasert rehabilitering i spesialisthelsetjenesten
Pasienter med hjerneslag som har behov for spesialisert døgnbasert rehabilitering i forlengelse av akuttoppholdet, bør få tilbud om innleggelse i rehabiliteringsenhet i spesialisthelsetjenesten.
SIGN: A1a.
.
Praktisk – slik kan anbefalingen følges
En rehabiliteringsenhet i spesialistenheten, bør ha spesiell kompetanse på rehabilitering ved hjerneslag, og ha som oppgave:
• å gi et tilbud til de pasientene som trenger spesialisert rehabilitering etter behandling i slagenhet
• å gi tilbud for utvalgte pasienter i senfase, både utredning, eksempelvis førerkortvurdering, skole, arbeid, og for spesifikke tiltak for å nå konkrete mål
• å gi veiledning til pasienter og pårørende samt samarbeidspartnere i helse- og omsorgstjenestene i kommunene og andre instanser [21].
• å utrede henviste pasienter fra allmennleger ev. fra andre sykehus- /sykehjemsavdelinger
• tilby og evt. utarbeide individuell plan for pasienter med behov for langvarige og koordinerte tjenester
De fleste pasienter med behov for spesialisert rehabilitering vil pga. funksjonsutfall ha behov for et døgntilbud initialt. Dersom pasienten har mulighet til å bo hjemme, bør pasienten lenger ut i rehabiliteringsforløpet få et dagtilbud eller et poliklinisk tilbud.
Tilbud i spesialisthelsetjenesten gis både i sykehus/sykehusavdelinger og i rehabiliteringsinstitusjoner med avtale med de regionale helseforetak. Hver region har en regional koordinerende enhet som gir nærmere informasjon om tilbudet i regionen, se deres respektive nettsider eller ring grønt nummer 800 300 61.
Se også veileder om pårørende i helse- og omsorgstjenesten, forskriften §4 om brukermedvirkning og pasient- og brukerrettighetsloven
Begrunnelse – dette er anbefalingen basert på
Pasienter med alvorlige utfall eller funksjonssvikt etter hjerneslag vil ofte trenge videre rehabilitering i sykehus. Effekten av spesialisert tverrfaglig rehabilitering i sykehus er godt dokumentert hvis pasientene samles i en egen enhet i rehabiliteringsavdelingen, slik at organiseringen blir tilsvarende det som internasjonalt er betegnet som rehabiliteringsslagenhet [1] [20] (SIGN:1a). Det er viktig at personalet har kompetanse om slag og slagrehabilitering, da spesialopplært personale ser ut til å være viktig for å oppnå de beste resultatene [1] [20] (1,3).
En slik rehabiliteringsavdeling bør være organisert med tverrfaglig team med generell rehabiliteringskompetanse og spesiell kompetanse i slagrehabilitering og kognitiv rehabilitering. Avdelingen bør ha spesialist i fysikalsk medisin og rehabilitering, nevrolog eller geriater, sykepleier, fysioterapeut, ergoterapeut, logoped, nevropsykolog og sosionom. Avdelingen bør ha kontakt med ernæringsfysiolog, hjelpemiddelsentral, ortopediingeniør, synspedagog, øyelege og andre relevante tjenester ved behov.
Det finnes noe kunnskap når det gjelder hvem som bør få tilbud om behandling i spesialisthelsetjenesten [1] [20] . I post-akuttfasen vil dette gjelde pasienter som har behov for multiple diagnostiske og terapeutiske intervensjoner som ikke er tilgjengelige i kommunen, har en medisinsk tilstand som krever oppfølging i sykehus og/eller har et så stort hjelpebehov at rehabiliteringen må organiseres slik at adekvat hjelp kan gis 24 t i døgnet. Pasienter med alvorlige sensomotoriske utfall, kognitive utfall og/eller språkproblemer, høy risiko for ernæringsdefisitt og alvorlige blære-/tarmproblemer, vil være eksempler på pasienter som kan være aktuelle for rehabilitering i sykehus. Likeså pasienter i yrkesaktiv alder som trenger en spesifikk yrkesrettet rehabilitering eller spesifikke intensive treningsopplegg.
Se også forskrift om habilitering og rehabilitering kap. 4.
Forskningsgrunnlag
Populasjon (P): Pasienter som har behov for spesialisert døgnbasert rehabilitering i forlengelse av akuttoppholdet
Tiltak (I): Rehabiliteringsopphold i spesialisthelsetjenesten som innehar spesialkompetanse innen slag
Sammenligning (C): Kommunal rehabilitering og rehabilitering uten spesialkompetanse innen hjerneslag
Beskrivelse av inkluderte studier
Referanser
1. Organised inpatient (stroke unit) care for stroke. https://www.helsedirektoratet.no/referanse/0002-0013-195346
20. Does the organization of postacute stroke care really matter? https://www.helsedirektoratet.no/referanse/0002-0013-195365
21. Forskrift om habilitering og rehabilitering https://www.helsedirektoratet.no/referanse/0002-0013-195366
Sist faglig oppdatert: 21.12.2017
Høyspesialisert, døgnbasert rehabilitering ved sjeldne og spesielt kompliserte funksjonsutfall
Pasienter med sjeldne og spesielt kompliserte funksjonsutfall bør få høyspesialisert rehabilitering, f.eks. ved regional rehabiliteringsavdeling med særskilt kompetanse.
SIGN: D4.
Pasienter med locked-in syndrom bør henvises til nasjonal behandlingstjeneste.
Praktisk – slik kan anbefalingen følges
Informasjon om Nasjonal behandlingstjeneste for rehabilitering ved locked-in syndrom: https://www.sunnaas.no/fag-og-forskning/kompetansesentre-og-tjenester/locked-in-syndrom
Begrunnelse – dette er anbefalingen basert på
Noen pasienter med hjerneslag har funksjonsutfall som er av et slikt omfang eller art at de bør få tilbud om rehabilitering i en enhet med spesiell kompetanse. Eksempler på dette kan være pasienter med hjernestammeslag, pasienter med komorbiditet som krever spesialkompetanse mm. I hver helseregion bør det være en avdeling som har kompetanse og kapasitet til å gi et rehabiliteringstilbud til disse pasientene.
Pasienter med locked-in syndrom henvises til Nasjonal behandlingstjeneste for rehabilitering ved locked-in syndrom.
Forskningsgrunnlag
Populasjon (P): Pasienter med sjeldne og spesielt kompliserte funksjonsutfall, locked-in syndrom
Tiltak (I): Høyspesialisert rehabilitering ved regional rehabiliteringsavdeling eller nasjonal enhet med særskilt kompetanse
Sammenligning (C): Kommunal rehabilitering eller rehabilitering i vanlig spesialisthelsetjeneste
Beskrivelse av inkluderte studier
Referanser
307. VA Stroke Study Neurologist care is associated with increased testing but improved outcomes https://www.helsedirektoratet.no/referanse/0002-0013-195652
308. What role do neurologists play in determining the costs and outcomes of stroke patients? https://www.helsedirektoratet.no/referanse/0002-0013-195653
Sist faglig oppdatert: 21.12.2017
Tilbud i den kommunale helse- og omsorgstjenesten om døgn-, dag- og hjemmerehabilitering.
Alle kommuner bør tilby tverrfaglig døgn-, dag- og hjemmerehabilitering ut fra den slagrammedes individuelle behov, eventuelt i samarbeid med andre kommuner.
SIGN: D4.
Praktisk – slik kan anbefalingen følges
Rehabiliteringstjenestene bør være organisert i egne enheter med eget tverrfaglig personale. Frisklivssentralene bør være en del av det totale rehabiliteringstilbudet, gjerne samorganisert med dette. Uavhengig av arena gjennomføres rehabiliteringen i tråd med faglige anbefalinger - samordnet, tverrfaglig og planmessig, med tilstrekkelig intensitet og ut ifra et pasient- og brukerperspektiv. Fokus bør være målrettet, oppgaverelatert trening, som gis i motiverende og stimulerende omgivelser. Informasjon om levevaner og ernæring bør inngå i tilbudet.
Det bør være regelmessig kontakt med fastlegen som er ansvarlig for den medisinske rehabiliteringen.
Hjemme- og dagrehabilitering
Forutsatt tilstrekkelig funksjonsnivå bør hjemmet være foretrukket arena for rehabilitering. Likevel kan bygningsmessige forhold, pårørendes mulighet til støtte og oppfølging, samt rehabiliteringsteamets ressurser til oppfølging i hjemmet være hindringer for optimal effekt. Hver kommune, eventuelle samarbeidende kommuner, bør ha ett eller flere rehabiliteringsteam med ansvar for hjemmebasert rehabilitering. Dette teamet bør bestå av lege, fysioterapeut, ergoterapeut og sykepleier, samt tilgang til logoped og sosionom ved behov. Det kan være hensiktsmessig med tett samarbeid med sykehusets rehabiliteringsteam om enkeltpersoner, både den første tiden etter utskrivning fra sykehus/rehabiliteringsinstitusjon og ved behov for veiledning senere i rehabiliteringsforløpet.
Hjemmebasert rehabilitering kan også gis som, eller i kombinasjon med, et dagtilbud. Det kan være lettere å gi rehabilitering av god kvalitet når flere personer rammet av hjerneslag er samlet i en dagavdeling. Sosiale aspekter kan øke trivsel og motivasjon. Daggrupper kan også egne seg som et vedlikeholdstilbud til slagrammede. Det kan være rom for individuell behandling i gruppene. Dagtilbud krever en tilfredsstillende transportordning og forutsetter akseptable avstander fra hjemmet til dagavdelingen slik at ikke selve transporten blir en for stor belastning.
Institusjonsbasert rehabilitering
Institusjonsbasert rehabilitering bør skje i egne kommunale rehabiliteringsavdelinger/-sentre. Hensikten er å sikre tilstrekkelig kompetanse og fokus på rehabilitering. Interkommunalt samarbeid kan være nødvendig for å skape et godt nok rehabiliteringstilbud. Det bør samarbeides med andre aktuelle kommunale aktører etter behov (fastlege, faggrupper utenfor kommunal rehabiliteringsavdeling/-senter, koordinerende enhet for habilitering og rehabilitering, søknadskontor/forvalterkontor, ambulerende rehabiliteringsteam, opplæringsetat, pleie- og omsorgstjenesten, NAV, senter for attføring m.fl.).
Sykehjem
Vurderingen av hvilke personer som skal tilbys opphold i sykehjem, må baseres på en faglig vurdering og personens og pårørendes ønsker. Vedvarende store utfall med komplette lammelser, store kognitive utfall, manglende evne til å motta instruksjon og uttalt blære-/og eller tarminkontinens er faktorer som ofte medfører at en person ikke kan nyttiggjøre seg intensiv eller spesialisert rehabilitering. Sykehjem bør også tilby fysio-/ergoterapi i form av funksjonstrening og kompenserende tiltak, et stimulerende miljø og kompetent pleiepersonale, slik at funksjoner kan vedlikeholdes og om mulig bedres.
Se også veileder og habilitering og rehabilitering, individuell plan og koordinator, forskrift om habilitering og rehabilitering kap.3, forskriften §4 om brukermedvirkning og pasient- og brukerrettighetsloven
Begrunnelse – dette er anbefalingen basert på
På bakgrunn av funksjon og behov vil personer rammet av hjerneslag ha ulike behov for rehabilitering. Kommunene, eventuelt i et samarbeid mellom flere kommuner, bør derfor ha tilbud om både døgn-, dag- og hjemmerehabilitering.
Hjemme- og dagrehabilitering
Rehabilitering i hjemmet fremmer autonomi, uavhengighet og reintegrering i samfunnet [153] (SIGN:1a) og kan sies å være den optimale rehabiliteringsarena for personer med lettere til moderat funksjonssvikt. I tillegg til den slagrammede blir også pårørende aktive medlemmer i rehabiliteringsteamet. Det finnes god dokumentasjon for effekten av trening rettet mot ADL hos hjemmeboende slagpasienter utført av fysioterapeut, ergoterapeut og tverrfaglige team [153] [172] [27] (SIGN:1a).
Ved hjemmebasert rehabilitering skjer rehabiliteringen i hjemmet og/eller i form av et dagtilbud. Studier har ikke vist noen forskjell i effekt på de to modellene [23] [22] [26] [24] [25] (SIGN: 1a-1b). Muligens er en kombinasjon av metodene mest effektiv, men her trengs mer forskning før sikre konklusjoner kan trekkes.
Studiene som er gjort på dagrehabilitering har vært sprikende og har ikke gitt grunnlag for konklusjoner om effekt sammenlignet med andre rehabiliteringstilbud [312] (SIGN: 1a). ESD-studiene tyder på bedre effekt av dagrehabilitering enn av institusjonsrehabilitering på døgnbasis [50] (SIGN:1b).
Institusjonsbasert rehabilitering: For personer med alvorlige utfall/funksjonssvikt, stort omsorgsbehov og/eller når hjemmet av andre grunner er uegnet som rehabiliteringsarena, kan institusjonsbasert rehabilitering være nødvendig for å kunne heve funksjonsnivået.
Sykehjem: Sykehjem kan være et tilbud til personer rammet av slag der funksjonssvikten er så stor at utskrivning til hjemmet ikke lar seg gjennomføre. Rehabilitering kan være forsøkt eller personen kan være vurdert til å ikke kunne nyttiggjøre seg intensiv eller spesialisert rehabilitering.
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag med behov for kommunal rehabilitering
Tiltak (I): Døgn-, dag- og hjemmerehabilitering organisert i egen avdeling med eget tverrfaglig personale
Sammenligning (C): Standard kommunal rehabilitering
Beskrivelse av inkluderte studier
Referanser
172. Occupational therapy for patients with problems in personal activities of daily living after stroke: systematic review of randomised trials https://www.helsedirektoratet.no/referanse/0002-0013-195517
312. Effects of day-hospital rehabilitation in stroke patients: a review of randomized clinical trials https://www.helsedirektoratet.no/referanse/0002-0013-195657
153. Therapy-based rehabilitation services for stroke patients at home https://www.helsedirektoratet.no/referanse/0002-0013-195498
22. Shared responsibility for ongoing rehabilitation: a new approach to home-based therapy after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195367
23. Home rehabilitation after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195368
24. Medical day hospital care for the elderly versus alternative forms of care https://www.helsedirektoratet.no/referanse/0002-0013-195369
25. Evaluation of a multiprofessional community stroke team: a randomized controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195370
26. Stroke rehabilitation after hospital discharge: a randomized trial comparing domiciliary and day‐hospital care https://www.helsedirektoratet.no/referanse/0002-0013-195371
27. Individual patient data meta-analysis of randomized controlled trials of community occupational therapy for stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195372
50. Stroke unit care combined with early supported discharge https://www.helsedirektoratet.no/referanse/0002-0013-195395
Sist faglig oppdatert: 21.12.2017
Opplæringstilbud i kommunen til slagrammede med ervervede språk- og kommunikasjonsvansker
Alle kommuner, eventuelt sammen med andre kommuner, skal ha et opplæringstilbud til slagrammede med ervervede språk- og kommunikasjonsvansker (lovhjemlet: [322]). Tilbudet bør organiseres slik at det er tilgang til logopedtjenester umiddelbart etter utskrivning fra sykehuset for å sikre kontinuitet i opplæringen.
SIGN: D4.
Praktisk – slik kan anbefalingen følges
Voksne med rettigheter etter opplæringslovens kap. 4A (https://lovdata.no) har rett til rådgivning for å kartlegge hvilke tilbud den enkelte har behov for. Opplæringen må ha et omfang, et innhold og en varighet som gir den voksne sjanse til å nå de mål som er realistiske . Se opplæringsloven (https://lovdata.no). Spesialundervisning kan være nødvendig og blir i så fall gitt på bakgrunn av en sakkyndig vurdering. Pedagogisk-psykologisk tjeneste (PPT) er ansvarlig for at det utarbeides sakkyndige vurderinger, og kommunen fatter vedtak om spesialundervisning. Det er rett til gratis skyss i forbindelse med opplæring hjemlet i loven (431).
Det kan være vanskelig for små kommuner å opprette adekvat tilbud til personer med ervervede språk- og talevansker, og interkommunale løsninger kan ofte være det mest hensiktsmessige [321].
Folketrygdloven (§ 5-10) har bestemmelser om behandling av språk- og talevansker. Disse bestemmelsene er et alternativ eller supplement til de tilbudene som er hjemlet i opplæringsloven [321], og gis på bakgrunn av henvisning fra lege. For å kunne innvilge søknad om logoped, må NAV ha bekreftelse fra kommunen om at de ikke kan gi et tilbud til den aktuelle bruker. Tjenestene som privatpraktiserende logopeder tilbyr, kan ofte etableres raskt og avhjelpe et akutt behov for intensiv behandling [321].
Statlig spesialpedagogisk støttesystem (Statped)
Statped bistår i de tilfeller hvor det ikke kan forventes at kommunen selv har kompetanse. Flere av Statped-sentrene gir tilbud til personer med afasi. Det ytes individuelle tjenester i form av utredning og kartlegging av språkvanskene, rådgivning og veiledning til pårørende og lokale fagfolk.
Det gis også bistand til utredning av kognitiv funksjon etter hjerneslag når f.eks. den slagrammede ønsker å komme i jobb eller utdanning igjen.
Som hovedregel er det kommunene ved opplæringsansvarlig, PPT eller sentra for voksenopplæring som søker bistand fra Statped. Brukere kan også henvises via NAV, og i noen grad fra helse- og sosialtjenesten. Rettighetene er hjemlet i opplæringsloven. Se opplæringsloven (https://lovdata.no).
Begrunnelse – dette er anbefalingen basert på
Voksne som på grunn av sykdom eller skade har behov for fornyet opplæring, har rett til det [322]. For voksne med språk- og talevansker har opplæringsetaten et spesielt ansvar. Det er viktig at tilbudet blir utformet slik at det ivaretar et omfattende behov i en tidlig fase etter sykdom eller skade. [313] (SIGN:1a)
Forskningsgrunnlag
Populasjon (P): Mennesker med ervervede språk- og kommunikasjonsvansker
Tiltak (I): Kommunalt tilbud om logopedtjenester umiddelbart etter utskrivning fra sykehus
Sammenligning (C): Ingen kommunal språkopplæring
Beskrivelse av inkluderte studier
Referanser
313. A meta-analysis of clinical outcomes in the treatment of aphasia https://www.helsedirektoratet.no/referanse/0002-0013-195658
321. Språk- og talevansker hos voksne: veileder til kommunene https://www.helsedirektoratet.no/referanse/0002-0013-195666
322. Opplæringslova med forskrifter: forarbeid og kommentarer. Lov om grunnskolen og den vidaregåande opplæringa (opplæringslova); forskrifter til opplæringslova. https://www.helsedirektoratet.no/referanse/0002-0013-195667
Sist faglig oppdatert: 21.12.2017
Tilbud om funksjonsvurdering og rådgivning fra spesialisthelsetjenesten til slagrammede, pårørende og kommune i senfasen
Spesialisthelsetjenesten bør i senfasen ved behov gi et tilbud som omfatter vurdering av funksjonsnivå, revurdering av målsettinger og rådgivning til den slagrammede og pårørende og eventuelt til helse- og omsorgstjenestene i kommunene.
Praktisk – slik kan anbefalingen følges
Ved nyoppståtte problemer, komplikasjoner, forverring i funksjon eller varig funksjonsnedsettelse der videre tiltak kan være aktuelle, vil det være rimelig å henvise til spesialisthelsetjenesten for vurdering, rådgivning og ev. tiltak utover det som tilbys i den kommunale helse- og omsorgstjenesten. Ved enkelte pasienter som initialt får rehabilitering i spesialisthelsetjenesten og der varig funksjonsnedsettelse og videre rehabiliteringsbehov forventes, vil det være avtalt i oppfølging i spesialisthelsetjenesten.
For kartlegging, vurdering og rådgiving er det mest aktuelt med poliklinisk tilbud, ev. ambulant, og i spesielle tilfeller innleggelse.
Veiledningsplikten tilsier også at rådgivning og kommunikasjon mellom spesialisthelsetjenesten og kommunen er sentral.
Se også forskrift om habilitering og rehabilitering §22 om koordinator i spesialisthelsetjenesten
Begrunnelse – dette er anbefalingen basert på
Observasjonsstudier viser at den største funksjonsbedringen ved et godt initialt rehabiliteringstilbud oftest oppnås i løpet av 3-6 måneder etter hjerneslaget. Flere studier tyder imidlertid på at bedring i ADL, fysisk funksjonsnivå, kognisjon og kommunikasjonen også kan finne sted etter denne fasen. Det kan derfor for en del pasienter være grunnlag for en fornyet tverrfaglig funksjonsvurdering i spesialisthelsetjenesten for å ta stilling til evt. nye tiltak
Forskningsgrunnlag
Populasjon (P): Slagrammede i senfase
Tiltak (I): Funksjonsvurdering fra spesialisthelsetjenesten
Sammenligning (C): Ingen ny funksjonsvurdering
Beskrivelse av inkluderte studier
Referanser
314. A treadmill and overground walking program improves walking in persons residing in the community after stroke: a placebo-controlled, randomized trial https://www.helsedirektoratet.no/referanse/0002-0013-195659
315. Therapy‐based rehabilitation services for patients living at home more than one year after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195660
316. Recovery plateau following stroke: fact or fiction? https://www.helsedirektoratet.no/referanse/0002-0013-195661
153. Therapy-based rehabilitation services for stroke patients at home https://www.helsedirektoratet.no/referanse/0002-0013-195498
317. Functional outcome 3 months after stroke predicts long-term survival https://www.helsedirektoratet.no/referanse/0002-0013-195662
318. High-intensity resistance training improves muscle strength, self-reported function, and disability in long-term stroke survivors https://www.helsedirektoratet.no/referanse/0002-0013-195663
319. Impact of functional status at six months on long term survival in patients with ischaemic stroke: prospective cohort studies https://www.helsedirektoratet.no/referanse/0002-0013-195664
320. Effectiveness of an intensive outpatient rehabilitation program for postacute stroke patients1 https://www.helsedirektoratet.no/referanse/0002-0013-195665
Sist faglig oppdatert: 21.12.2017
Prosesser i slagrehabilitering
Involvering av slagrammede og deres pårørende
Både den slagrammede og de pårørende bør involveres tidlig i rehabiliteringsprosessen.
SIGN: D4.
Begrunnelse – dette er anbefalingen basert på
Involvering av bruker og pårørende og det tverrfaglige teamet skal fremme en aktiv og selvbestemt deltakelse i rehabiliteringsprosessen og også ivareta pårørendes behov i den aktuelle situasjonen. Møter bør være regelmessige og avvikles etter en møteplan. Konklusjoner fra møtene bør dokumenteres i journalen [362];[357];[359];[358];[361];[360];[8].
Se også Veileder om pårørende i helse og omsorgstjenesten, forskrift om habilitering og rehabilitering § 4 og pasient - og brukerrettighetsloven
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag og deres pårørende.
Tiltak (I): Involvering av pasient og pårørende.
Sammenligning (C): Ingen Involvering av pasient og pårørende.
Beskrivelse av inkluderte studier
Referanser
8. What are the components of effective stroke unit care? https://www.helsedirektoratet.no/referanse/0002-0013-195353
357. Time and difficulty of tasks provided by family caregivers of stroke survivors https://www.helsedirektoratet.no/referanse/0002-0013-195702
358. Community reintegration after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195703
359. Caregiving problems and feelings experienced by family caregivers of stroke survivors the first month after discharge https://www.helsedirektoratet.no/referanse/0002-0013-195704
360. A meta-analysis of interventions for informal stroke caregivers https://www.helsedirektoratet.no/referanse/0002-0013-195705
361. Stroke: the increasing complexity of carer needs https://www.helsedirektoratet.no/referanse/0002-0013-195706
362. Collaborative systematic review of the randomised trials of organised inpatient (stroke unit) care after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195707
Sist faglig oppdatert: 21.12.2017
Verktøy for kartlegging og funksjonsvurdering av pasienter som har hatt hjerneslag
Ved slagrehabilitering bør det benyttes internasjonalt anerkjente og vanlig brukte tester både for kartlegging og for evaluering av tiltak. **
Praktisk – slik kan anbefalingen følges
Nedenfor presenteres noen tester som er reliabilitets- og validitetstestet, og som er vanlig å bruke i Norge og internasjonalt.
Det har tilkommet noen nye instrumenter for kartlegging av slagrammede siden utgaven av retningslinjen fra 2010. Men i tilknytning til denne revisjonen, er det ikke gjennomført en ny systematisk vurdering av dette.
Kartleggingsverktøy for bruk i akuttfasen som kan være relevant for den videre rehabilitering:
Kroppsfunksjon: National Institutes of Health Stroke Scale (NIHSS) [340]
Scandinavian Stroke Scale (SSS) [326]
Aktivitet: Barthel Index (BI) [499]
Global funksjon: Modified Rankin Scale (mRS) [343]
Tester for spesielle aspekter av rehabilitering etter hjerneslag:
a) Motorisk funksjon generelt
- Fugl-Meyer Assessment of stroke recovery [330]
- Motor Assessment scale [325]
- Motricity Index [327]
- Rivermead Motor Assessment [336]
b) Motoriske tester for hånd- og armfunksjon
- Fugl-Meyer Assessment of stroke recovery (arm) [330]
- Action Research Arm Test [338]
- Nine hole Peg Test [339]
- Frenchay Arm Test [332]
- Wolf Motor Function Test [350]
c) Motoriske tester for gangfunksjon og balanse
- Berg Balanse Skala [324]
- Timed up and go [342]
- 10 m gange [344]
- Functional Ambulation Categories [333]
d) Motoriske tester for truncuskontroll
- Trunc Impairment Scale [347]
- Trunc Control Test [370]
e) Tester for språk og tale
- Norsk grunntest for afasi [369]
- Pyramide- og Palmetesten (Pypat) [372]
- Ullevål afasiscreening test (UAS). (Test som er beregnet for sykepleiere) [373]
- Psykolingvistisk kartlegging av språkprosessering hos afasirammede (PALPA) (norsk oversettelse) [335]
- Frenchays dysartritest [329]
f) Kognitive tester
- Mini Mental Status Evaluering (MMSE, revidert norsk versjon) (462)
- Klokketest (462)
- Trail making A og B (462)
- Rivermead Behavior and Memory Test [349]
g) Vurdering av depresjon
- Montgomery and Aasberg Depression Rating Scale (MADRS) [341]
- Hospital Anxiety and Depression Scale (HADS) [351]
h) ADL funksjonsvurdering
- Functional Independence Measure (FIM) [331]
- I ADL Frenchay [348]
- Barthel Index (BI) [499]
i) Global funksjonsvurdering
- Modified Rankin Scale [343]
- Assessment of motor and process skills (AMPS) [371].
- Stroke impact scale (SIS) [328]
j) Bilkjøring
- Trail M aking test (TMT), Mini Mental Status Examination (MMSE), klokketest
- Se også Kognitiv svikt under "førerkort - veileder til helsekrav" fra Helsedirektoratet (2016)
Begrunnelse – dette er anbefalingen basert på
Det finnes ikke ett enkelt kartleggingsverktøy som dekker alle aspekter i forbindelse med funksjonsvurdering og rehabilitering av slagpasienter. ICF kan være et utgangspunkt, men behovet for kartlegging må være tilpasset den enkelte pasienten.
Krav til måleinstrumenter er at de må være reliable, valide og sensitive for endringer. Kjennskap til og ev. felles bruk av de samme standardiserte tester gir mange fordeler:
- enklere kommunikasjon med annet helsepersonell [334]
- testresultat kan gi grunnlag for valg av intervensjon [346]
- fremgang kan dokumenteres [346]
- forskningsresultater blir lettere å tolke [345]
Forskningsgrunnlag
Populasjon (P): Slagrammede
Tiltak (I): Kartlegging av ferdigheter
Sammenligning (C): Ingen evaluering av ferdigheter
Beskrivelse av inkluderte studier
Referanser
323. Functional evaluation: the barthel index, Maryland State https://www.helsedirektoratet.no/referanse/0002-0013-195668
324. The Balance Scale: reliability assessment with elderly residents and patients with an acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195669
325. Investigation of a new motor assessment scale for stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195670
326. The Scandinavian stroke scale predicts outcome in patients with mild ischemic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195671
327. Motor evaluation in vascular hemiplegia https://www.helsedirektoratet.no/referanse/0002-0013-195672
328. The stroke impact scale version 2.0 https://www.helsedirektoratet.no/referanse/0002-0013-195673
329. Frenchay dysartritest https://www.helsedirektoratet.no/referanse/0002-0013-195674
330. The post-stroke hemiplegic patient. 1. a method for evaluation of physical performance https://www.helsedirektoratet.no/referanse/0002-0013-195675
331. Advances in functional assessment for medical rehabilitation https://www.helsedirektoratet.no/referanse/0002-0013-195676
499. BDW, Functional evaluation: the Bartel Index https://www.helsedirektoratet.no/referanse/0002-0013-195844
332. Arm function after stroke: measurement and recovery over the first three months https://www.helsedirektoratet.no/referanse/0002-0013-195677
333. Clinical gait assessment in the neurologically impaired. Reliability and meaningfulness https://www.helsedirektoratet.no/referanse/0002-0013-195678
334. Clinical interpretation and use of stroke scales https://www.helsedirektoratet.no/referanse/0002-0013-195679
335. Psykolingvistisk kartlegging av språkprosessering hos afasirammede (PALPA)(Norsk oversettelse) https://www.helsedirektoratet.no/referanse/0002-0013-195680
336. Assessment of motor function in stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195681
338. A performance test for assessment of upper limb function in physical rehabilitation treatment and research https://www.helsedirektoratet.no/referanse/0002-0013-195683
339. Adult norms for the nine hole peg test of finger dexterity https://www.helsedirektoratet.no/referanse/0002-0013-195684
340. Modified National Institutes of Health Stroke Scale for use in stroke clinical trials https://www.helsedirektoratet.no/referanse/0002-0013-195685
341. A new depression scale designed to be sensitive to change https://www.helsedirektoratet.no/referanse/0002-0013-195686
342. The timed “Up & Go”: a test of basic functional mobility for frail elderly persons https://www.helsedirektoratet.no/referanse/0002-0013-195687
343. Cerebral vascular accidents in patients over the age of 60: II. Prognosis https://www.helsedirektoratet.no/referanse/0002-0013-195688
344. Responsiveness and predictability of gait speed and other disability measures in acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195689
345. Outcome assessment in randomized controlled trials of stroke rehabilitation https://www.helsedirektoratet.no/referanse/0002-0013-195690
346. The development of a clinical practice stroke guideline for physiotherapists in The Netherlands: a systematic review of available evidence https://www.helsedirektoratet.no/referanse/0002-0013-195691
347. Clinical tools to measure trunk performance after stroke: a systematic review of the literature https://www.helsedirektoratet.no/referanse/0002-0013-195692
348. Social activities after stroke: measurement and natural history using the Frenchay Activities Index https://www.helsedirektoratet.no/referanse/0002-0013-195693
349. The development and validation of a test battery for detecting and monitoring everyday memory problems https://www.helsedirektoratet.no/referanse/0002-0013-195694
350. Assessing Wolf motor function test as outcome measure for research in patients after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195695
351. The hospital anxiety and depression scale https://www.helsedirektoratet.no/referanse/0002-0013-195696
369. Norsk grunntest for afasi: håndbok https://www.helsedirektoratet.no/referanse/0002-0013-195714
371. Assessment of Motor and Process Skills. Vol. 1:Development, standardization, and administration manual https://www.helsedirektoratet.no/referanse/0002-0013-195716
Sist faglig oppdatert: 21.12.2017
Kartlegging og oppfølging av hjelpemidler etter hjerneslag
Slagrammedes behov for hjelpemidler bør kartlegges og følges opp gjennom rehabiliteringsforløpet.
SIGN: D4.
Praktisk – slik kan anbefalingen følges
Utlån av hjelpemidler formidles gjennom NAV Hjelpemiddelsentral som er etablert på fylkesbasis. De gir tilbud til brukere med vansker innenfor områdene syn, hørsel, bevegelse, kognisjon, kommunikasjon og yter tolketjenester til døve og døvblinde.
Hjelpemiddelsentralen har kompetanse om
• funksjonshemninger og konsekvensen av dem
• mulige løsninger
• produkter som finnes på markedet
• tilpasningsmuligheter
• muligheter for reparasjon, vedlikehold og gjenbruk
• tilrettelegging av det miljøet som hjelpemiddelet skal brukes i, både i hjemmet, på skolen, i arbeid og fritid.
Tilrettelegging for bruk av hjelpemidler skjer ofte som et ledd i den helhetlige rehabiliteringsprosessen som den slagrammede gjennomgår. Det vil derfor være den instans som til enhver tid tilbyr rehabilitering, som mest naturlig tar initiativ til utprøving av hjelpemidler og bistår i søknadsprosessen. Det er som oftest ergoterapeuten i det spesialiserte rehabiliteringsteamet eller i den kommunale helse- og omsorgshelsetjenesten som yter denne tjenesten.
I tilfeller der behovet for hjelpemidler er akutt, eller man er usikker på om behovet blir varig, er det kommunen som har ansvaret for å skaffe hjelpemidlene.
Ortopeditekniske tjenester blir levert av ortopeditekniske virksomheter, med ortopediingeniører og ortopediteknikere, og inkluderer tiltak for å begrense/avstemme/utligne/avhjelpe/redusere/oppheve funksjonsnedsettelser i støtte- og bevegelsesapparatet, samt rådgiving om og tilpassing av ortopediske hjelpemidler som bedrer funksjonsevnen.
Se også forskrift om habilitering og rehabilitering om koordinator i kommunen §21
Begrunnelse – dette er anbefalingen basert på
Mennesker med varige funksjonsnedsettelser har rett til hjelpemidler når disse er nødvendige og hensiktsmessige for å bedre funksjonsevnen i dagliglivet, skaffe/beholde arbeid eller bli pleiet i hjemmet. Retten er hjemlet i Lov om Folketrygd, og forvaltes av NAV.
Behovet for hjelpemidler bør vurderes kontinuerlig, avhengig av funksjons- og aktivitetsproblemer samt fase i rehabiliteringen.
(SIGN: D 4).
Forskningsgrunnlag
Populasjon (P): Slagrammede som kan ha rett til hjelpemidler
Tiltak (I): Kartlegging av behov og bistand til anskaffelse av hjelpemidler
Sammenligning (C): Ingen kartlegging av behov eller bistand til anskaffelse av hjelpemidler
Beskrivelse av inkluderte studier
Sist faglig oppdatert: 21.12.2017
Bruk av rehabiliteringsplan
Rehabiliteringsmål bør defineres i en rehabiliteringsplan og bør utarbeides sammen med pasient og pårørende basert på en omfattende tverrfaglig vurdering.
SIGN: C3.
Praktisk – slik kan anbefalingen følges
Å utarbeide realistiske mål og rehabiliteringsplaner er viktig. Arbeidet med rehabiliteringsplanen bør ta utgangspunkt i den enkeltes ønsker, ressurser, ferdigheter og kompetanse. Helsepersonell bidrar med kunnskap om prognose ved ulike utfall og funksjonssvikt, og kjennskap til effekter av trening og andre rehabiliteringstiltak.
En rehabiliteringsplan bør inneholde overordnede mål og delmål, tiltak for å oppnå målene, ansvarlig person for gjennomføring av tiltakene og tidspunkt for forventet måloppnåelse. Planen bør evalueres regelmessig for å evaluere måloppnåelse og justere, hhv. igangsette nye, tiltak. Den skal være skriftlig og være lett tilgjengelig for både pasient, pårørende og helsepersonell.
Arbeidet med målsettinger operasjonaliserer rehabiliteringsprosessen, fra et generelt ønske om bedring til eksplisitte målformuleringer. Mål bør være konkrete og utformet slik at det er mulig å evaluere om de er blitt oppnådd. Det foreslås å formulere såkalte "SMARTe" mål, der SMART kan stå for: spesifikt, målbart, akseptert (av alle), relevant og realistisk, og tidsavgrenset. Måloppnåelse er inspirerende og motiverende. Rehabiliteringstiltak kan rettes mot kroppsfunksjoner/-strukturer, aktiviteter og deltakelse, omgivelsesfaktorer og personlige faktorer.
Forståelsen av struktur, organisering og tilgjengelige ressurser på sykehus og i helse- og omsorgstjenestene i kommunene gjør en aktiv deltakelse for brukeren lettere.
Begrunnelse – dette er anbefalingen basert på
Tidlig planlegging av rehabilitering og definering av rehabiliteringsmål er en viktig del av behandlingen. Rehabiliteringsmål som blir definert og fulgt opp av et tverrfaglig team i samarbeid med pasienten og pårørende, fører til økt uavhengighet [7];[8].
Mange pasienter som har blitt rammet av hjerneslag vil ha behov for langvarige og koordinerte helse- og omsorgstjenester, og har dermed rett til å få utarbeidet individuell plan (IP). For denne pasientgruppen er det også særlig viktig med god samhandling. En mer detaljert rehabiliteringsplan kan være en delplan i IP.
Hos flerspråklige/ikke-norskspråklige slagrammede bør tolk inkluderes i planarbeidet.
Se også «Veileder om rehabilitering, habilitering, individuell plan og koordinator»
Forskningsgrunnlag
Populasjon (P): Pasienter med gjennomgått hjerneslag
Tiltak (I): Nedfelling av mål for rehabilitering i eget dokument
Sammenligning (C): Ingen bruk av rehabiliteringsplan
Beskrivelse av inkluderte studier
Referanser
7. Early supported discharge services for stroke patients: a meta-analysis of individual patients' data https://www.helsedirektoratet.no/referanse/0002-0013-195352
8. What are the components of effective stroke unit care? https://www.helsedirektoratet.no/referanse/0002-0013-195353
352. Motor recovery after stroke: a systematic review of the literature https://www.helsedirektoratet.no/referanse/0002-0013-195697
353. Goal setting in neurological rehabilitation: patients' perspectives https://www.helsedirektoratet.no/referanse/0002-0013-195698
354. Should patients participate in clinical decision making? An optimised balance block design controlled study of goal setting in a rehabilitation unit https://www.helsedirektoratet.no/referanse/0002-0013-195699
355. Probability of regaining dexterity in the flaccid upper limb https://www.helsedirektoratet.no/referanse/0002-0013-195700
356. Susceptibility to deterioration of mobility long-term after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195701
Sist faglig oppdatert: 21.12.2017
Evaluering av rehabiliteringstiltak
Systematisk evaluering av tiltak bør gjennomføres regelmessig så lenge rehabiliteringsprosessen varer.
SIGN: D4.
Begrunnelse – dette er anbefalingen basert på
Regelmessig evaluering i løpet av rehabiliteringsprosessen er en forutsetning for å kunne vurdere om tiltakene har noen effekt og bør foregå så lenge rehabiliteringsprosessen varer.
Det er en stor fordel om de samme evalueringsverktøy benyttes av alle aktørene gjennom hele rehabiliteringsprosessen. Se anbefaling om verktøy for kartlegging og funksjonsvurdering av pasienter som har hatt hjerneslag.
Hvis pasientene ikke oppnår rehabiliteringsmålene, bør følgende vurderes:
- justere målene
- forandre på intervensjonen
- avslutte intervensjoner rettet mot rehabiliteringsmålet
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag som får rehabilitering
Tiltak (I): Regelmessig evaluering av tiltak/behandling
Sammenligning (C): Ingen strukturert evaluering
Beskrivelse av inkluderte studier
Sist faglig oppdatert: 21.12.2017
Vurdering av behov for tiltak i senfasen.
Slagrammede som bor hjemme og har varige funksjonsnedsettelser bør i senfasen få vurdert sitt funksjonsnivå og om de kan ha nytte av videre tiltak for å forbedre eller opprettholde funksjon.
SIGN: B1a.
Praktisk – slik kan anbefalingen følges
Bruk av selvhjelpsprogrammer kan også være et godt alternativ [364].
Ved nyoppståtte problemer, komplikasjoner eller forverring i funksjon vil det være rimelig å henvise til spesialisthelsetjenesten (poliklinikk eller ambulant team, ev. avdeling; rehabiliteringsavdeling eller slagenhet) for vurdering og rådgivning.
Slagpasienters pårørende har i mange tilfelle behov for veiledning og oppfølging også i den senere fasen, og dette bør alltid tas med i betraktning i rehabiliteringen. Se også Veileder om pårørende i helse- og omsorgstjenesten.
Pasientorganisasjoner kan ha en viktig rolle i denne fasen. Se også anbefaling om «Informasjon og opplæring til slagrammede og deres pårørende» .
Begrunnelse – dette er anbefalingen basert på
Ut fra dagens kunnskap er det rimelig å konkludere med at den vesentlige bedringen i funksjonsnivået finner sted i løpet av de første 6 månedene [365].
De fleste pasientene kommer innenfor denne perioden til et punkt der de ikke lenger opplever vesentlig fremgang. Da er det vanlig å vurdere om rehabiliteringen med formål å øke det generelle funksjonsnivået bør avsluttes. Flere studier tyder imidlertid på at bedring i ADL og fysisk funksjonsnivå (mobilitet) også kan finne sted etter denne fasen [366];[363];[367]. Klinisk erfaring tilser at dette også kan gjelde f.eks. kognitiv og kommunikasjonsfunksjon. Det foreligger også en rekke mindre studier som finner at trening på spesifikke funksjoner kan føre til funksjonsbedring i senere faser, dette gjelder spesielt intensiv trening i form av korte perioder med høy intensitet. For noen intervensjoner foreligger det også systematiske oversiktsartikler som gir grunnlag for å foreslå tiltak hos utvalgte pasienter i den kroniske fasen, se anbefalinger om CIMT, anbefaling om intensiv språktrening og anbefaling om intensiv visuell skanning trening.
Forskningsgrunnlag
Populasjon (P): Hjemmeboende slagrammede som har avsluttet initial rehabilitering
Tiltak (I): Videre rehabilitering etter 6-12 mnd
Sammenligning (C): Ingen videre rehabilitering etter 6-12 mnd
Beskrivelse av inkluderte studier
Referanser
363. A treadmill and overground walking program improves walking in persons residing in the community after stroke: a placebo-controlled, randomized trial https://www.helsedirektoratet.no/referanse/0002-0013-195708
364. Strategies to enhance chronic disease self-management: how can we apply this to stroke? https://www.helsedirektoratet.no/referanse/0002-0013-195709
365. What determines good recovery in patients with the most severe strokes? https://www.helsedirektoratet.no/referanse/0002-0013-195710
366. High-intensity resistance training improves muscle strength, self-reported function, and disability in long-term stroke survivors https://www.helsedirektoratet.no/referanse/0002-0013-195711
367. Effectiveness of an intensive outpatient rehabilitation program for postacute stroke patients1 https://www.helsedirektoratet.no/referanse/0002-0013-195712
Sist faglig oppdatert: 21.12.2017
Sensorimotoriske forstyrrelser
Intensiv oppgaverelatert trening hos pasienter med motoriske problemer etter hjerneslag
Pasienter med motoriske problemer bør få intensiv oppgaverelatert trening som bør starte raskt etter slaget, og all personalet bør bidra i forbindelse med daglige gjøremål kombinert med fysioterapi og ergoterapi. Pasienter med pareser bør få spesifikk trening av muskelstyrke kombinert med oppgaverelatert trening for å bedre motorisk funksjon.
SIGN: A1a.
Praktisk – slik kan anbefalingen følges
Det finnes ikke evidens for at en global behandlingstilnærming er bedre enn en annen [381]. (Eksempler på globale behandlingstilnærminger er Propriocective Neuromuskulær Facilitering, Brunnstrøm-metoden, Bobath-konseptet og Motor Relearning Programme (MRP)).
Begrunnelse – dette er anbefalingen basert på
Oppgaverelatert trening kan defineres som konkret trening på de bevegelser, oppgaver og aktiviteter som pasienten har som mål å mestre [364]:[368]. Noen bruker begrepet funksjonell trening som betyr at oppgavene er knyttet til daglige praktiske gjøremål og at treningen er hensiktsmessig, sammensatt, variabel og gir mening [451]. I denne retningslinjen brukes begrepet oppgaverelatert trening gjennomgående om all trening som både er oppgaverelatert og funksjonell.
- Oppsummert forskning viser at følgende kriterier synes å være viktige for motorisk læring etter hjerneslag: [383] Oppgaverelatert trening, høy intensitet og tilstrekkelig mengde. Studier tyder på at oppgaverelatert trening for benfunksjon, gange og balanse og armfunksjon forbedrer motorisk funksjon. Den funksjonelle forbedringen er begrenset til det som trenes [378]:[389] (SIGN: 1a).
- Behandling som består av forskjellige komponenter fra ulike behandlingstilnærminger har vist seg å være mer effektiv enn ingen behandling når det gjelder motorisk funksjon av underekstremiteten og postural kontroll [386] (SIGN: 1a).
- Sittebalanse er viktig for selvstendighet i dagliglivets aktiviteter og er en prediktor for funksjon i den sammenheng [379];[380]. En studie viste at 29 % (n=338) av personer med slag hadde nedsatt sittebalanse 7-10 dager etter slaget [380]. Studier tyder på at trening som går ut på å strekke seg etter konkrete mål, bedrer balanse i sittende [389];[386];[382];[377];[376];[387] (SIGN: 1a). Studier som omhandler aktiviteter for å oppnå en mer symmetrisk sittestilling ved å strekke seg mot abstrakte mål viser ingen forbedring i balanse [387];[385] (SIGN: 1b).
- Om den motoriske funksjonen kan trenes opp, og i tilfelle hvor mye, er i stor grad avhengig av hvor uttalte paresene er i akuttfasen. Komplett paralyse eller meget uttalt parese indikerer ofte en dårlig prognose [352] (Valg av behandlingstiltak bør tilpasses pasientens problemer og muligheter).
- Muskulær styrke kan økes ved progressiv styrketrening alene [375];[374] (SIGN: 1a) og i kombinasjon med oppgaverelatert trening [390];[384] (SIGN: 1b). Evnen til å utføre hverdagsaktiviteter, balanse og utholdenhet kan også bedres ved styrketrening. Styrketrening kan være et egnet tiltak for pasienter som har tilstrekkelig funksjon til aktiv muskelkontraksjon for å utsette eller redusere sekundere komplikasjoner.
- Ulike former for elektrisk stimulering kan bidra til forbedret motorisk funksjon, men hvilken type elektrostimulering og hvilken dosering som er best egnet, er uavklart [388] (SIGN: 1a).
Forskningsgrunnlag
Populasjon (P): Slagrammede med nedsatt motorisk funksjon
Tiltak (I): Oppgaverelatert trening, treningsintensitet, styrketrening, elektrisk stimulering
Sammenligning (C): Ingen systematisk tilpasset trening eller ingen trening
Beskrivelse av inkluderte studier
Referanser
374. Strengthening interventions increase strength and improve activity after stroke: a systematic review https://www.helsedirektoratet.no/referanse/0002-0013-195719
375. Loss of strength contributes more to physical disability after stroke than loss of dexterity https://www.helsedirektoratet.no/referanse/0002-0013-195720
376. Sitting training early after stroke improves sitting ability and quality and carries over to standing up but not to walking: a randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195721
377. Task-related training improves performance of seated reaching tasks after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195722
378. Repetitive task training for improving functional ability after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195723
379. Sitting balance as an early predictor of functional improvement in association with depressive symptoms in stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195724
380. Disruption of sitting balance after stroke: influence of spoken output https://www.helsedirektoratet.no/referanse/0002-0013-195725
381. The effectiveness of the Bobath concept in stroke rehabilitation https://www.helsedirektoratet.no/referanse/0002-0013-195726
382. Stroke patients and long-term training: is it worthwhile? A randomized comparison of two different training strategies after rehabilitation https://www.helsedirektoratet.no/referanse/0002-0013-195727
383. Motor recovery after stroke: a systematic review https://www.helsedirektoratet.no/referanse/0002-0013-195728
384. Outcomes of progressive resistance strength training following stroke: a systematic review https://www.helsedirektoratet.no/referanse/0002-0013-195729
385. Training symmetry of weight distribution after stroke: a randomized controlled pilot study comparing task-related reach, Bo bath and feedback training approaches https://www.helsedirektoratet.no/referanse/0002-0013-195730
386. Physiotherapy treatment approaches for the recovery of postural control and lower limb function following stroke https://www.helsedirektoratet.no/referanse/0002-0013-195731
387. The effect of independent practice of motor tasks by stroke patients: a pilot randomized controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195732
388. Electrostimulation for promoting recovery of movement or functional ability after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195733
389. The impact of physical therapy on functional outcomes after stroke: what's the evidence? https://www.helsedirektoratet.no/referanse/0002-0013-195734
390. Task-oriented progressive resistance strength training improves muscle strength and functional performance in individuals with stroke https://www.helsedirektoratet.no/referanse/0002-0013-195735
352. Motor recovery after stroke: a systematic review of the literature https://www.helsedirektoratet.no/referanse/0002-0013-195697
364. Strategies to enhance chronic disease self-management: how can we apply this to stroke? https://www.helsedirektoratet.no/referanse/0002-0013-195709
368. Neural Darwinism: The theory of neuronal group selection https://www.helsedirektoratet.no/referanse/0002-0013-195713
451. Motorikk og samfunn: en samfunnsvitenskapelig tilnærming til motorisk atferd https://www.helsedirektoratet.no/referanse/0002-0013-195796
Sist faglig oppdatert: 21.12.2017
For pasienter som mottar døgnrehabilitering med målsetting om å bedre ADL-, gang- og/eller armfunksjon, foreslås minimum 3 timer målrettet trening 5 ganger i uka. (HØRING)
Anbefalingen gjelder for pasienter som mottar rehabilitering i døgnavdeling både i spesialist- og kommunehelsetjenesten og er basert på en tverrfaglig kartlegging av pasienten og utarbeidelse av definerte mål for rehabiliteringen ihht nasjonal anbefaling og ihht en pakkeforløp hjerneslag; etablering av rehabiliteringsplan. Anbefalingen gjelder for de fleste av pasientene som mottar døgnrehabilitering. Individuell vurdering må gjøres, men alle bør tilbys så mye trening som mulig ut fra pasientens forutsetninger
Målrettet trening kan gjennomføres som én-til-én- trening med helsepersonell med spesifikk kompetanse på rehabilitering som fysioterapeut eller ergoterapeut. Deler av treningen kan også gjennomføres av sykepleier eller annet helsepersonell som har kompetanse på rehabilitering eller veiledet av personell med spesifikk kompetanse på rehabilitering. Treningen kan også gjennomføres som gruppetrening veiledet av slik helsepersonell, eller egentrening. En forutsetning er at all denne treningen inngår i det tverrfaglige teamets strukturerte tilbud og er i samsvar med pasientens mål. I løpet av 3 hele timer med trening, bør det sikres minimum 2 timer med aktiv oppgaverelatert trening.
Pakkeforløp hjerneslag anbefaler for subakutt rehabilitering en median oppholdslengde i døgnrehabiliteringsavdeling på 4 uker (lenke). Også for døgnrehabilitering senere i forløpet foreslås minimum 3 timer målrettet trening 5 ganger i uka hvis målet er å bedre ADL-, gang- og/eller armfunksjon.
Praktisk – slik kan anbefalingen følges
Minimum 3 timers målrettet trening 5 ganger i uken foreslås å inngå i døgnrehabiliteringstilbud i både spesialist- og kommunehelsetjenesten. I treningstimer vil det også gå tid til annet enn aktiv trening, for eksempel veiledning, henting og justering av utstyr eller pauser. Minimum 2 av de 3 anbefalte timene satt opp til trening, forutsettes å gå til aktiv gjennomføring av øvelser.
Det forutsettes at den målrettede treningen er i samsvar med pasientens rehabiliteringsplan, og at den gjennomføres med helsepersonell som har spesifikk kompetanse på rehabilitering som ergoterapeut og/eller fysioterapeut. Deler av treningen kan også gjennomføres av sykepleier eller annet helsepersonell som har kompetanse på rehabilitering eller veiledet av personell med spesifikk kompetanse. Den anbefalte treningsmengden kan oppnås ved en kombinasjon av følgende tiltak:
- Én-til-én-trening med helsepersonell som har spesifikk kompetanse på rehabilitering som f eks fysioterapeut og ergoterapeut
- Trening med annet helsepersonellsom sykepleier eller annet helsepersonell som har kompetanse på rehabilitering eller som er veiledet av personell med spesifikk kompetanse på rehabilitering.
- ADL-trening med aktiv og oppgaverelatert trening, for eksempel i stell og måltidsituasjoner
- Gruppetrening i regi av helsepersonell som har kompetanse på rehabilitering
- Egentrening i form av et strukturert program som er laget av, og kontinuerlig tilpasses av, helsepersonell som har kompetanse på rehabilitering
- Bruk av rehabiliteringsteknologi, slik som robotassistert trening, spill- og virtual reality (VR)-teknologi og apper
Det er hensiktsmessig at deler av treningen har en intensitet som kan bidra til bedring av kondisjon og utholdenhet.
Ved oppgaveglidning er det viktig å sikre at tjenesten er av god kvalitet og faglig forsvarlig. Dette innebærer blant annet at treningsmetodene og -oppgavene kontinuerlig tilpasses pasientens progresjon. Ved egentrening har institusjonen et ansvar for å kontrollere og bidra til at denne faktisk gjennomføres. Opplæring i egentrening kan gjøre det enklere for pasienten å fortsette å trene i hjemlige omgivelser.
Det er viktig at det tverrfaglige teamet aktivt arbeider med å formidle til pasienter og eventuelt pårørende hva som anses som målrettet trening (jf. punktene over). Dette for å oppnå en felles forståelse og legge til rette for at pasienten aktivt bidrar til å få gjennomført den anbefalte treningsmengden.
Å være i stand til å gjennomføre aktiv rehabilitering er en forutsetning for å oppnå forventet nytte av døgnrehabilitering, jf. pakkeforløp hjerneslag. Noen pasienter vil likevel ikke være i stand til å gjennomføre den anbefalte treningsmengden. Årsaker kan for eksempel være komorbiditet eller økt trettbarhet i forbindelse med hjerneslaget. For at pasienten skal klare å oppnå den anbefalte treningsmengden kan treningen fordeles på mange korte økter per dag, legge inn hyppige pauser, utnytte ADL-situasjoner til trening og redusere bakgrunnsstøy. Individuelle vurderinger og tilpasninger vil alltid være nødvendig. Ved god tilpasning og tilrettelegging vil de fleste pasienter ha mulighet til å gjennomføre den anbefalte treningsmengden.
Begrunnelse – dette er anbefalingen basert på
Trening av ADL-, gang- og armfunksjon kan være aktuelt i ulike faser etter hjerneslag, og i ulike settinger. Hvor mye trening som bør gis for pasienter med hjerneslag, er et forskningsfelt under utvikling. Rsultatene som foreligger per i dag viser at det er nødvendig med en viss minimum mengde timer trening per dag og antall dager med trening per uke for å oppnå gode resultater. Ved å benytte de kriterier som er anført i det tverrfaglige vurderingsskjema slagenhet - pakkeforløp hjerneslag, vil en sikre at de fleste pasienter vil tåle det minimum av trening som er nødvendig for å oppnå god effekt av døgnrehabiltiering.
Anbefalingen om 3 timer daglig målrettet trening, er basert på en metaanalyse av Lohse et al., (2014). I studiene som inngår i denne analysen ble det i gjennomsnitt gitt 57 timer trening 5 dager i uka over 4 uker, dvs. i gjennomsnitt nesten 3 timer de 20 dagene det ble gitt trening. Økt treningsmengde kan umiddelbart tenkes å medføre behov for økte terapeutressurser. Det kan imidlertid også løses på andre måter, for eksempel økt bruk av gruppeterapi, opplæring av annet helsepersonell og egentrening. Et annet alternativ er eventuelt omprioritering av enkelte andre oppgaver. En studie (English et al., 2015) fant at 3 timer fysioterapi daglig tilbudt som sirkeltrening i gruppe var trygg og gjennomførbar med eksisterende ressurser. Bruk av robotassistert trening er også en måte å øke antall treningstimer for pasientene på, uten nødvendigvis behov for økte terapeutressurser.
Det må tas med i betraktning at terapitid ikke nødvendigvis samsvarer med tiden som faktisk blir brukt til aktiv gjennomføring av treningsoppgaver (Kaur 2013). På bakgrunn av dette anbefaler den australske nasjonale retningslinjen for hjerneslag (lenke) at minimum 3 timer per dag settes opp som trening i pasientens timeplan, for å sikre minimum 2 timer med aktive treningsoppgaver. De aktuelle studier har undersøkt den mengde trening som bør tilbys, og med fokus på oppgaverelatert trening. I tillegg finnes dokumentasjon på kondisjonstrening som omtales i anbefaling Oppgaverelatert trening for å øke kondisjon og utholdenhet.
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag
Tiltak (I): Økt mengde trening
Sammenligning (C): Standard mengde trening
Beskrivelse av inkluderte studier
Vi har listet opp effekten av økt treningsmengde på ADL-, gang- og arm-funksjon og angitt tillitten til effektestimatene for de ulike utfallene.
Følgende metaanalyser danner grunnlaget for anbefalingen etter de litteratursøk som er utført i tilknytning til utvikling av de Australske retningslinjer for hjerneslag og der Lohse (2014) og Schneider (2016) danner grunnlaget for den SOF tabell (Summery Of Findings tabell) som er utarbeidet (se nedenfor).
Det har ikke kommet ny kunnskap etter metaanalyser som er benyttet i denne anbefalingen.
Utfall | Studier | Effektstørrelse (SMD) | Usikkerhet (KI) | Tiltro til effektestimat |
|---|---|---|---|---|
ADL-funksjon | 36 studier inkludert 3064 pasienter | 0,22 | 0,09-0,34 | Moderat |
Gangfunksjon | 22 studier inkludert 2097 pasienter | 0,29 | 0,17-0,41 | Høy |
Arm- og gangfunksjon Inkludert studier med dobbel så stor treningsmende i intervensjonsgruppe smnl med kontrollgruppe | 14 sudier inkludert 954 pasienter ( kanskje angi hva som inngår ved SMD: 0.39 og SMD 0,59?? Treningsmengde doblet= 0.59 | 0,39 0,59 | 0,07-0,71 0,23-0,94 | Moderat |
Figur 1; Referanse: "Australian and New Zealand Living Clinical Guidelines for Stroke Management - Chapter 5 of 8: Rehabilitation" (date: Desember 2023)
Metaanalysen fra Schneider et al. (2016) samlet informasjon fra 14 studier (954 deltakere) der ekstra målrettet trening av samme type som ble gitt i kontrollgruppen. Det var en liten effekt av økt terapitid på funksjon i overekstremitet og underekstremitet kombinert. Effekten var større når intervensjonsgruppen fikk minst dobbelt så mye terapi som kontrollgruppen.
Metaanalysen fra Lohse et al. (2014) undersøkte data fra 30 studier med pasienter fra alle faser etter hjerneslag, totalt 1750 deltakere og pasienter inkludert var i en stabile mht hjerte- og lunge funksjon. Mens varigheten av treningen var omtrent lik i kontroll- og intervensjonsgruppen (ca. 4 uker), mottok intervensjonsgruppen ca. 33 timer mer trening enn kontrollgruppen. Intervensjonsgruppen hadde større bedring på validerte funksjonsmål. Effekten var større når intervensjonsgruppen fikk minst dobbelt så mye målrettet trening som kontrollgruppen.
De ulike studiene inkludert i metaanalysene brukte ulike effektmål. Det er derfor ikke mulig å sammenligne studiene direkte. Det er i slike metaanalyser vanlig å bruke «Standardized mean difference» (SMD) som er en statistisk metode som gjør det mulig å sammenligne studier som har brukt forskjellige effektmål. Generelt anses en SMD på 0,2-0,5 som liten effektstørrelse, 0,5-0,8 som moderat effektstørrelse og 0,8-1 som stor effektstørrelse. De fleste samleanalyser i slagrehabilitering som har benyttet SMD viser imidlertid liten statistisk effekt av intervensjonene (SMD < 0.5 ) og få oppnår moderat eller stor statistisk effekt (SMD > 0,5). I en av de største samleanalyse vedr slagrehabilitering der 50 ulike intervensjoner ble vurdert, så var det et fåtall som viste noe mer enn en liten effekt bedømt med SMD, selv om effekten vurderes som klinisk betydningsfull (Ref (P Langhorne et al ; Motor recovery after stroke: a systematic review: Lancet Neurol 2009; 8 741.754).
Følgende effektstørrelser ble observert ved økt treningsmengde (lenke australsk retningslinje):
- Bedring i ADL-funksjon: Den observerte effektstørrelsen var liten med en SMD på 0,22 (0,09-0,34).
- Bedring i gangfunksjon: Den observerte effektstørrelsen var liten med en SMD på 0,29 (0,17-0,41).
- Bedring i arm- og gangfunksjon kombinert: Den observerte effektstørrelsen var liten med en SMD på 0,39 (0,07-0,71). Hvis man kun inkluderte studiene der treningsmengden var minst dobbelt så stort i intervensjonsgruppen sammenlignet med kontrollgruppen, var effektstørrelsen moderat med en SMD på 0,59 (0,23-0,94).
Selv om SMD 0.2-0.5 ut fra statistiske kriter defineres som liten effekt, er det en utbredt klinisk erfaring at økt treningsmengde er assosiert med gode behandlingsresultater for å bedre ADL-, gang- og armfunksjon. Ved utarbeidelse av anbefalinger innen rehbailitering er det derfor vanlig å vektlegge også klinisk erfaring i tilelgg til SMD resultater.
Tiltroen til de observerte effektene er høy på utfallsmål gangfunksjon; den er moderat på utfallsmål ADL-funksjon og på utfallsmål arm- og gangfunksjon sammenslått:
Svakheter i studiene som bidrar til redusert tillitt er:
- ADL-funksjon: moderat heterogenitet mellom de inkluderte studiene, små effektstørrelser, forskjeller i dose mellom studiene ikke godt rapportert
- Gangfunksjon: variasjon i studienes kvalitet, direkte sammenligninger ikke tilgjengelig, brede konfidensintervaller, men konsistente resultater
- Arm- og gangfunksjon: i 60 % av studiene ingen intention-to-treat analyse, høy heterogenitet, mange studier med lavt antall deltakere
Kvaliteten på metoden som er brukt i utarbeidelsen av den australske retningslinjen er vurdert med FHI sin sjekkliste til å være moderat/høy.
Oppgaverelatert trening for å øke kondisjon og utholdenhet
Pasienter som har tilstrekkelig styrke i store muskelgrupper, bør få rehabilitering som inneholder oppgaverelatert trening som kan øke kondisjon og utholdenhet.
SIGN: A1a
Tredemølletrening kan anbefales for å bedre kondisjon.
SIGN:B1b
Begrunnelse – dette er anbefalingen basert på
Oppgaverelatert trening kan defineres som konkret trening på de bevegelser, oppgaver og aktiviteter som pasienten har som mål å mestre [364]:[368]. Noen bruker begrepet funksjonell trening som betyr at oppgavene er knyttet til daglige praktiske gjøremål og at treningen er hensiktsmessig, sammensatt, variabel og gir mening [451]. I denne retningslinjen brukes begrepet oppgaverelatert trening gjennomgående om all trening som både er oppgaverelatert og funksjonell.
- Kondisjonstrening viser i en systematisk oversikt fra 2004 (12 studier) positiv effekt når det gjelder gangfunksjon, og når det trenes oppgaverelatert [405] (SIGN: 1a).
- En metaanalyse fra 2006 (9 studier, hvorav 7 randomiserte) fant at pasienter med lett til moderat slag kunne forbedre ganghastighet og utholdenhet etter aerobic training, dvs. trening for å øke den kardiale utholdenheten [395] (SIGN: 1a).
- En metaanalyse fra 2007 med 21 studier som undersøkte effekt av enten kondisjonstrening, styrketrening for underekstremitetene eller gangrelatert trening, fant positiv effekt for kondisjonstrening på trappegang, og positiv effekt av gangtrening på hastighet og lengde. De fant ingen effekt på ADL [397] (SIGN: 1a).
- Tredemølletrening gir økt kardiovaskulær utholdenhet og forbedret gange [394] (SIGN:1b).
Forskningsgrunnlag
Populasjon (P): Slagrammede med behov for opptrening av utholdenhet og kondisjon
Tiltak (I): Trening som kan øke kondisjon/utholdenhet
Sammenligning (C): Ingen systematisk tilpasset trening eller ingen trening
Beskrivelse av inkluderte studier
Referanser
394. Treadmill exercise rehabilitation improves ambulatory function and cardiovascular fitness in patients with chronic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195739
395. The use of aerobic exercise training in improving aerobic capacity in individuals with stroke: a meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195740
397. Effects of exercise training programs on walking competency after stroke: a systematic review https://www.helsedirektoratet.no/referanse/0002-0013-195742
405. Physical fitness training for stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195750
Sist faglig oppdatert: 21.12.2017
Trening med høy intensitet av gangfunksjon og/eller balanse
For pasienter med nedsatt gangfunksjon og/eller balanse foreslås intensiv trening for å bedre gangfunksjon og/eller ADL- funksjon.
Praktisk – slik kan anbefalingen følges
"Treningsintensitet" kan defineres på forskjellige måter. De mest vanlige definisjonene omhandler:
- lengde av trening (f.eks. tid per økt)
- frekvens (f.eks. økter per uke)
- varighet (f.eks. antall uker med trening) eller
- total treningsmengde som en kombinasjon av økt lengde, frekvens og varighet
Hjertefrekvens kan være et intensitetsmål ved gangtrening - spesielt prosentandel av maksimal puls. Antall repetisjoner under treningen kan også være et mål for intensitet.
I studiene som ligger til grunn for denne anbefalingen, er intensitet definert som hyppigere eller lengre treningsøkter.
Trening med høy intensitet kan gjennomføres med terapeut eller gjennom veiledet egentrening.
Kunnskapsgrunnlaget viser en tendens til at høyere intensitet gir høyere effekt, men treningsopplegget må tilpasses den enkelte pasient, bl.a. ut ifra motorisk og kognitiv funksjon, komorbiditet og pasientens motivasjon og preferanser. Det er viktig å ta med disse forhold i planleggingen av treningsopplegget.
Begrunnelse – dette er anbefalingen basert på
Forskningen som ligger til grunn for denne anbefalingen viser trender mot at trening med høy intensitet kan øke gangfunksjon og ADL-funksjon sammenlignet med trening med lav intensitet. Det er ikke evidensgrunnlag for å gi klare anbefalinger vedr.økt intensitet når det gjelder generell trening av arm. Se også anbefaling om CIMT.
Målet med trening etter et hjerneslag vil være å forbedre funksjon og/eller hindre tap av funksjon, og å oppnå høyest mulig grad av uavhengighet, fysisk, psykisk og sosialt. Treningsintensitet har vært og er et aktuelt tema innen rehabiliteringsområdet, og klinisk erfaring tilsier at høyere intensitet øker effekten av treningen. Det er grunn til å anta at visse undergrupper av pasienter profiterer mer bedre på høy intensitet enn andre, men forskningsresultatene på dette feltet er usikre slik at det per nå ikke er mulig å gi konkrete anbefalinger. Det samme gjelder mer konkrete anbefalinger rundt dose-respons av fysisk trening.
Anbefalingen er basert på «oppsummert forskning» /vurdering av kunnskapsgrunnlaget og arbeidsgruppens samlede erfaring og kunnskap.
Forskningsgrunnlag
Populasjon (P): Slagrammede med nedsatt arm-/gangfunksjon og/eller balanse
Tiltak (I): Slagrammede med nedsatt arm-/gangfunksjon og/eller balanse
Sammenligning (C): Trening med lav intensitet
Beskrivelse av inkluderte studier
Kilde:
• Veerbeek JM, van Wegen E, van Peppen R, van der Wees PJ, Hendriks E, Rietberg M, et al. What is the evidence for physical therapy poststroke? A systematic review and meta-analysis. PLoS ONE [Electronic Resource] 2014;9(2): e87987.
• Lohse KR, Lang CE, Boyd LA. Is more better? Using metadata to explore dose-response relationships in stroke rehabilitation. Stroke 2014;45(7):2053-8.
• Cooke EV, Mares K, Clark A, Tallis RC, Pomeroy VM. The effects of increased dose of exercise-based therapies to enhance motor recovery after stroke: a systematic review and meta-analysis. BMC Med 2010;8:60
Motorisk trening et tiltak for å bedre gangfunksjon og/eller balanse hos pasienter som har hatt hjerneslag. Ved gjennomgang av litteratursøk ble det funnet tre relevante artikler som er inkludert i kunnskapsgrunnlaget:
En metaanalyse av 34 kontrollerte-randomiserte studier med 2236 voksne deltakere i alle faser etter hjerneslag (Lohse et al., 2014), viser at trening med høy intensitet (målt som antall planlagte treningstimer) gir bedret funksjon, eller hindrer svekkelse, av de affiserte motoriske funksjonene. Analysen er utført på tvers av ulike fysioterapeutiske intervensjoner.
Veerbeek et al., 2014 har gjort en systematisk oversikt og metaanalyse der de ser på hvilke fysioterapeutiske intervensjoner hos pasienter med gjennomgått slag som er evidensbasert (en oppdatering av nederlandsk database). En av metaanalysene ser på ADL. 36 kontrollerte-randomiserte studier med 3064 voksne deltakere (Veerbeek et al., 2014) viser at deltakerne som hadde flere timer med trening, uavhengig av type trening, skåret høyere på basale ADL-funksjoner enn de med færre treningstimer.
Cook et al. (2010) har gjort en systematisk oversikt med syv randomiserte kontrollerte studier og 680 deltakere for å undersøke effekten av økt treningsdose for å bedre motorisk funksjon etter hjerneslag. To av studiene viser raskere ganghastighet hos deltakerne som hadde høyere treningsdose sammenlignet med lavere (målt ved minutter per dag, antall ganger i uken og varighet i antall uker), både ved studieslutt (123 deltakere) og ved oppfølging (195 deltakere).
Det er en tendens til at intensiv trening har en positiv effekt på ADL- funksjon og gangfunksjon hos pasienter med nedsatt gangfunksjon og/eller balanse etter hjerneslag. Utfallsmålene i studiene som er vurdert, har små populasjoner, og kvaliteten på dokumentasjonen er vurdert til lav ved GRADE.
Kunnskapselementer som klinisk erfaring og brukerkunnskap er også trukket inn i utarbeidelsen av anbefalingen.
Utfall 1
Veerbeek et. al (2014) er en oppdatering av hvilke fysioterapeutiske intervensjoner hos slagrammede (uavhengig av komparator) som gir effekt, og eventuelt hvilke tidsperioder etter slaget som gir best effekt. Populasjonen var pasienter med hjerneslag over 18 år, hvor de fleste pasientene var i en tidlig rehabiliteringsfase, eller i en kronisk fase. Intensitet ble definert som antall timer trening, og forskjell mellom behandling ble definert ved timer trening hos intervensjonsgruppen minus trening hos kontrollgruppen. Det er blitt utført en metaanalyse som inkluderte 80 randomiserte kontrollerte-studier, hvorav 78 av studiene handlet om benfunksjon, og som viser at den gjennomsnittlige forskjellen på behandling var 17 timer over 10 uker, det vil si 1.7 timer i uken. Merk: Det er mange ulike intervensjoner, og det er få deltakere per intervensjon. Det er uklart hvorvidt deltakere, helsepersonell og studiepersonell er blindet i de inkluderte studiene.
Utfall 1: Basic ADL (bedre indikert ved høyere skår)
Sammenlignet med kontrollgruppen (færre timer trening), skåret deltakerne som hadde flere timer med trening, i gjennomsnitt 0.217 høyere (0.094 høyere til 0.339 høyere) på ADL ved studieslutt. Effektestimatet er basert på 3064 deltakere i 36 kontrollerte-randomiserte studier. Blant deltakerne fikk 1691 høyere dose (flere timer) trening, mens 1373 fikk lavere dose (færre timer) trening. Analysen inkluderer flere ulike intervensjoner (både arm- og gangfunksjon), og de fleste av deltakerne var enten i en tidlig rehabiliteringsfase eller i en kronisk fase. Kvaliteten på evidensgrunnlaget er lav grunnet redusert overførbarhet og høy heterogenitet mellom studiene. Det er liten tillit til resultatet.
Utfall 2
Lohse et al. (2014) er en metaanalyse som har til formål å finne dose-respons mellom planlagt terapi (timer) og kliniske mål på bedring av funksjon og/eller svekkelse av redusert funksjon. Populasjonen er voksne etter hjerneslag. Dose er definert som tiden satt av/planlagt til trening, og intervensjonene inkluderte både arm- og gangfunksjon. Metaanalysen inneholder mange ulike intervensjoner utført i alle faser etter hjerneslag hos voksne (type slag ikke spesifisert).
Utfall 2: Forbedret funksjon eller redusert svekkelse av funksjon (bedre er indikert ved høyere skår)
Sammenlignet med kontrollgruppen (færre timer trening), skåret deltakerne som hadde flere timer med trening i gjennomsnitt 0.35 høyere (0.26 høyere til 0.45 høyere) på forbedret funksjon eller redusert svekkelse av funksjon (målt ved standardiserte måleinstrumenter) ved studieslutt. Effektestimatet er basert på 2236 deltakere i 34 kontrollerte randomiserte studier. Blant deltakerne hadde 1113 planlagt mer tid til trening sammenlignet med 1123 som hadde færre timer satt av til trening. Analysen inkluderer flere ulike intervensjoner (både arm- og gangfunksjon), og det er ikke oppgitt hvilken fase etter hjerneslaget deltakerne var i. Kvaliteten på evidensgrunnlaget er lav grunnet risiko for systematiske feil i de inkluderte studiene og redusert overførbarhet. Det er liten tillit til resultatet.
Utfall 3,4,5
Cooke et al. (2010) er en systematisk oversikt som har til hensikt å undersøke effekten av økt dose treningsterapi for å forbedre motorisk fremgang etter hjerneslag. Oversikten inkluderer 7 randomiserte-kontrollerte studier og 680 deltakere. Den gjennomsnittlige alderen på deltakerne varierte fra 65.9 år til 76.5 år. Gjennomsnittlig tid fra innleggelse for hjerneslag var 35 dager. Dose ble definert som intensitet (minutter per dag), hyppighet (antall ganger i uken) og varighet (antall uker). Intervensjonene var treningsbaserte med den hensikt å stimulere muskelaktiviteten eller funksjonell aktivitet.
Utfall 3: Armfunksjon ved studieslutt (bedre er indikert ved høyere skår)
Armfunksjon er målt ved ARAT (Action Research Arm Test)
Sammenlignet med kontrollgruppen (lavere dose trening) skåret deltakerne som hadde høyere dose med trening i gjennomsnitt 0.1 høyere (5.7 lavere til 6.0 høyere) målt ved ARAT. Effektestimatet er basert på 258 deltakere i 3 kontrollerte randomiserte studier. Blant deltakerne fikk 126 høyere dose trening mens 132 fikk lavere dose med trening. Kvaliteten på evidensgrunnlaget er moderat grunnet liten informasjonsstørrelse og vidt/upresist effektestimat. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt. Det er middels tillit til resultatet.
Utfall 4: Armfunksjon ved oppfølging (bedre er indikert ved høyere skår)
Armfunksjon er målt ved ARAT (Action Research Arm Test), oppfølgingen var på 6 md.
Sammenlignet med kontrollgruppen (lavere dose trening) skåret deltakerne som hadde høyere dose trening i gjennomsnitt -6.4 lavere (-12.8 lavere til 0.0 høyere) målt ved ARAT. Effektestimatet er basert på 319 deltakere i 3 randomiserte kontrollerte studier. Blant deltakerne fikk 157 høyere dose trening mens 162 fikk lavere dose trening. Merk at en av de inkluderte studiene ikke oppga dose for kontrollgruppen. Kvaliteten på evidensgrunnlaget er lav grunnet høy risiko for systematiske feil i en av de inkluderte studiene, samt liten informasjonsstørrelse (<400) og et relativt vidt/upresist effektestimat. Det er liten tillit til resultatet.
Utfall 5: Styrke i armen ved studieslutt (bedre er indikert ved høyere skår)
Styrke i armen ble målt ved håndstyrke/håndkraft.
Sammenlignet med kontrollgruppen (lavere dose trening) skåret deltakerne som hadde høyere dose trening i gjennomsnitt -10.1 lavere (-19.1 lavere til -1.2 lavere) målt ved styrke/kraft i armen. Effektestimatet er basert på 195 deltakere i 2 randomiserte kontrollerte studier. Blant deltakerne fikk 97 høyere dose trening, mens 98 fikk lavere dose trening. Merk at en av de inkluderte studiene ikke oppgav dose for kontroll-gruppen. Kvaliteten på evidensgrunnlaget er moderat grunnet liten informasjonsstørrelse (<400) og et vidt/upresist effektestimat. Merk at retning på effekt er i favør av studiens kontrollgruppe, dvs. lavere dose trening. Det er lav tillit til resultatet.
Utfall 6: Ganghastighet ved studieslutt (bedre er indikert ved høyere skår)
Ganghastighet målt ved comfort walk speed.
Sammenlignet med kontrollgruppen (lavere dose trening) skåret deltakerne som hadde høyere dose trening i gjennomsnitt 0.3 høyere (0.1 høyere til 0.5 høyere) målt ved comfort walk speed. Effektestimatet er basert på 123 deltakere i 2 randomiserte-kontrollerte studier. Blant deltakerne fikk 58 høyere dose trening, mens 65 fikk lavere dose trening. Merk at retning på effekt viser i favør av studiens intervensjons-gruppe, dvs. høyere dose trening. Kvaliteten på evidensgrunnlaget er lavt grunnet meget liten informasjonsstørrelse (<400). Det er liten tillit til resultatet.
Utfall 7: Ganghastighet ved oppfølging (bedre er indikert ved høyere skår)
Ganghastighet ble mål ved comfort walk speed.
Sammenlignet med kontrollgruppen (lavere dose trening) skåret deltakerne som hadde høyere dose trening i gjennomsnitt 0.2 høyere (-0.1 lavere til 0.4 høyere) målt med comfort walk speed ved oppfølging (6 md). Effektestimatet er basert på 120 deltakere i 2 randomiserte-kontrollerte studier. Blant deltakerne fikk 59 høyere dose trening, mens 61 fikk lavere dose trening. Merk at konfidensintervallet krysser linjen for ingen forskjell i effekt. Kvaliteten på evidensgrunnlaget er lavt grunnet meget liten informasjonsstørrelse (<400). Det er liten tillit til resultatet.
Vurdering
Fordeler og ulemper
Fordeler:
Høyere dose trening (antall timer trening) er vist å ha noe bedre effekt på gangfunksjon og ADL- funksjon sammenlignet med lavere dose trening hos pasienter med hjerneslag.
Det er usikkert hvorvidt høyere dose trening har positiv effekt på armfunksjon.
Ulemper:
En mulig ulempe er overbelastning og smerter som følge av økt belastning på affisert side som trenes intensivt.
Det er høyere frafall ved trening med høy intensitet.
Konklusjon:
Fordelene med tiltaket veier antagelig opp for ulempene med tiltaket.
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen er vurdert til lav ved GRADE.
Kunnskapselementer som klinisk erfaring og brukerkunnskap er også trukket inn i utarbeidelse av anbefalingen.
Verdier og preferanser
Gangfunksjon og ADL-funksjon har stor betydning for aktivitet og deltagelse hos den enkelte, slik at mange vil ønske å gjøre en spesiell innsats for å bedre disse funksjonene.
Høyere frafall ved trening med høy intensitet tilsier at pasientens preferanser må tas med i vurderingen av hvilken intensitet som bør tilbys.
Tilbudet om trening med høy intensitet for slagrammede i helse- og omsorgstjenestene i kommunene vil kunne variere med tanke på tilgang til ressurser og kompetanse. Det er stor variasjon i dagens tilbud, og ved innføring av tiltaket vil ulikheten sannsynligvis reduseres.
Det vurderes som gjennomførbart å gi slagrammede tilbud om trening med høy intensitet. Barrierer for gjennomføringen kan være manglende ressurser og kompetanse.
Referanser
391. The effects of increased dose of exercise-based therapies to enhance motor recovery after stroke: a systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195736
392. Is more better? Using metadata to explore dose–response relationships in stroke rehabilitation https://www.helsedirektoratet.no/referanse/0002-0013-195737
393. What is the evidence for physical therapy poststroke? A systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195738
Trening av utholdenhet og gange hos slagrammede
Pasienter med gangproblemer etter hjerneslag bør få trening i forflytning, gange og utholdenhet for å bedre gangfunksjon og kondisjon.
SIGN: A1a.
Praktisk – slik kan anbefalingen følges
Balansen kan være forstyrret på mange plan etter et hjerneslag, og hva som er de viktigste årsakene til balanseproblemet hos den enkelte pasient bør vurderes. Nedsatt balanse innebærer økt risiko for fall og begrenser funksjonelle og sosiale aktiviteter.
Å gjenvinne gangfunksjon er et viktig mål for mange som rammes av hjerneslag, og for de fleste er det også et realistisk mål. Over 80 % av pasienter med selvstendig gangfunksjon før slaget gjenvinner gangfunksjonen innen de første 3 md. [399].
Behandling som består av forskjellige komponenter fra ulike behandlingstilnærminger har vist seg å være mer effektiv enn ingen behandling når det gjelder motorisk funksjon i underekstremitetene og postural kontroll [386] (SIGN:1a).
Enkelte studier tyder på at trening på tredemølle med vektavlastning er til nytte for personer med hjerneslag som i utgangspunktet har dårlig eller ingen gangfunksjon [402] (SIGN:1a). Det er også holdepunkter for at trening på tredemølle kombinert med vanlig gangtrening kan være effektivt hos personer med bevart, men svekket gangfunksjon etter hjerneslaget [402];[403]. Tredemølletrening gir økt kardiovaskulær utholdenhet og forbedret gange [400].
Trening på tredemølle, med eller uten vektavlastning, gir ingen signifikant bedring av gangfunksjonen i forhold til annen gangtrening [400] (SIGN:1a).
Elektromekanisk assistert gangtrening i kombinasjon med fysioterapi kan bidra til selvstendig gange og kan øke gangdistansen.Fremdeles er det uavklart om elektromekanisk assistert gangtrening bør inkluderes i slagrehabilitering [401].
Trening på en såkalt force-plattform, en plattform som gir visuell eller auditiv tilbakemelding om vektfordeling, kan forbedre ståbalanse, men har ikke vist bedring i gangfunksjonen eller økt uavhengighet av støtte [398].
Begrunnelse – dette er anbefalingen basert på
Studier viser at utholdenhetstrening bedrer gangfunksjonen (mobilitet). Forbedringen synes å være assosiert med oppgaverelatert trening, dvs. å gå [405];[395];[404] (SIGN:1a). Repetitiv oppgaverelatert trening gir bedring knyttet til gangdistanse, ganghastighet, og global muskelfunksjon [378] (SIGN:1a).
Styrketrening av underekstremiteter gir økt styrke og forbedret gangfunksjon uten å gi økt spastisitet [389] (SIGN:1a). Konkret trening av forflytning opp og ned i stol gir økt selvstendighet målt i forhold til redusert postural svai og redusert tid til å reise seg [378];[389];[386] (SIGN:1a).
Oppgaverelatert trening kan forbedre sitte- og ståbalanse og gangfunksjon [378];[389] (SIGN:1a), men har ikke vist noen sikker effekt på Berg-balanseskala [389] (nivå 1a). Den funksjonelle forbedringen er begrenset til det som trenes, og det er foreløpig uklart om forbedringen vedvarer utover treningsperioden [378] (SIGN:1a).
Sittebalanse er viktig for selvstendighet i dagliglivets aktiviteter og er en prediktor for funksjon i den sammenheng [379];[380]. En studie viste at 29 % (n=338) av personer med slag hadde nedsatt sittebalanse 7-10 dager etter slaget [380]. Studier tyder på at trening som går ut på å strekke seg etter konkrete mål bedrer balanse i sittende [389];[386];[382];[377];[376];[387] (SIGN:1a).
Forskningsgrunnlag
Populasjon (P): Slagrammede med nedsatt gangfunksjon (forflytningsevne)
Tiltak (I): Oppgaverelatert trening som kan bedre gangfunksjon (forflytningsevne)
Sammenligning (C): Ingen systematisk tilpasset oppgaverelatert gangtrening eller ingen trening
Beskrivelse av inkluderte studier
Referanser
376. Sitting training early after stroke improves sitting ability and quality and carries over to standing up but not to walking: a randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195721
377. Task-related training improves performance of seated reaching tasks after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195722
378. Repetitive task training for improving functional ability after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195723
379. Sitting balance as an early predictor of functional improvement in association with depressive symptoms in stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195724
380. Disruption of sitting balance after stroke: influence of spoken output https://www.helsedirektoratet.no/referanse/0002-0013-195725
382. Stroke patients and long-term training: is it worthwhile? A randomized comparison of two different training strategies after rehabilitation https://www.helsedirektoratet.no/referanse/0002-0013-195727
386. Physiotherapy treatment approaches for the recovery of postural control and lower limb function following stroke https://www.helsedirektoratet.no/referanse/0002-0013-195731
387. The effect of independent practice of motor tasks by stroke patients: a pilot randomized controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195732
389. The impact of physical therapy on functional outcomes after stroke: what's the evidence? https://www.helsedirektoratet.no/referanse/0002-0013-195734
395. The use of aerobic exercise training in improving aerobic capacity in individuals with stroke: a meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195740
397. Effects of exercise training programs on walking competency after stroke: a systematic review https://www.helsedirektoratet.no/referanse/0002-0013-195742
398. Force platform feedback for standing balance training after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195743
399. Recovery of walking function in stroke patients: the Copenhagen Stroke Study https://www.helsedirektoratet.no/referanse/0002-0013-195744
400. Treadmill exercise rehabilitation improves ambulatory function and cardiovascular fitness in patients with chronic stroke https://www.helsedirektoratet.no/referanse/0002-0013-195745
401. Electromechanical‐assisted training for walking after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195746
402. Treadmill training and body weight support for walking after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195747
403. Effects of task-specific locomotor and strength training in adults who were ambulatory after stroke: results of the STEPS randomized clinical trial https://www.helsedirektoratet.no/referanse/0002-0013-195748
404. Effects of exercise training programs on walking competency after stroke: a systematic review https://www.helsedirektoratet.no/referanse/0002-0013-195749
405. Physical fitness training for stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195750
Sist faglig oppdatert: 21.12.2017
Forebygging av fall
Tverrfaglige intervensjoner rettet mot risikofaktorer for fall både hos pasient og omgivelser, inkludert individuelt utformet treningsprogram, bør tilbys de slagrammede som er i risikogruppen for å falle.
SIGN: C1a.
Begrunnelse – dette er anbefalingen basert på
Forekomst av fall blant personer med hjerneslag er i en stor studie rapportert til 37 % (n=1104) [416]. I en norsk studie på 500 pasienter initialt behandlet i slagenhet med påfølgende tidlig støttet utskrivning (ESD), opplevde 30 % ett eller flere fall i løpet av de første 3 md. etter slaget [178].
En studie viser at 14 % får en skade som krever medisinsk behandling, men under 3 % får en fraktur. De fleste fall skjer innendørs. Slagrammede med depresjon, nedsatt funksjonsnivå, tidligere fall og høy alder har størst fallrisiko. Høyt funksjons- og aktivitetsnivå og god kognisjon reduserer risikoen [416] (SIGN:3). Ustø gange/falltendens i akuttfasen disponerer for fall også i det videre forløp [411] (SIGN:3). Underernæring øker fallrisikoen.
Den forskningsbaserte kunnskapen om trening for å forebygge fall er først og fremst basert på forskning på eldre med forskjellige diagnoser og i ulike settinger. Hvorvidt disse funnene kan generaliseres til personer med slag, er uklart. Anbefalinger i forhold til forebygging av fall blir derfor på generelt grunnlag basert på forskning på eldre.
Enkelte intervensjoner for å motvirke fall kan være effektive. Individuelle treningsprogram rettet mot styrke og balanse, Tai Chi, reduksjon av psykofarmaka og tverrfaglige intervensjoner rettet mot multiple risikofaktorer kan redusere fall [415] (SIGN: 1a).
Både intervensjonstrening med symmetrisk "reise seg og sette seg-øvelser" [414] (SIGN:1b), og visuell feedback og rytmisk vektskifte hadde bedre tilleggseffekt utover konvensjonell rehabilitering enn ulike andre terapeutiske intervensjoner for å redusere fall [413] (SIGN:2a). Trening med "reise seg og sette seg-øvelser" ga i forhold til en kontrollgruppe bedret forflytningsevne, livskvalitet og fysisk mobilitet, men bidro ikke til reduksjon av fall [412] (SIGN:1b).
Bruk av "hip protectors" ser ut til å ha liten effekt på reduksjon av hoftefraktur hos eldre generelt [418] (SIGN: 1a).
Det er lite eller ingen dokumentasjon på effekten av intervensjoner av miljøendringer i hjemmet for å unngå fall [417]. Det trengs større randomiserte kontrollerte studier for å bevise at reduksjon av potensielle risikofaktorer i hjemmet bidrar til mindre skader (SIGN 1a).
Forebyggende tiltak mot fall er generelt mangelfullt studert hos slagrammede, og de studier som foreligger er små, og har gitt motstridende resultater.
Forskningsgrunnlag
Populasjon (P): Slagrammede med fallrisiko
Tiltak (I): Tverrfaglige intervensjoner / Fallforebyggende tiltak
Sammenligning (C): Ingen spesifikke tiltak
Beskrivelse av inkluderte studier
Referanser
178. Medical complications in a comprehensive stroke unit and an early supported discharge service https://www.helsedirektoratet.no/referanse/0002-0013-195523
410. Peroneal nerve stimulation versus an ankle foot orthosis for correction of footdrop in stroke: impact on functional ambulation https://www.helsedirektoratet.no/referanse/0002-0013-195755
411. Predicting people with stroke at risk of falls https://www.helsedirektoratet.no/referanse/0002-0013-195756
412. Effects of Extra Training on the Ability of Stroke Survivors to Perform an Independent Sit-to-Stand: A Randomized Controlled Trial https://www.helsedirektoratet.no/referanse/0002-0013-195757
413. Effects of visual feedback rhythmic weight-shift training on hemiplegic stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195758
414. Symmetrical body-weight distribution training in stroke patients and its effect on fall prevention https://www.helsedirektoratet.no/referanse/0002-0013-195759
415. Interventions for preventing falls in elderly people https://www.helsedirektoratet.no/referanse/0002-0013-195760
416. Falls after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195761
417. Modification of the home environment for the reduction of injuries https://www.helsedirektoratet.no/referanse/0002-0013-195762
418. Hip protectors for preventing hip fractures in older people https://www.helsedirektoratet.no/referanse/0002-0013-195763
Sist faglig oppdatert: 21.12.2017
Bruk av ankel-fot-ortoser
Pasienter med dropfot etter hjerneslag bør vurderes for ankel-fot-ortoser.
Funksjonell elektrisk stimulering kan forsøkes ved redusert gangfunksjon.
SIGN:B1b.
Praktisk – slik kan anbefalingen følges
Helsepersonell bør kunne gjenkjenne tegn på behov for en ankel-fot-ortose. Kartlegging og vurdering bør skje i tverrfaglig samarbeid sammen med ortopediingeniør. Se også anbefalingen om kartlegging og oppfølging av hjelpemidler etter hjerneslag i kapittel om prosesser i slagrehabilitering.
Begrunnelse – dette er anbefalingen basert på
Både ankel-fot-ortoser og transkutan elektrisk stimulering kan forbedre gangfunksjonen i kronisk fase etter hjerneslag [410] (SIGN:1b). Ganghastighet øker ved bruk av ankel-fot-ortoser [406] (SIGN:1b), og en slik ortose fører ikke til redusert muskelaktivitet i fotekstensorene [407] (SIGN:1b). Bruk av ankel-fot-ortose kan også ha stabiliserende effekt på stå- og gangfunksjonen [409].
Det foreligger enkelte mindre studier hvor ulike former for funksjonell elektrisk stimulering og ankel-fot-ortoser er undersøkt. Funksjonell elektrisk stimulering av peroneusmuskulatur kan også gi økt ganghastighet [408].
Bruk av ankel-fot-ortose bør vurderes individuelt ut fra pasientens behov [409] (SIGN:B2a).
Forskningsgrunnlag
Populasjon (P): Slagrammede med dropfot relatert til hjerneslaget
Tiltak (I): Bruk av fotortoser og funksjonell elektrisk stimulering
Sammenligning (C): Ingen spesifikk behandling
Beskrivelse av inkluderte studier
Referanser
406. The effect of an ankle-foot orthosis on walking ability in chronic stroke patients: a randomized controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195751
407. Immediate and long-term effects of ankle-foot orthosis on muscle activity during walking: a randomized study of patients with unilateral foot drop https://www.helsedirektoratet.no/referanse/0002-0013-195752
408. The orthotic effect of functional electrical stimulation on the improvement of walking in stroke patients with a dropped foot: a systematic review https://www.helsedirektoratet.no/referanse/0002-0013-195753
409. Immediate effects of an individually designed functional ankle-foot orthosis on stance and gait in hemiparetic patients https://www.helsedirektoratet.no/referanse/0002-0013-195754
410. Peroneal nerve stimulation versus an ankle foot orthosis for correction of footdrop in stroke: impact on functional ambulation https://www.helsedirektoratet.no/referanse/0002-0013-195755
Sist faglig oppdatert: 21.12.2017
Bilateral armtrening hos pasienter med redusert armfunksjon etter hjerneslag
Bilateral armtrening bør tilbys slagrammede med redusert armfunksjon.
SIGN: A1a.
Begrunnelse – dette er anbefalingen basert på
Arm- og håndfunksjonen har stor betydning for å kunne utføre hverdagsaktiviteter, delta i arbeidsliv og fritidsaktiviteter. Mellom 55 % og 75 % av alle slagrammede har vedvarende redusert motorisk funksjon i en arm [420].
Bilateral armtrening kan også forbedre motorisk funksjon i den affiserte armen [425] (SIGN: 1a).
Elektromekanisk-assistert/robot-assistert behandling for personer med uttalte pareser kan forbedre armfunksjonen, men bidrar ikke til økt ADL-funksjon [423];[422];[452] (SIGN: 1a), og klare anbefalinger er derfor vanskelig å gi før mer forskning er gjennomført.
Elektrisk stimulering er en potensiell behandling for å bedre bevegelseskontroll og funksjonell aktivitet i armen etter hjerneslag, men resultatene er sprikende [388] (SIGN: 1a) og det kan ikke gis klare anbefalinger.
Det finnes ingen evidens for EMG-triggered neuromuscular electrical stimulation (EMG-NMES) i forhold til vanlig behandling/ingen behandling [424] (SIGN: 1a).
Botulinumtoksin A-behandling med mål å redusere muskeltonus og bedre passivt bevegelsesutslag i armen, hadde usikker effekt med hensyn til bedring av armfunksjonen [426] (SIGN: 1b).
Forskningsgrunnlag
Populasjon (P): Pasienter med redusert armfunksjon etter hjerneslag
Tiltak (I): Bilateral armtrening
Sammenligning (C): Unilateralt eller ingen armtrening
Beskrivelse av inkluderte studier
Referanser
388. Electrostimulation for promoting recovery of movement or functional ability after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195733
420. Effect of constraint-induced movement therapy on upper extremity function 3 to 9 months after stroke: the EXCITE randomized clinical trial https://www.helsedirektoratet.no/referanse/0002-0013-195765
422. Effects of Robot-Assisted Therapy on Upper Limb Recovery After Stroke: A Systematic Review https://www.helsedirektoratet.no/referanse/0002-0013-195767
423. Robotic-assisted rehabilitation of the upper limb after acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195768
424. Impact of EMG-triggered neuromuscular stimulation of the wrist and finger extensors of the paretic hand after stroke: a systematic review of the literature https://www.helsedirektoratet.no/referanse/0002-0013-195769
425. Bilateral movement training and stroke rehabilitation: a systematic review and meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195770
426. Treatment of upper extremity spasticity in stroke patients by focal neuronal or neuromuscular blockade: a systematic review of the literature https://www.helsedirektoratet.no/referanse/0002-0013-195771
452. Computerized arm training improves the motor control of the severely affected arm after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195797
Sist faglig oppdatert: 21.12.2017
CIMT hos pasienter med gjennomgått hjerneslag
Constraint-induced movement therapy (CIMT) foreslås for slagrammede med mild til moderat reduksjon i armfunksjon.
Praktisk – slik kan anbefalingen følges
«Constraint-induced» («fremkalt gjennom begrensninger») movement therapy er et supplement til annen rehabilitering av overekstremiteten. Hovedprinsippet er at den affiserte siden trenes intensivt ved at den uaffiserte siden ikke kan brukes under treningsoppgavene pga. såkalte «constraints» («begrensninger»). I praksis brukes det en vott på den uaffiserte siden (som regel 90 % av våken tid) slik at pasientene må bruke den affiserte siden for å gjennomføre treningsoppgaver.
Constraint-induced movement therapy (CIMT) foregår som oftest som gruppebehandling. Vesentlige faktorer er også at treningen er oppgaverelatert, dvs. at det trenes på relevante dagligdagse oppgaver, og at vanskelighetsgraden på oppgavene kontinuerlig tilpasses individuelt til pasientens funksjonsnivå («shaping»).
At trening er intensiv synes å være en viktig faktor, uten at det foreligger klar evidens for nøyaktig hvor intensiv treningen skal være, både med tanke på antall timer per dag/uke og antall uker. De fleste studier har brukt 2 til 5 timer med trening daglig over 2 til 3 uker, i noen studier lavere doser opp til 10 uker. Studiene tyder på best effekt av CIMT i kronisk fase etter 3 mnd.
Pasienten må ha en viss håndfunksjon for å kunne profitere på CIMT, vanlige kriterier er at pasientene må kunne ekstendere fingrene, og ev. håndleddet, til en viss grad, f.eks. minimum 10 grader i metakarpofalangeal og interfalangeal leddene og minimum 20 grader i håndleddet.
Tiltaket er krevende for pasienten slik at pasientens ønske om og motivasjon for slik intensiv trening er vesentlig. Det bør settes individuelle mål for treningen.
Begrunnelse – dette er anbefalingen basert på
Arm- og håndfunksjonen har stor betydning for å kunne utføre hverdagsaktiviteter, delta i arbeidsliv og fritidsaktiviteter. Mellom 55 % og 75 % av alle slagrammede har vedvarende redusert motorisk funksjon i en arm [420].
Forskningen viser at Constraint-Induced Movement Therapy (CIMT) for den hemiplegiske armen bedrer ADL-funksjon og armfunksjon i kronisk fase. Effekten sammenlignet med annen trening for parese i overekstremitet i tidlig fase, dvs. de tre første måneder etter hjerneslaget, er mindre og usikker.
Studiene er små, og ut fra GRADE-metodikken er det usikkert om funnene kan generaliseres fra deltakerne i studiene til alle pasienter med mild til moderat reduksjon i armfunksjon.
De positive resultatene gjelder pasienter med hjerneslag som har en viss grad av motorisk funksjon i arm og hånd og som ikke har kognitiv svikt. Det er vanskelig å konkludere om andre grupper vil oppnå samme effekt.
Arm- og håndfunksjonen har stor betydning for å kunne utføre hverdagsaktiviteter, delta i arbeidsliv og fritidsaktiviteter. Mellom 55 % og 75 % av alle slagrammede har vedvarende redusert motorisk funksjon i en arm [420].
Tiltaket krever spesialkompetanse med tanke på indikasjonsstilling, gjennomføring (tilgjengelig utstyr, kompetanse om egnede oppgaver og fortløpende tilpassing av vanskelighetsgraden) og håndtering av uønskede effekter.
Anbefalingen baserer seg på vurdering av kunnskapsgrunnlaget samt arbeidsgruppens samlede erfaring og kunnskap.
Forskningsgrunnlag
Populasjon (P): Slagrammede i tidlig og sen fase (> 3 mnd) med nedsatt armfunksjon
Tiltak (I): Constrained -Induces Movement Therapy
Sammenligning (C): Annen spesifikk eller standard eller ingen (i sen fase) trening for parese i overekstremitet
Beskrivelse av inkluderte studier
Resultattabell (PDF)
Flytskjema (PDF)
Søkestrategi (PDF)
Forskningsgrunnlaget som ligger til grunn for anbefalingen er basert på en systematisk litteraturoversikt av Corbetta et al. (2015). I denne systematiske oversikten har forfatterne samlet forskning om armfunksjon hos pasienter med hemiparese etter hjerneslag og vurdert effekten av CIMT (>3 timer/dag), modifisert CIMT (mCIMT) (<3 timer/dag), eller forced use (FU) (ingen særskilt opptrening) sammenlignet med andre rehabiliteringsteknikker (arbeids- eller fysioterapi) eller ingen opptrening (kun en til tre av 42 studier). Oversiktsartikkelen inkluderer 42 randomiserte kontrollerte studier med 1 453 pasienter med noe bevegelighet i overarm og hånd på slagrammet kroppsside.
Resultatene under er angitt som standardisert gjennomsnitt (SMD) når studiene inkludert i metaanalysen har brukt forskjellige måleverktøy. Når samme måleverktøy er brukt, angis vanlig gjennomsnitt (MD).
Funksjon i daglige aktiviteter ved avsluttet behandling (målt ved Functional Independence Measure (FIM) eller Barthel Index (BI)): Effektestimatet (funksjon i daglige aktiviteter) representerer «lav» effekt av CIMT (fra «ingen» til «moderat effekt») og viser at hos pasienter med hemiparese etter hjerneslag, kan CIMT ha noe effekt på funksjon i daglige aktiviteter sammenlignet med standard rehabilitering. Estimatet er basert på data fra 344 deltakere i 11 randomiserte kontrollerte studier som varte fra to til tre uker. Blant de 344 deltakerne fikk 180 CIMT og 164 vanlig/aktiv rehabilitering. Det var litt for få deltakere i studien, så tiltroen til effektestimatet er moderat.
Nærmere analyser viste at verken mengde trening (mer eller mindre enn 30 timer CIMT), utøvelse av CIMT (restriksjoner av bare hånd eller både hånd og arm), eller tid etter hjerneslaget (se egne estimater) innvirket på resultatet av daglig funksjonsnivå ved avsluttet CIMT-behandling. Det ble med andre ord ikke funnet subpopulasjoner av pasienter med hemiparese etter hjerneslag som vil respondere spesielt på CIMT.
Funksjon i daglige aktiviteter etter 3-6 måneder (målt ved FIM eller BI):
Effektestimatet (-0.21) representerer «ingen» effekt av CIMT (fra «moderat» kontrolleffekt til liten effekt av CIMT). Estimatet er basert på data fra 125 deltakere i tre randomiserte kontrollerte studier. Blant de 125 deltakerne fikk 76 CIMT og 49 vanlig/aktiv rehabilitering. Tiltroen til estimatet er lav fordi det er basert på så få deltakere.
Funksjon i daglige aktiviteter hos pasienter inkludert 0-3 mnd etter slaget:
Effektestimatet (0.07) representerer «ingen» effekt av CIMT (fra «liten» kontrolleffekt til «liten/moderat» effekt av CIMT). Estimatet er basert på data fra 164 deltakere i fem randomiserte kontrollerte studier. Blant de 164 deltakerne fikk 86 CIMT og 78 vanlig/aktiv rehabilitering. Tiltroen til estimatet er lav fordi det er basert på få deltakere og har stor variasjon.
Funksjon i daglige aktiviteter hos pasienter inkludert mer enn 9 mnd etter slaget: Effektestimatet (0.49) representerer «moderat» effekt av CIMT (fra «ingen» til stor effekt av CIMT). Estimatet er basert på data fra 62 deltakere i to randomiserte-kontrollerte studier. Blant de 62 deltakere fikk 32 CIMT og 30 vanlig/aktiv rehabilitering. Tiltroen til estimatet er lav fordi det er basert på veldig få deltakere og har stor variasjon.
Motorisk armfunksjon (vurdert ved ARAT, WMFT, EMF, MFT, The Rivermead Motor Assessment Arm scale, MAS): Effektestimatet (0.34) representerer «liten» effekt av CIMT (fra «minimal» til «moderat» effekt). Estimatet er basert på data fra 858 deltakere i 28 randomiserte-kontrollerte studier som varte i to-tre uker. Blant de 858 deltakere fikk 437 CIMT og 421 vanlig/aktiv rehabilitering eller ingen behandling. Estimatet er basert på mange deltakere og er presist med liten variasjon. Tiltroen til estimatet er høy.
Selvopplevd kvalitet på motorisk armfunksjon (vurdert ved MAL, en 5-punkts skala): Deltakere med hjerneslag som hadde fått CIMT, skåret gjennomsnittlig 0.68 poeng høyere (fra 0.47 til 0.88 høyere) enn de som ikke hadde hatt CIMT. Det er angitt at minimal klinisk relevant forskjell på MAL-skala er 1-1.1 poeng (Lang 2008). Målingene er basert på data fra 891 deltakere i 24 randomiserte kontrollerte studier som varte i to til ti uker. Blant de 891 deltakere fikk 448 CIMT og 443 vanlig/aktiv rehabilitering eller ingen behandling. Tiltroen til målingen er moderat fordi det ikke kan utelukkes systematiske feil i studiene.
Selvopplevd bruk av motorisk armfunksjon (vurdert ved MAL, en 5-punkts skala): Deltakere med hjerneslag som hadde fått CIMT skåret gjennomsnittlig 0.79 poeng høyere (fra 0.50 til 1.08 høyere) enn de som ikke hadde hatt CIMT. Målingene er basert på data fra 851 deltakere i 23 randomiserte kontrollerte studier som varte i to til ti uker. Blant de 851 deltakere fikk 429 CIMT og 422 vanlig/aktiv rehabilitering eller ingen behandling. Tiltroen til målingen er moderat fordi det ikke kan utelukkes systematiske feil i studiene.
Hemmet armmotorikk (vurdert ved FMA, CMII, Jamar hand dynamometer, maximal grip strength with a force transducer; shoulder and elbow isometric force): Effektestimatet representerer «stor» effekt av CIMT (fra «lav» til «veldig stor» effekt). Estimatet er basert på data fra 372 deltakere i 16 randomiserte kontrollerte studier som varte i to-ti uker. Blant de 372 deltakere fikk 188 CIMT og 186 vanlig/aktiv rehabilitering eller ingen behandling (én studie). Tiltroen til målingen er moderat fordi det ikke kan utelukkes systematiske feil i studiene.
Livskvalitet (målt ved Stroke Impact Scale): Resultatet viser at CIMT har liten innvirkning på livskvalitet, med en gjennomsnittlig forskjell til vanlig rehabilitering på 6,5 skåre (fra -1,20 lavere til 14,28 høyere). Undersøkelsen er basert på data fra 96 deltakere i tre randomiserte kontrollerte studier og ble målt etter 2-3 uker med trening. Tiltroen til estimatet er lav fordi det er basert på veldig få deltakere og viser stor variasjon.
Fingerferdighet (målt ved 9HPT, 16HPT, GPT): Effektestimatet representerer «lav til moderat» effekt av CIMT (fra «minimal» til «stor» effekt) sammenlignet med kontroll. Effektestimatet er basert på data fra 113 deltakere i 4 randomiserte kontrollerte studier som varte i to til seks uker. Blant de 113 deltakere fikk 57 CIMT og 56 vanlig/aktiv rehabilitering. Tiltroen til estimatet er lav fordi det er basert på veldig få deltakere og viser stor variasjon.
Vurdering
Fordeler og ulemper
Fordeler: CIMT ser ut til å gi noe økt arm-/håndfunksjon hos en begrenset gruppe pasienter med hjerneslag som har en viss grad av motorisk restfunksjon i arm og hånd og som ikke har kognitiv svikt.
Ulemper: CIMT er en intensiv treningsform, og man bør være obs på overbelastning og smerter hos pasientene.
Konklusjon: Det er vurdert at fordelene med tiltaket antagelig veier opp for ulempene.
Kvalitet på dokumentasjonen
Studiene er små og ut fra GRADE-metodikken er det usikkert om funnene kan generaliseres fra deltakerne i studiene til alle pasienter med mild til moderat reduksjon i armfunksjon.
Verdier og preferanser
Usikkerheten knyttet til både positive og negative effekter omkring dette tiltaket antyder at verdier og preferanser vil kunne variere fra pasient til pasient.
Ifølge evidensgrunnlaget har CIMT en større effekt på selvopplevd enn objektivt målt motorisk armfunksjon. Brukerperspektivet er derfor viktig når det skal tas avgjørelser om CIMT skal gjennomføres. Tiltaket vurderes akseptabelt for aktuelle pasienter.
Referanser
419. Constraint-induced movement therapy for upper extremities in people with stroke http://dx.doi.org/10.1002/14651858.CD004433.pub3
420. Effect of constraint-induced movement therapy on upper extremity function 3 to 9 months after stroke: the EXCITE randomized clinical trial https://www.helsedirektoratet.no/referanse/0002-0013-195765
Sist faglig oppdatert: 21.12.2017
Speilterapi ved nedsatt armfunksjon etter hjerneslag
For pasienter rammet av hjerneslag med komplett eller alvorlig lammelse i overekstremitet, foreslås det speilterapi for å bedre funksjon i arm og dagliglivets aktiviteter.
Praktisk – slik kan anbefalingen følges
Speilterapi gjennomføres ved at pasienten trener sin uaffiserte overekstremitet mens han/hun observerer denne i et speil, slik at hjernen «blir lurt» til å tro at det er den affiserte ekstremiteten som trenes.
I studiene som danner evidensgrunnlaget ble det gjennomført 10 til 60 minutter med speiltrening, dette 5 dager per uke og over en periode på 2 til 6 uker. Det mest vanlige var 30 minutter med speiltrening, 5 dager i uken over 4 uker.
Det brukes et enkelt speil, det finnes både kommersielle speil for formålet, og man kan bruke «hjemmesnekrede» løsninger.
Helsepersonell i et rehabiliteringsmiljø kan enkelt tilegne seg metoden, både i spesialist- og helse- og omsorgstjenestene i kommunen.
Pasienter med nedsatt kognisjon vil ha økt behov for opplæring og oppfølging.
Begrunnelse – dette er anbefalingen basert på
Lammelser forekommer hos over 80 % av pasienter med hjerneslag. Redusert kraft, svekket motorisk kontroll, nedsatt tempo, forstyrret automatisering, økt trettbarhet og ukoordinerte bevegelser er de mest fremtredende motoriske funksjonsnedsettelser. Behandlingstiltak som kan bedre motorisk funksjon kan derfor være av stor betydning.
Studiene gir ikke grunnlag for å identifisere subgrupper som har spesielt nytte av tiltaket, men indikerer at personer med alvorlige lammelser og smerteproblemer kan ha spesielt god nytte av dette tiltaket.
Flere studier med bruk av speilterapi viser en tendens til positiv effekt.
Forskningsdokumentasjonen som ligger til grunn for anbefalingen er noe varierende mht. om det er nytte av speilterapi og hvem som eventuelt kan ha nytte av den.
I begrunnelsen for å anbefale dette tiltaket er det vektlagt at det finnes få rehabiliteringstiltak for personer som har alvorlig redusert armfunksjon etter hjerneslag, at tiltaket har vesentlig effekt for noen pasienter (uten at det per i dag er kjent hvilke pasienter dette gjelder for), og at det ikke er vesentlige negative effekter forbundet med dette tiltaket.
Tiltaket er videre forholdsvis lett gjennomførbart til lave kostnader, og det er positive brukererfaringer.
Anbefalingen er vurdering av kunnskapsgrunnlaget samt arbeidsgruppens samlede erfaring og kunnskap.
Forskningsgrunnlag
Populasjon (P): Slagrammede med paralyse eller alvorlig parese i overekstremitet
Tiltak (I): Speilterapi
Sammenligning (C): Annen eller ingen behandling for paralyse eller alvorlig parese i overekstremitet
Beskrivelse av inkluderte studier
Resultattabell (PDF)
Flytskjema (PDF)
Søkestrategi (PDF)
Det ble funnet en systematisk oversikt som ble inkludert i kunnskapsgrunnlaget.
Kilde: Thieme H, Mehrholz J, Pohl M, Behrens J, Dohle C. Mirror therapy for improving motor function after stroke. Cochrane Database of Systematic Reviews 2012, Issue 3. Art. No.: CD008449. DOI: 10.1002/14651858.CD008449.pub2
Oversikten inkluderte 14 studier og 567 deltagere med gjennomgått hjerneslag.
Kvaliteten på dokumentasjonen er vurdert til lav ved GRADE.
Kunnskapselementer som klinisk erfaring og brukerkunnskap er også trukket inn i utarbeidelse av anbefalingen
Funksjon i øvre ekstremitet (armer): Bruk av speilterapi hos pasienter med hjerneslag og som har paralyse eller alvorlig parese i overekstremiteten (arm), kan forventes å gi noe mer bedring i armfunksjon sammenlignet med ingen speilterapi eller annen opptrening. Effektestimatet (dvs. armfunksjon) er basert på data fra 421 pasienter i 10 randomiserte kontrollerte studier som varte fra 4 til 14 uker. Blant disse fikk 194 pasienter speilterapi og 227 pasienter fikk enten falskt speil («sham») eller speil med begrensning i speilbildet. De ulike studiene brukte forskjellige verktøy for å måle armfunksjonen, derfor ble et såkalt standardisert gjennomsnitt for armfunksjon beregnet når studiene ble slått sammen og analysert. Et standardisert gjennomsnitt viser bare eventuelle forskjeller på gruppenivå, og ikke antall pasienter som skårer/ikke skårer for motorisk armfunksjon/armmotorikk. Forskjellen i standardisert gjennomsnittlig skåre hos de som fikk speilterapi i forhold til de som ikke fikk, var 0,53 poeng. Ut i fra størrelsen på gjennomsnittet er konfidensintervallet relativt stort, og den nedre grensen er nær linjen for ingen forskjell i effekt (0,04-1,01). Målinger som er angitt som standardisert gjennomsnitt, er vanskelig omsettbart i praksis. Tiltroen til estimatet er lav.
Det er estimert liten forskjell i hverdagsaktivitet mellom pasientene med hjerneslag og paralyse eller alvorlig parese i overekstremitet (arm) som fikk speilterapi og de som ikke fikk det. Effektestimatet (dvs. hverdagsaktivitet) er basert på data fra 217 pasienter i fire randomiserte kontrollerte studier som varte fra 4 til 6 uker. Ett av de fire studiene omhandlet parese i bein. Blant de 217 pasientene fikk 94 speilterapi og 123 enten falskt speil («sham») eller speil med begrensning i speilbildet. Effektmålet (hverdagsaktivitet) er beregnet ut i fra få studiedeltakere og er usikkert. Siden de ulike studiene brukte forskjellige verktøy for å måle hverdagsaktivitet, ble et såkalt standardisert gjennomsnitt for hverdagsaktivitet beregnet når studiene ble slått sammen og analysert. Et standardisert gjennomsnitt viser bare eventuelle forskjeller på gruppenivå og ikke antall pasienter som skårer/ikke skårer på daglig aktivitet. Forskjellen i standardisert gjennomsnittlig skåre på hverdagsaktivitet hos de som fikk speilterapi i forhold til de som ikke fikk, var 0,33 poeng. Ut i fra størrelsen på gjennomsnittet er konfidensintervallet relativt stort og den nedre grensen er nær linjen for ingen forskjell i effekt (0.05-0.60). Målinger som er angitt som standardisert gjennomsnitt er vanskelig omsettbart i praksis. Tiltroen til dette estimatet er lav.
Tilleggsopplysning:
Thieme et al., 2012 oppgir også oppsummert effekt av speilterapi for det sekundære utfallet «smerte» ved hvile og ved bevegelse*. Analysen inkluderte fem studier med totalt 188 deltakere (n=90 for intervensjon; n=98 for kontroll). To av disse studiene var med pasienter med hjerneslag som samtidig hadde diagnosen Complex Regional Pain Syndrome Type 1 (CRPSt1). Oppsummert effekt antyder redusert smerte ved intervensjon med speilterapi: SMD -1.10 (95% KI -2.10, -0.09; I 2=89%).
* Smerte ble vurdert ved Numerical Rating Scale (skåre fra 0 til 10), Visual Analogue Scale (skåre fra 0 til 10 eller 0 mm til 100 mm) og ved smerteseksjondelen av for Fugl-Meyer Assessment (normalisert for gjennomsnittlig skåre per punkt – 0 til 2; der 2 var indikasjon på ingen smerte).
Vurdering
Fordeler og ulemper
Fordeler:
En sterk anbefaling om bruk av speilterapi kan potensielt medføre at en stor gruppe pasienter vil bruke treningsenergien sin på et tiltak som har usikker effekt. På den andre siden synes mange mindre studier av speilterapi å vise en tendens til positiv effekt. Samtidig er det mange usikkerhetsmomenter i og mellom studiene, som tidspunkt for oppstart etter slag, varighet av hver enkelt treningsøkt og totalt. Speilterapi er likevel et tiltak som kan være til nytte hos en pasient med alvorlig nedsatt arm-/håndfunksjon der det er få andre intervensjoner med dokumentert effekt.
Ulemper: Tiltaket har ingen vesentlige ulemper, det innebærer lave kostnader og kan kuttes/avsluttes uten vesentlige problemer av verken klinisk eller kostnadsmessig art. Begrensninger for bruken ligger i at tiltaket fordrer et visst kognitivt funksjonsnivå. Personer med kognitiv svikt kan ha vansker med gjennomføring av tiltaket (initiativ, hukommelse, motivasjon) og kan ha et behov for økt oppfølging.
Konklusjon: Fordelene veier antageligvis opp for ulempene.
Kvalitet på dokumentasjonen
Studieresultatene varierer mht. om det er nytte av speilterapi og hvem som evt. kan ha nytte av den. Forskingsdokumentasjonen er vurdert til lav, og det ble påpekt at det er utfordrende å vurdere hvor vesentlig den kliniske effekten av speilterapi er når den er angitt som «standardisert gjennomsnitt».
Verdier og preferanser
Tiltaket har få ulemper, men det er uvisst om tiltaket har effekt for den enkelte. Funksjon i overekstremitet er viktig for å klare daglige aktiviteter. Det er få andre spesifikke treningstiltak for armfunksjon i denne pasientgruppen, slik at mange pasienter vil ønske å prøve ut tiltaket.
Referanser
421. Mirror therapy for improving motor function after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195766
Posisjonering av paretisk arm for å forebygge kontraktur
Posisjonering av paretisk arm bør vurderes hos pasienter som har risiko for kontrakturutvikling.
SIGN: C1b.
Praktisk – slik kan anbefalingen følges
Kontrakturer kan oppstå pga. lammelser eller spastisitet og fører til redusert bevegelsesutslag. Utadrotasjon i skulder, supinasjon i underarm, håndledds- og fingerekstensjon og dorsalekstensjon i fot er de bevegelser som oftest er affisert.
Begrunnelse – dette er anbefalingen basert på
Til forebygging og behandling av kontrakturer har det vært benyttet passiv tøyning eller ortoser, f.eks. splints for å korrigere posisjonen til en affisert kroppsdel. En ortose har som formål å forhindre uønsket bevegelse, men tillate ønsket bevegelse.
Ved kontrakturer i skulderen kan bruk av posisjoner som tøyer muskulatur (maksimalt utadrotert stilling av armen minst 30 min daglig) forebygge kontrakturer, men resultatene er ikke konsistente [437];[439];[438] (SIGN: 1b).
Ved kontrakturer i hånden viser program med 30 min passiv tøyning daglig av hånd og fingre ingen sikker effekt [440] (SIGN: 1b). Bruk av ortoser (f.eks. splint) for å unngå kontrakturer i hånden, ga ingen positiv effekt [431] (SIGN:1b). Tøyning utført av terapeuter for både skulder- og armmuskulatur førte heller ikke til mindre kontrakturer [443] (SIGN: 1b).
Ved "casting" fikseres leddet i en bestemt posisjon ved hjelp av individuelt tilpasset gips enten en gang eller i flere trinn. Det er funnet økning i passive bevegelsesutslag etter casting hos personer med traumatisk hjerneskade og hjerneslag, men lite effekt på spastisitet eller aktivitet [441];[442] (SIGN: 1a). Det er derfor vanskelig å gi noen klare anbefalinger om slik behandling.
Forskningsgrunnlag
Populasjon (P): Slagrammede med risiko for kontrakturutvikling
Tiltak (I): Behandling med tøyning, ortoser, posisjonering
Sammenligning (C): Annen eller ingen behandling
Beskrivelse av inkluderte studier
Referanser
437. Thirty minutes of positioning reduces the development of shoulder external rotation contracture after stroke: a randomized controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195782
438. Contracture preventive positioning of the hemiplegic arm in subacute stroke patients: a pilot randomized controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195783
439. A programme of static positional stretches does not reduce hemiplegic shoulder pain or maintain shoulder range of motion-a randomized controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195784
440. Four weeks of daily stretch has little or no effect on wrist contracture after stroke: a randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195785
441. A systematic review of upper extremity casting for children and adults with central nervous system motor disorders https://www.helsedirektoratet.no/referanse/0002-0013-195786
442. The use of casts in the management of joint mobility and hypertonia following brain injury in adults: a systematic review https://www.helsedirektoratet.no/referanse/0002-0013-195787
443. A pilot randomized controlled trial of a daily muscle stretch regime to prevent contractures in the arm after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195788
Sist faglig oppdatert: 21.12.2017
Tiltak ved spastisitet
Ved moderat til alvorlig spastisitet som begrenser funksjonsevne, gir smerte eller ubehag bør behandling med botulinumtoksin A vurderes.
SIGN: B1a
Behandlingen bør ledsages av øvelser og tøyning.
SIGN: C3
Orale anti-spastiske legemidler bør kun brukes unntaksvis.
SIGN: B1b
Begrunnelse – dette er anbefalingen basert på
Spastisitet blir vanligvis definert som en motorisk forstyrrelse karakterisert ved hastighetsavhengig økning i muskulær tonus og økte senereflekser. Spastisitet forekommer hos om lag 20 % av de slagrammede, men er i de fleste tilfeller ikke den avgjørende begrensningen for funksjon [453]. Hos noen pasienter kan imidlertid spastisitet hemme aktivitet, vanskeliggjøre pleie eller gi ubehag/smerte, og da kan tiltak for å forsøke å redusere spastisiteten være indisert. Kartlegging og behandling av spastisitet bør foregå i et tverrfaglig samarbeid der ulike tiltak vurderes, inkludert ikke-medikamentelle.
Botulinumtoksin A reduserer spastisitet og kan forbedre motorisk funksjon, særlig hos personer med noe bevart motorisk funksjon. Hvor stor funksjonell bedring som oppnås er uavklart [429];[434];[435];[430] (SIGN: 1a). Noen pasienter med mild spastisitet og ekstensoraktivitet i hånden, samt pasienter med uttalt spastisitet med risiko for kontrakturer i armen kan ha god nytte av botulinumtoksin A, men resultatene spriker [426] (SIGN: 1b). Botulinumtoksin B har ingen effekt på spastisitet [428] (SIGN:1b).
Intrathecal baklofen reduserer spastisitet, men det er risiko for infeksjoner [432] (SIGN:1b). Orale anti-spastiske medikamenter har som oftest liten effekt og gir ofte bivirkninger [433].
Det finnes ikke tilstrekkelig dokumentasjon til å kunne vurdere effekten av ortoser alene [431]. Det er uklart hvorvidt tøyning alene reduserer spastisitet, og om effekten vedvarer [427] (SIGN:1a). Øvelser, tøyning og/eller ortoser i forbindelse med botulinumtoksin A optimaliserer resultatet [436] (SIGN:C3).
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag og med spastisitet som begrenser funksjonsevne
Tiltak (I): Medikamentell behandling med botulinumtoksin A
Sammenligning (C): Annen eller ingen behandling
Beskrivelse av inkluderte studier
Referanser
426. Treatment of upper extremity spasticity in stroke patients by focal neuronal or neuromuscular blockade: a systematic review of the literature https://www.helsedirektoratet.no/referanse/0002-0013-195771
427. The effects of stretching in spasticity: a systematic review https://www.helsedirektoratet.no/referanse/0002-0013-195772
428. Botulinum toxin type B in upper-limb poststroke spasticity: a double-blind, placebo-controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195773
429. Does botulinum toxin improve the function of the patient with spasticity after stroke? https://www.helsedirektoratet.no/referanse/0002-0013-195774
430. Botulinum toxin type A for the treatment of the upper limb spasticity after stroke: a meta-analysis https://www.helsedirektoratet.no/referanse/0002-0013-195775
431. Is hand splinting effective for adults following stroke? A systematic review and methodological critique of published research https://www.helsedirektoratet.no/referanse/0002-0013-195776
432. Intrathecal baclofen for spastic hypertonia from stroke https://www.helsedirektoratet.no/referanse/0002-0013-195777
433. Oral antispastic drugs in nonprogressive neurologic diseases A systematic review https://www.helsedirektoratet.no/referanse/0002-0013-195778
434. Efficacy of botulinum toxin A in upper limb function of hemiplegic patients https://www.helsedirektoratet.no/referanse/0002-0013-195779
435. Post stroke hemiplegia: interest of botulinum toxin injection at the upper limb https://www.helsedirektoratet.no/referanse/0002-0013-195780
436. Use of botulinum toxin type A in management of adult spasticity. A European consensus statement https://www.helsedirektoratet.no/referanse/0002-0013-195781
Sist faglig oppdatert: 21.12.2017
Behandling av sentral smerte etter hjerneslag
Ved sentral smerte etter hjerneslag anbefales behandling med amitryptilin, pregabalin eller gabapentin.
SIGN: B1a)
Transkutan nervestimulering (TNS) kan forsøkes hos enkelte pasienter.
(SIGN: C1b)
Praktisk – slik kan anbefalingen følges
Sentral smerte etter hjerneslag forekommer hos ca. 5 % av pasientene etter hjerneslag [445] og omfatter gjerne hele den hemiplegiske siden. Smerten kan debutere tidlig, men som oftest noen uker/mnd. etter akuttfasen. Tilstanden skyldes sannsynligvis selve skaden i hjernen og sees særlig ved thalamusnære lesjoner.
Begrunnelse – dette er anbefalingen basert på
Ved sentral smerte kan behandling med amitryptilin 10-25 mg daglig, og av og til høyere dose, ha god effekt. Videre kan pregabalin med startdose 75 mg daglig eller gabapentin med gradvis økning opp til 2400 mg daglig forsøkes [444] SIGN: B1a).
I en studie med 15 pasienter med sentral smerte hadde 4 pasienter smertereduserende effekt av transcutan nervestimulering (TNS), 3 brukte fortsatt TNS ved oppfølging etter ca. 2 år; de 2 pasientene som hadde alvorlig redusert berøringssans, hadde ikke effekt [445] (SIGN:C1a).
Forskningsgrunnlag
Populasjon (P): Slagrammede med sentral smerteproblematikk
Tiltak (I): Medikamentell behandling
Sammenligning (C): Annen eller ingen behandling
Beskrivelse av inkluderte studier
Referanser
178. Medical complications in a comprehensive stroke unit and an early supported discharge service https://www.helsedirektoratet.no/referanse/0002-0013-195523
444. Pharmacologic treatment of central post-stroke pain https://www.helsedirektoratet.no/referanse/0002-0013-195789
445. Central post-stroke pain—the effect of high and low frequency TENS https://www.helsedirektoratet.no/referanse/0002-0013-195790
Sist faglig oppdatert: 21.12.2017
Bandasjer og elektrisk stimulering ved uttalt ødem
Elastiske bandasjer eller funksjonell elektrisk stimulering bør vurderes ved uttalt ødem.
SIGN: C3.
Begrunnelse – dette er anbefalingen basert på
Ødemer kan utvikles i lammede ekstremiteter pga. redusert mulighet til aktiv kontraksjon av musklene. Særlig subluksasjon, dårlig motorisk funksjon og nedsatt muskeltonus disponerer for håndødem og komplekst regionalt smertesyndrom. Omlag 1/3 av slagrammede med uttalt hemiparese eller håndparese utvikler ødem i den paretiske hånden, og 30 % av disse igjen utvikler i varierende grad et slikt smertesyndrom [449];[447].
Behandlingen er vanskelig. I klinisk praksis er det vanlig å sørge for at armen ikke henger ned, men holdes/støttes i horisontalplanet eller noe elevert. Pasienter med persepsjonsforstyrrelser (f.eks. neglekt) trenger hjelp til dette. Kompresjon ved hjelp av elastiske bandasjer kan redusere ødemtendensen [448] (SIGN: 3). Elektrisk stimulering av muskelpumpen har vist noe bedre effekt enn bare elevasjon av armen [446] (SIGN 3), mens intermitterende pneumatisk kompresjon ikke synes å ha noen effekt [450].
Forskningsgrunnlag
Populasjon (P): Slagrammede med ødemer
Tiltak (I): Kompresjon, elevasjon, elektrisk stimulering
Sammenligning (C): Annen eller ingen behandling
Beskrivelse av inkluderte studier
Referanser
446. The effects of neuromuscular stimulation-induced muscle contraction versus elevation on hand edema in CVA patients https://www.helsedirektoratet.no/referanse/0002-0013-195791
447. Reflex sympathetic dystrophy in hemiplegia https://www.helsedirektoratet.no/referanse/0002-0013-195792
448. Short-term effects of dynamic lycra splints on upper limb in hemiplegic patients https://www.helsedirektoratet.no/referanse/0002-0013-195793
449. Edema of the paretic hand in elderly post-stroke nursing patients https://www.helsedirektoratet.no/referanse/0002-0013-195794
450. Intermittent compression for the treatment of the oedematous hand in hemiplegic stroke: a randomized controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195795
Sist faglig oppdatert: 21.12.2017
Kognitive vansker
Screening/kartlegging av kognitive vansker etter hjerneslag
Alle pasienter bør screenes og observeres i tidlig fase med henblikk på kognitive vansker.
Ved spesifikke vansker gjennomføres en mer detaljert kartlegging. En funksjonsbeskrivelse av eventuelle vansker bør utarbeides, og konsekvensene relatert til aktivitet og deltakelse bør meddeles til pasient, pårørende og pleiepersonell. **
Praktisk – slik kan anbefalingen følges
Vurdering
Vurdering av kognitiv funksjon gjøres med standardiserte tester og/eller observasjon. I tidlig fase anbefales en enkel screening kombinert med systematisk observasjon. Slike vurderinger utføres ofte av ergoterapeut ved hjelp av observasjon i daglige aktiviteter og eventuelle enkle kognitive tester. Andre kilder til informasjon er intervju med pårørende og observasjoner som det tverrfaglige teamet gjør. En full kognitiv vurdering utført av nevropsykolog er sjelden indisert i akuttfasen, men kan være aktuelt senere, og særlig hvis det stilles spesielle krav til kognitiv fungering, som f.eks. i forbindelse med den slagrammedes vei tilbake til arbeid eller utdanning, og i noen tilfeller i ved vurdering av evne til bilkjøring.
Tilbakemelding
Dette er vesentlig med tanke på personens tilpasning til og mestring av de kognitive vanskene. Begrepet kognitiv funksjon/kognitive vansker er i seg selv ukjent for de fleste som opplever et hjerneslag for første gang. Det å skape en god forståelse for nye begrensninger og gjenværende muligheter for kognitiv fungering er vesentlig.
Begrunnelse – dette er anbefalingen basert på
Et hjerneslag kan i større eller mindre grad føre til reduksjon i kognitive funksjoner (dvs. tenke- og oppfatningsevnen). Avgrensede funksjoner kan rammes (fokale utfall), og/eller flere funksjoner kan rammes (global svikt).
Kognitive utfall kan redusere delaktighet i rehabilitering, medføre vanskeligheter med ADL og svekke mulighetene for deltakelse i samfunnet.
Etter hjerneslag reduseres vanligvis mental energi (økt trettbarhet, fatigue), samt mentalt tempo og effektivitet. Evnen til konsentrasjon, oversikt, initiativ, rom-retningsoppfatning og/eller språklig framstilling kan også svekkes. Emosjonell labilitet er vanlig. Andre evner og psykiske funksjoner kan også rammes direkte eller indirekte ved slag [455].
Vurdering av kognitiv funksjon er nødvendig for å kunne gi et adekvat rehabiliteringstilbud. En tidlig screening er vesentlig og bør gjennomføres av en person i teamet med spesialkunnskap. En detaljert kartlegging vil klargjøre hvilke type utfall personen har og være veiledende for teamet i valg av de mest hensiktsmessige tiltak i rehabiliteringen.
Tiltak ved kognitive vansker kan deles opp i forhold til vurdering, tilbakemelding, generell kognitiv stimulering og kompenserende tiltak.
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag
Tiltak (I): Kognitiv screening og ev. nærmere kartlegging, funksjonsbeskrivelse
Sammenligning (C): Ingen tiltak
Beskrivelse av inkluderte studier
Referanser
455. [Cognitive impairment after stroke--diagnosis and management] https://www.helsedirektoratet.no/referanse/0002-0013-195800
Sist faglig oppdatert: 21.12.2017
Generell stimulering og oppgaverelatert trening hos slagrammede med kognitive vansker
Ved kognitive funksjonsutfall anbefales generell stimulering og oppgaverelatert trening fra alt personell involvert i pasientens behandling og rehabilitering.
SIGN: D4.
Praktisk – slik kan anbefalingen følges
Kompenserende tiltak
Mye er forsøkt når det gjelder gjenopptrening av kognitive funksjoner, men optimismen har ofte vært større enn resultatene på dette området. Kognitiv rehabilitering vil i overskuelig framtid dreie seg mest om tilrettelegging og kompenserende tiltak for på en best mulig måte å leve videre med de begrensninger som måtte ha oppstått [457]. Informasjon til omsorgspersoner om hva det er nødvendig å være oppmerksom på eller hjelpe til med, kan være et slikt tiltak. Vurdering av arbeidsevne og ev. tilrettelegging av jobbsituasjonen er viktig for personer i arbeidsfør alder. Montering av kokeplatealarmer, signalur som varsler når det er på tide å ta medikamenter, synlig oversiktskalender og dagsplan for forskjellige aktiviteter er eksempler på kompenserende tiltak. Mange slike tiltak kan utføres av en kompetent ergoterapeut eller annet helsepersonell som har skaffet seg erfaring på dette området.
Begrunnelse – dette er anbefalingen basert på
Generell kognitiv stimulering
Det er lite dokumentasjon for at generell kognitiv stimulering kan føre til gjenvinning av spesifikke kognitive evner etter hjerneslag. Likevel betraktes generell kognitiv stimulering som en viktig del av rehabiliteringen etter hjerneskade. Mange former for trening på dagliglivets aktiviteter, oppgaverelatert trening, vil også kunne gi betydelig kognitiv stimulering. En studie i USA (en observasjons-/kohortstudie fra 7 rehabiliteringssykehus som omhandlet 713 pasienter) indikerer at kognitive utfordringer på relativt høyt nivå tidlig i forløpet var forbundet med bedre resultater [460].
En studie viste at et mer intensivt ergoterapitilbud var assosiert med større kognitiv bedring [458]. Denne studien var imidlertid liten og gir ikke i seg selv grunnlag for sikre konklusjoner. Den kognitive stimuleringen var her administrert av ergoterapeuter, men alt personell som er involvert i rehabiliteringsprosessen bør engasjeres i generelle stimuleringstiltak for å oppnå tilstrekkelig stimulering.
Forskningsgrunnlag
Populasjon (P): Slagrammede med kognitive vansker
Tiltak (I): Generell stimulering og oppgaverelatert trening
Sammenligning (C): Ingen tiltak, eller rehabilitering med mindre stimulering og oppgaverelatert trening
Beskrivelse av inkluderte studier
Referanser
457. Management of adult stroke rehabilitation care https://www.helsedirektoratet.no/referanse/0002-0013-195802
458. Relationship between rehabilitation therapies and outcome of stroke patients in Israel: a preliminary study https://www.helsedirektoratet.no/referanse/0002-0013-195803
460. Characterizing occupational therapy practice in stroke rehabilitation https://www.helsedirektoratet.no/referanse/0002-0013-195805
Sist faglig oppdatert: 21.12.2017
Kompenserende teknikker ved svikt i eksekutive funksjoner etter hjerneslag
Personer med svikt i eksekutive funksjoner bør få opplæring i bruk av kompenserende teknikker som bruk av "huskedagbok"/elektronisk dagbok eller nedskrevne sjekklister for å kunne utføre daglige aktiviteter.
SIGN: C1b.
Begrunnelse – dette er anbefalingen basert på
Eksekutive funksjoner regulerer adferd og er viktig for å utføre handlinger på en fornuftig og effektiv måte. De eksekutive funksjoner er av vesentlig betydning i en persons daglige fungering. Ved utfall kan personen ha vansker med planlegging og problemløsning og ha nedsatt dømmekraft og nedsatt impulshemming.
Det er begrenset evidens for effekt av intervensjon. En studie viser positiv effekt av bruk av "huskedagbok" for å initiere handlinger [349].
Forskningsgrunnlag
Populasjon (P): Slagrammede med svikt i eksekutive funksjoner
Tiltak (I): Bruk av kompenserende teknikker som bruk av "huskedagbok"/elektronisk dagbok eller nedskrevne sjekklister
Sammenligning (C): Ingen tiltak
Beskrivelse av inkluderte studier
Referanser
456. Evidence-based cognitive rehabilitation: updated review of the literature from 1998 through 2002 https://www.helsedirektoratet.no/referanse/0002-0013-195801
349. The development and validation of a test battery for detecting and monitoring everyday memory problems https://www.helsedirektoratet.no/referanse/0002-0013-195694
Sist faglig oppdatert: 21.12.2017
Generell stimulering og PC-trening ved oppmerksomhetsvansker
For pasienter med oppmerksomhetsvansker etter hjerneslag, anbefales generell stimulering med hyppige pauser. PC-trening kan vurderes.
SIGN: D4.
Praktisk – slik kan anbefalingen følges
Oppmerksomhetsvansker er en vanlig følge av hjerneslag, særlig i de første ukene hos de som får hjerneslag i den høyre hjernehalvdelen. Vansker med oppmerksomhet og konsentrasjon arter seg ofte som problemer med å holde på med aktivitet over tid, til lett å bli distrahert eller avledet eller vansker med å forholde seg til mer enn en ting av gangen.
Begrunnelse – dette er anbefalingen basert på
Det er vanskelig, ut fra foreliggende dokumentasjon, å skille effekt av spesifikk oppmerksomhetstrening fra effekt av mer generelle stimuleringstiltak og spontanbedring [456]. En Cochrane-oversikt vedrørende spesifikk oppmerksomhetstrening hos pasienter etter hjerneslag med bruk av IT-baserte oppgaver eller papir- og blyantoppgaver, konkluderer med at trening bedrer oppmerksomheten noe uten at dette medfører bedring av funksjon i dagliglivets aktiviteter [459] (SIGN:1a). Det synes ut fra dette ikke å være grunnlag for å anbefale slik trening for slagprammede på generell basis, men ut fra klinisk erfaring kan terapeutisk intervensjon i form av eksempelvis PC-trening vurderes hos enkelte pasienter [456] (SIGN: C1a).
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag og oppmerksomhetsvansker
Tiltak (I): Generell stimulering med hyppige pauser
Sammenligning (C): Ingen tiltak
Beskrivelse av inkluderte studier
Referanser
456. Evidence-based cognitive rehabilitation: updated review of the literature from 1998 through 2002 https://www.helsedirektoratet.no/referanse/0002-0013-195801
457. Management of adult stroke rehabilitation care https://www.helsedirektoratet.no/referanse/0002-0013-195802
458. Relationship between rehabilitation therapies and outcome of stroke patients in Israel: a preliminary study https://www.helsedirektoratet.no/referanse/0002-0013-195803
459. Cognitive rehabilitation for attention deficits following stroke https://www.helsedirektoratet.no/referanse/0002-0013-195804
460. Characterizing occupational therapy practice in stroke rehabilitation https://www.helsedirektoratet.no/referanse/0002-0013-195805
Sist faglig oppdatert: 21.12.2017
Trening med intensiv visuell skanning hos slagrammede med neglekt
Pasienter med neglekt som vurderes å ha nytte av trening med skanning-teknikker og stimulering for å rette oppmerksomheten mot den affiserte siden, foreslås å få tilbud om det.
Praktisk – slik kan anbefalingen følges
Trening med visuell skanning (også kalt «visual exploration therapy») har som formål å trene pasienten i kompenserende strategier for å endre atferd, det vil si å mestre utfordringene forbundet med neglekt og finne måter å omgå utfallene forbundet med neglekt. På denne måten skal pasienten i mindre grad oppleve begrensninger i aktiviteter og deltakelse. Trening med visuell skanning er dermed en «top-down» tilnærming som innebærer at pasienten får økt innsikt i sine vansker.
Trening med visuell skanning kan for eksempel foregå som penn og papir –terapi eller ved hjelp av datamaskin. Det brukes ulike teknikker som har som felles formål at pasienten bevisst skal kompensere ved å skanne/eksplorere det neglisjerte området. Terapien vil ofte bli gjennomført av psykolog eller ergoterapeut, men kan også gjennomføres av andre spesialopplærte fagpersoner eller under veiledning av psykolog eller ergoterapeut.
Neglekt kan ofte spontant bedre seg den første tiden etter hjerneslag slik at ressurskrevende tiltak er mer naturlig å igangsette dersom spontanbedring ikke inntreffer, eller der det er spesielt uttalt neglekt. Trening med visuell skanning kan også være spesielt aktuelt for pasienter som har økte krav til oppmerksomhet, f.eks. for pasienter der neglekt kan være en faktor som hindrer tilbakeføring til arbeid.
Det er ikke grunnlag for å konkludere at visuell skanning er bedre enn andre tiltak ved neglekt. Hovedfokus ved neglekt bør være på trening i ADL-funksjon. Alle pasienter med neglekt bør derfor tilbys generell stimulering og oppgaverelatert trening slik det generelt anbefales for slagrammede med kognitive vansker . Se anbefaling om generell stimulering og oppgaverelatert trening hos pasienter med kognitive vansker.
Begrunnelse – dette er anbefalingen basert på
For dette PICO-spørsmålet ble det samarbeidet med Socialstyrelsen i Sverige som gjennomførte en kunnskapsoppsummering.
Socialstyrelsen konkluderte med at det ikke var et tilstrekkelig godt nok kunnskapsgrunnlag for å gjennomføre en GRADE-vurdering.
Anbefalingen er en videreføring av retningslinjen fra 2010. Den er i hovedsak basert på klinisk erfaring og andre studier enn randomiserte kontrollerte forsøk. Det inngikk også i vurderingen at en systematisk oppsummering av kunnskapsbasert rehabilitering anbefaler tiltaket [463].
På grunn av det forannevnte er det ikke mulig å gi konkrete anbefalinger om intensitet, subgrupper som spesielt har nytte av tiltaket osv. De vises til de enkelte studiene som ligger til grunn for anbefalingen.
Anbefalingen er basert på oppsummert forskning samt arbeidsgruppens samlede erfaring og kunnskap.
Forskningsgrunnlag
Populasjon (P): Slagrammede med neglekt
Tiltak (I): Visuell scanning
Sammenligning (C): Annen neglektrehabilitering enn visuell scanning
Beskrivelse av inkluderte studier
I arbeidet med revisjon av eksisterende retningslinje har Norge samarbeidet med Sverige (Socialstyrelsen) på dette PICO om visuell scanning. Sverige skulle utføre litteratursøk, screening og utføre GRADE-vurdering. I dette arbeidet konkluderte Socialstyrelsen med at det ikke var et tilstrekkelig godt nok kunnskapsgrunnlag – for alle undersøkte utfallsmål (svært lav kvalitet). Socialstyrelsen kunne derfor ikke dra evidensbaserte slutninger om intervensjonen.
I arbeidet med revisjon av nasjonal retningslinje for behandling og rehabilitering ved hjerneslag måtte arbeidsgruppen ha en konsensusbasert prosess i arbeidet med en anbefaling på området.
«Vi identifierade en systematisk översikt av god kvalitet och 1 studie som publicerats efter översiktens sökdatum av medelgod kvalitet.
Den systematiska översikten innehöll 23 randomiserade studier med kognitiv rehabilitering som intervention (n=623 patienter). Visuell avsökning ingick som komponent i interventionen i 7 studier, varav tre av dessa undersökte visuell avsökning vs annan rehabilitering (n=28). De studier som ingick i den systematiska översikten hade enligt författarna låg till hög risk för bias; sammantaget strax under medelgod kvalitet. Tillförlitligheten till resultaten bedöms därför vara otillräcklig när det gäller effekt på spatial neglekt. De studier i översikten som matchade PICO hade få deltagare och mycket varierande risk för bias. För de utfall vi sökte fanns endast studier av låg till medelhög kvalitet.
Utfallen i den enskilda studien som ingår i underlaget (assessments of oculomotor function, visual scanning and functional ability) är inte desamma som utfallen i översikten och tillförlitligheten är otillräcklig eftersom resultaten enbart baseras på en studie.
Utifrån de 3 studierna i översikten går det heller inte att dra slutsatsen att effekt saknas, på grund av det mycket begränsade antalet patienter och de stora konfidensintervallen, varför resultatet är oklart och tillförlitligheten otillräcklig. Detta illustreras i underlagets resultattabell.
Vilken effekt har åtgärden?
- Det vetenskapliga underlaget är otillräckligt för att bedöma träning i visuell avsökning vid spatial neglekt. Åtgärden har en oklar effekt på spatial neglekt, funktionsförmågaförmåga och okulärmotoriska funktioner.
Resultatet av den enskilda studien indikerar dock att det finns anledning att uppmuntra kliniska studier med högre metodologisk design.
Kommentar
Av de systematiska översikter som identifierades valdes Bowen, 2011 eftersom den höll högst kvalitet, var senast publicerad och motsvarade PICO bäst. Bowen 2011 hade även det största totala deltagarantalet och fler nyproducerade studier (av högre kvalitet) än de andra översikterna. Dock inkluderades endast vissa studier i den systematiska översikten då den undersökte flera andra interventioner än enbart visuell avsökningsträning.
I flera av de artiklar som kvalitetsgranskades studerades metoder där man kombinerade visuell avsökningsträning med annan träning. Av dessa studier framgår att en kombination, där avsökningsträning läggs till en annan träning, har bättre effekt än enbart avsökningsträning.
Saknas någon information i studierna?
I den systematiska översikten saknas studier som utvärderat om träning av visuell avsökning har något effekt på graden av oberoende och ADL.»
Vurdering
Fordeler og ulemper
Fordeler: Ut fra klinisk erfaring er det grunn til å tro at tiltaket har noe positiv effekt, spesielt for utvalgte pasienter.
Ulemper: Dersom dette tiltaket blir så omfattende at det går utover andre rehabiliteringstiltak som er viktige for økt funksjon og mestring, vil det ikke være ønskelig. Dette vil spesielt gjelde pasienter med fatigue.
Konklusjon: Forskningen indikerer at man ikke vet om de ønskede effektene veier opp for de uønskede effekter, men ut fra erfaring er det grunn til å tro at fordelene kan veie opp for ulempene.
Kvalitet på dokumentasjonen
Vi har lav tiltro til effektestimatene slik at vi ikke kan trekke noen sikker konklusjon basert på dokumentasjonen om effekt av tiltaket.
Verdier og preferanser
Utfallsmålene synsfunksjon og ADL- funksjon anses som viktig med tanke på utforming av anbefaling på dette tiltaket. For pasienter i målgruppen vil tiltaket som regel være svært akseptabelt, da det potensielt bidrar til å bedre en for den enkelte pasienten vesentlig funksjonsnedsettelse.
Referanser
462. Cognitive rehabilitation for spatial neglect following stroke https://www.helsedirektoratet.no/referanse/0002-0013-195807
463. Evidence-based cognitive rehabilitation: updated review of the literature from 2003 through 2008 https://www.helsedirektoratet.no/referanse/0002-0013-195808
464. The Effect of Visual Scanning Exercises Integrated Into Physiotherapy in Patients With Unilateral Spatial Neglect Poststroke A Matched-Pair Randomized Control Trial https://www.helsedirektoratet.no/referanse/0002-0013-195809
Kompensatoriske teknikker og hjelpemidler ved hukommelsesvansker etter hjerneslag
Pasienter med hukommelsesvansker bør få opplæring i kompensatoriske teknikker og hjelpemidler slik som elektroniske dagbøker, dagsplaner og eventuelt auditive alarmer.
SIGN: D4.
Begrunnelse – dette er anbefalingen basert på
Hukommelsesvansker som fokale utfall er ikke av de vanligste symptomer etter hjerneslag, men nedsatt kapasitet for innlæring og lagring av informasjon ses i større eller mindre grad som en følge av generelt nedsatt psykomotorisk effektivitet.
Ulike fokale kognitive utfall kan hemme innlæring/hukommelse. Etter høyresidig hjerneslag vil ofte nedsatt oppmerksomhet medføre tilsynelatende hukommelsessvikt. Personer med nedsatt rom/retningsoppfatning eller med afasi, vil ha vansker med effektivt å lagre/huske hhv. visuell eller språklig informasjon.
En systematisk Cochrane-oversikt fra 2005 konkluderer med at det ikke er tilstrekkelig dokumentasjon for effekt av spesifikk kognitiv trening rettet mot hukommelsesproblemer [463]. Kompensatoriske strategier for bedring av hukommelse er bedre dokumentert for traumatisk hjerneskade.
Bruk av enkle hjelpemidler (huskebok, visuelle eller auditive påminnere etc.) kan være aktuelt for en del pasienter etter individuell vurdering.
Forskningsgrunnlag
Populasjon (P): Slagrammede med hukommelsesvansker
Tiltak (I): Kompensatoriske teknikker og hjelpemidler slik som elektroniske dagbøker, dagsplaner og ev. auditive alarmer
Sammenligning (C): Ingen tiltak
Beskrivelse av inkluderte studier
Referanser
456. Evidence-based cognitive rehabilitation: updated review of the literature from 1998 through 2002 https://www.helsedirektoratet.no/referanse/0002-0013-195801
Sist faglig oppdatert: 21.12.2017
Strategitrening ved apraksi eter hjerneslag
Strategitrening i tillegg til tradisjonell ergoterapiintervensjon for å bedre ADL-funksjon kan anbefales til pasienter med apraksi for å bedre planlegging og utføring av oppgaver.
SIGN: C1b.
Begrunnelse – dette er anbefalingen basert på
Apraksi er svikt i utføring av viljestyrte, målrettede handlinger som ikke kan tilskrives pareser, sensibilitetstap, koordinasjonsforstyrrelser eller tilstander i bevegelsesapparatet, og heller ikke nedsatt forståelse eller hukommelsessvikt. Pasienten har gjerne problemer med rekkefølgen eller utvelgelsen av delprosessene i en sammensatt motorisk sekvens, har tendens til perseverasjon (stereotyp gjentakelse av en enkelt bevegelse) og vansker med å bruke redskaper.
Apraksi opptrer oftest ved kortikale skader i venstre hemisfære og ofte samtidig med afasi.
En studie har vist at strategitrening (selvinstruksjon, skriftlige handlingssekvenser og det å se bilder av handlingssekvenser) kombinert med ergoterapi ga større bedring i ADL enn ergoterapi uten slike spesifikke tiltak, men ingen forskjell i motorisk funksjon eller grad av apraksi ved 5 måneders oppfølging (594) (SIGN:1b). En systematisk Cochrane-oversikt konkluderer med at det ikke foreligger tilstrekkelig dokumentasjon for å anbefale spesifikke terapeutiske intervensjoner (595).
Forskningsgrunnlag
Populasjon (P): Personer med apraksi
Tiltak (I): Strategitrening i tillegg til generell ergoterapi
Sammenligning (C): Ingen tiltak
Beskrivelse av inkluderte studier
Referanser
465. Efficacy of strategy training in left hemisphere stroke patients with apraxia: A randomised clinical trial https://www.helsedirektoratet.no/referanse/0002-0013-195810
466. Interventions for motor apraxia following stroke https://www.helsedirektoratet.no/referanse/0002-0013-195811
Sist faglig oppdatert: 21.12.2017
Generell stimulering og oppgaverelatert trening for slagrammede med romretningsvansker
Ved romretningsvansker anbefales generell stimulering og oppgaverelatert trening
SIGN: C3.
Praktisk – slik kan anbefalingen følges
Romretningsvansker
Romretningsvansker er problemer med å sette sammen deler til en helhet og å utføre handlinger i rommet. Ved romretningsvansker kan det være vanskelig å oppfatte forholdet mellom egen kropp og rommet omkring, kroppsdelenes innbyrdes forhold og det å forholde seg til høyre og venstre.
Problemer med avstandsbedømmelse kan vise seg ved at personen ikke klarer å gripe glasset som står på bordet eller heller kaffen utenfor koppen. De som har slike problemer kan f. eks. sette seg helt eller delvis utenfor stolen, kan ha vansker med påkledning eller med å orientere seg i nabolaget. Et stimulerende miljø ser ut til å fremme kognitive ferdigheter som rom retningssans [467] (SIGN: 3).
Begrunnelse – dette er anbefalingen basert på
Det finnes ikke grunnlag for å anbefale noen spesifikke treningsopplegg for pasienter med rom-retningsvansker.
Forskningsgrunnlag
Populasjon (P): Pasienter med agnosi eller rom retningsvansker etter hjerneslag
Tiltak (I): Generell stimulering, oppgaverelatert trening
Sammenligning (C): Ingen tiltak
Beskrivelse av inkluderte studier
Referanser
467. Brain plasticity in health and disease https://www.helsedirektoratet.no/referanse/0002-0013-195812
Sist faglig oppdatert: 21.12.2017
Generell stimulering og oppgaverelatert trening for slagrammede med agnosi
Ved agnosi anbefales generell stimulering og oppgaverelatert trening.
SIGN: D4.
Praktisk – slik kan anbefalingen følges
Agnosi
Agnosi er sviktende evne til å gjenkjenne sammensatte sensoriske stimuli som en helhet. Dette til tross for at de primære sansefunksjonene er intakte. Tilstanden er både funksjonshemmende og potensielt farlig, pga. at personen mangler evne til å beskytte seg mot farlige gjenstander. Rene agnosier sees relativt sjeldent, men agnosi er ofte til stede som et element i rom retningsvansker.
De vanligste former for agnosi er:
- Taktil agnosi. Pasienten har normal berøringssans, men klarer likevel ikke å kjenne igjen en gjenstand han holder i hånden og føler på.
- Visuell agnosi. Pasienten har normalt syn og kan beskrive detaljene i et bilde, men skjønner likevel ikke hva det forestiller.
- Prosopagnosi. Pasienten er ikke i stand til å gjenkjenne ansikter.
- Auditiv agnosi. Pasienten hører lyder, men klarer ikke å forstå meningsinnholdet.
Det foreligger ingen dokumentasjon som gir grunnlag for spesifikke anbefalinger i forhold til tiltak/intervensjoner.
Begrunnelse – dette er anbefalingen basert på
Det finnes ikke grunnlag for å anbefale noen spesifikke treningsopplegg for pasienter med agnosi.
lenke til anbefaling: "Ved kognitive funksjonsutfall anbefales generell stimulering og oppgaverelatert trening fra alt personell involvert i pasientens behandling og rehabilitering."
Forskningsgrunnlag
Populasjon (P): Pasienter med agnosi eller rom retningsvansker etter hjerneslag
Tiltak (I): Generell stimulering, oppgaverelatert trening
Sammenligning (C): Ingen tiltak
Beskrivelse av inkluderte studier
Referanser
467. Brain plasticity in health and disease https://www.helsedirektoratet.no/referanse/0002-0013-195812
Sist faglig oppdatert: 21.12.2017
Syn, hørsel og kommunikasjon
Vurdering av synsfunksjon hos pasienter med hjerneslag, eventuell henvisning til øyelege, optiker, ortoptist og/eller synspedagog
Synsfunksjonen bør vurderes etter hjerneslaget, og pasienter med synsproblemer bør henvises til øyelege, optiker, ortoptist og/eller synspedagog.**
Begrunnelse – dette er anbefalingen basert på
Synsproblemer har blitt rapportert hos opptil 60 % av slagrammede. I årsrapport norsk hjerneslagsregister 2015, har 18% rapportert om nytilkomne synsproblemer etter hjerneslaget. Det vanligste problemet er synsfeltutfall (tap av syn i visse deler av synsfeltet, oftest halvsidig homonym hemianopsi). Andre synsproblemer rapporteres også hyppig etter hjerneslag, som dobbeltsyn pga. øyemuskelparese, ustabil fokusering, lysømfintlighet med mer.
Det finnes ikke tilstrekkelig dokumentasjon for å kunne anbefale gjenopptrening av synsfeltet ved spesielle stimuleringstiltak eller forskjellige former for hjelpemidler. Kompensatorisk synstrening i form av visuelle skanningsteknikker kan forsøkes. Se også anbefaling om «Synsforbedrende tiltak hos pasienter med synsfeltutfall etter hjerneslag".
I tillegg til øyelege kan det være aktuelt å benytte synspedagoger som har kompetanse innenfor disse områdene. Enkelte ergoterapeuter med spesiell kompetanse i synstrening gir også opplæring i visuelle skanningsteknikker. Synskontakt er opprettet i mange kommuner med tanke på enkel rådgivning og oppfølging i bruk av synstekniske hjelpemidler i samarbeid med hjelpemiddelsentralen, og ved pasienter med synsvansker etter hjerneslag bør det tas kontakt med synskontakt tidlig.
Pasienter bør få vurdert synsfunksjonen etter hjerneslaget. Ved nyoppstått reduksjon i visus, dobbeltsyn eller synsfeltsutfall bør henvisning til øyelege vurderes. Hvor mange som også bør tilbys synstrening ved synspedagog er usikkert. Synspedagoger har til nå vært en lite tilgjengelig yrkesgruppe, men mye taler for at synspedagoger bør være tilgjengelige i en spesialisert rehabiliteringstjeneste og også gi oppfølging av synstrening etter utskrivelse.
Synstrening kan ivaretas av andre (f.eks. ergoterapeuter) med nødvendig kompetanse.
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag
Tiltak (I): Vurdere synsfunksjon og ev. viderehenvise
Sammenligning (C): Ingen vurdering eller viderehenvisning
Beskrivelse av inkluderte studier
Referanser
468. Å se er ikke alltid nok https://www.helsedirektoratet.no/referanse/0002-0013-195813
Sist faglig oppdatert: 21.12.2017
Synsforbedrende tiltak hos pasienter med synsfeltsutfall etter hjerneslag
Hos slagrammede med synsfeltsutfall foreslås det behandling med kompensatoriske tiltak.
Praktisk – slik kan anbefalingen følges
Alle slagrammede bør få vurdert synsfunksjonen etter hjerneslaget, og hjerneslagrammede med synsvansker bør vurderes for henvisning til øyelege, optiker, ortoptist og/eller synspedagog. Se anbefaling om vurdering av synsfunksjon hos pasienter med hjerneslag, eventuell henvisning til øyelege, optiker, ortoptis og/eller synspedagog.
Spesifikke kompensatoriske tiltak kan være trening i visuelle søkestrategier, trene øyebevegelser for lesing, bruk av blinklys eller fargetegn, trening i å utføre daglige aktiviteter.
For noen av tiltakene kan det være nødvendig med samarbeid mellom spesialist- og helse- og- omsorgstjenestene i kommunen og utdanningssektoren, for eksempel at tiltak starter i spesialist- og følges opp i helse- og- omsorgstjenestene i kommunen. Andre tiltak, som ADL-trening, kan være rent kommunale.
Tiltakene blir ofte gjennomført ved synspedagog eller ergoterapeut. Disse faggruppene kan også være veiledere for andre yrkesgrupper.
Variasjonen i tidspunktet etter hjerneslaget for når de kompensatoriske tiltakene er studert, er så stor at det ikke kan gis klare anbefalinger. Den erfaringsbaserte kunnskapen er at synsfeltutfall i noen grad spontanbedres. Det kan være grunnlag for å forsøke kompensatoriske tiltak opptil flere år etter hjerneslaget.
Begrunnelse – dette er anbefalingen basert på
Anbefalingen er basert på oppsummert forskning samt arbeidsgruppens samlede erfaring og kunnskap.
Synsproblemer er et stort problem for mange slagprammede, en prevalens på 20-60 % er rapportert.I årsrapport norsk hjerneslagsregister 2015, har 18% rapportert om nytilkomne synsproblemer etter hjerneslaget. I retningslinjen fra i 2010 står det at «alle slagpasienter bør få vurdert synsfunksjon etter hjerneslaget». Man fant da ikke tilstrekkelig dokumentasjon for å kunne anbefale behandlings/rehabiliteringstiltak. Det var derfor behov for å få et oppdatert kunnskapsgrunnlag som kunne danne grunnlag for en nasjonal anbefaling på området. Kunnskapsgrunnlaget inkluderer også pasienter med både synsfeltutfall og visuelt neglekt.
Rehabiliterende tiltak som har blitt forsøkt ved synsfeltutfall er å
- gjenvinne hele eller deler av synsfeltet (restitusjon)
- kompensere for synsutfallet ved å endre atferd og aktiviteter (kompensasjon)
- finne erstatninger for synsdefekten ved å bruke hjelpemidler (substitusjon)
Studiene som beskriver substitusjons- og restitusjonsstrategier er av svært lav kvalitet, og effektene er usikre.
Det er ikke funnet studier som omhandler effekter av utredning og screening.
Kompensasjonsstrategier (trening på øyebevegelser, lesing og utforsking av synsfeltet) kan muligens gi en bedring i
- visuell søkefunksjon (SMD: 1,04, 95% KI fra 0,48 til 1,60)
- leseferdighet (SMD: 0,91, 95% KI fra 0,49 til 1,33)
- evnen til å utføre dagliglivets aktiviteter (ADL) (SMD: 0,69, 95% KI fra 0,17 til 1,21)
Litteratursøket gir ikke grunnlag for å anbefale i hvilken tidsperiode etter hjerneslaget tiltakene bør iverksettes. Tidsangivelsen varierer i studiene fra 5 dager til 7,5 år.
Forskningsgrunnlag
Populasjon (P): Slagrammede med synsvansker relatert til slaget
Tiltak (I): Synsforbedrende tiltak
Sammenligning (C): Ingen spesifikk behandling mot synsvansker
Beskrivelse av inkluderte studier
SoF-tabell (PDF)
Flytskjema (PDF)
Søkestrategi (PDF)
Bestilling av en kunnskapsoppsummering til Kunnskapssenteret våren 2016. PICO ble spisset til å gjelde intervensjon av synsfeltsutfall og ikke alle synsvansker relatert til slaget:
«Hva er effekten av behandling rettet mot synsfeltsutfall hos personer som har hatt hjerneslag?»
Avgrenset oppdrag: oppdatert kunnskapsgrunnlag ut fra følgende systematiske oversikt (fra 2011): Pollock, A: Interventions for visual field defects in patients with stroke. Avgrenset søk med søkeord for synsfeltproblemer (visual field, hemianopsia, scotoma osv.)
Kunnskapssenteret har søkt i syv elektroniske databaser etter randomiserte kontrollerte studier av tiltak gitt til personer med synsfeltsutfall etter hjerneslag eller andre årsaker til synsfeltutfall. Det er blitt inkludert 21 studier (7 om kompensasjon, 7 om substitusjon, 6 om restitusjon, og 1 som sammenliknet kompensasjon og substitusjon).
Kompensasjonsstrategier (trening på øyebevegelser, lesing og utforsking av synsfeltet) kan muligens gi en bedring i visuell skanningfunksjon (Standardisert gjennomsnittlig forskjell [SMD]: 1,04 med 95 prosent konfidensintervall [KI] fra 0,48 til 1,60).
Kompensasjonsstrategier kan også muligens forbedre leseferdighet (SMD: 0,91, 95% KI fra 0,49 til 1,33) og evnen til å utføre dagliglivets aktiviteter (ADL, SMD: 0,69, 95% KI fra 0,17 til 1,21).
For substitusjons- og restitusjonsstrategier er dokumentasjonen av svært lav kvalitet, og effektene er usikre.
Vi har ikke funnet studier som omhandler effekter av utredning og screening.
Vurdering
Fordeler og ulemper
Fordeler: Det er en tendens til at tiltaket har en positiv effekt, men det er en usikkerhet rundt effektestimatene.
Ulemper: Det er ikke erfaring med eller rapportert noen ulemper/bivirkninger med tiltaket.
Konklusjon: Fordelene veier antagelig opp for ulempene.
Kvalitet på dokumentasjonen
Tiltroen er lav til effektestimatene for kompensasjonstiltak. Derfor kan det ikke trekkes konklusjoner basert på dokumentasjonen om effekt av tiltaket.
Verdier og preferanser
Utfallsmålene synsfunksjon og ADL- funksjon anses som viktige.
Akseptabilitet
Tiltaket ble vurdert til å være akseptabelt både for brukere, klinikere og tjenestene.
Referanser
486. Tiltak ved synsfeltutfall etter hjerneslag: en systematisk oversikt https://www.fhi.no/globalassets/dokumenterfiler/rapporter/synsfeltutfall-ved-slag-rapport-2017.pdf
Vurdering av pasienter med funksjonshemmende hørselstap ved øre-/nese-/halslege
Pasienter med funksjonshemmende hørselstap etter hjerneslag bør vurderes av øre-/nese-/halslege.**
Begrunnelse – dette er anbefalingen basert på
Redusert hørsel er sjelden en direkte følge av hjerneslag, men er hyppig forekommende i den eldre del av befolkningen og kan i stor grad komplisere rehabiliteringsprosessen. Undersøkelse av hørselsfunksjonen bør være en del av den kliniske undersøkelsen/kartleggingen. Utredning i samarbeid med øre-/nese-/halslege kan være nyttig.
Forskningsgrunnlag
Populasjon (P): Pasienter med funksjonshemmende hørselstap etter hjerneslag
Tiltak (I): Vurdering ved øre-/nese-/halslege
Sammenligning (C): Vurdering ved øre-/nese-/halslege
Beskrivelse av inkluderte studier
Sist faglig oppdatert: 21.12.2017
Screening for språkvansker av alle pasienter med slag i dominant hemisfære, kartlegging av språk- og talefunksjon
Alle pasienter med slag i dominant hemisfære bør screenes med tanke på språkvansker, og pasienter med språk- og kommunikasjonsvansker bør henvises til kartlegging av språk- og talefunksjon hos logoped. **
Begrunnelse – dette er anbefalingen basert på
Kommunikasjonsvansker som skyldes språk- og talevansker, pragmatiske vansker og andre relaterte kognitive svekkelser opptrer hos om lag 40 % av slagrammede [457]. Tidlig diagnostisering kan identifisere vanskene og tidlig intervensjon kan fremme bedring [313].
Diagnostisering og behandling av språk- og kommunikasjonsvansker er logopeders arbeidsfelt. Afasi og taleapraksi diagnostiseres ved screeningprøver og formell testing med Norsk grunntest for afasi. PALPA (Psycholinguistic Assessment of Language Processing in Aphasia) er et nyttig redskap for findiagnostisering av vansker innen språkprosessene.
Forskningsgrunnlag
Populasjon (P): Pasienter med slag i dominant hemisfære
Tiltak (I): Screening med tanke på språkvansker, kartlegging av språk- og talefunksjon ved logoped
Sammenligning (C): Ingen screening og kartlegging
Beskrivelse av inkluderte studier
Referanser
457. Management of adult stroke rehabilitation care https://www.helsedirektoratet.no/referanse/0002-0013-195802
313. A meta-analysis of clinical outcomes in the treatment of aphasia https://www.helsedirektoratet.no/referanse/0002-0013-195658
Sist faglig oppdatert: 21.12.2017
Språktrening
Språktrening ved afasi og/eller taleapraksi etter hjerneslag bør være spesifikk, igangsettes i akuttfasen og være av tilstrekkelig mengde og hyppighet.
SIGN: B1a.
Praktisk – slik kan anbefalingen følges
Taleapraksi forekommer oftest i forbindelse med afasi, og tiltak rettet mot disse vanskene blir oftest et ledd i den psykolingvistiske tilnærmingen til språk- og talevanskene.
Begrunnelse – dette er anbefalingen basert på
Metaanalyser som inneholder informasjon om både randomiserte og ikke randomiserte studier tyder på at språkterapi kan ha en positiv effekt i alle stadier i rehabiliteringen [469] [313] (SIGN: B1a/2b). Effekten er imidlertid størst hvis terapien starter i akutt fase [313] (SIGN: B1a/2b). Klinisk erfaring tilsier også at språkterapi bør gis så tidlig som mulig.
I en analyse av 8 studier for å undersøke effekten av intensitet, var signifikant positiv effekt bare til stede i de 4 studiene som hadde språktrening mer enn 5 t per uke [469]. Den gjennomsnittlige mengde terapi i de positive studiene var 8,8 t per uke i 11,2 uker (total mengde terapi 98,4 t). De fire negative studiene ga i gjennomsnitt 2 t per uke i 22,9 uker (total mengde terapi 43.6 t) [469] (SIGN: B1b/2a). Oversikten inneholdt også ikke-randomiserte studier og studier av lav metodisk kvalitet så sikre konklusjoner kan ikke trekkes. Studiene indikerer imidlertid en sammenheng mellom intensitet, treningsmengde og effekt, og at språktrening over 5 t per uke bør tilstrebes.
Single case-studier indikerer også at tiltak for afasirammede kan gi bedring i kronisk fase, også hos de som har hatt afasi i mer enn et år [477]. Klinisk erfaring tyder på at mange afasirammede kan ha nytte av logopedi over lengre tid (i mange tilfeller flere år) for å oppnå optimal språkfunksjon og for å vedlikeholde funksjonsnivå, men vitenskapelig dokumentasjon mangler.
Studier har vist at noen kan ha nytte av computer-baserte treningsprogram i kronisk fase [476] (SIGN: 2a).
Det er noe evidens til støtte for kognitiv-lingvistisk terapi for personer med afasi [472] (SIGN: 1b) [463] (SIGN: 2a) [471] (SIGN: 2b) [478] (SIGN: 3). Dette innebærer språkterapi rettet mot spesifikke utfall i språkprosesseringen på bakgrunn av psykololingvistisk diagnostisering.
Studier har også vist at deltagelse i kommunikasjonsgruppe forbedrer kommunikasjonsevnen sammenlignet med deltagelse i annen gruppeaktivitet [473] (SIGN: 2b).
Få studier har undersøkt intervensjon direkte rettet mot taleapraktiske vansker, og metodologiske svakheter gjør det vanskelig å trekke sikre konklusjoner [481]. Single case-studier tyder på noe effekt av terapi som benytter teknikker for å fasilitere korrekt taleproduksjon [470];[474]; [480] (SIGN: 3).
Forskningsgrunnlag
Populasjon (P): Slagrammede med afasi og/eller taleapraksi
Tiltak (I): Logopediske tiltak i akuttfasen
Sammenligning (C): Logopediske tiltak i senere faser
Beskrivelse av inkluderte studier
Referanser
456. Evidence-based cognitive rehabilitation: updated review of the literature from 1998 through 2002 https://www.helsedirektoratet.no/referanse/0002-0013-195801
469. Intensity of aphasia therapy, impact on recovery https://www.helsedirektoratet.no/referanse/0002-0013-195814
470. Effects of PROMPT therapy on speech motor function in a person with aphasia and apraxia of speech https://www.helsedirektoratet.no/referanse/0002-0013-195815
471. Evidence-based treatment outcomes in aphasia https://www.helsedirektoratet.no/referanse/0002-0013-195816
472. Effects of semantic treatment on verbal communication and linguistic processing in aphasia after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195817
473. The efficacy of group communication treatment in adults with chronic aphasia https://www.helsedirektoratet.no/referanse/0002-0013-195818
474. Long-term effectiveness of PROMPT treatment in a severely apractic-aphasic speaker https://www.helsedirektoratet.no/referanse/0002-0013-195819
313. A meta-analysis of clinical outcomes in the treatment of aphasia https://www.helsedirektoratet.no/referanse/0002-0013-195658
475. Training volunteers as conversation partners using supported conversation for adults with aphasia (SCA) a controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195820
476. The efficacy of computer-provided reading treatment for chronic aphasic adults https://www.helsedirektoratet.no/referanse/0002-0013-195821
477. Language rehabilitation in chronic aphasia and time postonset https://www.helsedirektoratet.no/referanse/0002-0013-195822
478. Therapy for naming difficulties in aphasia: Application of a cognitive neuropsychological model https://www.helsedirektoratet.no/referanse/0002-0013-195823
479. Treatment for acquired apraxia of speech: A review of efficacy reports https://www.helsedirektoratet.no/referanse/0002-0013-195824
480. Effects of treatment for sound errors in apraxia of speech and aphasia https://www.helsedirektoratet.no/referanse/0002-0013-195825
481. Interventions for apraxia of speech following stroke https://www.helsedirektoratet.no/referanse/0002-0013-195826
Sist faglig oppdatert: 21.12.2017
Opplæring i individuelt tilpassede kommunikasjonsstrategier og vurdering av kommunikasjonshjelpemidler hos slagrammede med store kommunikasjonsvansker
Pasienter med store kommunikasjonsvansker bør få opplæring i individuelt tilpassede kommunikasjonsstrategier, og det bør vurderes om de kan ha nytte av kommunikasjonshjelpemidler.
SIGN: D4.
Begrunnelse – dette er anbefalingen basert på
Muligheter for å gjenvinne språk- og kommunikasjonsferdigheter er primært avhengig av skadens omfang, men også en rekke individuelle faktorer kan ha betydning for prognosen. De fleste vil oppleve bedring av språk- og kommunikasjonsferdigheter, men ikke alle har mulighet for å gjenvinne et talespråk. Overordnet mål for rehabilitering på dette området er at den enkelte skal oppnå optimale språk- og kommunikasjonsferdigheter for å kunne delta på ønskede arenaer. Alternativ og supplerende kommunikasjon (ASK) kan være en del av en individuelt tilpasset kommunikasjonsstrategi. Opplæring i kommunikasjonsstrategier bør også inkludere opplæring av pårørende /samtalepartner, f.eks. i støttet samtalestrategier. Se også anbefaling om Informasjon til personer som omgås slagrammede med afasi.
De fleste afasirammede kan ikke nyttiggjøre seg høyteknologiske kommunikasjonshjelpemidler. Klinisk erfaring har imidlertid vist at noen personer med afasi kan ha nytte av enkle, spesialtilpassede, papirbaserte løsninger eller alminnelig teknologi.
Forskningsgrunnlag
Populasjon (P): Slagrammede med store kommunikasjonsvansker
Tiltak (I): Opplæring i individuelt tilpassede kommunikasjonsstrategier og vurdering av kommunikasjonshjelpemidler
Sammenligning (C): Ingen opplæring i individuelt tilpassede kommunikasjonsstrategier og ingen vurdering av kommunikasjonshjelpemidler
Beskrivelse av inkluderte studier
Sist faglig oppdatert: 21.12.2017
Intensiv språktrening i kronisk fase hos slagrammede med språkvansker
Hos slagrammede i kronisk fase med språkvansker (afasi) foreslås intensiv språktrening i en tidsbegrenset periode.
Praktisk – slik kan anbefalingen følges
Intensiv språktrening i kronisk fase (>3 mnd) gjennomføres fortrinnsvis i gruppe, gjerne 2 til 4 pasienter per terapeut 5 timer eller mer per uke. Tiltaket kan også gjennomføres individuelt. Tiltaket kan organiseres slik at språktreningen kun utføres av logoped eller i samarbeid med andre under veiledning av logoped.
Den intensive språktreningen bør inneholde «pugging» (gjentatt muntlig produksjon av ord og fraser); dette først og fremst relatert til benevning av bilder, ev. gjenstander. Treningen kan også inkludere språktrening på aktivitets- og deltakelsesnivået.
Evidensgrunnlaget inkluderer studier med ulik intensitet (som regel en til flere timer daglig) og av ulik lengde (som regel 2 til 4 uker).
I de opprinnelige studiene er det brukt såkalte «constraints» (begrensninger), dvs. at pasienten under treningen ikke får lov å peke, bruke gester o.l. Evidensen er uklar på hvor vesentlig dette er, mens høy treningsintensitet synes å være en avgjørende faktor.
Begrunnelse – dette er anbefalingen basert på
Dokumentasjonen viser en effekt av intensiv språktrening sammenlignet med lavintensiv språktrening. Forskningsoppsummeringen finner ingen forskjell i effekt når man sammenligner intensiv språktrening versus ingen språktrening. Kvaliteten på dokumentasjonen er vurdert til lav ved GRADE.
Anbefalingen tar utgangspunkt i en oppdatert kortversjon av Cochrane-oppsummeringen fra 2012 «Speech and language therapy for aphasia following stroke» som ble bestilt av Helsedirektoratet i desember 2015 («targeted update»). Dokumentasjonsgrunnlaget ble vurdert til lav kvalitet, og anbefalingen baserer seg derfor også i stor grad på arbeidsgruppens kliniske erfaring og kunnskap. Kort tid etter at arbeidsgruppa diskuterte anbefalingen ble det utgitt en fullrevidert Cochrane-oppsummering «Speech and language therapy for aphasia following stroke» (2016).
Anbefalingen er basert på «oppsummert forskning»/vurdering av kunnskapsgrunnlaget og arbeidsgruppens samlede erfaring og kunnskap.
Forskningsgrunnlag
Populasjon (P): Slagrammede i kronisk fase (>3 mnd) med språkvansker (afasi)
Tiltak (I): Intensiv språktrening (>5 t./uke)
Sammenligning (C): Ingen /lavintensiv språktrening (<5 t hver uke)
Beskrivelse av inkluderte studier
Helsedirektoratet bestilte en oppdatert Cochrane Review («targeted update») av Brady et al. 2012, Speech and language therapy for aphasia following stroke (PDF).
Supplementary information Intensive SLT (PDF)
Oversikten inkluderte 9 studier og 399 deltagere med gjennomgått hjerneslag med afasi, i kronisk fase. Dokumentasjonsgrunnlaget viser at intensiv språktrening trolig bedrer språkfunksjon sammenlignet med språktrening av lav intensitet. Dokumentasjonsgrunnlaget er vurdert til moderat kvalitet. Når det gjelder intensiv språktrening sammenlignet med ingen språktrening, er det liten eller ingen effekt. Denne dokumentasjonen er vurdert til lav kvalitet, og det er liten tillit til resultatet.
Kunnskapselementer som klinisk erfaring og brukerkunnskap er også trukket inn i utarbeidelse av anbefalingen.
Vurdering
Fordeler og ulemper
Fordeler: Intensiv språktrening kan gi en positiv effekt på språkfunksjon (språkforståelse, benevning og flytende tale) i dagliglivet.
Ulemper: Det er ingen negative utfall med tiltaket. Den fullreviderte Cochrane-oppsummeringen fra 2016 viser større frafall i gruppen med intensiv språktrening.
Fordelene med tiltaket vurderes å veie opp for ulempene.
Kvalitet på dokumentasjonen
Verdier og preferanser
Høyere frafall ved treningstilbud av høy intensitet sammenlignet med lavere intensitet indikerer at ikke alle pasienter ønsker denne treningsformen. Enkelte pasienter kan ha nytte av å oppleve mestring med sosiale aktiviteter som også kan gi språklig stimulering/trening. Tilbudet vil variere i kommuner og sykehus avhengig av ressurstilgangen (logopedkompetanse). Tilbudet vurderes akseptabelt for pasienter, pårørende og helsepersonell.
Referanser
482. Speech and language therapy for aphasia following stroke https://www.helsedirektoratet.no/referanse/0002-0013-195827
483. Speech and language therapy for aphasia following stroke https://www.helsedirektoratet.no/referanse/0002-0013-195828
Sist faglig oppdatert: 21.12.2017
Rehabilitering for slagrammede med dysartri
Behandling ved dysartri kan bestå i muskeltrening, direkte artikulasjonstrening og bevisstgjøring i forhold til talekvalitet, selvkorrigering og/eller innlæring i kompensatoriske strategier, samt ved alvorlig dysartri vurdere kommunikasjonshjelpemidler.
SIGN: C3.
Begrunnelse – dette er anbefalingen basert på
Dysartri er en fellesbetegnelse for talevansker som skyldes lammelser, svakhet eller manglende koordinering av muskulatur involvert i taleproduksjon, som er betinget av en skade i det sentrale eller perifere nervesystemet. Dysartri er en talevanske og ikke en språkvanske. Dysartri forekommer ofte hos slagrammede og er ofte kombinert med svelgevansker.
Målet med dysartribehandling er at den enkelte skal oppnå best mulige kommunikasjonsferdigheter.
En Cochrane-studie fant ingen kvalitetsstudier i forhold til behandling av dysartri hos pasienter med hjerneslag eller andre ikke-progressive hjerneskader, men fant evidens for effekt av behandling av dysartri hos pasienter med andre nevrologiske lidelser [484] (SIGN: 1a).
Studier uten kontrollgrupper tyder på at taletrening rettet mot svikt i taleprosessen og opplæring i kompensatoriske strategier kan være til nytte [487];[488]:[485] (SIGN: 3).
Personer med svær dysartri kan ha nytte av både enkle og høyteknologiske kommunikasjons hjelpemidler [489] (SIGN: 3). Spesialløsninger, med lyd og tastatur på små bærbare maskiner, gir god hjelp for mange.
Forskningsgrunnlag
Populasjon (P): Slagrammede med dysartri
Tiltak (I): Muskeltrening, direkte artikulasjonstrening og bevisstgjøring i forhold til talekvalitet, selvkorrigering og/eller innlæring i kompensatoriske strategier, samt ved alvorlig dysartri vurdere kommunikasjonshjelpemidler
Sammenligning (C): Ingen muskeltrening, direkte artikulasjonstrening og bevisstgjøring i forhold til talekvalitet, selvkorrigering og/eller innlæring i kompensatoriske strategier, eller ved alvorlig dysartri vurdere kommunikasjonshjelpemidler
Beskrivelse av inkluderte studier
Referanser
484. Speech and language therapy for dysarthria due to non‐progressive brain damage https://www.helsedirektoratet.no/referanse/0002-0013-195829
485. Long-Term Treatment of Severe DysarthriaA Case Study https://www.helsedirektoratet.no/referanse/0002-0013-195830
487. The Neuroscience on the Web Series: CMSD 642 Neuropathologies of Swallowing and Speech. www.csuchico.edu/~pmccaffrey/syllabi/SPPA342/index.html
488. Behavioral management of respiratory/phonatory dysfunction from dysarthria: a systematic review of the evidence goliath.ecnext.com/coms2/summary_0199-2858315_ITM
489. Does enteral nutrition affect clinical outcome? A systematic review of the randomized trials https://www.helsedirektoratet.no/referanse/0002-0013-195834
490. AAC for Persons with Dysarthria and Apraxia. https://www.helsedirektoratet.no/referanse/0002-0013-195835
Sist faglig oppdatert: 21.12.2017
Svelgevansker, ernæring og eliminasjon
Utredning av svelgevansker og svelgetrening
Pasienter med vedvarende svelgevansker bør henvises til logoped eller annen kompetent fagperson for videre utredning (inkludert eventuell videofluoroskopi) og svelgetrening.
SIGN: D4.
Pasienter bør henvises til videofluoroskopi ved alvorlig og vedvarende svelgevansker og/eller residiverende pneumonier.**
Begrunnelse – dette er anbefalingen basert på
Studier har vist varierende forekomst av svelgevansker hos slagrammede fra 19-81 % [181]. Aspirasjonspneumoni er den alvorligste komplikasjonen med økt risiko for død og alvorlig funksjonshemning [181];[491] , men svelgevansker kan også bidra til underernæring. I løpet av 2-4 uker bedrer svelgefunksjonen seg hos omlag 80 % av de pasientene som har svelgvansker initialt [491].
Ved alvorlige og langvarige svelgevansker og/eller residiverende pneumonier kan videofluoroskopi benyttes, for å avdekke hvor i svelgeprosessen vanskene opptrer [181]. I Norge gjøres denne undersøkelsen foreløpig bare ved noen større sykehus og spesialsykehus.
Når det gjelder andre behandlingsmessige tiltak ved svelgevansker, har disse vist varierende resultater. Det finnes noen holdepunkter for at modifikasjon (oftest fortykning) av mat og drikke, optimal sittestilling og opplæring i svelgeteknikker og/eller ulike treningsopplegg for svelgemuskulaturen kan være til nytte [135] (SIGN:1b), men studiene er små, og resultatene spriker slik at noen klare anbefalinger er ikke mulig å gi. Kliniske observasjoner [138];[209] og erfaringer er derfor hovedgrunnlaget for anbefalingene om tiltak ved svelgevansker.
Forskningsgrunnlag
Populasjon (P): Pasienter med svelgevansker etter hjerneslag
Tiltak (I): Utredning og tiltak ved svelgvansker og svelgtrening
Sammenligning (C): Ingen utredning eller tiltak
Beskrivelse av inkluderte studier
Referanser
491. Early assessments of dysphagia and aspiration risk in acute stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195836
209. Lærebok i rehabilitering https://www.helsedirektoratet.no/referanse/0002-0013-195554
174. Effect of timing and method of enteral tube feeding for dysphagic stroke patients (FOOD): a multicentre randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195519
181. Dysphagia after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195526
135. Interventions for dysphagia in acute stroke. Cochrane Library. Issue 2 https://www.helsedirektoratet.no/referanse/0002-0013-195480
138. Svelgetesting hindrer dødsfall https://www.helsedirektoratet.no/referanse/0002-0013-195483
Sist faglig oppdatert: 21.12.2017
Tiltak ved svelgevansker
Slagrammede med svelgevansker bør få tilpasset mat og drikke, sitte stødig og ha tilsyn og instruksjon.
SIGN: D4
PEG-sonde anbefales ved behov for sondeernæring i mer enn 3-4 uker.
SIGN: A1a
Begrunnelse – dette er anbefalingen basert på
Det finnes noen holdepunkter for at modifikasjon (oftest fortykning) av mat og drikke, optimal sittestilling og opplæring i svelgeteknikker og/eller ulike treningsopplegg for svelgemuskulaturen kan være til nytte [135] (SIGN:1b), men studiene er små og resultatene spriker slik at noen klare anbefalinger er ikke mulig å gi. Kliniske observasjoner [138];[209] og erfaringer er derfor hovedgrunnlaget for anbefalingene om tiltak ved svelgevansker.
Overlevelse bedres litt ved tidlig bruk (første uken) av nasogastrisk ernæringssonde hos akutte slagpasienter med svelgevansker [492];[494] (SIGN:1b). Dette er i samsvar med studier som viser at sondeernæring øker energi- og næringsstoffinntaket, og komplikasjonsrisiko og dødelighet reduseres generelt hos sykehuspasienter som allerede er underernært [493]. Se også Nasjonale faglige retningslinjer for forebygging og behandling av underernæring (Helsedirektoratet).
Ved langvarig behov for sondeernæring, dvs. mer enn 3-4 uker, kan sonde via percutan endoskopisk gastrostomi (PEG) gi mindre ubehag i svelget, og også lavere risiko for aspirasjon [492]. Tidlig innsetting av PEG-sonde er imidlertid ikke gunstig og synes å kunne gi en tendens til økt dødelighet og funksjonshemning [174].
Forskningsgrunnlag
Populasjon (P): Pasienter med svelgevansker
Tiltak (I): Tiltak i måltidssituasjonen
Sammenligning (C): Ingen tiltak
Beskrivelse av inkluderte studier
Referanser
491. Early assessments of dysphagia and aspiration risk in acute stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195836
492. Routine oral nutritional supplementation for stroke patients in hospital (FOOD): a multicentre randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195837
493. Protein and energy supplementation in elderly people at risk from malnutrition http://dx.doi.org/10.1002/14651858.CD003288.pub2
209. Lærebok i rehabilitering https://www.helsedirektoratet.no/referanse/0002-0013-195554
494. Disease-related malnutrition: an evidence-based approach to treatment https://www.helsedirektoratet.no/referanse/0002-0013-195839
174. Effect of timing and method of enteral tube feeding for dysphagic stroke patients (FOOD): a multicentre randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195519
181. Dysphagia after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195526
135. Interventions for dysphagia in acute stroke. Cochrane Library. Issue 2 https://www.helsedirektoratet.no/referanse/0002-0013-195480
138. Svelgetesting hindrer dødsfall https://www.helsedirektoratet.no/referanse/0002-0013-195483
Sist faglig oppdatert: 21.12.2017
Kartlegging av vekt og ernæring hos slagrammede
Pasienten bør veies hver uke, til samme tid og på den samme vekten. Ved fare for underernæring bør inntak av mat og drikke registreres og ernæringsstatus vurderes. Henvisning til klinisk ernæringsfysiolog bør vurderes. **
Praktisk – slik kan anbefalingen følges
Helsedirektoratet har utgitt nasjonale retningslinjer for forebygging og behandling av underernæring. Denne retningslinjen gir anbefalinger som også gjelder for slagrammede (se lenke til Nasjonale faglige retningslinjer for forebygging og behandling av underernæring).
Klinisk undersøkelse, blodprøver, BMI, kostanamnese, registrering av mat og drikke, samt generelle funksjonsvurderinger i forhold til å mestre daglige gjøremål (ADL) med f.eks. Barthel Index [499] eller enkel kognitiv screening med Mini Mental Status Test (MMS) er viktige vurderinger i forhold til helsetilstand. Stabil vekt over tid er en god indikator på at pasienten får i seg riktig mengde næring [209]. Det er viktig at indikasjoner er til stede før man setter i gang aktiv ernæringsbehandling, slik at det er de pasientene med behov for ekstra tilskudd, pr. os, i.v. eller via sonde, som får dette [494];634.
Mennesker som står i fare for underernæring, inkludert de som er rammet av svelgevansker, kan ha nytte av vurdering hos klinisk ernæringsfysiolog [492].
Begrunnelse – dette er anbefalingen basert på
Slagrammede er spesielt utsatt for underernæring på grunn av svelgevansker, kognitive eller psykiske vansker. Andelen pasienter som blir underernært etter hjerneslag varierer mellom 8-34 % (626). 8-16 % av akutte slagpasienter er underernærte (BMI <22) [495];[496];[497].
Pasienter med risiko for underernæring bør følges opp med kostregistrering og ev. supplement med høykalorikost. Det er ikke vist at ernæringstilskudd er nyttig for alle akutte slagpasienter, kun til underernærte pasienter [493]:[492](SIGN: 1a).
Tilstrekkelig næringstilførsel er avgjørende for optimal rehabilitering. Underernæring fører til tap av muskelmasse, energi og kroppsvev, noe som igjen kan føre til mentale forandringer som depresjon, tretthet, forvirring og engstelse [495];[496].
Mennesker som står i fare for underernæring, inkludert de som er rammet av svelgevansker, kan ha nytte av vurdering hos klinisk ernæringsfysiolog [492].
Forskningsgrunnlag
Populasjon (P): Slagrammede med risiko for underernæring
Tiltak (I): Kartlegging av vekt og ernæring, henvisning til klinisk ernæringsfysiolog
Sammenligning (C): Ingen tiltak død
Beskrivelse av inkluderte studier
Referanser
492. Routine oral nutritional supplementation for stroke patients in hospital (FOOD): a multicentre randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195837
209. Lærebok i rehabilitering https://www.helsedirektoratet.no/referanse/0002-0013-195554
494. Disease-related malnutrition: an evidence-based approach to treatment https://www.helsedirektoratet.no/referanse/0002-0013-195839
495. Poor nutritional status on admission predicts poor outcomes after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195840
496. Impact of premorbid undernutrition on outcome in stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195841
174. Effect of timing and method of enteral tube feeding for dysphagic stroke patients (FOOD): a multicentre randomised controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195519
497. Malnutrition in hospitalized elderly patients: when does it matter? https://www.helsedirektoratet.no/referanse/0002-0013-195842
498. Meta-analysis: protein and energy supplementation in older people https://www.helsedirektoratet.no/referanse/0002-0013-195843
499. BDW, Functional evaluation: the Bartel Index https://www.helsedirektoratet.no/referanse/0002-0013-195844
Sist faglig oppdatert: 21.12.2017
Tiltak ved blæreforstyrrelser
Bekkenbunnsmuskulaturen bør trenes ved urininkontinens.
SIGN: A1b
Pasienten bør kateteriseres dersom resturinen overstiger 150 ml, permanent kateter bør unngås.
SIGN: C3
Praktisk – slik kan anbefalingen følges
Urininkontinens er et vanlig og plagsomt problem etter hjerneslag, og mellom 40-60 % av pasientene er inkontinente i akuttfasen (640). 25 % har urininkontinens ved utskrivelse fra sykehus, og 15 % er inkontinente etter ett år [503].
Det finnes tre kliniske typer urininkontinens: Stress-, urge- og blandingsinkontinens. Årsakene er sammensatte, og tverrfaglig utredning og rehabilitering er grunnlaget for behandlingen. Slagrelaterte årsaksmekanismer til urininkontinens kan være:
• nedsatt sentral hemning og koordinasjon av blærens autonome reflekssystem
• nedsatt sensibilitet som svekker registreringen og oppfattelsen av blærevolum
• nedsatt forflytningsevne og svekket motorikk
• nedsatt kommunikasjonsevne
• nedsatt rom-/retningsorientering
• nedsatt evne til å utføre innlærte praktiske handlinger [511].
Det er viktig å iverksette målrettet behandling og tiltak som er rettet mot årsak og type urininkontinens. Pasientens blærefunksjon før hjerneslaget bør kartlegges tidlig i sykdomsforløpet, siden opp mot 20 % av slagrammede har hatt inkontinensproblemer før hjerneslaget.
Resturinmåling ved hjelp av ultralydbasert blæreskanner gir en enkel, skånsom og pålitelig måling. Der det ikke er tilgang til blæreskanner, vil restmåling ved hjelp av kateterisering være nødvendig [501].
Urinlekkasje som oppstår etter hjerneslag, og der personen selv ikke merker lekkasjen, er knyttet til dårlig prognose på lengre sikt (642).
Det er viktig å sette fokus på inkontinensproblem etter hjerneslag ved å tilføre kunnskap til helsepersonell som arbeider med slagrammede [500];651).
Begrunnelse – dette er anbefalingen basert på
Behandlingstiltak mot inkontinens er trening av muskulaturen i bekkenbunnen [504];[505] (SIGN: 1b), blæretrening, regelmessige WC-tider, og intermitterende kateterisering. Tidlig strukturerte tiltak ser ut til å ha en positiv effekt med tanke på vannlatingsproblemene også på lang sikt [503];[506] (SIGN: 1a).
Urinretensjon som følge av hjerneslag bør behandles med intermitterende kateterisering [501]. Tømming av urinblæren gjentas med en frekvens som tilsier at det ikke samles mer enn 400 ml i blæren [514]. For å unngå infeksjon bør intermitterende kateterisering i institusjon foregå sterilt (SIK, steril intermitterende katerisering). Prosedyren kan være ren (RIK, ren intermitterende katerisering) når pasienten befinner seg i hjemmet[502];[506] (SIGN: 1a). Permanent kateter bør unngås, men benyttes hvis intermitterende kateterisering ikke kan gjennomføres [501];[514] (SIGN: 3).
Forskningsgrunnlag
Populasjon (P): Pasienter med urininkontinens
Tiltak (I): Bekkenbunnstrening
Sammenligning (C): Ingen bekkenbunnstrening
Beskrivelse av inkluderte studier
Referanser
500. Urinary incontinence after stroke: identification, assessment, and intervention by rehabilitation professionals in Canada https://www.helsedirektoratet.no/referanse/0002-0013-195845
501. Urinary tract infection and bacteriurua in stroke patients: frequencies, pathogen microorganisms, and risk factors https://www.helsedirektoratet.no/referanse/0002-0013-195846
502. Urinary catheter policies for short‐term bladder drainage in adults https://www.helsedirektoratet.no/referanse/0002-0013-195847
503. Prevention and treatment of urinary incontinence after stroke in adults https://www.helsedirektoratet.no/referanse/0002-0013-195848
504. Pelvic floor muscle training is effective in women with urinary incontinence after stroke: a randomised, controlled and blinded study https://www.helsedirektoratet.no/referanse/0002-0013-195849
505. Is there a long-lasting effect of pelvic floor muscle training in women with urinary incontinence after ischemic stroke? https://www.helsedirektoratet.no/referanse/0002-0013-195850
506. An evaluation of multidisciplinary intervention governed by functional independence measure (FIMSM) in incontinent stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195851
511. Inkontinens etter hjerneslag https://www.helsedirektoratet.no/referanse/0002-0013-195856
Sist faglig oppdatert: 21.12.2017
Kosttiltak, fysisk aktivitet og medikamentell behandling ved obstipasjon
Obstipasjon er den hyppigste avføringsforstyrrelsen hos slagrammede og bør forebygges ved god hydrering, fiberrik kost, mest mulig fysisk aktivitet og om nødvendig laksantia.
SIGN: B1b.
Begrunnelse – dette er anbefalingen basert på
Obstipasjon er meget vanlig etter hjerneslag. Immobilisering, dehydrering og medikamenter er faktorer som ofte kan bidra til obstipasjon. 60 % av pasientene som er innlagt i rehabiliteringsavdeling etter hjerneslag har problemer med obstipasjon. Dette påfører den slagrammede tilleggsproblemer, og forebygging er derfor viktig [509].
En systematisk kartlegging av naturlige funksjoner er en forutsetning for å gi god behandling, og denne kartlegging bør inkludere rektal undersøkelse. Obstipasjon kan i noen grad forebygges med fiberrik kost, rikelig væskeinntak og mobilisering (652) (SIGN: 1b). Ved behov kan romoppfyllende midler, laksativer og klyster benyttes [511].
Inkontinens for avføring kan opptre hos om lag 1/3 av pasientene etter et hjerneslag, men disse tallene er noe vanskelig å tolke, da en del av pasientene var komatøse, og fordi noen også var inkontinente før hjerneslaget. 15 % av pasientene med inkontinens initialt etter slaget er også inkontinente etter 3 år [509];[510];[507].
Slagrelaterte årsaksmekanismer til inkontinens for avføring kan være:
- nedsatt sentral hemning og koordinasjon av endetarmens autonome reflekssystem
- nedsatt registrerings- og forståelsesevne mht. tarmfunksjon
- nedsatt forflytningsevne og svekket motorikk
- nedsatt kommunikasjonsevne
- nedsatt rom- /retningsorientering
- nedsatt evne til å utføre innlærte praktiske handlinger [511].
Det er lite kunnskap om hvilke behandlingsmessige tiltak som kan være nyttige ved inkontinens etter hjerneslag, og mer forskning er nødvendig [508].
Forskningsgrunnlag
Populasjon (P): Pasienter med obstipasjon
Tiltak (I): Kost og medikamentelle tiltak mot obstipasjon
Sammenligning (C): Ingen tiltak
Beskrivelse av inkluderte studier
Referanser
507. Isolated urinary, fecal, and double incontinence: Prevalence and degree of soiling in stroke survivors https://www.helsedirektoratet.no/referanse/0002-0013-195852
508. New-onset fecal incontinence after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195853
509. Treatment of constipation and fecal incontinence in stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195854
510. Prevalence of and factors associated with fecal incontinence in a large community study of older individuals https://www.helsedirektoratet.no/referanse/0002-0013-195855
511. Inkontinens etter hjerneslag https://www.helsedirektoratet.no/referanse/0002-0013-195856
Sist faglig oppdatert: 21.12.2017
Depresjon og emosjonell labilitet
Tiltak ved depresjon
Ved depresjon anbefales etablering av et trygt og støttende miljø (SIGN:C3), vurdering av psykoterapi (SIGN:B1a), og ved klar depresjon legemiddelbehandling fortrinnsvis med serotoninopptakshemmere (SSRI).
SIGN: A1a.
Praktisk – slik kan anbefalingen følges
Hovedsymptomer ved depresjon er redusert stemningsleie, interesse- og gledesløshet og energitap med trettbarhet og nedsatt aktivitet. Andre symptomer er redusert konsentrasjon og oppmerksomhet, redusert selvfølelse og selvtillit, redusert appetitt, søvnforstyrrelser, skyldfølelse, triste og pessimistiske tanker om fremtiden og planer om selvskading og selvmord.
Imidlertid er symptomer som energitap (fatigue), nedsatt libido og matlyst, søvnforstyrrelse og nedsatt konsentrasjon vanlige etter hjerneslag, det samme gjelder apatisymptomer som nedsatt initiativ, nedsatt motivasjon og emosjonell avflating som alle er relativt hyppig forekommende fokale utfall etter hjerneslag som lett kan feiltolkes som uttrykk for depresjon.
Depresjon kan gi nedsatt rehabiliteringspotensiale [516];[515].
Pasienten bør vurderes med henblikk på depresjon i løpet av første måned etter debut av hjerneslaget. Både ikke-medikamentell og medikamentell behandling av depresjon kan være aktuell.
Ikke-medikamentell behandling rettet mot depresjon kan være støttesamtaler, informasjon til pasient og pårørende i en slagskole eller ved et Lærings- og mestringssenter, samt generell oppfordring til fysisk aktivitet og trening [516].
Se også «Nasjonal retningslinje for diagnostisering og behandling av voksne med depresjon i primær- og spesialisthelsetjenesten»
Begrunnelse – dette er anbefalingen basert på
Et trygt og godt miljø rundt den slagrammede i rehabiliteringsfasen er oppbyggende for psykisk helse [516] (SIGN: 3). Det er også viktig å kartlegge, og om mulig redusere, medvirkende årsaker til depresjon, som smerte og sosial isolasjon [518] (SIGN: 1b).
En Cochrane-studie finner en liten, men signifikant effekt av psykoterapi på bedring av stemningsleie [517] .
Studier på farmakologisk behandling har benyttet varierende metodologi og dette vanskelig gjør metaanalyser. Medikamentell forebygging av depresjon har ingen dokumentert effekt og anbefales derfor ikke [515]. Effekt på etablert depresjon er best dokumentert for serotoninopptakshemmere (SSRI) [517]. Bivirkningsprofil bør vurderes ved valg av medikament.
Forskningsgrunnlag
Populasjon (P): Pasienter med depresjon etter hjerneslag
Tiltak (I): Støttende miljø
Sammenligning (C): Ingen tiltak
Beskrivelse av inkluderte studier
Referanser
515. Interventions for preventing depression after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195860
516. MEDISIN OG VITENSKAP-Tema: Hjerneslag-Depresjon, angst og andre emosjonelle symptomer ved hjerneslag https://www.helsedirektoratet.no/referanse/0002-0013-195861
517. Interventions for treating depression after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195862
518. Care management of poststroke depression https://www.helsedirektoratet.no/referanse/0002-0013-195863
Sist faglig oppdatert: 21.12.2017
Behandling av depresjon med legemidler
Pasienter med klar depresjon bør tilbys behandling med legemidler raskt, fortrinnsvis med serotoninopptakshemmere (SSRI) og med behandlingsvarighet 3-6 måneder.
SIGN: A1a.
Praktisk – slik kan anbefalingen følges
Begrunnelse – dette er anbefalingen basert på
Medikamentell forebygging av depresjon har ingen dokumentert effekt og anbefales derfor ikke [515]. Effekt på etablert depresjon er best dokumentert for serotoninopptakshemmere (SSRI) [517]. Bivirkningsprofil bør vurderes ved valg av medikament.
Forskningsgrunnlag
Populasjon (P): Pasienter med klar depresjon
Tiltak (I): Legemiddel behandling
Sammenligning (C): Ingen medikamentell behandling
Beskrivelse av inkluderte studier
Referanser
516. MEDISIN OG VITENSKAP-Tema: Hjerneslag-Depresjon, angst og andre emosjonelle symptomer ved hjerneslag https://www.helsedirektoratet.no/referanse/0002-0013-195861
517. Interventions for treating depression after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195862
Sist faglig oppdatert: 21.12.2017
Behandling av emosjonell labilitet med legemidler
Pasienter med emosjonell labilitet bør tilbys behandling med SSRI (seretonin reopptakshemmer).
SIGN: A1a.
Praktisk – slik kan anbefalingen følges
Begrunnelse – dette er anbefalingen basert på
Emosjonelle symptomer er blant de mest oversette problemer etter hjerneslag, og kan forekomme hos 10-25 % etter hjerneslag og kjennetegnes av umotivert gråt (oftest) og/eller latter som utover følgene for den slagrammede selv også kan være et sosialt handicap.
Symptomene avtar vanligvis i løpet av det første året etter slaget [516]. Ved behandling av emosjonell labilitet har SSRI dokumentert rask og god effekt [519] (SIGN: 1a).
Forskningsgrunnlag
Populasjon (P): Pasienter med emosjonell labilitet
Tiltak (I): Legemiddel behandling
Sammenligning (C): Ingen behandling
Beskrivelse av inkluderte studier
Referanser
516. MEDISIN OG VITENSKAP-Tema: Hjerneslag-Depresjon, angst og andre emosjonelle symptomer ved hjerneslag https://www.helsedirektoratet.no/referanse/0002-0013-195861
519. Pharmaceutical interventions for emotionalism after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195864
Sist faglig oppdatert: 21.12.2017
Psykoterapi ved depresjon
Pasienter med depresjon bør vurderes med henblikk på tilbud om psykoterapi.
SIGN: B1a.
Praktisk – slik kan anbefalingen følges
Begrunnelse – dette er anbefalingen basert på
Pasienten bør vurderes med henblikk på depresjon i løpet av første md. etter debut av hjerneslaget. Både ikke-medikamentell og medikamentell behandling av depresjon kan være aktuell.
Forskningsgrunnlag
Populasjon (P): Pasienter med depresjon
Tiltak (I): Psykoterapi
Sammenligning (C): Ingen psykoterapi
Beskrivelse av inkluderte studier
Referanser
517. Interventions for treating depression after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195862
Sist faglig oppdatert: 21.12.2017
Aktivitet og deltagelse
Tverrfaglig intervensjon rettet mot personnære aktiviteter i dagliglivet (PADL) etter hjerneslag
Alle pasienter med begrensninger i personnære aktiviteter i dagliglivet, PADL, bør få intervensjon rettet mot PADL fra et tverrfaglig team (inkludert ergoterapeut) som sikrer tilstrekkelig intensitet og mengde av trening gjennom hele døgnets våkne timer.
SIGN: A1a.
Begrunnelse – dette er anbefalingen basert på
Ergoterapiintervensjon med fokus på PADL har vist seg å fremme aktivitet, øke selvstendighet og redusere risiko for dårlig utfall (OR 0.67, KI 0.51 til 0.87). For hver 100 pasient som fikk behandling, unngikk 11 å bli hjelpetrengende i PADL [172] (SIGN:1a). En meta-analyse har i tillegg vist at ergoterapi i kommunehelsetjenesten rettet mot spesifikke aktivitetsproblemer er nyttig [27] (SIGN: 1a).
Terapibasert rehabilitering (vanligvis med ergoterapeut og/eller fysioterapeut i teamet) i kommunehelsetjenesten viste økte ferdigheter i PADL og forhindret funksjonsforverring (OR 0.72, KI 0.57 til 0.92). For hver 100 pasient som fikk behandling unngikk 7 å bli hjelpetrengende i PADL[153] .
Forskningsgrunnlag
Populasjon (P): Slagrammede med begrensninger i PADL
Tiltak (I): Intervensjon rettet mot PADL fra et tverrfaglig team (inkludert ergoterapeut) som sikrer tilstrekkelig intensitet og mengde av trening gjennom hele døgnets våkne timer
Sammenligning (C): Ingen tiltak
Beskrivelse av inkluderte studier
Referanser
172. Occupational therapy for patients with problems in personal activities of daily living after stroke: systematic review of randomised trials https://www.helsedirektoratet.no/referanse/0002-0013-195517
153. Therapy-based rehabilitation services for stroke patients at home https://www.helsedirektoratet.no/referanse/0002-0013-195498
27. Individual patient data meta-analysis of randomized controlled trials of community occupational therapy for stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195372
Sist faglig oppdatert: 21.12.2017
Bredt sammensatt rehabiliteringstilbud inkludert ergoterapi mot spesifikke begrensninger i IADL
Pasienter som etter hjerneslaget har begrensninger i å utføre instrumentell aktivitet i dagliglivet, IADL, bør få et bredt sammensatt rehabiliteringstilbud inkludert ergoterapi rettet mot disse spesifikke begrensningene.
SIGN: A1a.
Begrunnelse – dette er anbefalingen basert på
Instrumentell ADL (IADL) er mer komplekse aktiviteter som matlaging, husarbeid og barnestell, bruk av telefon og transportmidler, samt å gjøre innkjøp og ivareta sin økonomi.
En systematisk oversikt fra 2003, og noen andre randomiserte kontrollerte studier, viser at et bredt sammensatt (comprehensive) ergoterapitilbud fremmer instrumentell ADL etter slag [27];[527];[528] (SIGN: 1a). Et slik tilbud kan omfatte å trene sensomotoriske funksjoner, kognitive funksjoner og ferdigheter som påkledning, matlaging og husarbeid. Videre omfatter det rådgivning og instruksjon i bruk av tekniske hjelpemidler, bruk av skinner og slynger og undervisning av familie og andre nære pårørende [528].
Se også: Veileder om pårørende i helse- og omsorgstjenesten (Helsedirektoratet).
Forskningsgrunnlag
Populasjon (P): Slagrammede med begrensninger i å utføre IADL
Tiltak (I): Bredt sammensatt rehabiliteringstilbud inkludert ergoterapi
Sammenligning (C): Ingen tiltak
Beskrivelse av inkluderte studier
Referanser
527. Randomised controlled trial of an occupational therapy intervention to increase outdoor mobility after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195872
528. Occupational therapy for stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195873
27. Individual patient data meta-analysis of randomized controlled trials of community occupational therapy for stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195372
Sist faglig oppdatert: 21.12.2017
Slagrammede med behov for hjelp i hjemmet
Vurdering av behovet for hjemmebasert omsorg bør skje i god tid før utskrivning til hjemmet.
SIGN: D4 og **
Begrunnelse – dette er anbefalingen basert på
Vesentlige funksjonsnedsettelser kan innebære behov for hjemmebasert omsorg. Dette bør vurderes i god tid før utskrivning til hjemmet slik at de kommunale tjenestene kan planlegges og forberedes. Aktuelle aktører når det er behov for hjemmebasert omsorg er koordinerende enhet og helse- og- omsorgstjenesten i kommunen (hjemmehjelp, hjemmesykepleie, personlig assistent, matombringing o.a.).
Indikasjoner på behov for hjemmebasert omsorg kan være:
- Vesentlige problemer med ADL, særlig personlig ADL
- Problemer med å følge opp medikamentbehandling
- Falltendens
- Liten eller ingen mulighet til å stelle egen bolig, sørge for egne innkjøp, lage egen mat
- Alvorligere kognitive funksjonsnedsettelser
Alle indikasjonene forsterkes dersom den slagrammede bor alene (SIGN:D4).
Forskningsgrunnlag
Populasjon (P): Slagrammede
Tiltak (I): Kartlegging av behov for hjemmebasert omsorg i god tid før utskriving
Sammenligning (C): Avvente vurdering av behov for hjemmebasert omsorg
Beskrivelse av inkluderte studier
Sist faglig oppdatert: 21.12.2017
Boligtilpasning etter hjerneslag
Vurdering av behovet for boligtilrettelegging bør starte i tidlig fase etter hjerneslaget.
SIGN: D4 og **
Begrunnelse – dette er anbefalingen basert på
Personer med betydelig varig eller langvarig funksjonssvikt etter hjerneslag kan ha behov for boligtilrettelegging, kompenserende tiltak og andre tiltak i hjemmet. Omfattende boligendringer eller skifte av bolig tar tid. Derfor bør det gjennomføres en kartlegging av bolig og bosituasjon tidlig hos pasienter hvor motorikk/mobilitet og/eller kognitiv funksjonsevne er vesentlig redusert.
Omfattende endringer i bolig bør ikke skje før det er gjennomført en prognosevurdering som indikerer at pasienten har mulighet til å nå et funksjonsnivå som gjør at hun / han kan mestre å bo i egen bolig.
Aktuelle aktører i forbindelse med boligtilpasninger er spesialisthelsetjenesten (ergoterapeut, sosionom, ambulant team), koordinerende enhet og rehabiliteringstjenesten i kommunene, NAV Hjelpemiddelsentralen, NAV-kontoret i kommunen, boligkontoret i kommunen, Husbanken m.fl.
Indikasjoner på behov for tilrettelegging av bolig kan være:
- Avhengighet av hjelpemidler for forflytning, spesielt rullestol/elektrisk rullestol
- Kognitive vansker
- Adkomst til eller forflytning innenfor boligen innebærer bruk av trapper
- Inngang/oppholdsrom og bad/soverom befinner seg på ulike plan
- Badet inneholder badekar eller er for lite
- Dører/dørterskler hindrer mobilitet
Alle indikasjoner forsterkes dersom den slagrammede bor alene (SIGN: D4).
Forskningsgrunnlag
Populasjon (P): Slagrammede
Tiltak (I): Vurdering mht. tilrettelegging av bolig, med oppstart tidlig i forløpet
Sammenligning (C): Ingen / utsatt planlegging av tilrettelegging av bolig
Beskrivelse av inkluderte studier
Sist faglig oppdatert: 21.12.2017
Aktivitet og trening etter hjerneslag
Fysisk aktivitet og trening bør være relatert til målrettede oppgaver (oppgaverelatert trening) og anbefales for å redusere nevrologiske utfall og bedret funksjon.
SIGN: B1a.
Begrunnelse – dette er anbefalingen basert på
Fysisk aktivitet i forebygging og behandling er et satsningsområde på samfunns- og individnivå. Fysisk aktivitet defineres som enhver aktivitet der musklene benyttes. I forhold til intervensjoner er det forskjell på belastning mellom det som i litteraturen benevnes som fysisk aktivitet og fysisk trening. Begrepene er i denne retningslinjen definert på følgende måte:
Fysisk aktivitet: Kroppslig bevegelse som resulterer i en vesentlig økning i energiforbruket utover hvilenivå [526]. Belastningen er lett og påvirker i liten grad pust og hjertefrekvens (puls) [526].
Fysisk trening: Regelmessig gjentagelse av fysisk aktivitet over tid med målsetting å forbedre form, prestasjon eller helse [526]. Belastningen er høy og innebærer rask pust og at hjertefrekvensen øker til 80 % av det maksimale [526].
Oppgaverelatert trening i forbindelse med fysisk aktivitet tilsvarer hverdagens bevegelser og styrker kroppen i utførelsen av disse. Dette er målorientert konkret trening i forhold til oppgaver som det er viktig for personen å mestre [522].
Fysisk aktivitet og trening er nyttig og kan
• redusere risiko for hjerneslag [524];[525] (SIGN: 3)
• redusere nevrologiske utfall etter akutt hjerneslag og bidra til gjenoppretting av funksjon [389];[374];[382] (SIGN: 1a)
• bidra til å forhindre sekundære komplikasjoner, det vil si reaksjoner eller komplikasjoner som oppstår på grunn av utfall (8) [521];[520];[378];[386];[390];[377];[523] (SIGN: 1b)
I forhold til type fysisk trening så er oppgaverelatert trening best dokumentert og kan gi økt funksjon i ekstremiteter og bedret balanse [378];[389];[386];[390];[382];[377] (SIGN: 1a). Se også: kap. 44 om hjerneslag i Aktivitetshåndboken utgitt av Helsedirektoratet .
Forskningsgrunnlag
Populasjon (P): Pasienter med hjerneslag
Tiltak (I): Fysisk aktivitet og trening
Sammenligning (C): Ingen fysisk aktivitet og trening
Beskrivelse av inkluderte studier
Referanser
1. Organised inpatient (stroke unit) care for stroke. https://www.helsedirektoratet.no/referanse/0002-0013-195346
374. Strengthening interventions increase strength and improve activity after stroke: a systematic review https://www.helsedirektoratet.no/referanse/0002-0013-195719
520. Global and regional burden of disease and risk factors, 2001: systematic analysis of population health data https://www.helsedirektoratet.no/referanse/0002-0013-195865
521. Prevalence of stroke and stroke-related disability https://www.helsedirektoratet.no/referanse/0002-0013-195866
377. Task-related training improves performance of seated reaching tasks after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195722
522. Stroke rehabilitation: guidelines for exercise and training to optimize motor skill https://www.helsedirektoratet.no/referanse/0002-0013-195867
378. Repetitive task training for improving functional ability after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195723
523. Interventions for promoting physical activity https://www.helsedirektoratet.no/referanse/0002-0013-195868
524. Leisure time, occupational, and commuting physical activity and the risk of stroke https://www.helsedirektoratet.no/referanse/0002-0013-195869
525. Physical health-related quality of life predicts stroke in the EPIC-Norfolk https://www.helsedirektoratet.no/referanse/0002-0013-195870
382. Stroke patients and long-term training: is it worthwhile? A randomized comparison of two different training strategies after rehabilitation https://www.helsedirektoratet.no/referanse/0002-0013-195727
526. Principal components of fitness: relationship to physical activity and lifestyle https://www.helsedirektoratet.no/referanse/0002-0013-195871
386. Physiotherapy treatment approaches for the recovery of postural control and lower limb function following stroke https://www.helsedirektoratet.no/referanse/0002-0013-195731
389. The impact of physical therapy on functional outcomes after stroke: what's the evidence? https://www.helsedirektoratet.no/referanse/0002-0013-195734
390. Task-oriented progressive resistance strength training improves muscle strength and functional performance in individuals with stroke https://www.helsedirektoratet.no/referanse/0002-0013-195735
Sist faglig oppdatert: 21.12.2017
Mestring av livet etter gjennomgått hjerneslag
Mestring er viktig for livskvalitet, og tiltak som kan gi økt mestring bør vektlegges.
SIGN: B1b.
Begrunnelse – dette er anbefalingen basert på
Empowerment eller egenkraftmobilisering handler om å mobilisere og styrke folks egne krefter/ressurser, samt å redusere avmakt [534].
Mestring er i litteraturen knyttet til stressbegrepet og er et sentralt begrep når sykdom utgjør en trussel mot selve livet. I sosiologien er mestring ofte knyttet til begrepet "opplevelse av sammenheng" [529]. "Opplevelse av sammenheng" representerer en global holdning som består av tre komponenter; begripelighet, håndterbarhet og meningsfullhet. En sterk opplevelse av sammenheng gir økt følelse av mestring.
Motivasjon defineres ofte som det som forårsaker aktivitet hos individet, det som holder denne aktiviteten ved like, og det som gir den mål og mening. Det skilles ofte mellom indre og ytre motivasjon. Hvis en person gjør en aktivitet på grunn av interesse for selve aktiviteten, og denne aktiviteten er belønning nok i seg selv, er det snakk om indre motivasjon. Ytre motivasjon vil si at personen gjør noe fordi vedkommende ønsker å oppnå en belønning eller et mål utenfor selve aktiviteten.
Studier innen slagforskning som omhandler empowerment, mestring, og motivasjon relateres til livskvalitet, opplevd depresjon og deltakelse i samfunnet. Pårørendes opplevelse av mestring tillegges også betydning i denne sammenhengen. Det finnes få studier med fokus på mestring, og det er behov for prospektive studier [532].
Det finnes evidens for at informasjon bedrer pasienter og pårørendes kunnskap om slag og har en liten ikke-signifikant positiv effekt på pasienttilfredshet og depresjon [533]. Motiverende intervju synes å kunne lede til en viss bedring av stemningsleie til pasienter med slag [535]. Videre synes et høyt funksjonsnivå og gode mestringsstrategier å være viktige faktorer for opplevelse av livskvalitet [530].
En studie der et utdanningsprogram for å stimulere til aktiviteter ble vurdert i forhold til en kontrollgruppe uten slik stimulering, viste økt deltakelse i sosiale aktiviteter, større tilfredshet med fritiden og mindre depressive symptomer i intervensjonsgruppen [531].
Forskningsgrunnlag
Populasjon (P): Slagrammede
Tiltak (I): Tiltak som øker mestring
Sammenligning (C): Ingen spesielle tiltak for å øke mestring
Beskrivelse av inkluderte studier
Referanser
529. Helbredets mysterium https://www.helsedirektoratet.no/referanse/0002-0013-195874
530. Coping strategies as determinants of quality of life in stroke patients: a longitudinal study https://www.helsedirektoratet.no/referanse/0002-0013-195875
531. Effect of a home leisure education program after stroke: a randomized controlled trial https://www.helsedirektoratet.no/referanse/0002-0013-195876
532. Defining and quantifying coping strategies after stroke: a review https://www.helsedirektoratet.no/referanse/0002-0013-195877
533. Information provision for stroke patients and their caregivers https://www.helsedirektoratet.no/referanse/0002-0013-195878
534. Empowerment» og pasientstyrking–et undervisningsopplegg https://www.helsedirektoratet.no/referanse/0002-0013-195879
535. Motivational interviewing early after acute stroke https://www.helsedirektoratet.no/referanse/0002-0013-195880
Sist faglig oppdatert: 21.12.2017
Rådgivning om nære relasjoner og samliv
Det bør gis tilpasset rådgivning om nære relasjoner og samliv som en del av rehabiliteringen.
SIGN: B1b.
Begrunnelse – dette er anbefalingen basert på
Etter et hjerneslag kan livet bli dramatisk endret for mange, både for pasienten selv og for familien. Mange blir avhengige av hjelp fra nær familie, noe som igjen fører til at familierelasjoner og samliv berøres og roller endres. Avhengig av hvilken rolle den slagrammede hadde i familien før slaget, kan det være nødvendig at ektefellen eller andre familiemedlemmer overtar denne rollen [538];[539].
Rehabiliteringen påvirkes av familiens måte å fungere på. God kommunikasjon, evne til problemløsning og til å finne kompenserende løsninger, samt sterk følelsesmessig interesse for hverandre, karakteriserer en velfungerende familie [358].
Den som er rammet av hjerneslaget og dennes pårørende, må forberedes på livet etter rehabiliteringsfasen. God opplæring og rådgivning til pårørende kan opprettholde familiens funksjon, noe som igjen kan føre til at den som er rammet av hjerneslaget kan fungere bedre, både funksjonelt og sosialt [537].
Forskningsgrunnlag
Populasjon (P): Slagrammede
Tiltak (I): Tilpasset rådgivning / informasjon om nære relasjoner og samliv
Sammenligning (C): Rådgivning / informasjon om relasjoner og samliv
Beskrivelse av inkluderte studier
Referanser
537. A randomized controlled trial of an education and counselling intervention for families after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195882
538. Alt er som før, men ingenting er som det var: gamle kvinners opplevelser av livet etter hjerneslag https://www.helsedirektoratet.no/referanse/0002-0013-195883
539. Å leve med kronisk sykdom: en varig kursendring https://www.helsedirektoratet.no/referanse/0002-0013-195884
358. Community reintegration after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195703
Sist faglig oppdatert: 21.12.2017
Tiltak for økt sosial deltakelse
Pasienter med hjerneslag som opplever begrensninger i sosiale aktiviteter, bør få oppfølging i lokalmiljøet med fokus på å fremme sosiale og fritidsaktiviteter.
SIGN: A1a
Det bør legges til rette for gruppeaktiviteter.
SIGN: D4
Praktisk – slik kan anbefalingen følges
Slagrammede som opplever begrensninger i sosial deltakelse, bør få trening som gjør dem best mulig i stand til å mestre ønskede aktiviteter, og forholdene må legges til rette i miljøet rundt personen med sikte på størst mulig grad av selvstendighet og livskvalitet på egne premisser.
Mindre kommuner kan samarbeide om gruppetilbud, og slike tilbud kan eventuelt inkludere andre aktuelle pasientgrupper (etter mønster fra f.eks. «hjerte-smerte»-grupper).
Brukerorganisasjonenes tilbud er også viktige arenaer for sosial deltakelse.
Begrunnelse – dette er anbefalingen basert på
En rehabiliteringsplan/individuell plan bør inneholde spesifikke tiltak for å fremme sosial deltakelse hos personer som opplever begrensninger på dette feltet som følge av slaget. En meta-analyse viser at et systematisk ergoterapitilbud for hjemmeboende med fokus på fritidsaktiviteter fremmer aktivitet og deltakelse [27] (SIGN:1a).
Gruppetilbud der den slagrammede møter andre i samme situasjon, kan bidra til økt mestring og livskvalitet. Slik som for andre pasientkategorier, vil det derfor være hensiktsmessig å kunne gi tilbud om gruppebaserte aktiviteter (SIGN: D4).
Forskningsgrunnlag
Populasjon (P): Slagrammede med sosiale begrensninger
Tiltak (I): Oppfølging i hjemmemiljøet
Sammenligning (C): Ingen spesiell oppfølging
Beskrivelse av inkluderte studier
Referanser
27. Individual patient data meta-analysis of randomized controlled trials of community occupational therapy for stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195372
Sist faglig oppdatert: 21.12.2017
Sosiale aktivitets- og fritidstilbud i grupper for slagrammede
Det bør legges til rette for at slagrammede kan delta i sosiale aktivitets- og fritidstilbud i grupper.
SIGN: D4.
Begrunnelse – dette er anbefalingen basert på
Slagrammede, spesielt de med moderate til alvorlige funksjonshemminger og de med kommunikasjonsvansker, står i fare for å bli sosialt isolerte. Gruppetilbud der den slagrammede møter andre i samme situasjon, kan bidra til økt mestring og livskvalitet.
Slik som for andre pasientkategorier, vil det derfor være hensiktsmessig å kunne gi tilbud om gruppebaserte aktiviteter. Mindre kommuner kan samarbeide, og slike tilbud kan eventuelt inkludere andre aktuelle pasientgrupper (etter mønster fra f.eks. «hjerte-smerte»-grupper).Forskningsgrunnlag
Populasjon (P): Slagrammede med begrensninger i sosial aktivitet
Tiltak (I): Sosiale aktivitets- og fritidstilbud i grupper
Sammenligning (C): Ingen gruppetilbud for slagrammede
Beskrivelse av inkluderte studier
Sist faglig oppdatert: 21.12.2017
Seksualfunksjon etter hjerneslag
Seksuell dysfunksjon forekommer hyppig etter hjerneslag. Personer som har hatt hjerneslag bør aktivt gis anledning til å ta opp spørsmål som gjelder seksualfunksjonen. Pasienter som ønsker hjelp for dette, bør tilbys behandling eller henvises videre til personell med spesialkompetanse.
SIGN: D4.
Begrunnelse – dette er anbefalingen basert på
Nedsatt seksuell funksjon og misnøye med kvaliteten av den seksuelle aktiviteten etter hjerneslag er vanlig både hos pasientene selv og deres partnere. De mest vanlige seksuelle problemene inkluderer nedsatt libido, samleiefrekvens og seksuell tilfredshet [541] og nedsatt eller manglende ereksjon og ejakulasjon hos menn [542];[540], samt nedsatt vaginal fuktighet og evne til orgasme hos kvinner.
Redusert seksualfunksjon kan være forårsaket av lammelser og nedsatt bevegelsesevne. Hos mange spiller følelsesmessige faktorer og depresjon en rolle. En viktig faktor er også angst for at seksuell aktivitet kan bidra til et nytt slag. Det er ikke holdepunkter for at seksuell aktivitet fremprovoserer nye slag. Det er viktig at helsepersonell oppfordrer den slagrammede og hans/hennes partner å gjenoppta så normalt liv som mulig også når det gjelder seksualitet.
Problemer rundt seksualfunksjonen er ofte oversett i klinisk praksis. Mange pasienter og livsledsagere ønsker mer informasjon og rådgivning om seksuelle problemer etter slaget, dog ikke i akuttfasen.
Forskningsgrunnlag
Populasjon (P): Slagrammede og deres livsledsager
Tiltak (I): Aktiv informasjon vedrørende påvirkning av seksualfunksjonen etter hjerneslag og ev. behandling
Sammenligning (C): Ingen informasjon eller behandling vedr. seksualitet /samliv
Beskrivelse av inkluderte studier
Referanser
540. Sexual changes in hemiparetic patients https://www.helsedirektoratet.no/referanse/0002-0013-195885
541. Sexual functioning among stroke patients and their spouses https://www.helsedirektoratet.no/referanse/0002-0013-195886
542. Sexual dysfunction in stroke patients https://www.helsedirektoratet.no/referanse/0002-0013-195887
Sist faglig oppdatert: 21.12.2017
Førerkort etter hjerneslag
Før utskrivning til hjemmet bør alle som har hatt hjerneslag eller TIA spørres om de har og fortsatt ønsker å ha førerkort. For alle som har hatt hjerneslag eller TIA og ønsker å ha førerkort, skal kjøreevne vurderes. Det skal gis informasjon om regelverket, risiko, eventuelle restriksjoner og videre oppfølging.
SIGN: D4.
Praktisk – slik kan anbefalingen følges
Alle pasienter med hjerneslag eller TIA skal ha kjørekarens i minimum 1 måned.
For alle pasienter med hjerneslag eller TIA skal det vurderes om helsekravene til førerkort ikke er oppfylt utover 1 måned etter hjerneslaget/TIA.
Pasientene skal få informasjon om regelverket, risiko, eventuelle restriksjoner og videre oppfølging.
Etter et hjerneslag kan evnen til å kjøre bil på en sikker måte være midlertidig eller varig svekket. De vanligste årsakene er:
- forandringer i kognitive funksjoner
- svekket syn (synsfeltutfall/synsoppfattelse)
- epilepsi
- motoriske og sensoriske forandringer (lammelse eller styringsproblemer i arm og/eller ben
Det vises til Førerkortveilederen for spesifikke bestemmelser når det gjelder subgrupper av pasienter med hjerneslag/TIA (https://helsedirektoratet.no/retningslinjer/forerkortveilederen). Spesielle regler gjelder for pasienter med:
- atrieflimmer
- carotisstenose
- flere TIA
- risikofaktorer
Det må også tas hensyn til spesielle krav vedr. andre relevante sykdommer som f.eks. hypertensjon, diabetes mellitus og hjertesykdom.
En utslagsgivende faktor for lengden på kjørekarens er om det er «remisjon innen en uke». Dette er i førerkortforskriften nærmere beskrevet som at «det ikke er synsfeltutfall, kognitiv svikt, pareser eller følgetilstander som påvirker kjøreevnen.»
Det foreslås at dette kravet fortolkes slik at det ved vanlig klinisk/nevrologisk undersøkelse en uke etter hjerneslaget ikke fremkommer noen av de beskrevne funksjonsnedsettelser i den grad at de påvirker kjøreevnen.
Med de nye helsekravene er vurderingen av om helsekrav er oppfylt i større grad lagt til fastlegen. Fastlegen er den som sitter med informasjon om en førerkortsøkers totale helsetilstand. Ved sin vurdering har fastlegen den nærmeste rådgiver hos saksbehandlere på førerkortfeltet hos fylkesmannen i søkers hjemfylke.
Alle som har hatt hjerneslag med vedvarende synsfeltutfall eller annen synssvekkelse, bør følges opp av øyelege for vurdering av om førerkortforskriftenes helsekrav er oppfylt (SIGN: D4).
Alle som har hatt hjerneslag med manifest eller mistanke om epilepsi, bør henvises til nevrolog for vurdering av residivrisiko (SIGN: D4).
Å kunne kjøre bil er for mange vesentlig for god sosial fungering og dermed viktig for rehabiliteringsprosessen. Slagrammede og pårørende skal få informasjon om bilkjøring etter hjerneslag/TIA. Alle som har hatt slag med vedvarende funksjonssvikt, skal gjøres oppmerksom på at de ikke bør kjøre bil den første tiden etter slaget. For mange vil funksjonsutfallene bedre seg gradvis etter akuttfasen slik at de kan gjenoppta bilkjøring. Alle slagrammede med funksjonssvikt og som ønsker å fortsette å kjøre bil, bør få tilbud om vurdering av sin kjøreevne en viss tid etter slaget.
Slagrammede som varig ikke fyller vilkårene for å kunne kjøre bil, bør få hjelp til å omstille seg praktisk og følelsesmessig.
Begrunnelse – dette er anbefalingen basert på
Førerkortforskriften (https://lovdata.no/dokument/SF/forskrift) med Førerkortveilederen (https://helsedirektoratet.no/retningslinjer/forerkortveilederen) beskriver kravene til både pasienter og helsepersonell når det gjelder bilkjøring og hjerneslag/TIA.
Forskningsgrunnlag
Populasjon (P): Pasienter som har hatt hjerneslag/TIA
Tiltak (I): Førerkortvurdering
Sammenligning (C): Ingen førerkortvurdering
Beskrivelse av inkluderte studier
Sist faglig oppdatert: 21.12.2017
Tiltak for å komme tilbake i arbeid
Aktuelle pasienter med hjerneslag bør kartlegges i forhold til arbeidsmuligheter.
Arbeidsrehabilitering bør inkludere god planlegging, tilrettelegging og oppfølging, samt tidlig involvering av arbeidsplassen
SIGN: D4.
Praktisk – slik kan anbefalingen følges
Om arbeidsrehabilitering lykkes er avhengig av mange faktorer, og noen av de viktigste er:
• omfanget og alvorlighetsgraden av fysiske, kognitive og kommunikative vansker
• alder
• yrke, stilling og arbeidsoppgaver
• ønsker og motivasjon
• arbeidsgivers og kollegers holdninger og arbeidsstedets personalpolitikk
• arbeidsplassens og arbeidsoppgavenes tilretteleggingsmuligheter, ev. tilgang på andre arbeidsoppgaver
• andre arbeidsmuligheter
• arbeidsrehabiliteringens innhold, kvalitet og graden av oppfølging.
Når det gjelder slagrammede som er under utdanning, eller som nylig har avsluttet utdanning, bør en kartlegging av de varige konsekvensene av hjerneslaget foreligge før det blir gitt tilbud om arbeidsrettet rehabilitering.
Begrunnelse – dette er anbefalingen basert på
En systematisk oversikt (14 studier) viste at en tverrfaglig arbeidsrettet rehabilitering var gunstig for pasienter i alderen 16-65 år med traumatisk hjerneskade [536]. Oversikten viste at et intensivt tilbud ga raskere bedring for personer med moderat til alvorlig skade, mens det var moderat evidens for at videre poliklinisk oppfølging er gunstig for å vedlikeholde det som er oppnådd ved tidlig post-akutt rehabilitering.
Det er uklart i hvilken grad resultatene fra denne oversikten kan overføres til slagpasienter, og foreløpig må anbefalinger på dette området basere seg på klinisk erfaring.
Forskningsgrunnlag
Populasjon (P): Slagrammede som har mulighet for å komme tilbake i arbeid
Tiltak (I): Tidlig kontakt med arbeidsplass / arbeidsgiver
Sammenligning (C): Ingen kontakt med arbeidsplass / arbeidsgiver
Beskrivelse av inkluderte studier
Referanser
536. Multi-disciplinary rehabilitation for acquired brain injury in adults of working age https://www.helsedirektoratet.no/referanse/0002-0013-195881
Sist faglig oppdatert: 21.12.2017
Slagrammede og handikapidrett
Det bør gis informasjon til slagrammede om muligheten for helsesport og idrett for funksjonshemmede.
SIGN: D4.
Praktisk – slik kan anbefalingen følges
Tiltak for slagrammede, ut over informasjon, kan være å tilrettelegge for at vedkommende kan delta på ulike aktiviteter, å trene på ulike ferdigheter som muliggjør utøvelse av de aktivitetene som det er viktig for personen å delta i.
Henvisning til helsesportsenter bør vurderes for aktuelle pasienter.
Begrunnelse – dette er anbefalingen basert på
Aktiviteter som helsesport og idrett for funksjonshemmede øker slagrammedes sosiale deltakelse og kan gi positive mestringsopplevelser.
Forskningsgrunnlag
Populasjon (P): Yngre slagrammede
Tiltak (I): Deltakelse i handikapidrett
Sammenligning (C): «Standard» trening
Beskrivelse av inkluderte studier
Sist faglig oppdatert: 21.12.2017
Miljøfaktorer
Opplæring av pasient og pårørende etter hjerneslag
Pasient og pårørende skal få nødvendig opplæring.
Begrunnelse – dette er anbefalingen basert på
Hjerneslag fører vanligvis til sammensatte vansker. Ofte tilkommer både synlige og usynlige (kognitive) utfordringer. De fleste er kjent med at lammelser, synsvansker og talevansker kan forekomme, men er mindre kjent med de mentale endringer som eventuelt måtte oppstå. Det er derfor viktig at det gis informasjon også om dette. Informasjon og opplæring bør gis på generell basis, men også i forhold til hvilke utfordringer som gjelder spesielt for den enkelte pasient / slagrammede. Det bør også gis råd og veiledning om hvordan dette best kan håndteres i det daglige.
Se også lenke til veileder om pårørende i helse- og omsorgstjenesten. (Helsedirektoratet) .
Forskningsgrunnlag
Populasjon (P): Slagrammede og deres pårørende
Tiltak (I): Informasjon og opplæring
Sammenligning (C): Ingen opplæring/informasjon
Beskrivelse av inkluderte studier
Sist faglig oppdatert: 21.12.2017
Informasjon og opplæring til slagrammede og deres pårørende
Relevant og forståelig informasjon til pasienter og pårørende bør vektlegges gjennom hele forløpet. Dette inkluderer informasjon om brukerorganisasjoner, lærings- og mestringssentra og om koordinerende enhet i kommunen. Pasienter med uttalte sensoriske forstyrrelser bør få instruksjon/opplæring for å redusere risiko for skade av affisert side/ekstremitet.
SIGN: B1a og D4.
Praktisk – slik kan anbefalingen følges
Brukerorganisasjoner og likemannsarbeid:
Med likemannsarbeid menes overføring av personlig erfaring med en bestemt type funksjonsnedsettelse til en annen person med samme type funksjonsnedsettelse og mellom pårørende. Det finnes ingen fasit for hva likemannsarbeid er fordi det kan romme så mange former for mellommenneskelig støtte [549];[550].
Likemannsarbeid er blitt definert som "en samhandling mellom personer som opplever å være i samme båt, det vil si i samme livssituasjon, og hvor selve samhandlingen har som mål å være en hjelp, støtte eller veiledning partene i mellom". Det har å gjøre med et arbeid og et tilbud der det utveksles erfaringer og råd i forhold til spørsmål som ikke krever profesjonell bakgrunn (684).
Likemannsarbeid er et av regjeringens prioriterte tiltak i "Handlingsplan for funksjonshemmede 1998-2002" og er å betrakte som en grunnleggende aktivitet i funksjonshemmedes organisasjoner. Likemannsarbeid skal bygge på de erfaringer og de tradisjoner organisasjonen allerede har, og likemannsarbeid skal ha en naturlig plass i organisasjonens totale virksomhet [550].
Likemannsarbeid i arbeidsrehabilitering bygger på samme prinsipper og tankegang som det generelle likemannsarbeid gjør, men mens det ordinære likemannsarbeidet har en psykososial funksjon, er arbeidsrehabilitering mer knyttet mot spesifikke mål. Likemannsarbeid er en sentral aktivitet i brukerorganisasjonene. På lokalt nivå arrangeres det forskjellige typer samlinger for likemenn. Det arrangeres kurs i likemannsarbeid fra sentralt hold og i lokalforeningene. Noen organisasjoner har organisert opplæring av medlemmer for å sette dem i stand til å møte mennesker som er nyrammede. Disse personene blir "autoriserte likemenn".
Aktuelle brukerorganisasjoner for slagrammede er:
Landsforeningen for Slagrammede
Postboks 9217 Grønland
0134 Oslo
www.hjerneslag.no
Norsk Forening for Slagrammede
Skytterseter 25
2072 Dal
www.slagrammede.org
Afasiforbundet i Norge
Torggata 10
0181 Oslo
www.afasi.no
LHL hjerneslag
Storgt. 33 A, 6. etg.
0028 Oslo
https://www.lhl.no/lhl-hjerneslag/
Lærings- og mestringssentra:
Lov om spesialisthelsetjeneste pålegger helsetjenesten et ansvar for opplæring av pasienter og pårørende. Denne oppgaven skal integreres i det kliniske tilbudet og i fagmiljøet. De fleste helseforetakene har etablert Lærings- og mestringssentra som har som oppgave å understøtte opplæringstilbudet i sykehus og kommuner i samarbeid med brukerorganisasjonene og fagmiljøene. Flere av sentrene har utviklet spesifikke gruppebaserte tilbud for slagrammede og deres pårørende.
Lærings- og mestringssentra skal være en læringsarena for mennesker med varig sykdom eller vedvarende funksjonsendringer som følge av skade/sykdom. Viktige elementer i læringen er å tilegne seg kunnskap, ferdighet og holdninger til hvordan den enkelte skal leve med sin tilstand. Opplæringen kan styrke pasient og pårørende til å kunne leve med de utfordringer de møter i hverdagen, mestre ny livssituasjon og ta ansvar for egen helse.
Informasjon om lærings- og mestringssentra finnes på nettadressen www.mestring.no
Informasjon om rehabiliteringstilbud:
De regionale koordinerende enhetene for rehabilitering og habilitering kan gi informasjon om rehabiliteringstilbud. Enhetene har felles grønt (gratis) nummer 800 300 61.
Helse Nord: https://helse-nord.no/behandlingssteder/rehabilite...
Helse Midt: https://www.hnt.no/avdelinger/direktorens-stab/samhandlingsavdelingen/regional-koordinerende-enhet-rke/
Helse Vest: https://helse-bergen.no/regionalt-kompetansesenter...
Helse Sør-Øst: https://www.sunnaas.no/regional-koordinerende-enhe...
Begrunnelse – dette er anbefalingen basert på
Det er viktig at pasienter og deres pårørende får opplæring og informasjon om hva det innebærer å få hjerneslag. Det bør derfor være fokus på dette både i spesialisthelsetjenesten og i kommunen. For mange (både pasienter og pårørende) vil det være spesielt gunstig å ha kontakt med andre i tilsvarende situasjon.
Omtrent halvparten av alle personer med hjerneslag har nedsatt sensibilitet. Nedsatt sensibilitet er hyppigere hos personer med store motoriske utfall [547]. Ulike kvaliteter av sensibilitet kan være redusert etter et hjerneslag: Taktil sensibilitet, stereognosis (erkjenne et objekt ved hjelp av følelsessansen) eller propriosepsjon (å vite hvor en kroppsdel befinner seg i forhold til andre deler av kroppen). Terskelen for persepsjon (oppfatte sanseinntrykk) kan være høyere, eller persepsjonen kan være forsinket. Nedsatt sensibilitet gjør det vanskelig å tolke stimuli fra omgivelsene og å forholde seg til dem. Den hemiplegiske siden brukes mindre og det er større fare for skader [547]. Slagrammede og deres pårørende bør derfor få instruksjon/opplæring i hvordan de kan redusere risiko for skade av affisert side/ekstremitet.
Forskningsgrunnlag
Populasjon (P): Slagrammede og deres pårørende
Tiltak (I): Tilpasset informasjon
Sammenligning (C): Ingen informasjon
Beskrivelse av inkluderte studier
Referanser
546. Effectiveness of sensory and motor rehabilitation of the upper limb following the principles of neuroplasticity: patients stable poststroke https://www.helsedirektoratet.no/referanse/0002-0013-195891
547. Somatosensory impairment after stroke: frequency of different deficits and their recovery https://www.helsedirektoratet.no/referanse/0002-0013-195892
548. Sensory Loss in Hospital-Admitted People With Stroke: Characteristics, Associated Factors, and Relationship With Function https://www.helsedirektoratet.no/referanse/0002-0013-195893
549. Å være i samme båt. Likemassarbeidi funksjonshemmedes organisasjoner. En veileder https://www.helsedirektoratet.no/referanse/0002-0013-195894
550. Resultater og erfaringer fra Regjeringens handlingsplaner for funksjonshemmede og veien videre. https://www.regjeringen.no/no/dokumenter/st-meld-nr-34_1996-97/id191142/
551. Støtte blant sine egne... likemannsarbeid i funksjonshemmedes organisasjoner https://www.helsedirektoratet.no/referanse/0002-0013-195896
Sist faglig oppdatert: 21.12.2017
Informasjon til personer som omgås slagrammede med afasi
Ved afasi bør pårørende, rehabiliteringspersonell og andre relevante personer få informasjon om den afasirammedes kommunikative ferdigheter og opplæring i spesifikke strategier og teknikker som bidrar til å fremme personens muligheter til å delta i kommunikasjon.
SIGN: C2b.
Praktisk – slik kan anbefalingen følges
Bredtvet kompetansesenter (Statped).
Lenke: https://www.statped.no/laringsressurs/sprak-og-tale/Hvordan-samtale-med-personer-med-afasi/
Begrunnelse – dette er anbefalingen basert på
Alle som omgås slagrammede med afasi, bør få informasjon og opplæring vedrørende afasi, og om hvordan man på en best mulig måte kan kommunisere med den slagrammede.
Dersom det arrangeres kurs / temadager om dette og aktuelle teknikker, bør pårørende (ev andre aktuelle omsorgspersoner) oppfordres til å delta.
Forskningsgrunnlag
Populasjon (P): Personer som omgås slagrammede med afasi
Tiltak (I): Informasjon om afasi og opplæring i kommunikasjonsteknikker
Sammenligning (C): Ingen informasjon om afasi og opplæring i kommunikasjonsteknikker
Beskrivelse av inkluderte studier
Sist faglig oppdatert: 21.12.2017
Ivaretagelse av de slagrammedes pårørende
Alle enheter som gir behandling og rehabilitering til slagrammede, bør ha et opplegg for oppfølging av og informasjon til pårørende til den slagrammede.
SIGN: B1a.
Begrunnelse – dette er anbefalingen basert på
Å være pårørende til en slagrammet kan medføre betydelige belastninger og endringer i livssituasjonen. Samtidig er pårørende en viktig ressurs i rehabiliteringsprosessen og en nødvendig støtte for å mestre tilværelsen etter slaget.
Pårørende har behov for å lære om hjerneslag og slagets konsekvenser. De trenger å lære hvordan de kan gi omsorg og støtte. Dette kan gjøre det mulig for den slagrammede å bo hjemme.
Informasjon til pårørende bør inkludere informasjon om forebygging av hjerneslag, og spesielt om endring av livsstil [545].
Slagrammede og deres pårørende føler ofte at de ikke har fått nok informasjon etter et hjerneslag. Det finnes ikke entydig evidens for hvilken form for informasjonsformidling som er mest effektiv. Møter med undervisningskarakter ser ut til å være mer effektiv enn bare skriftlig informasjon [533]. Det er også viktig at pårørende får informasjon om forebygging av hjerneslag, og spesielt om endring av livsstil.
Barn som pårørende skal spesielt ivaretas.
Lenke til veileder om pårørende i helse- og omsorgstjenesten (Helsedirektoratet).
Forskningsgrunnlag
Populasjon (P): Slagrammedes pårørende
Tiltak (I): Informasjon og oppfølging
Sammenligning (C): Ingen spesiell oppfølging av pårørende
Beskrivelse av inkluderte studier
Referanser
543. Psychosocial functioning of spouses in the chronic phase after stroke: improvement or deterioration between 1 and 3 years after stroke? https://www.helsedirektoratet.no/referanse/0002-0013-195888
544. A comparison of studies on the quality of life of primary caregivers of stroke survivors: a systematic review of the literature https://www.helsedirektoratet.no/referanse/0002-0013-195889
533. Information provision for stroke patients and their caregivers https://www.helsedirektoratet.no/referanse/0002-0013-195878
Sist faglig oppdatert: 21.12.2017
Støtte til pårørende til slagrammede som har omsorgsoppgaver
Pårørende som har omsorgsoppgaver overfor en slagrammet, bør få støtte fra hjelpeapparatet i form av informasjon, veiledning og avlastning.
SIGN: D4.
Begrunnelse – dette er anbefalingen basert på
Omsorgsansvar for et familiemedlem i hjemmet kan ha fysisk, mental og psykologisk negativ effekt på omsorgsgiveren, og mange rammes av angst og depresjon [358]. At den slagrammede har afasi, kan øke omsorgspersonens stressnivå og dermed evne til å gi omsorg [544].
Ofte er det ektefellen som får det største ansvaret, og en studie viser at omtrent halvparten av disse opplevde å ha en stor omsorgsbyrde. De viste tegn på depresjon og var misfornøyd med livet [533]. Ektefellens sosiale og følelsesmessige behov bør være en del av oppfølgingen av den slagrammede. Gjennom rehabiliteringen bør det fokuseres mer på å opprettholde ektefelles evne til å utvikle og opprettholde et støttende nettverk [533].
Studier tyder på at økt sosial støtte, opplæring og rådgiving hjelper familien til en person med hjerneslag til å håndtere situasjonen, og at støttende og avlastende tiltak for pårørende bidrar til å styrke deres psykiske helse [358];[360];[545].
Lenke til veileder om pårørende i helse- og omsorgstjenesten (Helsedirektoratet).
Forskningsgrunnlag
Populasjon (P): Pårørende til slagrammede som har omsorgsoppgaver
Tiltak (I): Veiledning, informasjon, avlastning
Sammenligning (C): Ingen spesiell ivaretagelse av pårørende
Beskrivelse av inkluderte studier
Referanser
544. A comparison of studies on the quality of life of primary caregivers of stroke survivors: a systematic review of the literature https://www.helsedirektoratet.no/referanse/0002-0013-195889
545. Intervention studies for caregivers of stroke survivors: a critical review https://www.helsedirektoratet.no/referanse/0002-0013-195890
533. Information provision for stroke patients and their caregivers https://www.helsedirektoratet.no/referanse/0002-0013-195878
358. Community reintegration after stroke https://www.helsedirektoratet.no/referanse/0002-0013-195703
360. A meta-analysis of interventions for informal stroke caregivers https://www.helsedirektoratet.no/referanse/0002-0013-195705
Sist faglig oppdatert: 21.12.2017
Oppfølging av slagrammedes pårørende i senfasen
Slagrammedes pårørende bør ved behov få tilbud om veiledning/oppfølging også i senfasen.
SIGN: D4.
Begrunnelse – dette er anbefalingen basert på
Slagpasienters pårørende har i mange tilfeller behov for veiledning og oppfølging også i den senere fase, og dette bør alltid tas med i betraktning i rehabiliteringen. Pasientorganisasjoner kan ha en viktig rolle i denne fasen. Se de ulike interesseorganisasjoner for slagrammede;
Se også anbefaling om «Informasjon og opplæring til slagrammede og deres pårørende.
Lenke til veileder om pårørende i helse- og omsorgstjenesten (Helsedirektoratet).
Forskningsgrunnlag
Populasjon (P): Slagrammedes pårørende
Tiltak (I): Oppfølging i senfasen
Sammenligning (C): Ingen spesiell oppfølging i senfasen
Beskrivelse av inkluderte studier
Sist faglig oppdatert: 21.12.2017
Forkortelser
Sist faglig oppdatert: 21.12.2017
| ABCD | Age, Blood pressure, Clinical features, Duration of symptoms |
| ABCD² | Age, Blood pressure, Clinical features, Duration of symptoms/Diabetes |
| ACE | Angiotensin converting enzym |
| ADL | Activity of daily living |
| AF | Atrieflimmer |
| AMK | Akutt medisinsk kommunikasjonssentral |
| ARB | Angiotensin reseptorblokker |
| ASA | Acetylsalisylsyre |
| BI | Barthel Index |
| BMI | Body Mass Index |
| BT | Blodtrykk |
| KI | Konfidense intervall (95 %) |
| CNS | Sentralnervesystemet |
| CRP | C-reativt protein |
| CT | Computer tomografi |
| CTA | Computer tomografi angiografi |
| CTP | Computer tomografi perfusjon |
| DVT | Dyp venetrombose |
| DWI | Diffusjons vektet imaging/MR med diffusjonsserie |
| EF | Ejeksjonsfraksjon |
| EKG | Elektrokardiografi |
| ESD | Early supported discharge/tidlig støttet utreise |
| ESPRIT | European/Australasian Stroke Prevention in Reversible Ischaemia Trial |
| FAST | Face-arm-speech-test/ facialisparese, armparese, språk- og talevansker |
| FIM | Functinoal independence measure |
| GCS | Glasgow coma scale |
| GI | Gastro intestinal |
| GRADE | Grading of Recommendations, Assessment, Development and Evaluation |
| HAEST | Heparin in acute embolic stroke trial |
| Hb | Hemoglobin |
| HDL | High density lipoprotein |
| i.a. | Intra arteriell |
| IADL | Instrumentell Activity of Daily Living |
| ICF | International classification of function |
| INR | Internasjonal normalisert ratio |
| IST | International Stroke Trial |
| i.v. | Intravenøs |
| K | Kalium |
| KOLS | Kronisk obstruktiv lungesykdom |
| LDL | Low density lipoprotein |
| LMWH | Lav molekylvekt heparin/Lav molekylært heparin |
| MRA | Magnetisk resonans angiografi |
| MR | Magnetisk resonans |
| mRS | Modified Rankin Scale |
| Na | Natrium |
| NAV | Arbeids- og velferdsforvaltningen |
| NICE | National Institute for Health and Clinical Exellence |
| NIHSS | National Institutes of Health stroke scale |
| NNT | Number needed to treat |
| OR | Odds ratio |
| PADL | Personlig Activity of Daily Living |
| PEG | Perkutan endoskopisk gastrostomi |
| PFO | Patent foramen ovale |
| PWI | Perfusjons vektet imaging/ MR med perfusjonsserie |
| RCT | Randomisert kontrollert studie |
| RR | Relativ risiko |
| RRR | Relativ risikoreduksjon |
| rt-PA | Recombinant tissue plasminogen aktivator |
| SIGN | Scottish Intercollegiale Guidelines Group |
| SSS | Scandinavian Stroke Scale |
| SVT | Sinusvenetrombose |
| TCD | Transkranial doppler undersøkelse |
| TIA | Transitorisk iskemisk anfall |
| TNS | Transkutan nervestimulering |
| TOE | Transøsofagal ekkokardiografi |
| TTE | Transtorakal ekkokardiografi |
| UFH | Ufraksjonert heparin |
| UK | Urokinase |
| UVI | Urinveisinfeksjon |
| WHO | Verdens Helseorganisasjon |
Metode og prosess
27 temaer har gjennomgått revisjon med GRADE-metodikk (se under om kunnskapsbasert tilnærming). Forøvrig er mange anbefalinger fra 2010 videreført uten endringer da de fortsatt er vurdert å være aktuelle og adekvate. De anbefalingene fra 2010 som ble vurdert å være uaktuelle eller ikke lenger var dekkende, er strøket. En annen føring var at antall anbefalinger skulle reduseres slik at bare helt sentrale og viktige temaer som det er naturlig at Helsedirektoratet gir normerende anbefalinger om skulle videreføres. De anbefalinger som er videreført fra 2010 har beholdt SIGN-klassifiseringen fra retningslinjearbeidet i 2010. Antall anbefalinger har blitt redusert fra 430 til 145.
Overføring av anbefalinger fra retningslinjen utgitt i 2010 hvor SIGN-metodikken ble brukt som gradering av anbefalinger:
Anbefalinger av undersøkelsesmetoder og tester
Anbefalingene i denne retningslinjen står på følgende tre tilnærminger:
På områder der det er funnet mindre forskningsbasert kunnskap, har klinisk kunnskap og brukerkunnskap fått større vekt. Klinisk kunnskap og brukerkunnskap har fremkommet gjennom diskusjoner i arbeidsgruppen og mellom arbeidsgruppedeltakere og andre brukere og klinikere. I denne prosessen har det vært benyttet en standardisert arbeidsmetode fra GRADE-verktøyet (DECIDE). Verktøyet brukes til å utforme anbefalinger etter at forskningsgrunnlaget er kjent, og sikrer at brukerrepresentanter og klinikere går gjennom relevante forhold som verdier, ønskede og uønskede effekter, ressursbruk, likhet, akseptabilitet og gjennomførbarhet knyttet til det aktuelle spørsmålet. Noen av anbefalingene er forankret i lovverk.
Utarbeidelse av forskningsgrunnlaget
- Population (pasientgruppe)
- Intervention (tiltak)
- Comparison (sammenligning)
- Outcome (utfall)
De kliniske problemstillinger som har blitt revidert, ble valgt ut fra områder hvor det sannsynligvis var tilkommet kunnskap og nye rutiner på feltet, og ut fra følgende kriterier:
- Sikre god kvalitet
- Hindre uønsket variasjon i tjenesten
- Sikre riktige prioriteringer
- Løse samhandlingsutfordringer
- Sikre helhetlige pasientforløp
I en bred prosess med arbeidsgruppen endte vi opp med 27 PICO-spørsmål. Spørsmålene ble prioritert ut fra variasjoner i praksis, usikkerhet om effekt, samt viktighet for feltet. Senere i prosessen har det kommet til noen anbefalinger på grunnlag av diskusjon i arbeidsgruppen og innspill fra rådslag og fra ekstern referansegruppe.
Prosess for de 27 prioriterte problemstillingene gjennom GRADE-metodikk;
Det er i liten grad søkt etter enkeltstudier på spørsmål hvor det ikke ble funnet dokumentasjon i retningslinjer eller systematiske oversikter. Vi har tilstrebet å finne den seneste publiserte vitenskapen med høyest kvalitet, og som er basert på en pasientpopulasjon og en intervensjon som er nærmest norske forhold.
Lesing og sammendrag av artikler
Artiklene som ble ekskludert ble ekskludert på bakgrunn av:
GRADE-metodikk
Å gradere dokumentasjonsgrunnlaget for et PICO-spørsmål innebærer en systematisk vurdering av resultater og metodisk kvalitet på dokumentasjonen i tabellform (Veileder IS-1870,s 30, Vandvik, Berg & Vist, 2013 ). For å kunne gradere bør det foreligge utfallsmål i tall og helst effektstørrelser. Å bruke GRADE-metodikk i kunnskapsoppsummeringen blir derved en evaluering av den grad av tillit man kan ha til resultatene i de inkluderte studier (svært lav, lav, moderat eller høy dokumentasjonsstyrke).
Utarbeiding av anbefalinger
Spørsmålene som ble diskutert for å avgjøre styrken på anbefalingen var blant annet:
På bakgrunn av forskningsgrunnlaget ble erfaringer fra klinikere og brukere fremlagt og diskutert før endelig anbefaling ble formulert. Vurderingene som ligger til grunn for beslutning om endelige anbefalinger vises for alle anbefalinger der det er relevant.
Vurdering av anbefalinger med GRADE metodikk
Sterk anbefaling
Svak anbefaling
Ulike valg kan være riktig for ulike pasienter, og helse- og omsorgspersonell må hjelpe til med å vurdere hva som er riktig i den enkelte situasjon.
- Er det usikkerhet om balanse mellom nytte og skade?
- Er det lav kvalitet på dokumentasjonen /lav tiltro til effektestimatene?
- Er det usikkerhet eller variasjon vedrørende verdier og preferanser?
- Er det usikkerhet om netto gevinst er verdt kostnadene?
Anbefalingens rettslige betydning
Ved mistanke om eller ved sikkert hjerneslag skal det straks tas kontakt med AMK (medisinsk nødmeldetjeneste) for akuttmedisinsk bistand. Helsetjenesten må derfor organisere seg slik at man er i stand til å gi øyeblikkelig hjelp til pasienter med hjerneslag, jf. helse- og omsorgstjenesteloven § 3-2 første ledd pkt 3 jf. § 3-1. Selve organiseringen er nærmere regulert i akuttmedisinforskriften, herunder kommunal legevakt, ambulansetjeneste og AMK.
Etter et hjerneslag har pasienten rett på de helsetjenester som er nødvendige i forhold til behandling og videre oppfølging, jf. pasient- og brukerloven §§ 2-1a og 2-1b. Dette korresponderer med sykehusenes og kommunenes «sørge-for» ansvar jf. spesialisthelsetjenesteloven § 2-1a og helse- og omsorgstjenesteloven § 3-1.
Kravet til forsvarlig helsehjelp: Behandlingen og rehabiliteringen ved hjerneslag skal være i tråd med plikten til å yte forsvarlig hjelp i spesialisthelsetjenesteloven § 2-2 og helse- og omsorgstjenesteloven § 4-1 samt helsepersonelloven § 4. Å yte forsvarlig hjelp innebærer en plikt til å opptre i samsvar med de til enhver gjeldende faglige normer og lovbestemte krav til yrkesutøvelse og virksomhet. Retningslinjen for hjerneslag gir anbefalte handlingsvalg. Anbefalingene er å anse som gjeldende faglige normer på dette området da de er retningsgivende for forsvarlig behandling av pasienten(e). Det vises i denne sammenheng til at et avvik fra anbefalingene skal dokumenteres i pasientens journal, i tillegg til øvrig nødvendig informasjon, jf. journalforskriften § 8 første ledd bokstav h.
Retningslinjen anses på denne bakgrunn for å være normerende for helsetjenesten.
Målgrupper
Leder av redaksjonsgruppen og faglig leder
- Bent Indredavik, avdelingssjef/professor spesialist i indremedisin, og fysikalsk medisin og rehabilitering, Avdeling for hjerneslag, St Olavs Hospital/ Det medisinske fakultet, NTNU. Leder av Norsk hjerneslagsregister.
Akutt behandling av hjerneslag
- Rolf Salvesen, avd.overlege/professor dr. med. Nevrologisk avdeling. Nordlandssykehuset Bodø og Institutt for klinisk medisin, UIT Norges arktiske universitet . Helse Nord. Arbeidsgruppeleder.
- Arnstein Tveiten, PhD, spesialist i nevrologi, seksjonsoverlege nevrologisk avdeling Sørlandet Sykehus. Helse Sør-Øst.
- Dagny Sevheim, spesialrådgiver sykepleie/videreutdanning i geriatri og psykiatri. Stavanger Universitetssykehus. Helse Vest.
- Gitta Rohweder, spesialist i indremedisin, overlege, avdeling for hjerneslag. St Olavs Hospital. Helse Midt-Norge.
- Lars Thomassen, spesialist i nevrologi, professor ved Universitetet i Bergen. Overlege ved nevrologisk avdeling, Haukeland Universitetssykehus. Helse Vest.
- Lill Karin Mensen, overlege, spesialist i indremedisin og geriatri, medisinsk avdeling. Diakonhjemmet sykehus. Helse Sør-Øst.
- Ole Morten Rønning, førsteamanuensis/seksjonsoverlege og spesialist i nevrologi, Det medisinske fakultet, Universitetet i Oslo og Akershus universitetssykehus. Helse Sør-Øst.
- Torgeir Engstad, førsteamanuensis og overlege. Spesialist i indremedisin og geriatri. Overlege i Geriatrisk seksjon, Medisinsk klinikk Universitetssykehuset i Nord-Norge. Helse Nord.
- Yngve Müller Seljeseth, spesialist i indremedisin og geriatri. Seksjonsoverlege slag og alderdomssjukdommar, medisinsk avdeling Ålesund. Klinikk for medisin. Helse Møre og Romsdal HF. Helse Midt-Norge.
Brukerrepresentanter i DECIDE-møter
- Arne Hagen, NFS (Norsk forening for slagrammede)
- Hans Henrik Tøsdal, LFS (Landsforeningen for slagrammede)
- Torgeir Mathiesen, LHL
Sekundær forebygging ved hjerneslag
- Halvor Næss, overlege, spesialist i nevrologi og indremedisin. Nevrologisk avd, Haukeland universitetssykehus og professor Det medisinske fakultet, Universitetet i Bergen. Helse Vest. Arbeidsgruppeleder.
- Bente Thommessen, overlege, dr.med/spesialist i nevrologi, Nevroklinikken, Akershus universitetssykehus. Helse Sør-Øst.
- Ellisiv Mathiesen, professor i nevrologi, Det helsevitenskapelig fakultet, UiT Norges arktiske universitet og overlege, nevrologisk avdeling, Universitetssykehuset Nord Norge (UNN). Helse Nord.
- Hanne Ellekjær, overlege, dr.med/spesialist i indremedisin, avdeling for hjerneslag, St Olavs hospital. Helse Midt-Norge.
- Hege Ihle-Hansen: Phd/spesialist i indremedisin og geriatri, Oslo Universitetssykehus, Ullevål, seksjon for hjerneslag og Vestre Viken, Bærum Sykehus. Helse Sør-Øst.
Brukerrepresentanter i DECIDE-møter
- Arne Hagen (NFS)
- Dag B. Rosenberg (LHL)
- Marius Korsell (LFS)
Rehabilitering ved hjerneslag
- Frank Becker, førsteamanuensis / spesialist i fysikalsk medisin og rehabilitering, Universitetet i Oslo / Sunnaas sykehus. Helse Sør-Øst. Arbeidsgruppeleder.
- Cathrine Arntzen, forskningsgruppeleder/førsteamanuensis, ergoterapispesialist i eldres helse, Institutt for helse-og omsorgsfag, Det helsevitenskapelige fakultet, UiT Norges arktiske universitet. Helse Nord.
- Eva K. Reiten Bovim, overlege, spesialist i fysikalsk medisin og rehabilitering. Avd. For fysikalsk medisin og rehabilitering, St. Olavs Hospital. Helse Midt-Norge.
- Gro Elisabeth Aasland, avdelingsleder, Sykehuset Telemark. Helse Sør-Øst.
- Hild Fjærtoft, førsteamanuensis/daglig leder Norsk hjerneslagregister, St. Olavs Hospital / NTNU. Helse Midt-Norge.
- Inger Johansen, fastlege, spesialist i allmennmedisin Phd., Stavern legekontor. Avd for allmennmedisin, HELSAM, UiO.
- Ole Marius Ekeberg, spesialist i fysikalsk medisin og rehabilitering, seksjon fysikalsk medisin og rehabilitering Helse Fonna. Helse Vest.
Brukerrepresentanter i DECIDE-møter
- Iselin Løvhøiden (LHL)
- Grethe Lunde (NFS)
- Roger Amundsen (LFS)
Redaksjonsgruppe:
- Bent Indredavik, leder av redaksjonsgruppen.
- Frank Becker
- Halvor Næss
- Rolf Salvesen
- Prosjektledelsen på Helsedirektoratet.
Alle deltakerne i arbeidsgruppene avga skriftlig erklæring hvor de redegjorde for mulige faglige eller økonomiske interessekonflikter knyttet til dette arbeidet. Flere av arbeidsgruppedeltakerne opplyste å ha vært deltagere i ulike studier som berørte aktuelle problemstillinger. Helsedirektoratet vurderte alle deltakere i arbeidsgruppene med hensyn til habilitet. Ingen relevante interessekonflikter er identifisert, med unntak av Bent Indredavik som rapporterte at han har vært prosjektleder for to ulike forskningsprosjekt om Tidlig støttet utskriving. Dette spørsmålet ble håndtert i henhold til GRADE Working group sitt råd om håndtering av «Conflict of Interest» (Guyatt G, 2010), som angir at arbeidsgruppemedlemmet i slike tilfeller er fri til å være med i diskusjonen, men ikke kan spille inn i den endelige avgjørelsen med ordlyd eller styrke i anbefalingen.
Retningslinjeprosjektet har hatt støtte til metode, litteratursøk og digital utforming fra:
- Edel Camilla Holene seniorrådgiver, Helsedirektoratets retningslinjesekretariat.
- Astrid Merete Nøstberg, spesialbibliotekar, Spesialbibliotekar, Bibliotek for helseforvaltningen, Folkehelseinstituttet.
- Marita Heintz, spesialbibliotekar, Spesialbibliotekar, Bibliotek for helseforvaltningen, Folkehelseinstituttet.
- Anne Birgit Aga, rådgiver, avd. kommunikasjon og digitale kanaler, Helsedirektoratet
- Henny-Kristine Hougen
- Pernille Hauge
- Anne Hokstad (august 2015 – februar 2016 )
- Liv Hege Kateraas, seniorrådgiver Helsedirektoratet, med bistand fra Cesilie Aasen, seniorrådgiver Helsedirektoratet.
Gradering av anbefalinger som bygger på kunnskapsgrunnlag vurdert med SIGN-metodikk
(SIGN: Scottish Intercollegiate Guidelines Group)
Gradering av anbefalinger med SIGN metodikk
Sammenhengen mellom kunnskapsgrunnlaget og anbefalingene i retningslinjen er som følger:
Kunnskap | Anbefaling | |
| 1a | Gode store systematiske oversikter med entydige klare resultater/liten risiko for bias | A |
| 1a | Små meta-analyser/lite oppdaterte meta-analyser eller heterogene resultater med høy risiko for bias | B eller C |
| 1b | Minst to studier/alternativt en av adekvat størrelse og entydige klare resultater med liten risiko for bias | A |
| 1b | Små studier eller studier med heterogene resultater med høy risiko for bias | B eller C |
| 2a-b | Ikke randomisert studie med adekvat kontrollgruppe og adekvat størrelse og entydige resultater med liten risiko for bias | B |
| 2a-b | Ikke randomisert studie med kontrollgruppe med heterogene resultater eller høy risiko for bias | C |
| 3 | Gode beskrivende studier, observasjonsstudier av adekvat størrelse, men uten kontrollgruppe | C |
| 4 | Ingen gode studier som er særlig representative for temaet, men bred enighet i arbeidsgruppen om at dette ut fra klinisk erfaring er en viktig anbefaling. | D |
For diagnostiske metoder og andre tester eller undersøkelser er ovenstående klassifisering lite egnet. Anbefalinger av slike metoder og tester er derfor ikke gradert, men bygger på en oppfatning i arbeidsgruppene om at metoden eller testen er nyttig. Anbefalinger når det gjelder tester og undersøkelser er derfor merket med stjerne (*) i dokumentet