Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av hjernesvulster generelt (hos voksne)
Hva er nytt?
Sist faglig oppdatert: 17.04.2024
Hovedmomenter i oppdateringen av de nevroonkologiske handlingsprogrammene som ble publisert august 2023 og mindre oppdatering vår 2024:
- Handlingsprogrammene for diffuse høygradige og diffuse lavgradige gliomer ble slått sammen til ett handlingsprogram for diffuse gliomer
- Handlingsprogrammet for meningeomer ble strammet inn og det ble definert et tydelig MR kontrollopplegg
- I alle stråleappendixer er det lagt inn referanse til ny publikasjon fra KVIST vedrørende stråletoleransegrenser for viktige organer i og nær sentralnervesystemet (såkalte risikoorganer)
- Nasjonale insidenstall er oppdaterte i tråd med rapport fra det nyetablerte Hjernesvulstregisteret (kvalitetsregister i regi av Kreftregisteret)
- Hjernesvulstklassifiseringen er oppdatert og i tråd med WHOs klassifisering publisert november 2021
- Det er lagt inn egne kapitler skrevet av og for fastleger/primærleger
- Utvidet omtale av nukleærmedisinsk diagnostikk
- Den sannsynlige sammenhengen mellom oral hormonerstatningsterapi og meningeomer er omtalt
Sammendrag av anbefalingene
Sist faglig oppdatert: 17.08.2023
UTREDNING
- Alle pasienter hvor det er mistanke om høygradig hjernesvulst henvises til «Pakkeforløp for hjernekreft»
- Alle pasienter med progredierende sentralnervøse nevrologiske utfall eller nyoppstått vedvarende hodepine/endret karakter av kjent hodepine med varselssymptomer eller --funn bør utredes med MR cerebrum med henblikk på tilgrunnliggende hjernesvulst
- Pasienter med nyoppståtte epileptiske anfall bør utredes med MR cerebrum og EEG med henblikk på tilgrunnliggende hjernesvulst
- Ved fokal patologi på EEG eller fokal anfallsstart bør MR-kontroll i løpet av få måneder vurderes hvis første undersøkelse er normal
- Anbefalt basis MR-protokoll/tumorprotokoll ved utredning av hjernesvulst
Sekvens | Bildeplan |
T1 før kontrast | 3D |
TSE/FSE T2 | Transversal |
FLAIR | 3D |
Diffusjon | Transversal |
T1 etter intravenøs kontrast | 3D |
- Følgende pasientgrupper bør tas opp i MDT-møte:
- Utvalgte pasienter som planlegges operert (diskutere behandlingsstrategi/behov for kompletterende utredning)
- Utvalgte pasienter som nylig er biopsert eller operert for primær hjernesvulst (for gjennomgang av histologi og for å diskutere videre behandling og oppfølging)
- Pasienter med påvist eller mistenkt residiv hvor en ønsker tverrfaglig vurdering med tanke på aktuelle behandlingsalternativer
- Andre komplekse pasienter hvor flere spesialiteter er involvert i vurdering, behandling og oppfølging
BEHANDLING
- Kirurgi er førstelinjebehandling for de fleste pasienter med hjernesvulst. Behov for og type tilleggsbehandling bør som hovedregel vurderes av MDT
- Operasjonstilgang og bruk av avanserte hjelpemidler vurderes individuelt avhengig av pasient og svulsttype. MR bør tas innen 72 timer postoperativt for å vurdere reseksjonsgrad og eventuelle komplikasjoner som infarkter og blødninger
- Anfallsforebyggende behandling (antiepileptika) bør startes hos alle pasienter som har hatt ett sikkert eller overveiende sannsynlig symptomatisk epileptisk anfall
- Ved bruk av glukokortikoider som antiødembehandling ved hjernesvulst bør laveste effektive dose brukes postoperativt og det må fortløpende tas stilling til dose og behandlingslengde. Svulster uten radiologisk ødem skal som hovedregel ikke behandles med glukokortikoider
- Behandlende lege bør følge opp og om mulig forebygge bivirkninger av glukokortikoidbehandling over tid, der det er mulig
- Tromboseprofylakse bør vurderes individuelt hos immobiliserte pasienter med hjernesvulst
- Ikke-medikamentelle symptomrettede tiltak bør fortløpende vurderes og igangsettes ved behov gjennom hele forløpet
REHABILITERING OG OPPFØLGING
- Målet med oppfølging er vurdering av sykdomsstatus og indikasjon for videre tumorrettet behandling, symptomkontroll (inkludert epilepsi og nevrologiske utfall), rehabiliteringsbehov og kjøreegnethet, gi informasjon og diagnostisering av seneffekter etter sykdom og behandling
- Pasienter med hjernesvulst som ønsker det, bør få et individualisert tilbud om spesialisert og/eller kommunal rehabiliterende behandling tilpasset sykdomsutvikling og særskilte behov hos pasient og pårørende
- Samarbeid med kommunal helsetjeneste bør etableres for alle pasienter som forventes å ha vedvarende eller økende funksjonstap
- Kjøreegnethet skal vurderes etter retningslinjer for førerkort (https://www.helsedirektoratet.no/veiledere/forerkortveileder) hos alle pasienter med hjernesvulst
PATOLOGI
- Svulster i sentralnervesystemet klassifiseres etter WHOs retningslinjer av 2021
- Immunhistokjemisk farging for IDH1R132H og H3 pK28me3 gjøres på alle diffust infiltrerende gliomer
- Ved negativ immunhistokjemi gjøres utvidet molekylærgenetisk analyse på IDH1 kodon 132 og IDH2 kodon 172 ved MLPA og/eller sekvensering. Ved negativ MLPA bør det gjøres sekvensering for IDH
- Ved påvist tap av H3 p.K28me3-uttrykk gjøres utvidet molekylærgenetisk analyse på H3
- Ved glioblastomer hos pasienter eldre enn 54 år med bevart ATRX og H3 p.K28me3, uten mistanke om tidligere diffust CNS WHO grad 2 gliom, kan man vurdere å utelate utvidet molekylærgenetisk analyse ved negativ IDH immunhistokjemisk farging (da de fleste glioblastomer i denne aldersgruppen er IDH-villtype)
- ATRX immunfarging gjøres på alle diffust infiltrerende gliomer
- Alle IDH muterte astrocytomer histologisk grad 2 og 3 skal testes for homozygot delesjon CDKN2A/B for å utelukke molekylærgenetisk Grad 4 tumores
- 1p/19q-status undersøkes hos alle pasienter med påvist IDH-mutasjon
- I tilfeller med klassisk morfologi forenlig med astrocytom og tap av ATRX (og/eller nukleær p53-akkumulasjon) kan man vurdere å utelate analyse av 1p19q-status
- Molekylærpatologisk undersøkelse for MGMT-promotormetylering gjøres på alle grad 4 tumores
Fastlegens rolle hos pasienter med hjernesvulst
Sist faglig oppdatert: 17.08.2023
Innledning
I Norge diagnostiseres om lag 1.000 personer årlig med primær svulst i sentralnervesystemet (CNS), fordelt på knappe 1.000 voksne og 50 barn (Larsen, 2022). Primære hjernesvulster utgjør om lag en tredjedel av all kreft i barnealder, men bare 3 % av kreft hos voksne. Man skiller mellom primære svulster i CNS, som omhandles i dette handlingsprogrammet, og metastaser til CNS fra ekstrakranielle svulster. De siste og primære CNS-lymfomer omtales ikke i dette handlingsprogrammet.
Meningeomer er den klart hyppigste hjernesvulsttypen med 39 % av tilfellene, etterfulgt av hypofysesvulster (17%), glioblastom (14%) og nerveskjedesvulster (9%). Glioblastom er den hyppigste primære maligne hjernesvulstentiteten og utgjør 49% av de maligne svulstene (Ostrom et al., 2017).
Hyppigheten av de ulike svulstene varierer i ulike aldersgrupper. Mens pilocytisk astrocytom, germinalcellesvulster og embryonale svulster er hyppigst i ung alder, sees meningeom og glioblastom oftest hos eldre voksne (median alder henholdsvis 66 og 65 år) (Ostrom et al., 2020). For noen svulster er det tydelig forskjell i forekomst mellom kjønnene. For eksempel er meningeom hyppigst hos kvinner (12.22 vs 5.56 per 100.000) og glioblastom hyppigst hos menn (4.03 vs 2.54 per 100.000) ifølge aldersjusterte insidens-rater fra USA.
Forebygging
Det er gjort en rekker studier av mulige miljørelaterte risikofaktorer ved primær hjernesvulst, som for eksempel sigarettrøyking, premorbide sykdommer som for eksempel autoimmun sykdom, enkelte typer medikamenter, bruk av mobiltelefon, og så videre. Man har konkludert med at det ikke sikkert er vist kausal sammenheng mellom de fleste av miljøfaktorene og hjernesvulst. Det man imidlertid har fastslått, er at ioniserende stråling inkludert tidligere gjennomgått bestråling av hjernen disponerer for senere utvikling av hjernesvulster. Det følger av ovenstående at det er lite som kan forebygges. Imidlertid bør man unngå å utsette mennesker for unødvendig ioniserende stråling, for eksempel røntgen- og CT-undersøkelser.
Arvelighet
En svært liten andel av pasientene med hjernesvulst har predisponerende genetiske tilstander. Eksempler på dette er nevrofibromatose 1 og 2, Li-Fraumeni syndrom og von Hippel-Lindau syndrom. Se kapittel Behandling av lokalisert sykdom og kurativ behandling for detaljer.
Fastlegens rolle i diagnostikk og henvisning til Pakkeforløp for hjernekreft
Fastlegene har en viktig rolle i primærdiagnostikk, både med å avkrefte mistanke om hjernesvulst, utrede og eventuelt påvise hjernesvulst og henvise til Pakkeforløp for hjernekreft ved begrunnet mistanke.
Symptomatologi
Symptomatologi ved hjernesvulst er heterogen, avhengig av svulstens lokalisasjon og histologi, og symptomutviklingen er ofte en indikator på svulstens veksthastighet. Blødning i en hjernesvulst kan gi akutt oppstått slaglignende klinikk, men symptomene er ellers vanligvis progredierende over tid.
Symptomene kan klassifiseres i hovedgruppene:
Fokale symptomer
Epileptiske anfall
Symptomer på økt intrakranielt trykk
Generelle nevrologiske symptomer
Symptomatiske hjernesvulster gir i de fleste tilfeller fokalnevrologiske symptomer som indikerer svulstens lokalisasjon. Det kan blant annet dreie seg om motoriske, sensoriske eller kognitive utfallssymptomer, hjernenerveaffeksjon og redusert visus, alene eller i ulike kombinasjoner.
Lokalisasjonsrelaterte epileptiske anfall er et hyppig symptom ved hjernesvulster (Englot et al., 2016). Prevalensen varierer mellom ulike hjernesvulsttyper og er høyest ved langsomtvoksende svulster.
Forhøyet intrakranielt trykk skyldes masseeffekt av svulsten, ødem og/eller hydrocefalusutvikling. De klassiske symptomene hos voksne er gradvis utvikling av hodepine som ofte er verst om morgenen, kvalme og oppkast, og etter hvert hernieringssymptomer som påvirket bevissthet, pupilleforandringer og forandret respirasjon (Nelson et al., 2014). Hos mindre barn kan man ved høyt intrakranielt trykk over tid se økt hodeomkrets på grunn av ekspansjon av kraniet.
Pasienter med hjernesvulst rapporterer ikke sjelden symptomer uten åpenbar sammenheng med svulstens beliggenhet eller ødem, som irritabilitet, fatigue, personlighetsendringer og uspesifikk hodepine.
Begrunnet mistanke om hjernesvulst
Begrunnet mistanke om svulst i hjernen oppstår når minst ett av følgende kriterier er oppfylt:
- CT- eller MR-skanning, ofte utført på andre indikasjoner, har påvist romoppfyllende prosess i hjernevevet
- Nyoppståtte objektive fokale nevrologiske utfallssymptomer som for eksempel halvsidig parese, styringsproblemer eller språkforstyrrelser uten andre sannsynlige forklaringer som for eksempel hjerneslag
- Nyoppstått epileptisk anfall hos voksne
- Nyoppståtte, raskt progredierende endringer i adferd, personlighet eller kognisjon. Mindre endringer med langsom progresjon hvor mistanken om hjernesvulst er liten, kan utredes av fastlegen med MR
- Nyoppstått, progredierende hodepine eller alvorlig forverring av kronisk hodepine (trykkpreget) uten andre sannsynlige årsaker enn hjernesvulst. Hodepine som ikke virker trykksuspekt og med langsom progresjon hvor mistanken om svulst er liten, kan utredes av fastlegen med MR
Alle pasienter med begrunnet mistanke om hjernesvulst henvises «Pakkeforløp for hjernekreft». Det bør gjøres en generell somatisk undersøkelse og klinisk nevrologisk undersøkelse. Pasienten henvises til lokal nevrologisk eller nevrokirurgisk avdeling via telefonisk kontakt med vakthavende nevrolog eller nevrokirurg. Denne avgjør om pasienten skal legges inn eller tas imot til poliklinisk utredning. Henvisning sendes med pasienten ved akutt innleggelse, elektronisk er å foretrekke. Henvisende lege har ansvar for at eventuelle radiologiske undersøkelser oversendes. Det er viktig med god kommunikasjon med pasient og pårørende om hva som er funnet og hva som skal skje av utredning videre. En kan gjerne diskutere dette med vakthavende nevrolog/nevrokirurg. Ved uklare og vage symptomer kan videre utredning med bildediagnostikk (MR) gjøres hos fastlegen.
Fastlegens rolle for hjernesvulstpasienter i aktiv behandling
Fastlegens rolle i denne fasen vil variere alt etter pasientens kliniske situasjon, livssituasjon og avstand til sykehus. Fastlegen bør bidra etter pasientens ønsker og behov.
Diagnostisering, valg av behandling og initial oppfølging etter ferdigbehandlet sykdom er i stor grad sentralisert til universitetssykehus og større sykehus. Fastlegen skal få kopi av epikrise fra innleggelser og polikliniske notater med behandlingsplan. Oftest vil primærbehandling og kontroller foregå ved sykehus. Hvis epikrise med plan for aktuell behandling fra sykehus inkluderer oppgaver for fastlegen, skal pasienten informeres om å kontakte fastlege eller sykehusavdelingen hjelpe med dette dersom pasienten selv ikke er i stand til det.
Fastlegen skal bidra til å lindre smerter, kvalme og komplikasjoner etter behandling, og gi råd om ernæring. Legen må derfor vite om mulige bivirkninger av behandlingen som er gjort og henvise til sykehus for råd og håndtering ved mistanke om alvorlige, akutte komplikasjoner av behandling, ved infeksjon eller residiv.
Fastlegen kan bidra i behandling av angst, depresjon og andre psykiske plager, samt søvnvansker. Fastlegen kan også bidra til ivaretagelse av berørte familiemedlemmer, herunder eventuelle barn, og samarbeide med hjemmetjeneste der dette er aktuelt. Henvisning til lokalt vardesenter og rehabiliteringsinstanser kan også gjøres av fastlegen.
Sykemelding skal i aktiv behandlingsfase primært skrives av behandlende lege, med mindre fastlegen allerede har sykemeldt pasienten. Fastlegen skal bistå i kontakten med NAV der dette er hensiktsmessig.
Fastlegens rolle for pasienter som går til kontroller etter behandling
Primærbehandling og kontroller foregår som regel ved sykehus. Fastlege kan samarbeide med sykehus om kontroller ved langvarig sykdom der dette er hensiktsmessig, eller overta kontrollene etter at behandling ved sykehuset er avsluttet. Sykehusspesialisten skal da i epikrise beskrive detaljert oppfølgingsplan.
Fastlegens rolle for pasienter som har avsluttet oppfølging på sykehus
Pasienter som har avsluttet oppfølging på sykehus følges hos fastlegen. Dette kan være pasienter som antas kurert for sin hjernesvulst eller har stabil sykdom. Pasientene kan ha svært varierende behov som spenner fra diagnostisering og kontroll av senfølger etter sykdom og behandling, til avdekking og behandling av psykiske ettervirkninger og plager. Basert på eventuelle symptomer og funn henvises pasienter til relevante instanser. Eksempler på dette er:
- Diagnostisering og behandling av senskader etter kirurgi, strålebehandling og medikamentell behandling (stråleskader, nevropati, endokrin sykdom, fatigue) er viktig å kartlegge og det er mulig å henvise til poliklinikk for senskader etter kreft der dette er hensiktsmessig
- Bidra til å avdekke rehabiliteringsbehov, og tilby medisinsk oppfølging og behandling i rehabiliteringsforløpet. Dette inkluderer å henvise til fysikalsk behandling og stimulere til egenomsorg og aktivitet
- Oppfølging av sykemelding og samarbeid med NAV er vesentlige elementer i rehabiliteringsfasen for yrkesaktive kreftpasienter
- Fange opp symptom på tilbakefall av sykdom og henvise til rett instans dersom man får mistanke om sykdomstilbakefall
Det vises for øvrig til følgende fra Helsedirektoratet:
Fastlegens arbeid med palliasjon og omsorg ved livets slutt for pasienter med hjernesvulst
I denne fasen mottar mange pasienter behandling på sykehus, dels for symptomlindring, dels for livsforlengelse. Parallelt følges pasientene av fastlege og øvrig primærhelsetjeneste. Noen pasienter trenger behandling for infeksjoner i hjemmet. De har ofte tunnelert sentralt venekateter (CVK, Hickman) som brukes til blodprøvetaking, transfusjoner og intravenøs medikamentell behandling. Bruk og skylling av slike katetere er forbundet med risiko for luftemboli og infeksjon, og må bare gjøres av helsepersonell som har trening i dette og følger fastlagte prosedyrer. Hvis slikt personell, prosedyrer og utstyr ikke er tilgjengelig, må man ved behov ta blodprøver og gi intravenøs behandling i perifer vene på armen i allmennpraksis, selv om pasienten har innlagt sentralt venekateter.
Palliasjon og omsorg ved livets slutt for kreftpasienter må tilpasses den enkeltes kliniske situasjon og behov. Det vises til Helsedirektoratets nettsider med mer informasjon om fastlegenes rolle ved kreft, herunder fastlegens rolle i palliasjon og omsorg ved livets slutt.
Innledning
Sist faglig oppdatert: 17.08.2023
Svulster i sentralnervesystemet er en meget heterogen gruppe neoplasier og dette gjenspeiles i klassifikasjonssystemet til Verdens helseorganisasjon (WHO). De har en egen klassifikasjon for svulster i sentralnervesystemet (WHO Classification of Tumours Editorial Board, 2021), samt at hypofysesvulstene er tatt inn i klassifiseringen av svulster i endokrine organer (WHO Classification of Tumours Editorial Board, 2022). Gjeldende klassifikasjoner er fra henholdsvis 2021 og 2022. Siden den første utgaven av klassifikasjon for svulster i sentralnervesystemet kom i 1979 har mye skjedd; i andreutgaven av 1993 integrerte man immunhistokjemiske undersøkelser som grunnlag for diagnostikk, den tredje utgaven fra 2000 var vesentlig mer utfyllende enn de to første, mens den fjerde utgaven fra 2007 blant annet introduserte flere nye entiteter og inkluderte en oppdatering av graderingssystemet. 2016-revisjonen av den fjerde utgaven representerte et paradigmeskifte ved at molekylære svulstkarakteristika ble introdusert som en viktigere del av basis for klassifikasjon. Dette har medført at spesielt diffuse gliomer og embryonale svulster ble klassifisert vesentlig annerledes enn tidligere. I femte og seneste utgave av klassifikasjonen (2021) er molekylærgenetiske markører i enda større grad innlemmet i klassifikasjon og gradering av svulster i sentralnervesystemet.
Totalt har WHO nå definert 13 hovedgrupper av svulster i sentralnervesystemet; hver med flere undergrupper. Hjernemetastaser er tatt med som en egen gruppe, noe som ikke er unaturlig da de representerer de fleste tilfellene av svulst i sentralnervesystemet. De regnes imidlertid ikke med blant primære svulster i sentralnervesystemet og de skal heller ikke vektlegges i dette handlingsprogrammet. For omtale av hjernemetastaser vises det til de organspesifikke handlingsprogrammene (lungekreft, brystkreft, og så videre).
Det har vært utfordrende å lage et handlingsprogram som skal omfatte undergrupper av svulster i sentralnervesystemet, og vi har også vurdert nøye hvilken struktur dette skulle ha. Vi har endt opp med et format der vi har fire ulike handlingsprogrammer samlet under ett; ett (dette) er generelt om hjernesvulster og de tre andre er mer detaljerte om de hyppigst forekommende svulsttypene. De sistnevnte tre omhandler diffuse gliomer, meningeomer og hypofyseadenomer.
Epidemiologi
Insidens og epidemiologi
Sist faglig oppdatert: 17.04.2024
Man har de siste årene hatt tall tydende på at det i Norge diagnostiseres om lag 1000 personer årlig med primær svulst i det sentrale nervesystem (CNS), fordelt på ca 1000 voksne og 50 barn, ifølge Kreftregisterets tall fra 2021 (Larsen, 2022). I den første rapporten til det nyopprettede «Kvalitetsregister for hjerne- og ryggmargssvulster» fra 2023 stilles det spørsmål ved om dette er korrekt, og om det reelle tallet kan være dobbelt så høyt (Kreftregisteret, 2023). Videreutvikling av kvalitetsregisteret vil gi bedre tall i årene som kommer. Relativt sett utgjør primære hjernesvulster om lag en tredjedel av all kreft i barnealder, men bare 3 % av kreft hos voksne. I tallene fra Kreftregisteret over primære svulster i CNS inngår både godartede og ondartede svulster, og inkludert i tallene er også svulster i ryggmarg, hypofyse, corpus pineale, ductus kraniofaryngealis og de intrakranielle deler av hjernenervene. Ut fra forventet forekomst er det mistanke om betydelig underrapportering, og reell insidens kan være så høy som det dobbelte av de registrerte tilfellene. Hovedandelen av disse ikke-registrerte svulstene vil nok i liten grad påvirke morbiditet og mortalitet for personen det gjelder. Det er opprettet et nasjonalt kvalitetsregister for hjernesvulst i regi av Kreftregisteret og NBTC (Norwegian Brain Tumor Consortium). Første årsrapport er publisert og dette «Hjernesvulstregisteret» vil på sikt gi mer detaljert informasjon om insidens og fordeling av ulike hjernesvulsttyper (Kreftregisteret, 2023).
Figuren under er fra Kreftregisteret og viser insidens, mortalitet og 5-års relativ overlevelse ved primær hjernesvulst i Norge fra 70-tallet og fram til i dag (Larsen, 2022). Økningen i insidens er sannsynligvis hovedsakelig betinget i bedret diagnostikk og registrering, samt økende alder i befolkningen. Nedgangen i registrerte tilfeller de siste årene er antatt forårsaket av underrapportering til Kreftregisteret, heller enn en reell nedgang.
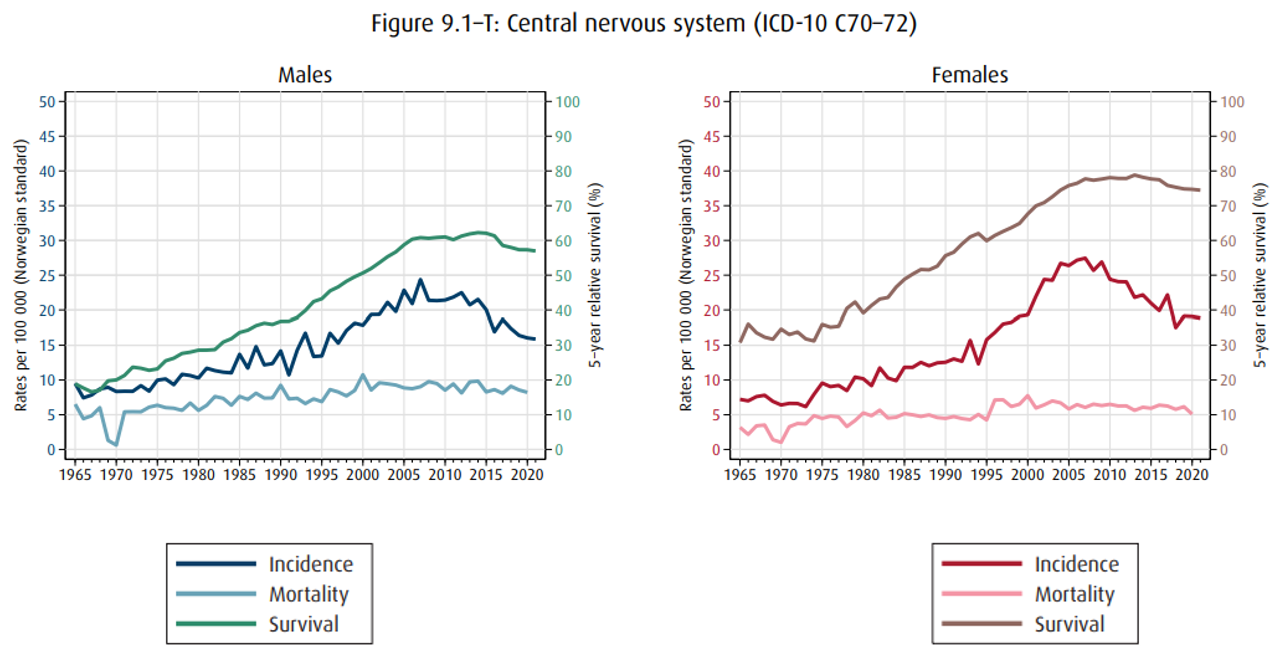
De norske tallene gjenspeiler ikke den internasjonale trenden i økt insidens av meningeomer, sannsynligvis som følge av økt bruk av MR caput. I siste rapport fra CBTRUS (Central Brain Tumor Registry of the United States), kan man se forekomst og fordeling av ulike svulsttyper i CNS (Ostrom et al., 2021). Meningeomer er den klart hyppigste hjernesvulsttypen med 39 % av tilfellene, etterfulgt av hypofysesvulster (17%), glioblastom (14%) og nerveskjedesvulster (9%). Glioblastom er den hyppigste maligne svulsten og utgjør 14% av alle primære hjernesvulster og 49% av de maligne, etterfulgt av diffuse CNS WHO grad 3 gliomer, øvrige gliomer og primært CNS-lymfom (Ostrom et al., 2021; Ostrom et al., 2017). Hyppigheten av de ulike svulstene varierer i ulike aldersgrupper. Mens pilocytisk astrocytom, germinalcellesvulster og embryonale svulster er hyppigst i ung alder, ses meningeom og glioblastom oftest hos eldre voksne (median alder henholdsvis 66 og 65 år) (Ostrom et al., 2020). For noen svulster er det tydelig forskjell i forekomst mellom kjønnene. For eksempel er meningeom hyppigst hos kvinner (12.22 vs 5.56 per 100.000), mens glioblastom er hyppigst hos menn (4.03 vs 2.54 per 100.000) ifølge aldersjusterte insidensrater fra USA.
Man skiller mellom primære svulster i CNS, som omtales i dette handlingsprogrammet, og metastaser til CNS fra ekstrakranielle svulster. I Kreftregisterets statistikk registreres hjernemetastaser og meningeale metastaser sammen med primærtumor. Metastaser er klart hyppigste svulst i CNS og mer enn 10 ganger hyppigere enn primær hjernesvulst (Ostrom et al., 2018). Hjernemetastaser ses hyppigst ved lungekreft, brystkreft, føflekkreft og nyrekreft, sjeldnere ved tykktarmskreft og andre kreftformer (Le Rhun et al., 2021). Metastaser til CNS omtales i nasjonale handlingsprogram spesifikt for de ulike primærdiagnosene.
Forebygging
Sist faglig oppdatert: 17.08.2023
Det foreligger en rekke studier av mulige miljørelaterte risikofaktorer ved primær hjernesvulst, som for eksempel sigarettrøyking, premorbide sykdommer som for eksempel autoimmun sykdom, enkelte typer medikamenter, bruk av mobiltelefon, og så videre. Det vises i sin helhet til et oversiktsarbeide med fyldige referanser (Michaud et al., 2017), der man har konkludert med at det ikke sikkert er vist kausal sammenheng mellom de fleste av miljøfaktorene og hjernesvulst. Det man imidlertid har fastslått, er at tidligere gjennomgått bestråling av hjernen disponerer for senere utvikling av enkelte typer hjernesvulster. Dette gjelder også for andre typer ioniserende stråling. En veldig liten andel av pasientene med hjernesvulst har predisponerende genetiske tilstander. Eksempler på dette er nevrofibromatose 1 og 2, Li-Fraumeni syndrom og von Hippel-Lindaus syndrom. Se kapittel Behandling av lokalisert sykdom og kurativ behandling for detaljer.
Det følger av ovenstående at det er lite som kan forebygges. Imidlertid bør man unngå å utsette mennesker for unødvendig ioniserende stråling. Dette innebærer også å være grundig med indikasjonsstilling for radiologiske undersøkelser basert på ioniserende stråling, for eksempel røntgen- og CT-undersøkelser.
Pakkeforløp for kreft
Sist faglig oppdatert: 17.08.2023
I 2015 ble «Pakkeforløp for hjernekreft» innført i helsetjenesten, sammen med øvrige pakkeforløp for kreft, og ble sist revidert 2020. Det bemerkes at man i «Pakkeforløp for hjernekreft» bare inkluderer høygradige hjernesvulster, samt pasienter hvor man har mistanke om diffust lavgradig gliom inntil man radiologisk eller ved hjelp av vevsprøve har utelukket høygradig hjernesvulst. Det betyr at pasienter med hypofyseadenomer og de fleste meningeomer ikke skal inkluderes i dette pakkeforløpet. Dersom man er i tvil om pasienten kan ha et høygradig gliom skal pasienten inkluderes i «Pakkeforløp for hjernekreft» og tas ut dersom man avkrefter mistanken om høygradig gliom. For pasienter med hjernemetastaser er det pakkeforløpet for morsvulstens organ, «Diagnostisk pakkeforløp for pasienter med uspesifikke symptomer på alvorlig sykdom som kan være kreft», «Pakkeforløp for metastaser med ukjent utgangspunkt», eller «Pakkeforløp for hjernekreft» som er aktuelle. Hvilket pakkeforløp som velges vil til enhver tid være avhengig av hvor mye og hvilken diagnostisk informasjon man har. Det følger av dette at en del pasienter vil måtte flyttes mellom pakkeforløp.
Om Pakkeforløp for kreft
Sist faglig oppdatert: 17.08.2023
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende, samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Les mer om Pakkeforløp for hjernekreft.
Det er egne Diagnoseveiledere for inngang til pakkeforløp for kreft.
Anbefalinger:
- Alle pasienter hvor det er mistanke om høygradig hjernesvulst henvises til «Pakkeforløp for hjernekreft»
Pakkeforløp hjem for pasienter med kreft
Sist faglig oppdatert: 17.08.2023
Pakkeforløp hjem for pasienter med kreft skal bidra til å sikre god struktur og logistikk i helsetjenesten, samt sikre trygghet og forutsigbarhet for personer som lever med kreft eller etter endt kreftbehandling. Les mer om Pakkeforløp hjem for pasienter med kreft.
Om Pakkeforløp for kreft
Sist faglig oppdatert: 17.08.2023
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende, samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Les mer om Pakkeforløp for hjernekreft.
Det er egne Diagnoseveiledere for inngang til pakkeforløp for kreft.
Anbefalinger:
- Alle pasienter hvor det er mistanke om høygradig hjernesvulst henvises til «Pakkeforløp for hjernekreft»
Pakkeforløp hjem for pasienter med kreft
Sist faglig oppdatert: 17.08.2023
Pakkeforløp hjem for pasienter med kreft skal bidra til å sikre god struktur og logistikk i helsetjenesten, samt sikre trygghet og forutsigbarhet for personer som lever med kreft eller etter endt kreftbehandling. Les mer om Pakkeforløp hjem for pasienter med kreft.
Diagnostikk og utredning
Sist faglig oppdatert: 17.08.2023
Fastlegene er sentrale for pasienter med hjernesvulst. De har en viktig rolle i primærdiagnostikk, både med å avkrefte mistanke om hjernesvulst og utrede og eventuelt påvise hjernesvulst. Kriterier for henvisning til «Pakkeforløp for hjernekreft» bør brukes.
Helsedirektoratet har i samarbeid med en arbeidsgruppe av fastleger, utarbeidet et dokument som beskriver fastlegenes rolle ved kreft. Alder, symptomatologi, progresjon av symptomer, i hvilket tidsaspekt eventuelle tegn på forhøyet intrakranielt trykk oppstår, og eventuelt kjent kreftsykdom er sentrale momenter i fastlegens vurdering av om hjernesvulst må mistenkes.
Symptomer
Sist faglig oppdatert: 17.08.2023
Symptomatologien ved hjernesvulst er heterogen, avhengig av svulstens lokalisasjon og histologi, og symptomutviklingen er ofte en indikator på svulstens veksthastighet. Symptomene kan dels skyldes direkte svulstinfiltrasjon og svulstvekst, dels ødem rundt svulsten. Blødning i en hjernesvulst kan gi akutt slaglignende klinikk, men symptomene er vanligvis progredierende over tid.
Symptomene kan klassifiseres i hovedgruppene:
- Fokale symptomer
- Epileptiske anfall
- Symptomer på økt intrakranielt trykk
- Generelle nevrologiske symptomer
Fokale symptomer
Symptomatiske hjernesvulster gir i de fleste tilfeller fokalnevrologiske symptomer som indikerer svulstens lokalisasjon. Det kan blant annet dreie seg om motoriske, sensoriske eller kognitive utfallssymptomer, hjernenerveaffeksjon, alene eller i ulike kombinasjoner. Kognitive symptomer er ikke alltid klinisk åpenbare og blir sannsynligvis ofte undererkjent dersom man ikke tester spesifikt for dette (Taphoorn et al., 2004). Symptomutviklingen er avhengig av svulstens veksthastighet og eventuell ødemutvikling. Ved høygradige svulster og metastaser er klinikken oftest subakutt og noen ganger akutt. Ved langsomtvoksende svulster, som for eksempel meningeom, kan symptomene progrediere over lengre tid, av og til flere år. Hypofyseadenomer og andre svulster i hypofyseregionen kan gi endokrine symptomer, i form av under- eller overproduksjon av hormoner.
Epileptiske anfall
Lokalisasjonsrelaterte epileptiske anfall er et hyppig symptom ved hjernesvulster (Englot et al., 2016). Prevalensen varierer mellom ulike hjernesvulsttyper og er høyest ved langsomtvoksende svulster. Prevalensen av epileptiske anfall er rapportert å være 90–100 % ved dysembryoplastisk nevroepitelial tumor (DNET) og gangliogliom, 60–85 % ved diffust gliom CNS WHO grad II og 30–60 % ved glioblastom (Armstrong et al., 2016; Kerkhof et al., 2013). Epileptiske anfall er ofte det initiale symptomet på hjernesvulst, spesielt ved diffuse CNS WHO grad 2 gliomer, men hos 20 % av gliompasientene debuterer anfallene senere i forløpet (Englot et al., 2016). Svulster med frontal eller temporal lokalisasjon regnes som mest epileptogene.
Voksne pasienter med nyoppståtte epileptiske anfall bør alltid utredes med henblikk på tilgrunnliggende hjernesvulst, og særlig ved mistanke om fokal anfallsdebut (Armstrong et al., 2016; Englot et al., 2016). I sjeldne tilfeller kan epileptiske anfall debutere før radiologiske funn forenlig med hjernesvulst. Ved normal MR, men vedvarende mistanke om fokal strukturell patologi, bør man vurdere kontrollundersøkelse med MR etter noen måneder (Khan et al., 2011).
De fleste epileptogene svulster affiserer kortex, men indirekte kortikal affeksjon som følge av økt trykk kan også gi epileptiske anfall. Patofysiologien ved svulstepilepsi er sammensatt og ennå bare delvis kartlagt, men både tumorale og peritumorale forhold antas å være av betydning. Anfallene utgår fra den fokale lesjonen og semiologien ved anfallsstart avspeiler derfor svulstens lokalisasjon. Anfallene kan være både uten og med påvirkning av bevissthet, og kan sekundærgeneraliseres, spesielt initialt i sykdomsforløpet. Anfallshyppigheten gjennom sykdomsforløpet er varierende, fra kun ett anfall på diagnosetidspunkt til behandlingsrefraktær epilepsi. Både svulstreseksjon og onkologisk behandling kan føre til bedret anfallssituasjon, mens noen pasienter har en oftest forbigående anfallsforverring under strålebehandling.
Anfallsøkning eller endring av anfallskarakter kan forutgå radiologisk påvisbart residiv, og terskelen for bildediagnostikk bør være lav ved endret anfallskontroll/-situasjon hos en pasient med hjernesvulst (Armstrong et al., 2016).
Symptomer på økt intrakranielt trykk
Økt intrakranielt trykk skyldes masseeffekt av svulsten, ødem og/eller hydrocefalusutvikling. De klassiske symptomene hos voksne er gradvis utvikling av hodepine som ofte er verst om morgenen, kvalme og oppkast, og etter hvert hernieringssymptomer som påvirket bevissthet, pupilleforandringer og forandret respirasjon (Nelson et al., 2014). Røde flagg for hodepine av sekundær årsak (for eksempel underliggende svulst) oppsummeres i SNARET: Høyere alder, kjent kreftsykdom, morgenhodepine og hodepine med nevrologiske utfall, epileptiske anfall eller endret bevissthet (Hodepine, 2021). Hos mindre barn kan man ved høyt intrakranielt trykk over tid se økt hodeomkrets på grunn av ekspansjon av kraniet.
Generelle nevrologiske symptomer
Pasienter med hjernesvulst rapporterer ikke sjelden symptomer uten åpenbar sammenheng med svulstens beliggenhet eller ødem, som irritabilitet, fatigue, personlighetsendringer og uspesifikk hodepine.
Utredning
Sist faglig oppdatert: 17.08.2023
Spesialisthelsetjenestens utredning ved mistanke om hjernesvulst er klinisk nevrologisk undersøkelse, generell somatisk undersøkelse og magnetresonansundersøkelse (MR-undersøkelse) av hjernen. MR-undersøkelse av hjernen er den foretrukne bildemodaliteten ved mistanke om hjernesvulst, se punkt Bildediagnostiske undersøkelser av svulster i sentralnervesystemet. Man må i enkelte kliniske situasjoner og ved enkelte svulsttyper også gjøre undersøkelser av ryggmargen (oftest MR), spinalvæsken (cytologi og tumormarkører), CT caput, blodprøver (tumormarkører for systemisk kreftsykdom, hormonnivåer, med mer) og andre tilleggsundersøkelser. Ved metastasemistanke er tilleggsundersøkelser med tanke på eventuell primærsvulst utenfor sentralnervesystemet indisert. Vurdering av øyelege og ØNH-lege er relevant der svulst eller planlagt behandling kan påvirke synsbanene eller hørsel. For utredningsforløp, se punkt Utredningsforløp.
Kliniske undersøkelser
Sist faglig oppdatert: 17.08.2023
Pasienter hvor man mistenker hjernesvulst skal gjennomgå vanlig somatisk undersøkelse med spesielt fokus på nevrologisk undersøkelse. Man etterspør endringer i adferd, personlighet eller innsik, ser etter fokalnevrologiske utfall - inkludert kognitive problemer som afasi, apraksi eller neglekt - og tegn på økt intrakranielt trykk. Hos barn er måling av hodeomkrets også viktig.
Bildediagnostiske undersøkelser av svulster i sentralnervesystemet
Sist faglig oppdatert: 17.08.2023
Ved klinisk mistanke om hjernesvulst er det sterk indikasjon for rask bildediagnostisk utredning. For korrekt prioritering og valg av protokoll må henvisningen til bildediagnostikk inneholde informasjon om mistanken om hjernesvulst og relevante opplysninger om symptomer, nevrologiske funn og hastighet av symptomutviklingen. Den viktigste bildemetoden er magnetisk resonans bildedanning (MR) og skal gjennomføres på alle pasienter hvor man mistenker hjernesvulst (såfremt det ikke foreligger kontraindikasjoner). Formålet med undersøkelsen er å bekrefte eller avkrefte svulstmistanken. Påvises svulst skal beskrivelsen gi informasjon om lokalisasjon, utbredelse og utseende, samt differensialdiagnostiske vurderinger om svulsttype. Ved kontroller skal undersøkelsen gi opplysninger om eventuelle komplikasjoner og restsvulst etter kirurgi, og effekt av kjemoterapi og strålebehandling. Det er viktig at man i henvisningen til MR opplyser hvilken tumorrettet intervensjon som er gitt og hvilke tidligere undersøkelser man ønsker at bildene skal sammenlignes med. Eventuell steroidbruk bør også presiseres i henvisningen. Radiolog må sørge for å sammenligne med relevante tidligere undersøkelser, spesielt bilder gjort tidlig postoperativt (baseline-bilder). Spesielt er dette viktig hos pasienter med saktevoksende svulster, hvor endring over tid ofte ikke erkjennes hvis man kun sammenligner med forrige kontroll og ikke med baseline-bilder.
MR-undersøkelse
MR er den klart viktigste bildemetoden både i primærutredning og ved kontroller av hjernesvulster. Pasienter med mistanke om hjernesvulst er en høyt prioritert gruppe som skal ha rask tilgang på MR-diagnostikk. En MR-undersøkelse består nesten alltid av flere MR-sekvenser som framstiller vevet på ulike måter, og sekvensene blir gjerne tatt i forskjellige bildeplan (Bitar et al., 2006; Castillo, 2014; Mabray et al., 2015; Mikulis et al., 2007; Roberts et al., 2007). Ved norske sykehus er det MR-utstyr fra ulike produsenter og med varierende alder, kvalitet og tekniske muligheter. Det er derfor ofte nødvendig med lokale tilpasninger av undersøkelsesprotokollene. Hvis mulig bør pasienten undersøkes på samme maskin ved de ulike MR-kontrollene for best mulig å kunne sammenligne undersøkelser med hverandre (Ellingson et al., 2015).
Sekvens | Bildeplan |
T1 før kontrast | 3D |
TSE/FSE T2 | Transversal |
FLAIR | 3D |
Diffusjon | Transversal |
T1 etter intravenøs kontrast | 3D |
T2-vektede sekvenser
På T2-vektede sekvenser vil cerebrospinalvæsken være lys, mens hvit hjernesubstans vil være litt mørkere enn grå substans. Siden nesten all patologi i hjernen som tumor, infarkt og inflammasjon medfører økt mengde vann i vevet, vil patologi som en hovedregel lyse opp, altså ha høyt signal, på T2-bilder. Den mest brukte T2-sekvensen i hjernen heter turbo (eller fast) spin ekko (TSE-T2). En tumorprotokoll vil nesten alltid inkludere en T2-sekvens i transversalplan.
FLAIR
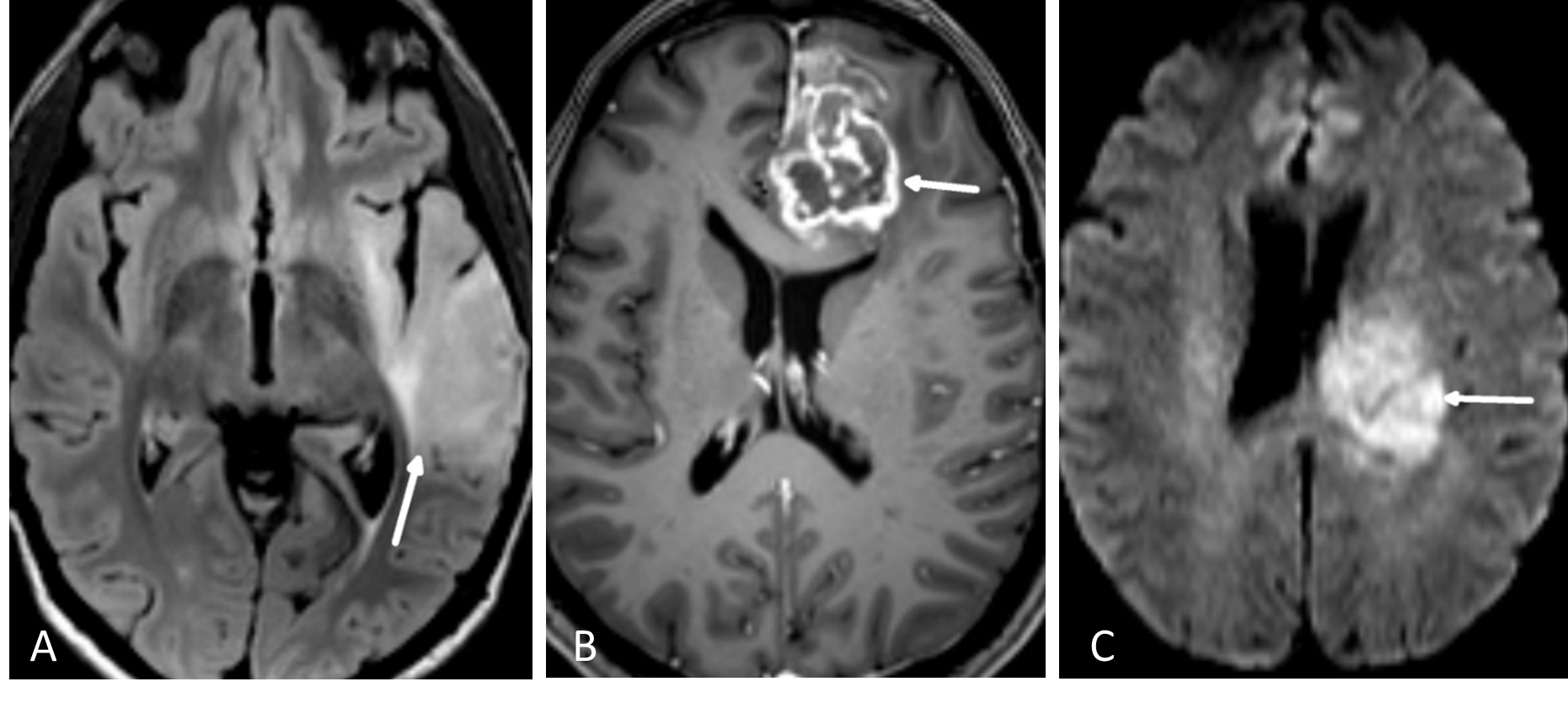
FLAIR er en MR-teknikk hvor man har eliminert det lyse signalet fra cerebrospinalvæsken i en T2-vektet bildesekvens (Figur 5.1). Man kan tro at når signalet i cerebrospinalvæsken undertrykkes blir også vann i en tumor svart. Det er imidlertid forskjell på MR-egenskapene til såkalt fritt vann (som i cerebrospinalvæske) og såkalt bundet vann som interagerer med blant annet makromolekyler i cellemembraner (som i en tumor). FLAIR-sekvensen er laget slik at det bare er det frie vannet som undertrykkes, mens bundet vann i patologiske lesjoner fortsatt lyser opp. En hjernetumorprotokoll vil alltid inneholde en FLAIR-sekvens, vanligvis som et 3D-volum som kan rekonstrueres i valgfrie bildeplan. Særlig på lavgradige, diffust infiltrerende svulster er FLAIR den mest sensitive bildesekvensen.
T1-vektede sekvenser
På T1-vektede MR-bilder av hjernen er cerebrospinalvæsken svart, fett i benmarg og underhud er lyst, mens hvit hjernesubstans er lysere enn grå substans. De mest brukte MR- kontrastmidler er gadolinium-chelater som gis intravenøst. Vev som tar opp kontrastmidlet får høyere signal (blir lyst) på kontrastforsterkede T1-bilder. MR-kontrastmidler krysser ikke en intakt blod-hjerne-barriere. Høygradig maligne hjernesvulster (CNS WHO grad 3-4), metastaser og meningeomer vil som regel lade opp kontrast, mens lavgradige nevroepiteliale svulster (CNS WHO grad 1-2) ofte ikke har kontrastopptak (Figur 5.1). Det er dog ingen absolutt sammenheng mellom kontrastopptak og graden av aggressivitet i svulsten. Alle tumorprotokoller inneholder T1-sekvenser før og etter intravenøs kontrast, enten som bildeopptak i transversal- og koronalplan, eller som et 3D-volumopptak som rekonstrueres i valgfrie bildeplan. Det sistnevnte er nå det vanligste. Det er et viktig poeng at ikke alt som lyser opp på T1-bilder er kontrastopptak, for eksempel har også blod og fett høyt T1-signal. For å unngå feiltolkning inneholder derfor tumorprotokollen også en T1-serie før kontrastinjeksjon.
Diffusjonssekvenser
Bildekontrasten på diffusjonsbilder avhenger av vannmolekylenes mobilitet i vevet. Mobiliteten til vannmolekylene er høy i rommet mellom cellene, men lav inne i cellene. Hjernesvulster med høy celletetthet som lymfomer og medulloblastomer, har lav diffusjon. Høygradige gliomer (CNS WHO grad 3 og 4) har høyere celletetthet og dermed lavere diffusjon enn gliomer med lavere malignitetsgrad (Figur 5.1). Diffusjonsvektede bilder er også nyttige for å skille mellom nekrose og abscesser.
Avanserte MR-teknikker som brukes i hjernesvulstdiagnostikk
Av og til oppnår man ikke tilstrekkelig diagnostisk avklaring med en MR-basisprotokoll som beskrevet over. I primærutredningen vil det ofte være differensialdiagnostiske avveininger hvorvidt et bildefunn faktisk representerer neoplastisk vev, eller om funnet representerer andre patologiske prosesser som for eksempel infeksjon, inflammasjon eller sirkulasjonsforstyrrelser. Eksempler på vanskelige bildediagnostiske problemstillinger ved oppfølging av pasienter med hjernesvulst, er differensiering mellom sykdomsprogresjon og strålenekrose, samt vurdering av om det kan foreligge malign transformasjon ved diffuse CNS WHO grad 2 gliomer. I slike tilfeller kan det være nødvendig å benytte mer avanserte MR-metoder for å oppnå en sikrere diagnose (Majos et al., 2009; Svolos et al., 2014). Dette er metoder som er tilgjengelige på alle universitetssykehus og på mange av de andre større sykehusene.
Diffusjon tensor imaging (DTI)
DTI er en videreutvikling av diffusjonsteknikken hvor man ser på retningsbestemt vannbevegelse i hjernevevet. Siden vannmolekylene beveger seg lettere langs nervecellenes aksoner i hvit substans enn på tvers, kan retningen av aksonbanene kartlegges. Dette er en metode som i svulstdiagnostikken særlig blir brukt for å kartlegge forløpet av viktige baner som pyramidebanene eller synsbanene før kirurgiske inngrep.
MR-perfusjon
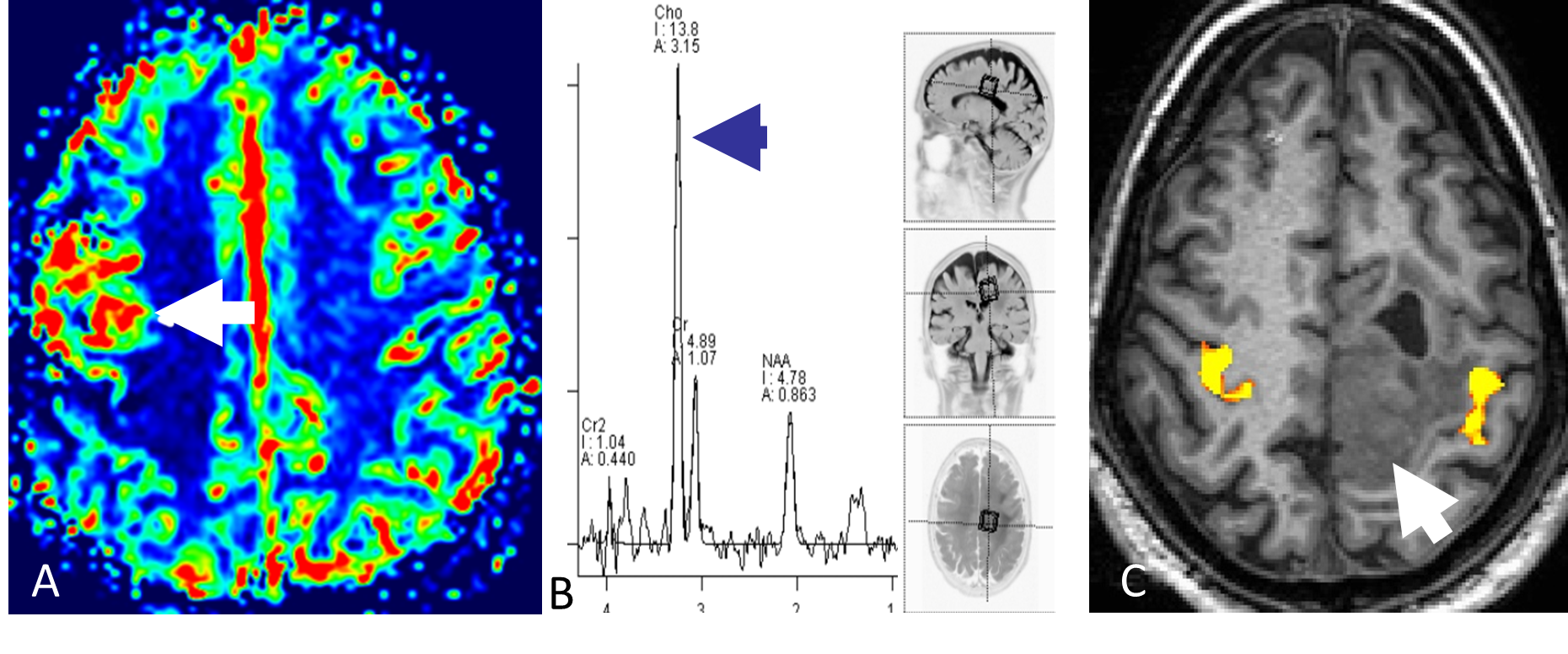
Ved å gi en rask intravenøs injeksjon med kontrastmiddel og deretter følge kontrastens passasje gjennom kapillærsirkulasjonen i hjernen, kan man ved MR-perfusjon få informasjon om variabler som blodvolum og blodperfusjon i hjernevev og tumor. Høygradig maligne svulster har typisk mange og store tumorkar og har derfor høyere blodvolum og perfusjon enn lavgradige svulster (Figur 5.2). MR-perfusjon kan videre differensiere svulster fra andre tilstander, for eksempel vil strålenekrose oftest ha lavt blodvolum og lav blodperfusjon (Mabray et al., 2015).
MR-spektroskopi (MRS)
MRS gir informasjon om biokjemiske forhold i hjerneparenchymet. Hydrogenkjerner har litt ulike MR-egenskaper avhengig av hvilket molekyl de er bundet til. Ved MRS brukes disse små forskjellene til å lage et spekter hvor toppene representerer ulike metabolitter og størrelsen på toppene indikerer konsentrasjonen i vevet. Ved en rekke tilstander endres vevets biokjemi; i maligne svulster øker for eksempel mengden av metabolitten cholin (Figur 5.2) (Mabray et al., 2015). Diagnostisk benyttes metoden særlig til å differensiere mellom ulike hjernesvulster og for å skille mellom tumor og annen type patologi.
BOLD fMRI
BOLD fMRI er en MR-metode som benyttes til kartlegging av hjerneaktivitet. I klinisk sammenheng benyttes BOLD fMRI særlig til å kartlegge viktige kortikale områder før kirurgisk behandling av hjernesvulster (Figur 5.2). Metoden har dessuten fått svært stor betydning i nevrovitenskapen for å øke forståelsen av hjernens funksjoner.
Ulemper og kontraindikasjoner ved MR
MR-undersøkelser tar tid, en hjerneundersøkelse varer typisk 20–40 minutter. For små barn er dette et problem og undersøkelse i narkose er ofte nødvendig. Dessverre kan ikke alle pasienter undersøkes med MR. Både drag fra magnetfeltet og varmeutvikling fra radiofrekvenspulsene kan skape farlige situasjoner hos pasienter med ulike typer implantater. De siste årene har svært mange implantater gjennomgått teknologiske endringer slik at de fleste pasienter med nyere modeller av pacemaker, ICD (defibrillator), nervestimulator, hjernestimulator, shuntventiler, med videre nå kan undersøkes med MR. Ofte må man ta spesielle forholdsregler før undersøkelsen, for eksempel må pacemaker og ICD stilles inn på MR-modus, dette krever samarbeid med kardiolog. Ved VP-shunt med justerbar ventil er kontroll av innstilling oftest nødvendig etter MR. Det er svært viktig at henviser i henvisning til MR opplyser tydelig hvis pasienten har denne type implantater slik at nødvendige forsiktighetsregler kan følges. Ferromagnetiske gjenstander som enkelte typer eldre cerebrale aneurysmeklips og metallfremmedlegemer vil fortsatt være kontraindikasjon for MR.
CT
CT er ved de fleste sykehus en lett tilgjengelig bildemetode. Dagens CT-maskiner er av multidetektor type (MDCT) som kan ta volumopptak ved at bordet som pasienten ligger på beveger seg gjennom maskinen mens røntgenrøret roterer kontinuerlig. For hver rotasjon av røntgenrøret tas mange snitt og bildeopptaket kan derfor gå svært raskt, et volumopptak av hodet vil typisk ta omtrent 10 sekunder. En ulempe med CT er at bløtdelskontrasten i hjerne og ryggmarg er dårligere enn på MR, og det medfører at det er vanskeligere å se svulster på CT. Særlig diffust infiltrerende hjernesvulster, svulster som ikke tar opp intravenøs kontrast og svulster i bakre skallegrop kan overses på CT. Undersøkelsen er derfor ikke egnet som primærundersøkelse ved klinisk mistanke om svulst. Unntaket er akutte tilfeller som nyoppståtte epileptiske anfall eller kliniske tegn på høyt intrakranielt trykk, hvor CT kan avklare om det er blødning eller andre forhold som krever akutt intervensjon. CT-undersøkelser gir strålebelastning som man må ta hensyn til, særlig hos unge pasienter og pasienter som har behov for gjentatte kontroller (se kapittel Forebygging). CT er derfor lite egnet til kontrollundersøkelser hos hjernesvulstpasienter og brukes i praksis bare når det foreligger kontraindikasjoner for MR. En CT caput-undersøkelse vil typisk gi en stråledose på 2.0 mSv. Til sammenlikning er gjennomsnittlig bakgrunnsstråling i Norge 3–4 mSv/år.
Nukleærmedisinsk bildediagnostikk
Nukleærmedisin er bruk av radioaktivt merkede sporstoff for diagnostikk eller behandling (Verger et al., 2022). Det mest brukte sporstoff – som er tilgjengelig på stort sett alle nukleærmedisinske enheter i Norge – er [18F]-merket fluordeoxyglukose ([18F]FDG). Dette sporstoffet utnytter at glukoseopptak er oppregulert i de fleste solide maligne svulster, for eksempel lungecancer, kolorektalcancer og lymfomer. Hjernesvulster med høyt [18F]FDG-opptak er hovedsakelig høygradige gliomer, hjernemetastaser og lymfomer. Lavgradige gliomer har ikke økt opptak av [18F]FDG.
Derimot har de aller fleste gliomer økt opptak av radioaktive aminosyrer. De mest brukte aminosyre-tracerne er [11C]metionin (kun ved Haukeland universitetssjukehus), [18F]fluoroethyltyrosin ([18F]FET) (ikke tilgjengelig i Norge), og [18F]dihydroxyphenylalanine ([18F]DOPA (kun ved Haukeland universitetssjukehus). I tillegg har [18F]fluciclovine vært brukt tidligere (Oslo universitetssykehus) (Albano et al., 2020; Karlberg et al., 2019). Fordelen med aminosyre-PET er at det ses opptak kun i malignt vev, men i kun liten grad i normalt hjernevev. Det er derfor en stor fordel om undersøkelsen tas på en hybrid PET/MR skanner der pasienten kan få utført både PET-opptak og MR av hjernen (også med intravenøs kontrast) i én seanse. Aminosyre-PET brukes mest for å skille tumorresidiv fra stråleinduserte forandringer og kan også brukes for å kartlegge behandlingsrespons (Law et al., 2019). Den kan også supplere primærdiagnostikk med MR dersom diagnosen er usikker eller man vil finne best egnede sted for hjernebiopsi (Dontala et al., Under publisering 2024).
Nesten alle meningeomer uttrykker somatostatin-reseptorer. For avbildning av meningeomer kan man derfor bruke sporstoffet [68Ga]DOTATOC eller analoger til dette (Dontala et al., Under publisering 2024).
Retningslinjer for tekniske aspekter ved bruk av PET-tracere er utgitt av internasjonale nukleærmedisinske foreninger i samarbeid med nevroonkologiske foreninger og oppført i de svulstspesifikke handlingsprogrammene.
Andre momenter ved bildediagnostikk
Bildeveiledet kirurgi og strålebehandling
Bildeveiledning (nevronaviasjon) kan øke presisjonen ved svulstkirurgi. Før inngrepet utføres typisk 3D-opptak med MR (T2, FLAIR og T1 etter kontrast) som overføres til nevronavigasjonenheten på nevrokirurgenes operasjonsstue. Bildeveiledning med 3D MR-bilder benyttes også ved planlegging av strålebehandling av hjernesvulster.
Postoperativ bildediagnostikk
Etter kirurgisk reseksjon av hjernesvulst bør det utføres en kontrollundersøkelse med MR for å kartlegge grad av svulstreseksjon, samt vurdere eventuell forekomst av komplikasjoner som infarkter og hematomer. Denne undersøkelsen gir også grunnlag for planlegging av postoperativ stråleterapi og senere for kontroll av respons på eventuell radiokjemoterapi (baseline-bilder). Undersøkelsen skal utføres innen 48 timer etter kirurgi fordi man etter dette får reaktive, postoperative forandringer i hjernevevet som gjør vurderingen av bildene vanskelig (Wen et al., 2010). Bildeprotokollen bør inneholde samme sekvenser som primærutredningen.
Bildediagnostiske kontrollintervaller for hjernesvulstpasienter
Intervallene mellom hver MR-kontroll vil variere avhengig av klinikk og svulsttype. Mange hjernesvulster vokser langsomt og for å kunne oppdage tumorvekst kan det være nødvendig å studere svulstområdet med flere påfølgende MR-undersøkelser. Det er derfor ønskelig at pasientene kontrolleres på samme institusjon og med samme bildeprotokoll hver gang. På denne måten sikrer man at alle bildeundersøkelser og sammenlignbare bildesekvenser er tilgjengelig for radiologen som gransker bildene. Det er også viktig at kliniker i henvisningen til MR opplyser om eventuell steroidbruk, samt siste tidspunkt for tumorrettet intervensjon og hva denne intervensjonen var. I forskningssammenheng vil behandlingsrespons og endringer i størrelsen av høygradige hjernesvulster bli vurdert etter MacDonald-kriteriene eller Response Assessment in Neuro-Oncology (RANO)-kriteriene (Quant et al., 2011; Wen et al., 2010). MacDonald-kriteriene multipliserer maksimal diameter av kontrastoppladende svulster i to perpendikulære retninger på samme transversalsnitt. Hvis det er flere lesjoner summeres verdiene av disse produktene. Komplett respons defineres som fravær av kontrastoppladende tumorvev, mens partiell respons er > 50 % reduksjon i svulstdiameterprodukt. MacDonald-kriteriene har flere begrensninger, blant annet er de gyldig bare for kontrastoppladende svulster. Ved behandling med radiokjemoterapi er det ikke uvanlig at kontrastopptak oppstår som en behandlingseffekt (såkalt pseudoprogresjon) uten at det er reell neoplastisk progresjon, mens noen typer kjemoterapi kan føre til at kontrastopptak forsvinner uten at det er endring i svulstens volum (såkalt pseudorespons) (Caroline et al., 2012; Huang et al., 2015; Tran et al., 2013). Ved bruk av MacDonald-kriteriene vil slike forhold gi misvisende resultater. Derfor har man tatt i bruk og i flere runder videreutviklet et noe mer presist vurderingssystem, RANO-kriteriene. Disse er ikke veldig ulike MacDonald-kriteriene; hovedforskjellen er at man tar med ikke-kontrastladende forandringer i vurderingen av neoplastisk status. Dette systemet bøter på noen av svakhetene ved MacDonald-kriteriene, men kan ikke til fulle eliminere de biologiske usikkerhetene man har rundt vurdering av pseudoprogresjon versus reell neoplastisk progresjon. For vurdering av klinisk status, som inngår i både MacDonald- og RANO-kriteriene, har man utviklet et verktøy kalt Neurologic assessment in neuro-oncology eller NANO-skalaen, samt at eventuell glukokortikoidbruk inngår som del av grunnlaget for konklusjon om sykdomsstatus (Nayak et al., 2017).
Laboratorieprøver
Sist faglig oppdatert: 17.08.2023
Laboratorieprøver har en relativt liten plass i utredningen av hjernesvulster. Standard pre- og postoperative blodprøver med tanke på det kirurgiske inngrepet er selvsagt viktig. Hormonell status er relevant ved mistanke om hypofyseadenom, men også for pasienter hvor man etter behandling kan få endret hormonbalanse (se avsnittet "Kontroll av endokrin funksjon"). Ved usikkerhet om det dreier seg om primær CNS-svulst eller metastaser vil tumormarkører i blod, eventuelt også i spinalvæske, kunne inngå som del av utredningen.
Utredningsforløp
Sist faglig oppdatert: 17.08.2023
Henvisningsrutiner
Pasienter med mistanke om høygradig primær hjernesvulst henvises til «Pakkeforløp for hjernekreft». Ved mistanke om, eller påvist annen hjernesvulst enn høygradig, vil det avhengig av klinikk oftest være naturlig med elektiv henvisning til nærmeste nevrokirurgiske, nevrologiske eller endokrinologiske avdeling. Ved mistanke om hjernemetastaser vil det avhengig av klinikk være naturlig med innleggelse i organrelevant sykehusavdeling, nevrologisk avdeling eller kreftavdeling. Vi viser til nasjonale veiledere for kreftpakkeforløp for utfyllende informasjon (se kapittel Pakkeforløp for kreft).
Det vises også til nasjonal veileder for pårørende.
Utredning
Klinisk mistanke om hjernesvulst bør føre til relevant bildediagnostikk, se punkt Bildediagnostiske undersøkelser av svulster i sentralnervesystemet. Hastegrad og nivå på utredning avhenger av symptomatologi og hva slags svulsttype man mistenker. Ved førstegangs epileptisk anfall, trykksymptomer eller rask utvikling av nevrologiske symptomer blir de fleste pasienter akutt innlagt i sykehus og bildediagnostikk foretatt der.
Vurdering i multidisiplinære team (MDT)
Mange pasienter med primære hjernesvulster har nytte av og bør vurderes av et multidisiplinært team (MDT). Teamet består ofte av nevrokirurg, nevroonkolog, nevroradiolog, nevrolog og nevropatolog. Også andre spesialiteter som oftalmolog, endokrinolog og nukleærmedisinsk spesialist kan være del av MDT. Avhengig av kompleksitet kan det være aktuelt å ta opp pasientene en eller flere ganger i sykdomsforløpet. Multidisiplinære team bør finnes ved alle universitetssykehus og man anbefaler ukentlige møter.
Følgende pasientgrupper bør tas opp i MDT:
- Utvalgte pasienter som planlegges operert (diskutere behandlingsstrategi og behov for kompletterende utredning)
- Utvalgte pasienter som nylig er biopsert eller operert for primær hjernesvulst (for gjennomgang av histologi og for å diskutere videre behandling og oppfølging), typisk der det kan være tvil om diagnose, der videre behandling kan være kontroversiell, der det foreligger begrenset evidens og behandlingsanbefalinger i retningslinjer er svake
- Pasienter med påvist eller mistenkt residiv hvor en ønsker tverrfaglig vurdering med tanke på aktuelle behandlingsalternativer
- Andre pasienter med komplekse problemstillinger hvor flere spesialiteter er involvert i vurdering, behandling og oppfølging
Stadieinndeling
Sist faglig oppdatert: 17.08.2023
Stadieinndeling i tradisjonell forstand er ikke relevant for de fleste grupper hjernesvulster. Dette skyldes at den klare majoritet av hjernesvulster ikke gir fjernspredning til andre organer (WHO Classification of Tumours Editorial Board, 2021). Det presiseres at stadieinndeling må skilles fra gradering av svulsten, det siste er meget sentralt også for hjernesvulster (WHO Classification of Tumours Editorial Board, 2021).
Anbefalinger:
- Alle pasienter hvor det er mistanke om høygradig hjernesvulst skal henvises til «Pakkeforløp for hjernekreft»
- Alle pasienter med progredierende sentralnervøse nevrologiske utfall eller nyoppstått vedvarende hodepine/endret karakter av kjent hodepine uten kjent årsak og hvor det foreligger røde flagg for sekundær hodepine, bør utredes med MR cerebrum med henblikk på tilgrunnliggende hjernesvulst
- Pasienter med nyoppståtte epileptiske anfall bør utredes med MR cerebrum og EEG med henblikk på tilgrunnliggende hjernesvulst
- Ved fokal patologi på EEG eller fokal anfallsstart bør MR-kontroll i løpet av få måneder vurderes hvis første undersøkelse er normal
- Anbefalt basis MR-protokoll/tumorprotokoll ved utredning av hjernesvulst:
Sekvens | Bildeplan |
T1 før kontrast | 3D |
TSE/FSE T2 | Transversal |
FLAIR | 3D |
Diffusjon | Transversal |
T1 etter intravenøs kontrast | 3D |
- Følgende pasientgrupper bør tas opp i MDT-møte:
- Utvalgte pasienter som planlegges operert (diskutere behandlingsstrategi/behov for kompletterende utredning)
- Utvalgte pasienter som nylig er biopsert eller operert for primær hjernesvulst (for gjennomgang av histologi og for å diskutere videre behandling og oppfølging)
- Pasienter med påvist eller mistenkt residiv hvor en ønsker tverrfaglig vurdering med tanke på aktuelle behandlingsalternativer
- Andre komplekse pasienter hvor flere spesialiteter er involvert i vurdering, behandling og oppfølging
Genetikk/ arvelig hjernekreft
Sist faglig oppdatert: 17.08.2023
Opphopning av svulster i sentralnervesystemet i en familie kan skyldes tilfeldigheter, kjente genetiske faktorer eller hittil ukjente genetiske faktorer. Flere tilfeller i en og samme familie er sett i 2,6 % av pasientene med svulster i sentralnervesystemet (Hemminki et al., 2010; Hemminki et al., 2009) og bare hos en liten andel av disse vil man finne arvelig genfeil i kjente tumor suppressor-gener.
Det er funnet potensielt arvelige kimcellemutasjoner hos 8,2 % av barn med svulster i sentralnervesystemet. Under halvparten hadde familiehistorie som tydet på arvelig risiko (Zhang et al., 2015).
Alle kimbanemutasjoner som gir forhøyet risiko for svulster i sentralnervesystemet gir samtidig en betydelig høyere risiko for andre kreftformer. Derfor kan arvelig årsak til svulster i sentralnervesystemet like gjerne mistenkes ved opphopning av flere ulike kreftformer i familien eller hos pasienten, som ved flere tilfeller av svulster i sentralnervesystemet. Ved arvelig kreft er det mest vanlig med autosomal dominant arvegang, men alle med kimbanemutasjon i familien trenger ikke å bli syke. Flere av de arvelige tilstandene kan skyldes medfødt nyoppstått («de novo») kimbanemutasjon hos den affiserte, slik at fravær av kreft i slekta ikke nødvendigvis taler mot en slik tilstand.
Henvisning av pasient med svulst i sentralnervesystemet til regional medisinsk genetisk avdeling bør vurderes dersom
- pasienten har minst en førstegradsslektning med svulst i sentralnervesystemet
- det er opphopning av krefttilfeller blant yngre voksne og barn i familien som kan knyttes til Li-Fraumeni syndrom eller Lynch syndrom, som for eksempel tidlig tarmkreft, tidlig brystkreft, sarkomer eller andre kreftformer
- pasienten har hatt annen type kreft før 60 års alder
- pasienten også har medfødte misdannelser, dysmorfe trekk og/eller utviklingsforstyrrelser
- et barn har svulst i sentralnervesystemet
- det gjennom utredning av sykdom er påvist en medfødt/kimbane sykdomsgivende variant, som gir økt risiko for ny sykdom/kreft hos pasient eller slektninger (av annen lege enn genetiker), bør henvises til medisinsk genetisk avdeling, både med tanke på informasjon både til pasient og til slektninger, og for mulighet for prediktiv test av slektninger
Arvelige syndromer med økt risiko for svulster i sentralnervesystemet
- Nevrofibromatose type 1 (NF1)
- Astrocytom, gliom, malign perifer nerveskjedetumor, nevrofibrom, optikusgliom, schwannom
- Nevrofibromatose type 2 (NF2)
- Astrocytom, ependymom, gliom, meningeom, nevrofibrom, schwannom
- Von Hippel-Lindau syndrom (VHL)
- Hemangioblastom, paragangliom
- Li-Fraumeni syndrom (TP53)
- Astrocytom, choroid plexus carcinom, glioblastom, gliom, medulloblastom
- Familiær adenomatøs polypose (APC)
- Medulloblastom
- Lynch syndrom/arvelig tykktarm- og livmorkreft (MLH1, MSH2, MSH6, PMS2, EPCAM)
- Glioblastom, gliom
- Konstitusjonelt mismatch repair-deficiency syndrom (CMMR-D) (MLH1, MSH2, MSH6, PMS2, EPCAM)
- Gangliogliom, glioblastom, gliom, medulloblastom, nevroblastom, primitiv nevroektodermal tumor
- Gorlin syndrom (PTCH1, SUFU, PTCH2)
- Medulloblastom, meningeom
- Tuberøs sklerose (TSC1, TSC2)
- Astrocytom, gliom
- Cowden syndrom (PTEN)
- Lhermitte-Duclos, meningeom
- Rhabdoid tumor predisposisjonssyndrom (SMARCB1)
- Atypisk teratoid/rhabdoid tumor
- Andre
Gentesting ved utredning av arvelig risiko for svulst i sentralnervesystemet
Genfeil i mange ulike gener er knyttet til økt risiko for svulst i sentralnervesystemet. Ved genetisk utredning vil det derfor være hensiktsmessig å tilby pasienten (eventuelt familiemedlemmer) gentest av et større genpanel som inkluderer de genene som er knyttet til arvelig økt risiko for svulster i sentralnervesystemet. Det er vanskelig å lage presise kriterier som dekker alle situasjoner der genetisk utredning kan være aktuelt. Dersom behandler eller pasient har ønske om genetisk utredning, kan pasient med svulst i sentralnervesystemet henvises til medisinsk genetisk avdeling, som så kan vurdere om det er grunnlag for gentesting.
Bioteknologiloven gir sterke føringer for genetisk testing av friske familiemedlemmer, og spesielt barn under 16 år. Dette kan bare skje i forbindelse med genetisk veiledning, og resultatet av testene skal kunne ha kliniske og terapeutiske konsekvenser.
Oppfølging/kontrollopplegg
Dersom det påvises genfeil vil kontrollopplegg tilpasses det aktuelle arvelig kreft syndrom. Om oppfølging tilbys vedrørende risiko for svulst i sentralnervesystemet, vil avhenge av hvilken genfeil som er påvist.
Aktuelle lenker
Nevrofibromatose type 1:
http://www.ncbi.nlm.nih.gov/books/NBK1109/
Nevrofibromatose type 2:
http://www.ncbi.nlm.nih.gov/books/NBK1201/
Li-Fraumeni syndrom:
http://www.ncbi.nlm.nih.gov/books/NBK1311/
Von Hippel-Lindau syndrom:
http://www.ncbi.nlm.nih.gov/books/NBK1463/
Familiær adenomatøs polypose:
https://www.ncbi.nlm.nih.gov/books/NBK1345/
Lynch syndrom og CMMR-D:
https://www.ncbi.nlm.nih.gov/books/NBK1211/
Gorlin syndrom:
https://www.ncbi.nlm.nih.gov/books/NBK1151/
Tuberøs sklerose:
http://www.ncbi.nlm.nih.gov/books/NBK1220/
Cowden syndrom:
https://www.ncbi.nlm.nih.gov/books/NBK1220/
Rhabdoid tumor predisposisjon:
https://www.ncbi.nlm.nih.gov/books/NBK469816/
European Reference Network (ERN) Genturis (Genetic tumour risk syndromes):
https://www.genturis.eu/l=eng/Guidelines-and-pathways/Clinical-practice-guidelines.html
Norsk portal for genetiske analyser:
http://www.genetikkportalen.no/default.asp
Her finnes oppdaterte opplysninger om tilbud om genetiske analyser i Norge, samt rekvisisjonsskjema.
Orphanet:
https://www.orpha.net/consor/cgi-bin/Disease.php?lng=EN
Her finnes i økende grad kortfattede beskrivelser av ulike tilstander, samt analysetilbud andre steder i verden. Portalen er også søkbar på gennavn og den er sponset av EU.
GeneTests/GeneReviews:
https://www.ncbi.nlm.nih.gov/books/NBK1116/
Her finnes også omfattende kliniske/genetiske oversikter. Siden er sponset av NIH, USA, og er derfor preget av amerikanske forhold som kan være noe ulike europeiske.
Behandling av lokalisert sykdom og kurativ behandling
Kirurgi
Sist faglig oppdatert: 17.08.2023
Kirurgi er primærbehandling ved de fleste intrakranielle svulster. Den kirurgiske behandlingen vil i stor grad ta sikte på å fjerne hele svulsten. Der hvor dette ikke er mulig, forsøker man å fjerne så mye av svulsten som er forenlig med et godt funksjonelt resultat.
Målet med kirurgi er å:
- skaffe vev til histologisk diagnose (biopsi)
- forsøke å fjerne tilstrekkelig, men samtidig ikke for mye av tumor (reseksjon), slik at pasienten bevarer hjernefunksjon med reduksjon av symptomer og masseeffekt, og at levetidsutsiktene bedres
- fjerne svulsten i sin helhet der det er mulig (ekstirpasjon)
Ulike operasjonsmetoder:
- Fjerning av hjernesvulst gjennom hodeskallen (kraniotomi, se under)
- Fjerning av hypofysesvulst gjennom nesen (transsphenoidalt, se «Handlingsprogram for hypofyseadenomer»)
Kirurgisk fjerning av hjernesvulst med kraniotomi
Fjerning av svulst med kraniotomi gjøres ved svulster i hjerne og hjernehinner. Ved kraniotomi åpnes skallen ved at det sages ut en bit av skallebenet. Det videre kirurgiske inngrepet avhenger av svulsttype og beliggenhet. Siktemålet er å fjerne så mye av svulstvevet som mulig.
Pasientens hode fikseres i trepunkts klave for å unngå bevegelser under inngrepet. Det gis antibiotika forebyggende for å forhindre infeksjon, og eventuelt trykksenkende behandling (glukokortikoider) som reduserer hjerneødem preoperativt. Pasienten ligger enten i rygg-, mage- eller sideleie (park bench-leie). Det lages et buet eller rett hudsnitt, og vevet skyves vekk slik at hodeskallen avdekkes. Det sages ut en benlapp, en bit av hodeskallen. Den ytterste hjernehinnen, senehinnen/dura mater, åpnes. Svulsten identifiseres og det tas vevsprøver for å typebestemme svulsten (histologisk undersøkelse og eventuelt frysesnitt). Alt synlig svulstvev fjernes under mikroskopet. Blødninger stanses før operasjonsfeltet skylles rent. Avslutningsvis festes benlappen med metallklemmer, og vevslagene lukkes lagvis.
.png)
Bruk av ulike hjelpemidler før og under operasjon gjør det mulig å gjennomføre så fullstendig fjerning som mulig, med godt funksjonelt resultat.
Nevronavigasjon
Nevronavigasjon kan brukes til å planlegge den operative tilgangen mest mulig hensiktsmessig og til å lokalisere svulster og andre sykelige og normale strukturer som ligger slik til at de ikke er synlig på hjernens overflate. Hensikten er ikke bare å finne disse svulstene lettere, men også å definere svulstens grenser bedre, slik at man oftere oppnår total fjerning av svulsten. Bilder til navigasjonssystemene kan tas før operasjon (MR, CT) og under operasjon (MR, ultralyd).
Ultralyd
Svært ofte brukes ultralyd under operasjonen. Denne metoden gir et godt overblikk over lokalisering av svulsten og andre strukturer, i tillegg at man fortløpende får informasjon over hvor mye av svulsten som er fjernet. Metoden kombineres gjerne med nevronavigasjon.
MR-metodikk
Nye avanserte MR-metoder (se punkt Bildediagnostiske undersøkelser av svulster i sentralnervesystemet) kan brukes til å kartlegge viktige funksjonelle områder og anatomiske strukturer i henholdsvis grå og hvit substans i hjernen, samt deres beliggenhet i forhold til hjernesvulster. Disse metodene er tatt i rutinemessig bruk ved reseksjon av hjernesvulster, hvor informasjonen fra disse undersøkelsene blir benyttet preoperativt til planlegging av operasjonen og intraoperativt til navigasjon under inngrepet.
Våken kraniotomi
Våken kraniotomi er operasjoner der pasienten er våken gjennom deler av inngrepet. Dette er aktuelt når svulsten ligger i eller nær funksjonelle områder (for eksempel motorikk eller språk) for å bevare den aktuelle funksjonen mest mulig.
Nevrofysiologisk monitorering og kortikal stimulering
Bruk av nevrofysiologisk monitorering og kortikal stimulering for å monitorere viktige kroppslige funksjoner under operasjon kan være gunstig for å unngå skader.
Etter operasjonen
Ved flere svulsttyper, som for eksempel meningeom og lavgradig meningeom, er pasientens prognose avhengig av så total svulstfjerning som mulig (Rogers et al., 2015). MR-kontroll tas innen 48 timer postoperativt for å vurdere om hele svulsten er fjernet (Wen et al., 2010). Bandasje fjernes vanligvis etter noen få dager. Metallklemmer og sting fjernes etter cirka 10 dager. Pasienten mobiliseres raskt etter kirurgi og utskrives normalt til lokalsykehus 2–3 dager etter operasjon.
Strålebehandling
Sist faglig oppdatert: 17.08.2023
Strålebehandling er en aktuell behandlingsmodalitet for mange pasienter med CNS-svulst. Det finnes ulike strålebehandlingsteknikker som beskrives kort nedenfor. Målet med all strålebehandling er å gi høyest mulig/adekvat stråledose til svulsten samtidig som normalvevet spares for stråledose så godt det lar seg gjøre. Samtidig vet man for enkelte svulsttyper at det å øke stråledosene utover et visst nivå ikke gir bedret overlevelse (Shaw et al., 2002; Singh et al., 2021). Fordi strålebehandling kan påvirke sårtilheling, bør den starte tidligst 1-2 uker etter operasjon. Etter reseksjon av høygradige diffuse gliomer (CNS WHO grad 3-4) vil man man som regel starte strålebehandling 3-4 uker etter operasjon, forutsatt at operasjonssåret er tilhelet. Det kan være aktuelt med noe lenger intervall ved CNS WHO grad 3 svulster, særlig for de med god prognose eller om man forventer sammenfall av sårhule/anatomiske endringer en tid etter operasjonen. Etter biopsi kan og bør man komme noe tidligere i gang, men det anbefales ikke oppstart tidligere enn 1-2 uker etter inngrepet. Forutsatt tilfredsstillende allmenntilstand kan strålebehandling som regel gis poliklinisk.
Det vises ellers til stråleappendix i de diagnosespesifikke handlingsprogrammene:
- Stråleappendix: Diffuse gliomer
- Stråleappendix: Hypofyseadenomer
- Stråleappendix: Meningeomer
Fraksjonert konvensjonell strålebehandling
Fraksjonert konvensjonell strålebehandling er den mest brukte type strålebehandling. Behandlingen deles opp i mange mindre enkeltdoser (en fraksjon hver dag mandag til fredag), og strekker seg som regel over 2 til 7 uker. Ekstern strålebehandling planlegges CT-basert, som 3D-konformal behandling (planlegge ut fra 3-dimensjonale CT-bilder), som IMRT (Intensity Modulated Radiation Therapy), VMAT (Volumetric Modulated Arc Therapy) eller som stereotaktisk behandling. Strålebehandling gis i henhold til ICRU-rapport 50, 62 og 83, utgitt av International Commision on Radiation Units and Measurements (Landberg et al., 1999; Landberg et al., 1993; Report 83: Prescribing, Recording, and Reporting Intensity-Modulated Photon-Beam Therapy (IMRT), 2010).
Stereotaktisk strålebehandling
Stereotaktisk strålebehandling er en form for strålebehandling hvor den totale stråledosen gis enten som én behandling eller som noen få behandlinger, og med høyere fraksjonsdose enn fraksjonert konvensjonell strålebehandling. Forutsetningen for stereotaktisk behandling er at svulsten er meget velavgrenset, slik at stråledosen i hovedsak kan begrenses til selve svulsten, og at svulsten ikke er for stor. Mens man ved Haukeland sykehus i Bergen gir behandlingen med gammakniv/strålekniv, gis det ved flere kreftavdelinger lineærakseleratorbasert stereotaktisk strålebehandling.
Interstitiell strålebehandling (brachyterapi)
Denne behandlingen baserer seg på implantasjon av radioaktive kilder, og muliggjør levering av høye doser til svulst. Brachyterapi er i praksis ikke i bruk ved primær hjernesvulst.
Partikkelterapi
Hos mange barn, og i noen tilfeller hos yngre voksne, med intrakranielle svulster kan partikkelterapi i form av protonterapi (eller sjeldnere karbonionterapi) være indisert (Dale et al., 2018; Indelicato et al., 2016). Partikkelterapi er en form for strålebehandling hvor man oftest kan spare normalvev for stråledose i større grad enn man kan med fotonstråling. Dette gjør behandlingsformen spesielt aktuelt hos barn med mange tiår forventet overlevelse. Partikkelterapi er per i dag ikke tilgjengelig i Norge, men to senter er under oppbygging (i Oslo og i Bergen) og skal etter planen stå ferdig i 2025 . Pasienter hvor protonterapi er indisert, må foreløpig henvises til utlandet via protonbroen som er opprettet. Slik henvisning skjer via onkolog ved stråleenheten ved nærmeste universitetssykehus. Det er utarbeidet felles nasjonale retningslinjer for hvilke pasienter som er aktuelle for protonterapi, og det er et mål at 75% av pasientene som skal motta protonterapi i Norge skal inkluderes i kliniske studier.
Bivirkninger under og etter strålebehandling
Bivirkninger av strålebehandling er avhengig av bestrålt område (lokalisasjon og volum), fraksjonsdose og totaldose, samt andre faktorer som alder, komorbiditet, konkomitant behandling, med videre. Generelt skilles det mellom akutte strålereaksjoner og seneffekter etter strålebehandling.
Akutte strålebivirkninger ses under eller innen få uker etter strålebehandlingen. Vanlige akutte strålereaksjoner er håravfall (ikke alltid forbigående, doseavhengig), hudrødme og svie i stråleområdet og sekretorisk otitt. Det er heller ikke uvanlig med strålereaktivt ødem som kan gi trykksymptomer som hodepine og kvalme (behandles med antiemetika ved behov), sjeldnere oppkast og forverring av nevrologiske utfall. Dette behandles med steroider og er som regel forbigående. Trøtthet og økt søvnbehov er vanlig og sees oftest et stykke ut i behandlingsperioden. Benmargspåvirkning er mer sjelden og sees nesten utelukkende når strålebehandlingen gis sammen med kjemoterapi og/eller i de få tilfeller hvor hele sentralnervesystemet behandles og mye benmarg inngår i strålefeltet. Akutte bivirkninger er oftest forbigående.
Seneffekter inntreffer måneder til flere år etter strålebehandlingen og kan sees hos langtidsoverlevere. Graden av seneffekter varierer fra mild til alvorlig og kan arte seg på ulike måter, som for eksempel kognitiv svikt, sosiale vansker, økt trettbarhet, manglende tiltaksevne, hypofysesvikt, vedvarende alopeci, katarakt, skade på sentrale synsbaner, nevrogent hørselstap og sekundære svulster. Strålenekrose, leukoencefalopati og vaskulære forandringer er blant de patogenetiske mekanismene.
Strålenekrose er en alvorlig komplikasjon som kan inntreffe etter strålebehandling. Slik nekrose oppstår typisk ett til tre år etter gjennomført strålebehandling, men kan også komme tidligere enn ett år og mer enn 10 år etter behandling. Risikoen er høyere blant annet ved høyere fraksjonsdose og høy total stråledose. Diagnosen kan være utfordrende og krever ofte samarbeid mellom nevroradiolog og stråleonkolog.
Stråleterapi kan føre til kognitiv svikt i varierende grad, fra mild svikt til alvorlig demens, og dette kan påvirke livskvaliteten betydelig (Aaronson et al., 2011). Forekomst av stålerelatert kognitiv svikt er vanskelig å tallfeste blant annet fordi redusert kognitiv funksjon er et svært vanlig symptom ved primær hjernesvulst, og kan ha ulike og sammensatte årsaker. Blant mulige årsaker er svulsten i seg selv, eventuell tumorvekst, annen tumorrettet behandling (kirurgi, kjemoterapi, medikamentell behandling), epilepsi, og pasientrelaterte faktorer som alder, depresjon, angst, søvnvansker og psykologisk stress. En oversiktsartikkel har slått fast at fokal strålebehandling ikke er hovedårsaken til kognitiv svikt hos pasienter med gliom (Taphoorn et al., 2004). Det bemerkes her at strålebehandling også kan forbedre nevrokognitiv funksjon og livskvalitet på bakgrunn av antineoplastisk effekt. Stråleterapiindusert kognitiv svikt er komplekst og per i dag finnes ingen forebyggende behandling. Seneffekter, herunder kognitiv svikt og fatigue, er nærmere omtalt i Helsedirektoratets rapport om seneffekter etter kreftbehandling som ble revidert i 2020, Seneffekter etter kreftbehandling.
Medikamentell behandling
Sist faglig oppdatert: 17.08.2023
Avhengig av svulsttype (histologi, malignitetsgrad, molekylære funn), alder og funksjonsnivå kan kjemoterapi være indisert som eneste behandling (i primærsituasjon eller ved residiv) eller som tilleggsbehandling til kirurgi og/eller strålebehandling. I forbindelse med strålebehandling kan kjemoterapi gis enten før (neoadjuvant), under (konkomitant) og/eller etter avsluttet strålebehandling (adjuvant/monoterapifase). Ved noen sjeldne molekylære subtyper av hjernesvulst kan målrettet behandling (targeted therapy) eller immunterapi være aktuelt, oftest innenfor kliniske studier. Vedrørende de forskjellige behandlingsopplegg henvises til kjemoterapiavsnitt og –appendix (Diffuse gliomer, Hypofyseadenomer og Meningeomer) for de svulstspesifikke handlingsprogrammene. Ved noen typer hypofysesvulster er antihormonell behandling en behandlingsopsjon.
Supplerende behandling
Sist faglig oppdatert: 17.08.2023
Symptomrettet behandling ved hjernesvulst skiller seg noe fra andre krefttyper og evidensen er variabel (Boele et al., 2014; Schiff et al., 2015). En nyttig inndeling er
- Antiødembehandling
- Annen medikamentell behandling av symptomer forårsaket av grunnsykdommen og/eller av behandlingen
- Ikke-medikamentelle symptomrettede tiltak
Ernæring
Det vises til punkt Supplerende behandling - rehabilitering, ernæring, fysisk aktivitet, psykososiale tiltak og andre palliative tiltak.
Fysisk aktivitet
Det vises til punkt Supplerende behandling - rehabilitering, ernæring, fysisk aktivitet, psykososiale tiltak og andre palliative tiltak.
Psykososiale tiltak
Det vises til punkt Supplerende behandling - rehabilitering, ernæring, fysisk aktivitet, psykososiale tiltak og andre palliative tiltak.
Antiødembehandling
Glukokortikoider er en meget sentral del av antiødembehandlingen for pasienter med hjernesvulst (Roth et al., 2010). De reduserer det vasogene peritumorale ødemet rundt hjernesvulster. Ødem er en klinisk problemstilling spesielt ved rasktvoksende svulster som høygradige gliomer og metastaser. Ødemkomponenten er vanligvis mer beskjeden ved svulster med langsom vekst, inntil de eventuelt når en størrelse som gir trykk på normale strukturer og dermed en trykkøkende effekt.
Den symptomatiske effekten av glukokortikoidbehandling inntrer innen 24–48 timer og kan være markant, dersom mye av pasientens symptomer skyldes ødemkomponent og ikke infiltrerende svulstvekst. I fall det siste er effekten av glukokortikoider vanligvis mer beskjeden. Mekanismen for den ødemdempende effekten er kun delvis kjent, men sannsynligvis normaliseres kapillær permeabilitet i og rundt svulst.
Det er ingen sikker evidens for å foretrekke et glukokortikoid fremfor et annet, men i Norge brukes hovedsakelig deksametason og metylprednisolon.
Laveste effektive dose skal brukes. For deksametason er døgndosering vanligvis 4–16 mg, med doser ut fra pasientens kliniske symptomer med nevrologiske utfall og tegn til økt intrakranielt trykk. Man bør ikke behandle ut fra bildediagnostikk alene, med mindre det er bildemessig fare for herniering eller trange forhold rundt akvedukten. Glukokortikoidbehandling er særlig aktuelt i preoperativ fase og ellers dersom pasienten har trykksymptomer i mer langtkommet fase. Glukokortikoidbehandling har en rekke bivirkninger som kan oppstå etter både kortere og lengre tids bruk, men bruk i under tre uker gir oftest relativt beskjedne og reversible bivirkninger. Glukokortikoiddose og nedtrappingsplan må vurderes fortløpende under behandlingen. Man bør bruke protonpumpehemmer som ulcusprofylakse ved steroidbruk. Ved langvarig glukokortikoidbruk (>4 uker) bør tilskudd av kalk og vitamin D gis, og i sjeldnere tilfeller kan det være aktuelt med PJP-profylakse, se avsnitt "Osteoporoseprofylakse" og "Pneumocystis jirovecii-profylakse". Gode retningslinjer for bruk av steroider finnes i Norsk elektronisk legehåndbok og i NEL Nevrologi.
Annen medikamentell symptomrettet behandling
Epilepsi
Epilepsi er et vanlig symptom ved hjernesvulst og det er mange aktuelle publikasjoner som omhandler temaet (Englot et al., 2016; Fisher et al., 2014; Khan et al., 2006; Perucca, 2013; van Breemen et al., 2007). I henhold til internasjonale anbefalinger bør anfallsforebyggende behandling startes hos alle pasienter med hjernesvulst hvor det har vært et sannsynlig eller sikkert epileptisk anfall. Anfallsforebyggende behandling skal ikke startes dersom ikke pasienten har hatt epileptiske anfall, med mindre det foreligger særlig grunn til det (Tremont-Lukats et al., 2008). Man anbefaler heller ikke slik behandling som pre- eller postoperativ profylakse hos pasienter som ikke har hatt anfall (Koubeissi, 2014).
Valg av anfallsforebyggende medikament bør gjøres ut fra en samlet vurdering av pasientens alder og komorbiditet, bivirkningsprofil, interaksjonsfare, eventuelt behov for raske terapeutiske serumnivåer og egnet administrasjonsform (Kerrigan et al., 2011). Første- og andregenerasjons epilepsibehandling med enzyminhiberende (eksempelvis karbamazepin og fenytoin) eller enzyminduserende (fenytoin) egenskaper kan påvirke metabolismen av deksametason og noen typer kjemoterapeutiske midler, men det foreligger ikke sikre data om interaksjonsproblematikk med temozolomid. Nyere tredjegenerasjons medikamenter gir generelt mindre sedasjon, sannsynligvis færre hematologiske bivirkninger og mindre interaksjonsproblematikk, men kan medføre psykiske bivirkninger. Det foreligger ikke evidens som tilsier at ett medikament skal foretrekkes fremfor et annet, men internasjonal konsensus er å velge nyere midler som lamotrigin, levetiracetam og andre, fremfor eldre medikamenter (Kerrigan et al., 2011). Valproat er også anbefalt, men her må man være spesielt oppmerksom på risikoen for hematologiske effekter ved samtidig bruk av kjemoterapi.
Pasienter som behandles med anfallsforebyggende medikamenter skal følges med regelmessige målinger av medikamentfastende serumspeil og generelle blodprøver (se Felleskatalogen under hvert enkelt medikament).
Seponering av anfallsforebyggende medikament kan være en aktuell problemstilling hos pasienter med meningeom eller diffust CNS WHO grad 2 gliom med anfallsfrihet over lengre tid (Soffietti et al., 2010). Det foreligger ingen generelle retningslinjer for dette ved hjernesvulst. Stillingtagen til seponering er avhengig av individuell risiko for residivanfall, funn ved andre undersøkelser, spesielt MR og EEG, sosiale konsekvenser av residivanfall og pasientens eget ønske. Ved svulster hvor progresjon er forventet i løpet av relativt kort tid vil seponering oftest ikke være aktuelt. I henhold til førerkortforskriftene har nedtrapping eller seponering av anfallsforebyggende medikament konsekvenser i form av karenstid for bilkjøring.
Osteoporoseprofylakse
Glukokortikoidbehandling over tid er assosiert med risiko for osteoporose og brudd, primært kompresjonsbrudd i rygg, og spesielt hos fallutsatte pasienter. Pasienter med andre risikofaktorer for osteoporose er spesielt utsatt, og bruk av anfallsforebyggende medisiner ved epilepsi kan også disponere for osteoporose. Alle pasienter hvor man antar behov for lengre tids bruk av glukokortikoider og forventet overlevelse som gjør problemstillingen relevant, bør ha tilskudd av kalsium og vitamin D i henhold til nasjonale retningslinjer for glukokortikoid-indusert osteoporose (Finnes et al., 2022). Videre anbefales det ved planlagt langvarig glukokortikoidbruk (>3 måneder) utredning med bentetthetsmåling (DXA). Ved indikasjon for forebyggende behandling med benresopsjonshemmer anbefales å komme i gang så snart som mulig. Alendronat peroralt, zoledronsyre intravenøst og denosumab (ved nyresvikt) er aktuelle preparater. Det vises til retningslinjer for forebygging av steroidindusert osteoporose ved ikke-maligne tilstander. For pasienter med hjernesvulst bør tilnærmingen individualiseres, og leveutsikter og totalsituasjon må tas i betraktning. Ved etablert osteoporose og eventuelt brudd vil det være aktuelt å behandle pasienten i samråd med relevant spesialist (endokrinolog, ortoped), og det vises til nasjonale retningslinjer for behandling av osteoporose (Borgen et al., 2022).
Behandling med zoledronsyre intravenøst og denosumab er assosiert med risiko for osteonekrose i kjeve. Pasienten bør før oppstart spørres om tannstatus og eventuelt vurderes hos egen tannlege, og invasiv tannbehandling bør om mulig unngås.
Pneumocystis jirovecii-profylakse
Pneumocystis jiroveci-pneumoni (PJP) er en opportunistisk infeksjon med potensielt alvorlig forløp som kan ses også hos pasienter med hjernesvulst, spesielt ved langvarig behandling med glukokortikoider og ved uttalt lymfopeni (Climans et al., 2022b).
Tidligere anbefalte man rutinemessig PJP-profylakse under primær radiokjemoterapi for glioblastom. En kanadisk studie viste imidlertid lav forekomst av PJP i denne situasjonen (<1% i løpet av ett år), og konkluderte med at rutinemessig profylakse med trimetoprim-sulfa ikke anbefales, da gevinsten ikke veier opp for ulempene (spesielt risiko for nøytropeni og behov for dosereduksjon eller seponering av temozolomid) (Climans et al., 2022a). Studien viste at forekomst av PJP var høyere ved lymfocyttall < 0.25 x109/L. Hos pasienter med behov for hødose glukokortikoider over tid (fire uker eller mer) eller ved påvist lymfopeni (<0.25-0.5 × 109/L), kan PJP-profylakse overveies under og de første 4 ukene etter konkomitant radiokjemoterapi.
Forekomst av PJP og eventuelt nytte av profylakse senere i sykdomsforløpet eller ved andre typer hjernesvulst er ikke kjent, men klinisk erfaring tilsier at PJP forekommer sjelden. I andre pasientgrupper (for eksempel pasienter med ikke-maligne sykdommer eller andre maligniteter enn hjernesvulst) har man tradisjonelt gitt PJP-profylakse ved glukokortikoidbehandling over tid (for eksempel >20 mg prednisolon daglig i mer enn 4 uker), men også her er det begrensede data (Roth et al., 2021; Stern et al., 2014; Taplitz et al., 2018). Indikasjon for PJP-profylakse ved hjernesvulst kan vurderes ved (forventet) bruk av høydose glukokortikoider over tid (>4 uker) eller lymfopeni (<0.25-0.5 × 109/L) hos pasienter med leveutsikter som tilsier at profylakse er relevant, men bivirkningsprofil, totalsituasjon og kost-nyttevurderinger må hensyntas. Ofte vil pasienter med hjernesvulst og som har behov for høydose glukokortikoider over tid ha alvorlig prognose og begrenset forventet levetid, og i praksis vil derfor PJP-profylakse sjelden være indisert.
Ved indikasjon for PJP-profylakse er førstevalget trimetoprim-sulfa (1 tablett daglig eller 2 tabletter 2 ganger daglig lørdag og søndag), og det vises til nasjonal veileder for antibiotika i sykehus (Helsedirektoratet, 2022).
Venøs tromboembolisme
Pasienter med hjernesvulst har forhøyet risiko for venøs tromboembolisme (VTE) (Cote et al., 2016; Perry, 2010; Silvani et al., 2011). Spesielt hos pasienter med diffust høygradig gliom er risikoen betydelig økt, med kumulativ 12-måneders risiko for VTE på omkring 30 %. Ved gliom av lavere grad er IDH mutasjon assosiert med lavere risiko enn ved IDH villtype tumor, men risikoen for VTE er fortsatt høyere enn i den generelle befolkningen. Også pasienter med andre typer hjernesvulster kan være utsatt for VTE, særlig peri- og postoperativt og/eller ved immobilisering (Diaz et al., 2022). Postoperativt bør man følge vanlige rutiner for tromboseprofylakse etter nevrokirurgiske inngrep.
Nytten av tromboseprofylakse med lavmolekylært heparin senere i forløpet er ikke avklart i studier, men bør vurderes individuelt ut fra risikoprofil for VTE, annen relevant sykdom og komorbiditet, grad og varighet av immobilisering, samt pasientens livskvalitet og leveutsikter. Det foreligger ikke anbefalinger om rutinemessig bruk av tromboseprofylakse til alle pasienter. Ikke-medikamentelle tiltak må alltid vurderes hos risikopasienter, se punkt "Ikke-medikamentelle symptomrettede tiltak".
Ved diffust høygradig gliom og manifest VTE anbefales lavmolekylært heparin fremfor warfarin, da risikoen for interaksjoner med andre medikamenter er mindre, og en rekke studier har vist at den terapeutiske effekten hos kreftpasienter er bedre ved bruk av lavmolekylært heparin enn warfarin. Det foreligger ikke data som sammenligner direktevirkende perorale antikoagulantia (DOAK) og lavmolekylært heparin ved VTE og gliom (Taillibert et al., 2015). Data fra den generelle kreftpopulasjonen tilsier at effekten antagelig er sammenlignbar og blødningsrisikoen antagelig ikke svært forskjellig ved DOAK-bruk, men lavmolekylært heparin anbefales fortsatt (Lee et al., 2020). Ved compliance-problematikk kan DOAK vurderes. DOAK metaboliseres via CYP3A4-systemet. Deksametason er en enzyminduktor. Risikoen for interaksjoner kan derfor være et argument mot DOAK, men den kliniske betydningen av dette er ikke studert.
Perifer nevrotoksisitet (perifer nevropati)
Vinkaalkaloider (deriblant vinkristin som inngår i PCV-kur) kan forårsake perifer nevrotoksisitet med affeksjon av nerverøtter og perifere nerver. Dette kan arte seg både som sensorisk nevropati (prikking/stikking, brenning, redusert sensibilitet, og så videre.) og motorisk nevropati (tremor, tap av dype senereflekser og i verste fall lammelser), og symptomene er ofte symmetriske med utbredelse i hender og/eller føtter. Noen pasienter opplever nevropatiske smerter i ekstremitetene. Tynnfibernevropati, med endret temperatur- og smertesans, og affeksjon av autonome nervesystem (eksempelvis obstipasjon, blæreforstyrrelse, postural hypotensjon, med mer) kan også ses.
Vinkaalkaloid-relatert perifer nevrotoksisitet er doseavhenging, og vanligvis oppstår symptomene underveis i behandlingen. For de fleste pasienter er plagene reversible, men perifer nevropati som senbivirkninger kan også ses. Ved signifikante eller tiltagende symptomer under behandling med PCV bør man ha lav terskel for seponering, se kjemoterapi-appendix i handlingsprogram for diffuse gliomer for nærmere detaljer.
Ved tvil eller ved plagsomme og/eller vedvarende symptomer bør man vurdere utredning med nevrofysiologisk testing og vurdering hos nevrolog. Klinisk presentasjon og oppfølging er grundig beskrevet i EANOs retningslinjer for kjemoterapiutløst nevrotoksisitet (Jordan et al., 2020). Det foreligger ingen effektiv medikamentell behandling av tilstanden. Pasienter med nevropatiske smerter bør få tilstrekkelig smertelindring (lokalbehandling eller systemisk), gjerne i samråd med palliativt team. Andre støttetiltak kan være aktuelt (for eksempel vurdering hos fysioterapeut eller ergoterapeut, tilpassing av fottøy og fallforebygging). Det vises for øvrig til Helsedirektoratets Rapport om seneffekter etter kreftbehandling (Seneffekter etter kreftbehandling (helsedirektoratet.no)).
Ikke-medikamentelle symptomrettede tiltak
Behov for denne typen tiltak vil ofte inngå som en del av kartlegging av rehabiliteringsbehov. Imidlertid vil sykdomsprogresjon med utvikling av nye nevrologiske symptomer, så vel som annen interkurrent sykdom, oftest medføre at nye eller endrede tiltak blir nødvendige. Det bør derfor være en kontinuerlig evaluering av behov for symptomrettede tiltak gjennom hele sykdomsforløpet, både av spesialisthelsetjeneste og kommunehelsetjeneste, i samarbeid med pasient og pårørende. Høyere fokus på ikke-medikamentelle tiltak er også en viktig del av «Pakkeforløp hjem».
Eksempler på ikke-medikamentelle symptomrettede tiltak er
- fysikalsk behandling for å opprettholde funksjon og muskulatur
- ganghjelpemidler og andre hjelpemidler i hjemmet i samarbeid med ergoterapeut
- synshjelpemidler og/eller trening hos synspedagog
- vurdering og oppfølging hos logoped og eventuelt tilpasning av språkhjelpemidler
- behandling av obstipasjon eller urininkontinens
- støttestrømper som tromboseprofylakse
- tilrettelagt ernæring og ernæringstilskudd
- psykologisk oppfølging av pasient og familie
- veiledning og støttesamtaler med sosionom og/eller sykehusprest
- integrert oppfølging av palliativt team
Organisering av behandling
Sist faglig oppdatert: 17.08.2023
Fastlege/primærlege har ansvar for pasienten frem til første kontakt med spesialisthelsetjenesten er tatt. Det vil deretter være aktuelle lokale sykehusavdeling, nevrologisk avdeling eller annen relevant avdeling som har ansvaret frem til første kontakt med neste ledd i behandlingskjeden. Nevrologisk avdeling, eller annen avdeling ved sykehus uten nevrologisk avdeling, igangsetter, om nødvendig, støttebehandling som antiødembehandling, antiepileptika og tromboseprofylakse. Ved symptomatisk epilepsi legges en plan for medisinering og oppfølging av denne videre i forløpet. Kjøreegnethet skal vurderes hos alle pasienter i henhold til førerkortforskriftene, av den spesialist som til enhver tid har hovedansvaret. Tilsyn og eventuelt behandling av fysioterapeut, ergoterapeut og logoped vurderes individuelt. Sosionom bør involveres for å vurdere behov for sosialmedisinske tiltak for pasient og pårørende. Pasienter og pårørende som har behov for henvisning til psykolog eller psykiater bør tilbys det.
Neste ledd vil som oftest enten være nevrokirurgisk avdeling eller kreftavdeling. Videre oppfølging kan foregå på nevrologisk avdeling, nevrokirugisk avdeling, kreftavdeling eller indremedisinsk avdeling avheng av svulstsituasjon og lokale forhold og avtaler.
Det ledd i behandlingskjeden som til enhver tid har ansvar for pasienten, har også løpende ansvar for informasjon og dialog med pasienten. Dette omfatter både medisinsk informasjon og hjelp med nødvendige sosialmedisinske tiltak. Dialog med pårørende er spesielt viktig ved kognitive symptomer som kan vanskeliggjøre forståelse, kommunikasjon og sykdomsinnsikt. Ved barn som pårørende må det tas spesielle hensyn.
Alle behandlingsbeslutninger tas av behandlende nevrologisk, onkologisk, nevrokirurgisk avdeling, eller annen relevant avdeling, når nødvendig utredning og vurdering er foretatt, eventuelt inkludert vurdering i multidisiplinært team. Beslutningen tas i samråd med pasient og helst pårørende.
Anbefalinger:
- Kirurgi er førstelinjebehandling for de fleste pasienter med hjernesvulst. Behov for og type tilleggsbehandling bør som hovedregel vurderes av MDT
- Operasjonstilgang og bruk av avanserte hjelpemidler vurderes individuelt avhengig av pasient og svulsttype. MR bør tas innen 72 timer postoperativt for å vurdere reseksjonsgrad og eventuelle komplikasjoner som infarkter og blødninger
- Anfallsforebyggende behandling (antiepileptika) bør startes hos alle pasienter som har hatt ett sikkert eller overveiende sannsynlig symptomatisk epileptisk anfall
- Ved bruk av glukokortikoider som antiødembehandling ved hjernesvulst bør laveste effektive dose postoperativt brukes og det må fortløpende tas stilling til dose og behandlingslengde. Svulster uten radiologisk ødem skal som hovedregel ikke behandles med glukokortikoider
- Behandlende lege bør følge opp og om mulig forebygge bivirkninger av glukokortikoidbehandling over tid
- Tromboseprofylakse bør vurderes individuelt hos immobiliserte pasienter med hjernesvulst
- Ikke-medikamentelle symptomrettede tiltak bør fortløpende vurderes og igangsettes ved behov gjennom hele forløpet
Oppfølging og kontroll etter avsluttet primærbehandling
Sist faglig oppdatert: 17.08.2023
Det vil være store individuelle forskjeller i oppfølgingen avhengig av diagnose og gjennomgått behandling. Noen pasienter har vært behandlet med kurativ intensjon, mens andre allerede ved primærdiagnose har uhelbredelig sykdom. I dette avsnittet nevnes kun generelle prinsipper i oppfølgingen. For diagnosespesifikke anbefalinger henvises til de spesifikke handlingsprogrammer for de vanligste svulsttypene. Kontrollopplegget bør alltid tilpasses den enkelte pasient og oppfølging av fastlege vil være sentralt for alle pasienter.
Dessverre finnes det kun sparsom vitenskapelig litteratur om oppfølging av pasienter med intrakranielle svulster inkludert gliomer (Stupp et al., 2010). Det finnes heller ingen studier som analyserer hvilken prognostisk betydning det har når i forløpet for eksempel gliomresidiv/-progresjon påvises. Det antas likevel at tidlig diagnostikk og behandling har betydning i hvert fall for pasientens livskvalitet og iblant også totaloverlevelse.
Anbefalingene som er gitt her baserer seg på det som er standard ved norske universitetssykehus.
Målet med oppfølging er å
- Påvise eventuell (symptomgivende) sykdomsprogresjon og i så fall vurdere indikasjon for ny tumorrettet behandling
- Oppdage og håndtere eventuelle behandlingsrelaterte bivirkninger og komplikasjoner
- Sikre og følge opp informasjon til pasient og pårørende om gitt behandling og eventuelle framtidige behandlingsmuligheter, inkludert rehabilitering og palliasjon
- Gi optimal palliativ og/eller symptomlindrende behandling, eksempelvis antiepileptisk, analgetisk, antiemetisk og antiødembehandling
- Koble inn annet støttepersonell etter behov, som kreftsykepleier, kreftkoordinator, fysioterapeut, sosionom, psykolog, ernæringsfysiolog og prest
- Gi tidlig tilbud om oppfølging også av palliativt team
- Vurdere behov for nevrorehabilitering
- Gi informasjon om Hjernesvulstforeningen og likepersontilbudet, samt andre tilbud som Vardesenter og Pusterom
- Tilby lærings- og mestringskurs
Kontroller
Sist faglig oppdatert: 17.08.2023
Hvem skal kontrollere pasienten
Det er store regionale forskjeller på hvem som kontrollerer pasienter med hjernesvulst. Oppfølging av denne pasientgruppen er i første rekke spesialisthelsetjenestens ansvar, selvsagt i et nært og godt samarbeid med primærhelsetjenesten. Det viktigste er at man alltid definerer tydelig hvem som har oppfølgingsansvaret. I den grad det er flere involverte må ansvarsfordelingen tydeliggjøres, også for pasient og pårørende. Hvem som skal ha hovedansvar for oppfølgingen er avhengig av diagnose, hvor pasienten bor og hva som er pasientens hovedproblem(er). Generelt bør pasienter i palliativ fase kontrolleres nærmest mulig hjemstedet (primærhelsetjenesten inkludert fastlege og/eller lokalsykehus). Noen momenter som kan ha betydning for hvem i sykehusene som skal kontrollere hvilke pasienter er følgende:
- Pasienter der neste behandlingstiltak med stor sannsynlighet blir kirurgi bør helst følges opp av nevrokirurg
- Pasienter med symptomatisk epilepsi/hvor epilepsien er en hovedutfordring bør helst følges opp av nevrolog
- Pasienter med meningeom som først ved progresjon skal vurderes for kirurgi, bør helst følges opp av nevrokirurg, alternativt av fastlege eller lokal nevrologisk avdeling som henviser til nevrokirurg ved vekst eller symptomer
- Pasienter med kirurgisk behandlet eller strålebehandlet meningeom følges av fastlege eller lokal nevrologisk avdeling etter at første polikliniske kontroll er gjort hos behandlende instans. Behandlende instans kontaktes ved spørsmål senere i forløpet
- Pasienter med gliom som kun er operert bør helst følges opp av nevrokirurg, eller nevrolog/onkolog i nært samarbeid med nevrokirurg
- Pasienter som har fått radiokjemoterapi for gliom bør helst følges opp av onkolog eller nevrolog i nært samarbeid med onkolog
- Pasienter som får palliativ kjemoterapi bør helst følges opp av nevrolog eller onkolog i nært samarbeid med palliativt team
- Pasienter som ikke får aktiv tumorrettet behandling bør helst følges opp av nevrolog eller onkolog
- Gi tidlig tilbud om oppfølging også av palliativt team
Ved påvisning av sykdomsprogresjon vil indikasjon for ny tumorrettet behandling være avhengig av diagnose, sykdomsutbredelse (kliniske og radiologiske funn), alder, allmenntilstand og tidligere gitt behandling. Ofte vil det være behov for ny vurdering av behandlingsalternativer i multidisiplinært team (MDT). Her vil en i felleskap ta stilling til hvorvidt det er aktuelt med ny tumorrettet behandling eller om det skal bli gitt god palliativ behandling alene.
Hva skal kontrolleres
Hva som skal kontrolleres avhenger dels av pasientens symptomer og plager og dels av hva man forventer å finne av langtidseffekter hos den enkelte pasient. Dette inkluderer
- sykdomsstatus
- allmenntilstand, funksjonsnivå (ECOG-status, Karnofsky score)
- anamnese, blodprøver og klinisk undersøkelse særlig med tanke på hormonforstyrrelser
- målrettet nevrologisk undersøkelse
- medikasjon som for eksempel glukokortikoider og antiepileptika
- ved epilepsi: Anfallskontroll, bivirkninger til antiepileptisk behandling og blodprøver (se punkt Epilepsi), problemstillinger knyttet til prevensjon og fertilitet der det er relevant
- å vurdere om det foreligger seneffekter/senbivirkninger (se punkt Seneffekter og senbivirkninger)
- å vurdere behov for rehabilitering og støttebehandling (se punkt Rehabilitering)
- å vurdere kjøreegnethet (se punkt Førerkort)
Supplerende undersøkelser
Radiologi
Hos pasienter med hjernesvulst vil det i praksis alltid være behov for MR-undersøkelse for å vurdere sykdomsstatus. Omfang av MR-undersøkelsen, hvilke serier som tas og intervall mellom undersøkelsene er avhengig av diagnose. Hvorvidt MR skal tas rutinemessig ved kliniske kontroller eller kun ved indikasjon/tilkomne symptomer må vurderes individuelt. Det vises til de svulstspesifikke handlingsprogrammer for detaljer og punkt Bildediagnostiske kontrollintervaller for hjernesvulstpasienter. Det er viktig å være klar over muligheten for pseudoprogressive forandringer etter kombinasjonsbehandling med stråleterapi og kjemoterapi. MR-perfusjon, MR-spektroskopi eller aminosyre-PET kan være til hjelp for å skille mellom pseudoprogresjon (behandlingsrelaterte forandringer) og reell sykdomsprogresjon, men ofte vil først den videre utviklingen gi et endelig svar. Er det behov for ny operasjon gjelder de samme radiologiske anbefalinger som ved førstegangs kirurgi, inkludert MR-kontroll innen 48–72 timer postoperativt for å vurdere grad av reseksjon og eventuelle komplikasjoner. Er det behov for ny tumorrettet behandling skal det som hovedregel tas ny MR som baseline for å kunne vurdere behandlingsrespons (Wen et al., 2010).
Kontroll av endokrin funksjon
Hypofysesvikt er vanlig hos pasienter som har vært behandlet for svulst i sentralnervesystemet. Spesielt gjelder dette etter gjennomført strålebehandling, hvor svikt i en eller flere akser inntrer hos flere enn halvparten av pasientene. Langvarig monitorering er nødvendig, da hypofysesvikten kan inntreffe fra ett til mer enn 20 år etter behandling (Kyriakakis et al., 2019; Mehta et al., 2019). Er det på bakgrunn av behandlingen risiko for hypofysesvikt, for eksempel etter høydosert strålebehandling, så bør basal endokrinologisk status måles årlig (Appelman-Dijkstra et al., 2011). Dette er spesielt viktig hos barn og dersom pasientens allmenntilstand endres. Hypofysær svikt kan opptre i alle hormonelle akser, med avtagende hyppighet i den somatotrope, gonadale, tyreotrope og kortikotrope akse. Aktuelle prøver er
- TSH, fritt T3 og fritt T4
- veksthormon (GH) og insulinlignende vekstfaktor 1 (IGF-1) (bør tas fastende)
- prolaktin, FSH, LH og SHBG hos alle. Testosteron hos menn og østrogen samt progesteron hos kvinner
- kortisol og ACTH. Disse tas om morgenen og er verdiløse hos pasienter som bruker glukokortikoider
Ved mistenkt hypofysesvikt tas disse prøvene og pasienten henvises til endokrinolog for vurdering og eventuell ytterligere prøvetaking og testing.
Andre blodprøver
Utenom årlige blodprøver vedrørende den endokrinologiske funksjonen nevnt ovenfor, tas blodprøver kun på indikasjon. Eksempler er blodprøver relatert til antiepileptisk behandling (serumspeil, hematologiske prøver, leverprøver) og glukokortikoidbruk (HbA1c og blodglukose).
Primærhelsetjenestens rolle
Sist faglig oppdatert: 17.08.2023
Det er viktig med et godt samarbeid mellom primærhelsetjeneste og sykehusvesenet for å ivareta kontrollene av pasienter med hjernesvulst. Avdekking av plager relatert til svulstsykdom og behandling er viktig, ikke minst for å vurdere rehabiliteringsbehov. Innføring av «Pakkeforløp hjem» vil stille krav til kartleggingssamtale i spesialisthelsetjenesten for avdekking av områder som må følges opp i primærhelsetjenesten. Fastlegen vil ofte ha en sentral rolle når det gjelder henvisning til aktuelle rehabiliteringsinstanser, eventuelt i samarbeid med lege i spesialisthelsetjenesten.
Seneffekter og senbivirkninger
Sist faglig oppdatert: 17.08.2023
Pasienter med hjernesvulst har ofte redusert funksjonsnivå, både av fysisk og psykisk art. Mange har også utfordringer av sosial, yrkesmessig og eksistensiell karakter. Kognitive utfall er et hyppig og muligens undererkjent symptom hos pasienter med hjernesvulst. Spesielt er økt trettbarhet et hyppig symptom. I tillegg kan kognitive følgetilstander av onkologisk behandling og psykotrope bivirkninger av antiepileptika og annen medikasjon påvirke pasientens funksjonsnivå og rehabiliteringspotensiale. Pasienter med hjernesvulst angir ofte til dels betydelig nedsatt livskvalitet, som en følge av alle faktorene nevnt ovenfor.
Seneffekter
Helsedirektoratet ga i 2017 ut rapporten Seneffekter etter kreftbehandling, den ble revidert i 2020. Målgruppen for rapporten er klinikere og annet helsepersonell som er i kontakt med kreftpasienter og pasienter som har vært gjennom kreftbehandling. Rapporten har kapitler om sekundær kreft, kardiovaskulære seneffekter, pulmonale seneffekter, hormonforstyrrelser etter kreftbehandling, seksualitet etter kreftbehandling, kognitive problemer, fatigue, seneffekter etter behandling av hjernesvulst, psykososiale forhold, tann- og munnhuleproblemer, spesielle forhold etter kreftbehandling hos barn, muskel-/skjelettskader, perifer nevropati og fertilitet.
Det er særlig viktig at fastleger, som skal følge opp pasienter som ikke har kontroller i spesialisthelsetjenesten, er oppmerksomme på risikoen for seneffekter etter kreftbehandling, og at disse kan debutere lenge etter avsluttet behandling.
Rehabilitering
Sist faglig oppdatert: 17.08.2023
Det er enighet om at rehabiliteringstilbudet for norske pasienter med hjernesvulst per i dag er for dårlig organisert. Rehabiliteringsinnsatsen bør inkludere vurdering av motoriske, sanse- og kognitive funksjoner, evne til å utføre daglige aktiviteter og deltagelse i sosiale og om mulig yrkesmessige sammenhenger. Pasienter med hjernesvulst og deres pårørende har ofte et stort behov for praktisk og sosialmedisinsk bistand. Vurdering av behov for og igangsetting av aktuelle tiltak bør inngå i et rehabiliteringstilbud.
Forutsetningen for å oppnå gode resultater i rehabiliteringen er bruk av tverrfaglig tilnærming, individualisert med hensyn på den enkeltes behov, ønsker og prognose. Dette bør også ligge til grunn ved sammensetting av det tverrfaglige teamet. Teamet kan omfatte lege, sykepleier, logoped, fysioterapeut, ergoterapeut, sosionom og nevropsykolog, eventuelt også andre spesialfunksjoner. Et samarbeid mellom spesialisthelsetjeneste og kommunehelsetjeneste er nødvendig og ønskelig for den videre rehabiliteringen, tilrettelegging av hjemmeforhold og sosialmedisinske aspekter i det videre forløpet. Palliativt team kan med fordel kobles inn tidlig hos pasienter med uhelbredelig sykdom.
Pasientene bør vurderes tidlig i forløpet, helst i den postoperative fasen. Det må da tas stilling til pasientens behov for rehabiliterende behandling, og om et spesialisert eller kommunalt rehabiliteringstilbud vil være best egnet for den enkelte. Pasientgruppen er heterogen og trenger i stor grad individualiserte tilbud. Realistiske målsettinger og vurdering av nytteverdi for den enkelte pasient i lys av allmenntilstand, leveutsikter, livskvalitet og egne ønsker må derfor være sentralt i rehabiliteringsprosessen, spesielt ut i forløpet av aggressiv kreftsykdom.
Studier viser at pasienter med hjernesvulst kan ha like gode resultater av målrettet rehabilitering som andre pasientgrupper (Finch et al., 2014; Gehring et al., 2009; Gehring et al., 2008; Huang et al., 1998; O'Dell et al., 1998; Waagemans et al., 2011; Zucchella et al., 2013). Studiene er imidlertid få og basert på små og heterogene populasjoner. Kognitiv rehabilitering er utprøvd i mindre studier. En Cochraneoversikt konkluderte med at det så langt ikke forelå randomiserte kontrollerte studier eller kontrollerte kliniske studier som med sikkerhet viser at multidisiplinær rehabiliterende behandling bedrer funksjon eller livskvalitet. Imidlertid har man en kontrollert studie og flere studier med lavere evidensnivå som indikerer gunstig effekt (Khan et al., 2015; Liu et al., 2009). Man konkluderte videre med at det ikke foreligger noen evidens for en motsatt effekt, og at det er et stort behov for høykvalitetsstudier i dette feltet.
Førerkort
Sist faglig oppdatert: 17.08.2023
Egnethet for bilkjøring reguleres i de norske førerkortforskriftene, og helsepersonells plikt i forhold til bilkjøring fremgår av Meldeplikten etter helsepersonelloven § 34.
Førerkortforskriftene stiller andre krav til førere av personbil enn for høyere førerkortklasser. Det følgende gjelder derfor for personbil (førerkort klasse BE). Kravene til anfallsfrihet er høyere for andre førerkortklasser, og sertifikat for disse klassene vil derfor i mange tilfeller være uaktuelt. Vi henviser derfor til førerkortforskriftene for nærmere opplysninger. Disse er under revisjon per mai 2023.
Følgende momenter er av spesiell betydning ved vurdering av kjøreegnethet hos pasienter med hjernesvulst: Epilepsi og grad av anfallskontroll, bruk av anfallsforebyggende medisin som kan påvirke kjøreegnethet, og andre nevrologiske symptomer som motoriske utfall, synsproblemer og kognitive utfall, samt hvorvidt sykdommen kan regnes som stabil. Sistnevnte er spesielt viktig ved høygradig diffust gliom og ved hjernemetastaser.
Høygradig diffus hjernesvulst vil som en hovedregel medføre varig kjøreforbud/varig tap av kjøretillatelse både på grunn av kognitive symptomer, andre nevrologiske utfall eller anfallssituasjon. I tillegg kan høy risiko for rask sykdomsprogresjon gjøre pasienten uegnet for bilkjøring i intervallet mellom to kontroller. Unntaksvis kan bilkjøring likevel vurderes hos pasienter med stabil sykdom over tid, i tett oppfølging og uten kliniske symptomer eller utfall som er uforenlig med kjøreegnethet.
Også ved diffust CNS WHO grad 2 gliom er sykdomsprogresjon forventet i de fleste tilfeller. Ved god anfallskontroll og mangel på nevrologiske eller kognitive utfall vil mange pasienter likevel fylle kravene til å føre personbil i deler av forløpet.
Samlet sett må vurdering av egnethet for bilkjøring alltid gjøres ved hjernesvulst, både ved diagnose og gjennom forløpet. I en del tilfeller er det åpenbart uegnethet for bilkjøring, i andre tilfeller kan det bli nødvendig med vurdering av ergoterapeut eller nevropsykolog eller å foreta en praktisk kjøreprøve (skal anbefales av Statsforvalter i henhold til gjeldende regelverk). Kjøresimulering gjøres per nå kun ved Sunnaas sykehus. Tvilstilfeller kan også diskuteres med Statsforvalterens kontor.
Tiltak og diskusjon i forhold til bilkjøring bør alltid dokumenteres i journalen. Pasienter som får kjøretillatelse, men hvor sykdomsprogresjon ikke kan utelukkes, bør informeres om særlig aktsomhet i forhold til eget ansvar og legekontakt ved nye symptomer eller anfall. Pårørende bør få samme informasjon.
Oppdaterte retningslinjer for førerkort finnes på https://helsedirektoratet.no/forerkort, med særlig henblikk på avsnittene om epilepsi, kognitiv funksjon og nevrologisk sykdom, herunder neoplasmer. Se også gjerne på NEL Nevrologi sine sider .
Anbefalinger:
- Målet med oppfølging er vurdering av sykdomsstatus og indikasjon for videre tumorrettet behandling, symptomkontroll (inkludert epilepsi og nevrologiske utfall), rehabiliteringsbehov og kjøreegnethet, gi informasjon og diagnostisering av seneffekter etter sykdom og behandling
- Pasienter med hjernesvulst som ønsker det, bør få et individualisert tilbud om spesialisert og/eller kommunal rehabiliterende behandling tilpasset sykdomsutvikling og særskilte behov hos pasient og pårørende
- Samarbeid med kommunal helsetjeneste bør etableres for alle pasienter som forventes å ha vedvarende eller økende funksjonstap
- Kjøreegnethet skal vurderes etter retningslinjer for førerkort hos alle pasienter med hjernesvulst
Behandling av residiverende/progredierende sykdom
Sist faglig oppdatert: 17.08.2023
Svulstrettet behandling ved tilbakefall eller gjenvekst av hjernesvulst avhenger blant annet av hvilken type hjernesvulst det dreier seg om, tidligere gjennomgått behandling, gjenværende behandlingsopsjoner, funsjonsnivå og sykdomsutbredelse. Det vises til handlingsprogrammene for de enkelte svulsttypene (Diffuse gliomer, Hypofyseadenomer og Meningeomer) for detaljer. Her gis en kortfattet og mer generell redegjørelse.
Ved tilbakefall av hjernesvulst kan svulstrettet behandling i form av ny operasjon, strålebehandling (konvensjonell/fraksjonert eller stereotaktisk), kjemoterapi og/eller annen medikamentell behandling være aktuelt. Det bør også vurderes om pasienten er aktuell for inklusjon i klinisk studie. Ofte er pasientens tilstand preget av både sykdom og tidligere gjennomgått behandling, og mange har redusert funksjonsnivå. Da vil behandlingen i større grad ha et palliativt og individuelt preg. Spesielt bør man ved kort intervall mellom primærbehandling og tilbakefall nøye vurdere nytten av videre svulstrettet behandling.
For å vurdere pasientens livskvalitet gjøres en helhetlig evaluering av symptomer, nevrologisk status, allmenntilstand, funksjonsnivå og glukokortikoiddose. Det er fortrinnsvis pasienter med god allmenntilstand som er tjent med nevrokirurgisk eller onkologisk behandling i residivsituasjon. Pasienter i god allmenntilstand bør som hovedregel diskuteres i MDT. Det bør ved behov forsøkes behandling med glukokortikoider for å vurdere hvor god allmenntilstand og hvor høyt funksjonsnivå som kan oppnås. For pasienter i redusert funksjonsnivå, eller der det ikke ligger til rette for svulstrettet behandling, vil det i residivsituasjon være mest aktuelt med lindrende behandling og støttebehandling.
Kirurgi
Sist faglig oppdatert: 17.08.2023
Reoperasjon kan vurderes for de fleste svulsttyper. Men ofte vil kirurgi være mer komplisert ved tilbakefall enn i primærsituasjon. Det er viktig at man veier eventuell gevinst av en reoperasjon opp mot risikoen forbundet med inngrepet. For retningslinjer og metode, se punkt Kirurgi om primæroperasjon.
Strålebehandling
Sist faglig oppdatert: 17.08.2023
Dersom pasienten ikke har mottatt strålebehandling tidligere, vil det for mange svulsttyper være aktuelt å vurdere dette i residivsituasjon. For pasienter som tidligere har mottatt strålebehandlig vil det være annerledes. Strålebehandling har man tradisjonelt gitt én gang. Bakgrunnen for dette er risiko for alvorlige strålerelaterte skader på strålesensitive organer som synsapparat, hjernestamme, indre øre, ryggmarg og hjernen i seg selv. Men med den teknologiske utviklingen man har sett de siste tiår har rebestråling blitt mer vanlig. Mange faktorer har betydning i vurderingen om rebestråling er aktuelt, for eksempel lokalisasjon, størrelse og beliggenhet av svulsten, pasientens funksjonsnivå og antatt prognose. Videre må det tas stilling til teknikk, fraksjonering og stråledose. Rebestråling kan gis som fraksjonert konvensjonell behandling på lineærakselerator eller som stereotaktisk strålebehandling. Stereotaktisk strålebehandling kan gis som enkeltbehandling eller som få fraksjoner med høy stråledose, og videre i form av gammakniv/strålekniv (landsfunksjon ved Haukeland Universitetssjukehus) eller ved bruk av lineærakselerator (gis ved flere norske sykehus). Man skiller mellom rebestråling (ny strålebehandling i samme område som tidligere) og strålebehandling i ny lokalisasjon. Det vises for øvrig til de svulstspesifikke handlingsprogrammene (Diffuse gliomer, Hypofyseadenomer og Meningeomer).
Medikamentell behandling
Sist faglig oppdatert: 17.08.2023
Muligheten for medikamentell svulstrettet behandling i residivsituasjon er blant annet avhengig av svulsttype. For pasienter med diffust gliom er kjemoterapi i form av temozolomid eller CCNU-basert behandling ofte den mest aktuelle behandlingsmodaliteten ved residiv. Videre bør det ved residiv vurderes om pasienten er kandidat for inklusjon i klinisk studie. Oversikt over pågående kliniske studier finnes blant annet på Helsenorge eller NNOIGs (Norsk nevroonkologisk interessegruppe) nettsider. I enkelte tilfeller kan det være aktuelt med utvidede molekylære analyser for å undersøke om det er tilgjengelig målrettet behandling (Capper et al., 2023), ofte innenfor rammene av kliniske studier. Se for øvrig kapittel Patalogi og de svulstspesifikke handlingsprogrammene (Diffuse gliomer, Hypofyseadenomer og Meningeomer). For pasienter i redusert funksjonsnivå, eller der det ikke er tilgjengelig etablert eller utprøvende svulstrettet behandling, vil det være mest aktuelt med lindrende lindrende og symptomrettet behandling. Glukokortikoider har ofte en sentral rolle her.
Supplerende behandling - rehabilitering, ernæring, fysisk aktivitet, psykososiale tiltak og andre palliative tiltak
Sist faglig oppdatert: 17.04.2024
Pasientens prognose vil ha betydning for fokuset på rehabilitering. For pasienter med god prognose ved tilbakefall vil rehabiliteringsbehovet ofte være stort, og ikke kvalitativt skille seg vesentlig fra primærdiagnose. For pasienter med uhelbredelig svulsttype og alvorlig prognose, vil det ved tilbakefall være mer fokus på symptomrettet behandling og støttetiltak og å unngå tiltak som medfører unødvendig bruk av tid borte fra familien, særlig dersom tiltakene medfører lav sannsynlighet for bedring av funksjon eller livskvalitet.
Det er gjennomført relativt få studier som evaluerer effekten av fysisk aktivitet hos pasienter med hjernesvulst. Basert på de studiene som foreligger, kliniske studier gjennomført hos kreftpasienter med andre kreftformer samt den nasjonale kreftstrategien, anbefales det at pasienter med hjernesvulst under og etter behandling er fysisk aktive og gjerne følger WHOs anbefalinger for fysisk aktivitet hos voksne. Pasienter med hjernesvulst kan oppleve begrensninger både med tanke på pareser, kognitiv svikt og fatigue; aktiviteten må derfor tilpasses pasienten og pasientens situasjon. Unødvendig press og opplevelse av manglende mestring ved å pålegge pasienten trening og mål som ikke kan oppnås må unngås.
Anbefalinger om aktivitetsnivå tilpasset den enkelte pasient gis ofte i forbindelse med utskrivelse fra nevrokirurgisk avdeling. De første 4 ukene etter nevrokirurgi skal man som hovedregel avstå fra mer hard/intens trening som tung vektløfting, løpetrening eller kontaktidrett. Å gå turer med gradvis økende lengde eller annen helt lett aktivitet uten større belastninger er nok den første tiden. Etter 4 uker kan man gradvis gjenoppta normalt aktivitetsnivå uten begrensninger, men trettbarhet kan ofte påvirke aktivitetsnivået hos mange også etter dette.
Videre vil symptombilde og funksjonsnivå vil ha betydning for hvilke støttetiltak som er aktuelle for den enkelte pasient og dens pårørende. For noen kan det være relevant med vurdering av henvisning til klinisk ernæringsfysiolog. Ved hyperglykemi (for eksempel ved langvarig glukokortikoidbruk) kan det være aktuelt med vurdering og eventuelt oppfølging hos endrokrinolog og/eller diabetessykepleier. Ved motoriske utfall kan det være nyttig med vurdering og oppfølging hos fysioterapeut og/eller ergoterapeut. Noen pasienter kan ha nytte av tilbud ved for eksempel Vardesenter eller Pusterom. Kursopphold ved Montebellosenteret kan være aktuelt dersom pasienter og eventuelt pårørende ønsker. Mange pasienter og pårørende har behov for veiledning av sosionom. Pasienter og pårørende som har behov for henvisning til psykolog eller psykiater bør tilbys det.
For pasienter med residiv av hjernesvulst kan tilstanden ofte være preget av både uhelbredelig kreftsykdom og progredierende nevrologiske utfall, og det vil ofte være behov for tverrfaglig oppfølging og oppfølging av palliativt team, se avsnitt Ikke-medikamentelle symptomrettede tiltak og Rehabilitering. Det vises også til nasjonalt handlingsprogram for palliasjon i kreftomsorgen (Palliasjon i kreftomsorgen – handlingsprogram - Helsedirektoratet).
Organisering av behandling
Sist faglig oppdatert: 17.08.2023
Pasienten skal så snart som mulig etter påvist residiv, oftest ved MR-undersøkelse, ha samtale med lege om resultatet av undersøkelsen og den begrunnede mistanken om residiv. Ansvarsforhold vil være som i primærsituasjonen og vurdering i MDT ofte sentralt.
Primærlege eller den avdeling som har pasienten til kontroller og/eller påviser residivet, har behandlingsansvaret inntil pasienten etter beslutning i MDT er vurdert ved nevrokirurgisk eller onkologisk avdeling. For en del pasienter vil nevrologisk avdeling ha ansvar for den onkologiske behandlingen. For pasienten der det er besluttet at det ikke skal gis videre svulstrettet behandling vil organisering av oppfølgingen kunne variere fra sykehus til sykehus. Ofte ligger hovedansvaret ved onkologisk avdeling, men nevrologisk avdeling, indremedisinsk avdeling og palliativt team kan også være ansvarlig avdeling for denne pasientgruppen.
Andre ressurser som kan være aktuelle i videre oppfølging av pasienter i palliativ fase inkluderer fastlege, sykepleietjeneste i kommunene, kreftkoordinator og palliative team i sykehus eller kommune, i tillegg til for eksempel fysio- og ergoterapitjeneste, sosionom, klinisk ernæringsfysiolog, logoped, psykolog og prestetjeneste.
Sjeldne svulster
Sist faglig oppdatert: 17.08.2023
Det følger av WHO-klassifikasjonen for svulster i sentralnervesystemet (WHO Classification of Tumours Editorial Board, 2021) at det finnes mange ulike typer svulster. Noen av disse er relativt vanlige og omtales i egne handlingsprogrammer (Diffuse gliomer, Hypofyseadenomer og Meningeomer), mens mange er (veldig) sjeldne. Utredningen for hjernesvulst vil oftest være ganske lik, mens behandlingen varierer betydelig. For de sjeldne svulsttypene vil man ikke ha kunnskap nok til å lage gode generelle behandlingsretningslinjer. Behandlingen må i slike tilfeller baseres på lite evidens og vil ofte være individualisert. Det samme gjelder oppfølging og kontroll, og det er avgjørende at denne type pasienter alltid diskuteres i MDT.
Patologi
Sist faglig oppdatert: 17.08.2023
Svulster i sentralnervesystemet (CNS; hjerne, hjernehinner og ryggmarg) diagnostiseres og klassifiseres etter «WHO Classification of Tumours of the Central Nervous System» (WHO Classification of Tumours Editorial Board, 2021). Den gjeldende klassifikasjonen fra 2021 er den femte utgaven og benevnes CNS-WHO 2021 i det følgende. Selv om metastaser fra neoplastisk sykdom i andre organer ikke er å vurdere som primære intrakranielle svulster, så har WHO likevel inkludert disse som en egen gruppe i klassifikasjonen. Hypofyseadenomer klassifiseres etter «WHO Classification of Tumours: Tumours of Endocrine Organs», og gjeldende klassifikasjon er fra 2022 (WHO Classification of Tumours Editorial Board, 2022).
I patologidelen av dette handlingsprogrammet vil kun et utvalg av svulsttypene hos voksne bli omtalt nærmere; de vanligste typene diffuse lavgradige og høygradige gliomer, hypofyseadenomer, meningeomer, metastaser og ependymomer. Det vises også til de entitetsspesifikke handlingsprogrammene (Diffuse gliomer, Hypofyseadenomer og Meningeomer) for mer informasjon.
WHO-klassifikasjonens 13 hovedgrupper og endringer i gradering og nomenklatur
Sist faglig oppdatert: 17.08.2023
CNS-WHO 2021 (WHO Classification of Tumours Editorial Board, 2021) presenterer nye diagnoser i 5. utgave av «Central nervous system tumours». I tillegg til tidligere etablerte og definerte histopatologiske og molekylærbiologiske karakteristika, inkorporeres nå ytterligere veletablerte molekylærbiologiske parametre i klassifikasjonen av flere svulstgrupper.
Etter CNS-WHO 2021 (WHO Classification of Tumours Editorial Board, 2021) deles svulstene fortsatt inn i fire grader basert på histopatologiske og molekylærgenetiske karakteristika. CNS WHO grad 1 svulster er lavgradige og kan ofte kureres ved kirurgi alene. Svulster klassifisert som CNS WHO grad 2 vokser ofte infiltrerende, residiverer ofte, og for noen entiteter kan man se transformasjon til høyere grad. Betegnelsen CNS WHO grad 3 brukes vanligvis på svulster med histologiske tegn på malignitet. CNS WHO grad 4 beskriver de mest høygradige svulstene der prognosen avhenger av tumorkategori og tilgjengelig behandling.
Tradisjonelt har gradering av svulster i sentralnervesystemet kun basert seg på histologiske parametre. Etter siste klassifikasjon er gradering avhengig av både histologi og molekylære markører, sistnevnte kan i noen tilfeller bestemme grad uavhengig av histologisk grad. Dette stiller nye krav til diagnostikken som utføres. Videre endres selve nummereringen av grad, fra tradisjonelt brukte romertall til arabiske tall. Dette for å unngå feil, da I, II, III og IV lett kan forveksles med hverandre i et system der diagnoser som «anaplastisk astrocytom» nå er fjernet og erstattet kun med «astrocytom IDH-mutert», etterfulgt av gradsangivelse. Videre er det ønskelig å standarisere gradsangivelse på tvers av organsystem, og WHO velger da arabiske tall foran romertall.
Betegnelsene NOS «not otherwise specified» og NEC «not elsewhere classified» tillater å skille ut tilfeller der 1) det er mangel på nødvendig diagnostisk informasjon (for eksempel molekylære markører) eller det er forsøkt utført analyser men disse er inkonklusive (NOS), eller 2) der tilleggsundersøkelser er utført tilfredsstillende, men resultatene av disse gir likevel ikke klar WHO-diagnose (NEC). Som eksempel nevnes «supratentorielt ependymom, NEC», der en ikke påviser ZFTA/YAP fusjon. Resultatet kan også være en deskriptiv diagnose der patologen angir en non-WHO terminologi for å beskrive tumor, og angir med det at tumor ikke fyller krav for standarisert WHO-diagnose til tross for adekvat og teknisk tilfredstillende diagnostisk utredning.
Etter siste CNS WHO-klassifikasjon inndeles svulster i CNS i følgende hovedgrupper:
- Gliomer, glionevronale og nevronale svulster
- Plexus choroideus svulster
- Embryonale svulster
- Svulster i corpus pineale
- Svulster i kraniale og paraspinale nerver
- Meningeomer
- Mesenkymale, ikke-meningoteliale svulster
- Melanocytære svulster
- Hematolymfoide svulster som involverer CNS
- Germinalcellesvulster
- Svulster i sella-regionen
- Metastaser til CNS
- Genetiske tumorsyndromer som involverer CNS
Gliomer, glionevronale svulster og nevronale svulster
Sist faglig oppdatert: 17.08.2023
Gliomer er et mye brukt samlebegrep for ulike typer svulster. De domineres av diffust infiltrerende gliomer, men omfatter også andre svulsttyper som mer avgrensede gliale, glionevronale og nevronale svulster. Ependymomer inngår også i denne gruppen, i siste klassifikasjon mer spesifikt klassifisert etter lokalisasjon og molekylærbiologiske markører. Begrepet «høygradig gliom» (HGG) er hyppig brukt og innbefatter svulster med CNS WHO grad 3 og 4, mens begrepet «lavgradig gliom» (LGG) refererer til CNS WHO grad 1 og 2.
En viktig endring i siste WHO-klassifikasjon er at diffuse infiltrerende gliomer nå deles inn i voksen type («adult-type») og pediatrisk type («pediatric-type») som i hovedsak opptrer hos henholdsvis voksne og barn/unge. I gruppen pediatrisk type finner man svulster som også kan opptre hos unge voksne, mens voksen type gliomer sjelden affiserer barn og unge. Disse to gruppene skiller seg fra hverandre ved definerte molekylærbiologiske markører, der voksen type gliomene fortsatt defineres ut fra molekylærgenetisk status inkludert IDH og 1p19q, mens pediatrisk type har helt andre markører som for eksempel MYB- eller MYBL1 for lavgradige svulster, og H3-mutasjoner for høygradige svulster. Biologisk er det også store ulikheter da voksen type gliomer som regel utvikler seg til høyere grad, de kan ikke resiseres i sin helhet og har et mer aggressivt forløp enn svulster av pediatrisk type. En annen betydelig endring innenfor klassifikasjon av voksen type svulstene er at spesifikke molekylærgenetiske markører er bestemmende for CNS WHO grad, uavhengig av histologisk grad. Dette gjelder for eksempel IDH-muterte gliomer med homozygot delesjon av CDKN2A/B som nå klassifiseres som CNS WHO grad 4, uavhengig av histologisk utseende. Voksen type diffuse IDH-villtype og H3-villtype astrocytomer med TERT-mutasjon, EGFR-amplifikasjon eller +7/-10 klassifiseres som glioblastom, IDH-villtype CNS WHO grad 4 uavhengig av histologiske karakteristika. Klassifikasjonen gir imidlertid ikke rom for IDH-villtype tumores med lavgradig histologi som ikke har disse molekylærgentiske karakteristika, slike svulster er i henhold til CNS-WHO 2021 ikke-eksisterende, mens de i forrige klassifikasjon var omtalt som «provisional entity».
Vi finner de fleste svulstene i voksen type gruppen, og disse vil nærmere omtales i det følgende. Selv om det er relativt få svulster innenfor pediatrisk type svulster vil de likevel kort beskrives, da klassifikasjonen for første gang gir kriterier for å definere disse nærmere som en egen gruppe, og slik skille de fra voksen type gliomer.
Den siste klassifikasjonen stiller således ytterligere krav til molekylærgenetiske undersøkelser i rutinediagnostikk av hjernesvulst. Dette har ressursmessige og tidsmessige konsekvenser av betydning for den enkelte patologiavdeling og for utredende og behandlende avdeling.
Voksen type (adult type) diffuse gliomer
Denne gruppen består av diffust infiltrerende gliomer som graderes CNS WHO grad 2, 3 eller 4 etter histologiske og molekylærgenetiske egenskaper. Inndelingen er:
Astrocytom, IDH-mutert
Oligodendrogliom, IDH-mutert, 1p19q-kodeletert
Glioblastom, IDH-villtype
Astrocytom, IDH-mutert
Denne gruppen inneholder diffust infiltrerende astrocytomer med mutasjon i IDH1 eller IDH2, med hyppig ATRX- og/eller TP53-mutasjon, og uten 1p19q-delesjon. Generelt viser tumorcellene høy grad av differensiering i retning astrocytter. Svulstene er kjennetegnet av diffust infiltrerende vekst som gjør at man i praksis aldri kan oppnå radikal fjernelse av alt svulstvev ved kirurgi. Histologiske kriterier for gradsinndeling er de samme som tidligere vedrørende mitotisk aktivitet, karproliferasjon og nekrose, men i henhold til CNS-WHO 2021-klassifikasjonen settes disse kriterier til side ved påvisning av den spesifikke molekylærgenetiske markøren homozygot delesjon av CDKN2A/B. Dette på bakgrunn av multiple retrospektive studier som indikerer kortere overlevelse korresponderende til grad 4 svulster blant pasienter med IDH-muterte astrocytomer med denne markøren0020 (WHO Classification of Tumours Editorial Board, 2021). Astrocytom, IDH-mutert graderes CNS WHO grad 2, 3 eller 4 etter histologiske og molekylærgenetiske markører:
CNS WHO grad 2: Histologisk grad 2, uten homozygot delesjon av CDKN2A/B
CNS WHO grad 3. Histologisk grad 3, uten homozygot delesjon av CDKN2A/B
CNS WHO grad 4: Histologisk grad 4, eller påvist homozygot delesjon av CDKN2A/B uavhengig av histologisk grad
Oligodendrogliom, IDH-mutert, 1p19q-kodeletert
I likhet med astrocytomene vokser oligodendrogliomene diffust infiltrerende i hjernevev og kan i praksis så godt som aldri fjernes radikalt ved kirurgi. Som i forrige klassifikasjon er oligodendrogliom hos voksne per definisjon et diffust infiltrerende gliom med IDH-mutasjon og kodelesjon av kromosomarmene 1p og 19q (WHO Classification of Tumours Editorial Board, 2021). De fleste oligodendrogliomer har et klassisk morfologisk utseende, men noen kan morfologisk ligne diffust infiltrerende astrocytom. Tumor klassifiseres i alle tilfeller som oligodendrogliom basert på molekylærgenetiske egenskaper, og graderes som tidligere i to grader basert på histopatologiske kriterier:
Oligodendrogliom, IDH-mutert, 1p19q-kodeletert, CNS WHO grad 2
Oligodendrogliom, IDH-mutert, 1p19q-kodeletert, CNS WHO grad 3
Glioblastom, IDH-villtype
Diffust infiltrerende gliom som er IDH-villtype og H3-villtype, med en eller flere av følgende histologiske eller genetiske egenskaper: mikrovaskulær proliferasjon, nekrose, TERT-promotormutasjon, EGFR-amplifikasjon og kromosom kopitallsendringen +7/-10. Disse svulstene graderes CNS WHO grad 4. De kan ha ulike histologiske subtyper som kjempecelleglioblastom, gliosarkom eller epiteloid glioblastom.
Til forskjell fra forrige klassifikasjon eksisterer det nå ikke en gruppe diffust IDH-villtype astrocytom med CNS WHO grad 2 eller 3. Klassifikasjonen tar således ikke høyde for eventuelle diffust infiltrerende tumores der man har histologisk grad 2 eller 3, IDH-villtype, og fravær av TERT-promotormutasjon, EGFR-mutasjon, +7/-10 eller H3-mutasjon. Slike tumores må da, hvis de finnes, angis med deskriptiv diagnose og NEC, etter utelukkelse av annen tumorentitet. I slike tilfeller anbefales på det sterkeste utvidet molekylær diagnostikk inklusive DNA-metyleringsanalyse med tanke på avgrensning mot pediatrisk type diffuse gliomer (se nedenfor).
Pediatrisk type diffuse lavgradige gliomer
I denne gruppen finner vi diffuse gliomer som opptrer hovedsakelig, men ikke bare, hos barn og unge. De kan også opptre hos yngre voksne. De har molekylærgenetiske egenskaper som klart skiller de fra voksen type diffust infiltrerende gliomer, og biologisk oppfører de seg distinkt forskjellig fra voksen type gliomer, med et mer benignt forløp. De graderes overveiende CNS WHO grad 1 og klassifiseres som følger:
Diffust astrocytom med endringer i MYB- eller MYBL1
Angiocentrisk gliom
Polymorf lavgradig nevroepitelial tumor hos unge (PLNTY)
Diffust lavgradig gliom, med endringer i MAPK-signalvei
Diffust astrocytom med alterasjoner i MYB eller MYBL 1 (CNS WHO grad 1
Diffust infiltrerende astrogliaderivert neoplasme med genetiske forandringer i MYB/MYBL1. Tumor er morfologisk lavgradig uten histologiske tegn til anaplasi. Foreløpige funn tilsier et benignt forløp.
Angiosentrisk gliom (CNS WHO grad 1)
I denne gruppen finner vi svulster med diffust og fokalt distinkt perivaskulært vekstmønster, og med lavgradig histologi. Molekylærgenetisk har de fleste svulstene i denne gruppen en
MYB::QKI-fusjon, resterende har som regel en annen MYB-alterasjon. Svulsten er sjelden forekommende og foreløpige data tyder på et benignt forløp der man i de fleste tilfeller kan oppnå total ekstirpasjon av tumor og kurasjon.
Polymorf lavgradig nevroepitelial tumor hos unge (PLNTY, CNS WHO grad 1
Lavgradig neoplasme hos unge og yngre voksne med sterk assosiasjon til epilepsi. Tumor viser et diffust vekstmønster, lavgradig morfologi, ofte med et oligodendroglialt preg, kalsifikasjoner, sterk og utbredt positivitet for immunmarkøren CD34, og aktiverende genetiske alterasjoner i MAPK-signalvei.
Lavgradig gliom, med endringer i MAPK-signalvei
Diffust lavgradig gliom med astrocytær og/eller oligodendroglial morfologi, opptrer som regel hos barn, og er karakterisert av endringer i gener som koder for MAPK-signalvei. Ofte finner man en intern tandemduplikasjon eller mutasjon i tyrosin kinase domenet i FGFR1, eller en BRAF V600-mutasjon. Tumor er IDH-villtype og H3-villtype, og har ikke homozygot delesjon av CDKN2A/B. Denne svulsttypen har ingen CNS WHO gradering.
Pediatrisk type diffuse høygradige gliomer
I denne gruppen finner vi følgende svulster:
Diffust midtlinjegliom, H3 K 27-alterert
Diffust hemisfærisk gliom, H3 G 34-mutert
Diffust pediatrisk type høygradig gliom, H3-villtype og IDH-villtype
Infantil type hemisfærisk gliom
Sistnevtne finnes bare i unge barn og beskrives derfor ikke videre i dette handlingsprogrammet.
Mutasjoner i gener som koder for Histon 3 (H3)-proteinet, er assosiert med 2 ulike pediatrisk type høygradige gliomer som nå er tatt inn i WHO-klassifikasjonen. De sees hyppigst i pediatrisk populasjon, men kan også affisere voksne. De har mutasjoner i H3-gener, hyppigst i H3-3A-genet, mer sjelden i andre H3 isoformer.
CNS-WHO 2016 inkluderte diffust midtlinjegliom H3 K27M-mutert som ny entitet. Dette ble definert som et høygradig diffust infiltrerende gliom, som regel i midtlinjen (for eksempel ponsgliom) med H3 K27M-mutasjon. Siste klassifikasjon definerer nå denne entiteten med andre kriterier enn tidligere, og navnet er derfor endret til «Diffust midtlinjegliom H3K27-alterert» (CNS-WHO grad 4). I tillegg er «Diffust hemisfærisk gliom H3 G34-mutert» (CNS-WHO grad 4), tatt inn som ny entitet i klassifikasjonen.
Det angis ulik nummerering av aminosyreposisjonen i aktuell litteratur, for eksempel H3K27M og H3p.K28M. Dette skyldes at WHO refererer til aminosyrens posisjon i ferdig translatert protein, basert på opprinnelig kartlegging av aminosyresekvensene i Histon 3-proteinet. Senere sekvensering av genet har vist at første aminosyre (startkodon) spaltes av etter translasjonen. Aminosyreposisjonene slik de angis i WHO «mangler» derfor den første aminosyren, relativt til DNA-basert nummering. Sistnevnte angis derfor numerisk en posisjon høyere (Leske et al., 2021).
Diffust midtlinjegliom H3 K27-alterert (CNS WHO grad 4)
I siste WHO-klassifikasjon beskrives dette som et infiltrerende midtlinjegliom med endringer i H3K27 som gir tap av trimetylering av aminosyren Lysin i posisjon 28 (27) , benevnt H3 p.K28me3 (K27me3). Dette kan påvises immunhistokjemisk. Tap av H3 p.K28me3 og samtidig påvist H3 p.K28-mutasjon (H3 K27) gir diagnosen. Den hyppigste H3 p.K28-mutasjonen (H3 p.K28M (K27M)) kan påvises ved immunhistokjemisk farging, andre mindre hyppig forekommende varianter finnes kun med sekvensering.
Tap av H3 pK28me3 (K27me3) uten påvisning av H3 pK28-mutasjon, men med enten EZHIP overekspresjon eller EGFR-mutasjon, er også tilstrekkelig for diagnosen. Førstnevnte kan påvises ved immunhistokjemi, mens EGFR-mutasjon må påvises molekylærgenetisk.
Disse svulstene antas å ha dårlig prognose. Selv om svulsten er hyppigere hos barn/unge og derfor definert som pediatrisk type diffust høygradig gliom, finnes diffust midtlinjegliom H3 K27-alterert i alle aldersgrupper.
Diffust hemisfærisk gliom, H3 G34-mutert (CNS WHO grad 4)
Diffust infiltrerende høygradig gliom i hemisfærer hos unge og yngre voksne. Tumor har en missense-mutasjon i H3-3A-genet. Mer enn 90% av rapporterte tilfeller har ATRX-alterasjon som ofte medfører immunhistokjemisk negativitet for ATRX, og TP53-mutasjon som ofte fører til nukleær akkumulasjon av p53. I motsatt til voksen type diffuse gliomer er denne entiteten overveiende negativ for OLIG2. Immunhistokjemisk kombinasjon av negativitet for IDH1 p.R132H, ATRX og OLIG2 i en glial svulst gir derfor mistanke om diagnosen. Sekvensering av H3-3A-genet med påvisning av H3 p.G35R/V (H3 G34)-mutasjon er nødvendig for diagnose. Immunhistokjemiske markører finnes, men er ansett lite spesifikke.
Diffust pediatrisk type høygradig gliom, H3- og IDH-villtype
Morfologisk høygradig gliom hos barn, ungdom og unge voksne uten endringer i H3. Entiteten har andre molekylærgenetiske markører og er nærmere omtalt i «Handlingsprogram for diffuse gliomer hos voksne».
Velavgrensede svulster
I denne gruppen finner vi delvis solide og velavgrensende svulster som pilocytisk astrocytom, pleomorft xantoastrocytom og chordoid gliom. Disse omtales ikke nærmere i dette handlingsprogrammet.
Glionevronale og nevronale svulster
Her finner vi entiteter som gangliogliom, dysembryoplastisk nevroepitelial tumor, sentralt neurocytom, med flere. Disse omtales ikke nærmere i dette handlingsprogrammet.
Ependymale svulster
Ependymomer er bygget opp av svulstceller som er differensiert i retning av ependymceller (cellene som kler hjernens ventrikkelsystem og sentralkanalen i medulla spinalis). Ependymomene er vanligvis velavgrensede svulster og kan derfor noen ganger helbredes ved kirurgi alene. De oppstår hyppigst i 4. ventrikkel og i ryggmargen, men kan også finnes supratentorielt, og noen ganger uten relasjon til ventrikkelsystemet.
Ependymom CNS WHO grad 1 er lavgradige svulster, ofte med distinkt morfologi som subependymom som hyppigst finnes i 4. ventrikkel hos voksne. Myksopapillært ependymom som ofte finnes i cauda equina kan residivere, progrediere lokalt og spres i cerebrospinalvæsken. Disse svulstene krever ofte gjentatt kirurgi og/eller strålebehandling og er derfor gradert CNS WHO grad 2.
Tidligere ble ependymomene delt inn i grad 2 og grad 3 svulster. I henhold til CNS-WHO 2021 er inndelingen nå bestemt av anatomisk lokalisasjon, samt definerte molekylærgenetiske markører. DNA metyleringsprofiler skiller mellom ulike ependymale svulster tilhørende ulike nivåer i CNS, og deler dem inn i molekylære grupper etter tre anatomiske lokalisasjoner: supratentorielle, bakre skallegrop og spinale svulster. Tidligere histologisk gradering er nå ikke obligat å angi, da man ikke finner at denne er av vesentlig betydning for prognose og forløp. Man kan likevel fortsatt gradere histologisk hvis man ønsker det. Foreliggende inndeling av ependymomer er som følger:
Supratentorielt ependymom
Supratentorielt ependymom med ZFTA-fusjon
Supratentorielt ependymom med YAP1-fusjon
Subependymom i bakre skallegrop
Bakre skallegropsependymom, gruppe A
Bakre skallegropsependymom, gruppe B
Spinalt ependymom
Spinalt myxopapillært ependymom
Spinalt ependymom med MYCN-amplifikasjon
Meningeomer
Sist faglig oppdatert: 17.08.2023
Meningeomene utgjør den klart største gruppen av svulster i hjernehinnene. Disse antas å utgå fra meningoteliale (araknoidale) celler og er vanligvis tilheftet den indre overflaten av dura. Meningeomene deles i en rekke undertyper basert på det mikroskopiske bildet. De hyppigst forekommende subgruppene er meningotelialt meningeom, fibrøst meningeom og blandet meningeom, som alle klassifiseres som meningeom CNS WHO grad 1.
Meningeomer som erfaringsmessig har økt tendens til residiv og/eller mer aggressivtvekstmønster klassifiseres som atypiske meningeomer CNS WHO grad 2 etter definerte histologiske kriterier. Noen histologiske undertyper av meningeomer, slik som chordoid meningeom og klarcellet meningeom, skal per definisjon klassifiseres CNS WHO grad 2.
De mest aggressive meningeomene klassifiseres som CNS WHO grad 3 og er de anaplastiske meningeomene. Dette er høygradige meningeomer med malign morfologi (anaplasi), og som kan likne karsinom, sarkom eller melanom. De har betydelig økt mitotisk aktivitet, tydelig anaplasi, TERT-mutasjon og/eller homozygot delesjon av CDKN2A/B. For ytterligere detaljer henvises til eget handlingsprogram for meningeomer.
Hypofyseadenomer
Sist faglig oppdatert: 17.08.2023
Hypofyseadenomer klassifiseres histopatologisk etter «WHO Classification of Tumours: Tumours of Endocrine Organs», og den gjeldende klassifikasjonen er fra 2022 (WHO Classification of Tumours Editorial Board, 2022). Hypofyseadenomer klassifiseres nå som nevroendokrin tumor (PitNET), der undergrupper nærmere defineres ut fra differensiering mot somatotrope, kortikotrope og gonadotrope tumores. Som overgang fra forrige klassifikasjon der begrepet hypofyseadenom ble brukt, angis nå PitNET/adenom for å indikere at begge begreper kan brukes, men PitNET foretrekkes.
I forrige CNS WHO-klassifikasjon ble skillet mellom typisk og atypisk hypofyseadenom fjernet. Det er like fullt viktig å identifisere svulstkarakteristika som kan predikere et aggressivt klinisk forløp. Immunfarginger kan brukes for å finne ut om svulstcellene produserer noen av hypofyse forlappshormonene eller ikke. Immunfarging for CAM5.2 kan brukes sammen med immunfarging for hormoner for å skille ut visse undertyper av hypofyseadenomer med tendens til aggressivt forløp, slik som «sparsomt granulært somatotropt adenom». Se eget handlingsprogram for hypofyseadenomer for mer detaljert informasjon.
Molekylærpatologi og anbefalt molekylærpatologisk diagnostikk
Sist faglig oppdatert: 17.08.2023
Det er ikke mulig å gå detaljert inn på genetiske endringer i alle typer hjernesvulster i dette handlingsprogrammet. Her vil bare de genetiske avvik som per i dag har praktisk klinisk betydning bli omtalt (Berghoff et al., 2013).
Tap av kromosomarmene 1p og 19q (LOH 1p/19q)
Det har lenge vært kjent at LOH (loss of heterozygosity) på kromosomarmene 1p og 19q er assosiert med bedre overlevelse og bedre respons på kjemoterapi og strålebehandling for pasienter med CNS WHO grad 3 diffust infiltrerende gliomer (Cairncross et al., 2006; Cairncross et al., 2013; van den Bent et al., 2013; van den Bent et al., 2006). Det har derfor vært vanlig å teste alle oligodendrogliomer og svulster med morfologi som oligoastrocytom (både CNS WHO grad 2 og 3) for LOH 1p/19q. Flere metoder er i bruk: fluorescens in situ hybridisering (FISH), PCR-basert analyse for tap av heterozygositet (LOH) og MLPA (multiplex ligation-dependent probe amplification)-analyse. Kombinert LOH for 1p og 19q (kodelesjon) sammen med mutasjoner i IDH finnes per definisjon i alle oligodendrogliomer hos voksne. Etter CNS-WHO 2016 skal også diffuse gliomer som morfologisk fremstår som diffust infiltrerende astrocytomer nå klassifiseres som oligodendrogliomer dersom det foreligger samtidig kodelesjon for 1p/19q og mutasjon i IDH.
ATRX
Mutasjoner/tap av genet alfa-thalassemia/mental retardation syndrome X-linked (ATRX) er ofte til stede sammen med mutasjoner i TP53 i IDH-muterte diffust infiltrerende astrocytomer CNS WHO grad 2, 3 og 4. Det er i flere studier sett at mutasjoner i ATRX nærmest alltid utelukker samtidig kodelesjon av 1p/19q. Men det er kontrovers rundt i hvilken grad immunhistokjemisk undersøkelse korrelerer med mutasjoner i ATRX. Imidlertid indikerer tap av kjernefarge i tumorceller i de fleste tilfeller en ATRX-mutasjon. Mutasjon i ATRX oppfattes derfor som en viktig markør for astrocytomer og benyttes i diagnostikk av gliomer. Tap av kjernefarge for ATRX ved immunhistokjemisk analyse støtter diagnosen astrocytom, mens bevart kjernefarge ikke er konklusiv og videre molekylærgenetiske undersøkelser er nødvendig. Da det finnes noen beskrevne tilfeller med kombinasjon av 1p19q kodelesjon og tap av ATRX kjernefarge, bør i det minste kasus med tap av ATRX men klassisk histologisk bilde av oligodendrogliom også testes for 1p/19q-kodelesjon. ATRX-mutasjoner finnes også i diffust midtlinjegliom H3 K27M–alterert og H3.3 G34R-muterte glioblastomer, som ikke har IDH-mutasjon. Svulster med ATRX-tap uten IDH-mutasjon bør derfor testes for H3-mutasjoner.
IDH1 og IDH2
Mutasjoner i isocitrat dehydrogenase 1 (IDH1) eller 2 (IDH2) finnes i majoriteten av diffuse CNS WHO grad 2 og 3 astrocytomer, og definisjonsmessig i alle oligodendrogliomer hos voksne (Ichimura et al., 2015; Sanson et al., 2009; Yan et al., 2009). Mutasjoner i IDH1 er langt hyppigere enn i IDH2. Ifølge både CNS-WHO 2016 og CNS-WHO 2021 anbefales sekvensering av IDH1 kodon 132 og IDH2 kodon 172 ved alle diffust infiltrerende gliomer CNS WHO grad 2 og 3 dersom tumor er negativ for IDH1-R132H-mutasjon ved immunhistokjemisk farging. MLPA er en annen teknikk for utvidet molekylærgenetisk analyse som dekker opp mot 98 % av alle IDH-mutasjoner. Ved negativ MLPA bør IDH-sekvensering utføres.
Ved glioblastom hos pasienter eldre enn 54 år, uten tidligere kjent diffust gliom og der tumor ikke ligger i midtlinjen (eller der H3 K27M-mutasjon er ekskludert), er det tilstrekkelig med negativ immunhistokjemisk undersøkelse for IDH1 (R132H) for å stille diagnosen glioblastom IDH-villtype. Hos yngre pasienter med glioblastom, og særlig hos pasienter med tidligere kjent diffust gliom og der tumor viser tap av ATRX, bør utvidet molekylærgenetisk analyse for IDH-status utføres.
MGMT
O6-Metylguanin-DNA metyltransferase (MGMT) er et reparasjonsprotein som fjerner promutagene alkylgrupper fra O6-posisjonen på guanin i DNA-molekylet. På denne måten beskyttes cellene mot alkylerende cytostatika. Metylering av MGMT-promotor kan føre til tap av MGMT-ekspresjon. MGMT-promotormetylering finnes i 45–75 % av glioblastomene (Bello et al., 2004), og ser ut til å være assosiert med lenger overlevelse hos pasienter som blir behandlet med temozolomid (Hegi et al., 2005; Stupp et al., 2005; Wick et al., 2013). Det er vist at eldre pasienter med MGMT-metylerte svulster kan ha relativt god effekt av monoterapi med temozolomid alene, uten strålebehandling (Malmstrom et al., 2012; Wick et al., 2012). Undersøkelse for MGMT-promotormetylering anbefales derfor utført hos alle pasienter med glioblastom. Flere metoder er her aktuelle; PCR, MS-MLPA og pyrosekvensering (Preusser et al., 2014).
Gentesting av svulstvev med NGS
Ved svulster i sentralnervesystemet er det aktuelt å undersøke flere gener i svulstvevet med tanke på diagnose, prognose og behandling. Svulstens mikroskopiske morfologi og resultater av immunhistokjemiske undersøkelser gir ofte informasjon om hvilke genanalyser som bør utføres. For å spare tid er det ønskelig å undersøke mest mulig på samme tid. Derfor anbefales nestegenerasjonssekvensering (NGS) fremfor enkeltanalyser. NGS undersøker gener ved hjelp av massiv parallell sekvensering og kartlegger på denne måten nukleotidenes rekkefølge i DNA eller RNA. Det finnes paneler av ulik størrelse som undersøker fra noen få gener til «alle» genene i genomet. I dag brukes små til større (opptil 500 gener) genpaneler ved undersøkelse av DNA og RNA fra svulster i sentralnervesystemet.
DNA-metylering
I den siste WHO-klassifikasjonen er også DNA-metylering omtalt, hvor man benytter en arrary-basert metode for å kartlegge metyleringsmønstre i tumors DNA. Metyleringsdata blir lastet opp til et CNS klassifiseringsverktøy som benytter maskinlæringsalgoritmer basert på en referanse-kohort med pasientprøver. Resultatet av en gitt prøve er basert på grad av likhet i metyleringsmønster med det som kjennetegner definerte undergrupper av svulster i referansekohorten. Klassifiseringsverktøyet er stadig under utvikling og er ansett som et forskningsverktøy, men kan benyttes som et diagnostisk supplement. Noen få entiter er kun definert ved DNA-metyleringsprofil.
Histopatologisk diagnostikk
Sist faglig oppdatert: 17.08.2023
Under operasjon for hjernesvulst foretas ofte frysesnittundersøkelse. Vev fra svulst fryses da ned i isopentan og det skjæres frysesnitt som farges med hematoxylin-erytrosin (eller hematoxylin-eosin). Frysesnitt gir mulighet for foreløpig diagnose under operasjonen og er især indisert der svaret på frysesnittet kan ha betydning for det videre kirurgiske inngrepet. En frysesnittdiagnose er i alle tilfeller å regne som en foreløpig diagnose der undersøkelse av formalinfiksert restmateriale må avventes før endelig diagnose stilles. Dersom det er praktisk mulig beholdes restmaterialet nedfrosset ved –80°C i diagnostisk biobank for eventuelle senere molekylærpatologiske undersøkelser.
Hovedpreparatet fikseres i formalin og innstøpes deretter i parafin. Dette vevet brukes til histologiske farginger, immunhistokjemiske undersøkelser, og molekylærgenetiske undersøkelser som for eksempel MLPA, PCR, pyrosekvensering, NGS og FISH.
For å stille en integrert diagnose må patologen vurdere tumors morfologi ved lysmikroskopi, resultatet av immunhistokjemiske farginger, og molekylærpatologiske funn. Svulstene klassifiseres etter CNS-WHO 2021.
Aktuelle immunhistokjemiske undersøkelser for nevroepiteliale svulster
Aktuelle immunhistokjemiske undersøkelser ved nevroepiteliale svulster er:
GFAP – nyttig for å skille gliomer fra andre svulster
Ki67 – proliferasjonsmarkør
P53 – positiv i mange diffust infiltrerende astrocytomer
IDH1 – ved alle diffust infiltrerende gliomer (se 11.5.3)
ATRX – tapt kjernefarge i IDH-positiv svulst er diagnostisk for diffust astrocytom
H3 K27M – ofte positiv i midtlinjegliomer
EMA – ofte positiv i ependymomer
P65 – ofte positiv i RELA-positive ependymomer
H3K27(28)me 3 - screening for tap av trimetylering av aminosyren Lysine i posisjon 28 (27) på H3. Aktuelt i diagnostikk av diffust midtlinjegliom, H3K27-alterert
Aktuelle immunhistokjemiske undersøkelser for meningeomer
Aktuelle immunhistokjemiske undersøkelser ved meningeomer er:
EMA – skille meningeom fra solitær fibrøs tumor (sammen med stat-6, CD34, S100, PGR)
Ki67 – finne områder med mest mitoser
Aktuelle immunhistokjemiske undersøkelser ved hjernemetastaser
Aktuelle immunhistokjemiske undersøkelser ved hjernemetastaser er:
Cytokeratiner – positive i karsinomer (ulike cytokeratoner kan differensiere mellom ulike karsinomtyper)
TTF-1 – tyder på metastase fra lungekarsinom
Napsin A – tyder på metastase fra lungekarsinom
AP-15 – tyder på metastase fra mammakarsinom
CDX2 – tyder på metastase fra adenocarinom i gastrointestinaltraktus
S100 – tyder på metastase fra malignt melanom
MelanA – tyder på metastase fra malignt melanom
HMB-45 – tyder på metastase fra malignt melanom
En rekke andre immunfarginger kan være aktuelle for å finne mulig origo til carcinommetastaser. Det henvises til spesiallitteraturen (Pekmezci et al., 2013).
Anbefalinger:
- Svulster i sentralnervesystemet klassifiseres etter WHOs retningslinjer av 2021
- Immunhistokjemisk farging for IDH1R132H og H3 pK28me3 gjøres på alle diffust infiltrerende gliomer
- Ved negativ immunhistokjemi gjøres utvidet molekylærgenetisk analyse på IDH1 kodon 132 og IDH2 kodon 172 ved MLPA og/eller sekvensering. Ved negativ MLPA bør det gjøres sekvensering for IDH
- Ved påvist tap av H3 p.K28me3-uttrykk gjøres utvidet molekylærgenetisk analyse på H3
- Ved glioblastomer hos pasienter eldre enn 54 år med bevart ATRX og H3p.K28me3, uten mistanke om tidligere diffust CNS WHO grad 2 gliom, kan man vurdere å utelate utvidet molekylærgenetisk analyse ved negativ IDH immunhistokjemisk farging (da de fleste glioblastomer i denne aldersgruppen er IDH-villtype)
- ATRX immunfarging gjøres på alle diffust infiltrerende gliomer
- Alle IDH muterte astrocytomer histologisk grad 2 og 3 skal testes for homozygot delesjon CDKN2A/B for å utelukke molekylærgenetisk grad 4 tumores
- 1p/19q-status undersøkes hos alle pasienter med påvist IDH-mutasjon
- I tilfeller med klassisk morfologi forenlig med astrocytom og tap av ATRX (og/eller nukleær p53-akkumulasjon) kan man vurdere å utelate analyse av 1p19q-status
- Molekylærpatologisk undersøkelse for MGMT-promotormetylering gjøres på alle grad 4 tumores
Metode og prosess
Bakgrunn
Sist faglig oppdatert: 17.04.2024
Nasjonalt handlingsprogram med retningslinje for diagnostikk, behandling og oppfølging av hjernesvulst er utarbeidet av en oppdateringsgruppe med representanter for alle de regionale helseforetakene, og i samarbeid med Helsedirektoratet.
Mange onkologiske faggrupper la i en årrekke ned et betydelig arbeid for å komme frem til konsensusbaserte faglige anbefalinger for diagnostikk og behandling av ulike typer kreft. Som ledd i Nasjonal strategi for kreftområdet (2006–2009) fikk Helsedirektoratet i oppdrag å videreutvikle og oppdatere faggruppenes anbefalinger til nasjonale handlingsprogrammer for kreftbehandling, i nært samarbeid med fagmiljøene, de regionale helseforetakene, Nasjonalt kunnskapssenter for helsetjenesten, og andre relevante myndigheter. De nasjonale handlingsprogrammene representerte en videreføring av faggruppenes anbefalinger.
Helsedirektoratet takker arbeidsgruppen for stor innsats i utarbeidelsen av handlingsprogrammet.
Formål med handlingsprogrammet
Sist faglig oppdatert: 17.04.2024
Nasjonale handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av kreft (Nasjonale handlingsprogram) skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
Rettslig betydning
Sist faglig oppdatert: 17.04.2024
Helsedirektoratet skal utvikle, formidle og vedlikeholde normerende produkter, det vil si nasjonale faglige retningslinjer, nasjonale veiledere, nasjonal faglige råd og pakkeforløp, som understøtter målene for helse- og omsorgstjenesten.
Nasjonale anbefalinger og råd skal baseres på kunnskap om god praksis, og skal bidra til kontinuerlig forbedring av virksomhet og tjenester, jf. spesialisthelsetjenesteloven § 7-3, helse- og omsorgstjenesteloven § 12-5 og folkehelseloven § 24.
Anbefalinger/råd utgitt av Helsedirektoratet er ikke rettslig bindende, men er faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet.
I situasjoner der helsepersonell velger løsninger som i vesentlig grad avviker fra gitte anbefalinger, skal dette dokumenteres, jf. journalforskriften § 6, bokstav g. Helsepersonell bør være forberedt på å begrunne sine valg i eventuelle klagesaker eller ved tilsyn.
Målgrupper
Sist faglig oppdatert: 17.04.2024
Målgrupper for de nasjonale handlingsprogrammene er spesialister innen medisin, kirurgi, onkologi, radiologi og patologi. De vil også være av interesse for allmennleger, pasienter, pårørende og andre aktører på kreftfeltet.
Handlingsprogram og Nye metoder
Sist faglig oppdatert: 17.04.2024
De regionale helseforetakene har ansvar for Nye metoder, et felles system for å beslutte hvilke metoder som kan tilbys i spesialisthelsetjenesten. Nye metoder er et prioriteringsverktøy. Beslutningene i Nye metoder gjelder nasjonalt, les mer her: Bakgrunn: Hvorfor har vi Nye metoder?
Handlingsprogram og andre normerende produkter kan ikke anbefale legemidler eller andre metoder som ikke har finansering i den offentlige helsetjenesten. Handlingsprogrammene oppdateres i overenstemmelse med beslutninger i Nye metoder.
Kunnskapsbasert metode
Sist faglig oppdatert: 17.04.2024
Kunnskapsbasert praksis innebærer at både forskningsbasert kunnskap, erfaringsbasert klinisk kunnskap og pasientenes/ brukernes ønsker og behov vurderes samlet. I utarbeidelsen og revidering av nasjonale handlingsprogram har det ikke vært med brukerrepresentanter i gruppene.
Innholdet i en retningslinje skal baseres på et oppdatert, gjennomarbeidet og dokumentert kunnskapsgrunnlag. Det innebærer at forskningslitteratur, klinisk erfaring og brukererfaring vurderes opp mot ønskede og uønskede konsekvenser av et tiltak. På områder der det er funnet mindre forskningsbasert kunnskap, og/eller overføringsverdien fra internasjonal til norsk helsetjeneste er lav, blir klinisk kunnskap og brukerkunnskap tillagt større vekt.
Dette nasjonale handlingsprogrammet inneholder svært mange anbefalinger. Det er ikke praktisk mulig, innenfor gitte ressursrammer, å samle all relevant forskningsbasert kunnskap for hver anbefaling. Den forskningsbaserte kunnskapen er hovedsakelig basert på forskning identifisert i anerkjente internasjonale retningslinjer og nyere studier. Det er heller ikke praktisk mulig å gjennomgående bruke GRADE eller SIGN-metodikken for gradering av kunnskapsgrunnlaget.
Handlingsprogram og andre normerende produkter skal også forholde seg til prioriteringskriteriene og ressursbruk. Med ressurser menes direkte kostnader, men også personell og tidsbruk.
Grad av normering
Sist faglig oppdatert: 17.04.2024
Grad av normering angis i teksten i hver enkelt anbefaling/råd:
- Når Helsedirektoratet skriver «skal», betyr det at anbefalingen/rådet er basert på lov eller forskrift, eller når det er så klart faglig forankret at det sjelden er forsvarlig å ikke gjøre som anbefalt
- Når det står bør» eller «anbefaler», er det en sterk anbefaling/råd som vil gjelde i de aller fleste tilfeller
- Når det står «kan» eller «foreslår» er det en svak anbefaling/råd der ulike valg kan være riktig for ulike pasienter
Tilhørende normerende publikasjoner
Sist faglig oppdatert: 17.04.2024
Arbeidsform og deltakere
Sist faglig oppdatert: 17.04.2024
Handlingsprogrammet revideres av en oppdateringsgruppe oppnevnt av Helsedirektoratet. Representantene i gruppen er utnevnt av de regionale helseforetakene. Helsedirektoratets bearbeidelse og gjennomgang av utkast til handlingsprogram, blir publisert på Helsedirektoratets nettside om kreft.
Referansegruppe – andre utgave av handlingsprogrammet
- Petter Brandal, Avdeling for kreftbehandling, Oslo universitetssykehus HF (leder)
- Kirsten Marienhagen, Kreftavdelingen, Universitetssykehuset Nord-Norge HF
- Line Bjorland, Avdeling for blod- og kreftsykdommer, Helse Stavanger HF, Stavanger universitetssjukehus
- Jorunn Brekke, Avdeling for kreftbehandling og medisinsk fysikk, Helse Bergen HF, Haukeland universitetssjukehus
- Tora Skeidsvoll Solheim, Kreftklinikken, St. Olavs Hospital HF
- Roar Kloster, Nevrokirurgi-, øre-nese-hals-, og øyeavdelingen, Universitetssykehuset Nord-Norge HF
- Ole Solheim, Nevrokirurgisk avdeling, St. Olavs Hospital HF
- Rupavathana Mahesparan, Nevrokirurgisk avdeling, Helse-Bergen HF, Haukeland universitetssjukehus
- Pål A. Rønning, Nevrokirurgisk avdeling, Oslo universitetssykehus HF
- Einar O. Vik-Mo, Nevrokirurgisk avdeling, Oslo universitetssykehus HF
- Anette Storstein, Nevrologisk avdeling, Helse-Bergen HF, Haukeland universitetssjukehus
- Kjell Arne Kvistad, Klinikk for bildediagnostikk, St. Olavs hospital HF
- Snezana Maric, Radiologisk avdeling, Helse-Bergen HF, Haukeland universitetssjukehus
- Anders Palmstrøm Jørgensen, Avdeling for endokrinologi, sykelig overvekt og forebyggende medisin, Oslo universitetssykehus HF
- Kristin Myrmel, Klinisk patologi, Universitetssykehuset Nord-Norge HF
- Pitt Niehusmann, Avdeling for patologi, Oslo universitetssykehus HF
- Anne J. Skjulsvik, Avdeling for patologi, St. Olavs hospital HF
- Urd Teresia Wangensteen, Avdeling for medisinsk genetikk, Oslo universitetssykehus HF
- James Connelly, Avdeling for nukleærmedisin, Oslo universitetssykehus HF
- Hanna Helgetun Krogh, fastlege, Kalvskinnet legesenter
Oppdateringsgruppe – andre utgave av handlingsprogrammet for hjernesvulst generelt
- Anette Storstein, Nevrologisk avdeling, Helse-Bergen HF, Haukeland (leder)
- Line Bjorland, Avdeling for blod- og kreftsykdommer, Helse Stavanger HF, Stavanger universitetssjukehus
- Kristin Myrmel, Klinisk patologi, Universitetssykehuset Nord-Norge HF
- James Connelly, Avdeling for nukleærmedisin, Oslo universitetssykehus HF
- Kjell Arne Kvistad, Radiologisk avdeling, St. Olavs hospital HF
- Urd Teresia Wangensteen, Avdeling for medisinsk genetikk, Oslo universitetssykehus HF
- Roar Kloster, Nevrokirurgi-, øre-nese-hals-, og øyeavdelingen, Universitetssykehuset Nord-Norge HF
- Petter Brandal, Avdeling for kreftbehandling, Oslo universitetssykehus HF
Kontaktpersoner i Helsedirektoratet
- Kontaktperson i Helsedirektoratet: Kaja Fjell Jørgensen, avdeling for fagutvikling i spesialisthelsetjenesten, kaja.fjell.jorgensen@helsedir.no.
- Fagansvarlig på kreftområdet er Sissi Espetvedt: sissi.leyell.espetvedt@helsedir.no
Habilitet
Sist faglig oppdatert: 17.04.2024
Representantene i oppdateringsgruppen har fylt ut Helsedirektoratets habilitetsskjema. Ingen interesser med konsekvenser for deltakelse i arbeidet er identifisert. Skjemaene er arkivert i Helsedirektoratet.
Referanser
Sist faglig oppdatert: 17.04.2024
Helsedirektoratet. (2012). Veileder for utvikling av kunnskapsbaserte retningslinjer (IS-1870). ISBN-nr. 978-82-8081-225-4. Hentet fra https://www.helsedirektoratet.no/









