Kreft i galleveier og galleblære - handlingsprogram
Innledning
Sist faglig oppdatert: 28.05.2024
Dette handlingsprogrammet gir anbefalinger for utredning og behandling ved mistanke om, eller for etablert:
- Intrahepatisk kolangiocarcinom
- Perihilært kolangiocarcinom
- Distalt kolangiocarcinom
- Galleblærecancer
Dette er fire kreftsykdommer i galleveiene med noen fellestrekk og flere individuelle særtrekk. Blant fellestrekkene er dårlig prognose og en høy andel pasienter som ikke kan tilbys potensielt kurativ kirurgisk behandling. Videre er diagnostikk, stadieinndeling og reseksjonsvurdering kompleks, biopsi oftest manglende eller mangelfull, og sykdommene såpass sjeldne at få får reell erfaring med et stort antall pasienter. Samtidig er den internasjonale forskningsfronten i rask utvikling.
Periampullære adenocarcinomer regnes ofte til gallegangssvulstene (biliary cancers), men er ikke tatt med i dette handlingsprogrammet. Oftest blir disse behandlet som pankreaskreft frem til biopsi eller resektat foreligger, og det henvises derfor til handlingsprogrammet for pankreaskreft.
For galleblærekreft skiller engelskspråklig litteratur mellom svulster som oppdages uventet ved rutineundersøkelse av kirurgisk resektat («incidental gallbladder cancer») og svulster som er diagnostisert, eller mistenkt, før eller under kirurgi. I mangel på et godt norsk begrep har vi i dette handlingsprogrammet brukt betegnelsen «insidentell» galleblærekreft for den første gruppen. Der svulsten er kjent før reseksjon, omtales dette kun som galleblærekreft eller galleblærekreft «in situ».
Fastlegens rolle
Sist faglig oppdatert: 28.05.2024
Epidemiologi
Sist faglig oppdatert: 28.05.2024
Det angis ca. 320 nye tilfeller av gallegangskreft (iberegnet galleblærekreft) per år i Norge, men bare omtrent to tredjedeler av disse er histologisk/cytologisk verifiserte. Av disse 320 er omtrent 130 intrahepatiske, 120 ekstrahepatiske (perihilære og distale) og 70 galleblærecancere (Larsen, 2023).
Det er stort sett adenocarcinomer, median alder er 73 år, men median alder kan være lavere hos individer med underliggende leversykdom (som PSC) eller koledochuscyste. Forekomsten er 2–3 ganger høyere hos kvinner. Etter nyere internasjonal terminologi regnes ikke periampullære kreftsvulster eller galleblærekreft som kolangiocarcinom, men som egne beslektede biliære kreftformer.
Kolangiocarcinomer deles i tre grupper (se nedenfor, med engelskspråklig forkortelse i parentes). De adskiller seg fra hverandre mht. forekomst, biologi og behandling:
- Intrahepatisk kolangiocarcinom (iCCA)
- Perihilært kolangiocarcinom (pCCA), tidligere: Klatskin-svulster
- Distalt kolangiocarcinom (dCCA)
Dette dokumentet omhandler også galleblærecancer (GBC), og i noen sammenhenger i dette handlingsprogrammet betegnes denne krefttypen som kolangiocarcinom fordi dette har vært praksis (bl.a. i statistikk fra Kreftregisteret og andre publikasjoner).
Fem-års overlevelse for alle kolangiocarcinomer rapporteres av Kreftregisteret (Larsen, 2021) å være omtrent 25 % – iberegnet insidentell galleblærekreft (som altså har vært ukjent før histologisk vurdering foreligger, og må antas å dra estimatet markant opp). For etablert tumor på diagnosetidspunktet anslås at færre enn en tredjedel av pasientene vil kunne tilbys reseksjonskirurgi. Publisert overlevelse for resecerte pasienter er avhengig av stadium og type, og vil derfor være tungt påvirket av seleksjon til kirurgi.
Generelle risikofaktorer
Sist faglig oppdatert: 28.05.2024
Spesielt primær skleroserende kolangitt (PSC) utgjør en betydelig risikofaktor for alle typer kolangiocarcinomer, med livstidsrisiko på 10–20 % (Weismüller et al., 2017). For denne pasientgruppen vises til dedikerte internasjonale retningslinjer (EASL Clinical Practice Guidelines on sclerosing cholangitis, 2022).
Visse andre lever- og/eller gallegangssykdommer preget av kronisk inflammasjon medfører en økt risiko for utvikling av kolangiocarcinom, selv om kolangiocarcinom også kan oppstå spontant i en i utgangspunktet frisk lever. Gallegangssykdommer som primær biliær kolangitt (PBC), gallestenssykdom og enkelte typer koledochuscyster er assosiert med økt risiko for utvikling av kolangiocarcinom (Clements et al., 2020). I endemiske områder (Thailand, Kina (Valle et al., 2021)) er leverikter (liver flukes) den klart viktigste risikofaktoren. De fleste kolangiocarcinomer i Norge oppstår hos pasienter uten kjente risikofaktorer.
Lang felles utførselsgang (ofte angitt til > 15 mm) for pankreassaft og galle («long common channel» eller «pancreato-biliary maljunction») er assosiert med utvikling av perihilært eller distalt kolangiocarcinom og galleblærekreft hos unge asiatiske kvinner (Hundal et al., 2014; Wernberg et al., 2014), men kanskje også hos vestlige pasienter (Muraki et al., 2022).
Noen koledochuscyster har malignt potensiale (se eget avsnitt Koledochuscyster).
Spesielle risikofaktorer for intrahepatisk kolangiocarcinom
Kronisk virale hepatitter (HBV, HCV), overvekt, metabolsk dysfunksjonsassosiert steatohepatitt (MASH) og levercirrhose er risikofaktorer, særlig for intrahepatisk kolangiocarcinom (Clements et al., 2020; Izquierdo-Sanchez et al., 2022).
Spesielle risikofaktorer for galleblærekreft
Norge er et lavinsidensland for galleblærekreft. Det rapporteres ca. 60–70 nye tilfeller per år. Rundt halvparten blir påvist etter kolecystektomi for antatt benign sykdom (insidentell GBC), og fanges først opp ved histologisk undersøkelse.
Kjente risikofaktorer for galleblærekreft er:
- Neoplastiske polypper i galleblæren
- Kronisk inflammasjon (gallesten/PSC).
Forkalket galleblære («porselensgalleblære») var tidligere ansett som en risikotilstand, men dette er betydelig tonet ned.
Pasienter med urfolksbakgrunn fra Chile/Andesplatået/Sørvest USA og pasienter fra noen regioner på det indiske subkontinent (bl.a. kvinner fra nord i India/Bangladesh og menn fra Korea) har svært forøket risiko for GBC. Det har også vært antydet økt risiko hos pasienter fra øst-europeiske land som Polen, Tsjekkia og Ungarn (Salazar et al., 2019; Valle et al., 2021).
Anbefaling:
- Det skal utvises spesiell kreftmistanke ved galleblæresykdom/-plager hos pasienter med primær skleroserende kolangitt (PSC). Terskel for utredning og behandling skal være svært lav.
Anbefaling:
- Det skal utvises spesiell kreftmistanke ved galleblæresykdom/‑plager med sannsynlig basis i kronisk inflammasjon hos pasienter fra høyinsidensområder. Terskel for utredning og behandling skal være svært lav.
Forebygging i helsetjenesten
Sist faglig oppdatert: 28.05.2024
De viktigste risikofaktorer som kan overvåkes/påvirkes er PSC, overvekt/metabolsk syndrom, virale hepatitter og cirrhose, galleblærepolypper, steinsykdom hos genetisk disponerte individer og koledochuscyster type I og IV.
Hvilke pasientgrupper skal utredes for mulig preklinisk sykdom – og hvordan?
Rutinemessig undersøkelse med tanke på kreftutvikling hos pasienter med PSC anbefales, med halvårlige blodprøver (leverprøver og CA19-9) og årlig ultralyd av galleblæren (Bowlus et al., 2019; Chapman et al., 2010). Avhengig av lokale ressurser kan ultralyd erstattes med MR/MRCP (Ali et al., 2018; American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference: definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis, 1992; Bowlus et al., 2019; Role of endoscopy in primary sclerosing cholangitis: European Society of Gastrointestinal Endoscopy (ESGE) and European Association for the Study of the Liver (EASL) Clinical Guideline, 2017), og MR/MRCP bør brukes der det er suspekt utfall på blodprøver (EASL Clinical Practice Guidelines on sclerosing cholangitis, 2022).
Effektiv og meningsfull radiologisk undersøkelse begrenses av utfordringene med å skille maligne fra benigne gallegangsstrikturer, og å oppdage tidlige stadier av kolangiocarcinom ved samtidig gallegangssykdom.
Anbefaling:
- Pasienter med PSC skal følges regelmessig med tanke på utvikling av galleblærekreft eller kolangiocarcinom.
Utredning og behandling av polypper i galleblæren
Galleblærepolypper påvises hyppig ved ultralydundersøkelse. De aller fleste av de små polyppene vil være «kolesterolpolypper» («veggfast gallesten») som definisjonsmessig ikke er polypper – og som ikke trenger behandling i kreftforebyggende øyemed. Kun et lite mindretall er neoplastiske («ekte polypper») som kan ha et malignt potensial, og diagnosen kan oftest avklares lokalt med dedikert ultralyd (kontrastforsterket og/eller med doppler), eller CT med kontrast. Den følgende omtalen gjelder neoplastiske polypper.
Neoplastiske polypper < 5 mm er sjelden maligne. Risikoen er økende med økende størrelse. Den lave morbiditeten ved laparoskopisk kolecystektomi i dag tilsier relativt liberal bruk av kolecystektomi, og et regime med kontroller vil ofte praktisk sett være en vanskelig strategi.
Ved PSC anbefaler enkelte internasjonale retningslinjer kolecystektomi ved alle galleblærelesjoner uansett størrelse (Chapman et al., 2010), mens den nyeste EASL-publikasjonen setter en grense ved 8 millimeter eller voksende polypper (EASL Clinical Practice Guidelines on sclerosing cholangitis, 2022).
Anbefaling:
- Primærutredning av polypper i galleblæren er dedikert ultralyd for å verifisere at det dreier seg om en neoplastisk (ekte) polypp.
Anbefaling:
- Polypper < 10 millimeter som ikke vokser over tre kontroller (årlig UL), trenger ikke kontrolleres videre.
Anbefaling:
- Anbefaling om kolecystektomi (på lokalsykehus):
- Polypper > 10 mm eller polypper som vokser.
- Polypper < 10 mm der pasienten ønsker kolecystektomi fremfor kontroller.
- Polypp hos pasient med PSC.
- Polypp hos pasient med opprinnelse fra et område som er endemisk for galleblærecancer.
- Ved mistanke om malign tumor skal pasienten henvises til spesialavdeling.
- Der det foreligger kontraindikasjoner mot kirurgi, eller pasienten ikke ønsker kirurgi for et mulig forstadium til kreft, kan kontroller være et alternativ gitt at det ikke foreligger klare risikofaktorer.Anbefalingen er da årlig UL - fortrinnsvis med kontrast -som kan avsluttes etter 3 år hvis det ikke tilkommer vekst (Foley et al., 2022; Kamaya et al., 2022).
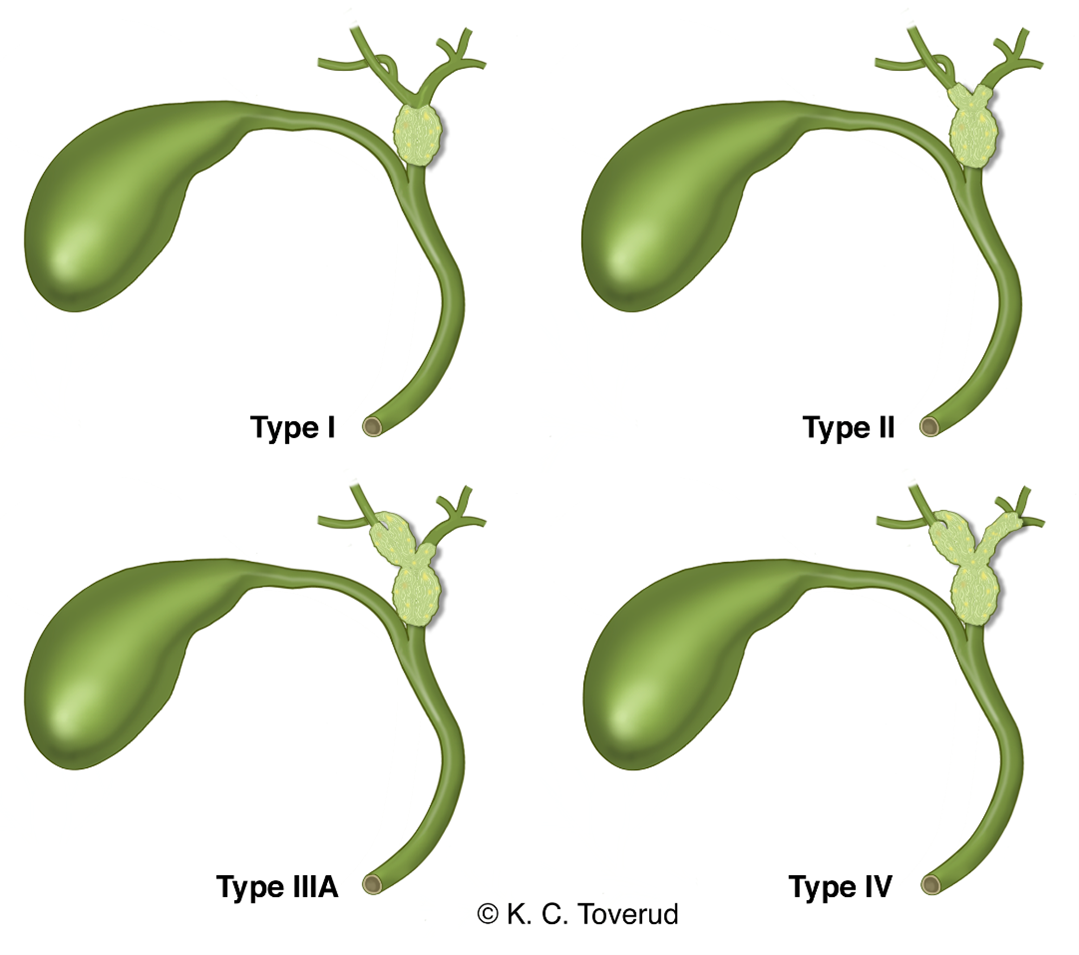
Koledochuscyster
Referanselitteraturen angir ganske sjablonmessig at koledochuscyster type I og IV skal reseceres pga. risiko for kreftutvikling, se figur. Distinksjonen mellom fysiologisk dilatasjon av koledochus og ekte koledochuscyste er usikker. Nesten alt datagrunnlag stammer fra asiatiske pasienter eller fra (symptomgivende) cyster hos barn og overførbarheten til asymptomatiske voksne, vestlige pasienter er usikker. En spørreundersøkelse blant nordeuropeiske kirurger demonstrerte at praksis er langt mer restriktiv (Brudvik et al., 2019).

I Dilatasjon av ekstrahepatiske gallegang (vanligste type, utgjør ca. 80–90 % av alle gallegangscyster); beskrives i tre underformer: Cystisk (Ia)/sakkulær (Ib)/fusiform (Ic)
II Ekstrahepatisk, supraduodenal gallegangsdivertikkel
III Intraduodenalt divertikkel (koledochocele)
IV Intra- og ekstrahepatisk dilatasjon av gallegang
Undertype IVa – Multiple intra- og ekstrahepatiske cyster
Undertype IVb – Multiple ekstrahepatiske cyster
V Multiple intrahepatiske cyster (Carolis sykdom) (Ten Hove et al., 2018).
Anbefaling:
- Det foreligger ikke tilstrekkelig datagrunnlag for å anbefale reseksjon for alle voksne, asymptomatiske, genetisk ikke-asiatiske pasienter med koledochuscystetype I eller IV.
Forstadier
Biliær intraepitelial neoplasi (BilIN) I-III beskriver mikroskopiske funn av intraepitelial neoplasi, med økende grad av dysplasi (lavgradig, moderat og høygradig). BilIN III er ekvivalent til carcinoma in-situ.
Intraduktal papillær neoplasi i gallegangen (IPNB) er den biliære analog til IPMN i pankreas (Ettel et al., 2015). Som i pankreas finnes dilatert gangsystem med makroskopisk papillær vekst, men viktige forskjeller er at kun et mindretall har mucinproduksjon samt at den pankreaticobiliære histologiske undertype nå er vanligst. Biopsier angir gradering av dysplasi som for IPMN.
Biliært mucinøst cystadenom (BMCA) regnes som forstadium (prekursor) for intrahepatisk biliært cystisk adenocarcinom (Averbukh et al., 2019). De utgjør en liten del av levercystene, og den typiske pasient er kvinne rundt 40–50 år. BMCA kan bli store og har gjerne et septert indre og en tykk vegg, tidvis med kalsifisering. De aller fleste har histologisk ovarialt stroma, likt motstykket mucinøs cystisk neoplasi (MCN) i pankreas (Ettel et al., 2015). Ved etablert diagnose anbefales reseksjon.
Pakkeforløp for kreft
Sist faglig oppdatert: 28.05.2024
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er et standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Les mer om Pakkeforløp for galleveiskreft.
Det er egne Diagnoseveiledere for inngang til pakkeforløp for kreft.
Diagnostikk og utredning
Symptomer
Sist faglig oppdatert: 28.05.2024
For perihilære og distale kolangiocarcinomer er ikterus det vanligste symptomet som leder til diagnose. Kolangitt er uvanlig. Intrahepatiske kolangiocarcinomer og galleblærekreft gir ikke tidlig obstruksjon av gallegang og dermed sene symptomer som oftest vil reflektere inflammasjon (smerter under høyre ribbebue) eller lokalavansert/metastatisk sykdom (ikterus/sykdomsfølelse/vekttap). Mange oppdages tilfeldig ved radiologiske undersøkelser.
Utredning ved lokalsykehus og henvisning
Sist faglig oppdatert: 28.05.2024
Dette er sjeldne og alvorlige sykdommer og tidlig kontakt med HPB-kirurg anbefales. Pasientene kan henvises så snart CT-abdomen foreligger. CT-thorax kan tas senere, men ventetid på dette bør ikke forsinke henvisning. Utredning ved lokalsykehus skal sikre relevante biokjemiske analyser og henvisningen bør inneholde en vurdering av pasientens komorbiditet, funksjonsnivå og preferanser. Hvis pasienten vurderes som mulig kandidat for kirurgisk behandling skal vedkommende henvises til spesialavdeling, og det skal ikke gjøres ERC, PTBD, biopsi, EUS, børstecyt eller noen form for invasiv utredning. Dette gjelder selv ved betydelig ikterus og/eller kolangitt.
Feilaktig instrumentering og tidstap kan forverre pasientens prognose.
De vanligste differensialdiagnosene for kolangiocarcinomer er:
- Intrahepatiske: Hepatocellulært carcinom, metastaser fra annet origo, abscess
- Perihilære/distale: Kolangitt, PSC, IgG-4-assosiert sykdom
- Galleblærekreft: Kolecystitt/adenomyomatose
Henvisningen bør inneholde informasjon om:
- Pasienten: Komorbiditet og risikofaktorer, funksjonsnivå (ECOG) og preferanser
- Lever: Cirrhose, hepatitt, PSC, annen leversykdom, etylmisbruk, leverfunksjon
- Annet: Tidligere pankreatitt, gallesten, kolecystitt, andre relevante sykdommer
- Standard blodprøver, samt CEA, CA 19-9, IgG-total/IgG-4 og aFP. (Disse kan ettersendes slik at det ikke forsinker henvisningen)
Det vises til eget avsnitt om Bildediagnostikk. Gitt at det foreligger en adekvat CT eller MR som gir mistanke om kreft, kan potensielt operable pasienter henvises til kirurgisk spesialavdeling uten ytterligere radiologisk utredning. Ventetid på radiologi ved lokalsykehus bør ikke forsinke henvisning til spesialavdeling.
Adenomyomatose i galleblæren kan av og til være vanskelig å differensiere sikkert fra galleblærekreft. I tvilstilfeller kan disse henvises til spesialavdeling for utfyllende diagnostikk og vurdering.
Utredning ved avdeling med spesialkompetanse
Sist faglig oppdatert: 28.05.2024
Hensikten med utredningen er å utelukke ikke-maligne tilstander, identifisere pasienter som kan få (og ha nytte av) reseksjon for kreftsykdom, samt avklare hvilke pasienter som bare skal ha et onkologisk tilbud. Dette er komplekst og tilligger avdelinger med spesialkompetanse i lever- og pankreaskirurgi. Muligheten for IgG-4 assosiert sykdom bør vurderes. Det kan være umulig å skille dette fra malignitet radiologisk, og adekvate laboratorieprøver bør tas. Også andre tilstander som infeksjon med actinomyces, PSC, sarkoidose i lever/galleveier og IPNB kan fremstå som hilære kolangiocarcinomer.
Når skal det gjøres cytologi eller biopsi?
Ved kvalifisert mistanke om kolangiocarcinom eller galleblærekreft skal det ikke tas biopsi dersom pasienten vurderes for kirurgi. Det samme gjelder børstecytologi.
I noen tilfeller kan preoperativ histologisk eller cytologisk diagnostikk av perihilært kolangiocarcinom være ønskelig. Diagnostisk kan man ved ERC eller PTC utføre børstecytologi, men spesifisitet og sensitivitet er lav. Kolangioskopi med biopsi har høyere sensitivitet og spesifisitet og kan brukes dersom strikturen tillater det (Badshah et al., 2019; Gerges et al., 2020). For begge modaliteter tilkommer en viss risiko for pankreatitt.
For pasienter som ikke skal reseceres, men hvor diagnose må sikres, kan EUS med FNA/B av tumor, eller lokoregional/perifer lymfeknute utføres.
Anbefaling:
- Det skal ikke gjøres perkutan biopsi ved mistanke om resektabelt (eller potensielt resektabelt) kolangiocarcinom/galleblærekreft. Cytologisk verifisering er ikke nødvendig for reseksjon og skal ikke rutinemessig forsøkes.
Anbefaling:
- Henvisning til spesialavdeling bør i tillegg til standard hematologiske prøver inneholde verdier for CRP, albumin, bilirubin og kreatinin. Det bør tas prøver for CA19-9, CEA, aFP, IgG-total og IgG‑4, men svar kan ettersendes eller ringes slik at dette ikke forsinker henvisningen.
Anbefaling:
- Henvisning til spesialavdeling bør skje omgående ved mistanke om kreft i galleveier eller galleblære for pasienter der kirurgisk behandling kan være aktuelt. Det bør ikke gjøres noen endoskopisk eller perkutan instrumentering, herunder heller ikke noe forsøk på ERC, PTC, biopsi, EUS, børstecyt eller noen form for invasiv utredning, selv ved betydelig ikterus.
For galleblærekreft in situ er målet å avklare diagnose, indikasjon (fravær av metastaser) og teknisk resektabilitet. Distinksjonen mellom carcinoma-in-situ (TiS)/T1a og T1b er i utgangspunktet ikke mulig preoperativt, og tumor som er synlig på CT/MR må antas å være T1b eller høyere. Biopsi skal ikke benyttes i situasjoner der kirurgi kan være aktuelt.
Anbefaling:
- Ved mistanke om galleblærekreft in situ skal galleblære/tumor ikke biopseres med mindre pasienten er uaktuell for kirurgisk reseksjon.
Bildediagnostikk ved mistanke om kreft i galleveier eller galleblære
Sist faglig oppdatert: 28.05.2024
Bildediagnostikk kan gjøres ved lokalsykehus etter avtale med spesialavdeling.
CT-undersøkelse bør omfatte thorax og abdomen. Kolangiocarcinomer har gjerne langsom kontrastoppladning, det anbefales opptak i følgende kontrastfaser: sen-arteriell, portovenøs, ekvilibriumfase og senfase (5–10 min. etter kontrastinjeksjon). Portovenøs fase kan gjerne inkludere bekken. God bildekvalitet er vesentlig, og det skal brukes tilstrekkelig stråledose og kontrastmiddeldose.
Komplett MR-undersøkelse bør omfatte både MRCP og avbildning av lever- og pankreasparenkym, inkludert senfaser etter kontrastinjeksjon, samt diffusjonsopptak. Det hepatocyttspesifikke kontrastmiddellet gadoksetinsyre (Primovist) kan være nyttig ved intrahepatisk kolangiocarcinom for å se satelittlesjoner/metastaser. For perihilære/distale kolangiocarcinomer brukes gjerne kontrastmidler uten hepatocyttopptak. Hvis tumor gir galleveisobstruksjon med forhøyet serum-bilirubin påvirkes både hepatocyttopptaket og galleveisutskillelsen av gadoksetinsyre. Hvis det er usikre stenoser framstilt på 3D MRCP kan man få supplerende informasjon med 2D opptak med tykkere snitt.
FDG-PET: For lav sensitivitet til rutinebruk, men kan være nyttig i noen tvilstilfeller eller der en vil avklare ekstrahepatisk sykdom (Weber et al., 2015).
Laboratorieprøver
Sist faglig oppdatert: 05.05.2023
Utover standardprøver bør CEA, CA 19-9, AFP, IgG-total og IgG-4 sikres.
Utredningsforløp
Sist faglig oppdatert: 05.05.2023
Se avsnitt Utredning ved lokalsykehus og henvisning.
Hvilke gallegangsstrikturer er malignitetssuspekte?
Sist faglig oppdatert: 28.05.2024
Pasienter med nyoppdaget striktur/stenose i galleveiene skal henvises kirurgisk spesialavdeling for malignitetsutredning. Pasienter med PSC har eget kontrollopplegg og blir henvist ved suspekte funn.
Kolangiocarcinomer kan vokse longitudinelt infiltrativt i vegg, nodulært som tumor, eller polypoid intraduktalt. For ekstrahepatiske kolangiocarcinom er den førstnevnte vanligst, og kan presentere seg som stenose uten solid tumor. Differensialdiagnoser inkluderer ekstern kompresjon eller benigne stenoser (iatrogene, inflammatoriske, IgG-4 sykdom, infeksjoner, stenproblematikk, etc). Initial utredning vil vektlegge disponerende sykdommer som PSC.
Visse bildediagnostiske funn øker sannsynlighet for malignitet. Dette er abrupt avslutning, lengde > 2 cm, veggtykkelse > 1.5 mm, uregelmessig vegg, asymmetrisk stenose, dårlig definert ytre avgrensning samt tilstedeværelse av fokal masse, lokale patologisk forstørrede lymfeknuter og spesifikke kontrastoppladningsmønstre ved CT/MR (Saluja et al., 2007; Suthar et al., 2015; Tirotta et al., 2020). CA 19-9 kan stige ved enhver gallegangsobstruksjon, og må tolkes med varsomhet i lys av dette (Liang et al., 2015). Lav verdi utelukker ikke kreft.
Klinisk og radiologisk stadieinndeling
Sist faglig oppdatert: 28.05.2024
Her er kun gjengitt de viktigste punktene for klinikeren. M1-sykdom utelukker alltid direkte reseksjon for disse sykdommene. (Komplett oversikt finnes på: TNM Classification of Malignant Tumours, 8th edition (uicc.org).
Stadieinndeling intrahepatisk kolangiocarcinom
For intrahepatisk kolangiocarcinom er «gammel» terminologi beholdt i UICC/TNM versjon 8, der N1=regional lymfeknutespredning, mens N2-kategorien er fjernet. Dette vanskeliggjør bruken av tilgjengelig evidens som er basert på terminologien opp til og med versjon 7.
Multifokalitet gir automatisk T2 og stadium II, N1-status gir automatisk stadium IIIB. Lymfeknuter ved trunkus coeliakus, para-aortalt eller paracavalt er M1-sykdom.
For høyresidige svulster omfatter regionale lymfeknuter hilære, peripankreatiske og periduodenale. For venstresidige svulster omfatter regionale lymfeknuter hilære og gastrohepatiske.
Stadieinndeling perihilært kolangiocarcinom
UICC versjon 8 har endret klassifisering av N-status for perihilære og distale kolangiocarcinomer (fra versjon 7) slik at forskjellen nå utelukkende dreier seg om antall lymfeknuter: N1(1‑3) og N2(≥4). Regionale lymfeknuter inkluderer de hilære. Patologiske lymfeknuter utenfor hilus klassifiseres som M1. N1-sykdom gir automatisk stadium IIIC.
Stadieinndeling distalt kolangiocarcinom
For ekstrahepatiske/distale kolangiocarcinomer er de regionale lymfeknuter langs koledochus, arteria hepatica medialt inn til trunkus, samt de posteriøre og anteriøre pankreatiske og langs AMS.
Stadieinndeling galleblærekreft
Tumorstadium er gjengitt i detalj, da det har direkte konsekvens for kirurgisk strategi.
- Tis: carcinoma in situ, infiltrasjon til basalmembranen
- T1a: infiltrasjon i lamina propria
- T1b: infiltrasjon av muscularis
- T2a: innvekst gjennom muskularis til perimuskulært bindevev/serosa, men kun i serosakledd «fri» del av fundus/corpus
- T2b: innvekst gjennom muskularis til perimuskulært bindevev i leverbundet del av fundus/corpus uten serosadekning
- T3: perimuskulær infiltrasjon, gjennomvekst av serosa eller direkte innvekst i lever eller andre naboorganer, altså ikke lenger begrenset til galleblæren
- T4: infiltrasjon av v. portae, a. hepatica, to eller flere ekstrahepatiske strukturer
Patologi
Sist faglig oppdatert: 28.05.2024
Intrahepatiske kolangiokarsinom
Subtyper
Disse svulstene deles inn i to typer: «large duct» og «small duct». «Large duct» oppstår nært leverhilus og ligner perihilært og ekstrahepatisk kolangiokarsinom. Small duct svulster forekommer typisk perifert i leveren.
Patogenese
Large duct tumor kan utvikle seg fra to typer intraduktale forstadier: biliær intraepitelial neoplasi (BilIN) og intraduktal papillær neoplasi (IPN) av gallegangene. BilIN utvikler seg til periduktalt infiltrerende karsinom som senere kan invadere leverparenkymet og danne solid, ekspanderende tumor. Ingen sikre definert forstadiumslesjon har blitt beskrevet for small duct tumor.
Makroskopisk utseende
Large duct iCCA vokser langs gallegangveggen som periduktale nodulære og skleroserende lesjoner nær høyre eller venstre levergang, og utvikler strikturer eller destruksjon av de affiserte gallegangene med variabel nodulær invasjon av leverparenkymet. Small duct tumor presenterer seg primært som hvitlige eller grå nodulære oppfylninger i leverparenkymet. I mer avanserte stadier består intarhepatiske kolangiocarcinomer av noduli av varierende størrelse som vanligvis vokser sammen.
Histopatologi
De intrahepatiske kolangiocarcinomene er nesten utelukkende adenokarsinomer hvor de fleste har et duktalt eller tubulært vekstmønster. De infiltrerer ofte portaltractus og portalkar (lymfekar og portale vener). Ved large duct iCCA er slimproduksjon vanlig, men dette er vanligvis fraværende i small duct svulster. Large duct svulster ligner histologisk på perihilært og ekstrahepatisk kolangiokarsinom. Perinevral og lymfatisk infiltrasjon og lymfeknutemetastaser er vanlig forekommende.
Small duct svulster danner tubulære formasjoner med distinkte lumina av kubiske til lave sylinderformede tumorceller med sparsomt cytoplasma, eller små tubulære, streng-lignende og spolformede formasjoner med et spaltelignende lumen. Vekstmønstrene sees ofte blandet. Small duct sykdom kan vise utbredt vekst i tumors periferi og sklerotiske og hypovaskulære områder sentralt.
Intrahepatiske kolangiocarcinomer graderes etter cellulær atypi og grad av kjerteldannelse (lavt, moderat, høyt differensiert).
Ekstrahepatisk cholangiokarsinom (perihilære og distale)
Patogenese
Det finnes to forstadier til disse karsinomene: biliær intraepitelial neoplasi og intraduktal papillær neoplasi, slik man også finner i intrahepatisk galleganger.
Makroskopisk utseende
Makroskopisk kan disse svulstene presentere seg som skleroserende, nodulære eller papillære typer. Den skleroserende typen er mest vanlig og danner strikturer. Tumor har ofte dårlig avgrensning.
Histopatologi
De fleste karsinomer er pankreatobiliær-type adenokarsinomer (uregelmessige kjertler og små cellegrupper ledsaget av desmoplastisk stroma, ofte med perinevral og lymfovaskulær invasjon).
Kombinert hepatocellulært-kolangiokarsinom (cHCC-CCA)
Patogenese
Patogenesen til cHCC-CCA er uklar. Flere molekylære studier av cHCC-CCA har støttet en felles klonal opprinnelse av disse komponentene. Noen studier har plassert cHCC-CCA nærmere intrahepatisk CCA enn HCC, men typiske mutasjoner sett ved HCC (f.eks. CTNNB1) og iCCA (f.eks. KRAS, IDH1) er påvist (Sasaki et al., 2017; Shibata et al., 2018).
Histopatologi
cHCC-CCA kan vise hele spekteret med typiske trekk for både HCC og intrahepatisk kolangiocarcinom. Det er ingen evidens som støtter en prosentmessig minimumsgrense for mengder av hver komponent som trengs for å stille diagnosen cHCC-CCA, og denne diagnosen stilles uavhengig av prosentandelen av hver komponent (WHO Classification of Tumours Editorial Board, 2019). Diagnosen stilles basert på H&E-morfologi og kan bekreftes ved hjelp av hepatocyttiske og kolangiocytiske immunhistokjemiske markører. Immunhistokjemiske funn alene er ikke tilstrekkelig for en cHCC-CCA-diagnose ved fravær av sikre histologiske funn. Fjernmetastaser kan vise enten cHCC-CCA-trekk eller en komponent av den opprinnelige tumoren
Et bredt spekter av immunhistokjemiske markører, som CK19, EpCAM, CD56, CD117 og CD133 har blitt brukt for å identifisere stamcelleegenskaper. Imidlertid er disse markørene ikke spesifikke for lever- eller kreftstamceller og kan være til stede både i HCC og iCCA.
Prognose
cHCC-CCA har vært assosiert med dårligere prognose enn HCC etter reseksjon. Det er så langt ikke identifisert prediktive markører for systemisk behandling. Prognosen for udifferensiert karsinom er dårligere enn HCC.
Galleblærecarcinom
Patogenese
Det antas at krefttilfellene drevet av forutgående inflammasjon går gjennom stadiene atrofi, metaplasi, dysplasi og til slutt karsinom, en prosess som kan ta tiår.
Makroskopisk utseende
De fleste galleblærecancere (70%) oppstår i fundus av galleblæren. De er vanligvis flate, faste, hvite, granulære og dårlig definerte svulster som typisk vokser diffust. Det er ofte vanskelig å skille karsinom fra kronisk kolecystitt selv med grundig makroskopisk undersøkelse. GBC-er som oppstår fra intrakolecystiske papillære neoplasmer har en eksofytisk komponent som kan fylle lumen av galleblæren.
Histopatologi
Adenokarsinom er den vanligste undergruppen av GBC, og kan ha flere ulike mønstre.
De fleste GBC-er har et pancreatobiliært utseende, og er morfologisk og biologisk like pankreatisk ductalt adenokarsinom (PDAC), bestående av bredt adskilte tubulære kjertler kledt av kubisk til sylinderformede celler i et variabelt cellulært eller kollagenøst, desmoplastisk stroma. Noen tumores viser meget høy grad av differensiering og kan være krevende å skille fra regelmessig slimhinne eller godartede lesjoner. Blant andre morfolgiske grupper finner man mikropapillært karsinom, intestinalt adenokarsinom, mucinøst adenokarsinom, klarcellet karsinom, lite sammenhengende/diffust infiltrerende karsinom med eller uten signetringceller, adenoskvamøst karsinom, plateepitelkarsinom, medullært karsinom, hepatoid karsinom, og sarkomatoid karsinom.
Differensialdiagnoser
Rokitansky–Aschoff sinus og adenomyomatøse forandringer kan være vanskelige å skille fra karsinom som viser små, tettpakkede kjertler med cellulær atypi, samt karsinom som oppstår i galleblærer med hyaliniserende kolecystitt. Luschka-kanaler kan ha et proliferativt og pseudoinfiltrativt utseende.
Rapportering
Rapporteringen bør være så enhetlig som mulig og gi mest mulig informasjon som kan være viktig for videre behandling av pasienten. International Collaboration on Cancer Reporting (https://www.iccr-cancer.org/datasets/published-datasets/digestive-tract/liver/) og Den norske patologforening har maler som kan brukes (Den norske patologforening, 2012).
Spesifikt om molekylære analyser
Sist faglig oppdatert: 28.05.2024
Kolangiocarcinomer og galleblærecarcinomer har relativt sett høy forekomst av mutasjoner, og enkelte av disse kan potensielt representere medikamentelle angrepspunkter («actionable targets»). Imidlertid er det per april 2024 ingen målrettet behandling godkjent for kolangiocarcinom. Siden genforandringer som kan utløse en aktuell målrettet behandling er relativt sjeldne, vanskeliggjør dette at nye behandlingsprinsipper kan testes gjennom den vanlige godkjenningsprosessen for medisinsk dokumentasjon: altså demonstrasjon av økt overlevelse i store randomiserte studier. Parallelt med at fagfeltet har utviklet seg, har slike målrettede medikamenter dog i økende grad blitt tilgjengelig for norske pasienter, dels gjennom kliniske studier (spesielt IMPRESS-Norway og etter hvert MATRIX-Rare), og dels gjennom programmer for «compassionate use» (CUP) i Norge (Sekretariatet for nye metoder, 2022).
Lite tilgjengelig vevsmateriale kan være begrensende for ulike molekylære analyser og adekvat mengde vev bør sikres for pasienter som ikke skal opereres (i praksis biopsi, ikke bare cytologi). Selv om noen onkogene mutasjoner antas å være gjensidig utelukkende (og strengt tatt taler for at videre analyser kan avlyses der det er påvist én mutasjon), vil ofte neste generasjons sekvensering (NGS) med genpaneler være å foretrekke fremfor en strategi med enkeltgenanalyser. NGS kan utføres på formalinfiksert parafinstøpt vev eller ferskfrosset vev. Der tilstrekkelig vev ikke er tilgjengelig, kan det vurderes å analysere sirkulerende tumor-DNA (ctDNA, «liquid biopsy») dersom slik metode er tilgjengelig.
Vi nevner derfor noen relevante tester som kan rekvireres i samråd med behandlende kliniker. Forut for en slik testing må pasienten informeres om risikoen for at man finner genforandringer der det i teorien finnes mulighet for respons eller nytte av en gitt behandling, men at behandlingen ikke finansieres av det offentlige.
Ekspertpanelet (helsenorge.no) kan forespørres om faglig råd.
Mikrosatellittinstabilitet
Svikt i «DNA mismatch repair» mekanismer (dMMR) og mikrosatellittinstabilitet (MSI-H) foreligger hos om lag 2 % av pasientene. Dette gir en fenotype som er assosiert med en relativt høy sannsynlighet for respons på behandling med immunologiske kontrollpunkthemmere (checkpoint inhibitors, PD-(L)1-hemmere).
Mutasjoner i enkeltgener
De hyppigst forekommende forandringene ligger i enkeltgenene IDH1 og FGFR2, og det er vist terapieffekt av medikamentene ivosidenib (IDH1-inhibitor) og pemigatinib (FGFR-tyrosinkinaseinhibitor), se avsnittet om onkologisk behandling. Det påvises mutasjoner langt oftere for intrahepatiske kolangiocarcinomer enn for kolangiocarcinomer i de andre lokalisasjonene. Videre er det også rapportert antitumorrespons ved bruk av målrettede medikamenter hos pasienter som har endringer i ERBB2, NRTK1/2/3, BRAF og BRCA1/2.
Anbefaling:
Molekylær profilering av svulstvev, fortrinnsvis med genpaneler (NGS), bør utføres for pasienter med inoperabel eller avansert kreft i galleveiene og god allmenntilstand.
Behandling
Kirurgisk behandling
Sist faglig oppdatert: 28.05.2024
Generell vurdering av resektabilitet
Kirurgi er eneste potensielt kurative behandling. Overlevelse avhenger primært av R-status, vaskulær invasjon og lymfeknutestatus. Reseksjon er beheftet med signifikant morbiditet (og for perihilære svulster også med signifikant mortalitet) og er kun aktuelt for pasienter i god allmenntilstand (WHO-ECOG status 0/1). I korthet består vurderingen av å avklare om pasienten er operabel, om tumor er resektabel, og å utelukke maligne ikke-regionale lymfeknuter eller andre metastaser. Ikke-maligne differensialdiagnoser må alltid vurderes. Hvis alt dette er tilfredsstillende kan pasienten eksploreres.
Maligne lymfeknuter utenfor leverligamentet vil i hovedsak utelukke reseksjon (unntatt for distale svulster) da prognosen er som ved metastasert sykdom (Kelly et al., 2014; Rassam et al., 2018), selv om noen av disse formelt vil kalles «regionale» etter UICC versjon 8. Hvis man skal resecere pasienter i situasjoner med patologi i formelt regionale lymfeknuter utenfor leverhilus bør inngrepet ha lav risiko da gevinsten er svært usikker. Selv N1-sykdom har stor innvirkning på overlevelse for intrahepatiske og perihilære kolangiocarcinomer, og for galleblærekreft og må med i vurderingen av mulig gevinst.
For distale kolangiocarcinomer vil i praksis alle lymfeknuter til høyre for arteria mesenterica superior være regionale og ikke utelukke reseksjon (mens aortocavale/periaortale vil regnes som M+).
Anbefaling:
- Reseksjon er kun aktuelt for pasienter i god allmenntilstand (WHO-ECOG 0/1).
Generelt om nytten av systematisk lymfadenektomi
Omtrent 40 % av pasientene med kolangiocarcinom har regional sykdom (N+) (Larsen, 2021; Liang et al., 2021). Prognosen er distinkt dårligere ved N+ status sammenliknet med N0 (Groot Koerkamp et al., 2015; Guglielmi et al., 2013; Liang et al., 2021; Morine et al., 2015). Det er ikke dokumentert om lymfadenektomi ved radikal kirurgi for kolangiocarcinom bare bedrer stadieinndeling eller om det også påvirker langtidsoverlevelse (Guglielmi et al., 2013). En nylig metaanalyse for intrahepatiske kolangiocarcinomer konkluderte med det samme (Zhou et al., 2019). Det finnes ingen RCT som kan belyse spørsmålet.
For lymfeknute-positiv sykdom rapporteres ofte et skille i langtidsoverlevelse mellom få (én eller to), eller flere lymfeknuter involvert (Liang et al., 2021; Suzuki et al., 2019). Andre peker på lymfeknuteratio, dvs. brøken med antall metastatiske lymfeknuter dividert på antall lymfeknuter ekstirpert, med en rate på 0.15–0.2 som prognostisk vannskille (Di Martino et al., 2022; Giuliante et al., 2016). Uansett rapporteres langtidsoverlevelse på opptil 10–30 % selv ved N+-sykdom, og best for de distale kolangiocarcinomene (Guglielmi et al., 2013; Morine et al., 2015; Suzuki et al., 2019). Formell lymfadenektomi er økende brukt både i vestlige og asiatiske land (Zhang et al., 2018), og selv om det er omdiskutert, må det anses som en integrert del av radikal kirurgi ved kolangiocarcinom, uansett lokalisasjon. Omfanget er spesifisert for den enkelte tumorentitet i respektive avsnitt.
UICC-manualen angir at disseksjonen ofte vil gi/bør gi minst 6 lymfeknuter ved reseksjon for intrahepatiske svulster og galleblærekreft, og 12–15 ved perihilære og distale svulster, men litteraturen peker på 6 lymfeknuter som tilstrekkelig. "Fangst" utover dette synes ikke å påvirke prognosen, men kan bidra til bedre staging (Giuliante et al., 2016; Liang et al., 2021).
Anbefaling:
- Systematisk lymfadenektomi anbefales for alle reseksjoner.
Om avlastende stenting av galleveier ved perihilære/distale kolangiocarcinomer
Som angitt over skal det ikke gjøres noen instrumentering på disse pasientene før det er konferert med senter som gjør lever- pankreas- og gallegangskirurgi (HPB-senter). Det bør uansett kun anlegges stent ved manifest kolangitt, eller som forberedelse til reseksjon eller kjemoterapi. Ikterus alene er ikke indikasjon for stenting. Pga. stentinduserte artefakter bør adekvat CT/MR/MRCP sikres før stenting. ERC og perkutant transhepatisk gallegangsdren (PTBD) har begge styrker og svakheter, og valget mellom modalitetene må individualiseres og baseres på obstruksjonsnivå, sykdomsutbredelse og lokale ressurser. Dette er pasientgrupper med spesielt høy risiko for infeksiøse komplikasjoner.
Ved resektabel eller potensielt resektabel sykdom
Der avlastning av perihilære eller intrahepatiske kolangiocarcinomer må gjøres bør dette i utgangspunktet bare omfatte fremtidig leverrest. Leversegmenter som planlegges resecert bør fortrinnsvis ikke kanyleres eller kontrastfremstilles. For distale (intrapankreatiske) kolangiocarcinomer bør stent unngås.
Der det planlegges kjemoterapi må galledrenasje sikres (bilirubinverdi forslagsvis under tre ganger øvre normalområde, evt. konferer med onkolog).
Ved ikke-resektabel sykdom
Noen pasienter vil trenge stent for å avlaste kolangitt, kløe eller for oppstart palliativ kjemoterapi. Perkutant transhepatisk galledren (PTBD) og retrograd stenting ved ERC har tradisjonelt vært ansett likeverdige for avlastning av fremtidig leverrest (FLR) forårsaket av perihilær eller hilusnær tumor (Hameed et al., 2016). En ny systematisk review konkluderer med noe mindre komplikasjoner hos pasienter som dreneres perkutant, transhepatisk (Van Eecke et al., 2022). Intrahepatiske svulster vil oftest stentes perkutant, mens helt distale og periampullære oftest stentes lettest med ERC. I en nederlandsk protokoll testes en ny teknikk («orphan stent») der en ved perkutan tilgang anbringer stent gjennom tumorbærende gallegang uten at papillen passeres og uten at det etterlates en ekstern komponent. OUS har REK-godkjenning for å inkludere pasienter i en slik kohortstudie.
Anbefaling:
- Avdeling med lever- og pankreaskirurgisk kompetanse skal ha vurdert pasienten før det gjøres noen instrumentering i galleveiene.
Volumekspanderende tiltak og preoperativ drenasje
Pasienter med svulster som affiserer hilus og medfører behov for leverreseksjoner med estimert restvolum på under 30 % må gjennomgå preoperative volumekspanderende tiltak somportveneembolisering (PVE) (Rassam et al., 2018). Dobbeltveneembolisering (DVE) er også et alternativ. Obstruerte galleganger i fremtidig leverrest (FLR), bør avlastes før det gjøres volumekspanderende tiltak. Den leverdelen som skal reseceres dreneres ikke. Ved kjent global leversykdom (NAFLD, steatose, fibrose osv.) bør restvolumet være minst 40 % (Esnaola et al., 2016), og sannsynligvis enda høyere. Tilstrekkelig avlastning vurderes ved normalisering av bilirubin med stent kun i FLR. Hvis det er stent også i kontralaterale lever (hvilket bør unngås), kan ikke normalisering av bilirubin alene brukes som indikasjon på funksjon i FLR. I slike tilfeller bør galleveienes kaliber i FLR være helt normalisert og volumkravet økes (Wiggers et al., 2016). Ved FLR i intervallet 30–50 % er det sannsynligvis ikke indisert å gjøre volumekspanderende tiltak såfremt man er sikker på at FLR er adekvat drenert og har kommet seg. Ved FLR > 50 % er det ikke indisert med avlastning av FLR selv ved sterkt forhøyet bilirubin (Wiggers et al., 2016).
Kirurgi ved intrahepatiske kolangiocarcinomer
Anslagsvis én av fem pasienter kan opereres (Olthof et al., 2023; Valle et al., 2021). Vurderingen er i hovedsak som ved annen leverreseksjon for malign tumor. Restleverens størrelse og funksjon vurderes. Ved tumor som vokser ned mot hilus, kan reseksjon av ekstrahepatiske galleveier være nødvendig. Preoperativ kjemoterapi (down-staging) bør vurderes ved lokalt avansert intrahepatisk kolangiocarcinom (kontakt med pedikkel eller levervene i gjenstående leverrest), og ved N1-sykdom og/eller multifokalitet (Le Roy et al., 2018).
Kirurgisk reseksjon av intrahepatiske kolangiocarciomer var assosiert med en 90-dagers postoperativ mortalitet på 12% og en 3-års overlevelse på rundt 50 % i en stor nederlandsk kohort (Olthof et al., 2023), men er sterkt påvirket av seleksjon. En stor meta-analyse oppgir 90-dagers mortalitet på 6 % (van Keulen et al., 2023). Ablasjonsbehandling kan være aktuelt hos enkelte pasienter med små lesjoner (Masoud et al., 2023).
Lymfadenektomi i leverhilus anbefales (Bagante et al., 2015; Bridgewater et al., 2014; Greenblatt et al., 2011). Ved venstresidige svulster er det tidvis tidlig lymfeknutemetastasering til ventrikkelens minorside og dette kvalifiserer alene ikke til M1-sykdom etter UJCC versjon 8. Den mest kraniale av de retropankreatiske lymfeknutene har sannsynligvis prognose som tilsvarer M1.Multifokalitet ved intrahepatiske kolangiocarcinomer
Multifokalitet er spesielt utfordrende. Det er ikke åpenbart om dette representerer multiple primærsvulster eller om alt er et uttrykk for intrahepatisk metastasering (Weber et al., 2015). Det er naturlig å oppfatte satellitt i annet segment enn primærtumor som metastase, og noen anser enhver multifokal tumor som et signal på inoperabilitet (Abou-Alfa et al., 2015). En stor kohortstudie av vestlige pasienter resecert for multifokal (>1) intrahepatisk kolangiocarcinom viste akseptabel overlevelse hos selekterte grupper. Faktorer assosiert med tidlig residiv og kort sykdomsspesifikk overlevelse var >2 tumores, lymfeknutemetastaser og R1-reseksjon (Buettner et al., 2019). Det ble imidlertid sett noen 5-års overlevere, spesielt i gruppen med bare to tumores. En ny meta-analyse bekrefter dette inntrykket (Jansson et al., 2023). Uansett må multiple tumores anses som et svært negativt prognostisk tegn (Moustafa et al., 2020), og preoperativ kjemoterapi bør vurderes. Spesielt gjelder dette ved multifokalitet over mer enn ett segment (Conci et al., 2018). Reseksjon av multifokalt intrahepatisk kolangiocarcinom bør vurderes strengt opp mot operativ risiko og gevinst, og ideelt sett i protokoll.
Anbefaling:
- Intrahepatisk kolangiocarcinom med multifokalitet (intrahepatiske metastaser, satellitter, flere primærsvulster) oppfattes som lokalavansert, og reseksjon anbefales ideelt sett innenfor studieprotokoll selv der det ikke foreligger manglende teknisk resektabilitet.
Kirurgi ved perihilære kolangiocarcinomer
Målet med kirurgi er å oppå en R0-reseksjon da flere studier tyder på at prognosen etter en R1 reseksjon er nesten like dårlig som for de ikke-resecerte. Nyere japanske studier viser at denne forskjellen ikke er målbar der det foreligger regionale metastatiske lymfeknuter (Hosokawa et al., 2023).
Resektabilitetsvurdering er ofte vanskelig og kan tidvis ikke avgjøres før eksplorasjon. Høyre leverarterie og portvene forløper rett bak gallegangens konfluens og dette gjør at disse hyppig er affiserte selv ved svulster som primært følger venstre gallegang. Bismuth-Corlette-klassifikasjonen har tradisjonelt vært enerådende, men gir ikke adekvat grunnlag for å bedømme resektabilitet eller overlevelse. Bismuth-Corlette type IV (2. ordens affeksjon av galleveier bilateralt) ble tidligere klassifisert som ikke-resektabel sykdom, men dette er ikke holdbart i dag (Ebata et al., 2018) selv om R1-raten må forventes å være høy. Ingen vestlige sentra har publisert serier som tilsvarer mer enn én reseksjon for perihilært kolangiocarcinom per måned.
Det er etter hvert betydelig dokumentasjon på at portvenerekonstruksjon for å oppnå resektabilitet har akseptabel morbiditet (Schimizzi et al., 2018; van Vugt et al., 2018). Rekonstruksjon av arteriesiden medfører mye høyere komplikasjonsrate, og er i utgangspunktet ikke indisert (der det samtidig skal gjøres formell leverreseksjon) (van Vugt et al., 2018). Bilateral arterieaffeksjon og portveneaffeksjon med kontralateral lobær atrofi signaliserer inoperabilitet.
Anbefaling:
- Volumekspanderende tiltak er anbefalt ved FLR < 30 %. God tilvekst fordrer at FLR allerede er adekvat drenert. Ved volum over 30 % uten adekvat/sikkert drenert FLR, må volumekspansjon vurderes individuelt.
Anbefaling:
- Drenasje av galleveier skal gjøres ved FLR < 50 %, og da kun i FLR. Drenasje av kontralaterale lever (som planlegges resecert) øker komplikasjonsrisikoen og ødelegger muligheten til å vurdere FLRs funksjon.
Anbefaling:
- Bilateral affeksjon av 2. ordens galleveier utelukker ikke R0-reseksjon.
Anbefaling:
- Portveneaffeksjon utelukker ikke reseksjon hvis portvenen kan rekonstrueres. Affeksjon av arterie til gjenværende lever vil vanligvis utelukke reseksjon.
Selv ved moderne radiologisk utredning påvises ikke-resektabel sykdom ved laparoskopi/laparotomi hos omtrent en tredjedel, og 20–30 % av pasienter operert med antatt R0 reseksjon har allikevel positiv margin (R1) (Mansour et al., 2015).
Reseksjon: Standard er formell leverreseksjon tilstrekkelig for å oppnå R0 med segment I og ekstrahepatiske galleveier samt lymfadenektomi i hilus (Hartog et al., 2016). Det er ikke dokumentert at lever- eller pankreasreseksjon øker overlevelsen der man kan sikre frie marginer ved reseksjon av tumor nedenfor konfluens (noen Bismuth-Corlette I eller II med veldig lav deling) (Kwon et al., 2014).
Arterieaffeksjon: Det er rimelig enighet ved vestlige sentra om at risikoen ved arterierekonstruksjon uten dokumentert overlevelsesgevinst ikke rettferdiggjør reseksjon (Hartog et al., 2016; van Vugt et al., 2018). Det er naturlig å vurdere dette noe annerledes hvis det ikke gjøres leverreseksjon (noen lave svulster).
Frysesnitt av gallegangsavsetning: har tradisjonelt vært anbefalt og ytterligere reseksjon kan tidvis resultere i R0. Det er dog ikke bevis for at bruk av frysesnitt eller ytterligere reseksjon forbedrer overlevelse med mindre markant større reseksjon kan utføres (Mantel et al., 2016).
Lymfadenektomi: Lymfatisk vev i leverhilus fjernes sammen med ekstrahepatisk gallegang.
Anbefaling:
Affeksjon av lymfeknuter utenfor leverligamentet tilsvarer ikke-regional lymfeknutemetastasering, og gir - i likhet med paraaortale og portocavale lymfeknuter - prognose som ved metastaser. Reseksjon anbefales ikke.
Kirurgi ved distale kolangiocarcinomer
Resektable distale kolangiocarcinomer går klar av gallegangenes konfluens. De opereres derved uten leverreseksjon, men med ekstrahepatiske galleveier, galleblære og regional lymfeknutehøst. For svulster som strekker seg ned i den intrapankreatiske delen av koledochus vil overgangen mot periampullære tumores og pankreastumor være vanskelig radiologisk, og utredning/reseksjonsvurdering vil oftest tilsvare tilsvarende vurdering for tumor i caput pankreatis.
Levertransplantasjon
Levertransplantasjon for ikke-resektabelt intrahepatisk kolangiocarcinom vurderes i ny protokoll (TESLA 1). Det skal foreligge stabil sykdom under kjemoterapi (6 mnd.) og ha gått minst 12 måneder fra diagnose. Det kan ikke foreligge noen form for ekstrahepatisk sykdom (inkludert lymfeknuter). Ikke-resektabelt residiv etter tidligere kirurgi (R0N0) kan i noen tilfeller vurderes gitt stabil sykdom under kjemoterapi (Oslo universitetssykehus, 2020). Lenke: TESLA1: Levertransplantasjon hos pasienter med ikke-operabel kreft i gallegangene i leveren - Oslo universitetssykehus HF (oslo-universitetssykehus.no)
Levertransplantasjon for ikke-resektable perihilært kolangiocarcinom vurderes i ny protokoll (TESLA 2). Det skal foreligge lokalisert sykdom, stabil under kjemoterapi i 10 måneder og påfølgende strålebehandling og ikke foreligge noen form for ekstrahepatisk sykdom (inkludert lymfeknuter). Det skal ha gått minst 12 måneder fra diagnosen (Oslo universitetssykehus, 2021). Lenke: TESLA2: Levertransplantasjon hos pasienter med kreft i gallegangene utenfor leveren - Oslo universitetssykehus HF (oslo-universitetssykehus.no)
Kirurgi ved galleblærekreft oppdaget in situ
All radiologisk påvist galleblærekreft må antas å være minst T1b.
- T1b: Standard kolecystektomi med regional lymfeknutehøst. Hvis tumor er i berøring med leverbundet del av galleblæren skal leverbrem tas med.
- T2a: Standard kolecystektomi (uten leverbrem), men med regional lymfeknutehøst.
- T2b: Utvidet kolecystektomi inklusive leverbrem fra Sg IVb/V og regional lymfeknutehøst.
- T3: Som T2b, samt med andre affiserte organdeler. Innvekst i duodenum/colon er ikke nødvendigvis assosiert med N+/M+-status og utelukker ikke reseksjon, selv om prognosen er dårlig.
- T4: Langtidsoverlevelse etter formell leverreseksjon, med reseksjon av kar og ekstrahepatiske galleveier, er anekdotisk og morbiditeten meget høy. Det anbefales derfor ikke reseksjon. Det er naturlig å revurdere situasjonen hvis det tilkommer markant og langvarig respons på kjemoterapi.
- T1b og høyere stadium:
- Ductus cysticus settes av flush i ductus hepatikus. Ved tumor i infundibulum eller annen mistanke om utstrekning til ductus, sendes frysesnitt av reseksjonsranden mtp. reseksjon av ekstrahepatiske galleveier.
- Lymfeknuter fjernes i leverhilus kranialt for pankreas og medialt til vena coronaria/trunkus coeliakus.
Tykkelsen på leverbrem (der det er anbefalt) er ikke avgjørende, men fri margin er avgjørende (Kwon et al., 2020). Minst 2 cm er rettledende for å unngå tumorkontakt/perforasjon. Formell segmentreseksjon er ikke nødvendig (Aloia et al., 2015). Sannsynligvis er det ikke gevinst av leverreseksjon der tumor utelukkende er lokalisert til peritonealkledd/fri del av fundus/corpus (Lee et al., 2015).
Mistanke om galleblærekreft under kolecystektomi
Dersom det ved kolecystektomi mistenkes galleblærekreft bør inngrepet avbrytes og pasienten henvises til senter med leverkirurgisk kompetanse. Kolangiografi, tumorbiopsi og perforasjon bør unngås.
Anbefaling:
- Ved intraoperativ mistanke om galleblærekreft bør inngrepet avbrytes og pasienten henvises til senter med leverkirurgisk kompetanse.
Anbefaling:
- Galleblærekreft ansees ikke resektabel hvis det foreligger fjernmetastaser eller maligne lymfeknuter utenfor leverhilus, eller der det er infiltrasjon av portvene eller leverarterie.
Kirurgi ved galleblærekreft oppdaget ved histologisk undersøkelse etter kolecystektomi
Galleblærekreft som oppdages ved histologisk undersøkelse etter kolecystektomi kalles også insidentell galleblærekreft (etter engelsk: «incidental gall bladder cancer»).
Pasientene bør utredes for eventuell re-reseksjon ved HPB-avdeling. Histologi bør revurderes av patolog med spesialkompetanse for å klarlegge T-stadium og reseksjonsmargin i ductus cysticus og mot leverbundet flate. Tilleggsutredning gjøres med CT-thorax/lever (3‑fase)/abdomen/bekken, evt. MRCP og blodprøver inkl. CA 19-9, CEA. Da galleblærekreft ofte synes godt på PET kan dette være nyttig for å utelukke disseminert sykdom ved T2+ eller evt. støtte avgjørelsen om å avstå fra ny kirurgi ved T1b. Ved PET kort tid etter primærinngrep kan lokal inflammasjon postoperativt være en feilkilde.
Målet er R0-reseksjon. Formell reseksjon av lever eller gallegang er kun indisert for å oppnå R0. Der det ved primærinngrepet er tilkommet perforasjon eller tumorskade, eller det foreligger andre klart negative prognostiske faktorer og man må anta at risiko for peritoneal utsæd er stor, kan det vurderes å legge inn en observasjonstid før ny radiologisk staging og eventuell re-eksplorasjon. Målet her er å unngå laparotomi uten gevinst (okkult utsæd) (Qadan et al., 2016). Prognosen er i all hovedsak bestemt av tumorbiologi – ikke av ventetid for re-eksplorasjon.
Pasienter med radiologisk (inkludert PET) sterk mistanke om maligne lymfeknuter i hilus kan vurderes for kjemoterapi før ny radiologisk staging og eventuell re-reseksjon.
Basert på histologisk T-stadium i resektatet fra kolecystektomien:
- BilIn-III/CiS/T1a: Ingen ytterligere tiltak (det samme gjelder dermed BilIN I–II).
- T1b: Gevinsten ved re-reseksjon er usikker hvis PET-CT er negativ. Individuell avgjørelse (Søreide et al., 2019).
- T2 eller T3: Re-reseksjon, hvis ikke kontraindisert (AT) eller avansert sykdom: Cysticusplate med leverbrem resesseres (se 6.1.9). Hos pasienter der man er sikker på at tumor er beliggende utelukkende i fri, serosakledd del av fundus/corpus, kan det vurderes om leverreseksjon kan fravikes, men kunnskapsgrunnlaget for dette er mangelfullt (Lee et al., 2015; Qadan et al., 2016).
- Lymfeknuter i ligamentet fjernes. Ikke indisert med ytterligere lymfadenektomi (Qadan et al., 2016).
Innledende eksplorativ laparoskopi vurderes ved T3+ tumor og hvis det var perforasjon under kolecystektomien. Trokarportene trenger ikke reseceres (Aloia et al., 2015; Qadan et al., 2016).
Anbefaling:
- Pasienter med insidentell galleblærekreft bør vurderes ved HPB-senter med tanke på re-reseksjon eller kjemoterapi.
Onkologisk behandling
Sist faglig oppdatert: 28.05.2024
Preoperativ kjemoterapi
Med neoadjuvant behandling forstås kjemoterapi før kirurgi ved direkte resektabel svulst med ambisjon om å redusere residivraten og derved bedre overlevelsen. Dette i motsetning til down staging eller down sizing som er kjemoterapi som har som ambisjon å endre de kirurgisk-tekniske forutsetningene eller erkjente negative prognostiske faktorer. Biopsibekreftet diagnose er som hovedregel en forutsetning for oppstart kjemoterapi.
Neoadjuvant kjemoterapi
Det finnes ingen randomiserte fase III-studier som støtter slik behandling.
Kjemoterapi for down-staging/down-sizing
Dette kan være aktuelt for pasienter der det foreligger:
- Teknisk grenseresektabilitet
- Prognostisk negative faktorer (avansert stadium), som ved stor primærtumor, multifokalitet, radiologisk suspekte lymfeknuter osv., dvs. en biologisk grensetilstand mot metastasert sykdom.
Det foreligger ikke fase III-studier som støtter bruk av preoperativ kjemoterapi. Samtidig følger det av situasjonen at effekten kan monitoreres radiologisk/biokjemisk hos den enkelte pasient, og behandlingen kan dermed avsluttes hvis gevinsten ikke er som ønsket – eller forlenges ved god respons, og det er naturlig å forsøke dette hos selekterte grupper. Noen pasienter vil progrediere på kjemoterapi, og disse pasientene vil sannsynligvis ha såpass aggressiv sykdom at de heller ikke ville profitert på reseksjon. Tumorrespons kan dermed veies opp mot bivirkninger.
Internasjonale retningslinjer anbefaler at preoperativ kjemoterapi vurderes ved radiologisk patologiske lymfeknuter i hilus ved intrahepatisk kolangiocarcinom (Vogel et al., 2023), og interessen for denne behandlingen er økende (Lang, 2021a).
Det er videre publisert data for pasienter med initialt ikke-resektable, eller grenseresektable intrahepatiske kolangiocarcinomer som har mottatt kjemoterapi før reseksjon og som har hatt overlevelse lik pasienter som har fått reseksjon direkte (Le Roy et al., 2018). Flere ulike kjemoterapiregimer ble benyttet i denne kohortstudien, men de fleste pasientene (44 av 74) hadde fått en kombinasjon av gemcitabin og oxaliplatin. I praksis vil man i denne situasjonen velge et gemcitabin-basert kombinasjonsregime (Gem-Ox, Gem-Cis). Neoadjuvant kjemoterapi fordrer histologisk eller cytologisk bekreftet kreftsykdom. For perihilære svulster bør dette gjøres med endoskopisk tilgang. For intrahepatiske svulster kan det gjøres perkutant.
Anbefaling:
- Preoperativ kjemoterapi for down-staging/down-sizing kan vurderes ved negative prognostiske faktorer og/eller ved grenseresektabilitet.
Adjuvant kjemoterapi
Generelt er adjuvant kjemoterapi konseptuelt utfordrende. Pasientene forutsettes radikalopererte, men antas å ha statistisk sannsynlighet for mikroskopisk (radiologisk negativ) restsykdom. Man kan ved oppstart av adjuvant behandling ikke skille de som virkelig er kurerte fra de med mikroskopisk restsykdom, og vurderingen av et tumorfritt forløp kan dermed kun bedømmes på gruppenivå. Høykvalitets fase III-studier er avgjørende for å kunne dokumentere effekt av slik behandling.
Foreløpige resultater av en britisk studie ved bruk av adjuvant capecitabine (BILCAP-studien) antydet klinisk meningsfull overlevelsesgevinst ved både R1 og R0-operert kolangiocarcinom. Denne studien inkluderte pasienter både med N0 og N+ sykdom, men ikke T1aN0R0. I påvente av endelig publikasjon uttalte NGICG-HPB gruppen at capecitabin midlertidig kunne vurderes som adjuvans. Da endelig publikasjon så forelå i 2019 (Primrose et al., 2019), fant gruppen at resultatene ikke tilsa at adjuvant capecitabin skulle anbefales rutinemessig.
Fem-års overlevelsesdata fra denne studien (Bridgewater et al., 2022) bekrefter det samme: det er en viss forskjell i overlevelse, men ikke signifikant. Studien er utført på en heterogen populasjon, rekruttering foregikk over mange år med få pasienter per senter, og kirurgien varierte, bl.a. med henblikk på lymfadenektomi. I lys av at øvrige studier i adjuvant setting ikke har vist økt overlevelse, spesielt PRODIGE-studien (som evaluerte gemcitabin/oxaliplatin) (Edeline et al., 2019), anbefales ikke adjuvant behandling rutinemessig i Norge. En fersk Cochrane-analyse støtter dette (Luvira et al., 2021).
Den japanske ASCOT-studien (Nakachi et al., 2023) antyder en mulig overlevelsesgevinst av det orale kjemoterapeutikum S1 sammenlignet med en ikke-behandlet kontrollgruppe, men langtidsdata foreligger ikke ennå. (Data cut-off date June 23 2021).
Acticca-1-studien randomiserer mellom capecitabin (kontroll) adjuvant og cisplatin/gemcitabin (intervensjon). Inklusjon var planlagt avsluttet i november 2021, men ble forsinket av COVID-pandemien. (Rekruttering skal være avsluttet (AMMF, 2022).)
Anbefaling:
- Det anbefales ikke rutinemessig adjuvant kjemoterapi ved resecert kolangiocarcinom.
Livsforlengende og/eller palliativ kjemoterapi
Median overlevelse ved palliativ kjemoterapi er ca. 1 år. Pasienter bør både være i god funksjonsklasse (ECOG 0-2) og ha tilfredsstillende lever- og nyrefunksjon for å kunne tåle systemisk onkologisk behandling. Mange vil trenge drenasje av obstruerte galleveier for å kunne motta systemisk behandling. Typisk må man tilstrebe en bilirubinverdi under 80 mmol/L, om mulig under 50 mmol/L. I en randomisert fase III studie ga gemcitabine-cisplatin (Gem-Cis) total overlevelse (OS) sammenliknet med gemcitabine monoterapi (Valle et al., 2010). Andre aktuelle gemcitabin-kombinasjoner med relativt lik effekt er Gem-Ox (oxaliplatin) og Gem-Cap (capecitabine). Kombinasjonskjemoterapi anses derfor som førstevalg ved lokalavansert sykdom, metastatisk sykdom eller inoperable lokale residiver. I Norge har også kobinasjonskjemoterapi med 5-FU/oxaliplatin (FLOX eller FOLFOX) blitt benyttet i førstelinje.
Det foreligger ingen etablert andrelinjes behandling. Man kan hos behandlingsmotiverte pasienter i god funksjonsklasse og allmenntilstand likevel vurdere 5-FU/irinotecan-basert kjemoterapi (FLIRI eller FOLFIRI).
Tillegg av immunterapi
PD-(L)1 hemmere som monoterapi har vist lave responsrater hos pasienter med kolangiocarcinom. TOPAZ-studien, en placebo-kontrollert fase III-studie (685 pasienter) der halvparten fikk PD-L1 hemmer (durvalumab) i tillegg til kjemoterapi (Gem-Cis) viste en statistisk signifikant forskjell i median overlevelse på 12.8 måneder (Gem-Cis + durvalumab) vs. 11. 5 måneder (Gem-Cis + placebo), p=0.021 (Oh et al., 2022). I en tilsvarende studie der pembrolizumab/placebo ble lagt til Gem-Cis (1069 pasienter), så man median overlevelse på 12.7 måneder i kjemoterapi+pembrolizumab-gruppen mot 10.9 måneder i kjemoterapi+placebo-gruppen (p=0·0034) (Kelley et al., 2023).
Behandling med Durvalumab i kombinasjon med gemcitabin og cisplatin til førstelinjebehandling av voksne med inoperabel eller metastatisk gallveiskreft er godkjent fra 1. juni 2024 https://www.nyemetoder.no/metoder/durvalumab-imfinzi-indikasjon-iii/.
Behandling med pembrolizumab i kombinasjon med GemCis er til vurdering i Nye Metoder
Målrettet behandling
For betraktninger rundt utvidet molekylær testing, samt forekomst av de aktuelle forandringer, se Spesifikt om molekylære analyser.
Av såkalt målrettet behandling, er det kun entrektinib som er innført som behandling i Norge (april 2024). Medikamentet er indisert der det er påvist NTRK-fusjon i svulstvevet hos pasienter som har a) lokalavansert eller metastatisk sykdom, eller der kirurgisk reseksjon forventes å kunne resultere i alvorlig morbiditet, og b) som ikke har mottatt tidligere behandling med NTREK-hemmer, og c) som ikke har noen tilfredsstillende behandlingsalternativer. Median responsvarighet med entrektinib er rapportert å være ti måneder, men med vide konfidensintervall (Doebele et al., 2020). Det må understrekes at forekomsten er svært lav (0.20%) hos pasienter med kolangiocarcinom (Westphalen et al., 2021).
Hos pasienter med tumorvev som har fått påvist fibroblastvekstfaktor-reseptor 2 (FGFR2)-fusjon eller rearrangering, har behandling med FGFR-hemmere vist responsrater på rundt 30 % (Abou-Alfa et al., 2020). Det har vært antatt at 10 til 15 % av kolangiocarcinomene har FGFR2-fusjon eller rearrangering, men anslagene er usikre. Beslutningsforum for nye metoder besluttet 12.12.2022 at "Pemigatinib (Pemazyre) innføres ikke som monoterapi til behandling av voksne med lokalt avansert eller metastatisk kolangiokarsinom med fibroblastvekstfaktor-reseptor 2 (FGFR2)-fusjon eller -rearrangering, med progresjon etter minst en tidligere linje med systemisk behandling" (Sekretariatet for nye metoder, 2022).
Ivosidenib har vist en sparsom effekt med tanke på overlevelse i en fase III-studie (10.7 måneder vs. 7.5 måneder med placebo) (Zhu et al., 2021). Bruk av medikamentet er til vurdering i Nye Metoder.
Anbefaling:
- GemCis med tillegg av durvalumab anbefales i 1. linje for pasienter i god allmenntilstand med inoperabelt kolangiocarcinom som ikke har intoleranse for noen av disse medikamentene. Alternativ behandling i 1. linje er GemOx eller GemCap.
Supplerende eller eksperimentell behandling ved lokalisert sykdom
Sist faglig oppdatert: 28.05.2024
Det er publisert en rekke studier hvor intervensjonsradiologiske metoder for lokoregional svulstbehandling er beskrevet. Ingen av metodene har så langt funnet en fast plass i internasjonale retningslinjer for behandling av kreft i galleveiene (Edeline et al., 2021).
SIRT/TARE
Selektiv intern radioterapi (SIRT), også betegnet som transarteriell radioembolisering (TARE), beskriver en metode hvor partikler ladet med radioaktivt stoff injiseres (super-) selektivt i arterier til svulst. Med metoden kan man oppnå svært høye stråledoser i tumor uten vesentlige bivirkninger i omgivende vev.
En singelsenter fase II-studie med 41 pasienter undersøkte kombinasjonen av SIRT med kjemoterapi som førstelinje behandling for ikke-resektable intrahepatiske kolangiocarcinomer. Man fant en median PFS på 14 måneder og median OS på 22 måneder, og 22 % av pasientene ble down-staget til kirurgi. En påfølgende RCT (SIRCCA trial) stoppet nylig inklusjon av pasienter grunnet rekrutteringsvansker. En metaanalyse fra 2021 av 18 publikasjoner med totalt 789 pasienter viste en samlet (pooled) overlevelse på 13,5 måneder ved ikke-resektabelt intrahepatisk kolangiocarcinom (Edeline et al., 2021; Mosconi et al., 2021). Ved OUS ble det startet en prospektiv kontrollert (ikke-randomisert) intervensjonsstudie for å teste dette i januar 2024 (TOMCAT).
TACE
Transarteriell kjemoembolisering kan enten utføres ved injeksjon av en emulsjon av oljeholdig kontrastmiddel og kjemoterapeutikum, eventuelt etterfulgt av arteriell embolisering, eller ved injeksjon av partikler ladet med cellegift.
En metaanalyse fra 2021 (Mosconi et al., 2021), sammenlignet overlevelse etter TARE og TACE ved ikke-resektabelt intrahepatisk kolangiocarcinom og fant ved samlet (pooled) analyse av 13 studier med totalt 903 pasienter en median overlevelse på 14,2 måneder i TACE gruppen. Betydelig inhomogenitet i pasientpopulasjonene gjør imidlertid tolkningen usikker. Det er ikke utført RCT for bruk av TACE ved intrahepatisk kolangiocarcinom
HAI/FUDR
Intraarteriell administrasjon i leveren (hepatic artery infusion, HAI) med bruk av et gammelt kjemoterapeutikum Floxuridin (FUDR) har vært forsøkt ved Memorial Sloan Kettering også ved ikke-resektabelt eller multifokalt intrahepatisk kolangiocarcinom. En multisenter RCT er under planlegging i USA/Rotterdam. Ved OUS ble det startet en prospektiv kontrollert (ikke-randomisert) intervensjonsstudie for å teste dette i januar 2024 (TOMCAT).
Anbefaling:
- Det anbefales ikke rutinemessig bruk av lokoregional terapi. Slike behandlingsformer skal vurderes nøye ved selekterte pasienter og bør primært kun tilbys innenfor forskningsprotokoll.
Strålebehandling
Sist faglig oppdatert: 05.05.2023
Strålebehandling mot kolangiocarcinom er lite brukt i Norge, og det finnes ikke studier som har vist effekt på overlevelse ved strålebehandling mot lokalisert sykdom.
Oppfølging og kontroll etter avsluttet kurativ behandling
Kontroller
Sist faglig oppdatert: 28.05.2024
Etter reseksjon bør pasienten tilbys postoperativ kontroll ved HPB-poliklinikk etter 4–5 uker for oppfølging av eventuelle komplikasjoner og informasjon om histologisvar. Pasienter operert for perihilære svulster har stor sannsynlighet for betydelig og langvarig morbiditet (van Keulen et al., 2021).
Nytten av systematiske kontroller utover den første postoperative fasen, baserer seg på at det skal være gevinst av re-reseksjon eller oppstart systemisk behandling ved ikke-symptomgivende residiv. For konvensjonell kjemoterapi er dette svært dårlig dokumentert. Det er imidlertid noen holdepunkter for at re-reseksjon ved residiv fra intrahepatiske svulster kan være hensiktsmessig (Bartsch et al., 2021; Lang, 2021b), og pasienter med slik sykdom og godt funksjonsnivå kan være egnet for systematisk kontroll, med CT hvert halvår i tre år. Det samme kan foreslås for levertransplanterte pasienter som har kolangiocarcinom i eksplantatet. For pasienter som er recesert for perihilært kolangiocarcinom eller for galleblærekreft, anses kirurgi ved residiv eller metastasering ikke å være indisert og det anbefales ikke rutinemessig kontroll. Ingen av disse anbefalingene er evidensbaserte.
Pasienter som ikke er i slikt kontrollopplegg henvises ved mistanke om residiv der det vil kunne få behandlingsmessig konsekvens (pasienter i god allmenntilstand/funksjonsklasse).
Ved funn av ikke-resektable lokale residiv, eller metastatisk sykdom, bør pasienten (som ved primært inoperabel sykdom) vurderes for palliativ onkologisk behandling.
Anbefaling:
- Pasienter i god funksjonsklasse, resecert eller transplantert for intrahepatisk kolangiocarcinom anbefales kontrollert med CT hvert halvår i tre år. For andre pasienter er det ikke grunnlag for generell anbefaling om rutinemessige kontroller.
Seneffekter etter behandling
Sist faglig oppdatert: 05.05.2023
I 2017 ga Helsedirektoratet ut rapporten Seneffekter etter kreftbehandling: faglige råd. Målgruppen for rapporten er klinikere og annet helsepersonell som er i kontakt med kreftpasienter, og pasienter som har vært gjennom kreftbehandling. Rapporten har kapitler om sekundær kreft, kardiovaskulære seneffekter, pulmonale seneffekter, hormonforstyrrelser etter kreftbehandling, seksualitet etter kreftbehandling, kognitive problemer, fatigue, langtidsbivirkninger etter behandling av hjernesvulst, psykososiale forhold, tann- og munnhuleproblemer og spesielle forhold etter kreftbehandling hos barn. En oppdatert og utvidet utgave ble publisert april 2020, der også temaene muskel- og skjelettskader, perifere neuropatier, seneffekter etter kreft i bekkenregion, fertilitet og lymfødem er inkludert.
Det er særlig viktig at fastleger, som skal følge opp pasienter som er skrevet ut fra spesialisthelsetjenesten, er oppmerksomme på risikoen for seneffekter etter kreftbehandling, og at disse kan debutere lenge etter avsluttet behandling.
Det vises for øvrig til dokumentet om fastlegenes rolle ved kreft.
Metode og prosess
Sist faglig oppdatert: 28.05.2024
Hva er nasjonale retningslinjer?
Nasjonal helse- og sykehusplan (2015–2019) (Helse- og omsorgsdepartementet, 2015) klargjør at Helsedirektoratet innenfor rettslige rammer, har en normerende rolle for helsetjenesten på tvers av helseregioner og tjenestenivå. Helsedirektoratet er derved eneste aktør som har mandat til å lage nasjonale retningslinjer for helsetjenesten. Helsedirektoratet har en koordinerende rolle for å utvikle overordnede referanserammer for kreftomsorgen, sammen med de regionale helseforetakene, kommunene og andre relevante myndighetsorganer og tjenester.
Nasjonale retningslinjer fra Helsedirektoratet er å betrakte som anbefalinger og råd, basert på oppdatert faglig kunnskap som er fremskaffet på en systematisk, kunnskapsbasert måte. De nasjonale retningslinjene gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet, og er ment som et hjelpemiddel ved de avveininger tjenesteyterne må gjøre for å oppnå forsvarlighet og god kvalitet i tjenesten.
Nasjonale retningslinjer er ikke rettslig bindende for mottakerne, men skal som faglig normerende langt på vei være styrende for de valg som skal tas. Ved å følge oppdaterte nasjonale retningslinjer vil fagpersonell bidra til å oppfylle kravet om faglig forsvarlighet i lovverket. Dersom en velger løsninger som i vesentlig grad avviker fra nasjonale faglige retningslinjer, bør en dokumentere dette og være forberedt til å begrunne sitt valg.
Kunnskapsbasert prosess
Helsedirektoratet legger til grunn at alle nasjonale retningslinjer skal være utarbeidet etter en metode med vekt på forskningsbasert kunnskap, tydelig og tilgjengelig dokumentasjon, brukermedvirkning, tverrfaglighet, fokus på praksis, implementering og oppdatering.
Det er en omfattende prosess å lage gode retningslinjer som tilfredsstiller krav til prosess, metode og transparens som er det nivået Helsedirektoratet og andre liknende organisasjoner har lagt til grunn for utforming av anbefalinger.
Bakgrunn og arbeidsprosess ved 1. utgave
Navn | Stilling | Sted |
|---|---|---|
Kristoffer Lassen (leder) | Kirurg | Oslo universitetssykehus |
Hanne Hamre | Onkolog | Akershus universitetssykehus |
Erling Bringeland | Kirurg | St. Olavs hospital |
Linn Såve Nymo | Kirurg | Universitetssykehuset i Nord-Norge |
Andreas Abildgaard | Radiolog | Oslo universitetssykehus |
Eric Dorenberg | Intervensjonsradiolog | Oslo universitetssykehus |
Christer Tønnesen | Gastroenterolog | Oslo universitetssykehus |
Henning Hellan | Radiolog | St. Olavs hospital |
Katrin Hammerling | Onkolog | Haukeland universitetssjukehus |
Trine Folseraas | Gastromedisiner | Oslo universitetssykehus |
Kjetil Søreide | Kirurg | Stavanger universitetssykehus |
Tormod Guren | Onkolog | Oslo universitetssykehus |
Habilitet
Alle gruppens medlemmer ble bedt om å oppgi potensielle interessekonflikter. Helsedirektoratet har vurdert arbeidsgruppens medlemmer som habile når det gjelder utarbeiding av utkast til nasjonale retningslinjer for diagnostikk, behandling, og oppfølging av kreft i galleveier og galleblære.
Oppdatering av retningslinjene
Utviklingen på kreftområdet går raskt. Innholdet i Nasjonale faglige retningslinjer vurderes derfor årlig, og oppdateres om nødvendig. Revisjonen gjøres av en oppdateringsgruppe.
Helsedirektoratet mottar forslag til representanter i oppdateringsgruppen fra Norsk Gastrointestinal cansergruppe, og sender en forespørsel til alle RHFene om utnevnelse. Gruppen oppnevnes deretter av Helsedirektoratet. Etter behov foretas det utskiftninger av representanter, eller det oppnevnes en ny oppdateringsgruppe.
2. utgave
Oppdatering av handlingsprogrammet er gjort av en nedsatt oppdateringsgruppe.
RHF | Navn | Spesialitet | Arbeidssted |
|---|---|---|---|
Helse Sør-Øst | Kristoffer Lassen (leder) | Kirurg | Oslo Univ.sykehus |
| Hanne Hamre | Onkolog | Akershus Univ.sykehus |
| Trine Folseraas | Gastromedisiner | Oslo Univ.sykehus |
| Eric Dorenberg | Intervensjonsradiolog | Oslo Univ.sykehus |
| Tormod Guren | Onkolog | Oslo Univ.sykehus |
Helse Vest | Katrin Hämmerling | Onkolog | Haukeland Univ.sykehus |
Helse Nord | Linn Såve Nymo | Kirurg | Univ.sykehuset Nord-Norge |
| Ørjan Solstad | Patolog | Univ.sykehuset Nord-Norge |
| Ragnhild Wold | Molekylærpatolog | Univ.sykehuset Nord-Norge |
Helse Midt | Henning Hellan | Radiolog | St.Olavs hospital |
| Erling Bringeland | Kirurg | St.Olavs hospital |
| Knut-Arne Wensaas | Fastlege |
|
| Karin Frydenberg | Fastlege |
|
Vesentlige endringer av anbefalinger defineres som endringer som vil påvirke innholdet, ikke grammatikalske eller språklige endringer som skal forbedre lesbarheten.
Vesentlige endringer fra 1. utgave
- Anbefaling under kapittelet Spesifikt om molekylære analyser er endret
- Fra: Molekylær profilering av svulstvev bør vurderes for pasienter med inoperabelt kolangiocarsinom og god allmentilstand, fortrinnsvis med genpaneler
- Til: Molekylær profilering av svulstvev, fortrinnsvis med genpaneler, bør utføres for pasienter med inoperabel eller avansert kreft i galleveiene og god allmenntilstand.
- Anbefaling under kapittelet Onkologisk behandling er endret
- Fra: Gem-Cis, Gem-Ox eller Gem-Cap anbefales i 1. linje for pasienter i god allmentilstand med inoperabelt kolangiocarcinom.
- Til: GemCis med tillegg av durvalumab anbefales i 1. linje for pasienter i god allmenntilstand med inoperabelt kolangiocarcinom som ikke har intoleranse for noen av disse medikamentene. Alternativ behandling i 1. linje er GemOx eller GemCap.









