Nasjonalt handlingsprogram med retningslinjer for utredning, behandling og oppfølging av levercellekreft ( hepatocellulært karsinom (HCC) )
Sammendrag av anbefalingene
Sist faglig oppdatert: 20.12.2024
Screening (kapittel 4)
- Pasienter med cirrhose uansett årsak, kronisk HBV eller HCV med henholdsvis signifikant eller brodannende fibrose og samtidig risikofaktorer, bør vurderes for screening med UL lever og AFP-måling hver sjette måned, også̊ etter vellykket antiviral behandling.
- Ved suspekte funn på̊ UL, skal det suppleres med flerfase CT eller MR lever.
- Nyoppståtte knuter < 1 cm bør kontrolleres etter fire måneder.
- For pasienter som ikke er aktuelle for levertransplantasjon, bør man avstå fra, eller avslutte, overvåking dersom alder, komorbiditet eller cirrhosens alvorlighetsgrad tilsier at pasienten ikke vil kunne nyttiggjøre seg noen form for behandling av et ev. HCC.
Diagnostikk (kapittel 5)
- I høyrisikopopulasjon (ved cirrhoselever, kronisk HBV-infeksjon eller tidligere gjennomgått HCC) er dynamisk undersøkelse med flerfase CT eller MR lever oftest tilstrekkelig for å stille HCC-diagnosen.
- Hos en pasient utenfor høyrisikopopulasjonen vil HCC-suspekte funn på CT/MR ikke være tilstrekkelig for å stille HCC-diagnosen, og biopsi kan være indisert etter MDT-vurdering.
- Ved mistanke om HCC måles hemoglobin, trombocytter, natrium, kreatinin, alfa-føtoprotein og leverfunksjonsprøver, inkludert albumin, bilirubin og INR.
- HCC graderes etter differensiering i et tredelt system i henhold til WHO.
- Makroskopisk undersøkelse og vevsuttak bør gjøres etter en standardisert prosedyre og kan følge gjeldende anbefalinger fra The Royal College of Pathologists.
- Rapportering av HCC i kirurgiske preparater bør gjøres etter et standardisert oppsett og kan følge gjeldene veileder fra International Collaboration for Cancer Reporting.
Kirurgi (kapittel 6)
- Pasienter med suspekt HCC bør diskuteres på regionalt MDT-møte ved avdeling med ansvar for leverkirurgi.
- Preoperativ utredning innbefatter vurdering av leverfunksjon, komorbiditet, funksjonsnivå (ECOG) og tumorutbredelse.
- Kirurgi begrenses i utgangspunktet til pasienter med BCLC-A. Pasienter med sykdomsutbredelse utover dette kan i selekterte tilfeller vurderes for kirurgi.
- Ablasjonsbehandling anbefales som førstevalg til pasienter med små lesjoner i en cirrhotisk lever.
- Pasienter med levercirrhose og HCC som ikke er kandidater for ablasjon eller reseksjon (inkludert Child-Pugh B og C), kan vurderes for levertransplantasjon innenfor Oslo-kriteriene. Pasienter utenfor Oslo-kriteriene kan ev. vurderes for nedgraderende behandling med TACE, TARE eller SBRT. TKI og immunterapi kan vurderes sombro mot levertransplantasjon.
Transarteriell kjemoembolisering, TACE (kapittel 6.3)
- TACE anbefales vurdert som førstelinjebehandling for pasienter som ikke kan behandles medreseksjon, ablasjon eller levertransplantasjon, og som har veldefinert tumorbyrde, bevart leverfunksjon (Child Pugh < B8) og er uten alvorlige tumorsymptomer (ECOG 0-1) eller ekstrahepatiske metastaser
- Respons evalueres iht. mRECIST.TACE kan også være aktuelt for å unngå tumorprogresjon i påvente av levertransplantasjon.
Transarteriell embolisering, TAE (kapittel 6.3)
- Transarteriell partikkelembolisering anbefales som førstevalg ved akutt blødende HCC.
Transarteriell radioembolisering, TARE / Selektiv intern radioterapi, SIRT (kap. 6.3)
- SIRT kan overveies i selekterte tilfeller med lokalisert tumorbyrde der annen behandling ikke kan gjennomføres, og i selekterte tilfeller som alternativ til TACE.
Stereotaktisk strålebehandling, SBRT (kapittel 6.4)
- SBRT gir beskjeden toksisitet og god lokal tumorkontroll. Behandlingen kan være aktuell hos pasienter med begrenset sykdom og velbevart leverfunksjon som ikke er kandidater for andre lokale modaliteter.
Systembehandling (kapittel 7)
- Atezolizumab i kombinasjon med bevacizumab eller durvalumab i kombinasjon med tremelimumab anbefales i førstelinje til behandling av inoperabel HCC, hvis det ikke foreligger kontraindikasjoner.
- Durvalumab, lenvatinib og sorafenib er også godkjente alternativer i førstelinjes behandling av inoperabel HCC.
- Regorafenib er godkjent som andrelinjes behandling ved progresjon på sorafenib.
- Det er foreløpig uavklart hva som er beste andrelinjes behandling etter atezolizumab/bevacizumab - durvalumab/tremelimumab eller durvalumab monoterapi - men aktuelle regimer som kan vurderes er lenvatinib, sorafenib og regorafenib.
Oppfølging og kontroll (kapittel 9)
- Etter reseksjon eller ablasjon anbefales flerfase CT eller MR lever og CT thorax, abdomen og bekken, samt AFP hver sjette måned i to år og deretter årlig i de neste tre år.
- Etter førstegangs TACE anbefales flerfase CT og AFP etter fire uker, deretter hver sjette måned i to år og deretter årlig i de neste tre år.
- Etter SIRT anbefales flerfase CT og AFP etter 3, 6, 12, 18 og 24 måneder, og deretter årlig i de neste tre år.
- Etter levertransplantasjon anbefales flerfase CT eller MR lever og CT thorax, abdomen og bekken, samt AFP hver sjette måned i to år, så årlig neste tre år og deretter oppfølging som for andre levertransplanterte.
- Systematisk kontroll forutsetter at pasienten ved residiv eller metastaser vil være aktuell for tumorrettet behandling.
Innledning
Sist faglig oppdatert: 18.04.2024
Dette handlingsprogrammet gjelder hepatocellulært karsinom (HCC) hos voksne, den absolutt vanligste formen for primær leverkreft.
Fibrolamellært karsinom er en sjelden form for HCC som utredes og behandles som andre HCC.
Angiosarkom og epiteloid hemangioendoteliom er svært sjeldne og omtales ikke.
Bakgrunn
Epidemiologi
Sist faglig oppdatert: 18.04.2024
Hepatocellulært karsinom er den vanligste formen for primær leverkreft (~90 %). På verdensbasis er HCC forbundet med betydelig sykdomsbyrde og regnes som den sjette hyppigste kreftform, den tredje vanligste kreftdødsårsak og den nest dødeligste kreftsykdom (etter pankreaskreft) (Siegel et al., 2022; Sung et al., 2021). Global insidens av HCC har de siste 10-15 år vært økende, og Verdens helseorganisasjon (WHO) anslår at insidensen vil overstige én million tilfeller i 2025 og at mer enn én million mennesker vil dø av sykdommen i 2030 (Anstee et al., 2019; IARC, 2020). Fem års total overlevelse er globalt omkring 20 %.
I Norge er insidensen av histologisk verifisert HCC ca. 3/100 000 for menn og 1/100 000 for kvinner med om lag 110 nye tilfeller per år (Brynestad, 2022). Den reelle insidensen er sannsynligvis vesentlig høyere, siden pasienter med kun klinisk og radiologisk diagnose ikke inngår i disse tallene. Det meldes årlig 350-380 tilfeller av primær leverkreft (ICD-10 diagnose C22, som også inkluderer intrahepatisk kolangiokarsinom og andre sjeldne kreftformer) til Kreftregisteret (Larsen, 2022).
Etiologi og patogenese
Sist faglig oppdatert: 18.04.2024
Mer enn 90 % av HCC-tilfeller oppstår hos pasienter med kronisk leversykdom. Levercirrhose er den klart viktigste risikofaktoren, og globalt oppstår mer enn to av tre i en cirrhotisk lever (European Association for the Study of the Liver, 2018). Norske data tyder imidlertid på at andelen pasienter med underliggende cirrhose er en del lavere (Eskesen et al., 2014), noe som kan reflektere forskjeller både i epidemiologi (lavere prevalens av cirrhose i befolkningen) og i cirrhose-diagnostikk (tidlig cirrhose kan være underdiagnostisert ved normale radiologiske funn). Insidensen varierer fra 1-6 % per år, avhengig av etiologi og stadium av leversykdom, alder, kjønn og flere andre faktorer (Lok et al., 2009). Risikoen øker proporsjonalt med Child-Pugh-klasse. Selv om HCC er den vanligste dødsårsaken hos pasienter med cirrhose globalt (Trinchet et al., 2015), er det en mer sjelden dødsårsak (10 %) hos pasienter med cirrhose i Norge (Haukeland et al., 2020).
Ved kronisk leversykdom vil vedvarende inflammasjon, nekrose, oksidativt stress, fibrose og regenerasjon kunne føre til akkumulasjon av genetiske og molekylære endringer som over tid kulminerer med dannelsen av dysplastiske noduli og HCC. De vanligste somatiske mutasjonene (TERT promotor, TP53 og CTNNB1) er foreløpig ikke angrepspunkter for terapi (Villanueva, 2019).
Risikofaktorer
Sist faglig oppdatert: 18.04.2024
Kronisk hepatitt B og C
Risikoen for HCC er spesielt høy hos pasienter med ubehandlet kronisk virushepatitt. Mens kronisk hepatitt B virus (HBV)-infeksjon er vanligste årsak (> 60 %) til HCC i høyendemiske områder (Sørøst-Asia og Afrika), er denne andelen under 10 % i Norge (Eskesen et al., 2014). Siden HBV er et DNA-virus som integreres i vertsgenomet (Wang et al., 1990), har viruset direkte onkogene effekter uavhengig av underliggende leverfibrose. Dette er noe av årsaken til at opptil 20 % av HBV-relatert HCC oppstår uten cirrhose.
Kronisk hepatitt C virus (HCV)-infeksjon har lenge vært den vanligste årsaken til HCC i vestlige land, inkludert Norge (Eskesen et al., 2014), men etter introduksjonen av direktevirkende antiviral behandling i 2014 har insidens og mortalitet av HCV-relatert HCC gått betydelig tilbake i mange land. Selv om HCV-relatert HCC kan utvikles i pre-cirrhotisk stadium, oppstår det i all hovedsak hos pasienter med etablert cirrhose. HCC-risiko ved ubehandlet HCV-cirrhose er 3-6 % per år (Lok et al., 2009).
NASH
Ikke-alkoholisk steatohepatitt (NASH) og fettlever uten inflammasjon eller fibrose relatert til metabolsk syndrom, samlet kalt «non-alcoholic fatty liver disease» (NAFLD), er den vanligste årsaken til kronisk leversykdom i den vestlige verden. Global insidens av NASH-relatert HCC har økt kraftig i takt med fedmeepidemien, og er på vei til å bli den vanligste årsaken til HCC i vestlige land (Younossi et al., 2018). Foreløpig er NASH årsak til en beskjeden andel av HCC i Norge (5-10 %). 30-50 % av NASH-relatert HCC oppstår imidlertid i en lever uten cirrhose, noe som reflekterer den komplekse patofysiologien ved NASH hvor oksidativt og metabolsk stress, insulinresistens og kronisk inflammasjon bidrar som drivere i karsinogenesen (Llovet et al., 2021).
Alkohol
Alkoholrelatert cirrhose innebærer HCC-risiko på 1-3 % per år og er årsak til 15-30 % av HCC-tilfeller (Jepsen et al., 2012). I tillegg til risikoen som kan tilskrives underliggende cirrhose, er det sannsynlig at alkohol har direkte toksisk-onkogene effekter hvor oksidativt stress står sentralt (Matsushita et al., 2019). Alkoholoverforbruk opptrer ofte som kofaktor som kan øke HCC-risikoen ved andre etiologier, for eksempel HCV og NASH.
Andre risikofaktorer
Mer sjeldne årsaker til HCC er cirrhose på grunn av immunologiske leversykdommer (autoimmun hepatitt (AIH), primær biliær kolangitt (PBC), primær skleroserende kolangitt (PSC)) og hemokromatose, hvorav sistnevnte er forbudet med spesielt høy risiko. Andre risikofaktorer er høy alder (høyeste insidens er rapportert hos personer over 70 år), mannlig kjønn (2-3 ganger økt risiko) og røyking, mens betydningen av kostholdsfaktorer er mer kontroversielt. Høy forekomst av aflatoksin B1 i Afrika (sopp-toksin som produseres av aspergillus under suboptimale lagringsforhold for blant annet korn) bidrar synergistisk til HCC-risiko ved HBV-infeksjon (Kew, 2003). Akutt intermitterende porfyri er forbundet med HCC-risiko uavhengig av stadium av leversykdom, sannsynligvis relatert til oksidativt stress sekundært til akkumulasjon av intermediære metabolitter.
Forebyggende tiltak
Sist faglig oppdatert: 18.04.2024
Forebygging og behandling av virushepatitt
HBV-infeksjon kan effektivt forebygges gjennom vaksinasjon og ved å forhindre vertikal smitte fra mor til barn under svangerskap og fødsel. I Norge er HBV-vaksine nå inkludert i barnevaksinasjonsprogrammet, og det gis rutinemessig immunglobulin og vaksine til nyfødte av HBsAg-positive mødre, samt antiviral behandling til mor i tredje trimester, dersom mor er høyviremisk (Folkehelseinstituttet, 2022). Dekningsgraden av vaksiner er imidlertid fortsatt lav i deler av Asia og Afrika sør for Sahara. HCV-smitte hos injiserende rusmiddelbrukere kan forebygges gjennom tilgang til rent brukerutstyr og legemiddelassistert rehabilitering (Platt et al., 2018). Latrogen smitte via transfusjoner eller gjenbruk av medisinsk utstyr er eliminert i den vestlige verden, men forekommer fortsatt i flere lavinntektsland (WHO, 2022).
Antiviral HBV-behandling med nukleosidanalog reduserer risiko for utvikling av cirrhose, og ved virussuppresjon over tid reduseres risikoen for HCC med 50-80 % (Baran, 2015). Behandlingen er ofte livslang og er forbundet med svært få bivirkninger (Johannessen et al., 2022). HCV-behandling med direktevirkende antivirale midler medfører varig virusfrihet hos 95-98 % etter 8-12 ukers tablettbehandling uten bivirkninger (Johannessen et al., 2022). Varig virusfrihet bremser videre progresjon av leversykdom og reduserer risikoen for HCC med 70 % (Ioannou et al., 2017). Ved allerede etablert cirrhose foreligger likevel en residualrisiko på 2 % per år, mens risikoen ved brodannende fibrose er betydelig lavere (0,5 % per år) (Lockart et al., 2022).
Reduksjon av alkoholkonsum
Behandling av underliggende leversykdom vil, uavhengig av etiologi, kunne bremse progresjon av leversykdommen og indirekte bidra til å redusere HCC-risiko. Klinisk erfaring viser at totalavhold fra alkohol kan føre til betydelig hepatisk regenerasjon, og i noen tilfeller reversere selv avansert alkoholrelatert leversykdom. Selv om det finnes lite data som dokumenterer effekten av alkoholavhold på HCC-risiko, anbefales alle pasienter med avansert fibrose eller cirrhose totalavhold fra alkohol.
Reduksjon av metabolsk risiko
Ved NASH er det vist at 7-10 % vektreduksjon kan reversere både steatose, inflammasjon og fibroseutvikling histologisk (Vilar-Gomez et al., 2015). Selv om det foreløpig finnes lite data som dokumenterer effekt på HCC-risiko, er vektreduksjon gjennom kostendring og økt fysisk aktivitet grunnpilaren i behandlingen av NASH (Midgard et al., 2021). Foreløpig finnes det ingen godkjent medikamentell behandling av NASH, men mange potensielle medikamenter er under utprøvning i fase 2- og fase 3-studier.
Reduksjon av øvrig metabolsk risiko gjennom antidiabetisk, antihypertensiv og lipidsenkende behandling står sentralt i håndteringen av NASH. Tallrike epidemiologiske studier har antydet at både metformin, statiner og acetylsalisylsyre (ASA) kan spille en rolle for å redusere HCC-risiko hos pasienter med kronisk leversykdom (Singh et al., 2013), men foreløpig er data mest overbevisende for ASA (Simon et al., 2020).
Inntak av kaffe
Epidemiologiske studier har vist at inntak av kaffe er assosiert med redusert risiko for HCC i et doseavhengig forhold (Kennedy et al., 2017). Den cytoprotektive effekten er tilskrevet de antioksidative egenskapene ved kaffe. Til tross for manglende kontrollerte studier, gir den europeiske foreningen for studiet av leveren (EASL) en sterk anbefaling om regelmessig kaffeinntak for pasienter med kronisk leversykdom (European Association for the Study of the Liver, 2018).
Forløpstider
Pakkeforløp for kreft
Sist faglig oppdatert: 18.04.2024
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er et standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende, samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Les mer om Pakkeforløp for primær leverkreft
Det er egne Diagnoseveiledere for inngang til pakkeforløp for kreft.
Overvåking av pasienter med risiko for HCC
Overvåkning av pasienter med økt risiko for HCC
Sist faglig oppdatert: 18.04.2024
Overvåking av HCC-utvikling er aktuelt for visse pasientgrupper fordi:
- det er mulig å identifisere individer med økt risiko
- det finnes en akseptabel metode for deteksjon av tidlig HCC
- prognosen er betydelig bedre når behandling iverksettes på et tidlig sykdomsstadium
Overlevelsesgevinst av et overvåkingsprogram er vist i en randomisert kontrollert studie blant pasienter fra Kina med ubehandlet HBV-infeksjon (Zhang et al., 2004), men disse funnene kan ikke uten videre ekstrapoleres til dagens forhold og andre pasientpopulasjoner. Det er imidlertid usannsynlig at det vil komme flere randomiserte studier som evaluerer effekten av HCC-overvåkning, og internasjonale retningslinjer anbefaler HCC-overvåking for enkelte pasientgrupper på bakgrunn av et godt teoretisk rasjonale og dokumentert effekt i en rekke observasjonelle studier. En fersk meta-analyse av 59 studier (145.000 pasienter) konkluderer med at HCC-overvåkning er assosiert med deteksjon av tidlig sykdom (relativ risiko (RR) 1.86), kurativ behandling (RR 1.83) og overlevelse (hazard ratio (HR) 0.67) hos pasienter med cirrhose, samtidig som det er assosiert med få og milde skadevirkninger (Singal et al., 2022).
Hvem skal tilbys HCC-overvåking?
Det regnes formålstjenlig å tilby overvåking når årlig HCC-risiko overskrider 1,5 % (European Association for the Study of the Liver, 2018; Marrero et al., 2018), noe som i praksis vil si hos alle pasienter med etablert levercirrhose, uavhengig av etiologi. Overvåkning er også aktuelt for følgende grupper uten at det foreligger cirrhose:
- HBV-pasienter med signifikant fibrose (leverstivhet > 8 kPa) og tilleggsfaktorer som øker HCC-risikoen (menn over 55 år, afrikansk etnisitet, virus-genotype C, HCC hos førstegrads-
slektning, diabetes mellitus type 2, NASH, alkoholoverforbruk) (Folkehelseinstituttet, 2022)
- Enkelte HCV-pasienter med brodannende fibrose (leverstivhet > 10 kPa) og tilleggsfaktorer som øker HCC-risikoen (diabetes mellitus type 2, NAFLD eller alkoholoverforbruk)
- Pasienter med akutt intermitterende porfyri, uavhengig av stadium av leversykdom
Det er foreløpig uavklart hvilke pasienter med pre-cirrhotisk NAFLD som vil ha nytte av overvåkning.
For pasienter med virale hepatitter skal beslutningen om overvåkning alltid basere seg på stadium av leversykdom før oppstart av antiviral behandling. Til tross for at risikoen på gruppenivå reduseres betraktelig etter behandling, finnes det foreløpig ikke gode nok verktøy for seleksjon av pasienter som kan avslutte overvåkningen (European Association for the Study of the Liver et al., 2021). Ved virale hepatitter er så langt ingen ikke-invasive metoder validert for fibrosediagnostikk etter oppnådd virologisk respons. Etter vellykket antiviral behandling oppnås raskt normalisering av fibrosemarkører og regresjon av leverstivhet, og testene må derfor tolkes med stor forsiktighet i denne konteksten.
Beslutningen om å tilby overvåking bør alltid journalføres og skje i samråd med pasienten etter individuell vurdering. Det er naturlig at kliniker som følger pasienten for tilgrunnliggende leversykdom (gastroenterolog eller infeksjonsmedisiner) også har ansvar for overvåking. For pasienter som ikke er aktuelle for levertransplantasjon, bør man avstå fra eller avslutte overvåking dersom alder, komorbiditet eller cirrhosens alvorlighetsgrad tilsier at pasienten ikke vil kunne nyttiggjøre seg noen form for behandling av et eventuelt HCC.
Metode for overvåking
Vi anbefaler ultralydundersøkelse av leveren hver sjette måned med samtidig måling av tumormarkøren alfa1-føtoprotein (AFP). Verdien av AFP er omdiskutert og anbefales ikke i alle retningslinjer. Bruk av AFP alene har svært begrensede testegenskaper, noe som reflekterer både mange falske negative (enkelte HCC-fenotyper gir lite eller ingen AFP-stigning) og falske positive (ved pågående hepatisk nekroinflammasjon). AFP er imidlertid spesielt nyttig i fravær av aktiv hepatitt, som ved supprimert HBV-infeksjon eller etter behandling av HCV-infeksjon. Seriemålinger over tid gjør det også mulig å påvise relative økninger av AFP-nivået.
Ultralydundersøkelsen bør gjennomføres enten av hepatolog med ultralydkompetanse, eller dedikert radiolog, og forutsetter UL-apparat av høy kvalitet og undersøker med tilstrekkelig kompetanse i cirrhose- og fokal leverlesjonsdiagnostikk. Ved utilstrekkelig innsyn kan man vurdere CT eller MR som primærundersøkelse for overvåkning. Det er ikke vist ytterligere effekt av å bruke kontrastforsterket ultralyd som primærundersøkelse. Økning av overvåkningsintervallet til ett år er forbundet med redusert overlevelse (European Association for the Study of the Liver, 2018).
Avklaring av funn
Tilkomne lesjoner < 1 cm anbefales kontrollert etter fire måneder. Lesjoner > 1 cm anbefales evaluert med flerfase CT eller MR. Kontrastforsterket ultralyd kan være nyttig ved uklare funn, men inngår ikke som anbefalt overvåkingsmetode. Mulige HCC-lesjoner bør vurderes i MDT-møte. Signifikant AFP-stigning uten samtidig UL-funn kan avklares med flerfase CT eller MR-lever.
Anbefaling
- Pasienter med cirrhose uansett årsak, kronisk HBV eller HCV - med henholdsvis signifikant eller brodannende fibrose og samtidig risikofaktorer - bør vurderes for overvåkning med UL-lever og AFP-måling hver sjette måned, også etter vellykket antiviral behandling.
- Ved suspekte funn på̊ UL, skal det suppleres med flerfase CT eller MR-lever.
- Nyoppståtte knuter < 1 cm bør kontrolleres etter fire måneder.
- For pasienter som ikke er aktuelle for levertransplantasjon, bør man avstå fra, eller avslutte, overvåking dersom alder, komorbiditet eller cirrhosens alvorlighetsgrad tilsier at pasienten ikke vil kunne nyttiggjøre seg noen form for behandling av et ev. HCC.
Utredning og diagnostikk
Utredningsforløp
Sist faglig oppdatert: 18.04.2024
Ved begrunnet mistanke om leverkreft, skal pasienten henvises til pakkeforløp for leverkreft ved et universitetssykehus med HPB-kirurgisk behandlingstilbud. Henvisende instans har ansvar for at alle relevante opplysninger foreligger, slik at pasienten raskt kan få en adekvat vurdering. Pasienten kan med det samme henvises til ikke-invasiv diagnostikk, inkludert radiologi (se nedenfor), slik at diagnostikken frem til beslutning ikke blir unødvendig forsinket. Undersøkelser som krever spesielle ressurser og kompetanse ivaretas av referansesykehuset.
Symptomer
Sist faglig oppdatert: 18.04.2024
Symptomer fra leverkreft er avhengig av sykdomsbyrde og kan ofte knyttes til underliggende leversykdom. I tidlig fase gir sykdommen ingen symptomer og den blir ofte påvist tilfeldig ved radiologiske undersøkelser, sjeldnere ved oppfølging av cirrhose eller annen leversykdom. Mer avansert sykdom kan gi redusert allmenntilstand, smerter og tegn til leverpåvirkning, samt symptomer fra ulike organmetastaser.
Kartlegging av leversykdom og komorbiditet
Sist faglig oppdatert: 18.04.2024
Anamnestiske holdepunkt for underliggende kronisk leversykdom kan være injiserende rusmiddelbruk, høyt alkoholkonsum, metabolsk syndrom, virushepatitt og autoimmunitet.
Kronisk leversykdom er ofte asymptomatisk inntil komplikasjoner til etablert cirrhose inntreffer. Typiske symptomer og funn sekundært til portal hypertensjon og leversyntesesvikt, er ascites, hepatisk encefalopati, variceblødning, ikterus, sarkopeni og underernæring. Alle pasienter med mistanke om portal hypertensjon skal kartlegges med gastroskopi for å avklare om det foreligger gastroøsofageale varicer. Alle pasienter med cirrhose skal klassifiseres med Child Pugh-skår.
Det er betydelig potensiale for reversibilitet av leversykdom dersom etiologisk faktor fjernes, spesielt etter antiviral behandling av hepatitt B og C, samt etter totalavhold fra alkohol. I klinisk praksis vil man i noen tilfeller kunne oppnå rekompensering av selv avansert dekompensert cirrhose innen tre til seks måneder, og den preoperative kartleggingen må ta høyde for dette. Ved ubehandlet kronisk virushepatitt bør antiviral behandling startes umiddelbart, og ved alkoholrelatert leversykdom bør tiltak mot underliggende alkoholavhengighet settes i gang så raskt som mulig.
I tillegg til stadium av leversykdom vil allmenntilstand, ernæringsstatus, komorbiditet (spesielt hjerte-/lungesykdom, overvekt, diabetes, kognitiv svikt) og generelt funksjonsnivå (ECOG-status) ha betydning for vurdering av behandlingsmuligheter.
Stadium av leverfibrose
Sist faglig oppdatert: 18.04.2024
Det er avgjørende for både prognose og behandlingsvalg å kartlegge stadium av leverfibrose ved HCC, spesielt bør det avklares om det foreligger cirrhose. En sikker cirrhosediagnose kan ofte stilles på bakgrunn av radiologiske, kliniske og biokjemiske funn. Imidlertid har ultralyd, CT og MR relativt lav sensitivitet for å påvise tidlig cirrhose, samtidig som radiologiske tegn på cirrhose kan forekomme hos leverfriske (Kielar et al., 2019). Det er da viktig å ta i bruk andre ikke-invasive metoder.
Serum-markøren FIB-4 (mdcalc.com) er en godt validert indeks basert på alder, ASAT, ALAT og trombocytter som anbefales til initial fibrosetesting (European Association for the Study of the Liver et al., 2021).
Hvis det ikke foreligger sikker cirrhose ut fra kliniske og radiologiske funn, samtidig som FIB-4 > 1,3, bør leverens stivhet undersøkes med elastografi. Både transient elastografi (FibroscanÒ) og ultralydbaserte metoder, som Acoustic Radiation Force Impulse Imaging og 2D-Shear Wave Elastography, har gode diagnostiske egenskaper. Optimale terskelverdier er i noen grad metode- og etiologispesifikke, og falske positive funn forekommer spesielt ved nekroinflammasjon og stuvning i leveren. Generelt vil man ved leverstivhet < 12 kPa kunne utelukke cirrhose med høy negativ prediktiv verdi. Leverstivhetsmåling kan også være av verdi hos pasienter der det er avklart at det foreligger cirrhose. Verdier i cirrhosespekteret (14-75 kPa) korrelerer med graden av portal hypertensjon og gir derfor prognostisk informasjon om risiko for lever-relaterte hendelser og død. I henhold til Baveno guidelines, kan man ved leverstivhet < 20 kPa og trombocytter > 150 utelukke behandlingstrengende øsofagusvaricer med høy negativ prediktiv verdi (de Franchis et al., 2022).
Leverbiopsi er tradisjonelt gullstandard for fibrosediagnostikk, men bruken er begrenset av invasivitet og risiko for underestimering av fibrosestadium. Likevel bør biopsi av både tumor og ikke-tumoraffisert leverparenkym vurderes hvis det er usikkert om det foreligger cirrhose, også fordi HCC-diagnosen bør verifiseres histologisk hos pasienter uten cirrhose. Beslutningen om biopsi bør tas på MDT-møte, der all relevant ikke-invasiv diagnostikk skal foreligge.
Bildediagnostikk
Sist faglig oppdatert: 18.04.2024
Kun i høyrisikopopulasjonen kan radiologisk diagnose alene være tilstrekkelig ved typiske funn. Det er derfor avgjørende for radiolog å vite om pasienten tilhører høyrisikopopulasjonen som er begrenset til: klinisk etablert levercirrhose, kronisk hepatitt B-infeksjon med signifikant leverfibrose eller aktuell eller tidligere gjennomgått HCC. Dette- og eventuelt andre vesentlige kliniskeopplysninger - er nødvendig for at radiologen skal kunne gi klinisk relevant diagnostisk informasjon ved rapportering, og må med i henvisningen til bildediagnostikk.
Som nevnt i kapittel 5.4, er det noen fallgruver ved radiologisk cirrhosediagnostikk som det er viktig å være oppmerksom på.
Høyrisikopopulasjon
Radiologisk diagnose kan være tilstrekkelig ved typiske funn. LI-RADS (acr.org), som er publisert av American College of Radiology, er en god veileder og mal for radiologisk utredning av pasientene (American College of Radiology Committee on LI-RADS®, 2018). Risiko for HCC deles inn i fem kategorier fra sikker benign (LR 1) til sikker malign (LR 5), samt malignt utseende, men ikke typisk HCC (LR-M) og tumor i vene (LR-TIV), se kapittel 5.5.3.
Det viktigste diagnostiske kriteriet for radiologisk påvisning av HCC er kontrastoppladningsmønsteret. HCC har hovedsakelig arteriell kontrastoppladning og viser typisk et kraftig og ujevnt oppladningsmønster, særlig i litt sen arteriell fase. Deretter sees typisk utvasking av kontrast. Andre hovedtrekk som kan indikere HCC, ifølge LI-RADS, er kontrastforsterket kapsel og terskelvekst (vekst ≥ 50 % innen 6 mnd.) (tabell 1). Dersom den arterielle kontrastladningen er ringlignende og perifert lokalisert, kan ikke Li-RADS 1-5 benyttes og kategorien Li-RADS M må vurderes. Dersom kriteriene for LR-M innfris, kan ikke diagnosen HCC stilles endelig ved bildediagnostikk, fordi annen malignitet (kolangiokarsinom, blandingstumor HCC/kolangiokarsinom eller metastase fra annen kreftsykdom) er hyppigere forekommende enn HCC.
(American College of Radiology Committee on LI-RADS®, 2018). CC BY 4.0.
Lavrisikopopulasjon
De typiske bildediagnostiske karakteristika for HCC er de samme i lavrisikopopulasjonen som i høyrisikopopulasjonen. Likevel kan videre avklaring med biopsi være nødvendig for å stille diagnosen, fordi andre differensialdiagnoser med samme eller lignende karakteristika (adenomer, hypervaskulære metastaser) er hyppigere i lavrisikopopulasjonen enn i høyrisikopopulasjonen (European Association for the Study of the Liver, 2018). Et alternativ til sylinderbiopsi kan være eksisjonsbiopsi, hvis det teknisk ligger til rette for det. Vurderingen bør gjøres på tverrfaglig møte. Biopsi skal tas før onkologisk behandling.
Spesielt om diagnostikk ved portvenetrombose og HCC
Portvenetrombose forekommer hos 10-25 % av pasienter med cirrhose (Yoshiji et al., 2021). Tumortrombe i portvenen forekommer dessuten ikke sjelden hos pasienter med HCC. Ved diagnostisering av HCC er det helt avgjørende for stadieinndeling at man skiller mellom tumortrombe og annen trombe i portvenen. Dette kan gjøres ved flerfase CT eller MR, der særlig funn av kontrastoppladning i trombe og MR-funn med diffusjonsrestriksjon i tromben er tegn på tumortrombe (European Association for the Study of the Liver, 2018; Vernuccio et al., 2021). Ved tumortrombe benyttes kategorien LR-TIV i LI-RADS.
Spesielt om modaliteter ved HCC-diagnostikk
CT: CT utføres med opptak i sen arteriell, portovenøs og sen kontrastfase, og med tilstrekkelig kontrastdose og stråledose til å sikre god diagnostikk.
Det er anbefalt dedikerte innstillinger for injeksjonshastighet og scan-tidspunkt (fortrinnsvis bolustracking). Serie uten kontrast kan benyttes som supplement i utvalgte situasjoner (for eksempel ved mistenkt tumortrombe eller mistenkt blødning). Ved stadieinndeling, kontroll etter tidligere behandling eller kontroll under systemisk behandling avbildes, i tillegg til flerfase lever, også thorax, samt øvrige abdomen og bekken i portovenøs fase (Lencioni et al., 2010; Llovet et al., 2020).
MR: MR er, som CT, godt egnet til å detektere kontrastdynamikken ved HCC ved bruk av ekstracellulært kontrastmiddel. MR har generelt høy sensitivitet for å påvise fokale leverforandringer, og er beste modalitet for deteksjon av tilleggskriterier som kan støtte vurderingen av om det foreligger HCC. Bruk av hepatocyttspesifikt kontrastmiddel er ikke like godt egnet som ekstracellulært kontrastmiddel for å vurdere kontrastdynamikk (Welle et al., 2020), men er særlig aktuelt i noen situasjoner:
- ved karakterisering av uavklart fokal leverlesjon (der HCC er en av flere mulige differensialdiagnoser) i ikke-cirrhotisk lever der HCC-suspekt kontrastladningsmønster allerede er etablert i annen undersøkelse, men påvisning av eventuelle ytterligere uoppdagede små noduler kan endre valg av kurativ behandlingsmetode (European Association for the Study of the Liver, 2018).
Ultralyd: Uten kontrast begrenses diagnostisk bruk til overvåkning av pasienter med risiko for HCC der det oppnås tilstrekkelig innsyn, se kapittel 4.1. Ultralyd med kontrast kan benyttes i trente hender som tilleggsverktøy for karakterisering av noduler i høyrisikopopulasjon der CT og/eller MR ikke var konklusiv (European Association for the Study of the Liver, 2018). Kontrastforsterket ultralyd (CEUS) av lever er lite hensiktsmessig som initial modalitet for karakterisering av påvist lesjon i cirrhose-lever, fordi det uansett kreves supplerende CT eller MR for videre avklaring.
18F FDG-PET har ingen plass i rutinemessig utredning av HCC.
Anbefaling
- I høyrisikopopulasjonen (ved cirrhoselever, kronisk HBV-infeksjon med signifikant leverfibrose eller tidligere gjennomgått HCC) er dynamisk undersøkelse med flerfase CT eller MR-lever oftest tilstrekkelig for å stille HCC-diagnosen.
- Hos en pasient utenfor høyrisikopopulasjonen, vil HCC-suspekte funn på CT/MR ikke være tilstrekkelig for å stille HCC-diagnosen, og biopsi kan være indisert etter MDT-vurdering.
Laboratorieprøver
Sist faglig oppdatert: 18.04.2024
Pasienter med HCC har ofte patologiske leverfunksjonsprøver på grunn av underliggende leversykdom og det må tas blodprøver som gjenspeiler grad av leverpåvirkning, inkludert bilirubin, albumin, INR, natrium og trombocytter. Serologiske prøver med tanke på virushepatitt og autoimmun sykdom, samt jernstatus kan gi etiologisk avklaring.
Det er ingen biomarkører som dekker behovet for risikostratifisering, tidlig oppdagelse, diagnose, prognose og behandlingsrespons. Serum alfa-føtoprotein (AFP) er den mest benyttede tumormarkøren for HCC, men har begrenset sensitivitet og spesifisitet. AFP-grense på 20 ng/ml gir sensitivitet på ca. 60 % og spesifisitet på 90 %, mens grense på 50 ng/ml gir sensitivitet på 47 % og spesifisitet på 96 %. AFP > 400 ng/ml er nærmest diagnostisk for HCC (Hanif et al., 2022). Det finnes imidlertid andre svulster som også̊ kan føre til forhøyet AFP (bl.a. intrahepatisk kolangiokarsinom, non-seminom, nevroendokrine neoplasier og hepatoid adenokarsinom i ventrikkel eller lunge) (Hanif et al., 2022). AFP kan også̊ være forhøyet hos pasienter med kronisk leversykdom, inkludert virushepatitt. Rundt 40 % av pasienter med HCC har normal s-AFP og markøren egner seg best for monitorering av pasienter etter behandling av HCC (ved initialt høy AFP), eller ved screening. Sporadisk måling av AFP har liten verdi.
Anbefaling
- Ved mistanke om HCC måles hemoglobin, trombocytter, natrium, kreatinin, alfa-føtoprotein og leverfunksjonsprøver, inkludert albumin, bilirubin og INR.
Patologi
Sist faglig oppdatert: 18.04.2024
Primære leversvulster inndeles i henhold til gjeldende klassifisering fra WHO (WHO Classification of Tumours Editorial Board, 2019). HCC er definert som en primær ondartet svulst i leveren bestående av epiteliale celler med hepatocellulær differensiering. De fleste HCC utvikles fra premaligne lesjoner ved kronisk leversykdom, mens en liten andel oppstår i normalt levervev. I sjeldne tilfeller oppstår HCC ved malign transformasjon av hepatocellulære adenomer.
Makroskopisk patologi
De fleste HCC har bløt konsistens og grønn til gul eller brun farge, men de fibrolamellære og skirrøse subtypene er fastere og ofte gråhvite. Nekrose og blødning kan forekomme. Svulstene er ofte omgitt av en fibrøs kapsel. WHO nevner fire makroskopiske vekstmønstre som har betydning for klinisk stadium: a) én solitær knute; b) én stor, dominant knute med multiple mindre satellitter; c) et stort antall små knuter som ligner cirrhotiske knuter (diffust eller cirrhotomimetisk mønster); og d) multiple primære HCC som ikke passer med ovennevnte mønstre. Satellitter er lesjoner som forekommer i nærheten av en enkelt, stor dominant knute. De er ofte multiple og vanligvis lokalisert innenfor 2 cm fra hovedtumor (WHO Classification of Tumours Editorial Board, 2019). Knuter som er i kontakt med hovedtumor skal oppfattes som en del av denne og ikke som satellitter (Burt et al., 2018).
Histopatologi
Generelle egenskaper
De neoplastiske cellene viser hepatocellulær differensiering morfologisk og/eller immunhistokjemisk, men tumor mangler som regel portalfelter og har fragmentert eller manglende nettverk av retikulin. Vanligvis ses aberrante (uparede) arterioler og økt uttrykk av CD34 i det sinusoidale endotelet. HCC har fire grunnleggende histologiske vekstmønstre som ofte forekommer i kombinasjoner: trabekulært, solid, pseudoglandulært og makrotrabekulært (Torbenson, 2021). I enkelte HCC ses galleproduksjon eller akkumulering av lipofuscin, glykogen eller fett. Hyaline legemer, Mallory-Denk legemer eller fibrinogen kan også ses. Progresjon av tumor kan ses der en lavere differensiert knute oppstår i en eksisterende HCC («knute-i-knute»).
Subtyper
Omkring en tredjedel av HCC kan klassifiseres i subtyper som dels har distinkte molekylære egenskaper. I 5. utgave av WHOs klassifisering nevnes åtte subtyper: steatohepatittisk, makrotrabekulært massivt, klarcellet, skirrøst, kromofobt, fibrolamellært, nøytrofilrikt og lymfocyttrikt (WHO Classification of Tumours Editorial Board, 2019). Fibrolamellært karsinom forekommer kun i levere uten cirrhose, mens de øvrige er beskrevet i både cirrhotiske og ikke-cirrhotiske levere. Fibrolamellære karsinomer uttrykker ofte CK7 og CD68 og nøytrofilrike HCC kan uttrykke granulocyte-colony-stimulating factor, men for øvrige ovennevnte subtyper er det ikke etablert diagnostiske immunhistokjemiske markører (Torbenson, 2021).
Små HCC
Små HCC har diameter ≤ 2 cm og er inndelt i tidlige HCC (eHCC) og små fremskredne HCC (pHCC). eHCC har makroskopisk utydelig avgrensning uten tumorkapsel. De er høyt differensiert, kan inneholde enkelte portalfelter og har få uparede arterioler. Små pHCC er makroskopisk tydelig avgrenset og har ofte tumorkapsel. De viser ekspansiv og mer infiltrativ vekst, mangler portalfelter og har oftere uparede arterier enn eHCC.
Histologisk gradering
I 5. utgave av WHOs klassifisering anbefales et tredelt graderingssystem (tabell 2). Ved grad 1 stilles malign diagnose ofte på grunnlag av tap av retikulin eller aberrant uttrykk av immunhistokjemiske markører, mens grad 3 kan kreve immunhistokjemi for bekreftelse av hepatocellulær differensiering. Primære udifferensierte karsinomer er ikke inkludert i graderingssystemet. For HCC med mer enn én grad, kan den høyeste graden og den dominerende graden rapporteres (WHO Classification of Tumours Editorial Board, 2019).
Grad | Overordnet vurdering | Kriterier |
|---|---|---|
1 - Høyt differensiert | Tumorcellene ligner modne hepatocytter med minimal til lett atypi Kan være nødvendig å skille fra hepatocellulært adenom eller dysplastisk nodulus | Cytoplasma: Rikelig og eosinofilt til moderat og basofilt Kjerner: Minimal til lett atypi |
2 - Middels differensiert | Klart malign ved HE-farging, og morfologien tyder sterkt på hepatocellulær differensiering | Cytoplasma: Rikelig og eosinofilt til moderat og basofilt Kjerner: Moderat atypi; enkelte flerkjernete celler aksepteres |
3 - Lavt differensiert | Klart malign ved HE-farging, men morfologien er forenlig med et bredt spekter av lavt differensierte karsinomer | Cytoplasma: Moderat til sparsomt, vanligvis basofilt Kjerner: Markert pleomorfi, kan inkludere anaplastiske kjempeceller |
WHO Classification of Tumours Editorial Board (2019). Copyright International Agency for Research on Cancer, 2019. Gjengitt med tillatelse.
Premaligne lesjoner
Premaligne hepatocellulære lesjoner omfatter dysplastiske foci og dysplastiske noduli, og ses nesten utelukkende i cirrhotiske levere. Dysplastiske foci er mikroskopiske forandringer (< 1 mm) og subklassifiseres som storcellete og småcellete forandringer samt jernfrie foci ved jernlagringssykdom. Dysplastiske noduli måler vanligvis 5-15 mm og klassifiseres som lavgradige eller høygradige, avhengig av cytologisk atypi og arkitektur.
Differensialdiagnose og immunhistokjemi
Det kan være vanskelig å skille mellom høyt differensiert HCC, dysplastiske noduli og benigne lesjoner, spesielt i nålebiopsier. Ved differensiering mellom dysplastiske noduli og HCC, kan tap av retikulin og utbredt CD34-positivitet i sinusoidalt endotel tale for HCC, og et panel med HSP70, glypican 3 og glutamin syntetase gir høy spesifisitet for HCC når to eller alle tre markørene er uttrykt. Fravær av CK7/CK19-positiv gallegangsproliferasjon omkring knuter kan tyde på stromal invasjon. Ved differensiering mellom hepatocellulært adenom og HCC, vil funn av brede trabekler, tallrike pseudoglandulære strukturer, småcellet morfologi, mitoser og tap eller fragmentering av retikulin tale for HCC. Ved differensiering mellom HCC og andre maligne svulster, kan immunhistokjemiske paneler som inkluderer arginase-1, HepPar1, polyklonalt antistoff mot karsinoembryonalt antigen (pCEA), CD10 og AFP bidra til å identifisere hepatocellulær differensiering (WHO Classification of Tumours Editorial Board, 2019).
Diagnostiske kriterier
WHO angir følgende diagnostiske kriterier som essensielle: Hepatocellulær differensiering bør være påvist morfologisk og eventuelt støttet av immunhistokjemiske markører. Malignitet bør være påvist i henhold til histologiske kriterier og eventuelt støttet av immunhistologiske markører. Det bør ikke foreligge definitiv heterotypisk, ikke-hepatocellulær (f.eks. kolangiocyttisk) differensiering (WHO Classification of Tumours Editorial Board, 2019).
Molekylærpatologi
Molekylærgenetiske undersøkelser er vanligvis ikke nødvendige for diagnostikk av HCC, men fluorescent in situ hybridisering (FISH) eller polymerasekjedereaksjon (PCR) kan brukes for påvisning av DNAJB1-PRKACA fusjonsgen ved fibrolamellært karsinom (Torbenson, 2021). En molekylær og immunologisk klassifikasjon av HCC har vært foreslått (Llovet et al., 2021), men foreløpig finnes ikke et bredt akseptert og klinisk relevant integrert morfologisk-molekylært klassifikasjonssystem for HCC (Torbenson, 2021).
Det er per mars 2023 ingen egnede molekylærgenetiske biomarkører for å predikere respons ved systemisk behandling av HCC. De vanligste drivermutasjonene (i TERT, CTNNB1 og TP53) mangler i dag behandlingsmuligheter, og bare 20-25 % av HCC har en kjent drivermutasjon som er relevant for målrettet behandling (Llovet et al., 2021). Entrektinib har imidlertid tumoragnostisk godkjenning i andre linje, dersom NTRK-fusjon påvises i tumor (se kapittelet Tumorrettet systemisk behandling). Immunhistokjemisk påvisning av PD-L1 er ikke nødvendig, da den prediktive verdien for effekten av PD-L1- og PD-1-hemmere foreløpig ikke er definert (Finn et al., 2020).
Prognostiske faktorer og stadieinndeling
Prognosen ved HCC kan predikeres av tumorgrad, karinfiltrasjon, intrahepatiske metastaser og stadium. Eksempler på mindre etablerte prognostiske faktorer er subtype av HCC, immunhistokjemisk uttrykk av CK19, amplifikasjon av FGF19 og genuttrykksprofil (WHO Classification of Tumours Editorial Board, 2019). Det er ikke etablert definitive grenseverdier for tumornekrose som korrelerer med prognose etter nedgradering eller retningslinjer for hvordan omfanget av nekrose bør vurderes (Burt et al., 2018). Ved klassifisering i patologisk tumour, node, and metastasis (TNM) korresponderer kategoriene pT og pN med T og N i den gjeldende kliniske TNM-klassifiseringen (Brierley et al., 2017).
Undersøkelse og rapportering av nålebiopsier
Indikasjoner for biopsi og klinisk informasjon
Nålebiopsi fra mistenkt eller mulig HCC er indisert i følgende situasjoner:
- Før enhver tumorrettet behandling hos pasienter uten cirrhose, hvis ikke MDT-møtet anbefaler reseksjon uten biopsi, se kap. 5.5.2 (European Association for the Study of the Liver, 2018)
- Ved ukarakteristisk kontrastopptak og mistanke om HCC, etter drøfting på MDT-møte (European Association for the Study of the Liver, 2018)
- Ved palliativ tumorrettet behandling (Childs et al., 2021)
The British Society of Gastroenterology, The Royal College of Radiologists og The Royal College of Pathologists (Neuberger et al., 2020) anbefaler at det ved biopsering av fokale lesjoner også tas en minst 20 mm lang biopsi fra ikke-lesjonelt levervev. Det bør angis tydelig på rekvisisjonen om en biopsi er fra en fokal lesjon eller fra øvrig levervev (Neuberger et al., 2020). Lesjonens størrelse, lokalisasjon (segment) og annen viktig klinisk informasjon (kronisk leversykdom, tidligere malign sykdom og bildediagnostiske funn) bør angis på rekvisisjonen.
Histologisk undersøkelse og rapportering av nålebiopsier
Kliniske opplysninger er svært viktige for den histologiske undersøkelsen. Den histologiske diagnosen bør følge etablerte morfologiske og immunhistokjemiske kriterier som skissert over. Anbefalinger om immunhistokjemiske markører ved ulike scenarier er gitt bl.a. i retningslinjene fra The Royal College of Pathologists (Wyatt et al., 2022). Her gis også anbefalinger om rapportering av nålebiopsier fra fokale lesjoner, inkludert følgende:
- Mottatt klinisk informasjon
- Makroskopisk beskrivelse, inkludert størrelse på biopsien(e)
- Tilstedeværelse eller fravær av vev fra den fokale lesjonen og fra ikke-lesjonelt levervev
- Morfologisk beskrivelse av lesjonen
- Resultater fra tilleggsundersøkelser, inkludert immunhistokjemi
- Kommentar om ikke-lesjonelt levervev, hvis tilstrekkelig vev er inkludert
- Definitiv diagnose for lesjonen når det er mulig, eller diskusjon om differensialdiagnose
- En konklusjon bestående av en konsis oppsummering av rapporten
- Diagnosekode
- Dokumentasjon av relevant intern og ekstern konsultasjon eller diskusjon med kliniker
Undersøkelse og rapportering av kirurgiske preparater med HCC
Kliniske opplysninger
Kliniske opplysninger er nødvendige for at patologen skal kunne gi klinisk relevant diagnostisk informasjon ved rapportering. The Royal College of Pathologists (Wyatt et al., 2022) anbefaler at følgende kliniske opplysninger inkluderes ved rekvisisjon av patologisk undersøkelse:
- Type kirurgisk prosedyre og inkluderte segmenter
- Tumors lokalisasjon og radiologiske funn (eller tilgjengelig radiologisk rapport)
- Mulighet for komplett reseksjon eller kjent resttumor
- Tidligere lokoregional behandling eller neoadjuvant kjemoterapi
- Kronisk leversykdom og etiologiske faktorer
- Inkluderte lymfeknuter, i hovedpreparatet eller separat
- Tidligere leverkirurgi
Makroskopisk undersøkelse og snittuttak
Før fiksering av større kirurgiske preparater kan det skjæres fikseringssnitt gjennom den fremre flaten, og eventuell galleblære bør åpnes og tømmes. Preparatet fikseres i formalin i minst 24 timer. Resektatet veies, og størrelsen måles i tre dimensjoner (anteroposteriør, mediolateral og superoinferiør). Lengden på ekstrahepatiske galleganger, samt antall og lokalisasjon av lymfeknuter (hilus, a. hepatica, v. portae, ductus cysticus), angis når disse er inkludert. Alle overflater bortsett fra leverkapselen bør markeres med tusj, inkludert reseksjonsrand i levervev, periduktalt disseksjonsplan ved hilus og eventuelt adherent vev på leverkapselen. Levervevet skjæres i maksimalt 10 mm tykke skiver vinkelrett mot reseksjonsranden i levervevet. Perihilært levervev kan skjæres i skiver vinkelrett mot overflaten for fremstilling av eventuell ekstrahepatisk tumorvekst i relasjon til reseksjonsranden. I totale hepatektomipreparater kan hilus skjæres ut som en vevsblokk og skivedeles parallelt med, eller vinkelrett mot leveroverflaten.
Antall tumorer og deres lokalisasjon, diameter og avstand fra reseksjonsrender noteres. Ved multiple tumorer (inkludert satellitter, multifokale tumorer og intrahepatiske metastaser) er det tilstrekkelig å angi diameter for minst de fem største lesjonene, samt minste og største diameter for ytterligere lesjoner (Burt et al., 2018). Multiple tumorer bør nummereres, og deres lokalisasjon angis etter segmentnummer eller på annen måte som tillater korrelasjon med bildediagnostikk. Preparatet undersøkes nøye for karinvasjon. Involvering av portvenens venstre eller høyre hovedgren, eller noen av de tre levervenene, bør noteres spesielt. Store lymfeknuter uten makroskopisk tumor støpes inn i sin helhet. Makroskopiske preparater bør fotograferes, og snittuttak og annen viktig informasjon bør noteres på bildene (Burt et al., 2020).
Det bør tas minst tre snitt fra tumor (hvis størrelsen tillater), og det bør tas snitt fra alle områder som skiller seg ut makroskopisk. Etter preoperativ behandling bør hele tumor undersøkes mikroskopisk hvis det er praktisk mulig. For mer selektiv prøvetaking anbefales et helt tverrsnitt av tumor, hvis tumor er ≤ 2 cm og ytterligere ett snitt per cm tumordiameter for større tumorer (Burt et al., 2020; Wyatt et al., 2020). International Collaboration for Cancer Reporting (ICCR) gir ingen anbefaling om hvor mange tumorer som bør undersøkes mikroskopisk, men det kan synes rimelig å ta snitt fra opp til ti lesjoner.
Snittuttaket bør inkludere følgende:
- Tumor med nærmeste reseksjonsrand (hvis det kan fremstilles i én blokk)
- Tumor med kapsel (hvis makroskopisk mulig invasjon)
- Tumor med omgivende levervev
- Øvrige deler av tumor (ved stor og/eller heterogen tumor)
- Tumor med relasjon til galleblæreseng og galleblære (hvis nærliggende tumor)
- Tumor med relasjon til andre tilgrensende strukturer
- Områder med mulig invasjon i kar eller galleganger
- Snitt fra levervev utenfor tumor (så langt som mulig fra tumor)
- Reseksjonsrender i galleganger og blodkar (hvis relevant)
- Leverhilus inkludert galleganger og blodkar (hvis relevant)
- Alle makroskopisk påvisbare lymfeknuter
-
Histologisk undersøkelse og rapportering av operasjonspreparater
Diagnostikk av HCC i operasjonspreparater følger de samme prinsippene som i biopsier. Ved rapportering anbefales bruk av et standardisert diagnoseoppsett som følger veilederen fra ICCR (Burt et al., 2020) og inneholder følgende elementer:
- Type kirurgisk preparat
- Preparatets størrelse i tre dimensjoner (mm)
- Preparatets vekt (g)
- Satellitter
- Makroskopisk ruptur av tumor
- Tumorstørrelse og antall
- Største tumordiameter
- Histologisk tumortype (HCC)
- Subtype av HCC
- Makroskopisk vekstmønster
- Histologisk tumorgrad
- Tumors utbredelse, makroskopisk og mikroskopisk
- Perinevral invasjon
- Karinvasjon, makroskopisk og mikroskopisk
- Annen patologi inkludert premaligne lesjoner
- Respons til neoadjuvant og lokoregional behandling
- Kirurgisk(e) margin(er)
- Lymfeknuter, totalt antall undersøkt og antall involverte
- Resultater av tilleggsundersøkelser (inkludert immunhistokjemi og molekylærgenetikk)
- Patologisk stadieinndeling (pTNM)
Elementer med fet skrift er essensielle for klinisk håndtering, stadieinndeling eller prognose med høyt evidensnivå og bør alltid rapporteres (kjerneelementer). Øvrige elementer kan ha klinisk betydning, og rapportering av disse anses som god praksis, men de støttes ikke av et høyt evidensnivå for pasienthåndtering (ikke kjerneelementer).
For TNM-klassifisering betraktes satellitter, multifokale tumorer og intrahepatiske metastaser som separate tumorer. På grunn av manglende internasjonal konsensus eller klart evidensgrunnlag for definisjoner av R1 ved HCC, anbefaler ICCR-rapportering av avstanden til marginen fremfor R-status. Rapportering av respons til preoperativ behandling er ikke et krav, men et estimat av andel nekrose kan gjøres ved kombinasjon av makroskopiske og mikroskopiske funn i opp til de fem største tumorknutene (Burt et al., 2020). Makroskopisk beskrivelse med snittuttak må inngå i svarrapporten.
Anbefaling
- HCC graderes etter differensiering i et tredelt system i henhold til WHO.
- Makroskopisk undersøkelse og vevsuttak bør gjøres etter en standardisert prosedyre og kan følge gjeldende anbefalinger fra The Royal College of Pathologists.
- Rapportering av HCC i kirurgiske preparater bør gjøres etter et standardisert oppsett og kan følge gjeldene veileder fra International Collaboration for Cancer Reporting.
Stadieinndeling
Sist faglig oppdatert: 18.04.2024
Behandlingsmuligheter og prognose ved HCC er avhengig av sykdomsutbredelse, eventuell underliggende kronisk leversykdom og pasientens generelle helsetilstand. Det finnes en rekke internasjonale klassifikasjonssystemer som alle har sine fordeler og begrensninger. Det er viktig at vurdering av pasienter med HCC skjer i samarbeid med sykehus med nødvendig HPB-kirurgisk kompetanse.
Vurdering av tumor
Det er en sammenheng mellom tumorstørrelse, mikrovaskulær invasjon og prognose. Både største tumordiameter, og summen av hver tumors største diameter, har betydning (Mazzaferro et al., 2018). Innvekst i kar, spesielt portvene, levervene eller vena cava inferior, signaliserer avansert sykdom og begrenser behandlingsvalg. Tumortrombe i galleveier er sjelden, men også et dårlig tegn. Satellitter regnes som separate svulster. HCC metastaserer (utenom lever) hyppigst til lunger, lokoregionale lymfeknuter, skjelett, binyrer og bukhinne.
Vurdering av leversykdom og -funksjon
Flere enn to av tre pasienter med HCC har noen grad av levercirrhose som kan begrense behandlingsmulighetene. Et enkelt system for å bestemme cirrhosegraden er Child-Pugh (CP). Basert på blodprøver (INR, albumin og bilirubin) samt ev. tilstedeværelse av ascites og encefalopati, klassifiseres pasientene i cirrhosegrad A, B eller C, der C er den mest alvorlige. Det er internasjonalt enighet om at kirurgi generelt ikke anbefales hos pasienter med mer enn 6 poeng, tilsvarende cirrhosegrad CP-A, men i noen tilfeller kan man vurdere å operere pasienter med inntil 7 poeng (CP-B7).
TABELL KOMMER
Tabell 3. Pugh, R.N., et al. (1973) Transection of the oesophagus for bleeding oesophageal varices. Br J Surg 60(8): 646-649.
I Model for End-Stage Liver Disease Na (MELD-Na)-skår inngår dialyse, kreatinin, bilirubin, INR og natrium (Kamath et al., 2001). Dekompensert leversykdom med ikterus, ascites og encefalopati er uttrykk for sviktende leverfunksjon uavhengig av Child-Pugh-skår eller MELD-Na-skår. Kompensert leverfunksjon kan deles inn etter albumin-bilirubin (ALBI)-skår.
ALBI og PALBI skårer pasientene ut fra albumin og bilirubin (og ev. trombocytter; ‘platelets’) for å predikere risiko for leversvikt før behandling, og har vist seg verdifulle blant annet i forkant av TACE-behandling (Johnson et al., 2015).
Alfa-føtoprotein inngår i flere systemer for stadieinndeling som en prognostisk faktor uansett tumorbyrde (Reig et al., 2022).
Vurdering av funksjonsnivå
Redusert funksjonsnivå og tilleggssykdommer kan begrense behandlingsmulighetene. Det er laget flere skåringssystemer, ett av dem er Eastern Cooperative Oncology Group Performance Status (ECOG PS), se vedlegg 2, som inngår i BCLC og består av seks kategorier (PS 0-5). American Society of Anesthesiologists’ klassifisering av komorbiditet består av fem kategorier (ASA 1-5), se vedlegg 3.
BCLC-algoritmen
Barcelona Clinic Liver Cancer (BCLC)-algoritmen, som ble utviklet i 1999, tar hensyn til pasientens allmenntilstand, sykdomsutbredelse og leverfunksjon, og danner en ramme der disse faktorene fører til stadieinndeling, en spesifikk terapianbefaling og et estimat for forventet overlevelse (figur 1). BCLC-systemet har blitt endret fortløpende med forbedret diagnostikk, prognose og kunnskapsbasert behandling. Det har blitt evaluert og validert i mange studier og er anbefalt av både den europeiske og den amerikanske foreningen for leversykdom (EASL og AASLD).
I siste utgave av BCLC-algoritmen fra 2022 (Reig et al., 2022) er intermediær-stadiet (BCLC-B) delt inn i tre grupper etter tumorbyrde og leverfunksjon. Den første subgruppen er pasienter som er kandidater for levertransplantasjon etter lokale kriterier (kfr. kap. 6.2). Den andre subgruppen er pasienter som ikke er kandidater for levertransplantasjon, men som har bevart blodstrøm i portvenen og veldefinerte svulster med selektiv tilgang til tilførende arterier, og som dermed kan være egnet for TACE. Indikasjonene for levertransplantasjon er utvidet og inkluderer BCLC-B pasienter etter vellykket nedgradering med TACE. Den tredje subgruppen omfatter pasienter med diffus, infiltrerende og utbredt bilobær sykdom, som anbefales systembehandling som for BCLC-C, i første linje.
Reseksjon er også i den siste oppdateringen forbeholdt pasienter med BCLC-0 og BCLC-A med én enkelt tumor. Det er imidlertid data som støtter reseksjon hos pasienter med multinodulær HCC, spesielt BCLC-A med to eller tre tumorer, hver ≤ 3 cm, men også for pasienter med resektabel HCC utenfor Milano-kriteriene, se kapittel 6.1.2.6. Pasienter med WHO/ECOG PS 1-2 er fortsatt i BCLC-C og dermed utelukket for reseksjon. Minst én studie har vist at WHO/ECOG PS 1 ikke er en absolutt kontraindikasjon for reseksjon (Wu et al., 2019). Dikotomi bevart/ikke-bevart leverfunksjon innebærer at en andel pasienter, som ellers kunne klassifiseres i BCLC 0-C ut fra tumorbyrde og relaterte symptomer, havner i BCLC-D. I algoritmen vektlegges betydningen av å individualisere behandlingen i en tverrfaglig sammenheng og handlingsrommet er utvidet fra tidligere.
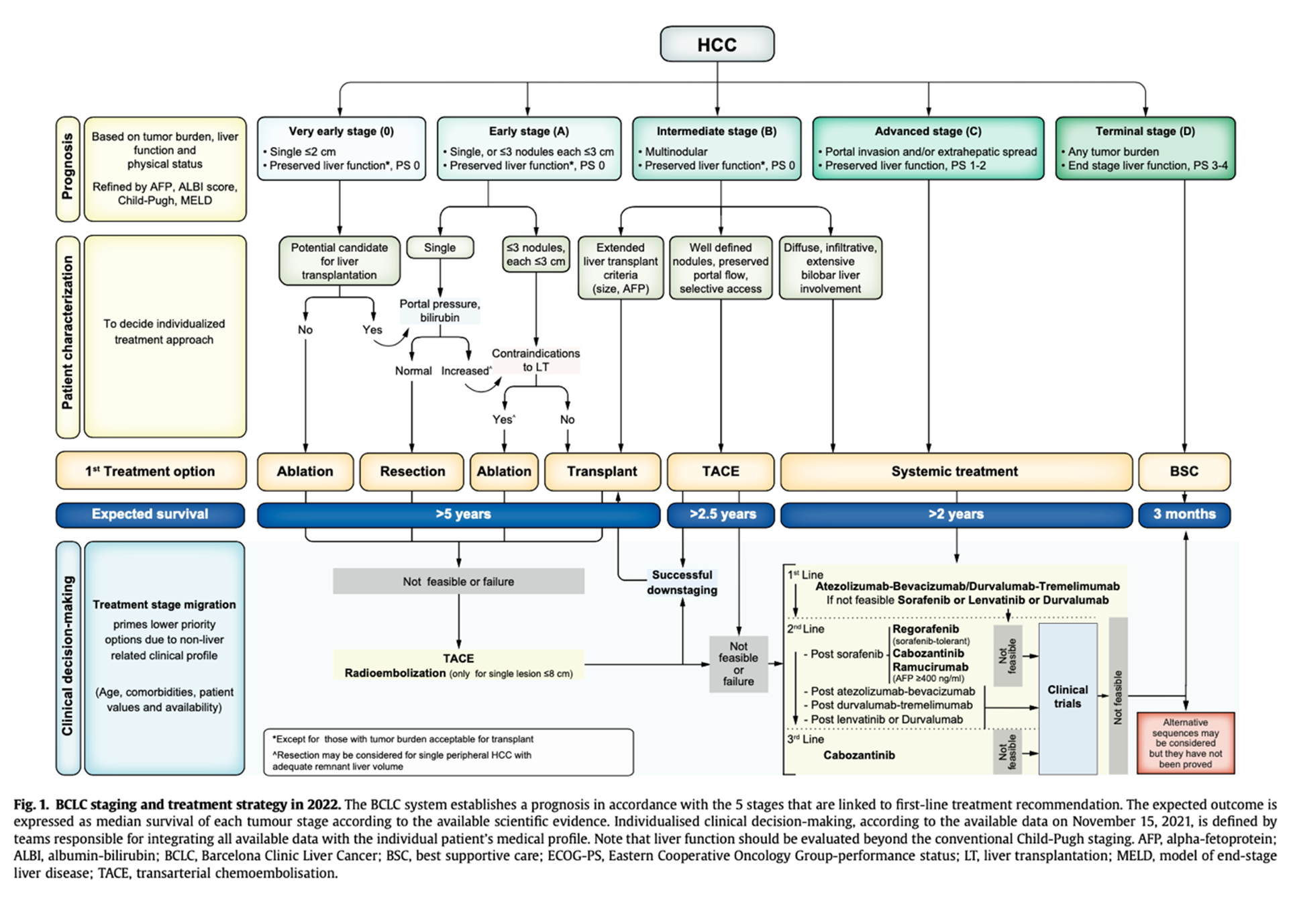
Se større figur
TNM-klassifikasjonen
TNM-klassifikasjonen til Union internationale contre le cancer (Brierley et al., 2017)/ The American Joint Committee on Cancer/ (UICC/AJCC), se vedlegg 4, er den mest brukte klassifiseringen for mange kreftformer. Den er basert på anatomi og brukes i liten grad ved HCC, fordi allmenntilstand og leverfunksjon ikke inngår.
Okuda/CLIP
Okuda-klassifikasjonen og Cancer of the Liver Italian Program (CLIP) er kliniske systemer som både tar hensyn til pasientens leverfunksjon og preoperativ tumorutbredelse. Systemene er imidlertid best egnet for å klassifisere pasienter i avansert sykdomsstadium og er uegnet for seleksjon av pasienter i tidlige stadier av sykdommen.
Hong Kong-klassifikasjonen (HKLC)
Hong Kong-kriteriene baserer seg i noen grad på samme parametere som BCLC, men åpner mulighet for potensielt kurativ behandling av pasienter med intermediær sykdom. I HKLC-algoritmen er ikke portal hypertensjon en så sentral faktor ved reseksjonsvurdering som i BCLC. Algoritmen er imidlertid i hovedsak validert i asiatiske populasjoner hvor underliggende leversykdom har annen etiologi enn i vestlige befolkningsgrupper (Yau et al., 2014).
Multidisiplinær tilnærming
Sist faglig oppdatert: 18.04.2024
Oppdaterte faglige retningslinjer og algoritmer gir en oversikt over kunnskapsgrunnlaget for de forskjellige intervensjoner, men når et behandlingsopplegg skal skreddersys til den enkelte pasienten er en tverrfaglig tilnærming avgjørende helt fra første diagnostiske undersøkelser til initial og senere behandling. Det krever et koordinert samarbeid mellom ulike spesialiteter slik at det sikres kompetanse i diagnostisk radiologi, patologi, intervensjonsradiologi, onkologi, kirurgi og hepatologi (Salgia et al., 2021). I utredningsfasen er det særdeles viktig med god dialog og tydelig ansvarsavklaring mellom henvisende lege og MDT-møtet, slik at all relevant informasjon om pasienten raskt blir tilgjengelig, og slik at det blir klart hvem som har ansvar for å bestille supplerende undersøkelser. Det er naturlig at forløpskoordinator fasiliterer dette samarbeidet i tillegg til å påse at tidsfrister i pakkeforløpet overholdes. Målet er å gjennomføre utredning og tolke funn inn i en helhet som omfatter blant annet tumorutbredelse og -byrde, underliggende leversykdom, leverfunksjon, komorbiditet, funksjonsnivå og skrøpelighet (frailty), ernæringsstatus, alder, psykososiale forhold og personlige preferanser, men også vurdering av behandling, respons og progresjon. Hos pasienter med mulig reversible tilstander som påvirker leverfunksjon og begrenser behandlingsmuligheter, for eksempel virushepatitt eller alkoholrelatert leversykdom, kan en etter vellykket behandling av den underliggende tilstanden vurdere behandlingsmulighetene på nytt.
Pasientene skal drøftes på regionalt multidisiplinært levermøte, og pasienter som ønskes vurdert for levertransplantasjon må henvises MDT-møtet ved OUS, Rikshospitalet.
Lokal behandling
Kirurgisk behandling
Sist faglig oppdatert: 18.04.2024
Preoperative vurderinger
Vurderingen fordrer oppdatert bildediagnostikk, leverfunksjonsprøver, informasjon om underliggende leversykdom (viral sykdom, alkohol), komorbiditet, funksjonsnivå (ECOG) og pasientens preferanser.
Bildediagnostikk
Som et minimum av utredning for kirurgi bør det foreligge CT-thorax og flerfase CT-lever/abdomen (se kapittelet Bildediagnostikk). Supplerende MR-lever med kontrast bør også gjennomføres så raskt som mulig hos potensielle reseksjonskandidater.
Leverfunksjon
Se kapittelet Utredning og diagnostikk. Ved mistanke om cirrhose og/eller redusert leverfunksjon, bør Child Pugh-skår beregnes, ev. også supplert med MELD-Na-skår og ALBI-skår. Anbefalte laboratorieprøver inkluderer INR, bilirubin, albumin, natrium, kreatinin og AFP. I tillegg kan gastromedisinsk utredning vurderes med eksempelvis transient elastografi og eventuelt leverbiopsi. Hvis funksjonen i framtidig leverrest mistenkes å være redusert, kan denne estimeres med nukleærmedisinsk funksjonsvurdering (99Tc-mebrofeninscan) der en verdi under 2.7 %/min/m2 indikerer signifikant redusert funksjon (de Graaf et al., 2010).
Portal hypertensjon
I noen tilfeller der det mistenkes klinisk signifikant portal hypertensjon, uten at dette er åpenbart ut fra kliniske og radiologiske funn, kan invasiv trykkgradientmåling (levervene – portvene) vurderes. Innkilt trykkgradient (Hepatic Venous Pressure Gradient, HVPG) angis som differansen mellom innkilt venetrykk (tilsvarer portvenetrykket) og trykket i vena cava inferior. Målingen utføres perkutant med transjugulær tilgang.
Levervolum
Ved større formelle reseksjoner er det nødvendig å evaluere fremtidig leverrest (FLR). Volumet kan beregnes i forhold til kroppsoverflate (BSA) og angis som en standardisert verdi (sFLR) jfr. Vautheys formel (Vauthey et al., 2002). Adekvat restvolum er direkte avhengig av estimert funksjon (se kap. 6.1.2.2).
Operabilitetskriterier
Cirrhotisk eller ikke-cirrhotisk lever
Ved vurdering for reseksjon er det viktig å skille mellom lever med og uten cirrhose. I en ikke-cirrhotisk lever med solitær tumor er kirurgi førstevalg, men ablasjon kan vurderes ved små og/eller sentrale lesjoner. I Norge har andelen av pasienter med HCC i ikke-cirrhotisk lever vært noe høyere enn i resten av verden, men den er avtagende (Eskesen et al., 2014). Kirurgi ved HCC og levercirrhose forutsetter i regelen godt kompensert funksjon (Child-Pugh A) og begrenset sykdom. Ved levercirrhose og små lesjoner (2-3 cm), kan ablasjon være et jevngodt alternativ til kirurgisk reseksjon (Shindoh et al., 2013), og ofte være førstevalg hos pasienter med klinisk portal hypertensjon.
Nødvendig restvolum
Større formelle reseksjoner kan vurderes gjennomført med akseptabel risiko dersom sFLR beregnes til > 30 % (ikke-cirrhotisk lever) eller > 40 % (cirrhotisk lever). Hvis restvolum ikke er tilstrekkelig, kan pasienten vurderes for volumekspanderende tiltak (portvene-embolisering) eller transplantasjon.
Leverens evne til å hypertrofiere (kinetisk veksthastighet, kinetic growth rate - KGR) estimeres med CT-kontroll to uker etter emboliseringen, og benevnes KGR2w (Shindoh et al., 2013). En KGR på > 2 prosentpoeng/uke anses å indikere god vekstfunksjon.
Portal hypertensjon: implikasjoner
Portal hypertensjon er en relativ kontraindikasjon mot reseksjon. HVPG > 5 mm Hg er patologisk, og gradient > 10-12 mm Hg innebærer signifikant økt risiko for perioperative komplikasjoner og mortalitet (10 %) (Azoulay et al., 2021). Kirurgi ved høyere trykk enn dette krever særskilt vurdering og bør kun gjøres i protokoll.
Pågående alkohol- og/eller annet rusmisbruk
Dette utgjør i utgangspunktet en klar kontraindikasjon mot reseksjon.
Aktiv hepatitt og antiviral behandling
Kirurgi bør utsettes noe ved ubehandlet virushepatitt. Antiviral behandling må starte umiddelbart, og leverkirurgi kan gjøres etter noen ukers behandling.
Multifokalitet og tumorstørrelse
Ifølge BCLC-kriteriene begrenses indikasjonen for reseksjon til pasienter med solitære svulster og sykdomsstadiene BCLC-0 (very early stage) og BCLC-A (early stage), mens pasienter med 2-3 lesjoner (alle < 3 cm), også BCLC-A, bør vurderes for ablasjon eller transplantasjon fremfor reseksjon. Det finnes imidlertid mange publikasjoner som viser at pasienter utenfor både BCLC- og Milan-kriteriene kan oppnå akseptabel langtidsoverlevelse etter reseksjon (Garancini et al., 2018; Tsilimigras, 2020; Zaydfudim et al., 2016). I en systematisk oversikt med 23 artikler og 2412 pasienter med multifokal sykdom var antall svulster avgjørende for 5-års overlevelse; ≤ 3 svulster: 49 % vs. > 3 svulster: 23 % (Glantzounis et al., 2018). En multisenterstudie med 1066 pasienter med levercirrhose viste 5-års overlevelse: ≤ 2 svulster: 58 % vs. > 2 svulster: 35 % (Li et al., 2019). Total tumorbyrde (størrelse og antall) kan bidra til å predikere overlevelse (Tsilimigras, 2020). Pasienter med begrenset multifokal sykdom og tumorstørrelse noe utover BCLC-kriteriene, kan ha overlevelsesgevinst etter reseksjon, eventuelt i kombinasjon med ablasjon, så lenge kirurgi er teknisk gjennomførbart med tanke på restvolum, portalt trykk og leverfunksjon. Slike reseksjoner bør fortrinnsvis gjøres i protokoll. Pasientgruppen er heterogen og må diskuteres individuelt og multidisiplinært for å oppnå best tilpasset behandling (Glantzounis et al., 2018; Koh et al., 2018; Ruff et al., 2020; Tsilimigras, 2020).
Makrovaskulær invasjon
Tumortromber i portas hovedstamme og tromber som vokser inn i vena cava inferior er absolutte kontraindikasjoner for kirurgi, selv om noen serier med resecerte tromber i vena cava er publisert fra Asia. Reseksjon av svulster med mer perifere tumortromber kan vurderes for kirurgi i selekterte tilfeller, og da helst i protokoll (Glantzounis et al., 2018).
Ekstrahepatisk spredning
Som hovedregel er funn av ekstrahepatisk metastasering et ekslusjonskriterium for kirurgisk reseksjon.
Kirurgisk teknikk og tilgang
Laparoskopisk tilgang har i flere serier vist sammenlignbare resultater med åpen teknikk med tanke på overlevelse. Randomiserte studier (laparoskopisk vs. åpen teknikk) med langtidsoverlevelse som endepunkt er ikke publisert. Imidlertid er det i flere case-control-studier og meta-analyser vist at minimalinvasiv leverkirurgi medfører mindre intraoperativt blodtap, lavere transfusjonsrate, færre liggedøgn og raskere postoperativ rekonvalesens uten å kompromittere reseksjonsmarginer eller radikalitet (El-Gendi et al., 2018; Hendi et al., 2021). Hos pasienter med cirrhose anses det også viktig å bevare bukveggens integritet i størst mulig grad, og minimalinvasiv tilgang kan bidra til dette.
Anatomisk vs. ikke-anatomisk reseksjon er omdiskutert. På den ene siden vil en ved anatomisk reseksjon kunne oppnå god margin og ta med portvenesirkuasjonen i det tumoraffiserte området av leveren for å forhindre tilbakefall, på den andre siden vil det redusere FLR og øke risiko for postoperativ leversvikt.
Frie reseksjonsmarginer tilstrebes. Dersom tumor ligger inntil intrahepatiske strukturer som innebærer at kirurgi øker risiko for postoperativ leversvikt, aksepteres R1-margin mot kar og galleveier, så lenge det ikke foreligger tegn til invasiv vekst (vaskulær R1).
Levertransplantasjon
Begrenset organtilgang gjør at levertransplantasjon generelt sett bare kan tilbys pasienter som tilfredsstiller definerte seleksjonskriterier. Kriteriene skal på gruppenivå kunne predikere en overlevelse etter transplantasjon som er sammenlignbar med den som oppnås for de fleste som blir levertransplantert. Alder, komorbiditet og forventet levetid vil påvirke beslutningen uavhengig av eventuell indikasjon for levertransplantasjon. Det er ikke spesifikke absolutte aldersgrenser, men sannsynligheten for prioritet til transplantasjon vil på grunn av de ovenfor nevnte begrensninger være redusert ved alder vel over 70 år, og spesielt dersom det foreligger samtidig sykdom som forventes å påvirke leveutsikten generelt.
Levertransplantasjon er indisert ved HCC i relativt tidlig fase og er spesielt velegnet ved samtidig leversykdom (Child B+C). Transplantasjon utgjør den optimale behandling ved HCC i cirrhotisk lever, da behandlingen fjerner svulstene samtidig som den underliggende årsaken elimineres. Begrensninger i tilgjengelige donorgraft gjør imidlertid at pasienter med resektable HCC i hovedregel skal tilbys leverreseksjon. Ekstrahepatisk tumorsykdom og makrovaskulær invasjon (annet enn segmentalgrener (Vp1)) er absolutte kontraindikasjoner. Tilbakefall etter transplantasjon kommer vanligvis innen de første to år etter transplantasjonen og er assosiert med meget dårlig prognose. Hensikten med transplantasjonskriteriene er derfor å selektere pasienter med liten risiko for tilbakefall. Størrelse og antall lesjoner brukes som surrogatmarkør for stadium, og alfaføtoprotein (AFP) i serum er en viktig markør for tumorbiologi.
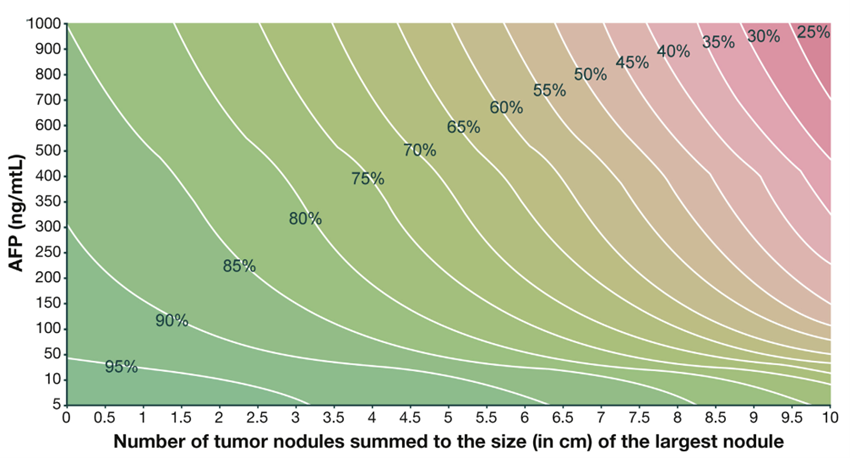
Oslo-kriteriene er noe videre enn de opprinnelige Milan-kriteriene, som danner grunnlag for transplantasjon-seleksjonen i BCLC-algoritmen og er basert på data fra metroticket-prosjektet (http://www.hcc-olt-metroticket.org) og det tilstrebes en estimert 5-års overlevelse på > 60% (Mazzaferro et al., 2018).
Hovedkriterier
Følgende radiologisk baserte morfologiske kriterier for omfang av sykdom kan godkjennes for levertransplantasjon hos pasienter som har AFP < 400:
Sum av antall lesjoner og største diameter (i cm) ≤ 7 (up-to-seven criteria) (Mazzaferro et al., 2009), eller
En tumor opptil 6,5 cm, eller opptil 3 lesjoner der den største er 4,5 cm og samlet tumordiameter ≤ 8 cm (UCSF-criteria) (Yao et al., 2001).
Nedgradering (downstaging) av tumorsykdom
Pasienter med morfologisk tumoraffeksjon i lever utenfor disse kriteriene (flere lesjoner/større diameter på største lesjon og/eller AFP > 400) må gjennomgå nedgradering etter protokoll (Yao et al., 2008; Yao et al., 2015). Aktuelle modaliteter for nedgradering er transarteriell kjemoembolisering (TACE), transarteriell radioterapi (TARE) eller stereotaktisk strålebehandling (SBRT) (Wong et al., 2021). Denne behandlingen kan eventuelt kombineres med ablasjon (radiofrekvens eller mikrobølger), men ablasjon alene kan ikke brukes som nedgradering og vil i så tilfelle kreve residivfri observasjonstid på ca. 12 måneder etter prosedyren. Dersom man oppnår objektiv respons med systemisk behandling, vil mulighet for lokalbehandling også kunne revurderes.
Radiologisk respons etter forsøk på nedgradering skal vurderes etter modifiserte RECIST kriterier (mRECIST) der maksimal diameter av kontrastladende vev måles for hver lesjon, og manglende kontrastoppladning er tegn på komplett respons, se vedlegg 5.
Omfang av tumorsykdom etter avsluttet nedgraderingsterapi bør være innenfor up-to-seven- eller UCSF-kriteriene, som beskrevet i kap. 6.1.4.1.
AFP må etter nedgradering være < 400.
Etter endt nedgradering bør pasienten observeres i 3 mnd. før listing for transplantasjon, men i ett år etter ablasjon eller SBRT.
Det kan vurderes å gi TKI eller atezolizumab og bevacizumab i ventetiden på transplantasjon.
Energibasert tumorablasjon
Sist faglig oppdatert: 18.04.2024
Ablasjon er en minimalinvasiv behandling som kan benyttes alene eller i kombinasjon med andre prosedyrer. Behandlingen tar sikte på å destruere vev uten at det samtidig fjernes. Det skilles mellom kjemisk ablasjon og energibasert ablasjon. I Norge gjøres ablasjoner i dag med bruk av varme eller strøm. Andre metoder, som etanolinjeksjoner og kryoablasjon, benyttes ikke lenger. Ved termoablasjon varmes vevet til temperaturer der det destrueres gjennom koagulasjon og nekrose. Tumorvevet med en ekstra brem omkring varmes opp med likestrøm (radiofrekvensablasjon, RFA) eller mikrobølger (mikrobølgeablasjon, MWA) via nåleelektroder plassert i eller rundt tumor. Ved MWA oppnås høyere temperatur raskere (kortere intervensjonstid) og ‘heat sink effekt’ har mindre betydning. Metodene benyttes om hverandre og anses stort sett som likeverdige (Chong et al., 2020).
For svulster opp til 2 cm har termoablasjon vist seg likeverdig med kirurgisk reseksjon med tanke på langtidsoverlevelse, men enkelte studier har vist noe høyere lokal residivrate. Ablasjon anbefales derfor som førstevalg framfor kirurgi ved små lesjoner hos pasienter med cirrhotisk lever.
Ablasjon krever samme radiologiske utredning som reseksjon. Pasienten må ha akseptable leverfunksjonsverdier (opp til CP B9). Det kreves ikke andre funksjonelle undersøkelser, og ablasjon kan gjøres hos pasienter med kliniske tegn til portal hypertensjon. Ekstrahepatisk spredning og tumortromber er kontraindikasjoner for ablasjon. Tidligere anlagt hepatikojejunostomi eller papillotomi er forbundet med økt risiko for infeksjon og er en relativ kontraindikasjon. Ved ablasjon bør det i slike tilfeller gis forlenget antibiotikaprofylakse.
Når svulster ligger nær sentrale galleveier, kan man vurdere ablasjon med irreversibel elektroporering (IRE). Ved denne metoden appliseres mikropulser med høy spenning (opptil 3000 V) mellom to eller flere nåleelektroder plassert rundt tumor. Dette resulterer i vevsdestruksjon i form av programmert celledød (apoptose) fremfor nekrose, som er tilfellet ved RFA og MWA. Metoden er tilgjengelig ved OUS, Rikshospitalet.
Alle ablasjonsteknikker kan benyttes perkutant eller kirurgisk (laparoskopiveiledet eller ved åpen tilgang), enten alene eller i kombinasjon. Perkutane ablasjoner kan gjennomføres med våken pasient i lokalanestesi, men narkose foretrekkes for optimal nåleplassering. Ved IRE er det absolutt nødvendig med narkose og totalt relaksert pasient. Hjerterytmeforstyrrelser er en kontraindikasjon, fordi de elektriske pulsene ved IRE må koordineres med repolariseringsfasen på EKG.
Ved ablasjon tilstrebes en margin på 1 cm. Den kan kontrolleres og ev. korrigeres ved hjelp av CT under prosedyren, men det er vanligere å kontrollere med flerfase CT kort tid etterpå, gjerne før utskrivelse. Dersom marginene ikke er kontrollert i forbindelse med prosedyren, anbefales flerfase CT etter én måned. Kontroller utover dette følger rutiner som etter kirurgisk reseksjon.
Ablasjon kan i noen tilfeller av HCC benyttes som «bridge» til levertransplantasjon, se avsnittet "Nedgradering (downstaging) av tumorsykdom" i kapittelet Kirurgisk behandling.
Anbefaling
- Pasienter med suspekt HCC bør diskuteres Pasienter med suspekt HCC på regionalt MDT-møte ved avdeling med ansvar for leverkirurgi.
- Preoperativ utredning innbefatter vurdering av leverfunksjon, komorbiditet, funksjonsnivå (ECOG) og tumorutbredelse.
- Kirurgi begrenses i utgangspunktet til pasienter med BCLC-A. Pasienter med sykdomsutbredelse utover dette kan i selekterte tilfeller vurderes for kirurgi.
- Ablasjonsbehandling anbefales som førstevalg til pasienter med små lesjoner i en cirrhotisk lever.
- Pasienter med levercirrhose og HCC som ikke er kandidater for ablasjon eller reseksjon (inkludert Child-Pugh B og C), kan vurderes for levertransplantasjon innenfor Oslo-kriteriene.
- Pasienter utenfor Oslo-kriteriene kan ev. gjennomgå nedgraderende behandling med TACE, TARE eller SBRT.
- TKI eller immunterapi kan vurderes som bro mot transplantasjon.
Transarterielle teknikker
Sist faglig oppdatert: 18.04.2024
Hepatocellulære karsinomer er i hovedsak hypervaskulære, og svulstenes arterielle blodforsyning gir mulighet til å indusere iskemi og nekrose i tumoren ved å blokkere denne. Dette åpner for terapeutisk intervensjon med perkutane transarterielle teknikker.
Transarteriell kjemoembolisering (TACE)
Ved TACE kombineres arteriell embolisering med cellegiftbehandling (Llovet et al., 2002). I Norge (og Norden ellers) gjøres dette vanligvis ved å bruke medikamentavgivende partikler (drug-eluting beads TACE; DEB-TACE) ladet med doksorubicin. Tilførende arterie kateteriseres så selektivt som mulig, og partiklene injiseres under angiografisk gjennomlysning inntil blodtilførselen til tumor opphører. Avhengig av tumorstørrelse og utbredelse, kan repeterte behandlingsprosedyrer være nødvendig. Metoden er tilgjengelig ved OUS, Rikshospitalet, og Haukeland universitetssjukehus.
For pasienter med intermediær HCC som ikke kan tilbys kurativ behandling, er TACE etablert som førstelinjebehandling i henhold til Barcelona-algoritmen (BCLC-B). For pasienter som primært vurderes for levertransplantasjon, kan TACE være aktuell i ventetiden for å unngå tumorprogresjon («bro til transplantasjon»). I noen tilfeller vil TACE fungere som «downstaging»-terapi og dermed muliggjøre potensiell kurativ behandling, og da spesielt levertransplantasjon. TACE brukes også etter «treatment stage migration» konseptet ved tidligere tumorstadier (BCLC-0/A) hvor reseksjon, ablasjon eller transplantasjon ikke er mulig (Reig et al., 2022).
TACE anses som velegnet hos pasienter uten tumorsymptomer, med bevart leverfunksjon og et begrenset antall veldefinerte svulster som muliggjør selektiv kateterisering av tilførende arterie(r). Forventet overlevelse vil da være over 2,5 år. Diffust utbredte svulster er dårlig egnet for TACE og her bør systemisk behandling vurderes (Reig et al., 2022). Pasientseleksjon er meget viktig for å oppnå forventet resultat, og flere verktøy har blitt utviklet, men ingen av dem er foreløpig universelt akseptert i klinisk hverdag (Han et al., 2020). Med utviklingen av mer effektiv systemisk behandling er det viktig å gjøre en individuell, pasientspesifikk evaluering på MDT-møtene, og da særlig for pasienter i grenseland mellom intermediært og avansert stadium (BCLC-B og BCLC-C). Kombinasjonsbehandling er kommentert i avsnittet "Transarteriell kombinert med annen behandling".
Kontraindikasjoner for TACE er stor, bilobær tumorbyrde, nedsatt allmenntilstand (ECOG > 2), sentral portveneokklusjon, sikker ekstrahepatisk spredning og generelle kontraindikasjoner mot angiografi (inklusive nyresvikt, dersom eGFR < 30 ml/min). Dekompensert leverfunksjon regnes også som kontraindikasjon og kun meget selekterte pasienter med CP > B7 kan tilbys TACE. Ipsilateral segmental- eller subsegmental portvenetrombe, stor tumor eller ascites er ikke kontraindikasjoner per se, og pasienter med dette bør vurderes individuelt.
Mange pasienter får stigning i leverprøver etter TACE. Post-emboliseringssyndrom (PES) kan sees tidlig etter TACE hos opptil 50 % av pasientene og karakteriseres av feber og magesmerter som skyldes iskemi av HCC og tumornekrose. PES er normalt selvbegrensende og varer mindre enn to døgn. Pasienter med PES og utbredt tumornekrose skal som regel ikke dreneres perkutant da man risikerer å kontaminere en ellers steril nekrose. Hvis man er i tvil bør man rådføre seg med avdelingen som utførte emboliseringen. Andre mulige komplikasjoner er reduksjon av leverfunksjon, skade på galleganger og infeksjon med leverabscess. Forsiktighet bør utvises hos pasienter etter papillotomi eller med hepatikojejunostomi pga. økt risiko for utvikling av leverabscess. Systemiske bivirkninger av doksorubicin ved DEB-TACE kan forekomme, men er sjelden (Vogl et al., 2011).
Behandlingsrespons evalueres med flerfase CT ca. fire uker etter første behandling. Respons vurderes ut fra kontrastopplading i tumor og er en viktig prognostisk faktor. Objektiv responsrate (komplett + partiell respons) bør ligge mellom 60 og 90 % vurdert i henhold til modifisert RECIST (mRECIST) (Han et al., 2020). Behandlingen kan gjentas dersom det foreligger kontrastladende tumorrest ved kontroll-CT (arteriell og venøs fase). Som regel bør 2 TACE-behandlinger utføres før en ev. konkluderer at en pasient ikke responderer. Dersom pasienten ikke responderer på TACE, får en betydelig reduksjon i leverfunksjon eller forverring i allmenntilstand, bør annen behandling vurderes (European Association for the Study of the Liver, 2018).
Anbefaling
- TACE anbefales vurdert som førstelinjebehandling for pasienter som ikke kan behandles med reseksjon, ablasjon eller levertransplantasjon, og som har veldefinert tumorbyrde, bevart leverfunksjon (Child Pugh < B8) og er uten alvorlige tumorsymptom (ECOG 0-1) eller ekstrahepatiske metastaser. Respons evalueres iht. mRECIST.
- TACE kan også være aktuelt for å unngå tumorprogresjon i påvente av levertransplantasjon.
Transarteriell embolisering (TAE)
TAE er tumorrettet partikkelembolisering, som TACE, men uten tilsatt medikament. Noen sentra bruker TAE istedenfor TACE, men internasjonale retningslinjer anbefaler fortrinnsvis bruk av medikamentavgivende partikler (Reig et al., 2022). TAE (eller reseksjon) anbefales som førstevalg ved akutt tumorblødning; fortrinnsvis med partikler fremfor coils, slik at mulighet for senere kjemoembolisering opprettholdes.
Anbefaling
- Transarteriell partikkelembolisering anbefales som førstevalg ved akutt blødende HCC.
Radioembolisering (TARE/SIRT)
Embolisering med yttrium-ladede partikler kalles «selektiv intern radioterapi» (SIRT) eller transarteriell radioembolisering (TARE). Behandlingen krever angiografisk og nukleærmedisinsk utredning med kvantifisering av lungeshunt og beregning av terapeutisk stråledose. Som regel vil arteriell tilførsel til behandlet del av lever ikke tettes, slik at postemboliseringssyndrom unngås, og metoden kan derfor også brukes ved portveneokklusjon.
SIRT kan være et alternativ til TACE ved tidlige stadier hvor kirurgi ikke er mulig (Salem et al., 2021). En fase 2 randomisert kontrollert studie (n=72) har vist lenger tid til progresjon og total overlevelse sammenlignet med TACE, men fase 3-studier er nødvendig (Dhondt et al., 2022). SIRT kan også brukes før hemihepatektomi for å oppnå tumorkontroll og samtidig volumøkning av fremtidig leverrest. Videre vil SIRT, som TACE, kunne redusere sykdomsomfang, slik at pasienten kan bli kandidat for transplantasjon (Salem et al., 2021). SIRT kan i sjeldne tilfeller tilbys som palliativ behandling hvis det foreligger portveneokklusjon som utelukker TACE (Reig et al., 2022). Kontraindikasjoner for SIRT er ellers de samme som for TACE. SIRT kan heller ikke tilbys pasienter med betydelig lungeshunt, eller hvis det foreligger anatomiske forhold som gjør at embolisering med partikler utenfor lever ikke kan unngås. Sammenlignet med TACE er SIRT en forholdsvis kostbar og ressurskrevende behandling og foreløpig forbeholdt nøye utvalgte pasienter. Behandlingen tilbys i dag ved Haukeland universitetssjukehus og OUS, Rikshospitalet.
Anbefaling
- SIRT kan overveies i selekterte tilfeller med lokalisert tumorbyrde der annen behandling ikke kan gjennomføres, og i selekterte tilfeller som alternativ til TACE.
Transarteriell kombinert med annen behandling
TACE og ablasjon: Det er mulig å kombinere transarteriell behandling, primært TACE, med ablasjon. Dette kan gjøres simultant eller sekvensielt. En kan da overvinne den enkelte metodes begrensninger og få bedre respons. Dette er ikke en etablert metode med veldefinerte seleksjonskriterier, og kunnskapsgrunnlaget er i hovedsak begrenset til kohort-studier (Yang et al., 2017). Data tyder likevel på bedre respons og overlevelse enn når metodene benyttes hver for seg.
TACE og systemisk behandling: En kinesisk randomisert, kontrollerte studie, LAUNCH-studien, har dokumentert overlevelsesgevinst ved å kombinere TACE og tyrosinkinasehemmere. Man sammenlignet TACE med og uten lenvatinib og viste OS på hhv. 17,8 md. og 11,5 md. (Peng et al., 2022). Tidligere har TACTICS-studien vist forlenget progresjonsfri overlevelse ved kombinasjon av TACE og sorafinib med PFS på 22,8 md. vs. 13,5 md., men ikke signifikant overlevelsesgevinst (Kudo et al., 2022). Mange studier pågår nå for å undersøke kombinasjon av TACE med nyere systemiske behandlinger, inkludert immunterapi. Dette kan komme til å utvide indikasjonene for både TACE og systemisk behandling.
Stereotaktisk strålebehandling
Sist faglig oppdatert: 18.04.2024
Stereotaktisk strålebehandling (stereotactic body radiotherapy, SBRT) kan være et behandlingsalternativ ved begrenset sykdom hos pasienter med HCC, og relativt god leverfunksjon (Child Pugh A og tidlig B), når kirurgisk behandling, inklusiv ablasjon, ikke er gjennomførbart (Wahl et al., 2016). Da det ikke foreligger prospektive randomiserte studier som har sammenlignet SBRT direkte mot andre lokoregionale behandlingsformer, er det imidlertid vanskelig å gi et entydig svar på når SBRT ev. bør velges framfor andre modaliteter. Stereotaktisk strålebehandling gir lokale ett- og tre-års tumorkontrollrater på hhv. 87-97% og 70-84% (Bujold et al., 2013; Rajyaguru et al., 2018), men grunnet hyppig residiv/progresjon utenfor strålebehandlet område gjenspeiles ikke dette nødvendigvis i økt progresjonsfri eller total overlevelse (Huang et al., 2012). Behandlingen gis oftest i form av 3-6 fraksjoner over 1-2 uker til totaldoser på 24-60 Gy. Stråledosen til andre nærliggende organer som ventrikkel, duodenum, kolon, cor og thoraxvegg vil kunne være dosebegrensende, men SBRT er generelt godt tolerert og har få bivirkninger, både på kort og lang sikt. Sjeldne langtidsbivirkninger som GI-blødning, stråleindusert leversvikt og økt ascitesproduksjon forekommer hos 1- 5 % av pasientene. SBRT kan også benyttes som nedgraderende behandling før levertransplantasjon eller annen lokal behandling (Wong et al., 2021).
Anbefalinger
- SBRT (stereotactic body radiotherapy) gir beskjeden toksisitet og god lokal tumorkontroll. Behandlingen kan være aktuell hos pasienter med begrenset sykdom og velbevart leverfunksjon som ikke er kandidater for andre lokale modaliteter.
Konvensjonell strålebehandling
Sist faglig oppdatert: 18.04.2024
Konvensjonell strålebehandling kan være aktuelt i palliativt øyemed for tumorkontroll og symptomlindring, for eksempel ved truende hudperforasjon og malign medullakompresjon (Chen, 2019).
Protonbehandling
Sist faglig oppdatert: 18.04.2024
Det er få randomiserte studier som sammenligner protonbehandling med annen etablert behandling ved lokalisert HCC og derfor vanskelig å gi et klart svar på når en ev. bør velge det fremfor andre behandlingsmodaliteter. En liten randomisert studie av protonbehandling sammenlignet med TACE hos pasienter som oppfylte transplantasjonskriteriene ved diagnose, viste i interimanalyse tilsvarende toårsoverlevelse og mindre toksisitet ved protonbehandlingen (Bush et al., 2016). En nyere randomisert fase 3 ikke-underlegenhetsstudie viste at protonbehandling ikke er dårligere enn RFA for behandling av små residivsvulster etter primærbehandling for HCC når primært endepunkt var 2-års lokal progresjonsfri overlevelse (Kim et al., 2021).
Den største gevinsten av protonbehandling sammenlignet med konvensjonell strålebehandling med fotoner, inkludert SBRT, vil sannsynligvis være god dekning av aktuelle tumorvolum med mindre stråledose til normalvevet omkring svulsten (lever, nyre, ventrikkel, duodenum, kolon, hjerte og thoraxvegg). Kanskje kan også stråledosen mot tumor økes.
Per i dag er ikke protonterapi tilgjengelig i Norge, men når behandlingen etableres, etter planen i løpet av 2024, vil mest sannsynlig pasienter med lokalisert HCC, der kirurgisk behandling, inklusiv ablasjon, ikke er gjennomførbart, kunne ha nytte av å inkluderes i aktuelle behandlingsprotokoller og kliniske studier.
Systemisk behandling
Systemisk tumorrettet behandling
Sist faglig oppdatert: 20.12.2024
Molekylær, målrettet behandling og immunterapi
For pasienter som ikke er kandidater for kirurgisk eller annen lokalbehandling grunnet lokalavansert eller metastatisk sykdom, kan systemisk tumorrettet behandling være et alternativ. I økende grad vurderes også nå systemisk behandling tidligere i sykdomsforløpet. Det er foreløpig for lite data til å vite eksakt hvordan behandlingen skal sekvenseres, men som nevnt (i avsnittet "Transarteriell kombinert med annen behandling" i kapittelet Transarterielle teknikker) har for eksempel en multisenter fase 3-studie fra Kina (LAUNCH-studien) vist betydelig gevinst av å kombinere TACE med lenvatinib (Peng et al., 2022). Per i dag har vi imidlertid ikke grunnlag for å anbefale neoadjuvant systemisk behandling i tilfeller der kurativ behandling er mulig.
Det er så langt heller ikke indikasjon for adjuvant behandling etter kirurgi utenfor kliniske studier. Sorafenib har ikke vist effekt i adjuvant setting (Bruix et al., 2015). Etter lovende fase 2-studier, avventes resultater fra studier med immunterapi i adjuvant setting,
Både effekt av - og toleranse for - systemisk behandling vil avhenge av at pasienten har bevart leverfunksjon, god allmenntilstand og funksjonsklasse (ECOG). Diagnosen bør sikres histologisk før onkologisk behandling.
Systemisk behandling, som er i rask utvikling, bygger nå på tre behandlingsprinsipper; multikinasehemming, angiogenesehemming og sjekkpunkthemming.
FIGUR KOMMER
Figur 3. Oversikt signalhemmere og antistoffer som har vist effekt mot HCC, og hvordan de påvirker T-celler, tumorceller og endotelceller (fase III-data markert med grønne og gule bokser; fase II-data markert med røde bokser). Llovet et al. (2021)
Immunterapi i form av PD-L1-hemmeren atezolizumab i kombinasjon med bevacizumab (atezo+bev), eller i form av PD-L1-hemmeren durvalumab i kombinasjon med CTLA4-hemmeren tremelimumab, er godkjent av Beslutningsforum til bruk i førstelinje for inoperabel HCC hos pasienter som ikke tidligere har mottatt systemisk behandling. (Atezolizumab (Tecentriq) - Indikasjon X - Nye metoder) (Durvalumab (Imfinzi) og tremelimumab (Imjudo) - Nye metoder)
IMbrave 150-studien viste både økt overlevelse (median OS 19,2 md. vs. 13,4 md.) og bedre livskvalitet ved behandling med atezo+bev enn ved sorafenib. Objektiv responsrate (OR) var 27,3 % (hvorav 5,5 % med komplett respons) i atezolizumab/bevacizumab-gruppen mot 11,9 % hos dem som fikk sorafenib. Med tanke påbevacizumab, vil pasientene ofte trenge gastroskopi for å utelukke behandlingstrengende varicer før oppstart. I tillegg må eventuell hypertensjon og venøs tromboembolisme behandles adekvat før oppstart. Ved arterielle tromboemboliske hendelser, eller alvorlig blødning, må bevacizumab seponeres. For atezolizumab må man være oppmerksom på immunologiske kontraindikasjoner og bivirkninger. Ved responsevaluering må man kjenne til muligheten for såkalt pseudoprogresjon, der det kan være aktuelt å kontinuere behandling i minst fire uker og gjenta responsevalueringen før det ev. konkluderes med progresjon (Costa et al., 2021).
I HIMALAYA-studien ga dobbel immunterapi i form av en enkelt dose med CTLA4-antistoff kombinert med kontinuerlig PD-L1-antistoff hver fjerde uke (STRIDE-regimet; Single Tremelimumab Regular Interval Durvalumab) bedre overlevelse enn sorafenib (median OS 16,4 md. vs. 13,8 md.) (Abou-Alfa, 2022). Som sekundært endepunkt viste studien at durvalumab i monoterapi var ikke-underlegen sammenlignet med sorafenib og bedre tolerert enn de to andre behandlingsregimene. Både kombinasjonsbehandlingen (durvalumab/tremelimumab) og durvalumab monoterapi er godkjent for bruk i førstelinje ved avansert eller inoperabelt HCC (Durvalumab (Imfinzi) og tremelimumab (Imjudo) - Nye metoder. Durvalumab (Imfinzi) - Indikasjon IV - Nye metoder). Dette er et godt alternativ til behandling med atezolizumab/bevacizumab i førstelinje i de tilfellene der det foreligger kontraindikasjoner for VEGF-hemmere, men ikke for sjekkpunkthemmere.
For pasienter som er aktuelle for kombinasjonsbehandling med immunterapi bør man diskutere begge alternativer, og vektlegge både fordeler og ulemper ved hvert regime (risiko for blødning, kardiovaskulære hendelser, immunmedierte bivirkninger, tilgjengelighet av langtidsdata, hyppighet av behandlingsbesøk, behov for endoskopi osv.) for å avgjøre det mest passende alternativet for den enkelte pasient, basert på bivirkningsprofil, pasientpreferanser og behandlingsmål.
Alternative behandlingsmuligheter i førstelinje er ulike multikinasehemmere. Sorafenib har inntil godkjenning av atezolizumab og bevacizumab vært førstelinjes behandling for disse pasientene, basert på resultatene fra SHARP-studien som ble publisert i 2008 (Llovet et al., 2008). Lenvatinib, en annen multikinasehemmer, viste ikke-underlegenhet (median OS 13,6 md. vs. 12,3 md.) og annerledes bivirkningsprofil, sammenlignet med sorafenib i REFLECT-studien (Kudo et al., 2018) og er basert på dette også godkjent som førstelinjes behandling ved HCC. Videre er regorafenib godkjent til bruk som andrelinjes behandling etter progresjon på sorafenib (Bruix et al., 2017). Det er foreløpig uavklart hva som er beste andrelinjesbehandling etter atezolizumab/bevacizumab - durvalumab/tremelimumab eller durvalumab monoterapi - men aktuelle regimer som kan vurderes vil være lenvatinib, sorafenib og regorafenib. De vanligste bivirkninger av disse medikamentene er fatigue, diaré og hånd- og fotsyndrom, som oftest vil være reversible ved dosereduksjon eller seponering. Andrelinjes behandling bør vurderes ved bevart leverfunksjon og godt funksjonsnivå etter både tyrosinkinasehemmere og immunterapi, siden data tyder på lengre sykdomskontroll enn ved kun én linjes behandling.
Ramucirumab og kabozantinib er inkludert som behandlingsalternativer i hhv. andrelinje og andre-/tredjelinje i hhv. REACH2-studien og CELESTIAL-studien. Estimert median overlevelse var 8,5 md. for pasienter med AFP > 400 og tidligere behandling med sorafenib som fikk ramucirumab mot 7,3 md. ved placebo (Zhu et al., 2019). Median overlevelse med kabozantinib var 10,2 md. vs. 8,0 md. for placebo (Kelley et al., 2020). Per november 2024 er disse medikamentene til vurdering i Nye metoder.
Biopsi for undersøkelse av genforandringer med tanke på mer målrettet terapi kan vurderes, men per november 2024 er det kun entrektinib som er godkjent målrettet behandling for pasienter med HCC. Entrektinib har tumoragnostisk godkjenning i andre linje eller senere, når ikke andre tilfredsstillende behandlingsalternativer foreligger, dersom NTRK-fusjon påvises i tumor, noe som imidlertid er svært sjelden ved HCC (Entrektinib (Rozlytrek) - Indikasjon II - Nye metoder).
Inklusjon i aktuelle kliniske studier bør tilstrebes i hele behandlingsløpet.

Konvensjonell kjemoterapi
Konvensjonell kjemoterapi, blant annet doksorubicin og FOLFOX (Qin et al., 2013), har tidligere vært forsøkt, men det er ikke dokumentert effekt på overlevelse, og det kan derfor ikke anbefales på generelt grunnlag.
Anbefalinger
- Atezolizumab i kombinasjon med bevacizumab eller durvalumab i kombinasjon med tremelimumab anbefales i førstelinje til behandling av inoperabel HCC hvis det ikke foreligger kontraindikasjoner.
- Durvalumab, lenvatinib og sorafenib er også godkjente alternativer i førstelinjes behandling av inoperabel HCC.
- Regorafenib er godkjent som andrelinjes behandling ved progresjon på sorafenib.
- Det er foreløpig uavklart hva som er beste andrelinjes behandling etter atezolizumab/bevacizumab - durvalumab/tremelimumab eller durvalumab monoterapi -men aktuelle regimer som kan vurderes er lenvatinib, sorafenib og regorafenib.
Palliasjon og støttebehandling
Palliativ støttebehandling
Sist faglig oppdatert: 18.04.2024
For en del av pasientene vil det ikke være aktuelt med tumorrettet behandling, siden det forutsetter god leverfunksjon (Child Pugh A og B) og god funksjonstatus (ECOG 0-1). Hos disse pasientene må symptomrettet lindrende behandling prioriteres. For generelle behandlingsprinsipper vises til: Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen.
Spesielt for denne pasientgruppen er overhyppighet av komorbiditet i form av leversykdom/leversvikt som bidrar til ikterus, ascites og ernæringsvansker. Ved tvil om plagene i hovedsak kommer fra kreftsykdommen eller den underliggende leversykdommen, kan det være gunstig å involvere gastroenterolog/hepatolog i vurdering og behandling også i denne fasen.
HCC er en strålefølsom tumorentitet og man skal være oppmerksom på muligheten for strålebehandling av lokaliserte symptomgivende metastaser, for eksempel i skjelettet eller ved truet hud.
Ernæring
Pasienter med dekompensert cirrhose taper av ulike grunner (lavt kalori-inntak, nedsatt næringsopptak og endret metabolisme) ofte både muskelmasse og kroppsvekt. Ernæringsstatus er assosiert med overlevelse, og det er viktig å fange opp behov for intervensjon (Perisetti et al., 2022). Generelt er peroral ernæring å foretrekke. Behandlingen må tilpasses den enkeltes behov, gjerne med involvering av klinisk ernæringsfysiolog.
Ikterus
Ikterus kan skyldes leversvikt ved underliggende leversykdom, stor tumorbyrde i lever og/eller gallegangsobstruksjon. Uttalt ikterus kan gi redusert allmenntilstand, tretthet, nedsatt appetitt, underernæring og kløe. Behandlingen vil være avhengig av pasientens totale situasjon, årsak og symptomtrykk. I terminalfase er behandlingen lindrende konservativ. Ved obstruksjon og forventet levetid utover få uker bør avlastning tilstrebes, enten endoskopisk (ERCP/stent, EUS/LAMS) eller intervensjonsradiologisk (PTC/stent/dren).
Ascites
Ascites kan skyldes leversvikt ved underliggende leversykdom, stor tumorbyrde i lever og/eller karsinomatose. Uttalt ascites kan blant annet gi tyngdefølelse og dyspné. Ved lette til moderate plager kan saltrestriksjon og diuretika forsøkes, men bør unngås dersom ascites skyldes eksudat på grunn av kreftsykdommen. Ved uttalte plager gir tapping rask lindring, men kortvarig effekt.
Øsofagusvaricer
Blødning fra øsofagusvaricer kan være livstruende. Pasient med levercirrhose og HCC bør tilbys gastroskopi for å vurdere om det foreligger varicer og eventuelt behov for blødningsprofylakse.
Annen supplerende behandling
Sist faglig oppdatert: 18.04.2024
Fysisk aktivitet
Det er av mange grunner gunstig å opprettholde fysisk aktivitet så langt som mulig, blant annet for å forebygge fatigue. Det er utarbeidet et forslag til treningsprogram for pasienter med fatigue i Seneffekter etter kreftbehandling (helsedirektoratet.no), 2020.
Oppfølging og kontroll etter tumorrettet behandling
Kontroll etter tumorrettet behandling
Sist faglig oppdatert: 18.04.2024
Pasienter som er behandlet for HCC med ablasjon eller reseksjon har betydelig risiko for tilbakefall (Kim et al., 2007). For å kunne tilby ytterligere tumorrettet behandling ved residiv eller nye tumorer, er det viktig å fange opp dette tidlig. De fleste tilbakefall kommer i løpet av de første to årene, slik at hyppigere kontroller den første tiden er nødvendig. Bildene bør vurderes ved avdeling med HPB-kirurgisk kompetanse, fordi det for eksempel kan være vanskelig å påvise mindre residiv inntil en TACE-behandlet lesjon, ablasjonstomt eller reseksjonskant.
For oppfølging etter ablasjon og reseksjon gjelder samme anbefaling, nemlig flerfase CT eller MR lever og CT thorax, abdomen og bekken, samt AFP hver sjette måned de første to årene, deretter årlig de neste tre årene. Dersom det ikke er gjort CT-kontroll av pasienten under eller umiddelbart etter ablasjon, bør det suppleres med flerfase CT etter én måned. For pasienter med høy risiko for residiv eller metastaser (stor tumorbyrde, karaffeksjon, forhøyet AFP), bør man vurdere hyppigere kontroller de første to årene.
Etter førstegangs TACE-behandling foretas vanligvis en evaluering etter ca. fire uker med flerfase CT og AFP for vurdering av behandlingsrespons. For strukturert responsevaluering bør mRECIST brukes, og dette er særlig viktig ved downstaging til transplantasjon. Ved tegn til gjenværende viabelt vev, kan det være aktuelt å gjenta behandlingen med TACE. Om det ikke er behov for flere behandlinger, anbefales videre kontroller som for ablasjon og reseksjon.
Etter SIRT utføres første kontroller etter tre og seks måneder med flerfase CT og AFP, deretter som ved TACE.
Etter levertransplantasjon for HCC anbefales det, i tillegg til rutineundersøkelser som for andre transplanterte (f.eks. halvårlig kontroll med CT eller MR-lever og CT thorax, abdomen og bekken, samt AFP i to år, så årlig i tre år, og deretter kun kontroller som for andre transplanterte (livslangt)).
Ved underliggende leversykdom vil pasienten følges av gastroenterolog for sin leversykdom og CT/MR-kontrollene, samt AFP bør inkluderes i dette løpet. Etter fem års residivfri oppfølging fortsetter overvåkning av pasienter med underliggende leversykdom som før påvist HCC. I epikrise fra behandlende sykehus må det komme tydelig frem om ansvaret for henvisning til radiologisk kontroll tilligger behandlende sykehus, eller om det overføres til henvisende sykehusavdeling. Pasienten må også informeres om hvem som har ansvaret for bestilling av ny radiologi.
Pasienter med HCC kan få metastaser i og utenfor lever, hyppigst i lunger, lymfeknuter, skjelett og binyrer (Yokoo et al., 2017). Ved ekstrahepatisk spredning er det ikke utsikt til kurativ behandling og pasienten bør henvises onkolog for vurdering av palliativ behandling.
Systematisk kontroll forutsetter at pasienten ved residiv eller metastaser vil være aktuell for tumorrettet behandling.
Anbefalinger
- Etter reseksjon eller ablasjon anbefales flerfase CT eller MR-lever og CT-thorax, abdomen og bekken, samt AFP hver sjette måned i to år og deretter årlig i de neste tre år.
- Etter førstegangs TACE anbefales flerfase CT og AFP etter fire uker, deretter hver sjette måned i to år, og deretter årlig de neste tre årene.
- Etter SIRT anbefales flerfase CT og AFP etter 3, 6, 12, 18 og 24 måneder, og deretter årlig i de neste tre årene.
- Etter levertransplantasjon anbefales flerfase CT eller MR lever og CT thorax, abdomen og bekken, samt AFP hver sjette måned i to år, så årlig i tre år, og deretter som for andre levertransplanterte.
- Systematisk kontroll forutsetter at pasienten ved residiv eller metastaser vil være aktuell for tumorrettet behandling.
Fastlegens rolle ved kreft
Sist faglig oppdatert: 18.04.2024
Fastlegene har en viktig rolle i forebygging, utredning og diagnostikk av kreftsykdom, og når det gjelder oppfølging av kreftpasienter og deres pårørende, både underveis i behandlingsforløpet og i etterkant: Fastlegens rolle ved kreft. Samhandling mellom tjenestenivåene er grunnlaget for fastlegens mulighet til å være en god støtte for pasient og pårørende underveis i utredning og behandling. Kunnskap om hva pasienten har vært igjennom påvirker fastlegenes mulighet til å fange opp seneffekter etter kreftbehandling og yte god helsehjelp i en palliativ fase.
Seneffekter
Sist faglig oppdatert: 18.04.2024
Det er særlig viktig at fastleger, som skal følge opp pasienter som er skrevet ut fra spesialisthelsetjenesten, er oppmerksomme på risikoen for seneffekter etter kreftbehandling, og at disse kan debutere lenge etter avsluttet behandling.
Helsedirektoratet har gitt ut faglige råd om seneffekter etter kreftbehandling rettet til klinikere og annet helsepersonell som er i kontakt med kreftpasienter, og pasienter som har vært gjennom kreftbehandling. Rådene omhandler blant annet sekundærkreft, organspesifikke seneffekter, seksualitet, kognitive problemer, fatigue og psykososiale forhold etter kreftbehandling. En oppdatert og utvidet utgave ble publisert april 2020: Seneffekter etter kreftbehandling.
Metode og prosess
Bakgrunn
Sist faglig oppdatert: 18.04.2024
Nasjonalt handlingsprogram med retningslinje for diagnostikk, behandling og oppfølging av levercellekreft (HCC) er utarbeidet av en nedsatt arbeidsgruppe med representanter for alle de regionale helseforetakene (se arbeidsform og deltakere), og i samarbeid med Helsedirektoratet.
Mange onkologiske faggrupper la i en årrekke ned et betydelig arbeid for å komme frem til konsensusbaserte faglige anbefalinger for diagnostikk og behandling av ulike typer kreft. Som ledd i Nasjonal strategi for kreftområdet (2006–2009), fikk Helsedirektoratet i oppdrag å videreutvikle og oppdatere faggruppenes anbefalinger til nasjonale handlingsprogrammer for kreftbehandling, i nært samarbeid med fagmiljøene, de regionale helseforetakene, Nasjonalt kunnskapssenter for helsetjenesten og andre relevante myndigheter. De nasjonale handlingsprogrammene representerer en videreføring av faggruppenes arbeid.
Helsedirektoratet takker arbeidsgruppen for stor innsats i utarbeidelsen av handlingsprogrammet.
Formålet med anbefalingene
Sist faglig oppdatert: 18.04.2024
Nasjonale handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av kreft (Nasjonale handlingsprogram) skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
Rettslig betydning
Sist faglig oppdatert: 18.04.2024
Helsedirektoratet skal utvikle, formidle og vedlikeholde normerende produkter, det vil si nasjonale faglige retningslinjer, nasjonale veiledere, nasjonal faglige råd og pakkeforløp, som understøtter målene for helse- og omsorgstjenesten.
Nasjonale anbefalinger og råd skal baseres på kunnskap om god praksis, og skal bidra til kontinuerlig forbedring av virksomhet og tjenester, jf. spesialisthelsetjenesteloven § 7-3 (lovdata.no), helse- og omsorgstjenesteloven § 12-5 (lovdata.no) og folkehelseloven § 24 (lovdata.no).
Anbefalinger/råd utgitt av Helsedirektoratet er ikke rettslig bindende, men er faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet.
I situasjoner der helsepersonell velger løsninger som i vesentlig grad avviker fra gitte anbefalinger, skal dette dokumenteres, jf. journalforskriften § 6, bokstav g (lovdata.no). Helsepersonell bør være forberedt på å begrunne sine valg i eventuelle klagesaker, eller ved tilsyn.
Målgruppe(r)
Sist faglig oppdatert: 18.04.2024
Målgrupper for de nasjonale handlingsprogrammene er spesialister innen medisin, kirurgi, onkologi, radiologi og patologi. De vil også være av interesse for allmennleger, pasienter, pårørende og andre aktører på kreftfeltet.
Handlingsprogram og Nye metoder
Sist faglig oppdatert: 18.04.2024
De regionale helseforetakene har ansvar for Nye metoder, et felles system for å beslutte hvilke metoder som kan tilbys i spesialisthelsetjenesten. Nye metoder er et prioriteringsverktøy. Beslutningene i Nye metoder gjelder nasjonalt, les mer her: Bakgrunn: Hvorfor har vi Nye metoder? (nyemetoder.no)
En viktig oppgave for Helsedirektoratet er å holde handlingsprogram og retningslinjer oppdaterte i henhold til beslutninger i Nye metoder. Handlingsprogram og andre normerende produkter kan ikke anbefale legemidler, eller andre metoder, som ikke har finansering i den offentlige helsetjenesten. Handlingsprogrammene oppdateres i overenstemmelse med beslutninger i Nye metoder.
Fagpersoner har viktige oppgaver i Nye metoder, for eksempel ved å sende inn forslag eller være med i utarbeidelsen av metodevurderinger. Les mer her: Fagpersoner og fageksperter (nyemetoder.no)
Kunnskapsbasert metode
Sist faglig oppdatert: 18.04.2024
Kunnskapsbasert praksis innebærer at både forskningsbasert kunnskap, erfaringsbasert klinisk kunnskap og pasientenes/ brukernes ønsker og behov vurderes samlet.
I utarbeidelsen og revidering av nasjonale handlingsprogram har det ikke vært med brukerrepresentanter i gruppene.
Innholdet i en retningslinje skal baseres på et oppdatert, gjennomarbeidet og dokumentert kunnskapsgrunnlag. Det innebærer at forskningslitteratur, klinisk erfaring og brukererfaring vurderes opp mot ønskede og uønskede konsekvenser av et tiltak. På områder der det er funnet mindre forskningsbasert kunnskap, og/eller overføringsverdien fra internasjonal til norsk helsetjeneste er lav, blir klinisk kunnskap og brukerkunnskap tillagt større vekt.
Dette nasjonale handlingsprogrammet inneholder svært mange anbefalinger. Det er ikke praktisk mulig, innenfor gitte ressursrammer, å samle all relevant forskningsbasert kunnskap for hver anbefaling. Den forskningsbaserte kunnskapen er hovedsakelig basert på forskning identifisert i anerkjente internasjonale retningslinjer og nyere studier.Det er heller ikke praktisk mulig å gjennomgående bruke GRADE eller SIGN-metodikken for gradering av kunnskapsgrunnlaget.
Handlingsprogram og andre normerende produkter skal også forholde seg til prioriteringskriteriene og ressursbruk. Med ressurser menes direkte kostnader, men også personell og tidsbruk.
Grad av normering
Sist faglig oppdatert: 18.04.2024
Grad av normering angis i teksten i hver enkelt anbefaling.
- Når Helsedirektoratet skriver «skal», betyr det at anbefalingen/rådet er basert på lov eller forskrift, eller når det er så klart faglig forankret at det sjelden er forsvarlig å ikke gjøre som anbefalt.
- Når det står bør» eller «anbefaler», er det en sterk anbefaling/råd som vil gjelde i de aller fleste tilfeller.
- Når det står «kan» eller «foreslår», er det en svak anbefaling/råd der ulike valg kan være riktig for ulike pasienter.
Tilhørende normerende publikasjoner
Sist faglig oppdatert: 18.04.2024
Arbeidsform og deltakere
Sist faglig oppdatert: 20.12.2024
Handlingsprogrammet utarbeides/revideres av en arbeidsgruppe/oppdateringsgruppe oppnevnt av Helsedirektoratet. Representantene i gruppen er utnevnt av de regionale helseforetakene. Etter Helsedirektoratets bearbeidelse og gjennomgang av utkast til handlingsprogram, blir handlingsprogrammet publisert på Helsedirektoratets temaside om kreft.
Første utgave av Nasjonalt handlingsprogram for hepatocellulært karsinom (HCC) 1 ble publisert 18.april 2024. Et utkast var på høring til aktuelle faggrupper og pasient-/brukerorganisasjoner før ferdigstillelse og publisering.
I den andre utgaven av handlingsprogrammet (3.september 2024), blekapittel 7 endret ifm. beslutninger i Nye metoder. I tillegg ble det gjort noen få språklige korreksjoner.
I denne tredje utgaven er det kun gjort endringer i kapittel 7, Systemisk behandling, med tilhørende endringer i "Sammendrag av anbefalingene".
Arbeidsgruppe
- Oddvar Sandvik (leder), Gastrokirurgisk avdeling, Stavanger universitetssjukehus
- Jon-Helge Angelsen, Avdeling for akutt og gastrokirurgi, Haukeland universitetssjukehus
- Ulrik Carling, Avdeling for radiologi og nukleærmedisin, Oslo universitetssykehus
- Olav Faisal Dajani, Kreftavdelingen, Oslo universitetssykehus
- John Willy Haukeland, Gastromedisinsk avdeling, Oslo universitetssykehus
- Kristoffer Lassen, Avdeling for gastro- og barnekirurgi, Oslo universitetssykehus
- Pål-Dag Line, Avdeling for transplantasjonsmedisin, Oslo universitetssykehus
- Inger Marie Løes, Avdeling for kreftbehandling og medisinsk fysikk, Haukeland universitetssjukehus
- Håvard Midgard, Gastromedisinsk avdeling, Oslo universitetssykehus
- Henrik Mikael Reims, Avdeling for patologi, Oslo universitetssykehus
- Bernt Christian Reitan, Radiologisk avdeling, Haukeland universitetssjukehus
- Bård Røsok, Avdeling for gastro- og barnekirurgi, Oslo universitetssykehus
- Trude Wik, Røntgenavdelingen, Universitetssykehuset Nord-Norge
Med bidrag fra overlege Arne Westgaard, Kreftavdelingen, Oslo universitetssykehus og medlemmer av NGICG-HPB
Kontaktpersoner i Helsedirektoratet
Ingunn Løvstad Sørensen, seniorrådgiver, avd. fagutvikling i spesialisthelsetjenesten
Ingunn.Lovstad.Sorensen@helsedir.no
Sissi Espetvedt, seniorrådgiver, avd. fagutvikling i spesialisthelsetjenesten
Fagansvarlig på kreftområdet
sissi.leyell.espetvedt@helsedir.no
1 Handlingsprogrammet har endret navn fra første til andre utgave
Habilitet
Sist faglig oppdatert: 18.04.2024
Representantene i arbeids-/oppdateringsgruppen har fylt ut Helsedirektoratets habilitetsskjema. Ingen interesser med konsekvenser for deltakelse i arbeidet er identifisert. Skjemaene er arkivert i Helsedirektoratet.
Referanser
Sist faglig oppdatert: 18.04.2024
Helsedirektoratet. (2012). Veileder for utvikling av kunnskapsbaserte retningslinjer (IS-1870). Oslo: Helsedirektoratet. Hentet fra https://www.helsedirektoratet.no/veiledere/utvikling-av-kunnskapsbaserte-retningslinjer
Øvrige referanser angis nederst i hvert kapittel.
Vedlegg
Forkortelser/forklaringer
Sist faglig oppdatert: 18.04.2024
AFP – alfa1-føtoprotein
AIH – autoimmun hepatitt
ALAT – alanin aminotransferase
ALBI – skåringssystem for levercirrhose; albumin-bilirubin
ALP – alkaliske fosfataser
ASAT – aspartat aminotransferase
ASA – acetylsalisylsyre (acetylsalicylic acid)
ASA – American Association of Anesthesiologists
BCLC – Barcelona clinic liver cancer
BMI – kroppsmasseindeks (body mass index)
BSA – kroppsoverflate (body surface area)
CD – antigener på celle-overflaten; mål for immunfenotyping (cluster of differentiation)
CEUS – kontrastforsterket ultralyd (contrast enhanced ultrasonography)
CLIP – Cancer of the Liver Italian Program
CK – cytokeratin
CP – Child-Pugh
CT – computertomografi
CTNNB1 – catenin beta-1
CTLA-4 – cytotoksisk T-lymfocytt-assosiert protein 4
DEB – medikamentavgivende partikler (drug-eluting beads)
DNA – deoksyribonukleinsyre (deoxyribonucelic acid)
EASL – European Association for the Study of the Liver
ECOG – Eastern Cooperative Oncology Group
eHCC – tidlig HCC (early HCC)
EKG - elektrokardiografi
ERCP – endoskopisk retrograd kolangiopankreatografi (endoscopic retrograde cholangiopancreatography)
ESMO – European Society for Medical Oncology
EUS – endoskopisk ultralyd (endoscopic ultrasonography)
18F FDG-PET – 2-[18F] fluoro-2-deoxy-D-glukose-positronemisjonstomografi
FGF19 – fibroblast-vekstfaktor 19 (fibroblast growth factor 4)
FIB 4 – fibrose-4; biomarkør for evaluering av leverfibrose
FISH – fluorescent-in situ-hybridiseringsteknikk (fluorescence in situ hybridization)
FLR – fremtidig leverrest (future liver remnant)
FNH – fokal nodulær hyperplasi
FOLFOX - kombinasjonskur av fluorouracil, oksaliplatin og kalsiumfolinat
GGT – gammaglutamyltransferase
Gy – gray = J/kg
HBV – hepatitt B-virus
HBsAg – hepatitt B overflate (surface) antigen
HCA – hepatocellulært adenom (hepatocellular adenoma)
HCC – hepatocellulært karsinom (hepatocellular carcinoma)
HCV – hepatitt C-virus
HE – hematoksylin-eosin
HKLC – Hong Kong liver cancer
HPB – lever-, galleveis- og pankreaskirurgi (hepato-pancreato-biliary)
HR – endring av risiko i forhold til en standard (hazard ratio)
HSP70 – varmesjokkprotein 70 (heat shock protein 70)
HVPG – innkilt trykkgradient; differanse mellom innkilt venetrykk (tilsvarer portvenetrykk) og trykk i vena cava inferior (hepatic venous pressure gradient)
ICCR – International Collaboration for Cancer Reporting
ICD-10 – medisinsk klassifiseringsliste fra Verdens helseorganisasjon (international classification of diseases and related health problems, 10th edition)
INR – internasjonalt normalisert ratio (international normalized ratio)
IRE – irreversibel elektroporering
KGR – kinetisk veksthastighet (kinetic growth rate)
LAMS – kort, dekket metallstent med krage i begge ender (lumen apposing metal stent)
LI-RADS – kvalitetssikringsverktøy for standardisert rapportering og datainnsamling av CT og MR av lesjoner hos pasienter med risiko for HCC (liver imaging reporting and data system)
MDT – multidisiplinært møte (multidisciplinary team)
MELD-Na - skåringssystem (6-40) for leversykdom (model for end-stage liver disease)
MR – magnetisk resonans bildefremstilling
MWA – mikrobølgeablasjon (microwave ablation)
NAFLD – fettlever uten inflammasjon eller fibrose (non-alcoholic fatty liver disease)
NASH – ikke-alkoholisk steatohepatitt (non-alcoholic steatohepatitis)
NGICG – Norsk gastrointestinal cancergruppe
OR – objektiv respons (objective response)
OS – total overlevelse (overall survival)
PALBI – skåringssystem for levercirrhose; blodplater (platelets)-albumin-bilirubin
PBC – primær biliær kolangitt (primary biliary cholangitis)
PCR – polymerasekjedereaksjon (polymerase chain reaction)
PD-L1 – programmert celledød-ligand 1 (Programmed death-ligand 1)
PES – post-emboliseringssyndrom
pHCC – progrediert HCC (progressed HCC)
PHT – portal hypertensjon
PS – funksjonsstatus (performance status)
PSC – primær skleroserende kolangitt (primary sclerosing cholangitis)
PTC – perkutan transhepatisk kolangiografi (percutaneous transhepatic cholangiography)
RECIST – standardisert metode for å måle tumormasse (response evaluation in solid tumours)
RFA - radiofrekvensablasjon
RR – relativ risiko
SBRT – stereotaktisk strålebehandling (stereotactic body radiotherapy)
SIRT – selektiv intern radioterapi
TACE – transarteriell kjemoembolisering (transarterial chemoembolization)
TAE – transarteriell embolisering
TARE – transarteriell radioembolisering
TERT – telomerase revers transkriptase
TNM – tumor, lymfeknuter og metastaser (tumour, node, metastasis)
TP53 – tumorprotein 53
TTP – tid til progresjon (time to progression)
UL – ultralyd
UCSF – University of Southern California
UICC – Union for International cancer control
WHO – Verdens helseorganisasjon (World Health Organization)
ECOG PS
Sist faglig oppdatert: 18.04.2024
ECOG PS | Funksjonsstatus |
|---|---|
0 | I stand til å utføre enhver normal aktivitet uten begrensning. |
1 | Ikke i stand til fysisk krevende aktivitet, men oppegående og i stand til å utføre lett arbeid. |
2 | Oppegående og i stand til all egenpleie, men ikke i stand til noe arbeid; oppe og i bevegelse mer enn halvparten av våken tid. |
3 | Bare i stand til begrenset egenpleie; bundet til seng eller stol mer enn halvparten av våken tid. |
4 | Helt hjelpetrengende; klarer ikke noe egenpleie; helt bundet til seng eller stol. |
5 | Død |
ASA-klassifikasjon
Sist faglig oppdatert: 18.04.2024
TNM-klassifikasjon
Sist faglig oppdatert: 18.04.2024
TNM versjon 8. Hepatocellulært karsinom etter Brierley (2017).
mRECIST
Sist faglig oppdatert: 18.04.2024
Oversettelse av Overall Response Assessment in mRECIST etter Lencioni et al.
Lencioni, R., & Llovet, J. M. (2010). Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Seminars in Liver Disease, 30(1), 52-60. https://doi.org/10.1055/s-0030-1247132









