Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av lungekreft, mesoteliom og thymom
Innledning
Sist faglig oppdatert: 31.10.2024
Lungekreft er den nest hyppigste kreftform hos både menn (etter prostatakreft) og kvinner (etter brystkreft), og samlet sett den kreftformen som tar flest liv i Norge. I 2012 ble det i Norge tapt like mange leveår til lungekreft som til brystkreft, prostatakreft og tykktarmkreft sammenlagt.
Utredning fram til avklart diagnose og beslutning om behandlingsvalg tar ofte lang tid ved lungekreft, og sykdommen gir i tidlig fase lite symptomer. Det store flertall er røykere eller eksrøykere og mange av symptomene på lungekreft er ikke vesensforskjellig fra normale røykerelaterte plager. Det er like fullt viktig at utredningstid og tid til start av behandling er så kort som mulig.
Dette handlingsprogrammet er oppdatert i henhold til tilgjengelig litteratur, og andre lands retningslinjer er også benyttet som grunnlag for anbefalingene. Det norske handlingsprogrammet er vurdert sammen med de andre nordiske lands retningslinjer, og ble omtalt på følgende vis: «The Norwegian guidelines are developed and updated according to the most rigorous methodology and have so far been updated most frequently» (Christensen, Jekunen, Heinonen, Dalton, & Rasmussen, 2017).
Det vises til følgende sentrale retningslinjer:
- Svenske retningslinjer:
https://cancercentrum.se/samverkan/cancerdiagnoser/lunga-och-lungsack/vardprogram/ - Danske retningslinjer:
http://www.lungecancer.dk/referenceprogram/ - Andre europeiske retningslinjer:
- European Society of Medical Oncology
https://www.esmo.org/guidelines/guidelines-by-topic/lung-and-chest-tumours - European Society of Thoracic Surgeons:
https://www.ests.org/educational_activities/online_educational_resources/guidelines.aspx - Britiske retningslinjer:
https://www.nice.org.uk/guidance/conditions-and-diseases/cancer/lung-cancer
- European Society of Medical Oncology
- Amerikanske retningslinjer:
- National Comprehensive Cancer Centers:
http://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf - American College of Chest Physicians:
https://www.chestnet.org/guidelines/thoracic-oncology
- National Comprehensive Cancer Centers:
Kliniske studier kan være aktuelt for mange pasienter – informasjon om dette kan finnes på
https://www.helsenorge.no/kliniske-studier
http://clinicaltrials.gov
Hovedpunkter under revisjon desember 2019
Immunterapi (nivolumab) som andrelinjesbehandling for pasienter i stadium IV med PD-L1-negativt plateepitelkarsinom, samt innføring av dakomitinib for non-plateepitelkarsinom med påvist EGFR-mutasjon er omtalt, etter at begge behandlingsmuligheter nå har positive vedtak i Beslutningsforum.
Revisjon april 2020
Immunterapi (atezolizumab) som andrelinjesbehandling for pasienter i stadium IV med PD-L1-negativt plateepitelkarsinom er omtalt, etter at behandlingsmuligheten nå har positivt vedtak i Beslutningsforum – med innføringsdato 1. april 2021.
Revisjon september 2020
Immunterapi (atezolizumab) i kombinasjon med bevacizumab, paklitaksel og karboplatin for pasienter med EGFR- eller ALK-positiv NSCLC som ikke lenger har nytte av målrettet behandling er omtalt, etter at behandlingsmuligheten nå har positivt vedtak i Beslutningsforum – med innføringsdato 1. oktober 2020. Videre er nytten av postoperativ stråleterapi revidert i henhold til nye data (avsnitt 7.2.2.).
Revisjon november 2020
Pembrolizumab (Keytruda) i kombinasjon med karboplatin og enten paklitaksel eller nab-paklitaksel ved førstelinjebehandling av metastatisk plateepitel ikke-småcellet lungekreft for pasienter med PD-L1-uttrykk < 50% er omtalt, etter at behandlingsmuligheten nå har positivt vedtak i Beslutningsforum – med innføringsdato 15. november 2020.
Revisjon januar 2021
Lorlatinib (Lorviqua) som andrelinjebehandling for ALK-positiv lungekreft er omtalt, etter at behandlingsmuligheten nå har positivt vedtak i Beslutningsforum – med innføringsdato 15. januar 2021 (avsnitt 8.4.2). Nye resultater ved adjuvant kjemoterapi med inklusjon av cisplatin/pemetreksed som et alternativ til cisplatin/vinorelbin ved ikke-plateepitelkarsinom er også omtalt (avsnitt 7.3.1). Videre er teksten ved hjernemetastaser justert ved at systemisk behandling kan forsøkes i stedet for helhjernebestråling (avsnitt 8.1.2). Endelig er moderne behandlingsprinispper ved dyp venetrombose/lungeemboli omtalt, idet DOAK er omtalt som behandling i stedet for lavmolekylært heparin (avsnitt 11.5).
Revisjon mars 2021
Brigatinib (Alunbrig) som førstlinjebehandling for ALK-positiv lungekreft er omtalt, etter at behandlingsmuligheten nå har positivt vedtak i Beslutningsforum. Prisforhandlinger vi avklare om dette skal foretrekkes over alektinib, med potensiell innføringsdato 1. juli 2021 (avsnitt 8.4.2).
Osimertinib (Tagrisso) som førstlinjebehandling, eller ved påvist T790M i andrelinje, for EGFR-positiv lungekreft er omtalt, etter at behandlingsmuligheten nå har positivt vedtak i Beslutningsforum (avsnitt 8.4.2).
Nye resultater med økt stråledose ved småcellet lungekreft, begrenset sykdom, gjør at standardbehandling for denne sykdomskategorien nå er endret fra 1,5 Gy x 2 x 15 til 1,5 Gy x 2 x 20. Det gis altså fire uker stråleterapi i stedet for tre, med start ved andre cellegiftkur (avsnitt 9.3.2).
Videre er det gjort noen semantiske endringer og oppklaringer i dokumentet, spesielt innen postoperativ strålebehandling NSCLC, samt mesoteliom og thymom. Terminologien for småcellet lungekreft er endret til det som er mest brukt internasjonalt, hhv LS-SCLC og ES-SCLC for begrenset og utbredt sykdom respektivt.
Revisjon oktober 2021
Immunterapi ved småcellet lungekreft utbredt sykdom er omtalt, etter at dette ble vedtatt innført av Beslutningsforum med start fra 1/11-21.
Kapitlet om preoperativ lungefunksjonsvurdering, samt patologi-kapitlet er gjennomgått og oppdatert.
Noen presiseringer angående kontrollopplegg (bl.a. at binyrer bør inkluderes i CT-opptak) er utført. Nye studier vedrørende adjuvant behandling er omtalt, men disse behandlingene er ennå ikke implementert.
Videre er det gjort noen semantiske endringer og oppklaringer i dokumentet, inkludert oppdatert epidemiologidata, og enkelte foreldede referanser er enten fjernet eller oppdatert.
Revisjon desember 2021
Entrektinib som førstelinjebehandling ved ROS1-positiv lungekreft er omtalt, etter at behandlingsmuligheten nå har positivt vedtak i Beslutningsforum – med innføringsdato 15. januar 2022. Entrektinib som behandlingsalternativ for NTRK-positiv lungekreft uten andre tilfredsstillende behandlingsalternativer er også omtalt, etter at behandlingsmuligheten nå har positivt vedtak i Beslutningsforum – med innføringsdato 15. januar 2022.
Revisjon november 2022
- Epidemiologi-kapitlet er oppdatert, enkelte figurer er sløyfet, og henvisning til Kvalitetsregister-rapporten er inkludert.
- Avsnittet om solitære pulmonale noduli er flyttet sammen med bildediagnostikkomtalen
- Avsnittet om lungekreftscreening diskuterer nå resultatene fra Nelson-studien, og omtaler den pågående norske pilotstudien.
- Oppdatert patologi-kapittel, inkludert beskrivelse av resektater, og utvidet behov for molekylære analyser
- Oppdatert omtale av utredning og behandling av nevroendokrine svulster, thymom og mesoteliom
- Presisert at pasienter i stadium II som er medisinsk inoperable, eller som ikke ønsker kirurgi, bør vurderes for stereotaksi om mulig, eller kjemo(immuno)radiasjon.
- Omtale av innføring av osimertinib som adjuvant behandling
- Presisert at torakalt radikalt opererte pasienter med radikalt behandlede single metastaser til hjerne eller binyre bør vurderes for adjuvant kjemoterapi som ved stadium II/III.
- Spesifisering av evalueringstidpsunkt ved neoadjuvant kjemoradioterapi (Pancoast)
- Tydeliggjøring av at helhjernebestråling for hjernemetastaser ikke nødvendigvis er fornuftig
- Omtale av MR-diagnostikk for å skille mellom intrakraniell strålenekrose eller residiv
- Behandlingsmuligheter ved sjeldne EGFR-mutasjoner, og anbefalinger vedr. kontrollopplegg, er omtalt
- Lorlatinib som førstelinjealternativ ved ALK-positiv sykdom er omtalt
- Behandlingsmuligheter ved MET-positivitet er omtalt
- Behandlingsmuligheter ved KRAS-positivitet er omtalt
- Immunterapi hos organtransplanterte er omtalt
- Oppdatering til TNM8-system for thymussvulster
- Kapitlene om komplikasjoner og palliasjon er flyttet etter behandlingskapitlene (nå kapittel 14 og 15)
- Utredning av nevroendokrine svulster med DOTATOC-PET er nå tilgjengelig i Norge, og er omtalt
- Enkelte figurer og tabeller er oppdatert og justert for bedre lesbarhet, og det er gjennomført en generell gjennomgang med tekstlig klargjøring, forkorting av tekst og oppdatering av referanser
Revisjon mai 2023
Kombinasjonen dabrafenib/trametinib som førstelinjebehandling ved BRAF-positiv lungekreft er omtalt, etter at behandlingsmuligheten nå har positivt vedtak i Beslutningsforum. Pralsetinib som behandlingsalternativ for RET-positiv lungekreft er også omtalt, etter at behandlingsmuligheten nå har positivt vedtak i Beslutningsforum.
Revisjon september 2023
Omtalen av adjuvant behandling med atezolizumab i 1 år etter gjennomført kjemoterapi til opererte NSCLC med PD-L1-uttrykk ≥50% er revidert, etter at behandlingsmuligheten nå har positivt vedtak i Beslutningsforum.
Revisjon mars 2024
- Epidemiologikapitlet er oppdatert
- Fastlegekapitlet er revidert ved at nytten av rtg toraks som første radiologiske undersøkelse er nedtonet
- Utredningskapitlet er totalrevidert, oppdatert og forenklet
- Omtale av neoadjuvant behandling av stadium II/III ikke-småcellet lungekreft med nivolumab og kjemoterapi er inkludert, etter at behandlingsmuligheten nå har positivt vedtak i Beslutningsforum.
- Behandlingsanbefaling ved progresjon på EGFR-rettet behandling er revidert, og inkluderer nå kjemoterapi i stedet for kjemoimmunterapi.
- Omtalen av behandling av oligometastaser er justert, med åpning for mer aggressiv behandling.
- Det er åpnet noe for behandling med zoledronsyre.
- Kapitlene om SCLC er gjennomgått og oppdatert.
- Diskusjonen omkring nytte av profylaktisk hjernebestråling ved SCLC er omarbeidet
- Omtalen av behandling av mesoteliom er lett revidert etter presentasjon av MARS2-datane som setter spørsmålstegn ved nytten av kirurgi.
- Viktigheten av adekvat stadiesetting ved Stokes krage og sentral okklusjon er poengtert
- Tekstlige endringer er utført gjennom hele handlingsprogrammet, og gamle referanser slettet og nye lagt til
Revisjon juni 2024
- Karboplatin som foretrukket platinumpreparat ved neoadjuvant behandling er presisert
- Alektinib som adjuvant behandling av ALK-positiv lungekreft er omtalt
- Omtale av osimertinib som konsoliderende behandling etter kjemoradiasjon ved EGFR-mutert NSCLC i stadium III
- Cemiplimab i kombinasjon med kjemoterapi som et førstelinjealternativ ved avansert PD-L1-positiv NSCLC uten mutasjoner er omtalt
- Studiedata på kombinasjonen kjemoterapi og osimertinib for EGFR-positiv NSCLC er kommentert
- Lorlatinib som førstelinjebehandling ved ALK-positiv sykdom anbefales nå
- Avregistreringen av RET-hemmeren pralsetinib er omtalt.
- Data på HER2-rettet behandling er omtalt
- Omtale av durvalumab som konsoliderende behandling etter kjemoradiasjon ved SCLC-LS
- I tillegg er det gjort en del mindre justeringer og semantiske korrigeringer
Revisjon oktober 2024
Selperkatinib som behandlingsalternativ for RET-positiv lungekreft er omtalt, etter at behandlingsmuligheten nå har positivt vedtak i Beslutningsforum. Monoterapi med atezolizumab hos NSCLC-pasienter som ikke er egnet for platinabasert kjemoterapi er også omtalt. Avsnittet om kontrollopplegg etter kurativ behadnling er lett justert. I tillegg er det gjort enkelte korreksjoner og semantiske endringer.
Sammendrag av anbefalingene
Sist faglig oppdatert: 31.10.2024
Diagnostikk og utredning
LABORATORIEPRØVER
Det bør ved utredning av lungekreft tas et utvalg laboratorieprøver for vurdering av metastaserende sykdom og/eller paraneoplastiske syndromer.
Tumormarkører anbefales ikke som ledd av utredning, men kan være nyttige i oppfølgning og kontroll av pasienter med lungekreft.
Hos pasienter med cancer origo incerta, eller der biopsi ikke er tilgjengelig, kan tumormarkører være til hjelp også i utredning.
HISTOPATOLOGISK DIAGNOSTIKK
Det anbefales å bevare så mye vev som mulig for molekylær testing. For subklassifisering av ikke-småcellete karsinomer, anbefales minimalt med immunhistokjemiske markører (TTF-1 og napsin A som adenokarsinommarkører, og p40 og CK5/6 som plateepitelkarsinommarkør).
Hvis subtypebestemmelse ikke er mulig kan terminologien NSCC-NOS brukes, men spesifikk diagnose skal tilstrebes.
AIS (adenokarsinom in situ), MIA (minimalt invasivt adenokarsinom), adenoskvamøst karsinom og storcellet karsinom diagnostiseres ikke i små biopsier eller cytologiske prøver.
Alle ikke-småcellete karsinomer skal testes for PD-L1-uttrykk. Andel tumorceller med PD-L1-uttrykk skal angis med minimum følgende kategorier: <1 %, 1-49 %, 50-74 % og 75-100 %.
Alle ikke-småcellete karsinomer ikke-plateepitelkarsinom bør undersøkes for mutasjoner i EGFR-, BRAF-, KRAS-, MET- og HER2-genene, for translokasjoner av ALK-, ROS1-, NTRK- og RET-genene, samt for fusjonstranskript mellom MET ekson 13 og ekson 15
Nestegenerasjonssekvensering er å foretrekke for molekylære analyser.
Kurativ behandling av ikke-småcellet lungekreft
KURATIV BEHANDLING NSCLC
Stadium I: Kirurgi alene. Stadium Ib og EGFR-mutasjon: adjuvant EGFR-hemmer. Ved inoperabilitet: kurativ stråleterapi.
Stadium II: Neoadjuvant kjemoimmunterapi før kirurgi, ev. kirurgi og adjuvant kjemoterapi, etterfulgt av adjuvant immunterapi ved PD-L1 > 50 % eller adjvuant EGFR-hemmer ved sensitiviserende EGFR-mutasjon. Ved inoperabilitet: Kurativ stråleterapi kombinert med kjemoterapi, etterfulgt av immunterapi ved PD-L1 ≥ 1 % og EGFR-negativitet.
Stadium III: Dersom operabel sykdom: neoadjuvant kjemoimmunterapi før kirurgi, ev. kirurgi og adjuvant kjemoterapi, etterfulgt av adjuvant immunterapi ved PD-L1 > 50 % % eller adjvuant EGFR-hemmer ved sensitiviserende EGFR-mutasjon. Ved inoperabilitet: Kurativ stråleterapi kombinert med kjemoterapi, etterfulgt av immunterapi ved PD-L1 ≥ 1 % og EGFR-negativitet.
Ved R1/R2: Postoperativ stråleterapi kan vurderes etter adjuvant kjemoterapi.
KIRURGI NSCLC
Lobektomi foretrekkes framfor sublobar reseksjon.
En bloc-reseksjon tilstrebes ved innvekst i nabostrukturer.
Det bør gjøres systematisk disseksjon av, eventuelt sampling fra, alle tilgjengelige lymfeknutestasjoner.
Ved peroperativt påvist N2-sykdom forsøkes komplett ipsilateral lymfeknutedisseksjon.
Ved ufri reseksjonsrand bør reoperasjon vurderes.
POSTOPERATIV STRÅLETERAPI
Postoperativ stråleterapi anbefales ikke verken ved pN0/pN1 eller pN2, ei heller ved infiltrasjon i pleura viscerale (PL1)
Postoperativ stråleterapi kan vurderes ved mikroskopisk irradikalitet (R1), i så fall gis2 Gy x 30 = 60 Gy.
Postoperativ stråleterapi kan vurderes ved makroskopisk irradikalitet (R2), i så fall gis 2 Gy x 30-35 = 60-70 Gy, eventuelt konkomitant med kjemoterapi som ved primær kjemoradiasjon.
NEOADJUVANT KJEMOIMMUNTERAPI
Operable pasienter i stadium II og III, som har tumor som uttrykker PD-L1 ≥ 1 %, og er EGFR- og ALK-negative, vurderes for neoadjuvant behandling.
Det gis 3 kurer nivolumab og platinumdublett med 3 ukers mellomrom.
Det skal tas ny CT 2-3 uker etter siste kur, og pasienten vurderes på nytt regionalt MDT-møte.
Operasjon gjøres innen 6 uker etter siste infusjon.
ADJUVANT MEDIKAMENTELL BEHANDLING
Opererte pasienter i stadium II og III som ikke har fått neoadjuvant kjemoimmunterapi gis fire kurer cisplatin + pemetreksed (ikke-plateepitelkarsinom) eller cisplatin + vinorelbin (plateepitelkarsinom, eller dersom pemetreksed ikke kan gis). Cisplatin kanerstattes med karboplatin.
Start innen åtte uker fra operasjonstidspunkt.
Aktuelt hos pasienter ≤70 år i god allmenntilstand (ECOG 0-1).
”Biologisk unge” >70 år bør vurderes for adjuvant kjemoterapi, karboplatin kan da være et alternativ til cisplatin.
I tillegg til kjemoterapi tilbys atezolizumab i 1 år ved PD-L1-uttrykk ≥ 50%, men ikke ved EGFR-mutasjon eller ALK-translokasjon.
Radikalopererte pasienter i stadium IB til III med påvist EGFR-mutasjon (delesjon i ekson 19 eller L858R) bør vurderes for adjuvant behandling i inntil 3 år med osimertinib. Kjemoterapi før oppstart EGFR-TKI vurderes gitt til disse etter vanlige rutiner.
ADJUVANT KJEMOTERAPI ETTER STEREOTAKSI FOR STADIUM I/II
Rutinemessig adjuvant behandling er ikke aktuelt etter stereotaktisk stråleterapi.
KJEMORADIOIMMUNOTERAPI VED STADIUM III
Konkomitant kjemoradioterapi anbefales: 2 Gy x 30-33 med to platinumbaserte cellegiftkurer med tre ukers intervall under strålebehandling.
Durvalumab gis ved EGFR-/ALK-negativ sykdom som ikke har progrediert etter kjemoradioterapi, og med PD-L1-uttrykk i ≥ 1 % av tumorcellene: 10 mg/kg hver 2. uke eller 1500 mg hver 4. uke i inntil 12 måneder.
PANCOAST-SVULSTER
Pancoast-svulster bør vurderes for neoadjuvant kjemoimmunterapi etterfulgt av kirurgi.
Alternativt vurderes konkomitant strålebehandling (2 Gy x 25) med to kurer platinumbasert kjemoterapi med 3 ukers mellomrom. Operasjonsvurdering etter ca 44 Gy.
Dersom fortsatt inoperabel kontinueres radioterapi til 60-66 Gy, etterfulgt av durvalumab ved PD-L1 ≥ 1 %.
KONTROLLER ETTER KURATIV BEHANDLING
En måned etter avsluttet kurativ behandling:
- Klinisk kontroll, ev. telefonisk kontakt (inkl. vurdering av patologi-svar)
For pasienter som har fått neoadjuvant kjemoimmunterapi eller kurativ stråleterapi:
- Klinisk undersøkelse og lab 3 mnd. etter behandling, deretter som andre som har fått kurativ behandling.
For andre som har fått kurativ behandling:
- Klinisk undersøkelse (og ev. lab etter immunterapi) og CT toraks inkl binyrer med kontrast 6, 12, 18 og 24 måneder etter avsluttet kurativ behandling:
3., 4. og 5. år:
- Sykehistorie og klinisk undersøkelse (ev. telefonkonsultasjon).
- CT toraks lavdose uten intravenøs kontrast.
Kontroller utover 5 år kan vurderes hos utvalgte pasienter.
Kontrollene bør gjennomføres i spesialisthelsetjenesten. Pasientene skal informeres om mulige symptomer og oppfordres til å ta kontakt ved nye symptomer eller forverring.
PET/CT eller fluorescensbronkoskopi har ingen dokumentert rolle i oppfølgingen.
Potensielt kurerte lungekreftpasienter som fortsatt røyker, oppfordres til røykeslutt.
Ikke-kurativ behandling av ikke-småcellet lungekreft
PALLIATIV STRÅLETERAPI MOT TORAKS
Pasienter med symptomer fra sentrale luftveier gis hypofraksjonert 8,5 Gy x 2
Pasienter i god allmenntilstand (ECOG 0-1) kan vurderes for 3 Gy x 10-13.
HJERNEBESTRÅLING
Etter kirurgi av solitær metastase bør stereotaksi av tumorkavitet tilbys fremfor helhjernebestrålig.
Ved 1-4 hjernemetastaser bør stereotaktisk teknikk benyttes.
Pasienter med hjernemetastaser som ikke er aktuelle for kirurgi eller stereotaksi, men som starter med (kjemo-)immunterapi eller målrettet medisin med kjent intracerebral effekt kan primært følges med MR caput uten stråleterapi.
Ved >4 hjernemetastaser og god allmentilstand kan helhjernebestråling vurderes (3 Gy x10 eller 4 Gy x5).
Pasienter i dårlig allmenntilstand (ECOG 2-4) har neppe nytte av helhjernebestråling og bør tilbys steroider.
FØRSTELINJEBEHANDLING AV PASIENTER MED IKKE-PLATEEPITELKARSINOM UTEN EGFR-, ALK-, ROS1-, NTRK-, RET- eller BRAF-MUTASJONER
Kombinasjonsbehandling med fire kurer pembrolizumab (200 mg flat dose), pemetreksed (500 mg/m2) og karboplatin (AUC 5) hver 3. uke etterfulgt av pembrolizumab (200 mg) og pemetreksed (500 mg/m2) inntil progresjon eller inntil to år.
Pembrolizumab alene (200 mg iv hver 3. uke/400 mg hver 6. uke), cemiplimab (350 mg iv hver 3. uke) eller atezolizumab (1200 mg iv hver 3. uke eller 1680 mg iv hver 4. uke) kan vurderes hos pasienter med høyt PD-L1-uttrykk, ved kontraindikasjoner mot kjemoterapi eller bekymring for at pasienten vil utvikle alvorlige bivirkninger av kjemoterapi.
FØRSTELINJEBEHANDLING AV PASIENTER MED PLATEEPITELKARSINOM
Kombinasjonsbehandling med fire kurer pembrolizumab (200 mg iv flat dose), paklitaksel (175-200 mg/m2) og karboplatin (AUC 5-6) hver 3. uke etterfulgt av pembrolizumab (200 mg iv hver 3. uke eller 400 mg iv hver 6. uke) inntil progresjon eller inntil to år.
Pembrolizumab alene (200 mg iv hver 3. uke/400 mg hver 6. uke), cemiplimab (350 mg iv hver 3. uke) eller atezolizumab (1200 mg iv hver 3. uke eller 1680 mg iv hver 4. uke) kan vurderes hos pasienter med høyt PD-L1-uttrykk, ved kontraindikasjoner mot kjemoterapi eller bekymring for at pasienten vil utvikle alvorlige bivirkninger av kjemoterapi.
PÅVIST AKTIVERENDE EGFR-MUTASJON
Osimertinib bør gis i første linje inntil progresjon.
Osimertinib anbefales ved progresjon hos EGFR-positive som ikke har fått osimertinib i førstelinje og som har påvist T790M-mutasjon.
Ved progresjon etter osimertinib kan kombinasjonen karboplatin/pemetreksed vurderes.
Inklusjon i kliniske studier kan være et alternativ.
PÅVIST ALK-POSITIVITET
TKI-behandling med lorlatinib (100 mg x1) bør gis i førstelinje inntil progresjon. Alektinib (600 mg x 2), alternativt brigatinib (90 mg x1 i en uke, deretter 180 mg x1) dersom lavere pris, kan også være et alternativ i førstelinje.
Dersom krizotinib er gitt i førstelinje, kan TKI-behandling med ceritinib (450 mg x 1 med mat) eller brigatinib (90 mg x1 i en uke, deretter 180 mg x1) gis.
Ved progresjon under ALK-hemmerbehandling, og lorlatinib ikke er gitt, bør videre ALK-rettet behandling med lorlatinib (100 mg x1) vurderes.
Ved progresjon uten videre tilgjengelig ALK-rettet behandling bør pasienter vurderes for behandling med kombinasjonen karboplatin/pemetreksed.
Inklusjon i kliniske studier kan være aktuelt.
PÅVIST BRAF-POSITIVITET
TKI-behandling med dabrafenib (150 mg x 2) kombinert med trametinib (2 mg x1) bør gis i førstelinje inntil progresjon.
Ved progresjon uten videre tilgjengelig BRAF-rettet behandling bør pasienter vurderes for behandling med immunterapi med eller uten kjemoterapi, basert på PD-L1-uttrykk.
Inklusjon i kliniske studier kan være aktuelt.
PÅVIST ROS1-POSITIVITET
TKI-behandling med selperkatinib (160 mg x 2) bør gis inntil progresjon.
Ved progresjon på selperkatinib kan immunterapi med eller uten kjemoterapi vurderes.
Inklusjon i kliniske studier kan være aktuelt.
PÅVIST NTRK-POSITIVITET
TKI-behandling med entrektinib (600 mg x 1) bør gis i inntil progresjon.
Inklusjon i kliniske studier kan være aktuelt.
PÅVIST RET-POSITIVITET
Pasienter bør vurderes for behandling med immunterapi med eller uten kjemoterapi, basert på PD-L1-uttrykk.
Inklusjon i kliniske studier kan være aktuelt.
BEHANDLING VED PROGRESJON
Pasienter som har respondert på førstelinje monoimmunterapi/immunkjemoterapi kan rebehandles dersom initial respons og progresjon >3 mndr etter behandlingsstopp.
Pasienter som har fått kombinasjonsbehandling immunterapi + kjemoterapi i førstelinje kan vurderes for docetaksel, men ikke om paklitaksel er gitt.
Pasienter som har fått monoterapi immunterapi i førstelinje kan vurderes for platinumdublett i andrelinje, og ev. docetaksel i tredjelinje, men ikke om paklitaksel er gitt.
Pasienter som progredierer etter førstelinjes kjemoterapi bør vurderes for immunterapi.
Inklusjon i kliniske studier kan være aktuelt.
Pasienter i dårlig allmenntilstand (ECOG 2-3) bør vurderes for palliativ strålebehandling ved symptomer og tilbys symptomatisk, ikke tumorrettet, medikamentell behandling.
SPESIFIKT VEDRØRERENDE IMMUNTERAPI
Spesiell årvåkenhet angående bivirkninger ved immunterapi er nødvendig. Fastlege og andre samarbeidspartnere må være informert.
Immunterapi anbefales ikke gitt utover 24 måneder.
Kortere behandling enn 24 måneder kan vurderes hos pasienter med komplett respons og/eller bivirkninger.
Steroidbruk skal minimeres, men utelukker ikke immunterapi.
Autoimmune sykdommer, organtransplantasjon eller kroniske infeksjoner er ingen absolutt kontraindikasjon mot immunterapi, men krever spesiell omtanke.
ANGIOGENESEHEMMERE
Angiogenesehemmere anbefales ikke ved ikke-småcellet lungekreft.
BEINRESORPSJONSHEMMERE
Behandling med zoledronsyre reduserer skjelettrelaterte hendelser og kan vurderes hos pasienter med ikke-småcellet lungekreft og utbredte skjelettmetastaser.
Pasientene bør få daglig tilskudd av kalsium og D-vitamin og bør vurderes av tannlege før oppstart grunnet risiko for osteonekrose i kjeven.
BRONKOSKOPISK INTERVENSJON
Pasienter med inoperabel malign sentral luftveisobstruksjon bør evalueres med tanke på endoskopisk intervensjon.
CT toraks og bronkoskopi bør alltid inngå i evalueringen av pasientene med tanke på anatomiske forhold som lengde og type av lesjon, mottakerforhold i distale luftveier, og intakt pulmonalsirkulasjon.
Tumorrettet behandling via bronkoskop har umiddelbar symptomatisk effekt, hvilket er viktig hos pasienter med relativt kort forventet levetid.
KONTROLLOPPLEGG ETTER IKKE-KURATIV BEHANDLING
Pasienter med inkurabel lungekreft bør ha et aktivt og individuelt tilpasset kontrollopplegg.
Etter førstelinjebehandling anbefales individuelt tilpasset relativt tett kontrollopplegg.
Kurativ behandling av lokalisert småcellet lungekreft (SCLC T1-4N0-3M0) – begrenset sykdom
KIRURGISK BEHANDLING AV SCLC
Pasienter med stadium I svulster (T1-2N0) bør, på grunnlag av grundig utredning, vurderes for kirurgisk reseksjon.
Startutredning er som regel CT toraks inkl. øvre abdomen. Kirurgi forutsetter videre negativ MR caput og PET/CT. Ved mistanke om positive glandler i toraks må dette utelukkes med EBUS/EUS/mediastinoskopi.
Postoperativt gis adjuvant 4 kurer kjemoterapi.
Ved stor risiko for perioperative komplikasjoner er kombinert kjemoradioterapi, ev. stereotaksi, et alternativ til kirurgi.
Hvis det peroperativt er påvist mediastinal patologi eller det ikke er utført systematisk lymfeknutedisseksjon, kan det gis postoperativ torakal strålebehandling som ved LS-SCLC. Denne bør starte innen 21-28 dager fra kjemoterapistart.
KJEMOTERAPI VED LS-SCLC
Pasienter med LS-SCLC tilbys fire kurer cisplatin/etoposid.
Karboplatin kan erstatte cisplatin ved alvorlige bivirkninger av cisplatin, redusert nyrefunksjon, redusert hørsel/tinnitus, redusert allmenntilstand (ECOG 2-3), høy alder (> 75 år) eller ved signifikant komorbiditet.
STRÅLETERAPI VED LS-SCLC
Konkomitant torakal stråleterapi (TRT) skal i utgangspunktet tilbys alle pasienter med LS-SCLC (unntak: reseserte stadium I-pasienter der mediastinum er verifisert negativ).
Det anbefales oppstart av TRT 21-28 dager etter første cellegiftkur.
Hyperfraksjonert stråleterapi med 1,5 Gy x 2 x 20 etterstrebes. Alternativt gis 1,5 Gy x 2 x15, 2,8 Gy x 15 eller 3 Gy x 10.
Målvolum begrenses til PET CT positive lesjoner, men ut fra størrelsen på lesjoner på doseplan CT tatt etter første cytostatika-kur. Dog skal tidligere affiserte glandelstasjoner inkluderes.
PROFYLAKTISK HJERNEBESTRÅLING, LS-SCLC
Profylaktisk helhjernebestråling kan være en mulighet for yngre LS-SCLC-pasienter uten vaskulær sykdom som ikke har progrediert etter kjemoradioterapi.
PCI skal ikke kombineres med kjemoterapi, men startes etter at kjemoterapi er avsluttet. Aktuell fraksjonering vil være 2,5 Gy x 10 (totalt 25 Gy).
Oppfølgning med MR caput kan være et godt alternativ.
ELDRE PASIENTER MED LS-SCLC
Eldre pasienter i god allmenntilstand, eller der redusert allmenntilstand relateres til tumorbyrde, bør motta optimal multimodal terapi.
Hos eldre pasienter med reelt svekket allmenntilstand kan man vurdere å redusere kjemoterapidosene og/eller gi TRT etter cytostatika.
RESIDIV, LS-SCLC
Pasienter i god allmenntilstand bør vurderes for 2. linjebehandling.
Ved sent residiv (>3 mnd) reintroduseres tidligere gitt cellegiftbehandling pluss immunterapi.
Ved tidlig residiv vil ACO kunne være aktuelt. Oral topotekan er likeverdig i effekt med ACO, men har noe mer hematologisk toksisitet og anbefales dersom ACO ikke er aktuelt.
Enkeltstoffbehandling med irinotekan, docetaksel, ifosfamid, temozolomid eller oral etoposid er også vist å kunne ha noe effekt.
Torakal strålebehandling er effektivt ved plagsomme tumorrelaterte symptomer fra toraks.
Ikke-kurativ behandling av metastatisk småcellet lungekreft (SCLC T1-4N0-3M1) - utbredt sykdom
KJEMOIMMUNTERAPI ES-SCLC
Førstelinje behandling er fire kurer karboplatin-etoposid sammen med atezolizumab, etterfulgt av atezolizumab hver 3. uke.
Selv ved ECOG 3 bør kjemoterapi vurderes hvis redusert allmenntilstand er klart relatert til pasientens lungekreft, men nytteverdien er sannsyligvis begrenset ved PS >1. Immunterapi kan ev. legges til om allmenntilstanden bedres.
Inklusjon i kliniske studier kan være aktuelt.
STRÅLETERAPI ES-SCLC
Rutinemessig torakal stråleterapi anbefales ikke ved ES-SCLC, men kan vurderes hos utvalgte pasienter med lav ekstratorakal sykdomsbyrde, ev. ved dårlig respons på systemisk behandling.
Torakal strålebehandling er aktuelt ved plagsomme tumorrelaterte symptomer.
Inklusjon i kliniske studier kan være aktuelt.
HJERNEBESTRÅLING ES-SCLC
ES-SCLC-pasienter bør tilbys MR-basert kontroll-opplegg (MR caput hver 3. måned i 1 år), alternativt profylaktisk hjernebestråling (i så fall 2,5 Gy x 10).
Ved primære hjernemetastaser hos kjemonaive pasienter bør kjemoterapi være førstevalg, strålebehandling sekundært.
Ved symptomgivende hjernemetastaser med begrenset respons på steroider og kjemoterapi bør helhjernebestråling tilbys.
ELDRE PASIENTER MED ES-SCLC
Eldre pasienter i god allmenntilstand bør motta standard kjemoimmunterapi
Der redusert allmenntilstand relateres til tumorbyrde, bør standard cytostatikabehandling gis, ev. med reduserte doser.
Eldre pasienter med reelt svekket allmenntilstand kan tilbys doseredusert cytostatika, ev monoterapi med oralt etoposid.
Palliativ strålebehandling kan også være et godt alternativ.
RESIDIV, ES-SCLC
Pasienter i god allmenntilstand bør vurderes for 2. linjebehandling.
Ved sent residiv (> 3 mndr etter avsluttet primærbehandling) anbefales det å reintrodusere tidligere cystostatikabehandling.
Ved tidlig residiv vil ACO (ev. karboplatin-irinotekan eller oralt topotekan) være aktuelt.
Torakal strålebehandling er effektivt ved plagsomme tumorrelaterte symptomer fra toraks.
Nevroendokrine lungesvulster (karsinoid og storcellet nevroendokrint karsinom)
KARSINOIDER
Karsinoider utredes og stadiesettes som lungesvulster for øvrig.
Ved typiske karsinoider stadium I og II og atypiske karsinoider anbefales somatostatinreseptor-basert bildediagnostikk.
Karsinoider i stadium I-III anbefales operert som vanlig primær lungekreft. En kan gjøre sublobær reseksjon ved små perifere typiske karsinoider, men komplett lymfeknutedisseksjon/sampling må gjennomføres.
Stereotaksi kan være et alternativ hos pasienter i stadium I/II som ikke ønsker kirurgi, eller er medisinsk inoperable.
Ved radikaloperert typisk karsinoid i stadium I, II og III og atypisk karsinoid stadium I anses pasienten ferdig behandlet etter radikal kirurgi.
Ved ufri reseksjonsrand eller peroperativt påvist N2-sykdom og atypisk histologi kan strålebehandling som ved NSCLC vurderes. Adjuvant kjemoterapi er ikke indisert.
Ved inoperabel karsinoid kan kjemoradiasjon (stadium III) eller medikamentell behandling vurderes.
Kontroller bør tilpasses individuelt, og pasienten bør følges i minimum 10 år etter operasjon.
STORCELLET NEVROENDOKRINT KARSINOM
Operable pasienter bør tilbys kirurgi.
Adjuvant kjemoterapi med 4 kurer cisplatin/etoposid bør vurderes, også for pasienter med sykdom i stadium I.
Strålebehandlingens rolle er ikke avklart, men kan vurderes ved lokalavansert inoperabel sykdom.
LCNEC og kombinerte SCLC/LCNEC behandles med kjemoterapi som ved SCLC og strålebehandles som ved NSCLC.
Malignt pleuralt mesoteliom (C45)
UTREDNING AV MESOTELIOM
Malignt pleuralt mesoteliom mistenkes ved pleuraeffusjon, pleural fortykkelse og samtidig brystsmerter.
CT toraks med kontrast er basis for diagnostikk og staging.
For videre cyto-/histologisk diagnostikk gjøres aspirering for cytologi, og pleural biopsering (helst torakoskopisk).
Histologisk bekreftelse av diagnosen må etterstrebes. Siden negativ cytologi/pleural biopsi ikke utelukker mesoteliom bør videre utredning gjøres.
Ved vurdering for kurativ behandling skal PET/CT utføres. I en ikke-kurativ situasjon er det ikke indikasjon for PET/CT, med mindre dette er ønskelig før biopsi, for mer sannsynlig å få representativ prøve.
KIRURGI AV MESOTELIOM
Kirurgi er kun aktuelt ved god allmenntilstand (ECOG 0-1), mindre enn 50 % sarkomatoid histologi og T1-3N0.
Neoadjuvant og evt adjuvant platinum/pemetreksed-kombinasjonskjemoterapi bør tilbys pasienter som vurderes for radikal kirurgi.
I Skandinavia henvises disse pasientene til Onkologisk avd, Rigshospitalet, København for endelig utredning og kirurgi. Henvisning bør sendes ved oppstart neoadjuvant kjemoterapi.
Stråleterapi skal ikke gjøres rutinemessig etter pleurektomi/dekortikasjon. Ved sikker gjenværende tumorrest, markert med klips, bør stråling vurderes med dosering 2 Gy x 25.
PALLIATIV STRÅLEBEHANDLING MESOTELIOM
Palliativ strålebehandling bør tilbys ved smertefulle lokale områder i toraks eller for å hindre obstruktive symptomer.
Ved langsom progresjon der en forventer et langt sykdomsforløp (epiteloid histologi) kan det vurderes gitt 4 Gy x 5 eller 3 Gy x 10-13, evt normofraksjonert stråleterapi til 40-50 Gy.
Ved kort forventet levetid anbefales hypofraksjonert behandling 8 Gy x 1.
PROFYLAKTISK STRÅLEBEHANDLING MOT STIKKANALER
Profylaktisk strålebehandling mot stikkanaler anbefales ikke som rutinebehandling.
MEDIKAMENTELL BEHANDLING AV MESOTELIOM
Pasienter i rimelig god allmenntilstand (ECOG 0-2) bør behandles med førstelinjes kombinasjonskjemoterapi 4-6 kurer cisplatin/karboplatin og pemetreksed ev. med tillegg av bevacizumab inntil progresjon eller uønsket toksistet.
Monoterapi med pemetreksed kan også velges ved kontraindikasjon for platinum eller om det oppstår behandlingsrelaterte plager som tilsier seponering av cisplatin/karboplatin.
Oppstart av kjemoterapi bør ikke forsinkes, og vurderes oppstartet før debut av symptomer. Det er bedre effekt og lengre overlevelse ved tidlig oppstart.
Nivolumab monoterapi anses som et godt alternativ dersom residivbehandling er aktuelt. Ev. kan man forsøke monoterapi med vinorelbin eller gemcitabin.
Inklusjon i kliniske studier kan være aktuelt.
PLEURODESE VED MESOTELIOM
Pleurodese bør vurderes ved plagsom gjentatt pleuravæske. Oppløst talkum anbefales benyttet.
Både torakoskopisk og vanlig pleuradreninstallasjon kan benyttes.
Thymus-svulster (C37)
UTREDNING AV THYMOM
CT med intravenøs kontrast er førstevalg ved utredning av oppfylninger i nivå med thymus.
MR toraks og PET/CT kan vurderes for å avklare spesifikke problemstillinger.
TNM8-klassifikasjonssystemet anbefales også for thymomer.
Dersom man etter radiologisk diagnostikk og tverrfaglig diskusjon konkluderer med operabilitet, er invasiv preoperativ histopatologisk diagnostikk ikke nødvendig.
Histologisk undersøkelse av preoperativ nålebiopsi, evt cytologi, supplert med immunhistokjemi er vanligvis tilstrekkelig for diagnose, inkludert subtype.
KIRURGI AV THYMOM
Som hovedregel skal alle thymomer fjernes kirurgisk.
Oftest er primær kirurgi å foretrekke, men ved stadium III og IV kan man vurdere preoperativ kjemoterapi, og ev. stråleterapi, dersom det er usikkert om tumor kan fjernes radikalt.
ADJUVANT BEHANDLING AV THYMOM
Postoperativ strålebehandling bør vurderes ved thymuskarsinomer, og ved ikke-radikalt opererte thymomer.
Ved R0-R1 gis 2 Gy x 25, mens ved R2 gis 2 Gy x 30 med konkomitant kjemoterapi.
Neoadjuvant kjemoradioterapi kan vurderes ved primært inoperable svulster.
Postoperativ kjemoterapi kan vurderes ved tymuskarsinomer i stadium III.
OPPFØLGNING ETTER BEHANDLING FOR THYMOM
De første 2 år anbefales halvårlig CT-undersøkelse med kontrast, deretter årlig i minimum totalt fem år for thymuskarsinomer og i minimum 10 år for thymomer.
Komplikasjoner ved lungekreft og øyeblikkelig hjelp-situasjoner
VENA CAVA SUPERIOR-SYNDROM
Initialt skal pasienten opp i sittende stilling og administreres O2 etter behov.
Høydose deksametason (4 mg x 4, 8 mg x 2) eller metylprednisolon (16 mg x 4) startes umiddelbart. Protonpumpehemmer som ulcusprofylakse startes samtidig.
Pasienten bør stadiesettes mtp. mulighet for potensielt kurativ behandling for SCLC.
Ved bekreftet eller mistenkt SCLC gis primær kjemoterapi og ev. immunterapi dersom pasienten er kjemo-naiv.
Ved kjemoresistent SCLC, ukjent histologi eller bekreftet NSCLC-histologi og betydelige klinisk plager skal pasienten vurderes for øyeblikkelig hjelp stenting av vena cava etterfulgt av strålebehandling.
Ved lite symptomer tross betydelige radiologifunn kan strålebehandling gjøres direkte uten forutgående stenting.
KOMPRESJON AV SENTRALE LUFTVEIER
Høydose deksametason (4 mg x 4, 8 mg x 2) eller metylprednisolon (16 mg x 4) startes umiddelbart. Protonpumpehemmer som ulcusprofylakse startes samtidig.
Ved kjent NSCLC eller uavklart histologi bør det vurderes intervensjonsbronkoskopi med laserbehandling og/eller stenting, deretter strålebehandling.
Ved kjent SCLC gis primært kjemoterapi og ev. immunterapi dersom pasienten er kjemo-naiv. Det kan gis strålebehandling om kjemoterapi er kontraindisert.
Ved residiv i tidligere bestrålt område vurderes intervensjonsbronkoskopi med stenting og/eller laserbehandling.
MALIGN MEDULLAKOMPRESJON
Høydose deksametason (4 mg x 4, 8 mg x 2) eller metylprednisolon (16 mg x 4) startes umiddelbart. Protonpumpehemmer som ulcusprofylakse startes samtidig.
Henvisning øhj. til multidisplinært team (onkolog, nevrokirurg, ortoped).
Ved steroideffekt eller om pasienten er medisinsk eller teknisk inoperabel, velges strålebehandling som primærbehandling.
Fraksjonering bør velges utfra forventet levetid:
<6 mndr: 8 Gy x 1
6-12 mndr: 4 Gy x 5
>12 mndr: 3 Gy x 10
Ved forverring under pågående strålebehandling, bør man vurdere om nevrokirurg/ortoped skal konsulteres på nytt med tanke på kirurgisk dekompresjon eller om iverksatt behandling skal avbrytes.
HYPERKALSEMI
Rehydrering med 2000 ml NaCl/døgn.
Bisfosfonat i form av zoledronat 4 mg eller pamidronat 90 mg.
Ved manglende respons kan en ny dose bisfosfonat gis etter 7-10 dager.
Figur- og tabelliste
Sist faglig oppdatert: 31.10.2024
Figurer
Figur 1 Prevalens, insidens og antall lungekreftforårsakede dødsfall i absolutte tall (Kreftregisteret 2023, Dødsårsakregisteret 2023).
Figur 2 Antall dødsfall forårsaket av lungekreft i Norge (Dødsårsaksregisteret, 2023).
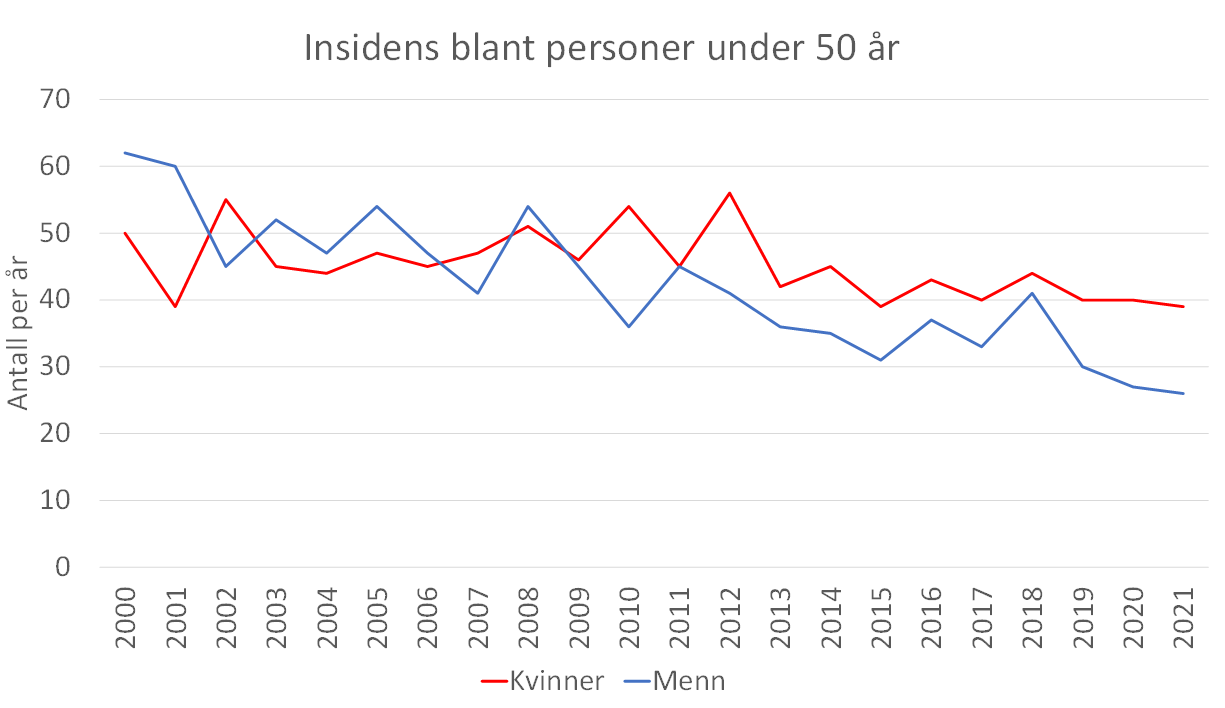
Figur 3 Insidens under 50 år (Kreftregisteret 2022).
Figur 4 Andel daglig- og av-og-til-røykere 2000-2021, 16-74 år, etter kjønn. (Statistisk sentralbyrå 2024).
Figur 5 Forekomst av daglig og av-og-til-røyking i ulike aldersgrupperk, etter kjønn, 2023 (Statistisk sentralbyrå 2024)
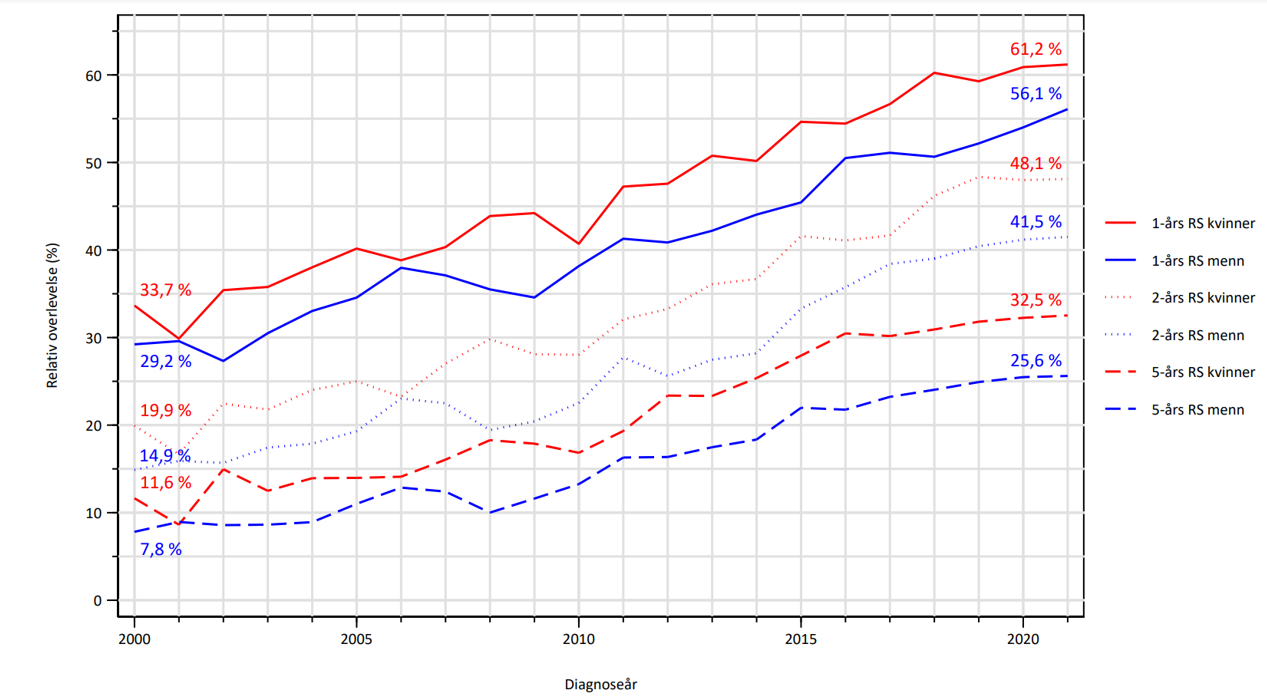
Figur 6 1-, 2- og 5-års relativ overlevelse, alle stadier samlet. Tall fra Kreftregisteret 2022.
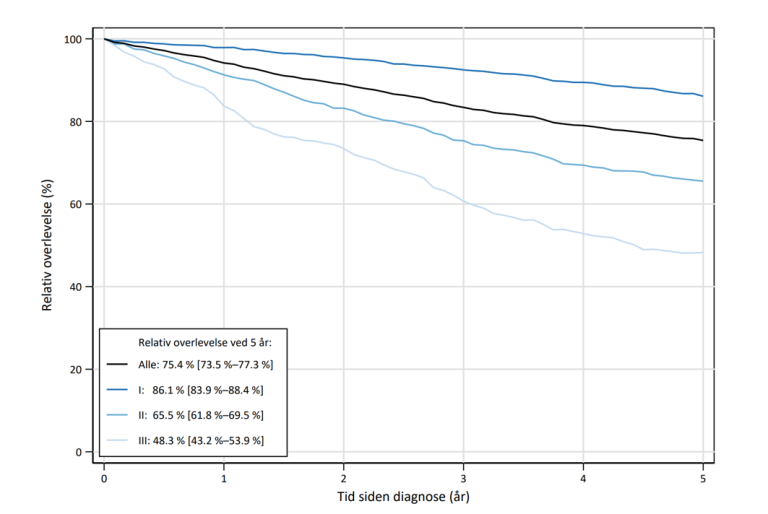
Figur 7 Relativ overlevelse opp til fem år etter operasjon ved de ulike stadiene (pTNM). (Kreftregisteret 2022).
Figur 8 Skjematisk oppsummering av utredning av lungekreft.
Figur 9 Forslag til utredningsalgoritme.
Figur 10 Algoritme for vurdering av operabilitet hos pasienter uten annen alvorlig komorbiditet. Figur hentet fra (Ha et al., 2016). d Risiko angitt som lav (<1 % risiko for postoperativ mortalitet), moderat (risiko varier avhengig av anstrengelses toleranse, reseksjonens størrelse) eller høy (>10 % risiko for postoperativ mortalitet).
Figur 11 Kart over lymfeknutestasjoner.
Figur 12 Inndeling av pulmonale noduli etter utseende på CT toraks.
Figur 13 Diagnostisk tilnærming i biopsier og pleuravæske ved mistanke om pleuralt malignt mesoteliom.
Figur 14 Testalgoritmer for immunhistokjemiske undersøkelser og molekylære analyser i små biopsier/cytologiske prøver.
Figur 15 Skjematisk oversikt over behandling av pasienter i stadium I-III som er aktuelle for kirurgi og tilleggsbehandling. Grå bokser viser behandlingsmulighet om neoadjuvant kjemoimmunterapi ikke velges.
Figur 16 Oversikt over forløp ved valg av neoadjuvant eller adjuvant behandling.
Figur 17 Radiokjemoimmunoterapi for inoperabel stadium II(N1)/III ikke-småcellet lungekreft.
Figur 19 Algoritme for behandling av hjernemetastaser.
Figur 20 Kombinasjonsbehandling med immunterapi og kjemoterapi for adenokarsinom.
Figur 21 Kombinasjonsbehandling med immunterapi og kjemoterapi for plateepitelkarsinom.
Figur 22 Behandlingsalgoritme for medikamentell behandling av avansert ikke-småcellet lungekreft.
Figur 23 Algoritme for behandling av LS-SCLC.
Figur 24 Algoritme for behandling av mesoteliom.
Figur 25 Eksempel på estimering av post-operativ lungefunksjon.
Tabeller
Tabell 1 Pakkeforløpstider for lungekreft.
Tabell 2 ECOG-klassifisering.
Tabell 3 Lungekreft TNM-inndeling, TNM 8.
Tabell 4 Lungekreft stadium-inndeling, TNM 8.
Tabell 5 Lymfeknutenivå i toraks.
Tabell 6 Aktuelle risikofaktorer ved bedømmelse av noduli
Tabell 7 Oppfølgingsalgoritme for solide noduli
Tabell 8 Oppfølgingsalgoritme for subsolide noduli
Tabell 9 Foreslått gradering av reseserte non-mucinøse adenokarsinom, tidlig stadium.
Tabell 10 Kriterier for klassifisering av resttumor.
Tabell 11 WHO-klassifikasjon av lungetumorer.
Tabell 12 Gradering av pleuralt diffust epitelioid mesoteliom.
Tabell 13 WHO 2021-klassifikasjonen av epiteliale thymussvulster, og diagnostiske kriterier.
Tabell 14 Oversikt over gener som bør inngå i molekylære analyser av adenokarsinom/NSCC-NOS.
Tabell 15 PV-kur.
Tabell 16 Karbo-/eto-(iv)/atezo-kur.
Tabell 17 Karbo-/eto-(po)/atezo-kur.
Tabell 18 ACO-kur.
Tabell 19 Karbo-/irinotekan-kur.
Tabell 20 Dosejustering karbo-/irinotekan-kur.
Tabell 21 TNM-8-klassifisering av malignt pleuralt mesoteliom.
Tabell 22 Stadieinndeling av malignt pleuralt mesoteliom.
Tabell 23 Masaokas stadieinndeling av thymom (anbefales erstattet med TNM).
Tabell 24 TNM8-klassifikasjon av thymomer.
Tabell 25 TNM8-stadieinndeling av thymomer.
Tabell 26 Behandlingsstrategier ved thymom.
Tabell 27 EDP-kur.
Tabell 28 ADOC-kur.
Tabell 29 Gradering av kunnskapsgrunnlag.
Tabell 30 Prediktorer for kirurgikomplikasjoner.
Tabell 31 Sannsynlighet for postoperativ mortalitet.
Tabell 32 Sannsynlighet for postoperativ mortalitet med betablokker.
Forkortelser
Sist faglig oppdatert: 31.10.2024
- ACO Cellegiftkombinasjonen doksorubicin (Adriamycin®), syklofosfamid og vinkristin (Oncovin®)
- ACTH Adrenokortikotropt hormon
- ADH Antidiuretisk hormon
- ALAT Alanin amino-transferase
- ALK Anaplastisk lymfom kinase
- ALP Alkalisk fosfatase
- APC Argon plasma koagulasjon
- ASAT Aspartat amino-transferase
- AUC Doseberegningsmåte for cellegift (karboplatin) (Area under curve)
- AV Arteriovenøs
- B-raf En serin/treonin-kinase kodet av protoonkogenet BRAF (Rapidly Accelerated Fibrosarcoma type B)
- BSC Ikke tumorrettet støttebehandling (Best supportive care)
- CA125 Tumormarkør (Cancer antigen 125)
- CAD Automatisk bildevurdering ved hjelp av kunstig intelligens (Computer-aided diagnosis, ev. Computer assisted detection)
- CCG Cellegiftkombinasjonen liposomal doksorubicin (Caelyx), karboplatin, og gemcitabin
- CD56 Overflatemarkør for nevroendokrine celler
- CEA Tumormarkør (carcinogent embryonalt antigen)
- CK5/6 Overflatemarkør for plateepitelkarsinomceller
- cMet Se Met
- CNS Hjerne og ryggmarg (Central nervous system)
- CNV Kopitallsvariasjon (copy number variation)
- CPET Preoperativ belastningstest (Cardiopulmonary exercise testing)
- CR Komplett respons (Complete response)
- CT Computer tomografi
- cTNM Klinisk TNM (Clinical TNM)
- CTV Makroskopisk tumorvev og subklinisk sykdom som tegnes inn ved stråleplanlegging (Clinical target volume)
- DLCO Gassdiffusjonskapasitet bedømt ved transferfaktor for CO (Diffusing capacity of the lung for carbon monoxide), synonymt med TLCO
- EBUS Endobronkial ultralydundersøkelse (Endobronchial ultrasound)
- EBUS-FNAC Endobronkial ultralydundersøkelse med fin-nåls-aspirasjonscytologi (Endobronchial ultrasound with fine needle aspiration cytology)
- ECOG Klassifikasjonssystem for funksjonsvurdering (Eastern cooperative oncology group)
- EGFR Epidermal vekstfaktorreseptor (Epidermal growth factor receptor)
- EKG Elektrokardiogram
- EML4-ALK Fusjonsgenet echinoderm microtubule-associated protein-like 4 (EML4) gene og anaplastic lymphoma kinase (ALK)
- EPP Ekstrapulmonal pleurektomi
- ERBB2 Gen som koder for Her2 (reseptortyrosinkinase i EGFR-familien)
- ESMO European Society of Medical Oncology
- EUS Ultralydundersøkelse via øsofagoskopi (Esophageal ultrasound)
- EUS-FNAC Ultralydundersøkelse via øsofagoskopi med fin-nåls-aspirasjonscytologi (Esophageal ultrasound with fine needle aspiration cytology)
- FDG 18-fluor deoksy gluokose (substrat ved PET-undersøkelse)
- FEV1 Forsert ekspirasjonsvolum i ett sekund (Forced expiratory volume in 1 second)
- FISH Fluorescens in situ hybridisering
- FNAC Fin-nåls-aspirasjonscytologi (Fine needle aspiration cytology)
- G-CSF Beinmargsstimulerende stoff (Granulocyte colony stimulating factor)
- GTV Makroskopisk tumorvev som tegnes inn ved stråleplanlegging (Gross tumour volume)
- Gy Dosebenevning for ioniserende stråling (Grey)
- Hb Hemoglobin
- HE Hematoxylin-eosin
- Her2 Human epidermal vekstfaktorreseptor 2, reseptor i EGFR-familien kodet av ERBB2-genet
- HPV Humant papillomavirus
- HR Hazard ratio
- HU Houndsfield units
- IHK Immunhistokjemi, antistoff-basert fargemetode for patologisk diagnostikk av vevssnitt (Immunohistochemistry)
- IMRT Intensitetsmodulert stråleterapi (Intensity Modulated Radiotherapy)
- ITV Makroskopisk tumorvev, subklinisk sykdom, og indre bevegelsesutslag som tegnes inn ved stråleplanlegging (Internal target volume)
- KI Konfidensintervall
- KOLS Kronisk obstruktiv lungesykdom
- KRas Signalprotein, kodet av protoonkogenet KRAS (Kirsten rat sarcoma virus-protein)
- LCNEC Storcellet nevroendokrint karsinom (large cell neuroendocrine carcinoma)
- LD Laktat dehydrogenase
- LIS Legemiddelinnkjøpssamarbeid (egentlig navn nå er Avdeling for legemiddelinnkjøp i HINAS (Helseforetakenes innkjøpsservice AS)
- Lkc Leukocytter
- Met En reseptortyrosinkinase; reseptor for hepatocytt vekstfaktor
- MPM Malignt pleuralt mesoteliom
- MR Magnetisk resonansavbildning
- Mut- Mutasjons-negativ
- Mut+ Mutasjons-positiv
- NaCl Natriumklorid
- NCCN National Comprehensive Cancer Network
- Nd-YAG Laser med neodymium-doped yttrium aluminium garnet
- NEK Nevroendokrint karsinom (= SCLC + LCNEC)
- NEN Nevroendokrin neoplasme (= NEK + NET)
- NET Nevroendokrin tumor (= typisk og atypisk karsinoid)
- NGS Nestegenerasjonssekvensering (next generation sequencing)
- NICE National Institute for Health and Clinical Excellence
- NLCG Norsk lungekreftgruppe (Norwegian lung cancer group)
- NOS Histologisk subtype ikke nærmere klassifiserbar (not otherwise specified)
- NRG1 Neuregulin 1; ligand for reseptorer i EGFR familien
- NSCC Ikke-småcellet karsinom (Non-small cell carcinoma)
- NSCLC Ikke-småcellet lungekreft (Non-small cell lung cancer)
- NSE Neuron-spesifikk enolase
- NTRK Nevrotrof reseptortyrosinkinase
- OS Totaloverlevelse (Overall survival)
- PCI Profylaktisk hjernebestråling (Prophylactic cranial irradiation)
- PD Progredierende sykdom (Progressive disease)
- PD1 Programmed cell death protein 1
- PD-L1 Programmed cell death ligand 1
- PET Positron emisjons-tomografi
- PET/CT PET koblet til CT
- PFS Progresjonsfri overlevelse (Progression free survival)
- PODLCO Postoperativ DLCO
- POFEV1 Postoperativ FEV1
- proGRP Serummarkør for SCLC (pro-gastrin releasing peptide)
- PSN Delvis solid nodulus (Partially solid nodule)
- pTNM Patologisk definert TNM (postoperativt) (Pathological TNM)
- PTV Det volumet som skal ha forskrevet stråledose (Planning target volume)
- PV Cellegiftkombinasjonen cisplatin og etoposid
- R0 Mikroskopisk frie reseksjonsrender
- R1 Mikroskopisk restsykdom i reseksjonsrender
- R2 Makroskopisk restsykdom i reseksjonsrender
- RATS Robotassistert torakoskopi
- RET En reseptortyrosinkinase
- RFA Radiofrekvensablasjon
- ROS1 Et protoonkogen, reseptor tyrosin kinase (c-ros oncogene 1)
- RR Responsrate
- RT Strålebehandling (Radioterapi)
- Rtg Røntgen
- SaO2 Oksygenmetning (Saturation level of oxygen in hemoglobin)
- SBRT Stereotaktisk strålebehandling utenfor hjernen (Stereotactic body radiation therapy)
- SCLC Småcellet lungekreft (Small cell lung cancer)
- ES-SCLC SCLC utbredt sykdom (Extended stage SCLC)
- LS-SCLC SCLC begrenset sykdom (Limited stage SCLC)
- SD Stabil sykdom (Stable disease)
- SIADH Uhensiktsmessig høy sekresjon av antidiuretisk hormon (Syndrome of inappropriate secretion of antidiuretic hormone)
- SPN Solitær pulmonal nodulus
- STAS Spredning av tumorceller i alveolerom (Spread Through Alveolar Space; også kalt aerogen spredning)
- SSN Subsolid nodulus
- SUV Standard uptake value
- TBNA Transbronkial nåleaspirasjon
- TKI Tyrosinkinasehemmer (Tyrosin kinase inhibitor)
- TLCO Transfer factor of the lung for carbon monoxide, synonymt med DLCO
- TNM Klassifikasjonssystem basert på svulst (T, tumor), lymfeknute (N, nodule) og fjernspredning (M, metastase)
- TRT Torakal radioterapi
- TTF-1 Tyreoidea transkripsjonsfaktor-1
- TTNA Transtorakal nåleaspirasjon
- TTNB Transtorakal nålebiopsi
- UL Ultralyd (ultrasound)
- VATS Videoassistert torakoskopi
- VCSS Vena cava superior-syndrom
- VDT Volumdoblings-tid
- VO2max Maksimalt oksygenopptak
Epidemiologi
Forekomst og dødelighet
Sist faglig oppdatert: 31.10.2024
Lungekreft er den nest hyppigste kreftform hos både menn og kvinner i Norge, ifølge Kreftregisteret. (kreftregisteret.no). På verdensbasis er lungekreft den vanligste kreftformen (Ferlay et al., 2021). Lungekreft utgjør ca 10 % av alle nye krefttilfeller i Norge. Insidensen stiger jevnt, mens prevalensen stiger bratt, og har blitt tredoblet siste 20 år (Figur 1). I 2023 ble det registrert 3319 nye tilfeller (kreftregisteret.no), og totalt 2142 personer døde av sykdommen dette året (fhi.no). Lungekreft er kreftformen som tar flest liv i Norge. I 2012 gikk nesten 33.000 leveår tapt pga lungekreft, omtrent like mange som av brystkreft, prostatakreft og tykktarmkreft sammenlagt (O. T. Brustugun, Møller, & Helland, 2014). På verdensbasis har en estimert at hele 1,8 millioner årlig dør av sykdommen (Ferlay et al., 2021).
Mesoteliom, svulster oppstått i mediastinum og thymus, samt kreft i trakea er langt sjeldnere. Mesoteliom diagnostiseres hos ca 10-15 kvinner og 60-70 menn per år, og dette har vært stabilt de siste par tiår. Thymom diagnostiseres hos færre enn 10 pasienter per år. Kreftregisteret har i perioden 2000-2020 totalt registrert 77 pasienter med trakealkreft (3,7 pasienter per år i snitt), 47 % var kvinner.
Kjønn
I 2022 ble lungekreft påvist hos 1730 kvinner og 1804 menn. De siste årene har det vært en viss nedgang i aldersjustert forekomst hos menn, og kanskje har man passert toppen også for kvinner. Mens fordelingen av lungekreft mellom menn og kvinner på 1950-tallet var 4,3:1, var tilsvarende fordeling i 2000 1,7:1 og i 2022 1:1. I aldersgruppene under 70 år er forekomsten av lungekreft høyere hos kvinner enn hos menn.
I 2022 døde 1011 kvinner og 1194 menn av lungekreft. Hos menn har det vært en gradvis nedgang over de siste år, og kanskje ser vi nå en avflating også hos kvinner (Figur 2).
Alder
Median alder ved diagnosetidspunkt var 71 år for både menn og kvinner i perioden 2014-18. Det er små aldersforskjeller mellom de histologiske undergruppene. Aldersgruppen 80 år og eldre sto for 14,6 % av tilfellene i 2000, dette steg til 22,5 % i 2021.
Det har ikke vært noen økning i insidensen i de yngste aldersgruppene (Figur 3). I aldersgruppen under 40 år fikk gjennomsnittlig 8,3 kvinner og 6,9 menn diagnosen lungekreft hvert år i perioden 2000-2021.
Stadiefordeling
Sist faglig oppdatert: 31.10.2024
Ifølge Kvalitetsregisteret for lungekreft diagnostiseres ca 28 % av lungekreftpasientene i stadium I, 8 % i stadium II, 20 % i stadium III og 44 % i stadium IV. Det er relativt store forskjeller i stadiumfordelingen blant de ulike histologiske subtypene. Plateepitelkarsinomgruppen har mindre hyppig fjernspredning på diagnostidspunktet, mens småcellet lungekreft sjelden oppdages i tidlig stadium og blir følgelig svært sjelden operert (O.T. Brustugun et al., 2018).
Histologi
Sist faglig oppdatert: 31.10.2024
Tradisjonelt har lungekreft vært dominert av plateepitelkarsinom. De siste 20 årene har imidlertid andelen plateepitelkarsinom vært svakt synkende både i Norge og andre vestlige land, mens andelen adenokarsinomer har økt. Adenokarsinom utgjør nå ca 50 % av all lungekreft (Nasjonalt kvalitetsregister for lungekreft) og er nå den vanligste subtypen hos begge kjønn.
Risikofaktorer for lungekreft
Sist faglig oppdatert: 31.10.2024
Røyking er dominerende risikofaktor for lungekreft og er årsak til 80-90 % av tilfellene. De siste årene har antall dagligrøykere blitt redusert, fra over 30 % på slutten av 90-tallet til under 10 % i 2021, og reduksjonen er spesielt stor i de yngre aldersgruppene. Andelen respondenter som oppgir å røyke av og til har holdt seg stabil rundt 10 % (Figur 4). Det er få unge som oppgir å røyker daglig, men av-og-til-andelen er høyest blant de yngste aldersgruppene (Figur 5).
Lungekreft oppstår også hos aldri-røykere, og er blant annet assosiert med passiv røyking, radon, luftforurensning og svevestøv (Turner et al., 2020). Ca 20 % av lungekrefttilfellene hos norske menn synes å være relatert til yrkeseksponering (Haldorsen, Andersen, & Boffetta, 2004).
Populasjonsstudier indikerer at risiko for utvikling av lungekreft kan være assosiert med arvelighet (de Alencar, Formiga, & de Lima, 2020). Kimbanemutasjoner i spesifikke gener kan også være forbundet med økt risiko for lungekreft (Bossé & Amos, 2018).
Overlevelse
Sist faglig oppdatert: 31.10.2024
For alle stadier under ett var 5-års relativ overlevelse 30 % i 2022 (27 % for menn og 34 % for kvinner) (Figur 6). Median overlevelse har økt fra 8,4 mndr i 2010 til 16,8 mndr i 2022.
De fleste langtidsoverlevende er operert, men overlevelse for opererte korrelerer med stadium, fra 86 % i stadium I, til 48,3 % i stadium III (Figur 7). For lungekreftopererte er risikoen større for å dø av lungekreft enn av andre årsaker selv mer enn 5 år etter operasjonen (Bugge et al., 2018). Pasienter som har fått stereotaktisk strålebehandling kan også forvente god overlevelse (Brustugun et al., 2018). I 2021 var 5-års relativ overlevelse uavhengig av behandling for stadium I 70,8 %, 49,3 % for stadium II og 22,9 % i stadium III. For pasienter i stadium IV er median overlevelse for 75-prosentilen over 15 mndr, mens median fortsatt er lav, ca 6 mndr.
For ytterligere detaljer omkring lungekreftepidemiologien henvises til Nasjonalt kvalitetsregister for lungekreft.
Fastlegens arbeid og ansvar ved lungekreft, mesoteliom og thymom
Sist faglig oppdatert: 31.10.2024
Fastlegens rolle i forebygging av lungekreft
Sist faglig oppdatert: 31.10.2024
Fastlegene må kjenne til forekomst av og risikofaktorer for lungekreft, mesoteliom og thymom.
Forekomst og risikofaktorer: Se kapitlet "Epidemiologi".
Arvelighet: Det er ingen kjent arvelighet for lungekreft.
Livsstilsfaktorer: Røyking er den viktigste årsak til lungekreft. Det er en klar sammenheng mellom risiko for lungekreft og mengde konsumert tobakk regnet ut fra antall «pakkeår»: 1 «pakkeår» tilsvarer 20 sigaretter daglig i 1 år. Økende alder gir økt risiko, men lungekreft kan forekomme også i de yngste aldersklasser. Lungekreft kan oppstå mange år etter at pasienten har sluttet å røyke.
Fastlegenes viktigste innsats i forebygging av lungekreft er å informere pasienter om risiko knyttet til røyking, motivere til røykeslutt og jobbe med røyke-avvenning overfor pasientene. https://helsedirektoratet.no/retningslinjer/roykeavvenning
Miljøfaktorer: Ca 20 % av alle lungekrefttilfellene i Norge kan tilskrives yrkesmessig eksposisjon, selv etter korrigering for røykevaner (Haldorsen et al., 2004). Fastlegene må ha en særlig årvåkenhet knyttet til pasienter som kan være eksponert for lungekreftfremkallende stoffer som asbest, radon og nikkel.
Andre risikofaktorer: ca 10 % av lungekreft oppstår hos aldri-røykere.
Fastlegens rolle i diagnostikk og henvisning til pakkeforløp ved lungekreft
Sist faglig oppdatert: 31.10.2024
Lungekreft kan debutere på ulike måter og i alle aldre. Ingen symptomer peker alene entydig mot lungekreft. Alle symptomene hos lungekreftpasienter kan også forekomme ved andre sykdommer. Mistanke bygger på en samlet vurdering hvor alder, røyke- og yrkesanamnese sett i sammenheng med pasientens symptomer avgjør om tilstanden krever videre utredning. Følgende symptomer gir mistanke om lungekreft og skal lede til rekvirering av CT toraks og øvre abdomen med kontrast:
- Hemoptyse eller
- Et av følgende uforklarlige og vedvarende (over 3 uker) symptomer eller funn. Hoste, bryst-/skuldersmerter, dyspné, vekttap, toraksfunn, heshet, finger-clubbing.
Det må i henvisning til bildediagnostikk opplyses om eventuelle risikofaktorer og at det er mistanke om kreft.
- CT toraks og øvre abdomen med intravenøs kontrast tas uten opphold ved klinisk mistanke om lungekreft, selv om røntgen toraks er normal
Lenke til Pakkeforløpet for lungekreft
Noen av sykdomspresentasjonene kommer som akutte medisinske problemstillinger. Det er derfor viktig å kjenne til alarmsymptomer knyttet til alvorlige komplikasjoner ved lungekreft som skal føre til øyeblikkelig hjelp innleggelse: De fire vanligste alvorlige komplikasjonene er:
- Kompresjon av vena cava superior (VCSS), Stokes krage
- Kompresjon av sentrale luftveier
- Tverrsnittslesjon av ryggmargen
- Hyperkalsemi
Se også kapitlet om palliasjon.
Fastlegens rolle for lungekreftpasienter som mottar tumorrettet behandling
Sist faglig oppdatert: 31.10.2024
Fastlegens rolle i denne fasen vil variere, alt etter pasientens kliniske situasjon, livssituasjon og avstand til sykehus. Fastlegen bør være tilgjengelig for å bistå i oppfølging av behandlingen der det er hensiktsmessig for pasienten, og må kommunisere med sykehuset når fastlegen har intervenert i behandlingen.
Fastlegen kan være en støtte og behandle angst, depresjon og andre psykiske plager. Fastlegen kan også bidra til å ivareta berørte familiemedlemmer, og samarbeide med hjemmetjeneste og sykehus der dette er aktuelt. Legen som stiller indikasjon for sykemelding, resepter og videre henvisninger og undersøkelser, gjør dette arbeidet. For pasienter som behandles langvarig (>8 uker) på sykehus/poliklinisk og hos fastlege parallelt, ivaretas sykemelding av fastlege når dette er hensiktsmessig for pasienten. I forbindelse med behandling på sykehus, f. eks. innleggelser og operasjoner, skriver sykehuslegen sykemelding – om nødvendig helt fram til første kontroll hos fastlege. Tidspunkt for kontrollen angis i epikrisen. Pasienten får ansvar for å bestille kontrolltimen.
Epikrisen skal gi informasjon om mulige bivirkninger og komplikasjoner som fastlegen bør være oppmerksom på. Spesielt er dette viktig under og etter immunterapi.
Vurdering av førerkort gjøres i samråd med spesialist og etter retningslinjer gitt i førerkortforskriften (https://www.helsedirektoratet.no/veiledere/forerkortveilederen). Vær spesielt oppmerksom på hjernemetastaser og bruk av smertestillende og beroligende medikamenter/sovemedisin.
Fastlegens rolle for pasienter som er i kontrollopplegg etter lungekreftbehandling
Sist faglig oppdatert: 31.10.2024
Handlingsprogrammet anbefaler at kontroll etter lungekreft skjer i regi av spesialisthelsetjenesten.
Se også kapittel 7.6 og kapittel 9.4.
Fastlegene vil med stor sannsynlighet ha kontakt med pasienten i denne tiden, dels på grunn av henvendelser for annen sykdom, dels på grunn av plager og spørsmål som angår kreftsykdommen.
Fastlegens rolle for pasienter som har avsluttet oppfølging for lungekreft på sykehus
Sist faglig oppdatert: 31.10.2024
Kontroll i sykehus etter lungekreftbehandling skjer gjennom flere år. Fordi lungekreft har høy mortalitet, er det få lungekreftpasienter som blir kreftfrie og avslutter oppfølging i spesialisthelsetjenesten. For de pasientene det gjelder, er fastlegen imidlertid viktig i videre medisinsk oppfølging, blant annet ved å
- Behandle redusert lungefunksjon og respirasjonssvikt etter kirurgiske behandling
- Behandle eventuell KOLS
- Motivere/opprettholde motivasjon for røykestopp.
- Behandle smerter etter lungekirurgi
- Behandle infeksjoner.
- Følge opp senskader etter behandling (blant annet nevropati), utmattelse og andre senplager.
- Følge opp med pneumokokk-, korona- og influensavaksine.
- Disse vaksinene gis etter Folkehelseinstituttets anbefalinger. Influensa- og konronavaksine kan gis under cellegiftbehandling, men bør trolig settes siste uken før ny cellegift-infusjon for å unngå nadir-perioden. Pneumokokkvaksine settes hvert 10. år, og bør for å få maksimal effekt settes før eller etter en periode med cellegiftbehandling. Utfra foreliggende data kan vaksinering gjøres med vanlig effekt, og uten mer bivirkninger, samtidig med pågående immunterapi (Wijn et al., 2018)
- Bistå i rehabilitering og oppmuntre til egentrening.
- Bistå med eventuell sykemelding/friskmeldingsprosess.
- Fange opp symptom på tilbakefall og/eller spredning og henvise til nytt pakkeforløp
Mange lungekreftpasienter avslutter aktiv behandling og kontroll på sykehus fordi sykdommen har kommet over i palliativ fase. Se kapittel 15.
Fastlegens rolle for overlevere etter lungekreft
Sist faglig oppdatert: 31.10.2024
Lungekreft har høy mortalitet og høy residivrate. De fleste residiv kommer innen fire år etter behandlingen, med en topp etter 9 måneder og ved slutten av andre og fjerde år, men om lag 10 % av residivene kommer opptil fem år eller senere. Det er også en viss risiko for utvikling av ny, primær lungekreft. Dette medfører at overlevere etter lungekreftbehandling, i tillegg til senfølger av behandling, må leve med en betydelig øket risiko for tilbakefall og/eller spredning av lungekreft.
De vanligste senfølger av lungekreftbehandling er dyspné og redusert lungefunksjon etter kirurgi, smerter i brystkassen, parestesier etter cellegiftbehandling og asteni. Fastlegen må behandle og følge opp disse.
Lenke til Generelt kapittel: Fastlegens rolle i oppfølging av kreftoverlevere
Lenke til senkomplikasjoner: Seneffekter etter kreftbehandling og Nasjonal kompetansetjeneste for seneffekter etter kreftbehandling ved Oslo universitetssykehus.
Fastlegens rolle ved tilbakefall og spredning av lungekreft
Sist faglig oppdatert: 31.10.2024
Rehenvise til pakkeforløp. Samme symptomer som førstegangs – presentasjon.
Se også kapittel 6.2.
Fastlegens håndtering tilpasses pasientens situasjon i kreftforløpet: For pasienter som er under oppfølging på sykehus, kontaktes avdelingen der oppfølgingen foregår. Dersom pasienten har avsluttet oppfølging på sykehus, henvises til nytt pakkeforløp.
Fastlegens arbeid med palliasjon og omsorg ved livets slutt for lungekreftpasienter
Sist faglig oppdatert: 31.10.2024
Mange lungekreftpasienter har langt fremskreden kreftsykdom når diagnosen stilles. Om lag 70 % av alle pasienter med lungekreft blir diagnostisert i et sykdomsstadium der kurativ behandling ikke er mulig, enten på grunn av stadium IV (40 %) eller i tidligere stadier med negative prognostiske faktorer (30 %). Dette betyr at mange lungekreftpasienter dør av sin kreftsykdom, og mange gjennomgår en palliativ fase av ulik varighet i sykdommen. I denne fasen mottar mange pasienter behandling på sykehus, dels for symptomlindring, dels for livsforlengelse og dels på grunn av livstruende komplikasjoner. Oppfølging fra palliativt team på lokalsykehus anbefales, fastlege kan henvise dersom det ikke er gjort fra spesialist. Parallelt følges pasientene av fastlege og øvrig kommunehelsetjeneste.
Se også kapittel 15.
Palliasjon og omsorg ved livets slutt for lungekreftpasienter må for øvrig tilpasses den enkeltes kliniske situasjon og hva som er størst utfordring. Dyspné og respirasjonssvikt kan være utfordrende å lindre på en god måte.
Se også kapittelet Fastlegens arbeid og ansvar ved lungekreft, mesoteliom og thymom
Fastlegens rolle i forebygging av lungekreft
Sist faglig oppdatert: 31.10.2024
Fastlegene må kjenne til forekomst av og risikofaktorer for lungekreft, mesoteliom og thymom.
Forekomst og risikofaktorer: Se kapitlet "Epidemiologi".
Arvelighet: Det er ingen kjent arvelighet for lungekreft.
Livsstilsfaktorer: Røyking er den viktigste årsak til lungekreft. Det er en klar sammenheng mellom risiko for lungekreft og mengde konsumert tobakk regnet ut fra antall «pakkeår»: 1 «pakkeår» tilsvarer 20 sigaretter daglig i 1 år. Økende alder gir økt risiko, men lungekreft kan forekomme også i de yngste aldersklasser. Lungekreft kan oppstå mange år etter at pasienten har sluttet å røyke.
Fastlegenes viktigste innsats i forebygging av lungekreft er å informere pasienter om risiko knyttet til røyking, motivere til røykeslutt og jobbe med røyke-avvenning overfor pasientene. https://helsedirektoratet.no/retningslinjer/roykeavvenning
Miljøfaktorer: Ca 20 % av alle lungekrefttilfellene i Norge kan tilskrives yrkesmessig eksposisjon, selv etter korrigering for røykevaner (Haldorsen et al., 2004). Fastlegene må ha en særlig årvåkenhet knyttet til pasienter som kan være eksponert for lungekreftfremkallende stoffer som asbest, radon og nikkel.
Andre risikofaktorer: ca 10 % av lungekreft oppstår hos aldri-røykere.
Fastlegens rolle i diagnostikk og henvisning til pakkeforløp ved lungekreft
Sist faglig oppdatert: 31.10.2024
Lungekreft kan debutere på ulike måter og i alle aldre. Ingen symptomer peker alene entydig mot lungekreft. Alle symptomene hos lungekreftpasienter kan også forekomme ved andre sykdommer. Mistanke bygger på en samlet vurdering hvor alder, røyke- og yrkesanamnese sett i sammenheng med pasientens symptomer avgjør om tilstanden krever videre utredning. Følgende symptomer gir mistanke om lungekreft og skal lede til rekvirering av CT toraks og øvre abdomen med kontrast:
- Hemoptyse eller
- Et av følgende uforklarlige og vedvarende (over 3 uker) symptomer eller funn. Hoste, bryst-/skuldersmerter, dyspné, vekttap, toraksfunn, heshet, finger-clubbing.
Det må i henvisning til bildediagnostikk opplyses om eventuelle risikofaktorer og at det er mistanke om kreft.
- CT toraks og øvre abdomen med intravenøs kontrast tas uten opphold ved klinisk mistanke om lungekreft, selv om røntgen toraks er normal
Lenke til Pakkeforløpet for lungekreft
Noen av sykdomspresentasjonene kommer som akutte medisinske problemstillinger. Det er derfor viktig å kjenne til alarmsymptomer knyttet til alvorlige komplikasjoner ved lungekreft som skal føre til øyeblikkelig hjelp innleggelse: De fire vanligste alvorlige komplikasjonene er:
- Kompresjon av vena cava superior (VCSS), Stokes krage
- Kompresjon av sentrale luftveier
- Tverrsnittslesjon av ryggmargen
- Hyperkalsemi
Se også kapitlet om palliasjon.
Fastlegens rolle for lungekreftpasienter som mottar tumorrettet behandling
Sist faglig oppdatert: 31.10.2024
Fastlegens rolle i denne fasen vil variere, alt etter pasientens kliniske situasjon, livssituasjon og avstand til sykehus. Fastlegen bør være tilgjengelig for å bistå i oppfølging av behandlingen der det er hensiktsmessig for pasienten, og må kommunisere med sykehuset når fastlegen har intervenert i behandlingen.
Fastlegen kan være en støtte og behandle angst, depresjon og andre psykiske plager. Fastlegen kan også bidra til å ivareta berørte familiemedlemmer, og samarbeide med hjemmetjeneste og sykehus der dette er aktuelt. Legen som stiller indikasjon for sykemelding, resepter og videre henvisninger og undersøkelser, gjør dette arbeidet. For pasienter som behandles langvarig (>8 uker) på sykehus/poliklinisk og hos fastlege parallelt, ivaretas sykemelding av fastlege når dette er hensiktsmessig for pasienten. I forbindelse med behandling på sykehus, f. eks. innleggelser og operasjoner, skriver sykehuslegen sykemelding – om nødvendig helt fram til første kontroll hos fastlege. Tidspunkt for kontrollen angis i epikrisen. Pasienten får ansvar for å bestille kontrolltimen.
Epikrisen skal gi informasjon om mulige bivirkninger og komplikasjoner som fastlegen bør være oppmerksom på. Spesielt er dette viktig under og etter immunterapi.
Vurdering av førerkort gjøres i samråd med spesialist og etter retningslinjer gitt i førerkortforskriften (https://www.helsedirektoratet.no/veiledere/forerkortveilederen). Vær spesielt oppmerksom på hjernemetastaser og bruk av smertestillende og beroligende medikamenter/sovemedisin.
Fastlegens rolle for pasienter som er i kontrollopplegg etter lungekreftbehandling
Sist faglig oppdatert: 31.10.2024
Handlingsprogrammet anbefaler at kontroll etter lungekreft skjer i regi av spesialisthelsetjenesten.
Se også kapittel 7.6 og kapittel 9.4.
Fastlegene vil med stor sannsynlighet ha kontakt med pasienten i denne tiden, dels på grunn av henvendelser for annen sykdom, dels på grunn av plager og spørsmål som angår kreftsykdommen.
Fastlegens rolle for pasienter som har avsluttet oppfølging for lungekreft på sykehus
Sist faglig oppdatert: 31.10.2024
Kontroll i sykehus etter lungekreftbehandling skjer gjennom flere år. Fordi lungekreft har høy mortalitet, er det få lungekreftpasienter som blir kreftfrie og avslutter oppfølging i spesialisthelsetjenesten. For de pasientene det gjelder, er fastlegen imidlertid viktig i videre medisinsk oppfølging, blant annet ved å
- Behandle redusert lungefunksjon og respirasjonssvikt etter kirurgiske behandling
- Behandle eventuell KOLS
- Motivere/opprettholde motivasjon for røykestopp.
- Behandle smerter etter lungekirurgi
- Behandle infeksjoner.
- Følge opp senskader etter behandling (blant annet nevropati), utmattelse og andre senplager.
- Følge opp med pneumokokk-, korona- og influensavaksine.
- Disse vaksinene gis etter Folkehelseinstituttets anbefalinger. Influensa- og konronavaksine kan gis under cellegiftbehandling, men bør trolig settes siste uken før ny cellegift-infusjon for å unngå nadir-perioden. Pneumokokkvaksine settes hvert 10. år, og bør for å få maksimal effekt settes før eller etter en periode med cellegiftbehandling. Utfra foreliggende data kan vaksinering gjøres med vanlig effekt, og uten mer bivirkninger, samtidig med pågående immunterapi (Wijn et al., 2018)
- Bistå i rehabilitering og oppmuntre til egentrening.
- Bistå med eventuell sykemelding/friskmeldingsprosess.
- Fange opp symptom på tilbakefall og/eller spredning og henvise til nytt pakkeforløp
Mange lungekreftpasienter avslutter aktiv behandling og kontroll på sykehus fordi sykdommen har kommet over i palliativ fase. Se kapittel 15.
Fastlegens rolle for overlevere etter lungekreft
Sist faglig oppdatert: 31.10.2024
Lungekreft har høy mortalitet og høy residivrate. De fleste residiv kommer innen fire år etter behandlingen, med en topp etter 9 måneder og ved slutten av andre og fjerde år, men om lag 10 % av residivene kommer opptil fem år eller senere. Det er også en viss risiko for utvikling av ny, primær lungekreft. Dette medfører at overlevere etter lungekreftbehandling, i tillegg til senfølger av behandling, må leve med en betydelig øket risiko for tilbakefall og/eller spredning av lungekreft.
De vanligste senfølger av lungekreftbehandling er dyspné og redusert lungefunksjon etter kirurgi, smerter i brystkassen, parestesier etter cellegiftbehandling og asteni. Fastlegen må behandle og følge opp disse.
Lenke til Generelt kapittel: Fastlegens rolle i oppfølging av kreftoverlevere
Lenke til senkomplikasjoner: Seneffekter etter kreftbehandling og Nasjonal kompetansetjeneste for seneffekter etter kreftbehandling ved Oslo universitetssykehus.
Fastlegens rolle ved tilbakefall og spredning av lungekreft
Sist faglig oppdatert: 31.10.2024
Rehenvise til pakkeforløp. Samme symptomer som førstegangs – presentasjon.
Se også kapittel 6.2.
Fastlegens håndtering tilpasses pasientens situasjon i kreftforløpet: For pasienter som er under oppfølging på sykehus, kontaktes avdelingen der oppfølgingen foregår. Dersom pasienten har avsluttet oppfølging på sykehus, henvises til nytt pakkeforløp.
Fastlegens arbeid med palliasjon og omsorg ved livets slutt for lungekreftpasienter
Sist faglig oppdatert: 31.10.2024
Mange lungekreftpasienter har langt fremskreden kreftsykdom når diagnosen stilles. Om lag 70 % av alle pasienter med lungekreft blir diagnostisert i et sykdomsstadium der kurativ behandling ikke er mulig, enten på grunn av stadium IV (40 %) eller i tidligere stadier med negative prognostiske faktorer (30 %). Dette betyr at mange lungekreftpasienter dør av sin kreftsykdom, og mange gjennomgår en palliativ fase av ulik varighet i sykdommen. I denne fasen mottar mange pasienter behandling på sykehus, dels for symptomlindring, dels for livsforlengelse og dels på grunn av livstruende komplikasjoner. Oppfølging fra palliativt team på lokalsykehus anbefales, fastlege kan henvise dersom det ikke er gjort fra spesialist. Parallelt følges pasientene av fastlege og øvrig kommunehelsetjeneste.
Se også kapittel 15.
Palliasjon og omsorg ved livets slutt for lungekreftpasienter må for øvrig tilpasses den enkeltes kliniske situasjon og hva som er størst utfordring. Dyspné og respirasjonssvikt kan være utfordrende å lindre på en god måte.
Se også kapittelet Fastlegens arbeid og ansvar ved lungekreft, mesoteliom og thymom
Pakkeforløp for kreft
Sist faglig oppdatert: 31.10.2024
Fra 1. januar 2015 ble Pakkeforløp for lungekreft innført.
Om pakkeforløp for lungekreft
Sist faglig oppdatert: 31.10.2024
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er et standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Les mer om Pakkeforløp for lungekreft
Det er egne Diagnoseveiledere for inngang til pakkeforløp for kreft.
Pakkeforløp hjem for pasienter med kreft
Sist faglig oppdatert: 31.10.2024
Pakkeforløp hjem for pasienter med kreft skal bidra til å sikre god struktur og logistikk i helsetjenesten, samt sikre trygghet og forutsigbarhet for personer som lever med kreft eller etter endt kreftbehandling.
Diagnostikk og utredning
Hensikt
Sist faglig oppdatert: 31.10.2024
Handlingsprogrammet er en veileder for helsepersonell som utreder tilstander hvor anamnese og/eller funn gir mistanke om lungekreft. Målsetningen er å stille en diagnose raskt og effektivt og mest mulig skånsomt for pasienten.
Presentasjonsformer
Sist faglig oppdatert: 31.10.2024
Lungekreft mistenkes og bør utredes om ett eller flere punkter under er tilstede. Samtidig røykeanamnese og alder over 40 år øker risikoen, og styrker mistanken.
- Patologisk bildefunn: på røntgen toraks eller CT, hvor bilder ofte er tatt på annen indikasjon enn symptomer fra lunge/luftveier. Typiske funn er oppfyllinger i lunger/hili/mediastinum og pleuravæske. Funn av små flekker, noduli, er beskrevet i eget avsnitt (se Pulmonale noduli).
- Symptomer forårsaket av tumors lokalisasjon i lunge / luftveier – eksempelvis ny eller endret hoste, tungpust og/eller ekspektorat. Andre symptomer kan være hemoptyse, sentrale eller perifere brystsmerter, tilbakevendende nedre luftveisinfeksjoner, heshet eller vena cava superior-syndrom. Listen er ikke utfyllende.
- Symptomer fra metastaser torakalt eller ekstratorakalt – eksempelvis symptomer fra skjelett, lever, binyrer, hjerne, ryggmarg, lymfeknuter. Metastaser trenger ikke nødvendigvis gi symptomer, og de kan være påvist tilfeldig ved bildediagnostikk eller klinisk undersøkelse.
- Paraneoplastiske fenomener som allmennsymptomene fatigue, anoreksi, vekttap og/eller nattesvette. Mer spesifikke paraneoplastiske fenomener (ses særlig, men ikke bare, ved småcellet lungekreft) – SIADH (syndrome of inappropriate ADH secretion), økt ACTH-sekresjon, hyperkalsemi, tromboemboli, nevropsykiatriske- og nevromuskulære fenomener (Upadhya, Ananthraju, Vadala, & Mohanty Mohapatra, 2021).
Oversikt utredning av lungekreft i spesialisthelsetjenesten
Sist faglig oppdatert: 31.10.2024
Utredningen må være tilstrekkelig omfattende til å gi svar på følgende fem punkter:
- Histologisk diagnose inkludert subgruppe og aktuelle mutasjoner (Histopatologisk diagnostikk)
- Utbredelse av sykdommen med klinisk TNM (cTNM)- og klinisk stadium (avsnitt "Utbredelse av sykdommen - prinsipper")
- Pasientens funksjonsnivå (avsnitt "Pasientens funksjonsnivå")
- Eventuell komorbiditet som kan påvirke behandlingsvalg og -mulighet (avsnitt "Utredning av komorbiditet")
- Pasientens ønske
Rekkefølge i utredningen
Ved mistanke om lungekreft skal utredning i spesialisthelsetjenesten starte med CT toraks og øvre abdomen utført med intravenøs kontrast (hvis ikke allerede tatt før henvisning). Videre utredning planlegges ut fra bildefunn, pasientens symptomer og de kliniske funn. Når utredningen er ferdig bør pasienten diskuteres i et multidisiplinært møte for valg av behandling (se Multidisiplinært team (MDT) - møte).
Første vurdering av pasienten
Anamnesen skal inneholde opplysninger om symptomer, eksponering for kreftfremkallende stoffer og eventuell komorbiditet. Ved mistanke om yrkesrelatert kreftsykdom bør pasienten henvises til arbeidsmedisinsk vurdering. Røykeanamnesen bør inneholde mengde og varighet (pakkeår). Komorbiditet som kan påvirke behandling av lungekreft utredes parallelt med kreftsykdommen. Dette gjelder spesielt (mistenkte) sykdommer i lunge, hjerte, nyrer og annen kreftsykdom. Pasientens sosiale forhold og egne tanker/ønsker rundt aktuell sykdom og evt. behandling bør også kartlegges.
Klinisk undersøkelse styres av symptomer og (mistanke om) komorbiditet, men må minimum inkludere lunge, toraks, hjerte, abdomen, collum og hud for å avdekke eventuelle metastaser.
Funksjonsstatus graderes i henhold til ECOG-reglene (se avsnitt "Pasientens funksjonsnivå").
Histologisk og/eller cytologisk diagnose – prinsipper
Generelt velges den lesjonen som er enklest å nå, og om mulig, gir mest opplysninger om utbredelse (ofte en metastase). Uansett, viktig å få nok materiale til at det kan bestemmes histologisk undertype og mutasjonsprofil.
Bronkoskopi er indisert ved sentrale lesjoner (se avsnitt om bronkoskopi i Utfyllende informasjon om utredning av lungekreft)
EBUS (EUS) er indisert ved kartlegging av lymfeknuter i hilus og mediastinum (se avsnitt om Endobronkial ultralyd (EBUS) i Utfyllende informasjon om utredning av lungekreft)
CT-veiledet biopsi er indisert ved svulster som ikke kan nås ved bronkoskopi, med eller uten radial EBUS (se avsnitt om CT- og ultralydveiledet veiledet biopsi av primærtumor i Utfyllende informasjon om utredning av lungekreft)
Ultralydveiledet biopsi er indisert ved perifere lunge lesjoner som ligger inntil brystveggen (se avsnitt om CT- og ultralydveiledet veiledet biopsi av primærtumor i Utfyllende informasjon om utredning av lungekreft)
Pleuravæske må alltid avklares med cytologisk og biokjemisk prøvetaking (se avsnitt Pleuravæskeanalyse i Utfyllende informasjon om utredning av lungekreft)
Metastaser (pleura, skjelett, hud, lever, binyrer, hjerne) undersøkes bare i den grad de er avgjørende for å bestemme utbredelsen av sykdommen og dermed valg av behandling.
En suspekt metastatisk lesjon som kan få avgjørende terapeutisk konsekvens anbefales avklart cytologisk/histologisk og/eller med supplerende bildediagnostikk for å styrke eller redusere mistanken om metastase. En singel metastase til f.eks. hjerne eller binyre trenger ikke utelukke kurativ tilnærming.
Utbredelse av sykdommen - prinsipper
For å bestemme utbredelsen er det først og fremst bildediagnostikk, eventuelt supplert med vevs- eller celleprøve, som er avgjørende. Utbredelsen angis etter reglene i gjeldende utgave av TNM (se avsnitt 1.6)
- CT toraks og øvre abdomen med kontrast er standard og utgangspunkt for all annen utredning. Se nærmere avsnitt CT toraks og øvre abdomen i Utfyllende informasjon om utredning av lungekreft.
- PET/CT er indisert for pasienter som etter CT-funn er aktuelle for potensielt kurativ behandling samt pasienter med oligometaster. Se nærmere avsnitt PET/CT i Utfyllende informasjon om utredning av lungekreft
- MR caput er aktuelt ved symptomer og vurderes i tillegg når funn av hjernemetastaser kan bli avgjørende for behandlingsvalg. Eksempelvis ved tentativt stadium III som vurderes for kurativ behandling, hos pasienter med SCLC, og ved adenokarsinom i stadium IV som er aktuelle for målrettet behandling. Se nærmere avsnitt MR-undersøkelser i Utfyllende informasjon om utredning av lungekreft
- EBUS (±EUS) er indisert ved mistanke om spredning til hilære eller mediastinale lymfeknuter hvor funnet er avgjørende for å kunne ta stilling til kirurgi (med eller uten neoadjuvant behandling). Også aktuelt ved stillingtaken til stereotaksi av primærtumor. Se nærmere avsnitt Endobronkial ultralyd (EBUS) i Utfyllende informasjon om utredning av lungekreft.
- Supplerende bildediagnostikk kan være aktuelt ved symptomer på innvekst i plexus brachialis (Pancoast tumor), toraksvegg, hjerte eller ryggrad hvor funnet er avgjørende for valg av behandling. Se nærmere avsnitt MR-undersøkelser og CT-undersøkelser utover CT toraks og øvre abdomen i Utfyllende informasjon om utredning av lungekreft.
Pasientens funksjonsnivå
Pasientens funksjonsstatus beskrives i henhold til et standardisert klassifikasjonssystem. I Norge brukes ECOG (Eastern Cooperative Oncology Group) -klassifikasjonen som vist i tabellen under.
Grad | ECOG – Performance status |
|---|---|
0 | I stand til å utføre enhver normal aktivitet uten begrensning |
1 | Ikke i stand til fysisk krevenede aktivitet, men oppegående og i stand til å utføre lett arbeid |
2 | Oppegående og i stand til all egenpleie, men ikke i stand til noe arbeid; oppe og i bevegelse mer enn 50 % av våken tid |
3 | Bare i stand til begrenset egenpleie; bundet til seng eller sto mer enn 50 % av våken tid |
4 | Helt hjelpetrengende; klarer ikke noen egenpleie; helt bundet til seng eller stol |
5 | Død |
Utredning av komorbiditet
Vurdering av lungefunksjonen i form av forsert spirometri og gassutveksling anbefales hos alle pasienter (se avsnitt om Lungefunksjonsundersøkelser i Utfyllende informasjon om utredning av lungekreft).
Vurdering av hjertefunksjonen er aktuelt før kirurgi, stråling og behandling med hjertetoksiske medikamenter (se avsnitt om Lungefunksjonsundersøkelser i Utfyllende informasjon om utredning av lungekreft).
Annen komorbiditet som kan få innvirkning på valg av behandling anbefales også utredet før behandlingsbeslutning.
Skjematisk oppsummering av utredningen
- Hvis initial CT og klinikk gir mistanke om begrenset eller lokalisert sykdom (antatt stadium I-III) og pasienten er potensielt aktuell for kurativ behandling er PET/CT sterkt anbefalt for å minske risikoen for å overse metastaser.
- Hvis CT og/eller klinikk viser ekstratorakal sykdom, pleurametastaser, pleuravæske eller kontralaterale lungemetastaser, er pasienten uaktuell for kurativ behandling (med unntak av solitære binyre- og hjernemetastaser). Det neste skritt er da å ta en biopsi av den best tilgjengelige lesjonen. Ofte vil det mest effektive være å ta biopsi av en metastase (diagnostikk og stadium i ett). PET/CT vil sjelden bidra med avgjørende tilleggsopplysninger hos disse pasientene.
- Ventetid på PET/CT bør ikke forsinke videre diagnostikk unødig. Ved lang ventetid kan man ta utgangspunkt i funnene på CT toraks og øvre abdomen for valg av beste sted å ta biopsi og/eller cytologi.
- Biopsi av primærlesjon (T) er aktuelt hvis det ikke er mistanke om spredning til lokale lymfeknuter (N+) eller når T ligger enklest tilgjengelig for diagnostisk avklaring.
- Cytologi av hilære/mediastinale lymfeknuter (N) ved hjelp av EBUS eller EUS er aktuelt når det får avgjørende betydning for valg av behandling. Se Figur 9.
- I henhold til Helsedirektoratets anbefaling for tidsbruk bør en utredning i de fleste tilfeller være ferdig innen 21 kalenderdager (se kapittel 5). Tips: utredningen går raskere hvis man bestiller prosedyrer parallelt og ikke suksessivt.
Forslag til utredningsalgoritme:
Etter innledende CT toraks og øvre abdomen med i.v. kontrast og en klinisk vurdering av om pasienten er tjent med videre utredning, foreslås det å dele pasientene inn i fire undergrupper som vist i figuren. Neste trinn vil være å vurdere hvor biopsi/cytologi enklest tas (ikke vist i figuren), bestille PET/CT og eventuell EBUS og MR caput. Rekkefølgen bestemmes i det enkelte tilfellet, men PET/CT anbefales før EBUS. Individuelle forhold skal alltid vektlegges. Modellen er et forslag og ikke en absolutt fasit. Tanken er også at man utreder mest mulig parallelt, altså at alle aktuelle undersøkelser bestilles når svaret på den innledende diagnostiske CT toraks med øvre abdomen foreligger. Figuren tar heller ikke inn i seg biopsering av primærtumor og/eller metastaser.
Begrunnelse for algoritmen:
- Gruppe 1 til venstre: Sjansen for å få finne okkulte metastaser i lokale lymfeknuter er <6% (Leong, Loveland, Gorelik, Irving, & Steinfort, 2019) og for å finne okkulte hjernemetastaser <1-4% hvorfor EBUS og MR caput ikke anbefales (Kim et al., 2020; Yang et al., 2019).
- Gruppe 2 fra venstre: EBUS anbefales dels fordi sjansen for å påvise N2/N3 ved antatt N1 er i prospektive studier vist å være rundt 20% (Leong et al., 2019), dels for å bekrefte/avkrefte funn på CT og PET med tanke på å avgjøre om pasienten skal kunne tilbys kirurgi (endelig N0-1(2)) og om neoadjuvant behandling er aktuelt (N1-2). MR caput bør vurderes spesielt i stadium III, da sjansen for å finne okkulte metastaser i initialt antatt stadium III i enkelte studier er vist å være opptil 23%, mens ved initialt antatt stadium II er tilsvarende tall 9% - dog en asiatisk studie, med høy andel aldri-røykere med EGFR-/ALK-positiv sykdom (Yang et al., 2019). I et norsk upublisert materiale (opererte ved OUS-Rikshospitalet i perioden 2006-2018) utviklet 13,8% av opererte lungekreftpasienter i stadium II (n=280) hjernemetastaser, etter median 15,6 mndr. Kun 1,8% fikk påvist hjernemetastaser første halvår etter operasjonen.
- Gruppe 3 fra venstre: EBUS anbefales for å bekrefte/avkrefte N3 sykdom hvis tvil om suspekte funn på CT og/eller PET kan skyldes reaktive lymfeknuter/annen sykdom. MR caput er viktig for å utelukke mistenkte og/eller okkulte hjernemetastaser da dette vil gjøre pasienten uaktuell for behandling med kurativ intensjon.
- Gruppe 4 fra venstre: Ved suspekt utbredt sykdom vil EBUS sjelden gi tilleggsinformasjon. Unntak er de tilfellene hvor EBUS utføres for enklest mulig å framskaffe cytologisk materiale til patologisk diagnose. MR caput anbefales da hjernemetastaser forekommer hos 27% av norske pasienter med multiple metastaser (M1c) (Nasjonalt kvalitetsregister for lungekreft)
Multidisiplinært team (MDT) - møte
Sist faglig oppdatert: 31.10.2024
Når utredningen er fullført bør pasienten fortrinnsvis diskuteres i et multidisiplinært møte for valg av behandling. Det er ikke definert hvilke spesialiteter som minimum må delta på et MDT-møte, men det bør inkludere leger som har erfaring med utredning og behandling av lungekreftpasienter (eksempelvis lungelege, radiolog, onkolog, patolog). Pasienter som er antatt aktuelle for kurativ behandling, klinisk stadium I-III, skal som hovedregel tas opp ved et regionalt MDT-møte hvor følgende spesialiteter må delta: toraksradiolog, lungelege, torakskirurg, onkolog, og hvor nukleærmedisiner og patolog i tillegg anbefales å delta. Bakgrunnen for å diskutere pasienter med antatt kurabel sykdom på regionalt MDT-møte er å sikre bred tverrfaglig vurdering og dermed korrekt behandling.
Til regionalt MDT-møte må det foreligge:
- Diagnostisk CT toraks og øvre abdomen tatt med i.v. kontrast, maksimalt fire uker gammel, med skriftlig besvarelse.
- PET/CT med skriftlig besvarelse
- MR caput med skriftlig besvarelse, for aktuelle pasienter
- Spirometri og gassdiffusjonstest
- Operabilitetsvurdering ved N0-N2 sykdom
- Skriftlig svar på all histologi og/eller cytologi inkludert minimum PD-L1-, EGFR- og ALK-analyser (evt positivt KRAS-svar som erstatning for EGFR/ALK)
- ECOG-status
- Informasjon om komorbiditet, og spesielt kontraindikasjoner for kjemoimmunterapi dersom det er aktuell behandling
- Informasjon om pasientens preferanser
Referat fra MDT-møte skal som et minimum inneholde hvem som deltar, sykehistorie, funn i form av en oppsummering av utredningen, cTNM og stadium, ECOG-status, pasientens ønsker samt begrunnet behandlingsvalg.
Resultatet av utredningen meldes samtidig til Kreftregisteret i eget elektronisk meldeskjema.
Utfyllende informasjon om utredning av lungekreft
Sist faglig oppdatert: 31.10.2024
CT toraks og øvre abdomen
CT toraks og øvre abdomen med intravenøst kontrastmiddel utføres hos alle pasienter med mistenkt lungekreft som er aktuelle for behandling.
Undersøkelsen utføres før bronkoskopi og annen prøvetaking for cytologisk/histologisk diagnostikk. Ved begrunnet mistanke om lungekreft bør ventetiden på CT ikke være mer enn noen få dager. Hos disse pasientene vil nytten av røntgen toraks primært være å kunne planlegge CT best mulig, for eksempel ved å påvise pleuravæske som med fordel kan tappes før CT.
Anbefalt CT-protokoll CT toraks og øvre abdomen
- Peroral kontrast: 0,5 l vann peroralt 15-30 minutter før undersøkelsen.
- Intravenøst kontrastmiddel: 2 ml/kg (ved konsentrasjon 350 mg I/ml), injeksjonshastighet 4 ml/s.Kontrastmengden kan justeres til 1,5 ml/kg ved overvekt og 2,5 ml/kg for atleter.
- Forsinkelse: Scan startes ca 85 sekunder etter påbegynt kontrastmiddelinjeksjon (gir portovenøs fase).Eksempel: 80 kg pasient får 160 ml kontrast med hastighet 4 ml/s i løpet av 40 sekunder. Bildeopptak starter da 45 sekunder etter all kontrast har blitt injisert
- Scanområde: Fra krikoidbrusken og forbi høyre leverspiss.
- Rekonstruksjoner:
- Aksial-, koronal- og sagittalplan med snittykkelse 2-3 mm i bløtdelsalgoritme
- Aksial serie over lungene med snittykkelse 0,6-1 mm i lunge og bløtdelsalgoritme
- MIP i koronarplan og/eller aksialplan
- + eventuelt ytterligere rekonstruksjoner / CAD i henhold til lokal rutine
Kommentar:
En venøs kontrastfase over toraks er fordelaktig for vurdering av sykdomsstadium og da spesielt for identifisering av henfall i lymfeknuter samt affeksjon av toraksvegg og venøse strukturer (Larici et al., 2021). Anbefalt protokoll gir også kontrastfremstilling av arterier, et bedre skille mellom tumor og atelektase, en bedre framstilling av pleura samt en bedre framstilling av supraklavikularregionen. Protokollen sparer også 1/3 av stråledosen sammenlignet med separate undersøkelser av toraks og øvre abdomen. Forutsatt venøs fremstilling i toraks og abdomen kan undersøkelsen alternativt utføres med testbolus eller «bolustracking».
Beskrivelse av CT toraks og øvre abdomen
Beskrivelsen fokuseres på de forhold som har betydning for stadieinndeling i henhold til gjeldende TNM-utgave.
Følgende bør beskrives:
- Størrelse, morfologi og beliggenhet av tumor samt eventuell affeksjon av nabostrukturer
- Mistanke om patologiske lymfeknuter med angivelse av størrelse i mm og stasjonsnummer
- Effusjon i pleura eller perikard
- Metastasesuspekte forandringer
- Usikre funn hvor det er indikasjon for ytterligere bildediagnostikk
- Komorbiditet som kan ha betydning for videre utredning / operabilitet
- Ved høy mistanke om primær lungecancer: anbefales det å anslå en tentativ TNM (den endelige cTNM settes på MDT-møtet når all utredning er ferdig)
Kommentar:
Den lengste diameteren av den solide tumorkomponenten målt i lungevindu, uavhengig av plan, er avgjørende for T-stadium (obs dette skiller seg fra målinger gjort ved funn av tilfeldige noduli, se pkt 1.7). Unntak er rene mattglasslesjoner som måler >30mm, disse angis som T1a. Spikulering og postobstruktive atelektaser skal ikke være en del av rapportert størrelse, men beskrives. Tetthet av tumor (solid / delvis solid / mattglass) beskrives og, når relevant, størrelsen på mattglasskomponenten.
Vurderingen av affeksjon av nabostrukturer og da spesielt innvekst i pleura (T2), mediastinum (T4) og toraksvegg (T3) kan være vanskelig på CT, men et sikkert funn er eksempelvis destruksjon av costa. Ved usikkerhet om innvekst velges alltid laveste aktuelle T-kategori.
Lymfeknuter rapporteres med kortaksemål med lokalisasjon i henhold til IASLC Lymph Node Map (se Figur 11) (El-Sherief, Lau, Carter, & Wu, 2018). Patologisk forstørrede lymfeknuter er generelt definert som kortaksediameter >10 mm. CT har en begrenset verdi for å skille mellom maligne og benigne lymfeknuter med en sensitivitet på ca 55% og spesifisitet på ca 81% (Silvestri et al., 2013), her har funn ved PET/CT/EBUS en sentral rolle.
Ved histologisk verifisert primær lungecancer bør CT-beskrivelsen inneholde en tentativ TNM. Ved tvil om riktig T eller N verdi brukes laveste (minst avanserte) kategori. Om en eller flere av kategoriene, som eksempelvis en lymfeknute, er radiologisk usikker kan dette beskrives «tentativ T3NxM0» eller «antatt benign lymfeknute i venstre hilus tentativt T3N0M0».
Undersøkelsen bør beskrives i løpet av to virkedager.
PET/CT
Generelle betraktninger
Positron emisjonstomografi (PET) med [18F]-fluoro-2-deoxy-glucose (FDG) kombinert med CT er en grunnleggende undersøkelse ved utredning av lungekreft. PET kan kombineres med lavdose CT, diagnostisk CT med eller uten intravenøs kontrast, og en kan supplere med egen serie av toraks i full inspirasjon. Grad av FDG-opptak, målt i «standardized uptake value (SUV)» gjenspeiler cellenes metabolske aktivitet i form av økt glukoseforbruk. De fleste maligne svulster i lungeparenkymet demonstrerer økt opptak av FDG med noen unntak (se "Vurdering av T-stadium"). Vev med fysiologisk høyt glukoseforbruk kan eksempelvis være hjerne, hjerte, gastrointestinaltraktus og muskulatur under/etter aktivitet. FDG utskilles primært via urinveiene (Kandathil & Subramaniam, 2022).
FDG er ikke en malignitetsspesifikk tracer og det er mange andre tilstander som kan gi økt opptak, eksempelvis infeksjoner, inflammasjoner eller benigne lesjoner. Det er derfor viktig å ha lav terskel for avklaring av «PET-positive» funn. Videre er det også mange faktorer som kan ha innvirkning på graden av opptak som kan bidra til en underestimering eller overestimering av graden av opptak.
Dersom tilgjengelig bør det tilstrebes å utføre respirasjonstrigget FDG-PET for å unngå effekten av pusteartefakter på opptaket i lesjoner. Dette er spesielt viktig for små lesjoner (<10 mm), og lesjoner som ligger i midtre/basale deler av lungene eller i lever. Nåværende (2017) Fleischner retningslinjer anbefaler FDG-PET for tilfeldig påvist solid pulmonal nodulus (SPN) > 8 mm (eller delvis solide lesjoner med solid komponent > 8 mm), mens nåværende (2015) British Thoracic Society (BTS) retningslinjer har samme størrelseskriterium, men inkorporerer en risikostratifisering før vurdering med FDG-PET. (Callister et al., 2015; MacMahon et al., 2017). American College of Chest Physicians (AACP) anbefaler FDG-PET hos personer med lav – moderat pre-test sannsynlighet (5 – 65%) for lungekreft med «indeterminate SPN» på CT, men disse krever minst to års oppfølging med CT for å bekrefte at det ikke foreligger malignitet dersom FDG-PET ikke demonstrerer økt opptak. For personer med samme kriterier, men med veldig lav risiko (< 5%) anbefales ikke FDG-PET for karakterisering (Gould et al., 2013). I SPUTNIK-studien var anbefalingen å vurdere opptaket i forhold til størrelsen av lesjonen, dvs. de senket kriteriet for malign/benign i mindre noduli da det er kjent at disse kan ha underestimert opptak (Weir-McCall et al., 2021). Generelt vil underestimeringen av opptaket være mer sannsynlig jo mindre lesjonen er. En må derfor ta med andre parametere enn kun opptak i vurderingen, slik som størrelse, morfologi, veksthastighet, og tetthet på CT (Kandathil & Subramaniam, 2022; Rogasch et al., 2022).
Den skriftlige rapporten fra PET-undersøkelsen skal inneholde en kvalitativ vurdering av opptaket i forhold til opptaket i blod, lever og cerebral korteks, samt en vurdering av sannsynlighet for malignitet basert på en 5-punkts Likertskala. Om en lesjon er malign eller ikke er en sammensatt vurdering og kan ikke bare baseres på økt opptak. Vurderingen bør være i tett samarbeid med radiolog. I mange studier benyttes enten opptak over blodbakgrunn, opptak over leverbakgrunn eller SUVmax >2.5 som definisjon på malignitet. I en klinisk hverdag benyttes ikke SUV-parametere for å definere malignitet.
Vurdering av T-stadium
For vurdering av T-stadium benyttes CT (som beskrevet i avsnitt "CT toraks og øvre abdomen"). FDG PET vil ofte underestimere tumorvolum, men kan bidra med å skille metabolsk aktivt tumorvolum fra atelektase og nekrose. Dette er nyttig ved perkutan biopsi og ved inntegning av strålefelt.
Flere studier har demonstrert varierende grad av opptak i primærtumor på bakgrunn av histologisk undertype. Plateepitelkarsinom har som regel høyt opptak på nivå med cerebral korteks. Visse subtyper av adenokarsinom har opptak mellom blod og lever, eller lavere slik som ved lepidisk vekstmønster (Lococo et al., 2022). Mucinøse adenokarsinomer har ofte lavt opptak men kan noen ganger ha høyt opptak på nivå med platepitelkarsinomer (Suárez-Piñera et al., 2018).
Småcellet karsinom (SCLC) og storcellet karsinom (LCNEC) har som regel høyt opptak på nivå som plateepitelkarsinomer.
Karsinoider har oftest lavt opptak men kan også helt mangle FDG-opptak, noe som gjør det vanskelig å skille dem fra benigne svulster, eksempelvis hamartomer (Dam et al., 2023; Tatcı, Özmen, Öztürk, & Demirağ, 2021).
Vurdering av N-stadium
FDG PET øker sensitiviteten og spesifisiteten i forhold til CT alene med tanke på diagnostikk av lymfeknutemetastaser i mediastinum. Sensitiviteten og spesifisiteten i forskjellige studier er ganske sprikende dels på grunn av forskjellige definisjoner av malign/ikke-malign (se tidligere avsnitt), og i hvilken grad tuberkulose er endemisk i landet hvor studien er utført. I nyere metaanalyser er sensitivitet og spesifisitet funnet å ligge på henholdsvis 77% og 86%. Men samtidig er den falsk negative og falsk positive andelen vist å være henholdsvis 7%-16% og 45%-48%. En annen studie fant at ved PET N0 sykdom var andelen okkult N1 sykdom 8% og N2 sykdom 10% (Dunne, Fick, & Jones, 2023). I nåværende retningslinjer fra European Society of Thoracic Surgeons/European Society for Medical Oncology (ESTS/ESMO) defineres «PET-positive» lymfeknuter som de med opptak over blodbakgrunn, og dermed er EBUS/EUS anbefalingene for verifisering basert på dette. For å øke sensitiviteten og spesifisiteten for deteksjon av mediastinale lymfeknutemetastaser har flere studier sett på andre prediktorer for okkulte N2-knuter slik som tumorhistologi, tumors differensieringsgrad, tumorstørrelse, tumoropptak på FDG PET, beliggenhet i lungeparenchymet, opptak i lymfeknuten på FDG PET og/eller størrelse på lymfeknuten på CT, uten at det foreligger overbevisende data for den ene eller andre parameteren. Generelt har FDG PET en høy negativ prediktiv verdi for å utelukke lymfeknutemetastaser, mens den positive prediktive verdien for å påvise lymfeknutemetastaser er lavere, da det ikke er like lett å skille mellom inflammatoriske og neoplastiske lymfeknuter. (Al-Ibraheem et al., 2021; Damirov, Büsing, et al., 2023; Damirov, Stoleriu, et al., 2023; X. Liao et al., 2023; Owens, Hindocha, Lee, Millard, & Sharma, 2023; Rogasch et al., 2021; Seol, Kim, & Kim, 2021).
I løpet av de siste årene har det kommet flere studier som diskuterer nytteverdien av FDG PET ved primære subsolide lesjoner < 3 cm. Lavt opptak i primærtumor gjør det vanskelig å skille mellom inflammasjon og malignitet spesielt der hvor det ikke foreligger noen observasjonstid. Videre er det en lav forekomst av okkulte lymfeknutemetastaser hos disse pasientene i tillegg til at lavt opptak i primærtumor gir en lavere sensitivitet for deteksjon av lymfeknutemetastaser. Således vil FDG-PET i disse tilfellene ikke kunne bidra til å avklare N-stadium før kurativ behandling. For pasienter med ren mattglassfortetning eller klinisk stadium IA med perifer tumor uten øvrige malignitetssuspekte funn på CT skriver American College of Chest Physicians (AACP) i sine retningslinjer at disse pasientene ikke trenger FDG PET før kurativ behandling. Samtidig anbefaler en konsensusuttalelse fra American Association for Thoracic Surgery (AATS) FDG PET for alle pasienter med nydiagnostisert lungekreft. Man må derfor avvente større studier og/eller oppdaterte ESTS/ESMO-retningslinjer for endelig avklaring om hvordan FDG PET bør inngå i utredning av subsolide lesjoner. I mellomtiden anbefales å gjøre PET/CT rutinemessig på alle med tentativ kurabel sykdom, med unntak av rene mattglasslesjoner (Kidane et al., 2023; Lococo et al., 2022; Pencharz et al., 2022; Y. J. Suh et al., 2020).
Vurdering av M-stadium
For utredning av fjernmetastaser (M-status) bidrar FDG PET signifikant i forhold til CT og øker sjansen for å finne metastaser. Dette er en av grunnene til at FDG PET/CT anbefales ved utredning av alle pasienter som i utgangspunktet er oppfattet å ha kurabel lungekreft. Ved erkjent stadium IV kreft gir den lite tilleggsinformasjon som vil påvirke behandlingsvalg.
Sensitiviteten og spesifisiteten er høy for påvisning av lunge-, pleura-, binyre-, lever- og benmargsmetastaser. For benmargsmetastaser øker den positive prediktive verdien signifikant dersom det foreligger korresponderende funn ved CT, men sannsynligheten er fortsatt høy ved manglende osteoblastisk reaksjon i/omkring metastasen. Skjelettscintigrafi har ingen rutinemessig plass i utredningen av skjelettmetastaser da PET/CT har høyere sensitivitet og spesifisitet. På grunn av høyt fysiologisk opptak i hjernevevet er sensitiviteten lav for deteksjon av hjernemetastaser og MR caput er derfor førstevalget ved utredning med tanke på dette (Chakrabarty, Mahajan, Patil, Noronha, & Prabhash, 2023). Noen ganger kan en dog oppdage hjernemetastaser ved FDG PET på grunn av manglende opptak i et større område med ødem omkring en hjernemetastase (Kandathil & Subramaniam, 2022; Owens et al., 2023).
PET/CT ved karsinoider
Nyere studier har demonstrert opptak ved FDG PET i opptil 93% av typiske karsinoider og 96% av atypiske karsinoider hvorfor FDG PET anbefales også i utredningen av karsinoider. Ved mistanke om karsinoid på CT kan en imidlertid vurdere somatostatinreseptor (SSR) avbildning med [68Ga]Ga-DOTA-TOC som førstevalg fremfor FDG PET i utredningen. Sammen med [68Ga]Ga-DOTA-TATE eller [64Cu]Cu-DOTA-TATE omtales [68Ga]Ga-DOTA-TOC som SSR PET. SSR PET har en høy sensitivitet og spesifisitet for karsinoider, men kan ikke skille mellom typiske- eller atypiske karsinoider. Typiske karsinoider har vanligvis høyere opptak ved SSR PET enn atypiske karsinoider, mens atypiske karsinoider vanligvis har høyere opptak ved FDG PET enn typiske karsinoider. Dette fordi at etter hvert som karsinoider de-differensierer så mister de ekspresjon av somatostatinreseptorer på celleoverflaten som gjør at opptaket ved SSR-PET blir lavere og opptaket ved FDG PET blir høyere pga. økt glukoseforbruk
Er FDG PET utført før histologisk bekreftelse av karsinoid anbefales supplement med SSR PET pre-operativt (dersom mulig) eller post-operativt. Ifølge litteraturen påvises metastaser utenfor toraks i ca. 10% av pasienter med karsinoid og funn av metastaser har en behandlingsmessig konsekvens i ca. 25% av pasientene. Atypiske karsinoider har en høyere sannsynlighet for metastasering en typiske karsinoider. Det er manglende data på nytten av SSR PET ved små typiske karsinoider. Er SSR PET utført før histologisk diagnose foreligger bør FDG PET utføres i tillegg ved mistanke om atypisk karsinoid (Ki-67 >4-5%) eller dersom SSR PET ikke demonstrerer økt opptak i primærtumor.
På grunn av lav sensitivitet anbefales ikke konvensjonell somatostatinreseptorscintigrafi med oktreotidpreparater. Avbildning med både SSR PET og FDG PET anbefales også dersom pasienten er en kandidat for peptidreseptor radionuklideterapi (PRRT) (Baudin, Caplin, Garcia-Carbonero, Fazio, Ferolla, Filosso, Frilling, de Herder, Hörsch, Knigge, Korse, Lim, Lombard-Bohas, Pavel, Scoazec, Sundin, & Berruti, 2021; Dam et al., 2023; Grøndahl et al., 2019; Prosperi et al., 2023).
PET/CT i oppfølging av behandling
Rutinemessig oppfølging med FDG-PET under- eller etter gjennomgått behandling er ikke anbefalt. FDG PET kan bidra i tilfeller der CT er inkonklusiv, og må vurderes i hvert enkelt tilfelle. I disse tilfellene er det viktig at histologi fra tidligere lungekreft opplyses om i henvisningen på grunn av varierende opptak i primærtumor, som nevnt tidligere. I tillegg er det viktig å opplyse om type pågående behandling og hvilket intervall behandlingen gis slik at FDG-PET ikke blir tatt for tett opptil sist behandling. Generelt bør en ikke utføre FDG PET i løpet av de første tre til seks månedene etter stråleterapi med spørsmål om lokalt residiv da FDG-opptaket stort sett er høyt på grunn av inflammasjon. Trolig er også nytteverdien liten i løpet av de 12 første månedene dersom en tar i betraktning tidspunktet for utvikling av residiv, men dette er avhengig av initialt stadium. Etter stråleterapi kan det foreligge økt FDG-opptak på grunn av inflammasjon i bestrålte områder i opptil to år som må tas med i vurderingen av lokalt residiv med FDG-PET. For de pasientene som får immunterapi var det nylig (2022) publisert retningslinjer fra den europeiske nukleærmedisinske organisasjonen EANM som omtaler fordeler og ulemper med FDG PET ved responsevaluering hos disse pasientene. Kort fortalt foreligger det ingen spesifikk anbefalt metabolsk responskriterier, og problemet med inflammasjon er større på grunn av immunmedierte bivirkninger som kan gjøre tolkningen vanskelig (Castello, Rossi, & Lopci, 2020; Kandathil, Kay, Butt, Wachsmann, & Subramaniam, 2018).
PET/CT oppsummert
- FDG PET anbefales ved utredning av primær lungekreft der kurativ intensjon enten med kirurgi, stråleterapi eller kjemoradiasjon er til stede.
- FDG PET anbefales ved karakterisering av solide pulmonale noduli og delvis solide lesjoner med solid komponent. Sannsynlighet for underestimering av opptaket øker jo mindre størrelsen på lesjonen er.
- FDG PET er ikke anbefalt ved rene mattglasslesjoner, med unntak hvor lesjonen er > 30 mm (T1a) og pasienten utredes med tanke på kurativ behandling.
- SSR PET bør vurderes fremfor FDG PET ved mistanke om karsinoid på CT.
- SSR PET anbefales ved histologisk verifisert karsinoid.
- FDG PET bør vurderes ved atypisk karsinoid, Ki-67 ³ 10% eller dersom SSR-PET ikke demonstrerer økt opptak i primærtumor.
- Skjelettscintigrafi er underlegen FDG PET og har ingen rutinemessig plass i utredningen av benmargsmetastaser.
- FDG PET anbefales ikke rutinemessig i oppfølgingen etter behandling.
- FDG PET kan være nyttig ved vurdering av responsevaluering hvor CT er inkonklusiv, og ved residiv etter både kirurgi og stråleterapi.
MR-undersøkelser
- MR caput: Når det er indisert å utelukke cerebrale metastaser.Anbefales vurdert ved tentativt stadium II- IV NSCLC og alle SCLC. Lav terskel for øvrig ved suspekte CNS-symptomer. Forekomsten av okkulte hjernemetastaser kan være høy, spesielt i stadium III (B. Yang et al., 2019). Risikoen er størst hos pasienter med adenokarsinom (M. Kim et al., 2020). Spesielt viktig hos pasienter i stadium IV som er aktuelle for målrettet behandling. I stadium IV forekommer hjernemetastaser hos 29% av pasientene ved diagnosetidspunktet, både med og uten påvist spesifikke mutasjoner (EGFR og ROS 29%, KRAS 30% og ALK 35% (Chakrabarty et al., 2023; Gillespie et al., 2023; Schoenmaekers, Dingemans, & Hendriks, 2018), og tilsvarende tall er sett i Norge (Nasjonalt kvalitetsregister for lungekreft).
- MR lever: Uavklarte leverlesjoner som kan representere metastaser. Små (˂1 cm) lavtette lesjoner representerer mest sannsynlig benigne cyster også hos pasienter med kjent kreftsykdom (Schwartz, Gandras, Colangelo, Ercolani, & Panicek, 1999). Indikasjon for mer sikker karakterisering med MR vurderes på individnivå.
- MR binyrer: Uavklarte funn ved flerfase CT binyrer eller ved kontraindikasjon for jodholdig kontrast.
- MR columna/bekken: Ved usikkerhet om skjelettmetastaser / avklaring av nevrologiske utfall.
- MR plexus brachialis: Mistanke om affeksjon av plexus brachialis ved sulcus superior-(Pancoast-) tumor
CT-undersøkelser utover CT toraks og øvre abdomen
- CT binyrer: Uavklarte lesjoner i binyrer. Initialt utføres serie uten intravenøs kontrast. Hvis det ikke påvises fettinnhold (≤10 HU) kompletteres med flerfaset kontrastserie (P. T. Johnson, Horton, & Fishman, 2009). Metastaser har forsinket utvasking av kontrast sammenlignet med adenomer.
- CT lever (flerfaset): Uavklarte lesjoner i lever som er uegnet for ultralyd og når MR er kontraindisert.
- CT caput: CT med kontrast har en sensitivitet på 92% for å oppdage hjernemetastaser. Faren for å overse små metastaser, leptomeningeal spredning og vansker med å skille metastaser i dura fra meningiomer gjør at MR caput er førstevalget ved utredning av hjerne metastaser (Chakrabarty et al., 2023). Unntak kan være hos pasienter med klaustrofobi, non-MR-kompatibel pacemaker, ved mistanke om livstruende cerebrale situasjoner eller når MR ikke er tilgjengelig.
- Prøvetaking: Veiledning ved biopsi av primærtumor og mulige metastaser.
Ultralyd
Ultralyd lever: Uavklarte lesjoner dersom egnet med hensyn til antall/lokalisasjon/habitus.Vurdering av leverparenkymet når jodholdig intravenøs kontrast og/eller MR er kontraindisert.
Ultralyd toraks Kan eventuelt avklare om det foreligger innvekst i brystvegg (lungeglidning).
Prøvetaking Veiledning ved pleurapunksjon og biopsi av tumor/lymfeknuter.
Bronkoskopi
Det diagnostiske utbytte ved fleksibel bronkoskopi avhenger av lungelesjonens lokalisasjon og størrelse. En metaanalyse viser en sensitivitet på 88% ved sentrale, endoskopisk synlige lesjoner, mens den er betydelig lavere ved perifere, ikke synlige tumorer. Henholdsvis 63% og 34% ved lesjoner over eller under 2 cm i diameter. Sensitiviteten bedres av antall metoder brukt i prøvetakingen (biopsi, børste, skylleprøver, transbronkial finnål), antall biopsier (anbefalt minst 3) og bruk av gjennomlysning ved perifere lesjoner (Rivera, Mehta, & Wahidi, 2013). I øvede hender kan radial EBUS og/eller navigasjonsbronkoskopi øke treffsikkerheten ved perifere lesjoner (se avsnittene "Bronkoskopi", "Radial endobronkial ultralyd" og "Elektromagnetisk navigasjonsbronkoskopi").
Ved bronkoskopi inspiseres stemmebåndenes bevegelighet og symmetri/asymmetri. Tegn til stemmebåndsparese kan tale for mediastinal tumorinfiltrasjon eller spredning til mediastinal lymfeknute. Ved en sentral, synlig bronkial tumor anbefales foto- og videodokumentasjon til hjelp for kirurgens vurdering av eventuell operasjonsteknisk tilnærming. Slimhinnebiopsier i flere nivå proksimalt for tumor for å påvise ev. submukøs tumorvekst kan være aktuelt dersom dette kan ha konsekvens for operasjonsteknikken (mulighet for bronkoplastikk eller sleeve-reseksjon vs pneumektomi). Angi om tumor involverer hovedbronkus eller carina (henholdsvis T2 og T4)
Bronkoskopi utføres vanligvis i lokalanestesi og mild sedasjon og er sjeldent beheftet med alvorlige komplikasjoner og pas kan utskrives etter få timer. Pneumotoraks ses i 1-6% av tilfellene etter transbronkial biopsi. Relative kontraindikasjoner til prosedyren inkludert prøvetaking er få og inkluderer: hypoksemi tross oksygentilskudd, intraktabel blødningsforstyrrelse (obs blodfortynnende medikamenter), alvorlig pulmonal hypertensjon, kardiovaskulær ustabilitet samt akutt hyperkapni.
Radial endobronkial ultralyd
Radial endobronkial ultralyd (R-EBUS) er en bronkoskopisk modalitet som benyttes til å lokalisere og vurdere perifere lungelesjoner. Under røntgengjennomlysning føres et kateter med en radial skannende ultralydprobe ned via bronkoskopets arbeidskanal ut til det relevante området, typisk et subsegment, hvor lesjonen er lokalisert. Når proben befinner seg i egnet lokalisasjon bedømt ut fra gjennomlysning og ultralydbilde, erstattes ultralydproben med en børste, finnål eller biopsitang hvoretter prøven tas. Undersøkelsen kan planlegges ut fra virtuell 3D CT bronkoskopi (se avsnitt "Bronkoskopi"). Sensitiviteten er i en metaanalyse beskrevet til rundt 70%, men varier fra 50 – 90% i enkeltstudier (Ali et al., 2017). Faktorer assosiert med bedre diagnostisk utbytte er lesjonens størrelse samt et konsentrisk «bronchus sign» i ultralydbildet. Atelektase i området kan gjøre tolkning av ultralydbildet vanskelig. Det er også en tendens til at lokal atelektase utvikles til lengre prosedyren pågår. De vanligste komplikasjoner til prosedyren er små blødninger samt pneumotoraks. Sistnevnte risiko er rundt 1%, noe som er lavere enn ved tradisjonelle transbronkiale biopsier utført i gjennomlysning.
Elektromagnetisk navigasjonsbronkoskopi
Elektromagnetisk navigasjonsbronkoskopi (ENB) består av en kombinasjon av fleksibel bronkoskopi, et virtuell 3D bilde av bronkialtreet og elektromagnetisk navigasjon.
Ruten ut til den perifere lungelesjon planlegges i et virtuelt 3D-bronkogram basert på pasientens CT toraks og egen software. Pasienten leires på et «magnetfelt» og via bronkoskopet innføres et kateter med elektromagnetisk probe og skopet navigeres via et GPS-liknende prinsipp frem til den perifere lungelesjon. Plasseringen kan bekreftes ved radial-EBUS og/eller gjennomlysning. Deretter fjernes proben mens man lar kateteret ligge på plass og instrumenter til biopsi og/eller cytologi føres inn til lesjonen.
ENB har i en metaanalyse vist en sensitivitet på 77 % ved perifere maligne lesjoner (Folch et al., 2020). Nyere systemer med bruk av tynnere skop, har vist en tilsvarende sensitivitet (Y. Li et al., 2023). Faktorer assosiert med høyere diagnostisk utbytte er størrelse av lungelesjon, lokalisasjon til over- eller midtlapp og samtidig bruk av R-EBUS. Det diagnostiske utbytte er som ved andre prosedyre avhengig av bronkoskopørens erfaring.
ENB kan også brukes til merking av lungelesjon med blekk eller coil preoperativt med tanke på å lette lokalisasjon ved kilereseksjon eller stereotaktisk bestråling.
Komplikasjoner relatert til ENB er blødninger (< 1 %) og pneumotoraks (2 %) (Folch et al., 2020).
Endobronkial ultralyd (EBUS)
EBUS brukes om to ulike undersøkelsesmodaliteter, radial EBUS og lineær EBUS. Radial EBUS omtales i avsnitt "Radial endobronkial ultralyd", mens lineær EBUS omtales her.
Ved lineær EBUS vurderes lymfeknuter langs trakea og de største bronkiene og ved EBUS-TBF (transbronkial finnål) utføres prøvetaking av lymfeknutene. EBUS har erstattet mediastinoskopi og er nå standarden for diagnostikk av mediastinale lymfeknuter (Dunne et al., 2023). Undersøkelsen kan utføres både på «våken-sederte» og pasienter i narkose. Ved narkose anbefales bruk av larynksmaske. Undersøkelsen anbefales utført av dedikerte leger da pasientvolum er viktig for trening og erfaring.
Finnålsaspirat ved hjelp av EBUS-nålene med 21 eller 22 G tas både til utstryk til umiddelbar vurdering (ROSE, se nedenfor) og settes på saltvann for å lage celleblokk, noe som tillater videre undersøkelser med immunhistokjemi (se 6.9.8). Ofte kan en på denne måten også få nok materiale for molekylærpatologiske undersøkelser. Det er også mulig å dytte materiale forsiktig ut av nålen ved hjelp av mandrengen, legge materialet på formalin og på denne måten sikre seg små sammenhengende vevsbrokker (finnålsbiopsi) for videre diagnostikk.
EBUS er viktig for å skille mellom teknisk operable og ikke-operable pasienter og bør utføres dersom CT toraks og/eller PET/CT gir mistanke om stadium II og III lungekreft. Ved planlagt stereotaksi av primær tumor eller neo-adjuvant behandling, anbefales det å utføre EBUS for å bekrefte stadium I, og slik unngå feilbehandling. Alle sykehus som driver med lungekreftutredning må ha tilgang til EBUS, enten i eget hus eller hos samarbeidende sykehus.
CT og FDG PET er ikke sensitive nok til å fange opp tidlig mediastinal lymfeknutespredning, eller spesifikke nok til å skille mellom benigne og maligne lymfeknuter. En lengste kortaksediameter på 10 mm i aksial-planet brukes ofte i bildediagnostikk for å skille mellom «normale» og «malignitetssuspekte» lymfeknuter, men i studier er det funnet at 21 % av knuter < 10 mm er maligne og at 40 % av knuter > 10 mm er benigne. Andre tilstander som hjertesvikt, inflammasjon og paramalign reaksjon kan gi forstørrede lymfeknuter på CT (Dunne et al., 2023). Inflammatoriske tilstander kan også gi økt opptak ved PET/CT.
Funn på CT toraks og FDG PET brukes i planleggingen av hvilke lymfeknuter som skal undersøkes. Hvis problemstillingen kun er å få en diagnose, eksempelvis ved utbredt sykdom, kan man stikke i den lymfeknuten som er mest suspekt og enklest tilgjengelig (selektiv EBUS). Hvis problemstillingen er å kartlegge utbredelsen av sykdommen anbefales det at man gjør en systematisk, forhåndsbestemt (ut fra CT og FDG PET) EBUS-TBF av ≥ 3 stasjoner inkludert stasjon 7 (Leong, Loveland, Gorelik, Irving, & Steinfort, 2019). Videre at man tar prøver av stasjoner i rekkefølgen N3 - N2 - N1 for å unngå forurensning av maligne celler i finnålen. Det anbefales å gjøre minimum tre stikk i hver knute da det bør foreligge tre representative negative prøver før man erklærer lymfeknuten for benign (De Leyn et al., 2014). Før prøvetakingen er anbefales det at man systematisk ser over aktuelle lymfeknutestasjoner for å kartlegge forholdene og se hvilke stasjoner som er mest suspekte og best egnede. Dette fordi undersøkelsen kan bli avbrutt av pasienten før fullført prøvetaking.
Ved å ha tilgang til ROSE (rapid on site evaluation) i form av cytolog eller screeningsteknikker kan man med en gang sjekke om man har truffet og fått representativt materiale. Dette kan både forkorte prosedyren og minske sjansen for at undersøkelsen må gjentas (Silvestri et al., 2013).
I følgende fire situasjoner bør EBUS alltid vurderes:
- Ved funn av forstørrede hilære lymfeknuter (N1) og/eller hilære knuter med økt opptak på FDG PET.
- Ved PET-negative primærtumorer av en viss størrelse.
- Ved primærtumor ≥ 3 cm.
- Ved sentral tumor.
I disse tilfellene er det en 6 %-30 % sjanse for å finne spredning til lymfeknutene (Vilmann et al., 2015). En systematisk gjennomgang viser at forekomsten av okkult N2 ved sannsynlig N0/N1(bedømt ut fra CT og/eller FDG PET), er 14 -21 % (Dunne et al., 2023). EBUS kan også vurderes når det kan få avgjørende betydning for planleggingen av mediastinale strålefelt.
EBUS er ikke ansett som nødvendig ved perifer primærtumor < 3 cm når CT og/eller FDG PET ikke gir mistanke om maligne lymfeknuter. Dette fordi sannsynligheten for å finne malign(e) lymfeknute(r) er < 6 % (Vilmann et al., 2015). I tilfeller hvor det er påvist fjernmetastaser (M+) vil EBUS oftest ikke ha noen tilleggsverdi.
EBUS kan skille lymfeknuter og oppfyllinger fra blodkar, og det kan også beskrive ultrasonografiske trekk som størrelse, form, avgrensing, heterogenitet, sentral hilusstruktur og nekrose. Disse egenskapene ved lymfeknutene kan brukes til støtte i vurderingen av malignitet hvis en knute er vanskelig tilgjengelig, men kriteriene er ikke sikre nok til å unnlate prøvetaking hvis det er teknisk mulig (Silvestri et al., 2013).
De mediastinale lymfeknutestasjoner 8, 9 og 3p kan ikke nås fra trakea, men er tilgjengelige fra øsofagus. I situasjoner hvor avklaring av disse stasjonene er nødvendig for stadieinndeling bør man derfor gjøre endoskopisk ultralyd i øsofagus (EUS) (Vilmann et al., 2015). I øvede hender kan også disse stasjonene nås med EBUS-bronkoskopet, såkalt EUS-B, gjerne i samme seanse som man undersøker mediastinum endobronkialt. EUS og EUS-B kan også være et supplement i stasjonene 2R/L, 4L og 7.
EBUS-bronkoskopet kan (som EUS) også nå venstre binyre for prøvetaking.
Ved mistanke om N3 knuter er vanligvis ikke EBUS indisert med mindre man mistenker sarkoidose, reaktive eller infeksiøse knuter og klarering av knutene vil være avgjørende for valg av behandling (kirurgi eller begrensning av strålefelt).
CT- og ultralydveiledet veiledet biopsi av primærtumor
Det bør tas CT-veiledet transtorakal biopsi av pasienter når annen diagnostisk avklaring ikke er mulig og når svaret er avgjørende for diagnose og/eller valg av behandling. Oftest gjelder dette perifere lesjoner men også mer sentrale lesjoner som ikke nås endoksopisk bør vurderes. Metaanalyser viser en sensitivitet på rundt 90 % både for biopsier (20-18 Gauge nåler) og finnålsaspirater (25-22 Gauge nåler) mens nålebiopsier noe oftere gir nok materiale (96 % vs 86 %) (Y. Li, Yang, Huang, & Cao, 2022).
Tilstedeværende cytologiservice, ROSE (rapid on site evaluation), har vist en signifikant høyere sensitivitet (+ 10 %) uten at det førte til hverken forlengelse av prosedyretiden eller flere komplikasjoner (D. Wu, Liu, Wang, Huang, & Xia, 2023). For diagnostikk av lesjoner som ligger inntil eller i pleura er ultralydveiledet punksjon vist å være like sensitiv som CT-veiledet punksjon, men med lavere komplikasjonsfare (X. Li & Kong, 2023).
Relative kontraindikasjoner mot biopsi er sterkt redusert lungefunksjon, pulmonal hypertensjon, koagulasjonsforstyrrelser, tidligere pneumektomi og mekanisk ventilasjon. Absolutt kontraindikasjon er en pasient som ikke samarbeider. Om pasienten bruker antikoagulantia bør disse nulles en uke før prosedyren og eventuelt erstattes med småmolekylært heparin s.c. Ubiopsert tumor kan være aktuell for stereotaktisk stråleterapi, om det sees radiologisk vekst kombinert med PET-positivitet (se avsnitt om sterotaktisk strålebehandling).
En av de vanligste komplikasjonene til CT-veiledet biopsi er blødning i lungeparenkymet (ca 20 %) med symptomer som akutt hoste og hemoptyse. Disse er som regel selvbegrensende. En metaanalyse viser at pneumotoraks etter CT-veiledet biopsi oppstår i 25,9 % av tilfellene, men at spredningen er stor mellom ulike studier, 4,3 % til 52,9 %. Til gjengjeld er behovet for toraksdren lavt, 6,9 % (0-15 %) (Huo, Chan, Habib, Lui, & Ridley, 2020).
Mulige risikofaktorer for å utvikle pneumotoraks er emfysem, transfissural tilgang, stor kaliber av biopsinål (≤ 18 gauge), multiple punksjoner av pleura, små noduli (≤ 2 cm) og dybden inn til lesjonen (Huo et al., 2020). Pneumotoraks oppstår ofte direkte eller kort tid etter biopsi, forsinket pneumotoraks er sjelden men forekommer og oftere ved punksjon i overlappene.
Blødning fra intercostalarterier til pleura er sjeldent men kan i alvorlige tilfeller kreve intervensjon. Dødsfall etter transtorakal lungebiopsi er svært sjelden, 0,07 % i en japansk studie (Tomiyama et al., 2006), men kan oppstå som en komplikasjon til systemiske luftembolier. Luftembolier forekommer i 0,5 % av undersøkelsene og behandles ved å legge pasienten i sideleie med venstre side opp slik at luften blir liggende i apex av venstre ventrikkel, samt gi pasienten 100 % oksygen (Mynarek & Bosse, 2016; Nakamura, Matsumoto, Inoue, Matsusue, & Fujii, 2021).
CT-veiledet biopsi utføres som regel av radiolog og det er viktig at pasienten er innforstått med risikoen for komplikasjoner før det henvises til biopsi.
Pleuravæskeanalyse
Hos pasienter med mistenkt lungekreft og pleuraeffusjon bør det utføres tapping av væske for diagnostikk. I utgangspunktet er pleuravæske hos pasient med lungekreft «malign inntil det motsatte er bevist».
Pleuratapping bør utføres ultralydveiledet. Et volum på 25-50 ml anbefales til cytologiske analyser inkludert celleblokk (Asciak et al., 2023). Volumet vil avhenge av tilgjengelig apparatur ved den lokale patologiavdeling. Diagnostisk sensitivitet er 74 % ved lungekreft og 45 % ved malignt mesoteliom. Ved residiv av pleuravæsken øker ny tapping sensitiviteten med 27 % og det anbefales derfor ny tapping ved negativt funn i første pleuratapping. Mutasjonsanalyse ved primært adenokarsinom kan bestemmes i 75-82 % av tilfellene. Faktorer som har betydning for det diagnostiske utbytte er histologisk undergruppe, kvalitet av prøven samt patologienhetens apparatur og ekspertise (Martinez-Zayas, Molina, & Ost, 2022).
Ved manglende diagnostisk resultat etter to separate pleuratappinger bør man vurdere annen utredningsmodalitet dersom det dreier seg om eksudat. Pleurabiopsi kan utføres UL eller CT veiledet med sensitivitet på 76 % og i siste instans torakoskopisk biopsi med sensitivitet > 90 %
Pleuraeffusjon hos en pasient med lungecancer er ikke ensbetydende med pleural spredning og kan være betinget av andre årsaker. Hvis der derimot påvises maligne celler ved pleuratapping har pas M+ sykdom og er ikke tilgjengelig for kurativ behandling.
Mediastinoskopi
I takt med økt bruk av EBUS og EUS som ledd i utredning av mediastinale lymfeknuter, har indikasjon for og betydning av mediastinoskopi minsket og utføres nå i liten grad.
Mediastinoskopi utføres ved torakskirurgiske avdelinger, under generell anestesi. Dette kan utføres enten som tradisjonell (TM) eller videoassistert cervikalt mediastinoskopi (VAM). Anbefaling er som minimum biopsi fra lymfeknute stasjon 4 R, 7 og 4 L, men proksimale lymfeknuter i stasjon 10 R og 10 L. kan også nåes (De Leyn et al., 2014).
Sensitiviteten og spesifisiteten ved VAM for lymfeknutespredning er henholdsvis 89 % og 100 % (Silvestri et al., 2013).
Komplikasjoner i relasjon til mediastinoskopi er blødning, stemmebåndsdysfunksjon, trakeal skade samt pneumotoraks (Lemaire et al., 2006).
I en nyere studie av pasienter med lungekreft, som utover EBUS fikk utført mediastinoskopi, så man marginal reduksjon (1 %) av uforutsett N2 lymfeknutespredning sammenliknet med de som kun fikk utført EBUS. Og dette på bekostning av forsinket operativ tumorreseksjon, økt morbiditet i relasjon til komplikasjoner ved mediastinoskopi (6 %), mortalitet (0,6 %) samt behov for gjentatt generell anestesi (Bousema et al., 2023). På denne bakgrunn foreslo tilhørende lederartikkel at EBUS nå er å anse som både førstevalg og godt nok alene for diagnostisering av spredning til mediastinale lymfeknuter ved utredning av lungekreft (Dunne et al., 2023).
Torakoskopi
Torakoskopi inndeles i medisinsk torakoskopi (MT) og videoassistert torakoskopi (VATS). Begge kan brukes i både diagnostisk og terapeutisk hensikt.
Indikasjonen for MT er utredning av uavklart pleuravæske, inkludert mistanke om malignitet. Metoden er vist å ha en diagnostisk sensitivitet på 95 % mot 75 % ved torakocentese alene (Avasarala, Lentz, & Maldonado, 2021). MT kan også brukes til å inspisere pleurahinnene og ta biopsier av pleura parietale. Prosedyren utføres under lokalanestesi og moderat sedasjon med enten et rigid eller semirigid torakoskop. MT krever trening og bør ikke utføres hvis torakocentese har gitt diagnosen.
VATS er et kirurgisk inngrep og utføres i generell anestesi. Indikasjoner i diagnostisk øyemed er biopsier av mediastinale lymfeknuter som ikke er tilgjengelig ved EBUS/EUS eller mediastinoskopi (lymfeknute stasjonene 3A, 5, 6, 8, 9), inspeksjon og biopsier fra pleura og innvendig brystvegg. Er også aktuell ved uavklart pleuravæske og for biopsi av pleura og uavklarte lungelesjoner. Videre kan metoden brukes i eksplorasjon for å se om det foreligger operabilitet, eksempelvis mediastinal invekst (T4) (Mehrotra, D'Cruz, & Arthur, 2023).
Lungefunksjonsundersøkelser
Spirometri og måling av gassdiffusjon inngår begge i utredning av all lungekreft. Dette fordi lungefunksjonen kan være påvirket av selve kreftsykdommen, pasienten kan ha annen lungesykdom, fordi resultatet kan få betydning for valg av behandling og/eller for å kunne følge eventuelle senere bivirkninger av behandlingen (medikamenter, stråle).
Spirometri er særlig viktig ved kurativ behandling hvor kirurgi er et alternativ. Det foreligger flere internasjonale retningslinjer som divergerer i sine anbefalinger (Ha, Mazzone, Ries, Malhotra, & Fuster, 2016; E. Lim et al., 2010; Matheos, Ram, & Canelli, 2020; Postmus et al., 2017; Salati & Brunelli, 2016). Feltet preges av gamle studier og mangel på randomiserte undersøkelser. Det er således ikke tatt høyde for at både operasjonsmetoder og postoperativ behandling har endret seg siste 20 årene. Retningslinjene baserer seg også delvis på eksperters mening om hva som er akseptabel risiko forbundet med kirurgi.
Hos pasienter hvor kirurgisk fjerning av lungevev er aktuelt er to spørsmål viktige:
- Tåler pasienten selve operasjonen (for eksempel «enlungeventilasjon»)?
- Vil pasienten ha nok lungevev igjen etter operasjonen til ikke å bli plaget av dyspnoe?
For både 1 og 2 gjelder at det ikke er satt en absolutt nedre grense for hva en pasient kan ha av lungefunksjon. Her vil annen komorbiditet (spesielt annen lungesykdom og hjertesykdom) samt pasientens stå-på-vilje telle inn. Samtidig er det viktig å informere pasienten grundig slik at det kan gjøres et realistisk samvalg av behandlingsmetode.
Prinsippene for vurdering av operabilitet hos pasienter uten annen alvorlig komorbiditet er skjematisk skissert i Figur 10 under (grensene er veiledende og ikke absolutte):
- Normal lungefunksjon (FEV1 og DLCO begge > 80 % av forventet): Ingen restriksjoner
- Er FEV1 og/eller DLCO <80 % av forventet eller den postoperative beregnede FEV1 og/eller DLCO < 60 % av forventet: utvid med anstrengelsestest. Her er flere valg: Kardiopulmonal belastningstest (CPET), trappetest (SCT), shuttle walk test (SWT) eller 6-minutters gangtest (6MWT).
- Hvis den postoperative beregnede FEV1 og/eller DLCO er < 30 % av forventet anbefales CPET.
- Hvis resultatet ved trappetest er minst fire etasjer (uten pauser), SWT > 400m eller 6MWT > 300-500 meter anses pasienten operabel.
- Hvis resultatet ved trappetest er lavere enn fire etasjer (uten pauser), SWT < 400m eller 6MWT < 500 meter anbefales CPET.
- Maksimalt oksygenopptak ved CPET:
- > 20 ml/kg/min (eller >75 % av forventet) - operasjon opp til og med pneumektomi kan utføres
- 10-20 ml/kg/min (eller 35-75 % av forventet) - individuell vurdering anbefales (annen sykdom, stå-på-vilje, størrelse på reseksjon).
- < 10ml/kg/min (eller <35 % av forventet) - operasjon frarådes.
Formler for beregning av postoperativ FEV1 og DLCO finnes i avsnitt "Formler for beregning av postoperativ FEV1, DLCO og VO2Max" i Vedlegg. Vær oppmerksom på at den faktiske lungefunksjonen ofte blir bedre enn beregnet i løpet av det første året etter operasjonen (Yokoba et al., 2018). Som en tommelfingerregel blir postoperativ lungefunksjon (minst) 85 % av den preoperative etter en singel lobektomi (Matsumoto et al., 2018).
d Risiko angitt som lav (<1 % risiko for postoperativ mortalitet), moderat (risiko varier avhengig av anstrengelses toleranse, reseksjonens størrelse) eller høy (>10 % risiko for postoperativ mortalitet)
Gjengitt fra Ha et al., 2016. Med tillatelse fra J Thorac Oncol i 2024.
Hjertefunksjon
Dersom pasienten har symptomer og tegn på hjertesykdom og/eller tidligere kjent hjertesykdom, bør hen vurderes av kardiolog for avklaring om hjertesykdommen har konsekvenser for planlagt lungekreftbehandling, for eksempel kirurgi, strålebehandling eller kardiotoksiske medikamenter (Lyon et al., 2022; Smilowitz & Berger, 2020). Konklusjon og uttalelse fra kardiolog bør inneholde en risikoangivelse (lav eller høy) for hjertekomplikasjoner ledsaget av behandlingsforslag. Spesielt pasienter med koronarstent eller alder over 75 år er utsatt for hjertekomplikasjoner i forbindelse med kirurgi.
Stadieinndeling (TNM)
Sist faglig oppdatert: 31.10.2024
Alle pasienter skal som resultat av utredningen bli klassifisert i et stadium, fortrinnsvis med en detaljert TNM. I Norge brukes stadieinndelingen utarbeidet av IASLC og for tiden er det 8. versjon som gjelder (Lababede & Meziane, 2018). Stadieinndelingen er en av de sterkeste prognostiske parameterne ved lungekreft og ligger alltid i bunnen for alle avgjørelser om valg av behandling. TNM-versjon 9 er ventet innført i starten av 2025.
Tx |
| Primary tumor cannot be assessed |
|---|---|---|
T0 |
| No evidence of primary tumor |
T1 |
| Tumor 3 cm or less in greatest diameter surrounded by lung or visceral pleura, without evidence og mail bronchus |
| T1a(mi) | Minimally invasive adenocarcinoma |
| T1a | Tumor 1 cm or less in greatest diameter |
| T1b | Tumor more than 1 cm but not more than 2 cm |
| T1c | Tumor more than 2 cm but not more than 3 cm |
T2 |
| Tumor more than 3 cm but not more than 5 cm; or tumor with any of the following features: Involves main brochus (without involving the carina), invades visceral pleura, associated with atelectasis or obstructive pneumonitis that extends to the hilar region |
| T2a | Tumor more than 3 cm but not more than 4 cm |
| T2b | Tumor more than 4 cm but not more than 5 cm |
T3 |
| Tumor more than 5 cm but not more than 7 cm or one that directly invades any of the following: chest wall, phrenic nerve, parietal pericardium, or associated separate tumor nodule(s) in the same lobe as the primary |
T4 |
| Tumors more than 7 cm or one that invades the following: diaphragm, mediastinum, heart, great vessels, trachea, recurrent laryngeal nerve, oesophagus, vertebral body, carina; separate tumor nodule(s) in a different ipsilateral lobe to that of the primary |
STAGE | T | N |
|
|---|---|---|---|
Occult | TX | N0 | M0 |
0 | Tis | NO | M0 |
IA1 | T1a(mi)/T1a | NO | M0 |
IA2 | T1b | NO | M0 |
IA3 | T1c | NO | M0 |
IB | T2a | NO | M0 |
IIA | T2b | N0 | M0 |
IIB | T1a-T2b | N1 | M0 |
| T3 | N0 | M0 |
IIIA | T1a-T2b | N2 | M0 |
| T3 | N1 | M0 |
| T4 | N0/N1 | M0 |
IIIB | T1a-T2b | N3 | M0 |
| T3/T4 | N2 | M0 |
IIIC | T3/T4 | N3 | M0 |
IVA | Any T | Any N | M1a/M1b |
IVB | Any T | Any N | M1c |
| N0 | N1 | N2 | N3 | M1a | M1b | M1c |
|---|---|---|---|---|---|---|---|
T1a | IA1 | IIB | IIIA | IIIB | IVA | IVA | IVB |
T1b | IA2 | IIB | IIIA | IIIB | IVA | IVA | IVB |
T1c | IA3 | IIB | IIIA | IIIB | IVA | IVA | IVB |
T2a | IB | IIB | IIIA | IIIB | IVA | IVA | IVB |
T2b | IIA | IIB | IIIA | IIIB | IVA | IVA | IVB |
T3 | IIB | IIIA | IIIB | IIIC | IVA | IVA | IVB |
T4 | IIIA | IIIA | IIIB | IIIC | IVA | IVA | IVB |
Lymfeknute-oversikt, UICC 8. utgave
Med tillatelse fra John Wiley and Sons i 2024.
Lymfeknutenivåer i toraks: Inndelingen i N1-N3 avhenger av om lymfeknutene sitter intrapulmonalt, i hilus eller i mediastinum og om de sitter på samme eller motsatt side av primærtumor. N1 er lymfeknuter i stasjonene 10-14 på samme side som primærtumor. N2-knuter sitter i stasjonene 2-9 på samme side som primærtumor. N3-knuter sitter i stasjon 1 (uavhengig av side) og stasjonene 2, 4, 5, 6 og 10-14 når de sitter på motsatt side av primærtumor. Stasjonene 3, 7, 8 og 9 regnes alltid som N2 (Asamura et al., 2015).
N0 | N1 | N2 | N3 | Lymfeknute (N) | |
|---|---|---|---|---|---|
- | - | - | + | Supraklavikulær/skalenus (ipsi- og/eller kontralateral) | |
- | - | - | + | Kontralateral | Mediastinal |
- | - | + | - | Ipsilateral | |
- | - | + | - | Subkarinal | |
- | - | - | + | Kontralateral | Hilær |
- | + | - | - | Ipsilateral | |
- | + | - | - | Peribronkial (ipsilateral) | |
Pulmonale noduli
Sist faglig oppdatert: 31.10.2024
Pulmonale noduli er tilfeldige funn av små fortetninger på røntgen toraks eller CT toraks. De minste på < 1 cm ses oftest kun på CT. En nodulus er en rund eller irregulær røntgentett flekk med en skarp eller uskarp avgrensning mot omkringliggende lungevev og måler ≤30mm i største diameter (MacMahon et al., 2017). De kalles mikronoduli hvis de er ≤ 4 mm. Ved mistanke om en nodulær lesjon på røntgen toraks bør dette snarest bekreftes eller avkreftes med CT. Tradisjonell røntgen toraks er ikke egnet verken i diagnostikk eller oppfølging av noduli.
Noduli deles inn i solide og subsolide etter utseende på CT toraks (se Figur 12). En solid nodulus er røntgentett og omgitt av lungevev, den ses både i lunge- og mediastinumvindu. En subsolid nodulus framstår som et område med mattglass med eller uten områder med solide komponenter. Begrepet mattglass innebærer økt tetthet i lungeparenkymet som ikke visker ut konturene av bronkier eller blodkar (ses derfor typisk kun i lungevindu og ikke i mediastinumvindu) (Hansell et al., 2008). En nodulus kan opptre alene eller flere samtidig i en eller flere lapper, i en eller begge lunger. De er vanlige hos røykere, 39 % av deltakerne i en amerikansk screeningstudie hadde noduli > 4 mm (Aberle et al., 2011), men de ses også hos aldri-røykere.
De aller fleste av disse flekkene er benigne men de kan være begynnelsen på lungekreft. I den amerikanske screeningstudien var > 95 % av alle solide noduli > 4 mm benigne (Aberle et al., 2011). Det er derfor laget egne retningslinjer for oppfølging av slike tilfeldig oppdagete noduli. I Norge er det vanligst å bruke reglene til Fleischner Society som anbefales her (MacMahon et al., 2017). Men British Thoracic Society (BTS) har også laget en akseptabel algoritme for oppfølging (Callister et al., 2015). BTS krever at bilder som sammenlignes skal være tatt på samme CT-maskin og bruker i tillegg volumberegninger, noe som tillater å avslutte kontrollene allerede etter 1 år (ved volumetrisk stabilitet) istedenfor 2 år (ved diameter-stabilitet som foreslått av Fleischner).
Pasientens risikofaktorer kombinert med lungefortetningens utseende og vekstmønster danner grunnlaget for risikovurdering og videre håndtering. Reglene gjelder ved tilfeldig oppdagete noduli og ikke hos pasienter med aktiv kreftsykdom, personer < 35 år, immunsupprimerte eller pasienter med aktiv infeksjon. For pasienter som deltar i screeningprogrammer gjelder egne algoritmer.
Vurderingsfaktorer i bedømmelsen av noduli (se også Tabell 6):
- CT-tekniske forhold ved oppfølgning: Lavdoseteknikk med tynne snitt (≈ 1 mm) i aksialplan med både kantforsterkning og bløtdelsalgoritme. Øvrige plan rekonstrueres forslagsvis som vanlig med 2-3 mm snitt i bløtdelsalgoritme. Mål angis i lengde og bredde (hvis > 10 mm) (Bankier et al., 2017).
- Pasientens risikofaktorer: Alder, tobakkseksponering, familiehistorikk mtp lungekreft, tidligere kreftsykdom (både lungekreft og annen kreft), emfysem eller lungefibrose, eksponering mot asbest eller radioaktive stoffer og symptomer på lungesykdom. Hos pasienter som på grunn av helsetilstanden eller annen alvorlig sykdom med dårlig prognose bør det alltid vurderes om det er riktig å anbefale kontroller. Spesielt gjelder dette om pasienten anses uegnet for utredning og påfølgende tumorrettet behandling. Endring i den generelle helsesituasjonen kan på samme måte medføre at man velger å avslutte et påbegynt kontrollopplegg.
- Nodulus’ utseende: Bedømmelse av tetthet er viktig for videre oppfølging. Delvis solide noduli har høyere risiko for malignitet, mens sannsynlighet for malignitet i solide noduli øker ved økende størrelse og ved spikulering.
- Nodulus’ størrelse: I Fleischner society’s kriterier er det angitt hvordan solide og subsolide noduli måles. I lungevindu måles lengste diameter inkludert mattglass og uansett plan samt diameter vinkelrett på denne i samme plan. Disse adderes og divideres på to. Resultatet er det som ligger til grunn for videre oppfølging (MacMahon et al., 2017). Vær oppmerksom på at dette skiller seg fra bestemmelse av T i TNM klassifiseringen hvor lengste diameter av den solide komponenten, uavhengig av plan, alene bestemmer T-verdien.
- Nodulus’ volumdoblingstid (VDT): I retningslinjer til BTS angis det at VDT < 400 dager er forbundet med malignitet, men både bronkiale karsinoider og adenokarsinomer kan ha lenger VDT enn dette. I en italiensk screeningstudie fant man at 74 % av krefttilfeller diagnostisert etter oppfølgende CT-undersøkelse hadde en volumdoblingstid under 400 dager, 15 % hadde 400-599 dager og hos 11 % lå VDT over 600 dager. Samtidig fant man en undergruppe av krefttilfellene på 16 % som hadde en median volumdoblingstid på kun 52 dager (Veronesi et al., 2012). En rask volumdoblingstid under 20 dager bør oftest gi mistanke om en inflammatorisk tilstand, eksempelvis infeksjon. Oftest angis kun mål i 2 dimensjoner i CT-beskrivelser. Det finnes imidlertid nettbaserte kalkulatorer der størrelse av lesjonen målt i diameter og datoene for undersøkelsene plottes inn og volumdoblingstiden regnes ut: https://www.brit-thoracic.org.uk/quality-improvement/guidelines/pulmonary-nodules/pn-risk-calculator/.
- Nodulus’ plassering: over- eller underlapp, relasjon til pleura inkludert fissurene er også faktorer som kan påvirke risiko for malignitet. Også dette er tatt med i https://www.brit-thoracic.org.uk/quality-improvement/guidelines/pulmonary-nodules/pn-risk-calculator/
- Antall noduli: I Nelsonstudien, som kun undersøkte storrøykere i aldersgruppen 55-70 år, var antall noduli opp til fire forbundet med økende sannsynlighet for malignitet, mens funn av flere enn fire noduli var forbundet med lavere sannsynlighet for malignitet.
- Egenskaper ved noduli som vanligvis ikke trenger oppfølging: innhold av fett, innhold av kalk med popkorn- eller laminær form, diffus eller sentralt plassert kalk, solid nodulus < 5 mm, subsolid eller ren mattglasslesjon < 6 mm hos pasienter uten risikofaktorer for lungekreft, solid nodulus som ikke har vokst etter 1 år (bedømt med volumetri).
Intrapulmonale lymfeknuter kan mistolkes som begynnende kreft. Disse knutene kjennetegnes ved at de er solide, uten kalk, har en skarp begrensning, oval eller polygonal form, befinner seg innenfor 15 mm fra pleura, er < 12 mm i diameter og ses oftest i midt- og underlappene (Schreuder et al., 2020). Å skille disse fra maligne noduli kan imidlertid være vanskelig (White & Rubin, 2020).

Risikofaktorer hos pasienten | Risikofaktorer ved nodulus |
|---|---|
Alder | Størrelse |
Tidligere eller aktiv røyker | Plassering i overlappen |
Antall pakkeår | Spikulae |
Lungekreft i familien | Drag mot pleura |
Tidligere kreftsykdom | Vaskularitet |
Hemoptyse | Solid, subsolid |
Lungeemfysem | Vekst(hastighet) |
| Lymfadenopati |
Solide | Størrelse | Antall | Risikogruppe | Oppfølging |
|---|---|---|---|---|
| < 6 mm (< 100 mm3) | Singel | Lav risiko | Ingen rutineoppfølging |
Høy risiko | Valgfri CT etter 12 mndr | |||
Multiple | Lav risiko | Ingen rutineoppfølging | ||
Høy risiko | Valgfri CT etter 12 mndr | |||
6-8 mm (100-250 mm3) | Singel | Lav risiko | CT etter 6-12 mndr, vurder CT etter 18-24 mndr | |
Høy risiko | CT etter 6-12 mndr, så etter 18-24 mndr | |||
Multiple | Lav risiko | CT etter 3-6 mndr, vurder CT etter 18-24 mndr | ||
Høy risiko | CT etter 3-6 mndr, så etter 18-24 mndr | |||
> 8 mm (> 250 mm3) | Singel | Alle | Vurder CT etter 3 mndr, PET/CT eller biopsi | |
Multiple | Lav risiko | CT etter 3-6 mndr, vurder CT etter 18-24 mndr | ||
Høy risiko | CT etter 3-6 mndr, så etter 18-24 mndr |
Subsolide noduli | Størrelse | Oppfølging |
|---|---|---|
Mattglass | < 6 mm | Ingen |
≥ 6 mm | CT etter 6-12 mndr, hvis tilstede, CT etter 3 og 5 år | |
Delvis solid | < 6 mm | Ingen |
≥ 6 mm | CT etter 3-6 mndr, hvis tilstede, CT årlig i 5 år | |
Multiple | < 6 mm | CT etter 3-6 mndr, hvis stabil, CT etter 2 og 4 år |
≥ 6 mm | CT etter 3-6 mndr. Håndtering etter mest suspekte nodulus |
Solide noduli > 8 mm anbefales tatt inn i pakkeforløp lungekreft, alternativt CT-kontroll etter 3 måneder. Hva man velger vil avhenge av individuell risikostratifisering. Ved delvis solide noduli hvor den solide komponenten måler > 8 mm anbefales pakkeforløp lungekreft.
Laboratorietester
Sist faglig oppdatert: 31.10.2024
Orienterende blodprøver er Hb, Lkc, trombocytter, CRP, elektrolytter, kalsium (ev. korrigert ionisert kalsium), alkalisk fosfatase (ALP), albumin, ALAT, total bilirubin, kreatinin.
Tumormarkører
Tumormarkører er biokjemiske parametre som måles i serum eller plasma hos pasienter med mistenkt eller kjent lungekreft. De er tumorassosierte men ikke tumor- eller organspesifikke. Tumormarkørene kan stige ved nedsatt nyre- eller leverfunksjon samt ved en del benigne lungesykdommer.
Tumormarkørene (CEA, NSE, ProGRP, SCC-antigen og CYFRA) har lav sensitivitet og skiller for dårlig mellom histologiske undertyper til å kunne anbefales brukt i primær utredning av lungekreft (J. Schneider, 2006; Stovold et al., 2012). Forhøyet NSE og proGRP er oftest assosiert med SCLC, og kan være til hjelp i utredning av pasienter med cancer origo incerta eller der biopsi ikke er tilgjengelig.
Anbefaling - laboratorieprøver
Det bør ved utredning av lungekreft tas et utvalg laboratorieprøver for vurdering av metastaserende sykdom og/eller paraneoplastiske syndromer.
Tumormarkører anbefales ikke som ledd av utredning, men kan være nyttige i oppfølgning og kontroll av pasienter med lungekreft.
Hos pasienter med cancer origo incerta, eller der biopsi ikke er tilgjengelig, kan tumormarkører være til hjelp også i utredning.
Histopatologisk diagnostikk
Sist faglig oppdatert: 31.10.2024
Generelt om besvarelse av biopsier, cytologiske prøver og resektat
Klassifisering av tumor og besvarelse av biopsier, cytologiske prøver og operasjonsresektat skal gjøres i henhold til anbefalinger og terminologi gitt ved gjeldende utgave av WHO-klassifikasjon (https://tumourclassification.iarc.who.int/). Den norske patologforenings mal for besvarelse av lungeresektat skal brukes som utgangspunkt for makroskopisk og mikroskopisk undersøkelse.
Remissen bør inneholde opplysninger om radiologiske funn, røykehistorie, tidligere kreftsykdommer, om det er mistanke om primær lungekreft eller metastaser, presis lokalisasjon for biopsi/cytologisk prøve, prøvetakingsmetode og tidligere relevant behandling.
Svar fra patolog skal inneholde:
- Informasjon om prøvens representativitet (gjelder biopsi/cytologiske prøver)
- Histologisk type lungekreft
- Resultat av IHK og molekylære analyser nødvendige for behandlingsvalg. Disse besvares vanligvis fortløpende. Se Figur 14 for testalgoritmer (IHK og molekylære analyser) samt Tabell 14 for oversikt over anbefalte gener som skal inngå i molekylære analyser. Se avsnitt "Besvarelse av resektat".
Endelig prøvesvar fra patolog bør foreligge før behandlingsbeslutning: I følge Pakkeforløp for lungekreft skal histologisk diagnose foreligge innen 4 kalenderdager etter biopsitakning og innen 2 kalenderdager for cytologiske prøver.
Besvarelse av resektater
Følgende informasjon bør foreligge fra kirurg:
- Type reseksjon (segmentreseksjon, kilereseksjon, lobektomi, pneumektomi)
- Operasjonsmetode (VATS, RATS, åpen)
- Medføgende adherente strukturer/vev (del av annen lapp, pleura parietale, perikard, toraksvegg, andre stukturer)
- Antall svulster i resektatet (basert på radiologi)
- Dersom neoadjuvant behandling:
- Type neoadjuvant behandling
- Største tumormål før og etter behandling
- Tumors lokalisasjon (sentral, perifer, relasjon til pleura/bronkus)
- Metastasesuspekte stasjoner må angis
- Lymfeknuter:
- skal legges på separate glass som merkes med stasjon
- informasjon om det er gjort komplett eller inkomplett høsting av lymfeknuter
Følgende opplysninger skal angis i patologibesvarelsen:
- Hva preparatet består av
- Histologisk diagnose. Ved adenokarsinom bør dominerende subtype angis
- Dersom neoadjuvant behandling er gitt:
- Prosent viabelt tumorvev ift tumorseng
- Sekundærforandringer til neoadjuvant behandling (f.eks fibrose, nekroser)
- Tumors lokalisasjon (bronkus/perifer/annet).
- Tumors største utstrekning i mm (gjelder infiltrerende komponent dersom adenokarsinom med lepidiske områder)
- Non-invasive adenokarsinom: tumors grad kan angis (WHO Classification of Tumours 5th ed. Thoracic tumours, 2021), men dette er valgfritt. Se Tabell 9.
- Radikalitet, reseksjonsrender og informasjon om fullstendig eller ufullstendig reseksjon :
- Det anbefales at R kategori (residual tumor descriptor) angis; se Tabell 10
- Korteste avstand til reseksjonsrender bør angis
- I noen tilfeller bør endelig R-kategori bestemmes i samråd med kirurg
- Tumors relasjon iht modfisert Hammar klassifikasjon (Travis et al., 2008) - elastin-fargning anbefales for bedre fremstilling av den elastiske membranen:
- PL0: ingen gjennomvekst av den elastiske membranen
- PL1: Tumor vokser gjennom den elastiske membranen, men ikke hele pleura viscerale
- PL2: Tumor vokser gjennom den elastiske membranen og hele pleura viscerale, men ikke inn i pleura parietale
- PL3: Tumorinfiltrasjon i pleura parietale
- Spredning av tumorceller i alveolerom (STAS): Angis som Påvist/Ikke påvist
- Lymfeknuter i hovedpreparat:
- Alle lymfeknuter skal fremføres for mikroskopisk undersøkelse
- Hvis mulig, skal lymfeknutene skivedeles i 2-3 mm tykke skiver
- Angi totalt antall lymfeknuter som er funnet, samt antall og lokalisasjon med metastase
- Lymfeknuter på separate glass:
- Nivå/lymfeknutestasjon skal angis
- Angi totalt antall lymfeknuter som er funnet, samt antall og lokalisasjon med metastase. Lymfeknutene er ofte fragmenterte, slik at det ofte ikke er mulig å angi antall
- Hvis mulig skal lymfeknutene skivedeles i 2-3 mm tykke skiver
- Hvis det foreligger metastase i lymfeknute skal det angis om det er tumorinfiltrasjon i lymfeknutekapsel og om det foreligger infiltrasjon i ekstranodalt vev
- Lungevev utenom tumor
- Angi som "normale forhold" eller beskriv eventuelle patologiske funn
- Atelektatiske forandringer skal angis. Kommenter eventuelle funn som kan gi mistanke om yrkeseksponering (f. eks støvmakler og silikoseknuter)
- pTN:
- Dersom det foreligger ≥ 2 svulster samtidig ("multiple pulmonary sites"), skal pTN angis iht IASLC sine retningslinjer for pTNM klassifisering (Detterbeck et al., 2016)
- pM skal ikke angis, heller ikke som pMx, da dette kan feiltolkes
- Angis som ypTN dersom det er gitt neoadjuvant behandling
- Biomarkører: se avsnitt "Spesifikt om molekylære analyser" og Tabell 14.
Grad | Differensiering | Histologisk mønster |
|---|---|---|
1 | Høyt differensiert | Overveiende lepidisk, fravær av eller < 20 % høygradig mønster* |
2 | Middels differensiert | Overveiende acinært eller papillært, fravær av eller < 20 % høygradig mønster* |
3 | Lavt differensiert | >20 % høygradig mønster, uansett subtype non-mucinøst adenokarsinom |
* Høygradig mønster: solid, mikropapillært, kribriformt eller komplekst glandulært (fusjonerte kjertler eller enkeltceller i desmoplastisk stroma)
| Deskriptor | Utfyllende kriterier (IASLC) |
|---|---|---|
RX | Kan ikke vurderes om det foreligger resttumor |
|
R0 | Ingen resttumor |
|
R1 | Mikroskopisk resttumor |
|
R2 | Makroskopisk resttumor | |
R0(un) | Ingen sikker resttumor, men ikke alle kriterier er oppfylt |
|
Histopatologisk klassifisering - ikke-småcellete karsinom (ikke-nevroendokrine)
For oppsummering av klassifisering av epiteliale svulster, anbefalt nomenklatur, immunhistokjemiske -og molekylære analyser, se Tabell 14.
Adenokarsinom
Adenokarsinomer vokser ofte perifert i lungen og utgjør ca 50-60 % av ikke-småcellete karsinomer. Hovedtypene er minimale invasive adenokarsinom (MIA; kan være mucinøse eller non-mucinøse), invasive non-mucinøse, invasive mucinøse, kolloide, fetale og enterisk type adenokarsinom. Invasive non-mucinøse adenokarsinom kan deles i subtypene lepidisk, acinært, papillært, mikropapillært og solid. Ofte foreligger det blanding av flere subtyper.
Atypisk adenomatøs hyperplasi (AAH) og adenokarsinom in situ (AIS) er preinvasive lesjoner og forløpere til adenokarsinom.
- PD-L1, ALK, ROS1 og molekylærpatologiske analyser skal utføres på «refleks», dvs ved førstegangsvurdering av biopsi/operasjonsresektat (se også 6.9.9).
Plateepitelkarsinom
Plateepitelkarsinomer utgjør ca. 25-30 % av ikke-småcellete karsinomer. Tumor vokser oftest sentralt i relasjon til store bronkiegrener. I henhold til 5. utgave av WHO-klassifikasjonen (WHO Classification of Tumours 5th ed. Thoracic tumours, 2021) deles plateepitelkarsinom i ikke-keratiniserende og basaloide plateepitelkarsinom, samt lymfoepiteliale karsinom. Lymfoepiteliale karsinomer i lunge er mest hyppige i Asia hos yngre, ikke-røykende pasienter, og er assosiert med Epstein Barr-virus.
- PD-L1-analyse skal utføres på «refleks»
- Andre molekylære analyser: på forespørsel fra kliniker
Storcellet karsinom
Udifferensierte ikke-småcellete karsinomer uten spesifikke morfologiske trekk som kjerteldannelse eller forhorning, samt immunhistokjemisk fravær av uttrykk for plateepitelmarkører (p40/CK5) og adenokarsinommarkører (TTF1/napsin A). Dersom det er immunfenotype som plateepitel eller adenokarsinom skal tumor klassifiseres i henhold til immunprofil. Storcellet karsinom er en eksklusjonsdiagnose som kun stilles på resektater. Se også 6.9.4.2.
- PD-L1, ALK, ROS1 og molekylærpatologiske analyser skal utføres på «refleks», dvs ved førstegangsvurdering av biopsi/operasjonsresektat (se også 6.9.9).
Adenoskvamøst karsinom
Består av to morfologisk og immunhistokjemisk ulike komponenter, med differensiering og immunfenotype forenlig med hhv plateepitelkarsinom og adenokarsinom. Tumor må inneholde > 10 % av hver histologisk variant for å klassifiseres i denne gruppen. Diagnosen stilles vanligvis ikke på små biopsier, kun på resektater. Hos unge, aldri-røykere med plateepitelkarsinom i biopsi, må man tenke på muligheten for adenoskvamøst karsinom.
- PD-L1, ALK, ROS1 og molekylærpatologiske analyser skal utføres på «refleks», dvs ved førstegangsvurdering av biopsi/operasjonsresektat (se også 6.9.9).
Ikke-småcellet karsinom – ikke nærmere klassifiserbart (NOS) (NSCC NOS)
Ekslusjonsdiagnose forbeholdt ikke-småcellete karsinomer som ikke er klassifiserbare på bakgrunn av histologi og IHK. I resektat kan man vurdere muligheten for storcellet karsinom.
- PD-L1, ALK, ROS1 og molekylærpatologiske analyser skal utføres på «refleks», dvs ved førstegangsvurdering av biopsi/operasjonsresektat (se også 6.9.9).
Sarkomatoid karsinom
Dette er svulster med epiteliale og sarkomlignende (sarkoide) celler. Hovedtypene er: pleomorft karsinom (som kan deles i subtypene pleomorft karsinom, kjempe celle karsinom og spolcellet karsinom), karsinosarkom og pulmonalt blastom. Epitelial differensiering kan være vanskelig å gjenkjenne, og immunhistokjemisk undersøkelse for epiteliale markører er ofte nødvendig.
- PD-L1, ALK, ROS1 og molekylærpatologiske analyser skal utføres på «refleks», dvs ved førstegangsvurdering av biopsi/operasjonsresektat (se også 6.9.9).
NUT karsinom
Dette er udifferensierte til lavt differensierte karsinom med rearrangering av genet nuclear protein in testis (NUTM1) på kromosom 15q14. Svulstene kan oppstå bl.a. i mediastinum/thymus og lunge. Områder med keratinisering kan forekomme. NUT karsinom er derfor en differensialdiagnose til lavt differenseierte plateepitelkarsinom. Dette er imidlertid sjeldne svulster. I en multikohortstudie som inkludert 14 100 pasiener med solide svulster (ikke bare torakale), ble NUT rearrangering funnet i 0,06 % (Stevens et al., 2019). I en norsk studie av 483 lungesvulster ble det ikke funnet uttrykk av NÙT1 poteinet i noen av svulstene (Lund-Iversen, Grøholt, Helland, Borgen, & Brustugun, 2015).
Torakale SMARCA4-“deficient” udifferensierte svulster
Udifferensierte, høy-gradige tumores karakterisert av inaktivering av SMARCA4 genet pga mutasjoner. Er assosiert med røyking. Komutasjoner i KRAS, STK11 og KEAP1 forekommer hos nesten halvparten av pasientene. Inaktivering av SMARCA4 kan også forekomme hos andre pasienter med ikke-småcellete karsinom.
Spyttkjerteltype-svulster
Dette er sjeldne svulster som utgår fra seromukøse kjertler i bronkialvegg. Subtypene er de samme som for spyttsvulster i hode/hals området. For diagnostikk av denne type svulster henvises det til gjeldende WHO-klassifikasjon.
Histopatologisk klassifisering og diagnostikk av nevroendokrine neoplasmer (NENs)
De nevroendokrine neoplasmene (NENs) i lunge deles inn i to hovedgrupper: 1) Nevroendokrine tumores (NETs) som omfatter typisk og atypisk karsinoid, og 2) Nevroendokrine karsinom (NEK) som omfatter småcellet karsinom (SCLC) og storcellet nevroendokrint karsinom (LCNEC). I WHO 2021-klassifikasjonen (WHO Classification of Tumours 5th ed. Thoracic tumours, 2021) er begrepene «lavgradig» og «nevroendokrin tumor grad 1 (NET G1)» innført for typisk karsinoid, mens begrepene «intermediær grad» og «nevroendokrin tumor grad 2 (NET G2)» er innført for atypisk karsinoid. Begrepene «typisk /atypisk karsinoid tumor» er beholdt og anbefalt brukt. NET og NEK skiller seg fra hverandre klinisk, epidemiologisk, molekylært og histologisk.
NET og NEK skilles histologisk på bakgrunn av arkitektur, antall mitoser / 2 mm2, tilstedeværelse eller fravær av nekroser og celle/kjernemorfologi. Ofte brukte immunhistokjemiske markører er synaptofysin, kromogranin A, INSM1 og CD56. CD56 bør brukes sammen med andre nevroendokrine markører, pga lav spesifisitet.
Typisk karsinoid tumor (NET G1) og atypisk karsinoid tumor (NET G2)
De karsinoide svulstene i lunge utgjør < 2 % av de maligne svulstene i lunge. Typisk karsinoid er vanligst og utgjør > 70 % av karsinoide tumores (Caplin et al., 2015). Ingen kjente risikofaktorer er identifisert. Sentral/endobronkial vekst er vanligst, men karsinoidene kan også oppstå perifert i lungene. Fjernmetastaser forekommer hos < 5 % av pasienter med typisk karsinoid og hos ca 20-30 % av pasientene med atypisk karsinoid (Rekhtman, 2010). Metastaser til regionale lymfeknuter, lever, skjelett og hjerne er vanligst, men metastaser til bl.a hud, øye og ovarier er beskrevet (Rekhtman et al., 2019).
Diagnostiske kriterier for typisk karsinoid:
- < 2 mitoser / 2 mm2 (telles i områdene med høyest mitoseaktivitet)
- Ingen forekomst av nekroser
Diagnostiske kriterier for atypisk karsinoid:
- 2-10 mitoser / 2 mm2 og/eller nekroser. 10-30 mitoser / 2 mm2 er beskrevet i noen tilfeller, og i slike tilfeller må man vurdere muligheten for NEK.
Som regel er operasjonsresektat og undersøkelse av hele tumor nødvendig for å kunne skille mellom typisk og atypisk karsinoid. Begrepet «Karsinoid tumor ikke nærmere spesifiserbart (karsinoid NOS) kan brukes i følgende situasjoner:
- I små biopsier/cytologi, hvor materialet er for sparsomt for sikker mitosetelling og vurdering av nekroser
- Ved metastatiske karsinoid; her anbefales det å bruke formuleringen «metastatisk karsinoid NOS»
- Opererte der ikke hele tumor er fremstilt for mikroskopisk undersøkelse
Proliferativ indeks vurdert ved immunhistokjemisk undersøkelse for Ki67 inngår ikke i diagnoskriteriene, siden cutoff-verdier for Ki67 har vært vanskelig å etablere. Iht WHO klassifikasjonen kan allikevel karsinoide tumores med en Ki67 proliferasjonsindeks > 5 % indikere atypisk karsinoid, mens proliferasjonsindeks > 30 % mer sannsynlig representerer NEK. Metastaser fra NET kan ha høyere Ki67 proliferativ indeks sammenlignet med primærtumor.
Storcellet nevroendokrint karsinom (LCNEC)
Tradisjonelt diagnostiseres LCNEC på bakgrunn av arkitektur, celle/kjernemorfologi og >10 mitoser/2 mm2 (median 70 mitoser/2 mm2). Proliferativ indeks inngår ikke i diagnosekriteriene, men Ki67 er som regel > 20 %. Molekylære studier indikerer at LCNEC består av minst to hovedtyper (J. George et al., 2018). Den ene typen har genomiske trekk av småcellet karsinom, med forandringer i RB1 og TP53 genene. Den andre hovedtypen har genomiske trekk av røykeassosiert adenokarsinom med mutasjoner i KRAS, STK11 og/eller KEAP1. En intermediær type, med genomiske trekk av både småcellet karsinom og adenokarsinom, er også beskrevet. Det er foreløpig ikke grunnlag for molekylær klassifisering av LCNEC i vanlig diagnostikk. Det er heller ikke grunnlag for testing for bl.a EGFR-mutasjoner eller ALK- og ROS1-translokasjoner, pga lav forekomst av forandringer i disse genene. Den prediktive verdien av PD-L1 er usikker, men PD-L1-testing anbefales inntil videre (se avsnitt "Målrettet behandling og immunterapi" Storcellet nevroendokrint karsinom (LCNEC)).
Småcellet karsinom
Småcellet karsinom utgjør om lag 15 % av all lungekreft. Tumor ligger ofte sentralt i lungen og vokser submukøst langs veggen av større bronkiegrener. I små biopsier har småcellet karsinom karakteristisk histologi. Tumorcellene er små til middels store (vanligvis < 3 x lymfocyttdiameter) og har høy mitoseaktivitet (> 10 mitoser / 2 mm2). Proliferativ indeks inngår ikke i diagnosekriteriene, men Ki67 er vanligvis > 60 %. Ca 90 % av småcellete karsinomer uttrykker nevroendokrine immunmarkører. Småcellet karsinom med dominerende ekspresjon av POU2F3 er assosiert med lavt eller fraværende immunhistokjemisk uttrykk for nevroendokrine markører. Det er foreløpig ikke grunnlag for molekylær klassifisering av småcellet karsinom i vanlig diagnostikk.
WHO klassifikasjon av lungetumorer
Tumortype WHO | Formulering besvarelse små biopsier/cytologi | Formulering besvarelse av resektat | IHK-markører/spesial-farging/molekylær |
|---|---|---|---|
ADENOKARSINOM | |||
Lepidisk adenokarsinom Mucinøst Nonmucinøst | Adenokarsinom med lepidisk vekstmønster
Hvis kun lepidisk: legg til «invasiv komponent kan ikke utelukkes» | Tumor ≤ 3 cm med ren lepidisk vekst: Adenokarsinom in situ
Tumor ≤ 3 cm med dominerende lepidisk vekst OG infiltrerende komponent ≤ 5 mm: Minimalt invasivt adenokarsinom | IHK: TTF1 Napsin A PD-L1 ALK ROS1
Spesialfarging Vurderes hvis negativ IHK alcian blå (AB) eller PAS: Ved funn av PAS+/AB+ i små biopsier skal tumor klassifiseres som adenokarsinom
Molekylær EGFR KRAS BRAF HER2 (ERBB2) RET NTRK NRG1 (inngår ikke i alle panel) MET |
Invasive non-mucinøse adenokarsinom Acinært Papillært Mikropapillært Solid | Adenokarsinom (beskriv hvilke vekstmønstere som er identifisert) | Adenokarsinom med dominerende…(fyll inn).. vekstmønster Angi % av hvert vekstmønster Hvis mikropapillær komponent tilstede: Skal alltid angis | |
Invasivt mucinøst karsinom Blandet mucinøst og nonmucinøst adenokarsinom | Invasivt mucinøst adenokarsinom (beskriv hvilke vekstmønstre som er tilstede; bruk begrepet mucinøst adenokarsinom med lepidisk mønster dersom rent lepidisk mønster) | Invasivt mucinøst adenokarsinom | |
Kolloid adenokarsinom | Adenokarsinom med kolloid trekk | Kolloid adenokarsinom | |
Føtalt adenokarsinom | Adenokarsinom med føtale trekk | Føtalt adenokarsinom | |
Enterisk type adenokarsinom | Adenokarsinom med enteriske trekk | Enterisk type adenokarsinom | |
NSCC (ikke-småcellet karsinom), sannsynlig adenokarsinom | Hvis positiv for TTF1/napsin A og negativ for p40: Ikke-småcellet karsinom, forenlig med adenokarsinom | Hvis positiv for TTF1/napsin A: Ikke-småcellet karsinom, forenlig med adenokarsinom | |
PLATEEPITELKARSINOM | |||
Keratiniserende (uavhengig av mengde keratin) Ikke-keratiniserende Basaloid (> 50 % basaloid utseende; hvis < 50 %: Med basaloid komponent |
|
| IHK: P40 CK5/6 PD-L1
Ved mistanke om lymfoepitelialt karsinom: CD8, EBER ISH |
Lymfoepitelialt karsinom i lunge | Lymfocyttrikt karsinom med plateepiteldifferensiering, lymfoepitelialt karsinom mulig | Lymfoepitelialt karsinom | |
NSCC (ikke-småcellet karsinom), sannsynlig plateepitelkarsinom | Hvis positiv for p40 og negativ for TTF1/napsin A: Ikke-småcellet karsinom, forenlig med plateepitelkarsinom
| Ikke-småcellet karsinom, forenlig med plateepitelkarsinom
| |
NSCC, NOS – IKKE-SMÅCELLET KARSINOM, IKKE NÆRMERE KLASSIFISERBART | |||
NSCC, NOS (Ikke tydelig vekstmønster av adeno-, plate- eller nevroendokrin differensiering eller uttrykk av typiske immunmarkører eller negativ slimfarging | Ikke-småcellet karsinom, ikke nærmere klassifiserbart | Storcellet karsinom | Molekylære undersøkelser: Som for adenokarsinom |
NEVROENDOKRINE NEOPLASMER | |||
Småcellet karsinom | Småcellet karsinom | Småcellet karsinom | IHK: Synaptofysin Kromogranin INSM1 (CD56) Ki67 (hotspots)
|
Storcellet nevroendokrint karsinom | NSCC (ikke-småcellet karsinom) med nevroendokrin morfologi og positive nevroendokrine markører, mulig LCNEC (storcellet nevroendrokrint karsinom) | Storcellet nevroendokrint karsinom | |
NSCC (ikke-småcellet karsinom) med nevroendokrin morfologi og negative nevroendokrine markører | NSCC (ikke-småcellet karsinom) med nevroendokrin morfologi,
Kommenter at morfologi er suspekt på LCNEC (storcellet nevroendrokrint karsinom) og at nevroendokrine markører er negative | Storcellet karsinom med nevroendokrin morfologi | |
Typisk karsinoid/NET G1 | Karsinoid tumor/nevroendokrin tumor, men grad kan ikke bestemmes | Typisk karsinoid/NET G1 | |
Atypisk karsinoid/NET G2 | Nevroendokrin tumor, atypisk karsinoid mulig | Atypisk karsinoid/NET G2 | |
STORCELLET KARSINOM | |||
Storcellet karsinom | NSCC, NOS (diagnosen skal kun stilles på resektat) | Storcellet karsinom | Molekylær: Som adenokarsinom |
SARKOMATOID KARSINOM | |||
pleomorft karsinom kjempecelle-karsinom spolcellet karsinom pulmonalt blastom karsinosarkom
| Ikke-småcellet karsinom med …(fyll inn type komponent tilstede)…
Kommenter om det er adeno -eller plateepitelkarsinom-komponent tilstede | Ikke-småcellet karsinom med…(fyll inn komponent), forenlig med (type sarkomatoid karsinom) | IHK: Som for adenokarsinom og plateepitelkarsinom
Molekylær Som adenokarsinom |
ADENOSKVAMØST KARSINOM | |||
Adenoskvamøst karsinom | Diagnosen kan ofte ikke stilles på små biopsier Hvis suspekt: gi en tolkning, spesifiser og kommenter: Dette kan representere adenoskvamøst karsinom | Adenoskvamøst karsinom
(Begge komponenter ≥ 10 %) | IHK: Som for adenokarsinom og plateepitelkarsinom
Molekylær: Som for adenokarsinom |
ANDRE | |||
NUT karsinom i toraks/mediastinum |
|
| IHK: NUT protein Molekylær: FISH eller NGS |
SMARCA4-deficient undifferentiated tumour (SMARCA4-UT) SMARCA4-deficient NSCLC |
|
| IHK: SMARCA4/BRG1 (tap av uttrykk) |
Histopatologisk klassifisering og diagnostikk av malignt mesoteliom
Maligne pleurale mesoteliomer er i WHO 2021 klassifikasjonen delt i to hovedtyper: 1) Lokalisert pleuralt mesoteliom, og 2) Diffust pleuralt mesoteliom. Lokalisert pleuralt mesoteliom er sjeldent med ca 160 rapporterte tilfeller, og kan forekomme i alle aldre og uten asbesteksponering. Kun diffust pleuralt mesoteliom, som i hovedsak skyldes asbesteksponering, er omtalt her og i kapittel 12.
Histologisk klassifisering og immunhistokjemiske markører for mesoteliom
De diffuse pleurale maligne mesoteliomene deles inn i epitelioide, sarkomatoide og bifasiske mesoteliom. Subtype skal angis i diagnose, siden dette er viktig både ift behandlingsbeslutning og prognose (se kapittel 12). Bifasiske mesoteliom består av blandet epitelioid og sarkomatoid komponent (≥ 10 % av hver komponent).
Anbefalte immunhistokjemiske markører for mesoteliale celler er calretinin, D2-40, WT1, CKae1/ae3 og CK5. Disse markørene er ikke mesotelspesifikke, og brukes som regel sammen med andre markører. Calretinin har lavere sensitivitet i sarkomatoide mesoteliom (50-60 %) enn i epitelioide (ca 90 %), mens D2—40 har fhv høy senstivitet i både epitelioide (80-100 %) og sarkomatoide mesoteliom (75-90 %) (Chapel, Schulte, Husain, & Krausz, 2020). For å skille mesoteliom fra karsinom, er flere epiteliale markører anbefalt, deriblant Ber-EP4, claudin 4 og MOC31.
Reaktiv versus malign pleural mesotelproliferasjon
I biopsier og cytologisk materiale (pleuravæske) kan det være vanskelig å skille malign mesotelprolifrasjon fra reaktiv proliferasjon, og påvisning av infiltrasjon av fett -eller lungevev eller nekroser har vært nødvendig for å kunne stille diagnosen. En rekke immunhistokjemiske markører har tidligere vært brukt for å skille mellom neoplastiske og reaktive mesoteliale celler, deriblant EMA, p53 og desmin. Disse er imidlertid lite spesifikke, og ikke anbefalt brukt (Chapel et al., 2020). Nye markører som BRCA-assosiert protein 1 (BAP1), MTAP og CDKN2A kan imidlertid være til hjelp for å skille maligne meosteliale celler fra reaktive, også i biopiser og cytologisk materiale (pleuravæske).
BAP1: Tap av BAP1 uttrykk forekommer i 70-80 av epitelioide mesoteliom, men i < 20 % av de sarkomatoide mesoteliomene (Chapel et al., 2020). Uttrykket er bevart i reaktive mesotelcller. Ved bevart uttrykk kan man imidlertid ikke utelukke muligheten for mesoteliom.
CDKN2A og MTAP: Homozygot tap av CDKN2A forekommer i > 90 % av sarkomatoide mesoteliom (100 % spesifisitet), men ikke ved reaktiv mesotelproliferasjon. Tap av CDKN2A kan påvises ved FISH eller NGS. p16 immunhistokjemi er ikke anbefalt, pga dårlig korrelasjon med tap av CDKN2A. Ko-delesjon av methylthioadenosin phosphorylase (MTAP)-genet er vanlig, og MTAP kan derfor brukes som surrogatmarkør for CDKN2A. Tap av uttrykk for MTPA ved immunhistokjemisk undersøkelse er korrelert med homozygot tap av CDKN2A (sensitivitet 65-88 %, spesifisitet 96-100 %) (Chapel et al., 2020). Se Figur 13.
Gradering av epitelioide mesoteliom
I epitelioide mesoteliom er morfologisk trekk som kjerneatypi, mitoserate og nekroser av prognostisk betydning (Kadota et al., 2012). På bakgrunn av dette, er det i WHO 2021-klassifikasjonen anbefalt gradering av epitelioide mesoteliom som lavgradig eller høygradig basert på scoring av kjernegrad og forekomst av nekroser. Gradering kan i noen tilfeller gjøres på biopsier, under forutsetning av at det er nekroser og tilstrekkelig tumorceller tilstede.
Gradering av pleuralt diffust epiteloid mesoteliom | Score | |
|---|---|---|
Kjerneatypi | Lett | 1 |
Moderat | 2 | |
| Grov | 3 |
Mitoserate | Lav mitoserate: ≤ 1 mitose/2 mm2 | 1 |
Intermediær mitoserate: 2-4 mitoser/2 mm2 | 2 | |
| Høy mitoserate: ≥ 5 mitoser/2 mm2 | 3 |
Kjernegrad I: Sum 2 eller 3 | Sum | |
Kjernegrad II: Sum 4 eller 5 | ||
| Kjernegrad III: Sum 6 | |
Nekroser | Tilstede | |
| Ikke tilstede |
|
Overall tumorgrad | ||
Lavgradig | Kjernegrad I, eller | |
| Kjernegrad II uten nekroser |
|
Høygradig | Kjerngrad II med nekroser, eller | |
| Kjernegrad III med/uten nekroser |
|
Histopatologisk klassifisering og diagnostikk av thymus-svulster
Histologisk undersøkelse av preoperativ nålebiopsi, ev. cytologi, supplert med immunhistokjemi er vanligvis tilstrekkelig for diagnose, men i noen tilfeller kan subtyping være vanskelig i små biopsier. Dersom man etter radiologisk diagnostikk og tverrfaglig diskusjon konkluderer med operabilitet, er invasiv preoperativ histopatologisk diagnostikk ikke nødvendig. Dersom man konkluderer med preoperativ onkologisk behandling bør man ta en biopsi før oppstart behandling.
Klassifikasjon og immunhistokjemi
De epiteliale thymussvulstene utgår fra epiteliale celler i mediastinalt eller ektopisk thymusvev og kjennetegnes ved thymus-lignende differensiering, med bl.a lobulært vekstmønster, perivaskulær oppklaring av stroma og tumorinfiltrerende, umodne T-lymfocytter. I WHO 2021-klassifikasjonen er det noen endringer i subtyping av epiteliale thymussvulster sammenlignet med tidligere klassifikasjoner. I tillegg er diagnostiske kriterier for de ulike subtypene angitt som «essensielle», samt «ønskelige» (Marx et al., 2022). For klassifisering og diagnostiske kriterier, se Tabell 13.
Thymussvulster uttrykker cytokeratiner, alltid AE1 subtyper, oftest subtyper 5/6 og 7, varierende subtyper 14 og 19. Ekspresjonsmønsteret av subtyper korrelerer i noen grad med type thymom. Thymuskarsinomer er ofte positive for CD5 og CD117. Lymfocyttpopulasjonene korrelerer i høy grad med thymomtype. Medullære thymocytter er T-celler som er CD3+, CD4+ eller CD8+, CD1a-, CD99- og TdT-, og B-celler som er CD20+. Kortikale thymocytter er T-celler som er CD3+, CD4+CD8+, CD1a+, CD99+ og TdT+.
Differensialdiagnoser avhenger av svulsttype. Viktigste differensialdiagnose ved thymom type A er thymom type B3, samt andre epiteliale og mesenchymale svulster. En aktuell differensialdiagnose ved thymom type B1 er T-lymfoblastisk lymfom. Differensialdiagnose ved thymom type B3 er på den ene siden thymom type A, og på den andre thymuskarsinom. Differensialdiagnose ved mistanke om thymuskarsinom er metastase, først og fremst fra lungekarsinom.
Anbefalte immunhistokjemiske undersøkelser er et panel med pan-cytokeratin, CD3, CD4, CD8, TdT, CD20, CD5 og CD117. Ved differensialdiagnose mot T-lymfoblastisk lymfom gjøres klonalitetsanalyse av T-cellereseptor genrearrangering. Ved differensialdiagnose mot metastase gjøres immunhistokjemisk farging for cytokeratinsubtyper og organspesifikke markører.
Molekylærpatolog
Genomiske data fra The Cancer Genome Atlas (TCGA) viser at GTF2I mutasjonen L424H er unik for thymomer (overall ca 38 %), med størst frekvens i thymom type A (nær 100 %) og AB (70 %) (Radovich et al., 2018). Andre gener som ofte er mutert i thymom, er HRAS, NRAS og TP53. Mutasjoner i HRAS forekommer overveiende i thymom type A og AB, mens mutasjoner i NRAS og TP53 er mere vanlig i thymom type B2 og B3, samt thymuskarsinom (Massoth et al., 2020). KMT2A-MAML2-fusjon er beskrevet i thymomer, men synes å være begrenset til type B2 og B3. YAP1-MAML2-fusjon er beskrevet i metaplastisk thymom. Forandringer i drivergener som er viktige ved behandlingsvalg er ikke detektert i thymom. Thymomer har lav tumormutasjonsbyrde (Radovich et al., 2018), og har ofte utbredt og sterkt uttrykk av PD-L1 (Padda et al., 2015).
Genomisk er det få likheter mellom thymom og thymuskarsinom. Vanligste genforandring i thymuskarsinom er tap av kromosom 16q. Forandringer i drivergener som er viktige for behandling er heller ikke detektert i thymuskarsinom. I likhet med thymomene, er det ofte utbredt og sterkt uttrykk av PD-L1 (Padda et al., 2015).
Diagnose | Nødvendige kriterier | Ønskelige kriterier | Kommentarer |
|---|---|---|---|
THYMOM | |||
Type A thymom (ca 11-12 %) |
| Sterkt uttrykk av epiteliale markører |
|
Type AB thymom (ca 25 %) |
| TdT ihk for vurdering av mengde TdT+ celler (utelukke type A, som er aktuell differensial diagnose) |
|
Type B1 thymom (ca 17 %) |
|
|
|
Type B2 thymom (ca 26-28 %) |
| Keratin, p40, p63: Uthever den økte tettheten av epiteliale celler
|
|
Type B3 thymom |
|
|
|
Mikronodulært thymom med lymfoid stroma |
lymfocyttrikt stroma uten epiteliale celler | CD20+/CD79a positive B-celler dominerer i lymfoid stroma |
|
Metaplastisk thymom |
|
|
|
Lipofibroadenom (sjelden, 6 rapporterte kasus) |
|
|
|
THYMUSKARSINOM (ca 20 % av epiteliale thymussvulster) | |||
Plateepitelkarsinom (ca 70-80 % av thymuskarsiomene) |
|
|
|
Basaloid karsinom (<5 % av thymuskarsinomene) |
| P40+ og/eller KIT (CD117)+Immunostaining Negative for TTF1, nevroendokrine markører og NUT |
|
Lymfoepitelialt karsinom (1,3-6 % av thymuskarsinomene) |
| EBER-ish ikke nødvendig for diagnose, men positiv EBER-ish støtter diagnosen
| Tumorcellene er postivie for pan-CK, p63 og p40. Varierende positivitet for CD5 og CD117 |
NUT karsinom (andel NUT karsinom i mediastinum/thymus vanskelig å anslå siden disse også kan oppstå i lunge og vokse inn i mediastinum) |
|
|
|
| Klarcellet karsinom (sjeldne; ca 25 rapporterte kasus) |
|
|
|
Lavgradig papillært karsinom (ca 3 % av thymuskarsinomene) |
| Ihk nødvendig for å utelukke metastase fra andre papillære svulster (lunge, pleura, gld. thyreoidea mm) |
|
Mucoepidermoid karsinom (ca 2,5 % av thymuskarsinomene) |
| Påvsning av MAML2 rearrangering støtter diagnosen, men fravær av MAML2 rearrangering utelukker ikke MEC |
|
Thymuskarsinom med adenoid cystisk karsinom (ACC) -lignende trekk (sjelden, < 10 rapporterte kasus) |
| Ihk:
| Vanligst lokalisasjon: Fremre mediastinum |
Enterisk type adenokarsinom (<5 % av thymuskarsinomene) |
| Ihk: Uttrykk for minst en av flg markører: CK20, CDX2, MUC2. | Metastase fra kolorektalt adenokarsinom eller adenokarsinom i lunge (intestinal/enterisk type) må utelukkes |
Adenokarsinom NOS (<5 % av adenokarsinomene)
|
| Ihk nødvendig for å ekskludere metastaser/andre adenokarsinom i thymus
| Ihk:
|
Adenoskvamøst karsinom (insidens ukjent) |
| Ihk: Uttrykk av p63/p40 og/eller CK5/6 i plateepitelkomponent |
|
Sarkomatoid karsinom (ca 2,5-10 % av thymuskarsinomene) Karsinosarkom |
| Ihk I noen tilfeller nødvendig (epiteliale markører, CD117) |
|
Udifferensiert karsinom (2,5 % av thymuskarsinomene) |
|
| Ihk/molekylære analyser må også inkludere uttrykk av NUT eller BRG1 (SMARCA4) eller forandringer i NUT1 (rearrangering) eller SMARCA4 (tap) |
Thymus karsinom NOS |
|
|
|
NEVROENDOKRINE NEOPLASMER | |||
Typisk karsinoid |
| Ihk:
| |
Atypisk karsinoid |
| ||
Nevroendokrine karsinom | |||
Småcellet karsinom |
|
|
|
Storcellet nevroendokrint karsinom |
| Påvisning av inaktiverende TP53 mutasjon og/eller tap av RB1 kan være til diagnostisk hjelp i noen kasus |
|
Besvarelse av biopsier og operasjonsresektat med epiteliale thymussvulster
Ved thymektomi bør kirurg merke preparatet slik at orientering bevares og medfølgende strukturer som innominate vener (høyre og venstre brachiocephalicus), lungevev, perikard og nervus phrenicus er tydelig identifiserbare. Ved umerket preparat tusjer patolog reseksjonsflatene, ev. med flere farger dersom orientering fremgår av makropreparatet.
I patologiremissen bør følgende fremgå: Pasient- og rekvirentidentifikasjon, relevante opplysninger om sykehistorie, i tillegg til radiologisk beskrivelse.
Besvarelse av små biopsier skal inneholde følgende: Type prosedyre/materiale, tumortype og subtype iht siste WHO klassifikasjon. Besvarelse av operasjonsresektat skal inneholde følgende informasjon:
- Type prosedyre (thymektomi, partiell thymektomi, annet)
- Tumors største diameter
- Histologisk type med subtype (se Tabell 13)
- Hvis thymom: Infiltrasjon/vekst gjennom kapsel skal angis (påvist/ikke påvist)
- Relasjon til eventuelle andre stukturer (mediastinalt fettvev, lungevev, mediastinale pleura, perikard, diafragma, andre strukturer).
- Tumors relasjon til reskesjonsrender (ufri/fri med korteste avstand)
- Karinfiltrasjon
- Lymfeknutestatus: totalt antall og antall med metastaser
- pTN (ev. pM)
- Eventuelle andre funn som fibrose, follikulær/epitelial hyperplasi, cystiske forandringer i tumor og andre forandringer
Spesifikt om immunhistokjemi, ikke-småcellet karsinom
Ved bruk av IHK for å skille mellom plate- og adenokarsinom, skal det brukes minimalt med markører for å sikre tilstrekkelig materiale til øvrige molekylære analyser (se Figur 14). Dobbeltfarging kan benyttes for å spare materiale.
PD-L1
Validert immunhistokjemisk test for PD-L1 skal gjøres som rutinemessig ledd i primærdiagnostikk («reflekstesting») på alle NSCC. Biopsimateriale anbefales, men cytologi kan også benyttes (Skov & Skov, 2017). Primært anbefales testkit med antistoff 22C3 (Dako), alternativt kan også antistoff SP263 (Ventana) benyttes. Andre PD-L1-antistoff anbefales ikke brukt. Andel tumorceller med PD-L1-uttrykk (tumor proportion score - TPS) skal angis med minimum følgende kategorier: <1 %, 1-49 %, 50-74 % og 75-100 % (se avsnitt "Førstelinjes behandling, ikke-plateepitelkarsinom, ikke-mutert i Medikamentell behandling i førstelinje) (Aguilar et al., 2018). PD-L1-uttrykket i immunceller vurderes ikke.
ALK og ROS1
Alle ikke-småcellete karsinom av ikke-plateepitelkarsinomtype skal testes for uttrykket av ALK og ROS1 protein i tumorcellene. Se Figur 14.
Spesifikt om molekylære analyser
Pga økende tilgang til målstyrt behandling, også via kliniske studier, er det nå mange gener som bør undersøkes mtp behandlingsrelevante forandringer (oppsummert i Tabell 14). Nestegenerasjonssekvensering (NGS) anbefales derfor framfor enkeltgenanalyser, men enkeltgenanalyser f.eks mtp EGFR- og KRAS-mutasjoner (hotpots) kan vurderes. Er det påvist mutasjoner i EGFR eller KRAS, er det ikke nødvendig med NGS siden forandringer i «driver-gener» som regel er gjensidig ekskluderende. Det er fortsatt ikke-småcellete karsinomer unntatt plateepitelkarsinom som skal testes. Siden resultat av molekylære analyser styrer behandlingsvalg for pasienter med avansert sykdom, er det viktig at resultatet av molekylære analyser foreligger innen < 10 arbeidsdager. For å unngå forsinkelser i behandlingsbeslutning anbefales det at molekylære analyser bestilles samtidig med eventuelle immunhistokjemiske analyser nødvendige for subklassifisering av tumor. Adjuvant behandling med osimertinib for pasienter med EGFR ekson 19-delesjoner eller L858R i ekson 21 forutsetter også at EGFR-status på pasienter som blir operert bør foreligge innen 14 dager etter operasjon, med mindre det er gjort analyse av diagnostisk biopsi..
For pasienter som er aktuelle for neoadjuvant kjemoimmunterapi, må EGFR- og ALK-svar (samt PD-L1) foreligge før beslutning om slik behandling tas.
Se for øvrig Figur 14.
Gen | Type genforandringer | Funksjon | Forekomst | Analysemetode | Pasientkarakteristika | Behandling | Kommentar |
|---|---|---|---|---|---|---|---|
EGFR | Mutasjoner (substitusjonsmutasjoner, InDels), ekson 18-21 | RTK | 12-15 % | DNA sekvensering | Ikke-røykere > røykere | Ja | Ekson 20-insersjoner ikke aktuell for standard terapi |
ALK | Rearrangering; | RTK | 2-5 % | IHK (screening), FISH, NGS | Ikke-røykere > røykere | Ja | IHK antistoff anbefalt:5A4 (Novocastra), D5F3 (Cell signaling) |
ROS1 | Rearrangering, mange fusjkonspartnere | RTK | 1-2 % | IHK (screening), FISH, NGS | Ikke-røykere > røykere | Ja | IHK antistoff anbefalt: D4D6 fra Cell Signaling Technology og SP384 fra Ventana Medical Systems |
KRAS | Substitusjonsmutasjoner; hotspots kodon 12, 13 og 61 |
| 30 % | DNA sekvensering | Røykere >> ikke-røykere | Ja, kliniske studier (kun G12C) |
|
BRAF | Substitusjonsmutasjoner (V600E) | Thr/Ser kinase | 2-3 % | DNA sekvensering |
| Ja | Non V600-mutasjoner ikke aktuell for BRAF-rettet behandling |
RET | Rearrangering | RTK | 1-2 % | FISH, NGS | Ikke-røykere > røykere | Ja |
|
ERBB2 (HER2) |
| RTK | 2 % | DNA sekvensering, FISH, IHK | Ikke-røykere > røykere | Ja, kliniske studier |
|
NTRK | Rearrangering | RTK | 1 % | IHK (screening), FISH, NGS |
| Ja | TRKA, TRKB og TRKC |
MET (Awad et al., 2016) |
| RTK | 3 % | Mutasjoner: DNA sekvensering Ekson 14 skipping: RNA-NGS/hybrid capture Amplifikasjon: FISH, NGS | Røykere > ikke-røykere | Ja | Ved påvist mutasjon i ekson 14 anbefales RNA basert NGS, ev. hybrid capture for påvisning av ekson 13-15 fusjonstranskript |
NRG1 | Rearrangering | Ligand til Erbb3 | Ca 0,3 % (alle typer NSCLC), ca 30 % IMA | FISH, NGS (RNA/hybrid capture) | Mucinøse adenokarsinom > andre ADC | Ja, kliniske studier | Inngår ikke i alle NGS-panel |
Forkortelser: RTK: reseptor tyrosin kinase; Thr: threonin; Ser: serin; InDels: insersjons og delesjonsmutasjoner; IMA: invasivt mucinøst adenokarsinom; ADC: adenokarsinom; FISH: fluorescens in situ hybridisering; NGS: nestegenerasjonsekvensering; IHK: immunhistokjemi.
Prøvetaking og molekylære analyser
Prøvetaker: Det er viktig å sikre mest mulig biopsimateriale/cytologisk materiale. Dersom det er tatt mange biopsier kan disse legges på separate glass. Dette kan bidra til en mer effektiv utnyttelse av materialet, da ulike glass kan brukes til ulike undersøkelser.
Prøvematerialet: Optimal fikseringstid for små er biopsier 6-12 timer. Lang fikseringstid, samt dekalsinering, kan medføre dårlig DNA- og RNA-kvalitet. Ved lite prøvemateriale bør patolog, ev. i samråd med kliniker, vurdere om molekylærpatologisk undersøkelse skal prioriteres foran ev. immunhistokjemisk undersøkelse.
Besvarelse av molekylære analyser
Det bør tilstrebes at resultat med tolkning av ev. relevante genforandringer kommer klart fram i rapporten. For oversikt over gener som er aktuelle for testing, se Tabell 14. Se også Figur 14. Den molekylærpatologiske svarrapporten bør inneholde følgende informasjon:
- Histologisk diagnose.
- Prosent andel neoplastiske celler i området som er benyttet for molekylærpatologisk undersøkelse.
- Molekylærpatologisk metode/plattform/kit.
- Hvilke gener/genområder som er undersøkt. Ved bruk av NGS angis hvilke gener panelet dekker (f.eks. som vedlegg).
- Resultat for relevante gener (se Tabell 14).
- Ved økt kopitall (NGS) for HER2 , anbefales supplerende immunhistokjemisk undersøkelse mtp uttrykket av HER2 i tumorcellene, eventuelt FISH for vurdering av HER2:kromosom 17-ratio og gjennomsnittlig antall HER2-kopier/cellekjerne. HER2 IHK/FISH vurderes iht kriteriene for brystkreft, intil det foreliger nternasjonale retningslinher for vurdering av HER2 abberasjoner i lungekreft.
- Ved øt kopitall (NGS) for MET bør FISH analyse vurderes, der både MET:kromosom 7-ratio og gjennomsnittlig antall MET kopier/cellekjerne angis.
- Ved rapportering av andre funn bør betydning og klinisk relevans av funnet kommenteres
- Det skal benyttes Human Genome Variation Society (HGVS) nomenklatur for angivelse av mutasjoner hvor koordinater oppgis både på nukleotid- og aminosyrenivå.
- Dersom materialet er uegnet for molekylære analyser skal årsak angis, f.eks om det er for lite tumorceller eller DNA tilstede, om det er dårlig DNA-kvalitet eventuelt andre årsaker
- Ved dårlig DNA kvalitet bør mulig årsak oppgis (lang fikseringstid, formalin-kvalitet, dekalsinert materiale)
EGFR analyser av plasma («flytende biopsi»)
Sirkulerende cellefritt tumor-DNA (ctDNA) er DNA som frigjøres til sirkulasjonen fra bl.a apoptotiske og nekrotiske tumorceller, og kan også sannsynligvis frigjøres fra levende tumorceller. I tilfeller hvor biopsitaking er vanskelig eller hvor biopsi/cytologisk materiale ikke er egnet for EGFR-analyse, kan validert EGFR-analyse av plasma brukes. Det er anbefalt og enten bruke Cobas EGFR Mutation test v.2 CE-IVD (Roche, Basel, Switzerland) som er godkjent av US Food and Drug Administration eller Therascreen mutation kits (Qiagen, Hilden, Germany) som er godkjent av European Medicines Agency. Analyser av ctDNA forutsetter optimal logistikk og metode for håndtering av blodprøve, nøye beregninger av deteksjonsgrenser, omfattende validering av metode og fortløpende kvalitetskontroll. Ved negative analyseresultat skal det angis at mutasjon ikke er detektert, men at dette ikke utelukker at mutasjon er tilstede i tumor. Når det gjelder preanalytisk håndtering av blod, henvises det til The European Committee for Standardization (CEN), Standardization and improvement of generic pre-analytical procedures for in vitro diagnostics for personalized medicine (SPIDIA4P) og International Organization for Standardization (ISO) for oppdaterte retningslinjer.
Anbefaling - histopatologisk diagnostikk
- Det anbefales å bevare så mye vev som mulig for molekylær testing. For subklassifisering av ikke-småcellete karsinomer, anbefales minimalt med immunhistokjemiske markører (TTF-1 og napsin A som adenokarsinommarkører, og p40 og CK5/6 som plateepitelkarsinommarkør).
- Hvis subtypebestemmelse ikke er mulig kan terminologien NSCC-NOS brukes, men spesifikk diagnose skal tilstrebes.
- AIS (adenokarsinom in situ), MIA (minimalt invasivt adenokarsinom), adenoskvamøst karsinom og storcellet karsinom diagnostiseres ikke i små biopsier eller cytologiske prøver.
- Alle ikke-småcellete karsinomer skal testes for PD-L1-uttrykk. Andel tumorceller med PD-L1-uttrykk skal angis med minimum følgende kategorier: <1 %, 1-49 %, 50-74 % og 75-100 %.
- Alle ikke-småcellete karsinomer ikke-plateepitelkarsinom bør undersøkes for mutasjoner i EGFR-, BRAF-, KRAS-, MET- og HER2-genene, for translokasjoner av ALK-, ROS1-, NTRK- og RET-genene, samt for fusjonstranskript mellom MET ekson 13 og ekson 15
- Nestegenerasjonssekvensering er å foretrekke for molekylære analyser.
Lungekreftscreening
Sist faglig oppdatert: 31.10.2024
Målsetning: Tidlig diagnostikk og behandling for primært å redusere dødeligheten i befolkningen ved en enkel, skånsom og lett tilgjengelig undersøkelsesmetode som kan tilbys en definert risikopopulasjon over hele landet (prinsippet om likeutredning og likebehandling), og metoden må være dokumentert kostnadseffektiv.
Generelle forutsetninger
WHO utarbeidet i 1968 en liste med forutsetninger for screening (J. M. Wilson & Jungner, 1968). Norge har også egne kriterier:
Tilstand
- Tilstanden skal være et viktig helseproblem
- Tilstandens naturlige forløp skal være tilstrekkelig kjent
- Tilstanden skal ha en symptomfri fase som kan detekteres
Test
- Det må finnes en sikker, presis og validert test
- Kriterier og prosedyrer for videre oppfølging av testpositive må være definert
- Testmetoden skal være akseptabel for målgruppen
Behandling
- Det må finnes tiltak eller behandling som gir bedre effekt i tidlig stadium enn ved klinisk diagnostikk
- Tiltak/behandling må være etablert og godt dokumentert
- Tiltak/behandling skal være akseptabel for målgruppen
Screeningprogrammet
- Screeningprogrammet skal redusere sykdomsspesifikk dødelighet eller sykelighet av tilstanden
- Helsegevinstene må være større enn de negative effektene
- Personvern og juridiske aspekter må være ivaretatt.
- Screeningprogrammet skal være akseptabelt fra et etisk perspektiv
- Informasjon om deltagelse i screeningprogrammet må være kunnskapsbasert og bidra til informerte valg.
Kostnader, økonomiske konsekvenser
- Screeningprogrammet skal tilfredsstille kravene til kostnadseffektivitet (Investeringskostnader, kostnader ved innføring av programmet (eller innføring av endringen som er foreslått), årlige kostnader til programmet, sammenliknet med 0-alternativ).
- Det må foreligge en plan for ledelse, kvalitetssikring og evaluering av programmet.
Utfordringer ved lungekreft-screening
Det er en rekke utfordringer ved en eventuell innføring av et screeningprogram for lungekreft. Blant annet er utvalgskriterier og kapasitet i utredning sentrale spørsmål. For en grundig drøfting av dette, vises til et publisert nordisk protokoll-forslag (Pedersen et al., 2017).
Lavdose CT-screening
Lavdose CT har vist å være effektiv for å diagnostisere lungekreft i tidlig stadium (Spiro, 2012). Men pga. for eksempel lead-time og length-time bias er tidlig diagnostikk ikke alltid ensbetydende med at lungekreftdødeligheten også blir redusert.
Gjennom de siste 10 år har flere internasjonale studier (Aberle et al., 2011; Aberle et al., 2013; Dominioni et al., 2012; Oken et al., 2011; Saghir et al., 2012) undersøkt effekten av screening. Særlig to studier har fokusert på lungekreftdødeligheten. Den første studien er en amerikansk studie med over 50 000 deltakere (NLST-studien), og denne har vist redusert lungekreftdødelighet på 20 % og reduksjon av totaldødelighet med 6,7 %. NLST sammenlikner screening med enten lavdose-CT eller rtg. toraks av risikoindivider i alderen 55-75 år og som har røykt minimum 30 pakkeår (Aberle et al., 2011). En lignende større europeisk randomisert studie fra Nederland og Belgia (NELSON-studien) med ca 16000 deltakere sammenligner lavdose CT med en kontrollgruppe som ikke får noen intervensjon. NELSON-studien viste at dødeligheten ble redusert mer enn det som var vist i NLST med signifikant dødelighets-reduksjon på 26 % hos menn og opp mot 60 % hos kvinner. I NELSON har man brukt volummålinger ved vurdering av kreftsuspekte noduli, hvilket kan forklare at et lavt antall noduli er blitt henvist til videre utredning (2,3 %) sammenholdt med NLST (27 %) (de Koning et al., 2020).
I Norge og i det fleste land i Europa har man ventet på resultater fra NELSON før man evt ville anbefale screening av høyrisiko-individer. Både European Respiratory Society (ERS) og European Society of Radiology (ESR) anbefaler innføring av screening med lavdose CT (Kauczor et al., 2015). EU kommisjonen publiserte 20. september 2022 en anbefaling om å utbygge lungekreft screenings program for høyrisiko personer imellom 50 -75 år (https://ec.europa.eu/commission/presscorner/detail/en/ip_22_5562).
Estimater gjort utfra tidligere studier og fra beregninger fra det norske folkehelseinstituttet viser at et sted mellom 60000 og 80000 storrøykere i aldersgruppen 55-75 år oppfyller kriteriene til å være med i et norsk lungekreft-screeningprogram. Et norsk gjennomføringsstudie for lungekreftscreening (TIDL), i tidligere Akershus fylke, ble i 2022 satt i gang etter støtte fra Kreftforeningen (https://kreftforeningen.no/en/lung-cancer-screenings-to-begin-in-norway/). Resultatene viser at interessen er stor blant befolkningen for et tilbud om lungekreftscreening, over 10 % av de 125 000 inviterte signerte samtykke for å delta i forskningsprosjektet og bli vurdert for screening. Det anbefales at røykeavvenning inngår som en sentral del av et etablert screeningprogram.
Konklusjon
NLST og NELSON har vist signifikant reduksjon i lungekreftdødeligheten ved screening med lavdose CT. Internasjonale faglige retningslinjer og EU kommisjonen anbefaler at lungekreftscreening gjennomføres. Også Norsk lungekreftgruppe mener lungekreftscreening bør etablere som et systematisk tilbud i Norge.
Kurativ behandling av ikke-småcellet lungekreft
Sist faglig oppdatert: 31.10.2024
Kirurgi eller stråleterapi kan gi helbredelse ved ikke-småcellet lungekreft i stadium I-III. Operasjon skal anbefales til pasienter i tidlige stadier som er medisinsk og teknisk operable. Hos pasienter i stadium I-III som er inoperable eller som ikke ønsker operasjon er strålebehandling et alternativ. Kjemoterapi alene er ikke kurativt, men kan sammen med kirurgi og/eller strålebehandling øke muligheten for helbredelse.
- I stadium I anbefales kirurgi alene, foruten pasienter i stadium Ib med EGFR-positiv sykdom, som kan vurderes for adjuvant EGFR-TKI.
- Inoperable pasienter i stadium I tilbys kurativ stråleterapi (stereotaksi)
- Operable pasienter i stadium II-III med PD-L1-negativ og EGFR-negativ sykdom anbefales kirurgi etterfulgt av adjuvant kjemoterapi
- Operable pasienter i stadium II-III med PD-L1-positiv og EGFR-negativ sykdom anbefales neoadjuvant kjemoimmunterapi etterfulgt av kirurgi, alternativt primær kirurgi etterfulgt av ev. adjuvant behandling
- Operable pasienter i stadium II-III med EGFR-positiv sykdom (uavhengig av PD-L1-uttrykk) anbefales kirurgi etterfulgt av adjuvant kjemoterapi og deretter adjuvant EGFR-TKI
- Inoperable pasienter i stadium II-III kan få strålebehandling, eventuelt kombinert med kjemoterapi, og etterfulgt av immunterapi ved EGFR-negativ, PD-L1-positiv sykdom.
Stadium III er en heterogen gruppe der optimal behandling differensieres i forhold til T- og N-stadium. Kurativ eller ikke-kurativ behandlingsintensjon må vurderes i forhold til definerte prognostiske faktorer. Allmenntilstand (performance status/ECOG-status) er det viktigste kriterium, og ved ECOG-status 2 eller dårligere er kurativt opplegg neppe indisert. Kirurgisk resektabilitet med hensyn til både T- og N-status må vurderes, en kan ikke regne med at neoadjuvant immunkjemoterapi vil krympe tumor. Alder, vekttap og tumorstørrelse må også tas i betraktning, men bør ikke enkeltvis være ekskluderende for kurativ intensjon. Pasienter med stadium III-sykdom og redusert allmenntilstand eller annen negativ prognostisk faktor er aktuelle for ikke-kurativ behandling, men bør likevel diskuteres i tverrfaglig møte (Se Kap. 8).
Figur 15 gir en skjematisk oversikt over pasienter i stadium I-III som er aktuelle for kirurgi og tilleggsbehandling.
Kirurgi
Sist faglig oppdatert: 31.10.2024
Reseksjon med kurativt siktemål er aktuelt ved behandling av lungekreft i stadium I og II. Det er vist at resultatene er bedre når kirurgien blir utført av spesialister i torakskirurgi ved sentre med et visst minimum antall årlige operasjoner (Al-Sahaf & Lim, 2015). Ved kirurgi må en alltid sette sanering av kreft som høyeste mål, og således alltid tilstrebe R0 reseksjon. Alikevel bør en tilstrebe skånsomhet ved operasjonen slik at luftlekkasje og drenstid blir minst mulig (Refai et al., 2011).
Indikasjoner
- cT1-3N0-1M0
- For sulcus superior, se kapittel Sulcus superior tumor (Pancoast-tumor) og lokalavanserte brystveggsvulster
- cT4N0-1M0 der T4-status reflekterer innvekst i resektabel mediastinal struktur (f eks carina, v. cava superior), virvelcorpus, eller i tilliggende lungelapp
- Resektabel tumor, N0 og kontralateral synkron tumor behandles som to primære lungekreft-tilfeller hvis begge er kurable
Spesielle situasjoner
N2-sykdom
Spredning til N2-lymfeknuter forverrer prognosen. Randomiserte studier har vist liten nytte av operasjon ved preoperativt påvist spredning til N2-lymfeknuter (Albain et al., 2009; van Meerbeeck et al., 2007), noe som understreker behovet for grundig mediastinal utredning. cN2-sykdom bør derfor ikke rutinemessig opereres utenfor spesifikke studier. Likevel kan det utfra data på subgrupper i nevnte studier, og andre ikke-randomiserte studier, være indikasjon for operasjon av utvalgte pasienter etter grundig diskusjon i tverrfaglig møte. Singel, liten N2-lymfeknute (< 3 cm) med liten primætumor kan være et slikt unntak.
Peroperativt oppdaget N2 (pN2) bør tilbys adjuvant behandling med kjemoterapi med start innen 8 uker, men ikke rutinemessig stråleterapi. Dersom ufri rand (R1-R2) kan postoperativ stråleterapi være aktuelt (se avsnitt "Postoperativ strålebehandling" i Strålebehandling). Rekkefølgen på strålebehandling og kjemoterapi er ikke sikkert avklart, men trolig er det gunstig å gi kjemoterapi før strålebehandling (Francis et al., 2017). Individuelle hensyn i forhold til alder, komorbiditet og allmenntilstand vil være avgjørende (Se også se avsnittene "Postoperativ strålebehandling" i Strålebehandling og "Adjuvant behandling etter kirurgi" i (Neo-)adjuvant medikamentell behandling).
Solitær eller oligometastatisk sykdom
Se avsnitt "Oligometastaser" samt "Hjernemetastaser" i Palliativ strålebehandling for hjernemetastaser.
Sulcus superior-tumor
Se eget kapittel Sulcus superior tumor (Pancoast-tumor) og lokalavanserte brystveggsvulster.
Karsinoider
Atypiske og typiske karsinoider opereres som NSCLC. Se kapittel "Kirurgi" i Typiske og atypiske karsinoide svulster.
Residiv
Intratorakalt residiv av NSCLC har dårlig prognose, men reseksjonsinngrep kan bedre overlevelsen (Hishida et al., 2006) og bør tilbys hvis mulig. Ved tvil om man står overfor residiv eller en metakron primærcancer, utføres utredning og behandling som ved primærcancer. Kurativ kjemoradioimmunterapi som ved stadium III kan vurderes (se avsnittet "Behandling ved stadium III").
Anbefaling - kurativ behandling ikke-småcellet lungekreft:
- Stadium I: Kirurgi alene. Stadium IB og EGFR-mutasjon: adjuvant EGFR-hemmer. Ved inoperabilitet: kurativ stråleterapi.
- Stadium II: Neoadjuvant kjemoimmunterapi før kirurgi, ev. kirurgi og adjuvant kjemoterapi, etterfulgt av adjuvant immunterapi ved PD-L1 > 50 % eller adjvuant EGFR-hemmer ved sensitiviserende EGFR-mutasjon. Ved inoperabilitet: Kurativ stråleterapi kombinert med kjemoterapi, etterfulgt av immunterapi ved PD-L1 ≥ 1 %.
- Stadium III: Dersom operabel sykdom: neoadjuvant kjemoimmunterapi før kirurgi, ev. kirurgi og adjuvant kjemoterapi, etterfulgt av adjuvant immunterapi ved PD-L1 > 50 % eller adjvuant EGFR-hemmer ved sensitiviserende EGFR-mutasjon. Ved inoperabilitet: Kurativ stråleterapi kombinert med kjemoterapi, etterfulgt av immunterapi ved PD-L1 ≥ 1 %.
- Ved R1/R2: Postoperativ stråleterapi kan vurderes etter adjuvant kjemoterapi.
Kirurgisk teknikk
Tilganger
Video-assistert torakoskopisk kirurgi (VATS) har blitt et foretrukket alternativ for lungekreft i stadium I-II, samt ved perifere svulster opp til 6 cm uten lymfeknuteinvolvering. Noen norske sykehus har også innført robot-assistert torakoskopisk kirurgi (RATS) som en videreføring av VATS (Veronesi, Novellis, Voulaz, & Alloisio, 2016). Den kirurgisk-onkologiske kvaliteten blir ikke kompromittert selv om inngrepet gjøres ved VATS (Berry, D'Amico, Onaitis, & Kelsey, 2014). Dersom dette ikke er mulig, kan det gjøres anterolateral muskelsparende torakotomi, evt posterolateral thorakotomi. VATS er vist å minske perioperative komplikasjoner og postoperativ smerte. VATS har også mindre negativ effekt på postoperativ lungefunksjon og immobilisering enn torakotomi, og er dermed å foretrekke på individer med dårlig lungefunksjon (Falcoz et al., 2015). Reseksjon via median sternotomi er aktuelt dersom det samtidig skal utføres hjertekirurgi.
Reseksjoner
Parenkym
Hoveddelen av kirurgiske reseksjoner utgjøres av lobektomier/bilobektomier og er gullstandard for behandling av primær lungekreft. Sublobære reseksjoner kan utføres dersom lungekapasiteten er lav og en ønsker å spare lungeparenkym. Bilobektomi kan gjøres ved høyresidig tumor ved overvekst på tilgrensede lapp. Pneumektomi utføres ved overvekst på samtlige lapper i en lunge eller ved tumorvekst som omfatter hovedbronkus.
Sublobære reseksjoner har høyere mortalitetet og økt risiko for lokalt residiv og skal kun vurderes hos individer med dårlig lungefunksjon. I slike situasjoner må en også vurdere morbiditeten av tilgangen (VATS vs. torakotomi) i forhold til resulterende morbiditet av volum lungevev fjernet (pneumektomi vs. lobektomi vs sublobær reseksjon) (McKenna et al., 2008). Sublobære reseksjoner har kurativt potensiale og er et alternativ til lobektomi ved svært begrenset lungefunksjon. En reseksjonskant på mer enn 2 cm ved større svulster og mer enn svulstens diameter er å foretrekke ved kilereseksjon av primær lungekreft. Segmentreseksjon er vist i flere studier å være et bedre alternativ enn ikke-anatomisk kilereseksjon (Kodama, Doi, Higashiyama, & Yokouchi, 1997). Stereotaktisk strålebehandling kan også være et alternativ i disse situasjonene (D. De Ruysscher, Nakagawa, & Asamura, 2014).
Dersom radikalitet ikke kan oppnås med lobektomi (på høyre side ev. bilobektomi), utføres pneumektomi eller sleeve lobektomi. Pneumektomi gir ofte betydelig funksjonsinnskrenkning og medfører økt risiko for peri- og postoperative komplikasjoner sammenliknet med lobektomier. Ved mindre overvekst på tilgrensende lapp, kan lobektomi pluss kile- eller segmentreseksjon overveies for å bevare lungevev og for å minske operasjonsrisikoen. Parenkymsparende inngrep (sleeve-reseksjon) bør derfor overveies også hos pasienter som anses å tåle pneumektomi (Ferguson & Lehman, 2003) [D].
Utvidet reseksjon
Dersom tumor vokser inn i toraksveggen, diafragma eller mediastinale strukturer utføres hvis mulig en bloc-reseksjon.
Lymfeknutedisseksjon
Ved lungekreftkirurgi bør en gjøre en reseksjon av hilære og mediastinale lymfeknuter. Dette kan gjøres som lymfeknute-sampling eller -disseksjon. Ved sampling henter en ut enkeltvise lymfeknuter fra hver ipsilaterale stasjon, mens en ved disseksjon tar bort alt vev, inkludert lymfeknuter, fettvev og bindevev, fra hver stasjon. Stasjonene må nøye nummereres etter IASLC sitt lymfeknutekart, 8. utgave (se avsnitt "Lymfeknute-oversikt, UICC 8. utgave" i Stadieinndeling (TNM)).
Hovedmotivet for å ta ut lymfeknuter er for å sikrest mulig bestemme pTNM for å kunne vurdere om adjuvant behandling skal gis. I European Society of Thoracic Surgeons (ESTS) guidelines anbefaler man å alltid gjøre systematisk disseksjon av alle lymfeknutestasjoner, så fremt det er mulig. Flere studier viser en trend mot bedret overlevelse ved lymfeknutedisseksjon sammenlignet med sampling. Det er også noen studier som ikke viser noen forskjell ved de forskjellige teknikkene.
Systematisk lymfeknutesampling er minstekrav ved lungekreftkirurgi fordi det gir en sikrere stadieinndeling, og i visse analyser, en trend mot bedre overlevelse.
Ufri reseksjonsrand eller infiltrasjon i visceral pleura
Re-reseksjon bør diskuteres påny på MDT møtet, men erfaringsmessig er reoperasjon sjelden aktuelt. Hvis det ikke ligger til rette for re-reseksjon, tilbys strålebehandling (se eget avsnitt) evt kombinert med kjemoterapi (Francis et al., 2017). NB! Merking av antatt ufrie områder med metallklips kan være til stor nytte for definisjon av målvolum ved evt påfølgende strålebehandling.
Infiltrasjon i viscerale pleura er ikke ensbetydende med ufri rand (altså fortsatt R0), men kan gi økt risiko for lokalt residiv. Merk at infiltrasjon i viscerale pleura gir økt T-stadium: T1a-c utfra størrelse blir T2a ved visceral infiltrasjon. Men T2a blir ikke T2b etc, og visceral infiltrasjon gir dermed ikke grunnlag for endret indikasjon for adjuvant kjemoterapi. Det diskuteres internasjonalt om store svulster (>5 cm) med dyp infiltrasjon (PL 2-3) kan ha nytte av postoperativ stråleterapi (Lakha, Gomez, Flores, & Wisnivesky, 2014), men foreløpig er evidensen ikke veldig sterk i fordel dette.
Anbefaling - kirurgi ikke-småcellet lungekreft:
- Lobektomi foretrekkes framfor sublobar reseksjon.
- En bloc-reseksjon tilstrebes ved innvekst i nabostrukturer.
- Det bør gjøres systematisk disseksjon av, eventuelt sampling fra, alle tilgjengelige lymfeknutestasjoner.
- Ved peroperativt påvist N2-sykdom forsøkes komplett ipsilateral lymfeknutedisseksjon.
- Ved ufri reseksjonsrand bør reoperasjon vurderes.
Strålebehandling
Sist faglig oppdatert: 31.10.2024
Pasienter i stadium I-III som er teknisk inoperable eller inoperable grunnet komorbiditet (medisinsk inoperable) samt pasienter som ikke vil opereres, vurderes for primær strålebehandling med kurativ intensjon.
Det er ikke publisert randomiserte studier som har sammenlignet kirurgisk behandling med kurativ fraksjonert strålebehandling, men det er publisert sammenslåtte data fra to små studier som randomiserte mellom lobektomi (n=27) og stereotaksi (n=31) (Chang et al., 2015). 3-års overlevelse hos gruppen som fikk stereotaksi var 95 %, mot 79 % hos de opererte (p=0,037).
Omlag 40 % av alle ikke-småcellet lungekreft er lokalavansert (st III) ved diagnosetidspunktet, og ved begrenset sykdom og god allmenntilstand er strålebehandling med kurativt siktemål aktuelt for disse. Se Non-kirurgisk behandling av stadium II/III.
Pasienter med ikke-småcellet lungekreft stadium I-III som er i dårlig allmenntilstand (ECOG 3-4) og/eller har betydelig spontant vekttap (større enn 5 % i 3 måneder eller større enn 10 % i 6 måneder), har en så dårlig prognose at det i de fleste tilfeller ikke er indisert med kurativ rettet behandling. Det forventes permanent lungefunksjonsnedsettelse ved dose over 20 Gy mot friskt lungevev. Derfor bør V20 (andel av totalt lungevolum, eksklusiv CTV, som mottar 20 Gy) ikke overstige 35 %. Radiokjemoterapi er ikke anbefalt hos pasienter med dårlig lungefunksjon (FEV1 < 1.0 L/s). Man kan i slike situasjoner tilby palliativ strålebehandling med et hypofraksjonert regime, evt kombinert med systemisk behandling. Se "Torakal bestråling" i Palliativ strålebehandling.
Preoperativ strålebehandling
Preoperativ strålebehandling er ikke indisert, bortsett fra ved Pancoast og ved lokalavansert sykdom med innvekst i brystvegg (T3N0) (se kapittel "Sulcus superior tumor (Pancoast-tumor) og lokalavanserte brystveggsvulster").
Postoperativ strålebehandling
Flere store analyser har vist at postoperativ strålebehandling gir dårligere overlevelse ved pN0 og pN1 sykdom, og en stor (n=501), moderne randomisert fase III-studie viste heller ikke nytte av postoperativ stråleterapi av radikalopererte med pN2-sykdom (Le Pechoux et al., 2022).
Derimot kan postoperativ strålebehandling redusere risiko for lokale residiver ved ufri reseksjon (mikroskopisk (R1) og makroskopisk (R2) irradikalitet; gjelder både innvekst i bronkialtre, mediastinum og pleura parietale) (Wang et al., 2015), men den absolutte nytten av stråleterapi også her er nok i stor grad ukjent. Det er derfor grunnlag for individuell vurdering, der pasientens syn også må vektlegges. Ulempen er først og fremst risiko for lunge- og hjertesekveler. Samtidig har man nå mer effektiv residivbehandling å tilby enn tidligere. Dersom man velger å avstå fra postoperativ strålebehandling bør disse pasientene kontrolleres noe hyppigere enn radikalopererte pga. høyere residivrisiko, for eksempel med CT hver 4. måned første 2 år. Se også Oppfølging og etterkontroll etter kurativ behandling for lungekreft.
Etter pneumektomi vil postoperativ stråleterapi neppe være aktuelt, pga redusert lungefunksjon og komplikasjonsfare. Også ved marginal lungefunksjon, bør man overveie å avstå fra strålebehandling.
Anbefaling - postoperativ stråleterapi:
- Postoperativ stråleterapi anbefales ikke verken ved pN0/pN1 eller pN2, ei heller ved infiltrasjon i pleura viscerale (PL1)
- Postoperativ stråleterapi kan vurderes ved mikroskopisk irradikalitet (R1), i så fall gis2 Gy x 30 = 60 Gy.
- Postoperativ stråleterapi kan vurderes ved makroskopisk irradikalitet (R2), i så fall gis 2 Gy x 30-35 = 60-70 Gy, eventuelt konkomitant med kjemoterapi som ved primær kjemoradiasjon.
Stereotaktisk strålebehandling
Strålebehandling med stereotaktisk teknikk er aktuelt ved inoperabel stadium I til T3N0-sykdom. Ved stereotaksi kan man gjennom bruk av mange feltretninger og gjerne ikke-koplanare felt, gi en adskillig høyere dose til tumorvev mens strålebelastningen til det friske vevet holdes på et akseptabelt lavt nivå. Det anvendes ekstrem hypofraksjonering, og et regime med 3 fraksjoner på 15-20 Gy (med biologisk effektiv totaldose tilsvarende over 100 Gy med konvensjonell fraksjonering) er mest brukt. I tillegg til denne radiobiologiske fordelen (høyere dose til tumor), er en slik behandling også pasientvennlig (kort behandlingstid) og den sparer apparattid.
Aktuelle svulster må ha begrenset størrelse (< 6 cm) og ved beliggenhet nær sentrale strukturer vurderes ofte flere (oftest 5-11) fraksjoner med lavere dose pr fraksjon.
Flere studier med stereotaksi ved stadium I ikke-småcellet lungekreft har vist lokal kontroll hos ca 90 % og 3-års sykdomsspesifikk overlevelse på 72-88 % av pasientene (Gulstene, Ruwanpura, Palma, & Joseph, 2022). Uansett alder har behandlingen en lav toksisitet (RTOG grad 3 toksisitet < 10 %) og risikoen for alvorlig senskade er under 3 %. En viktig faktor i risikoen for senskade er tumorens beliggenhet. Det er større risiko ved sentrale tumorer, spesielt de som ligger nær hovedbronkus og øsofagus (fare for fisteldannelse) (Lindberg et al., 2021). Stereotaksi er nå standardbehandling ved ikke-operabel stadium I ikke-småcellet lungekreft.
Protonterapi
Det er så langt ingen evidens for at protonbehandling av lungekreft gir bedre lokal kontroll, økt overlevelse eller mindre bivirkninger enn foton-basert strålebehandling (Z. Liao et al., 2018; Nantavithya et al., 2018; N. V. Patel et al., 2021). Protonstråling har følgelig ingen plass i rutinebehandling av lungekreft, men en rekke studier pågår og det kan bli aktuelt å inkludere pasienter i studier når de norske sentrene åpner (Mesko & Gomez, 2018).
Radiofrekvensablasjon (RFA)
Ved denne teknikken benyttes vekselstrøm til å danne høyfrekvente mikrobølger i en elektrode som under CT-veiledning føres inn i tumor. Oppvarming fører til vevsnekrose. Metoden har vist seg å være trygg og effektiv ved primære lever- og hjernetumores og brukes også ved lungesvulster (Palussière et al., 2021). Aktuelle for RFA er pasienter med histologisk verifisert sykdom med kontraindikasjoner mot kirurgi og strålebehandling, for eksempel ved residiv i tidligere bestrålt område. Inklusjonskriteriene omfatter største tumordiameter < 3 cm og > 1 cm avstand til sentrale blodkar eller luftveier. Behandlingen kan også gjentas. Dårlig hjerte/ lungefunksjon eller gjennomgått pneumektomi er eksklusjonskriterium. Pneumotoraks etter inngrepet er rapportert hos ca 15-42 % av pasientene (von Meyenfeldt et al., 2011).
(Neo-)adjuvant medikamentell behandling
Sist faglig oppdatert: 31.10.2024
Neoadjuvant kjemoimmunterapi
Tidligere er det vist at preoperativ (neoadjuvant) kjemoterapi har sammenlignbar effekt som postoperativ (adjuvant) kjemoterapi (Felip et al., 2010). Neoadjuvant behandling med kjemoterapi kombinert med immunterapi hos operable pasienter i stadium Ib til IIIa (TNM 7) har i fase III CheckMate 816-studien vist klart høyere grad av patologisk tumorrespons, bedre sykdomsfri overlevelse og tilsvarende bivirkningsprofil sammenlignet med kjemoterapi alene (Forde, Spicer, & Girard, 2022). I studien ble 358 pasienter (60% i stadium IIIa, og alle uten EGFR-mutasjoner eller ALK-translokasjoner) randomisert 1:1 til 3 sykler platinumdublett med eller uten nivolumab før operasjon. Det var i studien ingen øvre aldersgrense. Patologisk komplett respons (ingen gjenværende viable tumorceller i operasjonsresektatet) ble oppnådd hos 24,0 % av kombinasjonsgruppen, mot 2,2 % av de som kun fikk kjemoterapi. Hendelsesfri overlevelse (hendelse definert som progresjon, død, eller ikke gjennomført operasjon) etter 2 år var 63,8 % i kombinasjonsgruppen mot 45,3 % i kjemoterapigruppen (HR 0,63). Alvorlige behandlingsrelaterte bivirkninger (CTCAE grad 3-5) var sett hos 33,5 % i kombinasjonsgruppen og 36,9 % i kjemoterapigruppen, og bivirkninger som ledet til utsatt eller avlyst operasjon oppsto hos 4,5 % i kombinasjongruppen og 5,1 % i kjemoterapigruppen. Flere av de som fikk kombinasjonsbehandling ble operert enn de som fikk kjemoterapi alene (83 % vs. 75 %). To år etter randomisering var det bedre totaloverlevelse i kombinasjonsgruppen enn i kjemoterapigruppen (82,7 % vs. 70,6 %), men dette er foreløpig umodne tall. Subgruppeanalyser viste at effekten var større for pasienter i stadium III (HR 0,51) enn for stadium II (HR 0,81). Subgruppeanalyser av pasienter basert på PD-L1-nivå viste best effekt for pasienter med PD-L1-nivå ≥ 1 % (hendelsefri overlevelse ved 2 år hhv 76 % og 50%, HR 0,41). Behandlingsregimet er EMA-godkjent for operable pasienter med PD-L1 ≥1 %, stadium II og III (TNM 8) og uten EGFR- og ALK-forandringer.
Det pågår flere studier med tilsvarende design, men hvor også immunterapi i inntil 1 år etter operasjon er del av behandlingen. Noen av disse har publisert data i 2023 med lignende effekt- og bivirkningsdata som CheckMate 816-studien (Heymach et al., 2023; Wakelee et al., 2023). Ingen av disse har foreløpig ledet til EMA-godkjenning, og det er fortsatt uklart i hvilken grad postoperativ immunterapi gir tilleggseffekt.
På basis av CheckMate 816-studien anbefales operable pasienter uten påvist EGFR- eller ALK-forandringer, PD-L1-nivå ≥ 1%, i stadium II og III (TNM 8) å bli vurdert på regionalt MDT-møte for neoadjuvant kjemoimmunterapi. EGFR- og ALK-svar må foreligge før oppstart kjemoimmunterapi. Det gis 3 sykler nivolumab + kjemoterapi med 3 ukers mellomrom, etterfulgt av ny CT-evaluering (PET/CT anbefales ikke her) innen 3 uker etter siste kur og diskusjon på nytt MDT-møte for endelig operabilitetsvurdering. Operasjon bør gjøres innen 6 uker etter 3. kjemoimmunterapikur. For pasienter med non-plateepitelkarsinom anbefales kjemoterapikombinasjonen karboplatin (AUC 5) og pemetreksed (500 mg/kvm dag 1). Vitamin B12 og folsyre skal være startet minst 5 dager før første kur. For plateepitelkarsinomer anbefales karboplatin (AUC 5) og gemcitabin (1000 mg/kvm dag 1+8). Karboplatin kan eventuelt erstattes med cisplatin (75 mg/m2) uansett histologi, men både i Checkmate 816 og den senere publiserte Checkmate 77T-studien (perioperativ kjemoimmunterapi) (Cascone et al., 2024) synes effekten å være best hos pasienter som mottok karboplatin. Karboplatin (AUC 5) og paklitaksel (175 mg/kvm) kan være et alternativ uavhengig av histologi. Nivolumab doseres med 360 mg og gis samtidig med cellegift dag 1. Ved neutropeni grad 4 (nadir < 0,5 x109) bør kjemoterapidosen reduseres, og G-CSF kan vurderes ved neste kur(er).
Beslutningsforum vedtok 12.2.2024 følgende:
- Nivolumab (Opdivo) i kombinasjon med platinumbasert kjemoterapi innføres til neoadjuvant behandling av operabel ikke-småcellet lungekreft (NSCLC) med høy risiko for tilbakefall hos voksne pasienter hvor tumorer har PD-L1-ekspresjon ≥ 1%.
- Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
- Behandlingen kan tas i bruk fra beslutningstidspunktet
En oversikt over behandlingsforløpet for pasienter som er aktuelle for neoadjuvant eller adjuvant behandling er vist i Figur 16.
Anbefaling - neoadjuvant kjemoimmunterapi
- Operable pasienter i stadium II og III, som har tumor som uttrykker PD-L1 ≥ 1 %, og er EGFR- og ALK-negative, vurderes for neoadjuvant behandling.
- Det gis 3 kurer nivolumab og platinumdublett med 3 ukers mellomrom.
- Det skal tas ny CT 2-3 uker etter siste kur, og pasienten vurderes på nytt regionalt MDT-møte.
- Operasjon gjøres innen 6 uker etter siste infusjon
Adjuvant behandling etter kirurgi
Pasienter som har gjennomført neoadjuvant kjemoimmunterapi anbefales ikke adjuvant behandling. Dersom neoadjuvant behandling ikke er gitt, kan adjuvant kjemoterapi tilbys til pasienter med samme svulstkategorier som nevnt over (stadium II og III) basert på studier og metaanalyser som har vist gevinst i størrelsesorden 5-15 % økt 5-årsoverlevelse sammenlignet med kirurgi alene (Pignon et al., 2008; Winton et al., 2005). Effekt er ikke vist for pasienter med svulster under 4 cm uten lymfeknutemetastaser. Cisplatin/pemetreksed anbefales for pasienter med ikke-plateepitelkarsinom, mens cisplatin/vinorelbin anbefales for pasienter med plateepitelkarsinom (Kenmotsu et al., 2020; Kreuter et al., 2013). Karboplatin kan eventuelt erstatt cisplatin, spesielt hos eldre (Cuffe et al., 2012). Det gis inntil fire kurer.
I studiene ble adjuvant behandling anbefalt startet innen 8 uker, men det er også data som tyder på at senere start (opp til 4 måneder postoperativt) gir forbedret prognose sammenlignet med ingen adjuvant behandling (Salazar et al., 2017). Det er lite evidens for nytte av vekstfaktorstøtte (G-CSF), men dette kan eventuelt vurderes ved nøytropeniproblematikk som vanskeliggjør opprettholdelse av doseintensitet (Genova, Rijavec, & Grossi, 2016).
Ved storcellet nevroendokrint karsinom anbefales adjuvant kjemoterapi også ved stadium IB, med cisplatin/etoposid (se avsnitt "Medikamentell behandling" i Storcellet nevroendokrint karsinom (LCNEC)).
Immunterapi som adjuvant behandling
Hos pasienter med PD-L1-nivå ≥ 50 % som ikke har fått neoadjuvant kjemoimmunterapi, og som tilbys adjuvant kjemoterapi, kan også immunterapi tilbys. Dette er basert på en fase III studie (IMpower 010) som viste at 1 års behandling med atezolizumab (1200 mg iv hver 3. uke i inntil 1 år) økte 3-års sykdomsfri overlevelse hos pasienter i stadium II-IIIA og med PD-L1-uttrykk ≥ 50 % til 89,1 % hos de som hadde fått atezolizumab, mot 77,5 % i kontrollgruppen (HR 0,42) (Felip et al., 2021). Bivirkningsprofilen var som forventet ved immunterapi. Totaloverlevelsesdata er foreløpig umodne. Dette behandlingsregimet ble vurdert i Beslutningsforum 25.09.23 med følgende vedtak:
«Atezolizumab (Tecentriq) innføres som monoterapi til adjuvant behandling etter fullstendig reseksjon og platinabasert kjemoterapi av voksne pasienter med ikke-småcellet lungekreft (NSCLC) med høy risiko for tilbakefall der tumor har PD-L1-ekspresjon i ≥ 50 % av tumorcellene (TC) og som ikke har EGFR-mutant eller ALK positiv NSCLC.
Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
Behandlingen kan tas i bruk fra beslutningstidspunktet.»
Opererte med EGFR-mutasjon
Pasienter med operert EGFR-mutert ikke-småcellet lungekreft vil kunne ha nytte av adjuvant behandling med EGFR-hemmeren osimertinib. Det er publisert en fase III-studie som randomiserte 682 opererte pasienter i stadium IB-IIIA (TNM 7) med enten delesjon i ekson 19 eller punktmutasjonen L858R til 3 års behandling med enten placebo eller osimertinib 80 mg x1 p.o. (Y. L. Wu et al., 2020). Pasientene kunne ha fått standard adjuvant kjemoterapi før randomisering. Sykdomsfri overlevelse to år etter randomisering var markert bedre i gruppen som fikk osimertinib (89 %) sammenlignet med placebogruppen (52 %). Forskjellen var tydeligst hos pasienter som hadde sykdomsstadium II eller III (HR 0,17). Effekten var også signifikant i IB-gruppen (T-størrelse >3-5 cm, N0) med 4-års sykdomsfri overlevelse HR 0,41. Senere oppdatering har vist tilnærmet lik effekt for stadium IB i henhold til TNM 8 (n =199, T-størrelse > 3-4 cm, N0) med HR 0,44 (Herbst et al., 2023). Sannsynligheten for utvikling av hjernemetastaser var tydelig lavere i gruppen som fikk osimertinb (HR 0,24). Totaloverlevelsestallene er i favør osimertinib-behandling, med 5-årsoverlevelse på 88 % i osimertinibgruppen mot 78 % i placcebogruppen (Tsuboi et al., 2023), men det er verdt å kommentere at kun 42 % av pasientene i placebogruppen fikk osimertinib ved progresjon. Det var ingen forskjell i sykdomsfri overlevelse hos osimertinib-behandlede pasienter som hadde fått, eller ikke fått, adjuvant kjemoterapi før oppstart osimertinib. Det er derfor ikke opplagt at det er grunnlag for å gi kjemoterapi, men siden vi har langtidsoverlevelsesdata som viser signifikant positiv effekt av slik behandling er det trolig fornuftig å ikke utelate denne behandlingen til pasienter hvor dette kan være aktuelt (stadium II-III, god allmenntilstand).
Osimertinib som adjuvant behandling ble vurdert i Beslutningsforum 29.08.22 med følgende vedtak:
«Osimertinib (Tagrisso) som monoterapi innføres til adjuvant behandling etter fullstendig tumorreseksjon hos voksne med stadium IB-IIIA ikke-småcellet lungekreft (NSCLC) der tumor har epidermal vekstfaktor-reseptor (EGFR) ekson 19-delesjoner eller ekson 21 (L858R) substitusjonsmutasjoner.
Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
Behandlingen kan tas i bruk fra beslutningstidspunktet.»
Anbefaling - adjuvant medikamentell behandling
- Opererte pasienter i stadium II og III som ikke har fått neoadjuvant kjemoimmunterapi gis fire kurer cisplatin + pemetreksed (ikke-plateepitelkarsinom) eller cisplatin + vinorelbin (plateepitelkarsinom, eller dersom pemetreksed ikke kan gis). Cisplatin kanerstattes med karboplatin.
- Start innen åtte uker fra operasjonstidspunkt.
- Aktuelt hos pasienter ≤70 år i god allmenntilstand (ECOG 0-1).
- ”Biologisk unge” >70 år bør vurderes for adjuvant kjemoterapi, karboplatin kan da være et alternativ til cisplatin.
- I tillegg til kjemoterapi tilbys atezolizumab i 1 år ved PD-L1-uttrykk ≥ 50%, men ikke ved EGFR-mutasjon eller ALK-translokasjon.
- Radikalopererte pasienter i stadium IB til III med påvist EGFR-mutasjon (delesjon i ekson 19 eller L858R) bør vurderes for adjuvant behandling i inntil 3 år med osimertinib. Kjemoterapi før oppstart EGFR-TKI vurderes gitt til disse etter vanlige rutiner.
Opererte med ALK-translokasjon
Pasienter med operert ALK-translokert ikke-småcellet lungekreft vil kunne ha nytte av adjuvant behandling med ALK-hemmeren alektinib. Det er publisert en fase III-studie (ALINA-studien) som randomiserte 257 opererte pasienter i stadium IB-IIIA (TNM 7) med påvist ALK-traslokasjon til 2 års behandling med enten standard adjuvant kjemoterapi eller alektinib 600 mg x2 p.o. (Wu et al., 2024). Pasientene i alektinib-armen fikk ikke adjuvant kjemoterapi. Sykdomsfri overlevelse to år etter randomisering var markert bedre i gruppen som fikk alektinib (93,6 %) sammenlignet med kjemoterapigruppen (63,7 %, HR 0,24). Forskjellen var lik hos pasienter som hadde sykdomsstadium II eller III (HR 0,24). Sannsynligheten for utvikling av hjernemetastaser var også lavere i gruppen som fikk alektinib (CNS-sykdomsfri overlevelse etter 2 år var 98,4 % i alektinibgruppen mot 85,8 % i kjemoterapitgruppen, HR 0,22). Totaloverlevelsestallene er foreløpig umodne. Det var omtrent likt antall grad 3- og 4-bivirkninger i begge grupper (29,7 % for alektinibbehandlede og 30,8 % for kjemoterapibehandlede. Dosereduksjon og seponering pga bivirkninger forekom hos henholdsvis 25,8 % og 5,5 % av alektinibbehandlede pasienter.
Alektinib som adjuvant behandling er foreløig ikke vurdert av Beslutningsforum.
Adjuvant behandling etter steretotaksi
Adjuvant kjemoterapi før eller etter stereotaktisk stråleterapi er ikke analysert i prospektive studier. En publisert stor retrospektiv analyse viste at for pasienter i stadium T1-T3N0M0 var overlevelsen dårligere blant pasienter som hadde fått adjuvant kjemoterapi sammenlignet med ingen adjuvant behandling (Foster et al., 2019). En annen, mindre studie fant en lengre tid til residiv, men ingen bedret totaloverlevelse, blant pasienter som hadde fått adjuvant kjemoterapi (Kann et al., 2019). Det synes derfor rimelig å være varsom med adjuvant kjemoterapi etter stereotaksi, men slik behandling kan kanskje vurderes hos pasienter som er i god form (der stereotaksi er valgt pga pasientens ønske, og ikke pga medisinsk inoperabilitet), har stor svulst (>4 cm) og kjent histologi.
Anbefaling - adjuvant behandling etter stereotaksi for stadium I/II:
- Rutinemessig adjuvant behandling er ikke aktuelt etter stereotaktisk stråleterapi.
Non-kirurgisk behandling av stadium II/III
Sist faglig oppdatert: 31.10.2024
Medisinsk inoperable pasienter, eller pasienter som ikke ønsker kirurgi, i stadium II uten lymfeknutemetastaser bør vurderes for stereotaktisk stråleterapi (se avsnitt «Stereotaktisk strålebehandling» i Strålebehandling). I stadium II med N1-sykdom er konkomitant kjemoterapi etterfulgt av immunterapi (som stadium III) et alternativ til kirurgi (se avsnitt «Konkomitant kjemoradioterapi etterfulgt av immunterapi»).
Ubehandlet er prognosen i stadium III dårlig med 2 års overlevelse på 0-4 %, mens en metaanalyse viste ca 15 % 5-års overlevelse etter kombinert kjemoradioterapi (Aupérin et al., 2010). Konsoliderende immunterapi med preparatet durvalumab øker overlevelsen betydelig (se under).
Utfyllende informasjon om strålebehandling finnes i Faglige anbefalinger for strålebehandling ved ikke-småcellet lungekreft.
Konkomitant (samtidig) kjemoradioterapi er funnet mer effektiv enn sekvensiell behandling (Bi & Wang, 2015). Bivirkningene ved slik behandling kan være betydelige, og pasientene må derfor selekteres nøye. MR caput og PET/CT inngår i utredningen (se Oversikt utredning av lungekreft i spesialisthelsetjenesten). Ved tvil om pasienten er i stand til å gjennomføre konkomitant behandling, bør heller sekvensiell behandling velges, alternativt stråleterapi alene (D. De Ruysscher et al., 2009).
Konkomitant kjemoradioterapi etterfulgt av immunterapi
Ved konkomitant behandling gis kjemoterapi samtidig med strålebehandling, 2 Gy x 30-33. Ved store svulster som ikke ligger i nærheten av kritiske strukturer (hjerte, øsofagus, plexus) kan man overveie å eskalere dosen til 70 Gy. Pasienter som ikke er kandidat for kjemoradioterapi tilbys strålebehandling alene med 2 Gy x 33 – 35, totalt 66 – 70 Gy. Det er ikke konsensus hvilket kjemoterapiregime som er best (Bi & Wang, 2015). Vanligst brukt er 2 kurer platinumbasert kjemoterapi gitt med 3 ukers intervall. I Norge anbefales PV-regimet (se avsnitt «PV-regime» i Behandling av ikke-operabel begrenset sykdom, LS-SCLC), eventuelt cisplatin/vinorelbin. Første kur gis fra første eller andre strålebehandlingsdag. Det er svært begrenset med data på bruk av G-CSF ved konkomitant kjemotradioterapi ved ikke-småcellet lungekreft, og med moderne små strålefelt er trolig risikoen liten. Noen argumenterer for bruk av G-CSF ved neutropeni etter første kur, og dette er nå også implementert i enkelte internasjonale retningslinjer (Arrieta et al., 2020; Benna et al., 2020).
I en stor fase III-studie, «PACIFIC» ble opp til 12 måneders konsoliderende behandling med immunterapi med PD-L1-hemmeren durvalumab gitt til pasienter med lokalavansert ikke-resektabel sykdom etter konkomitant kjemoradiasjon (Antonia et al., 2017). Median progresjonsfri overlevelse var signifikant bedre med durvalumab versus placebo, med henholdsvis 16,8 måneder versus 5,6 måneder, p< 0.0001. Overlevelsesdata etter 34 mndr oppfølgningstid viste estimert 5-års overlevelse på 42,9 % i gruppen som fikk durvalumab mot 33,4 % i gruppen som fikk placebo (HR 0,72) (D. R. Spigel et al., 2022). Antall og alvorlighetsgrad av bivirkninger var sammenlignbare i de to armene. Pneumonitt eller strålepneumonitt hos pasienter som mottok durvalumab var for det meste lavgradig med få og et sammenlignbart antall grad 3- eller 4-tilfeller i de to gruppene.
Studien inkluderte også pasienter med EGFR- og ALK-positiv sykdom, men det er nå data som viser at immunterapi ikke er av nytte for disse pasientene (Arter & Nagasaka, 2024). EGFR-positive pasienter har nytte av EGFR-rettet behandling som beskrevet under i «Konkomitant kjemoradioterapi etterfulgt av EGFR-TKI hos EGFR-mutert NSCLC stadium III».
Durvalumab har markedsføringstillatelse til behandling av lokalavansert, inoperabel, ikke-småcellet lungekreft med PD‑L1-uttrykk ≥1 %, og med sykdom som ikke har progrediert etter platinabasert kjemoradiasjon. Denne behandlingen ble vurdert i Beslutningsforum 21.10.19 med følgende vedtak:
«Durvalumab (Imfinzi) kan innføres til behandling av lokalavansert, inoperabel ikke-småcellet lungekreft (NSCLC) hos voksne hvor tumor uttrykker PD-L1 ≥ 1 % av tumorcellene og med sykdom som ikke har progrediert etter platinabasert kjemoradiasjon.»
Durvalumab gis som intravenøs infusjon, 10 mg/kg hver 2. uke eller 1500 mg hver 4. uke, og bør startes innen 42 dager etter siste strålefraksjon. Det ble vist at tidlig oppstart korrelerer med bedre overlevelse ved at pasienter som ble randomisert innen 14 dager etter siste strålefraksjon hadde en HR=0,42, mot HR=0,81 ved randomisering senere enn 14 dager (Antonia et al., 2018). CT toraks og øvre abdomen som baseline 2-3 uker etter gjennomført kjemoradiasjon bør derfor tilstrebes. Behandlingen gis i inntil 1 år, eller til uakseptabel toksisitet (se Immunterapi: bivirkninger, behandlingsvarighet og annet) eller tilbakefall.
Skjematisk kan behandlingsopplegget framstilles som i Figur 17.
Konkomitant kjemoradioterapi etterfulgt av EGFR-TKI hos EGFR-mutert NSCLC stadium III
Pasienter med inoperabel NSCLC stadium III med påvist EGFR-mutasjon har ikke nytte av konsoliderende immunterapi som beskrevet over (Nassar et al., 2024).
I en stor fase III-studie, «LAURA» ble konsoliderende behandling med EGFR-hemmeren osimertinib gitt til pasienter med lokalavansert ikke-resektabel sykdom etter konkomitant kjemoradiasjon (Lu et al., 2024). Median progresjonsfri overlevelse var signifikant bedre med osimertinib versus placebo, med henholdsvis 39,1 måneder versus 5,6 måneder (HR 0,16, p < 0,001). Overlevelsesdata med foreløpig umodne data viste estimert 3-års overlevelse på 84 % i gruppen som fikk osimertinib mot 74 % i gruppen som fikk placebo (HR 0,81, p = 0,53). Bivirkninger av grad 3 og 4 forekom hos 35 % av osimertinib-behandlede pasienter, mot 12 % i placebogruppen. Pneumonitt eller strålepneumonitt var for det meste lavgradig i begge grupper, og forekom hos 48 % i osimertinib-gruppen og 38 % i placebogruppen.
Pasienter med radiologisk persisterende sykdom (non-komplett respons) etter kjemoradiasjon kan vurderes og behandles som ikke-kurert sykdom, og vurderes for osimertinib som i stadium IV.
Sekvensiell kjemoradioterapi stadium III
Ved tvil om toleransen for konkomitant kjemoradioterapi kan sekvensiell behandling gis med kjemoterapi før strålebehandling. Et platinumbasert kjemoterapi regime er anbefalt, 2 kurer før start av stråling. Immunterapi med durvalumab i inntil 1 år som beskrevet over kan vurderes også i disse situasjonene (sekvensiell kjemoterapi og radioterapi) utfra publiserte data (Garassino et al., 2022). Pasienter som ikke er kandidat for tillegg med kjemoterapi tilbys strålebehandling alene med 2 Gy x 33 – 35.
Anbefaling - kjemoradioimmunoterapi ved stadium III
- Konkomitant kjemoradioterapi anbefales: 2 Gy x 30-33 med to platinumbaserte cellegiftkurer med tre ukers intervall under strålebehandling.
- Durvalumab gis ved EGFR-/ALK-negativ sykdom som ikke har progrediert etter kjemoradioterapi, og med PD-L1-uttrykk i ≥ 1 % av tumorcellene: 10 mg/kg hver 2. uke eller 1500 mg hver 4. uke i inntil 12 måneder.
Sulcus superior tumor (Pancoast-tumor) og lokalavanserte brystveggsvulster
Sist faglig oppdatert: 31.10.2024
Pasienter med Pancoast-tumor (apikal lungetumor med affeksjon av apikale brystvegg med eller uten affeksjon av sympatiske nerveganglion og eventuelt Horners syndrom (Kozower, Larner, Detterbeck, & Jones, 2013; Pancoast, 1932)) har ofte lang overlevelse og mye smerter pga innvekst i lokale strukturer og/eller nerveaffeksjon. Disse bør vurderes på regionalt MDT med tanke på neoadjuvant kjemoimmunoterapi, se "Neoadjuvant kjemoimmunterapi" i (Neo-)adjuvant medikamentell behandling. Primært inoperable svulster kan gis radiokjemoterapi før ev. revurdering mtp operabilitet etter ca 44 Gy (Rusch et al., 2007). MR toraks kan være nødvendig. Ved fortsatt inoperabilitet kan stråleterapi kontinueres til 60-66 Gy, og 1 år durvalumab vurderes ved PD-L1 ≥ 1% (se 7.4.1).
Anbefaling - Pancoast-svulster
- Pancoast-svulster bør vurderes for neoadjuvant kjemoimmunterapi etterfulgt av kirurgi.
- Alternativt vurderes konkomitant strålebehandling (2 Gy x 25) med to kurer platinumbasert kjemoterapi med 3 ukers mellomrom. Operasjonsvurdering etter ca 44 Gy.
- Dersom fortsatt inoperabel kontinueres radioterapi til 60-66 Gy, etterfulgt av durvalumab ved PD-L1 ≥ 1 %.
Oppfølging og etterkontroll etter kurativ behandling for lungekreft
Sist faglig oppdatert: 31.10.2024
Hensikten med oppfølging etter behandling med kurativ intensjon er:
- Oppdage og håndtere eventuelle behandlingsrelaterte komplikasjoner i løpet av den første tiden
- Oppdage kurable tilbakefall av den primære lungekreften
- Oppdage evt ny primær lungekreft tidlig nok til at potensielt kurativ behandling kan gis
Forutsetningen for videre kontroller med henblikk på residiv eller ny tumor er at pasienten er aktuell for ytterligere behandling. Her vil postoperativ lungefunksjon, alder, pasientens ønske og funksjonsnivå være viktige elementer.
Oppfølging av komplikasjoner
Kirurgi
De vanligste komplikasjoner etter lungereseksjoner er redusert lungefunksjon og kroniske smerter (Nezu, Kushibe, Tojo, Takahama, & Kitamura, 1998).
Immunterapi
For mulige bivirkninger etter (neo-)adjuvant immunterapi, se "Bivirkninger ved immunterapi" i Immunterapi: bivirkninger, behandlingsvarighet og annet.
Strålebehandling
Komplikasjoner etter stråleterapi kan ramme lunger, hud, øsofagus, medulla, eller muskulatur (Fogh & Yom, 2014). Sjeldnere ser man skader på perikard og hjerte. Skadene kan være både akutte og kroniske. De akutte bivirkningene (se Nasjonalt program for strålebehandling) er som regel forbigående. Lungetoksisitet kan variere. Den øker med bestrålt volum og kumulativ stråledose. Toksisiteten ved en gitt totaldose er større dess kortere behandlingstid (Vogelius & Bentzen, 2012).
Lunge
Akutt strålepneumonitt inntrer typisk 4-12 uker etter oppstart strålebehandling, og kan ofte behandles vellykket med steroider, for eksempel prednisolon minst 1 mg/kg kroppsvekt daglig, deretter nedtrapping (Fogh & Yom, 2014).
Sen strålepneumonitt i fibrotisk fase oppstår gjerne etter 3-24 måneder, og representerer ofte en irreversibel lungeskade. Tilstanden oppstår hos om lag 8 % av pasientene (Cannon et al., 2013). Strålebehandling kan føre til tap av lungefunksjon selv om pasienten ikke opplever symptomer på pneumonitt (Mehta, 2005). Med dagens CT-baserte 3D-planlegging av strålefelt, eller med stereotaktisk teknikk (SBRT), kan en spare friskt vev og dermed også bevare lungefunksjonen i større grad enn med tidligere stråleteknikker (P. Baumann et al., 2008; Pia Baumann et al., 2009; Stanic et al., 2014).
I en ASTRO-QUANTEC-oversiktsartikkel er over 70 artikler med ulike dose-volum parametere og endepunkter for lunge gjennomgått. Til tross for usikkerhet knyttet til lungefunksjon før strålebehandling, kommer man med noen anbefalinger som begrenser risikoen for strålepneumonitt i forbindelse med planlegging for stråling:
- V20 (totalt lungevolum minus GTV som får 20 Gy eller mer) bør være < 35 %, V5 < 65 % og gjennomsnttlig lungedose (Mean Lung Dose, MLD) < 20 Gy (gjelder konvensjonell fraksjonering 2 Gy/fraksjon)
Øsofagus
Øsofagus eksponeres ofte ved kurativ strålebehandling av lokalavansert lungekreft. Akutt stråleøsofagitt oppstår under pågående behandling og kan variere i alvorlighetsgrad. I mange tilfeller kan pasienten oppleve dysfagi og/eller odynofagi i og rett etter behandlingsperioden. Som oftest er den forbigående og kan behandles med smertstillende, eventuelt med sondeernæring.
Senbivirkninger i øsofagus er som regel et resultat av fibrose og kan føre til strikturer eller fisteldannelse (Simone, 2017). Flere publikasjoner viser at konkomitant kjemoterapi øker risiko for skader i øsofagus. V60 (volumet i cm3 som har mottatt 60 Gy eller mer) korrelerte best med forekomst av øsofagitt (Bradley & Movsas, 2004). V60 = 15 cm3 vil gi ca. 30 % sannsynlighet for øsofagitt dersom stråleterapi blir gitt alene. Dersom V60 reduseres til 5 cm3 vil sannsynligheten synke til ca. 20 %. Med konkomitant kjemoterapi synes sannsynligheten å nær dobles for hvilken som helst verdi. I Thora-studien (SCLC) (Grønberg et al., 2021) brukte man gjennomsnittlig øsofagusdose (hele øsofagus tegnet inn) < 34 Gy som dosebegrensning.
Hjerte
Hjertetoksisitet blir sjelden rapportert som bivirkning ved strålebehandling av lungetumorer. Grunnen for dette er at det er få pasienter som er strålebehandlet for lungetumor som lever lenge nok til å utvikle hjertebivirkninger. Man kan forvente økende strålerelaterte hjertebivirkninger i takt med økende overlevelse som følge av mer effektiv behandling. Følgende totaldosenivå til hjertet kan gi signifikant risko for bivirkninger: Perikarditt ≥35 Gy, kardiomyopati ≥35 Gy, skade på koronararterien (≥30 Gy), klaffeskade (≥40 Gy) (Martinou & Gaya, 2013). Ischemisk hjertesykdom blir rapportert som den vanligste bidragsyteren til hjerterelaterte dødsfall. Det anbefales sterkt å begrense volumet av hjertet som bestråles til høye doser (> 35-40 Gy) så mye det lar seg gjøre uten å gå på bekostning av dekning av målvolumet. Følgende dosekrav anbefales: V50 Gy <25 %, V45 <60 %, V40 <80 %, mean heart dose (MHD) <20 Gy.
Medulla spinalis
Stråleindusert kronisk myelopati er en fryktet komplikasjon etter strålebehandling. Latensperioden synes å være bimodal med en insidens-topp ved 13 og 29 måneder. Maksdose på 50 Gy til medulla gir en frekvens på 0,2 % for stråleindusert myelopati, 6 % ved 60 Gy og 50 % ved 69 Gy (Schultheiss, 2008). Enkelte cytostatika er kjent å kunne ha en synergistisk effekt med stråling slik at toleransedosen reduseres, spesielt når kjemoterapi gis konkomitant. Dessverre foreligger det kun usikker dokumentasjon på denne synergieffekten og de fleste publikasjonene er basert på case-studier. Ved kombinasjonsbehandling skal det derfor vises aktsomhet i forhold til medullatoleranse og den kliniske vurderingen skal dokumenteres i pasientjournalen. Mange klinikker antar ca. 10 % reduksjon i medullatoleranse ved konkomitant kjemoterapi slik at toleransedosen settes ned til 45 Gy i flere stråleavdelinger i Norge.
Plexus brachialis
For plexus brachialis tilstrebes en dose < 60 Gy, men en dose på 66 Gy kan aksepteres. Risikoen for en klinisk manifest pleksopati (grad ≥ 2) vil da ikke overstige 5 %. NCCN-guidelines anbefaler en mediandose ≤ 69 Gy.Tumor-forårsaket pleksopati pga for lav stråledose kan være en større risiko enn stråleindusert pleksopati (Eblan et al., 2013).
Medikamentell behandling
De fleste bivirkninger av kjemoterapi inntrer under pågående behandling. Et unntak er perifer nevropati og oto- og nefrotoksisitet som kan oppstå også etter gjennomført behandling (Mao et al., 2007).
Oppfølging med hensyn til tumorresidiv
Residiv inntrer hyppig og kommer oftest innen fire år etter behandlingen, men om lag 10 % kan påvises opptil fem år eller senere (Bugge et al., 2018). Pasienter som på behandlingstidspunktet hadde lymfeknutemetastaser, har høyere residivrater og tidligere residiv. De fleste residiv oppdages som følge av symptomer (Chiu et al., 2003). Internasjonale retningslinjer anbefaler CT toraks i oppfølgingen av pasienter (Colt et al., 2013).
Oppfølging med hensyn til utvikling av ny primærtumor
Risikoen for å utvikle en ny primær lungekreft etter kurativ behandling av ikke-småcellet lungekreft er 0,5-2 % pr. år. Ny primær lungekreft kan utvikles mange år etter behandlingen av den opprinnelige svulsten.
Oppfølgingsintensitet og undersøkelsesmetoder
Det eksisterer ingen gode prospektiv sammenliknende studier på det mest effektive kontrollopplegg (Schmidt-Hansen, Baldwin, & Hasler, 2012). Noen pasienter vil kunne tilbys ny kirurgi ved begrenset tilbakefall eller ny tumor, med en rapportert 5-års overlevelse på henholdsvis mellom 8-40 % og 20-53 % (Mollberg & Ferguson, 2013; Rubins, Unger, Colice, & Physicians, 2007). For pasienter som ikke er operable kan stereotaktisk bestråling være aktuelt, med god lokal kontroll (Sonobe et al., 2014).
De fleste av de nye svulstene vil være asymptomatiske (Lou et al., 2013). For å oppdage residiv de første 2 årene anbefales derfor nå i en rekke internasjonale retningslinjer at kontrollene etter kurativ behandling bør gjøres med CT toraks med iv kontrast. Abdomen undersøkes altså ikke i diagnostisk kontrastfase, men toraksscanningen utvides til også å inkludere supraclavikulærregionen og binyrene, ved å utvide scanningsområdet til 5 cm over lungetoppen og under høyre leverspiss. De resterende kontrollene etter 2 år gjøres med lav-dose CT toraks for å evt oppdage nye primære svulster (Postmus et al., 2017; B. J. Schneider et al., 2020).
Selv om PET/CT er mer sensitiv enn CT har studier med PET/CT i oppfølging etter behandling ikke vist noen overlevelsesgevinst. PET/CT anbefales derfor ikke for kontroll etter behandling, men kan være aktuell ved utredning av nye svulster (Gorenberg, Bar-Shalom, & Israel, 2008; Takenaka et al., 2010).
Blodprøver med tumormarkører og fluorescens-bronkoskopi har ingen dokumentert plass i oppfølgingen av pasienter med lungekreft (Rubins et al., 2007), med unntak av blodprøver etter gjennomgått immunterapi. TSH, T4 mtp hyper-/hypotyreose, samt levermarkører mtp hepatitt kan da være aktuelt.
Evidens for valg av intervall og varighet av CT-kontroller foreligger ikke. Norsk praksis har vært å kontrollere pasientene i 5 år. Dog er dette individuelt og bør tilpasses den enkelte pasient hvor man tar hensyn til faktorer som alder og komobiditet. For noen pasienter kan det derfor være relevant med kontroll også etter 5 år med lavdose CT toraks hvert 2. år. Første kliniske kontroll bør gjøres ca 1 mnd etter operasjon. For pasienter som har fått neoadjuvant kjemoimmunterapi eller stereotaksi, bør kontroll med CT gjøres ca 12 uker etter operasjon/stereotaksi for å vurdere eventuell pneumonittutvikling, samt f.eks. immunterapirelaterte endokrinopatier.
Ikke-radikaloperte pasienter (R1/R2) som ikke har mottatt postoperativ strålebehandling bør kontrolleres noe hyppigere enn radikalopererte pga. høyere residivrisiko, for eksempel med CT hver 4. måned første 2 år (se også avsnitt «Postoperativ strålebehandling» i Strålebehandling).
Anbefaling - kontroller etter kurativ behandling
- En måned etter avsluttet kurativ behandling:
- Klinisk kontroll, ev. telefonisk kontakt (inkl vurdering av patologi-svar)
- For pasienter som har fått neoadjuvant kjemoimmunterapi eller kurativ stråleterapi:
- Klinisk undersøkelse og lab 3 mnd etter behandling, deretter som andre som har fått kurativ behandling.
- For andre som har fått kurativ behandling:
- Klinisk undersøkelse (og ev. lab etter immunterapi) og CT toraks inkl binyrer med kontrast 6, 12, 18 og 24 måneder etter avsluttet kurativ behandling:
- 3., 4. og 5. år:
- Sykehistorie og klinisk undersøkelse (ev. telefonkonsultasjon).
- CT toraks lavdose uten intravenøs kontrast.
- Kontroller utover 5 år kan vurderes hos utvalgte pasienter.
- Kontrollene bør gjennomføres i spesialisthelsetjenesten. Pasientene skal oppfordres til å ta kontakt ved nye symptomer eller forverring.
- PET/CT eller fluorescensbronkoskopi har ingen dokumentert rolle i oppfølgingen.
- Potensielt kurerte lungekreftpasienter som fortsatt røyker, oppfordres til røykeslutt.
Kirurgi
Sist faglig oppdatert: 31.10.2024
Reseksjon med kurativt siktemål er aktuelt ved behandling av lungekreft i stadium I og II. Det er vist at resultatene er bedre når kirurgien blir utført av spesialister i torakskirurgi ved sentre med et visst minimum antall årlige operasjoner (Al-Sahaf & Lim, 2015). Ved kirurgi må en alltid sette sanering av kreft som høyeste mål, og således alltid tilstrebe R0 reseksjon. Alikevel bør en tilstrebe skånsomhet ved operasjonen slik at luftlekkasje og drenstid blir minst mulig (Refai et al., 2011).
Indikasjoner
- cT1-3N0-1M0
- For sulcus superior, se kapittel Sulcus superior tumor (Pancoast-tumor) og lokalavanserte brystveggsvulster
- cT4N0-1M0 der T4-status reflekterer innvekst i resektabel mediastinal struktur (f eks carina, v. cava superior), virvelcorpus, eller i tilliggende lungelapp
- Resektabel tumor, N0 og kontralateral synkron tumor behandles som to primære lungekreft-tilfeller hvis begge er kurable
Spesielle situasjoner
N2-sykdom
Spredning til N2-lymfeknuter forverrer prognosen. Randomiserte studier har vist liten nytte av operasjon ved preoperativt påvist spredning til N2-lymfeknuter (Albain et al., 2009; van Meerbeeck et al., 2007), noe som understreker behovet for grundig mediastinal utredning. cN2-sykdom bør derfor ikke rutinemessig opereres utenfor spesifikke studier. Likevel kan det utfra data på subgrupper i nevnte studier, og andre ikke-randomiserte studier, være indikasjon for operasjon av utvalgte pasienter etter grundig diskusjon i tverrfaglig møte. Singel, liten N2-lymfeknute (< 3 cm) med liten primætumor kan være et slikt unntak.
Peroperativt oppdaget N2 (pN2) bør tilbys adjuvant behandling med kjemoterapi med start innen 8 uker, men ikke rutinemessig stråleterapi. Dersom ufri rand (R1-R2) kan postoperativ stråleterapi være aktuelt (se avsnitt "Postoperativ strålebehandling" i Strålebehandling). Rekkefølgen på strålebehandling og kjemoterapi er ikke sikkert avklart, men trolig er det gunstig å gi kjemoterapi før strålebehandling (Francis et al., 2017). Individuelle hensyn i forhold til alder, komorbiditet og allmenntilstand vil være avgjørende (Se også se avsnittene "Postoperativ strålebehandling" i Strålebehandling og "Adjuvant behandling etter kirurgi" i (Neo-)adjuvant medikamentell behandling).
Solitær eller oligometastatisk sykdom
Se avsnitt "Oligometastaser" samt "Hjernemetastaser" i Palliativ strålebehandling for hjernemetastaser.
Sulcus superior-tumor
Se eget kapittel Sulcus superior tumor (Pancoast-tumor) og lokalavanserte brystveggsvulster.
Karsinoider
Atypiske og typiske karsinoider opereres som NSCLC. Se kapittel "Kirurgi" i Typiske og atypiske karsinoide svulster.
Residiv
Intratorakalt residiv av NSCLC har dårlig prognose, men reseksjonsinngrep kan bedre overlevelsen (Hishida et al., 2006) og bør tilbys hvis mulig. Ved tvil om man står overfor residiv eller en metakron primærcancer, utføres utredning og behandling som ved primærcancer. Kurativ kjemoradioimmunterapi som ved stadium III kan vurderes (se avsnittet "Behandling ved stadium III").
Anbefaling - kurativ behandling ikke-småcellet lungekreft:
- Stadium I: Kirurgi alene. Stadium IB og EGFR-mutasjon: adjuvant EGFR-hemmer. Ved inoperabilitet: kurativ stråleterapi.
- Stadium II: Neoadjuvant kjemoimmunterapi før kirurgi, ev. kirurgi og adjuvant kjemoterapi, etterfulgt av adjuvant immunterapi ved PD-L1 > 50 % eller adjvuant EGFR-hemmer ved sensitiviserende EGFR-mutasjon. Ved inoperabilitet: Kurativ stråleterapi kombinert med kjemoterapi, etterfulgt av immunterapi ved PD-L1 ≥ 1 %.
- Stadium III: Dersom operabel sykdom: neoadjuvant kjemoimmunterapi før kirurgi, ev. kirurgi og adjuvant kjemoterapi, etterfulgt av adjuvant immunterapi ved PD-L1 > 50 % eller adjvuant EGFR-hemmer ved sensitiviserende EGFR-mutasjon. Ved inoperabilitet: Kurativ stråleterapi kombinert med kjemoterapi, etterfulgt av immunterapi ved PD-L1 ≥ 1 %.
- Ved R1/R2: Postoperativ stråleterapi kan vurderes etter adjuvant kjemoterapi.
Kirurgisk teknikk
Tilganger
Video-assistert torakoskopisk kirurgi (VATS) har blitt et foretrukket alternativ for lungekreft i stadium I-II, samt ved perifere svulster opp til 6 cm uten lymfeknuteinvolvering. Noen norske sykehus har også innført robot-assistert torakoskopisk kirurgi (RATS) som en videreføring av VATS (Veronesi, Novellis, Voulaz, & Alloisio, 2016). Den kirurgisk-onkologiske kvaliteten blir ikke kompromittert selv om inngrepet gjøres ved VATS (Berry, D'Amico, Onaitis, & Kelsey, 2014). Dersom dette ikke er mulig, kan det gjøres anterolateral muskelsparende torakotomi, evt posterolateral thorakotomi. VATS er vist å minske perioperative komplikasjoner og postoperativ smerte. VATS har også mindre negativ effekt på postoperativ lungefunksjon og immobilisering enn torakotomi, og er dermed å foretrekke på individer med dårlig lungefunksjon (Falcoz et al., 2015). Reseksjon via median sternotomi er aktuelt dersom det samtidig skal utføres hjertekirurgi.
Reseksjoner
Parenkym
Hoveddelen av kirurgiske reseksjoner utgjøres av lobektomier/bilobektomier og er gullstandard for behandling av primær lungekreft. Sublobære reseksjoner kan utføres dersom lungekapasiteten er lav og en ønsker å spare lungeparenkym. Bilobektomi kan gjøres ved høyresidig tumor ved overvekst på tilgrensede lapp. Pneumektomi utføres ved overvekst på samtlige lapper i en lunge eller ved tumorvekst som omfatter hovedbronkus.
Sublobære reseksjoner har høyere mortalitetet og økt risiko for lokalt residiv og skal kun vurderes hos individer med dårlig lungefunksjon. I slike situasjoner må en også vurdere morbiditeten av tilgangen (VATS vs. torakotomi) i forhold til resulterende morbiditet av volum lungevev fjernet (pneumektomi vs. lobektomi vs sublobær reseksjon) (McKenna et al., 2008). Sublobære reseksjoner har kurativt potensiale og er et alternativ til lobektomi ved svært begrenset lungefunksjon. En reseksjonskant på mer enn 2 cm ved større svulster og mer enn svulstens diameter er å foretrekke ved kilereseksjon av primær lungekreft. Segmentreseksjon er vist i flere studier å være et bedre alternativ enn ikke-anatomisk kilereseksjon (Kodama, Doi, Higashiyama, & Yokouchi, 1997). Stereotaktisk strålebehandling kan også være et alternativ i disse situasjonene (D. De Ruysscher, Nakagawa, & Asamura, 2014).
Dersom radikalitet ikke kan oppnås med lobektomi (på høyre side ev. bilobektomi), utføres pneumektomi eller sleeve lobektomi. Pneumektomi gir ofte betydelig funksjonsinnskrenkning og medfører økt risiko for peri- og postoperative komplikasjoner sammenliknet med lobektomier. Ved mindre overvekst på tilgrensende lapp, kan lobektomi pluss kile- eller segmentreseksjon overveies for å bevare lungevev og for å minske operasjonsrisikoen. Parenkymsparende inngrep (sleeve-reseksjon) bør derfor overveies også hos pasienter som anses å tåle pneumektomi (Ferguson & Lehman, 2003) [D].
Utvidet reseksjon
Dersom tumor vokser inn i toraksveggen, diafragma eller mediastinale strukturer utføres hvis mulig en bloc-reseksjon.
Lymfeknutedisseksjon
Ved lungekreftkirurgi bør en gjøre en reseksjon av hilære og mediastinale lymfeknuter. Dette kan gjøres som lymfeknute-sampling eller -disseksjon. Ved sampling henter en ut enkeltvise lymfeknuter fra hver ipsilaterale stasjon, mens en ved disseksjon tar bort alt vev, inkludert lymfeknuter, fettvev og bindevev, fra hver stasjon. Stasjonene må nøye nummereres etter IASLC sitt lymfeknutekart, 8. utgave (se avsnitt "Lymfeknute-oversikt, UICC 8. utgave" i Stadieinndeling (TNM)).
Hovedmotivet for å ta ut lymfeknuter er for å sikrest mulig bestemme pTNM for å kunne vurdere om adjuvant behandling skal gis. I European Society of Thoracic Surgeons (ESTS) guidelines anbefaler man å alltid gjøre systematisk disseksjon av alle lymfeknutestasjoner, så fremt det er mulig. Flere studier viser en trend mot bedret overlevelse ved lymfeknutedisseksjon sammenlignet med sampling. Det er også noen studier som ikke viser noen forskjell ved de forskjellige teknikkene.
Systematisk lymfeknutesampling er minstekrav ved lungekreftkirurgi fordi det gir en sikrere stadieinndeling, og i visse analyser, en trend mot bedre overlevelse.
Ufri reseksjonsrand eller infiltrasjon i visceral pleura
Re-reseksjon bør diskuteres påny på MDT møtet, men erfaringsmessig er reoperasjon sjelden aktuelt. Hvis det ikke ligger til rette for re-reseksjon, tilbys strålebehandling (se eget avsnitt) evt kombinert med kjemoterapi (Francis et al., 2017). NB! Merking av antatt ufrie områder med metallklips kan være til stor nytte for definisjon av målvolum ved evt påfølgende strålebehandling.
Infiltrasjon i viscerale pleura er ikke ensbetydende med ufri rand (altså fortsatt R0), men kan gi økt risiko for lokalt residiv. Merk at infiltrasjon i viscerale pleura gir økt T-stadium: T1a-c utfra størrelse blir T2a ved visceral infiltrasjon. Men T2a blir ikke T2b etc, og visceral infiltrasjon gir dermed ikke grunnlag for endret indikasjon for adjuvant kjemoterapi. Det diskuteres internasjonalt om store svulster (>5 cm) med dyp infiltrasjon (PL 2-3) kan ha nytte av postoperativ stråleterapi (Lakha, Gomez, Flores, & Wisnivesky, 2014), men foreløpig er evidensen ikke veldig sterk i fordel dette.
Anbefaling - kirurgi ikke-småcellet lungekreft:
- Lobektomi foretrekkes framfor sublobar reseksjon.
- En bloc-reseksjon tilstrebes ved innvekst i nabostrukturer.
- Det bør gjøres systematisk disseksjon av, eventuelt sampling fra, alle tilgjengelige lymfeknutestasjoner.
- Ved peroperativt påvist N2-sykdom forsøkes komplett ipsilateral lymfeknutedisseksjon.
- Ved ufri reseksjonsrand bør reoperasjon vurderes.
Strålebehandling
Sist faglig oppdatert: 31.10.2024
Pasienter i stadium I-III som er teknisk inoperable eller inoperable grunnet komorbiditet (medisinsk inoperable) samt pasienter som ikke vil opereres, vurderes for primær strålebehandling med kurativ intensjon.
Det er ikke publisert randomiserte studier som har sammenlignet kirurgisk behandling med kurativ fraksjonert strålebehandling, men det er publisert sammenslåtte data fra to små studier som randomiserte mellom lobektomi (n=27) og stereotaksi (n=31) (Chang et al., 2015). 3-års overlevelse hos gruppen som fikk stereotaksi var 95 %, mot 79 % hos de opererte (p=0,037).
Omlag 40 % av alle ikke-småcellet lungekreft er lokalavansert (st III) ved diagnosetidspunktet, og ved begrenset sykdom og god allmenntilstand er strålebehandling med kurativt siktemål aktuelt for disse. Se Non-kirurgisk behandling av stadium II/III.
Pasienter med ikke-småcellet lungekreft stadium I-III som er i dårlig allmenntilstand (ECOG 3-4) og/eller har betydelig spontant vekttap (større enn 5 % i 3 måneder eller større enn 10 % i 6 måneder), har en så dårlig prognose at det i de fleste tilfeller ikke er indisert med kurativ rettet behandling. Det forventes permanent lungefunksjonsnedsettelse ved dose over 20 Gy mot friskt lungevev. Derfor bør V20 (andel av totalt lungevolum, eksklusiv CTV, som mottar 20 Gy) ikke overstige 35 %. Radiokjemoterapi er ikke anbefalt hos pasienter med dårlig lungefunksjon (FEV1 < 1.0 L/s). Man kan i slike situasjoner tilby palliativ strålebehandling med et hypofraksjonert regime, evt kombinert med systemisk behandling. Se "Torakal bestråling" i Palliativ strålebehandling.
Preoperativ strålebehandling
Preoperativ strålebehandling er ikke indisert, bortsett fra ved Pancoast og ved lokalavansert sykdom med innvekst i brystvegg (T3N0) (se kapittel "Sulcus superior tumor (Pancoast-tumor) og lokalavanserte brystveggsvulster").
Postoperativ strålebehandling
Flere store analyser har vist at postoperativ strålebehandling gir dårligere overlevelse ved pN0 og pN1 sykdom, og en stor (n=501), moderne randomisert fase III-studie viste heller ikke nytte av postoperativ stråleterapi av radikalopererte med pN2-sykdom (Le Pechoux et al., 2022).
Derimot kan postoperativ strålebehandling redusere risiko for lokale residiver ved ufri reseksjon (mikroskopisk (R1) og makroskopisk (R2) irradikalitet; gjelder både innvekst i bronkialtre, mediastinum og pleura parietale) (Wang et al., 2015), men den absolutte nytten av stråleterapi også her er nok i stor grad ukjent. Det er derfor grunnlag for individuell vurdering, der pasientens syn også må vektlegges. Ulempen er først og fremst risiko for lunge- og hjertesekveler. Samtidig har man nå mer effektiv residivbehandling å tilby enn tidligere. Dersom man velger å avstå fra postoperativ strålebehandling bør disse pasientene kontrolleres noe hyppigere enn radikalopererte pga. høyere residivrisiko, for eksempel med CT hver 4. måned første 2 år. Se også Oppfølging og etterkontroll etter kurativ behandling for lungekreft.
Etter pneumektomi vil postoperativ stråleterapi neppe være aktuelt, pga redusert lungefunksjon og komplikasjonsfare. Også ved marginal lungefunksjon, bør man overveie å avstå fra strålebehandling.
Anbefaling - postoperativ stråleterapi:
- Postoperativ stråleterapi anbefales ikke verken ved pN0/pN1 eller pN2, ei heller ved infiltrasjon i pleura viscerale (PL1)
- Postoperativ stråleterapi kan vurderes ved mikroskopisk irradikalitet (R1), i så fall gis2 Gy x 30 = 60 Gy.
- Postoperativ stråleterapi kan vurderes ved makroskopisk irradikalitet (R2), i så fall gis 2 Gy x 30-35 = 60-70 Gy, eventuelt konkomitant med kjemoterapi som ved primær kjemoradiasjon.
Stereotaktisk strålebehandling
Strålebehandling med stereotaktisk teknikk er aktuelt ved inoperabel stadium I til T3N0-sykdom. Ved stereotaksi kan man gjennom bruk av mange feltretninger og gjerne ikke-koplanare felt, gi en adskillig høyere dose til tumorvev mens strålebelastningen til det friske vevet holdes på et akseptabelt lavt nivå. Det anvendes ekstrem hypofraksjonering, og et regime med 3 fraksjoner på 15-20 Gy (med biologisk effektiv totaldose tilsvarende over 100 Gy med konvensjonell fraksjonering) er mest brukt. I tillegg til denne radiobiologiske fordelen (høyere dose til tumor), er en slik behandling også pasientvennlig (kort behandlingstid) og den sparer apparattid.
Aktuelle svulster må ha begrenset størrelse (< 6 cm) og ved beliggenhet nær sentrale strukturer vurderes ofte flere (oftest 5-11) fraksjoner med lavere dose pr fraksjon.
Flere studier med stereotaksi ved stadium I ikke-småcellet lungekreft har vist lokal kontroll hos ca 90 % og 3-års sykdomsspesifikk overlevelse på 72-88 % av pasientene (Gulstene, Ruwanpura, Palma, & Joseph, 2022). Uansett alder har behandlingen en lav toksisitet (RTOG grad 3 toksisitet < 10 %) og risikoen for alvorlig senskade er under 3 %. En viktig faktor i risikoen for senskade er tumorens beliggenhet. Det er større risiko ved sentrale tumorer, spesielt de som ligger nær hovedbronkus og øsofagus (fare for fisteldannelse) (Lindberg et al., 2021). Stereotaksi er nå standardbehandling ved ikke-operabel stadium I ikke-småcellet lungekreft.
Protonterapi
Det er så langt ingen evidens for at protonbehandling av lungekreft gir bedre lokal kontroll, økt overlevelse eller mindre bivirkninger enn foton-basert strålebehandling (Z. Liao et al., 2018; Nantavithya et al., 2018; N. V. Patel et al., 2021). Protonstråling har følgelig ingen plass i rutinebehandling av lungekreft, men en rekke studier pågår og det kan bli aktuelt å inkludere pasienter i studier når de norske sentrene åpner (Mesko & Gomez, 2018).
Radiofrekvensablasjon (RFA)
Ved denne teknikken benyttes vekselstrøm til å danne høyfrekvente mikrobølger i en elektrode som under CT-veiledning føres inn i tumor. Oppvarming fører til vevsnekrose. Metoden har vist seg å være trygg og effektiv ved primære lever- og hjernetumores og brukes også ved lungesvulster (Palussière et al., 2021). Aktuelle for RFA er pasienter med histologisk verifisert sykdom med kontraindikasjoner mot kirurgi og strålebehandling, for eksempel ved residiv i tidligere bestrålt område. Inklusjonskriteriene omfatter største tumordiameter < 3 cm og > 1 cm avstand til sentrale blodkar eller luftveier. Behandlingen kan også gjentas. Dårlig hjerte/ lungefunksjon eller gjennomgått pneumektomi er eksklusjonskriterium. Pneumotoraks etter inngrepet er rapportert hos ca 15-42 % av pasientene (von Meyenfeldt et al., 2011).
(Neo-)adjuvant medikamentell behandling
Sist faglig oppdatert: 31.10.2024
Neoadjuvant kjemoimmunterapi
Tidligere er det vist at preoperativ (neoadjuvant) kjemoterapi har sammenlignbar effekt som postoperativ (adjuvant) kjemoterapi (Felip et al., 2010). Neoadjuvant behandling med kjemoterapi kombinert med immunterapi hos operable pasienter i stadium Ib til IIIa (TNM 7) har i fase III CheckMate 816-studien vist klart høyere grad av patologisk tumorrespons, bedre sykdomsfri overlevelse og tilsvarende bivirkningsprofil sammenlignet med kjemoterapi alene (Forde, Spicer, & Girard, 2022). I studien ble 358 pasienter (60% i stadium IIIa, og alle uten EGFR-mutasjoner eller ALK-translokasjoner) randomisert 1:1 til 3 sykler platinumdublett med eller uten nivolumab før operasjon. Det var i studien ingen øvre aldersgrense. Patologisk komplett respons (ingen gjenværende viable tumorceller i operasjonsresektatet) ble oppnådd hos 24,0 % av kombinasjonsgruppen, mot 2,2 % av de som kun fikk kjemoterapi. Hendelsesfri overlevelse (hendelse definert som progresjon, død, eller ikke gjennomført operasjon) etter 2 år var 63,8 % i kombinasjonsgruppen mot 45,3 % i kjemoterapigruppen (HR 0,63). Alvorlige behandlingsrelaterte bivirkninger (CTCAE grad 3-5) var sett hos 33,5 % i kombinasjonsgruppen og 36,9 % i kjemoterapigruppen, og bivirkninger som ledet til utsatt eller avlyst operasjon oppsto hos 4,5 % i kombinasjongruppen og 5,1 % i kjemoterapigruppen. Flere av de som fikk kombinasjonsbehandling ble operert enn de som fikk kjemoterapi alene (83 % vs. 75 %). To år etter randomisering var det bedre totaloverlevelse i kombinasjonsgruppen enn i kjemoterapigruppen (82,7 % vs. 70,6 %), men dette er foreløpig umodne tall. Subgruppeanalyser viste at effekten var større for pasienter i stadium III (HR 0,51) enn for stadium II (HR 0,81). Subgruppeanalyser av pasienter basert på PD-L1-nivå viste best effekt for pasienter med PD-L1-nivå ≥ 1 % (hendelsefri overlevelse ved 2 år hhv 76 % og 50%, HR 0,41). Behandlingsregimet er EMA-godkjent for operable pasienter med PD-L1 ≥1 %, stadium II og III (TNM 8) og uten EGFR- og ALK-forandringer.
Det pågår flere studier med tilsvarende design, men hvor også immunterapi i inntil 1 år etter operasjon er del av behandlingen. Noen av disse har publisert data i 2023 med lignende effekt- og bivirkningsdata som CheckMate 816-studien (Heymach et al., 2023; Wakelee et al., 2023). Ingen av disse har foreløpig ledet til EMA-godkjenning, og det er fortsatt uklart i hvilken grad postoperativ immunterapi gir tilleggseffekt.
På basis av CheckMate 816-studien anbefales operable pasienter uten påvist EGFR- eller ALK-forandringer, PD-L1-nivå ≥ 1%, i stadium II og III (TNM 8) å bli vurdert på regionalt MDT-møte for neoadjuvant kjemoimmunterapi. EGFR- og ALK-svar må foreligge før oppstart kjemoimmunterapi. Det gis 3 sykler nivolumab + kjemoterapi med 3 ukers mellomrom, etterfulgt av ny CT-evaluering (PET/CT anbefales ikke her) innen 3 uker etter siste kur og diskusjon på nytt MDT-møte for endelig operabilitetsvurdering. Operasjon bør gjøres innen 6 uker etter 3. kjemoimmunterapikur. For pasienter med non-plateepitelkarsinom anbefales kjemoterapikombinasjonen karboplatin (AUC 5) og pemetreksed (500 mg/kvm dag 1). Vitamin B12 og folsyre skal være startet minst 5 dager før første kur. For plateepitelkarsinomer anbefales karboplatin (AUC 5) og gemcitabin (1000 mg/kvm dag 1+8). Karboplatin kan eventuelt erstattes med cisplatin (75 mg/m2) uansett histologi, men både i Checkmate 816 og den senere publiserte Checkmate 77T-studien (perioperativ kjemoimmunterapi) (Cascone et al., 2024) synes effekten å være best hos pasienter som mottok karboplatin. Karboplatin (AUC 5) og paklitaksel (175 mg/kvm) kan være et alternativ uavhengig av histologi. Nivolumab doseres med 360 mg og gis samtidig med cellegift dag 1. Ved neutropeni grad 4 (nadir < 0,5 x109) bør kjemoterapidosen reduseres, og G-CSF kan vurderes ved neste kur(er).
Beslutningsforum vedtok 12.2.2024 følgende:
- Nivolumab (Opdivo) i kombinasjon med platinumbasert kjemoterapi innføres til neoadjuvant behandling av operabel ikke-småcellet lungekreft (NSCLC) med høy risiko for tilbakefall hos voksne pasienter hvor tumorer har PD-L1-ekspresjon ≥ 1%.
- Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
- Behandlingen kan tas i bruk fra beslutningstidspunktet
En oversikt over behandlingsforløpet for pasienter som er aktuelle for neoadjuvant eller adjuvant behandling er vist i Figur 16.
Anbefaling - neoadjuvant kjemoimmunterapi
- Operable pasienter i stadium II og III, som har tumor som uttrykker PD-L1 ≥ 1 %, og er EGFR- og ALK-negative, vurderes for neoadjuvant behandling.
- Det gis 3 kurer nivolumab og platinumdublett med 3 ukers mellomrom.
- Det skal tas ny CT 2-3 uker etter siste kur, og pasienten vurderes på nytt regionalt MDT-møte.
- Operasjon gjøres innen 6 uker etter siste infusjon
Adjuvant behandling etter kirurgi
Pasienter som har gjennomført neoadjuvant kjemoimmunterapi anbefales ikke adjuvant behandling. Dersom neoadjuvant behandling ikke er gitt, kan adjuvant kjemoterapi tilbys til pasienter med samme svulstkategorier som nevnt over (stadium II og III) basert på studier og metaanalyser som har vist gevinst i størrelsesorden 5-15 % økt 5-årsoverlevelse sammenlignet med kirurgi alene (Pignon et al., 2008; Winton et al., 2005). Effekt er ikke vist for pasienter med svulster under 4 cm uten lymfeknutemetastaser. Cisplatin/pemetreksed anbefales for pasienter med ikke-plateepitelkarsinom, mens cisplatin/vinorelbin anbefales for pasienter med plateepitelkarsinom (Kenmotsu et al., 2020; Kreuter et al., 2013). Karboplatin kan eventuelt erstatt cisplatin, spesielt hos eldre (Cuffe et al., 2012). Det gis inntil fire kurer.
I studiene ble adjuvant behandling anbefalt startet innen 8 uker, men det er også data som tyder på at senere start (opp til 4 måneder postoperativt) gir forbedret prognose sammenlignet med ingen adjuvant behandling (Salazar et al., 2017). Det er lite evidens for nytte av vekstfaktorstøtte (G-CSF), men dette kan eventuelt vurderes ved nøytropeniproblematikk som vanskeliggjør opprettholdelse av doseintensitet (Genova, Rijavec, & Grossi, 2016).
Ved storcellet nevroendokrint karsinom anbefales adjuvant kjemoterapi også ved stadium IB, med cisplatin/etoposid (se avsnitt "Medikamentell behandling" i Storcellet nevroendokrint karsinom (LCNEC)).
Immunterapi som adjuvant behandling
Hos pasienter med PD-L1-nivå ≥ 50 % som ikke har fått neoadjuvant kjemoimmunterapi, og som tilbys adjuvant kjemoterapi, kan også immunterapi tilbys. Dette er basert på en fase III studie (IMpower 010) som viste at 1 års behandling med atezolizumab (1200 mg iv hver 3. uke i inntil 1 år) økte 3-års sykdomsfri overlevelse hos pasienter i stadium II-IIIA og med PD-L1-uttrykk ≥ 50 % til 89,1 % hos de som hadde fått atezolizumab, mot 77,5 % i kontrollgruppen (HR 0,42) (Felip et al., 2021). Bivirkningsprofilen var som forventet ved immunterapi. Totaloverlevelsesdata er foreløpig umodne. Dette behandlingsregimet ble vurdert i Beslutningsforum 25.09.23 med følgende vedtak:
«Atezolizumab (Tecentriq) innføres som monoterapi til adjuvant behandling etter fullstendig reseksjon og platinabasert kjemoterapi av voksne pasienter med ikke-småcellet lungekreft (NSCLC) med høy risiko for tilbakefall der tumor har PD-L1-ekspresjon i ≥ 50 % av tumorcellene (TC) og som ikke har EGFR-mutant eller ALK positiv NSCLC.
Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
Behandlingen kan tas i bruk fra beslutningstidspunktet.»
Opererte med EGFR-mutasjon
Pasienter med operert EGFR-mutert ikke-småcellet lungekreft vil kunne ha nytte av adjuvant behandling med EGFR-hemmeren osimertinib. Det er publisert en fase III-studie som randomiserte 682 opererte pasienter i stadium IB-IIIA (TNM 7) med enten delesjon i ekson 19 eller punktmutasjonen L858R til 3 års behandling med enten placebo eller osimertinib 80 mg x1 p.o. (Y. L. Wu et al., 2020). Pasientene kunne ha fått standard adjuvant kjemoterapi før randomisering. Sykdomsfri overlevelse to år etter randomisering var markert bedre i gruppen som fikk osimertinib (89 %) sammenlignet med placebogruppen (52 %). Forskjellen var tydeligst hos pasienter som hadde sykdomsstadium II eller III (HR 0,17). Effekten var også signifikant i IB-gruppen (T-størrelse >3-5 cm, N0) med 4-års sykdomsfri overlevelse HR 0,41. Senere oppdatering har vist tilnærmet lik effekt for stadium IB i henhold til TNM 8 (n =199, T-størrelse > 3-4 cm, N0) med HR 0,44 (Herbst et al., 2023). Sannsynligheten for utvikling av hjernemetastaser var tydelig lavere i gruppen som fikk osimertinb (HR 0,24). Totaloverlevelsestallene er i favør osimertinib-behandling, med 5-årsoverlevelse på 88 % i osimertinibgruppen mot 78 % i placcebogruppen (Tsuboi et al., 2023), men det er verdt å kommentere at kun 42 % av pasientene i placebogruppen fikk osimertinib ved progresjon. Det var ingen forskjell i sykdomsfri overlevelse hos osimertinib-behandlede pasienter som hadde fått, eller ikke fått, adjuvant kjemoterapi før oppstart osimertinib. Det er derfor ikke opplagt at det er grunnlag for å gi kjemoterapi, men siden vi har langtidsoverlevelsesdata som viser signifikant positiv effekt av slik behandling er det trolig fornuftig å ikke utelate denne behandlingen til pasienter hvor dette kan være aktuelt (stadium II-III, god allmenntilstand).
Osimertinib som adjuvant behandling ble vurdert i Beslutningsforum 29.08.22 med følgende vedtak:
«Osimertinib (Tagrisso) som monoterapi innføres til adjuvant behandling etter fullstendig tumorreseksjon hos voksne med stadium IB-IIIA ikke-småcellet lungekreft (NSCLC) der tumor har epidermal vekstfaktor-reseptor (EGFR) ekson 19-delesjoner eller ekson 21 (L858R) substitusjonsmutasjoner.
Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
Behandlingen kan tas i bruk fra beslutningstidspunktet.»
Anbefaling - adjuvant medikamentell behandling
- Opererte pasienter i stadium II og III som ikke har fått neoadjuvant kjemoimmunterapi gis fire kurer cisplatin + pemetreksed (ikke-plateepitelkarsinom) eller cisplatin + vinorelbin (plateepitelkarsinom, eller dersom pemetreksed ikke kan gis). Cisplatin kanerstattes med karboplatin.
- Start innen åtte uker fra operasjonstidspunkt.
- Aktuelt hos pasienter ≤70 år i god allmenntilstand (ECOG 0-1).
- ”Biologisk unge” >70 år bør vurderes for adjuvant kjemoterapi, karboplatin kan da være et alternativ til cisplatin.
- I tillegg til kjemoterapi tilbys atezolizumab i 1 år ved PD-L1-uttrykk ≥ 50%, men ikke ved EGFR-mutasjon eller ALK-translokasjon.
- Radikalopererte pasienter i stadium IB til III med påvist EGFR-mutasjon (delesjon i ekson 19 eller L858R) bør vurderes for adjuvant behandling i inntil 3 år med osimertinib. Kjemoterapi før oppstart EGFR-TKI vurderes gitt til disse etter vanlige rutiner.
Opererte med ALK-translokasjon
Pasienter med operert ALK-translokert ikke-småcellet lungekreft vil kunne ha nytte av adjuvant behandling med ALK-hemmeren alektinib. Det er publisert en fase III-studie (ALINA-studien) som randomiserte 257 opererte pasienter i stadium IB-IIIA (TNM 7) med påvist ALK-traslokasjon til 2 års behandling med enten standard adjuvant kjemoterapi eller alektinib 600 mg x2 p.o. (Wu et al., 2024). Pasientene i alektinib-armen fikk ikke adjuvant kjemoterapi. Sykdomsfri overlevelse to år etter randomisering var markert bedre i gruppen som fikk alektinib (93,6 %) sammenlignet med kjemoterapigruppen (63,7 %, HR 0,24). Forskjellen var lik hos pasienter som hadde sykdomsstadium II eller III (HR 0,24). Sannsynligheten for utvikling av hjernemetastaser var også lavere i gruppen som fikk alektinib (CNS-sykdomsfri overlevelse etter 2 år var 98,4 % i alektinibgruppen mot 85,8 % i kjemoterapitgruppen, HR 0,22). Totaloverlevelsestallene er foreløpig umodne. Det var omtrent likt antall grad 3- og 4-bivirkninger i begge grupper (29,7 % for alektinibbehandlede og 30,8 % for kjemoterapibehandlede. Dosereduksjon og seponering pga bivirkninger forekom hos henholdsvis 25,8 % og 5,5 % av alektinibbehandlede pasienter.
Alektinib som adjuvant behandling er foreløig ikke vurdert av Beslutningsforum.
Adjuvant behandling etter steretotaksi
Adjuvant kjemoterapi før eller etter stereotaktisk stråleterapi er ikke analysert i prospektive studier. En publisert stor retrospektiv analyse viste at for pasienter i stadium T1-T3N0M0 var overlevelsen dårligere blant pasienter som hadde fått adjuvant kjemoterapi sammenlignet med ingen adjuvant behandling (Foster et al., 2019). En annen, mindre studie fant en lengre tid til residiv, men ingen bedret totaloverlevelse, blant pasienter som hadde fått adjuvant kjemoterapi (Kann et al., 2019). Det synes derfor rimelig å være varsom med adjuvant kjemoterapi etter stereotaksi, men slik behandling kan kanskje vurderes hos pasienter som er i god form (der stereotaksi er valgt pga pasientens ønske, og ikke pga medisinsk inoperabilitet), har stor svulst (>4 cm) og kjent histologi.
Anbefaling - adjuvant behandling etter stereotaksi for stadium I/II:
- Rutinemessig adjuvant behandling er ikke aktuelt etter stereotaktisk stråleterapi.
Non-kirurgisk behandling av stadium II/III
Sist faglig oppdatert: 31.10.2024
Medisinsk inoperable pasienter, eller pasienter som ikke ønsker kirurgi, i stadium II uten lymfeknutemetastaser bør vurderes for stereotaktisk stråleterapi (se avsnitt «Stereotaktisk strålebehandling» i Strålebehandling). I stadium II med N1-sykdom er konkomitant kjemoterapi etterfulgt av immunterapi (som stadium III) et alternativ til kirurgi (se avsnitt «Konkomitant kjemoradioterapi etterfulgt av immunterapi»).
Ubehandlet er prognosen i stadium III dårlig med 2 års overlevelse på 0-4 %, mens en metaanalyse viste ca 15 % 5-års overlevelse etter kombinert kjemoradioterapi (Aupérin et al., 2010). Konsoliderende immunterapi med preparatet durvalumab øker overlevelsen betydelig (se under).
Utfyllende informasjon om strålebehandling finnes i Faglige anbefalinger for strålebehandling ved ikke-småcellet lungekreft.
Konkomitant (samtidig) kjemoradioterapi er funnet mer effektiv enn sekvensiell behandling (Bi & Wang, 2015). Bivirkningene ved slik behandling kan være betydelige, og pasientene må derfor selekteres nøye. MR caput og PET/CT inngår i utredningen (se Oversikt utredning av lungekreft i spesialisthelsetjenesten). Ved tvil om pasienten er i stand til å gjennomføre konkomitant behandling, bør heller sekvensiell behandling velges, alternativt stråleterapi alene (D. De Ruysscher et al., 2009).
Konkomitant kjemoradioterapi etterfulgt av immunterapi
Ved konkomitant behandling gis kjemoterapi samtidig med strålebehandling, 2 Gy x 30-33. Ved store svulster som ikke ligger i nærheten av kritiske strukturer (hjerte, øsofagus, plexus) kan man overveie å eskalere dosen til 70 Gy. Pasienter som ikke er kandidat for kjemoradioterapi tilbys strålebehandling alene med 2 Gy x 33 – 35, totalt 66 – 70 Gy. Det er ikke konsensus hvilket kjemoterapiregime som er best (Bi & Wang, 2015). Vanligst brukt er 2 kurer platinumbasert kjemoterapi gitt med 3 ukers intervall. I Norge anbefales PV-regimet (se avsnitt «PV-regime» i Behandling av ikke-operabel begrenset sykdom, LS-SCLC), eventuelt cisplatin/vinorelbin. Første kur gis fra første eller andre strålebehandlingsdag. Det er svært begrenset med data på bruk av G-CSF ved konkomitant kjemotradioterapi ved ikke-småcellet lungekreft, og med moderne små strålefelt er trolig risikoen liten. Noen argumenterer for bruk av G-CSF ved neutropeni etter første kur, og dette er nå også implementert i enkelte internasjonale retningslinjer (Arrieta et al., 2020; Benna et al., 2020).
I en stor fase III-studie, «PACIFIC» ble opp til 12 måneders konsoliderende behandling med immunterapi med PD-L1-hemmeren durvalumab gitt til pasienter med lokalavansert ikke-resektabel sykdom etter konkomitant kjemoradiasjon (Antonia et al., 2017). Median progresjonsfri overlevelse var signifikant bedre med durvalumab versus placebo, med henholdsvis 16,8 måneder versus 5,6 måneder, p< 0.0001. Overlevelsesdata etter 34 mndr oppfølgningstid viste estimert 5-års overlevelse på 42,9 % i gruppen som fikk durvalumab mot 33,4 % i gruppen som fikk placebo (HR 0,72) (D. R. Spigel et al., 2022). Antall og alvorlighetsgrad av bivirkninger var sammenlignbare i de to armene. Pneumonitt eller strålepneumonitt hos pasienter som mottok durvalumab var for det meste lavgradig med få og et sammenlignbart antall grad 3- eller 4-tilfeller i de to gruppene.
Studien inkluderte også pasienter med EGFR- og ALK-positiv sykdom, men det er nå data som viser at immunterapi ikke er av nytte for disse pasientene (Arter & Nagasaka, 2024). EGFR-positive pasienter har nytte av EGFR-rettet behandling som beskrevet under i «Konkomitant kjemoradioterapi etterfulgt av EGFR-TKI hos EGFR-mutert NSCLC stadium III».
Durvalumab har markedsføringstillatelse til behandling av lokalavansert, inoperabel, ikke-småcellet lungekreft med PD‑L1-uttrykk ≥1 %, og med sykdom som ikke har progrediert etter platinabasert kjemoradiasjon. Denne behandlingen ble vurdert i Beslutningsforum 21.10.19 med følgende vedtak:
«Durvalumab (Imfinzi) kan innføres til behandling av lokalavansert, inoperabel ikke-småcellet lungekreft (NSCLC) hos voksne hvor tumor uttrykker PD-L1 ≥ 1 % av tumorcellene og med sykdom som ikke har progrediert etter platinabasert kjemoradiasjon.»
Durvalumab gis som intravenøs infusjon, 10 mg/kg hver 2. uke eller 1500 mg hver 4. uke, og bør startes innen 42 dager etter siste strålefraksjon. Det ble vist at tidlig oppstart korrelerer med bedre overlevelse ved at pasienter som ble randomisert innen 14 dager etter siste strålefraksjon hadde en HR=0,42, mot HR=0,81 ved randomisering senere enn 14 dager (Antonia et al., 2018). CT toraks og øvre abdomen som baseline 2-3 uker etter gjennomført kjemoradiasjon bør derfor tilstrebes. Behandlingen gis i inntil 1 år, eller til uakseptabel toksisitet (se Immunterapi: bivirkninger, behandlingsvarighet og annet) eller tilbakefall.
Skjematisk kan behandlingsopplegget framstilles som i Figur 17.
Konkomitant kjemoradioterapi etterfulgt av EGFR-TKI hos EGFR-mutert NSCLC stadium III
Pasienter med inoperabel NSCLC stadium III med påvist EGFR-mutasjon har ikke nytte av konsoliderende immunterapi som beskrevet over (Nassar et al., 2024).
I en stor fase III-studie, «LAURA» ble konsoliderende behandling med EGFR-hemmeren osimertinib gitt til pasienter med lokalavansert ikke-resektabel sykdom etter konkomitant kjemoradiasjon (Lu et al., 2024). Median progresjonsfri overlevelse var signifikant bedre med osimertinib versus placebo, med henholdsvis 39,1 måneder versus 5,6 måneder (HR 0,16, p < 0,001). Overlevelsesdata med foreløpig umodne data viste estimert 3-års overlevelse på 84 % i gruppen som fikk osimertinib mot 74 % i gruppen som fikk placebo (HR 0,81, p = 0,53). Bivirkninger av grad 3 og 4 forekom hos 35 % av osimertinib-behandlede pasienter, mot 12 % i placebogruppen. Pneumonitt eller strålepneumonitt var for det meste lavgradig i begge grupper, og forekom hos 48 % i osimertinib-gruppen og 38 % i placebogruppen.
Pasienter med radiologisk persisterende sykdom (non-komplett respons) etter kjemoradiasjon kan vurderes og behandles som ikke-kurert sykdom, og vurderes for osimertinib som i stadium IV.
Sekvensiell kjemoradioterapi stadium III
Ved tvil om toleransen for konkomitant kjemoradioterapi kan sekvensiell behandling gis med kjemoterapi før strålebehandling. Et platinumbasert kjemoterapi regime er anbefalt, 2 kurer før start av stråling. Immunterapi med durvalumab i inntil 1 år som beskrevet over kan vurderes også i disse situasjonene (sekvensiell kjemoterapi og radioterapi) utfra publiserte data (Garassino et al., 2022). Pasienter som ikke er kandidat for tillegg med kjemoterapi tilbys strålebehandling alene med 2 Gy x 33 – 35.
Anbefaling - kjemoradioimmunoterapi ved stadium III
- Konkomitant kjemoradioterapi anbefales: 2 Gy x 30-33 med to platinumbaserte cellegiftkurer med tre ukers intervall under strålebehandling.
- Durvalumab gis ved EGFR-/ALK-negativ sykdom som ikke har progrediert etter kjemoradioterapi, og med PD-L1-uttrykk i ≥ 1 % av tumorcellene: 10 mg/kg hver 2. uke eller 1500 mg hver 4. uke i inntil 12 måneder.
Sulcus superior tumor (Pancoast-tumor) og lokalavanserte brystveggsvulster
Sist faglig oppdatert: 31.10.2024
Pasienter med Pancoast-tumor (apikal lungetumor med affeksjon av apikale brystvegg med eller uten affeksjon av sympatiske nerveganglion og eventuelt Horners syndrom (Kozower, Larner, Detterbeck, & Jones, 2013; Pancoast, 1932)) har ofte lang overlevelse og mye smerter pga innvekst i lokale strukturer og/eller nerveaffeksjon. Disse bør vurderes på regionalt MDT med tanke på neoadjuvant kjemoimmunoterapi, se "Neoadjuvant kjemoimmunterapi" i (Neo-)adjuvant medikamentell behandling. Primært inoperable svulster kan gis radiokjemoterapi før ev. revurdering mtp operabilitet etter ca 44 Gy (Rusch et al., 2007). MR toraks kan være nødvendig. Ved fortsatt inoperabilitet kan stråleterapi kontinueres til 60-66 Gy, og 1 år durvalumab vurderes ved PD-L1 ≥ 1% (se 7.4.1).
Anbefaling - Pancoast-svulster
- Pancoast-svulster bør vurderes for neoadjuvant kjemoimmunterapi etterfulgt av kirurgi.
- Alternativt vurderes konkomitant strålebehandling (2 Gy x 25) med to kurer platinumbasert kjemoterapi med 3 ukers mellomrom. Operasjonsvurdering etter ca 44 Gy.
- Dersom fortsatt inoperabel kontinueres radioterapi til 60-66 Gy, etterfulgt av durvalumab ved PD-L1 ≥ 1 %.
Oppfølging og etterkontroll etter kurativ behandling for lungekreft
Sist faglig oppdatert: 31.10.2024
Hensikten med oppfølging etter behandling med kurativ intensjon er:
- Oppdage og håndtere eventuelle behandlingsrelaterte komplikasjoner i løpet av den første tiden
- Oppdage kurable tilbakefall av den primære lungekreften
- Oppdage evt ny primær lungekreft tidlig nok til at potensielt kurativ behandling kan gis
Forutsetningen for videre kontroller med henblikk på residiv eller ny tumor er at pasienten er aktuell for ytterligere behandling. Her vil postoperativ lungefunksjon, alder, pasientens ønske og funksjonsnivå være viktige elementer.
Oppfølging av komplikasjoner
Kirurgi
De vanligste komplikasjoner etter lungereseksjoner er redusert lungefunksjon og kroniske smerter (Nezu, Kushibe, Tojo, Takahama, & Kitamura, 1998).
Immunterapi
For mulige bivirkninger etter (neo-)adjuvant immunterapi, se "Bivirkninger ved immunterapi" i Immunterapi: bivirkninger, behandlingsvarighet og annet.
Strålebehandling
Komplikasjoner etter stråleterapi kan ramme lunger, hud, øsofagus, medulla, eller muskulatur (Fogh & Yom, 2014). Sjeldnere ser man skader på perikard og hjerte. Skadene kan være både akutte og kroniske. De akutte bivirkningene (se Nasjonalt program for strålebehandling) er som regel forbigående. Lungetoksisitet kan variere. Den øker med bestrålt volum og kumulativ stråledose. Toksisiteten ved en gitt totaldose er større dess kortere behandlingstid (Vogelius & Bentzen, 2012).
Lunge
Akutt strålepneumonitt inntrer typisk 4-12 uker etter oppstart strålebehandling, og kan ofte behandles vellykket med steroider, for eksempel prednisolon minst 1 mg/kg kroppsvekt daglig, deretter nedtrapping (Fogh & Yom, 2014).
Sen strålepneumonitt i fibrotisk fase oppstår gjerne etter 3-24 måneder, og representerer ofte en irreversibel lungeskade. Tilstanden oppstår hos om lag 8 % av pasientene (Cannon et al., 2013). Strålebehandling kan føre til tap av lungefunksjon selv om pasienten ikke opplever symptomer på pneumonitt (Mehta, 2005). Med dagens CT-baserte 3D-planlegging av strålefelt, eller med stereotaktisk teknikk (SBRT), kan en spare friskt vev og dermed også bevare lungefunksjonen i større grad enn med tidligere stråleteknikker (P. Baumann et al., 2008; Pia Baumann et al., 2009; Stanic et al., 2014).
I en ASTRO-QUANTEC-oversiktsartikkel er over 70 artikler med ulike dose-volum parametere og endepunkter for lunge gjennomgått. Til tross for usikkerhet knyttet til lungefunksjon før strålebehandling, kommer man med noen anbefalinger som begrenser risikoen for strålepneumonitt i forbindelse med planlegging for stråling:
- V20 (totalt lungevolum minus GTV som får 20 Gy eller mer) bør være < 35 %, V5 < 65 % og gjennomsnttlig lungedose (Mean Lung Dose, MLD) < 20 Gy (gjelder konvensjonell fraksjonering 2 Gy/fraksjon)
Øsofagus
Øsofagus eksponeres ofte ved kurativ strålebehandling av lokalavansert lungekreft. Akutt stråleøsofagitt oppstår under pågående behandling og kan variere i alvorlighetsgrad. I mange tilfeller kan pasienten oppleve dysfagi og/eller odynofagi i og rett etter behandlingsperioden. Som oftest er den forbigående og kan behandles med smertstillende, eventuelt med sondeernæring.
Senbivirkninger i øsofagus er som regel et resultat av fibrose og kan føre til strikturer eller fisteldannelse (Simone, 2017). Flere publikasjoner viser at konkomitant kjemoterapi øker risiko for skader i øsofagus. V60 (volumet i cm3 som har mottatt 60 Gy eller mer) korrelerte best med forekomst av øsofagitt (Bradley & Movsas, 2004). V60 = 15 cm3 vil gi ca. 30 % sannsynlighet for øsofagitt dersom stråleterapi blir gitt alene. Dersom V60 reduseres til 5 cm3 vil sannsynligheten synke til ca. 20 %. Med konkomitant kjemoterapi synes sannsynligheten å nær dobles for hvilken som helst verdi. I Thora-studien (SCLC) (Grønberg et al., 2021) brukte man gjennomsnittlig øsofagusdose (hele øsofagus tegnet inn) < 34 Gy som dosebegrensning.
Hjerte
Hjertetoksisitet blir sjelden rapportert som bivirkning ved strålebehandling av lungetumorer. Grunnen for dette er at det er få pasienter som er strålebehandlet for lungetumor som lever lenge nok til å utvikle hjertebivirkninger. Man kan forvente økende strålerelaterte hjertebivirkninger i takt med økende overlevelse som følge av mer effektiv behandling. Følgende totaldosenivå til hjertet kan gi signifikant risko for bivirkninger: Perikarditt ≥35 Gy, kardiomyopati ≥35 Gy, skade på koronararterien (≥30 Gy), klaffeskade (≥40 Gy) (Martinou & Gaya, 2013). Ischemisk hjertesykdom blir rapportert som den vanligste bidragsyteren til hjerterelaterte dødsfall. Det anbefales sterkt å begrense volumet av hjertet som bestråles til høye doser (> 35-40 Gy) så mye det lar seg gjøre uten å gå på bekostning av dekning av målvolumet. Følgende dosekrav anbefales: V50 Gy <25 %, V45 <60 %, V40 <80 %, mean heart dose (MHD) <20 Gy.
Medulla spinalis
Stråleindusert kronisk myelopati er en fryktet komplikasjon etter strålebehandling. Latensperioden synes å være bimodal med en insidens-topp ved 13 og 29 måneder. Maksdose på 50 Gy til medulla gir en frekvens på 0,2 % for stråleindusert myelopati, 6 % ved 60 Gy og 50 % ved 69 Gy (Schultheiss, 2008). Enkelte cytostatika er kjent å kunne ha en synergistisk effekt med stråling slik at toleransedosen reduseres, spesielt når kjemoterapi gis konkomitant. Dessverre foreligger det kun usikker dokumentasjon på denne synergieffekten og de fleste publikasjonene er basert på case-studier. Ved kombinasjonsbehandling skal det derfor vises aktsomhet i forhold til medullatoleranse og den kliniske vurderingen skal dokumenteres i pasientjournalen. Mange klinikker antar ca. 10 % reduksjon i medullatoleranse ved konkomitant kjemoterapi slik at toleransedosen settes ned til 45 Gy i flere stråleavdelinger i Norge.
Plexus brachialis
For plexus brachialis tilstrebes en dose < 60 Gy, men en dose på 66 Gy kan aksepteres. Risikoen for en klinisk manifest pleksopati (grad ≥ 2) vil da ikke overstige 5 %. NCCN-guidelines anbefaler en mediandose ≤ 69 Gy.Tumor-forårsaket pleksopati pga for lav stråledose kan være en større risiko enn stråleindusert pleksopati (Eblan et al., 2013).
Medikamentell behandling
De fleste bivirkninger av kjemoterapi inntrer under pågående behandling. Et unntak er perifer nevropati og oto- og nefrotoksisitet som kan oppstå også etter gjennomført behandling (Mao et al., 2007).
Oppfølging med hensyn til tumorresidiv
Residiv inntrer hyppig og kommer oftest innen fire år etter behandlingen, men om lag 10 % kan påvises opptil fem år eller senere (Bugge et al., 2018). Pasienter som på behandlingstidspunktet hadde lymfeknutemetastaser, har høyere residivrater og tidligere residiv. De fleste residiv oppdages som følge av symptomer (Chiu et al., 2003). Internasjonale retningslinjer anbefaler CT toraks i oppfølgingen av pasienter (Colt et al., 2013).
Oppfølging med hensyn til utvikling av ny primærtumor
Risikoen for å utvikle en ny primær lungekreft etter kurativ behandling av ikke-småcellet lungekreft er 0,5-2 % pr. år. Ny primær lungekreft kan utvikles mange år etter behandlingen av den opprinnelige svulsten.
Oppfølgingsintensitet og undersøkelsesmetoder
Det eksisterer ingen gode prospektiv sammenliknende studier på det mest effektive kontrollopplegg (Schmidt-Hansen, Baldwin, & Hasler, 2012). Noen pasienter vil kunne tilbys ny kirurgi ved begrenset tilbakefall eller ny tumor, med en rapportert 5-års overlevelse på henholdsvis mellom 8-40 % og 20-53 % (Mollberg & Ferguson, 2013; Rubins, Unger, Colice, & Physicians, 2007). For pasienter som ikke er operable kan stereotaktisk bestråling være aktuelt, med god lokal kontroll (Sonobe et al., 2014).
De fleste av de nye svulstene vil være asymptomatiske (Lou et al., 2013). For å oppdage residiv de første 2 årene anbefales derfor nå i en rekke internasjonale retningslinjer at kontrollene etter kurativ behandling bør gjøres med CT toraks med iv kontrast. Abdomen undersøkes altså ikke i diagnostisk kontrastfase, men toraksscanningen utvides til også å inkludere supraclavikulærregionen og binyrene, ved å utvide scanningsområdet til 5 cm over lungetoppen og under høyre leverspiss. De resterende kontrollene etter 2 år gjøres med lav-dose CT toraks for å evt oppdage nye primære svulster (Postmus et al., 2017; B. J. Schneider et al., 2020).
Selv om PET/CT er mer sensitiv enn CT har studier med PET/CT i oppfølging etter behandling ikke vist noen overlevelsesgevinst. PET/CT anbefales derfor ikke for kontroll etter behandling, men kan være aktuell ved utredning av nye svulster (Gorenberg, Bar-Shalom, & Israel, 2008; Takenaka et al., 2010).
Blodprøver med tumormarkører og fluorescens-bronkoskopi har ingen dokumentert plass i oppfølgingen av pasienter med lungekreft (Rubins et al., 2007), med unntak av blodprøver etter gjennomgått immunterapi. TSH, T4 mtp hyper-/hypotyreose, samt levermarkører mtp hepatitt kan da være aktuelt.
Evidens for valg av intervall og varighet av CT-kontroller foreligger ikke. Norsk praksis har vært å kontrollere pasientene i 5 år. Dog er dette individuelt og bør tilpasses den enkelte pasient hvor man tar hensyn til faktorer som alder og komobiditet. For noen pasienter kan det derfor være relevant med kontroll også etter 5 år med lavdose CT toraks hvert 2. år. Første kliniske kontroll bør gjøres ca 1 mnd etter operasjon. For pasienter som har fått neoadjuvant kjemoimmunterapi eller stereotaksi, bør kontroll med CT gjøres ca 12 uker etter operasjon/stereotaksi for å vurdere eventuell pneumonittutvikling, samt f.eks. immunterapirelaterte endokrinopatier.
Ikke-radikaloperte pasienter (R1/R2) som ikke har mottatt postoperativ strålebehandling bør kontrolleres noe hyppigere enn radikalopererte pga. høyere residivrisiko, for eksempel med CT hver 4. måned første 2 år (se også avsnitt «Postoperativ strålebehandling» i Strålebehandling).
Anbefaling - kontroller etter kurativ behandling
- En måned etter avsluttet kurativ behandling:
- Klinisk kontroll, ev. telefonisk kontakt (inkl vurdering av patologi-svar)
- For pasienter som har fått neoadjuvant kjemoimmunterapi eller kurativ stråleterapi:
- Klinisk undersøkelse og lab 3 mnd etter behandling, deretter som andre som har fått kurativ behandling.
- For andre som har fått kurativ behandling:
- Klinisk undersøkelse (og ev. lab etter immunterapi) og CT toraks inkl binyrer med kontrast 6, 12, 18 og 24 måneder etter avsluttet kurativ behandling:
- 3., 4. og 5. år:
- Sykehistorie og klinisk undersøkelse (ev. telefonkonsultasjon).
- CT toraks lavdose uten intravenøs kontrast.
- Kontroller utover 5 år kan vurderes hos utvalgte pasienter.
- Kontrollene bør gjennomføres i spesialisthelsetjenesten. Pasientene skal oppfordres til å ta kontakt ved nye symptomer eller forverring.
- PET/CT eller fluorescensbronkoskopi har ingen dokumentert rolle i oppfølgingen.
- Potensielt kurerte lungekreftpasienter som fortsatt røyker, oppfordres til røykeslutt.
Ikke-kurativ behandling av ikke-småcellet lungekreft
Sist faglig oppdatert: 31.10.2024
Andelen pasienter med NSCLC som får kurativt rettet behandling øker, men fortsatt blir de fleste diagnostisert i et sykdomsstadium der kurativ behandling ikke er mulig, enten pga stadium IV eller i tidligere stadier med negative prognostiske faktorer (Kvalitetsregisteret for lungekreft). Med moderne behandling kan målsetningen være både livsforlengende – til dels betydelig livsforlengende, symptomforebyggende og symptomlindrende.
Strålebehandling og/eller medikamentell behandling er aktuelt for de fleste med ikke-kurerbar sykdom.
Ved systemisk behandling menes «immunterapi» (PD-1- eller PD-L1-antistoff), målrettet behandling (perorale medikamenter ved påvist spesifikke mutasjoner), eller konvensjonell kjemoterapi (cellegift).
Alle pasienter med ikke-småcellet lungekreft skal være testet for PD-L1-uttrykk, og alle utenom plateepitelkarsinom-gruppen skal ha gjennomført molekylærpatologiske analyser, se 6.9.9. Behandling av metastatisk ikke-småcellet lungekreft omtales i detalj i dette kapitlet, men kan kort summeres på denne måten: Pasienter med ikke-småcellet lungekreft uten de nevnte mutasjonene skal vurderes for kombinasjonsbehandling med immunterapi og kjemoterapi, mens pasienter hvor ≥50 % av tumorcellene uttrykker PD-L1 kan vurderes for immunterapi som monoterapi i første linje. Ved adenokarsinom med påvist mutasjon tilbys målrettet behandling i første linje. Mange pasienter vil også ha nytte av andrelinjes behandling. Valg av andrelinjes behandling vil avhenge av mutasjonsstatus og tidligere gitt behandling. For noen pasienter vil ytterligere linjer med medikamentell behandling også være aktuelt.
Pasienter i stadium III med dårlige prognostiske faktorer behandles på samme måte som stadium IV-sykdom. Ved vurdering om pasienten er kandidat for tumorrettet behandling, må det legges vekt på prognose, livskvalitet, allmenntilstand (ECOG-status, se Tabell 2), komorbiditet, alder og pasientens ønsker.
Pasienter med oligometastaser kan vurderes for mer aggressiv behandling (Se avsnittet 8.1.6 "Oligometastaser" i kapitlet Palliativ strålebehandling).
For generelle palliative tiltak, se Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen.
Palliativ strålebehandling
Sist faglig oppdatert: 31.10.2024
Torakal bestråling
Palliativ stråling gir effektiv lindring av plagsomme symptomer fra sentrale luftveier. Hypofraksjonert stråling, 8,5 Gy x2, er godt dokumentert (Fairchild et al., 2008; S. Sundstrom et al., 2004). Enkeltpasienter, spesielt dersom de har lite sykdom utenom planlagt strålefelt, kan vurderes for mer høydosert, finere fraksjonert palliativ strålebehandling som 3Gy x10-13 eller 2,8 Gy x15 (Strøm et al., 2013). Strålebehandling til pasienter uten symptomer fra sentrale luftveier gir ingen tilleggsgevinst (Falk et al., 2002; Stein Sundstrom et al., 2005).
Endoluminal brakyterapi kan være et godt alternativ ved tumorvekst i luftrør/hovedbronkus, se Bronkoskopisk intervensjon.
Anbefaling - palliativ stråleterapi mot toraks:
- Pasienter med symptomer fra sentrale luftveier gis hypofraksjonert 8,5 Gy x 2
- Pasienter i god allmenntilstand (ECOG 0-1) kan vurderes for 3 Gy x 10-13 eller 2,8 Gy x15.
Hjernemetastaser
Hjernemetastaser kan behandles med kirurgi, stereotaktisk strålebehandling, helhjernebestråling, eller med systemisk behandling (spesielt de hvor målrettet behandling er aktuelt) med regelmessig MR-kontroll (som beskrevet i kontroll-avsnittet under) (Page et al., 2020; Yamamoto et al., 2014).
Kirurgisk cerebral metastasektomi er spesielt aktuelt ved store lesjoner (>4 cm), eller hvor det er ønskelig med biopsimateriale. En fase III-studie randomiserte mellom postoperativ gammaknivbehandling av reseksjonskavitet eller helhjernebestråling for ulike tumorgrupper, hvorav 59 % lungekreftpasienter (P. D. Brown et al., 2017). Behandlingene var likeverdig når det gjaldt overlevelse i likhet med funn i andre studier (Lamba et al., 2017). Imidlertid hadde de som ikke gjennomgikk postoperativ helhjernebestråling bedre kognitiv funksjon og bedre livskvalitet. Ved begrenset sykdom for øvrig og gode prognostiske faktorer kan stereotaksi av reseksjonskavitet være et godt alternativ til postoperativ helhjernebestråling. Hos eldre opererte pasienter eller pasienter med kognitiv svikt vil observasjon være et alternativ til helhjernebestråling.
Ved solitære hjernemetastaser gir stereotaktisk strålebehandling (Linac-basert eller med gammakniv) en overlevelsesgevinst sammenlignet med helhjernebestråling. Solitær hjernemetastase kan behandles med kurativ intensjon med stereotaksi eller kirurgi ved samtidig operabel lungetumor (S. Y. Yang et al., 2008).
Ved >1 (oligo-)metastaser er kortere behandlingstid og lavere risiko for kognitiv svikt et argument for stereotaksi dersom gjennomførbart, mens overlevelsen synes å være lik med begge teknikker (Suh, 2010). Totalvolum av metastaser, heller enn spesifikt antall, er avgjørende for om stereotaksi kan utføres. Spesielt hos eldre bør stereotaksi foretrekkes framfor helhjernebestråling grunnet signifikant høyere toksisitet og lavere overlevelse med sistnenvte modalitet (L. Chen et al., 2017). Ved stereotaktisk strålebehandling av hjernemetastaser, er det ønskelig med relativt fersk MR caput før planlegging (helst < 14 dager dersom det ikke er dokumentert langsom vekst).
Dersom stereotaktisk teknikk ikke er gjennomførbart (multiple metastaser) hos pasienter i relativt god allmenntilstand (ECOG 0-1) og med kontroll på ekstrakraniell sykdom kan helhjernebestråling med 3 Gy x 10 eller 4 Gy x 5, som sannsynligvis er likeverdig, vurderes. Imidlertid er det publisert en stor randomisert fase III-studie med 538 pasienter med ikke-småcellet lungekreft med hjernemetastaser som ikke var aktuelle for reseksjon eller stereotaksi. Studien viste ikke bedret overlevelse eller livskvalitet med helhjernebestråling sammenlignet med støttebehandling alene (Mulvenna et al., 2016). Iallfall hos pasienter i dårlig allmenntilstand (ECOG 2-4) vil helhjernebestråling neppe være nyttig, disse bør tilbys steroider og forøvrig god symptombehandling.
Pasienter som på diagnosetidspunkt har hjernemetastaser som ikke er aktuelle for stereotaksi eller kirurgi, men som starter behandling med målrettet medikasjon med kjent god intracerebral effekt (spesielt osimertinib, alektinib, brigatinib, lorlatinib) bør primært vurderes for oppfølgning med regelmessig MR caput uten helhjernebestråling (se Målrettet behandling) (Ando et al., 2020; S. M. Gadgeel et al., 2016; Page et al., 2020; Solomon et al., 2018; Wu et al., 2018). Tilsvarende er det data som tyder på god intracerebral effekt også av immunterapi (Eguren-Santamaria et al., 2020; Page et al., 2020; L. Sun et al., 2020). Pasienter med hjernemetastaser som er aktuelle for immunterapi og som ikke kan tilbys stereotaksi eller reseksjon bør følges med regelmessig MR caput. Fordi ikke alle oppnår intracerebral respons, bør første kontroll gjøres innen 2 måneder. Dette er spesielt viktig å huske på for de som får immunterapi, fordi responsraten er lavere enn ved målrettet behandling (ca. 30 % mot opptil 70 % for målrettet behandling).
Ved residiv kan stereotaktisk rebestråling gjøres, eventuelt total hjernebestråling (Sadikov et al., 2007).
Kontroll etter gjennomført behandling for hjernemetastaser
For pasienter i god allmenntilstand, ECOG 0-1, og med god sykdomskontroll for øvrig anbefales MR-kontroller med 3 måneders intervall. Rasjonalet er at en høy andel av pasientene får nye hjernemetastaser, og at utsiktene til lokal tumorkontroll er bedre hvis nye metastaser behandles med stereotaksi mens de er små og asymptomatiske (Patel et al., 2012).
En del pasienter utvikler strålereaktive forandringer i områdene for de stereotaktisk bestrålte hjernemetastasene. Dette kan oppstå fra få måneder til flere år etter behandlingen og ligner på residiv av metastasen. Differensieringen mellom residiv og strålereaktive forandringer er ofte vanskelig (Vellayappan et al., 2018). Flere faktorer er viktige for den radiologiske vurderingen:
- Kjennskap til tidligere strålebehandling (tidspunkt og lokalisasjon i hjernen)
- MR-sekvenser med høy detaljoppløsning
- Undersøkelsen bør inneholde diffusjon, T2, perfusjon, T1 med kontrast iv, SWI
- Tilgang til MR-bilder rett før strålebehandlingen og i forløpet etter behandlingen
Ved reelt tumorresidiv forventes det at lesjonen har solid preg på T2-vektet serie og at det er lav diffusjon og rask perfusjon i det kontrastladende vevet. Ved strålereaktiv forandring vil det typiske bildet være at lesjonen ikke har solid preg på T2-vektet serie, det er ikke lav diffusjon i det kontrastladende vevet, perfusjonen er langsom med akkumulering av kontrast og det kan være svært lav diffusjon i den sentrale nekrosen, såkalt koagulativ nekrose. Vurderingen kan være svært vanskelig da de ulike signalforandringene kan være tilstede i ulik grad. I noen tilfeller kan det foreligge kombinasjon av tumorresidiv og strålereaktive forandringer.
Differensieringen er viktig da det får terapeutisk konsekvens. Dersom man gir ny stereotaktisk strålebehandling mot forandringer som ikke representerer tumorresidiv, vi det forsterke de strålereaktive forandringene og etter hvert kunne gi manifest strålenekrose.
Anbefalinger - Hjernebestråling:
- Etter kirurgi av solitær metastase bør stereotaksi av tumorkavitet tilbys fremfor helhjernebestrålig.
- Ved 1-4 hjernemetastaser bør stereotaktisk teknikk benyttes.
- Pasienter med hjernemetastaser som ikke er aktuelle for kirurgi eller stereotaksi, men som starter med (kjemo-)immunterapi eller målrettet medisin med kjent intracerebral effekt kan primært følges med MR caput uten stråleterapi.
- Ved > 4 hjernemetastaser og god allmentilstand kan helhjernebestråling vurderes (3 Gy x10 eller 4 Gy x5).
- Pasienter i dårlig allmenntilstand (ECOG 2-4) har neppe nytte av helhjernebestråling og bør tilbys steroider.
Skjelettbestråling
Stråling av skjelettmetastaser kan gi effektiv lindring av smerter. Engangsfraksjon (eks 8 Gy x 1) er likeverdig med mer fraksjonert behandling og bør foretrekkes ved ukompliserte metastaser. Truende frakturer og truende malign medullakompresjon behandles med 3 Gy x10 ved god allmenntilstand. 4 Gy x5 eller 8 Gy x1 bør vurderes ved dårligere allmenntilstand og/eller relativt kort forventet levetid. Å avstå fra tumorrettet behandling må vurderes hos de dårligste pasientene.
Stereotaktisk bestråling, enten som enkeltfraksjon eller med få fraksjoner ved nærhet til spinalkanalen, kan være aktuelt ved columnametastaser uten affeksjon av spinalkanalen (Guckenberger et al., 2014; Waldeland, Brustugun, Ramberg, & Helland, 2012). Stereotaktisk bestråling (vanligvis en enkeltfraksjon mellom 12 og 24 Gy basert på metastasens størrelse og lokalisasjon) kan også være aktuelt ved skjelettmetastaser utenfor columna – spesielt hos pasienter med lang forventet levetid, da dette er vist å kunne gi høyere og mer langvarige smertelindringsresponser (Nguyen et al., 2019).
Levermetastaser
Ved massiv levermetastasering og smertefull kapselspreng kan det overveies å gi palliativ strålebehandling mot leveren. Målvolumet er hele organet og feltgrensene kan plasseres like rundt leveren. Bydder et al publiserte at et fraksjoneringsregime med 5 Gy x2 med 24 timers mellomrom ga god effekt (respons hos 54 % av pasientene) (Bydder et al., 2003). Eventuelt kan 8 Gy x1 eller 4 Gy x5 forsøkes (Lock et al., 2012). Stråleindusert leverskade kan oppstå ved doser rundt 30 Gy i 2-Gy fraksjoner til total lever, mens toleransen er langt høyere om < 25 % av leveren bestråles. Ved oligometastatisk sykdom kan stereotaktisk stråling med høyere fraksjonsdose benyttes, mye brukt er 15 Gy x3, eller 8-10 Gy x 5. Markering av metastasen med gullkorn kan være en fordel.
Binyremetastaser
Ved smertegivende metastaser kan en engangsfraksjon (8 Gy) eller fraksjonert behandling (3 Gy x10 eller 4 Gy x5) være aktuelt, avhengig av metastasens utbredelse og symptombilde samt pasientens allmenntilstand og metastase-situasjonen for øvrig. Ved singel binyremetastase kan stereotaksi med kurativt siktemål være relevant (se under).
Oligometastaser
Pasienter med oligometastatisk sykdom på diagnosetidspunktet kan vurderes for mer aggressiv behandling. Definisjonen på primært oligometastatisk sykdom varierer, men i de fleste studier har man inkludert pasienter med begrenset metastasering, vanligvis 1-3 metastaser.
Hjerne- eller binyremetastaser som kan reseseres radikalt eller behandles med stereotaktisk stråleterapi bør ikke oppfattes som kontraindikasjon mot radikal lungekirurgi eller kurativ stereotaktisk strålebehandling (Jasper, Stiles, McDonald, & Palma, 2022), spesielt ved N0 (Ashworth et al., 2014). Selekterte pasienter med N1/2 og solitær metastase kan også vurderes for kjemoradiasjon mot toraks og kirurgi/stereotaksi mot fjernmetastasen. Pasienter som er kandidater for mer aggressiv behandling av oligometastatisk sykdom skal utredes med PET/CT og MR caput, og evt histologisk verifisering av lymfeknuter dersom det har behandlingskonsekvens (Dingemans et al., 2019). Disse pasientene skal diskuteres på regionalt MDT møte for behandlingsanbefaling.
Evt nytte av neoadjuvant eller adjuvant behandling i denne gruppen er ikke avklart. Det er gjort små studier med både neoadjuvant kjemoterapi og TKI med gode PFS-data (Iyengar et al., 2018). Effektiv systemisk behandling er fremhevet som viktig for behandling av denne pasientgruppen, og neoadjuvant kjemo-immunterapi (som for stadium IV) kan også være et alternativ (Hendriks et al., 2023).
Det er i en randomisert fase II-studie vist at lokal konsolidativ behandling (stråleterapi eller kirurgi) mot inntil 3 gjenstående lesjoner etter førstelinjebehandling ga signifikant bedre overlevelse enn observasjon alene (41,2 mot 17,0 mndr) (Gomez et al., 2019). Totaldose og fraksjonering vil bestemmes utfra allmenntilstand og prognose samt metastasenes antall, størrelse og beliggenhet og det er derfor vanskelig å gi standard doseringsanbefalinger (Zhu et al., 2022).
Palliativ lungekirurgi
Sist faglig oppdatert: 31.10.2024
Kirurgisk intervensjon i palliativ situasjon er sjelden aktuelt. Anleggelse av perikardiopleuralt vindu kan forsøkes ved store perikardeffusjoner, fortrinnsvis torakoskopisk (D). Lungereseksjon kan være indisert ved store hemoptyser som er refraktære for strålebehandling, laser og angioembolisering (D). Lungeabscesser behandles vanligvis konservativt eller med perkutan drenering, men spesielt ved empyemutvikling (gjennombrudd til pleura) kan kirurgisk intervensjon bli aktuelt (D).
Medikamentell behandling i førstelinje
Sist faglig oppdatert: 31.10.2024
Førstelinjes behandling, ikke-plateepitelkarsinom, ikke-mutert
Pasienter med adenokarsinom uten påvist ALK-, EGFR- eller ROS1-mutasjon skal vurderes for kombinasjonsbehandling med immunterapi gitt sammen med kjemoterapi, alternativt immunterapi som monoterapi ved høyt PD-L1-uttrykk (se avsnitt 8.3.4: førstelinjes behandling ikke-småcellet lungekreft med PD-L1-lufttrykk > 50 %), eller uavhengig av PD-L1-uttrykk om kjemoterapi ikke er egnet. Denne anbefalingen baseres på flere studier, blant annet den såkalte Keynote 189-studien som var en stor fase III-studie (n=616) som randomiserte mellom standard kjemoterapi (pemetreksed og karboplatin/cisplatin etterfulgt av pemetreksed vedlikeholdsbehandling i opptil 2 år) eller samme type kjemoterapi kombinert med PD-1-hemmeren pembrolizumab hver 3. uke i opptil 2 år (Gandhi & Garassino, 2018). En oppdatert analyse etter median oppfølgningstid på litt over 5 år viste 5-års overlevelse på 19,4 % i kombinasjonsgruppen mot 11,3 måneder i kjemoterapigruppen (Garassino et al., 2023). Det var tydelig effektforskjell uavhengig av PD-L1-uttrykk (inkludert hos pasienter med PD-L1-negative svulster). Bivirkningsfrekvensen var 72,8 % grad 3-5 i kombinasjonsgruppen mot 67,3 % i kjemoterapigruppen.
Beslutningsforum vedtok 29. april 2019 følgende:
«Pembrolizumab (Keytruda®) i kombinasjon med pemetreksed og platiumholdig kjemoterapi kan innføres til førstelinjebehandling av ikke-småcellet lungekreft uten plateepitelhistologi med PD-L1 uttrykk lavere enn 50 prosent.»
Det er nå også publisert en fase III-studie med 466 inkluderte pasienter med avansert NSCLC uten EGFR-, ALK- eller ROS1-aberrasjoner hvor PD-1-antistoffet cemiplimab i kombinasjon med platinum-dublett ble sammenlignet med kjemoterapi alene (Gogishvili et al., 2022). Oppdaterte tall etter median 28,4 måneder oppfølgning viste en signifikant bedre totaloverlevelse i gruppen som fikk kombinasjonsbehandlingen (21,1 mndr) mot kjemoterapi alene (12,9 mndr), HR 0,65 (Makharadze et al., 2023). Bivirkninger av grad 3 eller høyere forekom noe hyppigere i kombinasjonsgruppen (48,7 %) mot 32,7 % i kjemoterapigruppen.
Subgruppeanalyser viste at median totaloverlevelse var lavere i gruppen som fikk kombinasjonsbehandling og som hadde PD-L1-uttrykk på under 1 % (median OS 12,8 mndr, HR 0,94) mot for gruppene som hadde 1-49 % PD-L1-utrykk (median OS 23,2 mndr, HR 0,50) og 50 % eller mer (median OS 23,5 mndr, HR 0,56).
Beslutningsforum vedtok 17. juni 2024 følgende:
«Cemiplimab (Libtayo) innføres i kombinasjon med platinabasert kjemoterapi til førstelinjebehandling av voksne pasienter med ikke-småcellet lungekreft (NSCLC) som uttrykker PD-L1 (i ≥ 1 % tumorceller), uten EGFR-, ALK- eller ROS1-avvik, som har:
- lokalavansert NSCLC som ikke er kandidater for definitiv kjemostråling
eller
- metastatisk NSCLC»
For pasienter NSCLC uavhengig av histologisk subtype, og PD-L1-uttrykk på 1% eller høyere kan dermed cemiplimab i kombinasjon med platinumdublett være et alternativ. Foreløpig er oppfølgningsvarigheten noe kortere enn for pembrolizumab-kombinasjonen, så det kan være grunn til å avvente beslutningen om å sidestille disse behandlingsalternativene.
Bruk av pemetreksed betinger substitusjon med vitamin B12 (1 mg s.c. hver 9. uke) og folsyre (350-1000 µg/dag) for å redusere toksisitet, dette skal være startet minst 5 dager før oppstart kombinasjonsbehandling. Behandlingsopplegget i detalj vil være 4 kurer i 3-ukers intervall med kombinasjonen pembrolizumab 200 mg iv, pemetreksed (500 mg/m2 iv) og karboplatin (AUC 5, maksimalt 750 mg iv). Deretter fortsetter behandlingen med 3 ukers intervall med pembrolizumab (200 mg iv) og pemetreksed (500 mg/m2 iv) i inntil 2 år.
Bivirkningene ved kombinasjonsbehandling synes å tilsvare den additive effekten av bivirkninger av immunterapi alene, samt av kjemoterapi alene, og det ser ikke ut til å oppstå synergi i forekomst eller alvorlighetsgrad, eller at helt nye bivirkningsproblemer oppstår. Imidlertid var det i Keynote 189-studien bemerket en noe høyere nyretoksisitet enn forventet (2,0 % grad 3 eller høyere) (Gandhi & Garassino, 2018). Ved toksisitet kan ett eller flere av stoffene avsluttes, men dersom pemetreksed avsluttes vil det fortsatt være aktuelt å kontinuere pembrolizumab. For ytterligere informasjon om bivirkninger relatert til immunterapi, se avsnitt «Bivirkninger ved immunterapi» i kapittel Immunterapi: bivirkninger, behandlingsvarighet og annet.
Pasienter hvor man er usikker på toleransen for kjemoterapi kan trolig profitere på immunterapi alene, utfra studier som viser overlegenhet av pembrolizumab som monoterapi sammenlignet med kjemoterapi alene hos pasienter med PD-L1-uttrykk ≥50 % (Reck et al., 2016), og minst likeverdighet ved lavere PD-L1-uttrykk (T. S. K. Mok et al., 2019). Spesielt ved PD-L1-uttrykk over 75 % er det uklart hvilken gevinst man har av å legge kjemoterapi til pembrolizumab alene (Aguilar et al., 2018). I slike tilfeller vil et mulig behandlingsregime være første kur gitt som pembrolizumab 200 mg, og ved god toleranse etter 3 uker overgang til 400 mg hver 6. uke. Ved 6-ukers intervall kan CT-evaluering før hver 2. kur, iallfall innledningsvis, være fornuftig. Se Immunterapi: bivirkninger, behandlingsvarighet og annet.
Skjematisk kan behandlingsopplegget framstilles som i Figur 19.
For pasienter NSCLC uavhengig av histologisk subtype, og PD-L1-uttrykk på 1% eller høyere kan dermed cemiplimab i kombinasjon med platinumdublett være et alternativ. Det er vanskelig å sammenligne studiene, da KN189 ikke inkluderte pasienter med plateepitelhistologi, og dette regimet er innført uavhengig av PD-L1-uttrykk, mens Empower-Lung 3 inkluderte alle NSCLC, og er innført kun ved PD-L1 ≥ 1%. Foreløpig er oppfølgningsvarigheten noe kortere for cemiplimab- enn for pembrolizumab-kombinasjonen.
I tillegg er monoterapi med atezolizumab en mulighet for pasienter som er uegnet for platinabasert kjemoterapi, basert på en studie som randomiserte 453 NSCLC-pasienter uavhengig av PD-L1-uttrykk til enten atezolizumab eller monoterapi gemcitabin eller vinorelbin (S. M. Lee et al., 2023). Pasienter i atezolizumab-gruppen hadde en noe lengre totaloverlevelse (10,3 måneder) enn kjemoterapigruppen (9,2 måneder), med en HR på 0,78.
Beslutningsforum vedtok 21.10.24 (nyemetoder.no) (PDF):
- Atezolizumab (Tecentriq) som monoterapi innføres til førstelinjebehandling av voksne med avansert ikke-småcellet lungekreft (NSCLC) som er uegnet for platinabasert kjemoterapi
- Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
- Behandlingen kan tas i bruk til aktuell indikasjon fra beslutningstidspunktet.
Førstelinjes behandling, ikke-plateepitelkarsinom, mutasjonspositiv
Det er fra flere studier tydelig at pasienter med EGFR- eller ALK-mutasjoner har bedre nytte av målrettet behandling enn immunterapi i første linje og pasienter med slike mutasjoner ble ikke inkludert i disse førstelinje-studiene med immunterapi. Pasienter med funn som muliggjør målrettet behandlng bør følgelig ikke tilbys immunterapi i første linje, se Målrettet behandling.
Førstelinjebehandling, plateepitelkarsinom
Også for pasienter med plateepitelkarsinom viser en stor (n=559) fase III-studie (Keynote 407) at kombinasjonen pembrolizumab og kjemoterapi (paklitaksel og karboplatin) gir bedre resultater enn kjemoterapi alene, uavhengig av PD-L1-uttrykk (Paz-Ares et al., 2018). En oppdatert overlevelsesanalyse, etter median oppfølgningstid på 14,3 måneder, viste median totaloverlevelse på 17,1 måneder i kombinasjonsgruppen, mot 11,6 måneder hos pasienter som kun fikk kjemoterapi, og grad 3-5-bivirkninger forekom hos 74,1 % i kombinasjonsgruppen mot 69,6 % i kjemoterapigruppen (Paz-Ares et al., 2020).
Kjemoterapien i studien ble gitt med relativt høye doser; paklitaksel 200 mg/kvm hver 3. uke, eller nab-paklitasel 100 mg/kvm ukentlig og karboplatin AUC 6. Man bør ha lav terskel for dosereduksjon, og dette bør vurderes spesielt hos eldre pasienter og pasienter med redusert allmenntilstand (ECOG 2). Paklitaksel og nab-paklitaksel gir risiko for kumulativ polynevropati, og spesiell varsomhet bør utvises hos personer som er spesielt disponert (f.eks. diabetisk nevropati). Paklitaksel kan gi allergiske reaksjoner, og forbehandling med steroider, antihistamin og H2-blokker er nødvendig. Nab-paklitaksel gir mindre risiko for allergiske reaksjoner og det er ikke nødvendig med slik forbehandling. I studien ble det ikke påvist effektforskjeller mellom pasienter som fikk nab-paklitaksel eller paklitaksel. Det var noe mer grad 3-4 anemi og neutropeni i gruppen som fikk nab-paklitaksel (henholdsvis 24 % og 34 %) sammenlignet med paklitaksel (10 % og 15 %), ellers var bivirkningsprofilen ganske lik (hårtap er hyppig). For de fleste vil dermed paklitaksel være å foretrekke over nab-paklitaksel.
Pasienter hvor man er usikker på toleransen for kjemoterapi kan trolig profitere på immunterapi alene, utfra studier som viser overlegenhet av pembrolizumab som monoterapi sammenlignet med kjemoterapi alene hos pasienter med PD-L1-uttrykk ≥50 %, og minst likeverdighet ved lavere PD-L1-uttrykk. Spesielt ved PD-L1-uttrykk over 75 % er det uklart hvilken gevinst man har av å legge kjemoterapi til pembrolizumab alene (Aguilar et al., 2018). Se under: avsnitt "Førstelinjebehandling NSCLC med PD-L1-uttrykk ≥50 %
Beslutningsforum vedtok 26. oktober 2020 følgende:
«Pembrolizumab (Keytruda) i kombinasjon med karboplatin og enten paklitaksel eller nab-paklitaksel kan innføres ved førstelinjebehandling av metastatisk plateepitel ikke-småcellet lungekreft for pasienter med PD-L1-uttrykk < 50 %.»
Behandlingsoppsettet med paklitaksel kan være som følger:
- Kvelden før kur: deksametason 20 mg po, pantoprazol 40 mg po
- Morgenen før kur: deksametason 20 mg po, pantoprazol 40 mg po, cetirizin 10 mg po, famotidin 20 mg po, ondansetron 8 mg po (ev. netupitant/palonosetron)
- Rekkefølge på kur:
- Pembrolizumab 200 mg iv over 30 min
- Paklitaksel 200 (ev. 175) mg/kvm iv over 3 timer
- Karboplatin AUC 6 (ev. AUC 5) iv over 1 time
- Kvelden kurdag: ondansetron 8 mg po
- Morgenen etter kur: deksametason 8 mg po
Skjematisk kan behandlingsopplegget framstilles som i Figur 20.
Subgruppeanalyser viste at median totaloverlevelse var lavere i gruppen som fikk kombinasjonsbehandling og som hadde PD-L1-uttrykk på under 1 % (median OS 12,8 mndr, HR 0,94)) mot for gruppene som hadde 1-49 % PD-L1-utrykk (median OS 23,2 mndr, HR 0,50) ) og 50 % eller mer (median OS 23,5 mndr, HR 0,56).
Beslutningsforum vedtok 17. juni 2024 følgende:
«Cemiplimab (Libtayo) innføres i kombinasjon med platinabasert kjemoterapi til førstelinjebehandling av voksne pasienter med ikke-småcellet lungekreft (NSCLC) som uttrykker PD-L1 (i ≥ 1 % tumorceller), uten EGFR-, ALK- eller ROS1-avvik, som har:
- okalavansert NSCLC som ikke er kandidater for definitiv kjemostråling,
eller
- metastatisk NSCLC»
For pasienter NSCLC uavhengig av histologisk subtype, og PD-L1-uttrykk på 1 % eller høyere kan dermed cemiplimab i kombinasjon med platinumdublett være et alternativ. Det er vanskelig å sammenligne studiene, da KN407 kun inkluderte pasienter med plateepitelhistologi, og dette regimet er innført uavhengig av PD-L1-uttrykk, mens Empower-Lung 3 inkluderte alle NSCLC, og er innført kun ved PD-L1 ≥ 1 %. Foreløpig er oppfølgningsvarigheten noe kortere for cemiplimab- enn for pembrolizumab-kombinasjonen.
Førstelinjes behandling ikke-småcellet lungekreft med PD-L1-uttrykk ≥ 50 %
PD-L1-uttrykket har betydning for behandlingsvalg i førstelinje, og PD-L1-analyse bør foreligge før behandlingsoppstart. Internasjonale data indikerer at om lag 1/3 av pasienter med avansert ikke-småcellet lungekreft har PD-L1-uttrykk på minst 50 %.
Pasienter med ikke-småcellet lungekreft og PD-L1-uttrykk ≥50 % kan vurderes for immunterapi som monoterapi i første linje basert på blant annet en fase III-studie (Keynote 024) hvor pasienter med ikke-småcellet lungekreft (både adenokarsinom og plateepitelkarsinom) og PD-L1-uttrykk ≥50 % ble randomisert til enten monoterapi med PD-1-hemmeren pembrolizumab, eller konvensjonell platinumdublett (Reck et al., 2016). Studien viste en klart bedre effekt av pembrolizumab sammenlignet med kjemoterapi. Pembrolizumab gav bedre progresjonsfri overlevelse enn standard platinumbasert kjemoterapi (10,3 måneder vs 6,0), bedre totaloverlevelse (median 30,0 mndr versus 14,2 mndr, HR 0,63) og høyere responsrate (46 % vs 28 %). Det var også færre grad 3-5 bivirkninger med pembrolizumab enn med platinum-dublett (27 % vs 53 %) (Reck et al., 2016).
Pembrolizumab monoterapi gis som flat dose 200 mg hver 3. uke eller 400 mg hver 6. uke (eksempelvis første kur 200 mg, derettter 400 mg-dosering) til progresjon eller til ikke-tolerable bivirkninger. Behandling utover to år er neppe indisert (se også avsnitt «Behandlingsvarighet ved immunterapi, og kontrollopplegg etter avsluttet behandling» i Immunterapi: bivirkninger, behandlingsvarighet og annet). CT-evaluering etter hver 2. kur ved 6-ukers intervall, evt hver 3. kur ved 3-ukers intervall).
Empower-Lung 1-studien randomiserte tidligere ubehandlede ikke-småcellet lungekreft-pasienter med PD-L1-uttrykk i ≥ 50 % av tumorceller til enten cemiplimab alene, eller kombinasjonskjemoterapi. Ved progresjon på cemiplimab kunne inntil fire kurer kjemoterapi legges til, og cemiplimab kontinueres (Sezer et al., 2021). PD-L1-uttrykk ble analysert med antistoffklonen 22C3. 710 pasienter ble randomisert 1:1, og av 563 som hadde bekreftet PD-L1 ≥ 50 % var median overlevelse 26,1 mndr for pasienter behandlet med cemiplimab, versus 14,2 mndr for kjemoterapigruppen (HR 0,57) (Özgüroğlu et al., 2023). Også her var bivirkningsprofilen i favør cemiplimab. Cemiplimab doseres 350 mg iv flatt, hver 3. uke.
Beslutningsforum vedtok 21. november 2022 følgende:
- Cemiplimab (Libtayo) innføres som monoterapi til førstelinjebehandling av voksne pasienter med ikke-småcellet lungekreft (NSCLC) som uttrykker PD-L1 (i ≥ 50 % tumorceller), uten EGFR-, ALK eller ROS1-avvik, som har:
enten
-
- lokalavansert NSCLC som ikke er kandidater for definitiv kjemostråling,
eller
-
- metastatisk NSCLC
- Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
- Behandlingen kan tas i bruk i forbindelse med oppstart av neste onkologianbud.
Beslutningsforum vedtok 22. mai 2017 følgende:
«Pembrolizumab (Keytruda®) innføres til førstelinjebehandling av lokalavansert eller metastatisk PD-L1 positiv ikke-småcellet lungekreft hos voksne med PD-L1 uttrykk på minst 50 % uten EGFR- eller ALK-positive mutasjoner i tumor.»
I en annen studie ble tidligere ubehandlede ikke-småcellet lungekreft-pasienter med uttrykk av PD-L1 randomisert til enten atezolizumab alene, eller kombinasjonskjemoterapi (Herbst et al., 2020). I denne studien ble 3192 pasienter screenet for PD-L1-status med et spesifikt assay (antistoffet SP142). Av totalgruppen ble 2605 av disse (82 %) funnet å ikke ha PD-L1-ekspresjon, mens 205 hadde høyt PD-L1-uttrykk og verken EGFR- eller ALK-mutasjon. I denne høy-uttrykksgruppen ble det påvist en overlevelsesgevinst hos dem som fikk atezolizumab (median overlevelse 20,2 måneder) sammenlignet med dem som fikk kjemoterapi (median overlevelse 13,1 måneder). Det er ikke opplagt at denne selekterte gruppen er sammenlignbar med pasientgruppen som ble inkludert i Keynote 024-studien nevnt over.
Beslutningsforum vedtok 30 august 2021 følgende:
- Atezolizumab (Tecentriq) innføres til førstelinjebehandling av metastatisk ikkesmåcellet lungekreft (NSCLC) med tumor som har PD-L1-ekspresjon i ≥ 50 % tumorceller (TC) eller i ≥ 10 % tumorinfiltrerende immunceller (IC) og som ikke har EGFR-mutasjons- eller ALK-translokasjonspositiv NSCLC.
- Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
- Behandlingen kan tas i bruk fra beslutningstidspunktet.
Atezolizumab kan være et alternativ som førstelinjebehandling hos ikke-småcellet lungekreft-pasienter med høyt PD-L1-uttrykk, men pembrolizumab eller cemiplimab anbefales som førstevalg på grunn av data fra en mindre selektert gruppe. Foretrukket preparat vil bli LIS-anbudsvinner.
Anbefaling - Førstelinjebehandling av pasienter med ikke-plateepitelkarsinom uten EGFR-, ALK- ROS1-, NTRK-, RET- eller BRAF-mutasjoner:
- Kombinasjonsbehandling med fire kurer pembrolizumab (200 mg flat dose), pemetreksed (500 mg/m2) og karboplatin (AUC 5) hver 3. uke etterfulgt av pembrolizumab (200 mg) og pemetreksed (500 mg/m2) inntil progresjon eller inntil to år.
- Pembrolizumab alene (200 mg iv hver 3. uke/400 mg hver 6. uke), cemiplimab (350 mg iv hver 3. uke) eller atezolizumab (1200 mg iv hver 3. uke eller 1680 mg iv hver 4. uke) kan vurderes hos pasienter med høyt PD-L1-uttrykk, ved kontraindikasjoner mot kjemoterapi eller bekymring for at pasienten vil utvikle alvorlige bivirkninger av kjemoterapi.
Anbefaling - Førstelinjebehandling av pasienter med plateepitelkarsinom:
- Kombinasjonsbehandling med fire kurer pembrolizumab (200 mg iv flat dose), paklitaksel (175-200 mg/m2) og karboplatin (AUC 5-6) hver 3. uke etterfulgt av pembrolizumab (200 mg iv hver 3. uke eller 400 mg iv hver 6. uke) inntil progresjon eller inntil to år.
- Pembrolizumab alene (200 mg iv hver 3. uke/400 mg hver 6. uke), cemiplimab (350 mg iv hver 3. uke) eller atezolizumab (1200 mg iv hver 3. uke eller 1680 mg iv hver 4. uke) kan vurderes hos pasienter med høyt PD-L1-uttrykk, ved kontraindikasjoner mot kjemoterapi eller bekymring for at pasienten vil utvikle alvorlige bivirkninger av kjemoterapi.
Førstelinjes behandling, andre histologier
Pasienter med storcellet nevroendokrint karsinom bør behandles særskilt, se Storcellet nevroendokrint karsinom (LCNEC). Adenoid cystisk karsinom er ansett lite kjemofølsom, men kombinasjonen cisplatin, epirubicin og syklofosfamid som også benyttes ved thymus-svulster kan være aktuelt (se avsnitt «Ikke-kurativ behandling» i Onkologisk behandling). Sarkomatoide karsinomer er også lite kjemofølsomme, men kan ha cMet-aberrasjoner og dermed være aktuelle for kliniske studier (se «Sarkomatoid karsinom» i Histopatologisk diagnostikk).
I sum ser dagens behandlingsalgoritme for medikamentell behandling av avansert ikke-småcellet lungekreft ut som i Figur 21.

Målrettet behandling
Sist faglig oppdatert: 31.10.2024
EGFR-mutasjon
Den viktigste prediktor for effekt av EGFR-hemmende behandling med EGFR-TKI er aktiverende EGFR-mutasjoner (Mut+), se f.eks. (Lynch et al., 2004). I non-plateepitelkarsinomer er andelen EGFR-positive i Norge ca 10 % (Nasjonalt kvalitetsregister for lungekreft). De vanligste mutasjonene er delesjoner i ekson 19, og punktmutasjonen L858R i ekson 21. Men ca 10 % av såkalte aktiverende mutasjoner forekommer som andre forandringer i eksonene 18, 19, 20 og 21. Insersjoner i ekson 20 er også aktiverende mutasjoner, men har oftest liten eller ingen nytte av dagens EGFR-TKI og kan være aktuelle for annen målrettet behandling (se "Uvanlige mutasjoner i EGFR-genet").
I Norge anbefales testing for EGFR-mutasjon som rutine hos alle pasienter med ikke-småcellet ikke-plateepitelkarsinom (se 6.9.9). Det er viktig å være klar over at osimertinib gitt etter immunterapi gir en ikke ubetydelig risiko for alvorlig pneumonitt, og man bør derfor avvente mutasjonssvar for å eventuelt kunne gi dette i første linje (Schoenfeld et al., 2019). Immunterapi i første linje uten EGFR-svar bør altså unngås, spesielt ved høy sannsynlighet for mutasjonspositivitet (lite- eller aldrirøykende pasient). Dersom det haster å komme i gang med behandling kan man f.eks. starte med kjemoterapi uten immunterapi første kur. Immunterapi etter osimertinib er ikke vist å gi økt pneumonittrisiko.
Gefitinib, erlotinib, afatinib, dakomitinib og osimertinib har alle markedsføringstillatelse som førstelinjebehandling for pasienter med avansert EGFR-mutert ikke-småcellet lungekreft. Gefitinib , erlotinib og afatinib oppfattes som tilnærmet likeverdige preparater (T. S. Mok et al., 2009; Rosell et al., 2012; Sequist et al., 2013), mens dakomitinib har noe lengre effektvarighet men mer bivirkninger (Y. L. Wu et al., 2017).
En fase III-studie randomiserte ubehandlede pasienter med EGFR-mutasjon til enten EGFR-hemmeren osimertinib, eller standard-behandling med enten gefitinib eller erlotinib (Soria et al., 2018). Overkrysning til osimertinib var mulig for de som ble randomisert til standard behandling. Median PFS var signifikant bedre for osimertinib med 18,9 måneder versus 10,2 måneder for standard behandling. PFS for pasienter med hjernemetastaser ved studieinklusjon var 15,2 måneder for osimertinib versus 9,6 måneder for standard behandling. CNS-progresjon tilkom hos 6 % i osimertinib-armen versus 15 % i standard-armen. Median OS for pasienter som fikk osimertinib var 38,6 måneder, mot 31,8 måneder i standard-armen (Ramalingam et al., 2020). Osimertinib har en relativt gunstig bivirkningsprofil; i denne studien ble det rapportert en forekomst av grad 3 eller høyere bivirkninger hos 42 % av pasientene som fikk osimertinib, mot 47 % av pasientene som mottok gefitinib eller erlotinib.
Beslutningsforum vedtok 22.3.2021 følgende:
«Osimertinib (Tagrisso) innføres til førstelinjebehandling av lokalavansert eller metastatisk EGFR-mutasjonspositiv ikke-småcellet lungekreft. Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen. Behandlingen kan tas i bruk fra 01.05.2021, da ny pris kan gjelde fra denne dato.»
Osimertinib oppfattes å ha tydelig bedre effekt, ikke minst intracerebralt, og en mildere bivirkningsprofil enn de andre EGFR-hemmerne. Norsk lungekreftgruppe vurderer derfor osimertinib som førstevalg. Ved toksisitet eller annen grunn til bytte av EGFR-hemmer, bør valg gjøres basert på pris og antatt toleranse.
Også pasienter med hjernemetastaser kan være aktuelle for primær behandling med osimertinib, spesielt dersom stereotaksi ikke er aktuelt. Disse bør følges med regelmessig MR caput.
Det er nå også publisert data som viser at pasienter med EGFR-mutert lungekreft som får kombinasjonen osimertinib og kjemoterapi (4 kurer karboplatin/pemetreksed etterfulgt av pemetreksed vedlikeholdsbehandling) har lengre median progresjonsfri overlevelse enn pasienter som starter med osimertinib alene (29,4 vs 19,9 måneder, HR 0,62) (Planchard et al., 2023). Effekten var størst hos pasienter med hjernemetastaser ved oppstart (24,9 vs 13,8 måneder, HR 0,47). Så langt er det ikke vist signifikant effekt på totaloverlevelse, og bivirkningsfrekvensen var ikke overraskende betydelig høyere i gruppen som fikk kombinasjonsbehandling (64 % grad 3-4, mot 27 % grad 3-4 i monoterapigruppen). Pasienter med behov for rask sykdomskontroll og stor sykdomsbyrde kan være spesielt aktuelle for slik kombinasjonsbehandling.
Uvanlige mutasjoner i EGFR-genet
Med få unntak har alle fase III-studier med EGFR-TKI ekskludert pasienter med andre EGFR-mutasjoner enn de vanlige del19 og L858R. Derfor er det begrenset kunnskap om effekten av EGFR-TKI ved såkalte uvanlige mutasjoner, som forekommer hos 10-15 % av alle med EGFR-mutert lungekreft.
I en post-hoc-analyse ble 38 pasienter med enten L861Q-, S768I- eller G719X-mutasjoner som var behandlet med afatinib samlet fra tre studier (en enkeltarm og to randomiserte studier). Den objektive responsraten var 71,1 % og PFS var 10,7 måneder, noe som førte til FDA-godkjenning av afatinib for disse spesifikke mutasjonene (i tillegg til de vanlige mutasjonene) (J. C. Yang et al., 2015). I samme analyse var det også en gruppe på 23 pasienter med ekson 20-insersjoner. Hos disse var objektive responsrate på afatinib kun 8,7 % og PFS 2,7 måneder. Lignende resultater ble rapportert fra en database med pasienter inkludert i ulike kliniske studier og programmer for utvidet tilgang (127 pasienter med uvanlige mutasjoner og 77 med ekson 20-insersjoner) (J. C. Yang et al., 2020; J. C. Yang et al., 2015).
Osimertinib har blitt evaluert hos pasienter med uvanlige mutasjoner i en prospektiv koreansk enarmet studie (J. H. Cho et al., 2020). Av 36 pasienter hadde 50 % objektiv respons og median PFS var 8,2 måneder. I en nordisk post-hoc analyse av 11 pasienter med uvanlige mutasjoner, behandlet med osimertinib i enten første eller senere linjer fant man en signifikant lengre median PFS hos pasienter med dobbelmutasjoner der G719X var en av mutasjonerene, sammenlignet med gruppen med singelmutasjoner (13,7 måneder versus 3,5 måneder, p=0,003) (Eide et al., 2022). Total overlevelse reflekterte PFS-resultatene (henholdsvis 29,3 måneder vs 7,5 måneder, p=0,001, for sammensatte mutasjoner vs andre mutasjoner). Blant 11 pasienter med hjernemetastaser ved start osimertinib, ble intrakranielle responser observert på tvers av alle grupper, og den totale intrakraniale responsraten var 36,4 %. Også den sjeldne punktmutasjonen L747P i ekson 19 (som altså ikke er en ekson 19-delesjon) har lavere responsrater enn de hyppig forekommende mutasjonene, men noen rapporterer om en viss effekt av afatinib og osimertinib, eventuelt i kombinasjon med kjemoterapi.
Insersjoner i EGFR-genets ekson 20 resulterer også i ligand-uavhengig EGFR signalering men induserer som oftest «steric hindrance» som blokkerer TKI-binding, og EGFR-TKI’ene nevnt over vil ha liten eller ingen effekt. Et mulig unntak er insersjonen A763_Y764 insFQEA, hvor det har vært flere rapporter om respons ved bruk av osimertinib (van Veggel et al., 2020; J. Y. Wu, Yu, & Shih, 2019). Antistoffet amivantamab har i en fase I-studie med 81 tidligere behandlede pasienter med ekson 20-insersjoner gitt responsrater på 40 %, median responsvarighet på 11,1 mndr, og median progresjonsfri overlevelse på 8,3 mndr (Park et al., 2021). En stor andel av pasientene utviklet utslett (86 %) og paronykier (45 %), men grad 3-4 hendelser var relativt sjeldne. Antistoffet gis ukentlig (1050 mg eller 1400 mg, ved vekt under eller over 80 kg) de første 4 ukene, deretter hver 2. uke til progresjon eller uakseptabel toksisitet.
Beslutningsforum vedtok 19.6.2023 følgende:
«1. Amivantamab (Rybrevant) innføres ikke til behandling av voksne pasienter med metastatisk ikke-småcellet lungekreft (NSCLC) med epidermal vekstfaktorreseptor (EGFR) ekson 20 innsettingsmutasjon, etter at platinabasert behandling har mislyktes.
2. Det er ikke dokumentert en klinisk nytte som står i forhold til prisen på legemidlet.
3. Sykehusinnkjøp bes gjenoppta forhandlingene med leverandør.»
Totalt sett er det rimelig å forsøke afatinib ved uvanlige mutasjoner utenom insersjoner i ekson 20, på bakgrunn av mer robuste data, men osimertinib kan også forsøkes, spesielt ved toksistetsproblematikk med afatinib. Førstelinjebehandling hos pasienter med ekson 20-insersjoner (med unntak av insersjonen A763_Y764 insFQEA som nevnt over) bør være kjemoterapi som karboplatin/pemetreksed, uavhengig av PD-L1-uttrykk pga liten sannsynlighet for effekt av immunterapi.
Bivirkninger ved EGFR-behandling
Bivirkningene ved EGFR-TKI inkluderer hudbivirkninger i ansikt og overkropp, noen utvikler også diare. Behandling med steroidsalve/krem, evt systemisk tetracyclin vil være aktuelt (Thatcher et al., 2009). Diarre kan håndteres med loperamid, alternativt opiumdråper (Dropizol®). Hos noen er bivirkningene av en slik grad at dosereduksjon eller bytte til en annen EGFR-TKI kan være aktuelt.
Oppfølgning under EGFR-behandling
Pasienter som starter EGFR-TKI kan rask utvikle bivirkninger, og bør etter få uker settes opp til en klinisk kontroll med blodprøver (tellinger, nyre- og leverprøver) samt EKG for vurdering av QT-tid. CT-evaluering anbefales hver 3. måned iallfall første år, før eventuelt lengre intervall. MR caput bør tas før oppstart, men påviste metastaser trenger ikke automatisk lede til stråleterapi (se avsnitt "Hjernemetastaser" i Palliativ strålebehandling). MR caput tas regelmessig (hver 3. måned) ved kjente hjernemetaser, og med lav terskel ved mistanke om tilkomst av hjernemetastaser.
Behandling etter progresjon på EGFR-hemmere
Osimertinib har markedsføringsgodkjennelse til bruk for pasienter med påvist T790M-mutasjon som har progrediert på minst en linje EGFR-hemmer, på bakgrunn av en fase III-studie var det bedret median progresjonsfri overlevelse med osimertinib (10,1 måneder mot 4,4 måneder med platinumdublett) (T. S. Mok et al., 2017). Færre pasienter i osimertinib-gruppen fikk grad 3-5-bivirkninger (23 % mot 47 %).
Beslutningsforum vedtok 22.3.2021 følgende:
«Osimertinib (Tagrisso) innføres til behandling av voksne pasienter med lokalavansert eller metastatisk EGFR T790M-mutasjonspositiv ikke-småcellet lungekreft. Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen. Behandlingen kan tas i bruk fra 01.05.2021, da ny pris kan gjelde fra denne dato.»
Osimertinib anbefales derfor ved progresjon hos EGFR-positive som ikke har fått osimertinib i førstelinje og som har påvist T790M-mutasjon i biopsi (eventuelt i blodprøve) tatt etter progresjon.
Ved progresjon etter osimertinib, eller ved ikke påvist T790M-mutasjon hos pasienter behandlet med annen EGFR-TKI enn osimertinib i førstelinje, anbefales karboplatin i kombinasjon med pemetreksed. Det kan være aktuelt å kontinuere osimertinib sammen med kjemoterapi, spesielt ved intracerebral non-progresjon. Også stråleterapi av singel-/oligoprogressive lesjoner kan være aktuelt, med kontinuert behandling med osimertinib. Immunterapi har ikke vist overbevisende effekt hos EGFR-positive tross eventuelt høyt PD-L1-uttrykk (Arter & Nagasaka, 2024; Lisberg et al., 2018). Docetaksel kan eventuelt forsøkes i tredjelinje. Kliniske studier kan være et godt alternativ.
Anbefaling — påvist aktiverende EGFR-mutasjon
- Osimertinib bør gis i første linje inntil progresjon.
- Osimertinib anbefales ved progresjon hos EGFR-positive som ikke har fått osimertinib i førstelinje og som har påvist T790M-mutasjon.
- Ved progresjon etter osimertinib kan kombinasjonen karboplatin/pemetreksed vurderes.
- Inklusjon i kliniske studier kan være et alternativ.
ALK-translokasjon
Flere medikamenter som spesifikt hemmer ALK-kinasen er nå tilgjengelige eller under utvikling. Alle tilgjengelige medikamenter kan brukes basert på IHK-svar uten FISH-bekreftelse.
Det første preparatet som fikk markedsføringstillatelse er krizotinib (Xalkori®). En randomisert fase III-studie viste at krizotinib gav en lengre progresjonsfri overlevelse (10,9 mndr) sammenlignet med kjemoterapi (7,0 mndr) (Solomon et al., 2014).
Ceritinib (Zykadia ®) har også markedsføringstillatelse i førstelinje basert på en randomisert fase III-studie som viste lengre PFS (16,6 måneder) enn med kjemoterapi (8,1 måneder) (Soria et al., 2017).
Både krizotinib og ceritinib har positivt vedtak fra Beslutningsforum for bruk i førstelinje, men disse er ikke lenger førstevalg.
Vanlige bivirkninger med krizotinib inkluderer synsforstyrrelser (lysglimt), mage-/tarmproblematikk og stigning i leverenzymer. Dosereduksjon kan være nødvendig.
Alektinib (Alecensa ®) har markedsføringstillatelse til behandling av ALK-positiv ikke-småcellet lungekreft både i første linje, og etter tidligere behandling med krizotinib (S. H. Ou et al., 2016; A. T. Shaw et al., 2016). Standarddosering er 600 mg x2 (8 kapsler à 150 mg). I førstelinjestudien var median progresjonsfri overlevelse for alektinib 25,7 måneder, mot 10,4 måneder for krizotinib (Peters et al., 2017). I alektinib-gruppen fikk 12 % hjernemetastaser, mot 45 % av de krizotinib-behandlede. Grad 3-5-bivirkninger var hyppigere hos de krizotinib-behandlede (50 % mot 41 %). Senere oppdatering av denne studien viste median progresjonsfri overlevelse for alektinib på 34,8 måneder, mot 10,9 måneder for krizotinib. Som nevnt over (8.1.2) kan pasienter med hjernemetastaser på diagnosetidspunkt starte behandling med alektinib og følges med MR caput i stedet for bestråling (S. M. Gadgeel et al., 2016).
Beslutningsforum vedtok 25.6.18 følgende:
«Alektinib (Alecensa®) kan innføres til førstelinjebehandling av ALK-positiv avansert ikke-småcellet lungekreft (NSCLC).»
Alektinib hos pasienter som tidligere er behandlet med krizotinib er til vurdering i Nye metoder, men beslutning er ikke fattet.
Alektinib har en relativt gunstig bivirkningsprofil, men muskelsmerter er vanlig. Det kan også være en utfordring å ta full dose med 8 tabletter daglig.
Brigatinib (Alunbrig ®) har markedsføringstillatelse til behandling av ALK-positiv ikke-småcellet lungekreft både i første linje, og etter tidligere behandling med krizotinib (Camidge et al., 2018; Camidge et al., 2020; Huber et al., 2020; D. W. Kim et al., 2017). Standarddosering startes med en uke med 90 mg x1 etterfulgt av 180 mg x1 (1 kapsel av respektiv styrke), dette er vist å redusere riskiko for «early onset pulmonary events» (EOPE). I førstelinjestudien var median progresjonsfri overlevelse for brigatinib 24,0 måneder, mot 11,0 måneder for krizotinib (Camidge et al., 2020). Hos pasienter med hjernemetastaser ved inklusjon i studien (n=96) var responsraten 78 % hos pasienter som fikk brigatinib, mot 26 % hos dem som fikk krizotinib. Som nevnt over (8.1.2 Hjernemetastaser) kan pasienter med hjernemetastaser på diagnosetidspunkt starte behandling med brigatinib og følges med MR caput i stedet for stråling av hjerne.
Beslutningsforum vedtok 15.2.21 følgende:
«1. Brigatinib (Alunbrig) innføres til førstelinjebehandling av ALK-positiv avansert ikke-småcellet lungekreft (NSCLC)
2. Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
3. Legemiddelet skal inngå i anbud og kan tas i bruk fra avtalestart som er 01.07.2021.Alektinib (Alecensa®) kan innføres til førstelinjebehandling av ALK-positiv avansert ikke-småcellet lungekreft (NSCLC).»
Brigatinib kan gi EOPE, med utvikling av dyspne og hypoksi i løpet av de første 7 dagene etter oppstart (Ng et al., 2020). Forekomsten er lavere med en start-dose på 90 mg første uke, rapportert hyppighet er da 4,5 %, med 3 % i grad 3 eller verre. Disse symptomene er vanligvis ikke uttrykk for pneumonitt, gir seg ofte av seg selv, men det kan bli behov for å pause medikamentet eller avvente videre opptrapping. I alvorlige tilfeller kreves oksygentilskudd. Pasienter skal derfor informeres om viktigheten av å holde seg til startdosenivået første uke og også gis beskjed om å ta kontakt med sykehus ved utvikling av dyspne.
Lorlatinib (Lorviqua ®) har markedsføringstillatelse til behandling av ALK-positiv ikke-småcellet lungekreft både i første linje, og etter tidligere behandling med ALK-hemmer. Femårsdata fra fase 3-studien med lorlatinib vs krizotinib er nå publisert (Solomon et al., 2024). I studien var 60 % av pasientene som startet med lorlatinib uten tegn til progresjon etter 5 år, mot 8 % av dem som startet krizotinib. Etter 5 år var fortsatt 92 % av pasienten som startet med lorlatinib uten tegn til intrakraniell progresjon, mot 21 % av de krizotinib-behandlede.
Beslutningsforum vedtok 23.5.22 følgende:
«1. Lorlatinib (Lorviqua) innføres til behandling av voksne pasienter med ALK-positiv avansert ikke-småcellet lungekreft (NSCLC) som ikke tidligere er behandlet med en ALK-hemmer.
2. Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
3. Behandlingen kan tas i bruk fra beslutningstidspunktet.»
Lorlatinib er også studert etter progresjon på andre ALK-hemmere, og viser effekt også etter alektinib og brigatinib (Solomon et al., 2018), se avsnitt "Behandling ved progresjon på ALK-hemmer" .
Verken briatinib eller alektinib har rapportert 5-års PFS, men 4-års PFS er 63 % for lorlatinib, 43,7 % for alektinib og 36 % for brigatinib.
Utfra foreliggende data oppfattes lorlatinib som et klart mer effektivt preparat enn brigatinib og alektinib og bør være førstevalg i førstelinje for ALK-positiv ikke-småcellet lungekreft. Men lorlatinib har en bivirkningsprofil som gjør at man skal vurdere om dette er det riktige valget til den enkelte pasient. Oppdaterte bivirkningsfrekvenser viser grad 3-4-bivirkninger hos 77 %, med hypertrigylseridemi (25 %), vektøkning (23 %) hyperkolesterolemi (21 %) og hypertensjon (12 %) som de hyppigste med grad 3–4. Også kognitive effekter av alle grader forekom hos 28 %, stemningsforstyrrelser hos 21 %, talepåvirkning av ulik type hos 6 % og psykotiske effekter hos 5 %. Dosereduksjoner og pauser i behandlingen kan bli nødvendig. Det er viktig å være oppmerksom på interaksjoner, spesielt med visse statiner som simvastatin. Anbefalt statin er rosuvastatin. Produsenten av lorlatinib (Pfizer) har publisert en god behandlingsveileder for håndtering av bivirkninger.
Behandling ved progresjon på ALK-hemmer
Brigatinib har markedsføringstillatelse til bruk etter krizotinib, basert blant annet på en fase 2-studie, som randomiserte 222 krizotinib-refraktære pasienter til to ulike doseringsregimer av brigatinib (Huber et al., 2020; D. W. Kim et al., 2017). I den aktuelle doseringsvarianten (90 mg daglig i 7 dager, etterfulgt av 180 mg daglig), var ORR 56 %, PFS 16,7 måneder og bivirkningene var relativt moderate. Denne behandlingen ble vurdert i Beslutningsforum 21.10.19 med følgende vedtak:
«Brigatinib (Alunbrig) kan innføres til behandling av voksne pasienter med anaplastisk lymfomkinase (ALK) positiv avansert ikke-småcellet lungekreft (NSCLC) tidligere behandlet med krizotinib.»
Alektinib har også markedsføringstillatelse til bruk etter krizotinib, basert blant annet på en liten fase III-studie som randomiserte 119 pasienter 2:1 til enten alektinib eller kjemoterapi (pemetreksed eller docetaksel). PFS var 10,9 mndr med alektinib mot 1,4 mndr med kjemo. Intrakraniell responsrate var 67 % med alektinib mot 0 % med kjemoterapi (Wolf et al., 2022). Alektinib som slik andrelinjebehandling er ikke vurdert i Beslutningsforum.
Ved progresjon på alektinib enten som første- eller andrelinje er den vanligste årsaken til resistens en sekundær punktmutasjon, G1202R. Lorlatinib er rapportert å være virksom tross tilstedeværelse av G1202R, og er vist å gi responsrater i området 30-40 % og median PFS på drøyt 6 mndr etter progresjon etter non-krizotinib ALK-hemmer (Felip, Shaw, et al., 2021; A. T. Shaw, Solomon, Besse, et al., 2019; Solomon et al., 2018). Lorlatinib har også god hjernepenetranse, med ca 50 % CNS-respons hos pasienter med hjernemetastaser og som hadde progrediert etter non-krizotinib ALK-hemmer. Lorlatinib gis som en tablett daglig, 100 mg. Bivirkninger inkluderer påvirkning av lipidstoffskiftet, samt mentale/kognitive endringer. Dosereduksjon til 75 mg x1, evt til 50 mg x1 kan være nødvendig.
Lorlatinib til bruk etter alektinib ble vurdert i Beslutningsforum 14.12.20 med følgende vedtak:
«Lorlatinib (Lorviqua) innføres til behandling av ALK-positiv avansert ikke-småcellet lungekreft (NSCLC) i andre- eller senere linjer. Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.»
Ingen av de andre tilgjengelige ALK-hemmerne er vist å ha effekt mot G1202R-mutasjonen. Brigatinib er rapportert å kunne gi responser hos enkeltpasienter med progresjon etter alektinib, men effekiten er generelt begrenset (Hochmair et al., 2019; S. I. Ou et al., 2022).
Ved progresjon etter lorlatinib anbefales karboplatin i kombinasjon med pemetreksed. Immunterapi har ikke vist overbevisende effekt hos ALK-positive tross eventuelt høyt PD-L1-uttrykk. Docetaksel kan eventuelt forsøkes i neste linje. Kliniske studier kan være et godt alternativ.
Anbefaling — påvist ALK-positivitet
- TKI-behandling med lorlatinib (100 mg x1) bør gis i førstelinje inntil progresjon. Alektinib (600 mg x 2), alternativt brigatinib (90 mg x1 i en uke, deretter 180 mg x1) dersom lavere pris, kan også være et alternativ i førstelinje.
- Dersom krizotinib er gitt i førstelinje, kan TKI-behandling med ceritinib (450 mg x 1 med mat) eller brigatinib (90 mg x1 i en uke, deretter 180 mg x1) gis.
- Ved progresjon under ALK-hemmerbehandling, og lorlatinib ikke er gitt, bør videre ALK-rettet behandling med lorlatinib (100 mg x1) vurderes.
- Ved progresjon uten videre tilgjengelig ALK-rettet behandling bør pasienter vurderes for behandling med kombinasjonen karboplatin/pemetreksed.
Inklusjon i kliniske studier kan være aktuelt.
BRAF-mutasjon
For detaljer rundt biologi og test-rutiner, se avsnitt "Spesifikt om molekylære analyser" i Histopatologisk diagnostikk.
Forekomsten av BRAF-mutasjoner er rundt 2%, og finnes både hos røykere og aldri-røykere. Kombinasjonen av BRAF-hemmeren dabrafenib og MEK-hemmeren trametinib har nå markedsføringstillatelse ved BRAFV600-positiv lungekreft uansett linje. Det er kun punktmutasjoner i kodon 600 (V600E/K/X) som gir behandlingsrespons med dagens BRAF/MEK-hemmere, disse utgjør ca 50 % av alle BRAF-mutasjoner som detekteres ved ikke-småcellet lungekreft.
I en ikke-randomisert fase II-studie ble 57 BRAFV600-muterte pasienter som hadde progrediert etter platinumdublett behandlet med kombinasjonen dabrafenib og trametinib (Planchard et al., 2016). Man fant en responsrate på 68,4 %, progresjonsfri overlevelse på 10,2 måneder og median overlevelse 18,2 mndr. Oppdaterte tall viste 5-årsoverlevelse på 19 % (Planchard et al., 2022). Bivirkningsfrekvensen var relativt høy, med 49 % grad 3-4. Pyreksi var hyppigst (56 %), fulgt av kvalme/diaré, asteni og nedsatt apetitt. Grad 3-4-nøytropeni ble sett hos 8 %, og hyponatremi hos 10 %.
I samme studie ble det også inkludert en kohort med 36 behandlingsnaïve BRAF muterte pasienter med lokalavansert eller metastatisk sykdom som mottok kombinasjonsbehandling med dabrafenib og trametinib (Planchard et al., 2017). Responsraten var 64 %, median PFS 10,8 måneder, median overlevelse 17,3 måneder og 5-årsoverlevelse 22 %. Bivirkningsprofilen var som hos tidligere behandlede.
Dabrafenib (150 mg x2) kombinert med trametinib (2 mg x1) har markedsføringstillatelse ved BRAF-mutert ikke-småcellet lungekreft både i første og senere linjer.
Kombinasjonen dabrafenib/trametinib ble vurdert av Beslutningsforum 22.5.23 med følgende konklusjon:
«1. Dabrafenib (Tafinlar) og trametinib (Mekinist) i kombinasjon innføres til behandling av voksne pasienter med avansert ikke-småcellet lungekreft med en BRAF V600-mutasjon.
2. Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
3. Behandlingen kan tas i bruk fra beslutningstidspunktet.»
Det synes utfra foreliggende data rimelig å anbefale dabrafenib/trametinib i førstelinje hos behandlingsnaïve pasienter med BRAF V600-mutasjon, mens denne kombinasjonen også er aktuell hos pasienter med BRAF-mutasjon som har fått annen behandling tidligere.
Ved progresjon på BRAF-hemmer gitt i førstelinje anbefales (kjemo-)immunterapi som ved førstelinjes behandling av ikke-mutert ikke-småcellet lungekreft. Immunterapi alene kan forsvares ved høyt PD-L1-uttrykk da responsratene ser ut til å tilsvare de man ser ved ikke-mutert lungekreft (i motsetning til ved f.eks. EGFR-mutasjoner) (Gibson et al., 2023; Guisier et al., 2020).
Anbefaling — påvist BRAF-positivititet
- TKI-behandling med dabrafenib (150 mg x 2) kombinert med trametinib (2 mg x1) bør gis i førstelinje inntil progresjon.
- Ved progresjon uten videre tilgjengelig BRAF-rettet behandling bør pasienter vurderes for behandling med immunterapi med eller uten kjemoterapi, basert på PD-L1-uttrykk.
- Inklusjon i kliniske studier kan være aktuelt.
ROS1-translokasjon
For detaljer rundt biologi og test-rutiner, se avsnitt "Spesifikt om molekylære analyser" i Histopatologisk diagnostikk. Som for EGFR og ALK forekommer ROS1-translokasjoner nærmest utelukkende i adenokarsinomer. Krizotinib hemmer aktivert ROS1, og har markedsføringstillatelse for førstelinjes-behandling eller etter annen behandling der denne aberrasjonen er påvist. I en ikke-randomisert studie med 50 pasienter med påvist ROS1-rearrangement som ble behandlet med krizotinib var responsvarighet 17,6 mndr og responsraten var 72 % (A. T. Shaw et al., 2014). Testing for ROS1 gjøres nå rutinemessig av alle med ikke-småcellet lungekreft av ikke-plateepitelkarsinomtype, altså samme populasjon som testes for ALK- og EGFR-mutasjoner.
Krizotinib ved ROS1-positivitet er vurdert av Beslutningsforum 23.4.18 med følgende konklusjon:
«Krizotinib (Xalkori®) kan innføres til behandling av ROS1-positiv ikke-småcellet lungekreft.»
Entrektinib er en tyrosinkinasehemmer som inhiberer både TRK- og ROS1-kinasene, og har god CNS-penetrans (Doebele et al., 2020; Drilon, Siena, et al., 2020; Drilon et al., 2017). I en sammenstilling av data fra tre tidlig-fasestudier med entrektinib ved ROS1-positiv ikke-småcellet lungekreft, fant man en respons hos 41 av 53 pasienter (77 %), og median responsvarighet på 24,6 måneder. Vektøkning og nøytropeni var de hyppigst forekommende grad 3-4-bivirkningene (Drilon, Siena, et al., 2020). I en oppdatering av disse studiene med totalt 161 pasienter ble det rapportert om responsrate på 67 %, median PFS 15,7 måneder og 81 % av pasientene var i live 12 måneder etter oppstart behahdling. Intrakraniell respons ble sett hos 19 av 24 pasienter (79 %) med median intrakraniell responsvarighet på 12,9 måneder. Bivirkningsprofilen var ikke endret (Dziadziuszko et al., 2021).
Entrektinib ved ROS1-positivitet er vurdert av Beslutningsforum 13.12.21 med følgende konklusjon:
«1. Entrectinib (Rozlytrek) innføres til behandling av lokalavansert eller metastatisk ROS1-positiv ikke-småcellet lungekreft som ikke tidligere er behandlet med ROS1-hemmere.
2. Innføringen er knyttet til en alternativ prisavtale, der tilbudt pris ved denne indikasjonen, forutsetter innføring av entrektinib (Rozlytrek) til behandling av pasienter over 12 år som har lokalavansert eller metastatisk kreft med NTRKfusjonspositive solide svulster.
3. Det forutsettes at prisen er lik eller lavere enn den prisen som er grunnlaget for denne midlertidige innføringen.
4. Behandlingen kan tas i bruk fra 15.01.2022 da ny pris kan gjelde fra denne datoen.»
Lorlatinib har effekt hos krizotinib-refraktær ROS1-positiv sykdom, men er ikke vurdert i Nye Metoder for denne indikasjonen (A. T. Shaw, Solomon, Chiari, et al., 2019). Ceritinib har effekt som førstelinjes ROS1-behandling, men har ikke ROS1-godkjenning (S. M. Lim et al., 2017).
Andre godkjente ALK-hemmere er ikke funnet å være virksomme ved ROS1-positiv sykdom. Kjemoterapi kombinert med immunterapi som ved førstelinjes behandling av ikke-mutert ikke-småcellet lungekreft anbefales ved progresjon på ROS1-hemmer. Immunterapi alene direkte etter ROS1-hemmer anbefales ikke grunnet antatt lave responsrater tross eventuelt høyt PD-L1-uttrykk.
Entrektinib og krizotinib er ikke sammenliknet direkte i kliniske studier for ROS1-positiv ikke-småcellet lungekreft. Real-world-data på krizotinib sammenlignet med studiedata på entrektinib tydet på en viss overlegenhet av entrektinib (Doebele et al., 2021). Foreliggende data, både CNS-effektivitet og en noe mer gunstig bivirkningsprofil, gjør at det er grunnlag for å anbefale entrektinib over krizotinib som førstevalg som førstelinjebehandling ved ROS1-positiv ikke-småcellet lungekreft.
Anbefaling - påvist ROS1-positivitet
- TKI-behandling med entrektinib (600 mg x 1) bør gis i førstelinje inntil progresjon.
- Krizotinib (250 mg x2) inntil progresjon er et alternativ ved intoleranse for entrektinib.
- Inklusjon i kliniske studier kan være aktuelt.
NTRK-translokasjon
For detaljer rundt biologi og test-rutiner, se avsnitt "Spesifikt om molekylære analyser" i Histopatologisk diagnostikk.
Genrearrangering som involverer nevrotrofin kinasegener (NTRK1, NTRK2, NTRK3) forekommer med en frekvens på ca 0,24 % ved ikke-småcellet lungekreft (Westphalen et al., 2021), og forårsaker uttrykk av konstitutivt aktive fusjonsproteiner med tropomyosin-reseptorkinase (TRKA/B/C) som er onkogene drivere av tumorvekst. Flere TRK-hemmere er utviklet, blant andre entrektinib og larotrektinib som begge er EMA-godkjente (Doebele et al., 2020; Hong et al., 2020).
Entrektinib er også aktuell for ROS1-positiv ikke-småcellet lungekreft (se 8.4.4). Entrektinib har indikasjon som monoterapi til pasienter med solide tumorer med påvist NTRK-genfusjon uten tilfredsstillende behandlingsalternativer. Median responsvarighet med entrektinib er rapportert å være 10 måneder, men med vide konfidensintervall (95 % 7,1 måneder til ikke estimerbar), og median PFS 11,2 måneder (Doebele et al., 2020). I denne studien hadde 27 % hjernemetastaser, og 10 av 54 pasienter hadde ikke-småcellet lungekreft.
I en studie hvor 159 NTRK-positive pasienter (12 med ikke-småcellet lungekreft) ble behandlet med larotrektinib, fant man en responsrate på 79 %, median responsvarighet på 35 måneder og median PFS 28 måneder (Hong et al., 2020). I denne studien var 31 % av pasientene barn og 8 % hadde hjernemetastaser. Direkte sammenligning av dataene mellom disse to studiene skal man dermed være forsiktig med.
TRK-hemmere har generelt betydelig mindre forekomst av bivirkninger enn cellegift, men vektøkning og anemi er hyppigst rapporterte.
Entrektinib ved NTRK-positivitet er vurdert av Beslutningsforum 13.12.21 med følgende konklusjon:
«1. Entrektinib (Rozlytrek) innføres midlertidig som monoterapi til behandling av voksne og pediatriske pasienter fra 12 års alder som har solide tumorer som uttrykker nevrotrofisk tyrosinreseptor kinase (NTRK)-genfusjon,
• og som har en lokalavansert eller metastatisk sykdom, eller der kirurgisk reseksjon forventes å kunne resultere i alvorlig morbiditet, og
• som ikke har mottatt tidligere behandling med NTRK-hemmer
• som ikke har noen tilfredsstillende behandlingsalternativer
2. Beslutningen er knyttet til en alternativ prisavtale som innebærer at prisen på legemiddelet starter på et redusert nivå og deretter kan følge den dokumenterte effekten.
3. Leverandør skal levere ny dokumentasjon før ny vurdering gjennomføres. En beskrivelse av dokumentasjonen legges fram for Bestillerforum for nye metoder som vurderer om det er tilstrekkelig grunnlag for en ny vurdering.
4. Det forutsettes at prisen er lik eller lavere enn den prisen som er grunnlaget for denne midlertidige innføringen.
5. Behandlingen kan tas i bruk fra 15.01.2022, da ny pris kan gjelde fra denne datoen.»
Larotrektinib er ikke vurdert av Beslutningsforum.
Pasienter som progredierer på standardbehandling (immunterapi med eller uten kjemoterapi) og som har NTRK-rearrangering bør tilbys TRK-hemmer.
Anbefaling - påvist NTRK-positivitet
- TKI-behandling med entrektinib (600 mg x 1) bør gis inntil progresjon.
- Inklusjon i kliniske studier kan være aktuelt.
MET-aberrasjon
I ikke-småcellet lungekreft kan forandringer i MET-genet være en primær driver, enten i form av spleise-mutasjoner som medfører fusjon mellom ekson 13 og 15 («ekson 14-skippingmutasjoner»), eller ved amplifikasjon av genet. Amplifikasjon av genet er også assosiert med primær eller sekundær resistens under behandling med målrettet behandling mot f.eks. EGFR-mutasjoner eller ALK-translokasjoner. Det er utviklet MET-hemmere, to har markedsføringsgodkjennelse; kapmatinib og tepotinib. Begge har kun indikasjon som andrelinjebehandling ved påvist MET ekson 14-skippingmutasjoner. Krizotinib har også en viss effekt mot MET-forandringer, men er ikke EMA-godkjent for denne indikasjonen.
I en ikke-randomisert fase II-studie ble pasienter med MET ekson 14-skippingmutasjon behandlet med kapmatinib 400 mg x2 til progresjon (Wolf et al., 2020). 69 av pasientene var tidligere behandlet med 1-2 linjer systemisk behandling, hos disse var responsraten 40 % og responsvarigheten 9,7 mndr. Hos 28 tidligere ubehandlede pasienter var responsraten 68 % og responsvarigheten 12,6 mndr. Perifert ødem og kvalme var hyppigste bivirkninger, hos henholdsvis 51 % og 45 %, de fleste av grad 1-2. Kapmatinib er også studert hos pasienter med MET-aberrasjoner (15 med ekson 14-skippingmutasjon, og 5 med med MET-amplifikasjon) som progredierte på krizotinib (Dagogo-Jack et al., 2021). Reponsraten var 10 % (2 pasienter) og median progresjonsfri overlevelse var 5,5 mndr.
Tepotinib er også aktivt mot MET ekson 14-skippingmutasjoner. I en enarmet fase II-studie ble 152 pasienter (median alder 73,1 år) med MET ekson 14-skippingmutasjon behandlet med tepotinib 450 mg x1 til progresjon (Paik et al., 2020). Responsraten var 45 % både i første og senere linjer, og responsvarighet 11 mndr var også uavnhengig av linje. Et lite antall (n=7) hadde målbare hjernemetastaser iflg RANO-BM, av disse hadde 5 partiell intrakraniell respons. Grad 3 eller verre bivirkninger oppsto hos 25 %, hyppigst uansett grad var ødem, kvalme og diarre.
Verken kapmatinib eller tepotinib er vurdert i Nye metoder-systemet.
Pasienter med MET ekson 14-skippingmutasjoner synes å ha lavere respons på immunterapi enn ikke-MET-mutert ikke-småcellet lungekreft, uavhengig av PD-L1-uttrykksnivå, og bør derfor neppe behandles med immunterapi alene (Sabari et al., 2018).
KRAS-mutasjon
KRAS-mutasjoner er den hyppigst forekommende genetiske forandringen ved ikke-småcellet lungekreft. I et materiale (n=1117) fra Norge fant man KRAS-mutasjoner hos 38 % av non-plateepitelkarsinom, og undertypen G12C hos 17 % (Wahl et al., 2021). Flere KRAS-hemmende medikamenter er under utvikling, og ett har markedsføringsgodkjennelse, sotorasib som har aktivitet spesifikt og utelukkende mot KRAS G12C-mutasjoner. I en enarmet fase 2-studie ble sotorasib gitt til KRAS G12C-positive pasienter som hadde progrediert etter minst èn linje systemisk behandling (Skoulidis et al., 2021). Av 126 inkludert pasienter var responsraten 37,1 %, median responsvarighet 11,1 måneder, progresjonsfri overlevelse var 6,8 måneder og median totaloverlevelse 12,5 måneder. I en fase 3-studie, som foreløpig kun er publisert som abstrakt, ble 345 tidligere behandlede KRAS G12C-pasienter randomisert 1:1 mellom sotorasib eller docetaksel (M. L. Johnson et al., 2022). Ett-års progresjonsfri overlevelse var 24,8 % med sotorasib mot 10,1 % med docetaksel, og responsraten var 28,1 % med sotorasib mot 13,2 % med docetaksel. I studien var overkrysning tillatt ved progresjon, og det ble ikke påvist totaloverlevelsesforskjell mellom gruppene.
I begge studier fikk ca 70 % av pasientene bivirkninger av sotorasib, ca 20-30 % var grad 3 eller verre. Hyppigste bivirkninger var diarre, kvalme, fatigue, og økning i leverprøver.
Sotorasib er til vurdering i Nye metoder. Inklusjon i kliniske studier kan være aktuelt.
RET-aberrasjon
For detaljer rundt biologi og test-rutiner, se avsnitt «Spesifikt om molekylære analyser» i Histopatologisk diagnostikk.
RET («rearrangert under transfeksjon») er en reseptor tyrosinkinase, og mutasjoner eller fusjoner i genet for RET kan føre til konstitutivt uttrykk av RET-proteinet som kan lede til utvikling av kreft i en rekke organer (Belli et al., 2020). RET-fusjoner kan påvises i 1—2 % av pasienter med ikke-småcellet lungekreft (i all hovedsak adenokarsinom). Selektive RET-tyrosinkinasehemmere er i likhet med andre nye medikamenter utviklet basert på molekylært mål heller enn tumordiagnose. To slike, selperkatinib og pralsetinib, har hatt markedsføringsgodkjennelse, men pralsetinib blir i 2024 avregistrert i Norge og ingen pasienter skal starte behandling med dette medikamentet. I kliniske studier med pralsetinib (Gainor et al., 2021; Griesinger et al., 2022) og selperkatinib (Drilon, Oxnard, et al., 2020; Drilon et al., 2023) ved RET-positiv lungekreft er det oppnådd responsrater hos tidligere ubehandlede pasienter på henholdsvis 72 og 84 %, og median varighet av respons opptil 22,3 måneder. Også intrakraniell effekt er god, med intrakranielle responsrater som i totalpopulasjonen. Toleransen er gjennomgående god. Kun 24 % av pasientene måtte avbryte behandling på grunn av bivirkninger.
I en randomisert fase 3-studie med 212 RET-positive, ubehandlede NSCLC-pasienter som sammenlignet selperkatinib mot platinumholdig kjemoterapi med eller uten pembrolizumab, var PFS 24,8 måneder med selperkatinib, og 11,2 måneder med kjemo(immun)terapi (Zhou et al., 2023). Tid til intrakranial progresjon var betydelig lengre i selperkatinib-gruppen (HR 0,28). Standard dosering for personer over 50 kg er 160 mg x2, og 120 mg x2 for de under. Dosereduksjon i fase 3-studien forekom hos 51 % av pasientene, og gradvis reduksjon til 40 mg x2 kan være aktuelt.
Det er også publisert data fra en stor (n=218) kohort av pasienter med påvist RET-translokasjon behandlet utenfor studie (Aldea et al., 2023). Nesten halvparten av pasientene (41 %) hadde røykehistorikk. Median totaloverlevelse hos pasienter som var behandlet med RET-hemmer (n=145) var betydelig lengre enn hos pasienter som ikke hadde fått slik behandling (50,6 måneder versus 16,3 måneder). Responsrater og bivirkningsforekomst var tilsvarende som i de kliniske studiene. Det er verdt å merke at bivirkningsforekomsten var høyere hos pasienter som hadde fått immunterapi før oppstart RET-hemmer, men at effekten av immunterapi etter RET-hemmer syntes å være høyere enn f.eks. ved EGFR-positiv sykdom. Det synes derfor grunnlag for å anbefale RET-hemmer som førstelinjebehandling ved påvist RET-aberrasjon, og immunterapi med eller uten kjemoterap (avhengig av PD-L1-uttrykk) som nestelinjebehandling.
Selperkatinib ble vurdert av Beslutningsforum 29.8.22 med følgende konklusjon (nyemetoder.no) (PDF):
1. Selperkatinib (Retsevmo) som monoterapi innføres til behandling av voksne med avansert RET-fusjonspositiv ikke-småcellet lungekreft (NSCLC) som ikke tidligere er behandlet med en RET-hemmer.
2. Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
3. Behandlingen kan tas i bruk fra 01.12.2024, da ny pris kan gjelde fra denne datoen.
Pralsetinib ved RET-positivitet ble vurdert av Beslutningsforum 22.5.23 og besluttet innført, men preparatet blir i 2024 avregistrert i Norge. Dermed skal ingen nye pasienter starte med dette medikamentet. Pasienter som allerede har startet kan fortsette så lenge medikamentet er tilgjengelig.
Anbefaling — påvist RET-positivitet
- TKI-behandling med selperkatinib (160 mg x 2) gis inntil progresjon.
- Ved progresjon på selperkatinib kan immunterapi med eller uten kjemoterapi vurderes.
- Inklusjon i kliniske studier kan være aktuelt.
HER2-mutasjon
HER2 er en reseptor tyrosin kinase- i EGFR-familien. Aktiverende mutasjoner i ekson 20-delen av Her2-genet, også kalt ERBB2 forekommer hos 2—4 % av pasienter med adenokarsinom NSCLC (Mazières et al., 2013). En rekke HER2-rettede medikamenter, som er effektive ved brystkreft, er forsøkt ved lungekreft uten overbevisende resultater. Imidlertid er det data som viser god effekt av immunkonjugatet trastuzumab derukstekan. Medikamentet består av en HER2-rettet antistoffdel (trastuzumab), og en cellegiftkomponent (topotekan-derivatet derukstekan), som er forbundet med en spesifikk kobling («linker»). Etter binding til HER2-reseptoren på celleoverflaten blir medikamentet internalisert og cellegiftkomponenten blir frikoblet og utøver sin virkning inne i kreftcellen. På tross av at man skulle forvente en høy konsentrasjon i kreftvev og lite effekt mot andre vev, er det også ved denne type medikamenter en del generelle bivirkninger som dels tilsvarer de man ser ved klassisk cellegiftbehandling, slik som nøytropeni, og dels er «nye» typer bivirkninger som pneumonitt.
Trastuzumab derukstekan er innført i Norge til bruk ved HER2-positiv brystkreft, og har også markedsføringsgodkjenning som monoterapi til behandling av avansert HER2-mutert NSCLC etter platinumbasert kjemoterapi med eller uten immunterapi. Denne godkjenningen er basert på en fase II-studie (DESTINY-Lung02) hvor 155 pasienter som tidligere hadde fått platinmuholdig kjemoterapi ble randomisert til to ulike doseringsnivåer (5,4 mg/kg eller 6,4 mg/kg) (Goto et al., 2023). Behandling ble gitt intravenøst hver 3. uke til progresjon eller uakseptable bivirkninger. Etter median oppfølgningstid på ca 11 mndr fant man responsrater på 49 % og 56 % for hhv 5,4 og 6,4 mg/kg-gruppene. Median behandlingsvarighet var henholdsvis 7,7 og 8,3 måneder. Grad 3 eller høyere bivirkninger forekom hos 39 % (5,4 mg/kg) og 58 % (6,4 mg/kg). Medikamentindusert interstitiell lungesykdom av grad 3 eller høyere forekom hos 2 % i begge dostrinn.
Trastuzumab derukstekan til bruk ved lungekreft er til vurdering i Nye metoder.
Behandling ved progresjon
Sist faglig oppdatert: 31.10.2024
Progresjon etter førstelinjes platinumdublett i kombinasjon med immunterapi (adenokarsinom uten mutasjoner og plateepitelkarsinom)
Dersom immunterapi er gitt i kombinasjon med kjemoterapi, vil aktuell behandling ved progresjon kunne være docetaksel. Effekten av docetaksel etter kombinasjonen immunterapi og platinumdublett er ikke formelt studert, men det er kjent at effekten av konvensjonell cytostatikabehandling etter progresjon på platinumdublett er generelt relativt begrenset. Slikt behandlingsforsøk bør derfor forbeholdes pasienter i god allmenntilstand (ECOG 0-1) og med respons på førstelinjes behandling. Pasienter som progredierer under pågående førstelinjes behandling har svært lav sannsynlighet for effekt av andrelinjes kjemoterapi (Ciuleanu et al., 2012; Gridelli et al., 2008; Tassinari et al., 2009). Docetaksel er godkjent som annenlinjes kjemoterapi ved progresjon eller residiv ved ikke-småcellet lungekreft. Behandling gis til progresjon eller intolererbare bivirkninger. Studien som bekreftet effekt av andre linje docetaksel sammenlignet med symptomlindring (BSC), vel å merke etter platinumdublett alene (ikke i kombinasjon med immunterapi) viste en gevinst i median OS fra 4,6 til 7,0 mnd og en 1-års overlevelse på 37 mot 11 % (Shepherd et al., 2000). Studien er definert som en fase III, men kun 104 pasienter var inkludert. Pasienter som hadde fått paklitaksel i første linje var ekskludert fra studien, og det er trolig ikke grunnlag for å gi docetaksel som andrelinjes behandling hos progredierende pasienter med plateepitelkarsinom som har fått paklitaksel/karboplatin/pembrolizumab i første linje.
Pasienter som initialt har respondert på immunterapi i kombinasjon med kjemoterapi, og som så progredierer i en behandlingspause eller etter seponering, bør kunne tilbys nytt behandlngsforsøk med immunterapi, spesielt om progresjonen kommer relativt seint (>3 måneder etter behandlingsstopp) (Prelaj et al., 2021).
Pasienter som initialt har respondert på immunterapi i kombinasjon med kjemoterapi, og som så progredierer i immunmonoterapi-fasen, bør kunne tilbys nytt behandlngsforsøk med platinumdublett, spesielt om progresjonen kommer relativt seint (>3 måneder etter kjemoterapikombinasjonen).
Pasienter med progresjon i en enkelt eller fåtallig lokalisasjon (oligoprogresjon) vil kunne ha nytte av lokalbehandling med for eksempel stereotaktisk stråleterapi mens systemisk behandling kontinueres (Rheinheimer et al., 2020).
Progresjon etter førstelinjes monoimmunterapi
Pasienter som initialt har respondert på immunterapi, og som så progredierer i en behandlingspause eller etter seponering, bør kunne tilbys nytt behandlingsforsøk med immunterapi, ev. i kombinasjon med kjemoterapi, spesielt om progresjonen kommer relativt seint (>3 måneder etter behandlingsstopp) (Prelaj et al., 2021).
Dersom kjemoterapi velges, er aktuell behandling for pasienter med adenokarsinom kombinasjonsbehandling med karboplatin (AUC 5) og pemetreksed (500 mg/kvm) hver 3. uke i inntil 4 kurer, etterfulgt eventuelt av pemetreksed monoterapi som vedlikeholdsbehandling inntil progresjon. For pasienter med plateepitelkarsinom er aktuell behandling kombinasjonsbehandling med karboplatin (AUC 5) dag 1 og vinorelbin 25 mg/m2 iv dag 1 og 8, men vinorelbin kan gis som tabletter der bruk av intravenøs infusjon ikke anses egnet. Anbefalt dosering vinorelbin 60 mg/m2 p.o. Særlig kan dette være hensiktsmessig dag 8 slik at pasienten slipper én reise (Jensen, Osterlind, & Rytter, 2008). Det anbefales inntil 4 kurer, gitt med 3 ukers mellomrom (Helbekkmo et al., 2007; von Plessen et al., 2006). Slik behandling forutsetter god allmenntilstand (ECOG 0-2), men alder i seg selv er ikke begrensende (Azzoli et al., 2009; Hotta et al., 2004). Studier før immunterapi-æraen der slik behandling ble gitt i førstelinje viste at man kunne oppnå en viss overlevelsesøkning og lindring av symptomer ("Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. Non-small Cell Lung Cancer Collaborative Group," 1995).
Ved ytterligere progresjon kan docetaksel vurderes, men se betraktninger under avsnitt "Progresjon etter førstelinjes platinumdublett i kombinasjon med immunterapi (adenokarsinom uten mutasjoner og plateepitelkarsinom)" angående sannsynlighet for effekt. Pasienter som har progrediert på tidligere gitt taksan (paklitaksel), har neppe effekt av docetaksel. Det bør sikres at molekylærpatologi-undersøkelser er utført mtp ev. nytte av målrettet behandling.
Progresjon etter førstelinjes platinumdublett
Dette er nå kun aktuelt for pasienter som har blitt behandlet med kjemoterapi uten immunterapi i første linje, før de nye immun-kombinasjonsbehandlingene ble innført. Både pembrolizumab, nivolumab og atezolzumab har positive Beslutningsforumvedtak til slik behandling, og kan gis i inntil to år, eller til progresjon eller uakseptabel toksisitet.
Pasienter i god allmenntilstand, med progresjon etter immunterapi i andrelinje, kan vurderes for kjemoterapi med docetaksel, men se betraktninger under avsnitt "Progresjon etter førstelinjes platinumdublett i kombinasjon med immunterapi (adenokarsinom uten mutasjoner og plateepitelkarsinom)" angående sannsynlighet for effekt. Pasienter som har progrediert på tidligere gitt taksan (paklitaksel), har neppe effekt av docetaksel. Det bør sikres at molekylærpatologi-undersøkelser er utført mtp ev. nytte av målrettet behandling.
Anbefaling - behandling ved progresjon
- Pasienter som har respondert på førstelinje monoimmunterapi/immunkjemoterapi kan rebehandles dersom initial respons og progresjon >3 mndr etter behandlingsstopp.
- Pasienter som har fått kombinasjonsbehandling immunterapi + kjemoterapi i førstelinje kan vurderes for docetaksel, men ikke om paklitaksel er gitt.
- Pasienter som har fått monoimmunterapi i førstelinje kan vurderes for platinumdublett i andrelinje, og ev. docetaksel i tredjelinje, men ikke om paklitaksel er gitt.
- Pasienter som progredierer etter førstelinjes kjemoterapi bør vurderes for immunterapi.
- Inklusjon i kliniske studier kan være aktuelt.
- Pasienter i dårlig allmenntilstand (ECOG 2-3) bør vurderes for palliativ strålebehandling ved symptomer og tilbys symptomatisk, ikke tumorrettet, medikamentell behandling.
Immunterapi: bivirkninger, behandlingsvarighet og annet
Sist faglig oppdatert: 31.10.2024
Bivirkninger ved immunterapi
Bivirkningene ved immunterapi er generelt milde, men kan være alvorlige. Spesielt bør man være oppmerksom på pneumonitter, kolitter og ulike endokrinopatier (inkludert hypofysitt). Også nevrologiske bivirkninger forekommer (Sechi & Zekeridou, 2021). Pasienter bør monitoreres med regelmessige blodprøver inkludert thyreoideastatus og leverparametre..
Hyppigst forekommer tyreoideaforstyrrelse som ofte kan kreve tyroksin-substitusjon. I slike tilfeller, eller ved andre endokrinologiske bivirkninger bør endokrinolog konsulteres. De fleste non-endokrinologiske bivirkninger skal behandles med steroider, ved alvorlige grader startes høye doser (tilsvarende prednisolon 1-2 mg/kg kroppsvekt, med gradvis nedtrapping). Alvorlig kolitt kan kreve tillegg av infliksimab, mens levertoksisitet kan kreve tillegg av mykofenolsyre (Cellcept ®). Infliksimab må unngås ved immunmediert hepatitt, pga medikamentets levertoksisitet. Relevant spesialist bør kontaktes. Flere gode artikler omtaler immunrelaterte bivirkninger og håndtering av disse (J. R. Brahmer et al., 2021; D. B. Johnson, Chandra, & Sosman, 2018).
ESMO har publisert oppdatert informasjon om vurdering og håndtering av bivirkninger med immunterapi: Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Legg merke til at alvorlige bivirkninger av immunterapi forekommer langt hyppigere når PD-(L)1-hemmere kombineres med CTLA4-hemmer (ipilimumab), noe som benyttes ved melanom, men sjelden ved lungekreft.
Behandlingsvarighet ved immunterapi, og kontrollopplegg etter avsluttet behandling
Det foreligger ingen gode data på hva som er riktig behandlingslengde med immunterapi ved ikke-småcellet lungekreft. Ulike studier har hatt ulikt oppsett angående dette:
- Studier med pembrolizumab:
- Keynote 001 (fase I-studie): ingen stopp (Garon et al., 2015)
- Keynote 010 (2. linje): inntil 24 mndr (Herbst et al., 2016)
- Keynote 024 & 189 (1. linje): inntil 35 sykluser (2 år) (Gandhi & Garassino, 2018; Reck et al., 2016)
- Studier med nivolumab:
- CheckMate 003 (fase I-studie): inntil 2 år (96 uker) (Gettinger et al., 2018)
- CheckMate 017 & 057 (2. linje): ingen stopp (Borghaei et al., 2015; J. Brahmer et al., 2015)
- CheckMate 153: randomisert ved 1 års behandling til enten stopp (uansett respons-status) og evt rebehandling ved progresjon, eller kontinuering (D. Spigel et al., 2017)
- Studier med atezolizumab:
- Poplar/OAK (2. linje): ingen stopp (Fehrenbacher et al., 2016; Rittmeyer et al., 2017)
- IMpower150 (1. linje): ingen stopp (Socinski et al., 2018)
- Studier med avelumab:
- Javelin 200 (2. linje): ingen stopp (Barlesi et al., 2018)
- Studier med durvalumab:
- Pacific (vedlikeholdsbehandling etter kjemoradiasjon stadium III): 1 år (Antonia et al., 2018)
Ingen data fra disse studiene støtter at lengre enn 2-års behandlingsvarighet gir bedre utkomme enn inntil 2-års varighet. Av de som var behandlet i CheckMate 003-studien hadde 75 % av de som levde i 5 år etter studiestart ikke mottatt annen behandling etter behandlingsslutt i studien (Gettinger et al., 2018).
Toksisitet (og kostnader) øker med behandlingslengde. Det er viktig å være klar over at det er en korrelasjon mellom respons og bivirkninger, og at man derfor ikke bør ha for høy terskel for å avslutte behandling ved bivirkninger (Teraoka et al., 2017). I en slik situasjon er det neppe grunnlag for å starte immunterapi igjen før det ev. er tegn til progresjon.
Per i dag synes derfor en rimelig anbefaling å være at pasienter kan tilbys inntil 2 års behandling med immunterapi, men at kortere behandlingsvarighet kan være aktuelt både hos pasienter som oppnår komplett respons tidligere, og hos pasienter som utvikler vesentlige bivirkninger.
Immunrelaterte bivirkninger kan oppstå også i tiden etter avsluttet immunterapi. Pasienter bør også følges for tilbakefall. Et forslag til kontrollalgoritme kan derfor være klinisk kontroll inkludert endokrinologi-prøver 6 uker etter siste kur (dersom ikke spesifikke bivirkninger krever tidligere kontroll), og kontroll med CT (regioner med tidligere kjent sykdom) 3 måneder etter siste kur. Deretter kan klinisk kontroll hver 3. måned og CT hver 6. måned være et aktuelt oppfølgningsregime, og lengre intervall etter hvert.
Epikrisen skal gi informasjon om mulige bivirkninger og komplikasjoner som fastlegen bør være oppmerksom på. Spesielt er dette viktig under og etter immunterapi.
Vaksinering, kortisonbruk og komorbiditet relatert til immunterapi
Pasienter som behandles med PD-1/PD-L1-hemmere bør følge standard vaksineringsprogram som foreslått av Folkehelseinstituttet, dvs influensavaksine årlig, og pneumokokkvaksine med påfyll hvert 10. år. Det foreligger ikke data som tyder på økte bivirkninger eller lavere effekt hos pasienter som behandles med immunterapi (Wijn et al., 2018).
Det er generelt anbefalt at kortikosteroider bør minimaliseres under pågående immunterapi fordi man har fryktet at steroider kan redusere effekten av slik behandling. De fleste studier har derfor hatt daglig inntak av 10 mg prednisolon eller tilsvarende, som maksimalt tillatt dose. Verdt å merke er Keynote 189-studien (kjemoterapi + pembrolizumab i førstelinje) som hadde protokollert bruk av deksametason 4 mg x2 fra dag -1 til dag +1 under alle kurer hvor pemetreksed ble gitt (Gandhi & Garassino, 2018). Selv om det er studier som viser at høydosert steroidbruk ved oppstart immunterapi er assosiert med dårligere progresjonsfri overlevelse (også i multivariatanalyser), kan det tenkes at dette er som følge av årsaken til steroid-bruken, og ikke nødvendigvis på grunn av steroid-dosen per se (Arbour et al., 2018; Ricciuti et al., 2019).
Selv om data foreløpig er sparsomme, er det indikasjoner på at pasienter med autoimmune sykdommer kan risikere økt forekomst av bivirkninger ved bruk av PD-1/PD-L1-hemmere. Hyppigst er milde varianter, som oppbluss av symptomer fra ledd og hud («flare») (Leonardi et al., 2018), men alvorlige bivirkninger kan også oppstå. Pasienter som allerede står på høydoserte steroider kan være vanskelig å behandle skulle en immunmediert toksisitet oppstå (og kan ha redusert effekt av immunterapi, som nevnt over). Men pasienter med velkontrollerte autoimmune sykdommer bør vurderes for immunterapi om dette er indisert – og etter grundig diskusjon med pasienten om mulige effekter (som ansees likeverdige som hos pasienter uten autoimmun sykdom), bivirkninger og evt alternative behandlingsstrategier. Det anbefales tett kontakt med aktuell spesialist for å vurdere optimal behandling (som unngåelse av systemisk immunsuppresjon om mulig), samt forebygge, evt behandle eksaserbasjoner av underliggende sykdom. For en grundig og oppdatert diskusjon, se (Kennedy, Bhatia, Thompson, & Grivas, 2019).
I de kliniske studier som ligger til grunn for godkjenningen av preparatene har følgende pasientgrupper ofte vært ekskludert: Pasienter med symptomgivende CNS-metastaser, HIV, hepatitt B- eller C-infeksjon, aktiv autoimmun sykdom, interstitiell lungesykdom, tidligere pneumonitt som har krevd systemisk steroidbehandling, tidligere alvorlig hypersensitivitetsreaksjon på et annet antistoff og pasienter som får immunosuppressiv behandling (inklusiv steroidbehandling). Behandling av slike pasienter må skje bare etter en nøye vurdering av risikoforholdene. Det er data som tyder på at organtransplanterte har en høy risiko for rejeksjon på behandling med immunsjekkpunktbehandling, men det er også eksempler på at nyretransplanterte kan profitere på slik behandling (Manohar, Thongprayoon, Cheungpasitporn, Markovic, & Herrmann, 2020). Også pasienter med kroniske virale sykdommer som HIV og hepatitt kan ha effekt av immunsjekkpunkthemmere uten å risikere oppbluss av infeksjonssykdommen (El Zarif et al., 2023; Ostios-Garcia et al., 2018; Tapia Rico, Chan, & Loo, 2020). Tett kontakt med infeksjonsmedisinere synes rimelig.
Anbefaling - spesifikt vedrørende immunterapi
- Spesiell årvåkenhet angående bivirkninger ved immunterapi er nødvendig. Fastlege og andre samarbeidspartnere må være informert.
- Immunterapi anbefales ikke gitt utover 24 måneder, men kan vurderes restartet ved residiv.
- Kortere behandling enn 24 måneder kan vurderes hos pasienter med komplett respons og/eller bivirkninger.
- Steroidbruk skal minimeres, men utelukker ikke immunterapi.
- Autoimmune sykdommer, organtransplantasjon eller kroniske infeksjoner er ingen absolutt kontraindikasjon mot immunterapi, men krever spesiell omtanke.
Angiogenesehemmere
Sist faglig oppdatert: 31.10.2024
VEGF-antistoffet bevacizumab er testet i flere fase III-studier ved avansert ikke-småcellet lungekreft (Reck et al., 2010; Sandler et al., 2006), men det er lite evidens for at bevacizumab er nyttig ved ikke-småcellet lungekreft.
VEGF-R-antistoffet ramucirumab (Cyramza ®) har markedsføringstillatelse i kombinasjon med docetaksel til andrelinjes behandling av ikke-småcellet lungekreft, men effekten var svært beskjeden (økt totaloverlevelse fra 9,1 til 10,5 mndr) (Garon et al., 2014). Det var noe mer bivirkninger i gruppen som fikk ramucirumab.
Anbefaling - angiogenesehemmere
- Angiogenesehemmere anbefales ikke ved ikke-småcellet lungekreft.
Beinresorpsjonshemmere
Sist faglig oppdatert: 31.10.2024
Mer enn 40 % av lungekreftpasientene i Norge diagnostiseres i stadium IV og skjelett er hyppigste lokalisasjon, både ved single (M1a) og multiple (M1b) fjernmetastaser med hhv 26 % og 50 % (Nasjonalt kvalitetsregister for lungekreft).
Zoledronsyre er indisert til forebygging av skjelettrelaterte hendelser hos voksne med utbredt kreftsykdom som involverer skjelettet. Ved behandling av ikke-småcellet lungekreft har medikamentet vært vurdert ikke indisert da tillegg av slik behandling ikke har vist økt overlevelse.
Med ny og bedre lungekreftbehandling og derav en stadig større andel pasienter som lever lenge med metastatisk sykdom er problemstillingen økende aktuell. Skjelettmetastaser er ofte smertefulle, kan føre til frakturer og hyperkalsemi, kan redusere funksjonsnivå og livskvalitet og utløser gjerne behov for strålebehandling og kirurgi.
En randomisert dobbelt blindet og placebokontrollert fase III-studie publisert i JCO tilbake i 2003 er beskrevet som den første studien som viste effekt av zoledronsyre på skjelettrelaterte hendelser ved ikke-småcellet lungekreft (Silva, Wilson, & Woll, 2015). Studien randomiserte mellom 4 mg og 8 mg zoledronsyre og inkluderte 773 pasienter med solide tumores unntatt bryst- og prostatakreft. Den største pasientgruppen var ikke-småcellet lungekreft med 49 % av pasientene. Armen med 8 mg ble etterhvert stanset grunnet bekymring for nyretoksisitet. Zoledronsyre 4 mg reduserte forekomsten av skjelettrelaterte hendelser inklusive hyperkalsemi til 38 % versus 47 % i placeboarmen (p=0,039), en effekt som vedvarte ifølge en oppdatering etter 21 mnd med behandling (Rosen et al., 2004; Rosen et al., 2003).
I en oversiktsartikkel publisert i 2015 adresseres mangelen på livskvalitetsdata og smerteregistrering i randomiserte studier med skjelettrelaterte hendelser som endepunkt. Artikkelen gjennomgår studier av både bisfosfonater, denosumab og radioisotoper. De fant ikke høykvalitetsstudier som viste effekt på livskvalitet eller reduserte smerter (Hendriks, Hermans, van den Beuken-van Everdingen, Hochstenbag, & Dingemans, 2016).
For bruk av disse medikamentene ved hyperkalsemi, se Hyperkalsemi.
Anbefaling - beinresorpsjonshemmere
- Behandling med zoledronsyre reduserer skjelettrelaterte hendelser og kan vurderes hos pasienter med ikke-småcellet lungekreft og utbredte skjelettmetastaser.
- Pasientene bør få daglig tilskudd av kalsium og D-vitamin og bør vurderes av tannlege før oppstart grunnet risiko for osteonekrose i kjeven.
Bronkoskopisk intervensjon
Sist faglig oppdatert: 31.10.2024
Tumorrettet behandling via bronkoskop er en viktig del av palliasjon ved lungekreft, og gir raskere lindring av dyspné og hemoptyse enn konvensjonell stråling og cytostatika.
Svulster i de sentrale luftveier kan nås med bronkoskopet, og intraluminale masser kan raskt og effektivt reduseres med laser, elektrokoagulasjon, argon plasma koagulasjon eller kryoterapi (Bolliger, Sutedja, Strausz, & Freitag, 2006). Ved ekstern kompresjon av trakea eller hovedbronkier kan det gjøres endobronkial stenting.
Ved tumorvekst i bronkialveggen er endobronkial brakyterapi en effektiv behandling som kan anvendes selv om pasienten tidligere har fått ekstern strålebehandling i området.
Alle intervensjonsbronkoskopiske metoder kan kombineres og de kan komplettere andre palliative tiltak som ekstern radioterapi og cytostatika.
Indikasjoner
Intervensjonsbronkoskopi er i de fleste tilfeller en palliativ behandling, og pasientene bør ha en viss forventet levetid etter en eventuell prosedyre. Effekten av behandlingen er sannsynligvis best når tumoren er nyoppdaget, og man fortsatt har andre behandlingsmuligheter (ekstern stråling og kjemoterapi).
Intraluminalt voksende tumor
Neodymium-doped yttrium aluminium garnet (Nd-YAG) laser har skjærende og koagulerende egenskaper velegnet for fjerning av svulstvev i trakea, hovedbronki, samt bronkialostier på lobusnivå. Argon plasma koagulasjon, elektrokoagulasjon samt kryoterapi brukes også for fjerning av intraluminale svulster, men sistnevnte har ikke umiddelbar vevsreduserende effekt. Ved store tumormasser er mekanisk debulking med stivt bronkoskop etter forutgående laserkoagulasjon for å redusere blødningsfaren effektivt, og forkorter operasjonstiden (Wahidi et al., 2007).
Tumorvekst i luftrørsveggen
Brakyterapi (Vergnon, Huber, & Moghissi, 2006) kan brukes ved tumorvekst i luftrørsveggen og kan ha god effekt på hemoptyse og dyspné som følge av tumorforårsaket luminal obstruksjon. Behandlingen gjennomføres i lokalbedøvelse, med bronkoskopisk nedføring av et tunnellert kateter forbi det aktuelle tumorområdet. En radioaktiv kilde (Iridium 192) føres deretter ned i kateteret og beveges trinnvis forbi svulsten over et på forhånd oppmålt område. Hemostatisk og palliativ dose er typisk 10-15 Gy gitt over 2-3 sesjoner, mens stråling med kurativ intensjon gis som 15-25 Gy over minst 3 sesjoner. Denne teknikken er kun tilgjengelig ved Haukeland universitetssjukehus.
Ytre kompresjon
Kritisk luftveiskompresjon pga. ekstern tumor eller lymfeknutemasser (> 50 % obstruksjon) krever nedlegging av stent. Innleggelse av metallgitterstenter er en relativt enkel prosedyre, som vanligvis gjøres med fleksibelt bronskoskop under gjennomlysning. Innleggelse av silikonstenter krever instrumentering med stivt bronkoskop (Ernst, Feller-Kopman, Becker, & Mehta, 2004).
Metallgitter- eller nitinol-stenter har den fordel at de sitter godt, såfremt dimensjonen er stor nok. Stentene er fleksible og tilpasser seg en slynget eller konisk formet luftvei, og er derfor mest brukt ved maligne lidelser.
Udekkede metallgitterstenter blir etter hvert dekket av slimhinne, og er vanskelige å fjerne når de har sittet noen måneder, mens dekkede metallgitterstenter eller hybridstenter kan fjernes selv etter mange måneder.
Silikonstenter er billige, men er mer utsatt for dislokasjon, og pasientene må inhalere saltvann og ev. beta-2-agonister eller mukolytika på forstøver et par ganger daglig, fordi de ellers lett går tett av inntørket sekret, siden det ikke skjer noen fukting av luft eller sekret inne i stenten (Wahidi et al., 2007).
Stenting kan også være aktuelt ved destruksjon av luftrørsveggen eller fistler til pleura eller spiserør. Ved trakeoøsofagale fistler stentes øsofagus vanligvis først, deretter eventuelt også trakea, dersom fistelen ikke kan tettes fra øsofagus. Ved stenting av øsofagus kan tumor og stent komprimere luftveiene, noe som kan nødvendiggjøre nedleggelse av stent i luftveiene.
Hemoptyse
Rundt 30 % av pasienter med lungekreft får hemoptyse i sykdomsforløpet (Cavaliere, Venuta, Foccoli, Toninelli, & La Face, 1996). Nd-YAG laser er en etablert metode for koagulasjon av tumorkar og penetrerer 5-10 millimeter ned i svulsten. Dette kan gi langvarig kontroll av blødning. Argon plasma koagulasjon virker kun i tumoroverflaten, men kan brukes når blødningskilden er vanskelig å identifisere. Effekten er god og metoden trygg med tanke på perforasjon av bronkialveggen.
Ved betydelig perifer blødning kan man plassere en bronkus-blokkerende ballong gjennom bronkoskopets arbeidskanal (Ernst et al., 2004). Denne kan ligge nede mens blødningen håndteres på annen måte (bronkialarterieembolisering, kirurgi, strålebehandling).
Brakyterapi kan også være et alternativ ved hemoptyse (se 8.9.1.2).
Behandlingsresultater
Effekten av endoskopisk intervensjon er avhengig av tumors lokalisasjon og graden av obstruksjon. Sentral luftveisobstruksjon er vanskelig å diagnostisere, og pasientene kommer ofte til utredning og behandling når det allerede foreligger en kritisk sentral luftveisobstruksjon (Ernst et al., 2004). Effekten av endoskopisk intervensjon kan være god idet pasienter kan gå fra å være sengeliggende og surstofftrengende til å være oppegående innen få timer.
Effekten av endoskopisk intervensjon inntreffer nærmest umiddelbart etter prosedyren, mens stråleterapi og cytostatika som regel først har effekt etter noen uker. Særlig har dette betydning for pasienter med kort forventet levetid. Symptomlindrende behandling bør derfor tilbys tidlig, slik at ikke pustebesvær og residiverende lungeinfeksjoner reduserer livskvaliteten unødig. Det er viktig å følge opp endoskopisk intervensjon med ekstern stråleterapi mot en sentralt sittende lungetumor, for å forlenge behandlingseffekten.
Endobronkial behandling gis før ekstratorakal stråling pga. grunn fare for endobronkialt ødem og inflammasjon (Wahidi et al., 2007).
Organisering av tilbudet i Norge
Et senter for intervensjonsbronkologi bør kunne tilby behandling for indikasjonene listet over: avsnitt "Indikasjoner". For øyeblikket er det kun Rikshospitalet, Haukeland universitetssjukehus og St. Olavs Hospital som tilbyr slik behandling. Disse avdelingene har noe forskjellig profil på tilbudet. Rikshospitalet legger ned silikon- og metallstenter ved luftveiskreft og benigne tilstander, mens Haukeland legger metallstenter hos pasienter med malign sykdom. Brakyterapi gjøres bare på Haukeland. Alle avdelinger tilbyr Nd-YAG-laserbehandling. Et senter for intervensjonsbronkologi bør ha et stort nedslagsområde for å oppnå høyt nok volum av prosedyrer, og anbefales derfor ikke etablert utenom universitetssykehus.
Henvisning
Når skal pasienter henvises?
Pasienter med inoperabel lungekreft bør vurderes for endoskopisk intervensjon ved affeksjon av sentrale luftveier, det vil si trakea, hovedbronkier eller stammebronkus (Cavaliere et al., 1996). Pasienter med endoskopisk synlige kreftforandringer i overlappene bør også følges nøye. Svulster i overlappen kan vokse raskt endobronkialt ut i hovedbronkus hvor det kan oppstå totalatelektase. Disse pasientene bør kontrolleres med bronkoskopi, for å starte behandling før totalatelektase er utviklet. Pasientene bør henvises til intervensjon før mer enn 50 % av lumen av hovedbronkus er obstruert. Når atelektase først har oppåstått, er det teknisk vanskelig å gjenåpne luftveiene.
Hvilke pasienter skal henvises?
Pasienter med ikke-småcellet lungekreft, og endobronkiale metastaser fra for eksempel nyre-, hypofarynx- eller colon-karsinomer eller fra malignt melanom kan være kandidater for intervensjonsbronkoskopi (Cavaliere et al., 1996).
Intervensjonsbehandling er imidlertid sjelden indisert ved småcellet lunge-karsinom, på grunn av den raske og gode responsen på cytostatika primært, og på grunn av svært kort forventet levetid ved residiv. Dersom kreft-veksten er langsom, vil endoskopisk intervensjon også være aktuelt hos denne pasientgruppen.
Endobronkiale karsinoider er i en særstilling, fordi behandlingen av disse kan ha et kurativt siktemål. Dette forutsetter at det ikke er tumorvekst utenfor bronkus (Brokx et al., 2007). Langtidsprognosen er god.
Adenoid cystisk karsinom er likeledes i en særstilling, ettersom disse pasientene har lang forventet levetid, ofte 10-20 år, og har god nytte av endoskopiske intervensjoner. Disse pasientene trenger ofte flere prosedyrer.
Anbefaling - Bronkoskopisk intervensjon:
- Pasienter med inoperabel malign sentral luftveisobstruksjon bør evalueres med tanke på endoskopisk intervensjon.
- CT toraks og bronkoskopi bør alltid inngå i evalueringen av pasientene med tanke på anatomiske forhold som lengde og type av lesjon, mottakerforhold i distale luftveier, og intakt pulmonalsirkulasjon.
- Tumorrettet behandling via bronkoskop har umiddelbar symptomatisk effekt, hvilket er viktig hos pasienter med relativt kort forventet levetid.
Kontrollopplegg etter ikke-kurativ behandling
Sist faglig oppdatert: 31.10.2024
Det foreligger begrenset litteratur og ingen klare anbefalinger for hvor tett oppfølgingen skal være ved ikke kurerbar sykdom (Reck, Popat, et al., 2014). Alder, allmenntilstand, progresjonshastighet, symptomer og pasientens preferanser vil variere, derfor må kontrollopplegget tilpasses individuelt. Som hovedregel bør pasientene henvises til lokalt palliativt team og de bør oppfordres til kontakt med fastlege, kreftkoordinator og kommunale sykepleietjenester.
Målet for kontrollene er å:
- Bidra til god livskvalitet og god symptomlindring
- Sørge for rask innsetting av palliative tiltak
- Sørge for god samhandling på tvers av profesjoner og nivå i helsetjenesten
- Identifisere pasienter som kan ha nytte av ytterligere behandlingslinjer
Kontroll etter 1. linje
God behandlingsrespons og god allmenntilstand gir grunnlag for å planlegge rebehandling ved progresjon. Derfor anbefales tett oppfølging etter førstelinjebehandling, avhengig av individuell behandlingsstrategi og muligheter for rebehandling.
Bildemodalitet velges ut fra tumors beliggenhet og vekstmønster. Hovedprinsipp er CT-toraks/øvre abdomen ved responsevalulering og før neste behandlingslinje.
Ved kontrollene ellers er det vanlig å veksle mellom CT og røntgen toraks avhengig av tumors beliggenhet og behandlingsstrategi. Hos pasienter med ECOG 2-3 foreligger generelt ikke evidens for nytte av andrelinjebehandling, og formodentlig ingen nytte av rutinemessige bildeundersøkelser.
Kontroll etter ytterligere behandlingslinjer
Radiologisk kontroll vurderes individuelt hver 6-12 uke hos dem med god behandlingsrespons og god allmenntilstand (ECOG 0-1), med tanke på rask iverksetting av neste linjebehandling.
Valg av bildemodalitet vurderes individuelt, avhengig av symptomer, tumorvekst og beliggenhet.
Anbefaling - Kontrollopplegg etter ikke-kurativ behandling:
- Pasienter med inkurabel lungekreft bør ha et aktivt og individuelt tilpasset kontrollopplegg.
- Etter førstelinjebehandling anbefales individuelt tilpasset relativt tett kontrollopplegg.
Kurativ behandling av lokalisert småcellet lungekreft (SCLC T1-4N0-3M0) - begrenset sykdom
Sist faglig oppdatert: 31.10.2024
Andel småcellet lungekreft (SCLC) har gått tilbake, sammenliknet med ikke-småcellet lungekreft, og utgjør ca. 15-19 % av all lungekreft (Sagerup, Småstuen, Johannesen, Helland, & Brustugun, 2011). SCLC presenterer seg langt oftere med spredning på diagnosetidspunktet enn annen lungekreft. På diagnosetidspunktet har omlag 35 % begrenset og 65 % utbredt sykdom. Tilstanden oppfattes ved diagnose som systemisk sykdom, uavhengig av stadium. TNM klassifikasjon skal i dag brukes rutinemessig (Vallieres et al., 2009). Dog er betegnelsene begrenset sykdom (limited stage, LS) og utbredt sykdom (extensive stage, ES) fortsatt i bruk i internasjonale retningslinjer siden det er denne inndelingen som først og fremst har betydning for valg av behandling.
Definisjon begrenset sykdom (LS-SCLC), behandlingsmodaliteter og behandlingseffekt
Sist faglig oppdatert: 23.12.2021
SCLC T1-4N0-3M0 innebærer en tumorutbredelse som begrenses til en hemitoraks, men kan maksimalt inkludere regionale lymfeknutemetastaser til hilære, mediastinale og supraklavikulære regioner både ipsi- og kontralateralt.
SCLC T1-4N0-3M0 er potensielt kurerbar. Responsrater etter konkomitant kjemoradioterapi er 70-90 % og 2- og 5-års overlevelse er respektive 40 % og 20-25 % i store randomiserte studier og metaanalyser. Den kurative behandlingen er multimodal og innebærer platinumbasert kjemoterapi, konkomitant stråleterapi og påfølgende profylaktisk hjernebestråling (Simon, Turrisi, & Physicians, 2007). I tillegg skal pasienter med T1-2N0 svulster vurderes for primær lungekirurgi (Schreiber et al., 2010).
Pasientene bør informeres om at røyking øker komplikasjonsrisiko etter lungekreftkirurgi og kan svekke effekt av strålebehandling.
Kirurgisk behandling av st. I SCLC
Sist faglig oppdatert: 31.10.2024
Pasienter i stadium I (cT1-2N0) skal utredes mht mulighet for kirurgisk reseksjon med kurativt siktemål (Schreiber et al., 2010).[NICE, 2011 #1019]. Muligheten for okkult nodal sykdom må utelukkes (Früh et al., 2013; Lad et al., 1994; B. J. Schneider, Saxena, & Downey, 2011; M. Sørensen, Pijls-Johannesma, Felip, & Group, 2010). Kun ca. 5 % av pasienter med SCLC er i stadium I (Ignatius Ou & Zell, 2009; Yu, Decker, Detterbeck, & Wilson, 2010).
Før ev. kirurgi må pasientene gjennomgå følgende undersøkelser for å utelukke regionale og fjernmetastaser. (Se kapittel 6):
- MR caput for å påvise ev. hjernemetastaser
- PET/CT for å påvise ev. ekstratorakale metastaser eller okkulte regionale lymfeknuter
- Usikre eller positive må funn følges opp med EBUS eller EUS
Etter komplett kirurgisk reseksjon, helst lobektomi, bør etterfølgende behandling tilbys. Det foreligger begrenset evidens, og internasjonale retningslinjer varierer noe (Zeng et al., 2022).
- Alle retningslinjer anbefaler postoperativ kjemoterapi. I Norge anbefales 4 kurer cisplatin eller karboplatin kombinert med etoposid som ved LS-SCLC
- Ved patologiske N2-lymfeknuter eller ufri rand (R1/2) synes alle å være enige om at postoperativ toraksbestråling bør vurderes gitt konkomitant med kjemoterapi som ved LS-SCLC. Postoperativ stråelterapi ved N1-lymfeknuter anbefales i noen retningslinjer, men for eksempel ikke av ASTRO.
- Profylaktisk hjernebestråling har tradisjonelt vært anbefalt, men nyere studier tyder på at MR-basert kontroll kan være et bedre alternativ (Gaebe et al., 2024). Dersom man etter diskusjon med pasienten vil tilby helhjernebestråilng vil 2,5 Gy x10 være mest aktuelt.
- Pasientene bør informeres om at røyking øker komplikasjonsrisiko etter lungekreftkirurgi
Multimodal behandling til denne gruppen har gitt 49-57 % 5-års overlevelse (Bischof et al., 2007).
Anbefaling - behandling av SCLC
- Pasienter med stadium I svulster (T1-2N0) bør, på grunnlag av grundig utredning, vurderes for kirurgisk reseksjon.
- Startutredning er som regel CT toraks inkl. øvre abdomen. Kirurgi forutsetter videre negativ MR caput og PET/CT. Ved mistanke om positive glandler i toraks må dette utelukkes med EBUS/EUS/mediastinoskopi.
- Postoperativt gis adjuvant 4 kurer kjemoterapi.
- Ved stor risiko for perioperative komplikasjoner er kombinert kjemoradioterapi, ev. stereotaksi, et alternativ til kirurgi.
- Hvis det peroperativt er påvist mediastinal patologi eller det ikke er utført systematisk lymfeknutedisseksjon, kan det gis postoperativ torakal strålebehandling som ved LS-SCLC. Denne bør starte innen 21-28 dager fra kjemoterapistart.
Behandling av ikke-operabel begrenset sykdom, LS-SCLC
Sist faglig oppdatert: 31.10.2024
Definisjon og behandling av LS-SCLC
SCLC T1-4N0-3M0 innebærer en tumorutbredelse begrenset til en hemitoraks, samt evt. regionale lymfeknutemetastaser til hilære, mediastinale og supraklavikulære regioner både ipsi- og kontralateralt. Pleuravæske aksepteres dersom man har tatt minst én cytologi uten funn av maligne celler. Ved svært små mengder pleuravæske er det ikke nødvendig å ta cytologi.
SCLC T1-4N0-3M0 er potensielt kurerbar. Responsrater etter konkomitant kjemoradioterapi er 70-90 % og 2- og 5-års overlevelse er respektive 40 % og 20-25 % i store randomiserte studier og metaanalyser. Den kurative behandlingen er multimodal og innebærer platinumbasert kjemoterapi, konkomitant toraksbestråling og ev. påfølgende profylaktisk hjernebestråling (Simon, Turrisi, & Physicians, 2007). Konsoliderende immunterapi er også vist å gi overlevelsesgevinst (se under).
Medikamentell behandling
Cellegift er basisbehandlingen ved LS-SCLC. Cisplatin er å anse som førstevalg ved kurativ behandling av LS-SCLC, men effekten av karboplatin er sannsynligvis i praksis likeverdig. Karboplatin vurderes ved intoleranse for eller risiko for betydelige bivirkninger av cisplatin (f eks redusert hørsel eller tinnitus), redusert nyrefunksjon, redusert allmenntilstand, alder 75 år eller eldre eller komorbiditet. Karboplatin doseres i prinsippet til AUC 6, men for de aller fleste er AUC 5 høy nok dose. Det anbefales 4 kurer cellegift (Früh et al., 2013).
I en fase III-studie («Adriatic») ble 530 pasienter som hadde gjennomgått stråleterapi (1,5 Gy x2 til 45 Gy eller 2 Gy x 30-33) konkomitant med 4 PV-kurer og hvor det ikke ble påvist progresjon, randomisert til 2 år med PD-L1-hemmeren durvalumab 1500 mg iv hver 4. uke, eller placebo (Spigel et al, ASCO 2024). Totaloverlevelsen var i favør av durvalumab, med median OS på 55,9 mndr i durvalumabgruppen og 33,4 mndr i placebogruppen (HR 0,73, p = 0,0104). Etter 3 år var 56,5 % av pasientene som hadde fått durvalumab i live, mot 47,6 % i placebogruppen. Bivirkningene av durvalumab var som man er kjent med når PD-1-/PD-L1-hemmere benyttes. Det var omtrent samme frekvens av strålepneumonitt/pneumonitt i begge grupper (33,6 % i durvalumabgruppen, mot 29,4 % i placebogruppen), og langt de fleste var grad 1-2.
PV-regime
Det gis fire kurer. Dosering beregnes ut fra pasientens kroppsoverflate.
Beh. dag | Stoff | Dose |
|---|---|---|
Dag 1 | Cisplatin | 75 mg/m2 i.v. |
Dag 1-3 | Etoposid | 100 mg/m2 i.v. |
Ny kur gis dag 22 | ||
Anbefalt hydreringsregime
Prehydrering: 1-2 liter (avhengig av hydreringsgrad/nyrefunksjon) NaCl over 2 timer. Etoposid tilsettes i 500 ml NaCl og gis siste halvtime av prehydrering. Cisplatin gis i 1000 ml NaCl over 2 timer. Posthydrering 1000 ml NaCl over 1 time. Total infusjonstid 5 timer, total væske: 3,5-4,5 liter. Akynzeo og deksametason som kvalmeprofylakse.
Dag 2-3 gis etoposid i 500 ml NaCl med 500 ml NaCl skyll. Kreatinin måles dag 2-3 for å vurdere nyrefunksjon.
Eventuell dosejustering
Siden behandlingsmålet er kurativt etterstrebes optimal behandlingsintensitet. G-CSF anbefales ikke rutinemessig pga manglende evidens for overlevelsesgevinst. I en eldre studie så man betydelig økt toksisitet ved bruk av vekstfaktor (GM-CSF) ved kjemoradioterapi ved SCLC (Bunn et al., 1995), mens en nyere subgruppe-analyse av CONVERT-studien ikke viste økt toksisitet ved bruk av G-CSF (Gomes et al., 2021).
Ved nøytrofile < 1,5 x109 og/eller trombocytter < 100 x109 utsettes kur 0,5-1 uke. Dersom kur må utsettes mer enn en uke bør neste kur vurderes redusert med 15-20 %.
Anbefaling - kjemoterapi ved LS-SCLC
- Pasienter med LS-SCLC tilbys fire kurer cisplatin/etoposid.
- Karboplatin kan erstatte cisplatin ved alvorlige bivirkninger av cisplatin, redusert nyrefunksjon, redusert hørsel/tinnitus, redusert allmenntilstand (ECOG 2-3), høy alder (> 75 år) eller ved signifikant komorbiditet.
Strålebehandling
Torakal strålebehandling
Samtidig torakal strålebehandling ble etablert etter at metaanalyser viste bedring av lokal kontroll (25-30 % residivreduksjon) og en økning i 3-årsoverlevelse med 5,4 %. Senere studier viser at 25-40% er i live 5 år etter kjemoradioterapi, og kjemoradioterapi er derfor den viktigste kurative behandlingen av SCLC (Faivre-Finn et al., 2017; Grønberg et al., 2021).
Kliniske studier og en Cochrane-gjennomgang har vist at tidlig strålebehandling (konkomitant med kjemoterapi) gir bedre effekt enn strålebehandling gitt etter avsluttet kjemoterapi (Pijls-Johannesma, De Ruysscher, Lambin, Rutten, & Vansteenkiste, 2005). Samtidig må mange pasienter henvises annet sykehus for strålebehandling og tumorstørrelse reduseres betydelig etter første kur. Det anbefales derfor konkomitant TRT og kjemoterapi med oppstart av TRT 21-28 daqer etter første dag av første cytostatikakur (Früh et al., 2013).
Konkomitant akselerert hyperfraksjonert TRT resulterte i økt 5-års overlevelse (26 % vs 16 %), men også klart mer grad 3-4 øsofagitt enn normofraksjonert TRT (Turrisi et al., 1999). Senere studier viser at når man begrenser strålefelt til PET/CT-positive lesjoner og bruker moderne stråleteknikker, så gir ikke hyperfraksjonert TRT mer bivirkninger, og andelen som opplever alvorlige bivirkninger er vesentlig lavere enn i Turrisi-studien (Faivre-Finn et al., 2017; Grønberg et al., 2021). En norsk studie viste en trend mot økt median overlevelse ved hyperfraksjonert (1,5 Gy x 2 x 15) sammenlignet med tidligere norsk standard-bestråling (2,8 Gy x 15) (Grønberg et al., 2016), og implementering av hyperfraksjoner TRT i Norge har resultert i en økning i median overlevelse på over 6 måneder og en fordobling av 5-års overlevelse (Graabak, Grønberg, Sandvei, Nilssen, & Halvorsen, 2022).
I den oppfølgende, nordiske studien på LS-SCLC (THORA) ble pasienter randomisert til hyperfraksjonert torakal bestråling til 45 Gy (1,5 Gy x 2 i 15 dager) eller 60 Gy (1,5 Gy x 2 i 20 dager). Studien viser en betydelig gevinst både i form av 2-års overlevelse (74 % vs 48 %), median overlevelse (43,6 vs 22,6 mndr) og 5-års overlevelse (40 % vs 28 %), og det var ikke mer bivirkninger i høydose-armen (grad 3-4 esofagitt 21 % vs 18 %), og vesentlig mindre enn i HAST-studien. Hyperfraksjonert toraksbestråling til 60 Gy er dermed standardbehandling i Norge.
Planlegging og gjennomføring av strålebehandling skal utføres i henhold til Faglige anbefalinger for kurativ strålebehandling av småcellet lungekreft. Pasientene bør informeres om at røyking kan svekke effekten av strålebehandling.
Anbefaling - stråleterapi ved LS-SCLC
- Konkomitant torakal stråleterapi (TRT) skal i utgangspunktet tilbys alle pasienter med LS-SCLC (unntak: reseserte stadium I-pasienter der mediastinum er verifisert negativ).
- Det anbefales oppstart av TRT 21-28 dager etter første cellegiftkur.
- Hyperfraksjonert stråleterapi med 1,5 Gy x 2 x 20 etterstrebes. Alternativt gis 1,5 Gy x2 x 15, 2,8 Gy x 15 eller 3 Gy x 10.
- Målvolum begrenses til PET CT positive lesjoner, men ut fra størrelsen på lesjoner på doseplan CT tatt etter første cytostatika-kur. Dog skal tidligere affiserte glandelstasjoner inkluderes.
Profylaktisk hjernebestråling (PCI)
Risiko for hjernemetastaser er > 50 % for pasienter med SCLC. En eldre meta-analyse viste at PCI ga 25 % redusert 3-års insidens for hjernemetastaser (Auperin et al., 1999). Dette gir 5-6 % økt overlevelse etter PCI ved LS-SCLC. Få av pasientene i denne studien var undersøkt med MR caput.
En gjennomgang av publiserte studier viser at PCI var assosiert med overlevelsesforbedring, men ikke når man kun inkluderte studier hvor det radiologisk var bekreftet fravær av hjernemetastaser før oppstart PCI (Gaebe et al., 2024). Det er derfor grunn til å stille spørsmål ved nytten av PCI når MR caput er gjort i forkant.
PCI kan vurderes tilbudt LS-SCLC pasienter i relativt god ECOG som ikke progredierer på kjemoradioterapi. Det anbefales fraksjonering 25 Gy/10 fraksjoner (Le Péchoux et al., 2009). PCI bør ikke gis samtidig med systemisk kjemoterapi. Pasienter > 65 år og/eller med alvorlig vaskulær sykdom kan ha økt risiko for å utvikle nevrokognitive bivirkninger (Le Péchoux et al., 2011; Wolfson et al., 2011). Oppfølgning med regelmessig MR caput kan være et godt alternativ, og dette bør diskuteres med pasienten.
Anbefaling - profylaktisk hjernebestråling, LS-SCLC
- Profylaktisk helhjernebestråling kan være en mulighet for yngre LS-SCLC-pasienter uten vaskulær sykdom som ikke har progrediert etter kjemoradioterapi.
- PCI skal ikke kombineres med kjemoterapi, men startes etter at kjemoterapi er avsluttet. Aktuell fraksjonering vil være 2,5 Gy x 10 (totalt 25 Gy).
- Oppfølgning med MR caput kan være et godt alternativ.
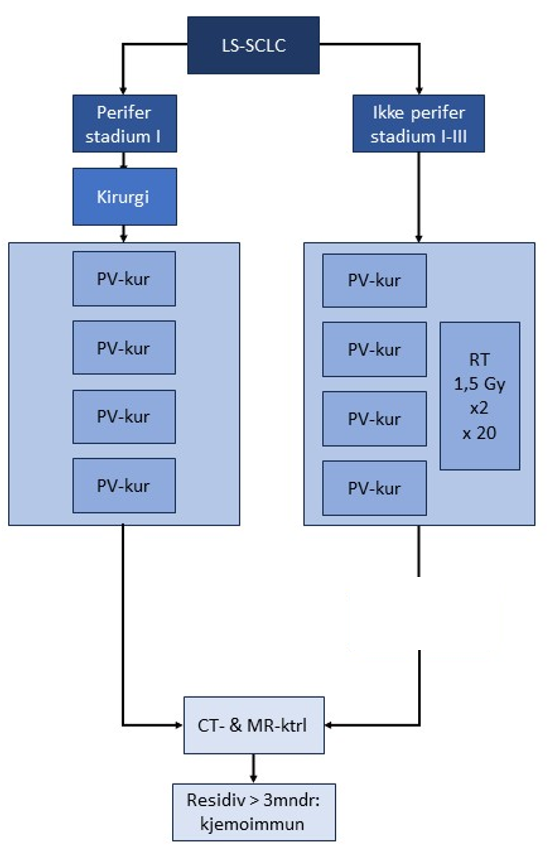
Pasienter over 75 år eller pasienter i generelt redusert allmenntilstand
Sist faglig oppdatert: 31.10.2024
Pasientens allmenntilstand og fysiske status bør være veiledende for behandlingsvalg i stedet for pasientens kronologiske alder. Eldre pasienter med god allmenntilstand (ECOG 0-2) og normal organfunksjon har tilsvarende effekt av behandlingen som yngre og bør få optimal multimodal behandling (Yuen et al., 2000). Ved redusert allmenntilstand som skyldes sykdomsbyrde bør pasienten få adekvat kurativ behandling til tross for redusert allmenntilstand.
Hos eldre pasienter med redusert allmenntilstand (ECOG 3-4), uavhengig av tumorbyrde, eller redusert organfunksjon bør en vurdere å redusere kjemoterapi-dosen (for eksempel med 25 %) og/eller gi TRT etter cytostatikabehandlingen (Früh et al., 2013; Rudin et al., 2015).
Profylaktisk helhjernebestråling er ikke aktuelt i denne aldersgruppen.
Anbefaling - eldre pasienter med LS-SCLC
- Eldre pasienter i god allmenntilstand, eller der redusert allmenntilstand relateres til tumorbyrde, bør motta optimal multimodal terapi.
- Hos eldre pasienter med reelt svekket allmenntilstand kan man vurdere å redusere kjemoterapidosene og/eller gi TRT etter cytostatika.
Kontroll etter behandling
Sist faglig oppdatert: 31.10.2024
For pasienter som er i god allmenntilstand, og som har hatt god respons på primærbehandling, anbefales utvidet CT toraks (helst med kontrast). Abdomen undersøkes altså ikke i diagnostisk kontrastfase, men toraksscanningen utvides til også å inkludere supraclavikulærregionen og binyrene, ved å utvide scanningområdet til 5 cm over lungetoppen og til kaudalt for binyrene. Undersøkelsen gjøres med 3-6 måneders intervall i 2 år, deretter lengre intervall (Früh et al., 2013). MR caput bør vurderes hver 3. måned første år, og hver 6. måned år 2 hos pasienter som ikke har fått PCI (B. J. Schneider et al., 2020).
Behandling ved residiv og plagsomme symptomer
Sist faglig oppdatert: 31.10.2024
Til tross for god responsrate ved SCLC begrenset sykdom (ORR 70-90 %) vil de fleste progrediere eller residivere.
Pasienter i god allmenntilstand bør vurderes for 2. linjebehandling, forutsatt respons av platinumbasert behandling i første linje, siden dette bedrer overlevelsen (Früh et al., 2013; Rudin et al., 2015). Om residivet kommer senere enn 3 mnd (sensitivt) reintroduseres førstelinjes cellegiftbehandling (inkludert immunterapi som ved utbredt sykdom, se avsnitt "Karboplatin-etoposid-atezolizumab" i Medikamentell behandling). Ved tidlig residiv (< 3 mnd, refraktær) vil andrelinje kombinasjonsbehandling være aktuell.
Det er begrenset kunnskap omkring effekt av 2. linjebehandling ved SCLC (Cheng, Evans, Stys-Norman, & Shepherd, 2007). Inklusjon i kliniske studier kan være et alternativ. 3. linjes behandling kan vurderes hos pasienter som har respondert i tidligere linjer.
Oral topotekan har i en fase III-studie, vurdert mot best supportive care (BSC), vist effekt med hensyn til respons og overlevelse (O'Brien, Ciuleanu, et al., 2006). I en fase III-studie ga iv topotekan tilsvarende overlevelse, men mer grad 4 toksisitet i form av anemi og trombocytemi sammenlignet med ACO (von Pawel et al., 1999). Peroral topotekan er funnet likeverdig med iv topotekan (von Pawel et al., 2001).
ACO er derfor mest aktuelt som 2. linjebehandling. Karboplatin-irinotekan har også vist effekt i en fase II-studie i 2. linje (G. Chen et al., 2009).
Palliativ strålebehandling bør vurderes ved behov for lindring av dyspné, hoste, hemoptyse eller tumorassosierte smerter i toraks (Bischof et al., 2007). Stereotaktisk strålebehandling mot solitære eller få hjernemetastaser kan være effektivt (Rusthoven et al., 2020), men ofte er det multiple hjernemetastaser slik at helhjernebestråling er mest aktuelt.
For generelle palliative tiltak vises til Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen.
Anbefaling - residiv, LS-SCLC
- Pasienter i god allmenntilstand bør vurderes for 2. linjebehandling.
- Ved sent residiv (>3 mnd) reintroduseres tidligere gitt cellegiftbehandling pluss immunterapi.
- Ved tidlig residiv vil ACO kunne være aktuelt. Oral topotekan er likeverdig i effekt med ACO, men har noe mer hematologisk toksisitet og anbefales dersom ACO ikke er aktuelt.
- Enkeltstoffbehandling med irinotekan, docetaksel, ifosfamid, temozolomid eller oral etoposid er også vist å kunne ha noe effekt.
- Torakal strålebehandling er effektivt ved plagsomme tumorrelaterte symptomer fra toraks.
Kirurgisk behandling av st. I SCLC
Sist faglig oppdatert: 31.10.2024
Pasienter i stadium I (cT1-2N0) skal utredes mht mulighet for kirurgisk reseksjon med kurativt siktemål (Schreiber et al., 2010).[NICE, 2011 #1019]. Muligheten for okkult nodal sykdom må utelukkes (Früh et al., 2013; Lad et al., 1994; B. J. Schneider, Saxena, & Downey, 2011; M. Sørensen, Pijls-Johannesma, Felip, & Group, 2010). Kun ca. 5 % av pasienter med SCLC er i stadium I (Ignatius Ou & Zell, 2009; Yu, Decker, Detterbeck, & Wilson, 2010).
Før ev. kirurgi må pasientene gjennomgå følgende undersøkelser for å utelukke regionale og fjernmetastaser. (Se kapittel 6):
- MR caput for å påvise ev. hjernemetastaser
- PET/CT for å påvise ev. ekstratorakale metastaser eller okkulte regionale lymfeknuter
- Usikre eller positive må funn følges opp med EBUS eller EUS
Etter komplett kirurgisk reseksjon, helst lobektomi, bør etterfølgende behandling tilbys. Det foreligger begrenset evidens, og internasjonale retningslinjer varierer noe (Zeng et al., 2022).
- Alle retningslinjer anbefaler postoperativ kjemoterapi. I Norge anbefales 4 kurer cisplatin eller karboplatin kombinert med etoposid som ved LS-SCLC
- Ved patologiske N2-lymfeknuter eller ufri rand (R1/2) synes alle å være enige om at postoperativ toraksbestråling bør vurderes gitt konkomitant med kjemoterapi som ved LS-SCLC. Postoperativ stråelterapi ved N1-lymfeknuter anbefales i noen retningslinjer, men for eksempel ikke av ASTRO.
- Profylaktisk hjernebestråling har tradisjonelt vært anbefalt, men nyere studier tyder på at MR-basert kontroll kan være et bedre alternativ (Gaebe et al., 2024). Dersom man etter diskusjon med pasienten vil tilby helhjernebestråilng vil 2,5 Gy x10 være mest aktuelt.
- Pasientene bør informeres om at røyking øker komplikasjonsrisiko etter lungekreftkirurgi
Multimodal behandling til denne gruppen har gitt 49-57 % 5-års overlevelse (Bischof et al., 2007).
Anbefaling - behandling av SCLC
- Pasienter med stadium I svulster (T1-2N0) bør, på grunnlag av grundig utredning, vurderes for kirurgisk reseksjon.
- Startutredning er som regel CT toraks inkl. øvre abdomen. Kirurgi forutsetter videre negativ MR caput og PET/CT. Ved mistanke om positive glandler i toraks må dette utelukkes med EBUS/EUS/mediastinoskopi.
- Postoperativt gis adjuvant 4 kurer kjemoterapi.
- Ved stor risiko for perioperative komplikasjoner er kombinert kjemoradioterapi, ev. stereotaksi, et alternativ til kirurgi.
- Hvis det peroperativt er påvist mediastinal patologi eller det ikke er utført systematisk lymfeknutedisseksjon, kan det gis postoperativ torakal strålebehandling som ved LS-SCLC. Denne bør starte innen 21-28 dager fra kjemoterapistart.
Behandling av ikke-operabel begrenset sykdom, LS-SCLC
Sist faglig oppdatert: 31.10.2024
Definisjon og behandling av LS-SCLC
SCLC T1-4N0-3M0 innebærer en tumorutbredelse begrenset til en hemitoraks, samt evt. regionale lymfeknutemetastaser til hilære, mediastinale og supraklavikulære regioner både ipsi- og kontralateralt. Pleuravæske aksepteres dersom man har tatt minst én cytologi uten funn av maligne celler. Ved svært små mengder pleuravæske er det ikke nødvendig å ta cytologi.
SCLC T1-4N0-3M0 er potensielt kurerbar. Responsrater etter konkomitant kjemoradioterapi er 70-90 % og 2- og 5-års overlevelse er respektive 40 % og 20-25 % i store randomiserte studier og metaanalyser. Den kurative behandlingen er multimodal og innebærer platinumbasert kjemoterapi, konkomitant toraksbestråling og ev. påfølgende profylaktisk hjernebestråling (Simon, Turrisi, & Physicians, 2007). Konsoliderende immunterapi er også vist å gi overlevelsesgevinst (se under).
Medikamentell behandling
Cellegift er basisbehandlingen ved LS-SCLC. Cisplatin er å anse som førstevalg ved kurativ behandling av LS-SCLC, men effekten av karboplatin er sannsynligvis i praksis likeverdig. Karboplatin vurderes ved intoleranse for eller risiko for betydelige bivirkninger av cisplatin (f eks redusert hørsel eller tinnitus), redusert nyrefunksjon, redusert allmenntilstand, alder 75 år eller eldre eller komorbiditet. Karboplatin doseres i prinsippet til AUC 6, men for de aller fleste er AUC 5 høy nok dose. Det anbefales 4 kurer cellegift (Früh et al., 2013).
I en fase III-studie («Adriatic») ble 530 pasienter som hadde gjennomgått stråleterapi (1,5 Gy x2 til 45 Gy eller 2 Gy x 30-33) konkomitant med 4 PV-kurer og hvor det ikke ble påvist progresjon, randomisert til 2 år med PD-L1-hemmeren durvalumab 1500 mg iv hver 4. uke, eller placebo (Spigel et al, ASCO 2024). Totaloverlevelsen var i favør av durvalumab, med median OS på 55,9 mndr i durvalumabgruppen og 33,4 mndr i placebogruppen (HR 0,73, p = 0,0104). Etter 3 år var 56,5 % av pasientene som hadde fått durvalumab i live, mot 47,6 % i placebogruppen. Bivirkningene av durvalumab var som man er kjent med når PD-1-/PD-L1-hemmere benyttes. Det var omtrent samme frekvens av strålepneumonitt/pneumonitt i begge grupper (33,6 % i durvalumabgruppen, mot 29,4 % i placebogruppen), og langt de fleste var grad 1-2.
PV-regime
Det gis fire kurer. Dosering beregnes ut fra pasientens kroppsoverflate.
Beh. dag | Stoff | Dose |
|---|---|---|
Dag 1 | Cisplatin | 75 mg/m2 i.v. |
Dag 1-3 | Etoposid | 100 mg/m2 i.v. |
Ny kur gis dag 22 | ||
Anbefalt hydreringsregime
Prehydrering: 1-2 liter (avhengig av hydreringsgrad/nyrefunksjon) NaCl over 2 timer. Etoposid tilsettes i 500 ml NaCl og gis siste halvtime av prehydrering. Cisplatin gis i 1000 ml NaCl over 2 timer. Posthydrering 1000 ml NaCl over 1 time. Total infusjonstid 5 timer, total væske: 3,5-4,5 liter. Akynzeo og deksametason som kvalmeprofylakse.
Dag 2-3 gis etoposid i 500 ml NaCl med 500 ml NaCl skyll. Kreatinin måles dag 2-3 for å vurdere nyrefunksjon.
Eventuell dosejustering
Siden behandlingsmålet er kurativt etterstrebes optimal behandlingsintensitet. G-CSF anbefales ikke rutinemessig pga manglende evidens for overlevelsesgevinst. I en eldre studie så man betydelig økt toksisitet ved bruk av vekstfaktor (GM-CSF) ved kjemoradioterapi ved SCLC (Bunn et al., 1995), mens en nyere subgruppe-analyse av CONVERT-studien ikke viste økt toksisitet ved bruk av G-CSF (Gomes et al., 2021).
Ved nøytrofile < 1,5 x109 og/eller trombocytter < 100 x109 utsettes kur 0,5-1 uke. Dersom kur må utsettes mer enn en uke bør neste kur vurderes redusert med 15-20 %.
Anbefaling - kjemoterapi ved LS-SCLC
- Pasienter med LS-SCLC tilbys fire kurer cisplatin/etoposid.
- Karboplatin kan erstatte cisplatin ved alvorlige bivirkninger av cisplatin, redusert nyrefunksjon, redusert hørsel/tinnitus, redusert allmenntilstand (ECOG 2-3), høy alder (> 75 år) eller ved signifikant komorbiditet.
Strålebehandling
Torakal strålebehandling
Samtidig torakal strålebehandling ble etablert etter at metaanalyser viste bedring av lokal kontroll (25-30 % residivreduksjon) og en økning i 3-årsoverlevelse med 5,4 %. Senere studier viser at 25-40% er i live 5 år etter kjemoradioterapi, og kjemoradioterapi er derfor den viktigste kurative behandlingen av SCLC (Faivre-Finn et al., 2017; Grønberg et al., 2021).
Kliniske studier og en Cochrane-gjennomgang har vist at tidlig strålebehandling (konkomitant med kjemoterapi) gir bedre effekt enn strålebehandling gitt etter avsluttet kjemoterapi (Pijls-Johannesma, De Ruysscher, Lambin, Rutten, & Vansteenkiste, 2005). Samtidig må mange pasienter henvises annet sykehus for strålebehandling og tumorstørrelse reduseres betydelig etter første kur. Det anbefales derfor konkomitant TRT og kjemoterapi med oppstart av TRT 21-28 daqer etter første dag av første cytostatikakur (Früh et al., 2013).
Konkomitant akselerert hyperfraksjonert TRT resulterte i økt 5-års overlevelse (26 % vs 16 %), men også klart mer grad 3-4 øsofagitt enn normofraksjonert TRT (Turrisi et al., 1999). Senere studier viser at når man begrenser strålefelt til PET/CT-positive lesjoner og bruker moderne stråleteknikker, så gir ikke hyperfraksjonert TRT mer bivirkninger, og andelen som opplever alvorlige bivirkninger er vesentlig lavere enn i Turrisi-studien (Faivre-Finn et al., 2017; Grønberg et al., 2021). En norsk studie viste en trend mot økt median overlevelse ved hyperfraksjonert (1,5 Gy x 2 x 15) sammenlignet med tidligere norsk standard-bestråling (2,8 Gy x 15) (Grønberg et al., 2016), og implementering av hyperfraksjoner TRT i Norge har resultert i en økning i median overlevelse på over 6 måneder og en fordobling av 5-års overlevelse (Graabak, Grønberg, Sandvei, Nilssen, & Halvorsen, 2022).
I den oppfølgende, nordiske studien på LS-SCLC (THORA) ble pasienter randomisert til hyperfraksjonert torakal bestråling til 45 Gy (1,5 Gy x 2 i 15 dager) eller 60 Gy (1,5 Gy x 2 i 20 dager). Studien viser en betydelig gevinst både i form av 2-års overlevelse (74 % vs 48 %), median overlevelse (43,6 vs 22,6 mndr) og 5-års overlevelse (40 % vs 28 %), og det var ikke mer bivirkninger i høydose-armen (grad 3-4 esofagitt 21 % vs 18 %), og vesentlig mindre enn i HAST-studien. Hyperfraksjonert toraksbestråling til 60 Gy er dermed standardbehandling i Norge.
Planlegging og gjennomføring av strålebehandling skal utføres i henhold til Faglige anbefalinger for kurativ strålebehandling av småcellet lungekreft. Pasientene bør informeres om at røyking kan svekke effekten av strålebehandling.
Anbefaling - stråleterapi ved LS-SCLC
- Konkomitant torakal stråleterapi (TRT) skal i utgangspunktet tilbys alle pasienter med LS-SCLC (unntak: reseserte stadium I-pasienter der mediastinum er verifisert negativ).
- Det anbefales oppstart av TRT 21-28 dager etter første cellegiftkur.
- Hyperfraksjonert stråleterapi med 1,5 Gy x 2 x 20 etterstrebes. Alternativt gis 1,5 Gy x2 x 15, 2,8 Gy x 15 eller 3 Gy x 10.
- Målvolum begrenses til PET CT positive lesjoner, men ut fra størrelsen på lesjoner på doseplan CT tatt etter første cytostatika-kur. Dog skal tidligere affiserte glandelstasjoner inkluderes.
Profylaktisk hjernebestråling (PCI)
Risiko for hjernemetastaser er > 50 % for pasienter med SCLC. En eldre meta-analyse viste at PCI ga 25 % redusert 3-års insidens for hjernemetastaser (Auperin et al., 1999). Dette gir 5-6 % økt overlevelse etter PCI ved LS-SCLC. Få av pasientene i denne studien var undersøkt med MR caput.
En gjennomgang av publiserte studier viser at PCI var assosiert med overlevelsesforbedring, men ikke når man kun inkluderte studier hvor det radiologisk var bekreftet fravær av hjernemetastaser før oppstart PCI (Gaebe et al., 2024). Det er derfor grunn til å stille spørsmål ved nytten av PCI når MR caput er gjort i forkant.
PCI kan vurderes tilbudt LS-SCLC pasienter i relativt god ECOG som ikke progredierer på kjemoradioterapi. Det anbefales fraksjonering 25 Gy/10 fraksjoner (Le Péchoux et al., 2009). PCI bør ikke gis samtidig med systemisk kjemoterapi. Pasienter > 65 år og/eller med alvorlig vaskulær sykdom kan ha økt risiko for å utvikle nevrokognitive bivirkninger (Le Péchoux et al., 2011; Wolfson et al., 2011). Oppfølgning med regelmessig MR caput kan være et godt alternativ, og dette bør diskuteres med pasienten.
Anbefaling - profylaktisk hjernebestråling, LS-SCLC
- Profylaktisk helhjernebestråling kan være en mulighet for yngre LS-SCLC-pasienter uten vaskulær sykdom som ikke har progrediert etter kjemoradioterapi.
- PCI skal ikke kombineres med kjemoterapi, men startes etter at kjemoterapi er avsluttet. Aktuell fraksjonering vil være 2,5 Gy x 10 (totalt 25 Gy).
- Oppfølgning med MR caput kan være et godt alternativ.

Pasienter over 75 år eller pasienter i generelt redusert allmenntilstand
Sist faglig oppdatert: 31.10.2024
Pasientens allmenntilstand og fysiske status bør være veiledende for behandlingsvalg i stedet for pasientens kronologiske alder. Eldre pasienter med god allmenntilstand (ECOG 0-2) og normal organfunksjon har tilsvarende effekt av behandlingen som yngre og bør få optimal multimodal behandling (Yuen et al., 2000). Ved redusert allmenntilstand som skyldes sykdomsbyrde bør pasienten få adekvat kurativ behandling til tross for redusert allmenntilstand.
Hos eldre pasienter med redusert allmenntilstand (ECOG 3-4), uavhengig av tumorbyrde, eller redusert organfunksjon bør en vurdere å redusere kjemoterapi-dosen (for eksempel med 25 %) og/eller gi TRT etter cytostatikabehandlingen (Früh et al., 2013; Rudin et al., 2015).
Profylaktisk helhjernebestråling er ikke aktuelt i denne aldersgruppen.
Anbefaling - eldre pasienter med LS-SCLC
- Eldre pasienter i god allmenntilstand, eller der redusert allmenntilstand relateres til tumorbyrde, bør motta optimal multimodal terapi.
- Hos eldre pasienter med reelt svekket allmenntilstand kan man vurdere å redusere kjemoterapidosene og/eller gi TRT etter cytostatika.
Kontroll etter behandling
Sist faglig oppdatert: 31.10.2024
For pasienter som er i god allmenntilstand, og som har hatt god respons på primærbehandling, anbefales utvidet CT toraks (helst med kontrast). Abdomen undersøkes altså ikke i diagnostisk kontrastfase, men toraksscanningen utvides til også å inkludere supraclavikulærregionen og binyrene, ved å utvide scanningområdet til 5 cm over lungetoppen og til kaudalt for binyrene. Undersøkelsen gjøres med 3-6 måneders intervall i 2 år, deretter lengre intervall (Früh et al., 2013). MR caput bør vurderes hver 3. måned første år, og hver 6. måned år 2 hos pasienter som ikke har fått PCI (B. J. Schneider et al., 2020).
Behandling ved residiv og plagsomme symptomer
Sist faglig oppdatert: 31.10.2024
Til tross for god responsrate ved SCLC begrenset sykdom (ORR 70-90 %) vil de fleste progrediere eller residivere.
Pasienter i god allmenntilstand bør vurderes for 2. linjebehandling, forutsatt respons av platinumbasert behandling i første linje, siden dette bedrer overlevelsen (Früh et al., 2013; Rudin et al., 2015). Om residivet kommer senere enn 3 mnd (sensitivt) reintroduseres førstelinjes cellegiftbehandling (inkludert immunterapi som ved utbredt sykdom, se avsnitt "Karboplatin-etoposid-atezolizumab" i Medikamentell behandling). Ved tidlig residiv (< 3 mnd, refraktær) vil andrelinje kombinasjonsbehandling være aktuell.
Det er begrenset kunnskap omkring effekt av 2. linjebehandling ved SCLC (Cheng, Evans, Stys-Norman, & Shepherd, 2007). Inklusjon i kliniske studier kan være et alternativ. 3. linjes behandling kan vurderes hos pasienter som har respondert i tidligere linjer.
Oral topotekan har i en fase III-studie, vurdert mot best supportive care (BSC), vist effekt med hensyn til respons og overlevelse (O'Brien, Ciuleanu, et al., 2006). I en fase III-studie ga iv topotekan tilsvarende overlevelse, men mer grad 4 toksisitet i form av anemi og trombocytemi sammenlignet med ACO (von Pawel et al., 1999). Peroral topotekan er funnet likeverdig med iv topotekan (von Pawel et al., 2001).
ACO er derfor mest aktuelt som 2. linjebehandling. Karboplatin-irinotekan har også vist effekt i en fase II-studie i 2. linje (G. Chen et al., 2009).
Palliativ strålebehandling bør vurderes ved behov for lindring av dyspné, hoste, hemoptyse eller tumorassosierte smerter i toraks (Bischof et al., 2007). Stereotaktisk strålebehandling mot solitære eller få hjernemetastaser kan være effektivt (Rusthoven et al., 2020), men ofte er det multiple hjernemetastaser slik at helhjernebestråling er mest aktuelt.
For generelle palliative tiltak vises til Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen.
Anbefaling - residiv, LS-SCLC
- Pasienter i god allmenntilstand bør vurderes for 2. linjebehandling.
- Ved sent residiv (>3 mnd) reintroduseres tidligere gitt cellegiftbehandling pluss immunterapi.
- Ved tidlig residiv vil ACO kunne være aktuelt. Oral topotekan er likeverdig i effekt med ACO, men har noe mer hematologisk toksisitet og anbefales dersom ACO ikke er aktuelt.
- Enkeltstoffbehandling med irinotekan, docetaksel, ifosfamid, temozolomid eller oral etoposid er også vist å kunne ha noe effekt.
- Torakal strålebehandling er effektivt ved plagsomme tumorrelaterte symptomer fra toraks.
Ikke-kurativ behandling av metastatisk småcellet lungekreft (SCLC T1-4N0-3M1) - utbredt sykdom
Sist faglig oppdatert: 31.10.2024
Ved utbredt SCLC er behandlingsmålet livsforlengelse, symptomforebygging og symptomlindring. Gjennomførbarhet av behandlingen og pasientens livskvalitet og preferanser/ønsker er derfor spesielt viktig. For generelle palliative tiltak vises det til handlingsprogram for palliasjon i kreftomsorgen.
Men selv pasienter i redusert allmenntilstand (ECOG 3-4), der denne er betinget i sykdomsbyrde, kan få en god og meningsfull behandlingseffekt. Prognosen ved utbredt sykdom er, til tross for responsrater opp mot 70 %, relativt dårlig med PFS på kun 5,5 mnd, median overlevelse på 9-11 mnd og 2-års overlevelsesrate 10 % (Wolfson et al., 2011). Langtidsoverlevere har historisk sett vært sjeldne, men etter innføring av immunterapi ser man at enn liten andel kan leve mer enn 5 år.
Definisjon utbredt sykdom
Sist faglig oppdatert: 31.10.2024
Utbredt sykdom (ES-SCLC) omfatter spredning utenfor hemitoraks, pleuraeffusjon med maligne celler og/eller fjernmetastaser. Behandlingsintensjon ved ES-SCLC er i hovedsak palliativ og livsforlengende.
For generelle palliative tiltak vises det til
Medikamentell behandling
Sist faglig oppdatert: 31.10.2024
Også ved ES-SCLC er cytostatika basisbehandlingen. For pasienter med god allmenntilstand er det flere fase III studier som viser at samtidig immunterapi etterfulgt av vedlikeholdsbehanndling med immunterapi forlenger overlevelsen sammenlignet med cytostatika alene (Horn et al., 2018; Paz-Ares et al., 2019; Rudin et al., 2020). I motsetning til ved ikke-småcellet lungekreft har ingen av disse studiene vist nytte av å selektere pasienter basert på PD-L1-uttrykk i tumorceller, eller andre biomarkører.
I IMpower133-studien ble 403 pasienter randomisert til enten fire kurer karboplatin/etoposid med placebo eller atezolizumab (1200 mg flat dose) hver 3. uke, etterfulgt av enten placebo eller atezolizumab hver 3. uke til progresjon, uakseptable bivirkninger, eller ingen videre klinisk nytte (Horn et al., 2018). Etter en median oppfølgningstid på 13,9 måneder var median totaloverlevelse 12,3 måneder i gruppen som fikk atezolizumab, mot 10,3 måneder i placebo-gruppen. En ekspansjonsstudie presentert på WCLC 2023 viste at 12 % av pasientene var i live etter 5 år. Dette er en høyere andel langtidsoverlevere enn etter cytostatika alene, samtidig som andelen langtidsoverleve er lavere enn etter immunterapi for avansert NSCLC. Det er også verdt å merke seg at overlevelseskurvene ikke separeres før etter ca. 7 måneder.
Beslutningsforum vedtok 27.9.21 følgende:
- Atezolizumab (Tecentriq) innføres til behandling i kombinasjon med kjemoterapi til førstelinjebehandling av utbredt småcellet lungekreft (ES-SCLC).
- Innføringen er knyttet til en pris-volum-avtale, og det forutsettes at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
- Behandlingen kan tas i bruk fra 01.11.2021, da ny pris kan gjelde fra denne datoen.
CASPIAN-studien randomiserte 537 pasienter til enten fire kurer med karboplatin eller cisplatin, etoposid og durvalumab etterfulgt av durvalumab til progresjon, eller cytostatika pluss placebo. Durvalumab-gruppen hadde median overlevelse 13,0 mndr, mot 10,3 mndr i placebo-gruppen (Paz-Ares et al., 2019). En oppdatering fra denne studien etter 39,4 måneder median oppfølgningstid, presentert ved ESMO 2021, viste at 17,6 % av pasienter behandlet med durvalumab og kjemoterapi var i live 3 år etter behandlingsstart, mot 5,8 % i gruppen som fikk placebo kombinert med kjemoterapi.
Beslutningsforum vedtok 22.5.23 følgende:
- Durvalumab (Imfinzi) innføres ikke i kombinasjon med etopsid og enten karboplatin eller cisplatin til førstelinjebehandling av voksne med utbredt småcellet lungekreft (SCLC-ED)
- Det er ikke dokumentert en klinisk nytte som står i forhold til prisen på legemidlet
- Sykehusinnkjøp bes gjenoppta forhandlingene med leverandør
Senere er det flere andre studier med andre PD-1/PD-L1 hemmere som bekrefter at immunterapi har en rolle i behandlingen av ES-SCLC. Men siden overlevelsesgevinsten er begrenset og man ikke har noen prediktive biomarkører, anbefales det pasienter inkluderes i TRIPLEX-studien (se informasjon på nlcg.no).
Karboplatin-etoposid-atezolizumab
Det gis inntil fire kurer karboplatin/etoposid. Etoposid ble gitt intravenøst i IMpower 133-studien, men hos pasienter hvor det er ønskelig å minimere tid på sykehus vil et alternativt regime kunne være intravenøs etoposid-infusjon dag 1, og peroral adminstrasjon dag 2-4. Karboplatindosen beregnes etter Calverts formel for AUC=5. Atezolizumab gis sammen med cellegiftkurene, og deretter hver 3. eller 4. uke. Bivirkningsprofilen med dette regimet tilsvarer det man ser ved immunterapi kombinert med kjemoterapi ved ikke-småcellet lungekreft (se avsnitt "Bivirkninger ved immunterapi" i Immunterapi: bivirkninger, behandlingsvarighet og annet). Det var i studien ingen bestemt stopp-dato for atezolizumab-dosering, men det er trolig som ved ikke-småcellet lungekreft ikke grunn til å gi behandling utover 2 år (se avsnitt Behandlingsvarighet ved immunterapi, og kontrollopplegg etter avsluttet behandling" i Immunterapi: bivirkninger, behandlingsvarighet og annet).
Beh. dag | Stoff | Dose |
|---|---|---|
Dag 1 | Atezolizumab | 1200 mg iv (flat dose) |
Dag 1 | Karboplatin | AUC = 5 (Calvert) |
Dag 1-3 | Etoposid | 100 mg/m2 iv |
Ny kur gis dag 22 | ||
eller
Behandlingsdag | Stoff | Dose |
|---|---|---|
Dag 1 | Atezolizumab | 1200 mg iv (flat dose) |
Karboplatin | AUC = 5 (Calvert) | |
Etoposid | 100 mg/m2 iv | |
Dag 2-4 | Etoposid | 200 mg/m2 po fordelt på morgen- og kveldsdose |
Ny kur gis dag 22 | ||
Anbefaling - kjemoimmunterapi ES-SCLC
- Førstelinje behandling er fire kurer karboplatin-etoposid sammen med atezolizumab, etterfulgt av atezolizumab hver 3. uke.
- Selv ved ECOG 3 bør kjemoterapi vurderes hvis redusert allmenntilstand er klart relatert til pasientens lungekreft, men nytteverdien er sannsyligvis begrenset ved PS >1. Immunterapi kan ev. legges til om allmenntilstanden bedres.
- Inklusjon i kliniske studier kan være aktuelt.
Strålebehandling
Sist faglig oppdatert: 31.10.2024
Torakal strålebehandling
Torakal strålebehandling (TRT) har generelt sett liten plass i rutinebehandling av utbredt SCLC (Früh et al., 2013).
En fase III-studie som randomiserte pasienter med utbredt SCLC med respons på kjemoterapi til enten torakal strålebehandling eller kontroll viste ingen signifikant overlevelsesforskjell mellom gruppene, men det ble vist bedre torakal sykdomskontroll (Slotman et al., 2015). Torakal strålebehandling er først og fremst aktuelt for pasienter med dårlig respons på førstelinjes systemisk behandling og bulky gjenværende sykdom sentralt i toraks.
TRT er også aktuelt som symptomrettet behandling, for eksempel ved kompresjon av sentrale luftveier eller store kar, eller hemoptyse (S. Sundstrom et al., 2004). Hypofraksjonert stråling som 8,5 Gy x 2, ev engangsfraksjoner er oftest adekvat, men mer fraksjonert strålebehandling, eks. 3 Gy x 13, kan være aktuelt hos pasienter med sykdomskontroll utenfor toraks. Se ”Faglige anbefalinger for lindrende strålebehandling ved lungecancer”.
Anbefaling - stråleterapi ES-SCLC
- Rutinemessig torakal stråleterapi anbefales ikke ved ES-SCLC, men kan vurderes hos utvalgte pasienter med lav ekstratorakal sykdomsbyrde ev. ved dårlig respons på systemisk behandling.
- Torakal strålebehandling er aktuelt ved plagsomme tumorrelaterte symptomer.
- Inklusjon i kliniske studier kan være aktuelt.
Hjernebestråling
Profylaktisk hjernebestråling (PCI)
Også ved ES SCLC er det vist at PCI reduserer risikoen for hjernemetastaser. I én studie fant man også en overlevelsesgevinst, mens man ikke fant dette i en senere studie. Det er derfor uavklart om PCI skal gis rutinemessig, ikke minst fordi mange studier på PCI ved SCLC er gjort uten uten adekvat radiologisk kartlegging av eventuelle hjernemetastaser før oppstart PCI. Det pågår to store studier hvor pasienter med SCLC randomiseres mellom PCI og MRI-kontroller som forhåpentligvis vil avklare nyttverdien av PCI.
Det er enda mer uavklart hvorvidt pasienter som får kjemo-immunterapi bør tilbys PCI siden det er veldig få pasienter som deltok i studiene som førte til innføring av kjemo-immunterapi som fikk PCI. På den ene siden kan man tenke seg at risikoen for hjernemetastaser øker fordi pasientene lever lenger, men man kan også tenke seg at risikoen for plagsomme sekveler etter PCI øker fordi pasientene lever lenger. Det er derfor ikke opplagt at pasienter med ES-SCLC skal tilbys forebyggende helhjernebestråling såfremt de følges med MR (anbefalt opplegg er da hver 3 måned første år) (Eze, Käsmann, & Manapov, 2019; Gaebe et al., 2024; Schild, Sio, Daniels, Chun, & Rades, 2017).
Problemstillingen bør diskuteres med pasienter, der toksisitet og andre ulemper ved helhjernebestråling veies mot en redusert risiko for hjernemetastaser. Dersom PCI velges anbefales 25 Gy i 10 fraksjoner på grunn av fare for nevrotoksistet ved høye doser, og behandlingsstart innen 6 uker etter avsluttet kjemoterapi (Wolfson et al., 2011).
Manifeste primære hjernemetastaser
Ved hjernemetastaser påvist i primærsituasjonen antas blod-hjerne-barrieren å være skadet/lekk. Hos kjemonaive pasienter bør derfor kjemoterapi med immunterapi være førstevalg, strålebehandling sekundært (Gigi Chen et al., 2008). I studier med kun kjemoterapi oppnådde ca 50 % av pasienter med hjernemetastaser intrakraniell respons, og det er ikke gitt at de som har meget god respons i hjerne rutinemessig skal henvises for hjernebestråling. Ved begrenset respons på primær kjemoimmunterapi og/eller persisterende symptom eller behov for steroider bør hjernebestråling gis. Anbefalt fraksjonering er 3 Gy x 10 ev. 4 Gy x 5 ved dårlig respons på systemisk behandling og stor tumorbyrde.
Stereotaktisk strålebehandling mot solitære eller få hjernemetastaser kan være et effektivt alternativ til helhjernebestråling, spesielt ved god ekstrakraniell sykdomskontroll (Rusthoven et al., 2020).
Pasienter med uttalte CNS-symptom som responderer dårlig på steroider bør vurderes for hjernebestråling før systemisk behandling. Målet er å forbedre pasientens allmenntilstand slik at immunterapi kombinert med kjemoterapi kan gis.
Vær spesielt oppmerksom på kjøretøyforskriftens helsekrav. For detaljer vises det til Helsedirektoratets førerkortveileder.
Anbefaling - hjernebestråling ES-SCLC
- ES-SCLC-pasienter bør tilbys MR-basert kontroll-opplegg (MR caput hver 3. måned i 1 år), alternativt profylaktisk hjernebestråling (i så fall 2,5 Gy x10).
- Ved primære hjernemetastaser hos kjemonaive pasienter bør kjemoterapi være førstevalg, strålebehandling sekundært.
- Ved symptomgivende hjernemetastaser med begrenset respons på steroider og kjemoterapi bør helhjernebestråling tilbys
Pasienter over 75 år eller pasienter i redusert allmenntilstand
Sist faglig oppdatert: 31.10.2024
Pasientens allmenntilstand og fysiske status bør være veiledende i behandlingsvurdering i stedet for pasientens kronologiske alder. Eldre pasienter med god allmenntilstand (ECOG 0-1) og normal organfunksjon har tilsvarende effekt av behandlingen som yngre og bør få optimal behandling.
Hos eldre pasienter med redusert allmenntilstand (ECOG 2-4) som ikke er forårsaket av tumorbyrde, eller redusert organfunksjon, bør en vurdere å gi cytostatika alene, og et. redusere dosene av cytostatika. Enkeltstoffbehandling med oralt etoposid kan også være aktuelt (Simon et al., 2007). Immunterapi alene har neppe effekt, basert på studier i andre- eller senere linjer (Chung et al., 2020; Pujol et al., 2019; D. R. Spigel et al., 2021). Er redusert allmenntilstand relatert til sykdomsbyrde bør pasienten tilbys standard cytostatika-behandling, evt. kan man starte med reduserte doser som evt. kan økes for påfølgende kurer dersom pasienten responderer godt. Palliativ strålebehandling kan også være et godt alternativ.
Anbefaling - behandling av eldre pasienter med ES-SCLC
- Eldre pasienter i god allmenntilstand bør motta standard kjemoimmunterapi
- Der redusert allmenntilstand relateres til tumorbyrde, bør standard cytostatikabehandling gis, ev. med reduserte doser.
- Eldre pasienter med reelt svekket allmenntilstand kan tilbys doseredusert cytostatika, ev monoterapi med oralt etoposid.
- Paliiativ strålebehandling kan også være et godt alternativ.
Kontroll etter gjennomført primærbehandling
Sist faglig oppdatert: 31.10.2024
Det anbefales CT-vurdering av respons etter primærbehandling. Pasienter som er i god allmenntilstand, med god respons på førstelinjebehandling og som er aktuelle for 2.-linjebehandling ved progresjon, kontrolleres deretter med CT toraks med 2-3 måneders mellomrom. MR caput med regelmessige mellomrom anbefales også, spesielt hos dem som ikke har fått PCI. For øvrige pasienter er det ikke indisert med rutinemessig bildemessig oppfølging.
Behandling ved residiv og andre plagsomme symptomer
Sist faglig oppdatert: 31.10.2024
En Cochrane oversikt publisert i 2009 (Pelayo Alvarez, Gallego Rubio, Bonfill Cosp, & Agra Varela, 2009) viste at residivbehandling resulterte i 2-3 mnd lengre median overlevelse enn blant de som fikk best supportive care (BSC). Om dette gjelder også etter førstelinjebehandling med immunterapi kombinert med kjemoterapi er ukjent. Pasienter i god allmenntilstand bør vurderes for 2.-linjebehandling, forutsatt respons i første linje.
Blant behandlingsrefraktære (ingen respons eller progresjon på initial immunterapi kombinert med kjemoterapi) og resistente pasienter med tidlig residiv (< 6 uker) vil behandlingseffekten være dårlig og klinisk nytte av videre behandling usikker. Om residivet kommer senere enn 3 mnd (sensitivt residiv) anbefales det å reintrodusere samme behandling som i første linje (Baize et al., 2020). Ved tidlig residiv (< 3 mnd, refraktær), forutsatt effekt i første linje, vil 2. linje kombinasjonsbehandling være aktuell, fortrinnsvis med ACO-kurer, karboplatin-irinotekan eller oralt topotekan. Det er ikke dokumentert gevinst av kjemoimmunterapi ved residiv.
Oral topotekan har i en fase III studie, målt mot BSC, vist effekt med hensyn til respons og overlevelse. I en annen fase III-studie var ACO likeverdig med iv topotekan, og ACO ga mindre grad 4-toksisitet (O'Brien, Ciuleanu, et al., 2006; von Pawel et al., 1999). Peroral topotekan er funnet likeverdig med iv topotekan (von Pawel et al., 2001). Hos pasienter med klinisk relevant respons på 2. linjes behandling (f. eks. > 3 mndrs progresjonsfrihet) kan man vurdere å gi 3. linjes behandling.
Palliativ strålebehandling er indisert ved behov for lindring av dyspné, hoste, hemoptyse eller tumorassosierte smerter i toraks (Bischof et al., 2007).
ACO
Det administreres oppt til fire kurer. Dosering beregnes ut fra pasientens kroppsoverflate, men vinkristin gis i dose 2 mg uansett kroppsoverflate.
Behandlingsdag | Stoff | Dose |
|---|---|---|
Dag 1 | Doksorubicin | 50 mg/m2 i.v. |
Syklofosfamid | 1000 mg/m2 i.v. | |
Vinkristin | 2 mg i.v. | |
Ny kur gis dag 22 | ||
Karboplatin-irinotekan
Det administreres opp til fire kurer. Irinotekan beregnes ut fra pasientens kroppsoverflate. Karboplatindosen beregnes etter Calverts formel for AUC=5
Behandlingsdag | Stoff | Dose |
|---|---|---|
Dag 1 | Karboplatin | AUC = 5 (Calvert) |
Irinotekan | 175 mg/m2 i.v. | |
Ny kur gis dag 22 | ||
Det benyttes ikke G-CSF for å opprettholde behandlingsintensitet. Ved hematologisk toksisitet reduseres dosene av hver cellegift i henhold til følgende dosereduksjonsskjema, evt utsettes kur med en uke:
Leukocytter | Trombocytter | Cytostatika-dose |
|---|---|---|
≥3,0 | ≥100 | 100 % |
2,5-2,9 | 75-99 | 75 % |
<2.5 | <75 | Utsett kur 1 uke |
Anbefaling - residiv, ES-SCLC
- Pasienter i god allmenntilstand bør vurderes for 2. linjebehandling.
- Ved sent residiv (> 3 mndr etter avsluttet primærbehandling) anbefales det å reintrodusere tidligere cystostatikabehandling.
- Ved tidlig residiv vil ACO (ev. karboplatin-irinotekan eller oralt topotekan) være aktuelt.
- Torakal strålebehandling er effektivt ved plagsomme tumorrelaterte symptomer fra toraks.
Definisjon utbredt sykdom
Sist faglig oppdatert: 31.10.2024
Utbredt sykdom (ES-SCLC) omfatter spredning utenfor hemitoraks, pleuraeffusjon med maligne celler og/eller fjernmetastaser. Behandlingsintensjon ved ES-SCLC er i hovedsak palliativ og livsforlengende.
For generelle palliative tiltak vises det til
Medikamentell behandling
Sist faglig oppdatert: 31.10.2024
Også ved ES-SCLC er cytostatika basisbehandlingen. For pasienter med god allmenntilstand er det flere fase III studier som viser at samtidig immunterapi etterfulgt av vedlikeholdsbehanndling med immunterapi forlenger overlevelsen sammenlignet med cytostatika alene (Horn et al., 2018; Paz-Ares et al., 2019; Rudin et al., 2020). I motsetning til ved ikke-småcellet lungekreft har ingen av disse studiene vist nytte av å selektere pasienter basert på PD-L1-uttrykk i tumorceller, eller andre biomarkører.
I IMpower133-studien ble 403 pasienter randomisert til enten fire kurer karboplatin/etoposid med placebo eller atezolizumab (1200 mg flat dose) hver 3. uke, etterfulgt av enten placebo eller atezolizumab hver 3. uke til progresjon, uakseptable bivirkninger, eller ingen videre klinisk nytte (Horn et al., 2018). Etter en median oppfølgningstid på 13,9 måneder var median totaloverlevelse 12,3 måneder i gruppen som fikk atezolizumab, mot 10,3 måneder i placebo-gruppen. En ekspansjonsstudie presentert på WCLC 2023 viste at 12 % av pasientene var i live etter 5 år. Dette er en høyere andel langtidsoverlevere enn etter cytostatika alene, samtidig som andelen langtidsoverleve er lavere enn etter immunterapi for avansert NSCLC. Det er også verdt å merke seg at overlevelseskurvene ikke separeres før etter ca. 7 måneder.
Beslutningsforum vedtok 27.9.21 følgende:
- Atezolizumab (Tecentriq) innføres til behandling i kombinasjon med kjemoterapi til førstelinjebehandling av utbredt småcellet lungekreft (ES-SCLC).
- Innføringen er knyttet til en pris-volum-avtale, og det forutsettes at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
- Behandlingen kan tas i bruk fra 01.11.2021, da ny pris kan gjelde fra denne datoen.
CASPIAN-studien randomiserte 537 pasienter til enten fire kurer med karboplatin eller cisplatin, etoposid og durvalumab etterfulgt av durvalumab til progresjon, eller cytostatika pluss placebo. Durvalumab-gruppen hadde median overlevelse 13,0 mndr, mot 10,3 mndr i placebo-gruppen (Paz-Ares et al., 2019). En oppdatering fra denne studien etter 39,4 måneder median oppfølgningstid, presentert ved ESMO 2021, viste at 17,6 % av pasienter behandlet med durvalumab og kjemoterapi var i live 3 år etter behandlingsstart, mot 5,8 % i gruppen som fikk placebo kombinert med kjemoterapi.
Beslutningsforum vedtok 22.5.23 følgende:
- Durvalumab (Imfinzi) innføres ikke i kombinasjon med etopsid og enten karboplatin eller cisplatin til førstelinjebehandling av voksne med utbredt småcellet lungekreft (SCLC-ED)
- Det er ikke dokumentert en klinisk nytte som står i forhold til prisen på legemidlet
- Sykehusinnkjøp bes gjenoppta forhandlingene med leverandør
Senere er det flere andre studier med andre PD-1/PD-L1 hemmere som bekrefter at immunterapi har en rolle i behandlingen av ES-SCLC. Men siden overlevelsesgevinsten er begrenset og man ikke har noen prediktive biomarkører, anbefales det pasienter inkluderes i TRIPLEX-studien (se informasjon på nlcg.no).
Karboplatin-etoposid-atezolizumab
Det gis inntil fire kurer karboplatin/etoposid. Etoposid ble gitt intravenøst i IMpower 133-studien, men hos pasienter hvor det er ønskelig å minimere tid på sykehus vil et alternativt regime kunne være intravenøs etoposid-infusjon dag 1, og peroral adminstrasjon dag 2-4. Karboplatindosen beregnes etter Calverts formel for AUC=5. Atezolizumab gis sammen med cellegiftkurene, og deretter hver 3. eller 4. uke. Bivirkningsprofilen med dette regimet tilsvarer det man ser ved immunterapi kombinert med kjemoterapi ved ikke-småcellet lungekreft (se avsnitt "Bivirkninger ved immunterapi" i Immunterapi: bivirkninger, behandlingsvarighet og annet). Det var i studien ingen bestemt stopp-dato for atezolizumab-dosering, men det er trolig som ved ikke-småcellet lungekreft ikke grunn til å gi behandling utover 2 år (se avsnitt Behandlingsvarighet ved immunterapi, og kontrollopplegg etter avsluttet behandling" i Immunterapi: bivirkninger, behandlingsvarighet og annet).
Beh. dag | Stoff | Dose |
|---|---|---|
Dag 1 | Atezolizumab | 1200 mg iv (flat dose) |
Dag 1 | Karboplatin | AUC = 5 (Calvert) |
Dag 1-3 | Etoposid | 100 mg/m2 iv |
Ny kur gis dag 22 | ||
eller
Behandlingsdag | Stoff | Dose |
|---|---|---|
Dag 1 | Atezolizumab | 1200 mg iv (flat dose) |
Karboplatin | AUC = 5 (Calvert) | |
Etoposid | 100 mg/m2 iv | |
Dag 2-4 | Etoposid | 200 mg/m2 po fordelt på morgen- og kveldsdose |
Ny kur gis dag 22 | ||
Anbefaling - kjemoimmunterapi ES-SCLC
- Førstelinje behandling er fire kurer karboplatin-etoposid sammen med atezolizumab, etterfulgt av atezolizumab hver 3. uke.
- Selv ved ECOG 3 bør kjemoterapi vurderes hvis redusert allmenntilstand er klart relatert til pasientens lungekreft, men nytteverdien er sannsyligvis begrenset ved PS >1. Immunterapi kan ev. legges til om allmenntilstanden bedres.
- Inklusjon i kliniske studier kan være aktuelt.
Strålebehandling
Sist faglig oppdatert: 31.10.2024
Torakal strålebehandling
Torakal strålebehandling (TRT) har generelt sett liten plass i rutinebehandling av utbredt SCLC (Früh et al., 2013).
En fase III-studie som randomiserte pasienter med utbredt SCLC med respons på kjemoterapi til enten torakal strålebehandling eller kontroll viste ingen signifikant overlevelsesforskjell mellom gruppene, men det ble vist bedre torakal sykdomskontroll (Slotman et al., 2015). Torakal strålebehandling er først og fremst aktuelt for pasienter med dårlig respons på førstelinjes systemisk behandling og bulky gjenværende sykdom sentralt i toraks.
TRT er også aktuelt som symptomrettet behandling, for eksempel ved kompresjon av sentrale luftveier eller store kar, eller hemoptyse (S. Sundstrom et al., 2004). Hypofraksjonert stråling som 8,5 Gy x 2, ev engangsfraksjoner er oftest adekvat, men mer fraksjonert strålebehandling, eks. 3 Gy x 13, kan være aktuelt hos pasienter med sykdomskontroll utenfor toraks. Se ”Faglige anbefalinger for lindrende strålebehandling ved lungecancer”.
Anbefaling - stråleterapi ES-SCLC
- Rutinemessig torakal stråleterapi anbefales ikke ved ES-SCLC, men kan vurderes hos utvalgte pasienter med lav ekstratorakal sykdomsbyrde ev. ved dårlig respons på systemisk behandling.
- Torakal strålebehandling er aktuelt ved plagsomme tumorrelaterte symptomer.
- Inklusjon i kliniske studier kan være aktuelt.
Hjernebestråling
Profylaktisk hjernebestråling (PCI)
Også ved ES SCLC er det vist at PCI reduserer risikoen for hjernemetastaser. I én studie fant man også en overlevelsesgevinst, mens man ikke fant dette i en senere studie. Det er derfor uavklart om PCI skal gis rutinemessig, ikke minst fordi mange studier på PCI ved SCLC er gjort uten uten adekvat radiologisk kartlegging av eventuelle hjernemetastaser før oppstart PCI. Det pågår to store studier hvor pasienter med SCLC randomiseres mellom PCI og MRI-kontroller som forhåpentligvis vil avklare nyttverdien av PCI.
Det er enda mer uavklart hvorvidt pasienter som får kjemo-immunterapi bør tilbys PCI siden det er veldig få pasienter som deltok i studiene som førte til innføring av kjemo-immunterapi som fikk PCI. På den ene siden kan man tenke seg at risikoen for hjernemetastaser øker fordi pasientene lever lenger, men man kan også tenke seg at risikoen for plagsomme sekveler etter PCI øker fordi pasientene lever lenger. Det er derfor ikke opplagt at pasienter med ES-SCLC skal tilbys forebyggende helhjernebestråling såfremt de følges med MR (anbefalt opplegg er da hver 3 måned første år) (Eze, Käsmann, & Manapov, 2019; Gaebe et al., 2024; Schild, Sio, Daniels, Chun, & Rades, 2017).
Problemstillingen bør diskuteres med pasienter, der toksisitet og andre ulemper ved helhjernebestråling veies mot en redusert risiko for hjernemetastaser. Dersom PCI velges anbefales 25 Gy i 10 fraksjoner på grunn av fare for nevrotoksistet ved høye doser, og behandlingsstart innen 6 uker etter avsluttet kjemoterapi (Wolfson et al., 2011).
Manifeste primære hjernemetastaser
Ved hjernemetastaser påvist i primærsituasjonen antas blod-hjerne-barrieren å være skadet/lekk. Hos kjemonaive pasienter bør derfor kjemoterapi med immunterapi være førstevalg, strålebehandling sekundært (Gigi Chen et al., 2008). I studier med kun kjemoterapi oppnådde ca 50 % av pasienter med hjernemetastaser intrakraniell respons, og det er ikke gitt at de som har meget god respons i hjerne rutinemessig skal henvises for hjernebestråling. Ved begrenset respons på primær kjemoimmunterapi og/eller persisterende symptom eller behov for steroider bør hjernebestråling gis. Anbefalt fraksjonering er 3 Gy x 10 ev. 4 Gy x 5 ved dårlig respons på systemisk behandling og stor tumorbyrde.
Stereotaktisk strålebehandling mot solitære eller få hjernemetastaser kan være et effektivt alternativ til helhjernebestråling, spesielt ved god ekstrakraniell sykdomskontroll (Rusthoven et al., 2020).
Pasienter med uttalte CNS-symptom som responderer dårlig på steroider bør vurderes for hjernebestråling før systemisk behandling. Målet er å forbedre pasientens allmenntilstand slik at immunterapi kombinert med kjemoterapi kan gis.
Vær spesielt oppmerksom på kjøretøyforskriftens helsekrav. For detaljer vises det til Helsedirektoratets førerkortveileder.
Anbefaling - hjernebestråling ES-SCLC
- ES-SCLC-pasienter bør tilbys MR-basert kontroll-opplegg (MR caput hver 3. måned i 1 år), alternativt profylaktisk hjernebestråling (i så fall 2,5 Gy x10).
- Ved primære hjernemetastaser hos kjemonaive pasienter bør kjemoterapi være førstevalg, strålebehandling sekundært.
- Ved symptomgivende hjernemetastaser med begrenset respons på steroider og kjemoterapi bør helhjernebestråling tilbys
Pasienter over 75 år eller pasienter i redusert allmenntilstand
Sist faglig oppdatert: 31.10.2024
Pasientens allmenntilstand og fysiske status bør være veiledende i behandlingsvurdering i stedet for pasientens kronologiske alder. Eldre pasienter med god allmenntilstand (ECOG 0-1) og normal organfunksjon har tilsvarende effekt av behandlingen som yngre og bør få optimal behandling.
Hos eldre pasienter med redusert allmenntilstand (ECOG 2-4) som ikke er forårsaket av tumorbyrde, eller redusert organfunksjon, bør en vurdere å gi cytostatika alene, og et. redusere dosene av cytostatika. Enkeltstoffbehandling med oralt etoposid kan også være aktuelt (Simon et al., 2007). Immunterapi alene har neppe effekt, basert på studier i andre- eller senere linjer (Chung et al., 2020; Pujol et al., 2019; D. R. Spigel et al., 2021). Er redusert allmenntilstand relatert til sykdomsbyrde bør pasienten tilbys standard cytostatika-behandling, evt. kan man starte med reduserte doser som evt. kan økes for påfølgende kurer dersom pasienten responderer godt. Palliativ strålebehandling kan også være et godt alternativ.
Anbefaling - behandling av eldre pasienter med ES-SCLC
- Eldre pasienter i god allmenntilstand bør motta standard kjemoimmunterapi
- Der redusert allmenntilstand relateres til tumorbyrde, bør standard cytostatikabehandling gis, ev. med reduserte doser.
- Eldre pasienter med reelt svekket allmenntilstand kan tilbys doseredusert cytostatika, ev monoterapi med oralt etoposid.
- Paliiativ strålebehandling kan også være et godt alternativ.
Kontroll etter gjennomført primærbehandling
Sist faglig oppdatert: 31.10.2024
Det anbefales CT-vurdering av respons etter primærbehandling. Pasienter som er i god allmenntilstand, med god respons på førstelinjebehandling og som er aktuelle for 2.-linjebehandling ved progresjon, kontrolleres deretter med CT toraks med 2-3 måneders mellomrom. MR caput med regelmessige mellomrom anbefales også, spesielt hos dem som ikke har fått PCI. For øvrige pasienter er det ikke indisert med rutinemessig bildemessig oppfølging.
Behandling ved residiv og andre plagsomme symptomer
Sist faglig oppdatert: 31.10.2024
En Cochrane oversikt publisert i 2009 (Pelayo Alvarez, Gallego Rubio, Bonfill Cosp, & Agra Varela, 2009) viste at residivbehandling resulterte i 2-3 mnd lengre median overlevelse enn blant de som fikk best supportive care (BSC). Om dette gjelder også etter førstelinjebehandling med immunterapi kombinert med kjemoterapi er ukjent. Pasienter i god allmenntilstand bør vurderes for 2.-linjebehandling, forutsatt respons i første linje.
Blant behandlingsrefraktære (ingen respons eller progresjon på initial immunterapi kombinert med kjemoterapi) og resistente pasienter med tidlig residiv (< 6 uker) vil behandlingseffekten være dårlig og klinisk nytte av videre behandling usikker. Om residivet kommer senere enn 3 mnd (sensitivt residiv) anbefales det å reintrodusere samme behandling som i første linje (Baize et al., 2020). Ved tidlig residiv (< 3 mnd, refraktær), forutsatt effekt i første linje, vil 2. linje kombinasjonsbehandling være aktuell, fortrinnsvis med ACO-kurer, karboplatin-irinotekan eller oralt topotekan. Det er ikke dokumentert gevinst av kjemoimmunterapi ved residiv.
Oral topotekan har i en fase III studie, målt mot BSC, vist effekt med hensyn til respons og overlevelse. I en annen fase III-studie var ACO likeverdig med iv topotekan, og ACO ga mindre grad 4-toksisitet (O'Brien, Ciuleanu, et al., 2006; von Pawel et al., 1999). Peroral topotekan er funnet likeverdig med iv topotekan (von Pawel et al., 2001). Hos pasienter med klinisk relevant respons på 2. linjes behandling (f. eks. > 3 mndrs progresjonsfrihet) kan man vurdere å gi 3. linjes behandling.
Palliativ strålebehandling er indisert ved behov for lindring av dyspné, hoste, hemoptyse eller tumorassosierte smerter i toraks (Bischof et al., 2007).
ACO
Det administreres oppt til fire kurer. Dosering beregnes ut fra pasientens kroppsoverflate, men vinkristin gis i dose 2 mg uansett kroppsoverflate.
Behandlingsdag | Stoff | Dose |
|---|---|---|
Dag 1 | Doksorubicin | 50 mg/m2 i.v. |
Syklofosfamid | 1000 mg/m2 i.v. | |
Vinkristin | 2 mg i.v. | |
Ny kur gis dag 22 | ||
Karboplatin-irinotekan
Det administreres opp til fire kurer. Irinotekan beregnes ut fra pasientens kroppsoverflate. Karboplatindosen beregnes etter Calverts formel for AUC=5
Behandlingsdag | Stoff | Dose |
|---|---|---|
Dag 1 | Karboplatin | AUC = 5 (Calvert) |
Irinotekan | 175 mg/m2 i.v. | |
Ny kur gis dag 22 | ||
Det benyttes ikke G-CSF for å opprettholde behandlingsintensitet. Ved hematologisk toksisitet reduseres dosene av hver cellegift i henhold til følgende dosereduksjonsskjema, evt utsettes kur med en uke:
Leukocytter | Trombocytter | Cytostatika-dose |
|---|---|---|
≥3,0 | ≥100 | 100 % |
2,5-2,9 | 75-99 | 75 % |
<2.5 | <75 | Utsett kur 1 uke |
Anbefaling - residiv, ES-SCLC
- Pasienter i god allmenntilstand bør vurderes for 2. linjebehandling.
- Ved sent residiv (> 3 mndr etter avsluttet primærbehandling) anbefales det å reintrodusere tidligere cystostatikabehandling.
- Ved tidlig residiv vil ACO (ev. karboplatin-irinotekan eller oralt topotekan) være aktuelt.
- Torakal strålebehandling er effektivt ved plagsomme tumorrelaterte symptomer fra toraks.
Nevroendokrine lungesvulster (karsinoid og storcellet nevroendokrint karsinom)
Sist faglig oppdatert: 31.10.2024
Under nevroendokrine lungesvulster hører de lavgradig maligne typiske karsinoidene (TC), de intermediært maligne atypiske karsinoidene (AC), og de høygradig maligne storcellede nevroendokrine tumorene (LCNEC) samt småcellet lungekreft (SCLC). De har til felles evnen til å syntetisere neuropeptider og tilstedeværelsen av nevroendokrine korn ved elektronmikroskopi av cellene. De skiller seg fra hverandre klinisk, epidemiologisk, og ved sine molekylære og histomorfologiske karakteristika. Karsinoidene har sannsynligvis annen opprinnelse enn de høymaligne variantene (Fernandez-Cuesta et al., 2014).
Karsinoidene som gruppe utgjør ca 2 % av all lungekreft, og typiske karsinoider er 8-10 ganger så vanlige som de atypiske. LCNEC utgjør ca 3 % av svulstene mens SCLC er den klart vanligste med ca 16 % av alle diagnostiserte tilfeller av lungekreft. SCLC omtales i kapittel 9 og 10.
Det ble i 2021 publisert europeiske retningslinjer for håndtering av pulmonale og thymiske karsinoider (Baudin, Caplin, Garcia-Carbonero, Fazio, Ferolla, Filosso, Frilling, de Herder, Hörsch, Knigge, Korse, Lim, Lombard-Bohas, Pavel, Scoazec, Sundin, Berruti, et al., 2021). En grundig amerikansk oversiktsartikkel understreker også at det er få gode studier på denne diagnosegruppen (Wolin, 2017).
For klassifisering og patologisk vurdering av nevroendokrine neoplasmer, se kapittel 6.9.4.
Typiske og atypiske karsinoide svulster
Sist faglig oppdatert: 31.10.2024
Karsinoide svulster er sjeldne, men forekomsten er økende med ca 1,2 nye tilfeller per 100 000 i Norge (Boyar Cetinkaya et al., 2017). De fleste karsinoide svulster oppstår i GI-traktus mens ca 17 % har opprinnelse i lungene (Detterbeck, 2010). Lungekarsinoider utgjør ca 2 % av primær lungekreftsykdom (Harpole, Feldman, Buchanan, Young, & Wolfe, 1992) og det skilles mellom typiske og atypiske karsinoide svulster. De typiske karsinoide svulstene er høyt differensierte og har vanligvis god prognose. Omtrent 10 % av lungekarsinoidene er atypiske (Fink et al., 2001), disse har høyere risiko for å utvikle metastaser og for tilbakefall etter kirurgi. Karsinoidene har ingen klar sammenheng med røyking, imidlertid er det sett mulig sammenheng mellom røyking og utvikling av atypiske karsinoider (Fink et al., 2001).
Vel 30 % av lungekarsinoidene er lokaliserte til trakea og hovedbronkiene, og i ca 10 % av tilfellene ses metastaser til mediastinale lymfeknuter. Hemoptyse ses hos 10 – 20 % av pasientene. I motsetning til de gastrointestinale karsinoidene, ses typisk karsinoid syndrom med flushing, diare og asthmaliknende symptomer svært sjelden, forekomsten er angitt til 2 % (Fink et al., 2001). Lungekarsinoider kan også produsere ACTH og gi Cushings syndrom. Se for øvrig "Typisk karsinoid tumor (NET G1) og atypisk karsinoid tumor (NET G2)" i Histopatologisk diagnostikk for klassifisering og histologisk vurdering av karsinoide tumores.
Utredning
I utgangspunktet håndteres karsinoider som ved utredning av lungesvulster generelt, men i det diagnosen karsinoid bekreftes, kan andre undersøkelser være indiserte (Caplin et al., 2015). Stadieinndelingen er som for lungekreft generelt. Sentrale svulster er ofte lett tilgjengelig for biopsi ved bronkoskopi og perifere lesjoner for cytologi, men definitiv diagnose vil ofte kreve større mengder vev.
Nukleærmedisinske somatostatin-baserte undersøkelser som 68Ga-DOTATATE/68Ga-DOTATOC og oktreotidscintigrafi med SPECT/CT kan anvendes i diagnostikken av nevroendokrine tumores, se "Vurdering av T-stadium" i Utfyllende informasjon om utredning av lungekreft.
Tumormarkøren kromogranin A kan være forhøyet i blod hos noen pasienter med karsinoider, men nivåene overlapper med den friske befolkningen, og kan være forhøyet ved en rekke medisinske tilstander (Korse et al., 2012). ProGRP er beskrevet å ha en viss prognostisk verdi men er ikke i rutinebruk (Korse et al., 2012). Ved mistanke om karsinoid syndrom bør urin-5HIAA måles i morgenurin.
Kirurgi
Primærbehandling for lungekarsinoider er kirurgi. Som hovedregel skal karsinoide svulster opereres etter samme prinsipp som annen primær lungekreft. Preoperativt har en som regel ikke nok vev til å skille mellom typisk og atypisk karsinoid. Sublobar reseksjon med inntil 5 mm margin kan være akseptabelt ved typiske karsinoider pga liten tendens til submukosal spredning (Filosso et al., 2013). Ved sublobær reseksjon av svulst som viser seg å være typisk karsinoid kan en avstå fra restlobektomi, men dette bør gjøres ved atypisk karsinoid. Overlevelsen etter 5- og 10 år for opererte pasienter med typiske karsinoider er mer enn 90 %, mens den for de atypiske er hhv 70 % og 50-60 % (Cardillo et al., 2004; Detterbeck, 2010; Wirth, Carter, Jänne, & Johnson, 2004). 5-20 % av typiske, og 30-70 % av atypiske karsinoider har spredning til lymfeknuter, og lymfeknutedisseksjon må derfor gjøres. For atypiske karsinoider er lymfeknutestatus, reseksjonsgrad og residiv faktorer forbundet med dårligere prognose (Cañizares et al., 2014).
Det er ikke holdepunkter for at adjuvant medikamentell behandling har effekt verken ved typiske eller atypiske karsinoider uansett lymfeknutestatus, og dette anbefales ikke (K. L. Anderson et al., 2017; Nussbaum et al., 2015).
Laserbehandling kan være nyttig for å avhjelpe bronkial obstruksjon før kirurgi og for å få oversikt perifert for tumor ved bronkoskopi. For medisinsk inoperable pasienter kan endobronkial laserbehandling være et alternativ. Laserbehandling er også beskrevet som en behandlingsmulighet med kurativt potensiale (Neyman et al., 2012).
Medikamentell behandling
Både typiske og atypiske karsinoider er mindre kjemofølsomme enn SCLC. I motsetning til gastrointestinale karsinoider, er det sparsomme data vedrørende effekt av medikamentell behandling på karsinoider med utgangspunkt i lungene.
Basert på en rekke små studier, hver med 4-5 pasienter synes somatostatinanaloger å ha en veksthemmende effekt hos 30-70 % av de behandlede. Somatostatinanaloger har ofte en meget god effekt på hormoninduserte symptomer som diare og flushing.
Peptidreseptor-radionuklidterapi (PRRT-behandling) er et etablert behandlingsprinsipp, som kan benyttes for behandling av undergrupper av pasienter med nevroendokrin kreft med spredning. Best dokumentasjon foreligger foreløpig for gastrointestinale nevroendokrine svulster (Strosberg et al., 2017). 177Lutetium-DOTATATE (Lutathera®) er et legemiddel som er godkjent av European Medicines Agency for behandling av nevroendokrine neoplasier. Norske pasienter har tidligere blitt sendt til Sverige eller Danmark for slik behandling, men Beslutningsforum fattet 27.8.18 vedtak om at denne behandlingen kan innføres i Norge (https://www.fhi.no/publ/2018/peptidreseptor-radionuklidterapi-basert-pa-lutetium-for-behandling-av-nevro/). Behandling med 177Lutetium-DOTATATE (Lutathera®) tilbys nå ved universitetssykehusene i Oslo, Bergen, Trondheim og Tromsø. Tumor må ha opptak på 68Ga-DOTATOC eller oktreotidscintigrafi, for å kunne behandles med Lutathera®. Prinsippet i behandlingen er at injisert legemiddel fester seg til somatostatinreseptorer på kreftcellene og det radioaktive 177Lutetium utsender β-partikler som bestråler tumor.
Interferon-alfa kan stoppe vekst (Granberg et al., 2001), men dette preparatet tolereres ofte svært dårlig. mTOR hemmeren everolimus har også vist veksthemmende effekt på lungekarsinoider med en median progresjonsfri overlevelse på 11 mnd (Yao et al., 2016). Disse biologiske behandlingene er per i dag mest aktuelle for pasienter med lungekarsinoider med lav proliferasjon, Ki 67 <10 / mitoseindeks < 20.
For mer hurtigvoksende karsinoider kan kjemoterapi med kombinasjonen temozolomid monoterapi, eller i kombinasjon med kapecitabin, ha effekt på en del pasienter (Crona et al., 2013). Også sunitinib er beskrevet å ha effekt ved lungekarsinoider (Kulke et al., 2008). Alternativt kan platinum/etoposid forsøkes (Moertel, Kvols, O'Connell, & Rubin, 1991). Grunnet betydelige bivirkninger anbefales dette først etter svikt på andre behandlinger eller ved svært rask veksthastighet, gjerne bekreftet ved en ny vevsprøve med proliferasjonsindeks-estimering da særlig atypiske karsinoider kan endre aggressivitetsgrad. Etablert behandling for gastrointestinale karsinoider med streptozocin og syklofosfamid eller 5FU har tvilsom effekt ved karsinoider i luftveiene (Moertel & Hanley, 1979).
Nyilg ble det publisert en ikke-randomisert fase 2-studie hvor 28 pasienter med metastatisk nevroendokrine sykdom (inkludert 11 med utgangspunkt i lunge) ble behandlet med kombinasjonen temozolamid og nivolumab. Av de 11 pasientene med metastatisk karsinoid fra lunge, responderte 7 (64%), PFS var 11,1 mndr (Owen et al., 2022).
Strålebehandling
Karsinoider er mindre strålefølsomme enn SCLC og indikasjoner for strålebehandling er omdiskuterte (Bilski et al., 2021). Postoperativ strålebehandling av atypiske karsinoider (men ikke typiske) vil kunne være aktuelt ved N2-sykdom og ved makroskopisk ufri rand etter kirurgi. Stråledose på opptil 60 Gy er beskrevet, gitt enten sekvensielt med kjemoterapi (platinum+etoposid) eller konkomitant (Mackley & Videtic, 2006). Stereotaksi kan være et alternativ til kirurgi hos pasienter med typisk/atypisk karsinoid i stadium I/II og som ikke ønsker kirurgi, eller er medisinsk inoperable (Singh, Chen, Cummings, & Milano, 2019). Teknisk inoperable svulster (stadium III) kan vurderes for kjemoradioterapi som ved ikke-småcellet lungekreft (se Non-kirurgisk behandling av stadium II/III).
Kontroller
Det finnes ingen studier som kan brukes til å skissere et evidensbasert oppfølgingsopplegg. Det er ikke helt uvanlig at pasienter med antatt kurativt behandlede lungekarsinoider kan få påvist residiv etter 5-15 år. Dermed vil et pragmatisk oppfølgingsopplegg kunne være: 6 mnd., 1 år, 2 år, 3 år, 4 år, 5 år, 7 år og 10 år etter kirurgi, og individuell vudering deretter.
Kontroller tilpasses individuelt og etter lokale bildediagnostiske protokoller. Typiske karsinoider metastaserer svært sjeldent, og CT toraks med kontrast er tilstrekkelig kontroll-modalitet. Ved atypiske lungekarsinoider, som kan være aggressive, anbefales kontroller med CT toraks/øvre abdomen med kontrast. Karsinoid-metastaser er ofte hypervaskulære og ses best i arteriell kontrastfase. Derfor anbefales kontrast i både arteriell fase og portovenøs fase over leveren, mens det er tilstrekkelig med kun venøs fase over toraks. MR abdomen bør vurderes hos pasienter under 50 år for å redusere strålebelastningen (Caplin et al., 2015).
Somatostatinreseptor-basert bildediagnostikk anbefales ikke i rutinekontroller. Samtidig kromogranin A -analyse gir erfaringsmessig liten/ingen tilleggsgevinst utover bildediagnostikk. Kontrollhyppighet justeres i forhold til pasientens alder, komorbiditet, antatt prognose og behandlingsalternativer ved ev. progresjon.
For pasienter som ikke er radikalt operert vil det avhengig av behandlingsmodalitet som velges være behov for kontroller med 3-6 mnd. intervaller
Behandlingsansvar
Behandlingen av pasienter med utbredt sykdom som ikke kan kureres ved kirurgi er i prinsippet som for nevroendokrine svulster utgått fra GI-traktus. Det anbefales derfor kontakt med avdelinger som behandler disse for råd og eventuelt overføring av videre behandling.
Anbefaling - karsinoider
- Karsinoider utredes og stadiesettes som lungesvulster for øvrig.
- Ved typiske karsinoider stadium I og II og atypiske karsinoider anbefales somatostatinreseptor-basert bildediagnostikk.
- Karsinoider i stadium I-III anbefales operert som vanlig primær lungekreft. En kan gjøre sublobær reseksjon ved små perifere typiske karsinoider, men komplett lymfeknutedisseksjon/sampling må gjennomføres.
- Stereotaksi kan være et alternativ hos pasienter i stadium I/II som ikke ønsker kirurgi, eller er medisinsk inoperable.
- Ved radikaloperert typisk karsinoid i stadium I, II og III og atypisk karsinoid stadium I anses pasienten ferdig behandlet etter radikal kirurgi.
- Ved ufri reseksjonsrand eller peroperativt påvist N2-sykdom og atypisk histologi kan strålebehandling som ved ikke-småcellet lungekreft vurderes. Adjuvant kjemoterapi er ikke indisert.
- Ved inoperabel karsinoid kan kjemoradiasjon (stadium III) eller medikamentell behandling vurderes.
- Kontroller bør tilpasses individuelt, og pasienten bør følges i minimum 10 år etter operasjon.
Storcellet nevroendokrint karsinom (LCNEC)
Sist faglig oppdatert: 31.10.2024
LCNEC utgjør rundt 3 % av de opererte lungekrefttilfellene og er forbundet med røyking (Travis, 2014). Diagnostikk av LCNEC kan være vanskelig i biopsier og cytologisk materiale, bl.a fordi overlappende trekk med småcellet karsinom eller adenokarsinom kan forekomme; se kapittel 6.9.4.2 for histopatologisk vurdering av LCNEC..
Aggressiv biologi og tendens til metastasering ligner i større grad småcellet enn ikke-småcellet lungekreft, mens respons på både kjemoterapi og strålebehandling er betydelig dårligere. Paraneoplastiske syndromer er ikke beskrevet (Gollard, Jhatakia, Elliott, & Kosty, 2010). Overlevelsen er lavere enn for ikke-småcellet lungekreft, det er angitt at 5-årsoverlevelse for opererte pasienter i tidlig stadium er 15 – 57 % (Travis, 2014).
Det er ikke publisert prospektive randomiserte studier som definerer optimal behandling av denne pasientgruppen. Studiene som foreligger er ofte retrospektive, har få pasienter og omhandler i stor grad opererte pasienter. Mangel på randomiserte studier gjenspeiles også i sprikende internasjonale retningslinjer fra ulike onkologiske miljøer.
Utredning
Stadieinndeling og utredning før behandling er som ved ikke-småcellet lungekreft.
Kirurgi
Stadium I-III vurderes for operasjon på samme måte som ved annen ikke-småcellet lungekreft. Overlevelsesdata synes å være noe dårligere sammenlignet med adenokarsinomer i samme stadium, med rapporterte 5-årsdata i stadium I og II på 50 % og 45 % respektivt (Raman, Jawitz, Yang, Voigt, et al., 2019)
Medikamentell behandling
LCNEC er aggressive på linje med SCLC. Kjemoterapi som ved SCLC er best dokumentert (Iyoda et al., 2009; Le Treut et al., 2013; Rossi et al., 2005).
Det er publisert studier som støtter adjuvant kjemoterapi til pasienter med LCNEC, også ved sykdom i stadium IB (men neppe for IA) (Raman, Jawitz, Yang, Tong, et al., 2019; Saji et al., 2010; Veronesi et al., 2006). Fire kurer cisplatin/etoposid vil være aktuell behandling.
Ved inoperabel sykdom foreligger det lite litteratur å støtte seg til, men et aktuelt behandlingsvalg er platinumbasert kjemoterapi som ved SCLC-ES, inkludert immunterapi. I en retrospektiv gjennomgang ble 49 pasienter med st IV LCNEC behandlet ved Memorial Sloan Kettering Cancer Center fra 2006 til 2013 identifisert (Naidoo et al., 2016). Hjernemetastaser var påvist hos 23/49 pasienter (47 %). 26 ble behandlet med platinum/etoposid med objektiv responsrate på 37 %. Samme regime i senere linjer ga ikke påvisbar respons. Median overlevelse for gruppen som helhet var 10.2 mnd. Pemetreksed har trolig ingen plass ved LCNEC (J. M. Sun et al., 2012).
Målrettet behandling og immunterapi
EGFR mutasjoner, BRAF V600E og ALK translokasjon (EML4-ALK) er rapportert i LCNEC, men pga lav forekomst er det ikke grunnlag for rutinemessig molekylærpatologisk undersøkelse. Utfra litteraturen synes det å være divergerende resutat hos pasienter behandlet med TKI’er (Ferrara et al., 2021).
PD-L1-positivitetsraten synes å være lav, som ved SCLC, og det er usikkert om PD-L1 er en prediktiv faktor for immunterapi ved LCNEC (Tsuruoka et al., 2017). Inntil mer informasjon foreligger, anbefales PD-L1-testing av disse svulstene. Det synes rimelig at immunterapi tilbys uavhengig av PD-L1-uttrykk, som ved SCLC-ES (Komiya, Ravindra, & Powell, 2021).
Strålebehandling
Medisinsk inoperable pasienter vil ha nytte av stråleterapi – stereotaksi om mulig, alternativt kjemoradiasjon som ved ikke-småcellet lungekreft. Postoperativ stråleterapi har ikke vist å gi gevinst (Limonnik, Abel, Finley, Long, & Wegner, 2020; Raman, Jawitz, Yang, Tong, et al., 2019; Raman, Jawitz, Yang, Voigt, et al., 2019).
Profylaktisk hjernebestråling er neppe nyttig (Rieber et al., 2015).
Kontroller
Kontrollopplegget etter behandling for LCNEC bør følge det som gjelder for ikke-småcellet lungekreft for øvrig.
Anbefaling - storcellet nevroendokrint karsinom
- Operable pasienter bør tilbys kirurgi.
- Adjuvant kjemoterapi med 4 kurer cisplatin/etoposid bør vurderes, også for pasienter med sykdom i stadium IB.
- Strålebehandlingens rolle er ikke avklart, men kan vurderes ved lokalavansert inoperabel sykdom.
- LCNEC og kombinerte SCLC/LCNEC behandles med kjemoimmunterapi som ved SCLC og strålebehandles som ved ikke-småcellet lungekreft.
Malignt pleuralt mesoteliom (C45)
Årsak og insidens
Sist faglig oppdatert: 31.10.2024
Malignt mesoteliom starter hyppigst i pleura parietalis (brysthinnen), og langt sjeldnere i peritoneum (bukhinnen). Asbesteksponering er den viktigste risikofaktoren for malignt pleuralt mesoteliom (MPM) (Noonan, 2017). Sammenhengen mellom mesoteliom og asbest ble første gang påvist på 60-tallet. Importen av asbest til Norge skjøt fart etter 2. verdenskrig. I 1977 ble import av asbest ble regulert, og i 1982 forbudt.
Fra eksponering til klinisk sykdom er latenstiden 30-50 år (Marinaccio et al., 2007). Tradisjonelt har arbeidere i industri der asbest har vært brukt blitt oftest og hardest rammet. Høy forekomst er observert hos arbeidere i bygningsindustrien (eternittplater), i smelteverksindustrien (isolasjon), sjøfolk og fiskere (maskinrom), og i bilverksteder (bremsebånd).
Risiko for mesoteliom synes å være økt blant pasienter med kimbanemutasjoner i BAP1-genet, som gir en økt risiko for ulike kreftformer inkludert mesoteliom (Hassan et al., 2019). Tap av DNA-reparasjonsproteinet BAP1 er forbundet med effekt av kjemoterapi og dermed bedre prognose (Louw et al., 2022). Ved mistanke om genetisk årsak (yngre pasienter, familiehistorikk) kan henvisning til genetisk veiledning være aktuelt.
De siste årene har insidensen i Norge vært ca 60-70 tilfeller for menn, og ca 15 tilfeller blant kvinner. Insidensen synes å gå noe ned, spesielt blant menn (Brustugun, Nilssen, & Eide, 2021; Å. Helland, Solberg, & Brustugun, 2012). Kjønnsforskjellen forklares med ulik yrkeseksponering.
Sykdomsutvikling
Sist faglig oppdatert: 31.10.2024
Typisk presentasjon er langsomt økende brystsmerter og/eller dyspné. I tidlige stadier er dyspné oftest forårsaket av pleuravæske. Mistanken styrkes ved radiologisk pleural fortykkelse/oppfylning. Progresjon skjer i hovedsak ved lokal/regional infiltrasjon/vekst, sjeldnere hematogen spredning. Metastasering skjer sent i forløpet og forårsaker sjelden symptomer. Direkte involvering av mediastinale strukturer er vanlig og de fleste pasienter har lokalt avansert sykdom.
Malignt mesoteliom har generelt en dårlig prognose med en median overlevelse på rundt 11 måneder, og 1- og 3-årsoverlevelse på henholdsvis ca 40 % og 10-15 %. Pasienter med epiteloid histologi (utgjør ca 70 % av MPM med histopatologisk subtyping) har bedre prognose (ca 16 månder) enn de med blandet (bifasisk) eller sarkomatoid (ca 20 % av MPM, ca 5 måneder median overlevelse) histologi (Brustugun et al., 2021). De få som lever >3 år har som regel mesoteliom av epiteloid type. Malignt mesoteliom kan vokse inn i lungeparenkym, perikard, og gjennom diafragma inn i abdominalhulen. Sykdommen har en spesiell tendens til å vokse ut i stikkanaler etter biopsi eller pleuravæsketapping, og kan gi smertefulle implantasjonsmetastaser.
Arbeidsmedisinsk vurdering
Sist faglig oppdatert: 31.10.2024
Ved sannsynliggjort sammenheng mellom yrkesmessig asbesteksponering og sykdommen er pasienten berettiget til ytelser etter folketrygdlovens § 13 og Lov om yrkesskadeforsikring. NAV behandler vanligvis saker om mesoteliom meget raskt når pasienten har rettet krav om yrkesskadeerstatning og avgitt opplysninger om asbestbruk i arbedislivet, og diagnosen er bekreftet ved epikrise eller liknende. Noen særskilt vurdering i form av spesialisterklæring fra yrkesmedisiner er normalt ikke nødvendig. Det er viktig å informere at pasienten selv må sette i gang prosessen med å kreve yrkesskadeytelser fra trygd og arbeidsgivers forsikring. Dersom dette gjøres først etter pasientens død bortfaller vanligvis retten til erstatning.
Diagnostikk
Sist faglig oppdatert: 31.10.2024
Det er viktig å kombinere sykehistorie, yrkeseksposisjon, klinisk undersøkelse, radiologi og patologi i diagnostikken av malignt mesoteliom. Ordinær røntgen toraks kan gi mistanke om mesoteliom.
Anbefalt utredning av MPM for diagnostikk og stadium er (Hallifax, Talwar, Wrightson, Edey, & Gleeson, 2017; A. Patel et al., 2021)
- CT toraks og abdomen med kontrast er basis for utredningen. For å oppnå tilstrekkelig kontrastoppladning i pleura anbefales venøs kontrastfase. CT skal kartlegge lokal utbredning av primærtumor, og evt tilstedeværelse av patologiske lymfeknuter og/eller fjernmetastaser
- Cytologi fra pleuraeffusjon. NB! Ofte negativ tross MPM-årsak. NB! Diagnosen kan ikke baseres på cytologi alene.
- Pleural biopsering. Anbefales torakoskopisk siden metoden tillater undersøkelse av pleura og tumorekstensjon med multiple dype og store biopsier. Gir best diagnostisk nøyaktighet.
Grundig initial stadieinndeling er essensiell for videre vurdering mht. både prognose og hensiktsmessig behandling. Det er vesentlig å subtype mesoteliom i epiteloid, bifasisk eller sarkomatoid type, siden dette har prognostisk betydning, og kan også ha betydning for behandlingsvalg (Brcic & Kern, 2020).
Løselig mesothelin-relatert peptid i serum (SMRP) kan ev. undersøkes; nivåene kan korrelere med sykdomsstatus (Hollevoet et al., 2012).
Se for øvrig kapittel 6.9.6 for histopatologisk diagnostikk av MPM.
TNM-8 klassifisering for malignt mesoteliom
Sist faglig oppdatert: 31.10.2024
Stadium | Forklaring |
|---|---|
T1 | Tumor limited to the ipsilateral parietal ± visceral ± mediastinal ± diaphragmatic pleura |
T2 | Tumor involving each of the ipsilateral pleural surfaces (parietal, mediastinal, diaphragmatic, and visceral pleura) with at least one of the following features: •involvement of diaphragmatic muscle •extension of tumor from visceral pleura into the underlying pulmonary parenchyma |
T3 | Describes locally advanced but potentially resectable tumor. Tumor involving all of the ipsilateral pleural surfaces (parietal, mediastinal, diaphragmatic, and visceral pleura) with at least one of the following features:
|
T4 | Describes locally advanced technically unresectable tumor. Tumor involving all of the ipsilateral pleural surfaces (parietal, mediastinal, diaphragmatic, and visceral pleura) with at least one of the following features:
|
N1 | Metastases in the ipsilateral bronchopulmonary, hilar, or mediastinal (including the internal mammary, peridiaphragmatic, pericardial fat pad, or intercostal lymph nodes) lymph nodes |
N2 | Metastases in the contralateral mediastinal, ipsilateral, or contralateral supraclavicular lymph nodes |
M1 | Distant metastasis present |
Stadium | N0 | N1 | N2 |
|---|---|---|---|
T1 | IA | II | IIIB |
T2 | IB | II | IIIB |
T3 | IB | IIIA | IIIB |
T4 | IIIB | IIIB | IIIB |
M1 | IV | IV | IV |
Anbefaling - Utredning av mesoteliom:
- Malignt pleuralt mesoteliom mistenkes ved pleuraeffusjon, pleural fortykkelse og samtidig brystsmerter.
- CT toraks med kontrast er basis for diagnostikk og staging.
- For videre cyto-/histologisk diagnostikk gjøres aspirering for cytologi, og pleural biopsering (helst torakoskopisk).
- Histologisk bekreftelse av diagnosen må etterstrebes. Siden negativ cytologi/pleural biopsi ikke utelukker mesoteliom bør videre utredning gjøres.
- Ved vurdering for kurativ behandling skal PET/CT utføres. I en ikke-kurativ situasjon er det ikke indikasjon for PET/CT, med mindre dette er ønskelig før biopsi, for mer sannsynlig å få representativ prøve.
Multimodal behandling i forbindelse med kirurgi av mesoteliom
Sist faglig oppdatert: 31.10.2024
Alternativer for behandling med kurasjonsmål av mesoteliom er kombinasjonen kjemoterapi, kirurgi, og/eller strålebehandling. Kirurgi alene er i praksis ikke aktuelt (Kantor & Wakeam, 2021). Det er essensielt at pasienten gjennomgår en grundig utredning, og behandles av adekvat kompetent tverrfaglige team.
Kjemoterapi gis neoadjuvant i håp om å nedstage tumor før kirurgi. Postoperativ stråleterapi er kun anbefalt der et er sikkert gjenværende tumorvev (forutsatt at lite lungevolum må bestråles). Kirurgien skal gjøres på grundig selekterte pasienter av erfarne torakskirurger (del av multidisiplinære team) som ledd i en klinisk studie (Stahel, Weder, Lievens, Felip, & Group, 2010).
Kirurgi
Sugerbaker et al publiserte i 1999 resultater fra 176 pasienter operert med ekstrapleural pneumektomi (EPP, en-bloc reseksjon av involvert pleura, lunge, ipsilateral diafragma, og ofte perikard) for MPM (Sugarbaker et al., 1999). Blant de som overlevde peroperativt (30 dager) var median overlevelse 19 mnd og 5-års overlevelse 15 %. I en undergruppe (n=31) med MPM stadium I av epiteloid type og frie reseksjonsrender var 5-års overlevelsen 46 %.
I 2011 ble det publisert en liten randomisert britisk studie som vurderte gjennomførbarhet av radikal kirurgi med EPP som del av trimodal terapi (Treasure et al., 2011). Femti pasienter ble etter neoadjuvant cisplatinbasert kjemoterapi randomisert til henholdsvis EPP eller ingen EPP. Median overlevelse viste seg å være dårligere i EPP armen (14.4 versus 19.5 mnd). Dette er en liten studie med spesielt to svakheter: 1) EPP ble gjennomført hos kun 67 % av pasienter randomisert til EPP-armen; 2) I alt 12 sykehus deltok i studien, dette gir kun 1,3 EPP-inngrep i snitt per sykehus. Valg av kirurgi for MPM er kontroversielt, spesielt siden data fra adekvate randomiserte studier ikke finnes (Kantor & Wakeam, 2021).
I MARS 2-studien ble 335 pasienter randomisert til pleural dekortikering eller cytostatika alene (E. Lim et al., 2024). Studien viste at pasienter som ble operert hadde flere komplikasjoner og pasientene som gjennomgikk kirurgi hadde en kortere median totaloverlevelse; 19,3 mndr mot 24,8 mndr for de som kun mottok kjemoterapi (p = 0,019). Studien har møtt en del kritikk (Grosso, Cerbone, & Curioni-Fontecedro, 2024), og det synes derfor riktig å fortsatt henvise selekterte pasienter til Rigshospitalet i København hvor man tilbyr partiell pleurektomi og dekortikering som må oppfattes å være tumorreduserende ikke-kurative inngrep. Dette senteret har vært Skandinavisk kompetansesenter for kirurgisk behandling av malignt mesoteliom siden 2003.
Seleksjon for henvisning til Rigshospitalet, København
Neoadjuvant kjemoterapi gis med inntil 6, men helst kun 3 kurer platinum-/pemetreksed-kombinasjon. PET/CT bør være gjort både ved behandlingsstart og etter 3 kurer. For mange kurer øker risiko for fibrosering som gjør pasienten teknisk inoperabel. Følgende kriterier må være oppfylt før operasjon ansees aktuelt:
- God allmenntilstand (ECOG 0-1)
- Epiteloid histologi og blandingstype (max 50 % sarkomatoid type)
- Ingen tegn på fibro-toraks med volumtap på syk side bedømt på CT.
- Lokalisert sykdom bedømt ved PET/CT: T1/T2N0 eventuelt begrenset T3 affeksjon etter 3-6 induksjonskurer pemetreksed/cisplatin.
- Alder < 75 år
- Adekvat kardiopulmonal funksjon (ingen angina, EF > 35 % (evt normal ekkokardiografi ved EF < normalnivå), FEV1 og DLCO >40 %)
Henvisning til København for kirurgi
De medisinske seleksjonskriterier må være oppfylt (se over). Pasienter som er potensielt operable kan henvises til København for vurdering ved oppstart neo-adjuvant kjemoterapi.
Spesifikk søknad om behandling i utlandet med økonomisk garanti må innhentes fra Utenlandskontoret innen hvert RHF legges ved henvisning inkl radiologi, og sendes:
Lungevisitationen afsnit 2152 (Kirurg Jesper Ravn)
Thoraxkirurgisk afdeling RT
Rigshospitalet
København DK
FAX 0045 35452182
Operativt inngrep
Preoperativt (i København) utføres mediastinoskopi for å utelukke N2-sykdom.
Partiell pleurektomi og dekortikering er teknisk og anestesiologisk vanskelig og tar 4 - 5 timer. Gjennomsnittslig postoperativ liggetid er 12 dager (luftlekkasje er vanlig problem), og ca 3 % må reopereres pga diafragmaruptur eller blødning.
Postoperativt opplegg
Første kontroll gjøres hos henvisende avdeling, og kontroll med CT anbefales hver 4. måned de første to år, deretter individuelt opplegg. Rigshospitalet i København kan gi spesifikke individuelle anbefalinger.
Postoperativ strålebehandling
Postoperativ strålebehandling er kun anbefalt der det er sikkert gjenværende tumorvev og der kun et lite lungevolum må bestråles. Kirurg vil i slike tilfelle ha markert aktuelt område med klips. Anbefalt postoperativ stråledose er 2 Gy x 25 fraksjoner.
Adjuvant kjemoterapi
Ingen randomiserte studier har undersøkt nytten av neoajuvant versus adjuvant kjemoterapi. I tre fase 2 studier (n=60-77) av trimodal behandling av MPM fant en at gjennomførbarheten av neoadjuvant cisplatinbasert kombinasjonskjemoterapi var god hos en stor andel av pasientene (de Perrot et al., 2009; Krug et al., 2009; Weder et al., 2007). I en systematisk oversikt over 32 av 58 relevante studier, fant en at pasienter med MPM profiterte på radikal kirurgi, spesielt i kombinasjon med neoadjuvant eller adjuvant kjemoterapi og adjuvant stråleterapi (Cao, Yan, Bannon, & McCaughan, 2010).
Det anbefales at pasienter som vurderes for kirurgi behandles med 3-6 kurer platinum-pemetreksed kjemoterapi neoadjuvant, og ved god toleranse og effekt kan også to adjuvante kurer vurderes.
Anbefaling - kirurgi av mesoteliom
- Kirurgi er kun aktuelt ved god allmenntilstand (ECOG 0-1), mindre enn 50 % sarkomatoid histologi og T1-3N0
- Neoadjuvant og evt adjuvant platinum/pemetreksed-kombinasjonskjemoterapi bør tilbys pasienter som vurderes for radikal kirurgi.
- I Skandinavia henvises disse pasientene til Onkologisk avd, Rigshospitalet, København for endelig utredning og kirurgi. Henvisning bør sendes ved oppstart neoadjuvant kjemoterapi.
- Stråleterapi skal ikke gjøres rutinemessig etter pleurektomi/dekortikasjon. Ved sikker gjenværende tumorrest, markert med klips, bør stråling vurderes med dosering 2 Gy x 25.
Strålebehandling
Sist faglig oppdatert: 31.10.2024
Strålebehandling mot toraksvegg
Torakal strålebehandling kan være effektiv symptomlindrende behandling, spesielt ved smerter (nerveaffiserende metastaser) eller for å forebygge obstruktive symptomer. Varighet av stråleeffekten er om lag 5 mnd ved fraksjonering 3 Gy x 10 (Bissett, Macbeth, & Cram, 1991). Diffuse metastaser som kler hele pleurahulen vil profitere lite på strålebehandling pga volum, og stråling mot store lungefelt vil dessuten gi betydelig risiko for pneumonitt (Holsti et al., 1997).
Ved langsom progresjon og et langt forventet sykdomsforløp (epiteloid histologi) kan det vurderes å gi normofraksjonert stråleterapi til totaldose 40-50 Gy.
For øvrig benyttes i hovedsak hypofraksjonert strålebehandling (Dirk De Ruysscher & Slotman, 2003), men optimal stråledose er uavklart (van Thiel, Surmont, & van Meerbeeck, 2011; Waite & Gilligan, 2007). Til pasienter i rimelig god allmenntilstand anbefales generelt fraksjonering 4 Gy x 5 eller 3 Gy x 10-13. Ved svekket allmenntilstand og kort forventet levetid vil man tilby en engangsfraksjon på 8 Gy.
Anbefaling - Palliativ behandling mesoteliom:
- Palliativ strålebehandling bør tilbys ved smertefulle lokale områder i toraks eller for å hindre obstruktive symptomer.
- Ved langsom progresjon der en forventer et langt sykdomsforløp (epiteloid histologi) kan det vurderes gitt 4 Gy x 5 eller 3 Gy x 10-13, evt normofraksjonert stråleterapi til 40-50 Gy.
- Ved kort forventet levetid anbefales hypofraksjonert behandling 8 Gy x 1.
Profylaktisk strålebehandling mot stikkanaler
Implantasjonsmetastaser etter transtorakale prosedyrer som biopsi og pleuratapping er et hyppig problem (20-40 %) ved MPM. Randomiserte studier har ikke påvist redusert frekvens av implantasjonsmetastaser mellom pasienter som fikk strålebehandling (10 Gy x1 eller 7 Gy x3) mot innstikkstedet versus ubehandlete pasienter (Bydder et al., 2004; O'Rourke et al., 2007).
Anbefaling - Profylaktisk strålebehandling mot stikkanaler:
- Profylaktisk strålebehandling mot stikkanaler anbefales ikke som rutinebehandling.
Medikamentell behandling
Sist faglig oppdatert: 31.10.2024
Kjemoterapi
Kjemoterapi alene er anbefalt til pasienter med teknisk eller medisinsk inoperabel MPM. Pasienter med sarkomatoid histologi har lave responsrater og kortvarig effekt av kjemoterapi, som vist i kontrollarmen i CheckMate 743-studien (Baas et al., 2021; Ellis et al., 2006; Kelly, Sharon, & Hassan, 2011).
Randomiserte studier har vist at cisplatin eller karboplatin kombinert med et antifolat (pemetreksed eller raltitreksed) øker responsrate og median overlevelse (12,1 og 11,4 mnd) signifikant sammenlignet med cisplatin alene (9,3 og 8,8 mnd) (van Meerbeeck et al., 2005; Vogelzang et al., 2003). Karboplatin gir tilsvarende effekt som cisplatin (O'Brien, Watkins, et al., 2006; Santoro et al., 2008).
En randomisert fase III-studie sammenlignet standard-kombinasjonen cisplatin og pemetreksed med cisplatin og pemetreksed pluss bevacizumab (15 mg/kg) hver 3. uke i inntil seks sykluser + evt bevacizumab vedlikehold til progresjon eller bivirkninger (Zalcman et al., 2016). Totaloverlevelse var signifikant bedre i bevacizumab-armen (18,8 vs 16,1 mndr), men denne behandlingen medførte noe mer grad 3-4 bivirkninger (71 % vs 62 %). Spesielt for yngre pasienter i god allmenntilstand kan kombinasjonen cisplatin/pemetreksed/bevacizumab være et godt alternativ.
En randomisert studie på umiddelbar versus forsinket kjemoterapi ved symptomdebut fra mesoteliom viste en signifikant lengre overlevelse ved raskt oppstart av behandling (O'Brien, Watkins, et al., 2006).
Det foreligger så langt ingen klar anbefaling om andrelinjes cytostatikabehandling ved mesoteliom, og dersom det er tilgjengelige studier bør pasientene vurderes henvist for dette. Fase II-studier viser aktivitet av f. eks. vinorelbine, gemcitabin og gemcitabin pluss ramucirumab. De to førstnevnte er mest aktuelle dersom man hos utvalgte pasienter ønsker å forsøke cytostatika-behandling ved residiv.
Immunterapi
Det er vist i flere studier at immunterapi har effekt ved mesoteliom, selv om effekten er begrenset for flertallet. En stor fase 3-studie randomiserte 605 ubehandlede pasienter med ikke-operabelt pleuralt mesoteliom til enten nivolumab (3 mg/kg hver 2. uke) og ipilimumab (1 mg/kg hver 6. uke) i inntil 2 år, eller standard kjemoterapi med inntil 6 sykler med platinum og pemetreksed (Baas et al., 2021). Etter en median oppfølgningstid på 30 måneder ble det påvist signifikant lengre overlevelse hos pasientene som ble behandlet med immunterapi (median 18,1 mndr mot 14,1 mndr). I begge gruppe ble grad 3-4 bivirkninger rapportert hos ca 30 %. Overlevelsesforskjellen var mest markert hos pasienter med non-epitelioid subtype, på grunn av begrenset effekt av cellegift i denne gruppen (median overlevelse med cellegift var 8,8 mndr, mot 18,1 mndr i gruppen som fikk immunterapi). Kombinasjonen ipilimumab/nivolumab ble vurdert av Beslutningsforum 19.6.23 med følgende konklusjon:
«1. Nivolumab (Opdivo) i kombinasjon med ipilimumab (Yervoy) innføres ikke til førstelinjebehandling av voksne pasienter med ikke-resekterbar malignt pleuralt mesoteliom.
2. Prisen for kombinasjonen er for høy i forhold til dokumentert klinisk nytte.
3. Sykehusinnkjøp bes gjenoppta forhandlingene med leverandør.»
Videre viser en annen fase III-studie at pembrolizumab pluss platinum/pemetrexed er mer effektivt enn platinum/pemetrexed alene, men overlevelsesgevinsten er begrenset (17.3 vs. 16.1 måneder). Pembrolizumab er også studert i andre linje i en fase III-studie Popat et al., 2020). Her ble 144 pasienter randomisert mellom kjemoterapi (gemcitabin eller vinorelbin) eller pembrolizumab, og studien viste ingen forskjell i verken på PFS eller OS.
I en fase III-studie ble 332 pasienter med progresjon etter kjemoterapi randomisert til enten nivolumab eller placebo. Man fant signifikant forlenget tid til progresjon (3,0 mndr mot 1,8 mndr) og totaloverlevelse (10,2 mndr mot 6,9 mndr) hos pasienter som fikk nivolumab (Fennell et al., 2021). Gevinsten er i samme størrelsesorden som ved residiv av ikke-småcellet lungekreft og behandlingen var godt tolerert. Nivolumab anses også som et bedre alternativ enn mer cytostatika fordi mange pasienter ofte har trøttet ut beinmargen etter førstelinjes behandling, noen pasienter oppnår langvarig sykdomskontroll og det er antydningsvis også effekt ved non-epiteliod histologi. Behandlingsforsøk med dette vil betinger positiv beslutning etter søknad til fagdirektør siden metoden foreløpig ikke har vært oppe til vurdering i Beslutningsforum.
Anbefaling - medikamentell behandling av mesoteliom
- Pasienter i rimelig god allmenntilstand (ECOG 0-2) bør behandles med førstelinjes kombinasjonskjemoterapi 4-6 kurer cisplatin/karboplatin og pemetreksed ev. med tillegg av bevacizumab inntil progresjon eller uønsket toksistet.
- Monoterapi med pemetreksed kan også velges ved kontraindikasjon for platinum eller om det oppstår behandlingsrelaterte plager som tilsier seponering av cisplatin/karboplatin.
- Oppstart av kjemoterapi bør ikke forsinkes, og vurderes oppstartet før debut av symptomer. Det er bedre effekt og lengre overlevelse ved tidlig oppstart.
- Nivolumab monoterapi anses som et godt alternativ dersom residivbehandling er aktuelt. Ev. kan man forsøke monoterapi med vinorelbin eller gemcitabin.
- Inklusjon i kliniske studier kan være aktuelt.
Pleurodese
Sist faglig oppdatert: 31.10.2024
Mange pasienter med MPM opplever symptomgivende pleuraeffusjon med betydelig dyspné. Pleurodese har derfor lenge vært anbefalt som en prosedyre som gjøres tidlig i pasientforløpet for å oppnå best mulig lindring, og samtidig færrest mulig stikkanalresidiv. Det er en trend mot mer vellykket pleurodese ved valg av torakoskopisk drenasje, men denne prosedyren er mer smertefull enn om det velges ordinært pleuradren for pleurodese. Ved bruk av pleuradren er responsraten noe lavere, men ikke av stor betydning. Det synes å være best dokumentasjon ved bruk av Steril Talkum (Scherpereel et al., 2010). Drenet stenges av i 60 minutter og seponeres etter 24-48 timer når væskeproduksjonen er under 250 ml/døgn (P. Shaw & Agarwal, 2004).
Anbefaling - Pleurodese ved mesoteliom:
- Pleurodese bør vurderes ved plagsom gjentatt pleuravæske. Oppløst talkum anbefales benyttet.
- Både torakoskopisk og vanlig pleuradreninstallasjon kan benyttes.
Thymus-svulster (C37)
Sist faglig oppdatert: 31.10.2024
Thymus (norsk: brisselen) produserer T-lymfocytter (T for thymus). Den ligger i øvre, fremre mediastinum og består hovedsakelig av epiteliale celler og lymfocytter (G. Anderson & Takahama, 2012). Thymus veier rundt 30 g i tidlig ungdom, og skrumper deretter gradvis inn.
Thymus-svulstene utgjør ca 25-30 % av de mediastinale svulstene, oppstår vanligvis i aldersgruppen 40-80 år, er sjeldne med om lag 5-10 tilfeller pr år i Norge (0,15:100 000), og forekommer litt hyppigere hos menn enn hos kvinner. Svulstene vokser vanligvis langsomt, kan være lokalt infiltrerende og kan metastasere til andre organer.
De epiteliale thymussvulstene deles i tre hovedgrupper: 1) thymom, 2) thymuskarsinom, og 3) nevroendokrine neoplasmer. Andre svulster som kan oppstå i mediastinum er germinalcellesvulster, hematolymfoide svulster og svulster oppstått i ektopisk thyreoidea- og parathyreoidealt vev. Bare thymussvulstene vil bli omtalt her, og det henvises til WHO 2021-klassifikasjonen for beskrivelse av andre mediastinale svulster.
Femårs overlevelse er for thymomer rundt 80 %, mens den er i størrelsesorden 40-60 % for thymus-karsinomer (Filosso et al., 2016; Masaoka, 2010). En tredel av pasientene med thymussvulst har myastenia gravis (Romi, 2011).
Stadieinndeling
Sist faglig oppdatert: 31.10.2024
Tidligere var Masaokas (også kalt Masaoka-Koga) stadieinndeling av thymomer (Tabell 23) den mest brukte (Detterbeck, Nicholson, Kondo, Van Schil, & Moran, 2011), men i WHO 2021-klassifikasjonen anbefales TNM8-klassifikasjonssystemet også for thymomer (se Tabell 24 og Tabell 25).
Stadium | Beskrivelse |
|---|---|
Stadium I | Makroskopisk og mikroskopisk komplett innkapslet |
Stadium II | A) Mikroskopisk transkapsulær invasjon |
B) Makroskopisk invasjon til omgivende fettvev eller adherent til mediastinal pleura eller perikard | |
Stadium III | A) Makroskopisk invasjon i naboorgan, uten invasjon i store kar |
B) Makroskopisk invasjon i naboorgan, med invasjon i store kar | |
Stadium IV | A) Pleural eller perikardiell disseminering |
B) Lymfogen eller hematogen metastasering |
I WHO 2021-klassifikasjonen anbefales TNM8-klassifikasjonssystemet også for thymomer.
Stadium | Beskrivelse | |
|---|---|---|
T1 | a | Komplett eller inkomplett innkapslet, ev. med innvekst i mediastinalt fettvev |
b | Innvekst i mediastinal pleura | |
T2 | Innvekst i perikard | |
T3 | Innvekst i lungevev, v. brachiocephalica, v. cava sup., brystvegg, n. phrenicus, hilære (ekstraperikardielle) lungekar | |
T4 | Innvekst i aorta, buekar, lungearterier, myokard, trakea eller øsofagus | |
N0 | Ingen metastaser til lymfeknuter | |
N1 | Metastaser til anteriore (perithymiske) lymfeknuter | |
N2 | Metastaser til dype intratorakale eller cervikale lymfeknuter | |
M0 | Ingen metastaser til pleura, perikard eller fjernmetastaser | |
M1 | a | Separate pleurale eller perikardielle metastaser |
b | Intraparenkymale lungemetastaser eller fjernmetastaser | |
TNM | Subkategori | N0 | N1 | N2 |
|---|---|---|---|---|
T1 | a | I | IVa | IVb |
b | ||||
T2 |
| II | IVa | IVb |
T3 |
| IIIa | IVa | IVb |
T4 |
| IIIb | IVa | IVb |
M1 | a | IVa | IVa | IVb |
b | IVb | IVb | IVb |
Utredning
Sist faglig oppdatert: 31.10.2024
Diagnostikk og behandlingsstrategi bør foregå i et tverrfaglig samarbeid mellom kirurg, onkolog, radiolog og patolog (Carter, Benveniste, Madan, Godoy, de Groot, et al., 2017). Ved behov skal andre spesialister som nevrologer involveres.
Om lag en tredel av alle thymussvulster blir oppdaget tilfeldig, uten at pasienten har symptomer. Symptomer kan være hoste, brystsmerter, kortpustethet, ødem i overkropp eller svelgvansker. Ca 50 % av thymussvulstene (typisk B-subtypen) produserer antistoff bl.a. mot acetylkolin-reseptor (anti-AChR). Dette gir myastenia gravis, karakterisert ved muskelsvakhet, spesielt i øyemuskulatur (hengende øyelokk). Motsatt finner man hos ca 15 % av myasteni-pasientene en thymussvulst (Romi, 2011). Thymom er også assosiert med andre autoimmune og hematologiske sykdommer, samt immunsvikttilstander (hypogammaglobulinemi, Good syndrom) (Girard et al., 2015).
I tillegg til standard blodprøvesett, kan beta-HCG og AFP inkluderes med tanke på ekstragonadal germinalcelletumor.
Radiologisk utredning inkluderer CT med intravenøs kontrast, som er førstevalg ved utredning av oppfylninger i nivå med thymus. MR toraks og PET/CT kan vurderes for å avklare spesifikke problemstillinger som vurdering av innvekst i naboorganer, eller utredning av mulige fjernmetastaser. MR toraks kan også utføres for å avgjøre om tumor representerer en cyste (Marom, 2013). Dessuten kan MR inn- og ut-av-fase brukes til differensiering mellom normalt thymusvev / thymus-hyperplasi og thymus-neoplasme. Normalt thymusvev og hyperplasi inneholder mikroskopisk fett som vises via inn- og ut-av-fase-MR (Carter, Benveniste, Madan, Godoy, de Groot, et al., 2017).
Differensialdiagnoser omfatter andre svulster som lymfom, kimcellesvulster, og hyppigst metastaser, samt struma, cyster og aortaaneurysmer.
For patologi-diagnostikk av thymussvulster, se "Histopatologisk klassifisering og diagnostikk av malignt mesoteliom" i Histopatologisk diagnostikk.
Myastenia gravis
Sist faglig oppdatert: 31.10.2024
Myasteni bør utredes av nevrolog med blant annet edrofoniumtest (Tensilon) og elektromyografi (EMG). Diagnosen bør bekreftes med påvisning av AChR-antistoff. Antistoff mot titin og RyR hos myastenipasienter yngre enn 60 år tyder på tilstedværelse av thymussvulst, mens fravær av disse antistoffene nærmest ekskluderer et thymusneoplasme (Romi, Skeie, Aarli, & Gilhus, 2000).
Pasienter med thymomassosiert myastenia gravis blir vanligvis ikke helbredet for sin myasteni selv etter komplett reseksjon av thymomet. Videre synes thymomer som er kombinert med myastenia gravis å være mindre aggressive enn thymomer uten myasteni (Fujii, 2011). Preoperativ plasmaferese eller intravenøs immunoglobulinbehandling kan benyttes for å redusere risikoen for postoperativ myasten krise (Romi, 2011).
Pasienter med myasthenia gravis kan få forverrede symptomer ved bruk av jodholdige kontrastmidler og man bør derfor vurdere behovet for kontrast, spesielt hvis pasienten allerede er svært preget av myasteni (Rath et al., 2017).
Patologi
Sist faglig oppdatert: 31.10.2024
Anbefaling - utredning av Thymom
- CT med intravenøs kontrast er førstevalg ved utredning av oppfylninger i nivå med thymus.
- MR toraks og PET/CT kan vurderes for å avklare spesifikke problemstillinger.
- TNM8-klassifikasjonssystemet anbefales også for thymomer.
- Dersom man etter radiologisk diagnostikk og tverrfaglig diskusjon konkluderer med operabilitet, er invasiv preoperativ histopatologisk diagnostikk ikke nødvendig.
- Histologisk undersøkelse av preoperativ nålebiopsi, evt cytologi, supplert med immunhistokjemi er vanligvis tilstrekkelig for diagnose, inkludert subtype.
Kirurgisk behandling
Sist faglig oppdatert: 31.10.2024
Som hovedregel skal alle thymomer fjernes kirurgisk. Det primære behandlingsmål er radikal kirurgisk reseksjon og hovedprinsippet er at hele thymus og omgivende fettvev skal fjernes selv om svulsten kun omfatter en mindre del av organet. Dette gjelder uavhengig om thymomet er ledsaget av myastenia gravis eller annet paraneoplastisk syndrom.
Median sternotomi er den mest benyttede kirurgiske tilgangen for thymektomi. Ved mindre svulster kan inngrepet utføres torakoskopisk.
TNM-8 klassifikasjonen bidrar til en klar inndeling av hvilke thymussvulster som er tilgjengelig for reseksjon (Carter, Benveniste, Madan, Godoy, Groot, et al., 2017). T1–3 ansees resektabelt, mens T4 inkluderer ikke-resektable strukturer. Klassifikasjonen har også en anbefaling om lokoregional lymfadenektomi ved alle typer thymussvulster.
Behandlingsstrategi
Oftest er primær kirurgi å foretrekke, men ved stadium III og IV kan man vurdere preoperativ kjemoterapi, og ev. stråleterapi, dersom det er usikkert om tumor kan fjernes radikalt.
Postoperativ kjemoterapi er sjelden indisert ved thymomer, men kan vurderes ved thymuskarsinom stadium III og IV. Postoperativ stråleterapi kan være indisert, men man må da vurdere nytte vs risko (se under).
TNM stadium | Anbefalt behandlingsstrategi |
|---|---|
I | Kun kirurgi. Strålebehandling kan vurderes ved kontraindikasjoner for kirurgi |
II | Kirurgi. Postoperativ strålebehandling kan vurderes for pasienter med R1- eller R2-reseksjon. Strålebehandling kan vurderes ved kontraindikasjoner for kirurgi. Vurder postoperativ strålebehandling ved tymuskarsinom. |
III | Kirurgi. Preoperativ kjemoterapi, eventuelt stråleterapi, dersom det er usikkert om tumor kan fjernes radikalt. R0/R1: Vurder postoperativ strålebehandling. Drøft fordeler/ulemper med pasienten. R2: Vurder postoperativ radiokjemoterapi. Radiokjemoterapi vurderes ved ikke-resektable svulster. Vurder postoperativ strålebehandling og kjemoterapi ved tymuskarsinom. |
IVa | Kirurgi, hvis mulig etter preoperativ kjemoterapi. R0/R1: Vurder postoperativ strålebehandling. Drøft fordeler/ulemper med pasienten R2: Vurder postoperativ radiokjemoterapi Vurder postoperativ strålebehandling ved tymuskarsinom og kjemoterapi dersom det ikke er gitt preoperativt |
IVb | Kjemoterapi. |
Dersom det ikke er mulig med radikal reseksjon av et thymom (WHO grad B1 eller lavere) er det rapportert at inkomplett reseksjon (debulking) kan bedre overlevelse (Falkson et al., 2009).
Ved residiv anbefaler Fujii at det skal opereres dersom residivet ser ut til å kunne fjernes kirurgisk (Fujii, 2011).
Anbefaling - kirurgi av Thymom
- Som hovedregel skal alle thymomer fjernes kirurgisk.
- Oftest er primær kirurgi å foretrekke, men ved stadium III og IV kan man vurdere preoperativ kjemoterapi, og ev. stråleterapi, dersom det er usikkert om tumor kan fjernes radikalt.
Onkologisk behandling
Sist faglig oppdatert: 31.10.2024
For radikalt opererte stadium III-IV kan postoperativ stråleterapi vurderes, men evidensgrunnlaget for dette er tynt (Komaki & Gomez, 2014). Sannsynlighet for økt lokal kontroll kan være til stede, men hjertetoksisitet må tas med i vurderingen, spesielt om hjertetoksisk kjemoterapi som antrasykliner benyttes. Det er ikke endelig vist at postoperativ stråleterapi øker totaloverlevelsen, men ikke-randomiserte studier har likevel antydet at dette kan gi overlevelsesgevinst etter radikal operasjon for thymuskarsinom (Ruffini et al., 2014). Thymomer, selv i stadium IV, har ofte et indolent forløp, og 5-års totaloverlevelse er rundt 65 % (men kun halvparten av denne mortaliteten kan tilskrives thymomet) (Huang, Detterbeck, Wang, & Loehrer, 2011). På basis av dette synes det rimelig å anbefale utelatelse av stråleterapi i slike situasjoner, men diskutere problemstillingen åpent med pasienten. Dersom bestråling gjennomføres, skal den preoperative tumorutbredelsen inkluderes i det kliniske målvolumet (CTV), men ikke normalt utseende («elektive») lymfeknuter. Aktuell stråledose er 2 Gy x 25, og oppstart innen 3 måneder. Total hjertedose bør være < 30 Gy. Postoperativ stråleterapi vil ikke være aktuelt ved R0 stadium I-II.
Ved ikke-radikalitet (R1-R2) etter kirurgi er det større grunnlag for postoperativ bestråling, men det er heller ikke her klarlagt om dette øker overlevelsen (Huang et al., 2011). Spesielt aktuelt kan det være ved R2 og thymuskarsinom, og her kan man vurdere konkomitant kjemoradiasjon (2 Gy x 30 med cisplatin-holdig kjemoterapi, eksempelvis samme PV-regime som benyttes ved stadium III ikke-småcellet lungekreft). Slik adjuvant behandling bør igangsettes innen 3 måneder etter operasjonen.
Ved store, primært inoperable svulster kan neoadjuvant behandling med kjemoradiasjon vurderes (Huang et al., 2011). Det blir da anbefalt cisplatin-holdig kjemoterapi, så PV-kurer kombinert med 2 Gy x 25 kan være et alternativ også her (Korst et al., 2014). Dersom fortsatt inoperabel etter denne stråledose, kan man vurdere å gå opp til totalt 60-66 Gy, under forutsetning av tilfredsstillende hjertedose. Debulking kan være et alternativ i selekterte tilfeller av thymom etter kjemoterapi, hvor en for eksempel ønsker å gjøre ev. øvrige restlesjoner tilgjengelig for definitiv strålebehandling, men er ikke ansett aktuelt ved thymus-karsinomer (Hamaji et al., 2015).
For pasienter med thymuskarsinom er indikasjonen for postoperativ strålebehandling sterkere enn for thymom, og bør vurderes spesielt etter kirurgi ved R0 reseksjon ved stadium III og IVa. For stadium II kan postoperativ strålebehandling vurderes ved R1 eller R2 reseksjon. Adjuvant kjemoterapi kan vurderes etter kirurgi ved stadium III og neoadjuvant kjemoterapi er anbefalt ved stadium IVa (Falkson et al., 2022).
Anbefaling - adjuvant behandling av thymom
- Postoperativ strålebehandling bør vurderes ved thymuskarsinomer, og ved ikke-radikalt opererte thymomer.
- Ved R0-R1 gis 2 Gy x 25, mens ved R2 gis 2 Gy x 30 med konkomitant kjemoterapi.
- Neoadjuvant kjemoradioterapi kan vurderes ved primært inoperable svulster.
- Postoperativ kjemoterapi kan vurderes ved tymuskarsinomer i stadium III.
Ikke-kurativ behandling
Ved avansert sykdom eller metastaser kan cisplatin-holdig kjemoterapi forsøkes, og de fleste vil også inkludere et antrasyklin (Wei et al., 2013). En rekke regimer er forsøkt, men siden det ikke foreligger randomiserte studier kan man ikke anbefale ett regime over et annet. I Norge har man bl.a. benyttet EDP-kurer (etoposid, doksorubicin og cisplatin), men det såkalte ADOC-regimet (doksorubicin, cisplatin, vinkristin og syklofosfamid) er også en kombinasjon som er brukt internasjonalt, alternativt uten vinkristin. Siden antrasykliner er hjertetoksisk, bør man vurdere å utelate dette om strålebehandling som involverer hjertet er gitt. Standard PV-kurer kan da være et alternativ. CT-basert evaluering bør gjøres etter 3 kurer, og antall kurer bestemmes av respons, toksistet, og ev. kumulativ kardiotoksisk dose for antrasykliner.
Immunterapi med PD-1/PD-L1-hemmere ser ut til å gi betydelig bivirkningsrisiko, spesielt ved thymom type A, B og AB, og pasienter bør være godt informert om dette før eventuell oppstart. Ved progredierende thymuskarsinom der andre behandlingsmuligheter er uttømt, bør dette kunne forsøkes (J. Cho et al., 2018; Jakopovic et al., 2020; Zhao & Rajan, 2019).
Ved residiv kan monoterapi med pemetreksed (500 mg/m2 hver 3. uke) eller paklitaksel (175 mg/m2 hver 3. uke) forsøkes (Berardi et al., 2014). Det er også rapportert at thymus-svulster som viser opptak ved oktreotid-scan har hatt effekt av subkutant oktreotid sammen med prednisolon. Responser var sett hos 12 av 38 pasienter (32 %), men alvorlige bivirkninger var hyppige (grad 4/5 hos 21 %) (Loehrer et al., 2004). Det er også lovende studier med antistoff-basert terapi, blant annet mot insulin-lignende vekstfaktor (Rajan et al., 2014).
Palliativ strålebehandling, inkludert stereotaksi, er aktuelt ved metastaser. Siden sykdommen kan ha et indolent forløp kan høyere stråledoser enn de man benytter ved lungekreft være fornuftig.
Molekylærpatologiske analyser er foreløpig ikke etablert del av diagnostikken. Det er likevel kasuistiske meddelelser og små ikke-randomiserte studier om genetiske aberrasjoner og tilhørende terapieffekter, slik at det kan vurderes å rekvirere slike analyser (f.eks. EGFR- og BRAF-mutasjonsbestemmelse) om annen terapi ikke er aktuell (Berardi et al., 2014).
EDP-kur
Behandlingsdag | Stoff | Dose |
|---|---|---|
Dag 1 | Doksorubicin | 40 mg/m2 iv |
Dag 2 | Etoposid | 100 mg/m2 iv |
Dag 3 | Etoposid | 100 mg/m2 iv |
Cisplatin | 40 mg/m2 iv | |
Dag 4 | Etoposid | 100 mg/m2 iv |
Cisplatin | 40 mg/m2 iv | |
Ny kur dag 29 | ||
ADOC-kur
Behandlingsdag | Stoff | Dose |
|---|---|---|
Dag 1 | Doksorubicin | 40 mg/m2 iv |
Cisplatin | 50 mg/m2 iv | |
Dag 2 | Ingen behandling | |
Dag 3 | Vinkristin | 0,6 mg/m2 iv |
Dag 4 | Syklofosfamid | 700 mg/m2 iv |
Ny kur gis dag 29. Obs! Ingen kjemo dag 2 | ||
Oppfølging
Sist faglig oppdatert: 31.10.2024
Etter radikaloperasjon med frie reseksjonsrender (R0) av stadium I/II-svulster er prognosen svært god, med 10-årsoverlevelse fra 70-90 % for thymomer, lavere for thymuskarsinomer (Masaoka, 2010). Men residiver kan komme etter lang tid, spesielt gjelder dette thymomer. Pasienter med inoperabel sykdom som har gjennomgått onkologisk behandling bør også følges regelmessig, og kan f.eks. vurderes for stereotaktisk stråleterapi mot metastaser. Gitt sykdommens sjeldenhet vil det trolig være fornuftig med en viss sentralisering også av kontrollvirksomheten.
Anbefaling - oppfølgning etter behandling for thymom
- De første 2 år anbefales halvårlig CT-undersøkelse med kontrast, deretter årlig i minimum totalt 5 år for thymuskarsinomer og i minimum 10 år for thymomer.
Komplikasjoner ved lungekreft og øyeblikkelig hjelp-situasjoner
Sist faglig oppdatert: 31.10.2024
Dette kapittel omtaler fire vanlige onkologiske hastesituasjoner som særlig rammer pasienter med lungekreft.
- Kompresjon av vena cava superior (VCSS), Stokes krage
- Kompresjon av sentrale luftveier
- Malign medullakompresjon
- Hyperkalsemi
Alle disse kliniske situasjoner krever rask medisinsk behandling, og det vil ikke alltid være mulig å stille en sikker diagnose før behandlingsstart (Walji, Chan, & Peake, 2008).
Intervensjoner i ulike øyeblikkelig hjelp situasjoner forutsetter følgende overveielser:
Ved kjent lungekreftdiagnose fra tidligere:
Dersom residiv/progresjon skjer mindre enn 2 år etter tidligere behandling av lungekreft, vil man kunne basere akuttbehandlingen på tidligere kjent histologi.
Ved ikke kjent lungekreftdiagnose:
Mistanken om underliggende lungekreft er større dersom pasienten har røykeanamnese og andre røykerelaterte sykdommer som KOLS og emfysem, samt høy alder.
Følgende karakteristika kan være veiledende i vurderingen av type lungekreft:
- SCLC: Sentral tumor, betydelig N2/N3, høy NSE eller proGRP
- ikke-småcellet lungekreft: Sentral eller perifer tumor, mindre grad av N2/N3, oftest normal NSE og proGRP
Vena cava superior syndrom (VCSS) - Stokes krage
Sist faglig oppdatert: 31.10.2024
Malign sykdom er årsak til mer enn 90 % av alle VCSS. Den venøse drenasjen av hode, hals, øvre toraks og armer foregår via vena cava. Selv om årens diameter er stor er veggene tynne og komprimeres lett. Det betyr at svulster som oppstår i mediastinum og øvre mediale del av høyre lunge lett kan komprimere vena cava. En gradvis/langsom avklemming medfører utvikling av kollateraler slik at det venøse blodet finner alternative veier. En raskere tumorvekst, derimot, gir ikke like stor kollateraldannelse. Pasienten får sine symptomer når den venøse blodsirkulasjonen, tross kollateraler, ikke er adekvat. Syndromet er hyppigere ved SCLC enn ikke-småcellet lungekreft. VCSS finnes på diagnosetidspunktet hos 10 % av SCLC pasientene, mot 1,7 % hos ikke-småcellet lungekreft-pasientene. Av alle med VCSS har 70-75 % lungekreft (L. D. Wilson, Detterbeck, & Yahalom, 2007).
Symptomer
Det er vanlig med ødem i ansikt, på hals og ut over armene. De aller fleste pasienter har dyspné, takypné og hoste. Mange pasienter har økt kartegning på brystet (kollateraler). Noen får Horners syndrom med ensidig miose, ptose, enopthalmus og nedsatt svettesekresjon i ansiktet. Hodepine og synsforstyrrelse kan være tilstede. Brystsmerter og svelgbesvær er også nokså vanlig. Pasienten kan også ha kompresjon av sentrale luftveier med dyspné/stridor som ledsagende symptom.
Diagnostikk
Det er viktig med rask klinisk undersøkelse og uredning med CT toraks. Hvis mulig bør histologi/cytologi sikres (bronkoskopi, lymfeknutebiopsi eller lignende) før behandlingsstart. Adekvat staging er viktig for å vurdere om f.eks. SCLC kan være i begrenset stadium og dermed aktuell for kurativ behandling.
Behandling
Pasienter med vena cava superior syndrom kan ha behov for rask behandling for å unngå sirkulasjonsvikt til vitale organer. Pasienten skal opp i sittende stilling og administreres O2 etter behov. Det startes med høydose deksametason (4 mg x 4, eller 8 mg x 2) eller metylprednisolon (Medrol 16 mg x 4).
Med unntak av helt livstruende situasjon er det er viktig at pasienter utredes som vanlig mht. mulighet for potensiell kurativ behandling før evt. onkologisk behandling startes. Stenting kan gi rask symptomlindring dersom pasienten ikke responderer på steroider.
Ved bekreftet eller mistenkt SCLC gis primær kjemoterapi og ev. immunterapi dersom pasienten er kjemonaiv. Ved kjemoresistent SCLC, ukjent histologi eller bekreftet ikke-småcellet lungekreft-histologi skal pasienten tilbys øyeblikkelig hjelp stenting av vena cava og/eller strålebehandling (Rowell & Gleeson, 2001). Stenting gjøres forut for strålebehandling ved betydelig klinikk for å oppnå en raskt forbedret blodsirkulasjon i området, deretter gis det strålebehandling. Ved lite symptomer tross betydelige radiologifunn kan strålebehandling gjøres direkte uten forutgående stenting.
Strålefraksjonering ved vena cava superior kompresjon er 3 Gy x 10 eller 2,8 Gy x 15. De to første fraksjonene gis på to påfølgende dager.
Ved avansert sykdom med negative prognostiske faktorer og/eller sykdom utenom toraks kan hypofraksjonert behandling 8,5 Gy x 2 velges (S. Sundstrom et al., 2004).
Anbefaling - vena cava superior-syndrom
- Initialt skal pasienten opp i sittende stilling og administreres O2 etter behov.
- Høydose deksametason (4 mg x 4, 8 mg x2) eller metylprednisolon (16 mg x 4) startes umiddelbart. Protonpumpehemmer som ulcusprofylakse startes samtidig.
- Pasienten bør stadiesettes mtp. mulighet for potensielt kurativ behandling for SCLC.
- Ved bekreftet eller mistenkt SCLC gis primær kjemoterapi og ev. immunterapi dersom pasienten er kjemo-naiv.
- Ved kjemoresistent SCLC, ukjent histologi eller bekreftet ikke-småcellet lungekreft-histologi og betydelige klinisk plager skal pasienten vurderes for øyeblikkelig hjelp stenting av vena cava etterfulgt av strålebehandling.
- Ved lite symptomer tross betydelige radiologifunn kan strålebehandling gjøres direkte uten forutgående stenting.
Kompresjon og okklusjon av sentrale luftveier
Sist faglig oppdatert: 31.10.2024
Tumorforandringer i mediastinum kan også komprimere sentrale luftveier (trakea, bronkier). Vel så ofte vil tumorvekst inne i luftveiene føre til en okklusjon og dermed plagsomme symptomer for pasienten.
Symptomer
Ved kompresjon og obstruksjon av sentrale luftveier vil tumor gi dyspné, stridor, takypné og ofte hoste. Disse symptomene kan ha utviklet seg gradvis og blir ikke sjelden mistolket som en forverring av obstruktiv lungesykdom.
Diagnostikk
Klinisk undersøkelse og utredning med CT toraks. Spirometri med karakteristisk flow-volum kurve kan gi mistanke om sentral obstruksjon. Hvis mulig bør histologi/cytologi sikres (bronkoskopi, lymfeknutebiopsi el). Dersom lymfom er en mulig differensialdiagnose (lav alder, høy LD, normal NSE) er det avgjørende å få en histologisk avklaring, og biopsi/cytologi bør gjøres før oppstart steroider. Som følge av alvorlig, truende dyspné er det viktig med rask behandlingsstart. Adekvat staging er viktig for å vurdere om f.eks. SCLC kan være i begrenset stadium og dermed aktuell for kurativ behandling.
Behandling
Det startes med høydose deksametason (4 mg x 4, eller 8 mg x 2) eller metylprednisolon (Medrol 16 mg x 4). Pasienter som har kjent ikke-småcellet lungekreft eller uavklart histologi bør først vurderes for intervensjonsbronkoskopi med laserbehandling og/eller stenting. Dette gjøres pr i dag på Haukeland universitetssjukehus, Oslo universitetssykehus, Rikshospitalet og St. Olavs hospital. Rekanalisering med krysosonde kan også være et alternativ, dette tilbys bl.a. ved Universitetssykehuset i Stavanger. Deretter gis strålebehandling med oppstart etter få dager. Fraksjonering etter generell sykdomstilstand og målvolumstørrelse, 3 Gy x 10 eller 8,5 Gy x 2 (S. Sundstrom et al., 2004). Pasienter som har kjent SCLC behandles primært med kjemoterapi og ev. immunterapi dersom pasienten er kjemo-naiv. Det kan gis strålebehandling om kjemoterapi ikke er egnet, for eksempel ved nyresvikt eller ved tidligere progresjon på aktuell kjemoterapi.
For pasienter som får residiv i et område som tidligere er eksternt strålebehandlet vurderes intervensjonsbronkoskopi med stenting og/eller laserbehandling. Endobronkial stråleterapi har ikke vist noen effekt utover hhv. Ekstern stråleterapi og laserbehandling (Reveiz, Rueda, & Cardona, 2012).
Anbefaling - kompresjon av sentrale luftveier
- Høydose deksametason (4 mg x 4, 8 mg x2) eller metylprednisolon (16 mg x 4) startes umiddelbart. Protonpumpehemmer som ulcusprofylakse startes samtidig.
- Ved kjent ikke-småcellet lungekreft eller uavklart histologi bør det vurderes intervensjonsbronkoskopi med laserbehandling og/eller stenting, deretter strålebehandling.
- Ved kjent SCLC gis primært kjemoterapi og ev. immunterapi dersom pasienten er kjemo-naiv. Det kan gis strålebehandling om kjemoterapi er kontraindisert.
- Ved residiv i tidligere bestrålt område vurderes intervensjonsbronkoskopi med stenting og/eller laserbehandling.
Malign medullakompresjon
Sist faglig oppdatert: 31.10.2024
Malign medullakompresjon er en tilstandd med kompresjon av medulla spinalis og/eller cauda equina som følge av tumorvekst inn i spinalkanalen og/eller intramedullære metastaser (Ropper & Ropper, 2017). Symptomene kan utvikle seg langsomt i løpet av uker eller akutt i løpet av få dager. Vel 60 % av tilfellene skyldes lunge-, prostata- eller brystkreft. Livskvalitet og prognose endres dramatisk (R. George, Jeba, Ramkumar, Chacko, & Tharyan, 2015).
Symptomer
Redusert kraft og/eller sensibilitet i ekstremiteter, smerter i ryggraden, inkontinens, urinretensjon, svekket koordinasjon.
Diagnostikk
Grundig anamnese inkl. varighet av symptomer er essensielt. Hvor raskt tilstanden har utviklet seg vil påvirke undersøkelser som skal gjøres (MR, evt CT) og behandlingsstrategi. Rask diagnostikk og behandlingstart kan være avgjørende for hvilke funksjoner som kan bevares/bedres siden paralyse som har vedvart over 24 timer sjelden er reverserbar.
Behandling
Det startes med høydose deksametason (4 mg x 4) eller metylprednisolon (Medrol 16 mg x 4) (Kumar et al., 2017; S. Sørensen, Helweg-Larsen, Mouridsen, & Hansen, 1994). Henvisning som øyeblikkelig hjelp til sykehus med multidisplinært team (onkolog, nevrokirurg, ortoped) for vurdering av de ulike behandlingsalternativ. Dersom steroidbehandling gir bedring av symptomene (mindre parese), eller hvis pasienten ikke oppfattes som operabel, velges strålebehandling som primærbehandling med oppstart innen 24 timer (R. George et al., 2015; Patchell et al., 2005).
Valg av fraksjonering avhenger av pasientens allmenntilstand og forventet levetid. For pasienter med forventet levetid på mindre enn seks måneder, anbefales endosert strålebehandling, hvor 8 Gy x 1 er best dokumentert. Slik hypofraksjonert strålebehandling har i randomiserte studier vist å gi samme gevinst når det gjelder fysisk funksjon og smertelindring som mer fraksjonert behandling, men behov for rebestråling forekommer oftere ved singel-fraksjonert behandling.
Randomiserte studier har vist samme funksjonsresultat og overlevelse med 4 Gy x 5 som med 3 Gy x 10 hos pasienter med forventet levetid under 1 år. Ved forventet levetid mellom ½ og 1 år anbefales derfor 4 Gy x 5, mens 3 Gy x10 forbeholdes pasienter med forventet levetid over 1 år. Strålebehandling tilstrebes startet med minimum to påfølgende dager, noe som iblant vil medføre behandling i helg. Ved progresjon av nevrologiske symptomer under pågående strålebehandling, bør man vurdere om nevrokirurg/ortoped skal konsulteres på nytt med hensyn på dekompresjon eller om iverksatt behandling skal avbrytes.
Det vises til Handlingsprogram for palliasjon i kreftomsorgen, og Faglige anbefalinger for lindrende strålebehandling ved lungecancer.
Anbefaling - Malign medullakompresjon:
- Høydose deksametason (4 mg x 4, 8 mg x2) eller metylprednisolon (16 mg x 4) startes umiddelbart. Protonpumpehemmer som ulcusprofylakse startes samtidig.
- Henvisning øhj. til multidisplinært team (onkolog, nevrokirurg, ortoped).
- Ved steroideffekt eller om pasienten er teknisk eller medisinsk inoperabel, velges strålebehandling som primærbehandling.
- Fraksjonering bør velges utfra forventet levetid:
- <6 mndr: 8 Gy x 1
- 6-12 mndr: 4 Gy x 5
- >12 mndr: 3 Gy x 10
- Ved forverring under pågående strålebehandling, bør man vurdere om nevrokirurg/ortoped skal konsulteres på nytt med tanke på kirurgisk dekompresjon eller om iverksatt behandling skal avbrytes.
Hyperkalsemi
Sist faglig oppdatert: 31.10.2024
Hyperkalsemi opptrer hos 1,5 % av alle pasienter med maligne sykdommer, også uten kjente skjelettmetastaser (paraneoplasi). Tilstanden er vanskelig å diagnostisere idet den kan arte seg som generell sykdomsprogresjon. Ubehandlet kan hyperkalsemi være livstruende.
Typiske symptomer
Konfusjon, somnolens, kvalme og brekninger, muskelsmerter, poliuri, tørste, obstipasjon, dehydrering, medtatthet.
Diagnostikk
S-kalsium, albuminkorrigert kalsium, (ev ionisert kalsium), ALP, Na, K, kreatinin.
Differensialdiagnose
Dersom pasientens CNS symptomer ikke bedrer seg under behandlingen, bør MR caput gjøres for å utelukke hjernemetastaser.
Behandling
Rehydrering med 2000 ml NaCl/24t. Etter rehydrering administeres et av bisfosfonatene zoledronsyre (Zometa®) 4 mg, eventuelt pamidronat 90 mg. Biokjemisk respons sees etter 2-4 dager, med laveste verdi 7-10 dager etter bisfosfonat-behandling. 90 % av de som behandles blir normokalsemiske, og effekten opprettholdes i opp til 3 uker. Ved manglende respons kan en ny dose bisfosfonat gis etter 7-10 dager etter forrige dose (Saunders, Ross, Broadley, Edmonds, & Patel, 2004).
Anbefaling - Hyperkalsemi:
- Rehydrering med 2000 ml NaCl/døgn.
- Bisfosfonat i form av zoledronat 4 mg eller pamidronat 90 mg.
- Ved manglende respons kan en ny dose bisfosfonat gis etter 7-10 dager.
Tromboembolisk sykdom hos kreftpasienter
Sist faglig oppdatert: 31.10.2024
Dyp venetrombose og lungeembolisme forekommer jevnlig hos lungekreftpasienter, og anbefales behandlet med direktevirkende orale antikoagulantia (DOAK) som apiksaban, edoksaban eller rivaroksaban (Desai et al., 2020; Li, Garcia, Lyman, & Carrier, 2019). Apiksaban (10 mg x2 første 7 dager, deretter 5 mg x2) oppfattes å ha best dokumentasjon hos lungekreftpasienter basert på den nylig publiserte Caravaggio-studien med 1155 inkluderte kreftpasienter (200 med lungekreft) som hadde en nylig tromboembolisk hendelse. Studien randomiserte mellom apiksaban eller lavmolekylærvekt heparin (LMVH) (Agnelli et al., 2020). Studien konkluderte med lik frekvens av re-trombosering (5,6 % med apiksaban og 7,9 % med dalteparin), og lik frekvens av alvorlig blødning (3,8 % mot 4,0 %). Det er verdt å legge merke til at pasienter med hjernemetastaser ikke var inkludert i studien, og i slike tilfeller kan LMVH vurderes brukt. Antikoagulasjonsbehandling bør være livsvarig ved ikke-kurabel sykdom (Schindewolf & Weitz, 2020). Se også retningslinjer fra Norsk selskap for trombose og hemostase (https://app.magicapp.org/#/guideline/jOpV9L).
Infeksjonsbehandling og vaksinering
Sist faglig oppdatert: 31.10.2024
Penicillin (2 mill x 4) er førstevalg ved pneumoni også hos lungekreftpasienter. Andrevalg bør være ciprofloksacin (400 mg x 2 i.v. eller 500 mg x 2 p.o). Absorbsjonen er 100 %, så hvis pasienten er i stand til å ta tabletter, kan tablettbehandling startes umiddelbart (langt lavere kostnad). Unntak vil være pasienter med tumorforandringer som klemmer av bronkier med risiko for postobstruksjonspneumoni og abscess-utvikling, piperacillin/tazobaktam (4 gram/0,5 g x 3) bør benyttes ved terapisvikt på penicillin hos disse. Ved infeksjon ved neutropeni skal antibiotikabehandling iverksettes raskt. Adekvat prøvetaking og første dose antibiotika (penicillin/aminoglykosid – obs! aminoglykosid skal unngås dersom cisplatin er gitt) bør være gjennomført innen èn time etter ordinering. Se for øvrig spesiallitteratur. Se også egne nasjonale retningslinjer om behandling av febril nøytropeni.
Pasienter med lungekreft bør anbefales årlig influensa- samt koronavaksine, også under pågående kjemo- eller immunterapi. Basert på relativt små studier av influensavaksinering av kreftpasienter er det trolig mest gunstig å sette vaksinen mellom cellegiftkurer, og ikke samme dag som cellegiftinfusjonen (Loulergue et al., 2011; Rousseau et al., 2012). Se også avsnitt "Vaksinering, kortisonbruk og komorbiditet relatert til immunterapi" i Immunterapi: bivirkninger, behandlingsvarighet og annet.
Pneumokokkvaksine (23-valent, polysakkarid-basert) bør tilbys ved diagnose eller senere, og repeteres hvert 10. år (www.fhi.no). Levende vaksiner bør unngås under pågående kjemo- eller immunterapi pga risiko for vaksine-indusert infeksjon (Rubin et al., 2014).
Ekstravasering av cellegift
Sist faglig oppdatert: 31.10.2024
Både taksaner (docetaksel) og vinka-alkaloider (vinorelbin, vinkristin) ansees å være vevstoksiske. Mens det ved ekstravasering av taksaner anbefales nedkjøling, skal det ved vinka-ekstravasering benyttes varmepakninger for å begrense vevsskaden. Ved ACO-kurer skal man være spesielt oppmerksom på dette; dersom doksorubicin er gått ekstravasalt skal det nedkjøles, mens det ved vinkristin benyttes oppvarming. De andre kjemoterapeutika som brukes ved lungekreft (platiner, pemetreksed, gemcitabin, cyklofosfamid og etoposid) er i mindre grad vevstoksiske.
Vena cava superior syndrom (VCSS) - Stokes krage
Sist faglig oppdatert: 31.10.2024
Malign sykdom er årsak til mer enn 90 % av alle VCSS. Den venøse drenasjen av hode, hals, øvre toraks og armer foregår via vena cava. Selv om årens diameter er stor er veggene tynne og komprimeres lett. Det betyr at svulster som oppstår i mediastinum og øvre mediale del av høyre lunge lett kan komprimere vena cava. En gradvis/langsom avklemming medfører utvikling av kollateraler slik at det venøse blodet finner alternative veier. En raskere tumorvekst, derimot, gir ikke like stor kollateraldannelse. Pasienten får sine symptomer når den venøse blodsirkulasjonen, tross kollateraler, ikke er adekvat. Syndromet er hyppigere ved SCLC enn ikke-småcellet lungekreft. VCSS finnes på diagnosetidspunktet hos 10 % av SCLC pasientene, mot 1,7 % hos ikke-småcellet lungekreft-pasientene. Av alle med VCSS har 70-75 % lungekreft (L. D. Wilson, Detterbeck, & Yahalom, 2007).
Symptomer
Det er vanlig med ødem i ansikt, på hals og ut over armene. De aller fleste pasienter har dyspné, takypné og hoste. Mange pasienter har økt kartegning på brystet (kollateraler). Noen får Horners syndrom med ensidig miose, ptose, enopthalmus og nedsatt svettesekresjon i ansiktet. Hodepine og synsforstyrrelse kan være tilstede. Brystsmerter og svelgbesvær er også nokså vanlig. Pasienten kan også ha kompresjon av sentrale luftveier med dyspné/stridor som ledsagende symptom.
Diagnostikk
Det er viktig med rask klinisk undersøkelse og uredning med CT toraks. Hvis mulig bør histologi/cytologi sikres (bronkoskopi, lymfeknutebiopsi eller lignende) før behandlingsstart. Adekvat staging er viktig for å vurdere om f.eks. SCLC kan være i begrenset stadium og dermed aktuell for kurativ behandling.
Behandling
Pasienter med vena cava superior syndrom kan ha behov for rask behandling for å unngå sirkulasjonsvikt til vitale organer. Pasienten skal opp i sittende stilling og administreres O2 etter behov. Det startes med høydose deksametason (4 mg x 4, eller 8 mg x 2) eller metylprednisolon (Medrol 16 mg x 4).
Med unntak av helt livstruende situasjon er det er viktig at pasienter utredes som vanlig mht. mulighet for potensiell kurativ behandling før evt. onkologisk behandling startes. Stenting kan gi rask symptomlindring dersom pasienten ikke responderer på steroider.
Ved bekreftet eller mistenkt SCLC gis primær kjemoterapi og ev. immunterapi dersom pasienten er kjemonaiv. Ved kjemoresistent SCLC, ukjent histologi eller bekreftet ikke-småcellet lungekreft-histologi skal pasienten tilbys øyeblikkelig hjelp stenting av vena cava og/eller strålebehandling (Rowell & Gleeson, 2001). Stenting gjøres forut for strålebehandling ved betydelig klinikk for å oppnå en raskt forbedret blodsirkulasjon i området, deretter gis det strålebehandling. Ved lite symptomer tross betydelige radiologifunn kan strålebehandling gjøres direkte uten forutgående stenting.
Strålefraksjonering ved vena cava superior kompresjon er 3 Gy x 10 eller 2,8 Gy x 15. De to første fraksjonene gis på to påfølgende dager.
Ved avansert sykdom med negative prognostiske faktorer og/eller sykdom utenom toraks kan hypofraksjonert behandling 8,5 Gy x 2 velges (S. Sundstrom et al., 2004).
Anbefaling - vena cava superior-syndrom
- Initialt skal pasienten opp i sittende stilling og administreres O2 etter behov.
- Høydose deksametason (4 mg x 4, 8 mg x2) eller metylprednisolon (16 mg x 4) startes umiddelbart. Protonpumpehemmer som ulcusprofylakse startes samtidig.
- Pasienten bør stadiesettes mtp. mulighet for potensielt kurativ behandling for SCLC.
- Ved bekreftet eller mistenkt SCLC gis primær kjemoterapi og ev. immunterapi dersom pasienten er kjemo-naiv.
- Ved kjemoresistent SCLC, ukjent histologi eller bekreftet ikke-småcellet lungekreft-histologi og betydelige klinisk plager skal pasienten vurderes for øyeblikkelig hjelp stenting av vena cava etterfulgt av strålebehandling.
- Ved lite symptomer tross betydelige radiologifunn kan strålebehandling gjøres direkte uten forutgående stenting.
Kompresjon og okklusjon av sentrale luftveier
Sist faglig oppdatert: 31.10.2024
Tumorforandringer i mediastinum kan også komprimere sentrale luftveier (trakea, bronkier). Vel så ofte vil tumorvekst inne i luftveiene føre til en okklusjon og dermed plagsomme symptomer for pasienten.
Symptomer
Ved kompresjon og obstruksjon av sentrale luftveier vil tumor gi dyspné, stridor, takypné og ofte hoste. Disse symptomene kan ha utviklet seg gradvis og blir ikke sjelden mistolket som en forverring av obstruktiv lungesykdom.
Diagnostikk
Klinisk undersøkelse og utredning med CT toraks. Spirometri med karakteristisk flow-volum kurve kan gi mistanke om sentral obstruksjon. Hvis mulig bør histologi/cytologi sikres (bronkoskopi, lymfeknutebiopsi el). Dersom lymfom er en mulig differensialdiagnose (lav alder, høy LD, normal NSE) er det avgjørende å få en histologisk avklaring, og biopsi/cytologi bør gjøres før oppstart steroider. Som følge av alvorlig, truende dyspné er det viktig med rask behandlingsstart. Adekvat staging er viktig for å vurdere om f.eks. SCLC kan være i begrenset stadium og dermed aktuell for kurativ behandling.
Behandling
Det startes med høydose deksametason (4 mg x 4, eller 8 mg x 2) eller metylprednisolon (Medrol 16 mg x 4). Pasienter som har kjent ikke-småcellet lungekreft eller uavklart histologi bør først vurderes for intervensjonsbronkoskopi med laserbehandling og/eller stenting. Dette gjøres pr i dag på Haukeland universitetssjukehus, Oslo universitetssykehus, Rikshospitalet og St. Olavs hospital. Rekanalisering med krysosonde kan også være et alternativ, dette tilbys bl.a. ved Universitetssykehuset i Stavanger. Deretter gis strålebehandling med oppstart etter få dager. Fraksjonering etter generell sykdomstilstand og målvolumstørrelse, 3 Gy x 10 eller 8,5 Gy x 2 (S. Sundstrom et al., 2004). Pasienter som har kjent SCLC behandles primært med kjemoterapi og ev. immunterapi dersom pasienten er kjemo-naiv. Det kan gis strålebehandling om kjemoterapi ikke er egnet, for eksempel ved nyresvikt eller ved tidligere progresjon på aktuell kjemoterapi.
For pasienter som får residiv i et område som tidligere er eksternt strålebehandlet vurderes intervensjonsbronkoskopi med stenting og/eller laserbehandling. Endobronkial stråleterapi har ikke vist noen effekt utover hhv. Ekstern stråleterapi og laserbehandling (Reveiz, Rueda, & Cardona, 2012).
Anbefaling - kompresjon av sentrale luftveier
- Høydose deksametason (4 mg x 4, 8 mg x2) eller metylprednisolon (16 mg x 4) startes umiddelbart. Protonpumpehemmer som ulcusprofylakse startes samtidig.
- Ved kjent ikke-småcellet lungekreft eller uavklart histologi bør det vurderes intervensjonsbronkoskopi med laserbehandling og/eller stenting, deretter strålebehandling.
- Ved kjent SCLC gis primært kjemoterapi og ev. immunterapi dersom pasienten er kjemo-naiv. Det kan gis strålebehandling om kjemoterapi er kontraindisert.
- Ved residiv i tidligere bestrålt område vurderes intervensjonsbronkoskopi med stenting og/eller laserbehandling.
Malign medullakompresjon
Sist faglig oppdatert: 31.10.2024
Malign medullakompresjon er en tilstandd med kompresjon av medulla spinalis og/eller cauda equina som følge av tumorvekst inn i spinalkanalen og/eller intramedullære metastaser (Ropper & Ropper, 2017). Symptomene kan utvikle seg langsomt i løpet av uker eller akutt i løpet av få dager. Vel 60 % av tilfellene skyldes lunge-, prostata- eller brystkreft. Livskvalitet og prognose endres dramatisk (R. George, Jeba, Ramkumar, Chacko, & Tharyan, 2015).
Symptomer
Redusert kraft og/eller sensibilitet i ekstremiteter, smerter i ryggraden, inkontinens, urinretensjon, svekket koordinasjon.
Diagnostikk
Grundig anamnese inkl. varighet av symptomer er essensielt. Hvor raskt tilstanden har utviklet seg vil påvirke undersøkelser som skal gjøres (MR, evt CT) og behandlingsstrategi. Rask diagnostikk og behandlingstart kan være avgjørende for hvilke funksjoner som kan bevares/bedres siden paralyse som har vedvart over 24 timer sjelden er reverserbar.
Behandling
Det startes med høydose deksametason (4 mg x 4) eller metylprednisolon (Medrol 16 mg x 4) (Kumar et al., 2017; S. Sørensen, Helweg-Larsen, Mouridsen, & Hansen, 1994). Henvisning som øyeblikkelig hjelp til sykehus med multidisplinært team (onkolog, nevrokirurg, ortoped) for vurdering av de ulike behandlingsalternativ. Dersom steroidbehandling gir bedring av symptomene (mindre parese), eller hvis pasienten ikke oppfattes som operabel, velges strålebehandling som primærbehandling med oppstart innen 24 timer (R. George et al., 2015; Patchell et al., 2005).
Valg av fraksjonering avhenger av pasientens allmenntilstand og forventet levetid. For pasienter med forventet levetid på mindre enn seks måneder, anbefales endosert strålebehandling, hvor 8 Gy x 1 er best dokumentert. Slik hypofraksjonert strålebehandling har i randomiserte studier vist å gi samme gevinst når det gjelder fysisk funksjon og smertelindring som mer fraksjonert behandling, men behov for rebestråling forekommer oftere ved singel-fraksjonert behandling.
Randomiserte studier har vist samme funksjonsresultat og overlevelse med 4 Gy x 5 som med 3 Gy x 10 hos pasienter med forventet levetid under 1 år. Ved forventet levetid mellom ½ og 1 år anbefales derfor 4 Gy x 5, mens 3 Gy x10 forbeholdes pasienter med forventet levetid over 1 år. Strålebehandling tilstrebes startet med minimum to påfølgende dager, noe som iblant vil medføre behandling i helg. Ved progresjon av nevrologiske symptomer under pågående strålebehandling, bør man vurdere om nevrokirurg/ortoped skal konsulteres på nytt med hensyn på dekompresjon eller om iverksatt behandling skal avbrytes.
Det vises til Handlingsprogram for palliasjon i kreftomsorgen, og Faglige anbefalinger for lindrende strålebehandling ved lungecancer.
Anbefaling - Malign medullakompresjon:
- Høydose deksametason (4 mg x 4, 8 mg x2) eller metylprednisolon (16 mg x 4) startes umiddelbart. Protonpumpehemmer som ulcusprofylakse startes samtidig.
- Henvisning øhj. til multidisplinært team (onkolog, nevrokirurg, ortoped).
- Ved steroideffekt eller om pasienten er teknisk eller medisinsk inoperabel, velges strålebehandling som primærbehandling.
- Fraksjonering bør velges utfra forventet levetid:
- <6 mndr: 8 Gy x 1
- 6-12 mndr: 4 Gy x 5
- >12 mndr: 3 Gy x 10
- Ved forverring under pågående strålebehandling, bør man vurdere om nevrokirurg/ortoped skal konsulteres på nytt med tanke på kirurgisk dekompresjon eller om iverksatt behandling skal avbrytes.
Hyperkalsemi
Sist faglig oppdatert: 31.10.2024
Hyperkalsemi opptrer hos 1,5 % av alle pasienter med maligne sykdommer, også uten kjente skjelettmetastaser (paraneoplasi). Tilstanden er vanskelig å diagnostisere idet den kan arte seg som generell sykdomsprogresjon. Ubehandlet kan hyperkalsemi være livstruende.
Typiske symptomer
Konfusjon, somnolens, kvalme og brekninger, muskelsmerter, poliuri, tørste, obstipasjon, dehydrering, medtatthet.
Diagnostikk
S-kalsium, albuminkorrigert kalsium, (ev ionisert kalsium), ALP, Na, K, kreatinin.
Differensialdiagnose
Dersom pasientens CNS symptomer ikke bedrer seg under behandlingen, bør MR caput gjøres for å utelukke hjernemetastaser.
Behandling
Rehydrering med 2000 ml NaCl/24t. Etter rehydrering administeres et av bisfosfonatene zoledronsyre (Zometa®) 4 mg, eventuelt pamidronat 90 mg. Biokjemisk respons sees etter 2-4 dager, med laveste verdi 7-10 dager etter bisfosfonat-behandling. 90 % av de som behandles blir normokalsemiske, og effekten opprettholdes i opp til 3 uker. Ved manglende respons kan en ny dose bisfosfonat gis etter 7-10 dager etter forrige dose (Saunders, Ross, Broadley, Edmonds, & Patel, 2004).
Anbefaling - Hyperkalsemi:
- Rehydrering med 2000 ml NaCl/døgn.
- Bisfosfonat i form av zoledronat 4 mg eller pamidronat 90 mg.
- Ved manglende respons kan en ny dose bisfosfonat gis etter 7-10 dager.
Tromboembolisk sykdom hos kreftpasienter
Sist faglig oppdatert: 31.10.2024
Dyp venetrombose og lungeembolisme forekommer jevnlig hos lungekreftpasienter, og anbefales behandlet med direktevirkende orale antikoagulantia (DOAK) som apiksaban, edoksaban eller rivaroksaban (Desai et al., 2020; Li, Garcia, Lyman, & Carrier, 2019). Apiksaban (10 mg x2 første 7 dager, deretter 5 mg x2) oppfattes å ha best dokumentasjon hos lungekreftpasienter basert på den nylig publiserte Caravaggio-studien med 1155 inkluderte kreftpasienter (200 med lungekreft) som hadde en nylig tromboembolisk hendelse. Studien randomiserte mellom apiksaban eller lavmolekylærvekt heparin (LMVH) (Agnelli et al., 2020). Studien konkluderte med lik frekvens av re-trombosering (5,6 % med apiksaban og 7,9 % med dalteparin), og lik frekvens av alvorlig blødning (3,8 % mot 4,0 %). Det er verdt å legge merke til at pasienter med hjernemetastaser ikke var inkludert i studien, og i slike tilfeller kan LMVH vurderes brukt. Antikoagulasjonsbehandling bør være livsvarig ved ikke-kurabel sykdom (Schindewolf & Weitz, 2020). Se også retningslinjer fra Norsk selskap for trombose og hemostase (https://app.magicapp.org/#/guideline/jOpV9L).
Infeksjonsbehandling og vaksinering
Sist faglig oppdatert: 31.10.2024
Penicillin (2 mill x 4) er førstevalg ved pneumoni også hos lungekreftpasienter. Andrevalg bør være ciprofloksacin (400 mg x 2 i.v. eller 500 mg x 2 p.o). Absorbsjonen er 100 %, så hvis pasienten er i stand til å ta tabletter, kan tablettbehandling startes umiddelbart (langt lavere kostnad). Unntak vil være pasienter med tumorforandringer som klemmer av bronkier med risiko for postobstruksjonspneumoni og abscess-utvikling, piperacillin/tazobaktam (4 gram/0,5 g x 3) bør benyttes ved terapisvikt på penicillin hos disse. Ved infeksjon ved neutropeni skal antibiotikabehandling iverksettes raskt. Adekvat prøvetaking og første dose antibiotika (penicillin/aminoglykosid – obs! aminoglykosid skal unngås dersom cisplatin er gitt) bør være gjennomført innen èn time etter ordinering. Se for øvrig spesiallitteratur. Se også egne nasjonale retningslinjer om behandling av febril nøytropeni.
Pasienter med lungekreft bør anbefales årlig influensa- samt koronavaksine, også under pågående kjemo- eller immunterapi. Basert på relativt små studier av influensavaksinering av kreftpasienter er det trolig mest gunstig å sette vaksinen mellom cellegiftkurer, og ikke samme dag som cellegiftinfusjonen (Loulergue et al., 2011; Rousseau et al., 2012). Se også avsnitt "Vaksinering, kortisonbruk og komorbiditet relatert til immunterapi" i Immunterapi: bivirkninger, behandlingsvarighet og annet.
Pneumokokkvaksine (23-valent, polysakkarid-basert) bør tilbys ved diagnose eller senere, og repeteres hvert 10. år (www.fhi.no). Levende vaksiner bør unngås under pågående kjemo- eller immunterapi pga risiko for vaksine-indusert infeksjon (Rubin et al., 2014).
Ekstravasering av cellegift
Sist faglig oppdatert: 31.10.2024
Både taksaner (docetaksel) og vinka-alkaloider (vinorelbin, vinkristin) ansees å være vevstoksiske. Mens det ved ekstravasering av taksaner anbefales nedkjøling, skal det ved vinka-ekstravasering benyttes varmepakninger for å begrense vevsskaden. Ved ACO-kurer skal man være spesielt oppmerksom på dette; dersom doksorubicin er gått ekstravasalt skal det nedkjøles, mens det ved vinkristin benyttes oppvarming. De andre kjemoterapeutika som brukes ved lungekreft (platiner, pemetreksed, gemcitabin, cyklofosfamid og etoposid) er i mindre grad vevstoksiske.
Palliasjon
Definisjon
Sist faglig oppdatert: 31.10.2024
Palliasjon er et medisinsk spesialområde hvor hovedfokuset er god livskvalitet for pasienter og deres familier (http://www.who.int/cancer/palliative/definition/en/). Kunnskap om grunnsykdommen, ulike behandlingsmetoder, grundig kartlegging og symptomlindring samt samarbeid på tvers av spesialiteter, profesjoner og nivå i helsetjenesten samt ivaretakelse av pårørende, står sentralt for å kunne tilby optimal behandling.
På engelsk benyttes ofte begrepene «supportive og palliative care». I følge European Society for Medical Oncology (ESMO) skal «supportive care» tilbys på alle stadier i kreftsykdommen, mens «palliative care» befatter seg med pasienter som ikke kan bli kurert (Cherny, Catane, Kosmidis, & Care, 2003). American Society for Clinical Oncology (ASCO) operererer ikke med dette skillet (Ferris et al., 2009) og ingen av de to organisasjonene beskriver forskjeller i innhold.
Verdens helseorganisasjon (WHO) fremhever at palliasjon er av betydning i hele sykdomsforløpet og ikke bare i livets sluttfase: « [Palliative care] is applicable early in the course of illness, in conjunction with other therapies that are intended to prolong life, such as chemotherapy or radiation therapy, and includes those investigations needed to better understand and manage distressing clinical complications.»
Livskvaliteten er vist å være generelt lavere hos pasienter med lungekreft enn ved annen kreft (Polanski, Jankowska-Polanska, Rosinczuk, Chabowski, & Szymanska-Chabowska, 2016). Tidlig oppstart (fra dag 1) av god palliativ behandling parallelt med tumorrettet behandling, kan øke både overlevelse og livskvalitet ved lungekreft. Dette ble vist i en egen studie i 2010 (Temel et al., 2010) og har blitt replikert i en rekke senere randomiserte studier (Hui & Bruera, 2016). Betydningen av integrasjon mellom onkologi og palliasjon ble fremhevet i et nylig publisert spesialnummer av Lancet Oncology (Kaasa et al., 2018). For ytterligere detaljer om palliasjon vises det til Handlingsprogram for palliasjon i kreftomsorgen og spesial-litteratur.
Systematisk kartlegging av symptomer
Sist faglig oppdatert: 31.10.2024
Subjektive symptomer bør måles på en systematisk måte og rapporteres av pasienten selv. På engelsk, og ofte på norsk, benyttes begrepet «patient-reported outcome measures» (PROMs) (Calvert et al., 2013). Det er godt dokumentert at helsepersonells vurdering av pasientens plager ikke sammenfaller med hva pasientene selv rapporterer, og at pasientene ofte underrapporterer dersom de ikke blir spurt systematisk. Edmonton Symptom Assessment System (ESAS) er et kartleggingsskjema som anbefales brukt i daglig praksis; det er oversatt til en rekke språk (Watanabe, Nekolaichuk, & Beaumont, 2012).
Vanlige tilstander og symptomer hos lungekreftpasienter
Sist faglig oppdatert: 31.10.2024
For detaljer om kartlegging og behandling av en rekke tilstander og symptomer hos kreftpasienter vises det til Handlingsprogram for palliasjon i kreftomsorgen, Kaasa og Loge: Palliasjon. En nordisk lærebok. Gyldendal 2016, Norsk Legemiddelhåndbok kap 21 og spesial-litteratur.
Ernæring
Anoreksi og kakeksi er hyppig ved lungekreft. Begge tilstandene er negative prognostiske faktorer både ved kirurgi og kjemoterapi. Nyere studier antyder at ernæringsintervensjon kan ha en positiv effekt på vekt, muskelmasse og livskvalitet (Payne, Larkin, McIlfatrick, Dunwoody, & Gracey, 2013). Tidlig og gjentatt kartlegging av ernæringsstatus anbefales (Chandrasekar, Tribett, & Ramchandran, 2016). Pasientene bør i tidlig fase oppfordres til inntak av kalori- og proteinrik kost. Ved langtkommet sykdom og kakeksi som ikke responderer på ernæringsbehandling, er det viktig å bidra til å tone ned fokus på ernæring. European Society for Clinical Nutrition and Metabolism (ESPEN) har utarbeidet retningslinjer for kreftpasienter (Arends et al., 2017).
Fysisk aktivitet
I en norsk studie ble det funnet at fysisk trening etter kirurgisk behandling av lungekreft førte til bedre kondisjon, muskelmasse og livskvalitet (Edvardsen et al., 2015). For pasienter med avansert lungekreft er det også funnet bedring av livskvalitet og at fysisk aktivitet er assosiert med bedre prognose. Denne effekten ser ut til å være størst ved tidlig igangsetting. Studier på dette feltet er få, små og med kort oppfølgingstid (Chandrasekar et al., 2016; Payne et al., 2013).
Smerte
Smerte er vanlig hos pasienter med lungekreft. Smerte kan ha svært mange årsaker og behandlingen må være årsaksrettet. Tumorrettet behandling inkludert strålebehandling bør alltid vurderes. For detaljer om medikamentell smertebehandling og palliativ strålebehandling vises det til Handlingsprogram for palliasjon i kreftomsorgen og Faglige anbefalinger for lindrende strålebehandling ved lungecancer.
Vær spesielt oppmerksom på kjøretøyforskriftens helsekrav vedrørende medikamentbruk. For detaljer vises det til Helsedirektoratets førerkortveileder.
Pustebesvær
Pasienter med lungekreft opplever ofte pustebesvær eller dyspné. Også her er årsaksrettet behandling sentralt som for eksempel tumorrettet behandling og tapping av pleuravæske. Flere ikke-medikamentelle og medikamentelle tiltak kan være aktuelle (D. J. Brown, 2006). Opioider kan bidra til indirekte reduksjon av oksygenbehovet og reduksjon av åndedrettssenterets følsomhet for karbondioksyd og anbefales for god symptomlindring (Jennings, Davies, Higgins, Gibbs, & Broadley, 2002).
Angst
En viss grad av angst er normalt i enkelte situasjoner, men kan ofte bli svært plagsomt hos pasienter med lungekreft. Angst kan forverre pustebesvær og vise versa. Kartlegging av utløsende årsaker og lindrende faktorer samt miljøtiltak og tilbud om samtalepartner er viktig. Benzodiazepiner anbefales som medikamentell symptomlindring. Antidepressiva bør vurderes hos pasienter med uttalt angst (for eksempel mirtazapin eller escitalopram) (Grassi, Nanni, Rodin, Li, & Caruso, 2018).
Omsorg ved livets slutt
Sist faglig oppdatert: 31.10.2024
God omsorg og lindring ved livets slutt er sentralt både for den døende pasienten og de pårørende som skal leve videre. Det er viktig at leger og sykepleiere erkjenner at pasienten er i ferd med å dø. Målsetting med alle tiltak skal da være best mulig lindring og å unngå uhensiktsmessig medisinsk utredning og behandling. Å dø er en irreversibel fysiologisk prosess. Som regel inntreffer en gradvis funksjonsforverring og pasienten blir mer og mer sengeliggende, slutter å ta til seg mat og drikke og mister gradvis interessen for omgivelsene. Bevissthetsnivået fluktuerer ofte og pusten endrer seg. Urinproduksjonen avtar, men blærekateter er som regel indisert for å unngå uro. Alt unødvendig utstyr bør tas ut av rommet og oksygen og intravenøse tilganger som regel fjernes. Pårørende trenger informasjon om hva som skjer med den døende pasienten og hva de kan forvente. Noen uker etter dødsfallet bør de etterlatte tilbys samtale.
Helsedirektoratet har publisert faglige råd for Forhåndssamtaler og planlegging ved begrenset forventet levetid.
Peroral medikasjon er som regel ikke mulig og subkutan administrasjon av medikamenter er anbefalt. Følgende fire medikamenter er sentrale for å oppnå god lindring i livets sluttfase: morfin, midazolam, haldol og glykopyrrolat. Detaljert informasjon om bruken av disse medikamentene finnes på hjemmesiden til Kompetansenter i lindrende behandling i Helse Vest.
Metode og prosess – handlingsprogram på kreftområdet
Bakgrunn
Sist faglig oppdatert: 31.10.2024
Nasjonalt handlingsprogram med retningslinje for diagnostikk, behandling og oppfølging av lungekreft, mesoteliom og thymom er utarbeidet av en oppdateringsgruppe for lungekreft med representanter for alle de regionale helseforetakene, og i samarbeid med Helsedirektoratet.
Mange onkologiske faggrupper la i en årrekke ned et betydelig arbeid for å komme frem til konsensusbaserte faglige anbefalinger for diagnostikk og behandling av ulike typer kreft.
Som ledd i Nasjonal strategi for kreftområdet (2006–2009) fikk Helsedirektoratet i oppdrag å videreutvikle og oppdatere faggruppenes anbefalinger til nasjonale handlingsprogrammer for kreftbehandling, i nært samarbeid med fagmiljøene, de regionale helseforetakene, Nasjonalt kunnskapssenter for helsetjenesten, og andre relevante myndigheter. De nasjonale handlingsprogrammene representerte en videreføring av faggruppenes arbeid.
Helsedirektoratet takker arbeidsgruppen for stor innsats i utarbeidelsen av handlingsprogrammet.
Formål med handlingsprogrammet
Sist faglig oppdatert: 31.10.2024
Nasjonalt handlingsprogram med retningslinje for diagnostikk, behandling og oppfølging av lungekreft, mesoteliom og thymom skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
Rettslig betydning
Sist faglig oppdatert: 31.10.2024
Helsedirektoratet skal utvikle, formidle og vedlikeholde normerende produkter, det vil si nasjonale faglige retningslinjer, nasjonale veiledere, nasjonal faglige råd og pakkeforløp, som understøtter målene for helse- og omsorgstjenesten.
Nasjonale anbefalinger og råd skal baseres på kunnskap om god praksis, og skal bidra til kontinuerlig forbedring av virksomhet og tjenester, jf. spesialisthelsetjenesteloven § 7-3, helse- og omsorgstjenesteloven § 12-5 og folkehelseloven § 24.
Anbefalinger/råd utgitt av Helsedirektoratet er ikke rettslig bindende, men er faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet.
I situasjoner der helsepersonell velger løsninger som i vesentlig grad avviker fra gitte anbefalinger, skal dette dokumenteres, jf. journalforskriften § 6, bokstav g. Helsepersonell bør være forberedt på å begrunne sine valg i eventuelle klagesaker eller ved tilsyn.
Målgrupper
Sist faglig oppdatert: 31.10.2024
Målgrupper for de nasjonale handlingsprogrammene er spesialister innen medisin, kirurgi, onkologi, radiologi og patologi. De vil også være av interesse for allmennleger, pasienter, pårørende og andre aktører på kreftfeltet.
Handlingsprogram og Nye metoder
Sist faglig oppdatert: 31.10.2024
De regionale helseforetakene har ansvar for Nye metoder, et felles system for å beslutte hvilke metoder som kan tilbys i spesialisthelsetjenesten. Nye metoder er et prioriteringsverktøy. Beslutningene i Nye metoder gjelder nasjonalt, les mer her: Bakgrunn: Hvorfor har vi Nye metoder? (nyemetoder.no)
Handlingsprogram og andre normerende produkter kan ikke anbefale legemidler eller andre metoder som ikke har finansering i den offentlige helsetjenesten. Handlingsprogrammene oppdateres i overenstemmelse med beslutninger i Nye metoder.
Kunnskapsbasert metode
Sist faglig oppdatert: 31.10.2024
Kunnskapsbasert praksis innebærer at både forskningsbasert kunnskap, erfaringsbasert klinisk kunnskap og pasientenes/ brukernes ønsker og behov vurderes samlet. I utarbeidelsen og revidering av nasjonale handlingsprogram har det ikke vært med brukerrepresentanter i gruppene.
Innholdet i en retningslinje skal baseres på et oppdatert, gjennomarbeidet og dokumentert kunnskapsgrunnlag. Det innebærer at forskningslitteratur, klinisk erfaring og brukererfaring vurderes opp mot ønskede og uønskede konsekvenser av et tiltak. På områder der det er funnet mindre forskningsbasert kunnskap, og/eller overføringsverdien fra internasjonal til norsk helsetjeneste er lav, blir klinisk kunnskap og brukerkunnskap tillagt større vekt.
Dette nasjonale handlingsprogrammet inneholder svært mange anbefalinger. Det er ikke praktisk mulig, innenfor gitte ressursrammer, å samle all relevant forskningsbasert kunnskap for hver anbefaling. Den forskningsbaserte kunnskapen er hovedsakelig basert på forskning identifisert i anerkjente internasjonale retningslinjer og nyere studier. Det er heller ikke praktisk mulig å gjennomgående bruke GRADE eller SIGN-metodikken for gradering av kunnskapsgrunnlaget.
Handlingsprogram og andre normerende produkter skal også forholde seg til prioriteringskriteriene og ressursbruk. Med ressurser menes direkte kostnader, men også personell og tidsbruk.
Grad av normering
Sist faglig oppdatert: 31.10.2024
Grad av normering angis i teksten i hver enkelt anbefaling/råd:
- Når Helsedirektoratet skriver «skal», betyr det at anbefalingen/rådet er basert på lov eller forskrift, eller når det er så klart faglig forankret at det sjelden er forsvarlig å ikke gjøre som anbefalt
- Når det står bør» eller «anbefaler», er det en sterk anbefaling/råd som vil gjelde i de aller fleste tilfeller
- Når det står «kan» eller «foreslår» er det en svak anbefaling/råd der ulike valg kan være riktig for ulike pasienter
Tilhørende normerende publikasjoner
Sist faglig oppdatert: 31.10.2024
- Pakkeforløp for lungekreft
- Diagnoseveileder for lungekreft
- Pårørendeveileder
- Seneffekter etter kreftbehandling
- Fastlegens rolle ved kreft
Det er egne diagnoseveiledere for inngang til pakkeforløp for kreft.
Arbeidsform og deltagere
Sist faglig oppdatert: 31.10.2024
Handlingsprogrammet oppdateres av en oppdateringsgruppe oppnevnt av Helsedirektoratet. Representantene i gruppen er utnevnt av de regionale helseforetakene. Helsedirektoratets bearbeidelse og gjennomgang av utkast til handlingsprogram, blir handlingsprogrammet publisert på temasiden om kreft.
Dette er en 27. utgave av Nasjonalt handlingsprogram med retningslinje for diagnostikk, behandling og oppfølging av lungekreft, mesoteliom og thymom.
Navn |
| Spesialitet | Helseforetak |
|---|---|---|---|
Odd Terje Brustugun
| Onkolog | Vestre Viken, HSØ | |
Bjørn Henning Grønberg | Onkolog | St. Olavs, HM | |
Al-Zubaydi, Mohammed Modar Saad | Onkolog | Helse Bergen, HV | |
Maria Moksnes Bjaanæs | Onkolog | OUS, HSØ | |
Nina Helbekkmo
| Onkolog | UNN, HN | |
Carin Elisabeth Meltzer | Radiolog | OUS, HSØ | |
Per Magnus Haram |
| Thoraxkirurg | St. Olavs, HM |
Sissel Wahl | Patolog | St. Olavs, HM | |
Henning Langen Stokmo | Nukleærmedisiner | Vestre Viken, HSØ | |
Terje Tollåli | Lungelege | Nordlandssykehuset Bodø, HN | |
Lars Fjellbirkeland
| Lungelege | OUS, HSØ | |
Håkon Olav Leira
| Lungelege | St. Olavs, HM | |
Martin Petersen | Lungelege | Helse Stavanger, HV | |
Ellen Fagerberg | ellen.anita.fagerberg@abildso.nhn.no; ellen@abildsolegene.no | Fastlege | Oslo |
Line Cecilie Christiansen | Fastlege | Stavanger |
Kontaktpersoner i Helsedirektoratet
Borghild Svorken, seniorrådgiver, Avdeling fagutvikling spesialisthelsetjenester
Fagansvarlig på kreftområdet er Sissi Espetvedt: sissi.leyell.espetvedt@helsedir.no
Habilitet
Sist faglig oppdatert: 31.10.2024
Representantene i oppdateringsgruppen har fylt ut Helsedirektoratets habilitetsskjema. Ingen interesser med konsekvenser for deltakelse i arbeidet er identifisert. Skjemaene er arkivert i Helsedirektoratet.
Referanser
Sist faglig oppdatert: 31.10.2024
Helsedirektoratet. (2012). Veileder for utvikling av kunnskapsbaserte retningslinjer (IS-1870). ISBN-nr. 978-82-8081-225-4. Hentet fra https://www.helsedirektoratet.no/
Øvrige referanser fremkommer bakerst i handlingsprogrammet.
Referanser
Sist faglig oppdatert: 31.10.2024
Aberle, D. R., Adams, A. M., Berg, C. D., Black, W. C., Clapp, J. D., Fagerstrom, R. M., . . . Team, N. L. S. T. R. (2011). Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med, 365(5), 395-409. doi:10.1056/NEJMoa1102873
Aberle, D. R., DeMello, S., Berg, C. D., Black, W. C., Brewer, B., Church, T. R., . . . Team, N. L. S. T. R. (2013). Results of the two incidence screenings in the National Lung Screening Trial. N Engl J Med, 369(10), 920-931. doi:10.1056/NEJMoa1208962
Agnelli, G., Becattini, C., Meyer, G., Muñoz, A., Huisman, M. V., Connors, J. M., . . . Investigators, C. (2020). Apixaban for the Treatment of Venous Thromboembolism Associated with Cancer. N Engl J Med, 382(17), 1599-1607. doi:10.1056/NEJMoa1915103
Aguilar, E., Gainor, J., Kravets, S., Khosrowjerdi, S., Lydon, C., Adeni, A., . . . Awad, M. (2018). Outcomes in NSCLC Patients Treated with First-Line Pembrolizumab and a PD-L1 TPS of 50-74% vs 75-100% or 0-89% vs 90-100%. J Thorac Oncol, 13(10), S367-S368.
Al-Ibraheem, A., Hirmas, N., Fanti, S., Paez, D., Abuhijla, F., Al-Rimawi, D., . . . Mansour, A. (2021). Impact of (18)F-FDG PET/CT, CT and EBUS/TBNA on preoperative mediastinal nodal staging of NSCLC. BMC Med Imaging, 21(1), 49. doi:10.1186/s12880-021-00580-w
Al-Sahaf, M., & Lim, E. (2015). The association between surgical volume, survival and quality of care. J Thorac Dis, 7(Suppl 2), S152-155. doi:10.3978/j.issn.2072-1439.2015.04.08
Albain, K. S., Swann, R. S., Rusch, V. W., Turrisi, A. T., Shepherd, F. A., Smith, C., . . . Cox, J. D. (2009). Radiotherapy plus chemotherapy with or without surgical resection for stage III non-small-cell lung cancer: a phase III randomised controlled trial. Lancet, 374(9687), 379-386. doi:10.1016/S0140-6736(09)60737-6
Aldea, M., Marinello, A., Duruisseaux, M., Zrafi, W., Conci, N., Massa, G., . . . Besse, B. (2023). RET-MAP: An International Multicenter Study on Clinicobiologic Features and Treatment Response in Patients With Lung Cancer Harboring a RET Fusion. J Thorac Oncol, 18(5), 576-586. doi:10.1016/j.jtho.2022.12.018
Ali, M. S., Trick, W., Mba, B. I., Mohananey, D., Sethi, J., & Musani, A. I. (2017). Radial endobronchial ultrasound for the diagnosis of peripheral pulmonary lesions: A systematic review and meta-analysis. Respirology, 22(3), 443-453. doi:10.1111/resp.12980
Anderson, G., & Takahama, Y. (2012). Thymic epithelial cells: working class heroes for T cell development and repertoire selection. Trends Immunol, 33(6), 256-263. doi:10.1016/j.it.2012.03.005
Anderson, K. L., Mulvihill, M. S., Speicher, P. J., Yerokun, B. A., Gulack, B. C., Nussbaum, D. P., . . . Hartwig, M. G. (2017). Adjuvant Chemotherapy Does Not Confer Superior Survival in Patients With Atypical Carcinoid Tumors. Ann Thorac Surg, 104(4), 1221-1230. doi:10.1016/j.athoracsur.2017.05.011
Ando, K., Akimoto, K., Sato, H., Manabe, R., Kishino, Y., Homma, T., . . . Sagara, H. (2020). Brigatinib and Alectinib for ALK Rearrangement-Positive Advanced Non-Small Cell Lung Cancer With or Without Central Nervous System Metastasis: A Systematic Review and Network Meta-Analysis. Cancers (Basel), 12(4). doi:10.3390/cancers12040942
Antonia, S. J., Villegas, A., Daniel, D., Vicente, D., Murakami, S., Hui, R., . . . Investigators, P. (2018). Overall Survival with Durvalumab after Chemoradiotherapy in Stage III NSCLC. N Engl J Med, 379(24), 2342-2350. doi:10.1056/NEJMoa1809697
Antonia, S. J., Villegas, A., Daniel, D., Vicente, D., Murakami, S., Hui, R., . . . Investigators, P. (2017). Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med, 377(20), 1919-1929. doi:10.1056/NEJMoa1709937
Arbour, K. C., Mezquita, L., Long, N., Rizvi, H., Auclin, E., Ni, A., . . . Hellmann, M. D. (2018). Impact of Baseline Steroids on Efficacy of Programmed Cell Death-1 and Programmed Death-Ligand 1 Blockade in Patients With Non-Small-Cell Lung Cancer. J Clin Oncol, 36(28), 2872-2878. doi:10.1200/JCO.2018.79.0006
Arends, J., Bachmann, P., Baracos, V., Barthelemy, N., Bertz, H., Bozzetti, F., . . . Preiser, J. C. (2017). ESPEN guidelines on nutrition in cancer patients. Clin Nutr, 36(1), 11-48. doi:10.1016/j.clnu.2016.07.015
Arrieta, O., Cardona, A. F., Lara-Mejía, L., Heredia, D., Barrón, F., Zatarain-Barrón, Z. L., . . . Rosell, R. (2020). Recommendations for detection, prioritization, and treatment of thoracic oncology patients during the COVID-19 pandemic: the THOCOoP cooperative group. Crit Rev Oncol Hematol, 153, 103033. doi:10.1016/j.critrevonc.2020.103033
Arter, Z. L., & Nagasaka, M. (2024). The Nail in the Coffin?: Examining the KEYNOTE-789 Clinical Trial's Impact. Lung Cancer (Auckl), 15, 1-8. doi:10.2147/LCTT.S443099
Asamura, H., Chansky, K., Crowley, J., Goldstraw, P., Rusch, V. W., Vansteenkiste, J. F., . . . International Association for the Study of Lung Cancer Staging and Prognostic Factors Committee, A. v. B. M., and Participating Institutions. (2015). The International Association for the Study of Lung Cancer Lung Cancer Staging Project: Proposals for the Revision of the N Descriptors in the Forthcoming 8th Edition of the TNM Classification for Lung Cancer. J Thorac Oncol, 10(12), 1675-1684. doi:10.1097/JTO.0000000000000678
Asciak, R., Bedawi, E. O., Bhatnagar, R., Clive, A. O., Hassan, M., Lloyd, H., . . . Rahman, N. M. (2023). British Thoracic Society Clinical Statement on pleural procedures. Thorax, 78(Suppl 3), s43-s68. doi:10.1136/thorax-2022-219371
Ashworth, A. B., Senan, S., Palma, D. A., Riquet, M., Ahn, Y. C., Ricardi, U., . . . Rodrigues, G. B. (2014). An individual patient data metaanalysis of outcomes and prognostic factors after treatment of oligometastatic non-small-cell lung cancer. Clin Lung Cancer, 15(5), 346-355. doi:10.1016/j.cllc.2014.04.003
Auperin, A., Arriagada, R., Pignon, J. P., Le Pechoux, C., Gregor, A., Stephens, R. J., . . . Aisner, J. (1999). Prophylactic cranial irradiation for patients with small-cell lung cancer in complete remission. Prophylactic Cranial Irradiation Overview Collaborative Group. N Engl J Med, 341(7), 476-484.
Aupérin, A., Le Péchoux, C., Rolland, E., Curran, W. J., Furuse, K., Fournel, P., . . . Pignon, J. P. (2010). Meta-analysis of concomitant versus sequential radiochemotherapy in locally advanced non-small-cell lung cancer. J Clin Oncol, 28(13), 2181-2190. doi:10.1200/JCO.2009.26.2543
Avasarala, S. K., Lentz, R. J., & Maldonado, F. (2021). Medical Thoracoscopy. Clin Chest Med, 42(4), 751-766. doi:10.1016/j.ccm.2021.08.010
Awad, M. M., Oxnard, G. R., Jackman, D. M., Savukoski, D. O., Hall, D., Shivdasani, P., . . . Sholl, L. M. (2016). MET Exon 14 Mutations in Non-Small-Cell Lung Cancer Are Associated With Advanced Age and Stage-Dependent MET Genomic Amplification and c-Met Overexpression. J Clin Oncol. doi:10.1200/JCO.2015.63.4600
Azzoli, C. G., Baker, S., Temin, S., Pao, W., Aliff, T., Brahmer, J., . . . Giaccone, G. (2009). American Society of Clinical Oncology Clinical Practice Guideline update on chemotherapy for stage IV non-small-cell lung cancer. J Clin Oncol, 27(36), 6251-6266.
Baas, P., Scherpereel, A., Nowak, A. K., Fujimoto, N., Peters, S., Tsao, A. S., . . . Zalcman, G. (2021). First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial. Lancet, 397(10272), 375-386. doi:10.1016/S0140-6736(20)32714-8
Baize, N., Monnet, I., Greillier, L., Geier, M., Lena, H., Janicot, H., . . . investigators, G. F. d. P.-C. (2020). Carboplatin plus etoposide versus topotecan as second-line treatment for patients with sensitive relapsed small-cell lung cancer: an open-label, multicentre, randomised, phase 3 trial. Lancet Oncol, 21(9), 1224-1233. doi:10.1016/S1470-2045(20)30461-7
Bankier, A. A., MacMahon, H., Goo, J. M., Rubin, G. D., Schaefer-Prokop, C. M., & Naidich, D. P. (2017). Recommendations for Measuring Pulmonary Nodules at CT: A Statement from the Fleischner Society. Radiology, 162894. doi:10.1148/radiol.2017162894
Barlesi, F., Vansteenkiste, J., Spigel, D., Ishii, H., Garassino, M., de Marinis, F., . . . Park, K. (2018). Avelumab versus docetaxel in patients with platinum-treated advanced non-small-cell lung cancer (JAVELIN Lung 200): an open-label, randomised, phase 3 study. Lancet Oncol. doi:10.1016/S1470-2045(18)30673-9
Baudin, E., Caplin, M., Garcia-Carbonero, R., Fazio, N., Ferolla, P., Filosso, P. L., . . . Berruti, A. (2021). Lung and thymic carcinoids: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up(☆). Ann Oncol, 32(4), 439-451. doi:10.1016/j.annonc.2021.01.003
Baudin, E., Caplin, M., Garcia-Carbonero, R., Fazio, N., Ferolla, P., Filosso, P. L., . . . clinicalguidelines@esmo.org, E. G. C. E. a. (2021). Lung and thymic carcinoids: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 32(4), 439-451. doi:10.1016/j.annonc.2021.01.003
Baumann, P., Nyman, J., Hoyer, M., Gagliardi, G., Lax, I., Wennberg, B., . . . Lewensohn, R. (2008). Stereotactic body radiotherapy for medically inoperable patients with stage I non-small cell lung cancer - a first report of toxicity related to COPD/CVD in a non-randomized prospective phase II study. Radiother Oncol, 88(3), 359-367. doi:10.1016/j.radonc.2008.07.019
Baumann, P., Nyman, J., Hoyer, M., Wennberg, B., Gagliardi, G., Lax, I., . . . Lewensohn, R. (2009). Outcome in a prospective phase II trial of medically inoperable stage I non-small-cell lung cancer patients treated with stereotactic body radiotherapy. J Clin Oncol, 27(20), 3290-3296.
Belli, C., Anand, S., Gainor, J. F., Penault-Llorca, F., Subbiah, V., Drilon, A., . . . Curigliano, G. (2020). Progresses Toward Precision Medicine in RET-altered Solid Tumors. Clin Cancer Res, 26(23), 6102-6111. doi:10.1158/1078-0432.CCR-20-1587
Benna, M., Guy, J. B., Bosacki, C., Jmour, O., Ben Mrad, M., Ogorodniitchouk, O., . . . Vallard, A. (2020). Chemoradiation and granulocyte-colony or granulocyte macrophage-colony stimulating factors (G-CSF or GM-CSF): time to think out of the box? Br J Radiol, 93(1109), 20190147. doi:10.1259/bjr.20190147
Berardi, R., De Lisa, M., Pagliaretta, S., Onofri, A., Morgese, F., Savini, A., . . . Cascinu, S. (2014). Thymic neoplasms: An update on the use of chemotherapy and new targeted therapies. A literature review. Cancer Treat Rev, 40(4), 495-506. doi:10.1016/j.ctrv.2013.11.003
Berry, M. F., D'Amico, T. A., Onaitis, M. W., & Kelsey, C. R. (2014). Thoracoscopic approach to lobectomy for lung cancer does not compromise oncologic efficacy. Ann Thorac Surg, 98(1), 197-202. doi:10.1016/j.athoracsur.2014.03.018
Bi, N., & Wang, L. (2015). Superiority of concomitant chemoradiation over sequential chemoradiation in inoperable, locally advanced non-small cell lung cancer: challenges in the selection of appropriate chemotherapy. Semin Radiat Oncol, 25(2), 122-132. doi:10.1016/j.semradonc.2014.11.003
Bilski, M., Mertowska, P., Mertowski, S., Sawicki, M., Hymos, A., Niedźwiedzka-Rystwej, P., & Grywalska, E. (2021). The Role of Conventionally Fractionated Radiotherapy and Stereotactic Radiotherapy in the Treatment of Carcinoid Tumors and Large-Cell Neuroendocrine Cancer of the Lung. Cancers (Basel), 14(1). doi:10.3390/cancers14010177
Bischof, M., Debus, J., Herfarth, K., Muley, T., Kappes, J., Storz, K., & Hoffmann, H. (2007). Surgery and chemotherapy for small cell lung cancer in stages I-II with or without radiotherapy. Strahlenther Onkol, 183(12), 679-684.
Bissett, D., Macbeth, F. R., & Cram, I. (1991). The role of palliative radiotherapy in malignant mesothelioma. Clin Oncol (R Coll Radiol), 3(6), 315-317.
Bolliger, C. T., Sutedja, T. G., Strausz, J., & Freitag, L. (2006). Therapeutic bronchoscopy with immediate effect: laser, electrocautery, argon plasma coagulation and stents. Eur Respir J, 27(6), 1258-1271.
Borghaei, H., Paz-Ares, L., Horn, L., Spigel, D. R., Steins, M., Ready, N. E., . . . Brahmer, J. R. (2015). Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med, 373(17), 1627-1639. doi:10.1056/NEJMoa1507643
Bossé, Y., & Amos, C. I. (2018). A Decade of GWAS Results in Lung Cancer. Cancer Epidemiol Biomarkers Prev, 27(4), 363-379. doi:10.1158/1055-9965.EPI-16-0794
Bousema, J. E., Dijkgraaf, M. G. W., van der Heijden, E., Verhagen, A., Annema, J. T., van den Broek, F. J. C., & group, M. E. s. (2023). Endosonography With or Without Confirmatory Mediastinoscopy for Resectable Lung Cancer: A Randomized Clinical Trial. J Clin Oncol, 41(22), 3805-3815. doi:10.1200/JCO.22.01728
Boyar Cetinkaya, R., Aagnes, B., Thiis-Evensen, E., Tretli, S., Bergestuen, D. S., & Hansen, S. (2017). Trends in Incidence of Neuroendocrine Neoplasms in Norway: A Report of 16,075 Cases from 1993 through 2010. Neuroendocrinology, 104(1), 1-10. doi:10.1159/000442207
Bradley, J., & Movsas, B. (2004). Radiation esophagitis: Predictive factors and preventive strategies. Semin Radiat Oncol, 14(4), 280-286. doi:10.1016/j.semradonc.2004.06.003
Brahmer, J., Reckamp, K. L., Baas, P., Crinò, L., Eberhardt, W. E., Poddubskaya, E., . . . Spigel, D. R. (2015). Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med, 373(2), 123-135. doi:10.1056/NEJMoa1504627
Brahmer, J. R., Abu-Sbeih, H., Ascierto, P. A., Brufsky, J., Cappelli, L. C., Cortazar, F. B., . . . Ernstoff, M. S. (2021). Society for Immunotherapy of Cancer (SITC) clinical practice guideline on immune checkpoint inhibitor-related adverse events. J Immunother Cancer, 9(6). doi:10.1136/jitc-2021-002435
Brcic, L., & Kern, I. (2020). Clinical significance of histologic subtyping of malignant pleural mesothelioma. Transl Lung Cancer Res, 9(3), 924-933. doi:10.21037/tlcr.2020.03.38
Brokx, H. A. P., Risse, E. K., Paul, M. A., Grunberg, K., Golding, R. P., Kunst, P. W. A., . . . Sutedja, T. G. (2007). Initial bronchoscopic treatment for patients with intraluminal bronchial carcinoids. J Thorac Cardiovasc Surg, 133(4), 973-978.
Brown, D. J. (2006). Palliation of breathlessness. Clin Med (Lond), 6(2), 133-136. doi:10.7861/clinmedicine.6-2-133
Brown, P. D., Ballman, K. V., Cerhan, J. H., Anderson, S. K., Carrero, X. W., Whitton, A. C., . . . Roberge, D. (2017). Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncol, 18(8), 1049-1060. doi:10.1016/S1470-2045(17)30441-2
Brustugun, O. T., Grønberg, B. H., Fjellbirkeland, L., Helbekkmo, N., Aanerud, M., Grimsrud, T. K., . . . Solberg, S. K. (2018). Substantial nation-wide improvement in lung cancer relative survival in Norway from 2000 to 2016 Lung Cancer, 122, 138-145.
Brustugun, O. T., Møller, B., & Helland, A. (2014). Years of life lost as a measure of cancer burden on a national level. Br J Cancer, 111(5), 1014-1020. doi:10.1038/bjc.2014.364
Brustugun, O. T., Nilssen, Y., & Eide, I. J. Z. (2021). Epidemiology and outcome of peritoneal and pleural mesothelioma subtypes in Norway. A 20 year nation-wide study. Acta Oncol, 60(10), 1250-1256. doi:10.1080/0284186X.2021.1955971
Bugge, A. S., Lund, M. B., Valberg, M., Brustugun, O. T., Solberg, S., & Kongerud, J. (2018). Cause-specific death after surgical resection for early-stage non-small-cell lung cancer. Eur J Cardiothorac Surg, 53(1), 221-227. doi:10.1093/ejcts/ezx274
Bunn, P. A., Crowley, J., Kelly, K., Hazuka, M. B., Beasley, K., Upchurch, C., . . . Gandara, D. R. (1995). Chemoradiotherapy with or without granulocyte-macrophage colony-stimulating factor in the treatment of limited-stage small-cell lung cancer: a prospective phase III randomized study of the Southwest Oncology Group. J Clin Oncol, 13(7), 1632-1641.
Bydder, S., Phillips, M., Joseph, D. J., Cameron, F., Spry, N. A., DeMelker, Y., & Musk, A. W. (2004). A randomised trial of single-dose radiotherapy to prevent procedure tract metastasis by malignant mesothelioma. Br J Cancer, 91(1), 9-10.
Bydder, S., Spry, N. A., Christie, D. R. H., Roos, D., Burmeister, B. H., Krawitz, H., . . . Berry, M. (2003). A prospective trial of short-fractionation radiotherapy for the palliation of liver metastases. Australasian Radiology, 47(3), 284-288. doi:doi:10.1046/j.1440-1673.2003.01177.x
Callister, M. E., Baldwin, D. R., Akram, A. R., Barnard, S., Cane, P., Draffan, J., . . . British Thoracic Society Standards of Care, C. (2015). British Thoracic Society guidelines for the investigation and management of pulmonary nodules. Thorax, 70 Suppl 2, ii1-ii54. doi:10.1136/thoraxjnl-2015-207168
Calvert, M., Blazeby, J., Altman, D. G., Revicki, D. A., Moher, D., Brundage, M. D., & Group, C. P. (2013). Reporting of patient-reported outcomes in randomized trials: the CONSORT PRO extension. JAMA, 309(8), 814-822. doi:10.1001/jama.2013.879
Camidge, D. R., Kim, H. R., Ahn, M. J., Yang, J. C., Han, J. Y., Lee, J. S., . . . Popat, S. (2018). Brigatinib versus Crizotinib in ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med, 379(21), 2027-2039. doi:10.1056/NEJMoa1810171
Camidge, D. R., Kim, H. R., Ahn, M. J., Yang, J. C. H., Han, J. Y., Hochmair, M. J., . . . Popat, S. (2020). Brigatinib Versus Crizotinib in Advanced ALK Inhibitor-Naive ALK-Positive Non-Small Cell Lung Cancer: Second Interim Analysis of the Phase III ALTA-1L Trial. J Clin Oncol, 38(31), 3592-3603. doi:10.1200/JCO.20.00505
Cannon, D. M., Mehta, M. P., Adkison, J. B., Khuntia, D., Traynor, A. M., Tomé, W. A., . . . Cannon, G. M. (2013). Dose-limiting toxicity after hypofractionated dose-escalated radiotherapy in non-small-cell lung cancer. J Clin Oncol, 31(34), 4343-4348. doi:10.1200/JCO.2013.51.5353
Cao, C. Q., Yan, T. D., Bannon, P. G., & McCaughan, B. C. (2010). A systematic review of extrapleural pneumonectomy for malignant pleural mesothelioma. J Thorac Oncol, 5(10), 1692-1703. doi:10.1097/JTO.0b013e3181ed0489
Caplin, M. E., Baudin, E., Ferolla, P., Filosso, P., Garcia-Yuste, M., Lim, E., . . . participants, E. c. c. (2015). Pulmonary neuroendocrine (carcinoid) tumors: European Neuroendocrine Tumor Society expert consensus and recommendations for best practice for typical and atypical pulmonary carcinoids. Ann Oncol. doi:10.1093/annonc/mdv041
Cardillo, G., Sera, F., Di Martino, M., Graziano, P., Giunti, R., Carbone, L., . . . Martelli, M. (2004). Bronchial carcinoid tumors: nodal status and long-term survival after resection. Ann Thorac Surg, 77(5), 1781-1785. doi:10.1016/j.athoracsur.2003.10.089
Carter, B. W., Benveniste, M. F., Madan, R., Godoy, M. C., de Groot, P. M., Truong, M. T., . . . Marom, E. M. (2017). ITMIG Classification of Mediastinal Compartments and Multidisciplinary Approach to Mediastinal Masses. Radiographics, 37(2), 413-436. doi:10.1148/rg.2017160095
Carter, B. W., Benveniste, M. F., Madan, R., Godoy, M. C., Groot, P. M., Truong, M. T., . . . Marom, E. M. (2017). IASLC/ITMIG Staging System and Lymph Node Map for Thymic Epithelial Neoplasms. Radiographics, 37(3), 758-776. doi:10.1148/rg.2017160096
Cascone, T., Awad, M. M., Spicer, J. D., He, J., Lu, S., Sepesi, B., . . . Investigators, C. T. (2024). Perioperative Nivolumab in Resectable Lung Cancer. N Engl J Med, 390(19), 1756-1769. doi:10.1056/NEJMoa2311926
Castello, A., Rossi, S., & Lopci, E. (2020). 18F-FDG PET/CT in Restaging and Evaluation of Response to Therapy in Lung Cancer: State of the Art. Curr Radiopharm, 13(3), 228-237. doi:10.2174/1874471013666191230144821
Cavaliere, S., Venuta, F., Foccoli, P., Toninelli, C., & La Face, B. (1996). Endoscopic treatment of malignant airway obstructions in 2,008 patients. Chest, 110(6), 1536-1542.
Cañizares, M. A., Matilla, J. M., Cueto, A., Algar, J., Muguruza, I., Moreno-Mata, N., . . . Members, E.-S. (2014). Atypical carcinoid tumours of the lung: prognostic factors and patterns of recurrence. Thorax, 69(7), 648-653. doi:10.1136/thoraxjnl-2013-204102
Chakrabarty, N., Mahajan, A., Patil, V., Noronha, V., & Prabhash, K. (2023). Imaging of brain metastasis in non-small-cell lung cancer: indications, protocols, diagnosis, post-therapy imaging, and implications regarding management. Clin Radiol, 78(3), 175-186. doi:10.1016/j.crad.2022.09.134
Chandrasekar, D., Tribett, E., & Ramchandran, K. (2016). Integrated Palliative Care and Oncologic Care in Non-Small-Cell Lung Cancer. Curr Treat Options Oncol, 17(5), 23. doi:10.1007/s11864-016-0397-1
Chang, J. Y., Senan, S., Paul, M. A., Mehran, R. J., Louie, A. V., Balter, P., . . . Roth, J. A. (2015). Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Oncol. doi:10.1016/S1470-2045(15)70168-3
Chapel, D. B., Schulte, J. J., Husain, A. N., & Krausz, T. (2020). Application of immunohistochemistry in diagnosis and management of malignant mesothelioma. Transl Lung Cancer Res, 9(Suppl 1), S3-S27. doi:10.21037/tlcr.2019.11.29
Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. Non-small Cell Lung Cancer Collaborative Group. (1995). BMJ, 311(7010), 899-909.
Chen, G., Huynh, M., Chen, A., Fehrenbacher, L., Gandara, D., & Lau, D. (2008). Chemotherapy for brain metastases in small-cell lung cancer. Clin Lung Cancer, 9(1), 35-38.
Chen, G., Huynh, M., Fehrenbacher, L., West, H., Lara, P. N., Yavorkovsky, L. L., . . . Lau, D. (2009). Phase II trial of irinotecan and carboplatin for extensive or relapsed small-cell lung cancer. J Clin Oncol, 27(9), 1401-1404. doi:10.1200/JCO.2008.20.2127
Chen, L., Shen, C., Redmond, K. J., Page, B. R., Kummerlowe, M., Mcnutt, T., . . . Kleinberg, L. (2017). Use of Stereotactic Radiosurgery in Elderly and Very Elderly Patients With Brain Metastases to Limit Toxicity Associated With Whole Brain Radiation Therapy. Int J Radiat Oncol Biol Phys, 98(4), 939-947. doi:10.1016/j.ijrobp.2017.02.031
Cheng, S., Evans, W. K., Stys-Norman, D., & Shepherd, F. A. (2007). Chemotherapy for relapsed small cell lung cancer: a systematic review and practice guideline. J Thorac Oncol, 2(4), 348-354.
Cherny, N. I., Catane, R., Kosmidis, P., & Care, E. T. o. S. a. P. (2003). ESMO takes a stand on supportive and palliative care. Ann Oncol, 14(9), 1335-1337. doi:10.1093/annonc/mdg379
Chiu, C. H., Chern, M. S., Wu, M. H., Hsu, W. H., Wu, Y. C., Huang, M. H., & Chang, S. C. (2003). Usefulness of low-dose spiral CT of the chest in regular follow-up of postoperative non-small cell lung cancer patients: Preliminary report. J Thorac Cardiovasc Surg, 125(6), 1300-1305.
Cho, J., Kim, H. S., Ku, B. M., Choi, Y. L., Cristescu, R., Han, J., . . . Ahn, M. J. (2018). Pembrolizumab for Patients With Refractory or Relapsed Thymic Epithelial Tumor: An Open-Label Phase II Trial. J Clin Oncol, JCO2017773184. doi:10.1200/JCO.2017.77.3184
Cho, J. H., Lim, S. H., An, H. J., Kim, K. H., Park, K. U., Kang, E. J., . . . Ahn, M. J. (2020). Osimertinib for Patients With Non-Small-Cell Lung Cancer Harboring Uncommon EGFR Mutations: A Multicenter, Open-Label, Phase II Trial (KCSG-LU15-09). J Clin Oncol, 38(5), 488-495. doi:10.1200/JCO.19.00931
Christensen, N. L., Jekunen, A., Heinonen, S., Dalton, S. O., & Rasmussen, T. R. (2017). Lung cancer guidelines in Sweden, Denmark, Norway and Finland: a comparison. Acta Oncol, 56(7), 943-948. doi:10.1080/0284186X.2017.1315172
Chung, H. C., Piha-Paul, S. A., Lopez-Martin, J., Schellens, J. H. M., Kao, S., Miller, W. H., . . . Ott, P. A. (2020). Pembrolizumab After Two or More Lines of Previous Therapy in Patients With Recurrent or Metastatic SCLC: Results From the KEYNOTE-028 and KEYNOTE-158 Studies. J Thorac Oncol, 15(4), 618-627. doi:10.1016/j.jtho.2019.12.109
Ciuleanu, T., Stelmakh, L., Cicenas, S., Miliauskas, S., Grigorescu, A. C., Hillenbach, C., . . . Gonzalez, E. E. (2012). Efficacy and safety of erlotinib versus chemotherapy in second-line treatment of patients with advanced, non-small-cell lung cancer with poor prognosis (TITAN): a randomised multicentre, open-label, phase 3 study. Lancet Oncol, 13(3), 300-308. doi:10.1016/S1470-2045(11)70385-0
Colt, H. G., Murgu, S. D., Korst, R. J., Slatore, C. G., Unger, M., & Quadrelli, S. (2013). Follow-up and surveillance of the patient with lung cancer after curative-intent therapy: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest, 143(5 Suppl), e437S-454S. doi:10.1378/chest.12-2365
Crona, J., Fanola, I., Lindholm, D. P., Antonodimitrakis, P., Öberg, K., Eriksson, B., & Granberg, D. (2013). Effect of temozolomide in patients with metastatic bronchial carcinoids. Neuroendocrinology, 98(2), 151-155. doi:10.1159/000354760
Cuffe, S., Booth, C. M., Peng, Y., Darling, G. E., Li, G., Kong, W., . . . Shepherd, F. A. (2012). Adjuvant chemotherapy for non-small-cell lung cancer in the elderly: a population-based study in Ontario, Canada. J Clin Oncol, 30(15), 1813-1821. doi:10.1200/JCO.2011.39.3330
Dagogo-Jack, I., Moonsamy, P., Gainor, J. F., Lennerz, J. K., Piotrowska, Z., Lin, J. J., . . . Heist, R. S. (2021). A Phase 2 Study of Capmatinib in Patients With MET-Altered Lung Cancer Previously Treated With a MET Inhibitor. J Thorac Oncol, 16(5), 850-859. doi:10.1016/j.jtho.2021.01.1605
Dam, G., Grønbæk, H., Sundlöv, A., Botling, J., Sundin, A., Petersen, R. H., . . . Langer, S. W. (2023). Nordic 2023 guidelines for the diagnosis and treatment of lung neuroendocrine neoplasms. Acta Oncol, 62(5), 431-437. doi:10.1080/0284186x.2023.2212411
Damirov, F., Büsing, K., Yavuz, G., Hatz, R., Manapov, F., Michels, J., . . . Roessner, E. (2023). Preoperative Hilar and Mediastinal Lymph Node Staging in Patients with Suspected or Diagnosed Lung Cancer: Accuracy of 18F-FDG-PET/CT:A Retrospective Cohort Study of 138 Patients. Diagnostics (Basel), 13(3). doi:10.3390/diagnostics13030403
Damirov, F., Stoleriu, M. G., Manapov, F., Büsing, K., Michels, J. D., Preissler, G., . . . Roessner, E. D. (2023). Histology of the Primary Tumor Correlates with False Positivity of Integrated 18F-FDG-PET/CT Lymph Node Staging in Resectable Lung Cancer Patients. Diagnostics (Basel), 13(11). doi:10.3390/diagnostics13111893
de Alencar, V. T. L., Formiga, M. N., & de Lima, V. C. C. (2020). Inherited lung cancer: a review. Ecancermedicalscience, 14, 1008. doi:10.3332/ecancer.2020.1008
de Koning, H. J., van der Aalst, C. M., de Jong, P. A., Scholten, E. T., Nackaerts, K., Heuvelmans, M. A., . . . Oudkerk, M. (2020). Reduced Lung-Cancer Mortality with Volume CT Screening in a Randomized Trial. N Engl J Med, 382(6), 503-513. doi:10.1056/NEJMoa1911793
De Leyn, P., Dooms, C., Kuzdzal, J., Lardinois, D., Passlick, B., Rami-Porta, R., . . . Zielinski, M. (2014). Revised ESTS guidelines for preoperative mediastinal lymph node staging for non-small-cell lung cancer. Eur J Cardiothorac Surg. doi:10.1093/ejcts/ezu028
de Perrot, M., Feld, R., Cho, B. C., Bezjak, A., Anraku, M., Burkes, R., . . . Johnston, M. R. (2009). Trimodality therapy with induction chemotherapy followed by extrapleural pneumonectomy and adjuvant high-dose hemithoracic radiation for malignant pleural mesothelioma. J Clin Oncol, 27(9), 1413-1418. doi:10.1200/JCO.2008.17.5604
De Ruysscher, D., Botterweck, A., Dirx, M., Pijls-Johannesma, M., Wanders, R., Hochstenbag, M., . . . Lambin, P. (2009). Eligibility for concurrent chemotherapy and radiotherapy of locally advanced lung cancer patients: a prospective, population-based study. Ann Oncol, 20(1), 98-102. doi:10.1093/annonc/mdn559
De Ruysscher, D., Nakagawa, K., & Asamura, H. (2014). Surgical and nonsurgical approaches to small-size nonsmall cell lung cancer. Eur Respir J, 44(2), 483-494. doi:10.1183/09031936.00020214
De Ruysscher, D., & Slotman, B. (2003). Treatment of intervention sites of malignant pleural mesothelioma with radiotherapy: a Dutch-Belgian survey. Radiotherapy and Oncology, 68(3), 299-302.
Desai, R., Koipallil, G. K., Thomas, N., Mhaskar, R., Visweshwar, N., Laber, D., . . . Jaglal, M. (2020). Efficacy and safety of direct oral anticoagulants for secondary prevention of cancer associated thrombosis: a meta-analysis of randomized controlled trials. Sci Rep, 10(1), 18945. doi:10.1038/s41598-020-75863-3
Detterbeck, F. C. (2010). Management of carcinoid tumors. Ann Thorac Surg, 89(3), 998-1005. doi:10.1016/j.athoracsur.2009.07.097
Detterbeck, F. C., Nicholson, A. G., Franklin, W. A., Marom, E. M., Travis, W. D., Girard, N., . . . Institutions, P. (2016). The IASLC Lung Cancer Staging Project: Summary of Proposals for Revisions of the Classification of Lung Cancers with Multiple Pulmonary Sites of Involvement in the Forthcoming Eighth Edition of the TNM Classification. J Thorac Oncol, 11(5), 639-650. doi:10.1016/j.jtho.2016.01.024
Detterbeck, F. C., Nicholson, A. G., Kondo, K., Van Schil, P., & Moran, C. (2011). The Masaoka-Koga stage classification for thymic malignancies: clarification and definition of terms. J Thorac Oncol, 6(7 Suppl 3), S1710-1716. doi:10.1097/JTO.0b013e31821e8cff
Dingemans, A. C., Hendriks, L. E. L., Berghmans, T., Levy, A., Hasan, B., Faivre-Finn, C., . . . Novello, S. (2019). Definition of Synchronous Oligometastatic Non-Small Cell Lung Cancer-A Consensus Report. J Thorac Oncol, 14(12), 2109-2119. doi:10.1016/j.jtho.2019.07.025
Doebele, R. C., Drilon, A., Paz-Ares, L., Siena, S., Shaw, A. T., Farago, A. F., . . . investigators, t. (2020). Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials. Lancet Oncol, 21(2), 271-282. doi:10.1016/S1470-2045(19)30691-6
Doebele, R. C., Perez, L., Trinh, H., Martinec, M., Martina, R., Riehl, T., . . . Crane, G. (2021). Comparative effectiveness analysis between entrectinib clinical trial and crizotinib real-world data in. J Comp Eff Res, 10(17), 1271-1282. doi:10.2217/cer-2021-0131
Dominioni, L., Rotolo, N., Mantovani, W., Poli, A., Pisani, S., Conti, V., . . . Imperatori, A. (2012). A population-based cohort study of chest x-ray screening in smokers: lung cancer detection findings and follow-up. BMC Cancer, 12, 18. doi:10.1186/1471-2407-12-18
Drilon, A., Oxnard, G. R., Tan, D. S. W., Loong, H. H. F., Johnson, M., Gainor, J., . . . Subbiah, V. (2020). Efficacy of Selpercatinib in in RET Fusion-Positive Non-Small-Cell Lung Cancer. N Engl J Med, 383(9), 813-824. doi:10.1056/NEJMoa2005653
Drilon, A., Siena, S., Dziadziuszko, R., Barlesi, F., Krebs, M. G., Shaw, A. T., . . . investigators, t. (2020). Entrectinib in ROS1 fusion-positive non-small-cell lung cancer: integrated analysis of three phase 1-2 trials. Lancet Oncol, 21(2), 261-270. doi:10.1016/S1470-2045(19)30690-4
Drilon, A., Siena, S., Ou, S. I., Patel, M., Ahn, M. J., Lee, J., . . . De Braud, F. G. (2017). Safety and Antitumor Activity of the Multitargeted Pan-TRK, ROS1, and ALK Inhibitor Entrectinib: Combined Results from Two Phase I Trials (ALKA-372-001 and STARTRK-1). Cancer Discov, 7(4), 400-409. doi:10.1158/2159-8290.CD-16-1237
Drilon, A., Subbiah, V., Gautschi, O., Tomasini, P., de Braud, F., Solomon, B. J., . . . Besse, B. (2023). Selpercatinib in Patients With RET fusion–positive non–small-cell lung cancer: updated safety and efficacy from the registrational LIBRETTO-001 phase I/II trial. J Clin Oncol, 41(2), 385-394. doi:10.1200/JCO.22.00393
Dunne, E. G., Fick, C. N., & Jones, D. R. (2023). Mediastinal Staging in Non-Small-Cell Lung Cancer: Saying Goodbye to Mediastinoscopy. J Clin Oncol, 41(22), 3785-3790. doi:10.1200/JCO.23.00867
Dziadziuszko, R., Krebs, M. G., De Braud, F., Siena, S., Drilon, A., Doebele, R. C., . . . Barlesi, F. (2021). Updated Integrated Analysis of the Efficacy and Safety of Entrectinib in Locally Advanced or Metastatic. J Clin Oncol, 39(11), 1253-1263. doi:10.1200/JCO.20.03025
Eblan, M. J., Corradetti, M. N., Lukens, J. N., Xanthopoulos, E., Mitra, N., Christodouleas, J. P., . . . Apisarnthanarax, S. (2013). Brachial plexopathy in apical non-small cell lung cancer treated with definitive radiation: dosimetric analysis and clinical implications. Int J Radiat Oncol Biol Phys, 85(1), 175-181. doi:10.1016/j.ijrobp.2012.03.051
Edvardsen, E., Skjønsberg, O. H., Holme, I., Nordsletten, L., Borchsenius, F., & Anderssen, S. A. (2015). High-intensity training following lung cancer surgery: a randomised controlled trial. Thorax, 70(3), 244-250. doi:10.1136/thoraxjnl-2014-205944
Eguren-Santamaria, I., Sanmamed, M. F., Goldberg, S. B., Kluger, H. M., Idoate, M. A., Lu, B. Y., . . . Gil-Bazo, I. (2020). PD-1/PD-L1 Blockers in NSCLC Brain Metastases: Challenging Paradigms and Clinical Practice. Clin Cancer Res, 26(16), 4186-4197. doi:10.1158/1078-0432.CCR-20-0798
Eide, I. J. Z., Stensgaard, S., Helland, Å., Ekman, S., Mellemgaard, A., Hansen, K. H., . . . Brustugun, O. T. (2022). Osimertinib in non-small cell lung cancer with uncommon EGFR-mutations: a post-hoc subgroup analysis with pooled data from two phase II clinical trials. Transl Lung Cancer Res, 11(6), 953-963. doi:10.21037/tlcr-21-995
El Zarif, T., Nassar, A. H., Adib, E., Fitzgerald, B. G., Huang, J., Mouhieddine, T. H., . . . Naqash, A. R. (2023). Safety and Activity of Immune Checkpoint Inhibitors in People Living With HIV and Cancer: A Real-World Report From the Cancer Therapy Using Checkpoint Inhibitors in People Living With HIV-International (CATCH-IT) Consortium. J Clin Oncol, 41(21), 3712-3723. doi:10.1200/JCO.22.02459
El-Sherief, A. H., Lau, C. T., Carter, B. W., & Wu, C. C. (2018). Staging Lung Cancer: Regional Lymph Node Classification. Radiol Clin North Am, 56(3), 399-409. doi:10.1016/j.rcl.2018.01.008
Ellis, P., Davies, A. M., Evans, W. K., Haynes, A. E., Lloyd, N. S., & Care, L. C. D. S. G. o. C. C. O. s. P. i. E.-b. (2006). The use of chemotherapy in patients with advanced malignant pleural mesothelioma: a systematic review and practice guideline. J Thorac Oncol, 1(6), 591-601.
Ernst, A., Feller-Kopman, D., Becker, H. D., & Mehta, A. C. (2004). Central airway obstruction. Am J Respir Crit Care Med, 169(12), 1278-1297.
Eze, C., Käsmann, L., & Manapov, F. (2019). Redefining the Role of Prophylactic Cranial Irradiation in the Modern Era of Active Surveillance in Small Cell Lung Cancer. JAMA Oncol, 5(1), 11-12. doi:10.1001/jamaoncol.2018.4833
Fairchild, A., Harris, K., Barnes, E., Wong, R., Lutz, S., Bezjak, A., . . . Chow, E. (2008). Palliative thoracic radiotherapy for lung cancer: a systematic review. J Clin Oncol, 26(24), 4001-4011.
Faivre-Finn, C., Snee, M., Ashcroft, L., Appel, W., Barlesi, F., Bhatnagar, A., . . . Team, C. S. (2017). Concurrent once-daily versus twice-daily chemoradiotherapy in patients with limited-stage small-cell lung cancer (CONVERT): an open-label, phase 3, randomised, superiority trial. Lancet Oncol, 18(8), 1116-1125. doi:10.1016/S1470-2045(17)30318-2
Falcoz, P. E., Puyraveau, M., Thomas, P. A., Decaluwe, H., Hürtgen, M., Petersen, R. H., . . . Group, E. D. C. a. E. M. I. I. (2015). Video-assisted thoracoscopic surgery versus open lobectomy for primary non-small-cell lung cancer: a propensity-matched analysis of outcome from the European Society of Thoracic Surgeon database. Eur J Cardiothorac Surg. doi:10.1093/ejcts/ezv154
Falk, S. J., Girling, D. J., White, R. J., Hopwood, P., Harvey, A., Qian, W., & Stephens, R. J. (2002). Immediate versus delayed palliative thoracic radiotherapy in patients with unresectable locally advanced non-small cell lung cancer and minimal thoracic symptoms: randomised controlled trial. BMJ, 325(7362), 465-465.
Falkson, C. B., Bezjak, A., Darling, G., Gregg, R., Malthaner, R., Maziak, D. E., . . . Care, L. C. D. S. G. o. C. C. O. s. P. i. E.-B. (2009). The management of thymoma: a systematic review and practice guideline. J Thorac Oncol, 4(7), 911-919.
Falkson, C. B., Vella, E. T., Ellis, P. M., Maziak, D. E., Ung, Y. C., & Yu, E. (2022). Surgical, Radiation, and Systemic Treatments of Patients with Thymic Epithelial Tumours: A Clinical Practice Guideline. J Thorac Oncol. doi:10.1016/j.jtho.2022.08.007
Fehrenbacher, L., Spira, A., Ballinger, M., Kowanetz, M., Vansteenkiste, J., Mazieres, J., . . . Group, P. S. (2016). Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet, 387(10030), 1837-1846. doi:10.1016/S0140-6736(16)00587-0
Felip, E., Altorki, N., Zhou, C., Csőszi, T., Vynnychenko, I., Goloborodko, O., . . . Investigators, I. (2021). Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet. doi:10.1016/S0140-6736(21)02098-5
Felip, E., Rosell, R., Maestre, J. A., Rodríguez-Paniagua, J. M., Morán, T., Astudillo, J., . . . Group, S. L. C. (2010). Preoperative chemotherapy plus surgery versus surgery plus adjuvant chemotherapy versus surgery alone in early-stage non-small-cell lung cancer. J Clin Oncol, 28(19), 3138-3145. doi:10.1200/JCO.2009.27.6204
Felip, E., Shaw, A. T., Bearz, A., Camidge, D. R., Solomon, B. J., Bauman, J. R., . . . Besse, B. (2021). Intracranial and extracranial efficacy of lorlatinib in patients with ALK-positive non-small-cell lung cancer previously treated with second-generation ALK TKIs. Ann Oncol, 32(5), 620-630. doi:10.1016/j.annonc.2021.02.012
Fennell, D. A., Ewings, S., Ottensmeier, C., Califano, R., Hanna, G. G., Hill, K., . . . investigators, C. t. (2021). Nivolumab versus placebo in patients with relapsed malignant mesothelioma (CONFIRM): a multicentre, double-blind, randomised, phase 3 trial. Lancet Oncol, 22(11), 1530-1540. doi:10.1016/S1470-2045(21)00471-X
Ferguson, M. K., & Lehman, A. G. (2003). Sleeve lobectomy or pneumonectomy: optimal management strategy using decision analysis techniques. Ann Thorac Surg, 76(6), 1782-1788.
Ferlay, J., Colombet, M., Soerjomataram, I., Parkin, D. M., Piñeros, M., Znaor, A., & Bray, F. (2021). Cancer statistics for the year 2020: An overview. Int J Cancer. doi:10.1002/ijc.33588
Fernandez-Cuesta, L., Peifer, M., Lu, X., Sun, R., Ozretić, L., Seidel, D., . . . Thomas, R. K. (2014). Frequent mutations in chromatin-remodelling genes in pulmonary carcinoids. Nat Commun, 5, 3518. doi:10.1038/ncomms4518
Ferrara, M. G., Stefani, A., Simbolo, M., Pilotto, S., Martini, M., Lococo, F., . . . Bria, E. (2021). Large Cell Neuro-Endocrine Carcinoma of the Lung: Current Treatment Options and Potential Future Opportunities. Front Oncol, 11, 650293. doi:10.3389/fonc.2021.650293
Ferris, F. D., Bruera, E., Cherny, N., Cummings, C., Currow, D., Dudgeon, D., . . . Von Roenn, J. H. (2009). Palliative cancer care a decade later: accomplishments, the need, next steps -- from the American Society of Clinical Oncology. J Clin Oncol, 27(18), 3052-3058. doi:10.1200/JCO.2008.20.1558
Filosso, P. L., Oliaro, A., Ruffini, E., Bora, G., Lyberis, P., Asioli, S., . . . Guerrera, F. (2013). Outcome and prognostic factors in bronchial carcinoids: a single-center experience. J Thorac Oncol, 8(10), 1282-1288. doi:10.1097/JTO.0b013e31829f097a
Filosso, P. L., Yao, X., Ruffini, E., Ahmad, U., Antonicelli, A., Huang, J., . . . Korst, R. (2016). Comparison of outcomes between neuroendocrine thymic tumours and other subtypes of thymic carcinomas: a joint analysis of the European Society of Thoracic Surgeons and the International Thymic Malignancy Interest Group. Eur J Cardiothorac Surg, 50(4), 766-771. doi:10.1093/ejcts/ezw107
Fink, G., Krelbaum, T., Yellin, A., Bendayan, D., Saute, M., Glazer, M., & Kramer, M. R. (2001). Pulmonary carcinoid: presentation, diagnosis, and outcome in 142 cases in Israel and review of 640 cases from the literature. Chest, 119(6), 1647-1651.
Fogh, S., & Yom, S. S. (2014). Symptom management during the radiation oncology treatment course: a practical guide for the oncology clinician. Semin Oncol, 41(6), 764-775. doi:10.1053/j.seminoncol.2014.09.020
Folch, E. E., Labarca, G., Ospina-Delgado, D., Kheir, F., Majid, A., Khandhar, S. J., . . . Fernandez-Bussy, S. (2020). Sensitivity and Safety of Electromagnetic Navigation Bronchoscopy for Lung Cancer Diagnosis: Systematic Review and Meta-analysis. Chest, 158(4), 1753-1769. doi:10.1016/j.chest.2020.05.534
Forde, P. M., Spicer, J., & Girard, N. (2022). Neoadjuvant Nivolumab plus Chemotherapy in Lung Cancer. Reply. N Engl J Med, 387(6), 572-573. doi:10.1056/NEJMc2208133
Foster, C. C., Rusthoven, C. G., Sher, D. J., Feldman, L., Pasquinelli, M., Spiotto, M. T., & Koshy, M. (2019). Adjuvant chemotherapy following stereotactic body radiotherapy for early stage non-small-cell lung cancer is associated with lower overall: A National Cancer Database Analysis. Lung Cancer, 130, 162-168. doi:10.1016/j.lungcan.2019.02.023
Francis, S., Orton, A., Stoddard, G., Tao, R., Hitchcock, Y. J., Akerley, W., & Kokeny, K. E. (2017). Sequencing of Postoperative Radiotherapy and Chemotherapy for Locally Advanced or Incompletely Resected Non-Small-Cell Lung Cancer. J Clin Oncol, JCO2017744771. doi:10.1200/JCO.2017.74.4771
Früh, M., De Ruysscher, D., Popat, S., Crinò, L., Peters, S., Felip, E., & Group, E. G. W. (2013). Small-cell lung cancer (SCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 24 Suppl 6, vi99-105. doi:10.1093/annonc/mdt178
Fujii, Y. (2011). Published guidelines for management of thymoma. Thorac Surg Clin, 21(1), 125-129, viii. doi:10.1016/j.thorsurg.2010.08.002
Gadgeel, S. M., Shaw, A. T., Govindan, R., Gandhi, L., Socinski, M. A., Camidge, D. R., . . . Ou, S. I. (2016). Pooled Analysis of CNS Response to Alectinib in Two Studies of Pretreated Patients With ALK-Positive Non-Small-Cell Lung Cancer. J Clin Oncol, 34(34), 4079-4085. doi:10.1200/JCO.2016.68.4639
Gaebe, K., Erickson, A. W., Li, A. Y., Youssef, A. N., Sharma, B., Chan, K. K. W., . . . Das, S. (2024). Re-examining prophylactic cranial irradiation in small cell lung cancer: a systematic review and meta-analysis. EClinicalMedicine, 67, 102396. doi:10.1016/j.eclinm.2023.102396
Gainor, J. F., Curigliano, G., Kim, D. W., Lee, D. H., Besse, B., Baik, C. S., . . . Subbiah, V. (2021). Pralsetinib for RET fusion-positive non-small-cell lung cancer (ARROW): a multi-cohort, open-label, phase 1/2 study. Lancet Oncol, 22(7), 959-969. doi:10.1016/S1470-2045(21)00247-3
Gandhi, L., & Garassino, M. C. (2018). Pembrolizumab plus Chemotherapy in Lung Cancer. N Engl J Med, 379(11), e18. doi:10.1056/NEJMc1808567
Garassino, M. C., Gadgeel, S., Speranza, G., Felip, E., Esteban, E., Dómine, M., . . . Rodríguez-Abreu, D. (2023). Pembrolizumab Plus Pemetrexed and Platinum in Nonsquamous Non-Small-Cell Lung Cancer: 5-Year Outcomes From the Phase 3 KEYNOTE-189 Study. J Clin Oncol, 41(11), 1992-1998. doi:10.1200/JCO.22.01989
Garassino, M. C., Mazieres, J., Reck, M., Chouaid, C., Bischoff, H., Reinmuth, N., . . . Faivre-Finn, C. (2022). Durvalumab After Sequential Chemoradiotherapy in Stage III, Unresectable NSCLC: The Phase 2 PACIFIC-6 Trial. J Thorac Oncol. doi:10.1016/j.jtho.2022.07.1148
Garon, E. B., Ciuleanu, T. E., Arrieta, O., Prabhash, K., Syrigos, K. N., Goksel, T., . . . Pérol, M. (2014). Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage IV non-small-cell lung cancer after disease progression on platinum-based therapy (REVEL): a multicentre, double-blind, randomised phase 3 trial. Lancet, 384(9944), 665-673. doi:10.1016/S0140-6736(14)60845-X
Garon, E. B., Rizvi, N. A., Hui, R., Leighl, N., Balmanoukian, A. S., Eder, J. P., . . . Investigators, K.-. (2015). Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med, 372(21), 2018-2028. doi:10.1056/NEJMoa1501824
Genova, C., Rijavec, E., & Grossi, F. (2016). Hematopoietic growth factors in lung cancer. Curr Opin Oncol, 28(2), 135-144. doi:10.1097/CCO.0000000000000268
George, J., Walter, V., Peifer, M., Alexandrov, L. B., Seidel, D., Leenders, F., . . . Thomas, R. K. (2018). Integrative genomic profiling of large-cell neuroendocrine carcinomas reveals distinct subtypes of high-grade neuroendocrine lung tumors. Nat Commun, 9(1), 1048. doi:10.1038/s41467-018-03099-x
George, R., Jeba, J., Ramkumar, G., Chacko, A. G., & Tharyan, P. (2015). Interventions for the treatment of metastatic extradural spinal cord compression in adults. Cochrane Database Syst Rev(9), CD006716. doi:10.1002/14651858.CD006716.pub3
Gettinger, S., Horn, L., Jackman, D., Spigel, D., Antonia, S., Hellmann, M., . . . Brahmer, J. (2018). Five-Year Follow-Up of Nivolumab in Previously Treated Advanced Non-Small-Cell Lung Cancer: Results From the CA209-003 Study. J Clin Oncol, 36(17), 1675-1684. doi:10.1200/JCO.2017.77.0412
Gibson, A. J. W., Pabani, A., Dean, M. L., Martos, G., Cheung, W. Y., & Navani, V. (2023). Real-World Treatment Patterns and Effectiveness of Targeted and Immune Checkpoint Inhibitor-Based Systemic Therapy in. JTO Clin Res Rep, 4(3), 100460. doi:10.1016/j.jtocrr.2022.100460
Gillespie, C. S., Mustafa, M. A., Richardson, G. E., Alam, A. M., Lee, K. S., Hughes, D. M., . . . Zakaria, R. (2023). Genomic Alterations and the Incidence of Brain Metastases in Advanced and Metastatic NSCLC: A Systematic Review and Meta-Analysis. J Thorac Oncol, 18(12), 1703-1713. doi:10.1016/j.jtho.2023.06.017
Girard, N., Ruffini, E., Marx, A., Faivre-Finn, C., Peters, S., & Committee, E. G. (2015). Thymic epithelial tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 26 Suppl 5, v40-55. doi:10.1093/annonc/mdv277
Gogishvili, M., Melkadze, T., Makharadze, T., Giorgadze, D., Dvorkin, M., Penkov, K., . . . Rietschel, P. (2022). Cemiplimab plus chemotherapy versus chemotherapy alone in non-small cell lung cancer: a randomized, controlled, double-blind phase 3 trial. Nat Med, 28(11), 2374-2380. doi:10.1038/s41591-022-01977-y
Gollard, R., Jhatakia, S., Elliott, M., & Kosty, M. (2010). Large cell/neuroendocrine carcinoma. Lung Cancer, 69(1), 13-18. doi:10.1016/j.lungcan.2009.12.011
Gomes, F., Faivre-Finn, C., Mistry, H., Bezjak, A., Pourel, N., Fournel, P., . . . Blackhall, F. (2021). Safety of G-CSF with concurrent chemo-radiotherapy in limited-stage small cell lung cancer - Secondary analysis of the randomised phase 3 CONVERT trial. Lung Cancer, 153, 165-170. doi:10.1016/j.lungcan.2021.01.025
Gomez, D. R., Tang, C., Zhang, J., Blumenschein, G. R., Hernandez, M., Lee, J. J., . . . Heymach, J. V. (2019). Local Consolidative Therapy Vs. Maintenance Therapy or Observation for Patients With Oligometastatic Non-Small-Cell Lung Cancer: Long-Term Results of a Multi-Institutional, Phase II, Randomized Study. J Clin Oncol, 37(18), 1558-1565. doi:10.1200/JCO.19.00201
Gorenberg, M., Bar-Shalom, R., & Israel, O. (2008). Patterns of FDG uptake in post-thoracotomy surgical scars in patients with lung cancer. Br J Radiol, 81(970), 821-825. doi:10.1259/bjr/26210052
Goto, K., Goto, Y., Kubo, T., Ninomiya, K., Kim, S.-W., Planchard, D., . . . Jänne, P. A. (2023). Trastuzumab Deruxtecan in Patients With HER2-Mutant Metastatic Non–Small-Cell Lung Cancer: Primary Results From the Randomized, Phase II DESTINY-Lung02 Trial. J Clin Oncol, 41(31), 4852–4863.
Gould, M. K., Donington, J., Lynch, W. R., Mazzone, P. J., Midthun, D. E., Naidich, D. P., & Wiener, R. S. (2013). Evaluation of Individuals With Pulmonary Nodules: When Is It Lung Cancer?: Diagnosis and Management of Lung Cancer, 3rd ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest, 143(5 Suppl), e93S-e120S. doi:10.1378/chest.12-2351
Graabak, G., Grønberg, B. H., Sandvei, M. S., Nilssen, Y., & Halvorsen, T. O. (2022). Thoracic Radiotherapy in Limited-Stage SCLC-a Population-Based Study of Patterns of Care in Norway From 2000 Until 2018. JTO Clin Res Rep, 3(2), 100270. doi:10.1016/j.jtocrr.2021.100270
Granberg, D., Eriksson, B., Wilander, E., Grimfjärd, P., Fjällskog, M. L., Oberg, K., & Skogseid, B. (2001). Experience in treatment of metastatic pulmonary carcinoid tumors. Ann Oncol, 12(10), 1383-1391.
Grassi, L., Nanni, M. G., Rodin, G., Li, M., & Caruso, R. (2018). The use of antidepressants in oncology: a review and practical tips for oncologists. Ann Oncol, 29(1), 101-111. doi:10.1093/annonc/mdx526
Gridelli, C., Ardizzoni, A., Ciardiello, F., Hanna, N., Heymach, J. V., Perrone, F., . . . De Marinis, F. (2008). Second-line treatment of advanced non-small cell lung cancer. J Thorac Oncol, 3(4), 430-440.
Griesinger, F., Curigliano, G., Thomas, M., Subbiah, V., Baik, C. S., Tan, D. S. W., . . . Mazières, J. (2022). Safety and efficacy of pralsetinib in RET fusion-positive non-small-cell lung cancer including as first-line therapy: update from the ARROW trial. Ann Oncol, 33(11), 1168-1178. doi:10.1016/j.annonc.2022.08.002
Grosso, F., Cerbone, L., & Curioni-Fontecedro, A. (2024). MARS 2 trial: the future of pleurectomy decortication in pleural mesothelioma. Lancet Respir Med, 12(6), 423-424. doi:10.1016/S2213-2600(24)00146-2
Grønberg, B. H., Halvorsen, T. O., Fløtten, Ø., Brustugun, O. T., Brunsvig, P. F., Aasebø, U., . . . Group, N. L. C. S. (2016). Randomized phase II trial comparing twice daily hyperfractionated with once daily hypofractionated thoracic radiotherapy in limited disease small cell lung cancer. Acta Oncol, 55(5), 591-597. doi:10.3109/0284186X.2015.1092584
Grønberg, B. H., Killingberg, K. T., Fløtten, Ø., Brustugun, O. T., Hornslien, K., Madebo, T., . . . Halvorsen, T. O. (2021). High-dose versus standard-dose twice-daily thoracic radiotherapy for patients with limited stage small-cell lung cancer: an open-label, randomised, phase 2 trial. Lancet Oncol, 22(3), 321-331. doi:10.1016/S1470-2045(20)30742-7
Grøndahl, V., Binderup, T., Langer, S. W., Petersen, R. H., Nielsen, K., Kjaer, A., . . . Knigge, U. (2019). Characteristics of 252 patients with bronchopulmonary neuroendocrine tumours treated at the Copenhagen NET Centre of Excellence. Lung Cancer, 132, 141-149. doi:10.1016/j.lungcan.2019.03.013
Guckenberger, M., Mantel, F., Gerszten, P. C., Flickinger, J. C., Sahgal, A., Létourneau, D., . . . Kersh, R. (2014). Safety and efficacy of stereotactic body radiotherapy as primary treatment for vertebral metastases: a multi-institutional analysis. Radiat Oncol, 9, 226. doi:10.1186/s13014-014-0226-2
Guisier, F., Dubos-Arvis, C., Viñas, F., Doubre, H., Ricordel, C., Ropert, S., . . . Bylicki, O. (2020). Efficacy and Safety of Anti-PD-1 Immunotherapy in Patients With Advanced NSCLC With BRAF, HER2, or MET Mutations or RET Translocation: GFPC 01-2018. J Thorac Oncol, 15(4), 628-636. doi:10.1016/j.jtho.2019.12.129
Gulstene, S., Ruwanpura, T., Palma, D., & Joseph, N. (2022). Stereotactic Ablative Radiotherapy in the Treatment of Early-Stage Lung Cancer - A Done Deal? Clin Oncol (R Coll Radiol), 34(11), 733-740. doi:10.1016/j.clon.2022.08.027
Ha, D., Mazzone, P. J., Ries, A. L., Malhotra, A., & Fuster, M. (2016). The Utility of Exercise Testing in Patients with Lung Cancer. J Thorac Oncol, 11(9), 1397-1410. doi:10.1016/j.jtho.2016.04.021
Haldorsen, T., Andersen, A., & Boffetta, P. (2004). Smoking-adjusted incidence of lung cancer by occupation among Norwegian men. Cancer Causes Control, 15(2), 139-147. doi:10.1023/B:CACO.0000019485.74818.d6
Hallifax, R. J., Talwar, A., Wrightson, J. M., Edey, A., & Gleeson, F. V. (2017). State-of-the-art: Radiological investigation of pleural disease. Respir Med, 124, 88-99. doi:10.1016/j.rmed.2017.02.013
Hamaji, M., Kojima, F., Omasa, M., Sozu, T., Sato, T., Chen, F., . . . Date, H. (2015). A meta-analysis of debulking surgery versus surgical biopsy for unresectable thymoma. Eur J Cardiothorac Surg, 47(4), 602-607. doi:10.1093/ejcts/ezu277
Hansell, D. M., Bankier, A. A., MacMahon, H., McLoud, T. C., Müller, N. L., & Remy, J. (2008). Fleischner Society: glossary of terms for thoracic imaging. Radiology, 246(3), 697-722. doi:10.1148/radiol.2462070712
Harkenrider, M. M., Bertke, M. H., & Dunlap, N. E. (2014). Stereotactic body radiation therapy for unbiopsied early-stage lung cancer: a multi-institutional analysis. Am J Clin Oncol, 37(4), 337-342. doi:10.1097/COC.0b013e318277d822
Harpole, D. H., Feldman, J. M., Buchanan, S., Young, W. G., & Wolfe, W. G. (1992). Bronchial carcinoid tumors: a retrospective analysis of 126 patients. Ann Thorac Surg, 54(1), 50-54; discussion 54-55.
Hassan, R., Morrow, B., Thomas, A., Walsh, T., Lee, M. K., Gulsuner, S., . . . Churpek, J. E. (2019). Inherited predisposition to malignant mesothelioma and overall survival following platinum chemotherapy. Proc Natl Acad Sci U S A, 116(18), 9008-9013. doi:10.1073/pnas.1821510116
Helbekkmo, N., Sundstrom, S. H., Aasebo, U., Brunsvig, P. F., von Plessen, C., Hjelde, H. H., . . . Bremnes, R. M. (2007). Vinorelbine/carboplatin vs gemcitabine/carboplatin in advanced NSCLC shows similar efficacy, but different impact of toxicity. Br J Cancer, 97(3), 283-289. doi:6603869 [pii] 10.1038/sj.bjc.6603869
Helland, Å., Solberg, S., & Brustugun, O. T. (2012). Incidence and survival of malignant pleural mesothelioma in norway: a population-based study of 1686 cases. J Thorac Oncol, 7(12), 1858-1861. doi:10.1097/JTO.0b013e318275b346
Hendriks, L. E., Hermans, B. C., van den Beuken-van Everdingen, M. H., Hochstenbag, M. M., & Dingemans, A. M. (2016). Effect of Bisphosphonates, Denosumab, and Radioisotopes on Bone Pain and Quality of Life in Patients with Non-Small Cell Lung Cancer and Bone Metastases: A Systematic Review. J Thorac Oncol, 11(2), 155-173. doi:10.1016/j.jtho.2015.10.001
Hendriks, L. E., Kerr, K. M., Menis, J., Mok, T. S., Nestle, U., Passaro, A., . . . clinicalguidelines@esmo.org, E. G. C. E. a. (2023). Non-oncogene-addicted metastatic non-small-cell lung cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol, 34(4), 358-376. doi:10.1016/j.annonc.2022.12.013
Herbst, R. S., Baas, P., Kim, D. W., Felip, E., Pérez-Gracia, J. L., Han, J. Y., . . . Garon, E. B. (2016). Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet, 387(10027), 1540-1550. doi:10.1016/S0140-6736(15)01281-7
Herbst, R. S., Giaccone, G., de Marinis, F., Reinmuth, N., Vergnenegre, A., Barrios, C. H., . . . Spigel, D. R. (2020). Atezolizumab for First-Line Treatment of PD-L1-Selected Patients with NSCLC. N Engl J Med, 383(14), 1328-1339. doi:10.1056/NEJMoa1917346
Herbst, R. S., Wu, Y. L., John, T., Grohe, C., Majem, M., Wang, J., . . . Tsuboi, M. (2023). Adjuvant Osimertinib for Resected EGFR-Mutated Stage IB-IIIA Non-Small-Cell Lung Cancer: Updated Results From the Phase III Randomized ADAURA Trial. J Clin Oncol, 41(10), 1830-1840. doi:10.1200/JCO.22.02186
Herder, G. J., van Tinteren, H., Golding, R. P., Kostense, P. J., Comans, E. F., Smit, E. F., & Hoekstra, O. S. (2005). Clinical prediction model to characterize pulmonary nodules: validation and added value of 18F-fluorodeoxyglucose positron emission tomography. Chest, 128(4), 2490-2496. doi:10.1378/chest.128.4.2490
Heymach, J. V., Harpole, D., Mitsudomi, T., Taube, J. M., Galffy, G., Hochmair, M., . . . Investigators, A. (2023). Perioperative Durvalumab for Resectable Non-Small-Cell Lung Cancer. N Engl J Med, 389(18), 1672-1684. doi:10.1056/NEJMoa2304875
Hishida, T., Nagai, K., Yoshida, J., Nishimura, M., Ishii, G.-i., Iwasaki, M., & Nishiwaki, Y. (2006). Is surgical resection indicated for a solitary non-small cell lung cancer recurrence? J Thorac Cardiovasc Surg, 131(4), 838-842.
Hochmair, M., Weinlinger, C., Schwab, S., Naber, J., Setinek, U., Krenbek, D., . . . Burghuber, O. C. (2019). Treatment of ALK-rearranged non-small-cell lung cancer with brigatinib as second or later lines: real-world observations from a single institution. Anticancer Drugs, 30(7), e0787. doi:10.1097/CAD.0000000000000787
Hollevoet, K., Reitsma, J. B., Creaney, J., Grigoriu, B. D., Robinson, B. W., Scherpereel, A., . . . van Meerbeeck, J. P. (2012). Serum mesothelin for diagnosing malignant pleural mesothelioma: an individual patient data meta-analysis. J Clin Oncol, 30(13), 1541-1549. doi:10.1200/JCO.2011.39.6671
Holsti, L. R., Pyrhonen, S., Kajanti, M., Mantyla, M., Mattson, K., Maasilta, P., & Kivisaari, L. (1997). Altered fractionation of hemithorax irradiation for pleural mesothelioma and failure patterns after treatment. Acta Oncol, 36(4), 397-405.
Hong, D. S., DuBois, S. G., Kummar, S., Farago, A. F., Albert, C. M., Rohrberg, K. S., . . . Drilon, A. (2020). Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol, 21(4), 531-540. doi:10.1016/S1470-2045(19)30856-3
Horn, L., Mansfield, A. S., Szczęsna, A., Havel, L., Krzakowski, M., Hochmair, M. J., . . . Group, I. S. (2018). First-Line Atezolizumab plus Chemotherapy in Extensive-Stage Small-Cell Lung Cancer. N Engl J Med, 379(23), 2220-2229. doi:10.1056/NEJMoa1809064
Hotta, K., Matsuo, K., Ueoka, H., Kiura, K., Tabata, M., & Tanimoto, M. (Writers). (2004). Meta-analysis of randomized clinical trials comparing Cisplatin to Carboplatin in patients with advanced non-small-cell lung cancer. In.
Huang, J., Detterbeck, F. C., Wang, Z., & Loehrer, P. J. (2011). Standard outcome measures for thymic malignancies. J Thorac Oncol, 6(7 Suppl 3), S1691-1697. doi:10.1097/JTO.0b013e3182254ac1
Huber, R. M., Hansen, K. H., Paz-Ares Rodríguez, L., West, H. L., Reckamp, K. L., Leighl, N. B., . . . Camidge, D. R. (2020). Brigatinib in Crizotinib-Refractory ALK+ NSCLC: 2-Year Follow-up on Systemic and Intracranial Outcomes in the Phase 2 ALTA Trial. J Thorac Oncol, 15(3), 404-415. doi:10.1016/j.jtho.2019.11.004
Hui, D., & Bruera, E. (2016). Integrating palliative care into the trajectory of cancer care. Nat Rev Clin Oncol, 13(3), 159-171. doi:10.1038/nrclinonc.2015.201
Huo, Y. R., Chan, M. V., Habib, A. R., Lui, I., & Ridley, L. (2020). Pneumothorax rates in CT-Guided lung biopsies: a comprehensive systematic review and meta-analysis of risk factors. Br J Radiol, 93(1108), 20190866. doi:10.1259/bjr.20190866
Ignatius Ou, S. H., & Zell, J. A. (2009). The applicability of the proposed IASLC staging revisions to small cell lung cancer (SCLC) with comparison to the current UICC 6th TNM Edition. J Thorac Oncol, 4(3), 300-310. doi:10.1097/JTO.0b013e318194a355
Iyengar, P., Wardak, Z., Gerber, D. E., Tumati, V., Ahn, C., Hughes, R. S., . . . Timmerman, R. D. (2018). Consolidative Radiotherapy for Limited Metastatic Non-Small-Cell Lung Cancer: A Phase 2 Randomized Clinical Trial. JAMA Oncol, 4(1), e173501. doi:10.1001/jamaoncol.2017.3501
Iyoda, A., Hiroshima, K., Moriya, Y., Iwadate, Y., Takiguchi, Y., Uno, T., . . . Yoshino, I. (2009). Postoperative recurrence and the role of adjuvant chemotherapy in patients with pulmonary large-cell neuroendocrine carcinoma. J Thorac Cardiovasc Surg, 138(2), 446-453. doi:10.1016/j.jtcvs.2008.12.037
Jakopovic, M., Bitar, L., Seiwerth, F., Marusic, A., Krpina, K., & Samarzija, M. (2020). Immunotherapy for thymoma. J Thorac Dis, 12(12), 7635-7641. doi:10.21037/jtd-2019-thym-12
Jasper, K., Stiles, B., McDonald, F., & Palma, D. A. (2022). Practical Management of Oligometastatic Non-Small-Cell Lung Cancer. J Clin Oncol, 40(6), 635-641. doi:10.1200/JCO.21.01719
Jennings, A. L., Davies, A. N., Higgins, J. P., Gibbs, J. S., & Broadley, K. E. (2002). A systematic review of the use of opioids in the management of dyspnoea. Thorax, 57(11), 939-944. doi:10.1136/thorax.57.11.939
Jensen, L. H., Osterlind, K., & Rytter, C. (2008). Randomized cross-over study of patient preference for oral or intravenous vinorelbine in combination with carboplatin in the treatment of advanced NSCLC. Lung Cancer, 62(1), 85-91.
Johnson, D. B., Chandra, S., & Sosman, J. A. (2018). Immune Checkpoint Inhibitor Toxicity in 2018. JAMA, 320(16), 1702-1703. doi:10.1001/jama.2018.13995
Johnson, M. L., De Langen, J., Waterhouse, D. M., Mazieres, J., Dingemans, A. C., Mountzios, G., . . . Paz-Ares , L. (2022). Sotorasib versus docetaxel for previously treated non-small cell lung cancer with KRAS G12C mutation: CodeBreaK 200 phase III study. Ann Oncol, 33, S808-S869.
Johnson, P. T., Horton, K. M., & Fishman, E. K. (2009). Adrenal mass imaging with multidetector CT: pathologic conditions, pearls, and pitfalls. Radiographics, 29(5), 1333-1351. doi:10.1148/rg.295095027
Kaasa, S., Loge, J. H., Aapro, M., Albreht, T., Anderson, R., Bruera, E., . . . Lundeby, T. (2018). Integration of oncology and palliative care: a Lancet Oncology Commission. Lancet Oncol, 19(11), e588-e653. doi:10.1016/S1470-2045(18)30415-7
Kadota, K., Suzuki, K., Colovos, C., Sima, C. S., Rusch, V. W., Travis, W. D., & Adusumilli, P. S. (2012). A nuclear grading system is a strong predictor of survival in epitheloid diffuse malignant pleural mesothelioma. Mod Pathol, 25(2), 260-271. doi:10.1038/modpathol.2011.146
Kandathil, A., Kay, F. U., Butt, Y. M., Wachsmann, J. W., & Subramaniam, R. M. (2018). Role of FDG PET/CT in the Eighth Edition of TNM Staging of Non-Small Cell Lung Cancer. Radiographics, 38(7), 2134-2149. doi:10.1148/rg.2018180060
Kandathil, A., & Subramaniam, R. M. (2022). FDG PET/CT for Primary Staging of Lung Cancer and Mesothelioma. Semin Nucl Med, 52(6), 650-661. doi:10.1053/j.semnuclmed.2022.04.011
Kann, B. H., Miccio, J. A., Stahl, J. M., Ross, R., Verma, V., Dosoretz, A. P., . . . Decker, R. H. (2019). Stereotactic body radiotherapy with adjuvant systemic therapy for early-stage non-small cell lung carcinoma: A multi-institutional analysis. Radiother Oncol, 132, 188-196. doi:10.1016/j.radonc.2018.10.017
Kantor, T., & Wakeam, E. (2021). Landmark Trials in the Surgical Management of Mesothelioma. Ann Surg Oncol. doi:10.1245/s10434-021-09589-5
Kauczor, H. U., Bonomo, L., Gaga, M., Nackaerts, K., Peled, N., Prokop, M., . . . (ERS), E. R. S. (2015). ESR/ERS white paper on lung cancer screening. Eur Respir J, 46(1), 28-39. doi:10.1183/09031936.00033015
Kelly, R. J., Sharon, E., & Hassan, R. (2011). Chemotherapy and targeted therapies for unresectable malignant mesothelioma. Lung Cancer, 73(3), 256-263. doi:10.1016/j.lungcan.2011.04.014
Kenmotsu, H., Yamamoto, N., Yamanaka, T., Yoshiya, K., Takahashi, T., Ueno, T., . . . Tsuboi, M. (2020). Randomized Phase III Study of Pemetrexed Plus Cisplatin Versus Vinorelbine Plus Cisplatin for Completely Resected Stage II to IIIA Nonsquamous Non-Small-Cell Lung Cancer. J Clin Oncol, 38(19), 2187-2196. doi:10.1200/JCO.19.02674
Kennedy, L. C., Bhatia, S., Thompson, J. A., & Grivas, P. (2019). Preexisting Autoimmune Disease: Implications for Immune Checkpoint Inhibitor Therapy in Solid Tumors. J Natl Compr Canc Netw, 17(6), 750-757. doi:10.6004/jnccn.2019.7310
Kidane, B., Bott, M., Spicer, J., Backhus, L., Chaft, J., Chudgar, N., . . . Stiles, B. (2023). The American Association for Thoracic Surgery (AATS) 2023 Expert Consensus Document: Staging and multidisciplinary management of patients with early-stage non-small cell lung cancer. J Thorac Cardiovasc Surg, 166(3), 637-654. doi:10.1016/j.jtcvs.2023.04.039
Kim, D. W., Tiseo, M., Ahn, M. J., Reckamp, K. L., Hansen, K. H., Kim, S. W., . . . Camidge, D. R. (2017). Brigatinib in Patients With Crizotinib-Refractory Anaplastic Lymphoma Kinase-Positive Non-Small-Cell Lung Cancer: A Randomized, Multicenter Phase II Trial. J Clin Oncol, 35(22), 2490-2498. doi:10.1200/JCO.2016.71.5904
Kim, M., Suh, C. H., Lee, S. M., Kim, H. C., Aizer, A. A., Yanagihara, T. K., . . . Kim, H. S. (2020). Diagnostic Yield of Staging Brain MRI in Patients with Newly Diagnosed Non-Small Cell Lung Cancer. Radiology, 297(2), 419-427. doi:10.1148/radiol.2020201194
Kodama, K., Doi, O., Higashiyama, M., & Yokouchi, H. (1997). Intentional limited resection for selected patients with T1 N0 M0 non-small-cell lung cancer: a single-institution study. J Thorac Cardiovasc Surg, 114(3), 347-353.
Komaki, R., & Gomez, D. R. (2014). Radiotherapy for Thymic Carcinoma: Adjuvant, Inductive, and Definitive. Front Oncol, 3, 330. doi:10.3389/fonc.2013.00330
Komiya, T., Ravindra, N., & Powell, E. (2021). Role of Immunotherapy in Stage IV Large Cell Neuroendocrine Carcinoma of the Lung. Asian Pac J Cancer Prev, 22(2), 365-370. doi:10.31557/APJCP.2021.22.2.365
Korse, C. M., Taal, B. G., Vincent, A., van Velthuysen, M. L., Baas, P., Buning-Kager, J. C., . . . Bonfrer, J. M. (2012). Choice of tumour markers in patients with neuroendocrine tumours is dependent on the histological grade. A marker study of Chromogranin A, Neuron specific enolase, Progastrin-releasing peptide and cytokeratin fragments. Eur J Cancer, 48(5), 662-671. doi:10.1016/j.ejca.2011.08.012
Korst, R. J., Bezjak, A., Blackmon, S., Choi, N., Fidias, P., Liu, G., . . . Keshavjee, S. (2014). Neoadjuvant chemoradiotherapy for locally advanced thymic tumors: a phase II, multi-institutional clinical trial. J Thorac Cardiovasc Surg, 147(1), 36-44, 46.e31. doi:10.1016/j.jtcvs.2013.08.061
Kozower, B. D., Larner, J. M., Detterbeck, F. C., & Jones, D. R. (2013). Special treatment issues in non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest, 143(5 Suppl), e369S-e399S. doi:10.1378/chest.12-2362
Kreuter, M., Vansteenkiste, J., Fischer, J. R., Eberhardt, W., Zabeck, H., Kollmeier, J., . . . investigators, T. (2013). Randomized phase 2 trial on refinement of early-stage NSCLC adjuvant chemotherapy with cisplatin and pemetrexed versus cisplatin and vinorelbine: the TREAT study. Ann Oncol, 24(4), 986-992. doi:10.1093/annonc/mds578
Krug, L. M., Pass, H. I., Rusch, V. W., Kindler, H. L., Sugarbaker, D. J., Rosenzweig, K. E., . . . Vogelzang, N. J. (2009). Multicenter phase II trial of neoadjuvant pemetrexed plus cisplatin followed by extrapleural pneumonectomy and radiation for malignant pleural mesothelioma. J Clin Oncol, 27(18), 3007-3013. doi:10.1200/JCO.2008.20.3943
Kulke, M. H., Lenz, H. J., Meropol, N. J., Posey, J., Ryan, D. P., Picus, J., . . . Fuchs, C. S. (2008). Activity of sunitinib in patients with advanced neuroendocrine tumors. J Clin Oncol, 26(20), 3403-3410. doi:10.1200/JCO.2007.15.9020
Kumar, A., Weber, M. H., Gokaslan, Z., Wolinsky, J. P., Schmidt, M., Rhines, L., . . . Fisher, C. G. (2017). Metastatic Spinal Cord Compression and Steroid Treatment: A Systematic Review. Clin Spine Surg, 30(4), 156-163. doi:10.1097/BSD.0000000000000528
Lababede, O., & Meziane, M. A. (2018). The Eighth Edition of TNM Staging of Lung Cancer: Reference Chart and Diagrams. Oncologist, 23(7), 844-848. doi:10.1634/theoncologist.2017-0659
Lad, T., Piantadosi, S., Thomas, P., Payne, D., Ruckdeschel, J., & Giaccone, G. (1994). A prospective randomized trial to determine the benefit of surgical resection of residual disease following response of small cell lung cancer to combination chemotherapy. Chest, 106(6 Suppl), 320S-323S.
Lakha, S., Gomez, J. E., Flores, R. M., & Wisnivesky, J. P. (2014). Prognostic significance of visceral pleural involvement in early-stage lung cancer. Chest, 146(6), 1619-1626. doi:10.1378/chest.14-0204
Lamba, N., Muskens, I. S., DiRisio, A. C., Meijer, L., Briceno, V., Edrees, H., . . . Broekman, M. L. (2017). Stereotactic radiosurgery versus whole-brain radiotherapy after intracranial metastasis resection: a systematic review and meta-analysis. Radiat Oncol, 12(1), 106. doi:10.1186/s13014-017-0840-x
Larici, A. R., Franchi, P., Del Ciello, A., Sica, G., Coviello, D., De Waure, C., . . . Manfredi, R. (2021). Role of delayed phase contrast-enhanced CT in the intra-thoracic staging of non-small cell lung cancer (NSCLC): What does it add? Eur J Radiol, 144, 109983. doi:10.1016/j.ejrad.2021.109983
Le Pechoux, C., Pourel, N., Barlesi, F., Lerouge, D., Antoni, D., Lamezec, B., . . . Bardet, A. (2022). Postoperative radiotherapy versus no postoperative radiotherapy in patients with completely resected non-small-cell lung cancer and proven mediastinal N2 involvement (Lung ART): an open-label, randomised, phase 3 trial. Lancet Oncol, 23(1), 104-114. doi:10.1016/S1470-2045(21)00606-9
Le Péchoux, C., Dunant, A., Senan, S., Wolfson, A., Quoix, E., Faivre-Finn, C., . . . Group, P. C. I. P. C. (2009). Standard-dose versus higher-dose prophylactic cranial irradiation (PCI) in patients with limited-stage small-cell lung cancer in complete remission after chemotherapy and thoracic radiotherapy (PCI 99-01, EORTC 22003-08004, RTOG 0212, and IFCT 99-01): a randomised clinical trial. Lancet Oncol, 10(5), 467-474. doi:10.1016/S1470-2045(09)70101-9
Le Péchoux, C., Laplanche, A., Faivre-Finn, C., Ciuleanu, T., Wanders, R., Lerouge, D., . . . Group, P. C. I. P. C. (2011). Clinical neurological outcome and quality of life among patients with limited small-cell cancer treated with two different doses of prophylactic cranial irradiation in the intergroup phase III trial (PCI99-01, EORTC 22003-08004, RTOG 0212 and IFCT 99-01). Ann Oncol, 22(5), 1154-1163. doi:10.1093/annonc/mdq576
Le Treut, J., Sault, M. C., Lena, H., Souquet, P. J., Vergnenegre, A., Le Caer, H., . . . Chouaid, C. (2013). Multicentre phase II study of cisplatin-etoposide chemotherapy for advanced large-cell neuroendocrine lung carcinoma: the GFPC 0302 study. Ann Oncol, 24(6), 1548-1552. doi:10.1093/annonc/mdt009
Lee, S. M., Schulz, C., Prabhash, K., Kowalski, D., Szczesna, A., Han, B., . . . Peters, S. (2023). First-line atezolizumab monotherapy versus single-agent chemotherapy in patients with non-small-cell lung cancer ineligible for treatment with a platinum-containing regimen (IPSOS): a phase 3, global, multicentre, open-label, randomised controlled study. Lancet, 402(10400), 451-463. doi:10.1016/S0140-6736(23)00774-2
Lee, T. H., Marcantonio, E. R., Mangione, C. M., Thomas, E. J., Polanczyk, C. A., Cook, E. F., . . . Goldman, L. (1999). Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation, 100(10), 1043-1049.
Lemaire, A., Nikolic, I., Petersen, T., Haney, J. C., Toloza, E. M., Harpole, D. H., Jr., . . . Burfeind, W. R. (2006). Nine-year single center experience with cervical mediastinoscopy: complications and false negative rate. Ann Thorac Surg, 82(4), 1185-1189; discussion 1189-1190. doi:10.1016/j.athoracsur.2006.05.023
Leonardi, G. C., Gainor, J. F., Altan, M., Kravets, S., Dahlberg, S. E., Gedmintas, L., . . . Awad, M. M. (2018). Safety of Programmed Death-1 Pathway Inhibitors Among Patients With Non-Small-Cell Lung Cancer and Preexisting Autoimmune Disorders. J Clin Oncol, 36(19), 1905-1912. doi:10.1200/JCO.2017.77.0305
Leong, T. L., Loveland, P. M., Gorelik, A., Irving, L., & Steinfort, D. P. (2019). Preoperative Staging by EBUS in cN0/N1 Lung Cancer: Systematic Review and Meta-Analysis. J Bronchology Interv Pulmonol, 26(3), 155-165. doi:10.1097/LBR.0000000000000545
Li, A., Garcia, D. A., Lyman, G. H., & Carrier, M. (2019). Direct oral anticoagulant (DOAC) versus low-molecular-weight heparin (LMWH) for treatment of cancer associated thrombosis (CAT): A systematic review and meta-analysis. Thromb Res, 173, 158-163. doi:10.1016/j.thromres.2018.02.144
Li, X., & Kong, L. (2023). Ultrasound versus computed tomography-guided transthoracic biopsy for pleural and peripheral lung lesions: a systematic review and meta-analysis. Acta Radiol, 64(12), 2999-3008. doi:10.1177/02841851231206349
Li, Y., Chen, W., Xie, F., Huang, R., Liu, X., Xiao, Y., . . . Sun, J. (2023). Novel electromagnetic navigation bronchoscopy system for the diagnosis of peripheral pulmonary nodules: a prospective, multicentre study. Thorax, 78(12), 1197-1205. doi:10.1136/thorax-2022-219664
Li, Y., Yang, F., Huang, Y. Y., & Cao, W. (2022). Comparison between computed tomography-guided core and fine needle lung biopsy: A meta-analysis. Medicine (Baltimore), 101(9), e29016. doi:10.1097/MD.0000000000029016
Liao, X., Liu, M., Li, S., Huang, W., Guo, C., Liu, J., . . . Wang, R. (2023). The value on SUV-derived parameters assessed on (18)F-FDG PET/CT for predicting mediastinal lymph node metastasis in non-small cell lung cancer. BMC Med Imaging, 23(1), 49. doi:10.1186/s12880-023-01004-7
Liao, Z., Lee, J. J., Komaki, R., Gomez, D. R., O'Reilly, M. S., Fossella, F. V., . . . Mohan, R. (2018). Bayesian Adaptive Randomization Trial of Passive Scattering Proton Therapy and Intensity-Modulated Photon Radiotherapy for Locally Advanced Non-Small-Cell Lung Cancer. J Clin Oncol, 36(18), 1813-1822. doi:10.1200/JCO.2017.74.0720
Lim, E., Baldwin, D., Beckles, M., Duffy, J., Entwisle, J., Faivre-Finn, C., . . . Ireland, S. f. C. S. i. G. B. a. (2010). Guidelines on the radical management of patients with lung cancer. Thorax, 65 Suppl 3, iii1-27. doi:10.1136/thx.2010.145938
Lim, E., Waller, D., Lau, K., Steele, J., Pope, A., Ali, C., . . . Investigators, M. (2024). Extended pleurectomy decortication and chemotherapy versus chemotherapy alone for pleural mesothelioma (MARS 2): a phase 3 randomised controlled trial. Lancet Respir Med, 12(6), 457-466. doi:10.1016/S2213-2600(24)00119-X
Lim, S. M., Kim, H. R., Lee, J. S., Lee, K. H., Lee, Y. G., Min, Y. J., . . . Cho, B. C. (2017). Open-Label, Multicenter, Phase II Study of Ceritinib in Patients With Non-Small-Cell Lung Cancer Harboring ROS1 Rearrangement. J Clin Oncol, 35(23), 2613-2618. doi:10.1200/JCO.2016.71.3701
Limonnik, V., Abel, S., Finley, G. G., Long, G. S., & Wegner, R. E. (2020). Factors associated with treatment receipt and overall survival for patients with locally advanced large cell neuroendocrine carcinoma of the lung: A National Cancer Database analysis. Lung Cancer, 150, 107-113. doi:10.1016/j.lungcan.2020.10.001
Lindberg, K., Grozman, V., Karlsson, K., Lindberg, S., Lax, I., Wersäll, P., . . . Lewensohn, R. (2021). The HILUS-Trial-a Prospective Nordic Multicenter Phase 2 Study of Ultracentral Lung Tumors Treated With Stereotactic Body Radiotherapy. J Thorac Oncol, 16(7), 1200-1210. doi:10.1016/j.jtho.2021.03.019
Lisberg, A., Cummings, A., Goldman, J. W., Bornazyan, K., Reese, N., Wang, T., . . . Garon, E. B. (2018). A Phase II Study of Pembrolizumab in EGFR-Mutant, PD-L1+, Tyrosine Kinase Inhibitor Naïve Patients With Advanced NSCLC. J Thorac Oncol, 13(8), 1138-1145. doi:10.1016/j.jtho.2018.03.035
Lock, M. I., Hoyer, M., Bydder, S. A., Okunieff, P., Hahn, C. A., Vichare, A., & Dawson, L. A. (2012). An international survey on liver metastases radiotherapy. Acta Oncol, 51(5), 568-574. doi:10.3109/0284186X.2012.681700
Lococo, F., Guerrera, F., Rena, O., Ampollini, L., Vannucci, J., Bertoglio, P., . . . Ruffini, E. (2022). Accuracy of (18)F-FDG in Detecting Stage I Lung Adenocarcinomas According to IASLC/ATS/ERS Classification. Heart Lung Circ, 31(5), 726-732. doi:10.1016/j.hlc.2021.10.011
Loehrer, P. J., Wang, W., Johnson, D. H., Aisner, S. C., Ettinger, D. S., & Trial, E. C. O. G. P. I. (2004). Octreotide alone or with prednisone in patients with advanced thymoma and thymic carcinoma: an Eastern Cooperative Oncology Group Phase II Trial. J Clin Oncol, 22(2), 293-299. doi:10.1200/JCO.2004.02.047
Lou, F., Huang, J., Sima, C. S., Dycoco, J., Rusch, V., & Bach, P. B. (2013). Patterns of recurrence and second primary lung cancer in early-stage lung cancer survivors followed with routine computed tomography surveillance. J Thorac Cardiovasc Surg, 145(1), 75-81; discussion 81-72. doi:10.1016/j.jtcvs.2012.09.030
Loulergue, P., Alexandre, J., Iurisci, I., Grabar, S., Medioni, J., Ropert, S., . . . Launay, O. (2011). Low immunogenicity of seasonal trivalent influenza vaccine among patients receiving docetaxel for a solid tumour: results of a prospective pilot study. Br J Cancer, 104(11), 1670-1674. doi:10.1038/bjc.2011.142
Louw, A., Panou, V., Szejniuk, W. M., Meristoudis, C., Chai, S. M., van Vliet, C., . . . Røe, O. D. (2022). BAP1 Loss by Immunohistochemistry Predicts Improved Survival to First-Line Platinum and Pemetrexed Chemotherapy for Patients With Pleural Mesothelioma: A Validation Study. J Thorac Oncol, 17(7), 921-930. doi:10.1016/j.jtho.2022.04.008
Lu, S., Kato, T., Dong, X., Ahn, M. J., Quang, L. V., Soparattanapaisarn, N., . . . Investigators, L. T. (2024). Osimertinib after Chemoradiotherapy in Stage III EGFR-Mutated NSCLC. N Engl J Med. doi:10.1056/NEJMoa2402614
Lund-Iversen, M., Grøholt, K. K., Helland, Å., Borgen, E., & Brustugun, O. T. (2015). NUT expression in primary lung tumours. Diagn Pathol, 10, 156. doi:10.1186/s13000-015-0395-9
Lynch, T. J., Bell, D. W., Sordella, R., Gurubhagavatula, S., Okimoto, R. A., Brannigan, B. W., . . . Haber, D. A. (2004). Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. N Engl J Med, 350(21), 2129-2139.
Lyon, A. R., López-Fernández, T., Couch, L. S., Asteggiano, R., Aznar, M. C., Bergler-Klein, J., . . . Group, E. S. D. (2022). 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J, 43(41), 4229-4361. doi:10.1093/eurheartj/ehac244
Mackley, H. B., & Videtic, G. M. (2006). Primary carcinoid tumors of the lung: a role for radiotherapy. Oncology (Williston Park), 20(12), 1537-1543; discussion 1544-1535, 1549.
MacMahon, H., Naidich, D. P., Goo, J. M., Lee, K. S., Leung, A. N. C., Mayo, J. R., . . . Bankier, A. A. (2017). Guidelines for Management of Incidental Pulmonary Nodules Detected on CT Images: From the Fleischner Society 2017. Radiology, 284(1), 228-243. doi:10.1148/radiol.2017161659
Makharadze, T., Gogishvili, M., Melkadze, T., Baramidze, A., Giorgadze, D., Penkov, K., . . . Rietschel, P. (2023). Cemiplimab Plus Chemotherapy Versus Chemotherapy Alone in Advanced NSCLC: 2-Year Follow-Up From the Phase 3 EMPOWER-Lung 3 Part 2 Trial. J Thorac Oncol, 18(6), 755-768. doi:10.1016/j.jtho.2023.03.008
Manohar, S., Thongprayoon, C., Cheungpasitporn, W., Markovic, S. N., & Herrmann, S. M. (2020). Systematic Review of the Safety of Immune Checkpoint Inhibitors Among Kidney Transplant Patients. Kidney Int Rep, 5(2), 149-158. doi:10.1016/j.ekir.2019.11.015
Mao, J., Kocak, Z., Zhou, S., Garst, J., Evans, E. S., Zhang, J., . . . Marks, L. B. (2007). The impact of induction chemotherapy and the associated tumor response on subsequent radiation-related changes in lung function and tumor response. Int J Radiat Oncol Biol Phys, 67(5), 1360-1369. doi:10.1016/j.ijrobp.2006.11.003
Marinaccio, A., Binazzi, A., Cauzillo, G., Cavone, D., Zotti, R. D., Ferrante, P., . . . Tumino, R. (2007). Analysis of latency time and its determinants in asbestos related malignant mesothelioma cases of the Italian register. Eur J Cancer, 43(18), 2722-2728. doi:S0959-8049(07)00748-4 [pii] 10.1016/j.ejca.2007.09.018
Marom, E. M. (2013). Advances in thymoma imaging. J Thorac Imaging, 28(2), 69-80; quiz 81-63. doi:10.1097/RTI.0b013e31828609a0
Martinez-Zayas, G., Molina, S., & Ost, D. E. (2022). Sensitivity and complications of thoracentesis and thoracoscopy: a meta-analysis. Eur Respir Rev, 31(166). doi:10.1183/16000617.0053-2022
Martinou, M., & Gaya, A. (2013). Cardiac complications after radical radiotherapy. Semin Oncol, 40(2), 178-185. doi:10.1053/j.seminoncol.2013.01.007
Marx, A., Chan, J. K. C., Chalabreysse, L., Dacic, S., Detterbeck, F., French, C. A., . . . Ströbel, P. (2022). The 2021 WHO Classification of Tumors of the Thymus and Mediastinum: What Is New in Thymic Epithelial, Germ Cell, and Mesenchymal Tumors? J Thorac Oncol, 17(2), 200-213. doi:10.1016/j.jtho.2021.10.010
Masaoka, A. (2010). Staging system of thymoma. J Thorac Oncol, 5(10 Suppl 4), S304-312. doi:10.1097/JTO.0b013e3181f20c05
Massoth, L. R., Hung, Y. P., Dias-Santagata, D., Onozato, M., Shah, N., Severson, E., . . . Williams, E. A. (2020). Pan-Cancer Landscape Analysis Reveals Recurrent KMT2A- MAML2 Gene Fusion in Aggressive Histologic Subtypes of Thymoma. JCO Precis Oncol, 4. doi:10.1200/PO.19.00288
Matheos, T., Ram, L., & Canelli, R. (2020). Preoperative Evaluation for Thoracic Surgery. Thorac Surg Clin, 30(3), 241-247. doi:10.1016/j.thorsurg.2020.04.003
Matsumoto, R., Takamori, S., Yokoyama, S., Hashiguchi, T., Murakami, D., Yoshiyama, K., . . . Akagi, Y. (2018). Lung function in the late postoperative phase and influencing factors in patients undergoing pulmonary lobectomy. J Thorac Dis, 10(5), 2916-2923. doi:10.21037/jtd.2018.05.27
Mazières, J., Peters, S., Lepage, B., Cortot, A. B., Barlesi, F., Beau-Faller, M., . . . Gautschi, O. (2013). Lung cancer that harbors an HER2 mutation: epidemiologic characteristics and therapeutic perspectives. J Clin Oncol, 31(16), 1997-2003.
McKenna, R. J., Mahtabifard, A., Yap, J., McKenna, R., Fuller, C., Merhadi, A., & Hakimian, B. (2008). Wedge resection and brachytherapy for lung cancer in patients with poor pulmonary function. Ann Thorac Surg, 85(2), 733-736.
Mehrotra, M., D'Cruz, J. R., & Arthur, M. E. (2023). Video-Assisted Thoracoscopy. In StatPearls. Treasure Island (FL).
Mehta, V. (2005). Radiation pneumonitis and pulmonary fibrosis in non-small-cell lung cancer: pulmonary function, prediction, and prevention. Int J Radiat Oncol Biol Phys, 63(1), 5-24. doi:10.1016/j.ijrobp.2005.03.047
Mesko, S., & Gomez, D. (2018). Proton Therapy in Non-small Cell Lung Cancer. Curr Treat Options Oncol, 19(12), 76. doi:10.1007/s11864-018-0588-z
Moertel, C. G., & Hanley, J. A. (1979). Combination chemotherapy trials in metastatic carcinoid tumor and the malignant carcinoid syndrome. Cancer Clin Trials, 2(4), 327-334.
Moertel, C. G., Kvols, L. K., O'Connell, M. J., & Rubin, J. (1991). Treatment of neuroendocrine carcinomas with combined etoposide and cisplatin. Evidence of major therapeutic activity in the anaplastic variants of these neoplasms. Cancer, 68(2), 227-232.
Mok, T. S., Wu, Y. L., Ahn, M. J., Garassino, M. C., Kim, H. R., Ramalingam, S. S., . . . Investigators, A. (2017). Osimertinib or Platinum-Pemetrexed in EGFR T790M-Positive Lung Cancer. N Engl J Med, 376(7), 629-640. doi:10.1056/NEJMoa1612674
Mok, T. S., Wu, Y. L., Thongprasert, S., Yang, C. H., Chu, D. T., Saijo, N., . . . Fukuoka, M. (2009). Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med, 361(10), 947-957.
Mok, T. S. K., Wu, Y. L., Kudaba, I., Kowalski, D. M., Cho, B. C., Turna, H. Z., . . . Investigators, K.-. (2019). Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial. Lancet, 393(10183), 1819-1830. doi:10.1016/S0140-6736(18)32409-7
Mollberg, N. M., & Ferguson, M. K. (2013). Postoperative surveillance for non-small cell lung cancer resected with curative intent: developing a patient-centered approach. Ann Thorac Surg, 95(3), 1112-1121. doi:10.1016/j.athoracsur.2012.09.075
Mulvenna, P., Nankivell, M., Barton, R., Faivre-Finn, C., Wilson, P., McColl, E., . . . Langley, R. E. (2016). Dexamethasone and supportive care with or without whole brain radiotherapy in treating patients with non-small cell lung cancer with brain metastases unsuitable for resection or stereotactic radiotherapy (QUARTZ): results from a phase 3, non-inferiority, randomised trial. Lancet, 388(10055), 2004-2014. doi:10.1016/S0140-6736(16)30825-X
Mynarek, G. K., & Bosse, G. (2016). [Not Available]. Tidsskr Nor Laegeforen, 136(16), 1323-1324. doi:10.4045/tidsskr.16.0684
Naidoo, J., Santos-Zabala, M. L., Iyriboz, T., Woo, K. M., Sima, C. S., Fiore, J. J., . . . Pietanza, M. C. (2016). Large Cell Neuroendocrine Carcinoma of the Lung: Clinico-Pathologic Features, Treatment, and Outcomes. Clin Lung Cancer, 17(5), e121-e129. doi:10.1016/j.cllc.2016.01.003
Nakamura, K., Matsumoto, K., Inoue, C., Matsusue, E., & Fujii, S. (2021). Computed Tomography-guided Lung Biopsy: A Review of Techniques for Reducing the Incidence of Complications. Interv Radiol (Higashimatsuyama), 6(3), 83-92. doi:10.22575/interventionalradiology.2021-0012
Nantavithya, C., Gomez, D. R., Wei, X., Komaki, R., Liao, Z., Lin, S. H., . . . Chang, J. Y. (2018). Phase 2 Study of Stereotactic Body Radiation Therapy and Stereotactic Body Proton Therapy for High-Risk, Medically Inoperable, Early-Stage Non-Small Cell Lung Cancer. Int J Radiat Oncol Biol Phys, 101(3), 558-563. doi:10.1016/j.ijrobp.2018.02.022
Nassar, A. H., Kim, S. Y., Aredo, J. V., Feng, J., Shepherd, F., Xu, C., . . . Goldberg, S. B. (2024). Consolidation Osimertinib Versus Durvalumab Versus Observation After Concurrent Chemoradiation in Unresectable EGFR-Mutant NSCLC: A Multicenter Retrospective Cohort Study. J Thorac Oncol, 19(6), 928-940. doi:10.1016/j.jtho.2024.01.012
Neyman, K., Sundset, A., Naalsund, A., Espinoza, A., Solberg, S., Kongerud, J., & Fosse, E. (2012). Endoscopic treatment of bronchial carcinoids in comparison to surgical resection: a retrospective study. J Bronchology Interv Pulmonol, 19(1), 29-34. doi:10.1097/LBR.0b013e3182446b52
Nezu, K., Kushibe, K., Tojo, T., Takahama, M., & Kitamura, S. (1998). Recovery and limitation of exercise capacity after lung resection for lung cancer. Chest, 113(6), 1511-1516.
Ng, T. L., Narasimhan, N., Gupta, N., Venkatakrishnan, K., Kerstein, D., & Camidge, D. R. (2020). Early-Onset Pulmonary Events Associated With Brigatinib Use in Advanced NSCLC. J Thorac Oncol, 15(7), 1190-1199. doi:10.1016/j.jtho.2020.02.011
Nguyen, Q. N., Chun, S. G., Chow, E., Komaki, R., Liao, Z., Zacharia, R., . . . Lewis, V. O. (2019). Single-Fraction Stereotactic vs Conventional Multifraction Radiotherapy for Pain Relief in Patients With Predominantly Nonspine Bone Metastases: A Randomized Phase 2 Trial. JAMA Oncol. doi:10.1001/jamaoncol.2019.0192
Noonan, C. W. (2017). Environmental asbestos exposure and risk of mesothelioma. Ann Transl Med, 5(11), 234. doi:10.21037/atm.2017.03.74
Nussbaum, D. P., Speicher, P. J., Gulack, B. C., Hartwig, M. G., Onaitis, M. W., D'Amico, T. A., & Berry, M. F. (2015). Defining the role of adjuvant chemotherapy after lobectomy for typical bronchopulmonary carcinoid tumors. Ann Thorac Surg, 99(2), 428-434. doi:10.1016/j.athoracsur.2014.08.030
O'Brien, M. E., Ciuleanu, T. E., Tsekov, H., Shparyk, Y., Cuceviá, B., Juhasz, G., . . . Crofts, T. (2006). Phase III trial comparing supportive care alone with supportive care with oral topotecan in patients with relapsed small-cell lung cancer. J Clin Oncol, 24(34), 5441-5447. doi:10.1200/JCO.2006.06.5821
O'Brien, M. E., Watkins, D., Ryan, C., Priest, K., Corbishley, C., Norton, A., . . . Sayer, R. (2006). A randomised trial in malignant mesothelioma (M) of early (E) versus delayed (D) chemotherapy in symptomatically stable patients: the MED trial. Ann Oncol, 17(2), 270-275. doi:10.1093/annonc/mdj073
O'Rourke, N., Garcia, J. C., Paul, J., Lawless, C., McMenemin, R., & Hill, J. (2007). A randomised controlled trial of intervention site radiotherapy in malignant pleural mesothelioma. Radiother Oncol, 84(1), 18-22.
Oken, M. M., Hocking, W. G., Kvale, P. A., Andriole, G. L., Buys, S. S., Church, T. R., . . . Team, P. P. (2011). Screening by chest radiograph and lung cancer mortality: the Prostate, Lung, Colorectal, and Ovarian (PLCO) randomized trial. JAMA, 306(17), 1865-1873. doi:10.1001/jama.2011.1591
Ostios-Garcia, L., Faig, J., Leonardi, G. C., Adeni, A. E., Subegdjo, S. J., Lydon, C. A., . . . Awad, M. M. (2018). Safety and Efficacy of PD-1 Inhibitors Among HIV-Positive Patients With Non-Small Cell Lung Cancer. J Thorac Oncol, 13(7), 1037-1042. doi:10.1016/j.jtho.2018.03.031
Ou, S. H., Ahn, J. S., De Petris, L., Govindan, R., Yang, J. C., Hughes, B., . . . Kim, D. W. (2016). Alectinib in Crizotinib-Refractory ALK-Rearranged Non-Small-Cell Lung Cancer: A Phase II Global Study. J Clin Oncol, 34(7), 661-668. doi:10.1200/jco.2015.63.9443
Ou, S. I., Nishio, M., Ahn, M. J., Mok, T., Barlesi, F., Zhou, C., . . . Kim, E. S. (2022). Efficacy of Brigatinib in Patients With Advanced ALK-Positive NSCLC Who Progressed on Alectinib or Ceritinib: ALK in Lung Cancer Trial of brigAtinib-2 (ALTA-2). J Thorac Oncol. doi:10.1016/j.jtho.2022.08.018
Owen, D. H., Benner, B., Wei, L., Sukrithan, V., Goyal, A., Zhou, Y., . . . Konda, B. (2022). A phase 2 clinical trial of nivolumab and temozolomide for neuroendocrine neoplasms. Clin Cancer Res. doi:10.1158/1078-0432.CCR-22-1552
Owens, C., Hindocha, S., Lee, R., Millard, T., & Sharma, B. (2023). The lung cancers: staging and response, CT, (18)F-FDG PET/CT, MRI, DWI: review and new perspectives. Br J Radiol, 96(1148), 20220339. doi:10.1259/bjr.20220339
Padda, S. K., Riess, J. W., Schwartz, E. J., Tian, L., Kohrt, H. E., Neal, J. W., . . . Wakelee, H. A. (2015). Diffuse high intensity PD-L1 staining in thymic epithelial tumors. J Thorac Oncol, 10(3), 500-508. doi:10.1097/JTO.0000000000000429
Page, S., Milner-Watts, C., Perna, M., Janzic, U., Vidal, N., Kaudeer, N., . . . O'Brien, M. (2020). Systemic treatment of brain metastases in non-small cell lung cancer. Eur J Cancer, 132, 187-198. doi:10.1016/j.ejca.2020.03.006
Paik, P. K., Felip, E., Veillon, R., Sakai, H., Cortot, A. B., Garassino, M. C., . . . Le, X. (2020). Tepotinib in Non-Small-Cell Lung Cancer with MET Exon 14 Skipping Mutations. N Engl J Med, 383(10), 931-943. doi:10.1056/NEJMoa2004407
Palussière, J., Cazayus, M., Cousin, S., Cabart, M., Chomy, F., Catena, V., & Buy, X. (2021). Is There a Role for Percutaneous Ablation for Early Stage Lung Cancer? What Is the Evidence? Curr Oncol Rep, 23(7), 81. doi:10.1007/s11912-021-01072-4
Pancoast, H. (1932). Superior pulmonary sulcus tumor. JAMA, 99, 1391-1396.
Park, K., Haura, E. B., Leighl, N. B., Mitchell, P., Shu, C. A., Girard, N., . . . Cho, B. C. (2021). Amivantamab in EGFR Exon 20 Insertion-Mutated Non-Small-Cell Lung Cancer Progressing on Platinum Chemotherapy: Initial Results From the CHRYSALIS Phase I Study. J Clin Oncol, 39(30), 3391-3402. doi:10.1200/JCO.21.00662
Patchell, R. A., Tibbs, P. A., Regine, W. F., Payne, R., Saris, S., Kryscio, R. J., . . . Young, B. (2005). Direct decompressive surgical resection in the treatment of spinal cord compression caused by metastatic cancer: a randomised trial. Lancet, 366(9486), 643-648.
Patel, A., Roshkovan, L., McNulty, S., Alley, E., Torigian, D. A., Nachiappan, A. C., . . . Katz, S. I. (2021). Delayed-Phase Enhancement for Evaluation of Malignant Pleural Mesothelioma on Computed Tomography: A Prospective Cohort Study. Clin Lung Cancer, 22(3), 210-217.e211. doi:10.1016/j.cllc.2020.06.002
Patel, N. V., Yu, N. Y., Koroulakis, A., Diwanji, T., Sawant, A., Sio, T. T., & Mohindra, P. (2021). Proton therapy for thoracic malignancies: a review of oncologic outcomes. Expert Rev Anticancer Ther, 21(2), 177-191. doi:10.1080/14737140.2021.1844567
Patel, S. H., Robbins, J. R., Gore, E. M., Bradley, J. D., Gaspar, L. E., Germano, I., . . . Metastases, E. P. o. R. O. B. (2012). ACR Appropriateness Criteria® follow-up and retreatment of brain metastases. Am J Clin Oncol, 35(3), 302-306. doi:10.1097/COC.0b013e31824be246
Payne, C., Larkin, P. J., McIlfatrick, S., Dunwoody, L., & Gracey, J. H. (2013). Exercise and nutrition interventions in advanced lung cancer: a systematic review. Curr Oncol, 20(4), e321-337. doi:10.3747/co.20.1431
Paz-Ares, L., Dvorkin, M., Chen, Y., Reinmuth, N., Hotta, K., Trukhin, D., . . . investigators, C. (2019). Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomised, controlled, open-label, phase 3 trial. Lancet, 394(10212), 1929-1939. doi:10.1016/S0140-6736(19)32222-6
Paz-Ares, L., Luft, A., Vicente, D., Tafreshi, A., Gümüş, M., Mazières, J., . . . Investigators, K.-. (2018). Pembrolizumab plus Chemotherapy for Squamous Non-Small-Cell Lung Cancer. N Engl J Med, 379(21), 2040-2051. doi:10.1056/NEJMoa1810865
Paz-Ares, L., Vicente, D., Tafreshi, A., Robinson, A., Soto Parra, H., Mazières, J., . . . Halmos, B. (2020). A Randomized, Placebo-Controlled Trial of Pembrolizumab Plus Chemotherapy in Patients With Metastatic Squamous NSCLC: Protocol-Specified Final Analysis of KEYNOTE-407. J Thorac Oncol, 15(10), 1657-1669. doi:10.1016/j.jtho.2020.06.015
Pedersen, J. H., Sørensen, J. B., Saghir, Z., Fløtten, Ø., Brustugun, O. T., Ashraf, H., . . . Gudbjartsson, T. (2017). Implementation of lung cancer CT screening in the Nordic countries. Acta Oncol, 56(10), 1249-1257. doi:10.1080/0284186X.2017.1329592
Pelayo Alvarez, M., Gallego Rubio, O., Bonfill Cosp, X., & Agra Varela, Y. (2009). Chemotherapy versus best supportive care for extensive small cell lung cancer. Cochrane Database Syst Rev(4), CD001990. doi:10.1002/14651858.CD001990.pub2
Pencharz, D., Modi, S., Bandyopadhyay, S., Alhun, U., Marchbank, N., Patel, A., & Wagner, T. (2022). Absence of clinical benefit of FDG PET-CT in staging T1 part-solid lung adenocarcinoma. Clin Radiol, 77(3), 195-202. doi:10.1016/j.crad.2021.11.013
Peters, S., Camidge, D. R., Shaw, A. T., Gadgeel, S., Ahn, J. S., Kim, D. W., . . . Investigators, A. T. (2017). Alectinib versus Crizotinib in Untreated ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med. doi:10.1056/NEJMoa1704795
Pignon, J. P., Tribodet, H., Scagliotti, G. V., Douillard, J. Y., Shepherd, F. A., Stephens, R. J., . . . Group, L. C. (2008). Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol, 26(21), 3552-3559. doi:10.1200/JCO.2007.13.9030
Pijls-Johannesma, M. C. G., De Ruysscher, D., Lambin, P., Rutten, I., & Vansteenkiste, J. F. (2005). Early versus late chest radiotherapy for limited stage small cell lung cancer. Cochrane Database Syst Rev(1).
Planchard, D., Besse, B., Groen, H. J., Souquet, P. J., Quoix, E., Baik, C. S., . . . Johnson, B. E. (2016). Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial. Lancet Oncol, 17(7), 984-993. doi:10.1016/S1470-2045(16)30146-2
Planchard, D., Besse, B., Groen, H. J. M., Hashemi, S. M. S., Mazieres, J., Kim, T. M., . . . Johnson, B. E. (2022). Phase 2 Study of Dabrafenib Plus Trametinib in Patients With BRAF V600E-Mutant Metastatic NSCLC: Updated 5-Year Survival Rates and Genomic Analysis. J Thorac Oncol, 17(1), 103-115. doi:10.1016/j.jtho.2021.08.011
Planchard, D., Jänne, P. A., Cheng, Y., Yang, J. C., Yanagitani, N., Kim, S. W., . . . Investigators, F. (2023). Osimertinib with or without Chemotherapy in EGFR-Mutated Advanced NSCLC. N Engl J Med, 389(21), 1935-1948. doi:10.1056/NEJMoa2306434
Planchard, D., Smit, E. F., Groen, H. J. M., Mazieres, J., Besse, B., Helland, Å., . . . Johnson, B. E. (2017). Dabrafenib plus trametinib in patients with previously untreated BRAFV600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol, 18(10), 1307-1316. doi:10.1016/S1470-2045(17)30679-4
Polanski, J., Jankowska-Polanska, B., Rosinczuk, J., Chabowski, M., & Szymanska-Chabowska, A. (2016). Quality of life of patients with lung cancer. Onco Targets Ther, 9, 1023-1028. doi:10.2147/OTT.S100685
Postmus, P. E., Kerr, K. M., Oudkerk, M., Senan, S., Waller, D. A., Vansteenkiste, J., . . . Committee, E. G. (2017). Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 28(suppl_4), iv1-iv21. doi:10.1093/annonc/mdx222
Prelaj, A., Pircher, C. C., Massa, G., Martelli, V., Corrao, G., Lo Russo, G., . . . Rebuzzi, S. E. (2021). Beyond First-Line Immunotherapy: Potential Therapeutic Strategies Based on Different Pattern Progressions: Oligo and Systemic Progression. Cancers (Basel), 13(6). doi:10.3390/cancers13061300
Prosperi, D., Carideo, L., Russo, V. M., Meucci, R., Campagna, G., Lastoria, S., & Signore, A. (2023). A Systematic Review on Combined [(18)F]FDG and (68)Ga-SSA PET/CT in Pulmonary Carcinoid. J Clin Med, 12(11). doi:10.3390/jcm12113719
Pujol, J. L., Greillier, L., Audigier-Valette, C., Moro-Sibilot, D., Uwer, L., Hureaux, J., . . . Souquet, P. J. (2019). A Randomized Non-Comparative Phase II Study of Anti-Programmed Cell Death-Ligand 1 Atezolizumab or Chemotherapy as Second-Line Therapy in Patients With Small Cell Lung Cancer: Results From the IFCT-1603 Trial. J Thorac Oncol, 14(5), 903-913. doi:10.1016/j.jtho.2019.01.008
Radovich, M., Pickering, C. R., Felau, I., Ha, G., Zhang, H., Jo, H., . . . Network, C. G. A. (2018). The Integrated Genomic Landscape of Thymic Epithelial Tumors. Cancer Cell, 33(2), 244-258.e210. doi:10.1016/j.ccell.2018.01.003
Rajan, A., Carter, C. A., Berman, A., Cao, L., Kelly, R. J., Thomas, A., . . . Giaccone, G. (2014). Cixutumumab for patients with recurrent or refractory advanced thymic epithelial tumours: a multicentre, open-label, phase 2 trial. Lancet Oncol, 15(2), 191-200. doi:10.1016/S1470-2045(13)70596-5
Ramalingam, S. S., Vansteenkiste, J., Planchard, D., Cho, B. C., Gray, J. E., Ohe, Y., . . . Investigators, F. (2020). Overall Survival with Osimertinib in Untreated, EGFR-Mutated Advanced NSCLC. N Engl J Med, 382(1), 41-50. doi:10.1056/NEJMoa1913662
Raman, V., Jawitz, O. K., Yang, C. J., Tong, B. C., D'Amico, T. A., Berry, M. F., & Harpole, D. H. (2019). Adjuvant Therapy for Patients With Early Large Cell Lung Neuroendocrine Cancer: A National Analysis. Ann Thorac Surg, 108(2), 377-383. doi:10.1016/j.athoracsur.2019.03.053
Raman, V., Jawitz, O. K., Yang, C. J., Voigt, S. L., Tong, B. C., D'Amico, T. A., & Harpole, D. H. (2019). Outcomes for Surgery in Large Cell Lung Neuroendocrine Cancer. J Thorac Oncol, 14(12), 2143-2151. doi:10.1016/j.jtho.2019.09.005
Rath, J., Mauritz, M., Zulehner, G., Hilger, E., Cetin, H., Kasprian, G., . . . Zimprich, F. (2017). Iodinated contrast agents in patients with myasthenia gravis: a retrospective cohort study. J Neurol, 264(6), 1209-1217. doi:10.1007/s00415-017-8518-8
Reck, M., Popat, S., Reinmuth, N., De Ruysscher, D., Kerr, K. M., Peters, S., & Group, E. G. W. (2014). Metastatic non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 25 Suppl 3, iii27-39. doi:10.1093/annonc/mdu199
Reck, M., Rodríguez-Abreu, D., Robinson, A. G., Hui, R., Csőszi, T., Fülöp, A., . . . Investigators, K.-. (2016). Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med, 375(19), 1823-1833. doi:10.1056/NEJMoa1606774
Reck, M., von Pawel, J., Zatloukal, P., Ramlau, R., Gorbounova, V., Hirsh, V., . . . Group, B. S. (2010). Overall survival with cisplatin-gemcitabine and bevacizumab or placebo as first-line therapy for nonsquamous non-small-cell lung cancer: results from a randomised phase III trial (AVAiL). Ann Oncol, 21(9), 1804-1809. doi:10.1093/annonc/mdq020
Refai, M., Brunelli, A., Salati, M., Pompili, C., Xiumè, F., & Sabbatini, A. (2011). Efficacy of anterior fissureless technique for right upper lobectomies: a case-matched analysis. Eur J Cardiothorac Surg, 39(6), 1043-1046. doi:10.1016/j.ejcts.2010.09.039
Rekhtman, N. (2010). Neuroendocrine tumors of the lung: an update. Arch Pathol Lab Med, 134(11), 1628-1638. doi:10.5858/2009-0583-RAR.1
Rekhtman, N., Desmeules, P., Litvak, A. M., Pietanza, M. C., Santos-Zabala, M. L., Ni, A., . . . Lai, W. C. (2019). Stage IV lung carcinoids: spectrum and evolution of proliferation rate, focusing on variants with elevated proliferation indices. Mod Pathol, 32(8), 1106-1122. doi:10.1038/s41379-019-0248-2
Reveiz, L., Rueda, J. R., & Cardona, A. F. (2012). Palliative endobronchial brachytherapy for non-small cell lung cancer. Cochrane Database Syst Rev, 12, CD004284. doi:10.1002/14651858.CD004284.pub3
Rheinheimer, S., Heussel, C. P., Mayer, P., Gaissmaier, L., Bozorgmehr, F., Winter, H., . . . Christopoulos, P. (2020). Oligoprogressive Non-Small-Cell Lung Cancer under Treatment with PD-(L)1 Inhibitors. Cancers (Basel), 12(4). doi:10.3390/cancers12041046
Ricciuti, B., Dahlberg, S. E., Adeni, A., Sholl, L. M., Nishino, M., & Awad, M. M. (2019). Immune Checkpoint Inhibitor Outcomes for Patients With Non-Small-Cell Lung Cancer Receiving Baseline Corticosteroids for Palliative Versus Nonpalliative Indications. J Clin Oncol, JCO1900189. doi:10.1200/JCO.19.00189
Rieber, J., Schmitt, J., Warth, A., Muley, T., Kappes, J., Eichhorn, F., . . . Rieken, S. (2015). Outcome and prognostic factors of multimodal therapy for pulmonary large-cell neuroendocrine carcinomas. Eur J Med Res, 20, 64. doi:10.1186/s40001-015-0158-9
Rittmeyer, A., Barlesi, F., Waterkamp, D., Park, K., Ciardiello, F., von Pawel, J., . . . Group, O. S. (2017). Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet, 389(10066), 255-265. doi:10.1016/S0140-6736(16)32517-X
Rivera, M. P., Mehta, A. C., & Wahidi, M. M. (2013). Establishing the Diagnosis of Lung Cancer: Diagnosis and Management of Lung Cancer, 3rd ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest, 143(5 Suppl), e142S-165S. doi:10.1378/chest.12-2353
Rogasch, J. M. M., Frost, N., Bluemel, S., Michaels, L., Penzkofer, T., von Laffert, M., . . . Furth, C. (2021). FDG-PET/CT for pretherapeutic lymph node staging in non-small cell lung cancer: A tailored approach to the ESTS/ESMO guideline workflow. Lung Cancer, 157, 66-74. doi:10.1016/j.lungcan.2021.05.003
Rogasch, J. M. M., Hofheinz, F., van Heek, L., Voltin, C. A., Boellaard, R., & Kobe, C. (2022). Influences on PET Quantification and Interpretation. Diagnostics (Basel), 12(2). doi:10.3390/diagnostics12020451
Romi, F. (2011). Thymoma in myasthenia gravis: from diagnosis to treatment. Autoimmune Dis, 2011, 474512. doi:10.4061/2011/474512
Romi, F., Skeie, G. O., Aarli, J. A., & Gilhus, N. E. (2000). Muscle autoantibodies in subgroups of myasthenia gravis patients. J Neurol, 247(5), 369-375.
Ropper, A. E., & Ropper, A. H. (2017). Acute Spinal Cord Compression. N Engl J Med, 376(14), 1358-1369. doi:10.1056/NEJMra1516539
Rosell, R., Carcereny, E., Gervais, R., Vergnenegre, A., Massuti, B., Felip, E., . . . Toracica, S. L. C. G. i. c. w. G. F. d. P.-C. a. A. I. O. (2012). Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol, 13(3), 239-246. doi:10.1016/S1470-2045(11)70393-X
Rosen, L. S., Gordon, D., Tchekmedyian, N. S., Yanagihara, R., Hirsh, V., Krzakowski, M., . . . Seaman, J. (2004). Long-term efficacy and safety of zoledronic acid in the treatment of skeletal metastases in patients with nonsmall cell lung carcinoma and other solid tumors: a randomized, Phase III, double-blind, placebo-controlled trial. Cancer, 100(12), 2613-2621. doi:10.1002/cncr.20308
Rosen, L. S., Gordon, D., Tchekmedyian, S., Yanagihara, R., Hirsh, V., Krzakowski, M., . . . Seaman, J. J. (2003). Zoledronic acid versus placebo in the treatment of skeletal metastases in patients with lung cancer and other solid tumors: a phase III, double-blind, randomized trial--the Zoledronic Acid Lung Cancer and Other Solid Tumors Study Group. J Clin Oncol, 21(16), 3150-3157. doi:10.1200/JCO.2003.04.105
Rossi, G., Cavazza, A., Marchioni, A., Longo, L., Migaldi, M., Sartori, G., . . . Brambilla, E. (2005). Role of chemotherapy and the receptor tyrosine kinases KIT, PDGFRalpha, PDGFRbeta, and Met in large-cell neuroendocrine carcinoma of the lung. J Clin Oncol, 23(34), 8774-8785. doi:10.1200/JCO.2005.02.8233
Rousseau, B., Loulergue, P., Mir, O., Krivine, A., Kotti, S., Viel, E., . . . Tournigand, C. (2012). Immunogenicity and safety of the influenza A H1N1v 2009 vaccine in cancer patients treated with cytotoxic chemotherapy and/or targeted therapy: the VACANCE study. Ann Oncol, 23(2), 450-457. doi:10.1093/annonc/mdr141
Rowell, N. P., & Gleeson, F. V. (2001). Steroids, radiotherapy, chemotherapy and stents for superior vena caval obstruction in carcinoma of the bronchus. Cochrane Database Syst Rev(4), CD001316.
Rubin, L. G., Levin, M. J., Ljungman, P., Davies, E. G., Avery, R., Tomblyn, M., . . . America, I. D. S. o. (2014). 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin Infect Dis, 58(3), e44-100. doi:10.1093/cid/cit684
Rubins, J., Unger, M., Colice, G. L., & Physicians, A. C. o. C. (2007). Follow-up and surveillance of the lung cancer patient following curative intent therapy: ACCP evidence-based clinical practice guideline (2nd edition). Chest, 132(3 Suppl), 355S-367S. doi:10.1378/chest.07-1390
Rudin, C. M., Awad, M. M., Navarro, A., Gottfried, M., Peters, S., Csőszi, T., . . . Investigators, K.-. (2020). Pembrolizumab or Placebo Plus Etoposide and Platinum as First-Line Therapy for Extensive-Stage Small-Cell Lung Cancer: Randomized, Double-Blind, Phase III KEYNOTE-604 Study. J Clin Oncol, 38(21), 2369-2379. doi:10.1200/JCO.20.00793
Rudin, C. M., Ismaila, N., Hann, C. L., Malhotra, N., Movsas, B., Norris, K., . . . Giaccone, G. (2015). Treatment of Small-Cell Lung Cancer: American Society of Clinical Oncology Endorsement of the American College of Chest Physicians Guideline. J Clin Oncol, 33(34), 4106-4111. doi:10.1200/JCO.2015.63.7918
Ruffini, E., Detterbeck, F., Van Raemdonck, D., Rocco, G., Thomas, P., Weder, W., . . . Venuta, F. (2014). Thymic Carcinoma: A Cohort Study of Patients from the European Society of Thoracic Surgeons Database. J Thorac Oncol, 9, 541–548.
Rusch, V. W., Chansky, K., Kindler, H. L., Nowak, A. K., Pass, H. I., Rice, D. C., . . . IASLC Staging and Prognostic Factors Committee, a. b., and participating institutions. (2016). The IASLC Mesothelioma Staging Project: Proposals for the M Descriptors and for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Mesothelioma. J Thorac Oncol, 11(12), 2112-2119. doi:10.1016/j.jtho.2016.09.124
Rusch, V. W., Giroux, D. J., Kraut, M. J., Crowley, J., Hazuka, M., Winton, T., . . . Gandara, D. (2007). Induction chemoradiation and surgical resection for superior sulcus non-small-cell lung carcinomas: long-term results of Southwest Oncology Group Trial 9416 (Intergroup Trial 0160). J Clin Oncol, 25(3), 313-318.
Rusthoven, C. G., Yamamoto, M., Bernhardt, D., Smith, D. E., Gao, D., Serizawa, T., . . . Robin, T. P. (2020). Evaluation of First-line Radiosurgery vs Whole-Brain Radiotherapy for Small Cell Lung Cancer Brain Metastases: The FIRE-SCLC Cohort Study. JAMA Oncol, 6(7), 1028-1037. doi:10.1001/jamaoncol.2020.1271
Sabari, J. K., Leonardi, G. C., Shu, C. A., Umeton, R., Montecalvo, J., Ni, A., . . . Drilon, A. (2018). PD-L1 expression, tumor mutational burden, and response to immunotherapy in patients with MET exon 14 altered lung cancers. Ann Oncol, 29(10), 2085-2091. doi:10.1093/annonc/mdy334
Sadikov, E., Bezjak, A., Yi, Q. L., Wells, W., Dawson, L., Millar, B. A., & Laperriere, N. (2007). Value of whole brain re-irradiation for brain metastases--single centre experience. Clin Oncol (R Coll Radiol), 19(7), 532-538. doi:10.1016/j.clon.2007.06.001
Sagerup, C. M., Småstuen, M., Johannesen, T. B., Helland, Å., & Brustugun, O. T. (2011). Sex-specific trends in lung cancer incidence and survival: a population study of 40,118 cases. Thorax, 66(4), 301-307. doi:thx.2010.151621 [pii]
10.1136/thx.2010.151621
Saghir, Z., Dirksen, A., Ashraf, H., Bach, K. S., Brodersen, J., Clementsen, P. F., . . . Pedersen, J. H. (2012). CT screening for lung cancer brings forward early disease. The randomised Danish Lung Cancer Screening Trial: status after five annual screening rounds with low-dose CT. Thorax, 67(4), 296-301. doi:10.1136/thoraxjnl-2011-200736
Saji, H., Tsuboi, M., Matsubayashi, J., Miyajima, K., Shimada, Y., Imai, K., . . . Ikeda, N. (2010). Clinical response of large cell neuroendocrine carcinoma of the lung to perioperative adjuvant chemotherapy. Anticancer Drugs, 21(1), 89-93. doi:10.1097/CAD.0b013e328330fd79
Salati, M., & Brunelli, A. (2016). Risk Stratification in Lung Resection. Curr Surg Rep, 4(11), 37. doi:10.1007/s40137-016-0158-x
Salazar, M. C., Rosen, J. E., Wang, Z., Arnold, B. N., Thomas, D. C., Herbst, R. S., . . . Boffa, D. J. (2017). Association of Delayed Adjuvant Chemotherapy With Survival After Lung Cancer Surgery. JAMA Oncol, 3(5), 610-619. doi:10.1001/jamaoncol.2016.5829
Sandler, A., Gray, R., Perry, M. C., Brahmer, J., Schiller, J. H., Dowlati, A., . . . Johnson, D. H. (2006). Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer. N Engl J Med, 355(24), 2542-2550.
Santoro, A., O'Brien, M. E., Stahel, R. A., Nackaerts, K., Baas, P., Karthaus, M., . . . Manegold, C. (2008). Pemetrexed plus cisplatin or pemetrexed plus carboplatin for chemonaïve patients with malignant pleural mesothelioma: results of the International Expanded Access Program. J Thorac Oncol, 3(7), 756-763. doi:10.1097/JTO.0b013e31817c73d6
Saunders, Y., Ross, J. R., Broadley, K. E., Edmonds, P. M., & Patel, S. (Writers). (2004). Systematic review of bisphosphonates for hypercalcaemia of malignancy. In.
Scherpereel, A., Astoul, P., Baas, P., Berghmans, T., Clayson, H., de Vuyst, P., . . . Force, E. R. S. E. S. o. T. S. T. (2010). Guidelines of the European Respiratory Society and the European Society of Thoracic Surgeons for the management of malignant pleural mesothelioma. Eur Respir J, 35(3), 479-495. doi:10.1183/09031936.00063109
Schild, S. E., Sio, T. T., Daniels, T. B., Chun, S. G., & Rades, D. (2017). Prophylactic Cranial Irradiation for Extensive Small-Cell Lung Cancer. J Oncol Pract, 13(11), 732-738. doi:10.1200/JOP.2017.026765
Schindewolf, M., & Weitz, J. I. (2020). Broadening the Categories of Patients Eligible for Extended Venous Thromboembolism Treatment. Thromb Haemost, 120(1), 14-26. doi:10.1055/s-0039-3400302
Schmidt-Hansen, M., Baldwin, D. R., & Hasler, E. (2012). What is the most effective follow-up model for lung cancer patients? A systematic review. J Thorac Oncol, 7(5), 821-824. doi:10.1097/JTO.0b013e31824afc55
Schneider, B. J., Ismaila, N., Aerts, J., Chiles, C., Daly, M. E., Detterbeck, F. C., . . . Altorki, N. (2020). Lung Cancer Surveillance After Definitive Curative-Intent Therapy: ASCO Guideline. J Clin Oncol, 38(7), 753-766. doi:10.1200/JCO.19.02748
Schneider, B. J., Saxena, A., & Downey, R. J. (2011). Surgery for early-stage small cell lung cancer. J Natl Compr Canc Netw, 9(10), 1132-1139.
Schneider, J. (2006). Tumor markers in detection of lung cancer. Adv Clin Chem, 42, 1-41.
Schoenfeld, A. J., Arbour, K. C., Rizvi, H., Iqbal, A. N., Gadgeel, S. M., Girshman, J., . . . Hellmann, M. D. (2019). Severe immune-related adverse events are common with sequential PD-(L)1 blockade and osimertinib. Ann Oncol, 30(5), 839-844. doi:10.1093/annonc/mdz077
Schoenmaekers, J. J. A. O., Dingemans, A. C., & Hendriks, L. E. L. (2018). Brain imaging in early stage non-small cell lung cancer: still a controversial topic? J Thorac Dis, 10(Suppl 18), S2168-S2171. doi:10.21037/jtd.2018.06.68
Schreiber, D., Rineer, J., Weedon, J., Vongtama, D., Wortham, A., Kim, A., . . . Rotman, M. (2010). Survival outcomes with the use of surgery in limited-stage small cell lung cancer: should its role be re-evaluated? Cancer, 116(5), 1350-1357. doi:10.1002/cncr.24853
Schreuder, A., Jacobs, C., Scholten, E. T., van Ginneken, B., Schaefer-Prokop, C. M., & Prokop, M. (2020). Typical CT Features of Intrapulmonary Lymph Nodes: A Review. Radiol Cardiothorac Imaging, 2(4), e190159. doi:10.1148/ryct.2020190159
Schultheiss, T. E. (2008). The radiation dose-response of the human spinal cord. Int J Radiat Oncol Biol Phys, 71(5), 1455-1459. doi:10.1016/j.ijrobp.2007.11.075
Schwartz, L. H., Gandras, E. J., Colangelo, S. M., Ercolani, M. C., & Panicek, D. M. (1999). Prevalence and importance of small hepatic lesions found at CT in patients with cancer. Radiology, 210(1), 71-74. doi:10.1148/radiology.210.1.r99ja0371
Sechi, E., & Zekeridou, A. (2021). Neurologic Complications of Immune Checkpoint Inhibitors in Thoracic Malignancies. J Thorac Oncol, 16(3), 381-394. doi:10.1016/j.jtho.2020.11.005
Seol, H. Y., Kim, Y. S., & Kim, S. J. (2021). Predictive Value of 18F-Fluorodeoxyglucose Positron Emission Tomography or Positron Emission Tomography/Computed Tomography for Assessment of Occult Lymph Node Metastasis in Non-Small Cell Lung Cancer. Oncology, 99(2), 96-104. doi:10.1159/000509988
Sequist, L. V., Yang, J. C., Yamamoto, N., O'Byrne, K., Hirsh, V., Mok, T., . . . Schuler, M. (2013). Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol, 31(27), 3327-3334. doi:10.1200/JCO.2012.44.2806
Sezer, A., Kilickap, S., Gümüş, M., Bondarenko, I., Özgüroğlu, M., Gogishvili, M., . . . Rietschel, P. (2021). Cemiplimab monotherapy for first-line treatment of advanced non-small-cell lung cancer with PD-L1 of at least 50%: a multicentre, open-label, global, phase 3, randomised, controlled trial. Lancet, 397(10274), 592-604. doi:10.1016/S0140-6736(21)00228-2
Shaw, A. T., Gandhi, L., Gadgeel, S., Riely, G. J., Cetnar, J., West, H., . . . investigators, s. (2016). Alectinib in ALK-positive, crizotinib-resistant, non-small-cell lung cancer: a single-group, multicentre, phase 2 trial. Lancet Oncol, 17(2), 234-242. doi:10.1016/S1470-2045(15)00488-X
Shaw, A. T., Ou, S. H., Bang, Y. J., Camidge, D. R., Solomon, B. J., Salgia, R., . . . Iafrate, A. J. (2014). Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med, 371(21), 1963-1971. doi:10.1056/NEJMoa1406766
Shaw, A. T., Solomon, B. J., Besse, B., Bauer, T. M., Lin, C. C., Soo, R. A., . . . Martini, J. F. (2019). Resistance Mutations and Efficacy of Lorlatinib in Advanced Anaplastic Lymphoma Kinase-Positive Non-Small-Cell Lung Cancer. J Clin Oncol, 37(16), 1370-1379. doi:10.1200/JCO.18.02236
Shaw, A. T., Solomon, B. J., Chiari, R., Riely, G. J., Besse, B., Soo, R. A., . . . Ou, S. I. (2019). Lorlatinib in advanced ROS1-positive non-small-cell lung cancer: a multicentre, open-label, single-arm, phase 1-2 trial. Lancet Oncol. doi:10.1016/S1470-2045(19)30655-2
Shaw, P., & Agarwal, R. (2004). Pleurodesis for malignant pleural effusions. Cochrane Database Syst Rev(1).
Shepherd, F. A., Dancey, J., Ramlau, R., Mattson, K., Gralla, R., O'Rourke, M., . . . Berille, J. (2000). Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy. J Clin Oncol, 18(10), 2095-2103.
Silva, S. C., Wilson, C., & Woll, P. J. (2015). Bone-targeted agents in the treatment of lung cancer. Ther Adv Med Oncol, 7(4), 219-228. doi:10.1177/1758834015582178
Silvestri, G. A., Gonzalez, A. V., Jantz, M. A., Margolis, M. L., Gould, M. K., Tanoue, L. T., . . . Detterbeck, F. C. (2013). Methods for Staging Non-small Cell Lung Cancer: Diagnosis and Management of Lung Cancer, 3rd ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest, 143(5 Suppl), e211S-250S. doi:10.1378/chest.12-2355
Simon, G. R., Turrisi, A., & Physicians, A. C. o. C. (2007). Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest, 132(3 Suppl), 324S-339S. doi:10.1378/chest.07-1385
Simone, C. B. (2017). Thoracic Radiation Normal Tissue Injury. Semin Radiat Oncol, 27(4), 370-377. doi:10.1016/j.semradonc.2017.04.009
Singh, D., Chen, Y., Cummings, M. A., & Milano, M. T. (2019). Inoperable Pulmonary Carcinoid Tumors: Local Control Rates With Stereotactic Body Radiotherapy/Hypofractionated RT With Image-Guided Radiotherapy. Clin Lung Cancer, 20(3), e284-e290. doi:10.1016/j.cllc.2019.02.003
Skoulidis, F., Li, B. T., Dy, G. K., Price, T. J., Falchook, G. S., Wolf, J., . . . Govindan, R. (2021). Sotorasib for Lung Cancers with KRAS p.G12C Mutations. N Engl J Med, 384(25), 2371-2381. doi:10.1056/NEJMoa2103695
Skov, B. G., & Skov, T. (2017). Paired Comparison of PD-L1 Expression on Cytologic and Histologic Specimens From Malignancies in the Lung Assessed With PD-L1 IHC 28-8pharmDx and PD-L1 IHC 22C3pharmDx. Appl Immunohistochem Mol Morphol, 25(7), 453-459. doi:10.1097/PAI.0000000000000540
Slotman, B. J., van Tinteren, H., Praag, J. O., Knegjens, J. L., El Sharouni, S. Y., Hatton, M., . . . Senan, S. (2015). Use of thoracic radiotherapy for extensive stage small-cell lung cancer: a phase 3 randomised controlled trial. Lancet, 385(9962), 36-42. doi:10.1016/S0140-6736(14)61085-0
Smilowitz, N. R., & Berger, J. S. (2020). Perioperative Cardiovascular Risk Assessment and Management for Noncardiac Surgery: A Review. JAMA, 324(3), 279-290. doi:10.1001/jama.2020.7840
Socinski, M. A., Jotte, R. M., Cappuzzo, F., Orlandi, F., Stroyakovskiy, D., Nogami, N., . . . Group, I. S. (2018). Atezolizumab for First-Line Treatment of Metastatic Nonsquamous NSCLC. N Engl J Med, 378(24), 2288-2301. doi:10.1056/NEJMoa1716948
Solomon, B. J., Besse, B., Bauer, T. M., Felip, E., Soo, R. A., Camidge, D. R., . . . Shaw, A. T. (2018). Lorlatinib in patients with ALK-positive non-small-cell lung cancer: results from a global phase 2 study. Lancet Oncol, 19(12), 1654-1667. doi:10.1016/S1470-2045(18)30649-1
Solomon, B. J., Liu, G., Felip, E., Mok, T. S. K., Soo, R. A., Mazieres, J., . . . Bauer, T. M. (2024). Lorlatinib Versus Crizotinib in Patients With Advanced ALK-Positive Non-Small Cell Lung Cancer: 5-Year Outcomes From the Phase III CROWN Study. J Clin Oncol, JCO2400581. doi:10.1200/JCO.24.00581
Solomon, B. J., Mok, T., Kim, D. W., Wu, Y. L., Nakagawa, K., Mekhail, T., . . . Investigators, P. (2014). First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med, 371(23), 2167-2177. doi:10.1056/NEJMoa1408440
Sonobe, M., Yamada, T., Sato, M., Menju, T., Aoyama, A., Sato, T., . . . Date, H. (2014). Identification of subsets of patients with favorable prognosis after recurrence in completely resected non-small cell lung cancer. Ann Surg Oncol, 21(8), 2546-2554. doi:10.1245/s10434-014-3630-9
Soria, J. C., Ohe, Y., Vansteenkiste, J., Reungwetwattana, T., Chewaskulyong, B., Lee, K. H., . . . Investigators, F. (2018). Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer. N Engl J Med, 378, 113-125. doi:10.1056/NEJMoa1713137
Soria, J. C., Tan, D. S., Chiari, R., Wu, Y. L., Paz-Ares, L., Wolf, J., . . . de Castro, G. (2017). First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer (ASCEND-4): a randomised, open-label, phase 3 study. Lancet, 389(10072), 917-929. doi:10.1016/S0140-6736(17)30123-X
Spigel, D., McLeod, M., Hussein, M., Waterhouse, D., Einhorn, L., Horn, L., . . . Jotte, R. (2017). Randomized results of fixed-duration (1-yr) vs continuous nivolumab in patients (pts) with advanced non-small cell lung cancer (NSCLC). Ann Oncol, 28, v460-v496.
Spigel, D. R., Faivre-Finn, C., Gray, J. E., Vicente, D., Planchard, D., Paz-Ares, L., . . . Antonia, S. J. (2022). Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. J Clin Oncol, 40(12), 1301-1311. doi:10.1200/JCO.21.01308
Spigel, D. R., Vicente, D., Ciuleanu, T. E., Gettinger, S., Peters, S., Horn, L., . . . Reck, M. (2021). Second-line nivolumab in relapsed small-cell lung cancer: CheckMate 331. Ann Oncol, 32(5), 631-641. doi:10.1016/j.annonc.2021.01.071
Spiro, S. G. (2012). Screening for lung cancer: we still need to know more. Thorax, 67(4), 283-285. doi:10.1136/thoraxjnl-2011-201541
Stahel, R. A., Weder, W., Lievens, Y., Felip, E., & Group, E. G. W. (2010). Malignant pleural mesothelioma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 21 Suppl 5, v126-128. doi:10.1093/annonc/mdq173
Stanic, S., Paulus, R., Timmerman, R. D., Michalski, J. M., Barriger, R. B., Bezjak, A., . . . Bradley, J. (2014). No clinically significant changes in pulmonary function following stereotactic body radiation therapy for early- stage peripheral non-small cell lung cancer: an analysis of RTOG 0236. Int J Radiat Oncol Biol Phys, 88(5), 1092-1099. doi:10.1016/j.ijrobp.2013.12.050
Stevens, T. M., Morlote, D., Xiu, J., Swensen, J., Brandwein-Weber, M., Miettinen, M. M., . . . Bridge, J. A. (2019). NUTM1-rearranged neoplasia: a multi-institution experience yields novel fusion partners and expands the histologic spectrum. Mod Pathol, 32(6), 764-773. doi:10.1038/s41379-019-0206-z
Stovold, R., Blackhall, F., Meredith, S., Hou, J., Dive, C., & White, A. (2012). Biomarkers for small cell lung cancer: neuroendocrine, epithelial and circulating tumour cells. Lung Cancer, 76(3), 263-268. doi:10.1016/j.lungcan.2011.11.015
Strosberg, J., El-Haddad, G., Wolin, E., Hendifar, A., Yao, J., Chasen, B., . . . Investigators, N.-T. (2017). Phase 3 Trial of. N Engl J Med, 376(2), 125-135. doi:10.1056/NEJMoa1607427
Strøm, H. H., Bremnes, R. M., Sundstrøm, S. H., Helbekkmo, N., Fløtten, O., & Aasebø, U. (2013). Concurrent palliative chemoradiation leads to survival and quality of life benefits in poor prognosis stage III non-small-cell lung cancer: a randomised trial by the Norwegian Lung Cancer Study Group. Br J Cancer, 109(6), 1467-1475. doi:10.1038/bjc.2013.466
Sugarbaker, D. J., Flores, R. M., Jaklitsch, M. T., Richards, W. G., Strauss, G. M., Corson, J. M., . . . Mentzer, S. J. (1999). Resection margins, extrapleural nodal status, and cell type determine postoperative long-term survival in trimodality therapy of malignant pleural mesothelioma: results in 183 patients. J Thorac Cardiovasc Surg, 117(1), 54-63.
Suh, J. H. (2010). Stereotactic radiosurgery for the management of brain metastases. N Engl J Med, 362(12), 1119-1127. doi:10.1056/NEJMct0806951
Suh, Y. J., Park, C. M., Han, K., Jeon, S. K., Kim, H., Hwang, E. J., . . . Goo, J. M. (2020). Utility of FDG PET/CT for Preoperative Staging of Non-Small Cell Lung Cancers Manifesting as Subsolid Nodules With a Solid Portion of 3 cm or Smaller. AJR Am J Roentgenol, 214(3), 514-523. doi:10.2214/ajr.19.21811
Sun, J. M., Ahn, M. J., Ahn, J. S., Um, S. W., Kim, H., Kim, H. K., . . . Park, K. (2012). Chemotherapy for pulmonary large cell neuroendocrine carcinoma: similar to that for small cell lung cancer or non-small cell lung cancer? Lung Cancer, 77(2), 365-370. doi:10.1016/j.lungcan.2012.04.009
Sun, L., Davis, C. W., Hwang, W. T., Jeffries, S., Sulyok, L. F., Marmarelis, M. E., . . . Aggarwal, C. (2020). Outcomes in Patients With Non-small-cell Lung Cancer With Brain Metastases Treated With Pembrolizumab-based Therapy. Clin Lung Cancer. doi:10.1016/j.cllc.2020.10.017
Sundstrom, S., Bremnes, R., Aasebo, U., Aamdal, S., Hatlevoll, R., Brunsvig, P., . . . Kaasa, S. (2004). Hypofractionated palliative radiotherapy (17 Gy per two fractions) in advanced non-small-cell lung carcinoma is comparable to standard fractionation for symptom control and survival: a national phase III trial. J Clin Oncol, 22(5), 801-810.
Sundstrom, S., Bremnes, R., Brunsvig, P., Aasebo, U., Olbjorn, K., Fayers, P. M., & Kaasa, S. (2005). Immediate or delayed radiotherapy in advanced non-small cell lung cancer (NSCLC)? Data from a prospective randomised study. Radiother Oncol, 75(2), 141-148.
Suárez-Piñera, M., Belda-Sanchis, J., Taus, A., Sánchez-Font, A., Mestre-Fusco, A., Jiménez, M., & Pijuan, L. (2018). FDG PET-CT SUVmax and IASLC/ATS/ERS histologic classification: a new profile of lung adenocarcinoma with prognostic value. Am J Nucl Med Mol Imaging, 8(2), 100-109.
Sørensen, M., Pijls-Johannesma, M., Felip, E., & Group, E. G. W. (2010). Small-cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 21 Suppl 5, v120-125. doi:10.1093/annonc/mdq172
Sørensen, S., Helweg-Larsen, S., Mouridsen, H., & Hansen, H. H. (1994). Effect of high-dose dexamethasone in carcinomatous metastatic spinal cord compression treated with radiotherapy: a randomised trial. Eur J Cancer, 30A(1), 22-27.
Takenaka, D., Ohno, Y., Koyama, H., Nogami, M., Onishi, Y., Matsumoto, K., . . . Sugimura, K. (2010). Integrated FDG-PET/CT vs. standard radiological examinations: comparison of capability for assessment of postoperative recurrence in non-small cell lung cancer patients. Eur J Radiol, 74(3), 458-464. doi:10.1016/j.ejrad.2009.03.007
Tapia Rico, G., Chan, M. M., & Loo, K. F. (2020). The safety and efficacy of immune checkpoint inhibitors in patients with advanced cancers and pre-existing chronic viral infections (Hepatitis B/C, HIV): A review of the available evidence. Cancer Treat Rev, 86, 102011. doi:10.1016/j.ctrv.2020.102011
Tassinari, D., Scarpi, E., Sartori, S., Tamburini, E., Santelmo, C., Tombesi, P., & Lazzari-Agli, L. (2009). Second-line treatments in non-small cell lung cancer. A systematic review of literature and metaanalysis of randomized clinical trials. Chest, 135(6), 1596-1609.
Tatcı, E., Özmen, Ö., Öztürk, A., & Demirağ, F. (2021). Contribution of (18)F-FDG PET/CT in the Differential Diagnosis of Pulmonary Hamartomas and Pulmonary Carcinoids. Mol Imaging Radionucl Ther, 30(2), 101-106. doi:10.4274/mirt.galenos.2021.20633
Temel, J. S., Greer, J. A., Muzikansky, A., Gallagher, E. R., Admane, S., Jackson, V. A., . . . Lynch, T. J. (2010). Early palliative care for patients with metastatic non-small-cell lung cancer. N Engl J Med, 363(8), 733-742. doi:10.1056/NEJMoa1000678
Teraoka, S., Fujimoto, D., Morimoto, T., Kawachi, H., Ito, M., Sato, Y., . . . Tomii, K. (2017). Early Immune-Related Adverse Events and Association with Outcome in Advanced Non-Small Cell Lung Cancer Patients Treated with Nivolumab: A Prospective Cohort Study. J Thorac Oncol, 12(12), 1798-1805. doi:10.1016/j.jtho.2017.08.022
Thatcher, N., Nicolson, M., Groves, R. W., Steele, J., Eaby, B., Dunlop, J., . . . Ukachukwu, I. (2009). Expert consensus on the management of erlotinib-associated cutaneous toxicity in the u.k. Oncologist, 14(8), 840-847.
Tomiyama, N., Yasuhara, Y., Nakajima, Y., Adachi, S., Arai, Y., Kusumoto, M., . . . Yamada, K. (2006). CT-guided needle biopsy of lung lesions: a survey of severe complication based on 9783 biopsies in Japan. Eur J Radiol, 59(1), 60-64. doi:10.1016/j.ejrad.2006.02.001
Travis, W. D. (2014). Pathology and diagnosis of neuroendocrine tumors: lung neuroendocrine. Thorac Surg Clin, 24(3), 257-266. doi:10.1016/j.thorsurg.2014.04.001
Travis, W. D., Brambilla, E., Rami-Porta, R., Vallières, E., Tsuboi, M., Rusch, V., . . . Committee, I. S. (2008). Visceral pleural invasion: pathologic criteria and use of elastic stains: proposal for the 7th edition of the TNM classification for lung cancer. J Thorac Oncol, 3(12), 1384-1390. doi:10.1097/JTO.0b013e31818e0d9f
Treasure, T., Lang-Lazdunski, L., Waller, D., Bliss, J. M., Tan, C., Entwisle, J., . . . trialists, M. (2011). Extra-pleural pneumonectomy versus no extra-pleural pneumonectomy for patients with malignant pleural mesothelioma: clinical outcomes of the Mesothelioma and Radical Surgery (MARS) randomised feasibility study. Lancet Oncol, 12(8), 763-772. doi:10.1016/S1470-2045(11)70149-8
Tsuboi, M., Herbst, R. S., John, T., Kato, T., Majem, M., Grohé, C., . . . Investigators, A. (2023). Overall Survival with Osimertinib in Resected. N Engl J Med, 389(2), 137-147. doi:10.1056/NEJMoa2304594
Tsuruoka, K., Horinouchi, H., Goto, Y., Kanda, S., Fujiwara, Y., Nokihara, H., . . . Ohe, Y. (2017). PD-L1 expression in neuroendocrine tumors of the lung. Lung Cancer, 108, 115-120. doi:10.1016/j.lungcan.2017.03.006
Turner, M. C., Andersen, Z. J., Baccarelli, A., Diver, W. R., Gapstur, S. M., Pope, C. A., . . . Cohen, A. (2020). Outdoor air pollution and cancer: An overview of the current evidence and public health recommendations. CA Cancer J Clin. doi:10.3322/caac.21632
Turrisi, A. T., Kim, K., Blum, R., Sause, W. T., Livingston, R. B., Komaki, R., . . . Johnson, D. H. (1999). Twice-daily compared with once-daily thoracic radiotherapy in limited small-cell lung cancer treated concurrently with cisplatin and etoposide. N Engl J Med, 340(4), 265-271.
Upadhya, P., Ananthraju, A., Vadala, R., & Mohanty Mohapatra, M. (2021). Endocrine paraneoplastic syndromes in lung cancer: a respiratory physician's perspective. Adv Respir Med, 89(4), 403-412. doi:10.5603/ARM.a2021.0075
Vallieres, E., Shepherd, F. A., Crowley, J., Van Houtte, P., Postmus, P. E., Carney, D., . . . Goldstraw, P. (2009). The IASLC Lung Cancer Staging Project: proposals regarding the relevance of TNM in the pathologic staging of small cell lung cancer in the forthcoming (seventh) edition of the TNM classification for lung cancer. J Thorac Oncol, 4(9), 1049-1059.
van Meerbeeck, J. P., Gaafar, R., Manegold, C., Van Klaveren, R. J., Van Marck, E. A., Vincent, M., . . . Giaccone, G. (2005). Randomized phase III study of cisplatin with or without raltitrexed in patients with malignant pleural mesothelioma: an intergroup study of the European Organisation for Research and Treatment of Cancer Lung Cancer Group and the National Cancer Institute of Canada. J Clin Oncol, 23(28), 6881-6889.
van Meerbeeck, J. P., Kramer, G. W., Van Schil, P. E., Legrand, C., Smit, E. F., Schramel, F., . . . Group, E. O. f. R. a. T. o. C.-L. C. (2007). Randomized controlled trial of resection versus radiotherapy after induction chemotherapy in stage IIIA-N2 non-small-cell lung cancer. J Natl Cancer Inst, 99(6), 442-450. doi:10.1093/jnci/djk093
van Thiel, E. R., Surmont, V. F., & van Meerbeeck, J. P. (2011). Malignant pleural mesothelioma: when is radiation therapy indicated? Expert Rev Anticancer Ther, 11(4), 551-560. doi:10.1586/era.10.169
van Veggel, B., Madeira R Santos, J. F. V., Hashemi, S. M. S., Paats, M. S., Monkhorst, K., Heideman, D. A. M., . . . de Langen, A. J. (2020). Osimertinib treatment for patients with EGFR exon 20 mutation positive non-small cell lung cancer. Lung Cancer, 141, 9-13. doi:10.1016/j.lungcan.2019.12.013
Vellayappan, B., Tan, C. L., Yong, C., Khor, L. K., Koh, W. Y., Yeo, T. T., . . . Sahgal, A. (2018). Diagnosis and Management of Radiation Necrosis in Patients With Brain Metastases. Front Oncol, 8, 395. doi:10.3389/fonc.2018.00395
Vergnon, J. M., Huber, R. M., & Moghissi, K. (2006). Place of cryotherapy, brachytherapy and photodynamic therapy in therapeutic bronchoscopy of lung cancers. Eur Respir J, 28(1), 200-218.
Veronesi, G., Maisonneuve, P., Bellomi, M., Rampinelli, C., Durli, I., Bertolotti, R., & Spaggiari, L. (2012). Estimating overdiagnosis in low-dose computed tomography screening for lung cancer: a cohort study. Ann Intern Med, 157(11), 776-784. doi:10.7326/0003-4819-157-11-201212040-00005
Veronesi, G., Morandi, U., Alloisio, M., Terzi, A., Cardillo, G., Filosso, P., . . . Spaggiari, L. (2006). Large cell neuroendocrine carcinoma of the lung: a retrospective analysis of 144 surgical cases. Lung Cancer, 53(1), 111-115. doi:10.1016/j.lungcan.2006.03.007
Veronesi, G., Novellis, P., Voulaz, E., & Alloisio, M. (2016). Robot-assisted surgery for lung cancer: State of the art and perspectives. Lung Cancer, 101, 28-34. doi:10.1016/j.lungcan.2016.09.004
Vilmann, P., Clementsen, P. F., Colella, S., Siemsen, M., De Leyn, P., Dumonceau, J. M., . . . Annema, J. T. (2015). Combined endobronchial and oesophageal endosonography for the diagnosis and staging of lung cancer. European Society of Gastrointestinal Endoscopy (ESGE) Guideline, in cooperation with the European Respiratory Society (ERS) and the European Society of Thoracic Surgeons (ESTS). Eur Respir J, 46(1), 40-60. doi:10.1183/09031936.00064515
Vogelius, I. R., & Bentzen, S. M. (2012). A literature-based meta-analysis of clinical risk factors for development of radiation induced pneumonitis. Acta Oncol, 51(8), 975-983. doi:10.3109/0284186X.2012.718093
Vogelzang, N. J., Rusthoven, J. J., Symanowski, J., Denham, C., Kaukel, E., Ruffie, P., . . . Paoletti, P. (2003). Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol, 21(14), 2636-2644.
von Meyenfeldt, E. M., Prevoo, W., Peyrot, D., Lai A Fat, N., Burgers, S. J., Wouters, M. W., & Klomp, H. M. (2011). Local progression after radiofrequency ablation for pulmonary metastases. Cancer, 117(16), 3781-3787. doi:10.1002/cncr.25958
von Pawel, J., Gatzemeier, U., Pujol, J. L., Moreau, L., Bildat, S., Ranson, M., . . . Ross, G. (2001). Phase ii comparator study of oral versus intravenous topotecan in patients with chemosensitive small-cell lung cancer. J Clin Oncol, 19(6), 1743-1749.
von Pawel, J., Schiller, J. H., Shepherd, F. A., Fields, S. Z., Kleisbauer, J. P., Chrysson, N. G., . . . Gralla, R. (1999). Topotecan versus cyclophosphamide, doxorubicin, and vincristine for the treatment of recurrent small-cell lung cancer. J Clin Oncol, 17(2), 658-667.
von Plessen, C., Bergman, B., Andresen, O., Bremnes, R. M., Sundstrom, S., Gilleryd, M., . . . Sorenson, S. (2006). Palliative chemotherapy beyond three courses conveys no survival or consistent quality-of-life benefits in advanced non-small-cell lung cancer. Br J Cancer, 95(8), 966-973. doi:6603383 [pii] 10.1038/sj.bjc.6603383
Wahidi, M. M., Govert, J. A., Goudar, R. K., Gould, M. K., McCrory, D. C., & Physicians, A. C. o. C. (2007). Evidence for the treatment of patients with pulmonary nodules: when is it lung cancer?: ACCP evidence-based clinical practice guidelines (2nd edition). Chest, 132(3 Suppl), 94S-107S. doi:10.1378/chest.07-1352
Wahl, S. G. F., Dai, H. Y., Emdal, E. F., Berg, T., Halvorsen, T. O., Ottestad, A. L., . . . Richardsen, E. (2021). The Prognostic Effect of KRAS Mutations in Non-Small Cell Lung Carcinoma Revisited: A Norwegian Multicentre Study. Cancers (Basel), 13(17). doi:10.3390/cancers13174294
Waite, K., & Gilligan, D. (2007). The role of radiotherapy in the treatment of malignant pleural mesothelioma. Clin Oncol (R Coll Radiol), 19(3), 182-187. doi:S0936-6555(06)00435-3 [pii] 10.1016/j.clon.2006.12.006
Wakelee, H., Liberman, M., Kato, T., Tsuboi, M., Lee, S. H., Gao, S., . . . Investigators, K.-. (2023). Perioperative Pembrolizumab for Early-Stage Non-Small-Cell Lung Cancer. N Engl J Med, 389(6), 491-503. doi:10.1056/NEJMoa2302983
Waldeland, E., Brustugun, O. T., Ramberg, C., & Helland, Å. (2012). [Stereotactic irradiation in spinal metastases]. Tidsskr Nor Laegeforen, 132(22), 2478-2479. doi:10.4045/tidsskr.12.1108
Walji, N., Chan, A. K., & Peake, D. R. (2008). Common acute oncological emergencies: diagnosis, investigation and management. Postgrad Med J, 84(994), 418-427.
Wang, E. H., Corso, C. D., Rutter, C. E., Park, H. S., Chen, A. B., Kim, A. W., . . . Yu, J. B. (2015). Postoperative Radiation Therapy Is Associated With Improved Overall Survival in Incompletely Resected Stage II and III Non-Small-Cell Lung Cancer. J Clin Oncol, 33(25), 2727-2734. doi:10.1200/JCO.2015.61.1517
Watanabe, S. M., Nekolaichuk, C. L., & Beaumont, C. (2012). The Edmonton Symptom Assessment System, a proposed tool for distress screening in cancer patients: development and refinement. Psychooncology, 21(9), 977-985. doi:10.1002/pon.1996
Weder, W., Stahel, R. A., Bernhard, J., Bodis, S., Vogt, P., Ballabeni, P., . . . Research, S. G. f. C. C. (2007). Multicenter trial of neo-adjuvant chemotherapy followed by extrapleural pneumonectomy in malignant pleural mesothelioma. Ann Oncol, 18(7), 1196-1202. doi:10.1093/annonc/mdm093
Wei, M. L., Kang, D., Gu, L., Qiu, M., Zhengyin, L., & Mu, Y. (2013). Chemotherapy for thymic carcinoma and advanced thymoma in adults. Cochrane Database Syst Rev, 8, CD008588. doi:10.1002/14651858.CD008588.pub2
Weir-McCall, J. R., Harris, S., Miles, K. A., Qureshi, N. R., Rintoul, R. C., Dizdarevic, S., . . . Gilbert, F. J. (2021). Impact of solitary pulmonary nodule size on qualitative and quantitative assessment using 18F-fluorodeoxyglucose PET/CT: the SPUTNIK trial. Eur J Nucl Med Mol Imaging, 48(5), 1560-1569. doi:10.1007/s00259-020-05089-y
Westphalen, C. B., Krebs, M. G., Le Tourneau, C., Sokol, E. S., Maund, S. L., Wilson, T. R., . . . de Braud, F. (2021). Genomic context of NTRK1/2/3 fusion-positive tumours from a large real-world population. NPJ Precis Oncol, 5(1), 69. doi:10.1038/s41698-021-00206-y
White, C. S., & Rubin, G. D. (2020). The Puzzle of the Perifissural Nodule. Radiol Cardiothorac Imaging, 2(4), e200409. doi:10.1148/ryct.2020200409
WHO Classification of Tumours 5th ed. Thoracic tumours. (2021). (Vol. 5). International Agency for Research on Cancer, Lyon (France): WHO.
Wijn, D. H., Groeneveld, G. H., Vollaard, A. M., Muller, M., Wallinga, J., Gelderblom, H., & Smit, E. F. (2018). Influenza vaccination in patients with lung cancer receiving anti-programmed death receptor 1 immunotherapy does not induce immune-related adverse events. Eur J Cancer, 104, 182-187. doi:10.1016/j.ejca.2018.09.012
Wilson, J. M., & Jungner, Y. G. (1968). [Principles and practice of mass screening for disease]. Bol Oficina Sanit Panam, 65(4), 281-393.
Wilson, L. D., Detterbeck, F. C., & Yahalom, J. (2007). Clinical practice. Superior vena cava syndrome with malignant causes. N Engl J Med, 356(18), 1862-1869.
Winton, T., Livingston, R., Johnson, D., Rigas, J., Johnston, M., Butts, C., . . . Shepherd, F. (2005). Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer. N Engl J Med, 352(25), 2589-2597.
Wirth, L. J., Carter, M. R., Jänne, P. A., & Johnson, B. E. (2004). Outcome of patients with pulmonary carcinoid tumors receiving chemotherapy or chemoradiotherapy. Lung Cancer, 44(2), 213-220. doi:10.1016/j.lungcan.2003.11.016
Wolf, J., Helland, Å., Oh, I. J., Migliorino, M. R., Dziadziuszko, R., Wrona, A., . . . Novello, S. (2022). Final efficacy and safety data, and exploratory molecular profiling from the phase III ALUR study of alectinib versus chemotherapy in crizotinib-pretreated ALK-positive non-small-cell lung cancer. ESMO Open, 7(1), 100333. doi:10.1016/j.esmoop.2021.100333
Wolf, J., Seto, T., Han, J. Y., Reguart, N., Garon, E. B., Groen, H. J. M., . . . Investigators, G. m.-. (2020). Capmatinib in MET Exon 14-Mutated or MET-Amplified Non-Small-Cell Lung Cancer. N Engl J Med, 383(10), 944-957. doi:10.1056/NEJMoa2002787
Wolfson, A. H., Bae, K., Komaki, R., Meyers, C., Movsas, B., Le Pechoux, C., . . . Choy, H. (2011). Primary analysis of a phase II randomized trial Radiation Therapy Oncology Group (RTOG) 0212: impact of different total doses and schedules of prophylactic cranial irradiation on chronic neurotoxicity and quality of life for patients with limited-disease small-cell lung cancer. Int J Radiat Oncol Biol Phys, 81(1), 77-84. doi:10.1016/j.ijrobp.2010.05.013
Wolin, E. M. (2017). Advances in the Diagnosis and Management of Well-Differentiated and Intermediate-Differentiated Neuroendocrine Tumors of the Lung. Chest, 151(5), 1141-1146. doi:10.1016/j.chest.2016.06.018
Wu, D., Liu, Y. Y., Wang, T., Huang, Y. Y., & Xia, P. (2023). Computed tomography-guided lung biopsy with rapid on-site evaluation for diagnosis of lung lesions: a meta-analysis. J Cardiothorac Surg, 18(1), 122. doi:10.1186/s13019-023-02212-6
Wu, J. Y., Yu, C. J., & Shih, J. Y. (2019). Effectiveness of Treatments for Advanced Non-Small-Cell Lung Cancer With Exon 20 Insertion Epidermal Growth Factor Receptor Mutations. Clin Lung Cancer, 20(6), e620-e630. doi:10.1016/j.cllc.2019.06.018
Wu, Y. L., Ahn, M. J., Garassino, M. C., Han, J. Y., Katakami, N., Kim, H. R., . . . Mok, T. S. K. (2018). CNS Efficacy of Osimertinib in Patients With T790M-Positive Advanced Non-Small-Cell Lung Cancer: Data From a Randomized Phase III Trial (AURA3). J Clin Oncol, 36(26), 2702-2709. doi:10.1200/JCO.2018.77.9363
Wu, Y. L., Cheng, Y., Zhou, X., Lee, K. H., Nakagawa, K., Niho, S., . . . Mok, T. S. (2017). Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutation-positive non-small-cell lung cancer (ARCHER 1050): a randomised, open-label, phase 3 trial. Lancet Oncol, 18(11), 1454-1466. doi:10.1016/S1470-2045(17)30608-3
Wu, Y. L., Dziadziuszko, R., Ahn, J. S., Barlesi, F., Nishio, M., Lee, D. H., . . . Investigators, A. (2024). Alectinib in Resected ALK-Positive Non–Small-Cell Lung Cancer. N Engl J Med, 390(14), 1265-1276. doi:10.1056/NEJMoa2310532
Wu, Y. L., Tsuboi, M., He, J., John, T., Grohe, C., Majem, M., . . . Investigators, A. (2020). Osimertinib in Resected EGFR-Mutated Non-Small-Cell Lung Cancer. N Engl J Med, 383(18), 1711-1723. doi:10.1056/NEJMoa2027071
Yamamoto, M., Serizawa, T., Shuto, T., Akabane, A., Higuchi, Y., Kawagishi, J., . . . Jokura, H. (2014). Stereotactic radiosurgery for patients with brain metastases - authors' reply. Lancet Oncol, 15(7), e248. doi:10.1016/S1470-2045(14)70221-9
Yang, B., Lee, H., Um, S. W., Kim, K., Zo, J. I., Shim, Y. M., . . . Kim, H. (2019). Incidence of brain metastasis in lung adenocarcinoma at initial diagnosis on the basis of stage and genetic alterations. Lung Cancer, 129, 28-34. doi:10.1016/j.lungcan.2018.12.027
Yang, J. C., Schuler, M., Popat, S., Miura, S., Heeke, S., Park, K., . . . Kim, E. S. (2020). Afatinib for the Treatment of NSCLC Harboring Uncommon EGFR Mutations: A Database of 693 Cases. J Thorac Oncol, 15(5), 803-815. doi:10.1016/j.jtho.2019.12.126
Yang, J. C., Sequist, L. V., Geater, S. L., Tsai, C. M., Mok, T. S., Schuler, M., . . . Wu, Y. L. (2015). Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol, 16(7), 830-838. doi:10.1016/S1470-2045(15)00026-1
Yang, S. Y., Kim, D. G., Lee, S. H., Chung, H. T., Paek, S. H., Hyun Kim, J., . . . Han, D. H. (2008). Pulmonary resection in patients with nonsmall-cell lung cancer treated with gamma-knife radiosurgery for synchronous brain metastases. Cancer, 112(8), 1780-1786. doi:10.1002/cncr.23357
Yao, J. C., Fazio, N., Singh, S., Buzzoni, R., Carnaghi, C., Wolin, E., . . . RAD001 in Advanced Neuroendocrine Tumours, F. u. T. R.-S. G. (2016). Everolimus for the treatment of advanced, non-functional neuroendocrine tumours of the lung or gastrointestinal tract (RADIANT-4): a randomised, placebo-controlled, phase 3 study. Lancet, 387(10022), 968-977. doi:10.1016/S0140-6736(15)00817-X
Yokoba, M., Ichikawa, T., Harada, S., Naito, M., Sato, Y., & Katagiri, M. (2018). Postoperative pulmonary function changes according to the resected lobe: a 1-year follow-up study of lobectomized patients. J Thorac Dis, 10(12), 6891-6902. doi:10.21037/jtd.2018.11.108
Yu, J. B., Decker, R. H., Detterbeck, F. C., & Wilson, L. D. (2010). Surveillance epidemiology and end results evaluation of the role of surgery for stage I small cell lung cancer. J Thorac Oncol, 5(2), 215-219. doi:10.1097/JTO.0b013e3181cd3208
Yuen, A. R., Zou, G., Turrisi, A. T., Sause, W., Komaki, R., Wagner, H., . . . Johnson, D. H. (2000). Similar outcome of elderly patients in intergroup trial 0096: Cisplatin, etoposide, and thoracic radiotherapy administered once or twice daily in limited stage small cell lung carcinoma. Cancer, 89(9), 1953-1960.
Zalcman, G., Mazieres, J., Margery, J., Greillier, L., Audigier-Valette, C., Moro-Sibilot, D., . . . (IFCT), F. C. T. I. (2016). Bevacizumab for newly diagnosed pleural mesothelioma in the Mesothelioma Avastin Cisplatin Pemetrexed Study (MAPS): a randomised, controlled, open-label, phase 3 trial. Lancet, 387(10026), 1405-1414. doi:10.1016/S0140-6736(15)01238-6
Zeng, H., De Ruysscher, D., X, H., Zheng, D., Yang, L., Ricardi, U., . . . Hendriks, L. (2022). Radiotherapy for small cell lung cancer in current clinical practice guidelines. J Natl Cancer Cent, 2(2), 113-125.
Zhao, C., & Rajan, A. (2019). Immune checkpoint inhibitors for treatment of thymic epithelial tumors: how to maximize benefit and optimize risk? Mediastinum, 3. doi:10.21037/med.2019.08.02
Zhou, C., Solomon, B., Loong, H. H., Park, K., Pérol, M., Arriola, E., . . . Investigators, L.-T. (2023). First-Line Selpercatinib or Chemotherapy and Pembrolizumab in RET Fusion-Positive NSCLC. N Engl J Med, 389(20), 1839-1850. doi:10.1056/NEJMoa2309457
Zhu, Z., Ni, J., Cai, X., Su, S., Zhuang, H., Yang, Z., . . . Fu, X. (2022). International consensus on radiotherapy in metastatic non-small cell lung cancer. Transl Lung Cancer Res, 11(9), 1763-1795. doi:10.21037/tlcr-22-644
Özgüroğlu, M., Kilickap, S., Sezer, A., Gümüş, M., Bondarenko, I., Gogishvili, M., . . . Rietschel, P. (2023). First-line cemiplimab monotherapy and continued cemiplimab beyond progression plus chemotherapy for advanced non-small-cell lung cancer with PD-L1 50% or more (EMPOWER-Lung 1): 35-month follow-up from a mutlicentre, open-label, randomised, phase 3 trial. Lancet Oncol, 24(9), 989-1001. doi:10.1016/S1470-2045(23)00329-7
Vedlegg
Sist faglig oppdatert: 31.10.2024
Vurdering av pasient
Formler for beregning av postoperativ FEV1, DLCO og VO2Max
Lobektomi
pre FEV1 = % av predikert verdi av FEV1 (post-bronkodilatator)
Antall segmenter tiltenkt fjernet kirurgisk (totalt 19: høyre overlapp - 3, midtlapp - 2, høyre underlapp - 5, venstre overlapp - 3, lingula - 2, venstre underlapp - 4)
a = antall obstruerte segment som er tiltenkt fjernet
b = antall ikke-obstruerte segment som er tiltenkt fjernet
predikert postoperativ (ppo) FEV1 = pre FEV1 x ((19 - a) – b) / 19 - a
Pneumektomi
pre FEV1 = % av predikert verdi av FEV1 (post bronkodilatator)
Kvantitativ lunge-perfusjonsscintigrafi:
predikert postoperativ (ppo) FEV1 = pre FEV1 x (1 – andel perfusjon i den del av lunge som skal fjernes)
ppo for DLCO og VO2 max regnes ut på samme måte

Kardial funksjon og vurdering av operabilitet
- Avstå midlertidig fra operasjon: dersom ustabil iskemisk hjertesykdom, aktuell alvorlig rytmeforstyrrelse eller alvorlig klaffesykdom.
- Revidert Cardiac Risk Index (RCRI) – kardial risikovurdering –(Lee et al., 1999)
| Seks uavhengige prediktorer for betydelige komplikasjoner |
1. Høy-risk kirurgi (vaskulær kirurgi, åpen intraperitoneal eller intratorakal kirurgi) |
2. Anamnese på iskemisk hjertesykdom (tidligere myokardinfarkt eller positiv CPET, aktuell brystsmerte forårsaket av myokard-iskemi, nitrat-behandling, eller patologiske Q-bølger i EKG, tidligere koronar revaskulering teller ikke alene) |
3. Anamnese på hjertesvikt (kompensert eller tidligere) |
4. Diabetes mellitus, IDDM (insulin-trengende) |
5. Tidligere hjerneslag |
6. Preoperativ serum-kreatinin >2.0 mg/dL (177 µmol/L) |
| Sannsynlighet for kardial død, non-fatalt myokardinfarkt, og non-fatal hjertestans, avhengig av antall prediktorer |
0 risiko-faktor - 0,4 % (95 % CI: 0,1-0,8) |
1 risiko-faktor - 1,0 % (95 % CI: 0,5-1,4) |
2 risiko-faktorer - 2,4 % (95 % CI: 1,3-3,5) |
³3 risiko-faktorer - 5,4 % (95 % CI: 2,8-7,9) |
Sannsynlighet for kardial død og non-fatalt myokardinfarkt, hjertestans eller ventrikkelflimmer, lungeødem, og komplett ledningsblokk, avhengig av antall prediktorer og bruk av betablokker |
0 risiko-faktor - 0,4 - 1,0 % versus <1 % med betablokker |
1 – 2 risiko-faktorer - 2,2 - 6,6 % versus 0,8 - 1,6 % med betablokker |
³3 risiko-faktorer - >9 % versus >3 % med betablokker |
Modell for utregning av sannsynlighet for malignitet
Modellen som beregner risikoen for malignitet beskrives ved følgende ligning (Herder et al., 2005):
Sannsynlighet for malignitet = eª/(1 + eª)
a = -6,8272 + (0,0391 x alder) + (0,7917 x tobakksrøyking) +(1,3388 x kreft) + (0,1274 x diameter) + (1,0407 x spikulering) + (0,7838 x lokalisasjon)
der e (2,7182) er grunntallet i den naturlige logaritme, alder er pasientens alder i år, tobakksrøyking = 1 hvis pasienten er nåværende eller tidligere røyker (ellers 0), kreft=1 hvis pasienten har en sykehistorie med tidligere ekstratorakal kreft som var diagnostisert for >5 år siden (ellers 0), diameter er diameter av nodulus i mm, spikulering = 1 hvis nodulus har spikulert avgrensning (ellers 0), og lokalisasjon = 1 hvis nodulus er lokalisert i en overlapp (ellers 0). Denne kalkulatoren er tilgjengelig på internett (http://www.nucmed.com/nucmed/SPN_Risk_Calculator.aspx).









