Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av maligne lymfomer
Forord
Sist faglig oppdatert: 10.12.2021
Mange medisinske faggrupper har i en årrekke lagt ned et betydelig arbeid for å komme frem til konsensusbaserte faglige anbefalinger for diagnostikk og behandling av ulike typer kreft. Som ledd i Nasjonal strategi for kreftområdet (2006–2009) fikk Helsedirektoratet i oppdrag å videreutvikle og oppdatere faggruppenes anbefalinger til nasjonale handlingsprogrammer for kreftbehandling, i nært samarbeid med fagmiljøene, de regionale helseforetakene, Nasjonalt kunnskapssenter for helsetjenesten, og andre relevante myndigheter. De nasjonale handlingsprogrammene representerer en videreføring og en formalisering av faggruppenes anbefalinger.
Nasjonale handlingsprogrammer for kreftbehandling skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet. Målgrupper for retningslinjene er leger og legespesialister innen medisin, kirurgi, onkologi, radiologi, patologi, hematologi og fastleger. De vil også være av interesse for andre faggrupper som er involvert i behandling av pasientgruppen og kan være av interesse for pasienter og pårørende.
Nasjonale retningslinjer fra Helsedirektoratet er å betrakte som anbefalinger og råd, basert på oppdatert faglig kunnskap som er fremskaffet på en systematisk, kunnskapsbasert måte. De nasjonale retningslinjene gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet og er ment som et hjelpemiddel ved de avveininger tjenesteyterne må gjøre for å oppnå forsvarlighet og god kvalitet i tjenesten. Nasjonale retningslinjer er ikke direkte rettslig bindende for mottagerne, men bør langt på vei være styrende for de valg som skal tas. Ved å følge oppdaterte nasjonale retningslinjer vil fagpersonell bidra til å oppfylle kravet om faglig forsvarlighet. Dersom en velger løsninger som i vesentlig grad avviker fra de nasjonale retningslinjene, bør en dokumentere dette og være forberedt på å begrunne sine valg. Sykehusenes eiere og ledelse bør tilrettelegge virksomheten slik at de nasjonale retningslinjene kan følges.
Helsedirektoratet takker arbeidsgruppen for stor innsats i utarbeidelsen av handlingsprogrammet. Vi håper handlingsprogrammet vil være et nyttig arbeidsredskap ved behandling av pasienter med lymfekreft. Innholdet i handlingsprogrammet vil vurderes årlig og om nødvendig oppdateres. Disse nasjonale retningslinjene for diagnostikk, behandling og oppfølging av pasienter med maligne lymfomer er sjuende utgave og er publisert 6. mars 2023.
Bjørn Guldvog
Helsedirektør
Endringer i den syvende utgaven av handlingsprogrammet (2023)
Sist faglig oppdatert: 06.03.2023
Følgende vesentlige endringer er tatt inn i denne sjuende utgaven av Handlingsprogrammet:
- Oppdateringer om behandling med kimær antigen reseptor (CAR) T-celler ved diffust storcellet B-celle lymfom
- Oppdateringer i kapitlet om behandling av follikulære lymfomer: Beskrivelse av behandling med lenalidomid i kombinasjon med rituximab både ved førstegangs sykdom og ved residiv, utdypning av behandling ved transformasjon.
- Oppdatering i kapitlet om behandling av DLBCL: Ved siden av innføringen av CAR-T også endret kapittel om CNS profylakse
- Justeringering av kontrollopplegg for både HL og NHL
- Mindre endringer av flere kapitlersom for eksempel epidemilogi og der studier er avsluttet eller nye studier startet.
Innledning
Sist faglig oppdatert: 10.12.2021
Maligne lymfomer utgjør om lag 4 % av alle nye krefttilfeller, og insidensen er økende. Mange pasienter blir helbredet, men det er også et stort antall som lever med sykdommen over lang tid. Således utgjør de maligne lymfomer en betydelig andel av pasientene ved kreft- og medisinske poliklinikker. Allmennpraktiserende leger og leger med andre spesialiteter vil også møte disse pasientene i ulike sammenhenger.
Kapitlene om utredning og stadieinndeling er relativt detaljerte ettersom dette er basis for en riktig behandling. Den nye WHO-klassifikasjonen (S. H. Swerdlow et al., 2016) tar i bruk så vel morfologiske, immunhistokjemiske, molekylærbiologiske, karyotypiske og kliniske opplysninger. Den histopatologiske diagnose er med dette blitt sikrere og behandlingen mer differensiert. Dagens billeddiagnostikk sikrer oss likeledes mer presise opplysninger om sykdomsutbredelse enn tidligere.
Kapitlene om behandling viser med all tydelighet hvor differensiert denne er blitt. Utviklingen går raskt og det er å forvente at handlingsprogrammet må oppdateres relativt hyppig.
Kapittelet om kontroller og oppfølging er omtalt mer skjematisk og tar sikte på å gi en rettledning for hvilke undersøkelser som er ønskelige på ulike tidspunkt etter avsluttet behandling. I tillegg omtales oppfølging og rehabilitering. Pasientomsorg i sitt videste begrep er ikke minst viktig for denne pasientgruppen. Relativt mange pasienter med maligne lymfomer får diagnosen i ung alder og sykdommen påvirker også de pårørende i stor grad. Sykdom og behandling kan for mange av de som rammes gi betydelige fysiske og psykiske plager over tid. Det er viktig med et tverrfaglig samarbeid basert på kunnskap og omsorg.
Patogenese og etiologi
Patogenese og etiologi ved Hodgkin lymfom
Sist faglig oppdatert: 10.12.2021
Hodgkin lymfom (HL) karakteriseres histologisk av et relativt lite antall tumorceller (Hodgkin og Reed-Sternberg celler – HRS) i et vev som domineres av ikke-neoplastiske celler. HL består av to entiteter; klassisk HL og nodulært lymfocyttrikt HL (tidligere paragranulom). Nyere biologiske studier har vist at HRS-celler stammer fra kimsenter B-celler, siden det kan påvises monoklonal immunglobulin-rearrangering med somatiske mutasjoner i tumorcellene i de aller fleste tilfeller. Klassisk HL HRS-celler er positive for CD30 og ofte også for CD15. De er vanligvis negative for CD45, men i ca. 20 % av tilfellene positive for CD20. Det er holdepunkter for at det foreligger en hemming av apoptose og at aktivering av den nukleære transkripsjonsfaktoren NFkB kan være viktig. HRS-celler i klassisk HL uttrykker ikke enkelte av de transkripsjonsfaktorer som er avgjørende for normal B-celle utvikling så som PU.1 og Oct-2. Amplifikasjon av kromosom 9 med PD-1L og PD-2L gir mulighet for vellykket behandling med anti PD-1 antistoffer.
Epstein-Barr virus har vært påvist i HRS-celler hos en høy andel av pasientene og kan være et etiologisk agens av betydning. Immunsuppresjon som ved HIV-infeksjon kan ha patogenetisk betydning.
Søsken av pasienter med Hodgkin lymfom har en tredoblet risiko for selv å utvikle Hodgkin lymfom mens risikoen for å utvikle andre lymfoproliferative sykdommer ikke er statistisk signifikant forskjellig for risikoen i normalbefolkningen (Kristinsson et al., 2009).
Patogenese og etiologi ved non-Hodgkin B celle lymfom
Sist faglig oppdatert: 10.12.2021
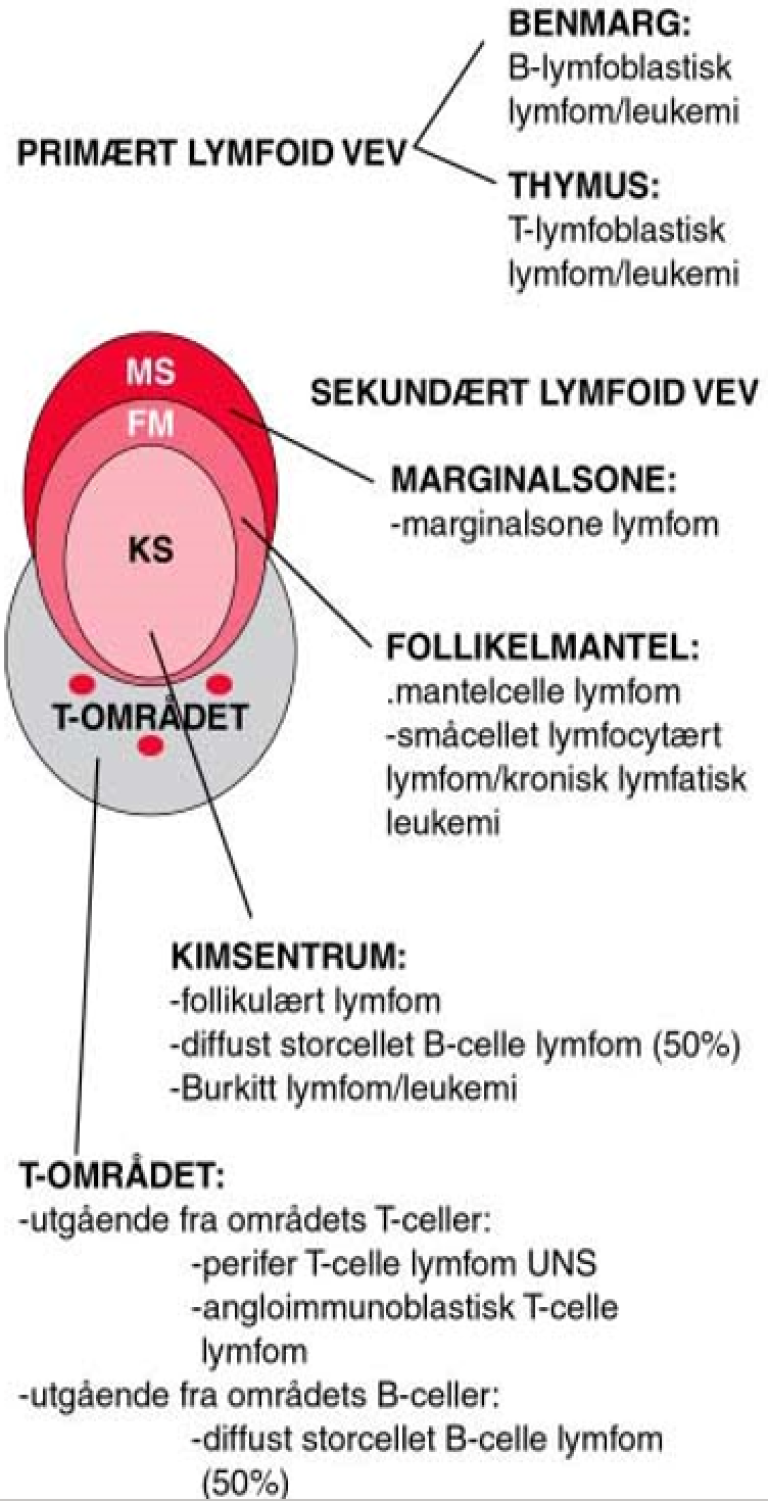
B-celle neoplasier kan betraktes som en klonal proliferasjon av B-celler «frosset» på et bestemt stadium av differensiering fra lymfoide stamceller til modne B-celler (plasmaceller). De forskjellige lymfomsykdommer avspeiler således differensieringsstadier av normale B-celler og danner et viktig grunnlag for den nyeste klassifikasjonen (S. H. Swerdlow et al., 2016). B-lymfocyttene har sitt opphav i umodne B-celleforstadier (B-lymfoblaster), som igjen har sitt opphav i en lymfoid stamcelle og dernest i den multipotente, hematopoietiske stamcelle i benmarg. B-cellerekken differensierer i benmarg og mucosa-assosiert lymfoid vev til modne B-celler med immunglobulin. På dette stadiet har B-cellen ikke vært utsatt for antigen, og den forlater benmargen. B-cellene modnes videre i perifere lymfeknuter hvor de blir antigenstimulert i T-celle området. Etter antigenstimulering vil en del av B-cellene umiddelbart differensiere til plasmaceller, mens en del vil migrere til kimsenteret hvor immunglobulin reseptoren vil bli «skreddersydd» til antigenet via ulike mekanismer, blant annet hypermutasjoner av antigenbindende sete. Noen B-celler differensieres i marginalsonen uten å gå gjennom kimsenteret. Disse sistnevnte B-cellene er antagelig viktige når det gjelder den såkalte T-celle uavhengige immunresponsen (non-protein antigener). Feil i differensierings-prosessene er sannsynligvis vesentlige når onkogene senskader oppstår. Mange lymfomer har translokasjoner som fører til transformasjon og som er viktige elementer i utvikling av malignitet. Tilstedeværelse av immunglobulin loci ved «break-points» for onkogene kromosomale translokasjoner har ført til teorier om at feil i rearrangering av V(D)J gener, isotype skifte og somatiske mutasjoner i kimsenteret kan forårsake slike translokasjoner. For øvrig er det spesielt for kronisk lymfatisk leukemi vist en påfallende stereotyp bruk av IGH V(D)J gener som tilsier at antigen stimulering er viktig i patogenesen av B-cellelymfomer.
B-lymfoblastisk leukemi/lymfoblastisk lymfom er sannsynligvis forskjellige kliniske uttrykksformer av samme sykdom. Opphavet er umodne prekursor B-lymfoblaster i benmargen. De maligne cellene ved en stor andel av mantelcellelymfomer er CD5 positive og korresponderer trolig til naive B-celler med små lymfocytter. Normale naive B-celler sirkulerer i blod og lymfe og finnes i mantelsonene i primære lymfoide follikler. Mantelcellelymfomer karakteriseres ved translokasjonen t(11;14). Immunglobulin promotorgener på kromosom 14 flyttes til kromosom 11 og gir overekspresjon av proliferasjonsproteinet cyclin D1. Dette igjen er sannsynligvis viktig for malign transformasjon. Både mantelcellelymfomer og KLL kjennetegnes, som deres normale opphav, av at de ofte er histologisk småcellete, klinisk utbredte og leukemiske. De maligne cellene ved KLL er nesten alltid CD5 positive. I om lag halvparten av tilfellene har IgVh-genet gjennomgått en somatisk hypermutasjon som i en normal B-celle knyttes til interaksjon med antigen. Dessuten viser genekspresjons-undersøkelser at disse cellene har en genprofil som «memory» B-celler. B-KLL er ikke karakterisert ved forekomst av et spesifikt gen-avvik som for eksempel mantelcelle lymfom og follikulært lymfom. Men noen genetiske avvik forekommer hyppig (del 13q, del 17p, del 11q og trisomi 12) og disse har sammenheng med mutasjonsstatus og prognostisk betydning. Man kjenner i liten grad årsaken til KLL, bortsett fra arv; risikoen for sykdommen er betydelig økt der førstegradsslektning har KLL eller annen lymfoproliferativ sykdom. Det foreligger dessuten store etniske forskjeller i insidens. Man tror KLL og SLL (småcellet lymfocytært lymfom) er forskjellige uttrykksformer av samme sykdom og at patogenese og etiologi derfor er lik. Storcellete diffuse B-celle lymfomer og Burkitt lymfomer har sitt opphav fra blastiske celler som har vært stimulert av antigen i kimsentre og karakteriseres ved muterte immunglobulin V-gener. I likhet med normale centroblaster, har diffuse storcellete B-celle lymfomer ofte også mutert BCL6 gen. Burkitt lymfom uttrykker Bcl-6 og har enten t(8;14), t(2;8) eller t(8;22) translokasjon som alle fører til overekspresjon av det proliferasjon-assosierte proteinet myc. Diffuse storcellete B-cellelymfomer kan også ha c-myc-translokasjon, men genekspresjonsarray kan likevel skille disse lymfomene fra Burkitt lymfom ved ulik ekspresjon av cellesyklusavhengige gener. Follikulære B-celle lymfomer har fenotype som centrocytter (modne centroblaster). Neoplasi oppstår sannsynligvis fordi centrocytter i kimsentre unngår apoptose som en følge av en kromosomal rearrangering t(14;18) som oppregulerer Bcl-2-ekspresjon. I motsetning til normale centrocytter, der ekspresjonen av det antiapoptotiske proteinet Bcl-2 nedreguleres, vil dette nå være vedvarende uttrykt. Marginalsone B-celle lymfomer derimot, korresponderer til hukommelses B-celler med opphav i marginalsonen i follikler. Translokasjonen t(11;18), som man finner ved disse lymfomene, særlig ved lokalisasjon i ventrikkel, gir opphav til et fusjonsprotein og resulterer i overekspresjon av anti-apoptose proteinet API2. Det er usikkert hvorvidt lymfoplasmacyttisk lymfom også har sin opprinnelse fra marginalsone B-celler. Se figur 1 over med de viktigste lymfomentitetene og deres opphavssted.
Infeksiøse agens har vært vist å kunne medvirke til utvikling av forskjellige former for B-celle lymfom (Ekstrom-Smedby, 2006; Suarez, Lortholary, Hermine, & Lecuit, 2006). Det mest klassiske eksempel er assosiasjonen mellom EBV og endemisk Burkitt lymfom i Afrika. Det er videre holdepunkter for at humant herpesvirus 8 spiller en viktig rolle ved primært effusjonslymfom og HIV-infeksjon ved multisentrisk Castlemans sykdom. Hepatitt C kan være assosiert med flere former for lymfom. SV40 virus spesifikke sekvenser ses i 40 % av NHL. Det spekuleres om dette er introdusert gjennom SV40-kontaminasjon i poliovaksine. Det sikreste eksempel på at en bakterie kan representere en utløsende årsak er MALT-lymfomer i ventrikkel, der eradikasjon av Helicobacter pylori kan gi tumor regresjon. Den viktigste kjente risikofaktor for å utvikle B-celle neoplasier er forandringer i immunsystemet, enten ved immunsuppresjon eller autoimmunitet. Immunsuppresjon som følge av HIV er en viktig risikofaktor for den betydelige økte insidensen av NHL hos denne pasientgruppen. Såkalt post-transplantasjons-lymfoproliferative tilstander (oftest B-celle lymfomer) forekommer hos pasienter som er organtransplanterte og bruker immundempende medikamenter i den hensikt å forhindre «graft versus host»-sykdom og avstøting av transplantater. Her er sannsynligvis redusert immunstatus sammen med EBV viktig for patogenesen. Det er en overhyppighet av NHL blant pasienter med reumatoid artritt. Sannsynligvis spiller både kronisk B-celleaktivering som ledd i autoimmuniteten og bruk av immunosuppressive medikamenter en rolle. Det er også rapportert NHL assosiert med Sjøgrens syndrom og Hashimotos thyreoiditt. Forøvrig vet man at det er en viss overhyppighet av B-celle lymfomer blant personer som har vært utsatt løsemidler, fargestoffer og pestisider over tid. Det er generelt en doblet risiko for søsken av pasienter med NHL til å utvikle NHL, mens risikoen for å utvikle samme typer av NHL er høyere (Kristinsson et al., 2009), noe som tyder på at germinalcellelinje risikogener er spesifikke for typer av NHL. Til tross for at det forekommer en opphopning av maligne lymfomer i enkelte familier, har det ikke vært mulig å påvise noen sikker genetisk disposisjon. I det siste er det blitt påvist at visse genetiske variasjoner i cytokin gener medfører høyere risiko for utvikling av non-Hodgkin lymfomer. Dette kan delvis forklare hvorfor det kan finnes en opphopning av maligne lymfomer i enkelte familier, selv om ikke alt er kjent ennå om arv og risiko for lymfomer.
Patogenese og etiologi ved non-Hodgkin T/NK-celle lymfom
Sist faglig oppdatert: 10.12.2021
T-celler oppstår fra umodne prekursorceller med utseende som lymfoblaster i thymus. I thymus får T-cellene sin antigenspesifikke T-celle reseptor, oftest av alfa/beta kjeder og sjeldnere av gamma/ delta kjeder. Etter dette migrerer T-cellene til blod og lymfoid vev som naive T-celler. I det sekundære lymfoide vev stimuleres T-cellene av antigen. Funksjonelt er det to hovedklasser av perifere T-celler. Det er såkalte T-hjelpe celler (uttrykker CD4) og T-cytotoksiske (drepe) celler (uttrykker CD8). T-hjelper celler inndeles videre i TH1 and TH2 celler i h.h.t. deres cytokinsekresjonsmønster. TH1 celler er T-celler som hjelper andre T-celler eller makrofager med modning og cellulære immunresponser. TH2-celler er T-celler som hjelper B-celler til å bli antistoffproduserende celler. T-drepe/killer celler er viktige i forsvaret mot virus. Selv om dette er viktig for immunologien, kan disse ulike funksjonelle typene av T-celler ikke med letthet korreleres til T-celle lymfomklassifikasjonen. Selv vel-definerte T-celle lymfomer som mycosis fungoides, kan enten oppstå fra en T-celle som uttrykker CD4 (som i de fleste tilfeller) eller CD8.
Prekursor T-lymfoblastisk leukemi/ lymfoblastisk lymfom stammer fra umodne prekursor T-lymfoblaster i thymus eller benmargen. De øvrige T-celle neoplasier stammer fra modne post-thymiske T-lymfocytter. T-celle lymfomer viser stor morfologisk variasjon, også innenfor hver subgruppe. Ulikt B-celleneoplasier, er de fleste perifere T-celle lymfomer ikke assosiert med spesifikke immunfenotypiske profiler. De har heller ikke anvendbare immunfenotypiske markører for monoklonalitet. Derfor er det ofte nødvendig å gjøre genetiske studier, som regel PCR-studier av rearrangerte T-celle reseptor gener, for å påvise monoklonalitet. Her er det således en fordel å ha ufiksert dypfryst vev, selv om slike undersøkelser også nå kan utføres på parafininnstøpt materiale. Det er ikke påvist spesifikke genaberrasjoner for de fleste T-celle lymfomer. Et av de få unntakene er systemisk anaplastisk storcellet lymfom som er sterkt assosiert med t(2;5) og som fører til økt ekspresjon av en tyrosin kinase (alk).
Viruset HTLV-1 er assosiert med adult T-celle lymfom/leukemi i Japan og på de Karibiske øyer, og er sannsynlig vesentlig i patogenesen ved dette T-celle lymfomet. For øvrig kjenner man ikke til miljøfaktorer som disponerer for utvikling av disse lymfomene. Enteropatitype T-celle lymfom hos voksne ses oftest hos pasienter med cøliaki.
Lite er kjent vedrørende patogenese av NK-celle lymfom. De har ikke komplett T-celle reseptor, men uttrykker oftest Є-kjeden til CD3 i cytoplasma, som kan påvises ved polyklonale antistoffer mot CD3. De kan også uttrykke antigener som også forekommer ved noen T-cellelymfomer som CD2, CD7, CD8, CD56 og CD57 samt cytotoksiske proteiner som perforin og granzymeB.
Epidemiologi
Sist faglig oppdatert: 06.03.2023
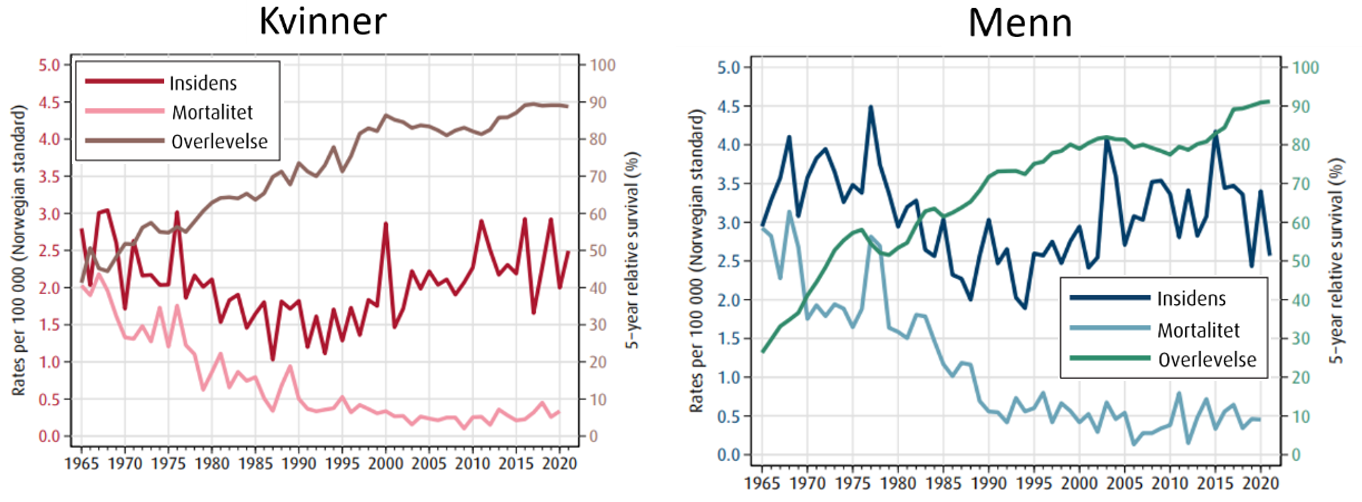
n-Hodgkin lymfomer (NHL) utgjør ca. 3 % av alle ondartede sykdommer diagnostisert i Norge hvert år. Til sammen utgjorde dette 1232 nye tilfelle i 2021 (Larsen, 2022). Ratio mellom menn og kvinner er 1.2. Fordelingen mellom indolente og aggressive NHL er tilnærmet lik. Det har vært en klar økning i insidens over tid, som vist i figur 2. Bedring i diagnostikk og klassifikasjon av lymfomer har ført til en 10–15 % skifte fra Hodgkin lymfom (HL) til NHL. Selv om det har vært en økende insidens for de fleste NHL, er økningen mest markant for diffust storcellet B-celle lymfom (Ekström-Smedby, 2006). Insidensen av de enkelte NHL varierer mye i forskjellige aldersgrupper, men er totalt sett økende med alder (figur 2). NHL er en sjelden sykdom i barnealder, med dominans av diffust storcellet B-cellelymfom og Burkitt lymfom. Anvendelse av intensive leukemi-regimer har ført til en utmerket overlevelse hos barn. Diffust storcellet B-cellelymfom forekommer i alle aldersgrupper, med økende insidens hos de eldre og med median debutalder på ca. 65 år. Derimot er indolent NHL en meget sjelden sykdom under 30 år. Median debutalder for follikulære lymfomer er rundt 60 år. Omtrent 14500 personer lever i Norge i dag etter behandling for NHL (Larsen, 2022).
HL er langt sjeldnere enn NHL, og insidensen er noe høyere blant menn enn kvinner (figur 3). Det ble diagnosisert 141 tilfelle i Norge i 2012 (Larsen, 2016). Insidensen av HL har vært relativt jevn over tid (figur 3). Årsaken kan være endringer i diagnostiske kriterier. Insidenskurven for HL er bimodal relatert til alder: den første toppen observeres hos unge voksne i aldersgruppen 15–34 år, den andre hos de eldre (> 50 år). Klassisk HL utgjør ca. 95 % av tilfellene og nodulært lymfocyttrikt HL bare 5 %. Undergruppene av klassisk HL; nodulær sklerose, blandet cellularitet, lymfocyttrikt og lymfocyttfattig står for henholdsvis 45 %, 40 %, 5 % og 5 % av tilfellene. Omtrent 2800 personer lever i Norge i dag etter behandling for HL (Larsen, 2016).
Klassifikasjon
Sist faglig oppdatert: 06.03.2023
Moderne lymfom-klassifikasjon følger WHO-klassifikasjonen (Swerdlow et al., 2016). De enkelte sykdommer defineres ut fra kombinerte kriterier fra morfologi, immunfenotype, genetiske forandringer og klinikk. Det er lagt vekt på å avgrense kliniske sykdomsentiteter som skiller seg tydelig i biologisk oppførsel og behandlingsrespons. Den histologiske klassifikasjon som ble benyttet i Norge fra omkring 1980 (Kiel-klassifikasjonen), delte NHL inn i lavgradige og høygradige maligne lymfomer.
Denne inndelingen er nå forlatt (se senere), men vår kunnskap om overlevelse ved ulike undergrupper av NHL er i stor grad basert på Kiel-klassifikasjonen. I 1994 ble det publisert et forslag til et revidert klassifikasjonssystem, REAL (Revised European-American Lymphoma)-klassifikasjonen som raskt fikk verdensomspennende tilslutning. Denne er i 2001 med mindre modifikasjoner avløst av WHO-klassifikasjonen. WHO-klassifikasjonen inkluderer både NHL og HL, myeloide neoplasier, som ikke omtales i dette heftet, lymfoide leukemier og plasmocytomer/myelomatose. Sjeldne entiteter i WHO-klassifikasjonen som histiocytære og dendrittisk-celle neoplasier og mastocytose blir ikke omtalt her.
De fleste morfologi-baserte undergrupper av storcellet B-celle lymfom i Kiel-klassifikasjonen er i WHO-klassifikasjonen slått sammen til diffust storcellet B-celle lymfom, og en rekke subtyper av perifer T-celle lymfom er slått sammen til perifer T-celle lymfom UNS. Derimot skilles de nodale fra de ekstranodale lymfomene, og det er tilkommet flere nye entiteter. De som oppføres i klassifikasjonen, betraktes som selvstendige sykdommer, og de grupperes som nevnt ikke lenger som lavgradig og høygradig NHL.
Klassifikasjonen er igjen revidert og foreløpig siste utgave av WHO-klassifikasjonen er publisert i 2017 (Swerdlow et al., 2016). Nye entiteter har kommet til. Overgangsformer mellom Burkitt lymfom og diffuse storcellete B-cellelymfomer (DLBCL) og mellom Hodgkin lymfom og DLBCL er definert. Flere undergrupper av DLBCL og perifere T-cellelymfomer har kommet til der alder, etiologi og lokalisasjon spiller en betydelig rolle for diagnosen. WHO-klassifikasjon av hematopoietiske og lymfoide neoplasier er gitt i tabellarisk form i vedlegg 1. Primære hudlymfomer har fått sin egen klassifikasjon (Willemze et al., 2019)
Det er i 2022 kommet to reviderte versjoner av WHO klassifikasjonen fra 2016. Det pågår en dialog om hvilken av disse som vil bli brukt i tiden fremover (Alaggio et al., 2022; Campo et al., 2022).
Overlevelse og prognostiske faktorer
Sist faglig oppdatert: 10.12.2021
Både for HL og NHL er høy alder, B-symptomer og nedsatt allmenntilstand funnet å være forbundet med redusert kreftspesifikk overlevelse. I store retrospektive multisenter-undersøkelser har også andre faktorer vist seg å ha prognostisk betydning (se senere). Registrering av allmennsymptomer gjøres både ved HL og NHL. B-symptomer forekommer hos 38 % av pasientene med HL og er dobbelt så hyppig (37 %) ved aggressive NHL sammenliknet med indolente NHL (19 %) (DNR-materiale).
Hodgkin lymfom – overlevelse og prognostiske faktorer
Sist faglig oppdatert: 06.03.2023
Overlevelsen ved HL har bedret seg betydelig gjennom de siste 50 år (se figur 3, i Epidemiologi). Dette anses å skyldes effektive cytostatikaregimer og bedret bruk av strålebehandling, men også en mer fullstendig utredning slik at pasientene kommer i riktig behandlingskategori. Det er ingen forskjell i overlevelse mellom ulike histologiske undergrupper eller for kvinner sammenliknet med menn (se figur 3, i Epidemiologi).
Prognostiske faktorer ved begrenset sykdom (stadium I-IIA)
Basert på data fra flere grupper er følgende risikofaktorer av prognostisk ugunstig betydning (Hasenclever & Diehl, 1998).
- SR > 50
- > 2 lymfeknutestasjoner involvert
- Sykdom under diafragma (med unntak av ensidig lyskeaffeksjon)
- Lymfocyttfattig histologi
- Bulky sykdom ≥ 10 cm
Prognostiske faktorer ved utbredt sykdom (stadium IIB-IV)
Basert på en multisenterstudie for prognostiske variabler hos pasienter som har fått «state of the art» kjemoterapi har det vært mulig å påvise følgende syv faktorer som uavhengige ugunstige prognostiske faktorer i multivariatanalyse (Hasenclever & Diehl, 1998):
- Alder > 45 år
- Albumin ≤ 40 g/L
- Hemoglobin < 10,5 g/dL
- Menn (mot kvinner)
- Stadium IV
- Leukocytose ≥ 16 x 109/L
- Lymfopeni < 0,6 x 109/L
De ulike risikofaktorene har tilnærmet like stor betydning, og man kan derfor legge sammen faktorene. Antallet faktorer kan derfor benyttes for å estimere en såkalt international prognostic score, IPS, som sier noe om prognose.
Non-Hodgkin lymfom – overlevelse og prognostiske faktorer
Sist faglig oppdatert: 10.12.2021
Leveutsiktene har bedret seg over tid, spesielt det siste 10-år (se figur 3, i Epidemiologi). Overlevelsen er omtrent den samme for kvinner som for menn (nær 80 % % er i live etter 5 år) og er i betydelig grad avhengig av stadium, histologi og alder.
Det har vært en positiv utvikling, spesielt for de aggressive lymfomene. Vi forventer en fortsatt bedring i overlevelse i de nærmeste år. Det er viktig å merke seg at 5-års overlevelse ikke er ensbetydende med kurasjon for indolente lymfomer, overlevelseskurven «flater» ikke ut.
Overlevelseskurvene «krysser» etter 10–15 år; flere med aggressive lymfomer dør i løpet av de første år, men langtidsoverlevelsen er høyest for pasienter med disse lymfomtypene.
Prognostiske faktorer ved aggressivt non-Hodgkin lymfom
International Prognostic Index (IPI) for aggressive NHL er basert på funn fra et internasjonalt samarbeid mellom flere sentre i mange land mht å finne pålitelige prognostiske faktorer (0–1, 2, 3, 4–5). Det ble påvist 5 uavhengige negative prognostiske faktorer:
- Alder > 60 år
- LDH forhøyet
- > 1 ekstranodal affeksjon
- WHO status ≥ 2
- Stadium III/IV
Avhengig av antall risikofaktorer (0–5) deler modellen pasientene inn i 4 risikokategorier med betydelig forskjell i prognose (0–1, 2, 3, 4–5). Ved en retrospektiv analyse av de kliniske risikofaktorer over etter at rituximab ble del av behandlingen, beholder IPI sin relevans, men grupperingen av faktorene bør endres (0 versus 1–2 versus 3–5) (Sehn et al., 2007).
Ved alder ≤ 60 år benytter man en såkalt aldersjustert IPI der følgende 3 faktorer har en uavhengig negativ prognostisk verdi:
- LDH forhøyet
- WHO status ≥ 2
- Stadium III/IV
Kreftspesifikk overlevelse hos pasienter i ulike IPI grupper er vist i vedlegg 2. Det skal bemerkes at moderne behandling, spesielt introduksjonen av rituximab, har forbedret prognosen for alle risikogrupper og alle disse kurvene vil i dag antakelig ligge 10–20 % høyere.
En mer raffinert IPI score (NCCN-IPI) er utviklet, skiller pasientene bedre i ulike risikogrupper og vil kunne erstatte IPI i årene som kommer. NCCI IPI bruker de samme kliniske faktorene, men med fire aldersgrupper med score 0–3 (≤ 40, 40–60, > 60–75, ≥ 75) og med tre LDH nivåer (normal, >1–3, > 3 x normal) (Zhou et al., 2014)
Prognostiske faktorer ved follikulært non-Hodgkin lymfom
Selv om International Prognostic Index er basert på aggressive lymfomer, har flere undersøkelser vist at indeksen er av verdi mht å skille pasienter med god og dårlig prognose også ved indolente lymfomer. Det viser seg imidlertid at de aller fleste pasienter havner i gruppen for god prognose, og man har derfor hatt behov for en egen indeks for denne pasientgruppen. Gjennom et større samarbeidsprosjekt har man kommet frem til en slik prognostisk indeks for follikulære lymfomer, som raskt har fått stor anvendelse:
Det er utarbeidet en såkalt FLIPI (follicular lymphoma international prognostic index)-score som kan brukes til å gruppere pasienter med follikulært lymfom i tre kategorier; lav, intermediær og høy risiko (Solal-Celigny et al., 2004). Overlevelse for pasienter med follikulært lymfom basert på lav (0–1 faktorer), middels (2 faktorer) eller høy (3–5 faktorer) for FLIPI score.
- Alder > 60 år
- LDH forhøyet
- Ann Arbor stadium III–IV
- Hemoglobinnivå < 12,0 g/dL
- Antall nodale stasjoner > 4
Det er verdt å merke seg at > 4 lymfeknutestasjoner affisert er en negativ faktor i FLIPI score, og at angivelse av lymfeknutestasjoner ikke følger den tradisjonelle Ann Arbor definisjonen, se figur 4 nedenfor.
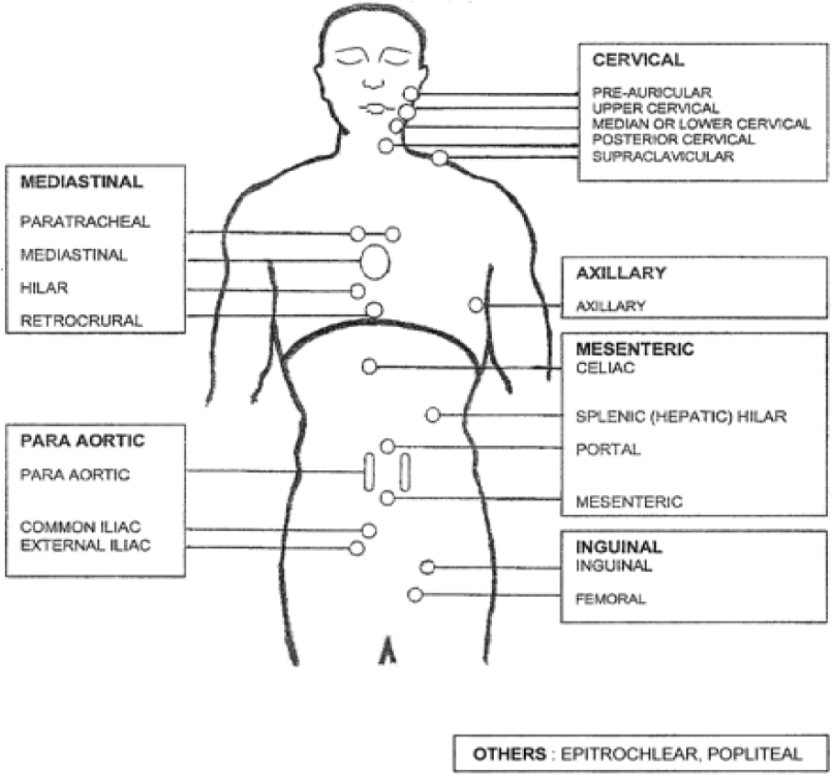
Selv om FLIPI representerer et framskritt og fortsatt er dominerende, er denne indeksen ikke optimal. Grunnlagsdata er hentet fra pre-rituximab-era. Indeksen er designet med overall survival (OS) som endepunkt, mens man i dag er enige om at progresjonsfri overlevelse (PFS) er bedre egnet for follikulære lymfomer. Man har derfor utviklet en FLIPI2, som tar hensyn til disse ting (Federico et al., 2009).
Prognostiske faktorer ved mantelcellelymfom
Mantlecell lymphoma international prognostic index (MIPI) stammer fra data fra kliniske studier i Tyskland. MIPI klassifiserer pasienter i tre risikogrupper; lav risiko, intermediær risiko og høy risiko basert på følgende faktorer (Hoster et al., 2008):
- Alder
- ECOG status
- LDH
- Leukocyttall
Der prosent Ki67 positive celler er tilgjengelig kan man kalkulere såkalt MIPI-C basert på de samme faktorer som over med tillegg av Ki67 (Hoster et al., 2016).
Utregning av MIPI og MIPI-C gjøres vha kalkulator som finnes på følgende link:
https://qxmd.com/calculate/calculator_149/mipi-mantle-cell-lymphoma-prognosis
Forløpstider ved lymfom
Om Pakkeforløp for lymfekreft
Sist faglig oppdatert: 10.12.2021
I 2015 ble Pakkeforløp for Lymfom implementert i helsetjenesten. Pakkeforløpet ble revidert i 2016 samtidig med resten av Pakkeforløpene for kreft.
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Formålet med Pakkeforløp for kreft er at pasienter skal oppleve et godt organisert, helhetlig og forutsigbart forløp uten unødvendig ikke-medisinsk begrunnet forsinkelse i utredning, diagnostikk, behandling og rehabilitering.
Forløpstidene i pakkeforløpet beskriver den maksimale tiden de ulike fasene i forløpet bør ta for et flertall av pasientene. Forløpstidene angis i kalenderdager. De enkelte fasenes forløpstid legges til slutt sammen til en samlet forløpstid, som angir tiden fra henvisning er mottatt til start behandling. Med utgangspunkt i pakkeforløpet skal et individuelt forløp tilrettelegges for hver enkelt pasient.
De regionale helseforetakene har det overordnede ansvaret for å sikre at pakkeforløpene med forløpstidene blir implementert og fulgt opp. Forløpstidene er normerende og er ikke en pasientrettighet. Fortsatt er det lovmessige grunnlaget pasientrettighetsloven § 2-2 og forskrift om prioritering av helsetjenester. Av og til vil det av faglige grunner være noen pasienter som ikke kan utredes ferdig innen normert forløpstid for oppstart av første behandling.
Dette gjelder spesielt for pasienter med uklare symptomer og uavklarte tilstander. Årsaker til avvik fra de normerte forløpstidene bør dokumenters i pasientjournalen.
Pakkeforløp for lymfekreft finnes på Helsedirektoratets nettsider, se www.helsedirektoratet.no
Det er utarbeidet en egen diagnoseveileder for fastleger for inngang til pakkeforløp. Diagnoseveileder finnes på www.helsedirektoratet.no
Det er også utarbeidet pasientinformasjonsskriv, som finnes på www.helsedirektoratet.no
Forløpstider
| Fra henvisning er mottatt på utredende avdeling til oppmøte | 4 kalenderdager | |
| Fra oppmøte på utredende avdeling til avsluttet utredning | 14 kalenderdager | |
| Fra avsluttet utredning til start behandling eller observasjon | Stråleterapi | 10 kalenderdager |
| Kjemo/immunterapi eller beslutning om observasjon | 3 kalenderdager | |
| Fra henvisning mottatt til start behandling eller observasjon | Stråleterapi | 28 kalenderdager |
| Kjemo/immunterapi eller beslutning om observasjon | 21 kalenderdager |
Diagnostikk og utredning
Anamnese og klinisk undersøkelse
Sist faglig oppdatert: 06.03.2023
Legg vekt på klinisk veksthastighet av sykdommen og evt. spontan tilbakegang. Registrer om det har vært B-symptomer (vekttap, feber, patologisk nattesvette) eller andre allmennsymptomer. Generell status med vekt på patologisk glandelsvulst og hepato/splenomegali.
Klinisk kjemiske undersøkelser
Sist faglig oppdatert: 10.12.2021
Ved førstegangs innleggelse tas følgende prøver:
Hemoglobin, leukocytter m/differensialtelling, trombocytter, eventuelt supplert med blodutstryk.
Kreatinin, urinstoff, urinsyre, Na, K, Ca, LDH, bilirubin, leverenzymer, SR, CRP, albumin, totalprotein, immunglobulinkvantitering, evt. serum proteinelektroforese med frie lette kjeder, β2-mikroglobulin, serologiske undersøkelser for CMV, HIV, HBV, HCV og EBV. Urinanalyser på nærmere indikasjon.
Histopatologisk diagnose
Sist faglig oppdatert: 06.03.2023
Det er utarbeidet detaljerte nasjonale retningslinjer for hematopatologisk diagnostikk (se Vedlegg 1). WHO-klassifikasjonen bruker multiple parametere for å klassifisere lymfomer. Ettersom lymfompatologi kan være krevende, bør det diagnostiske biopsimaterialet der det er begrunnet mistanke om lymfom, sendes direkte til spesialavdeling for lymfomdiagnostikk. Disse kan utføre nødvendige tilleggsundersøkelser (immunhistokjemi, genotyping med tanke på klonalitet, in situ hybridisering m.h.p. bestemte translokasjoner eller Epstein Barr virus). Patologen er ansvarlig for å bruke de undersøkelser som er nødvendig for å stille en sikker diagnose basert på WHO-klassifikasjonen. Bruk av tilleggsundersøkelser er avhenging av lymfomtype.
Histopatologisk utredning av malignt lymfom forutsetter representativ biopsi av affisert vev (helst lymfeknute der dette er tilgjengelig) og benmargsbiopsi og aspirat for immunhistologiske undersøkelser. Finnålsaspirasjonscytologi (FNAC) er kun unntaksvis indisert når det trengs et raskt foreløpig svar for behandling. FNAC skal alltid følges opp med en representativ biopsi for fullstendig typing av lymfomet. Der det ligger til rette for det anbefales kirurgisk biopsi fremfor nålebiopsi fordi det øker sjansen for representativt materiale og dermed for å oppnå korrekt diagnose. Flowcytometriske undersøkelser av blod og benmarg utfyller morfologisk undersøkelse av biopsi og aspirat, både med hensyn til hvorvidt sykdomsaffeksjon foreligger og eventuelt hvilken subtype. Visse typer lymfom er lettere å påvise med en teknikk fremfor en annen, avhengig av lymfomtype og graden av affeksjon. Flowcytometri er spesielt egnet ved småcellet lymfom i benmarg og blod. Hvilke undersøkelser som er indisert/nødvendig for de ulike diagnoser er varierer.
Biopsimateriale
WHO-klassifikasjonen bruker en multiparametrisk tilnærming til lymfomklassifikasjonen. Dette innebærer at morfologisk undersøkelse, immunfenotypisk undersøkelse, molekylærgenetiske, cytogenetiske, enkelte ganger virologiske og kliniske data kombinert danner det diagnostiske grunnlaget for lymfomtypen, eller snarere, lymfomentiteten.
F.eks.:
- Klonalitetsundersøkelse enten ved immunfenotyping eller molekylærgenetisk undersøkelse er absolutt nødvendig for å diagnostisere posttransplantasjonslymfoproliferativ sykdom
- Påvisning av Epstein-Barr virus er nødvendig for å diagnostisere ekstranodalt NK/T-cellelymfom, nasal type
- Klinisk informasjon mhp mediastinal lokalisasjon er nødvendig for diagnosen mediastinalt (thymisk) storcellet B-celle lymfom
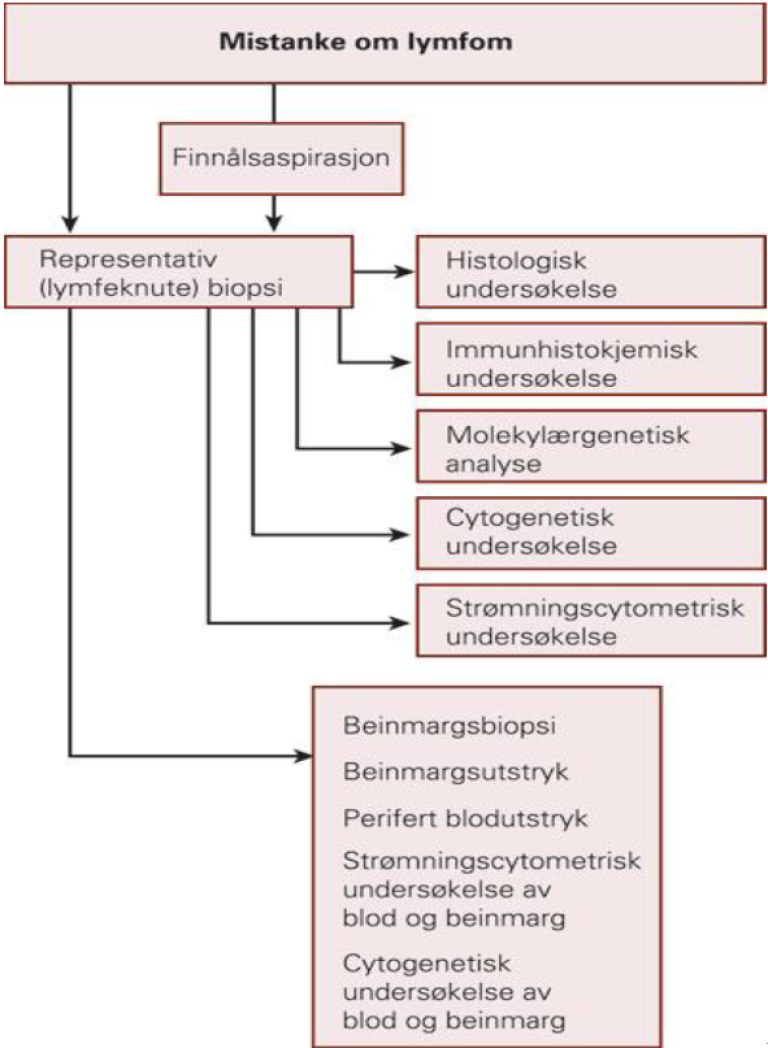
I og med at man ikke vet hvilke parametre som til slutt vil danne del av diagnosegrunnlaget ved forsendelse av vev til patologen, må vevet sendes på en standardisert måte sammen med relevante kliniske opplysninger.
Husk at jo større biopsi, jo bedre og raskere kommer man frem til en diagnose. Små biopsier resulterer ofte i ufullstendig undersøkelse og gjør det ofte nødvendig å rebiopsere (med tilsvarende forsinkelse av diagnose og behandling). Nålebiopsier bør derfor unngås så sant det er mulig.
En biopsi bør være så representativ som mulig. Ikke ta ut vev for diagnose kun fordi det er enklere å fjerne enn mer utbredt vevsaffeksjon på et vanskeligere tilgjengelig sted. I stedet, ta den biopsien som mest sannsynlig inneholder den mistenkte tumor. Ved generell perifer glandelsvulst er lyskebiopsi minst egnet for histologisk diagnostikk fordi lymfeknutene her oftere har reaktive forandringer enn i andre lokalisasjoner. Bruk av PET / CT kan være nyttig spesielt ved mistanke om transformasjon: biopsien tas fra område med høyest opptak.
Relevant klinisk informasjon som det bør opplyses om til patologen
- Type vev
- Hensikten med undersøkelsen: diagnostisk prøve, oppfølging, mistanke om hematologisk sykdom
- Sykdommens lokalisasjon: lymfeknute, ekstranodal, splenomegali, hepatomegali, leukemi
- Sykdomsdebut
- Kort sykehistorie: organtransplantasjon, hepatitt C virus infeksjon, langvarig medikamentell behandling som f.eks. metotreksat, difenylhydantoin, immunsuppressiva
- Patologer bør alltid informeres om mulig smittefare: hepatitt virus, mykobakterier, HIV
Standard forsendelse av vev
Generelt bør biopsi for lymfomdiagnostikk tas tidlig på dagen og helt ikke på fredager på grunn av håndtering av ferskt materiale. Alt vev, med unntak av benmargsbiopsier (se nedenfor), bør fortrinnsvis sendes ufiksert til patologen. Åpningstider for laboratoriet bør verifiseres på forhånd. Rutiner vedrørende forsendelse, transportmedium, transportbeholder m.v. bør avtales med laboratoriet som skal motta prøven. Vevsbiten må ikke bli liggende uten væske, da vil den fort tørke ut og tape kvalitet både i forhold til morfologi og tilleggsanalyser. Vevsbiten legges i avkjølt Ringers væske eller annet transportmedium i en mindre beholder. Dersom materialet ikke forventes å nå frem til patologilaboratoriet innen 30 minutter, bør beholderen med vevsbiten holdes avkjølt på isbiter i egnet beholder (f.eks. termosflaske). NB! Tørris må ikke brukes. Dersom biopsimaterialet ikke vil rekke frem innen 24 timer etter biopsitakningen, bør man fiksere minst en halvdel av materialet i formalin, mens den annen del sendes ufiksert og nedkjølt som beskrevet ovenfor. Ved tvil om det er nok vev til å ta av en bit ferskt vev eller om dette vil komme frem til laboratoriet i tide, legges alt vevsmatariale direkte i formalin. I så tilfelle, bør kirurgen dele opp vevet i tynne skiver (ikke tykkere enn 3 mm) på langs for å sikre god fiksering. Se figur 6. Ved oppdeling må man være forsiktig slik at vevet ikke blir klemt.
Benmargsbiopsi
I prinsippet taes benmargsbiopsier kun for stadieinndeling av lymfomer, ikke for å stille en nøyaktig diagnose. For dette formål må annen type vev sendes. Det er flere grunner til dette: noen lymfomer forandrer morfologi når de affiserer benmarg, f.eks. kan follikulært lymfom ha et utseende som ser mer lavgradig ut i benmargen enn i lymfeknuten; dekalsifisering av benmargen (som er nødvendig del av fremføringen) begrenser mulighetene for ulike undersøkelser som er mulig å gjøre på annet biopsimateriale; det er ofte minimal lymfomaffeksjon slik at fullstendig typing med immunhistokjemi kan vise seg umulig. Unntak fra denne regelen gjelder for diagnostisering av de lymfomproliferative sykdommene som er primære i benmarg, så som KLL, myelomatose og lymfoplasmacyttisk lymfom.
Relevant klinisk informasjon som det bør opplyses til patologen
Se avsnitt over om Biopsimateriale.
Standard forsendelse av vev
Benmargsbiopsien bør være stor nok, d.v.s. minimum 2 cm. I tillegg må man passe på ikke å klemme vevet ved biopsitaking. Biopsien bør sendes i egnet fikseringsmiddel. Laboratoriene bruker forskjellige fikseringsmidler, og man bør derfor ta kontakt med patologen som skal motta biopsien for informasjon vedr. fikseringsprosedyre.
Blod og benmargsutstryk
Se ovenstående vedr. benmargsbiopsi. Utstryk kan gi tilleggsinformasjon til benmargsbiopsien, særlig er den morfologiske vurderingen av småcellete lymfomer mer eksakt. F.eks. er diagnostisering av storgranulær T-lymfocyttleukemi svært vanskelig på benmargsbiopsien alene.
Relevant klinisk informasjon
Se avsnitt over om Biopsimateriale.
Standard forsendelse av utstryk
- Bruk fettfrie objektglass. Legg en liten dråpe blod/benmarg på den ene enden av glasset. Når det gjelder benmarg, må man forsikre seg om at benmargselementer er inkludert. Enkelte ganger kan det hjelpe å skylle ut sprøyten i EDTA før man aspirerer. Dette kan hindre at aspiratet klumper seg før utstryket lages.
- Dra glasset til å lage utstryket (slepet utstryksglass) mot dråpen i en vinkel på 30 grader til det berører blod/ benmargsdråpen. Blodet vil spre seg bak utstryksglasset ved hjelp av kapillarkraft, og man bør la det spre seg utover i glassets fulle bredde.
- Dra utstryksglasset lett og raskt nedover glasset slik at det dannes en fin hale.
- Lufttørk utstryket. Merk glasset med pasientens fulle navn (med blyant).
- Fiksering med metanol er å anbefale ved forsendelse
Flowcytometrisk undersøkelse
Flowcytometrisk undersøkelse har to store fordeler: multiparametrisk immunfenotyping gir en mer eksakt immunfenotype av cellene. Dette er viktig dersom man ønsker å påvise koekspresjon av markører på samme cellepopulasjon. Et typisk eksempel på dette er påvisning av restriksjon for immunglobulin lett kjede i B-celle neoplasier. Teknikken er også mer sensitiv når det gjelder å påvise små tumorpopulasjoner.
Det anbefales sterkt at den flowcytometrisk ansvarlige selv vurderer morfologien av tilsendt materiale før det analyseres, eventuelt har mulighet for å få en morfologisk vurdering. Grunnen til dette er at man kan arbeide mer målrettet m.h.p. å bestemme antistoffpanelet som skal brukes flowcytometrisk. Dette vil i stor grad øke det utbyttet man kan få av undersøkelsen.
Relevant klinisk informasjon
Se avsnitt over om Biopsimateriale.
Standard forsendelse av prøvemateriale
- Ta kontakt med den flowcytometrisk ansvarlige for nærmere retningslinjer, da disse kan være forskjellig fra laboratorium til laboratorium. Retningslinjene nevnt nedenfor er derfor generelle.
- Generelt bør prøven inneholde minimum 5 ml blod eller benmarg, tilsatt konserveringsfritt heparin som antikoagulasjonsmiddel. Vær nøye med å blande aspirert materiale (særlig benmarg) og heparin slik at koagulering unngås. Hvis utstrykspreparatet vurderes et annet sted (kliniker eller patologilaboratorium), må man huske å sende ekstra lufttørket utstryk sammen med den flowcytometriske prøven.
- Prøvene må ankomme laboratoriet senest 24 timer etter prøvetaking.
- Der man ønsker å utføre flowcytometri av vev, må biopsien sendes ufiksert og nedkjølt.
- Dersom annet biologisk materiale (eks pleuravæske) ønskes u.s. med flowcytometri, se under finnålsaspirasjon.
Finnålsaspirasjon
Finnålsaspirat kan undersøkes raskt, i motsetning til biopsier. Utbyttet er imidlertid såpass redusert sammenlignet med biopser at riktig WHO-klassifisering av lymfomet vanligvis ikke er mulig. Finnålsaspirasjon bør derfor være forbeholdt de tilfellene hvor det ønskes et foreløpig svar innen 24 timer, enten for rask behandlingsstart eller for en mer effektiv organisering av den diagnostiske utredningen av pasienten. Flowcytometrisk undersøkelse kan gi verdifull tilleggsinformasjon særlig for B-celle lymfomene. Finnålsaspirasjon bør alltid følges opp med biopsitaking.
Relevant klinisk informasjon
Se avsnitt over om Biopsimateriale.
Standard forsendelse av prøvemateriale
- Ta kontakt med cytologen/den flowcytometrisk ansvarlige for nærmere retningslinjer, da disse kan være forskjellig fra laboratorium til laboratorium. Retningslinjene nevnt nedenfor er derfor generelle. Utstryk fikseres før forsendelse.
- Dersom man i tillegg til de lufttørkete utstrykene skal sende materiale til flowcytometrisk undersøkelse, bør dette sendes i RPMI-væske (kfr. flowcytometrisk undersøkelse). Send alltid lufttørket utstryk sammen med prøven (se ovenstående).
- Prøvene må ankomme laboratoriet senest 48 timer etter prøvetaking, og helst innen 24 timer.
Cytogenetiske undersøkelser
Dette inngår ikke som rutineundersøkelse for de fleste tilfelle av maligne lymfomer, men bør utføres ved mistanke om lymfoblastlymfom. Mange typer av malignt lymfom karakteriseres ved spesifikke kromosomavvik, og påvisning av slike kan avklare en ellers vanskelig diagnose.
Dette er krevende og utføres foreløpig bare ved Avdeling for genetikk, Oslo Universitetssykehus, Radiumhospitalet (vev, blod og benmarg) og ved Avdeling for genetikk, Haukeland Universitetssykehus (blod og benmarg). En vellykket undersøkelse kan avklare om en neoplastisk prosess foreligger eller ikke, og kan, ved påvisning av spesifikke kromosomavvik være av stor betydning for diagnose og behandlingsvalg.
Spesifikke immunhistokjemiske og karyotypiske trekk for de viktigste lymfomtyper er angitt under kapitlet om behandling.
Enkelte av de forandringene som påvises ved de tradisjonelle cytogenetiske undersøkelsene kan også påvises ved molekylærgenetiske metoder (PCR, FISH f eks ved t(8;14) ved Burkitt lymfom). I tillegg til translokasjoner kan disse metodene også påvise monoklonalitet. Metodene utføres ved flere patologiske laboratorier.
Relevant klinisk informasjon
Rekvisisjon for kromosomundersøkelse kan fås ved henvendelse til Laboratorium for cytogenetikk Avdeling for Patologi Det norske radiumhospital HF eller tilsvarende ved Haukeland sykehus HF. Ufullstendige kliniske opplysninger kan vanskeliggjøre analysen og gi et dårligere svar tilbake. Se for øvrig ovenstående vedr. biopsimateriale.
Standard forsendelse av prøvemateriale
Veiledning for innsendende lege/sykehus for kromosomundersøkelse av benmarg, blod og vev samt tilsending av transportrør med medium kan fåes ved henvendelse til laboratoriet som skal utføre undersøkelsen, se ovenfor. Cytogenetisk undersøkelse av vev foretas som nevnt kun ved Det norske radiumhospital. Prøver mottas mandag–torsdag. Prøver mottatt til andre tider kan ikke tas hånd om optimalt. Patologen bør ordne forsendelse av vevet til cytogenetisk undersøkelse siden han har oversikt over vevets totale størrelse og hvor mye vev som er nødvendig for de ulike diagnostiske undersøkelsene. Blod- eller benmargsprøve sendes så snart som mulig på transportrør ved romtemperatur (bruk termos vintertid) til Laboratorium for Cytogenetikk, helst slik at den er laboratoriet i hende samme dag senest en time før arbeidsdagens slutt.
Billeddiagnostikk ved maligne lymfomer
Sist faglig oppdatert: 06.03.2023
CT- og ultralyd-undersøkelser
CT er fortsatt standard-undersøkelsen ved utredning og kontroll av maligne lymfomer hos voksne og brukes i de fleste tilfeller. Der det utføres PET/CT som evaluering under pågående – eller etter avsluttet behandling, anses ikke ordinær CT å være nødvendig.
CT Collum/thorax/aksille
- som regel gjøres dette ved både HL og NHL.
- vurder å supplere med MR eller ultralyd ved mistanke om affeksjon av thoraxveggen eller perikard.
CT Abdomen/bekken
- Dette er standard undersøkelse ved utredning av lymfomer.
- PET/CT, eventuelt ultralyd lever/milt /paraaortale rom eller MR gjøres i tillegg ved HL (bør også vurderes ved NHL) eller ved uklare funn på CT abdomen. To modaliteter kan ofte supplere hverandre og gi tilleggsinformasjon (eks PET/CT, CT/UL, CT/MR eller MR/UL).
MR-undersøkelser
Dette anbefales istedenfor CT hos barn og ungdom for å unngå unødvendig strålebelastning. Det er også aktuelt ved spesielle lokalisasjoner som lymfom i CNS.
PET/CT ved lymfom
PET/CT-undersøkelse har de seneste årene kommet inn som en viktig modalitet for diagnostikk og måling av behandlingseffekt(Juweid & Cheson, 2005, 2006) ved lymfomer. For rutinebruk er det radioaktivt merket glukose (Fluoro-deoxy-glucose, FDG) som er den aktuelle «tracer». FDG-PET er i utbredt bruk internasjonalt. I motsetning til CT og MR er PET/CT en funksjonell undersøkelse som måler opptak av glukose i vev og i stor grad kan differensiere mellom aktivt tumorvev og nekrose/fibrose. En rekke studier viser at PET har høyere sensitivitet og spesifisitet en annen billeddiagnostikk, som CT og MR, både ved Hodgkin og non-Hodgkin lymfomer. Det er imidlertid en ikke ubetydelig andel falskt positive funn og denne andelen øker hvis indikasjonen er svak/uklar. Positive funn bør som regel bekreftes med biopsi. Basert på foreliggende dokumentasjon har Norsk lymfomgruppe utarbeidet følgende anbefalinger for bruk av PET/CT ved lymfom:
- For korrekt stadieinndeling for alle med HL
- Ved aggressivt NHL der man er i tvil ved tradisjonell diagnostikk.
- Ved indolente NHL for å dokumentere begrenset stadium.
- Ved restforandringer etter fullført kjemoterapi ved utbredt stadium av HL og aggressivt NHL, der man er i tvil om dette representerer aktivt tumorvev eller ikke.
- Ved mistanke om progresjon under terapi eller residiv etter terapi ved aggressivt NHL og HL, der tradisjonell diagnostikk ikke kan avklare spørsmålet
- Ved residiv av HL og aggressivt NHL der det anses som viktig å nøyaktig definere lokalisasjon/utbredelse av sykdommen
- Interim PET/CT analyse etter 2 kurer ved Hodgkin lymfom uansett stadium basert på resultater fra randomiserte studier som dokumenterer respons-adaptert behandling (Andre et al., 2017; P. Johnson et al., 2016). Dersom interim PET er negativ, er det nok å gjøre en CT eller MR ved slutt av behandling.
PET anbefales ikke brukt rutinemessig ved oppfølging av pasienter som har fullført terapi. Det understrekes at man bør benytte PET primært for pasienter der resultatet vil få behandlingsmessige konsekvenser.
Andre undersøkelser og tiltak
Sist faglig oppdatert: 06.03.2023
Eksplorativ laparatomi / laparaskopi
Aktuelt dersom ovennevnte undersøkelser (spesielt ved HL) etterlater tvil om sykdomsstatus i abdomen, og der en avklaring av dette vil få vesentlige terapeutiske konsekvenser. Eksplorativ laparatomi, eventuelt laparaskopi er også aktuelt der sikker diagnose ikke kan stilles på annen måte, eksempelvis ved ultralydveiledet biopsi.
Trucutbiopsier kan være utilstrekkelig til å stille diagnoser som Hodgkin lymfom og til å gradere follikulære lymfomer, inkludert en avklaring om et follikulært lymfom har transformert til et diffust storcellet B-cellelymfom.
Ved henvisning til kirurgisk avdeling spesifiseres hva som ønskes utført (eks splenektomi, biopsi av organ, glandler, merking av resesert vev med klips før strålebehandling osv) og på hvilken måte materialet skal sendes til histologisk u.s.
Spinalpunksjon
Dette utføres ved lymfoblastisk lymfom og Burkitt lymfom uansett stadium, ved andre aggressive NHL som etter nasjonale retningslinjer bør få CNS-profylakse (se eget avsnitt), ved klinisk mistanke om CNS affeksjon og ved primære CNS lymfomer. Prosedyren bør ikke utføres før behandlingsstart ved aggressive NHL med leukemisering grunnet fare for kontaminasjon av tumorceller til CNS. Undersøkelser som bør gjøres er kvantitering av glukose og protein, celletall og cytologi. Flowcytometri og ev PCR viser seg å være den beste metoden for å påvise selv små klonale populasjoner av maligne celler i spinalvæsken og kan anbefales utført der det ligger til rette for dette, selv ved normalt celletall. Man anbefaler bruk av konserveringmiddel (eks Transfix®) der det vil ta flere timer før prøven kan analyseres (kan ikke brukes for cytologisk undersøkelse).
Endoskopier
Dette vurderes utført ved affeksjon av Waldeyers ring og ved primær ekstranodal sykdom med sikker eller mistenkt affeksjon av gastro-intestinaltraktus. Endoskopi bør i tillegg vurderes utført ved mantelcellelymfomer og marginalsonelymfomer avhengig av klinikk.
ØNH-undersøkelse
Vurderes utført ved HL og NHL med affeksjon av lymfeknuter på hals og ØNH-området for øvrig og ved lymfomer som er lokalisert til gastrointestinal (GI)-traktus.
Tannlege
Pasienter som skal strålebehandles mot munnhule eller gjennomgå kjemoterapi som forventes å kunne gi alvorlig benmargssuppresjon bør undersøkes av tannlege med tanke på sanering av infeksjonsfoci. Pasientene skal samtidig instrueres og gis råd vedrørende tannhygiene.
Hjerte-, lunge og nyrefunksjonsundersøkelser
Pasienter som skal gjennomgå belastende kjemoterapi og/eller strålebehandling, bør få undersøkt funksjonen til organer som er utsatt før behandlingsstart. Aktuelle problemstillinger der funksjonsundersøkelser er aktuelt er spirometri før full ABVD eller BEACOPP kjemoterapi (bleomycin er lungetoksisk i høye doser), hjertefunksjonsundersøkelse (MUGA scintigrafi eller ecco-dopler u.s.) hos eldre pasienter før CHOP kjemoterapi (doksorubicin er hjertetoksisk i høye doser) og renografi med glomerulær filtrasjonsrate før strålebehandling mot retroperitoneum der deler av nyrene kommer med i strålefeltet.
Nedfrysing og lagring av sæd
Menn som skal ha kjemoterapi eller strålebehandling under diafragma, må informeres om mulighetene for sædbanking. Dersom det er aktuelt, bestilles time på Kvinneklinikken, OUS eller St. Olavs Hospital. Lagret sæd blir automatisk destruert når pasienten fyller 55 år eller ved dødsfall.
Uttak og nedfrysing av ovarialvev med tanke på senere assistert befruktning
Ovarialfunksjon og fertilitet hos kvinner med lymfom kan allerede være redusert på diagnosetidspunktet(Lekovich et al., 2016). Risiko for ovarialinsuffisiens er for øvrig avhengig av pasientens alder i tillegg til forventet behandling. Alder og type kjemoterapi er viktigste vurderingskriterium i forhold til risiko for fertilitetstap og mulig gevinst av fertilitetsbevarende behandling. Ovarial/fertilitetsbevarende tiltak hos kvinner <40 år bør alltid vurderes dersom behandlingsintensjon er kurativ eller ved lavgradig maligne lymfomer med forventet langt behandlingsfritt intervall.
| Veldig lav risiko | Lav risiko <20 % | Intermediær risiko 20-80 % | Høy risiko >80 % |
|---|---|---|---|---|
Regime | ABVD <32 år Antimetabolitter
| ABVD ≥32 år 6 CHO(E)P/EPOCH, ≤35 år CVP 2 escBEACOPP | 6-8 escBEACOPP <30 år* 6 CHO(E)P/EPOCH ≥35 år
| HMAS 6-8 escBEACOPP ≥30 år Klorambucil |
Strålebeh |
|
| ≥2,5 Gy ovarial dose | ≥6,0 Gy ovarial dose |
*40-60 % risiko(Anderson et al., 2018; Behringer et al., 2013; Behringer et al., 2010; Carter et al., 2006; Lambertini et al., 2020; Meissner et al., 2014; Meissner et al., 2015; Schüring et al., 2018)
Behandlingsregimer der eksisterende kunnskap omkring gonadotoksisitet er mangelfull:
- Bendamustin; i egenskap av alkylerende cytostatika kan gonadotoksisitet forventes.
- Blokk kurer ad modum GMALL-02 protokollen. Dette er en mindre aktuell problemstilling da behandlingsstart ikke kan utsettes og ovarialvev ikke kan transplanteres pga risiko for kontaminasjon av maligne celler. For disse kvinnene kan GnRH vurderes.
Oophoropexi
Ved strålebehandling mot bekkenregionen vurderes kirurgi der ovariene plasseres utenfor strålefeltet (oophoropexi).
Uttak og nedfrysing av ovarialvev med tanke på senere assistert befruktning
I samhandling mellom pasient, fertilitetslege og onkolog kan nedenfor stående fertilitetsbevarende tiltak vurderes. Metodene 1) og 2) forutsetter utsettelse av behandlingsstart med 2 – 3 uker, mens 3) kan utføres i løpet av kort tid(Lambertini et al., 2020; Oktay et al., 2018). Ved aggressiv lymfekreftsykdom må forsinkelse av terapi og morbiditet ved prosedyren veies mot forventet fremtidig nytte.
- Nedfrysing av ubefruktede oocytter (egg): Kvinnen får gonadotropinstimulering for å øke antall modne egg som høstes ved transvaginal ultralydveiledet punksjon og lagres.
- Nedfrysing av befruktede agg (embryo): Stimulering og høsting som ved 1), befruktning utenfor kroppen og langtidslagring av embryo.
- Nedfrysing av ubefruktede egg og embryo kan utføres ved fertilitetsklinikker, og fødselsrate er henholdsvis mellom 30 og 40 %. Fødselsrate avhenger av antall lagrede oocytter og alder </> 35 år(Lambertini et al., 2020).
- Nedfrysing av ovarialvev: Prosedyren innebærer unilateral ooforektomi, nedfrysing og langtidslagring av eggstokkvev. Ved behov tines og transplanteres eggstokkvevet i gjenværende eggstokk, hud eller fritt i bukhulen for senere hormonstimulering og assistert befruktning. Veiledende aldersgrensen ved uttak er 35 år.
- Risikoen for kontaminering av vev med lymfomceller kan være tilstede ved Burkitt lymfom og ved leukemisering. Prosedyren er derfor uaktuell ved disse tilstandene. Risikoen ansees som liten ved Hodgkin lymfom og begrensede stadier av andre lymfomer (Bastings et al., 2013).
- Unilateral ooforektomi kan redusere spontan fertilitet(Wilkosz, Greggains, Tanbo, & Fedorcsak, 2014), og nedfrysing av eggstokkvev anbefales kun ved betydelig risiko for kjemoterapi-indusert infertilitet (> 50 %)(Nasjonal behandlingstjeneste for fertilitetsbevarende behandling med autologt ovarialvev. ).
- Suksessrate etter tilbakesetting av eggstokkvev er ~40 %(Lambertini et al., 2020). Det er født >180 barn på verdensbasis ved bruk av denne metoden per 2020 (Lambertini et al., 2020), også flere i Norge. Behandlingen utføres ved Reproduksjonsmedisinsk seksjon, OUS(Nasjonal behandlingstjeneste for fertilitetsbevarende behandling med autologt ovarialvev. ).
Regelverk: Tilgang til nedfrysing av egg, embryo eller eggstokkvev reguleres i bioteknologiloven. Nedfryste befruktede egg skal oppbevares til kvinnen er fylt 46 år, evt kortere ut fra virksomhetens ressurs- og nyttehensyn. Ubefruktede egg og eggstokkvev kan oppbevares så lenge det er behov for det, og det anses som medisinsk forsvarlig, i praksis til kvinnen er 45 år gammel. Lagrede egg, embryo og eggstokkvev kan kun settes tilbake til kvinnen som har avgitt vev. Ved pasientens død skal materialet destrueres. Dette følger av bioteknologiloven § 2-16.
Medikamentell ovarieproteksjon med GnRH agonist
GnRH agonist skal ikke velges fremfor dokumentert fertilitetsbevarende tiltak da dokumentasjon blant lymfompasienter er begrenset og motstridende (Behringer et al., 2012; Behringer et al., 2010; Demeestere et al., 2016; Oktay et al., 2018). I tilfeller der cryopreservasjon av egg, embryo eller eggstokkvev ikke er aktuelt kan GnRH agonist vurderes (Lambertini et al., 2020). Kontinuerlig behandling med GnRH agonistersupprimerer eggstokkens funksjon og kan muligens forebygge tap av ovarialreserve. Behandlingen bør starte 1–2 uker før oppstart av kjemoterapi og gis slik at effekten varer 1-2 uker etter siste kur. Anbefalt regime er goserelin 3,6 mg hver 4. uke. Oppstart med GnRH agonist må avventes hvis pasienten skal til nedfrysing av egg eller eggstokkvev.
Lymfom i allmennpraksis
Generelle betraktninger
Sist faglig oppdatert: 06.03.2023
Selv om antall nye tilfeller av lymfom (non-Hodgkin og Hodgkin lymfom) i Norge fortsatt er lavt i forhold til de store kreftsykdommer som ca. mammae, ca. prostatae, lungekreft og colorektal kreft, er det mange som lever i Norge etter kurert sykdom eller med indolent sykdom som har stor risiko for progresjon, tilbakefall eller seneffekter av behandling. Allmennpraktikeren ser disse pasientene med jevne mellomrom. De trenger diagnostisering, oppfølging under behandling, kontroller og eventuelt palliativ behandling. Mange er unge ved diagnosetidspunktet og forventes å leve lenge.
Diagnostisering, valg av behandling og initiale oppfølging etter ferdigbehandlet sykdom, er nå så avansert og spesialisert at det i stor grad overlates til de største sykehusene i landet. Detaljene rundt de enkelte behandlingsregimene er beskrevet i øvrige kapitler i denne handlingsplanen, men er for omfattende for daglig bruk i allmennpraksis. Det er derfor her laget et eget kapittel som omhandler allmennlegens rolle i pasientforløpet til lymfompasienter med vekt på henvisningsrutiner, samhandling med sykehus under aktiv behandling, sosialmedisinsk oppfølging og oppfølging av ferdigbehandlede pasienter. Kapittel Psykososial og fysisk kartlegging, støtte og behandling og Kontroll, oppfølging og rehabilitering er viktige støttekapitler i denne samhandlingen.
Primærhelsetjenestens viktigste rolle for denne pasientgruppen
Sist faglig oppdatert: 06.03.2023
- Henvise de rette pasientene til utredning ut fra anamnese, symptomer og funn. Ved begrunnet mistanke om lymfom som definert under kapittel Forløpstider ved lymfom skal pasientene henvises til utredning i pakkeforløp i regi av onkolog/hematolog og koordinert av forløpskoordinator.
- Støttesamtaler underveis i behandlingen (mange unge pasienter og unge familier). Primærlegens kunnskap om geografi, familierelasjoner, arbeidsmuligheter, organisering av hjemmetjenesten etc. er viktig med tanke på lokalt hjelpebehov og tilbud. Veiledning i sosiale og trygdemedisinske rettigheter ikke bare under aktiv sykdom, men også i rekonvalesensfasen.
- Delta sammen med 2. linjetjenesten i overvåkning av hematologiske parametere under cytostatikabehandling.
- Fange opp bivirkninger under cellegift og strålebehandling både i aktiv behandlingsfase og senskader. Stråleskader, stoffskifte, parestesier, kronisk fatigue, plager fra muskel og skjelett osv omtales i kapittel Kontroll, oppfølging og rehabilitering.
- Overta oppføling i henhold til fastlagt skjema etter at kontrollene ved sykehus er avsluttet. Ved disse kontrollene er overvåking med tanke på utvikling av senskader og andre følger av sykdommen eller behandlingen sentrale, samt overvåking av residiv. I tillegg må primærhelsetjenesten bistå med revaksinering der dette er anbefalt.
Utredning i allmennpraksis
Sist faglig oppdatert: 06.03.2023
Indolente (tidligere lavgradige) maligne non-Hodgkin lymfomer er ofte utbredt til mange lymfeknutestasjoner og/eller benmarg og vokser gjerne langsomt. Aggressive (tidligere høygradige) non-Hodgkin lymfomer utvikler seg ofte raskt. Hodgkin lymfom kan variere både i utbredelse og aggressivitet.
B-symptomer
- Nattesvette: gjentatt kraftig nattesvette siste måned.
- Feber: persisterende eller residiverende feber >38 siste måned uten kjent annen årsak.
- Vekttap: mer enn 10 % siste 6 måneder.
Andre symptom/funn
- Slapphet med eller uten samtid anemi.
- Infeksjonstendens med eller uten samtidig leukopeni. Ikke sjelden er residiverende infeksjoner uten bedring noe om går forut for lymfommistanken.
- Forstørrede lymfeknuter, ofte på hals, i aksiller og lyske. De maligne lymfeknutene er ofte fastere og uømme i forhold til de reaktive.
- Forstørret milt og eller lever forekommer, men er sjelden.
- Ved tumor i andre organer enn lymfeknute (ekstranodal organaffeksjon), vil lokalsymptom derfra dominere. Vanligst er GI traktus og ØNH. Testis, CNS og skjelett er andre mulige lokalisasjoner.
- Krafttap, vannlating og avføringsproblemer samt sensibilitetsforandringer kan indikere medullaaffeksjon.
- Dyspnoe forekommer.
- Hudkløe forekommer.
Laboratoriefunn
- Infeksjonsparametre som SR og CRP er ofte forhøyet
- LDH ofte forhøyet (spesielt aggressive non-Hodgkin Lymfom)
- Anemi, leukopeni / lymfocytose, trombocytopeni
- Organspesifikke funn som høy kreatinin og bilirubin
NB. Pasienter med lymfom går ofte lenge med mistanke om residiverende infeksjoner og får ulike antibiotikakurer uten forventet bedring. Da bør lymfommistanken skjerpes og vi må være liberale med henvisning til lymfeknutebiopsi eller cytologi der det er mulig. Alternativer er utredning ved ØNH avdeling, indremedisinsk avdeling eller barneavdeling avhengig av problematikk.
Radiologiske undersøkelser kommer i 2. rekke for å unngå tidsspill av lymfom-diagnose med mulig kurasjon.
Henvisningsrutiner til sykehus
Sist faglig oppdatert: 06.03.2023
Pasienter som har forstørrede lymfeknuter (> 2 cm) uten annen forklaring med eller uten allmenn-symptomer eller der radiologiske undersøkelser eller histologisk undersøkelser gir sterk mistanke om lymfom, skal henvises til sykehus med kompetent hematolog eller onkolog for inklusjon i pakkeforløp. En koordinert utredning med biopsi, radiologiske undersøkelser og benmargsundersøkelse med mer vil bli gjennomført.
Henvising til punksjoncytologi av forstørret lymfeknute alene vil ofte forsinke diagnostiseringen av maglinge lymfomer, da prøvene kan være falsk negative (ved Hodgkin lymfom og ved lavgradige lymfomer). Man bør da henvise direkte til biopsi.
Alle med forstørrede lymfeknuter i allmennpraksis kan ikke henvises. Ømme, lett forstørrede lymfeknuter submandibulært forbundet med tonsilitt eller tilsvarende i aksillen ved follikulitt, kan være normale funn. Er de store (over 1,5 cm), må de kontrolleres etter ca 2 uker. Supraclavikulær lokalisasjon av lymfeknuten øker sjansen for malignitet i forhold til tilsvarende forstørrede knuter som sitter høyere på halsen.
Hvis allmennsymptomene dominerer det kliniske bildet, er det naturlig å henvise til indremedisinsk poliklinikk. Barn henvises barneavdeling. Her må en bruke skjønn og tilpasse lokal praksis.
Oppfølging av lymfom i allmennpraksis (kliniske tips)
Sist faglig oppdatert: 06.03.2023
Under aktiv behandling
Når allmennlegen har fått epikrise med plan for aktuell behandling fra sykehus, bør første konsultasjon hos primærlegen finne sted. Man vil da gå gjennom epikrisen med pasienten, sikre at innholdet er forstått, samt legge en plan for rutinekontroller / hematologisk overvåkning hos allmennlegen mellom cytostatikakurene og repetere alarmsymptomene. Hvis avstanden til behandlende sykehus er stor, vil dette kunne hindre bomturer til sykehus hvis blodverdien er for lave til ny kur.
NB! Ta alltid kontakt med behandlende avdeling før kur utsettes eller behandlingsplan fravikes!
Infeksjonsovervåking og påvisning av neutropen feber er viktig. Leukocyttallet er typisk lavt 7–14 dager etter kur (nadirfasen). Pasienter med feber kombinert med neutrofile under 0,5 skal innlegges og behandles som sepsis.
Allmennlege må kunne justere smertebehandling, kvalmebehandling, og håndtere lokale stråleskader i hud.
Se nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen (Nasjonalt handlingsprogram for palliasjon i kreftomsorgen, 2015).
Økt risiko for tromboembolisk sykdom hos kreftpasienter
Kreftsykdom i seg selv regnes som høyrisikotilstand for tromboser, men også andre kliniske tilleggsrisikofaktorer må vektlegges når en vurderer om profylakse med lavmolekylært heparin skal iverksettes. Pasienter som er antikoagulert kan og skal som regel fortsette med antikoagulasjon, men warfarin bør som regel skiftes til lavmolekylært heparin eller direktevirkende orale antikoagulasjonsmidler (DOAK) under pågående cytostatikabehandling. Cytostatika vanskeliggjør muligheten for å holde INR i terapeutisk område pga interaksjoner samt at blødningsrisikoen øker ved eventuell utvikling av trombocytopeni. Enkelte pasienter med for eksempel kreft i GI-traktus kan ha økt blødningsrisiko. Skjønn ut fra totalsituasjonen må utvises, og man kan også vurdere om en kort behandlingspause er det beste og minst risikofylte (eksempler er primærprofylakse ved atrieflimmer eller «gamle» tromboemboliske hendelser). Ved tvil om indikasjonen for videre antikoagulasjon kan indremedisiner eller hematolog konsulteres.
Fatigue
Fatigue er en tilstand alle allmennleger bør kjenne til spesielt i relasjon til kreftpasienter som får stråleterapi eller cytostatika. Tilstanden karakteriseres ved en subjektiv følelse av økt ubehag og nedsatt funksjonskapasitet pga redusert energi. Det økte ubehaget og den nedsatte funksjonskapasiteten oppleves som en tretthet eller svakhet som ikke forsvinner ved hvile eller søvn. Fatigue under behandling er svært vanlig, men kan vedvare etter behandling i mange år, da som kronsik fatigue, hos en hel del.
Vi har ikke gode data på hvor hyppig dette er og hva som er beste behandling, men fatigue beskrives av kreftpasienter som den mest belastede behandlingsrelaterte plage til selve kreftsykdommen og er antagelig svært vanlig. I norske undersøkelser ser det ut som om ferdigbehandlede pasienter med Hodgkin lymfom er spesielt utsatte (Loge et al., 1999).
Et lett treningsprogram ser ut til å være viktig for å bryte den onde sirkelen av symptom som oftest er årsak til at ferdigbehandlede, friskmeldte kreftpasienter likevel ikke kommer seg tilbake i full jobb.
Etter avsluttet behandling i sykehus
Revaksinasjon
Etter høydosebehandling med autolog stamcellestøtte (HMAS) (kapittel Høydosebehandling med autolog stamcellestøtte) bør pasientene gjennomgå full revaksinering etter 12 mnd (stivkrampe, difteri og polio). Pneumokokkvaksine settes etter 1 år og seinere ca. hvert 5. år avhengig av målbart serumantistofftiter. Levende og perorale vaksiner bør unngåes i 2 år etter HMAS (omtales i kapittel Retningslinjer for vaksinasjon, avsnitt om Autolog og allogen stamcelletranslantasjon og kapittel Kontroll etter høydosebehandling med autolog stamcellestøtte). Influensavaksinering kan gis etter skjønn og de generelle anbefalinger fra Folkehelsa. Vaksinering etter HMAS (og i forbindelse med splenektomi) dekkes nå gjennom blåreseptordningen, § 4.3.
Overføring av kontrollene til primærhelsetjenesten
Fellesnevneren for oppfølging og kontroll i allmennpraksis av lymfompasienter som er behandlet for Hodgkin lymfom og aggressive non-Hodgkin lymfomer uansett tidspunkt etter avsluttet kontroll i sykehus, er vektlegging av behandlingsrelaterte bivirkninger (med spesielt fokus på pasienter etter store strålefelt).
For mange lymfompasienter vil det være aktuelt å overføre disse til 1. linjetjenesten før det er gått 5 år. Oppfølging vil fremkomme i epikrise og følger i hovedsak retningslinjer angitt i kapittel Kontroll, oppfølging og rehabilitering. Pasienter som har fått strålebehandling mot bryst- eller halsregionen følges spesielt opp med tanke på strålebivirkninger, spesielt hjerte- og karsykdom, sekundær cancer (brystkreftscreening for unge kvinner) og hypothyreose også etter at det er gått 10 år fra behandling. Helsedirektoratet har utgitt en brosjyre med informasjon og anbefalinger i denne situasjonen. Allmennpraktiker kan vurdere behov for henvisning til spesialisthelsetjenesten ved mistanke om slike alvorlige seneffekter.
Årlige kontroller i allmennpraksis
Sist faglig oppdatert: 06.03.2023
Lymfompasientene kontrolleres årlig i allmennpraksis. Indolent non-Hodgkin lymfom kan gi seine residiv mens Hodgkin lymfom og aggressivt non-Hodgkin lymfom sjelden residivierer etter 5 år. Senskader som hypotyreose, sekundær cancer, fibroseskader i muskulatur, hjerte og lunge er viktige. Se kapittel Kontroll, oppfølging og rehabilitering for oppfølging av pasienter som har fått stråleterapi mot hals og/eller mediastinum.
Klinisk undersøkelse: Bør omfatte blodtrykksmåling, palpasjon av lymfeknutestasjoner, palpere lever og milt samt lytte på hjerte og lunge. Halskar bør auskulteres dersom disse var med i strålefelt. Strålefelt inspiseres, og tegn til lokale residiv vurderes.
Blodprøvetakning: Hb, Leuk med diff, Trc, SR, LDH, kolesterol, TSH og FT4 inngår som standard (bilirubin, kreatinin, urin stiks, ALAT, ALP, ASAT vurderes på indikasjon).
Nyttige adresser/referanser for allmennpraktikere
Sist faglig oppdatert: 06.03.2023
Her ligger «Lindring i Nord» som er en meget nyttig håndbok i Lindrende behandling utgitt ved onkologisk avdeling UNN med overlege Tone Nordøy.
«Kreft i allmennpraksis» er utgitt av praksiskonsulentordningen ved UNN, kreftavdelingen ved Eldrid Liljedal. Den omhandler generelle nyttige tips innenfor kreftomsorgen i allmennpraksis alt fra trygderettigheter, informasjonskilder, stråleskader, hudpleie av hud i strålefelt, akutte onkologiske tilstander (for eksempel: tverrsnittlesjoner, hyperkalsemi osv) samt prosedyrer ved gjennomføring av cytostatikabehandling i allmennpraksis (revidert 2016).
På kreftforeningens nettsider ligger mye pasientrettet informasjon https://kreftforeningen.no. Kreftforeningen har også mange gode brosjyrer for ulike kreftformer som kan bestilles. Dette gjelder også hefte om trygdemedisin, «håndbok for foreldre med kreftsyke barn», «når foreldre dør», «mor eller far har kreft» osv.
Lærebøker
Kaasa, S., & Loge, J. H. (red.). (2016). Palliasjon: nordisk lærebok (3. utg.). Oslo: Gyldendal akademisk.Schlichting, E., & Wist, E. (red.). (2018). Kreftsykdommer: en basisbok for helsepersonell (5. utg.). Oslo: Gyldendal.
Wisløff, F., Gedde-Dahl, T., Tjønnfjord, G. E., & Holte, H. (red.). (2014). Blodsykdommer (7. utg.). Oslo: Gyldendal akademisk.
Psykososial og fysisk kartlegging, støtte og behandling
Psykososiale forhold: Kartlegging/støtte behandling før og under kreftbehandling
Sist faglig oppdatert: 06.03.2023
Pasienter med lymfom er en sammensatt gruppe som består av mange yngre pasienter. Flere er skoleelever/studenter som er i starten av sitt yrkesliv og voksenliv. Mange er i yrkesaktiv alder og er foreldre til barn under 18 år. Det betyr at de er i en sårbar livssituasjon der sykdom og behandling får konsekvenser både for pasientens og familiens dagligliv. Det kan bety følelsesmessige reaksjoner som krise, sorg, angst og depresjon, innvirkning på relasjonelle forhold (ektefelle, barn og sosialt nettverk), på utdannelse/arbeidsliv, på økonomi og levekår, samt åndelige og eksistensielle forhold (Holland et al., 2005). Kreft omtales ofte som en familiesykdom da hele familien blir sterkt berørt. I de senere årene har pårørendes situasjon, spesielt barn som pårørende, fått betydelig oppmerksomhet både i forskning og i klinikken. I henhold til ny § 10 i Lov om Helsepersonell er helsepersonell pålagt å bidra til å ivareta behovet for informasjon og nødvendig oppfølging av barn av foreldre med alvorlig somatisk sykdom.
Hvilke psykososiale bekymringer/problemer som kan oppstå vil være avhengig av
- Sykdommens alvorlighetsgrad
- Behandlingens varighet
- Om behandlingen har kurativt eller palliativt siktemål
- Pasienten/familiens nettverk og ressurser
I behandlingstiden vil pasienten ofte ha kontakt med flere behandlingsinstanser som regionsykehus, sentralsykehus, lokalsykehus (her både sengeposter og poliklinikker), samt primærhelsetjenesten gjennom fastlege og hjemmebaserte tjenester. Dette stiller store krav til samhandling og formidling av informasjon mellom instansene. Mange pasienter opplever det forvirrende og uklart hvem som egentlig har ansvaret i behandlingsperioden som ofte strekker seg over mange måneder. De psykososiale hjelpebehovene og tiltak som blir iverksatt på de ulike nivåene, blir ikke systematisk formidlet i epikriser og sykepleierapporter. Her er det et betydelig forbedringspotensial (se avsnitt om utskrivning).
Det bør allerede på diagnosetidspunktet gjøres en psykososial kartlegging av pasienten og familiens situasjon. Målsettingen er å:
- Forebygge at problemer oppstår ved informasjon, råd og veiledning om mestringsstrategier, om aktuelle rettigheter og offentlige hjelpe- og støtteordninger
- Fange opp risikopasienter/familier
- Avdekke behov for hjelp (følelsesmessig, praktisk, økonomisk, fysisk, tilbud til pårørende)
- Avklare behov for individuell plan
- Etablere kontakt med aktuelle hjelpeinstanser i pasientens hjemkommune
Sosionomer i sykehus vil være aktuelle fagpersoner til å foreta en slik kartlegging. De har spisskompetanse og bred kunnskap om rettigheter, hjelpe- og støtteordninger og kan gi adekvat informasjon, råd og veiledning. Sosionomer har også kompetanse i nettverk- og familiearbeid, kunnskap om lovverk og erfaring i å bruke de ulike velferdsinstanser i kommunene.
Det kommunale hjelpeapparatet er til dels svært oppdelt med forskjellig organisering. Det er derfor nødvendig å undersøke og til dels skreddersy hjelpetilbudet for den enkelte pasient.
Kommunene har i dag flere ordninger for å bedre samhandlingen, som koordinatorstillinger, dannelse av faglige nettverk og ansvarsgrupper som synes å fungere bra og gir bedre kreftomsorg.
Det er viktig å ha både et kortsiktig og et langsiktig perspektiv for det psykososiale arbeidet. Allerede på diagnosetidspunktet bør en ha tanker/planer for pasientens rehabilitering og tiltak som skal til for at pasienten og familiens skal komme best mulig tilbake til dagliglivet. Forskning og erfaring viser at alvorlig sykdom og langvarig behandling kan skape utfordringer i forhold til jobb, skole og studier. Det psykososiale arbeidet forutsetter tverrfaglig samarbeid. Aktuelle yrkesgrupper i tillegg til behandlingspersonalet som lege, sykepleier kan være sosionom, fysioterapeut, ergoterapeut, ernæringsfysiolog, psykiater, psykolog, psykiatrisk sykepleier og prest.
Det er en forutseting at det psykososiale arbeidet er et tilbud og at det utføres ut i fra pasienten og familiens ønsker og behov (brukerperspektivet)
Utsatte pasientgrupper som bør få tilbud om psykososial kartlegging:
- Unge pasienter under 18 år
- Ungdom/studenter over 18 år
- Pasienter med omsorg for barn/ungdom under 18 år
- Pasienter som er selvstendig næringsdrivende, spesielt enmannsforetak
- Pasienter med svakt sosialt nettverk
- Pasienter som tidligere har hatt store psykososiale belastninger
- Pasienter med tilbakefall av sykdommen
- Pasienter med sammensatte behov som trenger et tverrfaglig behandlings- og rehabiliteringsopplegg (Individuell plan)
Viktige rettigheter/hjelpeordninger
NAV: Består av tidligere Trygdeetat, Aetat (arbeidskontor) og Sosialetat. Etatene har felles kontor og felles internettsider som inneholder alle tilbud, lovverk, skjemaer etc. www.nav.no
Grunn- og hjelpestønad
Det er en utbredt oppfatning at grunn- og hjelpestønad er en rettighet ved kreftsykdom. Disse rettighetene er imidlertid begrenset til spesielle utgifter og situasjoner med et varighetskrav på 2–3 år.
Grunnstønad: Skal dekke helt eller delvis visse typer ekstrautgifter som har oppstått pga. sykdommen og som friske personer ikke har. Ekstrautgiftene må være løpende (ikke engangsutgift) og det er svært begrenset hvilke utgifter som dekkes. De viktigste ekstrautgiftene er til transport, telefon, støttebandasjer/strømper, ekstra slitasje på klær/sengetøy. Utgiftene og behovet må dokumenteres nøye og må overstige minimumssats.
Hjelpestønad: Hjelpestønad kan ytes til særskilt pleie-, omsorgs- og tilsynsbehov ved sykdom. Det er et vilkår at det foreligger et privat pleieforhold, dvs. at det er de pårørende som utfører det. Ved vurdering av hjelpebehovet kan det også legges vekt på stimulering, opplæring og trening som utføres i hjemmet. Søknadsskjema og mer utførlig omtale av grunn- og hjelpestønad i Folketrygdlovens kap. 6, www.nav.no
Alvorlig sykdom hos barn/ungdom under 18 år: Ved alvorlig sykdom har foreldrene rett til pleiepenger (tilsvarer sykepenger opptil 6 G) i henhold til folketrygdloven § 9‑11. Eget søknadsskjema NAV 09–11.05, «Legeerklæring ved krav om pleiepenger ved barns sykdom».
Barn/ungdom med kreft sykdom kan ha krav på grunnstønad og forhøyet hjelpestønad etter ovennevnte retningslinjer selv om behandlings- og rehabiliteringstiden er av kortere varighet. www.nav.no
Skoleungdom/studenter over 18 år: Kan ha rett til arbeidsavklaringspenger med minstesats (2G) dersom de har avbrutt studiene og har brukt opp retten til sykestipend i Lånekassen. De kan også søke arbeidsavklaringspenger dersom de har krav på sykepenger og sykepengegrunnlaget er lavere enn 2G, folketrygdloven § 11‑13. Søknadsskjema på nettet www.nav.no
Lånekassen kan gjøre om lån og stipend til sykestipend i inntil 4 ½ mnd. og ved varig uførhet kan studielån slettes. Informasjon og søknadsskjema på nettet: www.lanekassen.no
Universitetene og en del høyskoler har egen sosionomtjenesten og/ eller helsetjeneste. Undersøk på den enkelte utdanningsinstitusjon.
Pasienter i palliativ fase med kort forventet levetid: Pleiepenger kan ytes til pårørende i opptil 60 arbeidsdager per pasient for pleie i hjemmet i livets sluttfase. Pleiepenger forutsetter at pårørende har sykepengerettigheter. Pleiepenger utbetales tilsvarende det pårørende ville fått i sykepenger ved egen sykdom (opptil 6G). se Standard for palliasjon NFPM 2004 og Handlingsprogram for palliasjon (Nasjonalt handlingsprogram for palliasjon i kreftomsorgen, 2015).
Kreftforeningens hefte «Rettigheter for pasienter og pårørende» og ulike spesialhefter og tilbud til pasienter og pårørende. https://kreftforeningen.no/
Aktuelle lover og forskrifter
Forskrift om barns opphold i helseinstitusjon
Forskriften har bestemmelser om foreldrenes rettigheter i forhold til opphold, mat, reise.
«Med barn menes i denne forskrift personer under 18 år.» (§ 3, 1. ledd)
«Helseinstitusjonen skal tilby foreldrene kontakt med sosionom, psykolog og/eller annet støttepersonell mens barnet er innlagt». (§ 6, 5. ledd)
Lov om barn og foreldre
Regulerer ansvarsforhold og samhandling mellom barn og foreldre.
Kan være aktuelt i situasjoner hvor pasienter er under 18 år og foreldrene er skilt.
Lov om barnevernstjenester
Kan tilby avlastnings- og støttetiltak ut fra barnets (u/18 år) behov, barn som pasient eller barn som pårørende. Helsepersonell har meldingsplikt til barnevernet i bekymringssaker.
Lov om sosiale tjenester i arbeids- og velferdsforvaltningen
Økonomisk hjelp til vanskeligstilte
Praktiske hjelpetiltak Avlastningstiltak www.nav.no
Lov om Folketrygd
Lov om etablering og gjennomføring av psykisk helsevern
Lov om pasient- og brukerrettigheter § 2‑5, Individuell plan
«Pasient og bruker som har behov for langvarige og koordinerte helse- og omsorgstjenester, har rett til å få utarbeidet individuell plan i samsvar med bestemmelsene i helse- og omsorgstjenesteloven, spesialisthelsetjenesteloven og lov om etablering og gjennomføring av psykisk helsevern.»
Lov om spesialisthelsetjenesten § 2‑5, Individuell plan
«Helseforetaket skal utarbeide en individuell plan for pasienter med behov for langvarige og koordinerte tilbud. Helseforetaket skal samarbeide med andre tjenesteytere om planen for å bidra til et helhetlig tilbud for pasientene».
Jfr. Stm. 21 «Ansvar og meistring 98/99», s. 10 om rehabilitering som er
«tidsavgrensa, planlagte prosesser med klare mål og virkemiddel, der fleire aktørar samarbeider om å gi nødvendig assistanse til brukaren sin eigen innsats for å oppnå best mogleg funksjon og meistringsevne, sjølvstende og deltaking sosialt og i samfunnet».
Lov om helsepersonell, ny § 10a om helsepersonells plikt til bidra til å ivareta mindreårige barn som pårørende
Retningslinjer for fysioterapi til lymfompasienter
Sist faglig oppdatert: 06.03.2023
Behovet for fysioterapi innen denne pasientgruppen vil variere mye. Det vil være store forskjeller i de fysiske funksjonsforstyrrelser den enkelte pasient får som følge av sykdom og behandling. Et viktig prinsipp i fysioterapi innen onkologi er å optimalisere funksjon. For lymfompasientene vil det ofte være visse kritiske faser hvor fysioterapi er nødvendig for å redusere funksjonstap.
Følgende «hovedområder» utpeker seg med særlig behov for fysioterapi – intervensjon.
- Diagnose og oppstart av cellegiftbehandling og ev. strålebehandling
- Høydosebehandling med autolog stamcellestøtte og allogen stamcelletransplantasjon
- Perifer polynevropati
- Stråleskade
- Kronisk fatigue
- Muskel- og skjelettplager utover stråleskade
- Lymfødem
- Rehabilitering/opptrening
- Palliasjon
Dette er ingen fullstendig liste, og listen er bare ment som et hjelpemiddel til å identifisere utfordringene.
Lymfompasienter kan også få lymfødem, lunge/hjertekomplikasjoner og ulike sentrale og perifere nevrologiske utfall. Fysioterapitiltakene følger retningslinjer innen disse spesialfeltene (Lenker til andre handlingsplaner). Når det gjelder lymfødem kan oversikter over fysioterapeuter med lymfødemkompetanse innhentes på www.lymfoedem.no.
Fysioterapitiltak i forbindelse med diagnose og oppstart av behandling
A. Bakgrunn/Målsetting/Indikasjon
Fordi en langvarig behandlingsperiode ofte fører til generelle og spesielle fysiske funksjonsvansker er det viktig med en kartlegging av pasientens fysiske funksjonsnivå ved oppstart av behandling.
Tiltak: Generelle og spesifikke muskelstyrketester, balansetester, sensibilitetsundersøkelser, lungefunksjonprøver (spirometri) og testing av kondisjon (ergometersykkeltest) bør inngå i kartleggingen av risikopasienters fysiske funksjon før behandlingen.
Etter erfaringer ved Radiumhospitalet de siste årene anbefales det at pasientene får råd og veiledning i forhold til fysisk aktivitet/trening under selve behandlingsperioden. Pasienten bør ved hjelp av fysioterapeut eller idrettspedagog få utarbeidet et tilpasset treningsprogram.
B. Bakgrunn/Målsetting/Indikasjon
Mange lymfompasienter plages av kvalme som følge av cellegiftbehandlingen.
Tiltak: Elektroterapi i form av transkutan elektrisk nervestimulering (TENS) har vist seg å være et godt kvalmestillende tiltak (Dundee, Yang, & McMillan, 1991). Det kan også være aktuelt å tilby akupunktur mot kvalme (Ezzo et al., 2005).
C. Bakgrunn/Målsetting/Indikasjon
Lymfombehandlingen er langvarig og sammensatt og fører til store endringer i pasientens liv.
Tiltak: Det tverrfaglige team bør vurdere å utarbeide en Individuell Rehabiliteringsplan (IP) for pasienten. Norsk fysioterapiforbund og Kreftforeningen ser nytten av å definere rehabilitering som en prosess som starter ved diagnosen. I alle fall bør rehabiliteringsrettede tiltak iverksettes så snart behovet for dem er avdekket.
Terskelen for å henvise til fysioterapeut kan være lav, omfanget av fysioterapiintervensjonen tilpasses den enkelte pasients aktuelle funksjonsvansker.
Fysioterapitiltak i forbindelse med høydosebehandling
A. Bakgrunn/Målsetting/Indikasjon
Isolatperioden etter høydosebehandlingen er en periode hvor pasienten er særlig utsatt for infeksjoner og komplikasjoner. Et viktig mål for fysioterapien er å begrense omfanget av f.eks. pneumoni og muskelatrofi.
Tiltak: Ved de sykehusene i Norge som gir denne behandlingen er det retningslinjer i forhold til oppfølging av fysioterapeut. Det er stor likhet med hensyn på tiltak, men de er varierende når det gjelder hyppighet av tilbudet.
Som et minimum må alle pasienter motta informasjon om nytten av fysisk aktivitet under isolatperioden. De må også få veiledning og instruksjon i enkle øvelser/treningsprogram før oppstart av høydosebehandlingen.
Deretter bør pasienten få oppfølging minst tre ganger i uken (Dimeo, Stieglitz, Novelli-Fischer, Fetscher, & Keul, 1999; Knols, Aaronson, Uebelhart, Fransen, & Aufdemkampe, 2005). Aktuelle tiltak er lungefysioterapi og lavdoserte øvelser for bevegelighet, styrke og kondisjon. Massasje, tøyninger og avspenningsbehandling er også aktuelt.
Kontraindikasjoner for trening avtales ved den enkelte onkologiske avdeling. Per i dag tar man hensyn til feber og blodverdier, men med litt forskjellige grenser.
Ved utskrivelse bør det foreligge en individuell plan (IP) for videre rehabilitering.
Fysioterapeut bør følge opp denne planen for eksempel ved 3 mnd kontroll.
Perifer polynevropati
A. Bakgrunn/Målsetting/Indikasjon
En kjent bivirkning av cellegift-behandling er symptomer på mulig nerveskade i armer og bein. Av og til får pasientene diagnosen perifer polynevropati (Quasthoff & Hartung, 2002). En rekke cellegifter kan gi toksisk polynevropati, som for eksempel cisplatin, oncovin og taxol. Pasienter med lymfom er blant de som ofte rapporterer symptomer på mulig nerveskade. Avhengig av type cellegift, opplever pasienten plager i form av nedsatt hørsel, treg mage, autonome og/eller sensomotoriske utfall distalt i armer og bein.
Lymfompasienter opplever smerter i form av brenning, stikking og prikking som regel mest utbredt i fingre og tær. Andre sensoriske forstyrrelser arter seg som nummenhet og såkalt «putefølelse» under føttene. Noen utvikler kraftig overfølsomhet for trykk og berøring.
Det kan også forekomme autonome utfall som gir forstyrrelser i temperatur-reguleringen, (Raynauds fenomen) og treg mave. Det oppstår også motoriske utfall som forårsaker svekket balanse og andre, til dels alvorlige, funksjonshemninger. En del pasienter får muskelkramper, hyppigst i leggene. Mange av pasientene har betydelige funksjonsforstyrrelser som nedsetter livskvaliteten.
Tiltak: Alle pasienter som rapporterer symptomer på mulig perifer polynevropati bør vurderes av fysioterapeut. Det viktigste blir å avgjøre om pasienten trenger ortopediske eller tekniske hjelpemidler for å hindre fall.
Anerkjente lærebøker innenfor fysioterapi (Gjerstad, Skjeldal, & Helseth, 2003; Wittink & Michel, 2002) og medisin (Melsack & Wall, 1999) omtaler fysioterapitiltak i forhold til perifer polynevropati generelt. Tiltak som anbefales er: ulike former for sansemotorisk stimulering og sirkulasjonsfremmende tiltak (f.eks. massasje, aktive øvelser, leddmobilisering, balanseøvelser elektroterapi og akupunktur). I tillegg forordnes og tilpasses ulike hjelpemidler, bandasjer og støtteskinner, sistnevnte i samarbeid med legespesialister og ortopedi-ingeniører. Fysioterapeuter benytter ulike tilnærminger for å lindre perifer polynevropatisk smerte, høyfrekventert TENS bør prøves ut (Lofthus & Allen, 2006).
Mange av lymfompasientene kan ha rett til fri fysioterapi når de har fått cellegiftindusert polynevropati. Viser til Folketrygdlovens «Forskrift om stønad til dekning av utgifter til fysioterapi» C. Nevrologi, pkt. 3 «Alvorlig generalisert polynevropati».
Stråleskade
Strålebehandling kan gi varige skader i form av fibrosering som gir nedsatt elastisitet og tøybarhet av hud, fascier, sene- og muskelvev. Blod og lymfesirkulasjon kan bli nedsatt og nevropatier kan oppstå. Se også Nasjonalt handlingsprogram for brystkreft (Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av pasienter med brystkreft, 2018).
Tiltak: Klinisk erfaring tilsier at massasje, øvelser og lette tøyninger bidrar til å redusere (sen)skadene av strålebehandling.
Fri fysioterapi kan ytes etter forskriftens pkt. H. pkt 5 b. «Følgetilstand etter stråleskade».
Nedsatt hjerte-lunge funksjon som følge av strålebehandling mot mediastinum.
Tiltak: Lungefysioterapi, kondisjonstrening og styrketrening være aktuelt. (Se andre handlingsplaner.)
Kronisk fatigue
Kronisk fatigue er et hyppig forekommende symptom hos lymfompasienter. Denne spesielle følelsen av utmattelse og kraftløshet er plagsom og invalidiserende (Curt et al., 2000; Loge et al., 1999)
Tiltak: Forskning har vist at tilpasset trening/fysisk aktivitet kan redusere fatigue hos kreftpasienter (Dimeo et al., 1999; Knols et al., 2005). Enkelte fagmiljøer, særlig innen psykomotorisk fysioterapi og adferdspsykiatere/psykologer peker også på avspenningsbehandling som tiltak mot fatigue. Helt klare anbefalninger når det gjelder intensitet, varighet og frekvens i forhold til fysisk trening finnes ikke.
Muskel- og leddplage (utover stråleskade)
Mange lymfompasienter rapporterer smerter, muskelsvakhet, kramper, stivhet og diffuse plager (influensalignende) fra ledd og muskler.
Tiltak: Tiltak som massasje, varme/kuldebehandling, tøyninger, lett til moderat aktivitet og ulike sirkulasjonsfremmende tiltak synes å hjelpe.
TENS og annen elektroterapi kan dempe smertene.
Metastaser til skjelettet kan gi brudd og truende tverrsnittsituasjon.
Tiltak: Se Nasjonalt handlingsprogram for brystkreft (Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av pasienter med brystkreft, 2018) og Nasjonalt handlingsprogram for lungekreft (Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av lungekreft, mesoteliom og thymom, 2018).
Rehabilitering/fysisk opptrening
Dette er et område hvor det gjenstår å utarbeide faktabaserte tiltak. Rehabilitering må inngå i lymfombehandlingen på en annen måte enn i dag. Ved avdeling for kreftbehandling OUS har vi innført at pasienten skal få veiledning av fysioterapeut ved kontroll 3 måneder etter HMAS. De får også mulighet til veiledning av våre idrettspedagoger som har kompetanse innen fysisk trening av kreftpasienter. Se også andre handlingsplaner.
Palliasjon
Se Nasjonalt handlingsprogram for palliasjon (Nasjonalt handlingsprogram for palliasjon i kreftomsorgen, 2015).
Stadieinndeling, kriterier for behandlingsrespons og endepunkter for kliniske studier
Stadieinndeling
Sist faglig oppdatert: 10.12.2021
Rye-klassifikasjonen for maligne lymfomer fra 1966 ble modifisert i Ann Arbor i 1971, i Cotswold i 1989 (Lister et al., 1989) og på nordisk lymfommøte i Åre i 1997. Den nordiske modifikasjonen er innført ved alle avdelinger i Norden. Ann Arbor klassifikasjonen beholdes her i modifisert form for både Hodgkin lymfom (HL) og non-Hodgkin lymfom (NHL). Primært ekstranodalt lymfom skilles ut som egen gruppe, betegnes med Pe og stadieinndeles i henhold til Musshoffs forslag fra 1975.
| Nodale lymfomer | |
| Stadium I | Sykdom i en lymfeknuteregion (milt, thymus og Waldeyers ring regnes som nodal affeksjon). |
| Stadium II | Sykdom i to eller flere lymfeknuteregioner på samme side av diafragma eller en eller flere lymfeknuteregioner på samme side av diafragma med innvekst i ekstralymfatisk organ/vev (IIE). |
| Stadium II1 | Affeksjon av to naboregioner som naturlig inngår i ett strålefelt. |
| Stadium II2 | Affeksjon av flere regioner som ikke naturlig inngår i ett strålefelt |
| Stadium III | Sykdom i lymfeknuteregioner på begge sider av diafragma eller en eller flere lymfeknuteregioner på begge sider av diafragma med innvekst i ekstralymfatisk organ/vev (IIIE). |
| Stadium IV | Diffus eller disseminert sykdom i et eller flere ekstralymfatiske organ/vev med eller uten affeksjon av lymfeknuter. |
| Tilleggsopplysninger til Ann Arbor | |
| Ekstranodal vekst | Markeres med suffikset E. Lokalisert affeksjon av vev/organ i nær tilslutning til affiserte lymfeknuter slik at direkte vekst – per continuitatem kan antas. |
| Bulky sykdom | Markeres med suffikset X (diameter ≥ 7* cm). |
| Ingen/med allmenn symptomer | Markeres med suffikset A/B. |
| Spredningsorgan (st IV) | Markeres med første bokstav i organet, f.eks.: stadium IV L/H der L står for lunge og H står for hepar. |
| Lymfeknute størrelsen | Lymfeknuter i thorax/abdomen/bekken med minste tverrdiameter > 1,0 cm anses som patologisk forstørrede. |
| * Kan variere mellom diagnosegrupper | |
| Primært ekstranodalt lymfom | |
| Pe I | Primært engasjement av ekstranodalt organ/vev. |
| Pe IIE | Primært engasjement av ekstranodalt organ/vev med overvekst på annet organ/vev. |
| Pe II1 | Primært engasjement av ekstranodalt organ med spredning til regionale lymfeknuter. |
| Pe II 1E | Primært engasjement av ekstranodalt organ med spredning til regionale lymfeknuter og med overvekst på annet organ/vev. |
| Pe II2 | Primært engasjement av ekstranodalt organ med spredning til lymfeknuter utenom de regionale, men på samme side av diafragma. |
| Pe II2E | Primært engasjement av ekstranodalt organ med spredning til lymfeknuter utenom de regionale, men på samme side av diafragma samt overvekst på annet ekstranodalt organ/vev. |
Primært ekstranodale lesjoner eller lymfom-ekstensjon til ekstranodale lesjoner ses hyppigere ved aggressive lymfomer (ca. 40 %) enn ved indolente lymfomer (ca. 25 %). Primært ekstranodal sykdom er svært sjelden ved HL.
HL og NHL fordeler seg på de ulike stadier som vist i tabell 1:
Tabell 1: Fordeling av maligne lymfomer (%) på ulike stadier (fra Det norske radiumhospital)
| Stadium | Hodgkin | Non-Hodgkin | ||
|---|---|---|---|---|
| Indolente | Aggressive | Alle | ||
| I | 21 | 18 | 18 | 19 |
| II | 33 | 9 | 19 | 14 |
| III | 23 | 11 | 10 | 10 |
| IV | 23 | 61 | 53 | 57 |
B-symptomer
Pasientene klassifiseres i undergruppene A eller B avhengig av om de ikke har eller har ett eller flere av følgende allmennsymptomer:
- Uforklarlig vekttap på mer enn 10 % siste 6 måneder eller
- Uforklarlig persisterende eller residiverende feber med temperatur over 38° C siste måned eller
- Gjentatt kraftig nattesvette siste måned.
Allmenntilstand
Vi benytter «WHO performance status», som har følgende inndeling:
| Grad | Forklaring |
|---|---|
| 0 | I stand til å utføre alle normale aktiviteter uten restriksjoner. |
| 1 | Innskrenking i belastende aktiviteter, men oppegående og i stand til å utføre lettere arbeid. |
| 2 | Mobil og selvhjulpen, men ikke i stand til å utføre noe arbeid. Oppegående mer enn 50 % om dagen. |
| 3 | Selvhjulpen i begrenset grad. Bundet til seng eller stol mer enn 50 % av dagtid. |
| 4 | Helt ute av stand til å stelle seg selv. Fullstendig bundet til seng eller stol. |
Kriterier for behandlingsrespons
Sist faglig oppdatert: 06.03.2023
Både i den kliniske hverdag og når pasienter behandles etter protokoller for utprøvende behandling, er det viktig å ha klare retningslinjer for evaluering av behandlingen. Kriterier er utarbeidet av en internasjonal arbeidsgruppe (Cheson et al., 1999). Disse kriteriene har det vært bred enighet om og de benyttes fortsatt i utstrakt grad. Kriteriene har imidlertid blitt revidert i 2007 og 2014, blant annet for å tilpasses den økende bruk av PET/CT (Cheson et al., 2014; Cheson et al., 2007). Responskriteriene fra 1999 vil i noen grad være adekvate i rutinen, mens de nyere kriteriene gradvis vil overta innenfor studier og i situasjoner der det er mulig og ønskelig. Begge sett av responskriterier presenteres i det følgende i forkortet versjon:
Kriterier for behandlingsrespons (Cheson et al., 1999)
(Benyttes der PET/CT ikke utføres)
Komplett remisjon (KR)
- Fullstendig tilbakegang av alle kliniske, biokjemiske og radiologiske tegn til sykdom og tilbakegang av alle symptomer på sykdom hvis tilstede før behandling.
- Dette innebærer at alle lymfeknuter er normalisert i størrelse (≤ 1.5 cm i deres største transversale diameter for knuter > 1.5 cm ved behandlingsstart). Affiserte knuter med største diameter 1.1–1.5 cm før behandling må ha avtatt til < 1 cm.
- Milten, hvis affisert før behandling, må ha avtatt i størrelse og skal ikke være palpabel. Hva som er normal miltstørrelse er ikke definert.
- Benmargen, hvis affisert før behandling skal være normalisert ved mikroskopisk undersøkelse
Komplett remisjon, ubekreftet (KRu)
Kriteriene for komplett remisjon skal være oppfylt, men med en eller flere av de følgende trekk:
- Rest-tumor over 5 cm i største transversale diameter, men som har avtatt med mer enn 75 % i summen av produktet av deres største diametre (SPD).
- Ikke avklart benmargsfunn (økt antall og størrelse av lymfoide aggregater, men uten cytologisk eller arkitektonisk atypi).
Partiell remisjon (PR)
- ≥ 50 % tilbakegang i sum av SPD til de seks største lymfeknuter eller tumormasser, valgt fra ulike regioner der disse var affisert før behandling.
- Ingen størrelsesøking av andre knuter, lever eller milt.
- Knuter i lever og milt må ha avtatt med minst 50 % i SPD.
- Benmargsaffeksjon ansees irrelevant da affeksjon ikke ansees som målbar.
- Ingen nye lesjoner skal være tilkommet.
Progressiv sykdom (PD)
- ≥25 % øking i SPD av hvilken som helst lesjon som tidligere er identifisert, sammenliknet med før behandling.
- Tilsynekomst av nye lesjoner under eller ved avslutning av behandling.
Stabil sykdom (SD)
Defineres som dårligere respons enn PR, men uten å være PD.
Reviderte kriterier for behandlingsrespons (Cheson et al., 2007)
Sist faglig oppdatert: 10.12.2021
I den grad PET/CT er tilgjengelig, bør man vurdere å anvende de reviderte responskriteriene (Cheson et al., 2007). Dette er spesielt aktuelt der man har kurativt siktemål og der svaret vil ha terapeutisk konsekvens, for eksempel ved en liten resttumor etter avsluttet kjemoterapi for Hodgkins lymfom.
Komplett remisjon (KR)
- Fullstendig tilbakegang av alle kliniske tegn til sykdom og tilbakegang av alle symptomer på sykdom hvis til stede før behandling.
- a. Typisk FDG-avide lymfomer hos pasienter uten PET eller med positiv PET før behandling, aksepteres som KR uansett resttumors størrelse, så lenge den er PET negativ.
b. Variabel eller ukjent FDG-aviditet: Alle lymfeknuter er normalisert i størrelse (≤ 1.5 cm i deres største transversale diameter for knuter > 1.5 cm ved behandlingsstart). Affiserte knuter med største diameter 1.1–1.5 cm før behandling må ha avtatt til < 1 cm. - Milten, hvis affisert før behandling, må ha avtatt i størrelse og skal ikke være palpabel. Hva som er normal miltstørrelse er ikke definert.
- Benmargen, hvis affisert før behandling skal være normal ved mikroskopisk undersøkelse
Komplett remisjon, ubekreftet (KRu)
Denne faller bort ved bruk av ovenstående definisjon av KR.
Partiell remisjon (PR)
- ≥ 50 % tilbakegang i sum av SPD i opp til seks av de største lymfeknuter eller tumormasser, valgt fra ulike regioner der disse var affisert før behandling.
- Ingen størrelsesøking av andre knuter, lever eller milt.
- Knuter i lever og milt må ha avtatt med minst 50 % i SPD.
- Benmargsaffeksjon ansees irrelevant da affeksjon ikke ansees som målbar.
- Ingen nye lesjoner skal være tilkommet.
- Typisk PET-avide eller der man har positiv PET før behandlingsstart må være PET positive i minst en lokalisasjon.
- Ukjent PET-aviditet eller PET-negativ før behandling: Bruk vanlige CT-kriterier
Progressiv sykdom (PD)
- ≥25 % øking i SPD av hvilken som helst lesjon som tidligere er identifisert, sammenliknet med før behandling.
- Tilsynekomst av nye lesjoner under eller ved avslutning av behandling.
Stabil sykdom (SD)
Defineres som dårligere respons enn PR, men uten å være PD.
Vurdering av respons basert på PET-CT (Cheson et al., 2014)
Sist faglig oppdatert: 10.12.2021
Kriteriene for behandlingsrespons fra 2007 er utviklet for bruk av PET-CT etter avsluttet behandling. Definisjon av PET negativ sykdom er der i det store og hele opptak av FDG under eller lik bakgrunnen i mediastinale blodkar.
PET-CT brukes i stor grad også til utredning før behandling, evaluering av respons underveis i behandling og til justering av behandlingsintensitet. Kriteriene publisert i 2014 (Cheson et al., 2014) oppsummerer dette feltet.
Lugano kriterier supplerer og uttdyper evaluering av respons under og etter behandling basert på liknende prinsipper som kriteriene fra 2007. For lymfomer med kjent FDG opptak før behandling (fordi en scan er gjort) og de med høy sannsynlighet for preterapeutisk opptak av FDG (klassisk HL og aggressive NHL) kan behandlingsrespons underveis og etter behandling graderes etter en 5 punkts scala (Barrington et al., 2014). Grad 1 er intet målbart opptak, grad 2 opptak under eller lik blodkar i mediastinum, grad 3 er opptak over blodkar i mediastinum men under eller lik opptak i lever, grad 4 er moderat over bakgrunnsopptak i lever og grad 5 er opptak betydelig over leverbakgrunn eller nye lesjoner som representerer lymfom. Nye lesjoner med FDG opptak som neppe representerer lymfom, klassifiseres som X.
Bruk av 5 punkts skalaen for justering av behandling (intensiviering eller deeskalering) og avgjøresler etter behandling (indikasjon for ny biopsi, strålebehandling, videre annen systembehandling) er avhengig av blant annet histologi og behandlingsregime. Score 1 og 2 anses som KR i alle tilfeller, mens vurderingen av score 3–5 er mer individuell etter kontekst for PET-CT. I nyere tid har en forsøkt å harmomisere responskriteriene slik at score 1-3 oppfattes som negativt i de fleste tilfeller.
Endepunkter for kliniske studier
Sist faglig oppdatert: 10.12.2021
De viktigste endepunkter som bør være med i kliniske studier er hendelsesfri overlevelse (event-free survival eller time to treatment failure), progresjonsfri overlevelse (progression free survival) og totaloverlevelse (overall survival). Progresjonsfri overlevelse er et bedre endepunkt for aggressive enn for indolente lymfomer. For indolente lymfomer kan «Tid til neste behandling» (time to new treatment) kan være et mer relevant endepunkt.
Ulike studier bruker ulike endepunkter for varighet av remisjon og overlevelse.
| Endepunkt | Responskategori | Definisjon | Starttidspunkt |
|---|---|---|---|
| Totaloverlevelse | Alle pasienter | Død uavhengig av årsak | Inklusjon i studie |
| Hendelsesfri overlevelse | Alle pasienter | Behandlingssvikt eller død uavhengig av årsak | Inklusjon i studie |
| Progresjonsfri overlevelse | Alle pasienter | Sykdomsprogresjon eller død uansett årsak | Inklusjon i studie |
| Sykdomsfri overlevelse | I KR | Tid til tilbakefall eller død av lymfom eller toksisitet | Første dokumentasjon av respons |
| Responsvarighet | I KR, PR | Tid til tilbakefall eller progresjon | Første dokumentasjon av respons |
| Tid til neste behandling | Alle pasienter | Tid til neste behandling | Inklusjon i studie |
| Sykdomsspesifikk overlevelse | Alle pasienter | Død relatert til lymfom | Inklusjon i studie |
Behandling ved Hodgkin lymfom
Sist faglig oppdatert: 10.12.2021
Ansvaret for behandling av Hodgkin lymfom (HL) tilligger universitetsykehusene. Man skiller mellom to hovedtyper av HL; nodulær lymfocyttrik type og klassisk type. Den siste deles igjen inn i fire undergrupper som angitt i Vedlegg 1. Behandling ved nodulært lymfocyttrikt HL og klassisk HL er noe forskjellig, og de omtales derfor hver for seg.
Nodulært lymfocyttrikt Hodgkin lymfom (tidligere nodulært paragranulom)
Sist faglig oppdatert: 06.03.2023
Denne subgruppen av HL rammer oftest menn i alderen 30–50 år og presenterer seg regelmessig i stadium I eller II. Lymfomet gir som regel glandelsvulst på hals, i aksiller eller lysker. Mediastinum og benmarg er sjelden affisert.
Nodulært lymfocyttrikt Hodgkin lymfom lokalisert sykdom (stad I-IIA)
Inntil 2011 fikk denne gruppen stråleterapi til 30 Gy mot affiserte områder (involved field), uten kjemoterapi, om det ikke forelå risikofaktorer (Diehl et al., 1999). Data fra British Columbia viser at de med fordel kan behandles likt som som klassisk HL, det vil si at alle får 2 (ved fravær av risikofaktorer) eller 4 kurer (ved en eller flere risikofaktorer) ABVD før strålebehandling (Savage et al., 2011). AVD eller CHOP kan være et godt alternativ for pasienter over 60 år. Strålebehandling gis mot affisert område som beskrevet i vedlegg 5. Prognosen ved nodulært lymfocyttrikt HL er meget god, selv om tilbakefall kan forekomme over tid. Det anses per i dag ikke å være riktig å kombinere kjemoterapi med rituximab i denne gruppen. Det er ikke vist at PET-responsadapert behandling har noen verdi ved nodulær lymfocyttrik HL.
Anbefalinger:
Uten risikofaktorer | Med risikofaktorer (minst én) |
|---|---|
|
|
Kjemoterapi, 2 kurer ABVD + involved site strålebehandling, 20 Gy | Kjemoterapi, 4 kurer ABVD + involved sitestrålebehandling, 29,75 Gy |
Evidensnivå B
Uten risikofaktorer | Med risikofaktorer (minst én) |
|---|---|
|
|
Kjemoterapi, 2 kurer ABVD + involved site strålebehandling, 20 Gy | Kjemoterapi, 4 kurer ABVD + involved site strålebehandling, 29,75 Gy |
Evidensnivå B
Nodulært lymfocyttrikt Hodgkin lymfom utbredt sykdom (stad IIB-IV)
Behandlingen følger stort sett de samme retningslinjer som ved klassisk Hodgkin lymfom (se under). Dokumentasjonen angående hvilket regime som er å foretrekke er foreløpig sparsom, i utgangspunktet anbefales ABVD sammen med rituximab gitt ved 1. del av hver kur som standard. AVD eller CHOP kan være et godt alternativ for pasienter over 60 år. Det er ikke vist at PET responsadaptert behandling har noen verdi ved nodulært lymfocyttrikt HL. Det er indikasjoner på at alkylerende stoffer, som i LVPP-kur, kan være minst like effektivt som ABVD (Tsai et al., 2007). Denne formen av Hodgkin lymfom uttrykker CD20 på overflaten og studier viser at standard rituximab monoterapi har meget god effekt ved residiv (Advani et al., 2014; Schulz et al., 2008).
Anbefaling:
ABVD kjemoterapi kombinert med rituximab, 6 kurer.
Evidensnivå C
Nodulært lymfocyttrikt Hodgkin lymfom, residiv
Sene residiver forekommer ikke sjelden og de har ofte et indolent preg, men kan transformere til et non-Hodgkin lymfom. Ny biopsi anbefales. Standard terapi baseres på samme prinsipper som ved klassisk HL, selv om det mer usikkert om man kan oppnå varig kurativ effekt. Nytten av HMAS er heller ikke godt dokumentert. Regimer som ABVD, LVPP eller MIME kan forsøkes og det er holdepunkter for å gi disse regimene kombinert med rituximab, siden lymfomet er CD20 positivt. Rituximab monoterapi kan forsøkes som senere linje idet det er dokumentert gode responsrater (se over). Stråleterapi mot problemområder forventes å ha god effekt, selv ved bruk av lave doser helt ned mot 4 Gy.
Evidensnivå B
Behandling av klassisk Hodgkin lymfom
Sist faglig oppdatert: 06.03.2023
Klassisk HL deles inn i fire undergrupper histologisk og disse omtales i det følgende under ett. Behandlingen er tradisjonelt basert på stadium ved diagnose og enkelte andre kliniske risikofaktorer (risikoadaptert behandling). Sykdommen presenterer seg ofte i stadium I eller II over diafragma. Pasienter uten risikofaktorer fikk tidligere strålebehandling alene (stort sett kappefelt, omvendt Y-felt eller begge). Pasienter med risikofaktorer fikk kombinert kjemoterapi og samme strålefelt som pasienter uten risikofaktorer. De relativt store strålefeltene som har vært benyttet tidligere, gir høyere insidens av sekundærkreft og andre senbivirkninger. Det er i dag etablert at 2–4 cytostatikakurer med mindre strålefelt ved stadium I og II er en bedre behandling totalt sett for disse pasientene. Behandlingen ved stadium IIB, III og IV er basert på kjemoterapi, eventuelt supplert med mindre strålefelt.
Basert på gode resultater med individtilpasset behandling etter tidlig respons i PET-CT etter to kurer, gis i dag responsadaptert ved klassisk Hodgkin lymfom.
Klassisk Hodgkin lymfom begrenset sykdom (stadium IA og IIA)
Inndeling av risikogrupper av pasienter med tidlig sykdom (stadium I-IIA uten risikofaktorer) eller intermediær sykdom (stadium I-IIA med risikofaktorer) følger handlingsprogram utarbeidet av Nordisk lymfomgruppe (1999), der man benyttet 2–4 kurer med ABVD-regimet og i tillegg «modified involved field» stråleterapi. For pasienter uten risikofaktorer gir 20 Gy like bra overlevelse som 30 Gy (Engert et al., 2010). Anbefalt antall kurer bestemmes av hvorvidt pasientene har en eller flere risikofaktorer (Engert et al., 2007; Engert et al., 2003) som angitt nedenfor på flytskjema fra Nordisk protokoll:
Anbefalinger:
Uten risikofaktorer | Med risikofaktorer (minst én) |
|---|---|
|
|
Kjemoterapi, 2 kurer ABVD* + involved site strålebehandling, 20 Gy | Kjemoterapi, 4* kurer ABVD/eskalertBEACOPP + involved site strålebehandling, 29.75 Gy |
Uten risikofaktorer | Med risikofaktorer (minst én) |
|---|---|
|
|
Kjemoterapi, 2 kurer ABVD + involved site strålebehandling, 20 Gy | Kjemoterapi, 4 kurer ABVD + involved sitestrålebehandling, 29.75 Gy |
*To kurer eskalert BEACOPP ved positiv PET-CT etter 2 ABVD eller i stedet for ABVD i kur 3-4.
Basert på en randomisert studie fra EORTC (Andre et al., 2017), anbefales det at pasienter som har stadium I/IIA gjennomgår en interim PET-CT etter 2 ABVD-kurer. Ved komplett respons (Deauville score 1–3) gis ovennevte behandling i sin helhet. Norsk lymfomgruppe anser erfaringene med de ofte relativt små strålefeltene som gode, risiko for alvorlige seneffekter så langt som lav, og en anbefaler ikke å utelate strålebehandling eller erstatte dette med ytterlige kjemoterapi hos de fleste pasienter(Lagerlöf et al., 2020). Et unntak er pasienter med relativt utbredt stadium IIA, der et strålefelt vil gi dose til relevanter organer som hjerte, lunger eller bryst. Her viser nevnte EORTC studie at behandling med totalt 6 kurer (analogt til RATHL studien, se nedenfor) gir akseptabel progresjonsfri overlevelse selv uten strålebehandling.
Ved fortsatt PET opptak med Deauville score 4–5 etter 2 ABVD anbefales gitt 2 kurer eskalert BEACOPP etterfulgt av «involved site» strålebehandling til 30 Gy. Denne intensiveringen vil, spesielt hos pasienter med risikofaktorer, kunne forhindre en stor del av tilbakefallene i denne gruppen. Det forventes at under 20 % av pasientene med stadium I-IIA vil trenge en slik intensivering. Kryopreservering av ovarialvev kan være aktuelt hos yngre kvinner, og dette bør tenkes på tidlig og planlegges slik at man ikke mister behandlingsintensitet ved overgang til eskalert BEACOPP.
Nyere data fra den tyske HD17 viser at pasienter med intermediær sykdom (stadium I-IIA med risikofaktorer) kan behandles med 2 kurer eskalert BEACOPP etterfulgt av 2ABVD(Peter Borchmann et al., 2021). Dersom disse er PET-CT negative etter siste kur, kan strålebehandling utelates. Dette vil være et alternativ for flere pasienter, spesielt der fertilitet ikke lenger er et stort tema.
Evidensnivå A
Det kan være nyttig å ha et individtilpasset perspektiv på behandlingen av tidlig klassisk HL. Men, siden svært få pasienter i stadium I-IIA uten risikofaktorer får et residiv etter tidligere standardbehandling med 2-4 ABVD og invovled site strålebehandling til 20–30 Gy kan dette også benyttes der eskalering til BEACOPP ikke synes hesiktsmessig.
Retningslinjer for stråleterapi ved begrenset sykdom innebærer at man bruker «involved site» (Hoskin et al., 2013) der det settes en margin på 1,5 cm til opprinnelig tumorvolum kraniokaudalt og definerer dette som CTV (clinical target volume). Fortsatt synlige restglandler skal inkluderes i CTV. Det er fortsatt vanlig å inkludere hele den affiserte glandelstasjon i transversalplanet innenfor CTV. CTV skal ikke gå inn i ben, luft eller andre organer med mindre det var ekstranodal ekstensjon/innvekst der før behandlingsstart. Glandelregionenes anatomi slik de fremstilles på CT følger vanlige publiserte atlas for f.eks. hals, thorax, abdomen og bekken. For PTV (planning target volume) kommer en margin i tillegg for intern bevegelighet og instillingsusikkerhet. Marginer for intern bevegelighet kan reduseres ved pustestyrt behandling eller sikres bedre ved 4D opptak av CT bilder til planlegging. Doseringen er standardmessig 2 Gy x 10 (pasienter uten risikofaktorer og PET-negativ sykdom etter 2 ABVD) eller 1,75 Gy x 17 (pasienter med risikofaktorer og PET negativ sykdom etter 2 ABVD og alle pasienter med PET positiv sykdom etter 2 ABVD kurer). Ved bestråling av risikoorganer som hjerte, nyrer, hypofyse/chiasma og munn/svelg kan feltgrenser modifiseres. For detaljer rundt stråleterapi ved Hodgkin lymfom, se eget avsnitt i vedlegg 5 om stråleterapi.
PET-CT før oppstart behandling kan med fordel tas i behandlingsposisjon der strålebehandling planlegges som en del av behandlingen
Klassisk Hodgkin lymfom begrenset sykdom (stadium IA og IIA) over 60–65 år
Prognosen for Hodgkin lymfom er alvorligere etter 60–65 års alder (Engert et al., 2005). Noe av årsaken til de dårlige resultatene fra noen år tilbake er sannsynligvis at mange fikk LVPP-regimet som gir økt hematologisk toksisitet i denne aldersgruppen. ABVD, som har vært standard hos yngre de siste årene tolereres trolig bedre. Tyske studier har vist at flere enn 2 ABVD øker lungetoksisiteten (vs AVD). Behandlingen av eldre pasienter skiller seg likevel fra den hos yngre med et mer forsiktig og individualisert opplegg avhengig av allmenntilstand og andre kompliserende sykdommer. Etter algoritmen over har 2–4 CHOP kurer avhengig av risikofaktorer etterfulgt av strålebehandling vært benyttet ved en del norske sentre til pasienter over 60 år med Hodgkin lymfom (Kolstad et al., 2007b) (regimet er beskrevet under NHL). Nyere skandinaviske registerdata taler for at AVD er mer effektivt enn CHOP opp til 75 år. Trolig vil de fleste pasienter helt opp til 75 år tolerere AVD, og CHOP kan reserveres til pasienter der man er mer usikker. Dosetilpasninger er vesentlige.
Ved lokalisert sykdom er stråleterapi alene i enkelte tilfeller å foretrekke, avhengig av pasientens tilstand og sykdommens lokalisasjon, men dette er neppe kurativt på lang sikt om kun affisert område inkluderes i strålefelt.
Klassisk Hodgkin lymfom utbredt sykdom (stadium IIB-IV)
Til forskjell fra noen andre land og studiegrupper defineres klassisk HL som avansert ved stadium IIB eller høyere. Standard behandling for denne gruppen er kjemoterapi, eventuelt supplert med «involved site» stråleterapi til 29.75 Gy mot risikoområder eller resttumores. ABVD-regimet har vært gullstandard for behandling av pasienter med utbredt HL i Norge og i mange andre land (Canellos et al., 1992). Eskalert BEACOPP er et alternativt regime med høyere akutt toskistet, mulig også flere senkomplikasjoner, som man i Norge har valgt å resereve til pasienter med dårlig prognose,identifisert ved hjelp av kliniske risikofaktorer i International Prognostic Score (IPS) (Diehl et al., 2003; Fosså et al., 2012). På grunn av toksistet, blant annet risiko for infertilitet og mulig utvikling av myelodysplasi, har en i Norge ikke innført doseesklatert BEACOPP som standard for alle med avansert HL. For å redusere toksisitet, spesielt steroidindusert benmargsnekrose, er steroiddosen halvert i Norge i forhold til opprinnelig protokoll.
Nyere data fra responsadaptert behandling basert på effekt målt med PET-CT etter to kurer viser at man i større grad kan sidestille behandling som starter med ABVD og eskalert BEACOPP hva angår toksistet (Johnson et al., 2016). Også for pasienter med lav risiko(0–3 risikofaktorer) kan eskalert BEACOPP erstatte ABVD om et behandlingsvalg, spesielt om fertilitet ikke er en vesentlig bekymring. For pasienter med høy risiko (4 eller flere riskofaktorer) anbefales å starte med eskalert BEACOPP (Borchmann et al., 2017).
For pasienter som starter med ABVD, er resultater fra en stor internasjonal prospektiv fase III studie (RATHL) publisert (Johnson et al., 2016). Hovedhensikten med studien var å tilpasse behandlingsintensiteten til PET-respons på behandling etter 2 ABVD kurer. Pasienter som var PET negative (Deauville score 1–3) ble randomisert til 4 kurer AVD eller 4 kurer ABVD mens pasienter som var PET positive (Deauville score 4–5) fikk BEACOPP-basert behandling, enten som 4 kurer eskalert BEACOPP eller 6 kurer BEACOPP-14. Denne studien har ført til at man i Norge nå benytter samme strategi, dvs man hos pasienter med lavrisiko sykdom (IPS 0-3 og ønske om best mulig bevart fertilitet) kan starte med 2 ABVD og deretter de-eskalere til AVD eller intensiverer til BEACOPP basert på PET-CT svar. Kryopreservering av ovarilavev kan gjøres etter 2 ABVD dersom man skal eskalere til BEACOPP men må planlegges godt for ikke å miste behandlingsintensitet.
For pasienter som starter med doseeskalert BEACOPP, har HD-18 studien vist hvordan PET-CT etter to kurer kan styre videre behandling (Borchmann et al., 2018). Pasienter som er PET-negative (Deauville score 1–3) kan klare seg med ytterligere 2 kurer eskalert BEACOPP (Borchmann et al., 2018) . Prognosen for disse pasientene synes svært god med progresjonfri overlevelse over 92 % og lavere tosksitet enn tidligere ved fulle 6 eller 8 kurer. Pasienter som er PET-positive (Deauville score 4–5) skal ha yttereligere 4 kurer eskalert BEACOPP. Dette vil være en intensiv behandling for flere, og dosetilpasninger må påregnes underveis. Pasienter som er PET negative etter 2 esklaerte BEACOPP og dervidere behandling medBEACOPP anses for toksisk kan man vurdere de-eskalering til A (B)VD regimet (Casasnovas et al., 2019).
Anbefalinger:
Pasienter med lav risiko (IPS 0–3 eller etter individuell vurdering) kan starte med ABVD eller eskalert BEACOPP kjemoterapi 2 kurer. Etter 2 ABVD gis 4 kurer AVD eller 4 kurer doseeskalert BEACOPP avhengig av resultatet av interim PET.
Pasienter med høy risiko (IPS ≥4 eller etter individuell vurdering) gis eskalert BEACOPP, antall kurer avhengig av resultatet av interim PET, yttereligere 2 ved negativ PET, ytterligere 4 ved positiv PET.
Evidensnivå A
Studier viser at det ikke gir noen gevinst å supplere med strålebehandling til pasienter som er PET negative underveis eller etter behandling. Dersom det er gjort interim PET-CT som er negativ, vil det vanligvis ikke være nødvendig å gjenta denne etter avsluttet behandling, da er en CT eller MR tilstrekkelig for dokumentasjon av respons. Ved sykdom som er PET-positiv under behandling bør denne kontrolleres på nytt etter behandling.
Evidensnivå B
Utprøvende behandling
HD21 studien som randomiserer 4–6 eskalerte BEACOPP mot et modifisert regime inneholdende Brentuximab vedotin (BrECADD) er nylig avsluttet men ikke publisert.
Klassisk Hodgklin lymfom utbredt sykdom (stadium IIB-IV) over 60–65 år
CHOP regimet er vel utprøvd hos eldre pasienter med NHL, og har vært benyttet ved en del norske sentre til pasienter over 60 år med Hodgkin lymfom (Ansell et al., 2022; Kolstad et al., 2007b) (regimet er beskrevet under NHL). Trolig vil de fleste pasienter helt opp til 65 år tolerere ABVD, men høyere grad av toksisitet, spesielt også lungetoksisitet av bleomycin, må påregnes. Nyere skadinaviske registerdata taler for at AVD er mer effektivt enn CHOP opp til 75 år. Trolig vil de fleste pasienter helt opp til 765 år tolerere ABVD, og CHOP kan reserveres til pasienter der man er mer usikker. Dosetilpasninger er vesentlige. Vanligvis vil en velge å gi 6 kurer avhengig av toleranse og effekt etter samme retningslinjer som for pasienter under 60 år.
Interim PET-CT er ikke så nyttig, daeskalering til BEACOPP er vanskelig gjennomførbart i denne pasientgruppen. PET-CT på slutten av kjemoterapi kan avgjøre bruk av strålebehandling.
Utprøvende behandling
Det er gjennomført en studie i tysk-nordisk regi der brentuximab vedotin erstattet vincristin i CHOP regimet (B-CAP-studien). Resultater foreligger ikke enda.
HD21 studien er utvidet til å inneholde en arm for eldre pasienter 60-75 år som kan få BrECADD.
Anbefalinger:
For stadium IIB–IV: 6 AVD kurer.
Evidensnivå C
Strålebehandling ved stadium IIB og III-IV
Det har vært gjennomført store metaanalyser og dessuten randomiserte studier for å undersøke nytteverdien av stråleterapi hos pasienter som har gjennomgått full kjemoterapi svarende til 6–8 kurer ABVD eller BEACOPP.
Pasienter som oppnår en radiologisk komplett remisjon etter kjemoterap (etter kriterier fra tiden før PET-CT) trenger ikke strålebehandling (Aleman et al., 2003). Nyere data på pasienter med responsadaptert behandling som blir PET-negative etter to kurer med ABVD eller er PET-negative etter 4-6 esklaerte BEACOPP trenger ikke strålebehandling, ei heller ved risikoområder som «bulky» sykdom i mediastinum før oppstart av terapi eller restforandringer etter behandling.Ved rester som er er PET-positive bør man være liberal med å biopsere slike der dette er mulig. Ved positiv biopsi vil man vurdere å kun strålebehandle dette området til 29,75 Gy. Spesielt etter eskalert BEACOPP er dette godt dokumentert. Alternativet ville være å starte 2. linje kjemoterapi med tanke på å gjennomføre høydosebehandling med autolog stamcellestøtte etterpåKontroll av slirestlesjoner med CT etter 3 og 12 mnd er en aktuell løsning på denne usikkerhet.
Strålebehandling gis mot restumor etter «involved site» prinsippet. CTV defineres som restforandringer med en margin på 1,5 cm kraniokaudalt i lymfedrenasjens retning og inkluderer hele gladelregionen i transversalplanet. Margin til PTV kommer i tillegg for intern bevegelighet og innstillingsusikkerhet.
Anbefalinger:
Strålebehandling 29.75 Gy etter kjemoterapi reserveres tilfeller med lokalisert restsykdom, fortrinnsvis verifisert ved biopsi og/eller positiv PET undersøkelse.
Evidensnivå A
Klassisk Hodgkin lymfom hos pasienter under 18 år
For barn og ungdom er det spesielt viktig at den kumulative dose av hvert enkelt cytostatikum er minst mulig. Strålefeltene og stråledosene bør holdes så små og lave som mulig.. Ansvaret for behandling ligger hos universitetssykehus. Den tysk-østerrikiske Hodgkin-gruppen og senere en europeisk gruppe med bred tilslutning (Euronet) har gjennomført suksessive behandlingsprotokoller der behandlingen er tilpasset sykdomsutbredelsen men gradvis redusert med opprettholdt kurasjonsrate, men tilpasset sykdomsutbredelsen. . EuroNet-PHL-C1 studien startet i januar 2008 danner basis for standardbehandlingen i Norge (Mauz-Körholz et al., 2022). Den site EuroNet-PHL-C2 protokollenstartet i 2015 og er nettopp avsluttet.
Man deler inn i tre terapinivåer (Treatment level), som er noe endret sammenliknet med tidligere studier:
TL-1: | Stadium IA/B, IIA uten risikofaktorer |
TL-2: | Stadium IA/B, IIA med risikofaktorer (Senkning over 30 mm/h, største tumorvolum over 200 mL), stadium IEA/B, IIEA, IIB, IIIA |
TL-3: | Stadium IIEB, IIIEA/B, IIIB, IVA/B |
Alle pasienter får 2 OEPA-kurer. Det gjennomføres så en interim PET-CT. I TL-1 gis 1 COPDAC-28 kur om denne er negativ eller strålebehandling 20 Gy om denne er positiv. Pasienter i TL-2 og 3 ble randomisert til ytterligere 2 (TL-2) eller 4 (TL-3) kurer med COPDAC-28 (standard arm) eller DACOPDAC-21 (eksperimentell arm). Dersom interim PET CT var negativ ga en ikke strålebehandling. Dersom interim PET-CT var positiv ga man strålebehandling til hele det opprinnelige tumorvolum (standard armen, 20 Gy) eller kun til sykdom som fortsatt er PET postiv etter avsluttet kjemoterapi (eksperimentell arm), og da til 30 Gy. Studien søker å redusere bruken av strålebehandling kraftig ved å intesivere kjemoterapien noe.
I påvente av svar er det mulig å gi behandling etter den eksperimentell armen i Euronet-PHL-C2, spesielt i tilfeller der strålefelt ellers blir store.
Anbefalinger:
Behandling i henhold til EuroNet-PHL-C2 studien, her spesielt også den eksperimentelle armen i TL-2 og 3.
Evidensnivå A
Oppfølging under pågående kjemoterapi
Førstelinjebehandling ved HL har nesten alltid kurativ intensjon. Pasientene følges nøye i forbindelse med kurene. PET-CT etter to kurer må alltid gjøres (unntak eldre der dette kanskje ikke har konsekvens) , da behandlings valg avhenger av denne. Ved begrenset sykdom skal det utføres responsevaluering etter hver annen kur. Ved utbredt sykdom skal dette minst gjøres etter 2 kurer og etter 6 kurer. Der en er usikker på respons etter 2 kurer, kan det foretas en ny evaluering etter 4 kurer. Undersøkelsene rettes mot positive funn på diagnosetidspunktet. Den hyppige responsevalueringen vil identifisere pasienter som responderer dårlig på kjemoterapi og som derfor bør få et alternativt behandlingsopplegg. For barn og ungdom bør man vurdere å benytte MR som billeddiagnostikk ved evaluering (med mindre det foreligger lungeaffeksjon på diagnosetidspunkt) for å unngå unødig strålebelastning.
Generelt skal reduksjon av dose p.g.a. leukopeni under førstelinjebehandling unngås fordi sjansene for å oppnå komplett remisjon og helbredelse blir mindre. Erfaring med leukopeni under behandling med ABVD og OEPA viser at man kan administrere fulldoserte kurer uansett verdi av neutrofile, uten at neutropen feber må inntre. I noen få tilfeller må en benytte bruk av hematopoietiske vekstfaktorer, G-CSF (filgrastim, PEG-filgrastim, Lipeg-filgrastim eller tilsvarende), for å opprettholde doseintensiteten på ABVD eller OEPA. Ved eskalert BEACOPP er G-CSF obligat. Pasienter over 60 år er erfaringsmessig mer utsatt for behandlingsrelaterte komplikasjoner og må følges ekstra nøye. Pasienter som får ABVD kjemoterapi bør observeres med hensyn til bleomycinindusert lungetoksisitet. Spirometri bør utføres før oppstart av behandling og CT-thorax og lungefunksjonsundersøkelse bør utføres med lav terskel ved lungesymptomer underveis i behandlingen. Kardiologisk utredning foretas hos de som har kjent hjertesykdom før oppstart terapi og der det oppstår kliniske tegn til hjertesykdom under behandling.
Behandling ved residiv
Helbredelse er fortsatt mulig etter første residiv, og i noen tilfeller også ved senere residiver. Derfor er det påkrevd at spesialavdeling håndterer behandlingen. Prognosen er bedre desto lengre tid etter primærbehandlingen residivet oppstår. Det er viktig at strålebehandlingens plass i residivbehandlingen alltid blir vurdert.
Anbefalinger:
Pasienter under 65–70 år med første residiv (etter kjemoterapi som primærbehandling) eller med andre eller senere residiv er aktuelle for høydosebehandling med autolog stamcellestøtte (HMAS) (Linch et al., 1993; Schmitz et al., 2002). Ved sene residiver, begrenset residiv uten B-symptomer og der residivet ligger utenfor tidligere strålefelt kan residivbehandling uten HMAS overveies. Se kapittel Høydosebehandling med autolog stamcellestøtte.
Evidensnivå A
Induksjonskjemoterapi
Et regime som inneholder Gemcitabin (IGEV) har vist god effekt og evne til å mobilisere stamceller og regnes nå som førstevalg hos egnede pasienter (Santoro et al., 2007). DHAP, IME eller IKE kjemoterapi er alternative regimer som induksjon før HMAS. Med disse regimene unngås peroral alkylerende cytostatikabehandling, som er toksisk for hematopoietiske stamceller, og ytterligere bruk av antracycliner, som er hjertetoksisk. IKE er et mer intensivt regime enn IME, men er mindre egnet som mobiliseringsregime før HMAS (Jerkeman, Leppä, Kvaløy, & Holte, 2004).
Pasienter som ikke oppnår god nok remisjon før HMAS, spesielt pasienter som ikke blir PET negative etter 2–4 kurer, bør vurderes for Brentuximab vedotin enten alene eller sammen med annen kjemoterapi, som Bendamustin eller DHAP.
Evidensnivå B
Vedlikeholdsbehandling med brentuximab vedotin etter HMAS
Den randomiserteAETHERA studien viser at vedlikeholdsbehandling med brentuximab vedotin i ett år etter HMAS hos utvalgte pasienter med ugunstige prognostiske faktorer (B-symptomer, ekstra-nodal affeksjon, kort tid til residiv/progresjon etter primærbehandling) gav signifikant bedre progresjonsfri overlevelse (Moskowitz et al., 2015). Det var dog foreløpig ingen forskjell i total overlevelse. For pasienter som har fått Brentuximab vedotin før HMAS som del av induksjonbehandlingen reduseres antall kurer etter HMAS slik at totalt antall blir 16. Neutropeni og nevrotoksistet nødvendiggjør ofte dosereduksjoner.
Anbefaling:
Vedlikeholdsbehandling med brentuximab vedotin i ett år (16 doser) etter HMAS anbefales for utvalgte pasienter med ugunstige prognostiske faktorer.
Evidensnivå A
Behandling ved sent residiv
Ved residiver som oppstår mer enn to år etter primær diagnose, etter begrenset kjemoterapi første gang, der residivet er lokalisert og ligger utenfor tidligere strålefelt kan man fortsatt regne med å ha et kurativt siktemål uten konsolidering med HMAS. Pasienter med utbredt sykdom ved residiv eller med B-symptomer og pasienter som har gjennomgått full kombinasjonskjemoterapi svarende til 6–8 kurer ABVD eller BEACOPP, vil likevel kunne ha nytte av HMAS ved sent residiv da den videre residivfrekvensen synes være lavere enn ved konvensjonell behandling (Yuen et al., 1997). Valg av konvensjonelt behandlingsregime avhenger i stor grad av pasientens alder og tilstand, samt hvilket regime som ble benyttet forrige gang, merk spesielt akkumulert dose av antracycliner og bleomycin. Førstevalg vil for de fleste være IGEV, et regime som både gir gode responsrater og dessuten egner seg godt som mobiliseringssregime før stamcellehøsting. Andre aktuelle regimer er ABVD eller ABOD/LVPP, BEACOPP eller doseeskalert BEACOPP, IME, IKE, LVPP, CHOP, DHAP.
Strålebehandling alene eller i kombinasjon med kjemoterapi bør også vurderes, særlig ved lokaliserte residiv utenfor tidligere strålebehandlet område.
Anbefaling:
Individuell vurdering mht konsolidering med HMAS etter induksjonskjemoterapi. Faktorer som tilsier bruk av HMAS er residiv innenfor tidligere strålefelt, samt utbredt sykdom og B-symptomer på residivtidspunkt.
Evidensnivå B
Residiv etter HMAS og residiv hos pasienter som ikke er aktuelle for HMAS
Senere år er det kommet dokumentasjon på nye medikamenter som har effekt ved langtkommen HL. Brentuximab vedotin har høy aktivitet og gunstig toksisitetsprofil selv ved residiv etter HMAS og allogen stamcelle-transplantasjon (Younes et al., 2012). Medikamentet, alene eller i kombinasjon, har vært brukt til pasienter som ny induksjonsbehandling før allogen stamcelletransplantasjon, altså hos pasienter som fortsatt har et kurativt siktemål. Kombinasjon med strålebehandling er aktuelt for noen(Fossa et al., 2020). For pasienter med pallitativt siktemål og som responderer på brentuximab vedotin, må en vurdere behandlingslengden. I studier har disse fortsatt med behandling i lengre tid, men det er godt mulig at antall kurer hos pasienter med respons kan begrenses til 6 eller 8. Rebehandling ved residiv etter tidligere behandling er aktuelt.
PD-1 hemmere er effektive ved klassisk HL og både Pembrolizumab og Nivolumab har vist gode responsrater og gunstig toksistetsprofil. Begge er godkjent av Beslutingsforum for pasienter med residiv eller refraktær sykdom og som har gjennomgått både HMAS og Brentuximab vedotin. Pembrolizumab er også godkjent for pasienter som har residiv etter Brentuximab vedotin og som ikke er egnet eller kvalifisert for HMAS. På grunn av den immunologiske virkningsmekanismen må en være varsom når en kombinerer disse medikamentene med allogen stamcelletransplantasjon, men hvordan dette kan gjøres er ikke godt avklart.
Der kurativt siktemål ikke lenger er mulig, vil regimer som CEKP, BOP, gemcitabin, vinorelbin og trosfosfamid være aktuelle med den hensikt å gi responser, palliasjon og evt. livsforlengelse. Lokal strålebehandling kan være en god palliativ behandling ved kjemoresistent sykdom.
Utprøvende behandling
AERN studien (Absocopal Effect of Radiotherapy with Nivolumab) pågår siden 2020 og inkluderer pasienter som ikke har effekt av PD-1 hemmere. Pasientene fortsetter i studien med Nivolumab men en økt terapeutisk virkning tilstrebes (abskopal effekt) med samtidig strålebehandling av enkeltlesjoner. Aktuelle pasienter kan henvises til OUS Radiumhospitalet.
Anbefalinger:
Vurder behandlingsmål nøye for denne gruppen i samråd med regionalt referansesykehus. Brentuximab vedotin er et effektivt og lite toksisk behandlingsvalg for denne pasientengruppen og kan brukes som en bro til allogen transplantasjon eller kombineres med strålebehandling. PD-1 hemmere er et nytt behandlingsalternativ med immunologisk effekt. Mange pasienter i palliativ situasjon vil respondere på gjentatte regimer som Brentuximab vedotin, PD-1 hemmer, eller mer tradisjonelle regimer som CEKP, BOP, gemcitabin, og trofosfamid. Lokal strålebehandling kan gi god palliasjon ved kjemoresistent sykdom.
Evidensnivå B
Allogen stamcelletransplantasjon
Yngre pasienter kan vurderes for allogen stamcelletransplantasjon etter søknad til Nasjonal gruppe for allogen stamcelletransplantasjon. De fleste pasientene vil ha tilbakefall etter HMAS, og brentuximab vedotin kan være godt egnet som bro til transplantasjon. Forsiktighet bør utvises ved kombinasjon av PD-1 hemmer og allogen stamcelletransplantasjon pga immunologiske komplikasjoner.
Anbefalinger:
Utvalgte pasienter kan vurderes for allogen stamcelletransplantasjon ved god behandlingsrespons.
Evidensnivå C
Behandling ved Non-Hodgkin lymfom
Sist faglig oppdatert: 10.12.2021
Det har skjedd en rivende utvikling innen diagnostikken av NHL i de siste 10–15 årene. Nye fremskritt innen immunologi og cytogenetikk/ DNA-teknologi og spesielt bruk av immunfenotyping i diagnostikken har gitt en bedre klassifisering og sikrere diagnose i enkelttilfeller. For NHL er histologisk type viktigere for prognose og valg av behandling enn klinisk stadium (med unntak av stadium I). Dette skyldes dels at ca. 2 av 3 pasienter har utbredt sykdom (stadium III eller IV), men også at kjemoterapi her spiller en viktigere rolle enn stråleterapi.
Behandlingsresultatene har blitt bedre, særlig for aggressive lymfomer. Dette skyldes både bedre diagnostikk, mer intens induksjonsbehandling med kombinasjonskjemoterapi og ikke minst introduksjon av monoklonale antistoffer. Jo flere pasienter man får i komplett remisjon, helst så tidlig som mulig, desto flere pasienter blir langtidsoverlevere. Behandlingen av de mest aggressive lymfomer (lymfoblastisk- og Burkitt lymfom) har endret seg mest de siste årene. Disse behandles nå etter leukemiprotokoller og ca. 70 % blir langtidsoverlevere. I dag helbredes mer enn 60 % av pasientene med de øvrige aggressive NHL. For de mer langsomtvoksende, indolente NHL foreligger også nye behandlingsprinsipper som forlenger totaloverlevelsen for denne pasientgruppen.
B-celle lymfom
Sist faglig oppdatert: 06.03.2023
B-celleforstadier- B-lymfoblastisk leukemi/lymfom
Ved B-lymfoblastisk leukemi er det minst 25 % blaster i benmargsaspirat. B-lymfoblastisk lymfom (med < 25 % blaster i benmarg) forekommer sjelden og skal behandles etter protokoll for B-lymfoblastleukemi. Ved mistanke om denne sykdommen skal universitetsykehus kontaktes umiddelbart for overføring til øyeblikkelig utredning og behandlingsstart. Det stilles spesielle krav til diagnostikk, bla med avansert immunfenotyping og cytogenetiske undersøkelser. Sykdommen behandles med intensiv kombinasjonskjemoterapi etter protokoller for akutt lymfatisk leukemi. I stedet for vedlikeholds kjemoterapi over 2–3 år, tilbys pasienter under 65 år høydosebehandling med autolog stamcellestøtte (HMAS) i 1. remisjon. Selekterte undergrupper med negative prognostiske parametere eller dårlig respons under pågående primærbehandling bør vurderes for allogen stamcelletransplantasjon i første remisjon. Førstelinje behandling er fortsatt forskjellige ALL-protokoller (tidligere Hammersmith 82 regimet, nå NOPHO 2008 regimet eller andre egnede regimer) etter retningslinjer beskrevet i Nasjonal Handlingsplan for Blodsykdommer (Bersvendsen et al., 2014).
Anbefalinger:
Protokoller for ALL etterfulgt av HMAS, men for selekterte grupper allogen stamcelletransplantasjon.
Evidensnivå B
Moden B-celle neoplasier – indolente
Det er antageligvis fortsatt riktig å si at indolent NHL i utbredt stadium ikke kan kureres med dagens behandling. Det er ikke vist at levetiden påvirkes av hvorvidt behandlingen starter tidlig eller sent eller av behandlingsintensitet. Men nyere studier har vist overlevelsesgevinst for subgrupper, og registerstudier kan tyde på at nye behandlingsprinsipper har endret sykdommens naturlig forløp og forbedret leveutsiktene. Median «overall survival» fra diagnose ser nå ut til å være over 20 år. Observasjon («watch and wait») bør nok fortsatt velges der pasienten ikke er behandlingstrengende, men terskelen for å starte behandling er lavere i dag enn før. Internasjonalt er det ingen klar enighet om hvordan denne gruppen av pasienter skal behandles når de blir behandlingstrengende. Det er viktig å komme frem til bedre behandlingsmetoder, og vi anbefaler derfor at pasienter med disse lymfomentitetene inkluderes i pågående kliniske studier. Faktorer som avgjør behandlingsbehov er bl.a.: allmennsymptomer (B-symptomer), sekundære autoimmune tilstander, truende organkomplikasjoner, benmargssvikt under utvikling (fall i Hb, hvite, trombocytter), bulky tumor og progredierende/symptomgivende glandelsvulst. Pasientens eget ønske bør også spille en rolle, idet noen finner det psykisk meget belastende ikke å få behandling. Imidlertid vil mange pasienter kunne akseptere en «watch and wait» strategi hvis det gis god informasjon.
Småcellet lymfocytært lymfom (SLL)/kronisk lymfatisk leukemi (KLL)
SLL og KLL regnes som litt forskjellige presentasjoner av samme sykdom og behandles på samme måte. Ansvar ligger hos hematologene i Norge og retningslinjer for behandling av KLL foreligger i et eget handlingsprogram
Lymfoplasmacyttisk lymfom – Waldenstrøms makroglobulinemi
Ansvar for behandling og oppfølging ligger hos hematologene i Norge og retningslinjer for behandling foreligger i et eget handlingsprogram:
Solitært plasmocytom i ben
Diagnosen stilles på benbiopsi eller aspirat ved dominans av modne til dels atypiske plasmaceller, og utgjør 5 % av plasmacelleneoplasiene. Det foreligger røntgenologisk som regel en lytisk solitær destruksjon av ben. Enkelte pasienter kan ha monoklonal gammopati ved serumprotein elektroforese. Behandlingen består av strålebehandling, 2 Gy x 20 (Barzenje, Kolstad, Ghanima, & Holte, 2018). For detaljer rundt utforming av strålefelt, se eget avsnitt under stråleterapi, vedlegg 5. Behandlingsmålet er kurativt. Prognosen er relativt god, men over halvparten av pasientene utvikler generalisert sykdom (myelomatose). Plasmocytomer > 5 cm vurderes gitt 2 Gy x 25 (Soutar et al., 2004), eller kombinasjon av kjemoterapi og strålebehandling (Ozsahin et al., 2006).
Anbefaling:
Lokal strålebehandling 2 Gy x 20.
Evidensnivå B
Ekstraossøst plasmocytom
Diagnosen stilles ved histologisk undersøkelse av et ekstraossøs neoplasme og utgjør 3–5 % av plasmacelleneoplasiene. 80 % foreligger i øvre respirasjonstraktus. Behandlingen består av strålebehandling, 2 Gy x 20 (Barzenje et al., 2018). For detaljer rundt utforming av strålefelt, se eget avsnitt under stråleterapi, vedlegg 5. Avstand fra makrotumor til feltgrenser følger samme prinsipper som omtalt under for follikulære lymfomer. Eksisjonskirurgi kan være et behandlingsvalg, enten alene eller i kombinasjon med strålebehandling. Noen av pasientene kan ha monoklonal gammopati.
Anbefaling:
Lokal strålebehandling 2 Gy x 20.
Evidensnivå B
Marginalsone B-celle lymfom
Ekstranodalt marginalsone B-celle lymfom (MALT)
Spesielle ekstranodale lokalisasjoner som MALT lymfom i ventrikkel og orbita er omtalt i egne avsnitt (kapittel CNS profylakse og behandling ved systemisk CNS affeksjon). Ekstranodalt marginalsone B-celle lymfom (MALT lymfom) utgår fra slimhinner, hud, orbita eller kjertelvev (for eksempel lunge, mamma, thyroidea og GI traktus) og har bedre prognose enn de øvrige indolente lymfomene (Barzenje et al., 2017; Bertoni & Zucca, 2005; Cavalli, Isaacson, Gascoyne, & Zucca, 2001). Ved begrenset sykdom gis strålebehandling, 2 Gy x 12 med kurativt siktemål. Retningslinjer for stråleterapi følger de samme prinsipper som beskrevet for follikulært lymfom begrenset sykdom. Ved utbredt sykdom (sjelden) vil klorambucil – rituximab eller rituximab monoterapi være førstevalg (Zucca et al., 2013). I sjeldne tilfeller med mer aggressivt forløp kan man vurdere å kombinere C(H)OP og rituximab eller bendamustin og rituximab.
Anbefaling ved lokalisert sykdom (stadium Pe I-II):
Strålebehandling 2 Gy x 12.
For MALT-lymfomer i ventrikkel og orbita, se kapittel CNS profylakse og behandling ved systemisk CNS affeksjon.
Evidensnivå B
Anbefaling ved avansert sykdom:
Vurder behandlingsindikasjon og prognose. «Watch and wait». Ved behandlingstrengende sykdom kan man gi klorambucil-rituximab, rituximab monoterapi, R‑C(H)OP‑eller R-Bendamustin.
Evidensnivå B
Splenisk marginalsone B-celle lymfom
Splenisk marginalsone B-celle lymfom har regelmessig miltaffeksjon, ofte benmargs-affeksjon, men sjeldnere affeksjon av perifere lymfeknuter. Sykdommen kan være dominert av anemi forårsaket av autoimmunitet, splenomegali og/eller margfortrengning (Thieblemont & Coiffier, 2006). Behandlingsmålet er livsforlengende palliasjon. Pasientene lever lenge med sykdommen. Splenektomi vil oftest være indisert som første behandlingsvalg og har regelmessig god terapeutisk effekt samt bedrer en evt. hemolytisk tilstand. Der splenektomi ikke er ønskelig vil rituximab monoterapi kunne være et godt alternativ. Effekten av kjemoterapi er dårligere enn for KLL/lymfocytært lymfom, mens effekten av rituximab er god, gitt alene eller i kombinasjon med kjemoterapi (retrospektiv studie) (Bennett et al., 2005; Tsimberidou et al., 2006). Behandlingsprinsippene er de samme som for andre B-cellelymfomer med lav aggressivitet. Dette betyr at man – avhengig av alder, komorbiditet og sykdommens aggressivitet – kan velge rituximab monoterapi, klorambucil, eller C(H)OP og rituximab. Interferon-a2b har vært vist å kunne gi gode responser hos denne gruppen av lymfompasienter som samtidig er hepatitt C positive. Bendamustin og rituximab er et nytt regime som har vært vist å være effektivt.
Anbefaling ved lokalisert sykdom:
Splenektomi eller rituximab monoterapi.
Evidensnivå B
Anbefaling ved avansert sykdom:
«Watch and wait» ved lite symptomer. Ved behandlingsindikasjon vil fortsatt splenektomi kunne være nyttig. Alternativt kan man velge klorambucil-rituximab eller rituximab monoterapi eller ved mer avansert sykdom CHOP eller bendamustin i kombinasjon med rituximab.
Evidensnivå C
Nodalt marginalsone B-celle lymfom
Nodalt marginalsone B-celle lymfom affiserer lymfeknuter og i enkelte tilfeller benmarg og blod. Behandlingen er som for andre indolente lymfomer (se over), men respons på kjemoterapi kan være dårlig.
Anbefaling ved lokalisert sykdom (stadium I-II):
Strålebehandling 2 Gy x 12.
Evidensnivå C
Anbefaling ved avansert sykdom:
Vurder behandlingsindikasjon og prognose. Watch and wait. Ved behandlingstrengende sykdom kan man gi klorambucil-rituximab eller rituximab monoterapi eller C(H)OP-R eller Bendamustin-R.
Evidensnivå C
Follikulært lymfom grad 1, 2 og 3A
Follikulære lymfomer grad 1, 2 og 3A regnes som lite aggressive lymfomer og utgjør opp mot 60 % av de indolente lymfomer og ca. 20 % av alle NHL. Mye tyder på at også Follikulært lymfom grad 3A tilhører den samme gruppen indolente lymfomer. Cytogenetiske forandringer ses i de fleste tilfeller. Den vanligste er t(14;18)(q32;q21) translokasjonen som fører til rearrangering av BCL2 genet og en overekspresjon av Bcl-2-proteinet (anti-apoptotisk effekt). Cellene er som regel positive for immunglobulin-, CD10 og B-celle markører (CD19, CD20, CD22 og CD79a). Sykdommen affiserer typisk både perifere og sentrale (mediastinale og abdominale) lymfeknuter og hos 40 % benmarg. Mindre enn 1/3 av pasientene er i stadium I eller II ved diagnosetidspunkt. Som regel er det biopsi av forstørrete lymfeknuter som leder til diagnosen. Pasientene er ofte symptomfrie. Et mindretall av pasientene har B-symptomer. Prognosen er meget god med median levetid over 20 år fra diagnosetidspunkt.
Lokalisert sykdom
Behandlingen er lokal stråleterapi med kurativ intensjon, 2 Gy x 12 mot «involved site» som omfatter makrotumor (GTV) med 2–3 cm margin (ICV) i kraniokaudal retning. Feltgrensen blir da 3–4 cm fra GTV. I transversalplanet bør margin fra GTV til CTV være 1–2 cm og til feltgrense 2–3 cm. Det er vanlig å inkludere hele den affiserte glandelstasjon i transversalplanet innenfor CTV. Residiv innenfor det strålebehandlete området ses svært sjelden, men knapt halvparten av pasientene vil få residiv utenfor strålefeltet, og systemisk behandling er da aktuelt når de blir behandlingstrengende (Mauch, 2001). Vi anbefaler bruk av PET i denne situasjonen for å sikre at det faktisk er lokalisert sykdom.
Anbefaling ved lokalisert sykdom:
Strålebehandling 2 Gy x 12.
Evidensnivå B
Utbredt sykdom – primærbehandling
Som for alle indolente lymfomer er fortsatt «watch and wait» et godt alternativ hos de pasientene som har lite symptomgivende sykdom og lav tumorbyrde. Dette er imidlertid utfordret i en randomisert studie som viser bedret livskvalitet og progresjonsfri overlevelse ved rituximab monoterapi sammenliknet med observasjon (Ardeshna et al., 2014). Dette tilsier likevel ikke at alle skal starte med behandling; det er ingen gevinsti totaloverlevelse. Det er mye som tyder på at en differensiert strategi, der man forsøker å tilpasse opplegget etter pasientens alder, tumorutbredelse og andre faktorer, kan være en god tilnærming. . Stadig oftere refereres det til de franske GELF-kriterier som beslutningsgrunnlag for oppstart behandling (Brice et al., 1997). FLIPI-score (se kapittel om overlevelse og prognostiske faktorer) gjør det mulig å gruppere pasientene i tre kategorier (lav, intermediær og høy risk) med forskjellig prognose. Rituximab monoterapi anses av mange å være førstelinjebehandling, der det ikke foreligger krav til rask respons (Kimby et al., 2015; Martinelli et al., 2010). Flertallet av pasientene vil kunne oppnå en langvarig remisjon med dette alene. Dette gjelder særlig der det å bevare fertilitet er viktig, eller der toksisitet av kjemoterapi er et forventet problem eller uønsket av pasientene.
Et nytt tilgjengelig alternativ er rituximab kombinert med lenalidomid. Dette har i en randomisert fase III studie (AUGMENT) vist forbedret progresjonsfri overlevelse sammenliknet med rituximab + placebo (39 mnd vs 14 mnd) i residivsituasjonen, og kombinasjonen er godkjent av Beslutningsforum på denne indikasjonenen (Leonard et al., 2019). Det foreligger også data fra første linje-studier (RELEVANCE) som viser at rituximab-lenalidomid er omtrent like effektivt som kjemoteapi og mindre toksisk (Morschhauser et al., 2018). Vi har også erfaring fra en nordisk studie i første linje, der vi finner median progresjonsfri overlevelse på 5 år for kombinasjonen sml mot 2,3 år med rituximab alene (Zucca et al., 2019).
Klorambucil, evt. i kombinasjon med rituximab, forsvarer fortsatt en plass hos eldre, der toksisitet av mer intensiv terapi forventes å bli et problem. Hos yngre, og særlig de med mer aggressiv sykdom vil CHOP kombinert med rituximab forventes å gi en raskere respons og flere komplette remisjoner (Czuczman et al., 1999; Hiddemann et al., 2005). Mange vil hevde at dette er standardbehandling i dag, men dette er omdiskutert og praksis varierer. Det er ikke dokumentert at regimet gir bedre totaloverlevelse, men anses for å være mer egnet i situasjoner der tumormasser truer organfunksjoner (eks nyrer). Bendamustin-R kan være et alternativ til CHOP-R (Rummel et al., 2013). En nylig publisert randomisert studie sammen lignet obinutuzumab (O) og rituximab i kombinasjon med kjemoterapi etterfulgt av O vedlikeholdsbehandling i 2 år (Marcus et al., 2017). Progresjonsfri overlevelse var signifikant bedre i obinutuzumab-armen, men det var også mer toksistet. Obinutuzumab sammen med kjemoterapi er nå godkjent av Beslutningsforum som første linje behandling ved follikulært lymfom. Dette vil være et alternativ til R-Bendamustin og R-C(H)OP der man må vurdere effekt, toksistet og kostnader opp mot hverandre. Det kan være nyttig å spare obinutuzumab til residivsituasjonen og dette anbefales.
Anbefaling ved utbredt sykdom – primærbehandling:
Vurder behandlingsindikasjon og prognose. «Watch and wait» ved lite/ingen symptomer. Både behandlingsindikasjon og terapivalg kan variere, og man må vurdere alder, klinikk og evt senere behandlingsmuligheter før man starter. Henvisning til pågående kliniske studier bør overveies.
Rituximab monoterapi. Brukt i første linje er både responsrater og varighet gode og det er godt tolerert.
Evidensnivå B
6 kurer R-CHOP eller R-CVP ved aggressivt bilde der det er behov for rask repons. Alternativt R-Bendamustin, spesielt for eldre pasienter med komorbiditet som hjertesykdom
Evidensnivå A
Lenalidomid 20 mg daglig dag 1-21 og så en ukes pause. Inntil 12 sykluser på 28 dager kombinert med Rituximab dag 1, 8, 15 og 22 i syklus 1, og dag 1 i syklus 2-5 (8 doser)
Evidensnivå A
Klorambucil tabletter 15 mg/m2 i 5 dager gis hver fjerde uke, totalt 4–6 kurer eller til pasienten er i en god partiell eller komplett remisjon. Kontinuerlig behandling er et godt alternativ til de eldre (4–6 mg / m2 / dag).
Kan med fordel kombineres med rituximab hver 3.–4. uke.
Rituximab vedlikeholdsbehandling etter 1. linje induksjonsbehandling
En prospektiv randomisert studie publisert i 2011 (Salles et al., 2011) viste bedre progresjonsfri overlevelse med rituximab vedlikeholdsbehandling i 2 år. Tilsvarende er vist med Obinutuzumab vedlikehold i en nylig publisert studie (Marcus et al., 2017), men denne indikasjonen er ikke søkt til metodevurdering. Ettersom det ikke foreligger dokumentasjon for forlenget totaloverlevelse, anbefales ikke vedlikeholdbehandling som standardbehandling til alle pasienter i 1. remisjon, men kan gis der det er viktig å utsette (ytterligere) kjemoterapi så lenge som mulig, for eksempel hos fertile kvinner med barneønske og hos pasienter med ko-morbiditet der kjemoterapi innebærer en spesiell helserisiko (for eksempel ulike former for organsvikt). En nylig publisert studie viser imidlertid at re-behandling ved residiv gir like gode resultater som vedlikeholdsbehandling (Kahl et al., 2014).
Anbefaling:
Rituximab vedlikeholdsbehandling hver 2. mnd i 2 år kan vurderes for utvalgte pasienter der det anses som viktig å forlenge remisjonen.
Evidensnivå A
Utbredt sykdom – senere behandling
Det vil også i residivsituasjonen være mange behandlingsmuligheter, og man bør tidlig vurdere om pasienten kan være kandidat for pågående kliniske studier. Dersom pasienten primært har fått Rituximab monoterapi og har hatt god og langvarig effekt av dette, vil det kunne være nyttig å forsøke rebehandling med samme opplegg, evt supplert med rituximab vedlikehold. Ved mer usikker eller kortvarig respons vil man heller velge en type kombinasjonsbehandling. Ved andre og senere residiv bør man vurdere om pasienten er rituximab-refraktær (dårlig eller kortvarig respons < 6 mnd på siste behandling). Dette vil få konsekvenser for terapivalg. Obinutuzumab i kombinasjon med Bendamustin har vist god og lang respons(Sehn et al., 2016) hos rituximab-refraktære pasienter. Det ble gitt obinutuzumab vedlikeholdsbehandling i den eksperimentelle armen mens kontrollarmen ikke fikk vedlikehold. Det var altså en viss ubalanse i studien. Men O-Bendamustin etter fulgt av vedlikehold obinutuzumab er godkjent av Beslutningsforum for rituximab-refraktære pasienter med residiv av follikulært lymfom. Oppfølginsdata har vist overlevelsesgevinst av kombinasjonen og anbefaleshos rituximab-refraktære pasienter (Cheson et al., 2018). For pasienter med god effekt av R-kjemoterapi i første linje vil det være naturlig å rebehandle også med R-kjemoterapi. Effekt av R-Bendamustin er sammenlignbar med R-CHOP og med mindre akutt benmargstoksisitet. Man må dog være oppmerksom på lymfopeni-assosierte opportunistiske infeksjoner over noen måneder. Vedlikeholdsbehandling med rituximab hver 3. mnd i 2 år har vist signifikant bedre progresjonsfri overlevelse etter 2. linje kjemoterapi for follikulært lymfom (van Oers et al., 2006).
Som beskrevet i tidligere avsnitt om primærbehandling, er rituximab kombinert med lenalidomid et godt alternativ til kjemoterapi. Dette har vist forbedret progresjonsfri overlevelse i residivsituasjonen sammenliknet med rituximab + placebo (39 mnd vs 14 mnd), og kombinasjonen er godkjent av Beslutningsforum.
Rituximab vedlikeholdbehandlng for pasienter som er i remisjon forlenger residivfri overlevelse (Martinelli et al., 2010). Det foreligger også en studie der man finner bedring i både residvfri overlevelse og total overlevelse med vedlikeholdbehandling med rituximab hver 3. mnd i 2 år etter behandling med enten CHOP eller R-CHOP (van Oers et al., 2006; van Oers et al., 2010). Dette gjelder pasienter med residiv og støttes av en metaanalyse (Vidal et al., 2011).
Flere studier har vist at residiv av Folikulært NHL innen 24 månder (POD24) etter kjemoimmunterapi (eller Rituximab) er en robust markør for dårlig prognose og behandlingen bør vurderes diskutert med universitetssykehus(Casulo & Barr, 2019)
Anbefaling for pasienter med god respons på 1. linje:
Hvis det ble gitt rituximab monoterapi primært, kan man vurdere å gjenta dette.
Hvis det ble gitt R-kjemoterapi primært, kan man skifte og gi en annen kombinasjon med 6 kurer R-CHOP eller R-Bendamustin etter fulgt av vedlikehold rituximab i 2 år.
Evidensnivå A
Anbefaling for rituximab-refraktære pasienter:
6 kurer O-Bendamustin eller O-CHOP etter fulgt av vedlikehold med obinutuzumab i 2 år.
Evidensnivå A
Zevalin radioimmunterapi
90Y-ibritumomab-tiuxetan (Zevalin®) har i en rekke studier vist seg å ha god effekt ved follikulære lymfomer. Hele behandlingen fullføres på en uke og kan gjennomføres poliklinisk. Hovedproblemet er benmargssuppresjon med særlig trombocytopeni som inntrer etter 4–8 uker. Erfaringsmessig er responsene relativt kortvarige og behandlingen har vært lite brukt de siste årene. Behandlingen er godkjent for pasienter med residiv etter eller manglende respons på Rituximab.
Evidensnivå B
Idelalisib
Idelalisib (Zydelig®) er en PI3Kδ inhibitor som har visthøy responsrate hos pasienter med tilbakefall av indolente B celle lymfomer, inkludert follikulære (Gopal et al., 2014). Medikamentet kan gi neutropeni og forskjellige opportunistiske infeksjoner. Det er også rapportert om autoimmun diare/colitt og pneumonitt, slik at pasientene må informeres godt og følges tett. Beslutningsforum har godkjent idelalisib ved tilbakefall etter minst to tidligere systemiske behandlinger.
Evidensnivå C
Høydosebehandling med autolog stamcellestøtte (HMAS)
HMAS har en etablert indikasjon ved residiv av follikulære lymfomer, bl.a. basert på resultater fra en europeisk fase III studie som viser gevinst på total overlevelse sammenlignet med CHOP alene (Schouten et al., 2003). Pasienter under 65–70 år i god allmenntilstand kan være aktuelle kandidater for denne behandlingen, men fortrinnsvis ved 2. eller senere residiv.
Evidensnivå A
HMAS ved transformasjon av indolente lymfomer
Transformasjon fra indolent lymfom til mer aggressiv histologi er en ikke uvanlig hendelse og medfører gjerne forverret prognose. Dersom pasienten aldri har fått anthracykliner, vil mange anbefale å forsøke konvensjonell behandling primært (R-CHOP). Ved residiv med transformasjon etter tidligere kjemoterpi vil HMAS være aktuelt, særlig hos yngre pasienter. På bakgrunn av fase II studier anbefaler Norsk Lymfomgruppe at HMAS blir brukt hos utvalgte pasienter ved residiv av transformert lymfom (Blaker et al., 2014; Eide et al., 2011). Behandling med med kimære antigen reseptor T-celler (CAR-T) er nylig godkjent for pasienter med transfomert follikulært lymfom i 3. linje (se eget kapittel om CAR-T)
Evidensnivå B
Allogen stamcelle transplantasjon med redusert kondisjonering
Dette er en behandlingsform som vinner terreng internasjonalt. Lovende nasjonale resultater foreligger spesielt for indolente lymfomer (Fløisand et al., 2012). Behandlingen er beheftet med en rekke alvorlige bivirkninger, men har et kurativt siktemål. Utvalgte pasienter kan vurderes for denne behandlingen, og det sendes søknad til Nasjonal gruppe for allogen stamcelletransplantasjon med kopi til lymfomgruppen ved Radiumhospitalet.
Palliativ strålebehandling
Dette kan være et godt behandlingsalternativ ved tumormasser som truer organfunksjoner (obstruksjon av bronkialtre, ureteres, medullakompresjon) eller som gir smerter. Det er viktig å vurdere stråleterapi også hos pasienter med utbredt, kjemoresistent sykdom. Effekter kan oppnås selv med langt lavere doser enn det som vanligvis benyttes ved follikulære lymfomer (24 Gy). Det foreligger dokumentasjon for at lav-dose stråleterapi (2 Gy x 2) gir utmerket lokal kontroll (Haas et al., 2003) ved follikulære lymfomer. God effekt kan også forventes ved andre former for indolente lymfomer og selv ved mer aggressive lymfomer som mantelcelle lymfom og diffust storcellet B-celle lymfom (Haas et al., 2005).
Evidensnivå B
Utprøvende behandling
Utprøvende behandling ved residiv
INCMOR0280: Randomisert industrisponset fase III studie for pasienter med residiv av follikulært lymfom eller marginalsonelymfom: Rituximab-lenalidomid +/- tafasitamab
MERLIN-studien: Akademisk studie (NLG) for pasienter med primært refraktært eller tidlig residiv av follikulært lymfom innen 24mnd. Pasientene behandles med mosunetuzumab, et bispesifikt antistoff mot CD3 og CD20 i inntil 17 sykler (et år)
Moden B-celle lymfom – aggressive
Mantelcellelymfomer
Mantelcellelymfomer (MCL) er en distinkt type av NHL som karakteriseres histologisk av diffus eller vagt knutet vekst som utgjøres av relativt små centrocyttliknende celler. Viktige undergrupper består av større eller blastiske celler, og er kalt henholdsvis polymorf eller blastoid variant av mantelcellelymfom. Ved siden av morfologi stilles diagnosen ved immunhistokjemi (CD5+, CD23-, Cyclin D1+) og karyotypi t(11;14)(q13;q32) (PRAD1-gen involvert / Cyclin D1). Median alder ved sykdomsdebut er relativt høy (63 år) og tre av fire pasienter er menn. Denne subgruppen utgjør bare 6 % av alle NHL. Sykdommen er som regel utbredt med hyppig affeksjon av benmarg, milt og GI – traktus (Weisenburger & Armitage, 1996). Median overlevelse ved tradisjonell CHOP-basert terapi var vel 3 år, med 20–30 % i live etter 5 år. Det finnes også en leukemisk ikke-nodal variant av MCL som kan ha et fredelig forløp og der observasjon eller mindre intensiv behandling kan være å anbefale. Nye regimer er nå i bruk og har bedret prognosen for pasienter med MCL betraktelig.
Behandling
Klorambucil eller CHOP kjemoterapi har lenge vært standardbehandling, og målet har vært livsforlengende palliasjon, ikke kurasjon. Det er vist at man bedrer behandlingseffekten ved å legge rituximab til forskjellige regimer ved MCL (Lenz et al., 2005). En stor forbedring har vært oppnådd de senere år vist ved resultater fra fase II studier i regi av Nordisk Lymfomgruppe og en fase III studie i regi av Europeisk MCL nettverk der man kombinerer R-CHOP og R-Ara-C som induksjonsbehandling og deretter konsoliderer med HMAS (Geisler et al., 2008; Hermine et al., 2016; Kolstad et al., 2014). En nylig publisert randomisert studie viste forlenget PFS og OS hos pasienter som fikk vedlikeholdsbehandling med rituximab hver 2. mnd i 3 år etter HMAS der kontrollgruppen kun ble observert uten videre terapi (Le Gouill et al., 2017). Eldre pasienter som ikke er kandidater for HMAS har de senere år vært behandlet med R-CHOP, evt alternerende med R-Ara-C ved god allmenntilstand. En randomisert studie har vist at R-Bendamustin er minst like effektivt i første linje som CHOP-R og med færre bivirkninger (Rummel et al., 2013). En randomisert studie for pasienter > 65 år i regi av Europeiske MCL dokumenterte at rituximab vedlikehold gir bedre total overlevelse etter indusjonsbehandling med R-CHOP (Kluin-Nelemans et al., 2012). Vedlikeholdsbehandling med rituximab etter R-Bendamustin er ikke tilsvarende godt dokumentert. MCL-pasienter i stadium I-II kan behandles med 3 kurer R-CHOP etterfulgt av stråleterapi til 30 Gy med kurativt siktemål. Her en det viktig med en nitid utredning med PET/CT og evt skopier for å utelukke at sykdommen er mer utbredt.
Anbefaling:
Pasienter i stadium I/II behandles med 3 kurer R-CHOP etterfulgt av stråleterapi til 30 Gy.
Evidensnivå C
Pasienter med utbredt sykdom < 65–70 år behandles med alternerende R-maxi CHOP og R‑Ara-C etterfulgt av HMAS. Deretter vedlikeholdbehandling med rituximab hver 2. mnd i 3 år.
Evidensnivå A
Eldre pasienter behandles med CHOP-rituximab, Bendamustin-rituximab, evt. alternerende CHOP og høydose cytarabin og med tillegg av rituximab. Vedlikehold rituximab hver 2. mnd inntil progresjon.
Evidensnivå A
Utprøvende behandling
Altamira er en en-armet studie for pasienter >60år og som ikke er kandidater for HMAS i første remisjon. Behandlingen tester ut BTK hemmeren Acalabrutininb i kombinasjon med Rituximab. Med unntak av pasienter med blastoid variant eller TP53 mutasjon vil behandlingslengde styres av minimal residual disease (MRD) i blod og/eller benmarg. Acalabruinib vil gis i minimum 1 år og maksimalt 3 år. For de med blastoid variant eller TP53 mutasjon, gis Acalabrutinib i 3 år. Rituximab gis som vedllikeholdsbehandling hver 2. mnd. i totalt 3 år for begge grupper.
Behandling ved residiv
Ved residiv vil behandlingsmålet som regel være livsforlengende palliasjon. Aktuelle regimer er Fludarabin, cylofosfamid med rituximab (FCR), R-bendamustin og R-trofosfamid. Pasienter som er yngre enn 65–70 år og i uten vesentlig ko-morbiditet kan imidlertid henvises til allogen stamcelle transplantasjon med redusert kondisjonering ved Oslo Universitetssykehus. Ibrutinib (Imbruvica®) er en btk-inhibitor som på basis av en fase II studie (Wang et al., 2013) ved residiv av mantelcelle lymfom er godkjent av FDA for denne indikasjonen. Det ble oppnådd høye responsrater (68 %) og lang responsvarighet (17 mnd) med liten grad av toksisitet. Behandlingen er enda mere effektiv om man kombinerer med rituximab (Wang et al., 2016). En randomisert studie har dokumentert at ibrutinib er mere effektivt enn temsirolimus ved tilbakefall av MCL (Dreyling et al., 2016). Norsk Lymfomgruppe mener at ibrutinib er et meget effektivt og godt tolerert medikament som er godt egnet for en liten populasjon av pasienter med svært dårlig prognose og få behandlingstilbud. Behandlingen kan ha et kurativt siktemål når det benyttes som bro til allogen stamcelletransplantasjon for yngre pasienter. Etter vurdering i Nasjonalt system for vurdering av nye metoder i spesialisthelsetjenesten har imidlertid Beslutningsforum bestemt at denne behandlingen ikke kan tilbys pasienter med tilbakefall av MCL i Norge, ulikt situasjonen i USA og de fleste vestlige land.
Anbefaling:
R-Bendamustin, R-trofosfamid og ibrutinib er aktuelle alternativer. Ibrutinib er avslått av Beslutningsforum og betales ikke av det offentlige helsevesen. Allogen stamcelletransplantasjon kan vurderes hos utvalgte yngre pasienter. Ibrutinib ville være meget godt egnet som bro til transplantasjon.
Evidensnivå B
Diffust storcellet B-celle lymfom (DLBCL) og Follikulært lymfom grad 3B
DLBCL omfatter etter WHO klassifikasjonen flere subtyper og utgjør ca. 35 % av alle NHL og ca 50 % for pasienter over 70 år. Median alder ved diagnose er ca 70 år. Morfologisk foreligger store blastliknende celler med oftest tydelige nukleoli og mer eller mindre diffus vekst. Gruppen er heterogen mht karyotypiske avvik. Hyppigst foreligger t(3;14)(q27;q32) (BCL6-gen involvert), t(8;14)(q24;q32) (MYC gen involvert) og t(14;18)(q21;q32) (BCL2-gen involvert). Det siste indikerer follikelcenter-celleopprinnelse og medfører bedre prognose. Basert på genekspresjons-analyser (microarray) har man kunnet dele inn DLBCL i tre undergrupper, henholdsvis germinalcentercelle derivert DLBCL, aktivert B-celle lik DLBCL og en siste gruppe som ikke tilhører noen av de andre to. De fleste primært mediastinale går inn i den siste gruppen. Prognosen er forskjellig for de tre gruppene, dårligst prognose har aktivert B-DLBCL. Median alder ved sykdomsdebut er høy (ca 70 år), og like mange menn og kvinner får sykdommen. Pasientene er ofte alvorlig syke med rask sykdomsprogresjon, stor tumorutbredelse og allmennsymptomer. Ubehandlet har de en levetid på høyst noen måneder. Sykehistorien er som regel kort. 60 % har primært lymfeknuteaffeksjon, 40 % primært ekstranodal affeksjon. Relativ 5 –års overlevelse, oftest synonymt med kurasjon er aldersavhengig, 80% for pasienter under 65 år, 55% for pasienter over 65 år. Denne sykdomsgruppen krever rask behandling ved sykehus som har spesiell kompetanse på dette feltet. Hvis ikke primærbehandlingen lykkes, lever få pasienter mer enn 1–2 år tross standard andrelinje kjemoterapi. Pasientene starter så fort som mulig kombinasjons-kjemoterapi uten dosereduksjon etter adekvat utredning. CHOP regimet har i kontrollerte kliniske studier vist seg like effektivt og gir mindre bivirkninger enn regimer som inkluderer flere cytostatika (Fisher et al., 1993; Jerkeman et al., 1999). En stor tysk studie, publisert som to artikler viser imidlertid at pasienter under 60 år med normal LDH har høyere responsrater og bedre sykdomsfri overlevelse dersom etoposid legges til CHOP kjemoterapi (CHOEP21) (Pfreundschuh, Trumper, Kloess, Schmits, Feller, Rudolph, et al., 2004). Pasienter med forhøyet LDH ble ikke inkludert i denne studien. Videre viser den samme studien at for pasienter over 60 år er det signifikant bedre responsrater og overlevelse ved å gi CHOP-kurene hver 14. dag (CHOP-14) med vekstfaktorstøtte (G-CSF) Forskjellene var mest utslagsgivende for pasienter med forhøyet LDH, men gjeldende også for hele pasientgruppen (Pfreundschuh, Trumper, Kloess, Schmits, Feller, Rube, et al., 2004). Flere studier har vist overbevisende gevinst ved å legge rituximab til CHOP-analoge regimer (Coiffier et al., 2002; Pfreundschuh et al., 2008; Pfreundschuh et al., 2006). Det er ikke vist at CHOP14 + rituximab (CHOP14-R) gir bedre resultater enn CHOP21-R, men når CHOP-R gis med 14 dagers intervall, gir 6 kurer (med tillegg av to rituximabkurer) bedre overlevelse enn 8 kurer. Selv om studien er utført på eldre pasienter og med CHOP gitt hver 14. dag, kan vi ikke se noen grunn til ikke å anvende disse resultatene også for CHOP21 og for pasienter under 60 år.
Nytteverdien av doseintensivert behandling med CHOEP14-R støttes av en retrospektiv studie fra Danmark (Gang et al., 2012) og en tilsvarende fra Sverige (Wasterlid, Hartman, Szekely, & Jerkeman, 2017). Studier på bruk av høydose-behandling med autolog stamcellestøtte i første remisjon viser sprikende resultater og er ikke tatt i bruk i primærbehandlingen i Norge.
Mediastinalt (thymisk) storcellet B-cellelymfom
Mediastinalt (thymisk) storcellet B-cellelymfom er en subentitet av DLBCL som opptrer i mediastinum og har distinkte kliniske, immunfenotypiske og genotypiske trekk. Det kliniske bildet kan være aggressivt med tendens til vena cava superior syndrom og trombosering av store vener i mediastinum, på hals og i overekstremiteter. Behandlingen er som for DLBCL for øvrig, men med CHOP14-R med G-CSF støtte, gjerne med tillegg av etoposid for pasienter under 60 år (CHOEP14-R) (Martelli, Ferreri, & Johnson, 2008).
På grunnlag av resultater fra en rekke randomiserte studier (se over) konkluderer Norsk lymfomgruppe med at alle pasienter med aggressive B-celle lymfomer bør få rituximab kombinert med kjemoterapi som ledd i primærbehandlingen (Coiffier, 2006).
Standardbehandling for pasienter 18–65 år
Ved lokalisert sykdom (stadium I og stadium II1 (med to nabolymfeknute-stasjoner) sidestilles immunokjemoterapi med og uten strålebehandling. Med strålebehandling: Det gis 3–6 CHOP21-R etterfulgt av lokal strålebehandling (30 Gy ved CR eller PET negativ resttumor, ellers 36–40 Gy). Det gis 6 kurer ved stadium I bulky sykdom og / eller forhøyet LDH og ved stadium II1, ellers 3 kurer. Ved forhøyet LDH, som tegn på høy proliferasjonsrate i tumor, kan man benytte CHOP14-R. Uten strålebehandling: Det foreligger resultater fra FLYER-studien der pasienter <60 år i stadium I/IIA og IPI score på 0 ble randomisert mellom 6 kurer R-CHOP21 og 4 kurer R-CHOP21 + 2 kurer rituximab(Poeschel et al., 2020). Resultatene var gode og det var ingen forskjell i PFS eller OS mellom armene. Fire R-CHOP + 2 R kan benyttes som et alternativ for pasienter der bestråling ville medføre morbiditet (eks mot munnhule) eller uønskede doser mot risikoorganer (eks nyrer, hjerte, CNS). Vi velger å ekstrapolere dette til også å gjelde pasienter > 60 år. Ved stråleterapi defineres CTV som opprinnelig tumorvolum (GTV) med 2 cm margini kraniokaudal retning. I transversalplanet defineres margin fra GTV til CTV som 1 cm . Hele lymfeknutestasjonen inkluderes i transversalplanet.
Ved utbredt sykdom (stadium II2-IV), aldersjustert IPI 0–1 (se kapittel om Overlevelse og prognostiske faktorer) anbefales nå CHOP-21 R, 6 kurer etterfulgt av to rituximab-kurer (Pfreundschuh et al., 2008). Utvalgte pasienter med antatt dårlig prognose (aaIPI 2–3 eller IPI 3–5) kan få en mer intensiv behandling i form av CHOEP-21 R, CHOP-14 R eller CHOEP-14 R. Kur hver 14. dag anbefales særlig der LDH er forhøyet, som tegn på høy proliferasjonsrate i tumor. CHOEP-R kurer vurderes spesielt til yngre pasienter med aaIPI 2–3. En nordisk fase II studie (CRY-04) er publisert (Holte et al., 2013) og viste god overlevelse med få CNS residiver. Pasientene fikk 6 kurer CHOEP-14-R etterfulgt av systemisk høydose metotreksat og cytarabin som CNS-profylakse. I en oppfølgende nordisk fase II studie (CHIC-studien) med avsluttet inklusjon ultimo 2014 ble det gitt systemisk behandling med høydose metotreksat fra behandlingsstart samt tre kurer med liposomalt cytarabin intraspinalt med 4 ukers intervall som CNS profylakse. Se for øvrig eget kapittel CNS profylakse og behandling ved systemisk CNS affeksjon. Man har i den senere tid blitt oppmerksom på at høy doseintensitet (både av kjemoterapi og steroider) øker risiko for pneumocystis jirovecii (Gisselbrecht et al., 2010) infeksjon, og man anbefaler nå trimetoprim-sulfa profylakse til alle som får kurer hver 14. dag. CNS-profylakse gis til utvalgte pasienter med høy risiko (se eget avsnitt). Hvis PR ikke oppnås etter 3 kurer, er det indisert å skifte til annen-linjeregime (R-DHAP, R-IME) og vurdere om pasienten er aktuell for høydosebehandling med autolog stamcellestøtte.
Pasienter med translokasjon av MYC og BCL2 eller BCL6 genene (double hit) er i flere studier vist å gi dårligere prognose. Det samme gjelder der det er høy proteinekspresjon detektert ved immunhistokjemi (Sesques et al., 2017). Nyere data kan indikere at intensivert behandling her bedrer prognosen (Herrera et al., 2017). Tilstedeværelsen av MYC rearrangering er antagelig det avgjørende mens mange andre faktorer modulerer den biologiske relevansen (Campo, 2015, 2017; Sesques et al., 2017). Norsk Lymfomgruppe anbefaler at pasienter med molekylære pasienter med dobbel-hit karakteristika behandles etter nylig avsluttede nordiske studie (BIOCHIC), får behandling som ved Burkitt lymfom (GMALL-2002) eller dosejustert (DA)EPOCH-R kjemoterapi (eldre).
For å avklare om restoppfylninger representerer vitalt tumorvev eller ikke, anbefales PET/CT ved avsluttet behandling. Om mulig bør en PET-positiv lesjon biopseres. Ved lokalisert PET positiv / biopsi-positiv restsykdom bør lokal strålebehandling (2 Gy x 18–20) vurderes. CTV defineres som rest-tumor med minimum 1 cm margin, men hele glandelstasjonen inkluderes i transversalplanet som beskrevet over. Dersom det påvises vitalt tumorvev, er alternativet til stråleterapi annenlinje kjemoterapi og konsolidering med HMAS.
Anbefalinger:
Stadium I/II1A: CHOP14-R eller CHOP21-R 3–6 kurer, etterfulgt av stråleterapi 30–36Gy. Alternativt CHOP21-R fire kurer etterfulgt av 2 kurer rituximab monoterapi for pasienter med IPI 0.
Evidensnivå A
Pasienter i stadium II2-IV: 6 kurer CHO(E)P14/21-R (for valg, se avsnitt over) – etterfulgt av to kurer rituximab alene for pasienter med aaIPI 2–3 eller IPI 3–5. Husk PJP profylakse til alle unntatt til pasienter som får R-CHOP21-R. Pasienter må vurderes for CNS profylakse.
Evidensnivå A
Pasienter i stadium II2-IV med double hit biologi (se over) behandles i prospektive studier eller etter protokoll for Burkitt lymfom (se lengre ned, i avsnitt om Burkitt lymfom) eller med (DA)R‑EPOCH.
Evidensnivå C
Utprøvende behandling
GCT3013-02: Fase I/fase II industrsiponset fler-armet studie. Bispesifikt antistoff mot CD3 (T-celler) og CD20 (Epcoritamab) gis i kombinasjon med standardbehandling for pasienter over 18 år. En av behandlingsarmene er for pasienter med primært DLBCL, IPI 3-5. Epcoritamab gis i kombinasjon med R-CHOP.
Standardbehandling for eldre pasienter 65–80år
Ved lokalisert sykdom (stadium I og stadium II1) gis 3–6 CHOP21-R etterfulgt av lokal strålebehandling (30 Gy ved CR eller PET negativ resttumor ellers 36–40 Gy). Det gis 6 kurer ved stadium I bulky sykdom og / eller forhøyet LDH og ved stadium II1. Ved forhøyet LDH, som tegn på høy proliferasjonsrate i tumor anbefales CHOP14-R. Ved komplett remisjon etter 3 og 6 kurer kan stråleterapi utelates. En studie kan indikere at det ikke er gevinst ved bruk av strålebehandling etter 4 CHOP-kurer for denne aldersgruppen (Bonnet et al., 2007). Der strålebehandling antas å gi plagsomme bivirkninger, anbefales å utelukke strålebehandling etter 4 kurer, spesielt for pasienter over 70 år. Prinsipper for stråleterapi er som angitt over. For eldre pasienter over 60 år uten andre negative prognostiske tegn etter IPI modellen kan en etter Norsk lymfomgruppes mening overføre resultatene fra Flyer studien, dvs at disse kan behandles med 4 CHO21-R og 2 R alene uten strålebeandling.
Ved utbredt sykdom (stadium II2-IV) gis CHOP21-R for pasienter med normal LDH og CHOP14-R til pasienter med forhøyet LDH. Det anbefales rutinemessig 6 kurer etterfulgt av to kurer med rituximab alene som for pasienter under 65 år.
Mange pasienter i de høyere aldersgrupper har redusert allmenntilstand ved oppstart behandling, noe som ofte fører til lavere toleranse for særlig første kur. Av denne grunn anbefales det ved første kur å inversere CHOP, dvs starte med prednisolon 100 mg daglig i 4 dager sammen med væsketerapi og så administrere cytostatika/rituximab på dag 5.
For pasienter med kompliserende sykdommer (ko-morbiditet) over 65 år er det viktig å vurdere om pasientene er tjent med kurativ kjemoterapi. Denne vurderingen kan være vanskelig og bør i en del tilfelle overlates til spesialavdeling. Dersom lymfomsykdommen er utslagsgivende for den nedsatte allmenntilstand, kan det være riktig å starte behandling med kurativt siktepunkt, men å revidere behandlingsintensiteten tidlig under behandlingen. En fransk studie viser bedre overlevelse ved CHOP kjemoterapi enn COP for pasienter over 69 år, men forskjellen er ikke særlig stor. Eldre pasienter kan ha dårlig toleranse for prednisolon og vinkristin. Dosereduksjoner bør nøye overveies på grunnlag av anamnese og klinisk undersøkelse. Rutinemessig bruk av G-CSF anbefales som støttebehandling ved CHOP-R kjemoterapi i denne aldersgruppen.
For pasienter over 80 år vil fulldosert CHOP-R være vanskelig å gjennomføre. En fransk studie viser gode resultater for denne aldersgruppen ved å gi R-«miniCHOP», med 50 % dosering av cycklofosfamid, vinkristin og doksorubicin, 40 mg/m2 av prednisolon i 5 dager og normaldosert rituximab (Peyrade et al., 2011).
Anbefalinger:
Stadium I/II1A : CHOP14 eller R-CHOP21 3–6 kurer etterfulgt av stråleterapi . Alternativt CHOP21-R fire kurer etterfulgt av 2 kurer rituximab monoterapi for pasienter med IPI 1 (kun alder som tellende faktor, ellers ingen risikofaktorer).
Evidensnivå A
Stadium II2 -IV R-CHOP14 eller R-CHOP21 6 kurersupplert med to kurer rituximab.
Evidensnivå A
Alternative opplegg ved høy alder og komorbiditet. Se over.
Utprøvende behandling
POLAR Bear: Nordisk forskerinitiert randomisert fase III studie der man randomiserer mellom R-miniCHOP og antistoff-legemiddelkonjugatet Polatuzumab Vedotin (Polivy®) sammen med R-miniCHP. Polatuzumab Vedotin er et CD79b-spesigfikt monoklonalt antistoff kovalent bundet til den antimitotiske substansen monometyl auristatin (MMAE). Studien er for pasienter over 80 år og «svekkete» pasienter over 75 år. Alle regionsykehus i Norge deltar, også tre øvrige sentre i Helse Sør Øst.
Behandling ved svikt på førstelinjebehandling og residivbehandling
Høydosebehandling med autolog stamcellestøtte som konsoliderende behandling i andre remisjon bedrer leveutsiktene til et utvalg av pasientene med residiv. Pasienter under 65–70 år med residiv og med tilfredsstillende organfunksjoner vil være kandidater for HMAS som standardbehandling (Philip et al., 1995). Det samme gjelder for pasienter med svikt på førstelinjeregimet. Pasientgruppen bør vurderes ved universitetssykehus ved residiv. Forutsetningen for HMAS er at de oppnår minst partiell remisjon på tre induksjons-kurer. R-IME regimet benyttes her for å unngå ytterligere kardiotoksisitet av antracycliner før høydoseregimet (Mirza et al., 1991). Internasjonalt anbefales platin-holdige regimer som R-DHAP og R-GDP (Crump et al., 2014). Valg av regime bør bestemmes ut fra tidligere cytostatika-belastning, organfunksjoner, annen ko-morbiditet og alder. Hos unge pasienter med hissig sykdomsbilde bør mer intensiv residivbehandling som R-DHAP, R-GDP eller R-IKE-regimet vurderes (Bonnet et al., 2007; Crump et al., 2014; Moskowitz et al., 1999).
Pasienter som har fått immunokjemoterapi for sitt indolente lymfom før transplantasjon, behandles i utgangspunktet som pasienter med residiv / svikt på førstelinjebehandling av DLBCL do novo. Ved lang tid (5 år eller mer fra forrige behandling) og der antracycliner ikke er benyttet primært, kan man vurdere ordinær R-CHOP basert behandling.
Rundt halvparten av pasientene oppnår tilfredsstillende remisjon, og av de som gjennomgår HMAS, er fem års residivfri overlevelse ca. 50 %. Norsk lymfomgruppe anbefaler at man legger til rituximab som en del av residivbehandlingen før HMAS hos pasienter som ikke har fått det før, og der det har gått mer enn 6 mnd. siden fullført førstelinje behandling som har inkludert rituximab.
Pasienter som ikke mobiliserer tilstrekkelig med stamceller for HMASkan vurderes henvist for allogen stamcelle transplantasjon med redusert kondisjonering.
Pasienter som ikke har effekt av 2. linje behandling og ikke kan gjennomgå HMAS av denne grunn og pasienter som residiverer etter HMAS er etter avgjørelse i beslutningsforum aktuelle for behandling med kimære antigen reseptor T-celler (CAR-T) i 3. linje. Det samme kan gjelde for pasienter over 65–70 år som er medisinsk i stand til å tåle slik behandling. I Norge er aksikaptagenciloleucel (Yescarta®) godkjent av Beslutningforum basert på resultater fra Zuma-1 studien, mens tisagenlekleucel (Kymriah®) foreløpig ikke er godkjent for denne indikasjonen (Neelapu et al., 2017; Schuster et al., 2018). Bakgrunnen for godkjenning er Zuma-1 studien. Se eget kapittel nedenfor. Et mindretall av disse pasientene vil kunne oppnå en tilfredsstillende remisjon på konvensjonell immunokjemoterapi i 3. linje og kan da være aktuelle for allogen stamcelletransplantasjon.
For pasienter som ikke anses å kunne gjennomgå HMAS, CAR-T behandling eller allogen stamcelletransplantasjon, er behandlingsmålet som regel livsforlengende palliasjon i 2. og senere linjer. Regimer som kan benyttes er GeMOX, ENAP, trofosfamid, CVP, og IME. Man legger til rituximab hos de som ikke har fått det før, eller der det har gått minst et halvt år siden de responderte på et regime som inneholdt rituximab. Bruk av rituximab monoterapi har sannsynligvis liten hensikt grunnet dårlig effekt og kort varighet av en eventuell respons.Polatuzumab vedotin (Polivy®) i kombinasjon med Rituximab og Bendamustin (Pola-BR) er basert på en randomisert studie nylig godkjent av Beslutningsforum til behandling av pasienter med residiv/progresjon av DLBCL som ikke er kandidater for HMAS (Sehn et al., 2020). Kombinasjonen av Tafasitamab og lenalidomid har også vist lovende resultater for denne pasientgruppen, men behandlingen er ikke godkjent av Beslutningsforum enda (Salles et al., 2020).
Per desember 2022 har man i Norge tilgang til det T-celle-engasjerende bispesifikke antistoffet glofitamab (CD20xCD3) gjennom et compassionate-use-program fra produsenten. Dette kan være en aktuell behandlingsopsjon ved residiv/progresjon av DLBCL, PMBCL og transformerte lavgradige lymfomer. Også er her resultater lovende (Dickinson et al., 2022; Hutchings et al., 2021).
Strålebehandling bør overveies ved truende organfunksjoner og smerter ved lokaliserte lymfommanifestasjoner. Stråleterapi kan gi gode responser og bedret livskvalitet selv hos lymfompasienter med utbredt, kjemoresistent sykdom. Ved kort forventet levetid bør man overveie å redusere stråledose og benytte færre fraksjoner.
Anbefalinger:
Residiv/progresjon hos pasienter < 65–70 år behandles i 2. linje med IME, IKE, GDP eller DHAP og som regel i kombinasjon med rituximab.
Evidensnivå B
Konsolidering med HMAS for de som responderer.
Evidensnivå A
Pasienter med residiv/progresjon som er > 65-70 år eller av andre grunner ikke er kandidater for HMAS kan behandles i 2. linje med regimer som ovenfor eller Polatuzumab vedoton i kombinasjon med bendamustin og rituximab.
Pasienter med residiv/progresjon som < 65-70 år eller vurderes spreke nok til å tolerere behandling med CAR-T celler, vurderes for slik behandling i 3. linje.
Evidensnivå A
Eldre pasienter behandles med palliativt siktemål, behandling tilpasses hver enkelt pasient.
Evidensnivå D
Behandling med anti‑CD19 kimær antigenreseptor T-celler (CAR-T)
Beslutningforum godkjente i oktober 2022 etter flere år med gjentatte vurderinger å innføre CD19-rettet CAR-T-behandling i Norge. Godkjenningen gjelder for aksikabtagenciloleucel (Yescarta®) for behandling av diffust storcellet B-cellelymfom, primært mediastinalt B-cellelymfom og transformert follikulært lymfom i 3. linje. Behandlingen tilbys ved Oslo universitetssykehus (OUS) for hele landet.
Tisagenlekleucel (Kymriah®) er ikke innført for denne indikasjonen i Norge. OUS har tidligere deltatt i utprøvingen av dette CAR-T-produktet.
For detaljer om CAR-T se eget kapittel.
Utprøvende behandling ved residiv
GCT3013-05: Randomisert industrisponset studie for pasienter med residiv av Diffust storcellet B-cellelymfom som ikke er kandidater for HMAS: Bispesifikt antistoff mot CD3 (T-celler) og CD20 (Epcoritamab) som utprøvende behandling versus standardbehandling (R-GemOx).
GCT3013-02: Fase I/fase II industrisponset 5 armet studie. Epcoritamab (se over) gis i kombinasjon med standardbehandling for pasienter over 18 år. To av behandlingsarmene er for pasienter med residiv av DLBCL, hhv for pasienter som er / ikke er kandidater for HMAS.
MK-2140 En fase II industrisponset studie med Zilovertamab vedotin (MK-2140) ved progredierende eller tilbakevendende DLBCL. Studien er åpen i Bergen og Oslo.
Burkitt lymfom
De fleste tilfellene debuterer med en abdominaltumor i ileocoecalovergangen. Benmargsaffeksjon er relativt sjelden og benevnes som Burkitt leukemi når mer enn 25 % av de kjerneholdige cellene i margen er tumorceller. Kromosomtranslokasjon som involverer MYC onkogenet opptrer i 100 % av tilfellene. Da dette er avgjørende for diagnosen, bør man alltid forsøke å få undersøkt tumor mhtMYC-translokasjon (cytogenetisk eller FISH). Immunfenotypiske data viser at tumor er derivert fra germinative sentra (CD10+, BCL6+). Cellebildet er monomorft med blastpregete kjerner. Burkitt er den mest rasktvoksende tumor med nær 100 % Ki67-positive tumorceller. Median alder er ca. 30 år. Varianter av Burkitt lymfom (plasmacytoid differensiering, Burkitt-like) har også MYC translokasjon.
Behandling
Behandlingen følger samme retningslinjer uavhengig av om det foreligger benmargsaffeksjon eller ikke. Moderne behandling som skal styres fra universitetsykehus, har bedret prognosen betydelig. HMAS gitt som konsolidering i første remisjon synes ikke å bedre prognosen når de rette regimer benyttes. Ved oppstart av behandling opptrer regelmessig tumorlyse-syndrom, og profylaktiske forholdsregler må tas (se CNS profylakse og behandling ved systemisk CNS affeksjon). Behandlingsopplegget i Norge har fulgt tyske retningslinjer (BFM-varianter) over år med gode resultater (Smeland et al., 2004). Rituximab inkluderes i behandlingen og man følger GMALL- 2002 protokollen. Denne inneholder alternerende kurer (blokker), delvis redusert for eldre pasienter, med alkylerende cytostika over 5 dager, høydose metotreksat med calciumfolinat-redning, antracycliner, vincaalkaloider, etoposid, høydose cytarabin, steroider og intraspinal kjemoterapi. Resultater nylig publisert viser høy effektivitet for dette regimet (Hoelzer et al., 2014). For de aller eldste pasientene og pasienter med HIV/AIDS er dosejustert DA R-EPOCH et godt alternativ (Wilson et al., 2002). Det samme behandlingsopplegget som ved Burkitt lymfom benyttes ved Burkitt leukemi.
Anbefalinger:
Behandles i henhold til GMALL- 2002 protokollen.
Evidensnivå B
B-celle proliferasjoner med usikkert malignitetspotensiale
Lymfomatoid granulomatose
Dette er en sjelden tilstand som oftest er assosiert med en eller annen form for immundefekt. I de fleste tilfeller av grad 2 og grad 3 sykdom kan monoklonal rearrangering av immunglobulin gener påvises. Tumorcellene er positive for Epstein-Barr virus. Sykdommen karakteriseres klinisk ved noduli, oftest i lunger, men forekommer også i andre ekstranodale organer som hjerne, nyre, lever og hud. Histopatologisk graderes lymfomet fra 1–3. Allmennsymptomer er vanlige. Forløpet er varierende med en median levetid på under 2 år. Sykdom av grad 1og 2 kan svare på prednisolon, interferon; kombinasjonskjemoterapi med rituximab bør benyttes ved grad 3 sykdom.
Anbefalinger:
Prednisolon eller interferon ved grad 1/2, kombinasjonskjemoterapi i kombinasjon med rituximab ved grad 3.
Evidensnivå C
Post-transplantasjonslymfoproliferativ sykdom (PTLD)
Dette er en lymfoid proliferasjon eller et lymfom som utvikles som en konsekvens av immunsuppresjon hos en pasient som er transplantert med et solid organ eller benmarg. Histologien karakteriseres delvis av en proliferasjon av polymorfe B-celler (så som immunoblaster, plasmablaster og plasmaceller), oftest monoklonale og Epstein-Barr virus medierte. PTLD kan også være monomorfe, og skal da klassifiseres som tilsvarende lymfom (Burkitt lymfom, plasmacellemyelom etc.) i WHO-klassifikasjonen. Ekstranodale manifestasjoner er hyppigst. EBV-positive lesjoner, som opptrer tidlig, kan gå spontant tilbake ved å redusere intensiteten av den immunosuppressive behandling. Ved manglende effekt består behandlingen ved de polymorfe subtyper av rituximab monoterapi. Ved mer veldefinerte lymfomtyper som for eksempel DLBCL vil behandlingen bestå av rituximab monoterapi og ved behandlingssvikt i kombinasjon med CHOP. Hos ca. 60 % av pasientene er tilstanden dødelig, dels fordi behandlingsrelatert mortalitet er høy. Norsk lymfomgruppe anbefaler at disse pasientene vurderes sentralt i lymfomgruppen, Oslo Universitetssykehus i samråd med transplantasjonssenteret på Rikshospitalet.
Anbefalinger:
Modifikasjon av immunosuppressiv terapi.
Evidensnivå C
Rituximab monoterapi ved polymorfe subtyper.
Evidensnivå B
Rituximab monoterapi, eventuelt R-CHOP ved mer veldefinerte monomorfe subtyper.
Evidensnivå B
T/NK-celle lymfomer
Sist faglig oppdatert: 06.03.2023
T-celleforstadier
T-lymfoblastisk leukemi/lymfoblastisk lymfom
T-lymfoblastisk leukemi skilles fra lymfom ved at leukemivarianten skal ha mer enn 25 % lymfoblaster i en normocellulær benmarg. Leukemivarianten er like hyppig som lymfomvarianten. T-lymfoblastisk lymfom er 10 ganger hyppigere enn B-lymfoblastisk lymfom og opptrer hyppigst hos tenåringer eller unge voksne. Den vanligste manifestasjonen er en stor tumor i fremre mediastinum. Morfologisk er cellene middels store med blastliknende kjerner og sparsomt cytoplasma. Immunhistokjemisk er cellene positive for TdT, CD1, CD3 og ofte CD7. CD4 og CD8 kan være ko-uttrykt. Histologisk kan cellene være vanskelige å skille fra normale thymusceller, eventuelt som del av et thymom. Dette gjelder særlig ved cytologiske prøver eller små biopsier, og det bør derfor sendes så store biopsier som mulig for diagnostikk.
Behandling
Man følger induksjonsregimet for akutte lymfoblastiske leukemier (NOPHO 2008 protokollen, med tilpasninger også brukt for eldre pasienter over 45 år, eventuelt modifisert Hammersmith 82). I stedet for vedlikeholdsbehandling med hovedsakelig perorale cytostatika gjennom 1,5–3,5 år, bør/kan pasientene tilbys konsolidering med HMAS i første remisjon. Deretter gis konsoliderende stråleterapi, især ved bulky sykdom i mediastinum primært. Denne behandlingen gir en residivfri 3 års overlevelse på 50–80 % (Sweetenham et al., 2001). Pasienter under 35 år har en meget god prognose i en norsk retrospektiv undersøkelse (Bersvendsen et al., 2014). En ulempe ved denne behandlingen er den økede risiko for infertilitet. Ved residiv hos pasienter som har gjennomgått HMAS i første remisjon er prognosen meget alvorlig, men yngre pasienter som responderer på 2. linjebehandling bør vurderes for og henvises til allogen stamcelletransplantasjon. Tiden fra avsluttet primærbehandling til residiv er viktig for prognosen.
Anbefalinger:
Risikostratifisert behandling etter NOPHO protokoll eller modifisert Hammersmith-82 regime. Konsolidering med HMAS.
Evidensnivå B
Supplerende stråleterapi mot opprinnelig mediastinaltumor: 2 GY x 12–15.
Evidensnivå B
Modne T/NK-celle lymfomer
Gruppen er heterogen. Morfologien varierer betydelig mellom de ulike undergrupper. Monoklonal rearrangering av T-cellereseptor α/β og γ/δ kan være til hjelp der det er vanskelig å stille en sikker malignitetsdiagnose. De fleste T-celle lymfomer er CD4+/CD8- unntatt ved subkutant pannikulitt-lignende T-celle lymfom (CD4-/CD8+), enteropati-type T-celle lymfomer (CD4-/ CD8+) og hepatosplenisk γ/δ T-celle lymfom (CD4-/CD8-). Totalt utgjør gruppen ca. 10 % av NHL hvorav perifert T-celle lymfom er den største undergruppen (ca. 4 %). Med unntak av primært kutant anaplastisk storcellet lymfom, anaplastisk storcellet alk+ T-celle lymfom og mycosis fungoides er prognosen ved modne T-celle lymfomer dårligere enn for storcellete B-celle lymfomer. 5-års overlevelse varierer mellom 10 og 50 %. Den dårlige prognosen skyldes dels at en større andel pasienter har erkjente dårlige prognostiske faktorer (høy IPI score), og dels at T-cellefenotype i seg selv indikerer en dårligere prognose (Evens, Querfeld, & Rosen, 2006; Pfreundschuh, 2005). Enkelte undergrupper har en spesielt dårlig prognose (ekstranodalt NK/T nasal type T-cellelymfom, hepatosplenisk T-celle lymfom, enteropati-type T-celle lymfomer). Pasienter med T-cellelymfomer bør i hovedsak henvises regionsykehus.
Indolente T/NK-cellelymfomer
Primært kutane T-cellelymfomer
Primært kutane non-Hodgkin lymfomer kan være både av T-celleopprinnelse (75 %) og B-celleopprinnelse (25 %). Det er mange histologiske undergrupper. WHO-EORTC har nylig publisert en forent klassifikasjon av disse entitetene (R. Willemze et al., 2005). Her omtales kun de to hyppigste primære kutane T-cellelymfomene.
Primært kutant anaplastisk storcellet lymfom og lymfomatoid papulose
Primært kutant anaplastisk storcellet lymfom er oftest lokalisert til én lesjon og har utmerket prognose med lokal kirurgisk behandling og/eller lokal strålebehandling uten noen form for systemisk behandling. Kun mer disseminerte former skal ha cytostatikabehandling (CHOP) (R. Willemze & Meijer, 2003).
Det kan være vanskelig å skille disse lymfomene fra lymfomatoid papulose, som ofte har en anaplastisk histologi, men som klinisk har et benignt forløp med spontane remisjoner og ikke skal behandles. God dialog mellom patolog og kliniker er viktig!
Anbefalinger:
Primært kutant anaplastisk storcellet lymfom lokalisert sykdom: Kirurgi evt etterfulgt av stråleterapi lokalt. Systembehandling ved disseminert sykdom.
Evidensnivå B
Lymfomatoid papulomatose observeres ubehandlet.
Evidensnivå B
Mycosis fungoides/Sézary syndrom
Morfologisk foreligger små til middelstore lymfoide celler i hud med uregelmessige kjerner (cerebriforme). De lymfoide celler viser epidermotropisme med små ansamlinger av tumorceller i epidermis (Pautrier abscesser). De ulike kliniske presentasjonsformer gir karakteristiske histologiske forandringer. Den histologiske diagnose er vanskelig og kliniske opplysninger ofte nødvendig. Det er viktig å merke seg at det enkelte ganger er nødvendig med multiple biopsier før man finner de typiske diagnostiske forandringene. Klinikeren kan her være til stor hjelp for patologen ved å ta biopsi fra det mest affiserte området, og således innskrenke behovet for multiple biopsier. Rearrangering av T-cellereceptor γ/δ kan være til hjelp. Hyppigst er tumorcellene CD4-positive. Lidelsen er sjelden, mindre enn 1 % av alle NHL, dvs. ca. 10–15 nye tilfeller per år i Norge. Økt forekomst av mycosis fungoides sees hos pasienter med HL. Sykdomsdebuten er ofte snikende. Det kan ta flere år fra de første manifestasjoner opptrer til en sikker diagnose er stilt. Hudforandringene kan ha preg av papler eller plaques som utvikler seg til tumores eller generell erytrodermi. Forandringene kan holdes under kontroll i flere år med lokalbehandling, men regelen er progresjon til generalisert sykdom med tiden (år). De viktigste prognostike funn er grad av hudaffeksjon, forhøyet LDH og tykkelse på kutane infiltrater vurdert histologisk.
Lymfomet benevnes Sézary syndrom når det opptrer atypiske T-celler også i andre organer enn hud (lymfeknuter, benmarg, blod) og når det er diffus hudaffeksjon (erytrodermi). TNM klassifikasjonen benyttes ofte for stadieinndeling av denne lymfomtypen.
En optimal behandling gjennom hele sykdomsforløpet krever et godt samarbeid mellom dermatolog og onkolog. Et slikt samarbeid bør være formalisert ved alle universitetsykehus, evt. kan man tenke seg et flerregionalt samarbeid for denne sjeldne sykdomsgruppen. Tidlig sykdom behandles med lokale terapiformer, oftest ved hudlege. Systemisk behandling velges for pasienter med refraktær sykdom og pasienter som debuterer med ekstrakutan sykdom, og utføres av onkolog (unntatt behandling med retinoider og ofte også interferon). Også lokal strålebehandling gis i regi av onkolog.
Behandlingsmål generelt: sykdomskontroll, senere livsforlengende palliasjon.
Den mest utbredte behandling er lysbehandling med peroralt inntak av psoralener og UVA lys (PUVA behandling). Pasientene kan dra nytte av fotoforese (ekstrakorporeal PUVA). Behandlingen gis ved Rikshospitalet og i regi av hudavdelingen ved St. Olavs hospital. Behandlingen kan kombineres med interferon-α2a eller et A-vitaminderivat (beksaroten). Pensling med sennepsgass (mustin) gir komplette remisjoner og forlenget sykdomsfritt intervall, men av yrkeshygieniske årsaker er denne behandlingen ikke i bruk i Norge i dag. En lokal applikajson av klormetin (også kjent som mekloretamin, LEdaga®) i form av en gel har markedsføringstillatelse i Norge og er nå under vurdering hos Belutningsforum. Ved fortsatt begrenset sykdomsutbredelse men dypere lesjoner, og ved manglende effekt av PUVA, kan lokalbehandling med høyvolt strålebehandling være et godt alternativ. Ved utbredte hudlesjoner kan helhud elektronbestråling gi langvarige remisjoner. Denne behandling utføres i Norge kun ved Det Norske Radiumhospital. Interferon-α2a anses som førstevalg når systemisk behandling er indisert med responsrater på litt over 50 %. Bexarotene er et retinoid som også er registrert på denne indikasjonen og som evt. kan brukes i kombinasjon med interferon-α2a eller som nevnt ekstrakorporeal fotoferese.
Forøvrig benyttes kjemoterapi (klorambucil, metotreksat og gemcitabin monoterapi, kombinasjonskjemoterapi). EORTC har publisert terapianbefalinger for mycosis fungoides/Sezary syndrom (Trautinger et al., 2006). Histon deacetylase-hemmeren vorinostat har ikke lenger markedsføringstillatelse for bruk ved mycosis fungoides, og både pris og bivirkninger som kvalme og fatigue begrenser bruken.
Fase II studier med det monoklonale antistoffet alemtuzumab mot pan-T-celleantigenet CD52 (MabCampath®) har vist lovende effekter og kan vurderes brukt etter søknad til farmasøytisk firma (preparatet er avregistrert, sykehusapotek kan gi retningslinjer med skjema). MabCampath gir lymfopeni og fare for opportunistiske infeksjoner, spesielt CMV reaktivering. Denne behandling skal gis på spesialavdeling med erfaring med denne type terapi (Dearden, 2006). Gode resultater har vært vist i fase II og fase III studier (Duvic et al., 2015; Kim et al., 2015; Prince et al., 2017) med brentuximab vedotin ved residiv av CD30 positive kutane T‑cellelymfomer, men behandlingen er ikke anbefalt brukt over det offentlige helsevesen av beslutningsforum. Utvalgte tilfeller med svært alvorlig sykdomsforløp kan vurderes for allogen stamcelle transplantasjon med redusert kondisjonering ved Oslo universitetssykehus. Brentuximab vedotin kan være godt egnet som bro til transplantasjon (Mehra et al., 2015). Denne behandlingen har vist lovende resultater i små studier og kan være kurativ. Et monoklonalt antistoff mot CCR4 (mogamulizomab (Poteligio®)) har godkjent indikasjon på mycosis fungoides og Sezary syndrom på grunnlag av en større fase III studie og er til vurdering i «Nye metoder».
Anbefalinger:
Tidlig MF sykdom behandles med steroidsalver, PUVA, stråleterapi eller annen lokal behandling. Utbredt sykdom MF kan gjennomgå helhud elektronbestråling. Klormetin som gel er til vurdering i «Nye metoder». Ved mer alvorlige tilfeller anbefales systemisk behandling, som interferon α2a, bexaroten, klorambucil, metotreksat, gemcitabin, kombinasjonskjemoterapi, vorinostat, alemtuzumab (anti-CD52 antistoff). Ved Sezary syndrom kan man forsøke fotoferese eller systemterapi som angitt over. Brentuximab vedotin har god effekt, men er ikke anbefalt av «Nye metoder», likeledes er det monoklonale anti CCR4 antistoff vist effektivt og er til vurdering. Allogen stamcelletransplantasjon hos selekterte pasienter.
Evidensnivå B
Aggressive T/NK-celle lymfomer
Intensiv cytostatikabehandling anses som særlig viktig for denne gruppen da prognosen sett under ett er dårligere enn for aggressive B-celle lymfomer. Behandlingsmålet er kurativt. CHOP-basert kjemoterapi bør foretrekkes. Man anbefaler at pasienter < 65 år i stadium II-IV gis CHOP-14 6–8 kurer, avhengig av remisjonens kvalitet etter tre kurer. CHOEP-14 kan vurderes hos yngre pasienter med avansert sykdom. Pasienter som oppnår remisjon anbefales HMAS i første remisjon etter gode resultater vist i en nordisk fase II studie (d'Amore et al., 2012). Pasienter under 65 år med residiv etter HMAS bør vurderes henvist for allogen stamcelle transplantasjon med redusert kondisjonering. Pasienter > 65 år stadium II-IV behandles med CHOP-14 der LDH er forhøyet, for øvrig CHOP-21. Ved lokalisert sykdom følges de samme prinsipper som ved aggressive B-celle lymfomer, dvs 3–6 kurer etterfulgt av stråleterapi mot «involved site» med fraksjonering 2 Gy x 20.
Enteropati-type T-celle lymfom
Denne entiteten opptrer oftest på bakgrunn av cøliaki, som regel i voksen alder. I den siste versjonen av WHO klassifikasjonen blir betegnelsen monomorft epiteliotropisk intestinalt T-celle lymfom (MEILT) introdusert dersom det ikke foreligger cøliaki. Diagnosen stilles ikke sjelden ved eksplorativ laparatomi på grunnlag av subileus eller tarmperforasjon. Lesjonene starter intraepitelialt. Prognosen er dårligere enn for øvrige T-cellelymfomer.
Behandling: Se over. Lesjonene er ofte multifokale i jejenum og/eller ileum. Kirurgi er derfor ikke tilstrekkelig som eneste behandling. Vær spesielt oppmerksom på fare for tynntarmsperforasjon etter oppstart av kjemoterapi (Delabie et al., 2011).
Anbefalinger:
Pasienter < 65 år behandles med CHO(E)P-14, 6 kurer etterfulgt av HMAS.
Eldre pasienter behandles med CHOP-14/21.
Evidensnivå C
Hepatosplenisk T-celle lymfom
Dette er en systemisk, ekstranodal neoplasi som affiserer lever, milt og benmarg og som består av cytotoksiske T-celler (CD3+, CD4-, CD8-, TIA-1+, TCR γδ+). Isokromosom 7q er et karakteristisk cytogenetisk funn som kan hjelpe diagnostisk. Forløpet er aggressivt, remisjonene oftest kortvarige.
Svært sjelden entitet og derfor ingen konsensus om valg av induksjonsregime men utenfor protokoll velger noen induksjonsregimer som IKE eller DHAP til CR før konsolidering med HMAS eller allogen BMT hvis mulig(Voss et al., 2013).
Anbefaling:
Pasienter < 65 år behandles med CHO(E)P-14 6 kurer etterfulgt av HMAS.
Eldre pasienter behandles med CHOP-14/21.
Evidensnivå C
Angioimmunoblastisk T-celle lymfom (AILT)
Dette lymfomet er oftest utbredt på diagnosetidspunkt med affeksjon av lymfeknuter, lever, milt og benmarg. Paraneoplastiske symptomer fra hud og allmennsymptomer er vanlig, likeså symptomer på immundefekter. Prognosen er alvorlig med median overlevelse mindre enn 3 år.
Anbefaling:
Pasienter < 65 år behandles med CHO(E)P-14 6 kurer etterfulgt av HMAS.
Eldre pasienter behandles med CHOP-14/21.
Evidensnivå B
Perifer T-celle lymfom, UNS
Dette er en histologisk heterogen gruppe. Klinisk presenterer den seg oftest med nodal sykdom, men affeksjon av milt, lever og benmarg med et leukemisk blodbilde er relativt hyppig. Sykdommen er aggressiv.
Anbefaling:
Pasienter < 65 år behandles med CHO(E)P-14 6 kurer etterfulgt av HMAS.
Eldre pasienter behandles med CHOP-14/21.
Evidensnivå B
Anaplastisk storcellet T/NK-celle lymfom
Entiteten er som regel av T-cellefenotype, men forekommer også uten påviselig B- eller T-celle linjetilhørighet (0-celler). Ved histologisk undersøkelse er cellene vanligvis store med rikelig cytoplasma og uregelmessige kjerner. De uttrykker antigenet CD30. De fleste lymfomer er positive for ALK proteinet, spesielt hos menn under 40 år. Klinisk presenterer sykdommen seg ofte i stadium III eller IV med B-symptomer (Stein et al., 2000).
ALK-positive lymfomer har god prognose med CHOP-analoge cytostatikaregimer alene. Unntaket er pasienter med alder > 40 år og/eller IPI score ≥ 3 (A. J. Moskowitz, Lunning, & Horwitz, 2014). ALK-negative lymfomer har prognose som øvrige modne T-celle lymfomer og behandles som disse.
Brentuximab vedotin har vist effekt i CD30 posiive anaplastisk storcellet T-celle lymfom sammen med cycolofosfamid, doxorubicin og prednisolon (CHOP kurer der brentuximab erstatter vincristin)(Horwitz et al., 2019). Regiment er godkjentav Beslutningsforum i april 2021 og anbefales brukt i 1. linje og ved residiv om mulig.
Anbefaling:
ALK+ lymfomer behandles med CHOP-baserte regimer.
ALK+ lymfomer < 65 år med negative prognostiske faktorer som anført over behandles med CHO(E)P-14 etterfulgt av HMAS.
Evidensnivå B
ALK-lymfomer hos pasienter < 65 år behandles med CHO(E)P-14 etterfulgt av HMAS.
Evidensnivå C
Eldre pasienter behandles med CHOP-14/21.
Evidensnivå B
Ekstranodal NK/T cellelymfom, nasal type
Denne sjeldne varianten opptrer i nese / bihuler og har et aggressivt forløp og tradisjonelt svært dårlig prognose. En studie tyder imidlertid på at SMILE-regimet, evt. et mindre toksisk regime (GDP, også med asparaginase) gir bedre resultater (Kwong et al., 2012), og at lokal strålebehandling bør gis på et tidlig tidspunkt i behandlingsforløpet.
Evidensnivå C
Residivbehandling
Kurativt behandlingsmål
Yngre pasienter bør vurderes for allogen stamcelletransplantasjon ved oppnådd remisjon. Pasienter under 65 år med Alk+ storcellet anaplastisk lymfom vurderes for HMAS ved oppnådd remisjon på 2. linjeregime (IME).
Ved CD30 positive lymfomer (storcellete anaplastiske) viser brentuximab vedotin gode resultater (Garnock-Jones, 2013; Pro et al., 2012) og er et alternativ som en bro til HMAS (alk+ lymfomer) og anbefales der en planlegger allogen stamcelletransplantasjon.
For øvrige pasienter vil det realistiske behandlingsmålet være livsforlengende palliasjon. Alternative regimer er ENAP, IME, trofosfamid. Brentuximab vedotin kan være et godt alternativ ved kjemoressistent sykdom.
Beslutningsforum har godkjent at Brentuksimab vedotin (Adcetris®) kan innføres til behandling av pasienter med tilbakefall av CD30 positiv storcellet anaplastisk non-Hodgkin lymfom.
Anbefaling:
Allogen stamcelletransplantasjon til yngre pasienter.
Evidensnivå B
ALK+ lymfomer under 65 år behandles med IME etterfulgt av HMAS.
Evidensnivå B
Brentuximab vedotin 4–6 kurer ved CD30+ storcellet anaplastisk T celle lymfom med tilbakefall.
Evidensnivå B
Ved palliative behandlingsmål: se over.
CNS profylakse og behandling ved systemisk CNS affeksjon
Sist faglig oppdatert: 06.03.2023
CNS profylakse
Lymfomer av høy malignitetsgrad residiverer ikke sjelden i CNS (meningealt eller intracerebralt) (Boehme et al., 2007; Chamberlain, Nolan, & Abrey, 2005). Den største gruppen lymfomer, aggressive B celle lymfomer, har en risiko for CNS residiv som kan variere fra <1 % til opp mot 25 % hos pasienter med flere riskofaktorer. Utfordringen er å identifisere pasienter som bør spinalpunkteres med undersøkelse av spinalvæsken til cytologi og immunfenotyping samt ta MR caput, og pasienter som skal ha CNS profylakse. En risikomodell (CNS International Prognostic Index) for diffust storcellet B‑cellelymfom ble etablert ved å analysere en stor pasientpopulasjon på mer enn 2000 pasienter som gjennomgikk behandling med R-CHOP (Schmitz et al., 2016). Resultatene ble validert i et uavhengig datasett med ca 1600 pasienter fra British Columbia. De fant en 6 punkt score riskomodell bestående av International Prognostic Index (IPI) og affeksjon av nyrer og/eller binyrer.
Faktorer i CNS IPI:
- Nyre og/eller binyreaffeksjon
- Alder >60 år
- LD>normal
- WHO >1
- St III/IV sykdom
- Extranodal affeksjon >1
Risiko for CNS residiv etter 2 år var 0.6 % (KI: 0–1.2 %) i lavrisiko-gruppe (score 0–1), 3.4 % (KI: 2.2–4.4 %) i intermediærrisiko-gruppe (score 2–3) og 10.2 % (KI: 5.7–14.3 %) i høyrisiko-gruppe (score 4–6). Det var lignende funn i validerings-settet.
Pasienter i lav og intermediær risiko-gruppe behøver ikke diagnostiske eller terapeutiske tiltak mens høy risk-gruppe (score 4–6) bør få utført spinalpunksjon og MR caput og vurderes for CNS profylakse.
I tillegg bør følgende subtyper av non-Hodgkin lymfom gjennomgå profylaktisk behandling med CNS-aktive regimer, inkludert cytostatika gitt intraspinalt etter egnede protokoller: Lymfoblastisk lymfom og Burkitt lymfom uansett stadium (NOPHO 2008, modifisert Hammersmith-82, GMALL 2002-regimet).
Pasienter med affeksjon av testikler (stadium II-IV) eller CNS-nære strukturer (eks etmoidalsinus, skallebasis, intraspinal ekstradural manifestasjon) bør få aktiv CNS-rettet profylakse (Hill et al., 2006). Det samme bør muligens pasienter med >2 ekstranodale manifestasjoner (El-Galaly et al., 2017).
Pasienter med MYC rearrangert lymfom har en økt risiko for CNS affeksjon eller CNS residiv, også når justert for andre kliniske risk faktorer (Savage et al., 2009). Såkalt «dobbel hit» lymfom med både rearrangering av MYC og BCL2 (evt også BCL6: «trippel hit») behandles med intensive regimer som inkluderer CNS profylakse (Johnson et al., 2009).
Det har vært manglende konsensus for hvilken type CNS profylakse som bør benyttes. Intrathekal MTX profylakse har i flere retrospektive studier og metaanalyser ikke vist å kunne redusere risiko for CNS residiv (Eyre et al., 2020; Zhang et al., 2022). Forklaringen er sannsynligvist manglende penetrering inn i hjerneparenchymet hvor de fleste CNS residivene oppstår (Kansara et al., 2017). Denne formen for profylakse anbefales derfor ikke lenger. Gevinsten av systemisk MTX profylakse er også omdiskutert og vi mangler prospektive randomiserte studier. I en nylig publisert metaanalyse konkluderte man med redusert antall CNS residiv og bedre OS hos pasienter som hadde mottatt HD metotreksat. Pasientene mottok da i snitt MTX dose på 3-3,5g/m2 og mediant 2 kurer (Zhang et al., 2022). I de nordiske CHIC og BioCHIC studiene mottok pasienter 2 HD-MTX interponert mellom de første R-CHOP kurene, og avslutningsvis en HD cytarabin kur. Foreløpige resultater viser svært få CNS residiv i denne høyrisiko pasientgruppen (Leppa et al., 2022; Leppä et al., 2020).
Om MTX skal administreres interponert på dag 15 mellom de første 3 R-CHOP kurene, eller etter siste R-CHOP kur er omdiskutert. En nylig publisert retrospektiv analyse fant ingen forskjell i risiko for CNS residiv mellom pasienter som mottok MTX i begynnelsen versus på slutten av den systemiske behandlingen (Wilson et al., 2022). Det var dessuten en økt risiko for utsettelser av R-CHOP kurer dersom MTX ble administrert interponert mellom R-CHOP kurene. Nordisk erfaring fra CRY, CHIC og BIOCHIC studiene tilsier derimot at MTX tidlig i behandlingsløpet sannsynligvis gir en lavere risiko for CNS residiv (Holte et al., 2013; Leppa et al., 2022; Leppä et al., 2020).
Anbefalinger:
For pasienter med lymfoblastlymfom og Burkitt lymfom: CNS profylakse til alle pasienter i henhold til gjeldende regime som for akutte lymfoblastleukemier og Burkitt lymfom..
Evidensnivå A
Anbefalinger:
For pasienter med diffust storcellet B-cellelymfom der profylakse anses indisert, gis 2 høydose MTX i dosering 3-3,5g/m2 interponert dag 15 mellom de første 3 kurer av R-CHOP-21 eller R-DA-EPOCH. Der man anser at risiko for bivirkninger og utsettelse av hovedkurer er betydelig kan 2 MTX kurer administreres etter siste R-CHOP kur. Et alternativ er kuropplegg etter modell fra BIO- CHIC studien. Hos eldre pasienter vurderes behov for CNS profylakse individuelt, bl a behandlingsmål. Der mer intensiv profylakse anses indisert, som ved «dobbel» eller «trippel hit» kan man vurdere GMALL 2002.
Evidensnivå C
Behandling av systemisk sykdom med CNS-affeksjon på diagnosetidspunkt
Behandlingen bør styres fra universitetsykehus. Pasientene bør få GMALL2002 – basert kjemoterapi når de er under 50–60 år. Når de er over 60 år eller har betydelig komorbiditet, gis CHOP21(-R) med trippel intraspinal kjemoterapi på dag 1 og høydose metotreksat 3 g/m2 med folinat-redning på dag 15. Dette gjelder for de første 4 kurer. De aller eldste pasientene behandles individuelt.
Prognosen for pasienter med affeksjon i CNS primært er svært alvorlig. Individer som kommer i komplett remisjon etter primærbehandling bør vurderes for stråleterapi mot total hjerne med eller uten spinal akse (uten ved intracerebral, parenchymatøs affeksjon). Det kan da gis 2 Gy x 9 mot hele målvolumet (CNS), deretter ytterligere 2 Gy x 3 mot total hjerne. For detaljer rundt planlegging av denne behandlingen, se egen stråleterapidel (Vedlegg 5). Det er også aktuelt å konsolidere med HMAS hos yngre individer, istedenfor eller som et supplement til stråleterapi (Hollender, Kvaloy, Lote, Nome, & Holte, 2000).
Anbefaling:
Pasienter under 50–60 år: GMALL 2002 analog kjemoterapi. For pasienter som oppnår komplett remisjon på kjemoterapi vurderes konsoliderende behandling med HMAS og/eller strålebehandling mot total hjerne eller CNS akse. Eldre pasienter behandles individuelt da prognosen er dårlig.
Evidensnivå C
Spesielle ekstranodale lymfomlokalisasjoner
Sist faglig oppdatert: 06.03.2023
Primære CNS lymfomer (PCNSL)
PCNSL hos immunkompetente er en sjelden sykdom og utgjør 2–3 % av alle nye NHL. Insidensen er økende. Median alder ved diagnose er 62 år i et større dansk, populasjonsbasert materiale. Debutsymptomene er som for andre hjernesvulster.
Typiske MR funn er periventrikulær tumor, ofte multifokal. Dette funnet bør gi mistanke om PCNSL og da kan diagnosen i ca. 20 % stilles ved cytologisk (NB immuncytologi!) undersøkelse av spinalvæsken supplert med flowcytometri. Er denne undersøkelsen sikker, er det tilstrekkelig for å stille diagnosen primært CNS lymfom. For øvrig stilles diagnosen ved stereotaktisk biopsi. Steroidbehandling kan redusere tumor raskt og gjøre en biopsitaking og vurdering av preparatet vanskelig, man bør derfor unngå unødvendige mange dager med steroider før biopsi tas. Denne haster og rask kontakt med nevorkirugisk avdeling er vesentlig. Minst 5 % av pasientene har samtidig lymfom-affeksjon intraokulært slik at undersøkelse med spaltelampe hører med til utredningen. Diagnosen kan ved intraokulær affeksjon av og til sikres ved vitrektomi. I tillegg kommer vanlig lymfom-utredning for å utelukke at pasienten har generalisert lymfom. Dersom den kliniske tilstanden tillater det, er det ønskelig å utsette oppstart av steroider (for å unngå reetablering av blod-hjerne-barrieren) evt raskt trappe ned hvis pasienten har startet, til behandlingen med cytostatika starter opp (Batchelor & Loeffler, 2006).
Denne pasientgruppen skal henvises regionsykehus for utredning og behandling. Tradisjonelt har disse pasientene vært behandlet med strålebehandling av hele hjernen, men med en median overlevelse på bare 12–18 måneder. I 1980–90 årene ble det utført en rekke fase II studier som kombinerte kjemoterapi og strålebehandling. Den mediane overlevelsen ble økt i beste fall til 30–40 måneder. Det mest effektive cytostatikum har vært metotreksat gitt i gram-doser med folinat antidot, hvilket fører til terapeutiske konsentrasjoner i CNS. Kombinasjonen høydose metotreksat og høydose cytarabin synes å være bedre enn andre cytostatika-kombinasjoner (A. J. Ferreri et al., 2009). Inntil nylig har man i Norge i stor grad benyttet et regime fra Memorian Sloan Kettering Cancer Center med 5–7 kurer med høydose metotreksat hver 2. uke i kombinasjon med vinkristin og i tillegg prokarbazin ved kur 1, 3 og 5 og 7. Rituximab gis ved hver kur (R-MVP regimet). 7 kurer hvis ikke CR etter 5 kurer. Ved minst oppnådd PR gis 2 kurer høydose cytarabin med tre ukers mellomrom. Ved CR vurderes 23.4 Gy stråleterapi mot total hjerne, evt kan strålebehandling utelates. Ved PR/SD 45 Gy (P. G. Morris et al., 2013; Shah et al., 2007).
En randomisert studie (IELSG-32) hvor 1. randomisering ble publisert i 2015 dokumenterte at rituximab og thiotepa administrert i tillegg til metotreksat og cytarabin (MATRix-regimet) gav bedre overlevelse i første linje ved primære CNS-lymfomer i aldersgruppen 18–70 år (Ferreri et al., 2016). Studien hadde også en 2. randomisering mellom HMAS der høydosebehandlingen inneholdt thiotepa og bestråling mot total hjerne til 36 Gy (9 Gy i tillegg mot tumorsengen for de som ikke var i CR). Det var ingen signifikant forskjell i 2-års PFS mellom armene i denne studien (Ferreri et al., 2017). 7 års median oppfølging viste OS 40 % for hele studiepopulasjonen og nær 70 % for pasienter som hadde fått MATRIX + konsolidering. Det var ingen signifikant forskjell i OS mellom HMAS og strålebehandling, men mer neurotoksisitet hos pasienter som hadde fått strålebehandling (Ferreri et al., 2022).
En annen randomisert studie (IELSG-43) sammenliknet MATRix regimet etterfulgt av enten HMAS (inneholdende thiotepa) eller R-DeVIC kurer som konsolidering. Foreløpige resultat presentert som abstract på ASH 2022 viser 3 års PFS /OS 79% / 86 % i HMAS armen og 53 %/ 71 % i R-DeVIC armen. Det var ingen forskjell ved evaluering av neurokognitiv funksjon (Illerhaus et al., 2022).
Strålebehandling alene – og i særdeleshet kombinasjonen kjemoterapi (oftest inneholdende høydose metotreksat) gir høy frekvens av neurotoksisitet. Det gjelder først og fremst eldre pasienter. Lavdose bestråling til 23.4 Gy gir dog sannsynligvis mindre neurotoksisitet. Strålebehandling etter H-Mtx basert kjemoterapi har ikke gitt sikker overlevelsesgevinst sammenlignet med kjemoterapi alene (Korfel et al., 2015). RTOG 1114 studien sammenligner R-MPV +/ - strålebehandling til 23,4 Gy. Studien undersøker også neurotoksisitet. Ved median oppfølging 55 mnd var median PFS 25 mnd i kjemoterapiarmen og ikke nådd i kjemoterapi+RT armen. Median OS var ikke nådd i noen av armene. Det var ikke sett statistisk signifikante forskjeller i neurotoksisitet (Omuro et al., 2020). Vedlikeholdsbehandling med temozolamid hos eldre over 65 år har vist gode resultater i en Nordisk studie (Pulczynski et al., 2015). Ved bruk av bare kombinasjons-kjemoterapi er det langt færre som får neurotoksisitet. Residivene opptrer i CNS over tid, sene residiver er ikke sjelden (Gavrilovic et al., 2006; Goldkuhl et al., 2002) (samt upubliserte data fra Oslo universitetssykehus).
Anbefalinger:
Pasienter under 70 år:
I tilfeller der man mener at pasientene kan tolerere mer intensiv behandling anbefales induksjonsbehandling etter MATRix-regimet konsolidert med HMAS i 1. remisjon. Pasienter som ikke kan få HMAS vurderes for konsolidering med stråleterapi eller kjemoterapi (DeVIC) (Ferreri et al., 2017; Kasenda et al., 2012; Omuro et al., 2015). Et alternativ er R-MPV regimet og konsolidering med lavdosert strålebehandling 23.4 Gy for de som oppnår CR. I samme pasientgruppe kan man vurdere HMAS i andre remisjon etter induksjonsbehandling hvis det ikke har vært benyttet i førstelinjebehandlingen.
Pasienter over 70 år:
For pasienter over 70 år kan i mange tilfeller R-MVP regimet anvendes og evt dosetilpasses for alder. Strålebehandling vurderes for de som ikke har oppnådd komplett remisjon etter 5–7 kurer. Vedlikeholdsbehandling med temozolamid bør også overveies (Pulczynski et al., 2015). Almenntilstand og komorbiditet vil ofte være avgjørende for hva man kan tilby denne pasientgruppen og det anbefales at man evt diskuterer behandlingen med et av medlemmene i Nordisk CNS arbeidsgruppe.
Evidensnivå B
Utprøvende behandling
Lymfomer i gastrointestinal-traktus (GI-traktus)
Lymfomer i GI-traktus omtales spesielt da gruppen representerer spesielle problemstillinger. Vel 25 % av de primært ekstranodale lymfomer er lokalisert til GI-traktus, dvs. ca. 50 nye tilfeller per år i Norge. De fleste indolente lymfomer i ventrikkelen er av typen marginalsone B-celle lymfom. Diffuse storcellete B-celle lymfomer og mantelcelle lymfomer opptrer også hyppig i ventrikkel, men også i tynn- og tykktarm. Den hyppigste lymfomentiteten i tynntarm er imidlertid cøliaki-assosiert enteropati-associert T-celle lymfom.
Ved mistanke om ventrikkel-lymfomer bør det tas multiple endoskopiske biopsier. I tillegg til standard utredning bør det også utføres øre-nese-hals undersøkelse og ultralydundersøkelse av abdomen. Endoskopisk ultralyd vil kunne få øket anvendelse for å vurdere dybdevekst og lokal lymfeknuteaffeksjon. Kirurgi har vært anbefalt ved ventrikkel-lymfomer, dels for å fjerne tumor, dels for å hindre perforasjon ved oppstart av kjemoterapi eller strålebehandling (Koch et al., 1997). Data tyder imidlertid på at perforasjonsfrekvensen er lav og i liten utstrekning relatert til kjemoterapi / strålebehandling. Spørsmålet blir da om tumorreseksjon før kjemoterapi og/eller strålebehandling reduserer risikoen for residiv. Argumentene mot (subtotal) gastrektomi (morbiditet, per/ postoperativ mortalitet) må tillegges betydning. Vi vil følgelig begrense indikasjonen for ventrikkelreseksjon/gastrektomi til utvalgte tilfeller der det foreligger massiv gjennomvekst til serosa (høy perforasjonsfare), eller der det foreligger blødning som en alvorlig komplikasjon. Det er viktig at disse pasientene diskuteres på tverrfaglig basis mellom kirurg og onkolog. Ved begrenset sykdom blir det naturlig å benytte samme strategi som for de nodale lymfomer: stråleterapi (2 Gy x 12) ved indolente lymfomer (bortsett fra marginalsone lymfomer der protonpumpehemmer kombinert med antibiotika foretrekkes) og en kombinasjon av kjemoterapi (3–6 CHOP-analoge regimer med rituximab, se egne avsnitt) og strålebehandling (2 Gy x 15–20, avhenging av respons) ved de aggressive lymfomene. Morbiditeten ved strålebehandling til 40 Gy mot øvre abdomen kan være betydelig på kort og lang sikt. Dersom pasienten er i komplett remisjon etter 3 kurer, bør man overveie å gi ytterligere 3 kurer i stedet for strålebehandling. Når det gjelder utforming av strålefelt vises det til egen stråleterapidel.
Diagnosen enteropati-assosiert T-celle lymfom stilles ikke sjelden ved laparatomi som følge av subileus eller tarmperforasjon. Ved mer fredelig sykdomsdebut er det ofte nødvendig med laparatomi for å få en sikker diagnose. I tillegg vil det kunne være en fordel å fjerne klart patologiske tarmavsnitt før oppstart av kjemoterapi.
Ventrikkellymfomer
Indolente ventrikkellymfomer
Ekstranodale marginalsone B-celle lymfomer (MALT) stadium PelA
Dersom man ved endoskopisk biopsi påviser marginalsone B-celle lymfom, er det nødvendig med nye biopsier. Dette innebærer en biopsi fra antrum og corpus for urease hurtigtest, 10 biopsier fra makroskopisk affiserte områder og kvadrantbiopsier fra makroskopisk uaffiserte områder. Histologisk gradering etter Wotherspoons metode på en skala fra 0–5 utføres, der grad 4 og 5 er sikkert malignt. For diagnose er det nødvendig med molekylærgenetisk undersøkelse for immunglobulin gen rearrangering og også histokjemisk eller immunhistokjemisk undersøkelse for Helicobacter pylori (HP). Utover dette foretas standard lymfomutredning, inkludert CT-thorax/abdomen/bekken, ultralyd lever/milt/paraaortale rom, ØNH-undersøkelse, benmargsbiopsi og eventuelt PET/CT om man er i tvil om sykdommen er i begrenset stadium. Det har de senere år vært en synkende insidens av HP positive MALT-lymfomer i ventrikkel av uklare årsaker (Thieblemont & Zucca, 2017). Det kan ha en sammenheng med utstrakt bruk av protonpumpehemmere hos pasienter med gastritt-symptomer og antibiotika for andre formål.
Ved HP positive MALT-lymfomer i ventrikkel er eradikering av HP med trippelbehandling i 10–14 dager (Klacid 250 mg x 2, Elyzol 500 mg x 2, Lanzo 30 mg x 1) i flere mindre studier vist å kunne gi komplette remisjoner hos om lag 2/3 av pasientene der sykdommen er begrenset til ventrikkelslimhinnen, stadium PeIA og lokale lymfeknuter, stadium PeII1A (Wotherspoon et al., 1993). Det kan ta over ett år før remisjonen er komplett. Residiv etter eradikasjons-behandling kan forekomme, men er i de fleste tilfeller mikroskopisk. Denne behandlingsstrategien krever et nitidig oppfølgingsprogram, der man gjentar klinisk undersøkelse og endoskopier med biopsi (histologi og PCR analyse) etter 3 mnd og 6 mnd, deretter halvårlig til 3 år, deretter årlig til 5 år. Ultralyd øvre abdomen gjøres årlig i samme periode. Trippelbehandling er så lovende at den regnes som standardbehandling i Norge ved HP positive MALT-lymfomer i ventrikkel såfremt man følger retningslinjer for diagnostikk, behandling og kontroller. Lokalt mikroskopisk residiv følges kun med gastroskopier med biopsi, ingen behandling er nødvendig. Ikke sjelden vil de forsvinne over tid (Wundisch et al., 2005). Undergrupper med t(11;18)(q21;q21) (gir AP12-MALT1 fusjonsprodukt) og ekstra kopi av MALT1 er assosiert med resistens mot H. pylori eradikasjon (Liu et al., 2002; Nakamura et al., 2007) og kan påvises ved FISH metodikk. En stadig større andel av disse lymfomene er HP negative og det er vist har disse også kan respondere på trippelbehandling, men dette er mere usikkert enn ved de HP positive. Lokal stråleterapi ventrikkel og regionale glandler langs kurvaturene, coeliakaregionene, milthilus og subpylorisk med fraksjonering 2 Gy x 12 med kurativt siktemål er derfor å foretrekke som primærbehandling hos denne gruppen (Ohkubo et al., 2017). Lokalt makroskopisk residiv i ventrikkel og/eller regionale lymfeknuter behandles også med stråleterapi med kurativt siktemål. For detaljer rundt planlegging av strålebehandling, se egen stråleterapidel. Utbredte residiv behandles etter retningslinjer angitt for indolente lymfomer generelt, uten kurativt siktemål.
Anbefalinger:
HP positive MALT-lymfomer behandles med trippel eradikasjons-behandling med nitid oppfølging. Mikroskopisk restsykdom observeres ubehandlet.
HP negative MALT-lymfomer behandles med lokal stråleterapi til 24 Gy.
Ved resistent sykdom eller ved lokalt klinisk residiv gis også lokal strålebehandling til 24 Gy.
Evidensnivå A
Andre indolente lymfomer stadium PelA og PeII1A
Anbefalinger:
Lokal strålebehandling, 2 Gy x 12 mot ventrikkel, lymfeknuter langs kurvaturene, coeliakaregionen, milthilus og de subpyloriske lymfeknuter (Tsang & Gospodarowicz, 2007).
Ved alvorlig blødning og/eller massiv gjennomvekst til serosa med perforasjonsfare vurderes ventrikkelreseksjon eller gastrectomi etter tverrfaglig diskusjon mellom onkolog og kirurg. Hvis inngrepet er radikalt, gis ingen ytterligere behandling ved stadium PeI; og supplerende strålebehandling 2 Gy x 12 mot regionale lymfeknuter ved stadium PeII.
Evidensnivå B
Alle indolente lymfomer stadium PeII2 - stadium IV
Anbefalinger:
Oppfattes som ikke kurabel sykdom og behandles som utbredte indolente lymfomer, dvs «watch and wait» hvis de ikke er behandlingstrengende, og eventuelt som indolente lymfomer for øvrig. Lokal strålebehandling ved plagsomme lokalsymptomer.
Evidensnivå: se kapittel B-celle lymfom, avsnitt om Moden B-celle neoplasier – indolente.
Diffuse storcellete B-celle lymfomer i ventrikkel
Anbefalinger:
Vurder først behov for kirurgi etter retningslinjer som angitt over for indolente lymfomer.
Ved stadium PeI og PeII1 lokalisert følges de samme prinsipper som beskrevet for storcellet B-celle lymfom stadium I/II. Det gis 3–6 kurer CHOP-basert terapi med rituximab etterfulgt av strålebehandling (2 Gy x 15–20) med feltutforming som for indolente lymfomer PeI-PeII1, lokalisert. Et fullgodt alternativ der man ønsker å unngå stråleterapi vil være kun å behandle med kjemoterapi, 6 kurer etter retningslinjer for storcellet B‑celle lymfom.
Stadium PEII2 utbredt - IV behandles som diffust storcellet B-celle lymfom, utbredt sykdom. Supplerende strålebehandling vurderes på individuelt grunnlag (ved manglende KR lokalt etter kjemoterapi, vurder alternativt HMAS).
Evidensnivå: Se kapittel B-celle lymfom, avsnitt om Diffust storcellet B-celle lymfom (DLBCL) og Follikulært lymfom grad 3B.
Lymfomer i tarm (duodenum, tynn- og tykktarm inkludert rektum)
En bør alltid vurdere behovet for kirurgi før oppstart av kjemoterapi. Strålebehandling er sjelden indisert da lesjonene oftest er multifokale og tarm/ krøs er mobile og strålefeltet derfor vanskelig å bestemme. Diffuse storcellete B-celle lymfomer behandles etter vanlige retningslinjer. I en del tilfeller vil lesjonene her være unifokale, og det er mulig å fjerne disse kirurgisk. Det gis i så fall kjemoterapi, 3–6 kurer uten påfølgende strålebehandling. Hos pasienter med Burkitt lymfom er sykdommen ofte lokalisert til ileocoecal-overgangen og skal behandles i henhold til retningslinjer for denne lymfomgruppen gitt i eget avsnitt.
Anbefalinger:
Tarmreseksjon kan være indisert. Se for øvrig anbefaling for de respektive histologiske entiteter.
Evidensnivå: se kapittel B-celle lymfom og T/NK-celle lymfomer
Ekstranodalt lymfom i øre-nese-hals-området
Ekstranodale lymfomer i ØNH-området er nest hyppigst etter GI lymfomer (tonsille og lymfoid vev i Waldeyers ring oppfattes som nodale manifestasjoner). Sykdommen er som regel begrenset og prognosen gjennomgående god. Pasienten skal normalt henvises til universitetsykehus. Utredning og behandlingen følger retningslinjer gitt for de ulike lymfomentiteter. ØNH-undersøkelse og CT undersøkelse av regionen er obligatorisk. Øsofago-gastro-duodenoskopi bør utføres. For øvrig skal pasientene gjennomgå standard lymfomutredning. Ettersom de fleste pasienter vil få strålebehandling mot munnhule og svelg, skal pasientene undersøkes av tannlege for å sanere eventuelle infeksjonsfoci og få råd om tannhygiene. De fleste lymfomer i spyttkjertler og orbita er av marginalsone B-celle lymfom type (MALT) og har spesielt god prognose. Chlamydia psittaci kan være viktig etiologisk agens ved MALT-lymfomer i orbita og behandling med antibiotika (doxylin) alene har vært beskrevet å gi varig effekt hos rundt 60 % av pasientene (Han et al., 2015). Lymfomer i bihuler er oftest av diffust storcellet B-celle type og kan destruere ben i CNS-nære områder. Lymfomer i nese er ofte av nasal T/NK-celle type og har en alvorlig prognose (Zucca, Roggero, Bertoni, Conconi, & Cavalli, 1999).
Indolente lymfomer
Anbefalinger:
Ved stadium PeI og stadium PeII1 lokalisert gis strålebehandling, 2 Gy x 12 Gy ved marginalsonelymfomer og follikulære lymfomer, 2 Gy x 20 Gy ved ekstraossøse plasmacytomer. Utformingen av strålefeltet gjøres på basis av CT-veiledet doseplan. For detaljer rundt utforming av strålefelt, se egen stråleterapidel. Behandlingen av de ulike lymfomentiteter følger de aktuelle retningslinjene. Mer utbredte stadier behandles etter generelle prinsipper for indolente lymfomer, uten kurativt siktemål.
Evidensnivå B
Aggressive lymfomer
Disse behandles etter retningslinjer gitt i egne avsnitt. Ved CNS-nære lesjoner er det viktig å gi CNS-profylakse som er beskrevet i eget kapittel.
Lymfom i testikler
Diagnosen stilles ikke sjelden etter at det er utført orchiektomi på mistanke om germinalcelletumor. Histologisk foreligger oftest et aggressivt lymfom, enten av diffus storcellet B-celletype, Burkitt lymfom eller lymfoblastisk lymfom.
Diffuse storcellete B-celle lymfomer forekommer hyppigst hos eldre pasienter (Lote, Holte, Nome, Langholm, & Kvaløy, 2000). I motsetning til tidligere anbefales nå CNS-profylakse nå også ved lokalisert sykdom (stadium PeI)og dette anbefales også der testisaffeksjon er ledd i en mer utbredt sykdom. Ettersom CNS-residivene som regel opptrer parenchymatøst, anbefales høydose MTX som profylakse (Cheah, Wirth, & Seymour, 2014). Behandlingen følger angitte retningslinjer for storcellet diffust B-celle lymfom lokalisert sykdom. Lymfomet er ofte lokalisert til begge testikler, og strålebehandling også mot gjenværende testikkel (2 Gy x 12) anbefales av de fleste da residiver ikke sjelden opptrer her. For utforming av strålefelt, se egen stråleterapidel.
Anbefalinger:
Følg retningslinjer for de ulike lymfomentitetene.
Pasienter med diffust storcellet B-cellelymfom uansett stadium skal normalt ha CNS profylakse. Ved stadium PeI uten andre risikofaktorer er det aktuelt med 3 kurer CHOP21-R med interponert høydose MTX ved hver kur, ved mer utrbredt sykdom ved 4 av de første 6 kurene Kontralaterale testis bestråles etter avsluttet kjemoterapi. Indikasjonen vurderes individuelt ved høy alder.
Evidensnivå B
Lymfom i skjelett
Anbefalinger:
Primært utgangspunkt i skjelett er en uvanlig presentasjon. Prognosen skiller seg ikke vesentlig fra andre lymfomer med samme histologiske undergruppe, og behandlingen følger de ulike handlingsprogrammene. Diffust storcellet B-celle lymfom er langt vanligst. Ved lokalisert sykdom og utbredt sykdom med færre enn tre lokalisasjoner skal disse bestråles etter avsluttet kjemoterapi (2 Gy x 15). For utforming av strålefelt, se egen stråleterapidel.
Behandling ved AIDS-relatert lymfom (ARL)
Sist faglig oppdatert: 10.12.2021
Maligne non-Hodgkin lymfomer er hyppig forekommende blant pasienter med AIDS. HIV-positive pasienter har økt risiko for mange krefttyper men NHL er kanskje den viktigste, med en relativ risiko på ca. 200. Etter introduksjonen av mer effektiv antiviral behandling (HAART) omkring 1996 har dødeligheten av AIDS gått dramatisk ned i den vestlige verden, og den realtive risko for lymfom gått ned. Prevalensen av HIV positive individer øker imidlertid, og en del vil utvikle AIDS-relatert malignt lymfom (ARL).
Disse har vært kjennetegnet av aggressiv klinikk og dårlig toleranse for behandling, med svært dårlig prognose som resultat. Prognosen er imidlertid svært avhengig av CD4-tallet og antall HIV RNA-kopier. Begge er vanligvis vesentlig bedre i post-HAART æraen. Dette har gjort det mulig å behandle ARL med kurativt siktemål og tilnærmet samme regimer, som man bruker i lymfombehandlingen for øvrig (Diamond, Taylor, Im, Miradi, & Anton-Culver, 2006). Man må imidlertid ta visse spesielle hensyn:
- Man bør følge virus RNA og spesielt CD4-tallene underveis. Det rapporteres at det går et skille omkring 100 x 10-9 L CD4+ celler /. Dersom verdiene er lavere enn dette, bør man gjøre dosereduksjon, spesielt av Cyclofosfamid.
- Vekstfaktorer som G-CSF bør brukes rutinemessig fra første kur.
- Profylakse mot sopp og PJP anbefales, og evt også mot HHV.
- Rituximab (MabThera) har tidligere vært unngått pga «late onset» neutropeni og økt forekomst av infeksjoner og toksisk død og manglende dokumentasjon på overlevelsesgevinst (Kaplan et al., 2005). Nyere studier tyder imidlertid på at rituximab som tillegg til kjemoterapi øker både responsrater og total overlevelse, så sant man har kontroll med HIV-infeksjonen (forutsetter CD4-tall > 50) (Boue et al., 2006; Ezzat et al., 2007; Sparano, 2007). Kjemoterapi må som ellers velges ut fra histologi og den kliniske situasjon (Mounier et al., 2006). Det rapporteres at GMALL2002 er gjennomførbart ved Burkitts lymfom, mens CHOP-R eller EPOCH-R (se nedenfor) vil være et naturlig valg ved diffust storcellet B-cellelymfom. Disse to typene utgjør ≥ 90 % av alle ARL.
Anbefalinger:
I utgangspunktet behandles pasientene etter histologisk undergruppe med optimal dosering. Dosejusteringer kan bli nødvendig. Rituximab anbefales brukt så lenge man har kontroll over HIV-infeksjonen (CD4-tall over 50). Støttebehandling: G-CSF indisert. Profylaktisk behandling mot sopp, pneumocystis jirovecii pneumoni og herpes virus. Pneumocystis profylakse: Trimetoprim-Sulfa 1 tbl daglig, ved allergi Dapson 100 mg daglig eller Pentamidin inhalator 300 mg hver 4. uke (med spesialinhalator) Følg virus-titer og CD4 tall. Antiviral behandling i samråd med infeksjonsmedisiner.
Evidensnivå B
Høydosebehandling med autolog stamcellestøtte
Sist faglig oppdatert: 10.12.2021
Høydosebehandling med autolog stamcellestøtte innebærer bruk av høydose kjemoterapi, eventuelt kombinert med høyvolt helkroppsbestråling som medfører mulig irreversibel skade på de bloddannende stamceller. For å sikre fremtidig benmargsfunksjon, reinfunderes autologe bloddannende stamceller etter fullført høydosebehandling. 157142142142141140140140140140140140140140140140140140140140140140140139139139139139139139139139139139139139139139139139139139139139139139139139139139139139139139139139139138137137136135Stamcellene140140140140 er i forkant høstet fra blod (tidligere fra benmarg), frosset ned på flytende nitrogen og tint umiddelbart før reinfusjonen.
HMAS har fått økende anvendelse ved maligne lymfomer hos pasienter under ca. 65–70 år i god allmenntilstand og med tilfredsstillende organfunksjoner (d'Amore et al., 2012; Geisler et al., 2008; Linch et al., 1993; Philip et al., 1995; Schmitz et al., 2002; Sweetenham et al., 2001). Behandlingen har et som regel kurativt siktemål (langsiktig palliativt siktemål ved f.esk mantelcelle lymfom eller residiv av follikulært lymfom), og det forutsettes en god respons på induksjonsbehandling og perifer stamcellehøsting med et utbytte som er godt nok (> 2 x 106 CD34+ celler/kg kroppsvekt). Bruk av plerixafor (CRCX4-antagonist)) benyttes der CD34+ tallet i blod er lavt, men innenfor et definert «vindu» før høsting for å øke mobliseringen til blod (Girbl, Lunzer, Greil, Namberger, & Hartmann, 2014; Jantunen & Varmavuo, 2014). Plerixafor kan også benyttes etter G-CSF behandling ved nytt forsøk på stamcellehøsting.
Fagmiljøet i Norge regner HMAS ved følgende indikasjoner som etablert behandling
- Residiv av NHL av storcellet B eller T type, eller der man ikke oppnår komplett remisjon på første linje terapi ved disse lymfomer.
- Lymfoblastisk lymfom i første remisjon som et alternativ til vedlikeholdsbehandling med kjemoterapi i tradisjonelle doser.
- Residiv av Burkitt lymfom.
- Residiv av T- og B-lymfoblastisk lymfom, som ikke har fått HMAS som ledd i primærbehandlingen og der allotransplantasjon ikke er aktuelt.
- Mantelcellelymfom i første remisjon.
- Perifert T-cellelymfom i første remisjon (unntatt ALK-positivt storcellet anaplastisk T-celle lymfom)
- Utvalgte pasienter med residiv av follikulært lymfom.
- HL ved residiv eller ved manglende respons på primærbehandling og ved annet eller senere residiv.
- Utvalgte pasienter med residiv av transformert non-Hodgkin B-celle lymfom
Behandling med kimær antigen reseptor T-celler (CAR-T-celler)
Sist faglig oppdatert: 06.03.2023
Beslutningsforum godkjente i oktober 2022 etter flere år med gjentatte vurderinger å innføre CD19 retter CAR-T behandling i Norge. Godkjeningen gjelder for axicabtagene ciloleuce (Yescarta®) til behandling av diffust storcellet B-celle lymfom, primært mediastinalt B-celle lymfom og transformert follikulære lymfomer i 3. linje. Behandlingen tilbys ved Oslo Universitetssykehus for hele landet.
Pasienter som er aktuelle henvises på vanlig måte til OUS. På grunn av kompleksiteten i vurderingene både før henvising, under behandling og i ettertid, skal henvising komme fra regionsykehus pasienten tiljhører. Det er laget egen mal for henvising for å sikre at nødvendig informasjon er tilgjengelig. På grunn av tosksiteten i behandlingen vil det i utgangspunktet være mest aktuelt å henvise pasienter som er i et aldersskikt og har en helsetilstand som vi ellers vuderer som aktuell for HMAS.
God informasjonsflyt og tett samhandling mellom henvisende avdeling og OUS er vesentlig for å sikre effektiv og sikker gjennomføring av forundersøkelser, høsting av T-celler, produksjon av CAR-T produkt, eventuell cytoreduktiv terapi forut for reinfusjon av CAR-T produkt («bridging»), selve behandlingen med lymfodeplesjon og reinfusjon, oppfølging for bivirkninger og effekt i tiden etter behandling.
Vesentlige bivirkninger i fasen tett etter reinfusjon er såkalt cytokin frigjøringssyndrom («cytokine release syndrome») og nevologiske bivirkninger («immune cell associated neurological symptoms). Disse opptrer vanligst ila de første 14 dagene og pasienten vil være på sykehus eller hotell i denne perioden. Pasienten vil følges ved OUS frem til 30 dager etter behandling, men kan være hjemme om reiseveien er under 2 timer.
Vesentlige bivirkninger å følge med på etter behandling er vedvarende cytopeni (alle rekker kan være affisert men spesielt neutropeni og lymfopeni er vesentlige), immunglobulinmangel og infeksjonstendens.
Det er laget egne rutiner for hele CAR-T forløpet som er tilgjengelig på Oslo Universitetssykehus.
Allogen stamcelletransplantasjon med redusert kondisjonering
Sist faglig oppdatert: 10.12.2021
Tradisjonell allogen stamcelle transplantasjon har ikke vunnet frem som noen etablert terapi ved maligne lymfomer. Hovedgrunnen er en høy behandlingsrelatert mortalitet og morbiditet som overskygger en eventuell nytteverdi. En ny form for allogen transplantasjon utprøves nå ved sentre i mange land. Denne metoden innebærer bruk av kondisjoneringsregimer med redusert intensitet, der hensikten først og fremst er å indusere en T-celle suppresjon hos pasientene som gjør det mulig for dem å ta imot og beholde et allogent transplantat. Man mener at transplantatet vil kunne utøve en «graft versus lymphoma» effekt med mulig kurativ effekt på selve kreftsykdommen. Det foreligger nå resultater fra en rekke fase II studier som viser at enkelte pasientgrupper med lymfom kan ha en god effekt, sannsynligvis varig kurasjon av behandlingen, men toksisitet er fortsatt et stort problem (Anderlini et al., 2008; Dean et al., 2005; Dreger et al., 2005; Hertzberg et al., 2006; Khouri et al., 2003; Kusumi et al., 2005; Maris et al., 2004; E. Morris et al., 2004; Sureda et al., 2008; Van Besien, 2006). De publiserte resultatene fra Norge er også oppløftende (Fløisand et al., 2012).
Særlig såkalt transplantat-mot-vert sykdom og infeksjoner, samt organtoksisitet gir en behandlingsrelatert mortalitet på 10–30 %. Denne terapiformen er derfor kun aktuell for selekterte pasienter, men resultatene regnes som så lovende at man forventer at behandlingsformen vil øke i anvendelse i årene som kommer.
En faggruppe har på anmodning fra Helsedirektoratet gitt reviderte retningslinjer for allogen stamcelletransplantasjon. Flere undergrupper av maligne lymfomer er aktuelle (se Vedlegg 4). Pasientene må søkes til Nasjonal gruppe for allogen stamcelletransplantasjon. Vevstyping kan foretas av pasient og eventuelle søsken før vedtak i gruppen er fattet. Før søk etter ubeslektet foretas må det foreligge en anbefaling fra gruppen.
Anbefaling:
Utvalgte pasienter i residivsituasjon, fortrinnsvis pasienter med indolent sykdom, kan søkes til Nasjonal gruppe for allogen stamcelletransplantasjon.
Se deler av rapport: forslag til nasjonale retningslinjer for allogen stamcelletransplantasjon ved maligne lymfomer (Vedlegg 4).
Evidensgrad: C
Retningslinjer for bruk av G-CSF
Sist faglig oppdatert: 10.12.2021
Indikasjoner
Mobilisering av stamceller til perifert blod før autolog stamcellehøsting, dose som regel 10 µg/kg/dag.
G-CSF bør primært benyttes ved kjemoterapi med kurativ intensjon, men kan også vurderes der man ved palliativ kjemoterapi anser det som viktig å opprettholde høy doseintensitet.
Primær profylakse for å opprettholde doseintensitet ved kjemoterapi, der man har dokumentasjon på at dette ikke er mulig uten G-CSF (eks CHO(E)P-14, doseeskalert BEACOPP).
Primær profylakse hos pasienter i aplasi etter HMAS
Sekundær profylakse ved kjemoterapi der pasienten etter tidligere kur fikk neutropen feber.
Sekundær profylakse for å opprettholde doseintensitet ved kjemoterapi, der man har erfart at den aktuelle pasient utviklet neutropeni som ville føre til dosereduksjon eller utsettelse av kur (eks CHOP-21, standard BEACOPP).
Langvarig neutropen feber hos kritisk syk pasient (eks. alvorlig pneumoni, hypotensjon, alvorlig sepsis, soppinfeksjon)
Eldre pasienter (over 65 år) med aggressive lymfomer har lavere toleranse for intensiv kjemoterapi enn yngre. Man bør generelt ha lav terskel for å tilby støttebehandling med G-CSF som primærprofylakse til eldre pasienter.
Dose G-CSF (filgrastim, Neupogen®, Tevagrastim®, Nivestim® eller tilsvarende) som skal benyttes (når stamcellembilisering ikke er målet), er 5 µg/kg/dag, for pasienter over 80 kg benyttes 480 µg x 1 s.c., for øvrig benyttes 300 µg x 1 s.c. (i protokollerte studier kan doseringen være annerledes). G-CSF benyttes fra 2–5 dager etter kur til neutrofile > 5 x 109/l eller > 1 x 109/l i tre dager. En depotformulering av G-CSF (pegfilgrastim, Neulasta®, Lonquex®) anses som likeverdig med filgrastgim og blir benyttet i økende grad). Preparatet settes som en éngangsinjeksjon, 6 mg uavhengig av kroppsvekt én gang 1-2 dager etter gjennomført kur. Det er ikke dokumentert at dette er likverdig med filgrastim for mobilisering av stamceller til blod.
Man anbefaler ikke rutinemessig bruk av G-CSF ved:
Neutropeni uten feber mellom kurer.
Generelt ved neutropen feber, unntatt der pasienten er kritisk syk.
Forholdsregler
Grunnet rapporter om anafylaktoide reaksjoner etter G-CSF administrasjon, bør første dose gis på legekontor / sykehus med anafylaksiberedskap.
Rituximab/anti-CD-20 antistoffer – administrasjon, profylakse og sekundær immunsvikt
Sist faglig oppdatert: 10.12.2021
Rituximab brukes nå rutinemessig på alle avdelinger som behandler maligne lymfomer. Erfaringsgrunnlaget er derfor stort og litteraturen svært omfattende. Dette avsnittet er derfor ikke uttømmende, men har som mål å rette søkelyset på en del nyere, praktiske aspekter og problemstillinger ved bruk av dette medikamentet.
Det har gjerne utviklet seg litt forskjellige lokale rutiner, men generelt gis profylakse med paracet og antihistamin 30–60 minutter før kur. Det er også vanlig å gi Prednisolon 50–100 mg i alle fall før første kur. Denne gis også saktere enn påfølgende kurer, da det er størst risiko for infusjonsrelaterte bivirkninger initialt. Puls og blodtrykk (BT) monitoreres av sykepleier mens infusjonshastigheten gradvis økes. Risiko for slike bivirkninger er assosiert med tumorbyrde, proliferasjon og først og fremst leukemisering. Tradisjonelt har man krevet lymfocytter < 10 x 10-9 L, men denne grensen er senere flyttet til < 25. Høyrisikopasienter bør alltid ha Prednisolon samt tumorlyse profylakse. Det anbefales å starte med halv fart. Man kan også vurdere å dele dosen over 2 dager.
Rituximab finnes nå også tilgjengelig for subkutan injeksjon. Det doseres i en fast dose på 1400 mg gitt sammen med hyaluronidase, og dette gir like god biotilgjengelighet og effekt som intravenøst medikament. Det tolereres vanligvis godt og er tidsbesparende, slik at det anbefales å bruke denne administrasjonsformen som standard. Dette gjelder både som monoterapi og i kombinasjon med kjemoterapi både ved lavgradig og høygradig maligne B-cellelymfomer. Alle skal imidlertid ha 1. kur intravenøst og ha gjennomført en full kur i løpet av en dag før man skifter. Subcutant medikament kommer i en oppløsning som rommer 11,7 ml. Dette settes langsomt over ca. 5–6 minutter for å redusere risiko for komplikasjoner og ubehag. Alle pasienter observeres 15 minutter etterpå.
Rituximab er generelt godt tolerert, bortsett fra de infusjonsrelaterte bivirkninger man ofte ser innledningsvis. Dette er i grunnen overraskende, når man vet at ikke bare lymfomceller men også friske B-lymfocytter blir mer eller mindre eradikert så lenge man holder på og i flere måneder etter avsluttet behandling. I praksis har det også vist seg at rituximab kombinert med kjemoterapi gir en mer alvorlig subakutt immunsvikt enn det man ser etter kjemoterapi gitt alene. Det er blant annet påvist høyere risiko for Pneumocystis jiroveccii, og vi bruker derfor PCP profylakse når man gir behandling med høy doseintensitet (R-CHOP-14). Det er også observert økt risiko for reaktivering av latent hepatitt B etter kombinasjon av rituximab og kjemoterapi. I disse tilfeller vil det også være aktuelt med profylakse, for eksempel entekavir (se eget avsnitt).
Med økende bruk av rituximab og ikke minst ved langtidsbruk og vedlikeholdsbehandling, kan det oppstå nye utfordringer. Ikke overraskende vil man hos mange observere en hypogammaglobulinemi pga fravær av normale B-lymfocytter. Dette vil kunne bidra til immunsvikten. I tillegg ser man relativt hyppig utvikling av en såkalt «late onset neutropeni» (LON). Dette er erfaringsmessig en relativt benign og ofte selvbegrensende komplikasjon, men kunnskapen om dette er foreløpig utilstrekkelig.
Følgende tiltak/algoritme foreslås ved start behandling med Rituximab eller R-kjemo og vedlikehold Rituximab
- Første kur (R eller R-kjemo): Lymfocytter < 25 x 10-9L
- Vedlikehold R mono: Neutrofile ≥ 0,5 x 10-9L
- Ved IgG < 3 g/L, vurder nytteverdi av R vedlikehold opp mot infeksjonsrisiko
- Neutrofile < 0.5 ved R mono fører til midlertidig stopp av rituximab uten ytterligere tiltak
- Infeksjon/feber behandles på vanlig måte, evt som febril neutropeni ved neutrofile < 0,5
- Ved gjentatt infeksjon og fortsatt neutropeni gis G-CSF i tillegg til antibiotika
- Ved gjentatt infeksjon og IgG < 3 startes substitusjon, f.eks. Kiovig 20–30g q 4. uke (nadir IgG>6)
Infeksjonsprofylakse og retningslinjer for vaksinasjon
Hepatitt B
Sist faglig oppdatert: 10.12.2021
Hepatitt B virus reaktivering ved immunsuppressiv behandling
Pasienter smittet med hepatitt B (HBV core antistoff positive) har risiko for reaktivering eller forverring av eventuell aktiv hepatitt B når deres immunitet svekkes. Vær spesielt oppmerksom på etnisk asiatiske pasienter der hepatitt B er mye vanligere enn hos oss. All medikamentell immunsuppresjon kan medføre reaktivering, men risikoen er høyere ved behandling med glukokortikoider (Prednisolon > 20 mg/dag), antracycliner og purinanaloger, tyrosinkinase hemmere, mTOR hemmere, anti TNF alfa og spesielt anti CD 20 antistoffer (rituximab) og bredere antilymfocytt antistoffer, samt pasienter som skal gjennomgå stamcelletransplantasjon (Lok & Bonis, 2016).
Pasienter som er HBV core antistoff positive bør få sjekket ALAT, HBV surface antigen og HBV DNA nivå (gjøres på Folkehelseinstituttet) før oppstart immunsuppressiv behandling. Pasienter som er HBV surface antigen positive har høyest risiko for reaktivering, spesielt hvis de også er HBV e antigen positive eller har målbart HBV DNA nivå (opp til 70 %), selv ved kjemoterapi for solide svulster. Pasienter som er HBV surface antigen negative har vesentlig lavere risiko for reaktivering, men dersom de skal behandles med anti CD20 antistoffer (rituximab) er risikoen likevel opp til 40 % for reaktivering og de bør få forebyggende behandling.
Reaktivering er som oftest asymptomatisk og manifesterer seg bare med en økning i HBV DNA nivå (tidligere HBV DNA negative blir positive eller HBV DNA nivå øker med to log10 eller mer). Andre kan i tillegg ha en økning i aminotransferaser (ALAT) med eller uten kliniske symptomer som kvalme og oppkast. Alvorlig reaktivering er assosiert med ikterus, hepatisk dekompensering og i verste fall død. Pasienter med cirrhose har mer alvorlig prognose.
Anbefalinger:
Reaktivering forebygges med entekavir (Baraclude 0,5 mg x 1). Dosen reduseres ved redusert nyrefunksjon – se Felleskatalogen. Entekavir skal ikke brukes til pasienter som tidligere har vært behandlet med lamivudin. Tenofovir (Teva 245 mg x 1) bør velges hvis pasienten tidligere har vært behandlet med lamivudin. Tenofovir skal ikke brukes ved nedsatt nyrefunksjon – se Felleskatalogen. Hepatitt B virus viser nå så høy forekomst av resistens mot lamivudin at dette preparatet ikke bør brukes. Forebyggende behandling bør startes før eller samtidig med immunsuppressiv behandling, og vedvare minst seks måneder etter immunsuppressiv behandling er avsluttet. Etter behandling med anti CD 20 (rituximab) skal forebyggende behandling vedvare minst 12 måneder. Forebyggende behandling er effektiv og reduserer risiko for reaktivering med 90 %.
Evidensgrad: B
Pneumocystis jirovecii
Sist faglig oppdatert: 10.12.2021
Langvarig steroidmedikasjon og doseintensivert kjemoterapi med forkortet doseintervall (eksempel CHO(E)P14) gir økt risiko for pneumocystis jirovecii pneumoni (PJP) (Kolstad, Holte, et al., 2007). Bruk av rituximab og alemtuzumab synes å øke denne risikoen. Ved følgende kurer anbefales derfor PJP profylakse: CHOP eller CHOEP gitt med 14 dagers intervall med eller uten rituximab, EPOCH med eller uten rituximab, BEACOPP, Hammersmith- og liknende ALL regimer, purinanaloger i kombinasjon med stereoider og/eller rituximab, Bendamustin, ved bruk av alemtuzumab samt i forbindelse med høydose kjemoterapi med autolog eller allogen stamcellestøtte. Profylakse gis med trimetoprim – sulfa 1 tbl daglig. Ved allergi eller annen intoleranse er dapson eller pentamidininhalasjon alternative regimer.
Anbefaling:
Pasienter som får langvarig steroidmedikasjon og doseintensivert kjemoterapi har økt risiko for pneumocystis jerovecii-pneumoni og bør ha PJP profylakse med trimetoprim-sulfa.
Evidensgrad: B
Herpes hominis virus
Sist faglig oppdatert: 10.12.2021
Reaktivering av herpes virus under pågående tung kjemoterapi sees ved tilsvarende regimer som er omtalt i avsnittet over (pneumocystis jirovecii). Profylakse kan gis med aciclovir 200 mg x 3 eller valaciclovir 500 mg x 2 (Glenny, Fernandez Mauleffinch, Pavitt, & Walsh, 2009).
Anbefaling:
Profylakse mot herpesvirus med aciclovir elller valacyclovir anbefales ved tung kjemoterapi.
Evidensgrad: A
CMV reaktivering og infeksjon
Sist faglig oppdatert: 10.12.2021
CMV reaktivering overvåkes ved å måle virusmengden regelmessig før og under behandling med alemtuzumab og i forbindelse med allogen stamcelletransplantasjon (Boeckh & Ljungman, 2009). Det samme må vurderes for pasienter med lymfomer etter transplantasjon med solide organer som får kjemoterapi sammen med immunsuprresiv behandling. Ved økt virusmengde startes såkalt preemptiv behandling med ganciclovir, valganciclovir eller foscarnet. Behandlingen bør gis i samråd med infeksjonsmedisiner eller etter institusjonens retningslinjer.
Anbefaling:
CMV overvåking og preemptiv behandling med ganciclovir, valganciclovir eller foscarnet anbefales før og under behandling med alemtuzumab og i forbindelse med allogen stamcelletransplantasjon.
Evidensgrad: B
Retningslinjer for vaksinasjon
Sist faglig oppdatert: 10.12.2021
Splenektomi
Ved elektive inngrep gis konjugert 13-valent pneumokokkvaksine (Prevenar®), evt. også hemofilus- og meningokokkvaksine, senest 2 uker preoperativt. Polysakkarid 23-valent (Pneumovax®) gis tidligst 8 uker etter den konjugerte vaksinen av fastlege eller ved vaksinasjonspoliklinikk.
Ved akutt splenektomi, se under de ulike vaksiner
Pneumokokkvaksiner
- Konjugert 13-valent (Prevenar®). Gis før utskrivelse etter akutt splenektomi.(Del av barnevaksinasjonsprogrammet siden 2006.) Blå resept § 4.3
- Polysakkarid 23-valent (Pneumovax®). Gis til barn > 2 år og voksne, tidligst 8 uker etter konjugert 13-valent vaksine (Prevenar®). Før utskrivelse etter akutt kirurgi hvis konjugert 13-valent vaksine ikke skal gis. Blå resept § 4.3
Måling av titer/revaksinasjon etter 3 år ved splenektomi for cancer.
Polysakkarid 23-valent vaksine induserer ikke T-cellemediert immunitet, immunologisk hukommelse eller slimhinne-immunitet; gir 50–70 % beskyttelse mot invasiv pneumokokksykdom. Konjugert 13-valent vaksine dekker kun 50 % av pneumokokkstammene; gir immunitet hos barn < 2 år. Begge vaksiner gis voksne og barn > 2 år.
Meningokokkvaksine (konjugert vaksine mot gruppe A, C, W 135 og Y; Menveo®, Nimenrix®, blå resept § 4.3) til pasienter < 25 år. Behovet for revaksinasjon uavklart. Vaksine mot gruppe B (Bexsero®) er også godkjent.
Hemofilusvaksine (konjugert vaksine mot type b, Act-Hib®). Hemofilusvaksine har inngått i barnevaksinasjonsprogrammet siden 1992. Gis til uvaksinerte, før utskrivelse. Revaksinasjon ikke nødvendig.
Influensavaksine. Alle splenektomerte bør tilbys influensavaksine årlig p.g.a. farene forbundet med bakterielle sekundærinfeksjoner (gis av fastlege, nevnes i epikrise).
Antibiotika
Splenektomerte skal alltid ha fenoksymetylpenicillin (ved allergi erytromycin) for hånden og starte behandling selv ved luftveisinfeksjoner med gulgrønt ekspektorat, sår hals og symptomer på mellomørebetennelse og lungebetennelse hvis de ikke umiddelbart kommer til lege. Anbefales også etter tannekstraksjoner. Resept ved utskrivelse fornyes av fastlege (tablettenes holdbarhet ca. 3 år).
Anbefaling:
Vaksinasjon i forbindelse med splenektomi anbefales mot Pneumokokker (to ulike, kompletterende vaksiner), Meningokokker for pasienter under 25 år, Hemofilus til uvaksinerte og årlig mot influensa.
Autolog og allogen stamcelletranslantasjon
De ulike regionsykehus har utarbeidet retningslinjer for revaksinasjon etter autolog og allogen stamcelletransplantasjon. Disse retningslinjene er i tråd med internasjonale anbefalinger (Ljungman et al., 2009) og dekkes nå etter blåreseptordningen, § 4.3. Det bør utvises forsiktighet med bruk av levende vaksiner hos immunsupprimerte pasienter, og det anbefales å konferere med infeksjonsmedisiner eller Folkehelseinstituttet der slik vaksinasjon er aktuelt. Antistofftiteret bør måles og evt. opprettholdes ved revaksinasjon inntil hvert 3. år. Antistofftiter kan måles ved å sende serumprøve til Folkehelseinstituttet. Influensavaksine kan med fordel gis til pasienter som er under cellegiftbehandling, men effekten av vaksinen kan være nedsatt hos immunsupprimerte pasienter.
Anbefaling:
Revaksinasjon anbefales etter autolog og allogen stamcelletranslantasjon etter regionale retningslinjer.
Evidensgrad: C
Profylakse mot bakterie- og soppinfeksjoner
Sist faglig oppdatert: 10.12.2021
Anbefaling:
Norsk tradisjon tilsier at vi er tilbakeholdne med bruk av profylakse mot bakterieinfeksjoner og mot soppinfeksjoner som candida. Enkelte internasjonale studieprotokoller kan imidlertid ha som krav at slik profylakse gis.
Tumorlyse syndrom
Sist faglig oppdatert: 10.12.2021
Dette betegner en tilstand med hyperkalemi, hypermagnesemi, hyperfosfatemi, hyperurikemi samt forhøyet kreatinin og urinstoff som tegn på nyresvikt og som oppstår når et stort antall kreftceller går raskt i oppløsning. Spontan utvikling av tumorlysesyndrom ses fra tid til annen. Det er viktig å være oppmerksom på og forebygge utvikling av denne livstruende komplikasjonen ved kreftformer der oppstart av behandling medfører raskt celledrap. Problemet ses ofte ved akutte leukemier, lymfoblastlymfom og Burkitt lymfom, mindre hyppig ved andre aggressive B og T-celle lymfomer, og fortrinnsvis der det forligger store tumormasser. Det kan også forekomme ved mer indolente lymfomer med massiv leukemisering som behandles med monoklonale antistoffer. Tilstanden ses kun i forbindelse med første kur eller i starten av stråleterapi. Man bør være oppmerksom på at det også kan utløses ved start av steroider alene. Ved akutte leukemier og lymfoblastiske lymfomer er det vanlig å gi kjemoterapi med redusert intensitet initialt, med den hensikt å forhindre tumorlyse. Tumorlyse er omtalt i eget kapittel i «Cytostatikaboken», 8. utgave (Dahl, Lehne, & Christoffersen, 2016). Man bør være forsiktig ved bruk av aminoglykosider etter 1. kur ved aggressive lymfomer der faren for tumorlyse er stor.
Profylakse mot tumorlyse syndrom består av allopurinol 300-600 mg/d og forsert diurese ( man tilstreber en diurese på 2-3 l per døgn), ved aktiv tumorlysesyndrom økes diurese til 4–5 l per døgn de første 2–3 døgn. Alkalisering av urin gjøres ikke rutinemessig. Alkalinisert diurese øker presipitasjon av kalsiumfosfatkrystaller i nyrene, men nedsetter utfelling av urinsyrekrystaller (som kan forebygges ved allopurinol og/eller rasburicase). Alkalisering er kun vesentlig ved høydose MTX da det gir lavere nyretoksisitet av metotreksat. Pasientene bør observeres nøye de første døgn og undersøkes daglig mht elektrolyttforstyrrelser og stigning i urinsyre, kreatinin og urea. Pasienter som på forhånd har redusert nyrefunksjon, er mer utsatt. Skulle det komme tegn til alvorlig tumorlyse syndrom med nyresvikt, bør nefrolog kontaktes.
Det kan i sjeldne tilfeller bli nødvendig med hemodialyse. Rasburicase (Fasturtec®) hindrer og reduserer hyperurikemi. Dette er en rekombinant urinsyre oksydase og er svært effektivt. Man vil ofte komme til målet med en tredjedel av den anbefalte dose, evt gjentatt. Mange vil anbefale det brukt ganske liberalt ved de mest aggressive lymfomer, og man bør da gi dette som profylakse som alternativ til allopurinol. Rasburicase bør uansett finnes tilgjengelig ved alle avdelinger som behandler kreftformer der tumorlyse syndrom kan forekomme.
Hyperfosfatemi kan om nødvendig korrigeres med orale fosfatbindere, her kan gjerne sevelamerkarbonat (Renvela®) vurderes, evnt etter råd fra nefrolog.
Kontroll, oppfølging og rehabilitering
Generelt
Sist faglig oppdatert: 10.12.2021
Kontroll av pasienter behandlet for malignt lymfom har to formål, dels å påvise residiv eller sykdomsprogresjon, dels å identifisere komplikasjoner og andre uheldige følger av behandlingen.
Kontrollopplegget vil avspeile behandlingsmålet ved påvisning av residiv eller behandlingstrengende sykdomsprogresjon, lymfomets presentasjonsform og dets aggressivitet: Det er viktigere med hyppige kontroller ved et aggressivt lymfom der det er kurativt mål ved residivbehandlingen enn ved et indolent lymfom der ubehandlet observasjon er naturlig med mindre pasienten har plager av sykdommen. Undersøkelser har vist at de fleste residiver oppdages av pasienten selv mellom kontrollene (Elis et al., 2002). Det er heller ikke dokumentert at et tidlig påvist residiv gir bedre prognose enn der residivet er oppdages av pasienten selv (Guadagnolo, Punglia, Kuntz, Mauch, & Ng, 2006; Lin et al., 2012). Følgelig er et rigid kontrollopplegg med hyppige blodprøver og billedkontroller av begrenset verdi. De fleste residiver opptrer for øvrig i lokalisasjoner der det tidligere har vært sykdomsaffeksjon.
Hva som bør danne basis for kontrollenes innhold
Sist faglig oppdatert: 10.12.2021
Alle kontroller bør omfatte anamnese og klinisk undersøkelse, med spesiell vektlegging på glandelstatus og undersøkelse av hjerte, lunger og abdomen. Man bør fokusere på områder som har vært affisert av lymfom og strålebehandlete organer/områder med tanke på residiv og bivirkninger etter behandling. Blodprøvetaking utføres ved alle kontroller og bør innbefatte hematologiske prøver med differensialtelling av leukocytter, SR, LDH, TSH og fritt T4 hos pasienter som har fått strålebehandling mot hals og/eller øvre del av mediastinum, leverfunksjonsprøver og nyrefunksjonsprøver (særlig etter strålebehandling mot nyreregionene eller nefrotoksisk terapi ellers). Kvinner i fertil alder bør følges med LH, FSH, østrogen og SHBG.
Kontroller hos pasienter med økt risiko for hjerte- og karsykdom etter strålebehandling mot hals og thorax bør også ha fokus på vanlige risikofaktorer for slike sykdommer (røyking, overvekt, fysisk aktivitet, måling av blodtrykk og kolesterol).
Billedkontroll av thorax: En kan benytte enten rtg-thorax eller CT-thorax, men MR kontroll bør overveies der hyppige kontroller er påkrevet, spesielt hos barn og ungdom for å redusere strålebelastningen.
Billedkontroll av abdomen og bekken: Benytt ultralyd av lever, milt og retroperitoneum hos slanke pasienter fremfor CT. Multiple CT-kontroller innebærer en ikke ubetydelig strålebelastning over tid, og som alternativ til CT kontroller bør MR overveies. Hos barn og ungdom bør MR således innføres som rutine.
Oppleggene for kontroll gitt nedenfor er kun retningsgivende og gjelder så lenge pasienten er i remisjon. Ved kurativ behandling for HL og NHL kontrolleres respons minst en gang under kjemoterapi samt etter avsluttet kjemo- og eventuelt strålebehandling. Ved palliativt rettet kjemoterapi blir kontrollopplegget skjønnsmessig, likeledes for pasienter som observeres ubehandlet.
Kontrollopplegg for ulike lymfomer
Sist faglig oppdatert: 06.03.2023
Retningslinjene under gjelder for pasienter uten spesifikke symptomer, som i så fall bør foranledige videre relevante undersøkelser. De er retningsgivende og bør kunne fravikes basert på individuelle vurderinger. For utvalgte pasienter, f eks de med god prognose og som ikke har vesentlige senbivirkninger, eller med lang reisevei til kontroll vil telefonkonsultasjoner eller digitale konsultasjoner kunne erstatte oppmøte, etter individuell vurdering.
Hodgkin lymfom
Behandlingsmålet er kurasjon etter første-linjebehandling og også etter residiv-behandling for de fleste pasienter. Blodprøver bør innbefatte det som er angitt over. Klinisk undersøkelse gjøres ved alle kontroller.
- Første kontroll 1–2 mnd etter fullført terapi har til hensikt å avklare om pasienten er i komplett remisjon. Undersøkelsen skal innbefatte billedkontroll med CT, eventuelt PET/CT om interim PET/CT ikke viste komplett metabolsk respons
- De første 2 år etter fullført terapi kontroll hver 3. mnd. Ved usikre funn etter behandling kan ny kontroll med CT eller PET/CT etter 3 mnd vurderes. CT eller rtg-thorax + UL-abdomen etter ett år for pasienter som var i stadium IIB – IV ved diagnose.
- Pasienter som er i remisjon etter to år kan henvises til primærhelsetjesten med årlige kliniske kontroller med angivelse av retningslinjer for hva kontrollene bør innbefatte (eks thyreoideafunksjonsprøver TSH og FT4 hos pasienter som har gjennomgått strålebehandling mot hals). Kontrollene avsluttes etter 5 år om det ikke er gitt strålebehandling mot hals eller thorax.
- For pasienter som har gjennomgått strålebehandling mot hals eller thorax, anbefales livslang kontroll i primærhelsetjenesten fra 5 år med vektlegging på hjerte- og lungesymptomer, risikofaktorer for hjerte- og karsykdommer, stoffskifte og mammografi (se kapittel Seneffekter etter stråleterapi og Seneffekter etter kjemoterapi) der dette er aktuelt. Da bivirkningene etter strålebehandling kan komme sent, taler mye for at pasienter som har fått strålefelt mot hals eller mediastinum bør kontrolleres videre hele livet.
- Utvalgte pasienter bør følges i spesialisthelsetjenesten. Dette gjelder først og fremst pasienter som lider av langtidsbivirkninger som for eksempel fatique, uttalt nevropati og annet som i mange tilfeller forhindrer normal tilbakeføring i arbeidslivet hos yngre. Det er her spesielt viktig at leger ved lokalsykehus har kompetanse og interesse for denne pasientgruppen og kjenner til langtidsbivirkningene etter kreftbehandling (Foss Abrahamsen et al., 2002; Sankila et al., 1996).
Aggressivt non-Hodgkin lymfom
Behandlingsmålet er kurasjon etter første linjebehandling og også etter første residivbehandling for de fleste pasienter under 65 år. Blodprøver tas ved alle kontroller og innbefatter det som er angitt over. Klinisk undersøkelse gjøres ved alle kontroller.
- Første kontroll 1–2 mnd etter avsluttet terapi har til hensikt å avklare om pasienten er i komplett remisjon. Undersøkelsen skal innbefatte billedkontroll med CT eller PET/CT og eventuelt benmargsundersøkelser av positive funn før behandlingsstart.
- Første 2 år kontroll hver 3. mnd. CT thorax/abdomen/bekken utføres etter ett år kun hos de som var i stadium IIB – IV ved diagnose.
- Pasienter som er i remisjon etter to år kan henvises til primærhelsetjesten med årlige kliniske kontroller med angivelse av retningslinjer for hva kontrollene bør innbefatte (eks thyreoideafunksjonsprøver TSH og FT4 hos pasienter som har gjennomgått strålebehandling mot hals). Kontrollene avsluttes etter 5 år om det ikke er gitt strålebehandling mot hals eller thorax.
- For pasienter som har gjennomgått strålebehandling mot hals eller thorax, anbefales livslang kontroll i primærhelsetjenesten fra 5 år med vektlegging på hjerte- og lungesymptomer, risikofaktorer for hjerte- og karsykdommer, stoffskifte og mammografi (se kapittel Seneffekter etter stråleterapi og Seneffekter etter kjemoterapi) der dette er aktuelt. Da bivirkningene etter strålebehandling kan komme sent, taler mye for at pasienter som har fått strålefelt mot hals eller mediastinum bør kontrolleres videre hele livet.
- Utvalgte pasienter bør følges i spesialisthelsetjenesten. Dette gjelder først og fremst pasienter som lider av langtidsbivirkninger som for eksempel fatique, uttalt nevropati og annet som i mange tilfeller forhindrer normal tilbakeføring i arbeidslivet hos yngre. Det er her spesielt viktig at leger ved lokalsykehus har kompetanse og interesse for denne pasientgruppen og kjenner til langtidsbivirkningene etter kreftbehandling.
Indolent non-Hodgkin lymfom
Behandlingsmålet er kurasjon kun ved strålebehandling mot sykdom i stadium I eller stadium II, begrenset utbredelse. Alle pasienter bør gjennomgå nøye klinisk undersøkelse, evt. med billedundersøkelser etter avsluttet behandling for å stadfeste om det er oppnådd en tilfredsstillende remisjon eller ikke. Blodprøver tas ved hver kontroll og innbefatter det som er angitt over. Klinisk undersøkelse gjøres ved alle kontroller.
- Første kontroll 1–2 mnd etter fullført terapi bør innbefatte billedkontroll med CT og benmargsundersøkelser der dette er nødvendig for å stadfeste remisjonsstatus. Dette kan være av betydning ved senere tilkomne symptomer og funn.
- Første år: Klinisk kontroll hver 4. mnd. Rtg-thorax og ultralyd-abdomen eller CT av thorax/abdomen/bekken tas eventuelt etter ett år på grunnlag av klinisk skjønn. Ikke nødvendig for de som mottok stråleterapi for stadium I/II sykdom med kurativt siktemål.
- 2-5 år: Halvårlige kliniske kontroller for de med utbredt sykdom bør dette foregå i spesialisthelsetjenesten. De som mottok stråleterapi for stadium I/II med kurativt siktemål kan følges i primærhelsetjenesten.
- Videre årlige kontroller i spesialisthelsetjenesten på ubestemt tid for de som hadde stadium III og IV ved diagnose. Pasienter i stadium I og II som gjennomgikk stråleterapi med kurativt siktemål kan kontrolleres videre hos fastlege.
Ved indolente lymfomer kan alle kontroller etter den første overføres til lokalsykehus. Retningslinjer for når fastlege skal henvise pasienten tilbake til lokalsykehus bør være avklart. Et påvist tilbakefall uten symptomer innebærer ikke nødvendigvis at det foreligger behandlingsindikasjon.
Kontroll etter høydosebehandling med autolog stamcellestøtte
Sist faglig oppdatert: 10.12.2021
Ved residiv etter HMAS har man sjelden et kurativt behandlingstilbud. Unntaket gjelder sjeldne lokaliserte residiver som kan kontrolleres med strålebehandling, yngre pasienter som kan oppnå ny remsijon og henvises til allogen transplantasjon og pasienter der den medisinske utvikling gir grunnlag for studier med nye behandlingsformer. Mange pasienter med residiv etter slik behandling for indolente lymfomer, transformerte lymfomer og HL kan også leve lenge (mange år) med god livskvalitet etter at residiv er påvist. Ved residiv av aggressivt NHL er forløpet oftest mer fulminant.
Komplikasjoner og bivirkninger etter gjennomført behandling må påvises og registreres. Fysikalsk behandling ved muskel-skjelettplager er ofte nyttig. Psykiske plager kan opptre lang tid etter avsluttet behandling. En del pasienter må rehabiliteres til mindre tungt og krevende arbeid.
Ved utskriving etter HMAS skal pasienten informeres om gjeldende vaksinasjonsprogram: Full revaksinering (tre doser) av stivkrampe, difteri og kikhoste anbefales etter 12 mnd. Pneumokokkvaksine anbefales etter ett år, deretter ca. hvert 5. år på grunnlag av antistofftiter. Influensavaksinering kan være nyttig, men gis mer etter individuelt skjønn. Levende og perorale vaksiner bør unngås i 2 år etter HMAS. Utgifter til vaksiner etter HMAS dekkes nå av blåreseptordningen, § 4.3.
Intervallene mellom kontrollene kan følge de som gjelder for de ulike lymfomtyper.
Kliniske studier har egne opplegg for kontroller.
Seneffekter etter stråleterapi
Sist faglig oppdatert: 06.03.2023
Det er viktig å være klar over at stråleterapi (ordnet etter region bestrålt og generelt til slutt)
- mot munnhule gir munntørrhet og økt hyppighet av karies og tannkjøttsykdommer. Der tannlege kan dokumentere nedsatt tannhelse som følge av strålebehandling, har pasienten rett til refusjon av utgifter til tannbehandling etter dokumentasjon fra onkolog eller annen relevant spesialist om gitt behandling (konf. Folketrygdens § 5.6, pkt 3, 4, 13)
- mot halsen gir hypothyreose hos flere enn 50 % av pasientene etter lang oppfølgingstid. Det er økt risiko for arteriosklerose og problemer med blodforsyningen til hjernen (transitorisk ischemisk attakk, slag)
- mot thorax/mediastinum/aksiller gir økt risiko for brystkreft for kvinner som er strålebehandlet før 30-års alder. Slike kvinner skal tilbys screening for bryskreft (se avsnitt under, om Screening for brystkreft). Det er fare for redusert lunge og/eller hjertefunksjon. Hjertesykdom kan manifestere seg som koronar hjertesykdom, hjertesvikt og/eller klaffefeil. Ved symptomer eller funn som taler for slike komplikasjoner, bør pasientene henvises til spesialist med lungefunksjonstesting og adekvat hjertefunksjonsundersøkelse (ekkokardiografi, arbeids-EKG, koronarangiografi etc.).
- mot abdomen kan gi diaré og malabsorbsjon
- mot muskulatur gir fibrose, atrofi og nedsatt gjennomblødning med myalgier og belastningsskader til følge. Disse pasientene har oftest nytte av fysioterapi (varme, massasje og øvelser), og har rett på fritak fra egenandel (konf. Folketrygdens § 5.8, pkt. 5b).
- mot aksiller, lysker og ekstremiteter kan føre til lymfødem. Lymfødembehandling hos fysioterapeut med spesialkompetanse er av stor verdi ved slike symptomer. Husk fritak fra egenandel, (konf. Folketrygdens § 5.8, pkt. 6).
- gir generelt økt risiko for sekundærcancer innenfor bestrålt område også av andre typer enn brystkreft (lunge, thyreoidea, basaliomer, maligne melanomer). Pasienter som fortsatt røyker etter strålebehandling mot mediastinum løper en spesielt høy risiko for å få lungekreft og bør oppfordres til å slutte.
Helsedirektoratet i samarbeid med Kreftforeningen og Norsk Lymfomgruppe har i 2012 laget en brosjyre med informasjon: «Til deg som har fått strålebehandling for lymfekreft, informasjon om mulige seneffekter»
https://www.helsedirektoratet.no/brosjyrer/til-deg-som-har-fatt-stralebehandling-for-lymfekreft
Screening for brystkreft
Etter samtaler med Norsk Gruppe for brystcancer (NBCG) våren 2020 er det kommet et nytt og revidert forslag til hvordan screening for brystkreft hos kvinner skal foregå.
Kvinner som har fått strålebehandling mot thoraxregionen der brystvev inngår i feltet under en alder av 35 år, kan inngå i screening. Det er ikke lett på faglig grunnlag å avgjøre om det finnes en nedre grense for dose eller andel bestrålt brystvolum under hvilke man ikke vil anbefale screening. Denne avgjørelse overlates best til den enkelte onkolog med ansvar for pasientens strålebehandling.
På bakgrunn av dette anbefales tidlig diagnostikk til kvinnelige kreftoverlevere der onkolog etter individuell risikovurdering finner behov for slik oppfølging. Onkolog, fastlege og pasient må sammen passe på at oppfølging blir startet på rett tidspunkt. Tilbudet er differensiert etter brysttetthet da MR som tillegg til mammografi er viktigst hos kvinner med høy brysttetthet. Radiolog må derfor informere om brystetthet i svaret slik at tilbudet kan justeres ved behov.
Anbefaling:
- Disse kvinnene skal ha tilbud om årlig billeddiagnostikk fra 8-10 år etter mottatt strålebehandling, men ikke før fylte 25 år.
- Ved brysttetthet c og d tilbys pasienten årlig mammografi (ett skråbilde av hvert bryst) samt årlig MR mamma fram til fylte 70 år.
- Ved brystetthet a og b tilbys pasienten årlig to-plans mammografi fram til fylte 70 år.
- Etter 70 års alder er det onkolog eller fastlege som har ansvar for å vurdere om risikoprofil og generell helse tilsier at det er nødvendig med videre oppfølging med mammografi. Det er ikke aktuelt å gjøre MR mamma etter fylte 70 år.»
Screening kan foregå på alle sykehus med brystdiagnostisk senter (BDS). Det er forstått slik at radiolog vil foreta vurderingen om mammografisk tettet og at henvising til BDS kun bør inneholde ønsket om screening etter strålebehandling.
God informasjon til pasienten ved siste kontroll på sykehus etter behandling, typisk etter 2 eller 5 år, er vesentlig.
Se også: https://www.helsedirektoratet.no/retningslinjer/brystkreft-handlingsprogram
Seneffekter etter kjemoterapi
Sist faglig oppdatert: 10.12.2021
Det er viktig å være klar over at gjennomgått tung kjemoterapi
- Kan føre til infertilitet (spesielt alkylerende cytostatika og strålebehandling mot gonadene).
- Høye akkumulerte doser av bleomycin og doksorubicin kan føre til henholdsvis lunge- og hjertesvikt, spesielt i kombinasjon med strålebehandling mot mediastinum.
- Vinkristin gir regelmessig polynevropati og kan i alvorlige tilfelle kvalifisere til fritak fra egenandel hos fysioterapeut. (konf. Folketrygdens § 5.8, pkt. 3).
- Der tannlege kan dokumentere nedsatt tannhelse som følge av intensiv kjemoterapi / høydose kjemoterapi, har pasienten rett til refusjon av utgifter til tannbehandling etter dokumentasjon fra onkolog eller annen relevant spesialist om gitt behandling (konf. Folketrygdens § 5‑6, pkt 3, 4, 13)
- Sekundære leukemier/ myelodysplasi forekommer hyppigere hos de som har fått høye akkumulerte doser særlig av enkelte alkylerende stoffer og topoisomerase-hemmere (etoposid, tenoposid).
- Rundt 20-30 % av pasientene utvikler uforklarlige tretthetssymptomer (kronisk fatigue) som kan medføre grader av uførhet og nedsatt livskvalitet i betydelig grad. Plagene kan ogås bety konsentrasjonsvansker og hukommelses problemer i tillegg til ren redusert fysisk yteevne. Andre årsaker som depresjon, hypothyreose, hypogonadisme og andre hormonforstyrrelser, anemi og nedsatt lunge-, hjerte- og nyrefunksjon må først utelukkes før fatiguediagnosen stilles. Det er usikkert hvordan disse symptomer skal behandles, men støttesamtaler og tilretteleggelse av fysiske treningsprogrammer er trolig av verdi. Spesielt hvis pasienten har stressende arbeid som krever høyt tempo eller krevende fysisk arbeid, kan det komme på tale med omskolering/attføring i regi av NAV.
Rehabilitering
Sist faglig oppdatert: 10.12.2021
Intensiv kjemoterapi og strålebehandling kan som angitt medføre ulike plager over tid. Etterundersøkelser har vist at et betydelig antall pasienter sliter både med fysiske, psykiske og sosioøkonomiske problemer etter gjennomgått kurativ behandling. Mange pasienter trenger lang tid på å komme seg fysisk og psykisk. Unge pasienter synes å være spesielt utsatt for psykiske reaksjoner (angst/depresjon). Pasienter med indolente lymfomer gjennomgår gjerne flere behandlingsserier over år med mulige følger for almenntilstand og funksjonsnivå.
Disse aspekter må kartlegges, vurderes og følges opp ved henvisning til fastlege, spesialist og/eller andre faggrupper som sosionom og fysioterapeut, avhengig hva problemet består i og pasientens behov for hjelp. Graden av plager er svært varierende. Det er derfor nødvendig å lage individuelle opplegg for den enkelte pasient ut fra problemenes art, alder og motivasjon.
Rehabilitering av kreftpasienter har vært et forsømt område, og har fått fremtredende plass i Strategidokumentet for kreftbehandling. Helsedepartementet har også pålagt de regionale helseforetak å kartlegge behov og tilbud for rehabilitering etter kreftbehandling. Rapporter om dette finnes på helseregionenes internettsider.
Rehabilitering innbefatter både fysisk og psykososial behandling.
Fysisk rehabilitering
Lymfompasienter vil kunne oppleve følgende funksjonsforstyrrelser; plager fra muskler og skjelett, lymfødem, perifer polynevropati, nervesmerter, nedsatt hjerte- og lungekapasitet og fatigue. Et generelt treningsprogram med moderat intensitet tilrettelagt av fysioterapeut og/eller idrettspedagog kan ha gunstig innflytelse på generell muskel – og kondisjonssvekkelse og på kronisk fatigue
Mange av tilstandene gir rett til fri fysioterapi, ref. www.NAV.no, Folketrygdens kap. 5, § 5.8, pkt. 3, 5 og 6.
Tiltakene som fysioterapeuter benytter er; varme, massasje, tøyninger, øvelser for bevegelighet, balanse og styrke, elektroterapi, tilpasset generell fysisk trening, lungefysioterapi, avspenning og komplett manuell lymfedrenasje.
Komplett manuell lymfedrenasje utføres av fysioterapeuter med spesialkompetanse.Nærmere om retningslinjer for fysioterapi, se kapittel Psykososial og fysisk kartlegging, støtte og behandling.
Mange idrettspedagoger har kompetanse når det gjelder opptrening av kreftpasienter. Ergoterapeuter foretar ulike typer funksjonsvurderinger, funksjonstrening, tilrettelegging i bolig og anskaffelse av tekniske hjelpemidler.
Psykososial rehabilitering
Mange pasienter gir uttrykk for at første tiden etter utskrivning kan være svært vanskelig. Psykiske reaksjoner kan også komme lang tid etter avsluttet behandling.
Behov for profesjonell hjelp i rehabiliteringsfasen kan være de samme som i behandlingsfasen, se kapittel Psykososial og fysisk kartlegging, støtte og behandling. Støttesamtaler, terapeutisk behandling av angst/depresjon, familiebehandling, oppfølging av barn som pårørende er aktuelle tiltak i rehabiliteringsperioden.
Mange opplever et sterkt press på å skulle komme raskt tilbake til arbeidslivet og en del trenger informasjon, råd og veiledning om hvilke rettigheter de har som arbeidstagere.
Tidligere forskning viser at mange pasienter endrer karrierevei. Pasienter med tungt fysisk arbeid og/eller en arbeidssituasjon som oppleves som svært stressende kan ha behov for omskolering/yrkesrettet attføring. Det er NAV Arbeid som har ansvar både for råd og veiledning, yrkesveiledning og innvilgelse av attføringspenger/attføringsstønad.
De har også en rekke arbeidsmarkedstiltak som skal hjelpe arbeidstagere til å beholde et arbeid i det ordinære arbeidsliv, se www.NAV.no, Jobb og arbeidsliv.
Individuell plan: Pasienter som har «behov for langvarig og koordinerte tjenester, skal få utarbeidet en individuell plan». For helsetjenesten er rett til individuell plan nedfelt i pasientrettighetsloven § 2‑5, spesialisthelsetjenesteloven § 2‑5, kommunehelsetjenesteloven § 6‑2a og psykisk helsevernloven § 4‑1, samt Sosial- og helsedepartementets Forskrift om individuell plan av 010105.
Rehabilitering/attføringsinstitusjoner
Mange pasienter kan ha nytte av et institusjonsbasert rehabiliteringsopplegg. Flere institusjoner har i dag tilbud til kreftpasienter med spesifikke diagnoser. De aktuelle institusjonene er fra 2005 underlagt de enkelte helseregionene og er å finne på deres respektive nettsider.
Spesialsykehuset for Rehabilitering (Kysthospitalet i Stavern) har laget et eget rehabiliteringsopplegg for pasienter med lymfom. De tar også imot gjestepasienter fra andre regioner enn Helse Sør.
Montebello-senteret ved Lillehammer er et landsdekkende informasjons- og kurssted for kreftpasienter og deres pårørende hvor innholdet i kursene omfatter både fysiske og psykososiale temaer, samt mestring av det endrede liv. De har en rekke forskjellige kurs som retter seg både mot pasienten og familien, barn som pårørende. http://www.montebellosenteret.no/
Nasjonal registrering ved lymfoide maligniteter (lymfom, lymfoide leukemier og myelomatose)
Sist faglig oppdatert: 10.12.2021
Representanter fra Norsk lymfomgruppe, Norsk selskap for hematologi og Kreftregisteret har utarbeidet et skjema for primærutredning (i bruk f.o.m. 2012) og et skjema for førstelinjebehandling (i bruk f.o.m. 2016) av lymfomer og lymfoide leukemier. Fra 2018 vil skjemaet også inkludere myelomatose og plasmocytomer. Kvalitetsregisteret fikk nasjonal status i 2013 og har per i dag komplette data fra 2011 til og med 2016. Primærutredningsskjemaet inneholder nå ingen behandlingsdata og kan sendes inn så snart pasienten er ferdig utredet. Vi håper og tror dette vil bedre dekningsgraden i innrapporteringen, der det er et betydelig etterslep. Hvert sykehus har samme brukernavn og hver innmmelder eget passord. Hjelp til innlogging: kremt.mail@kreftregisteret.no eller tlf 22 92 87 99.
Målet med registreringen av lymfomer spesielt er å
- Komplettere patologimeldeskjemaet med spesifikke data som type lymfom, lokalisasjon, nodal/ekstranodal sykdom, stadium og andre relevante tumor- og pasientrelaterte data.
- Opprette en nasjonal database som grunnlag for: planlegging av kliniske studier for undergrupper av lymfom; bedømme seleksjon av pasienter i studier sammenliknet med et populasjonsbasert materiale.
- Følge over tid behandlingsresultatene for de ulike undergruppene.
- Gjøre det mulig for enkeltsykehus og regioner å sammenlikne sine data med de nasjonale når det gjelder diagnostikk, utredning og behandlingsresultater.
- For større analyser vil det være mulig å slå sammen nasjonale data med de øvrige nordiske land.
Utfylling av skjemaet er obligatorisk for alle norske sykehus. Skjemaet vil bli evaluert og justert i henhold til kommentarene som kommer. Figuren under viser grad av oppnåelse for utvalgte kvalitetsindikatorer. Vi ser dekningsgraden (innrapportert som regel av patologer) er god, mens den kliniske rapportering bør forbedres. Passientoverlevelsen er god, målet er skjønnsmessig, men basert på internasjonale tall.
Prosess og metode for utarbeiding av retningslinjene
Hva er nasjonale retningslinjer?
Sist faglig oppdatert: 10.12.2021
I henhold til Nasjonal helseplan (2007–2010) (Nasjonal helseplan (2007-2010), 2006) har Helsedirektoratet en normerende rolle for helsetjenesten på tvers av helseregioner og tjenestenivå. Helsedirektoratet har en koordinerende rolle for å utvikle overordnede referanserammer for kreftomsorgen, sammen med de regionale helseforetakene, kommunene og andre relevante myndighetsorganer og tjenester.
Lov om kommunale helse- og omsorgstjenester (Schmitz et al., 2012) § 12-5 fastslår at Helsedirektoratet er eneste aktør med mandat til å utvikle, formidle og vedlikeholde nasjonale faglige retningslinjer og veiledere som understøtter de mål som er satt for helse- og omsorgstjenesten.
De nasjonale faglige retningslinjene inneholder systematisk utviklede faglige anbefalinger som etablerer en nasjonal standard for utredning, behandling og oppfølging av pasientgrupper, diagnosegrupper og brukergrupper. Nasjonale faglige retningslinjer er et virkemiddel for å bidra til at helse- og omsorgstjenestene:
- Har god kvalitet
- Gjør riktige prioriteringer
- Ikke har uønsket variasjon i tjenestetilbudet
- Løser samhandlingsutfordringer
- Tilbyr helhetlige pasientforløp
Nasjonale faglige retningslinjer gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet.
Helsepersonell og alle deler av helse- og omsorgstjenesten er forpliktet til å yte forsvarlig helsehjelp. Retningslinjer, anerkjent fagkunnskap og allmenngyldige samfunnsetiske normer inngår som aksepterte grunnlag for vurdering av hva som er faglig forsvarlig. Retningslinjer er ment som et hjelpemiddel ved avveiningene tjenesteyterne må gjøre for å oppnå forsvarlig og god kvalitet i tjenesten. De er ikke rettslig bindende, men faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet. Helsepersonell må likevel vise faglig skjønn i vurderingen av hver enkelt pasient for å ta hensyn til individuelle behov. Dersom helsepersonell eller institusjoner velger å fravike anbefalinger i en retningslinje, skal dette dokumenteres og begrunnes.
Helsetjenestens eiere og ledelse har ansvar for tilrettelegging av virksomheten slik at anbefalinger gitt i nasjonale faglige retningslinjer kan følges.
Kunnskapsbasert prosess
Sist faglig oppdatert: 10.12.2021
Helsedirektoratet legger til grunn at nasjonale retningslinjer skal være utarbeidet etter en metode med vekt på forskningsbasert kunnskap, tydelig og tilgjengelig dokumentasjon, brukermedvirkning, tverrfaglighet, fokus på praksis, implementering og oppdatering.
Det er en omfattende prosess å lage gode retningslinjer som tilfredsstiller krav til prosess, metode og transparens som er det nivå Helsedirektoratet og andre internasjonale organisasjoner har lagt til grunn for utforming av anbefalinger.
Gradering av kunnskapsgrunnlaget
Sist faglig oppdatert: 10.12.2021
Ved utarbeiding av nasjonale retningslinjer stilles det krav om at all relevant kunnskap på området hentes frem, beskrives og vurderes på en systematisk og åpen måte.
I disse retningslinjene har man benyttet følgende graderingsmodell for å vise hvilket vitenskapelig grunnlag kunnskapen er basert på.
| Studietype | Evidensnivå | Gradering av evidensnivå |
|---|---|---|
| Kunnskap som bygger på systematiske oversikter og meta-analyser av randomiserte kontrollerte studier. | Nivå 1a | A |
| Kunnskap som bygger på minst én randomisert kontrollert studie | Nivå 1b | |
| Kunnskap som bygger på minst én godt utformet kontrollert studie uten randomisering | Nivå 2a | B |
| Kunnskap som bygger på minst én annen godt utformet kvasi-eksperimentell studie uten randomisering | Nivå 2b | |
| Kunnskap som bygger på godt utformede ikke eksperimentelle beskrivende studier, som sammenlignende studier, korrelasjonsstudier og case studier | Nivå 3 | C |
| Kunnskap som bygger på rapporter eller oppfatninger fra eksperter, komiteer og/eller klinisk ekspertise hos respekterte autoriteter | Nivå 4 | D |
I disse retningslinjene er kun kunnskapsgrunnlaget og ikke anbefalingene gradert.
Bakgrunn og arbeidsprosess ved første utgave av handlingsprogrammet (2008)
Sist faglig oppdatert: 06.03.2023
Nasjonale faggrupper tilsluttet Onkologisk Forum har i en årrekke arbeidet med – og utviklet behandlingsveiledere og handlingsprogram for ulike krefttyper. Helsedirektoratet ønsket i arbeidet med nasjonale handlingsprogrammer som ledd i Nasjonal strategi for kreftområdet å ta utgangspunkt i, og bygge på dette arbeidet. Helsedirektoratet rettet derfor i november 2005 en henvendelse til Norsk lymfomgruppe og ba om forslag til representanter til en arbeidsgruppe som skulle settes sammen av fagekspertise, Nasjonalt kunnskapssenter for helsetjenesten og Helsedirektoratet. Det ble bedt om at alle nødvendige faggrupper skulle være representert og at gruppen skulle bestå av fagfolk fra alle helseregioner.
RHF-ene medvirket i arbeidet gjennom representasjon i prosjektets styrings- og referansegruppe, samt ved mulighet til å gi tilbakemelding på arbeidsgruppenes sammensetning. RHF-ene ble også bedt om at fagfolk innenfor rammen av sin arbeidstid ble fristilt til retningslinjearbeidet, jf. Bestillerdokumentet fra Helse- og omsorgsdepartementet.
I første utgave av det Nasjonale handlingsprogrammet med retningslinjer for diagnostikk, behandling og oppfølging av maligne lymfomer har faggruppene, Kunnskapssenteret og Helsedirektoratet samarbeidet på følgende måte for å sikre en god håndtering av kunnskapsgrunnlaget for anbefalingene:
- I en tidlig fase av arbeidet har faggruppen avklart hva retningslinjene skal omfatte når det gjelder diagnostikk, behandling og oppfølging av lymfom. Retningslinjene er basert på en oppdatering av Norsk lymfomgruppes «Rødboka».
- Kunnskapssenteret har i samarbeid med faggruppen gjennomgått nåværende faglige anbefalinger («Rødboka» m.m.) med hensyn til metode og hvilket kunnskapsgrunnlag de er basert på.
- Faggruppen har i samarbeid med Helsedirektoratet og Kunnskapssenteret vurdert hvilke områder det har vært behov for kunnskapsstøtte fra Kunnskapssenteret.
- Kunnskapssenteret har identifisert og formidlet kunnskapsbaserte internasjonale retningslinjer og systematiske oversikter til Norsk Lymfomgruppe, ved søk på følgende nettsteder:
Søk etter retningslinjer
- Guidelines international network: http://www.g-i-n.net/
- NICE, UK: http://www.nice.org.uk/page.aspx?o=home
- SIGN, Scotland: http://www.sign.ac.uk/
- AHRQ, US: http://www.guideline.gov/
- Cancer care Ontario: http://www.cancercare.on.ca/
Søk etter systematiske oversikter
- CRD-databasene: http://www.crd.york.ac.uk/crdweb/
- Cochrane Library: http://www.mrw.interscience.wiley.com/cochrane/cochrane_search_fs.html
- Clinical evidence: https://bestpractice.bmj.com/evidence
Tidligere og nåværende medlemmer av Norsk lymfomgruppe har bidradd i betydelig grad ved utarbeidelse av handlingsprogrammet. Handlingsprogrammet baserte seg på, og var en videre utvikling av veilederen som var utarbeidet av Norsk lymfomgruppe.
En arbeidsgruppe med følgende sammensetning startet august 2006 arbeidet:
Harald Holte | OUS – Radiumhospitalet HF |
Bjørn Østenstad | OUS – Radiumhospitalet HF |
Arne Kolstad | OUS – Radiumhospitalet HF |
Peter Meyer | Stavanger universitetssykehus |
Øystein Fluge | Haukeland universitetssykehus |
Unn Merete Fagerli | St. Olavs Hospital |
Martin Maisenhölder | Universitetssykehuset Nord-Norge |
Marit Rinde | Akershus universitetssykehus |
Leif Bostad, patolog | Haukeland universitetssykehus |
Trond Hagtvedt, radiolog | OUS – Radiumhospitalet HF |
Eldrid Liljedal, spes. allmennp. | Allmennpraktiker |
Eva Baggerød, kreftsykepleier | OUS – Radiumhospitalet HF |
Kjersti Stokke, kreftsykepleier | OUS – Radiumhospitalet HF |
Gro Jacobsen Haugen, fysiot. | OUS – Radiumhospitalet HF |
Grete Herzog, sosionom | OUS – Radiumhospitalet HF |
Ingvild von Mehren Sæterdal Inger Norderhaug | Nasjonalt kunnskapssenter for helsetjenesten |
Helsedirektoratet har hatt prosjektledelse og sekretariatsfunksjon.
For å effektivisere arbeidet og forankre arbeidet enda tydeligere i fagmiljøet, ble det høsten 2006 besluttet at retningslinjenes forfattere i samarbeid med Nasjonalt kunnskapssenter for helsetjenesten og Helsedirektoratet skulle sluttføre arbeidet.
Arbeidsgruppe
- Harald Holte, avdeling for Medikamentell terapi, Oslo universitetssykehus (leder)
- Arne Kolstad, avdeling for Medikamentell terapi, Oslo universitetssykehus
- Bjørn Østenstad, Kreftsenteret, Ullevål Universitetssykehus
- Øystein Fluge, Kreftavdelingen, Haukeland Universitetssykehus
- Alexander Fosså Oslo universitetssykehus
Kapitlet om kreft i allmenpraksis er skrevet av spesialist i allmennmedisin Eldrid Liljedal, Målselv kommune/praksiskonsulent kreftavd. Universitetssykehuset Nord-Norge
- Kapitlet om psykososial og fysisk kartlegging, støtte og behandling er skrevet av sjefsosinom Grete Herzog og spesialfysioterapeut Gro Haugen, begge kreftklinikken, Oslo universitetssykehus.
- Medlemmer av norsk lymfomgruppe har vurdert og gitt tilbakemeldinger på innholdet i handlingsprogrammet.
- Forsker Ingvil von Mehren Sæterdal, Nasjonalt kunnskapssenter for helsetjenesten har bistått fagpersonene med gradering av kunnskapsgrunnlaget.
- Retningslinjene har vært til behandling i styringsgruppen i Norsk lymfomgruppe.
- Brukerorganisasjoner under Kreftforeningen har vært høringsinstans.
- Retningslinjene har vært forelagt de regionale helseforetakene.
- Retningslinjene har vært til uttalelse hos Den norske legeforening.
Forfatterne leverte vinter 2008 forslag til Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av maligne lymfomer. Nasjonalt kunnskapssenter for helsetjenesten og Helsedirektoratet ferdigstilte i samarbeid med forfatterne våren 2008 arbeidet og utkast til retningslinjer ble sendt på høring til Kreftforeningen og dens pasientorganisasjoner, samt til RHFene og Den norske legeforening til orientering.
Andre, tredje, fjerde, femte og sjette utgave (2010, 2012, 2016, 2019, 2021)
Basert på ny dokumentasjon ble handlingsprogrammet oppdatert og nye versjoner er publisert 2010 (2. utgave), 2012 (3. utgave), 2016 (4. utgave), 2019 (5. utgave), 2021 (6. utgave).
Oppdateringsgruppene ble ledet av Arne Kolstad.
Oppdateringsgruppen 2019 bestod av følgende medlemmer:
Arne Kolstad (leder av oppdateringsgruppen), OUS
Harald Holte, OUS
Unn Merete Fagerli, St. Olavs Hospital
Alexander Fosså, OUS
Bjørn Østenstad, OUS
Martin Maisenhølder, UNN
Peter Meyer, Stavanger Universitetssykehus
Øystein Fluge, Haukeland universitetssjukehus
Lars Helgeland, Haukeland universitetssjukehus
Sjette utgave (2021)
Oppdateringsgruppe
Oppdateringsgruppen 2021 har bestått av følgende medlemmer:
Alexander Fosså (leder av oppdateringsgruppen), OUS
Harald Holte, OUS
Unn Merete Fagerli, St. Olavs Hospital
Arne Kolstad, OUS
Bjørn Østenstad, OUS
Martin Maisenhølder, UNN
Peter Meyer, Stavanger Universitetssykehus
Øystein Fluge, Haukeland universitetssjukehus
Lars Helgeland, Haukeland universitetssjukehus
Syvende utgave (2023)
Oppdateringsgruppe
Oppdateringsgruppen har bestått av følgende medlemmer:
Alexander Fosså (leder av oppdateringsgruppen), OUS
Harald Holte, OUS
Unn Merete Fagerli, St. Olavs Hospital
Arne Kolstad, OUS
Bjørn Østenstad, OUS
Martin Maisenhølder, UNN
Peter Meyer, Stavanger Universitetssykehus
Øystein Fluge, Haukeland universitetssjukehus
Lars Helgeland, Haukeland universitetssjukehus
Habilitet
Sist faglig oppdatert: 10.12.2021
Alle gruppens medlemmer ble i forbindelse med arbeidet bedt om å oppgi potensielle interessekonflikter. Helsedirektoratet har vurdert arbeidsgruppens medlemmer som habile i forhold til å delta i arbeidet med nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av maligne lymfomer.
Oppdatering av retningslinjene
Sist faglig oppdatert: 10.12.2021
Utviklingen av ny behandling på kreftområdet går raskt. Helsedirektoratet tilstreber å foreta årlige vurderinger av behov for oppdatering.
Oppdateringen utføres av en arbeidsgruppe som består av fagpersoner oppnevnt av RHF-ene og Helsedirektoratet. Folkehelseinstituttet skal også bidra i arbeid med oppdatering av handlingsprogrammet.
De oppdaterte retningslinjene vil publiseres på helsedirektoratet.no og helsebiblioteket.no (web-versjon).
Aktuelle nettadresser
http://www.kreftforeningen.no
http://www.kreftregisteret.no/
http://www.legeforeningen.no
http://www.nordic-lymphoma.org
Cytostatikakurer: https://kreftlex.no/
WHO-klassifikasjon av hemato-poietiske og lymfoide neoplasier
Sist faglig oppdatert: 10.12.2021
|
| ICD10 | M-nummer |
| Malignt lymfom UNS | C85.9B | 95903 |
| Malignt non-Hodgkin lymfom UNS | C85.9B | 95913 |
|
|
|
|
| B-CELLE NEOPLASIER |
|
|
| Prekursor B-celle neoplasier |
| |
| B-lymfoblastisk leukemi | C91.0 | 98113 |
| B-lymfoblastisk lymfom | C83.5 | 98113 |
|
| ||
| Moden B-celle neoplasier |
| |
| Malignt non-Hodgkin B-celle lymfom UNS | C85.1 | 95963 |
| Kronisk lymfatisk leukemi | C91.1 | 98233 |
| Småcellet lymfocytært lymfom | C83.0 | 98233 |
| B-prolymfocyttleukemi | C91.3 | 98333 |
| Lymfoplasmacyttisk lymfom | C88.0 | 96713 |
| Splenisk marginalsonelymfom | C83.8D | 96893 |
| Hårcelleleukemi | C91.4 | 99403 |
| Plasmacellemyelom (Myelomatose) | C90.0 | 97323 |
| Monoklonal gammopati av usikker betydning | D47.2 | 97321 |
| Solitært plasmocytom i ben | C90.3 | 97313 |
| Ekstraossøst plasmocytom | C90.2 | 97343 |
| Primær amyloidose | C90.2 | |
| Plasmacelleleukemi | C91.7 | 97323 |
| Tung-kjede sykdom | C83.8 | 97623 |
| Extranodalt marginalsone utgående fra mucosa assosiert vev (MALT lymfom) | C83.4 | 96993 |
| Nodalt marginalsonelymfom | C83.8D | 96993 |
| Follikulært lymfom UNS | C82.9 | 96903 |
| Follikulært lymfom, grad 1 | C82.0 | 96913 |
| Follikulært lymfom, grad 2 | C82.1 | 96913 |
| Follikulært lymfom, grad 3 | C82.3 | 96983 |
| Mantelcellelymfom | C83.1 | 96733 |
| Diffust storcellet B-cellelymfom (DLBCL), NOS | C83.3 | 96803 |
| Primært DLBCL I CNS | C83.3 | 96803 |
| Primært kutant DLBCL, «leg type» | C83.3 | 96803 |
| EBV+ DLBCL hos eldre | C83.3 | 96803 |
| DLBCL assosiert med kronisk betennelse | C83.3 | 96803 |
| Primært mediastinalt (tymisk) storcellet B-cellelymfom | C83.3 | 96793 |
| Intravaskulært storcellet B-celle lymfom | C83.3 | 96853 |
| ALK+ storcellet B-cellelymfom | C83.3 | 97373 |
| Plasmablastisk lymfom | C83.3 | 97353 |
| Storcellet B-cellelymfom, utgående fra HHV-8 assosiert multisentrisk Castlemans sykdom | C83.3 | 97383 |
| Primært effusjonslymfom | C83.3 | 96783 |
| Burkitt lymfom | C83.7 | 96873 |
| Burkitt leukemi | C91.8 | 96873 |
| B-cellelymfom, uklassifisert, med trekk intermediært til DLBCL og Burkitt lymfom | C83.3 | 96803 |
| B-cellelymfom, uklassifisert, med trekk intermediært til DLBCL og Hodgkin lymfom | C85.1 | 95963 |
|
| ||
| B-celle proliferasjoner av usikker natur |
| |
| Lymfomatoid granulomatose | C88.7 | 97661 |
| Post-transplantasjonslymfoproliferativ sykdom, | C88.7 | 99711 |
| Lymfoid hyperplasi, usikker reaktiv/neoplastisk | D47.7 | 72205 |
|
| ||
| T-/NK-CELLE NEOPLASIER |
| |
| Prekursor T-celle neoplasier |
| |
| T-lymfoblastisk leukemi | C91.0 | 98373 |
| T-lymfoblastisk lymfom | C84.5B | 98373 |
| Blastisk plasmacytoid dendrittisk-celle neoplasi | C86.4 | 97273 |
|
| ||
| Moden/perifer T-/NK-celle neoplasier |
| |
| T-prolymfocyttleukemi | C91.6 | 98343 |
| Storgranulær T-lymfocyttleukemi | C91.7 | 98313 |
| Aggressiv NK-celleleukemi | C91.7 | 99483 |
| Adult T-celle leukemi/lymfom | C91.5 | 98273 |
| Ekstranodalt NK/T-cellelymfom, nasal type | C86.0 | 97193 |
| Enteropati-type T-celle lymfom | C86.2 | 97173 |
| Hepatosplenisk T-celle lymfom | C86.1 | 97163 |
| Subkutant pannikulitt-lignende T-celle lymfom | C86.3 | 97083 |
| Mycosis fungoides | C84.0 | 97003 |
| Sézary syndrom | C84.1 | 97013 |
| Primært kutant anaplastisk storcellet lymfom | C84.9 | 97183 |
| Perifer T-celle lymfom UNS | C84.4 | 97023 |
| Angioimmunoblastisk T-celle lymfom | C86.5 | 97053 |
| Anaplastisk storcellet lymfom | C84.6 | 97143 |
|
| ||
| T-celle proliferasjoner av usikker natur |
| |
| Lymfomatoid papulose | L41.2 | 97181 |
| Angioimmunoblastisk lymfadenopati | D47.7 | |
|
| ||
| HODGKIN LYMFOM |
| |
| Nodulært lymfocyttrikt Hodgkin lymfom | C81.0 | 96593 |
| Klassisk Hodgkin lymfom UNS | C81.9 | 96503 |
| Klassisk Hodgkin lymfom, nodulær sklerose UNS | C81.1 | 96633 |
| Klassisk Hodgkin lymfom, lymfocyttrikt | C81.4 | 96513 |
| Klassisk Hodgkin lymfom, blandet cellularitet | C81.2 | 96523 |
| Klassisk Hodgkin lymfom, lymfocyttfattig | C81.3 | 96533 |
|
| ||
| HISTIOCYTT/ DENDRITTISK CELLE NEOPLASIER |
| |
| Makrofag / histiocytt neoplasier |
| |
| Histiocytært sarkom | C96.8 | 97553 |
|
| ||
| Dendrittisk-celle neoplasier |
| |
| Langerhanscellehistiocytose | C96.5 | 97511 |
| Langerhanscellesarkom | C96.4 | 97563 |
| Interdigiterende dendrittisk-celle sarkom | C96.4 | 97573 |
| Indeterminat dendrittisk-celle tumor | C96.4 | 97573 |
| Follikulær dentrittisk celle sarkom | C96.4 | 97583 |
|
| ||
| MASTOCYTOSE |
| |
| Mastocytom UNS | D47.0 | 97401 |
| Indolent systemisk mastocytose | Q82.2 | 97411 |
| Systemisk mastocytose med assosiert annen klonal hematologisk sykdom | Q82.2 | 97413 |
| Aggressiv systemisk mastocytose | C96.9 | 97413 |
| Mastcelleleukemi | C94.3 | 97423 |
| Mastcellesarkom | C96.2 | 97403 |
| Gjeldende f.o.m. 18.10.18 |
|
Retningslinjer for lymfomdiagnostikk
Sist faglig oppdatert: 10.12.2021
Introduksjon
Lymfomdiagnostikk ble mer objektiv og samtidig mer komplisert etter at WHO i 2001 publiserte en ny klassifikasjon med retningslinjer for diagnostikk, basert på en foregående europeisk-amerikansk konsensus, Revised European and American Lymphoma (R.E.A.L.) klassifikasjonen. Dette arbeidet ble videreført i den 4. WHO-utgaven i 2008 og i en ytterligere revisjon i 2017. Hovedpunktene i den siste revisjonen ble publisert i 2016 ien artikkel i tidsskriftet Blood (S. H. Swerdlow et al., 2016)..
Diagnostikken foregår integrert og tar i bruk histologi/cytologi, immunfenotyping, genetikk og kliniske data. Det er en klar tendens i de seneste revideringer at det legges enda mer vekt på molekylærgenetiske funn og integrering av de ovenfor nevnte 4 hovedkriterier. Integreringen kommer trolig til å få enda større betydning i fremtiden, også i lys av at kjente prognostiske parametre i økende grad influerer på behandlingsopplegget.
Ved diagnostikk av lymfom, spesielt ved første gangs diagnose, bør det tilstrebes å klassifisere lymfomet i henhold til den nyeste WHO-klassifikasjonen (S.H. Swerdlow et al., 2017). Muligheten og kompetansen til å kunne bruke og tolke molekylær diagnostikk og utvidete immunhistokjemiske paneler er særlig viktig. Det er nødvendig med integrering av resultater av spesialanalyser sammen med konvensjonell histopatologi, for å kunne gi en samlet tolkning og vurdering. Hematopatologisk virksomhet bør legge til rette for integrering ved utstrakt samarbeid mellom patologer, onkologer, hematologer, immunologer og genetikere, ikke minst ved å integrere deres laboratorie-informasjonssystemer (LIS). Målet er å kunne stille en endelig diagnose etter de entiteter WHO-klassifikasjonen definerer og så langt det er mulig unngå ufullstendige og upresise diagnoser (som for eksempel ’småcellet lymfom’, ’storcellet B-cellelymfom’ osv.) Patologen bør kunne integrere alle utførte analyser til en fullstendig diagnose i henhold til WHO-kriteriene, slik at man ikke overlater dette ansvaret til kliniker. Ikke minst tillater tilrettelagt integrering hensiktsmessig bruk av ressurser; utfra morfologisk undersøkelse kan riktig panel for immunfenotyping bestemmes, og utfra disse resultatene kan målrettete genetiske analyser rekvireres.
Med de teknologiske krav som stilles til hematopatologisk diagnostikk, vil dette vanligvis innebære at endelig diagnose stilles på Regions-/Universitets-sykehus nivå. Generelt anbefales at diagnosene kvalitetssikres av patolog med kompetanse i hematopatologi på tilsvarende nivå.
For pasienter som inkluderes i ’Pakkeforløp for lymfomer’ (Pakkeforløp for lymfomer, 2016), gjelder følgende retninglinjer (sitat):
«For pasienter i Pakkeforløp for lymfomer, må biopsien gå direkte til regional spesialavdeling for lymfompatologi, som også har mulighet for molekylære undersøkelser. Det må sendes ferskt materiale. Er pasienten inkludert i pakkeforløp skal biopsier merkes CITO. Det er svar på biopsi som avgjør om diagnosen er korrekt og om pasienten har lymfom. Derfor er det helt essensielt at denne vurderingen foretas av patologer med spesiell kompetanse på lymfomdiagnostikk».
Dette heftet omtaler på en kortfattet måte retningslinjer for hematopatologisk diagnostikk i Norge. Følgende emner blir omtalt:
- Standard behandling inkludert forsendelse, av vev, benmargsbiopsier, benmargsaspirat og blodprøver
- Standard immunhistokjemiske paneler for lymfomdiagnostikk
- Molekylærpatologiske analyser for lymfomdiagnostikk
- Standard besvarelse for lymfomdiagnostikk
- Koder for lymfoid neoplasi etter norsk SNOMED revisjon 2015
Klaus Beiske, Radiumhospitalet, Oslo Universitetssykehus
Lars Helgeland, Haukeland Universitetssykehus
Håkon Hov, St Olavs Hospital
Lars Uhlin-Hansen, Universitetssykehus Nord-Norge
Faggruppen for hematopatologi i Den norske patologforening, juni 2017.
Signe Spetalen, Ida M. Ikonomou, Irene Langmyhr og Andrej Valkov takkes for verdifulle kommentarer.
1. Standard behandling av vev, benmargsbiopsier, benmargsaspirat og blodprøver
Eksisjonsbiopsi versus nålebiopsi
Vurdering av vevsarkitekturen er et viktig element i lymfomdiagnostikk, noe som optimalt vurderes i en eksisjonsbiopsi. Dette bør derfor tilstrebes ved primærdiagnostikk av lymfom, og bruk av nålebiopsier bør unngås mest mulig. Det kan utelukkende godtas når det klinisk er kontraindisert med eksisjon. Det bør her også påpekes at det ofte ikke kan avgis en endelig lymfomdiagnose på benmargsbiopsi.
Fiksering, nedfrysing, og cellesuspensjoner
Vevet bør forbehandles på følgende måte (og i denne rekkefølgen), der 1 og 2 er minimumstandard for forsvarlig hematopatologisk diagnostikk:
- God morfologi er noe av det viktigste for diagnostikken. En del av vevet bør derfor fikseres så raskt som mulig. Til vanlig bruker man 4 % bufret formaldehyd, men andre fikseringsvesker basert på Zink (f.eks. Bpluss) kan gi bedre morfologi. Enda viktigere er det å ha tynne snitt (<4µm) for å oppnå best mulig morfologi. Videre kan det være nyttig med imprint-preparater, som tillater bedre vurdering av cytomorfologien av de neoplastiske cellene og gir raskere resultater av FISH undersøkelser enn parafinsnitt. Et typisk eksempel er Burkitt lymfom.
- En del av vevet bør når det er mulig, fryses med tanke på videre molekylære tester. De fleste aktuelle genetiske tester utføres i dag på fiksert materiale. Dette er imidlertid ikke alltid optimalt grunnet degradering av DNA. Nye teknikker bl.a. dypsekvensering krever optimal DNA-kvalitet.
- Hvis biopsien er stor nok, er det tilrådelig å ta en del av prøven til flowcytometrisk undersøkelse. Prøven legges fortrinnsvis i celledyrkingsmedium, alternativt fysiologisk saltvann, i påvente av at cellesuspensjon lages. Flowcytometrisk analyse er særlig av interesse for påvisning av abnorme immunfenotyper eller immunoglobulin lett kjede restriksjon (B-celle lymfomer der differensialdiagnose er lymfoid hyperplasi). Multiparameter flowcytometri kan påvise ulike markører samtidig, også på små subpopulasjoner, noe som ikke er mulig med immunhistokjemi, der vurdering av dobbel ekspresjon eller tap av markører kan bli vanskelig, særlig når de neoplastiske celler ligger oppblandet med reaktive celler. Flowcytometri kan også i mange tilfelle gi et raskt foreløpig svar på om det foreligger lymfom og eventuelt type lymfom.
- Hvis biopsien videre tillater det, kan materiale sendes til cytogenetisk undersøkelse. PCR-analyse eller in situ hybridisering kan ikke erstatte en konvensjonell cytogenetisk undersøkelse fordi sistnevnte er en analyse av hele genomet og ikke bare av ett gen eller én translokasjon. Informasjonen man får gjennom cytogenetikken er i noen tilfeller uunnværlig fordi den kan være den eneste teknikk som beviser at det foreligger en klonal prosess.
- Forsendelse av prøver
a) Lymfoid vev
Generelt bør biopsi for lymfomdiagnostikk tas tidlig på dagen og helst ikke på fredager på grunn av håndtering av ferskt materiale som beskrevet ovenfor.
Sendes fortrinnsvis ufiksert på en slik måte at det ankommer laboratoriet i løpet av dagen. Åpningstider for laboratoriet bør verifiseres på forhånd. Ufiksert vev skal sendes nedkjølt. Rutiner vedrørende forsendelse, transportmedium, transportbeholder m.v. bør avtales med laboratoriet som skal motta prøven. Dersom det er usikkerheter vedrørende forsendelse, bør rekvirent kontakte laboratoriet når det er aktuelt. Vevsbiten må ikke bli liggende uten væske, da vil den fort tørke ut og tape kvalitet både i forhold til morfologi og tilleggsanalyser.
Alt biopsimaterialet skal følges av utfylt remisse med relevante opplysninger inklusive rekvirent, dato og klokkeslett for biopsitakning.
Dersom biopsimaterialet ikke vil rekke frem innen 24 timer etter biopsitakningen, bør man fiksere minst en halvdel av materialet i formalin, mens den annen del sendes ufiksert og nedkjølt som beskrevet ovenfor. Ved tvil om det er nok vev til å ta av en bit ferskt vev eller om dette vil komme frem til laboratoriet i tide, legges alt vevsmatariale direkte i formalin.
b) Benmarg
Benmargsbiopsier fikseres vanligvis i formalin, eller (alternativt) i en Sink-holdig fikseringsvæske, som gir enda bedre morfologi og likevel tillater immunhistokjemisk undersøkelse.
Det er ønskelig at benmargsbiopsi suppleres med utstryk/rullepreparat.
Biopsien bør minimum fikseres i 5 timer og kan ligge i fikseringsvæsken i flere døgn for senere analyse (i tilfelle forsendelse eller lang helg).
Benmargsaspirat og blod sendes ferskt med hensyn på flowcytometrisk undersøkelse og eventuelt molekylærgenetisk og cytogenetisk undersøkelse.
Alt biopsimaterialet skal følges av utfylt remisse med relevante opplysninger inklusive dato og klokkeslett for biopsitakning.
2. Standard immunhistokjemiske paneler for førstegangsdiagnoser
Panelene anbefales brukt systematisk for å unngå feil og for å kunne gi mest mulig fullstendig immunfenotype. Det er like viktig med rapportering av markører som er positive som med oppsummering av markører som er negative. Panelene dekker ikke alle mulige hematopatologiske neoplasier, men dekker de mest hyppige. For mer sjeldne neoplasier bør et utvidet panel av markører brukes etter anbefalinger i WHO-klassifikasjonen. Hvis flowcytometrisk undersøkelse er gjennomført kan panelet begrenses til de markørene som ikke er kommet med (f.eks. Ki67). Panelet bestemmes etter morfologisk vurdering av preparatet, og til en viss grad etter de kliniske opplysninger som foreligger.
Småcellet B-celle lymfom
CD20, CD79a, PAX5, CD138, CD10, BCL2, BCL6, CD3, CD5, CD21, CD23, cyclinD1, SOX-11, IgK, IgL, Ki67
Storcellet B-celle lymfom / Burkitt lymfom
CD20, CD79a, PAX5, MUM1, BCL2, BCL6, CD3, CD5, CD10, CD21, CD23, CD30, EBV (ISH), Ki67, c-Myc
Plasmacelle neoplasi
CD20, CD3, (CD79a, PAX5), CD138, IgK, IgL, IgM, IgG, IgA, cyclinD1, CD56
T-/NK-celle neoplasi
CD3, CD20, CD21, CD2, CD5, CD7, CD4, CD8, TIA1, granzymeB, CD56, CD57, EBV (ISH), CD30, ALK
Hodgkin lymfom
CD30, CD15, CD20, PAX5, CD3, EBV(ISH).
I tillegg ved mistanke om nodulær lymfocyttrik type: CD45, CD79a, BOB1, OCT2, CD57, CD21, MUM1
|
| CD20 | CD79b | CD3 | PAX5 | CD10 | CD5 | CD23 | CD138 | BCL2 | BCL6 | Ig | cyclinD1 | Sox-11 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| FL | ++ | + | – | + | ++ | – | +/– | – | + | ++ | o | – |
|
| MCL | ++ | + | – | + | – | ++ | – | – | + | – | o | + (–) | + |
| MZL | ++ | + | – | + | – | –(+) | +/– | – | + | –/+ | o | – |
|
| KLL | + | + | – | + | – | + | +/– | – | + | – | oo | – |
|
| LPL | +/– | + | – | + | – | – (+) | – | –/+ | + | – | cc | – |
|
| HCL | ++ | + | – | + | – (+) | – | – | – | + | – | o | +/– |
|
| TCL* | – | – | + | – | – (+) | +/– | – | – | + | –/+ | – | – |
|
FL: follikulært lymfom; MCL: mantelcellelymfom; MZL: marginalsonelymfom; KLL: småcellet lymfocytært lymfom/kronisk lymfatisk leukemi; LPL: lymfoplasmacyttisk lymfom; HCL: hårcelleleukemi; TCL: T-celle lymfom; o(o): overflate (sterk); c(c): cytoplasmatisk (sterk); (): reaktivitet i kjente varianter; *bør immunfenotypes ytterligere; ++: høy ekspresjon i alle celler; +: normal ekspresjon i alle celler: +/–: ekspresjon i >50 % av cellene; –/+: ekspresjon i <50 % av cellene.
|
| CD20 | CD79b | CD3 | PAX5 | CD10 | CD5 | CD23 | CD138 | BCL2 | BCL6 | MUM1 | EBV | CD30 | Ki67 % |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| DLBCL, UNS | + | + | – | + | (+)(–) | – (+) | –/+ | –/+ | +/++ | (+)(–) | (+)(–) | – | –/+ | <90 |
| PMBL | + | + | – | + | –/+ | – | +/– | –/+ | +/– | –/+ | +/– | – | +/– | <90 |
| EDLBCL | + | + | – | + | –/+ | – | –/+ | –/+ | + | –/+ | +/– | + | +/– | <90 |
| BL | + | + | – | + | ++ | –/+ | – | – | – | ++ | – | –/+ | – | >95 |
| PDHL | + | + | – | + | + | – | – | – | + | + | – | – | – |
|
| PBL | – | +/– | – | –/+ | – | – | – | + | + | – | + | +/– | + | >90 |
| PEL | – | + | – | –/+ | – | – | – | + | + | – | + | + | + | >90 |
| TCL* | – | – | + | – | – (+) | +/– | – | – | + | –(+) | +/– | – (+) | –/+ | <90 |
| ALCL* | – | – | –/+ | – | – | – | – | – | + | – | + | – | + | <90 |
DLBCL: diffust storcellet B-celle lymfom; PMBL: primært mediastinalt storcellet B-celle lymfom; EDLBCL: ulike EBV+ DLBCL varianter (posttransplant, alders-relatert, betennelse-relatert, lymfomatoid granulomatose, se WHO klassifikasjon); BL: Burkitt lymfom; PDHL: såkalt primært ‘double hit’ lymfom (C-MYC og BCL2 translokasjon); PBL: plasmablastisk lymfom; PEL: primært effusjonslymfom; TCL: T-celle lymfom; ALCL: anaplastisk storcellet lymfom; (): reaktivitet i kjente varianter; * bør immunfenotypes ytterligere etter første screening
DLBCL, UNS bør inndeles videre i lymfomer med kimsentercelle immunfenotype (GCB) etter følgende Hans’ algoritme (definisjon for + er når >30 % av lymfomcellene uttrykker markøren):
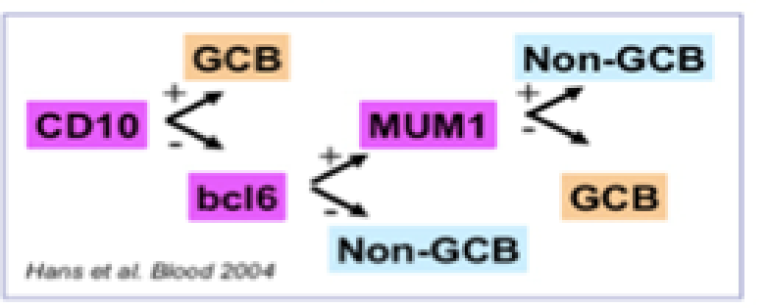
En undergruppe av storcellete B-lymfomer er spesielt aggressive og kan være aktuell for annen behandling enn standardbehandlingen for DLBCL. Denne gruppen har ofte trekk av Burkitt lymfom og/eller aberrasjoner i genene som koder for c-myc og bcl-2 og/eller bcl-6. Storcellete B-cellelymfomer skal derfor karakteriseres mtp. aberrasjoner i genet som koder for c-Myc. Den beste analysemetoden er interfase-FISH. Pga. at metoden er arbeidskrevende, er det foreløpig ikke påkrevd at FISH utføres på alle storcellete lymfomer da prevalens av MYC-aberrasjon er lav, men alle skal vurderes mtp FISH. WHO-klassifikasjonen har foreløpig ikke kommet med noen klar anbefaling om hvilke av disse lymfomene som skal gå til FISH. Vi i lymfomgruppen har på bakgrunn av publiserte data og egne erfaringer anbefalt screening av disse lymfomene med immunhistokjemisk undersøkelse for c-Myc. Ved positivitet på over 40–50 % av tumor bør FISH utføres. Ved positiv FISH må man samtidig undersøke om det foreligger BCL2- og/eller BCL6-aberrasjon vha FISH. Storcellete lymfomer med MYC-aberrasjon og/eller samtidig BCL2- og/eller BCL6-aberrasjon klassifiseres i egen gruppe (‘høygradig B-cellelymfom’). Diagnostikk av diffust storcellet B-cellelymfom hvor det ikke er tatt stilling til om det kan foreligge MYC-aberrasjon vil ikke være tilstrekkelig diagnostikk. NB: Det understrekes at utvelgelse av hvilke prøver som skal gå til FISH er patologens ansvar. Imidlertid bør dette utføres i nært samarbeid med onkolog både for å unngå underdiagnostisering (tilfeller der immun c-Myc er under 50 % og påvisning av MYC-aberrasjon vil være klinisk veldig viktig, f.eks. hos unge pasienter) og unngå ressurskrevende diagnostikk der ha liten eller ingen klinisk nytte (hos eldre pasienter eller pasienter med uttalt komorbiditet).
|
| CD20 | CD79b | CD3 | PAX5 | CD5 | CD138 | CD56 | Ig | cyclinD1 |
|---|---|---|---|---|---|---|---|---|---|
| PC/MGUS | –/+ | + | – | – | – | + | – (+) | cc | – (+) |
| LPL | +/– | + | – | + | –/+ | –/+ | – | o/c | – |
PC: plasmacytom/multippelt myelom; MGUS: monoklonal gammopati av ubestemt betydning;
o: overflate; c(c): cytoplasmatisk (sterk); (): reaktivitet i kjente varianter
LPL er strengt tatt ikke en plasmacelleneoplasi men forvirring kan oppstå med hensyn på differensialdiagnose med den cyclin D1+ varianten av plasmacelleneoplasi, som likeledes består av små lymfoplasmacytoide plasmaceller.
|
| CD20 | CD3 | CD2 | CD5 | CD7 | CD4 | CD8 | CD10 | TIA1/Gr.B | CD56 | CD57 | CD30 | ALK | PD1 | TCL1* | EBV |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PTCL, UNS | – | + | + | +/– | +/– | +/– | –/+ | – | – | – | – | –/+ | – | – | – | – |
| AITL | – | + | + | + | +/– | + | – | +/– | – | – | – | –/+ | – | + | – | +/– |
| EATL | – | + | + | – | + | – | –/+ | – | – | (+) | – | +/– | – | – | – | – |
| HSTL | – | + | + | – | + | – | –/+ | – | + | +/– | – | – | – | – | – | – |
| ALCL, ALK+ | – | –/+ | + | + | – | + | – | – | + |
|
| + | + | – | – | – |
| ALCL, ALK- | – | –/+ | +/– | +/– | – | + | – | – | + | – | – | + | – | – | – | – |
| MF | – | + | + | + | – | +(–) | –(+) | – | – | – | – | –/+ | – | – | – | – |
| SS | – | + | + | + | – | + | – | – | – | – | – | – | – | – | – | – |
| T-PLL | – | + | + |
| + | +/– | –/+ | – |
| – | – | – | – | – | + | – |
| T-LGL | – | + | + | +/– | +/– | – | + | – | + | – | + | – | – | – | – | – |
| ANKCL | – | + (c) | + | – | – | – | – | – | + | + | – | – | – | – | – | + |
| ATLL | – | + | + | + | – | + | – | – | – | – | – | +/– | – | – | – | – |
| ENK/TCL | – | + (c) | + | – | – | – | – | – | + | + | – | – | – | – | – | + |
| SPTCL | – | + | + | + | + | – | + | – | + | – | – | – | – | – | – | – |
| PCGDTCL | – | + | + | + | + | – | –/+ | – | + | + | – | – | – | – | – | – |
PTCL, UNS: perifer T-celle lymfom, UNS; AILT: angioimmunoblastisk TCL;
EATCL: enteropati-assosiert TCL; HSTCL: hepatosplenisk TCL; ALCL, ALK+: anaplastisk storcellet lymfom, ALK+; ALCL, ALK-: anaplastisk storcellet lymfom, ALK-; MF: mycosis fungoides; SS: Sézary syndrom; TPLL: T-celle prolymfocytisk leukemi; TLGL: T-celle stor granulær lymfocytisk leukemi; ANKCL:: agressiv NK-celle lymfom; ATCLL: adult T-celle leukemi/lymfom; ENK/TCL: ekstranodal NK/T-celle lymfom; SPTCL: subkutan pannukulitt-lignende TCL;PCGDTCL: primært kutant gamma-delta TCL; C: cytoplasmatisk; () reaktivitet i bestemte lymfomsubtyper;
* Vær oppmerksom på at markøren er positiv i en rekke B-celle lymfomer.
|
| CD45 | CD20 | CD3 | PAX5 | CD15 | CD30 | BOB1 | OCT2 |
|---|---|---|---|---|---|---|---|---|
| KHL | – | –/+ | – | + (svak) | +/– | + | +/– | +/– |
| NLRHL | + | + | – | ++ | – | – | ++ | ++ |
| ALCL* |
| – | –/+ | – | – | + | – | – |
KHL: klassisk Hodgkin lymfom; ALCL: anaplastisk storcellet lymfom;
* Bør immunfenotypes ytterligere etter første screening
3. Standard molekylærpatologiske undersøkelser
1. PCR analyser
B-celle neoplasi
Immunglobulin genrearrangering anbefales brukt som panel i de tilfellene hvor det er usikkert om det foreligger B-celle neoplasi eller reaktiv B-celle hyperplasi (f.eks. små endoskopiske biopsier, minimal infiltrasjon av marginalsonelymfom i lymfeknutebiopsi osv). Det anbefales sterkt at BIOMED-2 protokoller brukes. Ekstern kvalitetssikring anbefales både når det gjelder teknikk og tolkning.
Ved differensialdiagnostikk av lymfoplasmacyttisk lymfom versus andre småcellede B‑cellelymfomer, anbefales analyse av MYD88 mutasjon.
Ved usikkerhet ved diagnose hårcelleleukemi anbefales analyse av BRAF mutasjon.
T-celle neoplasi
T-cellereseptor genrearrangering anbefales brukt i alle tilfeller av T-celle lymfomer, med BIOMED-2 protokoller. Disse lymfomene er relativt sjeldne og testen øker sikkerhetsgraden av denne alvorlige diagnosen betraktelig.
2. FISH
Interfase FISH på vevsmateriale bør utføres der morfologi og immunfenotype gir mistanke om Burkitt lymfom. Det bør da analyseres med hensyn på MYC-translokasjon med break apart probe. Ved storcellete lymfomer skal det vurderes å utføre FISH mtp. MYC-translokasjon og eventuelt supplere med analyse av BCL2- og BCL6-translokasjoner for deteksjon av ’dobbel-hit’ eller ’trippel-hit’ lymfom, se over under storcellede B-cellelymfomer. FISH analyse av CCND1 translokasjoner er aktuell ved Cyclin D1-negativt mantelcellelymfom. Et hematopatologisk laboratorium bør også kunne utføre FISH for rearrangeringer av IRF4/DUSP22 genet, som forekommer ved en undergruppe av storcellete B-cellelymfomer hos yngre individer og har en noe bedre respons på behandling enn andre storcellete lymfomer, og hos en undergruppe ALK-negative anaplastiske storcellete lymfomer med bedre prognose.
Ved B-lymfoblastiske lymfomer/leukemier bør det legges til rette for genetisk testing, både molekylærgenetisk analyse, FISH og klassisk cytogenetikk.
Klassisk cytogenetikk utføres vanligvis ikke i patologilaboratorier. Dersom cytogenetiske undersøkelser er aktuelt må laboratorium som utfører slike analyser kontaktes.
4. Standard besvarelse for hematopatologi
Makroskopi
- Det bør beskrives alt som er mottatt og hvordan glass er merket.
- Deretter beskrives systematisk mål på vevsbiopsiene og hvordan vevet er viderebehandlet: type fiksering inkludert hvor mange og nummerering av briketter, nedfrysing, og om eventuelt deler av vevet er sendt videre til cytogenetikk, molekylær analyse, flowcytometrisk analyse eller om det finnes restvev etter behandlingen
Mikroskopi
1. Lymfoid vev
Følgende standard elementer (fet skrift) anbefales:
Vevstype
Biopsikvalitet: (tilfredsstillende, uegnet for diagnostikk, suboptimal for diagnostikk)
FOR IKKE-NEOPLASTISKE SYKDOMMER: beskriv først arkitektur (kapsel, sinuser, B-celle området, T-celle området, pulpa), deretter celletyper og deretter resultater fra immunfenotyping, immungenotyping eller FISH.
FOR NEOPLASTISKE SYKDOMMER:
- Type neoplasi etter WHO klassifikasjon: (for eksempel follikulært lymfom grad 1–2, diffust storcellet B celle lymfom, osv.)
- Arkitektur: (diffust,nodulært, ekstranodulært, perivaskulært, osv.)
- Celletype: (beskrivelse av cellenes morfologi)
- Immunfenotype: (oppsummering av immunfenotype også hvis resultatet er negativt. For eksempel: CD45+, CD20+, CD3-, osv.). Her kan det også henvises til resultater fra eksterne undersøkelser, f.eks. flowcytometrisk undersøkelse.
| + | brukes for positivt resultat |
| – | brukes for negativt resultat |
| +/– | brukes for delvis positivt resultat i tumorceller der >50 % av cellene er positive |
| –/+ | brukes for delvis positivt resultat i tumorceller der <50 % av cellene er positive |
| ++ | brukes for sterk positivitet, der det er viktig å vektlegge det |
| +(svak) | brukes for svak positivitet, der det er viktig å vektlegge det |
- immungenotype: (resultat fra immunglobulin- og T-celle reseptor genrearrangering)
- interfase genetikk: (resultat fra kromosomanalyse ved FISH)
2. Benmargsbiopsier
Følgende standard elementer (fet skrift) anbefales:
Vevstype:
Biopsikvalitet: (tilfredsstillende, uegnet for diagnostikk, suboptimal for diagnostikk)
Hematopoiese:
Cellularitet: (beskriv celletetthet i % av det samlede intertrabekulære rom)
Erytropoiese: (beskriv egenskaper: relativ andel, vekstmønster og morfologi)
Myelopoiese: (beskriv egenskaper: relativ andel, vekstmønster og morfologi)
Trombopoiese: (beskriv egenskaper: relativ andel, vekstmønster og morfologi)
Lymfoide celler: (gjelder ikke-lymfoid neoplasi, i tilfelle lymfoid neoplasi droppes denne beskrivelsen. Beskriv egenskaper: relativ andel, vekstmønster og morfologi)
Ikke-hematopoietisk celleinfiltrasjon: (beskriv. For eksempel: granulomatøs betennelse osv.)
Fibrose: (graderes etter WHO klassifikasjon ved Gomorifarging: grad 0/1/2/3. Dette gjøres spesielt ved alle primære benmargssykdommer)
Benvevet: (beskriv egenskaper: arkitektur og morfologi)
Resultat fra immunhistokjemisk undersøkelse (hvis aktuelt): prosent andel av CD34+ celler bør nevnes i tilfelle dysplasi.
Tumorinfiltrasjon: (droppes hvis ikke aktuelt. Det kan være aktuelt selv om det ikke finnes tumor, med beskrivelsen ’ikke påvist’ i tilfelle spesifikt klinisk spørsmål om tumorinfiltrasjon)
- type tumor: (karsinom, lymfom, osv.)
- infiltrasjonsandel: (% av det samlede intertrabekulære rom)
- infiltrasjonsmønster: (fokalt, diffust interstitielt, diffust massivt, nodulært, peritrabekulært, intertrabekulært, intrasinusoidalt)
- celletype: (beskrivelse av cellenes morfologi)
- immunfenotype: (oppsummering av immunfenotype. For eksempel: cytokeratin +, PSA+, CEA+ osv.)
Diagnose
Følgende rekkefølge anbefales:
- biopsiens vevsart, type og topografi (f.eks. benmargsbiopsi fra venstre crista, lymfeknutebiopsi fra venstre aksille, nålebiopsi fra lymfeknute i abdomen)
- diagnose etter WHO-klassifikasjon (her bruker man felles oversettelse av WHO-klassifikasjon, se vedlegg)
Vurdering
Diskusjon om diagnosen bør beskrives i separate felt, hvis nødvendig. Det er alltid viktig å ta opp eventuelle spørsmål som kliniker har stilt, skriftlig eller muntlig. For eksempel: ’det foreligger ingen holdepunkter for histologisk transformasjon’ ’Selv om pasienten har generell glandelsvulst, har vi ingen holdepunkt for neoplasi i foreliggende lymfeknutebiopsi’. Det er også særlig viktig å ta opp tilleggsundersøkelser som må til for å kunne stille diagnose etter WHO kriteriene.
Koding
Liste med morfologi-koder er vedlagt. Listen er basert på internasjonalt godkjente koder og anbefales brukt i Norge.
| Malignt lymfom | 95903 | |
| Non-Hodgkin lymfom | 95913 | |
| Non-Hodgkin lymfom, B-cellelymfom | 95963 | |
| Småcellet B-cellelymfom | 95983 | |
| Storcellet B-cellelymfom | 95993 | |
| Monoklonal B-cellelymfocytose | 96121 | |
| Monoklonal plasmacelleproliferasjon | 97321 | |
| Non-Hodgkin lymfom, T-cellelymfom | 95973 | |
| Akutt lymfatisk leukemi | 98213 | |
|
|
| |
| B LYMFOBLASTISK LEUKEMI/LYMFOM (BLL/L) |
| |
| BLL/L UNS | 98113 | |
| BLL/L med t(9;22)(q34;q11); BCR-ABL | 98123 | |
| BLL/L med t(v;11q23); MLL rearrangert | 98133 | |
| BLL/L med t(12;21)(p13;q22): TEL-AML1 (ETV6-RUNX1) | 98143 | |
| BLL/L med hyperdiploidi | 98153 | |
| BLL/L med hypodiploidi | 98163 | |
| BLL/L med t(5;14)(q31;q32); IL3-IGH | 98173 | |
| BLL/L med t(1;19)(q23;p13) E2A-PBX1 (TCF3-PBX1) | 98183 | |
|
|
| |
| T LYMFOBLASTISK LEUKEMI/LYMFOM | 98373 | |
|
|
| |
| MODEN B-CELLE NEOPLASI |
| |
| Kronisk lymfatisk leukemi/småcellet lymfocytært lymfom | 98233 | |
| B-prolymfocytt leukemi | 98333 | |
| Ekstranodalt marginalsonelymfom av MALT type | 96993 | |
| Nodalt marginalsonelymfom (inkl. pediatrisk type) | 96993 | |
| Splenisk marginalsonelymfom | 96893 | |
| Hårcelleleukemi | 99403 | |
| Splenisk B-celle lymfom/leukemi, ikke klassifierbar | 95963 | |
| Splenisk diffust småcellet B-celle lymfom i rød pulpa | 95963 | |
| Hårcelleleukemi variant | 95963 | |
| Lymfoplasmacyttisk lymfom | 96713 | |
| Mantelcellelymfom | 96733 | |
| Plasmacellemyelom | 97323 | |
| Solitært plasmacytom | 97313 | |
| Ekstraossøst plasmacytom | 97343 | |
| Follikulært lymfom UNS | 96903 | |
| Follikulært lymfom grad 1–2 | 96913 | |
| Follikulært lymfom grad 3A | 96953 | |
| Follikulært lymfom grad 3B | 96983 | |
| Diffust storcellet B-celle lymfom (DLBCL) UNS | 96803 | |
| Primært DLBCL i CNS | 96803 | |
| Primært kutant DLBCL, legg-type | 96803 | |
| EBV-positivt DLBCL | 96803 | |
| DLBCL assosiert med kronisk inflammasjon | 96803 | |
| T celle/histocyttrikt B-celle lymfom | 96883 | |
| Lymfomatoid granulomatose | 97661 | |
| Primært mediastinalt (thymisk) storcellet B-celle lymfom | 96793 | |
| Intravaskulært storcellet B-celle lymfom | 96853 | |
| ALK positivt storcellet B-celle lymfom | 97373 | |
| Plasmablastisk lymfom | 97353 | |
| Storcellet B-celle lymfom i HHV8-assosiert multisentrisk Castleman sykdom | 97383 | |
| Primært effusjonslymfom | 96783 | |
| Burkitt lymfom | 96873 | |
| Høygradig B-celle lymfom, uklassifisert (UNS og DTHIT) | 96803 | |
| B-celle lymfom, uklassifisert, med karakteristika av diffust storcellet B-celle lymfom og Hodgkin lymfom | 95963 | |
|
|
| |
| MODEN T-/NK-CELLE NEOPLASI |
| |
| T-prolymfocytt leukemi | 98343 | |
| Storgranulær T-lymfocytt leukemi | 98313 | |
| Storgranulær T-lymfocyttproliferasjon av usikker betydning | 98311 | |
| Kronisk NK-celle lymfoproliferativ sykdom | 98381 | |
| Aggressiv NK-celle leukemi | 99483 | |
| Systemisk EBV-positiv T-cellelymfom hos barn | 97243 | |
| Hydroa vacciniforme-liknende lymfom | 97253 | |
| Adult T-celle leukemi/lymfom | 98273 | |
| Ekstranodalt NK/T-celle lymfom, nasal type | 97193 | |
| Enteropati-assosiert T-celle lymfom | 97173 | |
| Hepatosplenisk T-celle lymfom | 97163 | |
| Kutant T-cellelymfom UNS | 97093 | |
| Subkutant pannikulitt-liknende T-celle lymfom | 97083 | |
| Mycosis fungoides | 97003 | |
| Sézary syndrom | 97013 | |
| Primær kutan CD30+ lymfoproliferativ sykdom |
| |
| Lymfomatoid papulose | 97181 | |
| Primært kutant anaplastisk storcellet lymfom | 97183 | |
| Primært kutant gamma-delta T-celle lymfom | 97263 | |
| Primært kutant CD4-positivt små/medium T-celle lymfoproliferativ sykdom | 97063 | |
| Perifer T-celle lymfom, UNS | 97023 | |
| Angioimmunoblastisk T-celle lymfom | 97053 | |
| Anaplastisk storcellet lymfom, ALK positivt | 97143 | |
| Anaplastisk storcellet lymfom, ALK negativt | 97023 | |
|
|
| |
| HODGKIN LYMFOM |
|
|
| Nodulært lymfocyttrikt Hodgkin lymfom | 96593 |
|
| Klassisk Hodgkin lymfom UNS | 96503 |
|
| Klassisk Hodgkin lymfom, nodulær sklerose | 96633 |
|
| Klassisk Hodgkin lymfom, lymfocyttrikt | 96513 |
|
| Klassisk Hodgkin lymfom, blandet cellularitet | 96523 |
|
| Klassisk Hodgkin lymfom, lymfocyttfattig | 96533 |
|
|
|
|
|
| HISTIOCYTÆR OG DENDRITTISK CELLE NEOPLASI |
|
|
| Histiocytært sarkom | 97553 |
|
| Langerhanscellehistiocytose | 97511 |
|
| Langerhanscellesarkom | 97563 |
|
| Interdigiterende dendrittiskcellesarkom (inkl. indeterminat dendrittiskcellesarkom) | 97573 |
|
| Follikulær dendrittiskcellesarkom | 97583 |
|
| Fibroblastisk retikulærcelletumor | 97593 |
|
| Disseminert juvenilt xanthogranulom |
|
|
| Blastisk plasmacytoid dendrittiskcelle neoplasi | 97273 |
|
|
|
|
|
| POSTTRANSPLANTASJON LYMFOPROLIFERATIVE SYKDOMMER (PTLS) | ||
| Posttransplantasjon lymfoproliferativ sykdom | 99711 |
|
| Plasmacyttisk hyperplasi | 99711 |
|
| Mononukleoseliknende PTLS | 99711 |
|
| Polymorf posttransplantasjon lymfoproliferativ sykdom | 99713 |
|
| Monomorf PTLS (B og T/NK typer) | Koder ovenfor |
|
| Klassisk Hodgkin lymfom type PTLS | Koder ovenfor |
|
Cytostatikakurer
Sist faglig oppdatert: 10.12.2021
Det er utarbeidet et Nasjonalt Cytostatikaregister som innbefatter kurdefinisjoner, arbeidsskjema og prisantydninger («Felleskatalogpris» + apotekomkostninger ved opptrekk). Registeret er lagt ut på nettet. Opplysninger om kurene fås også ved henvendelse til Universitetsykehus.
Generelt: Før hver kur måles alltid hemoglobin, leukocytter med differensialtelling og trombocytter i blod. Ved kurativt behandlingsmål angis som retningsgivende krav for å gi ny kur med 100 % dosering til riktig tid: Trombocytter ≥ 75 x 109/L og neutrofile granulocytter ≥ 1,0–1,5 x 109/L. ABVD kjemoterapi er ofte forbundet med lavere verdier av nøytrofile granulocytter, og ny kur kan oftest gis ved verdier over 0,5 x 109/L. Ved verdier lavere enn dette kontaktes for øvrig alltid behandlingsansvarlig sykehus for råd om doser og tidspunkt for kur. Dosereduksjon må forsøkes unngått, fordi det ofte influerer negativt på behandlingsresultat. Bruk av G-CSF for å unngå neutropen feber og opprettholde fulle doser kan bli aktuelt (se kapittel Høydosebehandling med autolog stamcellestøtte). Ved bleomycinholdig kjemoterapi (eks. ABVD) er det imidlertid klare holdepunkter for at G-CSF øker insidensen av bleomycinindusert pneumonitt, og forsiktighet med bruk av G-CSF må utvises.
Husk for øvrig at doxorubicin utskilles hovedsakelig i gallen og at dosen må reduseres ved forhøyet bilirubin. Totaldosen av doxorubicin må ikke overstige 550 mg/m2 pga kardiotoksisitet. Totaldosen av bleomycin må ikke overstige 360 000 IE grunnet fare for lungetoksistet, helst ikke over 300 000 IE der strålebehandling mot mediastinum planlegges.
Etoposid kan erstattes av etoposidfosfat (Etopofos®) med samme dosering.
Behandlingsregimer ved Hodgkin lymfom
| ABVD-kur | ||
| Doxorubicin | 25 mg/m2 i.v. | dag 1 og 15 |
| Bleomycin | 10 000 IE/m2 i.v. | dag 1 og 15 |
| Vinblastin | 6 mg/m2 i.v. | dag 1 og 15 |
| Dacarbazin | 375 mg/m2 i.v. | dag 1 og 15 |
| Ny kur starter hver 4. uke | ||
|
| ||
| BEACOPP-kur standard | ||
| Cyklofosfamid* | 650 mg/m2 i.v. | dag 1 |
| Doxorubicin | 25 mg/m2 i.v. | dag 1 |
| Etoposid | 100 mg/m2 i.v. | dag 1–3 |
| Procarbazin | 100 mg/m2 per os | dag 1–7 |
| Prednison | 40 mg/m2 per os | dag 1–7 |
| Vinkristin | 1,4 mg/m2 i.v. (maks. 2 mg) | dag 8 |
| Bleomycin | 10 000 IE/m2 i.v. | dag 8 |
| *Mesna (Uromitexan) | 20 % av cyklofosfamiddosen ved start cyklofosfamid, etter 0, 4 og 8 timer |
|
| Ny kur hver 3. uke | ||
|
| ||
| Doseeskalert BEACOPP | ||
| Cyklofosfamid* | 1250 mg/m2 i.v. | dag 1 |
| Doxorubicin | 35 mg/m2 i.v. | dag 1 |
| Etoposid | 200 mg/m2 i.v. | dag 1–3 |
| Procarbazin | 100 mg/m2 per os | dag 1–7 |
| Prednison | 40 mg/m2 per os | dag 1–7 |
| Vinkristin | 1,4 mg/m2 i.v. (maks. 2 mg) | dag 8 |
| Bleomycin | 10 000 IE/m2 i.v. | dag 8 |
| G-CSF eller Pegylert G-CSF | Ca 5 µg/kg sc
6 mg sc | fra dag 8
dag 8 |
| *Mesna (Uromitexan) | 20 % av cyklofosfamiddosen ved start og etter 4 og 8 timer |
|
| Ny kur hver 3. uke. PCP profylakse co-trimoxazol 2 tabl x 2 hver lør og søn | ||
|
| ||
| LVPP-kur | ||
| Klorambucil | 6 mg/m2 per os (maks. 10 mg) | dag 1–14 |
| Vinblastin | 6 mg/m2 i.v. | dag 1 og 8 |
| Procarbazin | 100 mg/m2 per os | dag 1–14 |
| Prednison | 15 mg x 3 per os (Prednison trappes ned over 3 dg.) | dag 1–14 |
| Ny kur hver 4. uke | ||
|
| ||
| CEKP-kur | ||
| Lomustin (CCNU) | 80 mg/m2 per os | dag 1 |
| Etoposid | 100 mg/m2 per os | dag 1–5 |
| Klorambucil | 6 mg/m2 per os | dag 1–5 |
| Prednisolon | 40 mg/ m2 per os | dag 1–5 |
| Ny kur hver 4. uke | ||
|
| ||
| BOP-kur | ||
| Bleomycin | 10 000 IE, i.v. | 1 gang ukentlig |
| Vinkristin | 2 mg i.v. | dag 1 og 8 |
| Prednison | 15 mg x 3 per os | dag 1–14 |
| Ny kur hver 4. uke | ||
|
| ||
| OPPA-kur (GPOH-HD 95) | ||
| Doxorubicin | 40 mg/m2 i.v. som 2 timers infusjon | dag 1 og 15 |
| Vinkristin | 1,5 mg/m2 i.v. max enkeltdose 2mg | dag 1, 8 og 15 |
| Procarbazin | 100 mg/m2 per os 2–3 doser per dag | dag 1–15 |
| Prednison | 60 mg/m2 p.o. fordelt på 3 doser per dag | dag 1–15 |
| Ny kur hver 4. uke | ||
|
| ||
| OEPA-kur ( EuroNet-PHL-C1) | ||
| Doxorubicin | 40 mg/m2 i.v. som 4 timers infusjon | dag 1 og 15 |
| Vinkristin | 1,5 mg/m2 i.v. max enkeltdose 2mg | dag 1, 8 og 15 |
| Etoposid | 125 mg/m2 i.v. som 2 t infusjon | dag 1-5 |
|
|
|
|
|
|
|
|
| Prednison | 60 mg/m2 p.o. fordelt på 3 doser per dag | dag 1–15 |
| Ny kur hver 4. uke | ||
|
| ||
| COPP-kur (GPOH-HD 95 og EutoNet-PHL-C1) | ||
| Cyklofosfamid | 500 mg/m2 i.v. som 30–60 min infusjon | dag 1 og 8 |
| Vinkristin | 1,5 mg/m2 i.v. max enkeltdose 2mg | dag 1 og 8 |
| Procarbazin | 100 mg/m2 p.o. fordelt på 2–3 doser per dag | dag 1–15 |
| Prednison | 40 mg/m2 p.o. fordelt på 3 doser per dag | dag 1–15 |
|
|
|
|
| Mesna 200 mg/m2 0, 4 og 8 timer etter cyklofosfamidinfusjonen. | ||
| Ny kur hver 4. uke | ||
|
| ||
| COP-DAC-kur (GPOH-HD 95 og EuroNet-PHL-C1) | ||
| Cyklofosfamid | 500 mg/m2 i.v. som 30–60 min infusjon | dag 1, 8 |
| Vinkristin | 1,5 mg/m2 i.v. max dose 2 mg | dag 1, 8 |
| Dakarbazin | 250 mg/m2 i.v. over 30 min | dag 1–3 |
| Prednisolon | 40 mg/m2 p.o. fordelt på 3 doser per dag | dag 1–15 |
| Mesna | 200 mg/m2 0, 4 og 8 timer etter cyklofosfamidinfusjonen |
|
| Ny kur hver 4. uke |
|
|
Behandlingsregimer ved non-Hodgkin lymfom
Rituximab i kombinasjon med kjemoterapi
Det foreligger dokumentert bedret effekt av å kombinere rituximab med CHOP-basert kjemoterapi ved både indolente og aggressive B-celle lymfomer. Som ledd i CHOP-kur skal først Prednisolon (100 mg) gis per os. Deretter administreres rituximab iv (375 mg/m2), og så selve CHOP-kuren, alt på samme dag. Ved kombinasjon med andre kurer foreligger ingen fastlagte regimer, men preparatet kan gjerne gis på første dag av kur, før kjemoterapi.
| CHOP-21 kur (evt + rituximab) | ||||
| Cyklofosfamid | 750 mg/m2 i.v. | dag 1 | ||
| Doxorubicin | 50 mg/m2 i.v. | dag 1 | ||
| Vinkristin | 1,4 mg/m2, max 2 mg i.v. | dag 1 | ||
| Prednison | 50 mg x 2 per os | dag 1–5 | ||
| (Rituximab | 375 mg/m2 iv | dag 1) | ||
| Ny kur hver 3. uke | ||||
|
| ||||
| CHOP-14 kur (evt + rituximab) | ||||
| Cyklofosfamid | 750 mg/m2 i.v. | dag 1 | ||
| Doxorubicin | 50 mg/m2 i.v. | dag 1 | ||
| Vinkristin | 1,4 mg/m2, max 2 mg i.v. | dag 1 | ||
| Prednison | 50 mg x 2 per os | dag 1–5 | ||
| (Rituximab | 375 mg/m2 iv | dag 1) | ||
| G-CSF | 300 µg < 75 kg s.c. 480 µg ≥75 kg s.c. | dag 4–10 dag 4–10 | ||
| eller |
|
| ||
| Pegylert-G-CSF | 6 mg s.c. | dag 4 | ||
| Ny kur hver 2. uke. Det foreslås å foreta blodtellinger med diff.-telling av leukocytter dag 10. Ved nøytrofile over 5 x 109/l seponeres G-CSF, for øvrig fortsettes til dag 12. PCP profylakse vurderes, især for pasienter som står på fast steroidmedikasjon, evt co-trimoxazol 2 tabl x 2 hver lør og søn. | ||||
|
| ||||
| CHOEP-21 kur (evt + rituximab) | ||||
| Cyklofosfamid | 750 mg/m2 i.v. | dag 1 | ||
| Doxorubicin | 50 mg/m2 i.v. | dag 1 | ||
| Vinkristin | 1,4 mg/m2, max 2 mg i.v. | dag 1 | ||
| Etoposid | 100 mg/m2 i.v. | dag 1–3 | ||
| Prednison | 50 mg x 2 per os | dag 1–5 | ||
| Ny kur hver 3. uke | ||||
|
| ||||
| CHOEP-14 kur (evt + rituximab) | ||||
| Cyklofosfamid | 750 mg/m2 i.v. | dag 1 | ||
| Doxorubicin | 50 mg/m2 i.v. | dag 1 | ||
| Vinkristin | 1,4 mg/m2, max 2 mg i.v. | dag 1 | ||
| Etoposid | 100 mg/m2 i.v. | dag 1–3 | ||
| Prednison | 50 mg x 2 per os | dag 1–5 | ||
| (Rituximab | 375 mg/m2 iv | dag 1) | ||
|
|
| forts. | ||
| G-CSF | 300 µg < 75 kg s.c. 480 µg ≥ 75 kg s.c. | dag 4–10 | ||
| eller |
|
| ||
| Pegylert G-CSF | 6 mg s.c. | dag 4 | ||
| Ny kur hver 2. uke. Det foreslås å foreta blodtellinger med diff.-telling av leukocytter dag 10. Ved nøytrofile over 5 x 109/l seponeres G-CSF, for øvrig fortsettes til dag 12. PCP profylakse anbefales, co-trimoxazol 2 tabl x 2 hver lør og søn. | ||||
|
| ||||
| COP-kur (evt + rituximab) | ||||
| Cyklofosfamid | 750 mg/m2 i.v. | dag 1 | ||
| Vinkristin | 1,4 mg/m2, max 2 mg i.v. | dag 1 | ||
| Prednison | 50 mg x 2 daglig per os | dag 1–5 | ||
| (Rituximab | 375 mg/m2 iv | dag 1) | ||
| Ny kur hver 3. uke | ||||
|
| ||||
| ENAP-kur | ||||
| Mitoxantrone | 10 mg/m2 i.v. | dag 1 | ||
| Cytarabin | 100 mg/m2 i.v., x 2 | dag 1 (12 t. intervall) | ||
| Etoposid | 100 mg/m2 i.v. 200 mg/m2 per os | dag 1 dag 2 og dag 3 | ||
| Prednison | 50 mg x 2 daglig per os | dag 1–5 | ||
| Kur gjentas hver 3.–4. uke | ||||
|
| ||||
| VIM-kur | ||||
| Ifosfamid | 1200 mg/m2 i.v. | dag 1–5 | ||
| Metotreksat | 30 mg/m2 i.v. | dag 1 og 5 | ||
| Etoposid1 | 90 mg/m2 i.v. | dag 1, 3, 5 | ||
| Mesna (Uromitexan) | 10 mg/kg blandes i ifosfamidposen. Deretter gis 20 mg/kg over 8 timer i.v. | dag 1–5 | ||
| 1 Vurder dosereduksjon av ifosfamid ved lav s-albumin | ||||
| Ny kur hver 4. uke | ||||
|
| ||||
| IKE-kur | ||||
| Ifosfamid* | 5000 mg/m2 i.v. | dag 2, 24 timers infusjon |
| |
| Karboplatin** | 5 x (GFR + 25) mg i.v. | dag 2, 1 times infusjon |
| |
| Etoposid | 100 mg/m2 i.v. | dag 1–3, 1 times infusjon |
| |
| G-CSF | 300 µg < 75 kg s.c. 480 µg P75 kg s.c. | dag 4–10 |
| |
| eller |
|
|
| |
| Pegylert -CSF | 6 mg s.c. | dag 4 |
| |
| * 5000 mg/m2 uromitexan i samme infusjonspose i.v. + 5000 mg/m2 uromitexan p.o. 4 og 8 timer etter avsluttet infusjon dag 3. ** Maksimum 800 mg. Kur gjentas hver 14. dag ved trombocytter over 50 x 109/l og neutrofile granulocytter > 1,0 x 109/l. PCP profylakse med co-trimoxazol anbefales, 2 t x 2 lør + søn |
| |||
|
|
|
|
| |
| EPOCH-R. dosejustert | |||
| Rituximab | 375 mg/m2 iv | Dag 1 | Etter skjema |
| Etoposid Doksorubicin Vinkristin | 50 mg/m2 iv/døgn 10 mg/m2 iv/døgn 0.4 mg/m2 iv/døgn | Dag 1–4 Dag 1–4 Dag 1–4 | Kontinuerlig infusjon i samme pose |
|
|
|
|
|
| Cyklofosfamid | 750 mg/m2 iv | Dag 5 | 30 min infusjon |
| Prednisolon | 50 mg x 2 po | Dag 1–5 |
|
| Neupogen® sc | 5 mikrogram/kg | Dag 6 til nøytrofile > 5 x 109/L etter nadir |
|
| Neulasta® sc | 6 mg | Dag 6 |
|
Dosejusteriong basert på blodtellinger x 2 per uke: Hvis nadir nøytrofile > 0.5; øk etoposid, doksorubicin og cyklofosfamid med 20 %, hvis nadir nøytrofile < 0.5 ved 1 eller 2 tellinger; samme dose, hvis nadir nøytrofile < 0.5 ved tre anledninger eller hvis platetallet < 25 ved 1 telling: 20 % reduksjon.
| Bendamustin-R |
|
|
| Bendamustin | 90 mg/m2 | dag 1–2 |
| Rituximab | 375 mg/m2 | dag 1 |
|
|
|
|
| Fludarabin-kur (evt + rituximab) | ||
| Fludarabin | 25 mg/m2 i.v. | dag 1–5 |
| (Rituximab | 375 mg/m2 | dag 1) |
| Ny kur hver 4. uke |
|
|
| PCP profylakse anbefales der behandlingen kombineres med steroider, | ||
|
|
|
|
| FC-kur (evt + rituximab) | ||
| Fludarabin | 25 mg/m2 i.v. | dag 1–3 |
| Cyklofosfamid | 250 mg/m2 | dag 1–3 |
| (rituximab | 375 mg/m2 | dag 1) |
| Ny kur hver 3.–4. uke |
|
|
| PCP profylakse anbefales med co-trimoxazol, evt 2 tabl x 2 lør og søn | ||
|
|
|
|
| Leukeran-kur | ||
| Leukeran | 15 mg/m2 | dag 1–5 |
| Ny kur hver 4. uke |
|
|
|
|
|
|
| Rituximab monoterapi | ||
| Rituximab | 375 mg/m2 i.v. | dag 1, 8, 15, 21 |
Obs infusjonrelaterte bivirkninger mest uttalt ved første kur, forbehandling med antihistamin og paracetamol samt nøye observasjon. F.o.m. infusjon nr 2 kan behandlingen gjennomføres på 90 minutter for de fleste.
GMALL-B-ALL/NHL 2002 basert kjemoterapi ved aggressive NHL hos pasienter under 20 år og ved Burkitt lymfom. Henvendelse til Universitetsykehus anbefales
Retningslinjer for Allogen stamcelletransplan-tasjon som vedrører maligne lymfomer
Sist faglig oppdatert: 06.03.2023
Maligne lymfomer adskiller seg fra de øvrige tilstander der allogen SCT er aktuelt ved å manifestere seg med målbare tumormasser ved billeddiagnostikk. Graden av tilbakegang av tumormassene er et vanlig mål på behandlingseffekt. I de fleste undersøkelser benyttes begrepene kjemosensitivitet og – resistens. Hvor god en remisjon er ved kjemosensitiv sykdom er ofte ikke definert i studier som omtaler resultater av SCT. Det skilles sjelden mellom komplett remisjon og partiell remisjon. Dette har i hvert fall delvis sammenheng med at restmanifestasjonene ofte i stor grad består av fibrøst vev og ikke vitalt tumorvev. Få studier har frem til nå benyttet 18FDG PET for remisjonsbedømmelse.
Vi har valgt å benytte begrepet «kjemosensitivitet» fremfor krav om komplett remisjon i de tabellariske anbefalingene. Generelt anbefaler vi dog at en bør oppnå en god partiell remisjon (minst 75 % tilbakegang av tumormanifestasjonene) for at allogen SCTR kan anbefales. Kravene bør være sterkest ved aggressive lymfomer (rask gjenvekst av tumor før graft versus lymphoma (GVL) effekten inntrer) og ved entiteter med dårligst dokumentasjon for GVL effekt (for eksempel Hodgkin lymfom).
Når er allogen stamcelletransplantasjon aktuelt
Høydosebehandling med autolog stamcelletransplantasjon (HMAS) er enten standardindikasjon eller under utprøving som lovende behandling ved de fleste lymfomentiteter før allogen SCT er aktuell behandling. Allogen SCT er således oftest først aktuelt ved første residiv der HMAS tilbys i 1. remisjon (mantelcellelymfom, T-cellelymfom, lymfoblastlymfom) eller senere remisjoner (øvrige lymfomentiteter omtalt og der HMAS tilbys i 2. eller senere remisjon). Unntak fra det som er omtalt over foreligger for eksempel ved indolente lymfomer med kjemosensitiv sykdom, men med manglende komplett remisjon i benmarg og dårlige leveutsikter. Det auologe stamcelleproduktet vil da med høy sannsynlighet være kontaminert og allogen stamcelletransplantasjon være en foretrukket prosedyre.
Hodgkin lymfom (4.9.3)
Anbefalinger:
Status | Familiegiver | Ubeslektet giver |
|---|---|---|
Første remisjon | BIU | BIU |
Annen remisjon | BIU | BIU |
Kjemosensitivt tilbakefall, > annen remisjon | KM (C) | KM (C) |
Refraktær sykdom | UB (D) | UB (D) |
Tillegg
Pasienter med indikasjon for HMAS, men utilstrekkelig antall stamceller: KM (D)
Estimat antall aktuelle pasienter per år
Pasienter i ny remisjon ved residiv etter HMAS: 3–5 pasienter, avhengig av bla krav til remisjonsstatus.
Dokumentasjon
Ingen randomiserte studier, men singel senter og multisenter studier (retrospektive og prospektive) med 25–58 pasienter og registerstudier. Den høye behandlingsrelaterte mortalitet (40–50 %) ved full kondisjonering gjør at behandling med redusert kondisjonering anses som mest aktuelt. Relativt ensartede resultater med behandlingsrelatert mortalitet på 16–20 %, 2–4 års OS 40–55 % men relapse rate på 40–60 %. Residiv etter HMAS anses som mest aktuelle indikasjon og allogen SCT anses da å være eneste kurative mulighet.
Kjemosensitivitet anses som viktig for behandlingsresultatet i de fleste studier. Studiene er for små og usystematiske til å avklare betydningen av familiegiver versus ubeslektet giver. Det synes å være relativt like resultater enten det er benyttet familiegiver eller ubeslektet giver. Hvis man vurderer en pasient egnet for allogen SCT, bør man derfor sannsynligvis søke å finne en ubeslektet giver hvis det ikke foreligger en beslektet.
Referanser
Alvarez, I., Sureda, A., Caballero, M. D., Urbano-Ispizua, A., Ribera, J. M., Canales, M., . . . Sierra, J. (2006). Nonmyeloablative stem cell transplantation is an effective therapy for refractory or relapsed hodgkin lymphoma: results of a spanish prospective cooperative protocol. Biology of blood and marrow transplantation, 12(2), 172-183. https://doi.org/10.1016/j.bbmt.2005.09.009
Anderlini, P., Saliba, R., Acholonu, S., Giralt, S. A., Andersson, B., Ueno, N. T., . . . Champlin, R. E. (2008). Fludarabine-melphalan as a preparative regimen for reduced-intensity conditioning allogeneic stem cell transplantation in relapsed and refractory Hodgkin's lymphoma: the updated M.D. Anderson Cancer Center experience. Haematologica, 93(2), 257-264. https://doi.org/10.3324/haematol.11828
Anderlini, P., Saliba, R., Acholonu, S., Okoroji, G. J., Donato, M., Giralt, S., . . . Champlin, R. E. (2005). Reduced-intensity allogeneic stem cell transplantation in relapsed and refractory Hodgkin's disease: low transplant-related mortality and impact of intensity of conditioning regimen. Bone marrow transplantation, 35(10), 943-951. https://doi.org/10.1038/sj.bmt.1704942
Baron, F., Storb, R., Storer, B. E., Maris, M. B., Niederwieser, D., Shizuru, J. A., . . . Sandmaier, B. M. (2006). Factors associated with outcomes in allogeneic hematopoietic cell transplantation with nonmyeloablative conditioning after failed myeloablative hematopoietic cell transplantation. Journal of clinical oncology, 24(25), 4150-4157. https://doi.org/10.1200/jco.2006.06.9914
Burroughs, L. M., Maris, M. B., Sandmaier, B. M., Leisenring, W., Jain Stuart, M., Niederwieser, D., . . . Maloney, D. G. (2004). HLA-matched related (MRD) or unrelated donor (URD) nonmyeloablative conditioning and hematopoietic cell transplant (HCT) for patients with advanced Hodgkin disease (HD). Biology of blood and marrow transplantation, 10(Suppl 1), 73-74.
Milpied, N., Fielding, A. K., Pearce, R. M., Ernst, P., & Goldstone, A. H. (1996). Allogeneic bone marrow transplant is not better than autologous transplant for patients with relapsed Hodgkin's disease. European Group for Blood and Bone Marrow Transplantation. Journal of clinical oncology, 14(4), 1291-1296. https://doi.org/10.1200/jco.1996.14.4.1291
Peggs, K. S., Hunter, A., Chopra, R., Parker, A., Mahendra, P., Milligan, D., . . . Mackinnon, S. (2005). Clinical evidence of a graft-versus-Hodgkin's-lymphoma effect after reduced-intensity allogeneic transplantation. Lancet, 365(9475), 1934-1941. https://doi.org/10.1016/s0140-6736(05)66659-7
Robinson, S. P., Schmitz, N., Taghipour, G., & Sureda, A. (2004). Reduced Intensity Allogeneic Stem Cell Transplantation for Hodgkin’s Disease. Outcome Depends Primarily on Disease Status at the Time of Transplantation. Blood, 104(11), 2322.
Schmitz, N., Dreger, P., Glass, B., & Sureda, A. (2007). Allogeneic transplantation in lymphoma: current status. Haematologica, 92(11), 1533-1548. https://doi.org/10.3324/haematol.11185
Sureda, A., Robinson, S., Canals, C., Carella, A. M., Boogaerts, M. A., Caballero, D., . . . Schmitz, N. (2008). Reduced-intensity conditioning compared with conventional allogeneic stem-cell transplantation in relapsed or refractory Hodgkin's lymphoma: an analysis from the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. Journal of clinical oncology, 26(3), 455-462. https://doi.org/10.1200/JCO.2007.13.2415
Thomson, K. J., Peggs, K. S., Smith, P., Cavet, J., Hunter, A., Parker, A., . . . Mackinnon, S. (2008). Superiority of reduced-intensity allogeneic transplantation over conventional treatment for relapse of Hodgkin's lymphoma following autologous stem cell transplantation. Bone marrow transplantation, 41(9), 765-770. https://doi.org/10.1038/sj.bmt.1705977
Diffuse storcellete B-cellelymfomer (4.9.4)
Anbefalinger (14.13):
Status | Match familiegiver | 10/10 match ubeslektet eller 1 antigen mismatch familiegiver | 9/10 match ubeslektet giver |
|---|---|---|---|
Første remisjon, intermediær / høyrisk sykdom ved diagnose | BIU | BIU | BIU |
2. remisjon | UB (C) | UB (C) | BIU |
3. remisjon | KM (C) | UB (C) | BIU |
Refraktær sykdom | BIU | BIU | BIU |
Tillegg: Indikasjon for HMAS, men oppnår ikke tilstrekkelig antall stamceller: KM (D)
Estimat antall aktuelle pasienter per år
Kjemosensitiv sykdom i 3. eller senere remisjon: 5
Kjemosensitiv sykdom i 2. remisjon: 10
Dokumentasjon
Ingen randomiserte studier, men institusjonsbaserte studier (retrospektive, og prospektive) med 15–40 pasienter og registerstudier. Ved kjemosensitivt tilbakefall (se 4.8.1) kan transplantasjon være et alternativ til HMAS, men kun innenfor studier godkjent av REK. Ved senere kjemosensitivt tilbakefall anses transplantasjon å være eneste kurative behandlingstilbud med OS (3 år) på 30–50 %. Behandlingsrelatert mortalitet ligger på 30–45 %, høyere for full kondisjonering enn for RIC (sammenliknende studier ikke utført). Kjemosensitivitet viktig for behandlingsresultat i de fleste studier.
Referanser
Full kondisjonering
Bierman, P. J., Sweetenham, J. W., Loberiza, F. R., Jr., Taghipour, G., Lazarus, H. M., Rizzo, J. D., . . . Goldstone, A. (2003). Syngeneic hematopoietic stem-cell transplantation for non-Hodgkin's lymphoma: a comparison with allogeneic and autologous transplantation--The Lymphoma Working Committee of the International Bone Marrow Transplant Registry and the European Group for Blood and Marrow Transplantation. Journal of clinical oncology, 21(20), 3744-3753. https://doi.org/10.1200/jco.2003.08.054
Dhedin, N., Giraudier, S., Gaulard, P., Esperou, H., Ifrah, N., Michallet, M., . . . Kuentz, M. (1999). Allogeneic bone marrow transplantation in aggressive non-Hodgkin's lymphoma (excluding Burkitt and lymphoblastic lymphoma): a series of 73 patients from the SFGM database. Societ Francaise de Greffe de Moelle. British journal of haematology, 107(1), 154-161.
Doocey, R. T., Toze, C. L., Connors, J. M., Nevill, T. J., Gascoyne, R. D., Barnett, M. J., . . . Song, K. W. (2005). Allogeneic haematopoietic stem-cell transplantation for relapsed and refractory aggressive histology non-Hodgkin lymphoma. British journal of haematology, 131(2), 223-230. https://doi.org/10.1111/j.1365-2141.2005.05755.x
Juckett, M., Rowlings, P., Hessner, M., Keever-Taylor, C., Burns, W., Camitta, B., . . . Vesole, D. (1998). T cell-depleted allogeneic bone marrow transplantation for high-risk non-Hodgkin's lymphoma: clinical and molecular follow-up. Bone marrow transplantation, 21(9), 893-899. https://doi.org/10.1038/sj.bmt.1701209
Kim, S. W., Tanimoto, T. E., Hirabayashi, N., Goto, S., Kami, M., Yoshioka, S., . . . Takaue, Y. (2006). Myeloablative allogeneic hematopoietic stem cell transplantation for non-Hodgkin lymphoma: a nationwide survey in Japan. Blood, 108(1), 382-389. https://doi.org/10.1182/blood-2005-02-0596
Rezvani, A. R., Storer, B., Maris, M., Sorror, M. L., Agura, E., Maziarz, R. T., . . . Maloney, D. G. (2008). Nonmyeloablative allogeneic hematopoietic cell transplantation in relapsed, refractory, and transformed indolent non-Hodgkin's lymphoma. Journal of clinical oncology, 26(2), 211-217. https://doi.org/10.1200/jco.2007.11.5477
Redusert kondisjonering
Kusumi, E., Kami, M., Kanda, Y., Murashige, N., Kishi, Y., Suzuki, R., . . . Takaue, Y. (2005). Reduced-intensity hematopoietic stem-cell transplantation for malignant lymphoma: a retrospective survey of 112 adult patients in Japan. Bone marrow transplantation, 36(3), 205-213. https://doi.org/10.1038/sj.bmt.1705027
Morris, E., Thomson, K., Craddock, C., Mahendra, P., Milligan, D., Cook, G., . . . Mackinnon, S. (2004). Outcomes after alemtuzumab-containing reduced-intensity allogeneic transplantation regimen for relapsed and refractory non-Hodgkin lymphoma. Blood, 104(13), 3865-3871. https://doi.org/10.1182/blood-2004-03-1105
Robinson, S. P., Goldstone, A. H., Mackinnon, S., Carella, A., Russell, N., de Elvira, C. R., . . . Schmitz, N. (2002). Chemoresistant or aggressive lymphoma predicts for a poor outcome following reduced-intensity allogeneic progenitor cell transplantation: an analysis from the Lymphoma Working Party of the European Group for Blood and Bone Marrow Transplantation. Blood, 100(13), 4310-4316. https://doi.org/10.1182/blood-2001-11-0107
T-celle lymfomer, inkl. kutane T-cellelymfomer (4.9.5)
Anbefalinger (14.14):
Status | Match familiegiver | 10/10 match ubeslektet eller 1 mismatch beslektet | 9/10 match ubeslektet donor |
|---|---|---|---|
Første remisjon | UB (C) | BIU | BIU |
Annen eller senere remisjon | KM (C) | KM (C) | BIU |
Refraktær | UB (D) | UB (D) | BIU |
Estimat antall aktuelle pasienter per år
Pasienter under 60 år i ny remisjon ved residiv etter HMAS inkluderes i denne gruppen:
6–10 pasienter per år, avhengig bl.a. av krav til remisjonsstatus.
Dokumentasjon
Lovende resultater fra små serier. 5-års OS er 50–70 %.
Referanser
Corradini, P., Dodero, A., Zallio, F., Caracciolo, D., Casini, M., Bregni, M., . . . Tarella, C. (2004). Graft-versus-lymphoma effect in relapsed peripheral T-cell non-Hodgkin's lymphomas after reduced-intensity conditioning followed by allogeneic transplantation of hematopoietic cells. Journal of clinical oncology, 22(11), 2172-2176. https://doi.org/10.1200/jco.2004.12.050
Kim, S. W., Tanimoto, T. E., Hirabayashi, N., Goto, S., Kami, M., Yoshioka, S., . . . Takaue, Y. (2006). Myeloablative allogeneic hematopoietic stem cell transplantation for non-Hodgkin lymphoma: a nationwide survey in Japan. Blood, 108(1), 382-389. https://doi.org/10.1182/blood-2005-02-0596
Kusumi, E., Kami, M., Kanda, Y., Murashige, N., Kishi, Y., Suzuki, R., . . . Takaue, Y. (2005). Reduced-intensity hematopoietic stem-cell transplantation for malignant lymphoma: a retrospective survey of 112 adult patients in Japan. Bone marrow transplantation, 36(3), 205-213. https://doi.org/10.1038/sj.bmt.1705027
Wulf, G. G., Hasenkamp, J., Jung, W., Chapuy, B., Truemper, L., & Glass, B. (2005). Reduced intensity conditioning and allogeneic stem cell transplantation after salvage therapy integrating alemtuzumab for patients with relapsed peripheral T-cell non-Hodgkin's lymphoma. Bone marrow transplantation, 36(3), 271-273. https://doi.org/10.1038/sj.bmt.1705036
Mantelcellelymfomer (4.9.6)
Anbefalinger (14.15):
Status | Match familiegiver | 10/10 match ubeslektet giver eller 1 mismatch familiegiver | 9/10 match ubeslektet giver |
|---|---|---|---|
Første remisjon | BIU | BIU | BIU |
Annen eller senere remisjon | KM (C) | KM (C) | BIU |
Refraktær sykdom | UB (D) | UB (D) | BIU |
Estimat antall aktuelle pasienter per år
Avhengig av krav til remisjon: 2–5.
Dokumentasjon
Registerdata: 5 års OS 31 %. Små senterbaserte studier 3 års OS 40–80 %. Én studie viser ingen forskjell mellom beslektet og ubeslektet giver.
Referanser
Khouri, I. F., Lee, M. S., Saliba, R. M., Jun, G., Fayad, L., Younes, A., . . . Champlin, R. E. (2003). Nonablative allogeneic stem-cell transplantation for advanced/recurrent mantle-cell lymphoma. Journal of clinical oncology, 21(23), 4407-4412. https://doi.org/10.1200/JCO.2003.05.501
Maris, M. B., Sandmaier, B. M., Storer, B. E., Chauncey, T., Stuart, M. J., Maziarz, R. T., . . . Maloney, D. G. (2004). Allogeneic hematopoietic cell transplantation after fludarabine and 2 Gy total body irradiation for relapsed and refractory mantle cell lymphoma. Blood, 104(12), 3535-3542. https://doi.org/10.1182/blood-2004-06-2275
Morris, E., Thomson, K., Craddock, C., Mahendra, P., Milligan, D., Cook, G., . . . Mackinnon, S. (2004). Outcomes after alemtuzumab-containing reduced-intensity allogeneic transplantation regimen for relapsed and refractory non-Hodgkin lymphoma. Blood, 104(13), 3865-3871. https://doi.org/10.1182/blood-2004-03-1105
Robinson, S., Taghipour, G., Canals, C., Russell, N., Beguin, Y., Zander, A., . . . Schmitz, N. (2006). O236: Reduced-intensity conditioning and allogeneic stem cell transplantation in mantle cell lymphoma: an update from the Lymphoma Working Party of the EBMT. Bone Marrow Transplant 37(Suppl 1), S25-26.
Burkitt/Burkitt liknende (4.9.7)
Mangelfull dokumentasjon for GVL effekt. Majoriteten av pasientene under 60 år oppnår varig remisjon på 1. linjebehandling. Vanskelig å oppnå remisjon på 2. linjebehandling.
Konklusjon
BIU
Lymfoblastlymfom (4.9.8)
Anbefaling:
- Remisjon: BIU
- Remisjon: SB (D)
Estimat antall pasienter per år
< 1
Dokumentasjon
De langt fleste pasienter under 60 år oppnår varig remisjon på 1. linjebehandling med ALL-regime konsolidert med HMAS. Stabil ny remisjon ved tilbakefall vanskelig å oppnå, men allogen stamcelletransplantasjon bør i så fall tilbys på linje med ALL residivpasienter.
Follikulært lymfom (4.9.9)
Anbefalinger:
Status | Match Familiegiver | Ubeslektet giver eller 1 antigen mismatch familiegiver |
|---|---|---|
Første remisjon | BIU | BIU |
Annen eller senere remisjon | KM (C) | KM (C) |
Refraktær sykdom | UB (C) | UB (C) |
Tillegg
Pasienter med indikasjon for HMAS, men utilstrekkelig antall stamceller: KM (D)
Estimat antall aktuelle pasienter per år
KM-gruppen: 5+5 (familiegiver + ubeslektet giver)
UB-gruppen : 5+5 (hvis egnet protokoll foreligger)
Dokumentasjon
Ingen randomiserte studier, men en rekke mindre studier fra enkeltinstitusjoner eller studiegrupper (retrospektive, og prospektive) med 40–80 pasienter, samt registerstudier (170 pasienter). Ganske likelydende resultater, som viser en median 3-års OS på nær 70 % med TRM på rundt 20 % og relapse rate på ca. 20 %. I flere oversiktsartikler anslås follikulære lymfomer å være den lymfoproliferative lidelse som kanskje er best egnet for allogen SCT. Studiene er for små og usystematiske til å avklare betydningen av familiegiver versus ubeslektet giver eller RIC versus MAC, og anbefalingene her er gitt ut fra generelle betraktninger om toksisitet. Kjemosensitivitet er antakeligvis mindre viktig for behandlingsresultatet ved denne diagnosen enn ved mer høygradig maligne (raskt prolifererende) sykdommer.
Referanser
Corradini, P., Dodero, A., Farina, L., Fanin, R., Patriarca, F., Miceli, R., . . . Tarella, C. (2007). Allogeneic stem cell transplantation following reduced-intensity conditioning can induce durable clinical and molecular remissions in relapsed lymphomas: pre-transplant disease status and histotype heavily influence outcome. Leukemia, 21(11), 2316-2323. https://doi.org/10.1038/sj.leu.2404822
Farina, L., & Corradini, P. (2007). Current role of allogeneic stem cell transplantation in follicular lymphoma. Haematologica, 92(5), 580-582.
Faulkner, R. D., Craddock, C., Byrne, J. L., Mahendra, P., Haynes, A. P., Prentice, H. G., . . . Russell, N. H. (2004). BEAM-alemtuzumab reduced-intensity allogeneic stem cell transplantation for lymphoproliferative diseases: GVHD, toxicity, and survival in 65 patients. Blood, 103(2), 428-434. https://doi.org/10.1182/blood-2003-05-1406
Ingram, W., Devereux, S., Das-Gupta, E. P., Russell, N. H., Haynes, A. P., Byrne, J. L., . . . Pagliuca, A. (2008). Outcome of BEAM-autologous and BEAM-alemtuzumab allogeneic transplantation in relapsed advanced stage follicular lymphoma. British journal of haematology, 141(2), 235-243. https://doi.org/10.1111/j.1365-2141.2008.07067.x
Morris, E., Thomson, K., Craddock, C., Mahendra, P., Milligan, D., Cook, G., . . . Mackinnon, S. (2004). Outcomes after alemtuzumab-containing reduced-intensity allogeneic transplantation regimen for relapsed and refractory non-Hodgkin lymphoma. Blood, 104(13), 3865-3871. https://doi.org/10.1182/blood-2004-03-1105
Rezvani, A. R., Storer, B., Maris, M., Sorror, M. L., Agura, E., Maziarz, R. T., . . . Maloney, D. G. (2008). Nonmyeloablative allogeneic hematopoietic cell transplantation in relapsed, refractory, and transformed indolent non-Hodgkin's lymphoma. Journal of clinical oncology, 26(2), 211-217. https://doi.org/10.1200/jco.2007.11.5477
Van Besien, K. (2006). The evolving role of autologous and allogeneic stem cell transplantation in follicular lymphoma. Blood reviews, 20(5), 235-244. https://doi.org/10.1016/j.blre.2006.01.001
Vigouroux, S., Michallet, M., Porcher, R., Attal, M., Ades, L., Bernard, M., . . . Milpied, N. (2007). Long-term outcomes after reduced-intensity conditioning allogeneic stem cell transplantation for low-grade lymphoma: a survey by the French Society of Bone Marrow Graft Transplantation and Cellular Therapy (SFGM-TC). Haematologica, 92(5), 627-634.
Retningslinjer for stråleterapi ved maligne lymfomer
Sist faglig oppdatert: 06.03.2023
Generelle betraktninger
Denne rådgiver for strålebehandling av maligne lymfomer er basert på OUS og Norsk lymfomgruppes rutiner og erfaringer samt relevante internasjonale publikasjoner gjennom de siste 15 år. Den er et forsøk på å gi en innføring i stråleterapiens plass i den som regel multimodale behandlingen av de enkelte lymfomentiteter.. Videre vil den forsøke å standardisere tekniske aspekter rundt gjennomføringen av strålebehandlingen. Rådgiveren er skrevet for leger, slik at de områder av strålebehandlingen denne har ansvar for skal kunne standardiseres.
Stråleterapi ved de enkelte lymfomentiteter omtales under de enkelte terapikapitler (se tidligere). Dette kapitelet fokuserer på generelle forhold rundt stråleterapi ved lymfom og spesielle problemer knyttet til stråleterapi av forskjellig anatomiske områder.
Det meste av erfaringsgrunnlag innen strålebehandling ved lymfomer baserer seg på kjente eller antatte spredningsmønstre innenfor det lymfatiske system, erfaringer med bestråling av en eller flere lymfeknuteregioner eller ekstranodale områder med tilstøtende lymfeknutestasjoner i målvolum av varierende størrelse samt relativt standardiserte feltoppsett. Ved tilpassing av CT-veiledet doseplanlegging har en de siste 10 år relativt konservativt forsøkt å bibeholde disse premissene i størst mulig grad. Ved bruk av CT basert konformal strålebehandling harhar både definisjon av målvolum/marginer samt mer kompliserte feltoppsett kommet tiltil Datagrunnlaget for bruk av nyere teknikker innen konformal strålebehandling (IMRT/Protonbestråling) ersparsomt, og vil kun omtales kort der det synes relevant.
Endring av anbefalt stråledose for pasienter med indolente lymfom og diffust storcellet B-celle lymfom
Norsk lymfomgruppe har i november 2011 diskutert endring av stråledoser ved NHL basert på en randomisert studie fra Storbritannia (Lowry et al., 2011). Studien viste i hovedsak at 30 Gy ved aggressive NHL og 24 Gy ved indolente NHL kunne være like effektivt som 40–45 Gy. Studien sammenfatter mange histologier, delvis pasienter med forskjellig kjemoterapi (de fleste uten rituximab) og delvis med både kurativ og palliativ behandlingsindikasjon. Ved gransking av data og tilbakemelding fra forfatterene av denne studien finner NLG at resultatene er mest relevant for to pasient grupper:
- Pasienter med DLBCL i stadium I-II der strålebehandling inngår som del av kombinert behandling. For pasienter som er i komplett remisjon (ingen resttumor eller PET negativ resttumor) kan man gi 30 Gy som konsoliderende strålebehandling der det anses som riktig å gi strålebehandling. For pasienter i partiell remisjon (resttumor med usikkert eller positivt PET opptak eller ukjent PET opptak) vil tidligere anbefalte stråledoser gjelde, dvs 36–40 Gy. De samme vurderinger vil gjelde for pasienter med DLBCL der strålebehandling vurderes for isolerte områder etter full kjemoterapi for utbredte stadier (restlesjoner, skjelettlesjoner, testikkelbestråling…) For andre pasientgrupper med aggressive NHL vil studien ikke gi pålitelig grunnlag for å endre stråledoser (f.eks. pasienter med kun strålebehandling for aggressivt lymfom, T-celle lymfomer etc).
- Pasienter med indolente lymfomer (follikulært lymfom grad I-II, marginalsonelymfom) i lokaliserte stadier som får kurativt rettet strålebehandling. Her viser studien klart at 24 Gy er like godt som 30 Gy. I analogi vil man anbefale 24 Gy til de som får RT med palliativt siktemål, men med langsiktig håp om lokal kontroll. For pasienter som får strålebehandling som konsolidering etter kjemoterapi for større resttumor vil også 24 Gy være retningsgivende, selv om en her ved mistanke om transformerte områder vil kunne vurdere høyere doser. For palliativ behandling med kortere forventet levetid vil doser individualiseres, men det skulle ikke være nødvendig å gi mer enn 24 Gy.
Definisjoner
For definisjon av målvolum og utforming av strålefelt benyttes ofte engelske uttrykk uten god oversettelse til norsk. Følgende definisjoner er delvis basert på StrålevernRapport 2003: 13, som igjen referer til ICRU50 og 62 samt NACP.
GTV (Gross Tumor Volume, Tumorvolum)
Dette er den palpable eller synlige utstrekning av malign vekst i øyeblikksbildet.
CTV (Clinical Target Volume, Tumorvolum)
Dette er det vevsvolum som inneholder GTV og/eller subklinisk mikroskopisk malign sykdom i øyeblikksbildet.
ITV (Internal Target Volume, Målvolum)
Dette er det volum som inneholder CTV pluss en indre margin som tar hensyn til indre bevegelser og eventuelle endringer av CTV. KVIST utvalget angir i StrålevernRapport2003: 12 at ITV vil være det naturlige volum en ønsker å gi en rekvirert dose, og at dette således i de fleste tilfeller er minimumskravet for planlegging av behandlingen (Levernes & Johannessen, 2003). Dette er en norsk tilnærming, og mulig ikke helt konform med alle internasjonale standarder.
PTV (Planning Target Volume, Planleggingsvolum)
Dette er et geometrisk volum som inneholder ITV med en setup margin som tar hensyn til antatte pasientbevegelser, samt variasjon i pasientopplegging og feltinnstilling (ytre bevegelser).
Feltgrense
Defineres som det forløpet 50 % isodosekurven utenfor målvolumet må ha for å gi en terapeutisk isodose (90 % isodose) som omslutter det målvolum en ønsker å behandle. Avstanden fra 90 til 50 % isodosen (penumbra) avhenger av flere forhold og ligger typisk på 5–7 mm.
Det er utarbeidet en tabell som sammenfatter standarder for bruk av begrepet GTV, for marginer for CTV og ITV samt utforming av feltgrensene ved strålebehandling av maligne lymfomer.
GTV | = | opprinnelig tumor (minus ballongeffekt) for indolent NHL stadium I/II1,aggressive NHL stadium I/II1, HD stadium I/IIA |
|
| resttumor for aggressive NHL stadium II2/IV, HL stadium IIB/IV |
CTV | = | GTV + 1,5 cm kraniokaudalt for begrenset sykdom/kort kjemoterapi |
|
| GTV + 1 cm kraniokaudalt for utbredt sykdom/full kjemoterapi |
|
| GTV + 1 cm i transversalplanet |
|
| CTV skal alltid inneholde hele lymfeknuteregionen i de nivåer som skal bestråles (begrenses ved lunge og ben, dersom det ikke er mistanke om infiltrasjon). |
|
| CTV kan ved indolent NHL stadium I/II1 inneholde deler av nærmeste ikke-affiserte lymfeknuteregion. |
ITV | = | CTV, dersom internbevegelighet kan neglisjeres (CNS, ØNH, DIBH teknikk i thorax) |
|
| CTV + 1 cm kraniokaudalt og + 0,5 cm transversalt i mediastinum(der DIBH ikke brukes) |
|
| CTV + 2–3 cm i mesenteriet |
|
| 4 D registering av CT bilder (innpust og utpust) ønskelig for målvolum i eller nær thorax, dvs også øvre abomen som milt, lever, øvre abdomen). Da brukesburkes 4 D bilder for å begrense margin til ITV som følger av pustebevegelser. |
PTV | = | defineres ikke rutinemessig ved inntegning |
Feltgrenser |
| ITV + Setupmargin og penumbra Feltgrenser bør i mange tilfeller ligge slik at senere skjøt blir lettest mulig |
Involved node
Strålefelt som omslutter makroskopisk affisert lymfeknute alene med knapp margin. Definisjonen er så langt lite brukt i Norge, men er på vei internasjonalt i studier.
Involved site
Strålefelt som omfatter makroskopisk affisert lymfeknute eller organ med noe større margin(Wirth et al., 2020).(Wirth et al., 2020) Etter begrenset kjemoterapi ved lokaliserte lymfomer benyttes opprinnelig makroskopisk affisert område som grunnlag (med unntak av «ballong effekten»). Ved restforandringer etter full kjemoterapi for avanserte stadier benyttes som regel resterende tumor som grunnlag (flere unntak). Hva som er adekvat margin fra makrotumor avhenger av flere faktorer. For tidlige stadier av NHL og HL med ingen eller kort kjemoterapi (3–6 CHOP-baserte kurer, 2–4 ABVD eller tilsvarende) bør marginene fra initial tumor til CTV i lymfebanenes lengderetning være 1,5cm fra initial utbredelse, i transversalplanet 1 cm (med unntak av ballongeffekten, dvs normale strukturer som var forskjøvet ved oppstart av behandling, men faller tilbake til sin original plass når tumor krymper, tegnes ikke inn). Der det er mistanke om infiltrasjon av naboorganer opprinnelig, må dette inkluderes i CTV, men med hensyntagen til at målvolumet blir større. Ved restforandringer etter full kjemoterapi for avansert NHL og HL blir 1 cm fra resttumor til CTV brukt. Marginer for intern beveglighet til ITV kommer i tillegg der det er nødvendig. Som hovedregel ved nodal affeksjon inkluderer målvolumet hele lymfeknuteregionen i transversalplanet for de nivåer som inkluderes.
Ved ekstranodale lymfomer/organmanifestasjoner er det av og til naturlig å ha med hele organet (Glandula thyreoidea, ventrikkel, hjerne, medulla spinalis)(Yahalom et al., 2015). Også her en må ta høyde for intern bevegelighet, f.eks. ventrikkelbevegelse, bevegelse av lungegrenser etc. Ved flere organlokalisasjoner er dette ikke mulig å gi fulle doser til hele organet pga av toleransen for ioniserende stråling (lunge, lever, nyre), og feltene/doser må utformes deretter.
Involved field
Tidligere ble hele den affiserte lymfeknuteregionen fullstendig i kraniokaudal retning inkludert i målvolumet, kalt involved field strålebehandling. Dette gav gjenkjennbare geometriske felt som har sine fordeler med henblikk på standardisering, reproduserbarhet, senere skjøt etc. Lymfeknuteregionene, slik de defineres i Ann Arbor klassifikasjonen, representerer dog ingen biologisk funksjonelle enheter og er ikke tenkt som basis for strålebehandling. Således er det naturlig å se regionene som sammenhengende i lymfedrenasjens lengderetning og bruke marginer til affiserte lymfeknuter for å unngå bestråling av hele regioner (for eksempel i hals/supraclaviculærregionen, i mediastinum og retroperitoneum). Deler av naboregioner kan inkluderes for å innfri de minimumsmarginer som er angitt ovenfor.
Extended field
Begrepet benyttes for felt som inkluderer makroskopiske affiserte regioner/organer og lymfeknuteregioner, der en antar at mikroskopisk sykdom foreligger. Dette kan da være nærmeste ikke makroskopisk affiserte region eller flere, mer fjerntliggende områder. Begrepet er utviklet for Hodgkin lymfom i en tid da strålebehandling ble brukt som eneste modalitet og gitt mot store områder med antatt mikroskopisk sykdom på en eller begge sider av diafragma (kappefelt, paraaortalfelt, omvendt Y-felt). For dagens praksis er begrepet extended field lite nyttig. For lokaliserte stadier av lavgradige NHL, der strålebehandling gis alene i kurativ intensjon, har en ved DNR valgt å inkludere nærmeste ikke-affiserte region i strålefeltet, altså et slags «minimally extended field», men dette gjøres ikke ved all norske stråleterapisentra.
Konvensjonell simulering versus konformal strålebehandling
Inntil for 20 år siden ble det meste av strålebehandling ved maligne lymfomer planlagt konvensjonelt ved gjennomlysning på simulator. Feltutforming ble foretatt ved å overføre informasjon fra den kliniske undersøkelse og radiologisk (og annen) diagnostikk til røntgenfilmer tatt på simulator. Doseberegninger ble gjort med konvensjonelle metoder i henhold til pasientens anatomi. Feltutformingen fulgte relativt standardiserte retningslinjer og orienterte seg stort sett etter synlige bløtvevs- og skjelettstrukturer og lymfeknuteregionenes og andre organers lokalisering i forhold til disse. Utforming av feltene er lettest å standardisere ved å se på dem som fragmenter av de store felter som tidligere ble gitt ved Hodgkin lymfom (høyt og lavt kappefelt, omvendt Y-felt). Det meste av erfaring innen strålebehandling av lymfomer, både nasjonalt og internasjonalt, har en fra stråleterapi som baserer seg på slike teknikker.
I dag får pasienter med kurativt rettet strålebehandling CT-doseplanlagt terapi. Dette er gjort ved større internasjonale sentra og har vist seg og være alt annet enn en triviell prosess (Gospodarowicz). Det etter hvert utarbeidet anbefalinger for fikseringsprosedyrer og selve CT‑undersøkelsen til bruk for de fleste situasjoner, standarder for inntegning av målvolum og marginer. Standarder for tolerable doser til risikoorganer er vanskeligere å definere, men dette er under utvikling. Generelt har en ved DNR forsøkt å bibeholde konvensjonelle feltoppsett ved overgang til konformal terapi med få hovedfelt inn i pasienten. Fordelen ved CT-doseplanlagt behandling ligger derfor hovedsaklig i å sikre definisjon målvolum i forhold til pasientens anatomi og tumorutbredelse, bedre dosefordeling ved bruk av segmenter innen hovedfelt, dokumentasjon av dosefordeling i målvolum og risikoorganer samt mulighet for modifikasjon av feltgrenser etter behov. I tillegg til disse fordelerkan feltoppsett via tredimensjonal terapiplanlegging (IMRT, VMAT) være overlegent bedre i mange vanskelige tilfeller.
Strålebehandling ved lymfomer baserer seg på erfaringer gjort med store felt mot flere lymfeknutestasjoner slik de er utviklet i form av kappefelt og omvendt Y-felt. Disse felt brukes i dag sjelden, men mange pasienter er fortsatt i live etter tidligere å ha fått slik behandling. Strålebehandling av lymfatiske regioner i hode/hals området, supraclaviculært, infraclaviculært, i mediastinum og aksiller og kombinasjoner av slike felt baserer på erfaringer med kappefelt. Likeledes kan bestråling av paraaortale, iliakale og inguinale/femorale lymfeknuter ses på som deler av omvendte Y-felt. Store felt som representerer modifikasjoner av kappefelt og omvendt Y-felt kan også forekomme den dag i dag. Det er således nyttig å ha satt seg inn i tankegangen og inntegningen av disse store feltene.
Kappefelt
Standard kappefelt brukes i dag sjelden. Behandling av øvre cervicale lymfeknuter (preauriculære, eventuelt retroauriculære, lymfekuter) og Waldeyers ring (såkalt tonsillefelt) var tidligere inkludert i «høyt kappefelt». «Lavt kappefelt» inkluderte submentale, submandibulære og nuchale lymfeknuter som øverste stasjoner. Mediastinum kunne utelates i enkelte tilfeller for behandling av såkalt «minimantel». Simulering kunne foregå i en (opptak av simulatorbilde/prikkebilde og inntegning av blokker samtidig) eller to seanser. Fra leges synspunkt var det viktig å påse at pasienten var godt fiksert (tilfredsstillende hakestrekk [5° overstrekk i mandiblen], armer i abdusert stilling ved bestråling av aksiller, armer rotert oppad ved lavt kappefelt, rotert nedad når tonsillefelt skulle skjøtes). En vurderte å markere palpable lymfeknuter eller biopsiarr med blytråd for å gjenfinne disse på simulatorfilm. Hos kvinner kunne en forsøke å fiksere mammae best mulig under lungeblokker.
Et stort felt (opptil 50 cm x 50 cm) ble stilt inn med kranielle grense 1 cm ovenfor kjevevinkelen, dette representerte ved god hakestrekk en linje som går fra hakespissen, under øregangen og til bunnen av bakre skallegrop. Dersom det var synlig tumor i dette området måtte en høyere feltgrense, eller lavere grense med skjøt til tonsillefelt utenfor makrotumor vurderes. Kaudale feltgrense ble lagt ved Th10/11. Dersom det skulle skjøtes mot tonsillefelt eller senere paraaortalfelt måtte feltgrenser plasseres slik at skjøtflytt ble mulig, men skjøt ikke ble gående gjennom makroskopisk affiserte områder. Dette måtte planlegges ved simulering, og fysiker ble gjerne konsultert. Feltgrenser til siden måtte gå utenfor thoraksveggen og et stykke ut på humerus, slik at laterale deler av aksillen ble dekket godt. Legen definerte plassering av blokker (figur). Standard var larynxblokk over strupehodet i forfeltet og medullablokk over cervicalcolumna i bakfeltet. Lungeblokker, humerusblokker og aksilleblokker ble brukt i begge felt. Larynxblokk og medullablokk ble gjerne utelatett ved cervicale tumores nær midtlinjen. Lungeblokker ble tegnet eller lagt ca. 0,5–1 cm innenfor thoraxveggene lateralt, langs underkant av 4. ribbe (for å dekke infraclaviculære regioner) og skulle følge konturen for øvre mediastinum og hilus med 1,5–2 cm margin inn i lungeparenchymet. Blokkene fulgte ikke hjerteskyggen på venstre side, men svingte inn under hilus, slik at venstre ventrikkel og lunge foran og bak hjertet ble skjermet. Humerusblokker ble tegnet fra sentrum av caput humeri og dekket deler av caput og halve humerusskaftet innenfor strålefeltet. Bløtvev og lunge kaudalt for aksillen ble skjermet med aksilleblokk (typisk i nivå med mamillen eller 6.–7. ribbes møte med laterale thoraxvegg). Inntegning av blokker kunne variere dersom tumors utbredelse tilsa dette, f.eks. kunne tumorinnvekst i fremre thoraxvegg nødvendiggjøre at større deler av fremre thoraxvegg må inkluderes. For mange pasienter var det aktuelt å blokke ut store deler av nedre mediastinum under hele eller deler av behandlingen for å redusere dosen til hjertet og hjerteklaffenivå.
Det er i dag sjelden aktuelt å gi hele kappefelt som anført ovenfor. Både ved HL og NHL gis i dag for det meste involved site strålebehandling mot affiserte områder og eventuelt antatt mikroskopisk affiserte naboregioner.
Tonsillefelter ved høyt kappefelt
Tonsillefeltene (som egentlig dekket store deler av Waldeyers ring, også kalt preaurikulærfelt) ble innstilt på simulator som motgående felt mot preaurikulære lymfeknuter og store deler av Waldeyers ring. Ved behandling mot høyt kappefelt ble det gitt kappefelt i kombinasjon med sidefelt i denne regionen. Kappefeltet ble stilt standardmessig inn slik at krysningspunktet for feltgrensene i for- og bakfeltet lå i et frontalplan gjennom øregangen. Ved bestråling mot tonsillefelt ble sidefeltene liggende helt eller delvis foran dette frontalplanet. Innstilling av grenser for tonsillefelt var standardmessig midt i sinus sphenoidalis som øvre grense (obs sella turcica med hypophysen samt orbitae), fremre grense bak tannrekken i over og underkjeven og nedre grense skjøtet mot øvre grense av kappefeltet. Bakre grense var standardmessig foran ytre øregang, men kunne ligge bak øregangen i enkelte situasjoner. Ved standard skjøt mot tonsillefelt ble skjøt plassert etter en utarbeidet standard i samråd med fysiker. Nedre grense for tonsillefelt med skjøt burde ikke gå i makrotumor, og ved høy cervical lymfadenopati måtte denne derfor flyttes kaudalt. Sidefeltene måtte da inneholde submandibulære og occipitale knuter, og sidefeltene hadde da form av felt slik en også i dag kan bruke det i bestråling av Waldeyers ring. Ved skjøt lengre ned på halsen mot utvidete sidefelt måtte skjøt og skjøtflytt likeledes planlegges ved simulering.
I dag er det sjelden aktuelt med hele kappefelt skjøtet mot tonsillefelt eller større sidefelt mot Waldeyers ring og øvre cervicale lymfeknuter.
Omvendt Y-felt
Omvendt Y-felt dekket lymfeknutestasjonene paraaortalt, iliakalt og inguinalt samt øvre femorale knuter. Som for kappefelt brukes omvendt Y-felt i dag sjelden, men det er nyttig å kjenne prinsippene for innstilling av disse. Pasienten lå på ryggen med armene langs siden. Legen påså at pasienten var godt fiksert på simulator, bla. om det hos mannlige pasienter er god nok sprik mellom bena for plassering av gonadeskjerming (nærskjerming). Ved DNR ble detbrukt blybelte ved unilateralt bestråling i bekken/lyske (dog-leg felt eller L-felt), i tillegg en gonadeskjerm festet til behandlingsbordet. Ekstra blokking tilsvarende til sammen 10 halvverdilag kunne vurderes i filterholderen. Ved bilateral bestråling i bekken/lyske ble det brukt en scrotumkopp med blyblokk over i tillegg til enten blyskjerm med blæreblokk i filterholderen eller blokking ved standard mangebladskollimatorer med tillegg av ekstra blokking. For kvinner må en vurdere om det er behov for skjerming av ovarier, hvilket i praksis kan bety at en på forhånd må ha utført en kryopreservering eller ovaropexie, der ovariene er flyttet ut av det lille bekken eller inn i midtlinjen bak uterus ved kirurgi. I slike tilfeller bør operasjonsclips fortelle hvor ovariene befinner seg. I tillegg vil ovariene bli skjermet av ekstra tykke blokker (10 halvverdilag) i filterholderen og eventuelt en gonadeskjerm (nærskjerming). Dersom det er usikkerhet om nyrenes funksjon, bør GFR med renografi blir gjort før simulering. For å lokalisere nyrene ved simulering gjøres intravenøs urografi, og en kan vurdere om andelen nyre som må ligge innen feltet nødvendiggjør senere endringer av feltene etter f.eks. 18–20 Gy. Vurder behov for å markere biopsi arr/palpable forandringer med blytråd.
Et stort rektangulært felt ble stilt inn med øvre feltgrense ThX/XI (figur). Nedre feltgrense nedenfor lysken med egnet margin i forhold f.eks. til palpable forandringer. Dersom også femorale lymfeknuteregioner skulle dekkes, kunne kaudale feltgrense legges ned på låret. Feltet ble begrenset lateralt av lyskeregionen største bredde, standard er her acetabulums laterale begrensning. Parallelt med nedre thorakal- og lumbalcolumna ned til L4 ble det lagt blokker for å skjerme nyrer og tarm. Standard var feltbredde som dekker tvertaggene bilateralt med 0,5–1cm margin, hvilket ga en bredde her på typisk 8–10 cm. Fra nedre kant L4 ble det tegnet blokk i en skrå linje ut mot acetabulums laterale grense. Fra acetabulum fortsetter feltgrense loddrett nedover.
Ved DNR har vi tradisjonelt brukt et filter i forfeltet med skrå linjer i nedre kant. Dette filter (flatfilter) skal ligge kaudalt for lyskebåndet, og har en standard vinkel (20 º) som gir en linje fra symfysen til laterale kant av acetabulum på begge sider. Nedenfor filtergrensen dekkes området kun av forfeltet, ovenfor gir forfeltet halvt dosebidrag med tillegg av bakfeltet. Dette gjøres for å redusere dose til caput femoris. Filtergrensen markeres med egen vinkelmal på simulatorbildet. Gonade og blæreskjerming for strålefeltet tegnes på simulatorbildet. Det har tradisjonelt vært brukt standard blokkmaler for dette. Dette er en egen blyblokk som settes i filterholderen i nedre del av feltet for å dekke gonadene og som har en rektangulær, forskyvbar del som kan forlenge denne kranielt som blokking for blæren. I dagens situasjon er mangebladskollimator med eventuelt tillegg av blokkmateriale (til sammen 10 halvverdilag) et mer naturlig alternativ.
Hadde pasienten tidligere hatt kappefelt skulle nedre grense på kappefeltet rekonstrueres i det akutelle leie og markeres på pasienten. Det skulle tas røntgenbilde av rekonstruksjonen, som godkjennes av lege. Det var rutine å legge medullablokk bakfra i skjøtområdet, 20 mm inn i feltet. Fysiker og lege måtte imidlertid godkjenne dette i hvert enkelt tilfelle.
Y-felt skulle vanligvis dekke begge lyskene, men i nyere tid er det langt mer vanlig at kun én side av bekkenet og lyske eller at kun lymfeknuter ned til Vv iliacae communes skal inkluderes. Det kunne hende at milten skal være med i målvolumet. Isolerte paraaortal-, inguinal- og lyskefelt kan ses som modifikasjoner av det samme Y-feltet. Innstillingsprosedyren var den samme som for Y-felt, men inklusivt/eksklusivt disse områdene.
Konvensjonell planlegging involved field strålebehandling
Som anført ovenfor er inntegning av involved field ved tradisjonell simulering lettest å standardisere ved å se på dem som deler av de klassiske felt. Vanligvis er det riktig å bestråle tumor sammen med den affiserte lymfeknuteregion eller deler av denne, omtrent slik disse er definert i Ann Arbor klassifikasjonen, for å få adekvate marginer både i retning for lymfedrenasjen og i transversalplanet. Dette gir lett gjenkjennbare feltoppsett som kan modifiseres basert på individuelle forhold i pasienten. I noen tilfeller inkluderes antatt mikroskopisk affiserte naboregioner. Således kan halsfelt, aksillefelt, paraaortalfelt etc. simuleres på grunnlag av de retningslinjer som er gitt for kappefelt og omvendt Y-felt.
Bruk av CT til strålebehandling
Rekvirering og fiksering
Det er viktig å tenke igjennom nødvendig posisjonering og fiksering av pasienten før CT opptak.
Ved bestråling i hode og hals området vil pasienten gjerne ligge i ryggleie og fikseres i maske (prøv å få til hakestrekk, 5º overstrekk av mandibula mot vertikalen). Dersom aksiller og/eller supraclaviculærregionene skal behandles bør 5 punkts maske foretrekkes da denne gir en bedre reproduserbarhet av skulderposisjonen. Dersom aksillen skal bestråles bør en forsøke å abdusere armene lett for å få noe luft mellom overarm og thoraxveggen. For doser under 35 Gy mot aksiller kan det antas at det ikke er nødvendig med fullt abduserte skuldre for å forebygge dermatitt. Dersom det ikke aktuelt med sidefelt mot hode eller halsregionen kan en også velge fiksering i med eleverte armer (f.eks. «wingboard» som ved adjuvant lokoregional strålebehandling ved Ca. mammae). Dette gir større frihet for feltoppsett i toraks, for eksemel tangentialfelt mot bryster eller thoraksveggen.
For infradiafragmale felt bør det hos menn være god bensprik for plassering av gonadeskjerming og armene må ligge langs siden av truncus.
Ved bestilling av CT-doseplanlagt behandling bør man vurdere om det er behov for intravenøs kontrast, og erfaringene tilsier at dette bør gis med mindre allergi eller annet taler i mot dette – det er som regel bedre å se mer enn mindre. For strålebehandling av ventrikkel er det aktuelt med peroral kontrast (vann fungerer også for dette formål), hvilket må spesifiseres. Pasienter med myelomatose må helst ikke ha intravenøs kontrast.
Spesielle forhold rundt fiksering må angis, f.eks. hvorvidt det skal fikseres i 3 punkts eller 5 punkts maske, eller om markeringer skal foretas (palpable funn, smertepunkter, arr m.m.). Eventuelt bør lege være tilstede under fiksering og CT-opptak. Spesielle retningslinjer bør eksistere for enkeltre regioner, for eksempel CT-opptak for behandling av ventrikkel eller total hjerne og for hele nevroakse.
Inntegning av målvolum og feltutforming
For involved site strålebehandling, der synlig makrotumor (initialt eller etter behandling) er hovedmål for behandlingen kan en praktisk gjerne begynne med å tegne inn makrotumor som GTV, og generere et CTV med ønsket margin(Wirth et al., 2020). Lymfeknuteregionen eller organet som tumor sitter i, tegnes inn i samme CTV, slik at CTV får ønsket konfigurasjon i alle nivåer. For nodal affeksjon skal CTV i lengderetning for lymfedrenasjen ha en margin til GTV på 1–2 cm, og i transversalplanet skal CTV som hovedregel inkludere hele lymfeknuteregionens bredde. Man må unngå å utelate deler av en region i samme snitthøyde, bl.a. fordi senere kantresidiver i dette området kan bli vanskelig å behandle. Eksempelvis strålebehandles en gitt høyde av mediastinum i sin helhet, ikke bare høyre eller venstre side. Dersom en hilusregion er affisert eller parakaridale knuter kun på en side av hjertet, kan en vurdere å begrese inntegning av CTV til denne delen av mediastinum/hilus, for å unngåmulg skadelig store volum. Likeledes behandles hele halsregionen på en side, ikke bare de laterale eller mediale andelene. CTV bør begrenses til naboorganer når det ikke er mistanke om innvekst i disse – for eksempel ved overgang mediastinum/lunge eller ved benete begrensninger. For behandling av involved site, der initialt volum før kjemoterapi er hovedmål for behandlingen, må CTV tegnes etter diagnostiske bilder før behandling. Tumors initiale utbredelse i bløtvev tegnes inn, men ikke frisktvev som tidligere var skjøvet til side av tumor, og som etter respons har falt tilbake på sin opprinnelige plass (viktig i mediastinum/retroperiotoneum for å skåne lunge og nyrer, såkalt ballongeffekt). Forskjeller i pasientens posisjonering ved diagnostiske CT eller MR bilder og ved CT doseplanlegging nødvendiggjør tilpasninger. Der 4 D bilder brukes vil disse være med på bestemme CTV sin utbredelse i in- og ekspirasjon.
Når antatt mikroskopisk affiserte naboregioner skal inkluderes i målvolumet, tegnes disse inn etter tilsvarende prinsipper. Inntegnede naboregioner representerer definisjonsmessig CTV.
ITV genereres ved å ta høyde for intern bevegelighet. I hode-hals region og CNS bør intern bevegelighet kunne neglisjeres, likeledes i thorax når DIBH eller 4 D bilder. I abdomen er ofte behov for større marginer for mesenteriale målvolum, men man må en ta hensyn til at fikserte organer som nyre, retroperitoneum og skjelett begrenser bevegeligheten. Retningsvisende marginer for intern bevegelighet er angitt i tabell over. I praksis tegnes gjerne kun CTV inn, som ved manglende intern bevegelighet kan settes lik ITV, eller legen bør definere ITV i henhold til de vurderinger av bevegelighet som er skissert ovenfor.
Avdelingen har definert hvilke marginer for innstillingsunøyaktighet og margin for penumbra som kommer i tillegg til dette i avhengighet av lokalisasjon og feltstørrelse.
International Lymphoma Radiation Oncology Group (ILROG) har utarbeidet retningslinjer med bildeeksempler for de fleste anatomiske regioner som kan være nyttige å se på(Dabaja, Ng, Terezakis, Plastaras, Yunes, Wilson, Specht, et al., 2020; Dabaja, Ng, Terezakis, Plastaras, Yunes, Wilson, Yang, et al., 2020; Wirth et al., 2020).
Inntegning av risikoorganer, vurdering av feltoppsett, dosevolumhistogrammer til målvolum og risikoorganer følger generelle retningslinjer.
Strålebehandling av forskjellige anatomiske områder
Total hjerne
Inngår i behandlingsopplegg for PCNSL(Yahalom et al., 2015), som CNS behandling/profylakse ved lymfoblastsykdom/ALL, ved behandling/profylakse av CNS manifestasjon ved diverse maligne lymfomer og brukes som palliasjonsbehandling. Pga lymfomers diffuse vekst og tendens til meningeal affeksjon er det nærmest alltid indisert å gi behandling som total hjernebestråling med liquorrommene., Boost mot deler av hjerne kan være aktuelt, mens beståling av kun deler av hjerne normalt ikke gjøres.
Ved PCNSL inngikk tidligere bestråling av hjerne ofte som konsolidering etter CNS rettet kjemoterapi hos yngre (<60 år). Strålebehandlingens rolle, totaldose og fraksjonering er usikker(Benjamin Kasenda et al., 2016). I kurative opplegg etter kjemoterapi har hyperfraksjonert behandling mulig fordeler. Stråleterapi, særlig i kombinasjon med kjemoterapi, gir ofte betydelig nevrotoksisitet. Dette problemet er mest uttalt hos eldre pasienter. Derfor er strålebehandling hos eldre gjerne forbeholdt pasienter uten effekt av kjemoterapi eller med residiv. Ved multimodale behandlingsopplegg for PCNSL er det normalt ikke aktuelt å gi strålebehandling mot medulla spinalis, selv om lumbalpunksjon har vist mer generalisert meningeal utsæd av tumorceller. Dersom det ikke foreligger kjent affeksjon av bulbus oculi, inkluderes bulbus ikke i strålefelt.
Ved behandling/profylakse for CNS-sykdom som ledd i kurative behandlingsopplegg ved ALL/lymfoblastsykdom brukes gjerne lavere doser (18–24 Gy i 1,8–2 Gy per fraksjon), oftest i kombinasjon med CNS rettet kjemoterapi/intratekal behandling. Det vil ofte være aktuelt å gi samtidig strålebehandling mot medulla spinalis.
Ved andre maligne lymfomer med CNS-affeksjon kan strålebehandling mot hjerne vurderes, enten som del av et kurativt opplegg eller palliativt. Også her kan det ved meningeal utsæd av tumorceller være aktuelt å kombinere med strålebehandling av medulla spinalis.
For strålebehandling av total hjerne (uten medulla) ligger pasienten i ryggleie og fikseres med maske. Det skal være lett fleksjon i nakken. Dersom det skal skjøtes mot medullafelt, må pasienten fikseres som beskrevet under kapittel total nevroakse. Ved CT-doseplanlagt behandling tegnes hele hjernen med ytre liqorrom inn som CTV. Ved nmange situasjoner skal øvre cervicalmarg inkluderes i CTV som da strekker seg lenger ned til f.eks. til C2/C3 eller C3/C4 nivå. Spesielt er dette relevant i de fleste protkoller for ALL. I praksis følges innsiden av ben i calvariet og spinalkanalen. Vær nøye med inntegningen ved skallebasis. Durasekkene som følger nerverøttene et stykke på vei ut i foramina intervertebralia inkluderes i CTV. Linser tegnes inn som risikoorgan. Man må ofte akseptere en linsedose over 4 Gy for å få god dekning til strukturene nær lamina cribrosa.
Totaldose og fraksjonering er avhengig av flere faktorer. For PCNSL og ALL/lymfoblastsykdom følges de aktuelle protokoller. Som palliasjonsbehandling brukes ofte 3 Gy x 10.
Total hjerne med nevroakse
Total nevroakse strålebehandles oftest som ledd i protokoller for ALL, der det inngår som del av CNS-profylakse eller behandling av manifest CNS-sykdom. Hos enkelte pasienter med lymfom i CNS kan strålebehandling av total nevroakse også bli brukt. Oftest gis behandling sammen med eller i tilslutning til CNS-rettet kjemoterapi/intratekal kjemoterapi. Pasienten fikseres i bukleie ved hjelp av vacfix, hodestøtte for bukleie og maske. Pasienten bør ligge mest mulig behagelig og skal ligge med skuldre så langt ned som mulig. Det bør være en viss overstrekk i nakken for å få minst mulig utgangsdose i munnhulen. Columna bør rettes mest mulig ut. Sedering er som regel nødvendig for å gjennomføre både fiksering, simulering og behandling hos barn.
Doseplanlegging med CT anbefales for bestråling av total CNS akse. Totalhjerne og spinalkanalen ut mot benet begrensing ned til minimum S2 tegnes inn som CTV. Man bør være nøye med å sikre at utposninger av subarachnoidalrommet ved hjernenerver og nerverøtter dekkes godt. Det kan lønne seg å legge isosenter for det øverste medullafeltet relativt høyt, slik at en får geometrisk relativt ren skjøt mot sidefeltene mot hjernen. Skjøtflytt kan dermed bli unødvendig mellom hjerne og øvre medullafelt. Skjøtflytt mellom medullafeltene gjøres rutinemessig.
For ALL/lymfoblastsykdom gis sjelden mer enn 12–18 Gy i fraksjoner på 1,8–2 Gy mot medulla spinalis. Samtidig får totalhjerne 18–24 Gy gitt som fraksjoner på 1,8–2 Gy.
Linser og ovarier/testis er risikoorganer.
Orbita
Maligne lymfomer utgår gjerne fra hud på øyelokk, glandula lacrimalis, conjunctiva eller retroorbitale strukturer, da oftest MALT-lymfomer med histologi marginalesonelymfom(Dabaja, Ng, Terezakis, Plastaras, Yunes, Wilson, Specht, et al., 2020; Yahalom et al., 2015). Ofte er disse lokaliserte lymfomer i stadium PeI. Intraokulære lymfomer er som regel histologisk DLBCL, forkommer gjerne som ledd i PCNSL og behandles som disse. Strålebehandlingen som del i multimodale opplegg bør da inkludere orbita. Aggressive lymfomer som DLBCL forekommer, gjerne som innvekst i orbita, ved mer lokalavansert sykdom i ØNH-gebetet.
Ved isolert hudaffeksjon på øyelokk kan lokal bestråling med elektroner eller røntgenstråler vurderes. Øyeskjold innenfor øyelokk kan i så fall brukes for å spare linse og retina. Ved mer dyptliggende lesjoner velges CT-doseplanlagt behandling med fotoner. Pasienten fikseres i maske. For å unngå senere skjøtproblematikk velges hele orbita innenfor benet begrensning som CTV. Ved stadium PeI tegnes lokale glandelstasjoner ikke inn som CTV. Vurdér bolus ved lesjoner nære hudoverflaten. Unngå varme områder i nærliggende risikoorganer som chiasma opticum og hypofyse. Ved marginalsonelymfomer i parrede organer generelt forekommer ofte residiv/nytt lymfom kontralateralt, kanskje spesielt ved affeksjon i orbita. Dette bør en ta høyde for når en velger feltoppsett, dvs. en bør unngå å spre dosen i friskt vev på kontralateralt side av hodet.
Ved marginalsonelymfom eller andre indolente lymfomer gis 2 Gy x 12. Ved aggressive lymfomer med innvekst i orbita som ledd i lokalavansert sykdom i ØNH-gebeter er fraksjoneringen 2 Gy x 15–20.
Nese/Bihuler
Dette er oftestOftest aggressive lymfomer (DLBCL, NK/T-celle lymfomer, Burkitt lymfom)(Dabaja, Ng, Terezakis, Plastaras, Yunes, Wilson, Specht, et al., 2020; Yahalom et al., 2015). Behandles gjerne med kjemoterapi initialt. Strålebehandling er aktuelt som konsoliderende behandling. Ved nasale NK-T celle lymfomer har strålebehandlingen en spesielt viktig plass.
Dersom feltene inkluderer over- og/eller underkjeven må pasientene ha vært vurdert av tannlege, og eventuell tannbehandling må avsluttes før fiksering og behandlingsstart. Pasientene fikseres med maske. Fordi det oftest er lokalavansert vekst med benet destruksjon, brukes initialt tumorvolum med 1 cm margin som CTV, også etter full kjemoterapi. Ved aggressive lymfomer gis 2 Gy x 15–20, ved NK/T celle lymfomer er doser på 50 Gy standard ved kurative opplegg. Nærhet til viktige risikoorganer setter begrensninger selv om det ofte lar seg gjøre å holde dose til chiasma, øyne og hypofyse under 40 Gy. Unngå varme områder i risikoorganer ved kompliserte feltoppsett.
Waldeyers ring
Ved siden av GI traktus er Waldeyers ring en vanlig lokalisasjon for ekstranodale lymfomer. Vanligvis er lymfomer i denne regionen DLBCL, men også follikulære lymfomer forekommer relativt ofte. Den hyppigste lokalisasjon er i ganetonsillen, dernest nasopharynx. Ved lokaliserte stadier (I-II1) av DLBCL gis strålebehandling etter CHOP basert kjemoterapi. Ved lokaliserte indolente lymfomer i Waldeyers ring (Stadium I-II1) gis behandling i kurativ intensjon alene. Pasientene må ha vært vurdert av tannlege, og eventuell tannbehandling må avsluttes før fiksering og behandlingsstart. Pasientene fikseres med maske.
Ved aggressive lymfomer i lokaliserte stadier (3–6 CHOP baserte kurer eller tilsvarende) er CTV definert av initialt tumorvolum før kjemoterapi med 1 cm margin. En har tidligere ansett hele Waldeyers ring som CTV i en slik situasjon, men anbefaler nå kun å gi behandling mot tumoraffisert område, for eksempel en ganetonsille. Opprinnelig affiserte lymfeknuterområder inkluderes i CTV, og hele glandelstasjonen i nivåer med lymfomaffeskjon inkluderes. Marginer i kaudal retning på hals bør være 1-2 cm fra opprinnelig lymfeknuteaffeksjon til grensen for CTV. Ved utbredt sykdom, der strålebehandling gis som konsolidering av restlesjoner etter lengre kjemoterapi brukes kun restlesjonen med 1 cm margin som CTV.
Ved lokaliserte indolente lymfomer i Waldeyers ring (Stadium I-II1), der strålebehandling gis i kurativ intensjon, behandles Waldeyers ring med affiserte lymfeknuterområder, eventuelt med neste drenerende ikke-affiserte lymfeknutestasjon. Synlig tumor tegnes inn med 1 cm margin som CTV. Waldeyers ring inkluderes i CTV fra skallebasis til tonsilla lingualis på tungebasis ned til os hyoid. Lymfeknuter behandles i utgangspunktet unilateralt på hals, ved lymfomaffeskjon nære midtlinjen i Waldeyers ring eventuelt bilateralt. Ved stadium I inkluderes eventuelt ikke-affiserte drenerende lymfeknuter på halsen i CTV (retropharyngeale, preaurikulære, submandibulære, occipitale knuter samt øvre halsregion). Ved stadium II1 eventuelt nærmeste ikke-affiserte lymfeknuteregion, dvs. nedre halsområde og eventuelt supraclaviculærregion med grense for CTV ved i nedkant av clavicula.
Inntegning av Waldeyers ring som CTV følger slimhinnene fra nedkant av skallebasis/sinus sphenoidalis, fremover til choncae og bakover til columna, der retropharyngeale knuter inkluderes. Området for munningen av Tuba eustachii tegnes inn. Tonsillae palatinae og tungeroten inkluderes ned til Os hyoid (eksempel). Ved synlig makrotumor inkluderes denne med 1 cm margin. Halslymfeknuter, inklusive retropharyngeale, submandibulære og submentale knuter, kan gjøres i henhold til retningslinjer utviklet for CT-diagnostikk (Dahancas nettsider, DAHANCA.oncology.dk).
Isosentrisk bestråling med halvblender muliggjør bestråling fra side til side mot Waldeyers ring, submandibulære, submentale og occipitale lymfeknuter på øvre del av hals og anteroposterior strålegang mot nedre del av hals/supraclaviculærregion (split field). Avanserte feltoppsett (VMAT) er å foretrekke ved unilateral bestråling for å skåne spyttkjertler best mulig. Standard fraksjonering 2 Gy x 15–20 ved aggressive lymfomer, 2 Gy x 12 ved indolente lymfomer. Risikoorganer: spyttkjertler, øyne, chiasma, hypofyse, tenner.
Glandula parotis og submandibularis
I spyttkjertler foreligger oftest indolente lymfomer i form av marginalesonelymfom. Slike lymfomer forekommer bl.a. ved underliggende Sjøgrens syndrom. Lokoregional begrenset sykdom er vanlig. Pasientene må ha vært vurdert av tannlege, og eventuell tannbehandling må avsluttes før fiksering og behandlingsstart. Pasientene fikseres med maske.
Ved isolert affeksjon av indolent lymfom i spyttkjertel på en side, defineres CTV som makrotumor med 1 cm margin. Ved synlig vekst utenfor spyttkjertelen inkluderes dette området i GTV med 1 cm margin i CTV. Resterende «friske» del av den affiserte spyttkjertel inkluderes også i CTV tuen videre margin. Glandula parotis kan gå ganske dypt inn mot pharynx. Ved indolente lymfomer med kurativ radioterapi for stadium PeI kan en vurdere å tegne inn drenerende ipsilaterale lymfeknuter på øvre del av halsen (submandibulært, submentalt og occiptialt samt øvre halsregion), ved PeII1 affiserte lymfeknuter samt nærmeste drenerende ikke affiserte område (nedre halsregion, eventuelt supraclaviculærregionen). Inntegning av halslymfeknuter, inklusive submandibulære og submentale knuter, kan gjøres i henhold til retningslinjer utviklet for CT-diagnostikk (Dahancas nettsider, DAHANCA.oncology.dk). Ved bilateral affeksjon gjøres inntegningen tilsvarende på kontralateral side.
Ved isolert affeksjon av aggressivt lymfom i spyttkjertel på en side (stadium PeI-PeII1) gis strålebehandling som regel etter CHOP basert kjemoterapi. Her defineres CTV som opprinnelig makrotumor før kjemoterapi med 1 cm margin. Ved synlig vekst utenfor spyttkjertelen inkluderes dette området med 1 cm margin i CTV. Resterende «friske» del av den affiserte spyttkjertel inkluderes også i CTV. Glandula parotis kan gå ganske dypt inn mot pharynx. Eventuelt affiserte regionale lymfeknuteområder inkluderes, med kaudal utstrekning av CTV til 1-2 cm nedenfor opprinnelig affiserte snitt. Glandelregionen inkluderes i sin helhet i transversalplanet i de snitt som er med i CTV.
Ved unilateral affeksjon av gl. parotis gjør feltoppsett slik at det er mulig å spare kontralateral parotis. Isosentrisk teknikk med halvblender (split field) omgår skjøtproblemer ved anteroposterior strålegang på hals/supraclaviculær områdene.
Fraksjonering ved indolente lymfomer 2 Gy x 12. Ved aggressive lymfomer brukes 2 Gy x 15–20. Risikoorganer: Spyttkjertler, spesielt Gl. parotis, tenner, øyne, linse, chiasma, hypofyse.
Halsregion og fossa supraclavicularis
Strålebehandling av lymfeknuter på hals forekommer i mange forskjellige sammenhenger. I Ann Arbor klassifikasjonen er hals med ipsilateral fossa supraclavicularis en region. For strålebehandling er det i mange tilfeller naturlig å skille øvre halsregion, nedre halsregion og fossa supraclavicularis på hver side fra hverandre. Således er det ofte riktig ved behandling av Waldeyers ring, der ingen halslymfeknuter er affisert, kun å ha med øvre halsregion. Ved behandling av mediastinum er det ofte riktig kun å inkludere fossa supraclavicularis bilateralt for å ha egnet margin til den tumor som ønskes bestrålt. Videre kan Fossa supraclavicularis og infraclavicularis på samme side inkluderes når aksillen bestråles.
Ved bestråling av øvre del av halsen, der underkjeven skal inkluderes, må pasientene ha vært vurdert av tannlege. Eventuell tannbehandling må være ferdig utført før fiksering og behandlingsstart. For de fleste behov er fiksering i 3-punkts- eller 5-punkts maske med lett overstrekk av mandiblen (5º) en egnet fiksering. Palpable forandringer og biopsiarr kan med fordel markeres.
For CT-doseplanlagt behandling kan inntegning av halslymfeknuter med fordel studeres på Dahancas nettsider (DAHANCA.oncology.dk) Det er en For beståling uten kjemoterapi gis behandling mot synlig tumor (GTV) med 1 cm margin til CTV. For bestråling etter kjemoterapi er opprinnelig tumor veildende for GTV med 1 cm margin til CTV, men der en tar hensyn til opprinnelig disloserte normale strukturer som har falt tilbake til sin opprinnelige plass etter behandling. CTV utvides slik at hele glandelregionene er med i CTV i transversalplanet og utvides 1-2 cm kraniokaudalt.
Fraksjonering ved indolente lymfomer 2 Gy x 12. Ved aggressive lymfomer brukes 2 Gy x 15–20, ved Hodgkin lymfom 2 Gy x 10 eller 1,75 Gy x 17. Risikoorganer: Da dosene sjelden går over 40 Gy, legger risikoorganer som medulla ikke like store begrensninger på behandlingen. Skjoldbruskkjertelen vil ofte delvis eller helt bli inkludert i strålefeltene.
Aksilleregion
Armen må fikseres enten lett abdusert fra thorax eller over hodet i wing-board. Palpable funn og eventuelle arr/hudforandringer markeres med blytråd. Vurder å bruke DIBH teknikk eller 4 D bildeopptak.
Ved inntegning av aksillen på CT er det viktig å være klar over at standard fikseringen ikke tillater 90º abduksjon av skulder, og sårhet i huden kan derfor muligens påregnes ved doser over 35 Gy(Dabaja, Ng, Terezakis, Plastaras, Yunes, Wilson, Specht, et al., 2020). Vurder derfor wingboard med armer fiksert over hodet dersom det i slike situasjoner ikke skal gis felt mot hode-hals region fra side til side. For beståling uten kjemoterapi gis behandling mot synlig tumor (GTV) med 1 cm margin til CTV. For bestråling etter kjemoterapi er opprinnelig tumor veildende for GTV med 1 cm margin til CTV, men der en tar hensyn til opprinnelig disloserte normale strukturer som har falt tilbake til sin opprinnelige plass etter behandling. CTV utvides slik at hele glandelregionene er med i CTV i transversalplanet og utvides 1-2 cm karanikaudalt. Mot thoraksveggen begrensens CTV ved ribben. Aksilletoppen opp mot Musculus pectoralis minor må tenges inn i CTV.
I praksis forekommer isolerte aksillefelt sjelden, og regionene behandles oftest sammen med tilstøtende supra- og infracalviculærregioner som da også tenges inn i CTV. Dersom det brukes DIBH må ingen ytterligere margin påregnes. Ved bruk a 4 D teknikk vil bilder i inspirasjon og ekspirasjon gi råd om inntegning av CTV slik at ingen ytterligere margin er nødvendig.
Infraclavikulærregionen
Dette er en egen region i Ann Arbor klassifikasjonen, men sjelden affisert alene. Den behandles nærmest alltid sammen med aksille og supraclaviculærregionen. Se ovenfor.
Mediastinum/lungehilus
I Ann Arbor Klassifikasjonen er mediastinum en region, og skilles fra hiluslymfeknutene på hver sin side. For behandling er det naturlig å se på mediastinum som en øvre region ovenfor carina, en midtre region rundt carina som inkluderer tracheobronkiale og bronkopulmonale lymfeknuter (altså lungehilus på begge sider) og lymfeknuter rett subcarinalt og ved basis cordis, samt en bakre/nedre region med lymfeknuter tydelig nedenfor carina beliggende bak hjertet lang øsophagus, aorta descendens og thoracalcolumna. Lymfomaffeksjon i mediastinum forekommer også, gjerne som store konglomerattumores, i nær relasjon til hjertet. Ved siden av affeksjon i midtre og bakre mediastinum forekommer parakardialt affeksjon langs/i pericard ventralt, ventrolateralt på høyre eller venstre side og i de cardiophreniske vinklene. Lymfomaffeksjon nære hjertet er ofte en stor utfordring for planleggingen av stråleterapi.
Fiksering av pasienter for strålebehandling av mediastinum avhenger av hvilke andre regioner som også skal behandles (armer lett abdusert, wingboard ved aksillebestråling, eller maske [fortrinnsvis 5 punkts maske] dersom hals skal inkluderes). DIBH urde være standard for de aller fleste pasienter, alternativt 4 D opptak av CT for å monitorere bevegelser ved pust. Ved direkte simulering bør den kraniokaudale utbredelsen av strålefelt i mediastinum individualiseres, slik at tumors utbredelse (initialt eller etter kjemoterapi) dekkes med riktig margin til feltgrense i kraniokaudal retning. Selv etter begrenset kjemoterapi er det alltid det aktuelle tumorvolum etter kjemoterapi som definerer margin ut i lunge, ikke initialt volum (ballongeffekten). Ved god effekt av den begrensede kjemoterapien kan det være aktuelt med noe snauere margin til basis cordis, for å skåne nivået med hjerteklaffer og avgang av coronararteriene. For behandling etter full kjemoterapi, der resttumor er målvolum, er dette kraniokaudal utbredelse for GTV med egnet margin til feltgrense. Mediastinum strålebehandles alltid i sin fulle bredde i de nivåer som inkluderes. Dette betyr at feltgrensene lateralt ligger 1,5–2 cm ut i lungevev, og følger hiluskonturene på simulatorbildet (se kappefelt). Dersom det har vært tumorutbredelse i thoraxveggen, og dette er med i det initiale tumorvolum som skal bestråles, må feltbredden tilpasses, eventuelt må det skjøtes mot elektronfelt eller tangentiale fotonfelt. Dersom øvre mediastinum er med i strålefeltet, er det av og til nødvendig å inkludere fossa supraclavicularis bilateralt for å få adekvat margin til makrotumor.
Mediastinum egner seg godt til CT-doseplanlagt behandling(Dabaja, Ng, Terezakis, Plastaras, Yunes, Wilson, Yang, et al., 2020). Inntegning etter begrenset kjemoterapi for f.eks tidlige stadier av Hodgkin lymfom skal følge opprinnelig tumorvolum. Opprinnelig tumor er defor GTV med 1 cm til CTV. CTV begrenses der tidligere ikke affiserte organer faller tilbake på sin orrinelige plass, slik som lunger lateralt eller muskulatur. CTV har en margin på 1 cm karniokaudalt. Hele mediastinums bredder er som regel inkludert i øvre mediastium der dette områdetområder er affisert, men i bakre og nedre del må tilpasninger gjøres for å unndå unødvendig beatåling av hjerte. CTV tilpasses ved 4 D inntegning til å dekke tumor i alle respirasjonfaser, men ellers ingen margin til ITV, ei heller ved DIBH.
Kritiske organer ved mediastinalbestråling er lunge, hjerte, medulla og mamma hos kvinner. Standard feltoppsett er felter forfra og bakfra da slike oppsett unngår å fordele dosen til større volumer av friskt vev. Innenfor denne løsningen er likevel mm er avanserte feltoppsett aktuelle, som såklat «Butterfly» teknikk(Voong et al., 2014). Ved vurdering av dose-volum-histogrammer bør en tenke på at samlet dose til hjerte ofte er liten, men at de kritiske strukturene i klaffenivå/avgang av coronararteriene ofte får full terapeutisk dose. Dette gjør at betraktninger rundt bestråling av partielle volumer av hjertet og tolerabilitet kan ha begrenset nytteverdi mht å forutsi senere hjertesykdom.
Lunge
Lungeaffeksjon forekommer sjelden isolert, av og til mer disseminert, både ved HL og NHL, som regel som ledd i generalisert sykdom(Yahalom et al., 2015). De fleste pasienter er kandidater for full kjemoterapi for sin respektive sykdom, og lungebestråling brukes da kun konsoliderende ved usikre restlesjoner. Noen ganger foreligger isolert affeksjon av lunge ved indolente lymfom (marginalsone lymfom blant annet). Da er primær bestråling av tumor mulig i kurativ intensjon(Yahalom et al., 2015). Det er sjelden aktuelt med unilateral lungebestråling, menmen noen ganger gis total lungebestråling sammen med mediastinalfelt. Det er sjelden at en må gi total lungebestrålinglungebestårling ved dagens protokollerprotkoller for lymfom.
Vedsimulering ligger pasienten med armene lett abdusert langs siden men ut fra overkroppen. DIBH bør brukes, alternativt 4 D opptak av CT bilder. For isolerte lungelesjoner kan stereotaktisk bestråling vurderes. Lungebestråling gjøres CT doseplanlagt.
total lungebeståling er Siden som regel mediastinum er med i målvolumet. Begge lunger og hele mediastinum tegnes inn på innsiden av thoraxveggen som et CTV. CTV justeres ved 4¤ D inntegning til å dekke lunger i alle pustefaser, ellers må ingen ytterligere margin påregnes ved DIBH. Eventuelle strukturer i mediastinum som skal behandles samtidig må defineres som et eget CTV. Eventuelt større fraksjonsdoser til mediastinum kan gis som konkomitant boost. Dosering til CTV lungerer da f.eks. 1,2 Gy x 10 og til mediastinum 1,75 Gy x 17, der 0,55 Gy gis til målvolummålvolum i mediastinum som konkomitant boost ved de første 10 fraksjonene, og deretter får CTV i mediastinum alene 1,75 Gy ved de siste 7 fraksjonene.
Enkeltlesjoner i lungen ved primær kurativ bestråling eller ved konsolidering etter kjemoterapi tenges inn som GTV, og det genereres en margin på 1 cm til CTV. CTV justeres ved 4 D bilder, mens ytterligere margin ikke er nødvendig ved DIBH. Uten 4 D eller DIBH må egnet margin til ITV velges, gjerne 1-2 cm karaniokaudlat og 1 cm transversal, mer i nedre enn i øvre del av lungene da førstnevnte beveger seg mer ved pusting.
Totaldosen til hele eller større deler av lungen bør ikke overstige 15–18 Gy. Vanlig dose/fraksjonering, avhengig av forutgående kjemoterapi, er 12 eller 15 Gy i 1,2–1,5 Gy fraksjoner. Ved bestråling av enkeltlesjoner brukes ved indolente lymfomer 2 Gy x 12, ved aggressive lymfomer 2 Gy x 15–20 og ved Hodgkin lymfom 1,75 Gy x 17. En kan vurdere stereotaktisk bestråling.
Paraaortalregion
Lymfeknuter paraaortalt, paracavalt og interaortocavalt fra diafragmakuppelen til aortabifurkaturen dekkes av et paraortalfelt. Strålebehandling mot paraaortalregionen forekommer i mange sammenhenger. Paraaortalfelt anses som en del av et omvendt Y-felt. Pasienten ligger prpr ryggen og armene langs siden.det brukes ikke knepute. Hos mannlige pasienter må det være god nok sprik mellom bena for plassering av gonadeskjerming (gonadeblokk eller blybelte). For kvinner må en vurdere om det er behov for skjerming av ovarier, kryopreservering eller ovaropexi. I slike tilfeller bør operasjonsclips fortelle hvor ovariene befinner seg. I tillegg vil ovariene bli skjermet av en gonadeskjerm (nærskjerming). Dersom det er usikkerhet om nyrenes funksjon, bør GFR med renografi blir gjort før simulering. For inntegning av paraaortalfelt på simulator ligger standardmessig øvre feltgrense ved Th10/11 og nedre feltgrense i nedkant av L4 eller L5. Avhengig av tumors kraniokaudale utbredelse bør feltgrense dog ha minimum 4–5 cm margin til initialt tumorvolum (ved kurativ behandling for lokaliserte indolente lymfomer eller etter begrenset kjemoterapi for tidlige stadier av HL og aggressive NHL) eller 2 cm margin til resttumor etter full kjemoterapi ved utbredt sykdom. Laterale feltgrenser må individualiseres i avhengighet av tumorutbredelse, nyrenes lokalisasjon, nyrefunksjon og totaldose. Tumorutbredelse i transversalplanet etter kjemoterapi med 2 cm margin definerer feltbredden. Dette gjelder også ved tidlige stadier av lymfom etter kort systembehandling, der skrumpning av tumor kan ha ført til at margin til nyre og tarm er bedret etter kjemoterapi (ballongeffekten). Som for andre regioner, strålebehandles paraaortalregionen i hele bredden i de nivåer der det er indisert. Standard feltbredde er slik at tverrtaggene ligger innenfor feltet med ca. 1 cm margin, hvilket gir feltbredde på 8–10 cm.
For CT-doseplanlagt behandling følger inntegning de samme prinsipper. Tumorvolum (GTV) initialt (for tidlige stadier etter begrenset kjemoterapi eller ved strålebehandling alene) eller etter kjemoterapi (avanserte stadier) med henholdsvis 1-2 (mer ved begrenset kjemoterapi) cm margin gir CTV i kraniokaudal retning. Aktuelt tumorvolum med 1 cm margin er CTV i transversalplanet, som alltid inkluderer paraortalregionen i sin fulle bredde i de aktuelle snitt. Der tumor opprinnelig skjøv på omliggende organer, men som etter behandling har flyttet seg tilbake, tegnes disse ikke inn i CTV. Kkun om det var innvekst i dsse, skal også dette området med i CTV.
Standard feltoppsett er anteroposterior strålegang, men i mange sammenhenger kan tumorutbredelsen i nyreregionen, sideforskjeller i nyrefunksjon o.l. nødvendiggjøre andre feltoppsett med bedre skjerming av friskt nyrevev, f.eks. skråstilte felt eller sidefelt. Paraortalfelt eller deler av dette kan gis sammen med bestråling av milthilus og/eller milt (se nedenfor), iliakalregionen (doglegfelt) eller iliakal, lyske og femoralregionene.
Risikoorganer er tarm og nyre.
Iliakalregion
Iliakalregionene dekker lymfeknuter langs iliakakarene fra aortabifurkaturen til ligamentum inguinale. Som regel strålebehandles iliacaregionen enten sammen med paraaortalfelt (doglegfelt) eller sammen med inguinal/femoralregionen. Strålebehandling mot iliakalregionen forekommer i mange sammenhenger. Strålebehandling av inguinalregion kan anses som en del av et omvendt Y-felt. Pasienten ligger med armene langs siden. Hos mannlige pasienter må det være god nok sprik mellom bena for plassering av gonadeskjerming (gonadeblokk eller blybelte). Ved bestråling av iliakalregionen på en side brukes gjerne blybelte, der scrotum trekkes over på kontralateral side.. Ved bilateral bestråling brukes om mulig skrotumkopp/gonadeblokk. For jenter og kvinner i fertil alder må en vurdere om det er behov for skjerming av ovarier, kryopreservering og/eller ovaropexi. I slike tilfeller bør operasjonsclips fortelle hvor ovariene befinner seg. I tillegg vil ovariene bli skjermet av en gonadeskjerm (nærskjerming). Dersom det er usikkerhet om nyrenes plassering i forhold til feltene og nyrenes funksjon, bør GFR med renografi blir gjort før simulering
For CT-doseplanlagt behandling følger inntegning de samme prinsipper om ovenfor. Tumorvolum (GTV) initialt (for tidlige stadier etter begrenset kjemoterapi eller ved strålebehandling alene) eller etter kjemoterapi (avanserte stadier) med henholdsvis 2og2–3 og 1-2 (mer ved begrenset kjemoterapi) cm margin gir CTV i kranio¬kaudal retning. Aktuelt tumorvolum med 1 cm margin er CTV i transversalplanet, som alltid inkluderer paraortalregionen i sin fulle bredde i de aktuelle snitt. Der tumor opprinnelig skjøv på omliggende organer, men som etter behandling har flyttet seg tilbake, tegnes disse ikke inn i CTV. Kun om det var innvekst i disse, skal også dette området med i CTV.
Inguinal- og femoralregionen
Lymfeknuter ved lyskebåndet og øvre del av låret defineres av Ann Arbor klassifikasjonen som en region. Lymfomaffeksjon forkommer i femoralregionen med relativt stor variasjon hva angår kaudal utbredelse. Strålebehandling mot inguinal/femoralregionen forekommer i mange sammenhenger(Dabaja, Ng, Terezakis, Plastaras, Yunes, Wilson, Specht, et al., 2020).
Strålebehandling av inguinal/femoralregionen kan anses som en del av et omvendt Y-felt. Pasienten ligger armene langs siden. Hos mannlige pasienter må det være god nok sprik mellom bena for plassering av gonadeskjerming (gonadeblokk eller blybelte). Ved bestråling av lyskeregionen på en side brukes gjerne blybelte eller annen form for fiksering, der scrotum trekkes over på kontralateral side. Ved bilateral bestråling brukes om mulig skrotumkopp/gonadeblokk. For jenter og kvinner i fertil alder må en vurdere om det er behov for skjerming av ovarier, kryopreservering og/eller ovaropexi. I slike tilfeller bør operasjonsclips fortelle hvor ovariene befinner seg. I tillegg vil ovariene bli skjermet av en gonadeskjerm (nærskjerming). Vurder behov for å markere biopsi arr/palpable forandringer med blytråd.
For CT-doseplanlagt behandling følger inntegning de samme prinsipper om ovenfor Tumorvolum (GTV) initialt (for tidlige stadier etter begrenset kjemoterapi eller ved strålebehandling alene) eller etter kjemoterapi (avanserte stadier) med henholdsvis 2–3 og 1-2 (mer ved begrenset kjemoterapi) cm margin gir CTV i kranio¬kaudal retning. Aktuelt tumorvolum med 1 cm margin er CTV i transversalplanet, som alltid inkluderer paraortalregionen i sin fulle bredde i de aktuelle snitt. Der tumor opprinnelig skjøv på omliggende organer, men som etter behandling har flyttet seg tilbake, tegnes disse ikke inn i CTV. Kun om det var innvekst i disse, skal også dette området med i CTV.
Distale iliakalregion opp til deling av A. iliaca communis kan tas med i CTV om det foreligger et stadium IA av indolent lymfom i lysken.
Milt
Milt og lymfeknuter langs miltkarene og ved milthilus oppfattes som en lymfatisk region i Ann Arbor klassifikasjonen. Behandling av milt, milthilus og lymfeknuter langs miltkarene inkluderer av og til også de øvre paraaortale lymfeknuter. Behandling bare av milten kan forekomme ved konsolidering av restlesjoner eller som palliasjon ved lymfominfiltrasjon i milt med splenomegali, abdominalt ubehag, hypersplenisme etc. Her er strålebehandling av milten også mulig som palliativ behandling ved leukemier og andre hematologiske lidelser(Zaorsky et al., 2017).
Lymfomaffeskjon i milt forekommer oftest som ledd i generalisert sykdom. Resttumor i milten etter full kjemoterapi for avansert Hodgkins lymfom (6–8 ABVD, 8 BEACOPP eller tilsvarende) eller aggressive lymfomer (6–8 CHOP baserte kurer eller tilsvarende) kan være gjenstand for konsoliderende strålebehandling, da mot hele milten. Alternativene kan være splenektomi, eller ved negativ biopsi, observasjon alene.
Ved lokaliserte stadier av Hodgkins lymfom (stadium IA/IIA) med miltaffeksjon, i den grad dette forkommer, kan tenkes gitt konsoliderende strålebehandling mot involved site etter 2–4 ABVD kurer eller tilsvarende. Ved lokaliserte stadier av aggressive lymfomer (stadium I -II1) gis konsoliderende strålebehandling etter CHOP basert kjemoterapi eller tilsvarende mot initialt tumorvolum før kjemoterapi. I begge sistnevnte tilfeller vil en velge å inkludere lymfeknuter langs miltkarene og om nødvendig øvre retroperitoneale lymfeknuter, slik at adekvate marginer til primært tumorområde oppnås. Ved store strålefelt vil kjemoterapi som ved utbredt sykdom kunne vurderes som et alternativ, med strålebehandling kun mot eventuelle restlesjoner. Som ved splenektomi bør pasienten ha fått pneumokokkvaksine minimum 2 uker før oppstart av strålebehandling av milten (se kapittel 18).
Pasienten liggerligger på ryggen med armer ned langs siden. Venstre nyre vil alltid delvis eller helt affiseres av behandlingen og kontroll av nyrefunksjon (totalt og hver side for seg) og nyrenes posisjon utføres før simulering/doseplanlegging dersom stråledosen vil bli over 20 Gy. DIBH bør velges, alterntativt 4 D opptak av CT. For CT-basert planlegging tegnes milt og eventuelt lymfeknuter i milthilus, langs miltkarene og øvre paraaortalregion inn som CTV. Dersom 4 D bilder er tatt, justeres CTV slik at det dekker milt og andre omårder i alle pustefaser, ellers kan CT anses som lik ITV.
Venstre nyre er risikoorgan.
Ventrikkelområdet
For pasienter med marginalsonelymfomer med H. pylori infeksjon regnes trippelbehandling som standardbehandling i Norge såfremt man følger retningslinjer for diagnostikk, behandling og kontroller. Pasienter med stadium PeI uten H. pylori infeksjon, pasienter som ikke kan eller ikke ønsker å følge det skisserte kontrollopplegg for eradikasjonsbehandling og sannsynligvis også pasienter der ugunstige cytogenetiske aberrasjoner er påvist er kandidater for primær strålebehandling. Likeledes kan pasienter med lymfom også i regionale lymfeknuter (primært stadium PeII1) og pasienter med lokalt residiv etter eradikasjonsbehandling behandles med stråleterapi. Ved andre former for indolente ventrikkellymfomer i stadium PeIA og PeII1 kan primærbehandlingen være lokal strålebehandling.
Ved alvorlig blødning og/eller massiv gjennomvekst til serosa med perforasjonsfare vurderes ventrikkelreseksjon eller gastrectomi etter tverrfaglig diskusjon mellom onkolog og kirurg. Hvis inngrepet er radikalt, gis ingen ytterligere behandling ved stadium PeI, og supplerende strålebehandling 2 Gy x 12, totalt 24 Gy, mot eventuell ventrikkelrest og mot regionale lymfeknuter ved stadium PeII.
Aggressive ventrikkellymfomer utgjøres for det meste av mantelcellelymfomer og diffuse storcellete B-celle lymfomer. Ved lokalisert sykdom (stadium PeI og PeII1) behandles disse likt og følger de samme prinsipper som beskrevet for storcellet B-celle lymfom stadium I/II.
Strålebehandling av ventrikkel og regionale lymfeknuter bør gjøres CT-veiledet(Dabaja, Ng, Terezakis, Plastaras, Yunes, Wilson, Specht, et al., 2020; Yahalom et al., 2015). Pasienten bør ligge på ryggen. Standarder må eksistere, slik at pasienten f.eks. møter med tom ventrikkel (faste minimum 6 timer), for hvor mye kontrast pasienten bør drikke før simulering (et lite glass vann fungerer best), og behandlingen bør gis fastende på morgenen på samme måte. DIBH eller 4 D opptak er veldig nyttig for å begrense bevegelighet av ventrikkel i tillegg. Nyre er risiko organ og ved tvil om funksjonen av venstre nyre bør GFR måles ved renografi.
Eventuelle synlige tumores representerer GTV og CTV genereres med 1 cm margin. Eventuelle endoskopiske funn kan også være til hjelp til å definere synlig tumor. Uansett inkluderes hele ventrikkelen eller eventuelle rester av denne etter operasjon i CTV. I stadium PeI inkluderes drenerende lymfeknuter som antas å ligge langs curvaturae minor et major, ved milthilus, ved truncus coelicacus og subpyloriske lymfeknuter. Ved stadium PeII1, der de nærmeste drenerende lymfeknutene er affisert, bør kanskje også sekundære lymfeknutestasjoner tas med, og disse går både over mot lever, pancreas og nedover paraaortalregionene. Ventrikkelen er bevegelig og det bør legges gode marginer til ITV. Ved 4 D bilder vil CTV kunne jsteres etter pustefaser, ved DIBH er dette ikke nødvending. Bevelgihet for intestinal bevegelse av vetrikkel og tarm og forskjellig fylning av magesekken må påregnes, slik av vi anbefaler en margin på 1-2 cm til ITV, i hvert fall i retninger kaudalt og transversalt. Kontrollbilder under behandling kan være nyttig for å vurdere om man treffer godt.
Standard fraksjonering er 2 Gy x 12 for marginalsonelymfomer og andre indolente lymfomer og 2 Gy x 15–20 for aggressive lymfomer. Som regel vil man ende opp med flerfelts-teknikker, gjerne anteroposteriore og laterale motgående felt.
Mesenteriet
Mesenteriale lymfeknuter utgjør en egen lymfeknuteregion i Ann Arbor klassifikasjonen. Regionen er dog stor i utbredelse og lesjoner i mesenteriet kjennetegnes av stor intern bevegelighet. Lymfomaffeksjon i mesenteriet forkommer i forekommer i mange sammenhenger.
Behandlingen gjøres etter CT-veiledet doseplanlegging(Dabaja, Ng, Terezakis, Plastaras, Yunes, Wilson, Specht, et al., 2020; Wirth et al., 2020). Pasienten ligger på ryggen. DIBH og 4 D bør vurders, spesielt for lesjoner som ligger høyt opp i bukien og påvirkes av pustebevegelser. For mannlige pasienter må det være god nok sprik mellom bena for plassering av gonadeskjerming (gonadeblokk eller blybelte). For kvinner må en vurdere om det er behov for skjerming av ovarier, kryopreservering av ovar eller eventuelt en ovaropexi. I slike tilfeller bør operasjonsclips fortelle hvor ovariene befinner seg. I tillegg vil ovariene bli skjermet av ekstra tykke blokker (10 halvverdilag) i filterholderen og en gonadeskjerm (nærskjerming). Dersom det er usikkerhet om nyrenes funksjon, bør GFR med renografi blir gjort før simulering. Vurder behov for å markere biopsi arr/palpable forandringer med blytråd.
Synlig tumor tegnes inn som et GTV og det legges en margin på 1 cm til CTV. Der dette er resttumor som skal bestråles etter kjemoterapi eller ingen kjemoterapi er gitt, er dette det endelige CTV. Om opprinnelig tumor skal inkluderes slik den var før systembehandling, utvides CTV til å dekke dette området. Det legges 2–3 cm margin for intern bevegelighet for ITV. ITV bør igjen begrenses, for eksempel er bevegeligheten inn mot de retroperitoneale strukturer som nyre og columna betydelig mindre enn i selve peritonealhulen. Avhengig av tumors lokalisasjon utgjør nyre, lever, tarm, rektum, blære og gonader viktige risikoorganer.
Lever
Lever er oftest affisert av lymfom som ledd i utbredt sykdom, og gjerne da med flere lesjoner eller diffus utbredelse i leveren. Dette gjelder både for Hodgkin lymfom og alle former for non-Hodgkin lymfom. I de fleste tilfeller vil pasientene være kandidater for kjemoterapi primært som ved utbredt sykdom, og kun isolerte restlesjoner vil være aktuelle for strålebehandling. Da toleransen for ioniserende stråler for hele leveren sannsynligvis ligger i underkant av 30 Gy (TD5/5 mht leversvikt) vil bestråling av hele organet være vanskelig dersom en ønsker å gi doser som ved maligne lymfomer for øvrig. Bestråling av opptil 1/3 av leveren er derimot godt mulig med doser opptil 50 Gy. Isolerte restlesjoner etter kjemoterapi kan derfor egne seg for konsoliderende strålebehandling. Primært ekstranodal affeksjon i leveren med lokalisert fokal lymfomutbredelse i lever er svært sjelden.
Skjelett
Primært utgangspunkt i skjelett er uvanlig ved maligne lymfomer, med unntak av solitært plasmocytom(Dabaja, Ng, Terezakis, Plastaras, Yunes, Wilson, Specht, et al., 2020; Tsang et al., 2018; Yahalom et al., 2015). Dersom lokaliserte maligne lymfomer i skjelett forekommer, er det ofte tvil om disse skal stadiesettes til PeI og behandles deretter, eller om disse skal oppfattes som primært generaliserte sykdomstilfeller. Skjelettaffeksjon forkommer oftest som ledd i generalisert sykdom ved alle histologiske undergrupper av HL og NHL. Myelomatose er som regel assosiert med skjelettpatologi som kan bli aktuell for strålebehandling. Skjelettaffeksjon kan også forekomme ved lokal ekstensjon av lymfom i ben, f.eks. ved ekstranodale lymfomer i bihuler, mediastinaltumor med innvekst i sternum eller thoraks, og ved retroperitonal glandelsvulst.
Ved isolert skjelettaffeksjon av et indolent lymfom kan dette være aktuelt for primær kurativ strålebehanlding, men dette er en sjelden konstallasjon. Solitære plasmactyomer er mer vanlige. Her tegnes synlig tumor ut i ben, evnt inklusive bløtdelstumor inn som et GTV. Et CTV genereres med 1 cm margin i transversalplanet, men inkluderer hele skjelettstrukturen i transversalplanet. Ved lange rørknokler er det nok lurt å ha en større margin i lengderetning, gjerne 4 -5 cm til CTV. Vanligvis er det ingen margin for intern bevegelighet, ved bestråling av thoraxskjelett må inntegning basert på 4 D eller DIBH vurderes.
Skjelettaffeksjon som ledd i generalisert sykdom eller ved ekstensjon til ben fra omliggende strukturer er det indisert å strålebehandle disse etter kjemoterapi, men kun dersom det foreligger 1 eller maksimalt 2 områder med benaffeksjon. Dersom det gis strålebehandling, skal behandling gis mot hele området med initial benaffeksjon som CTV, inklusive bløtdelstumor der denne har infiltrert andre strukturer, selv om tumor har respondert godt på kjemoterapi. Ved mer enn 2 områder med benaffeksjon vil spredning til skjelett måtte anses som såpass generalisert at strålebehandling ikke er fornuftig med mindre skjelettdestruksjon ønskes sikret for å forebygge frakturer.
Etter vanlige palliative retningslinjer er det aktuelt å strålebehandle skjelettaffeksjon med frakturfare, smerter eller kompresjon av medulla spinalis og annet nevrogent vev.
Feltene bør følge vanlige geometriske retningslinjer, slik at senere skjøt og rebehandling blir lettest mulig. Eksempelvis legges feltgrenser i columna alltid i intervertebralspaltene og hele virvelcorpus med tverrtagger og ryggtagger inkluderes. Likeledes bestråles lange rørknokler i full bredde med god margin i marghulens lengderetning. Ved bestråling av ekstremiteter er det viktig å være klar over en stor grad av innstillingsusikkerhet fra en fraksjon til den neste. Videre bør en forsøke å utelate en brem av friskt bløtvev fra strålefeltet for å forebygge lymfødemutvikling.
Fraksjonering ved kurativt siktemål/palliativt siktemål med mulig langvarig remisjon 2 Gy x 12 (indolente lymfomer), 1,75 Gy x 17 (Hodgkin lymfom) og 2 Gy x 15–20 (aggressive lymfomer). Ved palliativ indikasjon vurderes 3 Gy x 10 (frakturfare, bærende skjelettstrukturer), 4 Gy x 5 eller 8 Gy x 1 (smerte som indikasjon). For solitært plasmocytom med kurativt siktemål brukes 2 Gy x 20.
Hud
Det forekommer primære kutane lymfomer (PCL) og hudaffeksjon som ledd i generalisert sykdom(Specht, Dabaja, Illidge, Wilson, & Hoppe, 2015; Rein Willemze et al., 2019). PCL er definert som lymfomer som antas å oppstå i hud og som primært manifesterer seg kun i hud. Av T-celle lymfomer (ca. 70 % av PCL) dominerer mycosis fungoides, fulgt av storcellet anaplastisk CD30+ T-cellelymfom, lymfomatoid papulose og T-celle-lymfomer av forskjellig art. Av B-celle lymfomer (ca. 30 % av PCL) er marginalsone lymfomer og DLBCL vanligst. Det histologiske bildet korrelerer dårligere med det kliniske forløpet enn ved andre lymfomer (storcellet anaplastisk T-celle lymfom og DLBCL isolert i hud har relativt god prognose) og hudområdet for den primære lokalisasjonen kan ha betydning for prognosen (DLBCL på underekstremitet har en dårligere prognose enn øvrige PCL av typen DLBCL).
MF og lymfomatoid papulose er ofte diffust utbredt i hud og prognosen er generelt god. Lymfomatoid papulose er en benign lidelse som nesten alltid går i spontan regress og ikke behøver stråleterapi. For MF vil strålebehandling ofte være et ledd blant flere lokale tiltak. Avhengig av områdets størrelse og fare for kosmetisk skjemmende senreaksjoner i hud velges ofte fraksjonering 2 Gy x 15 eller 3 Gy x 8. I litteraturen anbefales også 8 Gy x 1 eller 4 Gy x 2 som en svært enkel behandling, men denne er ikke mye brukt ved OUS(Trautinger et al., 2006). Rebestråling er ofte mulig både en og to ganger ved fraksjonert behandling med rundt 24 Gy. Ved generalisert sykdom i hud som ikke lar seg behandle med andre lokale tiltak, er helhud elektronbestråling en mulighet (se nedenfor). CD30+ ALCL er ofte lokaliserte til et eller få områder i hud, og egner seg ofte for lokal strålebehandling, 20-40 Gy i fraksjoner på 2-2,5 Gy anbefales i litteraturen(Melchers et al., 2017). CD30- ACLC har selv med primær affeksjon i hud en dårligere prognose, og behandles gjerne med kjemoterapi som ved aggressive T-celle lymfomer generelt, eventuelt etterfulgt av strålebehandling. Ved lokalisert affeksjon (Stadium PeI) gis f.eks. 3 CHOP-baserte kurer etterfulgt av strålebehandling 2 Gy x 15–20. Ved mer utbredt hudaffeksjon oppfattes sykdommen som generalisert (Stadium IV) og behandles med 6 kurer og strålebehandling gis mot eventuelle restlesjoner, 2 Gy x 20. Det er mange grupper av cutane T-celle lymfomer som må ses hver for seg avhenging av histologisk entitet(Specht et al., 2015).
Ved PCL av typen B-celle lymfom er det noe dårligere med litteratur, også her er mye basert på ikke randomiserte historiske data(Specht et al., 2015). Indolente lymfomer (marginalsonelymfom, follikulære lymfom) med lokalisert sykdom (stadium PeI) eller få områder med affeksjon i hud behandles med strålebehandling alene, 2 Gy x 12. Ved utbredt sykdom i hud (stadium IV) kan behandlingen avventes og eventuelt gis til symptomatiske eller kosmetiske skjemmende områder. Systemisk behandling brukes kun dersom lokalbehandling ikke gir god nok kontroll. Ved aggressive B-celle lymfomer (DLBCL) gis strålebehandling i tilsutning til kjemoterapi i henhold til stadieadaptert opplegg. Ved lokalisert affeksjon (stadium PeI) gis 3 CHOP-baserte kurer og strålebehandling 2 Gy x 15–20, ved utbredt hudaffeksjon (stadium IV) 6 kurer, eventuelt etterfulgt av strålebehandling mot gjenværende restlesjoner.
Dersom lokale hudområder skal behandles, brukes som regel elektroner der energien og bruk av bolus tilpasses hvert enkelt tilfelle(Dabaja, Ng, Terezakis, Plastaras, Yunes, Wilson, Specht, et al., 2020). Feltgrensen bør være 2 cm fra synlig tumor ved kurative opplegg, mindre ved palliative. Røntgenstråler (fotoner med 50–150 keV) kan vurderes ved svært overfladiske lesjoner opptil 2–3 mm, men har sammenliknet med elektroner en lengre hale på dybdedosekurven, og gir således større dose til dypere strukturer. Ved kurvede overflater kan elektroner være vanskelig å bruke, og gjennombestråling ved fotoner med bolus, f.eks. av deler av en ekstremitet, kan være enklere.
Helhuds elektronbestråling
Bestråling av hele huden med elektroner blir brukt i behandling av maligne sykdommer med utbredelse i store områder av huden, for eksempel mycosis fungoides og andre non-Hodgkin lymfom med diffus utbredelse i hud(Trautinger et al., 2006). Oslo universitetssykehus har et etablert opplegg for gjennomføring av denne krevende behandlingsformen.
Det brukes to felt med elektroner med stor avstand fra kilde til pasient og feltene vinkles med nær horisontal strålegang skrått nedenifra og skrått ovenifra. Feltene vil da addere hverandre for å gi en relativt jevn dosefordeling i hele pasientens høyde. Ved å la pasienten rotere på en taburett under bestrålingen blir dosefordelingen tilnærmet jevn på huden. Pasienten skal stå sentrert på taburetten med føttene fra hverandre og holde seg med en hånd (om nødvendig med begge hender) i støtteanordningen som henger fra taket. Pasienten alternerer mellom fraksjonene med å holde høyre respektive venstre hånd opp. Den andre hånden holdes 10–15 cm ut fra kroppen. Måldosen, 1,2 Gy per fraksjon, gis med to felt per fraksjon, fem fraksjoner per uke. Det anbefales å gi 30–36 Gy målt som dosen i hudoverflaten, hvilket er i samsvar med internasjonale anbefalinger. Elektronenergien fra kilden (6 MeV) er lavere i hudoverflaten til pasienten med dybdedosekurve deretter, 80 % isodosen ligger på dyp 4 mm. Fordi store deler av dosen gis som tangentialbestråling, er dosemaksimum i hudoverflaten, til forskjell fra hudbestråling med elektroner vinkelrett på overflaten. Feltet vinklet nedenifra gir primært dose til huden på øvre kroppshalvdel, mens feltet vinklet ovenifra bidrar vesentlig med dose til huden på nedre kroppshalvdel. Bestrålingen bør starte på forskjellige steder under rotasjonen hver dag.
Behandlingen dekker ikke perineum, fotsålen og issen, slik at det kan bli aktuelt med tilleggsfelt mot disse lokalisasjonene. Disse gis som regel i form av felt med 2 Gy per fraksjon i siste del av behandlingen. Eventuelle plaque/tumorøse lesjoner som trenger behandling med større dybdedoser enn huden for øvrig, bør vurderes for lokale tilleggsfelt.
For helhud elektronbestråling for MF eller SS velges vanligvis 30-36 Gy i 1,5 Gy per fraksjon. 30-36 Gy er internasjonalt en konvensjonell dosering, men lavere doser er vurdert. Dette gir lavere akutt toksistet og mulighet for rebestråling(Jones et al., 2002; Kamstrup et al., 2015).
Ved helhuds elektronbestråling av hud ses bivirkninger først og fremst i hud, øyelinsene, neglene, hår, fingre og tær. Nærmest obligate bivirkninger er erytem i hud, ødem på hender og føtter (som kan vedvare noe tid etter behandlingen), stopp i negleveksten (men tap av negler er lite vanlig) og reversibel komplett alopeci. Sårdannelse på hender og føtter (eventuelt med superinfeksjon) og såre øyne (eventuelt med superinfeksjon) kan forekomme. Dersom sykdommen ikke er utbredt til hodebunnen, fingre og tær kan en vurdere å skjerme med blymatter/plater som tilpasses anatomien. Det benyttes øyeskjold, som regel av bly som støpt inn i voks eller gullbelagte messingblokker. Dersom også området utenfor øynene skal skjermes, kan man tilpasse blymatter som tapes fast. Hos menn er det fare for at testikler får relevante doser, og sædbanking bør vurderes før strålebehandling.
Scrotum/Testikler
Lymfom i testikler har oftest en aggressiv histologi der diffust storcellet B-celle lymfom, Burkitt lymfom eller lymfoblastisk lymfom/ALL dominerer(Yahalom et al., 2015). Diffuse storcellete B-celle lymfomer forekommer hyppigst hos eldre pasienter. Behandlingen av DLBCL i testikler følger angitte retningslinjer for diffust storcellet B-celle lymfom, se også spesielt behov for CNS profylakse. Lymfomet er ofte lokalisert til begge testikler, selv om kun en testikkel synes affisert klinisk og/eller radiologisk. Etter orchiektomi og adekvat kjemoterapi opptrer residiver ikke sjelden i gjenværende testikkel. Bestråling av scrotum/gjenværende testikler er muligens også viktig som ledd i profylakse for senere CNS-progresjon. Adjuvant strålebehandling mot scrotum anbefales derfor rutinemessig uansett stadium, uavhengig av om der er gjort orchiectomi og uansett forutgående kjemoterapi. Ved lymfoblastlymfom/ALL og Burkitts lymfom med testisaffeksjon er det diskutert om strålebehandling mot scrotum har en verdi som supplement til systemisk kjemoterapi, bla. under antagelsen av at blod-testis barrieren kan redusere kjemoterapiens effekt i testiklene. I fravær av gode data på dette området, må dette i så fall avgjøres i de individuelle tilfellene og protokollen det behandles etter.
Pasienten ligger i ryggleie med god bensprik. Det bør være varmt på rommet, pasienten mest mulig avslappet og pasienten berøres med mest mulig varme hender. Penis fikseres ut av strålegangen. Dersom anatomien tillater det, gis behandling med scrotum liggende på «benk». Scrotum med testikler pakkes inn i bolusmateriale, da scrotalhuden er tynn og en ellers ikke vil oppnå full dekning til testikler. Hele scrotum bør være med i målvolumet og kraniale grense for feltet må gå et stykke opp på penisroten, for å sikre at testiklene også ved retraksjon av funikkelen blir liggende innenfor feltet. Det kan gis fotoner forfra eller elektroner, der hele scrotums dybde må sikres full dose. Ved elektroner bør da eksempelvis 90 prosent isodosen i bakkant av målvolumet ligge i scrotalhuden dorsalt eller i bolusmaterialet under scrotum.
Alternativer til et slikt opplegg vil være nødvendig dersom scrotalhuden ikke er fleksibel nok. En kan da for eksempel vurdere elektroner gitt på egnet dyp inn skrått forfra mot scrotum/perineum med bruk av bolus.
Helkroppsbestråling
Helkroppsbestråling (Total Body Irradiation, TBI) representerer en ekstremvariant av strålebehandling, der hele kroppen utgjør målvolumet. Behandlingen representer en stor utfordring rent geometrisk, dosimetrisk og logistisk. Ved sidene av sykdommer utgående fra myeloide celler, er lymfatiske neoplasier kandidater for bruk av TBI av to grunner. Maligne lymfatiske sykdommer er strålefølsomme og må som oftest antas å være generalisert i utbredelse. Dosene som kan gis ved TBI er derimot sterkt begrenset, hovedsakelig pga akutt toksisitet fra benmargen (denne overvinnes ved etterfølgende transplantasjon av hematopoietiske stamceller) og lunger. Toksisiteten forbundet med TBI er betydelig.
Lav-dose TBI (mindre enn 2 Gy) gitt som enkelt fraksjon eller med fraksjoner 0,05–0,15 Gy/fraksjon med 2–5 fraskjoner per uke har tidligere vært brukt uten hematopoietisk stamcellestøtte, spesielt ved KLL og lavgradige lymfomer. Benmargsdepresjon, spesielt som trombocytopeni, er uttalt. Denne behandlingsformen brukes per i dag ikke i Norge.
TBI brukes i dag hovedsakelig som ledd i kondisjonering ved hematopoietisk stamcelletransplantasjon ved myeloide og lymfoide neoplasier og beslektede tilstander(Wong, Filippi, Dabaja, Yahalom, & Specht, 2018). Ved autolog eller syngen stamcelletransplantasjon er anti-tumor effekten av strålebehandlingen den tilsiktede virkning, som regel sammen med kjemoterapi. Ved allogen stamcelletransplantasjon vil bestråling gitt i egnede doser også medvirke til å supprimere pasientens eget immunforsvar slik at faren for avstøtning av de allogene stamcellene (host versus graft reaction, graft rejection) reduseres. Ved tradisjonell myeloablativ stamcelletransplantasjon gis gjerne doser høyere enn 9 Gy. Når en ser på faren for strålepneumonitt, tradisjonelt den mest alvorlige akutte toksisitet ved TBI, har det vist seg at fraksjonert behandling med 1,2–2 Gy per fraksjon gitt 1–2 ganger daglig kan være å foretrekke fremfor enkeltfraksjoner over 9 Gy, og at totaldosen ved fraksjonert behandling kan økes. Doseraten, varierende mellom 0,05–0,1 Gy/min (lav doserate) til 0,5–0,7 Gy/min (høy doserate) spiller også en viktig strålebiologisk rolle. Det vanligste kondisjoneringsregime inneholdende TBI ved OUS består av 13 Gy med fraksjonering 1,3 Gy x 10 med to fraksjoner daglig med lav doserate etterfulgt av høydose cyclofosfamid med 3 g/m2 daglig på to etterfølgende dager (totalt 6 g/m2). Et annet regime i senere år er 2 Gy x 6 gitt over tre dager sammen med kjemoterapi. Lungene skjermes i begge regimene for å redusere lungedosen ned mot eller under 10 Gy.
TBI har mulig en plass i kondisjoneringen ved såkalt allogen stamcelle transplantasjon med redusert kondisjonering (mini-allo transplantasjon). Her gis TBI i lavere doser, gjerne som en engangsfraksjon, men med doser langt under 8 Gy. Hensikten med TBI ved mini-allo er hovedsakelig å supprimere pasientens friske gjenværende immunsystem for å forebygge avstøtning av de allogene stamcellene. Det mest brukte regimet ved OUS er det såkalte Seattle-regimet der TBI med 2 Gy som en fraksjon kombineres med fludarabin.
Bruk av TBI som ledd i kondisjonering før stamcelletransplantasjon er en vurdering i hvert enkelt tilfelle. De vanligste indikasjonene for TBI er i dag som del av kondisjonering ved allogen stamcelletransplantasjon for enkeltpasienter med akutte leukemier, MDS og aplastisk anemi. TBI brukes i dag sjelden ved autologe stamcelletransplantasjoner der kondisjoneringsregimer bestående av cytostatika alene er mest brukt.
Det teoretiske grunnlaget for TBI er komplisert, og omtales her svært forenklet slik det relevant for prosedyren ved DNR. For å få plass til hele kroppen i et strålefelt må avstanden fra kilde til hud økes, og dette oppnås ved å stille inn strålekilden med horisontal strålegang slik at denne ligger lengst mulig fra den ene veggen i bunkeren. Pasienten posisjoneres lengst mulig vekk i den andre enden av bunkeren i ønsket posisjon. Apparatinnstilling og pasientposisjonering brukt ved OUS er vist i figur. Pasienten kan ligge på rygg og/eller i sideleie avhengig av om man vil gi strålebehandlingen med anteroposteriore felt, laterale felt eller en kombinasjon av dette. Ved OUS ligger pasienten, eventuelt med lett vinklede ben, på en egen seng og midtveis ved hver fraksjon snus sengen pasienten ligger på, 180 grader. I tillegg varieres mellom rygg og sideleie, for å få mest mulig homogen dosefordeling. Armene posisjoneres slik at de kompenserer for «manglende bløtvev» i lungene ved de fraksjoner der lungene ikke skal skjermes. Lungene skjermes ved fraksjonene 4 og 8 av 10, og pasientene holder armene unna lungenes forflater ved disse fraksjonene. RR bruker et støpt underlag av vacfix for å få et best mulig reproduserbart sideleie. For å få fulldekning i hud må det benyttes en skjerm av pleksiglass i egnet avstand mellom kilden og pasienten som genererer scatterelektroner.
Pga store variasjoner i pasienttykkelsen i retning for strålegangen og pga. store forskjeller i tetthet i vevet, spesielt i thorax med luftholdige lunger, er det en utfordring å få til en homogen dosefordeling i hele kroppen. Problemet er avhengig av posisjoneringen, dvs. om strålegangen er i anteroposterior retning eller fra siden. Armene kan delvis brukes som kompensasjon for «manglende bløtvev» i thorax og posisjoneringen av disse er derfor viktig ved de forskjellige stillingene pasienter skal innta under behandlingen. Kompensasjon er også nødvendig for å ta høyde for at hode og hals har et mindre tverrmål, spesielt ved lateral strålegang. De komplekse forhold knyttet til dosimetri løses i dag ved at planleggingen foregår CT-veiledet. Individuelle lungeblokker utformes ved simuleringen og posisjoneres på samme sted ved de fraksjonene der lungeblokker skal anvendes.
Før behandling må logistikken rundt hele stamcelletransplantasjonen være nøye planlagt. Stamceller må være tilgjengelig og klarert for bruk, enten de er høstet fra pasienten selv eller donor. Dager for strålebehandling må planlegges i forhold til innleggelse, transport til og fra stråleterapiavdelingen, dager for eventuell kjemoterapi og planlagt stamcellereinfusjon samt nødvendig oppfølging i forhold til eventuell aplasiperiode. Pga prosedyrens kompleksitet, morbiditet og mortalitet er god informasjon til pasienten og pårørende, også fra stråleterapiansvarlig onkolog, svært viktig. Tett dialog mellom hematolog og onkolog er viktig. Behandlingsopplegget krever en høy grad av compliance fra pasientens side. Behandling av barn, som krever narkose, utgjør et spesielt problem.
Planleggingen foregår i dag ved CT. Det lages en vacfix som stabiliserer pasienten i sideleie og som skal brukes ved de fraksjonene der lungene skal blokkes ut. Ved engangsfraksjon på 2 Gy er prosedyren enklere, da pasienten ligger i kun et leie (som regel ryggleie) og det ikke brukes lungeblokk.
Legen tegner inn lungeblokker på doseplanleggingsverktøyet. Ved selve behandlingen er pasienten innlagt senest dagen før behandling. Pasienten bør kvelden før 1. fraksjon starte med antiemetisk profylakse (minimum Ondansetron 8 mg x 2 eller tilsvarende) samt hydrering. Serotoninantagonist suppleres eventuelt med annen behandling, steroider kan bli nødvendig mot kvalme, hodepine og svimmelhet. Pasienten er som ledd i sin kondisjoneringsbehandling på vei inn i en alvorlig benmargsaplasi og bør håndteres både på post og ved behandlingsapparatet i forhold til dette. Smitteverntiltak kan være påkrevd som ved beskyttet isolasjon for neutropeni og fare for kontaktsmitte.
Referanser
Sist faglig oppdatert: 06.03.2023
Advani, R. H., Horning, S. J., Hoppe, R. T., Daadi, S., Allen, J., Natkunam, Y., & Bartlett, N. L. (2014). Mature results of a phase II study of rituximab therapy for nodular lymphocyte-predominant Hodgkin lymphoma. Journal of clinical oncology, 32(9), 912-918. https://doi.org/10.1200/JCO.2013.53.2069
Alaggio, R., Amador, C., Anagnostopoulos, I., Attygalle, A. D., Araujo, I. B. O., Berti, E., . . . Xiao, W. (2022). The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms. Leukemia, 36(7), 1720-1748. https://doi.org/10.1038/s41375-022-01620-2
Aleman, B. M., Raemaekers, J. M., Tirelli, U., Bortolus, R., van 't Veer, M. B., Lybeert, M. L., . . . Treatment of Cancer Lymphoma Group. (2003). Involved-field radiotherapy for advanced Hodgkin's lymphoma. The New England journal of medicine, 348(24), 2396-2406. https://doi.org/10.1056/NEJMoa022628
Anderlini, P., Saliba, R., Acholonu, S., Giralt, S. A., Andersson, B., Ueno, N. T., . . . Champlin, R. E. (2008). Fludarabine-melphalan as a preparative regimen for reduced-intensity conditioning allogeneic stem cell transplantation in relapsed and refractory Hodgkin's lymphoma: the updated M.D. Anderson Cancer Center experience. Haematologica, 93(2), 257-264. https://doi.org/10.3324/haematol.11828
Anderson, R. A., Remedios, R., Kirkwood, A. A., Patrick, P., Stevens, L., Clifton-Hadley, L., . . . Johnson, P. W. M. (2018). Determinants of ovarian function after response-adapted therapy in patients with advanced Hodgkin's lymphoma (RATHL): a secondary analysis of a randomised phase 3 trial. The Lancet. Oncology, 19(10), 1328-1337. https://doi.org/10.1016/s1470-2045(18)30500-x
Andre, M. P. E., Girinsky, T., Federico, M., Reman, O., Fortpied, C., Gotti, M., . . . Raemaekers, J. (2017). Early Positron Emission Tomography Response-Adapted Treatment in Stage I and II Hodgkin Lymphoma: Final Results of the Randomized EORTC/LYSA/FIL H10 Trial. Journal of clinical oncology, 35(16), 1786-1794. https://doi.org/10.1200/JCO.2016.68.6394
Ansell, S. M., Radford, J., Connors, J. M., Długosz-Danecka, M., Kim, W. S., Gallamini, A., . . . Straus, D. J. (2022). Overall Survival with Brentuximab Vedotin in Stage III or IV Hodgkin's Lymphoma. The New England journal of medicine, 387(4), 310-320. https://doi.org/10.1056/NEJMoa2206125
Ardeshna, K. M., Qian, W., Smith, P., Braganca, N., Lowry, L., Patrick, P., . . . Linch, D. C. (2014). Rituximab versus a watch-and-wait approach in patients with advanced-stage, asymptomatic, non-bulky follicular lymphoma: an open-label randomised phase 3 trial. The Lancet. Oncology, 15(4), 424-435. https://doi.org/10.1016/S1470-2045(14)70027-0
Barrington, S. F., Mikhaeel, N. G., Kostakoglu, L., Meignan, M., Hutchings, M., Mueller, S. P., . . . Cheson, B. D. (2014). Role of imaging in the staging and response assessment of lymphoma: consensus of the International Conference on Malignant Lymphomas Imaging Working Group. Journal of clinical oncology, 32(27), 3048-3058. https://doi.org/10.1200/JCO.2013.53.5229
Barzenje, D. A., Holte, H., Fosså, A., Ghanima, W., Liestøl, K., Delabie, J., & Kolstad, A. (2017). Long-term outcome for patients with early stage marginal zone lymphoma and mantle cell lymphoma. Leukemia & lymphoma, 58(3), 623-632. https://doi.org/10.1080/10428194.2016.1204653
Barzenje, D. A., Kolstad, A., Ghanima, W., & Holte, H. (2018). Long-term outcome of patients with solitary plasmacytoma treated with radiotherapy: A population-based, single-center study with median follow-up of 13.7 years. Hematological oncology, 36(1), 217-223. https://doi.org/10.1002/hon.2415
Bastings, L., Beerendonk, C. C., Westphal, J. R., Massuger, L. F., Kaal, S. E., van Leeuwen, F. E., . . . Peek, R. (2013). Autotransplantation of cryopreserved ovarian tissue in cancer survivors and the risk of reintroducing malignancy: a systematic review. Human reproduction update, 19(5), 483-506. https://doi.org/10.1093/humupd/dmt020
Batchelor, T., & Loeffler, J. S. (2006). Primary CNS lymphoma. Journal of clinical oncology, 24(8), 1281-1288. https://doi.org/10.1200/JCO.2005.04.8819
Behringer, K., Mueller, H., Goergen, H., Thielen, I., Eibl, A. D., Stumpf, V., . . . Borchmann, P. (2013). Gonadal function and fertility in survivors after Hodgkin lymphoma treatment within the German Hodgkin Study Group HD13 to HD15 trials. Journal of clinical oncology, 31(2), 231-239. https://doi.org/10.1200/jco.2012.44.3721
Behringer, K., Thielen, I., Mueller, H., Goergen, H., Eibl, A. D., Rosenbrock, J., . . . Borchmann, P. (2012). Fertility and gonadal function in female survivors after treatment of early unfavorable Hodgkin lymphoma (HL) within the German Hodgkin Study Group HD14 trial. Annals of oncology, 23(7), 1818-1825. https://doi.org/10.1093/annonc/mdr575
Behringer, K., Wildt, L., Mueller, H., Mattle, V., Ganitis, P., van den Hoonaard, B., . . . Borchmann, P. (2010). No protection of the ovarian follicle pool with the use of GnRH-analogues or oral contraceptives in young women treated with escalated BEACOPP for advanced-stage Hodgkin lymphoma. Final results of a phase II trial from the German Hodgkin Study Group. Annals of oncology, 21(10), 2052-2060. https://doi.org/10.1093/annonc/mdq066
Bennett, M., Sharma, K., Yegena, S., Gavish, I., Dave, H. P., & Schechter, G. P. (2005). Rituximab monotherapy for splenic marginal zone lymphoma. Haematologica, 90(6), 856-858.
Bersvendsen, H., Kolstad, A., Blystad, A. K., Aurlien, E., Fosså, A., Kvaløy, S. O., . . . Lauritzsen, G. F. (2014). Multimodal treatment with ALL-like chemotherapy, Auto-SCT and radiotherapy for lymphoblastic lymphoma. Acta oncologica, 53(5), 680-687. https://doi.org/10.3109/0284186X.2013.855816
Bertoni, F., & Zucca, E. (2005). State-of-the-art therapeutics: marginal-zone lymphoma. Journal of clinical oncology, 23(26), 6415-6420. https://doi.org/10.1200/JCO.2005.05.018
Blaker, Y. N., Eide, M. B., Liestøl, K., Lauritzsen, G. F., Kolstad, A., Fosså, A., . . . Holte, H. (2014). High dose chemotherapy with autologous stem cell transplant for patients with transformed B-cell non-Hodgkin lymphoma in the rituximab era. Leukemia & lymphoma, 55(10), 2319-2327. https://doi.org/10.3109/10428194.2013.871632
Boeckh, M., & Ljungman, P. (2009). How we treat cytomegalovirus in hematopoietic cell transplant recipients. Blood, 113(23), 5711-5719. https://doi.org/10.1182/blood-2008-10-143560
Boehme, V., Zeynalova, S., Kloess, M., Loeffler, M., Kaiser, U., Pfreundschuh, M., . . . German High-Grade Non-Hodgkin's Lymphoma Study Group. (2007). Incidence and risk factors of central nervous system recurrence in aggressive lymphoma--a survey of 1693 patients treated in protocols of the German High-Grade Non-Hodgkin's Lymphoma Study Group (DSHNHL). Annals of oncology, 18(1), 149-157. https://doi.org/10.1093/annonc/mdl327
Bonnet, C., Fillet, G., Mounier, N., Ganem, G., Molina, T. J., Thieblemont, C., . . . Groupe d'Etude des Lymphomes de l'Adulte. (2007). CHOP alone compared with CHOP plus radiotherapy for localized aggressive lymphoma in elderly patients: a study by the Groupe d'Etude des Lymphomes de l'Adulte. Journal of clinical oncology, 25(7), 787-792. https://doi.org/10.1200/JCO.2006.07.0722
Borchmann, P., Goergen, H., Kobe, C., Lohri, A., Greil, R., Eichenauer, D. A., . . . Engert, A. (2018). PET-guided treatment in patients with advanced-stage Hodgkin's lymphoma (HD18): final results of an open-label, international, randomised phase 3 trial by the German Hodgkin Study Group. Lancet, 390(10114), 2790-2802. https://doi.org/10.1016/S0140-6736(17)32134-7
Borchmann, P., Haverkamp, H., Lohri, A., Mey, U., Kreissl, S., Greil, R., . . . Engert, A. (2017). Progression-free survival of early interim PET-positive patients with advanced stage Hodgkin's lymphoma treated with BEACOPPescalated alone or in combination with rituximab (HD18): an open-label, international, randomised phase 3 study by the German Hodgkin Study Group. The Lancet. Oncology, 18(4), 454-463. https://doi.org/10.1016/S1470-2045(17)30103-1
Borchmann, P., Plütschow, A., Kobe, C., Greil, R., Meissner, J., Topp, M. S., . . . Engert, A. (2021). PET-guided omission of radiotherapy in early-stage unfavourable Hodgkin lymphoma (GHSG HD17): a multicentre, open-label, randomised, phase 3 trial. The Lancet. Oncology, 22(2), 223-234. https://doi.org/10.1016/S1470-2045(20)30601-X
Boue, F., Gabarre, J., Gisselbrecht, C., Reynes, J., Cheret, A., Bonnet, F., . . . Costagliola, D. (2006). Phase II trial of CHOP plus rituximab in patients with HIV-associated non-Hodgkin's lymphoma. Journal of clinical oncology, 24(25), 4123-4128. https://doi.org/10.1200/JCO.2005.05.4684
Brice, P., Bastion, Y., Lepage, E., Brousse, N., Haïoun, C., Moreau, P., . . . Solal-Céligny, P. (1997). Comparison in low-tumor-burden follicular lymphomas between an initial no-treatment policy, prednimustine, or interferon alfa: a randomized study from the Groupe d'Etude des Lymphomes Folliculaires. Groupe d'Etude des Lymphomes de l'Adulte. Journal of clinical oncology, 15(3), 1110-1117. https://doi.org/10.1200/jco.1997.15.3.1110
Campo, E. (2015). MYC in DLBCL: partners matter. Blood, 126(22), 2439-2440. https://doi.org/10.1182/blood-2015-10-671362
Campo, E. (2017). Pathology and classification of aggressive mature B-cell lymphomas. Hematological oncology, 35 Suppl 1, 80-83. https://doi.org/10.1002/hon.2406
Campo, E., Jaffe, E. S., Cook, J. R., Quintanilla-Martinez, L., Swerdlow, S. H., Anderson, K. C., . . . Zelenetz, A. D. (2022). The International Consensus Classification of Mature Lymphoid Neoplasms: a report from the Clinical Advisory Committee. Blood, 140(11), 1229-1253. https://doi.org/10.1182/blood.2022015851
Canellos, G. P., Anderson, J. R., Propert, K. J., Nissen, N., Cooper, M. R., Henderson, E. S., . . . Peterson, B. A. (1992). Chemotherapy of advanced Hodgkin's disease with MOPP, ABVD, or MOPP alternating with ABVD. The New England journal of medicine, 327(21), 1478-1484. https://doi.org/10.1056/NEJM199211193272102
Carter, A., Robison, L. L., Francisco, L., Smith, D., Grant, M., Baker, K. S., . . . Bhatia, S. (2006). Prevalence of conception and pregnancy outcomes after hematopoietic cell transplantation: report from the Bone Marrow Transplant Survivor Study. Bone marrow transplantation, 37(11), 1023-1029. https://doi.org/10.1038/sj.bmt.1705364
Casasnovas, R. O., Bouabdallah, R., Brice, P., Lazarovici, J., Ghesquieres, H., Stamatoullas, A., . . . Meignan, M. (2019). PET-adapted treatment for newly diagnosed advanced Hodgkin lymphoma (AHL2011): a randomised, multicentre, non-inferiority, phase 3 study. The Lancet. Oncology, 20(2), 202-215. https://doi.org/10.1016/s1470-2045(18)30784-8
Casulo, C., & Barr, P. M. (2019). How I treat early-relapsing follicular lymphoma. Blood, 133(14), 1540-1547. https://doi.org/10.1182/blood-2018-08-822148
Cavalli, F., Isaacson, P. G., Gascoyne, R. D., & Zucca, E. (2001). MALT Lymphomas. Hematology. American Society of Hematology. Education Program, (1), 241-258. https://doi.org/10.1182/asheducation-2001.1.241
Chamberlain, M. C., Nolan, C., & Abrey, L. E. (2005). Leukemic and lymphomatous meningitis: incidence, prognosis and treatment. Journal of neuro-oncology, 75(1), 71-83. https://doi.org/10.1007/s11060-004-8100-y
Cheah, C. Y., Wirth, A., & Seymour, J. F. (2014). Primary testicular lymphoma. Blood, 123(4), 486-493. https://doi.org/10.1182/blood-2013-10-530659
Cheson, B. D., Chua, N., Mayer, J., Dueck, G., Trněný, M., Bouabdallah, K., . . . Sehn, L. H. (2018). Overall Survival Benefit in Patients With Rituximab-Refractory Indolent Non-Hodgkin Lymphoma Who Received Obinutuzumab Plus Bendamustine Induction and Obinutuzumab Maintenance in the GADOLIN Study. Journal of clinical oncology, 36(22), 2259-2266. https://doi.org/10.1200/JCO.2017.76.3656
Cheson, B. D., Fisher, R. I., Barrington, S. F., Cavalli, F., Schwartz, L. H., Zucca, E., . . . United Kingdom National Cancer Research Institute. (2014). Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. Journal of clinical oncology, 32(27), 3059-3068. https://doi.org/10.1200/JCO.2013.54.8800
Cheson, B. D., Horning, S. J., Coiffier, B., Shipp, M. A., Fisher, R. I., Connors, J. M., . . . Canellos, G. P. (1999). Report of an international workshop to standardize response criteria for non-Hodgkin's lymphomas. NCI Sponsored International Working Group. Journal of clinical oncology, 17(4), 1244. https://doi.org/10.1200/JCO.1999.17.4.1244
Cheson, B. D., Pfistner, B., Juweid, M. E., Gascoyne, R. D., Specht, L., Horning, S. J., . . . International Harmonization Project on Lymphoma. (2007). Revised response criteria for malignant lymphoma. Journal of clinical oncology, 25(5), 579-586. https://doi.org/10.1200/JCO.2006.09.2403
Coiffier, B. (2006). Standard treatment of advanced-stage diffuse large B-cell lymphoma. Seminars in hematology, 43(4), 213-220. https://doi.org/10.1053/j.seminhematol.2006.07.004
Coiffier, B., Lepage, E., Briere, J., Herbrecht, R., Tilly, H., Bouabdallah, R., . . . Gisselbrecht, C. (2002). CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma. The New England journal of medicine, 346(4), 235-242. https://doi.org/10.1056/NEJMoa011795
Connors, J. M., Jurczak, W., Straus, D. J., Ansell, S. M., Kim, W. S., Gallamini, A., . . . Echelon- Study Group. (2018). Brentuximab Vedotin with Chemotherapy for Stage III or IV Hodgkin's Lymphoma. The New England journal of medicine, 378(4), 331-344. https://doi.org/10.1056/NEJMoa1708984
Crump, M., Kuruvilla, J., Couban, S., MacDonald, D. A., Kukreti, V., Kouroukis, C. T., . . . Shepherd, L. E. (2014). Randomized comparison of gemcitabine, dexamethasone, and cisplatin versus dexamethasone, cytarabine, and cisplatin chemotherapy before autologous stem-cell transplantation for relapsed and refractory aggressive lymphomas: NCIC-CTG LY.12. Journal of clinical oncology, 32(31), 3490-3496. https://doi.org/10.1200/JCO.2013.53.9593
Curt, G. A., Breitbart, W., Cella, D., Groopman, J. E., Horning, S. J., Itri, L. M., . . . Vogelzang, N. J. (2000). Impact of cancer-related fatigue on the lives of patients: new findings from the Fatigue Coalition. The oncologist, 5(5), 353-360. https://doi.org/10.1634/theoncologist.5-5-353
Czuczman, M. S., Grillo-Lopez, A. J., White, C. A., Saleh, M., Gordon, L., LoBuglio, A. F., . . . Varns, C. (1999). Treatment of patients with low-grade B-cell lymphoma with the combination of chimeric anti-CD20 monoclonal antibody and CHOP chemotherapy. Journal of clinical oncology, 17(1), 268-276. https://doi.org/10.1200/JCO.1999.17.1.268
d'Amore, F., Relander, T., Lauritzsen, G. F., Jantunen, E., Hagberg, H., Anderson, H., . . . Toldbod, H. E. (2012). Up-front autologous stem-cell transplantation in peripheral T-cell lymphoma: NLG-T-01. Journal of clinical oncology, 30(25), 3093-3099. https://doi.org/10.1200/JCO.2011.40.2719
Dabaja, B. S., Ng, A. K., Terezakis, S. A., Plastaras, J. P., Yunes, M., Wilson, L. D., . . . Yahalom, J. (2020a). Making Every Single Gray Count: Involved Site Radiation Therapy Delineation Guidelines for Hematological Malignancies. International journal of radiation oncology, biology, physics, 106(2), 279-281. https://doi.org/10.1016/j.ijrobp.2019.10.029
Dabaja, B. S., Ng, A. K., Terezakis, S. A., Plastaras, J. P., Yunes, M., Wilson, L. D., . . . Yahalom, J. (2020b). ILROG Lymphoma Mini-Atlas Part II, Hodgkin Lymphoma. International journal of radiation oncology, biology, physics, 108(4), 977-978. https://doi.org/10.1016/j.ijrobp.2020.05.063
Dahl, O., Lehne, G., & Christoffersen, T. (red.). (2016). Medikamentell kreftbehandling: cytostatikaboken (8. utg.). Oslo: Universitetet i Oslo, Avdeling for farmakologi.
Dean, R. M., Fowler, D. H., Wilson, W. H., Odom, J., Steinberg, S. M., Chow, C., . . . Bishop, M. R. (2005). Efficacy of reduced-intensity allogeneic stem cell transplantation in chemotherapy-refractory non-hodgkin lymphoma. Biology of blood and marrow transplantation, 11(8), 593-599. https://doi.org/10.1016/j.bbmt.2005.04.005
Dearden, C. (2006). The role of alemtuzumab in the management of T-cell malignancies. Seminars in oncology, 33(2 Suppl 5), S44-52. https://doi.org/10.1053/j.seminoncol.2006.01.029
Delabie, J., Holte, H., Vose, J. M., Ullrich, F., Jaffe, E. S., Savage, K. J., . . . Weisenburger, D. D. (2011). Enteropathy-associated T-cell lymphoma: clinical and histological findings from the international peripheral T-cell lymphoma project. Blood, 118(1), 148-155. https://doi.org/10.1182/blood-2011-02-335216
Demeestere, I., Brice, P., Peccatori, F. A., Kentos, A., Dupuis, J., Zachee, P., . . . Englert, Y. (2016). No Evidence for the Benefit of Gonadotropin-Releasing Hormone Agonist in Preserving Ovarian Function and Fertility in Lymphoma Survivors Treated With Chemotherapy: Final Long-Term Report of a Prospective Randomized Trial. Journal of clinical oncology, 34(22), 2568-2574. https://doi.org/10.1200/jco.2015.65.8864
Diamond, C., Taylor, T. H., Im, T., Miradi, M., & Anton-Culver, H. (2006). Improved survival and chemotherapy response among patients with AIDS-related non-Hodgkin's lymphoma receiving highly active antiretroviral therapy. Hematological oncology, 24(3), 139-145. https://doi.org/10.1002/hon.778
Dickinson, M., Carlo-Stella, C., Morschhauser, F., Bachy, E., Corradini, P., Iacoboni, G., . . . Hutchings, M. (2022). Glofitamab in patients with relapsed/refractory (R/R) diffuse large B-cell lymphoma (DLBCL) and ≥ 2 prior therapies: Pivotal phase II expansion results. Journal of clinical oncology, 40(16_suppl), 7500-7500. https://doi.org/10.1200/JCO.2022.40.16_suppl.7500
Diehl, V., Franklin, J., Pfreundschuh, M., Lathan, B., Paulus, U., Hasenclever, D., . . . German Hodgkin's Lymphoma Study Group. (2003). Standard and increased-dose BEACOPP chemotherapy compared with COPP-ABVD for advanced Hodgkin's disease. The New England journal of medicine, 348(24), 2386-2395. https://doi.org/10.1056/NEJMoa022473
Diehl, V., Sextro, M., Franklin, J., Hansmann, M. L., Harris, N., Jaffe, E., . . . Stein, H. (1999). Clinical presentation, course, and prognostic factors in lymphocyte-predominant Hodgkin's disease and lymphocyte-rich classical Hodgkin's disease: report from the European Task Force on Lymphoma Project on Lymphocyte-Predominant Hodgkin's Disease. Journal of clinical oncology, 17(3), 776-783. https://doi.org/10.1200/JCO.1999.17.3.776
Dimeo, F. C., Stieglitz, R. D., Novelli-Fischer, U., Fetscher, S., & Keul, J. (1999). Effects of physical activity on the fatigue and psychologic status of cancer patients during chemotherapy. Cancer, 85(10), 2273-2277.
Dreger, P., Brand, R., Milligan, D., Corradini, P., Finke, J., Lambertenghi Deliliers, G., . . . Chronic Leukemia Working Party of the Ebmt. (2005). Reduced-intensity conditioning lowers treatment-related mortality of allogeneic stem cell transplantation for chronic lymphocytic leukemia: a population-matched analysis. Leukemia, 19(6), 1029-1033. https://doi.org/10.1038/sj.leu.2403745
Dreyling, M., Jurczak, W., Jerkeman, M., Silva, R. S., Rusconi, C., Trneny, M., . . . Rule, S. (2016). Ibrutinib versus temsirolimus in patients with relapsed or refractory mantle-cell lymphoma: an international, randomised, open-label, phase 3 study. Lancet, 387(10020), 770-778. https://doi.org/10.1016/S0140-6736(15)00667-4
Dundee, J. W., Yang, J., & McMillan, C. (1991). Non-invasive stimulation of the P6 (Neiguan) antiemetic acupuncture point in cancer chemotherapy. Journal of the Royal Society of Medicine, 84(4), 210-212. https://doi.org/10.1177/014107689108400409
Duvic, M., Tetzlaff, M. T., Gangar, P., Clos, A. L., Sui, D., & Talpur, R. (2015). Results of a Phase II Trial of Brentuximab Vedotin for CD30+ Cutaneous T-Cell Lymphoma and Lymphomatoid Papulosis. Journal of clinical oncology, 33(32), 3759-3765. https://doi.org/10.1200/JCO.2014.60.3787
Eide, M. B., Lauritzsen, G. F., Kvalheim, G., Kolstad, A., Fagerli, U. M., Maisenhölder, M., . . . Holte, H. (2011). High dose chemotherapy with autologous stem cell support for patients with histologically transformed B-cell non-Hodgkin lymphomas. A Norwegian multi centre phase II study. British journal of haematology, 152(5), 600-610. https://doi.org/10.1111/j.1365-2141.2010.08519.x
Ekström-Smedby, K. (2006). Epidemiology and etiology of non-Hodgkin lymphoma--a review. Acta oncologica, 45(3), 258-271. https://doi.org/10.1080/02841860500531682
El-Galaly, T. C., Villa, D., Michaelsen, T. Y., Hutchings, M., Mikhaeel, N. G., Savage, K. J., . . . Cheah, C. Y. (2017). The number of extranodal sites assessed by PET/CT scan is a powerful predictor of CNS relapse for patients with diffuse large B-cell lymphoma: An international multicenter study of 1532 patients treated with chemoimmunotherapy. European journal of cancer, 75, 195-203. https://doi.org/10.1016/j.ejca.2016.12.029
Elis, A., Blickstein, D., Klein, O., Eliav-Ronen, R., Manor, Y., & Lishner, M. (2002). Detection of relapse in non-Hodgkin's lymphoma: role of routine follow-up studies. American journal of hematology, 69(1), 41-44. https://doi.org/10.1002/ajh.10017
Engert, A., Ballova, V., Haverkamp, H., Pfistner, B., Josting, A., Duhmke, E., . . . German Hodgkin's Study Group. (2005). Hodgkin's lymphoma in elderly patients: a comprehensive retrospective analysis from the German Hodgkin's Study Group. Journal of clinical oncology, 23(22), 5052-5060. https://doi.org/10.1200/JCO.2005.11.080
Engert, A., Franklin, J., Eich, H. T., Brillant, C., Sehlen, S., Cartoni, C., . . . Diehl, V. (2007). Two cycles of doxorubicin, bleomycin, vinblastine, and dacarbazine plus extended-field radiotherapy is superior to radiotherapy alone in early favorable Hodgkin's lymphoma: final results of the GHSG HD7 trial. Journal of clinical oncology, 25(23), 3495-3502. https://doi.org/10.1200/JCO.2006.07.0482
Engert, A., Plutschow, A., Eich, H. T., Lohri, A., Dorken, B., Borchmann, P., . . . Diehl, V. (2010). Reduced treatment intensity in patients with early-stage Hodgkin's lymphoma. The New England journal of medicine, 363(7), 640-652. https://doi.org/10.1056/NEJMoa1000067
Engert, A., Schiller, P., Josting, A., Herrmann, R., Koch, P., Sieber, M., . . . German Hodgkin's Lymphoma Study Group. (2003). Involved-field radiotherapy is equally effective and less toxic compared with extended-field radiotherapy after four cycles of chemotherapy in patients with early-stage unfavorable Hodgkin's lymphoma: results of the HD8 trial of the German Hodgkin's Lymphoma Study Group. Journal of clinical oncology, 21(19), 3601-3608. https://doi.org/10.1200/JCO.2003.03.023
Evens, A. M., Querfeld, C., & Rosen, S. T. (2006). T-cell non-Hogdkin's lymphoma. Cancer treatment and research, 131, 161-220.
Eyre, T. A., Djebbari, F., Kirkwood, A. A., & Collins, G. P. (2020). Efficacy of central nervous system prophylaxis with stand-alone intrathecal chemotherapy in diffuse large B-cell lymphoma patients treated with anthracycline-based chemotherapy in the rituximab era: a systematic review. Haematologica, 105(7), 1914-1924. https://doi.org/10.3324/haematol.2019.229948
Ezzat, H., Filipenko, D., Vickars, L., Galbraith, P., Li, C., Murphy, K., . . . Leitch, H. A. (2007). Improved survival in HIV-associated diffuse large B-cell lymphoma with the addition of rituximab to chemotherapy in patients receiving highly active antiretroviral therapy. HIV clinical trials, 8(3), 132-144. https://doi.org/10.1310/hct0803-132
Ezzo, J., Vickers, A., Richardson, M. A., Allen, C., Dibble, S. L., Issell, B., . . . Zhang, G. (2005). Acupuncture-point stimulation for chemotherapy-induced nausea and vomiting. Journal of clinical oncology, 23(28), 7188-7198. https://doi.org/10.1200/JCO.2005.06.028
Federico, M., Bellei, M., Marcheselli, L., Luminari, S., Lopez-Guillermo, A., Vitolo, U., . . . Solal-Celigny, P. (2009). Follicular lymphoma international prognostic index 2: a new prognostic index for follicular lymphoma developed by the international follicular lymphoma prognostic factor project. Journal of clinical oncology, 27(27), 4555-4562. https://doi.org/10.1200/JCO.2008.21.3991
Ferreri, A. J., Cwynarski, K., Pulczynski, E., Ponzoni, M., Deckert, M., Politi, L. S., . . . International Extranodal Lymphoma Study Group. (2016). Chemoimmunotherapy with methotrexate, cytarabine, thiotepa, and rituximab (MATRix regimen) in patients with primary CNS lymphoma: results of the first randomisation of the International Extranodal Lymphoma Study Group-32 (IELSG32) phase 2 trial. The Lancet. Haematology, 3(5), e217-227. https://doi.org/10.1016/S2352-3026(16)00036-3
Ferreri, A. J., Reni, M., Foppoli, M., Martelli, M., Pangalis, G. A., Frezzato, M., . . . International Extranodal Lymphoma Study Group. (2009). High-dose cytarabine plus high-dose methotrexate versus high-dose methotrexate alone in patients with primary CNS lymphoma: a randomised phase 2 trial. Lancet, 374(9700), 1512-1520. https://doi.org/10.1016/S0140-6736(09)61416-1
Ferreri, A. J. M., Cwynarski, K., Pulczynski, E., Fox, C. P., Schorb, E., Celico, C., . . . Illerhaus, G. (2022). Long-term efficacy, safety and neurotolerability of MATRix regimen followed by autologous transplant in primary CNS lymphoma: 7-year results of the IELSG32 randomized trial. Leukemia, 36(7), 1870-1878. https://doi.org/10.1038/s41375-022-01582-5
Ferreri, A. J. M., Cwynarski, K., Pulczynski, E., Fox, C. P., Schorb, E., La Rosee, P., . . . International Extranodal Lymphoma Study Group. (2017). Whole-brain radiotherapy or autologous stem-cell transplantation as consolidation strategies after high-dose methotrexate-based chemoimmunotherapy in patients with primary CNS lymphoma: results of the second randomisation of the International Extranodal Lymphoma Study Group-32 phase 2 trial. The Lancet. Haematology, 4(11), e510-e523. https://doi.org/10.1016/S2352-3026(17)30174-6
Fisher, R. I., Gaynor, E. R., Dahlberg, S., Oken, M. M., Grogan, T. M., Mize, E. M., . . . Miller, T. P. (1993). Comparison of a standard regimen (CHOP) with three intensive chemotherapy regimens for advanced non-Hodgkin's lymphoma. The New England journal of medicine, 328(14), 1002-1006. https://doi.org/10.1056/NEJM199304083281404
Fløisand, Y., Brinch, L., Gedde-Dahl, T., Tjønnfjord, G. E., Dybedal, I., Holte, H., . . . Kolstad, A. (2012). Ultra-short course sirolimus contributes to effective GVHD prophylaxis after reduced-intensity allogeneic hematopoietic cell transplantation. Bone marrow transplantation, 47(12), 1552-1557. https://doi.org/10.1038/bmt.2012.63
Foss Abrahamsen, A., Andersen, A., Nome, O., Jacobsen, A. B., Holte, H., Foss Abrahamsen, J., & Kvaløy, S. (2002). Long-term risk of second malignancy after treatment of Hodgkin's disease: the influence of treatment, age and follow-up time. Annals of oncology, 13(11), 1786-1791. https://doi.org/10.1093/annonc/mdf289
Fosså, A., Fiskvik, I. H., Kolstad, A., Lauritzsen, G. F., Aurlien, E., Blystad, A. K., . . . Holte, H. (2012). Two escalated followed by six standard BEACOPP in advanced-stage high-risk classical Hodgkin lymphoma: high cure rates but increased risk of aseptic osteonecrosis. Annals of oncology, 23(5), 1254-1259. https://doi.org/10.1093/annonc/mdr385
Fosså, A., Smeland, K., Fagerli, U. M., Galleberg, R. B., Bersvendsen, H. S., & Holte, H. (2020). Brentuximab vedotin in relapsed or refractory classical hodgkin lymphoma: real life experience in Norway 2011-2016. Acta oncologica, 59(1), 101-105. https://doi.org/10.1080/0284186X.2019.1652765
Gang, A. O., Strøm, C., Pedersen, M., d'Amore, F., Pedersen, L. M., Bukh, A., . . . Nully Brown, P. d. (2012). R-CHOEP-14 improves overall survival in young high-risk patients with diffuse large B-cell lymphoma compared with R-CHOP-14. A population-based investigation from the Danish Lymphoma Group. Annals of oncology, 23(1), 147-153. https://doi.org/10.1093/annonc/mdr058
Garnock-Jones, K. P. (2013). Brentuximab vedotin: a review of its use in patients with hodgkin lymphoma and systemic anaplastic large cell lymphoma following previous treatment failure. Drugs, 73(4), 371-381. https://doi.org/10.1007/s40265-013-0031-5
Gavrilovic, I. T., Hormigo, A., Yahalom, J., DeAngelis, L. M., & Abrey, L. E. (2006). Long-term follow-up of high-dose methotrexate-based therapy with and without whole brain irradiation for newly diagnosed primary CNS lymphoma. Journal of clinical oncology, 24(28), 4570-4574. https://doi.org/10.1200/JCO.2006.06.6910
Geisler, C. H., Kolstad, A., Laurell, A., Andersen, N. S., Pedersen, L. B., Jerkeman, M., . . . Nordic Lymphoma Group. (2008). Long-term progression-free survival of mantle cell lymphoma after intensive front-line immunochemotherapy with in vivo-purged stem cell rescue: a nonrandomized phase 2 multicenter study by the Nordic Lymphoma Group. Blood, 112(7), 2687-2693. https://doi.org/10.1182/blood-2008-03-147025
Girbl, T., Lunzer, V., Greil, R., Namberger, K., & Hartmann, T. N. (2014). The CXCR4 and adhesion molecule expression of CD34+ hematopoietic cells mobilized by "on-demand" addition of plerixafor to granulocyte-colony-stimulating factor. Transfusion, 54(9), 2325-2335. https://doi.org/10.1111/trf.12632
Gisselbrecht, C., Glass, B., Mounier, N., Gill, D. S., Linch, D. C., Trneny, M., . . . Schmitz, N. (2010). Salvage Regimens With Autologous Transplantation for Relapsed Large B-Cell Lymphoma in the Rituximab Era. Journal of clinical oncology, 28(27), 4184-4190. https://doi.org/10.1200/jco.2010.28.1618
Gjerstad, L., Skjeldal, O. H., & Helseth, H. (red.). (2003). Nevrologi og nevrokirurgi: fra barn til voksen: undersøkelse, diagnose, behandling (3. utg.). Nesbru: Vett & viten.
Glenny, A. M., Fernandez Mauleffinch, L. M., Pavitt, S., & Walsh, T. (2009). Interventions for the prevention and treatment of herpes simplex virus in patients being treated for cancer. The Cochrane database of systematic reviews, (1), CD006706. https://doi.org/10.1002/14651858.CD006706.pub2
Goldkuhl, C., Ekman, T., Wiklund, T., Telhaug, R., & Nordic Lymphoma Group. (2002). Age-adjusted chemotherapy for primary central-nervous system lymphoma--a pilot study. Acta oncologica, 41(1), 29-35. https://doi.org/10.1080/028418602317314037
Gopal, A. K., Kahl, B. S., de Vos, S., Wagner-Johnston, N. D., Schuster, S. J., Jurczak, W. J., . . . Salles, G. A. (2014). PI3Kdelta inhibition by idelalisib in patients with relapsed indolent lymphoma. The New England journal of medicine, 370(11), 1008-1018. https://doi.org/10.1056/NEJMoa1314583
Gospodarowicz, M. Personlig meddelelse.
Guadagnolo, B. A., Punglia, R. S., Kuntz, K. M., Mauch, P. M., & Ng, A. K. (2006). Cost-effectiveness analysis of computerized tomography in the routine follow-up of patients after primary treatment for Hodgkin's disease. Journal of clinical oncology, 24(25), 4116-4122. https://doi.org/10.1200/JCO.2006.07.0409
Han, J. J., Kim, T. M., Jeon, Y. K., Kim, M. K., Khwarg, S. I., Kim, C. W., . . . Heo, D. S. (2015). Long-term outcomes of first-line treatment with doxycycline in patients with previously untreated ocular adnexal marginal zone B cell lymphoma. Annals of hematology, 94(4), 575-581. https://doi.org/10.1007/s00277-014-2240-8
Hasenclever, D., & Diehl, V. (1998). A prognostic score for advanced Hodgkin's disease. International Prognostic Factors Project on Advanced Hodgkin's Disease. The New England journal of medicine, 339(21), 1506-1514. https://doi.org/10.1056/NEJM199811193392104
Helse- og omsorgsdepartementet. (2006). Nasjonal helseplan (2007-2010) (Særtrykk av St.prp. nr. 1 (2006–2007) kapittel 6). Oslo: Helse- og omsorgsdepartementet. Hentet fra http://www.regjeringen.no/upload/HOD/Sykehus/Nasjonal_helseplan_Sartrykk.pdf
Helsedirektoratet. (23. desember 2021). Maligne blodsykdommer - handlingsprogram: nasjonal faglig retningslinje. [nettdokument]. Oslo: Helsedirektoratet. Hentet 17. janaur 2023, fra https://www.helsedirektoratet.no/retningslinjer/maligne-blodsykdommer-handlingsprogram
Helsedirektoratet. (30. desember 2022). Lymfomer: pakkeforløp. [nettdokument]. Oslo: Helsedirektoratet. Hentet 17. januar 2023, fra https://www.helsedirektoratet.no/nasjonale-forlop/lymfomer
Hermine, O., Hoster, E., Walewski, J., Bosly, A., Stilgenbauer, S., Thieblemont, C., . . . European Mantle Cell Lymphoma Network. (2016). Addition of high-dose cytarabine to immunochemotherapy before autologous stem-cell transplantation in patients aged 65 years or younger with mantle cell lymphoma (MCL Younger): a randomised, open-label, phase 3 trial of the European Mantle Cell Lymphoma Network. Lancet, 388(10044), 565-575. https://doi.org/10.1016/S0140-6736(16)00739-X
Herrera, A. F., Mei, M., Low, L., Kim, H. T., Griffin, G. K., Song, J. Y., . . . Armand, P. (2017). Relapsed or Refractory Double-Expressor and Double-Hit Lymphomas Have Inferior Progression-Free Survival After Autologous Stem-Cell Transplantation. Journal of clinical oncology, 35(1), 24-31. https://doi.org/10.1200/JCO.2016.68.2740
Hertzberg, M., Grigg, A., Gottlieb, D., Szer, J., Roberts, A., Hoyt, R., . . . Bradstock, K. F. (2006). Reduced-intensity allogeneic haemopoietic stem cell transplantation induces durable responses in patients with chronic B-lymphoproliferative disorders. Bone marrow transplantation, 37(10), 923-928. https://doi.org/10.1038/sj.bmt.1705357
Hiddemann, W., Kneba, M., Dreyling, M., Schmitz, N., Lengfelder, E., Schmits, R., . . . Unterhalt, M. (2005). Frontline therapy with rituximab added to the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (CHOP) significantly improves the outcome for patients with advanced-stage follicular lymphoma compared with therapy with CHOP alone: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood, 106(12), 3725-3732. https://doi.org/10.1182/blood-2005-01-0016
Hill, Q. A., & Owen, R. G. (2006). CNS prophylaxis in lymphoma: who to target and what therapy to use. Blood reviews, 20(6), 319-332. https://doi.org/10.1016/j.blre.2006.02.001
Hoelzer, D., Walewski, J., Dohner, H., Viardot, A., Hiddemann, W., Spiekermann, K., . . . German Multicenter Study Group for Adult Acute Lymphoblastic Leukemia. (2014). Improved outcome of adult Burkitt lymphoma/leukemia with rituximab and chemotherapy: report of a large prospective multicenter trial. Blood, 124(26), 3870-3879. https://doi.org/10.1182/blood-2014-03-563627
Holland, J. C., & Reznik, I. (2005). Pathways for psychosocial care of cancer survivors. Cancer, 104(11 Suppl), 2624-2637. https://doi.org/10.1002/cncr.21252
Hollender, A., Kvaloy, S., Lote, K., Nome, O., & Holte, H. (2000). Prognostic factors in 140 adult patients with non-Hodgkin's lymphoma with systemic central nervous system (CNS) involvement. A single centre analysis. European journal of cancer, 36(14), 1762-1768. https://doi.org/10.1016/s0959-8049(00)00171-4
Holte, H., Leppä, S., Björkholm, M., Fluge, O., Jyrkkiö, S., Delabie, J., . . . Eriksson, M. (2013). Dose-densified chemoimmunotherapy followed by systemic central nervous system prophylaxis for younger high-risk diffuse large B-cell/follicular grade 3 lymphoma patients: results of a phase II Nordic Lymphoma Group study. Annals of oncology, 24(5), 1385-1392. https://doi.org/10.1093/annonc/mds621
Horwitz, S., O'Connor, O. A., Pro, B., Illidge, T., Fanale, M., Advani, R., . . . Trümper, L. (2019). Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma (ECHELON-2): a global, double-blind, randomised, phase 3 trial. Lancet, 393(10168), 229-240. https://doi.org/10.1016/s0140-6736(18)32984-2
Hoskin, P. J., Diez, P., Williams, M., Lucraft, H., Bayne, M., & Participants of the Lymphoma Radiotherapy, G. (2013). Recommendations for the use of radiotherapy in nodal lymphoma. Clinical oncology (Royal College of Radiologists (Great Britain)), 25(1), 49-58. https://doi.org/10.1016/j.clon.2012.07.011
Hoster, E., Dreyling, M., Klapper, W., Gisselbrecht, C., van Hoof, A., Kluin-Nelemans, H. C., . . . European Mantle Cell Lymphoma Network. (2008). A new prognostic index (MIPI) for patients with advanced-stage mantle cell lymphoma. Blood, 111(2), 558-565. https://doi.org/10.1182/blood-2007-06-095331
Hoster, E., Rosenwald, A., Berger, F., Bernd, H. W., Hartmann, S., Loddenkemper, C., . . . Klapper, W. (2016). Prognostic Value of Ki-67 Index, Cytology, and Growth Pattern in Mantle-Cell Lymphoma: Results From Randomized Trials of the European Mantle Cell Lymphoma Network. Journal of clinical oncology, 34(12), 1386-1394. https://doi.org/10.1200/JCO.2015.63.8387
Hutchings, M., Morschhauser, F., Iacoboni, G., Carlo-Stella, C., Offner, F. C., Sureda, A., . . . Dickinson, M. J. (2021). Glofitamab, a Novel, Bivalent CD20-Targeting T-Cell-Engaging Bispecific Antibody, Induces Durable Complete Remissions in Relapsed or Refractory B-Cell Lymphoma: A Phase I Trial. Journal of clinical oncology, 39(18), 1959-1970. https://doi.org/10.1200/jco.20.03175
Haas, R. L., Poortmans, P., de Jong, D., Aleman, B. M., Dewit, L. G., Verheij, M., . . . Bartelink, H. (2003). High response rates and lasting remissions after low-dose involved field radiotherapy in indolent lymphomas. Journal of clinical oncology, 21(13), 2474-2480. https://doi.org/10.1200/JCO.2003.09.542
Haas, R. L., Poortmans, P., de Jong, D., Verheij, M., van der Hulst, M., de Boer, J. P., & Bartelink, H. (2005). Effective palliation by low dose local radiotherapy for recurrent and/or chemotherapy refractory non-follicular lymphoma patients. European journal of cancer, 41(12), 1724-1730. https://doi.org/10.1016/j.ejca.2005.04.033
Illerhaus, G., Ferreri, A. J. M., Binder, M., Borchmann, P., Hasenkamp, J., Stilgenbauer, S., . . . Schorb, E. (2022). LBA-3 Effects on Survival of Non-Myeloablative Chemoimmunotherapy Compared to High-Dose Chemotherapy Followed By Autologous Stem Cell Transplantation (HDC-ASCT) As Consolidation Therapy in Patients with Primary CNS Lymphoma - Results of an International Randomized Phase III Trial (MATRix/IELSG43). Foredrag på 64th ASH Annual Meeting and Exposition, New Orleans, Louisiana 10.-13. desember 2022. Hentet fra https://ash.confex.com/ash/2022/webprogram/Paper171733.html
Jantunen, E., & Varmavuo, V. (2014). Plerixafor for mobilization of blood stem cells in autologous transplantation: an update. Expert opinion on biological therapy, 14(6), 851-861. https://doi.org/10.1517/14712598.2014.902927
Jerkeman, M., Anderson, H., Cavallin-Stahl, E., Dictor, M., Hagberg, H., Johnson, A., . . . Akerman, M. (1999). CHOP versus MACOP-B in aggressive lymphoma--a Nordic Lymphoma Group randomised trial. Annals of oncology, 10(9), 1079-1086. https://doi.org/10.1023/a:1008392528248
Jerkeman, M., Leppä, S., Kvaløy, S., & Holte, H. (2004). ICE (ifosfamide, carboplatin, etoposide) as second-line chemotherapy in relapsed or primary progressive aggressive lymphoma--the Nordic Lymphoma Group experience. European journal of haematology, 73(3), 179-182. https://doi.org/10.1111/j.1600-0609.2004.00294.x
Johnson, N. A., Savage, K. J., Ludkovski, O., Ben-Neriah, S., Woods, R., Steidl, C., . . . Horsman, D. E. (2009). Lymphomas with concurrent BCL2 and MYC translocations: the critical factors associated with survival. Blood, 114(11), 2273-2279. https://doi.org/10.1182/blood-2009-03-212191
Johnson, P., Federico, M., Kirkwood, A., Fosså, A., Berkahn, L., Carella, A., . . . Barrington, S. (2016). Adapted Treatment Guided by Interim PET-CT Scan in Advanced Hodgkin's Lymphoma. The New England journal of medicine, 374(25), 2419-2429. https://doi.org/10.1056/NEJMoa1510093
Jones, G. W., Kacinski, B. M., Wilson, L. D., Willemze, R., Spittle, M., Hohenberg, G., . . . Knobler, R. (2002). Total skin electron radiation in the management of mycosis fungoides: Consensus of the European Organization for Research and Treatment of Cancer (EORTC) Cutaneous Lymphoma Project Group. Journal of the American Academy of Dermatology, 47(3), 364-370. https://doi.org/10.1067/mjd.2002.123482
Juweid, M. E., & Cheson, B. D. (2005). Role of positron emission tomography in lymphoma. Journal of clinical oncology, 23(21), 4577-4580. https://doi.org/10.1200/JCO.2005.01.904
Juweid, M. E., & Cheson, B. D. (2006). Positron-emission tomography and assessment of cancer therapy. The New England journal of medicine, 354(5), 496-507. https://doi.org/10.1056/NEJMra050276
Kahl, B. S., Hong, F., Williams, M. E., Gascoyne, R. D., Wagner, L. I., Krauss, J. C., . . . Horning, S. J. (2014). Rituximab extended schedule or re-treatment trial for low-tumor burden follicular lymphoma: eastern cooperative oncology group protocol e4402. Journal of clinical oncology, 32(28), 3096-3102. https://doi.org/10.1200/JCO.2014.56.5853
Kamstrup, M. R., Gniadecki, R., Iversen, L., Skov, L., Petersen, P. M., Loft, A., & Specht, L. (2015). Low-dose (10-Gy) total skin electron beam therapy for cutaneous T-cell lymphoma: an open clinical study and pooled data analysis. International journal of radiation oncology, biology, physics, 92(1), 138-143. https://doi.org/10.1016/j.ijrobp.2015.01.047
Kansara, R., Villa, D., Gerrie, A. S., Klasa, R., Shenkier, T., Scott, D. W., . . . Savage, K. J. (2017). Site of central nervous system (CNS) relapse in patients with diffuse large B-cell lymphoma (DLBCL) by the CNS-IPI risk model. British journal of haematology, 179(3), 508-510. https://doi.org/10.1111/bjh.14229
Kaplan, L. D., Lee, J. Y., Ambinder, R. F., Sparano, J. A., Cesarman, E., Chadburn, A., . . . Scadden, D. T. (2005). Rituximab does not improve clinical outcome in a randomized phase 3 trial of CHOP with or without rituximab in patients with HIV-associated non-Hodgkin lymphoma: AIDS-Malignancies Consortium Trial 010. Blood, 106(5), 1538-1543. https://doi.org/10.1182/blood-2005-04-1437
Kasenda, B., Loeffler, J., Illerhaus, G., Ferreri, A. J. M., Rubenstein, J., & Batchelor, T. T. (2016). The role of whole brain radiation in primary CNS lymphoma. Blood, 128(1), 32-36. https://doi.org/10.1182/blood-2016-01-650101
Kasenda, B., Schorb, E., Fritsch, K., Finke, J., & Illerhaus, G. (2012). Prognosis after high-dose chemotherapy followed by autologous stem-cell transplantation as first-line treatment in primary CNS lymphoma--a long-term follow-up study. Annals of oncology, 23(10), 2670-2675. https://doi.org/10.1093/annonc/mds059
Khouri, I. F., Lee, M. S., Saliba, R. M., Jun, G., Fayad, L., Younes, A., . . . Champlin, R. E. (2003). Nonablative allogeneic stem-cell transplantation for advanced/recurrent mantle-cell lymphoma. Journal of clinical oncology, 21(23), 4407-4412. https://doi.org/10.1200/JCO.2003.05.501
Kim, Y. H., Tavallaee, M., Sundram, U., Salva, K. A., Wood, G. S., Li, S., . . . Horwitz, S. M. (2015). Phase II Investigator-Initiated Study of Brentuximab Vedotin in Mycosis Fungoides and Sezary Syndrome With Variable CD30 Expression Level: A Multi-Institution Collaborative Project. Journal of clinical oncology, 33(32), 3750-3758. https://doi.org/10.1200/JCO.2014.60.3969
Kimby, E., Ostenstad, B., Brown, P., Hagberg, H., Erlanson, M., Holte, H., . . . Nordic Lymphoma Group. (2015). Two courses of four weekly infusions of rituximab with or without interferon-alpha2a: final results from a randomized phase III study in symptomatic indolent B-cell lymphomas. Leukemia & lymphoma, 56(9), 2598-2607. https://doi.org/10.3109/10428194.2015.1014363
Kluin-Nelemans, H. C., Hoster, E., Hermine, O., Walewski, J., Trneny, M., Geisler, C. H., . . . Dreyling, M. H. (2012). Treatment of older patients with mantle-cell lymphoma. The New England journal of medicine, 367(6), 520-531. https://doi.org/10.1056/NEJMoa1200920
Knols, R., Aaronson, N. K., Uebelhart, D., Fransen, J., & Aufdemkampe, G. (2005). Physical exercise in cancer patients during and after medical treatment: a systematic review of randomized and controlled clinical trials. Journal of clinical oncology, 23(16), 3830-3842. https://doi.org/10.1200/JCO.2005.02.148
Koch, P., Grothaus-Pinke, B., Hiddemann, W., Willich, N., Reers, B., del Valle, F., . . . Tiemann, M. (1997). Primary lymphoma of the stomach: three-year results of a prospective multicenter study. The German Multicenter Study Group on GI-NHL. Annals of oncology, 8(Suppl 1), 85-88.
Kolstad, A., Holte, H., Fosså, A., Lauritzsen, G. F., Gaustad, P., & Torfoss, D. (2007a). Pneumocystis jirovecii pneumonia in B-cell lymphoma patients treated with the rituximab-CHOEP-14 regimen. Haematologica, 92(1), 139-140. https://doi.org/10.3324/haematol.10564
Kolstad, A., Laurell, A., Jerkeman, M., Gronbaek, K., Elonen, E., Raty, R., . . . Nordic Lymphoma Group. (2014). Nordic MCL3 study: 90Y-ibritumomab-tiuxetan added to BEAM/C in non-CR patients before transplant in mantle cell lymphoma. Blood, 123(19), 2953-2959. https://doi.org/10.1182/blood-2013-12-541953
Kolstad, A., Nome, O., Delabie, J., Lauritzsen, G. F., Fossa, A., & Holte, H. (2007b). Standard CHOP-21 as first line therapy for elderly patients with Hodgkin's lymphoma. Leukemia & lymphoma, 48(3), 570-576. https://doi.org/10.1080/10428190601126610
Korfel, A., Thiel, E., Martus, P., Mohle, R., Griesinger, F., Rauch, M., . . . Weller, M. (2015). Randomized phase III study of whole-brain radiotherapy for primary CNS lymphoma. Neurology, 84(12), 1242-1248. https://doi.org/10.1212/WNL.0000000000001395
Kristinsson, S. Y., Goldin, L. R., Björkholm, M., Koshiol, J., Turesson, I., & Landgren, O. (2009). Genetic and immune-related factors in the pathogenesis of lymphoproliferative and plasma cell malignancies. Haematologica, 94(11), 1581-1589. https://doi.org/10.3324/haematol.2009.008979
Kusumi, E., Kami, M., Kanda, Y., Murashige, N., Kishi, Y., Suzuki, R., . . . Takaue, Y. (2005). Reduced-intensity hematopoietic stem-cell transplantation for malignant lymphoma: a retrospective survey of 112 adult patients in Japan. Bone marrow transplantation, 36(3), 205-213. https://doi.org/10.1038/sj.bmt.1705027
Kwong, Y. L., Kim, W. S., Lim, S. T., Kim, S. J., Tang, T., Tse, E., . . . Chim, C. S. (2012). SMILE for natural killer/T-cell lymphoma: analysis of safety and efficacy from the Asia Lymphoma Study Group. Blood, 120(15), 2973-2980. https://doi.org/10.1182/blood-2012-05-431460
Lagerlöf, I., Holte, H., Glimelius, I., Björkholm, M., Enblad, G., Erlanson, M., . . . Molin, D. (2020). No excess long-term mortality in stage I-IIA Hodgkin lymphoma patients treated with ABVD and limited field radiotherapy. British journal of haematology, 188(5), 685-691. https://doi.org/10.1111/bjh.16232
Lambertini, M., Peccatori, F. A., Demeestere, I., Amant, F., Wyns, C., Stukenborg, J. B., . . . Jordan, K. (2020). Fertility preservation and post-treatment pregnancies in post-pubertal cancer patients: ESMO Clinical Practice Guidelines(†). Annals of oncology, 31(12), 1664-1678. https://doi.org/10.1016/j.annonc.2020.09.006
Larsen, I. K. (red.). (2022). Cancer in Norway 2021: cancer incidence, mortality, survival and prevalence in Norway. Oslo: Cancer Registry of Norway. Hentet fra https://www.kreftregisteret.no/globalassets/cancer-in-norway/2021/cin_report.pdf
Le Gouill, S., Thieblemont, C., Oberic, L., Moreau, A., Bouabdallah, K., Dartigeas, C., . . . Lysa Group. (2017). Rituximab after Autologous Stem-Cell Transplantation in Mantle-Cell Lymphoma. The New England journal of medicine, 377(13), 1250-1260. https://doi.org/10.1056/NEJMoa1701769
Lekovich, J., Lobel, A. L. S., Stewart, J. D., Pereira, N., Kligman, I., & Rosenwaks, Z. (2016). Female patients with lymphoma demonstrate diminished ovarian reserve even before initiation of chemotherapy when compared with healthy controls and patients with other malignancies. Journal of assisted reproduction and genetics, 33(5), 657-662. https://doi.org/10.1007/s10815-016-0689-1
Lenz, G., Dreyling, M., Hoster, E., Wormann, B., Duhrsen, U., Metzner, B., . . . Hiddemann, W. (2005). Immunochemotherapy with rituximab and cyclophosphamide, doxorubicin, vincristine, and prednisone significantly improves response and time to treatment failure, but not long-term outcome in patients with previously untreated mantle cell lymphoma: results of a prospective randomized trial of the German Low Grade Lymphoma Study Group (GLSG). Journal of clinical oncology, 23(9), 1984-1992. https://doi.org/10.1200/JCO.2005.08.133
Leonard, J. P., Trneny, M., Izutsu, K., Fowler, N. H., Hong, X., Zhu, J., . . . Gribben, J. G. (2019). AUGMENT: A Phase III Study of Lenalidomide Plus Rituximab Versus Placebo Plus Rituximab in Relapsed or Refractory Indolent Lymphoma. Journal of clinical oncology, 37(14), 1188-1199. https://doi.org/10.1200/jco.19.00010
Leppa, S., Jørgensen, J. M., Karjalainen-Lindsberg, M.-L., Beiske, K., Pedersen, M., Drott, K., . . . Holte, H. (2022). Biomarker-Driven Treatment Strategy in High-Risk Large B-Cell Lymphoma: Final Results of a Nordic Phase 2 Study. Blood, 140(Suppl 1), 1768-1769. https://doi.org/10.1182/blood-2022-158183
Leppä, S., Jørgensen, J., Tierens, A., Meriranta, L., Østlie, I., de Nully Brown, P., . . . Holte, H. (2020). Patients with high-risk DLBCL benefit from dose-dense immunochemotherapy combined with early systemic CNS prophylaxis. Blood advances, 4(9), 1906-1915. https://doi.org/10.1182/bloodadvances.2020001518
Levernes, S., & Johannessen, D. C. (2003). Volum og doser ved strålebehandling: definisjoner, retningslinjer for bruk, dokumentasjon og rapportering (StrålevernRapport 2003:12). Østerås: Statens strålevern. Hentet fra https://dsa.no/publikasjoner/stralevernrapport-12-2003-volum-og-doser-ved-stralebehandling/straalevernrapport-2003-12-volum-og-doser-ved-straalebehandling-definisjoner-retningslinjer-dokumentasjon-rapportering.pdf
Lin, T. L., Kuo, M. C., Shih, L. Y., Dunn, P., Wang, P. N., Wu, J. H., . . . Lu, S. C. (2012). Value of surveillance computed tomography in the follow-up of diffuse large B-cell and follicular lymphomas. Annals of hematology, 91(11), 1741-1745. https://doi.org/10.1007/s00277-012-1508-0
Linch, D. C., Winfield, D., Goldstone, A. H., Moir, D., Hancock, B., McMillan, A., . . . Hudson, G. V. (1993). Dose intensification with autologous bone-marrow transplantation in relapsed and resistant Hodgkin's disease: results of a BNLI randomised trial. Lancet, 341(8852), 1051-1054. https://doi.org/10.1016/0140-6736(93)92411-l
Lister, T. A., Crowther, D., Sutcliffe, S. B., Glatstein, E., Canellos, G. P., Young, R. C., . . . Tubiana, M. (1989). Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin's disease: Cotswolds meeting. Journal of clinical oncology, 7(11), 1630-1636. https://doi.org/10.1200/JCO.1989.7.11.1630
Liu, H., Ye, H., Ruskone-Fourmestraux, A., De Jong, D., Pileri, S., Thiede, C., . . . Du, M. Q. (2002). T(11;18) is a marker for all stage gastric MALT lymphomas that will not respond to H. pylori eradication. Gastroenterology, 122(5), 1286-1294. https://doi.org/10.1053/gast.2002.33047
Ljungman, P., Cordonnier, C., Einsele, H., Englund, J., Machado, C. M., Storek, J., & Small, T. (2009). Vaccination of hematopoietic cell transplant recipients. Bone marrow transplantation, 44(8), 521-526. https://doi.org/10.1038/bmt.2009.263
Lofthus, A. S., & Allen, S. M. (2006). Kan transkutan elektrisk nervestimulering lindre nevropatisk smerte? Fysioterapeuten, 73(4), 16-25.
Loge, J. H., Abrahamsen, A. F., Ekeberg, O., & Kaasa, S. (1999). Hodgkin's disease survivors more fatigued than the general population. Journal of clinical oncology, 17(1), 253-261. https://doi.org/10.1200/JCO.1999.17.1.253
Lok, A. S. F., & Bonis, P. A. L. (18. desember 2017). Hepatitis B virus reactivation associated with immunosuppressive therapy. [database]. Waltham, MA: UpToDate, Inc. Hentet 10. desember 2018
Lote, K., Holte, H., Nome, O., Langholm, R., & Kvaløy, S. (2000). Stage I high-grade non-Hodgkin's lymphoma. Acta oncologica, 39(7), 865-872. https://doi.org/10.1080/028418600750063631
Lowry, L., Smith, P., Qian, W., Falk, S., Benstead, K., Illidge, T., . . . Hoskin, P. (2011). Reduced dose radiotherapy for local control in non-Hodgkin lymphoma: a randomised phase III trial. Radiotherapy and oncology, 100(1), 86-92. https://doi.org/10.1016/j.radonc.2011.05.013
Marcus, R., Davies, A., Ando, K., Klapper, W., Opat, S., Owen, C., . . . Hiddemann, W. (2017). Obinutuzumab for the First-Line Treatment of Follicular Lymphoma. The New England journal of medicine, 377(14), 1331-1344. https://doi.org/10.1056/NEJMoa1614598
Maris, M. B., Sandmaier, B. M., Storer, B. E., Chauncey, T., Stuart, M. J., Maziarz, R. T., . . . Maloney, D. G. (2004). Allogeneic hematopoietic cell transplantation after fludarabine and 2 Gy total body irradiation for relapsed and refractory mantle cell lymphoma. Blood, 104(12), 3535-3542. https://doi.org/10.1182/blood-2004-06-2275
Martelli, M., Ferreri, A. J., & Johnson, P. (2008). Primary mediastinal large B-cell lymphoma. Critical reviews in oncology/hematology, 68(3), 256-263. https://doi.org/10.1016/j.critrevonc.2008.07.020
Martinelli, G., Schmitz, S. F., Utiger, U., Cerny, T., Hess, U., Bassi, S., . . . Ghielmini, M. (2010). Long-term follow-up of patients with follicular lymphoma receiving single-agent rituximab at two different schedules in trial SAKK 35/98. Journal of clinical oncology, 28(29), 4480-4484. https://doi.org/10.1200/JCO.2010.28.4786
Mauch, P. (2001). Follicular non-Hodgkin's lymphoma: the role of radiation therapy. Annals of hematology, 80(Suppl 3), B63-65. https://doi.org/10.1007/pl00022793
Mauz-Körholz, C., Landman-Parker, J., Balwierz, W., Ammann, R. A., Anderson, R. A., Attarbaschi, A., . . . Wallace, W. H. (2022). Response-adapted omission of radiotherapy and comparison of consolidation chemotherapy in children and adolescents with intermediate-stage and advanced-stage classical Hodgkin lymphoma (EuroNet-PHL-C1): a titration study with an open-label, embedded, multinational, non-inferiority, randomised controlled trial. The Lancet. Oncology, 23(1), 125-137. https://doi.org/10.1016/s1470-2045(21)00470-8
Mehra, T., Ikenberg, K., Moos, R. M., Benz, R., Nair, G., Schanz, U., . . . Cozzio, A. (2015). Brentuximab as a treatment for CD30+ mycosis fungoides and Sezary syndrome. JAMA dermatology, 151(1), 73-77. https://doi.org/10.1001/jamadermatol.2014.1629
Meissner, J., Tichy, D., Dietrich, S., Schmitt, T., Ziepert, M., Kuhnt, E., . . . Ho, A. D. (2014). Parenthood in long-term survivors after CHOP with or without etoposide treatment for aggressive lymphoma. British journal of haematology, 166(4), 612-615. https://doi.org/10.1111/bjh.12877
Meissner, J., Tichy, D., Katzke, V., Kühn, T., Dietrich, S., Schmitt, T., . . . Ho, A. D. (2015). Long-term ovarian function in women treated with CHOP or CHOP plus etoposide for aggressive lymphoma. Annals of oncology, 26(8), 1771-1776. https://doi.org/10.1093/annonc/mdv227
Melchers, R. C., Willemze, R., Daniëls, L. A., Neelis, K. J., Bekkenk, M. W., de Haas, E. R. M., . . . Quint, K. D. (2017). Recommendations for the Optimal Radiation Dose in Patients With Primary Cutaneous Anaplastic Large Cell Lymphoma: A Report of the Dutch Cutaneous Lymphoma Group. International journal of radiation oncology, biology, physics, 99(5), 1279-1285. https://doi.org/10.1016/j.ijrobp.2017.08.010
Melsack, R., & Wall, P. D. E. (red.). (1999). Textbook of pain (4. utg.). Edinburgh: Churchill Livingstone.
Mirza, M. R., & Brincker, H. (1991). MIME combination chemotherapy in recurrent or refractory lymphoproliferative malignancies. A phase II study. Acta oncologica, 30(1), 17-21. https://doi.org/10.3109/02841869109091807
Morris, E., Thomson, K., Craddock, C., Mahendra, P., Milligan, D., Cook, G., . . . Mackinnon, S. (2004). Outcomes after alemtuzumab-containing reduced-intensity allogeneic transplantation regimen for relapsed and refractory non-Hodgkin lymphoma. Blood, 104(13), 3865-3871. https://doi.org/10.1182/blood-2004-03-1105
Morris, P. G., Correa, D. D., Yahalom, J., Raizer, J. J., Schiff, D., Grant, B., . . . Omuro, A. (2013). Rituximab, methotrexate, procarbazine, and vincristine followed by consolidation reduced-dose whole-brain radiotherapy and cytarabine in newly diagnosed primary CNS lymphoma: final results and long-term outcome. Journal of clinical oncology, 31(31), 3971-3979. https://doi.org/10.1200/JCO.2013.50.4910
Morschhauser, F., Fowler, N. H., Feugier, P., Bouabdallah, R., Tilly, H., Palomba, M. L., . . . Salles, G. A. (2018). Rituximab plus Lenalidomide in Advanced Untreated Follicular Lymphoma. The New England journal of medicine, 379(10), 934-947. https://doi.org/10.1056/NEJMoa1805104
Moskowitz, A. J., Lunning, M. A., & Horwitz, S. M. (2014). How I treat the peripheral T-cell lymphomas. Blood, 123(17), 2636-2644. https://doi.org/10.1182/blood-2013-12-516245
Moskowitz, C. H., Bertino, J. R., Glassman, J. R., Hedrick, E. E., Hunte, S., Coady-Lyons, N., . . . Zelenetz, A. D. (1999). Ifosfamide, carboplatin, and etoposide: a highly effective cytoreduction and peripheral-blood progenitor-cell mobilization regimen for transplant-eligible patients with non-Hodgkin's lymphoma. Journal of clinical oncology, 17(12), 3776-3785. https://doi.org/10.1200/JCO.1999.17.12.3776
Moskowitz, C. H., Nademanee, A., Masszi, T., Agura, E., Holowiecki, J., Abidi, M. H., . . . Aethera Study Group. (2015). Brentuximab vedotin as consolidation therapy after autologous stem-cell transplantation in patients with Hodgkin's lymphoma at risk of relapse or progression (AETHERA): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet, 385(9980), 1853-1862. https://doi.org/10.1016/S0140-6736(15)60165-9
Mounier, N., Spina, M., Gabarre, J., Raphael, M., Rizzardini, G., Golfier, J. B., . . . Gisselbrecht, C. (2006). AIDS-related non-Hodgkin lymphoma: final analysis of 485 patients treated with risk-adapted intensive chemotherapy. Blood, 107(10), 3832-3840. https://doi.org/10.1182/blood-2005-09-3600
Nakamura, S., Ye, H., Bacon, C. M., Goatly, A., Liu, H., Banham, A. H., . . . Du, M. Q. (2007). Clinical impact of genetic aberrations in gastric MALT lymphoma: a comprehensive analysis using interphase fluorescence in situ hybridisation. Gut, 56(10), 1358-1363. https://doi.org/10.1136/gut.2007.123729
Neelapu, S. S., Locke, F. L., Bartlett, N. L., Lekakis, L. J., Miklos, D. B., Jacobson, C. A., . . . Go, W. Y. (2017). Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. The New England journal of medicine, 377(26), 2531-2544. https://doi.org/10.1056/NEJMoa1707447
Ohkubo, Y., Saito, Y., Ushijima, H., Onishi, M., Kazumoto, T., Saitoh, J. I., . . . Kurosumi, M. (2017). Radiotherapy for localized gastric mucosa-associated lymphoid tissue lymphoma: long-term outcomes over 10 years. Journal of radiation research, 58(4), 537-542. https://doi.org/10.1093/jrr/rrw044
Oktay, K., Harvey, B. E., Partridge, A. H., Quinn, G. P., Reinecke, J., Taylor, H. S., . . . Loren, A. W. (2018). Fertility Preservation in Patients With Cancer: ASCO Clinical Practice Guideline Update. Journal of clinical oncology, 36(19), 1994-2001. https://doi.org/10.1200/jco.2018.78.1914
Omuro, A., Correa, D. D., DeAngelis, L. M., Moskowitz, C. H., Matasar, M. J., Kaley, T. J., . . . Sauter, C. S. (2015). R-MPV followed by high-dose chemotherapy with TBC and autologous stem-cell transplant for newly diagnosed primary CNS lymphoma. Blood, 125(9), 1403-1410. https://doi.org/10.1182/blood-2014-10-604561
Omuro, A. M. P., DeAngelis, L. M., Karrison, T., Bovi, J. A., Rosenblum, M., Corn, B. W., . . . NRG. (2020). Randomized phase II study of rituximab, methotrexate (MTX), procarbazine, vincristine, and cytarabine (R-MPV-A) with and without low-dose whole-brain radiotherapy (LD-WBRT) for newly diagnosed primary CNS lymphoma (PCNSL). Journal of clinical oncology, 38(15_suppl), 2501-2501. https://doi.org/10.1200/JCO.2020.38.15_suppl.2501
Oslo universitetssykehus HF. (15. september 2022). Nasjonal behandlingstjeneste for fertilitetsbevarende behandling med eggstokkvev. [nettdokument]. Oslo: Oslo universitetssykehus HF. Hentet 17. januar 2023, fra https://oslo-universitetssykehus.no/fag-og-forskning/nasjonale-og-regionale-tjenester/nasjonal-behandlingstjeneste-for-fertilitetsbevarende-behandling-med-autologt-ovarialvev
Ozsahin, M., Tsang, R. W., Poortmans, P., Belkacémi, Y., Bolla, M., Dincbas, F. O., . . . Zouhair, A. (2006). Outcomes and patterns of failure in solitary plasmacytoma: a multicenter Rare Cancer Network study of 258 patients. International journal of radiation oncology, biology, physics, 64(1), 210-217. https://doi.org/10.1016/j.ijrobp.2005.06.039
Peyrade, F., Jardin, F., Thieblemont, C., Thyss, A., Emile, J. F., Castaigne, S., . . . Groupe d'Etude des Lymphomes de l'Adulte investigators. (2011). Attenuated immunochemotherapy regimen (R-miniCHOP) in elderly patients older than 80 years with diffuse large B-cell lymphoma: a multicentre, single-arm, phase 2 trial. The Lancet. Oncology, 12(5), 460-468. https://doi.org/10.1016/S1470-2045(11)70069-9
Pfreundschuh, M. (2005). Mature T-cell and NK/T-cell neoplasms. Clinical advances in hematology & oncology : H&O, 3(11), suppl 8-9.
Pfreundschuh, M., Schubert, J., Ziepert, M., Schmits, R., Mohren, M., Lengfelder, E., . . . German High-Grade Non-Hodgkin Lymphoma Study Group. (2008). Six versus eight cycles of bi-weekly CHOP-14 with or without rituximab in elderly patients with aggressive CD20+ B-cell lymphomas: a randomised controlled trial (RICOVER-60). The Lancet. Oncology, 9(2), 105-116. https://doi.org/10.1016/S1470-2045(08)70002-0
Pfreundschuh, M., Trumper, L., Kloess, M., Schmits, R., Feller, A. C., Rube, C., . . . German High-Grade Non-Hodgkin's Lymphoma Study Group. (2004a). Two-weekly or 3-weekly CHOP chemotherapy with or without etoposide for the treatment of elderly patients with aggressive lymphomas: results of the NHL-B2 trial of the DSHNHL. Blood, 104(3), 634-641. https://doi.org/10.1182/blood-2003-06-2095
Pfreundschuh, M., Trumper, L., Kloess, M., Schmits, R., Feller, A. C., Rudolph, C., . . . German High-Grade Non-Hodgkin's Lymphoma Study Group. (2004b). Two-weekly or 3-weekly CHOP chemotherapy with or without etoposide for the treatment of young patients with good-prognosis (normal LDH) aggressive lymphomas: results of the NHL-B1 trial of the DSHNHL. Blood, 104(3), 626-633. https://doi.org/10.1182/blood-2003-06-2094
Pfreundschuh, M., Trümper, L., Osterborg, A., Pettengell, R., Trneny, M., Imrie, K., . . . MabThera International Trial Group. (2006). CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group. The Lancet. Oncology, 7(5), 379-391. https://doi.org/10.1016/S1470-2045(06)70664-7
Philip, T., Guglielmi, C., Hagenbeek, A., Somers, R., Van der Lelie, H., Bron, D., . . . Chauvin, F. (1995). Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkin's lymphoma. The New England journal of medicine, 333(23), 1540-1545. https://doi.org/10.1056/NEJM199512073332305
Poeschel, V., Held, G., Ziepert, M., Witzens-Harig, M., Holte, H., Thurner, L., . . . German Lymphoma Alliance. (2020). Four versus six cycles of CHOP chemotherapy in combination with six applications of rituximab in patients with aggressive B-cell lymphoma with favourable prognosis (FLYER): a randomised, phase 3, non-inferiority trial. Lancet, 394(10216), 2271-2281. https://doi.org/10.1016/S0140-6736(19)33008-9
Prince, H. M., Kim, Y. H., Horwitz, S. M., Dummer, R., Scarisbrick, J., Quaglino, P., . . . Alcanza study group. (2017). Brentuximab vedotin or physician's choice in CD30-positive cutaneous T-cell lymphoma (ALCANZA): an international, open-label, randomised, phase 3, multicentre trial. Lancet, 390(10094), 555-566. https://doi.org/10.1016/S0140-6736(17)31266-7
Pro, B., Advani, R., Brice, P., Bartlett, N. L., Rosenblatt, J. D., Illidge, T., . . . Shustov, A. (2012). Brentuximab vedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large-cell lymphoma: results of a phase II study. Journal of clinical oncology, 30(18), 2190-2196. https://doi.org/10.1200/JCO.2011.38.0402
Pulczynski, E. J., Kuittinen, O., Erlanson, M., Hagberg, H., Fosså, A., Eriksson, M., . . . Fagerli, U. M. (2015). Successful change of treatment strategy in elderly patients with primary central nervous system lymphoma by de-escalating induction and introducing temozolomide maintenance: results from a phase II study by the Nordic Lymphoma Group. Haematologica, 100(4), 534-540. https://doi.org/10.3324/haematol.2014.108472
Quasthoff, S., & Hartung, H. P. (2002). Chemotherapy-induced peripheral neuropathy. Journal of neurology, 249(1), 9-17. https://doi.org/10.1007/pl00007853
Rummel, M. J., Niederle, N., Maschmeyer, G., Banat, G. A., von Grunhagen, U., Losem, C., . . . Study group indolent Lymphomas. (2013). Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet, 381(9873), 1203-1210. https://doi.org/10.1016/S0140-6736(12)61763-2
Salles, G., Duell, J., González Barca, E., Tournilhac, O., Jurczak, W., Liberati, A. M., . . . Maddocks, K. (2020). Tafasitamab plus lenalidomide in relapsed or refractory diffuse large B-cell lymphoma (L-MIND): a multicentre, prospective, single-arm, phase 2 study. The Lancet. Oncology, 21(7), 978-988. https://doi.org/10.1016/S1470-2045(20)30225-4
Salles, G., Seymour, J. F., Offner, F., Lopez-Guillermo, A., Belada, D., Xerri, L., . . . Tilly, H. (2011). Rituximab maintenance for 2 years in patients with high tumour burden follicular lymphoma responding to rituximab plus chemotherapy (PRIMA): a phase 3, randomised controlled trial. Lancet, 377(9759), 42-51. https://doi.org/10.1016/S0140-6736(10)62175-7
Sankila, R., Garwicz, S., Olsen, J. H., Dollner, H., Hertz, H., Kreuger, A., . . . Tulinius, H. (1996). Risk of subsequent malignant neoplasms among 1,641 Hodgkin's disease patients diagnosed in childhood and adolescence: a population-based cohort study in the five Nordic countries. Association of the Nordic Cancer Registries and the Nordic Society of Pediatric Hematology and Oncology. Journal of clinical oncology, 14(5), 1442-1446. https://doi.org/10.1200/JCO.1996.14.5.1442
Santoro, A., Magagnoli, M., Spina, M., Pinotti, G., Siracusano, L., Michieli, M., . . . Balzarotti, M. (2007). Ifosfamide, gemcitabine, and vinorelbine: a new induction regimen for refractory and relapsed Hodgkin's lymphoma. Haematologica, 92(1), 35-41. https://doi.org/10.3324/haematol.10661
Savage, K. J., Johnson, N. A., Ben-Neriah, S., Connors, J. M., Sehn, L. H., Farinha, P., . . . Gascoyne, R. D. (2009). MYC gene rearrangements are associated with a poor prognosis in diffuse large B-cell lymphoma patients treated with R-CHOP chemotherapy. Blood, 114(17), 3533-3537. https://doi.org/10.1182/blood-2009-05-220095
Savage, K. J., Skinnider, B., Al-Mansour, M., Sehn, L. H., Gascoyne, R. D., & Connors, J. M. (2011). Treating limited-stage nodular lymphocyte predominant Hodgkin lymphoma similarly to classical Hodgkin lymphoma with ABVD may improve outcome. Blood, 118(17), 4585-4590. https://doi.org/10.1182/blood-2011-07-365932
Schmitz, N., Pfistner, B., Sextro, M., Sieber, M., Carella, A. M., Haenel, M., . . . Marrow, T. (2002). Aggressive conventional chemotherapy compared with high-dose chemotherapy with autologous haemopoietic stem-cell transplantation for relapsed chemosensitive Hodgkin's disease: a randomised trial. Lancet, 359(9323), 2065-2071. https://doi.org/10.1016/S0140-6736(02)08938-9
Schmitz, N., Zeynalova, S., Nickelsen, M., Kansara, R., Villa, D., Sehn, L. H., . . . Savage, K. J. (2016). CNS International Prognostic Index: A Risk Model for CNS Relapse in Patients With Diffuse Large B-Cell Lymphoma Treated With R-CHOP. Journal of clinical oncology, 34(26), 3150-3156. https://doi.org/10.1200/JCO.2015.65.6520
Schouten, H. C., Qian, W., Kvaloy, S., Porcellini, A., Hagberg, H., Johnsen, H. E., . . . Kvalheim, G. (2003). High-dose therapy improves progression-free survival and survival in relapsed follicular non-Hodgkin's lymphoma: results from the randomized European CUP trial. Journal of clinical oncology, 21(21), 3918-3927. https://doi.org/10.1200/JCO.2003.10.023
Schulz, H., Rehwald, U., Morschhauser, F., Elter, T., Driessen, C., Rudiger, T., . . . Reiser, M. (2008). Rituximab in relapsed lymphocyte-predominant Hodgkin lymphoma: long-term results of a phase 2 trial by the German Hodgkin Lymphoma Study Group (GHSG). Blood, 111(1), 109-111. https://doi.org/10.1182/blood-2007-03-078725
Schuster, S. J., Bishop, M. R., Tam, C. S., Waller, E. K., Borchmann, P., McGuirk, J. P., . . . Maziarz, R. T. (2018). Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B-Cell Lymphoma. The New England journal of medicine, 380(1), 45-56. https://doi.org/10.1056/NEJMoa1804980
Schüring, A. N., Fehm, T., Behringer, K., Goeckenjan, M., Wimberger, P., Henes, M., . . . von Wolff, M. (2018). Practical recommendations for fertility preservation in women by the FertiPROTEKT network. Part I: Indications for fertility preservation. Archives of gynecology and obstetrics, 297(1), 241-255. https://doi.org/10.1007/s00404-017-4594-3
Sehn, L. H., Berry, B., Chhanabhai, M., Fitzgerald, C., Gill, K., Hoskins, P., . . . Connors, J. M. (2007). The revised International Prognostic Index (R-IPI) is a better predictor of outcome than the standard IPI for patients with diffuse large B-cell lymphoma treated with R-CHOP. Blood, 109(5), 1857-1861. https://doi.org/10.1182/blood-2006-08-038257
Sehn, L. H., Chua, N., Mayer, J., Dueck, G., Trneny, M., Bouabdallah, K., . . . Cheson, B. D. (2016). Obinutuzumab plus bendamustine versus bendamustine monotherapy in patients with rituximab-refractory indolent non-Hodgkin lymphoma (GADOLIN): a randomised, controlled, open-label, multicentre, phase 3 trial. The Lancet. Oncology, 17(8), 1081-1093. https://doi.org/10.1016/S1470-2045(16)30097-3
Sehn, L. H., Herrera, A. F., Flowers, C. R., Kamdar, M. K., McMillan, A., Hertzberg, M., . . . Matasar, M. J. (2020). Polatuzumab Vedotin in Relapsed or Refractory Diffuse Large B-Cell Lymphoma. Journal of clinical oncology, 38(2), 155-165. https://doi.org/10.1200/JCO.19.00172
Sesques, P., & Johnson, N. A. (2017). Approach to the diagnosis and treatment of high-grade B-cell lymphomas with MYC and BCL2 and/or BCL6 rearrangements. Blood, 129(3), 280-288. https://doi.org/10.1182/blood-2016-02-636316
Shah, G. D., Yahalom, J., Correa, D. D., Lai, R. K., Raizer, J. J., Schiff, D., . . . Abrey, L. E. (2007). Combined immunochemotherapy with reduced whole-brain radiotherapy for newly diagnosed primary CNS lymphoma. Journal of clinical oncology, 25(30), 4730-4735. https://doi.org/10.1200/JCO.2007.12.5062
Smeland, S., Blystad, A. K., Kvaløy, S. O., Ikonomou, I. M., Delabie, J., Kvalheim, G., . . . Holte, H. (2004). Treatment of Burkitt's/Burkitt-like lymphoma in adolescents and adults: a 20-year experience from the Norwegian Radium Hospital with the use of three successive regimens. Annals of oncology, 15(7), 1072-1078. https://doi.org/10.1093/annonc/mdh262
Solal-Celigny, P., Roy, P., Colombat, P., White, J., Armitage, J. O., Arranz-Saez, R., . . . Montserrat, E. (2004). Follicular lymphoma international prognostic index. Blood, 104(5), 1258-1265. https://doi.org/10.1182/blood-2003-12-4434
Soutar, R., Lucraft, H., Jackson, G., Reece, A., Bird, J., Low, E., . . . British Society for Haematology. (2004). Guidelines on the diagnosis and management of solitary plasmacytoma of bone and solitary extramedullary plasmacytoma. British journal of haematology, 124(6), 717-726. https://doi.org/10.1111/j.1365-2141.2004.04834.x
Sparano, J. A. (2007). HIV-associated lymphoma: the evidence for treating aggressively but with caution. Current opinion in oncology, 19(5), 458-463. https://doi.org/10.1097/CCO.0b013e3282c8c835
Specht, L., Dabaja, B., Illidge, T., Wilson, L. D., & Hoppe, R. T. (2015). Modern radiation therapy for primary cutaneous lymphomas: field and dose guidelines from the International Lymphoma Radiation Oncology Group. International journal of radiation oncology, biology, physics, 92(1), 32-39. https://doi.org/10.1016/j.ijrobp.2015.01.008
Stein, H., Foss, H. D., Durkop, H., Marafioti, T., Delsol, G., Pulford, K., . . . Falini, B. (2000). CD30(+) anaplastic large cell lymphoma: a review of its histopathologic, genetic, and clinical features. Blood, 96(12), 3681-3695.
Suarez, F., Lortholary, O., Hermine, O., & Lecuit, M. (2006). Infection-associated lymphomas derived from marginal zone B cells: a model of antigen-driven lymphoproliferation. Blood, 107(8), 3034-3044. https://doi.org/10.1182/blood-2005-09-3679
Sureda, A., Robinson, S., Canals, C., Carella, A. M., Boogaerts, M. A., Caballero, D., . . . Schmitz, N. (2008). Reduced-intensity conditioning compared with conventional allogeneic stem-cell transplantation in relapsed or refractory Hodgkin's lymphoma: an analysis from the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. Journal of clinical oncology, 26(3), 455-462. https://doi.org/10.1200/JCO.2007.13.2415
Sweetenham, J. W., Santini, G., Qian, W., Guelfi, M., Schmitz, N., Simnett, S., . . . Goldstone, A. H. (2001). High-dose therapy and autologous stem-cell transplantation versus conventional-dose consolidation/maintenance therapy as postremission therapy for adult patients with lymphoblastic lymphoma: results of a randomized trial of the European Group for Blood and Marrow Transplantation and the United Kingdom Lymphoma Group. Journal of clinical oncology, 19(11), 2927-2936. https://doi.org/10.1200/JCO.2001.19.11.2927
Swerdlow, S. H., Campo, E., Harris, N. L., Jaffe, E. S., Pileri, S. A., Stein, H., & Thiele, J. (red.). (2017). WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues (4. rev. utg.). (WHO Classification of Tumours, Volume 2). Lyon: IARC.
Swerdlow, S. H., Campo, E., Pileri, S. A., Harris, N. L., Stein, H., Siebert, R., . . . Jaffe, E. S. (2016). The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood, 127(20), 2375-2390. https://doi.org/10.1182/blood-2016-01-643569
Thieblemont, C., & Coiffier, B. (2006). Management of marginal zone lymphomas. Current treatment options in oncology, 7(3), 213-222. https://doi.org/10.1007/s11864-006-0014-9
Thieblemont, C., & Zucca, E. (2017). Clinical aspects and therapy of gastrointestinal MALT lymphoma. Best practice & research. Clinical haematology, 30(1-2), 109-117. https://doi.org/10.1016/j.beha.2017.01.002
Trautinger, F., Knobler, R., Willemze, R., Peris, K., Stadler, R., Laroche, L., . . . Whittaker, S. (2006). EORTC consensus recommendations for the treatment of mycosis fungoides/Sezary syndrome. European journal of cancer, 42(8), 1014-1030. https://doi.org/10.1016/j.ejca.2006.01.025
Tsai, H. K., & Mauch, P. M. (2007). Nodular lymphocyte-predominant hodgkin lymphoma. Seminars in radiation oncology, 17(3), 184-189. https://doi.org/10.1016/j.semradonc.2007.02.004
Tsang, R. W., Campbell, B. A., Goda, J. S., Kelsey, C. R., Kirova, Y. M., Parikh, R. R., . . . Yahalom, J. (2018). Radiation Therapy for Solitary Plasmacytoma and Multiple Myeloma: Guidelines From the International Lymphoma Radiation Oncology Group. International journal of radiation oncology, biology, physics, 101(4), 794-808. https://doi.org/10.1016/j.ijrobp.2018.05.009
Tsang, R. W., & Gospodarowicz, M. K. (2007). Low-grade non-hodgkin lymphomas. Seminars in radiation oncology, 17(3), 198-205. https://doi.org/10.1016/j.semradonc.2007.02.006
Tsimberidou, A. M., Catovsky, D., Schlette, E., O'Brien, S., Wierda, W. G., Kantarjian, H., . . . Keating, M. J. (2006). Outcomes in patients with splenic marginal zone lymphoma and marginal zone lymphoma treated with rituximab with or without chemotherapy or chemotherapy alone. Cancer, 107(1), 125-135. https://doi.org/10.1002/cncr.21931
Van Besien, K. (2006). The evolving role of autologous and allogeneic stem cell transplantation in follicular lymphoma. Blood reviews, 20(5), 235-244. https://doi.org/10.1016/j.blre.2006.01.001
van Oers, M. H., Klasa, R., Marcus, R. E., Wolf, M., Kimby, E., Gascoyne, R. D., . . . Hagenbeek, A. (2006). Rituximab maintenance improves clinical outcome of relapsed/resistant follicular non-Hodgkin lymphoma in patients both with and without rituximab during induction: results of a prospective randomized phase 3 intergroup trial. Blood, 108(10), 3295-3301. https://doi.org/10.1182/blood-2006-05-021113
van Oers, M. H., Van Glabbeke, M., Giurgea, L., Klasa, R., Marcus, R. E., Wolf, M., . . . Hagenbeek, A. (2010). Rituximab maintenance treatment of relapsed/resistant follicular non-Hodgkin's lymphoma: long-term outcome of the EORTC 20981 phase III randomized intergroup study. Journal of clinical oncology, 28(17), 2853-2858. https://doi.org/10.1200/JCO.2009.26.5827
Vidal, L., Gafter-Gvili, A., Salles, G., Dreyling, M. H., Ghielmini, M., Hsu Schmitz, S. F., . . . Shpilberg, O. (2011). Rituximab maintenance for the treatment of patients with follicular lymphoma: an updated systematic review and meta-analysis of randomized trials. Journal of the National Cancer Institute, 103(23), 1799-1806. https://doi.org/10.1093/jnci/djr418
Voong, K. R., McSpadden, K., Pinnix, C. C., Shihadeh, F., Reed, V., Salehpour, M. R., . . . Dabaja, B. S. (2014). Dosimetric advantages of a "butterfly" technique for intensity-modulated radiation therapy for young female patients with mediastinal Hodgkin's lymphoma. Radiation oncology (London, England), 9, 94. https://doi.org/10.1186/1748-717x-9-94
Voss, M. H., Lunning, M. A., Maragulia, J. C., Papadopoulos, E. B., Goldberg, J., Zelenetz, A. D., & Horwitz, S. M. (2013). Intensive induction chemotherapy followed by early high-dose therapy and hematopoietic stem cell transplantation results in improved outcome for patients with hepatosplenic T-cell lymphoma: a single institution experience. Clinical lymphoma, myeloma & leukemia, 13(1), 8-14. https://doi.org/10.1016/j.clml.2012.09.002
Wang, M. L., Lee, H., Chuang, H., Wagner-Bartak, N., Hagemeister, F., Westin, J., . . . Zhang, L. (2016). Ibrutinib in combination with rituximab in relapsed or refractory mantle cell lymphoma: a single-centre, open-label, phase 2 trial. The Lancet. Oncology, 17(1), 48-56. https://doi.org/10.1016/S1470-2045(15)00438-6
Wang, M. L., Rule, S., Martin, P., Goy, A., Auer, R., Kahl, B. S., . . . Blum, K. A. (2013). Targeting BTK with ibrutinib in relapsed or refractory mantle-cell lymphoma. The New England journal of medicine, 369(6), 507-516. https://doi.org/10.1056/NEJMoa1306220
Wasterlid, T., Hartman, L., Szekely, E., & Jerkeman, M. (2017). Impact on survival of addition of etoposide to primary chemotherapy in diffuse large B-cell lymphoma: a Swedish Lymphoma Registry study. Hematological oncology, 35(2), 151-157. https://doi.org/10.1002/hon.2256
Weisenburger, D. D., & Armitage, J. O. (1996). Mantle cell lymphoma-- an entity comes of age. Blood, 87(11), 4483-4494.
Wilkosz, P., Greggains, G. D., Tanbo, T. G., & Fedorcsak, P. (2014). Female reproductive decline is determined by remaining ovarian reserve and age. PLoS One, 9(10), e108343. https://doi.org/10.1371/journal.pone.0108343
Willemze, R., Cerroni, L., Kempf, W., Berti, E., Facchetti, F., Swerdlow, S. H., & Jaffe, E. S. (2019). The 2018 update of the WHO-EORTC classification for primary cutaneous lymphomas. Blood, 133(16), 1703-1714. https://doi.org/10.1182/blood-2018-11-881268
Willemze, R., Jaffe, E. S., Burg, G., Cerroni, L., Berti, E., Swerdlow, S. H., . . . Meijer, C. J. (2005). WHO-EORTC classification for cutaneous lymphomas. Blood, 105(10), 3768-3785. https://doi.org/10.1182/blood-2004-09-3502
Willemze, R., & Meijer, C. J. (2003). Primary cutaneous CD30-positive lymphoproliferative disorders. Hematology/oncology clinics of North America, 17(6), 1319-1332, vii-viii. https://doi.org/10.1016/s0889-8588(03)00117-5
Wilson, M. R., Eyre, T. A., Kirkwood, A. A., Wong Doo, N., Soussain, C., Choquet, S., . . . McKay, P. (2022). Timing of high-dose methotrexate CNS prophylaxis in DLBCL: a multicenter international analysis of 1384 patients. Blood, 139(16), 2499-2511. https://doi.org/10.1182/blood.2021014506
Wilson, W. H., Grossbard, M. L., Pittaluga, S., Cole, D., Pearson, D., Drbohlav, N., . . . Balis, F. (2002). Dose-adjusted EPOCH chemotherapy for untreated large B-cell lymphomas: a pharmacodynamic approach with high efficacy. Blood, 99(8), 2685-2693. https://doi.org/10.1182/blood.v99.8.2685
Wirth, A., Mikhaeel, N. G., Aleman, B. M. P., Pinnix, C. C., Constine, L. S., Ricardi, U., . . . Specht, L. (2020). Involved Site Radiation Therapy in Adult Lymphomas: An Overview of International Lymphoma Radiation Oncology Group Guidelines. International journal of radiation oncology, biology, physics, 107(5), 909-933. https://doi.org/10.1016/j.ijrobp.2020.03.019
Wittink, H., & Michel, T. H. (red.). (2002). Chronic pain management for physical therapists (2. utg.). Woburn, MA: Elsevier Science.
Wong, J. Y. C., Filippi, A. R., Dabaja, B. S., Yahalom, J., & Specht, L. (2018). Total Body Irradiation: Guidelines from the International Lymphoma Radiation Oncology Group (ILROG). International journal of radiation oncology, biology, physics, 101(3), 521-529. https://doi.org/10.1016/j.ijrobp.2018.04.071
Wotherspoon, A. C., Doglioni, C., Diss, T. C., Pan, L., Moschini, A., de Boni, M., & Isaacson, P. G. (1993). Regression of primary low-grade B-cell gastric lymphoma of mucosa-associated lymphoid tissue type after eradication of Helicobacter pylori. Lancet, 342(8871), 575-577. https://doi.org/10.1016/0140-6736(93)91409-f
Wundisch, T., Thiede, C., Morgner, A., Dempfle, A., Gunther, A., Liu, H., . . . Neubauer, A. (2005). Long-term follow-up of gastric MALT lymphoma after Helicobacter pylori eradication. Journal of clinical oncology, 23(31), 8018-8024. https://doi.org/10.1200/JCO.2005.02.3903
Yahalom, J., Illidge, T., Specht, L., Hoppe, R. T., Li, Y.-X., Tsang, R., & Wirth, A. (2015). Modern Radiation Therapy for Extranodal Lymphomas: Field and Dose Guidelines From the International Lymphoma Radiation Oncology Group. International journal of radiation oncology, biology, physics, 92(1), 11-31. https://doi.org/10.1016/j.ijrobp.2015.01.009
Younes, A., Gopal, A. K., Smith, S. E., Ansell, S. M., Rosenblatt, J. D., Savage, K. J., . . . Chen, R. (2012). Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin's lymphoma. Journal of clinical oncology, 30(18), 2183-2189. https://doi.org/10.1200/JCO.2011.38.0410
Yuen, A. R., Rosenberg, S. A., Hoppe, R. T., Halpern, J. D., & Horning, S. J. (1997). Comparison between conventional salvage therapy and high-dose therapy with autografting for recurrent or refractory Hodgkin's disease. Blood, 89(3), 814-822.
Zaorsky, N. G., Williams, G. R., Barta, S. K., Esnaola, N. F., Kropf, P. L., Hayes, S. B., & Meyer, J. E. (2017). Splenic irradiation for splenomegaly: A systematic review. Cancer treatment reviews, 53, 47-52. https://doi.org/10.1016/j.ctrv.2016.11.016
Zhang, N., Xu, D., Liu, B., Shi, X., Xie, X., & Wang, Z. (2022). Prophylaxis strategies containing high dose intravenous methotrexate on preventing CNS relapse for patients with diffuse large B-cell lymphoma at intermediate to high risk: A study based on 12 cohorts in the rituximab era. International immunopharmacology, 113(Pt A), 109299. https://doi.org/10.1016/j.intimp.2022.109299
Zhou, Z., Sehn, L. H., Rademaker, A. W., Gordon, L. I., Lacasce, A. S., Crosby-Thompson, A., . . . Winter, J. N. (2014). An enhanced International Prognostic Index (NCCN-IPI) for patients with diffuse large B-cell lymphoma treated in the rituximab era. Blood, 123(6), 837-842. https://doi.org/10.1182/blood-2013-09-524108
Zucca, E., Conconi, A., Laszlo, D., Lopez-Guillermo, A., Bouabdallah, R., Coiffier, B., . . . Thieblemont, C. (2013). Addition of rituximab to chlorambucil produces superior event-free survival in the treatment of patients with extranodal marginal-zone B-cell lymphoma: 5-year analysis of the IELSG-19 Randomized Study. Journal of clinical oncology, 31(5), 565-572. https://doi.org/10.1200/JCO.2011.40.6272
Zucca, E., Roggero, E., Bertoni, F., Conconi, A., & Cavalli, F. (1999). Primary extranodal non-Hodgkin's lymphomas. Part 2: Head and neck, central nervous system and other less common sites. Annals of oncology, 10(9), 1023-1033. https://doi.org/10.1023/a:1008313229892
Zucca, E., Rondeau, S., Vanazzi, A., Østenstad, B., Mey, U. J. M., Rauch, D., . . . the Nordic Lymphoma Group. (2019). Short regimen of rituximab plus lenalidomide in follicular lymphoma patients in need of first-line therapy. Blood, 134(4), 353-362. https://doi.org/10.1182/blood-2018-10-879643









