Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av melanom
Innledning
Sist faglig oppdatert: 05.07.2023
Melanom er blant de kreftformer som har økt mest i den vestlige verden over flere tiår. Mer enn ni av ti dødsfall som skyldes hudkreft i Europa, kan tilskrives melanom.
I 2018 ble det diagnostisert 2556 tilfeller av melanom i Norge. Denne kreftformen rammer relativt mange unge mennesker og er den nest vanligste kreftform hos både kvinner og menn i alderen 25 - 49 år. Dødsfall forårsaket av medfører derfor tap av mange leveår.
Den eneste kjente ytre risikofaktor er eksponering for sollys, og spesielt korte intense eksponeringer som medfører solbrenthet. Primær forebyggelse vil innebære informasjon til befolkningen om å endre sin solingsadferd. Sekundær forebyggelse søker å gi befolkningen informasjon om faresignaler ved melanom, slik at sykdommen kan diagnostiseres på et tidlig tidspunkt med bedret overlevelse. På denne måten kan både forekomst og dødelighet reduseres.
Oppdatering – 10. utgave
Hele handlingsprogrammet er gjennomgått og oppdatert.
Fastlegens arbeid og ansvar ved melanom
Fastlegens rolle i forebygging av melanom
Sist faglig oppdatert: 05.07.2023
Fastlegene må kjenne til forekomst av, og risikofaktorer for, melanom.
Melanom er blant de kreftformer som øker mest i den vestlige verden. Mer enn ni av ti dødsfall som skyldes hudkreft i Europa, tilskrives melanom.
Melanom i hud er den alvorligste formen for hudkreft, og er den kreftformen som øker mest i Norge. For aldersgruppen 25-49 år er melanom i hud den nest vanligste kreftformen. Dødsfall forårsaket av melanom medfører derfor tap av mange leveår, jamfør kapittelet Epidemiologi)
Den viktigste ytre risikofaktor er eksponering for UV-stråling, og spesielt korte intense eksponeringer som medfører solbrenthet. Primærforebygging bør følge Direktoratet for strålevern og atomsikkerhet sine råd for å beskytte seg i sola (dsa.no). Sekundærforebygging er å gi befolkningen informasjon om faresignaler, slik at sykdommen kan diagnostiseres tidlig og dermed bidra til bedret overlevelse.
Norge har høy og økende forekomst av melanom. Vi har også høy dødelighet sammenlignet med land med tilsvarende forekomst. Det er sannsynlig at den høye dødeligheten skyldes forsinkelse i diagnose, både pga. pasient og lege (Robsahm et al., 2018), men behandling av melanom kan også ha betydning.
Fastlegens rolle i diagnostikk og henvisning til pakkeforløp ved melanom
Sist faglig oppdatert: 05.07.2023
Fastlegen har en viktig oppgave i tidlig diagnostikk av melanomer. Tidlig diagnose og behandling av melanom er av avgjørende betydning for prognose (Bishop et al., 2007a; Bishop et al., 2007b).
Pasienten tar oftest kontakt fordi vedkommende eller pårørende har lagt merke til en hudforandring som er ny eller har forandret seg.
Den kliniske presentasjonen av melanom er varierende, men grundig anamnese sammenholdt med klinisk undersøkelse, og evt. Dermatoskopi, vil kunne bidra til diagnosen. Dermatoskopi krever erfaring og anbefales brukt av leger med denne kompetansen.
Melanomer er som oftest pigmentert og oppstår i ca. 50% av tilfellene på huden uten forutgående føflekk. Melanomer kan også være uten pigment, amelanotiske, noe som kan bidra til redusert mistanke om melanom, og dermed forsinke diagnosen.
Anamnese
Debuttidspunkt/varighet, endring i form, størrelse eller farge, kløe/smerter/stikninger, blødning/sårdannelse.
Risikofaktorer: UV-eksponering, tidligere gjennomgått melanom eller annen hudkreft, familiær forekomst av melanom, immunsuppresjon.
Klinisk undersøkelse
Den kliniske undersøkelsen bygger først og fremst på inspeksjon og evt. dermatoskopi.
Ved undersøkelse anbefales en systematisk tilnærming, ABCD(E)-regelen (Abbasi et al., 2004; Friedman et al., 1985)
A for Asymmetri
B for Begrensning
C for Kulør («colour»)
D for Diameter > 6 mm
(E for Endring)
For nodulære melanom brukes EFG i stedet (Kelly et al., 2003):
E for elevert
F for fast (firm)
G for Growing (voksende)
Pigmenterte lesjoner som avviker fra pasientens øvrige føflekker, og påkaller oppmerksomhet, kalles ofte «den stygge andungen». Dette er vist å være et melanomsensitivt tegn (Goodson et al., 2009).
Biopsi
Eksisjonsbiopsi av en melanomsuspekt hudlesjon skal gjøres ved at hele tumoren fjernes med en ellipseformet incisjon 2–5 mm ut i normal hud og med en pute av subdermalt fett.
Dette gjør en histologisk undersøkelse av hele lesjonen mulig, med bestemmelse av Breslow tykkelse, som igjen danner grunnlag for videre kirurgisk behandling.
Inkomplett biopsi, stansebiopsi av deler av lesjonen, eller overfladisk shavebiopsi skal ikke gjøres (unntak ved eksempelvis store lentigo maligna/ lentigo maligna melanom). Ved mistanke om melanom, merkes preparatet med pakkeforløp kreft på histologiremissen.
Primæreksisjonen kan foregå i primærhelsetjenesten, men ved meget store lesjoner, spesielle lokalisasjoner, som øyelokk eller under negl, bør pasienten henvises videre til spesialist i hudsykdommer eller plastikkirurg. Eksisjon på ekstremiteter bør foretas i ekstremitetens lengdeakse, ikke på tvers av lengdeaksen, for å minske morbiditet hos pasientene ved eventuell utvidet eksisjon.
Lesjoner som er uavklarte, og spesielt alle pigmenterte hudlesjoner som fjernes, skal rutinemessig innsendes for histologisk undersøkelse selv om det ikke er mistanke om malignitet.
Fastlegens rolle for pasienter som er i aktiv behandling
Sist faglig oppdatert: 05.07.2023
Fastlegens rolle i denne fasen vil variere, alt etter pasientens kliniske situasjon, livssituasjon og avstand til sykehus.
Fastlegen bør bidra etter pasientens ønsker og behov:
- Smerter og komplikasjoner etter kirurgi.
- Vite om bivirkninger av immunbehandling, og henvise til kreftavdelingen for råd og håndtering.
- Justere smerte- og kvalmebehandling.
- Gi råd om ernæring.
- Avdekke eventuell tromboembolisk sykdom.
- Avdekke alvorlige, akutte komplikasjoner ved behandling, og henvise til sykehus i pakkeforløp føflekkreft ved mistanke om:
- Lokoregionaltresidiv
- Fjernmetastaser
Fastlegen kan bidra i behandling av angst, depresjon og andre psykiske plager, samt søvnvansker. Fastlegen kan også bidra til ivaretagelse av berørte familiemedlemmer, herunder eventuelle barn, og samarbeide med hjemmetjeneste der dette er aktuelt. Henvisning til vardesenter kan også gjøres av fastlegen.
Fastlegens rolle i denne fasen vil variere avhengig av pasientens kliniske situasjon, livssituasjon og avstand til sykehus.
Fastlegen bør bidra etter pasientens ønsker og behov:
- Smerter og komplikasjoner etter kirurgi
- Avdekke alvorlige, akutte komplikasjoner ved behandling
- Vite om bivirkninger av immunbehandling, og henvise til kreftavdelingen for råd og håndtering
- Avdekke eventuell tromboembolisk sykdom
- Justere smerte- og kvalmebehandling
- Gi råd om ernæring
- Henvise til sykehus ved mistanke om:
- >
- Lokoregionalt residiv
- Fjernmetastaser
Fastlegen kan bidra i behandling av angst, depresjon og andre psykiske plager, samt søvnvansker. Fastlegen kan også bidra til ivaretagelse av berørte familiemedlemmer, herunder eventuelle barn, og samarbeide med hjemmetjeneste der dette er aktuelt. Henvisning til vardesenter kan også gjøres av fastlegen.
Fastlegens rolle for pasienter som er i kontrollopplegg etter behandling for melanom
Sist faglig oppdatert: 05.07.2023
Vel halvparten av alle pasienter behandlet for melanom får residiv. Av disse er vel 20 % lokale residiv, 50 % i regionale lymfeknuter og 30 % fjernmetastaser (Rueth et al., 2014). Fjernmetastaser forekommer bl.a. i hud, lunge, lever, hjerne og skjelett.
Vel 80 % av residiv etter gjennomgått melanom kommer i løpet av de første 3 årene etter behandling, selv om residiv etter mange år også er beskrevet.
Første kontroll etter behandling for kutant melanom stadium I og II skal foregå hos hudlege som skisserer videre kontrollopplegg ut fra gjeldende retningslinjer. Videre oppfølging kan skje hos fastlege. Deretter er kontrollerende lege ansvarlig for oppfølging og eventuelt henvisning tilbake til spesialisthelsetjenesten. Pasienter i risikogrupper som familiær opphopning, atypisk nevussyndrom eller flere primære melanomer, bør helt eller delvis følges opp av hudlege.
Anamnese: vekttap, endringer i helbredet siden sist, andre nye symptomer. Spørre pasienten om egenundersøkelse og kunnskap om dette.
Klinisk undersøkelse: Inspeksjon og palpasjon av operasjonsarr og området fra arr til nærmeste lymfeknutestasjon(er) for å se etter satellitt og in-transit metastaser. Palpasjon av alle lymfeknutestasjoner og inspeksjon av hudoverflaten.
Bildeundersøkelse: Pasienter med de stadier med høyest risiko for tilbakefall tilbys bildeundersøkelser (ultralyd, PET-CT, MR caput), jamfør tabellen i kapittelet om oppfølging og etterkontroll.
Fastlegens rolle for pasienter som har avsluttet oppfølging for melanom på sykehus/hudlege
Sist faglig oppdatert: 05.07.2023
Fastlegen bør:
- følge opp eventuelle senskader etter kirurgi, strålebehandling og medikamentell behandling, nevropati, asteni, lymfødem, endokrin sykdom og fatigue
- bistå i rehabilitering og oppmuntre til egentrening
- bistå med eventuell sykemelding/friskmeldingsprosess
- fange opp symptom på tilbakefall av sykdom og henvise til nytt pakkeforløp
Fastlegens rolle for overlevere etter melanom
Sist faglig oppdatert: 05.07.2023
Pasienter med tynne melanomer (<1 mm) har >95 % 5-års overlevelse, mens tykkelse >4 mm kombinert med ulcerasjon er assosiert med ca. 50 % 5-årsoverlevelse (Nasjonalt kvalitetsregister for melanom, 2021).
For mer informasjon, les Fastlegens rolle ved kreft.
Fastlegens arbeid med palliasjon og omsorg ved livets slutt for pasienter med melanom
Sist faglig oppdatert: 05.07.2023
I denne fasen mottar mange pasienter behandling på sykehus, dels for symptomlindring, dels for livsforlengelse. Parallelt følges pasientene av fastlege og øvrig kommunehelsetjeneste. For fastlegen er det i denne fasen viktig å kjenne til alarmsymptomer knyttet til alvorlige komplikasjoner ved melanom, som hovedsakelig skyldes komplikasjoner pga. metastasenes lokalisering eller bivirkninger av medikamentell behandling.
Palliasjon og omsorg ved livets slutt for kreftpasienter må for øvrig tilpasses den enkeltes kliniske situasjon og behov.
For mer informasjon, les Fastlegens rolle ved kreft.
Epidemiologi
Melanom Insidens
Sist faglig oppdatert: 05.07.2023
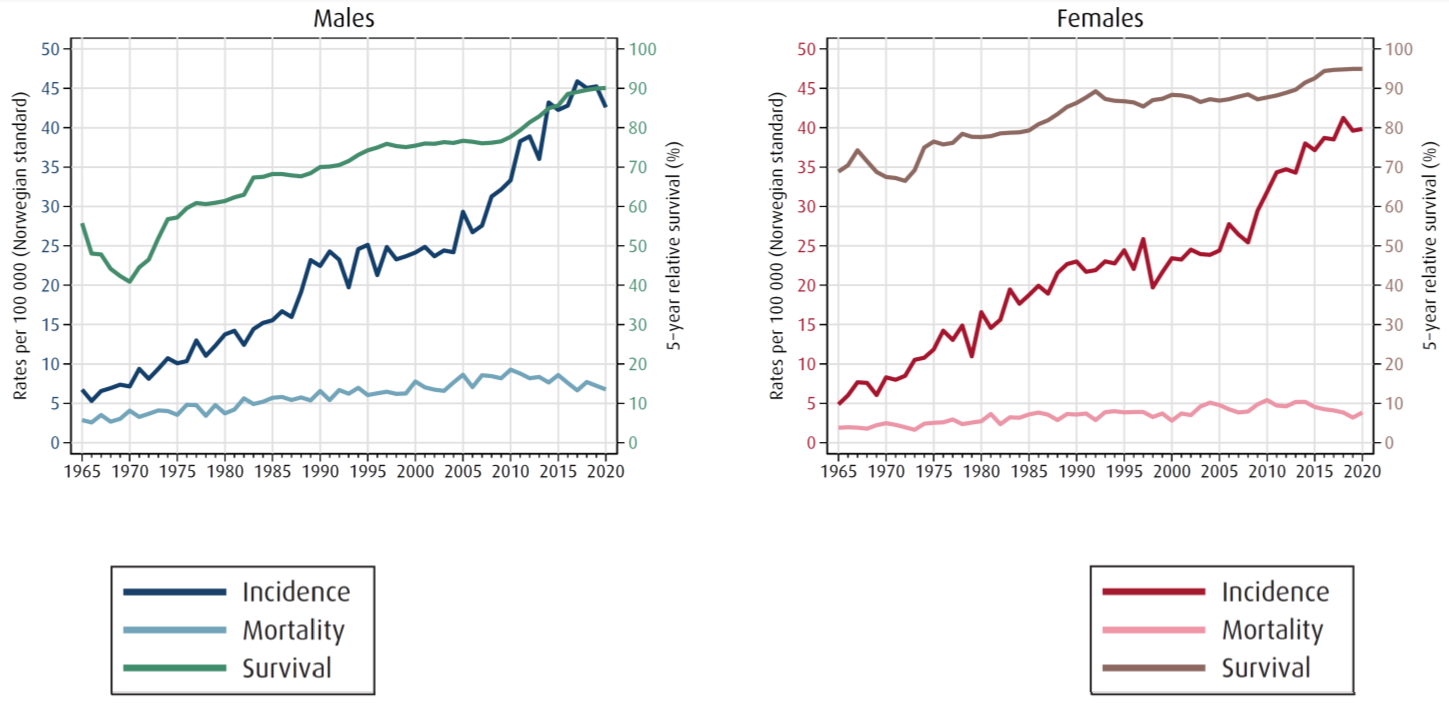
Melanom i hud er blant de kreftsykdommene med størst økning i antall nye tilfeller per år (insidens) siden Kreftregisteret ble opprettet i 1952. I 2020 ble det diagnostisert 2697 tilfeller av denne kreftformen, 1314 tilfeller blant kvinner og 1383 tilfeller blant menn og den aldersstandardiserte insidensraten (antall nye tilfeller per 100 000 personer) var henholdsvis 39.8 og 42.6 (Larsen, 2021). Til sammenligning var denne raten 1.8 for kvinner og 3.9 for menn i 1960. Den aldersstandardiserte insidensraten økte kraftig frem til ca. 1995, for deretter å være relativt stabil. Etter ca. 2005 ser vi en ny sterk økning, for begge kjønn, med samme intensitet som før 1995 (Figur 1). Vi er usikre på hva som forklarer avflating i denne 10-års-perioden. Både i Norge og andre europeiske land ser vi at den økte forekomsten av melanom i hud er drevet av økning av tumorer i T-stadium 1, men forekomsten av tykkere tumorer øker også (Sacchetto et al., 2018). Forekomst av melanom tilskrives i hovedsak ultrafiolett stråling, men den sterke økningen i insidens kan nok i noe grad også tilskrives økt diagnostisk intensitet og endringer i diagnosekriterier (Sacchetto et al., 2018). Insidensraten i Norge er 5. høyest i verden (Sung et al., 2021).
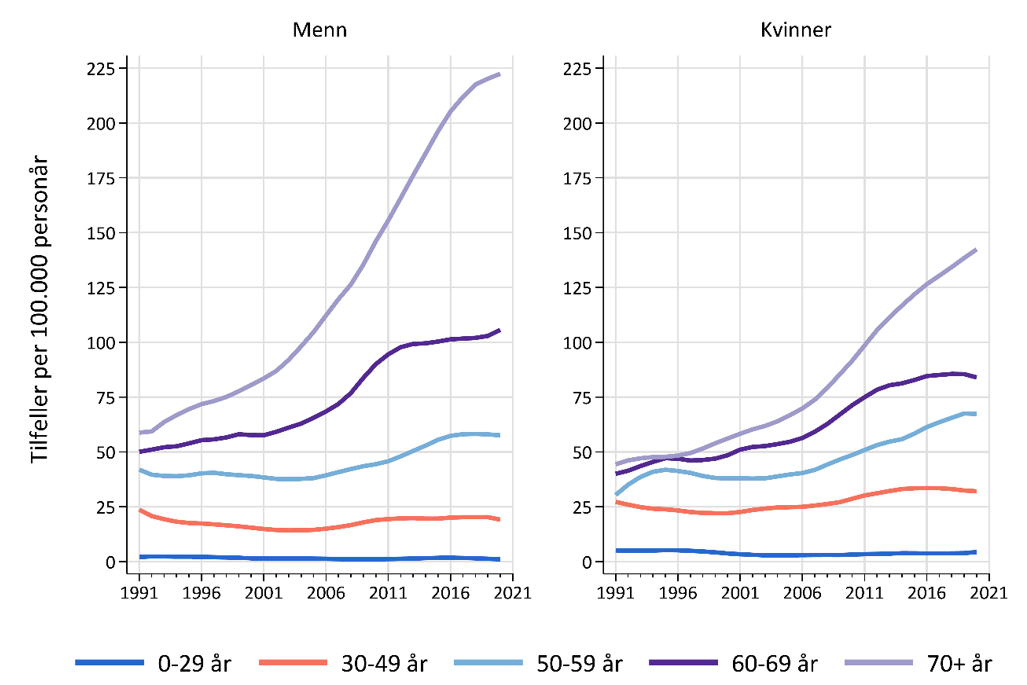
Før 50 års alder er insidensen høyere hos kvinner enn hos menn, mens det etter 50 års alder er motsatt. Dette den nest hyppigst forekommende kreftformen i aldersgruppen 25–49 år, for begge kjønn. I løpet av de siste 10 årene har insidensraten for disse vært stabil. Vi ser fortsatt en sterk økning for aldersgruppene over 70 år, og sterkere for menn enn for kvinner. Økningen for aldersgruppene 50-69 ser derimot ut til å flate ut, mest tydelig for menn (Figur 2).
Hos menn er de fleste melanomer lokalisert på bryst/rygg, og ben er den minst vanlige lokalisasjonen. Hos kvinner har ben tradisjonelt vært den vanligste lokalisasjonen, men forekomsten på bryst/rygg er nå like høy. Kvinner har færre melanom lokalisert på hode/hals enn menn.
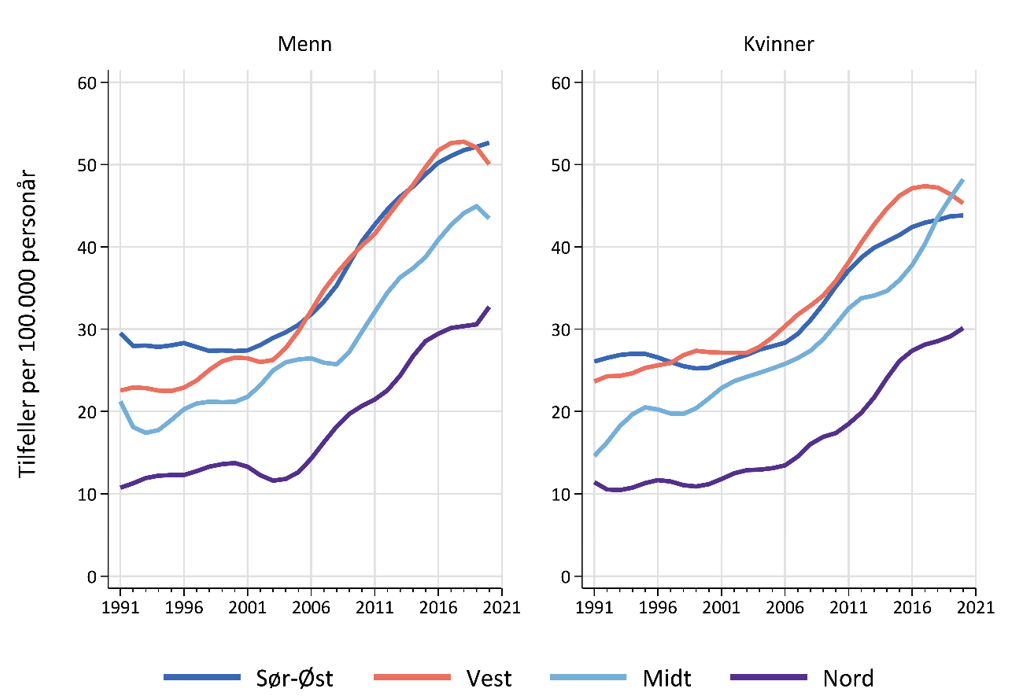
Melanom i hud har tradisjonelt vært mer enn dobbelt så hyppig forekommende i Sør-Norge sammenlignet med Nord-Norge (Larsen, 2021), som sammenfaller med forskjeller i klima og sol-eksponering. Over tid kan det se ut som om reisevaner er i ferd med å viske ut gradienten mellom landsdeler (Figur 3).
Mortalitet
Sist faglig oppdatert: 05.07.2023
Dødelighet av melanom har også økt gjennom hele perioden (Figur 1), men mest for menn over 60 år (Larsen, 2019). For de yngste aldersgruppene (<40 år) er dødeligheten uforandret gjennom hele perioden. I 2020 var dødeligheten for kvinner og menn henholdsvis 3.8 og 6.8 per 100 000. Andelen pasienter som diagnostiseres i T-stadium 1 (≤1 mm) er 56.1 % (2020), til sammenligning er denne andelen >70 % i Australia. Sammenlignet med andre land med tilsvarende høy forekomst har Norge høyere andel tykkere tumorer, høyere andel av nodulært melanom og mer avansert stadium ved diagnose (Robsahm et al., 2018). Dødelighetsraten i Norge er på nivå er på 2. plass i verden, bak New Zealand, som har dobbelt så høy forekomst av melanom i hud (Sung et al., 2021).
Overlevelse
Sist faglig oppdatert: 05.07.2023
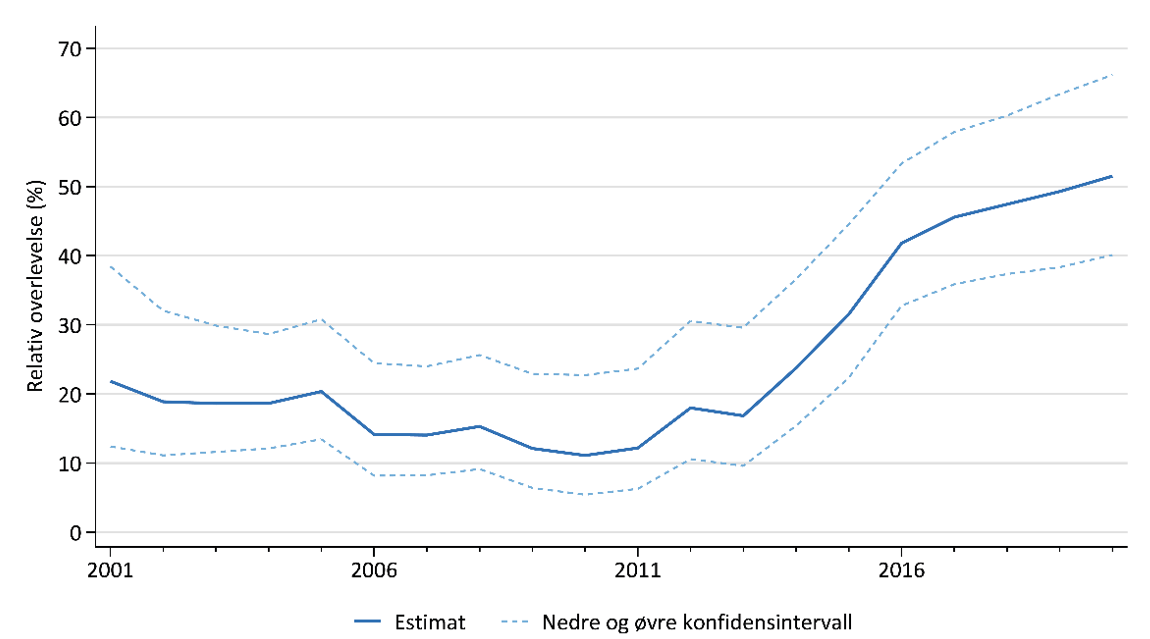
Gjennom hele perioden ser vi en kontinuerlig økning i overlevelse etter melanom i hud (Figur 1), men overlevelsen varierer etter kjønn, alder og stadium. Best overlevelse ser vi for kvinner, særlig i de yngste aldersgruppene (<40 år). I 5-års perioden 2016–2020 var 5 års relativ overlevelse ved melanom, for alle stadier samlet, 94.9 og 90.1 for henholdsvis kvinner og menn (Larsen, 2021). I samme periode var 5-års relativ overlevelse for pasienter med fjernmetastase 55.1% for kvinner og 36.6% for menn (Larsen, 2021), en vesentlig økning for begge kjønn siden 2010 (Figur 4) som mest sannsynlig er et resultat av ny medikamentell behandling. Kumulativ langtids-overlevelse grunnet sene dødsfall gir lavere overlevelse enn forventet etter både 10 og 15 år.
Overlevere etter melanom har økt risiko for en ny primær kreftdiagnose. Høyest er risikoen for å få et nytt melanom eller annen hudkreft men risikoen er også økt for flere andre kreftformer (Robsahm et al., 2014). God overlevelse etter melanom gir høy prevalens av sykdommen og en stadig større gruppe med forhøyet risiko for ny kreftsykdom. Antall personer i live etter diagnosen melanom i hud var 30 034 per 31.12.20 (prevalens). Det var 2 274, 7 948, 6 744 og 13 068 pasienter i live henholdsvis <1 år, 1–4 år, 5–9 år og ≥10 år etter diagnose (Larsen, 2021).
Oppsummert
Sist faglig oppdatert: 05.07.2023
Kort oppsummert, Norge har høy forekomst av melanom, som kan se ut til å flate ute for aldergruppene 50-69 år. Vi har også høy dødelighet, som delvis kan skyldes forsinkelse i diagnose (både hos pasient og lege) (Robsahm et al., 2021). Vi kan heller ikke utelukke at ulikheter med hensyn til screening-aktivitet og registrering kan forklare noe av forskjellene mellom land. Fordi >80% av melanomtilfellene har lokal sykdom ved diagnose er 5-års relativ overlevelse generelt god, ca. 90% for menn og 95% for kvinner (Nasjonalt kvalitetsregister for melanom, 2021). For melanom med metastase har overlevelsen økt i løpet av de seneste årene, som mest sannsynlig er et resultat av ny medikamentell behandling.
Forebygging
Primærforebygging
Sist faglig oppdatert: 05.07.2023
Ultrafiolett stråling (UV-stråling) fra sol og solarium øker risiko for melanom. Primærforebygging bør følge Direktoratet for strålevern og atomsikkerhet sine råd for å beskytte seg i sola (dsa.no). Fra Australia og USA rapporteres det nå om fallende forekomst i yngre aldersgrupper (Aitken et al., 2018; Paulson et al., 2020). Dette kan være et resultat av adferdsendringer med mindre direkte soleksposisjon og bruk av beskyttelse (skygge, klær, solkrem) (Watts et al., 2018).
UVA-/UVB-stråling
UV-stråling fra sol forårsaker de aller fleste tilfeller av melanom i hud. Aksjonsspekteret for induksjon av melanom er ikke kjent, men de kortbølgete UVB-strålene oppfattes av de fleste som viktigst for induksjon av melanom hos mennesket. Andre studier viser at også UVA kan indusere DNA-skade (Khan et al., 2018), og studier på fisk har vist at UVA alene kan indusere melanom. Konklusjonen i en EU-rapport fra 2016 er at det ikke finnes noen terskelverdi for UV-stråling og derfor heller ingen trygg nedre grense (Scientific Committee on Health, 2016). De epidemiologiske studiene dokumenterer en høyere forekomst av melanom innen samme populasjoner med fallende breddegrad. Andre forfattere underbygger denne teorien gjennom studier av klesvaner og spesiell eksposisjon. Korte, intense eksponeringer for UV-stråler på hud som ikke er pigmentert eller fortykket som følge av UVB påvirkning, øker risiko for melanom mest. Aktivitet som medfører slik eksposisjon, eksempelvis sydenturer i vinterhalvåret, vil derfor øke risikoen. En metaanalyse av 57 studier utført før 2002 som undersøkte sammenhengen mellom melanom og soleksponering fant en positiv assosiasjon mellom intermitterende soleksponering og risiko for melanom, og en invers assosiasjon mellom kronisk soleksponering og melanom (Gandini et al., 2005b). Studier fra Australia og Danmark viser at solforbrenninger i barne- og ungdomsårene er viktigere for melanomutvikling enn forbrenninger som skjer senere (Elwood et al., 1997). En populasjonsbasert studie fra Norge, basert på bosted, viser at soleksponering til enhver tid, uavhengig av alder, påvirker risikoen for melanom (Robsahm et al., 2001).
Solarier
Bruk av solarium medfører økt eksponering for UV-stråler for et stort hudareal. Solariene emitterer hovedsakelig langbølget UV-stråler (UVA), men også en fraksjon kortbølget UV-stråler (UVB).
Forskning viser en tydelig sammenheng mellom solariebruk og økt risiko for melanom. IARC publiserte i 2007 en systematisk oversiktsartikkel, som konkluderer med at risikoen for melanom øker med 75 % for personer som benytter solarium før 35 års alder (International Agency for Research on Cancer Working Group on artificial ultraviolet (UV) light and skin cancer, 2007). Basert på dette oppgraderte IARC solarier til klasse 1 karsinogen. En oversiktsartikkel fra 2019, har evaluert studier av sammenhengen mellom solariebruk og risiko for melanom i henhold til epidemiologiske kriterier for kausalitet og konkluderer at sammenhengen kan være kausal (Suppa et al., 2019). En norsk kohortstudie fant en klar dose-respons sammenheng mellom totalt antall solariebesøk og risiko for melanom, og at kvinner som begynte å bruke solarium før de var 30 år i gjennomsnitt var to år yngre ved melanom-diagnose sammenlignet med de som aldri hadde brukt solarium (Ghiasvand et al., 2017). I 2012 ble det innført 18 års aldersgrense for å ta solarium i Norge, men loven ble ikke håndhevet før 1. januar 2017. Til sammenligning har man i Australia og Brasil forbudt all solarievirksomhet. Et bredt fagmiljø i Norge står samlet bak konklusjonen om at solariebruk er kreftfremkallende og også uegnet som kilde til vitamin D (Nilsen et al., 2019).
Solkrem
Solkremer inneholder fysiske og/eller kjemiske filtre, som reflekterer eller absorberer UV-strålingen. Solkremer er vist å redusere DNA-skader i huden etter UV-eksponering, redusere UV indusert immunsuppresjon, redusere utvikling av føflekker (den sterkeste isolerte risikofaktor for utvikling av melanom), redusere aldringsforandringer i huden, og redusere forekomsten av aktiniske keratoser og plateepitelkarsinom (Kullavanijaya et al., 2005). Det er også vitenskapelig belegg for at regelmessig bruk av solkrem reduserer risikoen for å utvikle melanom (Green et al., 2011). En norsk studie av kvinner 40–75 år viser 18 % lavere risiko for melanom blant de som har brukt solkrem med SPF ≥15, sammenlignet med de som har brukt SPF <15 (Ghiasvand et al., 2016). FDA (Food and Drug Administration), AAD (American Academy of Dermatology) og vår egen Kreftforening anbefaler bruk av solkrem hvis fysisk beskyttelse, som for eksempel tildekking med klær eller opphold i skygge, ikke er mulig eller hensiktsmessig. Kreftforeningen anbefaler bruk av solkrem med minst solfaktor 30, dersom annen form for fysisk beskyttelse ikke er mulig eller hensiktsmessig. Det er videre vist at normal bruk av solkrem i sommerhalvåret ikke påvirker vitamin D-nivåene (Norval et al., 2009).
Anbefalinger:
- Det anbefales å følge solrådene fra Kreftforeningen for å unngå solforbrenninger. Bruk av solkrem med minst solfaktor 30 anbefales dersom annen form for fysisk beskyttelse ikke er mulig eller hensiktsmessig. (D)
- Bruk av solarium frarådes (B).
Sekundær forebygging
Sist faglig oppdatert: 05.07.2023
Kunnskap
Økt bevissthet og kunnskap i befolkningen om faresignaler ved melanom, gjør at personer med melanom kommer tidligere til diagnose i dag enn tidligere. Tynne melanom behandles kurativt med kirurgi og har svært god prognose. Antall tykke melanom, med dårlig prognose, er relativt konstant, og gruppen domineres av eldre menn. Tiltak for å nå denne gruppen mangler. Likeledes er etablerte kjennetegn på melanom som ABCD(E)-regelen, som er kjent blant leger og til dels i befolkningen, ikke tilstrekkelig dekkende for alle typer melanom (nodulære) (Robsahm et al., 2021), se kapittel Klinikk.
Økt kunnskap i befolkningen og blant leger er nødvendig for å oppnå tidligere deteksjon av melanom, og dermed bedret prognose. Norsk melanomgruppe ønsker å rette fokus mot økt kunnskap hos befolkningen og fastleger om risiko og faresignaler ved melanom.
Konstitusjonelle faktorer
Familiær opphopning/arv
Høyest risiko for melanom ser man blant de med særlig lys hud, rødt/lyst hår og fregner (Ghiasvand et al., 2019), og melanom vil derfor ha en tendens til å vise en viss familiær opphopning uten at det påvises endringer i enkeltgener. I tillegg finnes familiær opphopning av melanom som skyldes mutasjon i enkeltgener, se kapittel Genetikk.
Medfødte føflekker (kongenitte melanocyttiske nevi)
Medfødte føflekker forekommer hos ca. 1 % av nyfødte. Størrelsen angis ved PAS, projected adult size. Lesjoner < 1,5 cm PAS betegnes små, store nevi har PAS > 20 cm. I 2017 publiserte Kinsler og medarbeidere et 25-års materiale omfattende 450 pasienter med kongenitte melanocyttiske nevi, hvorav 12 utviklet melanom (Kinsler et al., 2017).
Solitære små og mellomstore kongenitte melanocyttiske nevi er ikke assosiert med vesentlig melanom-risiko, og trenger ikke spesiell oppfølging.
Multiple medfødte føflekker kan være assosiert med melanocyttiske lesjoner i sentralnervesystemet og eventuelt andre organ (kongenitalt melanocyttisk nevussyndrom, tidligere kalt nevrokutan melanose). Melanomutvikling var i Kinslers materiale assosiert med multiple kongenitte melanocyttiske nevi, og ofte store lesjoner med PAS > 60 cm. Melanomene forekom oftest i sentralnervesystemet, sjeldnere i hud.
Pasienter med store eller multiple kongenitte nevi følges opp i spesialisthelsetjenesten, som blant annet vurderer om det er indikasjon for MR av sentralnervesystemet.
Atypiske føflekker
Føflekker kan beskrives som atypiske basert på kliniske og/eller histologiske kriterier. Føflekker med histologisk atypi kalles ofte dysplastiske nevi, men nomenklaturen er sprikende.
En klinisk atypisk føflekk er minst 5 mm stor, asymmetrisk, har uregelmessig (ofte diffus) avgrensing og fargevariasjon. Eksisjon av atypiske føflekker anbefales ikke, med mindre det foreligger mistanke om malignitet. Dersom pasienter med multiple føflekker, hvorav noen atypiske, har melanom i nær familie (Atypisk nevussyndrom), bør pasienten henvises til hudlege for informasjon, opplæring og eventuell oppfølging (Soura et al., 2016).
Antall føflekker
Et stort antall føflekker (> 50) er en sterk risikofaktor for utvikling av melanom. En metaanalyse av 46 studier utført frem til 2002 bekreftet at personer med høyt antall føflekker og atypiske føflekker har økt risiko for utvikling av melanom (Gandini et al., 2005a).
Immunsuppresjon
Bruk av høye doser immundempende medikamenter (ikke kortikosteroider) har vist økt risiko for melanom (Berge et al., 2020). Disse pasientene bør få informasjon om gode solvaner samt egenundersøkelse av huden, og få tilbud om regelmessig undersøkelse av huden.
Screening
Tidligere studier har antydet at mortalitet av sykdommen faller etter innføring av systematisert screening (Katalinic et al., 2012), mens man senere har sett at dette ikke har vært en vedvarende nedgang og at det kan ha ulike årsaker (Stang et al., 2018). Utredning av potensielle gevinster og ulemper ved innføring av screening i Norge har vist at dette verken er et hensiktsmessig eller gjennomførbart tiltak (Halvorsen et al., 2018).
Anbefaling:
- Det er ønskelig å øke kunnskapsnivået hos befolkningen og leger om risiko og faresignaler ved melanom.
Pakkeforløp for kreft
Sist faglig oppdatert: 05.07.2023
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er et standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Les mer om Pakkeforløp for Melanom.
Det er egne Diagnoseveiledere for inngang til pakkeforløp for kreft.
Diagnostisering
Klinikk
Sist faglig oppdatert: 05.07.2023
Pasienten vil ofte oppsøke lege fordi hun eller han har lagt merke til endringer i en eksisterende føflekk, eller rask tilkomst av en ny, pigmentert lesjon. Endringene kan være økning i størrelse eller fargeforandring i en føflekk, eller tilkomst av blødning, sår eller endret sensasjon som kløe, smerter, stikninger etc. Ikke sjelden er det pasientens pårørende som har observert hudforandringen og oppfordret pasienten til å søke lege. Den kliniske presentasjon av melanom er variabel, men grundig anamnese sammenholdt med klinisk undersøkelse og eventuelt dermatoskopi, vil kunne bidra til at diagnosen mistenkes.
Anamnese
- Opplysninger om årsak til henvendelsen: debuttidspunkt/varighet, endring i form, størrelse eller farge, smerter/stikninger/kløe, blødning/sårdannelse.
- Opplysninger om kjente risikofaktorer: UV-eksponering, tidligere gjennomgått melanom eller annen hudkreft, familiær forekomst av melanom, immunsuppresjon.
Klinisk undersøkelse
Den kliniske undersøkelsen bygger først og fremst på inspeksjon og eventuelt dermatoskopi.
Pigmenterte lesjoner som avviker fra pasientens øvrige føflekker, og påkaller oppmerksomhet, kalles ofte «den stygge andungen» eller «the ugly duckling». Ugly duckling-tegnet er viktig for utvelgelse av suspekte lesjoner og er vist å kunne være et melanomsensitivt tegn (Goodson et al., 2009).
Ved undersøkelse av suspekte hudlesjoner vil en systematisk tilnærming være nyttig, for eksempel bruk av den såkalte ABCD(E)-regelen: (Abbasi et al., 2004; Friedman et al., 1985)
A for Asymmetri
B for Begrensning («border»)
C for Kulør («color»)
D for Diameter > 6 mm
E (for Endring)
For nodulære melanomer brukes EFG (Kelly et al., 2003):
E for Elevert
F for Fast («firm»)
G for Growing (voksende)
Det finnes en rekke algoritmer som brukes for dermatoskopi, og felles for alle er at vurdering av pigmentnettverk og fargevariasjoner står sentralt. Dermatoskopi krever erfaring og trening, og anbefales først og fremst brukt av hudleger og andre med spesiell kompetanse og interesse innen pigmenterte hudlesjoner. Ved bruk av dermatoskopi kan dermatologer med erfaring påvise melanom med høy sensitivitet og spesifisitet og antallet benigne lesjoner som må eksideres på grunn av usikkerhet reduseres (Goodson et al., 2009; Kittler et al., 2002; Vestergaard et al., 2008).
Det finnes flere leverandører av dataassisterte dermatoskopi-verktøy som beregner en indeks for risiko for malignitet i enkeltlesjoner. Foreløpig er ingen slike verktøy i rutinemessig bruk.
For pasienter i høyrisikogrupper kan helkroppsfotografier være nyttig for å følge utviklingen av føflekker, særlig med tanke på å oppdage nytilkomne lesjoner tidlig (Goodson et al., 2009).
Klinisk inndeling
Melanom deles inn i undergrupper ut fra kliniske og histologiske kriterier:
Superfisielt spredende melanom
Melanom av superfisiell spredningstype utgjør den største gruppen diagnostiserte melanom (>60 %). Melanomet presenterer seg som en lett forhøyet, uregelmessig avgrenset lesjon i huden med flere kulører, lys-mørk brun, blå-sort eller sort. Melanom av denne typen kan være i radial vekstfase i kort eller lang tid før de går over i vertikal vekstfase.
Nodulært melanom
Nodulære melanom utgjør ca. 15 % av melanomene og diagnostiseres hyppigst hos eldre, med overvekt av menn. Klinisk fremstår disse som en forhøyet knute med sort til blå farge, evt. med røde partier som stedvis kan bli blåhvite. Nodulære melanomer kan gi opphav til metastaser etter kort tid.
Lentigo maligna melanom
Lentigo maligna melanom viser seg ved at en lysebrun pigmentering (lentigo solare) i huden over år vokser og blir ujevnt pigmentert og mørkebrun/sort. Dersom histologien kun viser in situ-forandringer, brukes betegnelsen lentigo maligna, mens lentigo maligna melanom beskriver et infiltrerende melanom som klinisk ofte vil fremstå med lokal knutedannelse i et fra før brunpigmentert område. Melanom av denne typen finnes på soleksponert hud, oftest i ansiktet, hos eldre pasienter
Akralt melanom
Betegnelsen akralt melanom brukes om melanomer som utvikler seg distalt på ekstremitetene, på ikke-soleksponert hud som tær, fotsåler, fingre, håndflater eller under negler (subungualt melanom).
Melanom i negleapparat (subungualt melanom)
Subungualt melanom er en sjelden type melanom, og utgjør 1-3 % av alle melanomer hos kaukasiere (Littleton et al., 2019). Det oppstår i den proksimale del av negleapparatet (matrix) og sprer seg horisontalt til negleplate, neglefold og hyponykium (rett under neglekanten distalt), og vertikalt i neglesengen og videre ned i dermis. Tommelfinger og stortå er de vanligst affiserte. Utseende er veldig heterogent, og det finnes mange benigne differensialdiagnoser. Feiltolkning av tidlige funn er derfor vanlig. Det burde være lav terskel for henvisning til hudlege ved kroniske, uavklarte lesjoner under negl (Bristow et al., 2010).
De mest aktuelle differensialdiagnoser er nevus (spesielt hos barn og unge voksne), benign longitudinal melanonyki (misfarging av negl), subungualt hematom etter traume eller soppinfeksjon. Anamnese, klinisk og dermatoskopisk undersøkelse er avgjørende (Jefferson et al., 2012).
Klinisk fremstår melanom i negleapparat som irregulære brun/svarte streker eller misfarging av negleseng, som har forandret seg over tid. Subunguale melanom kan også være amelanotiske, og kan da feiltolkes som for eksempel kronisk paronyki eller innvokst negl. Negl-spesifikke «ABCDEF» retningslinjer er etablert for å diagnostisere subunguale melanomer (Levit et al., 2000):
A | Age: Range 20-90 y, peak 5th-7th decades Race: African-American, Native American, Asian |
B | Band (nail band): Pigment (Brown-Black) Breadth (≥3 mm) Border (irregular/blurred) |
C | Change: Rapid increase in size/growth rate of nail band Lack of Change: Failure of nail dystrophy to improve despite adequate treatment |
D | Digit involved: Thumb > hallux > index finger Single digit > multiple digits Dominant hand |
E | Extension: Extension of pigment to involve proximal or lateral nail fold (Hutchinson’s sign) or free edge of nail plate |
F | Family or personal history: Of previous melanoma or dysplastic nevus syndrome |
Disse kriteriene brukes kombinert med funn ved dermatoskopi. Dermatoskopisk ser man på bredden av pigmenteringen, hvor en bredde over 3 mm gir mistanke om melanom, over 6 mm bredde stor mistanke om melanom. Videre er flere enn én farge et faresignal (multicolor pigmentation) og asymmetri i pigmenteringen. Blekere farge mot periferien (border fading) er også et faresignal. Hutchinsons tegn (spredning av pigment til nærliggende hud) må også vurderes dermatoskopisk (Ohn et al., 2018).
Amelanotisk melanom
Alle melanom subtyper kan en sjelden gang forekomme som amelanotisk variant. Et nodulært amelanotisk melanom viser seg som en hurtig voksende nodulær tumor med hvitlig til rødlig farge, ev. med ulcerasjon eller blødning. Her blir EFG regelen spesielt viktig. En elevert lesjon som palperes fast og vokser må vurderes med tanke på melanom, selv om den ikke er pigmentert. Differensialdiagnostisk må muligheten for amelanotisk melanom særlig vurderes ved mistanke om pyogent granulom, hurtigvoksende fibromer eller kronisk sårdannelse i hud uten kjent årsak. Dette understøtter viktigheten av at alle lesjoner som fjernes, også av kosmetiske årsaker, sendes til histologisk undersøkelse.
Dermatoskopisk undersøkelse er vanligvis spesialistoppgave. (A)
Anbefalinger:
- Anamnese med vekt på lesjonens utvikling og ev. risikofaktorer kombinert med klinisk undersøkelse basert på ABCD(E)-, EFG- og ABCDEF (negl)-reglene.
Biopsi
Sist faglig oppdatert: 05.07.2023
Adekvat klinisk undersøkelse sammenholdt med anamnestiske opplysninger kan gi mistanke om melanom, men endelig diagnose stilles ved histopatologisk undersøkelse. Det er ønskelig at hele lesjonen fjernes, dersom mulig. Pigmenterte hudlesjoner som fjernes skal rutinemessig innsendes for histopatologisk undersøkelse, selv om det ikke er mistanke om malignitet, og derfor anbefales ikke fjerning med laser. Eksisjonsbiopsi av pigmenterte lesjoner i hud der utvikling av melanom ikke kan utelukkes bør kunne utføres av allmennlege eller hudlege, men ved spesielt store lesjoner, beliggenhet på kosmetisk utsatte steder, som for eksempel i ansikt, eller ved subunguale lesjoner, bør eksisjon foretas av kirurg/plastikkirurg.
Preparatet sendes til histologisk undersøkelse, og bør ved begrunnet mistanke om malignitet merkes CITO/pakkeforløp.
Eksisjonsbiopsi
Eksisjonsbiopsi av en melanomsuspekt hudlesjon gjøres ved at hele tumor fjernes med en ellipseformet incisjon 2-5 mm ut i normal hud og med en pute av subdermalt fett (Swetter et al., 2019). Dette gjør en histologisk undersøkelse av hele lesjonen mulig, med bestemmelse av Breslow tykkelse, som igjen danner grunnlag for videre kirurgisk behandling. Ved eksisjonsbiopsi på ekstremiteter, anbefales at elliptiske eksisjoner anlegges langsgående, da dette er optimalt for videre utvidet eksisjon og vaktpostprosedyren. Primæreksisjonen kan med fordel foregå i primærhelsetjenesten, men ved spesielle lokalisasjoner, eller andre omstendigheter, er det naturlig å henvise pasienten videre.
Begrenset (partiell) biopsi
Incisjonsbiopsi, stansebiopsi av deler av lesjonen eller overfladisk tangentiell biopsi (shavebiopsi) anbefales ikke (Ng et al., 2010; Swetter et al., 2019). I spesielle situasjoner, for eksempel større lesjoner med lokalisasjon i ansikt eller akralt, hos eldre, svekkede individer, eller ved mistanke om malignitetsutvikling i en liten del av en stor lesjon uegnet for eksisjon, kan det likevel være aktuelt med en begrenset biopsi (eksempelvis stansebiopsi). For biopsitakning negler, se nedenfor.
Dersom partiell biopsi er inadekvat til å planlegge videre behandling (utvidet eksisjon og SN), anbefales primæreksisjon (eksisjonsbiopsi med 2-5 mm marginer) før videre kirurgisk behandling.
Neglebiopsi
Korrekt biopsitaking er essensielt i diagnostikken ved mistanke om subungualt melanom. Avskrap og overfladiske biopsier fra negl er ikke diagnostiske og skal ikke brukes. Neglebiopsi krever inngående kunnskap om negleanatomi og neglekirurgi, og bør utføres av spesialister som er trent i dette. Det kan være nødvendig at hudleger samarbeider med ortopeder/håndkirurger/plastikkirurger om dette, der hudlegen stiller indikasjon til biopsering og angir hvor det skal biopseres. For adekvat diagnostikk ved longitudinal melanonyki må biopsi innebefatte neglematrix. Utfordringen er å få en diagnostisk biopsi og begrense risiko for sekvele etter kirurgi. Subunguale melanom kan vokse langsomt, så oppfølging kan være det riktige der mistanken om melanom er lav. Beroende på størrelse av lesjonen og beliggenhet, er forskjellige biopsier indisert (Jellinek, 2007). Neglavulsjon, enten total eller partiell, er som regel nødvendig for å visualisere og eksponere området som skal biopseres. Partiell avulsjon er mindre traumatisk og derfor oftest brukt.
Anbefalinger:
- Ved mistanke om melanom i hud anbefales eksisjonsbiopsi av hele lesjonen til histologisk undersøkelse. Kun i spesialtilfeller er det aktuelt med biopsi fra en begrenset del av lesjonen. (C)
Henvisningsrutiner
Sist faglig oppdatert: 05.07.2023
Dersom mistanken om melanom bekreftes histologisk, skal pasienten snarest mulig henvises til pakkeforløp for føflekkreft, til kirurg/plastikkirurg for utvidet eksisjon. Det er viktig at det kommer klart frem i henvisningen at det dreier seg om et melanom, og kopi av histologibesvarelse bør vedlegges.
Ved mistanke om melanom der allmennlege, eller hudlege av praktiske eller operasjonstekniske grunner (eks. større lesjoner, akrale/subunguale lesjoner) ikke kan utføre eksisjonsbiopsi, bør pasienten oftest henvises videre. Fra allmennlege skal pasienten vanligvis henvises til hudlege for diagnostisk avklaring, mens hudlegen vil henvise pasienten videre til kirurg/plastikkirurg.
Se kapittel om forløpstider i pakkeforløp for føflekkreft.
Anbefalinger:
- Diagnostisk biopsi kan gjøres av allmennlege/hudlege, ev. henvises pasienten direkte til hudlege/kirurg.
- Dersom mistanken om melanom bekreftes histologisk, skal pasienten snarest mulig henvises til pakkeforløp for føflekkreft til kirurg/plastikkirurg for utvidet eksisjon.
Histopatologisk diagnostikk
Sist faglig oppdatert: 05.07.2023
Klassifikasjon av melanom
Den tradisjonelle histologiske klassifikasjon av melanomer i hud (Clark et al., 1969) baserer seg i hovedsak på tilstedeværelsen av en in situ-komponent og utseendet av denne, eller fravær av en slik komponent, men også i noen grad på utseendet av den invasive komponenten. Enkelte melanomer kan være vanskelig å klassifisere. Melanomene inndeles i fire hovedtyper, i tillegg til sjeldnere varianter:
- Melanom av superfisiell spredningstype
- Nodulært melanom
- Lentigo maligna melanom
- Akralt melanom
In situ komponent
Ved melanom av superfisiell spredningstype har epidermis varierende tykkelse, men den er ikke atrofisk. Her sees vekst av oftest epiteloide, atypiske melanocytter langs basallaget, dels som større og mindre, konfluerende reder, dels også med lineær vekst. I tillegg sees pagetoid vekst av atypiske melanocytter oppover i epidermis, helt opp i granulærcellelaget. In situ-komponenten finnes utenfor den invasive del av tumor, enten utbredt hele veien rundt denne, eller bare som et asymmetrisk fokus. Det er viktig for korrekt klassifikasjon at tumor fjernes in toto.
Ved nodulært melanom er det ingen primær vekst av tumorceller i epidermis til siden for den invasive del av tumor, selv om en kan se sekundær innvekst i epitelet over tumor eller i kanten av denne. Epidermal affeksjon kan mangle helt.
Ved lentigo maligna er epidermis tynn og atrofisk, og det skal være tydelig tegn på aktinisk skade av bindevevet i underliggende dermis (solar elastose). Det sees en overveiende lineær, enlaget eller flerlaget vekst av atypiske epiteloide eller spolformede melanocytter langs basallaget av epidermis og øvre del av hårfolliklene, og enkelte reder kan sees.
Ved akralt melanom har epidermis preg av regionen (fotsåle/håndflate, tå/finger, subungualt), det vil si at den er tykk med forlengede retelister. Epidermis viser en kontinuerlig vekst av atypiske melanocytter, stedvis med rededannelse, som ofte er uskarpt avgrenset, dyskohesive og horisontalt orientert i forhold til epidermis. Vekst av atypiske melanocytter til høyere epidermallag (pagatoid vekst) befinner seg som regel langs hudrygger, svarende til pigmenteringsmønster. Dette er i motsetning til akrale nevi hvor pagatoid vekst sees langs furene. Av den grunn, biopsitakning perpendikulært for hudrygger og furer er essensielt for å skille mellom akrale nevi og melanomer histologisk (Nakamura et al., 2018).
En subgruppe av akralt melanom er subungualt melanom; en sjelden type som oppstår i neglematrix og sprer seg horisontalt til negleplate, neglefold og hyponykium, og vertikalt i dermis som melanomer i andre anatomisk lokalisering. Histologisk undersøkelse viser kontinuerlig voksende atypiske melanocytter lentiginøst (Littleton et al., 2019).
Invasiv komponent
Den invasive del av melanomet kan variere betydelig i utseende, avhengig av type, men også innenfor hver hovedtype av melanomer. Det kan være diffus eller knutet vekst av tumorceller, og disse kan være epiteloide eller spolformede, små eller store, av og til flerkjernede. Uvanlige celletyper kan sees, som signetringceller og formasjoner som ligner kjertler, og kar kan også forekomme. Cellene kan inneholde tydelig melaninpigment eller mangle dette (amelanotisk melanom). Det siste gjelder særlig nodulære melanomer. Desmoplastisk melanom er en variant av spolcellet melanom som alltid er i vertikal vekstfase (se nedenfor) og ofte amelanotisk. Tumor kan utgå fra lentigo maligna, og finnes særlig på hode og hals hos eldre. Det sees dyp og diffus (ofte neurotrop) infiltrasjon i et cellerikt, fibrøst stroma, og dette krever særlig stor eksisjonsbredde.
Hvis det dermale tumorvevet ikke henger tydelig fast på undersiden av epidermis, og især hvis man samtidig ikke finner noen epidermal tumorkomponent, bør patologen vurdere mulighet for melanommetastase. Klinisk korrelat er nødvendig for å fremme riktig diagnose. Hvis man i en slik situasjon heller ikke finner sikkert melaninpigment, bør det utføres immunhistokjemisk undersøkelse for å vise at det foreligger en melanocytt-derivert tumor. Andre tilstander, som funn av regressive forandringer superfisielt i dermis, kan representere regresjon i en primærtumor, og bør derfor ikke feiltolkes som metastase. Samme gjelder andre type «sjeldnere» melanomer for eks. melanomer i blå- eller kongenitte nevi som vanligvis mangler epidermal komponent.
Karakterisering av melanom
Histologisk informasjon er viktig for behandling og videre vurdering av melanompasienter. Mengden av tumorvev indikerer den forventede prognose. De viktigste variablene i henhold til siste TNM-klassifikasjon (AJCC 8. utg.) er tumortykkelse og ulcerasjon, men infiltrasjonsdybde etter Clark, mitosetall og andre forhold bør også vurderes og rapporteres (se nedenfor).
I siste utgave av TNM-klassifikasjonen foreligger det visse endringer når det gjelder hvilke patologivariable som kreves for pTNM kategorisering i forhold til tidligere. Clark’s infiltrasjonsnivå er så og si ute av klassifikasjonen, mens infiltrasjonsdybde og ulcerasjon har erstattet mitosetall for subkategorisering av pT1. Dette betyr ikke at Clark’s nivå og andre patologivariable ikke har verdi og ikke skal rapporteres (se senere kommentarer).
1. Tumortykkelse (ad modum Breslow)
Tumortykkelse regnes fortsatt for å være den viktigste histologiske enkeltfaktor. Denne måles (helst med mikrometer montert i mikroskopet) som vertikal avstand fra toppen av granulærcellelaget til den dypeste dermale (invasive) tumorcelle, og angis i millimeter med én desimal. Satellitter i dermis skal ikke inkluderes (Gershenwald et al., 2017). Ved ulcerasjon skal det måles fra bunnen av ulcerasjonen. Grenselagsutbredelse langs hårfollikler skal ikke regnes med. Vurderingen av tumortykkelse er ofte usikker/umulig når det foreligger regressive forandringer i tumor; en kan her angi to mål, ett medregnet regressiv sone. Det kan også være problematisk å vurdere tykkelse dersom man har en antatt benign komponent i tillegg og grensen mellom de to ikke er distinkt. Ved stor usikkerhet bør dette drøftes, og man kan i tillegg til tumormål angi maksimal tykkelse.
2. Infiltrasjonsdybde (ad modum Clark)
Nivå 1: Kun intraepidermal vekst (in situ).
Nivå 2: Infiltrasjon i øvre papillære del av dermis.
Nivå 3: Den infiltrerende vekst utfyller hele den papillære dermis som er fortykket.
Karpleksus på grensen til underliggende retikulære dermis presses nedover.
Nivå 4: Infiltrasjon ned i retikulære dermis.
Nivå 5: Infiltrasjon ned i subkutant fettvev.
Patologen skal tilse at de fremstilte histologiske snitt er representative for tumors vekstmåte og utbredelse, forutsatt at hele tumor er sendt inn. Snittene skal omfatte området med dypest infiltrasjon; som oftest er fornuftig å støpe hele tumor. Hvis det foreligger et in situ-melanom (nivå 1) er det ingen fare for metastasering. Stort sett forverres pasientens prognose med økende dybdevekst av tumor. I tillegg vil tykkelse av hudens ulike lag variere etter lokalisasjon, og dette tilsier at både Breslow og Clark bør rapporteres.
I siste utgave av TNM-klassifikasjonen (AJCC 8. utg.) har infiltrasjonsdybde og ulcerasjon erstattet infiltrasjondybde og mitosetall som grunnlag for subkategorisering av pT1 (Gershenwald et al., 2017; Keung et al., 2018).
Det er fortsatt slik at ved polyppøse melanomer og ved dype ulcerasjoner kan det foreligge et misforhold mellom Breslow og Clark, og det er i slike situasjoner viktig at begge parameterne oppgis. Melanom som oppstår i follikkelepitel med infiltrasjon ned til subkutant fettvev regnes ikke som nivå 5.
3. Tumors vekstfase
Clark og medarbeidere har beskrevet hvordan melanomer gjennomgår forskjellige faser under sin utvikling, og begrepene horisontal (radial) og vertikal vekstfase ble lansert (Clark et al., 1989). Melanomer i horisontal vekstfase regnes for å være «lavgradig» maligne med et svært lite metastaseringspotensial og omfatter såvel in situ-melanomer som melanomer med begrenset invasiv vekst (som regel kun i øvre del av dermis). Melanomer i vertikal vekstfase må oppfattes som mer «høygradig» maligne med økt risiko for metastasering.
For tynne svulster med en relativt begrenset invasiv komponent er det viktig å avgjøre hvorvidt det foreligger horisontal eller vertikal vekstfase. Ved vertikal vekstfase finnes større reder og dominante knuter, og tumorcelle-aggregatene skal være større enn det største epidermale redet. Funn av dermale mitoser (i sikre tumorceller) indikerer en vertikal fase. Disse forandringene kan være fokale. Selv om de fleste melanomer som eksideres nå er relativt tynne, kan man påvise vertikal vekstfase blant melanomer helt ned til 0,5 mm i tykkelse. Det er særlig viktig å vurdere vekstfase ved tynne melanomer <1.5 mm, Clark’s nivå 2–3. Derved kan man skille ut lesjoner i vertikal vekstfase med forventet dårligere prognose enn tilsvarende melanom i horisontal vekstfase med samme tykkelse.
I tilfeller der man f.eks. har stilt diagnosen «Invasivt melanom, superfisiell spredningstype, tykkelse 0,7 mm», kan det derfor i beskrivelsen presiseres om det histologiske bildet indikerer horisontal eller vertikal vekstfase.
4. Ulcerasjon
Uavhengig av tumortykkelse, er ulcerasjon forbundet med dårligere prognose og er inkludert i TNM-systemet. Ulcerasjon foreligger ved: defekt gjennom hele epidermis, inkludert stratum corneum og basalmembranen, og tilstedeværelse av reaksjon i sårflaten som fibrin og granulocytter. Ulcerasjon anvendes til subklassifisering av T1-4.
5. Mitosetall
I henhold til siste utgave av TNM-klassifikasjonen (AJCC 8. utg.) anbefales det at mitosetall angis ved alle primære melanomer. Mitosetall er derimot ikke lenger obligat for subklassifisering av pT1. Kategori pT1 (tykkelse £ 1.0 mm) inndeles i pT1a ved manglende ulcerasjon og < 0,8 mm; pT1b foreligger ved enten ulcerasjon uavhengig av infiltrasjonsdybde, eller infiltrasjonsdybde ≥ 0,8 mm £ 1,0 mm.
Vurdering av mitosetall: Området i den dermale (invasive) tumorkomponenten med mest mitotisk aktivitet identifiseres («hot spot»). Deretter telles et antall synsfelt (x400) som i sum minst svarer til 1 mm2 (synsfelt legges «kant-i-kant»). Dette området er ofte ved basis av tumor. Dersom en ikke finner noe «hot spot», anbefales det at man finner et synsfelt med minst 1 mitose og velger dette som startpunkt for deretter å legge til tilstrekkelig antall synsfelt (for minst 1 mm2). Mitosetallet regnes deretter ut som mitoser/mm2. Synsfeltet som benyttes skal måles for hvert mikroskop slik at nøyaktig utregning gjøres (slik som praksis er for mitosetelling i forbindelse med gradering av mammakarsinomer).
Dersom den invasive komponent er mindre enn 1 mm2 i areal, kan en velge å angi antall observerte mitoser og angi dette som et minimumstall per 1 mm2, eller alternativt kan en angi om mitoser er til stede eller ikke. I slike tilfeller kan en også fremstille flere parallelle snitt fra tumorblokken.
6. Andre faktorer ved primærtumor
Histologisk type: I henhold til tradisjonell klassifikasjon av melanomer gir tumortypen i seg selv ingen selvstendig informasjon om pasientens prognose. Imidlertid vil nodulære melanomer ofte være relativt tykke med ulcerert overflate, og dermed er denne typen knyttet til en dårligere prognose. Det motsatte er tilfellet ved f.eks. lentigo maligna melanom, som vanligvis utvikler seg fra lentigo maligna over lang tid og derfor gjennomgående er tynne. Histologisk type har også epidemiologisk interesse og registreres i Nasjonalt kvalitetsregister for melanom (Kreftregisteret, 2022).
Karinnvekst: Denne variabel er i en rekke studier vist å ha prognostisk betydning og bør derfor registreres.
Lymfocyttinvasjon (Tumorinfiltrerende lymfocytter (TIL)): Dette er også vist å ha prognostisk betydning og bør derfor kommenteres i beskrivelsen. Det er viktig at det er tumorinfiltrerende lymfocytter som skal vurderes og ikke peritumoral lymfocyttær betennelse (Edge et al., 2010; Mihm et al., 2015).
En rekke andre histologiske variable og tumorbiologiske markører er studert i melanomer, og en del av disse har prognostisk betydning. Tilstedeværelse av nekrose og regresjon bør beskrives, og tumorsatellitter bør også registreres. Funn av neurotropisme (tumorvekst langs nerver) bør rapporteres da dette kan ha direkte betydning for kirurgisk behandling.
Mikrosatellitter: Defineres som en lokal melanommetastase som ikke er klinisk erkjennelig. Histologisk fremstår som en ansamling av maligne melanocytter adskilt fra hoved tumor med upåfallende stroma (dvs. uten fibrose eller inflammasjon). I følge den siste TNM klassifisering (AJCC 8. utg.), er det ikke lenge minstekrav for avstand fra hoved lesjonen (men generelt innen 2 cm), heller ikke krav for minste størrelse på ansamling. Mikrosatellitter kan sees i dermis, subkutant fettvev, eller dypere. For å verifisere om ansamlinger er reelt adskilt fra tumor, anbefales nedskjæring av representativt snitt (Gershenwald et al., 2017).
In-transit metastaser: Dette er tumorreder eller knuter i hud eller underhud, hvor avstand fra primærtumor er mer enn 2 cm, men innenfor området til regionale lymfeknuter.
Tumorbiologiske markører: Betydningen av tumorbiologiske markører, for eksempel proliferasjonsmarkøren Ki-67, er ikke endelig klarlagt, selv om denne kan være til noe hjelp ved vurdering av usikre lesjoner (benign/malign).
En annen biologisk markør er Programmed Cell Death Ligand-1 (PD-L1). Denne markøren er ikke enda etablert som prediktiv markør for respons til immunterapi, men er nylig påvist å være assosiert med bedre overlevelse når utrykket av denne markøren i tumorcellene er lav eller negativ (<1%). Dette gjelder først og fremst de metastatiske inoperable melanomer behandlet med kombinert immunterapi, sammenlignet med monoterapi (Daud et al., 2016; Larkin et al., 2019; Weber et al., 2017). Per i dag foreligger ingen klare retningslinjer for histologisk tolkning av PD-L1 positivitet i metastaser fra melanomer. Det anbefales derfor å rapportere andel positive tumorceller i prosent (%). Positive tumorceller omfatter de med både partielt eller fullstendig membranøs positivitet. Alle grader av intensitet (svak, moderat eller sterk) er gjeldende. PD-L1 undersøkelse skal utføres etter rekvisisjon fra klinikker.
BRAF mutasjonsstatus bør kartlegges ved påvisning av første metastase fra melanom. Om immunhistokjemisk undersøkelse for BRAF anvendes, bør videre verifisering av BRAF genmutasjon gjøres gjennom ytterliggere molekylær analyse. Undersøkelsen bør utføres på metastatisk vev, evt. på primærtumor ved tilfeller med sparsomt metastatisk vev.
Ved påvisning av slimhinnemelanomer, bør mutasjonsstatus av NRAS og andre gener som KIT kartlegges på primærtumor ved diagnosesutgangspunkt.
For flere detaljer vises det til «Veileder i biopsibesvarelse av maligne svulster» (Den norske patalogforening, 2016), nyere tekstbøker, TNM-klassifikasjonen (AJCC 8. utg.) og originallitteratur.
7. Lymfeknuter
Ved utført lymfeknutetoalette bør det undersøkes henholdsvis minst 5/10/20 lymfeknuter for lyske-/ axille- og halsglandetoalett, hvis mulig. Det angis hvor mange lymfeknuter som er undersøkt, og hvor mange som er tumorinfiltrert. Det er hevdet at ekstra-nodal tumorvekst har betydning for prognose og dermed behandling, men dette er så langt ikke godt dokumentert. Ekstranodal vekst angis i histolopatologisk undersøkelse.
Histologisk undersøkelse av vaktpostlymfeknuter (Sentinel node biopsi): Det har vært en del diskusjon om hvordan lymfeknutene skal snittes, for eksempel hvor mange nivå som skal undersøkes, og bruk av immunhistokjemi. Det foreligger nå retningslinjer fra EORTC (Chakera et al., 2009), som er oppdatert i de nye retningslinjer fra EORTC 2019 (Cook et al., 2019), og det anbefales at disse i hovedsak følges.
Undersøkelsen gjøres på fikserte og paraffininnstøpte lymfeknuter. Kirurgene sender vanligvis inn 1 eller flere knuter. Disse friprepareres og bør måles (lengde), og det er viktig at ikke kapselen rives av under prepareringen. Hver lymfeknute som er mer enn 3–4 mm tykk bør deles i to langs hilusplan. Lymfeknutene legges i separat blokk (begge halvdeler i samme blokk hvis mulig); store lymfeknuter kan fordeles på flere blokker ved behov.
Lymfeknutene snittes slik at periferien av knutene med intakt kapsel kommer med i sin helhet.
EORTC angir at hver lymfeknute, eller begge halvdeler plassert i 1 blokk, snittes i 6 nivå, hvert nivå adskilt av enten50 µm (for de små lymfeknuter) eller større avstand, for eks. opptil 300 µm (for de store lymfeknuter). Slik justering av snitt-uttak i forhold til lymfeknutestørrelsen skal sikre deteksjon av tumorceller, for å oppnå et nøyaktig estimat av tumorvolum i lymfeknuten. Det tas 4 snitt fra hvert nivå, ett til HE(S), ett til immunhistokjemisk undersøkelse (for eks. S-100 eller Melan-A); to snitt oppbevares til senere.
Metastaser beskrives med hensyn til utseende (enkeltceller eller cellegrupper). Multilfokale metastaser rapporteres, og antall foci med metastaser angis i tall. Størrelse på den største ansamling måles (mm med 1 desimal). Lokalisasjon (randsinus/subkapsulær, parenchymatøs) og ekstranodal spredning skal også rapporteres.
I henhold til siste utgave av TNM-klassifikasjonen (AJCC 8. utg.) angis det at metastaser som kun er detektert immunhistokjemisk telles med (forutsetter minst 1 «melanocytt-spesifikk» markør (Melan-A, HMB-45, MART 1, SOX10), og det er ikke en nedre grense for hva som kvalifiserer for lymfeknute positivitet.
Diagnoseelementer
I henhold til siste utgave av TNM-klassifikasjonen (AJCC 8. utg), er tykkelse ad modum Breslow og ulcerasjon obligate variabler. Flere andre parametre bør også vurderes og beskrives, og det kan være naturlig å inkludere følgende som hovedrutine:
- Histologisk type, invasiv eller in situ, vekstfase
- Tumortykkelse, ved invasjon (Breslow), i tiendedels mm
- Infiltrasjonsdybde (Clark’s nivå 1–5)
- Ulcerasjon (påvist/ikke påvist)
- Mitosetall (omregnet til mitoser/mm2)
- Andre faktorer (karinnvekst, lymfocyttinfiltrasjon, nevrotropisme, mikrosatellitter, og funn av preeksisterende benign nevus)
- Reseksjonsrender
- Lymfeknutestatus
Anbefalinger:
- Patologisvar bør besværes med Breslow tykkelse og ulcerasjon. Andre histologiske funn som histologisk type, infiltrasjonsdybde (Clark), mitosetall, karinnvekst, lymfocyttinvasjon, mikrosatellitter og render bør også reporteres.
- Kartlegging av somatisk mutasjon for BRAF (ved metastaserende melanom) og NRAS, KIT (ved slimhinnemelanom) er viktig for kategorisering og videre behandling.
Utredning for stadieinndeling
Sist faglig oppdatert: 05.07.2023
Etter melanomdiagnose vurderes primærmelanom >=pT2a for utredning med vaktpostlymfeknutekirurgi for best mulig stadieinndeling.
TNM og stadiegrupperinger
Sist faglig oppdatert: 05.07.2023
Følgende oversikt er basert på TNM Classification of Malignant tumors, 8. utg (Brierley et al., 2017), og 8. utgave av AJCC (American Joint Commitee of cancer) stadieinndelingsmanual (Edge et al., 2010)
| T | Tykkelse (mm.) | Ulcerasjon / Mitoser | |
| Tis | Ia | Ia |
| T1 | ≤ 1.0 | a: Uten ulcerasjon og < 0,8 mm b: Med ulcerasjon og < 0,8 mm eller 0,8–1,0 mm |
| T2 | > 1.0–2.0 | a: Uten ulcerasjon b: Med ulcerasjon |
| T3 | > 2.0–4.0 | a: Uten ulcerasjon b: Med ulcerasjon |
| T4 | > 4.0 | a: Uten ulcerasjon b: Med ulcerasjon |
N |
| Antall pos. knuter | Nodal metastatisk byrde |
| N0 | 0 | Ia |
| N1 | 1 | a: klinisk okkult b: klinisk påvisbar c: Mikrosatelitt, satellitt eller in-transitmetastase uten regionale lymfeknutemetastaser |
| N2 | 2–3 | a: klinisk okkult b: klinisk påvisbar c: in-transit metastaser/ satellitter/mikrosatelitter med bare èn regional lymfeknutemetastase |
| N3 | Metastaser til 4 eller flere lymfeknuter eller sammenvokste lymfeknuter, eller både in-transit/ satellitt/mikrosatelitt metastase(r) og med to eller flere regionale lymfeknutemetastaser | a: klinisk okkulte b: klinisk påvisbare c: Saterlitt(er), Mikrosatelitt (er) eller in-transitmetastse(r) med to eller flere regionale lymfeknutemetastaser |
M |
| Lokalisasjon | Serum LDγ |
| M0 | Ingen metastaser | Ia |
| M1a | Fjernmetastaser i hud/ subcutis (inkl muskel) eller ikke-regionale lymfeknuter | LD ikke kjent/angitt |
| M1a (0) |
| Ikke forhøyet |
| M1a (1) |
| Forhøyet |
| M1b | Lungemetastaser med eller uten M1a metastaser | LD ikke kjent/angitt forts. |
| M1b (0) |
| Ikke forhøyet |
| M1b(1) |
| Forhøyet |
| M1c | Andre fjernmetastaser utenfor sentralnervesystemet, med eller uten M1a eller M1b metastaser | LD ikke kjent/angitt |
| M1c(0) |
| Ikke forhøyet |
| M1c (1) |
| Forhøyet |
| M1d | Fjernmetastase til sentralnervesystemet med eller uten metastaser til andre organsystem | LD ikke kjent/angitt |
| M1d(0) |
| Ikke forhøyet |
| M1d(1) |
| Forhøyet |
ia: ikke anvendelig
γ: Laktat dehydrogenase
Klinisk stadium α |
| Patologisk stadium β | ||||||
|---|---|---|---|---|---|---|---|---|
| T | N | M |
|
| T | N | M |
| T | N | M |
|
| T | N | M |
0 | Tis | N0 | M0 |
| 0 | Tis | N0 | M0 |
IA | T1a | N0 | M0 |
| IA | T1a | N0 | M0 |
IB | T1b T2a | N0 N0 | M0 M0 |
| IA IB | T1b T2a | N0 N0 | M0 M0 |
IIA | T2b T3a | N0 N0 | M0 M0 |
| IIA | T2b T3a | N0 N0 | M0 M0 |
IIB | T3b T4a | N0 N0 | M0 M0 |
| IIB | T3b T4a | N0 N0 | M0 M0 |
IIC | T4b | N0 | M0 |
| IIC | T4b | N0 | M0 |
III | Hvilken som helst T | ≥ N1 | M0 |
| IIIA | T1a/b-T2a | N1a el N2a | M0 M0 |
IV | Hvilken som helst T | Hvilken som helst N | M1a-d |
| IIIB | T0 | N1b, N1c | M0 |
T1a/b-T2a | N1b/c el N2b | M0 | ||||||
T2b/T3a | N1a-N2b | M0 | ||||||
|
|
|
|
| IIIC | T0 | N2b, N2c, N3b el N3c | M0 |
|
|
|
|
|
| T1a-T3a | N2c el N3a/b/c | M0 |
|
|
|
|
|
| T3b/T4a | ≥ N1a | M0 |
|
|
|
|
|
| T4b | N1a-N2c | M0 |
|
|
|
|
| IIID | T4b | N3a/b/c | M0 |
|
|
|
|
| IV | Hvilken som helst T, inkl Tis | Hvilken som helst N | M1a-d |
| T Category | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| T0 | T1a | T1b | T2a | T2b | T3a | T3b | T4a | T4b | |
| N Category | N1a | N/A | A | A | A | B | B | C | C | C |
N1b | B | B | B | B | B | B | C | C | C | |
N1c | B | B | B | B | B | B | C | C | C | |
N2a | N/A | A | A | A | B | B | C | C | C | |
N2b | C | B | B | B | B | B | C | C | C | |
N2c | C | C | C | C | C | C | C | C | C | |
N3a | N/A | C | C | C | C | C | C | C | D | |
N3b | C | C | C | C | C | C | C | C | D | |
N3c | C | C | C | C | C | C | C | C | D | |
Instructions
- Select patient's N category at left of chart
- Select patient's T category at top of chart
- Note letter at the intersection of T&N on grid
- Determine patient's AJCC stage using legend
N/A= Not assigned. Please see manual for details
Legend:
A Stage IIIA
B Stage IIIB
C Stage IIIC
D Stage IIID
Bildediagnostikk
Sist faglig oppdatert: 05.07.2023
Generelt
Anbefalingene for bruk av bildediagnostikk ved stadieinndeling er basert på eksisterende kunnskap om risiko for fjernmetastaser på diagnosetidspunktet. Risikoen er avhengig av både T- og N-status (Balch et al., 2004). Avgjørelsen om indikasjon for bildediagnostikk tas på bakgrunn av klinisk undersøkelse og patologiresultat etter tumoreksisjon og eventuell vaktpostprosedyre (SNB).
Det finnes ingen evidens for økt overlevelse som effekt av bildediagnostikk ved melanom, hverken i forbindelse med stadieinndeling eller i oppfølging. De fleste studier som er utført er av retrospektiv art, og prospektive, randomiserte studier av høy kvalitet mangler. Det betyr at anbefalingene i hovedsak er basert på studier med lavt evidensnivå. Det er i stor grad benyttet oppdaterte retningslinjer fra Australia og USA som grunnlag (Coit et al., 2019; Morton et al., 2018; Saw et al., 2018).
I høyrisikogruppen for utvikling av fjernmetastaser medregnes de tykkeste melanomene med ulcerasjon (stadium IIC) og melanomer med klinisk detekterbare lymfeknutemetastaser (stadium IIIB, IIIC og IIID)(Balch et al., 2004). I tillegg kommer gruppen med klinisk erkjent fjernmetastasering (stadium IV), som kan ha ytterligere okkult metastatisk sykdom.
De fleste studier viser at PET/CT har høyere sensitivitet og spesifisitet enn CT for deteksjon av metastaser fra melanom (Morton et al., 2018; Xing et al., 2011). Metoden avbilder dessuten hele kroppen, i motsetning til CT-undersøkelsen, der ekstremitetene utelates. FDG PET/CT kan være nyttig ved deteksjon av okkulte metastaser fra melanom hos asymptomatiske pasienter i høyrisikogruppen(Rodriguez Rivera et al., 2014). Metodens sensitivitet er avhengig av lesjonenes størrelse, lokalisasjon og opptaksintensitet. Lesjoner med diameter < 3–5 mm kan ikke karakteriseres.
Sensitiviteten for å avdekke hjernemetastaser er begrenset ved både PET/CT og CT, mens MR caput med intravenøs kontrast både har høy sensitivitet og spesifisitet for påvisning av spredning til hjerneparenkymet(Bochev et al., 2012). Tidlig diagnostikk av metastaser til CNS erviktig fordi symptomatiske hjernemetastaser er assosiert med betydelig morbiditet og dårlig overlevelse, samtidig som utfall av behandling er vesentlig bedre hos pasienter med lav CNS-tumorbyrde og /eller asymptomatiske metastaser (Goyal et al., 2015). Hjernemetastaser forekommer hos <5 % av pasienter med stadium I-IIIB sykdom, og bør derfor bare benyttes til stadieinndeling i høyrisikogruppen(Romano et al., 2010).
Ultralyd av regionale lymfeknutestasjoner før SN-biopsi er hensiktsmessig kun ved klinisk mistanke om lymfeknutemetastaser (Chai et al., 2012).
Stadium I-IIB
Se tabell 1 - Stadiekategorier for melanom
Nytteverdien av PET/CT er liten for pasienter med tynne til intermediært tykke melanomer, og bildediagnostikk medfører svært sjelden endring i den kliniske håndteringen (Morton et al., 2018; Schroer-Gunther et al., 2012). Falske positive funn kan medføre unødvendige invasive prosedyrer og/eller belastende kontrollopplegg med betydelig innvirkning på livskvalitet. I tillegg kommer hensynet til strålebelastning (Morton et al., 2018).
Rutinemessig PET/CT eller MR caput anbefales ikke for stadieinndeling i denne pasientgruppen (Morton et al., 2018).
Stadium IIC
Se tabell 2 - Stadiegruppering for melanom
Studier viser ingen klinisk nytteverdi ved bruk av PET/CT ved stadium I og II-sykdom sett under ett, men basert på tall for 10-års overlevelse, skiller stadium IIC seg ut som en høyrisikogruppe (Balch et al., 2004; Nasjonalt kvalitetsregister for melanom, 2021). Ifølge tall fra melanomregisterets årsrapport fra 2020 er 10 års relativ overlevelse 103% for pT1 melanom i Norge, mens 5 års relativ overlevelse ved stadium IIC er henholdsvis 58% for menn og 63% for kvinner (Keung et al., 2018). I American Joint Committee on Cancer Eighth Edition Cancer Staging Manual, er tall for 10-års overlevelse ved T1a- og T4b-melanomer henholdsvis 98 % og 75 % (Gershenwald et al., 2018).
Flere studier viser vesentlig nytteverdi av PET/CT for metastasedeteksjon ved tykke melanomer med ulcerasjon (T4b) (Morton et al., 2018; Schroer-Gunther et al., 2012).
Bruk av PET/CT for stadieinndeling ved stadium IIC-sykdom anbefales.
Stadium III
Stadium IIIA
Se tabell 3 - Melanoma stage III Subgrouops
Retrospektive studier viser at bildediagnostikk (PET/CT eller CT) påviser okkulte metastaser hos kun 0,5–3,7 % i denne pasientgruppen (Gold et al., 2007; Holtkamp et al., 2017; Morton et al., 2018), Prognose hva gjelder 10-års overlevelse er bedre enn ved stadium IIC-sykdom. I henhold til melanomregisterets årsrapport 2020 er 5- års relativ overlevelse ved stadium IIIA om lag 80% (med betydelig spredning i kondfidensintervallet), mens den ved stadium IIC er om lag 60% (Nasjonalt kvalitetsregister for melanom, 2021).
Bildediagnostikk medfører svært sjelden endring i den kliniske håndteringen. Falske positive funn kan medføre unødvendige invasive prosedyrer og/eller belastende kontrollopplegg, med betydelig innvirkning på livskvalitet. I tillegg kommer hensynet til strålebelastning (Holtkamp et al., 2017).
Rutinemessig bruk av PET/CT og MR caput ved stadieinndeling for stadium IIIA-sykdom anbefales ikke (Saw et al., 2018).
Ved særlige forhold (for eks. ung alder, stort mikrometastatisk fokus i SN (>2 mm), ekstranodal vekst, multiple mikrofoci i en lymfeknute, flere positive lymfeknuter) anbefales indikasjon for bildediagnostikk diskutert på individuell basis, og i forbindelse med MDT-melanommøter.
Ved oppstart av adjuvant behandling utredes IIIA-pasienten som IIIB.
Stadium IIIB – IIID
Se tabell 3 - Melanoma stage III Subgrouops
PET/CT har vesentlig nytteverdi for påvisning av fjernmetastaser hos pasienter med klinisk palpable lymfeknutemetastaser(Rodriguez Rivera et al., 2014; Saw et al., 2018). Studier viser at bruk av PET/CT på diagnosetidspunktet medfører endret behandlingsstrategi hos 19–35 % av pasienter i denne gruppen (Bastiaannet et al., 2009; Saw et al., 2018).PET/CT anbefales før kirurgi ved stadium IIIB-IIID, og MR caput anbefales for staging ved stadium IIIB – IIID-sykdom (Saw et al., 2018). Pasientene er aktuelle for vurdering av adjuvant behandling.
Klinisk oppdagede, metastasesuspekte lymfeknuter skal helst undersøkes cytologisk før henvisning til PET/CT.
Stadium IV
Se tabell 1 - Stadiekategorier for melanom
Disse pasientene er ofte kandidater for systemisk terapi, og bildediagnostikk er nødvendig for å få oversikt over tumorutbredelse før behandlingsstart. Studier viser at utredning med PET/CT og MR kan føre til endret behandlingsopplegg for denne pasientgruppen, spesielt når det i utgangspunktet er planlagt kirurgisk inngrep (Millward et al., 2018; Schule et al., 2016). Påvisning av hjernemetastaser vil også kunne endre behandlingsstrategi.
PET/CT og MR caput anbefales for fastsettelse av tumorutbredelse ved stadium IV-sykdom.
Stadium | PET/CT | MR caput |
|---|---|---|
I-IIB | nei | nei |
IIC | ja | nei |
IIIA | nei | nei |
IIIB | ja | ja |
IIIC | ja | ja |
IIID | ja | ja |
IV | ja | ja |
Melanom multidisiplinært team (MDT)
Sist faglig oppdatert: 05.07.2023
Melanom-MDT bør ha ukentlige møter for å sikre god utredning og behandling av melanompasienter. Det foreligger ikke evidens for effekten av MDT-møter for melanom, men slike møter er vist å øke overlevelse og behandlingskvalitet ved andre kreftformer (Kesson et al., 2012; Sainsbury et al., 1995), og antas å ha samme virkning for melanompasienter.
Tverrfaglig tilnærming gjør at behov for videre utredning kan avklares og behandlingsplan legges, med gevinst i unngått tidstap. Innlemming i kliniske studier kan vurderes.
Pasienter i stadium III og IV-situasjon bør diskuteres, i likhet med problemstillinger som primærtumores i uvanlig lokalisasjon samt vanskelige patologi- og/eller bildeutredninger. Pasienter med stadium I og II-sykdom behøver normalt ikke å diskuteres i MDT-møte.
Spesielt utfordrende kasus kan henvises til universitetsykehusenes melanom-MDT.
Fastlege og involverte lokalsykehus får tilbakemelding med konklusjon fra møtet.
I melanom-MDT bør følgende personer stille:
- Forløpskoordinator
- Spesialist i plastikkirurgi/annen spesialist med erfaring med melanomkirurgi
- Spesialist i onkologi med erfaring med behandling av melanompasienter
- Spesialist i radiologi
- Spesialist i nukleærmedisin
- Spesialist i hudpatologi
Andre spesialiteter deltar ved behov.
For lege i spesialisering som følger melanompasienter er møtene en nyttig læringsarena; legen får øvelse i å presentere pasienter, skrive referat og følge opp MDT-vedtak.
Anbefalinger:
- PET/CT anbefales før kirurgi ved stadium IIC samt IIIB-IIID, og MR caput anbefales for stadieinndeling ved stadium IIIB-IIID-sykdom (Saw et al., 2018). Pasientene er aktuelle for vurdering av adjuvant behandling.
- PET/CT og MR caput anbefales ved planlagt adjuvant behandling ved stadium IIIA – sykdom.
- PET/CT og MR caput anbefales for fastsettelse av tumorutbredelse ved stadium IV-sykdom.
- Pasienter med metastaser, primærtumor med uvanlig lokalisasjon eller komplisert sykehistorie bør tas opp på melanom-MDT. Utfordrende kasus kan henvises til universitetssykehusenes melanom-MDT.
Genetikk
Familiært melanom og arvelig melanom
Sist faglig oppdatert: 05.07.2023
Bakgrunn
Det er kjent at personer med visse hudtyper er mer disponert for melanom enn andre. Hudtype er et resultat av kompleks arv der mange ulike gener virker sammen. En relativt vanlig kreftform som melanom vil derfor ha en tendens til å vise familiær opphopning hos individer i én og samme familie med lys hudtype, uten at vi dermed ville vurdere det som arvelig melanom.
Leger som behandler og kontrollerer personer med melanom og med predisponerende hudtype, bør informere om at andre familiemedlemmer, særlig de med samme hudtype, bør beskytte seg mot solstråling og følge med på hudforandringer.
Familiær opphopning av melanom kan skyldes genfeil i to ulike gener: CDKN2A og CDK4. Personer med medfødt genfeil i et av disse genene har tydelig forhøyet risiko for melanom. Tilstanden kalles dominant arvelig melanom (Meyle et al., 2009). Det foreslås at «Arvelig melanom» forbeholdes de som har påvist genfeil i kjent predisponerende gen, og for tiden er dette CDKN2A og CDK4.
Det er diskutert om genfeil i andre gener bør vurderes i noen familier. Melanom kan være del av et syndrom. Genet BAP1 er knyttet til økt risiko for melanom, både uvealt og cutant (Carbone et al., 2013; Toussi et al., 2020). En eventuell forhøyet risiko for melanom ved for eksempel genfeil i BRCA2-genet, er så liten at det har liten praktisk betydning.
Det drives fortsatt omfattende arbeid for å finne andre gener og genetiske varianter som påvirker risiko for melanom bl.a. i regi av det internasjonale konsortiet GENOMEL (www.genomel.org). Stadig nye varianter beskrives, men foreløpig har disse ikke betydning for vurdering av risiko for sykdom hos enkeltindivider (Bishop et al., 2002).
Målrettede undersøkelser i høyrisikogrupper
Begrunnelsen for å gjøre målrettede undersøkelser er at melanom skal diagnostiseres tidlig. Det foreligger god dokumentasjon for sammenhengen mellom tidlig diagnostikk og prognose ved melanom (Bishop et al., 2007a; Bishop et al., 2007b). Nytten av systematiske kontroller av personer med familiær opphopning av melanom er vist i svensk studie fra 2007 (Hansson et al., 2007) (evidensgrad B).
Personer med påvist genfeil som er antatt å være sykdomsgivende, vil i dag tilbys oppfølging med årlig klinisk undersøkelse av hudlege. Eventuell bildediagnostikk som dokumenterer melanomene kan gjøres, men dette avgjøres av den hudlege/avdeling som er ansvarlig for undersøkelsene.
Personer med genfeil i CDKN2A eller CDK4 bør tilbys regelmessig kontroll ved hudavdeling med mulighet for digital dermatoskopi. Regelmessig undersøkelser kan starte ved fylte 20 år. Eventuelt tidligere i spesielle tilfeller.
Personer fra familier med opphopning av melanom uten påvist genfeil bør også tilbys regelmessig oppfølging med kontroller av hudforandringer, men dette kan skje hos fastlege eller spesialist i hudsykdommer. Før slike kontrollopplegg iverksettes, bør personen vurderes ved en medisinsk genetisk avdeling og eventuelt tilbys gentesting.
Målgrupper for risikoscreening på grunn av arv
- Familie med 3 eller flere melanomer hos 2 eller flere individer som er
- førstegrads-slektning (biologisk far eller mor, søsken, barn av indeksperson)
- andregrads-slektning (biologisk bestefar eller-mor, søsken av en forelder, nevøer eller nieser eller barnebarn til indekspersonen)
- eller tredjegrads-slektning (biologiske søskenbarn, besteforeldre sine foreldre, besteforeldre sin søsken, og barnebarn).
- Familie med melanom i kombinasjon med pankreaskreft (3 eller flere diagnoser kreves) hvor de syke er første-, andre- eller tredje-grads-slektninger (som overfor).
Genetisk veiledning og gentesting
Personer som tror de kan ha arvelig risiko for kreft kan etter henvisning bli vurdert ved en av landets medisinsk genetiske avdelinger (Oslo universitetssykehus, Haukeland universitetssykehus, St. Olavs hospital og Universitetssykehuset i Nord Norge). Bare medisinsk genetiske avdelinger har konsesjon til å oppbevare og sammenholde opplysninger om ulike individer i én og samme familie.
Gentesting skal normalt gjennomføres ved medisinsk genetisk avdeling. Gentesting av personer med påvist kreft med formål å finne ut om det er en arvelig årsak til sykdommen, såkalt diagnostisk gentesting, kan etter dagens lover gjøres av behandlende lege. Ved slik testing må legen informere om hva gentesting er, og at funn av genfeil kan innebære at de har risiko for andre krefttyper. Den som har rekvirert testen, har ansvar for å formidle resultatet av testen til pasienten. Dersom det er påvist genfeil ved diagnostisk gentest, bør pasienten henvises til medisinsk genetisk avdeling for genetisk veiledning, etter at rekvirerende lege har formidlet resultatet til pasienten. Gentesting av personer uten kreft kan bare gjennomføres av medisinsk genetisk avdeling.
Tiltak som målrettede helsekontroller blir anbefalt og igangsatt dersom klinisk genetiker finner at det er grunnlag for dette. Det er ikke uvanlig at folk overvurderer sin risiko for kreft. Genetisk veiledning kan dermed redusere folks uro og redusere mengden ubegrunnede helseundersøkelser.
Ved genetisk avdeling vil bl.a. risiko for kreft hos den enkelte gjennomgås, det vil si penetrans av den arvelige sykdommen (dvs. hvor stor andel av de med genfeil utvikler sykdommen). Det er kjent at det er en såkalt genotype-fenotype-korrelasjon for CDKN2A-genet. Det betyr at ulike genfeil i genet kan gi ulike risiko for sykdom (Goldstein et al., 2000). Det vil i de fleste tilfeller være vanskelig å angi eksakt livstidsrisiko for melanom, men mer kunnskap om dette vil komme etter hvert som familie med genfeil observeres over mange år.
Risiko for at sykdommen slår ut hos den enkelte vil også henge sammen med andre faktorer. Penetransen av arvelig melanom i CDKN2A-familier er vist å henge sammen med geografiske forhold. I land der forekomsten av melanom er høy, for eksempel i Australia, er også penetransen høyere av sykdommen hos de med arvelig disposisjon. Soleksponering påvirker altså også risiko for sykdommen hos individer med medfødt predisponerende genfeil (Bishop et al., 2009).
En viktig fordel med gentesting er at man kan avklare at et individ ikke har dominant arvelig høy risiko for melanom. I familier med kjent genfeil i CDKN2A eller CDK4, vil familiemedlemmer som ikke har familiens genfeil likevel kunne ha en lett forhøyet risiko for å utvikle melanom (Toussi et al., 2020). Familiemedlemmer som ikke får påvist genfeilen får ikke tilbud om hudkontroller, men bør informeres om viktigheten av å beskytte seg mot solstråling og følge med på hudforandringer.
Diagnostisk og prediktiv gentesting for genfeil er etablert som et helsetilbud i Norge. Forekomsten av genfeil er kartlagt i befolkningsundersøkelser av personer med minst to primære maligne melanom (Helsing et al., 2008). En spesiell CDK4-mutasjon er beskrevet på Vestlandet (Molven et al., 2005). Gentesting gjøres i dag ved Rikshospitalet, St. Olavs Hospital, Haukeland l Universitetssykehus og Universitetssykehuset i Nord Norge.
Kriterier for hvem som kan tilbys gentest er gitt i avsnittet ovenfor "Målgrupper for risikoscreening på grunn av arv".
Risiko for pankreaskreft
Medfødt genfeil i CDKN2A-genet kan også gi risiko for kreft i bukspyttkjertelen. Det er mest sannsynlig bare enkelte av genfeilene i genet som gir slik forhøyet risiko (Landi, 2009; Lynch et al., 2008). Dette må åpent drøftes med de som ber om gentest. Det finnes i dag ikke i rutinen tilbud om tidligdiagnostikk for pankreaskreft, og dette må de som testes være klar over på forhånd. Det skal høsten 2022 startes opp et forskningsprosjekt med pankreas-kontroller der alle universitets-sykehus er invitert til å delta, organisert av Oslo Universitetssykehus. Dersom dette blir et permanent tilbud i Norge, bør denne gruppen vurderes for slike kontroller.
Anbefalinger:
- Personer med opphopning av melanom i familien bør gis tilbud om henvisning av fastlege eller spesialist til en av landets avdelinger for medisinsk genetikk for vurdering for eventuell test (Se kriterier for test under "Målgrupper for risikoscreening på grunn av arv"). Personer som selv har hatt melanom kan tilbys diagnostisk gentest rekvirert av behandlende lege etter samme kriterier ("Målgrupper for risikoscreening på grunn av arv").
- Personer med økt risiko for melanom, med eller uten påvist genfeil, tilbys oppfølging med målrettede undersøkelser. Målet er tidlig diagnostikk og behandling av melanom, noe som antas å bedre prognosen (B).
Behandling av lokalisert sykdom / kurativ behandling
Kirurgisk behandling av histologisk verifisert melanom
Sist faglig oppdatert: 05.07.2023
For primæreksisjon, se kapittel om Diagnostisering. Ved stansebiopsert melanom anbefales at melanomet først fjernes som ved primæreksisjon før endelig diagnostikk, dette for ikke å hindre eventuell senere vaktpostlymfknutediagnostikk. Hvis pasienten ikke er aktuell for vaktpostlymfeknutediagnostikk, kan man eksidere i 1-2 cm margin avhengig av svar på stansebiopsi.
Utvidet eksisjon av histologisk verifisert melanom
De siste årene har de anbefalte eksisjonsbreddene for utvidet eksisjon ved histologisk påvist melanom blitt redusert. De fleste sårdefektene som oppstår med dagens anbefalinger kan lukkes direkte. Den utvidede eksisjonen/reeksisjonen bør gjøres ned til underliggende muskelfascie (Grotz et al., 2013; Hunger et al., 2014). Ved in situ melanom må man ikke gå ned til muskelfascie, men det kan noen ganger lette lukking av såret. Det er den målte bredden før incisjonen som gjelder, altså ikke marginen av det fikserte materialet. Anbefalingene er ikke basert på at man trekker fra histologisk fri margin før utvidet eksisjon. Hvem som skal utføre reeksisjonen avhenger av lokalisasjon, behovet for marginer og tilgjengelig kompetanse.
Type melanom / Breslow tykkelse | Eksisjonsbredde (in vivo) | Kunnskapsgrunnlag * |
|---|---|---|
In situ / Lentigo maligna | 0,5 cm | D, nivå 4 |
≤ 1,0 mm | 1 cm | A, nivå 1a |
> 1,0–2,0 mm | 1 cm | A, nivå 1a |
> 2,0–4,0 mm | 2 cm | A, nivå 1b |
> 4,0 mm / Desmoplastisk | 2–3 cm | B, nivå 2 |
*Balch et al., 2001; Cascinelli, 1998; Cohn-Cedermark et al., 2000; Garbe et al., 2012; Gillgren et al., 2011; Haigh et al., 2003; Haydu et al., 2016; Hayes et al., 2016; Hudson et al., 2013; Lens et al., 2002; Lens et al., 2007; Mocellin et al., 2011; Sladden et al.; Sladden et al., 2009; Tzellos et al., 2014; Wheatley et al., 2013)
Anbefalingene om hudmarginer ved utvidet eksisjon varierer noe mellom WHO og ulike land. Anbefalingene baserer seg hovedsakelig på store, randomiserte, kontrollerte studier hvor man har sammenlignet overlevelse og lokale tilbakefall mellom ulike eksisjonsmarginer (Gillgren et al., 2011). Problemet er at inklusjonskriteriene og marginene er ulike i studiene. Det er gjort 4 metaanalyser av data fra 5 randomiserte undersøkelser, blant annet et Cochrane review fra 2009 (Sladden et al., 2009). Ingen av disse har vist en statistisk signifikant forskjell i overlevelse eller residivfri overlevelse med smal eller bred eksisjon. Det pågår en stor randomisert multisenter studie for å se på om det er forskjell på 1 og 2 cm eksisjonsavstand av melanom >1 mm tykkelse (Moncrieff et al., 2015-2026).
Grunnlaget for anbefalinger ved in situ melanomer, melanomer med tykkelse over 4 mm, og ved spesielle lokalisasjoner, er svakere.
Ved stor diskrepans mellom klinisk og histologisk margin, kan dette vurderes på et melanom-MDT, der man i vurderingen også tar hensyn til alder og lokalisasjon.
Kirurgisk behandling ved spesielle lokalisasjoner
Fjerning i form av utvidet eksisjon av melanomer i ansikt, øre, fingre, tær og fotsåle kan være komplisert og krever spesielle hensyn. Ved primæreksisjon, se kapittel om Diagnostisering.
Ansikt: | I ansiktet setter tilgrensende vitale strukturer og kosmetiske vurderinger en grense for eksisjonsmarginene. |
Øre: | På øret utføres vanligvis en kileformet reeksisjon. Partiell eller total amputasjon av øret blir reservert store residiv, eller melanom med initialt stor utbredelse. Det etterstrebes å beholde øvre del av øret slik at pasientene kan benytte briller. |
Nese: | Eksisjon ned til perichondrium eller periost. Ev. fjerning av alle lag. |
Øyeregion: | 1 cm eksisjonsavstand medtagende orbicularis oculi i dybden, ev. fjerning av alle lag. |
Brystregion: | På et bryst anbefales det at primæreksisjonen blir utført ut fra gjeldende regler for melanom i hud. Svært sjelden er det aktuelt å utføre mastektomi. |
Fingre og negl: | På fingrene, og særlig tommelfinger, etterstrebes det å beholde så mye av fingrene som mulig. Dersom negleseng er involvert, anbefales det at fingeren blir amputert proximalt for distale interphalangealledd/ proximalt for tommelens interphalangealledd, og det anbefales minst 1 cm margin. Ved in situ melanom kan man forsøke å bevare et tynt lag over bein og legge på hudtransplantat med usikkerhet om fullstendig fjerning av in situ forandringene. Dette skal da gjøres i samvalg med pasienten. Amputasjon i metakarpalleddnivå / stråleamputasjon av 2 finger med skrå skjæring av metacarp blir reservert store tumores. Pasienter med subungualt melanoma in situ, eller subungualt melanom, bør vurderes drøftet på MDT-møte for behandlingsalternativer. |
Tær: | Det utføres oftest amputasjon av hele tåen i metatarsophalangealleddet siden dette ikke medfører særlig tap av funksjon. |
Fotsålen: | Melanom på plantarsiden av foten omfatter ofte store områder, og fullhudstransplantat, eller et tykt delhudstransplantat, kan benyttes for å dekke sårområdet. Dype fascier bør beholdes for å understøtte et hudtransplantat. Ved rekonstruktiv kirurgisk teknikk, kan man for å beholde god hud i vektbærende områder bruke en stilket eller fri hudlapp fra fotbuen som dekning. |
Anbefalinger:
- Histologisk verifiserte melanomer behandles med utvidet eksisjon ned til muskelfascie
- Margin baseres på primærlesjonens tykkelse uten fratrekk av fri histologisk margin. Se tabell 9.1.
Vaktpostlymfeknuter ved melanom
Vaktpostlymfeknute, eller sentinel node (SN), er definert som de(n) lymfeknuten(e) som mottar direkte lymfedrenasje fra området med primærtumor. Sentinel node biopsi (SNB) ved kutane melanom (MM) er som regel teknisk enkel å utføre.
Indikasjon
SNB anbefales i primærdiagnostikken av kutane melanom.
SNB gir mulighet for prognosevurdering og eventuelt adjuvant behandling ved subklinisk metastase, og dermed bedre stadievurdering og prognose med tanke på videre forløp.
Prosedyren er aktuell hos pasienter med hudmelanomer med tykkelse > 1,0 mm (Egger et al., 2019; Maurichi et al., 2020), dvs. pT2a og høyere. Det kan vurderes å gjøre SNB hos pT1b melanom etter diskusjon i melanom-MDT på bakgrunn av Breslows tykkelse, ulcerasjon, mitosetall, regresjon, karinnvekst, ung alder og etter grundig informasjon om fordeler og ulemper (Egger et al., 2019; Maurichi et al., 2020).
Ved tynne (< 0,8 mm) melanomer uten ulcerasjon (pT1a) er risikoen for lymfeknutemetastaser liten og det er lav funnrate (Agnese et al., 2003; Andtbacka et al., 2009; Warycha et al., 2009). Ved gjennomgang av tall fra melanomregisteret for årene 2018 og 2019, er det nasjonalt i denne gruppen ca. 10 pasienter med positiv SNB årlig. Det utgjør 2,5–2,9 % av de som får utført prosedyren i denne gruppen. (Meddelelse fra Melanomregisteret mars 2020.) På bakgrunn av dette, er kriteriene for automatisk å bli tilbudt prosedyrene endret til å gjelde fra pT2a. Melanompasienter med pT1b melanom som allikevel tilbys SNB prosedyren nedstages til stadium IA hvis den er negativ, og får dermed samme oppfølgning som de som er pT1a i utgangspunktet ifølge AJCC 2018 (Gershenwald et al., 2017). Se kapittel om Oppfølging og etterkontroll.
Ved tykke melanomer er funnraten høy. Tidligere var øvre grense for å anbefale SNB-prosedyre 4 mm, basert på at fjernmetastaser i denne gruppen er hyppigere, hvilket reduserer verdien av prosedyren med tanke på overlevelse (Caraco et al., 2004). Nå anbefales ingen øvre grense, og det antas at hos mange vil prosedyren forlenge sykdomsfri overlevelse grunnet oppstart av adjuvant behandling hos hovedparten av dem med positiv SNB. SNB tilbys derfor også pasienter med tumortykkelse høyere enn 4,0 mm (Gyorki et al., 2016).
Når kan SNB utelates?
Høy alder, komorbiditet, mental svikt og redusert funksjonsnivå er faktorer som kan gjøre SNB lite hensiktsmessig. Det er også relevant at man vurdere om pasienten kantåle eventuell medisinsk behandling. Det er ikke definert hvor grensene går, og i tvilstilfeller kan operasjonsindikasjonen diskuteres i melanom MDT-møte.
SNB i hode-hals regionen og i bekkenet ved underekstremitetsmelanomer
Melanom i hodebunn og ansikt har mer uforutsigbart drenasjemønster, og SNB-prosedyren bør gjøres ved et senter med erfaring fra kreftkirurgi på hode og hals. Inngrep i bekken er mer omfattende og gir økt morbiditet, og det anbefales ikke å hente ut SNB i bekkenet ved prosedyren som standard. Pasienter med SNB som ikke uthentes kan følges med ultralydsundersøkelse som et alternativ. (Karakousis et al., 2013).
SNB ved graviditet
SNB kan gjøres hos gravide etter diskusjon med pasienten. Da helst som samme dags prosedyre for å minimere stråling, og ved å utelate blåfarge som kan gi anafylaktisk sjokk i sjeldne tilfeller (Pentheroudakis et al., 2010).
Prosedyrebeskrivelse
Det anbefales å identifisere SNB ved bruk av lymfoscintigrafi (LS) og SPECT CT før utvidet eksisjon, da utvidet eksisjon kan forandre lymfedrenasjen hos noen pasienter og derved påvise feil vaktpostknute(r).
I Norge bruker de fleste 99m Tc-Nanocoll. Dette må settes intradermalt. Subcutis har annen lymfedrenasje, og epidermis mangler lymfedrenasje. Fire injeksjoner settes rundt melanom/arr med totalt injeksjonsvolum 0,1 ml. Det anbefales å bruke SPECT-CT for bedre lokalisering av vaktpostknuter, hvilket både gir bedre lokalisering av SNB, og også kan bidra til å oppdage suspekte knuter som medfører annen utredning enn SNB (Moncrieff et al., 2022). Tatovering av huden over påvist vaktpostknute letter både fjerning av lymfeknuter og kontroll med ultralyd (UL) senere.
Funnfrekvensen ved UL og cytologiscreening er angitt til mellom 1,7 til 65 % hos pasienter med metastaser i SNB (Faries et al., 2017; Rossi et al., 2003; Ulrich et al., 2011; Voit et al., 2006) (evidensgrad C). UL og cytologiscreening er ikke anbefalt før SNB-operasjon.
Oppleting gjøres med Geigerteller/γ-sonde og eventuelt blåfarge under operasjonen.
Tidspunkt: Isotopundersøkelsen kan ev. gjøres operasjonsdagen, da lymfedrenasjen fra hud er rask.
0,5–1 ml ufortynnet blåfarge (patentblått eller metylenblått) kan forenkle oppleting. Den settes intradermalt, og kan injiseres 1 time før eller ved start av operasjon.
Det har vært diskutert om bare den mest radioaktive knuten skal fjernes, eller om flere skal fjernes når disse også er radioaktive. Det er referert lavt antall falsk negative når alle knuter med aktivitet over 10 % av den mest aktive fjernes (Liu et al., 2011; McMasters et al., 2001). Normalt fjernes 1 til 2 lymfeknuter.
Hvis vaktpostoppleting mislykkes, skal det ikke gjøres lymfeknutetoalett pga. lav funnrate, og dermed mulighet for unødvendig morbiditet.
Morfologisk diagnostikk
Det har vært betydelig diskusjon om hva som skal regnes som signifikant metastase i SNB. ASCO-guidelines har dog ingen spesifikk grense nedad, og både TNM og AJCC 2017 klassifiserer alle metastaser uansett størrelse som stadium III (Amin et al., 2017; Brierley et al., 2017; Levitan, 2012; Wong et al., 2012).
På grunn av varierende prediktiv verdi av frysesnitt, og lav frekvens av metastaser, anbefales frysesnitt ikke brukt ved melanom. Standard undersøkelse gjøres på parafininnstøpte snitt (H-E, med immunhistokjemi) (Scolyer et al., 2008). Jf. Histopatologisk diagnostikk.
Effekt av vaktpostprosedyren (SNB)
Effekten av SNB på overlevelse er omdiskutert og til dels uavklart, tross MSLT-II studien.
Det er referert til at bare 20 % av pasienter i gruppen 1–4 mm har metastaser, og at kun 20 % av disse har spredning til andre lymfeknuter i samme lymfeknutestasjon (Thomas, 2008). Det har vært stilt spørsmål vedrørende klinisk relevans av minimale metastaser i vaktpost (Kyrgidis et al., 2015; Morton, 2012).
De-cog og MSLT-II studien har konkludert med at lymfeknutetoalett etter positiv vaktpostlymfeknute ikke påvirker melanomspesifikk overlevelse, og at eventuell overlevelsesgevinst allerede kommer ved SNB-prosedyren (Faries et al., 2017; Leiter et al., 2016; Morton, 2012).
Av denne grunn anbefales det ikke lenger at man automatisk gjør lymfeknutetoalett ved metastase i SNB, også sett i lys av til dels betydelig morbiditet ved lymfeknutetoalett, spesielt i lyske. Se for øvrig under avsnitt "Morfologisk diagnostikk" (Guggenheim et al., 2008; Kretschmer et al., 2008; Levitan, 2012; Sosialstyrelsen, 2009; Wong et al., 2012).
Funn av metastase i SNB gir økt sykdomsfritt intervall (RFS) når dette følges av lymfeknutetoalett som var rutine tidligere. Det forventes at RFS ikke endres selv om glandeltoalett nå utelates som rutine. Siste gjennomgang i 2014 av MSLT-I studien antyder også at melanomspesifikk overlevelse er bedre i vaktpostgruppen (Morton et al., 2006; Pasquali et al., 2010). Rundt 5 % av pasientene får regionalt residiv etter negativ SNB (falsk negativ rate) (Morton et al., 2014; Thomas, 2008).
Økt totaloverlevelse er ikke vist sikkert i prospektive serier, selv om det antas at noen blir kvitt sykdommen for godt.
Det anbefales at pasienter med metastase i SNB diskuteres i melanom MDT-møte. Dette for å kunne tilby pasienter med høy risiko for tilbakefall en plan for videre oppfølgning, kirurgi og eventuelt adjuvant behandling.
Kriterier for vurderingen i MDT-møte bør være tykkelse på primærtumor, antall metastatiske knuter, størrelse på det metastatiske fokus, lokalisasjon av metastase i knuten og ev. B-RAF mutasjon. For øvrig vil pasientens alder og komorbiditet ha betydning med tanke på nytteverdi, spesielt om pasienten er immunsupprimert.
Oppfølgning av høyrisikopasienter, basert på eksklusjonskriteriene til MSLT-II studien, definert som SNB-positive med ekstrakapsulær vekst, mikroskopiske satellittmetastaser, mer enn 3 metastatiske knuter, mer enn 2 involverte lymfeknutestasjoner og immunsuppresjon, har heller ikke vist dårligere overlevelse ved observasjon vs glandeltoalett (Broman et al., 2021).
Fra 26.8.19 er det åpnet for adjuvant behandling av stadium III og IV, (kapittel om Medikamentell behandling). Dermed har positiv vaktpostlymfeknute stor betydning for hvem som tilbys denne behandlingen. Stadium IIIA skal som hovedregel ikke starte adjuvant behandling, men anbefales tatt opp i melanom-MDT, og ved særlige prognostiske faktorer som metastase >1 mm i diameter kan adjuvant behandling være indisert.
Pasienter med metastaser i vaktpostknuter og som ikke får utført lymfeknutetoalett, skal ha ultralydovervåkning som ledd i oppfølgning. Dette er i tråd med MSLT-II studien, hvor pasienter med vaktpostmetastaser ble randomisert til enten overvåking eller lymfeknutetoalett (Faries et al., 2017; Morton, 2012).
Anbefalinger:
- Vaktpostprosedyre (SNB) anbefales i Norge ved kutant melanom fra pT2a og høyere. Kan vurderes hos pT1b. Dette begrunnet med kriterie for oppstart med adjuvant behandling, effekt på RFS (evidensgrad A), at vaktpoststatus er ønskelig ved inklusjon i studier og som prognostisk kriterium.
- SNB bør gjøres ved de større sykehusene i helseregionene (regionsykehus og områdesykehus). Pasientene skal få utført lymfoscintigrafi, og det anbefales SPECT-CT på forhånd.
Kirurgisk behandling av lokalt residiv og in-transit metastaser
Lokalt residiv defineres som tumorvekst i eller under arret etter primæroperasjonen.
Kirurgisk behandling er aktuelt ved enkeltresidiv, og består normalt av vid eksisjon i 1 cm avstand av tumor. In-transit metastaser er metastaser som oppstår mellom primærtumor og den regionale lymfeknutestasjon. Enkeltmetastaser av denne typen behandles med eksisjon i fritt vev (Balch et al., 2009) og etterfølgende vurdering av adjuvant behandling. Er det multiple svulster, vil behandlingen være avhengig av lokalisasjonen av metastasene, og bør diskuteres på melanom-MDT. Dersom metastasene er lokalisert på en ekstremitet, vil – når kirurgisk behandling ikke er aktuelt – behandling med isolert ekstremitets infusjon (ILI) eller perfusjon (ILP) være aktuelt (Beasley et al., 2008; Thompson et al., 2008). Denne typen behandling gjøres ved Oslo Universitetssykehus, Radiumhospitalet.
Amputasjon av ekstremitet er et veldig sjeldent brukt behandlingsalternativ.
Dersom svulsten sitter på truncus, eller på ekstremitet når ILI/ILP ikke er aktuelt, kan lokal strålebehandling eller CO2-laserbehandling av multiple lokale residiv være et alternativ (Hill et al., 1996). Dette vil særlig være aktuelt hos eldre mennesker. Elektrokjemoterapi (ECT) er en relativ ny tumor ablasjonsmetode som kan brukes ved kutane og subkutane metastaser når kirurgi ikke lenger er hensiktsmessig. Den kan repeteres, og kan brukes i tidligere bestrålte områder. Behandlingen gis ved Seksjon for Onkologisk plastikkirurgi, Oslo universitetssykehus, Radiumhospitalet (Marty et al., 2006; Mir et al., 2006).
Anbefalinger:
- Kirurgisk eksisjon av lokalt residiv er alltid første valg.
- Pasienten bør vurderes ved melanom-MDT på universitetssykehus, og bør henvises til melanom-MDT på Radiumhospitalet, Oslo universitetssykehus, ved indikasjon for ILI/ ILP eller elektrokjemoterapi.
Behandling av klinisk påviste lymfeknutemetastaser
Hos alle pasienter med melanom er det fare for metastasering til regionale lymfeknuter. Affiserte knuter er faste eller harde i konsistensen, runde eller lett buklete i overflaten, og er oftest den lymfeknuten som ligger nærmest primærlesjonen.
Lymfeknutemetastaser er sjelden ved melanomer < 1,0 mm i tykkelse, men for melanomer på 1,0 mm og tykkere vil tendensen til metastaser øke med økende tumortykkelse. Ved klinisk mistanke om lymfeknutemetastaser, eller ved klinisk eller radiologisk undersøkelse av lymfeknutemetastaser, kan cytologisk undersøkelse (FNAC) bekrefte diagnosen. En negativ FNAC er ikke nødvendigvis konklusiv og bør gjentas 1–2 ganger dersom knuten vedvarer å være suspekt etter en kort observasjonsperiode.
Åpen biopsi kan øke faren for tumorsøl og frarådes som førstevalg. Dersom åpen biopsi gjøres, bør hudinsisjonen legges slik at arret lett kan inkluderes i operasjonsfeltet ved et eventuelt senere radikal lymfeknutetoalett. Dette gjøres enten i kurativ hensikt, eller for å oppnå lokal kontroll.
Lokal kontroll er spesielt ønskelig i de tilfeller hvor det er truende tumorperforasjon, og kan gjøre kirurgi aktuelt selv om det foreligger fjernmetastasering.
Ved påvist lymfeknutemetastase gjøres stadieinndeling, se kapittel om TNM og stadiegrupperinger og pasienten tas opp i melanom-MDT for vurdering av adjuvant behandling. Som regel innebefatter staging PET CT for å utelukke fjernmetastaser før lymfeknutetoalett.
Lymfeknutetoalett ble tidligere noen ganger gjort elektivt (ELND), hvor det ikke er påvist spredning i lymfeknuter, men utføres nå kun terapeutisk (TLND) hvor det er klinisk affiserte lymfeknuter. ELND anbefales ikke da den ikke har vist noen sikker overlevelsesgevinst i forhold til TLND. Innføring av vaktpostprosedyre (SNB) har også gjort ELND uaktuelt.
Ved lymfeknutetoalett fjernes alt lymfeknuteholdig vev, inkl. fettvev, i regionen. Begrenset disseksjon garanterer ikke adekvat eksisjon av melanommetastaser, og det er derfor foreløpig ikke akseptabelt å gjøre isolert lymfeknutefjerning.
Formell disseksjon reduserer sjansen for residiv i dissekert lymfeknutestasjon. Ved adekvat lymfeknutedisseksjon kan 10 års overlevelse komme opp i 50 % hvis bare én knute er affisert (Balch et al., 1999; Hughes et al., 2000). Ved affeksjon av 2–3 knuter kan 10 års overlevelse opp mot 30 % oppnås.
Ved ekstranodal vekst forverres prognosen betydelig. Ved ekstranodal vekst, betydelig tumoraffeksjon eller ved tumorsøl under operasjonen, bør stråleterapi vurderes for å hindre lokalt residiv. Det anbefales å få BRAF-mutasjonsanalyse ved spredning til lymfeknuter hvis den ikke foreligger fra tidligere.
Aksilleglandeltoalett
Aksilleglandeltoalett gjøres mer omfattende og radikalt enn hva som er vanlig ved mammacancer (Balch et al., 2009; Haagensen, 1971; Stone et al., 1995). Hudincisjonen legges ofte på tvers, eller som en s-formet incisjon, og strekker seg fra den laterale kant av m. pectoralis major til kanten av m. latissimus dorsi.
De overfladiske knutene ligger nær de intercostobrachiale nerver. De dype knutene ligger under fascia axillaris.
Lymfeknutegruppene i aksillen er ikke godt adskilt, men den overfladiske gruppen kan anatomisk deles i de brachiale, subscapulare, pectorale, subpectorale og de thoracoepigastriske knutene. Beliggenheten gjør en-bloc fjernelse mulig.
Aksilletoalett bør innbefatte nivå 1, 2 og 3 ved utbredt metastasering. Nivå 3 betyr operasjon medialt for mediale kant av m. pectoralis minor.
For å få god tilgang til aksilletoppen kan det være nødvendig å dele m. pectoralis minor ved processus coracoideus, eller fjerne den. Husk den motoriske gren til m. pect. major som passerer langs, og til dels gjennom, m. pect. minor.
V. axillaris som er øvre begrensning kan i nødsfall reseseres, da inntakt kretsløp rundt scapula hindrer varig stase av armen. Disseksjonen fortsetter ned til 6. costa hvor m. lattisimus dorsi møter m. serratus anterior og man forsøker å skåne nn thoracodorsalis og thoracicus longus.
Lyskeglandeltoalett
De overflatiske knutene ligger vesentlig nedenfor lig. inguinale på begge sider av v. saphena magna. Bortsett fra hos ekstremt tynne pasienter, ligger lymfeknutene under Scarpa’s fascie. Hudincisjonen bør primært legges på langs, da det gjør det lettere ved ev. reoperasjon. Alternativt et par cm under og parallelt med lig. Inguinale, og svinges medialt ned i trigonum femorale (def. som området mellom lyskebånd, m. sartorius og mediale kant av m.adductor longus).
V. saphena magna kan inkluderes i preparatet fra spissen av det femorale triangel og til innmunningen i v. femoralis (Balch et al., 2009; Karakousis et al., 1986; Sterne et al., 1995; Stone et al., 1995).
Er det påvist metastatiske lymfeknuter i bekkenet, kan knutene langs iliacakarene fjernes i samme inngrep uten at det forverrer morbiditeten, eller ved et senere inngrep (Sterne et al., 1995). Man kan vurdere bruk av robotkirurgi for operasjon i bekkenet for å minske morbiditet. Fjerning av lymfeknuter i bekkenet bør gjøres ved universitetssykehusene.
Halsglandeltoalett
Anatomien på halsen er utfordrende og krever spesiell kunnskap. Det er per dags dato ikke enighet om omfanget av inngrepet i de forskjellige nivåer i forhold til påvist positiv SN og ved makroskopisk sykdom. Disse pasientene bør derfor diskuteres preoperativt i en tverrfaglig melanomgruppe. Inngrepet skal utføres ved avdeling med betydelig erfaring med glandeltoalett ved melanomsykdom og tilknytning til melanom-MDT-gruppe. Det er en vanskelig operasjon med stor fare for komplikasjoner (Balch et al., 2009). Det er angitt residiv opp til 28 %. Antall inngrep per år i Norge er begrenset, og sentralisering kan overveies.
Komplikasjoner
Plagsomme postoperative seromer tappes. Nervesmerter og dysfunksjoner er ofte forbigående.
Kantnekroser, lymfødem og sårinfeksjoner er hyppigere ved lysketoaletter enn ved andre lymfeknutetoaletter, og varierer i ulike serier fra 3–15 %.
DVT i leggen er angitt å forekomme i 5–14 %. Lymfødem er en alvorlig og varig komplikasjon. Den sees sjelden etter aksilletoalett, men hos ca 20 % etter lysketoalett. Profylaktisk anbefales det at pasientene etter aksilletoalett tar minst de samme hensyn som etter lymfeknutetoalett ved mammacancer, spesielt fordi operasjonen kan være mer omfattende.
Etter lysketoalett anbefales det at pasienten bruker elastisk strømpe om dagen i 3-6 mnd. etter operasjonen.
Anbefalinger:
- Makroskopiske lymfeknutemetastaser behandles med lymfeknutetoalett etter utredning for fjernmetastaser. Målsettingen er å få lokal kontroll, deriblant unngå hudgjennombrudd av tumorvev.
- Operativ behandling av lymfeknutemetastaser på hals eller i bekken bør utføres på universitetssykehusene.
- Ved lysketoaletter er tilheling ofte mer langtrukken. Trombose og ødemprofylakse er viktig.
- Pasientene bør tas opp på melanom-MDT til diskusjon for adjuvant behandling.
Strålebehandling
Sist faglig oppdatert: 05.07.2023
Primærtumor
De fleste cutane melanomer diagnostiseres i et tidlig stadium mens radikal kirurgisk eksisjon er mulig. Strålebehandling av primære melanom i hud er derfor sjelden aktuelt. Unntak er store lentigo maligna melanom i ansiktet. Dette er spesielt aktuelt hos eldre, og der rekonstruktiv kirurgi vil være vanskelig. Dosering 4 Gy x 12 ved lentigo maligna melanom som er mindre enn 4 cm, og 3 Gy x 17, eller eventuelt 2.5 Gy x 20, ved større lesjoner. Behandlingen er vanligvis kurativ.
Strålebehandling kan også være aktuelt postoperativt der det ikke foreligger frie reseksjonsflater og det ikke er aktuelt med ytterligere kirurgi.
Ved inoperabelt lokalavansert cutant melanom kan det være aktuelt å strålebehandle primærtumor, spesielt ved blødning eller sekresjon. Behandlingen er palliativ. Disse pasientene har ofte metastaser og har behov for systemisk behandling i tillegg.
Ved primærtumor i slimhinner i hode-, halsregionen kan det være aktuelt å gi strålebehandling og /eller immunterapi ved inoperable tumores, eller postoperativt for å bedre den lokale kontroll (Benlyazid et al., 2010).
Regionale lymfeknutemetastaser og in-transit metastaser
Det foreligger ikke sikre resultater som viser dokumentert effekt på residivfri overlevelse eller total overlevelse ved postoperativ strålebehandling etter lymfeknutetoalett, selv ved perinodal tumorvekst. En har derfor gått bort fra slik behandling, som dessuten kan medføre økt lymfødem og fibrose, og vanskeliggjøre reoperasjon ved residiv. Pasienter som er operert for stadium III sykdom kan dessuten som oftest få adjuvant behandling med PD-1 hemmer eller BRAF-/MEK hemmer.
Strålebehandling bør vurderes ved inoperable regionale metastaser eller inoperabelt residiv etter lymfeknutetoalett der immunterapi, BRAF-/MEK hemmer eller ECT (Elektrokjemoterapi) ikke er aktuelt eller har ønsket effekt. Behandlingen er palliativ. Vanlig fraksjonering er 3 Gy x 10 eller 4 Gy x 5-6.
Ved in- transit metastaser, spesielt på underekstremiteter, kan det være aktuelt å strålebehandle én eller flere cutane/subcutane metastaser, spesielt dersom kirurgi, systemisk behandling med immunterapi, BRAF-/MEK hemmer, ECT eller regional kjemoterapi (ILP – Isolated Limb Perfusion eller ILI – Isolated Limb Infusion) ikke er aktuelt eller har ønsket effekt.
Strålebehandling kan føre til en systemisk anti-tumor immunrespons som viser seg ved at metastaser utenfor målvolumet som strålebehandles også blir mindre – en såkalt abscopal effekt. Data støtter også en synergistisk effekt ved å kombinere strålebehandling og immunterapi med økte responsrater, så vel innenfor som utenfor strålebehandlet område (Park et al., 2015). Det er viktig å utnytte denne muligheten for eksempel ved in-transit metastaser.
Anbefalinger:
- Strålebehandling kan være aktuelt ved større lentigo maligna melanom i ansiktet, lokalavansert melanom, ved melanom i øyet og ved slimhinnemelanom i nese/bihuler/halsregionen (oftest postoperativt).
- Strålebehandling bør vurderes ved inoperable in-transit metastaser og postoperativt der det foreligger usikker radikalitet og reoperasjon, eller der systemisk behandling ikke er aktuelt (B).
Medikamentell behandling
Sist faglig oppdatert: 05.07.2023
Adjuvant medikamentell behandling
I dette kapitlet omtales bivirkninger av forskjellige medikamenter. Det bemerkes at denne omtalen ikke er fullstendig, og det vises til SPC (felleskatalogtekst) for de enkelte medikamentene.
Pasienter med melanom i stadium IIB, IIC, IIIA, IIIB, IIIC og IIID har relativt stor risiko for residiv med 5-års relativ overlevelse i Norge på henholdsvis 76%, 58 %, 78 %, 78 %, 54 % og 52 % hos menn, og 83%, 63 %, 82 %, 88 %, 61 % og 41% hos kvinner (Nasjonalt kvalitetsregister for melanom, 2021). For å hindre tilbakefall etter kirurgi er det forsøkt mange ulike former for tilleggsbehandling, såkalt adjuvant behandling.
BRAF/MEK hemmere (dabrafenib/trametinib)
Bakgrunn
I COMBI-AD studien, en randomisert fase III-studie, ble 870 pasienter med BRAF positiv V600E/K mutert stadium III melanom inkludert etter fullstendig kirurgisk reseksjon (134). Pasientene i behandlingsarmen fikk dabrafenib (BRAF- hemmer) 150 mg x 2 po + trametinib (MEK-hemmer) 2 mg x 1 po daglig opptil 1 år. Etter 3 år viste studien en tilbakefallsfri overlevelse (RFS) på 58 % hos pasienter i behandlingsarmen, mot 39 % i placeboarmen. Totaloverlevelse (OS) er 86 % i behandlingsarmen mot 77 % i placeboarmen. Høsten 2020 ble resultatene etter 5 års oppfølging publisert, og viste tilbakefallsfri overlevelse (RFS) på 52 % i behandlingsarmen og 36% i placeboarmen. Overlevelse uten fjernmetastaser var på henholdsvis 65% vs 54 % (Dummer et al., 2020). Total overlevelse (OS) var ikke analysert pga. manglende antall «events». Cure-rate kalkuleringen (etter ønske fra EMA presentert på ESMO 2018) predikerte en forskjell på 17% i langtids tilbakefallsfri overlevelse mellom behandlings- og placeboarmen (Dummer et al., 2018).
Bivirkninger
Vanlige bivirkninger som feber, frysninger, utslett, kvalme, diare, artralgi, fatigue, hyperkeratose, alopeci, noe økt fotosensitivitet, samt økt risiko for plateepitelcarcinom/keratoakantom, ble observert i studien. Alvorlige bivikninger som serøs retinopati og fall i EF%, kan forekomme, men det er svært sjelden. Ved symptomer fra øye anbefales henvisning til spesialist i øyesykdommer. Det anbefales kontroll av hjertefunksjon (Ekko/MUGA) ved oppstart, samt hver 3. mnd under behandling.
Dette er kjente bivirkninger fra tidligere studier med BRAF- og MEK-hemmere. Det ble ikke rapportert om nye hittil ukjente bivirkninger. 97 % av pasientene i behandlingsarmen opplevde bivirkninger, av dem fikk 41 % grad 3/4 bivirkning, og 26 % av pasientene måtte avslutte behandlingen grunnet uakseptabel toksisitet.
Adjuvant bruk av dabrafenib/trametinib kombinasjonen anbefales (Se anbefalinger).
Anbefalt dosering: Dabrafenib 150 mg x 2 po + trametinib 2 mg x 1 po i 1 år ( Ev. dosereduksjon ved bivirkninger)
Evidensgrad A
PD-1 hemmere
Nivolumab
Bakgrunn
I CA209-238 studien, en randomisert, dobbelt blindet fase III-studie, ble 906 pasienter som hadde gjennomgått fullstendig kirurgisk reseksjon for stadium IIIB, IIIC og IV melanom randomisert 1: 1 til iv behandling med nivolumab 3mg /kg Q2W, eller ipilimumab 3 mg/kg Q3W, 4 kurer, deretter hver 12. uke. Pasientene fikk behandling i opptil 1 år, til tilbakefall/uakseptabel toksisitet, eller hvis de trakk seg fra studien.
12 måneders residivfri overlevelse (RFS) ble presentert på ESMO 2017, og oppdaterte tall for 24 måneders residivfri overlevelse ble vist på ASCO 2018 (Weber et al., 2017). Studien viste residivfri overlevelse 12 måneder på 70,5 % i nivolumab gruppen og 60,8 % i ipili-mumab gruppen. Samme tall for 24 måneder var hhv. 63 % og 50 %, som var signifikante forskjeller, p <0,001. På subgruppeanalyser hadde pasienter med PD-L1 <5 % residivfri overlevelse på hhv. 55 % på nivolumab og 46 % ipilimumab, mens ved PD-L1 ≥5 % var tallene hhv. 76 % og 58 %. BRAF mutasjonsstatus så ikke ut til å ha noe å si for utfall av behandling, og resultatene i gruppene var ganske like. I gruppen med stadium III sykdom var residivfri overlevelse ved 24 måneder hhv. 64 % og 52 %, men den for stadium IV sykdom var hhv. 58 % og 44 %.
Studien (Ascierto et al., 2020), viser resultat etter 4 års oppfølging med recidivfri overlevelse (RFS) på 51,7 % for nivolumb, 41,2% for ipilimumab gruppen. 4 års total overlevelse (OS) 77,9% for nivolumab og 76,6% for ipilimumab.
Alvorlige bivirkninger grad 3–4 var hhv. 14,4 % og 45,9 % for nivolumab og ipilimumab. Behandlingen ble avbrutt pga. bivirkninger hos hhv. 9,7 % og 42,6 % respektivt. 2 dødsfall, dvs. 0,4 % relatert til bivirkninger, ble rapportert i ipilimumabgruppen i den første rapporten. På 4 års rapporten (ESMO 2020, Ascierto Lancet 2020) ble det også meldt om langtidsbivirkninger grad 3-4 med diare, diabetisk ketoacidose, og pneumonitt (en av hver i nivolumabgruppen) og kolitt (to pasienter i ipilimumabgruppen). Det har også kommet rapporter om at transplaterte pasienter har økt risiko for organavstøting og GVHD-reaksjon.
Bivikninger
Bivirkningsprofil på nivolumab adjuvant er tilsvarende som for stadium IV sykdom, dvs. vanlige bivirkninger er fatigue, utslett/hudkløe og kvalme, men alvorlige autoimmune sykdommer kan forekomme som ved ipilimumab, men i noe sjeldnere grad. Som ved ipilimumab er diaré en relativt vanlig bivirkning, og kan potensielt bli livstruende. I tillegg forekommer hepatitt, pneumonitt, nefritt, tyroiditt og hypofysitt. Omtale av bivirkningshåndtering finnes blant annet på hjemmesiden til Norsk melanomgruppe og i sykehusenes kvalitetshåndbøker.
Adjuvant bruk av nivolumab anbefales (Se anbefalinger).
Evidensgrad A
Anbefalt dosering: 480 mg iv hver 4. uke i ett år.
Pembrolizumab
Bakgrunn
I studien EORTC 1325 ble 1019 opererte stadium-III pasienter med >1 mm lymfeknutemetastase randomisert til å motta 200 mg pembrolizumab hver 3. uke i 1 år (18 doser), eller placebo (Eggermont et al., 2018). Primært endepunkt var residivfri overlevelse (RFS) i i total populasjonen og hos PD-L1 positive pasienter (>1 %). Ved median 15 måneders oppfølgning av populasjonen var 1 års RFS 75,4 % i pembrolizumab armen, mot 61 % for placebo. I den PD-L1 positive gruppen (n=853) var 1 års RFS 77,1 % i pembrolizumab armen, mot 62,6 % for placebo. Subgruppeanalyser, inkludert BRAF mutasjonsstatus, viste ingen signifikante forskjeller i effekt mellom gruppene.
Ny oppdatering etter 3 år oppfølging viser residivfri overlevelse på 63,7% vs 44,1% for henholdsvis pemrolizumab vs placebo (Eggermont et al., 2020). Ingen endring i subgruppeanalyser.
Ovelevelsestall forligger pt. ikke.
Bivirkninger
Forekomst av grad 3–5 bivirkninger var 14,7 % i pembrolizumab armen, mot 3,4 % ved placebo. 1 pasient døde av pembrolizumabutløst myositt. Samme bivirkninger kan som nevnt forkomme ved nivolumab.
En styrke ved designet av denne studien er at pasienter i placeboarmen som fikk påvist tilbakefall kunne starte opp med pembrolizumab i studien (part 2). Overlevelsen for disse pasientene vil dermed senere kunne sammenlignes med de som fikk pembrolizumab like etter operasjonen. Dette vil kunne gi svar på om man kan vente på tilbakefall, og så behandle med immunterapi, eller om man bør gi adjuvant behandling til alle like etter operasjon.
Overlevelsestallene er ennå ikke moden for denne studien.
Det er vanskelig å sammenligne tallene fra EORTC 1325 med CA209-238 siden sistnevnte inkluderte pasienter med dårligere prognose (stadium IIIb, IIIc og IV).
Adjuvant bruk pembrolizumab anbefales (Se anbefalinger).
Evidensgrad A
Anbefalt dosering: 400 mg iv hver 6. uke i ett år.
Ved valg av behandling (PD-1 hemmer eller BRAF/MEK-hemmere) bør det tas hensyn til forskjeller i administrasjonsform, bivirkninger og etterlevelse.
Anbefalinger:
- Pembrolizumab (Keytruda) anbefales til adjuvant behandling av voksne pasienter etter fullstendig reseksjon av melanom stadium III. 1,2 (A)
- Nivolumab (Opdivo) anbefales til adjuvant behandling etter fullstendig reseksjon av melanom stadium III og IV hos voksne og barn over 12 år. 1,2 (A)
- Dabrafenib (Tafinlar) i kombinasjon med trametinib (Mekinist) anbefales til adjuvant behandling etter fullstendig reseksjon av melanom stadium III med BRAF V600 mutasjon. 1,2 (A)
- (1) Det anbefales adjuvant behandling med PD-1 hemmer (Nivolumab eller Pembrolizumab) eller BRAF/MEK hemmer i form av Dabrafenib/Mekinist til pasienter med operert stadium III eller operert stadium IV melanom. Behandlingen bør starte senest 3 måneder etter operasjon. Ved overlappende indikasjon, avgjøres valg av medikament på bakgrunn av LIS-anbud. Valg mellom PD-1 hemmer og BRAF/ MEK hemmer gjøres i samråd med pasienten etter diskusjon av toksisitetsprofil og praktisk gjennomføring.
- (2) Til pasienter med stadium IIIA og lymfeknutemetastase < 1 mm anbefales ikke adjuvant behandling. Hos pasienter stadium IIIA med lymfeknutemetastase >1mm kan adjuvant behandling vurderes/diskuteres på MDT møte hvor risiko for residiv må veies opp mot mulige bivirkninger. Men det bør være unntak og ikke regelen å gi adjuvant behandling til denne pasientgruppen.
Neoadjuvant behandling
I studien SWOG S1801 fikk pasienter med klinisk detekterbart og resektabelt stadium IIIB-IV melanom enten 18 doser pembrolizumab hver 3. uke postoperativt (adjuvant) eller 3 kurer pembrolizumab hver 3. uke preoperativt (neoadjuvant) med påfølgende 15 kurer postoperativt (Patel et al., 2023). 313 pasienter ble randomisert og studien viser at event fri overlevelse (EFS) var signifikant bedre for neoadjuvant behandling sammenlignet med adjuvant i denne gruppen av pasienter (log-rank p=0.0015, Cox HR 0.59, 95% confidence interval (CI) 0.40-0.86). Antall pasienter som startet postoperativ pembrolizumab og antallet bivirkninger var likt i begge armene.
Antallet kurer med PD-1 hemmer er likt for adjuvant og neoadjuvant behandling med dette opplegget, og således er kostnadene det samme. På bakgrunn av den store nytten av neoadjuvant strategi, anbefales det at pasienter med klinisk detekterbar og resektabelt stadium IIIB-IV diskuteres på melanom-MDT med tanke på neoadjuvant behandling med PD-1 hemmer. Valg av PD-1 hemmer (pembrolizumab eller nivolumab) gjøres utfra hvilket medikament som anbefales i LIS-anbudet.
Primært inoperable hudmelanomer og slimhinnemelanomer kan være aktuelle for neo-adjuvant behandling etter «Prado-regimet» (Reijers et al., 2022) med dobbel immunterapi (B), eller med BRAF+MEK hemmere. Dersom dette vurderes, bør pasienten diskuteres på MDT-møtet ved nærmeste regionsykehus.
Anbefalinger:
- Pasienter med klinisk detekterbar og resektabelt stadium IIIB-IV diskuteres på melanom-MDT med tanke på neoadjuvant behandling med PD-1 hemmer.
- Primært inoperable hudmelanomer og slimhinnemelanomer kan være aktuelle for neo-adjuvant behandling etter diskusjon på melanom MDT-møte.
Oppfølging og etterkontroll etter avsluttet kurativ behandling
Innledning
Sist faglig oppdatert: 05.07.2023
Norge er blant de land i verden med høyest forekomst og dødelighet av melanom. Insidensen er stigende (Larsen, 2021). I løpet av de siste årene er det innført systematisk bruk av vaktpostdiagnostikk og det har kommet nye, mer effektive medikamenter i behandling av metastatisk sykdom. I tillegg er det en mer aktiv holdning til kirurgi og stereotaktisk strålebehandling ved metastatisk sykdom. Det har også vært utvikling innen billeddiagnostikk, med blant annet forbedring av ultralydteknikker og bruk av PET i kombinasjon med CT eller MR.
Det eksisterer i dag ulike anbefalinger internasjonalt om oppfølging og kontroll av melanom. Det finnes ingen studier som dokumenterer optimal rutineoppfølging av melanompasienter når det gjelder kontrollenes innhold, frekvens eller bruk av billeddiagnostikk (Cancer Council Australia et al., 2008; Dansk Melanom Gruppe, 2013; Dummer et al., 2011; Garbe et al., 2007; NCCN, 2013; NICE, 2015; Trotter et al., 2013). De fleste studier er retrospektive og utført på et tidspunkt med færre behandlingsmodaliteter enn i dag, hovedsakelig bruk av kirurgi ved lokoregionalt residiv eller solitære metastaser. Noen studier peker på at hyppig bruk av billeddiagnostikk er lite kostnadseffektivt, mens andre peker på muligheten for bedret overlevelse ved å oppdage residiv tidlig mens de ennå er operable.
Effekt av immunterapi og stereotaktisk hjernebestrålig er assosiert med behandlingsstart før pasienten har utviklet omfattende metastaser. Tidlig deteksjon av metastatisk sykdom kan derfor ha betydning for pasientens prognose (Livingstone et al., 2015; Rueth et al., 2015; Rueth et al., 2014; Rutkowski et al., 2014).
Anbefalinger om kontroll og oppfølging av melanom har vært gjenstand for revisjon i flere land de senere år, og både Danmark, Tyskland, Sveits og USA har innført nye anbefalinger om bruk av billeddiagnostikk hos undergrupper av pasienter (Trotter et al., 2013). Adjuvant behandling blir også nå implementert etter radikaloperert stadium III og IV-sykdom.
Av alle pasienter som får residiv er vel 20 % lokale residiv; dvs. satellitt eller in-transit metastaser, 50 % i regionale lymfeknuter og 30 % fjernmetastaser (Rueth et al., 2014). Ved lokalisert melanom er tumortykkelse (Breslow) den viktigste prognostiske faktor, dernest ulcerasjon. Eldre data viser at tumortykkelse 0,76–1,5 mm er forbundet med 25 % risiko for lokoregionale metastaser, og tykkelse > 1,5 mm mer enn 50 % risiko. Tilsvarende er det ved tumortykkelse 0,76–1,5 mm 8 % risiko for fjernmetastaser, mens det ved 4 mm tykkelse er mer enn 70 % risiko (Balch et al., 1992).
En europeisk multisenterstudie fra 2016 viste 5-års OS 95–100 % for stadium I, 65–92.8 % stadium II, 41–71 % stadium III, og 9–28 % stadium IV. 5-års residivfri overlevelse var 56 % for stadium II og 28–44 % for stadium III. Det bemerkes stor prognostisk variasjon innad i stadiene og differensieringen i oppfølgingen bør gjenspeile dette, for eksempel mellom IIA og IIB/C og mellom IIIA og IIIB/C (Svedman et al., 2016).
Vel 80 % av residiv etter gjennomgått melanom kommer i løpet av de første 3 årene, selv om residiv etter mange år også er beskrevet. Fjernmetastaser inntreffer senere (median 24–25 måneder) enn lymfeknutemetastaser (median 16–19 måneder) og satellitt og in-transit metastaser (median 17 måneder) (Personlig meddelse, 2015). En retrospektiv studie viste at for stadium III skjer de fleste residiv i løpet av de første 2–3 årene. Antall lymfeknuter med metastaser er viktigste prognostiske faktor hvor IIIA har en langt gunstigere prognose enn både stadium IIC, IIIB og IIIC (Romano et al., 2010).
Der det ikke lenger indikasjon for lymfeknutetoalett hos alle som får påvist metastase i vaktpostlymfeknute. Hos pasienter med positiv vaktpostlymfeknute som ikke opereres med lymfeknutetoalett, vil et mer aktivt kontrollregime understøttet av billeddiagnostikk være aktuelt.
Formålet med kontrollene
Sist faglig oppdatert: 05.07.2023
Formålet med kontrollene er å:
- diagnostisere lokale og regionale residiv mens de fortsatt er operable.
- diagnostisere nye melanom (2–8 %)
- gi kunnskap om egenundersøkelse og gode solvaner. (Kreftforeningen har f.eks. en folder «Følg med på føflekkene dine» som kan bestilles for utdeling til pasienter)
- gi trygghet for pasienten
- oppdage fjernmetastaser på et tidlig stadium hvor de ennå er egnet for behandling
Valg av billedmodalitet
Sist faglig oppdatert: 05.07.2023
En stor multisenterstudie med over 10 000 pasienter viser at ultralyd har høyest sensitivitet for å påvise lokoregionalt residiv, og PET-CT høyere sensitivitet enn CT på å oppdage fjernmetastaser (Xing et al., 2011). Når ultralyd benyttes i oppfølgingen av høyrisikopasienter, skal undersøkelsen gjøres av lymfeknutestasjon(er) identifisert med lymfescintigrafi.
Når det er utført SNB-diagnostikk på forhånd, undersøkes lymfeknutestasjon(er) basert på lymfoscintigrafifunn. Ultralydundersøkelse av arrområdet lokalt, samt området mellom lokalt arr og nærmeste lymfeknutestasjon(er), anbefales for å påvise eventuelle in-transit metastaser.
Der SNB-stasjon er ukjent gjelder følgende anbefaling:
- Ved primært melanom på truncus kan tumor metastasere til lymfeknutestasjon på motsatt side av kroppen. Ved melanom lokalisert superiort på rygg eller thorax, bør begge axiller og collum undersøkes. Er primærtumor lokalisert til bekken eller nedre del av abdomen, bør begge lysker undersøkes. Ved melanom lokalisert sentralt på truncus hvor det er usikkerhet om hvor lymfedrenasjen går, anbefales UL av både lysker og axiller bilateralt.
- Ved primærtumor i hode/halsområdet anbefales undersøkelse av begge sider collum.
- Ved lokalisasjon av tumor på ekstremitet undersøkes enten lyske eller axille samme side.
Ved ultralydvurdering av eventuelle metastatiske lymfeknuter, benyttes følgende kriterier, basert på erfaring med lymfeknutediagnostikk ved melanom (Oslo Universitetssykehus, Radiumhospitalet):
- Perifer perfusjon
- Tap av sentralt ekko (fettsinus), inkludert dislokasjon av denne mot periferien
- Ballongformet lymfeknute
- Oppsvulmet/voluminøs del av lymfeknute
- Område med lavere ekko enn i lymfeknutecortex for øvrig
- Annen uventet lymfeknutemorfologi
De tre førstnevnte kriteriene inngår i «Berlin-kriteriene» som er godt validerte (Voit et al., 2010). Vurdering av eventuelle in-transit metastaser er enklere siden dette er tumordeposisjoner langs lymfebaner i områder man ikke forventer å finne lesjoner/knuter, typisk i det subcutane rom. Ved ultralyd fremstår disse som svært hypoekkoiske.
Kontrollenes innhold
Sist faglig oppdatert: 05.07.2023
Anamnese: vekttap, endringer i helbredet siden sist, andre nye symptomer.
Klinisk undersøkelse: inspeksjon og palpasjon av operasjonsarr og området fra arr til nærmeste lymfeknutestatsjon(er) for å se etter satellitt og in-transit metastaser. Palpasjon av alle lymfeknutestasjoner, inspeksjon av hudoverflaten.
Billeddiagnostikk: Se tabeller i kapittel "Anbefalinger om kontrollenes hyppighet og bruk av billeddiagnostikk".
Blodprøver: Ikke rutinemessig. LD er en prognostisk faktor ved fjernmetastatisk sykdom og del av stagingen.
Andre grupper som har høyere risiko for residiv, som for eksempel immunsupprimerte, pasienter med systemsykdom og gravide, kan trenge tettere og mer langvarig oppfølging, men dette må vurderes individuelt.
Radiologisk utredning /oppfølging forutsetter at pasienten er vurdert til å tåle kirurgi eller systembehandling ved påvist spredning.
Anbefalinger om kontrollenes hyppighet og bruk av bildediagnostikk
Sist faglig oppdatert: 05.07.2023
| N | M | Stadium | Klinisk kontroll | Ultralyd | PET-CT* | MR | Kommentar |
| |
|---|---|---|---|---|---|---|---|---|---|---|
Tis | 0 | 0 | 0 | En kontroll etter 3 mnd |
|
|
| God info. Følges videre hvis spesiell risiko |
| |
T1a | 0 | 0 | IA | En kontroll etter 3 mnd |
|
|
| God info og div forbehold før avslutning individ og histologi (se eget punkt under) |
| |
T1b | sn0 | 0 | IA | En kontroll etter 3 mnd |
|
|
| Nedstages til 1A ved negativ SNB |
| |
T1b | 0 | 0 | IB | Første etter 3 mnd, så hver 6. mnd i 5 år |
|
|
| Når SNB ikke er utført |
| |
T2a | 0 | 0 | IB | Første etter 3 mnd, så hver 6. mnd i 5 år |
|
|
|
|
| |
T2b-3a | 0 | 0 | IIA | Første etter 3 mnd, så hver 6. mnd i 5 år |
|
|
|
|
| |
T3b-4a | 0 | 0 | IIB | Første etter 3 mnd, så hver 6. mnd i 5 år | Hver 6. mnd i 3 år | 12, 24 og 36 mnd | Ved klinisk mistanke | Ultralyd av arr, in transit og lymfeknutestasjon identifisert med scintigrafi |
| |
T4b | 0 | 0 | IIC | Første etter 3 mnd, så hver 6. mnd i 5 år | Hver 6. mnd i 3 år | 12, 24 og 36 mnd | Ved klinisk mistanke | Ultralyd av arr, in transit og lymfeknutestasjon identifisert med scintigrafi |
| |
Se tabell |
| 0 | IIIA | Første etter 3 mnd, så hver 6. mnd i 5 år | Hver 6. mnd i 3 år | Ved klinisk mistanke / oppstart medisinsk behandling | Ved klinisk mistanke | Ultralyd av arr, in transit og lymfeknutestasjon identifisert med scintigrafi. Stadium IIIA stages og følges som IIIB ved oppstart av adjuvant behandling. |
| |
|
| 0 | IIIB | Første etter 3 mnd, så hver 6. mnd i 5 år | Hver 6. mnd i 3 år | 12,24 og 36 mnd | Ved klinisk mistanke | Ultralyd av arr, in transit og lymfeknutestasjon identifisert med scintigrafi |
| |
|
| 0 | IIIC | Første etter 3 mnd, så hver 6. mnd i 5 år. | Hver 6. mnd i 3 år | 12,24 og 36 mnd | Samme som PET-CT | Ultralyd av arr, in transit og lymfeknutestasjon identifisert med scintigrafi |
| |
|
| 0 | IIID | Første etter 3 mnd, så hver 6. mnd i 5 år. | Hver 6. mnd i 5 år | 12,24 og 36 mnd | Samme som PET-CT | Ultralyd av arr, in transit og lymfeknutestasjon identifisert med scintigrafi |
| |
|
| 1 | IV | Individualiseres | Individualiseres | Minst 10 års oppfølging | ||||
* Suspekte lymfeknuter bør undersøkes cytologisk før henvisning til PET-CT. Ved høy mistanke om spredning, tas de opp på melanom MDT.
Det er svært viktig at man stager etter AJCC 8th edition der IIIA defineres slik: T-stadium maks 2 a (1–2 mm uten ulcerasjon) og maks N2a (2–3 lymfeknuter med mikrometastaser).
| T Category | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| T0 | T1a | T1b | T2a | T2b | T3a | T3b | T4a | T4b | |
| N Category | N1a | N/A | A | A | A | B | B | C | C | C |
N1b | B | B | B | B | B | B | C | C | C | |
N1c | B | B | B | B | B | B | C | C | C | |
N2a | N/A | A | A | A | B | B | C | C | C | |
N2b | C | B | B | B | B | B | C | C | C | |
N2c | C | C | C | C | C | C | C | C | C | |
N3a | N/A | C | C | C | C | C | C | C | D | |
N3b | C | C | C | C | C | C | C | C | D | |
N3c | C | C | C | C | C | C | C | C | D | |
Avslutning stadium 1A (pT1a og pT1b med negativ vaktpost)
Her må man ta hensyn til om det foreligger individuell økt risiko for nye melanom eller residiv.
For alle som avslutter kontroller, forutsettes god informasjon om egenundersøkelse og solvett.
Individuell risiko i forhold til nye melanom (kjent mutasjon, unge pasienter (<20), multiple inhomogene føflekker, hudtype 1, familiær forekomst uten påvist mutasjon, andre faktorer) kan være grunn til å følge opp pasienten f.eks årlig.
Det er også viktig å lese hele histologibeskrivelsen, da det kan foreligge histologiske funn som kan indikere mer aggressiv tumor uavhengig av Breslow. Der man har f.eks nodulær histologisk type (Dessinioti et al., 2019; Lattanzi et al., 2019), ≥ 2 mitoser, vaskulær infiltrasjon, ulcerasjon, nevrotropisme, akral lokalisering (Bello et al., 2013; Bradford et al., 2009; Chopra et al., 2020) eller desmoplastisk vekstmønster, bør man melde disse tilfellene opp til MDT. Dette gjelder også immunsupprimerte pasienter.
Pasientene må vurderes individuelt når det gjelder kontrollopplegg.
Hvem skal følge opp pasientene
Sist faglig oppdatert: 05.07.2023
Den første kontrollen etter melanom stadium I og II, samt ved ukjent primær tumor, bør foregå hos hudlege. Her skisseres videre kontrollopplegg ut fra gjeldende retningslinjer, og det gis en samlet vurdering. Den videre oppfølgingen kan ofte skje hos fastlege, men pasienter som vurderes å være i høyrisikogrupper for residiv (stadium IIB-IIC), eller med økt risiko for nye melanom, bør helt eller delvis følges opp av hudlege som også koordinerer billediagnostikken.
For stadium III bør hovedansvaret for oppfølgingen tilfalle spesialist tilknyttet de sykehusene som utfører SNB-diagnostikk og lymfeknutedisseksjon. Hvilken spesialist som har hovedansvar kan tilpasses lokale forhold avhengig av tradisjon og ressurser. Det kan være plastikkirurg, endokrinkirurg/generell kirurg, hudlege eller onkolog. Kontrollene kan fordeles mellom ulike spesialister der det er hensiktsmessig, men en spesialist må stå som hovedansvarlig og sørge for at billedundersøkelser blir gjennomført.
Seneffekter etter behandling
Sist faglig oppdatert: 05.07.2023
I 2017 ga Helsedirektoratet ut rapporten Seneffekter etter kreftbehandling: faglige råd. Målgruppen for rapporten er klinikere og annet helsepersonell som er i kontakt med kreftpasienter, og pasienter som har vært gjennom kreftbehandling. Rapporten har kapitler om sekundær kreft, kardiovaskulære seneffekter, pulmonale seneffekter, hormonforstyrrelser etter kreftbehandling, seksualitet etter kreftbehandling, kognitive problemer, fatigue, langtidsbivirkninger etter behandling av hjernesvulst, psykososiale forhold, tann- og munnhuleproblemer og spesielle forhold etter kreftbehandling hos barn. En oppdatert og utvidet utgave ble publisert april 2020, der også temaene muskel- og skjelettskader, perifere neuropatier, seneffekter etter kreft i bekkenregion, fertilitet og lymfødem er inkludert.
Det er særlig viktig at fastleger, som skal følge opp pasienter som er skrevet ut fra spesialisthelsetjenesten, er oppmerksomme på risikoen for seneffekter etter kreftbehandling, og at disse kan debutere lenge etter avsluttet behandling.
Behandling av inoperabel lokalavansert eller metastasert sykdom
Medikamentell behandling
Sist faglig oppdatert: 05.07.2023
I dette kapitlet omtales blant annet bivirkninger av forskjellige medikamenter. Det bemerkes at denne omtalen ikke er fullstendig, og det vises til SPC (felleskatalogtekst) for de enkelte medikamentene.
Generelt om systemisk behandling av inoperabel stadium III og stadium IV
Generelt bør pasienter med inoperabelt stadium III eller stadium IV vurderes for henvisning til inklusjon i utprøvende studier (se nedenfor). Pasienter som er villig til å delta i kliniske studier skal, ved behov for senere behandling, vurderes til den behandlingslinje de ville tilhøre dersom de ikke deltok i kliniske studier, dersom det ellers er faglig begrunnet. Dette er for å sikre at studiepasienter ikke skal miste muligheten til standard godkjent medisinsk behandling ved deltagelse i kliniske studier.
Pasienter som ikke ønsker eller ikke er inkluderbare i kliniske studier, vil få tilbud om systemisk behandling. Generelt forutsetter dette god allmenntilstand, ECOG 0–2, og ingen alvorlig komorbidet.
Pasienter hvor det billedmessig eller klinisk er mistanke om fjernmetastaser, skal i hovedsak biopseres for å verifisere diagnosen. 40–50 % av pasienter med metastatisk melanom har BRAF-mutasjon. Påvisning av BRAF-mutasjon vil ha betydning for valg av regime. Det bør i utgangspunktet gjøres BRAF-testing fra fjernmetastase, alternativt lymfeknutemetastase. BRAF-analyse kan også gjøres på primærtumor, for eksempel ved residiv i form av multiple hjernemetastaser eller små metastaser som ikke er tilgjengelige for biopsi, for eksempel i lunge eller lever. Det kan også være nyttig med oversikt over andre vanlige mutasjoner, således er det ønskelig med et genpanel som innbefatter NRAS og c-Kit i tillegg til BRAF. Det anbefales også å rekvirere PDL-1 test på nyeste biopsi fra metastatisk sykdom dersom nivolumab/ipilimumab-kombinasjonen er aktuell (se nedenfor).
Per i dag finnes det ikke dokumentasjon for at systemisk behandling ved metastatisk melanom kan gi kurasjon, selv om studier har vist at en andel pasienter har levd i mange år etter avsluttet behandling (Robert et al., 2019b; Wolchok et al., 2022). Pasienten må informeres om at behandlingen primært har symptomlindring og livsforlengelse som mål. Overfor pasienter i dårlig allmenntilstand eller med alvorlig komorbiditet, bør man i utgangspunktet være tilbakeholden med systemisk behandling grunnet risiko for alvorlige bivirkninger. Hos enkelte pasienter, særlig eldre, kan sykdommen stabilisere seg eller utvikle seg svært langsomt med lite eller ingen plager eller symptomer. I disse tilfellene kan man vurdere å observere metastatisk melanom ubehandlet.
Behandlingssekvens
De store kliniske studiene på metastatisk melanom som omtales under, er alle med tidligere ubehandlede pasienter. Det er ikke randomiserte prospektive studier som dokumenterer effekt av immunterapi eller BRAF/MEK hemming hos tidligere behandlede pasienter (2- linje). En cohort-studie viser at begge modaliterer har effekt i 1 og 2 linje (Czarnecka et al., 2019). DREAMseq studien er publisert i abstrakt form og tyder på at BRAF+ pasienter som starter med dobbel immunterapi gjør det bedre enn pasienter som starter med BRAF/MEK hemmere (Atkins et al., 2021).
BRAF/MEK-hemmere
Mellom 40–50 % av pasienter med metastatisk melanom har påvist BRAF-mutasjon. Ca. 75 % av disse har V600E-mutasjon og 15–20 % V600K. Andre mutasjoner er sjeldnere (Menzies et al., 2012). BRAF-positive pasienter med utbredt sykdom kan være aktuelle for behandling med BRAF og MEK hemmere. BRAF hemmere som monoterapi er studert, men brukes kun unntaksvis på grunn av redusert effekt og mer bivirkninger sammenlignet BRAF+MEK hemmere i kombinasjon. MEK er en signalveiskinase nedstrøms for BRAF, og hemming av MEK kan forsterke og forlenge effekten av BRAF-hemming.
Bakgrunn: I Combi-D og Combi-V studiene randomiserte man mellom dabrafenib+placebo/vemurafenib mot dabrafenib+trametinib (Robert et al., 2019a). Studiene viste en total overlevelse ved 5 år på 34% for D/T. Dabrafenib brukes 150 mg x 2 po, og trametinib 2 mg x1. I CoBRIM studien ble pasienter randomisert til vemurafenib + placebo eller vemurafenib + cobimetinib, og den viste økt median OS på 17,4 mot 22,3 mnd (Ascierto et al., 2016). Vemurafenib brukes 960 mg x 2 po og cobimetinib 60 mg po i 21 dager, deretter 7 dagers pause. I Colombus-studien gav man kombinasjonen av Enkorafenib (BRAF-hemmer) og Binimetinib (MEK-hemmer) (Dummer et al., 2018). Median OS var 33,6 mnd og median PFS var 14,9 mnd. Selv om kombinasjonen ikke var direkte sammenlignet med andre BRAF/MEK kombinasjoner, viser studien at kombinasjonen er relativt godt tolerert. Enkorafenib brukes 450 mg x 1 po, og binimetininb 45 mg x 2 po.
Bivirkninger ved BRAF/Mek kombinasjoner: Det er noe ulik bivirkningsprofil mellom de forskjellige BRAF/MEK kombinasjonene. Feber, frysninger, utslett, fototoxisitet, kvalme, diaré, fatigue, atralgi, hånd-fot syndrom og alopeci er rapportert i varierende grad. Alvorlige bivikninger som serøs retinopati og fall i EF%, kan forekomme. Ved symptomer fra øye anbefales henvisning til spesialist i øyesykdommer. Det anbefales kontroll av hjertefunksjon (Ekko/MUGA) ved oppstart, samt hver 3. mnd.
Immunterapi ipilimumab
Ipilimumab er et humant monoklonalt antistoff mot cytotoksisk T-lymfocytt antigen-4 (CTLA-4). Normalt nedregulerer CTLA-4 T-celle-aktivering. Ipilimumab potenserer dermed T-celle-aktivering.
Bakgrunn: Ipilimumab og glykoprotein-peptid-vaksine (Gp 100-vaksine) ble testet i en trearmet studie. Studien inkluderte pasienter som hadde inoperabelt stadium III/IV-melanom med progresjon av sykdommen etter systemisk behandling. Ipilimumab ga, som det første medikamentet noensinne, signifikant forlenget overlevelse (Hodi et al., 2010). Hos omtrent 20 % av pasientene gir ipilimumab langtidsoverlevelse.
Bivikninger: Bivirkningene ved bruk av medikamentet er autoimmunlignende symptomer. De vanligste er kolitt, hepatitt, hypofysitt og dermatitt. Disse funnene er senere bekreftet i flere store kliniske studier, inkludert når ipilimumab er gitt i første linje. Pasientene skal informeres om rask kontakt ved bivirkninger, særlig ved diaré. Bivirkninger kan komme sent, noen ganger mer enn ett år etter infusjonene.
Det anbefales ikke ipilimumab til pasienter med rask sykdomsprogresjon eller stort sykdomsvolum. Det må tas høyde for at en forbigående vekst (pseudoprogresjon) av tumormanifestasjoner kan forekomme. Dette er særlig viktig dersom kritiske organer er truet.
Ipilimumab gis med 3 mg/kg hver 3. uke. Totalt 4 kurer. Pasienten bør ha tumor respons eller stabil sykdom i minimum 6 måneder på PD-1 hemmer i 1.linje dersom ipilimumab skal forsøkes i 2. linje. Det anbefales hyppige kontroller hos onkolog under behandling med ipilimumab, samt godt samarbeid med fastlege og lokalsykehus. Leverprøver, hormonprøver og hematologi må tas før hver kur. Evaluering med CT/MR hver 3. mnd.
Immunterapi PD-1 hemmere
Melanom er en immunogen kreftsykdom, og nyere studier har vist at sykdommen kan behandles ved å påvirke immunsystemets kontrollposter (Immune Checkpoint Blockade). PD-1 (programmed death 1) er en reseptor uttrykt på T-celler og liganden PD-L1 er utrykt på tumorceller, og ved binding mellom disse nedsettes T-celle aktivering. PD-1 hemmere blokkerer denne bindingen og gir en økt T-celle respons.
Både pasienter som har fått påvist BRAF V600-mutasjon i tumor og de som ikke har mutasjonen bør vurderes for immunterapi.
Bakgrunn: Keynote-006 randomiserte pasienter mellom pembrolizumab (10mg/kg Q2W eller Q3W) og ipilimumab som 1. linjes behandling. Median OS var 32.7 mnd for pembrolizumab og 15.9 mnd for ipilimumab. Effekten i de to pembrolizumab gruppene var ganske lik. Alvorlige grad 3–5 bivirkninger var 17 % og 20 % (Robert et al., 2019b).
Checkmate –066 studien fikk pasienter uten BRAF-mutasjon nivolumab standard dose 3mg/kg Q2W mot dacarbazine 1. linje. 5 års overlevelse var 39 % mot 17 %. Median OS var 37.3 mnd mot 11.2 mnd. Overlevelsesgevinsten på nivolumab var lik uansett subgrupper (Robert et al., 2020).
Bivikninger: Vanlige bivirkninger på PD-1 hemmere er fatigue, utslett/hudkløe og kvalme, men alvorlige immunrelaterte bivirkninger kan forekomme som ved ipilimumab, men i noe sjeldnere grad. Som ved ipilimumab er diaré en relativt vanlig bivirkning, og kan potensielt bli livstruende. I tillegg forekommer hepatitt, pneumonitt og hypofysitt. Omtale av bivirkningshåndtering finnes i kapittelet om Medikamentell behandling.
Forsiktighetsregler ved bruk av PD1-hemmer:
- Pasienter med stor tumorbyrde og rask progresjon. I disse tilfeller bør man vurdere evt. BRAF hemmer dersom BRAF mutert.
- Pasienter med ECOG > 2.
- Pasienter med store ustabile hjernemetastaser: Først etter at lokal behandling med strålebehandling (stereotaktisk, gammakniv eller totale hjernefelt), eller forbehandling med BRAF-hemmer dersom BRAF-mutasjon foreligger, kan immunterapi vurderes.
- Pasienter med aktiv, autoimmun sykdom som behandles aktivt med immunsuppressiva.
Nivolumab gis 480 mg hver 4 uke, mens pembrolizumab gis 400 iv hver 6 uke. Leverprøver, hormonprøver og hematologi må tas før hver kur. Ved plagsomme eller alvorlige bivirkninger gjøres ikke dosereduksjon. Det anbefales å utsette kur til bivirkningene er under kontroll.
Nivolumab og pembrolizumab regnes som omtrent likeverdige i effekt og bivirkningsprofil. I utgangspunktet vil valg av medikament være det medikament som gir best prisanbud i LIS-samarbeidet. Avvik fra dette må begrunnes i pasientjournal.
Immunterapi gjennomføres ved sentre som har erfaring med dette og som har et opparbeidet system for trygg bivirkningshåndtering.
Behandlingsvarighet er to år basert på studiene som er gjennomført så langt. Studier av kortere behandlingstid er pågående. Det anbefales responsevaluering hver 12. uke. Behandlingen seponeres ved klare tegn til progress eller ikke-håndterbar toksisitet. Ved bekreftet komplett respons kan også kortere behandlingstid vurderes. En må ta høyde for at pseudoprogress på CT kan forekomme, og en bør derfor også ta hensyn til hvordan pasienten responderer klinisk (funksjonsklasse, symptomlindring o.l.). Dersom progress tilkommer etter at medikamentet ble seponert etter behandling med respons, kan rebehandling vurderes.
Immunterapi PD-1 hemmere i kombinasjon med anti CTLA-4
Dokumentasjon av sikkerhet og effekt er i hovedsak fra én randomisert, dobbeltblindet, multisenter, fase 3 studie, CheckMate 067 (Larkin et al., 2019). I studien sammenlignes behandling med nivolumab som monoterapi eller i kombinasjon med ipilimumab mot ipilimumab monoterapi. Pasientene (N=935) hadde avansert (inoperabelt eller metastatisk) melanom og var tidligere ubehandlet. Oppdaterte data foreligger (Wolchok et al., 2022).
Begge de nivolumab-holdige behandlingsarmene var signifikant bedre enn ipilimumab monoterapi på alle parametere. Studien var ikke designet med statistisk styrke til å kunne vise forskjell mellom kombinasjonsbehandling og nivolumab monoterapi. Resultatene må derfor tolkes med varsomhet. Kombinasjonsbehandling viste øket PFS sammenlignet med nivolumab monoterapi, median PFS hhv. 11,5 måneder og 6,9 måneder (HR 0,79: 95% KI 0,64-0,96). For OS var effekten ikke signifikant forskjellig for kombinasjonsbehandling og nivolumab monoterapi, HR 0,83 (95 % KI 0,66–1,03).
Subgruppeanalyser viser at det er pasienter med PD-L1 under 1% som har nytte av å legge til ipilimumab til nivolumab; HR 0,69 (0,5-0,97). Videre ser det ut til at BRAF-muterte har numerisk mer nytte av å legge til ipilimumab enn ikke-muterte (NS).
Anbefalt dose er 1 mg/kg nivolumab og 3 mg/kg ipilimumab hver 3. uke de første 4 dosene, deretter 480 nivolumab hver 4. uke. Begge administreres som en intravenøs infusjon, i løpet av 60 minutter for nivolumab og i løpet av 90 minutter for ipilimumab.
Bivirkninger er hyppigere og mer alvorlige med kombinasjonsbehandling enn med monoterapi. I CheckMate 067 var det 59 % som fikk bivirkninger grad 3–4 av kombinasjonsbehandling, og 23 % som fikk det av nivolumab monoterapi. De vanligste bivirkningene for kombinasjonsbehandling var diaré, utmattelse, kløe, utslett, kvalme, feber, nedsatt appetitt, ALT/AST økning og hypotyreoidisme. Behandlingsstopp på grunn av bivirkninger skjedde hos 40 % som fikk kombinasjonsbehandling, og 12 % som fikk monoterapi.
Diagnostisk test (PD-L1 ekspresjon) er ikke tilstrekkelig validert som rutine ved melanom ved norske patologiavdelinger. Beslutningsforum besluttet å åpne for bruk av kombinasjonen i 1. og 2. linje. Basert på publiserte kliniske data, vil opp mot 30% av pasientene kunne ha god effekt (objektiv respons) av 2. linjes kombinasjonsimmunterapi. Det er anslått median overlevelse rundt to år, og en del av pasientene vil trolig oppnå langtidsoverlevelse. Med dagens 2. linjes behandling (ipilimumab) oppnår kun ca 10-15% effekt (objektiv respons), og median overlevelse er trolig under ett år (Olson et al., 2021; Pires da Silva et al., 2021). Siden majoriteten av de pasientene som responderer på PD-1 hemmere i 1. linje kun har behov for monoterapi, vil en kunne spare mange pasienter for den økte risikoen for komplikasjoner med kombinasjonsimmunterapi ved å gi dette til de som har behov for 2. linjes immunterapi. Hos selekterte pasienter med god funksjonsklasse og som er informert om og villig til å akseptere en høyere risiko for bivirkninger, kan kombinasjonen av nivolumab og ipilimumab vurderes ved metastatisk melanom også i 1.linje. Ipi/Nivo kombinasjonsbehandling bør foregå på sykehus med erfaring fra bruk av ipilimumab. Behandling bør fortsette så lenge det er observert en klinisk fordel, eller til behandlingen ikke lenger tolereres av pasienten. Ved respons eller stabil sykdom ved 2 år, anbefales det å stanse behandlingen og observere ubehandlet videre.
Det anbefales at de patologiske avdelinger benytter samme metodikk for PD-L1 analyse som allerede innført ved lungekreft. Således anbefales PD-L1 test på representativt metastatisk vev fra en ferskest mulig biopsi. Detsettes ikke en fast grense for lav PD-L1 ekspresjon (1 % eller 5 %). Dette vil bli vurdert på nytt når det er samlet erfaring fra testmetodikk og analyse ved de forskjellige patologilaboratoriene. Resultatene fra PD-L1 testene må vurderes sammen med øvrige pasientopplysninger.
Kjemoterapi
Kjemoterapi er i dag lite i bruk ved melanom (Eggermont et al., 2004). Studier har vist at BRAF-muterte har svært lav responsrate på dakarbazine, ned mot 5 %, og det anbefales tilbakeholdenhet med bruk av dakarbazine hos disse. Hos BRAF-negative pasienter som ikke egner seg for ipilimumab, kan kjemoterapi fremdeles vurderes selv om forventet responsrate er lav (10–15 %). DTIC 850mg/m2 hver 3. uke eller 1000mg/m2 hver 3.–4. uke. Alternativt kan det tilbys Temozolomide (Temodal) 200mg/m2 i fem dager gitt med fire ukers syklus. Temozolomide har i flere fase-III studier vist lik effekt på progresjonsfri overlevelse som DTIC (Middleton et al., 2000). Temozolomide gis peroralt. Det passerer blod-hjerne-barrieren og kan egne seg ved metastaser til CNS, eller hos pasienter som ønsker tablettbehandling. Det kan gi alvorlig og langvarig trombocytopeni, og benmargsfunksjonen bør følges nøye (Agarwala, 2009; Eggermont et al., 2004). Pasientene må være behandlingsmotiverte og i god allmenntilstand. De må informeres om at responsraten er svært lav. Terskelen for å avbryte behandlingen må være lav dersom plagsomme bivirkninger inntreffer, eller det er mistanke om manglende effekt.
Pasienter med multiple metastaser til en underekstremitet kan få intensiv lokal cytostatikabehandling i de tilfeller der metastasene ikke kan fjernes kirurgisk (Kroon et al., 2009). OUS Radiumhospitalet har landsfunksjon i Norge for ILP («isolated limb perfusion») hvor det anvendes hypertermi og intra-arteriell melfalan, enten alene eller i kombinasjon med tumornekrose faktor (TNF) (Grünhagen et al., 2005). Elektrokjemoterapi (ECT) med Bleomycin kan vurderes ved plagsomme overflatiske lesjoner under forutsetning av at pasienten ikke har lungesykdom. Pasienter som skal vurderes for slik behandling må henvises direkte til OUS Radiumhospitalet.
Anbefalinger
Pasienter med inoperabel stadium III eller stadium IV med BRAF-mutasjon
1. linje:
1) PD-1 hemmer (A)
- Hos selekterte pasienter med god funksjonsklasse, og som er informert om - og villig til - å akseptere en høyere risiko for bivirkninger, kan kombinasjonen av nivolumab og ipilimumab vurderes (A).
1) BRAF/MEK hemmer i kombinasjon med MEK hemmer (A)
2. linje:
1) Immunterapi* dersom BRAF/MEK i første linje (B)
1) BRAF/MEK dersom immunterapi i første linje (B)
2) Ipilimumab monoterapi
- Dersom pasienten initialt responderte på PD-1 hemmer kan ipilimumab forsøkes i 2. linje (B).
Pasienter med inoperabel stadium III eller stadium IV uten BRAF-mutasjon
1. linje:
1) PD-1 hemmer (A)
- Hos selekterte pasienter med god funksjonsklasse, og som er informert om, og villig til å akseptere, en høyere risiko for bivirkninger, kan kombinasjonen av nivolumab og ipilimumab vurderes (A).
2. linje:
1) Dobbel immunterapi (PD-1+ CTLA4 hemmere) (B)
- Dersom PD-1 hemmer monoterapi gitt i første linje.
1) Ipilimumab (B)
- Dersom pasienten initialt responderte på PD-1 hemmer kan ipilimumab forsøkes i 2. linje. Dette forutsetter også at pasienten er i god funksjonsklasse, har lite tumor volum og langsomt utviklende sykdom.
2) DTIC
- Forventet respons ved DTIC er liten, men kan vurderes unntaksvis hos pasienter med god funksjonsklasse som har kontraindikasjoner immunterapi (1. linje) og pasienter som progredierer på immunterapi (2. linje) (A).
Pasienter med behandlingsresistente multiple metastaser til en ekstremitet
ILP (isolated limb perfusion) (B)
Pasienter med behandlingsresistente hudmetastaser
Elektrokjemoterapi (B)
* PD-1 hemmer monoterapi eller PD-1 hemmer + anti CTLA4
Anbefaling
- Ved metastatisk sykdom bør pasienten diskuteres på melanom-MDT. Kirurgi kan gjøres først og fremst hos pasienter med ett fokus. Det forutsettes tilfredsstillende billedutredning på forhånd. Adjuvant behandling er aktuelt.
Strålebehandling
Sist faglig oppdatert: 05.07.2023
Strålebehandling kan gi god palliasjon og lokal kontroll av inoperable metastaser, og ved progresjon av metastaser, til tross for systemisk behandling, spesielt hvis metastasene ikke er for store. I flere prospektive kliniske studier er det dokumentert objektiv remisjon av minst 50 % av bestrålte metastaser (Fenig et al., 1999; Peters et al., 1992).
Vanlig fraksjonering er 3 Gy x 10–12, 4 Gy x 5 og 8–10 Gy x 1. Lokalisasjon, feltstørrelse, sykdomsutbredelse, allmenntilstand og andre behandlingsmuligheter er avgjørende for hvilken fraksjonering som velges.
Ved metastaser fra melanom bør stråleterapi vurderes i følgende situasjoner:
Hudmetastaser som er symptomgivende og ikke kan fjernes kirurgisk, ikke har effekt av systemisk behandling eller kan behandles med elektrokjemoterapi (ECT).
Skjelettmetastaser som forårsaker smerter eller frakturfare, eller truer viktige strukturer (som for eksempel medulla spinalis eller nerverøtter). Kirurgisk behandling som laminectomi og stabilisering av columna bør vurderes i tillegg. Stereotaktisk strålebehandling kan gis med godt resultat ved én eller få metastaser i columna dersom disse ikke er lokalisert helt inntil spinalkanalen. Vanligvis gis da en fraksjon a 16 Gy. Slik behandling øker sannsynligheten for tumorkontroll og en rask klinisk respons. Rebestråling er mulig på grunn av redusert dosebidrag blant annet til medulla spinalis (Waldeland et al., 2012).
Rundt 50 % av pasientene med metastaserende melanom utvikler hjernemetastaser.
Ved få metastaser der kirurgi ikke er aktuelt, bør stereotaktisk strålebehandling vurderes (Sperduto et al., 2010). Vanligvis gis en fraksjon a 18–25 Gy avhengig av tumors diameter. Ved spesielle lokalisasjoner, eller bestråling av flere metastaser samtidig, gis behandlingen ofte fraksjonert. Det sees respons hos 85–90 % av pasientene (Noël et al., 2002). Postoperativ stereotaktisk strålebehandling bør vurderes ved mistanke om resttumor i operasjonskaviteten etter kirurgi. Rebestråling er ofte mulig. Å gi adjuvant strålebehandling mot hele hjernen etter lokal behandling bedrer ikke den intrakranielle kontroll (Hong et al., 2019).
Oftest har pasientene multiple hjernemetastaser. Hos pasienter med asymptomatiske metastaser og som ikke er avhengige av steroider, bør systemisk behandling vurderes.
Det kan være aktuelt å strålebehandle hele hjernen, men dette gjøres nå i liten grad etter at effektiv systemisk behandling ble tilgjengelig. Det oppnås forbigående symptomatisk bedring hos 60–70 % av pasientene. Hvis pasientens andre metastaser er under kontroll, vil man ofte gi 10 fraksjoner à 3 Gy. Ved utbredt sykdom vil man gi 5 fraksjoner à 4 Gy. Hjernemetastaser fra melanom er sjelden lokalisert i hippocampusregionen. Det kan derfor i fremtiden bli aktuelt å skjerme hippocampus under strålebehandling mot hele hjernen (Hong et al., 2014).
Ubehandlet er den mediane overlevelsen for pasienter med hjernemetastaser ca. 1–2 måneder, og 4–6 måneder med strålebehandling alene mot hele hjernen. Prognosen er bedre ved kirurgi og/eller stereotaktisk strålebehandling og med nyere systemisk behandling (Brennum et al., 2002).
Stereotaktisk strålebehandling har vært mest benyttet ved metastaser i hjerne og lunger, men gis også mot metastaser i begrensede områder i andre organer som lever, milt, binyrer og columna, og med meget gode resultat. Ved perifert beliggende lungemetastaser gis ofte 3 fraksjoner á 18 Gy. Ved metastaser nær thoraxveggen gis gjerne 11 Gy x 5. Ved metastaser beliggende nær hilus/mediastinum er vanlig fraksjonering 7.5 Gy x 8. Ved metastaser i for eksempel lever, milt og binyrer er vanlig fraksjonering 10–15 Gy x 3, avhengig av størrelse og beliggenhet.
Det pågår studier for om mulig å kunne avgjøre hvilke pasienter som vil ha effekt av stereotaktisk strålebehandling, og hvordan skille progresjon fra strålenekrose etter slik behandling.
Anbefalinger:
- Strålebehandling bør vurderes ved symptomgivende metastaser i hud der kirurgisk behandling eller elektrokjemoterapi ikke er aktuelt, eller eventuell systemisk behandling ikke har effekt.
- Strålebehandling – eventuelt kombinert med kirurgisk behandling – er aktuelt ved skjelettmetastaser som forårsaker smerter eller frakturfare, og ved metastaser som komprimerer eller truer viktige strukturer som medulla spinalis.
- Ved få hjernemetastaser bør stereotaktisk strålebehandling vurderes dersom kirurgisk behandling ikke er aktuelt. Ved asymptomatiske metastaser som ikke krever steroibehandling, bør systemisk behandling vurderes. Stereotaktisk strålebehandling kan også være aktuelt ved metastaser i begrensede områder i andre organer som lunger, lever, milt, binyrer og columna.
Kirurgi
Sist faglig oppdatert: 05.07.2023
Pasienter med metastatisk sykdom (stadium lV) har dårlig prognose. De siste 10 års forskning har medført gjennombrudd i den systemiske behandlingen. Til tross for dette vil det være en del pasienter som vil ha nytte av kirurgisk behandling. Selekterte pasienter med singel eller oligo metastaser kan ha nytte av kirurgi som førstevalg, spesielt ved tilbakefall i hud/underhud. Dette er ikke evaluert i prospektiv randomisert studie, men median overlevelse på 21 måneder er rapportert tidligere (Meyer et al., 2000; Miller, 1993; Overett et al., 1985; Patchell et al., 1990). Når kirurgi vurderes, forutsettes det at pasientene er nøye utredet billeddiagnostisk med tanke på flere foci (ultralyd, CT, MR, ev. PET) (Jimenez-Requena et al., 2010; Xing et al., 2011). Pasienter som er aktuelle for metastasekirurgi bør diskuteres på MDT-møte og eventuelt tilbys adjuvant behandling (Ascierto et al., 2020).
Anbefaling:
- Ved metastatisk sykdom bør pasienten diskuteres på melanom-MDT. Kirurgi kan gjøres først og fremst hos pasienter med ett fokus. Det forutsettes tilfredsstillende billedutredning på forhånd. Adjuvant behandling kan være aktuelt.
Hjernemetastaser
Sist faglig oppdatert: 05.07.2023
Opp mot 40% av pasienter med generalisert sykdom utvikler hjernemetastaser i løpet av sykdomsforløpet, men autopsistudier har vist forekomst opp til 74% (Sampson et al., 1998). Behandling av hjernemetastaser må vurderes utfra metastaseutbredelse i hjernen, pasientens allmentilstand og utbredelse av ekstrakraniell sykdom. Ved solitære metastaser har kirurgi tradisjonelt vært førstevalg, men i senere år har stereotaktisk stråling fått et større innpass. Medikamentell behandling har tradisjonelt vært lite benyttet ved hjernemetastaser da studier har vist marginal effekt. Temozolomid har tidligere vært benyttet da medikamentet krysser blod-hjernebarrieren. I en fase 2-studie med asymptomatiske hjernemetastaser hvor 80 % fikk temozolomide som førstevalg, fikk kun 7% intrakraniell respons med median PFS 1,2 måneder (Agarwala et al., 2004).
For medikamentell behandling av hjernemetastaser, se Anbefalinger om kontrollens hyppighet og bruk av billeddiagnostikk.
Kirurgisk behandling og stereotaktisk strålebehandling gir likeverdige resultater ved solitære hjernemetastaser som har egnet lokalisasjon for operasjon.
Kirurgi bør vurderes spesielt hvis det foreligger 1, ev. 2 hjernemetastaser, og det er behov for:
- en histologisk diagnose, og det ikke finnes andre metastaser som er lettere tilgjengelig for biopsi
- rask reduksjon av masseeffekten
Kirurgi kan i noen tilfelle også være aktuelt ved multiple metastaser der en stor lesjon medfører masseeffekt. En forutsetning for kirurgi er at lesjonen er lett tilgjengelig og at eventuell ekstrakraniell sykdom er under kontroll.
Postoperativ stereotaktisk strålebehandling mot operasjonskaviteten bør vurderes.
Medikamentell behandling av hjernemetastaser
Sist faglig oppdatert: 05.07.2023
Immunterapi ved asymptomatiske hjernemetastaser
Det foreligger i hovedsak fase 2-studier som undersøker effekten av immunterapi på hjernemetastaser fra melanom. I en studie med 51 pasienter behandlet med ipilimumab monoterapi, oppnådde 16% respons intracranielt (Margolin et al., 2012). Pembrolizumab ble utprøvd til 23 pasienter hvor 12 hadde fått lokal behandling for sine asymptomatiske hjernemetastaser først. Totalt 22% av pasientene oppnådde intrakraniell respons, 18% hadde ekstrakraniell respons, og 2 års OS var 48% (Goldberg et al., 2016).
Kombinasjonsbehandling med CTLA4 og PD-1 hemmere har i flere studier vist god respons. I ABC-studien ble 60 pasienter randomisert til én av 3 armer; enten ipilimumab + nivolumab, nivulomab monoterapi eller nivolumab etter progresjon på lokalbehandling. I kombinasjonsarmen var responsraten 46%, mot 20% ved monoterapi, og 15% hos pasienter med progresjon på lokalbehandling. 2 års overlevelse var henholdsvis 63%, 51% og 19%. PFS var uavhengig av PD-L1 uttrykk og toxiciteten, lik de studier hvor man kun behandlet for ekstrakraniell sykdom (Long et al., 2018). CheckMate 204 er en ikke-randomisert fase 2-studie med 94 pasienter med asymptomatiske hjernemetastaser (Tawbi et al., 2018). Pasientene fikk ipilimumab + nivolumab etterfulgt av nivolumab monoterapi. Intrakraniell responsrate var 57%, inkludert 26% med komplett respons (CR), partiell respons 30%, og 2 % hadde stabil sykdom i minst 6 måneder. Grade 3 or 4 adverse events ble rapportert hos 55% inkludert CNS hendelser hos 7%.
BRAF + MEK hemmere ved asymtomatiske hjernemetastaser
COMBI-MB studien undersøkte effekten av dabrafenib + trametinib hos 92 pasienter med asymptomatiske hjernemetastaser. Studien var delt i 3 kohorter; én asymptomatisk, én tidligere lokalbehandlet og én med mutasjon forskjellig fra V600E/K (Tawbi et al., 2018). Intrakraniell responsrate var 58 % uavhengig av tidligere lokalbehandling. Median responsvarighet var kortere enn ekstrakraniell responsvarighet; 6,5 versus 10,2 måneder, og median PFS var 5,2 måneder. Studien tillot opp mot 4 mg dexametason daglig, mot maks predisolon 10mg i ABC-studien.
Antiepileptika var utelatt i den asymptomatiske gruppen. Antiepileptika kan interagere med BRAF/MEK hemmere og anbefales i ESMO-guidelines kun i kombinasjon med immunterapi (Davies et al., 2017).
Monoterapi med dabrafenib ble undersøkt hos 172 pasienter i BREAK-MB studien. Responsraten var 39% uavhengig av tidligere lokalbehandling, og median PFS var 3,5 måneder (Long et al., 2012).
Anbefalinger om medikamentell behandling ved asymptomatiske hjernemetastaser:
BRAF wt
- Ipilimumab(3mg/kg) og Nivolumab (1mg/kg) hver 3. uke etterfulgt av Nivolumab monoterapi(480mg) hver 4. uke som 1.linje behandling.
- Nivolumab(480mg) hver 4.uke kan vurderes til pasienter uegnet for kombinasjonsterapi.
BRAF mutasjon påvist
- Ipilimumab (3mg/kg) og Nivolumab (1mg/kg) hver 3. uke etterfulgt av Nivolumab monoterapi(480mg) hver 4. uke som 1. linje behandling.
- Dabrafenib og Tafinlar som 2. linje behandling.
Antiepileptika kan ikke gis samtidig med BRAF/MEK hemmere grunnet risiko for interaksjon, men kan gis sammen med immunterapi.
Strålebehandling ved hjernemetastaser
Sist faglig oppdatert: 05.07.2023
Stereotaktisk strålebehandling (SRS)*
Ved én eller få hjernemetastaser (1- 4) med diameter < 4 cm der kirurgi ikke er aktuelt, bør stereotaktisk strålebehandling vurderes (Sperduto et al., 2010). Vanligvis gis en fraksjon á 18 - 25 Gy avhengig av tumors diameter. Det ønskes 100 % dose til kanten av PTV (Planning Target Volume) og 130 – 150 % dose til GTV (Gross Tumor Volume/identifisert tumor), det vil si en heterogen dosering mot tumor. Ved spesielle lokalisasjoner, for eksempel i forhold til risikoorganer eller bestråling av flere metastaser samtidig, gis behandlingen gjerne fraksjonert, ofte 7 - 9 Gy x 3.
Det sees respons hos 85 - 90 % av pasientene. Etter 6 måneder er 86 % av bestrålte lesjoner funnet progresjonsfrie og 76 % etter 1 år (Noël et al., 2002). Rebestråling er ofte mulig.
Postoperativ SRS bør vurderes avhengig av operasjonskavitetens størrelse, pasientens prognose, mistanke om resttumor og om det finnes systemiske behandlingsmuligheter. Risiko for recidiv i operasjonskaviteten uten postoperativ SRS er 70 % og median tid til recidiv er 27 uker (Sloan et al., 2009). Postoperativ SRS reduserer recidivraten i operasjonskaviteten til 20 % (Soffietti et al., 2017). Alternativt kan pasienter som får systemisk behandling følges med MR caput hver 3. måned.
Flere retrospektive studier har vist gode resultat med SRS også ved flere enn 4 metastaser (Hunter et al., 2012; Yamamoto et al., 2014). SRS kan derfor vurderes til utvalgte pasienter med 5 eller flere metastaser og lang forventet levetid. Teknisk sett kan SRS gis til 5 eller flere metastaser samtidig, blant annet ved Radiumhospitalet. Behandlingen gis imidlertid vanligvis i serier med for eksempel 4 metastaser i hver serie, da dette vil være mer skånsomt og mindre tidkrevende for pasienten.
Det pågår studier for om mulig å kunne avgjøre hvilke pasienter med hjernemetastaser som vil ha effekt av SRS, og hvordan man kan skille progresjon fra strålenekrose etter slik behandling (Digernes et al., 2018).
Å gi adjuvant strålebehandling mot hele hjernen etter lokal behandling (kirurgi og/eller SRS) bedrer ikke den intrakranielle kontroll (Hong et al., 2019).
* Stereotaktisk strålebehandling og gammakniv er likestilt.
Strålebehandling mot hele hjernen
Ved multiple hjernemetastaser der det ikke er aktuelt å gi SRS, immunterapi eller BRAF-/MEK hemmer kan strålebehandling mot hele hjernen vurderes. Hvis pasientens eventuelle ekstrakranielle metastaser er under kontroll, vil man ofte gi 10 fraksjoner á 3 Gy. Ved utbredt sykdom vil 5 fraksjoner á 4 Gy være et alternativ.
Hjernemetastaser fra melanom er sjelden lokalisert i Hippocampusregionen (Hong et al., 2014). Hippocampus sparende teknikk kan således bli aktuelt hos noen pasienter under strålebehandling mot hele hjernen. Dette for å minske risikoen for kognitiv påvirkning hos pasienter med lang forventet levetid (Gondi et al., 2014).
Prognosen er bedre ved kirurgi og/eller SRS og med nyere systemisk behandling enn ved strålebehandling mot hele hjernen alene (Long et al., 2018).
Strålebehandling kombinert med systemisk behandling
Strålebehandling mot hjernen kan gis uavhengig av tidspunkt for eventuell immunterapi eller kjemoterapi, for eksempel mellom to kurer. Enkelte serier med SRS under pågående behandling med BRAF-/MEK hemmere har ikke vist økte bivirkninger (Patel et al., 2016). Ved sykehus i Australia gis BRAF-/MEK hemmer samtidig med SRS, og også under strålebehandling mot hele hjernen. Det er der sett betydelig progresjon av ekstrakraniell sykdom under pause fra BRAF-/MEK hemmer behandling (Hong, 2022). Ved behandling med BRAF-hemmer alene er det sett økt hudtoksisitet.
Strålebehandling kan gi en synergistisk effekt sammen med immunterapi, i tillegg til at den kan ha en abscopal effekt (Park et al., 2015).
Anbefalinger:
- Ved få hjernemetastaser bør stereotaktisk strålebehandling vurderes dersom kirurgisk behandling ikke er aktuelt. Ved multiple metastaser kan strålebehandling mot hele hjernen være aktuelt. Ved asymptomatiske metastaser som ikke krever steroibehandling bør immunterapi med Ipilimumab og Nivolumab vurderes.
- Behandling med BRAF-/MEK hemmer kan ha god effekt på hjernemetastaser og muliggjøre eventuell stereotaktisk strålebehandling senere.
- Strålebehandling kan i noen tilfelle føre til en systemisk anti-tumor immunrespons - en abscopal effekt.
- Strålebehandling og immunterapi kan ha en synergistisk effekt.
Utprøvende behandling
Sist faglig oppdatert: 05.07.2023
Pasienter med metastatisk melanom bør få muligheten til å delta i kliniske studier av nye behandlinger. Universitetssykehusene har til enhver tid flere kliniske studier av nye behandlingsprinsipper ved melanom. Det dreier seg om ny målrettet behandling, vaksine-behandlinger og annen immunterapi.
Opplysninger om pågående studier ved melanom og inklusjonskriterier finnes på nettet:
Supplerende behandling
Sist faglig oppdatert: 05.07.2023
Det vises til Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen.
Bivirkningshåndtering immunterapi
Det er foreløpig ikke laget egne norske anbefalinger for behandling av immunterapi relaterte bivirkninger. Inntil dette er gjort anbefales det å benytte anbefalinger fra internasjonale organisasjoner som ESMO, ASCO (Brahmer et al., 2018) eller Dansk melanomgruppe.
Beslutninger i Beslutningsforum (Nye Metoder)
Sist faglig oppdatert: 05.07.2023
| Dato | Beslutning |
|---|---|
| 23.05.2023 |
|
| 25.08.2023 | Pembrolizumab (Keytruda®):
Nivolumab (Opdivo®):
Dabrafenib (Tafinlar®):
|
| 23.09.2019 | Beslutningsforum tok en vurdering av kombinasjonen Encorafenib (Braftovi®) og Binimetinib (Mektovi®) til behandling av voksne pasienter med ikke-operabelt eller metastatisk melanom med BRAF V600 mutasjon. Beslutningen ble da endret:
|
| 09.06.2017 | Beslutningsforum tok stilling til bruk av Nivolumab (Opdivo®) i kombinasjon med Ipilimumab (Yervoy®) ved avansert melanom: Nivolumab (Opdivo®) i kombinasjon med Ipilimumab (Yervoy®) innføres til førstelinjebehandling av pasienter med avansert inoperabel føflekkreft (melanom). |
| 24.05.2016 | Beslutningsforum tok stilling til bruk av kombinasjonsbehandling av BRAF-hemmeren Dabrafenib (Tafinlar®) og MEK-hemmeren Trametinib (Mekinist®), samt bruken av BRAF-hemmerne Vemurafenib (Zelboraf®) og Dabrafenib (Tafinlar®):
|
| 25.11.2015 | Beslutningsforum besluttet at PD-1-hemmerne Nivolumab (Opdivo®) og Pembrolizumab (Keytruda®) kan: «innføres til behandling av lokalavansert og metastaserende melanom. Dette forutsetter lik eller lavere pris enn dagens prisnivå, og at det skal inngå i fremtidige LIS-anbud». |
| 20.10.2015 | Beslutningsforum besluttet: «Inntil resultat av fullstendig metodevurdering foreligger, kontinueres bruk av Ipilimumab ved lokalavansert og metastatisk melanom». |
Sjeldne svulster
Melanom utgående fra slimhimmer
Sist faglig oppdatert: 05.07.2023
Melanom utgående fra slimhinner er sjeldne, de utgjør rundt 1-4 % av alle melanomer (Mihajlovic et al., 2012). De hyppigste lokalisasjonene er hode/hals-regionen, anorektalt og vulvovagianalt, men de kan i mer sjeldnere tilfeller også oppstå andre steder som i tynntarm, øsofagus eller galleblære.
Gjennomsnittlig alder er rundt 60-70 år (Chang et al., 1998), og opp mot 23 % av pasientene kan ha metastaser på diagnosetidspunktet (Lian et al., 2017). Diagnosen er sjelden. 38 personer ble diagnostisert med slimhinnemelanom i Norge i 2020 (Nasjonalt kvalitetsregister for melanom, 2021).
Etiologi er ukjent. Det er ikke funnet noen predisponerende faktorer til slimhinnemelanom, og det er heller ingen assosiasjon med UV-bestråling.
Det finnes intet internasjonalt etablert klassifikasjonssystem for melanom utgående fra slimhinner, dog brukes ofte følgende klassifikasjon:
Stadium I – Lokalisert sykdom
Stadium II – Regionale lymfeknute metastaser
Stadium III – Fjernmetastaser (152)
Kirurgisk behandling av primært slimhinnemelanom anses som førstevalg hos pasienter der tumor kan fjernes komplett. Man må være bevisst på at kirurgien kan være omfattende og til dels mutilerende, og gruppen har generelt sett en relativt dårlig 5-års overlevelse på 14-25 % (Furney et al., 2013; Lian et al., 2017).
Stadig mer publisert data på systembehandling med immunterapi foreligger. CheckMate-067-studien viste median 5-års overlevelse på 36% med kombinasjonen ipilimumab og nivolumab (Shoushtari et al., 2016). Sammenslåtte data (pooled analysis) har vist responsrater rundt 23,3 % for PD-1 hemmer monoterapi og 37,1 % ved kombinasjonsbehandling PD-1 hemmer og CTLA4 antistoff (D'Angelo et al., 2017).
BRAF-mutasjoner forekommer betydelig sjeldnere ved melanomer utgått fra slimhinnene enn hos hudmelanomer, og finnes kun i 3–15% av tilfellene. NRAS-mutasjoner forekommer i opp mot 10-15%, og KIT alterasjoner kan finnes hos 7–17% (Zebary et al., 2013). Mutasjonsanalyse bør derfor gjøres hos denne pasientgruppen, gjerne i form av Next Generation Sequencing (NGS) (Johnson et al., 2017; Lyu et al., 2016)
Melanom utgått fra slimhinne er en sjelden diagnose og ansvar for behandling av disse pasientene bør ligge hos regionssykehusene. Da pasientene har 5-års overlevelse under 25%, og dermed ofte dør av metastatisk sykdom, bør melanom-onkolog ha overordnet ansvar for behandlingen. Behandlingen diskuteres på et melanom-MDT-møte eller MDT-møte med melanom-onkolog til stede ved et regionssykehus før kirurgisk og/eller onkologisk behandling.
Melanom utgående fra slimhinner i hode/hals-regionen
Sist faglig oppdatert: 05.07.2023
Innledning
Melanom utgjør 1–2 % av alle maligne lidelser i hode-/halsregionen. Rundt 60% oppstår i nesekavitet, hvor melanom utgjør ca. 15 % av alle maligne tumores (Lawaetz et al., 2016). Sykdommen er dobbelt så hyppig hos menn som hos kvinner, med median alder rundt 60 år. Insidensen har vært uendret siste 25 år. Etiologien er ukjent. Sykdommen er ikke relatert til alkohol og tobakk, som er de vanligste karsinogene agens i hode/hals-regionen.
Klinikk
Pasienter med sinonasalt melanom er gjerne eldre enn 50 år, mens de med orale er yngre. Symptomer ved sinonasalt melanom er epistaxis, nasal stenose, diplopi og proptosis. Orale melanomer kan debutere som pigmenterte lesjoner, sår eller ved protese-mistilpasning. En del oppdages tilfeldig ved undersøkelse av munn og tenner. Lokal utbredelse kan være omfattende, med bendestruksjon og vekst inn i bihuler, hvor lokale residiver er vanlig. 10–25 % har lymfeknutemetastaser ved diagnosetidspunkt. Lymfeknutemetastaser er hyppigere ved orale melanomer enn ved sinonasale. Opp til 25 % vil utvikle lymfeknutemetastaser i sykdomsforløpet. 5–10 % har fjernmetastaser ved diagnosetidspunkt, halvparten vil kunne ha fjernmetastaser innen det første året (Bakkal et al., 2015). Spredning til lever, lunge, hjerne og underhud er vanlig. Det er oftest fjernmetastasene som tar livet av pasienten (Patel et al., 2002).
Stadieinndeling
Det finnes intet internasjonalt etablert klassifikasjonssystem for MM utgående fra slimhinner, dog er det vanlig å klassifisere som følger:
Stadium I – Lokalisert sykdom
Stadium II – Regionale lymfeknute metastaser
Stadium III – Fjernmetastaser (The Oral Cancer Foundation, 2010).
Patologi
Melanomene kan ha et variabelt makroskopisk utseende – gjerne polyppøse i nese/bihuler, flate ev. ulcererende i munnhule. Farge kan variere mellom rosa, rød, grå, brun og sort (skyldes bl.a. lysspredning i vev – Rayleigh scattering: spredning av lys av partikler med liten dimensjon sammenliknet med lysets bølgelengde). Ca. 1/3 av melanomene i nese-/munnhule er amelanotiske.
Melanomene antas å oppstå de novo fra melanocytter i slimhinnens basallag, hvor forholdet mellom melanocytter og epitelceller er 1:10. Histologien er variabel med sjeldnere lymfocyttinfiltrasjon sammenliknet med hudmelanomer. Elektronmikroskopi kan være nyttig til å påvise melanosomer. Melanin kan påvises ved spesialfarginger. Vimentin farger mesenchymale celler. Følgende monoklonale antistoffer kan brukes: S100, tyrosinase (T311), gp-100 (HMB-45) og MART-1/Melan A (A-103) (Patel et al., 2002).
Differensialdiagnoser
Følgende tilstander i slimhinner kan forveksles med melanom: Mb. Addison, «blue nevi», Kaposis sarcom, orale nevi, amalgam-tatovering, grafitt-tatovering, melanotisk makel, Peutz-Jeghers syndrom, fysiologisk pigmentering, ecchymoser og petechier (The Oral Cancer Foundation, 2010).
Behandling
Melanom i slimhinner er en relativt sjelden sykdom. Randomiserte studier finnes ikke, og derfor heller ingen «evidence based» behandling. Sykdommen har stort sett dårlig prognose, og ofte blir behandlingen palliativ. Det kan derfor stilles spørsmål ved hvorvidt store kirurgiske inngrep er indisert. Strålefølsomheten er som for hudmelanomer variabel, dog er de ikke resistente. Stor dose per fraksjon er bedre enn «liten». 8 Gy på dag 0, 7 og 21 har vært brukt. Ved Radiumhospitalet, OUS, brukes stort sett 2.5 Gy x 20 = 50 Gy.
Adjuvant strålebehandling kan vurderes der det foreligger korte kirurgiske marginer eller ufri margin der det ikke ligger til rette for ytterligere kirurgi. Behandlingen kan redusere lokalt recidiv, men gir ikke økt overlevelse (Li et al., 2015)(D)
Prognostiske faktorer
Tumortykkelse er en pålitelig prognostisk faktor. Lesjoner med tykkelse < 0.75 mm metastaserer sjeldent. Lesjoner med tykkelse > 5 mm har svært dårlig prognose. Tykkelsen kan være vanskelig å måle på sinonasale tumores. Karinfiltrasjon er også en signifikant prognostisk faktor og korrelerer med lokalt residiv, regionale og fjernmetastaser, så vel som sykdomsfri overlevelse (Patel et al., 2002).
Anbefalinger:
- Melanom utgått fra slimhinner i hode/hals-regionen er sjeldent. Diagnosen stilles ved biopsi, eventuelt med spesialfarginger. Når det foreligger en sikker histologisk diagnose, bør man utrede ytterligere med CT/PET-CT hode til bekken.
- Hvis primærtumor ikke er for omfattende, og det ikke foreligger fjernmetastaser, skal pasienten vurderes med tanke på kirurgi.
- Følges opp av melanom-onkolog og kirurg ved regionssykehus.
Melanom i genitaltractus
Sist faglig oppdatert: 05.07.2023
Melanom i kvinnelig genitaltractus
Innledning
Den lave forekomsten av primært genitalt melanom tilsier at pasienten må utredes med tanke på annet origo for primærtumor.
Begrensede data ligger til grunn for valg av behandling. Det foreligger få randomiserte studier, og anbefalinger er konsensusbasert. Mangel på studier innebærer at behandlingen i stor grad baseres på retningslinjer for kutane melanomer.
Evidensnivå C–D.
Epidemiologi
Melanom i kvinnelig genitaltractus utgjør < 1 % av alle melanomer, men ca. 10 % av alle maligne svulster i vulva (Stang et al., 2005). Insidensen synes å være stabil eller fallende. Median alder for diagnose er i slutten av 60-årene.
Det finnes ingen etablerte predisponerende faktorer.
Diagnostikk
Man kan benytte stadieinndeling brukt ved melanom i hode/hals.
Lymfeknutestatus i lysker må kartlegges. Dette kan gjøres ved CT eller ultralyd (UL) av lysker. Videre tas PET/CT for lokalisasjon av mulige fjernmetastaser. MR vurderes tatt der dette kan gi informasjon som er av betydning for valg av kirurgisk tilnærming.
Prognose
Pasienter med melanom i vulva har fem års overlevelse fra 24 -77 %, og i vagina fra 5 - 25 % (Frumovitz et al., 2010; Irvin et al., 2001; Verschraegen et al., 2001). Det foreligger ikke noen sikker prognostisk for overlevelse av vulvovaginal-cancer, men tumortykkelse, ulcerasjon og spredning til lymfeknuter anses å være av betydning.
Behandling
Kirurgi
Det er estimert at ca. 20 % av mucosale melanomer er multifokale (Lotem et al., 2003). Uavhengig av lokalisasjon, vil en vid lokal fjernelse av mucosale melanomer ned til fascienivå gi den beste sykdomsfrie overlevelsen når dette er teknisk mulig. Fri margin ved reseksjon kan være vanskelig å oppnå på grunn av vekstmønsteret (ofte lentiginøs), tumors multifokalitet, samt anatomiske begrensninger.
Ved vurdering av operabilitet, bør risikoen for ikke-fri margin veies opp mot sykelighet forbundet med et mere aggressivt inngrep. Hos en stor andel av pasientene må nytten av økt lokal kontroll vurderes i forhold til risikoen for fjernmetastaser. Retrospektive data viser ingen forskjell i sykdomsoverlevelse der man opererte med vid lokal eksisjon kontra mere omfattende kirurgi (DeMatos et al., 1998; Suwandinata et al., 2007). Behandlingen må diskuteres med pasienten, og livskvalitet må hensynstas.
Nytten av sentinel node (SN) prosedyre ved vulvovaginalt melanom der man preoperativt ikke mistenker lymfeknutemetastaser, er usikker (Dhar et al., 2007). I mindre serier har man antydet økt overlevelse ved lymfadenektomi, men flere studier har vist at radikal vulvektomi med bilateralt inguinofemoralt lyskeglandeltoalett ikke gir overlevelsesgevinst sammenliknet med vid lokal eksisjon alene (Jaramillo et al., 1985; Trimble et al., 1992).
Ved preoperativt påviste regionale lymfeknutemetastaser anbefales lymfeglandeltoalett (Voit et al., 2009).
Systemisk behandling
Det foreligger mangelfulle data vedrørende bruk av adjuvant systemisk behandling av mucosale melanomer, og heller ikke data som støtter bruk av checkpoint inhibitors. Adjuvant immunterapi i form av nivolumab, som er etablert ved melanom lokalisert til hud og med lymfeknutemetastaser, kan vurderes, men da i kliniske studie.
Ved annen metastatisk sykdom finnes svært begrenset litteratur, og man kan der velge å behandle i tråd med retningslinjer for kutant melanom.
BRAF-mutasjon bør kartlegges. Ved omkring 10 % av mucosale melanomer påvises BRAF-mutasjon.
Strålebehandling
Adjuvant strålebehandling ved anorektalt melanom kan minske lokoregionalt tilbakefall, men har ikke vist effekt på overlevelse (Tchelebi et al., 2016). Det foreligger ikke tilsvarende studier ved genitalt melanom, men en viss overføringsverdi er mulig.
Adjuvant strålebehandling kan vurderes der det foreligger korte kirurgiske marginer, og der det ikke ligger til rette for ytterligere kirurgi. Videre kan strålebehandling vurderes der pasienten ikke vil kunne tåle kirurgi, eller der målet er symptomlindring.
Oppfølging
Pasienter med slimhinnemelanom utgående fra vagina har en estimert 5-års overlevelse på 25 % eller dårligere. De dør av fjernmetastaser og må derfor følges opp av både gynekolog for lokalt recidiv samt melanom-onkolog. Screening med PET-CT/CT bør gjennomføres regelmessig for å fange opp fjernspredning.
Melanom i mannlig genitaltractus
Melanom i mannlig genitaltractus innebefatter svulst lokalisert til glans penis, meatus, fossa navicularis, urethra og prostata. I publikasjon med retrospektive data (Malik et al., 2004), var 2 og 5 års overlevelse hhv. 63 % og 31 %. Det var ingen overlevelse etter 2 år av pasienter med metastatisk sykdom ved diagnosetidspunktet. Melanom på penishud og skrotum oppfører seg som kutane melanom, og skal behandles deretter.
Det anbefales biopsitaking av alle pigmentforandringer på penis. Som ved melanomer med annen lokalisasjon, er behandlingen primært kirurgisk med vid margin. Penisamputasjon unngås hvis mulig.
Melanom anorektalt
Melanomer anorektalt er sjeldent, og utgjør under 1% av anorektale tumores. De fleste tumores er tykke, og tykkelsen er ikke prognostisk slik den er for kutane melanom. Ca. 20% har glandelmetastaser.
Det anbefales utredning med PET CT for fjernmetastaser og diskusjon på universitetssykehus melanom-MDT.
Tidligere ble det gjort rektumapmutasjon, men man har gått mere over til sfinkterbesparende vid eksisjon i 1-2 cm avstand, uten forverring av prognosen. På grunn av størrelse, kan rektumaputasjon stadig være nødvendig (Antoniuk et al., 1993; Bullard et al., 2003; Goldman et al., 1990; Konstadoulakis et al., 1995; Moozar et al., 2003; Pessaux et al., 2004; Ross et al., 1990; Roumen, 1996; Slingluff et al., 1990; Thibault et al., 1997; Weyandt et al., 2003; Yeh et al., 2006).
Anbefalinger:
- Melanom utgått fra slimhinner i genitaltraktus, og der det ikke foreligger fjernmetastaser - og der kirurgi er mulig - bør opereres.
- SN-prosedyre bør gjennomføres, men uten glandeltoilette ved positiv SN.
- Ved vurdering av operabilitet, bør risikoen for ikke-fri margin veies opp mot sykelighet forbundet med et mere aggressivt inngrep. Hos en stor andel av pasientene må nytten av økt lokal kontroll vurderes i forhold til risikoen for fjernmetastaser.
- Pasientene tas opp på melanom-MDT. Adjuvant behandling kan vurderes der det foreligger ufrie kirurgiske marginer, og der det ikke ligger til rette for ytterligere kirurgi. (D).
- Følges opp av melanom-onkolog og kirurg ved regionssykehus.
Anbefalinger slimhinnemelanom (sammendrag):
- Primærbehandling er kirurgi. Hvis primærtumor ikke er for omfattende, og det ikke foreligger fjernmetastaser, skal pasienten vurderes med tanke på kirurgi.
- Ved preoperativt påviste regionale lymfeknutemetastaser uten fjernmetastaser anbefales lymfeglandeltoalett. SN-prosedyre bør gjennomføres, men uten glandeltoalett ved positiv SN.
- Tumors status vedrørende mutasjoner bør kartlegges hos denne pasientgruppen, gjerne i form av Next Generation Sequencing (NGS). Patologisk vurdering bør inneholde mutasjonsanalyse av BRAF, NRAS samt KIT.
- Pasientene bør vurderes på melanom-MDT, eller av melanom-onkolog, før oppstart behandling.
- Pasientgruppen bør inkluderes i studier dersom mulig, ellers anses sjekkpunkthemmer-behandling som beste medikamentelle behandling for gruppen per i dag.
- Behandling av denne pasientgruppen ligger hos melanomansvarlige onkologer ved regionssykehus (OUS, Haukeland, St. Olavs og UNN).
- Pasientene bør følges opp av både kirurg og melanom-onkolog.
Melanom i øyet
Sist faglig oppdatert: 05.07.2023
Innledning
Maligne melanom i øyet er en alvorlig kreftsykdom. Med behandling er mortaliteten etter 10 år rundt 50 %. Moderne behandlingsmåter gir god, varig tumorkontroll lokalt, men har ikke kunnet bedre mortaliteten, som har vært uendret i flere tiår.
Tidligere ble disse svulstene fjernet sammen med hele øyet, enukleasjon. I dag behandles de fleste med stråling i form av brachyterapi, som har vist samme overlevelse etter 10 år (Diener-West et al., 2001) (A).
Epidemiologi
5 % av alle melanom i kroppen oppstår i øyet med naboområdene konjuktiva, orbita eller øyelokk. Den vanligste primære maligne svulst i øyet er uvealt melanom. Svulsten kan være lokalisert til iris (5 %), corpus ciliare (10 %) eller choroidea (85 %). Insidensen av uveale melanom er 5–8 pr. million innbyggere/år, (Jensen, 1963; Raivio, 1977) (B). Det har ikke vært noen registrert økning over de siste 50 år verken i forekomst eller dødelighet. Gjennomsnittlig alder ved diagnose er 55–65 år. Melanom i uvea sees sjelden før tjueårsalder. Det er ingen vesentlig kjønnsforskjell (Bergman et al., 2002; Osterlind, 1987; Raivio, 1977; Singh et al., 2003) (B).
Maligne melanom i konjuktiva er en sjelden tilstand. Insidensen har vært stabil over flere dekader (Isager et al., 2005; Seregard, 1998) (C).
Insidensen er ulik for de ulike folkegrupper. Den høyeste forekomsten sees hos kaukasiere, og den er økende med økende avstanden fra ekvator. Tilstanden er svært sjelden hos afrikanere og native amerikanere, og også sjeldnere hos asiatere (Isager et al., 2005; Seregard, 1998) (C).
Det er noen få kjente medisinske tilstander der det er økt risiko for å utvikle uvealt melanom. Dette omfatter sjeldne sykdommer, som for eksempel Oculodermal melanose, der tumor opptrer i det «mørke» øyet med 9 x økt forekomst. Det anbefales et kontrollopplegg (Singh et al., 2000) (C).
Det er ikke noen kjent genetisk belastning for å utvikle melanom ved Neurofibromatose type 1 (Mb Recklinghausen). Det er derfor ikke grunn for å kontrollere nære slektninger av pasienter med øyemelanom.
Dysplastisk nevus syndrom er heller ikke funnet å gi økt risiko for uveale melanom.
Anbefaling:
- Pasienter med Oculodermal melanose anbefales et kontrollopplegg ved lokal øyeavdeling.
Forebygging
Etiologien til uvealt melanom er trolig multifaktoriell. Et samvirke mellom vert, genetisk disposisjon og ytre miljø antas å ligge til grunn, men etiologien er fortsatt ukjent. Det er ingen kjente tiltak som kan forebygge tilstanden.
Miljøutløsende årsaker er ikke påvist for melanom i øyet. I motsetning til i hud, er det ikke funnet holdepunkter for at økt soleksponering (ultrafiolett lys: UV-A og UV-B) øker risikoen. Dette er i sterk kontrast til forholdene for hudmelanom.
Sveisearbeid synes å øke risikoen noe (Guenel et al., 2001; Shah et al., 2005) (B).
Eksponering for elektromagnetisk stråling har vært undersøkt som en mulighet for risiko. De data som foreligger har ikke gitt støtte for økt risiko (Johansen et al., 2002; Stang et al., 2001) (B).
Etiologien til uvealt melanom er trolig multifaktoriell. Et samvirke mellom vert, genetisk disposisjon og ytre miljø antas å ligge til grunn, men etiologien er fortsatt ukjent. Det er ingen kjente tiltak som kan forebygge tilstanden.
Miljøutløsende årsaker er ikke påvist for melanom i øyet. I motsetning til i hud, er det ikke funnet holdepunkter for at økt soleksponering (UV-A og UV-B) øker risikoen. Man har derfor ingen holdepunkter for at bruk av solbriller beskytter mot øyemelanom.
Sveisearbeid synes å øke risikoen noe (Guenel et al., 2001; Shah et al., 2005) (B).
Eksponering for elektromagnetisk stråling har vært undersøkt som en mulighet for risiko. De data som foreligger har ikke gitt støtte for økt risiko (Johansen et al., 2002; Stang et al., 2001) (B).
Tidlig diagnostikk
Nevi i uvea og i konjunktiva er vanlig i voksen alder. Undersøkelser fra Australia har vist at 6,5 % har nevi ved en tverrsnittsstudie av normalbefolkningen (Sumich et al., 1998) (B).
Basert på den påviste forekomsten av nevi, den kjente forekomsten av maligne uveale melanom i befolkningen og forekomsten av nevi ved autopsi (Ganley et al., 1973) (C), har en estimert hyppigheten av overgang fra nevus til en malign tilstand til å være < 1/15000/ år. Det er i praksis umulig å følge et stort antall nevi over mange år for å ha mulighet til å påvise maligne transformasjoner.
Grensetilfeller der det er uråd å skille mellom benign og malign patologi er studert i flere oppfølgingsstudier. Disse viser at det kreves 5 år før en kan avskrive en mistenkt tumor som sannsynlig ufarlig (Butler et al., 1994), og pasienten må derfor følges opp i denne tiden (B).
Sammenlikning av foto, ultralyd b-skann eller OCT (Ocular confocal tomography) tatt til ulik tid er avgjørende for å dokumentere endring; vekst i areal eller tykkelse, oransje pigmenteringer, hvite druser eller subretinal væske (Shields et al., 2000a; Shields et al., 2009) (B). Antallet henvisninger har økt mye etter at optikerene har tillatelse til å utvide pupillen, ta foto av øyebunnen og henvise til vurdering hos øyelege.
Symptomene ved uvealt melanom er uspesifikke og avhenger i stor grad av svulstens størrelse og lokalisasjon i øyet. Generelt kan man si at perifert beliggende svulster ofte vokser seg store før de gir symptomer, mens svulster lokalisert til bakre pol av øyet gir synsforstyrrelser på et tidligere stadium. Melanom i øyet fører ofte til en gradvis økende skygge i synsfeltet. Pga. eksudasjon fra tumor og sekundær netthinneløsning, kan noen pasienter oppleve hurtig synsreduksjon, metamorfopsi (fordreining av synsbildet) og fotopsier (lysblink). Svulster som vokser inn i øyets kammervinkel kan føre til sekundært glaukom med økt intraokulært trykk og smerter, som også kan opptre pga. inflammasjon. Om lag 30 % av uveale melanom blir påvist ved undersøkelse for annen øyetilstand. De er gjerne mindre i størrelse (Eskelin et al., 2002) (B).
Anbefaling:
- Mistenkelige nevi skal følges regelmessig hos øyelege i minst 5 år for å utelukke malignitet.
Utredning
Diagnostikk
Alle pasienter med synsforstyrrelser av ukjent årsak må undersøkes i spaltelampe og oftalmoskoperes i mydriasis. Et melanom i øyebunnen sees ofte som en gråbrun, sirkulær eller oval, prominerende tumor. Oftalmoskopisk kan et melanom være vanskelig å skille fra en benign nevus, men oransje pigmentering og eksudasjon omkring tumor, eller serøs avløsning helt perifert nedad, er ofte tegn på malignitet. Både ultralydundersøkelse og fluorescein-angiografi er avgjørende for å stille diagnosen. Tolkningen av ultralydbilder og angiografi krever erfaring. Ved ultralydundersøkelse gir uvealt melanom et karakteristisk bilde (88 %) med lav til moderat intern reflektivitet og/eller skjorteknappfasong. Ekstraskleral vekst påvises ved ultralyd først når tumordelen på utsiden av øyet er høyere enn 1,5 mm (Boldt et al., 2008) (B). Ved fluorescein-angiografi får man verdifull informasjon om svulstens karforsyning og lekkasje. Ultralyd- og MR-undersøkelse brukes også til å beregne svulstens størrelse og lokalisasjon. Ved små svulster og usikker diagnose kan det være nødvendig å observere tilstanden for å se om det tilkommer vekst eller andre malignitetstegn. Finnålsbiopsi av tumor kan være indisert for å skille mellom melanom og svulster av annen årsak. Den diagnostiske evne er blitt bedret betydelig (Accuracy of diagnosis of choroidal melanomas in the Collaborative Ocular Melanoma Study. COMS report no. 1, 1990) (A). Imidlertid er usikkerheten større når alle mulige intraokulære neoplasmer skal diagnostiseres: de fortil, de der mediene er uklare og de der enukleasjon ikke er et opplagt alternativ (Char et al., 1995) (B). Ved OUS (Ullevål) vil man prinsipielt prøve å sikre diagnosen ved en FNAB dersom det ikke er grunner som taler mot at dette blir gjort: at risikoen for komplikasjoner hos den enkelte pasient vurderes til å være for høy (Eide et al., 2009) (C). Adekvat klinisk undersøkelse, sammenholdt med anamnestiske opplysninger og non-invasiv utredning, regnes å være tilstrekkelig for å stille diagnosen uvealt melanom, selv om den endelige diagnosen ikke er baseres på cyto-histo-patologisk undersøkelse av vev fra lesjonen (Eide et al., 2009) (C). Dette er ikke i samsvar med praksis/ rådende syn ved andre melanomlokalisasjoner, f.eks. i hud.
Ved mistanke om uvealt melanom må det gjøres malignitetsutredning i form av en nøye klinisk undersøkelse, leverfunksjonstester og vanlig blodstatus (Eskelin et al., 2003; Eskelin et al., 1999)(C). For å utelukke at den påviste øyetumor representerer en metastase, og for å avgjøre om det allerede på dette stadiet foreligger spredning av det uveale melanomet, bør det utføres røntgen thorax og ultralyd abdomen eller PET-CT (284) (C). Malignitetsutredningen bør være startet i løpet av 14 dager, og kan med fordel styres av lokal øyeavdeling. Malignitetsutredningen og annen bildedokumentasjon (FA, ev. ICG) sendes da med henvisning til onkologisk øyeavdeling
Anbefaling:
- Malignitetsutredningen bør være startet i løpet av 14 dager, og kan med fordel styres av lokal øyeavdeling. Malignitetsutredningen og annen bildedokumentasjon (FA, ev. ICG) sendes da med henvisning til onkologisk øyeavdeling.
Stadieinndeling og TNM-klassifikasjon
Stadieinndeling av øyemelanom før planlegging av behandlingsopplegget har ikke hatt som krav at det skal foreligge en vevsprøve. To årsaker til dette er at den kliniske diagnosen uten invasive prøver regnes som sikker (Eide et al., 2009) (C), og at risikoen for å skade øyet har medført at de fleste er avvisende til behovet for biopsi som rutine. For choroidale melanomer har man sett at utredning med PET/CT-skann doblet påviste metastaser ved diagnosetidspunktet fra 2 % (Finger et al., 2005; Wagoner et al., 1982) (C) til 4 %.
Betydelige endringer er gjort i TNM-klassifikasjonen (tumor-node-metastase) fra den reviderte 4. utg. (1998), den 5. utg. (2004) og den som kom i 2010 (Edge et al., 2010; Malignant melanoma of the uvea, 2010). Hovedforandringen er at intraokulært trykk, affeksjon av corpus ciliare, eller gjennomvekst av sklera, graderes med bokstaver. Klinisk gjennomvekst flyttet tidligere tumor automatisk til T4, uavhengig av tumorstørrelse (Malignant melanoma of the uvea, 2010) (B).
Prognose
Uvealt melanom er en alvorlig sykdom med en mortalitet på mellom 30 og 50 % avhengig av svulstens størrelse og lokalisasjon, oppfølgingstid og en del andre parametere (Malignant melanoma of the uvea, 2010; Seregard et al., 1995; Singh et al., 2001) (B). De fleste studier, også den store COMS-studien fra Nord Amerika, hvor 1317 pasienter ble inkludert og fulgt i mer enn 11 år, har ikke kunnet påvise noen signifikant forskjell i overlevelse blant pasienter som ble behandlet med episkleral brachyterapi (I-125) eller enukleasjon (Diener-West et al., 2001) (A). Funnene er stadfestet ved lenger oppfølgingstid (Collaborative Ocular Melanoma Study Group, 2006) (A). Det blir fortsatt publisert oppfølgingsstudier fra COMS-materialet, som stadig følges opp.
Generelt kan man si at nye og moderne behandlingsformer har gjort at flere pasienter får beholde et funksjonsdyktig øye, uten at dette foreløpig har hatt noen vesentlig betydning for prognosen (mortaliteten) ved uvealt melanom (Mortality in patients with small choroidal melanoma. COMS report no. 4. The Collaborative Ocular Melanoma Study Group, 1997) (B).
De som har små svulster med god avstand til synsnerve og skarpsynsområdet, der synsstyrken er bra ved behandlingsstart, kan påregne å bevare et godt syn (Melia et al., 2001) (B).
Ved store og høye svulster er synsprognosen dårligere, fordi sentralsynet ved behandlingsstart er redusert pga. serøs avløsing av netthinna. Synsreduksjonen blir ofte permanent om avløsninga alltid er reversibel etter stråling. Stråling med høy dose av kritiske strukturer i øyet vil gi synstap når svulsten ligger nær slike, men som hovedregel er det slik at pasienten får noe syn, i motsetning til intet syn etter enukleasjon.
Patologisk diagnose og prognostiske elementer
- Histologisk type: spolecellet, epitelioid, blandingstype. De epitelioide har klart dårligst prognose (Mudhar et al., 2004) (C).
- Tumorareal- og tykkelse i mm.: Arealet er av størst betydning, og store svulster har dårligst utsikter (Seregard et al., 1995) (B)
- Lokalisasjon, infiltrasjon/ gjennomvekst: Irissvulster har god prognose, mens de i corpus ciliare har den alvorligste. Gjennomvekst forverrer prognosen betydelig (McLean et al., 1995) (C)
- Karmønster: Stor kartetthet og lukkete slynger forverrer prognosen (Folberg et al., 1993) (B)
- Kromosomale avvik (se nedenfor) (Robertson, 2008) (D)
Genetikk
Tumorvev til genetisk testing kan høstes ved enukleasjon eller ved biopsi. Studier har vist at tilstrekkelig materiale også kan skaffes ved finnålsaspirasjonsbiopsi (FNAB) (Young et al., 2007) (B). Endring i kromosom 3, 8 og 6 er viktige prognostiske markører (Damato et al., 2008; Sisley et al., 1998) (B) og mengden celler ved FNAB er tilstrekkelig til å måle genetiske parametre, slik som tap fra kromosom 3 eller gevinst til 8 (Naus et al., 2002) (B).
Flere studier har vist at endringer i tumorcellenes kromosomer er av betydning for overlevelsen. Særlig god er dokumentasjonen på at monosomi 3 status er viktig (Sisley et al., 1998) (B). Studie fra 1996 viste at 50% av pasientene med monosomi 3 fikk fjernspredning versus ingen med disomi 3. (Prescher et al., 1996) (B). Ved genekspresjonsprofiler (GEP) kan øyemelanomer deles inn i to klasser (klasse 1 og 2) der overlevelse åtte år etter enukleasjon var 95 % for pasientene i klasse-1 og 31 % i klasse 2 (Onken et al., 2004) (B).
Monosomi 3 ble påvist i 27 % i en serie med 56 melanom med tykkelse mindre enn 3 mm, 16 % gav utilstrekkelig materiale (Shields et al., 2007a) (B), mens 50–56 % ble påvist i et enukleasjonsmateriale med store melanom (Prescher et al., 1996) (B). Årsaken til dette avviket mellom store og små melanoma er ukjent.
Mange pasienter har kunnskap om at kromosomendringer er viktig for å stille en prognose. Det er å anta at flere vil etterspørre denne informasjonen for å få sikrere kunnskap om prognosen
Primærbehandling
Kirurgi
Enukleasjon: Tidligere var fjerning av øyet det eneste behandlingsalternativet ved melanom i øyet, noe som førte til synstap og eventuelle kosmetiske problemer. Ved stor svulst, innvekst i kammervinkel, gjennom øyevegg eller ved omkransning av synsnerven > 180 grader der muligheten for synsgevinst er liten, anbefales ofte enukleasjon. Da fjernes øyet kirurgisk og erstattes av et implantat og en øyeprotese, som med dagens teknikk gir et godt kosmetisk resultat. Hos yngre pasienter er en nøye avveining spesielt viktig.
Lokal reseksjon: Utføres særlig av svulster i fremre deler. Ekstern reseksjon av svulster baktil kan tilbys, men har stor operativ risiko.
Strålebehandling
Internasjonalt er strålebehandling den primære behandlingen av melanom over hele den utviklede delen av verden. Brachyterapi er den enkleste og rimeligste måten å yte strålebehandling på.
Brachyterapi: Episkleral brachyterapi er den behandlingen som er best dokumentert og mest benyttet internasjonalt i dag. Melanomer med størrelse og lokalisasjon som muliggjør en stråledose på ca. 100 Gy til apex av tumor, gis vanligvis brachyterapi med jod (I-125) eller ruthenium (Ru-106) som strålekilde. Strålekilden sys fast utenpå sklera, nøyaktig svarende til det stedet hvor svulsten er lokalisert inne i øyet. Stråleplaten forblir festet til øyet i vanligvis 2–7 dager, før den fjernes. Nøyaktig plassering er avgjørende for å unngå kantresidiv. Den synlige svulsten med en randsone på 1–2 mm skal dekkes. Mikroskopiske svulstceller utenfor dette området vil kunne gi tilbakefall. Som regel går tumor i regress i løpet av ½–2 år etter bestrålingen.
Behandlingen kan medføre en viss grad av synsreduksjon, men de fleste pasientene beholder et funksjonsdyktig øye. Komplikasjoner kan være manglende tumorkontroll, eller stråleskade av retina og synsnerve. Opp mot 90 % av de som blir behandlet kan regne med å beholde eget øye etter 10 år, kosmetisk pent og uten vesentlig ubehag (Seregard, 1999) (B). Etter 10 år viser oppfølging at 68 % av de behandlete har dårlig synsskarphet. Sjansen for synssparing er avhengig av synet ved start av behandling, størrelse og avstanden fra fovea og papillen. Dersom avstanden fra disse strukturene er mer enn 5 mm, er utsiktene bedre (Shields et al., 2000b) (C).
Protonterapi: Protonstråling gir et likeverdig, og i noen tilfeller et bedre tilbud enn brachyterapi. Særskilt gjelder det svulster som butter mot synsnerve eller som går inn mot makula (B). Protonbehandling er ikke tilgjengelig i Norge og disse pasienten sendes i dag til utlandet. Protonbehandling vil bli innført i Norge i 2024. Om man vil kunne tilby protonbestråling til uveale melanom i Norge etter 2024 er ennå ikke avklart.
Andre behandlingsalternativer
Transpupillær termoterapi (TTT) er en form for varmebehandling av svulsten ved hjelp av diodelaser, som kan benyttes som en tilleggsbehandling til brachyterapi eller protonstråling (Desjardins et al., 2006) (A). Pasienter som fikk TTT som tillegg hadde større reduksjon i tumortykkelse (p = 0.06), mindre avløst netthinne ved siste kontroll (p = 0.14) og mindre behov for enukleasjon (p = 0.02).
Pasienter til TTT som primærbehandling må selektertes strengt da behandlingen kan gi skade på retina, med synstap kort tid etter behandling. Svulster som butter mot eller henger over papillen, og de som krever mer enn 3 økter, har størst sjanse for lokalt tilbakefall. TTT bør kun brukes som monoterapi i helt spesielle tilfeller, som tumor nær kritiske, visuelle strukturer. Oppfølgingen må være tett (Shields et al., 2002; Aaberg et al., 2008) (B).
Strålekomplikasjoner
Tidlige bivirkninger til inngrepet er få. Diplopi sees i 5 % dersom en muskel må løsnes.
Synekier: fremre og bakre som følge av chorioidalavløsning og intraokulær inflammasjon.
Senbivirkninger er dels påregnelige effekter av strålingen; kraftigere reaksjon enn ventet eller utilstrekkelig respons på behandlingen. Kan observeres fra 6 måneder, men vanligvis etter 2 år (Gragoudas et al., 1999) (C):
- Vaskulopati med lukning av kar i strålefeltet
- Retinopati, eventuelt med makulaødem. All stråling gir øket risiko, men ved 40Gy synes en å nå et platå
- Papillopati > 50 Gy
- Neovaskulært glaukom ca. 10 %
- Glasslegemeblødning
- Strålekatrakt oppstår ofte når dosen overstiger 40 Gy. Den kan opereres på vanlig måte
- Smertefullt øye, eventuelt med pthise (skrumpning), kan kreve enukleasjon hos 6 % (Shields et al., 1990) (C)
- Residiv-utilstrekkelig svar på behandlingen: < 10 % (Jampol et al., 2002) (C)
- Skleral nekrose
Anbefalinger:
- Episkleral brachyterapi er den behandlingen som er best dokumentert og mest benyttet internasjonalt i dag
- Enukleasjon bør vurderes ved store svulster, ved betydelig gjennomvekst av sklera eller omkransning av synsnerven > 180 grader.
- Transpupillær termoterapi (TTT) som primærbehandling anbefales ikke.
Oppfølging
Det er ingen etablert adjuvant behandling for denne pasientgruppen i dag. Pasienter med T3 og T4 svulster bør forespørres om de ønsker å ta del i studier om de foreligger.
Organisering av behandling
Det er to øyeavdelinger i Norge (OUS og Haukeland) som er ansvarlige for diagnostikk og behandling av alle maligne intraokulære svulster.
Oppfølging og kontroll av disse pasientene etter behandling, og de med uklar diagnose, krever oppfølging i 5 år (de uavklarte grensetilfellene) eller 10 år (de behandlede) etter internasjonal standard (D). I utvalgte tilfeller vil det være aktuelt å søke hjelp utenlands. Protonstråling av melanom har i bestemte tilfeller klare medisinske fordeler. Endoreseksjon og spesielt ekstern reseksjon er behandlingsmåter som er krevende. Det er opparbeid ekspertise på slik behandling ved visse sentra i utlandet.
De aller fleste som får metastaser etter behandling for uvealt melanom, får metastaser innen 5 år fra diagnosetidspunktet. I sjeldne tilfeller er det beskrevet opptil 15–40 års latenstid før metastasene manifesterer seg.
Risikoen for å utvikle spredning er lik ved enukleasjon og strålebehandling (plate-behandling eller proton). Vi antar at hoveddelen av metastasering skjer før øyetumoren blir diagnostisert og behandlet (Kujala et al., 2003) (C).
Det finnes i dag ingen prospektive studier som dokumenterer nytten av rutineoppfølging av pasienter med okulært melanom, og slike studier vil neppe kunne bli gjennomført i dag. Derfor er det heller ingen internasjonal konsensus om hvordan slike pasienter skal følges opp. Oppfølging etter behandling for uvealt melanom bør tilpasses pasientens egne ønsker og prognose.
Nesten halvparten av pasientene med okulært melanom utvikler metastaser. Risikoen for metastaser er størst ved gjennomvekst av sklera eller store, epitelioide svulster, melanomceller med monosomi 3 eller BAP1 negativitet. De fleste som får metastaser utvikler det i løpet av de første 5 årene, men det kan også ta opp til 40 år før metastaser viser seg.
Siden metastaser til lever er så hyppig (80–90 % av tilfellene), og lever er eneste metastase lokalisasjon hos 60–80 %, anbefales det likevel at pasienter følges opp regelmessig med ultralyd av lever og eventuelt leverfunksjonsprøver (alkalisk fosfatase og LD) hvert år.
Anbefalinger:
- Pasienter operert for okulært melanom bør følges opp med ultralyd lever hver 6. måned i 2 år, deretter årlig i minimum 10 år.
- Pasienter under 50 år bør kontrolleres hvert ½ år de første 5 årene.
Metastatisk behandling
Ny og bedre lokalbehandling gjør at de flest pasienter med okulært melanom nå beholder noe av det synet de har ved diagnose. Prognosen for pasientgruppen har imidlertid ikke endret seg de siste 30 årene. Dette skyldes at det ikke finnes behandling som kan redusere hyppigheten av metastasering og at behandlingen av metastaser er like ineffektiv som tidligere. I 2020 fikk 71 personer i Norge diagnosen øyemelanom (Nasjonalt kvalitetsregister for melanom, 2021) og rundt halvparten av disse vil utvikle fjernmetastaser.
Bare 2 % av pasientene har påvisbare metastaser på diagnosetidspunktet, men efter 5 år har 31 % metastaser, etter 15 år 45 % og etter 25 år har 50 % av pasientene metastaser (Kivela et al., 2006; Kujala et al., 2003; Pach et al., 1986) (C). Øyet mangler lymfesystem, slik at okulært melanom metastaserer hematogent, og som regel til lever i 90 %, til lunge i 20 %, skjellet 16 % og til hud i 12 % av tilfellene (Kivela et al., 2006; Singh et al., 2005; 2001) (C). Metastasering til CNS skjer unntaksvis ved uvealt melanom i motsetning til ved kutant melanom.
Pasienter med primært uvealt melanom behandles ved øyeavdelingene ved Oslo Universitetssykehus og Haukeland Universitetssykehus. Pasienter med metastatisk sykdom fra okulært melanom utgjør en liten pasientgruppe. Grunnet sjelden diagnose og meget forskjellig etiologi enn kutane melanomer, bør denne pasientgruppen holdes mer samlet, og behandlingsansvar bør være hos melanomansvarlige onkologer ved regionssykehus (OUS, Haukeland, St. Olavs og UNN). Denne pasientgruppen bør diskuteres på melanom-MDT møte og vurderes for utprøvende kreftbehandling dersom det foreligger.
Ved solitære metastaser eller ved begrenset antall levermetastaser, kan det - etter å ha utelukket andre metastaser (CT, MR, PET/CT) - være aktuelt med kirurgisk reseksjon (Jimenez-Requena et al., 2010; Xing et al., 2011). Studier viser forlenget overlevelse etter reseksjon av metastaser i lever (Frenkel et al., 2009; Mariani et al., 2009) (C).
Stereotaktisk strålebehandling av levermetastaser kan vurderes dersom kirurgi ikke er mulig. Behandlingen kan gis mot én, opp til tre metastaser, med tre fraksjoner av 12 til 15 Gy. Dette kan gi god lokal tumorkontroll.
I mange tilfeller foreligger det multiple levermetastaser, og da kan isolert lever-perfusjon med melphalan og hyperthermi vurderes, men denne behandlingen tilbys ikke i Norge (Alexander et al., 2003; Peters et al., 2006) (C). Chemo-embolisering med infusjon av kjemoterapi i lever (Gupta et al., 2010; Kivela et al., 2006; Kodjikian et al., 2005; Salmon et al., 1998) (C), eller radio-embolisering med radioaktive (Yttrium-90) mikrosfærer, er annen mulighet (Kennedy et al., 2009) (C). Intrahepatisk behandling benyttes i mindre grad enn tidligere, men kan være et behandlingsalternativ.
Immunterapi i form av sjekkpunkthemmere; CTLA4- antistoffet ipilimumab eller PD-1 hemmerne nivolumab eller pembrolizumab har vært forsøkt med vesentlig dårligere responsrate enn for kutane melanomer.
En fase II studie fra USA med 35 pasienter viste i 2021 en ORR på 18%, og en median OS på 19,1 måneder med kombinasjonen ipilimumab og nivolumab (Pelster et al., 2021). Den spanske uveale melanom-gruppen publiserte i 2021 resultater fra sin fase II studie med 52 inkluderte pasienter der de så en median OS på 12.7 måneder (Piulats et al., 2021). Studiene viste best effekt ved ekstrahepatiske metastaser, men selv om studiene viser en moderat respons på kombinasjonsbehandlingen er det bedret mOS sammenliknet med kjemoterapi. Hos de med metastatisk uvealt melanom og god allmenntilstand, uten alvorlig komorbiditet, kan derfor kombinasjonen ipilimumab og nivolumab forsøkes.
Dersom pasienten grunnet komorbiditet eller høy alder ikke er i stand til å tåle kombinasjonsbehandlingen med ipilimumab + nivolumab, kan man forsøke med PD-1 hemmer monoterapi (nivolumab eller pembrolizumab). Det foreligger data fra flere EAP og fase II studier, men resultatene varierer mye og responsrater er dårligere enn sett med kombinasjonsbehandlingen.
Det finnes per i dag ingen anbefalt 2.linje-behandling etter progresjon på dobbelt sjekkpunkthemming med ipilimumab + nivolumab.
I 2021 kom fase III studie-data på tebentafusp, et bispesifikt fusjons-protein som binder både tumor celle og T celle. Det er en løs T-celle reseptor med to bindingsområder; en via CD3 til T-cellen og en som gjenkjenner og binder antigenet gp100 på tumor-celler. Pasientene må ha HLA-A*02:01 (en HLA-type som finnes hos ca 50% av kaukasiere). Studien randomiserte 378 pasienter inn 2:1, tebentafusp (252 pasienter) eller «investigator´s choice» (126 pasienter) (ipilimumuab, pembrolizumab eller dakarbazine). 1 års OS var 73 % for tebentafusp-armen versus 59 % for den andre armen (Nathan et al., 2021). Tebentafusp var relativt godt tolerert og det forekom ingen dødsfall i studien. Studien sammenliknet ikke med kombinasjonen ipilimumab + nivolumab. Behandlingen med tebentafusp ble godkjent av hhv. FDA i januar og EMA i april 2022 og norske pasienter har fått behandling med tebentafusp gjennom EAP (Early Access Program) i Norge. Tebentafusp innføres ikke som monoterapi til behandling av humant leukocyttantigen (HLA)-A*02:01-positive voksne pasienter med ikke-resektabelt eller metastatisk uvealt melanom (jf. Beslutningsforum, Nye metoder 24.04.23)
Konjunktivale melanomer er en sjelden tumorgruppe og utgjør 5% av øyemelanomer (Isager et al., 2006) (C). Basert på populasjonsdata fra nasjonale registere i Finland, Sverige, Danmark og Nederland, er insidensens 0.24 til 0.8 tilfeller av konjunktivalt melanom per en million innbyggere. (Isager et al., 2005; Missotten et al., 2005; Triay et al., 2009; Tuomaala et al., 2002) (C). I studiene fra Sverige og Finland fant man en økende insidens av konjunktivalt melanom korrelerende med kutant melanom som kan indikere en mulig assosiasjon mellom konjunktivalt melanom og UV stråling (Triay et al., 2009; Tuomaala et al., 2002) (C).
Risikofaktorer for å utvikle konjunktivalt melanom er ikke klare, men det foreligger sterk assosiasjon mellom primært ervervet melanose (primary aquired melanosis, PAM) og utvikling av konjunktivalt melanom. PAM med sterk atypi kan utvikle seg til konjunktivalt melanom i 13-50% av tilfellene (Shields et al., 2007b) (C). Den hyppigste lokalisasjonen er bulbære konjunktiva (Missotten et al., 2005) (C). Selv om 15-19 % kan være amelanotiske (Shields et al., 2000c) (C), vil de fleste være pigmenterte med vaskularisering omkring og ofte melanomse (Kenawy et al., 2013) (C).
Konjunktival melanom kan som kutane melanomer spre seg via lymfebanene. Risikofaktorer for lymfatisk spredning er; tumortykkelse mer enn 2 mm, ulcerasjon og økt mitotisk aktivitet (Esmaeli et al., 2012) (C). Tumores fra nasale konjunktiva drenerer primært til submandibulære lymfeknuter (Lim et al., 2006) (C) og resten drenerer til preaurikulære- og dype cervikale lymfeknuter (Esmaeli et al., 2001) (C).
Primærbehandling er kirurgi med cryoterapi i kantene (Chen et al., 2006; Damato et al., 2009; Oellers et al., 2012) (C) det er viktig å bevare Bowmans membran da denne opptrer som en naturlig barriere mot dypere invasiv vekst i øyet. Lokal, adjuvant behandling kan gis i form av mitomycin c (Kurli et al., 2005) (C) eller brachyterapi (Karim et al., 2011) (C)
Konjunktivale melanomer har flere likhetstrekk med kutane melanomer enn med uveale. BRAF-mutasjon kan foreligge hos pasienter med konkunktivale melanomer og bør derfor utredes patologiskt for dette ved diagnosetidspunkt (Griewank et al., 2013; Spendlove et al., 2004) (C). KIT og NRA- mutasjoner kan også forekomme (Griewank et al., 2013; Wallander et al., 2011) (C)
Data basert på fem store studier der man har studert tilsammen 734 tilfeller av konjunktivalte melanomer har vist en risiko for fjernspredning hos ca. 19% av pasientene (Esmaeli et al., 2001; Missotten et al., 2005; Shields et al., 2012; Tuomaala et al., 2004; Werschnik et al., 2002) (C). Hyppigste metastase lokalisasjoner er lymfeknuter, lever, lunger, hjerne og hud (Missotten et al., 2005; Shields et al., 2000c) (C).
Behandling av metastatisk sykdom bør vurderes ut i fra mutasjonsstatus og sykdomsutbredelse. Da dette er en meget sjelden sykdom foreligger lite, ny dokumentasjon på systembehandling, men man bør i utgangspunktet vurdere å behandle metastatisk sykdom som for kutane melanomer (Dagi Glass et al., 2017; Kini et al., 2017) (D).
Anbefalinger
- Pasienter med solitære eller begrenset antall levermetastaser vurderes for lever reseksjon, eller stereotaktisk strålebehandling.
- Behandling med sjekkpunkthemmer-kombinasjon ipilimumab og nivolumab bør vurderes dersom pasientene er i god allmenntilstand.
- Pasienter med konjunktivale melanomer bør behandles som ved kutane melanomer ved metastatisk sykdom.
Anbefalinger melanom i øyet (sammendrag):
- Strålebehandling kan gis som et tilbud til uveale melanompasienter uten å øke risikoen for metastaserende sykdom ut over det som oppnås med enukleasjon. Mortaliteten etter strålebehandling og enukleasjon er lik i et tiårsperspektiv, når lokal svulstkontroll blir nådd (A).
- Oppfølgingen etter behandlingen bør være styrt fra regional øyeavdeling og vare i 10 år (D).
- Ved mistanke om, eller påvist metastatisk sykdom, bør pasientene henvises til melanomansvarlige onkologer ved regionssykehus (OUS, Haukeland, St. Olavs og UNN) for videre utredning og/eller behandling. Grunnet sjelden diagnose og meget forskjellig etiologi fra kutane melanomer, bør behandlingsansvar samles hos regionssykehus.
- Pasientgruppen bør vurderes inkludert i studie dersom det foreligger.
Metode og prosess
Hva er nasjonale retningslinjer?
Sist faglig oppdatert: 05.07.2023
Nasjonale retningslinjer fra Helsedirektoratet er å betrakte som anbefalinger og råd, basert på oppdatert faglig kunnskap som er fremskaffet på en systematisk, kunnskapsbasert måte. De nasjonale retningslinjene gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet, og er ment som et hjelpemiddel ved de avveininger tjenesteyterne må gjøre for å oppnå forsvarlighet og god kvalitet i tjenesten.
Nasjonale retningslinjer er ikke rettslig bindende for mottakerne, men skal som faglig normerende langt på vei være styrende for de valg som skal tas. Ved å følge oppdaterte nasjonale retningslinjer vil fagpersonell bidra til å oppfylle kravet om faglig forsvarlighet i lovverket. Dersom en velger løsninger som i vesentlig grad avviker fra nasjonale faglige retningslinjer bør en dokumentere dette, og være forberedt til å begrunne sitt valg.
Kunnskapsbasert prosess
Sist faglig oppdatert: 05.07.2023
Helsedirektoratet legger til grunn at alle nasjonale retningslinjer skal være utarbeidet etter en metode med vekt på forskningsbasert kunnskap, tydelig og tilgjengelig dokumentasjon, brukermedvirkning, tverrfaglighet, fokus på praksis, implementering og oppdatering.
Det er en omfattende prosess å lage gode retningslinjer som tilfredsstiller krav til prosess, metode og transparens, som er det nivå Helsedirektoratet og andre liknende organisasjoner har lagt til grunn for utforming av anbefalinger.
Helsedirektoratet ønsker i arbeidet med nasjonale retningslinjer for kreftbehandling å bygge på det arbeidet faggruppene tilsluttet Onkologisk Forum i en årrekke hadde gjort med å lage behandlingsveiledere/handlingsprogram.
Ved førsteutgaven av retningslinjen samarbeidet faggruppen og Nasjonalt kunnskapssenter for helsetjenesten (nå FHI) tett for å sikre en god håndtering av kunnskapsgrunnlaget for anbefalingene:
- I en tidlig fase av arbeidet avklarte faggruppen hva retningslinjene skulle omfatte når det gjaldt diagnostikk, behandling og oppfølging av melanom.
- Kunnskapssenteret gjennomgikk i samarbeid med faggruppen de faglige anbefalingene med hensyn til metode og hvilket kunnskapsgrunnlag de skulle baseres på.
- Faggruppen vurderte, i samarbeid med Helsedirektoratet og Kunnskapssenteret, om det var behov for utredning av kunnskapsgrunnlaget for enkelte problemstillinger.
- Kunnskapssenteret identifiserte og formidlet kunnskapsbaserte internasjonale retningslinjer og systematiske oversikter, ved søk på følgende nettsteder:
Søk etter retningslinjer:
- Guidelines international network: http://www.g-i-n.net/
- NICE, UK: http://www.nice.org.uk/
- SIGN, Scotland: http://www.sign.ac.uk/
- AHRQ, US: http://www.guideline.gov/
- Cancer care Ontario: http://www.cancercare.on.ca/
Søk etter systematiske oversikter:
- CRD-databasene: http://www.crd.york.ac.uk/crdweb/
- Cochrane Library: http://www.mrw.interscience.wiley.com/cochrane/cochrane_search_fs.html
Gradering av kunnskapsgrunnlaget
Sist faglig oppdatert: 05.07.2023
Ved utarbeiding av nasjonale retningslinjer stilles det krav om at all relevant kunnskap på området hentes frem, beskrives og vurderes på en systematisk og åpen måte.
I denne retningslinjen er kunnskapsgrunnlaget gradert, ikke anbefalingen. Hvis anbefalingen skal graderes må en legge inn en vurdering av både kost- nytte og andre forhold som klinisk erfaring, skjønn og etikk. I tillegg må kunnskapsgrunnlaget vurderes. Dette er ikke gjort eksplisitt i forbindelse med dette arbeidet.
| Studietype | Evidensnivå | Gradering av evidensnivå |
|---|---|---|
| Kunnskap som bygger på systematiske oversikter og meta-analyser av randomiserte kontrollerte studier. | Nivå 1a | A |
| Kunnskap som bygger på minst én randomisert kontrollert studie. | Nivå 1b | |
| Kunnskap som bygger på minst én godt utformet kontrollert studie uten randomisering. | Nivå 2a | B |
| Kunnskap som bygger på minst én annen godt utformet kvasi-eksperimentell studie uten randomisering. | Nivå 2b | |
| Kunnskap som bygger på godt utformede ikke eksperimentelle beskrivende studier, som sammenlignende studier, korrelasjonsstudier og case studier. | Nivå 3 | C |
| Kunnskap som bygger på rapporter eller oppfatninger fra eksperter, komiteer og/eller klinisk ekspertise hos respekterte autoriteter. | Nivå 4 | D |
Bakgrunn og arbeidsprosess
Sist faglig oppdatert: 05.07.2023
Utvikling av de nasjonale handlingsprogrammene for kreftbehandling var et viktig tiltak under Nasjonal strategi for kreftområdet 2006–2009 (Helse- og omsorgsdepartementet, 2006) (forlenget til 2011). Og videre utvikling av de nasjonale handlingsprogrammene var en kjerneoppgave i oppfølging av Sammen mot kreft – Nasjonal Kreftstrategi 2013–2017 (Helse- og omsorgsdepartemenetet, 2013), og i videreføringen og oppdateringen av denne, jf. Nasjonal kreftstrategi Leve med kreft (2018–2022) (Helse- og omsorgsdepartementet, 2018). Nasjonale handlingsprogrammer for kreftbehandling skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
Nasjonale faggrupper tilsluttet Onkologisk Forum hadde i en årrekke arbeidet med, og utviklet, behandlingsveiledere og handlingsprogram for ulike krefttyper. Helsedirektoratet ønsket i arbeidet med nasjonale handlingsprogrammer, som ledd i oppfølgingen av Nasjonal strategi for kreftområdet, å bygge på dette arbeidet. Helsedirektoratet rettet derfor i november 2005 en henvendelse til Norsk Melanom Gruppe (NMG) og ba om forslag til representanter til en arbeidsgruppe som skulle settes sammen av fagekspertise, Nasjonalt kunnskapssenter for helsetjenesten og Helsedirektoratet. Det ble bedt om at alle nødvendige faggrupper skulle være representert, og at gruppen skulle bestå av fagfolk fra alle helseregioner.
RHF-ene medvirket i arbeidet gjennom representasjon i prosjektets styrings- og referansegruppe, samt ved mulighet til å gi tilbakemelding på arbeidsgruppenes sammensetning. RHF-ene ble også bedt om at fagfolk innenfor rammen av sin arbeidstid ble fristilt til retningslinjearbeidet, jf. Oppdragsdokumentet fra Helse- og omsorgsdepartementet.
En arbeidsgruppe bestående av følgende personer ble nedsatt i desember 2009:
| Navn | Arbeidssted |
|---|---|
Redaksjonskomite Kari Dolven Jacobsen (leder) | |
Trude Eid Robsahm | Kreftregisteret Kreftregisteret |
Ingeborg M. Bachmann | Hudavd., Haukeland universitetssykehus |
Ingeborg M. Bachmann | Hudavd., Haukeland unversitetssykehus Avd. for patologi, Haukeland universitetssykehus |
Lovise Mæhle | Enhet for arvelig kreft, Oslo universitetssykehus, Radiumhospitalet |
Christian Busch | Kirurgisk avd., Haukeland universitetssykehus |
Steinar Aamdal, | Seksjon for klinisk kreftforskning, Oslo universitetssykehus, Radiumhospitalet Hudavd., Haukeland universitetssykehus |
Hans Petter Gullestad | Kir.avd., Oslo universitetssykehus, Radiumhospitalet |
Jan Folkvard Evensen | Avd. for kreftbehandling, Oslo universitetssykehus, Radiumhospitalet Seksjon for gynekologisk kreft, Oslo universitetssykehus, Radiumhospitalet Øyeavd., Oslo universitetssykehus, Ullevål |
Oddbjørn Straume | Avd. for kreftbehandling, Haukeland universitetssykehus |
Lene Juvet, forsker, Nasjonalt kunnskapssenter for helsetjenesten bisto arbeidsgruppen med gradering av kunnskapsgrunnlaget, samt redigering og ferdigstillelse av retningslinjene.
Arbeidsgruppen leverte våren 2011 forslag til nasjonale retningslinjer for diagnostikk, behandling og oppfølging av melanom. Utkastet til retningslinjer ble høsten 2011 sendt på høring til Norsk melanomgruppe (NMG), RHFene, Legeforeningen, samt Kreftforeningen og dens pasientorganisasjoner.
Det nasjonale handlingsprogrammet med retningslinjer for diagnostikk, behandling og oppfølging av pasienter med melanom ble første gang publisert 17. november 2011. (IS-1869).
Oppdateringer av handlingsprogrammet
Sist faglig oppdatert: 05.07.2023
I 2013 ble retningslinjene oppdatert av en gruppe bestående av følgende personer:
- Lars A. Akslen, Avd for patologi, Haukeland universitetssjukehus
- Ingeborg M. Bachmann, Hudavd., Haukeland universitetssjukehus
- Nils A. Eide, Øyeavd, Oslo universitetssykehus, Ullevål
- Jan Folkvard Evensen, Avd. for kreftbehandling, Oslo universitetssykehus, Radiumhospitalet
- Hans E. Fjøsne, Kirurgisk klinikk, St. Olavs Hospital
- Jürgen Geisler, Kreftavd., Akershus universitetssykehus
- Hans Petter Gullestad, Kir. avd., Oslo universitetssykehus, Radiumhospitalet
- Per Helsing, Hudavd., Oslo universitetssykehus, Rikshospitalet
- Kari Dolven Jacobsen, Avd. for kreftbehandling, Oslo universitetssykehus, Radiumhospitalet
- Jarle Karlsen, Avd. for kreftbehandling, St. Olavs hospital
- Lovise Mæhle, Enhet for arvelig kreft, Oslo universitetssykehus, Radiumhospitalet
- Marta Nyakas, Seksjon for klinisk kreftforskning, Oslo universitetssykehus, Radiumhospitalet
- Trude Eid Robsahm, Kreftregisteret
- Tone Skeie-Jensen, Seksjon for gynekologisk kreft, Oslo universitetssykehus, Radiumhospitalet
- Oddbjørn Straume, Avd. for kreftbehandling, Haukeland universitetssjukehus
- Henrik Løvendahl Svendsen, Plastikkir. avd., Haukeland universitetssjukehus
- Steinar Aamdal, Seksjon for klinisk kreftforskning, Oslo universitetssykehus, Radiumhospitalet
Helsedirektoratet ferdigstilte i samarbeid med arbeidsgruppen handlingsprogrammet i november 2013 (IS-2118).
Handlingsprogrammet ble vinteren 2014/2015 revidert av samme gruppe som ved 2013-revisjonen, og oppdatert utgave ble publisert 13. februar 2015 (IS-2238). I den versjonen ble det kun foretatt revisjon av kapittel 7 Behandling av lokalisert sykdom/Kurativ behandling, og i kapittel 9 Behandling av metastaserende sykdom/livsforlengende og pallitativ behandling.
En ny utgave ble publisert 3. desember 2015 (IS-2419), i forbindelse med beslutninger tatt i Beslutningsforum i Nasjonalt system for innføring av nye metoder i spesialisthelsetjensten, 25. november 2015, vedrørende Nivolumab (Opdivo®) og Pembrolizumab (Keytruda®), samt innføring av pakkeforløp for kreft samme år. Det ble kun satt inn et nytt kapittel 4. Foreløpstider, og gjort endringer i kapittel 9 Behandling av metastaserende sykdom/livsforlengende og palliativ behandling.
I 2016 ble det nedsatt en ny arbeidsgruppe for oppdatering av handlingsprogrammet.
Navn | Spesialitet | Region | Sykehus/institusjon |
|---|---|---|---|
Oddbjørn Straume | Onkolog | Helse Vest | Haukeland universitetssjukehus |
Lars Akslen | Patolog | Helse Vest | Haukeland universitetssjukehus |
Ingeborg M. Bachmann | Dermatolog | Helse Vest | Haukeland universitetssjukehus |
Henrik L. Svendsen | Plast. kirurg | Helse Vest | Haukeland universitetssjukehus |
Thomas P. Bærland | Oftalmolog | Helse Sør-Øst | Oslo universitetssykehus |
Jan Folkvard Evensen | Onkolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Jürgen Geisler | Onkolog | Helse Sør-Øst | Akershus universitetssykehus |
Hans Petter Gullestad | Plast kirurg | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Ingrid Roscher | Dermatolog | Helse Sør-Øst | Oslo universitetssykehus, Rikshospitalet |
Kari Dolven Jacobsen | Onkolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Lovise Olaug Mæhle | Genetiker | Helse Sør-Øst | Oslo universitetssykehus, Rikshospitalet |
Marta Sølvi Nyakas | Onkolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Tone Skeie-Jensen | Gynekolog/onkolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Steinar Aamdal | Onkolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Hans E. Fjøsne | Kirurg | Helse Midt | St. Olavs hospital |
Jarle Karlsen | Onkolog | Helse Midt | St. Olavs hospital |
Trude Eid Robsahm | Dr.Philos/Forsker | Kreftregisteret | |
Katja Bremnes | Dermatolog | Helse Nord | Universitetssykehuset Nord-Norge |
Olav Inge Håskjold * | Radiolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
* Håskjold ble erstattet av Marianne Fretheim, radiolog, OUS/Radiumhospitalet, fra mars 2016
Lene Juvet, forsker ved FHI/Nasjonalt kunnskapssenter for helsetjenesten, bisto arbeidsgruppen ved behov.
I den 5. utgaven av handlingsprogrammet, (IS-2489, 8. september 2016), ble det gjort endringer i forbindelse med beslutninger tatt i Beslutningsforum for Nye metoder den 25.04.2016, tilknyttet legemidlene dabrafenib (Tafinlar), trametinib (Mekinist) og Vemurafenib (Zelboraf).
Den 6. utgaven forelå 17. oktober 2017 (IS-2664), med bakgrunn i beslutninger tatt i Beslutningsforum for Nye Metoder den 9.6.2017 tilknyttet legemiddelet Nivolumab (Opdivo®) i kombinasjon med Ipilimumab (Yervoy®) ved avansert melanom.
Den 7. utgaven forelå 18. september 2018 (IS-2723).
Navn | Spesialitet | Region | Sykehus/institusjon |
|---|---|---|---|
Oddbjørn Straume | Onkolog | Helse Vest | Haukeland universitetssjukehus |
Lars Akslen | Patolog | Helse Vest | Haukeland universitetssjukehus |
Ingeborg M. Bachmann | Dermatolog | Helse Vest | Haukeland universitetssjukehus |
Henrik L. Svendsen | Plastikkirurg | Helse Vest | Haukeland universitetssjukehus |
Jürgen Geisler | Onkolog | Helse Sør-Øst | Akershus universitetssykehus |
Hans Petter Gullestad | Plastikkirurg | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Truls Ryder | Plastikkirurg | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Roscher | Dermatolog | Helse Sør-Øst | Oslo universitetsykehus, Rikshospitalet |
Kari Dolven Jacobsen | Onkolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Lovise Olaug Mæhle | Genetiker | Helse Sør-Øst | Oslo universitetssykehus, Rikshospitalet |
Marta Sølvi Nyakas | Onkolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Steinar Aamdal | Onkolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Nils A. Eide | Oftalmolog | Helse Sør-Øst | Oslo universitetssykehus, Ullevål |
Marianne Fretheim | Radiolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Anna K. Winge | Onkolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Hans E. Fjøsne | Kirurg | Helse Midt | St. Olavs hospital |
Jarle Karlsen | Onkolog | Helse Midt | St. Olavs hospital |
Trude Eid Robsahm | Dr.Philos/Forsker | Kreftregisteret | |
Lene Bremnes | Dermatolog | Helse Nord | Univ. i Nord-Norge |
Lene Kroken | Fastlege |
| Nesttun Allmennpraksis |
I 8. utgave (IS-2853), var det kun kapittel 7.3 Medikamentell behandling (Lokalisert sykdom/kurativ behandling) og kapittel 9.3 Medikamentell behandling (Metastaserende sykdom/Livsforlengende og palliativ behandling), som ble oppdatert. Dette inkluderte blant annet nye anbefalinger og tilhørende beslutninger tatt i Beslutningsforum per september 2019.
Ved den 9. utgaven av handlingsprogrammet (IS-2931), ble hele handlingsprogrammet gjennomgått og oppdatert der det var behov.
Det har vært en fullstendig gjennomgang og oppdatering av handlingsprogrammet før publisering av denne 10. utgaven av handlingsprogrammet (juni 2023).
| Navn | Yrke | Sykehus/institusjon | |
|---|---|---|---|
Oddbjørn Straume (leder) | Onkolog | Helse Vest | Haukeland universitetssjukehus |
Ingeborg M. Bachmann | Dermatolog | Helse Vest | Haukeland universitetssjukehus |
Henrik L. Svendsen | Plastikkirurg | Helse Vest | Haukeland universitetssjukehus |
Kari Dolven Jacobsen | Onkolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Truls Ryder | Plastikkirurg | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Ingrid Roscher | Dermatolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Thomas P. Bærland | Oftalmolog | Helse Sør-Øst | Oslo universitetssykehus, Ullevål |
Marta Sølvi Nyakas | Onkolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Marianne Fretheim | Radiolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Skeie-Jensen | Gynekolog/Onkolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Anne K. Winge | Onkolog | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
Hans E. Fjøsne | Kirurg | Helse Midt | St. Olavs hospital |
Jarle Karlsen | Onkolog | Helse Midt | St. Olavs hospital |
Trude Eid Robsahm | Dr.Philos/Forsker | Kreftregisteret | |
Kaja Bremnes | Dermatolog | Helse Nord | Universitetssykehuset Nord-Norge |
Lene Kroken | Fastlege |
| Nesttun Allmennpraksis |
Tove Borgen | Fastlege |
| Frysja Legesenter, Oslo |
| Navn | Yrke | Sykehus/institusjon | |
|---|---|---|---|
| Sura Mohammed Aziz | Patolog | Helse Vest | Haukeland universitetssjukehus |
| Håvard Nordgaard | Plastikkirug | Helse Midt | St. Olavs hospital |
| Marit Langmyr | Radiolog | Helse Midt | St. Olavs hospital |
| Ragnhild Telnes | Dermatolog | Helse Midt | St. Olavs hospital |
| Ayca Løndalen | Nukleærmedisiner | Helse Sør-Øst | Oslo universitetssykehus, Radiumhospitalet |
| Tone Bøe Aaman Vamre | Genetiker | Helse Sør-Øst | Oslo universitetssykehus |
Habilitet
Alle gruppens medlemmer ble bedt om å oppgi potensielle interessekonflikter. Helsedirektoratet har vurdert arbeidsgruppens medlemmer som habile når det gjelder utarbeiding av utkast til nasjonale retningslinjer for diagnostikk, behandling, og oppfølging av melanom.
Ressursmessige konsekvenser
Nye behandlingsmetoder mot kreft kan medføre økte kostnader, men kan også føre til reduserte kostnader i andre deler av pasientbehandlingen. Anbefalingene i dette handlingsprogrammet kan derfor medføre omdisponering av ressurser i de regionale helseforetakene.
Vedlegg: TNM-stadier og stadiegrupperinger for melanom
Sist faglig oppdatert: 05.07.2023
Oversatt til norsk fra (Balch et al., 2009) TNM Classification of Malignant tumors, 8. utg (Brierley et al., 2017).
T | Tykkelse (mm.) | Ulcerasjon / Mitoser | |
| Tis | ia | Ia |
| T1 | ≤ 1.0 | a: Uten ulcerasjon og < 0,8 mm |
|
|
| b: Med ulcerasjon og < 0,8 mm eller 0,8–1,0 mm |
| T2 | > 1.0–2.0 | a: Uten ulcerasjon |
|
|
| b: Med ulcerasjon |
| T3 | > 2.0–4.0 | a: Uten ulcerasjon |
|
|
| b: Med ulcerasjon |
| T4 | > 4.0 | a: Uten ulcerasjon |
|
|
| b: Med ulcerasjon |
N |
| Antall pos. knuter | Nodal metastatisk byrde |
| N0 | 0 | Ia |
| N1 | 1 | a: klinisk okkult |
|
|
| b: klinisk påvisbar |
|
|
| c: Mikrosatelitt, satellitt eller in-transitmetastase uten regionale lymfeknutemetastaser |
| N2 | 2–3 | a: klinisk okkult |
|
|
| b: klinisk påvisbar |
|
|
| c: in-transit metastaser/ satellitter/mikrosatelitter med bare èn regional lymfeknutemetastase |
| N3 | Metastaser til 4 eller flere lymfeknuter eller sammenvokste lymfeknuter, eller både in-transit/ satellitt/mikrosatelitt metastase(r) og med to eller flere regionale lymfeknutemetastaser |
|
|
|
| a: klinisk okkulte |
|
|
| b: klinisk påvisbare |
|
|
| c: Saterlitt(er), Mikrosatelitt (er) eller in-transitmetastse(r) med to eller flere regionale lymfeknutemetastaser |
M |
| Lokalisasjon | Serum LDγ |
| M0 | Ingen metastaser | Ia |
| M1a | Fjernmetastaser i hud/ subcutis (inkl muskel) eller ikke-regionale lymfeknuter | LD ikke kjent/angitt |
| M1a (0) |
| Ikke forhøyet |
| M1a (1) |
| Forhøyet |
| M1b | Lungemetastaser med eller uten M1a metastaser | LD ikke kjent/angitt |
|
|
| forts. |
|
|
|
|
| M1b (0) |
| Ikke forhøyet |
| M1b(1) |
| Forhøyet |
| M1c | Andre fjernmetastaser utenfor sentralnervestystemet, med eller uten M1a eller M1b metastaser | LD ikke kjent/angitt |
| M1c(0) |
| Ikke forhøyet |
| M1c (1) |
| Forhøyet |
| M1d | Fjernmetastase til sentralnervesystemet med eller uten metastaser til andre organsystem | LD ikke kjent/angitt |
| M1d(0) |
| Ikke forhøyet |
| M1d(1) |
| Forhøyet |
ia: ikke anvendelig γ Laktat dehydrogenase | |||
Klinisk stadiumα |
| Patologisk stadiumβ | ||||||
|---|---|---|---|---|---|---|---|---|
| T | N | M |
|
| T | N | M |
| T | N | M |
|
| T | N | M |
0 | Tis | N0 | M0 |
| 0 | Tis | N0 | M0 |
IA | T1a | N0 | M0 |
| IA | T1a | N0 | M0 |
IB | T1b T2a | N0 N0 | M0 M0 |
| IA IB | T1b T2a | N0 N0 | M0 M0 |
IIA | T2b T3a | N0 N0 | M0 M0 |
| IIA | T2b T3a | N0 N0 | M0 M0 |
IIB | T3b T4a | N0 N0 | M0 M0 |
| IIB | T3b T4a | N0 N0 | M0 M0 |
IIC | T4b | N0 | M0 |
| IIC | T4b | N0 | M0 |
III | Hvilken som helst T | ≥ N1 | M0 |
| IIIA | T1a/b-T2a | N1a el N2a | M0 M0 |
IV | Hvilken som helst T | Hvilken som helst N | M1a-d |
| IIIB | T0 | N1b, N1c | M0 |
T1a/b-T2a | N1b/c el N2b | M0 | ||||||
T2b/T3a | N1a-N2b | M0 | ||||||
|
|
|
|
| IIIC | T0 | N2b, N2c, N3b el N3c | M0 |
|
|
|
|
|
| T1a-T3a | N2c el N3a/b/c | M0 |
|
|
|
|
|
| T3b/T4a | ≥ N1a | M0 |
|
|
|
|
|
| T4b | N1a-N2c | M0 |
|
|
|
|
| IIID | T4b | N3a/b/c | M0 |
|
|
|
|
| IV | Hvilken som helst T, inkl Tis | Hvilken som helst N | M1a-d |
Referanser
Balch, C. M., Gershenwald, J. E., Soong, S. J., Thompson, J. F., Atkins, M. B., Byrd, D. R., . . . Sondak, V. K. (2009). Final version of 2009 AJCC melanoma staging and classification. Journal of clinical oncology, 27(36), 6199-6206. https://doi.org/10.1200/JCO.2009.23.4799
Brierley, J. D., Gospodarowicz, M. K., & Wittekind, C. (red.). (2017). TNM classification of malignant tumours (8. utg.). Chichester, West Sussex, UK; Hoboken, NJ: Wiley-Blackwell.









