Nasjonal faglig retningslinje for diagnostikk, attakk- og sykdomsmodulerende behandling av multippel sklerose
Diagnostikk av multippel sklerose
Helsepersonell bør henvise pasienter til diagnostisk utredning ved symptomer som kan gi mistanke om multippel sklerose
Henvisende helsepersonell kan være fastleger, sykehusleger, privatpraktiserende leger eller legevaktleger.
Både alvorlige og mindre alvorlige symptomer kan gi grunn til å mistenke multippel sklerose (MS).
Nyoppståtte alvorlige symptomer, som eksempelvis tåkesyn eller synstap, dobbeltsyn eller lammelser er en øyeblikkelig hjelp situasjon. Kontakt vakthavende lege ved nevrologisk avdeling eller øyeavdeling for rask avklaring.
Ved mindre alvorlige symptomer eller symptomer som har vedvart over noe tid, bør en vurdere henvisning til MR-undersøkelse av hjerne og eventuelt ryggmarg, samtidig som pasienten henvises til nevrologisk utredning.
Praktisk – slik kan anbefalingen følges
Innhold i henvisning:
- beskrivelse av sykehistorie
- funn ved klinisk undersøkelse
- funn ved MR-undersøkelse og andre tilleggsundersøkelser, om dette er gjort
- eventuell annen sykdom og behandling
Hva gir grunn til å mistenke MS?
MS diagnostiseres oftest hos personer mellom 20 og 50 år, men kan også debutere hos barn og eldre. Flere kvinner enn menn rammes av MS.
Typiske subakutte symptomer som kan gi mistanke om MS er:
- tåkesyn eller synsreduksjon, ofte ledsaget av smerte ved bevegelse av øyet
- dobbeltsyn
- følesansforstyrrelse som ikke kan forklares av påvirkning av en enkeltnerve eller nerverot
- kraftsvikt eller lammelser
- koordinasjonsvansker inkludert ataksi
- blærefunksjonsforstyrrelse med urge og/eller retensjon
Andre symptomer som forsterker mistanken:
- plutselig og korte «strømstøt» ut i armer og eventuelt ned i ryggen og ut i bena ved nakkefleksjon (Lhermittes tegn)
- uttalte øyemotilitetsforstyrrelse som rammer konjugerte øyebevegelser og omfatter begge øynene (internukleær oftalmoplegi)
- forbigående forverring av synssymptomer i forbindelse med oppvarming og økt kroppstemperatur (Uhthoffs fenomen)
- Særlig ved trening, men også varmt vær, feber og sauna/varme bad
Funn som svekker mistanken:
- hyperakutt debut
- normale funn ved MR-undersøkelse av hjernen og eventuelt ryggmarg
- kortikale utfall som eksempelvis
- tale- og spåkforstyrrelse (afasi)
- forstyrrelse av viljestyrte og målrettede bevegelser uten at dette er knyttet til lammelser (apraksi)
- redusert oppmerksomhet mot egen kropp eller omgivelser på den ene siden, knyttet til kognitiv forstyrrelse eller synsfeltutfall (neglekt)
- muskelstivhet på grunn av økt muskelspenning (rigiditet) eller vedvarende økt muskelspenning som gir spasmeliknende eller vridende stillinger deler eller hele kroppen (dystoni)
Mer informasjon:
For detaljer og prosedyrer knyttet til diagnostisk utredning, behandling og pasientinformasjon henvises det til:
- Nevrologikapittel i Norsk Elektronisk Legehåndbok (nevrologi.legehandboka.no), redigert av Norsk nevrologisk forening - åpent tilgjengelig
- Norsk MS-veileder fra Nasjonal kompetansetjeneste for multippel sklerose (msveileder.no)
Begrunnelse – dette er anbefalingen basert på
Multippel sklerose (MS) er en kronisk immunbetennelsessykdom i sentralnervesystemet, som kan medføre et vidt spekter av symptomer med ledsagende funksjonstap. Sykdommen rammer i hovedsak unge voksne, og den krever livslang oppfølging (Aarseth, Smedal, Skår, & Wergeland, 2021).
Tall fra Norsk MS-register og biobank viser at omtrent 30 prosent av pasientene får sin diagnose mer enn to år etter symptomdebut. Variasjonen mellom ulike helseforetak er betydelig, selv om tallene må tolkes med forsiktighet fordi de er basert på få observasjoner (Aarseth et al., 2021). Forsinkelser i henvisning kan være en medvirkende årsak til sen diagnose.
Tidlig henvisning er en del av et godt pasientforløp som i kombinasjon med rask diagnostikk og tidlig oppstart av sykdomsmodulerende behandling gir bedre prognose. For referanser, se anbefaling om tid fra diagnose til oppstart av behandling. MR-undersøkelser er en vesentlig del av diagnostikken, for å eventuelt bekrefte en mistanke om MS og utelukke andre tilstander som kan gi liknende symptomer.
Pasienter og pårørende fremhever at tidlig henvisning og diagnose muliggjør tidlig oppstart med sykdomsmodulerende legemiddelbehandling, noe som kan forsinke og muligens forhindre utvikling av funksjonstap. Anbefalingen kan bidra til dette, samt å redusere ulikhet og uønsket variasjon i helsetjenestetilbudet til MS-pasienter. Mulige ulemper kan potensielt være økt overdiagnostikk og overbehandling, samt risiko for feildiagnostikk og feilbehandling.
Sist faglig oppdatert: 14.09.2022
Nevrolog bør tilpasse tiden fra mottatt henvisning til oppstart av diagnostisk utredning for multippel sklerose etter symptomenes alvorlighetsgrad og varighet
Nevrolog har ansvar for diagnostisk utredning av pasienter henvist med mistanke om multippel sklerose (MS).
- Alvorlige symptomer – øyeblikkelig hjelp
Vakthavende lege ved nevrologisk avdeling eller øyeavdeling bør begynne diagnostisk utredning av MS som del av øyeblikkelig hjelp hos pasienter med nyoppståtte alvorlige symptomer, som eksempelvis tåkesyn eller synstap, dobbeltsyn eller lammelser. - Moderat alvorlige symptomer – innen fire uker
Ved mistanke om aktiv MS bør nevrolog begynne diagnostisk utredning så snart som mulig, senest innen fire uker etter mottatt henvisning. Med aktiv MS menes sykehistorie med sterk mistanke om klinisk attakk innenfor siste uker, og særlig om det samtidig er påvist kontrastladende lesjoner på MR. - Mindre alvorlige symptomer eller ved mistanke om primær progredierende MS med langsom funksjonsforverring over tid – innen tolv uker
Ved mistanke om MS bør nevrolog begynne diagnostisk utredning innen tolv uker etter mottatt henvisning. Mindre alvorlige symptomer kan være følesansforstyrrelse i en ekstremitet eller sykehistorie måneder tilbake i tid, gjerne med lette, vedvarende symptomer som kan gi mistanke om MS.
Praktisk – slik kan anbefalingen følges
Kort om utredning og diagnostikk av MS
Det finnes verken unike symptomer, nevrologiske utfall eller funn ved supplerende undersøkelser som alene gir en MS-diagnose. Diagnosen stilles etter grundig evaluering og sammenstilling av:
- sykehistorie
- klinisk nevrologisk undersøkelse
- supplerende undersøkelser som omfatter MR, ryggmargsvæskeanalyser, samt eventuelt undersøkelse av de fremre synsbanene med synsstimuleringstest eller optisk koherens-tomografi
Diagnosen stilles ved påvisning av sykdomsaktivitet i sentralnervesystemet med spredning i tid og lokalisasjon, uten at det er holdepunkt for en annen mer sannsynlig årsak enn MS. Eksempler på andre årsaker er nevromyelitis optika spektrum sykdom (NMOSD), akutt disseminert encefalomyelitt (ADEM) eller myelin oligodendrocyte glycoprotein (MOG) assosiert sykdom. Gjeldende internasjonale diagnosekriterier er McDonald-kriteriene (Thompson AJ, 2018). Pasienter som ikke fyller diagnosekriteriene for MS kan ha klinisk isolert syndrom (CIS), men følges opp som MS.
Det tar noe tid å gjennomføre en diagnostisk utredning, men god logistikk reduserer tidsbruken.
En internasjonal konsensusartikkel oppgir frister for tiden fra mottatt henvisning til avklart diagnose. Fire uker angis som oppnåelig og en uke som noe å strekke seg etter (Hobart et al., 2019).
Registrer nydiagnostiserte pasienter i Norsk MS-register og biobank, se egen anbefaling.
Ordlyden «Oppstart av diagnostisk utredning» i anbefalingen forstås som «Første kontakt med nevrologisk avdeling» i registeret.
Mer informasjon
For detaljer og prosedyrer knyttet til diagnostisk utredning, behandling og pasientinformasjon henvises det til:
Begrunnelse – dette er anbefalingen basert på
Multippel sklerose (MS) er en kronisk immunbetennelsessykdom i sentralnervesystemet, som kan medføre et vidt spekter av symptomer med ledsagende funksjonstap. Sykdommen rammer i hovedsak unge voksne, og den krever livslang oppfølging (Aarseth et al., 2021)
Tidlig diagnose er viktig fordi det muliggjør tidlig oppstart med sykdomsmodulerende behandling, som kan forsinke og muligens forhindre utvikling av funksjonstap. Behandlingen er mest effektiv i tidlig fase av sykdommen, og bør derfor startes så tidlig som mulig. For referanser, se anbefaling om tid fra diagnose til oppstart av behandling. Tall fra Norsk MS-register og biobank viser at omtrent 30 prosent av pasientene får sin diagnose mer enn to år etter symptomdebut. Variasjonen mellom ulike helseforetak er betydelig, selv om tallene må tolkes med forsiktighet fordi de er basert på få observasjoner (Aarseth et al., 2021). Det kan være flere årsaker til sen diagnose, og forsinket diagnostikk kan være en medvirkende årsak.
Prioriteringsveilederen angir 12 uker som veiledende maksimal frist for start av utredning, men nevner også individuelle forhold som kan påvirke fristen. Anbefalingen tydeliggjør hvilke forhold dette gjelder og hvilke frister som er akseptable for ulike grupper av pasienter. Holdepunkter for aktiv MS og pågående sykdomsaktivitet og vevsskade kan være nyoppståtte alvorlige symptomer eller sterk mistanke om klinisk attakk innenfor siste uker med påvist kontrastladende lesjoner på MR. Det er da viktig med rask oppstart med behandling med målsetning om å begrense skadeomfang og hindre nye MS-attakk og tilkomst av nye MR-lesjoner. Om sykehistorien tilsier at det er noe tid (måneder) siden siste klinisk attakk og det ikke er påvist kontrastladende lesjoner på MR, vil hastegraden være mindre, men snarlig oppstart av sykdomsmodulerende behandling vil likevel være viktig.
Sist faglig oppdatert: 14.09.2022
Sykdomsmodulerende legemiddelbehandling
Nevrolog bør tilstrebe at tiden fra diagnostisert multippel sklerose til oppstart av sykdomsmodulerende legemiddelbehandling blir så kort som mulig
Oppstart av sykdomsmodulerende legemiddelbehandling bør skje innen tre uker etter at diagnosen er avklart for pasienter med nylig eller pågående sykdomsaktivitet. Ved behov for vaksinasjoner eller utvidet behov for utredning for endelig diagnostisk avklaring, kan det ta noe lengere tid før behandlingen startes opp.
Praktisk – slik kan anbefalingen følges
Med "så kort som mulig", tas det høyde for at det kreves noe tid til å gjennomføre nødvendige undersøkelser og eventuelle vaksinasjoner før valg og igangsetting av behandling kan gjennomføres. Se egen anbefaling for mer informasjon om valg av legemiddel.
For detaljer og prosedyrer knyttet til diagnostisk utredning, behandling og pasientinformasjon henvises det til:
Begrunnelse – dette er anbefalingen basert på
Forskning viser at tidlig oppstart med sykdomsmodulerende legemiddelbehandling er hensiktsmessig, men studiene har ikke en entydig definisjon av begrepet "tidlig oppstart". Anbefalingen spesifiserer at oppstart i de fleste tilfeller bør skje innen tre uker. Dette er ikke entydig basert på forskning, men i tråd med internasjonal konsensus (Hobart et al., 2019) og klinisk erfaring.
Randomiserte, placebokontrollerte studier har vist at tidlig oppstart med sykdomsmodulerende legemiddelbehandling reduserer risiko for nye attakk og overgang til klinisk sikker multippel sklerose (MS) hos pasienter med CIS/tidlige tegn på MS (Armoiry et al., 2018; Leist et al., 2014; Miller et al., 2019; Miller at al 2014). Dette er undersøkt for interferon-beta, glatirameracetat, kladribin og teriflunomid. Resultater for tidlig behandling med interferon-beta, glatirameracetat og teriflunomidmed sammenliknet med forsinket oppstart viste også at tidlig behandling bedre forebygger videre sykdomsutvikling. Det er også vist i registerstudier at tidlig opptrapping av behandling ved sykdomsgjennombrudd bedre forebygger videre sykdomsutvikling enn senere opptrapping av behandling (Brown et al. 2019, se forskningsgrunnlag i anbefalingen om høyeffektive sykdomsmodulerende legemidler). Klinisk erfaring og brukererfaring bygger opp under forskningsfunnene.
Pasienter og pårørende understreker at tidlig oppstart med sykdomsmodulerende legemiddelbehandling er viktig for å forsinke og muligens forhindre utvikling av funksjonstap. Anbefalingen kan bidra til at flere pasienter får kortere tid til oppstart av sykdomsmodulerende legemiddelbehandling, samt å redusere ulikhet og uønsket variasjon i helsetjenestetilbudet til MS-pasienter.
Forskningsgrunnlag
Populasjon (P): Personer med første symptom som kan gi mistanke om MS (CIS – clinically isolated syndrome)
Tiltak (I): • Monoklonale antistoffer: alemtuzumab, natalizumab, okrelizumab, rituksimab, ofatumumab • Sfingosin-1-fosfatreseptormodulatorer: fingolimod, ozanimod, ponesimod, siponimod • Interferoner: interferon beta 1a, interferon beta 1b, peginterferon beta 1a • Andre: dimeltylfumarat, glatirameracetat, kladribin, mitoksantron, teriflunomid
Sammenligning (C): Alle legemidler sammenliknet med hverandre (direkte eller i nettverksanalyser) Placebo
Beskrivelse av inkluderte studier
Forskningsgrunnlag for effekt av tidlig start med MS-legemidler
For problemstillingen "Hva er effekt av tidlig start med legemiddelbehandling for MS sammenliknet med forsinket start eller placebo for personer med første symptom som kan gi mistanke om MS (CIS) på funksjonsendring, livskvalitet og konversjon til klinisk sikker MS?" er det oppsummert resultater for effekt av legemidlene hos personer før klinisk sikker MS er bekreftet, samt resultater for effekt av å starte tidlig sammenliknet med forsinket oppstart.
Beskrivelse av inkludert systematisk oversikt for interferon beta og glatirameracetat
Armoiry og medarbeidere har oppsummert effekt av glatirameracetat og interferon beta 1a og 1b hos personer med CIS (Armoiry et al., 2018). De analyserte utfallene: attakkrate, progresjon til klinisk sikker MS (nytt attakk) eller sykdomsforverring målt ved Expanded Disability Status Scale (EDSS), og bivirkninger som gjorde at pasienten sluttet med studielegemiddel. Det ble utført systematiske søk i februar 2016.
Fem randomiserte kontrollerte studier ble inkludert. Personene som ble inkludert i disse studiene hadde én klinisk hendelse og samtidig klinisk stumme lesjoner på MR. Alle legemidler ble sammenliknet med placebo i de inkluderte studiene, men data er analysert med nettverks-metaanalyser. For langtidseffekter har forfatterne inkludert data fra studienes forlengelsesfaser (open-label extension studies).
Beskrivelse av inkludert randomisert kontrollert studie med kladribin
Personer som hadde hatt et første symptom som kunne gi mistanke om MS (CIS) og MR-funn ble tilfeldig fordelt til behandling med kladribin eller placebo. Leist og medarbeidere rapporterte effekt på tid til konversjon til klinisk sikker MS (nytt attakk), nye MR funn, behov for å slutte med studielegemiddel og bivirkninger (Leist et al., 2014). Studien kalles ORACLE MS.
Studien benyttet både 3,5 mg/g og 5,25 mg/kg kladribin og skulle vare i 96 uker, med en ytterligere 96 uker forlengelsesperiode. Studien ble stanset tidlig etter sponsors ønske.
Beskrivelse av inkludert randomisert kontrollert studie med teriflunomid
Personer med tidlige tegn på MS (CIS, hatt en nevrologisk hendelse konsistent med demyelinisering og MR-funn) ble tilfeldig fordelt til behandling med teriflunomid eller placebo. . Miller og medarbeidere rapporterte effekt på tid til konversjon til klinisk sikker MS (nytt attakk), nye MR-funn, endring i EDSS og uønskede hendelser (Miller et al., 2014). Studien kalles TOPIC.
Studien benyttet både 7 mg og 14 mg teriflunomid og skulle vare inntil 108 uker. Etter endt studieperiode kunne deltakere som hadde fått behandling i minst 24 uker bli med i en forlengelsesstudie (Miller et al., 2019). Studien ble stanset tidlig på sponsors ønske i 2012 på bakgrunn av nye diagnostiske kriterier for MS.
Resultater - effekt av sykdomsmodulerende behandling hos personer som har hatt første symptom som kan gi mistanke om MS
Funksjonsendring
Armoiry og medarbeidere rapporterte at hver av de inkluderte studiene viste at legemiddelet reduserte risikoen for konversjon fra CIS til klinisk sikker MS sammenliknet med placebo . De rapporterte tilsvarende resultater fra en random-effect nettverksanalyse som for de direkte sammenlikningene med placebo. Resultater fra indirekte analyser indikerte ikke at det var forskjell mellom interferon-beta legemidlene og glatirameracetat.
Leist og medarbeidere rapporterte at kladribin reduserte risiko for konversjon til klinisk sikker MS sammenliknet med placebo.
Miller og medarbeidere rapporterte at teriflunomid reduserte risiko for attakk som indikerte overgang til klinisk sikker MS sammenliknet med placebo.
|
Intervensjon |
IFN beta 1b 250 mcg/hver2.dag |
IFN beta 1a 30 mcg/1peruke |
GA 20mg daglig |
Placebo |
|---|---|---|---|---|
|
IFN beta 1a 44mcg /3peruke |
0,96 (0,56- 1,55) |
0,93 (0,56-1,55) |
0,87 (0,51-1,50) |
0,48 (0,31-0,74) |
|
IFN beta 1b 250 mcg/hver2.dag |
- |
0,97 (0,63-1,50) |
0,91 (0,57-1,45) |
0,50 (0,36-0,70) |
|
IFN beta 1a 30 mcg/1peruke |
- | - |
0,94 (0,61-1,45) |
0,52 (0,39-0,68) |
|
GA 20mg |
- | - | - |
0,55 (0,40-0,76) |
| - |
Kladribin 3,5 mg/kg |
Kladribin 5,25 mg/kg |
|
Overgang til klinisk sikker MS (Poser kriterier) |
0·33 (0·21–0·51) |
0·38 (0·25–0·58) |
|
Overgang til McDonald 2005 MS (ny MR-lesjon) |
0·50 (0·39–0·63) |
0·43 (0·33–0·55) |
Rsiko for overgang til klinisk sikker MS, uttrykt som hazard ratio med 95 % konfidensintervall sammenliknet med placebo (Miller og medarbeidere, 2014) -
Teriflunomid 7 mg
Teriflunomid 14 mg
Overgang til klinisk sikker MS
0·628 (0·416–0·949)
0·574 (0·379–0·869)
Livskvalitet
Vi identifiserte ikke resultater for livskvalitet.
Andel som konverterer til MS
Leist og medarbeidere (2O14) rapporterte at andel pasienter som konverterte til klinisk sikker MS (Poser kriterier) i løpet av perioden med dobbelt-blind behandling i ORACLE MS var 15 % i gruppen som fikk 5,25 mg/kg kladribin, 13 % hos de som fikk 3,5 mg/kg kladribin og 34 % i placebogruppen.
Miller og medarbeidere (2014) rapporterte at andel pasienter i TOPIC-studien med attakk som indikerte overgang til klinisk sikker MS var 18 % i gruppen som fikk teriflunomid 14 mg, 19 % hos de som fikk 7 mg teriflunomid og 28 % i placebogruppen.
Funksjonsendring på kort og lang sikt
I TOPIC-studien rapporterte Miller og medarbeidere (2014) at begge gruppene behandlet med teriflunomid hadde signifikant større reduksjon i EDSS score fra start til måling ved 108 uker enn de i placebogruppen. Det ble ikke vist statistisk signifikante forskjell for pasienter med vedvarende funksjonsforverring (redusert score i EDSS over 12 uker).
Tidlig oppstart med sykdomsmodifiserende behandling sammenliknet med forsinket oppstart – langtidseffekt
Interferon beta og glatirameracetat
Armoiry og medarbeidere presenterer også resultater for tid til klinisk definert MS basert forlengelsesstudiene til de studiene de hadde identifisert i sitt systematiske søk.
Ved fullført studieperiode, eller ved nytt attakk, kunne deltakerne som var fordelt til placebo gå over til behandling med aktivt legemiddel. De som hadde startet med legemiddel kunne fortsette med dette. Deltakerne ble så fulgt videre. Resultater fra oppfølgningsperioden kan sees på som effekt av umiddelbar sammenliknet med forsinket oppstart av legemiddelbehandling. Mellom 53 og 86 % av deltakerne deltok i slike forlengelsesstudier.
Resultat for årlig attakkrate (ARR) favoriserte også tidlig start med legemiddel, mens score for funksjonsnivå (EDSS) så ut til å holde seg godt for både de med tidlig og forsinket oppstart med legemiddel.
|
Intervensjon |
HR (95 % KI) |
Måletidspunkt |
|---|---|---|
|
IFN beta 1a 44mcg /3peruke |
0,68 (0,48-0,98) |
5 år |
|
GA 20mg daglig |
0,59 (0,44-0,80) |
5 år |
|
IFN beta 1a 30 mcg/1peruke |
0,61 (0,45-0,82) |
10 år |
|
IFN beta 1b 250 mcg/hver2.dag |
0,67 (0,53-0,85) |
11 år |
Teriflunomid
I forlengelsesstudien til TOPIC, kunne deltakerne som hadde fullført studien eller fremdeles var i den da den ble stanset tidlig og deltaker som hadde fått minst 24 uker med randomisert behandling før overgang til klinisk definert MS få delta (Miller et al, 2019). Det var 68 % av de som startet i TOPIC, om gikk over i forlengelsesstudien. Personer som hadde fått placebo ble da tilfeldig fordelt til behandling med 7 mg eller 14 mg teriflunomid og representerer dermed forsinket oppstart med legemiddelbehandling.
Forfatterne skriver at tidlig start med 14 mg teriflunomid reduserte risiko for å få klinisk sikker MS (nytt attakk) sammenliknet med de som fikk forsinket (se tabell nedenfor).
Forfatterne rapporterer også at det kun var en lav andel pasienter som opplevde sykdomsforverring, uavhengig av behandlingsgruppe. Baseline median EDSS score på 1,5 holdt seg godt til uke 300 i alle grupper med unntak av en økning til median EDSS score på 1,75 for gruppen som fikk sen oppstart med 7 mg teriflunomid.
|
Sammenlikning |
HR (95 % KI) |
|---|---|
|
Tidlig 14 mg teriflunomid vs senere 14 mg |
0,529 (0,317–0,883) |
|
Tidlig 7 mg teriflunomid vs senere 7 mg |
1,560 (0,886–2,747) |
|
Tidlig 14 mg teriflunomid vs tidlig 7 mg |
0,604 (0,394–0,925) |
Sist faglig oppdatert: 14.09.2022
Pasienter med nydiagnostisert multippel sklerose bør starte med høyeffektiv sykdomsmodulerende legemiddelbehandling
Som hovedregel bør alle pasienter med inflammatorisk sykdomsaktivitet starte sykdomsmodulerende behandling. For pasienter som ikke starter med sykdomsmodulerende legemiddelbehandling, se anbefaling om oppfølgingsplan.
Valg av sykdomsmodulerende legemiddelbehandling gjøres i samråd med pasienten. For nærmere beskrivelse av viktige faktorer som bør vurderes for individuell tilpasning av behandlingen, se "praktisk".
De sykdomsmodulerende legemidlene er gruppert i to grupper etter en vurdering av nytte-risiko forhold, se "Begrunnelse" for mer informasjon. Ikke alle høyeffektive sykdomsmodulerende legemidler er tilgjengelige i den offentlige helsetjenesten, se oversikt med relevante beslutninger i Nye metoder og gjeldende LIS legemiddelavtaler på MS-området (sykehusinnkjop.no).
Høyeffektive sykdomsmodulerende legemidler som er tilgjengelige i den offentlige helsetjenesten:
- Anti-CD20 antistoffer (rituksimab, ofatumumab*)
- Anti-CD52**
- Kladribin
- Natalizumab*
- S1PR-modulatorer (fingolimod, ozanimod, ponesimod)
* Kun tilgjengelig for særlig indikasjon, se oversikt med relevante beslutninger i Nye metoder.
**Legemiddelet med virkestoffet alemtuzumab er et anti-CD52 antistoff som også har høy effekt, men det gir samtidig høy risiko for alvorlige bivirkninger. Det er derfor ikke plassert sammen med øvrige høyeffektive legemidler i flytskjemaet (se "praktisk").
Gruppen av andre sykdomsmodulerende legemidler som er tilgjengelige i den offentlige helsetjenesten består av:
- Dimetylfumarat*
- Glatirameracetat
- Interferon-beta (interferon beta-1a, interferon beta-1b, peginterferon beta-1a)
- Teriflunomid
* Virkestoffet i dimetylfumarat likner et nytt legemiddel, Diroksimelfumarat. Diroksimelfumarat er godkjent for bruk i den offentlige helsetjenesten (nyemetoder.no) fra mai 2023, men er ikke vurdert i denne revisjonen.
Praktisk – slik kan anbefalingen følges
Disse gruppene starter som hovedregel med høyeffektiv sykdomsmodulerende legemiddelbehandling:
- Nydiagnostiserte pasienter med attakkpreget multippel sklerose (RRMS) som nylig (de siste årene) har hatt attakk, fått påvist kontrastladende lesjoner eller nye T2-lesjoner ved MR-undersøkelse.
- Nydiagnostiserte pasienter med primær progressiv multippel sklerose (PPMS) hvor det er holdepunkt for inflammatorisk sykdomsaktivitet i form av attakk, rask klinisk progresjon av funksjonstap eller påvist kontrastladende MR-lesjoner eller nye T2-lesjoner ved MR-undersøkelse.
- Nydiagnostiserte pasienter med sekundær progressiv multippel sklerose (SPMS) hvor det er holdepunkt for inflammatorisk sykdomsaktivitet i form av attakk, rask klinisk progresjon av funksjonstap eller påvist kontrastladende MR-lesjoner eller nye T2-lesjoner ved MR-undersøkelse.
Inflammatorisk sykdomsaktivitet er assosiert til yngre pasienter (anslagvis < 50 år) i første fase av sykdommen. Terskel for oppstart av behandling vil naturlig være lavere hos denne pasientgruppen.
Nydiagnostiserte pasienter med klinisk isolert syndrom (CIS) og typiske kliniske symptomer er også aktuelle for starte høyeffektiv sykdomsmodulerende legemiddelbehandling dersom
- annen diagnose er utelukket ved relevante tilleggsundersøkelser
- MR-undersøkelse viser spredning av lokalisasjon i sentralnervesystemet, men uten MR- eller ryggmargsvæske-holdepunkt for spredning i tid
Valg av sykdomsmodulerende legemiddelbehandling
Dette gjøres i samråd med pasienten, slik at vedkommende har tilstrekkelig grunnlag for å medvirke i beslutningene, jf. pasient og brukerrettighetsloven (lovdata.no).
Viktige forhold er:
- pasientens verdier og preferanser
- forventet nytte og risiko
- administrasjonsmåte av behandlingsalternativene
- graviditetsønske og fertilitet
- behov for raskt innsettende effekt
- andre sykdomstilstander hos pasienten
- behov for vaksinasjon
- særlige risikoforhold knyttet til de enkelte legemidlene, som eksempelvis John Cunningham virus (JCV) antistoff status ved natalizumab behandling
- beslutninger i Nye Metoder
- helseforetakenes avtaler for legemidler til behandling av MS (sykehusinnkjop.no)
Flytskjemaet nedenfor illustrerer valg av sykdomsmodulerende legemiddelbehandling. For oppfølging av sykdomsmodulerende legemiddelbehandling, se egen anbefaling om oppfølgingsplan.
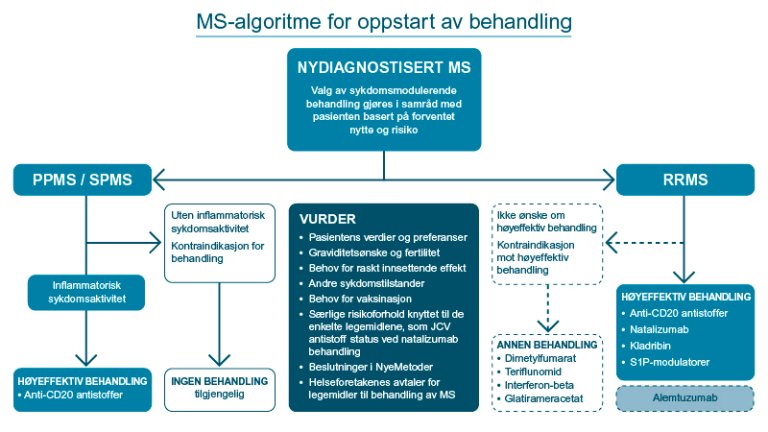
Mer informasjon om legemidlene i gruppen høyeffektive sykdomsmodulerende legemidler
Ofatumumab er innført når annet, rimeligere anti-CD20 antistoff er vurdert uegnet. Indikasjon for behandling med ofatumumab vil bli publisert i nevroNEL, men er per april 2024 spesifisert og publisert i et nyhetsbrev fra Nasjonalt kompetansesenter. Dokumenter i pasientjournalen at rimeligere alternativ er vurdert og begrunn valg av ofatumumab dersom det er aktuelt.
Klinisk erfaring, og etter hvert økende dokumentasjon, har vist at det er egenskaper ved de høyeffektive legemidlene som naturlig påvirker valg av behandling:
- S1PR-modulatorer er teratogene (se preparatomtale: ema.europa.eu), og er derfor lite aktuelle for kvinner i fertil alder.
- Natalizumab og anti-CD20 behandling har i randomiserte studier, sammenliknet mot placebo og aktiv komparator, vist raskt innsettende effekt (Barkhof et al., 2019; Hauser et al., 2017; Kappos et al., 2011; Miller et al., 2003; Polman et al., 2006) Kladribin er kun undersøkt i placebo-kontrollerte studier (Giovannoni et al., 2010; Leist et al., 2014) og data tyder på at medikamentet har noe senere innsettende effekt enn natalizumab og anti-CD20 behandling (okrelizumab)(Barkhof et al., 2019; de Stefano et al., 2022; Hauser et al., 2017; Kappos et al., 2011; Miller et al., 2003; Polman et al., 2006).
- S1PR-modulatorer har ikke dokumentert bedre effekt på sykdomsprogresjon enn interferon-beta og teriflunomid (Cohen et al., 2010; Cohen et al., 2019; Comi et al., 2019; Kappos et al., 2021) og anses derfor noe mindre potent enn anti-CD20 behandlinger som har vist dette (Hauser et al., 2020; Hauser et al., 2017; Steinman et al., 2022) . Registerdata indikerer også at S1PR-modulator (fingolimod) er noe mindre potent enn natalizumab (Spelman et al., 2022).
- Seponering eller bytte fra S1PR-modulatorer er assosiert med rebound risiko og alvorlig sykdomsforløp (Maunula, Atula, Laakso, & Tienari, 2024), noe som gjør denne gruppen mindre egnet for oppstartsbehandling hos nydiagnostiserte pasienter. Anti-CD20 behandling ser ut til mest effektivt å redusere risiko for rebound og sykdomsaktivitet etter seponering av S1PR modulatorer (Nygaard et al., 2022).
- Kladribin har kun to standard behandlingssykluser ved henholdsvis oppstart og etter ett år, og erfaring med dosering utover dette er svært begrenset (Holmøy, Torkildsen, & Myhr, 2017). Det gis ingen råd om dette i medikamentets preparatomtale (ema.europa.eu). Oppfølgingsstudier har imidlertid vist at det er en betydelig risiko for ny sykdomsaktivitet i påfølgende to år hvor 2/3 av pasientene får nye MR-T2 lesjoner og om lag 1/4 får nye attakk og/eller kontrastladende MR lesjoner (Comi et al., 2018; Giovannoni et al., 2018). Tilbakekomst av ny sykdomsaktivitet etter siste dose av kladribin, bekreftes også av italienske MS-registerdata (Patti et al., 2020).
- Andre registerdata tyder på at kladribin har noe bedre effekt enn fingolimod, men lavere effekt enn natalizumab og okrelizumab (anti-CD20 behandling) på attakkrate og sykdomsprogresjon (Roos et al, 2023). Dette bekreftes også av norske MS-registerdata som viser at kladribin har tydelig lavere effekt enn rituximab målt med tid til ny MR-lesjon og nytt attakk (Rød et al., 2024). Ny sykdomsaktivitet under og etter kladribin behandling som vises i norske registerdata (Rød et al., 2024), bekreftes av tilsvarende italienske data (Patti et al., 2020; Zanetta et al., 2023). Kladribin har også dårligere effekt enn rituximab i å hindre rebound sykdomsaktivitet etter seponering av fingolimod (Nygaard et al., 2022). Tilsvarende forskjell er vist i svenske MS-registerdata etter seponering av natalizumab (Alping et al., 2016), og økt risiko for ny sykdomsaktivitet etter skifte fra natalizumab eller fingolimod til kladribin er vist i oppfølgingsdata fra to tyske sentre (Pfeuffer et al., 2022).
- Natalizumab gir økt risiko for svært alvorlig JC-virus infeksjon hos JCV-positive pasienter (Major, Yousry, & Clifford, 2018). Denne risikoen kan reduseres ved screening for JCV før oppstart og under behandling. Som hovedregel ikke start med natalizumab behandling hos JCV-positive pasienter, og ved sero-konversjon, vurder bytte av behandling.
- Seponering eller bytte fra natalizumab er assosiert med rebound risiko og alvorlig sykdomsforløp (Barry, Erwin, Stevens, & Tornatore, 2019; Prosperini, Kinkel, Miravalle, Iaffaldano, & Fantaccini, 2019). Anti-CD20 behandling ser ut til mest effektivt å redusere risiko for rebound og sykdomsaktivitet etter seponering av natalizumab (Alping et al., 2016; Zhu et al., 2023).
- Anti-CD20 mAbs er under langtidsbehandling assosiert med hypogammablobulinemi (Alvarez, Longbrake, Rammohan, Stankiewicz, & Hersh, 2023). Monitorer derfor S-immunglobuliner og ved hypogammaglobulinemi før oppstart vurder annen behandling.
- Alemtuzumab er assosiert med høy forekomst og dels alvorlige autoimmune komplikasjon i tillegg til risiko for alvorlige kardiovaskulære komplikasjoner, samt reaktivering av kroniske virus infeksjoner Medikamentet er derfor på EMEA’s overvåkningsliste og brukes av den grunn i svært liten grad i Norge. Se informasjon fra EMA (ema.europa.eu).
Vaksinasjon og infeksjon
- S1PR-modulatorer er vist å gi manglende humoral og cellulær vaksinerespons, men med usikker påvirkning av risiko for alvorlige infeksjoner (Iannetta et al., 2021; König et al., 2022). Anti-CD20 behandling reduserer humoral- men ikke cellulær vaksinerespons, men med usikker påvirkning av risiko for alvorlig covid infeksjon (Torgauten et al., 2024).
- Sykdomsmodulerende behandling er generelt assosiert med noe økt risiko for infeksjoner, og noen studier indikerer at dette mer vanlig ved høy-effektiv behandling (Langer-Gould, Smith, Gonzales, Piehl, & Li, 2023).Det er usikkert om det er forskjell mellom de forskjellige preparatene, men infeksjonsrisikoen synes (uavhengig) av behandling å være assosiert til økende alder, pasientene funksjonsnivå og omfang av komorbiditet (Langer-Gould et al., 2023).
Se Legemiddelsøk hos Statens Legemiddelverk for preparatomtaler (SPC) for hvert enkelt legemiddel. For en samlet vurdering av hvordan disse egenskapene bør vektes i valg av behandling, vises det til NevroNel (https://nevrologi.legehandboka.no/).
Begrunnelse – dette er anbefalingen basert på
For å undersøke om det er ulik nytte av de forskjellige sykdomsmodulerende legemidlene vurderte vi effekt og sikkerhet av legemidlene i forhold til hverandre. Det viktigste forskningsgrunnlaget til dette er en systematisk oversikt med nettverksanalyse, publisert av Folkehelseinstituttet i 2019, hvor legemidlene ble sammenliknet med hverandre (Tjelle et al. 2019). Det er imidlertid kommet flere nye sykdomsmodulerende legemidler etter at denne oversikten ble publisert. Det ble derfor utført derfor et systematisk søk etter nyere oppsummert forskning. Resultatene er beskrevet nærmere i "forskningsgrunnlaget", for attakkpreget MS (Tjelle et al. 2019, Liu et al. 2021, Tong et al, 2021, Bartosik-Psujek et al., 2021) og for progressive former for MS (Samjoo et al., 2020; Autoridade Nacional do Medicamento e Produtos de & I.P, 2020; Ohm et al., 2020).
Arbeidsgruppen har bidratt med klinisk erfaring og brukererfaring som har supplert forskningsgrunnlaget i utarbeidelsen av anbefalingen. Arbeidsgruppen ga Helsedirektoratet tydelig innspill på at utfallsmål for legemidlenes effekter på funksjonsendring målt ved EDSS, risiko for funksjonstap, konversjon til sekundær progressiv MS eller attakkrate vektlegges mer enn utfallsmål for legemidlenes bivirkninger.
En samlet vurdering utgjør grunnlaget for å dele inn de sykdomsmodulerende legemidlene i to grupper: "høyeffektive" og "andre". Gruppen høyeffektive består av: monoklonale antistoffer (anti CD-20 antistoffer, natalizumab og alemtuzumab), kladribin og S1P-modulatorer. Ikke alle høyeffektive sykdomsmodulerende legemidler er tilgjengelige i den offentlige helsetjenesten, dette er tatt hensyn til i anbefalingen. Alemtuzumab er et monoklonalt antistoff med dokumentert høy effekt, men grunnet svært høy forekomst av bivirkninger og komplikasjoner vurdert å ha lavere nytte-risikoforhold. Legemiddelet er tilgjengelig, men brukes sjelden grunnet nevnte forhold. Gruppen med andre legemidler består av: dimetylfumarat, teriflunomid, interferon-beta, glatirameracetat. Definisjonen av "høyeffektiv" er i stor grad overlappende med den som brukes av Norsk MS-register og biobank Årsrapporten for 2020 (helse-bergen.no).
Beslutningsforum gjorde i 2019 beslutninger om bruk av rituksimab for RRMS.
- Rituksimab kan brukes til behandling av relapserende remitterende multippel sklerose (RRMS).
- Pasientene skal informeres om at behandling med rituksimab ved RRMS gis utenfor godkjent indikasjon, årsaken til dette og hva det innebærer.
- Behandling med rituksimab skal registreres i Norsk MS-register.
Tilsvarende vedtak ble gjort i 2020 for PPMS. Les mer på nyemetoder.no
Beslutningsforum vedtok i 2023 å innføre ofatumumab, når annet og rimeligere anti-CD20 antistoff er vurdert uegnet, til behandling av voksne med attakkpreget multippel sklerose (RRMS) med aktiv sykdom definert ved kliniske eller bildediagnostiske funn. Beslutningen bygger på forenklet metodevurdering fra Folkehelseinstituttet (Hamidi, V, 2021), prisforhandlinger med firmaet og diskusjoner i Beslutningsforum.
For å framskaffe et forskningsgrunnlag som kunne belyse om det er nyttig å starte med høyeffektiv sykdomsmodulerende legemiddelbehandling for pasienter med nydiagnostisert MS, ble det gjort et systematisk litteratursøk. Dette identifiserte imidlertid ingen relevante systematiske oversikter. Arbeidsgruppen bidro med flere relevante publikasjoner (Hillert et al., 2021; Brown et al., 2019; Buron et al., 2020; He et al., 2020; Iaffaldano et al., 2021; Sacca et al., 2019; Hanninen et al., 2021; Harding et al., 2019; Simonsen et al., 2021). Disse utgjør forskningsgrunnlaget for anbefalingen, og er hovedsakelig register- og kohortestudier. Resultatene tyder på en sannsynlig behandlingsgevinst på av å starte med høyeffektiv sykdomsmodulerende legemiddelbehandling. Det er undersøkt om risiko for funksjonstap, målt ved EDSS, konversjon til sekundær progressiv MS og attakkrate. Hvilke legemidler som defineres som høyeffektive varierer noe mellom publikasjonene.
Kunnskapsgrunnlaget for tidlig start med høyeffektiv sykdomsmodulerende legemiddelbehandling er moderat godt. Selv om resultater fra registre og kohorter vanligvis regnes å ha mindre styrke enn randomiserte kontrollerte studier i vurdering av effekt av tiltak, så antyder de tilgjengelige resultatene effekt av tidlig start av høyeffektiv sykdomsmodulerende legemiddelbehandling. Klinisk erfaring og brukererfaring støtter også tidlig start med høyeffektiv sykdomsmodulerende legemiddelbehandling. Dette fremgår også fra Norsk MS-register og biobank. Årsrapporten for 2020 (helse-bergen.no) viser at omlag 70 prosent av nydiagnostiserte pasienter med attakkpreget MS startet med høyeffektiv sykdomsmodulerende legemiddelbehandling.
Helsedirektoratet vurderer at anbefalingen sannsynligvis vil bidra til redusert ulikhet i tilbudet til pasienter med MS. Anbefalingen er akseptabel hos de viktigste interessentene som pasienter og helsepersonell. Høyeffektiv sykdomsmodulerende legemiddelbehandling kan medføre økt ressursbruk, knyttet til infusjonsbehandling som krever personell og lokaler i tillegg til legemiddelkostnader. Helsedirektoratet vurderer anbefalingen som gjennomførbar.
Forskningsgrunnlag
Populasjon (P): Personer med attakkpreget multippel sklerose (RRMS) Personer med klinisk isolert syndrom (CIS)
Tiltak (I): Høyeffektiv behandling
Sammenligning (C): Annen behandling (moderat effektiv- eller laveffektiv behandling)
Beskrivelse av inkluderte studier
Forskningsgrunnlag for start med høyeffektiv sykdomsmodulerende behandling
Først omtales kort de inkluderte studiene, deretter kommer oppsummering av resultatene for problemstillingen. "Hva er effekt av start med høyeffektiv behandling sammenlignet med annen behandling (moderat eller laveffektiv behandling) for personer med MS på funksjon (EDSS), bivirkninger, konversjon til progressiv MS og behov for legemiddelbytte?"
Hillert 2021
Forfatterne har gått sammen om å lage et nettverk med MS data (Big MS Data Network, BMSD) med data fra fem ulike registre, Danish MS Registry, Italian MS Registry, the Observatoire Français de la Sclérose en Plaques (OFSEP) registry, the MSBase Study Group og the Swedish MS Registry (Hillert et al., 2021).
I publikasjonen er det informasjon fra om lag 110 000 pasienter i perioden 1997 til 2016. Forfatterne har sett på behandlingsstopp; alle årsaker, midlertidige opphold, bytte til andre legemidler og varig seponering. Doseendring eller å legge til et ekstra legemiddel ble ikke regnet som opphold i behandling.
Brown og medarbeidere 2019
Forfatterne har undersøkt om det er en sammenheng mellom type legemiddel og timing av legemiddelstart og risiko for konversjon til sekundær progressiv MS. Det ble inkludert data fra registre i 21 land (MSBase + fem andre) (Brown et al., 2019). Deltakerne startet med legemiddelbehandling eller klinisk oppfølging i perioden 1988 til 2012, og det var krav om minst fire års oppfølgingstid. Legemidler som ble undersøkt var: interferon beta, glatirameracetat, fingolimod, natalizumab og alemtuzumab. Totalt 1555 pasienter ble matchet og inngikk i analysene.
Buron og medarbeidere 2020
Forfatterne undersøkte effekten av å starte med høyeffektive legemidler, definert som natalizumab, fingolimod, alemtuzumab, kladribin, daclizumab eller okrelizumab, sammenliknet annen behandling, definert som interferon beta, teriflunomid, dimetylfumarat eller glatirameracetat, på funksjonsforverring (EDSS) og attakkrate (Buron et al., 2020). De inkluderte behandlingsnaive pasienter fra det danske MS registeret og matchet 194 personer i hver gruppe. Personene hadde startet legemiddelbehandling i perioden 2001 til 2018. Primærutfallet var tid til 6 måneders bekreftet forverring i EDSS. Sekundærutfall var tid til første attakk.
He og medarbeidere 2020
He og medarbeidere sammenliknet funksjonsendring (EDSS) på lang sikt mellom pasienter som startet med høyeffektive legemidler i løpet av det første to årene fra diagnose med pasienter som først startet etter fire til seks år (He et al., 2020). I begge grupper kunne deltakerne ha fått annen sykdomsmodifiserende behandling før de fikk høyeffektive legemidler. De har benyttet MSBase registeret og det svenske MS-registeret som kilde. De har kategorisert rituksimab, okrelizumab, mitoksantron, alemtuzumab og natalizumab som høyeffektive legemidler.
He og medarbeidere hentet ut data til sine analyser fra registre i april 2017 for MSBase og september 2019 fra MS-registeret i Sverige. Inklusjonskriteret var minst seks sammenhengende måneder med høyeffektive legemidler og oppfølging i minst seks år fra sykdomsdebut. Totalt ble 213 personer som startet behandling innen to år matched med 253 personer som startet innen fire til seks år.
Iaffaldano og medarbeidere 2021
Iaffaldano og medarbeidere undersøkte tidlig start med høyeffektive legemidler, definert som fingolimod, natalizumab, mitoksantron, kladribin, med en eskaleringsstrategi hvor pasientene startet med glatirameracetat, interferoner, azathioprine (median tid til eskalering var 6,3 år) (Iaffaldano et al., 2021). Utfallene var endring i EDSS score opp til ti års oppfølgingstid. Forfatterne fikk matchet 363 par, fra 62 italienske MS sentra.
Sacca og medarbeidere 2019
Sacca og medarbeidere hadde som målsetting å identifisere prognostiske faktorer for behov for tidlig legemiddelbytte. De inkluderte 2954 nylig diagnostiserte pasienter fra 24 italienske MS sentra (iMUST) (Sacca et al., 2019). Årsaken til legemiddelbytte ble kategorisert som grunnet enten mangelfull effekt eller knyttet til manglende toleranse og sikkerhet.
Hanninen og medarbeidere 2021
Hanninen og medarbeidere undersøkte 6 måneders bekreftet EDSS progresjon og tid til første attakk hos finske pasienter med RRMS som startet med natalizumab, alemtuzumab, okrelizumab eller rituksimab (154 pasienter) sammenliknet med pasienter som startet med dimetylfumarat, glatirameracetat, interferon beta eller teriflunomid (1771 pasienter) (Hanninen et al., 2021). Inkluderte pasienter måtte ha startet med behandling innen tre år etter diagnose og ha minst 2,5 års oppfølgingstid. Det er gjort analyser for gruppene som helhet og for matchede pasienter.
Harding og medarbeidere 2019
Harding og medarbeidere benyttet data fra sørøst Wales (Harding et al., 2019). De undersøkte endring i EDSS score etter 5 år og bekreftet funksjonsforverring hos personer behandlet med alemtuzumab eller natalizumab sammenliknet med personer behandlet med interferon beta, glatirameracetat, dimetylfumarat, fingolimod, eller teriflunomid. Totalt startet 104 personer i den første gruppen og 488 i den andre gruppen. Personene som startet rett på høyeffektiv behandling var på gruppenivå noe yngre og hadde hatt flere årlige attakker(ARR) enn de som startet med en eskaleringsstrategi.
Simonsen og medarbeidere 2021
Simonsen og medarbeidere benyttet databasen BOT-MS (Buskerud, Oslo og Telemark) og inkluderte alle pasienter som hadde blitt behandlet med høyeffektive legemidler, definert som natalizumab, fingolimod eller alemtuzumab, eller med annen behandling, definert som interferon beta, glatirameracetat, teriflunomid eller dimetylfumarat, for mer enn 12 måneder (N=694) (Simonsen et al., 2021). Hovedutfallet var andel uten ny sykdomsaktivitet men det er også informasjon om legemiddelbytter.
Resultater
Funksjonsendring (EDSS)
He og medarbeidere utførte analyser på forskjell i EDSS score i perioden seks til ti år etter sykdomsdebut mellom matchede pasienter som startet med høyeffektiv behandling (rituksimab, okrelizumab, mitoksantron, alemtuzumab eller natalizumab) tidlig (innen 0-2 år) sammenliknet med senere (4-6 år) (He et al., 2020). Det var mulig med annen sykdomsmodifiserende behandling før start med høyeffektive legemidler og 73 % av de i sen oppstart gruppen hadde fått interferon beta eller glatirameracetat som første behandling.
Justert forskjell i gjennomsnitt EDSS score for hele perioden seks til ti år etter sykdomsdebut var -0,98 poeng (95 % KI fra -1,51 til – 0,45) i favør av tidlig start. Andel pasienter med EDSS score over seks var også konsistent høyere for de med sen oppstart sammenliknet med tidlig oppstart Måletidspunkt var seks til ti år etter sykdomsdebut.
Harding og medarbeidere analyserte 41 pasienter som startet med alemtuzumab eller natalizumab sammenliknet med 138 personer behandlet med interferon beta, glatirameracetat, dimetylfumarat, fingolimod, eller teriflunomid (Harding et al., 2019). De måtte ha tilgang til EDSS score ved baseline og etter 5 års oppfølgingstid for å bli analysert. En regresjonsmodell med justering for kovariater/forklaringsvariabler viste at gruppen som startet med høyeffektiv behandling hadde en lavere endring i EDSS score enn de som startet i eskaleringsgruppen, β = −0,85; 95% KI, −1,38 til −0,32. En sensitivitetsanalyse hvor fingolimod ble flyttet til høyeffektivgruppen endret ikke resultatene.
Iaffaldano og medarbeidere matchet 363 pasienter som startet enten fingolimod, natalizumab, mitoksantron eller kladribin med 363 pasienter som startet med glatirameracetat, interferon beta eller azathioprine (Iaffaldano et al., 2021). Det ble rapportert på forskjell mellom gruppene i endring av EDSS score fra baseline til måletidspunktet. Det var statistisk signifikant lavere endring i EDSS score for gruppen som startet med høyeffektiv behandling sammenliknet med de som inngikk i en eskaleringsstrategi ved alle årene 1 til 10 etter oppstart.
Risiko for funksjonstap
He og medarbeidere 2020 sine analyser av data fra MSBase og det svenske MS registeret viste at kumulativ risiko for sykdomsforverring var lavere i gruppen med tidligere start av høyeffektive legemidler (HR 0,34, 95 % KI 0,23–0,51) (He et al., 2020). Analysen går fra første gang pasienten fikk et sykdomsmodifiserende legemiddel. Forskjellen gjelder også for analyser fra sykdomsstart HR 0,46, 95 % KI 0,31–0,68. Høyeffektiv behandling besto av rituksimab, okrelizumab, mitoksantron, alemtuzumab og natalizumab. Tidlig start var 0-2 år etter sykdomsdebut, mens forsinket start var innen 4-6 år. I begge grupper kunne de ha fått annen sykdomsmodifiserende behandling først.
Buron og medarbeidere 2020 benyttet det danske MS registeret og fant at gruppen som fikk natalizumab, fingolimod, alemtuzumab, kladribin, daclizumab eller okrelizumab hadde lavere risiko for vedvarende EDSS forverring enn de som fikk interferon beta, teriflunomid, dimetylfumarat eller glatirameracetat, HR 0,53, 95 % KI 0,33–0,83 (Buron et al., 2020).
Hanninen og medarbeidere 2021 benyttet det finske MS registeret og fikk matchet 66 pasienter som startet med natalizumab, alemtuzumab, okrelizumab eller rituksimab med 66 pasienter som startet med dimetylfumarat, glatirameracetat, interferon beta eller teriflunomid (Hanninen et al., 2021). Pasientene hadde inntil seks års oppfølgingstid. Sannsynligheten for 6 måneders sykdomsforverring målt ved EDSS var lavere ved både 3 og 5 år for de som fikk de høyeffektive legemidlene. Totalt sett var HR 0,60, 95 % KI 0,39–0,91. En sensitivitetsanalyse hvor fingolimod ble inkludert i høyeffektiv gruppen gjorde at funnene ikke lenger var signifikant n=73; HR 0,74 95 % KI 0,49–1,11.
Harding og medarbeidere rapporterte at median tid til vedvarende sykdomsprogresjon (i EDSS) var 6 år (95% KI, 3,4-8,2) for de som startet med alemtuzumab eller natalizumab og 3.1 (95% KI, 2,6-4,0) for personer i eskaleringsgruppen som startet med interferon beta, glatirameracetat, dimetylfumarat, fingolimod, eller teriflunomid (log-rank test P =0,05) (Harding et al., 2019). Det ble ikke vist statistisk signifikant forskjell i tid til vedvarende sykdomsprogresjon, justert hazard ratio, 0,74; 95 % KI, 0,52-1,06.
Konversjon til sekundær progressiv MS
Brown og medarbeidere viste at pasienter som startet med fingolimod, alemtuzumab eller natalizumab (n = 235) hadde lavere konversjon til sekundær progressiv MS enn matchede pasienter som startet med glatirameracetat eller interferon beta (n = 380), HR var 0,66 (95 % KI, 0,44-0,99; median oppfølgingstid 5,8 år; IQR, 4,7-8,0 år) (Brown et al., 2019). Etter 5 år hadde, 7 % vs 12 %, og etter 9 år hadde 16 % vs 27 %, konvertert til sekundær progressiv MS.
Attakkrate
Hanninen og medarbeidere rapporterte at sannsynligheten for attakk ved 3 og 5 år var 27,6% (95 % KI 18,5–35,7) og 34,6 % (95 % KI 24,1–43,6) i gruppen som fikk natalizumab, alemtuzumab, okrelizumab eller rituksimab og 43,9 % (95 % KI 33,5–52,6) og 47,2% (95 % KI 36,6–56,1) hos de som startet med dimetylfumarat, glatirameracetat, interferon beta eller teriflunomid (Hanninen et al., 2021). Gjennomsnittlig antall attakker i oppfølgingsperioden på max 6 år var 0,7 (sd 1,54) i høyeffektiv gruppen og 1,4 (sd 2,5) hos de som fikk annen behandling.
Tid til nytt attakk
Buron og medarbeidere rapporterte at personer som fikk natalizumab, fingolimod, alemtuzumab, kladribin, daclizumab eller okrelizumab hadde lengre tid til første attakk sammenliknet med de som fikk interferon-beta, teriflunomid, dimetylfumarat eller glatirameracetat, HR 0,50, 95 % KI 0,37–0,67 (Buron et al., 2020).
Hanninen og medarbeidere rapporterte at pasientene som startet med natalizumab, alemtuzumab, okrelizumab eller rituksimab hadde lavere rate til første tilbakefall/attakk enn de som startet med dimetylfumarat, glatirameracetat, interferon beta eller teriflunomid, HR 0,70, 95 % KI 0,52–0,94, basert på 2x105 matchede pasienter (Hanninen et al., 2021). En sensitivitetsanalyse hvor fingolimod ble inkludert viste tilsvarende resultat, n=115; HR 0,64 95 % KI 0,52–0,94.
Behov for å bytte legemiddel
Hillert og medarbeidere definerte bytte av legemiddel dersom det ikke var mer enn seks måneder mellom avslutting av et legemiddel og start med et annet. Forfatterne har analysert for IFNβ-1a IM, IFNβ-1a SC, IFNβ-1b, glatirameracetat, IFNβ-1a uspesifisert, natalizumab, rituksimab, fingolimod, dimetylfumarat, teriflunomid, alemtuzumab og andre (Hillert et al., 2021).
I løpet av observasjonsperioden 1997 til 2016 ble 68 % av legemiddelbehandlingene stanset. Av disse byttet 87 % til et annet legemiddel innen 6 måneder. Antall stans omregnet til insidens per personår med behandling:
- Fingolimod 19,7 stopp per 100 personår, 95 % konfidensintervall (19,2 til 20,1)
- Natalizumab 22,6 stopp per 100 personår,95 % konfidensintervall (22,2 til 23. 0)
- Interferon beta 23,3 stopp per 100 personår,95 % konfidensintervall (23,2 til 23,5))
- Glatimeracetat 25,8 stopp per 100 personår,95 % konfidensintervall (25,4 til 26,2)
- Teriflunomid, alemtuzumab, rituksimab – ikke rapportert
Sacca og medarbeidere brukte data fra italienske MS sentra og fant at risiko for å bytte legemiddel på grunn av mangelfull effekt var redusert med 50 % for fingolimod, 87 % for natalizumab, 40 % for dimetylfumarat og 79 % for teriflunomid sammenliknet med interferon beta. Interferon beta og glatirameracetat hadde tilsvarende risiko for bytte (Sacca et al., 2019). Alle forskjellene var statistisk signifikante. Sammenliknet med interferon beta var risiko for bytte av legemiddel på bakgrunn av toleranse/sikkerhet følgende glatirameracetat HR 0,61 (0,46–0,81), dimetylfumarat 0,57 (0,35–0,92), fingolimod 0,35 (0,19–0,68) og natalizumab 1,43 (1,05– 1,94).
Simonsen og medarbeidere rapporterte at pasienter som startet med interferoner, glatirameracetat, teriflunomid eller dimetylfumarat hadde større sannsynlighet for å måtte bytte legemiddel enn de som startet behandling med natalizumab, fingolimod eller alemtuzumab, 65,2 vs. 29,2 %, p < 0.001 (Simonsen et al., 2021).
Alvorlige bivirkninger
Hanninen og medarbeidere rapporterte ingen dødsfall i høyeffektiv gruppen (n=154) og syv dødsfall i gruppen som fikk annen behandling (n=1771), hvorav ett var omtalt som "advanced MS" (Hanninen et al., 2021).
Harding og medarbeidere rapporterte om utvikling av autoimmune tilstander hos 47 % av de som fikk alemtuzumab og totalt 7 alvorlige uønskede hendelser (1,4 %) hos de som var i eskaleringsgruppen som startet behandling med interferoner, glatirameracetat, dimetylfumarat, fingolimod, eller teriflunomid (Harding et al., 2019).
Bivirkningsrate
Hanninen og medarbeidere rapporterte at det ikke var signifikant forskjell i uønskede hendelser mellom de som fikk høyeffektive legemidler og de som fikk andre legemidler, med henholdsvis 8,4 % og 14,2 % (Hanninen et al., 2021).
Livskvalitet
Livskvalitet var ikke rapportert for denne problemstillingen i identifisert forskning.
Nye MR-lesjoner
Nye MR-lesjoner var ikke rapportert for denne problemstillingen i identifisert forskning.
Sist faglig oppdatert: 30.04.2024
Oppfølging av pasienter med multippel sklerose
Pasienter med multippel sklerose bør følges opp etter en avtalt oppfølgingsplan
Oppfølgingsplanen bør tilpasses den enkelte pasientens behandling, sykdomsfase og behov.
- Ved oppstart eller skifte av sykdomsmodulerende behandling er oppfølging av bivirkninger i de første tre til seks månedene særlig viktig. Oppfølgingen tilpasses behandlingsvalget og kan gjøres gjennom avtaler om lavterskeltilbud for kontakt med MS-sykepleier.
- De første årene med ny behandling anbefales halvårlige kontroller hos behandlende nevrolog eller alternerende hos MS-sykepleier og nevrolog.
- Anbefalingen gjelder også pasienter som ikke bruker sykdomsmodulerende behandling, se "praktisk" for nærmere beskrivelse.
- Etter lengre tid (tre-fem år) med stabil sykdom, kan kontrollintervallene utvides basert på individuell vurdering.
- Kontrollene bør registreres i Norsk MS-register og biobank, se egen anbefaling.
- Utover avtalte kontroller, bør det legges til rette slik at det er enkelt for pasientene å ta kontakt med nevrologisk poliklinikk ved behov.
Praktisk – slik kan anbefalingen følges
- Tilstreb kontinuitet i oppfølgingen, slik at samme MS-sykepleier og nevrolog følger pasienten over lengre tid. Et alternativ er å etablere et koordinert MS-team som gir samme informasjon og oppfølging.
- Legg vekt på pasientens behov. Informasjon gis slik at vedkommende har tilstrekkelig grunnlag for å medvirke i beslutningene, jf. pasient og brukerrettighetsloven (lovdata.no)
- Vurder om enkelte av kontrollene egner seg for gjennomføring via telefon- eller videokonsultasjon.
Innhold i oppfølgende kontroller
- Klinisk vurdering av effekt (attakker og sykdomsprogresjon)
- Årlig skåring med Expanded Disability Status Scale (EDSS)
- Kartlegging av eventuelle bivirkninger
- Blodprøvekontroller (spesifikt for hvert legemiddel)
- Vurdering av behov for MR-undersøkelse
- Re-baseline MR undersøkelse etter 3-6 måneder ved oppstart av behandling
- Årlig i den første perioden opptil 5 år etter oppstart av sykdomsmodulerende legemiddelbehandling eller skifte av behandling
- Ved stabil sykdom kan intervallene økes basert på individuelle vurderinger (Wattjes et al., 2021)
- Vurdering av behov for symptombehandling og eventuelt henvisning for dette
- Vurdering av behov for tverrfaglig oppfølging og rehabilitering
- Vurdering av behov for fornying av førerkort, se veileder til førerkortforskriften
Oppfølging av pasienter som ikke starter sykdomsmodulerende behandling
Som hovedregel starter pasienter med inflammatorisk sykdomsaktivitet med sykdomsmodulerende legemiddelbehandling. I særlige tilfeller hvor dette ikke gjennomføres, er systematisk oppfølging viktig. Pasienter med RRMS, SPMS, PPMS eller CIS som ikke starter sykdomsmodulerende behandling, følges opp med ny klinisk- og MR-undersøkelse i spesialisthelsetjenesten etter 6 og 12 måneder, og deretter årlig i opptil 5 år. Ved klinisk eller MR-holdepunkt for sykdomsaktivitet vurderes oppstart med sykdomsmodulerende behandling som for pasienter med nydiagnostisert MS. Etter 5 år kan videre kontrollintervaller forlenges etter individuell vurdering for pasienter med RRMS, SPMS og PPMS. For pasienter med CIS kan videre oppfølging skje ved at fastlege eventuelt henviser til ny vurdering ved kliniske tegn til nevrologiske symptomer.
Skifte av sykdomsmodulerende legemiddelbehandling
Skifte av sykdomsmodulerende legemiddelbehandling kan medføre økt risiko for sykdomsaktivitet. Skifte av behandling planlegges derfor godt, slik at perioden fra seponering av pågående behandling til oppstart av ny behandling blir så kort som mulig. For pasienter som har god sykdomskontroll under annen behandling, anbefaler en som hovedregel å ikke skifte til høyeffektiv behandling. Ved skifte fra legemidler som gir risiko for rebound effekt (S1P-modulatorer og Natalizumab) velges høyeffektive legemidler med rask innsettende effekt (monoklonale antistoffer, som anti-CD20 antistoffer, eller eventuelt natalizumab).
Skifte av behandling grunnet bivirkninger
Sykdomsmodulerende legemiddelbehandling som gir plagsomme eller alvorlige bivirkninger, erstattes med et høyeffektivt legemiddel med forventet gunstigere bivirkningsrisikoprofil.
Skifte av behandling grunnet ny sykdomsaktivitet
Pasienter som mottar annen sykdomsmodulerende legemiddelbehandling og som opplever ny sykdomsaktivitet, bytter til høyeffektiv sykdomsmodulerende legemiddelbehandling.
For pasienter som allerede mottar høyeffektiv sykdomsmodulerende legemiddelbehandling og som opplever ny sykdomsaktivitet, er terskelen for skifte høyere på grunn av færre andre behandlingsalternativer. Ved skifte byttes det til annen høyeffektiv behandling som forventes å gi bedre sykdomskontroll.
Ved skifte av sykdomsmodulerende legemiddelbehandling gjøres en re-baseline MR undersøkelse etter 3-6 måneder.
Ved betydelig sykdomsaktivitet vurderes utprøvende behandling, se eget avsnitt nedenfor.
Avslutning av sykdomsmodulerende behandling
Vurder avslutning av sykdomsmodulerende behandling ved:
- langvarig progressiv sykdom med betydelig funksjonssvikt over flere år uten tegn til inflammatorisk sykdomsaktivitet målt ved kliniske attakker eller påvisning av kontrastladende lesjoner eller nye T2-lesjoner ved MR-undersøkelse
- betydelige bivirkninger der skifte av legemiddel ikke er mulig
En randomisert studie av pasienter med RRMS med gjennomsnittsalder 52 år ble stoppet av forskningsetisk komite i Nederland på grunn av høy forekomst av attakk eller MR-aktivitet i gruppen som seponerte behandlingen (26,7% mot 2,3% av de som kontinuerte behandlingen)(Coerver et al., 2023). Behandlingsavslutning kan vurderes hos eldre stabile pasienter, men det er ikke etablert generell aldersgrense – se avsnitt om problemstillinger med kunnskapsmangler.
Ved tilsynelatende langsom sekundær progresjon uten kliniske attakker etter langvarig sykdomsmodulering, er hovedregelen at behandlingen ikke seponeres. Dette gjelder særlig hos yngre pasienter (<50 år), som gjennomgående har større risiko for attakker enn eldre pasienter. Med økende alder avtar risikoen for inflammatorisk sykdomsaktivitet. Derved avtar også nytten av behandlingen, mens risikoen for komplikasjoner knyttet til langvarig immunsuppresjon øker, særlig hos pasienter med høy invaliditet og eventuelt komorbiditet. Behovet for vedvarende behandling med anti-CD20 antistoffer hos slike pasienter vurderes nøye. Seponering av natalizumab og S1P-modulatorer er forbundet med betydelig fare for kraftige attakker både hos eldre og yngre pasienter, spesielt dersom pasienten hadde stor sykdomsaktivitet før oppstart av behandlingen.
Ved enhver seponering av immunmodulerende behandling, og særlig av natalizumab og S1P-modulaotrer, kreves stor varsomhet og tett oppfølging med klinisk vurdering supplert med MR-undersøkelser for å avdekke eventuell reaktivering av inflammatorisk sykdom med nye attakker eller ny MR-aktivitet. Det er holdepunkter for at behandling med et anti-CD20 i en overgangsperiode etter avslutning av natalizumab og S1P-modulatorer reduserer risikoen for ny sykdomsaktivitet (rebound) (Alping et al., 2016; Nygaard et al., 2022; Zhu et al., 2023). Slik overgangsbehandling vil særlig være aktuelt hos pasienter som hadde uttalt inflammatorisk sykdomsaktivitet før oppstart med natalizumab eller S1P-modulator, og som av den grunn har stor risiko for reaktivering av inflammatorisk sykdomsaktivitet.
Problemstillinger med kunnskapsmangler
Risikoen for attakker og ny MR-aktivitet avtar med alderen, og derved også den potensielle nytten av behandlingen. Det er imidlertid ikke etablert noen aldersgrense for når behandlingen eventuelt bør avsluttes. En studie av overveiende yngre pasienter (gjennomsnittsalder 45 år) som seponerte ikke-høyeffektiv behandling etter minst 5 år stabil sykdom uten nye attakk eller nye MR-lesjoner, rapporterte om attakker eller MR-aktivitet hos 53% av pasientene som var yngre enn 45 år og 7,7% av pasientene eldre enn 55 år (Coerver et al., 2023).
I en randomisert kontrollert studie av klinisk stabile eldre pasienter >55 år (gjennomsnitt 62 år) som hovedsakelig brukte ikke-høyeffektiv behandling, fikk 16 av 132 (12,2%) pasienter som avsluttet behandlingen attakk eller MR aktivitet, mot 6 av 128 (4,7%) pasienter som fortsatte behandlingen (Corboy et al., 2023). Det var ikke forskjell i andelen som fikk EDSS-forverring.
Det pågår en diskusjon om hvor lenge en kan bruke anti-CDSe unntaksordning for enkeltpasienter i Nye metoder.20 antistoffer uten uheldige langtidsbivirkninger. Dette kan se ut til å variere i forhold til alder og funksjonsnivå hos pasientene. Foreløpige data indikerer at det er økt risiko for infeksjoner over tid, men samtidig er det vist at denne risikoen er lav. Det pågår studier som undersøker om forlengelse av doseintervaller bevarer effekten og gir lavere forekomst av bivirkninger og infeksjoner.
Vi har også begrenset kunnskap om hva som kan defineres som «eldre» pasienter med lavere behov for høyeffektive legemidler og eventuell høyere risiko for komplikasjoner ved bruk av disse.
Stamcellebehandling
Autolog stamcelletransplantasjon er til vurdering i Nye Metoder, og regnes som utprøvende behandling (se nedenfor) i Norge. Metoden ble meldt inn for vurdering i Nye metoder i 2014, og Nasjonalt kunnskapssenter for helsetjenesten utarbeidet en fullstendig metodevurdering (Giske et al., 2015). Beslutningsforum vedtok i 2016 at "Alle pasienter som får tilbud i Norge om autolog stamcelletransplantasjon ved multippel sklerose skal være omfattet av et vitenskapelig studium".
Studien RAM-MS gjennomføres i regi av Haukeland universitetssjukehus, med rekruttering fra hele Norge. Studien rekrutterer fortsatt og vil sannsynligvis være fullinkludert i løpet av våren 2024. Inklusjonskriteriene er attakkvis MS og MR-bekreftet attakk under pågående MS-behandling. Det er videre krav om alder mellom 18-50 år og EDSS mellom 0 og 5,5.
For pasienter som ikke oppfyller kriteriene for inklusjon i studien, kan det på individuelt grunnlag vurderes om autolog stamcelletransplantasjon likevel kan være aktuelt. Se unntaksordning for enkeltpasienter i Nye metoder.
I 2021 ble stamcellebehandling igjen tatt opp i Nye metoder. FHI utarbeidet da en kartleggingsundersøkelse over ny dokumentasjon. Konklusjonen i Bestillerforum ble at det ikke hadde tilkommet store og gode observasjonsstudier, og saken gikk ikke videre til Beslutningsforum.
Mer informasjon
Om utprøvende behandling: For pasienter hvor en ikke oppnår sykdomskontroll med etablert behandling, kan man vurdere utprøvende behandling. Både legemidler og autolog stamcelle-transplantasjon kan være aktuelle metoder for utprøvende behandling. Les mer:
- Veileder om nasjonale prinsipper for utprøvende behandling.
- Oversikt over kliniske studier Kliniske studier (helsenorge.no)
Om diagnostisk utredning, behandling og pasientinformasjon:
Begrunnelse – dette er anbefalingen basert på
Tall fra MS-registeret tyder på at tilbudet om oppfølgingskontroller varierer (Aarseth et al 2021). MS-registeret inneholder tre kvalitetsindikatorer som registreres på pasientenes polikliniske kontroller. Sykdomsaktivitet og funksjon ved MS evalueres ved:
- Andel MS-pasienter med oppdatert attakkstatus siste år
- Andel MS-pasienter med regelmessig MR undersøkelse
- Andel MS-pasienter med oppdatert funksjonsskår siste år
Tallene er imidlertid preget av lav dekningsgrad, lav måloppnåelse og stor spredning. Klinisk erfaring og brukererfaringer tilsier også at det er uønsket variasjon i tilbudet.
I tidligere utgave av retningslinjen var teksten om oppfølging en del av "praktisk informasjon" i anbefalingen om sykdomsmodulerende legemiddelbehandling. I arbeidet med denne utgaven ble det identifisert et behov for en egen anbefaling om oppfølging, slik at pasienter med multippel sklerose (MS) følges opp etter en avtalt oppfølgingsplan tilpasset sykdomsfase og behandling, og at dette er mest mulig likt ved alle nevrologiske avdelinger.
Anbefalingen er hovedsakelig basert på klinisk erfaring og praksis, samt brukererfaring. Den støtter seg også på anbefalinger fra European Medicines Agency (EMA) for oppfølging av de enkelte legemidlene for sykdomsmodulerende behandling og på internasjonal konsensus (Hobart et al., 2019). Det er ikke søkt etter litteratur for denne anbefalingen, og det er derfor knyttet usikkerhet til dokumentasjonen for anbefalingen. Punktet om forlengelse av intervall mellom MR-kontroller er basert på en klinisk retningslinje gitt ut av Magnetic Resonance Imaging in MS (MAGNIMS), Consortium of MS Centers (CMSC), and North American Imaging in MS Cooperative (NAIMS) (Wattjes et al., 2021).
Detaljert innhold i en oppfølgingsplan tilpasses den enkelte pasient, og oppgavene kan fordeles mellom lege og sykepleier. Omfanget av tiltakene i anbefalingen er ikke endret fra forrige utgave av retningslinjen, så den bør ikke samlet medføre økt ressursbruk. Systematisk bruk av oppfølgingsplan kan bidra til økt liket i tilbudet til pasienter med multippel sklerose.
Sist faglig oppdatert: 30.04.2024
MS-register og biobank
Nevrolog eller MS-sykepleier skal sikre at alle pasienter med multippel sklerose får informasjon og forespørres om samtykke til registrering i Norsk MS-register og biobank.
Inklusjon i registeret er basert på informert samtykke som innhentes av den avdeling/praksis som behandler pasienten. Pasienter kan oppleve det som en ekstra trygghetsramme å bli inkludert i systematisk oppfølging via MS-registeret, allerede fra diagnosetidspunktet. Dersom informasjon om Norsk MS-register og biobank og innhenting av samtykke er utfordrende på diagnosetidspunktet, kan dette gjøres ved oppfølgende konsultasjoner.
Data kan legges inn i registerets nettbaserte registreringsløsning med en gang diagnosen er stilt, og samtykke kan innhentes ved diagnose eller på et senere tidspunkt. Data innsamlet uten samtykke kan benyttes til lokalt kvalitetsforbedringsarbeid ved aktuelle avdeling, men dataene eksporteres til Norsk MS-register og biobank (helse-bergen.no) sentralt først når samtykke er innhentet. Det er derfor viktig å ha gode rutiner for innhenting av samtykke.
Praktisk – slik kan anbefalingen følges
Les mer om Norsk MS-register og biobank (helse-bergen.no)
Avdeling/praksis
- Påse at samtykke innhentes og at data fra debut og diagnose, samt påfølgende kontroller registreres.
Helsepersonell
- Gis tilgang til MS-registerets registerløsning etter søknad.
- All registrering skjer via Norsk Helsenett (mrs.nhn.no)
- Registrerer demografiske og kliniske data om debut, diagnose, behandling og sykdomsutvikling.
- Nye Metoder har gjort et unntak på gruppenivå (nyemetoder.no) for off-label behandling med rituksimab med krav om registrering i Norsk MS-register. Det er derfor særlig viktig med registrering av denne behandlingen i Norsk MS-register og biobank. Generelt skal MS-registeret benyttes til å registrere data om behandlinger gitt ved lignende unntak.
Pasienter
- Kan bidra til forskning og kvalitetsarbeid med sine data.
- Har tilgang til egne data via innsynsmodul på Helsenorge.no Disse dataene er strukturert og vises i en grafisk fremstilling for enkel oversikt. Pasientene kan da se den samme oversikten som sin behandler. Se se-egne-data (helse-bergen.no)
- Registrer Pasientrapporterte data via Helsenorge.no
- Kan rekrutteres til deltagelse i studier gjennom MS-registeret.
Nasjonale kvalitetsindikatorer
- Nasjonal og lokal måloppnåelse er tilgjengelig via Nasjonalt servicemiljø for medisinske kvalitetsregistre (kvalitetsregistre.no) og gjennom MS-registerets årsrapport. Lokale årsrapporter med resultat for hvert enkelt helseforetak sendes til behandlere og ledere ved de ulike helseforetakene.
- Nasjonale kvalitetsindikatorer for MS-feltet er (første halvår 2022) under utarbeidelse av Helsedirektoratet og Norsk MS-register og biobank, og planlegges innført i løpet av 2022.
Biobank
En biobank er etablert og lokalisert ved Nasjonalt folkehelseinstitutt i Oslo for DNA og serum.
Begrunnelse – dette er anbefalingen basert på
Norsk MS-register og biobank (helse-bergen.no) er et nasjonalt medisinsk kvalitetsregister, basert på skriftlig informert samtykke fra deltakende pasienter. Alle helseforetak og privatpraktiserende spesialister med avtale er pliktig til å registrere til nasjonale medisinske kvalitetsregistre, jf. forskrift om medisinske kvalitetsregistre §2-3 (lovdata.no).
Nytten av et helseregister avhenger blant annet av dekningsgraden og kvaliteten på dataene. Andelen av alle MS-pasienter i Norge som er registrert i registeret øker, og alle helseforetak har nå registrert minst 60 prosent av sine pasienter i registeret. (Aarseth, Smedal, Skår, & Wergeland, 2021 (helse-bergen.no). Hensikten med anbefalingen er å bidra til å øke dekningsgraden og bedre kvalitet på data som registreres. Gjennom dette kan etterlevelse av retningslinjen også evalueres.
Kvalitetssikring av diagnostiseringspraksis og behandling gir trygghet og verdsettes av pasienter, pårørende og helsepersonell. Norsk MS-register har hovedfokus på diagnostikk og behandling. Systematisk bruk av MS-registeret bidrar til:
- harmonisering av MS-diagnostikk og behandling
- redusert uønsket variasjon helsetjenestetilbudet til MS-pasienter
- kvalitetssikring av MS-diagnostikk og behandling
- at avdelinger og helseforetakene får oversikt over "sine" pasientpopulasjoner
- grunnlag for forskning
- økte muligheter for å delta i kliniske studier
- at pasienter får innsyn i egne data og visualisering av sykdomsutvikling og behandling
- mer tilfredse pasienter
Sist faglig oppdatert: 14.09.2022
Metode og prosess
Sist faglig oppdatert: 30.04.2024
Mål med retningslinjen
Retningslinjen skal bidra til mindre uønsket variasjon i tjenestene (se MS-registerets årsrapporter (kvalitetsregistre.no)). Målet er at personer med symptomer på MS raskt kommer til utredning og diagnostikk, og at det er lik tilgang til oppstart med høyeffektiv behandling. Helsedirektoratet har ansvar for alt innhold i retningslinjen.
Relaterte normerende publikasjoner fra Helsedirektoratet
Bakgrunn
Nasjonal faglig retningslinje for multippel sklerose ble publisert første gang i 2011 og revidert i 2017.Revisjonen (2021/2022) er gjort fordi fagmiljøet og brukerne meldte behov for en faglig oppdatert retningslinje.
Forvaltning
Fra 2023 er det etablert en forvaltningsprosess. Deltagerne er de samme som i revisjonsprosjektet (se nedenfor), bortsett fra at Jan Anders Istad erstatter Gudrun Østhassel som representant for MS-forbundet. Ambisjonen er en årlig gjennomgang av retningslinjen, med mulighet for ad hoc oppdateringer dersom det skjer noe av særlig betydning. Når det oppstår behov for større revisjoner, vil denne gruppen trolig avsluttes og ny prosjektgruppe etableres. På litt sikt kan det også tenkes at det ikke blir behov for denne retningslinjen lenger, fordi ny praksis er godt etablert uten særlig variasjon.
Endringer
April 2024:
- Retningslinjen er gjennomgått og det er gjort justeringer i anbefaling om høyeffektiv behandling (2.2) og oppfølging (3)
April 2023:
Anbefaling om høyeffektiv sykdomsmodulerende legemiddelbehandling i kapittel 2 er oppdatert i henhold til vedtak i Nye Metoder om å innføre Ofatumumab.
Revisjonen 2022 :
- Anbefalinger om forløp for henvisning og diagnostikk. Disse to anbefalingene erstatter den tidligere anbefalingen om henvisning.
- Anbefaling om tidlig oppstart med sykdomsmodulerende legemiddelbehandling, og anbefaling om oppstart med høyeffektiv sykdomsmodulerende legemiddelbehandling. Disse to anbefalingene erstatter den tidligere anbefalingen om sykdomsmodulerende legemiddelbehandling.
- Anbefaling om oppfølgingsplan
I tillegg er:
- Anbefalingen om Norsk MS-register og biobank oppdatert.
- Oversikten over beslutninger i Nye metoder for bruk av sykdomsmodulerende legemidler videreført på MS-temaside i Helsedirektoratet.
- Innhold som ikke er knyttet til anbefalinger avpublisert. Det medfører at mye tekst er avpublisert. Anbefalingene er kortfattede og strukturerte.
- Anbefalingen om attakkbehandling er avpublisert, det vises til Nevrologikapittel i Norsk Elektronisk Legehåndbok (nevrologi.legehandboka.no), redigert av Norsk nevrologisk forening
- Kapittelet om familieplanlegging, graviditet og amming er avpublisert, det vises til Nevrologikapittel i Norsk Elektronisk Legehåndbok (nevrologi.legehandboka.no), redigert av Norsk nevrologisk forening
- Anbefalingen om utprøvende behandling avpublisert, det vises til Veileder for utprøvende behandling.
Målgruppe
Målgruppen for retningslinjen er primært helsepersonell som arbeider med diagnostikk og behandling av MS, samt relevante beslutningstakere i spesialisthelsetjenesten. Anbefalingen om henvisning ved symptomer retter seg mot leger i primærhelsetjenesten. Retningslinjen gir også nyttig informasjon for helsepersonell i primærhelsetjenesten, brukere og pårørende.
Avgrensninger
Retningslinjen gir anbefalinger for henvisning, diagnostikk og sykdomsmodulerende legemiddelbehandling av MS hos voksne, oppfølging av pasienter med MS og rapportering til Norsk MS-register og -biobank.
Retningslinjen omfatter ikke:
- anbefalinger til barn
- familieplanlegging, graviditet og amming
- behandling av symptomer
- attakkbehandling
- sykdomslære
Gradering av styrken på anbefalinger
Retningslinjen består av anbefalinger som er merket sterke eller svake.
- Sterk anbefaling: Pasienter og helse- og omsorgspersonell vil i de fleste situasjoner mene at det er riktig å etterleve anbefalingen. Ved sterke anbefalinger for et tiltak (intervensjon) brukes begrepene "bør" og "det anbefales".
Dersom begrepene "må" eller "skal" brukes, er anbefalingen forankret i lov eller forskrift eller hvis det i de fleste situasjoner vil være faglig uforsvarlig å gjøre noe annet enn anbefalt. - Svak anbefaling: Ulike valg kan være riktig for ulike pasienter, og helse- og omsorgspersonell må hjelpe til med å vurdere hva som er riktig i den enkelte situasjon. Ved svake anbefalinger for et tiltak brukes begrepene «kan» og «det foreslås».
Anbefalingenes rettslige betydning
Helsedirektoratet skal utvikle, formidle og vedlikeholde nasjonale faglige retningslinjer og veiledere som understøtter målene for helse- og omsorgstjenesten.
Retningslinjer og veiledere skal baseres på kunnskap om god praksis og skal bidra til kontinuerlig forbedring av virksomhet og tjenester, jf. spesialisthelsetjenesteloven § 7-3 (lovdata.no) og helse- og omsorgstjenesteloven § 12-5 (lovdata.no).
Nasjonale faglige retningslinjer inngår som et akseptert grunnlag og setter en norm for hva som er faglig forsvarlig. Anbefalinger gitt i nasjonale faglige retningslinjer er ikke rettslig bindende, men er faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet. I situasjoner der helsepersonell velger løsninger som i vesentlig grad avviker fra gitte anbefalinger skal dette dokumenteres, jf. journalforskriften § 6, bokstav g (lovdata.no). En bør være forberedt på å begrunne sine valg i eventuelle klagesaker eller ved tilsyn.
Kunnskapsbasert tilnærming
Innholdet i en retningslinje skal baseres på et oppdatert, tydelig fremstilt, systematisk gjennomarbeidet og dokumentert kunnskapsgrunnlag (Helsedirektoratet, 2012). En kunnskapsbasert tilnærming innebærer at forskningslitteratur, klinisk erfaring og brukererfaring på en systematisk måte vurderes opp mot ønskede og uønskede konsekvenser av et tiltak. På områder der det er funnet mindre forskningsbasert kunnskap og/eller overføringsverdien fra internasjonal til norsk helsetjeneste er lav, blir klinisk kunnskap og brukerkunnskap tillagt større vekt.
Den forskningsbaserte kunnskapen er basert på systematiske oversiktsartikler identifisert ved hjelp av et systematisk litteratur søk supplert med primærstudier identifisert etter innspill fra deltakere i prosjektet, se dokumentasjonsark for oversikt. Det samme søket er brukt for å identifisere litteratur, men sortert og vurdert i henhold til de ulike problemsstillingene (CIS, RRMS, SPMS og PPMS). Ved hver anbefaling beskriver vi hvilken forskningsdokumentasjon den bygger på, og hvilke vurderinger som er gjort.
For å gå fra kunnskapsgrunnlag til anbefaling har det har vært benyttet en standardisert arbeidsmetode for å ha strukturerte diskusjoner om ulike perspektiver av for utforming av anbefalingene, DECIDE (decide-collaboration.eu). Metoden brukes for å utforme anbefalinger etter at forskningsgrunnlaget er kjent, og sikrer at brukerrepresentanter og klinikere går gjennom relevante forhold slik som verdier, ønskede og uønskede effekter, ressursbruk, likhet, akseptabilitet og gjennomførbarhet knyttet til det aktuelle spørsmålet.
Arbeidsform
Prosjekt 2021/2022
Revisjonen 2021/2022 ble gjort i et prosjekt i samarbeid med helsetjenesten og brukerrepresentanter. Helsedirektoratet har ledet arbeidet, medisinskfaglig leder har vært Kjell-Morten Myhr fra Universitetet i Bergen og Helse Bergen HF. Det har i prosessen blitt avholdt ni digitale og ett fysisk møte.
| Navn | Stilling | Virksomhet |
|---|---|---|
Børge M. Larsen | seniorrådgiver | Helsedirektoratet |
Hege Wang | seniorrådgiver | Helsedirektoratet |
Tove Ringerike | seniorrådgiver | Helsedirektoratet |
Kjersti Skjold Rønningen | seniorrådgiver | Helsedirektoratet |
Kjell-Morten Myhr | professor, overlege nevrologi | Universitetet i Bergen og Helse Bergen HF |
Trygve Holmøy | professor, seksjonsoverlege nevrologi AHUS | Helse Sør-Øst RHF |
Åslaug Rudjord Lorentzen | overlege nevrologisk avdeling Sørlandet sykehus | Helse Sør-Øst RHF |
Øivind Torkildsen | professor, overlege | Helse Vest RHF |
Linn Hofsøy Steffensen | Førsteamanuensis, overlege overlege nevrologisk avdeling UNN | Helse Nord RHF |
Katrine Krokenes Lian | overlege nevrologi UNN | Helse Midt-Norge RHF |
Gudrun Østhassel | kommunikasjonsleder MS-forbundet | MS-forbundet |
Lise Johnsen | leder styret i MS-forbundet | MS-forbundet |
Habilitet
Eksterne deltagerne har fylt ut skjema for kartlegging av interessekonflikter. Disse er vurdert og Helsedirektoratet har ikke funnet grunn til å trekke deltagernes habilitet i tvil i forbindelse med arbeidet. Habilitet har også vært eget punkt på dagsorden for hvert arbeidsgruppemøte. Ingen problematiske forhold ble avdekket.









