Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av nevroendokrine svulster i fordøyelsessystemet
Forord
Sist faglig oppdatert: 20.10.2020
Nasjonale handlingsprogrammer for kreftbehandling skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet. Målgrupper for retningslinjene er leger og legespesialister innen medisin, kirurgi, onkologi, radiologi, patologi og fastleger. De vil også være av interesse for andre faggrupper som er involvert i behandling av pasientgruppen og pasienter og pårørende.
Nasjonale retningslinjer fra Helsedirektoratet er å betrakte som anbefalinger og råd, basert på oppdatert faglig kunnskap som er fremskaffet på en systematisk, kunnskapsbasert måte. De nasjonale retningslinjene gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet, og er ment som et hjelpemiddel ved de avveininger tjenesteyterne må gjøre for å oppnå forsvarlighet og god kvalitet i tjenesten. Nasjonale retningslinjer er ikke direkte rettslig bindende for mottagerne, men bør langt på vei være styrende for de valg som skal tas. Ved å følge oppdaterte nasjonale retningslinjer vil fagpersonell bidra til å oppfylle kravet om faglig forsvarlighet. Dersom en velger løsninger som i vesentlig grad avviker fra de nasjonale retningslinjene, skal en dokumentere dette og være forberedt på å begrunne sine valg. Sykehusenes eiere og ledelse bør tilrettelegge virksomheten slik at de nasjonale retningslinjene kan følges.
Helsedirektoratet takker arbeidsgruppen for stor innsats i utarbeidelsen av de nasjonale retningslinjene. Vi håper retningslinjene vil være et nyttig arbeidsredskap ved behandling av pasienter med nevroendokrine svulster i fordøyelsessystemet.
Innholdet i de nasjonale retningslinjene vil vurderes årlig, og om nødvendig oppdateres. Disse nasjonale retningslinjene for diagnostikk, behandling og oppfølging av pasienter med nevroendokrine svulster i fordøyelsessystemet er publisert 15.10.2020.
Bjørn Guldvog
helsedirektør
Forkortelser
Sist faglig oppdatert: 20.10.2020
| 5-FU | 5-fluorouracil |
| 5-HIAA | 5-hydroksyindoleddiksyre |
| ATCH | Adrenokortikotropt hormon |
| BSC | Beste symptomlindrende behandling |
| CgA | Kromogranin A |
| CT | Computer tomografi |
| EC | Enterokromaffin |
| ECL | Enterokromaffin lignende |
| ENETS | «European Neuroendocrine Tumor Society» |
| EMR | Endoskopisk mukosal reseksjon |
| ESD | Endoskopisk submukosal disseksjon |
| EUS | Endoskopisk ultralyd |
| FDG | Druesukkerforbindelse (fluor-18-merket deoksyglukose/18F-FDG). |
| FNA | Finnålsaspirasjon |
| G-NET | Nevroendokrin tumor i magesekk |
| GEP | Gastroenteropankreatisk |
| GFR | Glomerulær filtrasjons rate |
| GI | Gastrointestinal |
| HPF | Største forstørrelse |
| IFN | Interferon |
| IHC | Immunohistokjemi |
| ISL2 | ISL LIM homeobox 2 (gen) |
| KI-67 | Proliferasjons markør |
| MDT | Multidisiplinært team |
| MEN | Multippel endokrine neoplasi |
| MR | Magnet resonans tomografi |
| mTOR | En proteinkinase essensiell for cellesyklusprogresjon |
| MW | Mikrobølge-ablasjon |
| NE | Nevroendokrine |
| NEC | Nevroendokrint karsinom |
| NEN | Nevroendokrin neoplasi |
| NET | Nevroendokrin tumor |
| NET G1 | Nevroendokrin tumor grad 1 |
| NET G2 | Nevroendokrin tumor grad 2 |
| NET G3 | Nevroendokrin tumor grad 3 |
| NNTG | Norsk nevroendokrin tumorgruppe |
| NSE | Neuron spesifikk enolase |
| P | Plasma |
| P-NET | Nevroendokrin tumor i pankreas |
| PET | Positron emisjons tomografi |
| PFS | Progresjonsfri overlevelse |
| PP | Pankreatisk polypeptid |
| PPI | Protonpumpe hemmer |
| PRRT | Peptid reseptor radionukleide terapi |
| RECIST | «Response evaluation criteria in solid tumors» |
| RE | Radioembolisering |
| RF | Radiofrekvens ablasjon |
| RR | Responsrate |
| S | Serum |
| SI-NET | Nevroendokrintumor i tynntarm |
| SPECT | Single Photon Emission Computed Tomography |
| SSA | Somatostatin analog |
| SSTR | Somatostatin reseptor |
| STZ | Streptozocin |
| TACE | Transarteriell kjemoembolisering |
| TAE | Transarteriell embolisering |
| TEM | Transanal endoskopisk mikrokirurgi |
| TNM | Klassifikasjonssystem for maligne svulster |
| U | Urin |
| UICC | «Union for International Cancer Control» |
| UL | Ultralyd (US) |
| VHL | Von Hippel Lindaus syndrom |
| VIP | Vasoaktivt intestinalt peptid |
| WHO | Verdens helse organisasjon |
| Z-E | Zollinger-Ellison syndrom |
Sammendrag av retningslinjene
Sist faglig oppdatert: 20.10.2020
|
| Evidensgrad |
| Genetikk og arvelige syndromer |
|
| • Arvelig årsak må mistenkes og utredes i samarbeid med genetiker hos pasienter med pankreas-NET i ung alder, ved familiær opphopning av NET, samt ved hormonforstyrrelser som ved MEN1. | C |
| Blodprøver og biomarkører |
|
| • Måling av S-CgA bør gjøres som ledd i primærdiagnostikk av NET. | C |
| • Hormonanalyser anbefales som ledd i primærdiagnostikk ved mistanke om symptomer som kan være forårsaket av hormonoverproduksjon. | C |
| • Måling av 5-HIAA i urin bør gjøres som ledd i primærdiagnostikk ved tynntarms NET eller ved ukjent primærtumor. | C |
| Radiologiske undersøkelser |
|
| • Ved primærutredning anbefales dedikert CT eller MR av thorax/abdomen/bekken. | C |
| • Ved oppfølging og kontroller anbefales dedikert CT abdomen, alternativt MR av yngre (under 50 år) pasienter ved forventet lang oppfølgingstid. | C |
| • Ved saktevoksende svulster må lesjonenes størrelse sammenlignes over en lengre periode. | D |
| Nukleærmedisinske undersøkelser |
|
| • 68Ga-DOTATOC PET skal utføres når det foreligger mistanke om NET ut fra CT eller MR funn, og ved utredning med tanke på PRRT-behandling. | B |
| • 68G-DOTATOC PET anbefales ikke som en del av den rutinemessige oppfølgingen ved NET. | D |
| • 18F-FDG PET kan vurderes som en del av primærutredningen ved middels differensierte NET (Ki67 indeks mellom 10 og 20 og da i tillegg til 68Ga-DOTATOC PET) og ved NEC, og anbefales dersom det har behandlingsmessige konsekvenser. | C |
| Endoskopi og endoskopisk ultralyd |
|
| • Endoskopi og EUS fra øvre og nedre GI traktus kan være indisert der primærtumor ikke er påvist ved billeddiagnostikk, og/eller for å ta nødvendige vevsprøver. | D |
| Klassifikasjon |
|
| Ved mistanke om NEN er det følgende minimumskriterier til et patologisvar: • Differenseringsgrad (høyt eller lavt differensiert). • Immunhistokjemi med CgA, Synaptofysin. • Immunhistokjemisk undersøkelse med Ki67 for vurdering av proliferasjonsindeks «hotspots» med mest mulig nøyaktig tallangivelse. • Ved NEC skal småcellet eller storcellet morfologi angis. • NEN klassifiseres i henhold til gjeldende WHO-klassifikasjon. | D |
| Kirurgi |
|
| • For å hindre frigjøring av endokrine substanser i forbindelse med anestesi eller kirurgi, anbefales perioperativ behandling med somatostatinanalog til pasienter med karsinoid syndrom og til pasienter med tynntarms NET med levermetastaser selv uten karsinoid syndrom. | C |
| • Perioperativ behandling med somatostatinanalog anbefales ved kirurgi til pasienter med nevroendokrine metastaser fra ukjent origo. | D |
| • Det anbefales ikke å gi adjuvant behandling etter kurativ kirurgi ved NET, men ved NEC. | D |
| Somatostatinanaloger |
|
| • For å hindre progresjon av sykdommen anbefales somatostatinanaloger som førstelinjebehandling ved alle NET med Ki-67 <10 % og dokumentert gjenværende tumorvev etter kirurgisk behandling. | A |
| • Somatostatinanaloger anbefales som symptomlindrende behandling ved funksjonelle NET, uavhengig av ev. progresjon. | B |
| Peptid reseptor radionuklide terapi (PRRT) |
|
| • Behandling med 177Lu-DOTATATE (Lutathera®) kan tilbys som 2. eller 3. linjebehandling til pasienter med NEN med høy tetthet av SSTR subtype 2 visualisert ved 68Ga-DOTATOC PET. | B |
| Annen medikamentell behandling |
|
| • Everolimus anbefales brukt som første eller andrelinjebehandling for progridierende gastroenteropankreatisk NET utenfor tynntarm. | A |
| • Everolimus anbefales brukt som tredjelinjebehandling for progredierende tynntarms NET. | A |
| • Sunitinib anbefales brukt som første eller andrelinjebehandling for progressiv NET utgående fra pankreas. | A |
| • Interferon anbefales som tredje eller fjerdelinjebehandlinge ved tynntarms NET når Ki-67<10 %. | C |
| Lokalbehandling av levermetastaser fra NET |
|
| • Leverreseksjon bør foretrekkes framfor radiofrekvensablasjon når det er mulig | D |
| • Ved alvorlige endokrine symptomer bør tumorreduserende behandling av levermetastaser vurderes. | C |
| • Leverarterieembolisering kan vurderes hvis det ikke foreligger portvenetrombose og kirurgi, eller RF-behandling er uaktuelt, og metastasene hovedsakelig er lokalisert til lever. |
|
| • Radiofrekvensablasjon er ikke anbefalt ved svulster >4 cm. | D |
| • Til noen få utvalgte pasienter med høyt differensierte svulster og sykdom begrenset til lever, kan levertransplantasjon være aktuell behandling. | C |
| Karsinoid hjertesykdom |
|
| • Hos pasienter med karsinoid syndrom anbefales rutinemessig ekkokardiografi ved diagnosetidspunktet, og senere dersom det tilkommer kliniske tegn eller symptomer på hjertesvikt. | D |
| • Ved påvist karsinoid hjertesykdom anbefales ekkokardiografi årlig, eller hyppigere ved klinisk mistanke om progresjon av hjertesvikt. | D |
| Nevroendokrint carcinom (NEC) |
|
| • Radikal kirurgi bør vurderes ved lokalisert sykdom. | D |
| • Ved lokalisert NEC i esofagus bør kjemoradioterapi initial gis framfor kirurgi. | C |
| • Adjuvant kjemoterapi med Cisplatin/carboplatin bør vurderes etter radikal kirurgi. | D |
| • Palliativ kjemoterapi bør startes raskt. | C |
| • Ved Ki-67 > 55 % og metastatisk sykdom anbefales kjemoterapi med platinum + etoposid. | C |
| • Ved Ki-67 < 55 % eller ved primærtumor utgående fra colorectal kan andre behandlingsregimer vurderes i metastatisk setting. | D |
| • 2. linje palliativ kjemoterapi kan gis ved god allmenntilstand. | C |
| Øsofagus |
|
| • EUS med FNA anbefales for diagnose og staging av Ø-NEN. | D |
| • Endoskopisk reseksjon anbefales der tumor er < 1 cm uten lymfeknuter. | D |
| • Kirurgi vurderes som ved annen øsofaguscancer når tumor er over >1 cm. | D |
| Ventrikkel |
|
| • Ved påvisning av nevroendokrine svulster i ventrikkel anbefales også biopsier av normalt utseende slimhinne i corpus for å skille undergrupper. | C |
| • Ved type 2 ventrikkel NET anbefales utredning for å påvise gastrinom. | D |
| • Ved type 3 anbefales utredning for å påvise ev. metastaser uansett størrelse av primærtumor. | D |
| • Ved type 1 og 2 skal tumor fjernes dersom de er 10 mm eller større, men anbefales fjernet allerede ved 7–8 mm. | C |
| • Ved type 3 med lokoregional sykdom uten påviste metastaser, anbefales kirurgisk reseksjon uansett størrelse av primærtumor. | D |
| Duodenum |
|
| • Som primærutredning anbefales CT pankreas, EUS og SRI for staging, samt måling av gastrin og CgA i serum. | D |
| • Ved påvisning av gastrinom må man vurdere om pasienten har et MEN1 syndrom. | C |
| • NET under 1–2 cm kan vanligvis fjernes endoskopisk. | C |
| • NET over 1–2 cm reseseres kirurgisk. | D |
| • Pasienter med gastrinom som ikke opereres radikalt, behandles med PPI. | C |
| Pankreas |
|
| • CT thorax og CT/MR abdomen med dedikerte bilder av pancreas, samt 68Ga-DOTATOC PET, utføres ved primærdiagnose for staging og før kirurgisk behandling. | C |
| • Måling av spesifikke hormoner utføres ved mistanke om hormonproduserende tumor. | D |
| • Ikke funksjonelle P-NET <1,5–2.0 cm kan observeres etter en intial vurdering av vekstpotensial ved bildekontroll, initialt med 3 mnd. intervall. | C |
| • Ved ikke resektabel metastatisk sykdom er SSA, kjemoterapi, everolimus, sunitinib og PRRT aktuelle behandlingsregimer. | B, C |
| Tynntarm |
|
| • Kartlegging av sykdomsutbredelse gjøres primært med CT (eventuelt MR) og 68Ga-DOTATOC PET. Endoskopiske undersøkelser gjøres etter behov. | C |
| • Tumormarkørene CgA og 5-HIAA skal tas som ledd i utredningen. | C |
| • Hos pasienter med carcinoid syndrom anbefales ekkokardiografi ved diagnosetidspunktet. | D |
| • Reseksjon av primærtumor med eventuelle lokale glandelmetastaser og levermetastaser anbefales dersom dette kan gjøres radikalt. | C |
| • Reseksjon av primærtumor og krøsmetastaser anbefales også ved avansert sykdom, dersom det kan bedre symptomer. | C |
| • Somatostatinanaloger anbefales som førstelinje medikamentell behandling ved gjenværende tumorvev. | A |
| • PRRT med 177Lu-DOTATATE (Lutathera®) er anbefalt som andrelinjebehandling ved tynntarms NET med høyt opptak på 68Ga-DOTATOC PET. | B |
| • Everolimus er tredjelinjebehandling ved progresjon av tynntarms NET. | A |
| Appendiks |
|
| • Appendiks-NET G1 eller G2 under 1 cm regnes som radikalt operert ved appendektomi og krever ingen videre utredning eller oppfølging gitt at det er: – Frie reseksjonsrender – Ikke dybdeinnvekst i mesoappendiks på 3 mm eller mer | C |
| • Appendiks-NET G1 eller G2 med størrelse 1–2 cm regnes som radikalt operert ved appendektomi og krever ingen videre utredning eller oppfølging gitt at det er: – Frie reseksjonsrender – Ikke dybdeinnvekst i mesoappendiks på 3 mm eller mer – Ikke innvekst i blod- eller lymfekar | C |
| • Dersom svulsten ikke regnes som radikalt operert etter kriteriene ovenfor, er det indikasjon for hemikolektomi med glandeldisseksjon. | C |
| • Ved appendiks-NET G1 eller G2 som er 2 cm eller større er det indikasjon for hemikolektomi med glandeldisseksjon. | C |
| • Er det utført hemikolektomi etter indikasjonene ovenfor ved G1 og G2 svulster, og det påvises lymfeknutemetastaser, er det indikasjon for oppfølging. | C |
| • Ved G3 svulster (NEC) uansett størrelse er det indikasjon for hemikolektomi med glandeldisseksjon og oppfølging som for andre G3 svulster. | C |
| • Før hemikolektomi bør det gjøres CT thorax, CT/MR abdomen, samt 68Ga-DOTATOC I, for å utelukke ikke-resektable fjernmetastaser. Ved fjernmetastaser er det normalt ikke indikasjon for hemikolektomi. | D |
| • Ved fjernmetaster er det indikasjon for oppfølging og behandling som for tynntarms-NET. | C |
| Rektum |
|
| • Ved G1 svulster < 1 cm radikalt fjernet er det ikke indikasjon for ytterligere utredning og oppfølging. | B |
| • Ved G1 svulster ≥ 1 cm og G2 svulster uansett størrelse anbefales CT thorax, CT/MR abdomen og bekken og 68Ga-DOTATOC PET. | C |
| • Ved G3 svulster uansett størrelse anbefales CT thorax, CT/MR abdomen og bekken og 18FDG-PET. | C |
| • Rektale NEN < 2 cm kan fjernes endoskopisk dersom det ikke påvises innvekst i muscularis propria. | B |
| • Rektale NEN ≥2 cm fjernes kirurgisk. | B |
| • Radikalt fjernede G1 svulster over 1 cm og G2 svulster følges opp som tynntarms-NET, radikalt fjernede G3 følges opp som andre G3 svulster. | C |
| • Ved innkomplett fjernet G1 og G2 svulster anbefales – i tillegg til bildediagnostikk som nevnt ovenfor – rektoskopi årlig i 3 år, deretter etter 2 år. | D |
| NET med ukjent utgangspunkt |
|
| • Ved NET uten kjent origo skal primær tumor forsøkes lokalisert. | D |
| • Valg av medisinsk behandling av NET med ukjent origo kan baseres på Ki-67 index og SRI-opptak. | D |
Innledning
Sist faglig oppdatert: 20.10.2020
Nevroendokrine neoplasmer (NEN) inkluderer både de høyt differensierte nevroendokrine svulster (NET) og lavt differensierte nevroendokrine karsinomer (NEC). NEN utvikles fra stamceller til, eller direkte fra, hormonproduserende celler. Tidligere ble NET ofte kalt «karsinoider». Dette uttrykket brukes nå lite.
Hormonproduserende celler finnes overalt i kroppen, og nevroendokrine svulster kan følgelig oppstå i de fleste organer.
Over de siste 20 år har forekomsten av NET i Norge økt ca. 30 %, mens forekomsten av NEC er ganske uendret. Årlig diagnostiseres ca. 550 NET, hyppigst utgående fra fordøyelsessystemet, oftest tynntarm, bukspyttkjertel eller blindtarmsvedheng (appendiks). Det diagnostiseres også ca. 550 NEC per år hvorav ca. 90 % er små- og storcellede lungekarsinomer, resten oppstår hovedsakelig i fordøyelsessystemet (Boyar Cetinkaya et al., 2017). Dette handlingsprogrammet omhandler NEN utgått fra fordøyelsessystemet. NEN utgått fra lunge omtales i Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av lungekreft, mesoteliom og thymom (Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av lungekreft, mesoteliom og thymom, 2014).
Symptomene er som for andre kreftsvulster i fordøyelsessystemet, men de høyt differensierte svulstene kan produsere symptomgivende hormoner. De lavt differensierte svulstene produserer svært sjelden symptomgivende hormoner.
For å kunne gi riktig behandling og oppfølging er det særdeles viktig å fastslå svulstenes differensieringsgrad på diagnosetidspunktet. Pasienter med høyt differensierte svulster og uhelbredelig spredning kan leve med sin kreftsykdom i årevis, mens pasienter med lavt differensierte svulster har dårlig prognose og lever ofte kun i få måneder uten behandling. Dersom sykdommen er begrenset, skal alltid kirurgi vurderes initialt med kurasjon som mål.
Utredning og behandling er prinsipielt som for andre kreftsykdommer, men enkelte undersøkelsesmetoder, som somatostatinreseptorbasert bildediagnostikk og behandlingsmodaliteter som somatostatinanaloger, er spesielle for denne svulsttypen.
Retningslinjene er med tillatelse fra Nordic Neuroendocrine Tumour Group, utarbeidet med basis i de nordiske retningslinjene for nevroendokrine svulster i fordøyelsessystemet publisert i 2014 (Janson et al., 2014). Innhold og tekst i dette handlingsprogrammet er omarbeidet nokså betydelig i forhold til de nordiske retningslinjene.
Hovedpunkter ved revisjon 2020
Sist faglig oppdatert: 20.10.2020
- Vi anbefaler ikke rutinemessig måling av CgA i oppfølgingen av pasienter med ikke-resektabel NET sykdom
- 68Ga-DOTATOC PET bør erstatte octreotid scintigrafi
- Ny WHO-klassifikasjon 2019, det innføres ny subgruppe; NET G3
- Nytt behandlingskapittel for NET G3
- PRRT behandling med 177Lu-DOTATATE (Lutathera®) er etablert i Norge
- Anbefalt oppfølgingstid ved radikalt operert NET er endret fra 15 til 12 år
- Indikasjon for høyresidig hemikolektomi ved appendiks-NET er endret
- Oppfølgingen ved rektal NET G2 er endret
- Immunterapi har foreløpig ingen rolle i behandling av GEP-NEN
Generelt om nevroendokrine neoplasmer
Epidemiologi
Sist faglig oppdatert: 20.10.2020
Nyere epidemiologiske studier viser en økende forekomst av nevroendokrine neoplasmer (NEN), og om lag 20 % av alle NEN er lokalisert til fordøyelseskanalen (Boyar Cetinkaya et al., 2017; Fraenkel, Kim, Faggiano, de Herder, & Valk, 2014; Hauso et al., 2008; Sandvik, Soreide, Gudlaugsson, Kvaloy, & Soreide, 2016). Likevel utgjør NEN kun 1,0–1,5 % av svulstene i fordøyelsesystemet (Lepage, Bouvier, & Faivre, 2013; Yao et al., 2008). De nevroendokrine svulstene i fordøyelsessystemet er hyppigst lokalisert i tynntarmen (~30 %) og appendiks (24 %), men er også relativt hyppige i pankreas (16 %) (Sandvik et al., 2016). Data fra større registre er fortsatt noe usikre, da kodingen av NEN i de forskjellige diagnosesystemene har delvis manglet, vært uklar og heller ikke konsistent.
Ved diagnose er median alder 65 år, med unntak av pasientene med NEN i appendiks og rektum som er yngre (Sandvik et al., 2016). Data fra 70-tallet anga en årlig insidens på omlag 1,0/100 000, mens i tidsrommet 2003–2007 hadde det økt til 3,0/100 000. Nye tall fra Norge viser en årlig insidens av GEP-NENs på 4,1–5,8/100 000 (Boyar Cetinkaya et al., 2017; Sandvik et al., 2016).
Den økende forekomsten av nevroendokrine svulster kan ha flere forklaringer. Klinikere og patologer er blitt mer årvåkne for diagnosen. Diagnostiske metoder er blitt forbedret (Hallet et al., 2015). Svulstene er inkludert i klassifiseringssystemer og blir rapportert mer korrekt og komplett til nasjonale eller regionale registre. Endringer i demografien med en større andel eldre i befolkningen, kan også være et bidrag til en økning av forekomsten, men en reel økning av forekomsten av GEP-NENs er ikke usannsynlig.
Prevalensen av GEP-NENs anslås å være opptil 35/100 000 som tilsier at 2100 pasienter har GEP-NENs i Norges befolkning (Yao et al., 2008). Nye tall fra Krefregistere antyder en prevalens av NET i Norge på hele 85/100 000 (upublisert). Av kreft i fordøyelsestrakten er det kun kolorektalcancer som har en høyere prevalens i befolkningen. Denne høye prevalensen skyldes at pasienter med NET ofte lever lenge med sykdommen. På diagnosetidspunktet har over halvparten av NEN-pasientene lokalisert sykdom, mens de resterende har regional sykdom eller avansert sykdom med påviste fjernmetastaser.
Genetikk og arvelige syndromer
Sist faglig oppdatert: 20.10.2020
GEP NET kan være en del av arvelige syndromer, særlig NET i pankreas og duodenum (Toumpanakis & Caplin, 2008). De vanligste arvelige formene er multippel endokrin neoplasi type 1 (MEN1) og von Hippel Lindaus syndrom (VHL). Pasienter med neurofibromatose type 1 og Carneys complex har økt forekomst av NET. Det er registrert enkelte familier med opphopning av tynntarms-NET (Hughes et al., 2016).
Ved MEN1 er det mutasjoner i tumor-suppressorgenet MEN1 som koder for proteinet menin. Dette gir økt risiko for særlig primær hyperparathyreoidisme, hypofyseadenomer og pankreas-NET. NET med utgangspunkt i andre organer forekommer også ved dette syndromet.
Ved VHL er VHL-supressorgenet mutert. Dette gir opphav til en rekke tumormanifestasjoner, blant annet pankreas-NET.
Arvelig årsak må mistenkes og utredes i samarbeid med genetiker hos pasienter med pankreas-NET i ung alder, ved familiær opphopning av NET, samt ved hormonforstyrrelser som ved MEN1.
Anbefalinger:
- Arvelig årsak må mistenkes og utredes i samarbeid med genetiker hos pasienter med pankreas-NET i ung alder, ved familiær opphopning av NET, samt ved hormonforstyrrelser som ved MEN1. (C)
Forebygging
Sist faglig oppdatert: 20.10.2020
Foruten enkelte arvelige syndromer som skyldes mutasjoner i enkeltgener, er lite kjent om hva som forårsaker nevroendokrine neoplasmer.
Ut fra epidemiologiske studier synes det å være en viss økt risiko for enkelte former for nevroendokrin kreft hos røykere (Rinzivillo et al., 2016). Utover dette er det ikke påvist disponerende faktorer som muliggjør målrettet forebygging.
Forløpstider
Sist faglig oppdatert: 20.10.2020
Fra 12.05.2015 ble Pakkeforløp for nevroendokrine svulster innført i helsetjenesten. www.helsedirektoratet.no/retningslinjer/pakkeforlop-for-nevroendokrine-svulster
Om Pakkeforløp for kreft
Sist faglig oppdatert: 20.10.2020
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Formålet med Pakkeforløp for kreft er at pasienter skal oppleve et godt organisert, helhetlig og forutsigbart forløp uten unødvendig ikke-medisinsk begrunnet forsinkelse i utredning, diagnostikk, behandling og rehabilitering.
Forløpstidene i pakkeforløpet beskriver den maksimale tiden de ulike fasene i forløpet bør ta for et flertall av pasientene. Forløpstidene angis i kalenderdager. De enkelte fasenes forløpstid legges til slutt sammen til en samlet forløpstid, som angir tiden fra henvisning er mottatt til start behandling. Med utgangspunkt i pakkeforløpet skal et individuelt forløp tilrettelegges for hver enkelt pasient.
De regionale helseforetakene har det overordnede ansvaret for å sikre at pakkeforløpene med forløpstidene blir implementert og fulgt opp. Forløpstidene er normerende og er ikke en pasientrettighet. Fortsatt er det lovmessige grunnlaget pasientrettighetsloven § 2‑2 (Lov om pasient- og brukerrettigheter (pasient- og brukerrettighetsloven)) og forskrift om prioritering av helsetjenester (Forskrift om prioritering av helsetjenester, rett til nødvendig helsehjelp fra spesialisthelsetjenesten, rett til behandling i utlandet og om klagenemnd (prioriteringsforskriften)). Av og til vil det av faglige grunner være noen pasienter som ikke kan utredes ferdig innen normert forløpstid for oppstart av første behandling.
Forløpstider for nevroendokrine svulster
Sist faglig oppdatert: 20.10.2020
I Pakkeforløp for nevroendokrine svulster er det utarbeidet følgende forløpstider ved mistanke om, eller bioptisk verifisert, nevroendokrin svulst, høyt og middels differensiert (G1-2):
| Fra henvisning mottatt til første fremmøte utredende avdeling |
| 14 kalenderdager |
| Fra første fremmøte i utredende avdeling til avsluttet utredning (beslutning tas) |
| 21 kalenderdager |
| Fra avsluttet utredning til start behandling | Kirurgisk behandling | 21 kalenderdager |
| Fra avsluttet utredning til start behandling | Medikamentell behandling | 21 kalenderdager |
| Fra avsluttet utredning til start behandling | Strålebehandling | 21 kalenderdager |
| Fra henvisning mottatt til start behandling | Kirurgisk behandling | 56 kalenderdager |
| Fra henvisning mottatt til start behandling | Medikamentell behandling | 56 kalenderdager |
| Fra henvisning mottatt til start behandling | Strålebehandling | 56 kalenderdager |
Er nevroendokrint karcinom lavt differensiert, G3, verifisert ved biopsi – eller dette ikke kan utelukkes – skal forløpstidene være vesentlig kortere enn de oppsatte.
I pakkeforløpet for nevroendokrine svulster er NEC spesifisert i teksten under tabellene for forløpstidene for NET i de enkelte kapitlene om inngang, utredning og behandling.
Pakkeforløp for nevroendokrine svulster finnes på Helsedirektoratets nettsider www.helsedirektoratet.no.
Det er utarbeidet en egen diagnoseveileder for fastleger for inngang til pakkeforløpet. Diagnoseveiledere finnes på www.helsedirektoratet.no.
Det er også utarbeidet pasientinformasjonsskriv, som finnes på www.helsedirektoratet.no.
Diagnose og utredning
Sist faglig oppdatert: 20.10.2020
Man kan få mistanke om nevroendokrin kreft ut fra anamnesen, spesielt ved hormonelle symptomer. Det er ikke uvanlig at mistanken om nevroendokrin svulst utløses på bakgrunn av funn i forbindelse med utredning for andre tilstander.
Ved begrunnet mistanke om nevroendokrin svulst har utredningen som mål å avklare følgende forhold:
- Diagnose
- Sykdomsutbredelse
- Behandlingsmuligheter
Sykehus med spesialkompetanse er ansvarlig for utredningsforløpet og vurdering i tverrfaglig møte. Utredningen kan utføres på lokalsykehus, men pasientene bør som regel henvises til universitetsykehus med erfaring og kompetanse innen fagområdet nevroendokrine svulster for en vurdering.
For alle pasienter skal det utføres detaljert anamnese, klinisk undersøkelse og blodprøvestatus. Ved symptomer på karsinoid syndrom må en være spesielt oppmerksom på kliniske tegn og symptomer på klaffeaffeksjon og hjertesvikt.
Symptomer
Sist faglig oppdatert: 20.10.2020
NET har ofte ingen symptomer i tidlig fase da svulstene er små og vokser langsomt. Symptomene kommer først når tumor når en viss størrelse, vokser inn i nærliggende vev eller begynner å produsere hormoner. Symptomene kan være generelle eller relatert til hvor tumor er lokalisert.
Hormonelle syndromer
NET i pankreas og duodenum kan produsere ulike typer hormoner som kan gi symptomer som beskrevet i tabellen under. Ved NEC er hormonelle symptomer sjeldent og pasientene har generelle symptomer som ved annen høygradig malign sykdom.
| NET | Aktiv substans | Insidens* | Assosiert | Symptomer |
|---|---|---|---|---|
| Insulinom | Insulin | 1–3 | 4–5 | Hypoglykemi |
| Gastrinom | Gastrin | 0.5–2 | 20–25 | Ulcus sykdom, refluks, diaré |
| Somatostatinom | Somatostatin | – | 45 | Diabetes, gallestein, diaré |
| VIPom | Vasoaktivt intestinal peptid | 0.05–0.2 | 6 | Diaré, hypokalemi |
| Glukagonom | Glukagon | 0.01–0.1 | 1–20 | Erytem, diabetes |
* Nye tilfeller/106 innb./år. Etter Jensen RT (R. T. Jensen et al., 2012)
Karsinoid syndrom
Det karsinoide syndrom forårsakes av frigjøring av hormoner (spesielt serotonin), i hovedsak fra svulster utgått fra tynntarm, og karakteriseres av diaré, «flushing», og sjeldnere astma. Syndromet ses hos <30 % av pasienter på diagnosetidspunktet og når det foreligger levermetastaser, eller når det foreligger metastaser som omgår leverens metabolisme og frigjør hormoner direkte til den systemiske sirkulasjon (for eksempel ved metastaser til ovarier, mediastinum eller retroperitoneum). Det karsinoide syndrom kan også skyldes hormonfrigjøring fra primære lunge-NET. Når det gjelder karsinoid hjertesykdom, se Karsinoid hjertesykdom.
Blodprøver og biomarkører
Sist faglig oppdatert: 20.10.2020
Blodprøver ved begrunnet mistanke om nevroendokrin svulst omfatter hematologisk status, samt nyre- og leverprøver: Hb, leukocytter, trombocytter, kreatinin, elektrolytter, INR, ALAT, ASAT, ALP, GT, bilirubin.
Nyrefunksjon er av betydning for gjennomføring av radiologiske undersøkelser med i.v. kontrast og eventuell senere behandling med kjemoterapi eller radionuklidterapi (PRRT). Kartlegging av leverfunksjon er spesielt viktig dersom det foreligger levermetastaser.
Kromogranin A
Mellom 60 og 80 % av NET-pasientene har økte S-CgA-verdier (Kanakis & Kaltsas, 2012). Høye nivåer gjenspeiler tumorbyrde og er forbundet med dårligere prognose (Janson et al., 1997). Måling av CgA kan være nyttig i diagnostisering, vurdering av behandlingseffekt og for påvisning av residiv (K. H. Jensen et al., 2013). Måling av CgA er ikke nyttig som verktøy for å påvise progresjon (Dam et al., 2020). Forhøyet CgA-verdi er ikke spesifikt for NET. Kronisk atrofisk gastritt, behandling med protonpumpehemmer, nyre-, lever- og hjertesvikt, samt andre krefttyper, kan gi forhøyede verdier (Tropea et al., 2006). Man får mer stabile resultater dersom blodprøven tas fastende (Jianu, Fossmark, Syversen, Hauso, & Waldum, 2010). Det finnes flere analysemetoder for CgA og de kan ha ulik sensitivitet og spesifisitet (Stridsberg, Eriksson, Oberg, & Janson, 2003).
Ved NEC finnes det ingen etablerte biomarkører.
Hormoner
Ved mistanke om hormonelle symptomer måles det hormonet som ved overproduksjon kan forårsake de konkrete symptomene. Aktuelle hormoner er gastrin, insulin, c-peptid, pro-insulin, glukagon, VIP, pankreatisk polypeptid (PP), somatostatin, ACTH og kalsitonin.
5-HIAA
5-hydroksyindoleddiksyre (5-HIAA) er et nedbrytningsprodukt av serotonin. Forhøyede verdier finnes hos 70–75 % av pasienter med NET i tynntarm. Tradisjonelt er 5-HIAA målt i 24 timers samleurin. Måling i morgenurin synes imidlertid å gi sammenlignbare resultater (Gedde-Dahl et al., 2013). Måling av 5-HIAA i urin krever diettrestriksjoner (unngå serotoninrik kost), Måling av 5-HIAA anbefales ved påvisning av tynntarms NET eller ved ukjent primærtumor.
Anbefalinger:
- Måling av S-CgA bør gjøres som ledd i primærdiagnostikk av NET. (C)
- Hormonanalyser anbefales som ledd i primærdiagnostikk ved mistanke om symptomer som kan være forårsaket av hormonoverproduksjon. (C)
- Måling av 5-HIAA i urin bør gjøres som ledd i primærdiagnostikk ved tynntarms NET eller ved ukjent primærtumor. (C)
Radiologiske undersøkelser
Sist faglig oppdatert: 20.10.2020
I den radiologiske rapporten beskrives primærtumor og metastaser i henhold til RECIST 1.1 kriterier (Maks 5 mållesjoner totalt, maks 2 per organ) som følges fra gang til gang for objektivt å kunne måle endringer i sykdomsutviklingen. Siden høyt og middels differensierte svulster (NET) vokser sakte, er det viktig å sammenligne lesjonenes størrelse over en lengre periode.
CT og MR
Computer tomografi (CT) og Magnetisk resonans tomografi (MR) er standard ved primærdiagnostikk og oppfølging av NEN. En dedikert protokoll for CT med intravenøst kontrastmiddel i arteriell og portovenøs fase er avgjørende for å visualisere og karakterisere NEN (se vedlegg). Det anbefales på diagnosetidspunktet å skanne thoraks (CT), abdomen og bekken for primærtumor og/eller metastaser (Pavel et al., 2012).
MR med intravenøst kontrastmiddel gir ofte en bedre visualisering og karakterisering av små lever- og pankreaslesjoner. Bruk av MR i oppfølging og kontroller gir ingen stråling, og anbefales særlig ved forventet lang oppfølgingstid. I tillegg kan MR fremstille lesjonene også uten bruk av intravenøst kontrastmiddel og kan derfor brukes hos pasienter med nyresvikt.
CT eller MR tynntarm kan ha ekstra verdi ved deteksjon av primærtumor i tynntarm (Ganeshan, Bhosale, Yang, & Kundra, 2013).
Anbefalinger:
- Ved primærutredning anbefales dedikert CT eller MR av thorax/abdomen/bekken. (C)
- Ved oppfølging og kontroller anbefales dedikert CT abdomen, alternativt MR av yngre (under 50 år) pasienter ved forventet lang oppfølgingstid. (D)
- Ved saktevoksende svulster må lesjonenes størrelse sammenlignes over en lengre periode. (D)
Nukleærmedisinske undersøkelser
Sist faglig oppdatert: 20.10.2020
68Ga DOTATOC PET/CT
Metoden anvender den DOTA-konjugerte somatostatinanalogen DOTATOC merket med den radioaktive nukliden Gallium-68 (68Ga) til å påvise høy tetthet av somatostatinreseptorer ved hjelp av PET. 68Ga-DOTATOC har affinitet hovedsakelig til SSTR type 2 som også er målreseptor for 177Lu-DOTATATE behandling.
Svulster med ingen eller lav tetthet av somatostatinreseptorer (SSTRs) lar seg ikke påvise med SSTR PET. Inntil nylig anvendte man i Norge SSTR-analoger merket med enten 99mTc (tektrotyd) eller 111In (Octreoscan) og avbildning med SPECT/CT med vanlig gammakamera. PET har langt høyere billedlig oppløselighet enn et gammakamera, og innføringen av 68Ga‑DOTATOC PET i Norge har vært et stort billediagnostisk fremskritt. Noen steder i Norgen er PET enda ikke lett tilgjengelig (og det er kapasitetsproblemer), og oktreotidundersøkelse med SPECT/CT kan i en del tilfeller fortsatt brukes. PET kan utføres som PET/CT, eller enkelte steder i Norge også som PET/MR.
68Ga-DOTATOC PET utføres som en del av primærutredningen av NET, men først etter at man har påvist tumor suspekt på NET ved annen modalitet som CT eller MR. Det er er sjeldent indikasjon for å gjøre 68Ga-DOTATOC PET basert kun på symptomer eller en økt kromogranin A når annen billeddiagnostisk ikke kan påvise NET. 68Ga-DOTATOC PET er også indisert som utredning av pasienter som kan egne seg for behandling med peptid reseptor radionuklide terapi (PRRT) med 177Lu-DOTATATE (Lutathera®) (se kapitlet Peptid reseptor radionuklide terapi (PRRT)).
Ved PET gjelder generelt at deteksjonsevnen ikke bare er avhengig av PET-scannerens billedlige oppløselighet, men hvor høyt opptak det er i en lesjon er også avgjørende. Fordi opptaket av 68Ga-DOTATOC ved høyt differensierte NET oftest er meget høyt, og bakgrunnsaktiviteten i friskt vev lav, kan selv meget små lesjoner påvises (få mm). Således kan metastaser til f.eks. små, morfologisk normalt utseende lymfeknuter påvises. Også benmargsmetastaser kan ofte være meget små. Disse forhold gjør at 68Ga-DOTATOC vil ha en helt annen plass i stadieinndeling av NET enn tidligere da SPECT/CT ble benyttet. 68Ga-DOTATOC PET har ingen rutinemessig plass i oppfølgingen av NET.
SSTR kan ha moderat tetthet også på annet vev som inflammasjon (f.eks. granulomatøs inflammasjon), samt andre maligne tumores. Det meget høye opptaket som ofte sees ved høyt differensiert NET er dog unikt høyt.
Det er ikke nødvendig å seponere somatostatinanalog behandling (SSA) før 68Ga-DOTATOC PET.
Flere PET tracere er i den seinere tid blitt tilgjengelig for SRI. Den vanligst brukte PET-tracer består av en somatostatin analog merket med 68-Gallium.
18 F-FDG PET/CT
18F-FDG PET kan være indisert ved G3-tumores (Ki indeks >20 %) (Panagiotidis et al., 2017). Behandling med 177Lu-DOTATATE (Lutathera®) kan av og til være aktuelt også for G3-tumores, og da skal det alltid gjøres både 18F-FDG PET og 68Ga DOTATOC, da det bør være høy tetthet av SSTR i alle lesjoner for at PRRT skal være aktuelt (Chan et al., 2017; Thang et al., 2018).
Ved metastastisk sykdom kan det være ulik differensiering i metastasene, og kombinasjonen 18F-FDG PET og 68Ga-DOTATOC kan gi verdifull informasjon om tumorheterogenitet. Således kan 18F-FDG være nyttig i tillegg til 68Ga-DOTATOC PET for G2-tumores med Ki indeks mellom 10 og 20. FDG PET kan være nyttig ved lav Ki67 indeks ved uventet progresjon og metastasering.
Anbefalinger:
- 68Ga-DOTATOC PET skal utføres når det foreligger mistanke om NET ut fra CT eller MR funn, og ved utredning med tanke på PRRT-behandling. (B)
- 68G-DOTATOC PET anbefales ikke som en del av den rutinemessige oppfølgingen ved NET. (D)
- 18F-FDG PET kan vurderes som en del av primærutredningen ved middels differensierte NET (Ki67 indeks mellom 10 og 20 og da i tillegg til 68Ga-DOTATOC PET) og ved NEC, og anbefales dersom det har behandlingsmessige konsekvenser. (C)
Endoskopi og endoskopisk ultralyd
Sist faglig oppdatert: 20.10.2020
Endoskopiske prosedyrer kan være aktuelt for å finne primærtumor, ta biopsier og for kartlegging av lesjoner før valg av behandlingsstrategi. Enkelte NET blir funnet tilfeldig ved endoskopi utført på annen indikasjon.
Gastroskopi gjøres for å avklare om det foreligger, eller kartlegge utbredelse av, NET i ventrikkel eller duodenum.
Ileokoloskopi brukes for å lete etter primærtumor i terminale ileum (tynntarms NET). Kapselendoskopi brukes for å lete etter primærtumor i tynntarm. Tarmobstruksjon må da være utelukket på forhånd med CT eller prøvekapsel.
Øvre og nedre enteroskopi brukes når man på forhånd har en idé om lokalisasjonen til tumor på bakgrunn av annen diagnostikk. Det er kun tilgjengelig ved enkelte universitetssykehus.
Endoskopisk ultralyd (EUS) brukes primært til staging av lesjoner i øsofagus, ventrikkel, duodenum, pankreas og rektum. EUS kan også brukes til å ta vevsprøver av lesjoner som ligger tett opptil tarmkanalen. Finnålsaspirasjon (FNA) til cytologi kan være nyttig i diagnostikken når det ikke er mulig å få tatt ordinære biopsier. EUS kan være nyttig der man har sterk mistanke om en funksjonell NET i pankreas/duodenum ved ellers negativ radiologi.
Anbefalinger:
Endoskopi og EUS fra øvre og nedre GI traktus kan være indisert der primærtumor ikke er påvist ved billeddiagnostikk, og/eller for å ta nødvendige vevsprøver. (D)
Patologi, klassifikasjon og stadieinndeling
Sist faglig oppdatert: 20.10.2020
Diagnosen stilles etter en samlet vurdering av tumors vekstmønster, cellemorfologi og immunhistokjemi. Et minstekrav til et patologisvar er en morfologisk beskrivelse med tanke på differensieringsgrad (høyt eller lavt differensiert) og fargning med immunhistokjemiske markører for kromogranin A (CgA), synaptofysin og Ki67 (Duan & Mete, 2016). Ved Ki67 > 20 % skal det også angis cellemorfologi (små-cellet eller stor-cellet). Biopsi eller resektat anbefales for vurdering av proliferasjonsindeks med Ki67. Ki67 indeks er vanskelig å estimere basert på et finnålsaspirat. Neuron spesifikk enolase (NSE) og N-CAM (CD56) regnes som lite spesifikke markører og bør ikke brukes alene i diagnostikken (Bussolati, Volante, & Papotti, 2001).
Klassifikasjon
Sist faglig oppdatert: 20.10.2020
Gastroenteropankreatiske neuroendokrine neoplasmer (GEP-NEN) klassifiseres i henhold til gjeldende WHO-klassifikasjonen fra 2019 og er skjematisk fremstilt i figur 5.1 (Digestive System Tumours, 2019). I henhold til WHO-klassifikasjonen deles NEN inn i neuroendokrine tumores grad 1, 2 og 3 (NET G1, G2 og G3) og neuroendokrine karsinomer (NEC). NET er høyt differensierte NEN og NEC er lavt differensierte NEN. GEP-NEN kan stadieinndeles i henhold til gjeldende UICCs TNM-klassifikasjon (Amin et al., 2017; TNM Classification of Malignant Tumours, 2016) og ESMO-guidelines (Oberg, Knigge, Kwekkeboom, Perren, & Group, 2012) (basert på ENETS TNM-klassifikasjon). Med tanke på kvalitet i fremtidig forskning og registrering, er det anbefalt å bruke TNM-stadieinndeling også for NET/NEC pasienter (Digestive System Tumours, 2019).
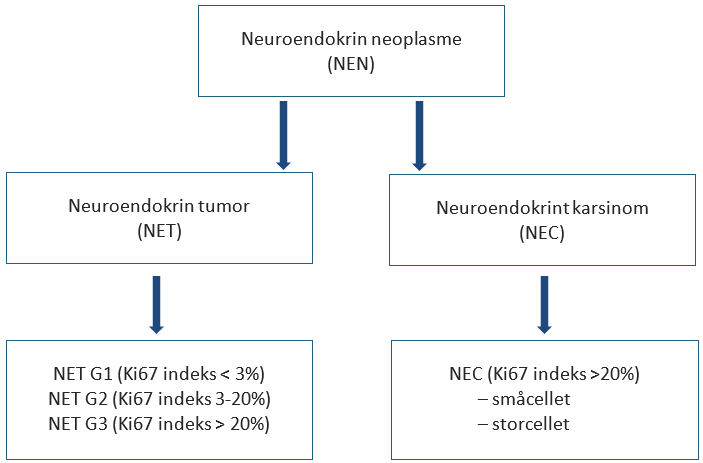
I den reviderte klassifikasjonen er det tatt inn en ny gruppe definert som høyt differensierte NEN med Ki67>20 %, NET G3. Disse behandles annerledes enn lavt differensierte NEN, NEC.
Nevroendokrine svulster (NET) G1-G3
Ved NET er tumor bygget opp av ensartede celler med morfologi som likner normale neuroendokrine (NE) celler i gastrointestinal (GI) traktus. Tumorcellene danner gjerne organoide reder og trabekler. Morfologi kan variere noe alt ettersom hvilken del av GI traktus tumor utgår fra.
Neuroendokrint karsinom (NEC)
Ved NEC er tumor bygget opp av små, mellomstore eller store celler med udifferensiert vekstmønster, eller med vekstmønster som kan minne om NET (Digestive System Tumours, 2019).
Ikke alle NEN med Ki67>20 % klassifiseres som NEC. I tilfeller hvor svulstene er høyt differensierte med Ki67>20 % klassifiseres de nå som NET G3.
MiNEN («mixed neuroendokrin/non-neuroendokrine neoplasm») består av to ulike tumorkomponenter som består av en neuroendokrin komponent og ikke-neuroendokrin komponent. Som oftest er den ikke-neuroendokrine komponenten et adenokarsinom og den neuroendokrine komponenten et NEC, disse omtales i slike tilfeller som MANEC («mixed adenoneuroendocrine carcinoma»). Hvilke tumorkomponenter som er til stede kan variere ut i fra hvilken del av GI traktus tumor utgår fra. Hver tumorkomponent utgjør 30–70 % av tumor. I tilfeller der mindre enn 30 % av tumor har NE-differensiering klassifiseres de som for eksempel adenokarsinom med neuroendokrin differensiering, og i tilfeller der mer enn 70 % av tumor har neuroendokrin differensiering, klassifiseres de som for eksempel NEC med adenocarcinom differensiering. Hvilke tumorkomponenter MiNEN er bygget opp av bør fremgå i patologirapporten.
Småcellet GEP NEC likner morfologisk på småcellet karsinom i lunge, og har gjerne negativ immunreaksjon for antistoff mot CgA. Disse svulstene kan i tillegg ha kun fokal positiv eller negativ reaksjon for synaptofysin. I tilfeller hvor både CgA og synaptofysin er negativ, er diagnosen småcellet NEC en eksklusjonsdiagnose.
Storcellet NEC er gjerne bygget opp av celler med store og pleomorfe kjerner som danner øyer/flak med eller uten nekroser, men kjertler kan også forekomme. I tilfeller hvor det foreligger lite differensierte GEP karsinomer bør patologene vurdere immunhistokjemiske (IHC) undersøkelser med synaptofysin og CgA for å se etter neuroendokrin differensiering i tumor. NEC viser gjerne sterk positiv reaksjon for synaptofysin og svak positiv eller negativ reaksjon for CgA.
I henhold til WHO-klassifikasjonen fra 2019 er NEC definert som lite differensierte NEN med proliferasjonsindeks > 20 % (Digestive System Tumours, 2019). Nyere forskning har vist at NEN med proliferativ aktivitet >20 % er mer heterogen enn tidligere antatt. NORDIC NEC-studien viste at NEN med proliferasjonsindeks > 55 % responderte bedre på platinum basert kjemoterapi sammenliknet med svulstene med proliferasjonsindeks mellom 20–55 %. Denne gruppen hadde likevel kortere median overlevelse sammenliknet med NEN med proliferasjonsindeks mellom 20–55 % (Sorbye et al., 2013). Andre studier har vist at svulstene med proliferasjonsindeks > 20 %, men med høyt differensiert morfologi, har bedre overlevelse sammenliknet med svulster med proliferasjonsindeks >20 % og lite differensiert morfologi (Basturk et al., 2015; Heetfeld et al., 2015; Tang et al., 2016). Sub-gruppen med Ki67 > 20 %, men med høyt differensiert morfologi, utgjør ca. 10 % av tilfellene og forekommer spesielt i pankreas. Slike svulster i pankreas ble derfor omklassifisert til NET G3 (Klöppel et al., 2017). I den siste WHO utgaven fra 2019 gjelder dette også for svulster oppstått andre steder i GI-tractus (Digestive System Tumours, 2019).
Proliferasjonsindeks Ki67
Vurdering av proliferasjonsindeks ved hjelp av Ki67 er obligatorisk for vurdering av tumorgrad (Digestive System Tumours, 2019; McCall et al., 2013). Ki67 indeks skal vurderes i områder med flest positive kjerner, såkalte «hot-spots». Antall positive celler vurdert i et område med 500–2000 celler angis i prosent. Det er flere måter å regne ut proliferasjonsindeksen på (Reid et al., 2015). Proliferasjonsindeksen skal angis med et mest mulig nøyaktig tallestimat (Rindi et al., 2006; J. R. Strosberg et al., 2010). Dette kan gjøres digitalt, ved hjelp av gitter, eller ved at en printer ut et Ki67 farget snitt fra et «hot-spot»-område og teller på papiret (Reid et al., 2015). Ki67 viser flere celler i deling sammenliknet med proliferasjonsindeks målt ved mitosetelling per 10 HPF, og det er dessuten vanskelig å identifisere «hot-spots» i tumor uten Ki67. I de tilfeller der Ki67 indeks og antall mitoser per 10 HPF angir ulik grad, er det anbefalt å velge høyeste grad.
Molekylærpatologi ved nevroendokrine neoplasmer
Selv om NET og NEC kan ha overlappende morfologi, tyder genanalyser på at disse svulstene ikke er relaterte (Digestive System Tumours, 2019; Jiao et al., 2011). Ved NET i pankreas er det ofte mutasjoner i MEN1 genet, DAXX og ATRX genene, gener assosiert med mTOR signalveiene, og noe sjeldnere von Hippel Lindau relaterte gener (Digestive System Tumours, 2019; Jiao et al., 2011). Disse mutasjonene er vanligvis ikke til stede ved NEC i pancreas. I disse svulstene er det vanligere med mutasjoner eller genetiske endringer i TP53, RB1 og andre karsinomassosierte gener (Jesinghaus et al., 2017; Konukiewitz et al., 2017; Yachida et al., 2012). Sporadiske NET i pankreas kan også være assosiert med mutasjoner i DNA reperasjonsgenene MUTYH, CHEK2 og BRCA2 (Digestive System Tumours, 2019; Waddell et al., 2015). I tilfeller der det er vanskelig å skille mellom NET G3 og NEC vil påvisning av mutasjoner i TP53 eller genetiske endringer i RB1 kunne være til hjelp til å skille mellom disse to entitetene. NET G3 kan ha tap av DAXX og ATRX, men nesten alltid normalt uttrykk av RB1 og TP53.
Anbefalinger:
Ved mistanke om NEN er det følgende minimumskriterier til et patologisvar:
- Differenseringsgrad (høyt eller lavt differensiert).
- Immunhistokjemi med CgA, Synaptofysin.
- Immunhistokjemisk undersøkelse med Ki67 for vurdering av proliferasjonsindeks «hotspots» med mest mulig nøyaktig tallangivelse.
- Ved NEC skal småcellet eller storcellet morfologi angis.
- NEN klassifiseres i henhold til gjeldende WHO-klassifikasjon. (D)
Generelt om behandling
Sist faglig oppdatert: 20.10.2020
Utredningen bør klarlegge sykdommens anatomiske utganspunkt, tumor differensieringsgrad (G1-3/NEC). Dette sammen med pasientens symptomer, alder, funksjonsnivå, andre sykdommer og egne preferanser danner grunnlaget for valg av behandling.
Kirurgi er eneste behandling som kan kurere pasienten. Vurdering av resektabilitet og operabilitet er derfor avgjørende. Etter endt utredning tas klinisk beslutning om anbefalt behandling, og om behandlingen har kurativt eller palliativt siktemål.
Beslutning tas primært i tverrfaglig møte, men der diagnostikken er klar og videre behandlingsløp er gitt i foreliggende faglige anbefalinger, kan beslutning tas uten et slikt tverrfaglig møte. Endelig beslutning om behandling tas i samråd med pasienten.
Det vitenskapelige grunnlaget for de ulike behandlingsmodaliteter ved GEP-NEN er ofte svakt på grunn av små og heterogene studiepopulasjoner (lokalisasjon av primærsvulst, differensieringsgrad, sykdomsutbredelse, komorbiditet, behandling), suboptimal studiedesign (retrospektive studier, seleksjonsbias, manglende kontrollgrupper) og varierende datakvalitet (registerstudier, ulike klassifiseringer og definisjoner). Det foreligger imidlertid studier av god kvalitet når det gjelder somatostatinanaloger, Everolimus, Sunitinib og PRRT. NEC omtales nærmere i kapitlet om Nevroendokrint carcinom (NEC).
Kirurgi
Sist faglig oppdatert: 20.10.2020
Alle pasienter med NEN skal vurderes med tanke på operativ behandling (Capurso et al., 2011; Norlen et al., 2012). Selv om de fleste som opereres for et insulinom i pankreas, NET i appendiks eller i rectum kan helbredes med kirurgi, er det generelt mindre enn 30 % av pasientene med GEP-NEN som kan opereres med kurativ intensjon. Sykdomsresidiv er vanlig også etter antatt kurativ kirurgi. Om kirurgi med kurativ intensjon ikke er mulig, kan likevel kirurgi, eller annen tumor-reduserende behandling, være nyttig for pasienten ved at symptomer relatert til lokoregional tumorvekst eller hormon utskillelse reduseres (Capurso et al., 2011; Norlen et al., 2012). Hvorvidt tumorreduserende kirurgi påvirker overlevelse er usikkert.
«Debulking kirurgi, dvs. at man opererer og fjerner mesteparten av svulstvevet, har også en plass ved nevorendokrin levermetastasering. Tradisjonelt har dette vært anbefalt dersom minst 90 % av metastatisk vev kunne fjernes. Nyere data peker på mulig overlevelsesgevinst også om prinsippet utvides til å gjelde for spredning fra pNETs, eller om man renonserer noe på 90 % kravet» (Morgan, Pommier, & Pommier, 2018; Tierney et al., 2019).
Perioperativ behandling med somatostatin analog
For å hindre frigjøring av endokrine substanser i forbindelse med anestesi eller kirurgi, anbefales perioperativ behandling med somatostatin analog til pasienter med karsinoid syndrom (Ramage et al., 2012; Roy, Carter, & Wright, 1987). Dette vil fortrinnsvis gjelde pasienter med metastatisk tynntarms NET. Pasienter uten symptomer eller pasienter med tumor lokalisasjon i f.eks. pankreas, er lite utsatt for karsinoid krise og profylakse synes ikke påkrevd (Ramage et al., 2012; Roy et al., 1987). Unntak er pasienter med levermetastaser fra tynntarm uten karsinoid syndrom. Disse har forhøyet risiko og bør få infusjon med somatostatinanalog ved kirurgi eller leverarterieembolisering (Condron, Pommier, & Pommier, 2016). Pasienter med metastaser fra ukjent primærtumor bør også få profylaktisk perioperativ behandling med SSA. Karsinoid krise kan oppstå til tross for infusjon og hos asymptomatiske pasienter som ikke får infusjon (Condron et al., 2016).
Kunnskapsgrunlaget er spinkelt. I Norge anbefales infusjon med Octreotid 50 μg/t med oppstart senest en time før kirurgi og varighet opptil 24 timer etter kirurgi (Roy et al., 1987).
Profylaktisk kolecystektomi
Langtidsbehandling med somatostatinanaloger øker dannelse av galleblærekonkrementer. Disse er vanligvis asymptomatiske. Profylaktisk kolecystektomi er ikke påkrevd, heller ikke ved planlagt leverarterieembolisering eller selektiv radioterapi. Dersom det er påvist galleblærekonkrementer hos en GEP-NEN pasient som planlegges for abdominal kirurgi, kan samtidig kolecystektomi vurderes (Norlen, Hessman, Stalberg, Akerstrom, & Hellman, 2010).
Adjuvant behandling etter kurativ kirurgi
Det er ikke holdepunkter for å gi adjuvant behandling etter kirurgi ved NET der det ikke er gjenværende tumorsykdom. Ved NEC anbefales adjuvant behandling (se kapittel for NEC).
Anbefalinger:
- For å hindre frigjøring av endokrine substanser i forbindelse med anestesi eller kirurgi, anbefales perioperativ behandling med somatostatinanalog til pasienter med karsinoid syndrom og til pasienter med tynntarms NET med levermetastaser selv uten karsinoid syndrom. (C)
- Perioperativ behandling med somatostatinanalog anbefales ved kirurgi til pasienter med nevroendokrine metastaser fra ukjent origo. (D)
- Det anbefales ikke å gi adjuvant behandling etter kurativ kirurgi ved NET, men ved NEC. (D)
Somatostatinanaloger
Sist faglig oppdatert: 20.10.2020
De fleste nevroendokrine svulster har somatostatinreseptorer. Somatostatinanaloger brukes både som symptomatisk og veksthemmende behandling. Det er uklart om grad av opptak ved somatostatinreseptor bildediagnostikk (SRI) kan si noe om behandlingsrespons eller ikke, men det er vist at somatostatinanaloger har effekt selv om det ikke er opptak (Rinke et al., 2009). Det foreligger to placebo-kontrollerte randomiserte kliniske studier av pasienter med ikke-resektabel NET som viser at somatostatin analoger har veksthemmende effekt (Caplin et al., 2014; Rinke et al., 2009). I PROMID-studien fant man hos pasienter med tynntarms NET at median tid til progresjon var signifikant lenger i gruppen som fikk octerotide LAR (14,3 mnd.) sammenlignet med placebo (6 mnd.). I CLARINET-studien fant man hos pasienter med ikke-funksjonelle nevroendorine svulster med forskjellige utgangspunkt at median progresjonsfri overlevelse var signifikant lenger i gruppen som fikk lanreotide autogel (>24 mnd.) sammenlignet med placebo (18 mnd.).
Vanlig dosering av somatostatinanaloger er:
Octreotide LAR 30 mg hver 4. uke eller Lanreotide autogel 120 mg hver 4. uke. Ved progresjon av sykdom, eller økende symptomer, anbefales det å forkorte intervallene (2–3 uker) mellom injeksjonene.
Det er ikke vist noen forskjell mellom de somatostatinanalogene som er på markedet når det gjelder symptomatisk eller biokjemisk respons (Modlin, Pavel, Kidd, & Gustafsson, 2010).
Vanlige bivirkninger av somatostatinanaloger er magesmerter, diaré, kvalme, subkutane knuter på injeksjonssted og dannelse av gallesteiner (Sorbye, Meyer, Mordal, Myhre, & Thiis-Evensen, 2020). Diaré kan være forårsaket av redusert eksokrin funksjon av pankreas som kan motvirkes ved å gi tilskudd av pankreasenzymer. Man må også være oppmerksom på at glukosenivåer og insulinbehov kan endres hos diabetikere ved bruk av somatostatinanalog. Det har vært vanlig å gi prøvedoser med hurtigvirkende somatostatinanalog før oppstart med langtidsvirkende somatostatinanalog, men det synes ikke å være nødvendig.
Anbefalinger:
- For å hindre progresjon av sykdommen anbefales somatostatinanaloger som førstelinjebehandling ved alle NET med Ki-67 <10 % og dokumentert gjenværende tumorvev etter kirurgisk behandling. (A)
- Somatostatinanaloger anbefales som symptomlindrende behandling ved funksjonelle NET, uavhengig av ev. progresjon. (B)
Peptid reseptor radionuklide terapi (PRRT)
Sist faglig oppdatert: 20.10.2020
Pasienter som har påvist svulster med høyt SSTR uttrykk kan behandles med målrettet radionuklidterapi hvor readionukliden er bundet til en somatostatinanalog med høy spesifikk binding til SSTR. I Norge benyttes beta-emitteren Lutetium-177 bundet til somatostatinanalogen Tyr3-oktreotate via chelatoren DOTA (177Lu-DOTATATE). 177Lu-DOTATATE har særlig høy affinitet for SSTR subtype 2, 6–9 ganger høyere enn 68Ga-DOTATOC. 177Lu-DOTATATE internaliseres i cellene og gir høy lokal stråledose med liten stråleffekt på omliggende friskt vev. Standard behandling består i 4 behandlinger hver med 7,4 GBq 177Lu-DOTATATE med ca. 8 ukers mellomrom. I forbindelse med infusjonen av 177Lu-DOTATATE gis aminosyreinfusjon med positivt ladete aminosyrer (arginin og lysin) for å redusere stråledosen til nyrene. Før behandling skal behandling med langtidsvirkende somatostatinanaloger være seponert i minimum 4 uker.
En fordel med Lutetium-177 er også en liten andel gammaemisjon, slik at man kan avbilde med gammakamera etter terapi og dermed foreta dosimetriske målinger.
(Kwekkeboom et al., 2005). PRRT er andre eller tredjelinjebehandling. Av behandlede pasienter har ca. 80 % effekt ved at sykdomsveksten stopper eller at svulstene blir mindre. PRRT er best dokumentert ved NET G1 og G2 (Brabander et al., 2017; J. Strosberg et al., 2017). Progresjonsfri overlevelse er 26 mnd (J. Strosberg et al., 2017). Det er også vist at NET G3 og NEC Ki67 < 55 % kan ha nytte av PRRT (Carlsen et al., 2019). PRRT behandlingen gis nå i Oslo (OUS), Bergen (Haukeland), Tromsø (UNN) og snart i Trondheim (St. Olav).
Behandlingen forutsetter kraftig økt tetthet av SSTR vist ved 68Ga-DOTATOC PET og kan vurderes dersom:
- Svulsten/svulstene ikke kan fjernes kirurgisk
- Inoperabel sykdom med progresjon tross standard første- ev. annenlinjebehandling
- Intraktable endokrine symptomer
Krav til behandling:
- Pasienten har generelt god allmenntilstand
- God nyrefunksjon (GFR>40 ml/min/1,73m2)
- God benmargsfunksjon
- God leverfunksjon
- Pasienten er selvhjulpen
Kvalme som oppstår under aminosyreinfusjon er vanlig. En blanding av arginin og lysin (Rollemans løsning) er å foretrekke fremfor generelle aminosyreblandinger pga. betydelig mindre kvalme. Andre bivirkninger er redusert nyrefunksjon og benmargsdepresjon som vanligvis er reversibel. En sjelden gang sees myelodysplastisk syndrom, leukemi (hos 1–2 % av behandlede), lever og nyresvikt (Bodei et al., 2015).
Beslutninger i Beslutningsforum for Nye metoder
Beslutningsforum tok 27.08.2018 følgende beslutning (ID2016_065):
- Peptidreseptor-radionuklidterapi basert på 177 Lutetium (Lutathera®) kan innføres i Norge som behandlingsmetode for nevroendokrine svulster.
- Helseregionene skal i felleskap gjennomgå hvordan et slikt tilbud kan organiseres etter initiativ fra fagdirektørene i RHF-ene.
- Tilråding om organisering av behandlingstilbudet skal forelegges AD-ene i RHF-ene for beslutning.
Anbefalinger:
- Behandling med 177Lu-DOTATATE (Lutathera®) kan tilbys som 2. eller 3. linjebehandling til pasienter med NEN med høy tetthet av SSTR subtype 2 visualisert ved 68Ga-DOTATOC PET. (B)
Kjemoterapi
Sist faglig oppdatert: 20.10.2020
Kjemoterapi ved GEP NEN
Siden kjemoterapi rammer celler i deling, vil man forvente en moderat klinisk effekt ved svulster med lav proliferasjonsindeks. Kjemoterapi er standard behandling ved NEC, både gitt adjuvant og palliativt. Ved NET er kjemoterapi best dokumentert ved pankreas NET. Nylig viste en fase III studie med 144 pasienter bedre effekt ved bruk av temozolomide+ capecitabine (PFS 23 mnd.) enn ved temozolomide alene (PFS 14 mnd.) ved progredierende pankreas NET G1-G2 (Kunz et al., 2018). Effekten i denne studien var uavhengig av Ki-67 verdi. Ved NET i tynntarm brukes vanligvis ikke kjemoterapi.
Hovedindikasjonen for bruk av kjemoterapi er dermed:
- Metastatisk og lokalavansert G1-G2 pankreas NET (se Pankreas).
- GEP-NEC (se Nevroendokrint carcinom (NEC)).
Testing for eventuell DPD-mangel
Omtrent 4–5 % av befolkningen har partiell DPD-mangel (Dihydropyrimidin-dehydrogenase), og kan risikere alvorlig toksisitet av 5-FU og kapecitabin (Meulendijks et al., 2015). Det er mulig å undersøke på noen genetiske varianter ved å undersøke DPYD genotype (Deenen et al., 2016). European Medicines Agency’s (EMA’s) Pharmacovigilance Risk Assessment Committee (PRAC) anbefalte nylig at alle pasienter som skal motta 5-FU, kapecitabine eller tegafur bør testes for eventuell mangel på DPD før man starter slik behandling. DPYD testing etableres nå i Norge og pasienter bør da testes før oppstart av 5-FU basert behandling. Ved genotype som tyder på redusert DPD-aktivitet, bør en følge internasjonale retningslinjer med redusert startdose (Amstutz et al., 2018). Ved genotype som tyder på manglende DPD-aktivitet bør behandling med 5-FU eller kapecitabine unngås.
Annen medikamentell behandling
Sist faglig oppdatert: 20.10.2020
Everolimus
mTOR-signalveien er ofte opp-regulert i NEN. Everolimus, en selektiv inhibitor av mTOR signalveien, har vist effekt ved NET-behandling i tre store fase III-studier. Radiant 3-studien (Yao et al., 2011) inkluderte 410 pasienter med metastatisk pankreas-NET, og viste en betydelig forbedret PFS for everolimus med 11,4 mnd. vs. 5,4 mnd. for placebo. Data fra Radiant 4-studien på 302 pasienter med metastatisk, progressiv ikke-funksjonell NET i mage-tarm og lunge (Yao et al., 2016) sammenliknet everolimus mot «best supportive care», og everolimus gruppen hadde signifikant bedre PFS 11 mnd. vs. 3,9 mnd.
De vanligste bivirkninger av everolimus er stomatitt, utslett, diaré, hyperglykemi, tretthet og infeksjoner. Dosereduksjon eller midlertidige avbrudd er ofte nødvendig. En alvorlig og ikke rent sjelden bivirkning (ca. 15 %) er non-infeksiøs pneumonitt (Iacovelli et al., 2012). Symptomer på dette er dyspnoe og hoste.
Sunitinib
Sunitinib er en multi-tyrosin kinase hemmer. I en fase III studie med 173 pasienter med P-NET, resulterte sunitinib-behandlingen i en betydelig forbedring i PFS til 11,4 mnd. vs. 5,5 mnd. for placebo (Raymond et al., 2011).
De vanligste bivirkninger av sunitinib er utslett, diaré, kvalme, oppkast, asteni og tretthet. Dosereduksjon eller midlertidige avbrudd er ofte nødvendig.
Immunterapi
Immunterapi med check-point inhibitorer har hatt skuffende resultater for GEP-NEN, og resultatene anses for svake til å anbefale bruk, med unntak hos pasienter med mikrosatelitt instabilitet (MSI). Kun enkeltresponser er sett ved NEC med 5 % responsrate (Vijayvergia et al., 2020), men respondere har hatt langvarig effekt. Kombinasjonen ipilimumab og nivolumab gav respons hos 3 av 8 pasienter (Patel et al., 2020).
MSI er til stede hos ca 6 % av NEC, og i denne gruppen kan immunterapi ha effekt (Azad et al., 2020; Sahnane et al., 2015).
Interferon
Interferon (IFN) alfa2b kan redusere NET-vekst og hormoninduserte symptomer. Vanligvis gis doser på 3–5 millioner enheter 3–5 ganger per uke som subkutane injeksjoner. Pegylert interferon (peginterferon alfa2b) synes å ha noe mindre bivirkninger og gis som subkutane injeksjoner, 50–150 µg/kg, én gang per uke.
Det finnes ingen placebokontollerte studier med IFN ved GEP-NET, men brukt ved tynntarms-NET er det registrert bedring av symptomer hos opptil 60 %, tumor reduksjon hos 10 % og tumorstabiliserende effekt hos opptil 65 %. Av og til varer effekten i lengre perioder (>36 mnd.) (Arnold et al., 2005; Faiss et al., 2003; Kolby, Persson, Franzen, & Ahren, 2003).
Det finnes tre randomiserte kontrollerte studier ved GEP-NET med kombinasjon av IFN og SSA. Kombinasjonsbehandlingen viste lengre tid til progresjon, dog ikke på statistisk signifikant nivå (Arnold et al., 2005; Faiss et al., 2003; Kolby et al., 2003). Interferon syntes å ha en additiv effekt til SSA for å redusere hormonsymptomer ved funksjonelle svulster.
Bivirkninger er vanlig, oftest influensaliknenede symptomer, utmattelse, redusert matlyst, psykiske symptomer og benmargspåvirkning. Erfaringsmessig tåler 1/3 behandlingen greit, 1/3 må slutte grunnet bivirkninger og 1/3 kan fortsette med akseptable bivirkninger.
Anbefalinger:
- Everolimus anbefales brukt som første eller andrelinjebehandling for progridierende gastroenteropankreatisk NET utenfor tynntarm. (A)
- Everolimus anbefales brukt som tredjelinjebehandling for progredierende tynntarms NET. (A)
- Sunitinib anbefales brukt som første eller andrelinjebehandling for progressiv NET utgående fra pankreas. (A)
- Interferon anbefales som tredje eller fjerdelinjebehandlinge ved tynntarms NET når Ki-67<10 %. (C)
Strålebehandling
Sist faglig oppdatert: 20.10.2020
Strålebehandling er aktuelt som palliativ behandling ved symptomgivende svulster og metastaser, særlig ved smertefulle skjelettmetastaser. Stereotaktisk strålebehandling kan også være aktuelt.
Strålebehandling, eventuelt i kombinasjon med kjemoterapi, kan vurderes som potensielt kurativ behandling ved NEC med lokalisert sykdom, spesielt ved primærtumor i øsofagus (Ku et al., 2008; Meng et al., 2013). Se Øsofagus.
Lokalbehandling av levermetastaser fra NET
Sist faglig oppdatert: 20.10.2020
Kirurgisk behandling og ablasjon
Palliativ, tumorreduserende behandling, enten med kirurgi eller radiofrekvensablasjon (RF) kan være indisert for å redusere alvorlige endokrine symptomer. Denne behandlingen har imidlertid ingen dokumentert betydning for overlevelse (J. Eriksson et al., 2008; Knigge & Hansen, 2012). RF-ablasjon er mindre effektivt på svulster over 4 cm. I en publisert systematisk oversikt om RF-ablasjon ved NET hadde de fleste pasienter multiple svulster med median diameter 3,8 cm (range 1–8 cm) (J. Eriksson et al., 2008; Knigge & Hansen, 2012). Symptombedring ble rapportert hos 90 % med en varighet på mellom 14–27 måneder. RF-ablasjon bør ikke utføres om leverreseksjon er indisert og teknisk mulig.
Hvis kirurgi eller RF-behandling er uaktuelt, og metastasene hovedsakelig er lokalisert til lever, eller det er progresjon av levermetastasene og ikke de ekstrahepatiske svulstene, kan leverarterieembolisering vurderes.
Sterotaktisk strålebehandling kan være aktuelt til enkelte som ikke er aktuellt for RF-behandling.
Leverembolisering
Nevroendokrine levermetastaser har sin blodforsyning i all hovedsak fra arteria hepatica. Dette gjør at nevroendokrine levermetastaser som ikke er tilgjengelig for behandling med reseksjon eller radiofrekvens ablasjon, kan behandles med arteriell leverembolisering (TAE). Ved negativ SRI er leverembolisering aktuelt. Ellers anbefales PRRT før leverembolisering da dette tolereres bedre og har bedre dokumentert effekt. Dersom metastasene er lokalisert både i høyre og venstre leverlapp, gjøres emboliseringen sekvensielt med et tidsrom på 4–12 uker mellom hver embolisering, mye avhengig av pasientens kliniske tilstand. Effekt på hormonelle symptomer og redusert tumorstørrelse ses hos ca. 50 %, men tallene varierer mellom forskjellige studier (Del Prete et al., 2014). Det er ikke dokumentert at kjemoembolisering (TACE) har bedre effekt enn ren partikkelembolisering (Fiore et al., 2014). Behandlingen er ressurskrevende, og pasientene kan bli svært medtatte med behov for hospitalisering, gjerne opptil flere uker.
Radioembolisering med intrahepatisk infusjon av 90Y dekkede partikler (SIRT) kan også være aktuell behandling. Absolutt kontraindikasjon mot leveremoblisering er sentral portvenetrombose (ikke ved SIRT), mens lite gjenværende normalt levervev og nedsatt allmenntilstand, er relative kontraindikasjoner. Leverarterieembolisering anbefales kun utført i sykehus som har erfaring med denne behandlingen.
Levertransplantasjon
Levertransplantasjon med kurativ hensikt kan vurderes i helt spesielle tilfeller. Pasienten må ikke ha fått påvist Ki-67 høyere enn 10 % på noen av sine svulster (fjernede eller gjenværende). Det må ikke foreligge ekstra-hepatisk sykdom (Mazzaferro et al., 2016). Basert på disse forutsetningene er det rapportert en 5-års overlevelse på over 90 %, og at over 80 % av de transplanterte pasientene er residivfrie etter fem år (Mazzaferro et al., 2016). Norske kriterier er i tillegg alder som regel ikke >65 år, stabil sykdom i ett år og minst ett år siden reseksjon av alt ekstrahepatisk svulstvev.
Anbefalinger:
- Leverreseksjon bør foretrekkes framfor radiofrekvensablasjon når det er mulig (D).
- Ved alvorlige endokrine symptomer bør tumorreduserende behandling av levermetastaser vurderes. (C)
- Leverarterieembolisering kan vurderes hvis det ikke foreligger portvenetrombose og kirurgi, eller RF-behandling er uaktuelt, og metastasene hovedsakelig er lokalisert til lever.
- Radiofrekvensablasjon er ikke anbefalt ved svulster >4 cm. (D)
- Til noen få utvalgte pasienter med høyt differensierte svulster og sykdom begrenset til lever, kan levertransplantasjon være aktuell behandling. (C)
Behandling av spesifikke symptomer
Sist faglig oppdatert: 20.10.2020
Noen symptomer ved NEN kan være spesielt plagsomme for pasientene.
Diaré
Sist faglig oppdatert: 20.10.2020
Diaré er hyppig både på diagnosetidspunktet og senere i forløpet. Det kan være flere årsaker til diaré, vanligst er hormonproduksjon fra pasientens svulster, følger etter tarmreseksjoner, samt bivirkning av medikamentell behandling.
Somatostatin analog (SSA) kan dempe hormonindusert diaré. Om ikke langtidsvirkende SSA er nok kan en supplere med hurtigvirkende SSA. Bruk av SSA kan imidlertid også gi diaré som bivirkning.
Fordøyelsesenzymer (Creon®, Pankrease®) tabl. kan prøves ved mistanke om SSA-indusert pankreasinsuffisiens. Start med 25 000 IE til måltider, og kan så trappes opp. Om pasienten ikke har effekt etter noen dager kan en seponere fordøyelsesenzymene.
Loperamid (Imodium®) tabl/mikstur 2–4 mg x 2–4 etter effekt kan forsøkes ved diaré.
Colestyramin (Questran®) 4 g, ½ pose x 1, så evt. opptrapping til 1x4 ved måltider, kan prøves hos pasienter som har fjernet terminale ileum som kan gi gallesyremalabsorpsjon.
Opiumsdråper (Dropizol) kan i mangel av effekt ved annen behandling forsøkes; 5–10 dr. inntil x 2–3.
Telotristat (Xermelo) (tryptofan hydroxylasehemmer med anti-serotonerg aktivitet) er et medikament som har vist effekt på diaréplager hos pasienter med metastatisk tynntarms NET og hormonindusert diaré (forhøyet 5-HIAA). Beslutningsforum besluttet 21.09.20 at Telotristat (Xermelo) ikke innføres til behandilng av diaré ved malignt karsinoid syndrom. «Det er dokumentert effekt av legemiddelet, men effekten over tid er usikker og prisen er for høy.»
Flushing
Sist faglig oppdatert: 20.10.2020
Den typiske flushingen opptrer ofte anfallsvis som en mørkerød til lilla hudrødme (erythem) på øvre delen av kroppen, først og fremst i ansiktet og på halsen. Flushing kan være av varierende lengde og intensitet, fra 2–5 minutter til flere timer. Flushingepisodene følges sjelden av varmefølelse/svette.
Enkelte pasienten har konstant flushing. Flushing kan utløses blant annet av fysiske og psykiske anstrengelser, måltider og alkohol. SSA har ofte god effekt på flushing. Av og til må dosen økes, og noen pasienter trenger tillegg av hurtigvirkende SSA.
Karsinoid hjertesykdom
Sist faglig oppdatert: 20.10.2020
Karsinoid hjertesykdom ved GEP-NEN kan oppstå hos pasienter med tynntarms NET med levermetastaser og karsinoid syndrom (Pellikka et al., 1993). Tidligere var karsinoid hjertesykdom en hyppig årsak til at pasienter med tynntarms NET døde. Man mener at høye serotonin nivåer i blod er en viktig faktor for utvikling av karsinoid hjertesykdom, med dannelse av fibrøse plakk som affiserer klaffene. Klaffesykdommen gir hovedsakelig høyresidig affeksjon med tricuspidal insuffisiens og pulmonal stenose, og pasienten får symptomer på høyresidig hjertesvikt med ødemer, nedsatt fysisk kapasitet og dyspne.
I tillegg til vanlig klinisk undersøkelse, inkludert auskultasjon og blodprøver med NT-pro BNP (Bhattacharyya, Toumpanakis, Caplin, & Davar, 2008), bør alle pasienter med tynntarms NET og levermetastaser undersøkes med ekkokardiografi, da selv nokså uttalt karsinoid hjertesykdom kan gi relativt lite symptomer. Dette er spesielt viktig før kirurgiske inngrep. Pasienter med NET i tynntarm kan leve lenge med sin sykdom til tross for utbredte metastaser, og alle pasienter med karsinoid hjertesykdom bør vurderes for klaffekirurgi og eventuelt opereres for sin klaffesykdom før man eventuelt velger å operere selve kreftsykdommen (Connolly et al., 1995). Dersom man ser tegn til karsinoid hjertesykdom ved ekkokardiografi, uten at det foreligger operasjonsindikasjon, bør pasienten følges relativt tett med ekkokardiografiundersøkelser. Årlige kontroller med NT-proBNP hos pasienter i risikogruppen kan være nyttig, men dokumentasjonen for dette er begrenset.
Anbefalinger:
- Hos pasienter med karsinoid syndrom anbefales rutinemessig ekkokardiografi ved diagnosetidspunktet, og senere dersom det tilkommer kliniske tegn eller symptomer på hjertesvikt. (D)
- Ved påvist karsinoid hjertesykdom anbefales ekkokardiografi årlig, eller hyppigere ved klinisk mistanke om progresjon av hjertesvikt. (D)
Nevroendokrint carcinom (NEC)
Patologi
Sist faglig oppdatert: 20.10.2020
Etter WHO-klassifikasjonen fra 2019, inndels nå NEN med Ki-67>20 % i to hovedgrupper avhengig av differensieringsgrad. Høyt differensierte NEN med KI-67 >20 % kalles NET G3, mens lavt differeniserte kalles nevroendocrine carcinom (NEC). Differensieringsgrad og mest mulig nøyaktig tallangivelse for Ki-67, skal alltid angis av patolog. Se også Patologi, klassifikasjon og stadieinndeling. NEC har Ki-67 >20 %, rikelig med mitoser og positiv immunhistokjemi for synaptophysin, mens mindre hyppig for CgA (Sorbye et al., 2013). NEC utgjør ca 85–90 % av alle NEN med Ki-67 > 20 % (Sorbye, Baudin, & Perren, 2018).
Klinisk presentasjon
Sist faglig oppdatert: 20.10.2020
NEC utgjør ca. 10–20 % av GEP NEN. Primærtumor forekommer vanligvis i øsofagus, ventrikkel, pankreas eller kolon (Sorbye et al., 2013). Metastatisk sykdom er ofte til stede allerede ved diagnosetidspunktet (Korse, Taal, van Velthuysen, & Visser, 2013). Symptomene er som regel knyttet til lokalisasjonen av primærtumor eller metastaser. Vekttap forekommer hyppig, mens hormon-indusert endokrine symptomer er ekstremt sjeldne. Sykdommen har ofte et aggressivt forløp med hurtig vekst.
Utredning
Sist faglig oppdatert: 20.10.2020
CT thorax/abdomen, ev. MR, skal utføres som initial staging. 18F-FDG PET viser vanligvis høyt opptak av FDG og bør utføres før kurativ kirurgisk behandling av lokalisert sykdom (Binderup et al., 2010). 68Ga-DOTATOC PET viser høyt tumoropptak for mange NEC, og kan være aktuelt å utføre i tillegg til 18F-FDG PET for pasienter med Ki-67 < 55 % når behandling med 177Lu-DOTATATE (Lutathera®) vurderes (Carlsen et al., 2019; Sorbye, Kong, & Grozinsky-Glasberg, 2020). CT/MR av hjernen skal kun utføres hvis det er kliniske symptomer på hjernemetastaser.
Behandling
Sist faglig oppdatert: 20.10.2020
Om radikal reseksjon av primærtumor er mulig, bør kirurgi vurderes (Haugvik et al., 2016; Shafqat, Ali, Salhab, & Olszewski, 2015; Xie et al., 2016).
Ved NEC i esofagus anbefales ikke primær kirurgi ved stadium III, men kjemoradioterapi alene eventuelt etterfulgt av kirurgi (Deng, Ni, Wang, Wang, & Chen, 2016; Ku et al., 2008; Meng et al., 2013; Sorbye, Strosberg, Baudin, Klimstra, & Yao, 2014).
Kirurgi for fjernmetastaser, eller debulking kirurgi, er generelt ikke anbefalt.
Adjuvant behandling
Selv om studiedata mangler, har det aggressive forløpet og hyppigheten av metastaser etter kirurgi ført til at internasjonale guidelines anbefaler adjuvant kjemoterapi etter antatt radikal kirurgi i form av 4–6 sykluser av cis/carboplatin og etoposide (Brenner et al., 2004; Ku et al., 2008). Profylaktisk hjernebestråling anbefales ikke.
Behandling ved metastaserende sykdom, palliativ behandling
Pasienter med metastatisk NEC som er aktuelle for palliativ kjemoterapi må henvises hurtig for vurdering før allmenntilstanden fallerer. Median overlevelse var i en nordisk studie kun 1 måned for pasienter som ikke fikk palliativ kjemoterapi (Sorbye et al., 2013). I den samme nordiske studien gav behandling med cis/carboplatin og etoposide en responsrate på 31 %, PFS var 4 måneder og median overlevelse 11 måneder (Sorbye et al., 2013). Det var ingen forskjell på effekt av cisplatin sammenliknet med carboplatin. Svulster med Ki-67 < 55 % responderte dårligere på platin-basert kjemoterapi, men pasientene hadde likevel en lengre overlevelse. Re-behandling med platin-basert kjemoterapi etter en behandlingspause gir ny respons hos ca. 50 % (Sorbye et al., 2013).
Standard palliativ behandling er platin-basert kjemoterapi med etoposid. Pasienter med NEC utgående fra colon og rectum, samt NEC med Ki-67 < 55 % ser ut til å ha en dårlig respons på platin-basert kjemoterapi, og annen kjemoterapi kan vurderes (Sorbye et al., 2014; Sorbye et al., 2013).
Det foreligger kun små studier med 2. linjebehandling etter platin-basert kjemoterapi. Aktuelle regimer er temozolomide-basert kjemoterapi, FOLFIRI eller FOLFOX (Hentic et al., 2012; Sorbye et al., 2014; Welin et al., 2011). Immunterapi med check-point inhibitorer har hatt skuffende resultater for GEP-NEC med kun 5 % responsrate (Vijayvergia et al., 2020). Respondere har dog hatt langvarig effekt. Kombinasjonen ipilimumab og nivolumab gav respons hos 3 av 8 pasienter (Patel et al., 2020). Resultatene anses for svake til å anbefale bruk med unntak av til pasienter med MSI. MSI er til stede hos ca 6 % av NEC, og immunterapi kan ha effekt i denne gruppen.
SRI opptak ved NEC er vanlig. PRRT kan vurderes ved opptak på SRI dersom Ki-67 < 55 % (Carlsen et al., 2019; Sorbye, Kong, et al., 2020), vanligvis som 2. linjebehandling.
Oppfølging og prognose
Sist faglig oppdatert: 20.10.2020
Radikalt opererte pasienter bør kontrolleres med CT hver 3. måned initialt da mange pasienter får hurtig residiv. Kontroller kan avsluttes etter 5 år. En analyse av over 2500 pasienter med GI-NEC diagnostisert i perioden 1973–2012 viste median overlevelse på 34 måneder for pasienter med lokalisert sykdom, 14 måneder ved regionale sykdom og 5 måneder ved metastatisk sykdom (Sorbye et al., 2014). Gunstige prognostiske parametere er god allmenntilstand, primær tumor i pankreas, normal serum LDH, normalt antall blodplater, immunhistokjemisk positivitet for CgA og Ki67 indeks < 55 % (Korse et al., 2013; Sorbye et al., 2013; J. R. Strosberg et al., 2010; Welin et al., 2011).
Anbefalinger:
- Radikal kirurgi bør vurderes ved lokalisert sykdom. (D)
- Ved lokalisert NEC i esofagus bør kjemoradioterapi initial gis framfor kirurgi. (C)
- Adjuvant kjemoterapi med Cisplatin/carboplatin bør vurderes etter radikal kirurgi. (D)
- Palliativ kjemoterapi bør startes raskt. (C)
- Ved Ki-67 > 55 % og metastatisk sykdom anbefales kjemoterapi med platinum + etoposid. (C)
- Ved Ki-67 < 55 % eller ved primærtumor utgående fra colorectal kan andre behandlingsregimer vurderes i metastatisk setting. (D)
- 2. linje palliativ kjemoterapi kan gis ved god allmenntilstand. (C)
Nevroendokrin tumor G3 (NETG3)
Klinisk presentasjon
Sist faglig oppdatert: 20.10.2020
Epidemiologiske data på denne relativt nylig definert subtype er begrensede. NET G3 utgjør mellom 1–15 % av GEP-NEN med Ki-67 > 20 %. Primær tumor forekommer vanligvis i pankreas (Heetfeld et al., 2015; Milione et al., 2017). Metastatisk sykdom er ofte til stede allerede ved diagnosetidspunktet (Sorbye et al., 2018). Median overlevelse ved metastatisk sykdom ser ut til å være 33–41 mnd., noe som er betydelig bedre enn ved NEC (Basturk et al., 2015; Heetfeld et al., 2015). Hormon-indusert endokrine symptomer kan forekomme.
Utredning
NET G3 er morfologisk høyt differensierte, men kan i noen tilfeller være vanskelig å skille fra NEC. Ki-67 indeks er vanligvis 21–50 %, og svært sjeldent høyere. CT thorax/abdomen bør utføres som initial staging. 68Ga-DOTATOC-PET viser oftest høyt opptak og bør utføres med tanke på mulig fremtidig radiopeptid behandling. 18F-FDG PET bør utføres før ev. PRRT behandling for å utelukke eventuell diskordant opptak.
Behandling
Behandling av lokalisert sykdom er lite dokumentert. I prinsippet bør kirurgi ved NET G3 vurderes som for NET G2. Kirurgi for fjernmetastaser kan være aktuelt.
Adjuvant behandling
I påvente av eventuelle studiedata, anbefales som ved NET G2 ingen adjuvant behandling.
Palliativ behandling
Det er for lite data til å gi bastante råd vedrørende optimal førstelinjepalliativ behandling. Responsrate (0–24 %) og progresjonsfri overlevelse (2,4–5 mnd.) er etter platina-basert behandling mye dårligere enn for NEC. En NET G2 behandlingsstrategi er anbefalt i påvente av data. Temozolomide/capecitabine, everolimus og sunitinib har alle vist effekt i små studier (Sorbye et al., 2019; Sorbye et al., 2018). Det er liten erfaring med bruk av SSA, men kan prøves forsøksvis ved NET G3 med Ki-67 i det lavere nivået. PRRT ser ut til å ha god effekt på NET G3 (Carlsen et al., 2019; Sorbye, Kong, et al., 2020), men det bør være høyt opptak på 68Ga-DOTATOC-PET i alle lesjoner påvist på 18F-FDG PET (ref).
Oppfølging og prognose
Radikalt opererte pasienter bør kontrolleres med CT thorax/abdomen hver 3.–6. måned initialt. NET G3 ser generelt ut til å ha en bedre prognose enn NEC, men verre enn for NET G2. Kontroller kan avsluttes etter (5-)10 år.
Palliativ behandling
Sist faglig oppdatert: 20.10.2020
De fleste NET-pasienter med metastaser har lang forventet levetid, selv om de ikke kan bli kurert for sin sykdom. Flere er i arbeid selv med avansert sykdom. Det kan by på psykososiale utfordringer å leve med en slik kreftsykdom, og her kan pasientforeningen for nevroendokrine svulster, CarciNor, være til hjelp (http://www.carcinor.no/).
Målet med ev. tumorrettet palliativ behandling er å oppnå forlenget levetid samtidig med best mulig symptomlindring og livskvalitet, og er beskrevet andre steder i handlingsprogrammet.
Pasienter med metastatisk NEN vil i den siste fasen av sykdommen kunne ha de samme plager og behov for symptomlindring som andre kreftpasienter (Palliasjon: nordisk lærebok, 2016), og man må vurdere om palliative team skal kobles inn som et supplement til oppfølging fra fastlege og hjemmetjenesten.
For mer informasjon om symptomrettet palliativ behandling, vises det til Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen
Oppfølging og kontroller
Sist faglig oppdatert: 20.10.2020
Oppfølgingslengde og kontrollhyppighet justeres i forhold til pasientens alder, komorbiditet, antatt prognose og behandlingsalternativer ved residiv eller progresjon.
Ved utskrivningssamtale med pasient og eventuelt pårørende, forberedes pasienten på hva han/hun kan forvente seg etter utskrivelsen, og det informeres om hvor pasienten kan henvende seg med problemer. Pasient og pårørende orienteres om kontrollopplegget.
Antatt radikalt opererte
Sist faglig oppdatert: 20.10.2020
Billeddiagnostikk
Ved kontroller bør det gjøres billeddiagnostikk. Hos pasienter under 50 år anbefales MR, der MR kan brukes for å redusere strålebelastningen. Ellers anbefales enten MR eller CT, avhengig av lokale preferanser, kompetanse og kapasitet. MR er generelt bedre på å visualisere leverpatologi, og CT kan være bedre på patologi ekstrahepatisk. Med mindre det er kontraindikasjoner mot kontrast, er det helt vesentlig at CT-undersøkelser av abdomen gjøres i både arteriell og portovenøs fase. Det er ikke indikasjon for å gjøre SRI rutinemessig. 68Ga-DOTATOC, ev. 18F-FDG PET, kan være nyttig ved mistanke om residiv eller progredierende sykdom når det er funn av usikker eriologi på CT eller MR.
Biomarkører
CgA i serum kan følges hos pasienter med NET som har fått påvist forhøyet CgA preoperativt.
Nytten av CgA i oppfølgingen er omdiskutert og lite dokumentert, og anbefales ikke uten samtidig bildekontroll. Dersom CgA var normal før operasjon, er det neppe grunn til å måle CgA rutinemessig.
Det er ikke indikasjon for å gjøre U-5HIAA målinger rutinemessig.
Hyppighet av kontroller etter antatt radikal operasjon
NET: Bør følges opp i 12 år fra tidspunkt for antatt radikaloperasjon. Dette gjelder også nevroendokrine appendikssvulster, der det etter gjeldene retningslinjer er indikasjon for hemikolektomi og det påvises glandelmetastaser i operasjonspreparatet, og hos pasienter med nevroendokrine rektumsvulster G2, uansett størrelse, og nevroendokrine rektumsvulster G1 større enn 1 cm. (D)
NEC: Bør følge opp i 5 år. (D)
|
| 3 mnd | 6 mnd | 1 år | 1,5 år | 2 år | 2,5 år | 3 år | 4 år | 5 år | 7 år | 9 år | 12 år |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NET G1-G3 |
| x | x |
| x |
| x | x | x | x | x | x |
| NEC | x | x | x | x | x | x | x | x | x |
|
|
|
Pasienter med gjenværende ikke-resektabelt tumorvev
Sist faglig oppdatert: 20.10.2020
Dette gjelder pasienter der reseksjon ikke er teknisk mulig, og hos pasienter med gjenværende tumorvev som er resektabelt, men der man av en eller annen grunn – som komorbiditet eller høy alder – ikke ønsker å tilby kirurgi.
Billeddiagnostikk
Ved kontroller bør det gjøres billeddiagnostikk etter de samme overveielser som er nevnt ovenfor under «Antatt radikalt opererte». Hos noen pasienter synes svulstene bedre på en modalitet enn en annen. Hvilken modalitet som er best egnet for den enkelte pasient må vurderes individuelt.
Biomarkører
Det er ikke indikasjon for å måle CgA, urin 5-HIIA eller hormoner rutinemessig i oppfølgingen (Dam et al., 2020).
Målinger av urin 5-HIIA kan gi nyttig informasjon dersom økende symptomer (diaré og flushing) tross uendret størrelse på svulstene vurdert fra bildemodaliteter, samt hos pasienter med karsinoid hjertesykdom hvor det trolig er viktig å senke hormonproduksjonen så lavt som mulig.
Hyppighet av kontroller av pasienter med gjenværende tumorvev
Sist faglig oppdatert: 20.10.2020
NET: Kontroller hver 3.–6. mnd. under behandling med kjemoterapi eller molekylært rettet behandling (everolimus/ sunitinib). Ved stabil sykdom kan intervallene økes til 6 mnd. Pasienter som er under behandling med somatostatinanalog/interferon kontrolleres hver 6 mnd., økende til hver 9.–18. mnd. ved stabil sykdom.
NEC: hver 2.–3. mnd., etter individuell vurdering.
Fastlegens rolle
Sist faglig oppdatert: 20.10.2020
Utredning, behandling og oppfølging av pasienter med NET er en spesialistoppgave, men fastlegen har en sentral plass i initial diagnostikk og henvisning. Underveis i behandlingen bidrar fastlegen med injeksjoner av somatostatinanaloger. Samarbeidet fortsetter også etter at pasienten har fått kontaktlege i spesialisthelsetjenesten, blant annet med håndtering av bivirkninger, lindring av symptomer, sykmelding og kontakt med NAV.
For generelle betraktninger rundt fastlegens rolle i norsk kreftomsorg, se publisert informasjon på Helsedirektoratets nettsider
Seneffekter og senbivirkninger
Sist faglig oppdatert: 20.10.2020
Det er i hovedsak lite problemer med seneffekter av behandling ved NET-svulster, da stråling og tradisjonell cytostatikabehandling er lite brukt.
Enkelte pasienter får vedvarende diaréplager etter tarmreseksjon ved tynntarms NET (høyresidig hemikolektomi), og må bruke gallesyrebindere fast for å unngå dette problemet. Omfattende pankreaskirurgi kan medføre eksokrin pankreasinsuffisiens, som gir symptomer i form av ubehag i magen, vekttap og diaré grunnet fettmalabsorpsjon. Disse plagene behandles effektivt med tilskudd av pankreasenzymer.
Behandling av NEC er, i motsetning til NET, basert på cytostatika. Pasienter som får platinumbaserte kurer og blir langtidsoverlevere, kan oppleve fatigue, nevropatier og nedsatt hørsel, men ofte går disse plagene over på lang sikt.
Rapport om seneffekter etter kreftbehandling
I 2017 ga Helsedirektoratet ut rapporten Seneffekter etter kreftbehandling: faglige råd. Målgruppen for rapporten er klinikere og annet helsepersonell som er i kontakt med kreft-pasienter, og pasienter som har vært gjennom kreftbehandling. Rapporten har kapitler om sekundær kreft, kardiovaskulære seneffekter, pulmonale seneffekter, hormonforstyrrelser etter kreftbehandling, seksualitet etter kreftbehandling, kognitive problemer, fatigue, langtids-bivirkninger etter behandling av hjernesvulst, psykososiale forhold, tann- og munnhuleproble-mer og spesielle forhold etter kreftbehandling hos barn. En oppdatert og utvidet utgave ble publisert april 2020, der også temaene muskel- og skjelettskader, perifere neuropatier, seneffekter etter kreft i bekkenregion, fertilitet og lymfødem er inkludert: Seneffekter etter kreftbehandling.
Det er særlig viktig at fastleger, som skal følge opp pasienter som er skrevet ut fra spesialisthelsetjenesten, er oppmerksomme på risikoen for seneffekter etter kreftbehandling, og at disse kan debutere lenge etter avsluttet behandling.
Øsofagus
Klinisk presentasjon
Sist faglig oppdatert: 20.10.2020
NEN i øsofagus er meget sjeldent, < 0,5 % av alle GEP-NET, og halvparten er NEC (Boyar Cetinkaya et al., 2017). Ved endoskopi finnes de aller fleste i nedre del av øsofagus, enten som en enkel lesjon (>90 %) eller diffuse mukosale lesjoner/ulcerasjon, sjeldnere som et tilfeldig funn i biopsier ved Barrets øsofagus eller i adeno-/plateepitelcarcinom. Mer enn 50 % har metastaser til regionale lymfeknuter ved diagnose.
Utredning
Sist faglig oppdatert: 20.10.2020
Øsofagoskopi med endoskopisk ultralyd (EUS) for biopsier og staging er standard diagnostikk. Metastaseutredning gjøres med CT eller MR, med tillegg av SRI ved NET og FDG-PET ved NEC. Behandling
Det foreligger lite dokumentasjon og internasjonale retningslinjer for behandling av NET i øsofagus. Det foreslås endoskopisk reseksjon ved NET i øsofagus der tumor er < 1 cm og uten lymfeknutespredning. Der tumor er > 1 cm og det ikke er mistanke om lymfeknutespredning, foreslås kirurgi som for annen øsofaguscancer. Ved øsofagus NEC er kjemoradioterapi det best dokumenterte kurative behandlingsalternativet (Kukar et al., 2013; Meng et al., 2013). (Se Nevroendokrint carcinom (NEC).)
For metastatisk sykdom finnes det lite dokumentasjon, og det anbefales behandling etter samme prinsipper som for andre NEN med samme grad av Ki-67.
Oppfølging og prognose
Sist faglig oppdatert: 20.10.2020
Kontrollhyppighet justeres i forhold til pasientens alder, komorbiditet, antatt prognose, behandlingsalternativer og -muligheter ved eventuelt residiv eller progresjon. (Se Oppfølging og kontroller).
Anbefalinger:
- EUS med FNA anbefales for diagnose og staging av Ø-NEN. (D)
- Endoskopisk reseksjon anbefales der tumor er < 1 cm uten lymfeknuter. (D)
- Kirurgi vurderes som ved annen øsofaguscancer når tumor er over >1 cm. (D)
Ventrikkel
Patologi og klassifikasjon
Sist faglig oppdatert: 20.10.2020
Nevroendokrine ventrikkelsvulster er oftest høyt differensierte og utgjør ca. 5 % av alle NET (Boyar Cetinkaya et al., 2017; Sandvik et al., 2016). Svulstene deles inn i tre grupper, type 1, 2 og 3 (Delle Fave et al., 2012). De to første gruppene er høyt differensierte og utvikles fra enterokromaffin-liknende celler (ECL- celler) ved høye serum gastrinnivåer. Svulstene av type 1 og 2 er ofte små og multiple, vokser svært langsomt og sprer seg normalt ikke før de blir 1 cm eller større.
Type 1 svulster sees ved høye gastrinnivåer sekundært til nedbryting av parietalceller ved atrofisk gastritt, og finnes oftest hos kvinner.
Type 2 svulster skyldes høye gastrinnivåer forårsaket av gastrinproduserende svulster; gastrinomer (Zollinger- Ellisons syndrom). Tumorliknende lesjoner i form av diffus, lineær og mikronodulær ECL hyperplasi antas å være forstadier til type 1, ev. type 2 svulster. Lite vites om det naturlige forløpet til disse hyperplasiene.
Type 3 utvikles uavhengig av gastrinnivåer og er lavere differensiert (ofte NEC), og har høyere Ki-67. De er single, ofte store, og har gjerne spredt seg på diagnosetidspunktet.
Det henvises ellers til Patologi, klassifikasjon og stadieinndeling.
Klinisk presentasjon
Sist faglig oppdatert: 20.10.2020
Ventrikkel NET påvises oftest tilfeldig ved gastroskopi. Ved avanserte svulster, og særlig ved type 3, kan det foreligge symptomer som for annen ventrikkelkreft. Ventrikkel NET produserer sjeldent symptomgivende hormoner.
Utredning
Sist faglig oppdatert: 20.10.2020
Diagnosen baserer seg på biopsi, ev. finnålsaspirasjon ved EUS-prosedyre, da det kan være vanskelig å få representative biopsier med vanlig biopsitang. Det bør i tillegg tas biopsier fra corpus ventrikkuli for å kunne skille mellom type 1 (atrofisk gastritt) og type 2 (Delle Fave et al., 2016), samt sjekke H.pylori status
Serum gastrin og CgA er normalt forhøyet ved type 1 og 2, sjeldnere ved type 3.
Det er normalt ikke indikasjon for nærmere utredning ved type 1, med mindre svulsten er 1 cm eller større. Ved type 2 anbefales utredning for å påvise et ev. gastrinom, og ved type 3 anbefales utredning med CT/MR og eventuelt 68Ga-DOTATOC PET.
Behandling
Sist faglig oppdatert: 20.10.2020
Type 1 og type 2
Type 1 og type 2 skal fjernes dersom de er 1 cm eller større (Delle Fave et al., 2016). Man anbefaler også å fjerne mindre (7–8 mm) lesjoner da de er enklere å behandle endoskopisk i et tidlig stadium. Dersom de ikke vokser inn i muscularis propria basert på endoskopisk ultralyd, anbefales endoskopisk mukosal reseksjon (EMR) eller endoskopisk submukosal disseksjon (ESD). Erfaringsmessig er det sjelden mulig å fjerne svulster over 1–2 cm endoskopisk. Alternativet er kirurgisk reseksjon som ved adenocarcinom i ventrikkelen.
Somatostatinanaloger kan stanse vekst eller redusere størrelsen av disse svulstene (Fykse, Sandvik, & Waldum, 2005). Betydningen av dette er prognostisk usikkert. Det kan per i dag derfor ikke anbefales å gi somatostatinanloger på denne indikasjonen.
Type 3
Om det foreligger lokoregional sykdom, anbefales kirurgisk reseksjon som ved vanlig adenocarcinom i ventrikkelen, uansett størrelse av primærtumor.
Metastatisk sykdom
Sist faglig oppdatert: 20.10.2020
For metastatisk sykdom finnes det lite dokumentasjon, og det anbefales behandling etter samme prinsipper som for andre NEN med samme grad av Ki-67.
For behandling av NEC, se Nevroendokrint carcinom (NEC).
Oppfølging og prognose
Sist faglig oppdatert: 20.10.2020
Kontrollhyppighet justeres i forhold til pasientens alder, komorbiditet, antatt prognose, behandlingsalternativer og -muligheter ved eventuelt residiv eller progresjon. (Se Oppfølging og kontroller).
Diffus, lineær og mikronodulær ECL hyperplasi
Diffus, lineær og mikronodulær ECL hyperplasi følges opp med en kontroll gastroskopi etter 1 år, deretter hvert 3. år.
Type 1: Svulster < 1 cm
Gastroskopier med 6–12 mnd. intervaller initialt, senere årlig eller hvert annet år, sannsynligvis livslangt. Hos pasienter som har fått fjernet svulster > 1 cm: Gastroskopikontroller som over. I tillegg CT/MR kontroller som ved antatt radikalt fjernede NET.
Type 2
Oppfølgingen vil avhenge av forhold ved pasientens gastrinom.
Type 3
Som for andre NEN, med tillegg av gastroskopikontroll etter 6 mnd, så årlig i 5 år.
Anbefalinger:
- Ved påvisning av nevroendokrine svulster i ventrikkel anbefales også biopsier av normalt utseende slimhinne i corpus for å skille undergrupper. (C)
- Ved type 2 ventrikkel NET anbefales utredning for å påvise gastrinom. (D)
- Ved type 3 anbefales utredning for å påvise ev. metastaser uansett størrelse av primærtumor. (D)
- Ved type 1 og 2 skal tumor fjernes dersom de er 10 mm eller større, men anbefales fjernet allerede ved 7–8 mm. (C)
- Ved type 3 med lokoregional sykdom uten påviste metastaser, anbefales kirurgisk reseksjon uansett størrelse av primærtumor. (D)
Duodenum
Patologi
Sist faglig oppdatert: 20.10.2020
Det henvises til eget patologikapittel – Patologi, klassifikasjon og stadieinndeling.
Klinisk presentasjon
Sist faglig oppdatert: 20.10.2020
De fleste svulster er sporadiske og ikke-funksjonelle. Blant de funksjonelle er gastrinom vanligst.
Ved påvisning av gastrinom, og da spesielt multiple svulster, må man mistenke MEN1-syndrom.
Utredning
Sist faglig oppdatert: 20.10.2020
Histologisk undersøkelse er avgjørende for å skille mellom de ulike typer duodenal NET. Serum måling av gastrin og CgA bør utføres. CT pankreas, EUS og SRI anbefales som staging.
Behandling
Sist faglig oppdatert: 20.10.2020
Utredning med billeddiagnostikk, endoskopi og biopsi danner grunnlag for gradering og staging som er viktige for valg av behandling.
NET under 1–2 cm i diameter:
Endoskopisk reseksjon er som oftest mulig og bør vurderes (Gincul et al., 2016; Margonis et al., 2016).
NET > 1–2 cm:
Åpen kirurgi med lokal reseksjon, enten som fullveggs reseksjon ved lokalisasjon på duodenums konvekse side, eller gjennom duodenotomi og eksisjon på medialsiden (Norton, 2005). Peroperativt palperes duodenum med tanke på øvrige små svulster, eventuelt kan duodenalvegg visuelt inspiseres ved peroperativ gastroskopi (Fendrich, Langer, Waldmann, Bartsch, & Rothmund, 2007).
Lokalavanserte svulster:
Ved papille svulster som ikke kan håndteres med lokal reseksjon og eventuell reimplantasjon av pankreas- og gallegang, eller ved øvrige avanserte svulster som ikke kan fjernes lokalt, utføres Whipples operasjon (Margonis et al., 2016).
Pasienter med gastrinom som ikke er radikalt operert behandles med PPI, ofte i store doser siden selv svært små gastrinomer kan gi alvorlige symptomer. Andre typer funksjonelle NET kan ha nytte av SSA-behandling. For metastatisk sykdom finnes det lite dokumentasjon og det anbefales behandling etter samme prinsipper som for andre NEN med samme grad av Ki-67.
Oppfølging og prognose
Sist faglig oppdatert: 20.10.2020
Kontrollhyppighet justeres i forhold til pasientens alder, komorbiditet, antatt prognose, behandlingsalternativer og -muligheter ved eventuelt residiv eller progresjon, se Oppfølging og kontroller.
Gastroskopikontroller er aktuelt hver 3.–12. mnd. For øvrig oppfølging som beskrevet i Oppfølging og kontroller. Prognosen er god, med en median overlevelse på mer enn 100 måneder ved lokaliserte og regionalt metastaserte svulster. For svulster med fjernmetastaser er 5-års overlevelse ca. 60 %.
Anbefalinger:
- Som primærutredning anbefales CT pankreas, EUS og SRI for staging, samt måling av gastrin og CgA i serum. (D)
- Ved påvisning av gastrinom må man vurdere om pasienten har et MEN1 syndrom. (C)
- NET under 1–2 cm kan vanligvis fjernes endoskopisk. (C)
- NET over 1–2 cm reseseres kirurgisk. (D)
- Pasienter med gastrinom som ikke opereres radikalt, behandles med PPI. (C)
Pankreas
Patologi
Sist faglig oppdatert: 20.10.2020
Det henvises til eget patologikapittel – Patologi, klassifikasjon og stadieinndeling.
Klinisk presentasjon
Sist faglig oppdatert: 20.10.2020
Nevroendokrine pankreas svulster (P-NET) utgjør 1–2 % av alle solide svulster i pankreas. Svulstene deles i to hovedgrupper, de funksjonelle, som har kliniske symptomer relatert til produksjon av ett eller flere hormoner, og de mer vanlige ikke-funksjonelle som kan debutere med symptomer som ved adenokarsinom i pankreas. P-NET er ofte et tilfeldig funn ved billeddiagnostikk for annen klinisk problemstilling. Ved de små, ikke-funksjonelle og asymptomatiske P-NET, kan observasjon uten behandling vurderes. Blant de funksjonelle er insulinomer de vanligste, etterfulgt av gastrinomer (R. T. Jensen et al., 2012). Selv små svulster på bare noen millimeter kan gi opphav til uttalte hormonelle symptomer.
Bortsett fra insulinomer, der mindre enn 10 % har spredt seg, har P-NET et betydelig malignt potensial, avhengig av differensieringsgrad og størrelse.
Funksjonelle svulster
Sist faglig oppdatert: 20.10.2020
Insulinom
Intet predileksjonssted i pankreas. Ofte små (< 1–2 cm) og ofte SRI negative. Mer enn 90 % er «benigne» og kan ofte enukleeres. Større svulster (> 2–3 cm) er oftere maligne.
Gastrinom
Predileksjonssted er området mellom pankreas-hodet, duodenum og ductus choledocus, og har stort potensiale for å spre seg. Man regner med at ¼ er assosiert med MEN1, mens ¾ er sporadiske.
Glucagonom
Predileksjonssted i corpus og cauda. Stort potensiale for å spre seg.
VIP-om
Oftest lokalisert i distale pankreas, men kan være multifokale. Stort potensiale for å spre seg.
Tumor ledd i MEN1/Zollinger-Ellingson eller von Hippel Lindau
Sist faglig oppdatert: 20.10.2020
Ved MEN1 er de vanligste manifestasjonene: primær hyperparathyreodisme, P-NET og hypofysetumor (prolactinom). Inntil 80 % har P-NET, oftest gastrinomer. De er ofte multifokale. Ved MEN1 er indikasjon og omfang av kirurgi omstridt. Ved von Hippel-Lindau er de vanligste manifestasjoner vaskulære lesjoner i CNS, nyre cyster/kreft, paragangliomer og PNET (ofte cystiske)
Utredning
Sist faglig oppdatert: 20.10.2020
CT-thorax og CT/MR abdomen med dedikerte bilder av pancreas samt noen ganger 68Ga.DOTATOC PET ved primærdiagnose og før kirurgisk behandling.
EUS-veiledet biopsi (FNAC) anbefales ved tvil om diagnose og ved usikkerhet vedrørende vekstpotensiale, dersom man planlegger å følge pasienten uten intervensjon (Larghi et al., 2012).
Måling av spesifikke hormoner utføres på mistanke om en funksjonell tumor. Se også punkt Symptomer. om hormonelle syndromer.
Ved mistanke om:
- Insulinom: Anbefales 72 timers fastetest med måling av insulin, pro-insulin og c-peptid ved blodsukker < 2.5 mmol/l og hypoglykemisymptomer eller <2.2 mmol/l uten følingssymptomer (R. T. Jensen et al., 2012).
- Gastrinom: Måle gastrin. Gastrinomer kan være vanskelige å påvise. Forhøyet gastrin kan ha flere årsaker (som atrofisk gastritt og ved PPI bruk), og gastrinnivået alene er ikke diagnostisk for et gastrinom. En sekretintest vil gi stigning av gastrin ved gastrinom. Kriteriet for en positiv sekretintest (2U/kg rask infusjon) er en stigning av gastrin på 120 pg/ml over basalt gastrinverdi (R. T. Jensen et al., 2012). Testen er vanskelig tolkbar dersom pasienten bruker PPI eller har atrofisk gastritt.
- Differnsialdiagnoser til små hypervaskulære lesjoner i pancreas: Bimilt, solide pseudopappilære neoplasmer (Franz tumor), serøse cystadenomer, pankreatisk GIST, metastaser (særlig nyrecancer).
Behandling
Sist faglig oppdatert: 20.10.2020
Observasjon ved ikke-funksjonelle svulster
Det er en viss sammenheng mellom tumordiameter og malignitetsrisiko. Risikoen for spredning er liten for svulster under 1,5–2 cm, selv om lokal glandelspredning kan påvises hos ca. 10 % av pasienter med svulster under 1 cm (Hashim et al., 2014). I en studie ble det observert at av de asymptomatiske svulstene <2 cm var 13 % WHO grad 2 eller 3, og 12 % hadde lymfeknutemetastaser. Begge disse forhold er negative prediktive faktorer med tanke på langtidsoverlevelse (Fischer et al., 2014). På den annen side konkluderer en større case-control studie med at observasjon av svulster < 3 cm er adekvat og trygt (Sadot et al., 2016). I praksis vil det være umulig å vite hvorvidt en nyoppdaget liten hypervaskulær pancreassvulst er en G1–2 eller G3. Det anbefales derfor nye bilder etter 3 mnd. for å vurdere veksthastigheten og eventuelt supplere med EUS med vevsprøve fra lesjonen for differensialsdiagnostisk avklaring. Er det ikke vekst kan man observere pasienten gitt at tumor er under 2 cm. (Massironi et al., 2016; Regenet et al., 2016) Små ikke-funksjonelle pankreas NET som observeres gis ikke behandling med SSA. Dersom det påvises vekst etter 3 mnd. bør man vurdere kirurgi selv om tumor er under 2 cm (Baechle et al., 2020).
Kirurgi må vurderes individuelt basert på pasientens ønsker, alder, komorbiditet og type inngrep som vil være aktuelt.
Kirurgi
Operabilitet og resektabilitetssvurdering av primær tumor ved kurativ behandling av P-NET er den samme som for pankreasadenocarcinom.
Levermetastaser er oftest multiple og bilobære, og behandling av disse omtales også i Generelt om behandling.
Mulige scenario ved funn av levermetastaser etter adekvat utredning
Dersom primærtumor og (lever) metastaser er resektable; operasjon i en eller to seanser med kurativ intensjon.
Dersom det foreligger ikke-resektable metastaser:
- Ved hormonproduserende metastaser vil tumorreduserende tiltak være viktig. Det er imidlertid slik at metastaser fra funksjonelle primærsvulster ikke selv trenger å være funksjonelle, og reseksjon av primærtumor kan alene gi symptombedring/-frihet.
- Ved non-funksjonelle svulster er det uavklart om det er gevinst ved reseksjon av primærtumor alene. Reseksjon kan være aktuelt for utvalgte pasienter med svulster i corpus/cauda regionen for å forhindre lokale komplikasjoner (Bertani et al., 2017; Capurso et al., 2011). Reseksjon kan også være aktuelt hos pasienter som kan bli kandidater for levertransplantasjon (se punkt Lokalbehandling av levermetastaser fra NET)
Medikamentell behandling
Adjuvant behandling
Det er ingen dokumentasjon for adjuvant behandling etter antatt radikal operasjon for pankreas NET, og hverken kjemoterapi eller SSA anbefales når det ikke er gjenværende tumorvev.
Behandling ved ikke-resektabel sykdom
Hos pasienter med metastatisk eller lokalavansert inoperabel sykdom finnes en rekke behandlingsalternativer i 1. linje (SSA, everolimus, sunitinib og kjemoterapi). Det finnes ingen prospektive sammenlignende studier som viser hvilket av alternativene som bør velges i 1. linje. Valg av behandling avhenger av faktorer som sykdomsutbredelse, tumors veksthastighet, Ki-67, forventet toleranse av behandlingen og pasientens preferanser.
PRRT er først aktuelt i 2. linje på lik linje med de tre andre alternativene.
Kjemoterapi
Temozolomid + kapecitabin (CAPTEM) brukes ofte som førstevalg når kjemoterapi benyttes i behandlingen pankreas NET.
Temozolomid i kombinasjon med kapecitabin har i en studie gitt en respons rate på 70 % og PFS på 18 måneder (J. R. Strosberg et al., 2011). I en nyere fase III studie (ECOG 2211) der 144 pasienter med progredierende pankreas NET ble randomisert til enten temozolomid alene eller til kombinasjonsbehandling med temozolomid og kapecitabin, var PFS signifikant høyere i kombinasjonsarmen (22,7 mnd vs 14,4 mnd). OS i monoterapiarmen var 38 mnd., mens den ennå ikke er nådd i kombinasjonsarmen (Kunz et al., 2018).
Toksisitet er vanligvis mild med kvalme og hematologisk toksisitet.
STZ i kombinasjon med 5-FU er et alternativ til CAPTEM og har vært brukt i flere tiår i behandling av pankreas NET. STZ i kombinasjon med 5-FU gis vanligvis initialt som en 5-dagers induksjonskur, etterfulgt av en-dags infusjon hver 3. uke. STZ er nefrotoksisk. Respons rater (RRs) på 6–40 % med progresjonsfri overlevelse (PFS) på 5–20 måneder, og median overlevelse på 16–24 måneder, er rapportert (B. Eriksson & Oberg, 1993; Moertel, Hanley, & Johnson, 1980).
Everolimus eller sunitinib
Everolimus eller sunitinib kan gis som 1. linjebehandling eller i senere linjer etter PRRT. Det foreligger ingen prospektiv studie som peker på hvilket av alternativene som er førstevalg. Ved insulinomer bør imidlertid everolimus være 1. linje grunnet blodsukkerhevende effekt.
PRRT
PRRT vurderes hos egnede pasienter med svulster med høyt SSTR uttrykk, og er først aktuelt i 2. eller senere linjer.
Symptomatisk behandling
Forhøyet syreproduksjon ved gastrinom
PPI kan kontrollere symptomene.
Hypoglykemi ved insulinom
Hyppige, små måltider kan redusere episodene med hypoglykemi. Everolimus har vist seg å være svært effektiv i behandlingen av hypoglykemi ved å hemme insulin sekresjon og øke insulin resistens hos pasienter med malign tumor (Bernard et al., 2013). Diazoxide, SSA (obs. paradoks effekt grunnet hemming av glucagonfrigjøring) og kontinuerlig glukoseinfusjon er andre muligheter som kan prøves. I noen tilfeller med alvorlige og hyppige hypoglykemianfall, kan kontinuerlig infusjon med glukagon bli nødvendig. Glukokortikoider anbefales ikke.
VIP-indusert diaré og hudlesjoner ved glukagonom kan reduseres effektivt med SSA.
Oppfølging og prognose
Sist faglig oppdatert: 20.10.2020
Kontrollhyppighet justeres i forhold til pasientens alder, komorbiditet, antatt prognose, behandlingsalternativer og -muligheter ved eventuelt residiv eller progresjon. (Se Oppfølging og kontroller.) Median overlevelse i en stor kohort av 324 pasienter var 99 måneder (Ekeblad et al., 2007). 5- og 10-års overlevelse var henholdsvis 64 % og 44 %. For pasienter med gastrinom, er 5-års overlevelse nær 100 % i fravær av levermetastaser, og 50 % når levermetastaser er til stede. For pasienter med malignt insulinom er median overlevelse kun 2 år.
Insulinomer: Pasienter som er radikalt operert for små svulster (<1 cm) bør ha en postoperativ klinisk og biokjemisk kontroll, men ytterligere kontroller anses ikke nødvendig. Prognosen er utmerket og lik normalbefolkningen.
For pasienter som er antatt radikalt operert ved kirurgi eller har gjenværende ikke-resektabelt tumorvev, anbefales en mer strukturert oppfølging, se Oppfølging og kontroller.
Anbefalinger:
- CT thorax og CT/MR abdomen med dedikerte bilder av pancreas, samt 68Ga-DOTATOC PET, utføres ved primærdiagnose for staging og før kirurgisk behandling. (C)
- Måling av spesifikke hormoner utføres ved mistanke om hormonproduserende tumor. (D)
- Ikke funksjonelle P-NET <1,5–2.0 cm kan observeres etter en intial vurdering av vekstpotensial ved bildekontroll, initialt med 3 mnd. intervall. (C)
- Ved ikke resektabel metastatisk sykdom er SSA, kjemoterapi, everolimus, sunitinib og PRRT aktuelle behandlingsregimer. (B, C)
Tynntarm
Patologi
Sist faglig oppdatert: 20.10.2020
Se eget generelt patologikapittel (Patologi, klassifikasjon og stadieinndeling).
Klinisk presentasjon
Sist faglig oppdatert: 20.10.2020
Omtrent 25–30 % av de gastroenteropankreatiske nevroendokrine neoplasmer utgår fra tynntarm og er hyppigst lokalisert til distale del av ileum (Digestive System Tumours, 2019; Pape et al., 2012). De fleste primærsvulstene er små, og i ca. 30 % av tilfellene er de multiple. Primærtumor har som regel Ki-67 indeks <5 %. På diagnosetidspunktet har mange pasienter metastasert sykdom. Metastasene er oftest lokalisert til mesenteriale eller paraaortale lymfeknuter samt til lever, men pasientene kan også ha carcinomatose, metastaser til skjelett og mediastinale lymfeknuter.
Primærtumor, samt de mesenteriale lymfeknuter, gir ofte opphav til lokal fibrose som kan gi tarmobstruksjon eller obstruksjon av store blodkar. Dette kan gi symptomer i form av magesmerter, vekttap eller ileus. Svulster blir ofte oppdaget som et tilfeldig funn på CT. Tynntarms NET med metastaser kan gi karsinoid syndrom (se Karsinoid hjertesykdom).
Utredning
Sist faglig oppdatert: 20.10.2020
CgA brukes som tumormarkør både på diagnosetidspunktet og under oppfølgingen (punkt Blodprøver og biomarkører).
Nedbrytningsproduktet av serotonin, 5-HIAA, måles i urin og hører med i diagnostikken (Diagnose og utredning). Det er en indikator på at pasientens svulster produserer serotonin og er følgelig utsatt for det karsinoide syndrom med eventuell hjerteaffeksjon.
Kartlegging av sykdomsutbredelse gjøres med CT (med arteriefase), ev. MR, og i tillegg 68Ga-DOTATOC PET (Diagnose og utredning).
Ileokoloskopi, kapselendoskopi eller enteroskopi kan gjøres for å identifisere primærtumor(er), samt for å ta biopsier for histologisk undersøkelse (Generelt om behandling).
Ekkokardiografi utføres hos alle pasienter med karsinoid syndrom ved diagnosetidspunktet med tanke på karsinoid hjertesykdom. Dette er spesielt viktig før eventuell kirurgi. Ekkokardiografi bør utføres årlig dersom det er påvist karsinoid hjertesykdom (Nevroendokrin tumor G3 (NETG3)).
Behandling
Sist faglig oppdatert: 20.10.2020
Kirurgi
Ved lokalisert sykdom fjernes primærtumor sammen med eventuelle mesenterielle lymfeknuter. Palpasjon av hele tynntarmen skal utføres med tanke på å oppdage flere primærsvulster, noe som forekommer hos inntil 30 % av pasientene, og derfor bør man ikke operere disse pasientene med lapraskopisk kirurgi.
Det er ingen dokumentasjon for nytten av adjuvant behandling etter radikal operasjon.
Pasienter med avansert sykdom, som ikke kan helbredes med kirurgi, bør opereres med reseksjon av primærtumor og regionale lymfeknutemetastaser dersom disse gir symptom på tarmobstruksjon eller iskemi (Capurso et al., 2012).
Hos pasienter med utbredt sykdom uten symptomer er det usikkert hva som er den beste strategien. Mange velger å fjerne primærtumor for å forebygge lokale komplikasjoner. Denne strategien er omdiskutert og må vurderes individuelt (Daskalakis et al., 2018). Ved manifest karsinoid hjertesykdom må pasienten vurderes for klaffekirurgi før eventuell abdominal kirurgi.
Om behandling av levermetastaser, se punkt Lokalbehandling av levermetastaser fra NET.
Medikamentell behandling
Somatostatinanaloger har både symptomatisk og veksthemmende effekt ved NET i tynntarm og er primærbehandling for de fleste pasienter med gjenværende påvisbar sykdom (Caplin et al., 2014; Rinke et al., 2009) (punkt Somatostatinanaloger). Ved progresjon anbefales å forkorte doseringsintervallet av SSA til 3 uker.
PRRT vurderes er andrelinjebehandling for pasienter med inoperabel og progredierende NET med høyt opptak på SRI.
Everolimus bør vurderes ved progresjon av sykdom som tredjelinjebehandling (Yao et al., 2016).
Interferon kan gis i kombinasjon med somatostatinanalog dersom somatostatinanaloger alene ikke har tilstrekkelig symptomatisk effekt, eller som fjerdelinjebehandling ved progresjon.
Kjemoterapi brukes vanligvis ikke.
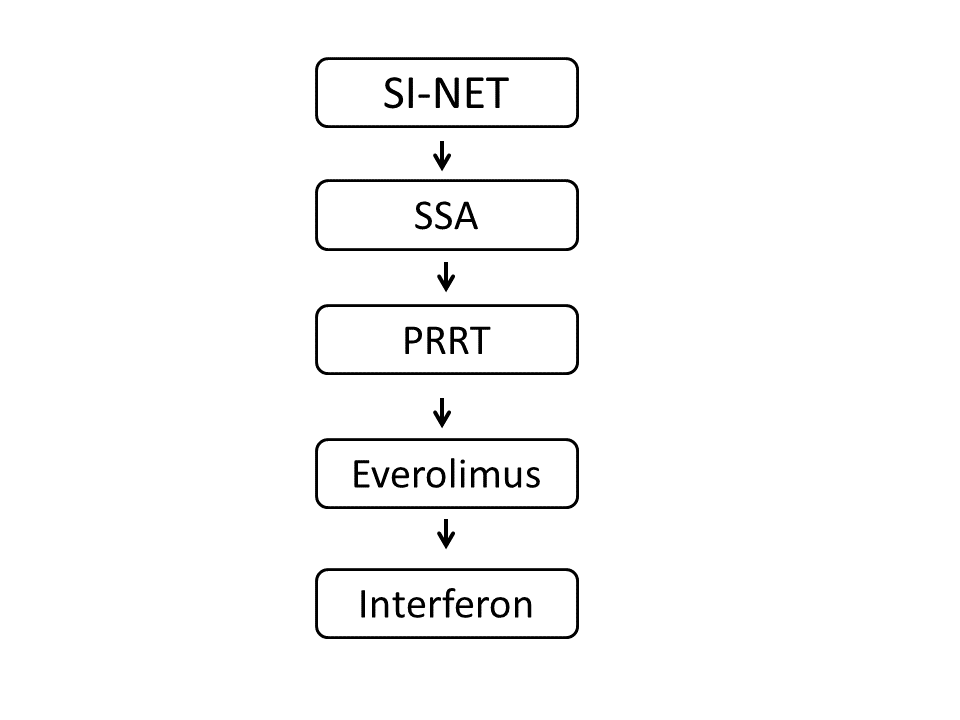
Oppfølging og prognose
Sist faglig oppdatert: 20.10.2020
Kontrollhyppighet justeres i forhold til pasientens alder, komorbiditet, antatt prognose, behandlingsalternativer og muligheter ved eventuelt residiv eller progresjon, se Oppfølging og kontroller.
Residiv er vanlig. Etter 15 år har opp mot 75 % av pasientene sykdomstilbakefall (Norlen et al., 2012) i eldre studier, og pasienten trenger langvarig oppfølging. Overlevelsen for pasientgruppen som helhet er likevel god. 5-års overlevelse for pasienter med lokalisert eller lokoregional sykdom er på over 75 %, og median overlevelse er > 8 år. Ved metastatisk sykdom er median overlevelse 5 år (Janson et al., 1997).
Anbefalinger:
- Kartlegging av sykdomsutbredelse gjøres primært med CT (eventuelt MR) og 68Ga-DOTATOC PET. Endoskopiske undersøkelser gjøres etter behov. (C)
- Tumormarkørene CgA og 5-HIAA skal tas som ledd i utredningen. (C)
- Hos pasienter med carcinoid syndrom anbefales ekkokardiografi ved diagnosetidspunktet. (D)
- Reseksjon av primærtumor med eventuelle lokale glandelmetastaser og levermetastaser anbefales dersom dette kan gjøres radikalt. (C)
- Reseksjon av primærtumor og krøsmetastaser anbefales også ved avansert sykdom, dersom det kan bedre symptomer. (C)
- Somatostatinanaloger anbefales som førstelinje medikamentell behandling ved gjenværende tumorvev. (A)
- PRRT med 177Lu-DOTATATE (Lutathera®) er anbefalt som andrelinjebehandling ved tynntarms NET med høyt opptak på 68Ga-DOTATOC PET. (B)
- Everolimus er tredjelinjebehandling ved progresjon av tynntarms NET. (A)
Appendiks
Patologi
Sist faglig oppdatert: 20.10.2020
Tubulære NET likner ikke klassiske NET og kan feildiagnostiseres som metastase fra adenokarsinom, se ellers Patologi, klassifikasjon og stadieinndeling.
Begercellekarsinoid klassifiseres nå som en variant av adenokarsinom og tas ikke med i dette handlingsprogrammet.
Klinisk presentasjon
Sist faglig oppdatert: 20.10.2020
Normalt påvises appendiks-NET av patolog i resektatet etter en akutt appendisitt. Sjeldnere påvises appendiks-NET etter utredning av symptomer grunnet avansert vekst eller spredning. De aller fleste appendiks-NET er små G1 svulster.
Utredning
Sist faglig oppdatert: 20.10.2020
Dersom det ikke er indikasjon for hemikolektomi basert på kriteriene nevnt nedenfor, er det ikke indikasjon for ytterligere utredning.
Før hemikolektomi bør det gjøres CT thorax, CT/MR abdomen og bekken, samt 68Ga-DOTATOC PET for å utelukke at det allerede foreligger fjernmetastasering.
CgA og U-5HIAA er sjelden forhøyet og anbefales ikke målt rutinemessig.
Behandling
Sist faglig oppdatert: 20.10.2020
Svulster <1 cm: Appendektomi regnes som kurativt gitt at tumor er G1 eller G2 og det er frie reseksjonsrender (Grozinsky-Glasberg et al., 2013; In't Hof, van der Wal, Kazemier, & Lange, 2008), og det ikke påvises dybdeinnvekst i mesoappendiks på 3 mm eller mer.
Svulster 1–2 cm: Appendektomi regnes som kurativt dersom det er frie reseksjonsrender, det ikke påvises innvekst i blod- eller lymfekar og det ikke er dybdeinnvekst i mesoappendiks på 3 mm eller mer.
Dersom appendektomi ikke regnes som kurativt etter disse rettningslinjene anbefales hemikolektomi med glandeldisseksjon, ellers regnes appendektomi som tilstrekkelig behandling gitt frie reseksjonsrender.
Svulster ≥2 cm: Indikasjon for hemikolektomi med glandeldisseksjon.
G3 svulster uansett størrelse: Indikasjon for hemikolektomi med glandeldisseksjon.
Gjennombrudd av serosa regnes ikke isolert som en indikasjon for hemikolektomi. Foreligger ikke-resektable fjernmetastaser, er det vanligvis ikke indikasjon for hemikolektomi.
Ved ikke-resektable fjernmetastaser er det indikasjon for behandling og oppfølging som for tynntarms-NET
Oppfølging og prognose
Sist faglig oppdatert: 20.10.2020
Dersom appendektomi vurderes som tilstrekkelig behandling er det ikke indikasjon for oppfølging eller ytterligere utredning. Er det funnet indikasjon for hemikolektomi, og det påvises lymfeknutemetastaser i resektatet, er det indikasjon for oppfølging som for tynntarms-NET. Påvises det ikke lymfeknutemetastaser i resektatet er det ikke indikasjon for kontroller. Kontrollhyppighet justeres i forhold til pasientens alder, komorbiditet, antatt prognose og behandlingsmuligheter ved ev. progresjon. (Se Oppfølging og kontroller.)
Anbefalinger:
- Appendiks-NET G1 eller G2 under 1 cm regnes som radikalt operert ved appendektomi og krever ingen videre utredning eller oppfølging gitt at det er:
- Frie reseksjonsrender
- Ikke dybdeinnvekst i mesoappendiks på 3 mm eller mer (C)
- Appendiks-NET G1 eller G2 med størrelse 1–2 cm regnes som radikalt operert ved appendektomi og krever ingen videre utredning eller oppfølging gitt at det er:
- Frie reseksjonsrender
- Ikke dybdeinnvekst i mesoappendiks på 3 mm eller mer
- Ikke innvekst i blod- eller lymfekar (C)
- Dersom svulsten ikke regnes som radikalt operert etter kriteriene ovenfor, er det indikasjon for hemikolektomi med glandeldisseksjon. (C)
- Ved appendiks-NET G1 eller G2 som er 2 cm eller større er det indikasjon for hemikolektomi med glandeldisseksjon. (C)
- Er det utført hemikolektomi etter indikasjonene ovenfor ved G1 og G2 svulster, og det påvises lymfeknutemetastaser, er det indikasjon for oppfølging. (C)
- Ved G3 svulster (NEC) uansett størrelse er det indikasjon for hemikolektomi med glandeldisseksjon og oppfølging som for andre G3 svulster. (C)
- Før hemikolektomi bør det gjøres CT thorax, CT/MR abdomen, samt 68Ga-DOTATOC I, for å utelukke ikke-resektable fjernmetastaser. Ved fjernmetastaser er det normalt ikke indikasjon for hemikolektomi. (D)
- Ved fjernmetaster er det indikasjon for oppfølging og behandling som for tynntarms-NET. (C)
Kolon
Sist faglig oppdatert: 20.10.2020
Se eget generelt patologikapittel, Patologi, klassifikasjon og stadieinndeling.
Klinisk presentasjon
Sist faglig oppdatert: 20.10.2020
Nevroendokrine svulster i cøkum er som oftest høyt differensierte G1/G2 svulster med klinikk, symptomer og prognose som for nevroendokrine tynntarmssvulster.
Nevroendokrine svulster utgående fra kolon ellers er som oftest G3 nevroendokrine karsinomer (NEC) og har dårligere prognose enn NEC utgående fra andre lokalisasjoner (Sorbye et al., 2013). Disse gir sjelden hormonelle symptomer, og klinikken er som for adenokarsinomer med stenosesymptomer, blødning, vekttap, og andre symptomer på utbredt sykdom.
Utredning
Sist faglig oppdatert: 20.10.2020
Diagnosen stilles med koloskopi og biopsi, ev. ved biopsier fra metastaser.
CT/MR av thorax, abdomen og bekken bør utføres. Det anbefales at man gjør SRI og undersøker CgA og urin-5HIAA ved diagnosetidspunkt ved G1/G2 svulster. Ved G3 svulster bør det gjøres 18FDG-PET.
Behandling
Sist faglig oppdatert: 20.10.2020
Ved lokalisert sykdom gjøres kirurgisk reseksjon som ved adenokarsinomer (hemikolektomi med D2 eller D3 kolon-reseksjon) både for G3 og G1/G2 svulster.
For NEC bør neo- og adjuvant kjemoterapi med platinum /etoposid vurderes, se Nevroendokrint carcinom (NEC).
Ved metastatisk sykdom ved G1/G2 svulster vil volumreduserende kirurgi og medikamentell behandling være som for G1/G2 svulster utgående fra tynntarm, se punkt Behandling.
For metastaserende NEC svulster er behandlingen som for andre GEP-NEC, se Nevroendokrint carcinom (NEC).
Oppfølging og prognose
Sist faglig oppdatert: 20.10.2020
Kontrollhyppighet justeres i forhold til pasientens alder, komorbiditet, antatt prognose, behandlingsalternativer og -muligheter ved eventuelt residiv eller progresjon. Kontroll og oppfølging etter samme prinsipper som for andre NEC og NET (se Oppfølging og kontroller).
Rektum
Klinisk presentasjon
Sist faglig oppdatert: 20.10.2020
Rektale nevroendokrine svulster er oftest små og oppdages tilfeldig ved endoskopier, og har oftest et utseende som andre rektale polypper, men de kan skille seg fra andre polypper ved at de har et sentralt «søkk». Større svulster kan gi symptomer som rektale adenokarsinomer. Symptomgivende hormonproduksjon er uvanlig. Svulstene er oftest av typen G1, og utgjør ca. 5 % v GEP-NET svulster.
Utredning
Sist faglig oppdatert: 20.10.2020
Diagnose stilles ved endoskopi med biopsi. Ved G2 og G3 svulster uansett størrelse, og ved G1 svulster som er 1 cm eller større, gjøres metastaseutredning med CT thorax, CT/MR abdomen og bekken, samt 68Ga-DOTATOC PET for G1 og G2 svulster. Ved G3 svulster bør det i stedet for 68Ga-DOTATOC PET primært utføres 18F-FDG PET. CgA kan måles ved G1 og G2 svulster.
Behandling
Sist faglig oppdatert: 20.10.2020
Innvekst i muscularis propria er en kontraindikasjon mot endoskopisk fjerning (endoskopisk mukosal reseksjon eller endoskopisk submukosal disseksjon) (Pape et al., 2012). Dersom man under utredning påviser glandelmetastaser og evt. fjernmetastaser, må det vurderes nytteverdien av å fjerne primærtumor.
Gitt at det ikke er indikasjon for ytterligere utreding, eller at man ikke påviser metastaser ved utredning, vil fjerning av primærtumor basere seg på følgende prinsipper:
- NEN under 1 cm: Kan normalt fjernes endoskopisk (Ramage et al., 2016).
- NEN 1–2 cm: Dybdeveksten avgjør hvorvidt svulsten kan fjernes endoskopisk, eller om det trengs et kirurgisk inngrep etter samme prinsipper som for adenokarsinomer1
- Rektale NEN >2 cm: Anbefales fjernet kirurgisk (Al Natour et al., 2012).
Ved innkomplett reseksjon anbefales kontroller for G1 og G2 svulster, mens for G3 svulster anbefales ytterligere kirurgi.
Dersom det påvises nevroendokrin tumor i biopsier fra en liten polypp, anbefales snarlig rektoskopi for å påvise polypprester eller sårflaten etter biopsi før denne tilheles og blir vanskelig identifiserbar. Dersom polyppområdet kan påvises, bør det gjøres endoskopisk mukosal reseksjon (Chen et al., 2016).
For metastastisk sykdom er behandlingsprinsippene som for andre NEN, se Generelt om behandling.
1Ved innvekst i muscularis propria kan ikke tumor fjernes radikalt med endoskopisk mukosal reseksjon eller endoskopisk submukosal disseksjon og det er indikasjon for kirurgisk inngrep etter samme prinsipper som for rektale adenokarcinomer eller evt. nyere endoskopiske teknikker som endoscopic full thickness resection (EFTR). Vurdering av om det er innvekst i muscularis propria kan gjøres med EUS eller at man ved forsøk på endoskopisk mukosal reseksjon eller endoskopisk submukosal disseksjon ikke greier å heve submucosa med svulsten etter injeksjon av væske under svulsten som tegn på innvekst i muscularis propria.
Oppfølging og prognose
Sist faglig oppdatert: 20.10.2020
Kontrollhyppighet justeres i forhold til pasientens alder, komorbiditet, antatt prognose og behandlingsmuligheter ved evt. progresjon, se Oppfølging og kontroller.
Ved radialt fjernede G1 svulster under 1 cm er det ikke indikasjon for kontroller. Ellers er kontrollopplegget som for andre NEN.
Ved innkomplett reseksjon av G1 og G2 svulster, bør pasienten følges med rektoskopi årlig i 3 år, deretter etter 2 år i tillegg til evt. annen oppfølging.
Anbefalinger:
- Ved G1 svulster < 1 cm radikalt fjernet er det ikke indikasjon for ytterligere utredning og oppfølging. (B)
- Ved G1 svulster ≥ 1 cm og G2 svulster uansett størrelse anbefales CT thorax, CT/MR abdomen og bekken og 68Ga-DOTATOC PET. (C)
- Ved G3 svulster uansett størrelse anbefales CT thorax, CT/MR abdomen og bekken og 18FDG-PET. (C)
- Rektale NEN < 2 cm kan fjernes endoskopisk dersom det ikke påvises innvekst i muscularis propria. (B)
- Rektale NEN ≥2 cm fjernes kirurgisk. (B)
- Radikalt fjernede G1 svulster over 1 cm og G2 svulster følges opp som tynntarms-NET, radikalt fjernede G3 følges opp som andre G3 svulster. (C)
- Ved innkomplett fjernet G1 og G2 svulster anbefales – i tillegg til bildediagnostikk som nevnt ovenfor – rektoskopi årlig i 3 år, deretter etter 2 år. (D)
NET med ukjent utgangspunkt
Patologi
Sist faglig oppdatert: 20.10.2020
Positivitet for serotonin indikerer primær tumor i ileum. TTF-1 positivitet indikerer primær tumor fra lunge. CDX2-positivitet indikerer primærtumor i mage-tarmkanalen. Videre kan spesifikke hormoner som gastrin, somatostatin, glukagon, proinsulin, insulin, PP, VIP og calcitonin undersøkes om tilgjengelig.
Klinisk presentasjon
Sist faglig oppdatert: 20.10.2020
Hos ca. 10 % av pasientene diagnostiseres metastaser fra NET uten kjent lokalisering av primærtumor. Oftest dreier det seg om lever- eller lymfeknutemetastaser. Lokalisasjon av primærtumor er viktig å identifisere for å kunne gi optimal behandlingen.
Metastaser påvises som regel på CT eller ultralyd hos pasienter undersøkt for abdominale plager, eller oppdages tilfeldig. Endokrine symptomer forekommer sjeldent.
Utredning
Sist faglig oppdatert: 20.10.2020
Serum CgA og U-5HIAA-undersøkelse bør utføres. Høy U-5HIAA indikerer tynntarm eller lunge som utgangspunkt.
CT-thorax/abdomen/bekken (ev. MR) og 68Ga-DOTATOC bør utføres. Indikasjon for 18F-FDG PET vurderes på bakgrunn av Ki-67 indeks. Endoskopi, EUS, MR tynntarm og kapselendoskopi kan være aktuelt.
Behandling
Sist faglig oppdatert: 20.10.2020
Kirurgi kan vurderes ved resektabel sykdom. Eldre studier har vist at i ca. 70–80 % av tilfellene med initialt ukjent origo for NET, var denne lokalisert i tynntarm (Bergsland & Nakakura, 2014). Likevel er nytten av eksplorativ laparatomi omdiskutert og lite benyttet, med mindre det er funn som gir spesifikk mistanke. Dersom primærtumor ikke lokaliseres, kan medisinsk behandling baseres på Ki-67 indeks, dvs. pasienter med lav Ki-67 behandles initialt med somatostatin analoger, og pasienter med høyere Ki-67 som ved pankreas NET/NEC (se Pankreas). Senere PRRT-behandling vurderes hos egnede pasienter, se punkt Peptid reseptor radionuklide terapi (PRRT).
Oppfølging og prognose
Sist faglig oppdatert: 20.10.2020
Kontrollhyppighet justeres i forhold til pasientens alder, komorbiditet, antatt prognose og behandlingsalternativer (se Oppfølging og kontroller).
Siden primærtumor oftest er lokalisert i tynntarm, anbefales kontrollopplegg som angitt for tynntarms NET. Pasienter med ukjent primærtumor har dårligere prognose enn pasienter med kjent primærtumor i ileum.
Anbefalinger:
- Ved NET uten kjent origo skal primær tumor forsøkes lokalisert. (D)
- Valg av medisinsk behandling av NET med ukjent origo kan baseres på Ki-67 index og SRI-opptak. (D)
Metode og prosess for utarbeidelse av retningslinjene
Sist faglig oppdatert: 20.10.2020
I henhold til Nasjonal helseplan (2007–2010) (Nasjonal helseplan (2007-2010), 2006) har Helsedirektoratet en normerende rolle for helsetjenesten på tvers av helseregioner og tjenestenivå. Helsedirektoratet har en koordinerende rolle for å utvikle overordnede referanserammer for kreftomsorgen, sammen med de regionale helseforetakene, kommunene og andre relevante myndighetsorganer og tjenester.
Lov om kommunale helse- og omsorgstjenester § 12‑5 (Lov om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven). LOV-2011-06-24-30) fastslår at Helsedirektoratet er eneste aktør med mandat til å utvikle, formidle og vedlikeholde nasjonale faglige retningslinjer og veiledere som understøtter de mål som er satt for helse- og omsorgstjenesten.
De nasjonale faglige retningslinjene inneholder systematisk utviklede faglige anbefalinger som etablerer en nasjonal standard for utredning, behandling og oppfølging av pasientgrupper, diagnosegrupper og brukergrupper. Nasjonale faglige retningslinjer er et virkemiddel for å bidra til at helse- og omsorgstjenestene:
- har god kvalitet
- gjør riktige prioriteringer
- ikke har uønsket variasjon i tjenestetilbudet
- løser samhandlingsutfordringer
- tilbyr helhetlige pasientforløp
Nasjonale faglige retningslinjer gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet.
Helsepersonell og alle deler av helse- og omsorgstjenesten er forpliktet til å yte forsvarlig helsehjelp. Retningslinjer, anerkjent fagkunnskap og allmenngyldige samfunnsetiske normer inngår som aksepterte grunnlag for vurdering av hva som er faglig forsvarlig. Retningslinjer er ment som et hjelpemiddel ved avveiningene tjenesteyterne må gjøre for å oppnå forsvarlig og god kvalitet i tjenesten. De er ikke rettslig bindende, men faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet. Helsepersonell må likevel vise faglig skjønn i vurderingen av hver enkelt pasient for å ta hensyn til individuelle behov. Dersom helsepersonell eller institusjoner velger å fravike anbefalinger i en retningslinje, skal dette dokumenteres og begrunnes.
Helsetjenestens eiere og ledelse har ansvar for tilrettelegging av virksomheten slik at anbefalinger gitt i nasjonale faglige retningslinjer kan følges.
Kunnskapsbasert prosess
Sist faglig oppdatert: 20.10.2020
Helsedirektoratet legger til grunn at alle nasjonale retningslinjer skal være utarbeidet etter en metode med vekt på forskningsbasert kunnskap, tydelig og tilgjengelig dokumentasjon, brukermedvirkning, tverrfaglighet, fokus på praksis, implementering og oppdatering.
Det er en omfattende prosess å lage gode retningslinjer som tilfredsstiller krav til prosess, metode og transparens, som er det nivå Helsedirektoratet og andre internasjonale organisasjoner har lagt til grunn for utforming av anbefalinger.
I forbindelse med første utgave av dette retningslinjearbeidet samarbeidet arbeidsgruppen og daværende Najonalt Kunnskapssenter for helsetjenesten (nå FHI) på følgende måte for å sikre en god håndtering av kunnskapsgrunnlaget for anbefalingene:
- I en tidlig fase av arbeidet avklarte arbeidsgruppen hva retningslinjene skulle omfatte når det gjaldt diagnostikk, behandling og oppfølging av nevroendokrine svulster.
- Kunnskapssenteret gjennomgikk i samarbeid med arbeidsgruppen de faglige anbefalingene med hensyn til metode og hvilket kunnskapsgrunnlag de var basert på.
Arbeidsgruppen vurderte i samarbeid med Helsedirektoratet og Kunnskapssenteret hvilke områder det var behov for kunnskapsstøtte fra Kunnskapssenteret.
Kunnskapssenteret identifiserte og formidlet kunnskapsbaserte internasjonale retningslinjer og systematiske oversikter til arbeidsgruppen, ved søk på følgende nettsteder:
- Guidelines international network: http://www.g-i-n.net/
- NICE, UK: http://www.nice.org.uk/
- SIGN, Scotland: http://www.sign.ac.uk/
- AHRQ, US: http://www.guideline.gov/
- Cancer care Ontario: http://www.cancercare.on.ca/
Søk etter systematiske oversikter:
- CRD-databasene: http://www.crd.york.ac.uk/crdweb/
- Cochrane Library: http://onlinelibrary.wiley.com/cochranelibrary/search/
- Clinical evidence: http://www.clinicalevidence.com/
Det bleogså gjort litteratursøk etter primærstudier i PubMed og Medline.
Gradering av kunnskapsgrunnlaget
Sist faglig oppdatert: 20.10.2020
Ved utarbeiding av nasjonale retningslinjer stilles det krav om at all relevant kunnskap på området hentes frem, beskrives og vurderes på en systematisk og åpen måte.
I dette handlingsprogrammet er det anvendt gradering av evidensnivå (A–D) for å vise hvilket vitenskapelig grunnlag kunnskapen er basert på.
| Studietype | Evidensnivå | Gradering av evidensnivå |
|---|---|---|
| Kunnskap som bygger på systematiske oversikter og meta-analyser av randomiserte kontrollerte studier | Nivå 1a
Nivå 1b | A |
| Kunnskap som bygger på minst én godt utformet kontrollert studie uten randomisering | Nivå 2a
Nivå 2b | B |
| Kunnskap som bygger på godt utformede ikke eksperimentelle beskrivende studier, som sammenlignende studier, korrelasjonsstudier og case studier | Nivå 3 | C |
| Kunnskap som bygger på rapporter eller oppfatninger fra eksperter, komiteer og/eller klinisk ekspertise hos respekterte autoriteter | Nivå 4 | D |
Kunnskapsgrunnlaget i disse retningslinjene er gradert i henhold til tabellen over.
I disse retningslinjene er kun kunnskapsgrunnlaget og ikke anbefalingene gradert. Hvis selve anbefalingene skal graderes, for eksempel ved bruk av GRADE-systemet, må man – i tillegg til å ha vurdert kunnskapsgrunnlaget – legge inn en vurdering av både kost-nytte og andre forhold (klinisk erfaring, skjønn, etikk, osv.). Dette er ikke gjort eksplisitt i forbindelse med dette arbeidet, og anbefalingene er derfor ikke gradert.
For å indikere kunnskapsgrunnlaget for anbefalingene, er det brukt gradering A–D. En anbefaling som er anført med D behøver derfor ikke å være en svakere anbefaling enn en som er anført A, B eller C. Det henspeiler kun til kunnskapsgrunnlaget anbefalingen er basert på. I enkelte sammenhenger vil klinisk erfaring og gjeldende praksis være et godt grunnlag for anbefalingen. I andre sammenhenger er det uttrykk for at det ikke finnes tilstrekkelig vitenskapelig dokumentasjon for anbefalingen, selv om det hadde vært ønskelig.
Bakgrunn og arbeidsprosess ved 1. utgave
Sist faglig oppdatert: 20.10.2020
Utvikling av de nasjonale handlingsprogrammene for kreftbehandling var et viktig tiltak under Nasjonal strategi for kreftområdet 2006–2009 (Nasjonal strategi for kreftområdet 2006-2009, 2006) (forlenget til 2011). Og videre utvikling av de nasjonale handlingsprogrammene var en kjerneoppgave i oppfølging av Sammen mot kreft – Nasjonal Kreftstrategi 2013–2017 (Sammen - mot kreft: nasjonal kreftstrategi 2013-2017, 2013), og i videreføringen og oppdateringen av denne, jf. Nasjonalt kreftstrategi Leve med kreft (2018–2022) (Leve med kreft: nasjonal kreftstrategi (2018–2022), 2018). Nasjonale handlingsprogrammer for kreftbehandling skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
Helsedirektoratet rettet en henvendelse til Norsk nevroendokrin Tumorguppe og ba om forslag til representanter til en arbeidsgruppe som skulle settes sammen av legespesialister fra relevante spesialiteter. Alle nødvendige faggrupper og alle helseregioner skulle være representert.
De regionale helseforetakene (RHF-ene) ble gitt mulighet til å gi tilbakemelding på arbeidsgruppenes sammensetning. RHF-ene ble også bedt om at fagfolk innenfor rammen av sin arbeidstid ble fristilt til retningslinjearbeidet, i henhold til tidligere Oppdragsdokument fra Helse- og omsorgsdepartementet.
Tidligere Kunnskapssenteret – nå Folkehelseinstituttet – bisto gruppen med metodestøtte, søk og gradering av kunnskapsgrunnlaget.
Helsedirektoratet og Folkehelseinstituttet ferdigstilte i samarbeid med arbeidsgruppen et høringsutkast som ble sendt på høring til RHF-ene, Den norske legeforening, Kreftforeningen og Nevroendokrin Tumorgruppe i april 2018. Etter høring vurderte arbeidsgruppen og Helsedirektoratet høringsinnspillene og justerte handlingsprogrammet. Endelig første utgave ble ferdigstilt og publisert av Helsedirektoratet i juni 2018.
Arbeidsgruppe – første utgave av handlingsprogrammet
Arbeidsgruppen har bestått av:
- Øyvind Hauso (gastroenterolog), St. Olavs Hospital – leder av arbeidsgruppen
- Erling Bringeland (kirurg), St. Olavs Hospital
- Astrid Dalhaug (onkolog), Nordlandssykehuset
- Jon Florholmen (gastroenterolog), Universitetssykehuset i Nord-Norge
- Gunter Kemmerich (radiolog), Oslo Universitetssykehus – Rikshospitalet
- Geir Olav Hjortland (onkolog), Oslo Universitetssykehus – Ullevål
- Eva Hofsli (onkolog), St. Olavs Hospital
- Thuy Lu (nukleærmedisiner), Universitetssykehuset i Nord-Norge
- Patricia Mjønes (patolog), St. Olavs Hospital
- Halfdan Sørbye (onkolog), Haukeland Universitetssykehus
- Jon Arne Søreide (kirurg), Stavanger Universitetssykehus
- Espen Thiis-Evensen (gastroenterolog), Oslo Universitetssykehus – Rikshospitalet
Åse Skår i Folkehelseinstituttet (sluttet 2017), bisto gruppen med metodestøtte, litteratursøk og gradering av kunnskapsgrunnlaget.
Arbeidsgruppe – andre utgave av handlingsprogrammet
Den samme arbeidsgruppen som utarbeidet førsteutgaven av handlingsprogrammet har gjennomgått og oppdatert handlingsprogrammet i 2020. I tillegg har følgende personer bidratt:
- Trond Bogsrud (nukleærmedisiner), Universitetssykehuset i Nord-Norge
- Oddvar Sandvik (kirurg), Stavanger Universitetssykehus
Habilitet
Sist faglig oppdatert: 20.10.2020
Arbeidsgruppenes medlemmer har i forbindelse med arbeidet bedt om å oppgi potensielle interessekonflikter. Helsedirektoratet har vurdert arbeidsgruppens medlemmer som habile i forhold til arbeid med dette nasjonale handlingsprogrammet.
Oppdatering av retningslinjene
Sist faglig oppdatert: 20.10.2020
Utviklingen av ny behandling på kreftområdet går raskt. Handlingsprogrammet vil vurderes årlig og om nødvendig oppdateres.
Oppdateringen utføres av en arbeidsgruppe som består av fagpersoner oppnevnt av RHF-ene og Helsedirektoratet. Folkehelseinstituttet skal også bidra i arbeidet med oppdatering av handlingsprogrammet.
De oppdaterte retningslinjene vil publiseres på helsedirektoratet.no og helsebiblioteket.no (webversjon).
Vedlegg
Sist faglig oppdatert: 20.10.2020
| Region | Lever/abdomen | ||
| Indikasjon | Hypervaskulære metastaser, cirrhose og primære levertumorer. | ||
| Forberedelser/utstyr | Pasienten bør være fastende minst 4 timer før us. Drikke mest mulig vann (evt. kontrast) ca. 1½–2 t før us. og minst ett glass like før iv.kontrast serie. Full blære hvis lille bekken er inkludert i undersøkelsen. | ||
| Pasientleie | Pasienten ligger på ryggen med bena først i gantry. Armene opp over hodet. | ||
| KM: Iomeron 350 mgI/ml KM mengde: Kontrast doseres etter pasientens vekt og en subjektiv vurdering av kroppstype. NaCl: 50 ml Flow: 3,5–5 ml/sek (tilpasses injeksjons tid) Injeksjonstid: 30–35 sekunder Injeksjonsside: Via venflon i fossa cubitii i høyre/venstre arm. Helst ikke gjennom CVK. Delay: | |||
|
| Senarteriell fase: | SmartPrep/SureStart første snitt nivå, ROI i aorta (180HU) 15 sekunders diagnostisk delay | |
|
| Portovenøs fase: | Injeksjonstid + 40 sekunder Eksempel: Senarteriell fase: 35 sek + scantid: 4 sek = 39 sek Injeksjonstid kontrastmiddel: 30 sek + 40 sek = 70 sek Portovenøs fase: 70 sek – 39 sek = 31 sek | |
|
| Dette blir en omtrentlig forsinkelse som regnes ut eksakt etter undersøkelsen (se delay i screensave + 15 sekunder) og noteres i RIS. | ||
| Gjennomføring | Pustebeskjed: «Pust inn, hold pusten» «Pust igjen» | ||
| Serier | Scout/dual scano | front+side | |
|
| 1. K- | Diafragma – gjennom lever | |
|
| 2. Senarteriell fase | Diafragma – gjennom lever | |
|
| 3. Portovenøs fase | Diafragma – crista/promotoriet/bekkenbunn | |
| Kriterier | Protokollen benyttes hvis det er mistanke om primær levertumor eller hypervaskulære metastaser (carcinoid, pankreas øy-celle-tumor, sarcom, melanom, binyretumor, mammae, nyre). K-: Radiolog angir om det ønskes serie uten kontrastmiddel. SENARTERIELL FASE: For optimal timing bør «Smart-prep» benyttes. Det er lagt inn en 15 sekunders diagnostisk forsinkelse for optimal fremstilling av hypervaskulære metastaser (parenkymarteriell fase). PORTOVENØS FASE: Undersøkelsen times slik at eksponering påbegynnes ca. 40 sekunder etter endt kontrastmiddelinjeksjon. Hos en gjennomsnittspasient vil portovenøs fase inntreffer ca. 20–50 sekunder etter endt kontrastinjeksjon. SENSERIE: Kan være til nytte ved påviste lesjoner av usikker etiologi. | ||
Referanser
Sist faglig oppdatert: 20.10.2020
Al Natour, R. H., Saund, M. S., Sanchez, V. M., Whang, E. E., Sharma, A. M., Huang, Q., . . . Gold, J. S. (2012). Tumor size and depth predict rate of lymph node metastasis in colon carcinoids and can be used to select patients for endoscopic resection. J Gastrointest Surg, 16(3), 595-602. https://doi.org/10.1007/s11605-011-1786-1
Amin, M. B., Greene, F. L., Edge, S. B., Compton, C. C., Gershenwald, J. E., Brookland, R. K., . . . Winchester, D. P. (2017). The Eighth Edition AJCC Cancer Staging Manual: Continuing to build a bridge from a population-based to a more "personalized" approach to cancer staging. CA Cancer J Clin, 67(2), 93-99. https://doi.org/10.3322/caac.21388
Amstutz, U., Henricks, L. M., Offer, S. M., Barbarino, J., Schellens, J. H. M., Swen, J. J., . . . Schwab, M. (2018). Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for Dihydropyrimidine Dehydrogenase Genotype and Fluoropyrimidine Dosing: 2017 Update. Clinical Pharmacology and Therapeutics, 103(2), 210-216. https://doi.org/10.1002/cpt.911
Arnold, R., Rinke, A., Klose, K. J., Muller, H. H., Wied, M., Zamzow, K., . . . Arnold, C. N. (2005). Octreotide versus octreotide plus interferon-alpha in endocrine gastroenteropancreatic tumors: a randomized trial. Clin Gastroenterol Hepatol, 3(8), 761-771.
Azad, N. S., Gray, R. J., Overman, M. J., Schoenfeld, J. D., Mitchell, E. P., Zwiebel, J. A., . . . Flaherty, K. T. (2020). Nivolumab Is Effective in Mismatch Repair-Deficient Noncolorectal Cancers: Results From Arm Z1D-A Subprotocol of the NCI-MATCH (EAY131) Study. J Clin Oncol, 38(3), 214-222. https://doi.org/10.1200/jco.19.00818
Baechle, J. J., Marincola Smith, P., Tan, M., Solórzano, C. C., Lopez-Aguiar, A. G., Dillhoff, M., . . . Idrees, K. (2020). Specific Growth Rate as a Predictor of Survival in Pancreatic Neuroendocrine Tumors: A Multi-institutional Study from the United States Neuroendocrine Study Group. Ann Surg Oncol, Apr 23 [Epub ahead of print]. https://doi.org/10.1245/s10434-020-08497-4
Basturk, O., Yang, Z., Tang, L. H., Hruban, R. H., Adsay, V., McCall, C. M., . . . Klimstra, D. S. (2015). The high-grade (WHO G3) pancreatic neuroendocrine tumor category is morphologically and biologically heterogenous and includes both well differentiated and poorly differentiated neoplasms. Am J Surg Pathol, 39(5), 683-690. https://doi.org/10.1097/pas.0000000000000408
Bergsland, E. K., & Nakakura, E. K. (2014). Neuroendocrine tumors of unknown primary: is the primary site really not known? JAMA Surg, 149(9), 889-890. https://doi.org/10.1001/jamasurg.2014.216
Bernard, V., Lombard-Bohas, C., Taquet, M. C., Caroli-Bosc, F. X., Ruszniewski, P., Niccoli, P., . . . Tumors, F. G. E. (2013). Efficacy of everolimus in patients with metastatic insulinoma and refractory hypoglycemia. European Journal of Endocrinology, 168(5), 665-674. https://doi.org/10.1530/Eje-12-1101
Bertani, E., Fazio, N., Radice, D., Zardini, C., Spinoglio, G., Chiappa, A., . . . Falconi, M. (2017). Assessing the role of primary tumour resection in patients with synchronous unresectable liver metastases from pancreatic neuroendocrine tumour of the body and tail. A propensity score survival evaluation. Eur J Surg Oncol, 43(2), 372-379. https://doi.org/10.1016/j.ejso.2016.09.011
Bhattacharyya, S., Toumpanakis, C., Caplin, M. E., & Davar, J. (2008). Usefulness of N-terminal pro-brain natriuretic peptide as a biomarker of the presence of carcinoid heart disease. Am J Cardiol, 102(7), 938-942. https://doi.org/10.1016/j.amjcard.2008.05.047
Binderup, T., Knigge, U., Loft, A., Mortensen, J., Pfeifer, A., Federspiel, B., . . . Kjaer, A. (2010). Functional imaging of neuroendocrine tumors: a head-to-head comparison of somatostatin receptor scintigraphy, 123I-MIBG scintigraphy, and 18F-FDG PET. Journal of Nuclear Medicine, 51(5), 704-712. https://doi.org/10.2967/jnumed.109.069765
Bodei, L., Kidd, M., Paganelli, G., Grana, C. M., Drozdov, I., Cremonesi, M., . . . Modlin, I. M. (2015). Long-term tolerability of PRRT in 807 patients with neuroendocrine tumours: the value and limitations of clinical factors. Eur J Nucl Med Mol Imaging, 42(1), 5-19. https://doi.org/10.1007/s00259-014-2893-5
Boyar Cetinkaya, R., Aagnes, B., Thiis-Evensen, E., Tretli, S., Bergestuen, D. S., & Hansen, S. (2017). Trends in Incidence of Neuroendocrine Neoplasms in Norway: A Report of 16,075 Cases from 1993 through 2010. Neuroendocrinology, 104(1), 1-10. https://doi.org/10.1159/000442207
Brabander, T., van der Zwan, W. A., Teunissen, J. J. M., Kam, B. L. R., Feelders, R. A., de Herder, W. W., . . . Kwekkeboom, D. J. (2017). Long-Term Efficacy, Survival, and Safety of [(177)Lu-DOTA(0),Tyr(3)]octreotate in Patients with Gastroenteropancreatic and Bronchial Neuroendocrine Tumors. Clin Cancer Res, 23(16), 4617-4624. https://doi.org/10.1158/1078-0432.Ccr-16-2743
Brenner, B., Shah, M. A., Gonen, M., Klimstra, D. S., Shia, J., & Kelsen, D. P. (2004). Small-cell carcinoma of the gastrointestinal tract: a retrospective study of 64 cases. Br J Cancer, 90(9), 1720-1726. https://doi.org/10.1038/sj.bjc.6601758
Bussolati, G., Volante, M., & Papotti, M. (2001). Classic and recent special stains used in differential diagnosis of endocrine tumors. Endocr Pathol, 12(4), 379-387.
Caplin, M. E., Pavel, M., Cwikla, J. B., Phan, A. T., Raderer, M., Sedlackova, E., . . . Investigators, C. (2014). Lanreotide in metastatic enteropancreatic neuroendocrine tumors. N Engl J Med, 371(3), 224-233. https://doi.org/10.1056/NEJMoa1316158
Capurso, G., Bettini, R., Rinzivillo, M., Boninsegna, L., Delle Fave, G., & Falconi, M. (2011). Role of resection of the primary pancreatic neuroendocrine tumour only in patients with unresectable metastatic liver disease: a systematic review. Neuroendocrinology, 93(4), 223-229. https://doi.org/10.1159/000324770
Capurso, G., Rinzivillo, M., Bettini, R., Boninsegna, L., Delle Fave, G., & Falconi, M. (2012). Systematic review of resection of primary midgut carcinoid tumour in patients with unresectable liver metastases. Br J Surg, 99(11), 1480-1486. https://doi.org/10.1002/bjs.8842
Carlsen, E. A., Fazio, N., Granberg, D., Grozinsky-Glasberg, S., Ahmadzadehfar, H., Grana, C. M., . . . Sorbye, H. (2019). Peptide receptor radionuclide therapy in gastroenteropancreatic NEN G3: a multicenter cohort study. Endocr Relat Cancer, 26(2), 227-239. https://doi.org/10.1530/erc-18-0424
Chan, D. L., Pavlakis, N., Schembri, G. P., Bernard, E. J., Hsiao, E., Hayes, A., . . . Bailey, D. L. (2017). Dual Somatostatin Receptor/FDG PET/CT Imaging in Metastatic Neuroendocrine Tumours: Proposal for a Novel Grading Scheme with Prognostic Significance. Theranostics, 7(5), 1149-1158. https://doi.org/10.7150/thno.18068
Chen, T., Yao, L. Q., Xu, M. D., Zhang, Y. Q., Chen, W. F., Shi, Q., . . . Zhong, Y. S. (2016). Efficacy and Safety of Endoscopic Submucosal Dissection for Colorectal Carcinoids. Clin Gastroenterol Hepatol, 14(4), 575-581. https://doi.org/10.1016/j.cgh.2015.07.048
Condron, M. E., Pommier, S. J., & Pommier, R. F. (2016). Continuous infusion of octreotide combined with perioperative octreotide bolus does not prevent intraoperative carcinoid crisis. Surgery, 159(1), 358-367. https://doi.org/10.1016/j.surg.2015.05.036
Connolly, H. M., Nishimura, R. A., Smith, H. C., Pellikka, P. A., Mullany, C. J., & Kvols, L. K. (1995). Outcome of cardiac surgery for carcinoid heart disease. J Am Coll Cardiol, 25(2), 410-416.
Dam, G., Grønbæk, H., Sorbye, H., Thiis Evensen, E., Paulsson, B., Sundin, A., . . . Tiensuu Janson, E. (2020). Prospective Study of Chromogranin A as a Predictor of Progression in Patients with Pancreatic, Small-Intestinal, and Unknown Primary Neuroendocrine Tumors. Neuroendocrinology, 110(3-4), 217-224. https://doi.org/10.1159/000503833
Daskalakis, K., Karakatsanis, A., Hessman, O., Stuart, H. C., Welin, S., Tiensuu Janson, E., . . . Stålberg, P. (2018). Association of a Prophylactic Surgical Approach to Stage IV Small Intestinal Neuroendocrine Tumors With Survival. JAMA oncology, 4(2), 183-189. https://doi.org/10.1001/jamaoncol.2017.3326
Deenen, M. J., Meulendijks, D., Cats, A., Sechterberger, M. K., Severens, J. L., Boot, H., . . . Schellens, J. H. (2016). Upfront Genotyping of DPYD*2A to Individualize Fluoropyrimidine Therapy: A Safety and Cost Analysis. J Clin Oncol, 34(3), 227-234. https://doi.org/10.1200/jco.2015.63.1325
Del Prete, M., Fiore, F., Modica, R., Marotta, V., Marciello, F., Ramundo, V., . . . Multidisciplinary Group for NeuroEndocrine Tumors of, N. (2014). Hepatic arterial embolization in patients with neuroendocrine tumors. J Exp Clin Cancer Res, 33, 43. https://doi.org/10.1186/1756-9966-33-43
Delle Fave, G., Kwekkeboom, D. J., Van Cutsem, E., Rindi, G., Kos-Kudla, B., Knigge, U., . . . Barcelona Consensus Conference, p. (2012). ENETS Consensus Guidelines for the management of patients with gastroduodenal neoplasms. Neuroendocrinology, 95(2), 74-87. https://doi.org/10.1159/000335595
Delle Fave, G., O'Toole, D., Sundin, A., Taal, B., Ferolla, P., Ramage, J. K., . . . Vienna Consensus Conference, p. (2016). ENETS Consensus Guidelines Update for Gastroduodenal Neuroendocrine Neoplasms. Neuroendocrinology, 103(2), 119-124. https://doi.org/10.1159/000443168
Deng, H. Y., Ni, P. Z., Wang, Y. C., Wang, W. P., & Chen, L. Q. (2016). Neuroendocrine carcinoma of the esophagus: clinical characteristics and prognostic evaluation of 49 cases with surgical resection. J Thorac Dis, 8(6), 1250-1256. https://doi.org/10.21037/jtd.2016.04.21
Digestive System Tumours. (2019). (5. utg.). (WHO Classification of Tumours, Volume 1). Lyon: IARC.
Duan, K., & Mete, O. (2016). Algorithmic approach to neuroendocrine tumors in targeted biopsies: Practical applications of immunohistochemical markers. Cancer Cytopathology, 124(12), 871-884. https://doi.org/10.1002/cncy.21765
Ekeblad, S., Sundin, A., Janson, E. T., Welin, S., Granberg, D., Kindmark, H., . . . Skogseid, B. (2007). Temozolomide as monotherapy is effective in treatment of advanced malignant neuroendocrine tumors. Clin Cancer Res, 13(10), 2986-2991. https://doi.org/10.1158/1078-0432.ccr-06-2053
Eriksson, B., & Oberg, K. (1993). An update of the medical treatment of malignant endocrine pancreatic tumors. Acta Oncol, 32(2), 203-208. https://doi.org/10.3109/02841869309083913
Eriksson, J., Stalberg, P., Nilsson, A., Krause, J., Lundberg, C., Skogseid, B., . . . Hellman, P. (2008). Surgery and radiofrequency ablation for treatment of liver metastases from midgut and foregut carcinoids and endocrine pancreatic tumors. World J Surg, 32(5), 930-938. https://doi.org/10.1007/s00268-008-9510-3
Faiss, S., Pape, U. F., Bohmig, M., Dorffel, Y., Mansmann, U., Golder, W., . . . Interferon Alfa Study, G. (2003). Prospective, randomized, multicenter trial on the antiproliferative effect of lanreotide, interferon alfa, and their combination for therapy of metastatic neuroendocrine gastroenteropancreatic tumors--the International Lanreotide and Interferon Alfa Study Group. J Clin Oncol, 21(14), 2689-2696. https://doi.org/10.1200/JCO.2003.12.142
Fendrich, V., Langer, P., Waldmann, J., Bartsch, D. K., & Rothmund, M. (2007). Management of sporadic and multiple endocrine neoplasia type 1 gastrinomas. Br J Surg, 94(11), 1331-1341. https://doi.org/10.1002/bjs.5987
Fiore, F., Del Prete, M., Franco, R., Marotta, V., Ramundo, V., Marciello, F., . . . Faggiano, A. (2014). Transarterial embolization (TAE) is equally effective and slightly safer than transarterial chemoembolization (TACE) to manage liver metastases in neuroendocrine tumors. Endocrine, 47(1), 177-182. https://doi.org/10.1007/s12020-013-0130-9
Fischer, L., Bergmann, F., Schimmack, S., Hinz, U., Priess, S., Muller-Stich, B. P., . . . Buchler, M. W. (2014). Outcome of surgery for pancreatic neuroendocrine neoplasms. Br J Surg, 101(11), 1405-1412. https://doi.org/10.1002/bjs.9603
Forskrift om prioritering av helsetjenester, rett til nødvendig helsehjelp fra spesialisthelsetjenesten, rett til behandling i utlandet og om klagenemnd (prioriteringsforskriften). FOR-2000-12-01-1208. Sist endret i FOR-2020-02-04-119 fra 01.03.2020. Hentet fra https://lovdata.no/dokument/SF/forskrift/2000-12-01-1208
Fraenkel, M., Kim, M., Faggiano, A., de Herder, W. W., & Valk, G. D. (2014). Incidence of gastroenteropancreatic neuroendocrine tumours: a systematic review of the literature. Endocr Relat Cancer, 21(3), R153-163. https://doi.org/10.1530/erc-13-0125
Fykse, V., Sandvik, A. K., & Waldum, H. L. (2005). One-year follow-up study of patients with enterochromaffin-like cell carcinoids after treatment with octreotide long-acting release. Scand J Gastroenterol, 40(11), 1269-1274.
Ganeshan, D., Bhosale, P., Yang, T., & Kundra, V. (2013). Imaging features of carcinoid tumors of the gastrointestinal tract. AJR: American Journal of Roentgenology, 201(4), 773-786. https://doi.org/10.2214/ajr.12.9758
Gedde-Dahl, M., Thiis-Evensen, E., Tjolsen, A. M., Mordal, K. S., Vatn, M., & Bergestuen, D. S. (2013). Comparison of 24-h and overnight samples of urinary 5-hydroxyindoleacetic acid in patients with intestinal neuroendocrine tumors. Endocr Connect, 2(1), 50-54. https://doi.org/10.1530/EC-12-0077
Gincul, R., Ponchon, T., Napoleon, B., Scoazec, J. Y., Guillaud, O., Saurin, J. C., . . . Walter, T. (2016). Endoscopic treatment of sporadic small duodenal and ampullary neuroendocrine tumors. Endoscopy, 48(11), 979-986. https://doi.org/10.1055/s-0042-112570
Grozinsky-Glasberg, S., Alexandraki, K. I., Barak, D., Doviner, V., Reissman, P., Kaltsas, G. A., & Gross, D. J. (2013). Current size criteria for the management of neuroendocrine tumors of the appendix: are they valid? Clinical experience and review of the literature. Neuroendocrinology, 98(1), 31-37. https://doi.org/10.1159/000343801
Hallet, J., Law, C. H., Cukier, M., Saskin, R., Liu, N., & Singh, S. (2015). Exploring the rising incidence of neuroendocrine tumors: a population-based analysis of epidemiology, metastatic presentation, and outcomes. Cancer, 121(4), 589-597. https://doi.org/10.1002/cncr.29099
Hashim, Y. M., Trinkaus, K. M., Linehan, D. C., Strasberg, S. S., Fields, R. C., Cao, D., & Hawkins, W. G. (2014). Regional lymphadenectomy is indicated in the surgical treatment of pancreatic neuroendocrine tumors (PNETs). Ann Surg, 259(2), 197-203. https://doi.org/10.1097/SLA.0000000000000348
Haugvik, S. P., Janson, E. T., Osterlund, P., Langer, S. W., Falk, R. S., Labori, K. J., . . . Sorbye, H. (2016). Surgical Treatment as a Principle for Patients with High-Grade Pancreatic Neuroendocrine Carcinoma: A Nordic Multicenter Comparative Study. Ann Surg Oncol, 23(5), 1721-1728. https://doi.org/10.1245/s10434-015-5013-2
Hauso, O., Gustafsson, B. I., Kidd, M., Waldum, H. L., Drozdov, I., Chan, A. K., & Modlin, I. M. (2008). Neuroendocrine tumor epidemiology: contrasting Norway and North America. Cancer, 113(10), 2655-2664. https://doi.org/10.1002/cncr.23883
Heetfeld, M., Chougnet, C. N., Olsen, I. H., Rinke, A., Borbath, I., Crespo, G., . . . other Knowledge Network, m. (2015). Characteristics and treatment of patients with G3 gastroenteropancreatic neuroendocrine neoplasms. Endocr Relat Cancer, 22(4), 657-664. https://doi.org/10.1530/ERC-15-0119
Hentic, O., Hammel, P., Couvelard, A., Rebours, V., Zappa, M., Palazzo, M., . . . Ruszniewski, P. (2012). FOLFIRI regimen: an effective second-line chemotherapy after failure of etoposide-platinum combination in patients with neuroendocrine carcinomas grade 3. Endocr Relat Cancer, 19(6), 751-757. https://doi.org/10.1530/ERC-12-0002
Hughes, M. S., Azoury, S. C., Assadipour, Y., Straughan, D. M., Trivedi, A. N., Lim, R. M., . . . Wank, S. A. (2016). Prospective evaluation and treatment of familial carcinoid small intestine neuroendocrine tumors (SI-NETs). Surgery, 159(1), 350-356. https://doi.org/10.1016/j.surg.2015.05.041
Iacovelli, R., Palazzo, A., Mezi, S., Morano, F., Naso, G., & Cortesi, E. (2012). Incidence and risk of pulmonary toxicity in patients treated with mTOR inhibitors for malignancy. A meta-analysis of published trials. Acta Oncol, 51(7), 873-879. https://doi.org/10.3109/0284186X.2012.705019
In't Hof, K. H., van der Wal, H. C., Kazemier, G., & Lange, J. F. (2008). Carcinoid tumour of the appendix: an analysis of 1,485 consecutive emergency appendectomies. J Gastrointest Surg, 12(8), 1436-1438. https://doi.org/10.1007/s11605-008-0545-4
Janson, E. T., Holmberg, L., Stridsberg, M., Eriksson, B., Theodorsson, E., Wilander, E., & Oberg, K. (1997). Carcinoid tumors: analysis of prognostic factors and survival in 301 patients from a referral center. Ann Oncol, 8(7), 685-690.
Janson, E. T., Sorbye, H., Welin, S., Federspiel, B., Gronbaek, H., Hellman, P., . . . Knigge, U. (2014). Nordic guidelines 2014 for diagnosis and treatment of gastroenteropancreatic neuroendocrine neoplasms. Acta Oncol, 53(10), 1284-1297. https://doi.org/10.3109/0284186x.2014.941999
Jensen, K. H., Hilsted, L., Jensen, C., Mynster, T., Rehfeld, J. F., & Knigge, U. (2013). Chromogranin A is a sensitive marker of progression or regression in ileo-cecal neuroendocrine tumors. Scand J Gastroenterol, 48(1), 70-77. https://doi.org/10.3109/00365521.2012.733953
Jensen, R. T., Cadiot, G., Brandi, M. L., de Herder, W. W., Kaltsas, G., Komminoth, P., . . . Barcelona Consensus Conference, p. (2012). ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: functional pancreatic endocrine tumor syndromes. Neuroendocrinology, 95(2), 98-119. https://doi.org/10.1159/000335591
Jesinghaus, M., Konukiewitz, B., Keller, G., Kloor, M., Steiger, K., Reiche, M., . . . Klöppel, G. (2017). Colorectal mixed adenoneuroendocrine carcinomas and neuroendocrine carcinomas are genetically closely related to colorectal adenocarcinomas. Mod Pathol, 30(4), 610-619. https://doi.org/10.1038/modpathol.2016.220
Jianu, C. S., Fossmark, R., Syversen, U., Hauso, O., & Waldum, H. L. (2010). A meal test improves the specificity of chromogranin A as a marker of neuroendocrine neoplasia. Tumour Biol, 31(5), 373-380. https://doi.org/10.1007/s13277-010-0045-5
Jiao, Y., Shi, C., Edil, B. H., de Wilde, R. F., Klimstra, D. S., Maitra, A., . . . Papadopoulos, N. (2011). DAXX/ATRX, MEN1, and mTOR pathway genes are frequently altered in pancreatic neuroendocrine tumors. Science, 331(6021), 1199-1203. https://doi.org/10.1126/science.1200609
Kanakis, G., & Kaltsas, G. (2012). Biochemical markers for gastroenteropancreatic neuroendocrine tumours (GEP-NETs). Best Pract Res Clin Gastroenterol, 26(6), 791-802. https://doi.org/10.1016/j.bpg.2012.12.006
Klöppel, G., Couvelard, A., Hruban, R. H., Klimstra, D. S., Komminoth, P., Osamura, R. Y., . . . Rindi, G. (2017). Neoplasms of the neuroendocrine pancreas. I: R. V. Lloyd, R. Y. Osamura, G. Klöppel, & J. Rosai (red.), WHO Classification of Tumours of Endocrine Organs (4. utg., s. 209-240). Lyon: IARC.
Knigge, U., & Hansen, C. P. (2012). Surgery for GEP-NETs. Best Pract Res Clin Gastroenterol, 26(6), 819-831. https://doi.org/10.1016/j.bpg.2012.12.005
Kolby, L., Persson, G., Franzen, S., & Ahren, B. (2003). Randomized clinical trial of the effect of interferon alpha on survival in patients with disseminated midgut carcinoid tumours. Br J Surg, 90(6), 687-693. https://doi.org/10.1002/bjs.4149
Konukiewitz, B., Schlitter, A. M., Jesinghaus, M., Pfister, D., Steiger, K., Segler, A., . . . Klöppel, G. (2017). Somatostatin receptor expression related to TP53 and RB1 alterations in pancreatic and extrapancreatic neuroendocrine neoplasms with a Ki67-index above 20. Mod Pathol, 30(4), 587-598. https://doi.org/10.1038/modpathol.2016.217
Korse, C. M., Taal, B. G., van Velthuysen, M. L., & Visser, O. (2013). Incidence and survival of neuroendocrine tumours in the Netherlands according to histological grade: experience of two decades of cancer registry. Eur J Cancer, 49(8), 1975-1983. https://doi.org/10.1016/j.ejca.2012.12.022
Ku, G. Y., Minsky, B. D., Rusch, V. W., Bains, M., Kelsen, D. P., & Ilson, D. H. (2008). Small-cell carcinoma of the esophagus and gastroesophageal junction: review of the Memorial Sloan-Kettering experience. Ann Oncol, 19(3), 533-537. https://doi.org/10.1093/annonc/mdm476
Kukar, M., Groman, A., Malhotra, U., Warren, G. W., Bogner, P., Nwogu, C. E., . . . Yendamuri, S. (2013). Small cell carcinoma of the esophagus: a SEER database analysis. Ann Surg Oncol, 20(13), 4239-4244. https://doi.org/10.1245/s10434-013-3167-3
Kunz, P. L., Catalano, P. J., Nimeiri, H., Fisher, G. A., Longacre, T. A., Suarez, C. J., . . . Benson, A. B. (2018). A randomized study of temozolomide or temozolomide and capecitabine in patients with advanced pancreatic neuroendocrine tumors: A trial of the ECOG-ACRIN Cancer Research Group (E2211). J Clin Oncol, 36(15_suppl), 4004. https://doi.org/10.1200/JCO.2018.36.15_suppl.4004
Kwekkeboom, D. J., Teunissen, J. J., Bakker, W. H., Kooij, P. P., de Herder, W. W., Feelders, R. A., . . . Krenning, E. P. (2005). Radiolabeled somatostatin analog [177Lu-DOTA0,Tyr3]octreotate in patients with endocrine gastroenteropancreatic tumors. J Clin Oncol, 23(12), 2754-2762. https://doi.org/10.1200/JCO.2005.08.066
Larghi, A., Capurso, G., Carnuccio, A., Ricci, R., Alfieri, S., Galasso, D., . . . Rindi, G. (2012). Ki-67 grading of nonfunctioning pancreatic neuroendocrine tumors on histologic samples obtained by EUS-guided fine-needle tissue acquisition: a prospective study. Gastrointest Endosc, 76(3), 570-577. https://doi.org/10.1016/j.gie.2012.04.477
Lepage, C., Bouvier, A. M., & Faivre, J. (2013). Endocrine tumours: epidemiology of malignant digestive neuroendocrine tumours. European Journal of Endocrinology, 168(4), R77-83. https://doi.org/10.1530/eje-12-0418
Leve med kreft: nasjonal kreftstrategi (2018–2022). (2018). Oslo: Helse- og omsorgsdepartementet. Hentet fra https://www.regjeringen.no/no/dokumenter/leve-med-kreft/id2598282/
Lov om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven). LOV-2011-06-24-30. Hentet fra https://lovdata.no/dokument/NL/lov/2011-06-24-30
Lov om pasient- og brukerrettigheter (pasient- og brukerrettighetsloven). LOV-1999-07-02-63. Sist endret i LOV-2019-12-20-104 fra 01.03.2020. Hentet fra https://lovdata.no/dokument/NL/lov/1999-07-02-63
Margonis, G. A., Samaha, M., Kim, Y., Postlewait, L. M., Kunz, P., Maithel, S., . . . Pawlik, T. M. (2016). A Multi-institutional Analysis of Duodenal Neuroendocrine Tumors: Tumor Biology Rather than Extent of Resection Dictates Prognosis. J Gastrointest Surg, 20(6), 1098-1105. https://doi.org/10.1007/s11605-016-3135-x
Massironi, S., Rossi, R. E., Zilli, A., Casazza, G., Ciafardini, C., & Conte, D. (2016). A wait-and-watch approach to small pancreatic neuroendocrine tumors: prognosis and survival. Oncotarget, 7(14), 18978-18983. https://doi.org/10.18632/oncotarget.7902
Mazzaferro, V., Sposito, C., Coppa, J., Miceli, R., Bhoori, S., Bongini, M., . . . Mariani, L. (2016). The Long-Term Benefit of Liver Transplantation for Hepatic Metastases From Neuroendocrine Tumors. American Journal of Transplantation, 16(10), 2892-2902. https://doi.org/10.1111/ajt.13831
McCall, C. M., Shi, C., Cornish, T. C., Klimstra, D. S., Tang, L. H., Basturk, O., . . . Hruban, R. H. (2013). Grading of well-differentiated pancreatic neuroendocrine tumors is improved by the inclusion of both Ki67 proliferative index and mitotic rate. Am J Surg Pathol, 37(11), 1671-1677. https://doi.org/10.1097/pas.0000000000000089
Meng, M. B., Zaorsky, N. G., Jiang, C., Tian, L. J., Wang, H. H., Liu, C. L., . . . Ping, W. (2013). Radiotherapy and chemotherapy are associated with improved outcomes over surgery and chemotherapy in the management of limited-stage small cell esophageal carcinoma. Radiother Oncol, 106(3), 317-322. https://doi.org/10.1016/j.radonc.2013.01.008
Meulendijks, D., Henricks, L. M., Sonke, G. S., Deenen, M. J., Froehlich, T. K., Amstutz, U., . . . Schellens, J. H. (2015). Clinical relevance of DPYD variants c.1679T>G, c.1236G>A/HapB3, and c.1601G>A as predictors of severe fluoropyrimidine-associated toxicity: a systematic review and meta-analysis of individual patient data. Lancet Oncology, 16(16), 1639-1650. https://doi.org/10.1016/s1470-2045(15)00286-7
Milione, M., Maisonneuve, P., Spada, F., Pellegrinelli, A., Spaggiari, P., Albarello, L., . . . La Rosa, S. (2017). The Clinicopathologic Heterogeneity of Grade 3 Gastroenteropancreatic Neuroendocrine Neoplasms: Morphological Differentiation and Proliferation Identify Different Prognostic Categories. Neuroendocrinology, 104(1), 85-93. https://doi.org/10.1159/000445165
Modlin, I. M., Pavel, M., Kidd, M., & Gustafsson, B. I. (2010). Review article: somatostatin analogues in the treatment of gastroenteropancreatic neuroendocrine (carcinoid) tumours. Alimentary Pharmacology and Therapeutics, 31(2), 169-188. https://doi.org/10.1111/j.1365-2036.2009.04174.x
Moertel, C. G., Hanley, J. A., & Johnson, L. A. (1980). Streptozocin alone compared with streptozocin plus fluorouracil in the treatment of advanced islet-cell carcinoma. N Engl J Med, 303(21), 1189-1194. https://doi.org/10.1056/NEJM198011203032101
Morgan, R. E., Pommier, S. J., & Pommier, R. F. (2018). Expanded criteria for debulking of liver metastasis also apply to pancreatic neuroendocrine tumors. Surgery, 163(1), 218-225. https://doi.org/10.1016/j.surg.2017.05.030
Nasjonal helseplan (2007-2010). (2006). (Særtrykk av St.prp. nr. 1 (2006–2007) kapittel 6.). Oslo: Helse- og omsorgsdepartementet. Hentet fra https://www.regjeringen.no/globalassets/upload/HOD/Sykehus/Nasjonal_helseplan_Sartrykk.pdf
Nasjonal strategi for kreftområdet 2006-2009. (2006). Oslo: Helse- og omsorgsdepartementet. Hentet fra https://www.regjeringen.no/globalassets/upload/hod/sykehus/kreftstrategi-2006-2009.pdf
Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av lungekreft, mesoteliom og thymom. (2014). (8. utg.). (IS-2654). Oslo: Helsedirektoratet. Hentet fra https://helsedirektoratet.no/retningslinjer/nasjonalt-handlingsprogram-med-retningslinjer-for-diagnostikk-behandling-og-oppfolging-av-lungekreft-mesoteliom-og-thymom
Norlen, O., Hessman, O., Stalberg, P., Akerstrom, G., & Hellman, P. (2010). Prophylactic cholecystectomy in midgut carcinoid patients. World J Surg, 34(6), 1361-1367. https://doi.org/10.1007/s00268-010-0428-1
Norlen, O., Stalberg, P., Oberg, K., Eriksson, J., Hedberg, J., Hessman, O., . . . Akerstrom, G. (2012). Long-term results of surgery for small intestinal neuroendocrine tumors at a tertiary referral center. World J Surg, 36(6), 1419-1431. https://doi.org/10.1007/s00268-011-1296-z
Norton, J. A. (2005). Surgery and prognosis of duodenal gastrinoma as a duodenal neuroendocrine tumor. Best Pract Res Clin Gastroenterol, 19(5), 699-704. https://doi.org/10.1016/j.bpg.2005.05.001
Oberg, K., Knigge, U., Kwekkeboom, D., Perren, A., & Group, E. G. W. (2012). Neuroendocrine gastro-entero-pancreatic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 23 Suppl 7, vii124-130. https://doi.org/10.1093/annonc/mds295
Palliasjon: nordisk lærebok. (2016). (3. utg.). Oslo: Gyldendal.
Panagiotidis, E., Alshammari, A., Michopoulou, S., Skoura, E., Naik, K., Maragkoudakis, E., . . . Bomanji, J. (2017). Comparison of the Impact of 68Ga-DOTATATE and 18F-FDG PET/CT on Clinical Management in Patients with Neuroendocrine Tumors. Journal of Nuclear Medicine, 58(1), 91-96. https://doi.org/10.2967/jnumed.116.178095
Pape, U. F., Perren, A., Niederle, B., Gross, D., Gress, T., Costa, F., . . . Barcelona Consensus Conference, p. (2012). ENETS Consensus Guidelines for the management of patients with neuroendocrine neoplasms from the jejuno-ileum and the appendix including goblet cell carcinomas. Neuroendocrinology, 95(2), 135-156. https://doi.org/10.1159/000335629
Patel, S. P., Othus, M., Chae, Y. K., Giles, F. J., Hansel, D. E., Singh, P. P., . . . Kurzrock, R. (2020). A Phase II Basket Trial of Dual Anti-CTLA-4 and Anti-PD-1 Blockade in Rare Tumors (DART SWOG 1609) in Patients with Nonpancreatic Neuroendocrine Tumors. Clin Cancer Res, 26(10), 2290-2296. https://doi.org/10.1158/1078-0432.Ccr-19-3356
Pavel, M., Baudin, E., Couvelard, A., Krenning, E., Oberg, K., Steinmuller, T., . . . Barcelona Consensus Conference, p. (2012). ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary. Neuroendocrinology, 95(2), 157-176. https://doi.org/10.1159/000335597
Pellikka, P. A., Tajik, A. J., Khandheria, B. K., Seward, J. B., Callahan, J. A., Pitot, H. C., & Kvols, L. K. (1993). Carcinoid heart disease. Clinical and echocardiographic spectrum in 74 patients. Circulation, 87(4), 1188-1196.
Ramage, J. K., Ahmed, A., Ardill, J., Bax, N., Breen, D. J., Caplin, M. E., . . . Ireland Neuroendocrine Tumour, S. (2012). Guidelines for the management of gastroenteropancreatic neuroendocrine (including carcinoid) tumours (NETs). Gut, 61(1), 6-32. https://doi.org/10.1136/gutjnl-2011-300831
Ramage, J. K., De Herder, W. W., Delle Fave, G., Ferolla, P., Ferone, D., Ito, T., . . . Vienna Consensus Conference, p. (2016). ENETS Consensus Guidelines Update for Colorectal Neuroendocrine Neoplasms. Neuroendocrinology, 103(2), 139-143. https://doi.org/10.1159/000443166
Raymond, E., Dahan, L., Raoul, J. L., Bang, Y. J., Borbath, I., Lombard-Bohas, C., . . . Ruszniewski, P. (2011). Sunitinib malate for the treatment of pancreatic neuroendocrine tumors. N Engl J Med, 364(6), 501-513. https://doi.org/10.1056/NEJMoa1003825
Regenet, N., Carrere, N., Boulanger, G., de Calan, L., Humeau, M., Arnault, V., . . . Mirallie, E. (2016). Is the 2-cm size cutoff relevant for small nonfunctioning pancreatic neuroendocrine tumors: A French multicenter study. Surgery, 159(3), 901-907. https://doi.org/10.1016/j.surg.2015.10.003
Reid, M. D., Bagci, P., Ohike, N., Saka, B., Erbarut Seven, I., Dursun, N., . . . Adsay, V. (2015). Calculation of the Ki67 index in pancreatic neuroendocrine tumors: a comparative analysis of four counting methodologies. Mod Pathol, 28(5), 686-694. https://doi.org/10.1038/modpathol.2014.156
Rindi, G., Kloppel, G., Alhman, H., Caplin, M., Couvelard, A., de Herder, W. W., . . . Wiedenmann, B. (2006). TNM staging of foregut (neuro)endocrine tumors: a consensus proposal including a grading system. Virchows Arch, 449(4), 395-401. https://doi.org/10.1007/s00428-006-0250-1
Rinke, A., Muller, H. H., Schade-Brittinger, C., Klose, K. J., Barth, P., Wied, M., . . . Group, P. S. (2009). Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. J Clin Oncol, 27(28), 4656-4663. https://doi.org/10.1200/JCO.2009.22.8510
Rinzivillo, M., Capurso, G., Campana, D., Fazio, N., Panzuto, F., Spada, F., . . . Delle Fave, G. (2016). Risk and Protective Factors for Small Intestine Neuroendocrine Tumours: A Prospectivecase-Control Study. Neuroendocrinology, 103(5), 531-537. https://doi.org/10.1159/000440884
Roy, R. C., Carter, R. F., & Wright, P. D. (1987). Somatostatin, anaesthesia, and the carcinoid syndrome. Peri-operative administration of a somatostatin analogue to suppress carcinoid tumour activity. Anaesthesia, 42(6), 627-632.
Sadot, E., Reidy-Lagunes, D. L., Tang, L. H., Do, R. K., Gonen, M., D'Angelica, M. I., . . . Allen, P. J. (2016). Observation versus Resection for Small Asymptomatic Pancreatic Neuroendocrine Tumors: A Matched Case-Control Study. Ann Surg Oncol, 23(4), 1361-1370. https://doi.org/10.1245/s10434-015-4986-1
Sahnane, N., Furlan, D., Monti, M., Romualdi, C., Vanoli, A., Vicari, E., . . . La Rosa, S. (2015). Microsatellite unstable gastrointestinal neuroendocrine carcinomas: a new clinicopathologic entity. Endocr Relat Cancer, 22(1), 35-45. https://doi.org/10.1530/erc-14-0410
Sammen - mot kreft: nasjonal kreftstrategi 2013-2017. (2013). Oslo: Helse- og omsorgsdepartementet. Hentet fra https://www.iccp-portal.org/system/files/plans/kreftstrategien_2013.pdf
Sandvik, O. M., Soreide, K., Gudlaugsson, E., Kvaloy, J. T., & Soreide, J. A. (2016). Epidemiology and classification of gastroenteropancreatic neuroendocrine neoplasms using current coding criteria. Br J Surg, 103(3), 226-232. https://doi.org/10.1002/bjs.10034
Shafqat, H., Ali, S., Salhab, M., & Olszewski, A. J. (2015). Survival of patients with neuroendocrine carcinoma of the colon and rectum: a population-based analysis. Dis Colon Rectum, 58(3), 294-303. https://doi.org/10.1097/DCR.0000000000000298
Sorbye, H., Baudin, E., Borbath, I., Caplin, M., Chen, J., Cwikla, J. B., . . . Garcia-Carbonero, R. (2019). Unmet Needs in High-Grade Gastroenteropancreatic Neuroendocrine Neoplasms (WHO G3). Neuroendocrinology, 108(1), 54-62. https://doi.org/10.1159/000493318
Sorbye, H., Baudin, E., & Perren, A. (2018). The Problem of High-Grade Gastroenteropancreatic Neuroendocrine Neoplasms: Well-Differentiated Neuroendocrine Tumors, Neuroendocrine Carcinomas, and Beyond. Endocrinology and Metabolism Clinics of North America, 47(3), 683-698. https://doi.org/10.1016/j.ecl.2018.05.001
Sorbye, H., Kong, G., & Grozinsky-Glasberg, S. (2020). PRRT in high-grade gastroenteropancreatic neuroendocrine neoplasms (WHO G3). Endocr Relat Cancer, 27(3), R67-r77. https://doi.org/10.1530/erc-19-0400
Sorbye, H., Meyer, L. S., Mordal, K. E., Myhre, S., & Thiis-Evensen, E. (2020). Patient reported symptoms, coping and quality of life during somatostatin analogue treatment for metastatic small- intestinal neuroendocrine tumours. Health and quality of life outcomes, 18(1), 188. https://doi.org/10.1186/s12955-020-01452-7
Sorbye, H., Strosberg, J., Baudin, E., Klimstra, D. S., & Yao, J. C. (2014). Gastroenteropancreatic high-grade neuroendocrine carcinoma. Cancer, 120(18), 2814-2823. https://doi.org/10.1002/cncr.28721
Sorbye, H., Welin, S., Langer, S. W., Vestermark, L. W., Holt, N., Osterlund, P., . . . Knigge, U. (2013). Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3): the NORDIC NEC study. Ann Oncol, 24(1), 152-160. https://doi.org/10.1093/annonc/mds276
Stridsberg, M., Eriksson, B., Oberg, K., & Janson, E. T. (2003). A comparison between three commercial kits for chromogranin A measurements. J Endocrinol, 177(2), 337-341.
Strosberg, J., El-Haddad, G., Wolin, E., Hendifar, A., Yao, J., Chasen, B., . . . Investigators, N.-T. (2017). Phase 3 Trial of 177Lu-Dotatate for Midgut Neuroendocrine Tumors. N Engl J Med, 376(2), 125-135. https://doi.org/10.1056/NEJMoa1607427
Strosberg, J. R., Coppola, D., Klimstra, D. S., Phan, A. T., Kulke, M. H., Wiseman, G. A., . . . North American Neuroendocrine Tumor, S. (2010). The NANETS consensus guidelines for the diagnosis and management of poorly differentiated (high-grade) extrapulmonary neuroendocrine carcinomas. Pancreas, 39(6), 799-800. https://doi.org/10.1097/MPA.0b013e3181ebb56f
Strosberg, J. R., Fine, R. L., Choi, J., Nasir, A., Coppola, D., Chen, D. T., . . . Kvols, L. (2011). First-line chemotherapy with capecitabine and temozolomide in patients with metastatic pancreatic endocrine carcinomas. Cancer, 117(2), 268-275. https://doi.org/10.1002/cncr.25425
Tang, L. H., Untch, B. R., Reidy, D. L., O'Reilly, E., Dhall, D., Jih, L., . . . Klimstra, D. S. (2016). Well-Differentiated Neuroendocrine Tumors with a Morphologically Apparent High-Grade Component: A Pathway Distinct from Poorly Differentiated Neuroendocrine Carcinomas. Clin Cancer Res, 22(4), 1011-1017. https://doi.org/10.1158/1078-0432.ccr-15-0548
Thang, S. P., Lung, M. S., Kong, G., Hofman, M. S., Callahan, J., Michael, M., & Hicks, R. J. (2018). Peptide receptor radionuclide therapy (PRRT) in European Neuroendocrine Tumour Society (ENETS) grade 3 (G3) neuroendocrine neoplasia (NEN) - a single-institution retrospective analysis. Eur J Nucl Med Mol Imaging, 45(2), 262-277. https://doi.org/10.1007/s00259-017-3821-2
Tierney, J. F., Poirier, J., Chivukula, S., Pappas, S. G., Hertl, M., Schadde, E., & Keutgen, X. (2019). Primary Tumor Site Affects Survival in Patients with Gastroenteropancreatic and Neuroendocrine Liver Metastases. International Journal of Endocrinology, 2019, 9871319. https://doi.org/10.1155/2019/9871319
TNM Classification of Malignant Tumours. (2016). (8. utg.). Oxford: Wiley-Blackwell.
Toumpanakis, C. G., & Caplin, M. E. (2008). Molecular genetics of gastroenteropancreatic neuroendocrine tumors. Am J Gastroenterol, 103(3), 729-732. https://doi.org/10.1111/j.1572-0241.2007.01777.x
Tropea, F., Baldari, S., Restifo, G., Fiorillo, M. T., Surace, P., & Herberg, A. (2006). Evaluation of chromogranin A expression in patients with non-neuroendocrine tumours. Clin Drug Investig, 26(12), 715-722.
Vijayvergia, N., Dasari, A., Deng, M., Litwin, S., Al-Toubah, T., Alpaugh, R. K., . . . Strosberg, J. R. (2020). Pembrolizumab monotherapy in patients with previously treated metastatic high-grade neuroendocrine neoplasms: joint analysis of two prospective, non-randomised trials. Br J Cancer, 122(9), 1309-1314. https://doi.org/10.1038/s41416-020-0775-0
Waddell, N., Pajic, M., Patch, A. M., Chang, D. K., Kassahn, K. S., Bailey, P., . . . Grimmond, S. M. (2015). Whole genomes redefine the mutational landscape of pancreatic cancer. Nature, 518(7540), 495-501. https://doi.org/10.1038/nature14169
Welin, S., Sorbye, H., Sebjornsen, S., Knappskog, S., Busch, C., & Oberg, K. (2011). Clinical effect of temozolomide-based chemotherapy in poorly differentiated endocrine carcinoma after progression on first-line chemotherapy. Cancer, 117(20), 4617-4622. https://doi.org/10.1002/cncr.26124
Xie, J. W., Sun, Y. Q., Feng, C. Y., Zheng, C. H., Li, P., Wang, J. B., . . . Huang, C. M. (2016). Evaluation of clinicopathological factors related to the prognosis of gastric neuroendocrine carcinoma. Eur J Surg Oncol, 42(10), 1464-1470. https://doi.org/10.1016/j.ejso.2016.08.004
Yachida, S., Vakiani, E., White, C. M., Zhong, Y., Saunders, T., Morgan, R., . . . Iacobuzio-Donahue, C. A. (2012). Small cell and large cell neuroendocrine carcinomas of the pancreas are genetically similar and distinct from well-differentiated pancreatic neuroendocrine tumors. Am J Surg Pathol, 36(2), 173-184. https://doi.org/10.1097/PAS.0b013e3182417d36
Yao, J. C., Fazio, N., Singh, S., Buzzoni, R., Carnaghi, C., Wolin, E., . . . Rad001 in Advanced Neuroendocrine Tumours, F. T. S. G. (2016). Everolimus for the treatment of advanced, non-functional neuroendocrine tumours of the lung or gastrointestinal tract (RADIANT-4): a randomised, placebo-controlled, phase 3 study. Lancet, 387(10022), 968-977. https://doi.org/10.1016/S0140-6736(15)00817-X
Yao, J. C., Hassan, M., Phan, A., Dagohoy, C., Leary, C., Mares, J. E., . . . Evans, D. B. (2008). One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol, 26(18), 3063-3072. https://doi.org/10.1200/jco.2007.15.4377
Yao, J. C., Shah, M. H., Ito, T., Bohas, C. L., Wolin, E. M., Van Cutsem, E., . . . Rad001 in Advanced Neuroendocrine Tumors, T. T. S. G. (2011). Everolimus for advanced pancreatic neuroendocrine tumors. N Engl J Med, 364(6), 514-523. https://doi.org/10.1056/NEJMoa1009290









