Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av pasienter med nyrekreft
Hva er nytt?
Sist faglig oppdatert: 27.09.2024
Oppdatering av handlingsprogram for nyrekreft 2024:
Nytt kapittel om fastlegens rolle ved Nyrecellekreft
Kapittel Diagnostikk og Utredning
- Det er gjort språklige endringer og kapittelet er redusert i omfang
- Nytt underkapittel om utredning av nyrekreft ved nyresvikt
Kapittel behandling av nyrecellekarsinom uten metastaser
- Aktiv overvåking
- Anbefalt vurdering av sårbarhet og sarkopeni når det er tvil om pasienten er aktuell for kirurgi
- Neoadjuvant og adjuvant behandling
- Oppdatert tekst
Kapittel behandling av nyrecellekarsinom med metastaser
- Behandlingsvalg første linje
- TKI monoterapi kan være et behandlingsalternativ i god prognosegruppe
- Kombinasjonsbehandling senere linjer
- Immunterapi etter tidligere progresjon på immunsjekkpunkthemmer anbefales ikke på generelt grunnlag
- Persontilpasset behandling
- Sekvensering ved klarcellet histologi anbefales kun unntaksvis for pasienter som skiller seg fra gruppen (ung alder, uvanlig presentasjon eller uvanlig respons på behandling)
Kapittel oppfølging
- Anbefalt oppfølging etter risikostratifisering
- Man kan vurdere å kutte ut CT thorax i oppfølging av pasienter med lavrisiko cancer T1a som er asymtomatiske uten trombocytopeni eller anemi.
- Kontroll av Bosniak cyster
- Kontroll ved Bosniak IIF er endret til 2 og 5 år (tidligere 1,3 og 5 år)
Forkortelser
Sist faglig oppdatert: 27.09.2024
AKSI: Aksitinib
ALP: Alkalisk fosfatase
AS: Aktiv overvåking
ASA: Klassifiseringssystem ved bruk av anestesi
BMI: Kroppsmasseindex
C64: Ondartet svulst i nyre utenom nyrebekken
CA: Kryoablasjon
CEUS: Kontrastforsterket ultralyd
CI: Konfidensintervall
CN: Cytoreduktiv nefrektomi.
CR: Komplett respons
CRP: C-reaktivt protein
CSS: Kreft spesifikk overlevelse
CT : Computertomografi
CTCAE: Common Terminology Criteria for Adverse Events
CTLA-4: Cytotoksisk T-lymfocytt antigen-4
DVT: Dyp vene trombose
EAU: European Association of Urology
ECOG: Pasientens funksjonsstatus (Eastern Cooperative Oncology Group)
GFR: Glomerulær filtrasjonsrate
EMA: European Medicines Agency. Det europeiske legemiddelbyrået
ESMO: European Society for Medical Oncology
FDA : Amerikansk overvåkingsorgan for medisinske produkter (Food and drug administration)
FDG: Radioaktiv isotop til bruk ved PET (fluoro-2-deoksyglukose)
FISH: Fluorescens In Situ hybridisering
FOV: Field of view
Gy: Gray (måleenhet for stråledose)
Hb: Hemoglobin
HR: Hazard ratio
HU: Hounsfield Units
I.v.: Intravenøst
IMD: Intermediær
IMDC: International Metastatic Renal Cell Carcinoma Disease Consortium
IPI: Ipilimumab
ISUP: International Society of Urological Pathology
ITT: Behandlingsintensjon (Intention to treat)
KABO: Kabozantinib
LENVA: Lenvatinib
LND: Lymfeknutedisseksjon
MDT: Multidisiplinært team/Tverrfaglig møte
MR: Magnetresonansundersøkelse
m-TOR: Proteinkinase som spiller en viktig rolle i forskjellige celleprosesser
MWA: Mikrobølgeablasjon
N: Antall målinger
NA: Kan ikke vurderes (not assessable)
NIVO: Nivolumab
NSF: Nefrogen systemisk fibrose
NUCG: Norsk Urologisk Cancergruppe
ORR: Responsrate (overall response rate)
OS: Total overlevelse (overall survival)
PARP: Poly (ADP-ribose) polymerase
PD-1 hemmer: Medikament som hemmer PD1-reseptor
PDGF-R: Platederivert vekstfaktor reseptor
PD-L1 hemmer: Medikament som hemmer PDL1 reseptor
PEMBRO: Pembrolizumab
PET/ CT: Positronemisjonstomografi/ computertomografi
PFS: Progresjonsfri overlevelse (progression free survival)
PO: Per oralt
QD: Daglig (Latin: quaque die)
Q2W: Hver 2.uke
Q3W: Hver 3.uke
RANK-L: Reseptoraktivator av nukleær faktor kappaB-ligand
RCC: Klarcellet nyrekreft
RFA: Radiofrekvensablasjon
RFS: Tilbakefallsfri overlevelse (recurrence free survival)
SR: Senkningsreaksjon
TA: Termal ablasjon
TKI: Tyrosinkinasehemmer
TNM: Klassifikasjonssystem for maligne svulster
UL: Ultralyd
VEGFR: Reseptorer for vaskulær endotelial vekstfaktor
VHL: von Hippel-Lindau
Fastlegens arbeid og ansvar ved nyrekreft
Sist faglig oppdatert: 27.09.2024
Generelle betraktninger rundt fastlegens rolle i norsk kreftomsorg.
Fastlegens rolle i forebygging av nyrekreft
Fastlegene bør kjenne til forekomst og risikofaktorer for nyrekreft og bruke kunnskapsbaserte metoder i arbeidet med disse.
Det ble registrert 958 nye tilfeller av nyrekreft i 2023 (Larsen, 2024). De fleste som får sykdommen er i alderen 60-80 år, og menn rammes hyppigere enn kvinner. Årsaken til nyrekreft er som regel ikke kjent, men røyking, hypertensjon og overvekt er de best dokumenterte risikofaktorene (Capitanio et al., 2019; Tahbaz et al., 2018). Fastlegen har derfor en viktig rolle i å informere om risiko knyttet til røyking og overvekt, samt motivere og gi råd om røykeslutt og livsstilsendring (se Helsedirektoratets retningslinje om røykeavvenning).
En liten andel av nyrekrefttilfellene er forårsaket av familiære genetiske forandringer, og disse pasientene er oftere yngre og kan ha bilateral sykdom (se kapittel 4 om arvelig nyrekreft)
Fastlegens rolle i diagnostikk og henvisning til pakkeforløp ved nyrekreft
Nyrekreft gir sjelden symptomer i tidlig stadium, og de fleste tilfeller oppdages tilfeldig i forbindelse med bildediagnostikk (Vasudev et al., 2020).
Likevel vil fåtall av pasienter ha symptomer fra lokal tumor i nyre, som blod i urin, smerter i flanke og/eller palpabel oppfylning i flanke, eller fra fjernmetastaser. Omtrent 30 % av pasientene har avvikende blodprøver i form av anemi, forhøyet CRP eller senkningsreaksjon (SR), polycytemi eller hyperkalsemi. Hypertensjon, vekttap og andre generelle symptomer er også vanlige.
Fastlegens rolle er å fange opp symptomer som kan være forenelige med nyrekreft og henvise til bildediagnostikk (CT urinveier/abdomen).
Ved funn av malignitetssuspekt lesjon i nyre henvises pasienten til urologisk avdeling via pakkeforløp (se Pakkeforløp for nyrekreft). I henvisningen skal det fremkomme hva som utløser den begrunnede mistanken om nyrekreft, og henvisningen merkes med «Pakkeforløp for nyrekreft».
Ved henvisning til pakkeforløp skal pasienten informeres om bakgrunnen for henvisningen og hva et pakkeforløp innebærer.
Fastlegens rolle for pasienter som er i aktiv behandling for nyrekreft
Fastlegens rolle i denne fasen vil variere med pasientens kliniske situasjon, livssituasjon og avstand til sykehus. Fastlegen bør være tilgjengelig for å bistå i oppfølging av behandlingen der det er hensiktsmessig for pasienten.
Fastlegen skal bidra til å lindre symptomer relatert til sykdommen, bivirkninger som oppstår under eller etter behandling og gir råd om aktivitet og ernæring. Vanlige symptomer og bivirkninger inkluderer smerter, kvalme, vekttap, hypertensjon, diabetes ved bruk av høye dose kortikosteroider og infeksjoner. Behandling med immunterapi kan oppstå under, men også opp til ett-to år etter at immunterapi behandling er avsluttet og kan gi auto-immune sykdommer i alle organsystemer.
For pasienter som er under behandling skal det alltid være lav terskel for å ta kontakt med sykehuset, særlig ved mistanke om auto-immune bivirkninger av immunterapi, alvorlige bivirkninger, eller ved mistanke om sykdomsprogresjon.
Sykehusene skal alltid sørge at fastlege får tilstrekkelig informasjon om mulige bivirkninger og komplikasjoner som fastlegen bør være oppmerksom på samt råd om oppfølging hvor det er behov for det (se Bivirkninger av medikamentell behandling).
Fastlegen kan være en støtte og behandle angst, depresjon og andre psykiske plager. Fastlegen kan også bidra til å ivareta berørte familiemedlemmer, og samarbeide med hjemmetjeneste og sykehus der dette er aktuelt. Det bør avklares individuelt om sykehuset eller fastlegen skal sørge for eventuell sykemelding i denne fasen. Pasientens beste bør være førende for valg av løsning.
Vurdering av førerkort gjøres i samråd med spesialist og etter retningslinjer gitt i førerkortforskriften. Vær spesielt oppmerksom på hjernemetastaser og bruk av smertestillende og beroligende medikamenter/sovemedisin.
Fastlegens rolle for pasienter som er i kontrollopplegg etter nyrekreftbehandling
Residiv, lokale eller fjernmetastaser, oppstår hovedsakelig i løpet av de første 5 årene etter behandling Likevel er det kjent at nyrecellekarsinom kan residivere mange år etter primær diagnose, og fastlegen skal alltid være oppmerksom på residiv hos en person som har vært behandlet for nyrekreft.
Pasienter som er blitt behandlet for nyrekreft følges opp individuelt i henhold til vurdert risiko for residiv eller metastaser. Kontrollopplegget foregår som regel i sykehus.
Fastlege kan samarbeide med sykehus om kontroller ved langvarig sykdom der dette er hensiktsmessig, eller overta kontrollene etter at behandling ved sykehuset er avsluttet. Sykehusspesialisten skal da i epikrise beskrive detaljert oppfølgingsplan.
Man bør være særlig oppmerksom på pasienter som har mottatt immunterapi da bivirkninger også kan oppstå etter at behandlingen er avsluttet, og risikoen er størst det første året etter avsluttet behandling. Fastlegen må ha lav terskel for kontakt med sykehuset ved nyoppståtte symptomer hos en pasient som har fått immunterapi (se Bivirkninger av medikamentell behandling).
Fastlegens rolle for pasienter som har avsluttet oppfølging av nyrekreft på sykehus
Pasienter som har avsluttet kontrollene på sykehus kan ha varierende behov for videre oppfølging. Fastlegens oppgave må derfor tilpasses den enkeltes behov og anbefalinger gitt i epikrise. Hyppighet av kontroller, samt bruk av bildediagnostikk og blodprøver må tilpasses målsettingen. Det bør komme frem hvilke funn som skal føre til re-henvisning til spesialisthelsetjenesten
Kontrollaktivitet hos fastlegen vil ofte dreie seg om å:
- Avdekke residiv og metastaser som kan behandles og gi bedre resultater for pasienten
- Avdekke fysiske og psykiske seneffekter og komplikasjoner som kan behandles eller lindres (se Helsedirektoratets rapport Seneffekter etter kreftbehandling og kapittelet Bivirkninger av medikamentell behandling i disse retningslinjene).
- Bidra til å avdekke rehabiliteringsbehov, og tilby medisinsk oppfølging og behandling i rehabiliteringsforløpet. Dette inkluderer å henvise til fysikalsk behandling og stimulere til egenomsorg og aktivitet.
- Følge opp samlet helsesituasjon, hvor kreftsykdommen er en del av livet til den enkelte pasient og pårørende. Herunder følger også oppfølging av sykemelding og samarbeid med NAV hos yrkesaktive pasienter.
Noen nyrekreftpasienter går ut av aktiv behandling og kontroll på sykehus fordi sykdommen har kommet over i palliativ fase (se neste avsnitt).
Fastlegens arbeid med palliasjon og omsorg ved livets slutt for nyrekreftpasienter
Palliasjon og omsorg ved livets slutt for nyrekreftpasienter må tilpasses den enkeltes kliniske situasjon og behov. Disse pasientene krever ofte tett oppfølging av fastlege i samarbeid med kommunal pleie- og omsorgstjeneste og eventuelt lindrende enhet ved sykehus.
Det vises til Helsedirektoratets nettsider med mer informasjon om fastlegenes rolle ved kreft, herunder fastlegens rolle i palliasjon og omsorg ved livets slutt (se Nasjonalt handlingsprogram for palliasjon i kreftomsorgen og Generelle betraktninger rundt fastlegens rolle i norsk kreftomsorg).
Epidemiologi og risikofaktorer
Forekomst
Sist faglig oppdatert: 27.09.2024
958 personer ble rammet av kreft i nyre (utenom nyrebekken) i Norge i 2023 (Larsen, 2024). Dette omfatter alle infiltrerende tilfeller.
Forekomsten av nyrekreft har steget jevnt både for menn og kvinner fram til de siste 10 år. De to siste femårsperiodene (2012–16 og 2017–21) har det vært høyere forekomst av nyrekreft (C64) i Norge for både menn og kvinner enn i alle femårsperioder før det (se også figur 2.1).
Det er lavest forekomst blant menn i Oslo og Innlandet og flest i Møre og Romsdal og Nordland. Blant kvinner er det færrest i Oslo og flest i Nordland (aldersjusterte data fra 2017–21).
De fleste (62 %) blir diagnostisert med lokal sykdom, 13 % med regional og 12 % med fjernmetastaser.
Kjønn og alder
I Norge ble 678 menn diagnostisert med nyrekreft noe som gjør det til den 8. vanligste kreftformen i Norge blant menn. Kvinner blir rammet langt sjeldnere enn menn (M:F ratio 2.3 basert på tall fra 2019–23). 280 kvinner fikk diagnosen i 2023. Dette gjør sykdommen til den 13. vanligste kreftformen hos kvinner. Nyrekreft utgjør 3.3 % av alle krefttilfeller hos menn og 1.6 % hos kvinner.
Median alder ved diagnose var 67 år for pasienter diagnostisert med nyrekreft i 2019–23. De fleste tilfeller oppsto i aldersgruppen 70–74 år.
Mortalitet og overlevelse
Sist faglig oppdatert: 27.09.2024
Mortalitet
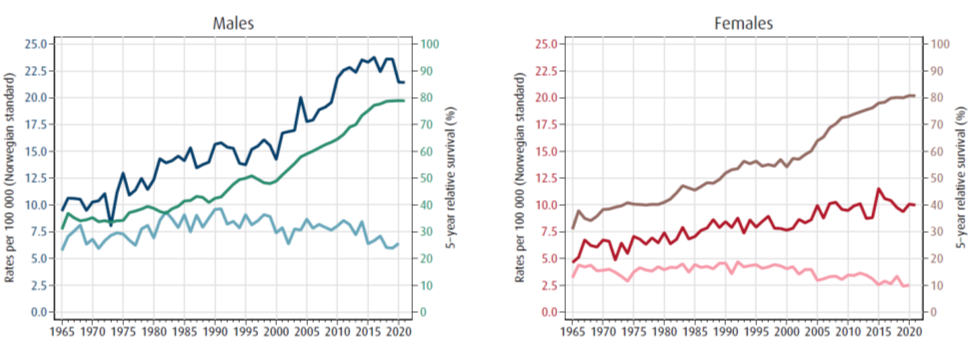
I 2022 døde 204 pasienter av nyrekreft (C64) i Norge, noe som utgjør 1.8 % av alle dødsfall forårsaket av kreft i Norge. 130 (64 %) var menn. Mortalitetsratene for nyrekreft har vært avtagende de siste 20 årene for både menn og kvinner.
Overlevelse
Per 31.12.2023 var det 9 564 personer i live med diagnosen nyrekreft. En tredjedel hadde fått diagnosen for mer enn 10 år siden. Siden mange nyrekreftpasienter blir diagnostisert med regional sykdom med god prognose, betyr det at det er mange kreftoverlevere. Det har vært en jevn økning i overlevelsen av nyrekreft i Norge de siste 50 årene. 5-års relativ overlevelse er henholdsvis 80 % og 83 % for menn og kvinner diagnostisert i 2019–23 og 93 % mot 95 % ved lokal sykdom.
Risikofaktorer
Sist faglig oppdatert: 27.09.2024
Årsaken til nyrekreft er oftest ikke kjent, men en liten andel er forårsaket av familiære genetiske forandringer (se kapittel Arvelig nyrekreft). Røyking, hypertensjon, overvekt og fedme er de best dokumentere risikofaktorene og mest effektive preventive tiltak er å unngå tobakk og redusere overvekt (Capitanio et al., 2019; Tahbaz et al., 2018). Andre mulige risikofaktorer som diett og yrkeseksponering for carcinogener er diskutert, men litteraturen er ikke konklusiv (Tahbaz et al., 2018).
Fastlegens rolle
Sist faglig oppdatert: 27.09.2024
Se mer om fastlegens rolle ved kreft.
Se avsnittene Symptomer, Utredning, Anbefalt oppfølging etter risikostratifisering og Oppfølging av pasienter med metastatisk nyrecellekarsinom for oppfølging av pasienter som er henholdsvis kurativt behandlet og har metastatisk nyrecellekreft.
Pakkeforløp for kreft
Sist faglig oppdatert: 27.09.2024
Fra 1. mai 2015 ble Pakkeforløp for nyrekreft innført i helsetjenesten.
Pakkeforløp for kreft for nyrekreft
Sist faglig oppdatert: 27.09.2024
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er et standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Les mer om Pakkeforløp for nyrekreft.
Det er egne Diagnoseveiledere for inngang til pakkeforløp for kreft.
Pakkeforløp hjem for pasienter med kreft
Sist faglig oppdatert: 27.09.2024
Pakkeforløp hjem for pasienter med kreft skal bidra til å sikre god struktur og logistikk i helsetjenesten, samt sikre trygghet og forutsigbarhet for personer som lever med kreft eller etter endt kreftbehandling.
Pakkeforløp for kreft for nyrekreft
Sist faglig oppdatert: 27.09.2024
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er et standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Les mer om Pakkeforløp for nyrekreft.
Det er egne Diagnoseveiledere for inngang til pakkeforløp for kreft.
Pakkeforløp hjem for pasienter med kreft
Sist faglig oppdatert: 27.09.2024
Pakkeforløp hjem for pasienter med kreft skal bidra til å sikre god struktur og logistikk i helsetjenesten, samt sikre trygghet og forutsigbarhet for personer som lever med kreft eller etter endt kreftbehandling.
Arvelig nyrekreft
Sist faglig oppdatert: 27.09.2024
Internasjonalt anslår man at mellom 2 og 8 % av nyrekrefttilfellene har monogenetisk årsak (Lui et al., 2019), og store tvillingstudier tyder også på at arv – både monogen og polygen – spiller en vesentlig rolle i utviklingen av nyrekreft (Mucci et al., 2016). Det er viktig å skille mellom den pasientgruppen som har økt risiko for nyrekreft på grunn av en kjent eller ukjent genetisk forandring, og den generelt økte risikoen som vil gjelde alle med en slektning med nyrekreft (Gudbjartsson et al., 2002).
Mistanke om arvelig betinget nyrekreft
Sist faglig oppdatert: 27.09.2024
Som ved andre arvelige krefttilstander, vil pasienter med genetisk betinget nyrekreft vanligvis diagnostiseres i yngre alder enn det som er vanlig i resten av befolkningen (Shuch et al., 2014), og de har oftere bilaterale eller multifokale svulster (Gudbjartsson et al., 2002; Nguyen et al., 2017). I tillegg finnes noe evidens for at pasienter med arvelig årsak har mer avanserte svulster, særlig hvis histologien er uvanlig og ikke-klarcellet (Carlo et al., 2018). Mange av de genetiske diagnosene som gir økt risiko for nyrekreft vil også gi manifestasjoner i andre organsystem, som skissert i tabell 4.1. I mange tilfeller vil en grundig familieanamnese også kunne gi mistanke om arvelighet, selv om en del pasienter vil ha nyoppståtte – dvs. ikke nedarvede – genfeil.
Følgende bør gi mistanke om genetisk betinget nyrekreft:
- Nyrekreft diagnostisert ved eller før 46 års alder.
- Nyrekreft hos en person som har minst én førstegradsslektning med nyrekreft.
- Bilateral eller multifokal nyrekreft.
- Uvanlig histologi og eller blandingshistologi.
- Nyrekreft hos en person som selv har tilleggstrekk som beskrevet i tabell 4.1, evt. har slektninger med slike trekk.
Pasienter med ett eller flere av trekkene nevnt over bør henvises til utredning ved Avd. for medisinsk genetikk ved Oslo universitetssykehus, Haukeland universitetssykehus, St. Olavs Hospital eller Universitetssykehuset i Nord-Norge.
Genetiske tilstander forbundet med økt risiko for nyrekreft
Sist faglig oppdatert: 27.09.2024
| Tilstand | Gen | Histologi ved nyreneoplasier | Andre kliniske manifestasjoner |
|---|---|---|---|
| Von Hippel-Lindau syndrom (VHL) | VHL | Klarcellet nyrecellekarsinom | Hemangiomer i sentralnervesystemet og retina, nyre- og pankreascyster, nevroendokrine svulster, feokromocytomer, endolymfatic sac tumors, cystadenomer i epidydimis/brede ligament |
| Hereditær papilær nyrekreft (HPRC) | MET | Papillært nyrecellekarsinom type 1 | Ingen |
| Hereditær leiomyomatose og nyrekreft (HLRCC) | FH | Papillært nyrecellekarsinom type 2, tubulocystisk papillært nyrecellekarsinom og svulster i samlerør | Kutane leiomyomer, uterine fibromer, binyreadenomer |
| Birt-Hogg-Dubé syndrom (BHD) | FLCN | Kromofobt nyrecellekarsinom, onkocytom, hybride varianter av kromofobt nyrecellekarsinom/onkocytom, sjeldnere klarcellet og papillært nyrecellekarsinom | Kutane fibrofollikulomer, pneumothorax, onkocytom i parotis |
| Hereditært paragangliom/ feokromocytom | SDHB SDHC SDHD | Klarcellet og uklassifisert nyrecellekarsinom | Feokromocytom, paragangliomer i hode-halsområdet, gastrointestinal stromal tumor (GIST) |
| PTEN hamartoma tumor syndrom (Cowden syndrom) | PTEN | Klarcellet, papillært og kromofobt nyrecellekarsinom | Kreft i skjoldbruskkjertel, bryst og endometrium, mucokutane lesjoner, makrocefali, Lhermitte-Duclos sykdom, autismespekterlidelser, lærevansker |
| BAP1-assosiert kreftsyndrom | BAP1 | Klarcellet nyrecellekarsinom | Uveale og kutane melanom, malignt mesoteliom i pleura |
| Tuberøs sklerose | TSC1 TSC2 | Angiomyolipomer, klarcellet, papillært og kromofobt nyrecellekarsinom | Angiofibromer, lymfangioleiomyomastose (LAM), subependymale astrocytomer, lesjoner i munnslimhinnen, shagreen patch, epilepsi, utviklingsforstyrrelser |
| Hyperparatyroidisme-kjevetumor syndrom | CDC73 | Alle subtyper, mixed epithelial stromal tumour (MEST), Wilms tumor | Hyperparathyroidisme og kreft i parathyroidea, kjevefibromer, uterine polypper og livmorkreft |
| Kromosom 3-translokasjoner | Klarcellet nyrecellekarsinom | Fertilitetsvansker, habituell abort, utviklingsforstyrrelser | |
| MITF-assosiert kreftsyndom | MITF | Usikkert, sannsynlig klarcellet og papillært nyrecellekarsinom | Melanom, kreft i bukspyttkjertel, feokromocytom |
| CHEK2-assosiert kreftsyndrom | CHEK2 | Alle subtyper | Økt risiko for kreft i bryst, prostata, kolon, muligens også thyroidea, ovarier, testikkel |
Tilpasset fra Lui et al. (2019). Copyright 2019 Elsevier. Gjengitt med tillatelse, 2024.
Se avsnitt Oppfølging av personer med arvelig betinget økt risiko for nyrekreft for oppfølging av pasienter med arvelig betinget økt risiko for nyrekreft.
Mistanke om arvelig betinget nyrekreft
Sist faglig oppdatert: 27.09.2024
Som ved andre arvelige krefttilstander, vil pasienter med genetisk betinget nyrekreft vanligvis diagnostiseres i yngre alder enn det som er vanlig i resten av befolkningen (Shuch et al., 2014), og de har oftere bilaterale eller multifokale svulster (Gudbjartsson et al., 2002; Nguyen et al., 2017). I tillegg finnes noe evidens for at pasienter med arvelig årsak har mer avanserte svulster, særlig hvis histologien er uvanlig og ikke-klarcellet (Carlo et al., 2018). Mange av de genetiske diagnosene som gir økt risiko for nyrekreft vil også gi manifestasjoner i andre organsystem, som skissert i tabell 4.1. I mange tilfeller vil en grundig familieanamnese også kunne gi mistanke om arvelighet, selv om en del pasienter vil ha nyoppståtte – dvs. ikke nedarvede – genfeil.
Følgende bør gi mistanke om genetisk betinget nyrekreft:
- Nyrekreft diagnostisert ved eller før 46 års alder.
- Nyrekreft hos en person som har minst én førstegradsslektning med nyrekreft.
- Bilateral eller multifokal nyrekreft.
- Uvanlig histologi og eller blandingshistologi.
- Nyrekreft hos en person som selv har tilleggstrekk som beskrevet i tabell 4.1, evt. har slektninger med slike trekk.
Pasienter med ett eller flere av trekkene nevnt over bør henvises til utredning ved Avd. for medisinsk genetikk ved Oslo universitetssykehus, Haukeland universitetssykehus, St. Olavs Hospital eller Universitetssykehuset i Nord-Norge.
Genetiske tilstander forbundet med økt risiko for nyrekreft
Sist faglig oppdatert: 27.09.2024
| Tilstand | Gen | Histologi ved nyreneoplasier | Andre kliniske manifestasjoner |
|---|---|---|---|
| Von Hippel-Lindau syndrom (VHL) | VHL | Klarcellet nyrecellekarsinom | Hemangiomer i sentralnervesystemet og retina, nyre- og pankreascyster, nevroendokrine svulster, feokromocytomer, endolymfatic sac tumors, cystadenomer i epidydimis/brede ligament |
| Hereditær papilær nyrekreft (HPRC) | MET | Papillært nyrecellekarsinom type 1 | Ingen |
| Hereditær leiomyomatose og nyrekreft (HLRCC) | FH | Papillært nyrecellekarsinom type 2, tubulocystisk papillært nyrecellekarsinom og svulster i samlerør | Kutane leiomyomer, uterine fibromer, binyreadenomer |
| Birt-Hogg-Dubé syndrom (BHD) | FLCN | Kromofobt nyrecellekarsinom, onkocytom, hybride varianter av kromofobt nyrecellekarsinom/onkocytom, sjeldnere klarcellet og papillært nyrecellekarsinom | Kutane fibrofollikulomer, pneumothorax, onkocytom i parotis |
| Hereditært paragangliom/ feokromocytom | SDHB SDHC SDHD | Klarcellet og uklassifisert nyrecellekarsinom | Feokromocytom, paragangliomer i hode-halsområdet, gastrointestinal stromal tumor (GIST) |
| PTEN hamartoma tumor syndrom (Cowden syndrom) | PTEN | Klarcellet, papillært og kromofobt nyrecellekarsinom | Kreft i skjoldbruskkjertel, bryst og endometrium, mucokutane lesjoner, makrocefali, Lhermitte-Duclos sykdom, autismespekterlidelser, lærevansker |
| BAP1-assosiert kreftsyndrom | BAP1 | Klarcellet nyrecellekarsinom | Uveale og kutane melanom, malignt mesoteliom i pleura |
| Tuberøs sklerose | TSC1 TSC2 | Angiomyolipomer, klarcellet, papillært og kromofobt nyrecellekarsinom | Angiofibromer, lymfangioleiomyomastose (LAM), subependymale astrocytomer, lesjoner i munnslimhinnen, shagreen patch, epilepsi, utviklingsforstyrrelser |
| Hyperparatyroidisme-kjevetumor syndrom | CDC73 | Alle subtyper, mixed epithelial stromal tumour (MEST), Wilms tumor | Hyperparathyroidisme og kreft i parathyroidea, kjevefibromer, uterine polypper og livmorkreft |
| Kromosom 3-translokasjoner | Klarcellet nyrecellekarsinom | Fertilitetsvansker, habituell abort, utviklingsforstyrrelser | |
| MITF-assosiert kreftsyndom | MITF | Usikkert, sannsynlig klarcellet og papillært nyrecellekarsinom | Melanom, kreft i bukspyttkjertel, feokromocytom |
| CHEK2-assosiert kreftsyndrom | CHEK2 | Alle subtyper | Økt risiko for kreft i bryst, prostata, kolon, muligens også thyroidea, ovarier, testikkel |
Tilpasset fra Lui et al. (2019). Copyright 2019 Elsevier. Gjengitt med tillatelse, 2024.
Se avsnitt Oppfølging av personer med arvelig betinget økt risiko for nyrekreft for oppfølging av pasienter med arvelig betinget økt risiko for nyrekreft.
Diagnostikk og utredning
Symptomer
Sist faglig oppdatert: 27.09.2024
Med mindre sykdommen er langtkommet, er de fleste nyresvulster asymptomatiske. Det betyr at de aller fleste tilfellene blir oppdaget tilfeldig, vanligvis på en kontrastforsterket CT i venøs fase.
Den klassiske triaden med flankesmerter, hematuri og palpabel svulst sees kun hos omtrent 5 % av pasientene og er assosiert med aggressiv sykdom. Symptomer ved nyrekreft skyldes oftest lokal vekst, blødninger eller fjernmetastaser (hoste/skjelettsmerter). Omtrent 30 % av pasientene med symptomatisk nyrecellekreft har paraneoplastiske syndromer i form av anemi, forhøyet senkningsreaksjon (SR), hypertensjon, vekttap, polycytemi eller hyperkalsemi.
De vanligste lokalisasjoner for fjernmetastaser er lunger, lymfeknuter, skjelett, lever, binyre, hud og hjerne. Metastatisk sykdom foreligger sjelden ved små nyretumorer (< 4 cm).
Opp mot 70 % av nyrekrefttilfellene oppdages tilfeldig i forbindelse med billeddiagnostikk av annen årsak (Vasudev et al., 2020).
Utredning
Sist faglig oppdatert: 27.09.2024
Det er nødvendig med grundig anamnese og generell klinisk undersøkelse. Funksjonsstatus og komorbiditet må også kartlegges, da det har betydning for utredning, behandling og prognose. Objektive verktøy er anbefalt, for eksempel ECOG/Karnofsky (Karnofsky score for performance status calculator, 2016; Oken et al., 1982). De fleste svulster er ikke palpable og klinisk undersøkelse gir ofte lite funn. Et hurtig utviklet varicocele kan i noen tilfeller være forårsaket av en retroperitoneal svulst med endret venøs drenasje. Ved mistanke om metastatisk sykdom, tas egnede radiologiske undersøkelser.
Se også Fastlegens rolle ved kreft.
Ved funn av metastatisk sykdom anbefales risikoskåring i henhold til IMDC (mdcalc.com) (International Metastatic RCC Database Consortium) Risk Score for RCC (Heng-kriterier) (Heng et al., [s.a.]; Heng et al., 2014) (Se avsnitt Risikogrupper etter International Metastatic RCC Database Consortium (IMDC)).
Laboratorieundersøkelser
Det finnes ingen spesifikke tumormarkører. Laboratorieprøver tas for å kartlegge nyrefunksjon, hematologiske verdier, samt prøver som kan indikere metastatisk sykdom (SR, CRP, kalsium, ALP). Laboratorieundersøkelser er også nødvendig for risikoklassifisering ved metastatisk sykdom. Analyse av urin, eventuelt med cytologisk vurdering, kan være aktuelt ved mistanke om urotelial etiologi.
Bildediagnostikk ved primærutredning
Sist faglig oppdatert: 27.09.2024
Radiologisk er det viktig å avklare om det dreier seg om en solid tumor (kontrastladene) eller cyste. Solide tumorer som er større enn 4 cm er oftest maligne, mens omtrent 30% av tumorene som er mindre enn 4 cm er benigne (Johnson et al., 2015)
Computertomografi (CT)
Kontrastforsterket CT er førstevalget for deteksjon og karakterisering av nyretumor. Nylig har en prospektiv studie vist at nefrografisk fase CT er like god som fire-fase CT for deteksjon av nyrecancer hos pasienter med synlig hematuri (Galtung et al., 2024).
Dersom eksisterende bilder viser en solid nyretumor, er det ikke lenger anbefalt med supplerende flerfase CT for nærmere karakterisering. Hvis det er usikkert om det dreier seg om en solid tumor, må behovet for supplerende CT bilder eller andre modaliteter vurderes individuelt. Flerfase CT kan ikke skille mellom godartede og ondartede svulster, og heller ikke differensiere mellom ulike undergrupper av ondartede svulster (Choudhary et al., 2009; Kang et al., 2014; Millet et al., 2011).
Hvis tumor er påvist med ultralyd eller MR, anbefales i de fleste tilfeller supplerende CT abdomen for å få bedre oversikt over tumor, anatomiske forhold og eventuelle metastaser.
Magnetresonanstomografi (MR)
MR inngår ikke som rutine ved utredning av nyrekreft, men kan være et supplement i visse situasjoner. Kontrastforsterket MR er bedre enn CT for å detektere svakt kontrastladende tumores og MR kan være nyttig for å påvise fett i tumor, noe som vanligvis indikerer benignt angiomyolipom (Dilauro et al., 2016; Egbert et al., 2013; Wang et al., 2018).
MR foretrekkes ved symptomgivende fjernmetastaser i hjerne eller skjelett.
| Svulstens karakteristika |
|
| Svulstens utbredelse og relasjoner |
|
| Anatomi |
|
| Funksjon |
|
| Metastaser |
|
Egenprodusert
Ultralyd (UL)
Ultralyd og kontrastforsterket ultralyd (CEUS) inngår ikke som rutine ved utredning av nyrekreft. På grunn av CEUS’ høyere sensitivitet for deteksjon av hypovaskulære lesjoner sammenliknet med CT, kan det være et nyttig supplement i visse situasjoner, spesielt når det er usikkert om en lesjon er solid (Barr et al., 2014; Bertolotto et al., 2015).
Utredning av nyrekreft ved nyresvikt
Kontrastforsterket CT er førstevalg, men ved nyresvikt kan man vurdere MR uten kontrast, eventuelt ultralyd eller kontrastforsterket ultralyd.
Det er ingen absolutt nedre GFR- grense for kontrastundersøkelse av urinveier, men forsiktighet bør utvises ved redusert nyrefunksjon. Europeiske retningslinjer er utarbeidet og revidert i 2018 av ESUR (European Society of Urogenital Radiologi) (van der Molen et al., 2018a, 2018b). Hovedregelen er at man kan gi intravenøs jodholdig kontrast til pasienter som normalt ved e-GFR 30 ml/min eller høyere. Ved e-GFR under 30 ml/min, skal pasienten normalt hydreres på forhånd. Dette skal skje med intravenøs infusjon av ringer eller nacl, og skal starte noen timer før undersøkelsen, eventuelt også pågå i etterkant. Det må vurderes redusert kontrast eller alternative metoder på individuell basis.
Dersom pasienten bruker metformin eller analoge medikamenter, skal disse seponeres etter anbefalte retningslinjer før intravenøs jodholdig kontrast, dersom e-GFR er 30 ml/t eller lavere. Metforminbruk må ikke gjenopptas før e-GFR er målt etter 48timer og nivå er vurdert som akseptabelt av ansvarlig lege.
Om indikasjonen for CT er sterk nok, og adekvate alternativer ikke finnes, kan man gi kontrast etter forbehandling med væske; helst da i samråd med nefrolog.
For detaljer se www.esur.org
Nukleærmedisinske undersøkelser
Ved nedsatt nyrefunksjon eller funn av multiple/bilaterale tumorer, kan funksjonsfordeling måles preoperativt både ved hjelp av isotoprenografi (99mTc‑MAG3) og nyrescintigrafi (99mTc-DMSA). Nyrescintigrafi med DMSA gir mer presis funksjonsfordeling enn renografi, spesielt ved redusert nyrefunksjon, dehydrering eller asymmetrisk funksjonsfordeling (Loft et al., 2011).
SPECT/CT: Tc-99m sestamibi SPECT/CT har potensiale til å kunne skille indolente onkocytære tumorer fra aggressive nyrecellekarsinomer (Gorin et al., 2016). Sestamibiscintigrafi er under utvikling og ytterligere studier er nødvendig før innføring i klinisk praksis. I påvente av slike studier tilrådes parallelle biopsier.
PET (positronemisjonstomografi): Brukes vanligvis ikke i primærutredning (diagnose og initial staging) siden FDG eller andre sporstoff viser varierende eller manglende opptak ved klarcellet nyrecellekarsinom (Ljungberg et al., 2022b; NCCN, 2013). PET utføres heller ikke rutinemessig i Norge ved mistanke om residiv, men kan i enkelte tilfeller ha en verdi.
Skjelettscintigrafi: Anbefales ikke da metastasene oftest er osteolytiske og undersøkelsen dermed blir for lite sensitiv.
Biopsi
Sist faglig oppdatert: 27.09.2024
Nyrebiopsier bør kun vurderes i tilfeller det forventes en klinisk konsekvens. Dette er spesielt relevant ved små nyresvulster (< 4 cm) hvor andelen benign histologi er forholdsvis høy. Tumor bør også være > 15mm fordi differensiering mellom papillært adenom og papillært nyrecellekarsinom baseres på størrelse (Moch et al., 2016).
Biopsi utføres oftest UL- eller CT- veiledet (med eller uten fusjon) med 16-18G sylinderbiopsinål under lokalanestesi. Det anbefales minimum to biopsier med god kvalitet. Prosedyren anses som trygg med svært liten risiko for postbiopsi blødning og metastasering/ seeding i stikkanalen (Marconi et al., 2016). Det foreligger godt samsvar mellom biopsi og kirurgisk preparat (Marconi et al., 2016; Richard et al., 2015). Det kan likevel forekomme underscoring av WHO tumorgrad, samt vansker i differensieringen mellom onkocytomer og kromofobe nyrecellekarsinomer (Marconi et al., 2016).
Biopsi kan være indisert:
- Ved aktiv overvåking initialt eller ved tumorvekst
- Metastatisk nyrecellekarsinom før medikamentell behandling
- Bildediagnostisk tvil om tumor etiologi (nyrecellekarsinom, urotelialt karsinom, lymfom, metastase, inflammatorisk eller infeksiøs prosess
- Tumor i singel nyre
- Ved multiple og/eller bilaterale tumorer
- Eldre og komorbide pasienter der inngrepet i seg selv kan være en større risiko
enn å leve med svulsten - Pasienter som risikerer behandlingskrevende nyresvikt etter kirurgi
- Før ablasjonsbehandling av nyretumorer, i egen separat intervensjon
- Vurderes ved Bosniak IV med større solide komponenter
Biopsi er ikke indisert hos:
- Komorbide og skrøpelige pasienter som skal behandles konservativt uansett biopsisvar
- Utvetydig malign tumor som uansett skal opereres
- Atypiske cyster uten solide elementer
Billeddiagnostikk ved staging av nyrecancer
Sist faglig oppdatert: 27.09.2024
CT thorax og abdomen er rutine ved TNM staging. Behov for supplerende CT angiografi for bedre fremstilling av karanatomi før kirurgi vurderes individuelt.
CT thorax kan utelates hos asymptomatiske pasienter med cT1a og cN0 uten anemi eller trombocytopeni (EAU kapittel 5.2.4).
Øvrig metastaseutredning utføres bare ved symptomatologi eller parakliniske funn suspekt på spredning. Ved mistanke om hjernemetastaser er MR førstevalg.
MR kan også supplere CT ved lokalavansert og metastatisk utbredelse dersom denne er utilstrekkelig fremstilt på CT. MR kan blant annet anvendes til å påvise innvekst i lever, bakre bukvegg, diafragma og avbilde en tumortrombes utstrekning i sentrale venestrukturer (Wu et al., 2019).
Atypiske cyster
Sist faglig oppdatert: 27.09.2024
Cystiske lesjoner med solid vev < 25 % av størrelsen klassifiseres etter Bosniak, mens lesjoner med > 25 % solid vev defineres som en cystisk tumor (Corica et al., 1999).
Nyrecyster beskrives i henhold til Bosniak v.2019 (Silverman et al., 2019). Primært anbefales CT ved vurdering av komplekse nyrecyster, men det finnes adapterte guidelines for bruk av MR. Ved kontroll, er det viktig at man bruker samme modalitet. UL med kontrast (CEUS) er foreløpig ikke inkludert i Bosniak 2019-versjonen.
- Bosniak 1-2 er simple- og hyperdense nyrecyster som ikke krever oppfølging
- Bosniak 2F er uavklarte cyster hvor oppfølging anbefales. Bosniak 2F cyster har lavt malignitetspotensial, og kun en svært liten andel progredierer til Bosniak 3-4 (Couture et al., 2023; Lucocq et al., 2021; Shen et al., 2023). Endringen kan være grunnet initial feilklassifisering eller en reel progresjon. Studier viser at eventuelle endringene skjer svært sakte, og erkjennes sjelden før etter 2-4 år (Shen et al., 2023; Tames et al., 2019). Av disse grunner anbefales første kontroll 2 år etter baseline undersøkelsen. Behov for videre kontroller må vurderes individuelt.
- Bosniak 3-4 cyster skal håndteres som en cystisk nyretumor. Det betyr at de har lavt malignitetspotensiale, og metastasterer sjelden/aldri (Winters et al., 2015). Disse skal vurderes av urolog for enten observasjon eller kirurgi.
Bosniak kalkulator finnes som app eller på https://bio.tools/bosniak-calculator.
Patologi
Patologiens rolle i den diagnostiske prosessen
Sist faglig oppdatert: 27.09.2024
Histopatologisk undersøkelse av svulstvevet legger grunnlaget for klassifisering av nyresvulsten, fastslår om inngrepet er radikalt eller ikke, og gir grunnlaget for å fastslå patologisk tumorstadium ifølge pTNM-klassifikasjonen (Brierley et al., 2017). Den siste utgaven av TNM-versjonen brukes i dag (Brierley et al., 2017). Fullstendig TNM-stadium bestemmes av resultatene fra klinikk, radiologi og histopatologisk undersøkelse.
Nyresvulstene klassifiseres hovedsakelig etter histopatologisk undersøkelse av rutinefargete hematoxylin-eosin vevssnitt, men en gruppe nyresvulster er definert ut fra molekylære karaktertrekk hvor supplerende undersøkelser med immunhistokjemi, FISH (Fluorescens In Situ Hybridisering) eller andre molekylære undersøkelser er nødvendig for endelig klassifisering. Histopatologisk diagnostikk baserer seg på vevsundersøkelse fra partiell eller radikal nefrektomi, av og til nålebiopsi. Nyresvulstene blir klassifisert etter WHO 2022 som i stor grad bygger på retningslinjer fra ISUP (International Society of Urological Pathology) konsensusmøte i Vancouver, 2012 (Srigley et al., 2013; WHO Classification of Tumours Editorial Board, 2022).
Innsending av kirurgisk preparat til histopatologisk diagnostikk
Sist faglig oppdatert: 27.09.2024
Remissen bør inneholde opplysninger som har relevans for patologisk vurdering. Minimum er: sideangivelse, forskjellige fraksjoner og klinisk TNM-stadium. Beholdere med nyrepreparatet og eventuelle andre preparater skal alle merkes med pasientdata og kobles til remissens opplysninger og fraksjoner.
På patologiavdelinger der det foreligger mulighet for biobanking skal preparatet sendes ferskt uten fiksering, optimalt på is for oppskjæring og biobanking, og deretter fiksering på formalin. Om preparatet sendes ferskt, bør tidspunktet for iskemi angis.
Der biobanking ikke er aktuelt, skal preparatet legges på formalin på operasjonsstuen.
Reseksjonsranden ved vena renalis bør markeres.
Nålebiopsi
Sist faglig oppdatert: 27.09.2024
Nålebiopsi gir en sikrere vurdering av typen nyresvulst sammenliknet med finnålsaspirasjon, og har høy spesifisitet (98–100 %) og sensitivitet (86–100 %) for diagnostisering av malignitet (Marconi et al., 2016). Vurdering av WHO/ISUP grad er utfordrende og anbefales ikke angitt i diagnosen, men kan gjengis i en vurdering.
Se også avsnitt Biopsi.
Frysesnittdiagnostikk
Sist faglig oppdatert: 27.09.2024
Frysesnittdiagnostikk bør begrenses til kasus hvor resultatet har stor betydning for behandling. Bedømmelse av frysesnitt kan være svært problematisk, og det er rapportert høy forekomst av falske negative og falske positive resultater (Algaba et al., 2005).
Makroskopisk undersøkelse av nyrepreparater
Sist faglig oppdatert: 27.09.2024
Det anbefales bruk av fastsatte maler. Alle forhold av betydning for TNM-klassifikasjonen må spesifiseres (Amin et al., 2017). For håndtering av nyrepreparater vises også til Handling and staging of Renal Cell Carcinoma – The International Society of Urological Pathology Consensus (ISUP) conference recommendations (Trpkov et al., 2013).
Resektat
Reseksjonsflater tusjes for best mulig vurdering av disse. Størrelse på preparatet angis i cm. Største tumordiameter angis i cm. Tumors avgrensning og snittflate beskrives. Relasjon mellom tumor og nyrekapsel/perirenalt fettvev og reseksjonsflate beskrives. Det må tas snitt fra ulike områder i tumor, særlig solide partier. Antall snitt er avhengig av tumors størrelse og makroskopisk utseende, men 1 snitt per cm av tumor med et minimum på 3 snitt anbefales å støpes inn. Snitt fra reseksjonsflate og områder som belyser tumors relasjon til kapsel og perirenalt vev, samt snitt fra makroskopisk upåfallende nyrevev må inkluderes.
Nefrektomi
Det anbefales å legge et initialt snitt langs preparatets lengdeakse. Tusjing av marginer, enten selektiv tusjing av reseksjonsflater nær tumor eller hele den ytre overflaten. Preparatet beskrives. Tumors lokalisasjon, antall, utbredelse, avgrensning og snittflate beskrives. Største utbredelse av tumor måles i cm. Ved mål av tumorstørrelse ekskluderes eventuell tumortrombe i nyrevene/vena cava. Ved multiple tumorer anbefales å måle utstrekning på de fem største. Tumors relasjon til kapsel/perirenalt fettvev/gerotas fascie/sinus fettvev/nyrebekken, samt store kar, binyre og eventuelle regionale lymfeknuter angis. Antall snitt til mikroskopisk undersøkelse er avhengig av tumors størrelse og makroskopisk utseende. Et snitt per cm av tumor med et minimum på 3 snitt anbefales å støpes inn, men snittuttak må tilpasses hvert enkelt preparat. Snitt fra områder med forskjellig makroskopisk karakter, inklusive nekrose, må inkluderes. Det må tas snitt for vurdering av eventuell innvekst i nyresinus, perirenalt fettvev, nyrebekken, reseksjonsflate og binyre, karstilk samt snitt fra makroskopisk upåfallende nyrevev.
Ved usikkerhet om innvekst i nyresinus makroskopisk, og/eller ved tumorstørrelse 5 cm eller mer, bør det støpes inn minst 3 blokker herfra. Ved multiple tumorer tas snitt fra de fem største.
Makroskopisk tumortrombe i randen av nyrevenen er ikke uten videre ensbetydende med at reseksjonsranden ikke er fri. Nyrevenen kan ha trukket seg sammen/tilbake etter reseksjonen slik at kirurgisk fri reseksjonsrand ved makroskopisk undersøkelse likevel synes å omslutte tumortromben. Her kan kirurgens vurdering og det preoperative bildet være avgjørende. ISUP konsensus anser marginen som positiv dersom det mikroskopisk er veggfast trombe i snitt fra reseksjonskant (Trpkov et al., 2013).
Histologisk diagnose
Sist faglig oppdatert: 27.09.2024
De tre hyppigst forekommende nyrecellekarsinomene er: Klarcellet nyrecellekarsinom (70–80 %), papillært nyrecellekarsinom (10–15 %), som ikke lenger deles inn i type I og II, og kromofobt nyrecellekarsinom (4–5 %). Videre finnes samlerør/collecting duct-karsinom som utgjør en meget liten gruppe, < 0,5 %, men de er meget aggressive og med en dårlig prognose.
Utover de vanlige subtypene av nyrecellekarsinomer beskrevet i 2022 WHO klassifikasjonen, utgjør andre typer nyresvulster ca. 10 %. Flere av disse er relativt sjeldne, noen sporadiske og andre familiære karsinomer. Andre går inn under «ikke klassifiserbare karsinomer». I noen tilfeller behandles disse annerledes enn de tre hyppigste nyrecellekarsinomene (se kapittel om arvelig nyrekreft og EAU retningslinjer (uroweb.org)). Man bør spesielt tenke på disse hos unge pasienter og morfologi som ikke er helt typisk for de vanlige subtypene.
Det tidligere Fuhrman graderingssystemet er erstattet av det såkalte WHO/ISUP graderingssystemet, som kun vurderer nukleolen, og er implementert og validert for klarcellet og papillært nyrecellekarsinom (Moch et al., 2016).
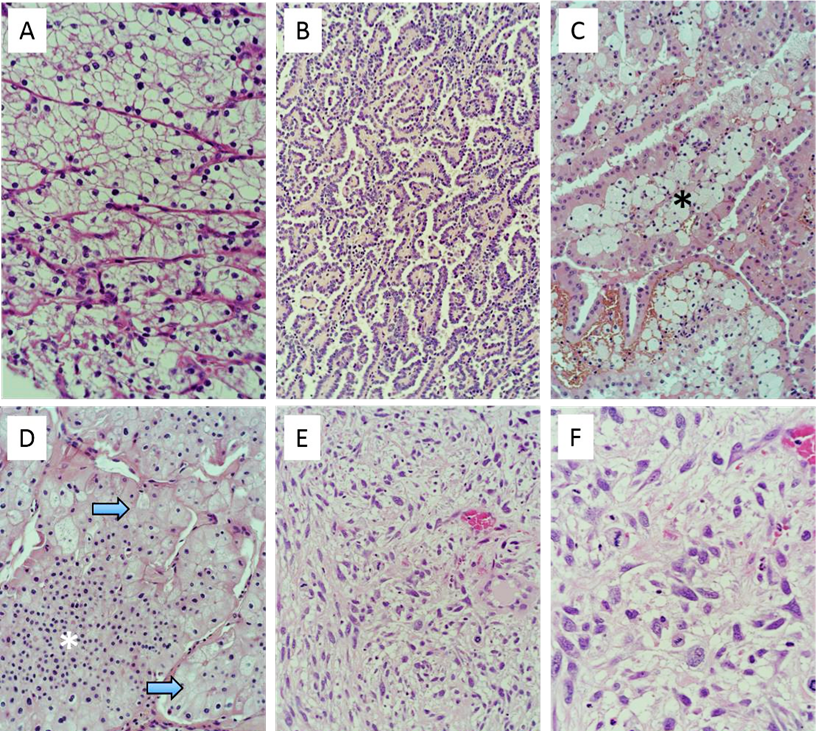
Regionalt cancercentrum, 2019, i offentlig eie
- Klarcellet nyrecellekarsinom med karakteristisk «tomt» cytoplasma og rikelig med kapillærer.
- Papillært nyrecellekarsinom (tidligere type 1) med papillære strukturer, celler med lite cytoplasma og runde cellekjerner, dvs. liten kjernepleomorfi.
- Papillært nyrecellekarsinom (tidligere type 2) bestående av celler med rikelig cytoplasma og større cellekjerner med stor variasjon i kjernestørrelse dvs. uttalt kjernepleomorfi. Fokalt sees for papillært nyrecellekarsinom karakteristisk intrapapillær ansamling av skumcellemakrofager (*).
- Kromofobt nyrecellekarsinom med klassisk morfologi – store cytoplasmarike celler, planteceller. Disse ligger i direkte tilslutning til blodkarene (pil). Innenfor disse sees mindre celler med eosinofilt cytoplasma (*).
- Sarkomatoid form av klarcellet nyrecellekarsinom. Spolformete, fibroblastliknende celler med uttalt kjernepleomorfi.
- Høyere forstørrelse av E. som viser kjernepleomorfi og mitoser. Sarkomatoid differensiering kan utvikles i alle former av nyrecellekarsinom og graderes alltid til WHO–ISUP 4.
ISUP graderingssystemet for klarcellet og papillært nyrecellekarsinom
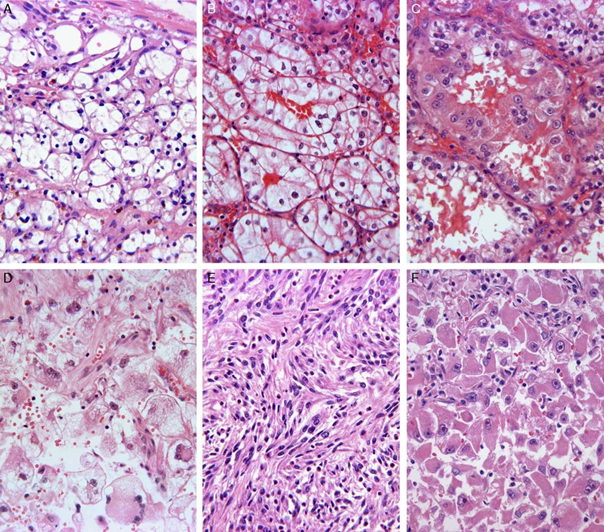
Figur gjengitt fra Delahunt et al. (2013). Copyright 2013 Wolters Kluwer. Gjengitt med tillatelse 2024.
- Grad 1: Nukleoli er lite iøynefallende eller fraværende ved 400x forstørrelse.
- Grad 2: Nukleoli er lett synlige ved 400x forstørrelse, men ikke prominente.
- Grad 3: Nukleoli er prominente og lett synlige ved 100x forstørrelse.
- Grad 4: Tilstedeværelse av «Tumor giant cells» og/eller markert kjernepleomorfi.
- Grad 4: Sarkomatoid karsinom.
- Grad 4: Karsinom med rhabdoid differensiering
Papillært adenom
Papillært adenom er en benign, kortikal svulst med papillær, tubulær eller tubulo-papillær morfologi, uten pseudokapsel og med størrelse under eller lik 15 mm (Moch et al., 2016).
Onkocytom
Onkocytom er en benign svulst som utgjør 3–7 % av solide nyresvulster. Nålebiopsi før eventuell kirurgisk intervensjon er en mulighet. Det er imidlertid vist at diagnosen onkocytom stilt på nålebiopsi, opprettholdes i kun 64,6 % etter kirurgi (Patel et al., 2017). Resten av svulstene viste seg overveiende å være kromofobe nyrecellekarsinomer. Da kromofobe nyrecellekarsinomer ofte er morfologisk heterogene, med områder morfologisk uatskillelige fra onkocytom, anbefales forsiktighet med å avgi diagnosen onkocytom på biopsi. Det anbefales heller å angi «Onkocytær renal neoplasi» med en kommentar om at bildet er forenlig med onkocytom gitt at materialet er representativt for hele lesjonen (EAU sine retningslinjer avsnitt 5.3 (uroweb.org)).
Noen svulster har overlappende morfologiske trekk mellom onkocytom og eosinofil variant av kromofobt nyrecellekarsinom. Det er foreslått å bruke benevnelsen «Onkocytær renal neoplasi av lavt malignitetspotensiale» i slike tilfeller. Varianter av betegnelsen «Hybrid onkocytær tumor» er brukt ulikt i litteraturen og foreslås forbeholdt hereditære svulster med blandet morfologi (mosaikk mønster) (Trpkov et al., 2021).
Prognostiske faktorer
Sist faglig oppdatert: 27.09.2024
Anatomiske, histologiske, kliniske, og molekylære faktorer gir oss prognostisk informasjon.
Anatomiske forhold/parametere gjenspeiles i TNM klassifiseringen; tumorstørrelse, infiltrasjon i nyrebekken/hilært-/perirenalt fettvev/nyrevenen eller dens segmentale forgreninger/binyre, spredning til regionale lymfeknuter og fjernmetastasering.
Histopatologiske prognostiske parametere inkluderer subklassifisering av nyrecellekarsinom, gradering av tumor i henhold til. WHO/ISUP graderingssystemet (Delahunt et al., 2013; Moch et al., 2016), sarkomatoid/rhabdoid differensiering, tumornekrose og kar.
Flere molekylære markører som involverer mutasjonsanalyser, metyleringsstatus og genekspresjonsprofilering, har blitt undersøkt som potensielle markører ved behandlingsvalg for metastatisk nyrecellekarsinom. Disse er ikke endelig validerte.
Stadieinndeling, risikogrupper og gradering av allmenntilstand
Stadieinndeling (TNM)
Sist faglig oppdatert: 27.09.2024
Tabell kommer.
Referanse: Kidney (ICD-O-3 C64) tnmcLINICAL Classification. Brierley et al., red (2017). Copyright 2017 Wiley
Risikogrupper etter International Metastatic RCC Database Consortium (IMDC)
Sist faglig oppdatert: 27.09.2024
Risikofaktorer
- Tid fra diagnose til start < 1 år
- Karnofsky < 80 %
- Anemi (< nedre normalområde)
- Hyperkalsemi (> øvre normalområde)
- Neutrofile (> øvre normalområde)
- Trombocytter (> øvre normalområde)
| Risikokategori | Antall risikofaktorer |
|---|---|
| Lav risiko | Ingen risikofaktorer |
| lntermediær risiko | 1–2 risikofaktorer |
| Høy risiko | ≥ 3 risikofaktorer |
Egenprodusert, basert på Heng et al. (2009). Vurdering av allmenntilstand (Karnofsky/ECOG)
Vurdering av allmenntilstand (Karnofsky/ECOG)
Sist faglig oppdatert: 27.09.2024
Tabell kommer.
Behandling av nyrecellekarsinom uten metastaser
Sist faglig oppdatert: 27.09.2024
Behandling av lokalisert nyrecellekarsinom uten metastaser er i hovedsak kirurgisk.
Dersom nyrebevarende behandling er mulig, bør dette vurderes fremfor radikal nefrektomi. I dag gjennomføres nyrekirurgi som åpne, laparoskopiske eller robotassistert laparoskopiske prosedyrer. I tillegg er bruk av ablative behandlinger økende.
Tverrfaglige møter (MDT)
Sist faglig oppdatert: 27.09.2024
Det er dokumentert nytte av tverrfaglige møter (MDT) (Pillay et al., 2016). Sykehus som utreder og behandler nyrecellekarsinom bør ha formelle tverrfaglige møter, eventuelt mulighet for videooppkobling til kompetente møter ved andre sykehus.
MDT gir behandlingsanbefaling og endelig beslutning tas sammen med pasienten. Urolog, onkolog og radiolog bør være til stede i møtene. Patolog og forløpskoordinator kan være med når det er behov for dette.
Aktiv overvåking (AS)
Sist faglig oppdatert: 27.09.2024
| Aktiv overvåking (AS) | Kurativ intensjon Strukturert oppfølging Behandling kan vurderes ved progresjon |
| Symptombasert behandling (watchful waiting) | Ingen kurativ intensjon Ingen eller individuell oppfølging |
Tall fra det svenske nyrekreft registeret (2017) viser at 80 % av nyoppdagede svulster er små (≤ 4 cm), og de aller fleste er tilfeldig oppdaget (Regionalt cancercentrum, 2022a, 2022b).
Mange av de små svulstene er benigne (30 %). Av de maligne er få aggressive og/eller lokalavanserte (Finelli et al., 2020; Volpe et al., 2004). Risikoen for metastaser er dessuten liten også etter fem års overvåking (Pierorazio et al., 2015; Smaldone et al., 2012; Whelan et al., 2019). Dette gjør at man må ta stilling til om en tilfeldig oppdaget svulst skal fjernes, følges med aktiv overvåking eller kun tilbys symptombasert behandling. Å fjerne alle små svulster ansees som overbehandling.
Mange pasienter er eldre og komorbide, og valg av optimal behandling er utfordrende. Hos alle pasienter, og særlig hos eldre, er det viktig å vurdere om annen sykdom hos pasienten utgjør en større helse- eller mortalitetsrisiko enn nyresvulsten. Det er ikke vist bedret total eller kreftspesifikk overlevelse (CSS) ved kirurgi på små nyresvulster i aldersgruppen > 75 år (Kunkle et al., 2008; Lane et al., 2010; Patel et al., 2012). En slik totalvurdering gjør at mange pasienter ikke trenger aktiv behandling.
Forhold som taler for aktiv overvåking av små svulster er høy alder (>75 år), redusert funksjonsklasse (ECOG), høy ASA score, multiple og bilaterale tumorer, singel nyre og alvorlig komorbiditet. Charlson comorbidity index (mdcalc.com) kan brukes for som hjelp til å vurdere levetidsutsikter (Charlson et al., 1994). AS er også aktuelt for pasienter < 75 år.
Strukturert oppfølging ved AS inkluderer billedkontroll 6–12 måneder etter diagnose, deretter årlig eller hvert andre år. Dette kan endres til utsatt intervensjon ved progresjon. Ved kontroll av pasienter i AS avklarer legen om strategien videre er fortsatt AS (ingen eller lav vekst), radikal behandling (høy vekst, pasientønske) eller endres til symptomstyrt behandling (pga. høy alder, forverret eller tilkommet komorbiditet) som gjør at pasienten ikke lenger er kandidat for kurativ behandling.
En systematisk gjennomgang av flere studier (de fleste retrospektive) påpeker at vurdering av sårbarhet («frailty») og sarkopeni kan være nyttig når det er tvil om pasienten er kandidat for kirurgi eller ei (for eksempel Comprehensive Geriatric Assessment). Det er registrert svakere perioperativt- og onkologisk utfall ved økt sårbarhet og sarkpeni (Campi et al., 2022).
Utsatt behandling/intervensjon er aktuelt dersom tumor vokser til 3–4 cm, har høy veksthastighet, kort doblingstid eller invasivt vekstmønster. Lav tilvekst regnes som ≤ 0,3 cm/år og høy som > 0,3–0,5 cm/år (Finelli et al., 2020). Vekstrate som kan variere, bør helst beregnes med samme bildemodalitet (Uzosike et al., 2018). I en canadisk prospektiv multisenterstudie for nyresvulster ≤ 4 cm, var det ingen eller lav vekst hos ca. 60 % av pasientene (Mason et al., 2011). Både benigne og maligne nyresvulster vokser.
De fleste pasienter vil etter god informasjon akseptere å bli fulgt i et strukturert kontrollprogram (Pierorazio et al., 2013). I noen tilfeller kan imidlertid pasientens livskvalitet forringes på grunn av alvorlig bekymring og frykt for sykdomsutvikling. Dersom det foreligger et sterkt ønske om aktiv behandling bør det tilbys kirurgi eller om mulig ablasjon (samvalg) (Pierorazio et al., 2015).
Symptomstyrt behandling bør benyttes for pasienter med kort forventet levetid og mye komorbiditet, der risikoen ved kirurgi eller anestesi utgjør en større helserisiko enn nyresvulsten alene (også for svulster > 4 cm). Pasienter kan rehenvises ved symptomer som hematuri og smerter.
Biopsi av tumor hos pasienter som inngår i AS kan være nyttig for diagnostikk og risikovurdering (Sebastià et al., 2020). Biopsi kan gjøres primært eller om tumor vokser, men kun gjennomføres om det har behandlingsmessig konsekvens. Det er overflødig hos komorbide og skrøpelige pasienter hvor symptomstyrt behandling er mest fornuftig (se også Biopsi).
Ablativ radikal behandling
Sist faglig oppdatert: 27.09.2024
Termal ablasjon (TA) er et skånsomt alternativ til kirurgi for T1a svulster < 3cm. TA er en ikke-kirurgisk nefronsparende teknikk som destruerer tumorvev lokalt ved bruk av enten varme, f.eks. radiofrekvensablasjon (RFA) og mikrobølgeablasjon (MWA), eller kulde i form av kryoablasjon (CA). Før ablasjon er det sterkt anbefalt at malign histologi er verifisert, da histologisk type/ subtype og gradering vil kunne ha betydning for videre oppfølgning. TA utføres overveiende perkutant CT-veiledet på nyre eventuelt supplert med UL i narkose eller sedasjon. TA har færre komplikasjoner, lavere kostnader, kortere behandlings- og liggetid enn kirurgi og bevarer nyrefunksjonen bedre.
I Norge utføres i dag overveiende MWA, men også RFA. CA som er særlig egnet for hilusnære svulster, har nylig blitt gjeninnført. CA og MWA gir tilsvarende behandlingsresultat med litt varierende prosedyretid og bivirkningsprofil.
Det mangler gode studier som sammenligner TA og partiell nefrektomi av T1a svulster vedrørende lokal residivfri overlevelse (local recurrence free survival). Enkelte studier har vist noe høyere risiko for lokalt residiv etter TA, andre studier har ikke bekreftet det (Chan et al., 2022; Pierorazio et al., 2016; Xing et al., 2018; Yanagisawa et al., 2022; Zhou et al., 2018).
Pasienter som tilbys TA må informeres om mulig noe høyere residivfrekvens enn ved kirurgi (Andrews et al., 2019; Campbell et al., 2021a; Campbell et al., 2021b). Ved påvist residiv gjøres som regel reablasjon eller kirurgisk behandling.
I flere internasjonale retningslinjer er TA angitt som et behandlingsvalg for selekterte pasienter med T1a nyretumor <3cm, mens andre likestiller TA med partiell nefrektomi som 1. linje behandling (Campbell et al., 2021a; Campbell et al., 2021b). I Norge er seleksjonskriterier for TA er blant annet: Alder, komorbiditet, redusert nyrefunksjon, singel nyre, bilaterale tumorer, hereditær nyrecellekarsinom og pasientønske. Disse seleksjonskriteriene er under stadig vurdering.
Man kan utvide indikasjon for enkelte pasienter med tumorstørrelse opp til 4cm (Campbell et al., 2021b; Richard et al., 2022).
Sterotaktisk strålebehandling ved små svulster
Stereotaktisk strålebehandling kan være et alternativ til kirurgi ved små svulster, men det trengs mer data fra randomiserte studier (Correa et al., 2019; Siva et al., 2017).
Kirurgisk radikal behandling
Sist faglig oppdatert: 27.09.2024
Kirurgisk behandling av T1a/T1b svulster (≤ 7 cm)
Ved svulster ≤ 4 cm anbefales nyrereseksjon dersom det er teknisk mulig og samtidig etterlater en funksjonell nyrerest. Nyrereseksjon er onkologisk likeverdig med radikal nefrektomi for T1a svulster. Metoden bør også vurderes ved større svulster (T1b) dersom den anatomiske beliggenheten gjør kirurgi mulig. Dette gjelder særlig hos pasienter med singel nyre, bilaterale svulster eller nyresvikt (MacLennan et al., 2012; Van Poppel et al., 2011). Det er vist at 26 % av de som diagnostiseres med nyrekreft allerede har GFR < 60 mL/ min selv med normal serum kreatinin (Huang et al., 2006).
Nyresparende kirurgi gir bedre totaloverlevelse (OS) enn radikal nefrektomi som følge av lavere forekomst av kronisk nyresvikt og sekundær kardiovaskulær morbiditet (Huang et al., 2020; Huang et al., 2009).
Nyrereseksjon kan gjennomføres laparoskopisk (konvensjonell eller robotassistert), åpent transabdominalt og retroperitonealt se avsnitt "Kirurgiske teknikker ved nyrereseksjon". Åpen nyrereseksjon skal primært prioriteres fremfor laparoskopisk nefrektomi.
Radikal nefrektomi ved T1-tumorer anbefales kun når nefronsparende kirurgi ikke er hensiktsmessig eller trygt. Det kan være ved sentral tumor eller avansert tumorvekst, samt hos pasienter med antatt dårlig toleranse for komplikasjoner ved reseksjon.
Nyresparende kirurgi er forbundet med økte perioperative komplikasjoner sammenlignet med radikal nefrektomi (Van Poppel et al., 2007). Dette gjør at man hos eldre med normal preoperativ nyrefunksjon og frisk kontralateral nyre, bør overveie radikal nefrektomi.
Kirurgisk behandling av T2-T3a svulster
Gullstandard ved T2-T3a nyrecellekarsinom er radikal nefrektomi. Denne kan gjennomføres laparoskopisk (konvensjonelt eller robotassistert) eller åpent da overlevelsesresultatene anses likeverdige. Faktorer som kan påvirke valg av metode er blant annet tumorstørrelse, vekstmønster, utbredelse av lymfeknuter og behov for glandeltoalett, nyrevenetrombe, pasientrelaterte forhold (for eksempel tidligere bukkirurgi eller stomi), kirurgens kompetanse og erfaring samt tilgjengelig utstyr.
Nyere data indikerer at nyrereseksjon også kan overveies hos nøye selekterte pasienter med T2 tumorer (Mir et al., 2017). En nylig publisert metaanalyse indikerer at nyrereseksjon ved T3a-sykdom kan være aktuelt i spesielt utvalgte tilfeller (Liu et al., 2021). Spesielt gjelder dette for pasienter med singel nyre, bilaterale tumorer og kronisk nyresykdom dersom gjenværende parenkym vurderes å kunne gi tilstrekkelig postoperativ nyrefunksjon.
Kirurgisk behandling av T3b, T3c og cT4 svulster
Ved nyrekreft med tumortrombe i vena cava holder 90 % av trombene seg nedenfor diafragma. Av de 10 % som strekker seg over diafragma, går 2/3 inn i høgre atrium. Lymfeknute- eller fjernmetastaser sees hos halvparten av trombepasientene (Blute et al., 2004). Hos pasienter uten metastaser kan mange ha infiltrasjon i perirenalt fett eller i hilus. Pasienter som ikke har metastaser lokalt eller generelt, kan behandles radikalt og har dermed god prognose (Bissada et al., 2003; Lardas et al., 2016; Zisman et al., 2003). Gitt god funksjonsklasse, er anbefalt behandling radikal nefrektomi med trombektomi. Komplikasjonsfrekvensen ved disse operasjonene er høyere enn for lokalisert nyrekreft (Chen et al., 2022; Shuch et al., 2009). Ved planlegging av kirurgi bør man involvere andre nødvendige spesialiteter. Pasienter med høye tromber, tromber inn i levervener, over diafragma og evt. til atriet, må opereres ved avdelinger med nødvendige kompetanse og erfaring med slike inngrep (hjertelungemaskin beredskap) (Blute et al., 2004; Shirodkar et al., 2009). I tilfeller der tumortromben infiltrerer cavaveggen, kan cavareseksjon med evt. graft bli nødvendig. Endret venøs sirkulasjon kan gi en blandet trombe med påleiring av venøs trombe på tumortromben (Blute et al., 2007; Liu et al., 2020).
Noen pasienter med trombe i vena cava og synkrone oligometastaser, kan være kandidater for kirurgi dersom metastaser også kan behandles; se kapittel Behandling av nyrecellekarsinom med metastaser om metastatisk nyrekreft.
Behandling av cT4 svulster
Forekomsten av cT4 svulster er tidligere rapportert til 5–15 %. Ved lokalt invasive svulster strekker tumorveksten seg gjennom gerotas fascie eller inn i naboorgan. Over halvparten av pasientene har lymfe- og fjernmetastaser (Margulis et al., 2007). Det kreves individuell og tverrfaglig vurdering i hvert enkelt tilfelle før behandling tilbys. Invasivitet kan være vanskelig å bedømme peroperativt, men gjennomgått kirurgi med ufri reseksjonsrand gir dårlig prognose (Borregales et al., 2016). Pasienter med makroskopisk resttumor bør diskuteres med onkolog.
Hvis radikal kirurgi ikke kan utføres skal pasienten diskuteres i tverrfaglig møte (MDT) med tanke på medikamentell behandling (Karellas et al., 2009; Margulis et al., 2007). Dersom man oppnår god respons på behandlingen, bør sekundær nefrektomi vurderes.
For både T3b-c- og T4-svulster er forekomsten av komplikasjoner og mortalitet ved kirurgi høyere enn ved lokaliserte nyresvulster. Det er derfor ekstra viktig med god og grundig pasient informasjon.
Kirurgiske teknikker ved nyrereseksjon
Det er ikke funnet forskjell i kreftspesifikk overlevelse mellom åpen, laparoskopisk eller robotassistert laparoskopisk nyrereseksjon (Ljungberg et al., 2022c).
Ved laparoskopisk kirurgi er liggetiden kortere og peroperativ blødning mindre enn ved åpen kirurgi. Imidlertid er gjennomsnittlig operasjonstid lengre enn ved åpen kirurgi (Gratzke et al., 2009).
Robotassistert laparoskopi gir kortere iskemitid enn konvensjonell laparoskopi og bør foretrekkes (Choi et al., 2015). Bruk av intraoperativ ultralyd anbefales, og er obligatorisk ved intrarenale svulster.
Nyrebevarende kirurgi bør utføres ved sentre med høyt volum av aktuell operativ teknikk (Hjelle et al., 2017). Trifekta skal tilstrebes; et inngrep uten komplikasjoner, iskemi tid <25 minutter og negative marginer (Peyronnet et al., 2018). Et døgnkontinuerlig intervensjonsradiologisk tilbud bør eksistere ved sentre som utfører nyrereseksjon. Embolisering vil ofte være førstevalget for håndtering av akutte postoperative blødningskomplikasjoner samt for arteriovenøse malformasjoner og pseudoaneurismer.
I preoperativ planlegging av nyrekirurgi anbefales anatomisk klassifisering av tumor. Scoringssystemer som f. eks «RENAL nephrometry score (mdcalc.com)» og «PADUA score» kan være nyttige for å beregne vanskelighetsgrad og kompleksitet ved nyrereseksjon, og risiko for postoperative komplikasjoner. Ved høy kompleksitet og score bør nefrektomi vurderes (Ficarra et al., 2009; Kutikov et al., 2009).
Kirurgiske teknikker ved radikal nefrektomi
Retrospektive studier som sammenlikner åpen og laparoskopisk radikal nefrektomi viser sammenlignbare onkologiske resultater. Laparoskopisk tilnærming ved T1-T2 svulster er i dag anbefalt kirurgisk teknikk.
Ved laparoskopisk kirurgi beskrives kortere liggetid, mindre blødning, mindre smerter og kortere rekonvalesens. Det er vist at laparoskopisk nefrektomi medfører mindre morbiditet enn åpen nefrektomi (Beisland et al., 2015b; Hemal et al., 2007; Laird et al., 2015; Steinberg et al., 2004).
Retrospektive kohortstudier viser ingen forskjell mellom robotassistert laparoskopisk vs. laparoskopisk nefrektomi, med unntak av lengre operasjonstid og høyere kostnader ved førstnevnte (Jeong et al., 2017).
Laparoskopisk teknikk kan vurderes ved T3 a/b, men slike svulster opereres oftest åpent. Ved preoperativ mistanke om tumortromber bør man vurdere karkirurgisk bistand.
Adrenalektomi
Ipsilateral adrenalektomi er ikke rutinemessig indisert. Det skal vurderes ved mistanke om direkte innvekst, metastase i binyre eller andre intraoperative forhold.
Tumor lokalisert til øvre pol er i seg selv ikke indikasjon for fjerning av samme sides binyre (Lane et al., 2009).
Lymfeknutedisseksjon (LND)
Lymfeknutestatus bedømmes klinisk ved funn på preoperativ CT/MR eller ved intraoperativ palpasjon.
Ved preoperativ T1-T2-sykdom og klinisk N0 viser studier at kun 4 % av pasientene har positive lymfeknuter. I tillegg er mindre enn 20 % av klinisk mistenkte positive glandler histologisk maligne. Det er derfor ikke støtte i litteraturen for rutinemessig LND ved klinisk N0-sykdom (Gershman et al., 2018).
Klinisk patologiske lymfeknuter skal fjernes da dette gir sikrere staging, prognostisk vurdering og kan bidra til bedre oppfølging. Det er derimot ikke vist bedret total overlevelse (Blom et al., 2009; Gershman et al., 2018). Utvidet glandeltoalett er fortsatt kontroversielt.
Embolisering
Preoperativ embolisering av nyrearterien kan benyttes for å redusere peroperativ blødning før radikal nefrektomi ved avanserte svulster med betydelig peritumoral vaskularisering eller kollateralsirkulasjon. Selektiv embolisering kan brukes alene som palliativ prosedyre ved blødning fra tumor hos ikke operabel pasient eller ved blødning etter nyrereseksjon.
Kirurgiske komplikasjoner
De vanligste intraoperative komplikasjonene ved nyrekirurgi er blødninger fra hiluskar og milt. Tarmskade kan også forekomme. Ved nyrereseksjoner er blødning fra reseksjonsområdet den mest alvorlige komplikasjonen. Det bør derfor være påkrevd at sentre som utfører nyrereseksjon har tilgang til selektiv coiling.
Ved mangelfull lukking av samlesystemet kan urinom utvikles mellom samlesystemet og reseksjonsflaten. Slike tilfeller kan ofte behandles med intern eller ekstern drenasje (Breda et al., 2009; Sun et al., 2012).
Postoperativt må bruken av tromboseprofylakse balansers mellom risikoen for alvorlig blødning og forekomsten av dyp venetrombose (DVT).
I EAU sine retningslinjer (uroweb.org) stratifiseres pasienter i lav (ingen risikofaktorer), medium (> 75 år, BMI>35 eller DVT i familien) og høyrisiko (kombinasjon av risikofaktorer eller tidligere DVT). Kompresjonsstrømper anbefales hos alle. Medikamentell behandling anbefales hos alle som opereres åpent samt hos de som gjennomgår laparoskopisk (inkludert robotassistert) nyrekirurgi og er i høyeste risikogruppe. Andre faktorers innvirkning på risiko for DVT må også tas hensyn til (f. eks. operasjonslengde, blodsykdommer, P piller eller immobilitet). (Tikkinen et al., 2022).
Når det gjelder mortalitet etter nyrekreftkirurgi, er norske tall på linje med internasjonale tall; 30 dagers mortalitet 0,89 %, for lokalisert nyrekreft 0,73 % og 2,6 % høyere ved kirurgi ved metastatisk nyrekreft (Hjelle et al., 2017).
Neoadjuvant og adjuvant behandling
Sist faglig oppdatert: 27.09.2024
Neoadjuvant medikamentell behandling for en operabel svulst anbefales ikke utenfor kliniske studier.
Det er ikke evidens for at adjuvant strålebehandling øker overlevelse (Rodríguez-Fernández et al., 2019).
Adjuvant behandling med tyrosinkinasehemmer (TKI) har i studier vist sprikende resultater vedrørende sykdomsfri overlevelse; det er ikke vist bedring i total overlevelse (OS) og anbefales ikke (Haas et al., 2016; Motzer et al., 2017; Ravaud et al., 2016; Sun et al., 2018). mTOR hemmer adjuvant har vist effekt på tilbakefallsfri overlevelse, men overlevelsesdata er ikke rapportert enda (Everest) (Ryan et al., 2023).
Effekt av adjuvant immunterapi har vært undersøkt i tre fase III studier (Choueiri et al., 2021b; Choueiri et al., 2024; Motzer et al., 2023; Pal et al., 2022). Studiene inkluderte kun pasienter med klarcellet histologi. Keynote 564 inkluderte pasienter i intermediær/ høy og høy risikogruppe. Pasientene fikk 1 år med pembrolizumab hver 3.uke eller placebo. Studien viste både økt sykdomsfri- og total overlevelse (Choueiri et al., 2021b; Choueiri et al., 2024). Absolutt forskjell i total overlevelse var 5% ved 48 måneders oppfølging (86.0 versus 91.2%). En femdel av pasientene (20.7% versus 11.5% med placebo) opplevde alvorlige bivirkninger av behandlingen (CTCAE grad 3 eller 4). Det ble ikke rapportert om dødsfall. De to andre studiene er negative og har ikke vist økt sykdomsfri- eller total overlevelse. Det har vært diskutert om valg av medikament (PD1 versus PDL1), inklusjonskriterier og behandlingslengde kan forklare forskjellene man ser i endepunktene. Vi mangler prediktive markører for hvem som har best nytte av adjuvant immunterapi.
Pasienter som tilfredsstiller inklusjonskriteriene i Keynote564 (pT2 grad 4 eller sarkomatoide trekk, pT3 og pT4 alle grader, pN+ alle grader, M1 NED uten påvist sykdom), bør vurderes for adjuvant behandling med pembrolizumab (se beslutning i nye metoder). Fordeler og ulemper med adjuvant behandling må vurderes nøye og på individuelt grunnlag i samråd med pasienten. Mulig gevinst må veies mot risiko for bivirkninger, inkludert sannsynlighet for livstruende og livsvarige bivirkninger. Indikasjonen for adjuvant behandling bør fortrinnsvis diskuteres i regionale MDT. Eventuell behandling skal starte innen 12 uker fra kirurgi. Det er ikke indikasjon for adjuvant behandling hos pasienter med ikke-klarcellet histologi.
Behandling av nyrecellekarsinom med metastaser
Sist faglig oppdatert: 27.09.2024
I årsrapporten fra kreftregisteret 2021 hadde 12 % av pasientene primærmetastatisk sykdom (Larsen, 2022). Gjennomgang av data fra det svenske nyrekreftregisteret viser at omtrent 20 % vil oppleve tilbakefall eller metastaser de første fem årene (Regionalt cancercentrum, 2022a). Disse tallene er sannsynligvis overførbare til norske forhold. Prognosen er bedre ved solitære enn multiple metastaser, og bedre ved metakrone enn synkrone metastaser.
Alle pasienter med metastatisk nyrecellekarsinom bør diskuteres i MDT-møter. Sykdomsutbredelsen må kartlegges grundig og pasientene må vurderes med tanke på prognose og funksjonsnivå. Konklusjon fra MDT bør oppsummeres i en behandlingsanbefaling.
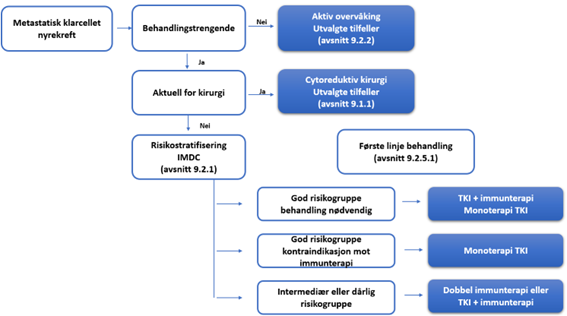
Kirurgi og strålebehandling
Sist faglig oppdatert: 27.09.2024
Cytoreduktiv nefrektomi samt kirurgi av residiv eller metastaser er aktuelt hos utvalgte pasienter. Dette gjelder også for konvensjonell- og stereotaktisk strålebehandling samt stråleknivbehandling.
Cytoreduktiv nefrektomi
Cytoreduktiv nefrektomi (CN) ved metastatisk sykdom kan i sjeldne tilfeller gi tilbakegang av metastaser. For majoriteten av pasienter vil imidlertid CN være et palliativt inngrep der medikamentell behandling vil bli nødvendig.
Det skilles mellom primær CN som utføres før systembehandling, og sekundær CN som vurderes hos pasienter med respons på medikamentell behandling. Palliativ nefrektomi kan vurderes for pasienter med hematuri, smerter og paraneoplasi. Et mer skånsomt alternativ kan være nyrekarembolisering.
Tidligere ble primær CN anbefalt for pasienter i god funksjonsklasse på bakgrunn av en randomisert studie (2004) som viste bedre overlevelse når primær CN ble kombinert med interferon vs. interferon alene (Flanigan et al., 2004). Senere har de to randomiserte studiene Carmena (2018) og Surtime (2019) sett på effekten av CN etter innføring av målrettet medikamentell behandling (Bex et al., 2019; Méjean et al., 2018). Carmenastudien viste at primær CN ikke lenger bør være standardbehandling for pasienter i intermediær og dårlig prognosegruppe. Studien viste at det ikke var dårligere å gi medikamentell behandling med sunitinib fra start sammenlignet med å gjøre nefrektomi først og deretter gå videre til medikamentell behandling med sunitinib. Surtime antydet bedret overlevelse ved sekundær CN sammenlignet med primær CN. Resultatet må tolkes med forsiktighet på grunn av dårlig rekruttering og prematur avslutning av studien. Flere i gruppen med sekundær CN kunne motta medikamentell behandling.
Pasienter i god prognosegruppe (i henhold til IMDC) samt de i intermediær prognosegruppe med lavt metastasevolum og kun en risikofaktor, skal vurderes for primær CN. Pasientene må være i god allmenntilstand. Primær CN har ingen nytte hos pasienter i dårlig funksjonsklasse, dårlig prognosegruppe, med høyt metastasevolum og liten primærsvulst (Bhindi et al., 2019; Ljungberg et al., 2020).
Dersom både primærsvulst og metastase kan fjernes radikalt, kan noen pasienter være sykdomsfrie en periode og medikamentell tilleggsbehandling utsettes.
Sekundær CN er et alternativ hos pasienter med lokale symptomer eller svært god respons på medikamentell behandling. Data tyder også på at det gir bedret OS for siste gruppe i motsetning til pasienter uten respons på medikamentell behandling (Bex et al., 2019). Tidspunktet for når sekundær CN skal gjennomføres må vurderes i hvert enkelt tilfelle, men pasientene bør diskuteres i MDT 6–9 måneder etter oppstart av medikamentell behandling.
For ikke-klarcellet etiologi er det dårligere kunnskapsgrunnlag, men retrospektive data kan tyde på bedre overlevelse av cytoreduktiv kirurgi enn uten (Graham et al., 2019). Medikamentell behandling bør imidlertid prioriteres på samme måte som ved klarcellet nyrecellekarsinom, da det er metastasene som i størst grad truer pasientene.
Kirurgi ved lokalt tumorresidiv
Lokalt residiv kan oppstå både etter nefrektomi og nyresparende kirurgi. Pasientens prognose er bedre ved sene residiv sammenlignet med de som får residiv det første året etter nefrektomi. Residivets størrelse, utbredelse og pasientens komorbiditet vil påvirke behandlingsvalg. Hos noen vil overvåking være riktig, mens andre kan tilbys ny nyrereseksjon, nefrektomi, lumpektomi eller ablativ behandling. Dersom residivet ikke kan fjernes bør pasienten vurderes av onkolog.
Metastasekirurgi
Kunnskap om lokal metastasebehandling finnes kun som retrospektive, sammenlignende og ikke-randomiserte studier. Studiene er heterogene både for pasientsammensetning, sykdomsutbredelse og tillegg av systembehandling, og må tolkes forsiktig.
En systematisk gjennomgang viser fordeler av komplett kirurgisk metastasefjerning fremfor annen lokal eller ingen behandling både for total- og kreftfri overlevelse (Dabestani et al., 2014).
Metastasene forekommer hyppigst i lunger, ben, lymfeknuter, lever, binyre eller hjerne. Utvalgte pasienter i god funksjonsklasse med gunstige tumor- og metastaseegenskaper, kan være kandidater for metastasekirurgi, strålebehandling eller ablasjon (Dabestani et al., 2016). Lokal metastasebehandling kan utsette behov for medikamentell behandling (Appleman et al., 2019; Procopio et al., 2019).
Tumorreseksjon av lungemetastaser kan gjøres om de er solitære eller samlet i en lungelapp. Alternativ til kirurgi kan være stereotaktisk strålebehandling.
Skjelettmetastaser opptrer typisk i humerus, femur, vertebra eller hofteledd, steder som alle kan gi smerter og dysfunksjon om de ikke behandles. Ved oligometastatisk sykdom kan radikal eksisjon med tumorprotese være aktuelt. Ved utbredt sykdom kan fiksasjon gjøres for å forebygge eller behandle brudd. Pasientene bør vurderes med tanke på postoperativ strålebehandling (Townsend et al., 1995).
Pasienter som ikke er kandidater for kirurgi kan tilbys strålebehandling eventuelt i kombinasjon med medikamentell behandling.
Kirurgisk fjerning av metastaser til lymfeknuter, binyrer og pankreas bør overveies om komplett metastasektomi kan gjennomføres. Levermetastaser kan også vurderes fjernet. Nye svulster i kontralateral nyre bør behandles med nyrereseksjon/ablasjon i stedet for nefrektomi.
Strålebehandling
Strålebehandling ved nyrecellekreft kan gi god symptomlindring og lokal kontroll avhengig av dosen som gis (Khoo et al., 2007; Lee et al., 2005; Reichel et al., 2007). Strålebehandling med høye doser pr fraksjon, har en økende rolle både ved synkrone metastaser, oligoprogresjon og blandet respons ved immunterapi eller målrettet behandling. Publiserte pasientserier viser at stereotaktisk behandling både mot primærsvulst, lokalt tilbakefall og oligometastaser kan gi langvarig kontroll (Beitler et al., 2004; Stenman et al., 2018; Svedman et al., 2006; Wersäll et al., 2005). Studier tyder på bedring i totaloverlevelse, og det er ikke vist økning av medikamentrelaterte bivirkninger (Ingrosso et al., 2021). Det er stor variasjon i valg av fraksjoneringsregime og et standardregime er ikke etablert. Stereotaktisk strålebehandling kan være et alternativ til kirurgisk fjerning av metastaser eller ny primærtumor i gjenstående nyre (Svedman et al., 2008).
Skjelettmetastaser og medullakompresjon
For symptomlindrende strålebehandling av skjelettmetastaser uten bløtvevskomponent, frakturfare eller nervekompresjon, anbefales engangsfraksjon 8 Gy x 1 (Chow et al., 2012; Rich et al., 2018). Ved større bløtdelskomponenter kan fraksjonert behandling overveies. Det er ikke vist forskjell i smertekontroll mellom stereotaktisk behandling og konvensjonell strålebehandling (Hunter et al., 2012).
Ved truende medullakompresjon, eller mistanke om dette, må høydose steroider startes umiddelbart og pasienter i god allmenntilstand bør vurderes med tanke på kirurgi. Kirurgi og postoperativ strålebehandling har vist bedre overlevelse og nevrologisk resultat sammenlignet med strålebehandling alene (Patchell et al., 2005). Dersom kirurgi ikke er aktuelt, bør strålebehandling startes raskest mulig. Det bør vanligvis gis fraksjonert behandling. Engangsbehandling 8 Gy x 1 kan vurderes hos pasienter med kortere forventet levetid (<6 måneder) (Hoskin et al., 2019; Rades et al., 2018).
Hjernemetastaser
Anbefaling om strålebehandling av hjernemetastaser baserer seg på internasjonale retningslinjer, selv om studiene inkluderer alle tumorgrupper (Olson et al., 2019; Soffietti et al., 2017). For pasienter i god allmenntilstand (ECOG 0–2) og singel hjernemetastase, anbefales kirurgi eller stereotaktisk strålebehandling/strålekniv. Det er ikke vist overlevelsesgevinst av stereotaksi/kirurgi ved flere metastaser (2–4), men det bør vurderes på grunn av økte bivirkninger av total hjernebestråling. Det er ikke anbefalt å rutinemessig gi total hjernebestråling etter stereotaksi eller kirurgi, men det kan vurderes i utvalgte tilfeller (Aoyama et al., 2015; Churilla et al., 2017; Soffietti et al., 2013). Total hjernebestråling med hippocampussparing bør vurderes hos pasienter med multiple metastaser og gunstige prognostiske faktorer. Ved dårlig prognose og redusert funksjonsnivå (ECOG 3–4), anbefales beste symptomlindrende behandling (BSC) (Mulvenna et al., 2016).
Medikamentell behandling
Sist faglig oppdatert: 27.09.2024
Behandling av tidligere ubehandlede pasienter med metastatisk nyrecellekarsinom baseres på en helhetlig vurdering av pasienten. Sykdomsutbredelse (tumorvolum samt lokalisasjon), symptomer, alder, komorbiditet, pasientens ønske og behandlingsmål bør sammen med risikogruppe danne grunnlag for behandlingsstrategi og medikamentvalg. Pasienter bør vurderes for inklusjon i kliniske studier der det er mulig.
For pasienter som får påvist metastaser etter adjuvant behandling, så finnes det per i dag ikke studier for hvordan disse best skal behandles. Tid fra gitt behandling til tilbakefall vil være avgjørende for behandlingsvalg.
Prognostiske risikofaktorer
Behandling av pasienter med metastatisk nyrecellekarsinom baserer seg på inndeling av pasientene i prognostiske risikogrupper.
IMDC-modellen (mdcalc.com) er den mest brukte. IMDC kriteriene integrerer 6 ulike kliniske og biokjemiske faktorer som deler pasientene inn i god, intermediær og dårlig risikogruppe. Inndelingen ble utviklet i TKI-æraen, men i fravær av immunterapi-spesifikke kriterier er samme inndeling brukt i kliniske studier med immunterapikombinasjoner. De har derfor blitt veiledende for behandlingsvalg.
| Risikofaktorer Tid fra diagnose til start av behandling < 1 år Karnofsky < 80 % Anemi (< nedre normalområde) Hyperkalsemi (> øvre normalområde) Neutrofile (> øvre normalområde) Trombocytter (> øvre normalområde) | |||
| Median OS (måneder) | |||
| Risikokategori | Antall risikofaktorer | Første linje | Andre linje |
| Lav risiko | Ingen risikofaktorer | 43,2 | 35,3 |
| lntermediær risiko | 1–2 risikofaktorer | 22,5 | 16,6 |
| Høy risiko | ≥3 risikofaktorer | 7,8 | 5,4 |
Egenprodusert, basert på Heng et al. (2009).
Tallene for median OS er basert på behandling med TKI; disse er forbedret etter innføring av nyere behandling (Escudier et al., 2019; Heng et al., 2009; Ko et al., 2015).
Aktiv overvåking
Aktiv overvåking kan være et alternativ for pasienter i god prognosegruppe uten symptomer og med begrenset sykdomsbyrde. Pasientene bør følges tett klinisk, biokjemisk og radiologisk (CT for eksempel hver 3. måned). Beslutning om å starte behandling baseres på veksthastighet og/eller tilkomst av nye lesjoner, metastaselokalisasjon (nærhet til vitale organer, lever- eller skjelettmetastaser) og utvikling av symptomer.
Medikamenter
Medikamentell behandling ved metastatisk klarcellet nyrecellekarsinom inkluderer medikamenter fra flere legemiddelgrupper. Medikamentene kan brukes i monoterapi eller i kombinasjon avhengig av sykdomsutbredelse, risikogruppe og behandlingslinje.
Immunterapi
Immunterapi aktiverer immunforsvaret ved å hemme ulike sjekkpunkt på T-cellene.
Immunterapi med antistoff rettet mot PD-1/PD-L1 og CTLA-4 har revolusjonert behandlingen av metastatisk nyrecellekarsinom.
Immunterapi spiller en viktig rolle i behandlingen av metastatisk nyrecellekarsinom, både i kombinasjon med TKI i første linje og som monoterapi i senere linjer.
EAU retningslinjer, avsnitt 7.4.3.2. (uroweb.org)
Tyrosinkinasehemmere
Tyrosinkinaser er viktige signalmolekyler i cellene, og er sentrale i reguleringen av mellom annet celledeling, differensiering og apoptose (Olsen, 2019). I kreftceller kan tyrosinkinasene være overaktive fordi reguleringsmekanismene ikke fungerer. Begrepet tyrosinkinasehemmer (TKI) brukes vanligvis om små molekyler som binder seg direkte til tyrosinkinasen og slik hemmer vekstsignalene i kreftcellen. De fleste tyrosinkinasehemmere er multikinasehemmere. De viktigste målmolekylene for disse medikamentene er vaskulært endotel vekstfaktor-reseptor VEGFR 1,2 og 3. Andre viktige målmolekyler er platederivert vekstfaktor-reseptor PDGF-R, c-KIT og c-MET.
De ulike TKI varierer med tanke på bivirkninger og farmakokinetiske egenskaper og dette kan ha betydning ved behandlingsvalg.
TKI kan brukes i alle linjer.
EAU retningslinjer, avsnitt 7.4.2.1. (uroweb.org)
Belzutifan
Belzutifan er en hemmer av HIF2α transkripsjonsfaktor. Medikamentet er godkjent av FDA for pasienter med metastatisk nyrecellecarcinom, etter behandling med immunterapi og tyrosinkinasehemmer (Albiges et al., 2023). Belzutifan er under utprøving i flere studier både i kombinasjon med tyrosinkinasehemmere og immunterapi, men det mangler publiserte effektdata.
EAU retningslinjer, avsnitt 7.4.2.4.1 (uroweb.org)
mTOR hemmere
mTOR er en proteinkinase som er essensiell for cellesyklusregulering. I tillegg til hemming av mTOR proteinkinasen, blokkerer mTOR hemmerne VEGF.
mTOR hemmere kan brukes i monoterapi og i kombinasjonsbehandling.
Andre
Kjemoterapi
Kjemoterapi har generelt ingen plass i behandlingen av nyrecancer. Men det kan vurderes for utvalgte pasienter, m.a. for pasienter med medullære nyrecellecarcinomer og samlerørskarsinomer.
Bevacizumab
Bevacizumab er et monoklonalt antistoff mot VEGF. Bevacizumab monoterapi eller kombinasjonsbehandling med interferon alfa anbefales ikke i Norge da det finnes bedre behandlingsalternativer.
Immunterapibasert kombinasjonsbehandling
For detaljert gjennomgang av de aktuelle studiene, vises til tabell 9.2 samt avsnitt 7.4.3 i EAU (uroweb.org)retningslinjer; alle kombinasjonene er aktuelle for førstelinjebehandling. Se detaljer vedrørende risikogruppe.
Dobbel immunterapi
Dokumentasjonen er basert på CheckMate 214-studien hvor tidligere ubehandlede pasienter med avansert/metastatisk klarcellet nyrecellekarsinom i intermediær og dårlig IMDC risikogruppe ble randomisert til kombinasjonsbehandling med ipilimumab/nivolumab eller sunitinib monoterapi (Motzer et al., 2018; Motzer et al., 2021b). Primære endepunkt var PFS, OS og ORR.
Andelen grad 3–4 bivirkninger var lavere for ipilimumab/nivolumab sammenlignet med sunitinib, men det ble registrert flere dødsfall i kombinasjonsarmen (8 (1.5 %) mot 4). Livskvalitetsdata var i favør av kombinasjonen (se avsnitt om bivirkninger av immunterapi).
Kombinert immunterapi og tyrosinkinasehemmer
Tre ulike kombinasjoner av immunterapi og TKI har vist overlevelsesgevinst ved førstelinjebehandling av metastatisk nyrecellekreft:
Pembrolizumab pluss aksitinib
Dokumentasjonen er basert på KeyNote-426-studien der tidligere ubehandlede pasienter med klarcellet nyrecellekarsinom ble randomisert til behandling med pembrolizumab i kombinasjon med aksitinib eller sunitinib (Rini et al., 2019). Primære endepunkt var PFS og OS i ITT-populasjonen.
68 % av pasientene i kombinasjonsarmen og 63 % i sunitinibarmen hadde grad 3–4 bivirkninger. (Se avsnitt om bivirkninger av medikamentell behandling.)
Nivolumab pluss kabozantinib
I CheckMate 9ER-studien ble pasientene randomisert til behandling med nivolumab i kombinasjon med kabozantinib eller sunitinib. Primært endepunkt var PFS i ITT-populasjonen (Choueiri et al., 2021a).
Grad 3–4 bivirkninger var høyere for nivolumab/kabozantinib sammenlignet med sunitinib (61 mot 51 %). (Se avsnitt om bivirkninger av medikamentell behandling.)
Pembrolizumab pluss lenvatinib
CLEAR/KEYNOTE 581-studien var en tre-armet studie hvor pasientene ble randomisert til behandling med pembrolizumab i kombinasjon med lenvatinib eller lenvatinib i kombinasjon med everolimus eller sunitinib alene (Motzer et al., 2021a). Primære endepunkt var PFS i ITT-populasjonen. Studien var ikke designet til å vise forskjellen mellom lenvatinib/pembrolizumab og lenvatinib/everolimus.
Grad ≥3 bivirkninger var høyere for pembrolizumab/lenvatinib sammenlignet med sunitinib (82.4 mot 71.8 %). (Se avsnitt om bivirkninger av medikamentell behandling.)
| Checkmate 214 N 1096 Median oppfølging 99.1 måneder | KEYNOTE-426 N 886 Median oppfølging 42.8 måneder | CheckMate 9ER N 651 Median oppfølging 55.6 måneder | CLEAR/KEYNOTE 581 N 1069 Median oppfølging 48.8 måneder |
|---|---|---|---|---|
Eksperimentell Arm | Nivolumab (NIVO) 3 mg/kg pluss ipilimumab (IPI) 1 mg/kg IV Q3W 4 doser deretter nivolumab 3 mg/kg IV Q2W vs. sunitinib 50 mg PO QD 4/2 uker | Pembrolizumab (Pembro) 200 mg IV Q3W pluss aksitinib (aksi) 5 mg PO QD vs. sunitinib 50 mg PO QD 4/2 uker | Nivolumab 240 mg IV Q2W pluss kabozantinib (kabo) 40 mg PO QD vs. sunitinib 50 mg PO QD 4/2 uker | Pembrolizumab 200 mg IV Q3W pluss lenvatinib (lenva) 20 mg PO QD vs. sunitinib 50 mg PO QD 4/2 uker |
Primære Endepunkt | PFS, OS og ORR i IMDC IMD/dårlig risiko populasjonen | PFS and OS i ITT-populasjonen | PFS i ITT-populasjonen | PFS i ITT-populasjonen |
IMDC Risikogruppe | God 23 % IMD 61 % Dårlig 17 % | God 31 % IMD 56 % Dårlig 13 % | God 23 % IMD 58 % Dårlig 19 % | God 31 % IMD 59 % Dårlig 9 % |
ORR/CR-rate (%) ITT-populasjonen | 39/12 | 69/11.6 | 55.7/13.6 | 71.3/18.3 |
PFS (måneder) ITT-populasjonen Median (95 % CI) HR (95 % CI) | Ipi/nivo 12.4 (9.9-16.8) Sunitinib 12.3 (9.8-15.2) HR 0.88 (0.75-1.03) p=0.0628 | Pembro/aksi 15.7 Sunitinib 11.1 HR 0.68 (0.58–0.80) p<0.0001 | Kabo/nivo 16.4 (12.5–19.3) Sunitinib 8.4 (7.0–9.7) HR 0.58 (0.49–0.70) p<0.0001 | Lenva/pembro 23.9 (20.8 to 27.7) Sunitinib 9.2(6.0 to 11.0) HR 0.47 (0.38 to 0.57) p<0.0001 |
OS (måneder) ITT-populasjonen Median (95 % CI) HR (95 % CI) | Ipi/nivo 52.7 (45.8-64.5) Sunitinib 37.8 (31.9-43.8) HR 0.72 (0.62-0.83) | Pembro/aksi 45.7 (43.6-NR) Sunitinib 40.1 (34.3–44.2) HR 0.73 (0.60–0.88) p<0.001 | Kabo/nivo 46.5 (40.6-53.4) Sunitinib 36 (29.2-42.8) HR 0.77 (0.63–0.95) p=0.0043 | Lenva/pembro 53.7 (48.7 to NE) Sunitinib 54.3 (40.9 to NE) HR 0.79 (0.63 to 0.99) P=0.0424) |
PFS (måneder) IMDC god Median (95 % CI) HR (95 % CI) | Ipi/nivo 12.4 (10.3-18.0) HR 1.76 (1.25-2.48) p=0.0073 | Pembro/aksi 20.7 Sunitinib 17.8 HR 0.76 (0.56–1.03) | Kabo/nivo 21.4 (12.8–24.6) Sunitinib 12.8 (9.4–16.6) HR 0.69 (0.48–1.00) | Lenva/pembro 28.6 (17.2 to 37.0) Sunitinib 12.9 (11.1 to 18.4) HR 0.50 (0.35 to 0.71)
|
PFS (måneder) IMDC IMD/dårlig Median (95 % CI) HR (95 % CI) | Ipi/nivo 12.4 (8.7-16.8) Sunitinib 8.5 (7.0-11.1) HR 0.73 (0.61-0.87) | Pembro/aksi 13,8 Sunitinib 8,2 HR 0.67 (0.55–0.81) | Kabo/nivo 15.4 (11.1–18.6) Sunitinib 7.1 (5.7–8.9) HR 0.56 (0.45–0.68)
| Lenva/pembro 22.1 (16.6 to 27.6) Sunitinib 5.9 (5.6 to 7.5) HR 0.43 (0.34 to 0.55)
|
OS (måneder) IMDC god Median (95 % CI) HR (95 % CI) | Ipi/nivo 77.9 (64.6-91.6) Sunitinib 66.7 (56.0-79.9) HR 0.82 (0.60-1.13) p=0.7673 | Pembro/aksi NR Sunitinib NR HR 1.17 (0.76–1.80) | Kabo/nivo 52.9 (40.8-NR) Sunitinib 58.9 (40.8-NR) HR 1.10 (0.69–1.75) | Lenva/pembro NR (NE-NE) Sunitnib 59.9 (58.8 to NE) HR 0.94 (0.58 to 1.52) |
OS (måneder) IMDC IMD/dårlig Median (95 % CI) HR (95 % CI) | Ipi/nivo 46.7 (35.0-55.7) Sunitinib 26.0 (21.8-32.6) HR 0.69 (0.59-0.81) p<0.0001
| Pembro/aksi NR Sunitinib NR HR 0.64 (0.52–0.80) | Kabo/nivo 43.9 (34.9-51.9) Sunitinib 29.3 (23.7-36.2) HR 0.73 (0.58–0.91)
| Lenva/pembro 47.9 (40.5 to NE) Sunitinib 34.3 (26.3 to 54.3) HR 0.74 (0.57 to 0.96) |
OS = total overlevelse.
PFS = progresjonsfri overlevelse.
ORR = objektiv respons rate.
CR = komplett respons.
NR = ikke målbart.
NA = kan ikke vurderes.
HR = hazard ratio.
CI = konfidensintervall.
Egenprodudert. Kilder: ADDIN EN.CITE.DATA (Albiges et al., 2020; Choueiri et al., 2021a; Motzer et al., 2021a; Motzer et al., 2022a; Porta et al., 2022; Powles et al., 2020; Rini et al., 2019)
| Checkmate 214 N 1096 Median oppfølging 99.1 måneder | KEYNOTE-426 N 886 Median oppfølging 42.8 måneder | CheckMate 9ER N 651 Median oppfølging 55.6 måneder | CLEAR/KEYNOTE 581 N 1069 Median oppfølging 48.8 måneder |
|---|---|---|---|---|
Eksperimentell Arm | Nivolumab (NIVO) 3 mg/kg pluss ipilimumab (IPI) 1 mg/kg IV Q3W 4 doser deretter nivolumab 3 mg/kg IV Q2W vs. sunitinib 50 mg PO QD 4/2 uker | Pembrolizumab (Pembro) 200 mg IV Q3W pluss aksitinib (aksi) 5 mg PO QD vs. sunitinib 50 mg PO QD 4/2 uker | Nivolumab 240 mg IV Q2W pluss kabozantinib (kabo) 40 mg PO QD vs. sunitinib 50 mg PO QD 4/2 uker | Pembrolizumab 200 mg IV Q3W pluss lenvatinib (lenva) 20 mg PO QD vs. sunitinib 50 mg PO QD 4/2 uker |
Primære Endepunkt | PFS, OS og ORR i IMDC IMD/dårlig risiko populasjonen | PFS and OS i ITT-populasjonen | PFS i ITT-populasjonen | PFS i ITT-populasjonen |
IMDC Risikogruppe | God 23 % IMD 61 % Dårlig 17 % | God 31 % IMD 56 % Dårlig 13 % | God 23 % IMD 58 % Dårlig 19 % | God 31 % IMD 59 % Dårlig 9 % |
ORR/CR-rate (%) ITT-populasjonen | 39/12 | 69/11.6 | 55.7/13.6 | 71.3/18.3 |
PFS (måneder) ITT-populasjonen Median (95 % CI) HR (95 % CI) | Ipi/nivo 12.4 (9.9-16.8) Sunitinib 12.3 (9.8-15.2) HR 0.88 (0.75-1.03) p=0.0628 | Pembro/aksi 15.7 Sunitinib 11.1 HR 0.68 (0.58–0.80) p<0.0001 | Kabo/nivo 16.4 (12.5–19.3) Sunitinib 8.4 (7.0–9.7) HR 0.58 (0.49–0.70) p<0.0001 | Lenva/pembro 23.9 (20.8 to 27.7) Sunitinib 9.2(6.0 to 11.0) HR 0.47 (0.38 to 0.57) p<0.0001 |
OS (måneder) ITT-populasjonen Median (95 % CI) HR (95 % CI) | Ipi/nivo 52.7 (45.8-64.5) Sunitinib 37.8 (31.9-43.8) HR 0.72 (0.62-0.83) | Pembro/aksi 45.7 (43.6-NR) Sunitinib 40.1 (34.3–44.2) HR 0.73 (0.60–0.88) p<0.001 | Kabo/nivo 46.5 (40.6-53.4) Sunitinib 36 (29.2-42.8) HR 0.77 (0.63–0.95) p=0.0043 | Lenva/pembro 53.7 (48.7 to NE) Sunitinib 54.3 (40.9 to NE) HR 0.79 (0.63 to 0.99) P=0.0424) |
PFS (måneder) IMDC god Median (95 % CI) HR (95 % CI) | Ipi/nivo 12.4 (10.3-18.0) HR 1.76 (1.25-2.48) p=0.0073 | Pembro/aksi 20.7 Sunitinib 17.8 HR 0.76 (0.56–1.03) | Kabo/nivo 21.4 (12.8–24.6) Sunitinib 12.8 (9.4–16.6) HR 0.69 (0.48–1.00) | Lenva/pembro 28.6 (17.2 to 37.0) Sunitinib 12.9 (11.1 to 18.4) HR 0.50 (0.35 to 0.71)
|
PFS (måneder) IMDC IMD/dårlig Median (95 % CI) HR (95 % CI) | Ipi/nivo 12.4 (8.7-16.8) Sunitinib 8.5 (7.0-11.1) HR 0.73 (0.61-0.87) | Pembro/aksi 13,8 Sunitinib 8,2 HR 0.67 (0.55–0.81) | Kabo/nivo 15.4 (11.1–18.6) Sunitinib 7.1 (5.7–8.9) HR 0.56 (0.45–0.68)
| Lenva/pembro 22.1 (16.6 to 27.6) Sunitinib 5.9 (5.6 to 7.5) HR 0.43 (0.34 to 0.55)
|
OS (måneder) IMDC god Median (95 % CI) HR (95 % CI) | Ipi/nivo 77.9 (64.6-91.6) Sunitinib 66.7 (56.0-79.9) HR 0.82 (0.60-1.13) p=0.7673 | Pembro/aksi NR Sunitinib NR HR 1.17 (0.76–1.80) | Kabo/nivo 52.9 (40.8-NR) Sunitinib 58.9 (40.8-NR) HR 1.10 (0.69–1.75) | Lenva/pembro NR (NE-NE) Sunitnib 59.9 (58.8 to NE) HR 0.94 (0.58 to 1.52) |
OS (måneder) IMDC IMD/dårlig Median (95 % CI) HR (95 % CI) | Ipi/nivo 46.7 (35.0-55.7) Sunitinib 26.0 (21.8-32.6) HR 0.69 (0.59-0.81) p<0.0001
| Pembro/aksi NR Sunitinib NR HR 0.64 (0.52–0.80) | Kabo/nivo 43.9 (34.9-51.9) Sunitinib 29.3 (23.7-36.2) HR 0.73 (0.58–0.91)
| Lenva/pembro 47.9 (40.5 to NE) Sunitinib 34.3 (26.3 to 54.3) HR 0.74 (0.57 to 0.96) |
OS = total overlevelse.
PFS = progresjonsfri overlevelse.
ORR = objektiv respons rate.
CR = komplett respons.
NR = ikke målbart.
NA = kan ikke vurderes.
HR = hazard ratio.
CI = konfidensintervall.
Kilder: ADDIN EN.CITE.DATA ADDIN EN.CITE.DATA (Albiges et al., 2020; Bourlon et al., 2024; Choueiri et al., 2021a; Motzer et al., 2021a; Motzer et al., 2024; Motzer et al., 2022a; Porta et al., 2022; Powles et al., 2020; Rini et al., 2019; Tannir et al., 2024)
Trippelbehandling
Resultater av den første studien med trippel behandling med ipilimumab/nivolumab og kabozantinib eller placebo, COSMIC-313, viser at trippel behandling forlenger progresjonsfri overlevelse (PFS) og reduserer risiko for progresjon med 27 % (Choueiri et al., 2023). Objektive responsrater var 43 % og 36 % for triplett- og dublett kombinasjoner og komplett respons var sett hos 3 % pasienter i begge armer. Effekten ble overraskende kun sett hos pasienter som tilhørte intermediær risikogruppe. Hele 79 % av pasientene hadde grad 3–4 bivirkninger.
Grunnet moderat effekt og betydelig toksisitet anbefales det å vente på OS data før denne behandlingen tas i bruk.
Behandlingsvalg første linje
Sist faglig oppdatert: 27.09.2024
De alternative kombinasjonsregimene er aldri direkte sammenlignet i studier. Selv om alle studiene har kontrollarm med sunitinib, bør direkte sammenligning av effektparametre gjøres med forsiktighet.
Høyest responsrate er vist i studier som kombinerer TKI og immunterapi, og bør tas med i vurdering hos pasienter med aggressiv og symptomgivende sykdom.
For dobbel immunterapi foreligger det dokumentasjon på at pasienter med komplett respons/nær komplett respons, har vedvarende respons etter seponering av behandling. Det er uavklart om dette også gjelder for immunterapi/TKI-kombinasjonen, men i studiene ble PD-1 hemmer stoppet etter 2 år.
For pasienter i intermediær og dårlig prognosegruppe har kombinasjonsbehandling med TKI og immunterapi eller dobbel immunterapi vist bedre overlevelse enn sunitinib monoterapi. For pasienter i god prognosegruppe er det ikke vist bedre overlevelse for kombinasjonsbehandling. TKI monoterapi kan derfor være et behandlingsalternativ for denne gruppen i tillegg til kombinasjonsbehandling. Kombinasjonsbehandling har vist bedre responsrate enn sunitinib monoterapi i alle studier.
Hos pasienter med kontraindikasjoner mot immunterapi, er TKI monoterapi fortsatt et alternativ uavhengig av prognosegruppe. Kombinasjonen lenvatinib/everolimus har vist bedre PFS sammenlignet med sunitinib monoterapi ved førstelinje behandling, men OS-data var ikke signifikante (Motzer et al., 2021a). Også for kabozantinib er det vist PFS gevinst for intermediær og dårlig risikogruppe, men ingen OS gevinst (Choueiri et al., 2018). Behandling med kabozantinib er per 2022 ikke godkjent i Beslutningsforum for nye metoder, og er av den grunn ikke inkludert i anbefalingene under.
Med mindre det fins særlige medisinske grunner, vil gjeldende Lis anbud være førende for behandlingsvalg.
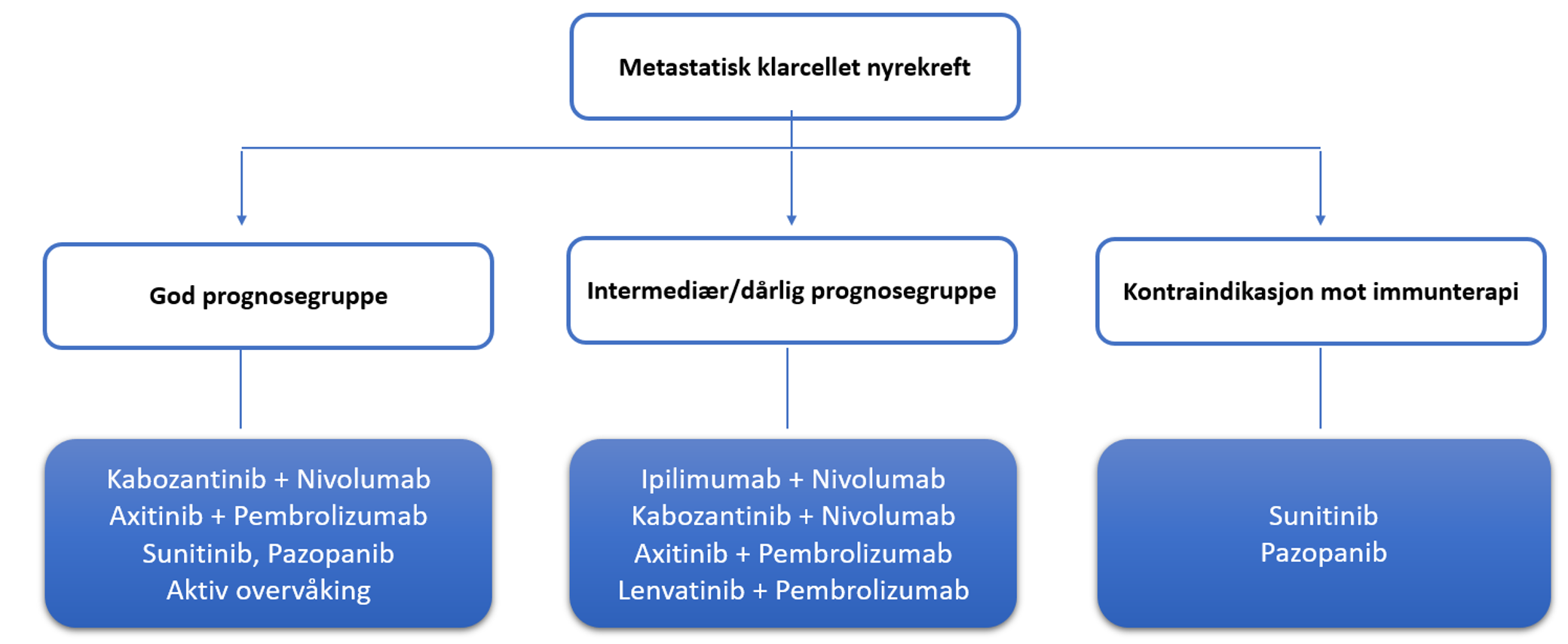
Behandlingsvalg senere linjer
Sist faglig oppdatert: 27.09.2024
Behandling i senere linjer er avhengig av det som ble benyttet i første linje.
Behandling etter kombinasjonsbehandling
Dokumentasjonen på andre- og senere linjes behandling er i hovedsak fra ikke-randomiserte studier som inkluderte få pasienter. I lys av rask utvikling av førstelinjebehandling godtas likevel dette datagrunnlaget for anbefaling, og pasientene bør vurderes for behandling.
Tydelig evidens for å anbefale bruk av et bestemt legemiddel eller kombinasjon framfor andre finnes ikke.
Monoterapi
Monoterapi med TKI har klinisk effekt og kan anbefales etter progresjon på kombinasjonsbehandling.
Kabozantinib har vist tydelig PFS og OS gevinst sammenlignet med everolimus hos pasienter som har progrediert på tyrosinkinasehemmer. Denne effekten var også sett hos få pasienter som var inkludert i samme studie og hadde progrediert både på TKI og nivolumab (Choueiri et al., 2015).
Aksitinib og tivozanib forlenger PFS etter progresjon på tyrosinkinasehemmere og kan gi klinisk effekt etter progresjon på immunterapi (Auvray et al., 2019; Ornstein et al., 2019; Rini et al., 2020).
Kryssresistens er ikke vanlig og ved progresjon anbefales det å bytte til TKI som ikke har vært brukt tidligere.
Nyere generasjons TKI med aksitinib, kabozantinib og tivozanib er å foretrekke. Sunitinib, pazopanib og sorafenib kan også brukes i senere linjer, men det finnes begrenset dokumentasjon for bruk etter immunterapibasert behandling.
Flere studier har vist bedre effekt av TKI sammenlignet med everolimus. Everolimus kan likevel være et behandlingsvalg i enkelte tilfeller.
Monoterapi med immunsjekkpunkthemmer anbefales ikke.
Kombinasjonsbehandling senere linjer
Lenvatinib pluss everolimus er godkjent fra EMA og FDA og anbefales fra ESMO sine retningslinjer basert på en prospektiv fase II-studie; det er vist betydelig lengre PFS ved kombinasjonsbehandling sammenlignet med monoterapi med everolimus (Motzer et al., 2015b). Foreløpig må det søkes til fagdirektør for denne kombinasjonen.
Lenvatinib pluss pembrolizumab har vist klinisk effekt i en prospektiv fase Ib/II-studie der pasientene tidligere var behandlet med nivolumab pluss ipilimumab, tyrosinkinasehemmere og immunterapi enten i kombinasjon eller sekvensielt. Responsraten (ORR) var på ca. 50 % som er betydelig i andre eller tredje behandlingslinje. Det mangler imidlertid data på sykdomsfri og total overlevelse (Lee et al., 2021).
En nylig publisert faste 3 studie, CONTACT-03, med kabozantinib pluss atezolizumab etter progresjon på immunterapi, har vist verken bedre sykdomsfri eller total overlevelse sammenlignet med monoterapi med kabozantinib (Pal et al., 2023).
På bakgrunn av sistenevnte studie, kan ikke bruk av immunterapi etter tidligere progresjon på immunsjekkpunkthemmer anbefales på generelt grunnlag.
Behandling etter tyrosinkinasehemmer
To randomiserte fase 3-studier med kabozantinib og nivolumab har vist OS gevinst sammenlignet med everolimus etter tidligere progresjon på monoterapi med sunitinib (Choueiri et al., 2015; Motzer et al., 2020; Motzer et al., 2015a).
Kabozantinib brukes sjelden som monoterapi i første linje. Det finnes ikke dokumentasjon for behandlingsvalg etter progresjon, og man kan følge samme anbefalinger som ved bruk av sunitinib.
Kombinasjonsbehandling med sjekkpunkthemmer pluss TKI eller dobbel immunterapi er ikke undersøkt i kliniske studier og kan derfor ikke anbefales på generelt grunnlag.
Ved senere linjer anbefales det å bytte til en TKI som ikke har vært brukt tidligere.
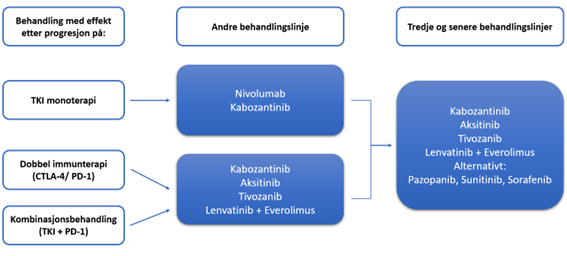
Ikke-klarcellet histologi
Sist faglig oppdatert: 27.09.2024
Omtrent 15 % av pasienter som behandles for metastatisk sykdom har ikke-klarcellet histologi. Flere fase 2-studier har vist effekt av både TKI og immunterapi hos disse pasientene. Både kombinasjonsbehandling og TKI monoterapi brukes i daglig klinisk praksis og erfaring tilsier at de har klinisk effekt. Det er økende evidens for at kombinasjonsbehandling med immunterapi og TKI gir bedre responsrate, men vi mangler data som viser økt overlevelse. Forventet responsrate er på 10–70 % avhengig av histologi og behandlingstype. Ytterligere 25–50 % av pasienter kan oppleve stabil sykdom og dermed klinisk nytte av behandlingen. For enkelte pasienter kan kjemoterapi også være et alternativ.
Papillære, kromofobe og ikke klassifiserbare svulster
Sunitinib gir høyere responsrate og lengre PFS enn everolimus hos pasienter med papillære, ikke-klassifiserbare og translokasjonstumorer. mTOR signalveien kan være overaktivert i kromofobe svulster og derfor har everolimus noe bedre effekt hos disse (Armstrong et al., 2016; Knox et al., 2017; Tannir et al., 2016).
Genetiske forandringer i MET genet kan forekomme ved papillære tumorer. MET inhibitorene kabozantinib og savolitinib har vist bedre responsrate og PFS enn sunitinib hos pasienter med kjent MET drevet tumor. Savolitinib er per i dag ikke godkjent av EMA (Choueiri et al., 2020; Pal et al., 2021).
Monoterapi med pembrolizumab har vist klinisk effekt med ORR på 28–42 % hos pasienter med papillær, ikke klassifiserbar eller sarkomatoid histologi. ORR var på kun 9,5 % ved kromofob histologi (McDermott et al., 2021).
Kombinasjonsbehandling med lenvatinib/everolimus har vist klinisk effekt hos pasienter med papillære, kromofobe og ikke-klassifiserbare svulster. Rapportert ORR var på 25–30 %. Samme effekt med ORR på 47 % var sett ved kombinasjonsbehandling med kabozantinib og nivolumab og lenvatinib og pembrolizumab. Pasienter med papillære, ikke klassifiserbare og translokasjonstumorer hadde bedre effekt med ORR opp til 71 %, mens effekt på kromofobe svulster var mindre med ORR på 15 % (Albiges et al., 2022; Hutson et al., 2021; Lee et al., 2022; McDermott et al., 2021).
Kombinasjonsbehandling med ipilimumab og nivolumab anbefales ikke pga. beskjeden effekt, høy risiko for bivirkninger og høy kostnad (Tachibana et al., 2021).
Monoterapi med sunitinib eller pazopanib samt kombinasjonsbehandling med TKI og sjekkpunkthemmer er å foretrekke. Monoterapi med kabozantinib, sjekkpunkthemmer og everolimus kan være aktuelt hos noen pasienter.
Sarkomatoid histologi
Post-hoc analyse av Checkmate-025-studien viste bedre effekt av kombinasjonsbehandling med nivolumab og ipilimumab sammenlignet med sunitinib hos pasienter med sarkomatoid histologi. Dette gjelder også ved klarcellet karsinom med delvis sarkomatoid differensiering (Tannir et al., 2021). Hos pasienter med overveiende sarkomatoid differensiering anbefales det kombinasjonsbehandling med nivolumab og ipilimumab.
For pasienter med klarcellet histologi med delvis sarkomatoid differensiering følges retningslinjer for klarcellet histologi.
Samlerørs og medullære nyrecellekarsinomer
Dette er sjeldne og aggressive svulster som oppstår i ung alder. Behandling med TKI gir lite effekt og kjemoterapi med karboplatin/paclitaxel, gemcitabine/platinum eller gemcitabine/platinum/taksan (+/– bevacizumab) anbefales (Shah et al., 2017).
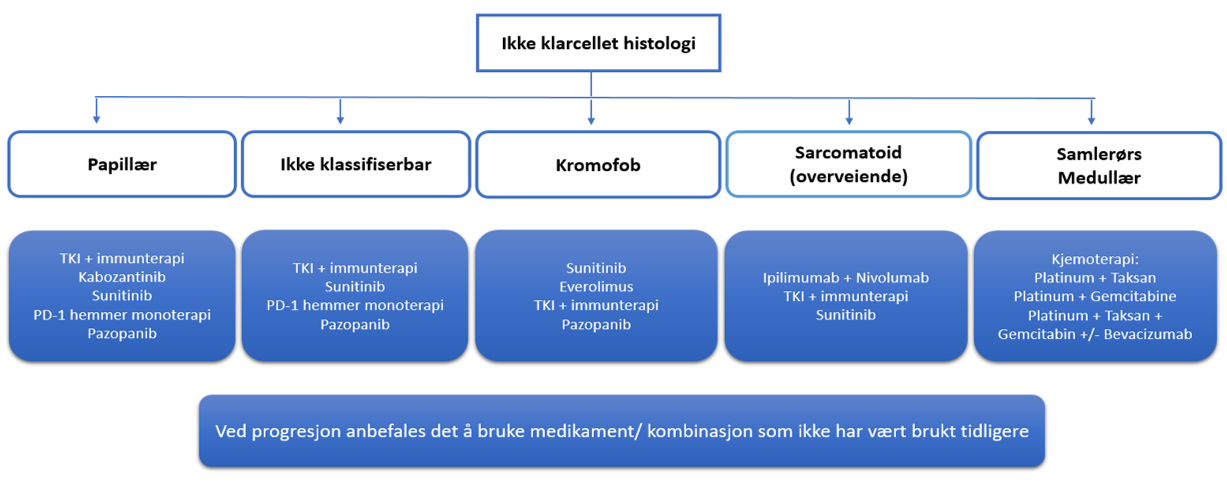
Persontilpasset behandling
Sist faglig oppdatert: 27.09.2024
Omtrent 5–10 % av pasienter med nyrecellekarsinom har arvelig nyrekreft forårsaket av en eller flere genetiske forandringer i kimbaneceller; se kapittel Arvelig nyrekreft for detaljer.
En oversikt over somatiske genforandringer hos pasienter med sporadisk nyrecellekarsinom er vist i tabell 9.3 (Bui et al., 2022; Riazalhosseini et al., 2016; Testa et al., 2020).
De fleste genetiske forandringer er i VHL-HIF signalveien og deretter forandringer i PI3K-AKT-mTOR, samt gener som har en rolle i regulering av epigenetiske prosesser og kromatin remodelering. Overaktiverte signalveier gir grunnlag for bruk av TKI og mTOR hemmere, og det er utviklet cMET hemmer for behandling av cMET muterte papillære svulster. HiF2alpha inhibitorer og PARP-hemmere basert på de hyppigste genetiske forandringene er under utvikling.
For pasienter med klarcellet histologi er det få tilgjengelige målrettede behandlingsmuligheter utenom allerede godkjente medikamenter. Omfattende genomisk sekvensering anbefales derfor ikke per i dag, kun for utvalge pasienter som skiller seg ut fra gruppen ved f.eks sykdom i ung alder, uvanlig presentasjon eller uvanlig respons på behandling. Hos pasienter med ikke-klarcellet histologi kan genomisk sekvensering avdekke arvelige krefttilstander som er hyppigere i denne pasientgruppen. Det kan også gi nyttig informasjon for behandlingsvalg og øker sannsynligheten for inklusjon i kliniske studier. Det anbefales derfor at disse pasientene henvises til genomisk sekvensering.
| Histologisk subtype | Somatiske mutasjoner, prevalens hvis rapportert (95 % CI) | Kopitallsvariasjon og translokasjoner | Terapeutisk implikasjon |
Klarcellet nyrecellekarsinom | VHL 64 % (58–69) PBMR1 36 % (33–38) SETD2 20 % (16–23) BAP1 13 % (11–15) KDM5C 10 % (8–13) MTOR 9 % (6–12) TP53 7 % (5–9) PTEN 7 % (4–9) PIK3CA 3 % (2–5) TSC 1/2 8 % (5–13) TET2, ARID1A, ATM, TCEB1, TERT promotor, BRCA 2, NF1, ROS1 osv. | Tap 3p, 14q, 9p, 6q, 8p og 15q Gain 5q | VGFR hemmere (TKI) < mTOR hemmere (everolimus, temsirolimus) |
| 7Papillært nyrecellekarsinom type I | MET, NRF2, CUK3 | Gain 3, 7, 16 og 17 | cMET hemmere (kabozantinib, savolitinib) |
| Papillært nyrecellekarsinom type II | CDKN2A, CDKN2B, TERT, NF2, FH, MET, SETD2 | Tap 3p, 14q og 22q Gain 7, 16, 17, 5q TFE3 translokasjon | cMET hemmere (kabozantinib, savolitinib) |
| Kromofobt nyrecellekarsinom | TP53,PTEN | Tap av 1,2,6,10,13,17,21 | NA |
Bivirkninger av medikamentell behandling
Sist faglig oppdatert: 27.09.2024
Alle pasienter som får medikamentell behandling for metastatisk nyrecellekarsinom må følges med tanke på bivirkninger.
Pasientene bør informeres muntlig og skriftlig før oppstart behandling. Pasientinformasjon om bivirkninger finnes ma. hos på www.kreftforeningen.no. Det anbefales å gradere bivirkninger som oppstår i henhold til Common Terminology Criteria for Adverse Events (CTCAE) | Protocol Development | CTEP (cancer.gov).
Bivirkninger av immunterapi
Pasienter som behandles med immunterapi må følges tett med tanke på bivirkninger. Bivirkningene kan potensielt ramme alle organsystemer, men hud, gastrointesinaltraktus, lever og endokrin toksisitet er vanligst. Generelt er bivirkningene håndterbare, men kan i enkelte tilfeller være fatale. Alle pasienter som skal ha behandling med immunterapi må få nøye muntlig og skriftlig pasientinformasjon. Pasienter med CTCAE grad 3 eller 4 bivirkning bør innlegges på sykehusavdeling med kompetanse på bivirkningshåndtering av immunterapi.
Det finnes flere gode retningslinjer for håndtering av bivirkninger fra immunterapi.
https://ehandboken.ous-hf.no/document/135421
https://www.esmo.org/guidelines/supportive-and-palliative-care/toxicities-from-immunotherapy
Bivirkninger av tyrosinkinasehemmere
Vanlige bivirkninger er utslett, fatigue, diare, mukositt og hånd-fotsyndrom. Pasientene må overvåkes jevnlig med tanke på utvikling av hypertensjon, levertoksisitet og hypotyreose.
For å håndtere bivirkninger kan det være nødvendig med dosejustering eller avbrudd i behandlingen. Behandlingen kan vanligvis gjenopptas når bivirkningene går tilbake, men permanent dosereduksjon kan være nødvendig.
Tyrosinkinasehemmere kan gi redusert sårtilheling og ved større kirurgiske inngrep anbefales opphold i behandlingen.
Bivirkninger av mTOR hemmere
Vanlige bivirkninger ved behandling med mTOR hemmere er diare, hudutslett, fatigue, infeksjon og pneumonitt. Pasientene bør overvåkes med tanke på hematologiske bivirkninger, hyperglykemi og hyperkolesterolemi.
Benresopsjonshemmere ved skjelettmetastaser
Sist faglig oppdatert: 27.09.2024
Hos pasienter med utbredte skjelettmetastaser, har behandling med bisfosfonater i form av zoledronsyre vist å øke tid til første skjelettrelaterte hendelse og redusere antall hendelser (Rosen et al., 2004). Denosumab er et monoklonalt antistoff mot RANK-L og er i en randomisert studie vist å være noninferior til zoledronsyre (Henry et al., 2011).
Behandling med enten zoledronsyre eller denosumab kan vurderes hos pasienter med metastatisk nyrecellekreft og utbredte skjelettmetastaser. Daglig tilskudd av kalk og vitamin D er også anbefalt.
På grunn av risiko for osteonekrose i kjeven, skal pasientene tilses av tannlege før oppstart behandling. Optimal behandlingslengde er ikke kjent, men fordi risiko for kjeveosteonekrose øker over tid har man ofte anbefalt å pause behandlingen etter 2 år.
Zoledronsyre har de siste årene vært førstevalg i Norge etter Lis-anbud, men denosumab kan gis til pasienter med kontraindikasjoner mot zoledronsyre (for eksempel nyresvikt).
Metastatisk nyrecellekarsinom hos eldre
Sist faglig oppdatert: 27.09.2024
Behandling av nyrecellekarsinom hos eldre bør baseres på individuell helsetilstand og ikke på kronologisk alder.
Alle pasienter med funksjonsnivå minst ECOG 2 bør vurderes for tumorrettet behandling uavhengig av kronologisk alder. Få pasienter over 65 år inkluderes i kliniske studier, men alder synes ikke å ha betydning for effekt av behandling. Det er mangelfulle data for toksisitet av medikamentell behandling hos eldre (Osterman et al., 2020; Quivy et al., 2013).
I henhold til «The International Society of Geriatric Oncology» anbefaler vi geriatrisk vurdering av alle over 70 år. Validerte screeningverktøy (som for eksempel G8 (legeforeningen.no)) bør brukes for å identifisere skrøpelige pasienter som trenger mer omfattende geriatrisk utredning (Kanesvaran et al., 2018).
Oppfølging
Sist faglig oppdatert: 27.09.2024
Det er ingen internasjonal konsensus vedrørende postoperativ oppfølging.
Det er ikke funnet økt total overlevelse ved å påvise tidlige residiv. Strukturerte kontroller gir imidlertid økt overlevelse sammenlignet med fravær av oppfølging (Beisland et al., 2016; Capitanio et al., 2020; Dabestani et al., 2019).
Litteraturen anbefaler å avslutte kontrollene når risiko for død av annen årsak overstiger risiko for død av nyrecancer (Stewart-Merrill et al., 2015). Eksempelvis har pasienter i lavrisikogruppen med Charlson comorbidity index (mdcalc.com) ≥2, høyere risiko for annen dødsårsak enn residiv av nyrecancer allerede 1 mnd. etter operasjonen uavhengig av alder.
Oppfølging av pasienter som har gjennomgått kirurgisk behandling for nyrecellekarsinom er todelt:
- Første kontroll søker å avdekke tidlige postoperative komplikasjoner. Blodtrykk og nyrefunksjon må også kontrolleres. Spesielt fokus bør rettes mot pasienter med nyresvikt, diabetes, karsykdom og overvekt.
- Senere kontroller rettes mot påvisning av residiv eller metastatisk sykdom. 80 % av metastasene oppstår de første to årene etter kirurgi, og 75–85 % innen fem år. Metastaser etter 10 år er sjeldne, men forekommer (Beisland et al., 2004; Ljungberg et al., 1999; McNichols et al., 1981).
Risikoscoring hos pasienter operert for nyrecellecarcinom
Sist faglig oppdatert: 27.09.2024
Risiko for tilbakefall av sykdom avhenger av flere faktorer, og kontrollopplegg bør individualiseres og differensieres i henhold til slik risikostratifisering. Vanligst i dag er UISS/Leibovich score (link.springer.com) der pasienter deles inn i lav, medium eller høy risiko for residiv eller metastaser (Klatte et al., 2018). Denne gjelder primært ved klarcellet nyrecellekarsinom, men brukes for både papillære og kromofobe svulster (Beisland et al., 2015a; Leibovich et al., 2003; Leibovich et al., 2018).
| Primærtumor stadium | pT1a | 0 |
| pT1b | 2 | |
| pT2 | 3 | |
| pT3-4 | 4 | |
| Størrelse | < 10 cm | 0 |
| >10 cm | 1 | |
| Lymfeknutestadium | N0< | 0 |
| N1 | 2 | |
| Kjernegrad | 1-2 | 0 |
| 3 | 1 | |
| 4 | 3 | |
| Tumornekrose | Ikke Nekrose | 0 |
| Nekrose til stede | 1 |
| Risikoscore | UISS/Leibovich |
|---|---|
| Lav | 0-2 poeng |
| Medium | 3-5 poeng |
| Høy | 6-11 poeng |
Egenprodusert, basert på Klatte et al. 2018.
Anbefalt oppfølging etter risikostratifisering
Sist faglig oppdatert: 27.09.2024
| 6 uker | 3 mnd | 6 mnd | 1 år | 1.5 | 2 | 3 | 4 | 5 | 7 | 10 | |
| Lav | x | CT | CT | CT | |||||||
| Medium | x | CT | CT | CT | CT | CT | CT | CT | CT | ||
| Høy | x | CT | CT | CT | CT | CT | CT | CT | CT | CT | CT |
Gjengitt fra Ljungberg et al. 2022b. Copyright 2022 European Association of Urology. Gjengitt med tillatelse 2024.
Hos pasienter med lavrisiko cancer T1a asymptomatisk uten trombocytopeni eller anemi kan man vurdere å kutte ut CT thorax i oppfølging (EAU kapittel 5.2.4 (uroweb.org))
I tillegg anbefales årlig blodprøver (Hb, kreatinin inkl. eGFR, CRP, SR, ALP). Ved mistanke om eller påviste metastaser bør LD, kalsium, nøytrofile samt trombocytter tas. Vurder hyppigere kontroller ved nyresvikt.
Ved mye komorbiditet eller hos eldre pasienter anbefales kontrollene avsluttet etter 3 år ved lavrisiko og 5 år i medium risikogruppe. Ved positive marginer eller reseksjon av tumorer > 7 cm anbefales oppfølging tilsvarende en risikogruppe høyere.
Kontroll ved aktiv overvåking
Første kontroll etter 6 – 12 mnd. Deretter kontroller årlig eller hvert annet år. Kontrollene fortsetter til pasienten ikke lenger anses operabel eller har kort forventet levetid.
Se også avsnitt Aktiv overvåking (AS).
Kontroll etter ablativ behandling
Første kontroll etter 6 måneder og deretter årlige kontroller, vanligvis følges de i inntil 5 år. Ved residiv kan reablasjon eller kirurgi vurderes.
Kontroll av Bosniak cyster
Vanligvis kan kontroller avsluttes etter 5 år, men kontrollforløp for cystiske nyrelesjoner vurderes individuelt avhengig av alder og tilleggssykdommer:
| Bosniak I | Ingen kontroller |
| Bosniak IIF | 2 og 5 år. Hvis klassifikasjonen endres underveis følges pasienten videre i tråd med den nye klassifiseringen |
| Bosniak III | Vurderes for aktiv overvåking eller behandling |
| Bosniak IV | Vurderes for behandling |
Endring i morfologi over tid har trolig den største prediktive verdien. Økende septa- eller veggtykkelse eller tilkommet nodularitet tolkes som progresjon (Schoots et al., 2017). Cystens størrelse i seg selv er ikke en prognostisk faktor for malignitet. Hvis man ønsker å kontrollere videre med MR, er det fordelaktig å utføre en baseline MR umiddelbart etter den diagnostiske flerfase CT.
Oppfølging av pasienter med metastatisk nyrecellekarsinom
Sist faglig oppdatert: 27.09.2024
Pasienter som får medikamentell behandling for metastatisk nyrecellekarsinom, følges av onkolog og eventuelt kreftsykepleier i samarbeid med pasientens fastlege. Oppfølgingen er individualisert (se fastlegens rolle ved kreft).
Den medikamentelle behandlingen kan gi et stort spekter av bivirkninger fra mange organsystem og krever regelmessige kliniske kontroller og blodprøvekontroller. Oppfølging og behandling av bivirkninger bør skje i samarbeid mellom onkolog, fastlege og eventuelt sykepleier i poliklinikk. Se avsnitt Bivirkninger av medikamentell behandling.
Pasienter som er under aktiv tumorrettet behandling evalueres vanligvis hver 3.-4. måned. Evalueringen bør inkludere vurdering av klinisk respons, bivirkninger samt radiologiske undersøkelser.
Etter avslutning av tumorrettet behandling anbefales ikke rutinemessige bildeundersøkelser, men dette vurderes individuelt på bakgrunn av symptomer. Disse pasientene følges ofte av fastlege i samarbeid med palliativ team og/eller lokalsykehus og henvises til urolog eller onkolog ved behov.
Seneffekter etter behandling for nyrecellekarsinom
Sist faglig oppdatert: 27.09.2024
Les mer i rapporten Seneffekter etter kreftbehandling.
Oppfølging av personer med arvelig betinget økt risiko for nyrekreft
Sist faglig oppdatert: 27.09.2024
Oppfølging av pasienter og familier med økt risiko for nyrekreft bør vurderes av genetiker i forbindelse med utredning og diagnostikk. Genetisk veiledning er også lovpålagt før prediktiv/presymptomatisk gentest av friske familiemedlemmer (jamfør Bioteknologiloven). Innholdet i oppfølgingen vil avhenge av diagnose, alder, sykehistorie og familiehistorie.
Rutinekontroller skal avsluttes når det ikke lenger har behandlingsmessige konsekvenser.
I familier der den genetiske forandring/diagnosen er kjent
For en del genetiske tilstander finnes standardiserte kontrollopplegg utarbeidet av internasjonale faggrupper – f.eks. Birt-Hogg-Dubé syndrom (Menko et al., 2009; PDQ Cancer Genetics Editorial Board, 2002) og tuberøs sklerose (Northrup et al., 2021). Andre tilstander er så sjeldne at det ikke finnes faglig konsensus, og et spesialtilpasset kontrollopplegg må utarbeides gjennom nasjonale og tverrfaglige samarbeid.
I familier uten kjent genetisk diagnose
I enkelte familier vil man se en opphopning av nyrekreft uten at man klarer å påvise en genetisk forklaring, til tross for adekvat utredning. I slike tilfeller stilles gjerne diagnosen «familiær nyrekreft», og radiologisk oppfølging av førstegradsslektninger av de syke i familien kan være indisert. Oppfølging bør tilpasses i den enkelte familie, men tentativt kan MR-undersøkelse av nyrene hvert 3. – 4. år være et fornuftig utgangspunkt.
Primærundersøkelse er fortrinnsvis MR med kontrast. Påfølgende kontroller kan utføres uten kontrast inntil det oppstår lesjon(er); dette fordi man ikke kjenner konsekvensene av kumulativ akkumulasjon av gadolinium i kroppen. Klarcellet nyrekreft kan fremstå cystisk. En må derfor være oppmerksomme på nytilkomne lesjoner med cystisk utseende på MR uten kontrast.
Metode og prosess ved utarbeidelse av retningslinjene
Bakgrunn
Sist faglig oppdatert: 27.09.2024
Nasjonal helse- og sykehusplan (2015–2019) (Helse- og omsorgsdepartementet, 2015) klargjør at Helsedirektoratet innenfor rettslige rammer, har en normerende rolle for helsetjenesten på tvers av helseregioner og tjenestenivå. Helsedirektoratet er derved eneste aktør som har mandat til å lage nasjonale retningslinjer for helsetjenesten. Helsedirektoratet har en koordinerende rolle for å utvikle overordnede referanserammer for kreftomsorgen, sammen med de regionale helseforetakene, kommunene og andre relevante myndighetsorganer og tjenester.
Nasjonale retningslinjer fra Helsedirektoratet er å betrakte som anbefalinger og råd, basert på oppdatert faglig kunnskap som er fremskaffet på en systematisk, kunnskapsbasert måte. De nasjonale retningslinjene gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet, og er ment som et hjelpemiddel ved de avveininger tjenesteyterne må gjøre for å oppnå forsvarlighet og god kvalitet i tjenesten.
Nasjonale retningslinjer er ikke rettslig bindende for mottakerne, men skal som faglig normerende langt på vei være styrende for de valg som skal tas. Ved å følge oppdaterte nasjonale retningslinjer vil fagpersonell bidra til å oppfylle kravet om faglig forsvarlighet i lovverket. Dersom en velger løsninger som i vesentlig grad avviker fra nasjonale faglige retningslinjer, bør en dokumentere dette og være forberedt til å begrunne sitt valg.
Helsedirektoratet takker arbeidsgruppen for stor innsats i utarbeidelsen av handlingsprogrammet.
Formål med handlingsprogrammet
Sist faglig oppdatert: 27.09.2024
Nasjonale handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av kreft (Nasjonale handlingsprogram) skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
Rettslig betydning
Sist faglig oppdatert: 27.09.2024
Helsedirektoratet skal utvikle, formidle og vedlikeholde normerende produkter, det vil si nasjonale faglige retningslinjer, nasjonale veiledere, nasjonal faglige råd og pakkeforløp, som understøtter målene for helse- og omsorgstjenesten.
Nasjonale anbefalinger og råd skal baseres på kunnskap om god praksis, og skal bidra til kontinuerlig forbedring av virksomhet og tjenester, jf. spesialisthelsetjenesteloven § 7-3, helse- og omsorgstjenesteloven § 12-5 og folkehelseloven § 24.
Anbefalinger/råd utgitt av Helsedirektoratet er ikke rettslig bindende, men er faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet.
I situasjoner der helsepersonell velger løsninger som i vesentlig grad avviker fra gitte anbefalinger, skal dette dokumenteres, jf. journalforskriften § 6, bokstav g. Helsepersonell bør være forberedt på å begrunne sine valg i eventuelle klagesaker eller ved tilsyn.
Målgrupper
Sist faglig oppdatert: 27.09.2024
Målgrupper for de nasjonale handlingsprogrammene er spesialister innen medisin, kirurgi, onkologi, radiologi og patologi. De vil også være av interesse for allmennleger, pasienter, pårørende og andre aktører på kreftfeltet.
Handlingsprogram og Nye metoder
Sist faglig oppdatert: 27.09.2024
De regionale helseforetakene har ansvar for Nye metoder, et felles system for å beslutte hvilke metoder som kan tilbys i spesialisthelsetjenesten. Nye metoder er et prioriteringsverktøy. Beslutningene i Nye metoder gjelder nasjonalt, les mer på nyemetoder.no: Bakgrunn: Hvorfor har vi Nye metoder?
Handlingsprogram og andre normerende produkter kan ikke anbefale legemidler eller andre metoder som ikke har finansering i den offentlige helsetjenesten. Handlingsprogrammene oppdateres i overenstemmelse med beslutninger i Nye metoder.
Kunnskapsbasert metode
Sist faglig oppdatert: 27.09.2024
Kunnskapsbasert praksis innebærer at både forskningsbasert kunnskap, erfaringsbasert klinisk kunnskap og pasientenes/ brukernes ønsker og behov vurderes samlet. I utarbeidelsen og revidering av nasjonale handlingsprogram har det ikke vært med brukerrepresentanter i gruppene.
Innholdet i en retningslinje skal baseres på et oppdatert, gjennomarbeidet og dokumentert kunnskapsgrunnlag. Det innebærer at forskningslitteratur, klinisk erfaring og brukererfaring vurderes opp mot ønskede og uønskede konsekvenser av et tiltak. På områder der det er funnet mindre forskningsbasert kunnskap, og/eller overføringsverdien fra internasjonal til norsk helsetjeneste er lav, blir klinisk kunnskap og brukerkunnskap tillagt større vekt.
Dette nasjonale handlingsprogrammet inneholder svært mange anbefalinger. Det er ikke praktisk mulig, innenfor gitte ressursrammer, å samle all relevant forskningsbasert kunnskap for hver anbefaling. Den forskningsbaserte kunnskapen er hovedsakelig basert på forskning identifisert i anerkjente internasjonale retningslinjer og nyere studier. Det er heller ikke praktisk mulig å gjennomgående bruke GRADE eller SIGN-metodikken for gradering av kunnskapsgrunnlaget.
Handlingsprogram og andre normerende produkter skal også forholde seg til prioriteringskriteriene og ressursbruk. Med ressurser menes direkte kostnader, men også personell og tidsbruk.
Grad av normering
Sist faglig oppdatert: 27.09.2024
Grad av normering angis i teksten i hver enkelt anbefaling/råd:
- Når Helsedirektoratet skriver «skal», betyr det at anbefalingen/rådet er basert på lov eller forskrift, eller når det er så klart faglig forankret at det sjelden er forsvarlig å ikke gjøre som anbefalt
- Når det står bør» eller «anbefaler», er det en sterk anbefaling/råd som vil gjelde i de aller fleste tilfeller
- Når det står «kan» eller «foreslår» er det en svak anbefaling/råd der ulike valg kan være riktig for ulike pasienter
Tilhørende normerende publikasjoner
Sist faglig oppdatert: 27.09.2024
Arbeidsform og deltakere
Sist faglig oppdatert: 27.09.2024
Handlingsprogrammet oppdateres av en oppdateringsgruppe oppnevnt av Helsedirektoratet. Representantene i gruppen er utnevnt av de regionale helseforetakene. Helsedirektoratets bearbeidelse og gjennomgang av utkast til handlingsprogram, blir handlingsprogrammet publisert på Helsedirektoratets nettside.
Første versjon av handlingsprogrammet (IS-1525 nr 1) 20.12.07–11.06.12
Helsedirektoratet rettet i november 2005 en henvendelse til Norsk Urologisk Cancer Gruppe (NUCG) og ba om forslag til representanter til en arbeidsgruppe som skulle settes sammen av fagekspertise, Nasjonalt kunnskapssenter for helsetjenesten og Helsedirektoratet. Det ble bedt om at alle nødvendige faggrupper skulle være representert og at gruppen skulle bestå av fagfolk fra alle helseregioner.
En arbeidsgruppe ble nedsatt. Denne valgte å starte med prostatakreft, men kunne orientere om at dr. Christian Beisland nettopp hadde disputert på temaet nyrecellekreft. Dr. Christian Beisland ble av arbeidsgruppen og NUCG bedt om han kunne skrive et utkast til nasjonale retningslinjer for nyrecellekreft. Patologidelen av retningslinjene er laget i samarbeid med seksjonsoverlege Leif Bostad, Avdeling for patologi, Gades institutt, Haukeland Universitetssykehus. Professor Olbjørn Klepp, Helse Sunnmøre/NTNU, har bidratt i utarbeidelsen innenfor strålebehandling og systemisk behandling av metastaserende sykdom. Seksjonsleder Inger Norderhaug, Nasjonalt kunnskapssenter for helsetjenesten har bistått Beisland i arbeidet, bl.a. med gradering av kunnskapsgrunnlaget samt redigering og ferdigstillelse av retningslinjene.
RHFene har medvirket i arbeidet gjennom representasjon i prosjektets styrings- og referansegruppe, samt ved mulighet til å gi tilbakemelding på arbeidsgruppenes sammensetning. RHFene ble også bedt om at fagfolk innenfor rammen av sin arbeidstid ble fristilt til retningslinjearbeidet, jf. Oppdragsdokumentet fra Helse- og omsorgsdepartementet.
Nasjonalt handlingsprogram med retningslinjer for utredning, behandling og kontroll av nyrecellekreft ble utgitt første gang 20.12.2007.
Andre versjon av handlingsprogrammet (IS-1525 nr. 2) 12.06.12–02.09.15
Den reviderte utgave ble utarbeidet av samme forfattere som ved første versjon, men i tillegg bidro overlege Daniel Heinrich, Kreftavdelingen, Akershus universitetssykehus særlig innenfor strålebehandling og systemisk behandling av metastaserende sykdom.
Tredje versjon av handlingsprogrammer (IS-2364) 03.09.15
Fra 1. mai 2015 ble Pakkeforløp for nyrekreft innført. De tidligere forløpstidene i handlingsprogram for nyrekreft ble i foreliggende versjon erstattet av de nye tidene i Pakkeforløp for nyrekreft.
Fjerde versjon av handlingsprogrammet 2022
Vi startet arbeidet med å oppdatere handlingsprogrammet i februar 2021. Det har vært tidkrevende både på grunn av pandemi og lang tid siden forrige oppdatering. Det er gjort strukturelle endringer og det er forsøkt å gjøre handlingsprogrammet kort og presis.
Femte versjon av handlingsprogrammet 2024
Leder | Maria Nyre Vigmostad, stipendiat, onkolog, Helse Stavanger HF |
|---|---|
Helse Nord | Bård Soltun, urolog, Harstad Gunnar Oltmanns, radiolog, Tromsø |
Helse Midt | Liselotte Rian, urolog, St. Olavs hospital Bjørg Aksnessæther, PhD, onkolog, Ålesund Susan Frances Deane, radiolog, St. Olav |
Helse Vest | Karin Margrethe Hjelle, PhD, urolog, Haukeland Ida Wiig Sørensen, PhD, overlege, medisinsk genetikk, Haukeland |
Helse Sør-Øst | Katarina Puco, onkolog, Lovisenberg diakonale sykehus Anne Helene Køstner, stipendiat, onkolog, Kristiansand Ulrica Axcrona, PhD, patolog, OUS |
| Fastleger | Heidi Lidal Fidjeland Hanna Helgetun Krogh |
Kontaktpersoner i Helsedirektoratet
Kontaktperson i Helsedirektoratet er Kaja Fjell Jørgensen, seniorrådgiver, kaja.fjell.jorgensen@helsedir.no
Fagansvarlig på kreftområdet er Sissi Espetvedt, sissi.leyell.espetvedt@helsedir.no
Habilitet
Sist faglig oppdatert: 27.09.2024
Representantene i arbeids-/oppdateringsgruppen har fylt ut Helsedirektoratets habilitetsskjema. Ingen interesser med konsekvenser for deltakelse i arbeidet er identifisert. Skjemaene er arkivert i Helsedirektoratet.
Referanser
Sist faglig oppdatert: 27.09.2024
Helsedirektoratet. (2012). Veileder for utvikling av kunnskapsbaserte retningslinjer (IS-1870). ISBN-nr. 978-82-8081-225-4. Hentet fra https://www.helsedirektoratet.no/









