Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av pasienter med pancreaskreft
Forord
Sist faglig oppdatert: 05.07.2021
Mange medisinske faggrupper har i en årrekke lagt ned et betydelig arbeid for å komme frem til konsensusbaserte faglige anbefalinger for diagnostikk og behandling av ulike typer kreft. Som ledd i Nasjonal strategi for kreftområdet (2006–2009) fikk Helsedirektoratet i oppdrag å videreutvikle og oppdatere faggruppenes anbefalinger til nasjonale handlingsprogrammer for kreftbehandling, i nært samarbeid med fagmiljøene, de regionale helseforetakene, Nasjonalt kunnskapssenter for helsetjenesten, og andre relevante myndigheter. De nasjonale handlingsprogrammene representerer en videreføring og en formalisering av faggruppenes anbefalinger.
Nasjonale handlingsprogrammer for kreftbehandling skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet. Målgrupper for retningslinjene er leger og legespesialister innen medisin, kirurgi, onkologi, radiologi, patologi og fastleger. De vil også være av interesse for andre faggrupper som er involvert i behandling av pasientgruppen og pasienter og pårørende.
Nasjonale retningslinjer fra Helsedirektoratet er å betrakte som anbefalinger og råd, basert på oppdatert faglig kunnskap som er fremskaffet på en systematisk, kunnskapsbasert måte. De nasjonale retningslinjene gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet og er ment som et hjelpemiddel ved de avveininger tjenesteyterne må gjøre for å oppnå forsvarlighet og god kvalitet i tjenesten. Nasjonale retningslinjer er ikke direkte rettslig bindende for mottagerne, men bør langt på vei være styrende for de valg som skal tas. Ved å følge oppdaterte nasjonale retningslinjer vil fagpersonell bidra til å oppfylle kravet om faglig forsvarlighet. Dersom en velger løsninger som i vesentlig grad avviker fra de nasjonale retningslinjene, bør en dokumentere dette og være forberedt på å begrunne sine valg. Sykehusenes eiere og ledelse bør tilrettelegge virksomheten slik at de nasjonale retningslinjene kan følges.
Helsedirektoratet takker arbeidsgruppen for stor innsats i utarbeidelsen av handlingsprogrammet. Vi håper handlingsprogrammet vil være et nyttig arbeidsredskap ved behandling av pasienter med bukspyttkjertelkreft. Handlingsprogrammet vurderes for oppdatering årlig. Denne sjette utgaven av handlingsprogrammet for pancreaskreft er publisert 05.07.2021.
Bjørn Guldvog
Helsedirektør
Sammendrag av anbefalingene
Sist faglig oppdatert: 05.07.2021
Risikofaktorer (kapittel 6)
|
| Evidensgrad |
| Symptomer som kan gi mistanke om pancreaskreft bør i særlig grad vurderes hos pasienter som røyker, er overvektige, har nyoppstått diabetes uten kjente risikofaktorer, har kronisk pankreatitt i sykehistorien, eller hvor det kan være mistanke om arvelig disposisjon. | C |
| Hos pasienter hvor det foreligger mistanke om arvelig risiko for pancreaskreft (på grunn av flere tilfeller av pancreaskreft og/eller andre krefttyper som malignt melanom, brystkreft eller prostatakreft i familien), bør henvises til senter som kan gi klinisk genetisk veiledning og eventuelt utføre gentesting. Det samme gjelder ved kreftdiagnose i ung alder. | C |
Diagnose (kapittel 7)
|
| Evidensgrad |
| CT undersøkelse (m/«pancreas protokoll» + CT thorax) er basisundersøkelser i diagnostikk, utredning og stadiumvurdering. | B |
| MR er indisert ved spesielle problemstillinger. EUS (eventuelt m/FNA) og PET-CT kan være nyttige supplerende undersøkelsesmodaliteter. | B |
| ERCP er en terapeutisk prosedyre, og har ingen plass i diagnostikken av pancreaskreft. Prosedyren bør ikke gjøres før det er utført adekvat bildediagnostikk med CT pancreas. | D |
| Ved klinisk mistanke om sykdomstilbakefall utføres primært CT abdomen. | B |
| Diagnostisk laparoskopi i generell anestesi er kun aktuelt ved spesielle problemstillinger, og er ikke del av standard utredningen. | B |
| Tumormarkører (CA 19‑9) har ingen plass i screening, og har liten diagnostisk verdi, men kan gi prognostisk informasjon, og være til nytte for monitorering av effekten av systemisk behandling. | B |
| Pre-operativ perkutan ultralydveiledet biopsi/cytologi av antatt pancreaskreft frarådes på grunn av risiko for implantasjonsmetastaser, og fordi undersøkelsen har lav sensitivitet. Hvis pre-operativ morfologisk diagnose anses som nødvendig, bør EUS-FNA foretrekkes. | C |
Behandling av lokalisert sykdom/Kurativ behandling (kapittel 9)
Kirurgi (kapittel 9.1)
|
| Evidensgrad |
| Utredning, evaluering og behandling av pasienter med pancreaskreft bør foregå på sentra med adekvat spesialkompetanse som samarbeider i multidisiplinære team, og som har døgnkontinuerlig kompetent vakt innen alle fagområder som er involvert i behandlingen. | C |
| Pre-operativ galleavlasting (fortrinnsvis endoskopisk) hos ikteriske pasienter med bilirubin < 250 µmol/L reduserer ikke den generelle risikoen for postoperative komplikasjoner, men øker risikoen for infeksjonskomplikasjoner. | A |
| Pylorusbevarende- og tradisjonell («Whipple’s») pancreatoduodenectomi er likeverdige metoder. | B |
| Reseksjon av v.portae og/eller v.mesenterica superior for å oppnå radikal kirurgi kan utføres. Overlevelsen er som hos pasienter uten venereseksjon. | C |
| Tidlig peroral ernæring reduserer risikoen for komplikasjoner. | A |
Patologi (kapittel 9.2)
|
| Evidensgrad |
| Operasjonspreparatet (fortrinnsvis «ferskt») skal merkes og orienteres slik at patologen kan bearbeide makropreparatet og gjøre adekvat mikroskopi for å kunne besvare de sentrale problemstillinger knyttet til tumortype, størrelse, lokalisering, reseksjonsrender, lymfeknutestatus, og eventuelt reseserte strukturer (f. eks. veneresektat). | D |
| Standardisert disseksjon, inkl. aksial oppskjæring av pancreatoduodenectomi-preparater, omfattende vevsinnstøping og bruk av R1-definisjon basert på 1 mm avstand resulterer i en nøyaktigere vurdering av cancerorigo, tumorstørrelse, T-stadium og reseksjonsstatus. | C |
| Bruk av diagnosemal gir en mer nøyaktig og komplett vurdering av prognostiske faktorer. | C |
| Patologibesvarelsen bør senest foreligge innen 3-4 uker. | D |
Adjuvant behandling (kapittel 9.3)
|
| Evidensgrad |
| Neoadjuvant behandling er per i dag ikke del av standardbehandlingen ved resektabel pancreaskreft. | D |
| Neoadjuvant kjemoterapi anbefales ved borderline resektabel sykdom. | C |
| Selekterte pasienter med primært, ikke-resektabel, lokalavansert pancreaskreft med tegn til god og langvarig (4-6 mnd.) biokjemisk og radiologisk respons på kjemoterapi bør rehenvises til universitetssykehus som utfører pancreaskirurgi for responsevaluering med tanke på muligheten for eventuell kirurgi. | D |
| Endelig histologibeskrivelse av operasjonspreparatet med en bekreftelse på at pasienten har adenokarsinom utgående fra pancreas skal foreligge før oppstart adjuvant behandling. Alt makroskopisk tumorvev må være fjernet (dvs. en R0 eller R1 reseksjon er utført). | D |
| Adjuvant behandling bør starte senest innen 12 uker fra operasjonstidspunktet. Det bør utføres en CT thorax/abdomen/bekken både ved behandlingsoppstart, og etter gjennomført adjuvant kjemoterapi. | A |
| Pasienten bør være i god allmenntilstand og god funksjonsklasse (ECOG 0‑1) ved oppstart behandling. Alder og komorbiditet må også tas i betraktning både med hensyn på om adjuvant behandling skal anbefales og ved valg av regime. | C |
| mFOLFIRINOX, bestående av 5FU, leukovorin, irinotecan og oxaliplatin gitt hver 14. dag, er standard adjuvant regime hos pasienter som er i god allmenntilstand og fullt restituert etter operasjonen. Eventuelt vurderes GemCap gitt i form av gemcitabine dag 1, 8 og 15 i en 4 ukers syklus kombinert med capecitabine 2 ganger daglig dag 1-22, gemcitabine monoterapi dag 1, 8 og 15 i en 4 ukers syklus eller FLV gitt i form av 5-FU og leukovorin 2 påfølgende dager hver 14. dag. | A |
Oppfølgning og etterkontroll etter kurativ behandling (kapittel 10)
|
| Evidensgrad |
| Pasienten bør ha en etterkontroll ved kirurgisk poliklinikk 4–6 uker etter gjennomført operasjon med kurativ intensjon. Her bør informasjon om endelig histologi, og andre generelle forhold tas opp. Pasienten må få oppsummert og repetert den gjennomførte behandling og resultatene av denne. Vurdering av pasientens aktuelle allmenn- og ernæringstilstand bør vektlegges og dokumenteres. | D |
| Om pasienten er aktuell for adjuvant kjemoterapi, må pasienten henvises til kreftavdeling for vurdering og informasjon så snart histologisvaret foreligger. | D |
| Etter gjennomført primærbehandling (operasjon + eventuell adjuvant kjemoterapi) følges pasientene videre av fastlege. Fokus bør legges på vurdering av allmenn- og ernæringstilstand og på symptomer som kan gi mistanke om residiv eller metastaser. | D |
| Det er ikke vitenskapelig grunnlag for å anbefale noe spesielt tidsintervall mellom slike konsultasjoner, og heller ikke grunnlag for å anbefale rutinemessig bruk av bildediagnostikk eller spesielle blodprøver. | C |
| Ved klinisk mistanke om residiv/metastaser bør utredning med CT abdomen/ thorax, relevante blodprøver inkl. CA 19‑9 som tumormarkør vurderes. Pasienten bør vurderes med hensyn på palliativ kreftrettet behandling, men også for eventuelt behov for symptomrettet og generell palliativ behandling. | D |
Palliativ behandling ved lokalavansert, inoperabel tumor og metastatisk sykdom (kapittel 11)
Palliativ kirurgi/intervensjon (kapittel 11.1)
|
| Evidensgrad |
| I palliativ sammenheng bør obstruksjoner i galleveier og/eller duodenum fortrinnsvis avlastes med endoskopiske stenter framfor kirurgisk avlastning. | A |
| Endoskopisk galleavlastning er å foretrekke framfor perkutan transhepatisk tilgang, så lenge endoskopi er mulig og tilgjengelig. | C |
| Selvekspanderende metallstenter (SEMS) er å foretrekke framfor plastikkstenter for galleavlastning i en palliativ situasjon. | B |
| PEG sonde kan gi en effektiv avlastning av mage-tarmkanalen ved høye obstruksjoner. | C |
| Coeliacusblokade kan være indisert der man ikke oppnår tilfredsstillende lindring med medikamentell smertebehandling eller der denne gir uakseptable bivirkninger. | A |
Palliativ kreftrettet behandling (kapittel 11.2)
Palliativ kjemoterapi
|
| Evidensgrad |
| Gemcitabine (1000 mg/m2 gis i.v. som monoterapi) har gitt økt overlevelse sammenlignet med 5-FU hos pasienter ved avansert sykdom. | A |
| FOLFIRINOX som 1. linje gir økt overlevelse hos pasienter i god funksjonsstatus (ECOG 0‑1) sammenlignet med gemcitabine monoterapi. Behandlingen forutsetter nøye oppfølgning av bivirkninger og eventuelt dosejusteringer. Disse pasientene vil vanligvis trenge G-CSF støtte. | A |
| Kombinasjonen nab-paclitaxel/gemcitabine som 1. linje gir økt overlevelse sammenliknet med gemcitabine monoterapi og er et alternativ som 1. linjebehandling. | A |
| 2. linjebehandling kan vurderes hos pasienter i god allmenntilstand (funksjonsstatus ECOG 0‑1). Både gemcitabine monoterapi og kombinasjonen nab-paclitaxel/gemcitabine kan være aktuelt som 2. linjebehandling etter FOLFIRINOX/FLOX-kurer gitt i 1. linje. Hos pasienter som har fått et gemcitabineholdig regime som 1. linjebehandling kan oxaliplatinholdig kjemoterapi (FOLFIRINOX/FLOX-kurer) være et alternativ som 2. linjebehandling. Behandlingen kan eventuelt startes i redusert dose for å vurdere toleransen. | D |
Strålebehandling
|
| Evidensgrad |
| Palliativ strålebehandling kan være aktuelt ved lokaliserte, symptomgivende sykdomsmanifestasjoner (både ved lokale residiv og metastaser) hos enkelte pasienter. | C |
| Ved smertefulle skjelettmetastaser hvor det ikke foreligger frakturfare eller risiko for medullakompresjon, kan det gis hypofraksjonert strålebehandling med 8 Gy x 1. | A |
| Ved bløtvevsmetastaser tilpasses fraksjoneringen til lokalisasjon, målvolum og pasientens forventede levetid. Vanlig fraksjonering vil være 4 Gy x 5 eller 3 Gy x 10. | D |
Støtte behandling (kapittel 11.3.2)
|
| Evidensgrad |
| Tiltak som kan bidra til ivaretakelse av ernæringsstatus (kartlegging, veiledning, perorale kosttilskudd, apetittstimulerende medikamenter) er viktig tidlig i sykdomsforløpet. | B |
| Enteral ernæring er å foretrekke framfor intravenøs. | B |
| Aktiv (intravenøs eller via sonde) ernærings- og væskebehandling for en begrenset periode, kan vurderes i situasjoner hvor pasienten ikke klarer å ta til seg nok selv og dette forringer livskvaliteten. | D |
| I den aller siste fasen av sykdommen er det ikke nødvendig å fokusere på dekning av ernæringsbehov. Hydrering med 500–1000 ml væske i.v. eller s.c. per døgn kan gis dersom dette bedrer pasientens symptomer. | C |
Innledning
Sist faglig oppdatert: 05.07.2021
Nasjonalt handlingsprogram for kreftbehandling skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet, og likeverdig over hele landet.
Dette handlingsprogrammet omhandler kreft i bukspyttkjertelen, pancreaskreft, og med det menes (duktalt) adenokarsinom i pancreas.
Fordi symptomer og funn, utredning og mye av behandlingen er den samme for flere andre typer svulster (for eksempel distalt kolangiokarsinom, duodenalcancer og cancer i ampulla Vateri) som er lokalisert periampullært i relasjon til caput pancreatis, finner vi det riktig å omtale også disse svulstene i denne sammenhengen.
Nevro-endokrine svulster (NET) i pancreas og andre sjeldnere svulsttyper drøftes ikke nærmere i dette handlingsprogrammet. NET omtales i et eget nasjonalt handlingsprogram for nevroendokrine svulster som samlet gruppe.
Endringer i tidligere utgaver av handlingsprogrammet
I 2. utgave er et kapittel om forløpstider tatt inn i handlingsprogrammet. Disse forløpstidene gjelder for alle kreftsykdommer. Ved en inkurie var ikke dette kapittelet med i 1. publiserte utgave av handlingsprogrammet. Ellers er det ingen forskjeller i 1. og 2. utgave av handlingsprogrammet.
I 3. utgave av handlingsprogrammet (høsten 2016) er det satt inn en beskrivelse av «borderline-resectable» pancreaskreft, der vi har tatt stilling til den definisjonen (det finnes flere brukt internasjonalt) vi anser er mest hensiktsmessig å bruke i vår praksis i Norge. En rekke litteraturreferanser er oppdatert. Kapittelet om patologi er til dels helt omskrevet, og praktiske kliniske anbefalinger er tydeliggjort. Mal for rapportering av patologibeskrivelse er oppdatert.
I 4. og 5. utgave av handlingsprogrammet (publisert mars 2017 og april 2017) er en rekke litteraturreferanser oppdatert. Kapittelet om patologi er til dels helt omskrevet, og praktiske kliniske anbefalinger er tydeliggjort. Mal for rapportering av patologibeskrivelse er oppdatert. I tillegg er kapittelet om cystiske pancreaslesjoner fjernet, som i mange sammenhenger kan være en diagnostisk og terapeutisk utfordring. Denne kliniske problemstillingen krever en ny gjennomgang for å kunne være nyttig i daglig klinisk praksis. En veiledning omkring denne problemstillingen står seg best i form av et eget dokument, noe som går utover det mandatet for denne oppdateringsgruppen. Forskjell i 4. og 5. utgave er kun at én referanse er lagt til som ikke var i 4. utgave mars 2017.
Endringer i 6. utgave av handlingsprogrammet
Klassifikasjon av og anbefalte behandlingssekvenser for pancreaskreft i henhold til anatomiske og radiologiske definisjoner (resektabel, borderline resektabel, lokalavansert/primært ikke-resektabel, metastastisk) er tydeligere spesifisert i 6. utgave (Figur 10). Anbefalt adjuvant kjemoterapi etter reseksjon med kurativ intensjon er oppdatert i henhold til resultater fra nye randomiserte studier. Kapittelet «Risikofaktorer» er utdypet i forhold til arvelig disposjon for pancreakreft og råd om eventuell genetisk veiledning og testing ved påvist pancreaskreft. TNM klassifikasjon er oppdatert. «Forslag til mal for strukturert radiologi rapport av adenokarsinom i pancreas» er lagt til (addendum 13.1). «Forslag til mal for strukturert patologi rapport ved adenokarsinom etter pancreasreseksjon» er oppdatert (addendum 13.2). En rekke litteraturreferanser er oppdatert. NGICG-HPB publiserte i januar 2019 dokumentet «Retningslinjer for utredning, behandling og kontroll av cystiske pancreaslesjoner» (NGICG-HPB, 2019) og dette kapittelet er utelatt fra og med 4. utgave av handlingsprogrammet.
Epidemiologi
Sist faglig oppdatert: 05.07.2021
Pancreaskreft er en av de viktigste dødsårsakene blant kreftpasienter, og globalt sett dør årlig 400 000 av pancreaskreft, og tallet er økende (Bray et al., 2018). Det er anslått at pancreaskreft i 2030 blir den nest hyppigste årsaken til kreftdødelighet i Europa og USA (Kamisawa, Wood, Itoi, & Takaori, 2016).
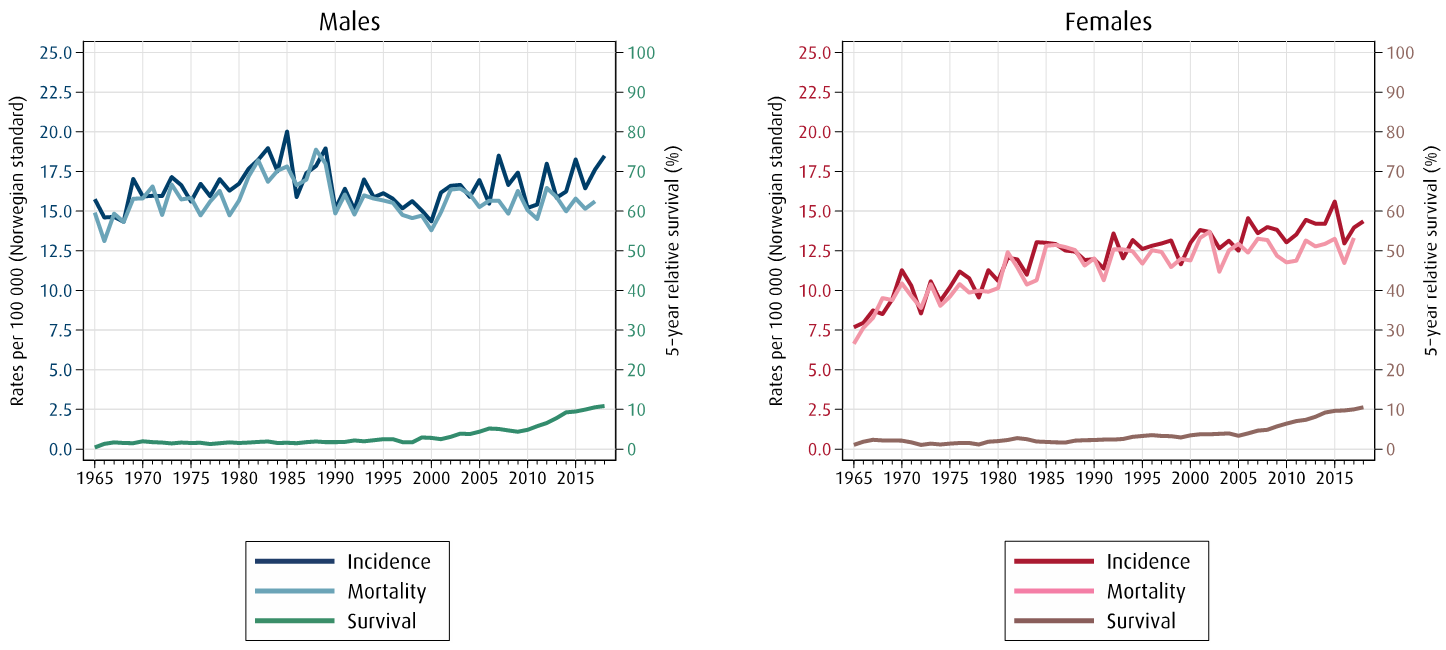
I Norge diagnostiseres årlig vel 800 nye tilfeller med pancreaskreft (Norway). Forekomsten er tilnærmet lik hos kvinner og menn. Den årlige insidensen er relativt stabil, og samlet for begge kjønn er insidensen 14/100 000 (Figur 1) (K. Søreide, Aagnes, Møller, Westgaard, & Bray, 2010). Dødeligheten er imidlertid høy, og sykdommen er den fjerde hyppigtse årsaken til kreftdødelighet (Carioli et al., 2020).
Det har skjedd relativt lite med hensyn til prognosen når vi ser hele sykdomsgruppen under ett, fordi avansert sykdom ofte foreligger allerede på diagnosetidspunktet, og effekten av tilgjengelig kjemoterapi er begrenset (Huang et al., 2018; Kamisawa et al., 2016) .
For de relativt få pasientene (< 15–20 %) som kan opereres med kurativ hensikt er prognosen bedret (Huang et al., 2018; Huang et al., 2019). Dette kan knyttes både til en annen og bedre tumorbiologi og gunstigere utgangspunkt hva gjelder kirurgisk-onkologiske faktorer, men også til en bredere anvendelse av multimodal behandling (Bilimoria et al., 2007).
Forløpstider
Sist faglig oppdatert: 05.07.2021
I 2015 ble Pakkeforløp for bukspyttkjertelkreft innført i helsetjenesten, sammen med øvrige Pakkeforløp for kreft. Alle pakkeforløpene kom i reviderte utgaver i 2016.
Om Pakkeforløp for kreft
Sist faglig oppdatert: 05.07.2021
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Formålet med Pakkeforløp for kreft er at pasienter skal oppleve et godt organisert, helhetlig og forutsigbart forløp uten unødvendig ikke-medisinsk begrunnet forsinkelse i utredning, diagnostikk, behandling og rehabilitering.
Forløpstidene i pakkeforløpet beskriver den maksimale tiden de ulike fasene i forløpet bør ta for et flertall av pasientene. Forløpstidene angis i kalenderdager. De enkelte fasenes forløpstid legges til slutt sammen til en samlet forløpstid, som angir tiden fra henvisning er mottatt til start behandling. Med utgangspunkt i pakkeforløpet skal et individuelt forløp tilrettelegges for hver enkelt pasient.
De regionale helseforetakene har det overordnede ansvaret for å sikre at pakkeforløpene med forløpstidene blir implementert og fulgt opp. Forløpstidene er normerende og er ikke en pasientrettighet. Fortsatt er det lovmessige grunnlaget pasientrettighetsloven § 2‑2 og forskrift om prioritering av helsetjenester. Av og til vil det av faglige grunner være noen pasienter som ikke kan utredes ferdig innen normert forløpstid for oppstart av første behandling.
Forløpstider for bukspyttkjertelkreft
Sist faglig oppdatert: 05.07.2021
I Pakkeforløp for bukspyttkjertelkreft er det utarbeidet følgende forløpstider:
| Fra henvisning mottatt til første fremmøte utredende avdeling |
| 8 kalenderdager |
| Fra første fremmøte i utredende avdeling til avsluttet utredning (beslutning tas) |
| 14 kalenderdager |
| Fra avsluttet utredning til start behandling | Kirurgisk behandling | 14 kalenderdager |
| Fra avsluttet utredning til start behandling | Medikamentell behandling | 14 kalenderdager |
| Fra henvisning mottatt til start behandling | Kirurgisk behandling | 36 kalenderdager |
| Fra henvisning mottatt til start behandling | Medikamentell behandling | 36 kalenderdager |
Pakkeforløp for bukspyttkjertelkreft finnes på Helsedirektoratets nettsider Se www.helsedirektoratet.no
Det er utarbeidet en egen diagnoseveileder for fastleger for inngang til pakkeforløp. Diagnoseveileder finnes på www.helsedirektoratet.no
Det er også utarbeidet pasientinformasjonsskriv, som finnes på www.helsedirektoratet.no
Organisering av behandling
Sist faglig oppdatert: 05.07.2021
Det bør være lav terskel for henvisning til spesialiserte sentra med nødvendig utredningskompetanse og behandlingsansvar for denne pasientgruppen. Flertallet av pasienter som utredes for pancreaskreft blir vurdert inoperable; enten fordi det påvises fjernmetastaser eller lokalavansert sykdom, eller fordi andre sykdommer, sterkt redusert funksjonsnivå og/eller svært høy alder ikke er forenlig med et omfattende kirurgisk inngrep (Bjerregaard, Mortensen, Schonnemann, & Pfeiffer, 2013; Hidalgo, 2010; Warshaw, Lillemoe, & Fernandez-Del Castillo, 2012). God dialog mellom lokalsykehus og behandlingssentra om enkeltpasienter er viktig. På den måten kan de fleste pasienter få nødvendig palliativ behandling ved lokalsykehuset, forutsatt at det er adekvat tilbud og kompetanse for bl.a. endoskopisk intervensjon og smertebehandling.
Utredning og behandling av pasienter med potensielt resektabel pancreaskreft bør foregå ved definerte sykehus i regionene (Bilimoria et al., 2007; J.A. Tol, van Gulik, Busch, & Gouma, 2012; van Heek et al., 2005) som har:
- Radiologisk avdeling med kompetanse og utstyr for presis vurdering av stadium og resektabilitet. Det forutsetter radiologisk spesialkompetanse innen CT og MR diagnostikk.
- Kirurgisk avdeling med gastrokirurger med spesialkompetanse innen alle typer pancreaskirurgi.
- Samlet god kompetanse innen endoskopisk og radiologisk pancreasdiagnostikk (inkl. EUS), intervensjon for tilstander forårsaket av pancreaskreft og behandling av eventuelle komplikasjoner til pancreaskirurgi.
- Kreftavdeling og onkologer med kompetanse innen behandling av pancreaskreft, både med kurativt og palliativt siktemål.
- Patologisk avdeling og patologer med spesialkompetanse på feltet, og god frysesnittdiagnostikk.
- Anestesi- og intensivavdeling med adekvat kompetanse og kapasitet.
- Etablerte multidisiplinære team basert på fagmiljøer omtalt ovenfor.
Risikofaktorer
Sist faglig oppdatert: 05.07.2021
Årsakene til pancreaskreft er fortsatt stort sett uavklart (Bond-Smith, Banga, Hammond, & Imber, 2012; Hidalgo, 2010; Vincent, Herman, Schulick, Hruban, & Goggins, 2011). En rekke faktorer har vært vurdert, men en sikker assosiasjon mellom risiko for og forekomst av pancreaskreft er kun dokumentert for røyking (Alsamarrai, Das, Windsor, & Petrov, 2014; Hidalgo, 2010; Vrieling et al., 2010). Det er også en økt forekomst av kronisk pankreatitt i sykehistorien til pasienter med pancreaskreft. Størst risiko har pasienter med hereditær pankreatitt, som imidlertid er meget sjelden (Rebours, Levy, & Ruszniewski, 2012; Solomon & Whitcomb, 2012). Selv om flere studier har vist en assosiasjon mellom diabetes type 2 og pancreaskreft, er det ikke påvist noen sikker kausalitet (Ben et al., 2011; Molina-Montes et al., 2020). Nyere studier viser at nyoppstått diabetes type 2 ofte er en følge av pancreaskreft, heller enn en risikofaktor (Molina-Montes et al., 2020). Sammenhengen mellom langvarig diabetes type 2 og pancreaskreft er mer kompleks på grunn av interferens med fedme, som i seg selv er en risikofaktor for pancreaskreft (Genkinger et al., 2015; Molina-Montes et al., 2020).
Det er grunnlag for å anta at 5 – 10 % av pancreaskrefttilfellene har arvelig årsak (Peters, Tseng, & Miksad, 2016). Pasienter med arvelig pancreaskreft kan deles i to grupper. Den første gruppen er de pasientene som har økt risiko for pancreaskreft som del av et syndrom der andre tilstander inngår, f.eks. familiært malignt melanom (påvist genfeil i CDKN2A-genet), Peutz-Jegher syndrom eller hereditær pankreatitt (Goggins et al., 2020). Dette er en veldig liten gruppe. Ved mistanke om et arvelig syndrom, bør familien henvises til genetisk veiledning og eventuelt gentesting. Den andre og større gruppen er pasienter med familiær pancreaskreft definert som pasienter som har to førstegradsslektninger med pancreaskreft, eller to eller flere andregrads-slektninger hvorav én er under 50 år (Goggins et al., 2020; Templeton & Brentnall, 2013). I mange tilfeller finner man ikke en genetisk årsak selv om det er en familiær opphopning av pancreaskreft.
De fleste av 20 tumorsuppressorgener som man tester for i familier med opphopning av kreft er forbundet med lett til moderat forhøyet risiko for pancreaskreft (Goggins et al., 2020). Personer med feil i tumorsuppressorgener har kompleks kreftrisiko og forhøyet risiko for flere krefttyper. Det er først og fremst risiko for andre krefttyper enn pancreaskreft. Genfeil i tumorsuppressorgener som BRCA2 og CDKN2A er forbundet med lett til moderat forhøyet risiko for pancreaskreft. Selv om det fortsatt ikke er identifisert en kausal sammenheng mellom konkrete gener og familiær opphopning av pancreaskreft, bør henvisning til sentra med kompetanse på genetisk veiledning og testing vurderes, spesielt hvis det foreligger flere tilfeller av pancreaskreft og/eller andre krefttyper som malignt melanom, brystkreft eller prostatakreft i familien og ved uventet lav alder på diagnosetidspunktet (Ghaneh, Costello, & Neoptolemos, 2007; Syngal et al., 2015). Hensikten med gentesting er å avklare om det er en arvelig årsak til kreft i familien. Dersom det påvises genfeil i et av genene som undersøkes, vil familiemedlemmer få tilbud om gentesting for å avklare sin risiko. Den som rekvirerer analysen er ansvarlig for å gi informasjon om resultatet til pasienten. Dersom det påvises sykdomsgivende genfeil, skal pasienten henvises til genetisk veiledning ved medisinsk genetisk avdeling etter at behandlende lege har informert pasienten om svaret. Den medisinsk genetiske avdelingen vil gi råd om eventuell oppfølging og testing av slektninger. Slektninger som får påvist genfeil vil få kontroller for tidlig diagnostikk og/eller forebygging av kreftsykdom som disse genene gir høy risiko for i henhold til gjeldende handlingsprogram, for eksempel brystkreft (BRCA1 eller BRCA 2), tarmkreft (Lynch syndrom (LS) med mutasjoner i mismatch repair (MMR) genene (MLH1, MSH2, MSH6, PMS2) eller EPCAM genet, Familiær adenomatøs polypose som skyldes feil i APC genet), eller eggstokk-kreft (BRCA1 eller BRCA 2, Lynch syndrom med mutasjoner i mismatch repair (MMR) genene MLH1, MSH2, MSH6, PMS2). Screening for pancreaskreft i høyrisikogrupper anbefales bare som ledd i forskningsprogram (Goggins et al., 2020). MR/MRCP og endoskopisk ultralydundersøkelse er de vanligst brukte modalitetene for screening.
Anbefalinger:
|
| Evidensgrad |
| Symptomer som kan gi mistanke om pancreaskreft bør i særlig grad vurderes hos pasienter som røyker, er overvektige, har ny-oppstått diabetes uten kjente risikofaktorer, har kronisk pankreatitt i sykehistorien, eller hvor det kan være mistanke om arvelig disposisjon. | C |
| Pasienter hvor det foreligger mistanke om arvelig risiko for pancreaskreft (på grunn av flere tilfeller av pancreaskreft og/eller andre krefttyper som malignt melanom, brystkreft eller prostatakreft), bør henvises til senter som kan gi klinisk genetisk veiledning og eventuelt utføre gentesting. Det samme gjelder ved kreftdiagnose i ung alder. | C |
Diagnose
Sammendrag av anbefalinger
|
| Evidensgrad |
| CT undersøkelse (m/«pancreas protokoll» og CT thorax og bekken) er basisundersøkelser i diagnostikk og utredning. | B |
| MR spesielt og EUS (eventuelt m/FNA) og PET-CT kan være nyttige supplerende undersøkelsesmodaliteter hos utvalgte pasienter. | B |
| ERCP er en terapeutisk prosedyre, og har ingen plass i diagnostikken av pancreaskreft. Prosedyren bør ikke gjøres før det er utført adekvat bildediagnostikk med CT pancreas. | D |
| Ved klinisk mistanke om sykdomstilbakefall utføres primært CT. Ved mistanke om lokoregionalt residiv anbefales «CT pancreas protokoll». | B |
| Diagnostisk laparoskopi i generell anestesi er kun aktuelt ved spesielle problemstillinger, og er ikke del av standard utredning. | B |
| Tumormarkører (CA 19‑9) har ingen plass i screening, og har liten diagnostisk verdi, men kan gi prognostisk informasjon, og være til nytte for monitorering av effekten av systemisk kjemoterapi. | B |
| Pre-operativ perkutan ultralydveiledet biopsi/cytologi av antatt pancreaskreft frarådes på grunn av risiko for implantasjonsmetastaser, og fordi undersøkelsen har lav sensitivitet. Hvis pre-operativ morfologisk diagnose anses som nødvendig, bør EUS-FNA foretrekkes. | C |
Symptomer
Sist faglig oppdatert: 05.07.2021
Symptomene er ofte vage (Bond-Smith et al., 2012; Schmidt-Hansen, Berendse, & Hamilton, 2016). Smertefri («stille») ikterus hos en pasient > 50–60 år er et alarmtegn som bør medføre videre utredning med tanke på pancreaskreft. I tillegg er en kombinasjon av vekttap og et av de mer uspesifikke symptomene nevnt nedenfor, en klinisk problemstilling som vil kreve nærmere utredning (Schmidt-Hansen et al., 2016). Mange pasienter (75–80 %) har avansert sykdom (enten lokoregionalt, eller i form av metastaser) allerede ved diagnosetidspunktet (Hidalgo, 2010; Simianu, Zyromski, Nakeeb, & Lillemoe, 2010). De vanligste symptomer og funn er:
| Symptom / funn | Forekomst |
|---|---|
| Ikterus | 70 % |
| Ufrivillig vekttap (> 5–10 %) | 50-90 % |
| Smerter | 75-80 % |
| Ernæringsproblemer | 50-75 % |
| Anoreksi | 15-40 % |
| Nyoppdaget diabetes mellitus (uten kjente risikofaktorer) | 15-40 % |
| Ascites | 5 % |
| Ventrikkelretensjon Akutt pankreatitt | 5 % 3 % |
Akutt «ideopatisk» pankreatitt hos pasienter > 50 år er også en situasjon hvor undersøkelse med tanke på pancreastumor bør overveies.
Utredning
Sist faglig oppdatert: 05.07.2021
Utredningen skal sannsynliggjøre diagnosen og avklare lokalisasjon, størrelse og utbredelse av primærtumor og om det foreligger metastaser. Bildediagnostikken danner grunnlaget for å vurdere om kirurgisk behandling med kurativ intensjon er mulig, men framskaffer også viktig informasjon i forhold til andre behandlingsvalg (Michl, Pauls, & Gress, 2006).
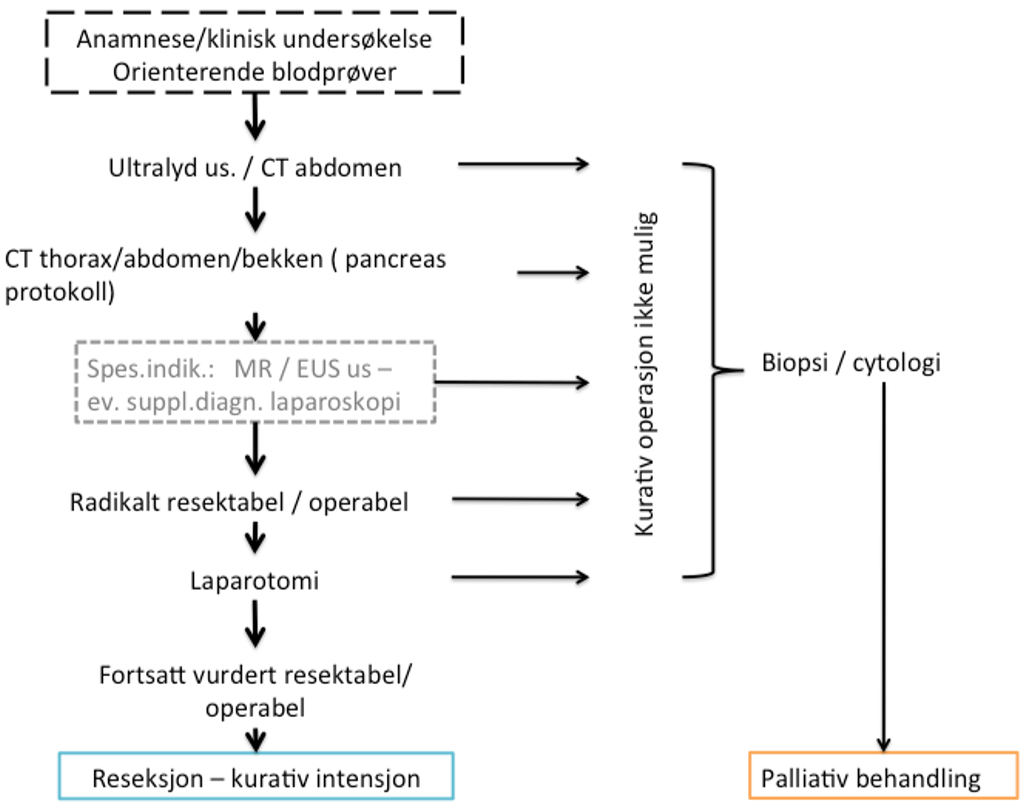
Ved sterk klinisk mistanke om pancreaskreft skal det utføres dedikert CT pancreas, og samtidig CT thorax og bekken for kartlegging av eventuelle fjernmetastaser (Al-Hawary et al., 2014). I mange tilfeller kan pasienten ha presentert seg med uspesifikke symptomer i øvre abdomen, og det kan primært være utført andre typer undersøkelser, som CT abdomen i én fase (portovenøs fase), ultralyd eller MRCP. Ved funn av tumor eller tumorsuspekte funn på CT abdomen, ultralyd eller MRCP skal det gjøres supplerende diagnostikk og preoperativ kartlegging med dedikert CT pancreas, med mindre pasienten av ulike årsaker ikke er aktuell for operativt inngrep med kurativ intensjon (Al-Hawary et al., 2014).
Både CT og MR har stor treffsikkerhet for diagnostikk og lokoregional stadieinndeling ved pancreaskreft. CT pancreas er referansemodalitet fordi den gir best kartlegging av relevante blodkar (Horton & Fishman, 2002; Zhao et al., 2009). MR pancreas kan benyttes ved kontraindikasjoner mot CT med kontrast (kontrastallergi). MR er et viktig supplement til CT når mistenkt tumor ikke er synlig på CT, ved uavklarte leverlesjoner og når CT-funnene ikke entydig kan skille pancreaskreft fra andre differensialdiagnoser (Schima, Ba-Ssalamah, Goetzinger, Scharitzer, & Koelblinger, 2007). MR brukes også ved utredning av cystiske pancreaslesjoner (NGICG-HPB, 2019).
For diagnostikk og stadieinndeling: «CT Pancreas protokoll» inkluderer CT Pancreas (2 fase) + resten av abdomen/bekken og CT thorax (Al-Hawary et al., 2014; Horton & Fishman, 2002; Wong & Raman, 2010):
Tumordeteksjon er best i pancreas-parenkymfase ved ca. 40-50 sekunder, mens levermetastaser detekteres best i portovenøs fase ved ca. 70–80 sekunder. Begge faser er viktige for lokal resektabilitetsvurdering. Det er viktig med nok kontrast, ca. 150–180 ml, flow ca. 4 ml/s, og at kontrastmengden kan justeres etter vekt og habitus. Undersøkelsen utføres i multidetektor skanner med helicalt volumopptak med tynne sub-mm snitt. Datasettet kan overføres til egen tolkningsenhet for postprosessering for ulike bilderekonstruksjoner av mesenterialkar og gallegang/pancreasgang. Dokumentasjon med lagring av tynne snitt eller standard 2-3 mm reformater blir så overført til PACS. Ved tilsendte bilder, er det viktig at de tynne sub-mm snittene overføres rekvirende sykehus. To‑faseundersøkelse gir tilfredsstillende kartlegging av karanatomien. Dual energy CT kan bl.a. gi bedre deteksjon ved å gjøre subtile pancreaslesjoner bedre synlig og gi bedre vevskarakterisering (George, Wortman, Fulwadhva, Uyeda, & Sodickson, 2017), men er ikke etablert standard ved preoperativ utredning.
Mål for undersøkelsen er:
- Tumordiagnostikk – typisk adenokarsinom eller annet?
- Radiologisk TNM klassifisering
- Karaffeksjon
Duktalt adenokarsinom er typisk karfattig. Både tumor og eventuelle levermetastaser er vanligvis hypodense i forhold til normalt kontrastladende parenkym. Noen få (< 10 %) av adenokarsinomene i pancreas er isodense, og skiller seg ikke fra pancreasparenkymet på CT (Kim et al., 2010). Selv om det ikke identifiseres en sikker lesjon ved CT, kan sekundære forandringer gi mistanke om tumor; slik som dilatasjon av gallegang og pancreasgang, abrupt stenose i pancreasgangen, parenkymatrofi, endret ytre kontur eller tap av lobulering.
Dual energy CT kan gi økt deteksjon (George et al., 2017), og MR og/eller EUS kan være avklarende (Fusaroli, Kypraios, Eloubeidi, & Caletti, 2012; Schima et al., 2007) når tumor ikke er identifisert på CT.
Resektabilitetsvurdering. Se under kapittelet «Kirurgi og vurdering av resektabilitet».
Viktige radiologiske funn i vurderingen av lokal resektabilitet er (Al-Hawary et al., 2014)
- Lokalisasjon og størrelse av tumor.
- Tumors relasjon til omgivende fettvev, organer og blodkar.
- Relasjon til vener og arterier (truncus coeliacus, a. mesenterica superior, a. hepatica communis/propria, v. mesenterica superior, v. portae, aorta, vena cava) skal vurderes spesielt. Karaffeksjon bør beskrives med grad av affeksjon: formendring, okklusjon, tumorkontakt < eller > 180 grader av karets omkrets og lengdeutstrekning i cm, og eventuell avstand fra veneaffeksjon til de proksimale jejunal- og ilealvener (dvs. om det foreligger venestamme proksimalt og distalt på v. mesenterica superior/v. portae som muliggjør venerekonstruksjon).
- Avvik fra normal anatomi (galleveier, blodkar).
Metastaser er vanligst til lymfeknuter, lever og peritoneum, og er ofte små. Ved usikre funn i lever og tvil om levermetastaser hos pasient med ellers resektabel tumor skal det være lav terskel for å gjøre MR lever (Schima et al., 2007). Ved kontraindikasjon mot MR kan gjøres kontrastforsterket ultralyd (Callery et al., 2009). Det er generelt vanskelig å skille mellom metastatiske og reaktive lymfeknuter. Likevel er det viktig å beskrive grad av bildemessig mistanke om malignitet, om lymfeknutene er lokalisert peripancreatisk eller ikke (i eller utenfor reseksjonsområdet). Ved tvil om peritoneale metastaser vurderes laparoskopi (Allen, Gurusamy, Takwoingi, Kalia, & Davidson, 2013).
Studier har vist fordeler ved å benytte en strukturert rapport/standardmal ved beskrivelse av pancreaskreft for en standardisert beskrivelse av tumor og for å sikre at man har vurdert og rapportert alle relevante funn som har betydning for staging og eventuell planlegging av kirurgi (Al-Hawary et al., 2014; Dimarco et al., 2020). Av tekniske årsaker kan det være vanskelig å få slike maler inn i PACS/RIS, men standardmalen kan i tilfelle gjerne brukes som huskeliste slik at alle relevante momenter vurderes og beskrives i friteksten. Se addendum «Forslag til mal for strukturert radiologi rapport av adenokarsinom i pancreas».
Radiologivurdering etter gjennomgått neoadjuvant behandling. Se under kapittel «Radiologi etter gjennomgått kjemoterapi».
Andre modaliteter
Sist faglig oppdatert: 05.07.2021
Endoskopisk ultralyd (EUS) kan gi en god oversikt over hele pancreas, og kan være nyttig for påvisning og avklaring av mindre svulster (Cascinu, Falconi, Valentini, & Jelic, 2010; Majumder, Chubineh, & Birk, 2012). Pre-operativ vevsdiagnostikk/cytologi er vanligvis ikke indisert hos pasienter som er kandidater for direkte «radikal-kirurgi» for antatt adenokarsinom i pancreas basert på adekvat bildediagnostikk (Asbun et al., 2014). I sjeldne tilfeller kan morfologisk avklaring være ønskelig (mistanke om lymfom, annen atypisk primær tumor, eller autoimmun pankreatitt (AIP) type 2). EUS-FNA/FNB kan være aktuelt for å avklare slike usikre lesjoner (Dumonceau et al., 2017; Hewitt et al., 2012). EUS-FNA er også anvendelig for å sikre morfologisk materiale før oppstart av palliativ kjemoterapi, eller der morfologisk diagnose er nødvendig før oppstart av neoadjuvant kjemoterapi (Dumonceau et al., 2017).
Finnålsaspirasjon (FNA) for cytologi kan gjøres med lineært EUS endoskop, med en høy spesifisitet (98 %) og god sensitivitet (85 %), og en komplikasjonsfrekvens på under 3 % (Majumder et al., 2012). Et positivt resultat er å stole på, mens en negativ prøve ikke sikkert kan utelukke kreft eller annet neoplasme i pancreas (Brugge et al., 2014). Tynne punksjonsnåler (22-25 G) gir vanligvis gode prøver for morfologisk vurdering (Madhoun et al., 2013). Tilstedeværelse av cytopatolog i forbindelse med EUS prosedyren, som kan bekrefte at materialet er adekvat, vil øke presisjonen ytterligere. Dersom cytolog ikke er tilgjengelig kan primær FNB med prøve på formalin være å foretrekke. FNB vil også kunne være et viktig supplement hvis det er problematisk å få sikkert diagnostisk materiale ved FNA. Ved negativ FNA/FNB og sterk mistanke om malign sykdom bør prosedyren gjentas.
PET-CT sin plass i utredning av pancreaskreft er fortsatt under utvikling og bruken er uavklart. PET-CT kan vurderes som supplerende undersøkelse med tanke på fjernmetastaser hos pasienter med potensielt resektabel sykdom, men hvor andre indikatorer tilsier høy risiko for metastatisk sykdom, som betydelig forhøyet CA 19-9, stor primærtumor og store regionale lymfeknuter (Network, 2020).
Endoskopisk retrograd cholangio-pancreatografi (ERCP) har liten plass i diagnostisk sammenheng, men brukes først og fremst for avlasting av galleveiene. Hos pasienter som utredes med tanke på kurativ kirurgi, er det viktig for kvaliteten av bildediagnostikken at CT undersøkelsen gjennomføres før en ERCP-prosedyre med eventuell endoskopisk stentinnleggelse. ERCP-prosedyren kan gi inflammasjon og maskere tumor, og dermed gjøre det umulig å bestemme sykdomsstadium for pasienten i ettertid. Endoskopisk galleavlastning med stent gjøres oftest i palliativ hensikt, enten på grunn av symptomer (ikterus m/uttalt kløe), ved akutt kolangitt eller for å redusere s-bilirubin (fortrinnsvis < 50 µmol/L) og bedre leverfunksjonen før man kan starte palliativ kjemoterapi. Med hensyn til galledrenasje av pasienter som er aktuelle for operativ behandling, se eget avsnittet om «Perioperative tiltak».
Percutan transhepatisk cholangiografi (PTC) med drenasje eller EUS veiledet galledrenasje er en alternativ tilnærming hvis endoskopisk tilgang med tanke på drenasje mislykkes eller er vanskelig.
Perkutan biopsi/cytologi for morfologisk bekreftelse av malign sykdom i primærtumor eller metastase er nødvendig hos pasienter som ikke er operable før oppstart av kjemoterapi eller strålebehandling (Amin et al., 2006). Resektable svulster opereres vanligvis basert på bildediagnostikk, uten perkutan vevsprøve (Asbun et al., 2014). Perkutan biopsi skal også unngås hvis det skal gis kjemoterapi før ny resektabilitetsvurdering på grunn av risiko for implantasjonsmetastaser. Man bør i slike tilfeller velge EUS med FNA/FNB.
Residiv av pancreaskreft: Ved klinisk mistanke om sykdomstilbakefall utføres primært CT (Yamauchi et al., 2012). Det er ikke etablert standard teknikk ved spørsmål om residiv. CT-undersøkelse i portovenøs fase vil framstille eventuelle metastaser og vanligvis også lokoregionalt tumorresidiv, men CT pancreas kan noen ganger gi bedre framstilling om tumorvevet er bedre synlig i pancreas-parenkymfase. Andre undersøkelser som er nevnt ovenfor må vurderes på bakgrunn av symptomer og klinisk problemstilling.
Pre-operativ laparoskopi
Sist faglig oppdatert: 05.07.2021
Nytten av pre-operativ laparoskopisk evaluering, med eller uten laparoskopisk ultralyd, diskuteres. Hensikten er å unngå «ikke-terapeutiske laparotomier» hos pasienter som viser seg å ha inoperabel sykdom, men hvor den preoperative bildediagnostikken ikke har avdekket avansertert lokoregional tumorvekst, peritoneal karsinomatose eller levermetastaser. Laparoskopi er bare aktuelt hos selekterte pasienter ved sterk mistanke om disseminert sykdom (høye CA 19-9 verdier, usikre CT/MR funn), da klinisk nytte av rutinemessig laparoskopi hos alle pasienter med antatt resektabel pancreaskreft ikke står i forhold til risiko og omkostninger (Garcea et al., 2012; Mayo et al., 2009; Slaar et al., 2011).
Blodprøver – tumormarkører
Sist faglig oppdatert: 05.07.2021
Klinisk nytte av tumormarkører (CA 19‑9, Kromogranin A [CgA], CEA) ved utredning av pancreassvulster er omdiskutert (Ballehaninna & Chamberlain, 2012). Forhøyede CA 19‑9 verdier kan forekomme ved alle typer galleveisobstruksjon/ikterus, kronisk pankreatitt, og ved kreft i galleveier eller andre steder i GI traktus (Ballehaninna & Chamberlain, 2012; Katz et al., 2010). CA 19-9 er derfor ikke egnet som en screeningtest eller for diagnostisering av pancreaskreft (Ballehaninna & Chamberlain, 2012). Prøven kan gi noe prognostisk informasjon (Ballehaninna & Chamberlain, 2012; Hartwig et al., 2013) og være til nytte ved monitorering av effekten av systemisk behandling (Ballehaninna & Chamberlain, 2012; Locker et al., 2006). CgA er en tumormarkør for nevroendokrine svulster (Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av nevroendokrine svulster i fordøyelsessystemet, 2020).
Differensialdiagnostikk
Sist faglig oppdatert: 05.07.2021
Kronisk fokal pankreatitt, «mass-forming» pankreatitt kan være svært vanskelig å skille fra adenokarsinom ved alle modaliteter (Low, Panu, Millo, & Leen, 2011), men MR kan avklare noen (Fattahi et al., 2009). Dual energy CT kan også være nyttig (Yin et al., 2015).
Autoimmun pankreatitt (AIP) er en type kronisk pankreatitt assosiert med autoimmun inflammatorisk prosess, og klassifiseres i to undertyper (Shimosegawa et al., 2011). Type 1 er en IgG4-relatert systemisk sykdom som ofte kan ha ekstrapancreatisk affeksjon. Type 2 involverer kun pancreas og er IgG4-negativ. Type 2 rammer oftere yngre pasienter enn type 1, og er også assosiert med IBD, særlig ulcerøs colitt. Autoimmun pankreatitt kan gi generell eller fokal affeksjon av pancreas og viser seg bildemessig oftest med en generelt forstørret pancreas, men forandringen kan være fokal (Maillette de Buy Wenniger, Rauws, & Beuers, 2012), og den fokale typen er særlig vanskelig å skille fra pancreaskreft bildemessig. Typiske bildefunn er generell eller fokal forstørrelse av pancreas, tap av normal lobulær kontur, forsinket kontrastopptak, uregelmessig pancreasgang, peripankreatisk «stranding» og en lavattenuerende «kapsel» (Lee et al., 2009). Behandlingsstrategien bygger på en samlet vurdering av klinikk, IgG4-serologi, bildediagnostikk og eventuelt EUS med FNA/FNB (S. H. Moon & Kim, 2012; S.H. Moon et al., 2008; Takuma et al., 2012).
Paraduodenal pankreatitt («groove pancreatitis») eller cystisk duodenal dystrofi (Manzelli et al., 2011), er en uvanlig form for segmental kronisk pankreatitt, og involverer furen mellom mediale duodenalvegg og pancreas. Typisk er cystiske forandringer i duodenalveggen, fortykkelse av duodenalvegg og en hypodens oppfylling mellom duodenum og caput pancreatis. Supplerende MR kan være nyttig (Manzelli et al., 2011).
Nevroendokrine svulster (NET): Hormonproduserende svulster er oftest små, mens de store svulstene er mindre endokrint aktive. Store nevroendokrine svulster er ofte mer høygradig maligne. Typisk er hypervaskulære lesjoner og metastaser (sen arteriefase viktig ved CT), eventuelt med kalk. Cystiske komponenter kan forekomme. Utredning biokjemisk/ endokrinologisk (Insulinom? Gastrinom? Glucagonom? etc.) er viktig avhengig av kliniske symptomer, og CgA er en nyttig tumormarkør (Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av nevroendokrine svulster i fordøyelsessystemet, 2020). Nucleærmedisinsk undersøkelse (Octreotid scintigrafi, Ga-DOTATOC PET, og eventuelt FDG-PET) hører med til utredningen. Behandlingen er vanligvis individuelt tilpasset, og sammensatt (Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av nevroendokrine svulster i fordøyelsessystemet, 2020).
Andre periampullære neoplasmer som kreft i ampulla Vateri, i duodenum, og i distale gallegang, kan være vanskelige å skille fra hverandre med bildediagnostikk.
Andre sjeldne pancreasneoplasmer kan være solid pseudopapillært neoplasme (SPPN) (unge kvinner), pancreaticoblastom (barn), anaplastisk karsinom (blødning og nekrose), acinærcelle karsinom (stor tumor, fettvevsnekrose). Primært sarkom i pancreas er ekstremt sjelden.
Metastaser til pancreas er sjeldne. Nyre, mamma, lunge, kolon, ventrikkel og melanom er vanligste utgangspunkt.
Lymfom er sjelden i pancreas, men viktig å ha i mente siden det ikke er en kirurgisk tilstand.
Inndeling i stadier
TNM klassifikasjon
Sist faglig oppdatert: 05.07.2021
Basert på 8. utgave av TNM-klassifikasjonen (TNM Classification of Malignant Tumours, 8th Edition, 2017).
Karsinomer utgående fra pancreas
| pTx | Tumor, ingen informasjon |
| pT0 | Tumor ikke påvist |
| pTis | Carcinoma in situ (inkluderer PanIN-III) |
| pT1a | Tumors største diameter ≤ 0.5 cm |
| pT1b | Tumors største diameter > 0.5 cm - ≤ 1 cm |
| pT1a | Tumors største diameter > 1 cm- ≤ 2 cm |
| pT2 | Tumors største diameter > 2 cm ≤ 4 cm |
| pT3 | Tumors største diameter > 4 cm |
| pT4 | Tumorvekst med affeksjon av truncus coeliacus eller a. mesenterica superior |
| pNx | Ingen informasjon |
| pN0 | Ingen metastaser i regionale lymfeknuter |
| pN1 pN2 | Metastaser i 1-3 regionale lymfeknuter Metastaser i ≥ 4 regionale lymfeknuter |
| pM0 | Ingen fjernmetastaser |
| pM1 | Fjernmetastaser påvist |
Stadieinndeling:
| Stadium | T | N | M |
|---|---|---|---|
| 0 | is | 0 | 0 |
| IA | 1 | 0 | 0 |
| IB | 2 | 0 | 0 |
| IIA | 3 | 0 | 0 |
| IIB | 1,2,3 | N1 | 0 |
| III | 4 (enhver N) | N2 (T1, 2, 3) | 0 |
| IV | enhver | enhver | 1 |
Karsinomer utgående fra ekstrahepatisk gallegang – distal
| pTx | Tumor, ingen informasjon |
| pT0 | Tumor ikke påvist |
| pTis | Carcinoma in situ |
| pT1 | Tumor infiltrerer gallegangen < 5 mm |
| pT2 | Tumor infiltrerer gallegangen 5 mm - ≤ 12 mm |
| pT3 | Tumor infiltrerer gallegangen > 12 mm |
| pT4 | Tumorvekst med affeksjon av truncus coeliacus eller a. mesenterica superior |
| pNx | Ingen informasjon |
| pN0 | Ingen metastaser i regionale lymfeknuter |
| pN1 | Metastaser i 1-3 regionale lymfeknuter |
| pN2 | Metastaser i ≥ 4 regionale lymfeknuter |
| pM0 | Ingen fjernmetastaser |
| pM1 | Fjernmetastaser påvist |
Karsinomer utgående fra Ampulla Vaterii
| pTx | Tumor, ingen informasjon |
| pT0 | Tumor ikke påvist |
| pTis | Carcinoma in situ |
| pT1 | Tumor begrenset til ampulla Vateri eller sphincter Oddii |
| pT2 | Tumor infiltrerer duodenalveggen forbi sphincter of Oddi og/eller innvekst i duodenal submucosa |
| pT3a | Tumor infiltrerer pancreas ≤ 0.5 cm |
| pT3b | Tumor infiltrerer pancreas > 0.5 cm, eller innvekst i peripancreatisk vev eller duodenal serosa |
| pT4 | Tumor infiltrerer peripankreatisk vev, tilgrensende organer eller strukturer |
| pNx | Ingen informasjon |
| pN0 | Ingen metastaser i regionale lymfeknuter |
| pN1 | Metastaser i 1-2 regionale lymfeknuter |
| pN2 | Metastaser i ≥ 3 regionale lymfeknuter |
| pM0 | Ingen fjernmetastaser |
| pM1 | Fjernmetastaser påvist |
Behandling av lokalisert sykdom / kurativ behandling
Sist faglig oppdatert: 05.07.2021
Utredning, vurdering og behandling av pancreaskreftpasienter bør foregå på sentra med adekvat spesialkompetanse som samarbeider i multidisiplinære team, og som har døgnkontinuerlig kompetent vakt innen alle fagområder som er involvert i behandlingen.
Kirurgi
Sist faglig oppdatert: 05.07.2021
Vurdering av resektabilitet
Faktorer som bidrar til den relativt lave reseksjonsraten ved pancreaskreft er hyppig forekomst av lymfeknutemetastaser «lokalt», men likevel utenfor reseksjonsområdet, og tumorinvasjon i det retroperitoneale rom. Affeksjon av sentrale kar, først og fremst av a. mesenterica superior og coeliaca-aksen, er også uttrykk for lokalavansert sykdom. Det er internasjonal enighet om at svulstaffeksjon av disse to karene er å oppfatte som en generell kontraindikasjon mot reseksjon (Mollberg et al., 2011). Arteriereseksjoner kan derfor bare helt unntaksvis anbefales, og da som ledd i kontrollerte studier. Svulster i corpus med begrenset affeksjon av truncus coeliacus kan i selekterte tilfeller vurderes for Applebys operasjon (Klompmaker et al., 2018). En begrenset affeksjon av a.hepatica, og da oftest ved avgangen av a. gastroduodenale, er ingen kontraindikasjon mot operasjon (Callery et al., 2009; Kleive et al., 2018; Mollberg et al., 2011).
Graden av karaffeksjon av v. portae og v.mesenterica superior må bedømmes individuelt. Pancreasreseksjon med reseksjon av v.portae og/eller v.mesenterica superior kan gjøres med samme overlevelse som hos opererte pasienter uten venereseksjon (Kleive et al., 2017; Leach et al., 1998; Tseng et al., 2004; Zhou, Zhang, Liu, Li, & Xu, 2012). En stor amerikansk populasjonsbasert studie viste at andelen pancreasreseksjoner med samtidig karreseksjon økte fra 0.7 % i 2000 til 6.0 % i 2009. Postoperative komplikasjoner var hyppigere etter karreseksjon, selv om den postoperative mortaliteten var den samme (Worni et al., 2013). Affeksjon av v.portae/v. mesenterica superior er ingen kontraindikasjon mot operasjon hvis det foreligger en proksimal og distal venestamme som muliggjør venerekonstruksjon (Kleive et al., 2017). Karkirurgisk kompetanse er nødvendig. Etter reseksjon av affisert kar med tumorfrie reseksjonsrender gjøres rekonstruksjon; enten som en primær kar-anastomose (Wang et al., 2012) eller med bruk av graft (autologt graft, allograft, syntetisk graft) (Labori et al., 2020).
Internasjonalt inndeles ikke-metastatisk pancreaskreft i primært resektabel, borderline resektabel og lokalavansert tumor i henhold til National Comprehensive Cancer Network (NCCN) sine definisjoner som er basert på radiologi (CT) (Bockhorn et al., 2014; Ducreux et al., 2015; Network, 2020).
Resektabilitetskriterier ved pancreaskreft i henhold til National Comprehensive Cancer Network). Versjon 1.2020 (Network, 2020)
| Resektabilitets status | Arterieside | Venøs side |
|---|---|---|
| Resektabel | Ingen tumorkontakt med arterier [(truncus coeliacus (TC), a.mesenterica superior (AMS) eller a.hepatica communis (AHC)]. | Ingen tumorkontakt med v. mesenterica superior (VMS) eller v.portae (VP) eller ≤ 180⁰ kontakt uten uregelmessighet i venekontur. |
| Borderline resektabel | Caput/processus uncinatus:
Corpus/cauda pankreatis:
|
|
| Lokalavansert | Caput/processus uncinatus:
Corpus / cauda pankreatis:
|
|
Primær operativ behandling
Kirurgi er basis for kurativ behandling av pancreaskreft, men kun en mindre andel (< 15–20 %) av pasientene har resektabel sykdom på diagnosetidspunktet (Bjerregaard et al., 2013; Simianu et al., 2010; Vincent et al., 2011). Siden de aller fleste resektable svulstene er lokalisert til caput pancreatis, vil operativ behandling vanligvis innebære en pancreatoduodenectomi (Whipple’s operasjon). Dette er en omfattende operasjon (Kleive et al., 2017; Marangoni, Morris-Stiff, Deshmukh, Hakeem, & Smith, 2012) og hensyn til pasientens alder, komorbiditet, allmentilstand og eget ønske, er viktig i vurderingen av behandlingsopplegget. I løpet av det siste tiåret har endringer rundt den tekniske gjennomføring av inngrepet og den perioperative overvåkning bidradd til bedre resultater. Median operasjonstid er omkring 5 timer, og det postoperative sykehusoppholdet er median 10 dager (Kleive et al., 2017; Nymo et al., 2020).
Typer av periampullære svulster
Å skille mellom de ulike typer periampullære kreftsvulster både pre- og peroperativt er vanskelig. Kirurgi er basis for kurativ behandling av periampullære svulster. Prognosen for duodenalkreft og ampullecancer er betydelig bedre enn for duktalt adenokarsinom i pancreas (He et al., 2014). Intrapancreatisk distalt kolangiokarsinom har også en bedre prognose, og det synes viktig å identifisere disse (Deshpande et al., 2016). En aktiv holdning til reseksjon av periampullære kreftsvulster kan bidra til at man ikke underbehandler og avslår kirurgi hos pasienter med svulster som har et annet utgangspunkt, der prognosen er betydelig bedre.
Operasjonsmetoder
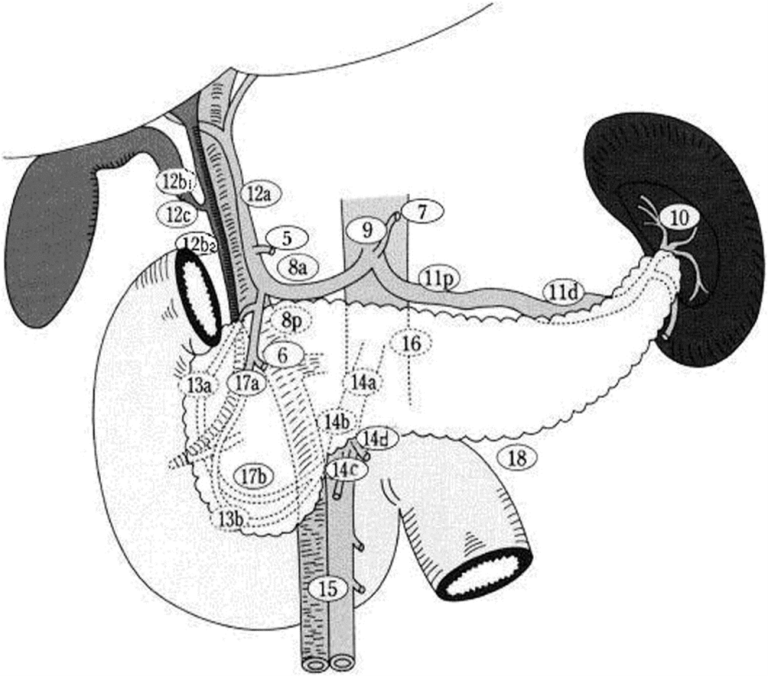
Da de aller fleste resektable adenokarsinomer er lokalisert til caputdelen av pancreas, fokuserer vi først og fremst på operasjon for disse svulstene. Pancreatoduodenectomi, slik denne operasjonen ble presentert i 1935 (Whipple, Parsons, & Mullins, 1935), omfatter reseksjon av caput pancreatis, reseksjon av ventrikkelens distale del (antrum), og i tillegg reseksjon av duodenum og første del (ca. 10–15 cm) av jejunum. Kolecystektomi og reseksjon av distale gallegang hører også med (Christians, Tsai, Tolat, & Evans, 2013). Uansett operasjonsmetode, er det viktig å få med lymfeknuter rundt pancreasresektatet, noe som er av betydning for den postoperative stadievurderingen. Standard reseksjon av caput pankreatis omfatter disseksjon av lymfeknuter over og under pylorus (stasjon 5, 6), på høyre side av ligamentum hepatoduodenale (stasjon 12b1, 12b2 og 12c), de bakre pancreaticoduodenale lymfeknuter (13a, 13b), lymfeknuter på høyre side av a.mesenterica superior (14a, 14b), de fremre pancreaticoduodenale lymfeknuter (17a, 17b) og lymfeknuter foran a.hepatica communis (8a) (Figur 3) (J. A. Tol et al., 2014). Derimot er det ikke vist at en utvidet lymfeknutedisseksjon utover dette gir gevinst i form av bedret langtidsoverlevelse (Michalski et al., 2007).
Ved pancreatoduodenectomi bør første transeksjon av gallegang og pankreas tilstrebes utført gjennom makroskopisk vurdert «tumorfritt» parenkym for å oppnå negative reseksjonsrender. Frysesnitt fra reseksjonsranden kan vurderes, men anses ikke obligat fordi det er omdiskutert om rereseksjon og endring fra R1 til RO status øker overlevelsen (Petrucciani et al., 2016). Hvis det tas frysesnitt skal fortsatt reseksjon til friskt vev vurderes ved R1, men det bør ikke gå på bekostning av makroskopisk vurdert normalt pankreasvev eller gallegang. R1 status forekommer hyppigst i reseksjonsranden mot a.mesenterica superior. Periadventitial disseksjon rundt arterien skal derfor tilstrebes.
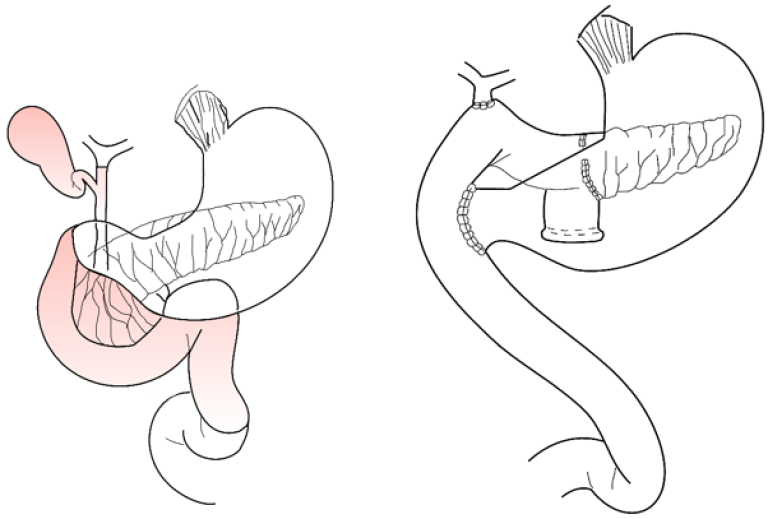
Ved pancreatoduodenectomi re-etableres gastrointestinal kontinuitet ved anastomose mellom henholdsvis rest-pancreas (pancreaticojejunostomi), gallegang (hepaticojejunostomi) og ventrikkel/duodenalrest (gastro-/duodenojejunostomi) til jejunum (Figur 4). Etter at Traverso og Longmire introduserte pylorusbevarende pancreatoduodenectomi (PPPD) i 1978 (Traverso & Longmire, 1978), har denne modifikasjonen blitt vanlig i mange sentra. Hele ventrikkelen med pylorus bevares, og man setter av duodeneum ca 2 cm distalt for pylorus (Figur 4). En metaanalyse basert på 7 randomiserte studier viste ingen forskjell i perioperativ mortalitet, morbiditet og frekvensen av ventrikkel-retensjon ved PPPD vs. klassisk pancreatoduodenectomi. De onkologiske langtidsresultater var lik, men man fant en kortere operasjonstid og mindre peroperativ blødning ved PPPD (Huttner et al., 2016).
Total pancreatektomi kan være nødvendig i enkelte tilfeller. Om tumor er lokalisert til corpus eller cauda pancreatis, er distal pancreasreseksjon med disseksjon av lymfeknutestasjon 10, 11 og 18 og splenektomi aktuelt (J. A. Tol et al., 2014). Adenokarsinomer lokalisert til distale del av pancreas er sjeldnere, og på grunn av lokal tumorvekst og sykdomsutbredelse ved diagnosetidspunktet hos disse pasientene er det enda sjeldnere at kurativ operativ behandling er mulig. Laparoskopisk distal pancreatectomi med splenektomi kan gjøres hos selekterte pasienter med antatt pancreaskreft, og på kort sikt vil pasientene erfare de samme gevinster som laparoskopisk tilgang generelt gir (van Hilst et al., 2019). Det foreligger ingen randomiserte studier over langtidsoverlevelse etter åpen vs. laparoskopisk operasjon for duktale adenokarsinomer i pancreas (van Hilst et al., 2019).
Komplikasjoner
Pancreaskirurgi kan anses som en relativt trygg behandling, med en postoperativ mortalitet på 2–5 %. Postoperative komplikasjoner er hyppig og forekommer hos 30–50 % av pasientene (Datta & Vollmer, 2016; Dudekula, Munigala, Zureikat, & Yadav, 2016; Hoem & Viste, 2012; Kleive et al., 2017; J. A. Søreide, Sandvik, & Søreide, 2016).
De vanligste kirurgiske komplikasjoner etter pancreatoduodenectomier er :
- Forsinket postoperativ ventrikkeltømning (10-15 %) (Kunstman et al., 2012)
- Pancreasfistel (5-15 %) (Bassi et al., 2005; Kleive et al., 2017)
- Blødning (5-7 %) (Correa-Gallego et al., 2012; Kleive et al., 2017)
- Sårinfeksjon (3-11 %)
- Intraabdominal abscess (1-4 %)
De vanligste kirurgiske komplikasjoner etter distale pankreasreseksjoner er (van Hilst et al., 2019):
- Pancreasfistel (15-20 %)
- Blødning (3-5 %)
- Forsinket postoperativ ventrikkeltømning (2-7 %)
- Sårinfeksjon (1-4 %)
- Intraabdominal abscess (1-4 %)
De aller fleste komplikasjoner kan takles med konservative tiltak, eller ved hjelp av intervensjonsradiologi og endoskopi. Reoperasjonsfrekvens etter pancreatoduodenectomi varierer og er ved norske sykehus 10-14 % (Kleive et al., 2017; Nymo et al., 2020).
Målet for kirurgisk behandling er å bedre overlevelsen. Selv etter antatt radikal kirurgi for pancreaskreft er prognosen alvorlig. Nyere nasjonale (Hoem & Viste, 2012; Labori et al., 2016) og internasjonale (Huang et al., 2018) populasjonsbaserte studier angir en 5-års overlevelse på mellom 6–20 %. Flere faktorer, som for eksempel alder, ASA grad, påvisning av lymfeknutemetastaser og ufrie reseksjonsrender, samt type og alvorlighetsgrad av postoperative komplikasjoner, spiller alle en rolle for prognosen både på kort og lengre sikt (Eeson et al., 2012; Westgaard et al., 2009). På bakgrunn av slik kunnskap, er det viktig å differensiere den prognostiske informasjonen til pasienten.
Perioperative tiltak
Pre-operativ rutinemessig galleavlastning hos ikteriske pasienter er ikke indisert (Dumonceau et al., 2018; van der Gaag et al., 2010) . Dette må vurderes på spesifikke og individuelle indikasjoner. Enhver pre-operativ manipulering i galleveier øker risikoen for infeksjon og post ERCP pankreatitt, og infeksjonskomplikasjoner postoperativt (Dumonceau et al., 2018; van der Gaag et al., 2010). På den annen side vil ekstrahepatisk galleveisokklusjon kunne kompromittere leverfunksjonen, og konsekvenser av eventuelt nedsatt leverfunksjon må veies opp mot mulige komplikasjoner av invasiv galleavlastning. Hos ikteriske pasienter som utredes for mistenkt pancreaskreft er det derfor viktig at adekvat pre-operativ utredning med adekvat bildediagnostikk gjennomføres innen om lag en uke, slik at pasienten kan tilbys tidlig operasjon.
Kolangitt er en klar indikasjon for pre-operativ galleavlastning (Dumonceau et al., 2018). Mange vil også vurdere avlastning om s-bilirubin er > 250 µmol/L hvis pasienten av ulike årsaker ikke kan bli operert innen 1-2 uker, fordi risikoen for postoperativ leversvikt øker med høye bilirubinverdier. En studie har vist at s-bilirubin hos ikterisk pasient stiger med cirka 100 enheter per uke i påvente av operasjon (Mansfield et al., 2006). Hvis pasienten i påvente av operasjon har betydelige plager av ikterus med kløe og i tillegg stigende s-bilirubin verdier, styrkes indikasjonen for galleavlastning. Galleavlastning bør uansett ikke utføres før adekvat bildeundersøkelse (CT pancreas protokoll 2 fase) er utført. En slik rekkefølge kan også få betydning for bl.a. valg av stenttype som anvendes for avlastning. Hvis det er utført preoperativ galleavlastning vil operativ behandling bli planlagt i løpet av 2-4 uker etter prosedyren. Ved langvarig ikterus kan det foreligge malabsorpsjon og vitamin K mangel, og vitamin K bør gis før operasjonen for å unngå blødningstendens.
«Enhanced recovery after surgery» (ERAS) prinsipper for pancreaskirurgi bør følges for å sikre et et systematisert og optimalisert perioperativt forløp (Melloul et al., 2020). Tromboseprofylakse og adekvat antibiotika profylakse er viktig i relasjon til operativ behandling av pancreaskreft. Som tromboseprofylakse anbefales lav molekyklært heparin som bør gis i 28 dager etter operasjonen (Melloul et al., 2020). Som anibiotikaprofylakse anbefales Doksysyklin p.o./i.v. 400 mg og Metronidazol 1 g p.o./i.v. (Helsedirektoratet, 2020). Det er vanlig å gi protonpumpehemmer (PPI) under det postoperative sykehusoppholdet. Prevalensen av eksokrin pankreasinsufficiens er 70-100 % etter pancreatoduodenectomi och 0–42 % efter distal pankreatektomi (Sabater et al., 2016). Mange anbefaler derfor rutinemessig postoperativ enzymsubstitisjon (Creon 25000™; 1–2 kapsler til hvert måltid) for de nærmeste 3 måneder (Gianotti et al., 2018). Dette bør kontinueres ved behov, og i tilstrekkelige doser, for å unngå symptomer på og følger av eksokrin pancreasinsuffisiens. I tillegg bør man etter klassisk pancreatoduodenectomi hvor det er gjort antrumreseksjon sikre oppfølging og behandling med hensyn på vitamin B12 .
Profylakse med octreotid (Sandostatin ™ - en syntetisk somatostatin analog) for å redusere risikoen for postoperativ komplikasjoner etter pancreaskirurgi har vært mye benyttet, men er omdiskutert og brukes ikke rutinemessig (Adiamah et al., 2019; K. Søreide & Labori, 2016).
De fleste bruker 1–2 abdominale dren etter operasjon for pancreaskreft. Tidlig fjerning av dren er viktig (senest innen 3.-4. postoperative dag), da dette reduserer risikoen for intra-abdominal infeksjon og pancreasfistel (Diener et al., 2011; Kawai et al., 2006). Risikofaktorer for postoperative pancreasfistel er flere, og ulike tiltak for å forebygge denne komplikasjonen må nøye vurderes (K. Søreide & Labori, 2016).
Total parenteral ernæring er forbundet med økt risiko for postoperative komplikasjoner (Brennan, Pisters, Posner, Quesada, & Shike, 1994). Tidlig peroral væske og ernæring er trygt, og bør tilstrebes (Lassen et al., 2008). Dette vil trolig også bedre pasientenes komfort.
Anbefalinger:
|
| Evidensgrad |
|---|---|
| Utredning, vurdering og behandling av pasienter med pancreaskreft bør foregå på sentra med adekvat spesialkompetanse som samarbeider i multidisiplinære team, og som har døgnkontinuerlig kompetent vakt innen alle fagområder som er involvert i behandlingen. | C |
| Pre-operativ galleavlasting (fortrinnsvis endoskopisk) hos ikteriske pasienter med bilirubin < 250 µmol/L reduserer ikke den generelle risikoen for postoperative komplikasjoner, men øker risikoen for infeksjonskomplikasjoner. | A |
| Pylorusbevarende- og tradisjonell («Whipple’s») pancreatoduodenectomi er likeverdige metoder. | B |
| Reseksjon av v.portae og/eller v.mesenterica superior for å oppnå radikal kirurgi kan utføres, uten at dette øker komplikasjonsrisikoen. Overlevelsen er som hos pasienter uten venereseksjon. | C |
| Tidlig peroral ernæring reduserer risikoen for komplikasjoner. | A |
| Tromboseprofylakse og adekvat antibiotika profylakse er viktig i relasjon til operativ behandling av pancreaskreft. | C |
| Det anbefales rutinemessig postoperativ enzymsubstitisjon (Creon 25000™; 1-2 kapsler til hvert måltid) i minimum 3 måneder etter pancreatoduodenectomi. | C |
Patologi
Sist faglig oppdatert: 05.07.2021
Patologisk-anatomisk klassifikasjon av benigne og maligne svulster i pancreas baserer seg på WHO klassifikasjonen (Gill;A.J. & Lam;A.K., 2019). Duktalt adenokarsinom, som utgjør mer enn 85 % av alle pancreassvulster, er definert som en infiltrerende epitelial svulst med glandulær differensiering og viser et karakteristisk prominent desmoplastisk stroma. Morfologisk intra- og intertumor heterogenitet er uttalt ved duktalt adenokarsinom, og i tillegg til de såkalte subtyper som har en dårligere eller en bedre prognose enn «vanlig duktalt adenokarsinom», forekommer et bredt spektrum av morfologisk variasjon som ikke er omtalt i WHO klassifikasjonen (C. Verbeke, 2016).
Preparathåndtering og disseksjon
Makroskopisk vurdering og snittuttak av operasjonspreparatet er krevende for patologen, og inngående erfaring og nært samarbeid med kirurgen er nødvendig for adekvat håndtering av pancreatoduodenectomipreparater. Med unntak av duodenum, ventrikkel og galleblære som bør åpnes og skylles, bør preparatet ikke oppskjæres før fiksering. For å unngå autolyse av sentrale pancreasområder, bør formalinfiksering av pancreatoduodenectomipreparater ikke vare lenger enn 48 timer. Etter fiksering, og før det tas ut vevsblokker, er tusjmarkering av pancreasoverflatene med en standard fargekode viktig, både for vevsorientering under makroskopisk undersøkelse og for mikroskopisk vurdering av reseksjonsrender. De forskjellige overflatene som til sammen danner den circumferente reseksjonsranden i pancreato-duodenectomipreparater og distale pancreasresektater er illustrert i Figur 5 og 6. Av flere ulike disseksjonsmetoder som brukes ved håndtering av pancreatoduodenectomipreparater er aksial oppskjæring («axial slicing») (Figur 7) den som anbefales, fordi den er enklest å gjennomføre, og samtidig bidrar mest til korrekt diagnose av svulstens størrelse, utbredelse, affeksjon av reseksjonkanter og cancerorigo (Chandrasegaram et al., 2015; C.S. Verbeke & Gladhaug, 2012). Med denne teknikken skjæres pancreashodet i 3 mm tykke skiver i det aksiale planet slik at de viktigste anatomiske landemerkene (ampulla, pancreashovedgang, intrapancreatisk gallegang) framstilles i samme disseksjonsskive (Figur 8), og svulstens forhold til utgangspunkt og overflater kan nøyaktig undersøkes. Spesielt viktig er det å skille duktale adenokarsinomer utgått fra pancreas fra kreftsvulster som har sitt utgangspunkt i ductus choledochus, ampulla eller duodenum. Dette har direkte kliniske implikasjoner bl.a. for korrekt indikasjonsstilling for adjuvant behandling. Differensialdiagnosen stilles først og fremst under makroskopisk undersøkelse, basert på svulstens sentrum i forhold til ampulla, ductus choledochus og duodenum (Campell & Verbeke, 2013; C.S. Verbeke & Gladhaug, 2012). For å muliggjøre retrospektiv gjennomgang av makroskopiske forandringer er det ønskelig at funnene dokumenteres med høykvalitets oversikts- og nærbilder av preparatskivene (Figur 8).
Pancreaskreft har som regel en diffus utbredelse, og avgrensning mot sekundær fibrose og betennelse er ofte makroskopisk vanskelig å bedømme. Omfattende snittuttak er derfor viktig for å sikre en adekvat histologisk diagnose av tumorstørrelse (og dermed T-stadium), lymfeknutestatus, og radikalitet av det operative inngrepet. Innstøpning av et utvalg av disseksjonsskiver som storsnitt anbefales. Særlig ved utvidet reseksjon er kirurgisk merking av ytterligere anatomiske strukturer (f. eks. med karresektat, binyre eller del av ventrikkel) er det nødvendig med målrettede snitt av tumorkritiske områder i preparatet.
Alle lymfeknuter bør innstøpes komplett og vurderes separat for regionale og ikke-regionale lymfeknutestasjoner (TNM Classification of Malignant Tumours, 8th Edition, 2017; J. A. Tol et al., 2014). For pancreatoduodenectomipreparater bør gjennomsnittlig minst 15 lymfeknuter undersøkes (J. A. Tol et al., 2014).
Konkret anbefales å støpe inn vevsprøver en-bloc, dvs. å ikke dissekere ut lymfeknuter og andre vevsstrukturer eller å separere f. eks. et veneresektat fra pancreasoverflaten. De aksiale eller sagittale vevsnittene fra Whipple og distale pancreatektomipreparater deles opp som illustrert i Figur 9, slik at relasjonen mellom tumor, viktige anatomiske strukturer, lymfeknuter og preparatoverflater kan undersøkes. Samtidig tillater en slik fremgangsmåte nøyaktig måling av tumorstørrelsen i to dimensjoner (kfr. nedenfor).
Makroskopisk undersøkelse av pancreasresektater etter neoadjuvant/preoperativ behandling kan være utfordrende, ettersom disse ofte er resultat av utvidede kirurgiske prosedyrer. I tillegg er resttumorvev vanskelig å skille fra tumorfri fibrose, som betyr at alt vev som ikke er helt upåfallende bør støpes inn for en nøyaktig vurdering av tumorstørrelse og tumorregresjon.
Mikroskopisk vurdering av solide svulster
Siden det vanligvis ikke foreligger pre-operativ morfologisk (cytologi/histologi) diagnose, er histologisk klassifikasjon av tumor primært det viktigste ved undersøkelse av operasjons-preparatet. I noen tilfeller kan kroniske betennelsestilstander imitere en malign tumor både klinisk og bildediagnostisk.
En rekke histologisk ulike svulster som skiller seg i behandling, oppfølging og prognose, kan utvikles i pancreas, og det er viktig å skille disse fra duktalt adenokarsinom. T-stadium og lymfeknutestatus er de to viktigste prognostiske faktorer som bør rapporteres ved duktalt adenokarsinom, etterfølgt av tumorinnvekst i blodkar eller perineuralt. Vurdering av reseksjonsrendene er viktig, ikke kun som prognostisk faktor for den individuelle pasienten, men også for tilbakemelding til kirurger og radiologer. Identifikasjon av mikroskopisk reseksjonsrandaffeksjon (R1) er mest nøyaktig ved bruk av aksial disseksjonsteknikk og en R1-diagnose basert på < 1 mm avstand mellom tumor og overflate (Chandrasegaram et al., 2015). Fordi den anteriore pancreasoverflaten er en mesotel-dekket anatomisk overflate, er R1 i denne retningen definert som tumor gjennombrudd (0 mm avstand). Igjen, omfattende prøvetaking, inkl. fra områder uten makroskopisk tydelig tumorinfiltrasjon, er viktig for nøyaktig vurdering av reseksjonsrendene (Network, 2020). Variasjonen i R1-rate kan først og fremst forklares av ulik histopatologisk undersøkelses-teknikk, heller enn av ulik kirurgisk teknikk (C. S. Verbeke, 2013; C.S. Verbeke & Gladhaug, 2012). Når det gjelder duktalt adenokarsinom utgående fra pancreas finner man ved nøyaktig patologisk undersøkelse at det i majoriteten av operasjonspreparatene (> 60–80 %) er én eller flere reseksjonsrender affisert (R1), også etter reseksjon av v. mesenterica superior/v. portae (Chandrasegaram et al., 2015; Kleive, Labori, Line, Gladhaug, & Verbeke, 2020; C. S. Verbeke, 2013).
Tumorstørrelse, og dermed T-stadium, kan være vanskelig å bedømme etter neoadjuvant terapi, dersom resttumorvevet forekommer i form av flere separate foci som ligger spredt mellom ikke-neoplastisk vev. Det er viktig at det angis hvilken metode som er brukt for å bestemme tumor-størrelsen: måling av dimensjoner inkl. imellomliggende ikke-tumorvev eller totalsummen av størrelsen på de individuelle tumorfoci (C. Verbeke, Haberle, Lenggenhager, & Esposito, 2018). Fordi definisjonen av R0/R1 ikke er etablert for pancreaskreft etter neoadjuvant behandling, anbefales det at man oppgir den korteste avstanden til reseksjonranden heller enn bare R0 eller R1 i patologisvaret. Til tumorregresjons-gradering anbefales CAP-skjemaet, som skiller mellom komplett regresjon (grad 0), nærmest komplett regresjon kjennetegnet av kun enkelte residuelle tumorceller eller få tumorcellegrupper (grad 1), delvis respons (grad 2) og lite/ingen tegn til terapieffekt (grad 3) ((CAP), 2017).
Intraoperativ frysesnittdiagnostikk
Den viktigste problemstillingen ved frysesnitt fra transeksjonsranden i pancreas eller gallegang er identifikasjonen av invasivt adenokarsinom. In-situ neoplasi, dvs PanIN eller IPMN, kan være vanskelig å skille fra hverandre, og ved tvetydig funn er «intraduktal neoplasi, uklart om PanIN eller IPMN» et pragmatisk svar. Mens dysplasigraden utgjør viktig informasjon, er tilstedeværelsen av høygradig dysplasi (dvs PanIN-3) ved operasjon for invasivt duktalt adenokarsinom av begrenset klinisk betydning på grunn av den relativt korte overlevelsestiden for pasienter med pancreaskreft (Fong, Ferrone, Lillemoe, & Fernandez-Del Castillo, 2016; Matthaei et al., 2011).
Ved operasjon for ikke-invasiv IPMN er dysplasigraden og affeksjon av hovedgangen vs. sideganger i frysesnitt fra pancreastranseksjonsranden viktig informasjon for den intraoperative indikasjonsstillingen for utvidet reseksjon. I de tilfellene der pancreasgangene (særlig hovedgangen) i frysesnittet mangler epitelbekledningen, skal man ikke svare «ingen holdepunkter for neoplasi», men undersøke dypere snitt eller snitt fra den andre siden av vevsskiven. Dersom disse ytterligere undersøkelsene ikke viser vurderbart gangepitel, bør muligheten om å få tilsendt en ny vevsprøve diskuteres med kirurgen.
Diagnostikk på finnålsbiopsier
En vesentlig andel av pasienter med pancreaskreft har allerede lokalavansert eller metastatisk sykdom ved diagnosetidspunktet. For å kunne starte med kjemoterapi er histologisk bekreftelse på basis av EUS-FNB fra primærtumoren (ved lokalavansert pancreaskreft) eller leverbiopsi (ved levermetastaser) nødvendig. Diagnosen duktalt adenokarsinom er helt overveiende basert på morfologiske kriterier, men kan være utfordrende dersom materialet er sparsomt og/eller karsinomet er høyt differensiert. For å kunne skille mellom høyt differensiert duktalt adenokarsinom og ikke-neoplastisk sylinderepitel er det per i dag kun SMAD4 som tillater utvetydig identifikasjon av adenokarsinom i ca. 50 % av kasus med genmutasjon og tilsvarende negativ kjernefarging. De fleste duktale adenokarsinomer farger positivt for CA 19-9, CEA og maspin, mens CA125 og mesothelin er positive i ca. 50 % hhv 50-70 % av kasus (Dennis et al., 2005; Liu et al., 2012; Winter et al., 2012). Det er ingen markør som er spesifikk for pancreaskreft og som tillater entydig avgrensning fra adenokarsinom med ekstrapancreatisk opphav. Mens mange duktale adenokarsinomer er CK7+/CK20- og uttrykker MUC1 og MUC5AC, er uttrykk av CK20 og varierende ekspresjon av muciner et vanlig funn ved ellers konvensjonell pancreaskreft. Særlig ventrikkelkreft og duodenalkreft lar seg oftest ikke definitivt skille fra pancreaskreft (kfr. nedenfor). Immunhistokjemisk farging for CA125, mesothelin og S100P kan være nyttig, men resultatet må alltid tolkes i sammenheng med det kliniske bildet. Innhenting av kliniske opplysninger, særlig tumors størrelse og utseende på bildediagnostikk (solid/cystisk), er essensielt for å gi klinisk relevant diagnostisk informasjon.
For tumores i pancreashodet med utbredt vekst i duodenum kan endoskopiske duodenalbiopsier være aktuelle, ofte med klinisk spørsmål om tumors origo: pancreas eller duodenum. Svaret kan sjelden være definitivt, fordi duodenalt adenokarsinom viser et bredt morfologisk spektrum, inkl. en pancreatobiliær type (Xue et al., 2017). I tillegg fører såkalt “intestinal mimicry” til at duktalt adenokarsinom ved infiltrasjon i duodenalveggen ofte viser intestinal morfologi og immunhistokjemisk profil. Dessuten kan infiltrasjon av pancreaskreft i duodenalslimhinnen resultere i et adenom-liknende bilde pga “kolonisering” av det intestinale epitellaget (Campell & Verbeke, 2013).
Forstadier
Som for alle andre epiteliale svulster i kroppen antar man at utviklingen av karsinom i pancreas skjer via en trinnvis prosess i gangepitelet som kan omfatte lavgradig og høygradig intraepitelial neoplasi (dysplasi). Dette betegnes som PANcreatisk Intraepitelial Neoplasi (PanIN) og inndeles i lav- og høygradig, hvor sistnevnte er ekvivalent med «carcinoma in situ». Lav-gradig PanIN har generelt en høy prevalens i befolkningen over 40 år og er derfor av begrenset klinisk interesse (Hruban & Klimstra, 2014). Høygradig PanIN derimot er sjelden og må skilles fra intraduktal spredning av invasivt adenokarsinom («gangcancerisering») som er et histologisk nærmest identisk funn i opp til 70 % av operasjonspreparater for pancreaskreft (Basturk et al., 2015; Yamasaki, Suda, Nobukawa, & Sonoue, 2002). I praksis betyr det at høygradig PanIN ikke bør diagnostiseres dersom affiserte gangstrukturer ligger i nærhet av invasivt karsinom og overgangen mellom normal og neoplastisk epitelbekledning er brå.
Mucinøs cystiske neoplasi og intraductal mucinøs papillær neoplasi er ytterligere potensielle forstadier til invasivt duktalt adenokarsinom.
Cystiske neoplasier
Diagnostikk av cystiske pancreaslesjoner basert på kirurgiske reseksjonspreparater, biopsier eller FNAC har økende betydning. Primært er det viktig å skille mellom serøse cystiske neoplasier, som er godartete, og mucinøse cystiske neoplasier, som kan progrediere til invasivt adenokarsinom. Sistnevnte gruppe omfatter mucinøs cystisk neoplasme (MCN) og intraductal papillær mucinøs neoplasi (IPMN). Intraductal onkocyttær papillær neoplasi (IOPN) og intraductal tubulopapillær neoplasi (ITPN) er ytterliggere to, svært sjeldne cystiske neoplasier som også kan progrediere til invasivt adenokarsinom. Malignitetsrisikoen er korrelert med dysplasigraden, som ofte varierer mellom forskjellige cyster i én og samme tumor. Derfor er det viktig at lesjonen innstøpes subtotalt, særlig fra områder med et mer solid preg, som tyder på mulig malign transformasjon (Del Chiaro et al., 2013). Prognosen ved MCN, IPMN, IOPN og ITPN er først og fremst bestemt av tilstedeværelse av invasivt karsinom og dets størrelse og utbredelse.
Prekursorlesjonen og det invasive karsinomet (histologisk type, differensieringsgrad, størrelse, T‑stadium) bør karakteriseres separat. Ved IPMN kan invasivt karsinom være assosiert - dvs i direkte forbindelse med prekursorlesjonen - eller separat («concomitant»). Forskjellen mellom disse to situasjonene er relevant og basert på nøyaktig undersøkelse av pancreasvevet mellom IPMN og invasivt karsinom og måling av avstanden (Fong et al., 2016). Nyere studier viser at ytterligere flere morfologiske funn er korrelert med malignitetsrisiko i IPMN: (i) neoplastisk epiteltype (intestinal, gastrisk, pancreatobiliær), (ii) vekst i pancreashovedgangen, sideganger eller en kombinasjon av begge to (blandings IPMN), (iii) størrelsen av lesjonen, og (iv) maksimum diameter av pancreashovedgangen. Disse fire faktorene bør derfor inkluderes i patologisvaret (Adsay et al., 2016).
Patologisvar
Et dokument som beskriver standardisert preparathåndtering og snittuttak fra resektater etter pancreatoduodenectomi bør foreligge ved alle patologiavdelinger hvor dette er aktuelt. Se addendum «Forslag til mal for strukturert patologi rapport av adenokarsinom etter pancreasreseksjon». Beskrivelse av preparatet med snittuttak må inngå i prøvesvaret sammen med standardisert diagnoseoppsett. Det anbefales bruk av malen fra ICCR (International Collaboration for Cancer Reporting) (C. Verbeke et al., 2020).
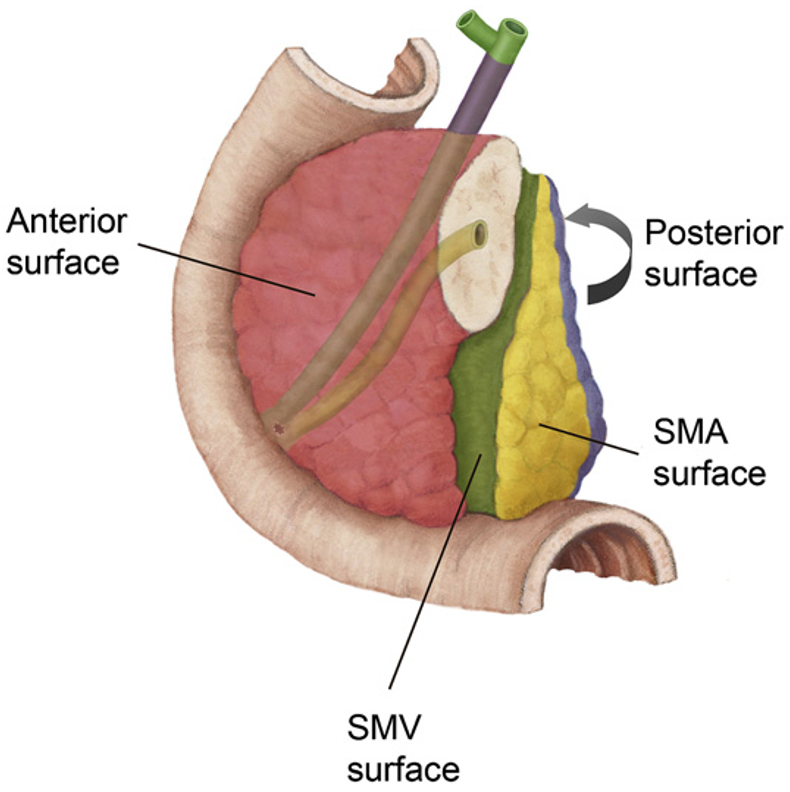
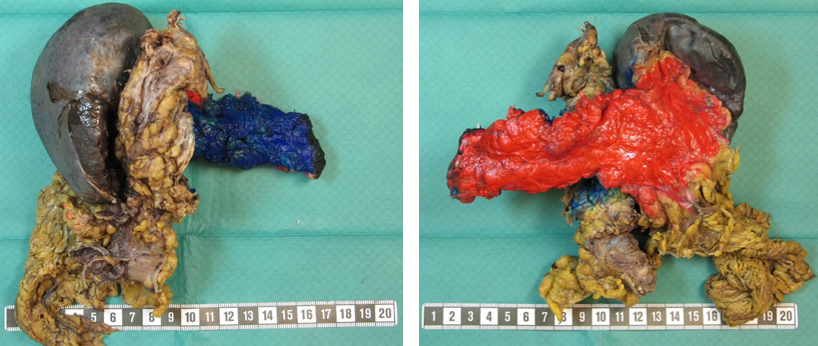
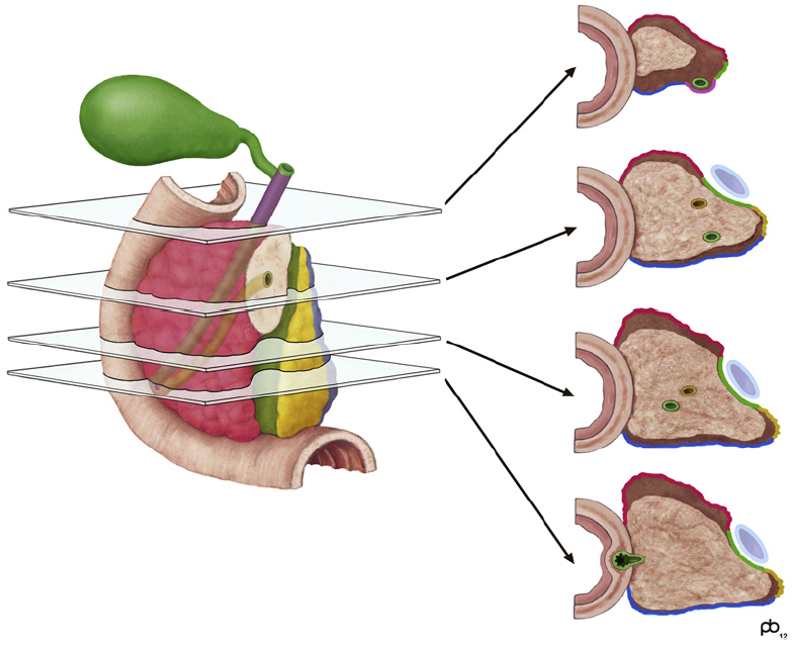
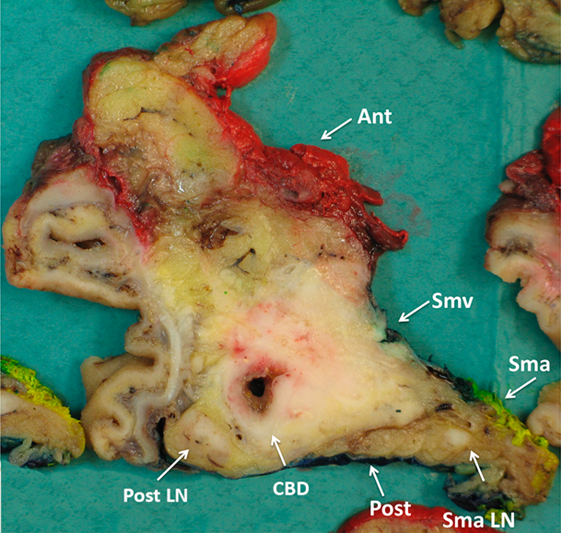
Forkortelser:
Ant = anteriøre overflate, CBD = ductus choledochus, Post = posteriøre overflate, Post LN = posteriør lymfeknute, Smv = overflate mot v. mesenterica superior, Sma = overflate mot a. mesenterica superior, Sma LN = lymfeknute i peripancreatisk fettvev mot a. mesenterica superior (etter (C.S. Verbeke & Gladhaug, Under publisering 2016)). 4
1Reprinted from Surg Clin North Am 2013;93 (3):647–62. Verbeke CS. Resection margins in pancreatic cancer. Copyright (2017), with permission from Elsevier.
2Reprinted from American College of Surgeons and the Alliance for Clinical Trials in Oncology, Nelson H, Hunt KK, Veeramachaneni N, Blair S, Chang G, et al., red. Operative Standards for Cancer Surgery: Volume 1: Breast, lung,pancreas, colon. Philadelphia: Walters Kluver; 2015. Copyright (2017) with permission from Elsevier.
3Reprinted from Surg Clin North Am 2013;93 (3):647–62. Verbeke CS. Resection margins in pancreatic cancer. Copyright (2017), with permission from Elsevier.
4Reprinted from Surg Pathol Clin 2016. Verbeke CS, Gladhaug IP. Dissection of pancreatic specimens. Copyright (2017), with permission from Elsevier.
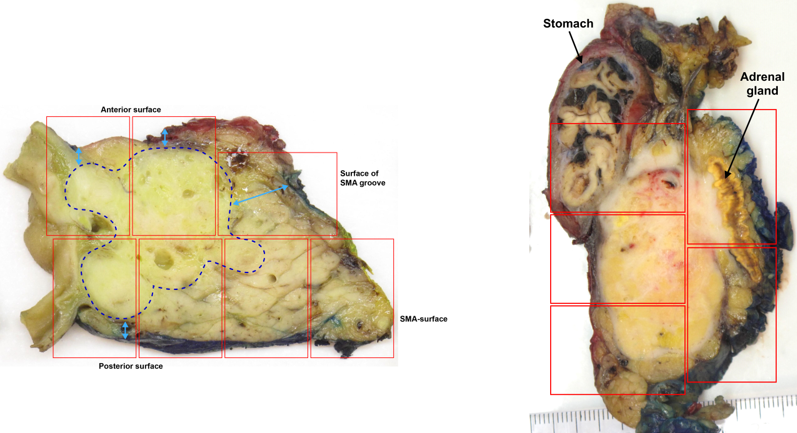
Anbefalinger:
|
| Evidensgrad |
|---|---|
| Operasjonspreparatet (fortrinnsvis «ferskt») skal merkes og orienteres slik at patologen kan orientere og bearbeide makropreparatet og gjøre adekvat mikroskopi for å kunne besvare de sentrale problemstillinger knyttet til tumortype, størrelse, lokalisering, reseksjonsrender, lymfeknutestatus, og eventuelt ytterligere reseserte strukturer (f. eks. veneresektat). | D |
| Standardisert disseksjon, inkl. aksial oppskjæring av pancreatoduodenectomi-preparater, med vevsinnstøping og bruk av en R1-definisjon basert på 1 mm avstand, resulterer i en mer nøyaktig vurdering av cancerorigo, tumorstørrelse, T-stadium og reseksjonsstatus. | C |
| Bruk av diagnosemal gir en mer nøyaktig og komplett vurdering av prognostiske faktorer. | D |
| Patologibesvarelsen bør foreligge senest innen 2-3 uker. | D |
Onkologisk forbehandling ved lokalisert sykdom
Sist faglig oppdatert: 05.07.2021
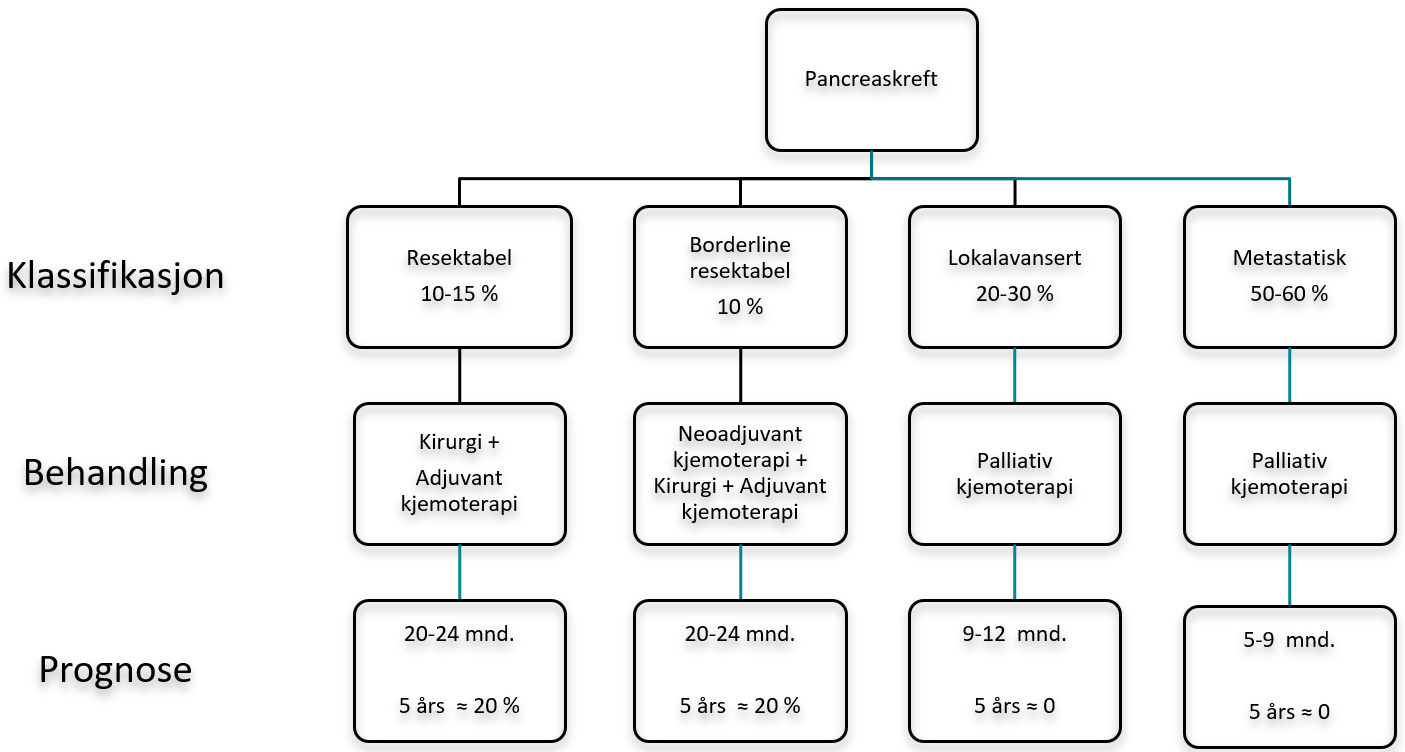
Resektabel: operasjon direkte fulgt av adjuvant kjemoterapi. Borderline resektabel: neoadjuvant kjemoterapi, pasienter med radiologisk stabil sykdom eller respons vurderes for operasjon.
Lokalavansert: palliativ kjemoterapi (en meget liten andel pasienter som får kjemorespons vil kunne være aktuelle for eksplorasjon og eventuell operasjon). Metastatisk: palliativ kjemoterapi.
Onkologisk behandling i form av kjemoterapi er en meget viktig del av behandlingen også hos pasienter som får gjennomført reseksjon med kurativ intensjon. Gjennomføring av hele behandlingssekvensen med kirurgi og neoadjuvant/adjuvant kjemoterapi er viktig for å bedre overlevelsen for pasienter med resektabel og borderline resektabel pancreaskreft (Labori et al., 2016).
Ved primært resektable svulster hos operable pasienter (neoadjuvant kjemoterapi)
Standard behandling ved resektabel pancreaskreft er operasjon direkte fulgt av adjuvant kjemoterapi i 6 mnd. (Conroy et al., 2018; Labori et al., 2016; J. P. Neoptolemos et al., 2017; J.P. Neoptolemos et al., 2004). Det foreligger ingen randomiserte studier som avklarer om neoadjuvant kjemoterapi og/eller strålebehandling bedrer overlevelsen sammenlignet med operasjon direkte fulgt av adjuvant kjemoterapi (Sohal et al., 2021). Internasjonalt ser man imidlertid en økende bruk av neoadjuvant kjemoterapi også hos primært operable pasienter (Cloyd et al., 2020). Ikke randomiserte studier viser redusert antall pasienter med histologisk N+ sykdom og antall R1 reseksjoner (Versteijne et al., 2018). Flere pågående studier, blant annet en nordisk multisenterstudie, vurderer effekten av neoadjuvant kjemoterapi ved resektabel pancreaskreft (Labori et al., 2017), men per i dag anbefales ikke dette gitt i Norge utenfor kliniske studier.
Ved borderline resektable svulster (neoadjuvant kjemoterapi)
Ved borderline resektable svulster, hvor det radiologisk foreligger begrenset karaffeksjon, har man ved preoperativ behandling som mål å øke andelen med frie reseksjonsrender hos de som blir operert og redusere risikoen for lokalt residiv (Laurence et al., 2011). Det foreligger begrenset dokumentasjon for at dette er mulig (Bockhorn et al., 2014). Preoperativ kjemoterapi er likevel praksis ved mange sentra i verden i slike situasjoner, og i Norge er dette etablert som standardbehandling ved borderline resektabel pancreakreft i tråd med internasjonale anbefalinger (Bockhorn et al., 2014; He, Schulick, & Del Chiaro, 2021; Network, 2020). En annen intensjon med preoperativ behandling er å unngå unødvendig operasjon hos pasienter som utvikler metastatisk sykdom noen få måneder etter kirurgisk behandling ved direkte kirurgi. Fravær av tumorprogresjon eller ingen tilkomst av metastaser under (preoperativ) kjemoterapi over 2-4 mnd. tilsier at pasienter med borderline resektabel sykdom skal vurderes for kirurgi.
En nederlandsk randomisert studie (PREOPANC-1, 246 pasienter) sammenliknet operasjon direkte fulgt av 6 sykluser adjuvant gemcitabine (standardarmen) med preoperativ radiokjemoterapi (den eksperimentelle armen) med 3 sykluser gemcitabine (andre syklus med 2,4 Gy x 15 strålebehandling), fulgt av operasjon og 4 sykluser adjuvant gemcitabine hos pasienter med resektabel og borderline resektabel pancreaskreft (Versteijne et al., 2020). Det var ingen forskjell i median overlevelse (14.3 mnd. vs. 16 mnd., p=0.096) mellom de to gruppene. Subgruppe analyse av pasienter med henholdsvis resektabel (133 pasienter) og borderline resektabel (113 pasienter) pancreaskreft viste ingen forskjell i median overlevelse ved resektabel sykdom, men signifikant bedre median overlevelse (17.6 mnd. vs. 13.2 mnd.) ved preoperativ radiokjemoterapi ved borderline resektabel sykdom.
Resultatene fra PREOPANC-1 støtter praksisen med å tilby pasienter med borderline resektable svulster neoadjuvant behandling, men ettersom neoadjuvant radiokjemoterapi her er sammenlignet med direkte kirurgi kun etterfulgt av gemcitabine monoterapi, og ikke dagens anbefalte adjuvante behandling, gir den ikke endelig svar i dagens situasjon. Det finnes foreløpig ikke studier som har sammenlignet kombinasjonsregimene vi benytter i adjuvant setting i dag (mFOLFIRINOX eller gemcitabine/nab-paclitaxel) med preoperativ radiokjemoterapi. En randomisert studie fra USA sammenliknet imidlertid mFOLFIRINOX (53 pasienter) og gemcitabine/nab-paclitaxel (47 pasienter) som perioperativ kjemoterapi (3 mnd. neoadjuvant/3 mnd. adjuvant) ved resektabel pancreaskreft og viste lik 2-års overlevelse (47 % vs 48 %) og median overlevelse (23.2 mnd. vs 23.6 mnd.) med akseptabel toksisitet i begge grupper (Sohal et al., 2021). Per i dag vil man anbefale at eventuell neoadjuvant behandling gis i form av kombinasjons-kjemoterapi alene.
Borderline resektabel pancreaskreft er i de norske retningslinjene definert radiologisk, anatomisk i forhold til grad av karaffeksjon påvist på CT. Internasjonalt benyttes i tillegg en klinisk definisjon for borderline resektabel sykdom (Isaji et al., 2018): 1) Pasienter med radiologisk, anatomisk resektabel sykdom, men som har biologiske indikatorer som betydelig forhøyet CA 19-9, suspekte, men ikke sikkert verifiserte fjernmetastaser, eller bioptisk verifiserte eller PET-CT suspekte regionale lymfeknutemetastaser, eller 2) pasienter med radiologisk, anatomisk resektabel sykdom og ingen biologiske indikatorer på aggressiv sykdom, men med komorbiditet og/eller ECOG >2. Dette understreker betydningen av en grundig klinisk vurdering av pasienter som skal få utført eventuell pancreasreseksjon hvor man i tillegg til radiologiske kriterier må ta hensyn til pasientens komorbiditet, ECOG status og funksjonsnivå («frailty»).
Ved lokalavanserte, primært ikke-resektable svulster (kjemoterapi/down-sizing)
Ved lokalavanserte svulster har kjemoterapi som mål å gjøre primært ikke-resektable svulster resektable ved at en oppnår en reduksjon i svulstens størrelse («down-sizing») og grad av karaffeksjon. I ulike studier er ofte både pasienter med borderline resektable og pasienter med lokalavanserte, primært ikke-resektable svulster inkludert. Dette vanskeliggjør vurderingen av reell reseksjonsrate etter gjennomført neoadjuvant/preoperativ behandling for disse to gruppene. Det er flere rapporter om at pasienter med lokalavansert pancreaskreft har oppnådd down-sizing etter (preoperativ) kjemoterapi som har muliggjort vellykket reseksjon. Andelen pasienter med lokalavansert pancreaskreft som vil kunne opereres anses å være meget lav (Maggino et al., 2019; Walma et al., 2020). Det er likevel viktig at utvalgte pasienter med lokalavansert pancreaskreft med tegn til biokjemisk og radiologisk respons etter 4-6 mnd. kjemoterapi blir rehenvist til sentra som utfører pancreaskirurgi for responsevaluering med tanke på mulighetene for eventuell kirurgi.
Ved bruk av kjemoterapi ved borderline resektable svulster og lokalavanserte, primært ikke-resektable svulster, er det naturlig å velge et kjemoterapiregime med høy responsrate. De regimene som i palliativ situasjon har gitt høyest responsrate er FOLFIRINOX og gemcitabine/ nab-paclitaxel (Conroy et al., 2011; Von Hoff et al., 2013) (se kapittel Palliativ behandling ved lokalavansert inoperabel tumor og metastasisk sykdom).
Man kan tenke seg at det hos noen få utvalgte pasienter med vedvarende lokalisert sykdom kan være aktuelt å gi konsoliderende strålebehandling (f. eks. 2 Gy x 25) i et forsøk på å få en lokalavansert svulst til å bli resektabel, men det finnes lite data på nytten av dette, og faren for toksisitet er ofte betydelig, slik at dette nok bør forbeholdes pasienter der kjemoterapi ikke lenger er effektivt eller tolerert (Ducreux et al., 2015).
Dersom kjemoterapi skal gis, må biopsi for å verifisere diagnosen foreligge, og pasienter med ikterus må vurderes for galledrenasje, da kjemoterapi krevere relativt normale bilirubinverdier (s-bilirubin < 50 µmol/L).
Radiologi etter gjennomgått kjemoterapi
Etter gjennomgått neoadjuvant/preoperativ behandling undersøkes pasienten på nytt med CT pancreas, inkludert thorax og bekken, for å vurdere om det er tegn på behandlingsrepons eller om det er tilkommet metastaser eller annen sykdomsprogresjon. Duktalt adenokarsinom er en fibrotisk tumor, og det kan være vedvarende bløtvev/fibrose uten tumorceller langs involverte karstrukturer. Det er vist at CT er dårlig til å skille desmoplastisk reaksjon eller tumorfibrose fra viabelt tumorvev og ofte overstages tumorstørrelse/T-stadium og karaffeksjon etter neoadjuvant/preoperativ behandling (Ferrone et al., 2015; Katz et al., 2012). Standard kriterier for vurdering av karaffeksjon som brukes i primærstagingen er ikke valid etter neoadjuvant/preoperativ behandling. Fravær av tumorprogresjon eller ingen tilkomst av metastaser tilsier vanligvis at pasienter med borderline resektabel sykdom skal tilbys kirurgi. Flere studier har vurdert andre metoder, som DWI (diffusjon) på MR, ulike analyser av jod-opptak ved dual energy-CT, PET-CT og PET-MR, for å skille tumorvev fra fibrose og viser bedre resultater enn vurdering med CT, men dette er foreløpig ikke validerte eller etablerte metoder.
Adjuvant behandling
Sist faglig oppdatert: 05.07.2021
Langtidsoverlevelsen er svært dårlig for pasienter med pancreaskreft, selv hos de som er operert med kurativ intensjon (Hidalgo, 2010; Vincent et al., 2011). Adjuvant behandling etter gjennomført radikal kirurgi har til hensikt å redusere risikoen for tilbakefall av sykdommen, for dermed å bedre langtids-overlevelsen. I tillegg ønsker man å utsette tidspunkt for et eventuelt sykdomstilbakefall, for dermed å bedre den sykdomsfrie overlevelsen.
Adjuvant radiokjemoterapi gir ingen overlevelsesgevinst sammenlignet med adjuvant kjemoterapi alene. Det har vært rapportert redusert overlevelse hos pasienter som fikk postoperativ strålebehandling (J.P. Neoptolemos et al., 2004).
Adjuvant kjemoterapi har derimot vist å gi en overlevelsesgevinst sammenlignet med operasjon alene. Den store ESPAC-1-studien (541 pasienter) konkluderte med at 5-FU-basert radiokjemoterapi førte til redusert overlevelse, mens 5-FU-basert adjuvant kjemoterapi alene bedret overlevelsen signifikant sammenlignet med ingen adjuvant behandling (J.P. Neoptolemos et al., 2004). I 2007 viste CONKO-001 studien (368 pasienter) at adjuvant gemcitabine ga en signifikant bedret sykdomsfri overlevelse sammenlignet med kirurgi alene (median overlevelse 13.4 mnd. vs. 6.7 mnd.) (Oettle et al., 2007).
Adjuvant 5-FU/leukovorin ble deretter sammenlignet med adjuvant gemcitabine i ESPAC-3-studien (1088 pasienter) (J.P. Neoptolemos et al., 2010). Adjuvant gemcitabine bedret ikke den sykdomsfrie overlevelsen, livskvaliteten eller den total overlevelsen sammenlignet med 5FU-basert kjemoterapi etter radikal kirurgi. Den mediane overlevelsen (23.6 mnd. vs 23 mnd.) var lik for de to gruppene. I begge studier ble 5‑års overlevelsen doblet hos gruppen som fikk kjemoterapi (ESPAC-1 studien (J.P. Neoptolemos et al., 2010) 22.5 % vs. 11.5 % • CONKO 001-studien (Oettle et al., 2007) 20.7 % vs. 10.4 %).
ESPAC-4 studien sammenliknet gemcitabine (standard armen) og gemcitabine + capecitabine (GemCap) (den eksperimentelle armen) (732 pasienter) (J. P. Neoptolemos et al., 2017). Av inkluderte pasienter i studien hadde 60 % av pasientene fått en R1 reseksjon og 80 % hadde lymfeknutemetastaser i operasjonspreparatet. Dette tyder på at det ikke var en svært selektert pasientgruppe som ble inkludert, men en pasient populasjon tilsvarende det en ser i vanlig klinisk praksis. Median overlevelse i gemcitabin gruppen var 25.5 mnd. og 28 mnd. i kombinasjonsarmen med en 5 års overlevelse på henholdsvis 16 % og 29 %.
PRODIGE-24 studien sammeliknet gemcitabine (standard armen) og modifisert FOLFIRINOX
(fluorouracil, leucovorin, irinotecan, oxaliplatin) (eksperimentelle armen) (493 pasienter) (Conroy et al., 2018). Median overlevelse i gemcitabine gruppen var 35 mnd. og 54.4 mnd. i gruppen som fikk modifisert FOLFIRINOX (mFOLFIRINOX). Median sykdomsfri overlevelse var henholdsvis 12.8 mnd. og 21.6 mnd.. Median alder var på 63 og 64 år. Grad 3 eller 4 bivirkninger forekom hyppigere i kombinasjonsarmen (75.9 %) enn i gemcitabin gruppen (52.9 %). For å inkluderes i studien måtte pasientene ved randomisering i perioden 3-12 uker etter operasjonen være fullt restituert med ECOG status 0-1. CA 19-9 måtte være < 180 U/ml. Av inkluderte pasienter i studien hadde 43 % av pasientene fått en R1 reseksjon og 74 % hadde lymfeknutemetastaser i operasjonspreparatet.
Basert på overstående vil man i praksis vurdere å gi mFOLFIRINOX, bestående av 5FU, leukovorin, irinotecan og oxaliplatin hver 14. dag som adjuvant regime hos pasienter som er i god allmenntilstand og fullt restituert etter operasjonen dersom alder og/eller komorbiditet ikke taler i mot dette. Eventuelt vurderes GemCap gitt i form av gemcitabine dag 1, 8 og 15 i en 4 ukers syklus kombinert med capecitabine 2 ganger daglig dag 1-22. Gemcitabine monoterapi dag 1, 8 og 15 i en 4 ukers syklus eller FLV gitt i form av 5-FU og leukovorin 2 påfølgende dager hver 14. dag kan også vurderes gitt hos eldre pasienter eller pasienter med komorbiditet som er til hinder for bruk av kombinasjonsregimene. Selv om høy alder i seg selv ikke er en
kontraindikasjon mot kjemoterapi bør man ved alder over 75 år kritisk vurdere om adjuvant behandling skal anbefales og hvilket regime som skal velges.
Eventuell adjuvant kjemoterapi bør være påbegynt senest innen 12 uker fra operasjonstidspunktet (Valle et al., 2014). Det bør utføres en CT thorax /abdomen/bekken både ved behandlingsoppstart, og etter gjennomført adjuvant kjemoterapi.
Anbefalinger:
|
| Evidensgrad |
|---|---|
| Neoadjuvant behandling er per i dag ikke del av standardbehandlingen ved primært resektable svulster. | D |
| Neoadjuvant kjemoterapi anbefales ved borderline resektable svulster. | C |
| Selekterte pasienter med primært, ikke-resektabel, lokalavansert pancreaskreft med tegn til god og langvarig (4-6 mnd.) biokjemisk og radiologisk respons på kjemoterapi bør rehenvises til universitetssykehus som utfører pancreaskirurgi for responsevaluering med tanke på muligheten for eventuell kirurgi. | D |
| Endelig histologibeskrivelse av operasjonspreparatet med en bekreftelse på at pasienten har adenokarsinom utgående fra pancreas må foreligge før oppstart av adjuvant behandling. Alt makroskopisk tumorvev må være fjernet (dvs. en R0 eller R1 reseksjon er utført). | D |
| Etter radikal operasjon (R0-R1) for adenokarsinom i pancreas vurderes pasienten for adjuvant behandling. Adjuvant behandling gis i 6 mnd.. | A |
| Adjuvant behandling bør starte senest innen 12 uker fra operasjonstidspunktet. Det bør utføres en CT thorax /abdomen/bekken både ved behandlingsoppstart og etter gjennomført adjuvant kjemoterapi. | C |
| Pasienten bør være i god allmenntilstand og god funksjonsklasse (ECOG 0‑1) ved oppstart behandling. Alder og komorbiditet må også tas i betraktning både med hensyn til om adjuvant behandling skal anbefales og ved valg av regime. | C |
| mFOLFIRINOX, bestående av 5FU, leukovorin, irinotecan og oxaliplatin gitt hver 14. dag er standard adjuvant regime hos pasienter som er i god allmenntilstand og fullt restituert etter operasjonen. Eventuelt vurderes GemCap gitt i form av Gemcitabine dag 1, 8 og 15 i en 4 ukers syklus kombinert med capecitabine 2 ganger daglig dag 1-22, Gemcitabine monoterapi dag 1, 8 og 15 i en 4 ukers syklus eller FLV gitt i form av 5-FU og leukovorin 2 påfølgende dager hver 14. dag. | A |
Oppfølging og etterkontroll etter kurativ behandling
Sammendrag av anbefalinger
|
| Evidensgrad |
|---|---|
| Pasienten bør ha en etterkontroll på kirurgisk poliklinikk 4–6 uker etter gjennomført operasjon med kurativ intensjon. Her bør informasjon om endelig histologi, og avklaring av andre generelle forhold tas opp. Pasienten må få summert opp og repetert den gjennomførte behandling og resultatene av denne. Vurdering av pasientens aktuelle allmenn- og ernæringstilstand bør vektlegges og dokumenteres. | D |
| Dersom pasienten er aktuell for adjuvant kjemoterapi, må pasienten henvises til kreftavdeling for vurdering og informasjon så snart histologisvaret foreligger. | D |
| Etter gjennomført primærbehandling (operasjon + eventuell adjuvant kjemoterapi) følges pasientene videre av fastlege. Fokus bør rettes mot vurdering av allmenn- og ernæringstilstand og på symptomer som kan gi mistanke om residiv eller metastaser. | D |
| Det er ikke vitenskapelig grunnlag for å anbefale noe spesielt tidsintervall mellom slike konsultasjoner, og heller ikke grunnlag for å anbefale rutinemessig bruk av bildediagnostikk eller spesielle blodprøver. | C |
| Ved klinisk mistanke om residiv/metastaser bør utredning med CT abdomen/ thorax, relevante blodprøver og CA 19‑9 som tumormarkør vurderes. Pasienten bør vurderes for palliativ tumorrettet behandling, men også for behov for symptomrettet og generell palliativ behandling. | D |
Kontroll hos kirurg etter gjennomført operativ behandling med kurativ intensjon
Sist faglig oppdatert: 05.07.2021
Opererte pasientene bør tilbys en kontroll hos kirurg 4–6 uker etter utskrivning slik at relevant informasjon, som f. eks. endelig svar på histologi, uavklarte spørsmål knyttet til det gjennomførte operative inngrepet, og eventuelle komplikasjoner, kan gjennomgås (Labori, Verbeke, & Gladhaug, 2015). Like viktig er vurdering av allmenn- og ernæringstilstand (eventuelt behov for enzymsubstitusjon). Funksjonsstatus (ECOG-status) bør dokumenteres. Relevante blodprøver bør kontrolleres, inkludert fastende blodsukker (obs. diabetes mellitus).
Om pasienten er aktuell for og interessert i adjuvant kjemoterapi, må henvisning sendes til kreftavdeling for vurdering så snart histologisvaret foreligger. Eventuell adjuvant kjemoterapi bør være påbegynt senest innen 12 uker fra operasjonstidspunktet (Valle et al., 2014). Det bør utføres en CT thorax /abdomen/bekken både ved behandlingsoppstart og etter gjennomført adjuvant kjemoterapi.
Det er ikke grunnlag for å anbefale en spesifikk poliklinisk oppfølgning ved sykehuset framfor den kontakten pasienten likevel har med fastlegen sin. Eventuell blodprøvekontroll og radiologisk utredning bør være symptomrettet.
Oppfølgning under adjuvant kjemoterapi
Sist faglig oppdatert: 05.07.2021
For pasienter som gjennomfører adjuvant kjemoterapi i regi av en kreftavdeling, skjer oppfølgning ved poliklinikken der i den perioden behandlingen pågår (om lag 6 mnd.). Det bør utføres en CT thorax /abdomen/bekken både ved behandlingsoppstart, og etter gjennomført adjuvant kjemoterapi. Det er viktig å ha in mente den høye risikoen for residiv, og utrede eventuelle symptomer på dette, slik at behandlingsopplegget kan endres ved eventuelt påvist residiv eller metastaser under pågående adjuvant behandling.
Etter avsluttet adjuvant kjemoterapi avsluttes oppfølgingen i spesialisthelsetjenesten, og pasienten bes kontakte sin fastlege for videre generell oppfølgning. Formidling av relevant informasjon mellom sykehus og fastlege er viktig for å ivareta pasienten best mulig i det videre forløpet.
Oppfølgning hos fastlege
Sist faglig oppdatert: 05.07.2021
Rutinemessig bruk av bildediagnostikk eller spesifikke blodprøver som ledd i oppfølgningen har ikke vist seg å gi noen prognostisk gevinst hos denne pasientgruppen (Daamen et al., 2019; Tzeng et al., 2012).
Det er imidlertid viktig å fokusere på pasientens ernæringstilstand (bl.a. om det er behov for fortsatt enzymsubstitusjon), allmenntilstand, generelt funksjonsnivå (ECOG-status), tegn på dårlig regulering av eventuell diabetes mellitus og eventuell smerteproblematikk.
Bildediagnostiske undersøkelser, blodprøver og tumormarkører som CA 19‑9 bør reserveres for pasienter med nye symptomer eller kliniske funn som gir mistanke om residiv eller metastaser, eller der spesifikke kliniske problemstillinger krever nærmere avklaring. Særlig for pasienter som kan være kandidater for tumorrettet palliativ behandling, eller som har plagsomme symptomer, bør man ha lav terskel for utredning med dertil egnet bildediagnostikk. CT vil som regel være førstevalg.
Konkrete kliniske problemstillinger som oppstår i forløpet bør tas opp med relevant spesialist ved sykehuset, oftest gastrokirurg eller onkolog, men de konkrete henvisningsrutiner vil variere fra sted til sted i landet.
Hos pasienter med avansert sykdom kan bl.a. smertebehandlingen være en utfordring. Kontakt med og eventuelt konsultasjon ved smertepoliklinikk eller et palliativt team kan være en viktig ressurs, også for fastlegen. På den måten kan fastlegen og kommunehelsetjenesten bistå pasienten med god og nødvendig palliasjon i en hjemmesituasjon, eller i en lokal institusjon, uten at sykehusinnleggelse blir nødvendig.
Seneffekter
Sist faglig oppdatert: 05.07.2021
Rapport om seneffekter etter kreftbehandling
Helsedirektoratet ga ut rapporten Seneffekter etter kreftbehandling. Faglige råd i 2017. Målgruppen for rapporten er klinikere og annet helsepersonell som er i kontakt med kreftpasienter og pasienter som har vært gjennom kreftbehandling. Rapporten har kapitler om blant annet sekundær kreft, kardiovaskulære seneffekter, pulmonale seneffekter, hormon-forstyrrelser etter kreftbehandling, seksualitet etter kreftbehandling, kognitive problemer, fatigue, psykososiale forhold og tann- og munnhuleproblemer. Det planlegges også en oppdatert og utvidet rapport utgitt ved årsskiftet 2017/2018 med flere nye tema.
Det er særlig viktig at fastleger, som skal følge opp pasienter som er skrevet ut fra spesialist-helsetjenesten, er oppmerksomme på risikoen for seneffekter etter kreftbehandling, og at disse kan debutere lenge etter avsluttet behandling.
Palliativ behandling ved lokalavansert inoperabel tumor og metastasisk sykdom
Sist faglig oppdatert: 05.07.2021
De fleste pasienter med pancreaskreft vil ikke være kandidater for kurativ kirurgi på diagnosetidspunktet; enten på grunn av lokalavansert tumorvekst, eller på grunn av påviste fjernmetastaser (oftest i lever, lunge, lymfeknuter eller peritoneum). Av de som blir operert, får 80-90 % tilbakefall av sykdommen (Groot et al., 2019; Hidalgo et al., 2015; Labori et al., 2016). Leveutsiktene er begrenset, og median overlevelse ved metastatisk sykdom er 6-9 mnd., og 9-12 mnd. ved lokalavansert sykdom (Michl & Gress, 2013).
De fleste pasientene med pancreaskreft vil i løpet av sykdomsforløpet ha behov for ulike palliative tiltak. Symptomer som smerter, kvalme, ikterus og ernæringsproblemer vil ofte være knyttet til obstruksjon av galleveier og/eller mage-tarm traktus samt affeksjon av nerver på bakre bukvegg. Obstruksjonen kan skyldes både lokal tumorvekst og carcinomatose. Sykdommen medfører ofte betydelig vekttap og redusert allmenntilstand. Hovedhensikten med både tumor- og symptomrettet palliativ behandling er å lindre og forebygge plager, slik at pasienten kan ha best mulig livskvalitet og samtidig oppnå forlenget levetid.
En multidisiplinær tilnærming er avgjørende for å vurdere og avhjelpe symptomer knyttet til obstruksjon av galleveier og duodenum, ventrikkelretensjon og kreftrelaterte smerter (Conrad & Lillemoe, 2012). Samarbeid med en palliativ enhet vil være nyttig da mange pasienter kan få behov for mer avansert smertebehandling i form av smertepumper eller nerve blokade (spesielt coeliacus blokade).
Det er et mål at pasienten i størst mulig grad skal kunne være hjemme, eller i nærheten av sitt hjem og sine pårørende, og motta nødvendig smertebehandling og omsorgstjenester der, selv om dette selvsagt ikke må gå på bekostning av adekvat symptomlindring.
Palliativ kirurgi / intervensjon
Sist faglig oppdatert: 05.07.2021
Ikke alle pasienter får symptomer som er plagsomme. Profylaktiske tiltak hos asymptomatiske pasienter er sjelden eller aldri indisert.
Avlastende kirurgi kan vurderes hvis man ikke kommer til målet med andre og mindre invasive tiltak (fortrinnsvis endoskopiske stenter). Det er ingen vitenskapelig støtte for å anbefale omfattende kirurgi i form av pancreatoduodenectomi i en palliativ hensikt (Gillen, Schuster, Friess, & Kleeff, 2012).
Obstruksjon av galleveier
Denne pasientgruppen har gjerne symptomer og funn som er knyttet til obstruksjon av galleveier og/eller duodenal obstruksjon/ventrikkelretensjon. Ikterus alene er ingen sterk indikasjon for galleveisavlastning, men pasienter som er aktuelle for palliativ kjemoterapi må ved ikterus vurderes for galledrenasje siden kjemoterapi fordrer relativt normale bilirubinverdier, dvs. s-bilirubin < 50 µmol/L). Mange pasienter vil som følge av uttalt ikterus kunne få redusert allmenntilstand, kløe, nedsatt appetitt, uttalt tretthet, og eventuelt infeksjon/kolangitt - og en samlet vurdering vil avgjøre indikasjon og tidspunkt for en galleavlastning.
Både endoskopiske og perkutane teknikker er aktuelle for galledrenasje (Costamagna & Pandolfi, 2004; Cote & Sherman, 2010), primært bør ERCP forsøkes for transpapillær stenting (Dumonceau et al., 2018). Selvekspanderende metallstenter (SEMS) bør velges både i en preoperativ og palliativ setting (J. A. Tol et al., 2015). Heldekkede SEMS bør velges i en preoperativ setting og kan også gjerne brukes i en palliativ setting. Dersom det ikke oppnås adekvat drenasje ved ERCP kan det anlegges stent via perkutan tilgang (PTC). EUS-veiledet galledrenasje med SEMS enten via ventrikkel (hepaticogastrostomi) eller duodenum (choledochoduodenostomi) direkte til galleblære eller gallegang er vist å ha klinisk suksess tilsvarende PTC og med færre komplikasjoner, og flere sentra i Norge har denne teknikken tilgjengelig (Dumonceau et al., 2018).
Obstruksjon av ventrikkel og duodenum
Dette var tidligere et rent kirurgisk problem. Introduksjon av endoskopisk plassert selvekspanderende duodenal stent i metall (SEMS) er nå blitt et godt alternativ for mange pasienter (Upchurch, Ragusa, & Cirocchi, 2018). Mange pasienter får dermed reetablert passasjen i øvre del av mage-tarm kanalen, og på den måten kan de innta peroral væske og næring. Minst 80-90 % av pasientene får en god og varig avlastning. Likevel gjenstår det en rekke spørsmål og utfordringer knyttet til sider av denne behandlingen (Larssen, Medhus, & Hauge, 2009), spesielt ved en viss forventet levetid (over 3-4 mnd.). Det er viktig å ha in mente at ikke alle pasienter med symptomer og tegn på ventrikkelretensjon har mekanisk obstruksjon, men ofte gastroparese/tarmparalyse som årsak. Rtg ØVD kan være hensiktsmessig både for differensialdiagnostikk og nivåbestemmelse av eventuell mekanisk obstruksjon
Hvis man under laparotomi med tanke på kurativ kirurgi finner forhold som gjør at det planlagte inngrepet likevel ikke er mulig, kan kirurgisk avlastning av galleveier og ventrikkel være aktuelt. Kirurgisk avlastning av både av galleveier (choledocho/hepatico-jejunostomi) og ventrikkel (gastro-jejunostomi) har tidligere vært anbefalt (Kneuertz et al., 2011). Ny kunnskap indikerer at endoskopisk avlastning med stent hos mange av disse pasientene objektivt vurdert er et minst likeveldig og ofte bedre tilbud (Almadi, Barkun, & Barkun, 2015; Williamsson, Wennerblom, Tingstedt, & Jonsson, 2016). En bedret pre-operativ utredning gjør også at man stadig sjeldnere havner i denne situasjonen, og problemstillingen er kun aktuell hos inntil 10 % av de som blir operert (Kneuertz et al., 2011).
Perkutan gastrostomi, enten endoskopisk (PEG) eller radiologisk, kan overveies hos enkelte pasienter som en mini-invasiv avlastning ved høye (proksimale) tarmobstruksjoner som ikke kan avlastes med stent. PEG sonden kan erstatte en naso-gastrisk sonde, som mange opplever som ubehagelig. PEG gir dessuten mulighet for å drikke, noe pasientene oftest synes er verdifullt.
Coeliacus blokade
Det kan være en utfordring å oppnå god smertelindring hos enkelte pasienter med lokalavansert pancreaskreft. En eldre randomisert studie viste at per-operativ coeliacus blokade i forbindelse med operativ avlastende dobbel by-pass av galleveier og ventrikkel, var effektiv som smertebehandling. I tillegg var det en signifikant bedret overlevelse i gruppen som fikk peroperativ blokade (Lillemoe et al., 1993). Coeliacus blokade kan være et aktuelt tiltak hos pasienter med inoperable svulster eller residiv/metastaser av pancreaskreft. Prosedyren kan gjennomføres laparoskopisk (Strong et al., 2006), men også veiledet av endoskopisk ultralyd (Gress, Schmitt, Sherman, Ikenberry, & Lehman, 1999) og CT (Kambadakone, Thabet, Gervais, Mueller, & Arellano, 2011). MR veiledet blokade (Akural et al., 2013) er også mulig, selv om den kliniske anvendelsen er mindre utbredt.
En nylig publisert Cochrane oversikt konkluderer med at selv om den signifikante forskjellen mellom blokade og medikamentell smertebehandling er relativt liten, har coelicus blokade i den fordelen at den gir færre bivirkninger enn opiatbasert smertebehandling (Arcidiacono, Calori, Carrara, McNicol, & Testoni, 2011).
Anbefalinger:
|
| Evidensgrad |
|---|---|
| I palliativ sammenheng bør obstruksjoner i galleveier og/eller duodenum fortrinnsvis avlastes med endoskopiske stenter. | A |
| Endoskopisk galleavlastning er å foretrekke framfor perkutan transhepatisk tilgang, så lenge endoskopi er mulig og tilgjengelig. | C |
| Selvekspanderende metallstenter (SEMS) er å foretrekke framfor plaststenter for galleavlastning i en palliativ situasjon. | B |
| PEG sonde kan gi en effektiv avlastning av mage-tarmkanalen ved høye obstruksjoner, og også hos pasienter der kirurgisk behandling ikke er aktuell. | C |
| Coeliacusblokade kan være indisert der man ikke oppnår tilfredsstillende lindring med medikamentell smertebehandling eller der denne gir uakseptable bivirkninger. | A |
Palliativ kreftrettet behandling
Sist faglig oppdatert: 08.05.2024
Palliativ kjemoterapi
Pasienter som har metastatisk sykdom på diagnosetidspunktet vil ofte ikke være aktuelle for kjemoterapi – dette på grunn av redusert allmenntilstand og stort vekttap (Bjerregaard et al., 2013).
Hos de som er aktuelle for tumorrettet behandling vil biopsi av primærtumor (ved lokalavansert sykdom) eller eventuelt fra metastaser (ved metastatisk sykdom) være viktig for verifikasjon av diagnosen, men på sikt også for å gi mulighet for supplerende molekylærpatologiske analyser og mer målrettet behandling.
Tidligere har gemcitabine monoterapi vært standard systemisk behandling av pasienter med avansert pancreaskreft (residiv etter primærbehandling, lokalavansert sykdom eller metastatisk sykdom på diagnosetidspunktet). Dette baserte seg på studier (H. Burris & Storniolo, 1997; H. A. Burris et al., 1997) som viste at gemcitabine ga 6 ukers overlevelsesgevinst sammenliknet med 5FU/leukovorin, som tidligere hadde vist å gi en bedret overlevelse på 6 uker sammenlignet med «best supportive care» (Glimelius et al., 1995; Palmer et al., 1994). Det ble lagt spesielt vekt på at 25 % av pasientene i gemcitabine-gruppen hadde såkalt «clinical benefit» (smertereduksjon, vektøkning og bedring i allmenntilstand) sammenliknet med 5 % i 5FU/leukovorin gruppen.
Denne behandlingen gis som gemcitabine en gang ukentlig i 7 uker med påfølgende radiologisk evaluering, evaluering av symptomer og gjerne bestemmelse av tumormarkøren CA 19–9 i uke 8. Ved respons, uttrykt som partiell tumorregress eller stabil sykdom, og god subjektiv toleranse av behandlingen, kontinueres behandlingen. I neste 2‑måneders syklus gis ukentlig behandling i 3 uker, etterfulgt av 1 uke pause før 3 nye behandlingsuker og evaluering i uke 8. Denne behandlingen tolereres subjektivt godt hos de fleste. Den gir lite eller intet håravfall, og begrenset hematologisk toksisitet, men man skal være oppmerksom på trombocytopeni, plagsomme ankelødemer og sjeldnere tilfeller av pneumonitt. Varighet av behandlingen, og om og når behandlingspauser kan eller bør legges inn, avgjøres på bakgrunn av respons og toleranse, men i 1. linje vil man oftest ta sikte på behandling i inntil 6 mnd..
I 2011 publiserte Conroy og medarbeidere en studie hvor 342 pasienter i funksjonsklasse 0–1 med tidligere ubehandlet metastastisk pancreaskreft ble randomisert til gemcitabine alene eller FOLFIRINOX (Conroy et al., 2011). FOLFIRINOX ga en signifikant høyere reponsrate (32 % vs. 9 %), og både median progresjonsfri overlevelse (6.4 mnd. vs. 3.3 mnd.) og median total overlevelse (11.1 mnd. vs. 6.8 mnd.) var høyere. Imidlertid var det også betydelig mer bivirkninger i gruppen som fikk FOLFIRINOX (Gounaris, Zaki, & Corrie, 2010). Denne behandlingen kan være et alternativ hos pasienter med god funksjonsklasse, og tilnærmet normal s-bilirubin.
Gjennomføring av FOLFIRINOX behandlingen etter studieprotokoll forutsetter for de fleste pasienter bruk av vekstfaktor (G-CSF). Erfaring tilsier at en moderat dosereduksjon i FOLFIRINOX regimet gir god toleranse med fortsatt god behandlingsrespons, og ved de fleste institusjoner er det vanlig å gi første kur i 80 % dose for å kartlegge toleransen før man eventuelt øker til 100 % fra kur nummer 2. Internasjonalt blir FOLFIRINOX i økende grad ansett som standard 1. linjebehandling ved metastatisk pancreaskreft.
I en randomisert fase 3 studie ble nab-paclitaxel/gemcitabine kombinasjonen sammenlignet med gemcitabine monoterapi (Von Hoff et al., 2013). Kombinasjonsbehandlingen ga signifikant økt overlevelse, progresjonsfri overlevelse og responsrate sammenlignet med gemcitabine monoterapi. Median økt overlevelse var 1.8 mnd. (8.5 mnd. vs 6.7 mnd.). Kombinasjonsregimet ga også signifikant økte bivirkninger. Det foreligger ingen sammenligning mellom FOLFIRINOX og nab-paclitaxel/ gemcitabine regimene.
Basert på overstående vil man hos pasienter i god funksjonsklasse, der komorbiditet eller alder ikke er til hinder, velge FOLFIRINOX med G-CSF-støttte eller nab-paclitaxel/gemcitabine som 1. linjebehandling i palliativ setting. Ved bruk av FOLFIRINOX kan første kur gis i 80 % dosering og med G-CSF støtte. Hos eldre, eller ved andre kontraindikasjoner mot ovennevnte kombinasjons-regimer, vil gemcitabine monoterapi eller behandling etter Nordic FLOX regimet være aktuelle behandlingsalternativer.
Dokumentasjonen for 2. linjebehandling er begrenset. Sannsynligvis er det pasienter som har hatt god respons og langvarig stabilisering på 1. linjebehandling og som fremdeles er i god funksjonsklasse ved progresjon som har størst nytte av tilbud om 2. linje kjemoterapi. I praksis vil man nok imidlertid forsøke 2. linjebehandling hos pasienter i god funksjonsklasse også ved rask progresjon på 1. linjebehandling i håp om respons på endret regime, men pasienten bør da være i ECOG 0-1.
Hos pasienter som har fått FOLFIRINOX som 1. linjebehandling kan både gemcitabine monoterapi og kombinasjonen nab-paclitaxel/gemcitabine være aktuelt å vurdere som 2. linjebehandling, og hos pasienter som har fått et gemcitabineholdig regime som 1. linjebehandling kan oxaliplatinholdig kjemoterapi (FOLFIRINOX/Nordic FLOX-kurer) eventuelt med dosereduksjon, være et alternativ som 2. linjebehandling.
Tumorrettet behandling krever god oppfølgning, og må evalueres kontinuerlig underveis i forhold til symptomer og effekt på selve tumor. Man må unngå å strekke behandlingen utover det tidspunkt der behandlingen ikke lenger har effekt, og hvor plagsomme bivirkninger og symptomer dominerer.
Vurdering av behandlingsvarighet og doseintensitet på bakgrunn av målbar behandlingseffekt (radiologisk og eventuelt biokjemisk) og pasientens subjektive plager er svært viktig. I praksis evalueres toleranse og klinisk effekt fra kur til kur, mens radiologisk respons evalueres cirka hver 2. mnd. i hele behandlingsperioden.
Anbefalinger:
| Evidensgrad |
|---|---|
Gemcitabine (1000mg/m2 gis i.v. som monoterapi) har gitt økt overlevelse sammenlignet med 5-FU hos pasienter ved avansert sykdom. | A |
FOLFIRINOX som 1. linje gir økt overlevelse hos pasienter i god funksjonsstatus (ECOG 0‑1) sammenlignet med gemcitabine monoterapi. Behandlingen forutsetter nøye oppfølgning av bivirkninger og eventuelle dosejusteringer. Disse pasientene vil vanligvis trenge G-CSF støtte og 1. kur bør vurderes gitt i 80 % dose. | A |
Kombinasjonen nab-paclitaxel/gemcitabine som 1. linje gir økt overlevelse sammenliknet med gemcitabine monoterapi og er et alternativt valg for 1. linje behandling. | A |
2. linjebehandling kan vurderes hos pasienter i god allmenntilstand (funksjonsstatus ECOG 0‑1). Både gemcitabine monoterapi og kombinasjonen nab-paclitaxel/gemcitabine kan være aktuelt som 2. linjebehandling etter FOLFIRINOX/FLOX-kurer gitt i 1. linje. Hos pasienter som har fått et gemcitabineholdig regime som 1. linjebehandling kan oxaliplatinholdig kjemoterapi (FOLFIRINOX/FLOX-kurer) være et alternativ som 2. linjebehandling. Behandlingen kan eventuelt startes med dosereduksjon for å vurdere toleransen. | D |
Palliativ strålebehandling
Hos pasienter med lokalavansert ikke-resektabel pancreaskreft gir strålebehandling kombinert med gemcitabine sammenlignet med gemcitabine alene en marginal økt overlevelse 11.1 mnd. vs. 9.2 mnd., og den progresjonsfrie overlevelsen (PFS) på 6.7 mnd. vs. 6.0 mnd. er lik (Mukherjee et al., 2013). Ettersom gevinsten av supplerende radioterapi var marginal og toksisititen økte betydelig, vil man ikke rutinemessig anbefale strålebehandling fremfor kjemoterapi selv ved lokalisert sykdom. Palliativ strålebehandling med ulike fraksjoneringer vil imidlertid kunne være aktuelt hos enkelte pasienter med symptomgivende primærtumor, lokalt residiv eller metastaser når kjemoterapi ikke er et alternativ grunnet manglende effekt eller toleranse (Ducreux et al., 2015). Lokalisasjon, symptomer, forventet levetid og mulighet for annen avlastende behandling vurderes nøye i slike situasjoner.
Strålebehandling kan være aktuelt for å lindre smertefulle skjelettmetastaser (McQuay, Collins, Carroll, & Moore, 2000). Hypofraksjonert behandling med 8 Gy x 1 kan gis mot skjellettmetastaser der smerter er indikasjonen (Sze, Shelley, Held, & Mason, 2004). Ved frakturfare eller dersom det er risiko for affeksjon av ryggmargen, bør det gis fraksjonert behandling, forslagsvis 3 Gy x 10. Mot bløtvevsmetastaser kan det gis 4-5 Gy fraksjoner til en totaldose på ca 20 Gy eller 3 Gy x 10, avhengig av lokalisasjon, størrelse på målvolumet og forventet levetid. Spesielt ved abdominalfelt er det viktig å ta hensyn til størrelse og lokalisasjon på målvolumet når man doserer og fraksjonerer, på grunn av risiko for plagsomme bivirkninger som kvalme og diaré og eventuelt tarmperforasjon.
Anbefalinger:
| Evidensgrad |
|---|---|
Palliativ strålebehandling kan være aktuelt ved lokaliserte, symptomgivende sykdomsmanifestasjoner (både ved lokale residiv eller metastaser) hos enkelte pasienter. | C |
Ved smertefulle skjelettmetastaser hvor det ikke foreligger frakturfare eller risiko for medullakompresjon, kan det gis hypofraksjonert strålebehandling med 8 Gy x 1. | A |
Ved bløtvevsmetastaser tilpasses fraksjoneringen til lokalisasjon, målvolum og pasientens forventede levetid. Vanlig fraksjonering vil være 4 Gy x 5 eller 3 Gy x 10. | D |
Målrettet behandling/Presisjonsmedisin
Molekylærpatologiske analyser, inkludert genanalyser, av primærtumor eller metastaser kan identifisere spesifikke molekylære forandringer som kan åpne for mer målrettet behandling av pasienter med avansert kreftsykdom. Anbefalinger fra ESMO, ASCO og NCCN understreker viktigheten av å utføre rimelige og tilgjengelige kimbane- og somatiske genetiske analyser tidlig i forløpet hos pasienter med avansert pancreaskreft som kan vurderes for videre systemisk tumorrettet behandling etter progresjon på 1. linjebehandling (Conroy et al., 2023; Mosele et al., 2020; NCCN, 2021; Sohal et al., 2020).
De vanligste patogene somatiske variantene ved pancreaskreft er KRAS (G12D, 40 %) og KRAS (G12V, 30 %), mens kun 6-8 % av svulstene er KRAS wild type (wt). Pasienter med KRAS wt svulster har bedre prognose og de har også en hyppigere forekomst av andre molekylærpatologiske varianter som potensielt kan være tilgjengelig for målrettet behandling. Men om en påvist variant er egnet for målrettet behandling vil imidlertid både være avhengig av at det faktisk foreligger aktuelle medikamenter med potensiell effekt ved den gitte varianten, og om det i så fall finnes godkjente medikamenter for aktuelle indikasjon, tilgjengelige studier eller muligheter for behandling utenfor protokoll («off label»).
Påvist mikrosatelitt instabilitet (MSI) har vist seg å være prediktivt for respons på immunterapi, og mulighet for bedret overlevelse, på tvers av mange ulike kreftformer. Cirka 0.8-1.5 % av pasienter med pancreaskreft vil ha en defekt i reparasjonsproteinene (dMMR/MSI), og kan således ha nytte av behandling med sjekkpunkthemmere (Hu et al., 2018). Sjekkpunkthemmere er internasjonalt godkjent for behandling av pasienter med dMMR/MSI-kreftsykdom uavhengig av utgangspunkt. Samtidig foreligger det få studier der pasienter med pancreaskreft med dMMR/MSI er behandlet med immunterapi. To retrospektive studier, av henholdsvis 31 og 32 pasienter med pancreaskreft med dMMR/MSI, viste responsrater på 50-75 %, hvorav 10-20% hadde komplett respons (Coston et al., 2023; Taieb et al., 2023). De fleste av pasientene med pancreaskreft som får påvist dMMR/MSI vil ha Lynch syndrom, men sporadiske tilfeller kan også forekomme.
Mutasjoner i BRCA1/2, PALB2 og andre HRD-assosierte gener påvises hos 5-10 % av pasientene med pancreaskreft, og kan testes i tumorvev eller i blodprøve (kimbane). Disse genene koder for proteiner, som er kritiske for reparasjon av DNA og har vist seg å være prediktive for økt følsomhet for behandling med platinumholdig kjemoterapi (Pokataev et al., 2020; Rebelatto et al., 2019). Platinumholdig kjemoterapi (som oxaliplatin og cisplatin) foretrekkes som 1.-linjes behandling hos pasienter med BRCA-mutasjon eller andre HRD- assosierte gendefekter- dersom det ikke foreligger kontraindikasjoner. Behandling med poly adenosindifosfat ribose polymerase (PARP) hemmere til metastatisk pancreaskreft som vedlikeholdsbehandling etter respons på FOLFIRINOX har ligget til metodevurdering i Nye metoder siden 2019, men er per april 2024 ikke godkjent for refusjon i Norge (Kindler et al., 2022).
Varianter som eventuelt kan være tilgjengelig for målrettet behandling hos pasienter med pancreaskreft fordeler seg på 5-9 % HRD (inkludert både kimbane og somatiske mutasjoner i BRCA1/2 og PALB2), 3 % Axl mutasjoner, 3 % BRAF mutasjoner, 2 % HER2/ERBB2- amplifikasjon, 1.5 % dMMR/MSI-H, 1 % KRAS (G12C) mutasjoner, 0.5 % NRG1 fusjoner, <0.4 % NTRK fusjoner og <0.2 % ALK translokasjoner (Zheng-Lin & O'Reilly, 2021). Data for effekt av molekylær målrettet behandling ved pancreaskreft er imidlertid svært begrenset, også for behandling rettet mot HRD og dMMR/MSI, og pasienter som får påvist disse sjeldne molekylære variantene i tumorvevet bør om mulig inngå i kliniske studier dersom de skal behandles med målrettet terapi.
I studien IMPRESS Norway brukes molekylærdiagnostikk (genpanelsekvensering) for å finne nye behandlingsmuligheter for pasienter med langtkommen kreftsykdom uavhengig av kreftdiagnose (Helland et al., 2022). Pasienter med avansert pancreaskreft og god almenntilstand bør vurderes henvist til IMPRESS studien ved progress på 1. linjebehandling. Nytten av inklusjon i denne studien for pasienter med avansert pancreaskreft anses å være størst hvis det foreligger MSI eller KRAS wt tumor da øvrige varianter som er tilgjengelige for målrettet terapi er svært sjelden i svulster med påvist KRAS mutasjon. Dette styrker rasjonalet for reflekstesting av MSI-status og KRAS mutasjoner tidlig i forløpet for pasienter som kan være kandidater for systemisk tumorrettet behandling selv om disse genvariantene per i dag ikke umiddelbart medfører andre behandlingsmuligheter. Inklusjon i IMPRESS Norway vil for utvalgte pasienter både kunne åpne for behandling i en av behandlingskohortene i studien og for mulighet til å delta i andre legemiddelstudier hvor spesifikke molekylære forandringer er del av inklusjons - eller eksklusjonsgrunnlaget.
Anbefalinger:
| Evidensgrad | |
| Hos pasienter med borderline resektabel/lokalavansert og metastatisk pancreaskreft som starter 1. linjebehandling kjemoterapi anbefales molekylær patologisk analyse av biopsi fra primær tumor/metastase for avklaring av KRAS mutasjonsstatus og undersøkelser for om det foreligger mikrosatelitt instabililitet i tumor (MSI). Dette bør utføres tidlig i forløpet slik at pasienten kan vurderes for mer målrettet behandling ved svikt i 1. linjesbehandling. Dette understreker viktigheten av å ta gode biopsier før oppstart behandling. | D |
| For pasienter som blir operert for pankreaskreft er residivrisikoen høy og KRAS og MSI status bør derfor også inngå i primæranalysene av operasjonspreparatet dersom pasienten ved et eventuelt tilbakefall anses å kunne være kandidat for systemisk kreftrettet behandling. | D |
Utvidet genpanel analyse (multigen next generation sequencing (NGS)) ved pankreaskreft anbefales ikke rutinemessig og er per i dag kun aktuelt som ledd i forskningsprotokoll(er). | D |
Referanser:
Conroy, T., Pfeiffer, P., Vilgrain, V., Lamarca, A., Seufferlein, T., O'Reilly, E. M., . . . Committee, E. G. (2023). Pancreatic cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up(dagger). Ann Oncol. doi:10.1016/j.annonc.2023.08.009
Coston, T., Desai, A., Babiker, H., Sonbol, M. B., Chakrabarti, S., Mahipal, A., . . . Starr, J. S. (2023). Efficacy of Immune Checkpoint Inhibition and Cytotoxic Chemotherapy in Mismatch Repair-Deficient and Microsatellite Instability-High Pancreatic Cancer: Mayo Clinic Experience. JCO Precis Oncol, 7, e2200706. doi:10.1200/PO.22.00706
Helland, A., Russnes, H. G., Fagereng, G. L., Al-Shibli, K., Andersson, Y., Berg, T., . . . Smeland, S. (2022). Improving public cancer care by implementing precision medicine in Norway: IMPRESS-Norway. J Transl Med, 20(1), 225. doi:10.1186/s12967-022-03432-5
Hu, Z. I., Shia, J., Stadler, Z. K., Varghese, A. M., Capanu, M., Salo-Mullen, E., . . . O'Reilly, E. M. (2018). Evaluating Mismatch Repair Deficiency in Pancreatic Adenocarcinoma: Challenges and Recommendations. Clin Cancer Res, 24(6), 1326-1336. doi:10.1158/1078-0432.CCR-17-3099
Kindler, H. L., Hammel, P., Reni, M., Van Cutsem, E., Macarulla, T., Hall, M. J., . . . Golan, T. (2022). Overall Survival Results From the POLO Trial: A Phase III Study of Active Maintenance Olaparib Versus Placebo for Germline BRCA-Mutated Metastatic Pancreatic Cancer. J Clin Oncol, 40(34), 3929-3939. doi:10.1200/JCO.21.01604
Mosele, F., Remon, J., Mateo, J., Westphalen, C. B., Barlesi, F., Lolkema, M. P., . . . Andre, F. (2020). Recommendations for the use of next-generation sequencing (NGS) for patients with metastatic cancers: a report from the ESMO Precision Medicine Working Group. Ann Oncol, 31(11), 1491-1505. doi:10.1016/j.annonc.2020.07.014
NCCN. (2021). Pancreatic adenocarcinoma, Version 2. 2021, NCCN Practice Guidelines in Oncology.
Pokataev, I., Fedyanin, M., Polyanskaya, E., Popova, A., Agafonova, J., Menshikova, S., . . . Tjulandin, S. (2020). Efficacy of platinum-based chemotherapy and prognosis of patients with pancreatic cancer with homologous recombination deficiency: comparative analysis of published clinical studies. ESMO Open, 5(1), e000578. doi:10.1136/esmoopen-2019-000578
Rebelatto, T. F., Falavigna, M., Pozzari, M., Spada, F., Cella, C. A., Laffi, A., . . . Fazio, N. (2019). Should platinum-based chemotherapy be preferred for germline BReast CAncer genes (BRCA) 1 and 2-mutated pancreatic ductal adenocarcinoma (PDAC) patients? A systematic review and meta-analysis. Cancer Treat Rev, 80, 101895. doi:10.1016/j.ctrv.2019.101895
Sohal, D. P. S., Kennedy, E. B., Cinar, P., Conroy, T., Copur, M. S., Crane, C. H., . . . Laheru, D. (2020). Metastatic Pancreatic Cancer: ASCO Guideline Update. J Clin Oncol, 38(27), 3217-3230. doi:10.1200/JCO.20.01364
Taieb, J., Sayah, L., Heinrich, K., Kunzmann, V., Boileve, A., Cirkel, G., . . . Pilla, L. (2023). Efficacy of immune checkpoint inhibitors in microsatellite unstable/mismatch repair-deficient advanced pancreatic adenocarcinoma: an AGEO European Cohort. Eur J Cancer, 188, 90-97. doi:10.1016/j.ejca.2023.04.012
Zheng-Lin, B., & O'Reilly, E. M. (2021). Pancreatic ductal adenocarcinoma in the era of precision medicine. Semin Oncol, 48(1), 19-33. doi:10.1053/j.seminoncol.2021.01.005
Annen palliativ behandling
Sist faglig oppdatert: 05.07.2021
Symptomrettet palliativ behandling
I tillegg til symptomer som er relatert til malign obstruksjon i mage-tarm kanalen, forekommer ofte symptomer som smerter, depresjon, kvalme, munntørrhet, ascites og dyspnoe hos pasienter med pancreaskreft.
For generelle medikamentelle behandlingsprinsipper av disse symptomene viser vi til:
Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen (Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen, 2014) http://helsedirektoratet.no/publikasjoner/nasjonalt-handlingsprogram-med-retningslinjer-for-palliasjon-i-kreftomsorgen-/Sider/default.aspx.
Støttebehandling
Ernæring
Redusert allmenntilstand og vekttap/kakeksi er ofte framtredende hos pasienter med pancreaskreft (Gärtner et al., 2016). Man må skille mellom primær og sekundær kakeksi (Nordøy, Thoresen, Kvikstad, & Svensen, 2006), selv om det ofte vil være komponenter av begge ved pancreaskreft. Primær kakeksi er en følge av metabolske forstyrrelser utløst av kreftsykdommen, hvor bl.a. appetittreguleringen blir påvirket. Vekttapet forklares ikke ved for lite matinntak, men ved endret metabolisme (Fearon et al., 2011). Den endrete metabolismen fører bl.a. til større tap av muskelmasse enn ved vanlig underernøæring, og innebærer at ernæringsbehandling ikke gir forventet vektøkning og bedring av ernæringsstatus (Stewart, Skipworth, & Fearon, 2006). Det finnes i dag ingen behandling som kan reversere primær kakeksi.
Ved sekundær kakeksi er metabolismen normal, men matinntaket er redusert eller tapet av næringsstoffer forhøyet.
Årsaker til sekundær kakeksi kan være:
- for lite matinntak på grunn av symptomer som smerter, kvalme, oppkast, smaks-forandringer, munntørrhet, svelgvansker, obstipasjon, psykososiale faktorer osv.,
- økt tap eller økte behov sekundært til diaré, malabsorbsjon, ascites, infeksjoner etc eller
- tap av muskelmasse som følge av immobilisering.
Pasientenes ernæringsstatus bør kartlegges tidlig og følges opp, gjerne av ernæringsfysiolog (Vashi, Popiel, Lammersfeld, & Gupta, 2015). Mange pasienter kan ha nytte av perorale næringstilskudd, spesielt i en tidlig fase av sykdommen. De viktigste målene for ernæringstiltak i forbindelse med pancreaskreft er å opprettholde tilfredsstillende vekt og aktivitetsnivå.
Medikamentelle tiltak mot sekundær kakeksi som kan bidra til å motvirke vekttap og forebygge underernæring (Yavuzsen, Davis, Walsh, LeGrand, & Lagman, 2005).
- Kortikosteroider kan øke appetitten, redusere kvalme og smerter, og bidra til at pasienten føler seg bedre, men effekten opphører vanligvis etter noen uker.
Dose: 20–40 mg prednisolon, eller tilsvarende, per dag i 2–4 uker. Seponeres ved manglende effekt. - Metoklopramid øker ventrikkeltømmingen og lindrer tidlig metthetsfølelse og kvalme.
Dose: 10 mg en halv time før hvert hovedmåltid inntil 3 ganger daglig.
Aktiv ernærings- og væskebehandling vil i all hovedsak gjelde pasienter som har forventet levetid over 2–3 mnd. og der andre tiltak er prøvd uten effekt (Arends et al., 2006). Ved forventet levetid under 2-3 mnd. er sondeernæring eller intravenøs ernæring vanligvis ikke indisert (Plonk & Arnold, 2005). Det finnes imidlertid unntak, som å hjelpe pasienten gjennom et operativt inngrep, en infeksjon eller annen komplikasjon eller ved obstruksjon av GI-tractus tidlig i sykdomsforløpet. Det er vanlig å stoppe eller redusere mengden ernæring hvis pasienten begynner å akkumulere væske, får bivirkninger av behandlingen eller ikke lenger gjør seg nytte av ernæring (primær kakeksi). Det foreligger ingen randomiserte studier som belyser effekten av parenteral ernæring i (Good, Cavenagh, Mather, & Ravenscroft, 2008) palliativ fase, og kun få studier som har undersøkt parenteral væskebehandling.
I den aller siste fasen vil de fleste pasienter ikke føle sult (Dy, 2006). Væskebehandling i terminalfasen er også omdiskutert. Hvis det er indikasjon for hydrering, er det tilstrekkelig med 500–1000 ml væske per døgn. Væske kan eventuelt gis subcutant. Tørr munn skal behandles ved munnstell, da dette ikke nødvendigvis lindres ved parenteral væsketilførsel (Nordøy et al., 2006).
Anbefalinger:
|
| Evidensgrad |
|---|---|
| Tiltak som kan bidra til ivaretakelse av ernæringsstatus (kartlegging, veiledning, perorale kosttilskudd, apetittstimulerende medikamenter) er viktig tidlig i sykdomsforløpet. | B |
| Enteral ernæring er å foretrekke framfor intravenøs. | B |
| Aktiv (intravenøs eller via sonde) ernærings- og væskebehandling for en begrenset periode, kan vurderes i situasjoner hvor pasienten ikke klarer å ta til seg nok selv og dette forringer livskvaliteten. | D |
| I den aller siste fasen av sykdommen er det ikke nødvendig å fokusere på dekning av ernæringsbehov. Hydrering med 500–1000 ml væske i.v. eller s.c. per døgn gis dersom dette bedrer pasientens symptomer. | C |
Metode og prosess
Hva er nasjonale retningslinjer?
Sist faglig oppdatert: 05.07.2021
I henhold til Nasjonal helseplan (2007–2010) (Nasjonal helseplan (2007-2010), 2006) har Helsedirektoratet en normerende rolle for helsetjenesten på tvers av helseregioner og tjenestenivå. Helsedirektoratet har en koordinerende rolle for å utvikle overordnede referanserammer for kreftomsorgen, sammen med de regionale helseforetakene, kommunene og andre relevante myndighetsorganer og tjenester.
Lov om kommunale helse- og omsorgstjenester (Lov om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven). LOV-2011-06-24-30) § 12‑5 fastslår at Helsedirektoratet er eneste aktør med mandat til å utvikle, formidle og vedlikeholde nasjonale faglige retningslinjer og veiledere.
De nasjonale faglige retningslinjene inneholder systematisk utviklede faglige anbefalinger som etablerer en nasjonal standard for utredning, behandling og oppfølging av pasientgrupper, brukergrupper eller diagnosegrupper. Nasjonale faglige retningslinjer er et virkemiddel for å bidra til at helse- og omsorgstjenestene:
- har god kvalitet
- gjør riktige prioriteringer
- ikke har uønsket variasjon i tjenestetilbudet
- løser samhandlingsutfordringer
- tilbyr helhetlige pasientforløp
Nasjonale faglige retningslinjer gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet. Sentrale fagmiljøer og tjenestemottakere er aktivt involvert i utarbeidelsen.
Helsepersonell og alle deler av helse- og omsorgstjenesten er forpliktet til å yte forsvarlig helsehjelp. Retningslinjer, anerkjent fagkunnskap og allmenngyldige samfunnsetiske normer inngår som aksepterte grunnlag for vurdering av hva som er faglig forsvarlig. Retningslinjer er ment som et hjelpemiddel ved avveiningene tjenesteyterne må gjøre for å oppnå forsvarlig og god kvalitet i tjenesten. De er ikke rettslig bindende, men faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet. Helsepersonell må likevel vise faglig skjønn i vurderingen av hver enkelt pasient for å ta hensyn til individuelle behov. Dersom helsepersonell eller institusjoner velger å fravike anbefalinger i en retningslinje, skal dette dokumenteres og begrunnes.
Helsetjenestens eiere og ledelse har ansvar for tilrettelegging av virksomheten slik at anbefalinger gitt i nasjonale faglige retningslinjer kan følges.
Kunnskapsbasert prosess
Sist faglig oppdatert: 05.07.2021
Helsedirektoratet legger til grunn at alle nasjonale retningslinjer skal være utarbeidet etter en metode med vekt på forskningsbasert kunnskap, tydelig og tilgjengelig dokumentasjon, brukermedvirkning, tverrfaglighet, fokus på praksis, implementering og oppdatering.
Det er en omfattende prosess å lage gode retningslinjer som tilfredsstiller krav til prosess, metode og transparens som er det nivå Helsedirektoratet og andre liknende organisasjoner har lagt til grunn for utforming av anbefalinger.
Helsedirektoratet ønsker i arbeidet med nasjonale retningslinjer for kreftbehandling å bygge på det arbeid faggruppene tilsluttet Onkologisk Forum i en årrekke har gjort med å lage behandlingsveiledere.
I dette retningslinjearbeidet har arbeidsgruppen og Kunnskapssenteret samarbeidet på følgende måte for å sikre en god håndtering av kunnskapsgrunnlaget for anbefalingene:
I en tidlig fase av arbeidet har arbeidsgruppen avklart hva retningslinjene skal omfatte når det gjelder diagnostikk, behandling og oppfølging av pancreaskreft.
Kunnskapssenteret har i samarbeid med arbeidsgruppen gjennomgått de faglige anbefalinger med hensyn til metode og hvilket kunnskapsgrunnlag de er basert på.
Arbeidsgruppen har i samarbeid med Helsedirektoratet og Kunnskapssenteret vurdert hvilke områder det har vært behov for kunnskapsstøtte fra Kunnskapssenteret.
Kunnskapssenteret har identifisert og formidlet kunnskapsbaserte internasjonale retningslinjer og systematiske oversikter til arbeidsgruppen, ved søk på følgende nettsteder:
Søk etter retningslinjer:
Guidelines international network: http://www.g-i-n.net/
NICE, UK: http://www.nice.org.uk/page.aspx?o=home
SIGN, Scotland: http://www.sign.ac.uk/
AHRQ, US: http://www.guideline.gov/
Cancer care Ontario: http://www.cancercare.on.ca/
Søk etter systematiske oversikter:
CRD-databasene: http://www.crd.york.ac.uk/crdweb/
Cochrane Library: http://www.mrw.interscience.wiley.com/cochrane/cochrane_search_fs.html
Clinical evidence: http://www.clinicalevidence.com/ceweb/conditions/index.jsp
Det er gjort litteratursøk etter primærstudier i PubMed og Medline.
Gradering av kunnskapsgrunnlaget
Sist faglig oppdatert: 05.07.2021
Ved utarbeiding av nasjonale retningslinjer stilles det krav om at all relevant kunnskap på området hentes frem, beskrives og vurderes på en systematisk og åpen måte.
I denne versjonen av retningslinjen har man anvendt gradering av evidensnivå (A–D) for å vise hvilket vitenskapelig grunnlag kunnskapen er basert på.
| Studietype | Evidensnivå | Gradering av evidensnivå |
|---|---|---|
| Kunnskap som bygger på systematiske oversikter og meta-analyser av randomiserte kontrollerte studier | Nivå 1a
Nivå 1b | A |
| Kunnskap som bygger på minst én godt utformet kontrollert studie uten randomisering | Nivå 2a
Nivå 2b | B |
| Kunnskap som bygger på godt utformede ikke eksperimentelle beskrivende studier, som sammenlignende studier, korrelasjonsstudier og case studier | Nivå 3 | C |
| Kunnskap som bygger på rapporter eller oppfatninger fra eksperter, komiteer og/eller klinisk ekspertise hos respekterte autoriteter | Nivå 4 | D |
Kunnskapsgrunnlaget i disse retningslinjene er gradert i henhold til tabellen over. I disse retningslinjene er kun kunnskapsgrunnlaget og ikke anbefalingene gradert. Hvis selve anbefalingene skal graderes, (for eksempel ved bruk av GRADE-systemet, må man, i tillegg til å ha vurdert kunnskapsgrunnlaget, også legge inn en vurdering av både kost-nytte og andre forhold (klinisk erfaring, skjønn, etikk, osv.). Dette er ikke gjort eksplisitt i forbindelse med dette arbeidet, og anbefalingene er derfor ikke gradert.
For å indikere kunnskapsgrunnlaget for våre anbefalinger, har vi brukt gradering A–D. En anbefaling som er anført med D behøver derfor ikke å være en svakere anbefaling enn en som er anført A, B eller C. Det henspeiler kun til kunnskapsgrunnlaget anbefalingen er basert på. I enkelte sammenhenger vil klinisk erfaring og gjeldende praksis være et godt grunnlag for anbefalingen. I andre sammenhenger er det uttrykk for at det ikke finnes tilstrekkelig vitenskapelig dokumentasjon for anbefalingen, selv om det hadde vært ønskelig.
Bakgrunn og arbeidsprosess ved 1. utgave (januar 2014)
Sist faglig oppdatert: 05.07.2021
Utvikling av de nasjonale handlingsprogrammene for kreftbehandling har vært et viktig tiltak under Nasjonal strategi for kreftområdet (2006–2009) (forlenget til 2011) (Nasjonal strategi for kreftområdet 2006-2009, 2006). Og videre utvikling av de nasjonale handlingsprogrammene er en kjerneoppgave i oppfølging av Nasjonal Kreftstrategi 2013–2017 – Sammen mot kreft.
Nasjonale handlingsprogrammer for kreftbehandling skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
Nasjonale faggrupper tilsluttet Onkologisk Forum har i en årrekke arbeidet med og utviklet behandlingsveiledere og handlingsprogram for ulike krefttyper. Helsedirektoratet har tatt utgangspunkt i, og bygget på dette arbeidet.
Helsedirektoratet rettet derfor høsten 2011 en henvendelse til NGICG og ba om forslag til representanter til en arbeidsgruppe som skulle settes sammen av legespesialister fra relevante spesialiteter. Alle nødvendige faggrupper og alle helseregioner skulle være representert.
Helsedirektoratet oversendte forslag til sammensetning av arbeidsgruppen til de regionale helseforetakene (RHF-ene), og medlemmene av gruppen er deretter oppnevnt av sine RHF. RHF-ene ble også bedt om at fagfolkene innenfor rammen av sin arbeidstid ble fristilt til retningslinjearbeidet, i henhold til tidligere Oppdragsdokument fra Helse- og omsorgsdepartementet.
Kunnskapssenteret har bistått gruppen med metodestøtte, søk og gradering av kunnskapsgrunnlaget.
Styret for Norsk Gastrointestinal Cancer Gruppe (NGICG) har hatt handlingsprogrammet til vurdering og gitt innspill til arbeidsgruppen før utkast ble sendt Helsedirektoratet.
Arbeidsgruppen leverte i juni 2013 forslag til retningslinjer for diagnostikk, behandling og oppfølgning av pancreaskreft til direktoratet. Helsedirektoratet og Kunnskapssenteret ferdigstilte i samarbeid med arbeidsgruppen et høringsutkast som ble sendt på høring i august 2013 til landets fire regionale helseforetak (RHF-ene), Den norske legeforening, Kreftforeningen og Norsk Gastrointestinal Cancer Gruppe (NGICG). Etter høring vurderte arbeidsgruppen og Helsedirektoratet høringsinnspillene og justerte handlingsprogrammet. Endelig utgave ble ferdigstilt og publisert av Helsedirektoratet i januar 2014.
Arbeidsgruppe – 1. og 2. utgave av handlingsprogrammet
- Jon Arne Søreide, Avdeling for gastroenterologisk kirurgi, Stavanger universitetssjukehus, Stavanger (leder)
- Jon Erik Grønbech, Avdeling for gastroenterologisk kirurgi, St. Olavs Hospital, Universitetssykehuset i Trondheim
- Ivar Gladhaug, Avdeling for gastroenterologisk kirurgi, Oslo universitetssykehus, Rikshospitalet, Oslo
- Kristoffer Lassen, Avdeling for gastroenterologisk kirurgi, Universitetssykehuset i Nord-Norge, Tromsø
- Svein Dueland, Kreftklinikken, Oslo universitetssykehus, Oslo
- Rune Smaaland, Avdeling for kreft- og blodsykdommer, Stavanger universitetssjukehus, Stavanger
- Truls Hauge, Gastromedisinsk avdeling, Oslo universitetssykehus, Ullevål, Oslo
- Marit Olstad, Klinikk for Bildediagnostikk, St. Olavs Hospital, Trondheim
- Anders Drolsum, Avdeling for Radiologi og Nukleærmedisin, Oslo universitetssykehus, Ullevål, Oslo
- Tor Jakob Eide, Avdeling for patologi, Oslo universitetssykehus, Rikshospitalet, Oslo
Åse Skår og Marianne Klemp, Nasjonalt kunnskapssenter for helsetjenesten, har bistått gruppen med metodestøtte, litteratursøk og gradering av kunnskapsgrunnlaget
Arbeidsgruppe – 3. utgave av handlingsprogrammet
- Jon Arne Søreide (leder), Avd. for gastroenterologisk kirurgi, Stavanger universitetssjukehus, Stavanger
- Jon Erik Grønbech, Avd. for gastroenterologisk kirurgi, St. Olavs Hospital, Universitetssykehuset i Trondheim.
- Kristoffer Lassen, Avd. for gastroenterologisk – & HPB-kirurgi og barnekirurgi, Oslo universitetssykehus, Rikshospitalet, Oslo
- Svein Dueland Kreftklinikken, Oslo universitetssykehus, Oslo & Avd. for blod og kreftsykdommer, Stavanger Universitetssjukehus, Stavanger
- Marit Olstad, Radiologisk avdeling, St. Olavs Hospital, Universitetssykehuset i Trondheim.
- Caroline Verbeke, Avdeling for patologi, Oslo universitetssykehus, Rikshospitalet, Oslo
Arbeidsgruppe – 4. og 5. utgave av handlingsprogrammet
- Jon Arne Søreide (leder), Avd. for gastroenterologisk kirurgi, Stavanger universitetssjukehus, Stavanger
- Jon Erik Grønbech, Avd. for gastroenterologisk kirurgi, St. Olavs Hospital, Universitetssykehuset i Trondheim.
- Kristoffer Lassen, Avd. for gastroenterologisk – & HPB-kirurgi og barnekirurgi, Oslo universitetssykehus, Rikshospitalet, Oslo
- Svein Dueland Kreftklinikken, Oslo universitetssykehus, Oslo & Avd. for blod og kreftsykdommer, Stavanger Universitetssjukehus, Stavanger
- Marit Olstad, Radiologisk avdeling, St. Olavs Hospital, Universitetssykehuset i Trondheim.
- Caroline Verbeke, Avdeling for patologi, Oslo universitetssykehus, Rikshospitalet, Oslo
Oppdatering av handlingsprogrammet 2021, 6. utgave
Sist faglig oppdatert: 05.07.2021
Arbeidsgruppe – 6. utgave
- Knut Jørgen Labori (leder), Avd. for gastro- og barnekirurgi, Oslo universitetssykehus, Rikshospitalet, Oslo
- Erling A. Bringeland, Avd. for gastroenterologisk kirurgi, St. Olavs Hospital, Universitetssykehuset i Trondheim
- Kim Mortensen, Avdeling for gastroenterologisk kirurgi, Universitetssykehuset i Nord-Norge, Tromsø
- Svein Dueland, Kreftklinikken, Oslo universitetssykehus, Oslo & Avd. for blod og kreftsykdommer, Stavanger Universitetssjukehus, Stavanger
- Inger Marie Løes, Avdeling for kreftbehandling og medisinsk fysikk, Haukeland universitetssjukehus
- Synnøve Nordermoen, Radiologisk avdeling, St. Olavs Hospital, Universitetssykehuset i Trondheim.
- Caroline Verbeke, Avdeling for patologi, Oslo universitetssykehus, Rikshospitalet, Oslo
Habilitet
Sist faglig oppdatert: 05.07.2021
Arbeidsgruppenes medlemmer har i forbindelse med arbeidet bedt om å oppgi potensielle interessekonflikter. Helsedirektoratet har vurdert arbeidsgruppens medlemmer som habile i forhold til arbeid med dette nasjonale handlingsprogrammet.
Oppdatering av retningslinjene
Sist faglig oppdatert: 05.07.2021
Utviklingen av ny behandling på kreftområdet går raskt. Handlingsprogrammet vil vurderes årlig og om nødvendig oppdateres.
Oppdateringen utføres av en arbeidsgruppe som består av fagpersoner oppnevnt av RHF-ene og Helsedirektoratet. Kunnskapssenteret i Folkehelseinstituttet skal også bidra i arbeid med oppdatering av handlingsprogrammet.
De oppdaterte retningslinjene vil publiseres på www.helsedirektoratet.no og helsebiblioteket.no (web-versjon).
NGICG eller arbeidsgruppen kontakter Helsedirektoratet dersom det er behov for å oppdatere handlingsprogrammet oftere enn årlig.
Addendum
Forslag til mal for strukturert radiologi rapport av adenokarsinom i pancreas
Sist faglig oppdatert: 05.07.2021
Forslag til mal for strukturert patologi rapport av adenokarsinom etter pancreasreseksjon
Sist faglig oppdatert: 05.07.2021
Referanser
Sist faglig oppdatert: 05.07.2021
(CAP), C. o. A. P. Protocol for the examination of specimens from patients with carcinoma of the pancreas.https://documents.cap.org/protocols/cp-gihepatobiliary-pancreas-exocrine-17protocol-4001.pdf
Adiamah, A., Arif, Z., Berti, F., Singh, S., Laskar, N., & Gomez, D. (2019). The Use of Prophylactic Somatostatin Therapy Following Pancreaticoduodenectomy: A Meta-analysis of Randomised Controlled Trials. World J Surg, 43(7), 1788-1801. https://doi.org/10.1007/s00268-019-04956-6
Adsay, V., Mino-Kenudson, M., Furukawa, T., Basturk, O., Zamboni, G., Marchegiani, G., . . . Hruban, R. H. (2016). Pathologic Evaluation and Reporting of Intraductal Papillary Mucinous Neoplasms of the Pancreas and Other Tumoral Intraepithelial Neoplasms of Pancreatobiliary Tract: Recommendations of Verona Consensus Meeting. Ann Surg, 263(1), 162-177. https://doi.org/10.1097/sla.0000000000001173
Akural, E., Ojala, R. O., Jarvimaki, V., Kariniemi, J., Tervonen, O. A., & Blanco Sequeiros, R. (2013). MR-guided Neurolytic Celiac Plexus Ablation: An Evaluation of Effects and Injection Spread Pattern in Cancer Patients with Celiac Tumor Infiltration. Cardiovasc Intervent Radiol, 36(2), 472-478. https://doi.org/10.1007/s00270-012-0417-x
Al-Hawary, M. M., Francis, I. R., Chari, S. T., Fishman, E. K., Hough, D. M., Lu, D. S., . . . Simeone, D. M. (2014). Pancreatic ductal adenocarcinoma radiology reporting template: consensus statement of the Society of Abdominal Radiology and the American Pancreatic Association. Radiology, 270(1), 248-260. https://doi.org/10.1148/radiol.13131184
Allen, V. B., Gurusamy, K. S., Takwoingi, Y., Kalia, A., & Davidson, B. R. (2013). Diagnostic accuracy of laparoscopy following computed tomography (CT) scanning for assessing the resectability with curative intent in pancreatic and periampullary cancer. Cochrane Database Syst Rev, (11), CD009323. https://doi.org/10.1002/14651858.CD009323.pub2
Almadi, M. A., Barkun, J. S., & Barkun, A. N. (2015). Stenting in Malignant Biliary Obstruction. Gastrointest Endosc Clin N Am, 25(4), 691-711. https://doi.org/10.1016/j.giec.2015.06.002
Alsamarrai, A., Das, S. L., Windsor, J. A., & Petrov, M. S. (2014). Factors that affect risk for pancreatic disease in the general population: a systematic review and meta-analysis of prospective cohort studies. Clin Gastroenterol Hepatol, 12(10), 1635-1644.e1635; quiz e1103. https://doi.org/10.1016/j.cgh.2014.01.038
American College of Surgeons and the Alliance for Clinical Trials in Oncology, Nelson, H., Hunt, K. K., Veeramachaneni, N., Blair, S., Chang, G., & Halverson, A. (red.). (2015). Operative Standards for Cancer Surgery: Volume 1: Breast, lung,pancreas, colon. Philadelphia: Walters Kluver.
Amin, Z., Theis, B., Russell, R. C., House, C., Novelli, M., & Lees, W. R. (2006). Diagnosing pancreatic cancer: the role of percutaneous biopsy and CT. Clin Radiol, 61(12), 996-1002.
Arcidiacono, P. G., Calori, G., Carrara, S., McNicol, E. D., & Testoni, P. A. (2011). Celiac plexus block for pancreatic cancer pain in adults. Cochrane Database Syst Rev, (3), CD007519. https://doi.org/10.1002/14651858.CD007519.pub2
Arends, J., Bodoky, G., Bozzetti, F., Fearon, K., Muscaritoli, M., Selga, G., . . . Espen. (2006). ESPEN Guidelines on Enteral Nutrition: Non-surgical oncology. Clin Nutr, 25(2), 245-259. https://doi.org/10.1016/j.clnu.2006.01.020
Asbun, H. J., Conlon, K., Fernandez-Cruz, L., Friess, H., Shrikhande, S. V., Adham, M., . . . International Study Group of Pancreatic, S. (2014). When to perform a pancreatoduodenectomy in the absence of positive histology? A consensus statement by the International Study Group of Pancreatic Surgery. Surgery, 155(5), 887-892. https://doi.org/10.1016/j.surg.2013.12.032
Ballehaninna, U. K., & Chamberlain, R. S. (2012). The clinical utility of serum CA 19-9 in the diagnosis, prognosis and management of pancreatic adenocarcinoma: An evidence based appraisal. J Gastrointest Oncol, 3(2), 105-119. https://doi.org/10.3978/j.issn.2078-6891.2011.021
Bassi, C., Dervenis, C., Butturini, G., Fingerhut, A., Yeo, C., Izbicki, J., . . . International Study Group on Pancreatic Fistula, D. (2005). Postoperative pancreatic fistula: an international study group (ISGPF) definition. Surgery, 138(1), 8-13.
Basturk, O., Hong, S. M., Wood, L. D., Adsay, N. V., Albores-Saavedra, J., Biankin, A. V., . . . Furukawa, T. (2015). A Revised Classification System and Recommendations From the Baltimore Consensus Meeting for Neoplastic Precursor Lesions in the Pancreas. Am J Surg Pathol, 39(12), 1730-1741. https://doi.org/10.1097/pas.0000000000000533
Ben, Q., Xu, M., Ning, X., Liu, J., Hong, S., Huang, W., . . . Li, Z. (2011). Diabetes mellitus and risk of pancreatic cancer: A meta-analysis of cohort studies. Eur J Cancer, 47(13), 1928-1937. https://doi.org/10.1016/j.ejca.2011.03.003
Bilimoria, K. Y., Bentrem, D. J., Ko, C. Y., Tomlinson, J. S., Stewart, A. K., Winchester, D. P., & Talamonti, M. S. (2007). Multimodality therapy for pancreatic cancer in the U.S. : utilization, outcomes, and the effect of hospital volume. Cancer, 110(6), 1227-1234.
Bjerregaard, J. K., Mortensen, M. B., Schonnemann, K. R., & Pfeiffer, P. (2013). Characteristics, therapy and outcome in an unselected and prospectively registered cohort of pancreatic cancer patients. Eur J Cancer, 49(1), 98-105. https://doi.org/10.1016/j.ejca.2012.07.017
Bockhorn, M., Uzunoglu, F. G., Adham, M., Imrie, C., Milicevic, M., Sandberg, A. A., . . . Izbicki, J. R. (2014). Borderline resectable pancreatic cancer: a consensus statement by the International Study Group of Pancreatic Surgery (ISGPS). Surgery, 155(6), 977-988. https://doi.org/10.1016/j.surg.2014.02.001
Bond-Smith, G., Banga, N., Hammond, T. M., & Imber, C. J. (2012). Pancreatic adenocarcinoma. Bmj, 344, e2476. https://doi.org/10.1136/bmj.e2476
Bray, F., Ferlay, J., Soerjomataram, I., Siegel, R. L., Torre, L. A., & Jemal, A. (2018). Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin, 68(6), 394-424. https://doi.org/10.3322/caac.21492
Brennan, M. F., Pisters, P. W., Posner, M., Quesada, O., & Shike, M. (1994). A prospective randomized trial of total parenteral nutrition after major pancreatic resection for malignancy. Ann Surg, 220(4), 436-441.
Brugge, W., Dewitt, J., Klapman, J. B., Ashfaq, R., Shidham, V., Chhieng, D., . . . Staerkel, G. (2014). Techniques for cytologic sampling of pancreatic and bile duct lesions. Diagn Cytopathol, 42(4), 333-337. https://doi.org/10.1002/dc.23096
Burris, H., & Storniolo, A. M. (1997). Assessing clinical benefit in the treatment of pancreas cancer: gemcitabine compared to 5-fluorouracil. Eur J Cancer, 33(Suppl 1), S18-S22.
Burris, H. A., Moore, M. J., Andersen, J., Green, M. R., Rothenberg, M. L., Modiano, M. R., . . . Von Hoff, D. D. (1997). Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol, 15(6), 2403-2413.
Callery, M. P., Chang, K. J., Fishman, E. K., Talamonti, M. S., William Traverso, L., & Linehan, D. C. (2009). Pretreatment assessment of resectable and borderline resectable pancreatic cancer: expert consensus statement. Ann Surg Oncol, 16(7), 1727-1733. https://doi.org/10.1245/s10434-009-0408-6
Campell, F., & Verbeke, C. S. (2013). Pathology of the pancreas: a practical approach. London: Springer.
Carioli, G., Bertuccio, P., Boffetta, P., Levi, F., La Vecchia, C., Negri, E., & Malvezzi, M. (2020). European cancer mortality predictions for the year 2020 with a focus on prostate cancer. Ann Oncol, 31(5), 650-658. https://doi.org/10.1016/j.annonc.2020.02.009
Cascinu, S., Falconi, M., Valentini, V., & Jelic, S. (2010). Pancreatic cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 21(Suppl 5), v55-58. https://doi.org/10.1093/annonc/mdq165
Chandrasegaram, M. D., Goldstein, D., Simes, J., Gebski, V., Kench, J. G., Gill, A. J., . . . Barbour, A. P. (2015). Meta-analysis of radical resection rates and margin assessment in pancreatic cancer. Br J Surg, 102(12), 1459-1472. https://doi.org/10.1002/bjs.9892
Christians, K. K., Tsai, S., Tolat, P. P., & Evans, D. B. (2013). Critical steps for pancreaticoduodenectomy in the setting of pancreatic adenocarcinoma. J Surg Oncol, 107(1), 33-38. https://doi.org/10.1002/jso.23166
Cloyd, J. M., Shen, C., Santry, H., Bridges, J., Dillhoff, M., Ejaz, A., . . . Tsung, A. (2020). Disparities in the Use of Neoadjuvant Therapy for Resectable Pancreatic Ductal Adenocarcinoma. J Natl Compr Canc Netw, 18(5), 556-563. https://doi.org/10.6004/jnccn.2019.7380
Conrad, C., & Lillemoe, K. D. (2012). Surgical palliation of pancreatic cancer. Cancer J, 18(6), 577-583. https://doi.org/10.1097/PPO.0b013e3182797dfe
Conroy, T., Desseigne, F., Ychou, M., Bouche, O., Guimbaud, R., Becouarn, Y., . . . Ducreux, M. (2011). FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med, 364(19), 1817-1825.
Conroy, T., Hammel, P., Hebbar, M., Ben Abdelghani, M., Wei, A. C., Raoul, J. L., . . . the Unicancer, G. I. P. G. (2018). FOLFIRINOX or Gemcitabine as Adjuvant Therapy for Pancreatic Cancer. N Engl J Med, 379(25), 2395-2406. https://doi.org/10.1056/NEJMoa1809775
Correa-Gallego, C., Brennan, M., FD'Angelica, M., IDeMatteo, R., PFong, YKingham, T., . . . Allen, P. J. (2012). Contemporary experience with postpancreatectomy hemorrhage: results of 1,122 patients resected between 2006 and 2011. J Am Coll Surg, 215(5), 616-621. https://doi.org/10.1016/j.jamcollsurg.2012.07.010
Costamagna, G., & Pandolfi, M. (2004). Endoscopic stenting for biliary and pancreatic malignancies. J Clin Gastroenterol, 38(1), 59-67.
Cote, G. A., & Sherman, S. (2010). Advances in pancreatobiliary endoscopy. Curr Opin Gastroenterol, 26(5), 429-435. https://doi.org/10.1097/MOG.0b013e32833d171f
Datta, J., & Vollmer, C. M., Jr. (2016). Advances in Surgical Management of Pancreatic Diseases. Gastroenterol Clin North Am, 45(1), 129-144. https://doi.org/10.1016/j.gtc.2015.10.002
Del Chiaro, M., Verbeke, C., Salvia, R., Kloppel, G., Werner, J., McKay, C., . . . Segersvard, R. (2013). European experts consensus statement on cystic tumours of the pancreas. Dig Liver Dis, 45(9), 703-711. https://doi.org/10.1016/j.dld.2013.01.010
Dennis, J. L., Hvidsten, T. R., Wit, E. C., Komorowski, J., Bell, A. K., Downie, I., . . . Oien, K. A. (2005). Markers of adenocarcinoma characteristic of the site of origin: development of a diagnostic algorithm. Clin Cancer Res, 11(10), 3766-3772. https://doi.org/10.1158/1078-0432.CCR-04-2236
Deshpande, V., Konstantinidis, I. T., Castillo, C. F., Hezel, A. F., Haigis, K. M., Ting, D. T., . . . Ferrone, C. R. (2016). Intra-pancreatic Distal Bile Duct Carcinoma is Morphologically, Genetically, and Clinically Distinct from Pancreatic Ductal Adenocarcinoma. J Gastrointest Surg, 20(5), 953-959. https://doi.org/10.1007/s11605-016-3108-0
Diener, M. K., Mehr, K. T., Wente, M. N., Kieser, M., Buchler, M. W., & Seiler, C. M. (2011). Risk-benefit assessment of closed intra-abdominal drains after pancreatic surgery: a systematic review and meta-analysis assessing the current state of evidence. Langenbecks Arch Surg, 396(1), 41-52. https://doi.org/10.1007/s00423-010-0716-0
Dimarco, M., Cannella, R., Pellegrino, S., Iadicola, D., Tutino, R., Allegra, F., . . . Vernuccio, F. (2020). Impact of structured report on the quality of preoperative CT staging of pancreatic ductal adenocarcinoma: assessment of intra- and inter-reader variability. Abdom Radiol (NY), 45(2), 437-448. https://doi.org/10.1007/s00261-019-02287-7
Ducreux, M., Cuhna, A. S., Caramella, C., Hollebecque, A., Burtin, P., Goere, D., . . . Committee, E. G. (2015). Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 26 Suppl 5, v56-68. https://doi.org/10.1093/annonc/mdv295
Dudekula, A., Munigala, S., Zureikat, A. H., & Yadav, D. (2016). Operative Trends for Pancreatic Diseases in the USA: Analysis of the Nationwide Inpatient Sample from 1998-2011. J Gastrointest Surg, 20(4), 803-811. https://doi.org/10.1007/s11605-015-3067-x
Dumonceau, J. M., Deprez, P. H., Jenssen, C., Iglesias-Garcia, J., Larghi, A., Vanbiervliet, G., . . . Polkowski, M. (2017). Indications, results, and clinical impact of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline - Updated January 2017. Endoscopy, 49(7), 695-714. https://doi.org/10.1055/s-0043-109021
Dumonceau, J. M., Tringali, A., Papanikolaou, I. S., Blero, D., Mangiavillano, B., Schmidt, A., . . . van Hooft, J. E. (2018). Endoscopic biliary stenting: indications, choice of stents, and results: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline - Updated October 2017. Endoscopy, 50(9), 910-930. https://doi.org/10.1055/a-0659-9864
Dy, S. M. (2006). Enteral and parenteral nutrition in terminally ill cancer patients: a review of the literature. Am J Hosp Palliat Care, 23(5), 369-377. https://doi.org/10.1177/1049909106292167
Daamen, L. A., Groot, V. P., Intven, M. P. W., Besselink, M. G., Busch, O. R., Koerkamp, B. G., . . . Dutch Pancreatic Cancer, G. (2019). Postoperative surveillance of pancreatic cancer patients. Eur J Surg Oncol, 45(10), 1770-1777. https://doi.org/10.1016/j.ejso.2019.05.031
Eeson, G., Chang, N., McGahan, C. E., Khurshed, F., Buczkowski, A. K., Scudamore, C. H., . . . Chung, S. W. (2012). Determination of factors predictive of outcome for patients undergoing a pancreaticoduodenectomy of pancreatic head ductal adenocarcinomas. HPB (Oxford), 14(5), 310-316. https://doi.org/10.1111/j.1477-2574.2012.00448.x
Fattahi, R., Balci, N. C., Perman, W. H., Hsueh, E. C., Alkaade, S., Havlioglu, N., & Burton, F. R. (2009). Pancreatic diffusion-weighted imaging (DWI): comparison between mass-forming focal pancreatitis (FP), pancreatic cancer (PC), and normal pancreas. J Magn Reson Imaging, 29(2), 350-356. https://doi.org/10.1002/jmri.21651
Fearon, K., Strasser, F., Anker, S. D., Bosaeus, I., Bruera, E., Fainsinger, R. L., . . . Baracos, V. E. (2011). Definition and classification of cancer cachexia: an international consensus. Lancet Oncol, 12(5), 489-495.
Ferrone, C. R., Marchegiani, G., Hong, T. S., Ryan, D. P., Deshpande, V., McDonnell, E. I., . . . Fernandez-del Castillo, C. (2015). Radiological and surgical implications of neoadjuvant treatment with FOLFIRINOX for locally advanced and borderline resectable pancreatic cancer. Ann Surg, 261(1), 12-17. https://doi.org/10.1097/SLA.0000000000000867
Fong, Z. V., Ferrone, C. R., Lillemoe, K. D., & Fernandez-Del Castillo, C. (2016). Intraductal Papillary Mucinous Neoplasm of the Pancreas: Current State of the Art and Ongoing Controversies. Ann Surg, 263(5), 908-917. https://doi.org/10.1097/sla.0000000000001567
Fusaroli, P., Kypraios, D., Eloubeidi, M. A., & Caletti, G. (2012). Levels of evidence in endoscopic ultrasonography: a systematic review. Dig Dis Sci, 57(3), 602-609. https://doi.org/10.1007/s10620-011-1961-y
Garcea, G., Cairns, V., Berry, D. P., Neal, C. P., Metcalfe, M. S., & Dennison, A. R. (2012). Improving the diagnostic yield from staging laparoscopy for periampullary malignancies: the value of preoperative inflammatory markers and radiological tumor size. Pancreas, 41(2), 233-237. https://doi.org/10.1097/MPA.0b013e31822432ee
Genkinger, J. M., Kitahara, C. M., Bernstein, L., Berrington de Gonzalez, A., Brotzman, M., Elena, J. W., . . . Jacobs, E. J. (2015). Central adiposity, obesity during early adulthood, and pancreatic cancer mortality in a pooled analysis of cohort studies. Ann Oncol, 26(11), 2257-2266. https://doi.org/10.1093/annonc/mdv355
George, E., Wortman, J. R., Fulwadhva, U. P., Uyeda, J. W., & Sodickson, A. D. (2017). Dual energy CT applications in pancreatic pathologies. Br J Radiol, 90(1080), 20170411. https://doi.org/10.1259/bjr.20170411
Ghaneh, P., Costello, E., & Neoptolemos, J. P. (2007). Biology and management of pancreatic cancer. Gut, 56(8), 1134-1152.
Gianotti, L., Besselink, M. G., Sandini, M., Hackert, T., Conlon, K., Gerritsen, A., . . . Bassi, C. (2018). Nutritional support and therapy in pancreatic surgery: A position paper of the International Study Group on Pancreatic Surgery (ISGPS). Surgery, 164(5), 1035-1048. https://doi.org/10.1016/j.surg.2018.05.040
Gill;A.J., & Lam;A.K. (2019). Tumours of the pancreas. Lyon, France: IACR.
Gillen, S., Schuster, T., Friess, H., & Kleeff, J. (2012). Palliative resections versus palliative bypass procedures in pancreatic cancer—a systematic review. Am J Surg, 203(4), 496-502.
Glimelius, B., Hoffman, K., Graf, W., Haglund, U., Nyren, O., Pahlman, L., & Sjoden, P. O. (1995). Cost-effectiveness of palliative chemotherapy in advanced gastrointestinal cancer. Ann Oncol, 6(3), 267-274.
Goggins, M., Overbeek, K. A., Brand, R., Syngal, S., Del Chiaro, M., Bartsch, D. K., . . . International Cancer of the Pancreas Screening, c. (2020). Management of patients with increased risk for familial pancreatic cancer: updated recommendations from the International Cancer of the Pancreas Screening (CAPS) Consortium. Gut, 69(1), 7-17. https://doi.org/10.1136/gutjnl-2019-319352
Good, P., Cavenagh, J., Mather, M., & Ravenscroft, P. (2008). Medically assisted nutrition for palliative care in adult patients. Cochrane Database Syst Rev, (4), CD006274. https://doi.org/10.1002/14651858.CD006274.pub2
Gounaris, I., Zaki, K., & Corrie, P. (2010). Options for the treatment of gemcitabine-resistant advanced pancreatic cancer. JOP, 11(2), 113-123.
Gress, F., Schmitt, C., Sherman, S., Ikenberry, S., & Lehman, G. (1999). A prospective randomized comparison of endoscopic ultrasound- and computed tomography-guided celiac plexus block for managing chronic pancreatitis pain. Am J Gastroenterol, 94(4), 900-905.
Groot, V. P., Gemenetzis, G., Blair, A. B., Rivero-Soto, R. J., Yu, J., Javed, A. A., . . . He, J. (2019). Defining and Predicting Early Recurrence in 957 Patients With Resected Pancreatic Ductal Adenocarcinoma. Ann Surg, 269(6), 1154-1162. https://doi.org/10.1097/SLA.0000000000002734
Gärtner, S., Kruger, J., Aghdassi, A. A., Steveling, A., Simon, P., Lerch, M. M., & Mayerle, J. (2016). Nutrition in Pancreatic Cancer: A Review. Gastrointest Tumors, 2(4), 195-202. https://doi.org/10.1159/000442873
Hartwig, W., Strobel, O., Hinz, U., Fritz, S., Hackert, T., Roth, C., . . . Werner, J. (2013). CA19-9 in potentially resectable pancreatic cancer: perspective to adjust surgical and perioperative therapy. Ann Surg Oncol, 20(7), 2188-2196. https://doi.org/10.1245/s10434-012-2809-1
He, J., Ahuja, N., Makary, M. A., Cameron, J. L., Eckhauser, F. E., Choti, M. A., . . . Wolfgang, C. L. (2014). 2564 resected periampullary adenocarcinomas at a single institution: trends over three decades. HPB (Oxford), 16(1), 83-90. https://doi.org/10.1111/hpb.12078
He, J., Schulick, R. D., & Del Chiaro, M. (2021). Landmark Series: Neoadjuvant Treatment in Borderline Resectable Pancreatic Cancer. Ann Surg Oncol. https://doi.org/10.1245/s10434-020-09535-x
Helsedirektoratet. (2020). Antibiotika i sykehus. Nasjonal faglig retnignslinje.: Helsedirektoratet.
Hewitt, M. J., McPhail, M. J., Possamai, L., Dhar, A., Vlavianos, P., & Monahan, K. J. (2012). EUS-guided FNA for diagnosis of solid pancreatic neoplasms: a meta-analysis. Gastrointest Endosc, 75(2), 319-331. https://doi.org/10.1016/j.gie.2011.08.049
Hidalgo, M. (2010). Pancreatic cancer. N Engl J Med, 362(17), 1605-1617.
Hidalgo, M., Cascinu, S., Kleeff, J., Labianca, R., Lohr, J. M., Neoptolemos, J., . . . Heinemann, V. (2015). Addressing the challenges of pancreatic cancer: future directions for improving outcomes. Pancreatology, 15(1), 8-18. https://doi.org/10.1016/j.pan.2014.10.001
Hoem, D., & Viste, A. (2012). Improving survival following surgery for pancreatic ductal adenocarcinoma--a ten-year experience. Eur J Surg Oncol, 38(3), 245-251. https://doi.org/10.1016/j.ejso.2011.12.010
Horton, K. M., & Fishman, E. K. (2002). Multidetector CT angiography of pancreatic carcinoma: part 2, evaluation of venous involvement. AJR Am J Roentgenol, 178(4), 833-836.
Hruban, R. H., & Klimstra, D. S. (2014). Adenocarcinoma of the pancreas. Semin Diagn Pathol, 31(6), 443-451. https://doi.org/10.1053/j.semdp.2014.08.004
Huang, L., Jansen, L., Balavarca, Y., Babaei, M., van der Geest, L., Lemmens, V., . . . Brenner, H. (2018). Stratified survival of resected and overall pancreatic cancer patients in Europe and the USA in the early twenty-first century: a large, international population-based study. BMC Med, 16(1), 125. https://doi.org/10.1186/s12916-018-1120-9
Huang, L., Jansen, L., Balavarca, Y., Molina-Montes, E., Babaei, M., van der Geest, L., . . . Brenner, H. (2019). Resection of pancreatic cancer in Europe and USA: an international large-scale study highlighting large variations. Gut, 68(1), 130-139. https://doi.org/10.1136/gutjnl-2017-314828
Huttner, F. J., Fitzmaurice, C., Schwarzer, G., Seiler, C. M., Antes, G., Buchler, M. W., & Diener, M. K. (2016). Pylorus-preserving pancreaticoduodenectomy (pp Whipple) versus pancreaticoduodenectomy (classic Whipple) for surgical treatment of periampullary and pancreatic carcinoma. Cochrane Database Syst Rev, (2), CD006053. https://doi.org/10.1002/14651858.CD006053.pub6
Isaji, S., Mizuno, S., Windsor, J. A., Bassi, C., Fernandez-Del Castillo, C., Hackert, T., . . . Wolfgang, C. L. (2018). International consensus on definition and criteria of borderline resectable pancreatic ductal adenocarcinoma 2017. Pancreatology, 18(1), 2-11. https://doi.org/10.1016/j.pan.2017.11.011
Kambadakone, A., Thabet, A., Gervais, D. A., Mueller, P. R., & Arellano, R. S. (2011). CT-guided celiac plexus neurolysis: a review of anatomy, indications, technique, and tips for successful treatment. Radiographics, 31(6), 1599-1621.
Kamisawa, T., Wood, L. D., Itoi, T., & Takaori, K. (2016). Pancreatic cancer. Lancet, 388(10039), 73-85. https://doi.org/10.1016/s0140-6736(16)00141-0
Katz, M. H., Fleming, J. B., Bhosale, P., Varadhachary, G., Lee, J. E., Wolff, R., . . . Balachandran, A. (2012). Response of borderline resectable pancreatic cancer to neoadjuvant therapy is not reflected by radiographic indicators. Cancer, 118(23), 5749-5756. https://doi.org/10.1002/cncr.27636 [doi]
Katz, M. H., Varadhachary, G. R., Fleming, J. B., Wolff, R. A., Lee, J. E., Pisters, P. W., . . . Evans, D. B. (2010). Serum CA 19-9 as a marker of resectability and survival in patients with potentially resectable pancreatic cancer treated with neoadjuvant chemoradiation. Ann Surg Oncol, 17(7), 1794-1801. https://doi.org/10.1245/s10434-010-0943-1
Kawai, M., Tani, M., Terasawa, H., Ina, S., Hirono, S., Nishioka, R., . . . Yamaue, H. (2006). Early removal of prophylactic drains reduces the risk of intra-abdominal infections in patients with pancreatic head resection: prospective study for 104 consecutive patients. Ann Surg, 244(1), 1-7.
Kim, J. H., Park, S. H., Yu, E. S., Kim, M. H., Kim, J., Byun, J. H., . . . Lee, M. G. (2010). Visually isoattenuating pancreatic adenocarcinoma at dynamic-enhanced CT: frequency, clinical and pathologic characteristics, and diagnosis at imaging examinations. Radiology, 257(1), 87-96.
Kleive, D., Labori, K. J., Line, P. D., Gladhaug, I. P., & Verbeke, C. S. (2020). Pancreatoduodenectomy with venous resection for ductal adenocarcinoma rarely achieves complete (R0) resection. HPB (Oxford), 22(1), 50-57. https://doi.org/10.1016/j.hpb.2019.05.005
Kleive, D., Sahakyan, M. A., Berstad, A. E., Verbeke, C. S., Gladhaug, I. P., Edwin, B., . . . Labori, K. J. (2017). Trends in indications, complications and outcomes for venous resection during pancreatoduodenectomy. Br J Surg, 104(11), 1558-1567. https://doi.org/10.1002/bjs.10603
Kleive, D., Sahakyan, M. A., Khan, A., Fosby, B., Line, P. D., & Labori, K. J. (2018). Incidence and management of arterial injuries during pancreatectomy. Langenbecks Arch Surg, 403(3), 341-348. https://doi.org/10.1007/s00423-018-1666-1
Klompmaker, S., van Hilst, J., Gerritsen, S. L., Adham, M., Teresa Albiol Quer, M., Bassi, C., . . . group, E. A. D.-C. s. (2018). Outcomes After Distal Pancreatectomy with Celiac Axis Resection for Pancreatic Cancer: A Pan-European Retrospective Cohort Study. Ann Surg Oncol, 25(5), 1440-1447. https://doi.org/10.1245/s10434-018-6391-z
Kneuertz, P. J., Cunningham, S. C., Cameron, J. L., Torrez, S., Tapazoglou, N., Herman, J. M., . . . Pawlik, T. M. (2011). Palliative surgical management of patients with unresectable pancreatic adenocarcinoma: trends and lessons learned from a large, single institution experience. J Gastrointest Surg, 15(11), 1917-1927. https://doi.org/10.1007/s11605-011-1665-9
Kunstman, J. W., Fonseca, A. L., Ciarleglio, M. M., Cong, X., Hochberg, A., & Salem, R. R. (2012). Comprehensive analysis of variables affecting delayed gastric emptying following pancreaticoduodenectomy. J Gastrointest Surg, 16(7), 1354-1361. https://doi.org/10.1007/s11605-012-1873-y
Labori, K. J., Katz, M. H., Tzeng, C. W., Bjornbeth, B. A., Cvancarova, M., Edwin, B., . . . Gladhaug, I. P. (2016). Impact of early disease progression and surgical complications on adjuvant chemotherapy completion rates and survival in patients undergoing the surgery first approach for resectable pancreatic ductal adenocarcinoma - A population-based cohort study. Acta Oncol, 55(3), 265-277. https://doi.org/10.3109/0284186X.2015.1068445
Labori, K. J., Kleive, D., Khan, A., Farnes, I., Fosby, B., & Line, P. D. (2020). Graft type for superior mesenteric and portal vein reconstruction in pancreatic surgery - A systematic review. HPB (Oxford). https://doi.org/10.1016/j.hpb.2020.11.008
Labori, K. J., Lassen, K., Hoem, D., Gronbech, J. E., Soreide, J. A., Mortensen, K., . . . Dueland, S. (2017). Neoadjuvant chemotherapy versus surgery first for resectable pancreatic cancer (Norwegian Pancreatic Cancer Trial - 1 (NorPACT-1)) - study protocol for a national multicentre randomized controlled trial. BMC Surg, 17(1), 94. https://doi.org/10.1186/s12893-017-0291-1
Labori, K. J., Verbeke, C. S., & Gladhaug, I. P. (2015). Information needs among patients and a surveillance strategy after surgery for pancreatic and periampullary cancer. HPB (Oxford), 17(7), 659. https://doi.org/10.1111/hpb.12411
Larssen, L., Medhus, A. W., & Hauge, T. (2009). Treatment of malignant gastric outlet obstruction with stents: an evaluation of the reported variables for clinical outcome. BMC Gastroenterol, 9, 45.
Lassen, K., Kjaeve, J., Fetveit, T., Trano, G., Sigurdsson, H. K., Horn, A., & Revhaug, A. (2008). Allowing normal food at will after major upper gastrointestinal surgery does not increase morbidity: a randomized multicenter trial. Ann Surg, 247(5), 721-729. https://doi.org/10.1097/SLA.0b013e31815cca68
Laurence, J. M., Tran, P. D., Morarji, K., Eslick, G. D., Lam, V. W., & Sandroussi, C. (2011). A systematic review and meta-analysis of survival and surgical outcomes following neoadjuvant chemoradiotherapy for pancreatic cancer. J Gastrointest Surg, 15(11), 2059-2069. https://doi.org/10.1007/s11605-011-1659-7
Leach, S. D., Lee, J. E., Charnsangavej, C., Cleary, K. R., Lowy, A. M., Fenoglio, C. J., . . . Evans, D. B. (1998). Survival following pancreaticoduodenectomy with resection of the superior mesenteric-portal vein confluence for adenocarcinoma of the pancreatic head. Br J Surg, 85(5), 611-617.
Lee, T. Y., Kim, M. H., Park do, H., Seo, D. W., Lee, S. K., Kim, J. S., & Lee, K. T. (2009). Utility of 18F-FDG PET/CT for differentiation of autoimmune pancreatitis with atypical pancreatic imaging findings from pancreatic cancer. AJR Am J Roentgenol, 193(2), 343-348.
Lillemoe, K. D., Cameron, J. L., Kaufman, H. S., Yeo, C. J., Pitt, H. A., & Sauter, P. K. (1993). Chemical splanchnicectomy in patients with unresectable pancreatic cancer. A prospective randomized trial. Ann Surg, 217(5), 447-455.
Liu, H., Shi, J., Anandan, V., Wang, H. L., Diehl, D., Blansfield, J., . . . Lin, F. (2012). Reevaluation and identification of the best immunohistochemical panel (pVHL, Maspin, S100P, IMP-3) for ductal adenocarcinoma of the pancreas. Arch Pathol Lab Med, 136(6), 601-609. https://doi.org/10.5858/arpa.2011-0326-OA
Locker, G. Y., Hamilton, S., Harris, J., Jessup, J. M., Kemeny, N., Macdonald, J. S., . . . Bast, R. C. (2006). ASCO 2006 update of recommendations for the use of tumor markers in gastrointestinal cancer. J Clin Oncol, 24(33), 5313-5327.
Lov om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven). LOV-2011-06-24-30.
Low, G., Panu, A., Millo, N., & Leen, E. (2011). Multimodality imaging of neoplastic and nonneoplastic solid lesions of the pancreas. Radiographics, 31(4), 993-1015. https://doi.org/10.1148/rg.314105731
Madhoun, M. F., Wani, S. B., Rastogi, A., Early, D., Gaddam, S., Tierney, W. M., & Maple, J. T. (2013). The diagnostic accuracy of 22-gauge and 25-gauge needles in endoscopic ultrasound-guided fine needle aspiration of solid pancreatic lesions: a meta-analysis. Endoscopy, 45(2), 86-92. https://doi.org/10.1055/s-0032-1325992
Maggino, L., Malleo, G., Marchegiani, G., Viviani, E., Nessi, C., Ciprani, D., . . . Salvia, R. (2019). Outcomes of Primary Chemotherapy for Borderline Resectable and Locally Advanced Pancreatic Ductal Adenocarcinoma. JAMA Surg, 154(10), 932-942. https://doi.org/10.1001/jamasurg.2019.2277
Maillette de Buy Wenniger, L., Rauws, E. A., & Beuers, U. (2012). What an endoscopist should know about immunoglobulin-G4-associated disease of the pancreas and biliary tree. Endoscopy, 44(1), 66-73. https://doi.org/10.1055/s-0031-1291540
Majumder, S., Chubineh, S., & Birk, J. (2012). Pancreatic cancer: an endoscopic perspective. Expert Rev Gastroenterol Hepatol, 6(1), 95-103. https://doi.org/10.1586/egh.11.93
Mansfield, S. D., Sen, G., Oppong, K., Jacques, B. C., O'Suilleabhain, C. B., Manas, D. M., & Charnley, R. M. (2006). Increase in serum bilirubin levels in obstructive jaundice secondary to pancreatic and periampullary malignancy--implications for timing of resectional surgery and use of biliary drainage. HPB (Oxford), 8(6), 442-445. https://doi.org/10.1080/13651820600919860
Manzelli, A., Petrou, A., Lazzaro, A., Brennan, N., Soonawalla, Z., & Friend, P. (2011). Groove pancreatitis. A mini-series report and review of the literature. JOP, 12(3), 230-233.
https://pubmed.ncbi.nlm.nih.gov/21546697/
Marangoni, G., Morris-Stiff, G., Deshmukh, S., Hakeem, A., & Smith, A. M. (2012). A modern approach to teaching pancreatic surgery: stepwise pancreatoduodenectomy for trainees. J Gastrointest Surg, 16(8), 1597-1604. https://doi.org/10.1007/s11605-012-1934-2
Matthaei, H., Hong, S. M., Mayo, S. C., dal Molin, M., Olino, K., Venkat, R., . . . Hruban, R. H. (2011). Presence of pancreatic intraepithelial neoplasia in the pancreatic transection margin does not influence outcome in patients with R0 resected pancreatic cancer. Ann Surg Oncol, 18(12), 3493-3499. https://doi.org/10.1245/s10434-011-1745-9
Mayo, S. C., Austin, D. F., Sheppard, B. C., Mori, M., Shipley, D. K., & Billingsley, K. G. (2009). Evolving preoperative evaluation of patients with pancreatic cancer: does laparoscopy have a role in the current era? J Am Coll Surg, 208(1), 87-95.
McQuay, H. J., Collins, S. L., Carroll, D., & Moore, R. A. (2000). Radiotherapy for the palliation of painful bone metastases. Cochrane Database Syst Rev, (2), CD001793. https://doi.org/10.1002/14651858.CD001793
Melloul, E., Lassen, K., Roulin, D., Grass, F., Perinel, J., Adham, M., . . . Demartines, N. (2020). Guidelines for Perioperative Care for Pancreatoduodenectomy: Enhanced Recovery After Surgery (ERAS) Recommendations 2019. World J Surg, 44(7), 2056-2084. https://doi.org/10.1007/s00268-020-05462-w
Michalski, C. W., Kleeff, J., Wente, M. N., Diener, M. K., Buchler, M. W., & Friess, H. (2007). Systematic review and meta-analysis of standard and extended lymphadenectomy in pancreaticoduodenectomy for pancreatic cancer. Br J Surg, 94(3), 265-273.
Michl, P., & Gress, T. M. (2013). Current concepts and novel targets in advanced pancreatic cancer. Gut, 62(2), 317-326. https://doi.org/10.1136/gutjnl-2012-303588
Michl, P., Pauls, S., & Gress, T. M. (2006). Evidence-based diagnosis and staging of pancreatic cancer. Best Pract Res Clin Gastroenterol, 20(2), 227-251. https://doi.org/10.1016/j.bpg.2005.10.005
Molina-Montes, E., Coscia, C., Gomez-Rubio, P., Fernandez, A., Boenink, R., Rava, M., . . . PanGen, E. U. S. I. (2020). Deciphering the complex interplay between pancreatic cancer, diabetes mellitus subtypes and obesity/BMI through causal inference and mediation analyses. Gut. https://doi.org/10.1136/gutjnl-2019-319990
Mollberg, N., Rahbari, N. N., Koch, M., Hartwig, W., Hoeger, Y., Buchler, M. W., & Weitz, J. (2011). Arterial resection during pancreatectomy for pancreatic cancer: a systematic review and meta-analysis. Ann Surg, 254(6), 882-893. https://doi.org/10.1097/SLA.0b013e31823ac299
Moon, S. H., & Kim, M. H. (2012). The role of endoscopy in the diagnosis of autoimmune pancreatitis. Gastrointest Endosc, 76(3), 645-656. https://doi.org/10.1016/j.gie.2012.04.458
Moon, S. H., Kim, M. H., Park, D. H., Hwang, C. Y., Park, S. J., Lee, S. S., . . . Lee, S. K. (2008). Is a 2-week steroid trial after initial negative investigation for malignancy useful in differentiating autoimmune pancreatitis from pancreatic cancer? A prospective outcome study. Gut, 57(12), 1704-1712. https://doi.org/10.1136/gut.2008.150979
Mukherjee, S., Hurt, C. N., Bridgewater, J., Falk, S., Cummins, S., Wasan, H., . . . Maughan, T. (2013). Gemcitabine-based or capecitabine-based chemoradiotherapy for locally advanced pancreatic cancer (SCALOP): a multicentre, randomised, phase 2 trial. Lancet Oncol, 14(4), 317-326. https://doi.org/10.1016/S1470-2045(13)70021-4
Nasjonal helseplan (2007-2010). (2006). (Særtrykk av St.prp. nr. 1 (2006-2007) kapittel 6). Oslo: Helse- og omsorgsdepartementet. Hentet fra http://www.regjeringen.no/upload/HOD/Sykehus/Nasjonal_helseplan_Sartrykk.pdf
Nasjonal strategi for kreftområdet 2006-2009. (2006). Oslo: Helse- og omsorgsdepartementet. Hentet fra https://www.regjeringen.no/globalassets/upload/hod/sykehus/kreftstrategi-2006-2009.pdf
Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av nevroendokrine svulster i fordøyelsessystemet. (2020). (Vol. IS-2946): Helsedirektoratet.
Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen. (2014). Oslo: Helsedirektoratet. Hentet fra https://helsedirektoratet.no/retningslinjer/nasjonalt-handlingsprogram-med-retningslinjer-for-palliasjon-i-kreftomsorgen
Neoptolemos, J. P., Palmer, D. H., Ghaneh, P., Psarelli, E. E., Valle, J. W., Halloran, C. M., . . . Buchler, M. W. (2017). Comparison of adjuvant gemcitabine and capecitabine with gemcitabine monotherapy in patients with resected pancreatic cancer (ESPAC-4): a multicentre, open-label, randomised, phase 3 trial. Lancet, 389(10073), 1011-1024. https://doi.org/10.1016/s0140-6736(16)32409-6
Neoptolemos, J. P., Stocken, D. D., Bassi, C., Ghaneh, P., Cunningham, D., Goldstein, D., . . . Buchler, M. W. (2010). Adjuvant chemotherapy with fluorouracil plus folinic acid vs gemcitabine following pancreatic cancer resection: a randomized controlled trial. JAMA, 304(10), 1073-1081.
Neoptolemos, J. P., Stocken, D. D., Friess, H., Bassi, C., Dunn, J. A., Hickey, H., . . . Buchler, M. W. (2004). A randomized trial of chemoradiotherapy and chemotherapy after resection of pancreatic cancer. N Engl J Med, 350(12), 1200-1210.
Network, N. C. C. (2015). Practice Guidelines in Oncology:Pancreatic adenocarcinoma V1.2020.
NGICG-HPB. Retningslinjer for utredning, behandling og kontroll av cystiske pancreaslesjoner. fra https://ngicg.no/handlingsprogram/retningslinjer
Nordøy, T., Thoresen, L., Kvikstad, A., & Svensen, R. (2006). Ernæring og væskebehandling til pasienter med ikke-kurabel kreftsykdom. Tidsskr Nor Lægeforen, 126(5), 624-627.
Norway, C. R. o. Cancer in Norway 2018. Cancer incidence, mortality, survival and prevalence in Norway.
Nymo, L. S., Kleive, D., Waardal, K., Bringeland, E. A., Soreide, J. A., Labori, K. J., . . . Lassen, K. (2020). Centralizing a national pancreatoduodenectomy service: striking the right balance. BJS Open. https://doi.org/10.1002/bjs5.50342
Oettle, H., Post, S., Neuhaus, P., Gellert, K., Langrehr, J., Ridwelski, K., . . . Riess, H. (2007). Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA, 297(3), 267-277.
Palmer, K. R., Kerr, M., Knowles, G., Cull, A., Carter, D. C., & Leonard, R. C. (1994). Chemotherapy prolongs survival in inoperable pancreatic carcinoma. Br J Surg, 81(6), 882-885.
Peters, M. L., Tseng, J. F., & Miksad, R. A. (2016). Genetic Testing in Pancreatic Ductal Adenocarcinoma: Implications for Prevention and Treatment. Clin Ther, 38(7), 1622-1635. https://doi.org/10.1016/j.clinthera.2016.03.006
Petrucciani, N., Nigri, G., Debs, T., Giannini, G., Sborlini, E., Antolino, L., . . . Ramacciato, G. (2016). Frozen section analysis of the pancreatic margin during pancreaticoduodenectomy for cancer: Does extending the resection to obtain a secondary R0 provide a survival benefit? Results of a systematic review. Pancreatology, 16(6), 1037-1043. https://doi.org/10.1016/j.pan.2016.09.004
Plonk, W. M., & Arnold, R. M. (2005). Terminal care: the last weeks of life. J Palliat Med, 8(5), 1042-1054. https://doi.org/10.1089/jpm.2005.8.1042
Rebours, V., Levy, P., & Ruszniewski, P. (2012). An overview of hereditary pancreatitis. Dig Liver Dis, 44(1), 8-15. https://doi.org/10.1016/j.dld.2011.08.003
Sabater, L., Ausania, F., Bakker, O. J., Boadas, J., Dominguez-Munoz, J. E., Falconi, M., . . . de-Madaria, E. (2016). Evidence-based Guidelines for the Management of Exocrine Pancreatic Insufficiency After Pancreatic Surgery. Ann Surg, 264(6), 949-958. https://doi.org/10.1097/SLA.0000000000001732
Schima, W., Ba-Ssalamah, A., Goetzinger, P., Scharitzer, M., & Koelblinger, C. (2007). State-of-the-art magnetic resonance imaging of pancreatic cancer. Top Magn Reson Imaging, 18(6), 421-429. https://doi.org/10.1097/rmr.0b013e31816459e0
Schmidt-Hansen, M., Berendse, S., & Hamilton, W. (2016). Symptoms of Pancreatic Cancer in Primary Care: A Systematic Review. Pancreas, 45(6), 814-818. https://doi.org/10.1097/mpa.0000000000000527
Shimosegawa, T., Chari, S. T., Frulloni, L., Kamisawa, T., Kawa, S., Mino-Kenudson, M., . . . International Association of, P. (2011). International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology. Pancreas, 40(3), 352-358. https://doi.org/10.1097/MPA.0b013e3182142fd2
Simianu, V. V., Zyromski, N. J., Nakeeb, A., & Lillemoe, K. D. (2010). Pancreatic cancer: progress made. Acta Oncol, 49(4), 407-417. https://doi.org/10.3109/02841860903447051
Slaar, A., Eshuis, W. J., van der Gaag, N. A., Nio, C. Y., Busch, O. R., van Gulik, T. M., . . . Gouma, D. J. (2011). Predicting distant metastasis in patients with suspected pancreatic and periampullary tumors for selective use of staging laparoscopy. World J Surg, 35(11), 2528-2534.
Sohal, D. P. S., Duong, M., Ahmad, S. A., Gandhi, N. S., Beg, M. S., Wang-Gillam, A., . . . Hochster, H. S. (2021). Efficacy of Perioperative Chemotherapy for Resectable Pancreatic Adenocarcinoma: A Phase 2 Randomized Clinical Trial. JAMA Oncol. https://doi.org/10.1001/jamaoncol.2020.7328
Solomon, S., & Whitcomb, D. C. (2012). Genetics of Pancreatitis: An Update for Clinicians and Genetic Counselors. Curr Gastroenterol Rep, 14(2), 112-117. https://doi.org/10.1007/s11894-012-0240-1
Stewart, G. D., Skipworth, R. J., & Fearon, K. C. (2006). Cancer cachexia and fatigue. Clin Med, 6(2), 140-143.
Strong, V. E., Dalal, K. M., Malhotra, V. T., Cubert, K. H., Coit, D., Fong, Y., & Allen, P. J. (2006). Initial report of laparoscopic celiac plexus block for pain relief in patients with unresectable pancreatic cancer. J Am Coll Surg, 203(1), 129-131.
Syngal, S., Brand, R. E., Church, J. M., Giardiello, F. M., Hampel, H. L., Burt, R. W., & American College of, G. (2015). ACG clinical guideline: Genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol, 110(2), 223-262; quiz 263. https://doi.org/10.1038/ajg.2014.435
Sze, W. M., Shelley, M., Held, I., & Mason, M. (2004). Palliation of metastatic bone pain: single fraction versus multifraction radiotherapy - a systematic review of the randomised trials. Cochrane Database Syst Rev, (2), CD004721. https://doi.org/10.1002/14651858.CD004721
Søreide, J. A., Sandvik, O. M., & Søreide, K. (2016). Improving pancreas surgery over time: Performance factors related to transition of care and patient volume. Int J Surg, 32, 116-122. https://doi.org/10.1016/j.ijsu.2016.06.046
Søreide, K., & Labori, K. J. (2016). Risk factors and preventive strategies for post-operative pancreatic fistula after pancreatic surgery: a comprehensive review. Scand J Gastroenterol, 51(10), 1147-1154. https://doi.org/10.3109/00365521.2016.1169317
Søreide, K., Aagnes, B., Møller, B., Westgaard, A., & Bray, F. (2010). Epidemiology of pancreatic cancer in Norway: trends in incidence, basis of diagnosis and survival 1965-2007. Scand J Gastroenterol, 45(1), 82-92.
Takuma, K., Kamisawa, T., Gopalakrishna, R., Hara, S., Tabata, T., Inaba, Y., . . . Igarashi, Y. (2012). Strategy to differentiate autoimmune pancreatitis from pancreas cancer. World J Gastroenterol, 18(10), 1015-1020.
Templeton, A. W., & Brentnall, T. A. (2013). Screening and surgical outcomes of familial pancreatic cancer. Surgical Clinics of North America, 93(3), 629-645.
TNM Classification of Malignant Tumours, 8th Edition. (2017). (8. utg.). Oxford: Wiley-Blackwell.
Tol, J. A., Gouma, D. J., Bassi, C., Dervenis, C., Montorsi, M., Adham, M., . . . Charnley, R. M. (2014). Definition of a standard lymphadenectomy in surgery for pancreatic ductal adenocarcinoma: a consensus statement by the International Study Group on Pancreatic Surgery (ISGPS). Surgery, 156(3), 591-600. https://doi.org/10.1016/j.surg.2014.06.016
Tol, J. A., van Gulik, T. M., Busch, O. R., & Gouma, D. J. (2012). Centralization of highly complex low-volume procedures in upper gastrointestinal surgery. A summary of systematic reviews and meta-analyses. Dig Surg, 29(5), 374-383. https://doi.org/10.1159/000343929
Tol, J. A., van Hooft, J. E., Timmer, R., Kubben, F. J., van der Harst, E., de Hingh, I. H., . . . Gouma, D. J. (2015). Metal or plastic stents for preoperative biliary drainage in resectable pancreatic cancer. Gut. https://doi.org/10.1136/gutjnl-2014-308762
Traverso, L. W., & Longmire, W. P. (1978). Preservation of the pylorus in pancreaticoduodenectomy. Surg Gynecol Obstet, 146(6), 959-962.
Tseng, J. F., Raut, C. P., Lee, J. E., Pisters, P. W., Vauthey, J. N., Abdalla, E. K., . . . Evans, D. B. (2004). Pancreaticoduodenectomy with vascular resection: margin status and survival duration. J Gastrointest Surg, 8(8), 935-949. https://doi.org/10.1016/j.gassur.2004.09.046
Tzeng, C. W., Fleming, J. B., Lee, J. E., Wang, X., Pisters, P. W., Vauthey, J. N., . . . Katz, M. H. (2012). Yield of clinical and radiographic surveillance in patients with resected pancreatic adenocarcinoma following multimodal therapy. HPB (Oxford), 14(6), 365-372. https://doi.org/10.1111/j.1477-2574.2012.00445.x
Upchurch, E., Ragusa, M., & Cirocchi, R. (2018). Stent placement versus surgical palliation for adults with malignant gastric outlet obstruction. Cochrane Database Syst Rev, 5, CD012506. https://doi.org/10.1002/14651858.CD012506.pub2
Valle, J. W., Palmer, D., Jackson, R., Cox, T., Neoptolemos, J. P., Ghaneh, P., . . . Buchler, M. W. (2014). Optimal duration and timing of adjuvant chemotherapy after definitive surgery for ductal adenocarcinoma of the pancreas: ongoing lessons from the ESPAC-3 study. J Clin Oncol, 32(6), 504-512. https://doi.org/10.1200/JCO.2013.50.7657
van der Gaag, N. A., Rauws, E. A., van Eijck, C. H., Bruno, M. J., van der Harst, E., Kubben, F. J., . . . Gouma, D. J. (2010). Preoperative biliary drainage for cancer of the head of the pancreas. N Engl J Med, 362(2), 129-137. https://doi.org/10.1056/NEJMoa0903230
van Heek, N. T., Kuhlmann, K. F., Scholten, R. J., de Castro, S. M., Busch, O., Rvan Gulik, T. M., . . . Gouma, D. J. (2005). Hospital volume and mortality after pancreatic resection: a systematic review and an evaluation of intervention in the Netherlands. Ann Surg, 242(6), 781-788.
van Hilst, J., de Rooij, T., Klompmaker, S., Rawashdeh, M., Aleotti, F., Al-Sarireh, B., . . . European Consortium on Minimally Invasive Pancreatic, S. (2019). Minimally Invasive versus Open Distal Pancreatectomy for Ductal Adenocarcinoma (DIPLOMA): A Pan-European Propensity Score Matched Study. Ann Surg, 269(1), 10-17. https://doi.org/10.1097/SLA.0000000000002561
Vashi, P., Popiel, B., Lammersfeld, C., & Gupta, D. (2015). Outcomes of systematic nutritional assessment and medical nutrition therapy in pancreatic cancer. Pancreas, 44(5), 750-755. https://doi.org/10.1097/mpa.0000000000000336
Verbeke, C. (2016). Morphological heterogeneity in ductal adenocarcinoma of the pancreas - Does it matter? Pancreatology, 16(3), 295-301. https://doi.org/10.1016/j.pan.2016.02.004
Verbeke, C., Brosens, L., Campbell, F., Del Chiaro, M., Esposito, I., Feakins, R. M., . . . Washington, K. (2020). Carcinoma of the Exocrine Pancreas Histopathology Reporting Guide. International Collaboration on Cancer Reporting; Sydney, Australia. . http://www.iccr-cancer.org/datasets/published-datasets/digestive-tract/pancreas
Verbeke, C., Haberle, L., Lenggenhager, D., & Esposito, I. (2018). Pathology assessment of pancreatic cancer following neoadjuvant treatment: Time to move on. Pancreatology. https://doi.org/10.1016/j.pan.2018.04.010
Verbeke, C. S. (2013). Resection margins in pancreatic cancer. Surg Clin North Am, 93(3), 647-662. https://doi.org/10.1016/j.suc.2013.02.008
Verbeke, C. S., & Gladhaug, I. P. (2012). Resection margin involvement and tumour origin in pancreatic head cancer. Br J Surg, 99(8), 1036-1049.
Verbeke, C. S., & Gladhaug, I. P. (Under publisering 2016). Dissection of pancreatic specimens. Surg Pathol Clin.
Versteijne, E., Suker, M., Groothuis, K., Akkermans-Vogelaar, J. M., Besselink, M. G., Bonsing, B. A., . . . Dutch Pancreatic Cancer, G. (2020). Preoperative Chemoradiotherapy Versus Immediate Surgery for Resectable and Borderline Resectable Pancreatic Cancer: Results of the Dutch Randomized Phase III PREOPANC Trial. J Clin Oncol, 38(16), 1763-1773. https://doi.org/10.1200/JCO.19.02274
Versteijne, E., Vogel, J. A., Besselink, M. G., Busch, O. R. C., Wilmink, J. W., Daams, J. G., . . . Dutch Pancreatic Cancer, G. (2018). Meta-analysis comparing upfront surgery with neoadjuvant treatment in patients with resectable or borderline resectable pancreatic cancer. Br J Surg, 105(8), 946-958. https://doi.org/10.1002/bjs.10870
Vincent, A., Herman, J., Schulick, R., Hruban, R. H., & Goggins, M. (2011). Pancreatic cancer. Lancet, 378(9791), 607-620.
Von Hoff, D. D., Ervin, T., Arena, F. P., Chiorean, E. G., Infante, J., Moore, M., . . . Renschler, M. F. (2013). Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med, 369(18), 1691-1703.
Vrieling, A., Bueno-de-Mesquita, H. B., Boshuizen, H. C., Michaud, D. S., Severinsen, M. T., Overvad, K., . . . Riboli, E. (2010). Cigarette smoking, environmental tobacco smoke exposure and pancreatic cancer risk in the European Prospective Investigation into Cancer and Nutrition. Int J Cancer, 126(10), 2394-2403. https://doi.org/10.1002/ijc.24907
Walma, M. S., Brada, L. J., Patuleia, S. I. S., Blomjous, J. G., Bollen, T. L., Bosscha, K., . . . Dutch Pancreatic Cancer, G. (2020). Treatment strategies and clinical outcomes in consecutive patients with locally advanced pancreatic cancer: A multicenter prospective cohort. Eur J Surg Oncol. https://doi.org/10.1016/j.ejso.2020.11.137
Wang, F., Arianayagam, R., Gill, A., Puttaswamy, V., Neale, M., Gananadha, S., . . . Samra, J. S. (2012). Grafts for mesenterico-portal vein resections can be avoided during pancreatoduodenectomy. J Am Coll Surg, 215(4), 569-579. https://doi.org/10.1016/j.jamcollsurg.2012.05.034
Warshaw, A. L., Lillemoe, K. D., & Fernandez-Del Castillo, C. (2012). Pancreatic surgery for adenocarcinoma. Curr Opin Gastroenterol, 28(5), 488-493. https://doi.org/10.1097/MOG.0b013e3283567f2c
Westgaard, A., Laronningen, S., Mellem, C., Eide, T. J., Clausen, O. P., Moller, B., & Gladhaug, I. P. (2009). Are survival predictions reliable? Hospital volume versus standardisation of histopathologic reporting for accuracy of survival estimates after pancreatoduodenectomy for adenocarcinoma. Eur J Cancer, 45(16), 2850-2859.
Whipple, A. O., Parsons, W. B., & Mullins, C. R. (1935). Treatment of Carcinoma of the Ampulla of Vater. Ann Surg, 102(4), 763-779.
Williamsson, C., Wennerblom, J., Tingstedt, B., & Jonsson, C. (2016). A wait-and-see strategy with subsequent self-expanding metal stent on demand is superior to prophylactic bypass surgery for unresectable periampullary cancer. HPB (Oxford), 18(1), 107-112. https://doi.org/10.1016/j.hpb.2015.08.009
Winter, J. M., Tang, L. H., Klimstra, D. S., Brennan, M. F., Brody, J. R., Rocha, F. G., . . . Allen, P. J. (2012). A novel survival-based tissue microarray of pancreatic cancer validates MUC1 and mesothelin as biomarkers. PLoS One, 7(7), e40157. https://doi.org/10.1371/journal.pone.0040157
Wong, J. C., & Raman, S. (2010). Surgical resectability of pancreatic adenocarcinoma: CTA. Abdom Imaging, 35(4), 471-480. https://doi.org/10.1007/s00261-009-9539-2
Worni, M., Castleberry, A. W., Clary, B. M., Gloor, B., Carvalho, E., Jacobs, D. O., . . . White, R. R. (2013). Concomitant Vascular Reconstruction During Pancreatectomy for Malignant Disease: A Propensity Score-Adjusted, Population-Based Trend Analysis Involving 10 206 Patients. JAMA Surg, 148, 331-338. https://doi.org/10.1001/jamasurg.2013.1058
Xue, Y., Vanoli, A., Balci, S., Reid, M. M., Saka, B., Bagci, P., . . . Adsay, V. (2017). Non-ampullary-duodenal carcinomas: clinicopathologic analysis of 47 cases and comparison with ampullary and pancreatic adenocarcinomas. Mod Pathol, 30(2), 255-266. https://doi.org/10.1038/modpathol.2016.174
Yamasaki, S., Suda, K., Nobukawa, B., & Sonoue, H. (2002). Intraductal spread of pancreatic cancer. Clinicopathologic study of 54 pancreatectomized patients. Pancreatology, 2(4), 407-412. https://doi.org/10.1159/000065089
Yamauchi, F. I., Ortega, C. D., Blasbalg, R., Rocha, M. S., Jukemura, J., & Cerri, G. G. (2012). Multidetector CT evaluation of the postoperative pancreas. Radiographics, 32(3), 743-764. https://doi.org/10.1148/rg.323105121
Yavuzsen, T., Davis, M. P., Walsh, D., LeGrand, S., & Lagman, R. (2005). Systematic review of the treatment of cancer-associated anorexia and weight loss. J Clin Oncol, 23(33), 8500-8511.
Yin, Q., Zou, X., Zai, X., Wu, Z., Wu, Q., Jiang, X., . . . Miao, F. (2015). Pancreatic ductal adenocarcinoma and chronic mass-forming pancreatitis: Differentiation with dual-energy MDCT in spectral imaging mode. Eur J Radiol, 84(12), 2470-2476. https://doi.org/10.1016/j.ejrad.2015.09.023
Zhao, W. Y., Luo, M., Sun, Y. W., Xu, Q., Chen, W., Zhao, G., & Wu, Z. Y. (2009). Computed tomography in diagnosing vascular invasion in pancreatic and periampullary cancers: a systematic review and meta-analysis. Hepatobiliary Pancreat Dis Int, 8(5), 457-464.
Zhou, Y., Zhang, Z., Liu, Y., Li, B., & Xu, D. (2012). Pancreatectomy combined with superior mesenteric vein-portal vein resection for pancreatic cancer: a meta-analysis. World J Surg, 36(4), 884-891. https://doi.org/10.1007/s00268-012-1461-z









