Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av pasienter med thyroideakreft
Forkortelser
Sist faglig oppdatert: 30.06.2017
| AFAP | Attenuert familiær adenomatøs polypose |
| antiTPO | Thyroidea peroxidase antistoff |
| ATA | American Thyroid Association |
| ATC | Anaplastisk thyroideocarcinom |
| BRAF | proto-oncogene B-Raf |
| BTA | British Thyroid Association |
| CEA | Carcinoembryonalt antigen |
| CT | Computertomografi |
| DTC | Differensiert thyroideacancer |
| FAP | Familiær adenomatøs polypose |
| FDG | Fluourodeoxyglucose |
| FDOPA | Fluorodopa |
| FNA(C) | Finnålsaspirasjonscytologi |
| FNMTC | familiær ikke-medullær thyroideakreft |
| FT3 | Trijodthyronin |
| FT4 | fri thyroxin |
| MEN | Multippel endokrin neoplasi |
| MR | Magnettomografi |
| MTC | Medullær thyroidea cancer |
| NaF | Natrium Fluorid (PET) |
| NCI | National Cancer Institute |
| NIFTP | noninvasiv folliculær thyroida neoplasme med papillære kjerneforandringer |
| PACS | Picture Archiving and Communication System |
| PDTC | Poorly differentiated thyroid cancer |
| PET | Positronemisjonstomografi |
| proGRP | Pro-gastrin-releasing peptide |
| PTC | Papillær thyroidea cancer |
| PTH | Parathyroideahormon |
| RET | receptor tyrosine kinase protooncogen |
| rhTSH | rekombinant humant Thyroidea stimulerende hormon |
| RPMI-rør | Roswell Park Memorial Institute medium-rør |
| SPECT | Single-photon emission computed tomography |
| Tg | Thyroglobulin |
| TRAS | Thyroid reseptor antistoff |
| TSH | Thyroidea stimulerende hormon |
| TTF | Thyroid transcription factor |
| UICC | Union internationale contre le cancer |
| VUS | Variant med usikker betydning |
| WBS | Whole body scan |
Sammendrag
Sist faglig oppdatert: 30.06.2017
I Norge får årlig rundt 300 pasienter diagnostisert thyroideacarcinom (differensiert thyroideacarcinom (DTC), medullært thyroideacarcinom (MTC), anaplastisk thyroideacarcinom (ATC)). Samtidig viser estimat at over 30 % av befolkningen har knuter i thyroidea. Prognosen ved thyroideacarcinom er vanligvis god (10 års overlevelse >80 %). Sjelden forekommer anaplastiske carcinomer som har veldig dårlig prognose. Andre sjeldne svulster er lymfom, sarkom og metastaser fra andre organ.
Standard ved utredning av thyroideaknuter og thyroideacarcinom er klinisk undersøkelse, noen få blodprøver (først og fremst thyroideastimulerende hormon (TSH), evt. s-calcitonin), ultralyd og finnålscytologi (FNC). Utredningen bør foretas ved tverrfaglige thyroideasentere, som kan være del av et utvidet brystdiagnostisk senter men kan også være selvstendig.
Standardbehandling ved thyroideacarcinom er total thyroidektomi og lymfeknutedisseksjon. Omfang av lymfeknutedisseksjonen bestemmes i forhold til carcinomtype og tumorstadium. Pasienter med lavrisiko carcinom kan opereres med mindre inngrep. Ved DTC suppleres behandlingen eventuelt med radiojodterapi og TSH-supprimerende medikamentell behandling. Generellt sett går utviklingstrenden internasjonalt i retning av å deintensivere behandlingen for lavrisikogruppene, for å redusere bivirkninger og overbehandling Mulig overdiagnostikk og overbehandling er har store konsekvenser for disse pasientene der flertallet har en svært god prognose. Dette er drøftet i det nyeste internasjonale retningslinjer og review. Ved lokalavansert thyroideacarcinom kan det være indisert å utføre reseksjoner for eksempel av trachea og/eller øsofagus.
Nylig har ”the Endocrine Pathology Society” ekspertgruppe publisert internasjonal konsensus om reklassifisering av noninvasiv folliculær variant av papillær thyroid cancer (FVPTC) en benign lesjon som skal betegnes “noninvasive follicular thyroid neoplasm with papillary-like nuclear features” (NIFTP). Det er konsensus om at NIFTP gruppen oppfører seg biologisk lignende det man observerer for benigne folliculære adenom. Denne reklassifiseringen vil ha betydning for diagnostikk, behandling og malignitetsrater (særlig for Bethesda gruppe IV og V), og kan redusere risiko for mulig overbehandling.
Ved familiær thyroideacarcinom gjelder spesielle anbefalinger for utredning, terapi og oppfølging. Gendiagnostikk og profylaktisk thyroidektomi bør alltid tilbys ved familiær MTC.
Ekstern stråling og/eller medikamentell kreftbehandling kan være aktuelle ved lokalavansert sykdom og/eller fjernmetastaser.
Pasienter med lav residivrisiko kan følges opp av egen lege. Pasienter med intermediær risiko bør følges ved thyroideasentere i minst 5 år, deretter av fastlegen. Ved høy residivrisiko følges pasientene ved thyroideasentere i minst 20 år. Pasienter med vedvarende tumor skal følges livslangt av spesialiserte avdelinger.
Forløpstider og pakkeforløp
Sist faglig oppdatert: 30.06.2017
Fra 1. september 2015 ble Pakkeforløp for kreft i skjoldbruskkjertelen innført i helsetjenesten.
Om Pakkeforløp for kreft
Sist faglig oppdatert: 30.06.2017
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Formålet med Pakkeforløp for kreft er at pasienter skal oppleve et godt organisert, helhetlig og forutsigbart forløp uten unødvendig ikke-medisinsk begrunnet forsinkelse i utredning, diagnostikk, behandling og rehabilitering.
Forløpstidene i pakkeforløpet beskriver den maksimale tiden de ulike fasene i forløpet bør ta for et flertall av pasientene. Forløpstidene angis i kalenderdager. De enkelte fasenes forløpstid legges til slutt sammen til en samlet forløpstid, som angir tiden fra henvisning er mottatt til start behandling. Med utgangspunkt i pakkeforløpet skal et individuelt forløp tilrettelegges for hver enkelt pasient.
De regionale helseforetakene har det overordnede ansvaret for å sikre at pakkeforløpene med forløpstidene blir implementert og fulgt opp. Forløpstidene er normerende og er ikke en pasientrettighet. Fortsatt er det lovmessige grunnlaget pasientrettighetsloven § 2-2 og forskrift om prioritering av helsetjenester. Av og til vil det av faglige grunner være noen pasienter som ikke kan utredes ferdig innen normert forløpstid for oppstart av første behandling.
Forløpstider for skjoldbruskkjertelkreft
Sist faglig oppdatert: 30.06.2017
I Pakkeforløp for skjoldbruskkjertelkreft er det følgende forløpstider:
| Fra henvisning mottatt til første fremmøte utredende avdeling |
| 10 kalenderdager |
| Fra første fremmøte i utredende avdeling til avsluttet utredning (beslutning tas) |
| 10 kalenderdager |
| Fra avsluttet utredning til start behandling | Kirurgisk behandling | 21 kalenderdager
|
| Fra henvisning mottatt til start behandling | Kirurgisk behandling | 41 kalenderdager
|
Ved alarmsymptomer, hos barn <18 år og ved anaplastisk cancer skal utredning og behandling starte raskere.
Pakkeforløp for skjoldbruskkjertelkreft finnes på Helsedirektoratets nettsider Se www.helsedirektoratet.no
Det er utarbeidet en egen diagnoseveileder for fastleger for inngang til pakkeforløp. Diagnoseveileder finnes på www.helsedirektoratet.no
Det er også utarbeidet pasientinformasjonsskriv, som finnes på www.helsebiblioteket.no og på www.helsedirektoratet.no
Epidemiologi, risiko og prognose
Sist faglig oppdatert: 30.06.2017
Thyroideacarcinom har utspring i follikelcellene eller C-cellene i thyroidea. Fra follikelcellene utgår papillært thyroideacarcinom (PTC; ca. 70 % av maligne tumorer i thyroidea), follikulært thyroideacarcinom (FTC; ca. 15 %), lite differensiert thyroideacarcinom (poorly differentiated thyroid cancer (PDTC; <5 %) og ATC (<5 %). PTC og FTC nevnes ofte sammen som DTC. Fra C-cellene utgår MTC (<10 %). Det kan også (1–2 %) utvikle seg lymfom eller sarkom i thyroidea, og thyroidea kan være sete for metastaser.
I Norge ble det diagnostisert gjennomsnittlig 338 nye tilfeller per år av thyroideacarcinom i tidsrommet 2011–2015. Det tilsvarer ca. 1 % av de nye krefttilfellene i landet. I 2015 var insidensraten 10 per 100.000 kvinner og 3,9 per 100.000 menn (www.kreftregisteret.no). Nær halvparten av pasientene er yngre enn 50 år når sykdommen påvises.
Leveutsiktene etter behandling for thyroideacarcinom er generelt gode. Per 31.12.2015 levde 5.421 personer i Norge som tidligere har vært behandlet for thyroideacarcinom, derav ca. 3.000 som har levd mer enn 10 år etter at diagnosen ble stilt. Thyroideacarcinom innebærer for mange pasienter behov for livslang oppfølging av lege.
Relativ overlevelse for menn med thyroideacarcinom (alle typer) diagnostisert 2011–2015 var 89,8 %, tilsvarende for kvinner 92,9 %. Det er store forskjeller i prognose etter behandling, fra nær 100 % langtidsoverlevelse for «lokaliserte» papillære carcinomer til nær 90 % mortalitet innen ett år for ATC.
DTC har den beste prognose med 10-årsoverlevelse for PTC >90 % og FTC ca. 85 %. Ved PDTC forverres prognosen imidlertid betydelig. Ved MTC er 10-årsoverlevelse mellom 75–80 %. ATC har en veldig alvorlig prognose med 5-årsoverlevelse <20 %.
For risikovurderingen er risiko for død av thyroideacarcinom (carcinomspesifikk mortalitet) viktigst. Ofte omtales risiko imidlertid som risiko for residiv eller rett og slett som risiko uten å presisere hva slags risiko det dreier seg om. Hva som i eldre litteratur omtales som residiv, særlig lymfeknutemetastaser ved PTC, dreier seg sannsynligvis oftest om restsykdom som tidligere ikke lot seg detektere på grunn av lite sensitive laboratorieanalyser og lav bildeoppløsning for ultralydutstyr og annet bildediagnostisk utstyr av eldre dato.
Med risiko menes i disse retningslinjer økt risiko for både residiv (ala ATA) og død (TNM) av thyroideacarcinom. Preoperativ risikovurdering har betydning for valg av behandling og brukes i disse retningslinjer som grunnlag for definisjon av «behandlingsgrupper». Risikovurdering etter utført primærbehandling baseres særlig ved DTC både på tumorbiologiske parametere og status etter behandling (særlig påvisbar vs. ikke påvisbar restsykdom). Denne typen risikovurdering har betydning for oppfølging av pasientene. I disse retningslinjer brukes risikovurdering etter utført primærbehandling som grunnlag for definisjon av «residivrisikogrupper» og anbefalt kontrollopplegg.
Forebygging
Sist faglig oppdatert: 30.06.2017
Radioaktivitet og jodmangel er risikofaktorer for DTC, særlig hos barn og ungdom. Jodmengden ved ernæring er i en viss grad avgjørende for utvikling av DTC. I land eller regioner med høyt jodopptak, som i Norge, finnes det først og fremst papillære carcinomer. I regioner med jodmangel forekommer follikulære og anaplastiske carcinomer oftere enn ved tilstrekkelig jodopptak.
Det er ellers ingen konkrete tiltak som kan anbefales for å forebygge thyroideacarcinom.
Tidlig diagnostikk og screening
Sist faglig oppdatert: 30.06.2017
Thyroideacarcinomer er relativ sjeldne i forhold til forekomst av knute i skjoldbruskkjertelen. Undersøkelser viser at prevalensen av palpable thyroideaknuter i den voksne befolkning er opp mot 5–10 %. Prevalens av thyroideaknuter ved ultralydundersøkelse av halsen, eller ved autopsi, er så høy som 40 til 50 % hos voksne. Det er derfor en utfordring både å skille maligne fra benigne knuter og å velge behandlingsomfang ut fra ulik klinisk risiko og svulstens vekstmønster og utbredelse.
Ultralyd
Sist faglig oppdatert: 30.06.2017
Ultralyd hos personer uten palpasjonsfunn og uten risikofaktorer (tidligere stråling, familieanamnese, kjent genetisk disposisjon) er unødvendig og anbefales derfor ikke som rutinemessig screeningmetode.
Vanligvis er det ingen indikasjon for generell screening. Familiær opphopning av thyroidea-carcinom kan imidlertid være grunn for individuell og familiær screening. Ved tidligere stråleeksposisjon bør terskelen for malignitetsutredning av glandula thyroidea være lavere enn ellers, men det anbefales ikke generell screening hos slike pasienter heller.
Ved arvelig thyroideacarcinom gjelder spesielle anbefalinger, inkludert profylaktisk kirurgi særlig ved arvelig MTC (viser til punkt om profylaktisk kirurgi).
Calcitoninscreening ved knutestruma
Sist faglig oppdatert: 30.06.2017
Rutinemessig analyse av s-calcitonin hos pasienter med knute i thyroidea er kontroversielt. Små MTC kan være en utfordring ved FNC, og det finnes en relativ høy rate falskt negative svar slik at det er ønskelig å forbedre den diagnostiske sensitivitet. Flere store studier har vist at s-calcitonin konsentrasjonen (avhengig av type assay) er tett korrelert med C-celle-hyperplasi og tumordiameter både ved sporadisk og familiær MTC. Måling av s-calcitonin hos pasienter med thyroideaknuter er derfor anbefalt i flere internasjonale retningslinjer. Noen studier tyder på at calcitoninscreening kan forbedre prognosen siden pasienter kan diagnostiseres før manifestasjon av symptomatisk MTC, men det foreligger ikke klar evidens. Særlig med hensyn til MTC insidens er antallet pasienter med thyroideaknuter som må undersøkes (screenes) for å identifisere en pasient med tidlig og potensielt kurabel sporadisk MTC veldig høy. I tillegg er det usikkert om identifikasjon av slike små MTC alltid har biologisk/klinisk betydning (overutredning/overbehandling). Ytterligere uavklarte spørsmål er ved hvilken knutediameter målingen bør foretas, og ved hvilke intervaller kontroller bør gjennomføres. Calcitoninmåling er logistisk sett mer krevende enn mange andre hormonprøver. Blodprøver må umiddelbart fryses etter sentrifugering, og det er i Norge kun få laboratorier som tilbyr calcitoninmåling.
I Norge anbefales derfor ikke generell calcitoninscreening. Ved klinisk mistanke om medullær cancer eller knuter med mikroforkalkninger bør s-calcitonin imidlertid analyseres. S-calcitonin bør også vurderes hos alle pasienter som skal opereres siden operasjonsstrategi kan påvirkes.
Generell calcitoninmåling hos pasienter med thyroideaknuter bør vurderes på universitetssykehus eller sykehus der laboratoriene tilbyr calcitoninanalyser.
Diagnostikk
Organisasjon og utredning
Sist faglig oppdatert: 30.06.2017
Standard for utredning av knuter i thyroidea/mistanke om carcinom i glandula thyroidea er
- grundig klinisk vurdering med anamnese/familieanamnese
- analyse av spesielle blodprøver
- ultralyd
- ultralydveiledet finnålscytologi (FNC)
- thyroideascintigrafi ev.
Thyroideascintigrafi er vanligvis ikke indisert ved utredning av knuter. Thyroideascintigrafi med 99mTc-perteknetat vil dog være indisert hos pasienter med lav eller supprimert TSH for å utelukke hyperfungerende adenom for dermed å unngå unødvendig invasiv diagnostikk. Thyroideascintigrafi forut for ultralyd og FNC vil for øvrig være særlig aktuelt hos pasienter fra land med jodfattighet. Hyperfungerende og dermed scintigrafisk «varme» knuter er praktisk talt alltid benigne (follikulært adenom) og cytologisk undersøkelse er ikke indisert. En cytologi fra en autonom knute vil gjerne gi svar «follikulær neoplasi» (Bethesda kategori IV).
Etter etablering av spesialiteten Bryst- og endokrinkirurgi er ofte knutediagnostikken organisert i tilslutning til brystdiagnostiske sentere. Særlig på større sentere som håndterer thyroideacarcinompasienter, er det viktig å ha en multidisiplinær faggruppe (MDT) bestående av endokrinkirurg, radiolog, cytolog/patolog, endokrinolog, nukleærmedisiner, onkolog, øre-nese-hals (ØNH) lege og evt. thoraxkirurg. Det bør gjennomføres regelmessige multidisiplinære møter.
Pasienter med thyroideaknuter bør fortrinnsvis utredes ved tverrfaglige thyroideasentere med thyroideateam som behersker omfattende thyroideadiagnostikk. Slike thyroideasentere kan være tilknyttet et brystdiagnostisk senter men kan også være selvstendige enheter.
Klinikeren er oftest en endokrinkirurg, men kan også være ØNH-lege . Ultralydundersøkelsen bør vurderes av en ultralyd-kompetent lege. FNC bør tas ultralydveiledet. Det er en fordel å ha en screener/cytolog tilstede. For cytologen kan det også være nyttig å få direkte informasjon om klinikk og ultralydfunn.
Ved påvist thyroideacarcinom er det ofte aktuelt med ytterligere undersøkelser for å kartlegge sykdommens utbredelse både lokalt og systemisk.
Med økende bruk av FDG PET/CT i utredning og oppfølging av cancer generelt, blir et stadig økende antall pasienter henvist til knuteutredning som følge av et tilfeldig funn av en knute i thyroidea med økt opptak av FDG. Fokalt økt FDG-opptak i thyroidea forkommer som tilfeldig funn hos ca. 1,2 % av pasienter undersøkt med PET for annen kreftform enn thyroideacancer. Fokalt økt FDG-opptak vil hos ca. 1/3 av disse pasientene skyldes malignitet (oftest PTC,og pasientene bør henvises til knutediagnostikk med UL og evt. FNC). Diffust økt opptak skyldes vanligvis thyroiditt, og med mindre slik tilstand er kjent bør pasientene utredes biokjemisk (s-FT4, s-FT3, s-TSH, s-antiTPO og ev s-TRAS).
Kliniske symptomer
Sist faglig oppdatert: 30.06.2017
Ofte oppdages thyroideacarcinom på grunn av en knute i skjoldbruskkjertelen eller forstørrete lymfeknuter på halsen. Knuter oppdages i økende grad ved helseundersøkelser («helsesjekk») på røntgeninstitutt med ultralyd, computertomografi (CT)-, magnetresonanstomografi (MR)- eller positronemisjonstomografi (PET)/CT-undersøkelser. Dette gjør at stadig flere pasienter henvises til spesialistenhetene som utreder thyroidealidelser.
Symptomer som krever rask utredning (alarmsymptomer)
I forbindelsen med avansert tumor i thyroidea kan det forekomme trykksymptomer, ømhet, svelge- og pustevansker, heshet og blodig hoste. Veldig sjelden er thyroideacarcinom grunn til hormonelle symptomer (hyperthyreose ved differensiert carcinom eller diare ved medullær cancer).
Kliniske symptomer som tyder på aggressiv biologi eller lokalavansert cancer, og som vil kreve hurtig utredning og behandlingsstart er:
- Fiksert tumor
- Rask tumorvekst
- Heshet (rekurrensparese)
- Blodig hoste
- Svelge- og pustevansker hos tidligere frisk pasient
- Smerter hos tidligere frisk pasient
Laboratoriediagnostikk
Sist faglig oppdatert: 30.06.2017
Et minimum av blodprøver som er nødvendig ved knutediagnostikk er fri thyroxin (FT4), TSH og thyroidea peroxidase antistoff (antiTPO).
TSH er avgjørende i forhold til evt. utredning med scintigrafi og biopsi. Alle pasienter med knuter og supprimert TSH bør undersøkes med scintigrafi.
Hos pasienter der kirurgi er planlagt, bør det i tillegg tas s-calcium og s-calcitonin.
Høy s-calcitonin vil vanligvis gi grunn til endret strategi. Calcitoninmåling bør vurderes hos alle pasienter med knuter men anbefales foreløpig ikke generelt i Norge. Ved lett eller moderat forhøyet s-calcitonin kan det være aktuelt å utføre en stimulasjonstest. Ved påvist MTC bør også CEA bestemmes.
Provokasjonstest ved s-calcitonin
Tidligere var stimulasjonstester (pentagastrin eller kalsiuminfusjon) anbefalt både i utredning preoperativt og i oppfølgingen. Pentagastrin er nå vanskelig tilgjengelig. Tolkningen av stimulasjonstestene kan være vanskelig. Målemetodene for s-calcitonin er blitt bedre med lavere nedre målegrense og mindre problemer med interferens. Det er derfor usikkert om provokasjonstest kan gi bedre sensitivitet og spesifisitet enn analyse av basal s-calcitonin. Indikasjon for stimulasjonstest bør derfor vurderes av erfaren thyroideaspesialist og individuelt.
Ultralyddiagnostikk
Sist faglig oppdatert: 30.06.2017
Visse karakteristika er hyppigere assosiert med malignitet enn andre. De viktigste er hypoekkoisk solid tumor, uskarp avgrensning mot omgivende thyroideavev, mikrokalk, infiltrasjon gjennom thyroideakapselen og patologiske lymfeknuter på halsen. Dersom en tumor mangler samtlige malignitetskriterier, vil den være benign i nesten alle tilfelle. Denne evnen til å kunne skille mellom benigne og maligne tumorer krever betydelig erfaring og godt utstyr.
Hele halsen skal undersøkes for evt. å påvise solide eller cystiske patologiske lymfeknuter som kan representere metastaser fra et thyroideacarcinom eller annen malign sykdom. Omvendt kan en patologisk lymfeknute, for eksempel lateralt på halsen, være første funn ved en thyroideacancer. Primærtumor i thyroidea kan være meget liten i forhold til en lymfeknutemetastase.
Ultralyd er også basis for biopsitaking i thyroidea ved knuter som trenger cytologisk/histologisk utredning. I praksis er det ved flerknutet struma imidlertid ikke mulig å ta FNC av alle påviste tumorer, og indikasjon for FNC må derfor vurderes av en ultralydkompetent lege. Indikasjon for FNC bygger på ultralydfunn og anamnestiske opplysninger som kan gi mistanke om malignitet.
Til undersøkelse og punksjon av thyroidea benyttes vanligvis et lineært lydhode med høy oppløsning/høy frekvens (≥10 MHz) for å få så god detaljoppløsning som mulig i tumor. Hos pasienter med store struma må man ofte benytte lavere frekvens for å oppnå bedre vevspenetrasjon for å få tilfredsstillende oversikt. Da svekkes imidlertid detaljoppløsningen betydelig.
Grunnet liten sannsynlighet for klinisk relevant carcinom i knuter <10 mm, gjøres FNC hos disse kun hos pasienter med risiko-sykehistorie (positiv familieanamnese, tidligere stråleeksposisjon) og/eller ellers malignitetssuspekte ultralydfunn. Ved thyroiditt er parenkymet som regel generelt hypoekkoisk og ofte med en grov kjertelstruktur, hvilket er uvanlig ved thyroideatumorer. Det er derfor vanligvis unødvendig å ta FNC ved denne tilstanden hvis man ikke finner fokale lesjoner.
Før pasienter med påvist thyroideacarcinom opereres, skal det utføres en preoperativ ultralydundersøkelse av halsens lymfeknuter evt. med FNC, for bedre å kunne fastslå sykdomsutbredelsen. Dokumentasjon av eventuelle funn, eventuelt med videosekvenser for å få frem dynamiske aspekter, må lagres i PACS. Videre er det avgjørende med et godt samarbeid mellom kirurg og radiolog. Det kan være en fordel hvis operatøren er med ved en preoperativ undersøkelse eller kan utføre en orienterende undersøkelse selv.
Utredning av tilfeldige funn av knuter i thyroidea
Økende bruk av forskjellige bildediagnostiske modaliteter har etterhvert gitt en svært høy forekomst av tilfeldige funn av knuter i thyroidea. Dette er som forventet når man vet at tilnærmet halvparten av den voksne befolkning har knuter i sin thyroidea. De aller fleste av disse er benigne og trenger ingen videre utredning. På grunn av det høye antallet er det nødvendig å vurdere/begrense hvilke av disse tilfeldig påviste knutene som er nødvendig å utrede videre. ACR Incidental Thyroid Findings Committee har blant annet sett nærmere på dette, og konklusjonene fra deres arbeide anbefales også som en retningslinje for norsk praksis. Siden forekomst og aktualitet er forskjellig i forskjellige aldersgrupper, anbefales en differensiering med hensyn på alder. Knuter hos barn er ikke så vanlig, og terskelen for undersøkelse hos thyroideakompetent ultralydlege kan være lav for denne gruppen. Anbefalingen er også basert på at det ikke samtidig er andre funn som gir mistanke om cancer, så som patologiske lymfeknuter eller mistanke om innvekst i naboorgan.
Alder under 35 år:
Tilfeldige funn av knuter over 10 mm anbefales nærmere undersøkt av thyroideakompetent ultralydlege, eventuelt med FNC dersom dette er indisert, forutsett normale leveutsikter ellers. Ellers ingen utredning,
Alder 35 år og oppover:
Tilfeldige funn av knuter over 15 mm anbefales nærmere undersøkt av thyroideakompetent ultralydlege, eventuelt med FNC dersom dette er indisert, forutsatt normale leveutsikter ellers. Ellers ingen utredning.
Med økende bruk av FDG PET/CT i utredning og oppfølging av cancer generelt, blir et stadig økende antall pasienter henvist til knuteutredning som følge av et tilfeldig funn av en knute i thyroidea med økt opptak av FDG. Fokalt økt FDG-opptak som tilfeldig funn vil hos ca. 1/3 av disse pasientene skyldes malignitet (oftest PTC). Disse pasientene anbefales derfor henvist til knutediagnostikk. På grunn av at pretestsannsynligheten for malignitet er så vidt høy, anbefales ekstra nøye ultralydvurdering av aktuell lokalisasjon og lav terskel for UL-veiledet FNC av lesjoner, uavhengig av knutens størrelse (forutsatt normale leveutsikter ellers).
Diffust økt opptak skyldes vanligvis thyroiditt, og med mindre slik tilstand er kjent bør pasientene utredes biokjemisk (s-FT4, s-FT3, s-TSH, s-antiTPO og ev s-TRAS).
Det vises for øvrig til ”White paper of the ARC Incidental Thyroid findings comittee” og til felles europeiske retningslinjer for ultralyd i oppfølgningen av pasienter med thyroideakreft.
Biopsi
Sist faglig oppdatert: 30.06.2017
Finnålscytologi (FNC) har vist seg å være den beste diagnostiske metoden for utredning av tumor thyroidea, og bør være førstevalg ved evaluering av tumor i glandula thyroidea. FNC fra lesjoner i thyroidea bør utføres av leger (kirurger, radiologer eller cytologer) som har spesiell erfaring i punksjonsteknikk. Lokalanestesi er som regel ikke nødvendig. Det er en fordel å ha tilstede cytolog eller screener for å umiddelbart kunne bedømme materialets tilstrekkelighet og kvalitet. FNC bør utføres ultralydveiledet også ved palpable knuter.
Histologisk nålebiopsi (grovnålsbiopsi) er aktuelt der man ønsker å differensiere mellom malignt lymfom og thyroiditt, eller mellom lite differensiert og anaplastisk thyroideacancer. Det kan også vurderes ved gjentatte ikke diagnostiske/ikke konklusive FNC og vedvarende mistanke om malignitet. Grovnålsbiopsi skal alltid utføres ultralydveiledet og med lokalbedøvelse. Det bør tas flere biopsier, og helst fra flere områder i lesjonen for å oppnå representativitet.
Åpen biopsi er sjelden indisert men kan vurderes dersom det ellers ikke blir nok vev for omfattende undersøkelser (flere markører kan bli nødvendig).
Ved alvorlig blødningsforstyrrelse må forholdsregler tas før nødvendig biopsi.
Indikasjon for FNC
Det viktigste kriterium med hensyn til om det bør tas FNC er malignitetsmistanke ved ultralydundersøkelsen. Dernest betyr størrelsen på lesjonen(e) mye for vurderingen. I litteraturen går anbefalingene ofte ut på å biopsere lesjoner over 10 mm, mens for eksempel de amerikanske retningslinjer (ATA) gir ulike diameter avhengig av ultralydfunnet.
Ultralyddiagnostikken har utviklet seg mye seneste år, apparaturen har blitt bedre og evnen til å gradere malignitetsmistanke har økt. Knuter som er helt klart benigne behøves ikke å biopseres – uavhengig av størrelse. Dersom det ikke oppfattes avklart om en knute er benign, anbefales FNC ved diameter over 10 mm.
Funn av en eller flere små thyroideaknuter (≤10 mm) påvist tilfeldig ved annen undersøkelse av halsen (ultralyd, CT eller MR), utredes vanligvis ikke videre. Unntak gjøres hvis det foreligger bildemessig mistanke om cancer, familiær thyroideacancerbelastning eller andre risikofaktorer for thyroideacarcinom som for eksempel tidligere stråling mot halsen.
Ved biopsi av flerknutet struma bør den/de mest suspekte knuten(e) biopseres.
Ved uavklart diagnose etter ultralydveiledet FNC må pasienten henvises videre til et thyroideasenter med høyere kompetansenivå.
Ved knuter >40 mm som etter ultralyd ikke klassifiseres som helt sikkert benigne, bør operasjon uansett cytologisk diagnose vurderes. Til tross for lavere sensitivitet bør slike knuter likevel biopseres før operasjonen.
Teknikk for finnålscytologi
Ved punksjon av thyroideatumorer benyttes oftest tynne nåler med en tykkelse på 27 evt 25 G. Det punkteres fortrinnsvis uten aspirasjon. Blir materialet for sparsomt, vil overgang til tykkere nål (23 G) og/eller aspirasjon kunne gi mer cellemateriale. Ved dyptliggende lesjoner kan det benyttes nål med mandreng. Ved follikulære neoplasier med typisk eikehjulspreget vaskularisering, vil det også ofte være nyttig å bruke nål med mandreng for å unngå at nålen umiddelbart fylles med blod. Prøvetakingen bør gjøres ultralydveiledet.
Det bør tas cytologisk materiale fra de mest suspekte områdene i tumor, særlig fra periferien. Hvis materialet ikke kan bedømmes umiddelbart anbefales det flere punksjoner (2–4 ganger) for å sikre representativt materiale.
Preparering og farging av materialet
Generelt benyttes to fremgangsmåter for håndtering av FNC-materialet.
1. Direkte utstryk
Materialet skal strykes ut umiddelbart, for å unngå koagulering, på merkede glass og deretter lufttørkes. Lufttørkede glass fikseres og hurtigfarges med løsninger av typen Diff Quick (Hemacolor e.l.). Noe materiale/noen glass kan eventuelt spritfikseres for Papanicolaou/Pap-farging (bedre kjernedetaljer ved PTC).
2. Spesialhåndtering av materialet til ulike undersøkelser
Ved ønske om utvidete undersøkelser (behov for immuncytokjemi) kan noe materiale sprøytes i «CytoLyt-løsning» for senere immuncytokjemisk undersøkelse, noe materiale kan sprøytes i et Roswell Park Memorial Institute medium-rør (RPMI-rør) som det senere lages en cytoblokk av til immunhistokjemisk undersøkelse. Calcitonin (evt ProGRP) målt i wash-out-materiale i buffer/saltvann kan brukes ved spørsmål om medullært carcinom (både fra primærtumor og fra lymfeknutemetastaser). Thyroglobulin (Tg) kan måles i wash-out-materiale ved spørsmål om lymfeknutemetastaser fra papillære carcinomer. Ved et bilde passende med lymfocyttproliferasjon/mistanke om lymfom, kan det tas materiale på RPMI-rør til flowcytometrisk immunfenotyping.
Vurdering av representativitet
Det er foreslått at et diagnostisk materiale må inneholde minst 6 grupper av follikelepitelceller i hver av minst to punksjoner. Ved påvisning av cyster skal det evakueres så mye væske som mulig, og i tillegg tas eventuelt også en punksjon fra restlesjonen (uten aspirasjon). Cystevæske skal helst undersøkes i sin helhet og det bør lages minst 2–6 utstryk av fersk væske. Resten av væsken sentrifugeres, og det lages 2–4 utstryk av nedspunnet materiale.
Krav til den skriftlige cytologiske besvarelsen
I tillegg til diagnosen bør rapporten inneholde:
- Informasjon om lesjonens/lesjonenes lokalisasjon
- Kort beskrivelse av typen materiale (cystevæske, blodig)
- Forslag i forhold til evt. behov for nye prøver.
Mikroskopisk vurdering ved finnålscytologi
I henhold til internasjonale anbefalinger, er det utarbeidet en norsk versjon av Bethesda-systemet for rapportering av FNC fra lesjoner i thyroidea.
Beskrivelsen bør klassifiseres i seks kategorier (Tabell 1):
I Ikke diagnostisk eller uegnet (malignitetsrisiko 1–4 %).
II Benign (malignitetsrisiko 0–3 %)
III Irregulære celler/follikulær lesjon med usikker betydning (malignitetsrisiko 5–15 %)
IV Follikulær neoplasi eller suspekt på follikulær neoplasi (malignitetsrisiko 15–30 %)
V Mistanke om malignitet (malignitetsrisiko 60–75 %)
VI Malign (malignitetsrisiko 97–99 %)
Kategoriene skal brukes som veiledning både i forhold til ytterligere diagnostikk, behandling og kontroll (Tabell 1).
| Diagnostisk kategori | Malignitetsrisiko | Oppfølging |
|---|---|---|
| I. Ikke diagnostisk eller uegnet Kun cystevæske, acellulært materiale eller umulig å vurdere grunnet mye blod og liknende | 1–4 % | Ny ultralydveiledet FNC |
| II. Benign Forenlig med benign, ikke-neoplastisk follikulær knute (adenomatøs knute, kolloid knute, Graves) Forenlig med lymfocytær (Hashimoto) thyroiditt (må passe med klinikken) Forenlig med granulomatøs (subakutt) thyroiditt Andre | 0–3 % | Klinisk oppfølging |
| III. Irregulære celler med usikker betydning eller follikulær lesjon med usikker betydning En overvekt av microfollikler i et cellefattig materiale med lite kolloid En overvekt av oncocytære celler i et cellefattig materiale med lite kolloid Tolkning av follikelcellemorfologi er vanskelig på grunn av utilfredsstillende kvalitet på materialet (blodtilblanding/lufttørkingsartefakter) Et moderat til cellerikt materiale med kun oncocytære celler der klinikken antyder benign oncocytær lesjon av typen thyroiditt eller kolloid knute Fokale celleforandringer som kan gi mistanke om papillært carcinom i et ellers benignt preget aspirat av den typen som sees ved Hashimoto thyroiditt eller kolloidrikt, benignt preget materiale Cyste-bekledende celler med avvikende morfologi (for eksempel kjernefurer, intranukleære pseudoinklusjoner) i et ellers benignt preget materiale Liten populasjon av follikulære celler med kjerneforstørrelse og tydelig nukleol (tidl. radiojodbehandling, medikamentell behandling) og reparative forandringer Atypisk lymfoid infiltrat, ikke tilstrekkelig for malign diagnose | 5–15 % | Ny ultralydveiledet FNC |
| IV. Follikulær neoplasi eller suspekt på follikulær neoplasi | 15–30 % | Vanligvis kirurgi (vurderes i forhold til klinikk) |
| V. Mistanke om malignitet Mistanke om papillært carcinom Mistanke om medullært carcinom Mistanke om metastase Mistanke om lymfom Andre | 60–75 % | Kirurgi |
| VI. Malign Papillært thyroideacarcinom Lite differensiert carcinom Medullært thyroideacarcinom Udifferensiert (anaplastisk) carcinom Plateepitelcarcinom Carcinom med blandet bilde (spesifiser) Metastatisk carcinom Non-Hodgkin lymfom** Andre | 97–99 % | Kirurgi |
* National Cancer Institute (NCI) arrangerte i 2007 et møte i Bethesda for å utarbeide terminologi og morfologikriterier for FNC-materiale fra thyroidea.
Bethesda-systemet ble presentert i «Am J Clin Pathol» 2009 ved E. Cibas og S. Ali.
** Behandling etter retningslinjer for behandling av lymfom
Molekylære markører ved finnålscytologi
Markører som kan bidra til å bedre diagnostikken av lesjoner i thyroidea er fokusert på cytologisk materiale som er klassifisert som uavklart og suspekt, men ikke sikkert malignt (tilsvarer kategoriene III-V i Bethesda-klassifikasjonen).
BRAF mutasjonen, den molekylære mutasjonen som hyppigst har vært assosiert med papillært carcinom (40–60 %), blir testet ut ved flere sentra som en diagnostisk modalitet. Imidlertid er det få prospektive studier hvor resultatene er publisert, og den kliniske betydning prognostisk er usikker, spesielt for mikrocarcinom. BRAF mutasjonen er en meget sterk indikator på at det foreligger PTC, noe som styrker indikasjonen for at definitiv kirurgi kan utføres istedenfor diagnostisk hemithyroidektomi. Det er viktig å være oppmerksom på at et negativt resultat av en BRAF-analyse ikke utelukker malignitet.
Flere molekylære tester som undersøker et stort panel av gener er utviklet for bruk på cytologisk materiale fra thyroidealesjoner som viser en morfologi klassifisert som Bethesda kategori III–V. Disse molekylære multigen-testene, som også er mye omtalt i nyere publikasjoner, benyttes i liten grad i Europa, dels på bakgrunn av rapportert lav spesifisitet, dels på bakgrunn av svært høye kostnader. I de oppdaterte anbefalingene i ATA retningslinjene (2015), er det angitt at det ikke foreligger «long-term outcome data» for bruken av molekylær status som et tillegg til morfologivurdering av preparater i Bethesda gr. III, for bestemmelse av terapivalg. Konklusjonen er at gevinsten ved bruk av disse markørene er ukjent for pasienter med thyreoideaknuter. For en stor andel av kasus i Bethesda kategori III, vil en ny punksjon være avklarende, og vesentlig mindre kostbar enn en molekylær undersøkelse. Det anbefales foreløpig ikke bruk av disse molekylære multigen-testene i Norge i rutinediagnostikken av thyroidealesjoner. Behov for validering støttes også i nye internasjonale publikasjoner.
Oppfølging av ikke opererte thyroideaknuter
Sist faglig oppdatert: 30.06.2017
Ved kolloide knuter er risikoen for at det utvikler seg carcinom fra disse knutene praktisk talt null, slik at det er tilstrekkelig å overlate kliniske kontroller til fastlegene. Fastlegen henviser pasienten til ny undersøkelse og kontroll ved thyroideapoliklinikken dersom knutene tiltar i størrelse, gir økende trykksymptomer, og dersom det utvikler seg hyperthyreose.
Ved knuter som ikke klassifiseres som enkle cyster eller kolloide knuter, bør kontroll-undersøkelser utføres. Ut fra ultralyd/FNC-funnene vil tidsintervallene vanligvis være 1–2 år.
Knuter som blir funnet uten sikker volumøkning trenger ingen videre kontroller med mindre de er gruppe 3 etter Bethesda-klassifisering. Ved sikker volumøkning bør ny FNC overveies.
Primærutredning etter påvist thyroideacarcinom
Sist faglig oppdatert: 30.06.2017
Optimal kirurgi krever god kartlegging basert på tilstrekkelig utredning. Ultralyd utført av kompetent lege har sentral betydning.
Røntgen thorax har ikke rutinemessig plass i primærutredningen av pasienter med carcinom i thyroidea.
CT og evt. MR av hals og CT thorax er først og fremst indisert ved fikserte svulster eller ved annen mistanke om utbredt sykdom. CT hals uten kontrast har lite verdi.
Hvis det ved differensiert thyroideacarcinom brukes jodholdige kontrastmidler (ved CT), bør det gå minst 9 uker fra jodholdig kontrast er gitt til undersøkelse eller behandling med 131-jod. Ved usikkerhet omkring jodeksponering kan det måles jodid i urin.
Ved lite differensiert carcinom og ved anaplastisk carcinom, bør stagingundersøkelse med CT hals, thorax og abdomen utføres.
Ved medullær thyroideacarcinom anbefales at omfanget av stagingundersøkelsen bestemmes i forhold til s-calcitonin.
Bruk av PET/CT er ikke standard i primærutredningen. Imidlertid har betydningen av PET/CT ved residivutredning økt i løpet av de siste årene, særlig ved metastaser fra DTC som ikke lenger tar opp jod (jod-negative metastaser) (FDG) og ved metastaserende MTC (FDG og/eller FDOPA).
Ved mistanke om innvekst i trachea og/eller øsofagus bør pasientene undersøkes med endoskopi (tracheoskopi, evt. øsofagoskopi) og evt. endoskopisk ultralyd.
Laryngoskopisk vurdering av stemmebåndene er standard før alle thyroideaoperasjoner uansett diagnose. Recurrensparese er den sikreste prodiktor for invasiv vekst, og mange med parese (2/3) har ikke subjektive stemmeforandringer.
Utredning ved residivmistanke
Sist faglig oppdatert: 30.06.2017
Utredningen ved residiv omfatter i første omgang ultralyd og FNC. Tilleggsundersøkelser som brukes avhengig av situasjonen omfatter radiojodscintigrafi med 123-Jod eller 131-Jod (ved DTC), måling av tumormarkører, CT, MR, endoskopi, endoskopisk ultralyd, skjelettscintigrafi og PET/CT med ulike tracere. Utredningen ved residiv bør kun foretas ved avdelinger med spesialkompetanse.
Ved DTC og mistanke om residiv brukes serum thyroglobulin (s-Tg) som veldig sensitiv og spesifikk tumormarkør hos thyroidektomerte pasienter. s-Tg måles enten under lav TSH (basal s-Tg) eller etter endogen eller eksogen TSH-stimulering (stimulert s-Tg). Måling av stimulert s-Tg kan være indisert når resultatet får betydning for terapi eller kontrollopplegg. Ikke påvisbar stimulert s-Tg utelukker vanligvis residiv eller metastaser. Det er riktignok viktig at pasientene ikke har Tg-antistoff.
Ved MTC brukes som veldig sensitive tumormarkører s-calcitonin og CEA.
Mens PET/CT ikke brukes i rutineutredning ved primærutredning av thyroideacarcinom, har betydningen av PET ved residiv økt betydelig i løpet av de siste årene. Ved DTC har FDG-PET relativt høy sensitivitet, særlig ved jodnegativt residiv eller metastaser. Ved MTC kan det være aktuelt å bruke andre tracer som FDOPA istedenfor eller i tillegg til FDG. NaF PET/CT kan også være et alternativ til vanlig skjelettscintigrafi.
Dersom CT med kontrast benyttes i utredningen må det gå minst 5 og helst 9 uker før det kan gi radioaktivt jod for diagnostikk eller behandling. I de aller fleste tilfeller er det fullt forsvarlig å utsette en undersøkelse eller behandling med radioaktivt jod i 9 uker dersom en CT med kontrast er indisert.
PET/CT ved DTC
FDG PET/CT benyttes først og fremst hos pasienter med persisterende forhøyet eller stigende s-Tg etter operasjon og radiojodbehandling. Ved DTC bør gjerne TSH-stimulert Tg>10 pg/L før FDG PET/CT rekvireres. I tillegg til lokalisering av sykdom som ikke har latt seg påvise med annen bildediagnostikk, vil en FDG PET/CT undersøkelse gi prognostisk informasjon. Høyt opptak av FDG i metastatiske lesjoner er assosiert med sykdomsprogresjon og dårlig prognose, mens lavt FDG opptak er assosiert med indolent sykdom og god prognose. For påvisning av små lymfeknutemetastaser på halsen er UL mer sensitiv enn FDG-PET/CT, men undersøkelsene er komplementære. FDG PET/CT kan også være indisert ved staging og restaging av mer avansert sykdom. Særlig høyt opptak av FDG sees ved cancere med oncocytært cellebilde (Hürthlecelle-carcinomer), og ved slik cancertype er det av en rekke forfattere anbefalt staging og restaging med FDG PET/CT.
FDG PET/CT kan synes å være noe mer sensitiv ved høyt DTC under TSH-stimulasjon enn uten stimulering ved at flere lesjoner detekteres og opptaket i de enkelte lesjonene er høyre enn uten TSH-stimulering. Ved Hürthlecellecarcinomer og lavere differensierte carcinomer er TSH-stimulering neppe nødvendig.
FDG- PET/CT ser også ut til å kunne være nyttig ved evaluering av terapirespons ved bruk av kinasehemmere.
PET ved MTC
For lokalisering av høyt differensiert metastaserende sykdom som ikke har latt seg erkjenne ved annen bildediagnostikk kan FDOPA PET/CT være nyttig. Ved lavere differensiert sykdom, først og fremst når calcitoninverdier er >250 pmol/l, dersom calcitonin-doblingstid er kortere enn ca. 1 år, eller hos pasienter hvor CEA er forholdsmessig høyere enn s-calcitonin, vil FDG-PET/CT være å foretrekke fremfor FDOPA PET/CT. Høyt opptak av FDG i metastatiske lesjoner er assosiert med sykdomsprogresjon og dårlig prognose, mens lavt FDG opptak er assosiert med indolent sykdom og bedre prognose. Det er uvisst om høyt opptak på FDG PET/CT gir prognostisk informasjon utover hva økning i s-calcitonin gjør.
Histopatologi
Sist faglig oppdatert: 30.06.2017
Ved diagnostikk av thyroideapreparater stilles det stadig større krav til standardisert vurdering og rapportering. Retningslinjer for histologisk vurdering av maligne svulster, inklusive thyroideacancer, er tidligere publisert (Bostad et al.: Veileder i biopsibesvarelse av maligne svulster, Den norske lægeforening, 2001; ny utgave 2012 fra Den norske patologforening). I det følgende gis supplerende retningslinjer og kommentarer.
Makroskopisk vurdering
Fiksering og beskjæring
God fiksering er viktig for optimal histologisk vurdering. Det bør i minst mulig grad skjæres i preparatet før fiksering (fordi fiksering av overflatestrukturer er viktig). Thyroideakapselen kan forskyves dersom den er gjennomskåret (skrumpning) ved fiksering. Store preparater kan skjæres gjennom etter for eksempel ett døgns fiksering, og deretter etterfikseres. Snittene bør fortrinnsvis legges på tvers. Vev bør i minst mulig grad fjernes før vurdering ved patolog. Det bør ikke skjæres i bakre flate.
Overflaten beskrives. Strukturer som muskulatur, store kar og nerver bemerkes, samt relasjon til tumorvev, og eventuell suturmerkede lesjoner (konferer opplysninger på remisse). Det undersøkes for eventuell gjennomvekst av tumorvev til thyroideas overflate. Før beskjæring kan overflaten tusjes, særlig viktig er dette for bakflaten, der det ikke foreligger noen tydelig hinne/kapsel.
Det må deles fra vedhengende fettvev med lymfeknuter (særlig nedad), andre lymfeknuter (øvre rand) og eventuelt vedhengende lobus pyramidalis for separat vurdering (lokalisering til fradelte lymfeknuter og annet vev noteres).
Dersom hele thyroidea er fjernet, kan sidelapper fradeles isthmus og beskjæres separat.
Som hovedregel bør thyroidealappene seriesnittes på tvers, slik at skivene så vidt henger sammen baktil.
Forandringer på snittflatene beskrives, og kan eventuelt også fotograferes. Det må tas representative snitt.
Mistanke om innvekst i muskulatur, nerver eller kar bemerkes spesielt.
Lymfeknuter telles, både vedhengende og separat innsendte, diameter på den største noteres, lymfeknutene deles (fortrinnsvis i hilumplan) og snittflaten beskrives.
Det bør lages en skisse hvor uttatte snitt markeres. Fotografering av preparatet, før beskjæring og etter påvisning av bestemte lesjoner, kan være til hjelp.
Snittuttak
Ved små og mellomstore svulster (<20 mm) bør hele tumor støpes inn. Snittene plasseres fortløpende i kassetter, fra øvre mot nedre pol.
Ved større svulster er det viktig med flere snitt som viser relasjon til svulstens kapsel (dersom denne foreligger; dette er særlig viktig ved follikulære neoplasier), og flere snitt med relasjon til preparatets overflate ved mistanke om infiltrasjon ut i/gjennom denne (ved utbredt tumorvekst kan det i tillegg overveies å støpe inn ett storsnitt).
Det tas også snitt fra andre knuter og fra upåfallende thyroideavev.
Det tas snitt fra alle lymfeknuter, de små todeles (langs hilumplan hvis mulig) og begge halvdeler innstøpes. Fra store knuter tas representative snitt.
Mikroskopisk vurdering
Klassifisering
Klassifisering av maligne svulster gjøres i henhold til internasjonale kriterier beskrevet i siste utgave av WHO (2004) og AFIP.
1. Papillære carcinomer
Diagnosen baseres på en kombinasjon av kompleks papillær struktur (forgrenede papiller) og/eller karakteristiske kjerneforandringer (mattglasstruktur, kjernefurer, inklusjoner). Disse kjerneforandringene er ikke spesifikke for malignitet, og det kan noen ganger være problematisk å finne kjerner som fyller disse kriteriene. Ved tvil bør dette komme til uttrykk i diagnosen (»usikkert malignitetspotensiale»).
Papillære carcinomer forekommer i mange varianter; i regelen skal en spesifikk komponent dominere (> 75 %) før tumor diagnostiseres som en variant.
Eksempler på subklassifisering:
- Follikulær variant
- Solid variant
- Diffus skleroserende variant
- «Tall cell» variant
Gradering er ikke anbefalt som standard, men har vært foreslått. De individuelle kriterier bør vurderes og beskrives (WHO 2004): markert kjerneatypi, mikronekroser, karinnvekst, og også økt mitotisk aktivitet, da tilstedeværelse av disse i papillære carcinomer kan indikere en dårligere prognose. (Følgende skjema har også vært foreslått: G1 Høyt differensiert; G2 Middels høyt differensiert; G3 Lite differensiert; G4 Udifferensiert; G2 er da definert ved tilstedeværelse av minst ett av de før nevnte kriterier).
I en internasjonal konsensus som nettopp er publisert av ”the Endocrine Pathology Society” ekspertgruppe er noninvasiv folliculær variant av papillær thyroid cancer (FVPTC) reklassifisert til benign lesjon som skal betegnes “noninvasive follicular thyroid neoplasm with papillary-like nuclear features” (NIFTP). Det er konsensus om at NIFTP gruppen oppfører seg biologisk lignende det man observerer for benigne folliculære adenom. Denne viktige reklassifiseringen vil ha stor betydning for frekvens av malignitetsrater.
Det viktige er å angi forandringer som kan indikere en mer aggressiv tumor enn det gjennomsnittlige, enten definert ved en spesifikk subtype/variant knyttet til dårligere prognose, eller ved tilstedeværelse av nevnte kriterier (markert kjerneatypi, mikronekroser, karinnvekst, økt mitotisk aktivitet).
2. Follikulære neoplasier
Tumorvevets relasjon til tumorkapsel og kar er sentralt. Et follikulært carcinom foreligger dersom en kapselkledt tumor med follikulært vekstmønster, uten «papillære» kjerneforandringer, viser infiltrasjon gjennom egen kapsel og/eller karinfiltrasjon. Infiltrasjonen i egen kapsel skal være abrupt og vise gjennomvekst, ikke bare innvekst; invasjon bør ikke forveksles med irregulær sklerose perifert i tumor. Forandringer etter finnålsaspirasjon og eventuell sylinderbiopsi kan feiltolkes som invasjon.
Innvekst i kar skal vurderes nøye, og gjøres perifert i relasjon til tumorkapselen. Follikulære svulster (adenomer) kan vise noe kjernevariasjon og enkelte mitoser, uten at dette i seg selv tilsier malignitet; funn av atypiske mitoser trekker i malign retning.
Solitære follikulære knuter som er velavgrenset og uten komplett kapsel oppfattes oftest som manifestasjon av knutet kolloid struma. Noen slike knuter kan være ganske cellerike («adenomatøse knuter» som del av knutet kolloid struma). Studier har indikert at slike knuter kan representere neoplasier, selv om ikke alle har komplett kapsel, slik at det nok ikke alltid er full overenstemmelse mellom morfologiske og biologiske kriterier.
Follikulære carcinomer (FTC) foreligger i to former: FTC med begrenset eller minimal invasivitet (grad av invasjon kan presiseres i beskrivelse) og FTC med utbredt invasivitet med helt eller delvis manglende tumorkapsel. Karinvasjon er av prognostisk betydning men foreløpig er cutt-offs ikke definert. Vurderingen av karinnvekst er så langt ikke standardisert, slik at antall av kar med tumorinvasjon bør foreløpig ikke brukes til terapeutiske opplegg eller prognosevurdering.
3. Carcinomer med oxyfil differensiering
Carcinomer med oxyfil differensiering kan være ekstra problematiske, dette gjelder både malignitetsvurdering og typing. Sistnevnte fordi disse neoplasmer kan ha små papillære strukturer, men dette tilsier ikke diagnosen papillært carcinom, uten at de har korrekt kjernetype, eller omfattende kompleks papillær struktur, og dette er meget sjelden. Disse svulstene vil oftest være varianter av follikulære neoplasier (adenomer eller carcinomer).
4. Lite differensiert carcinom
Kategorien lite differensiert carcinom er en hybrid som anvendes nærmest som typediagnose, men som egentlig er uttrykk for en gradering. Den anvendes i hovedsak om to kategorier svulster: de som svarer til varianten insulært carcinom, og svulster som befinner seg i en mellomgruppe mellom differensiert og udifferensiert (anaplastisk) carcinom. Dette vil oftest være svulster med solid arkitektur, grovere kjerneatypi (ikke mattglasstype), tendens til nekroser, mitoser, og karinnvekst.
5. Udifferensierte (anaplastiske) carcinomer
Udifferensierte (anaplastiske) carcinomer finnes i ulike varianter og representerer sjelden noen utfordring med hensyn til malignitet. Lymfomer er i regelen lette å identifisere etter immunfenotyping. Grenseoppgang til mesenkymale svulster kan imidlertid være vanskelig, da spolcellede carcinomer kan være nærmest negative for cytokeratiner. Immunhistokjemi og eventuell ultrastrukturell undersøkelse må gjøres i slike tilfeller.
Grenseoppgang til lite differensiert carcinom kan være en aktuell problemstilling. Grov kjerneatypi, multiple mitoser og utbredte nekroser, samt spolcellet differensiering (eventuelt kjempeceller) taler for udifferensiert carcinom. Ofte foreligger kun finnålsbiopsi. Dersom det tas sylinderbiopsier, bør flere biopsier tas og helst fra flere områder av lesjonen, fordi en ofte treffer områder som er dominert av nekrose. Åpen biopsi vil være et godt alternativ utfra en diagnostisk synsvinkel. Det er viktig med materiale som er tilstrekkelig for immunhistokjemisk undersøkelse (ofte multiple markører).
6. Medullære carcinomer
Ved medullære carcinomer bør thyroideavevet utenfor undersøkes systematisk, for å se etter C-celle-hyperplasi, som finnes særlig ved familiær forekomst (på basis av RET-mutasjon).
Histologisk beskrivelse/rapport/diagnose
Beskrivelsen bør omfatte:
- Type preparat (total thyroidektomi, lobektomi, lymfeknutereseksjoner)
- Hovedklassifisering av tumor
- Eventuell subtype/variant
- (Eventuelt gradering)
- Størrelse
- Solitær eller multifokal (multisentrisitet eller intra-glandulær spredning)
- Ensidig eller bilateral
- Relasjon til svulstens kapsel og eventuelt kapselgjennombrudd (fokalt, begrenset eller utbredt)
- Relasjon til thyroideakapselen og ekstrathyroidalt vev (fettvev, muskulatur, nerver; fokalt, begrenset eller utbredt); pT4 er svulster som vokser ekstrathyroidalt; alle udifferensierte carcinomer klassifiseres som pT4
- Eventuell innvekst i kar (utbredelse)
- Reseksjonsflate (for eksempel baktil mot trachea)
- Eventuell lymfeknuteaffeksjon (antall knuter affisert av totalt antall fjernet med henvisning til lymfeknutenes lokalisering, eventuell perinodal vekst)
Frysesnitt
Frysesnitt er ingen sikker undersøkelse ved thyroideacancer, særlig ikke ved follikulære neoplasier, der malignitetsdiagnose ikke kan avgis uten at det finnes helt overbevisende gjennomvekst av kapsel eller karinnvekst, men her skal det vises stor forsiktighet. Frysesnitt anbefales ikke som rutine. Unntaket kan være ved spørsmål om metastaser fra papillært carcinom i lymfeknuter ved liten eller ikke sikkert påvist primærtumor, da det oftest er en lettere diagnose på frysesnitt, og kan avgjøre om det skal gjøres thyroidektomi .
Biopsier
Sylinderbiopsier (eller kirurgiske biopsier) tas fra tid til annen, oftest fra avanserte svulster i thyroideaområdet, med spørsmål om lite differensiert eller udifferensiert carcinom, eller malignt lymfom. Biopsiene er ofte diagnostiske, men kan vise for sparsomt materiale, og her bør man ikke strekke seg for langt. Dette er diagnoser med betydelige behandlingskonsekvenser. Materialet bør være av et visst omfang, også fordi det ofte må gjøres immunhistokjemi (se Biopsi, avsnitt om "preparering og farging av materialet"). Ved follikulære neoplasier skal en være oppmerksom på at cytologisk eller histologisk nålebiopsi kan føre til forandringer i kapsel som kan mistolkes for malignitet.
Supplerende undersøkelser
Vanlige immunmarkører, for eksempel for thyroglobulin, calcitonin, epiteliale proteiner, kar, samt amyloidfargning, anvendes på samme måte som ellers i diagnostisk patologi.
Det har vært skrevet en del om markører som muligens kan bidra til typediagnoser (CK 19, Galectin-3, og flere), men her skal man vise forsiktighet, og der er fortsatt ingen tydelig konsensus på dette felt. Molekylærgenetiske undersøkelser er heller ikke konklusive. Rearrangering av RET-proto-onkogenet (somatisk) (PTC 1–3 og flere) har ingen etablert klinisk betydning ved papillært carcinom. Om lag halvparten av papillære carcinomer har mutert BRAF (oftest V600E). Den prognostiske betydningen av BRAF mutasjonen er fortsatt usikker. Dersom man har mistanke om papillært carcinom ved FNC (men fravær av papillær struktur og sikre kriterier forøvrig), kan BRAF mutasjonsstatus undersøkes på cytologisk materiale (se Biopsi, avsnitt om "molekylære markører ved finnålscytologi").
Det forekommer en sjelden gang metastaser til thyroidea som kan presentere seg klinisk (i tillegg til at dette finnes oftere ved obduksjon). Ved uvanlig utseende tumorvev bør også metastase vurderes, og suppleres med immunprofilering og eventuelt andre indiserte molekylære undersøkelser.
Konsultasjon
Som ved all annen patologidiagnostikk er det viktig med intern konsultering dersom man er i tvil om hvordan et preparat skal vurderes. Dette blir presisert stadig mer i ulike sammenhenger, og det diskuteres om dobbeltsignering skal innføres som obligatorisk ved de fleste malignitetsdiagnoser. Ekstern konsultering bør også benyttes, ved at preparater sendes til kolleger nasjonalt eller internasjonalt der kompetanse finnes.
TNM – klassifisering (UICC versjon 7)
Sist faglig oppdatert: 30.06.2017
Primærtumor (T)1
| TX | Primærtumor kan ikke vurderes |
| T0 | Primærtumor ikke påvisbar. |
| T1 | Intrathyroidal tumor ≤2 cm største diameter |
| T1a | Intrathyroidal tumor ≤1 cm største diameter |
| T1b | Intrathyroidal tumor >1 cm (men ≤2 cm) største diameter |
| T2 | Intrathyroidal tumor >2 cm men ≤4 cm største diameter |
| T3 | Intrathyroidal tumor >4 cm største diameter eller tumor med minimal ekstrathyroidal vekst (for eksempel innvekst i musculus sternothyroideus eller perithyroidalt bløtvev) |
| T4a | Ekstrathyroidal tumor med innvekst i subkutant bløtvev, larynx, trachea, øsofagus eller nervus recurrens |
| T4b | Ekstrathyroidal tumor med innvekst i fascia prevertebralis eller arteria carotis eller store mediastinale kar |
1 Multifocale cancere av alle histologiske typer skal betegnes (m) – største diameter bestemmer T klassifikasjon, for eksempel T2m.
Alle anaplastiske carcinomer klassifiseres som T4 tumores
| T4a | (kun anaplastisk carcinom) Tumor (uansett størrelse) begrenset til thyreoidea |
| T4b | (kun anaplastisk carcinom) Tumor med utstrekning forbi thyreoidea kapselen |
Regionale lymfeknuter (N)
| NX | Regionale lymfeknuter kan ikke vurderes |
| N0 | Ingen regionale lymfeknutemetastaser |
| N1 | Regionale lymfeknutemetastaser |
| N1a | Sentrale lymfeknutemetastaser (nivå VI (pretracheale, paratracheale, prelaryngeale lymfeknuter)) |
| N1b | Metastaser i andre unilaterale, bilaterale eller kontralaterale cervicale (nivå I, II, III, IV eller V) eller retropharyngeale eller lymfeknuter i øvre mediastinum (nivå VII) |
Fjernmetastaser (M)
| M0 | Ingen fjernmetastaser |
| M1 | Fjernmetastaser |
Tumorstadier
| Stadium | T | N | M |
| Differensiert (papillært eller follikulært) thyroideacarcinom | |||
| Alder <45 år | |||
| I | Alle T | Alle N | M0 |
| II | Alle T | Alle N | M1 |
| Alder ≥45 år | |||
| I | T1 | N0 | M0 |
| II | T2 | N0 | M0 |
| III | T3 | N0 | M0 |
|
| T1–3 | N1a | M0 |
| IVa | T1–3 | N1b | M0 |
|
| T4a | N0, N1a-b | M0 |
| IVb | T4b | Alle N | M0 |
| IVc | Alle T | Alle N | M1 |
| Medullær thyroideacarcinom | |||
| I | T1 | N0 | M0 |
| II | T2–3 | N0 | M0 |
| III | T1–3 | N1a | M0 |
| IVA | T1–3 | N1b | M0 |
|
| T4a | Alle N | M0 |
| IVB | T4b | Alle N | M0 |
| IVC | (Hver) Alle T | Alle N | M1 |
| Anaplastisk thyroideacarcinom | |||
| IVA | T4a | Alle N | M0 |
| IVB | T4b | Alle N | M0 |
| IVC | Alle T | Alle N | M1 |
Resttumor klassifikasjon (R)
RX Tilstedeværelse av resttumor kan ikke vurderes
R0 Ingen resttumor
R1 Mikroskopisk resttumor
R2 Makroskopisk resttumor
Genetikk og arv
Sist faglig oppdatert: 30.06.2017
Thyroideacarcinom kan være del av et arvelig kreftsyndrom (der genfeil er påvist) eller opptre familiært der en ikke kjenner involverte gen(er). Det antas at ca. 5–10 % av thyroidea-krefttilfellene er arvelige/familiære. Påvisning av arvelig/familiær kreft får betydning både for pasienten selv og slektninger.
Mistanke om arvelig/familiær kreft kan foreligge på bakgrunn av hvilken krefttype som er påvist, mange krefttilfeller i nær familie og/eller krefttilfellene har oppstått i ung alder. Ved mistanke om arvelig/familiær kreft anbefales henvisning til en medisinsk genetisk avdeling.
Gentesting er en viktig del av utredningen av arvelig disposisjon for thyroideacarcinom. Primært bør gentesting skje hos en pasient med relevant cancer. Etter Bioteknologiloven er dette diagnostisk gentesting og kan rekvireres av alle leger. En anbefaler imidlertid at en medisinsk genetisk avdeling tidlig kobles inn der en har stor mistanke om arvelig sårbarhet.
Tolking av gentestsvar kan være en stor utfordring. Fra RET-genet er vi kjent med mange genfeil som påvises ofte (for eksempel i posisjon 634), og sykdomsrisiko er godt dokumentert. For andre genvarianter kan det herske usikkerhet om denne er sykdomsgivende eller nøytral. Genvariantene klassifiseres fra klasse 1 (benign sekvensvariant) til klasse 5 (sikker sykdomsgivende variant). Nye ikke-publiserte genvarianter ender ofte opp i klasse 3 (VUS = variant med usikker betydning). Ved påvisning av VUS er det ikke påvist noen sikker sykdomsgivende genfeil i familien. Det kan gjøres segregasjonsstudier i familien (følger genfeilen sykdomstilfellene), men det skal ikke gjøres prediktiv gentesting i denne familien. Slike genfunn bør regelmessig revurderes.
Prediktiv gentesting (dvs testing av en person som per i dag ikke har relevant sykdom) er regulert i Bioteknologiloven og det kreves genetisk veiledning før, under og etter prøvetaking. Dette for å forberede risikanden for at han har en risiko for sykdom, motivere han å følge kontrollopplegget og klargjøre betydningen av funn for hans nære familie (særlig barn).
Ved både arvelige og familiære kreftsyndromer er kontrollopplegget for pasienten og familiemedlemmer vesentlig. Et godt kontrollopplegg har som målsetning å oppdage krefttilfeller på et tidlig stadium slik at muligheten for helbredelse øker. Enkelte ganger kan det være behov for risikoreduserende fjerning av friske organ. På den måten vil pasienten/familien kunne minske morbiditet/mortalitet. Et godt og tillitsvekkende kontrollopplegg vil også gjøre det enklere for utsatte familiemedlemmer å opprettholde en god livskvalitet.
Kontrollopplegget kan inneholde regelmessige kontroller også av andre organ enn thyroidea. Et individ som har arvet en genfeil, vil ha denne i alle kroppens celler som har cellekjerne. Det er således viktig å gi alle risikopersoner et kvalitetssikret kontrollopplegg som omfatter alle nøkkelorganer for gjeldende syndrom. Kontrolloppleggene endrer seg stadig, og de kontrollene som er nevnt under pkt. 6.1 og 6.2 er kun veiledende.
Differensiert thyroideacarcinom
Sist faglig oppdatert: 30.06.2017
Ca. 5–10 % av DTC-tilfellene har en arvelig eller betydelig familiær komponent. Ettersom kunnskap om polygen/multifaktoriell arv vil øke, vil denne prosentandelen sannsynligvis bli noe større de kommende år.
De arvelige kreftsyndromene som involverer DTC kan skilles i to hovedgrupper: (a) der DTC er viktigste kreftformen i syndromet og (b) der DTC har en mindre hyppig forekomst og andre kreftformer dominerer. Ved noen av disse syndromene er kreftgenet kjent, for andre er det kjent et område av genomet der en mener kreftgenet er lokalisert. For en tredje gruppe vet vi lite om den molekylærgenetiske årsaken.
Arvelige kreftsyndromer der DTC er hovedfunn
FNMTC (familiær ikke-medullær thyroideakreft)
Inklusjonskriterier:
- tre eller flere 1. eller 2. gradsslektninger med non-medullær thyroideakreft og
- andre kjente arvelige kreftsyndromer er utelukket.
Arv/gener: Oppfattes som autosomalt dominant tilstand med variabel ekspressivitet og nedsatt penetrans. Det er lokalisert flere områder i genomet som kan inneholde det kritiske genet. Syndromet kan deles opp i flere undergrupper.
Gentesting: Foreløpig ikke aktuelt, men det forventes endring her de kommende årene.
Kontrollopplegg for risikopersoner (førstegradsslektninger av person med thyroideakreft): Ultralydundersøkelse hvert annet år.
DTC som ledd i arvelig kreftsyndrom der annen kreft dominerer
Familiær adenomatøs polypose (FAP)
FAP er et kreftsyndrom med hundrevis av adenomatøse polypper i tykktarmen. Det finnes også en subtype med færre enn hundre polypper (AFAP = attenuert familiær adenomatøs polypose). Også andre organer både i gastrointestinaltraktus og ellers kan være involvert. Ca. 1–3 % av pasientene med FAP får DTC, kvinner er mest utsatt.
Arv/gen: Autosomal dominant arvegang. Skyldes genfeil i APC-genet (tumor supressorgen). Gentesting tilgjengelig.
Kontrollopplegg thyroidea: Anbefales ikke generelt. Men i familier der andre familiemedlemmer har DTC, bør risikopersoner gå til årlig thyroideaundersøkelse.
Cowden syndrom
Cowden syndrom eller PTEN-hamartoma tumor syndrom er en tilstand med økt risiko for brystkreft, godartede og ondartede thyroideasykdommer (kreft særlig follikulær type), hamartøse polypper i gastrointestinaltractus, macrocefali (stort hode; 94 % har hodeomkrets >2,0 SD), hudforandringer, dysplastisk gangliocytom av lillehjernen (Lhermitte-Duclos sykdom).
Ca. 75 % får knuter/adenomer i thyroidea; ca. halvparten av disse utvikler DTC.
Arv/gen: Autosomal dominat arvegang. Skyldes genfeil i PTEN-genet. Gentesting tilgjengelig
Kontrollopplegg thyroidea: Årlig ultralyd fra barnealder.
Carney’s kompleks
Sjeldent syndrom med myxomer i hjerte og hud, hyperpigmentering, endokrine tumores og schwannomer. Opptil 75 % har multiple knuter i thyroidea. DTC kan utvikles hos en person med multiple thyroideaadenomer.
Arv/gen: Autosomal dominant tilstand. PRKAR1A-genet, gentesting tilgjengelig.
Kontrollopplegg thyroidea: Ultralydundersøkelse i ung voksen alder. Deretter ved behov.
Werner syndrom
Sjeldent syndrom karakterisert ved prematur aldring. Gjennomsnittlig levealder 54 år. Forekomst 1/200.000 i USA.
Disse pasientene har økt risiko for en rekke kreftsykdommer herunder DTC.
Arv/gen: Autosomal recessiv tilstand. WRN-genet tilgjengelig for gentesting.
Kontrollopplegg thyroidea: Årlig ultralyd.
MEN 2A
Vedrørende dette syndromet se nærmere beskrivelse under "medullært thyroideacarcinom" (MTC). DTC-risiko kun beskrevet ved enkelte RET-genfeil. Mest kjente RET-genfeil c.2410G>A [p.V804M].
Arvegang/gen: Autosomal dominant. RET-onkogen.
Kontrollopplegg thyroidea: se under "medullært thyroideacarcinom" (MTC)
Medullært thyroideacarcinom
Sist faglig oppdatert: 30.06.2017
MTC opptrer i opptil 25 % av tilfellene som arvelige/familiær tilstand. De fleste arvelige tilfellene er del av MEN2 syndromene (MEN = multiple endokrine neoplasier). Ved funn av medullær thyroideakreft bør en alltid genteste for genfeil i RET-genet.
MEN2-tilstanden kan gi svulster/kreft i hormonproduserende organ som thyroidea (MTC, praktisk talt 100 %), binyremarg (feokromocytom, 50 %) og parathyroidea (ca. 25 %).
Arvegang/gen: Autosomal dominant arvegang. Genfeil i RET-genet gir syndromet. RET er et protoonkogen. MEN2 er et av de svært få syndromene der genfeil i et protoonkogen er sykdomsårsak. Genfeil i nesten alle andre protoonkogener er ikke forenlig med liv. De fleste genfeilene i RET-genet er i eksonene 10, 11 og 13–16. Ulike mutasjoner gir ulik sykdomsrisiko (genotype-fenotype-korrelasjon).
Kontrollopplegg/thyroidea: Profylaktisk thyroidektomi anbefales for alle med RET-genfeil. Tidspunktet er avhengig av mutasjon.
Kontrollopplegg: Fjerning av thyroidea i barne/ungdomsalder. Årlig calcitoninmåling og ultralyd.
Behandling ved lokalisert thyroideacarcinom
Sist faglig oppdatert: 30.06.2017
I dette kapittelet omtales primær og residivbehandlingen ved thyroideacarcinom som omfatter kirurgi, og ved DTC også radiojodbehandlingen og TSH-supprimerende medikamentell behandling.
I tillegg inneholder kapitelet behandlingen ved lokalavansert sykdom som også kan omfatte ekstern stråleterapi og cellegiftbehandling..
I motsetning til ved mange andre cancere er radikal primærbehandling ofte indisert også ved metastasert sykdom. Dette fordi pasientene kan leve lenge med fjernmetastaser, og lokale problemer kan forverre klinisk forløp dersom lokal kontroll ikke kan oppnås.
Ved DTC skilles det mellom 3 «behandlingsgrupper» med hensyn til kirurgisk behandling og radiojodterapi og 3 «residivrisikogrupper» med hensyn til TSH-supprimerende behandling og oppfølging.
Tabell 2
| Behandlingsgruppe | Definisjon | Behandling |
|---|---|---|
| 1 Lavrisiko |
|
|
| 2 Intermediær risiko |
|
|
| 3 Høyrisiko |
|
|
1Risikofaktorer: familiær opphopning, tidligere stråleeksposisjon, histologiske varianter (for eksempel oxyfil)
2For kirurgisk behandling aksepteres som lav risiko kun solitære PTC, med hensyn til radiojodbehandling også multifokale PTC ≤10 mm med maksimalt 3 foci
3Inntil 2 sentrale intranodale lymfeknutemetastaser ved T1–2 PTC hos pasienter <45 år kan klassifiseres i denne gruppen
4ATA og BTA anfører «strong recommendation»: Total thyroidektomi uten profylaktisk sentral lymfeknutedisseksjon er adekvat behandling i denne gruppen
5Doseringen bestemmes i forhold til klinisk situasjon
Tabell 3
Kliniske implikasjoner av behandlingsrespons og reklassifikasjon ved differensiert thyroideakreft behandlet med total thyroidektomi og RAJ ablasjon av thyroidearest.
(Fritt oversatt fra ATA retningslinjene 2015, justert i samsvar med at vi Norge nå har en sensitiv Tg analyse med deteksjonsgrense 0,1 µg/L (ATA er satt opp i forhold til 0,2 µg/L) og redusert behov for stimulert Tg-måling.)
| Kategori | Definisjon | Klinisk sykdomskonsekvens | Kontrollopplegg/oppfølgning |
|---|---|---|---|
| Utmerket respons | Negativ bildediagnostikk | 1–4 % residiv | Ved utmerket terapirespons kan kliniske kontroller, UL og måling av serum Tg / TgAb skje med økende tidsintervall. Kontroll med måling av Tg / TgAb trenger ikke foretas hyppigere enn 1 gang i året og TSH bør oftest ligge i referanseområdet. |
|
| Og |
| |
|
| Ikke målbar basal (= ustimulert) Tg < 0,1 µg/L* | <1 % sykdomsspesifikk død | |
| Biokjemisk inkomplett respons | Negativ bildediagnostikk og målbar basal Tg >0,1 µg/L* eller stigende Tg Ab | Minst 30 % utvikler seg spontant til NED1 20 % oppnår NED etter tilleggsbehandling 20 % utvikler strukturelt sykdomsresidiv <1 % sykdomsspesifikk død | Noen av pasientene med Tg 0,1–1 µg/L faller til < 0,1 i løpet av 12–18 mnd. Ved stabil eller fallende serum Tg anbefales fortsatt observasjon under TSH suppresjon hos de fleste av pasientene. Stigende Tg eller Tg Ab verdier (i gjentatte prøver over tid) bør lede til nye undersøkelser og evt. tilleggsbehandling. |
| Strukturell inkomplett respons | Klinisk/bildediagnostiske tegn til sykdom. | 50–85 % vil ha vedvarende sykdom på tross av tilleggsbehandling | En strukturell inkomplett respons kan føre til tilleggsbehandling eller vedvarende observasjon avhengig av flere kliniske og sykdoms faktorer: inkludert størrelse, RAJ-aviditet, 18FDG-aviditet og spesifikk histologi i de strukturelle lesjonene |
|
| Ved alle Tg verdier +/– Tg Ab | Sykdomsspesifikk død i opptil 11 % med loko-regionale metastaser og 50 % med strukturelle fjernmetastaser | |
| Usikker respons | Uspesifikke funn ved billeddiagnostikk Svakt opptak i thyroideasengen ved RAJ skanning Ustimulert Tg målbar, men < 1 µg/L Stimulert Tg målbar, men < 10 µg/L eller Tg Ab verdier stabile eller fallende i fravær av strukturell sykdom | 15–20 % vil vise strukturell sykdom identifiserbar ved oppfølgning Hos de resterende, vil de uspesifikke forandringer være stabile eller forsvinne < 1 % sykdomsspesifikk død | En usikker respons bør lede til fortsatt observasjon med tilpassede gjentatte billedundersøkelse og serum Tg målinger. Uspesifikke forandringer som blir mistenkelige over tid kan vurderes med billeddiagnostikk eller cytologi/ biopsi. |
* I fravær av Tg antistoffer (Tg Ab)
1NED (No evidence of disease: ingen tegn til sykdom)
Tabell 4
| Risiko-gruppe | Definisjon: behandlings-grupper tabell 2 | Vanlig primærkirurgi | Radiojod-behandling | Post-terapiscan og Tg | Initialt TSH behandlings-nivå | Oppfølging |
|---|---|---|---|---|---|---|
| Lav | 1 | Hemithyreoidectomi | Ingen | Postoperativ Tg kan måles som utgangspunkt | TSH 0,5-1,5 (2,0)
| - ktr thyreoidea-senter 1-5 år -ultralyd -Evt sTg
|
| Inter-mediær | 2 | Total thyreoidectomi +/-lymfeknute-disseksjon | Oftest | -Negativ scan -Tg ikke påvisbar/ negative antistoff -Negativ ultralyd | TSH 0,1-0,5
| -Årlig ktr 5-10 år -ultralyd |
| Høy | 3 | Total thyreoidectomi +lymfeknutedisseksjon | Alltid | -Positivt postterapiscan -forhøyet Tg | TSH < 0,1 | Livslangt ved thyreoideasenter |
Kirurgisk behandling
Sist faglig oppdatert: 30.06.2017
Preoperativ forberedelse og utredning
Informasjon gis av opererende kirurg og skal omfatte sykdom, utbredelse, forestående operasjon og komplikasjonsrisiko. Skriftlig informasjon bør gis i tillegg. Det skal journalføres at informasjonen er gitt og at pasienten har gitt sitt informerte samtykke.
Før operasjonen bør minimum TSH, s-calcium og 25-hydroxyvitamin D bestemmes og evt s-calcitonin.
Alle pasientene bør preoperativt undersøkes med ultralyd av operatøren eller med operatør tilstede.
Preoperativ laryngoskopi er obligatorisk. Pasienter med rekurrensparese kontralateralt til den aktuelle operasjonssiden bør henvises til sentere med spesiell erfaring, og kirurgi bør utføres ved hjelp av nervemonitorering.
Ved mistanke om innvekst i trachea eller metastaser i mediastinum, må det gjøres MR-/CT undersøkelse, eventuelt med tillegg av endoskopi i trachea og øsofagus.
Røntgen columna med fleksjon og ekstensjon for å avsløre atlanto-occipital subluksasjon hos pasienter med rheumatoid artritt kan gi grunnlag for spesielle hensyn ved leie på operasjonsbordet.
Tromboseprofylakse er diskutabelt, men kan gis ved spesielle indikasjoner (for eksempel ved operasjonstid > 120 minutter, eller høyrisiko pasienter med trombofili).
Antibiotikaprofylakse gis ikke rutinemessig. Den kan likevel vurderes ved større residivoperasjoner, perforasjon til mucosa og/eller lang operasjonstid (>4–5 timer).
Medikamentell forbehandling før operasjon
Det er ingen evidens for spesiell preoperativ behandling bortsett fra at pasienter med hyperthyreose bør få thyrostatisk behandling.
Med hensyn til postoperativ hypokalsemi og hyppig vitamin D mangel i Norge kan preoperativ normalisering av vitamin D vurderes.
Calcium og vitamin D mangel korrigeres med tilskudd av calcium kombinert med vitamin D3 (for eksempel 800 IU vitamin og calcium 1000 mg) over flere dager. Ved alvorlig vitamin D mangel (<30 nmol/L) bør det gis ekstra tilskudd med vitamin D (for eksempel kolekalsiferol 100.000 IU (Detremin 5 ml i løpet av 1 dag, eventuelt fordelt på to doser).
Ved kjent lav serum-magnesium (<0,70 mmol/L) kan det gis tilskudd med magnesium 120 mg x 3 over noen dager. Dersom det er mistanke om alvorlig magnesium-mangel, kan en vurdere å gi magnesium intravenøst (MgSO4 eller MgCl 10–30 mmol i 1000 ml NaCl over 6 timer dersom normal nyrefunksjon).
Kirurgi ved differensiert thyroideacarcinom
Ved DTC bør omfanget av operasjonen avgjøres i forhold til behandlingsgruppene (gruppe 1–3) som baseres på resultatene av preoperativ utredning. Ved behandlingsgruppene 1 og 3 er det god konsensus med hensyn til kirurgisk behandling, mens det i gruppe 2 til en viss grad kan foretas en individuell avgjørelse, særlig med hensyn til profylaktisk sentral lymfeknutedisseksjon.
Indikasjon for radiojodterapi og TSH supprimerende behandling baseres derimot på informasjon etter histologisk undersøkelse og undersøkelser i forbindelse med radiojodterapi (helkroppsscan og s-Tg).
Som behandlingsgruppe 1 eller lavrisiko differensiert thyroideacarcinom regnes:
- Solitært intrathyroidalt papillært thyroideacarcinom ≤10 mm uten lymfeknutemetastaser
- Minimalt-invasivt follikulært thyroideacarcinom ≤40 mm uten karinvasjon og uten lymfeknutemetastaser
Papillært mikrocarcinom
Papillært mikrocarcinom (mikro-PTC) defineres basert kun på diameter (papillært thyroideacarcinom ≤10 mm). Det må ikke forveksles med lavrisiko papillært thyroideacarcinom.
Prevalens av mikro-PTC ved autopsi er ca. 5 %, men i enkelte arbeider opp til 35 %. Franske studier har vist at mikro-PTC som årsak til operasjon for thyroideacarcinom har økt fra 13 % i 1980 til 37 % i år 2000, noe som tas som uttrykk for bedre diagnostikk (ultralyd).
Papillært carcinom ≤10 mm kan ha:
- Ekstrathyroidal utbredelse (15 til 44 %)
- Multifokalitet (28 til 43 %)
- Bilateral utbredelse (16 til 25 %)
- Lymfeknutemetastaser (19 til 50 %)
Etter kirurgisk behandling av mikro-PTC er sykdomsspesifikk mortalitet <2 % inntil 30 år. Lokalresidivrisiko etter hemithyroidektomi er ca. 20 %, etter total thyroidektomi ca. 5 %. Risikofaktorer for residiv er multifokal og bilateral forekomst, ekstrathyroidal vekst av primærtumor, klinisk lymfeknuteaffeksjon, histologitype og operasjonsomfang.
Ved profylaktisk lymfeknutedisseksjon er det påvist lymfeknutemetastaser ved mikro-PTC hos opp til 61 %. Det er imidlertid ikke sikre holdepunkter for at profylaktisk lymfeknutedisseksjon har betydning for langtidsprognosen. Rapporterte behandlingsopplegg varierer fra observasjon alene til total thyroidektomi og radiojod.
1. Lavrisiko mikro-PTC
Det er holdepunkter for at «lavrisiko» mikro-PTC (negativ familieanamnese for thyroideacarcinom, ikke tidligere strålebehandling, ikke lymfeknutemetastaser, unifokal, intrathyroidal tumor) til og med kan observeres uten operasjon.
I Norge anbefales det foreløpig i slike situasjoner fortsatt hemithyroidektomi. Ved istmuscarcinom kan en istmusreseksjon anses som tilstrekkelig. Det er ingen indikasjon for radiojod eller TSH supprimerende behandling.
2. Ikke lavrisiko mikro-PTC
De øvrige mikro-PTC behandles som papillære cancere generelt. Dersom mikro-PTC blir funnet tilfeldig i et operasjonspreparat er kompletterende total thyroidektomi indisert hvis det påvises ekstrathyroidal vekst, multifokalitet eller lymfeknutemetastaser.
Reseksjonsomfang thyroidea
Følgende begreper skal brukes:
- Hemithyroidektomi: komplett fjerning av en thyroidealapp inkludert isthmus og lobus pyramidalis
- Nesten-total hemithyroidektomi: hemithyroidektomi hvor maks. 1g thyroideavev er igjen
- Total thyroidektomi: fjerning av begge thyroidealapper, isthmus og lobus pyramidalis.
Nesten-total hemithyroidektomi kan være indisert ved vanskelige disseksjonsforhold paratrachealt for å beskytte nervus recurrens og/eller parathyroideakjertel.
Hvis det ikke gjøres total thyroidektomi/hemithyroidektomi, skal kirurgen nøyaktig beskrive omfanget av reseksjonen av hver lapp (begrepene subtotal lobektomi og subtotal thyroidektomi er upresise og skal unngås).
Papillært thyroideacarcinom
Total thyroidektomi utføres hvis minst en av følgende faktorer er til stede:
- Tumor med diameter større enn 1 cm *
- Multifokal sykdom
- Gjennomvekst av thyroideakapsel
- Forekomst av metastaser (lokale, regionale eller fjern-)
- Tidligere bestrålt hals
- Familiær thyroideacarcinom
Kirurgi i en seanse bør tilstrebes. BRAF analyse ved FNC kan være av nytte siden BRAF mutasjonen sterkt assosieres med papillære cancere.
Hemithyroidektomi kan være aktuelt hvis alle følgende faktorer er oppfylt:
- Tumor med diameter ≤ 1 cm *
- Ikke tidligere bestråling av halsen
- Unifokal sykdom
- Ikke gjennomvekst av thyroideakapsel
- Ikke metastaser
- Ikke holdepunkter for familiært carcinom
* ATA 2015 og BTA 2014 åpner for hemithyroidectomi ved < 4 cm) (DATHYRCA < 2 cm) uten andre risiki.
En bør være klar over at en del av disse kriteriene vanligvis vil kunne bestemmes kun på histologipreparat – altså postoperativt. Ved knuter ≤10 mm på ultralyd som blir funnet som PTC ved FNC (mikro-PTC) bør en være bevisst på at det ikke nødvendigvis foreligger «lavrisiko» mikro-PTC.
Ved mistanke om noen av de nevnte risikofaktorene bør en total thyroidektomi vurderes. Alternativt kan en hemithyroidektomi utføres, men pasientene bør informeres om at det kan bli nødvendig å utføre en kompletterende thyroidektomi på et senere tidspunkt.
Follikulært thyroideacarcinom
FNC kan ikke skille mellom follikulære adenomer og carcinomer. Det samme gjelder vanligvis for frysesnitt. Hvis samlet vurdering av all diagnostisk informasjon indikerer follikulær neoplasi, skal det utføres diagnostisk hemithyroidektomi. Ved tegn til gjennomvekst av thyroideakapselen bør total thyroidektomi overveies i same seanse, spesielt hos eldre. Total thyroidektomi krever at pasienten er forberedt på og har akseptert muligheten.
Hvis endelig histologisk diagnose bekrefter at det foreligger follikulært adenom, er pasienten ferdigbehandlet.
Hvis endelig histologisk diagnose bekrefter at det foreligger FTC er videre behandling avhengig av utført primæroperasjon, tumordiagnose og tumordiameter.
Etter kun unilateral utført thyroidektomi er det aktuelt med kompletterende total thyroidektomi hvis det foreligger minst en av følgende faktorer:
- FTC med utbredt invasivitet eller karinvasjon
- Minimalt invasiv FTC med diameter > 4 cm
- Oxyfilt (Hürthle-celle) carcinom
Hemithyroidektomi kan anses som tilstrekkelig hvis ingen av disse faktorene er tilstede.
Lite differensiert thyroideacarcinom
Ved lite differensiert thyroideacarcinom (PDTC) bør det utføres total thyroidektomi. Hos høyrisiko-pasienter (for eksempel høy alder, recurrensparese på tumorsiden) kan det ved unilateral tumor unntaksvis vurderes å utføre kun en hemithyroidektomi.
Disseksjon av lymfeknuter
Regionale lymfeknutemetastaser kan være tilstede på diagnosetidspunktet i 20–90 % ved papillære carcinomer. Dette medfører at pasienter med påvist thyroideacarcinom alltid bør få undersøkt hele halsen med ultralyd preoperativt.
Noen studier rapporterer at lymfeknutemetastaser ikke har klinisk relevans for lavrisikopasienter. «Surveillance, Epidemiology, and End Result (SEER) database» fant imidlertid at blant 9904 pasienter med PTC ville lymfeknutemetastaser, alder >45 år, fjernmetastaser og stor tumor, signifikant predikere dårligere prognose ved multivariat analyse. 14-års overlevelse uten lymfeknutemetastaser var 82 %, og med lymfeknutemetastaser 79 % (p<0.05). En annen SEER studie konkluderte med at cervicale lymfeknutemetastaser medførte en uavhengig risiko for redusert overlevelse, men bare hos pasienter med follikulært carcinom og alder over 45 år.
De regionale lymfeknutene omfatter det sentrale kompartment, de laterale cervikale og de øvre mediastinale lymfeknutene. Disse kan beskrives med UICC (Robbins) system eller med Dralles kompartmentsystem:
(Tabell 5, Bilde 1):
- Kompartmentsystem (Dralle) med et sentralt, to laterale og et mediastinalt kompartment
- UICC system med seks nivå på hver side og et mediastinalt nivå.
Lymfeknutedisseksjon er prinsipielt ikke indisert ved «lavrisiko-cancere».
Med hensyn til pre- og intraoperativ vurdering av lymfeknutene kan det skilles mellom profylaktisk og terapeutisk lymfeknutedisseksjon. Profylaktisk lymfeknutedisseksjon beskriver fjerning av lymfeknuter som verken klinisk eller bildemessig viser tegn til metastaser.
Ved terapeutisk lymfeknutedisseksjon er det påvist metastaser pre eller peroperativt.
Avhengig av tumortype og tumordiameter foreligger metastaser i inntil 30–50 % ved profylaktisk lymfeknutedisseksjon. På den andre siden er den prognostiske betydningen av små lymfeknutemetastaser, særlig ved PTC, usikker. Små metastaser kan dessuten behandles med radioaktiv jod. Sentral lymfeknutedisseksjon øker kirurgisk morbiditet særlig med tanke på hypoparathyroidisme, men også for forbigående og permanent recurrensskade. Profylaktisk lymfeknutedisseksjon er derfor noe kontroversiell. På den ene siden kan påvisning av mikroskopiske metastaser bidra til en upstaging av pasienter som medfører økt bruk av radiojod. På den andre siden kan noen grupper unngå radiojod dersom metastaser ikke påvises.
En profylaktisk lymfeknutedisseksjon i nivå VI bør også vurderes med tanke på redusert risiko for reoperasjon og komplikasjoner ved residiv i det sentrale kompartment. Sekundæroperasjoner har noe høyere risiko for skader av nervus recurrens og parathyroidea enn primæroperasjonen.
En mellomløsning kan være å gjøre ipsilateral profylaktisk lymfeknutedisseksjon.
Profylaktisk lateral eller mediastinal lymfeknutedisseksjon anbefales derimot ikke. Lymfeknutedisseksjon bør gjennomføres systematisk (fjerning av alle lymfeknutene og alt fettvev i et kompartment) og ikke som fjerning av bare enkelte knuter («berry picking»).
- Det anbefales å gjøre terapeutisk sentral (nivå VI) lymfeknutedisseksjon sammen med total thyreoidectomi for pasienter med kliniske metastaser i sentrale lymfeknuter, for å fjerne all sykdom i sentrale halsfelt.
- Profylaktisk sentral lymfeknutedisseksjon (ipsilateral eller bilateral) bør vurderes ved papillært tyreoideacarsinom som er T3 eller T4, klinisk involverte laterale lymfeknuter (cN1b), eller dersom informasjon om lymfeknutestatus brukes til å planlegge videre behandling.
- Thyreoidectomi uten profylaktisk sentral lymfeknutedisseksjon kan være tilstrekkelig for små (T1 eller T2), noninvasive, kliniske lymfeknutenegative PTC (cN0), og for de fleste follikulære cancere.
Terapeutisk lateral lymfeknutedisseksjon bør utføres hos pasienter med biopserte metastaser i laterale halslymfeknuter.
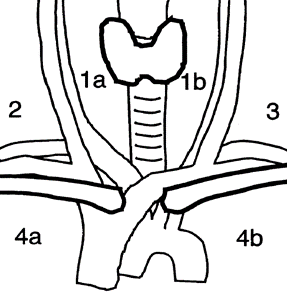
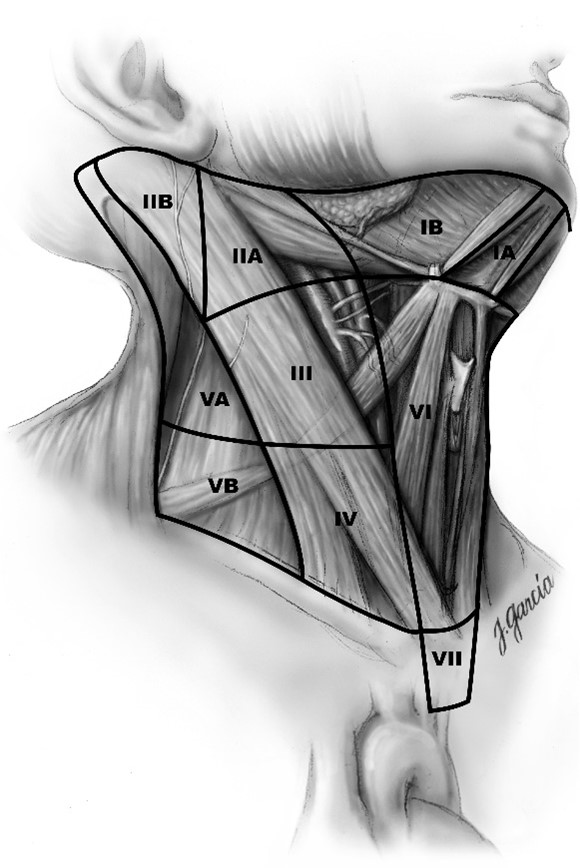
|
| Kompartmentsystem (Dralle) | UICC system (Robbins)1 |
|---|---|---|
| Cervicosentrale lymfeknuter | Kompartment 1 1a høyre side 1b venstre side | Nivå I (submentale og submandibulære lymfeknuter) Nivå VI sentrale lymfeknuter Nivå VII inferiore sentrale lymfeknuter2 |
| Cervicolaterale lymfeknuter | Kompartment 2 høyre side Kompartment 3 venstre side | Nivå IIA, IIB øvre jugulære lymfeknuter Nivå III midtre jugulære lymfeknuter Nivå IV nedre jugulære lymfeknuter Nivå VA, VB laterale jugulære lymfeknuter |
| Mediastinale lymfeknuter | Kompartment 4 (øvre infrabachiocephale lymfeknuter) 4a høyre side 4b venstre side | – |
1Nivå I (submentale og submandibulære lymfeknuter) er ikke del av det sentrale kompartmentet
2Nivå VII beregnes som inferior del av det sentrale kompartmentet, og som omfatter lymfeknutene som ligger superiort for vena brachiocephalica sinistra og som ofte ikke kan fjernes via cervical tilgang
Sentral lymfeknutedisseksjon (nivå VI)
Sentral lymfeglandeldisseksjon (nivå VI) omfatter de prelaryngeale, pretracheale og paratracheale/-øsofageale lymfeknutene. Ved kirurgi i denne regionen er både nervus recurrens, nervus laryngeus superior (ramus externus) og parathyroidekjertlene i fare for å bli skadet. Disseksjon må derfor utføres med spesiell forsiktighet.
Nervus laryngeus recurrens identifiseres alltid og følges visuelt. Bruk av intraoperativ nervemonitoring særlig ved bruk av permanent overvåkning av nervus vagus kan være en fordel og anbefales. Nervus laryngeus superior identifiseres, visuelt eller «negativt» ved at operatøren ser at nerven ikke inkluderes ved ligering av karene ved øvre pol.
Parathyroideakjertlene identifiseres og de to øvre kan ofte dissekeres fri med nativ karforsyning, mens de to nedre ofte må fjernes, findeles og implanteres i musculus sternocleidomastoideus (vevsdiagnosen parathyroidea kan ved behov kontrolleres med frysesnittundersøkelse). Implantasjonsstedet merkes med ikke-resorberbar tråd for å lette senere identifisering.
Lateral lymfeknutedisseksjon (nivå II, III, IV og V)
Dersom det er påvist metastaser til lymfeknuter i det laterale halsfelt preoperativt eller under operasjonen, skal det utføres lymfeknutedisseksjon på den affiserte siden, med bevaring av nervus accessorius, nervus vagus, nervus phrenicus, nervus hypoglossus, sympatiske grensestreng, plexusfasciklene, m. sternocleidomastoideus og v. jugularis interna.
Omfang av lateral lymfeknutedisseksjon ved DTC er ikke tilstrekkelig validert. Det er ikke klart om det ved lymfeknutemetastaser lokalisert til kun et nivå vil være tilstrekkelig å fjerne kun dette nivå, eller om det bør gjøres fullstendig kompartmentdisseksjon. Siden det ikke er mulig å utelukke flere metastaser ved påvist metastase i et nivå, bør fullstendig kompartmentdisseksjon utføres for å redusere residivrisiko.
Mediastinal lymfeknutedisseksjon
Etter Robbins klassifikasjonen omfatter nivå VII kun lymfeknutene som ligger superiort for vena brachiocephalica sinistra (anonyma). Det mediastinale kompartment etter Dralle inkluderer også de infrabrachiocephale lymfeknutene som kan bli involvert hos inntil 5–10 % av pasientene med store tumores. Mediastinal lymfeknutedisseksjon krever derfor vanligvis sternumsplitt, særlig hvis de retrocavale paratracheale lymfeknutene skal fjernes.
Ved mediastinal lymfeknutedisseksjon bør nervus vagus, nervus recurrens og nervus phrenicus identifiseres og bevares.
Det er ingen indikasjon for profylaktisk mediastinal lymfeknutedisseksjon. Ved påviste mediastinale lymfeknutemetastaser bør en mediastinal lymfeknutedisseksjon kun utføres hvis det ellers ikke er avansert generalisert eller raskt progredierende sykdom.
Kompletterende kirurgi
Ved postoperativ carcinomdiagnose etter utført ikke-total thyroidektomi må fullstendig fjerning av thyroidea og evt. lymfeknutedisseksjon vurderes.
Ved «lavrisiko carcinom» (solitær intrathyroidal nodal negativ PTC ≤10 mm, minimal-invasiv nodal negativ FTC ≤40 mm uten karinnvekst) og fullstendig fjernet tumor er ikke videre tiltak indisert.
Ved ikke-lavrisiko carcinom bør pasientene reopereres siden total thyroidektomi er forutsetning for radiojodbehandling. Kun ved veldig lite thyroidearestvev kan radiojodbehandling vurderes uten kompletterende kirurgi.
I forhold til lymfeknutedisseksjon gjelder prinsipielt anbefalingene som er gitt for primærsituasjonen. Likevel bør indikasjon for profylaktisk lymfeknutedisseksjon grundig vurderes siden risiko for kirurgi-assosierte komplikasjoner er økt ved reoperasjon. Profylaktisk sentral lymfeknutedisseksjon bør imidlertid alltid utføres ved pT3 eller pT4 PTC.
Hvis det er indikasjon for kompletterende kirurgi, bør operasjonen utføres enten i løpet av 4 dager eller 3 måneder etter første operasjon.
Kirurgi ved lokoregionalt residiv
Ved lokalt residiv er det vanligvis indikasjon for ny operasjon.
Omfang og tidspunkt for operasjonen bør bestemmes individuelt i forhold til estimert prognose, pasientens situasjon og operasjonsrisiko.
Det bør skilles mellom lokalt residiv som oftest er lokalisert paratrachealt eller paraøsofagalt, med økt risiko for infiltrasjon av vitale organer, og lymfeknutemetastaser som kan sitte i en viss avstand fra de vitale strukturene. Det kan også forekomme bløtvevsmetastaser i for eksempel muskulaturen.
Noen residiv vokser veldig langsomt og kan til og med i noen tilfeller observeres, mens andre residiv viser rask progresjon som krever hurtig operasjon. Vurderingen krever god kunnskap og betydelig erfaring med slike pasienter.
Som ved primærkirurgi bør kirurgi ved residiv utføres som systematisk og kompartment-orientert kirurgi. Ved residiv i et tidligere omfattende operert kompartment kan en selektiv lymfeknutefjerning være tilstrekkelig.
Hos pasienter som ikke er operable, og ved nye lymfeknutemetastaser i allerede opererte områder, har ultralydveiledet etanolinjeksjon vist seg som et meget godt alternativ til kirurgi.
Lokalavansert differensiert thyroideacarcinom
Dette er en undergruppe der utredning og behandling skiller seg fra anbefalte retningslinjer for behandling av thyroideacarcinom uten lokal invasivitet, og utredning og behandling må tilpasses dette. Lokalt invasiv thyroideacarcinom representerer en alvorlig prognostisk gruppe i en ellers relativt indolent pasientpopulasjon. Kirurgien må ivaretas og utføres i sentra med tilstrekkelig spesifikk ekspertise og i samarbeid med tverrfaglig team som dekker alle behandlingsopsjoner. Differensieringsgrad og invasjonsmønster er av stor betydning for behandlingsstrategi. Forekomsten er ca 15 % (3–16 %) av nydiagnostiserte pasienter med thyroideacarcinom.
Lokalavansert thyroideacarcinom defineres som T4 stadium med ekstrakapsulær ekstensjon. Ved lokalavansert carcinom finnes det innvekst i muskulatur (55 %), nervus recurrens (ca. 45 %), trachea (ca. 35 %), øsofagus (ca. 20 %), vena jugularis interna og (veldig sjelden) arteria carotis communis. Innvekst i larynx er sjeldnere. Vanligvis er det direkte ekstensjon fra tumor i thyroidea, men også lokal innvekst fra metastaser kan gi tilsvarende problemer.
Lokal invasivitet er en prognostisk negativ faktor og indikerer en redusert langtidsprognose. Sammenlignet med andre prognostiske faktorer som alder, kjønn, histologi, tumorstørrelse og fjernmetastaser, er ekstrathyroidal invasjon den faktor som har størst negativ betydning for pasienter med høy-differensiert thyroideacarcinom med reduksjon fra 91 % til 45 % ti-års overlevelse. Hos ca. 50 % av de som dør av DTC skyldes det lokal tumorinvasjon, hovedsakelig på grunn av kvelning og blødning ved lokoregionale residiv.
Reseksjoner av nervus recurrens, trachea, øsofagus og larynx medfører signifikant postoperativ morbiditet. Behovet for radikalitet må veies opp mot morbiditet som følge av kirurgi og ekstensive reseksjoner. Ved høyt differensierte cancere er lokal mikroskopisk radikalitet sannsynligvis ikke så avgjørende for langtidsprognosen som ved lavt differensierte varianter der særlig effekt av radiojod ikke kan påregnes.
Kirurgisk reseksjon er av avgjørende betydning i behandling av lokalavansert DTC, med komplett reseksjon med frie marginer som hovedmål. Denne gruppen skal ha også ha ablasjon med radioaktivt jod og livslang suppresjonsbehandling. Hos enkelte bør ekstern strålebehandling vurderes særlig ved ikke mikro- eller makroskopisk frie reseksjonsrender.
Strategi for kirurgisk reseksjon
1. Rette muskulatur
Ved mistanke om invasjon bør musculus sternothyroideus resesseres, evt. også musculus sternohyoideus. Enkelte anbefaler regelmessig reseksjon av musculus sternothyroideus ved anteriort beliggende tumor. Dette har lite eller ingen funksjonell følge, med mulig unntak for sangere, og ingen stor konsekvens.
2. Nervus recurrens
En preoperativt fungerende nerve som er adherent til et carcinom eller lymfeknutemetastase, kan ofte dissekeres fri fra tumor og bevares uten reseksjon så lenge det ikke etterlates noen makroskopisk tumor. Studier har vist at det ikke er forskjell i overlevelse ved reseksjon kontra preservasjon, så fremt det gis radioaktiv jod. Jod-aviditet er imidlertid vanligvis ikke kjent preoperativt, men histologisk aggressiv eller lavt differensiert tumor er mulig indikasjon for mer aggressiv kirurgi. Når nerven er infiltrert og har nedsatt funksjon bør den komplett resesseres en bloc med tumor. Kompensatorisk korrigerende kirurgi i form av thyroplastikk (dersom symptomatisk) kan vurderes senere. Nervesutur eller interposisjon av nerver (for eksempel ansa cervicalis) kan vurderes. Veldig sjelden kan lokal kompresjon av nerven medføre nedsatt funksjon. Nerven bør om mulig bevares siden funksjonen kan komme tilbake etter dekompresjon.
Bilateral recurrensparese er en alvorlig komplikasjon som vanligvis fordrer trakeotomi for å holde fri luftvei. Preoperativ stemmebåndsundersøkelse er avgjørende for å unngå reseksjon av eneste fungerende nervus recurrens, og det anbefales intraoperativ nervemonitorering særlig dersom det foreligger en preoperativ ensidig recurrensparese.
3. Trachea
Invasjonsmønsteret og dybdeinfiltrasjon er av avgjørende betydning ved valg av kirurgisk strategi.
Høyt differensiert tumor uten invasjon i perikondriet eller gjennomvekst av veggen (stadium I) kan ofte fjernes ved hjelp av tangential veggreseksjon (shaving).
Ved gjennomvekst av veggen (stadium II-IV) eller lavt differensiert tumor bør en tracheal reseksjon utføres enten i form av et vindu med rekonstruksjon, eller circumferensiell med ende til ende anastomose. Frysesnitt for vurdering av marginer anbefales. Vanligvis kan 5–6 cm av trachea resesseres. Dette er prosedyrer som kun bør utføres ved sentra med betydelig spesifikk kirurgisk kompetanse og intensivmedisinsk ekspertise (OUS-RH/Haukeland).
4. Larynx
Invasjon i larynx er indikasjon for individuell tilrettelagt kirurgisk strategi og vanligvis partiell laryngeal reseksjon.
5. Øsofagus
På grunn av anatomiske forhold involveres øsofagus vanligvis sent, og oftest kun muskularis-laget, sjeldnere mucosa. Plassering av en stor sonde i øsofagus er til hjelp i vurderingen av om det er mulig å spare mucosa. Dersom gjennomgående reseksjon er nødvendig, må denne lukkes vanntett uten tensjon, eventuelt med vaskularisert lapp, og må utføres av kirurg med spesifikk rekonstruktiv erfaring. Autolog tynntarmtransplantasjon kan være nødvendig.
6. Karinvasjon
Det foreligger relativt sjelden innvekst i vena jugularis eller arteria carotis. Vena jugularis kan ukomplisert fjernes på en side. Dersom indisert, krever reseksjon av arteria carotis communis vanligvis interponat med vene eller protese.
Profylaktisk kirurgi
Ved familiær DTC er det vanligvis ikke indikasjon for profylaktisk kirurgi (thyroidektomi).
Medullært thyroideacarcinom
MTC regnes som en mer avansert og alvorlig sykdom enn differensiert thyroideacarcinom. På grunn av dette, og fordi forekomsten er lavere, bør pasienter med MTC kun behandles i sentere med bred erfaring (fortrinnsvis universitetssykehus).
MTC har gjerne tidlig i sykdomsforløpet lymfeknute- og fjernmetastaser (skjelett, lunge, lever). Ca. 25 % av pasientene med MTC har en arvelig bakgrunn ved aktiverende kimbanemutasjoner i RET proto-onkogenet (MEN 2, multippel endokrin neoplasi) med mutasjons-avhengig risiko for feokromocytom og primær hyperparathyroidisme (genotype-fenotype-korrelasjon).
Familiær MTC deles inn i FMTC (kun MTC), MEN 2A (MTC, primær hyperparathyroidisme (PHPT), feokromocytom) og MEN 2B (MTC, feokromocytom, karakteristisk fenotype med oro-gastro-intestinal ganglioneuromatosis, øyeforandringer og abnormal utvikling av det muskuloskjelettale systemet, ikke PHPT).
Som sensitive tumormarkører brukes basal og stimulert s-calcitonin og CEA. S-calcitonin har vist seg å være et sensitivt verktøy med hensyn til (a) sannsynligheten av lymfeknutemetastaser og (b) prognosen. Ved MEN 2 utvikles MTC via neoplastisk c-celle-hyperplasi (hyperplasi-carcinom-sekvens). Det er en kontroversiell diskusjon om sporadiske MTC også utvikler seg via c-celle-hyperplasi eller de-novo. Omvendt er det ukjent om pasienter med sporadisk c-celle-hyperplasi har en risiko for å utvikle MTC.
Pasienter med påvist eller suspekt MTC bør i tillegg til ultralyd hals undersøkes med måling av s-calcitonin og CEA. Kontrast-CT eller MR av hals, thorax og abdomen bør vurderes ved høye s-calcitonin verdier for å utelukke mediastinale lymfeknutemetastaser og fjernmetastaser. I tillegg kan en skjelettscintigrafi være indisert ved tydelig forhøyet s-calcitonin.
Dersom RET proto-onkogenet ikke har blitt analysert før operasjonen bør s-calcium, PTH, p-metanefrin og p-normetanefrin måles for å utelukke feokromocytom og primær hyperparathyroidisme. Prinsipielt sett er det imidlertid obligat å analysere RET proto-onkogenet hos alle pasienter med MTC.
Pasienter med MEN 2A har mutasjons- og aldersavhengig risiko for PHPT og feokromocytom. Begge tilstander må utredes i forkant av operasjon for MTC. Ved PHPT må operasjonsstrategien i halsen tilpasses, ved feokromocytom må binyreoperasjonen utføres før halsoperasjonen. Dette bør også vurderes hos pasienter med FMTC (selv om forekomst av PHPT eller feokromocytom er svært sjelden) og MEN 2B (PHPT er ikke del av syndromet).
Operasjonsomfang ved primæroperasjon
Standardomfang er vanligvis total thyroidektomi og sentral lymfeknutedisseksjon både ved sporadisk og familiær MTC.
Lymfeknutedisseksjon bør utføres som systematisk og kompartment-orientert fjerning av alt bløtvev (lymfeknuter og fettvev) i mikrodisseksjonsteknikk.
Profylaktisk lateral lymfeknutedisseksjon bør vurderes ved høy s-calcitonin. Det er kontroversielt om det i så fall bør utføres kun ipsilateral lateral lymfeknutedisseksjon, eller bilateral lateral lymfeknutedisseksjon. Omfanget bør bestemmes avhengig av s-calcitonin, diameter av primærtumor og pasienten. Det anmerkes at det ikke foreligger entydige «cut-off» verdier.
Profylaktisk mediastinal lymfeknutedisseksjon er ikke indisert.
Terapeutisk cervical lymfeknutedisseksjon er vanligvis indisert hos alle pasienter med påvist lymfeknutemetastaser. Terapeutisk mediastinal lymfeknutedisseksjon bør vurderes ved mediastinale lymfeknutemetastaser. Mediastinale lymfeknutemetastaser bør fjernes hvis disse truer å infiltrere viktige organer, og pasientene befinner seg i en stabil sykdomssituasjon.
Kompletterende kirurgi
Hos pasienter med insidentelt funnet MTC etter kirurgi må en genetisk bakgrunn utelukkes (fullstendig RET proto-okongen analyse er obligatorisk).
Etter utført total thyroidektomi er det verken ved sporadisk eller familiær MTC indikasjon for ytterligere operasjon dersom s-calcitonin ligger både basalt og stimulert under deteksjonsgrensen.
Pasienter med sporadisk MTC som ble operert med mindre enn total thyroidektomi bør kompletteres med total thyroidektomi hvis tumordiameter er >20 mm eller ved patologisk stimulasjonstest. Pasienter med unifokal MTC ≤20 mm og ikke stimulerbar s-calcitonin kan oppfølges uten kompletterende kirurgi dersom pasienten er informert og har gitt samtykke.
Omfanget av lymfeknutedisseksjon bør bestemmes avhengig av s-calcitonin.
Kirurgi ved residiv
Ved cervicalt residiv er det stort sett alltid indikasjon for ny kirurgi siden infiltrasjon av nerver, kar, trachea eller øsofagus kan bli livstruende («The neck is the pacemaker of the disease»). Hittil ikke opererte kompartmenter bør fjernes fullstendig i ovennevnte teknikk. Ved residiv i primæropererte kompartmenter kan en selektiv tumorreseksjon vurderes. Etanolinjeksjon i lymfeknutemetastaser kan hos enkelte være et alternativ til kirurgi i tidligere opererte områder.
Lokalavansert medullært thyroideacarcinom
Ved MTC med invasjon i nerver, kar, trachea eller øsofagus, bør en utvidet reseksjon vurderes hos pasienter som er i god allmentilstand uten påvisbare fjernmetastaser, eller i utvalgte tilfeller ved isolerte metastaser til lever eller lunge men med stabile s-calcitonin verdier. Vurderingen vil være avhengig av infiltrasjonsgrad.
Profylaktisk kirurgi
Hos personer med kjente sykdomsrelevante RET kimbanemutasjoner er det indikasjon for kirurgi før MTC oppstår (profylaktisk fjerning av thyroidea, evt. med sentralt lymfeknutetoalett).
I følge ATA retningslinjer deles det inn i fire risikogrupper med hensyn til aldersavhengig risiko for å utvikle MTC (se ovenfor: genotype-fenotype-korrelasjon): gruppe A omfatter de minst aggressive RET-mutasjoner, mens gruppe D omfatter MEN 2B pasienter. Sistnevnte pasienter må opereres så fort som mulig og muligens i løpet av det første leveåret. Hos alle andre (gruppe A-C) er det anbefalt å fjerne thyroidea før skolealderen. Tidspunktet bør bestemmes etter måling av basal og evt. stimulert s-calcitonin. Hos pasienter i gruppe A (og evt. gruppe B) kan det være forsvarlig å utsette operasjonen til >10 (-20) års alder hvis s-calcitonin er normal (årlig undersøkelse).
For utfyllende informasjon vises det til ATA retningslinjer for pediatrisk thyroideacancer.
Vedrørende stimulasjonstest se kliniske symptomer, avsnitt om "symptomer som krever rask utredning (alarmsymptomer)".
Anaplastisk thyroideacarcinom
ATC er den mest aggressive og hurtigvoksende solide tumor i thyroidea. Den vokser raskt lokalt på halsen, gir hyppig recurrensparese og pustebesvær. Alle ATC klassifiseres som T4 (se kapittel 5). Fjernmetastaser opptrer gjerne initialt eller innen få måneder. De fleste ATC er lokalavanserte (T4b) ved diagnose, og nesten ingen helbredes uansett terapeutisk tilnærming. Median levetid er under ett år. Hos de få som helbredes foreligger det gjerne et lite, intrathyroidalt fokus av ATC i et struma eller et DTC (T4a).
ATC behandles kun ved universitetssykehus.
Lokal kontroll er viktig på grunn av symptomer og livskvalitet. Preoperativ hyperfraksjonert strålebehandling kan gi bedre lokal kontroll enn kirurgi alene. Tumorcellene har en rask celledeling, og derfor en høy veksthastighet. Der er betydelig gjenvekst mellom strålefraksjonene dersom disse bare gis en gang daglig.
Dersom det foreligger resektabel tumor er total thyroidektomi med profylaktisk eller terapeutisk sentral lymfeknutedisseksjon standardoperasjon. Ved lymfeknutemetastaser i de laterale kompartment kan en lateral lymfeknutedisseksjon vurderes, men ofte reflekterer denne situasjonen inkurabilitet. Hos risikopasienter kan det være en fordel å redusere operasjonens omfang til reseksjon av den tumorbærende thyroidealappen. Tumorvolum-reduserende kirurgi har ingen effekt på prognosen.
Svært ofte er tumor imidlertid verken primært eller sekundært operabel, da gis definitiv strålebehandling til høyere doser, se 6.4.2.
Krav til operasjonsbeskrivelse
Operasjonsbeskrivelsen må inneholde en kort beskrivelse av indikasjonen og at pasienten er informert om dette, og om risiko både for eventuell stemmebåndskade og nedsatt parathyroideafunksjon og andre komplikasjoner.
Diagnosen og prosedyren bør eksakt angis sammen med riktig koding.
Bruk av spesielt utstyr (for eksempel ultralydsaks, andre spesielle disseksjonshjelpemidler, nervemonitorering) bør nevnes.
Operasjonsbeskrivelsen skal inneholde en kort beskrivelse av den anatomiske situasjonen og tumor (lokalisasjon, størrelse, infiltrasjon av andre organer, suspekte lymfeknuter, anatomiske varianter). Hele operasjonen bør beskrives i alle relevante aspekter. Ved vanskelig eller tidkrevende disseksjon bør dette anføres. Særlig håndteringen av nervene (minst nervus recurrens, nervus vagus og nervus laryngeus superior) og parathyroideakjertlene må beskrives. Når det gjelder parathyroidea bør det gis informasjon om hvor mange som ble funnet/bevart/ autotransplantert/merket/biopsert. Med hensyn til nervene skal det beskrives på hvilken måte nervene ble identifisert og hvor. Ved bruk av nervemonitoring bør resultatene og teknikk angis.
Operasjonsomfang må beskrives. Ved lymfeknutedisseksjon skal operasjonsbeskrivelsen gi nøyaktig informasjon om omfanget og intraoperative funn.
Operasjonsresultatet må angis (for eksempel makroskopisk radikal/ikke radikal operasjon).
Intraoperative komplikasjoner må nevnes.
Det bør angis på hvilken måte hemostase ble utført (for eksempel bruk av hjelpemidler), og på hvilken måte halsen ble lukket.
Operasjonsbeskrivelsen bør også inneholde postoperative beskjeder i tilfellet slike gis.
Håndtering av operasjonsmaterialet
Remissen må inneholde kliniske opplysninger og evt. spesielle problemstillinger. Kirurgen må merke preparatene for eksempel med sutur i øvre thyroideapol. Operasjonspreparatet bør i minst mulig grad være skåret i. Spesielle lesjoner bør merkes med sutur og beskrives i remissen. Lymfeknuter kan med fordel monteres på isoporplate, og ulike grupper og lymfeknutestasjoner markeres.
Profylakse og håndtering av komplikasjoner
Nerveskader
- Nervus recurrens (nervus laryngeus inferior)
- Nervus laryngeus superior (ramus externus)
- Nervus accessorius
- Nervus hypoglossus
- Nervus phrenicus
- Sympatikusskade
Prinsipielt gjelder at nervene bør fremstilles og identifiseres hvis det dissekeres i nærheten av dem.
Dette gjelder særlig nervus recurrens både ved thyroidektomi og sentral lymfeknutedisseksjon. Under operasjonen skal nervus recurrens aktivt identifiseres visuelt ved forsiktig disseksjon. Identifikasjon inferiort for thyroidea kan være sikrest fordi nerven kan dele seg i flere grener. Også kapselnær disseksjon uten visuell identifikasjon kan medføre nerveskade, spesielt ved cancer. Samtidig må man ikke strekke eller manipulere for mye med nerven eller diatermere blodkar på eller like ved nerven. Ved differensiert thyroideacarcinom er det sjeldent indikasjon for å ofre nerven. Selv ved adherent tumor har radikal reseksjon med nerven ikke gitt bedre prognose enn nervebevarende kirurgi.
Alle pasienter skal undersøkes pre- og postoperativt med laryngoskopi for å dokumentere stemmebåndsfunksjonen samt endotracheale forhold. Nedsatt stemmebåndsfunksjon preoperativt kan gi mistanke om invasivt voksende tumor. Profesjonelle stemmebrukere (spesielt sangere) bør undersøkes med stroboskopisk laryngoskopi.
Intraoperativ nervemonitorering kan være til hjelp for å identifisere nerven. Selv om det ikke er vist at rutinemessig nervemonitorering bedrer resultatene ved primæroperasjon, gjør det at man kan verifisere den visuelle identifikasjonen av nerven, og gjør disseksjonen lettere om det er vanskelig anatomi pga primærtumor eller sentrale lymfeknutemetastaser. Det kan være særlig nyttig ved total thyoidektomi og ved kompletterende eller residivkirurgi. Signaltap kan påvirke operasjonsstrategien i tilfellet det påvises nerveskade etter utført første side (for eksempel utsette side nr. 2 til nerven har fått normal funksjon tilbake). For sikkert å kunne tolke og stole på nervemonitorering, anbefales det brukt regelmessig.
Kontinuerlig nervemonitorering av nervus vagus er under utprøving, særlig med hensyn på om truende nerveskader kan oppdages så lenge de er reversible. Konklusive data foreligger hittil ikke. Nervemonitorering tillater vurdering av stemmbåndsfunksjon etter utført kirurgi uten at laryngoskopi er umiddelbart nødvendig.
Nervus laryngeus superior (ramus externus) har variabelt forløp i forhold til øvre thyroideapol. Det er usikkert om generell identifisering av denne nerven vil ha fordeler. Ved ligatur av arteria thyroidea superior og mobilisering av øvre thyroideapol, bør man imidlertid forsikre seg om at nerven ikke blir skadet.
Ved lateral lymfeknutedisseksjon bør nervus accessorius, nervus hypoglossus, nervus phrenicus og truncus sympathicus bevares. Dette forutsetter vanligvis at disse nervene identifiseres.
1. Ensidig rekurrensskade
Rekurrensskade defineres som nedsatt ab- og adduksjon av ipsilaterale stemmebånd. Stemmebåndet inntar vanligvis en paramedian eller intermediær stilling. Dette gir ufullstendig lukking av stemmespalten og dysfoni, dårlig motstand ved hosting, aspirasjonstendens og tale- og anstrengelsesdyspnoe. Stemmen blir klangfattig med luftlekkasje og redusert toneregister. Stemmen kan postoperativt være relativt normal, men ved tiltagende atrofi av denervert muskulatur blir problemene mer fremtredende. Sjeldnere er stemmebåndet i median stilling hvilket gir dyspnoe, men mindre stemmepåvirkning.
Reanastomosering av nervus recurrens ved reseksjon for tumorinvasjon gir ikke funksjon (autoparalyse) og men kan gi tonus og redusert atrofi av stemmebåndet.
Ved verifisert skade bør pasienten oppmuntres til å bruke stemmen. Stemmehvile er uhensiktsmessig. Samtidig skal pasienten henvises til logoped for å forebygge feil bruk av ekstern larynxmuskulatur (kompensatorisk). Mindre enn halvparten av pasientene får spontan bedring av stemmebåndsfunksjonen. Tidlig injeksjonbehandling kan vurderes.
Er det fortsatt paralyse med nedsatt stemmekvalitet etter et år, bør pasienten vurderes med tanke på kompensatorisk kirurgi. Økt støtte og fylde i stemmebåndet kan oppnås ved /implantasjon av fettvev, injeksjon (hydroxylapatite eller hyaluronsyre) eller protese (thyroplastikk). Medialisering av stemmebåndet kan gi bedre lukning av stemmespalten.
2. Bilateral rekurrensskade
Ved bilateral rekurrensskade er symptomene avhengig av stemmebåndenes stilling. Stemmen er desto bedre jo nærmere stemmebåndene står midtlinjen, men samtidig blir stridor og dyspnoe mere uttalt. Ved postoperativ stridor må reintubasjon eller trakeotomi vurderes. Ved vedvarende bilateral paralyse kan bakre kordektomi (ekstirpasjon av bakre del av stemmebåndet) redusere stridor og dyspnoe, men vil samtidig gi dårligere stemmefunksjon. For disse pasientene er stemmetrening hos logoped indisert.
3. Skade av nervus laryngeus superior
Skade på nervus laryngeus superior (som innerverer musculus cricothyroideus (hjelper med å addusere og stramme stemmebåndet)) kan gi lavere toneleie og reduserer øvre del av toneregisteret. Sensoriske fibre er viktige for beskyttende reflekser, og skade kan gi aspirasjonstendens.
Anamnese og stroboskopisk laryngoskopi med påvisning av økt glottisbølgeamplitude gir gode holdepunkt for diagnosen.
4. Skade av nervus accessorius
Skade av nervus accessorius gir hengende skulder og problemer med å løfte armen over horisontalplanet i rett lateral eller bakre stilling på grunn av parese av musculus trapezius. Ved lateralt lymfeknutetoalett skal nerven aktivt identifiseres. Differensiert thyroideacarcinom gir sjelden grunn for å ofre nerven. Nedsatt funksjon kan allikevel forekomme og er lett å identifisere umiddelbart postoperativt. Ved omfattende arrdannelse kan gradvis redusert funksjon inntre. Skulderøvelser er viktige for å opprettholde mest mulig av skulderfunksjonen og pasienten bør henvises til fysioterapeut.
5. Skade av truncus sympathicus
Skade av sympatiske grensestreng kan gi Horners syndrom. Ved uttalte symptomer kan pasientene henvises til øyelege til vurdering av øyelokk-kirurgi.
6. Skade av nervus hypoglossus
Skade av nervus hypoglossus kan opptre etter submandibulær disseksjon, og er oftest forbigående. Ved permanent skade bør pasientene vurderes av ØNH lege.
Hypocalcemi
Hypocalcemi postoperativt kan være forbigående eller permanent. Årsakene kan være operasjonstraumet i seg selv med ødem i området den første tiden etter operasjonen, skadet eller midlertidig nedsatt karforsyning til parathyroidea, eller at parathyroideakjertlene har blitt med i resektatet. Operasjonspreparatet undersøkes med hensyn på om parathyroideakjertler har blitt aksidentelt fjernet. Om parathyroideakjertler identifiseres, bør disse reimplanteres.
Etter total thyroidektomi er det ikke uvanlig med lette hypocalcemi-symptomer en kort periode. Insidensen av permanent postoperativ hypocalcemi ligger på ca 2 % avhengig av kirurgens erfaring og tumorens utbredelse.
Ved reoperasjon er risikoen for postoperativ hypocalcemi betydelig økt, og det er også av den grunn viktig at det første inngrepet er så radikalt som nødvendig.
Dersom kirurgen ser at en parathyroideakjertel blir devaskularisert eller har blitt med thyroidearesektatet ut, skal/bør parathyroideakjertelen autotransplanteres. En slik finsnittet, transplantert kjertel vil vanligvis gjenoppta sin funksjon i løpet av få uker til 2–3 måneder. Vanligvis implanteres vevet i en lomme i musculus sternocleidomastoideus. Lommen bør merkes med ikke resorberbar tråd. Ved MEN 1 og 2 med risiko for HPT bør transplantasjonen foretas i underarmen.
Disseksjonen i det sentrale kompartment bør gjøres forsiktig med hensyn til parathyroideakjertlene og deres blodforsyning. Det er kontroversielt om kjertlene bør aktivt identifiseres. Om man ikke finner kjertlene på vanlig sted og man er sikker på at kjertlene ikke er med i reseksjonspreparatet, er det er ikke anbefalt å lete etter eventuelt ektopisk lokaliserte kjertler.
Akutt hypocalcemi
Symptomer oppstår ofte de første postoperative døgnene, gjerne allerede få dager etter utført kirurgi, og kan omfatte stikninger og nummenhet i ekstremitetene og ansiktet, og kramper særlig i de små musklene (tetani). Akutt postoperativ hypocalcemi er ofte en skremmende og traumatisk opplevelse for pasienten. Det er imidlertid ikke streng korrelasjon mellom s-calcium og symptombilde, og mange pasienter med lav s-calcium er klinisk asymptomatiske. Profylaktisk substitusjon av både calcium og vitamin D bør vurderes i forhold til den intraoperative situasjon.
Pasienten må derfor informeres om risikoen for å kunne få hypocalcemi etter operasjonen, og kunnskap om symptomene på lav s-calcium, klinisk observasjon og daglig måling av s-calcium er nødvendig. Måling av PTH intra- eller postoperativt kan være nyttig for å kunne vurdere videre forløp.
Det er ikke konsensus med hensyn til når substitusjonsbehandling bør startes ved asymptomatiske pasienter. Indikasjonen er klar ved symptomer. Oral calciumsubstitusjon bør foretrekkes. Ved lav s-calcium kan det være en fordel å gi calcium regelmessig, og om nødvendig i tillegg ved behov. Calciumtabletter (eller brusetabletter) á 500 mg kan gis flere ganger per døgn. Det er liten risiko for overdosering med calciumtabletter, da pasienten vanligvis blir oppmerksom på symptomene på lav calcium og kan dosere seg selv for å holde symptomene borte. Det kan være en fordel å gi en fast dose med for eksempel 2 g per døgn og substituere videre etter behov.
Ved kraftige symptomer eller uttalt hypocalcemi (< 1,8 mmol/L albuminkorrigert) som er refraktære på oral substitusjon, bør calcium gis langsomt intravenøst (for eksempel 20 mmol calciumklorid i 500 ml NaCl over 12 timer). Initialt kan en ved kramper gi calcium 5 mmol i 50 ml NaCl over 10 minutter. Noen behøver calciuminfusjon gjentatt over flere døgn. Når tilstanden tillater det, bør man gå over til oral calciumtilførsel
Dersom vitamin D-status ikke er sjekket eller korrigert før operasjonen, kan det ved uttalte symptomer gis engangstilskudd kolekalsiferol 100.000 IU (Detremin 5 ml i løpet av 1 dag, eventuelt fordelt på to doser). Ellers bør indikasjon for vitamin D-substitusjon vurderes individuelt. Det anbefales enten calcitriol (0,5–1 μg per døgn) eller alfacalcidiol (0,5–1 μg per døgn) med tillegg av calcium 500 mg daglig, evt mer ved behov. Høye calciumdoser over uker og måneder bør unngås for å unngå utfellinger av kalk i urinveier og i verste fall nefrocalcinose. Det er da bedre å starte med vitamin D tidlig, slik at calciumtilførselen kan reduseres.
Ved lav s-magnesium bør magnesium substitueres. Hvis det er lette symptomer anbefales magnesium 120 mg x 3 daglig peroralt. Dersom s-magnesium er <0,7 mmol/L og pasientene har kraftige symptomer, bør man vurdere å gi magnesium intravenøst, forslagsvis 10–30 mmol MgSO4 eller MgCl, i 1000 ml NaCl over 6 timer, forutsatt normal nyrefunksjon
Calcium og vitamin D bør trappes ned gradvis. Det er viktig å ikke overbehandle. S-calcium bør ligge ved nedre normalgrense.
Kontroll med albuminkorrigert s-calcium bør gjennomføres med 2 ukers mellomrom inntil stabilt nivå. PTH bør måles hver 2. måned for å vurdere parathyroideafunksjonen. Er PTH målbar eller til og med i normalområdet og alle symptomer på hypocalcemi opphører, bør behandlingen forsøksvis stoppes, da parathyreoidea-kjertlene kan være restituert.
Permanent hypocalcemi
Dersom hypocalcemiproblemet fortsetter mer enn 1 år, har pasienten fått permanent postoperativ hypocalcemi. Da behøves livsvarig behandling med høy dose av vitamin D eller aktivert vitamin D (vitamin D-analog ), og et kontrollopplegg som innebærer regelmessig oppfølgning av calciumstatus.
Basisbehandling er tilskudd med calcium 500–1000 mg daglig samt 800 IU vitamin D3 pr dag.
I tillegg behøver pasienten ofte behandling med vitamin aktivert vitamin D som har relativt kort halveringstid og rask effekt, for eksempel calcitriol 0,5–3 μg daglig eller alfacalcidiol 0,5–3 μg daglig. Oppstart av potent aktivert vitamin D bør foregå med langsom doseøkning fra laveste anbefalte dose, hvis man ikke har tidligere doser å støtte seg til.
Dersom en velger å bruke aktivert vitamin D, bør pasienten også ha tilskudd med vanlig vitamin D-preparat (800 IU per dag), dersom 25(OH)D < 60 nmol/L.
Ved innstilling av behandling med vitamin D og calcium bør s-calcium ligge omkring eller like under nedre normalgrense (2,15–2,20 mmol/l). Calcium (ionisert eller albuminkorrigert) bør, når alt har stabilisert seg, kontrolleres hver 3.–6. måned hos pasient som bruker permanent vitamin-D-analog. Calcium- og fosfatutskillelse i urinen bør følges. D-vitaminbehandling medfører fare for høy calciumutskillelse i nyrene og dermed risiko for utvikling av nyresykdom, særlig hvis s-calciumnivået ikke ligger lavt og hvis s-fosfatverdiene blir høye. Man bør prøve å holde D-vitamindoseringen lav, unngå høye fosfatverdier, og redusere renal utskillelse ved å gi magnesiumtilskudd, thiazid eller fosfatbinder.
Dersom det foreligger magnesiummangel (< 0.70 mmol/L) gis peroralt tilskudd med 120 mg x 1–3 per dag.
Pasienter med permanent hypocalcemi har alltid PTH-mangel. Vedlikeholdsbehandling med PTH som daglig subkutan injeksjon eller kontinuerlig infusjon(1–2 µg), er foreløpig på utprøvningsstadiet.
Blødning
Blødninger etter thyroideakirurgi kan bli livstruende og må behandles umiddelbart med reoperasjon. Sykehus som driver thyroideakirurgi må ha en faglig tilfredstillende beredskap til å håndtere dette, både mhp kirurg og anestesi. Sykehuset har ansvar for at det er vakthavende personell tilstede som har kompetanse til å håndtere problemet. Blødning gjør operasjonsfeltet uoversiktlig og medfører risiko for skade på recurrensnerve og biskjoldbruskkjertler.
Infeksjon
Dyp infeksjon kan være en farlig komplikasjon med risiko for mediastinitt og erosjonsblødning. Antibiotika gis og operativ drenasje bør vurderes.
Chyluslekkasje
Særlig ved lateral lymfeknutedisseksjon inferiort på venstre side (nivå IV) kan det komme lekkasje fra ductus thoracicus der den munner inn i venevinkelen mellom vena jugularis interna og vena subclavia. Erkjennes dette intraoperativt kan man lukke den med clips eller forsiktig suturering, gjerne med dekning av muskulatur eller injeksjon av fibrinlim i ductus.
Ved postoperativ lekkasje kan det forsøkes behandlet med lokal kompresjon og passivt dren. Effekt av diett er usikker. Octreotid kan prøves, men det foreligger ikke evidens. Ved vedvarende fistel med volum >500 ml bør reoperasjon vurderes.
Radiojodbehandling
Sist faglig oppdatert: 30.06.2017
Radiojodbehandling kan være indisert ved DTC, men radiojodbehandling er aldri indisert ved MTC og ATC.
Det teoretiske grunnlaget for radiojodbehandling er som følger:
- Stråleindusert destruksjon av eventuelle mikrometastaser i lymfeknuter og mikroskopiske fjernmetastaser
- Stråleindusert destruksjon av eventuelle cancerceller i gjenværende thyroideavev og reseksjonsflater
- Stråleindusert destruksjon av rester av normalt kjertelvev som vil være kilde for s-thyroglobulin (s-Tg) produksjon for dermed å øke spesifisiteten ved s-Tg-målinger
Et postterapiscan er mye mer sensitivt enn et diagnostisk scan med 131jod eller 123jod, på grunn av mye høyere inngitt aktivitet ved terapi enn ved diagnostikk.
Det er dog ingen evidens for at rutinemessig bruk av radiojodablasjon hos lavrisikopasienter gir færre residiv eller redusert dødelighet, og det er derfor en klar trend i retning av mer selektiv bruk av radiojodbehandling av DTC basert på en samlet risikovurdering.
PTC residiverer først og fremst med lymfeknutemetastaser på halsen. Et oppfølgingsopplegg med regelmessig måling av s-Tg med særlig vektlegging på endring av s-Tg-nivå over tid, ultralyd av hals eventuelt supplert med FNC og måling av Tg i aspirat, gjør at rutinemessig radiojodablasjon av normalt kjertelvev hos pasienter med lav risiko ikke kan forsvares.
Indikasjon for radiojodbehandling
Radiojodablasjon av normale vevsrester hos lavrisikopasienter benyttes ikke rutinemessig. Ikke holdepunkt for at radiojodablasjon gavner denne pasientgruppen. Ablasjonsdose kan være aktuelt hos pasient med FTC med minimal karinvasjon (få kar) for å oppnå et godt postterapiscan.
Adjuvant radiojodbehandling kan vurderes gitt hos pasienter med intermediær risiko, mens slik behandling er indisert hos høyrisikopasienter. Flere behandlinger kan være aktuelt.
Radiojodbehandling benyttes ved radiojodkonsentrerende metastaser som responderer på behandlingen. Flere behandlinger er oftest aktuelt.
Behandling av gravide kvinner er kontraindisert. Kvinner i fertil alder bør undersøkes med graviditetstest (s-HCG) dersom usikkert om gravide eller ikke.
Behandlingsgruppe 1
[risko for sykdoms-spesifikk død er meget lav og risiko for restsykdom / residiv er lav (<3 %)]
Solitær intrathyroidal papillær thyroideacarcinom0 < 40 mm og multiple mPTC med frie reseksjonsrender og all tumor resesert, uten kliniske lymfeknutemetastaser, uten fjernmetastasering uten ekstrathyroidal invasjon og uten andre tegn til økt risiko for recidiv eller død (stråling, familieanamnese, histologisk aggressiv variant såsom tall cell variant), skal ikke ha behandling med radioaktivt jod. Dersom det foreligger multifokal sykdom med flere enn 3 foci, kan radiojodbehandling vurderes. Det foreligger ingen konsensus om antall i det hele tatt eller ev. hvor mange foci som skal foreligge før mer aggressiv behandling bør gis.
For pasienter med minimalt invasiv follikulært thyroideacarcinom med størrelse ≤40 mm og uten karinvasjon eller andre risikofaktorer, er radiojodablasjon ikke indisert.
Behandlingsgruppe 2
[intermediær risiko for restsykdom / residiv, relativt lav risiko for død]
Radioaktivt jod vil være indisert hos selekterte pasienter basert på en total risikovurdering. Gruppen omfatter tumor > 4cm (både PTC og FTC), aggressive histologiske varianter uansett størrelse, mikroskopisk ekstrathyroidal invasjon uavhengig av tumorstørrelse, klinisk lymfeknutemetastasering eller >5 lymfeknutemetastaser <3 cm lengste diameter, intrathyroidal PTC 1–4 cm med V600BRAF mutasjon. Andre forhold som alder (> 45 år), familiær opphopning og tidligere strålebehandling mot halsen er av betydning. Noen anser ikke-utført sentral lymfeknutedisseksjon (mikroskopiske lymfeknutemetastaser kan ikke utelukkes) og/eller relativ høy postoperativ s-Tg som tilleggsargument for å anbefale radiojodbehandling. Det kan se ut til at adjuvant behandling med radioaktivt jod har nytteverdi særlig ved aggressive histologiske varianter, ved lymfeknutemetastaser utover det sentrale halsfelt og gjerne større og voksende knuter og hos pasienter med høy alder.
Behandlingsgruppe 3
[restsykdom lokalt og / eller fjernmetastaser og økt risiko for sykdoms-spesifikk død]
Radiojodbehandling er indisert hos alle pasienter i denne gruppen. Gruppen omfatter lokalinfiltrerende restsykdom uansett størrelse, lymfeknutemetastaser med lengste diameter >3 cm og FTC med utbredt karinvasjon og / eller ekstranodal vekst. Flere behandlinger vil være aktuelt ved jodkonsentrerende restsykdom / metastaser når objektiv behandlingseffekt foreligger.
Radiojodbehandling av barn
Det er holdepunkt for at man hos barn bør være særdeles restriktiv med bruk av radioaktivt jod.
Noen anbefaler radiojodbehandling kun hos høyrisko barn med ikke-operable jodkonsentrerende fjernmetastaser, eller etter inkomplett kirurgi med restsykdom.
Barn bør kun vurderes ved institusjon med spesiell erfaring med denne aldersgruppen (OUS/HUS).
Stimulering av jodopptak
Radiojodbehandling må foretas under TSH-stimulering, enten etter seponering av L-tyroksin (Levaxin) ev. trijodtyronin, eller ved bruk av rhTSH. Det er ingen internasjonal konsensus om hvilken metode som bør velges. Det har vært vanlig å benytte rhTSH for ablasjon av normalt kjertelvev og adjuvant behandling. Når det gjelder pasienter med metastatisk sykdom mangler data fra langtidsoppfølging av pasienter forbehandlet med rhTSH, men det finnes gode argument, både medisinske og sosiale, for å benytte rhTSH fremfor seponering. Det foreligger ingen evidens for at seponering av L-thyroksin gir bedre resultat enn bruk av rhTSH, og det er en trend for økende bruk av rhTSH. Hos barn vil de fleste benytte rhTSH uansett.
To ukers forbehandling med jodfattig diett (inntak <50 µg/døgn) anbefales forut for radiojodbehandling. Radiologisk undersøkelse med jodholdig kontrastmiddel (f.eks. CT, radiologisk undersøkelse av urinveiene) må ikke ha vært utført innen de siste 5 og helst innen de siste 9 ukene før radiojodbehandling. Andre forhold som kan påvirke jodopptaket er bruk av taremel i brøddeig, inntak av enkelte naturmedisiner og hjertemedisinen amiodaron. Ved tvil om jodinntak kan det måles jodid i konsentrert morgenurin.
Ved forbehandling med L-thyroksin seponering tas blodprøve for analysering av minst s-Tg, Tg-antistoff, TSH, FT4, s-calcium og kreatinin uken før behandling, samt dagen før behandling. Ved forbehandling med rhTSH tas blodprøve for analysering av minst s-Tg, Tg-antistoff, TSH, FT4 og calcium forut for første injeksjon av rhTSH, og blodprøve for analysering av s-Tg, Tg-antistoff og TSH foretas rett før radiojodbehandlingen (dag 3). Både ved endogen og eksogen TSH-stimulering tas blodprøve 3 dager etter radiojodbehandlingen for måling av s-Tg, Tg-antistoff og TSH.
Seponering av L-thyroksin
Seponering av L-thyroksin over 3–5 uker gir en stor psykisk belastning med forbigående sterkt redusert livskvalitet. Hvor lenge seponering av L-thyroksin må foretas avhenger av utgangsverdien for TSH. Ved fullt supprimert TSH må ofte seponeringen vare hele 5 uker, mens ved TSH > 0,1 mIE/L kan 4 uker være tilstrekkelig. Hos barn vil gjerne 3 uker være tilstrekkelig. Et mål for tilstrekkelig seponering vil være TSH ≥ 30mIE/L, men muligens er enda høyere TSH en fordel. Dersom TSH etter seponering er ≤ 30 mIE/L eller annet ønsket nivå, kan det i tillegg gis en enkel dose med rhTSH.
Trijodthyronin gir hyppigere bivirkninger og er vanskeligere å dosere enn L-thyroksin. Prosedyre med å seponere L-thyroksin og sette pasientene på trijodthyronin som ledd i forbehandling til radiojodbehandling anbefales ikke.
Etter seponering av L-thyroksin kan det allerede andre eller tredje dag etter radiojodtilførselen startes opp med trijodthyronin 20 µg morgen og middag for bruk i 10 dager i tillegg til samme L-thyroksin dose som forut for den midlertidige seponeringen. Hensikten med tillegg av trijodthyronin er først og fremst å komme raskere ut av den hypothyreote fasen. Teoretisk kan det også synes gunstig at det induseres et raskt fall i TSH, slik at man reduserer nedbrytningen av thyroglobulin og utskillelse av radiojoderte hormoner. I hypothyreot fase nedsettes nyrefunksjonen og retensjonstiden for radioaktivt jod forlenges, og dermed oppnås noe høyere initialt tumoropptak. Kumulativ dose til nyrene blir imidlertid også høyere.
Forbehandling med rhTSH
Ved eksogen TSH-stimulasjon gis 2 intramuskulære injeksjoner hver med 0,9 mg rhTSH henholdsvis 2 og 1 dag med 24 timers intervall forut for diagnostisk eller terapeutisk radiojoddose. Det er intet holdepunkt for at L-thyroksin bør seponeres under stimulering med rhTSH, verken av hensyn til jodinnholdet i L-thyroksin eller av hensyn til grad av stimulering. Ved bruk av rhTSH er det derfor ikke nødvendig å seponere L-thyroksin.
Administrasjon av radioaktivt jod og isolasjon
Diagnostiske og terapeutiske aktiviteter med radioaktivt jod gis per os som gelatinkapsler eller blandet i vann som drikke. For å sikre raskt opptak bør pasienten være fastende i 4 timer før og i 2 timer etter inntak. 123I for diagnostikk gis intravenøst.
Radiojodablasjon av normale vevsrester hos lavrisikopasienter benyttes ikke rutinemessig. Dersom likevel benyttes gis vanligvis 1.2 GBq 131Jod.
Adjuvant radiojodbehandling kan vurderes gitt hos pasienter med intermediær risiko, mens slik behandling er indisert hos høyrisikopasienter. Flere behandlinger kan være aktuelt. Vanlig aktivitet er 1.2 til 3.7 GBq.
Radiojodbehandling benyttes ved radiojodkonsentrerende metastaser som responderer på behandlingen. Flere behandlinger er oftest aktuelt. Vanlig aktivitet er 3.7 til 7.4 GBq. Vanligst er å gi fast aktivitet, mens tumordosimetri sannsynligvis vil bli benyttet i nær fremtid. For pasienter med utbredt lungemetastasering bør retinert aktivitet i lungene etter 48 timer ikke overskride 2 GBq. For pasienter >80 år og hos pasienter med nyresvikt bør det utføres en blod-/benmargsdosimetri forut for behandling.
Etter behandling med radioaktivt jod er det vanlig å isolere pasienten på isolatrom i sykehus inntil strålehastigheten (dosehastigheten) har falt til under 25µSv/time målt i avstand 1 meter fra pasienten. Hensikten med isolasjonen er beskyttelse av omgivelsene mot radiojodets høye gammaenergi (fysisk sett kun medium energi). Dersom medisinske eller psykososiale forhold tilsier det, kan andre former for isolasjon som ivaretar strålehensyn til omgivelsene overveies. Strålevernhensyn bør særlig tas i forhold til barn. Det kan av strålevernhensyn av og til være aktuelt å sykemelde en pasient i 1–2 uker etter radiojodbehandling.
Postterapiscan
Postterapiscan kan utføres fra 3–10 dager etter inngitt behandlingsdose med 131-Jod. Supplerende SPECT/CT kan gi nyttig tilleggsinformasjon utover helkroppsscan for presis lokalisering av opptak. På grunn av høy aktivitet og betydelig strålepenetrasjon av kollimatorsepta 3 dager etter radiojodbehandling, kan det ofte være en fordel å utsette SPECT-CT til 5–7 dager etter jodbehandling.
For pasienter med negativt postterapiscan, men med persisterende målbar s-Tg, er ytterligere radiojodbehandling vanligvis ikke indisert.
Etter stimulering med rhTSH vil s-Tg typisk være noe høyere dag 5 enn første dag etter at andre dose med rhTSH er injisert (dag 3). Denne TSH-stimulerte s-Tg-økningen fra dag 3 til 5 kan av og til være umulig å skille fra stråleindusert lekkasje av s-Tg fra restvev. Problemstillingen kan være relevant ved negative postterapiscan, i hvert fall teoretisk betraktet, fordi stråleindusert thyroiditt med lekkasje av s-Tg kan være et tegn på jodkonsentrerende restvev, analogt til positivt postterapiscan, og kan således reise spørsmål om ytterligere radiojod bør gis. Problemstillingen kan vanligvis løses ved gjentatt TSH-stimulert s-Tg-måling etter for eksempel 9–12 måneder. Ved økende s-Tg vil man være mer liberal med å gi en tilleggsdose med radioaktivt jod tross negativt postterapiscan, særlig dersom man tidligere har hatt jodkonsentrerende restvev.
Bivirkninger av radiojodbehandling
For senbevirkninger se også kapittelet om senbivirkninger.
Det er viktig å forberede pasientene på akutte og potensielt permanente bivirkninger.
Ømhet på halsen og kvalme er de vanligste akutte bivirkninger av radiojodbehandling. Stråleindusert thyroiditt i restvev gir ømhet på halsen og kan oppstå allerede noen timer etter inntak av terapidose. Bivirkningen er kun unntaksvis behandlingstrengende. Stråleindusert gastritt kan også oppstå kun få timer etter inntak av radiojoddosen, og kvalmestillende behandling bør gis liberalt fordi det er svært uheldig om en pasient som nettopp har fått radioaktivt jod kaster opp får for lav tumordose og i tillegg kontaminering av tøy og isolatrom. Ømhet på halsen og kvalme går gjerne komplett tilbake i løpet av et par døgn.
Lett hevelse og ømhet av spyttkjertler, særlig glandula parotis, men også submandibularis, er også en vanlig akutt bivirkning. Mange anbefaler bruk av syrlige drops fra dagen etter radiojodinntaket for å få skylt ut opptatt radioaktivt jod fra spyttkjertlene. Det bør ikke suges syrlige drops første døgnet etter jodopptaket, fordi det vil øke spyttkjertelopptaket og dermed stråledosen til kjertlene. Ømhet og hevelse av spyttkjertler kan vare opptil en uke. Permanent nedsatt spyttsekresjon sees gjerne etter to behandlinger eller flere, og øker med antall behandlinger. Nedsatt spyttsekresjon kan føre til tannproblemer.
En ikke uvanlig bivirkning er forbigående redusert smakssans. Redusert smakssans varer vanligvis i flere uker, men kan vare opptil flere måneder.
Erfaringsmessig er utmattelsseymptomer / fatique rapportert hos en del pasienter som har gjennomgått radiojodbehandling, med varighet i opptil et par år, evt lenger.
Se også kapitlet om senbivirkninger etter radiojodbehandling.
Diagnostisk radiojodscan
Diagnostisk radiojodscan er ikke indisert rutinemessig forut for radiojodbehandling da resultat av slik undersøkelse sjelden fører til endret behandlingsplan. Diagnostisk scan med enten 131I (74–185 MBq) eller 123I kan dog foretas når resultat av slik undersøkelse kan forventes å få betydning for gjennomføringen av planlagt radiojodbehandling.
Postterapiscan med ev. supplerende SPECT/CT er alltid indisert 3–7 dager etter behandlingsdosen, Rutinemessig bruk av diagnostisk radiojodscan med 123-Jod eller 131-Jod som kontroll 6–12 måneder etter radiojodbehandling er vanligvis ikke indisert. Med forløpskontroll av s-Tg, oppfølging med ultralyd hals med eventuelt FNC og måling av Tg i aspirat, gir radiojodscan sjelden nyttig tilleggsinformasjon. Kun ved økende s-Tg-verdier med negativ UL hals, eller misforhold mellom s-Tg-verdi og funn på hals, kan diagnostisk scan av og til være nyttig, selv om direkte behandlingsdose etterfulgt av postterapiscan vanligvis er å foretrekke. Et postterapiscan er langt mer sensitivt for påvisning av jodkonsentrerende metastaser enn diagnostisk scan med 123-Jod eller 131-Jod. PET/CT med 124-Jod har høyere sensitivitet og spesifisitet enn diagnostiske undersøkelser med 131-Jod og 124-Jod, men er foreløpig ikke tilgjengelig i Norge.
Diagnostiske radiojodscan med 131-Jod er derimot en nødvendig undersøkelse ved tumordosimetri.
Et spesialtilfelle er pasienter med tyroksinkrevende primær hypotyreose som grunnsykdom. Disse pasientene vil typisk ha meget lavt eller intet radiojodopptak i normalt restvev på halsen, og de normale vevsrestene vil således ikke bli abladert. Eventuelle metastaser vil derimot sannsynligvis konsentrere jod og bli abladert på lik linje med metastaser hos pasienter med normal thyroideafunksjon forut for kirurgi.
Stunning
Etter inntak av 131I, enten i forbindelse med et diagnostisk scan eller en terapidose, reduseres thyroideacellenes jodopptak for en periode på flere måneder. Betegnelsen stunning benyttes om dette fenomenet. Målbar stunningeffekt er beskrevet med aktivitet så lav som 72 MBq (40 % reduksjon i 24-timers jodopptak), og effekten ser ut til å øke med økende aktivitet og er angitt betydelig ved 165–370 MBq. En betydelig stunningeffekt er også påvist i cellekulturer. Betydningen av stunningeffekten er likevel kontroversiell. Mulig stunning er en av grunnene til at diagnostisk jodscan med 131I bør unngås forut for radiojodbehandling. Eksperimenter med cellekulturer kan tyde på at også 123-Jod kan gi stunning. Den kliniske betydningen av denne in vitro påviste effekt av 123-Jod er uviss. Stunning kan muligens også resultere i redusert FDG-opptak. Muligens kan stunningeffekt unngås dersom behandlingsdose gis innen ett døgn etter at diagnostisk aktivitet er gitt. Således kan det av og til være aktuelt å gi f.eks. 1.2 GBq 131-Jod en dag, og ved positivt scan dagen etter, kan det umiddelbart etterpå gis ytterligere f.eks. 6.0 GBq.
Sikkerhet ved flyplasser
På enkelte flyplasser foretas måling av radioaktivitet. Pasienter som skal ut og reise med fly i løpet av to måneder etter behandling med radioaktivt jod bør utstyres med en erklæring som dokumenterer at pasienten har vært behandlet med radioaktivt jod, og det må opplyses om type radionuklid, fysisk halvtid, energinivå, samt tidspunkt for behandlingen. Brevet må signeres av lege eller fysiker med tittel, stempel og kontaktadresse.
Medikamentell behandling
Sist faglig oppdatert: 30.06.2017
Behandling med thyroideahormon
TSH supprimerende behandling
Pasienter behandlet for DTC skal ha livslang suppresjons- eller substitusjonsbehandling, men grad av suppresjon vil avhenge av grad av risiko for residiv eller restsykdom. Det må også tas hensyn til pasientens L-thyroksin toleranse (for eksempel hjertesykdom). Vekst av thyroideavev stimuleres av TSH og hemming av TSH-utskillelsen reduserer derfor risikoen for residiver og øker overlevelsen.
Hos pasienter med lokal restsykdom og metastaser bør TSH være <0.1 mIE/l så sant det ikke foreligger spesielle kontraindikasjoner.
Pasienter som er klinisk og biokjemisk fri for sykdom, men med høy risiko, bør ha TSH suppresjonsbehandling for å holde TSH i området 0,1–0,5 mIE/l i 5 år.
Hos pasienter som er frie for sykdom og med lav risiko for residiv, bør TSH kunne ligge i nedre del av referanseområdet (0,5–1,5 (2,0) mIE/l) som ved vanlig substitusjonsbehandling.
Lavrisikopasienter med målbar s-Tg (<2 µg/L) etter total thyroidektomi på grunn av at de ikke har fått 131Jod, trenger heller ikke suppresjonsbehandling. Pasienter med mistanke om metastatisk sykdom på grunn av målbar s-Tg bør imidlertid få suppresjonsbehandling.
L-thyroksin skal brukes fremfor trijodthyronin ved suppresjonsbehandling. Behandlingen startes med 125 µg daglig hos voksne, lavere dose hos eldre og hjertesyke og 150 µg hos store voksne menn. Ved oppstart av L-thyroksin-natrium kontrolleres TSH og fritt T4 etter 6–8 uker, og ukedosen økes med 50–100 μg hver 6.–8. uke inntil ønsket TSH-nivå. Blodprøve for måling av TSH og fritt T4 skal tas medikamentfastende og 6–8 uker etter dosejustering.
Pasientens selv og pasientens primærlege skal informeres om grad av suppresjonsbehandling/ substitusjonsbehandling og anbefalt TSH nivå. Anbefalt behandlingsmål for TSH skal ikke endres uten konferering med behandlingsansvarlig sykehuslege.
Etter inntak av L-thyroksin vil nivået av FT4 i serum øke på grunn av topp etter absorbsjon av L-thyroksin. Hvis FT4 måles like etter tablettinntak, kan FT4 verdien være over referansegrensen. Dette kan føre til feilaktig reduksjon av pasientens L-thyroksindose. Kontrollprøve av TSH og FT4 bør derfor tas medikamentfastende (vanligvis 8 timer etter inntak), det vil si at pasienten bør vente med dagens tablett til etter prøvetakning.
Substitusjonsbehandling
Følgende pasientgrupper skal ha substitusjonsbehandling (TSH 0,5–1,5 (2,0) mIE/L):
- Pasienter behandlet for medullært thyroideacarcinom
- Pasienter behandlet for anaplastisk thyroideacarcinom
- Pasienter behandlet for microPTC eller minimal invasiv FTC
- Lavrisikopasienter behandlet for DTC uten tegn til restsykdom (ikke målbar s-Tg, normal ultralyd hals)
Også ved substitusjonsbehandling er L-thyroksin å foretrekke framfor trijodthyronin.
Vedlikeholdsdosen av L-thyroksin (oftest er 125–150 μg daglig) styres etter TSH-verdi og etter kliniske symptomer. Ukedosen økes med 50–100 μg hver 6.–8. uke til ønsket TSH-nivå og klinikk.
Blodprøve for måling av TSH og FT4 skal tas medikamentfastende 6–8 uker etter dosejustering.
Pasientens og pasientens primærlege skal informeres om behandlingen og behandlingsmål. Behandlingsmål skal ikke endres uten konferering med behandlingsansvarlig sykehuslege.
Behandling ved graviditet
Dersom en kvinne ønsker å bli gravid, er tidligere behandlet differensiert thyroideacarcinom ingen kontraindikasjon. Graviditet anbefales imidlertid ikke før sykdommen er ferdigbehandlet og de planlagte terapidosene er gitt. Kvinnen bør vente minst 6 måneder etter radiojod-behandling før hun blir gravid. Graviditet bør også vente til pasienten er ferdigbehandlet og T4 doseringen er stabilisert.
Det er viktig for fosterutviklingen og graviditeten at behandlingen med thyroideahormoner er optimalisert gjennom hele graviditeten. L-thyroksin behovet stiger i graviditeten – mest i første halvdel (økt behov 10–80 %). Det kan være en utfordring å behandle pasienten slik at stoffskiftet ligger optimalt. En pasient som er thyroidektomert, og deretter abladert med høydose radioaktivt jod, kan behøve større dosehøyning enn en pasient med primær hypothyreose.
Anbefalt nivå av TSH, som er avhengig av pasientens residivrisiko, bør følges også under graviditet. Thyroideaprøvene bør følges hver 4. uke, med etterfølgende dosejustering. Hypothyreose skal unngås.
Hos pasient som presenterer med høy risiko for residivtumor, men som nå er fri for sykdom (klinisk og biokjemisk) bør TSH-suppresjon vedlikeholdes gjennom graviditet, med TSH-verdi mellom 0,1 og 0,5 mIE/L.
Hos alle andre pasienter som er fri for sykdom, bør TSH-verdi ligge mellom 0,5 og 1,5 (2) mIE/L.
Kvinner som bruker substitusjonsdose av L-thyroksin, bør øke dosen med 20–30 % straks graviditeten er bekreftet. Man bør månedlig kontrollere TSH, som skal ligge mellom 0,5 og 1,5 (2) mIE/L, og FT4, som skal ligge høyt i normalområdet (avhengig av målemetode for FT4).
Kvinner som bruker suppresjonsdose med L-thyroksin, har lav TSH, og en hypofyse som har vært supprimert i lengre tid, kan av den grunn være vanskelig å vurdere under graviditet, og man må iblant akseptere lav verdi av TSH.
Straks barnet er født, bør kvinnen gå tilbake til samme dose L-thyroksin som hun hadde før hun ble gravid, med blodprøvekontroll 6 uker etter fødselen.
Behandling av barn
Barn trenger høyere vektadaptert dose L-thyroksin enn voksne (behovet per kg kroppsvekt avtar med alderen). Både suppresjons- og substitusjonbehandling må styres i samarbeid med pediater/endokrinolog med erfaring med pasientgruppen.
Bivirkninger av suppresjonsbehandling
Se Senbivirkninger.
Cellegiftbehandling i primærbehandlingen
Ingen former av thyroideacarcinom er særlig følsomme for cytostatica. På grunn av eldre rapporter om responser ved bruk av doxorubicin, er ukedose doxorubicin fortsatt i bruk sammen med strålebehandling ved anaplastisk thyroideacarcinom. Annen bruk av medikamentell behandling i kurativ hensikt, er eksperimentell.
Ekstern strålebehandling
Sist faglig oppdatert: 30.06.2017
Differensiert og medullært thyroideacarcinom
DTC og MTC er blant de mindre strålefølsomme svulstene.
Postoperativ strålebehandling anbefales derfor bare ved makroskopisk gjenstående tumorvev (R2), men kan overveies ved mikroskopisk ufri rand (R1) ved svulster med aggressivt vekstmønster som lite differensiert insulært carcinom.
Lokal strålebehandling er også indisert ved primær inoperabilitet og inoperabelt lokoregionalt residiv. De samme pasientene skal som regel også ha radiojod, som med fordel kan gis først, også fordi ekstern strålebehandling krever CT doseplan med jodholdig kontrast.
Volum:
GTV = Gjenværende makroskopisk tumorvev
CTVE-høyrisiko = GTV med 1 cm margin, thyroideasengen, involverte lymfeknutenivåer + evt. det neste ikke involverte lymfeknutenivå og nivå 6.
CTVE-lavrisiko = Nivå 2 fra angulus mandibulae, nivå 3, 4 og 5 – hvis nivå 2, 3 eller 4 er involvert på samme side, mediastinale lymfeknuter til carina
Doser:
GTV 68 Gy
CTVE-høyrisiko 60 Gy
CTVE-lavrisiko 50 Gy
Anaplastisk thyroideacarcinom
Ved ATC er tumor svært ofte verken primært eller sekundært operabel (T4b). Strålebehandling gis da definitiv til høyere doser.
Aktuelle fraksjoneringsmønstre er:
- T4a: 48 Gy hyperfraksjonert over snaut 3 uker til ITV som alltid omfatter nivå VI, fraksjonsdose ,6 Gy, 2 behandlinger daglig sammen med ukedose doxorubicin etterfulgt av palliativt kirurgisk inngrep.
- Ved varig inoperabel tumor T4b: 64 Gy hyperfraksjonert over 4 uker, fraksjonsdose 1,6 Gy, innskrenkning til GTV etter 48 Gy. Ukedose doxorubicin kan gis konkomitant.
Med slik behandling oppnår man ofte en partiell remisjon og lokal kontroll på halsen, og unngår svært plagsomme lokale symptomer og en død i asfyxi.
Behandlingen er belastende på slimhinnene særlig i siste halvdel og etter avsluttet strålebehandling. Pasienten må informeres om dette, og få adekvat smertelindring og følges opp med hensyn til ernæring eventuelt med midlertidig ernæringssonde.
Bivirkninger
Akutte bivirkninger av strålebehandlingen skriver seg for det meste fra slimhinnepåvirkning. Sårhet, lettblødende slimhinner, soppinfeksjon, ernæringsvansker, behov for midlertidig ernæringssonde og smerter. Hudsårhet opptrer også. Vanlige retningslinjer for hudstell under og etter strålebehandling gjelder.
Supplerende behandling
Sist faglig oppdatert: 30.06.2017
Ekstern strålebehandling mot hals vil gi sårhet i slimhinnene med evt. behov både for analgetika, tilskudd av næringsdrikker og ernæringssonde i en periode under og etter behandlingen.
Oppfølging og etterkontroll etter avsluttet kurativ behandling
Differensiert thyroideacarcinom
Sist faglig oppdatert: 30.06.2017
Formålet med langtidskontroll er:
- å oppdage potensielt kurable residiv
- å behandle den behandlingsrelaterte morbiditeten
- å sikre at pasientens stoffskifte er passende regulert
Kontrollopplegget og hvor kontrollene skal foregå (ved thyroideasenter eller hos fastlege), avhenger av utbredelse og histologi ved primærbehandling, og resultatet av primærbehandlingen.
Ti til tolv måneder etter avsluttet primærbehandling (kirurgi med evt. etterfølgende radiojodablasjon) gjøres en vurdering med hensyn til hvilken oppfølgingsgruppe pasientene tilhører (tabell 4).
Følgende faktorer legges til grunn:
- preoperative risikofaktorer (stråleeksponering; genetisk belastning)
- primærtumors histologi og utbredelse av sykdom
- postterapiscan etter siste radiojoddose
- 10–12 måneder etter avsluttet primærbehandling
resultat av UL hals
resultat av s-Tg (basal eller stimulert) og Tg-antistoff - Alder og komorbiditet.
Risikogruppene (tabell 4) sier noe om risiko for tilbakefall av sykdommen og risiko for død. Generelt er risiko for død ved DTC meget liten. Risiko for å oppdage restsykdom/residiv spesielt metastatiske lymfeknuter på hals er noe større, men påvirker sjelden risiko for død.
Hensikten med vurderingen 10–12 måneder etter primærbehandling er å eventuelt kunne flytte pasientene over til en mer fordelaktig gruppe (tabell 4). Det vil videre skje en kontinuerlig vurdering på bakgrunn av resultatene ved kontrollene med hensyn til hvilken gruppe pasientene tilhører.
I oppfølgingen av pasienter behandlet for DTC står ultralydundersøkelse og måling av s-Tg sentralt, sammen med måling av TSH og FT4. Ultralydundersøkelse av halsen bør generellt inngå ved alle kontroller hos spesialist.
Pasienter i behandlingsgruppe 1 som ikke trenger total thyroidektomi eller radiojod og har veldig lav residivrisiko og nesten ikke noen dødelighetsrisiko, og som grupperes i risikogruppe 1, kan følges hos egen lege. Kontrollopplegg tilsvarer situasjonen for pasienter som er operert for benigne thyroidealidelser.
Thyroglobulin (s-Tg)
S-Tg er et glykoprotein som dannes i normale og neoplastiske follikulære thyroideaceller. S-Tg er en nyttig tumormarkør i oppfølgingen av pasienter med DTC. Hos pasienter hvor det er utført total thyroidektomi og som også har fått ablasjonsdose 131-Jod, skal s-Tg ikke være målbar. Målbar Tg hos total thyroidektomerte pasienter som har fått ablasjonsdose 131-jod, tyder på viabelt restvev, restsykdom eller metastaser. Tg verdi må vurderes mot kjent mengde restvev og grad av stimulering (TSH verdi).
S-Tg kan ikke brukes som tumormarkør ved utredning av knute i thyroidea da konsentrasjonen i blodet varierer med mengde thyroideavev, grad av TSH stimulering, patologiske forandringer som thyroiditt, benigne og maligne neoplasier.
S-Tg elimineres via lever. Biologisk halvtid etter total thyroidektomi er rapportert til å variere fra 6–95 timer. Gjennomsnittlig halveringstid er omkring 65 timer. Dette betyr at det bør gå 1–3 måneder etter operasjon (avhengig av nivået til preoperativt målt s-Tg) før s-Tg verdi kan tillegges diagnostisk betydning med hensyn til restvev/restsykdom/metastaser. Etter ablasjonsbehanding vil de fleste uten restvev ha s-Tg under deteksjonsgrensen innen 6 måneder, men hos noen kan det ta >18 måneder før normalt restvev er borte og s-Tg har falt under deteksjonsgrensen. Økning i s-Tg verdier hos pasienter på L-thyroksin suppresjonsbehandling er også tegn på restsykdom og/eller metastaser, og pasienten må undersøkes nærmere.
Thyroglobulinantistoff (Tg-antistoff)
Mellom 10 og 25 % av befolkningen har autoantistoff mot Tg (den høyeste forekomsten sees hos pasienter med DTC).
Tg-antistoff kan interferere i målemetodene for s-Tg. Tg-anstistoff vil kunne gi for lave s-Tg verdier. Måling av s-Tg hos Tg-antistoff positive pasienter er derfor av begrenset nytte.
Tg-antistoff er også en surrogat tumormarkør. Vedvarende Tg-antistoff eller konvertering fra Tg-antistoff negativ til Tg-antistoff positiv kan tyde på restsykdom/residiv.
Krav ved måling av s-Tg
- Immunometrisk metode
- Tg standardisert mot CRM-457 referansepreparat
- Med funksjonell sensitivitet på 0,2 μg/l eller lavere
- Måling av Tg-antistoff i hver prøve
- Kunne utføre recoverytest dersom pasienten har Tg-antistoff
- God dokumentasjon for presisjonen (langtidsoppfølging)
Prøvene bør sendes til samme laboratorium for å sikre kontinuitet hos den enkelte pasient.
Stimulert s-Tg-måling
Eksogent rekombinant humant TSH (rhTSH), evt. endogent TSH (hypothyreot fase), øker sensitiviteten av Tg-målingene. Mer sensitive målemetoder for s-Tg har redusert behovet for stimulasjonstester (både med endogen stimulering (hypothyreot fase) og med rhTSH). Rutinemessig stimulering 10–12 måneder etter avsluttet primærbehandling hos alle kan ikke lenger anbefales.
Stimulert s-Tg måling bidrar ikke noe til behandlingskonseptet og er derfor ikke anbefalt hos:
- Pasienter med kjent restsykdom eller residiv
- Pasienter uten påvist restsykdom eller residiv (basert på negativ postterapiscan og ultralyd) men sikkert forhøyet s-Tg (>1 ug/L) på L-thyroksin suppresjon
- Pasienter med Tg-antistoff (stimulering vil ikke endre usikkerheten i s-Tg målingene)
Hos pasienter uten påvist restsykdom eller residiv (basert på negativ postterapiscan og ultralyd) og ikke målbar s-Tg eller med lave s-Tg-verdier (<1 μg/l hos total eller nær total thyroidektomerte) på L-thyroksinbehandling men med høyere risiko til å utvikle residiv, kan det være aktuelt å gjøre endogent eller eksogent TSH stimulert s-Tg-måling, siden påvist signifikant s-Tg-stigning kan ha prognostisk og terapeutisk betydning.
Det anbefales stimulert s-Tg-måling 10–12 måneder etter primærbehandling (kirurgi og radiojodbehandling) hos følgende pasientgrupper:
- Pasienter med PTC pT3–4
- Pasienter med grov-invasiv FTC
- Pasienter med lymfeknutemetastaser
Stimulert s-Tg-måling 10–12 måneder etter primærbehandling (kirurgi og radiojodbehandling) anses som unødvendig hos følgende pasientgrupper:
- Pasienter i risikogruppe A
- Pasienter med PTC T1b-2N0 (inntil 2 intranodale lymfeknutemetastaser aksepteres)
- Pasienter med minimal-invasiv FTC som ikke tilhører gruppe A
Protokoll ved rhTSH stimulert Tg-måling
Dag 1: Blodprøve for måling av Tg, Tg-Ab, TSH og FT4 tas før injeksjon av rhTSH
Dag 1: Første injeksjon 0,9 mg rhTSH im.
Dag 2: Andre injeksjon 0,9 mg rhTSH im.
Dag 3: Blodprøve for måling av Tg, TgAb og TSH
Dag 5: (72 timer etter siste injeksjon rhTSH) tas blodprøve for måling av Tg, TgAb og TSH
Tg-måling ved positiv TgAb
- Tilstedeværelse av TgAb i serum vil kunne gi falsk lave Tg-verdier (målt med immunometrisk metode).
- Ikke målbare Tg-verdier kan ikke tillegges vekt.
- Målbar Tg-verdi hos pasient med positiv TgAb betyr at det er Tg-produserende vev, men endringer i Tg-nivåene må tolkes med forsiktighet.
- Pasienter med positive TgAb må i tillegg følges med ultralyd av hals og evt helkroppsscintigrafi (WBS)
Oppfølging av pasienter med DTC og positiv TgAb
Pasienter uten andre risikofaktorer
Kontrollopplegget presentert i tabell 4 og teksten over, kan ikke brukes hos pasienter med antistoff mot Tg (TgAb), da TgAb kan gi falsk lav Tg-verdi. Disse pasientene må så lenge de er TgAb positive, følges med:
- Måling av Tg og TgAb
- Ultralyd
- rhTSH eller endogent stimulert helkroppsscintigrafi (WBS)
- CT thorax, evt 18-F-FDG PET/CT
Medullært thyroideacarcinom
Sist faglig oppdatert: 30.06.2017
Pasienter med MTC bør følges opp minst 20 år etter operasjonen. Det anbefales måling av s-calcitonin og CEA hver 6. måned de første 2 år, deretter årlig. Hos kurerte pasienter er calcitonin etter total thyroidektomi ikke påvisbar. Stimulasjonstest for calcitonin etter operasjon for MTC er sjelden indisert. Hos pasienter med påvisbar s-calcitonin gir testresultatet ikke noen relevant tilleggsinformasjon. Hos pasienter uten påvisbar s-calcitonin finnes det en veldig liten gruppe som vil la seg stimulere. Informasjonen som trekkes fra testresulatet (at pasienten sannsynlig ikke er kurert men har mikroskopisk sykdom) har imidlertid ikke noen diagnostiske eller terapeutiske konsekvenser. Mange pasienter kan ha lave, målbare calcitoninverdier over år uten at man finner restvev eller residiv. Calcitonin har kort halveringstid i blodet og kan normalt svinge en del. Dette må man ta hensyn til ved vurdering av endringer. Det er vanlig å beregne doblingstiden for calcitonin. Kort doblingstid er tegn på progresjon og noe dårligere prognose.
Hos pasienter med sporadisk MTC som er operert med hemithyroidektomi bør imidlertid en stimulasjonstest ca. 3–6 måneder etter operasjonen vurderes.
Hos pasienter med ikke påvisbar s-calcitonin og CEA bør UL hals gjennomføres årlig de første 5 år, deretter kan avstandene utvides. Det er ikke indikasjon for annen bildediagnostikk.
Pasienter med MTC bør følges ved et thyroideasenter.
Pasienter med familiær MTC bør følges av enten endokrinolog eller endokrinkirurg med hensyn på andre endokrine manifestasjoner.
Pasienter med MEN 2B representerer en spesiell utfordring og bør kun følges av en erfaren spesialist på et universitetssykehus.
I tillegg til calcitonin og CEA kan det være nyttig å måle andre markører som proGRP og eventuelt kromogranin A. Tumors evne til produksjon av andre tumormarkører kan mulig si noe om subgrupper av MTC, og dermed om prognose.
Senbivirkninger
Senbivirkninger etter kirurgi
Sist faglig oppdatert: 30.06.2017
Følgetilstand ved nerveskader og vedvarende hypocalcemi kan regnes som senbivirkninger som relateres umiddelbart til kirurgi. Bortsett fra bivirkninger ved langvarig bruk av L-thyroksin klager mange pasienter etter total thyroidektomi for cancer over nedsatt livskvalitet.
Senbivirkninger etter radiojodbehandling
Sist faglig oppdatert: 30.06.2017
Permanent nedsatt spyttsekresjon sees gjerne etter to behandlinger eller flere og øker med antall behandlinger. Nedsatt spyttsekresjon kan føre til tannproblemer, og en anbefaler hyppigere undersøkelse ved tannlege og oppfølgning hos tannpleier.
Testikulær funksjon reduseres noe etter behandling med radioaktivt jod, men det skjer vanligvis en normalisering i løpet av 6 måneder. For unge menn hvor akkumulert aktivitet over 14,8 GBq, kan det eventuelt tilbys sædbanking. Menn som har vært til behandling med radioaktivt jod bør ikke foreta befruktning før minst 6 måneder etter radiojodbehandlingen.
Forbigående gonadesvikt sees også hos kvinner, og forbigående menstruasjonsforstyrrelser sees hos ca. 25 % i opptil 10 måneder etter radiojodbehandling. Det er lite holdepunkt for permanent gonadesvikt, mulig unntatt ved høye akkumulerte aktiviteter. I en stor undersøkelse av 627 kvinner behandlet med radioaktivt jod ble det ikke funnet noen forskjell i fertilitet, antall fødsler eller prematuritet sammenlignet med en kontrollgruppe. Det er rapportert om noe tidligere menopause (ca. 1 år) hos kvinner som har vært behandlet med radioaktivt jod. Kvinner som har vært gjennom behandling med radioaktivt jod bør ikke bli gravide før tidligst 6 måneder etter behandling (noen anbefaler minst 12 måneder).
Sannsynligheten for å utvikle sekundær malignitet øker med akkumulert inngitt aktivitet og er signifikant ved akkumulerte aktiviteter over ca. 20 GBq.
Senbivirkninger etter TSH-supprimerende behandling
Sist faglig oppdatert: 30.06.2017
Ved høydose thyroksinbehandling (suppresjonsbehandling) får pasienten lett hypertyreose som kan lede til hjerteproblemer, spesielt hos eldre personer med underliggende hjertesykdom. Imidlertid er det ingen ting som tyder på varige senbivirkninger på hjertet når dosen igjen er i fysiologisk nivå. Hos eldre pasienter som skal bruke høy dose L-thyroksin, bør man være ekstra oppmerksom på hjertefunksjonen.
Imidlertid har høydose L-thyroksin senbivirkninger på skjelettet på grunn av høy turnover i benvev mens stoffskiftet er høyt, og problemer med å kunne bygge opp benmassen igjen etter normalisering av dosen. Personer som har brukt thyroksin suppresjonsbehandling i en del år bør derfor vurderes mtp lav benmasse, med spørsmål om behov for behandling. Dette gjelder også de pasientene man velger å la gå på høydose L-thyroksin i årene framover. Alle pasienter som bruker høy dose L-thyroksin bør ligge bra i Vitamin D-status, og få i seg tilstrekkelig med kalsium. Risikoen er størst etter menopause.
Senbivirkninger etter ekstern strålebehandling
Sist faglig oppdatert: 30.06.2017
Senbivirkninger av ekstern strålebehandling mot hals er nedsatt spyttsekresjon dersom spyttkjertler har vært med i strålefeltet, dessuten tørre slimhinner som funksjon av direkte bestråling mot disse. Stivhet i svelget og noe grovere stemme forekommer også. Medulla spinalis er et risikoorgan, men doseplanene lages slik at risiko for skade er liten (< 5 %). Strålefibrose av lungetoppene vil kunne oppstå måneder etter avsluttet strålebehandling. Huden blir «solbrent» under pågående strålebehandling, forsiktighet i sterk sol må utvises og krem med høy solfaktor brukes resten av livet.
Langtidsbivirkninger kan kreve kontinuerlig oppfølging med medikamenter, evt hyperbar oksygenbehandling (HBO).
Senbivirkninger etter medikamentell behandling
Sist faglig oppdatert: 30.06.2017
Det vises til kapittelet for medikamentell behandling. Slik behandling er lite etablert og for tiden i rask endring.
Hjertesvikt er mulig senbivirkning av doxorubicin, men dosene som gis er så små og få, at kumulativ dose for risiko ikke oppnås.
Behandling av metastaserende sykdom / livsforlengende og palliativ behandling
Sist faglig oppdatert: 30.06.2017
Fjernmetastaser diagnostiseres ofte ved billeddiagnostikk alene, for eksempel etter påvist stigende thyroglobulin. Noen ganger bør en metastase verifiseres ved cytologisk eller histologisk biopsi, fordi differensierte tumores ikke helt sjelden dedifferensierer og dermed endrer sykdomsforløpet. Disse pasientene kan ha behov for flere ulike behandlingsformer samtidig og/eller over tid.
I et årelangt sykdomsforløp med fjernmetastaser kan det også opptre annen primærcancer, evt. stråleindusert cancer.
Kirurgi
Sist faglig oppdatert: 30.06.2017
Fordi DTC er svært langsomtvoksende, kan pasienter leve i årevis med sine fjernmetastaser, også etter at disse ikke lenger tar opp radioaktivt jod. Metastasene kan stå i ro i flere år, evt. vise langsom progresjon. Palliativ kirurgi er indisert ikke bare på solitære metastaser, men også på en eller flere metastaser som gir symptomer eller truer med å affisere vitale funksjoner. Indikasjonen kan være både å forebygge symptomer og å palliere.
Kirurgien kan utføres av endokrinkirurg, ØNH-kirurg, thoraxkirurg, GI-kirurg, ortoped eller annen, avhengig av lokalisasjon og problemstilling. Dersom kirurgi er mulig og ansees nyttig, foretrekkes det fremfor palliativ strålebehandling eller medikamentell kreftbehandling, etter at radiojod er prøvd.
Postoperativ strålebehandling må vurderes individuelt.
Skjelettmetastaser kan vurderes for kirurgisk inngrep og instillasjon av sement.
Radiojodterapi ved fjernmetastaser
Sist faglig oppdatert: 30.06.2017
Ved systemisk behandling av fjernmetastaser fra DTC er radiojod førstevalg. Forutsetningen er at metastasene tar opp jod. Dersom postterapiscan er positivt, er det aktuelt å fortsette radiojodbehandling så lenge der er opptak og klinisk og/eller biokjemisk effekt av behandlingen. Behandlingene gis med 6–8 måneders mellomrom.
Best effekt av radiojodbehandling sees ved små metastaser med høyt opptak. Behandlingseffekten på diffuse, mikroskopiske lungemetastaser med høyt opptak (»svarte lunger» på scintigrafi) er særlig god. Skjelettmetastaser vil ofte respondere dårlig på behandling med radioaktivt jod til tross for høyt opptak, men eksempler på det motsatte sees også.
Ved forhøyet s-Tg men hvor foregående postterapiscan var negativt, gis ny behandling med radioaktivt jod kun dersom s-Tg viste signifikant reduksjon etter foregående terapidose.
Jodkonsentrerende lungemetastaser
Radioaktivt jod er effektiv behandling for mikronodulære lungemetastaser, og komplett remisjon kan oppnås etter gjentatte behandlinger. Behandling med radioaktivt jod bør foretas hvert halvår så lenge jodkonsentrerende sykdom foreligger og så lenge behandlingseffekt foreligger. Lungefibrose og pneumonitt er rapportert som sjeldne bivirkninger etter høye akkumulerte behandlingsdoser. Anbefalt aktivitet er 3.7–7.4 GBq. Lungefunksjonsundersøkelser bør foretas før, etter og ev midtveis i behandling. Det er anbefalt at retinert aktivitet i lunger 48 timer etter inntatt behandlingsdose med radioaktivt jod bør være under 2 GBq.
Jodkonsentrerende makronodulære metastaser kan også forsøkes behandlet med radioaktivt jod, først og fremst med et palliativt mål. Behandlingen kan gjentas så lenge klar behandlingseffekt foreligger. Anbefalt aktivitet er 3.7–7.4 GBq eller basert på doseberegninger.
Behandling med radioaktivt jod er ikke indisert ved makronodulære metastaser med lavt, inhomogent jodopptak, eller i metastaser uten jodopptak.
Jodkonsentrerende skjelettmetastaser
Radiojodbehandling av jodkonsentrerende ikke-operable skjelettmetastaser er indisert. Anbefalt aktivitet er 3.7–7.4 GBq, eller beregnet aktivitet utfra dosimetri dersom tumorvolum kan beregnes utfra CT eller MR. Behandlingen kan gjentas hver 6.–12. måned så lenge jodkonsentrerende sykdom foreligger og så lenge behandlingseffekt foreligger. Det vil ofte være aktuelt å kombinere radiojodbehanding med ekstern strålebehandling. Ved slik kombinert behandling anbefales det at radiojodbehandling gis før oppstart av ekstern strålebehandling for å sikre høy dose i målvolumet raskest mulig (unngå «stunning» med redusert jodopptak (se avsnittet om «stunning»)). Det er ingen internasjonal konsensus om hvor lenge man bør vente med oppstart av ekstern strålebehandling etter at radioaktivt jod er gitt, men vi anbefaler minst 2 uker.
Andre jodkonsentrerende metastaser
Ikke-operable jodkonsentrerende metastaser kan behandles med 131I (3.7–7.4 GBq (eller beregnet aktivitet utfra dosimetri)) og gjentas hver 6.–12. måned så lenge behandlingseffekt kan påvises. Målet med behandlingen vil først og fremst være palliasjon, og behandlingen må vurderes opp mot andre alternativ. Det kan se ut til at enkelte bløtvevsmetastaser ved FTC som utviser høyt opptak både av FDG og av radioaktivt jod responderer meget godt på radiojodbehandling.
Radionuklidbehandling ved medullær thyroideacancer
Sist faglig oppdatert: 30.06.2017
Det finnes ikke overbevisende dokumentasjon for generell nytte av radionuklidbehandling av metastaserende MTC med 131Jod-MIBG. Det finnes god dokumentasjon for nytteverdi av radionuklidbehandling av gastroenteropancreatiske nevroendokrine tumores med 90Yttrium eller 177Lutetium-merket somatostatinreseptor-analoger, men det foreligger ikke tilstrekkelig dokumentasjon for nytte ved andre nevroendokrine tumores inkludert pasienter med metastaserende MTC.
Ekstern strålebehandling
Sist faglig oppdatert: 30.06.2017
Palliativ ekstern strålebehandling av symptomgivende metastaser følger stort sett samme retningslinjer som for andre tumorgrupper. Det er imidlertid noen karakteristika som er særegne for differensiert thyroideacarcinom. Metastasene kan være langsomtvoksende. De kan være solitære. De er ikke veldig strålefølsomme, og pasientene har ofte lang forventet levetid selv med metastatisk sykdom. Disse faktorene gjør at man ofte overveier kirurgi.
Når strålebehandling gis, er kontroll over tid og friskvevskade faktorer som må overveies. Det betyr at dosering 2 Gy x 25–30 kan være å foretrekke fremfor det mer konvensjonelle 3 Gy x 10 eller engangsfraksjon (smertebehandling). Ved solitære eller få metastaser kan stereotaksi overveies.
Ved indikasjon for palliativ strålebehandling av metastaser fra anaplastiske, lite differensierte og medullære thyroideacarcinomer, anbefales fraksjonering 3 Gy x 10.
Stereotaksi bør vurderes ved hjernemetastaser, og stereotaksi eller radiofrekvensablasjon kan vurderes på andre solitære eller få metastaser.
Medikamentell kreftbehandling
Sist faglig oppdatert: 30.06.2017
Cyostatika og annen medikamentell behandling vurderes når det foreligger radiojodresistens. Radiojodresistens defineres nå som:
- Påvisbare metastaser som ikke (lenger) tar opp jod
- Påvisbare metastaser som tar opp jod, men som ikke lenger responderer
- Vurdering av annen behandling bør også foretas etter kumulativ radiojodaktivitet på 22,2 GBq (600mCi) pga senbivirkninger av radiojod
Differensiert thyroideacarcinom
Tradisjonelle cellegiftbehandling har liten effekt ved differensierte thyroideacarcinomer. De mest brukte cellegiften er antracycliner (doxorubicin, epirubicin) og platina-forbindelser (cisplatin, carboplatin). Doxorubicin skal ha en responsrate på ca 30 %, men referansene er gamle og varigheten av respons er kort. Taxaner har fått en plass i senere tid, evt. sammen med strålebehandling. Vi anbefaler ikke rutinemessig bruk av cytostatica.
Av denne grunn er det allment akseptert å ta pasienter inn i forsøksbehandling med nyere medikamenter i placebokontrollerte studier, dersom kirurgi og radiojod ikke er aktuelle behandlingsformer. Dette er først og fremst angiogeneseinhibitorer og proteinkinase-/tyrosinkinasehemmere (TKI). Target er tyrosinkinase til VEGF-reseptor, dessuten er spesielt MAP-kinase signalvei og inhibitorer RET, RAS, RAF og MEK interessante. Mekanismene er imidlertid ikke svært godt forstått ennå, og der er ikke alltid samsvar mellom tumoruttrykk og effekt av medikament. Det foreligger flere fase 2 studier av medikamenter i disse klassene som viser effekt. Der er også forsøksbehandling med talidomidlignende stoff og immunterapi. Andre aktuelle strategier er mTOR hemmere, BRAF hemmere evt i kombinasjon med anti HER2.
Det foreligger 2 fase 3 studier for DTC:
DECISION studien, sorafenib vs placebo (3) viser økt progresjonsfri overlevelse på 10,8 md vs 5,8 md, men ikke økt total overlevelse. Cross over var tillatt etter første progresjon.
SELECT studien, lenvatinib (4) viser økt progresjonsfri overlevelse på 18,3 md vs 3,6 md, men ikke økt total overlevelse. Cross over var tillatt ved første progresjon. Dosedefinerende studie planlegges. Problemstilling: Standard dose ga mye bivirkninger, men pasienter med dosereduksjon gjorde det også bra.
Det finns også en randomisert placebokontrollert fase 2 studie (5) på vandetanib som viser progresjonsfri overlevelse 11,1 md vs 5,9 md.
Immunterapi er ikke etablert for DTC, men utprøvende behandling pågår.
En del europeiske og amerikanske sentra de senere årene behandlet pasienter utenom studier, dersom slike ikke var tilgjengelig.
Det synes å være enighet om følgende indikasjon:
- Kirurgi og radiojod er ikke indisert eller mulig
- Pasienten har sykdom i progresjon
- Pasienten har symptomer fra sin metastaserende cancer
Både sorafenib (Nexavar) og lenvatinib ( Lenvima) er godkjent for bruk på indikasjonen progressiv lokalavansert/ metastaserende, radiojodresistent DTC. I henhold til ATAs retningslinjer 2015 og oppdatert PubMed-søk sept 2016 er det ennå ikke avklart hvilket som er det foretrukne legemidlet i 1.linjebehandling.Det er foreløpig ikke utført studier som sammenligner sorafenib og lenvatinib ”head to head”på denne behandlingsindikasjonen. Dessuten avventes supplerende resultater fra SELECT-studien. Foreløpig praktiseres derfor:
1. linje lenvatinib Lenvima ®
2. linje sorafenib Nexavar ® lenvatinib Lenvima dersom ikke brukt i 1.linje
3. linje vandetanib Caprelsa ®
Det må søkes om refusjon på blå resept etter § 3.a, og pasientene må følges nøye. Behandlingen bør gis av onkolog som har erfaring med TKI. Evaluering bør gjøres med bildediagnostikk, markører er av mindre nytte.
Lite differensiert thyroideacarcinom
Disse carcinomene utgjør en mellomgruppe mellom de differensierte og de udifferensierte. Dette er ofte store tumorer med histologisk blandingsbilde av differensierte og lite differensierte områder, men leveutsiktene er bedre enn ved anaplastisk thyroideacarcinom. Onkologisk behandles disse i likhet med differensiserte carcinomer, men ekstern strålebehandling er mer brukt, på halsen i fraksjonering som ved anaplastisk thyroideacarcinom, ved metastaser i ordinær fraksjonering, 3Gy x 10. Behandling med kinaseinhibitorer kan vurderes på samme indikasjoner som for differensierte carcinomer.
Anaplastisk thyroideacarcinom
Ingen cytostatica gir lenger levetid eller bedre livskvalitet for pasientene. Medikamentell behandling med nyere stoffer bør foregå i studier, og det må gjøres en individuell vurdering av hver enkelt pasient med tanke på om det er grunnlag for å prøve palliativ behandling. Man kan evt støtte seg til anbefalinger fra ATA.
Medullært thyroideacarcinom
MTC er en sjelden sykdom, og man antar at per år har 17 nye pasienter i Norden behov for oppstart av systemisk behandling.
Heller ikke for medullære thyroideacarcinomer er tradisjonelle cytostatica effektive, og fremgangen har kommet etter 2 fase 3 studier:
ZETA studien, vandetanib vs placebo (1) rapporterte signifikant median progresjonsfri overlevelse, 30,5 md vs 19,3 md, signifikant bedret partiell respons (PR) og klinisk effekt (PR+SD), og signifikant lavere calcitoninnivå i blod i utprøvingsarmen. Total overlevelse var ikke forskjellig, noe som ikke var å vente siden placeboarmen ble tilbudt aktivt stoff ved progresjon.
EXAM studien, cabozantinib vs placebo (2) viste median progresjonsfri overlevelse 11,2 md vs 4 md. og signifikant bedret respons og progresjonsfri overlevelse ved ett år. Inklusjonskriteriene var strengere enn i ZETA studien, cross over var ikke tillatt.
For å starte behandling skal det foreligge progresjon av sykdommen og symptomgivende metastaser.
Det må søkes om refusjon på blå resept etter § 3.a, og pasientene må følges nøye. Behandlingen bør gis av onkolog som har erfaring med TKI. Evaluering bør gjøres med bildediagnostikk, markører er av mindre nytte
Bivirkninger av Tyrosinkinasehemmere (TKI) og oppfølging av pasientene
De ulike medikamentene har ulik bivirkningsprofil, men listen under gjelder for mange.
Håndtering av bivirkninger (adverse effects = AE) er nøkkelen til suksess ved TKI-behandling. Informasjon til pasienten og forebygging er essensielt. De fleste AE er håndterbare.
Hos 50–70 % pasienter må TKI dosereduseres/seponeres på grunn av bivirkninger. Generell tilnærming er å seponere TKI ved AE med CTCAE-grad 3 eller høyere og reintrodusere ev i redusert dose ved tilbakegang av AE.
AE er stort sett forbundet med mekanismer ved VEGFR-hemming.
- Hypertensjon
- Hånd-fot syndrom og exanthemer – obs fotosensitivitet
- Diare/kvalme/oppkast
- Redusert matlyst/vekttap/fatigue
- Proteinuri
- Redusert nyrefunksjon
- Redusert hjertefunksjon
- Forlenget QTc (spesielt for vandetanib, men også sett ved lenvatinib)
- Nedsatt sårtilheling
- Blødning og tromboserisko
- Økt TSH – behov for økt Levaxindose
- GI-perforasjon/fistler
- Posterior reversibel leukoencephalopati
- Andre
Det må søkes om refusjon på blå resept etter § 3.a, og pasientene må følges nøye. Behandlingen bør gis av onkolog som har erfaring med TKI.
Annen behandling av metastaser
Sist faglig oppdatert: 30.06.2017
Bisfosfonater bør vurderes hos pasienter med skjelettmetastaser.
Ved skjelettmetastaser kan instilliasjon av sement vurderes, denne foretas oftest av intervensjonsradiolog.
Radiofrekvensablasjon kan være aktuelt ved bløtvevsmetastaser.
Sjeldne svulster i thyroidea
Lymfom
Sist faglig oppdatert: 30.06.2017
Ved lymfom i thyroidea er behandlingen ikke kirurgisk. Behandlingsansvarlig er onkologene og pasientene skal henvises etter diagnose til spesialisert onkologisk avdeling. Ellers gjelder både for utredning og behandling retningslinjene for lymfom.
Lymfom i thyroidea er sjelden, men må alltid has i tankene når man står overfor en pasient med en hurtigvoksende tumor, som gjerne er 8–10 cm stor, og som gir økende dysfagi og lufthunger. Konsistensen er gjerne meget fast, men ikke steinhard. Tumor virker kanskje mer homogen enn en anaplastisk cancer. Det kliniske bildet er svært likt med ATC. CT/MR viser en homogen tumor.
Hovedpoenget er å komme raskt til en histologisk diagnose ettersom et lymfom ofte kan behandles ikke-kirurgisk med stråler og/eller cellegift (og eventuelt steroider), med en frapperende effekt på stridor og dysfagi i løpet av få dager. I noen tilfeller kan en temporær trakeotomi være nødvendig. Lymfomer i thyroidea kan ha ulik malignitetsgrad, og den onkologiske behandlingen kan variere.
Svulster av denne type er harde og «fibrøse» og gir sjelden godt nok materiale ved FNC (flow- RPMI). Derfor bør det allerede initialt tas histologiske biopsier til «cito» histologisk vurdering. Ved lymfom ønsker patologene gjerne ytterligere materiale for å typebestemme lymfom, og det er da indikasjon for en «åpen» kirurgisk biopsi i lokalanestesi.
Sarkom og andre sjeldne svulster
Sist faglig oppdatert: 30.06.2017
Det kan også forekomme sarkomer, plateepitelcarcinomer og andre svært sjeldne svulster som klinisk likner ATC. Man har i dag ikke så effektiv spesifikk behandling som man har for lymfomer.
Ved alle hurtigvoksende, «aggressive» tumores i thyroidea bør det allerede initialt under utredningen tas histologiske biopsier for å få hurtig avklaring av om det foreligger et lymfom, som kan behandles effektivt, eller om det foreligger ATC eller maligne svulster fra ulike andre vevstyper, der behandlingen oftest blir palliativ og tilpasset individuelt sykdomsbilde.
Pasienter med slike svulster må drøftes tverrfaglig. Ved sarkom kan det være en fordel å overlate hovedansvar til sarkomgruppen som er etablert ved universitetssykehus.
Metastaser til thyroidea
Sist faglig oppdatert: 30.06.2017
Metastaser forkommer i thyroidea med/uten cervikale lymfeknutemetastaser. Ikke sjelden vokser metastasene gjennom organkapselen. Forekomst har betydelig økt på grunn av oftere og tidligere diagnose ved bred bruk av CT, MR og ikke minst PET og på grunn av bedre prognose ved mange krefttyper.
Utfra prognostisk betydning anbefales å skille mellom metastaser fra klarcellet nyrecellcarcinom og andre primære svulster (for eksempel colorektalt carcinom, melanom, mammacarcinom, bronchialcarcinom). Nyrecellecarcinommetastaser kan noen ganger opereres i kurativ intensjon. Å unngå lokale komplikasjoner som kan oppstå ved innvekst i vitale organer kan også være operasjonsindikasjon. Bortsett fra kirurgisk behandling kan også ekstern strålebehandling vurderes for å oppnå lokal kontroll. I noen tilfeller kan det være indisert med trakeotomi.
Prinsipielt sett bør pasientene alltid vurderes helt individuelt. Ved ekstrathyroidal vekst bør man med hensyn til evt. kirurgi være mer tilbakeholdende.
Nyrecellecarcinommetastaser manifesteres gjerne både i thyroidea og i lymfeknutene. Operasjonene kan vanligvis begrenses på den involverte siden. Unntaksvis kan det være indisert å fjerne deler av naboorganer (muskulatur, nerver, sjelden trachea og/eller øsofagus) i tilfelle det foreligger infiltrasjon. Behandlingen er ellers som ved metastasert nyrecellecarcinom, og henholdsvis onkologene og/eller urologene må være involvert i oppretting av tverrfaglig behandlingsopplegg.
Ved andre metastaser kan operasjonen også være indisert, men her først og fremst med palliativ intensjon. Operasjonene bør derfor begrenses til ikke-mutilerende inngrep, og komplikasjoner bør absolutt unngås (for eksempel ved å utføre kun unilateral kirurgi). Som ved nyrecellecarcinom er det obligatorisk å drøfte pasientene tverrfaglig.
Spesielle situasjoner
Gravide
Sist faglig oppdatert: 30.06.2017
Dersom thyroideacarcinom primærdiagnostiseres under svangerskap, kreves det grundig gjennomgang av individuelle faktorer for å avgjøre hva som taler for, og hva som taler mot umiddelbar kirurgisk behandling under svangerskapet. Godt informert pasient må selv være med å avgjøre om operasjon skal gjøres etter pasienten har født.
I tilfeller med PTC, uten tegn til ekstranodal vekst eller store lymfeknutemetastaser, kan det være rett å vente med operasjon til etter fødsel. Ved lokalavansert carcinom (sjelden hos unge kvinner), ved follikulært carcinom, Hürtlecelle-carcinom, og ved mistanke om fjernmetastaser kan det være nærliggende å anbefale å foreta operasjon under svangerskapet. Også medulIært thyroideacarcinom taler for å ikke vente til etter fødsel.
Generelt vil nok alder over 35–40 år legges på vektskålen for operasjon uten å vente til post partum.
Dersom det velges operasjon under svangerskapet, så anbefales på generell anestesiologisk basis, operasjon i andre trimester.
Barn
Sist faglig oppdatert: 30.06.2017
Thyroideacarcinom kan forekomme hos barn, men er sjelden. ATA har utarbeidet egne retningslinjer for pediatrisk thyroideacancer, og det vises til disse. Det er færre enn fem pasienter med thyroideacarcinom <18 år som behandles hvert år i Norge. Det handler først og fremst om PTC eller familiær MTC. På grunn av relativt liten skjoldbruskkjertel må det påregnes at også små cancere relativt tidlig kan komme i kontakt med thyroideakapsel og vokse ekstrathyroidalt (T3–4). I forhold til voksne har barn og ungdom med PTC relativt ofte multifokale tumores (inntil 40 %), lymfeknutemetastaser (>60–70 %) og fjernmetastaser (inntil 10 %), vanligvis til lunge. Prognosen er imidlertid veldig bra og 20-års overlevelse er >98 %.
Ved MTC finnes det ved MEN 2A i våre dager på grunn av systematisk familiescreening oftest kun små tumores som diagnostiseres «tilfeldig» ved profylaktisk thyroidektomi. Ved MEN 2B der mange har de novo mutasjon i RET protoonkogenet er MTC oftest allerede avansert ved diagnose. Det er derfor av stor betydning at barn med MEN 2B diagnostiseres så tidlig som mulig. Kliniske tegn som er tilknyttet MEN 2B er uttalt obstipasjon (»Pseudo-Hirschsprung» på grunn av intestinal ganglioneuromastosis) og gråting uten tårer (nedsatt tårevæskeproduksjon). Ved slike symptomer bør nærmere utredning vurderes. MEN 2B er riktignok «an orphan disease» med insidens nær 1:1000000 og det finnes kun fem dokumenterte pasienter i Norge.
Kirurgi hos barn med thyroideacarcinom skilles, bortsett fra andre dimensjoner og det faktum at thymus kan være veldig stor i halsen hos små barn, prinsipielt ikke fra kirurgi hos voksne. Thymus kan lyse ved jodscintigrafi og må ikke forveksles med lymfeknutemetastaser i mediastinum. Den høyere raten av lymfeknutemetastaser hos barn kan imidlertid medføre at indikasjonen til profylaktisk sentral men også lateral lymfeknutedisseksjon bør stilles mer liberalt enn hos voksne. Ved T4-situasjon bør barn alltid vurderes med hensyn til reseksjon av infiltrerte organer. Det gjelder også ved påviste fjernmetastaser hvis det ikke foreligger raskt progredierende sykdom (noe som er uvanlig særlig ved PTC).
Kirurgi og radiojodbehandling hos barn med thyroideacarcinom er spesialistoppgave som krever høy grad av ekspertise, og bør i Norge tilbys kun i Bergen (Haukeland) eller Oslo (OUS).
Vedrørende radiojodterapi, TSH-supprimerende terapi og oppfølging, vises til spesialkapitlene.
Eldre (>80 år)
Sist faglig oppdatert: 30.06.2017
Generelt sett tyder ingen ting på at eldre pasienter bør få en annen behandling enn yngre. Med hensyn på prognose ved DTC og MTC er alder (45 år) et viktig prognosekriterium, men alder >80 år betyr ikke nødvendigvis en ytterligere prognostisk forverring.
Likevel bør komorbiditet tas med i vurderingen, særlig ved avansert sykdom. Eldre pasienter har ofte reduserte kompensasjonsreserve dersom komplikasjoner oppstår. Ved lokalavansert sykdom bør mutilerende operasjoner unngås. Det kan for eksempel være riktig å bevare en enda fungerende nervus recurrens ved begynnende infiltrasjon, fremfor å resessere nerven.
Ved DTC bør en med hensyn til kardial komorbiditet være forsiktig ved TSH-supprimerende behandling.
Pasienter med redusert compliance eller inkontinens kan med tanke på strålehygiene være nesten umulig å behandle med radiojod. Også ekstern stråleterapi kan være krevende (mobilitet, svelgefunksjon). Tracheostomi kan gjøre det vanskelig å sende pasientene hjem.
Som hos barn bør eldre pasienter hovedsakelig behandles ved thyroideasentere med bred erfaring, og alltid drøftes tverrfaglig.
Metode og prosess
Hva er nasjonale retningslinjer?
Sist faglig oppdatert: 30.06.2017
Utvikling av de nasjonale handlingsprogrammene for kreftbehandling var et viktig tiltak under Nasjonal strategi for kreftområdet (2006–2009 (forlenget til 2011) og videre utvikling av de nasjonale handlingsprogrammene er en kjerneoppgave i oppfølging av Sammen mot kreft- Nasjonal Kreftstrategi 2013-2017. Nasjonale handlingsprogrammer for kreftbehandling skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
I henhold til Nasjonal helseplan (2007-2010) har Helsedirektoratet en normerende rolle for helsetjenesten på tvers av helseregioner og tjenestenivå. Helsedirektoratet har en koordinerende rolle for å utvikle overordnede referanserammer for kreftomsorgen, sammen med de regionale helseforetakene, kommunene og andre relevante myndighetsorganer og tjenester.
Lov om kommunale helse- og omsorgstjenester § 12-5 fastslår at Helsedirektoratet er eneste aktør med mandat til å utvikle, formidle og vedlikeholde nasjonale faglige retningslinjer og veiledere. De nasjonale faglige retningslinjene inneholder systematisk utviklede faglige anbefalinger som etablerer en nasjonal standard for utredning, behandling og oppfølging av pasientgrupper, brukergrupper eller diagnosegrupper.
Nasjonale faglige retningslinjer inneholder systematisk utviklede faglige anbefalinger som etablerer en nasjonal standard for utredning, behandling og oppfølgning av pasientgrupper eller diagnosegrupper.
Nasjonale faglige retningslinjer er et virkemiddel for å bidra til at helse- og omsorgstjenestene:
- har god kvalitet
- gjør riktige prioriteringer
- ikke har uønsket variasjon i tjenestetilbudet
- løser samhandlingsutfordringer
- tilbyr helhetlige pasientforløp
Nasjonale faglige retningslinjer gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet. Sentrale fagmiljøer og tjenestemottakere er aktivt involvert i utarbeidelsen.
Helsepersonell og alle deler av helse- og omsorgstjenesten er forpliktet til å yte forsvarlig helsehjelp. Retningslinjer, anerkjent fagkunnskap og allmenngyldige samfunnsetiske normer inngår som aksepterte grunnlag for vurdering av hva som er faglig forsvarlig. Retningslinjer er ment som et hjelpemiddel ved avveiningene tjenesteyterne må gjøre for å oppnå forsvarlig og god kvalitet i tjenesten. De er ikke rettslig bindende, men faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet. Helsepersonell må likevel vise faglig skjønn i vurderingen av hver enkelt pasient for å ta hensyn til individuelle behov. Dersom helsepersonell eller institusjoner velger å fravike anbefalinger i en retningslinje, skal dette dokumenteres og begrunnes.
Helsetjenestens eiere og ledelse har ansvar for tilrettelegging av virksomheten slik at anbefalinger gitt i nasjonale faglige retningslinjer kan følges.
Helsedirektoratet legger til grunn at nasjonale retningslinjer skal være utarbeidet med vekt på forskningsbasert kunnskap, tilgjengelig dokumentasjon, tverrfaglighet, fokus på praksis, implementering og oppdatering.
Bakgrunn og arbeidsprosess ved første utgave av handlingsprogrammet (utgitt 2017)
Sist faglig oppdatert: 30.06.2017
I Norge er det fortsatt regionale forskjeller i preoperativ diagnostikk av tumor thyroidea, i valg av kirurgisk strategi og oppfølgingsprogram. Det er også nasjonale forskjeller i overlevelse for pasienter med thyroideacarcinom, selv innen Europa i områder med relativt like økonomiske og sosiale forhold, slik at det er ønskelig å ha egne nasjonale retningslinjer.
Retningslinjer for diagnostikk, behandling og oppfølging av DTC ble utarbeidet i 2007 av fagmiljøet etter et nasjonalt møte der alle aktuelle fagområder var invitert. Disse retningslinjene ble sendt på høring i alle relevante fagmedisinske foreninger.
Helsedirektoratet ønsket i 2011 å utarbeide et nasjonalt handlingsprogram med retningslinjer for skjoldbruskkjertelkreft. Arbeidsgruppen fra 2007 i noe utvidet form, var kjernen i gruppen som har utarbeidet det nasjonale handlingsprogrammet.
Helsedirektoratet ba RHF-ene om oppnevning av representanter til arbeidsgruppen som skulle settes sammen av fagekspertise, Nasjonalt kunnskapssenter for helsetjenesten og Helsedirektoratet. Det er lagt vekt på at alle nødvendige faggrupper skal være representert og at gruppen består av fagfolk fra alle helseregioner.
RHF-ene ble også bedt om at fagfolk innenfor rammen av sin arbeidstid ble fristilt til retningslinjearbeidet, jf. Oppdragsdokumentet fra Helse- og omsorgsdepartementet.
Helsedirektoratet etablerte arbeidsgruppen i 2011. I en tidlig fase av arbeidet har arbeidsgruppen avklart hva retningslinjene skal omfatte når det gjelder diagnostikk, behandling og oppfølging av skjoldbruskkjertelkreft.
Kunnskapssenteret har identifisert og formidlet kunnskapsbaserte internasjonale retningslinjer og systematiske oversikter til faggruppen, ved søk på følgende nettsteder:
Søk etter retningslinjer:
Guidelines international network: http://www.g-i-n.net/
NICE, UK: http://www.nice.org.uk/page.aspx?o=home
SIGN, Scotland: http://www.sign.ac.uk/
AHRQ, US: http://www.guideline.gov/
Cancer care Ontario: http://www.cancercare.on.ca/
Søk etter systematiske oversikter:
CRD-databasene: http://www.crd.york.ac.uk/crdweb/
Cochrane Library: http://www.mrw.interscience.wiley.com/cochrane/cochrane_search_fs.html
Clinical evidence: http://www.clinicalevidence.com/ceweb/conditions/index.jsp
Helsedirektoratet ferdigstilte i samarbeid med forfatterne i 2016 utkast til retningslinjer som ble sendt på høring til RHF-ene, Den norske legeforening og Kreftforeningen. Etter høring ble endelig utgave ferdigstilt og publisert 29.06.2017.
Nasjonale retningslinjer har som mål å presentere kunnskap om hvordan man kan oppnå best mulig langtidsprognose for den enkelte pasient. Dette gjelder overlevelse, og morbiditet av sykdom og av behandling. En vil kartlegge grunnlaget for å differensiere behandling og oppfølgingsrutiner. Det foreligger flere nasjonale retningslinjer for thyroideacarcinom, også felles europeiske. Det vises til retningslinjer fra blant annet USA (American Thyroid Association og NCCN), Storbritannia, Sverige, Danmark og Tyskland for ekstensive litteraturreferanser. Disse retningslinjene er delvis kontroversielle. Denne norske oversikten omhandler først og fremst praktiske sider ved diagnostikk og behandling.
Retningslinjene fra 2007 omfattet kun utredning og behandling av DTC. Denne aktuelle revisjonen ble utvidet med MTC, ATC og sjeldne svulster i thyroidea (lymfom, sarkom, metastaser).
Det finnes fortsatt lite data fra randomiserte studier innen dette feltet. Anbefalingene i retningslinjene bygger derfor mest på deskriptive og non-randomiserte komparative studier og ekspertvurderinger. Handlingsprogrammet utgitt i 2017 ligger nært opp til de publiserte europeiske/amerikanske retningslinjene.
Referansene er ment som forslag til videre lesning og utdypning. For alle kapitlene er både de europeiske (inkludert danske, svenske, britiske (BTA) tyske og amerikanske (ATA, NCCN) retningslinjer viktige referanser. ATA, NCCN og BTA retningslinjer for thyroidecancer har nylig blitt oppdatert.
Arbeidsgruppen ved første utgave (2017)
Endokrinkirurgi:
Prof., Overlege Michael Brauckhoff, Helse Bergen
Overlege Kristin Helset, St. Olav Hospital
Overlege Trond Harder Paulsen, OUS/Aker
Prof., Overlege Jan Erik Varhaug, Helse Bergen
ØNH kirurgi:
Prof., Avd. overlege Terje Osnes, OUS/RH
Medisinsk biokjemi:
Prof., Overlege Trine Bjøro, OUS/DNR
Onkologi:
Overlege dr. med. Øystein Fluge, Helse Bergen
Overlege dr. med. Anne-Birgitte Jacobsen, OUS/DNR
Patologi/Cytologi:
Prof., Overlege Lars A Akslen, Helse-Bergen
Overlege, PhD Krystyna Grøholt, OUS/DNR
Overlege, PhD Eva Sigstad, OUS/DNR
Nukleærmedisin:
Prof., Overlege Martin Biermann, Helse-Bergen
Overlege, PhD Trond Velde Bogsrud, OUS/DNR
Radiologi:
Overlege Olav Inge Håskjold, OUS/DNR
Endokrinologi:
Prof., Overlege Rolf Jorde, UNN/Tromsø
Overlege, dr. med. Ingrid Norheim, OUS/Aker
Medisinsk genetikk:
Overlege Lars Fredrik Engebretsen, Helse Bergen
Overlege, dr. med. Lovise Mæhle, OUS/DNR
Redaksjonen ble etter oppnevnelsen ledet av Jan Erik Varhaug, som pga sykdom valgte å trekke seg fra arbeidet underveis. Michael Brauckhoff, som ledet arbeidet videre, døde brått og uventet høsten 2014. Arbeidet var da i nesten ferdig og det er mindre endringer og oppdateringer som er foretatt senere, særlig med hensyn til ATA retningslinjene som kom 2015. Terje Osnes har ledet arbeidet i avslutningen.
Oppdatering av retningslinjene
Sist faglig oppdatert: 30.06.2017
Handlingsprogrammet vil vurderes årlig og oppdateres.
Oppdateringen utføres av en oppdateringsgruppe som består av fagpersoner oppnevnt av RHF-ene og Helsedirektoratet. Kunnskapssenteret i Folkehelseinstituttet skal også bidra i arbeid med oppdatering av handlingsprogrammet.
Gradering av kunnskapsgrunnlaget
Ved neste revisjon av handlingsprogrammet vil Kunnskapssenteret i Folkehelseinstituttet samarbeide med oppdateringsgruppen om gradering av kunnskapsgrunnlaget for anbefalingene i handlingsprogrammet.
Publisering
Retningslinjene vil publiseres på helsedirektoratet.no og helsebiblioteket.no
Referanser
Sist faglig oppdatert: 30.06.2017
Guidelines
Francis GL, Waguespack SG, Bauer AJ, Angelos P, Benvenga S, Cerutti JM, Dinauer CA, Hamilton J, Hay ID, Luster M, Parisi MT, Rachmiel M, Thompson GB, Yamashita S; American Thyroid Association Guidelines Task Force. Management Guidelines for Children with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2015 Jul;25(7):716–59
Haugen BR Md, Alexander EK, Bible KC, Doherty G, Mandel SJ, Nikiforov YE, Pacini F, Randolph G, Sawka A, Schlumberger M, Schuff KG, Sherman SI, Sosa JA, Steward D, Tuttle RM Md, Wartofsky L. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer.Thyroid. 2015 Oct 14.
Leenhardt L,. Erdogan MF. Hegedus L, Mandel SJ, Paschke R, Rago T, and G. Russa. 2013 European Thyroid Association Guidelines for Cervical Ultrasound Scan and Ultrasound-Guided Techniques in the Postoperative Management of Patients with Thyroid Cancer. Eur Thyroid J. 2013 Sep; 2(3): 147–159.
Nasjonale retningslinjer for thyreoideacancer 2015: http://www.dahanca.oncology.dk
NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Thyroid Carcinoma. Version 2.2015, NCCN.org
Perros P, Boelaert K, Colley S, Evans C, Evans RM, Gerrard Ba G, Gilbert J, Harrison B, Johnson SJ, Giles TE, Moss L, Lewington V, Newbold K, Taylor J, Thakker RV, Watkinson J, Williams GR; British Thyroid Association. Guidelines for the management of thyroid cancer. Clin Endocrinol (Oxf). 2014 Jul;81 Suppl 1:1–122.
Pacini F, Schlumberger M, Dralle H, et al. European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium. Eur J Endocrinol 2006; 154: 787.
Smallridge, Ain, et al. American Thyroid Association Guidelines for Management of Patients with Anaplastic Thyroid Cancer. Thyroid 22(11): 1104-1139, 2012
UUICSverige (ikke nasjonale): www.oc.gu.se (2006) og www.ocsyd.lu.se (1999)
Wells SA Jr, Asa SL, Dralle H, Elisei R, Evans DB, Gagel RF, Lee N, Machens A, Moley JF, Pacini F, Raue F, Frank-Raue K, Robinson B, Rosenthal MS, Santoro M, Schlumberger M, Shah M, Waguespack SG; American Thyroid Association Guidelines Task Force on Medullary Thyroid Carcinoma. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid. 2015 Jun;25(6):567–610.
Studier
Ahmed SR, Ball DW. Clinical review: Incidentally discovered medullary thyroid cancer: diagnostic strategies and treatment. J Clin Endocrinol Metab 2011;96:1237–1245
Alex Stagnaro-Green et al. Guidelines of the Amarican Thyroid Association for Diagnosis and Management of Thyroid Disease During Pregnancy and Postpartum. Thyroid 2011; Volume 21, No 10, 1081–1125.
Asa SL.: My approach to oncocytic tumours of the thyroid. J Clin Pathol. 2004, 57, 225–32.
Baudin E, Travagli JP, Ropers J et al. Microcarcinoma of the thyroid gland: the Gustave-Roussy Institute experience. Carcinom1998; 83(3):553–559.
Berner A, Sigstad E, Pradhan M, Groholt KK, Davison B: Fine-needle aspiration cytology of the thyroid gland: comparative analysis of experience at three hospitals. Diagn Cytopathol 2006, 34, 97–100
Biermann, Martin; Kråkenes, Jostein; Brauckhoff, Katrin; Haugland, Hans Kristian; Akslen, Lars A.; Heinecke, A.; Varhaug, Jan Erik; Brauckhoff, Michael. 2015. Post-PET ultrasound improves specificity of 18F-FDG-PET for recurrent differentiated thyroid cancer while maintaining sensitivity. Acta Radiol. 2015 Nov;56(11):1350–60
Biermann, Martin; Pixberg, M. K.; Riemann, B.; Schuck, A.; Heinecke, A.; Schmid, K. W.; Willich, N.; Dralle, H.; Schober, O. 2009. Clinical outcomes of adjuvant external-beam radiotherapy for differentiated thyroid cancer Results after 874 patient-years of follow-up in the MSDS-trial. Nuklearmedizin. 48: 89–98.
Bogsrud TV, Karantanis D, Nathan MA et al. The value of quantifying 18F-FDG uptake in thyroid nodules found incidentally on whole-body PET-CT. Nucl Med Commun. 2007; 28: 373–81.
Bogsrud TV, Karantanis D, Nathan MA, Mullan BP, Wiseman GA, Kasperbauer JL, Reading CC, Björo T, Hay ID, Lowe VJ. The prognostic value of 2-deoxy-2-[18F]fluoro-D-glucose positron emission tomography in patients with suspected residual or recurrent medullary thyroid carcinoma. Mol Imaging Biol. 2010 Oct;12(5):547–53.
Brose MS, Nutting CM, Jarzab B, et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double blind, phase 3 trial. Lancet 2014; 384: 319–28
Brose MS, Smit J, Capdevila J, Elisei R, et al. Regional approaches to the management of patients with advanced, radioactive iodine-refractory differentiated thyroid carcinoma. Expert Rev Anticancer Ther 12:1137–47, 2012
Carter WB, Tourtelot JB, Savell JG, Lilienfeld H. New treatments and shifting paradigms in differentiated thyroid carcinommanagement. CarcinomControl. 2011 Apr;18(2):96–103.
Ceresini G, Corcione L, Morganti S, Milli B, Bertone L, Prampolini R, Petrazzoli S, Saccani M, Ceda GP, Valenti G. : Ultrasound-guided fine-needle capillary biopsy of thyroid nodules, coupled with on-site cytologic review, improves results. Thyroid. 2004, 14, 385–9.
Chambon G, Alovisetti C, Idoux-Louche C, Reynaud C, Rodier M, Guedj AM, Chapuis H, Lallemant JG, Lallemant B. The use of preoperative routine measurement of basal serum thyrocalcitonin in candidates for thyroidectomy due to nodular thyroid disorders: results from 2733 consecutive patients. J Clin Endocrinol Metab 2011;96:75–81
Cheung K, Roman SA, Wang TS, Walker HD, Sosa JA. Calcitonin measurement in the evaluation of thyroid nodules in the United States: a cost-effectiveness and decision analysis. J Clin Endocrinol Metab 2008;93:2173–2180
Choi KU, Kim JY, Park do Y, Lee CH, Sol MY, Han KT, Kim YG.: Recommendations for the management of cystic thyroid nodules. ANZ J Surg. 2005, 75, 537–41
Chow SM, Law SC, Chan JK, Au SK, Yau S, Lau WH. Papillary microcarcinoma of the thyroid-Prognostic significance of lymph node metastasis and multifocality. Carcinom2003; 98(1):31–40.
Clinical Oncology 2004;16:561–68
Cooper DS, Doherty GM, Haugen BR et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009; 19: 1167–214.
Cooper DS, Specker B, Ho M et al. Thyrotropin suppression and disease progression in patients with differentiated thyroid cancer: results from the National Thyroid CarcinomTreatment Cooperative Registry. Thyroid 1998; 8(9):737–744.
Daniels GH. Screening for medullary thyroid carcinoma with serum calcitonin measurements in patients with thyroid nodules in the United States and Canada. Thyroid 2011; 21:1199–1207
Dottorini ME, Lomuscio G, Mazzucchelli L, Vignati A, Colombo L. Assessment of female fertility and carcinogenesis after iodine-131 therapy for differentiated thyroid carcinoma. J Nucl Med. 1995 Jan;36(1):21–7.
Dralle H, Machens A, Brauckhoff M. Syndromic Medullary Thyroid Carcinoma: MEN 2A and MEN 2B. In: Randolph GW (Ed) Surgery of the thyroid and parathyroid glands. Elsevier Science. Philadelphia. 2nd edition. In press.
E.L. Mazzaferri. Approach to the pregnant patient with thyroid cancer. JCEM 96: 265–72, 2011
Elisei R, Schlumberger MJ, Müller SP, et al. Cabozantinib in Progressive Medullary Thyroid Cancer. J Clin Oncol 2013, 31:3639–46
Faggiano A, Milone F, Ramundo V, Chiofalo MG, Ventre I, Giannattasio R, Severino R, Lombardi G, Colao A, Pezzullo L. A decrease of calcitonin serum concentrations less than 50 percent 30 minutes after thyroid surgery suggests incomplete C-cell tumor tissue removal. J Clin Endocrinol Metab 2010;95:E32-E36
Frates MC et al. Management of thyroid nodules detected at US: Society of Radiologists in ultrasound consensus conference statement. Radiology 2005; 237: 794–800.
Gharib H, Papini E, Paschke R et al. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi and European Thyroid Association medical guidelines for clinical practice for the diagnosis and management of thyroid nodules: Executive summary of recommendations. Endocrine Practice 2010; 16(3) May/June 468–475.
Guidelines of the Papanicolaou Society of Cytopathology for the examination of fine-needle aspiration specimens from thyroid nodules. The Papanicolaou Society of Cytopathology Task Force on Standards of Practice. Diagn Cytopathol. 1996, 15, 84–9.
Haslerud T1, Brauckhoff K2, Reisæter L3, Küfner-Lein R4, Heinecke A5, Varhaug JE6, Biermann M7. F18-FDG-PET for recurrent differentiated thyroid cancer: a systematic meta-analysis. Acta Radiol. 2015 Jul 9. pii: 0284185115594645. [Epub ahead of print]
Hasselgren M, Hegedüs L, Godballe C, Bonnema SJ. Benefit of measuring basal serum calcitonin to detect medullary thyroid carcinoma in a Danish population with a high prevalence of thyroid nodules. Head Neck 2010;32:612–618
Hassell LA, Gillies EM, Dunn ST.: Cytologic and molecular diagnosis of thyroid cancers: is it time for routine reflex testing? CarcinomCytopathol. 2012 Feb 25;120(1):7–17.
Hay ID, Gonzalez-Losada T, Reinalda MS et al. Long-term outcome in 215 children and adolescents with papillary thyroid carcinomtreated during 1940 through 2008. World J Surg 2010; 34: 1192–202.
Hay ID, Grant CS, van Heerden JA, Goellner JR, Ebersold JR, Bergstralh EJ. Papillary thyroid microcarcinoma: a study of 535 cases observed in a 50-year period. Surgery 1992; 112(6):1139–1146.
Hegedus L, Bonnema SJ, Bennedbaek FN. : Management of simple nodular goiter: current status and future perspectives. Endocr Rev. 2003, 24, 102–32.
Heilo A, Sigstad E, Fagerlid KH, Håskjold OI, Grøholt KK, Berner A, Bjøro T, Jørgensen LH: Efficacy of ultrasound-guided percutaneous ethanol injection treatment in patients with a limited number of metastatic cervical lymph nodes from papillary thyroid carcinoma. The Journal of clinical endocrinology and metabolism 06/2011; 96(9):2750–5.
Hoang JK, Langer JE, Middleton WD, Wu CC, Hammers LW, Cronan JJ, Tessler FN, Grant EG, Berland LL. Managing incidental thyroid nodules detected on imaging: white paper of the ACR Incidental Thyroid Findings Committee.J Am Coll Radiol. 2015 Feb;12(2)
Hung GU, Lee KW, Liao PY, Yang LH, Yang KT. The influence of I-131 therapy on FDG uptake in differentiated thyroid cancer. Ann Nucl Med. 2008 Jul;22(6):481–5.
Ito Y, Tomoda C, Uruno T et al. Papillary microcarcinoma of the thyroid: how should it be treated? World J Surg 2004; 28(11):1115–1121.
Ito Y, Tomoda C, Uruno T et al. Preoperative ultrasonographic examination for lymph node metastasis: usefulness when designing lymph node dissection for papillary microcarcinoma of the thyroid. World J Surg 2004; 28(5):498–501.
Ito Y, Uruno T, Nakano K et al. An observation trial without surgical treatment in patients with papillary microcarcinoma of the thyroid. Thyroid 2003; 13(4):381–387.
Jamshid Farahati et al.: Differentiated Thyroid Cancer. Carcinom1996; 77:172–80.
Jamshid Farahati et al.: Differentiated Thyroid Cancer. Carcinom1996; 77:172–80.
Karantanis D, Bogsrud TV, Wiseman GA et al. Clinical significance of diffusely increased 18F-FDG uptake in the thyroid gland. J Nucl Med 2007; 48: 896–901.
Karges W, Dralle H, Raue F, Mann K, Reiners C, Grussendorf M, Hüfner M, Niederle B, Brabant G; German Society for Endocrinology (DGE) – Thyroid Section. Calcitonin measurement to detect medullary thyroid carcinoma in nodular goiter: German evidence-based consensus recommendation. Exp Clin Endocrinol Diabetes 2004;112: 52–58
Kim AW, Maxhimer JB, Quiros RM, Weber K, Prinz RA. Surgical management of well-differentiated thyroid carcinomlocally invasive to the respiratory tract. J Am Coll Surg 2005; 201(4):619–627.
Kim EK, Park CS, Chung WY et al. New sonographic criteria for recommending fine-needle aspiration biopsy of nonpalpable solid nodules of the thyroid. Am J Roentgenol 2002; 178: 687–691.
Koopmans KP, de Groot JW, Plukker JT, de Vries EG, Kema IP, Sluiter WJ, Jager PL,Links TP. 18F-dihydroxyphenylalanine PET in patients with biochemical evidence of medullary thyroid cancer: relation to tumor differentiation. J Nucl Med. 2008 Apr;49(4):524–31.
Kouvaraki MA, Shapiro SE, Lee JE, Evans DB, Perrier ND. Surgical management of thyroid carcinoma. J Natl Compr Canc Netw 2005; 3(3):458–466.
Leboulleux S, Bastholt L, Krause T, et al. Vandetanib in locally advanced or metastatic differentiated thyroid cancer: a randomised, double blind, phase 2 trial. Lancet Oncol 2012; 13: 897–905
Leenhardt L, Grosclaude P, Cherie-Challine L. Increased incidence of thyroid carcinoma in france: a true epidemic or thyroid nodule management effects? Report from the French Thyroid CarcinomCommittee. Thyroid 2004; 14(12):1056–1060.
Lundh C, Lindencrona U, Postgård P, Carlsson T, Nilsson M, Forssell-Aronsson E. Ma C, Xie J, Lou Y, Gao Y, Zuo S, Wang X. The role of TSH for 18F-FDG-PET in the diagnosis of recurrence and metastases of differentiated thyroid carcinoma with elevated thyroglobulin and negative scan: a meta-analysis. Eur J Endocrinol. 2010 Aug;163(2):177–83.
M. Biermann et al.: Multicenter Study Differentiated Thyroid Carcinoma(MSDS). Diminished acceptance of adjuvant external beam radiotherapy. Nuclearmedizin 2003;42:244–50
Machens A, Dralle H. Biomarker-based risk stratification for previously untreated medullary thyroid cancer. J Clin Endocrinol Metab 2010;95:2655–2663
Machens A, Hauptmann S, Dralle H. Medullary thyroid carcinomresponsiveness to pentagastrin stimulation: an early surrogate parameter of tumor dissemination? J Clin Endocrinol Metab 2008;93:2234–2238
Machens A, Hoffmann F, Sekulla C, Dralle H. Importance of gender-specific calcitonin thresholds in screening for occult sporadic medullary thyroid cancer. Endocr Relat Cancer. 2009;16:1291–1298
Machens A, Lorenz K, Dralle H. Individualization of lymph node dissection in RET (rearranged during transfection) carriers at risk for medullary thyroid cancer: value of pretherapeutic calcitonin nivås. Ann Surg 2009;250: 305–310
Mazzaferri EL, Kloos RT. Clinical review 128: Current approaches to primary therapy for papillary and follicular thyroid cancer. J Clin Endocrinol Metab 2001; 86(4):1447–1463.
Nikiforov YE, Seethala RR, Tallini G, Baloch ZW, Basolo F, Thompson LD, Barletta JA, Wenig BM, Al Ghuzlan A, Kakudo K, et al. Nomenclature revision for encapsulated follicular variant of papillary thyroid carcinoma: a paradigm shift to reduce overtreatment of indolent tumors. JAMA Oncol. April 14, 2016.
Oertel YC, Oertel JE.: Thyroid cytology and histology. Baillieres Best Pract Res Clin Endocrinol Metab. 2000, 14, 541–57.
Orell SR, Philips J.: Broadsheet number 57: problems in fine needle biopsy of the thyroid. Pathology. 2000, 32, 191–8.
P.C.Wilson et al: Overview The Management of Advanced Thyroid Cancer. Clinical Oncology 2004;16:561–68
P.C.Wilson et al: Overview The Management of Advanced Thyroid Cancer.
Pacini F, Ladenson PW, Schlumberger M, Driedger A, Luster M, Kloos RT, Sherman S, et al. Radioiodine ablation of thyroid remnants after preparation with recombinant human thyrotropin in differentiated thyroid carcinoma: results of an international, randomized, controlled study. J Clin Endocrinol Metab 2006; 91:926–32.
Pacini F, Schlumberger M, Dralle H et al. European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium. Eur J Endocrinol 2006; 154: 787–803.
Papini E et al. Risk of malignancy in nonpalpable thyroid nodules: Predictive value of ultrasound and color-Doppler features. J Clin Endocrinol Metab 2002; 87:1941–1946.
Papini E, Guglielmi R, Bianchini A et al. Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color-Doppler features. J Clin Endocrinol Metab 2002; 87(5):1941–1946.
Pelizzo MR, Boschin IM, Toniato A, et al. Papillary thyroid microcarcinoma (PTMC): Prognostic factors, management and outcome in 403 patients. Eur J Surg Oncol 2006;32:1144–8
Pellegriti G, Scollo C, Lumera G, Regalbuto C, Vigneri R, Belfiore A. Clinical behavior and outcome of papillary thyroid cancers smaller than 1.5 cm in diameter: study of 299 cases. J Clin Endocrinol Metab 2004; 89(8):3713–3720.
Pillarisetty VG, Katz SC, Ghossein RA, Tuttle RM, Shaha AR. Micromedullary thyroid cancer: how micro is truly micro? Ann Surg Oncol 2009;16:2875–2881
Postgård P, Himmelman J, Lindencrona U, Bhogal N, Wiberg D, Berg G, Jansson S, Nyström E, Forssell-Aronsson E, Nilsson M. Stunning of iodide transport by (131)I irradiation in cultured thyroid epithelial cells. J Nucl Med. 2002 Jun;43(6):828–34.
Pryma DA, Schöder H, Gönen M, Robbins RJ, Larson SM, Yeung HW. 2006. Diagnostic accuracy and prognostic value of 18F-FDG PET in Hürthle cell thyroid carcinompatients. J Nucl Med; 47: 1260–6.
Radiation-induced thyroid stunning: differential effects of (123)I, (131)I, (99m)Tc, and (211)At on iodide transport and NIS mRNA expression in cultured thyroid cells. J Nucl Med. 2009 Jul;50(7):1161–7.
Raffel A, Cupisti K, Krausch M, Wolf A, Schulte KM, Roher HD. Incidentally found medullary thyroid cancer: treatment rationale for small tumors. World J Surg 2004;28:397–401
Randolph GW, Kamani D. The importance of preoperative laryngoscopy in patients undergoing thyroidectomy: voice, vocal cord function, and the preoperative detection of invasive thyroid malignancy. Surgery 2006; 139(3):357–362.
Richard W. Tsang et al.: The Effect of Surgery, Radioiodine, and External Radiation Therapy on the Clinical Outcome of Patients with Differentiated Thyroid Carcinoma. Carcinom1998; 82:375–88.
Richard W. Tsang et al.:The Effect of Surgery, Radioiodine, and External Radiation Therapy on the Clinical Outcome of Patients with Differentiated Thyroid Carcinoma. Carcinom1998; 82:375–88.
Rosato L, Avenia N, Bernante P et al. Complications of thyroid surgery: analysis of a multicentric study on 14,934 patients operated on in Italy over 5 years. World J Surg 2004; 28(3):271–276.
Roti E, Rossi R, Trasforini G et al. Clinical and histological characteristics of papillary thyroid microcarcinoma: results of a retrospective study in 243 patients. J Clin Endocrinol Metab 2006; 91(6):2171–2178.
Saxena P, Bhatnagar A, Nishad DK, Tyagi R, Rana P, Ali S, Mittal G. Transient cell function disruption by low dose acute exposure of ionizing radiation. Indian J Exp Biol. 2011 Dec;49(12):895–903.
Scheumann GF, Gimm O, Wegener G, Hundeshagen H, Dralle H. Prognostic significance and surgical management of locoregional lymph node metastases in papillary thyroid cancer. World J Surg 1994; 18(4):559–567.
Schlumberger M, De Vathaire F, Ceccarelli C, Delisle MJ, Francese C, Couette JE, Pinchera A, Parmentier C. Exposure to radioactive iodine-131 for scintigraphy or therapy does not preclude pregnancy in thyroid carcinompatients. J Nucl Med. 1996 Apr;37(4):606–12.
Schlumberger M, Pacini F, Wiersinga WM et al. Follow-up and management of differentiated thyroid carcinoma: a European perspective in clinical practice. Eur J Endocrinol 2004; 151(5):539–548.
Sclumberger MJ, Tahara M, Wirth LJ, et al. Lenvatinib versus Placebo in Radioiodine-Refractory Thyroid Cancer. NEJM 2015; 372: 621–30
Shaha AR. Invited commentary: Vocal cord evaluation in thyroid surgery. Surgery 2006; 139(3):363–364.
Shimura H et al. Techniques in thyroidology. Distinct diagnostic criteria for ultrasonographic examination of papillary thyroid carcinoma: A multicenter study. Thyroid 2005; 15:251–258.
Solbiati L et al. The thyroid gland. Textbook on diagnostic ultrasound chapter 21 by Rumenac CM, Wilson SR, Charboneau JW. Mosby 2002.
Tala H, Robbins R, Fagin JA, Larson SM, Tuttle RM. Five-year survival is similar in thyroid carcinompatients with distant metastases prepared for radioactive iodine therapy with either thyroid hormone withdrawal or recombinant human TSH. J Clin Endocrinol Metab. 2011 Jul;96(7):2105–11.
Tessler FN, Tublin ME. Thyriod sonography: Current application and future directions. Am J Roentgenol 1999; 173: 437–443.
The British Thyroid Association guidelines for the management of thyroid carcinomin adults. Fine needle aspiration cytology. https://www.british-thyroid-association.org/
Theoharis C, Roman S, Sosa JA: The molecular diagnosis and management of thyroid neoplasms. Curr Opin Oncol. 2012 Jan;24(1):35–41. Review.
Tuttle RM, Ball DW, Byrd D, Daniels GH, Dilawari RA, Doherty GM, Duh QY, Ehya H, Farrar WB, Haddad RI, Kandeel F, Kloos RT, Kopp P, Lamonica DM, Loree TR, Lydiatt WM, McCaffrey J, Olson JA Jr, Parks L, Ridge JA, Shah JP, Sherman SI, Sturgeon C, Waguespack SG, Wang TN, Wirth LJ; National Comprehensive CarcinomNetwork. Medullary carcinoma. J Natl Compr Canc Netw 2010;8:512–530
Vaccarella S, Franceschi S, Bray F, Wild CP, Plummer M, Dal Maso L. Worldwide Thyroid-Cancer Epidemic? The Increasing Impact of Overdiagnosis. N Engl J Med. 2016 Aug 18;375(7):614-7
Valle LA, Kloos RT. The prevalence of occult medullary thyroid carcinoma at autopsy. J Clin Endocrinol Metab 2011;96:E109-E113
van Tol KM, Jager PL, Piers DA, Pruim J, de Vries EG, Dullaart RP, Links TP. Better yield of (18)fluorodeoxyglucose-positron emission tomography in patients with metastatic differentiated thyroid carcinoma during thyrotropin stimulation. Thyroid 2002; 12:381–7.
Wada N, Duh QY, Sugino K et al. Lymph node metastasis from 259 papillary thyroid microcarcinomas: frequency, pattern of occurrence and recurrence, and optimal strategy for neck dissection. Ann Surg 2003; 237(3):399–407.
Wang W, Larson SM, Fazzari M et al. Prognostic value of [18F]fluorodeoxyglucose positron emission tomographic scanning in patients with thyroid cancer. J Clin Endocrinol Metab 2000; 85: 1107–13.
Wells SA Jr, Robinson BG, Gagal RF, et al. Vandetanib in patients with locally advanced or metastatic medullary thyroid cancer: a randomized, double blind phase III trial. J Clin Oncol 2012; 30:134–41
Yang GC, Liebeskind D, Messina AV.: Should cytopathologists stop reporting follicular neoplasms on fine-needle aspiration of the thyroid? Cancer. 2003, 99, 69–74.









