Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av kreft i tykktarm og endetarm
Hva er nytt?
Sist faglig oppdatert: 20.12.2023
Oppdateringen av Handlingsprogrammet for tarmkreft 20. desember 2023 (10. utgave) har vesentlige nyheter om:
- Kapittel 9: Behandling av tykktarmskreft uten metastaser hvor det fokuseres på preoperativ kartlegging med CT med karrekonstruksjon og lymfeknutedisseksjon ved høyresidig og ved venstresidig tykktarmskreft og med oppdaterte tegninger for de ulike prosedyrene.
- Kapittel 10: Kirurgisk behandling av endetarmskreft uten fjernmetastaser har nye momenter for behandling av lavrisiko T1 svulster og vurderinger av operasjon med transanale teknikker.
- Kapittel 11: Onkologisk behandling av endetarmskreft har flere oppdateringer og nye referanser både for preoperativ og postoperativ strategi.
- Kapittel 13: Behandling av resektable og potensielt resektable metastaser har mange nye presiseringer både innen onkologi og kirurgi.
- Kapittel 14: Behandling av ikke-kurable metastaser med nye presiseringer hva gjelder immunterapi.
- Kapittel 17: Patologi har mye nytt, blant annet innen molekylærpatologi og at reflekstesting av MMR/MSI skal utføres hos alle pasienter med nyoppdaget adenokarsinom i tykk- og endetarm.
Innledning
Sist faglig oppdatert: 20.12.2023
Norsk Gastrointestinal Cancer Gruppe (NGICG) publiserte og oppdaterte fra tidlig på 1990-tallet anbefalinger for utredning, behandling og oppfølging av tykk- og endetarmskreft gjennom «Grønnboka» og senere på NGICG sine hjemmesider (www.ngicg.no). NGICG stod bak opprettelsen av Rectumcancerregisteret sammen med Kreftregisteret og Kreftforeningen i 1993. Resultatene fra Rectumcancerregisteret har vært benyttet som basis for faglige anbefalinger både om behandlingsrutiner og faglige standarder. Disse anbefalingene synes å være akseptert og langt på vei fulgt i fagmiljøene.
Da Nasjonalt handlingsprogram for tykk- og endetarmskreft første gang ble publisert som nasjonal faglig retningslinje av Helsedirektoratet i 2010, erstattet denne «Grønnboka». Dette handlingsprogrammet har senere vært oppdatert en rekke ganger.
Gjennom rapportene fra Rectumcancerregisteret er det dokumentert en vesentlig reduksjon i lokale residiv og bedring i 5-års overlevelse etter behandling for endetarmskreft. Fra 2007 ble registeret utvidet til også å omfatte tykktarmskreft (Colorectalcancerregisteret). Dette har senere endret navn til Nasjonalt kvalitetsregister for tykk- og endetarmskreft, og er et av flere nasjonale kvalitetsregistre ved Kreftregisteret. Kolorektalgruppen i NGICG (NGICG-CR) er identisk med Fagrådet for tarmkreft i Kreftregisteret og har det faglige ansvaret for registeret. Årsrapporten viser behandlingsresultater og en del informasjon om stadier og behandlingen som er gitt for alle pasienter med tykk- og endetarmskreft, både på nasjonal basis og for hvert enkelt sykehus (Kreftregisteret, 2023b). Før registeret startet var det 28% lokale residiver ved endetarmskreft for de som var behandlet med kurativ intensjon, men de siste 25 årene har andelen som får lokale residiv blitt redusert, og er nå ca. 4 %. Andelen som får fjernspredning er redusert fra omkring 35% før registeret startet til 18% for endetarmskreft og 14% for tykktarmskreft. Komplett og valid innrapportering fra sykehusene er nødvendig for å kunne lage rapporter, både nasjonalt og for sykehus. Kvaliteten på dataene i registeret har vært undersøkt ved en større gjennomgang av pasientjournaler. Data om tilbakefall og metastaser etter kurativ behandling hadde god kvalitet (Dørum et al., 2017). Det er gode resultater når man sammenligner overlevelse i Norge med andre land (Benitez Majano et al., 2019; Glimelius et al., 2016).
Volum og kvalitet
Forholdet mellom volum og kvalitet i behandling av kreft har vært fokus for en rekke publikasjoner og offentlige utredninger. For visse diagnoser eller prosedyrer har enkelte publikasjoner vist at høyt volum fører til bedre behandlingsresultat, mens det for andre diagnoser eller prosedyrer ikke er påvist en slik sammenheng. I et internasjonalt perspektiv vil flertallet av norske sykehus som behandler tykk- og/eller endetarmskreft fremstå som sentre med relativt lavt volum. Vurderingen av volum og kvalitet må også ta hensyn til om det foreligger et tverrfaglig miljø omkring den aktuelle kreftsykdommen. Data fra kvalitetsregisteret for tykk- og endetarmskreft har vist at sykehus hvor det kun sporadisk opereres endetarmskreft har hatt utilfredsstillende resultater, og flere sykehus med små volum har sluttet med elektiv kirurgisk behandling av endetarmskreft. Den årlige årsrapporten fra kvalitetsregisteret rapporterer en rekke kliniske resultater og kvalitetsindikatorer på nasjonalt nivå og på sykehusnivå. Det er derfor viktig at de enkelte institusjonene bruker årsrapporten til kontinuerlig kvalitetsarbeid.
Kirurgisk kompetanse
Kirurgisk behandling av tykk- og endetarmskreft skal utføres av spesialister i gastroenterologisk kirurgi med sitt hovedvirke innen kolorectalkirurgi. Institusjoner med alenespesialister eller med vikarbasert faglighet innen gastroenterologisk kirurgi bør avstå fra elektiv operativ behandling av tykk- og endetarmskreft. Ved kurative operasjoner for endetarmskreft bør to gastrokirurger med hovedvirke innen kolorectalkirurgi utføre inngrepet.
Tverrfaglige team
Nytten av tverrfaglige møter/team er dokumentert i litteraturen (MacDermid et al., 2009). Det skal være formelle tverrfaglige møter på alle sykehus som behandler tykk- og endetarmskreft, der utredning og behandling av pasienter med tykk- og endetarmskreft diskuteres. Tverrfaglige møter for vurdering av tykk- og endetarmskreft må ha deltakelse av gastrokirurg, radiolog og onkolog. Der nødvendig kompetanse ikke er fysisk tilgjengelig på institusjonen må det etableres kvalitativt tilfredsstillende videokonferanseordninger med et annet kompetent fagmiljø, alternativt kan pasienten henvises til annet sykehus for tverrfaglig vurdering. Tverrfaglige møter bør ha mulighet for tilknytning av patolog. Ved vurdering av kurativ behandling hvor metastasekirurgi inngår bør relevant kompetanse innhentes.
Kvalitetsindikatorer
For å kunne vurdere om anbefalingene i handlingsprogrammet blir fulgt har Fagrådet for tarmkreft i Kreftregisteret utarbeidet kvalitetsindikatorer. Arbeidet med å utvikle kvalitetsindikatorer er en kontinuerlig prosess som binder Nasjonalt kvalitetsregister for tykk- og endetarmskreft sammen med handlingsprogrammet for behandling av tykk- og endetarmskreft (Kreftregisteret, 2023a).
Resultatene formidles blant annet på:
- kvalitetregistre.no (Nasjonalt servicemiljø for medisinske kvalitetsregistre, 2023)
- Nasjonale kvalitetsindikatorer (Helsedirektoratet, 2023)
- Årsrapport fra tykk- og endetarmsregisteret (Kreftregisteret, 2023b).
Tykktarm | Endetarm |
|---|---|
Datakvalitet Dekningsgrad utredningsmelding Dekningsgrad kirurgimelding | Datakvalitet Dekningsgrad: kirurgimelding |
Prosessindikatorer Andel operert med laparoskopi Andel <60 år undersøkt for MSI/dMMR
| Prosessindikatorer Angitt avstand til mesorektale fascie Andel strålebehandlet før operasjon Andel operert med laparoskopi Andel <60 år undersøkt for MSI/dMMR |
Resultatindikatorer Dødelighet 100 dager etter elektiv operasjon 5-års relativ overlevelse etter operasjon 5-års relativ overlevelse etter diagnose
| Resultatindikatorer Andel uten lokalt tilbakefall 5 år etter operasjon Dødelighet 100 dager etter elektiv operasjon 5-års relativ overlevelse etter operasjon 5-års relativ overlevelse etter diagnose |
Epidemiologi og risikofaktorer
Sist faglig oppdatert: 20.12.2023
Forekomst, mortalitet og overlevelse
På verdensbasis diagnostiseres rundt 1,9 millioner tilfeller av tykk- og endetarmskreft årlig, og det er den tredje største kreftformen målt i antall (Ferlay et al., 2020). Informasjon om global forekomst finnes hos WHO/IARC sin side Cancer today.
I Norge er tykk- og endetarmskreft den nest hyppigste kreftdiagnosen blant både kvinner og menn målt i både antall og rater (Larsen, 2023). I 2022 ble det registrert 4 745 nye tilfeller av tarmkreft i Norge. Det utgjorde 12 prosent av alle ny-diagnostiserte tilfeller (Larsen, 2023). Innen fylte 80 år vil nær 6 prosent av kvinnene og 7 prosent av mennene rammes av tykk- og endetarmskreft. Median alder ved diagnose er 74 år for tykktarmskreft, og 70 år for endetarmskreft. Tarmkreft opptrer sjeldent blant personer <40 år. De siste årene er det imidlertid observert en økt forekomst blant unge voksne i Nord-Amerika og Europa, inkludert Norge (Araghi et al., 2019; Vuik et al., 2019). Risikoen for tykktarmkreft, for alle aldre samlet, har økt jevnt siden Kreftregisteret startet registreringen i 1953. De siste årene har det imidlertid vært en utflating av ratene, og blant menn ses en liten nedgang de siste årene. For endetarmskreft har ratene vært relativt stabile siden 1980-tallet, og det ses en liten nedgang i ratene de seneste årene, særlig blant menn.
Andelen som overlever sin kreftdiagnose i 5 år eller mer (5-års relativ overlevelse) har økt jevnt, og er rundt 70 % for både tykktarmskreft og endetarmskreft. Ved lokalisert sykdom vil mer enn 95 % av pasientene overleve sin kreftsykdom i 5 år eller mer. Tilsvarende tall for pasienter med lokalavansert utbredelse er i overkant av 80 %, mens 5-års relativ overlevelse for pasienter med fjernspreding er rundt 20 % (Larsen, 2023). Det har vært en tydelig reduksjon i mortalitetsratene for endetarmskreft. For tykktarmskreft har mortalitetsratene vært mer stabile, men det ses en liten nedgang, særlig blant menn de siste 10–15 årene.
Mer informasjon:
- Kreftregisterets temaside for helsepersonell om tarmkreft
- Cancer in Norway 2021, Special issue for overlevelse
Risiko og forebygging
Som for de fleste kreftformer øker risikoen for tarmkreft med alderen. Sykdommen opptrer sjelden blant unge, men etter fylte 50 år ses en sterk økning i forekomsten. I Norge diagnostiseres 7 % av tilfellene i aldersgruppen 0–49 år, 33 % av tilfellene i aldergruppen 50–69 år, og 60 % av tilfellene i aldersgruppen 70 år eller mer. Se statistikk fra de nordiske kreftregistrene Nordcan for aldersspesifikk forekomst i Norge.
Økt risiko for tarmkreft ses også hos personer som har foreldre, søsken eller barn som har hatt tarmkreft før fylte 55 år (Lowery et al., 2016), tidligere funn av høyrisiko adenomer (Imperiale et al., 2014), og hos personer med inflammatorisk tarmsykdom som ulcerøs kolitt (Zhou et al., 2019) eller Crohns sykdom (Canavan et al., 2006). Det antas at mindre enn 5 % av tilfellene skyldes medfødte genfeil, men om lag 20 % av alle tilfellene kan være relatert til familiær tarmkreft hvor genfeilen er ukjent. For mer informasjon om arvelig kreft se kapittel Arvelig tykk- og endetarmskreft.
Som forebygging står tiltak rettet mot livsstil sentralt. En oppsummering fra World Cancer Research Fund/American Institute for Cancer Research anslår at en stor del av tilfellene av tykk- og endetarmskreft kan forebygges ved hjelp av endring av kosthold og livsstil (World Cancer Research Fund et al., 2007, 2011, 2018). Matvarer som reduserer risikoen for både tykk- og endetarmskreft er produkter som inneholder kostfiber, fullkorn og melkeprodukter. I tillegg har fysisk aktivitet en beskyttende effekt for tykktarmskreft, men det å være fysisk aktiv har liten effekt på risikoen for endetarmskreft. På den andre siden, er rødt og særlig bearbeidet kjøtt, alkohol og fedme faktorer som øker risikoen for kreft i både tykktarm og endetarm (World Cancer Research Fund et al., 2007, 2011, 2018). Røyking er også vist å være en risikofaktor for tarmkreft (International Agency for Research on Cancer, 2022).
Resultater fra randomiserte studier gir støtte for at både screening med sigmoidoskopi og testing for blod i avføring reduserer dødelighet av tykk- og endetarmskreft. Imidlertid er det ikke avklart hvilken screeningmetode som egner seg best i et helhetlig folkehelseperspektiv (Holme et al., 2013; Holme et al., 2014). I dag er immunkjemisk påvisning av okkult blod i avføring (iFOBT) og screening med koloskopi de mest utbredte metodene for tarmkreftscreening. Foreløpig foreligger det bare en randomisert studie som har publisert langtidsdata på koloskopiscreening. Studien fant at screening med koloskopi reduserte tarmkreftinsidens, men ingen signifikant reduksjon i tarmkreftrelatert mortalitet etter 10 års oppfølging (Bretthauer et al., 2022). Det pågår flere randomiserte studier som sammenlikner iFOBT og screeningkoloskopi direkte, og langtidsresultater fra disse vil kunne bidra til økt kunnskap.
I Helse Sør-Øst har det siden 2012 pågått et randomisert pilotprosjekt som sammenlikner test for blod i avføringen og sigmoidoskopi og som undersøker strategier for å optimalisere et screeningprogram på nasjonalt nivå. Pilotprosjektet inkluderer rundt 140 000 kvinner og menn i alderen 50–74 år, bosatt i deler av opptaksområdene for Østfold og Vestre Viken helseforetak (Randel et al., 2021). Langtidsresultater på tarmkreftforekomst og -dødelighet foreligger foreløpig ikke.
I 2022 startet det nasjonale screeningprogrammet for tarmkreft i Norge, se omtale i kapittel Diagnostikk og utredning.
Mer informasjon:
Pakkeforløp
Sist faglig oppdatert: 20.12.2023
Pakkeforløp for tykk- og endetarmskreft ble innført i helsetjenesten 1. mai 2015.
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er et standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Se kapittel Polypper i tykk- og endetarm og dysplasi ved ulcerøs kolitt for en diskusjon om prognostisk betydning av aktuelle symptomer som utløser pakkeforløp.
Les mer om pakkeforløpet med tilhørende forløpstider: Pakkeforløp for tykk- og endetarmskreft
Det er utarbeidet egne diagnoseveiledere for inngang til pakkeforløp.
Pakkeforløp hjem for pasienter med kreft skal bidra til å sikre god struktur og logistikk i helsetjenesten, samt sikre trygghet og forutsigbarhet for personer som lever med kreft eller etter endt kreftbehandling. Les mer om Pakkeforløp hjem for pasienter med kreft.
Fastlegens arbeid og ansvar ved tykk- og endetarmskreft
Fastlegens rolle i forebygging av tykk- og endetarmskreft
Sist faglig oppdatert: 20.05.2022
Fastlegene må kjenne til forekomst, arv og risikofaktorer for tykk- og endetarmskreftkreft og bruke kunnskapsbaserte metoder i arbeid med disse.
Det har vært en markant økning i insidensrate for tykktarmskreft for begge kjønn de siste 60 år. Økningen har vært sterkere enn i de andre nordiske landene. Insidensraten for endetarmskreft steg frem til 1990-tallet, men har vært relativt stabil siden.
Prognoser anslår at det i 2032–36 vil være mer enn 6000 nye tilfeller årlig av tykk- og endetarmskreft. Det er en økning på 46 % fra det observerte nivået i 2018. Hoveddelen av denne økningen skyldes aldringen i befolkningen.
Se kapittelet om epidemiologi og forekomst
Arvelighet
Tykk- og endetarmskreft opptrer oftest sporadisk, men om lag 3 % av tilfellene skyldes feil i spesifikke gener og om lag 20 % kan skyldes en arvelig disposisjon. Se kapittel Arvelig tykk- og endtarmskreft.
Familieanamnesen er avgjørende for identifikasjon av personer med økt risiko for kreft. Ved risiko for at det kan foreligge polyposesyndromer eller Lynch syndrom anbefales å tilby genetisk veiledning. Ved opphopning av tykk- og endetarmskreft i familier uten at det er påvist kjent genfeil er anbefalt overvåkning koloskopi hver 5. år fra 40 års alder.
Risikofaktorer
Økt forekomst av tykk- og endetarmkreft er assosiert med alkohol, fedme og høy andel av rødt kjøtt i kostholdet, mens fiberrik kost og fysisk aktivitet er assosiert med lavere forekomst.
Fastlegens rolle I diagnostikk og henvisning til pakkeforløp for tykk- og endetarmskreft
Sist faglig oppdatert: 20.05.2022
Fastlegen vil møte pasienter tidlig i sykdomsutviklingen, i en fase hvor symptomene ofte er vage og uspesifikke. Å sette symptomer, varighet og funn inn i rett sammenheng er sentralt i den diagnostiske prosessen. Det er laget egne diagnoseveiledere for klargjøring av inklusjonskriteriene i Pakkeforløp for kreft, se https://www.helsedirektoratet.no/pakkeforlop/pakkeforlop-for-kreft-diagnoseveiledere/diagnoseveiledere.
Tilstedeværelse av ett eller flere av følgende kriterier hos pasienter over 40 år gir inngang til pakkeforløp for tykk- og endetarmskreft:
- Uavklart blødning fra tarmen
- Funn av tumor eller polypp ved rektal undersøkelse/ano-/rektoskopi
- Endring av et ellers stabilt avføringsmønster i over fire uker
Kreft i tykk- og endetarm forekommer også hos personer under 40 år, selv om det er sjeldent. Diagnosen bør imidlertid overveies ved tilsvarende symptomer eller funn, og henvises til vurdering av spesialist med høy prioritet. I tillegg må man også være årvåken for endringer i allmenntilstand, smerter, hemoglobin-fall og tilfeller av tarmkreft hos 1.- og 2.-gradsslektninger.
Lenke til Diagnoseveilederen i Pakkeforløp for tykk- og endetarmskreft:
https://helsedirektoratet.no/retningslinjer/pakkeforlop-for-kreft-diagnoseveiledere/seksjon?Tittel=diagnoseveiledere-1164#tykk--og-endetarmskreft
Lenke til Pakkeforløp for tykk og endetarmskreft:
https://www.helsedirektoratet.no/pakkeforlop/tykk-og-endetarmskreft
Fastlegens rolle for pasienter med tykk- og endetarmskreft i aktiv behandling
Sist faglig oppdatert: 20.05.2022
Fastlegens rolle i denne fasen vil variere, alt etter pasientens kliniske situasjon, livssituasjon og avstand til sykehus. Fastlegen bør være tilgjengelig for å bistå i oppfølging av behandlingen der det er hensiktsmessig for pasienten.
Innholdet kan være:
- Smerter og komplikasjoner etter kirurgi
- Hematologisk overvåkning mellom eventuelle cytostatikakurer
- Håndtere bivirkninger av cytostatisk behandling
- Justere smerte- og kvalmebehandling
- Gi råd om ernæring
- Håndtere lokale stråleskader i hud og bekken ved endetarmskreft som primært strålebehandles
- Avdekke eventuell tromboembolisk sykdom
- Overvåke eventuelle elektrolyttforstyrrelser ved avlastende eller permanent stomiAvdekke andre alvorlige, akutte komplikasjoner som tarmobstruksjon og anastomosesvikt
- Følge opp sykemelding og utskrivning av resepter
Fastlegen kan bidra i behandling av angst, depresjon og andre psykiske plager, samt søvnvansker. Fastlegen kan også bidra til ivaretagelse av berørte familiemedlemmer, herunder eventuelle barn, og samarbeide med hjemmetjeneste der dette er aktuelt. Eventuell sykmelding eller foreskriving av medikamenter bør skje i regi av den pårørendes fastlege.
Fastlegens rolle for pasienter som er kontrollopplegg etter kurativ behandling for tykk- og endetarmskreft
Sist faglig oppdatert: 20.05.2022
Handlingsprogrammet anbefaler at pasienter med tykk- og endetarmskreft i stadium I, eller der komorbiditet eller høy alder tilsier at onkologisk eller kirurgisk behandling av residiv eller metastaser ikke er tilrådelig, vanligvis ikke skal ha systematisk kontrollopplegg. Det har vært lang tradisjon for at pasienter med sykdom i stadium II og III (Dukes B og C) skal følges i 5 år på sykehus eller hos fastlegen etter første kontroll i spesialisthelsetjenesten etter ½ år.
Det anbefalte kontrollopplegget er etter siste revisjon av handlingsprogrammet endret til færre kontroller og mindre billeddiagnostikk. Organisering av tilbudet for den enkelte pasient skal utformes i sykehuset, og kan etter nærmere avtale overføres til fastlegen. Overføring og oppfølging hos fastlege må trygges gjennom tydelig informasjon og veiledning til pasient og fastlege. Denne må ivareta det at fastlegene ikke har innkallingsrutiner og pasientens ansvar derfor blir større.
Det anbefalte 5 års kontrollopplegget finnes i kapittel Systematisk oppfølging etter kurativ behandling for kreft i tykk- og endetarm:
Symptomer og tegn som kan indikere tilbakefall og spredning av tykk- og endetarmskreft:
- Endrede avføringsvaner
- Rektalblødning
- Sykdomsfølelse
- Mage-/bekkensmerter
Ved uavklart rektalblødning eller endring i avføringsvane, eller mistanke om tilbakefall på grunn av patologiske funn ved laboratorieprøver eller billeddiagnostikk, må pasienten henvises tilbake for rask utredning og behandling selv om mistanke om residiv ikke gir rett til nytt pakkeforløp.
Utover de systematiske kontrollene som er beskrevet i Handlingsprogrammet (i lenken over), vil fastlegen fortsatt følge opp disse pasientene som ledd i vanlig klinisk praksis, og enkelte problemstillinger vil være knyttet til kreftsykdommen også utover 5 års oppfølging, for eksempel:
- Følge opp senskader etter kirurgi, strålebehandling og cytostatisk behandling, blant annet fordøyelsesplager, LARS (Low anterior resection syndrome; ca 50 % av pasienter som får anastomose etter rectumreseksjon og særlig etter preoperativ kjemo-radioterapi, nevropati, kronisk utmattelse, blæreforstyrrelse og redusert seksualfunksjon.
- Fange opp symptom på tilbakefall og/eller spredning og henvise tilbake til ny utredning og behandling
Fastlegens rolle for pasienter som er i rehabilitering
Sist faglig oppdatert: 20.05.2022
- I alle deler av utredning, behandling og videre liv må fastlegen bistå i rehabiliteringen med forståelse og kunnskap om det som er viktig for pasienten.
- Spesielt er trening og riktig kosthold vesentlig da det bedrer prognosen spesielt for denne pasientgruppen
- Bistå med eventuell sykemelding/friskmeldingsprosess.
- Evt henvise til spesialisert rehabilitering
Fastlegens rolle ved tilbakefall og spredning av tykk- og endetarmskreft
Sist faglig oppdatert: 20.05.2022
Fastlegen må være oppmerksom på symptomer og tegn som kan indikere tilbakefall og spredning av tykk- og endetarmskreft:
- Endrede avføringsvaner
- Rektalblødning
- Sykdomsfølelse
- Mage-/bekkensmerter
- Kronisk hoste
- Funn ved billedundersøker
Fastlegens håndtering tilpasses pasientens situasjon i kreftforløpet: For pasienter som er under oppfølging på sykehus, kontaktes avdelingen der oppfølgingen foregår. Dersom pasienten har avsluttet oppfølging på sykehus, henvises til rask ny utredning og behandling på sykehus.
Fastlegens rolle for overlevere etter tykk- og endetarmskreft
Sist faglig oppdatert: 20.05.2022
Fem års relativ overlevelse (andelen som overlever minst 5 år, justert for overlevelsen i normalbefolkningen) har økt jevnt siden begynnelsen av 1970-tallet, fra under 30 % på 1960-tallet, til over 65 % i den siste 5-års perioden (2014–18).
De vanligste senfølger etter behandling for tykk- og endetarmskreft er komplikasjoner etter stråleterapi, kjemoterapi og kirurgi. Fastlegen må ha en aktiv rolle i å identifisere senfølger, vurdere henvisning og delta i oppfølging av dem.
For oppfølging av overlevere etter tykk- og endetarmskreft, se kapittel Systematisk oppfølging etter kurativ behandling for kreft i tykk- og endetarm
- Helsedirektoratets faglige råd knyttet til seneffekter etter kreft
- Nasjonalt kompetansesenter for seneffekter etter kreftbehandling
Fastlegens rolle i arbeid med palliasjon og omsorg ved livets slutt pasienter med tykk- og endetarmskreft
Sist faglig oppdatert: 20.05.2022
25–30 % av pasientene med tykk- og endetarmskreft har inkurabel sykdom på diagnosetidspunktet eller er ikke kandidater for kurativ behandling av andre grunner. 20 % av alle pasienter som er kurativt behandlet, får senere residiv og/eller metastaser. Flertallet av disse er ikke kurable. I denne fasen mottar mange pasienter behandling på sykehus, dels for symptomlindring, dels for livsforlengende behandling og dels på grunn av livstruende komplikasjoner. Parallelt følges pasientene av fastlege og øvrig kommunehelsetjeneste og eventuelt palliativt senter. For fastlegen er det i denne fasen viktig å kjenne til symptomer knyttet til alvorlige komplikasjoner ved tykk- og endetarmskreft, slik som ileus, hjernemetastaser og medullakompresjon. Palliasjon og omsorg ved livets slutt for kreftpasienter må for øvrig tilpasses den enkeltes kliniske situasjon og hva som er størst utfordring. Se også kapittel Palliativ behandling og «Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen» (Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen, 2019).
Fastlegens rolle i forebygging av tykk- og endetarmskreft
Sist faglig oppdatert: 20.05.2022
Fastlegene må kjenne til forekomst, arv og risikofaktorer for tykk- og endetarmskreftkreft og bruke kunnskapsbaserte metoder i arbeid med disse.
Det har vært en markant økning i insidensrate for tykktarmskreft for begge kjønn de siste 60 år. Økningen har vært sterkere enn i de andre nordiske landene. Insidensraten for endetarmskreft steg frem til 1990-tallet, men har vært relativt stabil siden.
Prognoser anslår at det i 2032–36 vil være mer enn 6000 nye tilfeller årlig av tykk- og endetarmskreft. Det er en økning på 46 % fra det observerte nivået i 2018. Hoveddelen av denne økningen skyldes aldringen i befolkningen.
Se kapittelet om epidemiologi og forekomst
Arvelighet
Tykk- og endetarmskreft opptrer oftest sporadisk, men om lag 3 % av tilfellene skyldes feil i spesifikke gener og om lag 20 % kan skyldes en arvelig disposisjon. Se kapittel Arvelig tykk- og endtarmskreft.
Familieanamnesen er avgjørende for identifikasjon av personer med økt risiko for kreft. Ved risiko for at det kan foreligge polyposesyndromer eller Lynch syndrom anbefales å tilby genetisk veiledning. Ved opphopning av tykk- og endetarmskreft i familier uten at det er påvist kjent genfeil er anbefalt overvåkning koloskopi hver 5. år fra 40 års alder.
Risikofaktorer
Økt forekomst av tykk- og endetarmkreft er assosiert med alkohol, fedme og høy andel av rødt kjøtt i kostholdet, mens fiberrik kost og fysisk aktivitet er assosiert med lavere forekomst.
Fastlegens rolle I diagnostikk og henvisning til pakkeforløp for tykk- og endetarmskreft
Sist faglig oppdatert: 20.05.2022
Fastlegen vil møte pasienter tidlig i sykdomsutviklingen, i en fase hvor symptomene ofte er vage og uspesifikke. Å sette symptomer, varighet og funn inn i rett sammenheng er sentralt i den diagnostiske prosessen. Det er laget egne diagnoseveiledere for klargjøring av inklusjonskriteriene i Pakkeforløp for kreft, se https://www.helsedirektoratet.no/pakkeforlop/pakkeforlop-for-kreft-diagnoseveiledere/diagnoseveiledere.
Tilstedeværelse av ett eller flere av følgende kriterier hos pasienter over 40 år gir inngang til pakkeforløp for tykk- og endetarmskreft:
- Uavklart blødning fra tarmen
- Funn av tumor eller polypp ved rektal undersøkelse/ano-/rektoskopi
- Endring av et ellers stabilt avføringsmønster i over fire uker
Kreft i tykk- og endetarm forekommer også hos personer under 40 år, selv om det er sjeldent. Diagnosen bør imidlertid overveies ved tilsvarende symptomer eller funn, og henvises til vurdering av spesialist med høy prioritet. I tillegg må man også være årvåken for endringer i allmenntilstand, smerter, hemoglobin-fall og tilfeller av tarmkreft hos 1.- og 2.-gradsslektninger.
Lenke til Diagnoseveilederen i Pakkeforløp for tykk- og endetarmskreft:
https://helsedirektoratet.no/retningslinjer/pakkeforlop-for-kreft-diagnoseveiledere/seksjon?Tittel=diagnoseveiledere-1164#tykk--og-endetarmskreft
Lenke til Pakkeforløp for tykk og endetarmskreft:
https://www.helsedirektoratet.no/pakkeforlop/tykk-og-endetarmskreft
Fastlegens rolle for pasienter med tykk- og endetarmskreft i aktiv behandling
Sist faglig oppdatert: 20.05.2022
Fastlegens rolle i denne fasen vil variere, alt etter pasientens kliniske situasjon, livssituasjon og avstand til sykehus. Fastlegen bør være tilgjengelig for å bistå i oppfølging av behandlingen der det er hensiktsmessig for pasienten.
Innholdet kan være:
- Smerter og komplikasjoner etter kirurgi
- Hematologisk overvåkning mellom eventuelle cytostatikakurer
- Håndtere bivirkninger av cytostatisk behandling
- Justere smerte- og kvalmebehandling
- Gi råd om ernæring
- Håndtere lokale stråleskader i hud og bekken ved endetarmskreft som primært strålebehandles
- Avdekke eventuell tromboembolisk sykdom
- Overvåke eventuelle elektrolyttforstyrrelser ved avlastende eller permanent stomiAvdekke andre alvorlige, akutte komplikasjoner som tarmobstruksjon og anastomosesvikt
- Følge opp sykemelding og utskrivning av resepter
Fastlegen kan bidra i behandling av angst, depresjon og andre psykiske plager, samt søvnvansker. Fastlegen kan også bidra til ivaretagelse av berørte familiemedlemmer, herunder eventuelle barn, og samarbeide med hjemmetjeneste der dette er aktuelt. Eventuell sykmelding eller foreskriving av medikamenter bør skje i regi av den pårørendes fastlege.
Fastlegens rolle for pasienter som er kontrollopplegg etter kurativ behandling for tykk- og endetarmskreft
Sist faglig oppdatert: 20.05.2022
Handlingsprogrammet anbefaler at pasienter med tykk- og endetarmskreft i stadium I, eller der komorbiditet eller høy alder tilsier at onkologisk eller kirurgisk behandling av residiv eller metastaser ikke er tilrådelig, vanligvis ikke skal ha systematisk kontrollopplegg. Det har vært lang tradisjon for at pasienter med sykdom i stadium II og III (Dukes B og C) skal følges i 5 år på sykehus eller hos fastlegen etter første kontroll i spesialisthelsetjenesten etter ½ år.
Det anbefalte kontrollopplegget er etter siste revisjon av handlingsprogrammet endret til færre kontroller og mindre billeddiagnostikk. Organisering av tilbudet for den enkelte pasient skal utformes i sykehuset, og kan etter nærmere avtale overføres til fastlegen. Overføring og oppfølging hos fastlege må trygges gjennom tydelig informasjon og veiledning til pasient og fastlege. Denne må ivareta det at fastlegene ikke har innkallingsrutiner og pasientens ansvar derfor blir større.
Det anbefalte 5 års kontrollopplegget finnes i kapittel Systematisk oppfølging etter kurativ behandling for kreft i tykk- og endetarm:
Symptomer og tegn som kan indikere tilbakefall og spredning av tykk- og endetarmskreft:
- Endrede avføringsvaner
- Rektalblødning
- Sykdomsfølelse
- Mage-/bekkensmerter
Ved uavklart rektalblødning eller endring i avføringsvane, eller mistanke om tilbakefall på grunn av patologiske funn ved laboratorieprøver eller billeddiagnostikk, må pasienten henvises tilbake for rask utredning og behandling selv om mistanke om residiv ikke gir rett til nytt pakkeforløp.
Utover de systematiske kontrollene som er beskrevet i Handlingsprogrammet (i lenken over), vil fastlegen fortsatt følge opp disse pasientene som ledd i vanlig klinisk praksis, og enkelte problemstillinger vil være knyttet til kreftsykdommen også utover 5 års oppfølging, for eksempel:
- Følge opp senskader etter kirurgi, strålebehandling og cytostatisk behandling, blant annet fordøyelsesplager, LARS (Low anterior resection syndrome; ca 50 % av pasienter som får anastomose etter rectumreseksjon og særlig etter preoperativ kjemo-radioterapi, nevropati, kronisk utmattelse, blæreforstyrrelse og redusert seksualfunksjon.
- Fange opp symptom på tilbakefall og/eller spredning og henvise tilbake til ny utredning og behandling
Fastlegens rolle for pasienter som er i rehabilitering
Sist faglig oppdatert: 20.05.2022
- I alle deler av utredning, behandling og videre liv må fastlegen bistå i rehabiliteringen med forståelse og kunnskap om det som er viktig for pasienten.
- Spesielt er trening og riktig kosthold vesentlig da det bedrer prognosen spesielt for denne pasientgruppen
- Bistå med eventuell sykemelding/friskmeldingsprosess.
- Evt henvise til spesialisert rehabilitering
Fastlegens rolle ved tilbakefall og spredning av tykk- og endetarmskreft
Sist faglig oppdatert: 20.05.2022
Fastlegen må være oppmerksom på symptomer og tegn som kan indikere tilbakefall og spredning av tykk- og endetarmskreft:
- Endrede avføringsvaner
- Rektalblødning
- Sykdomsfølelse
- Mage-/bekkensmerter
- Kronisk hoste
- Funn ved billedundersøker
Fastlegens håndtering tilpasses pasientens situasjon i kreftforløpet: For pasienter som er under oppfølging på sykehus, kontaktes avdelingen der oppfølgingen foregår. Dersom pasienten har avsluttet oppfølging på sykehus, henvises til rask ny utredning og behandling på sykehus.
Fastlegens rolle for overlevere etter tykk- og endetarmskreft
Sist faglig oppdatert: 20.05.2022
Fem års relativ overlevelse (andelen som overlever minst 5 år, justert for overlevelsen i normalbefolkningen) har økt jevnt siden begynnelsen av 1970-tallet, fra under 30 % på 1960-tallet, til over 65 % i den siste 5-års perioden (2014–18).
De vanligste senfølger etter behandling for tykk- og endetarmskreft er komplikasjoner etter stråleterapi, kjemoterapi og kirurgi. Fastlegen må ha en aktiv rolle i å identifisere senfølger, vurdere henvisning og delta i oppfølging av dem.
For oppfølging av overlevere etter tykk- og endetarmskreft, se kapittel Systematisk oppfølging etter kurativ behandling for kreft i tykk- og endetarm
- Helsedirektoratets faglige råd knyttet til seneffekter etter kreft
- Nasjonalt kompetansesenter for seneffekter etter kreftbehandling
Fastlegens rolle i arbeid med palliasjon og omsorg ved livets slutt pasienter med tykk- og endetarmskreft
Sist faglig oppdatert: 20.05.2022
25–30 % av pasientene med tykk- og endetarmskreft har inkurabel sykdom på diagnosetidspunktet eller er ikke kandidater for kurativ behandling av andre grunner. 20 % av alle pasienter som er kurativt behandlet, får senere residiv og/eller metastaser. Flertallet av disse er ikke kurable. I denne fasen mottar mange pasienter behandling på sykehus, dels for symptomlindring, dels for livsforlengende behandling og dels på grunn av livstruende komplikasjoner. Parallelt følges pasientene av fastlege og øvrig kommunehelsetjeneste og eventuelt palliativt senter. For fastlegen er det i denne fasen viktig å kjenne til symptomer knyttet til alvorlige komplikasjoner ved tykk- og endetarmskreft, slik som ileus, hjernemetastaser og medullakompresjon. Palliasjon og omsorg ved livets slutt for kreftpasienter må for øvrig tilpasses den enkeltes kliniske situasjon og hva som er størst utfordring. Se også kapittel Palliativ behandling og «Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen» (Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen, 2019).
Arvelig tykk- og endtarmskreft
Sist faglig oppdatert: 20.05.2022
Det anslås at omlag 3 % av tilfellene med tykk- og endetarmskreft skyldes medfødt genfeil i et kreftgen med høy penetrans og dominant arvegang (Baglietto et al., 2006). Lynch syndrom (LS) skyldes feil i et av mismatch reparasjonsgenene (MLH1, MSH2, MSH6, PMS2) eller EPCAM genet (Vasen et al., 2013). Familiær adenomatøs polypose (FAP) som skyldes feil i APC genet, og andre mer sjeldne arvelige kreftsyndromer inngår også i denne gruppen (Beggs et al., 2010; Bulow, 2003; Cairns et al., 2010; Vasen, Tomlinson, & Castells, 2015). Personer med genfeil i et av disse genene vil ha en betydelig økt livstidsrisiko for å utvikle tykk- og endetarmskreft, ofte i yngre alder.
Omlag 20 % av alle med tykk- og endetarmskreft kan ha familiær tarmkreft (Baglietto et al., 2006). Det vil si at det er en opphopning av tykk- og endetarmskreft i familien, men genfeil er ukjent. Personer i disse familiene vil oftest ha en moderat økt risiko for å utvikle tykk- og endetarmskreft sammenliknet med bakgrunnsbefolkningen.
Identifikasjon og oppfølging av risikopersoner og familier kan forebygge tykk- og endetarmskreft, og derfor er familieanamnese viktig (Tranø, Wasmuth, Sjursen, & Vatten, 2011).
Hos pasienter som har utviklet kreft skal det tas opp familieanamnese med hensyn til kreft og informasjon om tidligere polypper.
Det bør rekvireres mikrosatellitt instabilitet (MSI) og/eller immunhistokjemiske (IHC) undersøkelser i svulstvev fra pasienten da det kan ha konsekvens for valg av behandling og kan gi en indikasjon på genetisk disposisjon (LS). Ved påvist MSI og/eller manglende uttrykk av MMR proteiner ved IHC skal BRAF V600E mutasjon og/eller MLH1 promoter hypermetylering være utelukket for å indikere LS. Dersom det er indikasjon på LS bør pasienten få tilbud om genetisk veiledning og eventuelt gentesting (Vasen et al., 2013) (evidensgrad D).
Se kapittel Tester for Lynch syndrome og Molekylærpatologisk undersøkelse om molekylærpatologiske undersøkelser.
Det skilles mellom pasienter som har klinisk sykdom og friske familiemedlemmer når det gjelder behandling og overvåking. I tilfeller hvor affisert slektning ikke er tilgjenglig for testing, kan friske familiemedlemmer henvises til genetisk veiledning og utredning.
Ved mistanke om at det kan foreligge arvelig kreft kan pasienten og/eller friske familiemedlemmer henvises til genetisk veiledning og utredning, før eventuelt tiltak i form av koloskopi settes i verk. Se henvisningskriterier kapittel Henvisningskriterier til genetisk veiledning og utredning.
Henvisningskriterier til genetisk veiledning og utredning
Sist faglig oppdatert: 20.05.2022
- Pasienter <60 år, som ved undersøkelse av tumorvev får påvist:
Mikrosatellittinstabilitet og/eller manglende uttrykk av mismatch reparasjonsproteiner ved immunhistokjemisk undersøkelse, som ikke forklares av BRAF V600E mutasjon og/eller MLH1 promoter hypermetylering - Debut av tykk- og endetarmskreft <50 år
- To nære slektninger med tykk- og endetarmskreft <60 år
- Tre nære slektninger med tykk- og endetarmskreft <70 år
- Tre nære slektninger med Lynch syndrom relaterte svulster som kreft i tykk- og endetarm, endometrium, duodenum, nyrebekken/ureter, ventrikkel med flere, minst en <50 år.
- En person med flere Lynch syndrom relaterte primære svulster
- Alle med ≥ 10 adenomatøse polypper diagnostisert ved én koloskopi
- Alle med hamartomatøse polypper
- Friske personer som ønsker prediktiv gentest for kjent genfeil i familien
Henvisningskriteriene over er basert på dokumentasjon i litteraturen (Cairns et al., 2010; Møller, Stormorken, & Apold, 2006; Umar et al., 2004; Vasen et al., 2015; Vasen, Watson, Mecklin, & Lynch, 1999).
(Nære slektninger er førstegradsslektninger eller slektninger i rett opp-eller nedadstigende linje.)
Kliniske syndromer og kontroll
Sist faglig oppdatert: 20.05.2022
Internasjonale retningslinjer for identifikasjon og oppfølging av Lynch syndrom (LS) (Vasen et al., 2013) og familiær adenomatøs polypose (FAP) og attenuert FAP (AFAP) (Vasen et al., 2008) er utarbeidet. For mer sjeldne syndromer med økt risiko for polypper/kreft, f.eks. Hamartomsyndromene, Peutz-Jeghers syndrom (STK11 genet), Juvenil polypose syndrom (SMAD/BMPR1A genene) og Cowden syndrom (PTEN genet), vises til oversiktsartikler (Cairns et al., 2010; Vasen et al., 2015). Polymerase proofreading associated polyposis, PPAP (POLD1/POLE genene), er opphopning av polypper og kreft i tykk- og endetarm. (M. F. Hansen et al., 2015). Genetiske tester av disse genene er tilgjengelige.
For Sagtakket polyposesyndrom (SPS) er mulige underliggende genfeil ikke kjent. Det vises til kapittel Polypper, vedrørende henholdsvis klassifisering og oppfølging.
Lynch syndrom (LS)
1–3 % av alle pasienter med tykk- og endetarmskreft kan ha LS (Vasen et al., 2013). Pasienter/familier med LS har en betydelig økt livstidsrisiko for tykk- og endetarmskreft og andre kreftsvulster (Bonadona et al., 2011; Møller et al., 2017; ten Broeke et al., 2015). Tarmkreft kan oppstå i yngre alder, og en pasient kan ha flere samtidige (synkrone) svulster eller ha LS-assosierte kreftsvulster i egen sykehistorie og økt risiko for senere kreftsvulster (metakrone svulster).
Livstidsrisiko for tarmkreft hos individer med LS er 10–47 % og avhenger av kjønn og hvilket av MMR genene som er mutert (Bonadona et al., 2011; Møller et al., 2017; ten Broeke et al., 2015). Karsinogenesen er aksellerert (De Jong et al., 2004), intervallene mellom overvåkning må derfor være korte. I praksis ikke sjeldnere enn hvert annet år etter indivduell vurdering, avhengig av funn ved koloskopiovervåkning (De Jong et al., 2004; Vasen et al., 2013) (evidensgrad C). Anbefalt overvåkning er koloskopi hvert annet år fra 25 års alder. Ved forekomst av tubulære adenomer anbefales ny koloskopi hvert 2. år ved normale funn etter fullstendig polypektomi. (Vasen et al., 2013) (evidensgrad D).
Regelmessig koloskopi av Lynch syndrom-familier har vist å redusere insidens av tykk- og endetarmskreft (Jarvinen et al., 2000).
For kvinner i familier med Lynch syndrom er livstidsrisiko for endometriecancer ca 12–54 % ved påvist MMR genfeil og avhenger av hvilket gen som er mutert (Bonadona et al., 2011; Møller et al., 2017; ten Broeke et al., 2015). Det er også økt risiko for andre LS-assosierte kreftsvulster.
Polyposesyndromer
Familiær adenomatøs polypose (FAP)
Under 1 % av alle som diagnostiseres med tykk- og endetarmskreft kan ha FAP (Bulow, 2003). FAP er karakterisert med hundrevis av polypper i rektum og kolon. Polypper oppstår i barne- og ungdomsalder (Vasen et al., 2008). Det er tilnærmet 100 % risiko for utvikling av kreft i tykk- og endetarm innen 40 års alder dersom pasienten ikke får fjernet tykk- og endetarm. Annen kreftsykdom kan forekomme. Karakteristiske øyebunnsforandringer, fundus polypper, adenomer i duodenum, osteomer, epidermoider og desmoider forekommer. Desmoider i buk og bukvegg kan vokse invasivt og medføre økt sykelighet og død (Bulow, 2003; Vasen et al., 2008).
FAP skyldes autosomal dominant nedarvede mutasjoner i APC-genet, og gentest er tilgjengelig. Ca 15–20 % av FAP skyldes nye mutasjoner (Aretz et al., 2004). Disse pasientene har følgelig ingen FAP-relatert opphopning av tykk- og endetarmskreft i familien. Der FAP er påvist, må pasienten og familien få grundig informasjon. Pasienten må få tilbud om kontrollopplegg. Anbefalt overvåkning er rekto-sigmoidoskopi av risikopersoner, og det bør startes ved 10–12 års alder. Dersom man finner polypper i endetarmen, skal pasienten koloskoperes og deretter overvåkes årlig med koloskopi (og biopsier av polypper). De fleste FAP-pasienter opereres med profylaktisk kolektomi eller proktokolektomi mellom 15 og 25 års alder. Overvåkning er vist å gi reduksjon av tykk- og endetarmskreft.
Øvre endoskopi bør starte ved 25–30 års alder (Vasen et al., 2008) (evidensgrad D). Duodenale polypper fjernes endoskopisk for å redusere risikoen for duodenale carsinomer Oppfølging baseres på antall, størrelse og grad av dysplasi av polypper i duodenum, og klassifiseres etter Spigelman score (Spigelman, Williams, Talbot, Domizio, & Phillips, 1989).
Attenuert familiær adenomatøs polypose (AFAP)
AFAP skyldes dominant nedarvede mutasjoner i APC-genet, med polypper (10–99 adenomer, debut >30 år) og senere debut av tykk- og endetarmskreft enn ved FAP (Nielsen et al., 2007). Oppfølgingen er tilsvarende overvåkning av FAP, men med start ved 18–20 års alder. Koloskopi anbefales pga tendens til adenomer i proksimale tykktarm. Øvre endoskopi anbefales som ved FAP (Nielsen et al., 2007) (evidensgrad D).
MutYH-assosiert polypose (MAP)
MAP utgjør < 1 % av alle som er diagnostisert med tarmkreft og er karakterisert ved færre polypper (>10 <100) enn ved FAP og høyere debutalder (Al-Tassan et al., 2002). Årsaken er mutasjoner i MUTYH-genet (Nielsen et al., 2007), og arvegangen er autosomal recessiv, det vil si at man må arve genfeilen fra begge foreldre. Gentester er tilgjengelig. Oppfølgingen er som ved AFAP (evidensgrad B). Mutasjonsbærere, det vil si individer som bare har arvet genfeilen fra en av foreldrene, har ikke påvist betydelig økt risiko for tarmkreft, og overvåkning er ikke nødvendig (Balaguer et al., 2007).
Øvrige polyposesyndromer utgjør til sammen < 1 % av alle med diagnosen tykk- og endetarmskreft (Beggs et al., 2010; Bulow, 2003; Cairns et al., 2010; Vasen et al., 2015).
Familiær tykk- og endetarmskreft (FCRC)
Begrepet brukes om opphopning av tykk- og endetarmskreft i familier. Genfeil er i stor grad ukjent, og kliniske kriterier for de kjente arvelige syndromene trenger ikke være oppfylt (Beggs et al., 2010; Bulow, 2003; Nielsen et al., 2007; Umar et al., 2004; Vasen et al., 1999). Cirka 20 % av alle med tykk- og endetarmskreft kan ha familiær tarmkreft (Baglietto et al., 2006).
Anbefalingene om oppfølging av familier med forekomst av tarmkreft spriker mellom ulike internasjonale guidelines og reflekterer det begrensete kunnskapsgrunnlaget (Cairns et al., 2010; Lowery et al., 2016; Segnan, Patnick, & von Karsa, 2010). Generelt er risikoen for kreft høyere jo yngre pasienten er og øker med antall affiserte familiemedlemmer.
Dokumentasjonen for å anbefale koloskopi hos pasienter med en førstegradsslektning med tarmkreft er dårlig. Evidensmessig er det ikke vist noen effekt av koloskopioppfølging av disse (Cairns et al., 2010; Lowery et al., 2016; Segnan et al., 2010). EUs guidelines fra 2010 anbefaler at slektninger med en førstegradsslektning med tarmkreft kan delta i det ordinære screeningprogrammet, og dette anbefales også i Norge (evidensgrad D) (Cairns et al., 2010; Lowery et al., 2016; Segnan et al., 2010).
Oppfølging med koloskopi anbefales til personer hvor det er to første- eller en første- og en annengradsslektning med tarmkreft før fylte 60 år. Koloskopi anbefales også til personer med 3 eller flere første- eller andregradsslektninger med tarmkreft før 70 år (Cairns et al., 2010). Hver side av familien vurderes for seg. Ved normale funn ved første koloskopi anbefales ny koloskopi om 5 år. Ved gjentatte normale koloskopier kan man vurdere sjeldnere kontroller (evidensgrad D) (Hampel et al., 2005; Møller et al., 2006).
Anbefalt overvåkning av pasienter og førstegradsslektninger er koloskopi hvert 5. år fra 40 år ved normale funn (Cairns et al., 2010; Hampel et al., 2005; Mesher et al., 2014; Møller et al., 2006) (evidensgrad C). Oppfølging tilbys personer hvor det er to første- eller en første- og en annengradsslektning med tarmkreft før fylte 60 år eller tre nære slektninger med tarmkreft før 70 år (Cairns et al., 2010). Risikopersoner er de som selv har hatt kreft og deres friske førstegradsslektninger. Hver side av familien vurderes for seg. Oppfølging av pasienter og friske slekninger bør organiseres på bakgrunn av genetikers råd i nært samråd mellom den aktuelle personen og fastlegen.
Anbefaling
- Mikrosatellitt instabilitet og/eller immunhistokjemiske undersøkelser bør utføres i svulstvev fra alle pasienter med tykk- og endetarmskreft <60 år (evidensgrad B)
- Pasienter med holdepunkt for Lynch syndrom bør få tilbud om genetisk veiledning (evidensgrad D).
- Pasienter med Lynch syndrom og påvist genfeil bør koloskoperes hvert annet år fra 25 års alder. Hvis tubulære adenomer påvises, bør det gjøres en ny koloskopi etter ett år, deretter eventuelt tilbake til hvert annet år (evidensgrad D).
- Fastlegen henviser pasienter med Lynch syndrom og påvist genfeil til relevant spesialist for Lynch syndrom-assosierte kreftformer for adekvat kontrollopplegg på bakgrunn av genetikers råd (evidensgrad C)
- Oppfølging av pasienter med Lynch syndrom og påvist genfeil hos relevant spesialist for Lynch-syndrom assosierte kreftformer baseres på genetikers anbefaling, og organiseres i samråd med pasient og fastlege (evidensgrad C)
- Pasienter med risiko for Familiær adenomatøs polypose bør sigmoidoskoperes fra 10–12 års alder. Dersom man finner polypper i endetarmen, skal pasienten koloskoperes. Øvre endoskopi bør starte ved 25–30 års alder (evidensgrad D).
- Pasienter med Attenuert familiær adenomatøs polypose eller MuTYH assosiert polypose følges opp på samme måte som ved Familiær adenomatøs polypose, men med start ved 18–20 års alder (evidensgrad C).
- Personer med 1 førstegradsslektning med påvist tykk- eller endetarmskreft anbefales deltagelse i det ordinære tarmscreeningprogrammet fra 55 års alder (evidensgrad D).
- Personer med minst 1 førstegradslektning og 1 første- eller andregradsslektning med diagnostisert tarmkreft før 60 års alder anbefales koloskopi hvert 5. år fra fylte 40 år (evidensgrad D).
- Personer med 3 eller flere første- og andregradsslektninger med tarmkreft før 70 års alder anbefales koloskopi hvert 5. år fra fylte 40 år (evidensgrad D).
Behandling
Sist faglig oppdatert: 20.05.2022
Lynch syndrom
Tykk- og endetarmskreft hos Lynch syndrom-pasienter behandles vanligvis som sporadisk kreft. Total eller subtotal kolektomi bør gjøres ved synkrone kreftsvulster og/eller multiple polypper (Vasen et al., 2013) (evidensgrad D). Dersom man velger segmental tarmreseksjon ved etablert tarmkreft, må man være oppmerksom på risiko for metakron CRC.
Lynch syndrom-pasienter som ikke har fått fjernet tykk- og endetarm, bør overvåkes med koloskopi etter avsluttet kontroll for CRC, ikke sjeldnere enn hvert annet år, etter individuell vurdering, til 70–75 år (Cairns et al., 2010; Vasen et al., 2013) (evidensgrad D).
Påvisning av MSI er av betydning for prognose og valg av behandling. LS-assosierte svulster er rapportert å ha annen effekt av ulike cytostatika enn sporadisk tarmkreft (Jacob, Aguado, Fallik, & Praz, 2001). Retningslinjer for behandling er foreløpig lik sporadisk tarmkreft, men med visse muligheter for avvik. Se kapittel Postoperativt om adjuvant kjemoterapi ved stadium II tykktarmskreft.
FAP
Dersom høygradig dysplasi påvises i polypper er profylaktisk kirurgi aktuelt. Avhengig av utbredelse, størrelse og mengde avgjøres omfanget av kirurgi. Vanligvis er proktokolektomi det som skal gjøres og da med rekonstruktive prosedyrer – dvs reservoar kirurgi (Aziz et al., 2006) (evidensgrad D). Kolektomi med ileorektal anastomose (IRA) kan være aktuelt i spesielle tilfeller der det er få og små adenomer i rektum som kan fjernes og overvåkes inntil kompletterende kirurgi blir nødvendig.
Kirurgisk behandling av FAP skal i utgangspunktet skje ved universitetssykehus.
Behandlende kirurg må kunne informere pasienten om indikasjoner for kirurgi. Pasientene skal informeres om de ulike kirurgiske alternativer inkludert muligheter for kikkhullstilganger, samt rekonstruktiv kirurgi (reservoarkirurgi) av kompetent kirurg ved et senter som driver med denne type kirurgi. Har man ikke erfaring eller slik kompetanse i primærsykehuset, skal pasienten henvises til informasjon og beslutningstaking ved det sykehuset som skal gjennomføre operasjon og oppfølging.
Primær profylakse ved Lynch syndrom og FAP
Daglig inntak av acetylsalicylsyre ved Lynch syndrom har vist signifikant reduksjon i forekomst av kreft (Burn et al., 2011) (Evidensgrad A). En pågående studie søker å avklare optimal dose (Burn et al., 2011). Man avventer resultatene av denne studien før det eventuelt gis anbefalinger til mutasjonsbærere om daglig inntak av acetylsalicylsyre.
Kjemoprevensjon med bruk av COX2-hemmere ved FAP har vist reduksjon av størrelse og antall polypper (Phillips et al., 2002) men er ikke anbefalt på grunn av kardiovaskulære birvirkninger (Solomon et al., 2008). Duodenalpolypose kan kanskje bremses med potente Cox-2 hemmere, men dette må veies mot bivirkningsprofilene på så vel medikamentene som det operative tiltak og er en spesialistoppgave.
Anbefaling
- Tykk- og endetarmskreft hos pasienter med Lynch syndrom behandles oftest som sporadisk kreft, men subtotal kolektomi eller total kolektomi bør vurderes, spesielt ved synkron kreft eller ved multiple polypper (evidensgrad D).
- Pasienter med Lynch syndrom som har gjenværende tykktarm/endetarm, bør overvåkes med koloskopi etter avsluttet 5 års kontroll ikke sjeldnere enn hvert annet år, etter indivduell vurdering til 70–75 år (evidensgrad D).
- Pasienter med FAP bør proktokolektomeres profylaktisk ved 15–25 års alder. Hvis grov atypi påvises tidligere er det absolutt operasjonsindikasjon (evidensgrad D). Ileoanalt reservoar må vurderes.
Om den genetiske utredning og veiledning
Sist faglig oppdatert: 20.05.2022
Genetisk veiledning inkluderer vurdering av egen risiko for kreft, tilbud om gentester og informasjon om konsekvensene av testing, samt henvisning til medisinsk oppfølging og risikoreduserende tiltak.
All genetisk utredning og gentesting er underlagt Bioteknologiloven (Lov om humanmedisinsk bruk av bioteknologi m.m. (bioteknologiloven). LOV-2003-12-05-100) og krever informert samtykke. Diagnostiske tester er testing av affisert individ, og prediktive tester er testing av frisk person. Prediktiv test forutsetter genetisk veiledning, og gentester ved mistanke om arvelig sykdom må i slike tilfeller rekvireres av genetiker.
Prediktiv testing av barn (<16 år) gjøres bare når det er av betydning for behandlingsvalg/profylakse allerede i barnealder.
Amsterdam II kriteriene og de reviderte Bethesda kriterier for identifikasjon av mulig Lynch syndrom
Sist faglig oppdatert: 20.05.2022
Reviderte Amsterdamkriterier (Amsterdam II): (Vasen et al., 1999)
- Minst tre slektninger med tykk- og endetarmskreft eller LS relatert kreft*.
- To generasjoner skal være affisert.
- Minst én diagnostisert <50 år. FAP skal være ekskludert. Tykk- og endetarmskreft skal være histologisk verifisert.
* Kreft i endometrium, duodenum, nyrebekken/ureter, ventrikkel, lever- og galleganger, bukspyttkjertel, og eggstokker mfl.
Reviderte Bethesda-kriterier: (Umar et al., 2004)
Kriterier for å selektere tykk- og endetarmskreft for MSI/IHC*-testing.
(Det er tilstrekkelig at ett av kriteriene er oppfylt)
- Tykk- og endetarmskreft hos pasient <50 år.
- Synkron eller metakron tykk- og endetarmskreft eller andre LS-relaterte svulster, uavhengig av alder.
- Tykk- og endetarmskreft med MSI-H fenotype tumor** hos pasienter <60 år.
- Tykk- og endetarmskreft diagnostisert hos pasient med én eller flere førstegradsslektninger (foreldre, søsken, barn) med en LS-relatert*** svulst, og hvor én av svulstene er diagnostisert <50 år.
- Tykk- og endetarmskreft diagnostisert hos pasient med ≥2 første- eller andre-(besteforeldre, tanter, onkler, barnebarn) gradsslektninger med LS-relaterte svulster, uavhengig av alder.
* MSI/IHC gjøres på patologisk anatomisk avdeling ved en del større sykehus.
** Histologiske karaktertrekk i tumor: lavt differensiert/udifferensiert karsinom, signetringceller, Crohnlignende lymfocyttaggregasjon, slimproduksjon i >50 % av tumorcellene, lymfocyttaggregasjon eller kribriformt vekstmønster
**** Kreft i endometrium, duodenum, nyrebekken/ureter, ventrikkel, lever- og galleganger, bukspyttkjertel, og eggstokker mfl.
Tabell 5.1
| Poengangivelse | |||
| 1P | 2P | 3P | |
| Antall polypper | 1–4 | 5–20 | >20 |
| Størrelse (mm) | 1–4 | 5–10 | >10 |
| Histologi | Tubulær | Tubulovilløs | Villøs |
| Dysplasi | Mild | Moderat | Grov |
|
| Spigelman score og endoskopiintervaller | ||
| Stage | |||
| 0 | 0 | 4 år | |
| I | 1–4 | 3 til 4 år | |
| III | 5–6 | 1 til 3 år | |
| III | 7–8 | 6 til 12 mnd | |
| IV | 9–12 | Hvis ikke duodenektomi, 6 mnd | |
Henvisningskriterier til genetisk veiledning og utredning
Sist faglig oppdatert: 20.05.2022
- Pasienter <60 år, som ved undersøkelse av tumorvev får påvist:
Mikrosatellittinstabilitet og/eller manglende uttrykk av mismatch reparasjonsproteiner ved immunhistokjemisk undersøkelse, som ikke forklares av BRAF V600E mutasjon og/eller MLH1 promoter hypermetylering - Debut av tykk- og endetarmskreft <50 år
- To nære slektninger med tykk- og endetarmskreft <60 år
- Tre nære slektninger med tykk- og endetarmskreft <70 år
- Tre nære slektninger med Lynch syndrom relaterte svulster som kreft i tykk- og endetarm, endometrium, duodenum, nyrebekken/ureter, ventrikkel med flere, minst en <50 år.
- En person med flere Lynch syndrom relaterte primære svulster
- Alle med ≥ 10 adenomatøse polypper diagnostisert ved én koloskopi
- Alle med hamartomatøse polypper
- Friske personer som ønsker prediktiv gentest for kjent genfeil i familien
Henvisningskriteriene over er basert på dokumentasjon i litteraturen (Cairns et al., 2010; Møller, Stormorken, & Apold, 2006; Umar et al., 2004; Vasen et al., 2015; Vasen, Watson, Mecklin, & Lynch, 1999).
(Nære slektninger er førstegradsslektninger eller slektninger i rett opp-eller nedadstigende linje.)
Kliniske syndromer og kontroll
Sist faglig oppdatert: 20.05.2022
Internasjonale retningslinjer for identifikasjon og oppfølging av Lynch syndrom (LS) (Vasen et al., 2013) og familiær adenomatøs polypose (FAP) og attenuert FAP (AFAP) (Vasen et al., 2008) er utarbeidet. For mer sjeldne syndromer med økt risiko for polypper/kreft, f.eks. Hamartomsyndromene, Peutz-Jeghers syndrom (STK11 genet), Juvenil polypose syndrom (SMAD/BMPR1A genene) og Cowden syndrom (PTEN genet), vises til oversiktsartikler (Cairns et al., 2010; Vasen et al., 2015). Polymerase proofreading associated polyposis, PPAP (POLD1/POLE genene), er opphopning av polypper og kreft i tykk- og endetarm. (M. F. Hansen et al., 2015). Genetiske tester av disse genene er tilgjengelige.
For Sagtakket polyposesyndrom (SPS) er mulige underliggende genfeil ikke kjent. Det vises til kapittel Polypper, vedrørende henholdsvis klassifisering og oppfølging.
Lynch syndrom (LS)
1–3 % av alle pasienter med tykk- og endetarmskreft kan ha LS (Vasen et al., 2013). Pasienter/familier med LS har en betydelig økt livstidsrisiko for tykk- og endetarmskreft og andre kreftsvulster (Bonadona et al., 2011; Møller et al., 2017; ten Broeke et al., 2015). Tarmkreft kan oppstå i yngre alder, og en pasient kan ha flere samtidige (synkrone) svulster eller ha LS-assosierte kreftsvulster i egen sykehistorie og økt risiko for senere kreftsvulster (metakrone svulster).
Livstidsrisiko for tarmkreft hos individer med LS er 10–47 % og avhenger av kjønn og hvilket av MMR genene som er mutert (Bonadona et al., 2011; Møller et al., 2017; ten Broeke et al., 2015). Karsinogenesen er aksellerert (De Jong et al., 2004), intervallene mellom overvåkning må derfor være korte. I praksis ikke sjeldnere enn hvert annet år etter indivduell vurdering, avhengig av funn ved koloskopiovervåkning (De Jong et al., 2004; Vasen et al., 2013) (evidensgrad C). Anbefalt overvåkning er koloskopi hvert annet år fra 25 års alder. Ved forekomst av tubulære adenomer anbefales ny koloskopi hvert 2. år ved normale funn etter fullstendig polypektomi. (Vasen et al., 2013) (evidensgrad D).
Regelmessig koloskopi av Lynch syndrom-familier har vist å redusere insidens av tykk- og endetarmskreft (Jarvinen et al., 2000).
For kvinner i familier med Lynch syndrom er livstidsrisiko for endometriecancer ca 12–54 % ved påvist MMR genfeil og avhenger av hvilket gen som er mutert (Bonadona et al., 2011; Møller et al., 2017; ten Broeke et al., 2015). Det er også økt risiko for andre LS-assosierte kreftsvulster.
Polyposesyndromer
Familiær adenomatøs polypose (FAP)
Under 1 % av alle som diagnostiseres med tykk- og endetarmskreft kan ha FAP (Bulow, 2003). FAP er karakterisert med hundrevis av polypper i rektum og kolon. Polypper oppstår i barne- og ungdomsalder (Vasen et al., 2008). Det er tilnærmet 100 % risiko for utvikling av kreft i tykk- og endetarm innen 40 års alder dersom pasienten ikke får fjernet tykk- og endetarm. Annen kreftsykdom kan forekomme. Karakteristiske øyebunnsforandringer, fundus polypper, adenomer i duodenum, osteomer, epidermoider og desmoider forekommer. Desmoider i buk og bukvegg kan vokse invasivt og medføre økt sykelighet og død (Bulow, 2003; Vasen et al., 2008).
FAP skyldes autosomal dominant nedarvede mutasjoner i APC-genet, og gentest er tilgjengelig. Ca 15–20 % av FAP skyldes nye mutasjoner (Aretz et al., 2004). Disse pasientene har følgelig ingen FAP-relatert opphopning av tykk- og endetarmskreft i familien. Der FAP er påvist, må pasienten og familien få grundig informasjon. Pasienten må få tilbud om kontrollopplegg. Anbefalt overvåkning er rekto-sigmoidoskopi av risikopersoner, og det bør startes ved 10–12 års alder. Dersom man finner polypper i endetarmen, skal pasienten koloskoperes og deretter overvåkes årlig med koloskopi (og biopsier av polypper). De fleste FAP-pasienter opereres med profylaktisk kolektomi eller proktokolektomi mellom 15 og 25 års alder. Overvåkning er vist å gi reduksjon av tykk- og endetarmskreft.
Øvre endoskopi bør starte ved 25–30 års alder (Vasen et al., 2008) (evidensgrad D). Duodenale polypper fjernes endoskopisk for å redusere risikoen for duodenale carsinomer Oppfølging baseres på antall, størrelse og grad av dysplasi av polypper i duodenum, og klassifiseres etter Spigelman score (Spigelman, Williams, Talbot, Domizio, & Phillips, 1989).
Attenuert familiær adenomatøs polypose (AFAP)
AFAP skyldes dominant nedarvede mutasjoner i APC-genet, med polypper (10–99 adenomer, debut >30 år) og senere debut av tykk- og endetarmskreft enn ved FAP (Nielsen et al., 2007). Oppfølgingen er tilsvarende overvåkning av FAP, men med start ved 18–20 års alder. Koloskopi anbefales pga tendens til adenomer i proksimale tykktarm. Øvre endoskopi anbefales som ved FAP (Nielsen et al., 2007) (evidensgrad D).
MutYH-assosiert polypose (MAP)
MAP utgjør < 1 % av alle som er diagnostisert med tarmkreft og er karakterisert ved færre polypper (>10 <100) enn ved FAP og høyere debutalder (Al-Tassan et al., 2002). Årsaken er mutasjoner i MUTYH-genet (Nielsen et al., 2007), og arvegangen er autosomal recessiv, det vil si at man må arve genfeilen fra begge foreldre. Gentester er tilgjengelig. Oppfølgingen er som ved AFAP (evidensgrad B). Mutasjonsbærere, det vil si individer som bare har arvet genfeilen fra en av foreldrene, har ikke påvist betydelig økt risiko for tarmkreft, og overvåkning er ikke nødvendig (Balaguer et al., 2007).
Øvrige polyposesyndromer utgjør til sammen < 1 % av alle med diagnosen tykk- og endetarmskreft (Beggs et al., 2010; Bulow, 2003; Cairns et al., 2010; Vasen et al., 2015).
Familiær tykk- og endetarmskreft (FCRC)
Begrepet brukes om opphopning av tykk- og endetarmskreft i familier. Genfeil er i stor grad ukjent, og kliniske kriterier for de kjente arvelige syndromene trenger ikke være oppfylt (Beggs et al., 2010; Bulow, 2003; Nielsen et al., 2007; Umar et al., 2004; Vasen et al., 1999). Cirka 20 % av alle med tykk- og endetarmskreft kan ha familiær tarmkreft (Baglietto et al., 2006).
Anbefalingene om oppfølging av familier med forekomst av tarmkreft spriker mellom ulike internasjonale guidelines og reflekterer det begrensete kunnskapsgrunnlaget (Cairns et al., 2010; Lowery et al., 2016; Segnan, Patnick, & von Karsa, 2010). Generelt er risikoen for kreft høyere jo yngre pasienten er og øker med antall affiserte familiemedlemmer.
Dokumentasjonen for å anbefale koloskopi hos pasienter med en førstegradsslektning med tarmkreft er dårlig. Evidensmessig er det ikke vist noen effekt av koloskopioppfølging av disse (Cairns et al., 2010; Lowery et al., 2016; Segnan et al., 2010). EUs guidelines fra 2010 anbefaler at slektninger med en førstegradsslektning med tarmkreft kan delta i det ordinære screeningprogrammet, og dette anbefales også i Norge (evidensgrad D) (Cairns et al., 2010; Lowery et al., 2016; Segnan et al., 2010).
Oppfølging med koloskopi anbefales til personer hvor det er to første- eller en første- og en annengradsslektning med tarmkreft før fylte 60 år. Koloskopi anbefales også til personer med 3 eller flere første- eller andregradsslektninger med tarmkreft før 70 år (Cairns et al., 2010). Hver side av familien vurderes for seg. Ved normale funn ved første koloskopi anbefales ny koloskopi om 5 år. Ved gjentatte normale koloskopier kan man vurdere sjeldnere kontroller (evidensgrad D) (Hampel et al., 2005; Møller et al., 2006).
Anbefalt overvåkning av pasienter og førstegradsslektninger er koloskopi hvert 5. år fra 40 år ved normale funn (Cairns et al., 2010; Hampel et al., 2005; Mesher et al., 2014; Møller et al., 2006) (evidensgrad C). Oppfølging tilbys personer hvor det er to første- eller en første- og en annengradsslektning med tarmkreft før fylte 60 år eller tre nære slektninger med tarmkreft før 70 år (Cairns et al., 2010). Risikopersoner er de som selv har hatt kreft og deres friske førstegradsslektninger. Hver side av familien vurderes for seg. Oppfølging av pasienter og friske slekninger bør organiseres på bakgrunn av genetikers råd i nært samråd mellom den aktuelle personen og fastlegen.
Anbefaling
- Mikrosatellitt instabilitet og/eller immunhistokjemiske undersøkelser bør utføres i svulstvev fra alle pasienter med tykk- og endetarmskreft <60 år (evidensgrad B)
- Pasienter med holdepunkt for Lynch syndrom bør få tilbud om genetisk veiledning (evidensgrad D).
- Pasienter med Lynch syndrom og påvist genfeil bør koloskoperes hvert annet år fra 25 års alder. Hvis tubulære adenomer påvises, bør det gjøres en ny koloskopi etter ett år, deretter eventuelt tilbake til hvert annet år (evidensgrad D).
- Fastlegen henviser pasienter med Lynch syndrom og påvist genfeil til relevant spesialist for Lynch syndrom-assosierte kreftformer for adekvat kontrollopplegg på bakgrunn av genetikers råd (evidensgrad C)
- Oppfølging av pasienter med Lynch syndrom og påvist genfeil hos relevant spesialist for Lynch-syndrom assosierte kreftformer baseres på genetikers anbefaling, og organiseres i samråd med pasient og fastlege (evidensgrad C)
- Pasienter med risiko for Familiær adenomatøs polypose bør sigmoidoskoperes fra 10–12 års alder. Dersom man finner polypper i endetarmen, skal pasienten koloskoperes. Øvre endoskopi bør starte ved 25–30 års alder (evidensgrad D).
- Pasienter med Attenuert familiær adenomatøs polypose eller MuTYH assosiert polypose følges opp på samme måte som ved Familiær adenomatøs polypose, men med start ved 18–20 års alder (evidensgrad C).
- Personer med 1 førstegradsslektning med påvist tykk- eller endetarmskreft anbefales deltagelse i det ordinære tarmscreeningprogrammet fra 55 års alder (evidensgrad D).
- Personer med minst 1 førstegradslektning og 1 første- eller andregradsslektning med diagnostisert tarmkreft før 60 års alder anbefales koloskopi hvert 5. år fra fylte 40 år (evidensgrad D).
- Personer med 3 eller flere første- og andregradsslektninger med tarmkreft før 70 års alder anbefales koloskopi hvert 5. år fra fylte 40 år (evidensgrad D).
Behandling
Sist faglig oppdatert: 20.05.2022
Lynch syndrom
Tykk- og endetarmskreft hos Lynch syndrom-pasienter behandles vanligvis som sporadisk kreft. Total eller subtotal kolektomi bør gjøres ved synkrone kreftsvulster og/eller multiple polypper (Vasen et al., 2013) (evidensgrad D). Dersom man velger segmental tarmreseksjon ved etablert tarmkreft, må man være oppmerksom på risiko for metakron CRC.
Lynch syndrom-pasienter som ikke har fått fjernet tykk- og endetarm, bør overvåkes med koloskopi etter avsluttet kontroll for CRC, ikke sjeldnere enn hvert annet år, etter individuell vurdering, til 70–75 år (Cairns et al., 2010; Vasen et al., 2013) (evidensgrad D).
Påvisning av MSI er av betydning for prognose og valg av behandling. LS-assosierte svulster er rapportert å ha annen effekt av ulike cytostatika enn sporadisk tarmkreft (Jacob, Aguado, Fallik, & Praz, 2001). Retningslinjer for behandling er foreløpig lik sporadisk tarmkreft, men med visse muligheter for avvik. Se kapittel Postoperativt om adjuvant kjemoterapi ved stadium II tykktarmskreft.
FAP
Dersom høygradig dysplasi påvises i polypper er profylaktisk kirurgi aktuelt. Avhengig av utbredelse, størrelse og mengde avgjøres omfanget av kirurgi. Vanligvis er proktokolektomi det som skal gjøres og da med rekonstruktive prosedyrer – dvs reservoar kirurgi (Aziz et al., 2006) (evidensgrad D). Kolektomi med ileorektal anastomose (IRA) kan være aktuelt i spesielle tilfeller der det er få og små adenomer i rektum som kan fjernes og overvåkes inntil kompletterende kirurgi blir nødvendig.
Kirurgisk behandling av FAP skal i utgangspunktet skje ved universitetssykehus.
Behandlende kirurg må kunne informere pasienten om indikasjoner for kirurgi. Pasientene skal informeres om de ulike kirurgiske alternativer inkludert muligheter for kikkhullstilganger, samt rekonstruktiv kirurgi (reservoarkirurgi) av kompetent kirurg ved et senter som driver med denne type kirurgi. Har man ikke erfaring eller slik kompetanse i primærsykehuset, skal pasienten henvises til informasjon og beslutningstaking ved det sykehuset som skal gjennomføre operasjon og oppfølging.
Primær profylakse ved Lynch syndrom og FAP
Daglig inntak av acetylsalicylsyre ved Lynch syndrom har vist signifikant reduksjon i forekomst av kreft (Burn et al., 2011) (Evidensgrad A). En pågående studie søker å avklare optimal dose (Burn et al., 2011). Man avventer resultatene av denne studien før det eventuelt gis anbefalinger til mutasjonsbærere om daglig inntak av acetylsalicylsyre.
Kjemoprevensjon med bruk av COX2-hemmere ved FAP har vist reduksjon av størrelse og antall polypper (Phillips et al., 2002) men er ikke anbefalt på grunn av kardiovaskulære birvirkninger (Solomon et al., 2008). Duodenalpolypose kan kanskje bremses med potente Cox-2 hemmere, men dette må veies mot bivirkningsprofilene på så vel medikamentene som det operative tiltak og er en spesialistoppgave.
Anbefaling
- Tykk- og endetarmskreft hos pasienter med Lynch syndrom behandles oftest som sporadisk kreft, men subtotal kolektomi eller total kolektomi bør vurderes, spesielt ved synkron kreft eller ved multiple polypper (evidensgrad D).
- Pasienter med Lynch syndrom som har gjenværende tykktarm/endetarm, bør overvåkes med koloskopi etter avsluttet 5 års kontroll ikke sjeldnere enn hvert annet år, etter indivduell vurdering til 70–75 år (evidensgrad D).
- Pasienter med FAP bør proktokolektomeres profylaktisk ved 15–25 års alder. Hvis grov atypi påvises tidligere er det absolutt operasjonsindikasjon (evidensgrad D). Ileoanalt reservoar må vurderes.
Om den genetiske utredning og veiledning
Sist faglig oppdatert: 20.05.2022
Genetisk veiledning inkluderer vurdering av egen risiko for kreft, tilbud om gentester og informasjon om konsekvensene av testing, samt henvisning til medisinsk oppfølging og risikoreduserende tiltak.
All genetisk utredning og gentesting er underlagt Bioteknologiloven (Lov om humanmedisinsk bruk av bioteknologi m.m. (bioteknologiloven). LOV-2003-12-05-100) og krever informert samtykke. Diagnostiske tester er testing av affisert individ, og prediktive tester er testing av frisk person. Prediktiv test forutsetter genetisk veiledning, og gentester ved mistanke om arvelig sykdom må i slike tilfeller rekvireres av genetiker.
Prediktiv testing av barn (<16 år) gjøres bare når det er av betydning for behandlingsvalg/profylakse allerede i barnealder.
Amsterdam II kriteriene og de reviderte Bethesda kriterier for identifikasjon av mulig Lynch syndrom
Sist faglig oppdatert: 20.05.2022
Reviderte Amsterdamkriterier (Amsterdam II): (Vasen et al., 1999)
- Minst tre slektninger med tykk- og endetarmskreft eller LS relatert kreft*.
- To generasjoner skal være affisert.
- Minst én diagnostisert <50 år. FAP skal være ekskludert. Tykk- og endetarmskreft skal være histologisk verifisert.
* Kreft i endometrium, duodenum, nyrebekken/ureter, ventrikkel, lever- og galleganger, bukspyttkjertel, og eggstokker mfl.
Reviderte Bethesda-kriterier: (Umar et al., 2004)
Kriterier for å selektere tykk- og endetarmskreft for MSI/IHC*-testing.
(Det er tilstrekkelig at ett av kriteriene er oppfylt)
- Tykk- og endetarmskreft hos pasient <50 år.
- Synkron eller metakron tykk- og endetarmskreft eller andre LS-relaterte svulster, uavhengig av alder.
- Tykk- og endetarmskreft med MSI-H fenotype tumor** hos pasienter <60 år.
- Tykk- og endetarmskreft diagnostisert hos pasient med én eller flere førstegradsslektninger (foreldre, søsken, barn) med en LS-relatert*** svulst, og hvor én av svulstene er diagnostisert <50 år.
- Tykk- og endetarmskreft diagnostisert hos pasient med ≥2 første- eller andre-(besteforeldre, tanter, onkler, barnebarn) gradsslektninger med LS-relaterte svulster, uavhengig av alder.
* MSI/IHC gjøres på patologisk anatomisk avdeling ved en del større sykehus.
** Histologiske karaktertrekk i tumor: lavt differensiert/udifferensiert karsinom, signetringceller, Crohnlignende lymfocyttaggregasjon, slimproduksjon i >50 % av tumorcellene, lymfocyttaggregasjon eller kribriformt vekstmønster
**** Kreft i endometrium, duodenum, nyrebekken/ureter, ventrikkel, lever- og galleganger, bukspyttkjertel, og eggstokker mfl.
Tabell 5.1
| Poengangivelse | |||
| 1P | 2P | 3P | |
| Antall polypper | 1–4 | 5–20 | >20 |
| Størrelse (mm) | 1–4 | 5–10 | >10 |
| Histologi | Tubulær | Tubulovilløs | Villøs |
| Dysplasi | Mild | Moderat | Grov |
|
| Spigelman score og endoskopiintervaller | ||
| Stage | |||
| 0 | 0 | 4 år | |
| I | 1–4 | 3 til 4 år | |
| III | 5–6 | 1 til 3 år | |
| III | 7–8 | 6 til 12 mnd | |
| IV | 9–12 | Hvis ikke duodenektomi, 6 mnd | |
Polypper i tykk- og endetarm og dysplasi ved ulcerøs kolitt
Polypper
Sist faglig oppdatert: 20.05.2022
Det er to hovedkategorier av epiteliale polypper i tykktarmen; adenomer og sagtakkede (engelsk: serrated) lesjoner. Videre deles disse inn i undergrupper som vist i tabellen under, tabellen baserer seg på WHO sin nyeste oppdatering fra 2019 (Digestive System Tumours, 2019).
Tabell 6.1
Type lesjoner | Undergrupper | Beskrivelse |
|---|---|---|
Sagtakkete | Hyperplastiske polypper |
|
| Bredbasede sagtakkete lesjoner | Uten/med dysplasi |
| Tradisjonelle sagtakkete adenomer | Lavgradig/høygradig dysplasi |
Adenomer | Tubulære | Lavgradig/høygradig dysplasi |
| Tubulovilløse | Lavgradig/høygradig dysplasi |
| Villøse | Lavgradig/høygradig dysplasi |
Adenomer
De fleste tilfeller av tykk- og endetarmskreft (CRC) utvikles fra adenomer. Inntil 25 % av 50-årige og halvparten av 70-årige nordmenn har adenomer (Vatn & Stalsberg, 1982), men de færreste adenomer (<10 %) blir til cancer. I løpet av 2 til 3 år viser 2/3 av adenomene tegn til regresjon (Hoff, Foerster, Vatn, Sauar, & Larsen, 1986; Hofstad et al., 1996; Loeve et al., 2004) og 2–14 % forsvinner fullstendig (Vleugels, Hazewinkel, Fockens, & Dekker, 2017). Risikoen for CRC etter polypektomi er assosiert med lesjonens størrelse og dysplasigrad i tillegg til antall adenomer (Calderwood, Lasser, & Roy, 2016).
Hyperplastiske polypper
Hyperplastiske polypper viser histologisk ingen tegn til kjerneatypi eller dysplasi, og har vært oppfattet som ikke-neoplastiske. Ved undersøkelse med tanke på molekylære mekanismer viser imidlertid mange av de hyperplastiske polyppene KRAS og BRAF mutasjoner som indikerer at de kan gi opphav til malignitet. Histologiske er det ikke mulig å skille polypper med eller uten slike mutasjoner, og kunnskapen om hvilke molekylære egenskaper som vil gi en eventuell utvikling av malignitet er foreløpig begrenset. Man antar at små (<5 mm) hyperplastiske polypper i rektum ikke har malignitetspotensiale, og trenger derfor ikke fjernes.
Bredbasete sagtakkete lesjoner (BSL)
Bredbaserte sagtakkete lejsoner er ofte flatt voksende, bredbasete lesjoner, lett å overse ved koloskopi (de fleste er mindre enn 5–10 mm), og det kan være vanskelig å se tydelig overgang mellom lesjonen og normal slimhinne. De er oftest lokalisert i proksimale del av tykktarmen og kan være vanskelige å fjerne komplett med slyngereseksjon (Pohl et al., 2013). BSL har potensiale for utvikling av kreft via den såkalte «serrated pathway» (Leggett & Whitehall, 2010; Pai, Mäkinen, & Rosty, 2019), og utgjør 25 % av tarmkrefttilfellene (Crockett & Nagtegaal, 2019).
Typiske funn er BRAF-mutasjoner og metylering av DNA. Noen BSL (4–8 %) vil inneholde dysplastiske foci (Crockett & Nagtegaal, 2019), og dette synes å gi økt malignitetspotensiale.
Tradisjonelt sagtakket adenom
Disse adenomene viser et sagtakket preg, og har også andre spesifikke histopatologiske trekk. De ser oftest ut som stilket polypp eller litt bredere/høyere (eksofytisk/filiform), men kan også være flate. De er sjeldne og er gjerne lokalisert i venstre kolon og rektum. De progredierer vanligvis ikke gjennom de samme signalveiene som bredbasede sagtakkete polyppe (East et al., 2017; Rex et al., 2012)
Sagtakket polypose syndrome
Det som tidligere ble omtalt som «Hyperplastisk polypose syndrom» kalles nå «sagtakket polypose syndrom» (SPS). Dette er det vanligste polyposesyndromet med en prevalens på 1:111 (0,9 %) i FOBT-basert screening kohorter og 1:238 (0,42 %) i primær koloskopi kohorter (Bleijenberg et al., 2020). Det er assosiert med betydelig økt risiko for CRC. I to studier var 5-års risiko for CRC 2–7 % hos pasienter med sagtakket polyppose syndrom som inngikk i et kontrollprogram med koloskopi (Boparai et al., 2010; Carballal et al., 2016).
Diagnosen SPS baseres på endoskopiske funn og er av WHO definert slik (Rosty, Brosens, Dekker, & Nagtegaal, 2019):
I. Minst 5 sagtakkete polypper proksimalt for rectum, alle ≥5 mm og minst to ≥10 mm
eller
II. Mer enn 20 sagtakkete polypper uansett størrelse utbredt over colon, med minst ≥5 proksimalt for rectum.
Antall polypper er kumulativt over flere koloskopier og alle subtyper av sagtakkede polypper/lesjoner telles.
Symptomer
Sist faglig oppdatert: 20.05.2022
Bortsett fra store, distalt lokaliserte polypper som kan gi synlig blod og/eller slim i avføringen, gir de fleste kolorektale polypper ikke symptomer.
Diagnostikk og behandling av polypper
Sist faglig oppdatert: 20.05.2022
Koloskopi
Koloskopi regnes som gullstandard ved kolorektal diagnostikk og gir mulighet for vevsprøvetaking og terapi. Selv om koloskopi er gullstandard vet vi at patologi blir oversett (Zhao et al., 2019) og at dette kan ha konsekvenser for pasientene (Wieszczy, Regula, & Kaminski, 2017). Risikoen for å overse patologi er redusert hvis undersøkelsen er av høy kvalitet (Wieszczy et al., 2017). En koloskopi av «høy kvalitet» er definert ved at koloskopet er ført til og med cøkum, tarmtømmingen er av god kvalitet og alle polypper er fjernet, med unntak av små (<5 mm) hyperplastiske polypper i rektum.
Kvaliteten på skopier varierer mellom koloskopisentra og skopører (Lund, Trads, Njor, Erichsen, & Andersen, 2019), og pasienter som er koloskopert av leger med høy adenom deteksjonsrate har lavere risiko for senere forekomst og død av CRC sammenlignet med skopører med lav adenom deteksjonsrate (Corley, Levin, & Doubeni, 2014; Kaminski et al., 2010). Strukturert supervisjon på senternivå er assosiert med økt polypp deteksjonsrate (Kaminski et al., 2016) og lavere andel smertefulle undersøkelser (Hoff et al., 2021; Kaminski et al., 2016).
Anbefaling
- Endoskopienheter og koloskopører bør delta i nasjonalt kvalitetsregister for endoskopiske undersøkelser (Gastronet) (Evidensgrad D)
- Opplæring av nye koloskopører bør gjøres av instruktører som både kjenner prinsippene for strukturert supervisjon og kvaliteten på egne undersøkelser. (Evidensgrad D)
Benigne polypper
Behandling av benigne polypper gjøres for å forhindre utvikling av kreftsykdom. En må sikre seg at disse virkelig er benigne. Best grunnlag for dette gis ved fullstendig fjerning i én seanse (en bloc av polypper < 20 mm) for å vurdere reseksjonsflate. Polypper 20 mm og større fjernes vanligvis i flere deler (piece meal), men man bør også her vurdere en bloc reseksjon (f.eks ESD eller TEM i rektum). Alle polypper uavhengig av størrelse bør fjernes med mindre carcinomutvikling mistenkes. Unntaket er maligne stilkete polypper og bredbasete polypper der man kun mistenker overfladisk infiltrasjon. Det er ikke nødvendig å fjerne små (<5 mm) hyperplastiske polypper i rektum da disse ikke har noe malignitetspotensiale.
Overfladiske biopsier underestimerer dysplasigrad og kan bomme på cancerfoci – spesielt i store polypper (>10 mm) hvor polyppektomien er både diagnostisk og terapeutisk (Gondal et al., 2005). Alt polyppvev må derfor sendes til histopatologsk undersøkelse. Det er anslått at <1 % av adenomer med diameter <10 mm er maligne. Tilsvarende risiko for malignitet for større adenomer: 10 % med diameter 10–20 mm og 20–50 % med diameter >20 mm (Gastrointestinal pathology: an atlas and text, 1999). Perforasjonsfaren ved terapeutisk koloskopi er 0,5–2 per 1000 koloskopier (Rutter, Nickerson, Rees, Patnick, & Blanks, 2014). Blødningsfaren ved terapeutisk koloskopi er ca. 3–10 per 1000 polypectomier (Derbyshire, Hungin, Nickerson, & Rutter, 2017). Perforasjonsfaren er størst ved store polypper i coecum (Rutter et al., 2014). Polyppektomi må veies mot risiko ved inngrepet, alder, ko-morbiditet og den trusselen lesjonen forventes å utgjøre for resterende forventet levetid. Koloskopikontroller kan være et alternativ – forutsatt at pasienten følger opp kontrollavtaler.
Anbefaling
- Alle kolorektale polypper bør fjernes med unntak av små, hyperplastiske polypper i rektum. Mistanke om carcinomutvikling og fare for komplikasjoner må tas med i vurderingen. (Evidensgrad A)
- Alt polyppvev bør sendes til histopatologisk undersøkelse. (Evidensgrad C)
Maligne polypper
Ved påvist adenokarsinom i stilket polypp skal tumor klassifiseres etter Haggitt’s klassifikasjon mens en ved bredbasede polypper bruker sm klassifikasjon (Kikuchi) med angivelse av eventuell innvekst i blod- og lymfekar, differensieringsgrad samt eventuell tumor budding angis (Gschwantler et al., 2002; Haggitt, Glotzbach, Soffer, & Wruble, 1985; Hassan et al., 2007; Muto, Sawada, & Sugihara, 1991; Nakadoi et al., 2012; Netzer et al., 1998; Seitz et al., 2004; Shaukat et al., 2020).
Slyngereseksjon anses som tilstrekkelig behandling ved karsinom dersom slyngen er lagt på makroskopisk fri stilk og polyppen ble fjernet i ett stykke (ikke stykkevis). I tillegg må infiltrasjonen ikke være dypere enn til og med Haggitt nivå 3, og det må være mikroskopisk sikker fri rand (Haggitt et al., 1985) For at slyngereseksjon skal anses som tilstrekkelig behandling, må tumor heller ikke være lavt differensiert, og det må ikke være påvist infiltrasjon i blod- eller lymfekar eller påvist budding.
Ved Haggit grad 4 er risiko for lymfeknutemetastaser i flere materialer over 10 % (risiko ved Haggit 1-3 er < 1 %) (Nivatvongs et al., 1991; Resch & Langner, 2015), men det er en heterogen gruppe med varierende grad av differensiering eller påvist blod- eller karinfiltrasjon eller budding som uansett bør anbefales stor operasjon. Hvis disse risikofaktorer ikke er til stede og det er teknisk mulig å oppnå frie render kan en gjøre lokal re-reseksjon av tomten. Dette er vanligvis greit i rectum med TEM og av og til også endoskopisk i kolon. Polypptomten må da klassifisere ut fra dybdevekst av tumor som ved bredbasede polypper (se under) og en kan bruke samme kriterier som for bredbasede polypper med tanke på om lokal reseksjon er tilstrekkelig da risiko for lymfeknutemetastaser er tilnærmet lik for bredbasede polypper og Haggitt 4 (Resch & Langner, 2015).
Bredbasede polypper med tidlig cancer (T1), samt stilkede polypper Haggitt nivå 4, skal klassifiseres etter sm klassifikasjonen (Kikuchi). Sm klassifikasjonen er avhengig av tilstedeværelse av muskularis propria for å gjøre tredelingen (sm 1 til 3). Der hvor det er gjort submucosal reseksjon skal dybdevekst i antall mikrometer fra muscularis mucosa bli angitt. Dyp infiltrasjon tilsvarer dybdevekst lik eller mer enn 1000 mikrometer og tilsvarer sm 2 eller mer (Choi et al., 2015; Shaukat et al., 2020).
Forekomsten av lymfeknutemetastaser ved reseksjonskirurgi etter funn av maligne polypper med T1 cancer er rapportert til 6–10 %, mens det ved T1 sm1 eller invasjonsdybde mindre enn 1000 mikrometer er 0–4 % (Choi et al., 2015; Nakadoi et al., 2012; Shaukat et al., 2020).
Risiko for lymfeknutemetastaser ved T1 cancer avhenger av følgende risikofaktorer: differensieringsgrad, lymfatisk invasjon, vaskulær infiltrasjon, budding grad 2 eller 3 og dybdevekst. Odds Ratio for lymfeknutemetastaser er høyest for de lavt differensierte og deretter i avtagende grad ut fra angitt rekkefølge over (Choi et al., 2015; Shaukat et al., 2020).
Forutsatt at dybdevekst ikke er dypere enn sm 1 og ingen andre risikofaktorer (se over), kan disse fjernes med lokal reseksjon enten endoskopisk i colon eller TEM/TAMIS/endoskopisk i rectum (Choi et al., 2015; Shaukat et al., 2020). Forutsetning er at de er komplett fjernet med sikker fri rand (mer enn 1 millimeter) (Shaukat et al., 2020).
Flere studier viser at selv ved dypere dybdevekst (sm2 og dels sm3) forutsatt at andre risikofaktorer ikke er til stede, er det lav risiko (1,2–1,9 %) for glandelmetastaser (Nakadoi et al., 2012; Yoshii et al., 2014). 100 dagers mortalitet i Norge er 3,0 % ved reseksjonskirurgi av colon, og for rectum 1,8 % (Nasjonalt kvalitetsregister for tykk- og endetarmskreft, 2021). Ut fra dette kan dypere infiltrasjon, forutsatt ikke andre risikofaktorer til stede, vurderes på individuell basis i samråd med pasient hvor morbiditet knyttet til inngrepet (f.eks rectum amputasjon) er lite akseptabelt eller alder og eller komorbiditet gjør at stor kirurgi er risikabelt.
Ved mistanke om tidlig cancer og lokal fjerning er det viktig at prosedyren gjøres av leger med stor erfaring i dette. I rectum bør ultralyd gjøres for å bedømme dybdevekst av svulsten da dette er en bedre undersøkelse enn MR for bedømming av dybdevekst på tidlig cancer i rectum.
Anbefaling
- Sm 1 cancere eller submucosal invasjon mindre enn 1 millimeter i colon og rectum uten andre risikofaktorer kan anses radikalt fjernet med lokal eksisjon (endoskopisk i colon og eller TEM/Tamis/endoskopisk i rectum). (Evidensgrad C).
- Behandling av flate/bredbasete maligne polypper bør diskuteres i tverrfaglig møte, fortrinnsvis med patolog til stede. (Evidensgrad D).
- Stilkete polypper Haggit 1-3 med fri stilk ≥ 1 mm og uten andre risikofaktorer kan anses radikalt fjernet endoskopisk (Evidensgrad C).
Oppfølging
Sist faglig oppdatert: 20.05.2022
Benigne polypper
Polyppenes antall, størrelse, vekstmønster og dysplasigrad utgjør grunnlaget for risikostratifisering av pasientene. Det er nylig publisert reviderte retningslinjer fra Storbritannia, ESGE og USMSTF (USA) (Gupta et al., 2020; Hassan et al., 2020; Rutter et al., 2020). Risikostratifiseringene varierer noe mellom de tre anbefalingene.
Evidensgrunnlaget for risikostratifisering i de norske anbefalingene er som følger:
Antall: Det er en mulig assosiasjon mellom antall fjernede polypper og senere risiko for utvikling av kreft i tykk- og endetarm. Mens det tidligere har vært enighet om at stigende antall øker risikoen har nyere studier vist at det ikke er forskjell i risiko for senere utvikling av kreft for pasienter med 4 eller færre adenomer, gitt at disse er små (under 10 mm i diameter) og ikke har høygradig dysplasi (Atkin, Wooldrage, et al., 2017; Hassan et al., 2020; He et al., 2020; Wieszczy et al., 2020). Pasienter med 5 eller flere adenomer har en noe høyere risiko for kreft senere i livet (Atkin, Wooldrage, et al., 2017; Hassan et al., 2020). Vi anbefaler at pasienter med ≥ 5 adenomer stratifiseres til høyrisikogruppen, i likhet med anbefalinger fra ESGE. Det finnes ikke god dokumentasjon for risiko ved multiple små sagtakkete polypper. Imidlertid er sagtakkete polypper forløper for 20–30 % av tarmkrefttilfellene. Samtidig forekomst av både adenomer og sagtakkete polypper kan øke kreftrisikoen. Vi har derfor valgt, i overensstemmelse med de britiske retningslinjene, at antall adenomer og sagtakkete polypper < 10 mm skal summeres.
Størrelse: Økende polyppstørrelse gir større sjanse for at en polypp inneholder tubulovilløse forandringer, høygradig neoplasi og malignitet (Hassan et al., 2010). For både adenomer og sagtakkede polypper benyttes 10 mm som en grense for å skille mellom polypper med lav og høy risiko. Det er usikkerhet knyttet til måling av polyppstørrelse og det anbefales å bruke en åpen biopsitang eller slynge som hjelp for å måle størrelsen (Hassan et al., 2020).
Villøsitet: Villøsitet er nært korrelert til polyppstørrelse, og små polypper med villøse elementer forekommer sjelden. I flere studier er ikke størrelse inkludert i multivariatanalyser, og villøsitet som uavhengig risikofaktor er derfor usikker (Coleman et al., 2015). I noen studier der både dysplasigrad og størrelse inkluderes i mulitvariatanalyser, er ikke begge lenger uavhengige risikofaktorer for metakron cancer (Atkin, Wooldrage, et al., 2017; Fairley, Li, Komar, Steigerwalt, & Erlich, 2014). Inter-patolog variasjonen er også betydelig (J. A. Gibson & Odze, 2016). Villøsitet har aldri vært inkludert i britiske retningslinjer og er tatt ut som risikofaktor i de nylig publiserte ESGE-retningslinjene. Vi anbefaler derfor at pasienter med villøsitet i polypp som eneste risikofaktor ikke medfører stratifisering til høyrisikogruppen. Det er viktig å være oppmerksom på at det også kan være en betydlige inter-patolog variasjon også for vurdering av dysplasigrad (J. A. Gibson & Odze, 2016).
Dysplasi: Pasienter som har adenomer med høygradig dysplasi har betydelig høyere risiko for å få påvist kreft ved neste undersøkelse enn de med lavgradig dysplasi (Atkin, Brenner, et al., 2017; Click, Pinsky, Hickey, Doroudi, & Schoen, 2018; T. J. Lee et al., 2013; Wieszczy et al., 2020). I multivariate analyser er dette en risikofaktor for senere utvikling av avanserte adenomer og kreft uavhengig av størrelse (Click et al., 2018). Vi anbefaler derfor at pasienter som har adenomer med høygradig dysplasi stratifiseres til høyrisikogruppen.
Bredbasede sagtakkede lesjoner (BSL) utgjør en liten andel (ca. 2–8 %) av polyppene i kolon og av disse er kun ca. 0,5 % klassifisert som tradisjonelle sagtakkede adenomer (TSA) (Crockett & Nagtegaal, 2019; Erichsen et al., 2016). Odds ratio for CRC var > eller = 2–3 hos pasienter med BSL, BSL med dysplasi og tradisjonelle sagtakkede adenomer sammenlignet med pasienter uten adenomer (Erichsen et al., 2016). Vi anbefaler at pasienter med BSL med dysplasi, uavhengig av størrelse stratifiseres til høyrisikogruppen og at pasienter med TSA, uavhengig av størrelse og dysplasigrad stratifiseres til høyrisikogruppen.
Oppsummert anbefales en inndeling i en høy- og lavrisikogruppe ift kontrollintervaller med koloskopi:
Som høy risiko for metakron cancer regnes individer med:
- 5 eller flere adenomer og/eller sagtakkete polypper < 10 mm# eller
- Minst ett adenom eller sagtakket polypp ≥ 10 mm eller
- Minst ett adenom med høygradig dysplasi eller
- Minst en sagtakket polypp med dysplasi
Som lav risiko for metakron cancer regnes individer med:
- 4 eller færre (summert):
- Adenomer < 10 mm og med lavgradig dysplasi og/eller
- Sagtakkete lesjoner < 10 mm# og uten dysplasi
# Små (< 5 mm) hyerplastiske polypper i rektum skal ikke telles med.
Gevinsten ved rutinemessig koloskopikontroll etter polyppfjerning er høyst usikker, og de valgte tidsintervallene er arbitrære og dårlig dokumentert. Det finnes ingen randomiserte studier som viser at kontroll med koloskopi reduserer forekomst av CRC eller død av CRC. Observasjonsstudier har vist bortimot halvert risiko for CRC for deltakere som gjennomførte en eller flere koloskoipikontroller i høyrisikogruppen. Disse studiene er vanskelige å tolke på grunn av seleksjonsbias (Atkin, Wooldrage, et al., 2017; Cottet et al., 2012; Cross et al., 2020).
Usikkerheten ved nytten av kontroll-koloskopier gir seg utslag i svært ulike anbefalinger i internasjonale retningslinjer. For høyrisikogruppen er man både i Europa og USA havnet på anbefaling om 3-års intervall, noe vi også anbefaler i Norge.
For lavrisikogruppen derimot, varierer anbefalingene fra ingen anbefalt kontroll til kontroll etter 5 eller 10 år (Gupta et al., 2020; Hassan et al., 2020; Rutter et al., 2020). Lavrisikogruppen utgjør om lag to tredjedeler av alle individer med adenomer (Bretthauer et al., 2016). En nylig publisert meta-analyse viste en HR for CRC insidens på 1,26 (95 % KI 1,06–1,51) og 1,15 (95 % KI 0,76–1,74) for CRC død i lavrisikogruppen sammenlignet med en gruppe uten adenomer ved koloskopi. Gjennomsnittlig oppfølgingstid var 8,5 år.
Retningslinjer fra Storbritannia og ESGE anbefaler ikke rutinemessig kontroll av lavrisikogruppen. Imidlertid anbefales det at personer i lavrisikogruppen deltar i screeningprogrammer for tarmkreft på lik linje med befolkningen forøvrig. Hvis screening ikke er tilgjengelig, anbefaler ESGEs retningslinjer at man skal vurdere en ny koloskopi etter 10 år.
I Norge er det aldersgruppen 55–65 år som får tilbud om screening med test for blod i avføringen. Dersom man har vært til koloskopi i regi av screeningprogrammet, blir man ikke invitert til nye screeningrunder med test for blod i avføringen.
For lavrisikogruppen anbefales det etter gjennomføring av høykvalitets koloskopi med fjerning av alle premaligne polypper å delta i screeningprogram der dette tilbys på lik linje med befolkningen forøvrig. Ut over dette har vi ikke grunnlag for å anbefale kontrollkoloskopi i denne gruppen. Et unntak kan være yngre pasienter med adenomer i lavrisikogruppen uten kjent genetisk disposisjon som har mer enn ti år til de vil inngå i et screeningprogram (<45 år). For disse anbefaler vi kontroll koloskopi innen 10 år eller etter en individuell vurdering.
Dersom man har vært ved 3-års kontroll i høyrisikogruppen, men man ikke finner nye polypper som gir grunnlag for fortsatt å være i høyrisikogruppen, anbefales en kontroll etter 5 år.
Anbefaling
- Personer i høyrisikogruppen bør tilbys koloskopikontroll etter 3 år (evidensgrad C)
- Personer i lavrisikogruppen tilbys ikke rutinemessig koloskopikontroll. Personer i lavrisikogruppen bør oppfordres til å delta i Tarmscreeningprogrammet på lik linje med befokningen forøvrig. Hos unge pasienter med mer enn 10 år til deltakelse i screeningprogrammet (< 45 år), anbefales koloskopi innen 10 år eller etter en individuell vurdering (evidensgrad D)
Forutsetning for anbefalte kontrollintervaller
Det er en forutsetning for de veiledende kontrollintervallene i figur 6.1 under at den initiale koloskopien er av høy kvalitet (cøkum intubert, god tømmingskvalitet, komplett fjerning av alle polypper unntatt små (<5 mm) hyperplastiske polypper i rektum).
Funn ved første undersøkelse
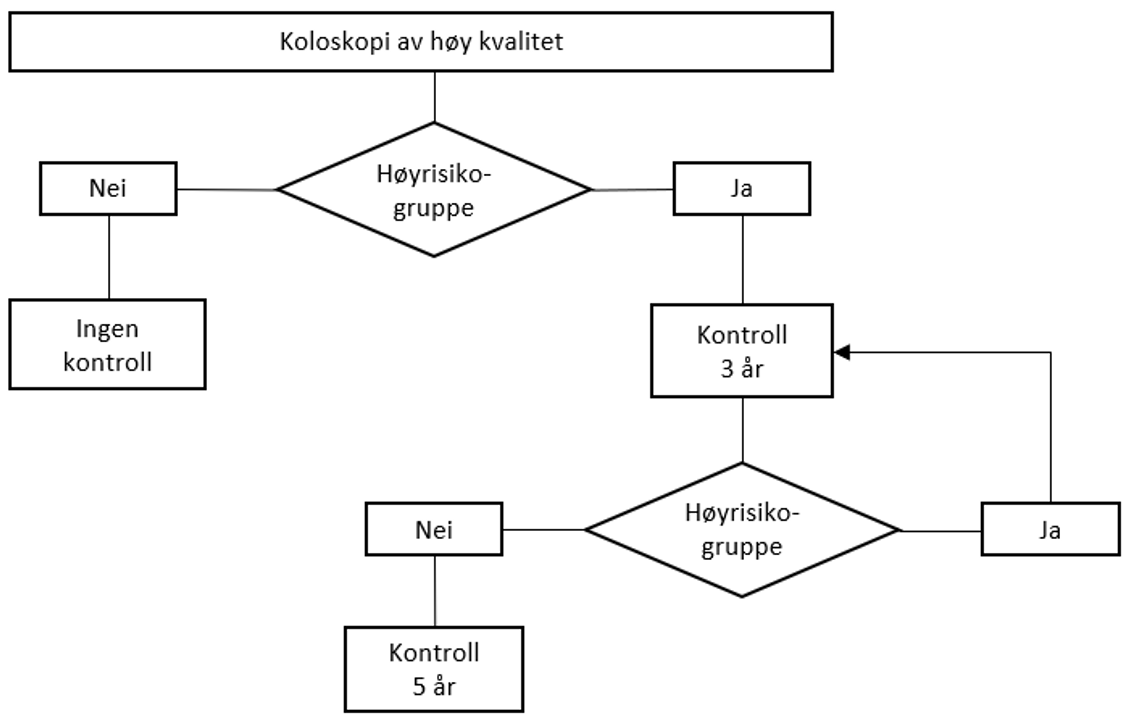
Høyrisikogruppe (minst 1 av følgende): 5 eller flere adenomer og/eller sagtakkete polypper < 10 mm eller minst ett adenom eller sagtakket polypp >= 10 mm eller minst ett adenom med høygradig dysplasi eller minst en sagtakket polypp med dysplasi.
Lavrisikogruppe: 4 eller færre (summert) adenomer < 10 mm og med lavgradig dysplasi og/eller sagtakkete lesjoner < 10 mm og uten dysplasi.
Kontrollintervall vil også avhenge av reseksjonsmetode
Polypper skal i så stor grad som mulig fjernes komplett og i ett stykke. Dette muliggjør vurdering av reseksjonsranden. Dersom polyppen er fjernet i flere stykker (piecemeal reseksjon), har studier vist at 20 % av lesjoner <20 mm fjernes ufullstendig (Pohl et al., 2013). Residiv eller residualvev etter reseksjon av lesjoner 10–20 mm kan påvises ved så mange som 18 % av pasientene (Belderbos, Leenders, Moons, & Siersema, 2014). Ved piecemeal reseksjon av polypper ≥20 mm har studier vist residivrater på 12–24 % 3–6 måneder etter indeksskopien (tidlig residiv). 75 % av residivene oppdages innen 3 måneder, mens 90 % oppdages innen 6 måneder (Belderbos et al., 2014; Pellise et al., 2017). Det forekommer også senresidiv, 4–12 % 15–18 måneder etter indeksskopien (Belderbos et al., 2014; Klein et al., 2019; A. Moss et al., 2015; Pellise et al., 2017).
Anbefaling
- Piecemeal reseksjon av polypper <20 mm: Polypptomten bør kontrolleres etter 6 måneder (Evidensgrad C).
- Piecemeal reseksjon av polypper ≥20 mm: Polypptomten bør kontrolleres 6 og 18 måneder etter indeksskopien (Evidensgrad C).
- Ved komplett reseksjon og normale tomtekontroller, anbefales koloskopi kontroll i henhold til flytskjema (3 år etter siste kontroll) (se figur 6.1 over) (Evidensgrad D).
Maligne polypper
Det finnes lite litteratur på dette, men forutsetning for denne anbefalingen er at polyppen er radikalt fjernet med fri reseksjonsrand og uten risikofaktorer (lav differensieringsgrad, lymfatisk invasjon, vaskulær infiltrasjon, budding grad 2 eller 3 og dybdevekst ≥1 mm eller Haggitt nivå 4). De fleste residiv og metakrone cancere oppstår de første tre årene etter behandling, og vi har lagt oss på den engelske anbefalingen at ved radikal fjerning bør pasienten kontrolleres med full koloskopi etter 3 år (Rutter et al., 2020).
Anbefaling
Ved radikal fjerning av maligne polypper med vurderbare render, fri reseksjonsrand på minst 1 mm og uten risikofaktorer, bør pasienten kontrolleres med full koloskopi etter 3 år, og deretter følge kontrollopplegg i figur 6.1 (Evidensgrad D).
IBD og kreft
Sist faglig oppdatert: 20.05.2022
Utvikling av dysplasi og karsinom kan være en komplikasjon til inflammatorisk tarmsykdom (IBD), med forekomst av CRC ved ulcerøs kolitt (UC) på 2 % etter 10 år, 8 % etter 20 år og hele 18 % etter 30 år (J. A. Eaden, Abrams, & Mayberry, 2001). Nye populasjonsbaserte studier viser imidlertid lavere forekomst (C. N. Bernstein, Blanchard, Kliewer, & Wajda, 2001; Hovde et al., 2017; Jess et al., 2006; Lakatos et al., 2006; Palli et al., 2000; Winther, Jess, Langholz, Munkholm, & Binder, 2004), men det synes klart at pasienter med UC har en økt forekomst av CRC i forhold til normalbefolkningen. Risiko for CRC er relatert til lang sykdomsvarighet, utbredt sykdom, tidlig debut, høy intensitet av inflammasjon, forekomst av spontan CRC i slekt og samtidig forekomst av primær skleroserende kolangitt (PSC) (Magro et al., 2017). Crohns sykdom i tykktarm disponerer også for CRC, muligens på lik linje med UC (C. N. Bernstein et al., 2001; Friedman et al., 2001). Median alder ved diagnosen av CRC-IBD i Norge er 44 år (Brackmann et al., 2009). Besøk hos sykehusspesialist 1–2 ganger per år har vært assosiert med redusert risiko for CRC-IBD (J. Eaden, Abrams, Ekbom, Jackson, & Mayberry, 2000).
Dysplasi ved IBD
På grunn av manglende kunnskap om den naturlige utviklingen av dysplasi er det usikkerhet omkring hvilken behandlingsstrategi man skal velge ved påvist dysplasi. Det er ikke gjennomført randomiserte, kontrollerte studier der man har sammenlignet kolektomi med endoskopisk fjerning av neoplastiske lesjoner etterfulgt av koloskopikontroller.
Utifra dagens kunnskap og i tråd med ECCO (European Crohn and Colitis Organisation) sine anbefalinger kan påviste dysplastiske lesjoner i polypoide lesjoner fjernes endoskopisk (som regel ved EMR eller ESD) forutsatt at lesjonene fremstår som skarpt avgrenset og at det ikke påvises dysplasi i flat slimhinne rundt lesjonen (kriterier for resektabilitet). Lesjonene må kunne fjernes komplett, og det skal ikke påvises ikke-polypoid dysplasi andre steder i kolon/rektum. Pasienten må også kunne tilbys et kontrollopplegg med kromoendoskopi (evidensgrad D) (Laine et al., 2015). Ikke-polypoide lesjoner kan også bli behandlet med endoskopisk fjerning forutsatt at lesjonen kan fjernes komplett, og at det ikke foreligger ikke-polypoide dysplasi andre steder i kolon/rektum.
Ved påvist høygradig dysplasi i tilstøtende mucosa eller hvis lesjonen ikke kan fjernes fullstendig, bør (prokto)kolektomi anbefales. Ved lavgradig dysplasi er bildet mer sammensatt og behandlingsstrategien bør diskuteres med pasienten i samråd med multidisplinært team (Laine et al., 2015), og være avhengig av flere faktorer som pasientens holdning til hva som er akseptabel risiko for senere kreft, holdning til proktokolektomi, sykdomsaktivitet, alder og risiko ved kirurgisk inngrep. Det skal være lav terskel for å anbefale proktokolektomi, også hos de med moderat dysplasi. ECCO sine anbefalinger begrunner lav terskel for kirurgi ved lavgradig dysplasi med høy forekomst (15–54 %) av grov dysplasi/cancer i operasjonspreparater fra pasienter operert på indikasjonen lavgradig dysplasi (Fumery et al., 2017). Multifokalitet styrker operasjonsindikasjonen. Pasienten bør ved valg av operasjonsmetode få tilbud om samtale med kirurg med bred erfaring i operasjoner ved ulcerøs kolitt, inkludert reservoarkirurgi. Polypper lokalisert proksimalt for betennelsen ved ulcerøs kolitt bør anses som ordinære polypper og behandles deretter.
Anbefaling
- Dysplastiske lesjoner ved inflammatorisk tarmsykdom vurderes fjernet endoskopisk ved EMR eller ESD der dette er mulig, og pasienten bør tilbys oppfølging med kromoendokoskopi. Alternativt må (prokto)kolektomi vurderes og diskuteres med pasienten (evidensgrad D).
Kontroll ved IBD
Det mangler randomiserte studier for å anbefale endoskopisk overvåking av IBD-pasienter generelt, men en lang rekke caseserier indikerer en positiv effekt og to større caseserier har vist bedre overlevelse hos endoskopisk kontrollerte pasienter på grunn av tidlig oppdagelse av CRC. Den tredje European evidence-based consencus on diagnosis and managment of ulcerative colitis (Magro et al., 2017), anbefaler systematisk endoskopisk overvåking av alle, bortsett fra de med sykdomsaktivitet kun lokalisert til rektum. Det synes natulig at en i Norge inntil bedre dokumentasjon evt. foreligger forholder seg til disse anbefalingene.
Foci med dysplasi ved UC er ofte vanskelig å erkjenne endoskopisk fordi lesjonene oftest er flate. I tillegg kan tarmslimhinnen være forandret pga. kronisk inflammasjon. Det er derfor viktig å bruke endoskop med høyoppløselige bilder ved disse undersøkelsene og, om mulig, tilstrebe å undersøke ved inaktiv sykdom. Tradisjonelt har IBD-pasienter med venstresidig kolitt og totalkolitt blitt fulgt med koloskopi og ikke-målrettede kvadrantbiopsier for hver 10. cm av kolon. Ved en slik tilnærming vil dysplasi kun påvises i om lag 1 av 1000 biopsier (Laine et al., 2015). I 2015 ble den såkalte SCENIC consensus statement (Surveillance for Colorectal Endoscopic Neoplasia Detection and Management in Inflammatory Bowel Disease Patients) publisert (Laine et al., 2015). Ved bruk av kromoendoskopi (farging av slimhinnen) dobles sannsynligheten for å se dysplastiske lesjoner (absolutt risikoøkning 6 %), og ekspertgruppen anbefalte derfor at koloskopikontroller utføres som kromoendoskopi med målrettede biopsier. Man anslår at ca. 10 % av dysplastiske IBD-lesjoner er «usynlige» ved kromendoskopi og kun kan oppdages ved ikke-målrettede biopsier. Ekspertgruppen kIarte ikke å oppnå enighet om det skulle utføres ikke-målrettede biopsier i tillegg til målrettede biopsier ved kromendoskopi, men konklusjonen er at endoskopisk overvåking, hvis mulig, bør utføres med kromoendoskopi (Beaugerie et al., 2013).
I tråd med de europeiske anbefalingene bør screeningkoloskopi tilbys åtte år etter symptomdebut hos alle pasienter for å revurdere sykdomsutbredelse og utelukke dysplasi. Hos pasienter med samtidig primær skleroserende kolangitt (PSC) bør årlig screeningkoloskopi utføres så snart diagnosen PSC er stilt, uavhengig av sykdomsaktivitet, -utbredelse og ‑varighet. Høyrisikopasienter (PSC, strikturer eller påvist dysplasi i løpet av de siste fem årene, eller totalkolitt med stor sykdomsaktivitet) bør følges med årlig koloskopi. Pasienter med moderat risiko (totalkolitt med moderat eller liten aktivitet, postinflammatoriske polypper eller familiehistorie med CRC) bør følges med koloskopi hvert 2. til 3. år. Pasienter uten høy eller moderat risiko anbefales fulgt med koloskopi hvert 5. år. Det er viktig at pasienten revurderes med henblikk på høy, moderat eller lav risiko i forbindelse med hver koloskopi, slik at kontrollintervallet eventuelt endres (Magro et al., 2017).
Morfologisk inndeles dysplastiske IBD-lesjoner i polypoide (Paris klasse I) eller ikke-polypoide (Paris klasse II). I tillegg beskrives hvorvidt lesjonen er skarpt avgrenset mot omgivende flat slimhinne (kriterium for endoskopisk resektabilitet). Å ta rikelig med biopsier rundt lesjonen er derfor nødvendig for å avdekke dysplasi i tilstøtende flat slimhinne. Det er uklart om de to undertypene har forskjellig malignitetspotensiale. I en metaanalyse av 10 studier der 376 pasienter fikk fjernet polypoide lesjoner og ble fulgt i 54 måneder med kontrollkoloskopier, var den årlige CRC-risikoen 0,5 % (Wanders et al., 2014). Histopatologisk inndeles dysplasi ved IBD i høygradig og lavgradig. I tillegg kan en bruke betegnelsen uviss dysplasi («indefinite for dysplasia»), eks. ved mye inflammasjon kan det være vanskelig å skille regenerative forandringer fra premalign dysplasi. Den gamle betegnelsen DALM («dysplasia-associated lesions or mass») er ikke lenger i bruk. Dysplasidiagnosen bør bekreftes av to patologer.
Kromoendoskopi utføres med fargestoff (indigocarmin eller metylenblått) tilsatt saltvann eller vanlig vann. Én ampulle (5 ml) indigocarmin (8 mg/ml) eller én ampulle (10 ml) metylenblått (5 mg/ml) tilsatt 100 ml vann (hhv. 0,04 % eller 0,05 %) er som regel tilstrekkelig for en orienterende farging av tarmsegmentene. For detaljert inspeksjon av suspekte lesjoner i slimhinnen anbefales det høyere konsentrasjon (tre ampuller indigocarmin eller metylenblått/100 ml vann). Fargeløsningen appliseres på slimhinnen med spraykateter eller direkte tilsatt spylevæsken. Det er helt nødvendig med en komplett rengjort tarm for å få til en vellykket kromendoskopi.
Anbefaling
- Pasienter med IBD-kolitt > 8 år bør inngå i et kontrollopplegg med koloskopi (evidensgrad C)
- Kontrollintervallene ved IBD-kolitt bør justeres etter vurdering av risiko (evidensgrad D)
- Overvåkingskoloskopier ved IBD-kolitt bør utføres som kromoendoskopi (evidensgrad D)
Diagnostikk og utredning
Generelt
Sist faglig oppdatert: 20.12.2023
Symptomer
Symptomer og funn ved tykk- og endetarmskreft avhenger dels av svulstens lokalisering. Ofte vokser svulsten langsomt og vil kunne gi ulike kliniske manifestasjoner (Bloom & Webster, 2006; Majumdar, Fletcher, & Evans, 1999). Tall i parentes angir hyppighet (Steinberg, Barkin, Kaplan, & Stablein, 1986).
- Knapt halvparten av pasienter med tykk- og endetarmskreft opplever obstruksjonssymptomer i form av endring av avføringsvaner eller magesmerter. Dette er vanligere ved venstresidig enn høyresidig kreftsykdom (Majumdar et al., 1999).
- Blødning viser seg enten som synlig blod med avføringen eller som anemi med slapphet når blodet blander seg helt i avføringen lenger proksimalt i tykktarmen.
- Frisk blødning er meget vanlig ved svulster i endetarmen og sigmoideum og avtar jevnt i hyppighet ved svulster i proksimal retning i tykktarmen
- Anemi er svært hyppig ved svulster proksimalt i tykktarmen og blir mindre hyppig jo mer distalt svulsten er. Det ses hos 75 % ved svulster i cøkum og ascendens mot 30 % ved svulst i rektum (Edna, Karlsen, Jullumstro, & Lydersen, 2012).
- Allmennsymptomer som asteni ses hos 20 %, mens vekttap på diagnostidspunkt foreligger hos under 10 %.
Noen pasienter kan ha flere ulike symptomer samtidig. Ingen av symptomene er imidlertid spesifikke for kolorektal kreft og opptrer også ved flere andre tilstander i fordøyelsestraktus (Ford et al., 2008).
De aller fleste symptomer har lav sensitivitet og spesifisitet for kolorektal kreft (Bjerregaard, Tottrup, Sorensen, & Laurberg, 2007; Ford et al., 2008). Unntaket er palpabel tumor og mørk rød rektalblødning (Ford et al., 2008). Med økende alder øker den prediktive verdien av symptomene (Hamilton et al., 2009).
15–25 % av alle med kolorektal kreft debuterer under bilde av akutt abdomen med ileus, større blødninger eller tarmperforasjon (Nesbakken & Gaard, 2007) (evidensgrad D). Én av fem (Kreftregisteret, 2009; Steinberg et al., 1986) har spredning ved diagnosetidspunktet, hyppigst til intraabdominale lymfeknuter, peritoneum, lever og lunger, og kan ha symptomer fra disse organene (evidensgrad C).
Klinisk undersøkelse
Klinisk undersøkelse og rektaleksplorasjon (eventuelt rektoskopi) bør utføres da inntil 10 % av alle kolorektale svulster kan påvises ved denne enkle undersøkelsen (Gastroenterological endoscopy, 2002) (evidensgrad D).
Laboratorieprøver
Test for okkult blod i avføring benyttes i mange land ved screening for kolorektal kreft. Immunkjemiske tester (iFOBT) anbefales framfor de gamle kjemiske testene på grunn av bedre sensitivitet og i tillegg økt brukervennlighet (ikke behov for kostrestriksjoner og kun behov for én prøve). Slike tester er sensitive særlig ved gjentatte testrunder og ved lav grenseverdi for positiv prøve.
Immunkjemiske tester anbefales også fremfor kjemiske tester ved utredning av pasienter med tarm-symptomer. En negativ iFOBT vil kunne redusere sannsynligheten for alvorlig sykdom. Kvantitativ iFOBT vil i tillegg ha klinisk nytteverdi ved at mengden av blod korrelerer med alvorlighetsgrad av sykdom, og iFOBT-resultatet kan derfor være til hjelp i vurderingen av hastegrad for koloskopi.
Test for blod i avføringen kan imidlertid ikke erstatte den kliniske vurderingen og ved begrunnet mistanke om kreft i tykk- eller endetarmen skal pasienter henvises til pakkeforløp uavhengig av testresultatet (se kriterier under). Ved opplysning om synlig blod/blødning er det ikke behov for å utføre test for å påvise okkult blod i avføringen.
Anemi er et kardinalfunn ved kreft i tykk- og endetarm og forekommer hyppigere jo lenger proksimalt svulsten er lokalisert. Hemoglobin skal tas ved mistanke om kreft i fordøyelses¬kanalen. Okkult tarmblødning må utelukkes ved tilfeldig påvist jernmangelanemi siden anemi kan være eneste tegn på kreft i tykktarm eller endetarm. CRP og SR kan være normal eller forhøyet, men har ingen plass i primærdiagnostikken. Forhøyet serum alkalisk fosfatase (ALP) kan skyldes lever- eller skjelettmetastaser. Utredning med leverblodprøver bidrar ikke til å diagnostisere primærtumor, men forhøyede verdier kan tyde på metastasering til lever. CEA er ingen screeningprøve for kolorektal kreft.
Referanser:
- Tester for okkult blod i avføring, anbefaling 01.02.2023 v. 1.1 (noklus.no)
- Monahan KJ, Davies MM, Abulafi M, et al Faecal immunochemical testing (FIT) in patients with signs or symptoms of suspected colorectal cancer (CRC): a joint guideline from the Association of Coloproctology of Great Britain and Ireland (ACPGBI) and the British Society of Gastroenterology (BSG) Gut 2022;71:1939-1962.
Pakkeforløp
Det er begrunnet mistanke om kreft i tykk- og endetarm hos pasienter over 40 år med ett eller flere av følgende symptomer eller funn:
- Uavklart blødning fra tarmen
- Funn av tumor eller polypp ved ano-/rektoskopi
- Endring av et ellers stabilt avføringsmønster i over fire uker
Hvis et av de aktuelle symptomer eller funn foreligger, skal det sendes en henvisning merket «Pakkeforløp for tykk- og endetarmskreft». Når et helseforetak mottar en henvising merket «Pakkeforløp tykk- og endetarmskreft» skal det planlegges et utredningsforløp for påvisning av kreft inntil mistanken er bekreftet eller avkreftet.
Pasienter med uspesifikke symptomer uten symptomer fra mage/tarm henvises til Diagnostisk pakkeforløp hvis det er begrunnet mistanke om alvorlig sykdom.
For noen pasienter kan det være nødvendig og riktig at utredningen tar noe lenger tid. Pasientens preferanser og valg kan føre til at forløpstidene fravikes. Der alvorlig komorbiditet eller særlige forhold ved tumor må tas hensyn til med tilleggsutredninger eller forbehandling av pasienten, vil også forløpstidene måtte fravikes. Slike forlengede forløpstider vil vanligvis ikke ha noen negativ konsekvens for behandlingsresutat.
Nasjonalt tarmscreeningprogram
Tarmscreeningprogrammet startet opp i 2022 og ble rullet ut gradvis til å bli et nasjonalt tilbud i 2023. Kvinner og menn inviteres til screening med immunkjemisk påvisning av okkult blod i avføring (iFOBT) annethvert år fra 55 års alder inntil de fyller 65 år. Dersom det påvises blod over grenseverdien (15 µg hemoglobin/g feces) i prøven, blir deltagere henvist til oppfølgende koloskopi på sykehuset. Mer informasjon om programmet finnes på tarmscreening.no.
I Helse Sør-Øst har det siden 2012 pågått en pilotstudie for et nasjonalt screeningprogram, der de inviterte ble randomisert til enten iFOBT eller sigmoidoskopi. Inklusjon av nye deltakere ble avsluttet i 2019. Screeningsentre i piloten er ved Bærum sykehus og Sykehuset Østfold, Moss.
Tykktarmskreft
Sist faglig oppdatert: 20.05.2022
Primærdiagnostikk
Koloskopi er primær metode for utredning av mulig tykktarmskreft. Diagnosen stilles ved biopsi. For opptil 10 % av pasientene vil koloskopi være ufullstendig på grunn av dårlig tømning, smertefull prosedyre, obstruksjon av lumen eller vanskelig instrumentering (Rabeneck et al., 2007).
Bildediagnostiske metoder har fått økende betydning både for primærdiagnostikk og preoperativ kartlegging av erkjent kreft (Dewhurst et al., 2012; N. J. Smith et al., 2007; Tudyka et al., 2014). CT-kolografi har erstattet røntgen av kolon (Atkin et al., 2013), og er nå etablert som en likeverdig metode som koloskopi for deteksjon av lesjoner ≥ 10 mm (Burling & International Collaboration for, 2010; Neri et al., 2013; Pickhardt, Hassan, Halligan, & Marmo, 2011). For små polypper (6–9 mm) faller treffsikkerheten, og koloskopi er foreløpig bedre enn CT-kolografi (Halligan et al., 2005). For å sikre høy kvalitet på CT-kolografi er det viktig å etablere nasjonale kurs og standarder (radfag.no, 2014).
CT-kolografi er ikke bedre tolerert av pasienter sammenlignet med koloskopi (de Wijkerslooth et al., 2012), og pasienter med alarmsymptomer bør primært undersøkes med koloskopi. Hvis tumor påvises ved CT-kolografi, bør koloskopi med biopsi utføres samme dag på samme tarmtømning. Ved ufullstendig koloskopi, vil CT-kolografi kunne kartlegge proksimale tykktarm. Dette bør tilstrebes utført på samme tarmtømning (Hansmann & Burling, 2013).
Mellom 15 og 30 % av pasienter med tykk- og endetarmskreft debuterer med akutte obstruktive symptomer, perforasjon eller blødning (Kolfschoten et al., 2012). CT abdomen og bekken med intravenøs kontrast spiller i denne situasjonen en viktig rolle for å bestemme videre valg av behandling.
Røntgen colon med enkelt-/dobbeltkontrast har ikke lenger noen plass i utredningen av tykk- og endetarmskreft.
Preoperativ utredning
Ved mistanke om kreft i tykktarm vil preoperativ utredning med CT thorax, abdomen og bekken kartlegge TNM status. CT angiografi anbefales inkludert for å kartlegge relevant karanatomi, hvilket er viktig i kirurgenes forberedelse til eventuell laparaskopisk kirurgi CT-kolografi kan inkluderes for å få et detaljert kart over tumor i tykktarm, med eventuell relasjon til synkron tumor og signifikante polypper før valg av strategi ved laparoskopisk reseksjon (M. Gaard, Drolsum A, Vikil E, & V., 2014). Oversikt over TNM og stadieinndeling finnes i kapittel UICC: TNM-klassifisering og stadieinndeling.
Lokal stadieinndeling (T-status)
T-status er en viktig prognostisk faktor (Dighe, Blake, et al., 2010). CT kan differensiere mellom T1-T3/T4 svulster, noe som vil kunne få stor betydning hvis neoadjuvant behandling blir etablert praksis (Foxtrot Collaborative, 2012).
Lokoregionale lymfeknuter (N-status)
Den radiologiske vurderingen av lymfeknuter er fortsatt vanskelig. Bruk av størrelseskriterier har vist seg å være usikker (Dighe, Purkayastha, et al., 2010), men kan, sammen med antall locoregionale lymfeknuter og evt. uregelmessig kontur, være tegn på lymfeknutemetastaser.
Kartlegging av metastaser (M-status)
CT har vist stor nøyaktighet for påvising av metastaser (Leufkens, van den Bosch, van Leeuwen, & Siersema, 2011), der spedning til lever og lunger utgjør de vanligste lokalisasjoner. Spredning til lymfeknuter utenfor reseksjonsområdet, til peritoneum og oment, andre solide organer i abdomen og skjelett inngår i kartleggingen.
Lever: En uavklart leverlesjon vil kunne karakteriseres nærmere med kontrastforsterket ultralyd hvis de akustiske forholdene er gode og lesjonen har en viss størrelse. En fordel med ultralydskontrast er at den også kan gis til pasienter med nyresvikt (Westwood et al., 2013).
Når det forekommer flere uavklarte leverlesjoner, og lesjonene i tillegg er små, er karakteristikk og deteksjon med MR med diffusjon og leverspesifikt kontrastmiddel å foretrekke (Muhi et al., 2011). Ved preoperativ planlegging før metastasekirurgi, er MR en robust metode for deteksjon av metastaser <1 cm, også ved steatose, som forekommer i stor grad etter kjemoterapi (Lafaro, Roumanis, Demirjian, Lall, & Imagawa, 2013).
Lunger: Lungemetastaser kan detekteres med høy sensitivitet med CT Thorax. Selv om spesifisiteten kan være lav (20–74 %), vil en basisundersøkelse være et godt grunnlag for videre oppfølging (Parnaby et al., 2012).
Anbefaling
- Koloskopi med biopsi er primær metode for diagnostikk av tykktarmskreft
- Ved ufullstendig koloskopi er CT-kolografi indisert som komplementær metode (evidensgrad A)
- CT-thorax, abdomen og bekken er basis for vurdering av TNM-status (evidensgrad D).
Endetarmskreft
Sist faglig oppdatert: 20.05.2022
Primærdiagnostikk
Diagnosen stilles som regel ved rektoskopi med biopsi. Svulstens nivå skal anføres med avstand fra svulstens nedre begrensning til ytre analåpning. Radiær utstrekning av svulsten, lengden på svulsten og om den er fiksert eller ikke anføres når dette er mulig. Primærdiagnosen stilles av og til ved bildediagnostiske metoder som CT/MR-bekken, men da oftest som tilfeldig funn. Som for tykktarmskreft er det viktig å sikre histologisk diagnose også hos pasienter som ikke skal opereres, i tilfelle det er aktuelt med onkologisk behandling.
Preoperativ utredning
Nøyaktig preoperativ utredning av endetarmskreft har avgjørende betydning for valg av riktig behandlingsstrategi. For å vurdere overflatiske tumores, T1 versus T2, er endorektal ultralyd fremsdeles ansett som mest nøyaktig. For mer avanserte stadier, er MR førstevalgs metode (evidensgrad A). MR undersøkelsen bør utføres ved sentra som utfører rektumkirurgi og har multidisiplinære team (Burton et al., 2006) (evidensgrad B). Som minste krav, bør det brukes overflatespole og undersøkelsen bør inneholde høyoppløselig 2D T2-vektet seriei 3 plan eller 3D T2W gjennom hele bekkenet, og høyoppløslig T2-vektet serie vinkelrett på tumoraffiserte tarmavsnitt. Ved lave tumores som involverer sfincterapparatet bør det også gjøres en serie parallelt med analkanalen. (MERCURY Study Group, 2006) (evidensgrad B). I tillegg anbefales en transversal diffusjonsvektet serie med minst 2 b-verdier (0-1000).
Målet med undersøkelsen er å identifisere pasienter med økt risiko for lokalt residiv eller metastatisk sykdom, dvs. pasienter med tumor med kort avstand til eller gjennomvekst av den mesorektale fascie (MRF), tumor i nedre rektum, tumor med ekstramural tumordybde > 5 mm (T3c), tumor med ekstramural vene innvekst, mucinøs tumor, spredning til lymfeknuter særlig utenfor MRF og evt affeksjon av den peritoneale omslagsfolden. Utredningen skal munne ut i en radiologisk stadieinndeling i henhold til TNM 8 (TNM: classification of malignant tumors, 2016) med samtidig beskrivelse av tilleggs risikofaktorer som nevnt ovenfor.
Det anbefales bruk av strukturert radiologisk rapport da dette har vist mer konsistent beskrivelse av alle aktuelle parametre (Hansmann & Burling, 2013; Pendse & Taylor, 2013; Rabeneck et al., 2007) (evidensgrad B). Se vedlegg.
Tumors avstand til MRF er en av de viktigste lokale prognostiske faktorer og kan med stor nøyaktighet måles på MR (Al-Sukhni et al., 2012; 2006) (evidensgrad A). Ved vekst gjennom MRF, skal truede eller affiserte anatomiske strukturer beskrives.
Tumors lokalisasjon i rektum har betydning for valg av kirurgisk metode og for prognose da lave tumores (også T2) har økt risiko for lokalt residiv. MR kan med stor nøyaktighet angi avstand fra tumors nedre begrensning til musculus puborectalis (Shihab, Moran, Heald, Quirke, & Brown, 2009). For lave tumores skal evt. innvekst i elementene i sfinkterapparatet og det intersfinkteriske plan angis (Shihab et al., 2009).
Ekstramural tumordybde > 5 mm er en uavhengig prognostisk faktor. Differensiering mellom T2 og tidlig T3 stadium er utfordrende på MR, da det er vanskelig å skille inflammasjon/fibrose fra minimal tumor gjennomvekst. For mer avansert gjennomvekst, har metoden stor nøyaktighet (Tudyka et al., 2014) (evidensgrad A). Den ekstramurale tumordybden skal angis hvis mulig. I tillegg kan man benytte en T3 subklassifikasjon (T3a-d), se vedlegg 2.
Tumor kan innholde varierende mengder mucin. MR har svært høy deteksjonsevne, langt høyere enn histologisk biopsi, for påvisning av mucin (S. K. Yu, Chand, Tait, & Brown, 2014). Tumor med over 50 % mucin har dårligere prognose.
Ekstramural vene innvekst (EMVI) er hyppig forekommende og er en prognostisk faktor uavhengig av tumor stadium. EMVI gir økt risiko for lokalt residiv og metastaser (van de Velde et al., 2014) og bør beskrives med avstand til MRF. MR har moderat nøyaktighet for å identifisere EMVI (N. J. Smith et al., 2008) (evidensgrad B).
Den radiologiske vurderingen av lymfeknuter er fortsatt vanskelig. Bruk av størrelseskriterier har vist seg å være usikker. Man har oppnådd bedre sensitivitet/spesifisitet ved å bruke morfologiske kriterier (G. Brown et al., 2003; J. H. Kim, Beets, Kim, Kessels, & Beets-Tan, 2004) (evidensgrad B). Pga. usikkerheten ved lymfeknutediagnostikk, kan det være hensiktsmessig å karakterisere lymfeknutene som åpenbart maligne, usikre eller benigne. Færre enn 4 maligne lymfeknuter (N1) i mesorektum innebærer liten risiko for lokalt residiv. Pga. moderat/lav diagnostisk nøyaktighet bør usikre mesorektale lymfeknuter ikke ha avgjørende betydning ved valg av preoperativ terapi (Hermanek, Merkel, Fietkau, Rodel, & Hohenberger, 2010). Usikre lymfeknuter utenfor MRF krever derimot ekstra oppmerksomhet da de ikke fjernes ved standard TME. Lymfeknutespesifikke kontrastmidler er under utforskning, men foreløpig er ingen midler klare for klinisk bruk.
MR for responsevaluering gir best resultat når undersøkelsen vurderes av erfarne radiologer (van der Paardt, Zagers, Beets-Tan, Stoker, & Bipat, 2013) (evidensgrad B). Undersøkelsen er anbefalt 6–8 uker etter avsluttet radiokjemoterapi og før kirurgi etter 10–12 uker. MR har høy negativ prediktiv verdi for affeksjon av MRF etter neoadjuvant behandling (U. B. Patel & Brown, 2013) (evidensgrad B). Det er imidlertid ikke klart hvordan man best måler respons og nøyaktigheten for bestemmelse av T stadium har vist seg å være begrenset med en tendens til overstaging. MR kan heller ikke påvise mikroskopiske grupper med tumorceller i fibrosen som oppstår etter behandling (Hole, Larsen, Groholt, Giercksky, & Ree, 2013) (evidensgrad B). Primær MR undersøkelse bør derfor hovedsakelig legges til grunn når reseksjon planlegges. Nyere studier har oppnådd bedret nøyaktighet for T stadium, bl.a ved bruk av diffusjonsvektede sekvenser (DWI), som gjør det lettere å vurdere komplett eller nær komplett respons (van der Paardt et al., 2013). Bruk av en MR-tilpasset tumor regresjonskala, se vedlegg har vist god korrelasjon til histologi og overlevelse (U. B. Patel & Brown, 2013). En fullstendig responsevaluering bør inneholde både klinisk undersøkelse og MR. Det antas at betydningen av responsevaluering kommer til å øke i fremtiden, da det er internasjonale trender mot mer differensiert behandling etter neoadjuvant radiokjemoterapi.
Rektal ultralyd regnes som beste bildemodalitet for å skille mellom premaligne og maligne svulster (Akasu et al., 2000; Starck, Bohe, Simanaitis, & Valentin, 2003), og for stadieinndeling av T1- og T2-svulster (Bipat et al., 2004; Kauer, Prantl, Dittler, & Siewert, 2004) (evidensgrad B). Overstaging av tumorinnvekst forekommer i 0–12 % av tilfellene, understaging er sjeldnere og skyldes oftest mikroskopisk innvekst i perirektalt vev. Ultralydhode med frekvens på 10MHz eller høyere gir mer nøyaktig stadieinndeling enn når lavere frekvenser benyttes (Kauer et al., 2004). Rektal ultralyd er spesielt nyttig i de tilfeller man vurderer å gjøre en lokal reseksjon transanalt. Metoden er også bedre enn MR til evaluering av distale svulster for å avdekke eventuell innvekst i sfinkterapparatet. Metoden har i en meta-analyse vist samme grad av nøyaktighet som MR for vurdering av lymfeknutestatus (Bipat et al., 2004). Metoden er imidlertid svært operatøravhengig, med begrenset mulighet for regranskning om ultralydundersøkelsen ikke er utført med 3-dimensjonal teknikk.
CT bekken er et godt alternativ der MR ikke kan gjennomføres (Dietrich et al., 2006; Dighe, Swift, & Brown, 2008; Recommendations for cross-sectional imaging in cancer management: computed tomography-CT, magnetic resonance imaging-MRI, positron emission tomography-PET-CT, 2006). For høytsittende tumores har den tilnærmet samme nøyaktighet som MR, men er dårligere for vurdering av infiltrasjon i sphincter ani, levator ani og vesiculae seminales/prostata ved lave tumores. Hvis det kun er utført CT bekken bør undersøkelsen vurderes av radiolog som er vant til å vurdere MR rektum.
CT thorax, abdomen og bekken er et nødvendig supplement til MR bekken for kartlegging av fjernmetastaser. Vurdering som ved tykktarmskreft, se over (kapittel Tykktarmskreft, avsnitt Preoperativ utredning).
Anbefaling
- Ano-rektoskopi med biopsi og måling av avstand fra analåpning til nedre kant av tumor skal alltid utføres (evidensgrad D).
- Dedikert høyoppløselig MR-undersøkelse med overflatespole skal utføres i primærutredning av endetarmskreft for TN-stadium (evidensgrad B)
- MR undersøkelsen skal kartlegge tumors lokalisasjon i rektum og tilleggsrisikofaktorer som tumors avstand til MRF, ekstramural tumordybde, EMVI og evt. mucinøs tumor. (evidensgrad B)
- Det anbefales bruk av standardisert, strukturert radiologisk rapport (evidensgrad B)
- Usikre mesorektale lymfeknuter bør ikke tillegges avgjørende betydning ved valg av preoperativ terapi (evidensgrad D)
- På grunn av usikre kriterier for responsevaluering med MR bør primærundersøkelsen primært legges til grunn for planlegging av reseksjon. (evidensgrad D)
- Rektal ultralyd anbefales ved stadieinndeling av T1 og T2 svulster (evidensgrad B)
- CT thorax, abdomen og bekken skal gjøres for M-status. (evidensgrad D)
- Utredning og behandling bør organiseres som et kompakt pasientforløp med standardiserte tidsfrister for alle ledd i prosessen
Perioperativ behandling ved kirurgi for kreft i tykk- og endetarm
Sist faglig oppdatert: 20.05.2022
Den perioperative behandlingen skal minimalisere det operative kirurgi-anestesi traumet samt konsekvensene av dette for å oppnå raskere restitusjon av ulike fysiologiske prosesser, dvs. en bedret rekonvalesens. Evidensbaserte behandlingsprotokoller har vært tilgjengelige i flere år (Fearon et al., 2005; Lassen et al., 2009), og utvidete og fullstendig oppdaterte revisjoner er utarbeidet i 2012–2017 (Gustafsson et al., 2013; Herbert et al., 2017; Ljungqvist, 2014; Nygren et al., 2012).
Disse protokollene oppsummerer beste tilgjengelige evidensgrunnlag og følgende anbefaling for et tyvetalls deler av den perioperative behandlingsprotokollen. Sannsynligvis er ikke alle elementer like avgjørende, men inntil videre er det ikke tilstrekkelig datagrunnlag til å velge ut de mest sentrale. Noen av elementene er tungt dokumenterte generelle rutiner (antibiotikaprofylakse, profylakse mot venøs tromboembolisme), mens andre er basert på svake data og konsensus i ekspertgrupper. Tilnærmingen bør uansett være multimodal og systematisk.
Kapitlet er bygget opp med anbefalinger. Som originalreferanser for de enkelte anbefalingene vises i hovedsak til de siste publiserte arbeidene fra ERAS-gruppen, der dette er systematisk gjennomgått (Gustafsson et al., 2013; Ljungqvist, 2014; Nygren et al., 2012; Zhuang, Ye, Zhang, Chen, & Yu, 2013).
Det er en utfordring å innføre evidensbaserte rutiner som ofte bryter med tradisjonell praksis (Lassen et al., 2005). Dette krever en dedikert lokal plan for implementering og monitorering (Forsmo et al., 2018; Ljungqvist, 2014; Maessen et al., 2007; Zhuang et al., 2013).
Preoperativt
Sist faglig oppdatert: 20.05.2022
Grundig og spesifikk informasjon er vist å være gunstig for rekonvalesens og smertekontroll, spesielt hos engstelige pasienter. Informasjonen bør detaljert forberede pasienten på det kommende sykehusoppholdet og anskueliggjøre pasientens egen rolle i gjenopptreningen (evidensgrad C).
Tarmtømming skal ikke brukes rutinemessig ved reseksjon av tykktarm (konsistent nivå 1-evidens, evidensgrad A) (Guenaga, Matos, & Wille-Jorgensen, 2011; Kaslow, Gani, Alshaikh, & Canner, 2018). Tarmtømming er omstridt ved reseksjoner av endetarm (rektum) (nivå 1 evidens. Nyere studier indikerer at peroral dekontaminering med ikke absorberbart antibiotikum som neomycin sannsynligvis kan redusere antall postoperative sårinfeksjoner og muligens også antall anastomoselekkasjer (McSorley, Steele, & McMahon, 2018). Andre studier (Rollins, Javanmard-Emamghissi, & Lobo, 2018) viser ikke at mekanisk tarmtømming alene reduserer postoperative infeksjoner eller morbiditet, men det er i noen studier sett en tilleggseffekt av mekanisk tarmtømming til peroral dekontaminering (Klinger et al., 2019). Denne tilleggseffekten er det likevel en del usikkerhet knyttet til, og er best dokumentert i de amerikanske registerstudiene hvor det er færre høyresidige hemikolektomier enn i MOBILE studien (Koskenvuo et al., 2019). Det er logisk å benytte tarmtømming der det planlegges reseksjoner av endetarm med avlastende stomi.
Anemi. Hb status inngår i preperativ utredning. Anemi er den hyppigste hematologiske tilstand påvist preperativt, noe som kan medføre peroperativ transfusjon, som igjen er assosiert med øket morbiditet, mortalitet og forlenget hospitalisering. Pasienter bør evalueres så tidlig som mulig preoperativt for å korrigere anemi og lave jernlagre. Dette er spesiellt viktig hos pasienter der man kan forvente et større peroperativt blodtap (Kansagra & Stefan, 2016).
Faste kan reduseres til 2 timer for klare væsker og 6 timer for fast føde (nivå 1 evidens, evidensgrad A) (Brady, Kinn, & Stuart, 2003; Jensen et al., 2010; I. Smith et al., 2011).
Karbohydratrik drikke kan trygt gis i volum på 400 ml (50 g) inntil 2 timer før innledning av anestesi (M. D. Smith et al., 2014; Soop, Nygren, Myrenfors, Thorell, & Ljungqvist, 2001). Dette reduserer preoperativ tørste, sult og engstelse, og den postoperative insulinresistens reduseres (evidensgrad B) (Hausel et al., 2001; M. D. Smith et al., 2014; Soop et al., 2001). Det må gjøres individuell vurdering av pasienter med obstruksjon i øvre gastrointestinaltraktus eller diabetes. Konsistent reduksjon av komplikasjoner er ikke vist.
Premedikasjon bør bare gis etter individuell vurdering og som kortvirkende beroligende midler som ikke forlenger rekonvalesens (evidensgrad A) (Walker & Smith, 2009). Opiater, samt hypnotika og sedativa med lang virkningstid, reduserer mulighet for tidlig fødeinntak og mobilisering postoperativt (Walker & Smith, 2009). Man kan med fordel bruke kortvirkende sedering på operasjonsstuen, for eksempel ved etablering av epidural anestesi.
Tromboseprofylakse bør gis i form av lav-molekylvekt heparin (LMWH) eller ufraksjonert heparin (UHF) subkutant (evidensgrad A). LMWH er enklere å administrere (1 gang per dag). Varighet av tromboseprofylakse er omdiskutert. Det er dokumentert at forlenget profylakse ut over én uke gir ytterligere redusert trombosetendens (Bergqvist et al., 2002; Rasmussen, Jorgensen, & Wille-Jorgensen, 2009), men med raskere mobilisering og økt bruk av laparoskopisk tilgang er tilgjengelig evidens ikke nødvendigvis fullt gyldig.
Det er uklari i hvilken grad LMWH kan øke risiko for epidurale hematomer hos pasienter som får analgesi med epiduralkateter. Det bør være et tidsintervall på minst 12 timer mellom siste LMWH-dose og innstikk/seponering av epiduralkateter (Bergqvist, Lindblad, & Matzsch, 1993; Vandermeulen, Van Aken, & Vermylen, 1994).
Antibiotikaprofylakse mot anaerobe og aerobe mikrober reduserer infeksiøse komplikasjoner etter tykk- og endetarmskirurgi (R. L. Nelson, Gladman, & Barbateskovic, 2014; R. L. Nelson, Glenny, & Song, 2009) og bør gis som en enkelt dose 1 time før knivstart (evidensgrad A) (Bratzler et al., 2004). Ved varighet av inngrep > 3 timer bør antibiotika med kort halveringstid eventuelt administreres på nytt (R. L. Nelson et al., 2014; Song & Glenny, 1998). Det er naturlig å velge etablert effektiv kombinasjon samt reservere nyere preparater for infeksiøse komplikasjoner. Perorale antibiotika gir sannsynligvis adekvat beskyttelse (Bratzler et al., 2004; R. L. Nelson et al., 2014; Song & Glenny, 1998).
Forebygging og behandling av postoperativ kvalme (PONV): Det er rasjonelt å gi optimalt tilbud til alle pasienter med tanke på målsetning om rask mobilisering og matinntak, og viktig å identifisere høyrisikopasienter. Total intravenøs anestesi samt engangsdose deksametason (8–16 mg) og/eller serotoninantagonist reduserer PONV (Kranke & Eberhart, 2011).
Intraoperativt
Sist faglig oppdatert: 20.05.2022
Anestesiprotokoll: Optimal protokoll er ikke fastlagt. Imidlertid er det holdepunkt for at total intravenøs anestesi (TIVA/TCI) gir oppvåkning og mobiliserbar pasient raskere enn tradisjonell balansert anestesi med gass og fentanyl. Narkose suppleres med epidural som legges midt-torakalt (evidensnivå 1 med en viss inkonsistens, evidensgrad A/B), men dette er basert på serier med åpen kirurgi. Lavdoserte epidurale kombinasjonsregimer med lokalanestesi/opioid gitt peroperativt gir mindre frisetting av stresshormoner og mindre postoperativ insulinresistens (Uchida, Asoh, Shirasaka, & Tsuji, 1988), men igjen savnes data for laparaskopisk kirurgi. Sannsynligvis blir det mindre bruk av epiduralanestesi for denne gruppen. Det er utviklet andre og lovende teknikker for perifer blokade ved bukkirurgi (transverse abdominal plane block) (Abdallah, Chan, & Brull, 2012).
Nasogastrisk sonde (ventrikkelsonde) skal ikke benyttes rutinemessig postoperativt ved reseksjoner av tykk- og/eller endetarm (evidensgrad A) (R. Nelson, Edwards, & Tse, 2007).
Forebygging av intraoperativ hypotermi: Målsetning er normoterm pasient ved avslutning av inngrepet. Aktiv varming minsker kirurgisk stress, peroperativ blødning og komplikasjoner (evidensgrad A) (De Witte, Demeyer, & Vandemaele, 2010).
Perioperativ væskebehandling har tradisjonelt medført en vektoppgang på 3–6 kg ved reseksjoner av tykktarm (Lobo et al., 2002). Dette forlenger postoperativ tarmparalyse (evidensgrad A/B) (Lobo et al., 2002), kan svekke anastomosen og redusere vevsoksygenering (Brandstrup et al., 2003; Tambyraja, Sengupta, MacGregor, Bartolo, & Fearon, 2004). Meta-analyse som sammenligner «restriktive» regimer med «liberale» er vanskelig fordi regimene varierer sterkt lokalt. Tilgjengelig dokumentasjon tilsier et regime som sikter mot uendret kroppsvekt (Brandstrup et al., 2003; Lobo et al., 2002; Rahbari et al., 2009). Både hypovolemi og overbelastning med væske og salter er uheldig. Intraoperativ målstyrt («goal-directed») væskestyring er vist å være fordelaktig (Noblett, Snowden, Shenton, & Horgan, 2006; Walsh, Tang, Bass, & Gaunt, 2008) og bør vurderes på individuell basis, særlig hos høy-risikopasienter (evidensgrad A), selv om dokumentasjonen i hovedsak er fra lav-risikopasienter (ASA II). Dog er det usikkert hvor mye dette betyr hvis det benyttes en kombinasjon av et standardisert perioperativt regime med stressreduksjon (Lassen et al., 2009) og laparoskopisk tilgang (Senagore et al., 2009). Målstyrt væsketerapi bidrar til å avklare om væsketilførsel øker kardialt slagvolum, ikke om pasienten er i behov av forbedret perifer oksygenering. Narkose i kombinasjon med epidural gir hypotensjon. Væske bør i slike situasjoner kun gis i den grad det foreligger hypovolemi og evt kombineres med vasopressor i titrert dose for å opprettholde adekvat blodtrykk (Holte et al., 2004). Målsetningen bør være uendret kroppsvekt etter operasjonen slik at man unngår ødem, som blant annet påvirker tarmfunksjon postoperativt (Brandstrup et al., 2003). Pasienter bør motiveres til å dekke sitt væskebehov oralt fra første postoperative dag (evidensgrad B).
Postoperativt
Sist faglig oppdatert: 20.05.2022
Bruk av intraabdominale dren ved anastomoser på tykktarm har ikke vist å redusere antall eller alvorlighetsgrad av lekkasjer og bør ikke brukes rutinemessig (evidensgrad A) (Jesus, Karliczek, Matos, Castro, & Atallah, 2004; Karliczek et al., 2006). Det finnes holdepunkter for at korttidsbruk av dren til bekkenet kan være gunstig etter lav fremre reseksjon av endetarmen (K. C. Peeters et al., 2005).
Suprapubisk urinkateterisering tolereres bedre og gir mindre morbiditet enn transuretralt kateter (McPhail, Abu-Hilal, & Johnson, 2006). De fleste studiene er utført på populasjoner med katetertid på 4–7 dager. Det er derfor tvilsomt om det er forskjeller også for korttidskateterisering (evidensgrad A). Økende bruk av laparoskopisk teknikk og mindre bruk av epiduralt kateter medfører mindre behov for langvarig kateterisering.
Forebygging av postoperativ tarmparalyse. Det er intet prokinetisk preparat på markedet med dokumentert effekt. Epidural analgesi fremfor intravenøs opiatanalgesi er vist å forebygge postoperativ ileus (evidensgrad A) (Guay, Nishimori, & Kopp, 2016; Jorgensen, Wetterslev, Moiniche, & Dahl, 2000; Marret, Remy, Bonnet, & Postoperative Pain Forum, 2007). Overbelastning med salt og væske gir tarmparalyse (se over) og må unngås (evidensgrad A). Oralt magnesiumoksyd er dokumentert å bedre tarmfunksjon etter abdominal hysterektomi og i rapporter fra dedikerte fast-track sentra (Basse, Madsen, Billesbølle, Bardram, & Kehlet, 2003; Basse, Madsen, & Kehlet, 2001) (evidensgrad B). Dette har vært utfordret i nyere studier (J. Andersen et al., 2012). Laparoskopisk tilgang gir raskere reetablering av tarmfunksjon enn åpen kirurgi (Tjandra & Chan, 2006), men dette er ikke validert mot åpen kirurgi med optimaliserte perioperative rutiner.
Postoperativ smertebehandling: Etter åpen kirurgi har epidural smertebehandling 2–3 døgn postoperativt vist å gi optimal virkning ved bruk av lavdosert lokalanestesi/opioid (evidensgrad A/B) (Block et al., 2003; Marret et al., 2007; Zutshi et al., 2005). Systemiske opioder gir sedasjon og økt insidens av kvalme. Epidural har gunstige effekter på kirurgisk stressrespons og bedrer tarmperistaltikk postoperativt (Guay et al., 2016; Jorgensen et al., 2000).
Ikke-opoide analgetika (paracetamol) bør utnyttes optimalt. NSAID har vist å gi redusert opioidbehov etter seponering av epidural og kan brukes i denne perioden hvis det ikke foreligger kontraindikasjoner (J. Andersen, Hjort-Jakobsen, Christiansen, & Kehlet, 2007; Basse, Hjort Jakobsen, Billesbolle, Werner, & Kehlet, 2000; Cepeda et al., 2005). Der er rapportert mulig assosiasjon mellom anastomoselekkasje og bruk av NSAID med overveiende Cox-2 hemmende effekt (Gorissen et al., 2012). Det foreligger ikke etablert konsensus om beste analgesi regime etter laparoskopisk tilgang, men epiduralanestesi brukes i avtagende grad hos disse pasientene.
Postoperativ ernæringsstøtte: Matinntak uten opphold etter reseksjoner av tykk- og endetarm er trygt (evidensgrad A), reduserer risikoen for infeksjoner og liggetid, og øker ikke risikoen for anastomoselekkasje (H. K. Andersen, Lewis, & Thomas, 2006; Han-Geurts et al., 2007; Lewis, Egger, Sylvester, & Thomas, 2001). Underernærte pasienter kan gis næringsdrikker i opp til 8 uker postoperativt for å gjenvinne ernæringsstatus, proteinlagre og livskvalitet (evidensgrad A) (Beattie, Prach, Baxter, & Pennington, 2000). Effekten av postoperative næringsdrikker til elektive pasienter som ikke er underernærte, er omstridt (Hyltander et al., 2005; Smedley et al., 2004).
Tidlig mobilisering: Sengeleie medfører økt insulinresistens, tap av muskelmasse og muskelstyrke, redusert lungefunksjon og lav oksygenering (Kehlet & Wilmore, 2002). Sengeleie øker også risikoen for tromboemboliske komplikasjoner. En pleieplan med daglige mål og en pasientdagbok for mobilisering vil være nyttig. Det er viktig at pasienten er i et miljø som oppmuntrer til tidlig mobilisering (mat og TV utenfor pasientrom). Abdominale dren og urinkateter hindrer mobilisering og bør unngås når det er mulig.
Anbefaling
- Perioperativ behandling bør følge retningslinjer foreslått av ERAS-gruppen (Gustafsson et al., 2013; Lassen et al., 2009; Nygren et al., 2012) slik de er presentert i dette kapitlet (evidensgrad A)
Preoperativt
Sist faglig oppdatert: 20.05.2022
Grundig og spesifikk informasjon er vist å være gunstig for rekonvalesens og smertekontroll, spesielt hos engstelige pasienter. Informasjonen bør detaljert forberede pasienten på det kommende sykehusoppholdet og anskueliggjøre pasientens egen rolle i gjenopptreningen (evidensgrad C).
Tarmtømming skal ikke brukes rutinemessig ved reseksjon av tykktarm (konsistent nivå 1-evidens, evidensgrad A) (Guenaga, Matos, & Wille-Jorgensen, 2011; Kaslow, Gani, Alshaikh, & Canner, 2018). Tarmtømming er omstridt ved reseksjoner av endetarm (rektum) (nivå 1 evidens. Nyere studier indikerer at peroral dekontaminering med ikke absorberbart antibiotikum som neomycin sannsynligvis kan redusere antall postoperative sårinfeksjoner og muligens også antall anastomoselekkasjer (McSorley, Steele, & McMahon, 2018). Andre studier (Rollins, Javanmard-Emamghissi, & Lobo, 2018) viser ikke at mekanisk tarmtømming alene reduserer postoperative infeksjoner eller morbiditet, men det er i noen studier sett en tilleggseffekt av mekanisk tarmtømming til peroral dekontaminering (Klinger et al., 2019). Denne tilleggseffekten er det likevel en del usikkerhet knyttet til, og er best dokumentert i de amerikanske registerstudiene hvor det er færre høyresidige hemikolektomier enn i MOBILE studien (Koskenvuo et al., 2019). Det er logisk å benytte tarmtømming der det planlegges reseksjoner av endetarm med avlastende stomi.
Anemi. Hb status inngår i preperativ utredning. Anemi er den hyppigste hematologiske tilstand påvist preperativt, noe som kan medføre peroperativ transfusjon, som igjen er assosiert med øket morbiditet, mortalitet og forlenget hospitalisering. Pasienter bør evalueres så tidlig som mulig preoperativt for å korrigere anemi og lave jernlagre. Dette er spesiellt viktig hos pasienter der man kan forvente et større peroperativt blodtap (Kansagra & Stefan, 2016).
Faste kan reduseres til 2 timer for klare væsker og 6 timer for fast føde (nivå 1 evidens, evidensgrad A) (Brady, Kinn, & Stuart, 2003; Jensen et al., 2010; I. Smith et al., 2011).
Karbohydratrik drikke kan trygt gis i volum på 400 ml (50 g) inntil 2 timer før innledning av anestesi (M. D. Smith et al., 2014; Soop, Nygren, Myrenfors, Thorell, & Ljungqvist, 2001). Dette reduserer preoperativ tørste, sult og engstelse, og den postoperative insulinresistens reduseres (evidensgrad B) (Hausel et al., 2001; M. D. Smith et al., 2014; Soop et al., 2001). Det må gjøres individuell vurdering av pasienter med obstruksjon i øvre gastrointestinaltraktus eller diabetes. Konsistent reduksjon av komplikasjoner er ikke vist.
Premedikasjon bør bare gis etter individuell vurdering og som kortvirkende beroligende midler som ikke forlenger rekonvalesens (evidensgrad A) (Walker & Smith, 2009). Opiater, samt hypnotika og sedativa med lang virkningstid, reduserer mulighet for tidlig fødeinntak og mobilisering postoperativt (Walker & Smith, 2009). Man kan med fordel bruke kortvirkende sedering på operasjonsstuen, for eksempel ved etablering av epidural anestesi.
Tromboseprofylakse bør gis i form av lav-molekylvekt heparin (LMWH) eller ufraksjonert heparin (UHF) subkutant (evidensgrad A). LMWH er enklere å administrere (1 gang per dag). Varighet av tromboseprofylakse er omdiskutert. Det er dokumentert at forlenget profylakse ut over én uke gir ytterligere redusert trombosetendens (Bergqvist et al., 2002; Rasmussen, Jorgensen, & Wille-Jorgensen, 2009), men med raskere mobilisering og økt bruk av laparoskopisk tilgang er tilgjengelig evidens ikke nødvendigvis fullt gyldig.
Det er uklari i hvilken grad LMWH kan øke risiko for epidurale hematomer hos pasienter som får analgesi med epiduralkateter. Det bør være et tidsintervall på minst 12 timer mellom siste LMWH-dose og innstikk/seponering av epiduralkateter (Bergqvist, Lindblad, & Matzsch, 1993; Vandermeulen, Van Aken, & Vermylen, 1994).
Antibiotikaprofylakse mot anaerobe og aerobe mikrober reduserer infeksiøse komplikasjoner etter tykk- og endetarmskirurgi (R. L. Nelson, Gladman, & Barbateskovic, 2014; R. L. Nelson, Glenny, & Song, 2009) og bør gis som en enkelt dose 1 time før knivstart (evidensgrad A) (Bratzler et al., 2004). Ved varighet av inngrep > 3 timer bør antibiotika med kort halveringstid eventuelt administreres på nytt (R. L. Nelson et al., 2014; Song & Glenny, 1998). Det er naturlig å velge etablert effektiv kombinasjon samt reservere nyere preparater for infeksiøse komplikasjoner. Perorale antibiotika gir sannsynligvis adekvat beskyttelse (Bratzler et al., 2004; R. L. Nelson et al., 2014; Song & Glenny, 1998).
Forebygging og behandling av postoperativ kvalme (PONV): Det er rasjonelt å gi optimalt tilbud til alle pasienter med tanke på målsetning om rask mobilisering og matinntak, og viktig å identifisere høyrisikopasienter. Total intravenøs anestesi samt engangsdose deksametason (8–16 mg) og/eller serotoninantagonist reduserer PONV (Kranke & Eberhart, 2011).
Intraoperativt
Sist faglig oppdatert: 20.05.2022
Anestesiprotokoll: Optimal protokoll er ikke fastlagt. Imidlertid er det holdepunkt for at total intravenøs anestesi (TIVA/TCI) gir oppvåkning og mobiliserbar pasient raskere enn tradisjonell balansert anestesi med gass og fentanyl. Narkose suppleres med epidural som legges midt-torakalt (evidensnivå 1 med en viss inkonsistens, evidensgrad A/B), men dette er basert på serier med åpen kirurgi. Lavdoserte epidurale kombinasjonsregimer med lokalanestesi/opioid gitt peroperativt gir mindre frisetting av stresshormoner og mindre postoperativ insulinresistens (Uchida, Asoh, Shirasaka, & Tsuji, 1988), men igjen savnes data for laparaskopisk kirurgi. Sannsynligvis blir det mindre bruk av epiduralanestesi for denne gruppen. Det er utviklet andre og lovende teknikker for perifer blokade ved bukkirurgi (transverse abdominal plane block) (Abdallah, Chan, & Brull, 2012).
Nasogastrisk sonde (ventrikkelsonde) skal ikke benyttes rutinemessig postoperativt ved reseksjoner av tykk- og/eller endetarm (evidensgrad A) (R. Nelson, Edwards, & Tse, 2007).
Forebygging av intraoperativ hypotermi: Målsetning er normoterm pasient ved avslutning av inngrepet. Aktiv varming minsker kirurgisk stress, peroperativ blødning og komplikasjoner (evidensgrad A) (De Witte, Demeyer, & Vandemaele, 2010).
Perioperativ væskebehandling har tradisjonelt medført en vektoppgang på 3–6 kg ved reseksjoner av tykktarm (Lobo et al., 2002). Dette forlenger postoperativ tarmparalyse (evidensgrad A/B) (Lobo et al., 2002), kan svekke anastomosen og redusere vevsoksygenering (Brandstrup et al., 2003; Tambyraja, Sengupta, MacGregor, Bartolo, & Fearon, 2004). Meta-analyse som sammenligner «restriktive» regimer med «liberale» er vanskelig fordi regimene varierer sterkt lokalt. Tilgjengelig dokumentasjon tilsier et regime som sikter mot uendret kroppsvekt (Brandstrup et al., 2003; Lobo et al., 2002; Rahbari et al., 2009). Både hypovolemi og overbelastning med væske og salter er uheldig. Intraoperativ målstyrt («goal-directed») væskestyring er vist å være fordelaktig (Noblett, Snowden, Shenton, & Horgan, 2006; Walsh, Tang, Bass, & Gaunt, 2008) og bør vurderes på individuell basis, særlig hos høy-risikopasienter (evidensgrad A), selv om dokumentasjonen i hovedsak er fra lav-risikopasienter (ASA II). Dog er det usikkert hvor mye dette betyr hvis det benyttes en kombinasjon av et standardisert perioperativt regime med stressreduksjon (Lassen et al., 2009) og laparoskopisk tilgang (Senagore et al., 2009). Målstyrt væsketerapi bidrar til å avklare om væsketilførsel øker kardialt slagvolum, ikke om pasienten er i behov av forbedret perifer oksygenering. Narkose i kombinasjon med epidural gir hypotensjon. Væske bør i slike situasjoner kun gis i den grad det foreligger hypovolemi og evt kombineres med vasopressor i titrert dose for å opprettholde adekvat blodtrykk (Holte et al., 2004). Målsetningen bør være uendret kroppsvekt etter operasjonen slik at man unngår ødem, som blant annet påvirker tarmfunksjon postoperativt (Brandstrup et al., 2003). Pasienter bør motiveres til å dekke sitt væskebehov oralt fra første postoperative dag (evidensgrad B).
Postoperativt
Sist faglig oppdatert: 20.05.2022
Bruk av intraabdominale dren ved anastomoser på tykktarm har ikke vist å redusere antall eller alvorlighetsgrad av lekkasjer og bør ikke brukes rutinemessig (evidensgrad A) (Jesus, Karliczek, Matos, Castro, & Atallah, 2004; Karliczek et al., 2006). Det finnes holdepunkter for at korttidsbruk av dren til bekkenet kan være gunstig etter lav fremre reseksjon av endetarmen (K. C. Peeters et al., 2005).
Suprapubisk urinkateterisering tolereres bedre og gir mindre morbiditet enn transuretralt kateter (McPhail, Abu-Hilal, & Johnson, 2006). De fleste studiene er utført på populasjoner med katetertid på 4–7 dager. Det er derfor tvilsomt om det er forskjeller også for korttidskateterisering (evidensgrad A). Økende bruk av laparoskopisk teknikk og mindre bruk av epiduralt kateter medfører mindre behov for langvarig kateterisering.
Forebygging av postoperativ tarmparalyse. Det er intet prokinetisk preparat på markedet med dokumentert effekt. Epidural analgesi fremfor intravenøs opiatanalgesi er vist å forebygge postoperativ ileus (evidensgrad A) (Guay, Nishimori, & Kopp, 2016; Jorgensen, Wetterslev, Moiniche, & Dahl, 2000; Marret, Remy, Bonnet, & Postoperative Pain Forum, 2007). Overbelastning med salt og væske gir tarmparalyse (se over) og må unngås (evidensgrad A). Oralt magnesiumoksyd er dokumentert å bedre tarmfunksjon etter abdominal hysterektomi og i rapporter fra dedikerte fast-track sentra (Basse, Madsen, Billesbølle, Bardram, & Kehlet, 2003; Basse, Madsen, & Kehlet, 2001) (evidensgrad B). Dette har vært utfordret i nyere studier (J. Andersen et al., 2012). Laparoskopisk tilgang gir raskere reetablering av tarmfunksjon enn åpen kirurgi (Tjandra & Chan, 2006), men dette er ikke validert mot åpen kirurgi med optimaliserte perioperative rutiner.
Postoperativ smertebehandling: Etter åpen kirurgi har epidural smertebehandling 2–3 døgn postoperativt vist å gi optimal virkning ved bruk av lavdosert lokalanestesi/opioid (evidensgrad A/B) (Block et al., 2003; Marret et al., 2007; Zutshi et al., 2005). Systemiske opioder gir sedasjon og økt insidens av kvalme. Epidural har gunstige effekter på kirurgisk stressrespons og bedrer tarmperistaltikk postoperativt (Guay et al., 2016; Jorgensen et al., 2000).
Ikke-opoide analgetika (paracetamol) bør utnyttes optimalt. NSAID har vist å gi redusert opioidbehov etter seponering av epidural og kan brukes i denne perioden hvis det ikke foreligger kontraindikasjoner (J. Andersen, Hjort-Jakobsen, Christiansen, & Kehlet, 2007; Basse, Hjort Jakobsen, Billesbolle, Werner, & Kehlet, 2000; Cepeda et al., 2005). Der er rapportert mulig assosiasjon mellom anastomoselekkasje og bruk av NSAID med overveiende Cox-2 hemmende effekt (Gorissen et al., 2012). Det foreligger ikke etablert konsensus om beste analgesi regime etter laparoskopisk tilgang, men epiduralanestesi brukes i avtagende grad hos disse pasientene.
Postoperativ ernæringsstøtte: Matinntak uten opphold etter reseksjoner av tykk- og endetarm er trygt (evidensgrad A), reduserer risikoen for infeksjoner og liggetid, og øker ikke risikoen for anastomoselekkasje (H. K. Andersen, Lewis, & Thomas, 2006; Han-Geurts et al., 2007; Lewis, Egger, Sylvester, & Thomas, 2001). Underernærte pasienter kan gis næringsdrikker i opp til 8 uker postoperativt for å gjenvinne ernæringsstatus, proteinlagre og livskvalitet (evidensgrad A) (Beattie, Prach, Baxter, & Pennington, 2000). Effekten av postoperative næringsdrikker til elektive pasienter som ikke er underernærte, er omstridt (Hyltander et al., 2005; Smedley et al., 2004).
Tidlig mobilisering: Sengeleie medfører økt insulinresistens, tap av muskelmasse og muskelstyrke, redusert lungefunksjon og lav oksygenering (Kehlet & Wilmore, 2002). Sengeleie øker også risikoen for tromboemboliske komplikasjoner. En pleieplan med daglige mål og en pasientdagbok for mobilisering vil være nyttig. Det er viktig at pasienten er i et miljø som oppmuntrer til tidlig mobilisering (mat og TV utenfor pasientrom). Abdominale dren og urinkateter hindrer mobilisering og bør unngås når det er mulig.
Anbefaling
- Perioperativ behandling bør følge retningslinjer foreslått av ERAS-gruppen (Gustafsson et al., 2013; Lassen et al., 2009; Nygren et al., 2012) slik de er presentert i dette kapitlet (evidensgrad A)
Kirurgisk behandling av tykktarmskreft uten metastaser
Sist faglig oppdatert: 20.05.2022
Kunnskapen om behandling av tykktarmskreft er i hovedsak basert på kohortstudier av varierende kvalitet og det er gjennomført få prospektive randomiserte studier. I tillegg har kirurgisk praksis og kunnskap om tykktarmens kar- og lymfeanatomi ledet fram til den behandlingsteknikk og de anbefalinger vi har i dag (Vogel et al., 2022). Høyre kolons krøs har større variasjoner i karanatomi, og den mesokoliske disseksjon er derfor mer krevende enn ved venstresidig tykktarmskreft. Det er også holdepunkt for at høyre- og venstresidige svulster i tykktarmen har ulik tumorbiologi.
Dersom preoperativ utredning indikerer kurativt siktemål, må det tilstrebes en onkologisk adekvat kirurgisk prosedyre. Dette innebærer reseksjon av tumorbærende tarmsegment med adekvate marginer og reseksjon av intakt mesokolon med regionale lymfeknuter.
Generelt om kirurgi
Sist faglig oppdatert: 20.12.2023
Omfanget av lymfeknutedisseksjon
I Norge har en tradisjonelt brukt følgende terminologi for å beskrive omfanget av lymfeknutedisseksjon: D2-, komplett D2- og D3-disseksjon. Det skal som et minimum utføres en komplett D2-disseksjon ved alle inngrep med kurativt siktemål (evidensgrad D). Komplett D2-disseksjon ved høyresidig hemikolektomi defineres som fjerning av lymfeknuter som ligger i mesenteriet frem til avgangen av den regionale karforsyningen på venesiden. Ved høyresidige svulster tilsvarer dette disseksjon langs høyre kant av vena mesenterica superior. Standard ved venstresidige svulster har vært at arteria mesenterica inferior settes av 1 cm fra aorta, dette tilsvarer D3 disseksjon. Komplett mesokolisk eksisjon (CME) innebærer at mesenteriet fjernes i korrekt sjikt baktil og bringes uskadet ut av pasienten, se punkt "Disseksjon rundt primærtumor / mesokolisk plan". I Europa brukes CME som betegnelse på inngrepet som gjøres og sentral vaskulær ligatur (CVL) betyr sentral avsetning av arterier til preparatet (Tejedor et al., 2022).
Omfanget av tarmreseksjon
Vanlig praksis har vært å fjerne tumorbærende tarmsegment med 10 cm fri margin oralt og distalt, men 5 cm margin er vurdert å være tilstrekkelig i tykktarm (Smith et al., 2010) (evidensgrad D), og 5 cm fri distal margin er akseptert som tilstrekkelig ved endetarmskreft. Ut fra onkologiske hensyn anbefales 10 cm fri margin langs tarmrøret og de perikoliske lymfeknuter i alle segmenter av tykktarm, unntatt ved cancer i rektosigmoideovergangen, der 5 cm fri distal margin er tilstrekkelig.
Reseksjonens omfang vil i tillegg være bestemt av karanatomi og sirkulasjonsforholdene i tarmen etter at lymfeknutedisseksjonen og sentral karavsetning er gjennomført, se figur 1. Avvik fra standardreseksjoner skal dokumenteres i operasjonsbeskrivelsen.
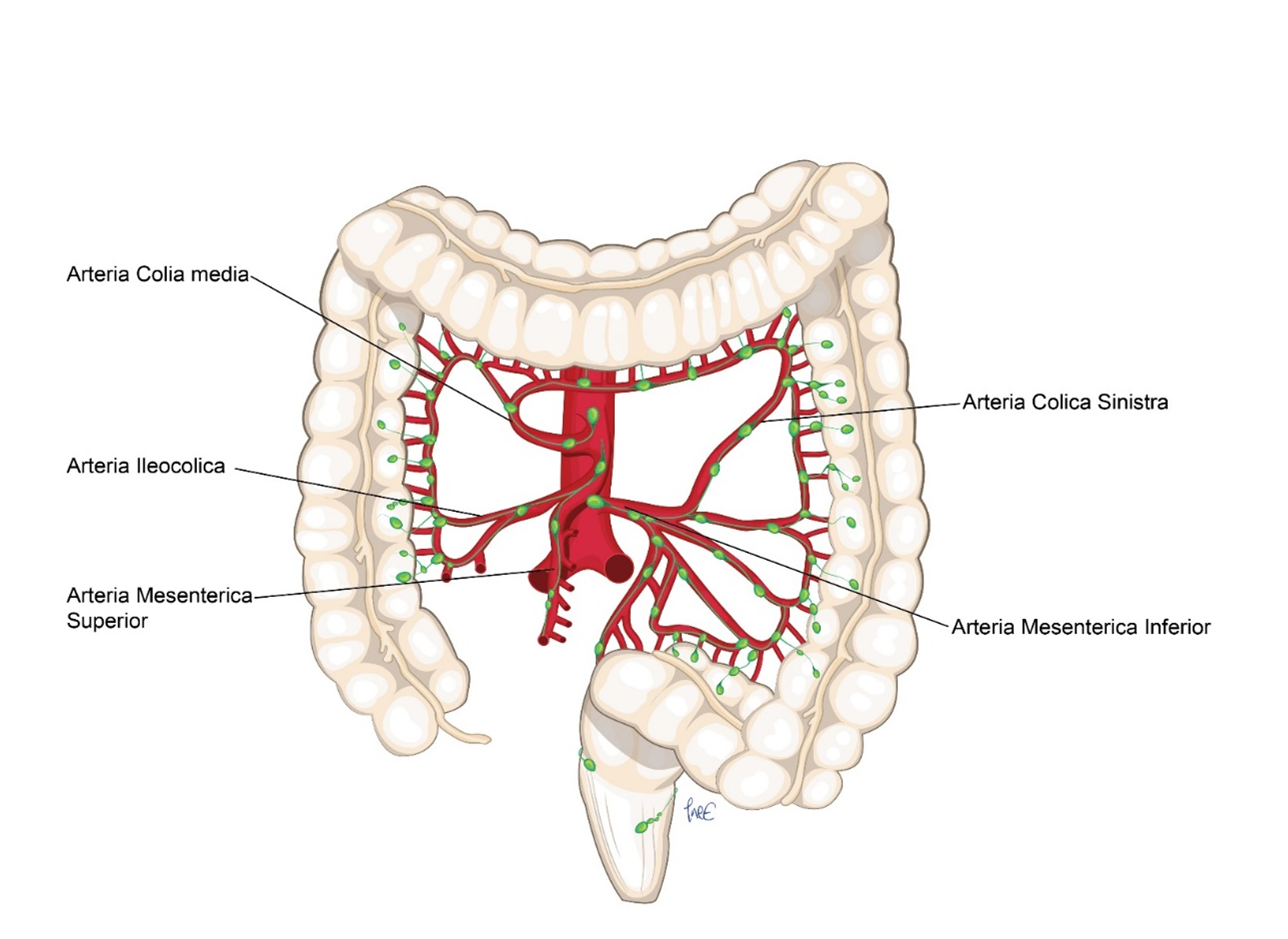
Disseksjon rundt primærtumor / mesokolisk plan
I alle tykktarmsavsnitt finnes et definert anatomisk plan retroperitonealt. Dette planet går i et virtuelt hulrom mellom den viscerale fascien på baksiden av mesokolon og den parietale fascien som avgrenser retroperitoneum. Ved nøyaktig disseksjon kan dette planet følges rundt hele tykktarmens forløp, og når tarmen da er mobilisert fram, vil man ha en intakt mesokolon og tykktarm som inneholder primærtumor, alle lymfekar og lymfeknuter samt blodkarene. Fremre del av et slikt kirurgisk-onkologisk preparat er kledd av peritoneum. Denne disseksjonen rundt primærtumor og tilhørende tarmkrøs benevnes komplett mesokolisk eksisjon (complete mesocolic excision, CME) Foreløpig er det ikke godt dokumentert at rutinemessig disseksjon av de helt sentrale lymfeknuter er assosiert med bedre langtidsoverlevelse (Palmeri et al., 2022).
Patologisk vurdering av operasjonspreparatet med tanke på kirurgisk kvalitet er imidlertid vanskelig, viser stor variasjon og kan ikke brukes til å sammenlikne ulike sykehus (Munkedal et al., 2016).
Dersom tumor infiltrerer i naboorganer, må reseksjonen utføres som en bloc-reseksjon som innbefatter både primærtumor og hele eller deler av infiltrerte naboorgan(er) som ett preparat, og uten å blottlegge tumorvev. Ved R0 en bloc-reseksjon kan en oppnå tilnærmet samme langtidsresultat som for svulster som ikke infiltrerer i naboorganer (Croner et al., 2009). Hvis en dissekerer inn i tumorvev, forverres prognosen dramatisk (Hunter et al., 1987). Ved tvil om man har oppnådd frie reseksjonsrender, bør det tas biopsi av gjenværende vev (randbiopsier). Områder med suspekt gjenværende tumorvev som ikke kan fjernes, bør merkes med metall-klips med tanke på eventuell senere strålebehandling.
Iatrogen, tumornær tarmperforasjon forekommer sjeldent ved tykktarmskreft. Det er vanligere at tumor perforerer preoperativt. Perforasjon innebærer dårligere prognose.
Spesielle forhold ved høyresidig tykktarmskreft
Karanatomien til høyre colon varierer vesentlig mer enn til venstre del av tykktarmen. Med forholdene nevnt under kapittel 9.1.1 anbefales at man ved høyre hemikolektomi minimum dissekerer langs høyre kant av vena mesenterica superior (VMS) for sikker identifisering av ileocolica-karene som da kan settes av på høyre side av VMS, og deretter dissekerer langs venen (VMS) mot kranialt og setter av høyre gren av arteria colica media på nivå med avgangen. Arteria colica dextra foreligger sjeldent og deles også på høyre side av VMS. Operasjonen betegnes som komplett D2 disseksjon, se figur 2.
.png)
Hvis preoperativ CT viser sikre maligne lymfeknuter i D3 området uten fjernmetastaser bør en vurdere å operere pasienten på sykehus som utfører utvidet lymfadenektomi i D3 området. Det er ingen konsensus med tanke på omfanget av D3 disseksjon ved høyresidig hemikolektomi. Noen definerer D3 disseksjonen til å omfatte lymfevevet til frem til venstre side av arteria mesenterica superior, men den mest utbredte oppfatning er å dissekere til venstre margin av vena mesenterica superior, se figur 3 og 4, og tabell 1. På grunn av variasjoner på karanatomien kan preoperativ CT med karrekonstruksjon utføres for å bidra til planlegging av optimal kirurgi.
.png)
.png)
| CME plan | SMV frigjort | Trunk of Henle frigjort | Vaskulær ligatur | SMA frigjort | Surgical trunk |
D2 | Ja | Nei | Nei | Til høyre for SMV | Nei | Inkomplett |
Komplett D2 | Ja | Lateralt | Ja/Nei | Til høyre for SMV | Nei | Inkomplett |
CME/CVL | Ja | Ja | Ja | Sentralt | Nei | Komplett |
D3 | Ja | Ja | Ja | Sentralt | Ja | Komplett |
|
|
|
|
|
|
|
Tabell 1: Tabellen gir en oversikt over definisjoner og terminologi vedrørende kirurgisk radikalitet ved høyresidig hemikolektomi. CME= komplett mesokolisk eksisjon, CVL= sentral vaskulær ligatur, SMV=Vena mesenterica superior, SMA=Arteria mesenterica superior, Surgical trunk = Den delen av lymfatisk drenasje som ligger semisirkulært rundt mesenterialroten.
Ved cancer i høyre flexur anbefales utvidet høyresidig hemikolektomi med sentral avsetning av arteria colica media, se figur 5. Ved cancer i kolon transversum anbefales karavsetning og lymfeknutedisseksjon som vist i figur 6.
.png)
.png)
Spesielle forhold ved kreft i venstre fleksur
Arteriell blodtilførsel til svulster i miltfleksuren kommer fra arteria colica media (ACM, eller grener utgående fra ACM) og/eller arteria colica sinistra (ACS, utgående fra arteria mesenterica inferior, IMA). Man antar at lymfeknutedrenasjen fra miltfleksuren følger arteriell blodforsyning.
Det er uavklart hva slags operative konsekvenser variasjonen i blodtilførsel til miltfleksuren får. Det er ikke påvist økt overlevelse (sykdomsfri eller total overlevelse) ved mer sentral karligering med avsetning av ACM ved utløpet fra arteria mesenterica superior. Selv om man i enkelte tilfeller har påvist lymfeknutespredning til høyre sides lymfeknutestasjoner, viser metaanalyser ingen gevinst ved subtotal kolektomi.
Anbefaling:
Ved svulster i miltfleksuren, anbefales segmentektomi med 10 cm proximal og distal rand. Operatøren setter av arteria colica sinistra ved utløpet av arteria mesenterica inferior, for å få med distale lymfeknuter. Man fridissekerer vena mesenterica inferior, før venen settes av. Videre setter man av venstre sides arteria colica media rett etter delingsstedet (bifurkaturen), se figur 7. Hos overvektige pasienter med trangt krøs, kan subtotal kolektomi vurderes, for å unngå tensjon i anastomosen (Andersen et al., 2022; Crippa et al., 2021; Degiuli et al., 2020; Hamabe et al., 2018; Manceau et al., 2018; Martínez-Pérez et al., 2017; Miyake et al., 2018).
.png)
Spesielle forhold ved kreft i sigmoideum
Det er i nyere studier ikke påvist bedre kirurgisk eller onkologisk overlevelse ved å sette av arteria mesenterica inferior sentralt. Flere studier peker på at en kan spare arteria colica sinistra men utføre glandelfjerning rundt avgangen av arteria mesenterica inferior (Palmeri et al., 2022).
Operasjonsbeskrivelse
Operasjonsbeskrivelsen bør inneholde detaljerte opplysninger om den onkologiske lymfovaskulære disseksjonen, og en evaluering av operasjonspreparatet før dette fikseres og videresendes patologen.
Følgende punkter bør beskrives:
- Hvilket tarmsegment er fjernet og reseksjonsmarginer langs tarmrøret
- Nivå for karavsetning
- Standard eller utvidet / modifisert disseksjon
- Intakt, mindre rifter eller dypere skader på mesokolisk fascie
- Som dokumentasjon på komplett karnær disseksjon kan foto vedlegges
Laparoskopisk kirurgi
Store randomiserte studier har vist at laparoskopisk og åpen tykktarmsreseksjon er likeverdige når det gjelder det onkologiske resultat og komplikasjoner (Colon Cancer Laparoscopic or Open Resection Study Group et al., 2009; Fleshman et al., 2007; Guillou et al., 2005; Hazebroek et al., 2002; Jayne et al., 2010; Kuhry et al., 2005; NICE, 2021) (evidensgrad A). En norsk studie viser at laparoskopisk kirurgi ga samme relative overlevelse som åpen tilgang ved elektiv operasjon for svulster i stadium I-III (Stormark et al., 2016). Laparoskopisk kirurgi gir færre sårinfeksjoner og bukveggsbrokk, og også kortere liggetid og raskere rekonvalesens enn åpen prosedyre selv om forskjellen er liten dersom åpen kirurgi blir utført i henhold til for eksempel ERAS protokoller for akselerert pasientforløp (Kuhry et al., 2008).
Anbefalinger:
- Ved tykktarmskreft anbefales reseksjon av tumorbærende tarmsegment med 10 cm fri margin, men ved tumor i rektosigmoidovergangen er 5 cm distal margin tilstrekkelig (evidensgrad D).
- Tarmreseksjonens omfang vil som regel være bestemt av sirkulasjonsforholdene i tarmen etter gjennomført lymfeknutedisseksjon med tilhørende deling av karene (evidensgrad D).
- For å kartlegge karanatomien preoperativt kan det utføres CT med karrekonstruksjon
- Inngrep med kurativt siktemål for tykktarmskreft skal gjøres med minimum en komplett D2 reseksjon (evidensgrad D).
- Disseksjon rundt primærtumor og tilhørende tarmkrøs gjøres nøyaktig og i det mesokoliske plan (evidensgrad D). Dersom planet er brutt av tumorvev, må det utføres utvidet en bloc reseksjon (evidensgrad D).
- Operasjonsbeskrivelsen bør inneholde detaljerte opplysninger om den onkologiske, lymfovaskulære disseksjonen, og en evaluering av operasjonspreparatet før dette fikseres og videresendes patologen
Akutt presentasjon
Sist faglig oppdatert: 20.12.2023
Om lag 15–25 % av alle pasienter med tykktarmskreft innlegges akutt på grunn av ileus (flertallet), perforasjon (sjeldnere) eller større blødning (svært sjelden). Mortaliteten er høy (10–25 %), og morbiditet svært høy (> 50 %) ved akutt operasjon, enten det utføres reseksjon eller kun avlastning (Jestin et al., 2005; McArdle et al., 2004; Phillips et al., 1985; Sjo et al., 2009; Umpleby et al., 1984). En betydelig del av akutte pasienter har høy alder, komorbiditet og er skrøpelige. Det er viktig å tilpasse behandlingen til pasientens fysiologiske reserver og egne preferanser.
Perforasjon
Perforasjon kan skje til fri bukhule, enten i tumorområdet (sjelden) eller i cøkum pga dilatasjon ved tykktarmsileus. Disse pasientene må opereres straks. Vanligvis gjøres reseksjon av tumorbærende tarmsegment, inkludert sirkulatorisk påvirket tarm uten primær anastomose.
Perforasjon med lokalisert perikolisk abscess kan dreneres radiologisk og evt. opereres sekundært når infeksjonen er sanert.
Intestinal obstruksjon
Ved intestinal obstruksjon må man vurdere hvor mye det haster med avlastning. Obstruksjon utvikler seg gjerne langsomt, og ofte er umiddelbar avlastning ikke nødvendig.
Dersom det er medisinsk forsvarlig å vente, bør man sørge for at kompetent kolorektal kirurg er tilgjengelig ved operasjonen, og det kan være aktuelt å overflytte pasienten til større sykehus med nødvendig kompetanse.
Graden av hast avhenger av hvor dilatert tykktarmen er (CT), om ileocøkalklaffen tillater dilatasjon av tynntarm (tykktarms-distensjonen skjer da langsomt). Klinisk er allmenntilstand og ømhet over cøkum viktig.
Kontrast pr rektum vil vise om, og hvor det foreligger stenose. Ved mistanke om obstruerende tumor i colon/rectosigmoid overgang anbefales å utføre CT abdomen/bekken med rektal kontrast.
Høyresidig tykktarmsileus (tumor i høyre side og transverum)
Pasienten behandles med høyresidig hemikolektomi (evt. utvidet) og primær anastomose. Ileostomi uten anastomosering anlegges om pasientens allmenntilstand og tilleggssykdommer tilsier dette. Mortalitet anslås til ca. 10 % (Lee et al., 2001). Eventuelt kan bypass eller ileostomi gjøres dersom reseksjon ikke er mulig.
Venstresidig tykktarmsileus
Det er to hovedalternativer for behandling, akutt operasjon eller stenting for dekompresjon av tarmen. Akutt kirurgi medfører øket risiko for komplikasjoner, mens stenting kan ha onkologisk negative effekter med fare for stentperforasjon (CReST Collaborative Group, 2022).
Hos pasienter i god allmenntilstand anbefales akutt operasjon, hos pasienter i tydelig redusert allmenntilstand og med høy risiko ved akutt operasjon anbefales stenting.
Det er ikke godt avklart om prognosen bedres ved staget prosedyre; akutt avlastning med stomi eller stent (Vogel et al., 2022). Deretter i senere prosedyre reseksjon med anastomose eller stomi avhengig av pasientens aktuelle tilstand. De amerikanske retningslinjene anbefaler to-staget tilnærming.
Akutt operasjon
Det er tre hovedmetoder:
- Reseksjon med anastomose. Anastomoseproblemer kan reduseres ved å utføre enten
- subtotal kolektomi med ileosigmoidal/ileorektal anastomose (Tilney et al., 2007). Dette er vanlig metode i Norge og kan anbefales hos pasienter med god allmenntilstand.
- Reseksjon uten anastomose (Hartmanns prosedyre) (Koruth et al., 1985; Single-stage treatment for malignant left-sided colonic obstruction: a prospective randomized clinical trial comparing subtotal colectomy with segmental resection following intraoperative irrigation. The SCOTIA Study Group. Subtotal Colectomy versus On-table Irrigation and Anastomosis, 1995). Redusert allmenntilstand, samt forhold som taler for kortere operasjonstid og mot anastomose kan tilsi valg av Hartmann.
- Unntaksvis vil proksimal avlastende stomi eller bypass være eneste alternativ hos skrøpelige pasienter. Det kan for høyrisiko pasienter gjøres i lokal/epidural anestesi.
Stenting
Stent kan benyttes som «bro» til senere kirurgi for pasienter med sterkt forhøyet risiko for perioperativ mortalitet knyttet til primær operasjon eller mulige komplikasjoner. Stent anbefales også hos pasienter med metastatisk sykdom der rask oppstart av palliativ kjemoterapi er indisert.
Stenting skal imidlertid kun vurderes når tumors lokalisasjon ut fra CT synes å tillate grei innføring av guidewire og korrekt plassering av stent. Stentprosedyre skal gjøres med største forsiktighet, og blokking av tumorområdet skal aldri gjøres (van Hooft et al., 2020).
Anbefalinger:
- Ved perforasjon må pasienter opereres.
- Stent eller avlastende stomi kan benyttes som «bro» til senere kirurgi for pasienter med sterkt forhøyet risiko for perioperativ mortalitet knyttet til primær operasjon eller mulige komplikasjoner.
Palliative tiltak hos pasienter med metastasert sykdom, eller som ikke tåler reseksjon av andre grunner
Sist faglig oppdatert: 20.12.2023
Om lag 20% av pasientene med colon cancer, har metastasert sykdom ved diagnosetidspunkt. De fleste har multiple metastaser og kun få kan tilbys metastasekirurgi i forbindelse med primærbehandlingen (Angelsen et al., 2017). Oppstart av palliativ kjemoterapi bør vurderes hos pasienter med asymptomatisk primærtumor, når alder og allmenntilstand tilsier det. Ved symptomer som obstruksjon eller blødning bør reseksjon av primærtumor vurderes. Effekten av reseksjonen av primærtumor på overlevelsen er omdiskutert, og bedre overlevelse ved reseksjon ansees som en seleksjonseffekt (Eisenberger et al., 2008; Scheer et al., 2008).
Ved resektabel primærtumor uten fjernmetastaser, bør skrøpelige pasienter, eller som som ikke tåler reseksjon av andre grunner, få en helhetlig vurdering av pasientens situasjon, forventet funksjonsnivå etter kirurgisk behandling inkl. eventuelle komplikasjoner, og pasientens individuelle ønsker/preferanser for gjenværende levetid. Når kirurgisk behandling velges, bør pasientens preferanser dokumenteres preoperativt dersom det skulle oppstå behov for resuscitering, intubering eller behandling på intensivstasjon. Viktige kriterier ved denne vurderingen bl.a. ECOG status (ECOG 3-4 tilsier tilbakeholdenhet med reseksjon) og redusert kognitiv funksjon. Det bør etableres kontakt med palliativt team med tanke på organisering av et adekvat palliativt behandlingstilbud for pasient og pårørende (Rostoft, 2017).
Ved tumorblødning gis transfusjoner ved behov, evt antikoagulasjon må vurderes seponert.
Obstruksjonssymptomer eller begynnende ileus kan forsøkes opphevet med endoskopisk stentinnleggelse (se over), lokal proksimal avlastning (sigmoideostomi, transversostomi, cøkostomi, bøyleileostomi) eller intern bypass.
Det vises forøvrig til nasjonalt handlingsprogram for palliasjon.
Lokalt residiv
Sist faglig oppdatert: 20.12.2023
Lokalt residiv uten påvist inoperable metastaser, skal vurderes for operasjon, eventuelt etter forutgående onkologisk behandling. Behandling av lokale residiv bør sentraliseres til sykehus med ressurser og erfaring i denne typen behandling.
Annen lokalisasjon/histologi
Sist faglig oppdatert: 20.12.2023
Adenokarsinom i appendix vermiformis
Denne sykdommen er meget sjelden, med insidensrate på ca. 1 per 1 million per år (McGory et al., 2005). Høyresidig hemikolektomi er standard behandling. (evidensgrad C).
Adjuvant behandling følger samme retningslinjer som for tykktarmskreft.
Pseudomyxoma peritonei
Pseudomyxoma peritonei (PMP) er en malign tilstand i appendix vermiformis karakterisert av mucinøs ascites og peritoneale mucinøse implantater. Den forekommer hos 3–4 pasienter/million/år i Norge. Tilstanden diagnostiseres dels ved kirurgiske avdelinger og dels ved gynekologiske avdelinger da under bilde av ovarialtumor. Sykdommens naturlige forløp er langsom progresjon til død pga følgetilstander av høyt abdominaltrykk. Tradisjonelt har tilstanden blitt behandlet med repeterte intervall-debulkinger for palliasjon, med økende risiko for komplikasjoner ved hvert påfølgende inngrep og med begrenset mulighet for langtidsoverlevelse og uten helbredelse (Moran et al., 2008). Det finnes ulike klassifiseringssystemer, men en mye brukt klassifikasjon deler sykdommen histologisk inn i disseminert peritoneal adenomucinose (DPAM), peritoneal mucinøs karsinomatose (PMCA) og en intermediær form (Ronnett et al., 2001).
Behandling
PMP behandles med maksimal cytoreduktiv kirurgi (CRS) og direkte etterfølgende hyperterm intraabdominal kjemoterapi (HIPEC) med mitomycin C. En bør fjerne appendix og henvise pasientene til vurdering for CRS-HIPEC ved Oslo universitetssykehus, Radiumhospitalet. Fem-års overlevelse i et stort institusjonsmateriale er 80 % ved adenomucinose (DPAM) og 28 % ved mucinøs karsinomatose (PMCA) (Sugarbaker et al., 1999). I en systematisk review varierer 5-års overlevelsestall for pseudomyxom (52 %–96 %) (Yan et al., 2007). Ved Radiumhospitalet er 10-års overlevelsen 69 %, og 10-års sykdomsfri overlevelse 47 % (Sørensen et al., 2012).
Anbefaling:
- Ved adenokarsinom i appendix er høyresidig hemikolektomi standardprosedyre (evidensgrad C).
- Pseudomyxoma peritonei behandles med maksimal cytoreduktiv kirurgi (CRS) og direkte etterfølgende hyperterm intraabdominal kjemoterapi (HIPEC) (evidensgrad C)
Adjuvant kjemoterapi
Sist faglig oppdatert: 20.12.2023
Bakgrunn
Hensikten med adjuvant (postoperativ) kjemoterapi er å eliminere mikroskopisk sykdom. Det er godt dokumentert både gjennom randomiserte studier, meta-analyser og systematiske oversikter at 6 måneders postoperativ behandling med 5-fluorouracil (5-FU) i kombinasjon med folinat (leukovorin) bedrer 5-års sykdomsfri overlevelse ved stadium II (2–4 %) og stadium III (10–15 %) tykktarmskreft (Dahl, 2007; Efficacy of adjuvant fluorouracil and folinic acid in colon cancer. International Multicentre Pooled Analysis of Colon Cancer Trials (IMPACT) investigators, 1995; Francini et al., 1994; Glimelius et al., 2005; O'Connell et al., 1997). Respektive tall for bedring i total overlevelse etter fem år er ca. 2 % ved stadium II (Figueredo, Charette, Maroun, Brouwers, & Zuraw, 2004) og 7–8 % ved stadium III (Gill et al., 2004). Dersom man vurderer adjuvant behandling hos pasienter med høyrisiko stadium II, er det ønskelig at kliniker ber om at tumorvevet vurderes for mikrosatelittinstabilitet (MSI). Pasienter med svulster som mangler uttrykk av proteinene og/eller er instabile synes ikke å ha effekt av adjuvant 5-FU. Perorale pyrimidiner som kapecitabin er vist å være like effektive som intravenøs 5-FU/folinat i adjuvant sammenheng (Lembersky et al., 2006; Twelves et al., 2005). I en ny oversikt og meta-analyse av studier fra de siste 10 årene, var det ingen forskjell i sykdomsfri overlevelse i stadium II hos de som fikk adjuvant kjemoterapi eller ikke, mens det var en forskjell på 10 % til fordel for adjuvant kjemoterapi i stadium III (Böckelman, Engelmann, Kaprio, Hansen, & Glimelius, 2015).
Kombinasjonsbehandling
Tillegg av oksaliplatin til 5-FU/folinat, bedrer sykdomsfri overlevelse etter tre år fra 73 til 78 % (stadium II og III sett under ett) (Andre et al., 2004). Overlevelsesdata etter ti år viser en bedring i totaloverlevelse fra 59 til 67,1 % for stadium III, men ingen effekt for stadium II (79,5 % uten og 78,4 % med oxaliplatin) (André et al., 2015). Det er publisert data for at kombinasjonen av kapecitabin tabletter og oxaliplatin (XELOX) bedrer overlevelsen sammenlignet med 5-FU/folinat (Schmoll et al., 2015). I en annen studie er det vist at kapecitabin og oxaliplatin (kalt CAPOX) er likverdig med FOLFOX6 regimet (Pectasides et al., 2015).
Behandling hos eldre
Data tyder på at tillegg av adjuvant oxaliplatin til 5FU ikke bedrer overlevelse hos pasienter over 70 år (André et al., 2015; Yothers et al., 2011), det anbefales derfor monoterapi med 5FU/kapecitabin. Pasienter over 75 år bør vurderes individuelt med tanke på adjuvant behandling (vurdere funksjonsnivå, allmenntilstand og komorbiditet).
Tidspunkt for oppstart
Flere retrospektive analyser viser at det er viktig at behandlingen starter uten unødige forsinkelser, helst innen 4–6 uker etter operasjon og senest innen 8 uker (Berglund, Cedermark, & Glimelius, 2008; Biagi et al., 2011; Des Guetz, Nicolas, Perret, Morere, & Uzzan, 2010; Hershman et al., 2006; Sun et al., 2016; S. Yu et al., 2013). I en studie hvor man hos alle ga oxaliplatinbasert behandling fant man imidlertid ingen forskjell om behandlingen startet før eller etter 8 uker (Peixoto et al., 2015). Dessverre viser norske data at bare halvparten av pasientene starter behandlingen innen 6 uker (F. Olsen, Uleberg, Jacobsen, & Balteskard, 2016). Det er holdepunkt for at behandling startet senere enn 12 uker har mindre effekt og derfor bidrar med bivirkninger uten sikker nytteeffekt. En bør tilstrebe å starte kjemoterapi innen 4–6 uker etter operasjon.
Varighet av behandlingen
Det er ikke vist bedre overlevelse ved lengre behandling enn 6 måneder (Des Guetz, Uzzan, Morere, Perret, & Nicolas, 2010; Neugut et al., 2006). Hvis behandlingen må avbrytes på grunn av neutropeni eller andre bivirkninger tyder en studie på at man ikke har dårligere resultat (Kumar et al., 2015). Hvis oxaliplatin må seponeres på grunn av bivirkninger, fortsetter man med 5FU/folinat eller kapecitabin til man har gitt det planlagte antall kurer.
I 2018 ble det publisert resultater (sykdomsfri overlevelse) fra en sammenslåing av seks studier med over 12 000 pasienter som undersøkte 3 versus 6 måneder med FOLFOX eller CAPOX (Grothey et al., 2018). Hovedkonklusjonen er at 3 ikke er like godt som 6 måneder, men forskjellen er bare på 0,9 % (74,6 vs 75,5 % 3-års sykdomsfri overlevelse) for hele gruppen. Hovedeffekten hentes ut de 3 første månedene for alle. Ved subgruppeanalyser viser det seg at 3 md. behandling med CAPOX er tilstrekkelig ved lavrisiko-sykdom, definert som T1-3N1 (ca. 83 % 3-års sykdomsfri overlevelse). Ved bruk av Folfox viser resultatene litt bedre effekt av 6 måneders behandling, men forskjellen er liten og studiene var ikke konstruert for å vise forskjell mellom regimene. Ved T4 og N2 derimot er 6 måneder 1,7 % bedre (62,7 mot 64,4 % 3-års sykdomsfri overlevelse).
Det er klar forskjell i oksaliplatinindusert nevropati mellom gruppene. Risikoen for nevropati grad 2 eller høyere er betydelig lavere hos de som får 3 måneders (14–16 %) sammenlignet med 6 måneders behandling (45–48 %).
Oppsummert er det like godt å behandle i 3 måneder for lavrisiko-gruppen, best dokumentert for CAPOX. CAPOX oppleves som mer toksisk enn Folfox. Ved høyrisiko er det en ekstragevinst å øke behandlingslengden fra 3 til 6 måneder. Denne gevinsten bør dog vurderes mot økt risiko for nevropati, og avgjørelsen bør tas i samvalg med pasienten. Ved toksisitet kan også videre behandling gis uten oksaliplatin.
Dersom det gis monoterapi med 5FU eller kapecitabin, er standard 6 måneders behandling.
Gevinsten ved adjuvant behandling ved stadium II er marginal
I Norge har vi definert høyrisikopasienter i stadium II som pasienter med tumornær perforasjon, pT4 og få undersøkte lymfeknuter (≤ 12) (Edler, Ohrling, Hallstrom, Karlberg, & Ragnhammar, 2007; M. J. Kim et al., 2015; Zhang et al., 2016). Det er ikke endelig avklart hvilke kriterier man ellers skal legge vekt på av andre kjente risikofaktorer som lav differensieringsgrad, karinvekst, perineural invasjon eller klinisk presentasjon med obstruksjon/perforasjon (Glimelius, Tiret, Cervantes, & Arnold, 2013) for å tilby adjuvant kjemoterapi.
Pasienter med påvist mikrosatelittinstabilitet (MSI) manglende uttrykk av dMMR hos høyrisiko stadium II/stadium III
Det er nå i flere analyser vist at pasienter med stadium II med mikrosatellitt instastabilitet (MSI), eller med tap av uttrykk av en eller flere reperasjonsproteiner (dMMR) ved immunhistokjemisk undersøkelse har så god prognose at de ikke trenger adjuvant behandling (Church, Midgley, & Kerr, 2013; Dienstmann, Salazar, & Tabernero, 2015; Merok et al., 2013; Ribic et al., 2003). Kliniker rekvirerer analyse av MSI/uttrykk av MMR hos pasienter med høyrisiko stadium II. Det er heller ikke klart dokumentert at pasienter i stadium II har bedre overlevelse etter behandling med oxaliplatin, behandlingen kan derfor baseres på 5-FU/folinat eller kapecitabin (André et al., 2015; Yothers et al., 2011).
Også for stadium III pasienter er det vist i retrospektive studier at MSI/dMMR er en prognostisk faktor for bedre overlevelse (Bertagnolli et al., 2009; Gavin et al., 2012; Ribic et al., 2003; Zaanan et al., 2011), men det er usikkert hvilken betydning man skal tillegge MSI status (Hutchins et al., 2011; Zaanan et al., 2010). Det er uklart om 5-FU alene er nyttig ved påvist MSI (med unntak av Lynch syndrom), og hvis man skal gi behandling til MSI positive pasienter i stadium III anbefales oxaliplatin basert kjemoterapi (Buecher et al., 2013).
Hverken irinotekan, bevacizumab eller cetuximab gir tilleggsgevinst ved adjuvant behandling (Dahl, 2007; Saltz et al., 2007; Van Cutsem, Labianca, et al., 2009). Behandling med antistoffer i tillegg til konvensjonell kjemoterapi frarådes derfor utenfor kliniske studier.
Bivirkninger og komplikasjoner
Behandling med oksaliplatin bør gis av personell med erfaring med stoffet. Den vanligste dosebegrensende bivirkning ved bruk av oksaliplatin er kumulativ perifer sensorisk nevropati, som ofte utløses eller forverres av kulde. Smerte og/eller funksjonelle utfall bør føre til dosejustering eller avbrudd i behandlingen. Nevropati bedres som oftest med tiden, men kan vare mer enn to år hos over 10 % av pasientene (Land et al., 2007). De alvorligste (grad III-IV) forekommer hos <1 % etter 1–2 år. Risiko for persisterende nevropati må vurderes mot pasientens yrkesmessige situasjon. Andre bivirkninger er allergiske reaksjoner, kuldeintoleranse, larynxspasme, diare og hånd-fot syndrom.
Anbefalinger for adjuvant behandling
- Adjuvant kjemoterapi bør starte 4–6 uker postoperativt (evidensgrad D).
- Det anbefales at svar på DPYD genotype (evidensgrad B) foreligger før behandling med 5-FU/kapecitabin (se kapittel Medikamentell behandlingsstrategi, avsnitt Molekylær og DPYD diagnostikk).
Stadium III
- Pasienter < 75 år med påviste lymfeknutemetastaser (stadium III) eller tumorknuter anbefales adjuvant kjemoterapi (evidensgrad A).
- For pasienter <70 år vurderes kombinasjonsbehandling med 5-FU/folinat eller kapecitabin og oxaliplatin ((evidensgrad A).
- Ved T1-3N1- (lavrisiko) anbefales CAPOX i 3 md. eller FOLFOX i 3–6 md.
- Ved T4 eller N2 (høyrisiko) anbefales CAPOX/FOLFOX i 6 md.
- For pasienter 70–75 år vurderes monoterapi FLv eller kapecitabin i 6 md (evidensgrad B).
- For pasienter over 75 år vurderes monoterapi FLv eller kapecitabin i 6 md basert på funksjonsnivå, allmenntilstand og komorbiditet (evidensgrad D).
Høyrisiko stadium II
- Mikrosatelitt status/uttrykk av reparasjonsproteiner i primærtumor bør avklares (evidensgrad B)
- Pasienter med påvist mikrosatelitt instabilitet (MSI) /tap av reparasjonsproteiner (dMMR) har god prognose og minimal effekt av 5-FU, de trenger ikke adjuvant behandling dersom de skal ha 5-FU monoterapi (evidensnivå A). Ved behov for oksaliplatin-regime bør de ha adjuvant behandling.
- Pasienter <75 år med ett av følgende karakteristika skal vurderes for adjuvant kjemoterapi (evidensgrad B/C):
- pT4 tumor
- Perforasjon nær tumor (før/under operasjonen)
- Hvis totalt antall undersøkte lymfeknuter er ≤ 12
- Pasienter <70 år med pT4-tumor behandles som ved høyrisiko stadium III og vurderes for CAPOX/FOLFOX i 6 md.
- For pasienter <70 år med andre risikofaktorer enn pT4 vurderes kombinasjonsbehandling med 5-FU/folinat eller kapecitabin og oxaliplatin med CAPOX i 3 md. eller FOLFOX i 3–6 md.
- For pasienter 70–75 år vurderes monoterapi FLv eller kapecitabin i 6 md. (evidensgrad B).
- For pasienter over 75 år vurderes monoterapi FLv eller kapecitabin i 6 md. basert på funksjonsnivå, allmenntilstand og komorbiditet (evidensgrad D).
Generelt om kirurgi
Sist faglig oppdatert: 20.12.2023
Omfanget av lymfeknutedisseksjon
I Norge har en tradisjonelt brukt følgende terminologi for å beskrive omfanget av lymfeknutedisseksjon: D2-, komplett D2- og D3-disseksjon. Det skal som et minimum utføres en komplett D2-disseksjon ved alle inngrep med kurativt siktemål (evidensgrad D). Komplett D2-disseksjon ved høyresidig hemikolektomi defineres som fjerning av lymfeknuter som ligger i mesenteriet frem til avgangen av den regionale karforsyningen på venesiden. Ved høyresidige svulster tilsvarer dette disseksjon langs høyre kant av vena mesenterica superior. Standard ved venstresidige svulster har vært at arteria mesenterica inferior settes av 1 cm fra aorta, dette tilsvarer D3 disseksjon. Komplett mesokolisk eksisjon (CME) innebærer at mesenteriet fjernes i korrekt sjikt baktil og bringes uskadet ut av pasienten, se punkt "Disseksjon rundt primærtumor / mesokolisk plan". I Europa brukes CME som betegnelse på inngrepet som gjøres og sentral vaskulær ligatur (CVL) betyr sentral avsetning av arterier til preparatet (Tejedor et al., 2022).
Omfanget av tarmreseksjon
Vanlig praksis har vært å fjerne tumorbærende tarmsegment med 10 cm fri margin oralt og distalt, men 5 cm margin er vurdert å være tilstrekkelig i tykktarm (Smith et al., 2010) (evidensgrad D), og 5 cm fri distal margin er akseptert som tilstrekkelig ved endetarmskreft. Ut fra onkologiske hensyn anbefales 10 cm fri margin langs tarmrøret og de perikoliske lymfeknuter i alle segmenter av tykktarm, unntatt ved cancer i rektosigmoideovergangen, der 5 cm fri distal margin er tilstrekkelig.
Reseksjonens omfang vil i tillegg være bestemt av karanatomi og sirkulasjonsforholdene i tarmen etter at lymfeknutedisseksjonen og sentral karavsetning er gjennomført, se figur 1. Avvik fra standardreseksjoner skal dokumenteres i operasjonsbeskrivelsen.

Disseksjon rundt primærtumor / mesokolisk plan
I alle tykktarmsavsnitt finnes et definert anatomisk plan retroperitonealt. Dette planet går i et virtuelt hulrom mellom den viscerale fascien på baksiden av mesokolon og den parietale fascien som avgrenser retroperitoneum. Ved nøyaktig disseksjon kan dette planet følges rundt hele tykktarmens forløp, og når tarmen da er mobilisert fram, vil man ha en intakt mesokolon og tykktarm som inneholder primærtumor, alle lymfekar og lymfeknuter samt blodkarene. Fremre del av et slikt kirurgisk-onkologisk preparat er kledd av peritoneum. Denne disseksjonen rundt primærtumor og tilhørende tarmkrøs benevnes komplett mesokolisk eksisjon (complete mesocolic excision, CME) Foreløpig er det ikke godt dokumentert at rutinemessig disseksjon av de helt sentrale lymfeknuter er assosiert med bedre langtidsoverlevelse (Palmeri et al., 2022).
Patologisk vurdering av operasjonspreparatet med tanke på kirurgisk kvalitet er imidlertid vanskelig, viser stor variasjon og kan ikke brukes til å sammenlikne ulike sykehus (Munkedal et al., 2016).
Dersom tumor infiltrerer i naboorganer, må reseksjonen utføres som en bloc-reseksjon som innbefatter både primærtumor og hele eller deler av infiltrerte naboorgan(er) som ett preparat, og uten å blottlegge tumorvev. Ved R0 en bloc-reseksjon kan en oppnå tilnærmet samme langtidsresultat som for svulster som ikke infiltrerer i naboorganer (Croner et al., 2009). Hvis en dissekerer inn i tumorvev, forverres prognosen dramatisk (Hunter et al., 1987). Ved tvil om man har oppnådd frie reseksjonsrender, bør det tas biopsi av gjenværende vev (randbiopsier). Områder med suspekt gjenværende tumorvev som ikke kan fjernes, bør merkes med metall-klips med tanke på eventuell senere strålebehandling.
Iatrogen, tumornær tarmperforasjon forekommer sjeldent ved tykktarmskreft. Det er vanligere at tumor perforerer preoperativt. Perforasjon innebærer dårligere prognose.
Spesielle forhold ved høyresidig tykktarmskreft
Karanatomien til høyre colon varierer vesentlig mer enn til venstre del av tykktarmen. Med forholdene nevnt under kapittel 9.1.1 anbefales at man ved høyre hemikolektomi minimum dissekerer langs høyre kant av vena mesenterica superior (VMS) for sikker identifisering av ileocolica-karene som da kan settes av på høyre side av VMS, og deretter dissekerer langs venen (VMS) mot kranialt og setter av høyre gren av arteria colica media på nivå med avgangen. Arteria colica dextra foreligger sjeldent og deles også på høyre side av VMS. Operasjonen betegnes som komplett D2 disseksjon, se figur 2.
.png)
Hvis preoperativ CT viser sikre maligne lymfeknuter i D3 området uten fjernmetastaser bør en vurdere å operere pasienten på sykehus som utfører utvidet lymfadenektomi i D3 området. Det er ingen konsensus med tanke på omfanget av D3 disseksjon ved høyresidig hemikolektomi. Noen definerer D3 disseksjonen til å omfatte lymfevevet til frem til venstre side av arteria mesenterica superior, men den mest utbredte oppfatning er å dissekere til venstre margin av vena mesenterica superior, se figur 3 og 4, og tabell 1. På grunn av variasjoner på karanatomien kan preoperativ CT med karrekonstruksjon utføres for å bidra til planlegging av optimal kirurgi.
.png)
.png)
| CME plan | SMV frigjort | Trunk of Henle frigjort | Vaskulær ligatur | SMA frigjort | Surgical trunk |
D2 | Ja | Nei | Nei | Til høyre for SMV | Nei | Inkomplett |
Komplett D2 | Ja | Lateralt | Ja/Nei | Til høyre for SMV | Nei | Inkomplett |
CME/CVL | Ja | Ja | Ja | Sentralt | Nei | Komplett |
D3 | Ja | Ja | Ja | Sentralt | Ja | Komplett |
|
|
|
|
|
|
|
Tabell 1: Tabellen gir en oversikt over definisjoner og terminologi vedrørende kirurgisk radikalitet ved høyresidig hemikolektomi. CME= komplett mesokolisk eksisjon, CVL= sentral vaskulær ligatur, SMV=Vena mesenterica superior, SMA=Arteria mesenterica superior, Surgical trunk = Den delen av lymfatisk drenasje som ligger semisirkulært rundt mesenterialroten.
Ved cancer i høyre flexur anbefales utvidet høyresidig hemikolektomi med sentral avsetning av arteria colica media, se figur 5. Ved cancer i kolon transversum anbefales karavsetning og lymfeknutedisseksjon som vist i figur 6.
.png)
.png)
Spesielle forhold ved kreft i venstre fleksur
Arteriell blodtilførsel til svulster i miltfleksuren kommer fra arteria colica media (ACM, eller grener utgående fra ACM) og/eller arteria colica sinistra (ACS, utgående fra arteria mesenterica inferior, IMA). Man antar at lymfeknutedrenasjen fra miltfleksuren følger arteriell blodforsyning.
Det er uavklart hva slags operative konsekvenser variasjonen i blodtilførsel til miltfleksuren får. Det er ikke påvist økt overlevelse (sykdomsfri eller total overlevelse) ved mer sentral karligering med avsetning av ACM ved utløpet fra arteria mesenterica superior. Selv om man i enkelte tilfeller har påvist lymfeknutespredning til høyre sides lymfeknutestasjoner, viser metaanalyser ingen gevinst ved subtotal kolektomi.
Anbefaling:
Ved svulster i miltfleksuren, anbefales segmentektomi med 10 cm proximal og distal rand. Operatøren setter av arteria colica sinistra ved utløpet av arteria mesenterica inferior, for å få med distale lymfeknuter. Man fridissekerer vena mesenterica inferior, før venen settes av. Videre setter man av venstre sides arteria colica media rett etter delingsstedet (bifurkaturen), se figur 7. Hos overvektige pasienter med trangt krøs, kan subtotal kolektomi vurderes, for å unngå tensjon i anastomosen (Andersen et al., 2022; Crippa et al., 2021; Degiuli et al., 2020; Hamabe et al., 2018; Manceau et al., 2018; Martínez-Pérez et al., 2017; Miyake et al., 2018).
.png)
Spesielle forhold ved kreft i sigmoideum
Det er i nyere studier ikke påvist bedre kirurgisk eller onkologisk overlevelse ved å sette av arteria mesenterica inferior sentralt. Flere studier peker på at en kan spare arteria colica sinistra men utføre glandelfjerning rundt avgangen av arteria mesenterica inferior (Palmeri et al., 2022).
Operasjonsbeskrivelse
Operasjonsbeskrivelsen bør inneholde detaljerte opplysninger om den onkologiske lymfovaskulære disseksjonen, og en evaluering av operasjonspreparatet før dette fikseres og videresendes patologen.
Følgende punkter bør beskrives:
- Hvilket tarmsegment er fjernet og reseksjonsmarginer langs tarmrøret
- Nivå for karavsetning
- Standard eller utvidet / modifisert disseksjon
- Intakt, mindre rifter eller dypere skader på mesokolisk fascie
- Som dokumentasjon på komplett karnær disseksjon kan foto vedlegges
Laparoskopisk kirurgi
Store randomiserte studier har vist at laparoskopisk og åpen tykktarmsreseksjon er likeverdige når det gjelder det onkologiske resultat og komplikasjoner (Colon Cancer Laparoscopic or Open Resection Study Group et al., 2009; Fleshman et al., 2007; Guillou et al., 2005; Hazebroek et al., 2002; Jayne et al., 2010; Kuhry et al., 2005; NICE, 2021) (evidensgrad A). En norsk studie viser at laparoskopisk kirurgi ga samme relative overlevelse som åpen tilgang ved elektiv operasjon for svulster i stadium I-III (Stormark et al., 2016). Laparoskopisk kirurgi gir færre sårinfeksjoner og bukveggsbrokk, og også kortere liggetid og raskere rekonvalesens enn åpen prosedyre selv om forskjellen er liten dersom åpen kirurgi blir utført i henhold til for eksempel ERAS protokoller for akselerert pasientforløp (Kuhry et al., 2008).
Anbefalinger:
- Ved tykktarmskreft anbefales reseksjon av tumorbærende tarmsegment med 10 cm fri margin, men ved tumor i rektosigmoidovergangen er 5 cm distal margin tilstrekkelig (evidensgrad D).
- Tarmreseksjonens omfang vil som regel være bestemt av sirkulasjonsforholdene i tarmen etter gjennomført lymfeknutedisseksjon med tilhørende deling av karene (evidensgrad D).
- For å kartlegge karanatomien preoperativt kan det utføres CT med karrekonstruksjon
- Inngrep med kurativt siktemål for tykktarmskreft skal gjøres med minimum en komplett D2 reseksjon (evidensgrad D).
- Disseksjon rundt primærtumor og tilhørende tarmkrøs gjøres nøyaktig og i det mesokoliske plan (evidensgrad D). Dersom planet er brutt av tumorvev, må det utføres utvidet en bloc reseksjon (evidensgrad D).
- Operasjonsbeskrivelsen bør inneholde detaljerte opplysninger om den onkologiske, lymfovaskulære disseksjonen, og en evaluering av operasjonspreparatet før dette fikseres og videresendes patologen
Akutt presentasjon
Sist faglig oppdatert: 20.12.2023
Om lag 15–25 % av alle pasienter med tykktarmskreft innlegges akutt på grunn av ileus (flertallet), perforasjon (sjeldnere) eller større blødning (svært sjelden). Mortaliteten er høy (10–25 %), og morbiditet svært høy (> 50 %) ved akutt operasjon, enten det utføres reseksjon eller kun avlastning (Jestin et al., 2005; McArdle et al., 2004; Phillips et al., 1985; Sjo et al., 2009; Umpleby et al., 1984). En betydelig del av akutte pasienter har høy alder, komorbiditet og er skrøpelige. Det er viktig å tilpasse behandlingen til pasientens fysiologiske reserver og egne preferanser.
Perforasjon
Perforasjon kan skje til fri bukhule, enten i tumorområdet (sjelden) eller i cøkum pga dilatasjon ved tykktarmsileus. Disse pasientene må opereres straks. Vanligvis gjøres reseksjon av tumorbærende tarmsegment, inkludert sirkulatorisk påvirket tarm uten primær anastomose.
Perforasjon med lokalisert perikolisk abscess kan dreneres radiologisk og evt. opereres sekundært når infeksjonen er sanert.
Intestinal obstruksjon
Ved intestinal obstruksjon må man vurdere hvor mye det haster med avlastning. Obstruksjon utvikler seg gjerne langsomt, og ofte er umiddelbar avlastning ikke nødvendig.
Dersom det er medisinsk forsvarlig å vente, bør man sørge for at kompetent kolorektal kirurg er tilgjengelig ved operasjonen, og det kan være aktuelt å overflytte pasienten til større sykehus med nødvendig kompetanse.
Graden av hast avhenger av hvor dilatert tykktarmen er (CT), om ileocøkalklaffen tillater dilatasjon av tynntarm (tykktarms-distensjonen skjer da langsomt). Klinisk er allmenntilstand og ømhet over cøkum viktig.
Kontrast pr rektum vil vise om, og hvor det foreligger stenose. Ved mistanke om obstruerende tumor i colon/rectosigmoid overgang anbefales å utføre CT abdomen/bekken med rektal kontrast.
Høyresidig tykktarmsileus (tumor i høyre side og transverum)
Pasienten behandles med høyresidig hemikolektomi (evt. utvidet) og primær anastomose. Ileostomi uten anastomosering anlegges om pasientens allmenntilstand og tilleggssykdommer tilsier dette. Mortalitet anslås til ca. 10 % (Lee et al., 2001). Eventuelt kan bypass eller ileostomi gjøres dersom reseksjon ikke er mulig.
Venstresidig tykktarmsileus
Det er to hovedalternativer for behandling, akutt operasjon eller stenting for dekompresjon av tarmen. Akutt kirurgi medfører øket risiko for komplikasjoner, mens stenting kan ha onkologisk negative effekter med fare for stentperforasjon (CReST Collaborative Group, 2022).
Hos pasienter i god allmenntilstand anbefales akutt operasjon, hos pasienter i tydelig redusert allmenntilstand og med høy risiko ved akutt operasjon anbefales stenting.
Det er ikke godt avklart om prognosen bedres ved staget prosedyre; akutt avlastning med stomi eller stent (Vogel et al., 2022). Deretter i senere prosedyre reseksjon med anastomose eller stomi avhengig av pasientens aktuelle tilstand. De amerikanske retningslinjene anbefaler to-staget tilnærming.
Akutt operasjon
Det er tre hovedmetoder:
- Reseksjon med anastomose. Anastomoseproblemer kan reduseres ved å utføre enten
- subtotal kolektomi med ileosigmoidal/ileorektal anastomose (Tilney et al., 2007). Dette er vanlig metode i Norge og kan anbefales hos pasienter med god allmenntilstand.
- Reseksjon uten anastomose (Hartmanns prosedyre) (Koruth et al., 1985; Single-stage treatment for malignant left-sided colonic obstruction: a prospective randomized clinical trial comparing subtotal colectomy with segmental resection following intraoperative irrigation. The SCOTIA Study Group. Subtotal Colectomy versus On-table Irrigation and Anastomosis, 1995). Redusert allmenntilstand, samt forhold som taler for kortere operasjonstid og mot anastomose kan tilsi valg av Hartmann.
- Unntaksvis vil proksimal avlastende stomi eller bypass være eneste alternativ hos skrøpelige pasienter. Det kan for høyrisiko pasienter gjøres i lokal/epidural anestesi.
Stenting
Stent kan benyttes som «bro» til senere kirurgi for pasienter med sterkt forhøyet risiko for perioperativ mortalitet knyttet til primær operasjon eller mulige komplikasjoner. Stent anbefales også hos pasienter med metastatisk sykdom der rask oppstart av palliativ kjemoterapi er indisert.
Stenting skal imidlertid kun vurderes når tumors lokalisasjon ut fra CT synes å tillate grei innføring av guidewire og korrekt plassering av stent. Stentprosedyre skal gjøres med største forsiktighet, og blokking av tumorområdet skal aldri gjøres (van Hooft et al., 2020).
Anbefalinger:
- Ved perforasjon må pasienter opereres.
- Stent eller avlastende stomi kan benyttes som «bro» til senere kirurgi for pasienter med sterkt forhøyet risiko for perioperativ mortalitet knyttet til primær operasjon eller mulige komplikasjoner.
Palliative tiltak hos pasienter med metastasert sykdom, eller som ikke tåler reseksjon av andre grunner
Sist faglig oppdatert: 20.12.2023
Om lag 20% av pasientene med colon cancer, har metastasert sykdom ved diagnosetidspunkt. De fleste har multiple metastaser og kun få kan tilbys metastasekirurgi i forbindelse med primærbehandlingen (Angelsen et al., 2017). Oppstart av palliativ kjemoterapi bør vurderes hos pasienter med asymptomatisk primærtumor, når alder og allmenntilstand tilsier det. Ved symptomer som obstruksjon eller blødning bør reseksjon av primærtumor vurderes. Effekten av reseksjonen av primærtumor på overlevelsen er omdiskutert, og bedre overlevelse ved reseksjon ansees som en seleksjonseffekt (Eisenberger et al., 2008; Scheer et al., 2008).
Ved resektabel primærtumor uten fjernmetastaser, bør skrøpelige pasienter, eller som som ikke tåler reseksjon av andre grunner, få en helhetlig vurdering av pasientens situasjon, forventet funksjonsnivå etter kirurgisk behandling inkl. eventuelle komplikasjoner, og pasientens individuelle ønsker/preferanser for gjenværende levetid. Når kirurgisk behandling velges, bør pasientens preferanser dokumenteres preoperativt dersom det skulle oppstå behov for resuscitering, intubering eller behandling på intensivstasjon. Viktige kriterier ved denne vurderingen bl.a. ECOG status (ECOG 3-4 tilsier tilbakeholdenhet med reseksjon) og redusert kognitiv funksjon. Det bør etableres kontakt med palliativt team med tanke på organisering av et adekvat palliativt behandlingstilbud for pasient og pårørende (Rostoft, 2017).
Ved tumorblødning gis transfusjoner ved behov, evt antikoagulasjon må vurderes seponert.
Obstruksjonssymptomer eller begynnende ileus kan forsøkes opphevet med endoskopisk stentinnleggelse (se over), lokal proksimal avlastning (sigmoideostomi, transversostomi, cøkostomi, bøyleileostomi) eller intern bypass.
Det vises forøvrig til nasjonalt handlingsprogram for palliasjon.
Lokalt residiv
Sist faglig oppdatert: 20.12.2023
Lokalt residiv uten påvist inoperable metastaser, skal vurderes for operasjon, eventuelt etter forutgående onkologisk behandling. Behandling av lokale residiv bør sentraliseres til sykehus med ressurser og erfaring i denne typen behandling.
Annen lokalisasjon/histologi
Sist faglig oppdatert: 20.12.2023
Adenokarsinom i appendix vermiformis
Denne sykdommen er meget sjelden, med insidensrate på ca. 1 per 1 million per år (McGory et al., 2005). Høyresidig hemikolektomi er standard behandling. (evidensgrad C).
Adjuvant behandling følger samme retningslinjer som for tykktarmskreft.
Pseudomyxoma peritonei
Pseudomyxoma peritonei (PMP) er en malign tilstand i appendix vermiformis karakterisert av mucinøs ascites og peritoneale mucinøse implantater. Den forekommer hos 3–4 pasienter/million/år i Norge. Tilstanden diagnostiseres dels ved kirurgiske avdelinger og dels ved gynekologiske avdelinger da under bilde av ovarialtumor. Sykdommens naturlige forløp er langsom progresjon til død pga følgetilstander av høyt abdominaltrykk. Tradisjonelt har tilstanden blitt behandlet med repeterte intervall-debulkinger for palliasjon, med økende risiko for komplikasjoner ved hvert påfølgende inngrep og med begrenset mulighet for langtidsoverlevelse og uten helbredelse (Moran et al., 2008). Det finnes ulike klassifiseringssystemer, men en mye brukt klassifikasjon deler sykdommen histologisk inn i disseminert peritoneal adenomucinose (DPAM), peritoneal mucinøs karsinomatose (PMCA) og en intermediær form (Ronnett et al., 2001).
Behandling
PMP behandles med maksimal cytoreduktiv kirurgi (CRS) og direkte etterfølgende hyperterm intraabdominal kjemoterapi (HIPEC) med mitomycin C. En bør fjerne appendix og henvise pasientene til vurdering for CRS-HIPEC ved Oslo universitetssykehus, Radiumhospitalet. Fem-års overlevelse i et stort institusjonsmateriale er 80 % ved adenomucinose (DPAM) og 28 % ved mucinøs karsinomatose (PMCA) (Sugarbaker et al., 1999). I en systematisk review varierer 5-års overlevelsestall for pseudomyxom (52 %–96 %) (Yan et al., 2007). Ved Radiumhospitalet er 10-års overlevelsen 69 %, og 10-års sykdomsfri overlevelse 47 % (Sørensen et al., 2012).
Anbefaling:
- Ved adenokarsinom i appendix er høyresidig hemikolektomi standardprosedyre (evidensgrad C).
- Pseudomyxoma peritonei behandles med maksimal cytoreduktiv kirurgi (CRS) og direkte etterfølgende hyperterm intraabdominal kjemoterapi (HIPEC) (evidensgrad C)
Adjuvant kjemoterapi
Sist faglig oppdatert: 16.01.2024
Monoterapi
Adjuvant behandling med 5-fluorouracil (5-FU) bedrer 5-års sykdomsfri overlevelse ved stadium II (2–4 %) og stadium III (10–15 %) tykktarmskreft (Dahl, 2007; Francini et al., 1994; Glimelius et al., 2005; O'Connell et al., 1997). Bedring i total overlevelse etter fem år er ca. 2 % ved stadium II (Figueredo et al., 2004) og 7–8 % ved stadium III (Gill et al., 2004). En meta-analyse viste ingen forskjell i sykdomsfri overlevelse i stadium II hos de som fikk adjuvant kjemoterapi eller ikke, mens det var en forskjell på 10 % til fordel for adjuvant kjemoterapi i stadium III (Böckelman et al., 2015). Perorale pyrimidiner som kapecitabin er vist å være like effektive adjuvant som intravenøs 5-FU/folinat (Lembersky et al., 2006; Twelves et al., 2005).
Sirkulerende tumor DNA (ctDNA) og digital patologi og kunstig intelligens har vist seg å bedre prognostisering og kan antakelig bidra til bedre seleksjon av pasienter som har nytte av adjuvant kjemoterapi, men metodene er foreløpig ikke i rutinemessig bruk i Norge (Kleppe et al., 2022; Tie et al., 2019).
Kombinasjonsbehandling
Tillegg av oksaliplatin til 5-FU, bedrer sykdomsfri overlevelse etter tre år fra 73 til 78 % (stadium II og III sett under ett) (André et al., 2004). Etter ti år ses en bedring i totaloverlevelse fra 59 til 67,1 % for stadium III, men ingen effekt for stadium II (79,5 % uten og 78,4 % med oksaliplatin) (André et al., 2015). Kombinasjonen kapecitabin og oksaliplatin (CAPOX) bedrer også overlevelsen sammenlignet med 5-FU monoterapi (Schmoll et al., 2015), og det er vist at CAPOX er likeverdig med FOLFOX6 (Pectasides et al., 2015). Hverken irinotekan, bevacizumab eller cetuximab gir tilleggsgevinst ved adjuvant behandling (Dahl, 2007; Saltz et al., 2007; Van Cutsem et al., 2009).
Behandling av eldre
Eldre pasienter er gjennomgående underrepresentert i studier på adjuvant kjemoterapi ved coloncancer. Nytten av slik behandling må imidlertid anses dokumentert også for eldre pasienter (Sargent et al., 2001). Toleransen er overveidende god, framfor alt for monoterapi med 5-FU eller kapcitabin.
Data tyder på at tillegg av oksaliplatin til 5-FU eller kapecitabin i adjuvant setting i liten grad bedrer overlevelsen hos pasienter over 70 år (André et al., 2004; André et al., 2015; Sargent et al., 2001)(Haller et al 2015). I denne aldersgruppen anbefales for de fleste derfor monoterapi med 5-FU eller kapecitabin.
Pasienter over 75 år bør vurderes individuelt basert på allmenntilstand, funksjonsnivå, komorbiditet og polyframasi. Onkogeriatrisk vurdering kan bidra til bedret seleksjon av pasienter.
Tidspunkt for oppstart
Flere retrospektive analyser viser at det er viktig at behandlingen starter uten unødige forsinkelser, helst innen 4–6 uker etter operasjon og senest innen 8 uker (Berglund et al., 2008; Biagi et al., 2011; Des Guetz et al., 2010a; Hershman et al., 2006; Sun et al., 2016; Yu et al., 2013).
Varighet av behandlingen
Det er ikke vist bedre overlevelse ved lengre behandling enn 6 måneder (Des Guetz et al., 2010b; Neugut et al., 2006). Hvis oxaliplatin må seponeres på grunn av bivirkninger, bør man fortsette man med 5-FU eller kapecitabin til man har gitt det planlagte antall kurer. Avbrudd av oksaliplatin etter 3 md ser ikke ut til å føre til dårligere prognose, dersom 5-FU kontinueres til 6 md (Gallois et al., 2023).
For å undersøke varighet av adjuvant behandling er det publisert resultater fra et stort internasjonalt samarbeid (IDEA collaboration) ved sammenslåing av seks studier som undersøkte 3 versus 6 md. CAPOX eller FOLFOX (André et al., 2020a; Grothey et al., 2018). Oppdaterte overlevelsesdata ble publisert i 2020. Hovedkonklusjonen er at 3 md. ikke er likeverdig 6 md., men forskjellen i overlevelse er <1% (74,6 vs 75,5 % 3-års sykdomsfri overlevelse og 82,4 vs 82,8 % 5-års totaloverlevelse) for hele gruppen. Hovedeffekten hentes ut de 3 første månedene.
Adjuvant behandling ved stadium III
Videre er det gjort subgruppeanalyser mellom de to regimene og lavrisiko (T1-T3N1) og høyrisiko sykdom (T4N+ og N2). Ved bruk av CAPOX var det ingen reduksjon i sykdomsfri overlevelse eller totaloverlevelse for gruppen som helhet eller pasienter med lavrisiko sykdom ved 3 versus 6 md. behandling. Ved høyrisiko sykdom ble det sett økt 5 års sykdomsfri overlevelse på 2,6 % (55,6 vs 58,2 %) og 5-års overlevelse på 1 % (71,4 vs 72,4 %) ved bruk av 6 md. behandling. Denne marginale forskjellen gjør at 3 md. behandling med CAPOX kan anses tilstrekkelig også ved høyrisiko. Ved bruk av FOLFOX var det observert økt 5-års overlevelse på 1,2 % (82,6 vs 83,8 %) for hele gruppen. Forskjellen er betydelig mindre for lavrisiko gruppen (5 års sykdomsfri overlevelse 76,6 vs 79%, 5-års overlevelse 89,1 vs 89,4 %) enn for høyrisikogruppen (5-års sykdomsfri overlevelse 55,8 vs 60,8 %, 5-års overlevelse 72,5 vs 75,5 %). For pasienter i lavrisikogruppen kan derfor 3 md. FOLFOX anses tilstrekkelig.
Det er klar forskjell i oksaliplatinindusert nevropati mellom gruppene. Risikoen for nevropati grad 2 eller høyere er betydelig lavere etter 3 md. (14–16 %) sammenlignet med 6 md. behandling (45–48 %).
Oppsummert er det like god effekt ved å behandle i 3 md. for lavrisiko-gruppen (T1-3N1), best dokumentert for CAPOX. CAPOX oppleves som noe mer toksisk enn FOLFOX. Ved høyrisiko (T4 eller N2) bør man behandle 6 md. ved bruk av FOLFOX. Det er en marginal ekstragevinst å øke behandlingslengden fra 3 til 6 md. ved bruk av CAPOX. Denne gevinsten bør dog vurderes mot økt risiko for nevropati, og avgjørelsen bør tas i samvalg med pasienten. Ved neurotoksisitet kan videre behandling gis uten oksaliplatin.
Dersom det gis monoterapi med 5FU eller kapecitabin, er standard 6 md. behandling.
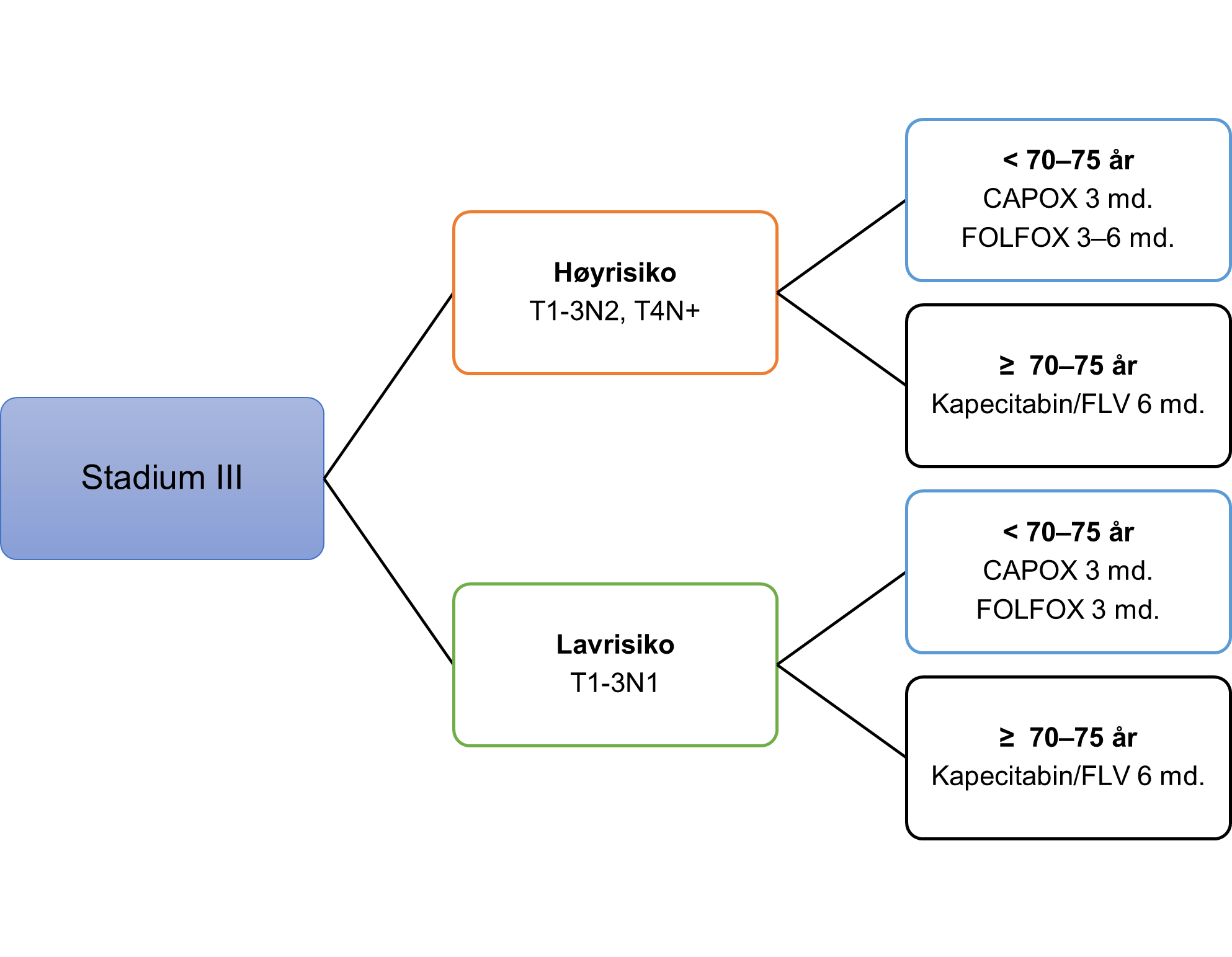
Adjuvant behandling ved stadium II
Det finnes lite evidens for nytte av adjuvant behandling ved stadium II da de fleste behandlingsanbefalinger er basert på subgruppeanalyser av studier for stadium II-III. Det ser imidlertid ut til at disse pasientene har god prognose uten nytte av adjuvant kjemoterapi dersom ingen risikofaktorer er til stede. Ved påvisning av risikofaktorer er derimot sannsynlighet for residiv betydelig økt og disse pasientene skal vurderes for adjuvant behandling. I Norge er disse faktorene definert som høyest risiko: tumornær perforasjon, pT4 eller få undersøkte lymfeknuter (≤12) (Edler et al., 2007; Kim et al., 2015; Zhang et al., 2016). Det er vist god effekt av adjuvant behandling ved T4 (Teufel et al., 2020). Det er ikke endelig avklart hvilke kriterier man ellers skal legge vekt på av andre kjente risikofaktorer som lav differensieringsgrad, karinvekst, perineural invasjon eller klinisk presentasjon med obstruksjon/perforasjon (Argilés et al., 2020) for å tilby adjuvant kjemoterapi. Hos pasienter med pT4-tumor anbefales CAPOX i 3-6 md. eller FOLFOX i 6 md. Ved perforasjon nær tumor (før/under operasjon) og/eller totalt antall undersøkte lymfeknuter <12 anbefales CAPOX i 3 md. eller FOLFOX i 3-6 md. Flere studier har vist at pasienter med stadium II med MSI/dMMR-tumor har bedre prognose og ikke nytte av adjuvant kjemoterapi med 5-FU alene (Ribic et al., 2003; Sargent et al., 2010; Sinicrope et al., 2011), og hos pasienter som ikke anses kandidat for oksaliplatin-basert regime bør en avstå fra adjuvant kjemoterapi.
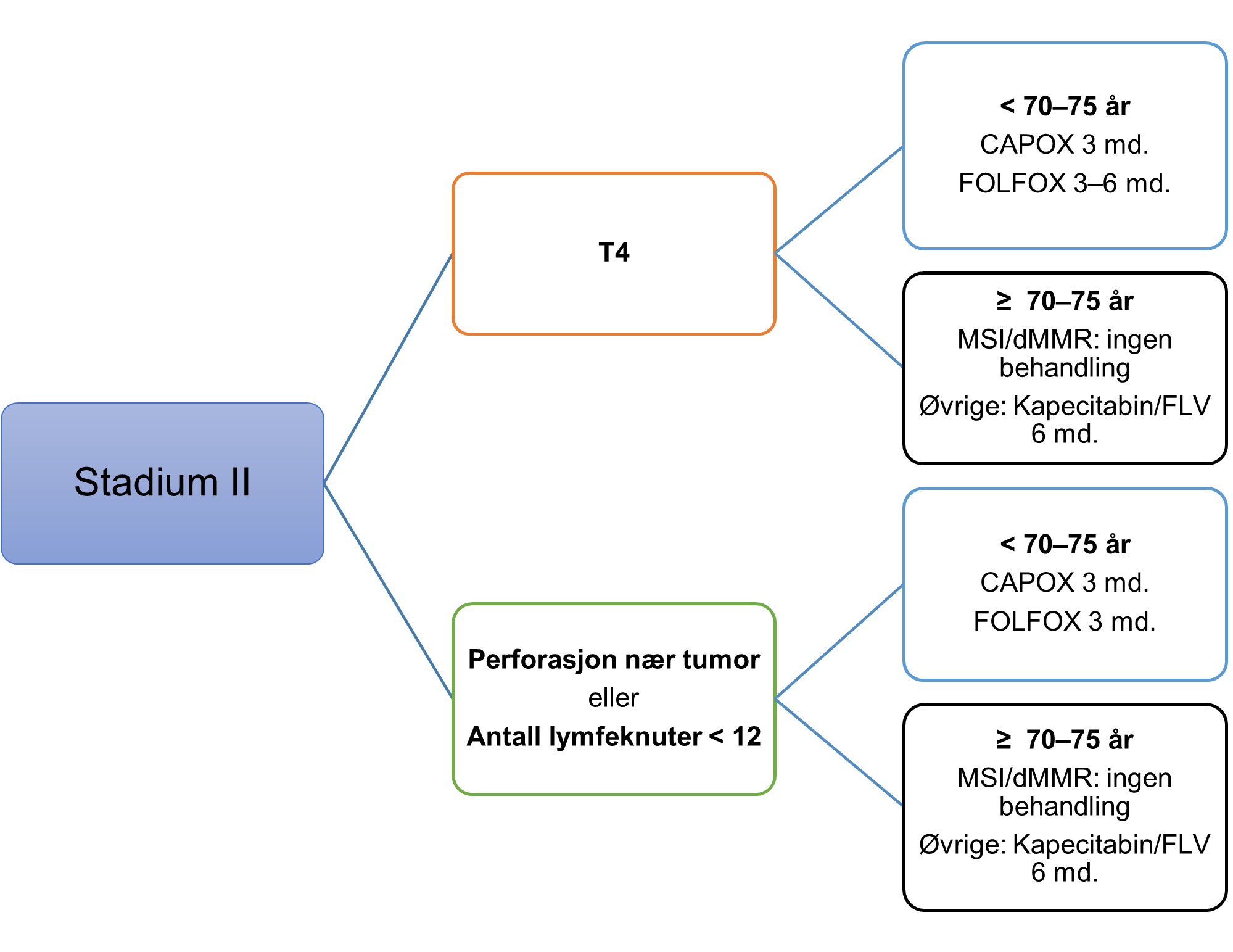
Bivirkninger og komplikasjoner
Den vanligste dosebegrensende bivirkning ved bruk av oksaliplatin er kumulativ perifer sensorisk nevropati, som ofte utløses eller forverres av kulde. Klinisk relevant nevrotoksisitet bør føre til avbrudd i oksaliplatinbehandlingen, eventuelt dosejustering. Nevropati bedres som oftest med tiden, men kan gi livsvarige plager. I en randomisert studie fant man vedvarende nevropati i mer enn to år hos >10 % av pasientene hvor de alvorligste (grad III-IV) forekomr hos <1 % etter 1–2 år (Land et al., 2007). I en populasjonsbasert finsk studie ble det rapportert nevropati hos 69 % (grad I/II/III/IV hos 36/24/8/1%) ved median 4,2 år etter endt adjuvant behandling (Soveri et al., 2019). Andre bivirkninger er allergiske reaksjoner, kuldeintoleranse, larynxspasme, diare og hånd-fot syndrom.
Neoadjuvant behandling
Nytten av neoadjuvant behandling er fortsatt ikke helt avklart. I en nylig studie ble pasienter med tykktarmskreft T3-4 randomisert til 6 uker neoadjuvant oksaliplatinbasert kjemoterapi eller ikke, og 98 % ble operert. Etter neoadjuvant kjemoterapi ble det T og N downstaging (Morton et al., 2023). I NICHE studien, fikk pasienter med T3-4 eller N+ tykktarmskreft en kur med nivolumab/ipilimumab før kirurgi. Blant pasienter med dMMR hadde 19 av 20 patologisk komplett respons (Chalabi et al., 2020). Videreføring av studien (NICHE 2) med flere pasienter ble presentert på ESMO 2022 med oppsiktsvekkende god respons, men langtidsresultater foreligger ikke ennå.
Annet
Det pågår studier (ikke i Norge) for å undersøke nytten av PD-1-hemmer i kombinasjon med adjuvant kjemoterapi ved stadium III dMMR tykktarmskreft. Adjuvant behandling etter metastasebehandling omtales i kapittel om resektable metastaser (se kapittel 13).
Anbefalinger for adjuvant behandling:
- Adjuvant kjemoterapi anbefales til pasienter operert for tykktarmskreft stadium III og stadium II med risikofaktorer (evidensgrad A).
- Adjuvant kjemoterapi bør starte 4–6 uker postoperativt (evidensgrad D).
- Svar på DPYD-genotype skal foreligge før behandling med 5-FU/kapecitabin (evidensgrad B) (se kapittel Medikamentell behandlingsstrategi, avsnitt Molekylær og DPYD diagnostikk).
- For pasienter <70 år anbefales kombinasjonsbehandling med 5-FU/folinat eller kapecitabin og oksaliplatin (evidensgrad A).
- For pasienter 70–75 år anbefales vanligvis monoterapi med 5-FU/folinat eller kapecitabin i 6 md, men kombinasjonsbehandling kan vurderes basert på funksjonsnivå, allmenntilstand og komorbiditet (evidensgrad B). For pasienter over 75 år kan monoterapi 5-FU/folinat eller kapecitabin i 6 md. vurderes basert på funksjonsnivå, allmenntilstand og komorbiditet (evidensgrad D).
- Pasienter med stadium II dMMR/MSI har ikke nytte av monoterapi 5-FU (evidensnivå B).
- Ved neurotoksisitet kan oksaliplatin seponeres etter 3 md. og eventuell resterende behandling gis med 5-FU (evidensnivå B).
Anbefalinger for pasienter i stadium III aktuelle for kombinasjonsbehandling:
- Ved lavrisiko (T1-tumor eller 3N1) anbefales CAPOX i 3 md. eller FOLFOX i 3 md.
- Ved høyrisiko (T4-tumor eller N2) anbefales CAPOX 3 md. eller FOLFOX i 3–6 md (André et al., 2020b; Hamre, 2023).
Anbefalinger for pasienter i stadium II aktuelle for kombinasjonsbehandling:
Følgende karakteristika anses som risikofaktorer ved stadium II og anbefales adjuvant kjemoterapi:
- Ved pT4 anbefales CAPOX i 3 md. eller FOLFOX i 3–6 md.
- Ved perforasjon nær tumor (før/under operasjon) anbefales CAPOX i 3 md. eller FOLFOX i 3–6 md.
- Ved totalt antall undersøkte lymfeknuter <12 anbefales CAPOX i 3 md. eller FOLFOX i 3–6 md
Kirurgisk behandling av endetarmskreft uten fjernmetastaser
Sist faglig oppdatert: 20.12.2023
Anbefalinger:
- Onkologisk er karavsetning med bevaring av arteria colica sinistra adekvat i de fleste tilfeller, og funksjonelt fordelaktig (evidensgrad B)
- Total mesorektal eksisjon (TME) er den anbefalte kirurgiske teknikk ved operativ behandling av endetarmskreft (evidensgrad C). Ved tumor i øvre del av rektum er PME likeverdig forutsatt 5 cm reseksjonsmargin i mesorektum distalt for tumor.
- Hos ubestrålte med en svulst distalt i endetarmen er en distal margin ned mot 1 cm adekvat. Hos bestrålte synes ikke en kort pDRM være en risikofaktor (evidensgrad C)
- Ved affeksjon eller gjennomvekst av mesorektal fascie må inngrepet utvides med en bloc reseksjon av affiserte organer/strukturer (evidensgrad C)
- Lavrisiko T1 cancere kan behandles med endokospisk reseksjon/TEM/TAMIS (evidensgrad B).
- For høyrisiko distal pT1 svulst, bør kompletterende kirurgi tilbys etter 6 uker, men adjuvant kjemoradioterapi kan være et alternativ.
- Pasienter med overveiende sannsynlige lymfeknutemetastaser på bekkenveggen bør tilbys preoperativ strålebehandling, og ved liten respons bør de vurderes for påfølgende kirurgi på bekkenveggen da det gir bedre lokal kontroll.
- Antibiotika- og trombolyseprofylakse skal gis. Se her for anbefalt antibiotikaprofylakse.
Tumor med distale begrensning 15 cm eller mindre fra ytre analåpning vurdert med stivt rektoskop betegnes som rektumtumor. Det er viktig å være oppmerksom på at både fleksibel skopi og avstandsangivelse ved kolografi ofte gir lengre avstander.
Alle pasienter med endetarmskreft skal i utgangspunktet vurderes med tanke på kirurgi i radikal eller palliativ hensikt, med mindre den medisinske tilstanden er slik at pasienten ikke tåler det eller sykdommen er kommet så langt at palliativ reseksjon ikke er hensiktsmessig. Alle pasienter skal vurderes av et tverrfaglig team for å avklare multimodal behandling. Kirurgen må ved preoperativ samtale informere om muligheten for vanlige postoperative komplikasjoner, risiko for anastomosesvikt og forventet funksjonelt resultat ved mulige operasjonsmetoder. Endelig valg av operasjonmetode må avgjøres i samråd med pasienten ut fra tumors størrelse, lokalisasjon, komorbiditet og pasientens ønsker. Det pålegger den enkelte avdeling å organisere pasientforløpet på en måte hvor pasientens samvalg og informasjon blir ivaretatt i møte mellom pasient og lege i god tid før inngrepet.
Det er meget sjelden behov for akutt kirurgi ved endetarmskreft, men Hartmanns operasjon, avlastende sigmoideostomi eller total kolektomi og ileostomi kan være aktuelle behandlingsformer ved stenoserende kreft. Ved stenose i øvre del av endetarmen kan midlertidig stent (Gargallo et al., 2019) være et godt alternativ, men det krever erfaring med metoden.
Kirurgisk teknikk
Sist faglig oppdatert: 20.12.2023
Mesorektal eksisjon
Total mesorektal eksisjon (TME) er den anbefalte teknikken ved endetarmskreft (Heald et al., 1982) (evidensgrad C). Det innebærer fjerning av primærtumor sammen med dens lymfatiske spredningsvei in toto, dvs. med disseksjon langs den mesorektale fascie der de autonome nervene til bekkenet ikke skades. Hvis tumor vokser ut over den mesorektale fascie eller inn i andre organer, vil inngrepet måtte utvides med en bloc-reseksjon av affiserte organer og/eller bekkenvegg utenfor mesorektum i form av utvidet TME (b TME, beyond TME) så langt dette er teknisk og medisinsk forsvarlig (Bernaola et al., 2018). Siktemålet er en radikaloperasjon med makroskopisk og mikroskopisk fri reseksjonskant (R0-reseksjon). Disseksjonsplanet må planlegges ut fra tumors utbredelse ved MR før preoperativ kjemoradioterapi (Larsen et al., 2009). Ved høytsittende tumor kan partiell mesorektal eksisjon (PME) utføres, se avsnittet under om reseksjonsmarginer.
Karavsetning
Arteria rectalis superior kan avsettes like etter avgangen av arteria colica sinistra da det ikke er dokumentasjon på at mer sentral ligatur vil bedre prognosen (Akagi et al., 2020; Yasuda et al., 2016), og de funksjonelle resultatene kan også påvirkes negativt ved høy ligatur (Lange et al., 2008; Sato et al., 2003). Sentral karavsetting av arteria mesenterica inferior kan imidlertid være nødvendig for tilstrekkelig mobilisering av tarmen for anleggelse av anastomose.
Reseksjonsmarginer
Det grunnleggende prinsipp i kirurgisk behandling av endetarmskreft er fjerning av all tumor en bloc slik at man oppnår en R0-reseksjon. Det er viktig å oppnå gode marginer både sirkumferensielt og i lengderetning. Perforasjon av tumor eller tumornært tarmsegment gir tre ganger høyere risiko for lokalt residiv og må unngås (Eriksen et al., 2004). Spesiell forsiktighet må utvises under perinealdisseksjonen ved rektumamputasjon. Ved tumor i øvre del av rektum kan man unnlate å fjerne hele mesorektum (PME – Partiell Mesorectal Excision), men da må man resessere minst 5 cm av mesorektum distalt for tumor grunnet mulighet for lymfeknutemetastaser i denne delen av mesorektum. Der hvor hele mesorektum fjernes ned til bekkenbunnen (TME), kan distal margin på tarmrøret være ned mot 1 cm når dette er nødvendig for anastomosering (Tjandra et al., 2005) (evidensgrad B). En nasjonal studie utgående fra NGICG (Bernstein et al., 2012) viste at en distal reseksjonsmargin (DRM) ≤ 10 mm målt i prepraratet hos ikke-bestrålte medførte økt risiko for lokalt residiv, mens DRM som risikofaktor for lokalt residiv var mer usikker hos de bestrålte. I senere publikasjoner betraktes ikke DRM som risikofaktor for lokalt residiv hos bestrålte (Pahlman et al., 2013; Rutkowski et al., 2012). Dersom DRM hos ubestrålte pasienter er kortere enn 10 mm bør pasienten overvåkes noe hyppigere enn ved standard oppfølging.
Anbefaling:
- Onkologisk er karavsetning med bevaring av arteria colica sinistra adekvat i de fleste tilfeller (evidensgrad B)
- Total mesorektal eksisjon (TME) er den anbefalte kirurgiske teknikk ved operativ behandling av endetarmskreft (evidensgrad C). Ved tumor i øvre del av rektum er PME likeverdig forutsatt 5 cm reseksjonsmargin i mesorektum distalt for tumor.
- Hos ubestrålte med en svulst distalt i endetarmen kan en margin ned mot 1 cm være adekvat når dette er nødvendig for anastomosering. Hos bestrålte synes ikke en kort DRM være en risikofaktor (evidensgrad B)
- Ved affeksjon eller gjennomvekst av mesorektal fascie må inngrepet utvides med en bloc reseksjon av affiserte organer/strukturer (evidensgrad C)
Laparoskopisk endetarmskirurgi
Laparoskopisk teknikk ved operasjon for endetarmskreft må følge de samme onkologiske prinsipper som åpen teknikk. En systematisk oppsummering fra Cochrane sist oppdatert 2014 konkluderer med likeverdige onkologiske kort- og langtidsresultater ved laparoskopisk som ved åpen kirurgi (Vennix et al., 2014). I denne oppsummeringen er laparoskopisk teknikk forbundet med kortere liggetid, færre sårinfeksjoner og færre blødningskomplikasjoner, men uten påvist forskjell i postoperativ livskvalitet. Likeverdige langtidsresultater uten forskjell i overlevelse eller residiv er også beskrevet i nyere studier (Bonjer et al., 2015; Jeong et al., 2014; Ng et al., 2014). Det er imidlertid bekymringsfullt at nyere studier viser usikkerhet rundt den onkologiske kvaliteten av operasjonspreparatet ved laparoskopisk tilgang (Fleshman et al., 2015; Martinez-Perez et al., 2017; Stevenson et al., 2015). Selv om laparoskopisk teknikk ved endetarmskreft fikk aksept i andre og tidligere studier (Martel et al., 2012), er det viktig å stille krav til opplæring og kvalitetssikring av prosedyren. Det påhviler derfor det enkelte sykehus som utfører denne typen inngrep et særlig ansvar for selv å dokumentere kompetanse, sikkerhet og resultater.
Robotassistert endetarmskirurgi
I følge årsrapporten for 2021 var 37,7 % (mot 19,6% i 2018) av all endetarmskirurgi i Norge med abdominal tilgang utført robotassistert, mens 46,2 % var ordinær laparoskopisk. Robotassistert endetarmskirurgi vil kunne gi bedre oversikt og instrumenthåndtering i forhold til ordinær laparoskopi. De fleste meta-analyser og i RCT studien ROLARR som sammenliknet ordinær laparoskopisk og robotassistert endetarmskirurgi fant man at metodene er sidestilte hva gjelder onkologiske korttidsresultater (Huang et al., 2019; Jayne et al., 2017; Lam et al., 2021; Safiejko et al., 2021; Staderini et al., 2016). Nyere metaanalyser viser også at robotassistert kirurgi bidrar til kortere hospitaliseringstid og færre komplikasjoner sammenliknet med ordinær laparoskopi (Crippa et al., 2021; Kowalewski et al., 2021; Safiejko et al., 2021; Wang et al., 2020). I ROLARR studien fant man ingen forskjell i sykdomsfri og total overlevelse. Konvertering fra minimal-invasiv kirurgi til åpen kirurgi er assosiert med dårligere prognose (Allaix et al., 2016). I de fleste kjente meta-analyser er det signifikant flere konverteringer til åpen kirurgi ved ordinær laparoskopisk endetarmskirurgi sammenliknet med robotassistert kirurgi (Huang et al., 2019; Phan et al., 2019; Safiejko et al., 2021; Wang et al., 2020). En nasjonal norsk studie av 1284 pasienter med data fra NORGAST og Kreftregisteret viste at robotkirurgi hadde likeverdige resultater mht. reseksjonsrand og lymfeknuter, men med signifikant færre konverteringer til åpen kirurgi sammenlignet med konvensjonell laparoskopi, 2.1% versus 9.6%. Konverteringer var assosiert med flere komplikasjoner (Myrseth et al., 2022a).
Det kan tyde på at robotassistert endetarmskirurgi kan brukes for selekterte grupper som forventes å være vanskeligere ved ordinær laparoskopi og som derfor tradisjonelt ville vært operert åpent. Robot assistert kirurgi ved endetarmskreft er til vurdering i Nyemetoder, les mer her.
Det er også med robotassistert kirurgi viktig å stille krav til opplæring og kvalitetssikring av prosedyren. Det påhviler derfor det enkelte sykehus som utfører denne typen inngrep, et særlig ansvar for selv å dokumentere kompetanse, sikkerhet og resultater.
Kombinert laparoskopisk og transanal tilgang
Reseksjon av rectum hos pasienter med kreft i endetarmen ved hjelp av transanal total mesorektal eksisjon (taTME) i kombinasjon med transabdominal tilgang ble lansert i 2010 som en ny teknikk. Hensikten med denne teknikken er blant annet å unngå permanente kolostomier ved å muliggjøre en lav anastomose til analkanalen: Det viser seg imidlertid at enkelte studier viser høye tall for anastomosesvikt (15%), alvorlig LARS symptomer (33-67%) og varig stomi (inntil 35%) (Bjoern et al., 2019; Penna et al., 2019; Wasmuth et al., 2020). Prosedyren ansees som svært kompleks og krever strukturert opplæring og god kvalitetssikring før den kan implementeres i standard pasientbehandling.
Flere norske sykehus tok i bruk metoden fra 2014 og framover, men med bakgrunn i varsel fra blant annet DNR om et urovekkende antall pasienter med tidlig lokalt residiv etter å ha blitt operert med metoden, besluttet HF-fagdirektørene etter brev fra NGICG-CR i januar 2019 at bruk av metoden skulle stanses. Beslutningen gjelder inntil man har mer kunnskap om prosedyren og årsakene til de dårlige resultatene ved bruk i Norge (Wasmuth et al., 2020).
Watch and wait
"Watch and wait" har vært beskrevet i litteraturen de siste 20 årene. Metoden har vært benyttet for enkeltstående pasienter i Norge som har gjennomgått radiokjemoterapi og hvor svulsten har klinisk komplett remisjon, og hvor pasienten av ulike grunner ikke har kunnet gjennomgå et større kirurgisk inngrep. Med bakgrunn i dette, og at strategien kan gi færre med stomi, ble denne behandlingsmetoden forsøkt testet ut i en prospektiv multisenterstudie fra og med 2018. Denne ble stanset i november 2020 på grunn av uventede resultater. Utenlandske resultater for "watch and wait" er ikke direkte overførbare til norske forhold, da det til dels er store forskjeller i hvilke tumorstadier som behandles med radiokjemoterapi fra et land til et annet, og i Norge benyttes radiokjemoterapi hovedsakelig til pasienter med de mest avanserte svulstene.
Operasjonstyper
Sist faglig oppdatert: 20.12.2023
Lav fremre reseksjon
Lav fremre reseksjon bør anvendes ved kreft i øvre og midtre del av endetarm. Ved kreft lokalisert på bekkenbunnen kan lav fremre reseksjon benyttes hvis det vil være mulig å avsette endetarmen nedenfor tumor slik at man får tilstrekkelig sirkumferensiell fri margin og fri margin distalt på minst 1 cm. Ende-til-ende anastomoser gir færre alvorlige komplikasjoner og reintervensjoner sammenliknet med side-til-ende (Planellas et al., 2020), men ende-til-side, rette koloanale anastomoser og J-pouch kan vurderes ved lave anastomoser (Brown et al., 2008; Ooi et al., 2009).
Anastomoseteknikk
Lave anastomoser krever oftest bruk av sirkulær stapler, og trippelstapling teknikk har vist gode resultater (Edwards et al., 2007). Ultralave anastomoser kan håndsys nedenfra. Flere enn to avfyringer av suturmaskin for å lukke rektum ved laparoskopisk kirurgi er vist å øke forekomsten av anastomoselekkasjer og spesiell oppmerksomhet må utvises ved deling (Balciscueta et al., 2020; Braunschmid et al., 2017). Såkalt «omegasutur» er lansert for å samle stapler-raden på rektumstumpen bedre rundt stapler-piggen (anvil), og man unngår med det å skyte den sirkulære anastomosen på tvers av staplerraden på rektumstumpen (Brunner et al., 2022).
Skylling av rectum med avklemming av tarmlumen nedenfor tumor før avsetting har vært anbefalt for å unngå tumorceller i tarmlumen og stapler-hodet. Nyere publikasjoner støtter opp om at skylling før tarmdeling fortsatt bør benyttes uavhengig av teknikk (åpen, laparoskopisk eller robotkirurgi (Rondelli et al., 2012; Simillis et al., 2013; Zhou et al., 2014), selv om litteraturen ikke er like konsistent på hvilken betydning skylling har i reduksjon av risiko for lokalt residiv (Baig et al., 2021; Okoshi et al., 2020) (evidensgrad C).
Nytten av dren til bekkenbunnen er dårlig dokumenter og en randomisert studie fra 2017 (Denost et al., 2017) viser ingen fordeler for pasientene med dren (evidensgrad C).
Avlastende bøyleileostomi
Anastomoselekkasje er en relativt hyppig (10–13 %) og livstruende komplikasjon til lav fremre reseksjon og en av hovedårsakene til postoperativ død (Matthiessen et al., 2006). Resultater fra 2018 fra NorGast viser 5 % lekkasjer med behov for reoperasjon (Grad C) innen 30 dager (Lassen et al., 2019). Ved siden av manifest lekkasje regnes bekkenabscess også som anastomoselekkasje (Rahbari et al., 2010).Uavhengig av avlastende stomi utviklet 14.7% anastomoselekkasje i en norsk studie, hvorav 26 % hadde bekken abscess og 74 % hadde direkte lekkasje (Olsen et al., 2019).
Den skandinaviske tradisjonen har vært å bruke avlastende bøyleileostomi etter strålebehandling og ved lave anastomoser. Studier viser redusert forekomst av symptomatiske lekkasjer og færre reoperasjoner ved bruk av avlastende stomi ved lave anastomoser (Matthiessen et al., 2007; Olsen et al., 2019). En ny norsk studie (Myrseth et al., 2022b) viser imidlertid at selv om det er færre reoperasjoner for anastomoselekkasje hos pasienter med avlastende stomi, er reoperasjonsraten innen 30 dager lik for pasienter med og uten avlastende stomi. Også andre studier viser at lekkasjefrekvensen etter ett år er lik med eller uten avlastende stomi (Borstlap et al., 2018). I tillegg kommer stomirelaterte komplikasjoner som hudproblemer, dehydrering og nyresvikt (Forsmo et al., 2016), og komplikasjoner relatert til tilbakelegging av avlastende stomi (Ihnát et al., 2016).. En ny dansk-svensk randomisert studie viser at tidlig lukking av midlertidig ileostomi etter 8–13 dager trygt kan gjøres hos utvalgte pasienter og med færre komplikasjoner enn om lukkingen skjer senere enn 3 måneder (Danielsen et al., 2017; Jafari et al., 2013). Ved intraoperativ god anastomosekvalitet (tarm uten spenning, godt sirkulert tarm-ende, komplette anastomose-ringer, negativ luftprøve) kan man unnlate å legge avlastende stomi.
The Norwegian Stoma Trial er en multisenter studie som har til hensikt å undersøke praksisen med bruk av avlastende og permanent stomi i behandlingen av endetarmskreft og vurdere valg av strategi opp mot komplikasjoner, helse-relatert livskvalitet og hospitaliseringstid. Inkluderingen av pasienter startet høsten 2022, og studien vil kunne gi mer kunnskap om eventuell gevinst av avlastende stomi clinicaltrials.gov.
Hartmanns operasjon
Prosedyren kan benyttes som alternativ til lav fremre reseksjon hos skrøpelige pasienter eller der de lokale forholdene i bekkenet er slik at man ikke vil anlegge en anastomose. Det er imidlertid også morbiditet knyttet til Hartmanns operasjon. En studie fra Radiumhospitalet viser 21 % bekkenabscess etter Hartmann hos bestrålte pasienter (Thorgersen et al., 2017). Tilsvarende er det vist at strålebehandling øker risikoen for intervensjonskrevende bekkenabscess (Jonker et al., 2015).. Risiko for reoperasjon og komplikasjoner er signifikant høyere enn ved rektumamputasjon med intersphinkterisk reseksjon (Popiolek et al., 2019). Rektumamputasjon med intersfinkterisk reseksjon kan være et bedre alternativ hos pasienter som velger permanent stomi fremfor anastomose av hensyn til funksjon.
Rektumamputasjon
Rektumamputasjon (abdomino-perineal reseksjon, APR) (Mandava et al., 1996) benyttes ved kreft i nedre del av endetarmen hvor lav fremre reseksjon ikke vil være tilstrekkelig for å oppnå fri reseksjonskant. Ved tumorinfiltrasjon i m. levator ani eller i m. sphincter ani externus anbefales sylindrisk APR med vid eksisjon av m. levator ani evt. i mageleie. Sylindrisk APR er assosiert med høyere forekomst av sårkomplikasjoner (Holm et al., 2007; Prytz et al., 2014). Etter APR hos bestrålte er andelen bekkenabscesser relativt høyt, f.eks. 25% i et norsk materiale (Thorgersen et al., 2017). Ved vid sylindrisk eksisjon er det ofte nødvendig å tilføre vev i bekkenbunnen enten i form av VRAM-lapp eller gluteallapp. Dette gjelder også dersom bakre vaginalvegg må resesseres på grunn av lokal innvekst. Pasienter med behov for slik rekonstruksjon må opereres ved senter med tilgang på plastikkirurg med erfaring i avanserte lappe-plastikker. En VRAM-lapp bedrer sårtilhelingen i bekkenet og har i en studie vist å redusere andel med manglende sårtilheling etter 3 mnd fra 30% til 10 % (Spasojevic et al., 2018).
Lokal tumorreseksjon ved tidlig cancer
Lokal tumorreseksjon i rektum innebærer et mindre operasjonstraume og er organbevarende. Lokale metoder er endoskopisk mukosareseksjon (EMR), endoskopisk submukosal disseksjon (ESD) og transanal endoskopisk eksisjon. Konvensjonell transanal tilgang med hake anbefales kun for helt distale svulter (de Graaf et al., 2011). Transanal endoskopisk reseksjon gjøres enten med rigid eller fleksibel plattform. Fleksible plattformer samles under begrepet transanal minimal invasiv kirurgi (TAMIS). Som rigid plattform brukes et operasjonsrektoskop til CO2 insufflasjon og etablering av et pneumorektum. Ulike systemer er tilgjengelige: Transanal endoskopisk mikrokirurgi (TEMÒ) og transanal endoskopisk operasjon (TEOÒ). Der en lokal eksisjon ikke er mulig, bør man tilby lav fremre rektumreseksjon eller abdominoperineal reseksjon med permanent stomi. Sammenliknet med lokal reseksjon har transabdominale metoder høyere morbiditet og mortalitet.
Til tross for grundig preoperativ diagnostikk er staging usikker. Preoperativ biopsi har en varierende sensitivitet på mellom 47% - 70% (Lossius et al., 2022a; Oien et al., 2019). Ved godartet preoperativ histologi og usikker billeddiagnostikk er lokal eksisjon som totalbiopsi et meningsfullt alternativ. I de fleste tilfeller er preoperativ klassifikasjon av lavrisiko og høyrisiko T1-svulst (definert under) ikke mulig. Ved preoperativ mistanke om malignitet bør pasienten utredes med MR, og funn diskuteres i multidisplinært team. Pasienten må informeres grundig om mulig risiko, spesielt med tanke på onkologisk radikalitet ved lokal tumor reseksjon. Hos skrøpelige pasienter med høy komorbiditet kan man tilby transanal eksisjon og/eller kjemoradioterapi som et kompromiss også ved mer avanserte kreftstadier.
Valg av metode er avhengig av preoperativ histologi, stadium, størrelse (< 3 cm), avstand til lukkemuskel og relasjon til peritoneal omslagsfold. «Piece meal» reseksjon bør unngås da det vanskeliggjør radikalitetsvurdering.
Ved påvist adenokarsinom skal tumor klassifiseres som angitt i kapitel 6.3: Maligne polypper. For at lokal reseksjon ansees som tilstrekkelig må reseksjonsranden i dybde og lateralt være fri med minst en millimeter margin (Shaukat et al., 2020) og ha lav risiko for lokalt tilbakefall (kapitel 6.3.). For høyrisiko pT1 svulst ( definert som lesjon med minst en histopatologisk påvist risikofaktor som positiv reseksjonrand (<1mm eller tumor i reseksjonplan), lymfovaskulær invasjon, lav differenseringsgrad, dyp submukosal invasjon (Haggitt 4, sm3 eller>1000mm), og tumorbudding eller T2 svulst, anbefaler man formell kompletterende operasjon (van Oostendorp et al., 2020). Hovedrisikofaktor for lymfeknutemetastaser er lymfovaskulær invasjon hvor opptil 20% av pasientene kan ha lymfeknutemetastaser (Bosch et al., 2013). For høyrisiko pT1 svulst, ser adjuvant kjemoradioterapi ut til å ha lik risiko for lokalt tilbakefall som kompletterende operasjon med TME, og kan være et alternativ til kompletterende kirurgi (van Oostendorp et al., 2020).
Det er viktig å være klar over at fullveggseksisjon og tumormanipulasjon kan føre til implantasjon av tumorceller i mesorektum, som kan føre til ekstramuralt residiv. Ved behov for en onkologisk reoperasjon er det mesorektale sjiktet bevart og en kompletterende operasjon lettere. Ideelt tidspunkt for kompletterende kirurgi har vist seg å være 6 uker etter den lokale tumorreseksjonen, gitt komplett sårtilheling. Disse pasientene får ikke prognose tap sammenliknet med tilsvarende stadium hos pasienter primært operert med TME. Imidlertid er pasienter med en distal lesjon som etter lokal eksisjon krever kompletterende kirurgi, under økt risiko for permanent stomi (Lossius et al., 2022b).
Metastaser på bekkenveggen
Metastaser i laterale lymfeknuter forekommer hos knapt 10 % av pasienter med rektumcancer, men hyppigere (15–20 %) ved lav cancer (< 6 cm) (Moriya et al., 1989; Sugihara et al., 2006; Takahashi et al., 2000; Yano et al., 2008) eller lokalavansert cancer. Det er velkjent at disse pasientene har langt dårligere prognose enn pasienter uten metastaser i denne lokalisasjonen og mange anser derfor lymfeknutemetastaser på bekkenveggen som tegn på systemisk sykdom (Shihab et al., 2011).
Det er ingen konsensus om hvordan metastasesuspekte lymfeknuter på bekkenveggen skal håndteres. I Asia har tradisjonen vært systematisk lymfeknutedisseksjon, mens det i Vesten ikke har vært noen utbredt tradisjon for dette. De senere år er det en økende interesse for å utføre lateral lymfeknute disseksjon (LLND) dersom pasienter etter bestråling fortsatt har forstørrede lymfeknuter med malignitetskriterier i bekkenet (Kroon et al., 2022).
En internasjonal sammenlignende multisenterstudie utgående fra Japan og som inkluderte pasienter med lav rektumcancer, viste at forekomst av lokalt residiv var signifikant høyere i gruppen pasienter med laterale lymfeknutemetastaser (kort-akse ≥ 7 mm initial MR) som kun fikk TME kirurgi etter neoadjuvant behandling sammenliknet med gruppen pasienter som i tillegg ble operert med lymfeknutedisseksjon, LR 19.5% vs. 5.7%, P = 0.042 (Ogura et al., 2019b). Senere studier har videre vist at pasienter med iliacale lymfeknutemetastaser og som ved re-stageing etter neoadjuvant behandling fortsatt har vedvarende patologiske kriterier, blant annet kort-akse ≥ 4 mm , har en lokal residivfrekvens på over 50 % om de ikke får lymfeknutedisseksjon (Ogura et al., 2019a). Tilsvarende synes vedvarende patologiske obturator lymfeknuter > 6 mm etter neoadjuvant behandling å gi økt risiko for metastaser (Schaap et al., 2021) om de ikke gjennomgår LLND
I disse studiene ble LLND utført som blokkdisseksjon av de regionale lymfeknuter og ikke som disseksjon av enkeltstående maligne lymfeknuter.
En systematisk review fra 2022 fant at neoadjuvant behandling før LLND ved TME kirurgi hos pasienter med antatt metastatiske lymfeknuter reduserte forekomst av lokale residiv, men påvirket ikke sykdomsfri overlevelse eller total overlevelse (Kroon et al., 2022). Større studier må se på dette i framtiden.
Anbefaling:
- Lavrisiko T1 cancere kan behandles med endokospisk reseksjon/TEM/TAMIS (evidensgrad B).
- For høyrisiko distal pT1 svulst, bør kompletterende kirurgi tilbys etter 6 uker, men adjuvant kjemoradioterapi være et alternativ.
- Pasienter med overveiende sannsynlige lymfeknutemetastaser på bekkenveggen bør tilbys preoperativ strålebehandling, og ved liten respons bør de vurderes for påfølgende kirurgi på bekkenveggen da det gir bedre lokal kontroll.
Kirurgisk teknikk
Sist faglig oppdatert: 20.12.2023
Mesorektal eksisjon
Total mesorektal eksisjon (TME) er den anbefalte teknikken ved endetarmskreft (Heald et al., 1982) (evidensgrad C). Det innebærer fjerning av primærtumor sammen med dens lymfatiske spredningsvei in toto, dvs. med disseksjon langs den mesorektale fascie der de autonome nervene til bekkenet ikke skades. Hvis tumor vokser ut over den mesorektale fascie eller inn i andre organer, vil inngrepet måtte utvides med en bloc-reseksjon av affiserte organer og/eller bekkenvegg utenfor mesorektum i form av utvidet TME (b TME, beyond TME) så langt dette er teknisk og medisinsk forsvarlig (Bernaola et al., 2018). Siktemålet er en radikaloperasjon med makroskopisk og mikroskopisk fri reseksjonskant (R0-reseksjon). Disseksjonsplanet må planlegges ut fra tumors utbredelse ved MR før preoperativ kjemoradioterapi (Larsen et al., 2009). Ved høytsittende tumor kan partiell mesorektal eksisjon (PME) utføres, se avsnittet under om reseksjonsmarginer.
Karavsetning
Arteria rectalis superior kan avsettes like etter avgangen av arteria colica sinistra da det ikke er dokumentasjon på at mer sentral ligatur vil bedre prognosen (Akagi et al., 2020; Yasuda et al., 2016), og de funksjonelle resultatene kan også påvirkes negativt ved høy ligatur (Lange et al., 2008; Sato et al., 2003). Sentral karavsetting av arteria mesenterica inferior kan imidlertid være nødvendig for tilstrekkelig mobilisering av tarmen for anleggelse av anastomose.
Reseksjonsmarginer
Det grunnleggende prinsipp i kirurgisk behandling av endetarmskreft er fjerning av all tumor en bloc slik at man oppnår en R0-reseksjon. Det er viktig å oppnå gode marginer både sirkumferensielt og i lengderetning. Perforasjon av tumor eller tumornært tarmsegment gir tre ganger høyere risiko for lokalt residiv og må unngås (Eriksen et al., 2004). Spesiell forsiktighet må utvises under perinealdisseksjonen ved rektumamputasjon. Ved tumor i øvre del av rektum kan man unnlate å fjerne hele mesorektum (PME – Partiell Mesorectal Excision), men da må man resessere minst 5 cm av mesorektum distalt for tumor grunnet mulighet for lymfeknutemetastaser i denne delen av mesorektum. Der hvor hele mesorektum fjernes ned til bekkenbunnen (TME), kan distal margin på tarmrøret være ned mot 1 cm når dette er nødvendig for anastomosering (Tjandra et al., 2005) (evidensgrad B). En nasjonal studie utgående fra NGICG (Bernstein et al., 2012) viste at en distal reseksjonsmargin (DRM) ≤ 10 mm målt i prepraratet hos ikke-bestrålte medførte økt risiko for lokalt residiv, mens DRM som risikofaktor for lokalt residiv var mer usikker hos de bestrålte. I senere publikasjoner betraktes ikke DRM som risikofaktor for lokalt residiv hos bestrålte (Pahlman et al., 2013; Rutkowski et al., 2012). Dersom DRM hos ubestrålte pasienter er kortere enn 10 mm bør pasienten overvåkes noe hyppigere enn ved standard oppfølging.
Anbefaling:
- Onkologisk er karavsetning med bevaring av arteria colica sinistra adekvat i de fleste tilfeller (evidensgrad B)
- Total mesorektal eksisjon (TME) er den anbefalte kirurgiske teknikk ved operativ behandling av endetarmskreft (evidensgrad C). Ved tumor i øvre del av rektum er PME likeverdig forutsatt 5 cm reseksjonsmargin i mesorektum distalt for tumor.
- Hos ubestrålte med en svulst distalt i endetarmen kan en margin ned mot 1 cm være adekvat når dette er nødvendig for anastomosering. Hos bestrålte synes ikke en kort DRM være en risikofaktor (evidensgrad B)
- Ved affeksjon eller gjennomvekst av mesorektal fascie må inngrepet utvides med en bloc reseksjon av affiserte organer/strukturer (evidensgrad C)
Laparoskopisk endetarmskirurgi
Laparoskopisk teknikk ved operasjon for endetarmskreft må følge de samme onkologiske prinsipper som åpen teknikk. En systematisk oppsummering fra Cochrane sist oppdatert 2014 konkluderer med likeverdige onkologiske kort- og langtidsresultater ved laparoskopisk som ved åpen kirurgi (Vennix et al., 2014). I denne oppsummeringen er laparoskopisk teknikk forbundet med kortere liggetid, færre sårinfeksjoner og færre blødningskomplikasjoner, men uten påvist forskjell i postoperativ livskvalitet. Likeverdige langtidsresultater uten forskjell i overlevelse eller residiv er også beskrevet i nyere studier (Bonjer et al., 2015; Jeong et al., 2014; Ng et al., 2014). Det er imidlertid bekymringsfullt at nyere studier viser usikkerhet rundt den onkologiske kvaliteten av operasjonspreparatet ved laparoskopisk tilgang (Fleshman et al., 2015; Martinez-Perez et al., 2017; Stevenson et al., 2015). Selv om laparoskopisk teknikk ved endetarmskreft fikk aksept i andre og tidligere studier (Martel et al., 2012), er det viktig å stille krav til opplæring og kvalitetssikring av prosedyren. Det påhviler derfor det enkelte sykehus som utfører denne typen inngrep et særlig ansvar for selv å dokumentere kompetanse, sikkerhet og resultater.
Robotassistert endetarmskirurgi
I følge årsrapporten for 2021 var 37,7 % (mot 19,6% i 2018) av all endetarmskirurgi i Norge med abdominal tilgang utført robotassistert, mens 46,2 % var ordinær laparoskopisk. Robotassistert endetarmskirurgi vil kunne gi bedre oversikt og instrumenthåndtering i forhold til ordinær laparoskopi. De fleste meta-analyser og i RCT studien ROLARR som sammenliknet ordinær laparoskopisk og robotassistert endetarmskirurgi fant man at metodene er sidestilte hva gjelder onkologiske korttidsresultater (Huang et al., 2019; Jayne et al., 2017; Lam et al., 2021; Safiejko et al., 2021; Staderini et al., 2016). Nyere metaanalyser viser også at robotassistert kirurgi bidrar til kortere hospitaliseringstid og færre komplikasjoner sammenliknet med ordinær laparoskopi (Crippa et al., 2021; Kowalewski et al., 2021; Safiejko et al., 2021; Wang et al., 2020). I ROLARR studien fant man ingen forskjell i sykdomsfri og total overlevelse. Konvertering fra minimal-invasiv kirurgi til åpen kirurgi er assosiert med dårligere prognose (Allaix et al., 2016). I de fleste kjente meta-analyser er det signifikant flere konverteringer til åpen kirurgi ved ordinær laparoskopisk endetarmskirurgi sammenliknet med robotassistert kirurgi (Huang et al., 2019; Phan et al., 2019; Safiejko et al., 2021; Wang et al., 2020). En nasjonal norsk studie av 1284 pasienter med data fra NORGAST og Kreftregisteret viste at robotkirurgi hadde likeverdige resultater mht. reseksjonsrand og lymfeknuter, men med signifikant færre konverteringer til åpen kirurgi sammenlignet med konvensjonell laparoskopi, 2.1% versus 9.6%. Konverteringer var assosiert med flere komplikasjoner (Myrseth et al., 2022a).
Det kan tyde på at robotassistert endetarmskirurgi kan brukes for selekterte grupper som forventes å være vanskeligere ved ordinær laparoskopi og som derfor tradisjonelt ville vært operert åpent. Robot assistert kirurgi ved endetarmskreft er til vurdering i Nyemetoder, les mer her.
Det er også med robotassistert kirurgi viktig å stille krav til opplæring og kvalitetssikring av prosedyren. Det påhviler derfor det enkelte sykehus som utfører denne typen inngrep, et særlig ansvar for selv å dokumentere kompetanse, sikkerhet og resultater.
Kombinert laparoskopisk og transanal tilgang
Reseksjon av rectum hos pasienter med kreft i endetarmen ved hjelp av transanal total mesorektal eksisjon (taTME) i kombinasjon med transabdominal tilgang ble lansert i 2010 som en ny teknikk. Hensikten med denne teknikken er blant annet å unngå permanente kolostomier ved å muliggjøre en lav anastomose til analkanalen: Det viser seg imidlertid at enkelte studier viser høye tall for anastomosesvikt (15%), alvorlig LARS symptomer (33-67%) og varig stomi (inntil 35%) (Bjoern et al., 2019; Penna et al., 2019; Wasmuth et al., 2020). Prosedyren ansees som svært kompleks og krever strukturert opplæring og god kvalitetssikring før den kan implementeres i standard pasientbehandling.
Flere norske sykehus tok i bruk metoden fra 2014 og framover, men med bakgrunn i varsel fra blant annet DNR om et urovekkende antall pasienter med tidlig lokalt residiv etter å ha blitt operert med metoden, besluttet HF-fagdirektørene etter brev fra NGICG-CR i januar 2019 at bruk av metoden skulle stanses. Beslutningen gjelder inntil man har mer kunnskap om prosedyren og årsakene til de dårlige resultatene ved bruk i Norge (Wasmuth et al., 2020).
Watch and wait
"Watch and wait" har vært beskrevet i litteraturen de siste 20 årene. Metoden har vært benyttet for enkeltstående pasienter i Norge som har gjennomgått radiokjemoterapi og hvor svulsten har klinisk komplett remisjon, og hvor pasienten av ulike grunner ikke har kunnet gjennomgå et større kirurgisk inngrep. Med bakgrunn i dette, og at strategien kan gi færre med stomi, ble denne behandlingsmetoden forsøkt testet ut i en prospektiv multisenterstudie fra og med 2018. Denne ble stanset i november 2020 på grunn av uventede resultater. Utenlandske resultater for "watch and wait" er ikke direkte overførbare til norske forhold, da det til dels er store forskjeller i hvilke tumorstadier som behandles med radiokjemoterapi fra et land til et annet, og i Norge benyttes radiokjemoterapi hovedsakelig til pasienter med de mest avanserte svulstene.
Operasjonstyper
Sist faglig oppdatert: 20.12.2023
Lav fremre reseksjon
Lav fremre reseksjon bør anvendes ved kreft i øvre og midtre del av endetarm. Ved kreft lokalisert på bekkenbunnen kan lav fremre reseksjon benyttes hvis det vil være mulig å avsette endetarmen nedenfor tumor slik at man får tilstrekkelig sirkumferensiell fri margin og fri margin distalt på minst 1 cm. Ende-til-ende anastomoser gir færre alvorlige komplikasjoner og reintervensjoner sammenliknet med side-til-ende (Planellas et al., 2020), men ende-til-side, rette koloanale anastomoser og J-pouch kan vurderes ved lave anastomoser (Brown et al., 2008; Ooi et al., 2009).
Anastomoseteknikk
Lave anastomoser krever oftest bruk av sirkulær stapler, og trippelstapling teknikk har vist gode resultater (Edwards et al., 2007). Ultralave anastomoser kan håndsys nedenfra. Flere enn to avfyringer av suturmaskin for å lukke rektum ved laparoskopisk kirurgi er vist å øke forekomsten av anastomoselekkasjer og spesiell oppmerksomhet må utvises ved deling (Balciscueta et al., 2020; Braunschmid et al., 2017). Såkalt «omegasutur» er lansert for å samle stapler-raden på rektumstumpen bedre rundt stapler-piggen (anvil), og man unngår med det å skyte den sirkulære anastomosen på tvers av staplerraden på rektumstumpen (Brunner et al., 2022).
Skylling av rectum med avklemming av tarmlumen nedenfor tumor før avsetting har vært anbefalt for å unngå tumorceller i tarmlumen og stapler-hodet. Nyere publikasjoner støtter opp om at skylling før tarmdeling fortsatt bør benyttes uavhengig av teknikk (åpen, laparoskopisk eller robotkirurgi (Rondelli et al., 2012; Simillis et al., 2013; Zhou et al., 2014), selv om litteraturen ikke er like konsistent på hvilken betydning skylling har i reduksjon av risiko for lokalt residiv (Baig et al., 2021; Okoshi et al., 2020) (evidensgrad C).
Nytten av dren til bekkenbunnen er dårlig dokumenter og en randomisert studie fra 2017 (Denost et al., 2017) viser ingen fordeler for pasientene med dren (evidensgrad C).
Avlastende bøyleileostomi
Anastomoselekkasje er en relativt hyppig (10–13 %) og livstruende komplikasjon til lav fremre reseksjon og en av hovedårsakene til postoperativ død (Matthiessen et al., 2006). Resultater fra 2018 fra NorGast viser 5 % lekkasjer med behov for reoperasjon (Grad C) innen 30 dager (Lassen et al., 2019). Ved siden av manifest lekkasje regnes bekkenabscess også som anastomoselekkasje (Rahbari et al., 2010).Uavhengig av avlastende stomi utviklet 14.7% anastomoselekkasje i en norsk studie, hvorav 26 % hadde bekken abscess og 74 % hadde direkte lekkasje (Olsen et al., 2019).
Den skandinaviske tradisjonen har vært å bruke avlastende bøyleileostomi etter strålebehandling og ved lave anastomoser. Studier viser redusert forekomst av symptomatiske lekkasjer og færre reoperasjoner ved bruk av avlastende stomi ved lave anastomoser (Matthiessen et al., 2007; Olsen et al., 2019). En ny norsk studie (Myrseth et al., 2022b) viser imidlertid at selv om det er færre reoperasjoner for anastomoselekkasje hos pasienter med avlastende stomi, er reoperasjonsraten innen 30 dager lik for pasienter med og uten avlastende stomi. Også andre studier viser at lekkasjefrekvensen etter ett år er lik med eller uten avlastende stomi (Borstlap et al., 2018). I tillegg kommer stomirelaterte komplikasjoner som hudproblemer, dehydrering og nyresvikt (Forsmo et al., 2016), og komplikasjoner relatert til tilbakelegging av avlastende stomi (Ihnát et al., 2016).. En ny dansk-svensk randomisert studie viser at tidlig lukking av midlertidig ileostomi etter 8–13 dager trygt kan gjøres hos utvalgte pasienter og med færre komplikasjoner enn om lukkingen skjer senere enn 3 måneder (Danielsen et al., 2017; Jafari et al., 2013). Ved intraoperativ god anastomosekvalitet (tarm uten spenning, godt sirkulert tarm-ende, komplette anastomose-ringer, negativ luftprøve) kan man unnlate å legge avlastende stomi.
The Norwegian Stoma Trial er en multisenter studie som har til hensikt å undersøke praksisen med bruk av avlastende og permanent stomi i behandlingen av endetarmskreft og vurdere valg av strategi opp mot komplikasjoner, helse-relatert livskvalitet og hospitaliseringstid. Inkluderingen av pasienter startet høsten 2022, og studien vil kunne gi mer kunnskap om eventuell gevinst av avlastende stomi clinicaltrials.gov.
Hartmanns operasjon
Prosedyren kan benyttes som alternativ til lav fremre reseksjon hos skrøpelige pasienter eller der de lokale forholdene i bekkenet er slik at man ikke vil anlegge en anastomose. Det er imidlertid også morbiditet knyttet til Hartmanns operasjon. En studie fra Radiumhospitalet viser 21 % bekkenabscess etter Hartmann hos bestrålte pasienter (Thorgersen et al., 2017). Tilsvarende er det vist at strålebehandling øker risikoen for intervensjonskrevende bekkenabscess (Jonker et al., 2015).. Risiko for reoperasjon og komplikasjoner er signifikant høyere enn ved rektumamputasjon med intersphinkterisk reseksjon (Popiolek et al., 2019). Rektumamputasjon med intersfinkterisk reseksjon kan være et bedre alternativ hos pasienter som velger permanent stomi fremfor anastomose av hensyn til funksjon.
Rektumamputasjon
Rektumamputasjon (abdomino-perineal reseksjon, APR) (Mandava et al., 1996) benyttes ved kreft i nedre del av endetarmen hvor lav fremre reseksjon ikke vil være tilstrekkelig for å oppnå fri reseksjonskant. Ved tumorinfiltrasjon i m. levator ani eller i m. sphincter ani externus anbefales sylindrisk APR med vid eksisjon av m. levator ani evt. i mageleie. Sylindrisk APR er assosiert med høyere forekomst av sårkomplikasjoner (Holm et al., 2007; Prytz et al., 2014). Etter APR hos bestrålte er andelen bekkenabscesser relativt høyt, f.eks. 25% i et norsk materiale (Thorgersen et al., 2017). Ved vid sylindrisk eksisjon er det ofte nødvendig å tilføre vev i bekkenbunnen enten i form av VRAM-lapp eller gluteallapp. Dette gjelder også dersom bakre vaginalvegg må resesseres på grunn av lokal innvekst. Pasienter med behov for slik rekonstruksjon må opereres ved senter med tilgang på plastikkirurg med erfaring i avanserte lappe-plastikker. En VRAM-lapp bedrer sårtilhelingen i bekkenet og har i en studie vist å redusere andel med manglende sårtilheling etter 3 mnd fra 30% til 10 % (Spasojevic et al., 2018).
Lokal tumorreseksjon ved tidlig cancer
Lokal tumorreseksjon i rektum innebærer et mindre operasjonstraume og er organbevarende. Lokale metoder er endoskopisk mukosareseksjon (EMR), endoskopisk submukosal disseksjon (ESD) og transanal endoskopisk eksisjon. Konvensjonell transanal tilgang med hake anbefales kun for helt distale svulter (de Graaf et al., 2011). Transanal endoskopisk reseksjon gjøres enten med rigid eller fleksibel plattform. Fleksible plattformer samles under begrepet transanal minimal invasiv kirurgi (TAMIS). Som rigid plattform brukes et operasjonsrektoskop til CO2 insufflasjon og etablering av et pneumorektum. Ulike systemer er tilgjengelige: Transanal endoskopisk mikrokirurgi (TEMÒ) og transanal endoskopisk operasjon (TEOÒ). Der en lokal eksisjon ikke er mulig, bør man tilby lav fremre rektumreseksjon eller abdominoperineal reseksjon med permanent stomi. Sammenliknet med lokal reseksjon har transabdominale metoder høyere morbiditet og mortalitet.
Til tross for grundig preoperativ diagnostikk er staging usikker. Preoperativ biopsi har en varierende sensitivitet på mellom 47% - 70% (Lossius et al., 2022a; Oien et al., 2019). Ved godartet preoperativ histologi og usikker billeddiagnostikk er lokal eksisjon som totalbiopsi et meningsfullt alternativ. I de fleste tilfeller er preoperativ klassifikasjon av lavrisiko og høyrisiko T1-svulst (definert under) ikke mulig. Ved preoperativ mistanke om malignitet bør pasienten utredes med MR, og funn diskuteres i multidisplinært team. Pasienten må informeres grundig om mulig risiko, spesielt med tanke på onkologisk radikalitet ved lokal tumor reseksjon. Hos skrøpelige pasienter med høy komorbiditet kan man tilby transanal eksisjon og/eller kjemoradioterapi som et kompromiss også ved mer avanserte kreftstadier.
Valg av metode er avhengig av preoperativ histologi, stadium, størrelse (< 3 cm), avstand til lukkemuskel og relasjon til peritoneal omslagsfold. «Piece meal» reseksjon bør unngås da det vanskeliggjør radikalitetsvurdering.
Ved påvist adenokarsinom skal tumor klassifiseres som angitt i kapitel 6.3: Maligne polypper. For at lokal reseksjon ansees som tilstrekkelig må reseksjonsranden i dybde og lateralt være fri med minst en millimeter margin (Shaukat et al., 2020) og ha lav risiko for lokalt tilbakefall (kapitel 6.3.). For høyrisiko pT1 svulst ( definert som lesjon med minst en histopatologisk påvist risikofaktor som positiv reseksjonrand (<1mm eller tumor i reseksjonplan), lymfovaskulær invasjon, lav differenseringsgrad, dyp submukosal invasjon (Haggitt 4, sm3 eller>1000mm), og tumorbudding eller T2 svulst, anbefaler man formell kompletterende operasjon (van Oostendorp et al., 2020). Hovedrisikofaktor for lymfeknutemetastaser er lymfovaskulær invasjon hvor opptil 20% av pasientene kan ha lymfeknutemetastaser (Bosch et al., 2013). For høyrisiko pT1 svulst, ser adjuvant kjemoradioterapi ut til å ha lik risiko for lokalt tilbakefall som kompletterende operasjon med TME, og kan være et alternativ til kompletterende kirurgi (van Oostendorp et al., 2020).
Det er viktig å være klar over at fullveggseksisjon og tumormanipulasjon kan føre til implantasjon av tumorceller i mesorektum, som kan føre til ekstramuralt residiv. Ved behov for en onkologisk reoperasjon er det mesorektale sjiktet bevart og en kompletterende operasjon lettere. Ideelt tidspunkt for kompletterende kirurgi har vist seg å være 6 uker etter den lokale tumorreseksjonen, gitt komplett sårtilheling. Disse pasientene får ikke prognose tap sammenliknet med tilsvarende stadium hos pasienter primært operert med TME. Imidlertid er pasienter med en distal lesjon som etter lokal eksisjon krever kompletterende kirurgi, under økt risiko for permanent stomi (Lossius et al., 2022b).
Metastaser på bekkenveggen
Metastaser i laterale lymfeknuter forekommer hos knapt 10 % av pasienter med rektumcancer, men hyppigere (15–20 %) ved lav cancer (< 6 cm) (Moriya et al., 1989; Sugihara et al., 2006; Takahashi et al., 2000; Yano et al., 2008) eller lokalavansert cancer. Det er velkjent at disse pasientene har langt dårligere prognose enn pasienter uten metastaser i denne lokalisasjonen og mange anser derfor lymfeknutemetastaser på bekkenveggen som tegn på systemisk sykdom (Shihab et al., 2011).
Det er ingen konsensus om hvordan metastasesuspekte lymfeknuter på bekkenveggen skal håndteres. I Asia har tradisjonen vært systematisk lymfeknutedisseksjon, mens det i Vesten ikke har vært noen utbredt tradisjon for dette. De senere år er det en økende interesse for å utføre lateral lymfeknute disseksjon (LLND) dersom pasienter etter bestråling fortsatt har forstørrede lymfeknuter med malignitetskriterier i bekkenet (Kroon et al., 2022).
En internasjonal sammenlignende multisenterstudie utgående fra Japan og som inkluderte pasienter med lav rektumcancer, viste at forekomst av lokalt residiv var signifikant høyere i gruppen pasienter med laterale lymfeknutemetastaser (kort-akse ≥ 7 mm initial MR) som kun fikk TME kirurgi etter neoadjuvant behandling sammenliknet med gruppen pasienter som i tillegg ble operert med lymfeknutedisseksjon, LR 19.5% vs. 5.7%, P = 0.042 (Ogura et al., 2019b). Senere studier har videre vist at pasienter med iliacale lymfeknutemetastaser og som ved re-stageing etter neoadjuvant behandling fortsatt har vedvarende patologiske kriterier, blant annet kort-akse ≥ 4 mm , har en lokal residivfrekvens på over 50 % om de ikke får lymfeknutedisseksjon (Ogura et al., 2019a). Tilsvarende synes vedvarende patologiske obturator lymfeknuter > 6 mm etter neoadjuvant behandling å gi økt risiko for metastaser (Schaap et al., 2021) om de ikke gjennomgår LLND
I disse studiene ble LLND utført som blokkdisseksjon av de regionale lymfeknuter og ikke som disseksjon av enkeltstående maligne lymfeknuter.
En systematisk review fra 2022 fant at neoadjuvant behandling før LLND ved TME kirurgi hos pasienter med antatt metastatiske lymfeknuter reduserte forekomst av lokale residiv, men påvirket ikke sykdomsfri overlevelse eller total overlevelse (Kroon et al., 2022). Større studier må se på dette i framtiden.
Anbefaling:
- Lavrisiko T1 cancere kan behandles med endokospisk reseksjon/TEM/TAMIS (evidensgrad B).
- For høyrisiko distal pT1 svulst, bør kompletterende kirurgi tilbys etter 6 uker, men adjuvant kjemoradioterapi være et alternativ.
- Pasienter med overveiende sannsynlige lymfeknutemetastaser på bekkenveggen bør tilbys preoperativ strålebehandling, og ved liten respons bør de vurderes for påfølgende kirurgi på bekkenveggen da det gir bedre lokal kontroll.
Palliative tiltak hos pasienter med metastasert sykdom, eller som ikke tåler reseksjon av andre grunner
Sist faglig oppdatert: 20.12.2023
Om lag 20% av pasientene med rectum cancer, har metastasert sykdom ved diagnosetidspunkt. De fleste har multiple metastaser og kun få kan tilbys metastasekirurgi i forbindelse med primærbehandlingen (Angelsen et al., 2017). Oppstart av palliativ kjemoterapi bør vurderes hos pasienter med asymptomatisk primærtumor, når alder og allmenntilstand tilsier det. Ved symptomer som obstruksjon eller blødning bør reseksjon av primærtumor vurderes. Effekten av reseksjonen av primærtumor på overlevelsen er omdiskutert, og bedre overlevelse ved reseksjon ansees som en seleksjonseffekt (Eisenberger et al., 2008; Scheer et al., 2008).
Ved resektabel primærtumor uten fjernmetastaser, bør skrøpelige pasienter, eller som som ikke tåler reseksjon av andre grunner, få en helhetlig vurdering av pasientens situasjon, forventet funksjonsnivå etter kirurgisk behandling inkl. eventuelle komplikasjoner, og pasientens individuelle ønsker/preferanser for gjenværende levetid. Når kirurgisk behandling velges, bør pasientens preferanser dokumenteres preoperativt dersom det skulle oppstå behov for resuscitering, intubering eller behandling på intensivstasjon. Viktige kriterier ved denne vurderingen bl.a. ECOG status (ECOG 3-4 tilsier tilbakeholdenhet med reseksjon) og redusert kognitiv funksjon. Det bør etableres kontakt med palliativt team med tanke på organisering av et adekvat palliativt behandlingstilbud for pasient og påørende.
Ved tumorblødning gis transfusjoner ved behov, evt antikoagulasjon må vurderes seponert.
Obstruksjonssymptomer eller begynnende ileus kan forsøkes opphevet med endoskopisk stentinnleggelse (se over), lokal proksimal avlastning (sigmoideostomi, transversostomi, cøkostomi, bøyleileostomi) eller intern bypass.
Det vises forøvrig til nasjonalt handlingsprogram for palliasjon.
Onkologisk behandling av endetarmskreft
Sist faglig oppdatert: 20.12.2023
Strålebehandling og cellegiftbehandling av endetarmskreft gis med flere ulike formål. Det viktigste er størrelsesreduksjon av svulsten for å øke muligheten for radikal kirurgi og redusere risiko for lokalt recidiv. Kjemoterapi vil også minske risiko for fjernmetastaser.
Alle pasienter med rektumcancer skal diskuteres i et tverrfaglig møte (MDT) etter at stadieinndeling og klinikk er kartlagt. Konsekvenser for funksjon, for eksempel LARS syndrom, og andre mulige seneffekter, er en viktig del av pasientinformasjon som grunnlag for informert samtykke.
Andelen pasienter som får neoadjuvant strålebehandling har de siste årene ligget mellom 30 % til 40 %. Andelen som får kort strålebehandling (5 Gy x 5) er økende og var i 2021 17 %, mens andelen som fikk lang strålebehandling (kjemoradioterapi) var 19 % (Nasjonalt kvalitetsregister for tykk- og endetarmskreft, 2021).
Preoperativ kjemoradioterapi (CRT) har bedre effekt og mindre bivirkninger enn postoperativ kjemoradioterapi (Sauer et al., 2012; Sebag-Montefiore et al., 2009). Årsakene kan være forskjeller i strålefølsomhet og ulikt tynntarmsvolum som bestråles. Etter rektumkirurgi er det vanligvis mere tynntarm i det lille bekken, spesielt etter rektumamputasjon, og tynntarmen er ofte fiksert.
Resektabel og potensielt resektabel endetarmskreft
Sist faglig oppdatert: 20.12.2023
Endetarmskreft er en heterogen gruppe, fra små tidlige svulster som bør opereres direkte, til mer utbredte svulster med høy risiko for lokalt residiv og metastasering, og behov for preoperativ behandling før kirurgi. Dette gjør at resultatene i studier varierer mye avhengig av pasientutvalget.
Vurderingen av primær kirurgi versus neoadjuvant behandling før kirurgi baseres på følgende funn fra klinisk undersøkelse og radiologisk utredning (MR bekken/rektum og CT thorax/abdomen/bekken):
- Tumorhøyde (nedre, midtre, øvre rektum)
- Tumors invasive del i forhold til tarmens omkrets, angitt som klokkeslett
- Infiltrasjonsdybde av tumoren. Ved lokalavansert tumor skal infiltrasjonsdybde i det perirektale fettvevet angis (ekstramural tumorvekst/T3 subklassifikasjon) og innvekst i naboorganer (T4b) eller peritoneale omslagsfold (T4a).
- Avstand til forventet cirkumferensiell reseksjonsmargin (CRM) som omfatter mesorektal fascie (MRF), vagina/uterus, prostata, m. levator ani og m. puborectalis.
- Patologiske lymfeknuter og tumordepositter, både i og utenfor mesorektum (laterale bekkenvegg, omfatter fossa obturatoria, foramen ischiadicum majus og områdene langs iliaca interna og externa karene).
- Ekstramural vaskulær invasjon (EMVI).
- Fjernmetastaser.
MRF og CRM
Flere studier viser at 2 mm avstand fra tumor og/eller tumordepositt til MRF er tilstrekkelig for å predikere fri margin (Bernstein et al., 2009; Nagtegaal et al., 2002; Taylor et al., 2011). Det er grunn til å tro at kort avstand til mistenkt patologisk lymfeknute med intakt kapsel gir mindre risiko for residiv enn kort avstand til primærtumor. Det anbefales preoperativ strålebehandling hvis avstanden fra tumor eller tumordepositt til MRF er ≤ 2 mm, eller ≤ 1 mm fra patologisk lymfeknute.
Neoadjuvant behandling gis som konvensjonell strålebehandling (2 Gy x 25, eventuelt 1,8 Gy x 28) samtidig med 5-FU basert kjemoterapi, eller kort strålebehandling (5 Gy x 5) uten samtidig kjemoterapi. Begge fraksjoneringsregimer er vist i randomiserte studier og meta-analyser å redusere forekomsten av lokale residiv med cirka 50 %, også ved bruk av total mesorektal eksisjon (TME) kirurgi (Erlandsson et al., 2017; Valentini et al., 2014; van Gijn et al., 2011).
I Norge har anbefalingene i stor grad vært basert på risikofaktorer knyttet til reseksjons-marginen. Studier viser at kort avstand til CRM gir økt risiko for lokalt residiv (Bernstein et al., 2012; Nagtegaal et al., 2008; Wibe et al., 2002), og T4-svulster med organinnvekst (T4b) har høyere risiko for tilbakefall. Tumors avstand til CRM predikeres ved avstand fra svulst til MRF og/eller m. levator ani, m. puborectalis, prostata/ glandula seminalis eller vagina/ uterus på aktuelle MR-bilder (Beets-Tan et al., 2001; MERCURY Study Group, 2006).
Til tross for ulike retningslinjer har resultatene med hensyn til tilbakefall og overlevelse vist seg å være relativt sammenfallende i Norge og Sverige (Glimelius et al., 2016).
Konvensjonell preoperativ strålebehandling med 1,8–2 Gy’s fraksjoner til 50–50,4 Gy gir bedre resultater med samtidig (strålesensibiliserende) kjemoterapi, 5-FU eller kapecitabin, enn strålebehandling til 50 Gy alene (Braendengen et al., 2008; Glimelius et al., 2003), og er assosiert med akseptabel akutt- og sentoksisitet (Birgisson et al., 2007; Braendengen et al., 2011; Bruheim et al., 2010; Pietrzak et al., 2007). Det er også grunnlag for at resektable svulster uten affeksjon av MRF og med relativt liten risiko for recidiv (T3a/b, N1a/b, EMVI-) i større grad kan behandles med 5 Gy x 5 alene med god tumor skrumpning, og hos ca. 10 % også patologisk komplett respons (Erlandsson et al., 2019).
EMVI +, N1c, dybdevekst
Det er publisert flere artikler som omhandler MR og betydningen av risikofaktorer for lokalt og systemisk tilbakefall. Tumors dybdevekst (ekstramural tumorvekst) målt i millimeter og angitt som T3 a–d subklassifikasjon (Patel et al., 2011; Taylor et al., 2008) og EMVI+ (Chand et al., 2016) ser ut til å ha stor prognostisk og prediktiv betydning (Chand et al., 2015; Lord et al., 2022a; Lord et al., 2022b). Videre har også N-substadium, spesielt N1c, der det påvises tumordepositter/tumorsatellitter langs drenerende vener, prognostisk betydning. N1c er, i motsetning til de andre N-stadiene, uttrykk for hematogen spredning og dermed et tidlig stadium av systemisk sykdom. En kan vurdere preoperativ strålebehandling (evt. kombinert med kjemoterapi) til pasienter med T3-4 tumor og/eller påvist EMVI+ eller N1c, uavhengig av avstand til MRF.
T4a
Ved høytsittende tumores som kun har vokst inn mot, eller inn i peritoneum (T4a), og som kan fjernes kirurgisk med god margin, er det ingen klar evidens vedrørende preoperativ behandling. Enkelte anbefaler direkte kirurgi, andre 5 Gy x 5 eller kjemoradioterapi før kirurgi (Schmoll et al., 2012). Generelt anbefales ikke preoperativ strålebehandling, men er det påvist langstrakt innvekst i den peritoneale omslagsfolden og/eller allerede MR morfologiske tegn forenlig med fokal peritoneal carcinomatose der primær kirurgi ikke vil gi god nok margin, bør preoperativ kjemoradioterapi vurderes. Her kan behandling basert på RAPIDO-studien (Bahadoer et al., 2021) med kort strålebehandling og påfølgende kjemoterapi være et aktuelt alternativ. Pasienter med pT4a tumor som ikke har fått strålebehandling bør tilbys adjuvant kjemoterapi med henvisning til onkologisk vurdering på samme måte som coloncancer (som anbefalt i ESMO guidelines (Glynne-Jones et al., 2017)).
Lavtsittende tumores
I nedre del av rektum der det anatomisk er lite eller ikke mesorektalt fettvev og kort avstand til m. levator ani/m. puborectalis, prostata/glandula seminalis eller vagina/portio, er det ofte diskutabelt hva som er riktig behandling for å oppnå tilstrekkelig fri margin. Lavtsittende svulster har høyere risiko for residiv, delvis relatert til korte marginer til CRM eller relatert til peroperativ tumornær perforasjon og ufrie render (R1-reseksjon), sammenlignet med høyere beliggende svulster som opereres med lav fremre reseksjon eller Hartmann (Anderin et al., 2013; West et al., 2010).
I nedre rektum vil i noen tilfeller selv små svulster (T2) ha kort margin til CRM. Det vil være indikasjon for preoperativ strålebehandling ved de fleste lave svulster (T2/ avansert T2 – T4b stadium), der man ikke har nok mesorektalt fettvev mellom tumor/ tumoraffisert muscularis og MRF. Ved mindre utbredt cancer (T1 sm1- T1 sm3 og tidlig T2 stadium) der man har minst 1 mm eller mer bevart muscularis og der det kan oppnås adekvat margin ved kirurgi alene, kan primær kirurgi vurderes uten behov for preoperativ strålebehandling. Behandlingsvalg hos pasienter med lave, tidlige svulster (T1 sm1- T1 sm3 og tidlig T2 stadium) vil ofte være basert på en individuell vurdering, og bør dokumenteres tydelig i MDT-notatet.
Signal/homogenitet, utseende og relasjon til drenerende vener benyttes for å skille tumorsatellitter fra lymfeknutemetastaser og reaktive lymfeknuter. MR er den best egnede modaliteten for slik kartlegging preoperativt. Retningslinjer fra European Society of Gastrointestinal Radiology (Beets-Tan et al., 2018) for vurdering av lymfeknutemetastaser legger vekt på følgende kriterier: kortakse diameter ≥ 9 mm, og minst ett av kriteriene rund form, uregelmessig kant eller heterogent signal. Hvis lymfeknuten er mindre, 5–8 mm, må to kriterier være til stede, og ved diameter < 5 mm må alle tre tilleggskriterier være oppfylt.
Strålebehandling med tanke på å oppnå klinisk komplett respons er foreløpig kun anbefalt innen kliniske studier. Pasienter som defineres medisinsk inoperable, kan vurderes for palliativ strålebehandling med tanke på lokal kontroll.
Primært ikke-resektabel endetarmskreft
Sist faglig oppdatert: 20.12.2023
Lokalt avansert svulst forekommer hos ca. 10–15 % av pasientene med endetarmskreft. Det vil si at svulsten vokser inn i omgivende organer (T4b) eller helt inn til den mesorektale fascien eller mot bekkenveggen (Bjerkeset et al., 1987). Siktemålet for preoperativ CRT er å skrumpe svulsten, og dermed øke mulighetene for radikal kirurgi eller å begrense omfanget av det kirurgiske inngrepet, og redusere risiko for lokoregionalt tilbakefall. I tillegg ønsker en å sterilisere drenasjeområdet fra tumor og organer/strukturer med innvekst for å redusere faren for residiv og metastaser. Det er viktig at pasienten vurderes på et MDT med erfaring fra denne pasientgruppen, og at inntegning av målvolum tar hensyn til utbredelsen av tumor. Pasienten bør opereres ved sentra med erfaring i kirurgi utenfor TME-planet («Beyond TME») og multiviscerale reseksjoner. Ved innvekst i vagina (behov for vaginal reseksjon) eller maligne lymfeknuter på laterale bekkenvegg som ikke er synlig etter strålebehandling, kan operasjon ved sentra uten slik spesialkompetanse vurderes. Standardbehandling har vært preoperativ strålebehandling mot primærsvulst og lymfeknuteregioner med dose til tumor opp til 50–50,4 Gy sammen med 5FU eller kapecitabin. Studier har vist resektabilitet opp til 80 %, komplett patologisk respons hos ca. 9–20 % (Mariathasan et al., 2018), og blant de opererte, langtidsoverlevelse på 50–65 % (Frykholm et al., 2001; Gerard et al., 2006; Rominger et al., 1985). Disse pasientene har høy metastaserisiko i sykdomsforløpet og bør vurderes for total neoadjuvant terapi (Mariathasan et al., 2021).
5 Gy x 5 med påfølgende kjemoterapi vs. kjemoradioterapi
I RAPIDO-studien (Bahadoer et al., 2021), ble pasienter med lokalt avanserte svulster (T4a/b, N2, MRF+, EMVI+, eller maligne lymfeknuter på bekkenveggen) randomisert til standard preoperativ kjemoradioterapi og evt. adjuvant kjemoterapi, eller eksperimentell arm med strålebehandling 5 Gy x 5 etterfulgt av kjemoterapi med 6 CAPOX eller 9 FOLFOX kurer før kirurgi. I alt 920 pasienter ble randomisert, og oppdaterte resultater etter 5 års oppfølging viser signifikant redusert sykdomsrelatert behandlingssvikt (disease-related treatment failure, DrTF) på 27.8 % vs. 34 % (p=0,048) i den eksperimentelle armen (Dijkstra et al., 2023). Dette var det primære endepunkt i studien.
Det var færre metastaser i den eksperimentelle armen (23 % vs. 30,4 % etter 5 år), og færre metastaser i lever (9 % vs 15 %, p=0,002). Total overlevelse var ikke forskjellig, 81,7 % vs
80,2 % (p=0,5). Det var imidlertid høyere forekomst av lokale recidiv i eksperimentell arm sammen-lignet med standard arm (10,1 % vs. 6,1 %, p=0.027).
Det er diskutert ulike faktorer som forklaring til dette; at forlenget periode med kjemoterapi med RAPIDO-regimet gir en mer fragil og fibrotisk mesorectum og at tradisjonell 3D-konformal strålebehandling ble benyttet i større grad ved kort strålebehandling, mens IMRT/VMAT ble benyttet i større grad ved CRT. Andre mulige forklaringer som diskuteres er om økt grad av tumorskrumpning i RAPIDO-armen medførte større grad av lav fremre reseksjon enn rektumamputasjon.
Registrering av toksisitet og livskvalitet viste at behandlingen ble gjennomgående godt tolerert, uten tydelig forskjell mellom behandlingsarmene.
I RAPIDO studien ble kun 8 % av inkluderte pasienter (69/826) operert med kirurgi av andre organer. Det er gjort analyser for subgrupper, inkludert cT4, som alle er i favør av eksperimentell gruppe med tanke på DrTF, men ikke egne analyser for pasienter med T4b med hensyn på lokalt residiv eller overlevelse. Det foreligger derfor ikke tilstrekkelig dokumentasjon for å innføre RAPIDO regimet som standard vedT4b svulster.
Det fremkom ikke signifikant økt risiko for lokalt residiv (LRR) ved RAPIDO-regimet vs. CRT ved metastatiske lymfeknuter på bekkenvegg (Bahadoer et al., 2023). Ved metastatiske lymfeknuter på bekkenvegg ble det vist økt risiko for lokalt residiv (HR 1,79 (1,02-3,13) p= 0,042), men uavhengig av behandlingsregime.
Det er planlagt ytterligere spesifikke analyser i RAPIDO-studien, spesielt for å forstå forskjellene i andelen lokale recidiv.
En polsk studie, som sammenliknet CRT med 50 Gy vs. kort strålebehandling 5 Gy x 5 og 3 FOLFOX, fant ingen forskjell i lokal kontroll eller sykdomsfri overlevelse (Bujko et al., 2016; Ciseł et al., 2019). I denne studien var imidlertid ikke utredning med MR obligatorisk.
Total neoadjuvant terapi
Total neoadjuvant terapi (TNT) med kjemoterapi før eller etter preoperativ CRT eller kort strålebehandling har i de senere år vært undersøkt i flere randomiserte studier (Conroy et al., 2021; Fokas et al., 2022; Garcia-Aguilar et al., 2022; Jin et al., 2022), i tillegg til RAPIDO. Inklusjonkriterier har vært lokalt avanserte svulster definert som T4, T3 med kort avstand til MRF, mrEMVI+, og mrN2. Ulike kombinasjoner av kjemoterapi både før og etter strålebehandling har vært forsøkt. Intensjonen har vært å spare organer, oppnå downstaging for de mest lokalavanserte svulstene før kirurgi, og å forhindre fjernmetastaser.
PRODIGE 23-studien (Conroy et al., 2021) viste bedre 3 år DFS (75 % vs 69 %) med FOLFIRINOX før CRT sammenlignet med CRT hos pasienter med cT3 eller cT4M0 cancer. Begge grupper fikk adjuvant FOLFOX i hhv. 3 md. og 6 md. Behandlingsrekkefølgen ser ikke ut til å ha betydning for total eller sykdomsfri overlevelse, men det er rapportert høyere klinisk og patologisk komplett responsrate og mulighet for organbevarende strategi dersom CRT gis først (Fokas et al., 2022; Garcia-Aguilar et al., 2022). Alle studiene rapporterer andel pasienter med patologisk komplett respons (pCR) opp mot 30 % ved TNT og rundt 15 % ved CRT alene. I OPRA-studien rapporterte man klinisk komplett respons (cCR) på over 50 % hos pasienter som fikk CRT etterfulgt av FOLFOX/CAPOX i 4 md.
Pasienter med lokalt avansert rektumcancer (LARC) har økt risiko for fjernmetastaser, totalt 43 % i et materiale fra Radiumhospitalet, med total 5-års overlevelse på 32 %, mot 89 % hos de som ikke utvikler metastaser (Mariathasan et al., 2021).
Det forventes at TNT vil kunne gi både øket radikalitet, redusert behov for organreseksjoner, og redusert forekomst av fjernmetastaser.
For pasienter med stadium T4b kan man vurdere TNT i form av CRT til 50 Gy etterfulgt av neoadjuvant kjemoterapi (FOLFOX/(FOLFIRINOX)/CAPOX i ca. 1-2 md.) etterfulgt av responsevaluering. Ved respons/stabil sykdom og akseptabel toleranse kontinueres kjemoterapi inntil FOLFOX x 8/(FOLFIRINOX x 6)/CAPOX x 6 kurer etterfulgt av ny responsevaluering og operasjon. Man kan også gi kjemoterapi først etterfulgt av CRT.
Pasientene vil da kunne få like omfattende systemisk behandling som i RAPIDO i tillegg til at man optimaliserer sannsynligheten for respons i bekkenet ved å gi CRT 50 Gy. Behandlingsopplegget tilsvarer OPRA studien (dersom man gir FOLFOX/CAPOX) eller PRODIGE 23 (dersom man gir FOLFIRINOX før CRT) og er derfor godt dokumentert i studier. FOLFIRINOX kan vurderes når det er kliniske, molekylære eller radiologiske karakteristika som skulle tilsi behov for spesielt aggressiv behandling.
Behandling av pasienter med høy alder og/eller redusert funksjonsevne
Sist faglig oppdatert: 20.12.2023
Hos disse pasientene kan kort strålebehandling med 5 Gy x 5 og kirurgi etter 8–10 uker være et alternativ (Hatfield et al., 2009; Radu et al., 2008). Ved potensielt resektabel tumor hvor kirurgi kan bli aktuelt, vil man ved planlegging av kort strålebehandling definere clinical target volume (CTV) på samme måte som ved ordinær strålebehandling (50 Gy). Den akutte toksisiteten er generelt lav, men sene tilfeller av alvorlig diare kan inntreffe. Innskrenkning av for eksempel øvre og fremre feltgrense kan vurderes ved høy alder, redusert allmenntilstand eller andre risikofaktorer (Radu et al., 2008).
Synkrone metastaser
Sist faglig oppdatert: 20.12.2023
Hos pasienter med endetarmskreft og synkrone metastaser, gjøres en individuell vurdering av behandlingsplan i MDT møtet. En bør tilstrebe best mulig behandling av primærtumor og av metastasene i et komprimert pasientforløp.
Ved resektable metastaser bør en vurdere kjemoterapi før/etter metastasekirurgi, og for primærtumor bør en vurdere behov for strålebehandling, fortrinnsvis som 5 Gy x 5 eller alternativt CRT (Mariathasan et al., 2021; van Dijk et al., 2013; van Gijn et al., 2015).
Behandlingsopplegg og anbefalinger preoperativ strålebehandling og kjemoterapi
Sist faglig oppdatert: 31.01.2024
Anbefalinger:
- Preoperativ strålebehandling 5 Gy x 5 skal vurderes til pasienter med ≤ 2 mm fra tumor/ tumordepositt til forventet cirkumferent reseksjonsmargin (CRM) eller ≤ 1 mm fra patologisk lymfeknute til CRM uten andre høyrisikofaktorer.
- Preoperativ strålebehandling 5 Gy x 5 og kjemoterapi (RAPIDO-regime) anbefales for pasienter med minst ett av følgende kriterier: T4a med innvekst i omslagsfolden og/eller tegn til fokal peritoneal carcinomatose, CRM+ (≤1 mm), N1c, N2 eller EMVI+. Pasienten bør være i god funksjonsstatus, ECOG 0-1, uten kontraindikasjoner for strålebehandling og kombinasjons-kjemoterapi.
- Pasienter med mrT4b eller tumordepositter som medfører usikkerhet vedrørende resektabilitet, bør vurderes for kjemoradioterapi 1,8–2,0 Gy x 25–28 med kapecitabin.
- Behandlingsanbefaling for pasienter med T4b som forventes å kunne tåle total neoadjuvant terapi:
To likeverdige alternativer:
1) Kjemoterapi før kjemoradioterapi (CRT):
- FOLFOX/(FOLFIRINOX)/CAPOX i ca. 1-2 md. etterfulgt av responsevaluering. Ved respons/stabil sykdom og akseptabel toleranse kontinuere kjemoterapi til inntil FOLFOX x 8/(FOLFIRINOX x 6)/CAPOX x 6 etterfulgt av ny responsevaluering. Deretter CRT til 50 Gy, responsevaluering og operasjon.
2) Kjemoradioterapi (CRT) før kjemoterapi:
- CRT til 50 Gy etterfulgt av kjemoterapi med samme regimer som nevnt over.
- Pasienter med metastatiske lymfeknuter på laterale bekkenvegg: her foreligger ingen konsensus slik at enten CRT eller kort strålebehandling 5 Gy x 5 med påfølgende kombinasjonskjemoterapi (RAPIDO) kan benyttes.
- Pasienter som ikke anses å tåle kombinasjonsbehandling som ved RAPIDO-regime, bør vurderes for preoperativ strålebehandling 5 Gy x 5 eller CRT 1,8–2,0 Gy x 25–27 med kapecitabin
- Pasienter med redusert funksjonsnivå/allmenntilstand og/eller alvorlig komorbiditet, og til pasienter i redusert allmenntilstand, eller pasienter med synkrone metastaser, kan preoperativ strålebehandling med 5 Gy x 5 være et godt alternativ.
Praktisk gjennomføring av behandling etter RAPIDO-regimet
I RAPIDO-studien var det to mulige kjemoterapi-regimer etter kort strålebehandling 5 Gy x 5, enten 6 CAPOX kurer eller 9 kurer FOLFOX-4. I våre retningslinjer har vi helt gått over til å benytte CAPOX eller modifisert FOLFOX-6. Det har vært diskusjoner om antall kurer og effekt versus toksisitet (van der Valk et al., 2020).
Behandlingsopplegg med justering av antallet kjemoterapikurer preoperativt basert på toksisitet og compliance:
Uke 1: Kort strålebehandling 5 Gy x 5
Uke 3–20 (3–14): Kjemoterapi med CAPOX x 4–6 eller FOLFOX x 6–9.
Uke 22–24 (16–18): Kirurgi 2–4 uker etter avsluttet siste kur med kjemoterapi
CAPOX har varighet 3 uker, FOLFOX 2 uker.
Ved usikkerhet om resektabilitet kan en vurdere boost til GTV + 1 cm med 2 Gy x 2–3.
MR bekken bør utføres etter 2–3 kurer hvis usikkerhet om tumorprogresjon/effekt.
CAPOX: Kapecitabin 1000 mg/m² peroralt dag 1–14, Oksaliplatin 130 mg/m² i.v. dag 1, pause fra behandling dag 15–21. Intervall mellom kurene 3 uker.
mFOLFOX(6): Oksaliplatin 85 mg/m² i.v. dag 1, Calciumfolinat 400 mg/m² i.v. dag 1, bolus Fluorouracil 400 mg/m² i.v. dag 1, Fluorouracil 2400 mg/m² i.v. i 46–48 timer på Baxterpumpe. Intervall mellom kurene 2 uker.
Kjemoradioterapi til 50 Gy
Dosering: Kapecitabin tabletter, 825 mg/m2, tas morgen og kveld alle dagene med strålebehandling. Alternativt FLv-stråle med 5-FU i.v. 400 mg/m2 og Calciumfolinat 100 mg i.v. gitt ca. 30–45 min før strålebehandling to påfølgende dager i uke 1, 3 og 5.
Anbefaling vedrørende DPYD-test:
- Det anbefales at svar på DPYD genotype (evidensgrad B) foreligger før behandling med 5-FU/kapecitabin (se kapittel Molekylær og DPYD diagnostikk). Ved påvist mutasjon følges gjeldende retningslinjer med hensyn til utelating eller dosereduksjon av 5-FU basert kjemoterapi.
Evaluering av respons:
Kort strålebehandling 5 Gy x 5 eller kjemoradioterapi:
MR rektum/bekken, CT thorax/abdomen/bekken og eventuelt rektoskopi 4–8 uker etter avsluttet behandling. Hvis det er progresjon av tumor, må pasienten opereres snarest. Ved respons på strålebehandling planlegges operasjon utført ca. 8–12 uker etter fullført strålebehandling.
RAPIDO-regimet:
MR rektum/bekken og CT thorax/abdomen/bekken gjøres 1–2 uker etter at siste kurdag er avsluttet. Eventuelt også ny rektoskopi. Sette inn tidspunkt for planlagt operasjon her?
Hvis operasjon planlegges på annet sykehus enn der kjemoterapi administreres, så er det viktig med tydelig logistikk rundt rekvirering av røntgenundersøkelser og oppmelding til diskusjon på MDT møte der operasjon skal utføres.
Strålebehandling - praktisk inntegning av strålefelt
Sist faglig oppdatert: 31.01.2024
GTV (gross tumour volume):
GTV betegner makroskopisk tumor. Man tegner inn kontur av primær tumor, oftest inklusive hele omkretsen av tarmlumen, idet det er vanskelig å skille tumorutbredelsen tydelig fra normal tarmslimhinne ut fra MR og CT. Navnes GTVp
I tillegg tegnes inn de lymfeknuter eller tumordeposisjoner som oppfattes som malignt vev (kan evt navnes GTVn).
CTV (clinical target volume):
CTV betegner risikoområde for subklinisk spredning. «Elektivt» CTV inkluderer relevante lymfeknutestasjoner (CTVe_46 eller CTVe_25), mens «boost» CTV (CTVp/n_50) = GTVp/n + 1cm isotrop margin som korrigeres for skjelett og muskulatur med mindre det mistenkes direkte innvekst (Joye et al., 2015; Roels et al., 2006).
Ved 5 Gy x 5 behandles kun elektivt felt (CTVe_25), ingen boost. Makroskopisk tumor skal imidlertid være inkludert med 1 cm margin så den bør tegnes.
Inntegning av elektivt CTV (CTVe_46/CTVe_25)
Inkluderes hos alle:
- Presacralområdet
- Mesorektum inkludert den mesorektale fascien fra promontoriet/rectalis superior-karene og ned til nivået der m. levator ani går inn i rectumveggen/toppen av puborektalis-slyngen. Dette blir vanligvis nedre grense for CTV (bør være minimum 2 cm fra GTV). M. levator ani inkluderes med noen mm margin.
- Laterale lymfeknuter:
- Iliaca interna fra promontorienivå/delingen av illiaca communis
- Obturator-knuter (kan utelates ved T3N0 beliggende over omslagsfold/>10cm fra analåpning)
I tillegg må CTVp/n være inkludert i det elektive volumet.
Inkluderes hos utvalgte pasienter:
- Iliaca eksterna knuter:
- T4 svulster med klar innvekst i fremre organer
- ved metastase i lyske
- ved store metastaser i obturatorgebetet
- Lysker:
- inkluderes ved innvekst i nedre 1/3 av vagina eller betydelig infiltrasjon i følgende organ: ischiorektalfossa, analkanal eller sfinkterapparatet.
CTV rundt kar tegnes med 7 mm margin eller mot begrensende anatomiske strukturer. Ventralt for iliaca externa må margin vurderes opp mot risiko for metastase kontra risiko for tynntarmstoksisitet hos den enkelte pasient.
Lave tumores (< 5–6 cm fra analåpningen)
Analkanal og sfinkter inkluderes med 5–10 mm margin. Ved stor tumorinfiltrasjon i fossa ischiorektalis inkluderes dette området i sin helhet.
Strålebehandling kan gis med 3-felt konvensjonell behandling, evt. kan man bruke IMRT, gjerne med simultan integrert boost.
Postoperativ (adjuvant) behandling
Sist faglig oppdatert: 20.12.2023
Positiv margin (R1-reseksjon med histologisk verifisert tumor ≤ 1 mm fra reseksjonskant eller R2-reseksjon) er en betydelig risikofaktor for utvikling av residiv (Ceelen et al., 2009; Dahl et al., 1990; Wibe et al., 2002). Perforasjon av tumor eller tumornær tarm gir også økt risiko for tilbakefall (Eriksen et al., 2004). Postoperativ strålebehandling reduserer risiko for residiv og øker overlevelsen for pasienter med høy risiko for tilbakefall (Tveit et al., 1997). Det er imidlertid også økt risiko for metastastisk sykdom, og pasientene bør vurderes for adjuvant kjemoterapi.
Postoperativ CRT (2 Gy x 25 med kapecitabine eller 5FU) reduserer risiko for lokalt residiv (Krook et al., 1991; Tveit et al., 1997) Det er ikke påvist effekt av adjuvant kjemoterapi hos pasienter som har fått preoperativ CRT (Bosset et al., 2014). I en kanadisk meta-analyse fant man effekt av adjuvant kjemoterapi både ved tykk- og endetarmskreft (Dube et al., 1997). De siste europeiske konsensus retningslinjene (EURECCA) (Valentini et al., 2014) gir noe støtte for behandling av pN+ og andre risikofaktorer som invasjon i kar/lymfekar og uklar reseksjonsmargin, hvis pasienten ikke har fått preoperativ behandling.
Effekten av adjuvant kjemoterapi uten forutgående strålebehandling er ikke avklart. Noen studier har vist effekt, mens i andre studier er det en subgruppe effekt på svulster beliggende i øvre 5 cm av rektum (Breugom et al., 2015). Den siste oppdateringen av EORTC studien (Bosset et al., 2014) viser imidlertid ikke samme effekt hos de med høye cancere.
I en oversiktsartikkel basert på 24 randomiserte studier og ca 10 000 pasienter (Poulsen et al., 2015), konkluderer Poulsen et al at det ikke er evidens for adjuvant kjemoterapi hos pasienter som har fått preoperativ (kjemo-)radioterapi for rektum cancer. For pasienter som ikke er behandlet preoperativt støtter flere studier adjuvant kjemoterapi med 5-FU alene.
I en review artikkel (Glimelius, 2020) er den generelle konklusjonen at det ikke er sikker evidens for effekt av adjuvant kjemoterapi ved rektumcancer. Resultatene påvirkes imidlertid av ulike faktorer, bl a lang tid til start av behandling.
Det argumenteres for at pasienter med stadium T4a eller stadium III som ikke har fått preoperativ strålebehandling bør vurderes for postoperativ kjemoterapi som ved sigmoideumcancer (se avsnitt om adjuvant kjemoterapi ved coloncancer).
En nyere studie vedr adjuvant kjemoterapi ved ypN+ rektumcancer, inkluderte pasienter fra Nederland og Frankrike (n=239) (Denost et al., 2023). Studien var en prospektiv, men ikke randomisert, sammenlignende cohort studie. Analysene viste høyere forekomst av metastaser i gruppen som ikke fikk kjemoterapi (32.0% (n=40) vs 17.5% (n=11), P=0.034). Sykdomsfri overlevelse ved 1 and 5 år postoperativt var signifikant bedre i gruppen som fikk adjuvant kjemoterapi (92% vs 80% ved 1 år; 72% vs 51% ved 5 år, P=0.024). Det var ingen forskjell i total overlevelse.
Anbefalinger:
- Postoperativ strålebehandling 2 Gy x 25 kombinert med kjemoterapi (kapecitabin eller nordisk FLv i doser tilpasset samtidig strålebehandling), kan vurderes ved (evidensgrad A):
- Mikroskopisk (CRM ≤ 1 mm) eller makroskopisk ikke-radikal reseksjon (R1 eller R2)
- Per- eller preoperativ tumornær perforasjon. Kjemoterapi alene kan også være et alternativ.
- Postoperativ kjemoterapi kan være et alternativ til postoperativ strålebehandling ved høy risiko for lokalt residiv/metastatisk sykdom, spesielt ved T4a eller andre risikofaktorer som N+ og EMVI.
- Pasienter operert for endetarmskreft etter neoadjuvant CRT tilbys ikke adjuvant kjemoterapi som standardbehandling, men kan vurderes individuelt ved risikofaktorer.
- Pasienter som ikke har fått preoperativ behandling kan vurderes for adjuvant kjemoterapi som ved coloncancer, spesielt ved svulster beliggende i øvre tredjedel av rektum.
Resektabel og potensielt resektabel endetarmskreft
Sist faglig oppdatert: 20.12.2023
Endetarmskreft er en heterogen gruppe, fra små tidlige svulster som bør opereres direkte, til mer utbredte svulster med høy risiko for lokalt residiv og metastasering, og behov for preoperativ behandling før kirurgi. Dette gjør at resultatene i studier varierer mye avhengig av pasientutvalget.
Vurderingen av primær kirurgi versus neoadjuvant behandling før kirurgi baseres på følgende funn fra klinisk undersøkelse og radiologisk utredning (MR bekken/rektum og CT thorax/abdomen/bekken):
- Tumorhøyde (nedre, midtre, øvre rektum)
- Tumors invasive del i forhold til tarmens omkrets, angitt som klokkeslett
- Infiltrasjonsdybde av tumoren. Ved lokalavansert tumor skal infiltrasjonsdybde i det perirektale fettvevet angis (ekstramural tumorvekst/T3 subklassifikasjon) og innvekst i naboorganer (T4b) eller peritoneale omslagsfold (T4a).
- Avstand til forventet cirkumferensiell reseksjonsmargin (CRM) som omfatter mesorektal fascie (MRF), vagina/uterus, prostata, m. levator ani og m. puborectalis.
- Patologiske lymfeknuter og tumordepositter, både i og utenfor mesorektum (laterale bekkenvegg, omfatter fossa obturatoria, foramen ischiadicum majus og områdene langs iliaca interna og externa karene).
- Ekstramural vaskulær invasjon (EMVI).
- Fjernmetastaser.
MRF og CRM
Flere studier viser at 2 mm avstand fra tumor og/eller tumordepositt til MRF er tilstrekkelig for å predikere fri margin (Bernstein et al., 2009; Nagtegaal et al., 2002; Taylor et al., 2011). Det er grunn til å tro at kort avstand til mistenkt patologisk lymfeknute med intakt kapsel gir mindre risiko for residiv enn kort avstand til primærtumor. Det anbefales preoperativ strålebehandling hvis avstanden fra tumor eller tumordepositt til MRF er ≤ 2 mm, eller ≤ 1 mm fra patologisk lymfeknute.
Neoadjuvant behandling gis som konvensjonell strålebehandling (2 Gy x 25, eventuelt 1,8 Gy x 28) samtidig med 5-FU basert kjemoterapi, eller kort strålebehandling (5 Gy x 5) uten samtidig kjemoterapi. Begge fraksjoneringsregimer er vist i randomiserte studier og meta-analyser å redusere forekomsten av lokale residiv med cirka 50 %, også ved bruk av total mesorektal eksisjon (TME) kirurgi (Erlandsson et al., 2017; Valentini et al., 2014; van Gijn et al., 2011).
I Norge har anbefalingene i stor grad vært basert på risikofaktorer knyttet til reseksjons-marginen. Studier viser at kort avstand til CRM gir økt risiko for lokalt residiv (Bernstein et al., 2012; Nagtegaal et al., 2008; Wibe et al., 2002), og T4-svulster med organinnvekst (T4b) har høyere risiko for tilbakefall. Tumors avstand til CRM predikeres ved avstand fra svulst til MRF og/eller m. levator ani, m. puborectalis, prostata/ glandula seminalis eller vagina/ uterus på aktuelle MR-bilder (Beets-Tan et al., 2001; MERCURY Study Group, 2006).
Til tross for ulike retningslinjer har resultatene med hensyn til tilbakefall og overlevelse vist seg å være relativt sammenfallende i Norge og Sverige (Glimelius et al., 2016).
Konvensjonell preoperativ strålebehandling med 1,8–2 Gy’s fraksjoner til 50–50,4 Gy gir bedre resultater med samtidig (strålesensibiliserende) kjemoterapi, 5-FU eller kapecitabin, enn strålebehandling til 50 Gy alene (Braendengen et al., 2008; Glimelius et al., 2003), og er assosiert med akseptabel akutt- og sentoksisitet (Birgisson et al., 2007; Braendengen et al., 2011; Bruheim et al., 2010; Pietrzak et al., 2007). Det er også grunnlag for at resektable svulster uten affeksjon av MRF og med relativt liten risiko for recidiv (T3a/b, N1a/b, EMVI-) i større grad kan behandles med 5 Gy x 5 alene med god tumor skrumpning, og hos ca. 10 % også patologisk komplett respons (Erlandsson et al., 2019).
EMVI +, N1c, dybdevekst
Det er publisert flere artikler som omhandler MR og betydningen av risikofaktorer for lokalt og systemisk tilbakefall. Tumors dybdevekst (ekstramural tumorvekst) målt i millimeter og angitt som T3 a–d subklassifikasjon (Patel et al., 2011; Taylor et al., 2008) og EMVI+ (Chand et al., 2016) ser ut til å ha stor prognostisk og prediktiv betydning (Chand et al., 2015; Lord et al., 2022a; Lord et al., 2022b). Videre har også N-substadium, spesielt N1c, der det påvises tumordepositter/tumorsatellitter langs drenerende vener, prognostisk betydning. N1c er, i motsetning til de andre N-stadiene, uttrykk for hematogen spredning og dermed et tidlig stadium av systemisk sykdom. En kan vurdere preoperativ strålebehandling (evt. kombinert med kjemoterapi) til pasienter med T3-4 tumor og/eller påvist EMVI+ eller N1c, uavhengig av avstand til MRF.
T4a
Ved høytsittende tumores som kun har vokst inn mot, eller inn i peritoneum (T4a), og som kan fjernes kirurgisk med god margin, er det ingen klar evidens vedrørende preoperativ behandling. Enkelte anbefaler direkte kirurgi, andre 5 Gy x 5 eller kjemoradioterapi før kirurgi (Schmoll et al., 2012). Generelt anbefales ikke preoperativ strålebehandling, men er det påvist langstrakt innvekst i den peritoneale omslagsfolden og/eller allerede MR morfologiske tegn forenlig med fokal peritoneal carcinomatose der primær kirurgi ikke vil gi god nok margin, bør preoperativ kjemoradioterapi vurderes. Her kan behandling basert på RAPIDO-studien (Bahadoer et al., 2021) med kort strålebehandling og påfølgende kjemoterapi være et aktuelt alternativ. Pasienter med pT4a tumor som ikke har fått strålebehandling bør tilbys adjuvant kjemoterapi med henvisning til onkologisk vurdering på samme måte som coloncancer (som anbefalt i ESMO guidelines (Glynne-Jones et al., 2017)).
Lavtsittende tumores
I nedre del av rektum der det anatomisk er lite eller ikke mesorektalt fettvev og kort avstand til m. levator ani/m. puborectalis, prostata/glandula seminalis eller vagina/portio, er det ofte diskutabelt hva som er riktig behandling for å oppnå tilstrekkelig fri margin. Lavtsittende svulster har høyere risiko for residiv, delvis relatert til korte marginer til CRM eller relatert til peroperativ tumornær perforasjon og ufrie render (R1-reseksjon), sammenlignet med høyere beliggende svulster som opereres med lav fremre reseksjon eller Hartmann (Anderin et al., 2013; West et al., 2010).
I nedre rektum vil i noen tilfeller selv små svulster (T2) ha kort margin til CRM. Det vil være indikasjon for preoperativ strålebehandling ved de fleste lave svulster (T2/ avansert T2 – T4b stadium), der man ikke har nok mesorektalt fettvev mellom tumor/ tumoraffisert muscularis og MRF. Ved mindre utbredt cancer (T1 sm1- T1 sm3 og tidlig T2 stadium) der man har minst 1 mm eller mer bevart muscularis og der det kan oppnås adekvat margin ved kirurgi alene, kan primær kirurgi vurderes uten behov for preoperativ strålebehandling. Behandlingsvalg hos pasienter med lave, tidlige svulster (T1 sm1- T1 sm3 og tidlig T2 stadium) vil ofte være basert på en individuell vurdering, og bør dokumenteres tydelig i MDT-notatet.
Signal/homogenitet, utseende og relasjon til drenerende vener benyttes for å skille tumorsatellitter fra lymfeknutemetastaser og reaktive lymfeknuter. MR er den best egnede modaliteten for slik kartlegging preoperativt. Retningslinjer fra European Society of Gastrointestinal Radiology (Beets-Tan et al., 2018) for vurdering av lymfeknutemetastaser legger vekt på følgende kriterier: kortakse diameter ≥ 9 mm, og minst ett av kriteriene rund form, uregelmessig kant eller heterogent signal. Hvis lymfeknuten er mindre, 5–8 mm, må to kriterier være til stede, og ved diameter < 5 mm må alle tre tilleggskriterier være oppfylt.
Strålebehandling med tanke på å oppnå klinisk komplett respons er foreløpig kun anbefalt innen kliniske studier. Pasienter som defineres medisinsk inoperable, kan vurderes for palliativ strålebehandling med tanke på lokal kontroll.
Primært ikke-resektabel endetarmskreft
Sist faglig oppdatert: 20.12.2023
Lokalt avansert svulst forekommer hos ca. 10–15 % av pasientene med endetarmskreft. Det vil si at svulsten vokser inn i omgivende organer (T4b) eller helt inn til den mesorektale fascien eller mot bekkenveggen (Bjerkeset et al., 1987). Siktemålet for preoperativ CRT er å skrumpe svulsten, og dermed øke mulighetene for radikal kirurgi eller å begrense omfanget av det kirurgiske inngrepet, og redusere risiko for lokoregionalt tilbakefall. I tillegg ønsker en å sterilisere drenasjeområdet fra tumor og organer/strukturer med innvekst for å redusere faren for residiv og metastaser. Det er viktig at pasienten vurderes på et MDT med erfaring fra denne pasientgruppen, og at inntegning av målvolum tar hensyn til utbredelsen av tumor. Pasienten bør opereres ved sentra med erfaring i kirurgi utenfor TME-planet («Beyond TME») og multiviscerale reseksjoner. Ved innvekst i vagina (behov for vaginal reseksjon) eller maligne lymfeknuter på laterale bekkenvegg som ikke er synlig etter strålebehandling, kan operasjon ved sentra uten slik spesialkompetanse vurderes. Standardbehandling har vært preoperativ strålebehandling mot primærsvulst og lymfeknuteregioner med dose til tumor opp til 50–50,4 Gy sammen med 5FU eller kapecitabin. Studier har vist resektabilitet opp til 80 %, komplett patologisk respons hos ca. 9–20 % (Mariathasan et al., 2018), og blant de opererte, langtidsoverlevelse på 50–65 % (Frykholm et al., 2001; Gerard et al., 2006; Rominger et al., 1985). Disse pasientene har høy metastaserisiko i sykdomsforløpet og bør vurderes for total neoadjuvant terapi (Mariathasan et al., 2021).
5 Gy x 5 med påfølgende kjemoterapi vs. kjemoradioterapi
I RAPIDO-studien (Bahadoer et al., 2021), ble pasienter med lokalt avanserte svulster (T4a/b, N2, MRF+, EMVI+, eller maligne lymfeknuter på bekkenveggen) randomisert til standard preoperativ kjemoradioterapi og evt. adjuvant kjemoterapi, eller eksperimentell arm med strålebehandling 5 Gy x 5 etterfulgt av kjemoterapi med 6 CAPOX eller 9 FOLFOX kurer før kirurgi. I alt 920 pasienter ble randomisert, og oppdaterte resultater etter 5 års oppfølging viser signifikant redusert sykdomsrelatert behandlingssvikt (disease-related treatment failure, DrTF) på 27.8 % vs. 34 % (p=0,048) i den eksperimentelle armen (Dijkstra et al., 2023). Dette var det primære endepunkt i studien.
Det var færre metastaser i den eksperimentelle armen (23 % vs. 30,4 % etter 5 år), og færre metastaser i lever (9 % vs 15 %, p=0,002). Total overlevelse var ikke forskjellig, 81,7 % vs
80,2 % (p=0,5). Det var imidlertid høyere forekomst av lokale recidiv i eksperimentell arm sammen-lignet med standard arm (10,1 % vs. 6,1 %, p=0.027).
Det er diskutert ulike faktorer som forklaring til dette; at forlenget periode med kjemoterapi med RAPIDO-regimet gir en mer fragil og fibrotisk mesorectum og at tradisjonell 3D-konformal strålebehandling ble benyttet i større grad ved kort strålebehandling, mens IMRT/VMAT ble benyttet i større grad ved CRT. Andre mulige forklaringer som diskuteres er om økt grad av tumorskrumpning i RAPIDO-armen medførte større grad av lav fremre reseksjon enn rektumamputasjon.
Registrering av toksisitet og livskvalitet viste at behandlingen ble gjennomgående godt tolerert, uten tydelig forskjell mellom behandlingsarmene.
I RAPIDO studien ble kun 8 % av inkluderte pasienter (69/826) operert med kirurgi av andre organer. Det er gjort analyser for subgrupper, inkludert cT4, som alle er i favør av eksperimentell gruppe med tanke på DrTF, men ikke egne analyser for pasienter med T4b med hensyn på lokalt residiv eller overlevelse. Det foreligger derfor ikke tilstrekkelig dokumentasjon for å innføre RAPIDO regimet som standard vedT4b svulster.
Det fremkom ikke signifikant økt risiko for lokalt residiv (LRR) ved RAPIDO-regimet vs. CRT ved metastatiske lymfeknuter på bekkenvegg (Bahadoer et al., 2023). Ved metastatiske lymfeknuter på bekkenvegg ble det vist økt risiko for lokalt residiv (HR 1,79 (1,02-3,13) p= 0,042), men uavhengig av behandlingsregime.
Det er planlagt ytterligere spesifikke analyser i RAPIDO-studien, spesielt for å forstå forskjellene i andelen lokale recidiv.
En polsk studie, som sammenliknet CRT med 50 Gy vs. kort strålebehandling 5 Gy x 5 og 3 FOLFOX, fant ingen forskjell i lokal kontroll eller sykdomsfri overlevelse (Bujko et al., 2016; Ciseł et al., 2019). I denne studien var imidlertid ikke utredning med MR obligatorisk.
Total neoadjuvant terapi
Total neoadjuvant terapi (TNT) med kjemoterapi før eller etter preoperativ CRT eller kort strålebehandling har i de senere år vært undersøkt i flere randomiserte studier (Conroy et al., 2021; Fokas et al., 2022; Garcia-Aguilar et al., 2022; Jin et al., 2022), i tillegg til RAPIDO. Inklusjonkriterier har vært lokalt avanserte svulster definert som T4, T3 med kort avstand til MRF, mrEMVI+, og mrN2. Ulike kombinasjoner av kjemoterapi både før og etter strålebehandling har vært forsøkt. Intensjonen har vært å spare organer, oppnå downstaging for de mest lokalavanserte svulstene før kirurgi, og å forhindre fjernmetastaser.
PRODIGE 23-studien (Conroy et al., 2021) viste bedre 3 år DFS (75 % vs 69 %) med FOLFIRINOX før CRT sammenlignet med CRT hos pasienter med cT3 eller cT4M0 cancer. Begge grupper fikk adjuvant FOLFOX i hhv. 3 md. og 6 md. Behandlingsrekkefølgen ser ikke ut til å ha betydning for total eller sykdomsfri overlevelse, men det er rapportert høyere klinisk og patologisk komplett responsrate og mulighet for organbevarende strategi dersom CRT gis først (Fokas et al., 2022; Garcia-Aguilar et al., 2022). Alle studiene rapporterer andel pasienter med patologisk komplett respons (pCR) opp mot 30 % ved TNT og rundt 15 % ved CRT alene. I OPRA-studien rapporterte man klinisk komplett respons (cCR) på over 50 % hos pasienter som fikk CRT etterfulgt av FOLFOX/CAPOX i 4 md.
Pasienter med lokalt avansert rektumcancer (LARC) har økt risiko for fjernmetastaser, totalt 43 % i et materiale fra Radiumhospitalet, med total 5-års overlevelse på 32 %, mot 89 % hos de som ikke utvikler metastaser (Mariathasan et al., 2021).
Det forventes at TNT vil kunne gi både øket radikalitet, redusert behov for organreseksjoner, og redusert forekomst av fjernmetastaser.
For pasienter med stadium T4b kan man vurdere TNT i form av CRT til 50 Gy etterfulgt av neoadjuvant kjemoterapi (FOLFOX/(FOLFIRINOX)/CAPOX i ca. 1-2 md.) etterfulgt av responsevaluering. Ved respons/stabil sykdom og akseptabel toleranse kontinueres kjemoterapi inntil FOLFOX x 8/(FOLFIRINOX x 6)/CAPOX x 6 kurer etterfulgt av ny responsevaluering og operasjon. Man kan også gi kjemoterapi først etterfulgt av CRT.
Pasientene vil da kunne få like omfattende systemisk behandling som i RAPIDO i tillegg til at man optimaliserer sannsynligheten for respons i bekkenet ved å gi CRT 50 Gy. Behandlingsopplegget tilsvarer OPRA studien (dersom man gir FOLFOX/CAPOX) eller PRODIGE 23 (dersom man gir FOLFIRINOX før CRT) og er derfor godt dokumentert i studier. FOLFIRINOX kan vurderes når det er kliniske, molekylære eller radiologiske karakteristika som skulle tilsi behov for spesielt aggressiv behandling.
Behandling av pasienter med høy alder og/eller redusert funksjonsevne
Sist faglig oppdatert: 20.12.2023
Hos disse pasientene kan kort strålebehandling med 5 Gy x 5 og kirurgi etter 8–10 uker være et alternativ (Hatfield et al., 2009; Radu et al., 2008). Ved potensielt resektabel tumor hvor kirurgi kan bli aktuelt, vil man ved planlegging av kort strålebehandling definere clinical target volume (CTV) på samme måte som ved ordinær strålebehandling (50 Gy). Den akutte toksisiteten er generelt lav, men sene tilfeller av alvorlig diare kan inntreffe. Innskrenkning av for eksempel øvre og fremre feltgrense kan vurderes ved høy alder, redusert allmenntilstand eller andre risikofaktorer (Radu et al., 2008).
Synkrone metastaser
Sist faglig oppdatert: 20.12.2023
Hos pasienter med endetarmskreft og synkrone metastaser, gjøres en individuell vurdering av behandlingsplan i MDT møtet. En bør tilstrebe best mulig behandling av primærtumor og av metastasene i et komprimert pasientforløp.
Ved resektable metastaser bør en vurdere kjemoterapi før/etter metastasekirurgi, og for primærtumor bør en vurdere behov for strålebehandling, fortrinnsvis som 5 Gy x 5 eller alternativt CRT (Mariathasan et al., 2021; van Dijk et al., 2013; van Gijn et al., 2015).
Behandlingsopplegg og anbefalinger preoperativ strålebehandling og kjemoterapi
Sist faglig oppdatert: 31.01.2024
Anbefalinger:
- Preoperativ strålebehandling 5 Gy x 5 skal vurderes til pasienter med ≤ 2 mm fra tumor/ tumordepositt til forventet cirkumferent reseksjonsmargin (CRM) eller ≤ 1 mm fra patologisk lymfeknute til CRM uten andre høyrisikofaktorer.
- Preoperativ strålebehandling 5 Gy x 5 og kjemoterapi (RAPIDO-regime) anbefales for pasienter med minst ett av følgende kriterier: T4a med innvekst i omslagsfolden og/eller tegn til fokal peritoneal carcinomatose, CRM+ (≤1 mm), N1c, N2 eller EMVI+. Pasienten bør være i god funksjonsstatus, ECOG 0-1, uten kontraindikasjoner for strålebehandling og kombinasjons-kjemoterapi.
- Pasienter med mrT4b eller tumordepositter som medfører usikkerhet vedrørende resektabilitet, bør vurderes for kjemoradioterapi 1,8–2,0 Gy x 25–28 med kapecitabin.
- Behandlingsanbefaling for pasienter med T4b som forventes å kunne tåle total neoadjuvant terapi:
To likeverdige alternativer:
1) Kjemoterapi før kjemoradioterapi (CRT):
- FOLFOX/(FOLFIRINOX)/CAPOX i ca. 1-2 md. etterfulgt av responsevaluering. Ved respons/stabil sykdom og akseptabel toleranse kontinuere kjemoterapi til inntil FOLFOX x 8/(FOLFIRINOX x 6)/CAPOX x 6 etterfulgt av ny responsevaluering. Deretter CRT til 50 Gy, responsevaluering og operasjon.
2) Kjemoradioterapi (CRT) før kjemoterapi:
- CRT til 50 Gy etterfulgt av kjemoterapi med samme regimer som nevnt over.
- Pasienter med metastatiske lymfeknuter på laterale bekkenvegg: her foreligger ingen konsensus slik at enten CRT eller kort strålebehandling 5 Gy x 5 med påfølgende kombinasjonskjemoterapi (RAPIDO) kan benyttes.
- Pasienter som ikke anses å tåle kombinasjonsbehandling som ved RAPIDO-regime, bør vurderes for preoperativ strålebehandling 5 Gy x 5 eller CRT 1,8–2,0 Gy x 25–27 med kapecitabin
- Pasienter med redusert funksjonsnivå/allmenntilstand og/eller alvorlig komorbiditet, og til pasienter i redusert allmenntilstand, eller pasienter med synkrone metastaser, kan preoperativ strålebehandling med 5 Gy x 5 være et godt alternativ.
Praktisk gjennomføring av behandling etter RAPIDO-regimet
I RAPIDO-studien var det to mulige kjemoterapi-regimer etter kort strålebehandling 5 Gy x 5, enten 6 CAPOX kurer eller 9 kurer FOLFOX-4. I våre retningslinjer har vi helt gått over til å benytte CAPOX eller modifisert FOLFOX-6. Det har vært diskusjoner om antall kurer og effekt versus toksisitet (van der Valk et al., 2020).
Behandlingsopplegg med justering av antallet kjemoterapikurer preoperativt basert på toksisitet og compliance:
Uke 1: Kort strålebehandling 5 Gy x 5
Uke 3–20 (3–14): Kjemoterapi med CAPOX x 4–6 eller FOLFOX x 6–9.
Uke 22–24 (16–18): Kirurgi 2–4 uker etter avsluttet siste kur med kjemoterapi
CAPOX har varighet 3 uker, FOLFOX 2 uker.
Ved usikkerhet om resektabilitet kan en vurdere boost til GTV + 1 cm med 2 Gy x 2–3.
MR bekken bør utføres etter 2–3 kurer hvis usikkerhet om tumorprogresjon/effekt.
CAPOX: Kapecitabin 1000 mg/m² peroralt dag 1–14, Oksaliplatin 130 mg/m² i.v. dag 1, pause fra behandling dag 15–21. Intervall mellom kurene 3 uker.
mFOLFOX(6): Oksaliplatin 85 mg/m² i.v. dag 1, Calciumfolinat 400 mg/m² i.v. dag 1, bolus Fluorouracil 400 mg/m² i.v. dag 1, Fluorouracil 2400 mg/m² i.v. i 46–48 timer på Baxterpumpe. Intervall mellom kurene 2 uker.
Kjemoradioterapi til 50 Gy
Dosering: Kapecitabin tabletter, 825 mg/m2, tas morgen og kveld alle dagene med strålebehandling. Alternativt FLv-stråle med 5-FU i.v. 400 mg/m2 og Calciumfolinat 100 mg i.v. gitt ca. 30–45 min før strålebehandling to påfølgende dager i uke 1, 3 og 5.
Anbefaling vedrørende DPYD-test:
- Det anbefales at svar på DPYD genotype (evidensgrad B) foreligger før behandling med 5-FU/kapecitabin (se kapittel Molekylær og DPYD diagnostikk). Ved påvist mutasjon følges gjeldende retningslinjer med hensyn til utelating eller dosereduksjon av 5-FU basert kjemoterapi.
Evaluering av respons:
Kort strålebehandling 5 Gy x 5 eller kjemoradioterapi:
MR rektum/bekken, CT thorax/abdomen/bekken og eventuelt rektoskopi 4–8 uker etter avsluttet behandling. Hvis det er progresjon av tumor, må pasienten opereres snarest. Ved respons på strålebehandling planlegges operasjon utført ca. 8–12 uker etter fullført strålebehandling.
RAPIDO-regimet:
MR rektum/bekken og CT thorax/abdomen/bekken gjøres 1–2 uker etter at siste kurdag er avsluttet. Eventuelt også ny rektoskopi. Sette inn tidspunkt for planlagt operasjon her?
Hvis operasjon planlegges på annet sykehus enn der kjemoterapi administreres, så er det viktig med tydelig logistikk rundt rekvirering av røntgenundersøkelser og oppmelding til diskusjon på MDT møte der operasjon skal utføres.
Strålebehandling - praktisk inntegning av strålefelt
Sist faglig oppdatert: 31.01.2024
GTV (gross tumour volume):
GTV betegner makroskopisk tumor. Man tegner inn kontur av primær tumor, oftest inklusive hele omkretsen av tarmlumen, idet det er vanskelig å skille tumorutbredelsen tydelig fra normal tarmslimhinne ut fra MR og CT. Navnes GTVp
I tillegg tegnes inn de lymfeknuter eller tumordeposisjoner som oppfattes som malignt vev (kan evt navnes GTVn).
CTV (clinical target volume):
CTV betegner risikoområde for subklinisk spredning. «Elektivt» CTV inkluderer relevante lymfeknutestasjoner (CTVe_46 eller CTVe_25), mens «boost» CTV (CTVp/n_50) = GTVp/n + 1cm isotrop margin som korrigeres for skjelett og muskulatur med mindre det mistenkes direkte innvekst (Joye et al., 2015; Roels et al., 2006).
Ved 5 Gy x 5 behandles kun elektivt felt (CTVe_25), ingen boost. Makroskopisk tumor skal imidlertid være inkludert med 1 cm margin så den bør tegnes.
Inntegning av elektivt CTV (CTVe_46/CTVe_25)
Inkluderes hos alle:
- Presacralområdet
- Mesorektum inkludert den mesorektale fascien fra promontoriet/rectalis superior-karene og ned til nivået der m. levator ani går inn i rectumveggen/toppen av puborektalis-slyngen. Dette blir vanligvis nedre grense for CTV (bør være minimum 2 cm fra GTV). M. levator ani inkluderes med noen mm margin.
- Laterale lymfeknuter:
- Iliaca interna fra promontorienivå/delingen av illiaca communis
- Obturator-knuter (kan utelates ved T3N0 beliggende over omslagsfold/>10cm fra analåpning)
I tillegg må CTVp/n være inkludert i det elektive volumet.
Inkluderes hos utvalgte pasienter:
- Iliaca eksterna knuter:
- T4 svulster med klar innvekst i fremre organer
- ved metastase i lyske
- ved store metastaser i obturatorgebetet
- Lysker:
- inkluderes ved innvekst i nedre 1/3 av vagina eller betydelig infiltrasjon i følgende organ: ischiorektalfossa, analkanal eller sfinkterapparatet.
CTV rundt kar tegnes med 7 mm margin eller mot begrensende anatomiske strukturer. Ventralt for iliaca externa må margin vurderes opp mot risiko for metastase kontra risiko for tynntarmstoksisitet hos den enkelte pasient.
Lave tumores (< 5–6 cm fra analåpningen)
Analkanal og sfinkter inkluderes med 5–10 mm margin. Ved stor tumorinfiltrasjon i fossa ischiorektalis inkluderes dette området i sin helhet.
Strålebehandling kan gis med 3-felt konvensjonell behandling, evt. kan man bruke IMRT, gjerne med simultan integrert boost.
Postoperativ (adjuvant) behandling
Sist faglig oppdatert: 20.12.2023
Positiv margin (R1-reseksjon med histologisk verifisert tumor ≤ 1 mm fra reseksjonskant eller R2-reseksjon) er en betydelig risikofaktor for utvikling av residiv (Ceelen et al., 2009; Dahl et al., 1990; Wibe et al., 2002). Perforasjon av tumor eller tumornær tarm gir også økt risiko for tilbakefall (Eriksen et al., 2004). Postoperativ strålebehandling reduserer risiko for residiv og øker overlevelsen for pasienter med høy risiko for tilbakefall (Tveit et al., 1997). Det er imidlertid også økt risiko for metastastisk sykdom, og pasientene bør vurderes for adjuvant kjemoterapi.
Postoperativ CRT (2 Gy x 25 med kapecitabine eller 5FU) reduserer risiko for lokalt residiv (Krook et al., 1991; Tveit et al., 1997) Det er ikke påvist effekt av adjuvant kjemoterapi hos pasienter som har fått preoperativ CRT (Bosset et al., 2014). I en kanadisk meta-analyse fant man effekt av adjuvant kjemoterapi både ved tykk- og endetarmskreft (Dube et al., 1997). De siste europeiske konsensus retningslinjene (EURECCA) (Valentini et al., 2014) gir noe støtte for behandling av pN+ og andre risikofaktorer som invasjon i kar/lymfekar og uklar reseksjonsmargin, hvis pasienten ikke har fått preoperativ behandling.
Effekten av adjuvant kjemoterapi uten forutgående strålebehandling er ikke avklart. Noen studier har vist effekt, mens i andre studier er det en subgruppe effekt på svulster beliggende i øvre 5 cm av rektum (Breugom et al., 2015). Den siste oppdateringen av EORTC studien (Bosset et al., 2014) viser imidlertid ikke samme effekt hos de med høye cancere.
I en oversiktsartikkel basert på 24 randomiserte studier og ca 10 000 pasienter (Poulsen et al., 2015), konkluderer Poulsen et al at det ikke er evidens for adjuvant kjemoterapi hos pasienter som har fått preoperativ (kjemo-)radioterapi for rektum cancer. For pasienter som ikke er behandlet preoperativt støtter flere studier adjuvant kjemoterapi med 5-FU alene.
I en review artikkel (Glimelius, 2020) er den generelle konklusjonen at det ikke er sikker evidens for effekt av adjuvant kjemoterapi ved rektumcancer. Resultatene påvirkes imidlertid av ulike faktorer, bl a lang tid til start av behandling.
Det argumenteres for at pasienter med stadium T4a eller stadium III som ikke har fått preoperativ strålebehandling bør vurderes for postoperativ kjemoterapi som ved sigmoideumcancer (se avsnitt om adjuvant kjemoterapi ved coloncancer).
En nyere studie vedr adjuvant kjemoterapi ved ypN+ rektumcancer, inkluderte pasienter fra Nederland og Frankrike (n=239) (Denost et al., 2023). Studien var en prospektiv, men ikke randomisert, sammenlignende cohort studie. Analysene viste høyere forekomst av metastaser i gruppen som ikke fikk kjemoterapi (32.0% (n=40) vs 17.5% (n=11), P=0.034). Sykdomsfri overlevelse ved 1 and 5 år postoperativt var signifikant bedre i gruppen som fikk adjuvant kjemoterapi (92% vs 80% ved 1 år; 72% vs 51% ved 5 år, P=0.024). Det var ingen forskjell i total overlevelse.
Anbefalinger:
- Postoperativ strålebehandling 2 Gy x 25 kombinert med kjemoterapi (kapecitabin eller nordisk FLv i doser tilpasset samtidig strålebehandling), kan vurderes ved (evidensgrad A):
- Mikroskopisk (CRM ≤ 1 mm) eller makroskopisk ikke-radikal reseksjon (R1 eller R2)
- Per- eller preoperativ tumornær perforasjon. Kjemoterapi alene kan også være et alternativ.
- Postoperativ kjemoterapi kan være et alternativ til postoperativ strålebehandling ved høy risiko for lokalt residiv/metastatisk sykdom, spesielt ved T4a eller andre risikofaktorer som N+ og EMVI.
- Pasienter operert for endetarmskreft etter neoadjuvant CRT tilbys ikke adjuvant kjemoterapi som standardbehandling, men kan vurderes individuelt ved risikofaktorer.
- Pasienter som ikke har fått preoperativ behandling kan vurderes for adjuvant kjemoterapi som ved coloncancer, spesielt ved svulster beliggende i øvre tredjedel av rektum.
Palliativ strålebehandling
Tumor i det lille bekken – lokalavansert primærtumor eller residiv – kan gi betydelig morbiditet med smerter, fistler, vannlatings- og avføringsproblemer. Det er derfor av stor verdi å oppnå lokal kontroll også dersom pasienten ikke behandles med kurativ intensjon. Palliativ strålebehandling gir god symptomlindring av symptomer i bekkenet (Cameron, Kersten, Vistad, Fossa, & Guren, 2014; Cameron et al., 2016). Ulike palliative stråleregimer kan være aktuelle. Behandlingen kan gis med 5 Gy x 5, evt kan også 3 Gy x 10–13, evt 2 Gy x 25 benyttes. Strålefeltet omfatter svulsten med marginer. Pasientens almenntilstand, funksjonsnivå, sykdomsutbredelse, forventet levetid og symptomer vil avgjøre behandlingsvalget.
Protonbehandling
Det finnes foreløpig svært lite litteratur om bruk av protonterapi ved endetarmskreft. Noe dokumentasjon foreligger ved bruk av protonterapi ved rebestråling av residiv (Koroulakis et al., 2021).
Gevinsten vil sannsynligvis være god dekning av aktuelle strålevolum med mindre stråledose til normalvev omkring svulsten (tynntarm, urinblære, hofteledd). Kanskje kan også stråledosen økes mot tumor. En antar at protonbehandling vil kunne være gunstig ved rebestråling av endetarmskreft eller andre tilfeller der det er viktig å redusere dose til normalvev.
Studier må avventes før en kan komme med anbefalinger.
Immunterapi
Våren 2022 ble det presentert svært lovende resultater i en studie med immunterapi, der pasienter med dMMR (MSI) rektumcancer stadium II og III fikk dostarlimab (PD-1-hemmer) neo-adjuvant i 6 mnd. Av 16 inkluderte pasienter hadde 12 nådd planlagt oppfølgingstid på 6 mnd etter avsluttet behandling. Alle 12 pasientene hadde oppnådd komplett klinisk respons ut fra klinisk undersøkelse, skopi med biopsier, MR, CT og PET/CT. (N Engl J Med 2022; 386:2363-2376).
I studien var det planlagt standard preoperativ kjemoradioterapi hvis viabel tumor etter immunterapi. Foreløpig har ingen hatt behov for slik behandling.
Dette er en fase II studie ved en singel institusjon med få pasienter. Det er fremdeles tidlig i oppfølgingen, og forfatterne understreker at resultatene må etterprøves i større prospektive studier. Men resultatene er usedvanlig lovende. Andelen dMMR/MSI ved rektumcancer er ca 3% (N Engl J Med 2022: 387;186 (letter)). Hvis det er gode resultater vedrørende langtidsoverlevelse, og disse pasientene kan slippe cellegift, strålebehandling og kirurgi, såkalt organbevarende behandling, så vil det være et stort fremskritt sammenlignet med standard behandling.
Det anbefales at alle pasienter med tykk- og endetarmskreft testes for dMMR/MSI som del av primær utredning, uavhengig av sykdomsstadium. Pasienter med lokalt avansert rektumcancer (LARC) med verifisert dMMR/ MSI vil kunne vurderes for behandling med immunterapi, men det vil spesielt gjelde pasienter der det er usikkerhet om man får til et radikalt inngrep uten optimal downstaging. Dette må gjøres i en i kontrollert setting med en standardisert og tett oppfølgning av pasientene, og helst i form av en klinisk studie.
Behandling av lokalt residiv av endetarmskreft
Sist faglig oppdatert: 20.05.2022
Residiv av endetarmskreft kan forårsake betydelig redusert levetid og livskvalitet pga. smerter, blødning, tarmstenoser eller fistler til skjede, tarm eller blære. Ubehandlet er median overlevelse ca. 15 måneder (Nielsen et al., 2015), men behandling med kjemoradioterapi og kirurgi kan gi 5-års overlevelse hos 20–35 % (Gunderson et al., 1997; Troja, El-Sourani, Abdou, Antolovic, & Raab, 2015), i selekterte serier opp til 50 % (You et al., 2016). Et godt resultat er avhengig av at disse pasientene behandles ved sentra som har ekspertise og volum for denne typen behandling.
Preoperativ (neoadjuvant) strålebehandling eventuelt rebestråling
Sist faglig oppdatert: 20.05.2022
Preoperativ strålebehandling bør være standard ved lokalt residiv (M. H. Hansen et al., 2009) (evidensgrad C). De fleste lokale residiv av endetarmskreft sitter utenfor tarmveggen, affiserer bekkenveggen og er fikserte når de blir oppdaget. Pasienter med lokalt residiv bør i prinsippet vurderes og behandles på samme måte som pasienter med primært lokalavansert endetarmskreft hvis strålebehandling mot bekkenet ikke er utført tidligere (Glimelius et al., 2013). I enkelte tilfeller kan det være indikasjon for re-bestråling hos pasienter som tidligere har fått neoadjuvant eller adjuvant strålebehandling. Ofte brukes hyperfraksjonert teknikk 1,2 Gy 2 ganger daglig til en totaldose på 40,8 Gy, eller 1,5 Gy 2 ganger daglig til totaldose 40–45 Gy, kombinert med kapecitabin (Das et al., 2010; Guren et al., 2014; Mohiuddin, Marks, & Marks, 2002; Valentini et al., 2006). Målvolumet er tumor med marginer, og en bør vurdere flerfelt strålebehanlding eller IMRT for å redusere normalvevstoksisitet. I Norge vil denne behandlingen kun være aktuell for noen få pasienter i året, og den bør derfor sentraliseres og registreres. Ved palliativ intensjon kan det være aktuelt med rebestråling med en fraksjon daglig, for eksempel 2 Gy x 10–15 uten samtidig kjemoterapi (M. K. Ng, Leong, Heriot, & Ngan, 2013).
Anbefaling
- Lokalt residiv bør behandles med preoperativ strålebehandling hvis mulig. Re‑bestråling kan vurderes hos enkelte pasienter (evidensgrad C).
Kontraindikasjon for kirurgi
Sist faglig oppdatert: 20.05.2022
Vanlige kontraindikasjoner for residivkirurgi er: tumor som infiltrerer S1-virvelen, tumorvekst i sakralkanalen, affeksjon av nervene L5 eller S1 eller av vena iliaca communis/externa (D. J. Lee, Sagar, Sadadcharam, & Tan, 2017; Milne et al., 2013). Alder >75 år kombinert med redusert funksjonsnivå og/eller alvorlig komorbiditet, eller betydelig komorbiditet alene, er en relativ kontraindikasjon for større residivkirurgi. Hydronefrose er av enkelte regnet som kontraindikasjon (Lev-Chelouche, Keidar, Rub, Matzkin, & Gutman, 2001; Lopez, Kraybill, Downey, Johnston, & Bricker, 1987), men dette kan ikke vises i en norsk behandlingsserie (S. G. Larsen, Wiig, & Giercksky, 2005).
Kirurgisk behandling
Sist faglig oppdatert: 20.05.2022
Resultatene av residivkirurgi er betydelig bedre om kirurgi og neoadjuvant behandling kombineres (P. J. Tanis, Doeksen, & van Lanschot, 2013). Fem års overlevelsen etter R0-reseksjon er nær den samme som etter behandling av lokalavansert endetarmskreft, men R0-status er vanskeligere å oppnå ved residivkirurgi (Wiig, Larsen, Dueland, & Giercksky, 2008).Tumor bør fjernes en bloc, og en bør ha mulighet til å utføre bekkeneksentrasjon eller abdominosakral reseksjon (Wanebo, Gaker, Whitehill, Morgan, & Constable, 1987), samt ha tilgang til plastikk kirurgisk kompetanse.
Anbefaling
- Kirurgi, eventuelt med preoperativ strålebehandling eller rebestråling, er eneste kurative behandlingsalternativ for lokalt residiv (evidensgrad C).
Preoperativ (neoadjuvant) strålebehandling eventuelt rebestråling
Sist faglig oppdatert: 20.05.2022
Preoperativ strålebehandling bør være standard ved lokalt residiv (M. H. Hansen et al., 2009) (evidensgrad C). De fleste lokale residiv av endetarmskreft sitter utenfor tarmveggen, affiserer bekkenveggen og er fikserte når de blir oppdaget. Pasienter med lokalt residiv bør i prinsippet vurderes og behandles på samme måte som pasienter med primært lokalavansert endetarmskreft hvis strålebehandling mot bekkenet ikke er utført tidligere (Glimelius et al., 2013). I enkelte tilfeller kan det være indikasjon for re-bestråling hos pasienter som tidligere har fått neoadjuvant eller adjuvant strålebehandling. Ofte brukes hyperfraksjonert teknikk 1,2 Gy 2 ganger daglig til en totaldose på 40,8 Gy, eller 1,5 Gy 2 ganger daglig til totaldose 40–45 Gy, kombinert med kapecitabin (Das et al., 2010; Guren et al., 2014; Mohiuddin, Marks, & Marks, 2002; Valentini et al., 2006). Målvolumet er tumor med marginer, og en bør vurdere flerfelt strålebehanlding eller IMRT for å redusere normalvevstoksisitet. I Norge vil denne behandlingen kun være aktuell for noen få pasienter i året, og den bør derfor sentraliseres og registreres. Ved palliativ intensjon kan det være aktuelt med rebestråling med en fraksjon daglig, for eksempel 2 Gy x 10–15 uten samtidig kjemoterapi (M. K. Ng, Leong, Heriot, & Ngan, 2013).
Anbefaling
- Lokalt residiv bør behandles med preoperativ strålebehandling hvis mulig. Re‑bestråling kan vurderes hos enkelte pasienter (evidensgrad C).
Kontraindikasjon for kirurgi
Sist faglig oppdatert: 20.05.2022
Vanlige kontraindikasjoner for residivkirurgi er: tumor som infiltrerer S1-virvelen, tumorvekst i sakralkanalen, affeksjon av nervene L5 eller S1 eller av vena iliaca communis/externa (D. J. Lee, Sagar, Sadadcharam, & Tan, 2017; Milne et al., 2013). Alder >75 år kombinert med redusert funksjonsnivå og/eller alvorlig komorbiditet, eller betydelig komorbiditet alene, er en relativ kontraindikasjon for større residivkirurgi. Hydronefrose er av enkelte regnet som kontraindikasjon (Lev-Chelouche, Keidar, Rub, Matzkin, & Gutman, 2001; Lopez, Kraybill, Downey, Johnston, & Bricker, 1987), men dette kan ikke vises i en norsk behandlingsserie (S. G. Larsen, Wiig, & Giercksky, 2005).
Kirurgisk behandling
Sist faglig oppdatert: 20.05.2022
Resultatene av residivkirurgi er betydelig bedre om kirurgi og neoadjuvant behandling kombineres (P. J. Tanis, Doeksen, & van Lanschot, 2013). Fem års overlevelsen etter R0-reseksjon er nær den samme som etter behandling av lokalavansert endetarmskreft, men R0-status er vanskeligere å oppnå ved residivkirurgi (Wiig, Larsen, Dueland, & Giercksky, 2008).Tumor bør fjernes en bloc, og en bør ha mulighet til å utføre bekkeneksentrasjon eller abdominosakral reseksjon (Wanebo, Gaker, Whitehill, Morgan, & Constable, 1987), samt ha tilgang til plastikk kirurgisk kompetanse.
Anbefaling
- Kirurgi, eventuelt med preoperativ strålebehandling eller rebestråling, er eneste kurative behandlingsalternativ for lokalt residiv (evidensgrad C).
Behandling av resektable og potensielt resektable metastaser
Levermetastaser
Sist faglig oppdatert: 20.12.2023
Årlig diagnostiseres ca. 4500 nye pasienter med tykk- og endetarmskreft. Omtrent 20 % har synkrone metastaser (Søreide et al., 2008), og senere vil ytterligere 15–20 % av pasientene få diagnostisert levermetastaser. I Norge vil dette si mer enn 1500 pasienter i året. Anslagsvis 20–30 % av disse er aktuelle for operativ behandling (Angelsen et al., 2017). Nye pre- og peroperative teknikker og effektiv kjemoterapi har utvidet mulighetene. Det ble gjort ca 450 leverreseksjoner ved de fem universitetsklinikkene i 2018 (Lassen et al., 2019), hvorav anslagsvis 340 (75 %) for metastaser. Ablasjoner er ikke medregnet.
Diagnostikk
Preoperativ bildediagnostikk skal innbefatte flerfase CT og/eller MR lever med leverspesifikt kontrastmiddel. Ultralyd med kontrast benyttes tidvis til vurdering av leverlesjoner hvor det på CT og/eller MR er tvil om diagnosen. Det skal videre utføres CT-thorax, abdomen og bekken og eventuell primærtumor i tykk- eller endetarm må utredes etter egne retningslinjer. PET-CT kan benyttes for å avklare eventuell ekstrahepatisk sykdom (Bonanni et al., 2014; Sahani et al., 2014; Selzner et al., 2004; Wiering et al., 2005).
Leverbiopsi
Leverbiopsi er kun indisert hvis det ikke foreligger mulighet for reseksjon eller hvis diagnosen ikke er radiologisk sikker. Hvis pasienten planlegges operert for levermetastaser/annen malign leverlesjon, ansees biopsi å utgjøre en risiko for implantasjonsmetastaser (Colorectal Cancer Collaborative Group, 2001; Jones et al., 2005) (evidensgrad C).
Resektabilitets- og operabilitetsvurdering
Det er teknisk resektabel sykdom hvis tilstrekkelig funksjonelt levervev gjenstår. Dette betyr i praksis > 20 % fungerende parenkym (> 30 % ved kjemoterapipreget og 40-50 % ved cirrhotisk eller på annen måte syk lever) med bevart arteriell og portal inflow, adekvat galledrenasje og adekvat venedrenasje. Ekstrahepatiske metastaser skal i utgangspunktet være resektable. Det er sannsynlig at utvalgte pasienter med begrenset antall ikke-resektable lungemetastaser kan ha glede av leverreseksjon. Det gjøres peritonektomi med HIPEC og lungereseksjoner også hos pasienter med levermetastaser, men hovedprinsippet i dag er at leveren skal være «under kontroll». Skillet mellom kurativt og palliativt siktemål er glidende: Mange pasienter oppnår betydelig forlenget livslengde og livskvalitet ved kirurgi selv om de ikke blir komplett tumorfrie. En rekke negative prognostiske faktorer er identifisert: ekstrahepatiske metastaser, høy CEA-verdi etter kjemoterapi, dårlig/ingen respons på kjemoterapi, mange metastaser, store metastaser, mutasjon i KRAS eller BRAF genene, maligne lymfeknuter ved primærtumor, raske residiv osv. Selv blant pasienter med flere av disse karakteristika er det imidlertid noen langtidsoverlevere (>5 år) etter kirurgi. Det påpekes at reseksjon er en fordel, selv ved R1-reseksjon, det vil si «kant i kant» med tumor, spesielt hos pasienter med god respons på preoperativ kjemoterapi. Det tilstrebes likevel en sikker tumorfri margin. En viktig begrensning er størrelsen og kvaliteten på den gjenværende delen av leveren. Denne kan imidlertid økes med volumekspanderende tiltak.
Anbefalinger:
- Leverbiopsi er kun indisert hvis pasienten ikke skal/kan opereres for levermetastaser eller diagnosen ikke er radiologisk sikker (evidensgrad C).
- Operasjonsindikasjon kan foreligge selv ved ekstrahepatiske manifestasjoner (evidensgrad D).
Kirurgisk behandling av levermetastaser
Pasienter som kan være aktuelle for kirurgisk behandling skal vurderes i multidisiplinært møte (MDT) før behandlingen bestemmes. Hovedprinsippet er å bevare mest mulig normalt levervev.
Erfaringen med laparoskopisk teknikk er økende og også formelle hemihepatektomier kan gjøres laparoskopisk. Laparoskopisk teknikk gir noe raskere funksjonell rekonvalesens (fire mot fem dager) og derved ett døgns raskere utskrivelse enn åpen teknikk (fem mot seks dager) i en blindet europeisk multisenterstudie (Fichtinger, 2021). For mindre reseksjoner er forskjellen sannsynligvis omtrent den samme basert på data fra den norske ikke-blindede COMET-studien (Fretland et al., 2018). Ved mindre reseksjoner (kilereseksjoner, lateral venstresidig reseksjon) er laparoskopisk teknikk også etablert som likeverdig onkologisk (Aghayan et al., 2021). Det utføres et økende antall lokale reseksjoner, og disse kan utføres laparoskopisk eller åpent. Metodevalg vil bestemmes av metastasen(e)s beliggenhet og kirurgens preferanser.
Volumekspanderende tiltak
Portveneembolisering (PVE) anvendes for å øke størrelsen på den planlagte restlever. Ved god teknikk i ikke-cirrhotisk lever når man sannsynligvis adekvat volum i over 80 % av tilfellene, avhengig av hvor dårlig utgangspunktet er. Det vil dog være noen pasienter som ikke får adekvat tilvekst. Intraoperativ portvenedeling med tillegg av in situ deling av leverparenkym (ALPPS) er i en skandinavisk RCT (LIGRO) vist å gi raskere hypertrofi av fremtidig leverrest (FLR), og kan hos selekterte pasienter forsøkes hvis man ikke har oppnådd adekvat størrelse av FLR ved portveneembolisering (Sandström et al., 2018). Det er dog beheftet med øket komplikasjonsrate. Dobbeltveneembolisering (av portvene og ipsilateral levervene; «liver vein deprivation») er også en teknikk som kan gi mer hypertrofi enn PVE alene. Teknikken er etablert ved OUS og eventuell tilleggsgevinst evalueres i en pågående europeisk studie (DRAGON).
Operasjon i to seanser er aktuelt der det foreligger uttalt metastasering til begge leverlapper eller der gjenværende del (future liver remnant, FLR) bedømmes for liten.
Ablasjonsbehandling
Termisk ablasjon (radiofrekvensablasjon (RFA) eller mikrobølgeablasjon (MWA)) benyttes som supplement til kirurgi og kan være et alternativ til leverreseksjon. Termisk ablasjon alene vurderes oftest ved små (<3 cm) metastaser, der det er medisinske kontraindikasjoner for kirurgi (Higgins et al., 2006; Ko et al., 2014; Stoltz et al., 2014; Tanis et al., 2014), eller hvor reseksjon vil gi uønsket stort parenkymtap. Det er fortsatt omdiskutert om langtidsresultatene er likeverdige med reseksjon der begge modaliteter er mulige.
Irreversibel elektroporering (IRE, «nanonkniv») er en ikke-termisk ablasjonsteknikk som kan brukes i svært selekterte tilfeller der termisk ablasjon er uegnet pga nærhet til kar og galleganger. Dette tilbudet er i Norge foreløpig kun etablert ved OUS.
Stereotaktisk bestråling (SBRT)
Det vises til eget avsnitt lenger ned i dette kapittelet (se underkapittel Stereotaktisk strålebehandling av metastaser). SBRT har vært lite benyttet for levermetastaser i Norge, men brukes utstrakt i Danmark. Ved små svulster som ikke er tilgjengelig for reseksjon eller ablasjon kan dette vurderes hvis avstand til risikoorganer er tilstrekkelig.
Behandlingsrekkefølge ved levermetastaser ved diagnosetidspunktet (synkrone metastaser)
Ved diagnosetidspunktet for kreft i tykk- eller endetarm har ca. 20 % levermetastaser. Pasienter med ikke-stenoserende primærtumor og synkrone levermetastaser bør vurderes i multidisiplinært team før det iverksettes behandling.
Metastatisk sykdom ved diagnosetidspunktet (stadium IV/synkrone metastaser) indikerer at det foreligger systemsykdom. Dette utgjør rasjonalet for å vurdere initiell systemisk behandling fremfor lokalbehandling, selv om sykdomsmanifestasjonene hver for seg er teknisk resektable. Ettersom median alder ved påvist coloncancer er 73 år (Larsen, 2021), er det imidlertid sannsynlig at ca halvparten av pasientene ikke vil være kandidater for kombinasjonskjemoterapi grunnet alder og/eller komorbiditet, og disse bør likevel vurderes for resektabilitet og medisinsk operabilitet.
Ved symptomer fra primærtumor kan det være aktuelt at denne behandles først og deretter metastasene, men som regel vurderes altså kjemoterapi (3–6 kurer) før kirurgi fordi det anses viktigst å få kontroll over (lever)metastasene. Pasienter som oppnår respons på kjemoterapi, vil oftest ha effekt både på levermetastasene og primærtumor. Pasienter med progresjon på kjemoterapi derimot har dårligere prognose, og kirurgisk behandling av levermetastasene eller en asymptomatisk primærtumor vil oftest avhenge av at man får respons på neste linje systemisk behandling. EXCALIBUR-protokollene (OUS) inkluderer pasienter med multiple ikke-resektable metastaser og progresjon eller utilstrekkelig respons på systemisk kjemoterapi for utprøving av eksperimentell behandling i denne situasjonen.
Ved kreft i endetarmen og synkrone levermetastaser er retningslinjene for strålebehandling de samme som ved endetarmskreft alene. Fraksjonering med 5 Gy x 5 bør foretrekkes dersom det ikke er nødvendig med kjemoradioterapi til 50 Gy for «down-staging» av primærtumor. Det kan være aktuelt med operasjon av levermetastaser i tidsvinduet mellom avsluttet strålebehandling og endetarmskirurgi.
Hos pasienter med resektabel primærtumor og resektable levermetastaser, kan man vurdere å gjennomføre leverreseksjonen først (inngrepet med lavest komplikasjonsrisiko), deretter reseksjon av primærtumor (Adam, 2007) (evidensgrad D).
Synkrone operasjoner
Hos pasienter hvor det planlegges en begrenset leverreseksjon, kan samtidig operasjon av primærtumor i tykktarm vurderes. Økende bruk av laparoskopisk teknikk både for tykk- og endetarmskreft og for lokal reseksjon i lever gjør at synkron operasjon kan vurderes for egnede pasienter. Det er avgjørende at den samlede (primærtumor + leverreseksjon) operative belastningen ikke blir for stor.
Anbefalinger:
- Pasienter som kan være aktuelle for leverreseksjon og/eller ablasjon, skal vurderes i multidisiplinært team (MDT) før oppstart behandling
- Lokal tumorrettet behandling er eneste kurative mulighet ved levermetastaser, og skal tilbys pasienter som kan få utført radikal reseksjon/ablasjon med adekvat fremtidig leverrest (FLR)
- Ved synkrone metastaser bør man vurdere kjemoterapi før reseksjon av primærtumor og metastaser
- Endetarmskreft bør vurderes for preoperativ strålebehandling etter vanlige retningslinjer, kort strålebehandling 5 Gy x 5 foretrekkes hvis mulig
- Hos pasienter med resektabel primærtumor og resektable levermetastaser, kan det vurderes å gjennomføre leverreseksjonen først (inngrep med lavest komplikasjonsrisiko), deretter reseksjon av primærtumor (evidensgrad D)
- Synkron (simultan) reseksjon av primærtumor og levermetastase(-r) kan vurderes hos pasienter med lav ECOG-score og liten tumorutbredelse i lever
Kjemoterapi ved primært resektable levermetastaser
Selv om kirurgisk fjerning av levermetastaser er mulig hos en rekke pasienter, er 5-års overlevelsen bare 45–50 % (Brudvik et al., 2013; Storli et al., 2019) og 70 % av pasientene vil få residiv (Brudvik et al., 2013). Man søker derfor tilleggsbehandling som kan redusere residivrisikoen, men nytten er uviss. Diskusjonen har dreid seg om kjemoterapi før reseksjon (preoperativ/neoadjuvant), etter reseksjon (postoperativ/adjuvant) eller en kombinasjon av begge deler (perioperativ). I begrepene neoadjuvant/adjuvant ligger at behandlingen gis i tillegg til annen hovedbehandling (her: kirurgi/reseksjon/ablasjon). Konseptuelt er det viktig å skille neoadjuvant kjemoterapi fra «down-sizing» eller «down-staging» der kjemoterapi skal gjøre kirurgi teknisk lettere eller teknisk mulig. Tilsvarende skal begrepet adjuvant kjemoterapi kun brukes i situasjoner der pasienten er makroskopisk tumorfri.
Neoadjuvant kjemoterapi
Det er ingen data fra randomiserte studier som dokumenterer økt totaloverlevelse ved neoadjuvant kjemoterapi. Eventuelle studier må ta med de som progredierer under kjemoterapi og ikke får reseksjon som planlagt (intention to treat, ITT) i analysene. Det er imidlertid tvilsomt om en slik randomisert studie vil la seg gjennomføre ettersom neoadjuvant behandling er såpass innarbeidet i fagmiljøet. Bruken av neoadjuvant kjemoterapi er økende internasjonalt og drives nok i betydelig grad av ønske om en viss biologisk seleksjon. Med økende grad av molekylærbiologiske undersøkelser av tumor så vel som sirkulerende tumor-DNA, vil slik seleksjon forhåpentlig kunne gjøres på annet vis i fremtiden.
Adjuvant kjemoterapi etter kirurgisk behandling av levermetastaser
I en liten randomisert studie gav adjuvant 5 FU en signifikant økt DFS (33,5 vs 26,7 mnd), men ingen signifikant overlevelsesgevinst sammenlignet med ingen behandling etter reseksjon (Portier et al., 2006). En nylig publisert japansk RCT (Kanemitsu et al., 2021) viste også forbedret DFS ved adjuvant oxaliplatinbasert kjemoterapi etter reseserte metastaser, men heller ikke den viste gevinst på overlevelse. Det er i dag den største og metodologisk sterkeste dokumentasjonen vi har, men også den har svakheter som lang inkluderingsperiode og sein oppstart av adjuvant kjemoterapi. Den var heller ikke styrkeberegnet for overlevelse, kun for DFS. Adjuvant kjemoterapi anbefales dermed ikke gitt rutinemessig, men kan vurderes dersom pasienten ikke tidligere har fått adjuvant kjemoterapi. Dersom det allerede er gitt kjemoterapi før kirurgi av primærtumor og/eller metastaser bør antall adjuvante kurer reduseres tilsvarende slik at total behandlingstid med kjemoterapi begrenses til 6 måneder.
Perioperativ (neoadjuvant/adjuvant) kjemoterapi
I en EORTC-studie (Nordlinger et al., 2008) ble 364 pasienter <75 år med ≤ 4 resektable levermetastaser (mediant én metastase) fra kolorektalkreft randomisert til leverkirurgi med eller uten pre- og postoperativ kjemoterapi (FOLFOX, 6 kurer før og 6 etter kirurgi). Kjemoterapi økte 3-års sykdomsfri overlevelse blant de som gjennomgikk leverreseksjon, men kun pasienter i god allmenntilstand og med forhøyet CEA (> 5) hadde nytte av behandlingen, uavhengig av antall metastaser (Sorbye et al., 2012). 5-års overlevelse var ikke signifikant forskjellig (Nordlinger et al., 2013). Dette resultatet utelukker ikke at noen pasienter kan ha hatt nytte av den neoadjuvante komponenten, men at denne effekten druknet i manglende effekt hos majoriteten, eller manglende effekt av den andre komponenten. Det er ikke dokumentert at perioperativ kjemoterapi bedrer overlevelsen og det anbefales derfor ikke gitt rutinemessig selv om det nok brukes en del internasjonalt.
Anbefalinger:
- Pasienter i funksjonsklasse ECOG 0/1 med usikker biologisk cancersituasjon kan vurderes for neoadjuvant oxaliplatinbasert kjemoterapi. Trekk som taler for slik strategi kan være synkrone, multiple eller store metastaser, og/eller forhøyet CEA. Dokumentasjonen er mangelfull.
- Pasienter med lav CEA, og enkelt resektable metakrone metastaser anbefales operert uten preoperativ kjemoterapi
- Adjuvant kjemoterapi etter kirurgisk behandling for levermetastaser anbefales ikke gitt rutinemessig, men kan vurderes dersom pasienten ikke tidligere har fått adjuvant kjemoterapi etter reseksjon av primærtumor.
Kjemoterapi ved potensielt resektable metastaser
Hensikten er å konvertere primært vanskelig/ikke-resektable levermetastaser til resektable metastaser etter god respons på kjemoterapi (Adam et al., 2004).) Selv om det er stor enighet vedrørende de absolutt inoperable tilfeller, er det betydelig individuell variasjon mellom kirurgers vurderinger av grensetilfellene. Ved evaluering av behandlingsrespons bør det alltid vurderes i MDT møte om metastasene er blitt resektable. Residivraten etter leverkirurgi hos denne pasientgruppen er imidlertid høy.
I en situasjon hvor det er mulighet for senere kirurgi ved god behandlingsrespons, bør det velges et kjemoterapiregime med høyest mulig responsrate frem til tumor har blitt resektabel (Cartwright, 2012; R. P. Jones et al., 2014). Dette innebærer kombinasjonsregime med 5FU og oksaliplatin og/eller irinotecan, eventuelt i kombinasjon med antistoff, se avsnitt om metastastatisk sykdom. Dersom tumor er KRAS-villtype, vil tillegg av EGFR-hemmer kunne øke responsraten ytterligere (Folprecht et al., 2014). Trippelbehandling med FOLFOXIRI (eventuelt med tillegg av bevacizumab) kan gi responsrater over 70 %, men regimet er toksisk, og det er derfor bare aktuelt for selekterte pasienter (Loupakis, Cremolini, Masi, et al., 2014; Masi et al., 2010). For pasienter med tumores med MSI/dMMR status anbefales immunterapi (Pembrolizumab).
Dersom man velger å bruke VEGF-hemmere forut for planlagt kirurgi må man legge inn tilstrekkelig intervall (4–6 uker) (Gruenberger et al., 2008; Kozloff, Yood, Berlin, Flynn, Kabbinavar, Purdie, Ashby, Dong, Sugrue, & Grothey, 2009) mellom siste kur og operasjon (eventuelt gi siste kur uten antistoff). Det vil også være hensiktsmessig å vente i ca 4 uker etter siste behandling med kjemoterapi før kirurgi for å sikre at pasienten har kommet seg gjennom nadirfasen. Videre må man ha i mente at kjemoterapi kan medføre levertoksisitet og dermed påvirke mulighetene for senere kirurgi, slik at det totale antallet kurer forut for mulig kirurgi bør begrenses (Kishi et al., 2010; Robinson, Wilson, Burt, Manas, & White, 2012).
Postoperativ kjemoterapi anbefales ikke gitt rutinemessig (se avsnittet over om Adjuvant kjemoterapi etter kirurgisk behandling av levermetastaser).
Disse anbefalingene gjelder for pasienter i god allmenntilstand og funksjonsklasse.
Anbefaling:
- Ved potensielt resektable levermetastaser anbefales systemisk tumorrettet behandling med høyest mulig responsrate frem til eventuell reseksjon (evidensgrad C). Dette innebærer immunterapi til pasienter med MSI/dMMR tumores og ellers kombinasjonskjemoterapi med 5FU og oksaliplatin eller irinotecan, eventuelt i kombinasjon med antistoff.
Kontroll etter leverreseksjoner
For pasienter som vil kunne være kandidater for ytterligere kreftrettet behandling, anbefales kontroll med CT thorax, abdomen, bekken samt måling av CEA hver 6. måned i 5 år. Kontrollene må samordnes med oppfølging av primærtumor. Re-reseksjon av nye levermetastaser skal vurderes på lik linje med primær vurdering av metastasekirurgi (Brudvik et al., 2013; Muhi et al., 2011; Thelen et al., 2007; Wicherts et al., 2013). Dette styrker grunnlaget for en strukturert oppfølging av denne pasientgruppen.
Anbefaling:
- Pasienter som vil kunne tåle ytterligere kreftrettet behandling bør være i et strukturert kontrollopplegg etter gjennomgått leverreseksjon
Lungemetastaser fra tykk- og endetarmskreft
Sist faglig oppdatert: 20.12.2023
Flere andre kreftformer har høyere tendens enn tykk- og endetarmskreft til å metastasere til lunge, men tykk- og endetarmskreft er den nest hyppigste metastase i lunge (Corrin et al., 2006). Av dem som opereres for tykk- og endetarmskreft, utvikler 10 % lungemetastaser etter en observasjonstid på 0–20 år (Shirouzu et al., 1995).
I 1947 presenterte Alexander og Haigh det første materialet med pasienter operert for lungemetastaser, og de foreslo følgende 3 kriterier for reseksjon:
- Metastasesykdom begrenset til lunge.
- Primærtumor er behandlet definitivt.
- Pasienten må tåle komplett reseksjon av alle lungemetastasene.
Disse kriteriene har ikke blitt vitenskapelig evaluert, men refereres fortsatt.
Til Lungekirurgiregistereti Norge (www.legeforeningen.no/Fagmed/Norsk-thoraxkirurgisk-forening/thoraxkirurgiregisteret) blir det årlig rapportert 150–200 operasjoner for lungemetastaser, og dette utgjør om lag 25 % av alle operasjonene for malign tumor i lunge. Det er et inntrykk at metastaser fra tykk- og endetarmskreft utgjør den største andelen av lungemetastaseoperasjonene.
Dokumentasjon
Det finnes ingen kontrollerte studier som dokumenterer effekten av kirurgi for lungemetastaser fra tykk- og endetarmskreft. I en spørreundersøkelse blant thoraxkirurger i Europa svarte 99 % at de anså lungemetastaser fra tykk- og endetarmskreft å være indikasjon for lungereseksjon (Internullo et al., 2008). Et materiale har vist 30 % 10-års overlevelse etter lungereseksjon for metastase fra tykk- og endetarmskreft (McCormack et al., 1992). En oversiktsartikkel konkluderer med at 5-års overlevelse ligger mellom 38 % og 64 % (median 53 %) for en «undergruppe med sterkt selekterte pasienter» (Pfannschmidt et al., 2007). Utover kriteriene fra 1947 (se over) føyde de til:
- Metastasene må være teknisk resektable.
- Ingen metastaser utenfor thorax er påvist.
Gevinsten av neoadjuvant kjemoterapi ved resektable lungemetastaser er ikke avklart. PET-CT har ingen plass i rutinemessig utredning eller preoperativ avklaring for disse pasientene.
Kombinerte lunge- og levermetastaser fra tykk- og endetarmskreft
Mellom 5 % og 10 % av pasientene med tykk- og endetarmskreft får diagnostisert lever- og lungemetastaser (Avital et al., 2006). Synkrone lunge- og levermetastaser er et svært dårlig prognostisk tegn, og reseksjon av metastaser vil da kun unntaksvis være indisert. Fjorten arbeider med både lunge- og leverreseksjoner hos til sammen 353 pasienter er gjennomgått (Barlow et al., 2009), og median overlevelse etter kirurgi varierer fra 16 til 87 mnd., 5-års overlevelse varierte fra 11 % til 52 %, og et materiale presenterte 10-års overlevelse på 16 %. Det er konkludert med at lunge- og leverreseksjon kan forsvares hos sterkt selekterte pasienter (Avital et al., 2006; Barlow et al., 2009), og det er angitt følgende seleksjonskriterier:
- Ingen tegn til lokalt residiv av primærtumor.
- Ingen påviste metastaser utenom lever og lunge.
- Både lever- og lungemetastasene vurderes resektable med klar margin, samt at det er tilstrekkelig funksjonelt vev igjen.
- Pasienten har tilstrekkelig reservekapasitet i lungene for planlagt reseksjon.
- Pasienten må tåle lang generell anestesi.
Lymfeknutemetastaser/metastaser utenom lever og lunge
Metastaser utenom thorax er omtalt som kontraindikasjon mot operasjon for lungemetastase (Pfannschmidt et al., 2007). Likeledes bør lymfeknutemetastaser i lungehilus oppfattes som disseminert sykdom, og annen behandling enn kirurgi bør tilbys.
Tidspunkt for lungereseksjon
1-, 3- og 5-års overlevelse etter reseksjon av lungemetastaser (fra flere typer primærsvulster) på henholdsvis 91 %, 76 % og 76 % er beskrevet (Tanaka et al., 2008). Den gruppen som ble raskt operert etter påvisning av lungemetastaser, hadde dårligere overlevelse enn gruppen som ble operert etter en observasjonsperiode på 3 måneder. En slik utsettelse avslører en del pasienter med ikke erkjent disseminert sykdom.
Lungereseksjoner, operativ morbiditet og mortalitet
Nær 80 % av operasjonene for lungemetastaser er sublobare reseksjoner. Resten er lobektomier, noen bilobektomier og kun sjeldent pneumonektomier. Begrensede reseksjoner, samt at den aktuelle pasientgruppen har mindre komorbiditet enn pasienter med primær lungecancer, tilsier at operativ morbiditet og mortalitet vil være lav (Avital et al., 2006; Barlow et al., 2009). Operativ (30-dagers) mortalitet bør ligge under 1 %.
Andre behandlingsformer for lungemetastaser
Radiofrekvensablasjon (RFA) har vært i bruk for svulster i lungene i noen år. I et materiale hvor lungemetastaser ble behandlet med RFA (Fanucchi et al., 2016) er det vist akseptable resultater.
Stereotaktisk strålebehandling (SBRT) har kommet som et godt supplement til kirurgi for kurering av kreft i lunge. I et ikke-randomisert materiale med pasienter med lungemetastaser var 5-årsoverlevelse etter SABR (Stereotactic ablative radiotherapy) omtrent som ved kirurgi (Lodeweges et al., 2017). Også SBRT kritiseres for utilstrekkelig dokumentasjon med tanke på overlevelse (Macbeth et al., 2016)
Møter i tverrfaglig team
Gitt den store usikkerhet det er i indikasjon, de komplikasjonspotensialer behandlingen kan ha, samt at det er flere behandlingsmodaliteter, er det nødvendig at pasienter som ønskes vurdert for behandling av lungemetastaser skal diskuteres i tverrfaglig team hvor også thorax-radiolog, -kirurg, samt onkolog deltar. Et slikt tverrfaglig møte kan om nødvendig foregå ved videokonferanse.
Prognostiske faktorer
Økende antall lungemetastaser, samt kort tid fra diagnose av primærtumor til påvisning av lungemetastase(r) påvirker prognosen negativt (Blackmon et al., 2012; Gonzalez et al., 2013) Ut over dette er det ikke påvist selvstendige, statistisk signifikante faktorer som predikerte overlevelse (Pfannschmidt et al., 2007).
Tom Treasure har foretatt en kritisk vurdering av dokumentasjonen for lungemetastasekirurgi og satt opp prognostiske forhold knyttet til overlevelse etter pulmonal metastasektomi (Treasure et al., 2009):
Forhold som påvirker overlevelse | Fordelaktig | Intermediært | Negativt |
|---|---|---|---|
Tid siden primær-operasjon | > 36 måneder | 12–36 måneder | 0–12 måneder |
Antall metastaser | 1 | 2–5 | > 5 |
Affeksjon av 1 eller 2 lunger | Unilateral | Bilateral | Bilateral |
CEA-verdi | < 5 | 5–10 | > 10 |
Levermetastaser | Ingen | Operativt fjernet | Til stede |
Denne oversikten er også i tråd med vår oppfatning av at økende multiplisitet og spredning er uttrykk for dårlig prognose. For ytterligere fordyping anbefales to oversiktsartikler (Chua et al., 2012; Gonzalez et al., 2012).
Anbefalinger:
- Inntil resultater av kontrollerte undersøkelser foreligger, anbefales det at lungemetastaser fra tykk- og endetarmskreft kan opereres (evidensgrad C).
- Som hovedregel bør rekkefølgen være at lungemetastaser opereres sist.
- Forutsetninger for operativ behandling er at:
- Det ikke foreligger kreftsykdom utenfor lungene.
- Alle metastaser kan fjernes radikalt.
- Forhold som svekker indikasjon for operasjon for lungemetastase:
- Kort tid fra behandling av primærtumor til funn av lungemetastase.
- Flere lungemetastaser.
- Engasjement av flere lungelapper.
- Forhøyet CEA.
- Levermetastaser.
- Påviste lymfeknutemetastaser i lungehilus.
Peritoneale metastaser
Sist faglig oppdatert: 20.12.2023
Behandlingen av peritoneale metastaser (peritoneal karsinomatose) har endret seg fra palliasjon til en aggressiv, aktiv behandling hos selekterte pasienter (Sugarbaker, 2003). Maksimal cytoreduktiv kirurgi (CRS) med etterfølgende hyperterm intraperitoneal kjemoterapi (HIPEC) er en lovende behandling for peritoneal karsinomatose og har gitt pasienter med begrenset tumorutbredelse i peritoneum en mulighet for helbredelse. Femårs overlevelsen ved kirurgi for karsinomatose og etterfølgende HIPEC er 35–50 %, selv om en del pasienter får lokalt tilbakefall eller fjernmetastaser i oppfølgingstiden (Frøysnes et al., 2016). Behandlingen gis i Norge på Oslo universitetssykehus, Radiumhospitalet som har nasjonal behandlingstjeneste fra 2009.
Hyppighet
Cirka 5 % av pasienter med primær tykk- og endetarmskreft har karsinomatose ved diagnosetidspunktet, og ved residiv har 25 % karsinomatose (Lemmens et al., 2011; Verwaal et al., 2005). Opptil halvparten av pasientene er uten samtidige systemiske metastaser (Jayne et al., 2002). Årlig vurderes nærmere 300 pasienter med tykk- og endetarmskreft i behandlingstjenesten. I 2016 ble det gitt CRS-HIPEC til 83 pasienter ved Oslo universitetssykehus, Radiumhospitalet og 113 ble operert som en del av behandlingsprogrammet. Nær 80 % av pasientene hadde tykk- og endetarmskreft som utgangspunkt, de resterende pseudomyxom og få abdominalt mesoteliom.
Klassifikasjon
Peritoneal cancer indeks (PCI; brukes til å beskrive utbredelsen av sykdommen i 9 bukregioner og 4 avsnitt av tynntarm. Den er en viktig prognostisk faktor for komplett cytoreduksjon og prognose. Sykdommen lokaliseres enten til steder for drenasje av ascitesvæske (over lever, i det store oment og mot ventrikkelens majorside) eller der tyngdekraften fører tumorcellene (bekkenet eller parakolisk). Tynntarm er lenge spart på grunn av tarmbevegelse, og karsinomatose her forekommer særlig dersom det foreligger adheransedannelse eller utbredelsen er omfattende.
Dokumentasjon
I en randomisert studie mellom peritonektomi med HIPEC og onkologisk behandling (5FU og Leukoverin) fra 2003 var median overlevelse etter peritonektomi cirka 22 mnd. og ved onkologisk behandling 12 mnd (Verwaal et al., 2008) (Evidensgrad A). Moderne systemisk kjemoterapi har bedret overlevelsen, men 5-års overlevelse er sjelden (Elias et al., 2009). I flere andre rapporter har 5-års overlevelsen ved CRS-HIPEC vært 30–50 % (Elias et al., 2006; Glehen et al., 2004; Verwaal et al., 2008) (Evidensgrad B). Behandlingsresultater fra Oslo universitetssykehus, Radiumhospitalet viser 5-års overlevelse ved peritoneale metastaser fra tykk- og endetarmskreft 36 % og tilsvarende median overlevelse 48 mnd (svulster med utgangspunkt fra appendix ikke medtatt) (Frøysnes et al., 2016).Tre faktorer er funnet å være viktige for overlevelse: tumor differensiering, PCI og grad av cytoreduksjon (Yan et al., 2008). Antall organreseksjoner er ikke funnet å bety noe for overlevelse (Franko et al., 2008). Ved PCI index > 12 er sjansen for lokalt recidiv stor. I en systematisk review av 76 studier fant man mean mortalitet etter CRS-HIPEC til 2,8 %, mean morbiditet til 33 %, og 5-års overlevelse på 34–43 % (Huang et al., 2017).
Metode
Prinsippet ved maksimal cytoreduktiv kirurgi (CRS) (Sugarbaker, 2010) er å fjerne all peritoneum parietale med synlig tumor. På tarmen kan små tumorfoci eventuelt brennes vekk med diatermi eller vaporiseseres med plasma jet. Ved større affeksjon må tarmsegmentet fjernes. En opererer i region for region i buken og fjerner alt synlig tumorvev. Normale peritonealflater røres normalt ikke. En starter ofte med omentectomi. Deretter gjøres ofte endelig kirurgi i bekkenet med peritonectomi og reseksjon av rektum og genitalia interna ved behov. Reseksjon av peritoneum parakolisk og behov for tykktarmskirurgi vurderes. Deretter vurderes behovet for reseksjon av peritoneum på diafragmakupler, galleblære og milt. CRS-inngrep tar ofte 6–9 timer før etterfølgende HIPEC som forlenger inngrepet med 3 timer. Reoperasjoner på grunn av infeksjoner, tarmslyng, blødning eller lekkasjer kan bli nødvendig (ca. 10 %). Median liggetid på Radiumhospitalet er 9 dager etter operasjon, men kan være betydelig lenger i noen sentra.
Hyperterm intraperitoneal kjemoterapi (HIPEC)
Dersom en oppnår maksimal cytoreduksjon (CC 0(–1)) gis det påfølgende HIPEC.
Ved å administrere cytostatika intraperitonealt kan konsentrasjonen i skyllevæsken økes betydelig i forhold til om det ble gitt intravenøst. For å forsterke effekten av cytostatika varmes denne opp slik at væsken i bukhulen holder 41–42 °C under hele perfusjonen (90 minutter). Mitomycin C (35 mg/m2, maks 70 mg) er den cellegiften som er best dokumentert ved HIPEC og mest brukt internasjonalt. Denne cellegiften har mange gunstige farmakokinetiske egenskaper ved intraperitoneal bruk, hemmer DNA syntesen i kreftcellene og har økt cytotoksisk virkning ved oppvarming (van Ruth et al., 2003). En bruker en perfusjonsmaskin til å distribuere cellegiften i bukhulen med stor flow og for å varme opp denne til ønsket temperatur. Det gjøres en stor randomisert studie (Prodige 7) i Europa for å se på verdien av HIPEC behandlingen i tillegg til den maksimalt debulkende kirurgien til CC-0. Preliminære data viser lik perioperativ morbiditet og mortalitet i gruppene med og uten HIPEC. Overlevelsesdata vil foreligge i 2018.
Inklusjonskriterier for CRS-Hipec
- Begrenset utbredelse av synkrone eller metakrone peritoneale metastaser fra tykk- og endetarmskreft uten tegn til annen ikke-resektabel systemisk kreftsykdom.
- Mucinøs intraabdominal tumorutbredelse fra appendix vermiformis (pseudomyxoma peritonei (PMP)), uavhengig av tumorutbredelse
- Begrenset utbredelse av abdominalt mesoteliom
- (Vedrørende second-look ved tykk- og endetarmskreft – se avsnitt "Second-look")
Eksklusjonskriterier
- Sentrale glandelmetastaser etter utredning ved bruk av CT, MR, evt. PET eller laparoscopi
- Ikke-resektable organmetastaser
- Peritoneale metastaser på større avsnitt av tynntarmen (gjelder ikke ved PMP)
- Peritoneal Cancer Index (PCI) (Sugarbaker, 2003) over 22–25 (gjelder ikke v. PMP)
- ECOG performance status ≥ 2–3
- Betydelig komorbiditet
- Tegn til tumorprogresjon under pågående kjemoterapi vurdert ved CT eller tumormarkører.
- Utilgjengelig bukhule på grunn av omfattende adheranser
- Signetringcelledifferensiering er en relativ kontraindikasjon
Synkrone peritoneale metastaser
Ved påvisning av peritoneale metastaser under pågående primæroperasjon av tykk- og endetarmskreft på eget sykehus anbefales at primærtumor fjernes, men at det gjøres minst mulig utløsning av carcinomatose. Tumorvev tenderer til å vokse fast i fibrøse adheranser og vanskeliggjør endelig kirurgi. Aktuelle pasienter bør henvises til Oslo universitetssykehus for CRS med HIPEC, og dette kan ofte organiseres innefor 1–2 uker av primæroperasjonen.
Behandlingen med CRS-HIPEC kan utføres på ulike tidspunkt, ved primærdiagnose eller seinere. A) Primær kirurgi av tumor og peritoneale metastaser i den nasjonale behandlingstjenesten, og HIPEC på slutten av operasjonen; B) Primærbehandling på eget sykehus og overførsel til behandlingstjenesten for CRS-HIPEC innen ca. 2 uker; C) Primærbehandling på eget sykehus og deretter oppstart av systemisk kjemoterapi. Pas. kan da vurderes for CRS-HIPEC i behandlingstjenesten etter noen kurer med systemisk kjemoterapi eller etter 6 måneders behandling.
Ved synkrone, peritoneale metastaser og ubehandlet primær tykk- og endetarmskreft har en lite informasjon om sykdommens utvikling over tid. Primær reseksjon av tumor og peritoneale metastaser kan allikevel i en del situasjoner være aktuelt i den nasjonale behandlingstjenesten. Følgende forhold tas alltid med i vurderingen av tidlig operasjon:
- Alder: Hos en ung pasient vil en tøye inklusjonskriteriene mot mer aggressiv kirurgi, både da omfattende behandling tolereres bedre i ung alder, og da potensiell gevinst er større. Dette kan tale for å forsøke å fjerne peritoneale metastaser i samme seanse. Ved høy alder er det mer naturlig å gjøre primærkirurgien ved eget sykehus først, før CRS-HIPEC vurderes i den nasjonale behandlingstjenesten noe senere.
- Lymfeknutemetastaser: Mistanke om mange lymfeknutemetastaser ved CT-utredning taler for primærkirurgi på eget sykehus da prognosen ved samtidig lymfeknutemetastaser er dårlig og dette øker behovet for systemisk kjemoterapi. CRS-HIPEC kan vurderes i den nasjonale behandlingstjenesten på senere tidspunkt (etter systemisk kjemoterapi).
- Ileus/subileus: Et akutt passasjehinder i tarm vil ofte nødvendiggjøre snarlig kirurgi på eget sykehus. Vi anbefaler at primærtumor fjernes om mulig, alternativt at tarmen avlastes. Ved begrenset peritoneal sykdom anbefales CRS-HIPEC vurdert i den postoperative fasen.
- Operable, synkrone lever- eller lungemetastaser: Peritoneum er her ikke lenger barriere for videre sykdomsspreding, og systemisk behandling må vurderes. Dette vil tale for at primærcanceren behandles ved eget sykehus. Tidspunkt for eventuell håndtering av peritoneal sykdomsutbredelse kan diskuteres med behandlingstjenesten.
Metakrone peritoneale metastaser
Dersom en pasient med tykk- og endetarmskreft utvikler peritoneale metastaser i løpet av kontrolloppfølgingen kan det være aktuelt med CRS-HIPEC i slik metakron setting. Resultatene er best om pasienten henvises når carcinomatosen oppdages, og ikke etter at kjemoterapi har sviktet (Elias et al., 2006). Se inklusjons- og eksklusjonskriteriene over.
Second-look
Second-look operasjon utføres 9–12 måneder etter primæroperasjonen og bør vurderes hos asymptomatiske pasienter i god almentilstand som primært fikk utført antatt kurativ operasjon, men som man vet har høy risiko for utvikling av peritoneal carcinomatose, nemlig ved (Elias et al., 2008):
- iatrogen perforasjon i tumorområdet
- opererte metastaser til ovarier
- carcinomatose makroscopisk radikalt fjernet ved primæroperasjon
Eventuell second-look operasjon bør drøftes med Radiumhospitalet; om, når og hvordan slik operasjon skal gjøres. En velger ofte å gi denne gruppen 6 måneder systemisk kjemoterapi etterfulgt av 3 måneder observasjon uten behandling før CRS-HIPEC. Det presiseres at det ved second-look behandling på nevnte indikasjoner er vanlig å gi HIPEC også om tumor ikke lenger kan påvises i bukhulen da ny carcinomatose ellers er vanlig.
Stereotaktisk strålebehandling av metastaser
Sist faglig oppdatert: 20.12.2023
Pasienter med kolorektalkreft hvor det foreligger inoperable lever- eller lungemetastaser uten lymfeknute- eller annen fjernspredning, kan være aktuelle for stereotaktisk strålebehandling (Rusthoven et al., 2009). Det kan også være aktuelt ved få hjernemetastaser.
Det benyttes svært målrettede stråler i meget høye doser fordelt på fraksjonert behandling, for eksempel tre polikliniske behandlingsdager i løpet av én uke. Pasienter med opptil 3–4 lesjoner, av begrenset størrelse, og med egnet beliggenhet kan være aktuelle for slik behandling. Foreløpig er stereotaktisk strålebehandling ikke sammenlignet med kirurgisk behandling i randomiserte studier. Dette er et relativt nytt behandlingstilbud som er under utvikling.
Behandling av ikke-kurable metastaser
Kirurgisk strategi for behandling av primærtumor ved definitivt inoperable metastaser på diagnosetidspunktet
Sist faglig oppdatert: 20.12.2023
Hvis primærtumor hverken gir stenosesymptomer eller betydelig anemi, bør man starte palliativ kjemoterapi direkte framfor palliativ reseksjon av primærtumor, særlig hvis der foreligger utbredt metastasering (Cirocchi et al., 2012; Poultsides et al., 2009). Ved mindre utbredte metastaser og god allmenntilstand, kan man vurdere kirurgi av primærsvulsten (Faron et al., 2015; Maroney et al., 2018; Nitsche et al., 2018; Wilkinson et al., 2015), men strategien har ikke vist bedre overlevelse i randomiserte studier (Kanemitsu et al., 2021; Rahbari et al., 2022).
Medikamentell behandlingsstrategi
Sist faglig oppdatert: 31.01.2024
Medikamentell behandling av ikke-operabel sykdom har som mål å forlenge levetid, lindre symptomer og opprettholde livskvalitet (Sorbye et al., 2009). Median overlevelse har økt fra ca. 6 måneder på 1980-tallet til 30 måneder (Venook et al., 2017) for pasienter som får kombinasjonskjemoterapi i studier (Glimelius et al., 2012). Basert på tall fra Kreftregisteret har median overlevelse ved synkron metastatisk sykdom økt fra 5 til 12 md., med en større økning i overlevelse for yngre pasienter (Sorbye et al., 2013). 5-års relativ overlevelse for stadium IV er nå 20% for koloncancer og 24% for rectumcancer (Larsen, 2022)Pasienter som er i for dårlig allmenntilstand til å motta kjemoterapi har svært kort forventet levetid (Sorbye et al., 2009).
Behandlingsstrategien vil avhenge av hvorvidt det er ønskelig med rask respons på grunn av symptomer (Van Cutsem et al., 2016), eller om behandlingen først og fremst har som mål å hindre videre progresjon og gi forlenget levetid. Dersom rask respons er ønskelig anbefales kombinasjonskjemoterapi gitt som infusjonsregimer sammen med antistoff. Ved mindre intensiv behandling kan en starte med monoterapi for senere å gi kombinasjons-behandling (Ducreux et al., 2011; Gramont Lesparre et al., 2009; Koopman et al., 2007; Seymour et al., 2007). Oppstart av behandling kan eventuelt avventes hvis sykdommen har liten tumorbyrde og langsom vekst, for eksempel ved få og små lungemetastaser.
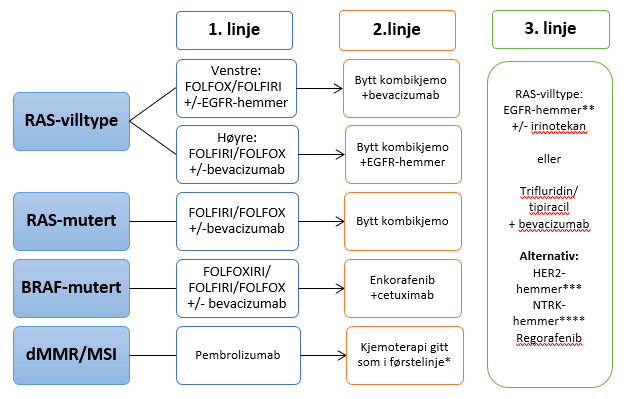
Ved lite sykdomsbyrde kan det i førstelinje gis monoterapi 5FU og bytte til kombinasjonskjemo ved progresjon. Hos skrøpelige/eldre bør kjemoterapi gis i redusert dose.
*dMMR/MSI og progress på førstelinje behandles videre som ved anbefaling for første-, andre- og tredjelinje basert på RAS/BRAF status
**dersom ikke gitt tidligere eller som reintroduksjon dersom gitt i førstelinje
***ved påvist HER2-amplifisering og RAS villtype kan man vurdere behandling rettet mot HER2
****ved påvist NTRK-fusjon
Molekylær og DPYD diagnostikk
Sist faglig oppdatert: 31.01.2024
Molekylærpatologisk undersøkelse er avgjørende for valg av behandling, og anbefales utført hos alle pasienter som er aktuelle for systemisk behandling. dMMR/MSI utføres på alle pasienter ved diagnose. Svaret bør foreligge i løpet av 1–2 uker. DPYD testes før oppstart av 5-FU eller kapecitabin.
RAS mutasjoner
Om lag 50 % av pasienter med metastatisk CRC har KRAS eller NRAS mutasjon. Disse pasientene har ikke nytte av behandling med epidermal vekstfaktor reseptor (EGFR)-hemmer (Vale et al., 2012). Kun pasienter med villtype RAS skal tilbys EGFR-hemmer.
BRAF mutasjon
Om lag 10–20 % av pasienter med metastatisk CRC har BRAFV600E mutasjon. Disse pasientene har generelt dårligere prognose og oftest kort forventet levetid (Tveit et al., 2012). Pasientene kan vurderes for mer intensiv første linjes behandling i form av trippel kjemoterapi regime, ev. i kombinasjon med bevacizumab. Pasienter som har progrediert på kjemoterapi har god effekt av kombinasjonsbehandling med BRAF- og EGFR-hemmer (Kopetz et al., 2019).
MSI/dMMR
Om lag 5-7 % av pasienter med mCRC har MSI/dMMR tumor (Le et al., 2017; Aasebø et al., 2019). Disse pasientene har som regel dårlig prognose og dårlig effekt av kjemoterapi (Aasebø et al., 2019). De kan derimot ha god og langvarig respons på immunterapi med immunsjekkpunkthemmere (Le et al., 2015; Overman et al., 2018; Overman et al., 2017). Monoterapi pembrolizumab eller nivolumab gir ORR på 31-38%. Høyere responsrate på 65 % er vist ved bruk av dobbel sjekkpunkthemming (nivolumab + ipilimumab) (André et al., 2022). Pembrolizumab har også vist langvarig respons og dobling av PFS sammenlignet med kjemoterapi i 1. linjebehandling (André et al., 2020).
Andre
HER2/ERBB2 amplifikasjon forekommer hos om lag 3-5% av mCRC og forekommer hyppigst i RAS villtype svulster. HER2-rettet behandling har i fase II studier i denne gruppen gitt klinisk signifikante responsrater etter progresjon på standard behandling (Meric-Bernstam et al., 2019; Sartore-Bianchi et al., 2016). HER2 amplifikasjon er i retrospektive studier også assosiert med resistens mot EGFR-hemmere (Raghav et al., 2019). Det anbefales at man tester for HER2 amplifikasjon hos pasienter med RAS villtype svulst for å detektere de som kan ha nytte av målrettet behandling i senere behandlingslinjer.
NTRK fusjonsgener er svært sjeldne ved CRC med en insidens <1%. Insidensen er høyest ved høyresidige MSI/dMMR svulster og testing bør vurderes spesielt for disse. Ved påvist NTRK fusjonsgen er behandling med entrectinib godkjent for tumoragnostisk bruk i Norge.
Testing for eventuell DPD-mangel
Omtrent 3–8 % av pasienter med kolorektalcancer har partiell DPD-mangel (dihydropyrimidin-dehydrogenase), og kan risikere alvorlig toksisitet av 5-FU og kapecitabin
(Meulendijks et al., 2015). Det er mulig å undersøke på noen genetiske varianter ved å undersøke DPYD genotype (Deenen et al., 2016). DPYD skal testes og svar bør foreligge før oppstart av 5-FU basert behandling. Ved genotype som tyder på redusert DPD-aktivitet, bør en følge internasjonale retningslinjer med redusert startdose og opptrapping av dose ved god toleranse (Amstutz et al., 2018). Ved genotype som tyder på manglende DPD-aktivitet bør behandling med 5-FU eller kapecitabin unngås.
Anbefaling:
- RAS/BRAF-status, MSI/dMMR-status (evidensgrad A) og DPYD genotype (evidensgrad B) bør foreligge før valg av behandling.
Behandlingspauser og vedlikeholdsbehandling
Sist faglig oppdatert: 20.12.2023
Det anbefales vanligvis behandling i 4–6 md. ved partiell respons/stabil sykdom og akseptable bivirkninger før behandlingspause eller vedlikeholdsbehandling (Chibaudel et al., 2009; Salvatore et al., 2021; Simkens et al., 2015). Behandlingspauser har ikke vist å gi tap av levetid sammenliknet med behandling til progresjon dersom behandling er gitt i 4 md. før en behandlingspause (Adams et al., 2021). Ved behandlingspause bør pasienten følges med ny CT-evaluering etter 2–3 måneder, for deretter å gjenoppta kjemoterapi ved progresjon (Sørbye et al., 2008). Samme behandlingsregime kan gi ny respons selv om det foreligger progresjon allerede etter 2–3 måneder behandlingspause (Chibaudel et al., 2009; de Gramont et al., 2007; Grothey, 2010).
En kan vurdere vedlikeholdsbehandling med 5-FU og evt. i kombinasjon med bevacizumab eller EGFR-hemmer som alternativ til behandlingspause. Dette er spesielt aktuelt for pasienter med dårlige prognostiske faktorer som karsinomatose, høy CEA og leukocytose/trombocytose.
Vedlikeholdsbehandling med monoterapi bevacizumab eller EGFR-hemmer har ikke vist effekt.
Venstresidig vs. høyresidig cancer
Sist faglig oppdatert: 20.12.2023
Lokalisasjonen av primærtumor har prognostisk og prediktiv betydning ved kolorektalkreft (Hamfjord et al., 2022). Metastatiske høyresidige svulster har dårligere prognose enn venstresidige eller rektale svulster, og undergruppene responderer ulikt på antistoff behandling (Brulé et al., 2015; Schrag et al., 2016; Tejpar et al., 2016; Venook et al., 2016). Venstresidige villtype RAS/BRAF svulster har best nytte av EGFR hemmer i første linje, mens nytten er mer usikker for høyresidige villtype RAS/BRAF svulster.
Aktuelle medikamenter og bivirkninger
Sist faglig oppdatert: 20.12.2023
5-FU: Vanlige bivirkninger er slimhinne-affeksjon med rennende øyne og nese, kvalme, diare, tørr hud i hender og føtter og palmoplantart erytem (hånd-fot syndrom). Enkelte pasienter kan få brystsmerter (angina), hjerteinfarkt, hjertesvikt, arytmier, og hjertestans er også rapportert, og forsiktighet skal utvises hos pasienter med kjent kardiell komorbiditet. Hos pasienter med DPD-mangel kan bivirkningene bli svært uttalte (se Medikamentell behandlingsstrategi).
Kapecitabin: Som 5-FU.
Oksaliplatin: Dosebegrensende er kumulativ perifer nevropati med etter hvert også motoriske symptomer med funksjonsnedsettelse. Symptomene forverres ved kulde-eksponering. Nevropatien er som oftest reversibel, men noen pasienter (10–30 %) kan ha betydelige plager mer enn 1 år etter avsluttet behandling. Enkelte pasienter utvikler allergisk reaksjon mot oksaliplatin, ofte etter 8–10 kurer eller ved reintroduksjon, og behandlingen må da ofte seponeres. Ved reintroduksjon brukes lengre infusjonstid og økt premedikasjon.
Irinotekan: Irinotekan kan gi akutt kolinergt syndrom, diaré og hårtap. Irinotekan anbefales ikke ved nedsatt leverfunksjon og forsiktighet bør utvises ved nedsatt nyrefunksjon.
Bevacizumab: De vanligste bivirkninger er hypertensjon og proteinuri. Mer sjeldne men alvorlige bivirkninger er arteriell og venøs tromboemboli (1–2 %; hos eldre 4–5 %) samt perforasjon i GI-tractus (1–2 %), risiko for blødning og forsinket sårtilheling. Ved opptreden av asymptomatisk lungeemboli under behandling med bevacizumab kan pasienten fortsette behandlingen under dekke av DOAC/NOAC, eventuelt etter en kort pause fra kjemoterapi på 1–2 uker. Hos pasienter med tidligere arterielle tromboemboliske episoder, vanskelig regulerbar hypertensjon eller inflammatorisk tarmsykdom bør en være tilbakeholden med medikamentet. Forsiktighet skal utvises ved hjernemetastaser. Bevacizumab synes ikke å øke risiko for alvorlige blødninger hos pasienter som får antikoagulasjonsbehandling (Leighl et al., 2011). Medikamentet bør være seponert 4 uker før elektiv kirurgi og 1 uke før mindre inngrep som for eksempel innleggelse av veneport og biopsi. Behandling med bevacizumab bør ikke starte før 4 uker etter et større kirurgisk inngrep.
Cetuximab/panitumumab: Den vanligste bivirkningen er akne-liknende hudreaksjoner. Profylaktisk tetracyclinbehandling ser ut til å være gunstig (Scope et al., 2007). EGFR hemmere kan også gi allergisk reaksjon og alvorlig hypomagnesemi.
Trifluridin/tipiracil: Antimetabolitten trifluridin i kombinasjon med tymidinfosforylase hemmeren tipiracil. De vanligste bivirkningene er nøytropeni, GI-toksisitet, nedsatt appetitt og fatigue.
Regorafenib: Multikinasehemmeren kan gi uttalte bivirkninger som asteni/fatigue, anemi, trombocytopeni, GI-toksisitet, hand-foot syndrom, infeksjoner og hypertensjon.
Enkorafenib: De vanligste bivirkningene er kvalme, fatigue, magesmerter, diare og nedsatt appetitt hodepine, muskel/skjelettsmerter. Sjeldnere, men potensielt alvorlige bivirkninger er nye primære kutane maligniteter, forlenget QT tid, venstre ventrikkel dysfunksjon og okulære toksisiter. Det anbefales regelmessig dermatologisk undersøkelse og kontroll av EKG og venstre ventrikkelfunksjon.
S-1: S-1 inneholder tegafur/gimeracil/oteracil og har mindre bivirkninger som hjertetoksisitet og hånd-fot syndrom enn 5-FU/kapecitabin.
Pembrolizumab: Immune checkpunkt hemmer (ICI) med bivirkninger som andre ICI.
Førstelinjebehandling
Sist faglig oppdatert: 31.01.2024
Kjemoterapi
5-fluorouracil (5-FU)/folinat kombinert med oksaliplatin eller irinotekan er førstelinje behandlingsalternativ hos de fleste pasienter (Van Cutsem et al., 2016). Kombinasjonsregimene gir lengre progresjonsfri levetid og nær doblet responsrate sammenlignet med 5-FU/folinat alene (de Gramont et al., 2000; Douillard et al., 2000). Internasjonalt brukes som oftest infusjonsregimene FOLFOX og FOLFIRI, der 5-FU gis som kontinuerlig infusjon over 48 timer. I Norge har de enkelt administrerbare bolusregimene FLOX eller FLIRI vært mye brukt (Glimelius et al., 2002; Glimelius et al., 2008; Sorbye et al., 2004). Effekten på overlevelse er sammenlignbar mellom bolus vs. infusjonsregimene, men sistnevnte gir høyere responsrate (Glimelius et al., 2008; Tournigand et al., 2004). 5-FU kan erstattes av peroral kapecitabin i kombinasjon med oksaliplatin (CAPOX), som er likestilt med FOLFOX (Cassidy et al., 2008).
Totaloverlevelsen ser ikke ut til å være nevneverdig dårligere om en starter med 5-FU monoterapi for så å legge til oksaliplatin eller irinotekan ved progresjon framfor å starte med kombinasjonsregimer (Ducreux et al., 2011; Gramont Lesparre et al., 2009; Koopman et al., 2007; Seymour et al., 2007). En slik sekvensiell behandling kan være et alternativ når responsraten ikke er avgjørende eller når man er usikker på toleransen for kjemoterapi.
S-1 kan være et alternativ når det ikke er mulig å begynne med eller fortsette med 5-FU grunnet hjertetoksisitet eller kjent kardiell komorbiditet. S1 kan kombineres med oksaliplatin eller irinotekan (Derksen et al., 2022; Winther et al., 2019). 3-4% av pasienter som får 5-FU/kapecitabin må stoppe behandlingen pga. hjertetoksitet, og opptil 10-17% pga hånd-fot syndrom. En større retrospektive studie viste at pasienter med hjertetoksisitet på 5-FU/kapecitabin kunne fortsette behandlingen ved å bytte over til S1-basert behandling (Osterlund et al., 2022). S-1 er under vurdering i Nye Metoder.
Tillegg av Bevacizumab
Flere studier har vist at angiogenesehemmeren bevacizumab gir en tilleggseffekt til andre kjemoterapiregimer (Fuchs et al., 2007; Hurwitz et al., 2004; Kabbinavar et al., 2005; Saltz et al., 2008). Det finnes ingen spesifikk markør som kan predikere effekt av bevacizumab men kan spesielt vurderes til pasienter med peritoneal karsinomatose eller BRAFmutasjon. Når trifluridin/tipiracil gis bør det kombineres med bevacizumab.
Tillegg av EGFR-hemmer
Cetuximab og panitumumab er antistoff som bindes til EGF reseptoren. Behandling med
EGFR-hemmer har ikke vist effekt hos pasienter med RAS-mutasjoner (KRAS exon 2–4 og NRAS exon 2–4) (Amado et al., 2008; Douillard et al., 2013; Lievre et al., 2008; Vale et al., 2012; Van Cutsem et al., 2007) eller BRAF mutasjon i tumor (Cohen et al., 2021; Pietrantonio et al., 2015b).Førstelinje behandling med EGFR-hemmer hos pasienter med RAS-villtype tumor har vist 10–20 % økning i responsraten sammenlignet med kjemoterapi alene, og vist økt sykdomsfri og total overlevelse (Bokemeyer et al., 2011; Douillard et al., 2013; Douillard et al., 2010; Maughan et al., 2011; Tveit et al., 2012; Van Cutsem et al., 2009). Behandling med EGFR-hemmer i kombinasjon med irinotekan-basert kjemoterapi har vist økt overlevelse, men når EGFR-hemmer kombineres med en oksaliplatinkombinasjon ser 5-FU regimet ut til å påvirke effekten. EGFR-hemmer i kombinasjon med infusjonsregimet FOLFOX har vist overlevelsesgevinst, men ikke i kombinasjon med bolus 5-FU (Tveit et al., 2012) eller kapecitabin (Ku et al., 2012; Maughan et al., 2011). Dokumentasjonen er best for bruk av cetuximab i kombinasjon med et irinotekanholdig infusjonsregime (FOLFIRI), og for panitumumab i kombinasjon med et oksaliplatinholdig infusjonsregime (FOLFOX). For pasienter som ikke er egnet for infusjonsregimet FOLFIRI kan FLIRI med en EGFR-hemmer være en mulighet selv om studiedata mangler.
Immunsjekkpunkthemmere ved MSI/dMMR
PD-L1 immunsjekkpunkthemmere har i flere studier vist effekt hos mCRC pasienter med MSI (Le et al., 2017; Le et al., 2015; Overman et al., 2018; Overman et al., 2017). I en randomisert studie mellom pembrolizumab og kjemoterapi i 1. linje gav pembrolizumab 44% responsrate sammenlignet med 33% i kjemoterapiarmen. Det ble observert langvarige responser og signifikant økning i progresjonsfri overlevelse (16,5 vs. 8,2 md. (André et al., 2020). Man kunne ikke påvise signifikant økt overlevelse, sannsynligvis grunnet studiens cross-over design (Diaz et al., 2022). En tredjedel av pasientene hadde progress på pembrolizumab ved første evaluering etter seks ukers behandling, men man må være klar over muligheten av pseudoprogresjon hos en andel av pasientene (Colle et al., 2021). Ikke-randomiserte studier ser ut til å vise enda bedre effekt av kombinasjonen nivolumab og ipilimumab med 69% responsrate (Lenz et al., 2022). Det anbefales at pasienter med MSI gis pembrolizumab monoterapi som 1. linjebehandling uavhengig av BRAF status, se vedtak i Nye metoder.
Anbefaling (førstelinjebehandling):
- Der rask respons er ønskelig anbefales kombinasjonskjemoterapi gitt som infusjons-regimer eller triplett sammen med antistoff (evidensgrad A). Ved mindre intensiv behandling kan en starte med monoterapi for senere å gi kombinasjonsbehandling (evidensgrad C).
- Kombinasjonsbehandling med 5-FU/kapecitabin og enten irinotekan (FOLFIRI/FLIRI) eller oksaliplatin (FOLFOX/CAPOX/FLOX) anses som likeverdige i 1. linjebehandling (evidensgrad A).
- Ved respons/stabil sykdom kan man vurdere behandlingspause etter 4-6 md., og gjenoppta behandling ved progresjon.
- RAS/BRAF villtype
- Venstresidig: Kombinasjonsbehandling med EGFR-hemmer anbefales (evidensgrad A).
- Høyresidig: Kombinasjonsbehandling med bevacizumab bør vurderes (evidensgrad B).
- RAS mutert: Kombinasjonsbehandling med bevacizumab bør vurderes (evidensgrad A).
- BRAF mutert: Kombinasjonsbehandling eller trippel kjemoterapi evt. kombinert med bevacizumab anbefales (evidensgrad B).
- MSI: Behandling med pembrolizumab monoterapi anbefales (evidensgrad A).
Trippel kjemoterapi
Sist faglig oppdatert: 20.12.2023
Trippel kombinasjonen FOLFOXIRI, har høyere responsrater og mulig bedret overlevelse sammenlignet med dublett (Falcone et al., 2007; Loupakis et al., 2014a). Trippelregimet har gitt spesielt oppløftende resultater ved BRAF muterte svulster (Loupakis et al., 2014a; Loupakis et al., 2014b). Tillegg av bevacizumab til trippelregimet ser ut til å gi ytterligere økt responsrate og overlevelse (Cremolini et al., 2016), mens tillegg av EGFR hemmer øker kun responsraten (Modest et al., 2019). Regimet er mest aktuell om man er avhengig av god respons som ved potensielt resektabel sykdom samt ved BRAF mutasjon. Regimet er dog forbundet med tildels betydelig toksisitet.
Eldre
Sist faglig oppdatert: 20.12.2023
Eldre er ofte ikke inkludert i kliniske studier og det finnes derfor lite evidens for behandling av denne pasientgruppen. De har ofte mer komorbiditet og redusert organfunksjon hvilket gir økt risiko for bivirkninger og funksjonstap av palliativ kjemoterapi. Selekterte eldre pasienter inkludert i studier med god allmenntilstand (ECOG 0–1) og uten vesentlig komorbiditet synes å tåle kjemoterapi godt (Audisio et al., 2012; Leo et al., 2013; Venderbosch et al., 2012). Overlevelsesgevinsten av palliativ kjemoterapi ser midlertidig ut til å være noe mindre hos eldre pasienter i uselekterte populasjoner (Sorbye et al., 2013; Sorbye et al., 2009), og med mer uttalte bivirkninger. Hos skrøpelige eldre velges ofte kun 5-FU/kapecitabin ev. i kombinasjon med bevacizumab (Aparicio et al., 2018; Cunningham et al., 2013). I en randomisert nordisk studie med eldre pasienter som ikke var kandidat for standard kjemoterapi, ga doseredusert kombinasjonsbehandling (SOX) både økt progresjonsfri overlevelse og mindre bivirkninger sammenlignet med fulldose monoterapi (S1). Dette kan tyde på at man bør vurdere doseredusert kombinasjonskjemoterapi framfor monoterapi hos denne pasientgruppen. Tillegg av Irinotekan til 5-FU hos eldre pasienter har ikke vist økt overlevelse. EGFR-hemmer alene til skrøpelige eldre pasienter gir akseptabel progresjonsfri overlevelse og bivirkningsprofil (Pietrantonio et al., 2015a; Sastre et al., 2015), men randomiserte studier mangler.
Andrelinjebehandling
Sist faglig oppdatert: 31.01.2024
Generelt anbefales at man ved progresjon på irinotekanholdig kombinasjonsbehandling endrer til oksaliplatinholdig kombinasjonsbehandling, og vice versa. Ved progresjon på monoterapi med 5-FU eller kapecitabin kan kombinasjonsbehandling vurderes i 2. linje dersom pasienten er i god allmenntilstand (ECOG 0-1). Redusert allmenntilstand er hovedårsaken til at pasientene ikke starter 2. linjebehandling, og denne gruppen har meget kort forventet levetid.
Effekten av bevacizumab i 2. linje i kombinasjon med oksaliplatinbasert regime gir økt median overlevelse på 2,1 md. (Giantonio et al., 2007).. Bruk av EGFR-hemmer som 2. linjebehandling etter initial kombinasjonskjemoterapi har ikke vist statistisk signifikant økning i totaloverlevelse, men forlenget progresjonsfri overlevelse og høyere respons rate. Bruk av bevacizumab i 2. linje etter progresjon på 1. linje ga en signifikant, men liten økning på 1,4 md. i median overlevelse og dette anbefales vanligvis ikke.
Ved MSI/dMMR er det ikke avklart hva som er beste 2. linjebehandling etter pembrolizumab. MSI er generelt en dårlig prognostisk faktor ved mCRC (Aasebø et al., 2019), så kombinasjonskjemoterapi evt. i kombinasjon med antistoff bør vurderes (evidens grad C). Ved MSI og BRAF mutasjon kan enkorafenib/cetuximab vurderes. Dersom det ved påvist MSI ikke er gitt pembrolizumab i 1. linje, anbefales behandling med nivolumab i kombinasjon med ipilimumab som 2. linjes behandling (Andre et al., 2022) (evidens grad B). Se vedtak i Nye Metoder. Kombinasjonen kan også gis til pasienter med progresjon under eller kort tid etter (innen 6 mnd) adjuvant eller neoadjuvant fluoropyrimidinbasert kjemoterapi. Nivolumab + ipilimumab kan vurderes hos pasienter som har progrediert på pembrolizumab og påfølgende fluoropyrimidinbasert kjemoterapi, men det er begrenset dokumentasjon for behandlingseffekt i denne settingen.
Ved BRAFV600E mutasjon og progresjon på kjemoterapi, er det dokumentert 26 vs. 2% responsrate og forlenget overlevelse (9,0 vs. 5,4 md.) ved behandling med BRAF-hemmeren enkorafenib, MEK-hemmeren binimtinib, og EGFR-hemmeren cetuximab, sammenlignet med irinotekan og cetuximab (Kopetz et al., 2019). Subgruppeanalyser tyder imidlertid på lik effekt av dublett uten MEK-hemmer, og behandling med enkorafenib og cetuximab anbefales.
Anbefaling (andrelinjebehandling):
- Ved svikt på irinotekanholdig regime i 1. linje, anbefales oksaliplatinholdig regime i 2. linje (evidensgrad A).
- Ved svikt på oksaliplatinholdig regime i 1. linje anbefales irinotekanholdig regime i 2. linje (evidensgrad A). Et alternativ kan være irinotekan alene.
- Ved progresjon på monoterapi 5-FU/kapecitabin i 1. linje kan kombinasjonskjemoterapi være aktuelt som 2. linjebehandling dersom pasienten er i god allmenntilstand (ECOG 0–1) (evidensgrad B).
- Dersom EGFR-hemmer er gitt i 1. linje kan bevacizumab i 2. linje vurderes (evidensgrad B).
- Dersom bevacizumab er gitt i 1. linje, kan EGFR-hemmer vurderes ved RAS/BRAF villtype i 2 linje.
- Ved BRAF mutert svulst anbefales kombinasjonsbehandling med BRAF-hemmer enkorafenib og EGFR-hemmer cetuximab.
- Ved MSI/dMMR og BRAF villtype og progresjon på pembrolizumab bør kjemoterapi gis. Dersom det ved påvist MSI ikke er gitt pembrolizumab i 1. linje, anbefales det behandling med nivolumab + ipilimumab (evidensgrad B). Kombinasjonen kan også gis til pasienter med progresjon under eller kort tid etter (innen 6 mnd) adjuvant eller neoadjuvant fluoropyrimidinbasert kjemoterapi.
Tredjelinjebehandling eller senere behandling
Sist faglig oppdatert: 31.01.2024
Pasienter kan være aktuelle for 3. linjebehandling etter progresjon på 5-FU, irinotekan- og oksaliplatinholdige regimer. Pasientens allmenntilstand er den viktigste faktoren ved vurdering av videre medikamentell behandling og bør fortrinnsvis kun vurderes ved ECOG 0-1.
EGFR-hemmer
Cetuximab i kombinasjon med irinotekan gir en overlevelsesgevinst på ca. 4–5 md. sammenlignet med ingen behandling hos pasienter som har hatt progresjon på 5-FU, oksaliplatin- og irinotekanbehandling, og som ikke tidligere har fått EGFR-hemmer (Shitara et al., 2011). Cetuximab monoterapi ga overlevelsesgevinst sammen-lignet med ingen behandling (Karapetis et al., 2008). Panitumumab monoterapi ga en signifikant gevinst i progresjonsfri overlevelse (Price et al., 2014). Data tyder på at reintroduksjon av EGFR hemmer i 3. linje etter progresjon i 1. linje kan ha noe effekt (Parseghian et al., 2019). Analyse av sirkulerende tumor DNA for å detektere resistensmekanismer mot EGFR-hemmer ser ut til å kunne bidra til bedre seleksjon av pasienter for reintroduksjon av EGFR-hemmer (Sartore-Bianchi et al., 2022).
Trifluridin/tipiracil
Trifluridin/tipiracil gir en økt median overlevelse fra 5,3 til 7,1 md. sammenlignet med placebo (Mayer et al., 2015). Trifluridin/tipiracil med tillegg av bevacizumab gir en større effekt enn trifluridin/tipiracil alene (OS 9,4 vs. 6,7 md.) (Pfeiffer et al., 2020). Tilsvarende funn ble nylig bekreftet i Sunlight studien (OS 10.8 vs. 7.5 md) (Prager et al., 2023). I begge studier hadde over 70% av pasienter motatt bevacizumab i en tidligere linje. Kombinasjonen trifluridin/tipiracil og bevacizumab anbefales til pasienter i god allmenntilstand der 3. linje kjemoterapi er indisert. I henhold til en nylig studie kan det se ut som trifluridin/tipiracil monoterapi ikke har effekt ved påvist KRAS G12 mutasjon, og dette er en faktor som kan tas med i vurdering en om slik behandling skal gis (van de Haar et al., 2023).
Regorafenib
Regorafenib har i en fase III studie vist å øke median overlevelse med 1,4 md. sammenlignet med placebo (Grothey et al., 2013). På bakgrunn av beskjeden overlevelsesgevinst og høy grad av toksisitet anbefales ikke rutinemessig bruk. Om man velger å gi behandlingen, bør man vurdere å starte i lav startdose (Bekaii-Saab et al., 2019).
HER2-hemmer
HER2-rettet behandling har i ikke-randomiserte fase 2-studier gitt respons hos 28-55% av pasienter med HER2-amplifiserte, RAS villtype svulster med progresjon på minst to linjer kjemoterapi. Ulike former for HER2-blokade har blitt undersøkt, blant annet trastuzumab + pertuzumab, trastuzumab + lapatinib og trastuzumab-deruxtecan (Meric-Bernstam et al., 2019; Sartore-Bianchi et al., 2016; Siena et al., 2021). HER2-rettet behandling er ikke godkjent for rutinemessig bruk ved mCRC i Norge. Ved påvist HER2-amplifikasjon og RAS villtype svulst kan HER2-hemmer vurderes om tilgjengelig etter progresjon på 5-FU, oksaliplatin og irinotekan.
NTRK-hemmer
Behandling med larotrectinib og entrectinib har i tumoragnostiske studier vist respons hos >50% av svulster med påvist NTRK fusjonsgen. Responsen ser ut til å være noe lavere ved mCRC (Doebele et al., 2020). Entrectinib er i Norge godkjent for tumoragnostisk bruk ved NTRK-fusjonspositive solide svulster hvor det ikke foreligger andre tilfredsstillende alternativer.
Fruquintinib
Fruquintinib har nylig vist økt overlevelse som 4-5 linjes behandling vs. placebo (7.4 vs. 4.8 md), og eventuell vurdering i Nye Metoder avventes (Dasari et al, 2023)
Anbefaling (tredjelinjebehandling):
- Pasienten bør ha god allmenntilstand (ECOG 0-1).
- Trifluridin/tipiracil i kombinasjon med bevacizumab anbefales dersom det foreligger indikasjon for tredjelinjebehandling (evidensgrad A).
- Dersom RAS villtype kan EGFR hemmer gis enten i kombinasjon med irinotekan eller som monoterapi til pasienter som ikke tidligere har fått EGFR hemmer (evidensgrad A).
- NTRK-hemmer entrectinib kan vurderes ved påvist NTRK-fusjon.
- HER2-rettet behandling kan vurderes om tilgjengelig ved HER2-amplifisering og RAS villtype (evidensgrad C).
Palliativ behandling
Sist faglig oppdatert: 20.05.2022
Innledning
Sist faglig oppdatert: 20.05.2022
I dette kapittelet omtales prinsippene for palliativ behandling. 25–30 % av pasientene med kolorektalcancer har inkurabel sykdom på diagnosetidspunktet eller er ikke kandidater for kurativ behandling av andre grunner. 30–40 % av alle pasienter som er kurativt behandlet, får senere residiv og/eller metastaser. Flertallet av disse er ikke kurable. Målet med behandling av denne pasientgruppen er å oppnå forlenget levetid samt best mulig symptomlindring og livskvalitet.
Palliativ behandling – definisjon
Sist faglig oppdatert: 20.05.2022
WHO definerer palliativ behandling som lindring av symptomer for å oppnå best mulig livskvalitet og eventuelt livsforlengelse for pasienter med inkurabel sykdom. I sin nyeste definisjon legges det vekt på tidlig identifisering av problemstillinger som krever palliativ behandling (WHO Definition of Palliative Care, 2010). Palliativ behandling retter seg mot den enkelte pasientens individuelle behandlingsmål som for eksempel livskvalitet, mens ikke-kurativ behandling bare sier noe om en behandlingseffekt på tumorsykdommen målt ved for eksempel overlevelse, komplikasjoner mm. (Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen, 2019). Palliativ behandling kan være tumorrettet eller symptomrettet. Sentralt i valg av behandling er vurdering av hvor langt pasienten har kommet i sykdomsprosessen (figur 15.1). Tumorrettet behandling gis ofte i tidlig fase, mens symptomlindring er viktigere senere i forløpet. Dette er spesielt viktig ved vurdering av invasive prosedyrer sent i sykdomsforløpet når forventet levetid er meget kort. Det er viktig å vurdere om og når det palliative teamet skal involveres, både for optimal symptomlindring og for å etablere et nettverk i primærhelsetjenesten (individuell plan).
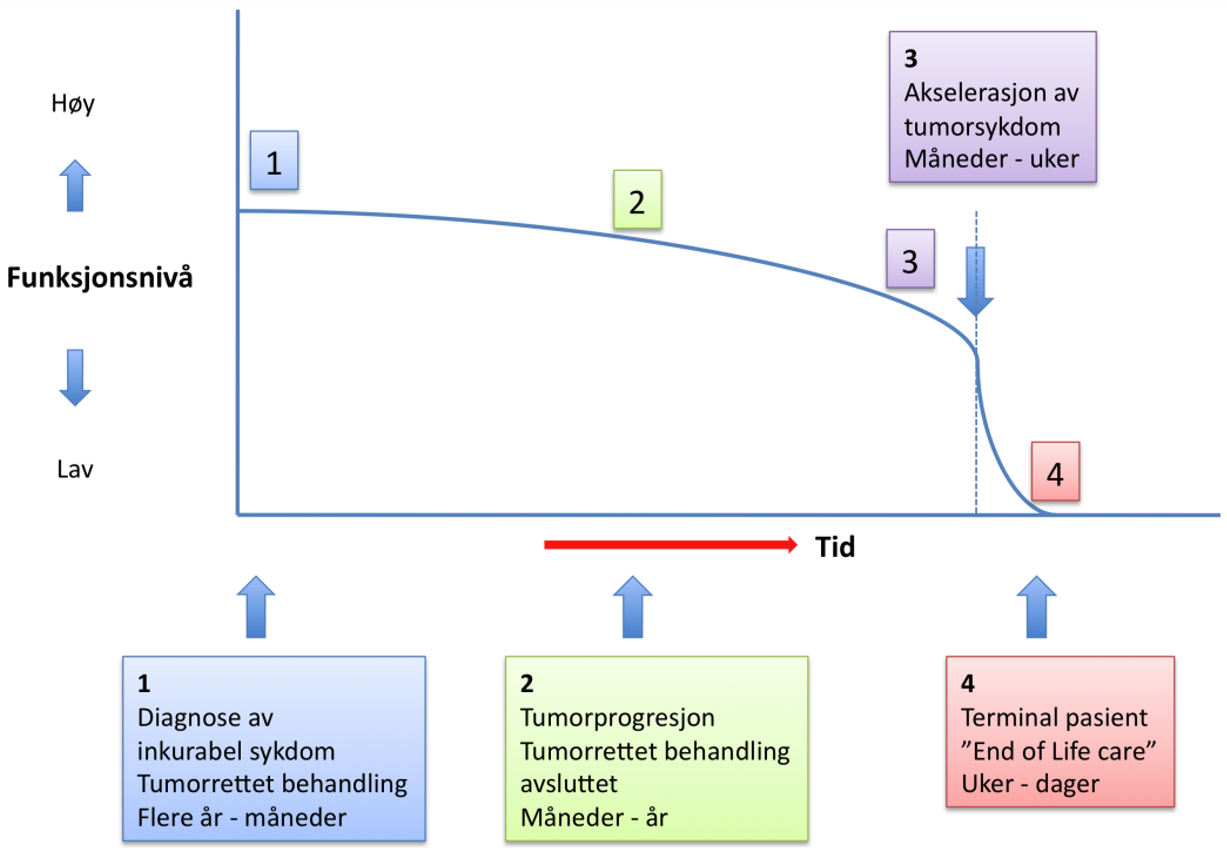
ECOG status
Pasientens funksjonsstatus bør beskrives i henhold til ECOG funksjonsstatus:
ECOG 0 – Ingen funksjonsbegrensninger
ECOG 1 – Kan utføre lettere oppgaver/aktiviteter selv
ECOG 2 – Oppegående >50 % av våken tid på døgnet
ECOG 3 – Sengeliggende/i stol >50 % av våken tid på døgnet
ECOG 4 – Sengeliggende, avhengig av hjelp
Tidlige integrasjon av palliasjon ved avansert kreftsykdom
Sist faglig oppdatert: 20.05.2022
Tidlige palliative intervensjoner ved avansert kreftsykdom har blitt et nytt konsept som sikter på å finne den optimale balansen mellom best mulig livskvalitet og lengst mulig liv, med samtidig minst mulig risiko for uønskede hendelser (Hannon & Zimmermann, 2013; Howie & Peppercorn, 2013; Zimmermann et al., 2014). Dette innebærer at man vurderer allerede tidlig i et aktivt behandlingsforløp for avansert kreft om det er behov for palliative tiltak, og revurderer behandlingsintensiteten for den eneklte pasienten for å unngå eventuell overbehandling.
Palliative intervensjoner
Sist faglig oppdatert: 20.05.2022
Palliativ kirurgi er indisert når kliniske problemstillinger krever intervensjon for å lindre symptomer ved uhelbredelig sykdom. Med palliativ kirurgi menes all intervensjonsbasert behandling som har bedring av livskvalitet som hovedmål.
Komplikasjoner ved palliative kirurgiske intervensjoner vil ofte være irreversible. Dette må tas spesielt hensyn til ved indikasjonsstilling for inngrep som skal bedre livskvalitet og hvor en komplikasjon altså kan føre til betydelig forringet livskvalitet. Omfattende kirurgiske inngrep er vanligvis ikke aktuelt når pasienten er i en fase der sykdomsforløpet akselerer og forventet levetid er mindre enn ca. 2 måneder (figur 15.1). Et multidisiplinært samarbeid mellom kirurg, endoskopør, intervensjonsradiolog, onkolog og andre involverte spesialister vil vanligvis være en viktig forutsetning for å gjøre riktige behandlingsvalg.
Minimalt invasive prosedyrer for palliativ behandling
Sist faglig oppdatert: 20.05.2022
Endoskopi
- Stenter ved maligne obstruksjoner i GI-traktus (Breitenstein et al., 2007; Dormann, Meisner, Verin, & Lang, 2004; Jeurnink et al., 2007; A. C. Moss, Morris, & Mac, 2006; Sebastian, Johnston, Geoghegan, Torreggiani, & Buckley, 2004; Watt, Faragher, Griffin, Rieger, & Maddern, 2007), se også «Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen» (Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen, 2019) Plaststenter (galleveier) – ved malign icterus. Selvekspanderende metallstenter (SEMS) i øsofagus, ventrikkel, duodenum/tynntarm, galleveier, tykk- og endetarm.
- Argon plasmakoagulasjon ved blødning fra tumor eller slimhinneblødninger etter strålebehandling; mest aktuelt i rektosigmoidområdet. Kan også anvendes for tumorreduksjon i spesielle tilfelle (Spinelli, Calarco, Mancini, & Ni, 2006).
- Perkutan endoskopisk gastrostomi (PEG) som avlastning ved malign tarmobstruksjon (Meyer & Pothuri, 2006; Pothuri et al., 2005).
- Ulike typer drenasje (abscess, væskelokulamenter, fri væske) ved bruk av endoskopisk ultralyd (EUS)
Selvekspanderende stenter i tykk og endetarm er oftest indisert ved venstresidige obstruksjoner. Komplikasjoner fra kolorektale stenter er perforasjon, migrasjon og stentobstruksjon. Stenoser som lar seg passere uten problemer for et koloskop, skal ikke stentes fordi stenten ofte da migrerer. Stentmigrasjon kan også ses ved tumorregresjon i forbindelse med tumorrettet behandling og ved innvekst av tumor utenfor tykktarmen. Ved obstruksjon i endetarmen kan lavtsittende stenter medføre smerter, blødning og irritasjon eller inkontinens for avføring.
Pasienter med kolorektale stenter bør bruke laksantia som laktulose eller macrogol for å unngå okklusjon av stenten, spesielt ved bruk av opiater. Ved stentokklusjon bør pasienten endoskoperes med tanke på å fjerne fecalia fra stent, eller vurdere innsettelse av en ny stent ved tumorinnvekst.
Intervensjonsradiologi
- Stenter ved maligne obstruksjoner
- Galleveier via perkutan transhepatisk kolangiografi (PTC), eventuelt kombinert med endoskopi for intern stent (kombinert prosedyre) (van Delden & Lameris, 2008)
- Ureter via perkutan pyelostomi
- Vena cava inferior (plagsomme hevelser i underekstremitetene)
- Perkutan drenasje
- Ventrikkel og tynntarm (perkutan gastrostomi eller jejunostomi) ved malign tarmobstruksjon
- Galleveier (PTC), oftest temporær med ekstern eller kombinert ekstern/intern drenasje før stenting
- Perkutan pyelostomi
- Drenasje av abscesser/væskelokulamenter/fri væske
- Embolisering
- Blødning fra tarm, lever, galleveier
- Symptomgivende levertumores volumreduksjon
- Radiofrekvensablasjon (RFA)
- I tillegg til kirurgi og kjemoterapi vil RFA (åpen eller perkutan) av levermetastaser kunne være et alternativ for selekterte pasienter med ikke-resektable metastaser, forankret i de multidisiplinære leverteam i påvente av randomiserte studier (Stang, Fischbach, Teichmann, Bokemeyer, & Braumann, 2009).
Palliative kirurgiske inngrep
Sist faglig oppdatert: 20.05.2022
Når det gjelder reseksjon av asymptomatisk primærtumor ved sikkert inoperable fjernmetastaser, se kapittel Levermetastaser. Ved symptomgivende stenoser som ikke lar seg behandle med stent, kan bypass eller reseksjon være indisert. Reseksjon kan også være aktuelt hvis primærtumor gir transfusjonskrevende anemi.
Palliativ strålebehandling av lokalavanserte svulster
Sist faglig oppdatert: 20.05.2022
Palliativ strålebehandling kan benyttes for å redusere tumorvolum, eller ved symptomer som smerter eller blødning (Cameron et al., 2016). Det er dokumentert god symptomlindring, men det er usikkert hvilken fraksjonering som er best. Ofte benyttes 3 Gy x 10–13, som tolereres godt. 5 Gy x 5 har god effekt i neoadjuvant setting og benyttes mer og mer også i palliativ setting. Store engangsfraksjoner på 8–10 Gy kan være effektive og tolerable for symptomkontroll ved for eksempel blødning eller smerter (Spanos et al., 1987).
Valg av fraksjonering bør gjøres i lys av forventet levetid og komorbiditet (figur 15.1).
Konkomitant kjemoterapi vil oftest ikke være formålstjenlig i den palliative situasjonen (W. P. Ceelen, Van Nieuwenhove, & Fierens, 2009; Frykholm et al., 2001).
Anbefaling
- Palliativ strålebehandling bør vurderes ved lokale plager (evidensgrad C).
Ekstraabdominelle metastaser
Sist faglig oppdatert: 20.05.2022
Forekomsten av metastaser til skjelett (10 %) og hjerne (3 %) har økt de siste årene og kan være assosiert med bedret systembehandling (Sundermeyer, Meropol, Rogatko, Wang, & Cohen, 2005).
Hjernemetastaser
Maksimalt tre metastaser, alle <3 cm ved MR, kan vurderes for nevrokirurgisk ekstirpasjon (solitær metastase) eller stereotaktisk strålebehandling. Ved flere eller større metastaser er standardbehandlingen 3 Gy x 10 mot total hjerne. Median overlevelse etter bestråling mot total hjerne er 4–5 måneder, men gir god symptomlindring (Silva et al., 2017), og det kan vurderes å gi kun steroidbehandling ved langtkommen sykdom (Nieder, Pawinski, & Balteskard, 2009).
Medullakompresjon
Ved truende medullakompresjon som er vurdert at ikke skal opereres, gis kortikosteroider og strålebehandling. Oftest har 3 Gy x 10 vært benyttet. Imidlertid er prognosen relativ dårlig ved tykk- og endetarmskreft, og hypofraksjonert behandling bør vurderes som førstevalg (Hoskin et al., 2017; Rades et al., 2006).
Skjelettmetastaser
70 % av pasienter med smertefulle skjelettmetastaser har effekt av strålebehandling med enkeltfraksjon (8 Gy x 1), og dette er like godt som fraksjonert regime (Chow et al., 2012). Effekten inntrer vanligvis innen 4–6 uker. Ved fortsatt smerter vil de fleste ha nytte av rebestråling med enkeltfraksjon (Chow et al., 2014). På grunn av dårlig prognose ved skjelettmetastaser og at effekten kun synes å være smertelindring, bør ikke lang fraksjonering benyttes (Bostel et al., 2017).
Levermetastaser
CT doseplanlagt eller stereotaktisk strålebehandling mot levermetastaser kan gi god, men kortvarig symptomlindring ved lokale plager. Strålebehandling av hele leveren kan overveies ved kapselspreng som følge av massiv metastasering (Borgelt, Gelber, Brady, Griffin, & Hendrickson, 1981; Russell, Clyde, Wasserman, Turner, & Rotman, 1993), men er lite brukt.
Systematisk oppfølging etter kurativ behandling for kreft i tykk- og endetarm
Sist faglig oppdatert: 20.05.2022
Systematisk oppfølging etter kurativ behandling for kolorektal kreft har en lang tradisjon i Norge. Oppfølgingsprogrammet ble etablert på 1980- og 90 tallet (jfr «Grønnboka» utgitt fra NGICG). Målsettingen med slik oppfølging var å øke kreftoverlevelse på befolkningsnivå ved å oppdage og behandle residiv og metastaser i tidlig og asymptomatisk fase, og med bedre muligheter for å tilby kurativ behandling.
Det norske oppfølgingsprogrammet ble bare evaluert en gang for en kohort pasienter i tidsrommet 1996–1999 med tanke på hvilken effekt det har (Korner, Soreide, Stokkeland, & Soreide, 2005), og det ble gjort en omfattende revisjon i forbindelse med første utgave av nasjonalt behandlingsprogram i 2010 med tilpassing til nyeste standard innen bildediagnostikk.
Imidlertid har store nye randomiserte studier vist at intensiv oppfølging ikke øker overlevelsen på befolkningsnivå, selv om tiden til oppdagelse av tilbakefall var kortere (GILDA studie) (Rosati et al., 2016) og antall inngrep for kirurgisk behandling av metastaser var høyere ved intensiv oppfølging (FACS studie) (Primrose et al., 2014). Den nylig publiserte COLOFOL studien viser heller ingen effekt av intensiv oppfølging på kreft-relatert mortalitet (Wille-Jørgensen et al., 2018). Disse funn er i samsvar med en stor amerikansk registerstudie («comparative effectiveness» studie) som heller ikke finner en sammenheng mellom intensitet av oppfølgingen og kreft-relatert dødelighet (Snyder, Hu, Cuddy, & et al., 2018). Den nyeste oppdaterte systematiske oversikt fra Cochrane konkluderer også med at intensiv systematisk oppfølging etter kurativ kirurgi for kreft i tykk- og endetarm ikke forbedrer overlevelsen på befolkningsnivå, og at mulige skadelige effekter ikke er tilstrekkelig dokumentert i litteraturen (Jeffery, Hickey, & Hider, 2019). Det er dessuten tydelige tegn til at systematisk oppfølging praktiseres ulik i helsetjenesten i Norge, både innenfor sykehusene, men også hvordan oppfølgingen skjer i regi av primærhelsetjenesten (Søreide et al., 2012). På denne bakgrunn kan nytten av systematisk oppfølging basert på tradisjonelt konsept ikke lenger forsvares i forhold til ressursene som hittil er brukt (Sanoff, 2018).
Imidlertid kan oppdagelse og behandling av en resektabel metastase/residiv være avgjørende for leveutsiktene på individnivå. Dette gjelder spesielt resektable levermetastaser som viktigste lokalisasjon for tilbakefall med et kurativt behandlingstilbud, og i mindre grad lungemetastaser. De fleste metastaser utvikler seg i løpet av de første tre år, og en nederlandsk studie viser at overdødeligheten knyttet til kolorektal kreft i stadium I-III er svært lav 3–5 år etter kurativ behandling, når man har overlevd de første 3 år uten at metastatisk sykdom ble påvist («conditional excess mortality», betinget relativ overlevelse) (Janssen-Heijnen et al., 2007).
Det er også et faktum at moderne behandling av kolorektal kreft har resultert i vesentlig bedre prognose og relativ overlevelse, og andel kreftoverlevere har økt betraktelig. Samtidig har en stadig høyere andel av langtidsoverlevere til dels betydelige senvirkninger etter kirurgisk og/eller onkologisk behandling, enten i form av mer generelle symptomer som fatigue eller mer spesifikke plager (Bregendahl, Emmertsen, Lindegaard, & Laurberg, 2015; Bregendahl, Emmertsen, Lous, & Laurberg, 2013). Dette gjelder spesielt pasienter som ble behandlet for kreft i endetarmen, men også ved tykktarmskreft etter tilleggsbehandling med cellegift. Den nye kreftstrategien slår fast at det er økt behov for å fokusere på seneffekter etter kreftbehandling ved å tilby målrettet behandling (Helse- og omsorgsdepartementet, 2018).
Videre er det viktig å gi mulighet for tilpassing av kontroller etter den enkelte pasientens behov basert på god samhandling mellom fastlege og spesialist.
Hensikten med kontrollene er:
- Å sikre god informasjon til pasient og pårørende etter primærbehandling
- Å sikre adekvat oppdagelse og behandling av resektable metastaser i lever og lungene
- Å kartlegge og behandle symptomer og funksjonsnedsettelse etter kreftbehandling
Det nye nasjonale oppfølgingsprogram etter kurativ behandling for kreft i tykk- og endetarm baseres på følgende premisser:
- Screening for resektable metastaser i lever og lunge de første 3 år når risiko er høyest
- Fokus på behandlingsrelaterte negative innvirkninger på funksjon/livskvalitet
- Tarm-/neo-rectum funksjon
- Funksjon av bekkenorganer
- Andre stråle-effekter (mikrofrakturer i bekken, nevropati)
- Effekter relatert til adjuvant kjemoterapi
- Generelle symptomer som fatigue
- Mulighet for kontakt med helsevesenet mellom intervallene ved plager relatert til kreftbehandling
- Kontrollopplegget forutsetter at det er gjort en fullstendig utredning av gjenværende tykk- og endetarm i forbindelse med primærbehandlingen av det aktuelle krefttilfellet.
Det er viktig å understreke at pasienter med uklare funn eller spesielle risikofaktorer kan få et individuelt tilpasset kontrollopplegg.
Tid postop. | Ca. recti | Ca. coli |
|---|---|---|
1 mnd | CEA Informasjon om histologifunn Klinisk status/restituering | CEA Informasjon om histologifunn Klinisk status/restituering Henvisning til adjuvant kjemo ved indikasjon dersom ikke gjort Evt funksjonsforstyrrelse følges opp på individuelt nivå |
3–6 mnd | Kirurg: Klinisk evaluering mtp funksjon av neo-rectum/LARS og funksjon av blære- og seksualfunksjon. Henvisning til relevante spesialister ved behov. Videre oppfølging av behandlingsrelaterte plager på individuelt nivå. | Onkolog – avsluttende kontroll hvis adjuvant kjemoterapi er gitt; evt. funksjonsforstyrrelse følges opp på individuelt nivå |
6 mnd | CEA | CEA |
12 mnd | CEA CT lunger/lever/abdomen/bekken | CEA CT lunger/lever/abdomen |
18 mnd | CEA | CEA |
24 mnd | CEA CT lunger/lever/abdomen/bekken | CEA CT lunger/lever/abdomen |
30 mnd | CEA | CEA |
36 mnd | CEA CT lunger/lever/abdomen/bekken | CEA CT lunger/lever/abdomen |
60 mnd | CEA Koloskopi | CEA Koloskopi |
Hvilke pasienter skal følges opp
- Pasienter med kurative reseksjoner av kreft i tykk- og endetarm i alle stadier skal kontrolleres 1 måned etter avsluttet behandling, og følges opp på individuell basis og ved behov med hensyn til seneffekter/funksjonsforstyrrelser knyttet til kreftbehandlingen
- Screening for resektable metastaser i lever og lungene etter 1, 2 og 3 år skal tilbys pasienter med kurative reseksjoner av kreft i tykk- og endetarm i stadium II–III dersom helsetilstanden forøvrig tillater relevant onkologisk og kirurgisk behandling. Etter fylte 80 år anbefales ikke rutinemessig oppfølging.
Systematisk oppfølging etableres ved sykehusavdeling, mens videre oppfølging skjer i samarbeid mellom sykehus og fastlegen. Organisering av tilbudet kan innbefatte delegert sykepleier-basert poliklinikk av rutinekontroller med supervisjon av spesialist. Pasienten skal gis anledning til å delta i og ta ansvar for gjennomføring av kontrollene, og skal få utlevert skriftlig kontrollplan ved første kontroll etter en måned.
Rutinemessig rektoskopi etter lav fremre reseksjon for rectum cancer anbefales ikke lenger (Tronstad, Simpson, Olsen, Pfeffer, & Karliczek, 2020).
Pasienter med vedvarende symptomer knyttet til behandling/seneffekter skal i utgangspunkt ha god kontakt med fastlege, og kan på individuelt grunnlag få anledning til å ta direkte kontakt med behandlende kirurgisk avdeling.
Pasienter med symptomer tydende på intervall-residiv skal i utgangspunkt kontakte fastlege, men har også anledning å ta direkte kontakt med behandlende kirurgisk avdeling i løpet av de første tre år, forøvrig med fastlegen.
For oppfølging av pasienter med arvelige krefttilstander gjelder retningslinjene i kapittel Arvelig tykk- og endtarmskreft. Pasienter som er operert for lever- eller lungemetastaser følges opp etter eget skjema/retningslinjer fra HPB gruppen – se kapittel Behandling av resektable og potensielt resektable metastaser.
Patologi
Sist faglig oppdatert: 20.12.2023
Det kan være hensiktsmessig med ensartede besvarelser fra patologiavdelinger i hele landet. Dette vil kunne bidra til å få med alle faktorer som er viktige for stadieinndeling og for videre behandling. Se forslag til mal ved besvarelse av reseksjonspreparater med tykk- og endetarmskreft i vedlegg til dette kapittelet.
Makrohåndtering
Sist faglig oppdatert: 20.12.2023
Prøver til histologisk undersøkelse fikseres i 10 % nøytral bufret formalin (4 % formaldehyd). En alternativ fikseringsvæske er GEWF løsning (Newell et al., 2001) som kan gi bedre visualisering og funn av økt antall lymfeknuter. Se tabell nedenfor. Ofte er preparatet først fiksert i formalin for så å bli fiksert i GEWF på grunn av funn av få lymfeknuter. Flere patologilaboratorier har kvalitetssikrede analyser som kun er utprøvd på formalinfiksert materiale. Det er noe varierende rapportering om bruk av GEWF påvirker uttrykk av antistoffer (kan være variasjon mellom ulike antistoff) (Norderval et al., 2016; Tasi et al., 2012), og eventuell bruk av GEWF skal dokumenteres i rapporten med tanke på dette. Kvaliteten på DNA synes ikke være påvirket av bruk av GEWF (Norderval et al., 2016).
Absolutt alkohol (C2H5OH) | 625 ml | 3125 ml | 10 000 ml |
Konsentrert fomaldehyd | 100 ml | 500 ml | 3400 ml |
Destillert vann | 212 ml | 1062 ml | 1600 ml |
Konsentrert eddiksyre (CH3COOH) | 63 ml | 313 ml | 1000 ml |
Total mengde | 1000 ml | 5000 ml | 16 000 ml |
Mikrohåndtering
Sist faglig oppdatert: 20.12.2023
Det lages 3–5 μm tykke snitt fra formalinfiksert vev og farges med standard farging for det enkelte laboratorium. Mikroskoperes og besvares etter mal.
UICC: TNM-klassifisering og stadieinndeling
Sist faglig oppdatert: 20.12.2023
International Union against cancer (UICC) har utarbeidet en TNM-klassifisering som baserer seg på:
T – Utbredelse av primærtumor
N – Fravær eller tilstedeværelse av tumorvev i lymfeknuter
M – Fravær eller tilstedeværelse av fjernmetastaser
I tillegg har man ytterlige deskriptive symboler som angis som prefiks. Disse bør brukes korrekt, og p viser til at klassifikasjonen er etter patologisk vurdering. y brukes som betegnelse der hvor pasienten har mottatt tilleggsbehandling før operasjon. Den 8. utgaven av TNM-klassifikasjonen benyttes, og dette er også i samsvar med Kreftregisterets rutiner (Sobin et al., 2016).
På bakgrunn av at TNM-klassifisering foretas kan kliniker stadieinndele sykdomsutbredelsen, og dette regnes som den mest signifikante faktor med hensyn til prognose. Denne UICC stadieinndelingen gir mer informasjon enn Dukes’ klassifisering og har erstattet denne.
Anbefaling:
- UICC stadieinndeling erstatter Dukes’ klassifikasjon. (evidensgrad D)
Histologisk gradering
Sist faglig oppdatert: 20.12.2023
Det histologiske svaret skal være til hjelp for klinikere med tanke på videre behandling av pasientene, og vurdering om tumorvevet er av lav- eller høygradig karakter samt eventuelle spesielle karakteristika ansees som viktig. Histologisk gradering er prognostisk viktig ettersom lite differensierte svulster er assosiert med lymfeknutemetastaser (Caputo et al., 2014).
- Lavgradig: Korte (og ofte få) strimler med lite cytologisk atypi.
- Høygradige: Kribriform arkitektur hvor cellene i stor grad også har høygradig cytologiske forandringer og/eller tilstedeværelse av signetringceller i <50% av tumor.
Andre subtyper vil i stor grad være direkteplassert som lav- eller høygradige, og i henhold til ICCR skal kun subtype angis.
- Signetringcellekarsinomer, udifferensierte karsinomer, mikropapillære karsinomer, sarkomatoide karsinomer osv anses som høygradige adenokarsinomer.
- Serraterte adenokarsinomer og adenom-liknende karsinomer vil i de aller fleste tilfellene ikke vise noen komponent av høygradig karakter slik at disse beskrives som lavgradige. Dersom man allikevel finner en høygradig komponent må dette rapporteres.
Adenokarsinom med komponenter av to eller flere subtyper rapporteres som «blandet histologisk type» og angivelse av prosentandel og eventuell gradering for hver subtype.
Det er ikke satt noen grense for hvor stor de forskjellige komponentene må være, men hver komponent må oppfattes som relevant.
Andre funn som er av prognostisk betydning skal så langt det er mulig implementeres i en histopatologisk rapport. Se også tabell 6.02 i WHO sin klassifisering av tumorer i GI-traktus (WHO Classification of Tumorous Editorial Board, 2019). De viktigste er:
- Tumor budding, enkeltceller eller små grupper av ≤ 4 tumorceller i bindevevet i tilslutning til den invasive tumorkomponenten er assosiert med lymfeknutemetastaser i T1-tumorer og overlevelse ved stadium II (Lugli et al., 2017)
- Rikt lymfocyttisk infiltrat i forbindelse med tumorvev er oftest en immunrespons som synes å være forbundet med mindre metastatisk vekst og dermed forlenget overlevelse (Galon et al., 2006; Pages et al., 2005).
- Perineural infiltrasjon er tumorvev som ligger i tilslutning til nerver, og det er vist at dette kan være en viktig prognostisk faktor assosiert med høyere forekomst av metastatisk sykdom, residiv og kortere overlevelse (Bentzen et al., 1992; Betge et al., 2012; Liebig et al., 2009).
- Tumorvev i ekstramurale vener er også en prognostisk markør som gir økt risiko for lymfeknute- og fjernmetastaser (Leijssen et al., 2019). Det må rapporteres spesifikt at det dreier seg om ekstramurale vener, og ikke bare som kar.
Lymfeknuter
Sist faglig oppdatert: 20.12.2023
Faktorer som er avgjørende for antall lymfeknuter i et resektat er blant annet kvaliteten på kirurgens disseksjon (komplett mesokolisk eksisjon), lengden på preparatet og anatomisk lokalisasjon med sannsynlighet for å finne flest lymfeknuter i nedadgående del av tykktarmen. Dersom det er funnet <12 lymfeknuter og ingen av disse inneholder tumorvev, bør dette føre til regranskning av prepratet. Dette er fordi <12 lymfeknuter ikke regnes som adekvat for at man med rimelig sikkerhet kan si at pasienten ikke har lymfeknutemetastaser og dette vil kunne utløse adjuvant kjemoterapi for pasienten. Funn av antall lymfeknuter kan påvirkes av mange faktorer som preparatets beskaffenhet og også om pasienten har fått preoperativ stråling (rektum) (Wijesuriya et al., 2005).
Ekstrakapsulær lymfeknuteinvasjon (ECLNI) betyr at man finner tumorvev i en lymfeknute som bryter gjennom kapselen og ut i det omliggende fettvev og kan finnes i opptil 50 % av tilfellene med lymfeknutemetastaser. Slik ekstrakapsulær/perinodal vekst er forbundet med økt antall lymfeknuter med metastaser, dårligere overlevelse og oftere synkrone levermetastaser (Al Sahaf et al., 2011; Suzuki et al., 2014). ECLNI regnes ikke som en kjernevariabel av RCP eller ICCR, og rapporteres ofte ikke i patologirapporter (Loughrey et al., 2020a; Loughrey et al., 2018).
Funn av mucin i lymfeknute skal registreres som metastase dersom pasienten ikke har mottatt neoadjuvant behandling (Smith et al., 2010). Ved gjennomgått neoadjuvant behandling registreres lymfeknuten positiv kun dersom det finnes vitale tumorceller i lymfeknuten. Dypere nivåer anbefales om man er i tvil.
Histopatologisk evaluering av tumorrespons
Sist faglig oppdatert: 20.12.2023
Grad av tumorregresjon som følge av neoadjuvant terapi ved endetarmskreft kan være et mål på behandlingseffekten og kan scores etter ulike klassifikasjoner. Mye av tumorvevet kan forsvinne slik at det nesten bare er strålefibrose og rester av slimsjøer tilbake. Lymfeknutene forsvinner også ofte. Vurdering av stråleeffekt kan gjøres etter et graderingssystem, se tabell (Ryan et al., 2005).
TRG 1 | Ikke påvist carcinomceller eller kun mindre foci av carcinomceller i <5 % av tumorområdet. Mucinsjøer kan sees, men mangler carcinomceller |
|---|---|
TRG 2 | Kombinasjon av carcinomceller og fibrose der carcinomcellene utgjør 5–50 % av tumorområdet |
TRG 3 | Carcinomcellene utgjør >50 % av tumorområdet. Noe fibrose kan sees, men kan være vanskelig å skjelne fra desmoplastisk respons. |
Dersom man ikke påviser resttumor ved vanlig snittuttak anbefales at hele det makroskopiske området støpes inn.
pTNM skal ha prefiks y (ypTNM) og en skal vurdere vitalt tumorvev i T og N vurderingen (Den norske legeforening, 2012).
Anbefaling:
- Det anbefales evaluering av tumorrespons etter neoadjuvant behandling for å vurdere effekt av behandling
Polypper med adenocarcinom i tykk og endetarm
Sist faglig oppdatert: 20.12.2023
For å beskrive hvor dypt kreftceller infiltrerer i polyppøse adenomer (T1-svulster), benyttes to klassifiseringssystemer. For stilkede polypper brukes klassifisering etter Haggitt (nivå 1–4 (Haggitt et al., 1985; Rothenberger et al., 2002)). I tillegg brukes gradering for utbredelse i submucosa (Sm-gradering 1–3), som er mest aktuell i forhold til bredbasede polypper. Se tabell:
T1 | Haggitt 1 – i polypphodet |
|
T1 | Haggitt 2 – i polypphalsen |
|
T1 | Haggitt 3 – i polyppstilken |
|
T1 | Haggitt 4 – i polyppbasis | Sm 1 – øvre 1/3 av submucosa |
T1 | Haggitt 4 | Sm 2 – midtre 1/3 av submucosa |
T1 | Haggitt 4 | Sm 3 – nedre del av submucosa |
Sm-graderingen forutsetter at man finner gjennomvekst av muscularis mucosae, og at hele submucosa ned til overgang til muscularis propria er med. Klinikerne etterspør gjerne Sm selv om det ikke er mulig å vurdere dette på polyppektomipreparater.
Se forslag til "Mal for polypper med infiltrerende karsinom" i vedlegg til kapittelet. Denne kan brukes etter polyppektomier og på TEM-preparater (transanal endoskopisk mikrokirurgi)
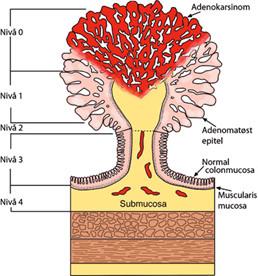
.png)
Spesifikk måling av submucosal infiltrasjon i flate lesjoner er en tilleggsparameter som kan være viktig når kliniker skal kunne beregne risikoen for lymfeknutemetastaser og/eller resttumor; nødvendigheten for formell tarmreseksjon evt. ytterligere endoskopisk behandling. Man finner i nyere litteratur at dyp submukosal infiltrasjon (DSI) alene kanskje ikke er en selvstendig prognostisk markør med tanke på lymfeknutemetastaser på lik linje med differensieringsgrad, TB og lymfekarinfiltrasjon (Nakadoi et al., 2012; Zwager et al., 2022). Funn av kun denne markøren bør derfor kanskje tillegges begrenset verdi.
I enkelte tilfeller kan det være vanskelig å måle dybden på submukosal infiltrasjon på grunn av for eksempel suboptimalt orientert biopsimateriale (Kouyama et al., 2016). I utgangspunktet måles dybden fra muscularis mucosae, men dersom denne ikke er fremstilt måles dybden fra toppen av polyppen som vist i Figur 3.
.png)
Beskrivelse av «tumor budding» (TB, enkeltliggende eller små grupper av 4 eller færre celler i invasiv front av tumor) er anbefalt ved rapportering av tykk- og endetarmskreft. International Tumor Budding Consensus Conference (ITBCC) 2016 fremhever at TB er en uavhengig predikter for lymfeknutemetastaser ved pT1-tumores (Lugli et al., 2017) og Collage of American Pathologists (CAP) har TB i templaten sin for rapportering på biopsier fra tykk- og endetarmskreft (Burgart et al., 2020). I det britiske screeningprogrammet avventes rapportering av TB til man har validert nytten i screeningprogram (NHS Bowel Cancer Screening Programme. Guidance on reporting lesions, 2017). International Collaboration on Cancer Reporting angir at TB nok bør tas med i en svarrapport, men er fortsatt en NON-CORE parameter (Rosty et al., 2020). En konsensusstudie (Delphie, 2021) anbefaler at TB rapporteres ved T1 tumorer ettersom lav grad av TB (Bd1, se under) uten andre risikofaktorer gjør at man oppfatter sjansen for lymfeknutemetastaser som svært lav (Bosch et al., 2013; Haddad et al., 2021).
For TB anbefales en tredelt score i ett «hotspot» 20X synsfelt (0.785 mm2).
- 0-4 buds; lav grad av budding (Bd1)
- 5-9 buds; intermediær grad av budding (Bd2)
- ≥10 buds; høy grad av budding (Bd3)
I to meta-analyser har man funnet at infiltrasjon i lymfekar kan predikere senere funn av lymfeknutemetastaser (Beaton et al., 2013; Bosch et al., 2013). Det er ønskelig at man skiller mellom infiltrasjon i lymfekar og vene dersom dette er mulig.
European guidelines (2010) anbefaler et ekspertpanel (endoskopør, patolog og kirurg) som sammen med pasienten foretar en begrunnet avgjørelse for formell reseksjon i tilfeller med påvist karsinom i et polyppektomipreparat hvor det er frie reseksjonsrender.
Anbefaling:
- Polypper med adenokarsinomer (T1-svulster) bør rapporteres etter mal
Mal for tykktarmskreft
Sist faglig oppdatert: 20.12.2023
Ved bruk av mal (se vedlegg) sikrer man at forhåndsdefinerte momenter kommer med, og kliniker kan lettere vurdere premissene for blant annet stadieinndeling (Haugland et al., 2011).
Anbefaling:
- Det anbefales bruk av mal ved besvarelse av reseksjonspreparater med tykktarmskreft (evidensgrad D)
Mal for endetarmskreft
Sist faglig oppdatert: 20.12.2023
Mal for resektater fra endetarmskreft (se vedlegg) er svært lik den som anbefales brukt for tykktarmskreft. Svulstens lokalisasjon over eller under omslagsfolden vurderes i tillegg til at det gjøres vurdering av mesorektum, se tabell. Det synes å være funn av færre lymfeknuter i endetarm enn i tykktarm, som kan være effekt av blant annet stråling (Koren et al., 1997).
Komplett | Mesorektum Defekter «Coning» CRM | Intakt, glatt Ikke dypere enn 5 mm Ingen Glatt og jevn |
|---|---|---|
Nesten komplett | Mesorektum Defekter «Coning» CRM | Moderat bulk, irregulær Ingen synlig muscularis propria Moderat Irregulær |
Inkomplett | Mesorektum Defekter Coning CRM | Lite bulk Inn til muscularis propria Ja Irregulær |
Anbefaling:
- Det anbefales bruk av mal ved besvarelse av reseksjonspreparater med endetarmskreft (evidensgrad D)
Tester for Lynch syndrome
Sist faglig oppdatert: 20.12.2023
Lynch syndrom (LS) skyldes kimbanemutasjoner i mismatch reparasjons- (MMR) genene, og arvegangen er autosomal dominant. Ved testing med tanke på Lynch syndrom undersøkes først tumorvevet med tanke på uttrykk av reparasjonsproteiner (MMR) ved immunhistokjemi, eller påvisning av mikrosatelitt instabilitet (MSI) ved hjelp av PCR. Dette regnes som en indirekte test. Dersom man finner forandringer som kan gi mistanke om Lynch syndrom, må man undersøke normalvev (for eksempel blod) fra pasienten for å se etter mutasjoner (direkte test), dvs om forandringene ligger i kimbanen / er nedarvet. Dette gjøres etter utredning ved medisinsk genetikk.
Det skal gjøres reflekstesting på svulster til alle pasienter under 60 år med tanke på LS.
Bethesta-kriteriene beskriver typiske histologiske karaktertrekk som gjør at man bør undersøke med tanke på MMR/MSI uavhengig av alder (lavt differensiert/udifferensiert karsinom, signetceller, Crohnliknende lymfocyttaggregasjon, slimproduksjon i >50 % av tumorcellene, lymfocyttaggregasjon eller kribriformt vekstmønster) (Umar et al., 2004). Ved historikk av synkron eller metakron tykk- og endetarmskreft eller andre LS-relaterte svulster (kreft i endometrium, duodenum, nyrebekken/ureter, ventrikkel, lever- og galleganger, bukspyttkjertel og eggstokker mfl) bør man også vurdere undersøkelse av MMR/MSI selv om pasienten er over 60 år.
Se for øvrig pkt Henvisningskriterier til genetisk veiledning og utredning vedr andre indikasjoner for henvisning til genetiker. Genetiker koordinerer de ulike helsetiltak i familier med påvist eller sannsynlig mutasjon.
Molekylærpatologisk undersøkelse
Sist faglig oppdatert: 20.12.2023
Molekylærpatologisk undersøkelse er i økende grad viktig for valg av behandling. MMR/MSI-status er viktig hos pasienter med stadium II sykdom ettersom pasientene med manglende uttrykk av en eller flere reperasjonsproteiner (deficient MMR [dMMR]) eller MSI har så god prognose at de ikke trenger adjuvant (postoperativ) behandling. Også for stadium III har pasienter med dMMR/MSI bedre overlevelse, og adjuvant behandling legges opp i henhold til retningslinjer (se Pasienter med påvist mikrosatelittinstabilitet (MSI) manglende uttrykk av dMMR hos høyrisiko stadium II/stadium III). MMR/MSI status er også nødvendig for pasienter med inoperabel/metastatisk sykdom ettersom de med dMMR/MSI har dårligere prognose og dårligere effekt av kjemoterapi (se MSI/dMMR). Imidlertid inngår nå immunterapi som mulig behandling ved inoperabel eller metastatisk sykdom (se MSI) hos pasienter med dMMR/MSI. Det er nå økende fokus på immunterapi som primærterapi uten påvist metastatisk sykdom, etter at det er vist svært lovende resultater med neoadjuvant immunterapi av tykktarmskreft (Chalabi et al., 2020; Chalabi et al., 2022) og endetarmskreft (Cercek et al., 2022). Ved metastatisk eller inoperabel sykdom skal det gjøres analyse av RAS og BRAF mutasjoner fordi det får betydning for valg av medikamentell kreftbehandling (Cervantes et al., 2023).
Det bør også gjøres undersøkelse av HER2-status, da nye ESMO guidelines anbefaler spesifikk behandling ved HER2-positiv tumor i 3. linje hos pasienter uten mutasjon i RAS (RAS WT) (Cervantes et al., 2023), og det i tillegg er seleksjonskriterium for klinisk studie i tidligere linje. Se vedlegg for scoring av HER2.
NTRK-fusjoner kan i sjeldne tilfeller forekomme, men vil ikke være en del av standard undersøkelse.
Mutasjoner i RAS og BRAF er oftest tilstede både primærtumor og metastaser. Også manglende uttrykk av reparasjonsproteiner (dMMR) og/eller mikrosatelitt-instabilitet (MSI) viser stor grad av samsvar mellom primærtumor og metastase. Undersøkelse med tanke på mutasjoner i RAS eller BRAF samt Her2-status og evt NTRK gjøres etter henvisning fra kliniker.
Spesifikt om immunhistokjemi (IHK)
Sist faglig oppdatert: 20.12.2023
- Mismatch reparasjonsproteiner (MMR):
- Undersøkelse på uttrykk av de fire reparasjonsproteinene MLH1, PMS-2, MSH-2 og MSH-6. Omtales som «proficient» om alle uttrykkes (pMMR), og som «deficient» (dMMR) om en eller flere ikke uttrykkes.
- Prevalensen av dMMR/MSI i adenokarsinomer i tykk- og endetarm oppgis til å være rundt 10-15 % (Abrha et al., 2020; Sinicrope et al., 2012), men adenokarsinomene i rektum utgjør kun omtrent 3 % (Papke et al., 2022),
- PD-L1:
- Testing med tanke på uttrykk av PD-L1 har foreløpig ingen plass i utredningen om immunterapi hos pasienter med utbredt CRC ettersom denne behandlingen vurderes på bakgrunn av dMMR.
- BRAF:
- De aller fleste mutasjonene i BRAF (90 %) er resultat av substitusjon av valin med glutaminsyre (V600E). Denne mutasjonen kan man detektere ved hjelp av immunhistokjemi.
- Her 2:
- Ved scoring av Her2 anbefaler ESMO (Van Cutsem et al., 2014) at man benytter «Heracles dignostic criteria» (Valtorta et al., 2015) hvor man har benyttet VENTANATM 4B5 immunhistokjemi, og enten FISH eller SISH. Se tabell 17.12.1 nedenfor.
- NTRK:
- Sjeldent forekommende fusjon i CRC (<0,5 %), men oftere hos de som er dMMR (6-16 %). Kan detekteres ved immunhistokjemi, med må bekreftes ved NGS (Cervantes et al., 2023).
Scoring av Her-2
| Immunhistokjemisk farging | Immunhistokjemisk uttrykk | Immunhistokjemisk klassifisering |
|---|---|---|
Ingen farging |
| Negativ |
Svak farging (1+) uansett hvor mange celler | Segmentell eller granulær | Negativ |
Moderat (2+) i < 50 % av cellene | Hvilket som helst fargemønster | Negativ |
Moderat (2+) i > 50 % av cellene | Membranøs farging, basolateral eller lateral | Usikker – gjenta IHK. Til FISH/SISH om fortsatt >50 % |
Intens (3+) i ≤10 % av cellene | Membranøs, basolateral eller lateral | Negativ |
Intens (3+) i >10 % av cellene | Membranøs, basolateral eller lateral | Positiv |
Spesifikt om deteksjon av mikrosatelittinstabilitet (MSI)
Sist faglig oppdatert: 20.12.2023
MSI forårsakes av manglende funksjon av de proteinene som skal reparere feil ved nydanning av DNA etter splitting med DNA polymerase. Dette gir opphopning av mutasjoner spesielt i områder med repetisjoner av nukleotider (mikrosatelitter), og kan testes ved forskjellige metoder.
- PCR: Et begrenset antall spesifikke primere benyttes for å koble seg på områder på DNA som koder for mikrosatelitter.
- NGS: En lang rekke områder som koder for mikrosatelitter kan undersøkes samtidig, men søket etter de «riktige» områdene er også her av vesentlig betydning.
Spesifikt om molekylære analyser
Sist faglig oppdatert: 20.12.2023
Per i dag er det fortsatt kun noen få genforandringer som det er godkjent målrettet behandling for. Økende omfang av kliniske studier kan gi tilgang til nye medikamenter, og dette kan medføre økning i antall gener som skal testes for at pasienter kan kunne få tilbud om inklusjon i kliniske studier. Ved CRC foreligger som regel relativt rikelig med tumorvev slik at man vil ha tilgang til mer materiale om det skal utføres videre molekylære analyser. Neste generasjons sekvensering (NGS) vil kunne være å foretrekke fremfor enkeltgenanalyser for å spare tumorvev, og også for å få et større panel av analyser samtidig. Gener som per i dag er viktige for behandling av CRC er oppsummert i tabell 1. Forandringene i noen av disse genene er gjensidig ekskluderende som vil si at dersom det er påvist mutasjon i for eksempel KRAS vil det ikke foreligge mutasjon i NRAS eller BRAF.
Det bør etableres rutiner slik at dette helst kan besvares i løpet av 2 uker. ASCO anbefaler at 90 % av rapportene skal være tilgjengelig innen 10 dager fra den dagen henvendelsen ankommer det laboratoriet som utfører molekylær patologi (Sepulveda et al., 2017).
| Gen | Type genforandring | Funksjon protein | Forekomst | Analyse-metode | Behandling | Kommentar |
|---|---|---|---|---|---|---|
KRAS | Mutasjoner Exon 2, 3 og 4 | KRAS | 35-45 % | DNA sekvensering, NGS | Ja | Pasienter med mutasjon ikke aktuell for terapi med anti-EGFR |
NRAS | Mutasjon Exon 2 og 3 | NRAS | 5-10 % | DNA sekvensering, NGS | Ja | Pasienter med mutasjon ikke aktuell for terapi med anti-EGFR |
BRAF | Mutasjon Exon 15 | BRAF | 8-12 % | DNA sekvensering, NGS | Ja | Non V600-mutasjoner ikke aktuell for BRAF-rettet behandling |
dMMR/MSI | Metylering eller mutasjon | MLH-1 PMS-2 MSH-2 MSH-6 | Totalt 10-15%, rektum alene ≈ 3 % | Immunhisto-kjemi, PCR eller andre tilsvarende metoder | Ja | Prognose og behandling av Stadium II og III. Behandling av metastastsik sykdom mht immunhistokjemi og immunterapi. Immunterapi som primærbehandling på indikasjon. |
| Her2 | ERBB2 amplifikasjon | Her2 | 5% av de med meta-statisk CRC | IH SISH/FISH | Ja | Metastatisk CRC, spesifikk behandling 3. linje. Studier |
NTRK | Fusjon | NTRK | <0,5 % dMMR/MSI: 6-16 % | Immunhisto-kjemi, NGS | Ja | Positiv immunhistokjemi bekreftes av NGS. Evt som 3. linje behandling |
Prøvetakning og besvarelse av molekylære analyser
Sist faglig oppdatert: 20.12.2023
Prøvetaker: Det er viktig å sikre flere biopsier fra tumorvev. Dersom det er tatt mange biopsier kan disse legges på separate glass. Dette kan bidra til en mer effektiv utnyttelse av materialet, da ulike glass kan brukes til ulike undersøkelser.
Prøvematerialet: Optimal fikseringstid for små er oftest under 24 timer. Lang fikseringstid kan medføre dårlig DNA kvalitet; Dersom det er lite materiale skal patologen ringe inn området med størst andel tumorceller. Andelen tumorceller skal anslås.
Besvarelse av molekylære analyser:
Det bør tilstrebes at resultat med tolkning av molekylære analyser kommer klart fram i rapporten. Den molekylærpatologiske svarrapport bør inneholde følgende informasjon:
- Morfologisk diagnose
- Prosentvis andel neoplastiske celler i området som er benyttet for molekylærpatologisk undersøkelse
- Molekylærpatologisk metode/plattform/kit
- Hvilke genområder som er undersøkt:
- Ved bruk av EGFR-kit skal det angis hvilke mutasjoner Det skal angis hvilke mutasjoner som er dekket ved undersøkelsen (kan eventuelt henvise til informasjon i laboratoriehåndbok, genetikkportalen eller andre steder hvor avdelingen har gjort slik informasjon tilgjengelig)
- Ved bruk av NGS angis hvilke gener panelet dekker. For å unngå unødvendig mye informasjon som kan forvirre i selve svarrapporten, bør denne informasjonen legges ved som vedlegg. Eventuelt kan det henvises til informasjon i laboratoriehåndbok, genetikkportalen eller andre steder hvor avdelingen har gjort slik informasjon tilgjengelig.
- Resultat for relevante områder i gener med behandlingsmessig konsekvens angis i svarrapport, per nå gjelder dette RAS og BRAF (mutasjoner). Ytterligere resultater fra NGS utover funn i de over nevnte gener skal lagres i avdeling for patologi, og full rapport skal kunne meddeles kliniker ved forespørsel.
- Det skal benyttes Human Genome Variation Society (HGVS) nomenklatur for angivelse av mutasjoner hvor koordinater oppgis både på nukleotid- og aminosyrenivå.
- Dersom materialet er uegnet for molekylære analyser skal årsak angis, f.eks om det er for lite tumorceller eller DNA tilstede, om det er dårlig DNA-kvalitet eventuelt andre årsaker
- Ved dårlig DNA kvalitet bør mulig årsak oppgis (lang fikseringstid, formalin-kvalitet, dekalsinert materiale)
Anbefaling:
- Reflekstesting av MMR/MSI hos alle pasienter med nyoppdaget adenokarsinom i tykk- og endetarm
- Molekylær patologisk analyse av RAS og BRAF utføres ved utbredt sykdom ved tykk- og endetarmskreft (evidensgrad D)
- Ved metastatisk sykdom bør svar på RAS, BRAF foreligge innen 2 uker etter rekvirering (evidensgrad D)
Utprøvende behandling
Sist faglig oppdatert: 20.12.2023
Utprøvende behandling er pasientbehandling hvor effekt og bivirkninger av den nye behandlingen ennå ikke er dokumentert, eller ikke er dokumentert hos denne pasientgruppen eller ved dette sykdomsstadiet. Hva som tilbys av utprøvende behandling vil være i stadig endring og vil variere ved sykehusene. Utprøvende behandling tilbys innenfor formelt godkjente protokoller hvor det er angitt bestemte kriterier for deltakelse i studien. Slike utprøvende behandlinger med kontrollerte studier, kan forventes utført ved sykehus med multidisiplinære team og med har den nødvendige kompetanse til å gjennomføre studier.
Les mer om utprøvende behandling i Helsedirektoratets veileder: Utprøvende behandling - nasjonale prinsipper - Helsedirektoratet
Et utvalg av utprøvende behandling som pågår i Norge presenteres i dette kapitlet.
Levertransplantasjon
Sist faglig oppdatert: 20.12.2023
Det er gjort noen få forsøk med levertransplantasjon for metastatisk tykk- og endetarmskreft med spredning lokalisert til leveren. En pilotstudie fra Oslo universitetssykehus, Rikshospitalet viste en 5 års overlevelse på 60 % (Hagness et al., 2013). Det pågår utprøvende behandling med levertransplantasjon til selekterte grupper ved OUS-Rikshospitalet. Pasienter med levermetastaser uten ekstrahepatisk sykdom, eller med begrenset ekstrahepatisk sykdom, kan henvises HPB-gruppen for vurdering i studie.
Hepatisk intravaskulær behandling
Sist faglig oppdatert: 20.12.2023
Enkelte behandlingsmodaliteter for direkte behandling av levermetastaser er under utprøving. Disse metodene er basert på tradisjonelle intravaskulære teknikker med portal, arteriell eller selektiv arteriell tilførsel av kjemoterapi eller andre stoffer, eventuelt selektiv intrahepatisk bestråling med 90Y-partikler.
Kjemoterapi
Sist faglig oppdatert: 20.12.2023
Utprøvning av nye legemidler, enten som enkeltstoff eller i kombinasjon med tradisjonelle kjemoterapiregimer, kan være aktuelt ved adjuvant behandling, sammen med stråleterapi eller ved behandling av metastaserende sykdom. Selv om kliniske studier kan foregå som forskningsprosjekt ved enkeltinstitusjoner, er det vanlig at legemiddelutprøvning skjer parallelt ved mange institusjoner (multisenterstudier). Rent formelt inndeles klinisk legemiddelutprøvning i fire faser, fase I – fase IV (Legemiddelverket, 2023; Stein, 2005).
Fase I (Human farmakologi). Studier hvor et nytt medikament eller medikamentkombinasjon benyttes for første gang på mennesker, og det primære formål er å kartlegge medikamentets humane farmakologi. Fase 1-studier er svært ressurskrevende, og det aktuelle pasientantallet er ofte under 50.
Fase II (Terapeutisk eksplorativ). Studier som først og fremst skal kaste lys over den terapeutiske effekt av et medikament eller behandlingsregime hos aktuelle pasienter. Spørsmål rundt ulike kombinasjoner, administrasjon, dose eller behandlingsvarighet blir belyst. Fase II-studier har ofte en design hvor pasientene randomiseres til én av to behandlingsarmer. Vanligvis inkluderes 50 til 200 pasienter.
Fase III (Terapeutisk bekreftende): Dette er store studier (500–5000 pasienter) hvor det primære formål er å bekrefte sikkerhet og effektivitet av et nytt behandlingsregime. Studiene randomiserer vanligvis pasientene til én av to eller flere behandlingsalternativer. En behandlingsarm (kontrollarm) vil vanligvis representere den etablerte behandlingen. Fase III-studier utføres ofte som ledd i å få godkjent et nytt legemiddel.
Fase IV (Terapeutisk bruk): Fase IV-studier foregår etter at et legemiddel er godkjent. Studiene gjøres på godkjent indikasjon og har som sitt primære formål ytterligere dokumentasjon av sikkerhet og effekt. Fase IV-studier gjøres nesten alltid i regi av legemiddelindustrien.
Fase II, III og IV-studier, ofte anbefalt av eller utført i regi av det nasjonale fagmiljøet, vil for enkeltpasienter kunne være et alternativ eller supplement til de etablerte terapianbefalingene. I hovedsak foregår slike studier ved de onkologiske sykehusavdelingene. Noen studier er bare aktuelle for undergrupper av pasienter, for eksempel dersom svulsten har spesifikk mutasjon (for eksempel BRAF mutasjon). Pasienter som har gjennomgått de etablerte behandlingslinjene, er motiverte og i god allmenntilstand, kan vurderes for fase I eller tidlige fase II-studier. Disse pasientene kan henvises til Enhet for utprøvende kreftbehandling, Avdeling for kreftbehandling, Oslo universitetssykehus, Radiumhospitalet.
Metode og prosess
Bakgrunn
Sist faglig oppdatert: 20.12.2023
Mange onkologiske faggrupper la i en årrekke ned et betydelig arbeid for å komme frem til konsensusbaserte faglige anbefalinger for diagnostikk og behandling av ulike typer kreft. Som ledd i Nasjonal strategi for kreftområdet (2006–2009) fikk Helsedirektoratet i oppdrag å videreutvikle og oppdatere faggruppenes anbefalinger til nasjonale handlingsprogrammer for kreftbehandling, i nært samarbeid med fagmiljøene, de regionale helseforetakene, Nasjonalt kunnskapssenter for helsetjenesten, og andre relevante myndigheter. De nasjonale handlingsprogrammene representerer en videreføring og en formalisering av faggruppenes anbefalinger.
Nasjonalt handlingsprogram med retningslinje for diagnostikk, behandling og oppfølging av tykk- og endetarmskreft ble utarbeidet første gang i 2010 av en arbeidsgruppe med representanter for alle de regionale helseforetakene, og i samarbeid med Helsedirektoratet. Oppdateringen desember 2023 er den tiende revisjonen. Helsedirektoratet takker arbeidsgruppene for stor innsats i utarbeidelsen av handlingsprogrammet. (Se nedenfor for oversikt over deltagere)
Formål med anbefalingene
Sist faglig oppdatert: 20.12.2023
Nasjonale handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av kreft (Nasjonale handlingsprogram) skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
Rettslig betydning
Sist faglig oppdatert: 20.12.2023
Helsedirektoratet skal utvikle, formidle og vedlikeholde normerende produkter, det vil si nasjonale faglige retningslinjer, nasjonale veiledere, nasjonal faglige råd og pakkeforløp, som understøtter målene for helse- og omsorgstjenesten.
Nasjonale anbefalinger og råd skal baseres på kunnskap om god praksis, og skal bidra til kontinuerlig forbedring av virksomhet og tjenester, jf. spesialisthelsetjenesteloven § 7-3, helse- og omsorgstjenesteloven § 12-5 og folkehelseloven § 24.
Nasjonale anbefalinger og råd setter en norm for hva som er faglig forsvarlig. Anbefalinger og råd utgitt av Helsedirektoratet er ikke rettslig bindende, men er faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet.
I situasjoner der helsepersonell velger løsninger som i vesentlig grad avviker fra gitte anbefalinger, skal dette dokumenteres, jf. journalforskriften § 6, bokstav g. Helsepersonell bør være forberedt på å begrunne sine valg i eventuelle klagesaker eller ved tilsyn.
Målgrupper
Sist faglig oppdatert: 20.12.2023
Målgrupper for de nasjonale handlingsprogrammene er spesialister innen medisin, kirurgi, onkologi, radiologi og patologi. De vil også være av interesse for allmennleger, pasienter, pårørende og andre aktører på kreftfeltet.
Omfang og avgrensning
Sist faglig oppdatert: 20.12.2023
- Dette nasjonale handlingsprogrammet omtaler kun kreft i tykktarm og endetarm av typen adenokarsinomer. Disse utgår fra slimproduserende celler i slimhinnen i tarmen. Disse utgjør mer enn 98% av alle kreftsvulster i tykktarm og endetarm.
- Andre sjeldne typer er ikke omtalt. Disse omfatter:
- lymfomer som utgår fra lymfevev i tarmveggen
- GIST (Gastrointestinal stromal tumor) som utgår fra bindevev i tarmveggen
- NET og NEC som utgår fra nevroendokrine celler i tarmveggen
- melanomer som utgår fra pigmentceller i tarmveggen
Utredning, behandling og oppfølging av disse krefttypene er beskrevet i andre nasjonale handlingsprogrammer.
- I denne oppdateringen er disse kapitlene som er revidert og oppdatert:
- Behandling av tykktarmskreft uten metastaser (9)
- Kirurgisk behandling av endetarmskreft uten fjernmetastaser (10)
- Onkologisk behandling av endetarmskreft (11)
- Behandling av resektable og potensielt resektable metastaser (13)
- Behandling av ikke-kurable metastaser (14)
- Patologi (17)
- Metode og prosess (19)
- Det har ikke vært brukerrepresentanter med i arbeidsgruppene. Norilco og Kreftforeningen legger ned et betydelig arbeide for brukergruppene for denne kreftsykdommen.
Handlingsprogram og Nye metoder
Sist faglig oppdatert: 20.12.2023
De regionale helseforetakene har ansvar for Nye metoder, et felles system for å beslutte hvilke metoder som kan tilbys i spesialisthelsetjenesten. Nye metoder er et prioriteringsverktøy. Beslutningene i Nye metoder gjelder nasjonalt, les mer her: Bakgrunn: Hvorfor har vi Nye metoder?
Handlingsprogram og andre normerende produkter kan ikke anbefale legemidler eller andre metoder som ikke har finansering i den offentlige helsetjenesten. Handlingsprogrammene oppdateres i overenstemmelse med beslutninger i Nye metoder.
Kunnskapsbasert metode
Sist faglig oppdatert: 20.12.2023
Kunnskapsbasert praksis innebærer at både forskningsbasert kunnskap, erfaringsbasert klinisk kunnskap og pasientenes/ brukernes ønsker og behov vurderes samlet. I utarbeidelsen og revidering av nasjonale handlingsprogram har det ikke vært en tradisjon for brukermedvirkning.
Innholdet i en retningslinje skal baseres på et oppdatert, gjennomarbeidet og dokumentert kunnskapsgrunnlag (Helsedirektoratet, 2012). Det innebærer at forskningslitteratur, klinisk erfaring og brukererfaring vurderes opp mot ønskede og uønskede konsekvenser av et tiltak. På områder der det er funnet mindre forskningsbasert kunnskap, og/eller overføringsverdien fra internasjonal til norsk helsetjeneste er lav, blir klinisk kunnskap og brukerkunnskap tillagt større vekt.
Dette nasjonale handlingsprogrammet inneholder svært mange anbefalinger. Det er ikke praktisk mulig, innenfor gitte ressursrammer, å samle all relevant forskningsbasert kunnskap for hver anbefaling. Den forskningsbaserte kunnskapen er hovedsakelig basert på forskning identifisert i anerkjente internasjonale retningslinjer og nyere studier. Det er heller ikke praktisk mulig å gjennomgående bruke GRADE eller SIGN-metodikken for gradering av kunnskapsgrunnlaget.
Handlingsprogram og andre normerende produkter skal også forholde seg til prioriteringskriteriene og ressursbruk. Med ressurser menes direkte kostnader, men også personell og tidsbruk.
Grad av normering
Sist faglig oppdatert: 20.12.2023
Grad av normering angis i teksten i hver enkelt anbefaling/råd:
- Når Helsedirektoratet skriver «skal», betyr det at anbefalingen/rådet er basert på lov eller forskrift, eller når det er så klart faglig forankret at det sjelden er forsvarlig å ikke gjøre som anbefalt.
- Når det står bør» eller «anbefaler», er det en sterk anbefaling/råd som vil gjelde i de aller fleste tilfeller.
- Når det står «kan» eller «foreslår» er det en svak anbefaling/råd der ulike valg kan være riktig for ulike pasienter.
Relaterte normerende publikasjoner
Sist faglig oppdatert: 20.12.2023
Arbeidsform og deltakere
Sist faglig oppdatert: 20.12.2023
Handlingsprogrammet revideres av arbeidsgrupper oppnevnt av Helsedirektoratet. Representantene i gruppen er utnevnt av de regionale helseforetakene. Etter Helsedirektoratets bearbeidelse og gjennomgang av utkast til handlingsprogram, blir handlingsprogrammet publisert på Helsedirektoratets nettside: Kreft - Helsedirektoratet
Handlingsprogrammet ble publisert desember 2023 i revidert utgave.
Arbeidet er ledet av Arne Wibe, St. Olavs hospital, Overlege, Spesialist i Gastroenterologisk Kirurgi
Kapittel | Ansvarlig | Deltagere i arbeidsgruppene |
|---|---|---|
1 Innledning | Arne Wibe |
|
2 Epidemiologi | Inger Kristin Larsen Kreftregisteret |
|
3 Pakkeforløp | Helsedirektoratet |
|
4 Fastlegens arbeid og ansvar ved tykk- og endetarmskreft | Karin Frydenberg | Knut Arne Wensaas |
5 Arvelig tykk- og endetarmskreft | Øyvind Holme | Astrid Stormorken
Gruppe for arvelig kreft i Helsedirektoratet |
6 Polypper i tykk- og endetarm og dysplasi ved ulcerøs kolitt | Øyvind Holme | Arne Færden
Sonja Eriksson Steigen Universitetssykehuset i Nord-Norge |
7 Diagnostikk og utredning | Stig Norderval Universitetssykehuset i Nord-Norge | Øyvind Holme
Cornelia Rösler |
8 Perioperativ behandling ved kirurgi for tykk- og endetarmskreft | Maria Gaard | Kenneth Thorsen |
9 Kirurgisk behandling av tykktarmskreft uten metastaser | Thomas Andre Waksvik Moger | Maria Gaard
Frank Pfeffer
Hartwig Kørner
Knut Magne Augestad |
10 Kirurgisk behandling av endetarmskreft uten metastaser | Tor Eivind Bernstein | Stig Norderval Stein Larsen |
11 Onkologisk behandling av endetarmskreft | Morten Brændengen | Magnar Johansen
Jørgen Smeby Anne Hansen Ree |
12 Behandling av lokalt residiv av endetarmskreft | Arne Wibe | Stein Larsen |
13 Behandling av resektable og potensielt resektable metastaser | Halfdan Sørbye | Kristoffer Lassen
Kristine Øverås Aasebø
Inger Marie Løes
Morten Brændengen
Eva Hofsli
Marianne Grønlie Guren
Jørgen Smeby |
14 Behandling av ikke-kurable metastaser | Halfdan Sørbye
| Eva Hofsli
Morten Brændengen
Marianne Grønlie Guren
Jørgen Smeby
Magnar Johansen |
15 Palliativ behandling | Hartwig Kørner | Magnar Johansen |
16 Systematisk oppfølging etter avsluttet kurativ behandling for tykk- og endetarmskreft | Hartwig Kørner |
|
17 Patologi | Sonja Eriksson Steigen Universitetssykehuset i Nord-Norge |
|
18 Utprøvende behandling | Marianne Grønlie Guren
| Svein Dueland Tormod Guren
Stein Larsen |
Prosess og metode | Helsedirektoratet |
|
Kontaktperson i Helsedirektoratet er Hege Wang (seniorrådgiver), avd. spesialisthelsetjenester
Fagansvarlig på kreftområdet er Sissi Espetvedt (spesialrådgiver): sissi.leyell.espetvedt@helsedir.no
Habilitet
Sist faglig oppdatert: 20.12.2023
Representantene i arbeids-/oppdateringsgruppen har fylt ut Helsedirektoratets habilitetsskjema. Ingen interesser med konsekvenser for deltakelse i arbeidet er identifisert. Skjemaene er arkivert i Helsedirektoratets arkiv, og innsyn kan gis ved forespørsel.
Kontaktpersoner i Helsedirektoratet
Sist faglig oppdatert: 20.12.2023
Kontaktperson i Helsedirektoratet: Hege Wang (seniorrådgiver), avd. spesialisthelsetjenester
Fagansvarlig på kreftområdet er Sissi Espetvedt (spesialrådgiver): sissi.leyell.espetvedt@helsedir.no
Vedlegg
Vedlegg til kapittel 7.3, avsnitt Preoperativ utredning
Sist faglig oppdatert: 20.05.2022
Kommentarer til strukturert rapport
Det anbefales å bruke strukturert rapport ved beskrivelse av MR rektum da studier har vist at man ved dette oppnår en mer fullstendig vurdering. Vi har ikke tatt utfordringen med å utforme et skjema som kan legges inn i de forskjellige tekstbehandlingssystemer. Vedlagte skjema må derfor lokalt konverteres til eget RIS. I enkleste form, kan det brukes som en huskeliste ved diktering.
Funn eller situasjoner som ikke dekkes i skjemaet, bør kommenteres i fri tekst. En kort beskrivelse i fri tekst kan også gi et bedre generelt intrykk av tumor, f.eks: Stor, aggressivt utseende tumor med invekst i levator ani.
Primær TNM klassifikasjon
For beskrivelse ved primær utredning, skal alle punkter på skjemaet besvares så langt det er aktuelt eller mulig.
Responsevaluering
Når det gjelder responsevaluering etter neoadjuvant behandling, er situasjonen mer komplisert med mange uavklarte punkter. Blant annet er det ikke bestemt hvordan man best måler respons. Det vedlagte skjemaet er en oversikt over punkter som er vanlig å vurdere, uten at den eksakte nytteverdien for alle punktene er avklart. Det er allikevel et par punkter som skal besvares:
- Har behandlingen endret på tumorutbredelse slik at MRF eller andre organer nå ikke er affisert? MR har høy negativ prediktiv verdi for affeksjon av MRF etter neoadjuvant behandling.
- Har tumor vist respons?
- Enten angitt ved en omtrentlig vurdering av volumendring, ingen/liten/stor. Alternativt kan man gjøre en enkel volumberegning (bredde x dybde x lengde) før og etter behandling og angi volumendring i %. Bredde og dybde måles da i et enkelt snitt hvor tumorutbredelse er størst og tumorlengde tilsvarer tumors utbredelse i tarmens lengdeakse.
- Fibrosedannelse? Angis som ja/nei eller ved MR tumor regressjonsgrad, mrTRG. Se vedlegg 3.
TNM klassifikasjon etter neoadjuvant behandling er spesielt vanskelig og har i studier vist lav til moderat treffsikkerhet, og det er usikkert i hvilken grad det er hensiktsmessig å utføre. Det er internasjonalt ikke enighet om man ved TNM klassifikasjon ved responsevaluering kun skal vurdere fortsatt tumorsuspekte områder, eller om man også skal inkludere den oppståtte fibrosen i tumorvolumet. Om man velger den ene eller andre metoden, vil man enten over- eller underklassifisere tumor.
MR tumor regresjonsgrad mrTGR
- mrTRG 1 (bare fibrose, ikke synlig tumor signal)
- mrTRG 2 (>75 % fibrose, lite synlig tumor signal)
- mrTRG 3 (50 % tumor signal og 50 % fibrose)
- mrTRG 4 (<25 % fibrose, tumor signal dominerer)
- mrTRG 5 (ikke synlig fibrose, uendret eller økt tumor signal)
Mengde angivelsene av tumor og fibrose er omtrentlige.
Mucin
I skjemaet er mucin ikke omhandlet, fordi mucin er en a-cellulær masse som ikke nødvendigvis reagerer på neo-adjuvant behandling. Manglende volumreduksjon av mucin betyr derfor ikke at tumor ikke har respondert på behandling. Under neo-adjuvant behandling kan det også tilkomme slimsjøer som antakelig er en del av behandlingseffekt.
MR rektum, primær TNM klassifikasjon av ca rekti
Billedkvalitet (god/ suboptimal,/ ikke diagnostisk)
Tumors lokalisasjon
Avstand tumor – m Puborektalis
Tumors lengde i anal-oral retning
Sirkumferensiell utbredelse
T- stadium
☐ T1 eller T2
☐ T2/T3a
☐ T3a-d ekstramural tumor dybe
☐ T3/mulig T4, mulig innvekst i
☐ T4a
☐ T4b, innvekst i
Mucin (nei / ja < 50 % / ja > 50 %)
Affeksjon av anus
☐ Innvekst i submucosa
☐ Innvekst i interne sphinkter
☐ Innvekst i intersphinkteriske spalte
☐ Innvekst i eksterne sphinkter
☐ Gjennomvekst av eksterne sphinkter
EMVI (ekstramural vene innvekst) (nei/ ja/usikker)
Lymfeknuter (LK) og tumordeposisjoner
☐ N1 1–3 LK (malignt utseende) Antall
☐ N2 > 3 LK (malignt utseende) Antall
☐ LK utenfor MRF (malignt utseende) Lokalisasjon
☐ usikre LK Lokalisasjon
MRF (Avstand og klokkeslett)
Tumor – MRF
Malign lymfeknute – MRF
EMVI- MRF
«Stranding» (tumor eller fibrose?) – MRF
Fjernmetastaser eller ascites
Tentativt TNM stadium
Fri tekst:
T3 subklassifikasjon
T3a – ekstramural tumor dybde < 1 mm
T3b – ekstramural tumordybde 1–5 mm
T3c – ekstramural tumordybde > 6–15 mm
T3d – ekstramural tumordybde > 15 mm
En T3 tumor vokser gjennom m propria og ut i perirektalt fett. Dette er en heterogen gruppe med svært varierende prognose som ikke gjenspeiles i TNM systemet. Det er derfor utviklet en T3 subklassifikasjon. T3a vil ha nærmest samme prognose som en T2 tumor mens T3c-d vil ha en lavere 5 års overlevelse.
MR rektum, responsevaluering ca rekti
Tidligere MR:
Radiokjemoterapi:
Billedkvalitet:
Tumors lokalisasjon
Avstand tumor/fibrose – m Puborektalis
Sirkumferensiell utbredelse tumor/fibrose
Tumor størrelse
Tumor/fibrose lengde i anal-oral retning
Volumreduksjon av tumor (ingen/liten/stor)
T-stadium
Uendret T stadium (ja/nei)
Åpenbart endret T-stadium (fra T … – til T …)
Ikke lenger affeksjon av
Affeksjon av anus (tumor/fibrose)
☐ Uendret sphincter affeksjon
☐ Endret sphincter affeksjon, ikke lenger affeksjon av
Lymfeknuter (LK) og tumordeposisjoner
☐ Uendret N- stadium
☐ Ikke lenger malignt utseende LK
☐ Fortsatt malignt utseende LK lokalisasjon
☐ Usikre LK lokalisasjon
MRF (avstand og klokkeslett)
Tumor/fibrose – MRF
Malign lymfeknute/fibrose – MRF
«Stranding» – MRF
MR tumor regressjons grad mrTRG
☐ mrTRG 1 (bare fibrose, ikke synlig tumor signal)
☐ mrTRG 2 (>75 % fibrose, lite synlig tumor signal)
☐ mrTRG 3 (50 % tumor signal og 50 % fibrose)
☐ mrTRG 4 (<25 % fibrose, tumor signal dominerer)
☐ mrTRG 5 (ikke fibrose, uendret eller økt tumor signal)
DWI: Tumor suspekt signal (høyt signal ved høy b-verdi)(Uendret/mindre/ikke til stede)
Fjernmetastaser eller ascites
Resyme:
Behandlingsrepons (ja/nei)
Endret relasjon til MRF (ja/nei)
Fri tekst:
Vedlegg til kapittel 13 – Resektable ekstrahepatiske metastaser fra tykk- og endetarmskreft
Sist faglig oppdatert: 20.05.2022
Peritoneal karsinomatose indeks (PCI)
Peritoneal karsinomatose kan variere fra nærmest mikroskopisk til store mengder mucinøst, interperitonealt tumorvev. Etter Sugarbaker (Sugarbaker, 2010) inndeles buken i 9 regioner og tynntarmen opp i 4. I hvert av de 13 områdene anføres lesjonsstørrelser i en tallskala fra 0 til 3. Det regnes ut en Peritoneal Carcinomatosis Index (PCI) som er summen av lesjonsstørrelsene fra alle områder (0–39).
Cytoreduksjon etter kirurgi
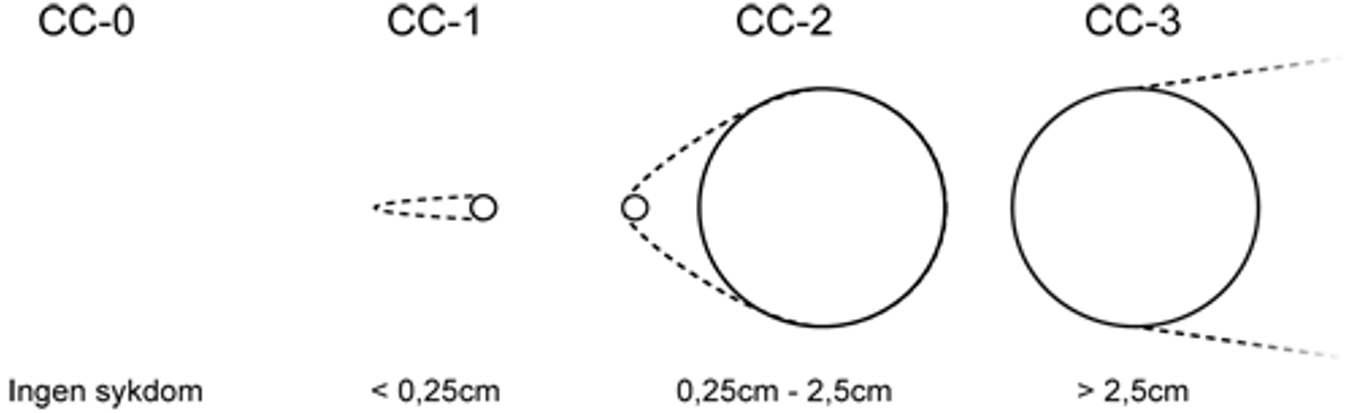
Vedlegg til kapittel 14 Behandling av ikke-kurable metastaser
Sist faglig oppdatert: 20.05.2022
Kjemoterapiregimer
| Kurnavn | 5 FU | Kalsiumfolinat | Oksaliplatin | Irinotecan | Syklus |
|---|---|---|---|---|---|
| Nordisk Flv (Glimelius et al., 1998; 1992) | 500 mg/m2 | 100 mg eller 60 mg/m2 |
|
| 2 uker |
| FLOX (Sorbye et al., 2004) | Som over | Som over | 85 mg/m2 |
| 2 uker |
| FLIRI (Glimelius et al., 2002; Glimelius et al., 2008) | Som over | Som over |
| 180 mg/m2 | 2 uker |
| mFOLFOX64 (Andre et al., 2007; Cassidy et al., 2008; de Gramont et al., 2000; Tournigand et al., 2004) | 400 mg/m2 bolus + 600 mg/m2 over 22 timer dag 1–2 | 200 mg/m2 | 85 mg/m2 |
| 2 uker |
| FOLFIRI (Douillard et al., 2000) | 400 mg/m2 + 2400 mg/m2 dag 1 på 46 timer | 400 mg/m2 |
| 180 mg/m2 | 2 uker |
| CAPOX (Cassidy et al., 2008) | Kapecitabin 1000 mg/m2 x2 |
| 130 mg/m2 |
| 3 uker |
| Irinotecan – mono (Sorbye et al., 2007) |
|
|
| 350 mg/m2 | 3 uker |
| Irinotecan – mono |
|
|
| 180 mg/m2 | 2 uker |
Kapecitabin monoterapi: 1000–1250 mg/m2 x2 dag 1–14, deretter 7 dagers opphold.
Bevacizumab: 5 mg/kg dag 1 hver 2. uke eller 7,5 mg dag 1 hver 3. uke.
Cetuximab: Initialdose 400 mg/m2. Påfølgende ukentlige dose 250 mg/m2.
Panitumumab: 6 mg/kg dag 1 hver 14 dag
Regorafenib: 160 mg i 3 uker, deretter 1 uke opphold.
Trifluridin: 35 mg/m2 to ganger daglig dag 1–5 og dag 8–12 hver 28. dag.
Pembrolizumab: 200 mg iv hver 3. uke
Nivolumab: 240 mg hver 2. uke 6 ganger, deretter 480 mg hver 4. uke
Vedlegg til kapittel 17 – Patologi
Sist faglig oppdatert: 20.05.2022
pTNM-klassifikasjon 8. utgave (Sobin et al., 2016)
TX | Tumor, ingen informasjon | |
T0 | Tumor ikke påvist | |
Tis | Carcinoma in situ: invasjon i lamina propria | |
T1 | Tumor vokser inn i submucosa | |
T2 | Tumor vokser inn i muscularis propria | |
T3 | Tumor vokser inn subserosa eller ikke-peritonealisert pericolisk/perirektalt vev | |
T4 | Tumor invaderer direkte inn i andre organer eller strukturer, og /eller perforerer viscerale peritoneum | |
T4a | Tumor perforerer viscerale peritoneum (involverere overflaten) | |
T4b | Tumor invaderer andre organer eller strukturer |
NX | Ingen informasjon | |
N0 | Metastaser ikke påvist | |
N1 | Metastase til 1–3 regionale lymfeknuter | |
N1a | Metastase til 1 regional lymfeknute | |
N1b | Metastaser til 2–3 regionale lymfeknuter | |
N1c | Tumorknute(r) (satelitt(er) i subserosa eller i ikke-peritonealisert pericolisk bløtvev uten regionale lymfeknutemetastaser | |
N2 | Metastaser til 4 eller flere regionale lymfeknuter | |
N2a | Metastaser til 4–6 regionale lymfeknuter | |
N2b | Metastaser til ≥7 regionale lymfeknuter |
Isolerte tumorknuter i mesokolon uten sikker lymfeknuteopprinnelse (ujevne eller infiltrative ytre begrensninger) kan representere diskontinuerlig spredning, venøs invasjon med ekstravaskulær spredning (V1/2) eller en totalt reorganisert lymfeknute (N1/2). Ved fravær at lymfeknutemetastaser klassifiseres disse som N1c. Ved funn av isolerte tumorceller (enkeltceller eller små grupper av celler lik eller under 0,2 m skal disse klassifiseres som N0i i henhold til 8. utgaven av TNM-klassifikasjonen. De som er fra 0,2 – 2 skal angis som N1a(mi).
M0 | Ingen fjernmetastaser | |
M1 | Fjernmetastaser | |
M1a | Metastaser til kun ett organ (lever, lunge, ovarie, ikke-regionale lymfeknuter uten peritoneale metastaser | |
M1b | Metastaser til mer enn ett organ | |
M1c | Metastase til peritoneum med eller uten andre organer involvert |
Stadieinndeling
Stadium 0 | Tis | N0 | M0 |
Stadium I | T1, T2 | N0 | M0 |
Stadium II | T3, T4 | N0 | M0 |
Stadium IIA | T3 | N0 | M0 |
Stadium IIB | T4a | N0 | M0 |
Stadium IIC | T4b | N0 | M0 |
Stadium III | Uansett T | N1, N2 | M0 |
Stadium IIIA | T1, T2 | N1 | M0 |
T1 | N2a | M0 | |
Stadium IIIB | T1, T2 | N2b | M0 |
T2, T3 | N2a | M0 | |
T3, T4a | N1 | M0 | |
Stadium IIIC | T3, T4a | N2b | M0 |
T4a | N2a | M0 | |
T4b | N1, N2 | M0 | |
Stadium IV | T uansett | N uansett | M1 |
Stadium IVA | T uansett | N uansett | M1a |
Stadium IVB | T uansett | N uansett | M1b |
Stadium IVC | T uansett | N uansett | M1c |
Mal tykktarmskreft
Veiledning diagnosetekst
Preparatets art og hoveddiagnose med histologisk type, for eksempel:
Tykktarmsresektat med ulcererende og strikturerende tumor.
Lavgradig adenokarsinom i colon.
Funn | Veiledning |
|---|---|
Preparat | Høyresidig hemikolektomi, reseksjon av colon transversum etc. |
Preparatlengde | Angi i cm |
Tumors største diameter: | Angi i mm |
Tumors lokalisasjon: | Sigmoideum, venstre fleksur etc. |
Tumors histologiske type | Adenokarsinom, mucinøst adenokarsinom etc. |
Histologisk grad: | Lavgradig/høygradig |
Dypeste infiltrasjon: | I submucosa, muscularis propria, perikolisk fett,serosagjennombrudd, i tilstøtende strukturer |
Minste avstand fra tumor til sirkumferente reseksjonsflate: | Angi i mm |
Endereseksjonsrender: | Frie/ikke frie (angis ofte i mm) |
Antall lymfeknuter undersøkt: | Antall |
Antall lymfeknuter med tumorvev: | Antall + antall med ekstrakapsulær vekst (ikke kjernevariabel) |
Tumor budding | Bd1-Bd3 |
Tumorinfiltrasjon i ekstramurale vener: | Påvist/ikke påvist |
Perinevral tumorinfiltrasjon | Påvist/ikke påvist |
pTNM-klassifikasjon: | Se tabell for stadieinndeling over |
Annen patologi: | Adenomer, divertikler etc. |
Mal endetarmskreft
Veiledning diagnosetekst
Preparatets art og hoveddiagnose med histologisk type, for eksempel:
Rektosigmoidalt resektat med ulcerovegeterende tumor.
Lavgradig adenokarsinom i rektum.
Funn | Veiledning |
|---|---|
Preparatlengde | Angi i cm |
Tumors største diameter: | mm |
Tumors lokalisasjon: | Distalt for/proksimalt for/på begge sider av peritoneums omslagsfold |
Histologisk grad: | Lavgradig/høygradig |
Dypeste infiltrasjon: | I submucosa, muscularis propria, perirektalt fett, til serosaoverflaten, i tilstøtende strukturer. |
Minste avstand fra tumor til sirkumferente reseksjonsflate: | Angi i mm |
Mesorektum: | Dette gjøres makroskopisk (komplett, nesten komplett og inkomplett). Se vedlegg 7 |
Endereseksjonsrender: | Frie/ikke frie (angis ofte i mm) |
Antall lymfeknuter undersøkt: | Antall |
Antall lymfeknuter med tumorvev: | Antall + antall med ekstrakapsulær vekst (ikke kjernevariabel) |
Tumor budding | Bd1-Bd3 |
Tumorinfiltrasjon i ekstramurale vener: | Påvist/ikke påvist |
Perinevral tumorinfiltrasjon | Påvist/ikke påvist |
pTNM-klassifikasjon: | Se tabell for stadieinndeling over |
Annen patologi: | Adenomer etc. |
Mal for polypper med infiltrerende karsinom
Malen er et forslag fra representanter for gastrogruppen i Den Norske Patologiforeningen. Se også Tarmscreeningens kvalitetsmanual (Kreftregisteret, 2023).
Veiledning diagnose
Preparatets art og hoveddiagnose med histologisk type, for eksempel:
Tubulovilløst (tubulært/villøst) stilket/flatt adenom med høygradig dysplasi med adenokarsinom i stilken.
Andre funn | Veiledning |
|---|---|
Tumors lokalisasjon: | sigmoideum, venstre fleksur etc |
Differensieringsgrad | Høygradig, lavgradig eller «kan ikke vurderes» |
Karsinomets største diameter | Måles i millimeter. Hvis ikke mulig å måle skal det rapporteres «kan ikke vurderes». |
Infiltrasjonsdybde | pT-klassifikasjon. Kan rapportere «kan ikke vurderes». |
Haggitt-klassifikasjon | Polypphodet må være fremstilt tilstrekkelig. Kan rapportere «kan ikke vurderes». |
Sm-klassifikasjon | Hele submucosa representert for å angi denne. Kan rapportere «kan ikke vurderes». |
Lymfekarinnvekst | Ikke påvist/påvist/kan ikke vurderes |
Venekarinnvekst | Ikke påvist/påvist intramural/kan ikke vurderes |
Dybde submukosal infiltrasjon | Måles i dybde fra muscularis mucosae, angis i millimeter med en desimal, evt i µm. Hvis ikke mulig å måle skal det rapporteres «kan ikke vurderes». |
Avstand reseksjonsrand | Gjelder lesjoner med malignitet. Angis i mm og måles på snitt. Hvis ikke mulig å måle skal det rapporteres «kan ikke vurderes».
For lesjoner som er komplett eller usikker komplett fjernet med biopsitang, eller fjernet med slyngereseksjon måles:
For lesjoner som er fjernet endoskopisk med submukosal disseksjon måles:
|
Antall tumor «buds» | Antall av "tumor buds" i et hotspot areal, 20x forstørrelse (0,785 mm2). |
Graden av tumor «budding» | Lav (0-4 buds), intermediær (5-9 buds) eller høy grad (mer enn 10 buds) av «budding». Kan rapportere «kan ikke vurderes». |
pTNM-klassifikasjon: | pT1 |
Referanser
Sist faglig oppdatert: 20.05.2022
Abdallah, F. W., Chan, V. W., & Brull, R. (2012). Transversus abdominis plane block: a systematic review. Reg Anesth Pain Med, 37(2), 193-209.
Adam, R. (2007). Colorectal cancer with synchronous liver metastases. Br J Surg, 94(2), 129-131. https://doi.org/10.1002/bjs.5764
Adam, R., Delvart, V., Pascal, G., Valeanu, A., Castaing, D., Azoulay, D., . . . Bismuth, H. (2004). Rescue surgery for unresectable colorectal liver metastases downstaged by chemotherapy: a model to predict long-term survival. Ann Surg, 240(4), 644-657; discussion 657-648. https://doi.org/10.1097/01.sla.0000141198.92114.f6
Aghayan, D. L., Kazaryan, A. M., Dagenborg, V. J., Røsok, B. I., Fagerland, M. W., Waaler Bjørnelv, G. M., . . . Edwin, B. (2021). Long-Term Oncologic Outcomes After Laparoscopic Versus Open Resection for Colorectal Liver Metastases : A Randomized Trial. Ann Intern Med, 174(2), 175-182. https://doi.org/10.7326/m20-4011
Ahlquist, D. A., Wieand, H. S., Moertel, C. G., Mcgill, D. B., Loprinzi, C. L., Oconnell, M. J., . . . Ellefson, R. D. (1993). Accuracy of Fecal Occult Blood Screening for Colorectal Neoplasia - a Prospective-Study Using Hemoccult and Hemoquant Tests. Jama-Journal of the American Medical Association, 269(10), 1262-1267. Accuracy of fecal occult blood screening for colorectal neoplasia. A prospective study using Hemoccult and HemoQuant tests - PubMed (nih.gov)
Akasu, T., Kondo, H., Moriya, Y., Sugihara, K., Gotoda, T., Fujita, S., . . . Kakizoe, T. (2000). Endorectal ultrasonography and treatment of early stage rectal cancer. World J Surg, 24(9), 1061-1068. https://doi.org/10.1007/s002680010151
Al-Sukhni, E., Milot, L., Fruitman, M., Beyene, J., Victor, J. C., Schmocker, S., . . . Kennedy, E. (2012). Diagnostic accuracy of MRI for assessment of T category, lymph node metastases, and circumferential resection margin involvement in patients with rectal cancer: a systematic review and meta-analysis. Ann Surg Oncol, 19(7), 2212-2223. https://doi.org/10.1245/s10434-011-2210-5
Al-Tassan, N., Chmiel, N. H., Maynard, J., Fleming, N., Livingston, A. L., Williams, G. T., . . . Cheadle, J. P. (2002). Inherited variants of MYH associated with somatic G:C-->T:A mutations in colorectal tumors. Nat Genet, 30(2), 227-232. https://doi.org/10.1038/ng828
Al Sahaf, O., Myers, E., Jawad, M., Browne, T. J., Winter, D. C., & Redmond, H. P. (2011). The prognostic significance of extramural deposits and extracapsular lymph node invasion in colon cancer. Dis Colon Rectum, 54(8), 982-988. https://doi.org/10.1097/DCR.0b013e31821c4944
Amado, R. G., Wolf, M., Peeters, M., Van Cutsem, E., Siena, S., Freeman, D. J., . . . Chang, D. D. (2008). Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. Journal of Clinical Oncology, 26(10), 1626-1634. https://doi.org/10.1200/Jco.2007.14.7116
Amstutz, U., Henricks, L. M., Offer, S. M., Barbarino, J., Schellens, J. H. M., Swen, J. J., . . . Schwab, M. (2018). Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for Dihydropyrimidine Dehydrogenase Genotype and Fluoropyrimidine Dosing: 2017 Update. Clin Pharmacol Ther, 103(2), 210-216. https://doi.org/10.1002/cpt.911
Anderin, C., Granath, F., Martling, A., & Holm, T. (2013). Local recurrence after prone vs supine abdominoperineal excision for low rectal cancer. Colorectal Dis, 15(7), 812-815. https://doi.org/10.1111/codi.12148
Andersen, H. K., Lewis, S. J., & Thomas, S. (2006). Early enteral nutrition within 24h of colorectal surgery versus later commencement of feeding for postoperative complications. Cochrane Database of Systematic Reviews, (4), CD004080.
Early enteral nutrition within 24h of colorectal surgery versus later commencement of feeding for postoperative complications - PubMed (nih.gov)
Andersen, J., Christensen, H., Pachler, J. H., Hallin, M., Thaysen, H. V., & Kehlet, H. (2012). Effect of the laxative magnesium oxide on gastrointestinal functional recovery in fast-track colonic resection: a double-blind, placebo-controlled randomized study. Colorectal Dis, 14(6), 776-782. https://doi.org/10.1111/j.1463-1318.2011.02796.x
Andersen, J., Hjort-Jakobsen, D., Christiansen, P. S., & Kehlet, H. (2007). Readmission rates after a planned hospital stay of 2 versus 3 days in fast-track colonic surgery. Br J Surg, 94(7), 890-893. https://doi.org/10.1002/bjs.5669
Andre, T., Boni, C., Mounedji-Boudiaf, L., Navarro, M., Tabernero, J., Hickish, T., . . . Investigators, M. (2004). Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer. New England Journal of Medicine, 350(23), 2343-2351. https://doi.org/10.1056/NEJMoa032709
André, T., de Gramont, A., Vernerey, D., Chibaudel, B., Bonnetain, F., Tijeras-Raballand, A., . . . de Gramont, A. (2015). Adjuvant Fluorouracil, Leucovorin, and Oxaliplatin in Stage II to III Colon Cancer: Updated 10-Year Survival and Outcomes According to BRAF Mutation and Mismatch Repair Status of the MOSAIC Study. J Clin Oncol, 33(35), 4176-4187. https://doi.org/10.1200/jco.2015.63.4238
André, T., Shiu, K. K., Kim, T. W., Jensen, B. V., Jensen, L. H., Punt, C., . . . Diaz, L. A., Jr. (2020). Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med, 383(23), 2207-2218. https://doi.org/10.1056/NEJMoa2017699
Andre, T., Tournigand, C., Mineur, L., Fellague-Chebra, R., Flesch, M., Mabro, M., . . . de Gramont, A. (2007). Phase II study of an optimized 5-fluorouracil-oxaliplatin strategy (OPTIMOX2) with celecoxib in metastatic colorectal cancer: a GERCOR study. Ann Oncol, 18(1), 77-81. https://doi.org/10.1093/annonc/mdl336
Angelsen, J. H., Horn, A., Sorbye, H., Eide, G. E., Løes, I. M., & Viste, A. (2017). Population-based study on resection rates and survival in patients with colorectal liver metastasis in Norway. Br J Surg, 104(5), 580-589. https://doi.org/10.1002/bjs.10457
Araghi, M., Soerjomataram, I., Bardot, A., Ferlay, J., Cabasag, C. J., Morrison, D. S., . . . Arnold, M. (2019). Changes in colorectal cancer incidence in seven high-income countries: a population-based study. Lancet Gastroenterol Hepatol, 4(7), 511-518. https://doi.org/10.1016/s2468-1253(19)30147-5
Aretz, S., Uhlhaas, S., Caspari, R., Mangold, E., Pagenstecher, C., Propping, P., & Friedl, W. (2004). Frequency and parental origin of de novo APC mutations in familial adenomatous polyposis. Eur J Hum Genet, 12(1), 52-58. https://doi.org/10.1038/sj.ejhg.5201088
Atkin, W., Brenner, A., Martin, J., Wooldrage, K., Shah, U., Lucas, F., . . . Duffy, S. W. (2017). The clinical effectiveness of different surveillance strategies to prevent colorectal cancer in people with intermediate-grade colorectal adenomas: a retrospective cohort analysis, and psychological and economic evaluations. Health Technol Assess, 21(25), 1-536. https://doi.org/10.3310/hta21250
Atkin, W., Dadswell, E., Wooldrage, K., Kralj-Hans, I., von Wagner, C., Edwards, R., . . . Halligan, S. (2013). Computed tomographic colonography versus colonoscopy for investigation of patients with symptoms suggestive of colorectal cancer (SIGGAR): a multicentre randomised trial. Lancet, 381(9873), 1194-1202. https://doi.org/10.1016/s0140-6736(12)62186-2
Atkin, W., Wooldrage, K., Brenner, A., Martin, J., Shah, U., Perera, S., . . . Cross, A. J. (2017). Adenoma surveillance and colorectal cancer incidence: a retrospective, multicentre, cohort study. Lancet Oncol, 18(6), 823-834. https://doi.org/10.1016/s1470-2045(17)30187-0
Audisio, R. A., & Papamichael, D. (2012). Treatment of colorectal cancer in older patients. Nature reviews. Gastroenterology & hepatology, 9(12), 716-725. https://doi.org/10.1038/nrgastro.2012.196
Avital, I., & DeMatteo, R. (2006). Combined resection of liver and lung metastases for colorectal cancer. Thorac Surg Clin, 16(2), 145-155, vi. https://doi.org/10.1016/j.thorsurg.2005.12.002
Aziz, O., Athanasiou, T., Fazio, V. W., Nicholls, R. J., Darzi, A. W., Church, J., . . . Tekkis, P. P. (2006). Meta-analysis of observational studies of ileorectal versus ileal pouch-anal anastomosis for familial adenomatous polyposis. Br J Surg, 93(4), 407-417. https://doi.org/10.1002/bjs.5276
Baglietto, L., Jenkins, M. A., Severi, G., Giles, G. G., Bishop, D. T., Boyle, P., & Hopper, J. L. (2006). Measures of familial aggregation depend on definition of family history: meta-analysis for colorectal cancer. Journal of clinical epidemiology, 59(2), 114-124. https://doi.org/10.1016/j.jclinepi.2005.07.018
Bahadoer, R. R., Dijkstra, E. A., van Etten, B., Marijnen, C. A. M., Putter, H., Kranenbarg, E. M., . . . Hospers, G. A. P. (2021). Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol, 22(1), 29-42. https://doi.org/10.1016/s1470-2045(20)30555-6
Balaguer, F., Castellvi-Bel, S., Castells, A., Andreu, M., Munoz, J., Gisbert, J. P., . . . Gastrointestinal Oncology Group of the Spanish Gastroenterological, A. (2007). Identification of MYH mutation carriers in colorectal cancer: a multicenter, case-control, population-based study. Clin Gastroenterol Hepatol, 5(3), 379-387. https://doi.org/10.1016/j.cgh.2006.12.025
Barlow, A. D., Nakas, A., Pattenden, C., Martin-Ucar, A. E., Dennison, A. R., Berry, D. P., . . . Waller, D. A. (2009). Surgical treatment of combined hepatic and pulmonary colorectal cancer metastases. Eur J Surg Oncol, 35(3), 307-312. https://doi.org/10.1016/j.ejso.2008.06.012
Basse, L., Hjort Jakobsen, D., Billesbolle, P., Werner, M., & Kehlet, H. (2000). A clinical pathway to accelerate recovery after colonic resection. Ann Surg, 232(1), 51-57. https://doi.org/10.1097/00000658-200007000-00008
Basse, L., Madsen, J. L., Billesbølle, P., Bardram, L., & Kehlet, H. (2003). Gastrointestinal transit after laparoscopic versus open colonic resection. Surg Endosc, 17(12), 1919-1922. https://doi.org/10.1007/s00464-003-9013-0
Basse, L., Madsen, J. L., & Kehlet, H. (2001). Normal gastrointestinal transit after colonic resection using epidural analgesia, enforced oral nutrition and laxative. British Journal of Surgery, 88(11), 1498-1500. https://doi.org/10.1046/j.0007-1323.2001.01916.x
Bateman, A. C., Jaynes, E., & Bateman, A. R. (2009). Rectal cancer staging post neoadjuvant therapy--how should the changes be assessed? Histopathology, 54(6), 713-721.
Beattie, A. H., Prach, A. T., Baxter, J. P., & Pennington, C. R. (2000). A randomised controlled trial evaluating the use of enteral nutritional supplements postoperatively in malnourished surgical patients. Gut, 46(6), 813-818. https://doi.org/10.1136/gut.46.6.813
Beaugerie, L., Svrcek, M., Seksik, P., Bouvier, A. M., Simon, T., Allez, M., . . . Carrat, F. (2013). Risk of colorectal high-grade dysplasia and cancer in a prospective observational cohort of patients with inflammatory bowel disease. Gastroenterology, 145(1), 166-175.e168. https://doi.org/10.1053/j.gastro.2013.03.044
Beets-Tan, R. G., Beets, G. L., Vliegen, R. F., Kessels, A. G., Van Boven, H., De Bruine, A., . . . van Engelshoven, J. M. (2001). Accuracy of magnetic resonance imaging in prediction of tumour-free resection margin in rectal cancer surgery. Lancet, 357(9255), 497-504. https://doi.org/10.1016/s0140-6736(00)04040-x
Beets-Tan, R. G. H., Lambregts, D. M. J., Maas, M., Bipat, S., Barbaro, B., Curvo-Semedo, L., . . . Blomqvist, L. (2018). Magnetic resonance imaging for clinical management of rectal cancer: Updated recommendations from the 2016 European Society of Gastrointestinal and Abdominal Radiology (ESGAR) consensus meeting. Eur Radiol, 28(4), 1465-1475. https://doi.org/10.1007/s00330-017-5026-2
Beggs, A. D., Latchford, A. R., Vasen, H. F., Moslein, G., Alonso, A., Aretz, S., . . . Hodgson, S. V. (2010). Peutz-Jeghers syndrome: a systematic review and recommendations for management. Gut, 59(7), 975-986. https://doi.org/10.1136/gut.2009.198499
Belderbos, T. D., Leenders, M., Moons, L. M., & Siersema, P. D. (2014). Local recurrence after endoscopic mucosal resection of nonpedunculated colorectal lesions: systematic review and meta-analysis. Endoscopy, 46(5), 388-402. https://doi.org/10.1055/s-0034-1364970
Benitez Majano, S., Di Girolamo, C., Rachet, B., Maringe, C., Guren, M. G., Glimelius, B., . . . Walters, S. (2019). Surgical treatment and survival from colorectal cancer in Denmark, England, Norway, and Sweden: a population-based study. Lancet Oncol, 20(1), 74-87. https://doi.org/10.1016/s1470-2045(18)30646-6
Bentzen, S. M., Balslev, I., Pedersen, M., Teglbjaerg, P. S., Hanberg-Sorensen, F., Bone, J., . . . et al. (1992). Time to loco-regional recurrence after resection of Dukes' B and C colorectal cancer with or without adjuvant postoperative radiotherapy. A multivariate regression analysis. Br J Cancer, 65(1), 102-107. https://doi.org/10.1038/bjc.1992.19
Berger, A. C., Sigurdson, E. R., LeVoyer, T., Hanlon, A., Mayer, R. J., Macdonald, J. S., . . . Haller, D. G. (2005). Colon cancer survival is associated with decreasing ratio of metastatic to examined lymph nodes. J Clin Oncol, 23(34), 8706-8712.
Berglund, A., Cedermark, B., & Glimelius, B. (2008). Is it deleterious to delay the start of adjuvant chemotherapy in colon cancer stage III? Ann Oncol, 19(2), 400-402. https://doi.org/10.1093/annonc/mdm582
Bergqvist, D., Agnelli, G., Cohen, A. T., Eldor, A., Nilsson, P. E., Le Moigne-Amrani, A., . . . Investigators, E. I. (2002). Duration of prophylaxis against venous thromboembolism with enoxaparin after surgery for cancer. N Engl J Med, 346(13), 975-980. https://doi.org/10.1056/NEJMoa012385
Bergqvist, D., Lindblad, B., & Matzsch, T. (1993). Risk of combining low molecular weight heparin for thromboprophylaxis and epidural or spinal anesthesia. Semin Thromb Hemost, 19 Suppl 1(Suppl 1), 147-151.
Bernstein, C. N., Blanchard, J. F., Kliewer, E., & Wajda, A. (2001). Cancer risk in patients with inflammatory bowel disease: a population-based study. Cancer, 91(4), 854-862.
Cancer risk in patients with inflammatory bowel disease: a population-based study - PubMed (nih.gov)
Bernstein, T. E., Endreseth, B. H., Romundstad, P., & Wibe, A. (2012). Improved local control of rectal cancer reduces distant metastases. Colorectal Dis, 14(10), e668-678. https://doi.org/10.1111/j.1463-1318.2012.03089.x
Bernstein, T. E., Endreseth, B. H., Romundstad, P., Wibe, A., & Grp, N. C. C. (2009). Circumferential resection margin as a prognostic factor in rectal cancer. British Journal of Surgery, 96(11), 1348-1357. https://doi.org/10.1002/bjs.6739
Bertagnolli, M. M., Niedzwiecki, D., Compton, C. C., Hahn, H. P., Hall, M., Damas, B., . . . Redston, M. (2009). Microsatellite instability predicts improved response to adjuvant therapy with irinotecan, fluorouracil, and leucovorin in stage III colon cancer: Cancer and Leukemia Group B Protocol 89803. J Clin Oncol, 27(11), 1814-1821. https://doi.org/10.1200/JCO.2008.18.2071
Betge, J., Pollheimer, M. J., Lindtner, R. A., Kornprat, P., Schlemmer, A., Rehak, P., . . . Langner, C. (2012). Intramural and extramural vascular invasion in colorectal cancer: prognostic significance and quality of pathology reporting. Cancer, 118(3), 628-638. https://doi.org/10.1002/cncr.26310
Biagi, J. J., Raphael, M. J., Mackillop, W. J., Kong, W. D., King, W. D., & Booth, C. M. (2011). Association Between Time to Initiation of Adjuvant Chemotherapy and Survival in Colorectal Cancer A Systematic Review and Meta-analysis. Jama-Journal of the American Medical Association, 305(22), 2335-2342. https://doi.org/10.1001/jama.2011.749
Bipat, S., Glas, A. S., Slors, F. J., Zwinderman, A. H., Bossuyt, P. M., & Stoker, J. (2004). Rectal cancer: local staging and assessment of lymph node involvement with endoluminal US, CT, and MR imaging--a meta-analysis. Radiology, 232(3), 773-783. https://doi.org/10.1148/radiol.2323031368
Birgisson, H., Pahlman, L., Gunnarsson, U., & Glimelius, B. (2007). Late adverse effects of radiation therapy for rectal cancer - a systematic overview. Acta Oncol, 46(4), 504-516. https://doi.org/10.1080/02841860701348670
Bjerkeset, T., Morild, I., Mork, S., & Soreide, O. (1987). Tumor Characteristics in Colorectal-Cancer and Their Relationship to Treatment and Prognosis. Diseases of the Colon & Rectum, 30(12), 934-938. https://doi.org/10.1007/Bf02554279
Bjerregaard, N. C., Tottrup, A., Sorensen, H. T., & Laurberg, S. (2007). Diagnostic value of self-reported symptoms in Danish outpatients referred with symptoms consistent with colorectal cancer. Colorectal Dis, 9(5), 443-451. https://doi.org/10.1111/j.1463-1318.2006.01170.x
Bjugn, R., & Dirdal, H. U. (2001). Kolorektalcancer--erfaringer med bruk av maler for rapportering av patologisk-anatomiske data. Tidsskr Nor Lægeforen, 121(14), 1697-1701.
Blackmon, S. H., Stephens, E. H., Correa, A. M., Hofstetter, W., Kim, M. P., Mehran, R. J., . . . Vaporciyan, A. A. (2012). Predictors of recurrent pulmonary metastases and survival after pulmonary metastasectomy for colorectal cancer. Ann Thorac Surg, 94(6), 1802-1809. https://doi.org/10.1016/j.athoracsur.2012.07.014
Bleijenberg, A. G., JE, I. J., van Herwaarden, Y. J., Carballal, S., Pellisé, M., Jung, G., . . . Dekker, E. (2020). Personalised surveillance for serrated polyposis syndrome: results from a prospective 5-year international cohort study. Gut, 69(1), 112-121. https://doi.org/10.1136/gutjnl-2018-318134
Block, B. M., Liu, S. S., Rowlingson, A. J., Cowan, A. R., Cowan, J. A., Jr., & Wu, C. L. (2003). Efficacy of postoperative epidural analgesia: a meta-analysis. JAMA, 290(18), 2455-2463. https://doi.org/10.1001/jama.290.18.2455
Bloom, S., & Webster, G. D. (2006). Oxford handbook of gastroenterology and hepatology. Oxford: Oxford University Press.
Bokemeyer, C., Bondarenko, I., Hartmann, J. T., de Braud, F., Schuch, G., Zubel, A., . . . Koralewski, P. (2011). Efficacy according to biomarker status of cetuximab plus FOLFOX-4 as first-line treatment for metastatic colorectal cancer: the OPUS study. Annals of Oncology, 22(7), 1535-1546. https://doi.org/10.1093/annonc/mdq632
Bonadona, V., Bonaïti, B., Olschwang, S., Grandjouan, S., Huiart, L., Longy, M., . . . Bonaiti-Pellie, C. (2011). Cancer risks associated with germline mutations in MLH1, MSH2, and MSH6 genes in Lynch syndrome. JAMA, 305(22), 2304-2310. https://doi.org/10.1001/jama.2011.743
Bonanni, L., De'liguori Carino, N., Deshpande, R., Ammori, B. J., Sherlock, D. J., Valle, J. W., . . . O'Reilly, D. A. (2014). A comparison of diagnostic imaging modalities for colorectal liver metastases. Eur J Surg Oncol, 40(5), 545-550. https://doi.org/10.1016/j.ejso.2013.12.023
Bonjer, H. J., Deijen, C. L., Abis, G. A., Cuesta, M. A., van der Pas, M. H., de Lange-de Klerk, E. S., . . . Group, C. I. S. (2015). A randomized trial of laparoscopic versus open surgery for rectal cancer. N Engl J Med, 372(14), 1324-1332. https://doi.org/10.1056/NEJMoa1414882
Boparai, K. S., Mathus-Vliegen, E. M., Koornstra, J. J., Nagengast, F. M., van Leerdam, M., van Noesel, C. J., . . . Dekker, E. (2010). Increased colorectal cancer risk during follow-up in patients with hyperplastic polyposis syndrome: a multicentre cohort study. Gut, 59(8), 1094-1100. https://doi.org/10.1136/gut.2009.185884
Borgelt, B. B., Gelber, R., Brady, L. W., Griffin, T., & Hendrickson, F. R. (1981). The palliation of hepatic metastases: results of the Radiation Therapy Oncology Group pilot study. Int J Radiat Oncol Biol Phys, 7(5), 587-591. https://doi.org/10.1016/0360-3016(81)90370-9
Borschitz, T., Heintz, A., & Junginger, T. (2006). The influence of histopathologic criteria on the long-term prognosis of locally excised pT1 rectal carcinomas: results of local excision (transanal endoscopic microsurgery) and immediate reoperation. Dis Colon Rectum, 49(10), 1492-1506; discussion 1500-1495. https://doi.org/10.1007/s10350-006-0587-1
Borstlap, W. A. A., Westerduin, E., Aukema, T. S., Bemelman, W. A., & Tanis, P. J. (2017). Anastomotic Leakage and Chronic Presacral Sinus Formation After Low Anterior Resection: Results From a Large Cross-sectional Study. Ann Surg, 266(5), 870-877. https://doi.org/10.1097/sla.0000000000002429
Bosset, J. F., Calais, G., Mineur, L., Maingon, P., Stojanovic-Rundic, S., Bensadoun, R. J., . . . Collette, L. (2014). Fluorouracil-based adjuvant chemotherapy after preoperative chemoradiotherapy in rectal cancer: long-term results of the EORTC 22921 randomised study. Lancet Oncol, 15(2), 184-190. https://doi.org/10.1016/s1470-2045(13)70599-0
Bostel, T., Förster, R., Schlampp, I., Sprave, T., Bruckner, T., Nicolay, N. H., . . . Rief, H. (2017). Spinal bone metastases in colorectal cancer: a retrospective analysis of stability, prognostic factors and survival after palliative radiotherapy. Radiat Oncol, 12(1), 115. https://doi.org/10.1186/s13014-017-0852-6
Brackmann, S., Andersen, S. N., Aamodt, G., Langmark, F., Clausen, O. P., Aadland, E., . . . Vatn, M. H. (2009). Relationship between clinical parameters and the colitis-colorectal cancer interval in a cohort of patients with colorectal cancer in inflammatory bowel disease. Scand J Gastroenterol, 44(1), 46-55. https://doi.org/10.1080/00365520801977568
Brady, M., Kinn, S., & Stuart, P. (2003). Preoperative fasting for adults to prevent perioperative complications. Cochrane Database Syst Rev, (4), CD004423. https://doi.org/10.1002/14651858.CD004423
Braendengen, M., Tveit, K. M., Berglund, A., Birkemeyer, E., Frykholm, G., Pahlman, L., . . . Glimelius, B. (2008). Randomized phase III study comparing preoperative radiotherapy with chemoradiotherapy in nonresectable rectal cancer. J Clin Oncol, 26(22), 3687-3694. https://doi.org/10.1200/JCO.2007.15.3858
Braendengen, M., Tveit, K. M., Bruheim, K., Cvancarova, M., Berglund, A., & Glimelius, B. (2011). Late patient-reported toxicity after preoperative radiotherapy or chemoradiotherapy in nonresectable rectal cancer: results from a randomized Phase III study. Int J Radiat Oncol Biol Phys, 81(4), 1017-1024. https://doi.org/10.1016/j.ijrobp.2010.07.007
Brandstrup, B., Tonnesen, H., Beier-Holgersen, R., Hjortso, E., Ording, H., Lindorff-Larsen, K., . . . Danish Study Group on Perioperative Fluid, T. (2003). Effects of intravenous fluid restriction on postoperative complications: comparison of two perioperative fluid regimens: a randomized assessor-blinded multicenter trial. Ann Surg, 238(5), 641-648. https://doi.org/10.1097/01.sla.0000094387.50865.23
Bratzler, D. W., Houck, P. M., Surgical Infection Prevention Guidelines Writers, W., American Academy of Orthopaedic, S., American Association of Critical Care, N., American Association of Nurse, A., . . . Surgical Infection, S. (2004). Antimicrobial prophylaxis for surgery: an advisory statement from the National Surgical Infection Prevention Project. Clin Infect Dis, 38(12), 1706-1715. https://doi.org/10.1086/421095
Bregendahl, S., Emmertsen, K. J., Lindegaard, J. C., & Laurberg, S. (2015). Urinary and sexual dysfunction in women after resection with and without preoperative radiotherapy for rectal cancer: a population-based cross-sectional study. Colorectal Dis, 17(1), 26-37. https://doi.org/10.1111/codi.12758
Bregendahl, S., Emmertsen, K. J., Lous, J., & Laurberg, S. (2013). Bowel dysfunction after low anterior resection with and without neoadjuvant therapy for rectal cancer: a population-based cross-sectional study. Colorectal Dis, 15(9), 1130-1139. https://doi.org/10.1111/codi.12244
Breitenstein, S., Rickenbacher, A., Berdajs, D., Puhan, M., Clavien, P. A., & Demartines, N. (2007). Systematic evaluation of surgical strategies for acute malignant left-sided colonic obstruction. Br J Surg, 94(12), 1451-1460. https://doi.org/10.1002/bjs.6007
Bretthauer, M., Kaminski, M. F., Løberg, M., Zauber, A. G., Regula, J., Kuipers, E. J., . . . Adami, H. O. (2016). Population-Based Colonoscopy Screening for Colorectal Cancer: A Randomized Clinical Trial. JAMA Intern Med, 176(7), 894-902. https://doi.org/10.1001/jamainternmed.2016.0960
Breugom, A. J., Swets, M., Bosset, J. F., Collette, L., Sainato, A., Cionini, L., . . . van de Velde, C. J. (2015). Adjuvant chemotherapy after preoperative (chemo)radiotherapy and surgery for patients with rectal cancer: a systematic review and meta-analysis of individual patient data. Lancet Oncol, 16(2), 200-207. https://doi.org/10.1016/s1470-2045(14)71199-4
Brown, C. J., Fenech, D. S., & McLeod, R. S. (2008). Reconstructive techniques after rectal resection for rectal cancer. Cochrane Database Syst Rev, (2), CD006040. https://doi.org/10.1002/14651858.CD006040.pub2
Brown, G., Richards, C. J., Bourne, M. W., Newcombe, R. G., Radcliffe, A. G., Dallimore, N. S., & Williams, G. T. (2003). Morphologic predictors of lymph node status in rectal cancer with use of high-spatial-resolution MR imaging with histopathologic comparison. Radiology, 227(2), 371-377. https://doi.org/10.1148/radiol.2272011747
Brudvik, K. W., Bains, S. J., Seeberg, L. T., Labori, K. J., Waage, A., Taskén, K., . . . Bjornbeth, B. A. (2013). Aggressive treatment of patients with metastatic colorectal cancer increases survival: a scandinavian single-center experience. HPB Surg, 2013, 727095. https://doi.org/10.1155/2013/727095
Bruheim, K., Guren, M. G., Skovlund, E., Hjermstad, M. J., Dahl, O., Frykholm, G., . . . Tveit, K. M. (2010). Late side effects and quality of life after radiotherapy for rectal cancer. Int J Radiat Oncol Biol Phys, 76(4), 1005-1011. https://doi.org/10.1016/j.ijrobp.2009.03.010
Brulé, S. Y., Jonker, D. J., Karapetis, C. S., O'Callaghan, C. J., Moore, M. J., Wong, R., . . . Goodwin, R. A. (2015). Location of colon cancer (right-sided versus left-sided) as a prognostic factor and a predictor of benefit from cetuximab in NCIC CO.17. Eur J Cancer, 51(11), 1405-1414. https://doi.org/10.1016/j.ejca.2015.03.015
Buecher, B., Cacheux, W., Rouleau, E., Dieumegard, B., Mitry, E., & Lievre, A. (2013). Role of microsatellite instability in the management of colorectal cancers. Dig Liver Dis, 45(6), 441-449. https://doi.org/10.1016/j.dld.2012.10.006
Bujko, K., Wyrwicz, L., Rutkowski, A., Malinowska, M., Pietrzak, L., Kryński, J., . . . Wydmanski, J. (2016). Long-course oxaliplatin-based preoperative chemoradiation versus 5 x 5 Gy and consolidation chemotherapy for cT4 or fixed cT3 rectal cancer: results of a randomized phase III study. Ann Oncol, 27(5), 834-842. https://doi.org/10.1093/annonc/mdw062
Bulow, S. (2003). Results of national registration of familial adenomatous polyposis. Gut, 52(5), 742-746. https://doi.org/10.1136/gut.52.5.742
Burling, D., & International Collaboration for, C. T. c. S. (2010). CT colonography standards. Clin Radiol, 65(6), 474-480. https://doi.org/10.1016/j.crad.2009.12.003
Burn, J., Gerdes, A. M., Macrae, F., Mecklin, J. P., Moeslein, G., Olschwang, S., . . . Bishop, D. T. (2011). Long-term effect of aspirin on cancer risk in carriers of hereditary colorectal cancer: an analysis from the CAPP2 randomised controlled trial. Lancet, 378(9809), 2081-2087. https://doi.org/10.1016/s0140-6736(11)61049-0
Burton, S., Brown, G., Daniels, I. R., Norman, A. R., Mason, B., & Cunningham, D. (2006). MRI directed multidisciplinary team preoperative treatment strategy: the way to eliminate positive circumferential margins? Br J Cancer, 94(3), 351-357. https://doi.org/10.1038/sj.bjc.6602947
Böckelman, C., Engelmann, B. E., Kaprio, T., Hansen, T. F., & Glimelius, B. (2015). Risk of recurrence in patients with colon cancer stage II and III: a systematic review and meta-analysis of recent literature. Acta Oncol, 54(1), 5-16. https://doi.org/10.3109/0284186x.2014.975839
Baatrup, G., Endreseth, B. H., Isaksen, V., Kjellmo, A., Tveit, K. M., & Nesbakken, A. (2009). Preoperative staging and treatment options in T1 rectal adenocarcinoma. Acta Oncol, 48(3), 328-342. https://doi.org/10.1080/02841860802657243
Cairns, S. R., Scholefield, J. H., Steele, R. J., Dunlop, M. G., Thomas, H. J., Evans, G. D., . . . Woodhouse, C. R. (2010). Guidelines for colorectal cancer screening and surveillance in moderate and high risk groups (update from 2002). Gut, 59(5), 666-689. https://doi.org/10.1136/gut.2009.179804
Calderwood, A. H., Lasser, K. E., & Roy, H. K. (2016). Colon adenoma features and their impact on risk of future advanced adenomas and colorectal cancer. World journal of gastrointestinal oncology, 8(12), 826-834. https://doi.org/10.4251/wjgo.v8.i12.826
Cameron, M. G., Kersten, C., Vistad, I., Fossa, S., & Guren, M. G. (2014). Palliative pelvic radiotherapy of symptomatic incurable rectal cancer - a systematic review. Acta Oncol, 53(2), 164-173. https://doi.org/10.3109/0284186x.2013.837582
Cameron, M. G., Kersten, C., Vistad, I., van Helvoirt, R., Weyde, K., Undseth, C., . . . Guren, M. G. (2016). Palliative pelvic radiotherapy for symptomatic rectal cancer - a prospective multicenter study. Acta Oncol, 55(12), 1400-1407. https://doi.org/10.1080/0284186x.2016.1191666
Cancer in Norway 2018: cancer incidence, mortality, survival and prevalence in Norway. (2019). Oslo: Cancer Registry of Norway. Hentet fra https://www.kreftregisteret.no/globalassets/cancer-in-norway/2018/cin2018.pdf
Cancer in Norway 2020: cancer incidence, mortality, survival and prevalence in Norway. (2021). Oslo: Cancer Registry of Norway. Hentet fra https://www.kreftregisteret.no/globalassets/cancer-in-norway/2020/cin-2020.pdf
Carballal, S., Rodríguez-Alcalde, D., Moreira, L., Hernández, L., Rodriguez, L., Rodriguez-Moranta, F., . . . Balaguer, F. (2016). Colorectal cancer risk factors in patients with serrated polyposis syndrome: a large multicentre study. Gut, 65(11), 1829-1837. https://doi.org/10.1136/gutjnl-2015-309647
Cartwright, T. H. (2012). Treatment decisions after diagnosis of metastatic colorectal cancer. Clin Colorectal Cancer, 11(3), 155-166. https://doi.org/10.1016/j.clcc.2011.11.001
Cassidy, J., Clarke, S., Diaz-Rubio, E., Scheithauer, W., Figer, A., Wong, R., . . . Saltz, L. (2008). Randomized phase III study of capecitabine plus oxaliplatin compared with fluorouracil/folinic acid plus oxaliplatin as first-line therapy for metastatic colorectal cancer. Journal of Clinical Oncology, 26(12), 2006-2012. https://doi.org/10.1200/Jco.2007.14.9898
Ceelen, W., Fierens, K., Van Nieuwenhove, Y., & Pattyn, P. (2009). Preoperative chemoradiation versus radiation alone for stage II and III resectable rectal cancer: a systematic review and meta-analysis. Int J Cancer, 124(12), 2966-2972. https://doi.org/10.1002/ijc.24247
Ceelen, W. P., Van Nieuwenhove, Y., & Fierens, K. (2009). Preoperative chemoradiation versus radiation alone for stage II and III resectable rectal cancer. Cochrane Database Syst Rev, (1), CD006041.
Cepeda, M. S., Carr, D. B., Miranda, N., Diaz, A., Silva, C., & Morales, O. (2005). Comparison of morphine, ketorolac, and their combination for postoperative pain: results from a large, randomized, double-blind trial. Anesthesiology, 103(6), 1225-1232.
Chand, M., Siddiqui, M. R., Swift, I., & Brown, G. (2016). Systematic review of prognostic importance of extramural venous invasion in rectal cancer. World J Gastroenterol, 22(4), 1721-1726. https://dx.doi.org/10.3748/wjg.v22.i4.1721
Chau, I., Brown, G., Cunningham, D., Tait, D., Wotherspoon, A., Norman, A. R., . . . Oates, J. (2006). Neoadjuvant capecitabine and oxaliplatin followed by synchronous chemoradiation and total mesorectal excision in magnetic resonance imaging-defined poor-risk rectal cancer. J Clin Oncol, 24(4), 668-674. https://doi.org/10.1200/JCO.2005.04.4875
Cheng, H., Deng, Z., Wang, Z. J., Zhang, W., & Su, J. T. (2011). Lateral lymph node dissection with radical surgery versus single radical surgery for rectal cancer: a meta-analysis. Asian Pac J Cancer Prev, 12(10), 2517-2521.
Chibaudel, B., Maindrault-Goebel, F., Lledo, G., Mineur, L., Andre, T., Bennamoun, M., . . . de Gramont, A. (2009). Can chemotherapy be discontinued in unresectable metastatic colorectal cancer? The GERCOR OPTIMOX2 Study. J Clin Oncol, 27(34), 5727-5733.
Choi, J. Y., Jung, S. A., Shim, K. N., Cho, W. Y., Keum, B., Byeon, J. S., . . . Kong, K. A. (2015). Meta-analysis of predictive clinicopathologic factors for lymph node metastasis in patients with early colorectal carcinoma. J Korean Med Sci, 30(4), 398-406. https://doi.org/10.3346/jkms.2015.30.4.398
Chow, E., van der Linden, Y. M., Roos, D., Hartsell, W. F., Hoskin, P., Wu, J. S., . . . Wong, R. K. (2014). Single versus multiple fractions of repeat radiation for painful bone metastases: a randomised, controlled, non-inferiority trial. Lancet Oncol, 15(2), 164-171. https://doi.org/10.1016/s1470-2045(13)70556-4
Chow, E., Zeng, L., Salvo, N., Dennis, K., Tsao, M., & Lutz, S. (2012). Update on the systematic review of palliative radiotherapy trials for bone metastases. Clin Oncol (R Coll Radiol), 24(2), 112-124. https://doi.org/10.1016/j.clon.2011.11.004
Chua, T. C., & Morris, D. L. (2012). Therapeutic potential of surgery for metastatic colorectal cancer. Scand J Gastroenterol, 47(3), 258-268. https://doi.org/10.3109/00365521.2012.640823
Church, D. N., Midgley, R., & Kerr, D. J. (2013). Stage II colon cancer. Chinese clinical oncology, 2(2), 16. https://doi.org/10.3978/j.issn.2304-3865.2013.03.03
Cirocchi, R., Trastulli, S., Abraha, I., Vettoretto, N., Boselli, C., Montedori, A., . . . Platell, C. (2012). Non-resection versus resection for an asymptomatic primary tumour in patients with unresectable stage IV colorectal cancer. Cochrane Database Syst Rev, 8(8), CD008997. https://doi.org/10.1002/14651858.CD008997.pub2
Ciseł, B., Pietrzak, L., Michalski, W., Wyrwicz, L., Rutkowski, A., Kosakowska, E., . . . Bujko, K. (2019). Long-course preoperative chemoradiation versus 5 × 5 Gy and consolidation chemotherapy for clinical T4 and fixed clinical T3 rectal cancer: long-term results of the randomized Polish II study. Ann Oncol, 30(8), 1298-1303. https://doi.org/10.1093/annonc/mdz186
Click, B., Pinsky, P. F., Hickey, T., Doroudi, M., & Schoen, R. E. (2018). Association of Colonoscopy Adenoma Findings With Long-term Colorectal Cancer Incidence. JAMA, 319(19), 2021-2031. https://doi.org/10.1001/jama.2018.5809
Coleman, H. G., Loughrey, M. B., Murray, L. J., Johnston, B. T., Gavin, A. T., Shrubsole, M. J., . . . Cantwell, M. M. (2015). Colorectal Cancer Risk Following Adenoma Removal: A Large Prospective Population-Based Cohort Study. Cancer Epidemiol Biomarkers Prev, 24(9), 1373-1380. https://doi.org/10.1158/1055-9965.Epi-15-0085
Colle, R., Radzik, A., Cohen, R., Pellat, A., Lopez-Tabada, D., Cachanado, M., . . . André, T. (2021). Pseudoprogression in patients treated with immune checkpoint inhibitors for microsatellite instability-high/mismatch repair-deficient metastatic colorectal cancer. Eur J Cancer, 144, 9-16. https://doi.org/10.1016/j.ejca.2020.11.009
Colon Cancer Laparoscopic or Open Resection Study Group, Buunen, M., Veldkamp, R., Hop, W. C., Kuhry, E., Jeekel, J., . . . Bonjer, H. J. (2009). Survival after laparoscopic surgery versus open surgery for colon cancer: long-term outcome of a randomised clinical trial. Lancet Oncol, 10(1), 44-52. https://doi.org/10.1016/s1470-2045(08)70310-3
Conroy, T., Bosset, J. F., Etienne, P. L., Rio, E., François, É., Mesgouez-Nebout, N., . . . Borg, C. (2021). Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol, 22(5), 702-715. https://doi.org/10.1016/s1470-2045(21)00079-6
Corley, D. A., Levin, T. R., & Doubeni, C. A. (2014). Adenoma detection rate and risk of colorectal cancer and death. N Engl J Med, 370(26), 2541. https://doi.org/10.1056/NEJMc1405329
Corrin, B., & Nicholson, A. G. (2006). Pathology of the lungs. Philadelphia: Churchill Livingstone.
Cottet, V., Jooste, V., Fournel, I., Bouvier, A. M., Faivre, J., & Bonithon-Kopp, C. (2012). Long-term risk of colorectal cancer after adenoma removal: a population-based cohort study. Gut, 61(8), 1180-1186. https://doi.org/10.1136/gutjnl-2011-300295
Cremolini, C., Loupakis, F., Masi, G., Lonardi, S., Granetto, C., Mancini, M. L., . . . Falcone, A. (2016). FOLFOXIRI or FOLFOXIRI plus bevacizumab as first-line treatment of metastatic colorectal cancer: a propensity score-adjusted analysis from two randomized clinical trials. Ann Oncol, 27(5), 843-849. https://doi.org/10.1093/annonc/mdw052
Crockett, S. D., & Nagtegaal, I. D. (2019). Terminology, Molecular Features, Epidemiology, and Management of Serrated Colorectal Neoplasia. Gastroenterology, 157(4), 949-966.e944. https://doi.org/10.1053/j.gastro.2019.06.041
Croner, R. S., Merkel, S., Papadopoulos, T., Schellerer, V., Hohenberger, W., & Goehl, J. (2009). Multivisceral resection for colon carcinoma. Dis Colon Rectum, 52(8), 1381-1386. https://doi.org/10.1007/DCR.0b013e3181ab580b
Cross, A. J., Robbins, E. C., Pack, K., Stenson, I., Kirby, P. L., Patel, B., . . . Wooldrage, K. (2020). Long-term colorectal cancer incidence after adenoma removal and the effects of surveillance on incidence: a multicentre, retrospective, cohort study. Gut, 69(9), 1645-1658. https://doi.org/10.1136/gutjnl-2019-320036
Cunningham, D., Lang, I., Marcuello, E., Lorusso, V., Ocvirk, J., Shin, D. B., . . . Saunders, M. P. (2013). Bevacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label, randomised phase 3 trial. Lancet Oncol, 14(11), 1077-1085. https://doi.org/10.1016/s1470-2045(13)70154-2
Dahl, O. (2007). Adjuvant kjemoterapi ved tykktarmskreft. Tidsskr Nor Lægeforen, 127(23), 3094-3096.
Dahl, O., Horn, A., Morild, I., Halvorsen, J. F., Odland, G., Reinertsen, S., . . . Thunold, J. (1990). Low-dose preoperative radiation postpones recurrences in operable rectal cancer. Results of a randomized multicenter trial in western Norway. Cancer, 66(11), 2286-2294. https://pubmed.ncbi.nlm.nih.gov/2245382/
Danielsen, A. K., Park, J., Jansen, J. E., Bock, D., Skullman, S., Wedin, A., . . . Rosenberg, J. (2017). Early Closure of a Temporary Ileostomy in Patients With Rectal Cancer: A Multicenter Randomized Controlled Trial. Ann Surg, 265(2), 284-290. https://doi.org/10.1097/sla.0000000000001829
Danish Colorectal Cancer Group. (2010). Retningslinier for diagnostik og behandling af kolorektal cancer: Kirurgisk behandling af cancer recti. [nettdokument]. København: Dansk kirurgisk selskab. Hentet 31.05.2013, fra https://kunskapsbanken.cancercentrum.se/diagnoser/tjock-och-andtarmscancer/vardprogram/
Danske Multidisciplinære Cancer Grupper, & Regionernes Kliniske Kvalitetsudviklingsprogram. (2019). Arvelig tarmkræft. København: DCCG.dk. Hentet fra https://dccg.dk/retningslinjer/kolorektal-cancer/
Das, P., Delclos, M. E., Skibber, J. M., Rodriguez-Bigas, M. A., Feig, B. W., Chang, G. J., . . . Crane, C. H. (2010). Hyperfractionated accelerated radiotherapy for rectal cancer in patients with prior pelvic irradiation. Int J Radiat Oncol Biol Phys, 77(1), 60-65. https://doi.org/10.1016/j.ijrobp.2009.04.056
de Gramont, A., Buyse, M., Abrahantes, J. C., Burzykowski, T., Quinaux, E., Cervantes, A., . . . Tournigand, C. (2007). Reintroduction of oxaliplatin is associated with improved survival in advanced colorectal cancer. J Clin Oncol, 25(22), 3224-3229.
de Gramont, A., Figer, A., Seymour, M., Homerin, M., Hmissi, A., Cassidy, J., . . . Bonetti, A. (2000). Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer. J Clin Oncol, 18(16), 2938-2947.
De Jong, A. E., Morreau, H., Van Puijenbroek, M., Eilers, P. H., Wijnen, J., Nagengast, F. M., . . . Vasen, H. F. (2004). The role of mismatch repair gene defects in the development of adenomas in patients with HNPCC. Gastroenterology, 126(1), 42-48. https://doi.org/10.1053/j.gastro.2003.10.043
de Wijkerslooth, T. R., de Haan, M. C., Stoop, E. M., Bossuyt, P. M., Thomeer, M., Essink-Bot, M. L., . . . Dekker, E. (2012). Burden of colonoscopy compared to non-cathartic CT-colonography in a colorectal cancer screening programme: randomised controlled trial. Gut, 61(11), 1552-1559. https://doi.org/10.1136/gutjnl-2011-301308
De Witte, J. L., Demeyer, C., & Vandemaele, E. (2010). Resistive-heating or forced-air warming for the prevention of redistribution hypothermia. Anesth Analg, 110(3), 829-833. https://doi.org/10.1213/ANE.0b013e3181cb3ebf
Deenen, M. J., Meulendijks, D., Cats, A., Sechterberger, M. K., Severens, J. L., Boot, H., . . . Schellens, J. H. (2016). Upfront Genotyping of DPYD*2A to Individualize Fluoropyrimidine Therapy: A Safety and Cost Analysis. J Clin Oncol, 34(3), 227-234. https://doi.org/10.1200/jco.2015.63.1325
Denost, Q., Rouanet, P., Faucheron, J. L., Panis, Y., Meunier, B., Cotte, E., . . . Laurent, C. (2017). To Drain or Not to Drain Infraperitoneal Anastomosis After Rectal Excision for Cancer: The GRECCAR 5 Randomized Trial. Ann Surg, 265(3), 474-480. https://doi.org/10.1097/sla.0000000000001991
Derbyshire, E., Hungin, P., Nickerson, C., & Rutter, M. D. (2017). Post-polypectomy bleeding in the English National Health Service Bowel Cancer Screening Programme. Endoscopy, 49(9), 899-908. https://doi.org/10.1055/s-0043-113442
Des Guetz, G., Nicolas, P., Perret, G. Y., Morere, J. F., & Uzzan, B. (2010). Does delaying adjuvant chemotherapy after curative surgery for colorectal cancer impair survival? A meta-analysis. Eur J Cancer, 46(6), 1049-1055. https://doi.org/10.1016/j.ejca.2010.01.020
Des Guetz, G., Uzzan, B., Morere, J. F., Perret, G., & Nicolas, P. (2010). Duration of adjuvant chemotherapy for patients with non-metastatic colorectal cancer. Cochrane Database Syst Rev, (1), CD007046. https://doi.org/10.1002/14651858.CD007046.pub2
Dewhurst, C., Rosen, M. P., Blake, M. A., Baker, M. E., Cash, B. D., Fidler, J. L., . . . Yee, J. (2012). ACR Appropriateness Criteria pretreatment staging of colorectal cancer. J Am Coll Radiol, 9(11), 775-781. https://doi.org/10.1016/j.jacr.2012.07.025
Diana, M., & Marescaux, J. (2015). Robotic surgery. Br J Surg, 102(2), e15-28. https://doi.org/10.1002/bjs.9711
Dienstmann, R., Salazar, R., & Tabernero, J. (2015). Personalizing colon cancer adjuvant therapy: selecting optimal treatments for individual patients. J Clin Oncol, 33(16), 1787-1796. https://doi.org/10.1200/jco.2014.60.0213
Dietrich, C. F., Kratzer, W., Strobe, D., Danse, E., Fessl, R., Bunk, A., . . . Greis, C. (2006). Assessment of metastatic liver disease in patients with primary extrahepatic tumors by contrast-enhanced sonography versus CT and MRI. World J Gastroenterol, 12(11), 1699-1705. https://doi.org/10.3748/wjg.v12.i11.1699
Digestive System Tumours. (2019). (5 utg.). (WHO Classification of Tumours, Volume 1). Lyon: International Agency for Reasearch on Cancer.
Dighe, S., Blake, H., Koh, M. D., Swift, I., Arnaout, A., Temple, L., . . . Brown, G. (2010). Accuracy of multidetector computed tomography in identifying poor prognostic factors in colonic cancer. Br J Surg, 97(9), 1407-1415. https://doi.org/10.1002/bjs.7096
Dighe, S., Purkayastha, S., Swift, I., Tekkis, P. P., Darzi, A., A'Hern, R., & Brown, G. (2010). Diagnostic precision of CT in local staging of colon cancers: a meta-analysis. Clin Radiol, 65(9), 708-719. https://doi.org/10.1016/j.crad.2010.01.024
Dighe, S., Swift, I., & Brown, G. (2008). CT staging of colon cancer. Clin Radiol, 63(12), 1372-1379. https://doi.org/10.1016/j.crad.2008.04.021
Dormann, A., Meisner, S., Verin, N., & Lang, A. W. (2004). Self-expanding metal stents for gastroduodenal malignancies: Systematic review of their clinical effectiveness. Endoscopy, 36(6), 543-550. https://doi.org/10.1055/s-2004-814434
Douillard, J. Y., Cunningham, D., Roth, A. D., Navarro, M., James, R. D., Karasek, P., . . . Rougier, P. (2000). Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicentre randomised trial. Lancet, 355(9209), 1041-1047. https://pubmed.ncbi.nlm.nih.gov/10744089/
Douillard, J. Y., Oliner, K. S., Siena, S., Tabernero, J., Burkes, R., Barugel, M., . . . Patterson, S. D. (2013). Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med, 369(11), 1023-1034. https://doi.org/10.1056/NEJMoa1305275
Douillard, J. Y., Siena, S., Cassidy, J., Tabernero, J., Burkes, R., Barugel, M., . . . Gansert, J. (2010). Randomized, Phase III Trial of Panitumumab With Infusional Fluorouracil, Leucovorin, and Oxaliplatin (FOLFOX4) Versus FOLFOX4 Alone As First-Line Treatment in Patients With Previously Untreated Metastatic Colorectal Cancer: The PRIME Study. Journal of Clinical Oncology, 28(31), 4697-4705. https://doi.org/10.1200/Jco.2009.27.4860
Dube, S., Heyen, F., & Jenicek, M. (1997). Adjuvant chemotherapy in colorectal carcinoma: results of a meta-analysis. Dis Colon Rectum, 40(1), 35-41. https://doi.org/10.1007/BF02055679
Ducreux, M., Malka, D., Mendiboure, J., Etienne, P. L., Texereau, P., Auby, D., . . . Federation Francophone de Cancerologie Digestive -05 Collaborative, G. (2011). Sequential versus combination chemotherapy for the treatment of advanced colorectal cancer (FFCD 2000-05): an open-label, randomised, phase 3 trial. Lancet Oncol, 12(11), 1032-1044. https://doi.org/10.1016/S1470-2045(11)70199-1
Dybdahl, J. H., Daae, L. N., Larsen, S., & Myren, J. (1984). Occult faecal blood loss determined by a 51Cr method and chemical tests in patients referred for colonoscopy. Scand J Gastroenterol, 19(2), 245-254.
Dørum, L. M., Larsen, I. K., Kndusen, K. O., Aaserud, S., Vonen, B., & Møller, B. (2017). Evaluering av datakvaliteten i Nasjonalt kvalitetsregister for tykk- og endetarmskreft. Oslo: Kreftregisteret. Hentet fra https://www.kreftregisteret.no/globalassets/publikasjoner-og-rapporter/andre-publikasjoner/rapport-kvalitetssikringsprosjekt-nasjonalt-kvalitetsregister-for-tykk--og-endetarmskreft.pdf
Eaden, J., Abrams, K., Ekbom, A., Jackson, E., & Mayberry, J. (2000). Colorectal cancer prevention in ulcerative colitis: a case-control study. Aliment Pharmacol Ther, 14(2), 145-153. https://doi.org/10.1046/j.1365-2036.2000.00698.x
Eaden, J. A., Abrams, K. R., & Mayberry, J. F. (2001). The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut, 48(4), 526-535. https://doi.org/10.1136/gut.48.4.526
East, J. E., Atkin, W. S., Bateman, A. C., Clark, S. K., Dolwani, S., Ket, S. N., . . . Rees, C. J. (2017). British Society of Gastroenterology position statement on serrated polyps in the colon and rectum. Gut, 66(7), 1181-1196. https://doi.org/10.1136/gutjnl-2017-314005
Edler, D., Ohrling, K., Hallstrom, M., Karlberg, M., & Ragnhammar, P. (2007). The number of analyzed lymph nodes - a prognostic factor in colorectal cancer. Acta Oncol, 46(7), 975-981. https://doi.org/10.1080/02841860701203537
Edna, T. H., Karlsen, V., Jullumstro, E., & Lydersen, S. (2012). Prevalence of Anaemia at Diagnosis of Colorectal Cancer: Assessment of Associated Risk Factors. Hepato-Gastroenterology, 59(115), 713-716. https://pubmed.ncbi.nlm.nih.gov/22469713/
Edwards, D. P., Sexton, R., Heald, R. J., & Moran, B. J. (2007). Long-term results show triple stapling facilitates safe low colorectal and coloanal anastomosis and is associated with low rates of local recurrence after anterior resection for rectal cancer. Tech Coloproctol, 11(1), 17-21.
Efficacy of adjuvant fluorouracil and folinic acid in colon cancer. International Multicentre Pooled Analysis of Colon Cancer Trials (IMPACT) investigators. (1995). Lancet, 345(8955), 939-944.
Elias, D., Goere, D., Di Pietrantonio, D., Boige, V., Malka, D., Kohneh-Shahri, N., . . . Ducreux, M. (2008). Results of systematic second-look surgery in patients at high risk of developing colorectal peritoneal carcinomatosis. Annals of Surgery, 247(3), 445-450. https://doi.org/10.1097/SLA.0b013e31815f0113
Elias, D., Lefevre, J. H., Chevalier, J., Brouquet, A., Marchal, F., Classe, J. M., . . . Bonastre, J. (2009). Complete cytoreductive surgery plus intraperitoneal chemohyperthermia with oxaliplatin for peritoneal carcinomatosis of colorectal origin. J Clin Oncol, 27(5), 681-685. https://doi.org/10.1200/JCO.2008.19.7160
Elias, D., Raynard, B., Farkhondeh, F., Goere, D., Rouquie, D., Ciuchendea, R., . . . Ducreux, M. (2006). Peritoneal carcinomatosis of colorectal origin. Gastroenterol Clin Biol, 30(10), 1200-1204. https://doi.org/10.1016/s0399-8320(06)73512-6
Erichsen, R., Baron, J. A., Hamilton-Dutoit, S. J., Snover, D. C., Torlakovic, E. E., Pedersen, L., . . . Sørensen, H. T. (2016). Increased Risk of Colorectal Cancer Development Among Patients With Serrated Polyps. Gastroenterology, 150(4), 895-902.e895. https://doi.org/10.1053/j.gastro.2015.11.046
Eriksen, M. T., Wibe, A., Syse, A., Haffner, J., Wiig, J. N., Norwegian Rectal Cancer, G., & Norwegian Gastrointestinal Cancer, G. (2004). Inadvertent perforation during rectal cancer resection in Norway. Br J Surg, 91(2), 210-216. https://doi.org/10.1002/bjs.4390
Erlandsson, J., Holm, T., Pettersson, D., Berglund, Å., Cedermark, B., Radu, C., . . . Martling, A. (2017). Optimal fractionation of preoperative radiotherapy and timing to surgery for rectal cancer (Stockholm III): a multicentre, randomised, non-blinded, phase 3, non-inferiority trial. Lancet Oncol, 18(3), 336-346. https://doi.org/10.1016/s1470-2045(17)30086-4
Erlandsson, J., Lörinc, E., Ahlberg, M., Pettersson, D., Holm, T., Glimelius, B., & Martling, A. (2019). Tumour regression after radiotherapy for rectal cancer - Results from the randomised Stockholm III trial. Radiother Oncol, 135, 178-186. https://doi.org/10.1016/j.radonc.2019.03.016
Fairley, K. J., Li, J., Komar, M., Steigerwalt, N., & Erlich, P. (2014). Predicting the risk of recurrent adenoma and incident colorectal cancer based on findings of the baseline colonoscopy. Clin Transl Gastroenterol, 5(12), e64. https://doi.org/10.1038/ctg.2014.11
Falcone, A., Ricci, S., Brunetti, I., Pfanner, E., Allegrini, G., Barbara, C., . . . Masi, G. (2007). Phase III trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan (FOLFOXIRI) compared with infusional fluorouracil, leucovorin, and irinotecan (FOLFIRI) as first-line treatment for metastatic colorectal cancer: the Gruppo Oncologico Nord Ovest. J Clin Oncol, 25(13), 1670-1676. https://doi.org/10.1200/jco.2006.09.0928
Fanucchi, O., Ambrogi, M. C., Aprile, V., Cioni, R., Cappelli, C., Melfi, F., . . . Mussi, A. (2016). Long-term results of percutaneous radiofrequency ablation of pulmonary metastases: a single institution experience. Interactive cardiovascular and thoracic surgery, 23(1), 57-64. https://doi.org/10.1093/icvts/ivw089
Faron, M., Pignon, J. P., Malka, D., Bourredjem, A., Douillard, J. Y., Adenis, A., . . . Ducreux, M. (2015). Is primary tumour resection associated with survival improvement in patients with colorectal cancer and unresectable synchronous metastases? A pooled analysis of individual data from four randomised trials. Eur J Cancer, 51(2), 166-176. https://doi.org/10.1016/j.ejca.2014.10.023
Fearon, K. C., Ljungqvist, O., Von Meyenfeldt, M., Revhaug, A., Dejong, C. H., Lassen, K., . . . Kehlet, H. (2005). Enhanced recovery after surgery: a consensus review of clinical care for patients undergoing colonic resection. Clin Nutr, 24(3), 466-477. https://doi.org/10.1016/j.clnu.2005.02.002
Fekjær, H., & Møller, B. ([s.a.]). Nordpred software package [software]. Oslo: Cancer Registry of Norway. Hentet fra https://www.kreftregisteret.no/en/Research/Projects/Nordpred/Nordpred-software/
Ferlay, J., Ervik, M., Lam, F., Colombet, M., Mery, L., Piñeros, M., . . . Bray, F. (2020). Cancer Today. [database]. Lyon: International Agency for Research on Cancer. Hentet 27. september 2021, fra http://gco.iarc.fr/today
Fichtinger, R. S. (2021). Laparoscopic versus open hemihepatectomy: The ORANGE II PLUS multicenter randomized controlled trial. Foredrag på 14th Congress of the European-African Hepato-Pancreato-Biliary Association (E-AHPBA), 15-17 September 2021, Bilbao. Virtual Congress.
Figueredo, A., Charette, M. L., Maroun, J., Brouwers, M. C., & Zuraw, L. (2004). Adjuvant therapy for stage II colon cancer: a systematic review from the Cancer Care Ontario Program in evidence-based care's gastrointestinal cancer disease site group. J Clin Oncol, 22(16), 3395-3407. https://doi.org/10.1200/JCO.2004.03.087
Fleshman, J., Branda, M., Sargent, D. J., Boller, A. M., George, V., Abbas, M., . . . Nelson, H. (2015). Effect of Laparoscopic-Assisted Resection vs Open Resection of Stage II or III Rectal Cancer on Pathologic Outcomes: The ACOSOG Z6051 Randomized Clinical Trial. JAMA, 314(13), 1346-1355. https://doi.org/10.1001/jama.2015.10529
Fleshman, J., Sargent, D. J., Green, E., Anvari, M., Stryker, S. J., Beart, R. W., Jr., . . . Nelson, H. (2007). Laparoscopic colectomy for cancer is not inferior to open surgery based on 5-year data from the COST Study Group trial. Ann Surg, 246(4), 655-662; discussion 662-654. https://doi.org/10.1097/SLA.0b013e318155a762
Folprecht, G., Gruenberger, T., Bechstein, W., Raab, H. R., Weitz, J., Lordick, F., . . . Kohne, C. H. (2014). Survival of patients with initially unresectable colorectal liver metastases treated with FOLFOX/cetuximab or FOLFIRI/cetuximab in a multidisciplinary concept (CELIM study). Ann Oncol, 25(5), 1018-1025. https://doi.org/10.1093/annonc/mdu088
Ford, A. C., Veldhuyzen van Zanten, S. J., Rodgers, C. C., Talley, N. J., Vakil, N. B., & Moayyedi, P. (2008). Diagnostic utility of alarm features for colorectal cancer: systematic review and meta-analysis. Gut, 57(11), 1545-1553. https://doi.org/10.1136/gut.2008.159723
Forsmo, H. M., Erichsen, C., Rasdal, A., Tvinnereim, J. M., Körner, H., & Pfeffer, F. (2018). Randomized Controlled Trial of Extended Perioperative Counseling in Enhanced Recovery After Colorectal Surgery. Dis Colon Rectum, 61(6), 724-732. https://doi.org/10.1097/dcr.0000000000001007
Forsmo, H. M., Pfeffer, F., Rasdal, A., Sintonen, H., Körner, H., & Erichsen, C. (2016). Pre- and postoperative stoma education and guidance within an enhanced recovery after surgery (ERAS) programme reduces length of hospital stay in colorectal surgery. Int J Surg, 36(Pt A), 121-126. https://doi.org/10.1016/j.ijsu.2016.10.031
Foxtrot Collaborative, G. (2012). Feasibility of preoperative chemotherapy for locally advanced, operable colon cancer: the pilot phase of a randomised controlled trial. Lancet Oncol, 13(11), 1152-1160. https://doi.org/10.1016/s1470-2045(12)70348-0
Francini, G., Petrioli, R., Lorenzini, L., Mancini, S., Armenio, S., Tanzini, G., . . . Lorenzi, M. (1994). Folinic Acid and 5-Fluorouracil as Adjuvant Chemotherapy in Colon-Cancer. Gastroenterology, 106(4), 899-906. https://pubmed.ncbi.nlm.nih.gov/8143995/
Franko, J., Gusani, N. J., Holtzman, M. P., Ahrendt, S. A., Jones, H. L., Zeh, H. J., III, & Bartlett, D. L. (2008). Multivisceral resection does not affect morbidity and survival after cytoreductive surgery and chemoperfusion for carcinomatosis from colorectal cancer. Ann Surg Oncol, 15(11), 3065-3072.
Fretland Å, A., Dagenborg, V. J., Bjørnelv, G. M. W., Kazaryan, A. M., Kristiansen, R., Fagerland, M. W., . . . Edwin, B. (2018). Laparoscopic Versus Open Resection for Colorectal Liver Metastases: The OSLO-COMET Randomized Controlled Trial. Ann Surg, 267(2), 199-207. https://doi.org/10.1097/sla.0000000000002353
Friedman, S., Rubin, P. H., Bodian, C., Goldstein, E., Harpaz, N., & Present, D. H. (2001). Screening and surveillance colonoscopy in chronic Crohn's colitis. Gastroenterology, 120(4), 820-826. https://doi.org/10.1053/gast.2001.22449
Frykholm, G. J., Pahlman, L., & Glimelius, B. (2001). Combined chemo- and radiotherapy vs. radiotherapy alone in the treatment of primary, nonresectable adenocarcinoma of the rectum. Int J Radiat Oncol Biol Phys, 50(2), 427-434. https://doi.org/10.1016/s0360-3016(01)01479-1
Frøysnes, I. S., Larsen, S. G., Spasojevic, M., Dueland, S., & Flatmark, K. (2016). Complete cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for colorectal peritoneal metastasis in Norway: Prognostic factors and oncologic outcome in a national patient cohort. J Surg Oncol, 114(2), 222-227. https://doi.org/10.1002/jso.24290
Fuchs, C. S., Marshall, J., Mitchell, E., Wierzbicki, R., Ganju, V., Jeffery, M., . . . Barrueco, J. (2007). Randomized, controlled trial of irinotecan plus infusional, bolus, or oral fluoropyrimidines in first-line treatment of metastatic colorectal cancer: results from the BICC-C Study. J Clin Oncol, 25(30), 4779-4786. https://doi.org/10.1200/JCO.2007.11.3357
Fumery, M., Dulai, P. S., Gupta, S., Prokop, L. J., Ramamoorthy, S., Sandborn, W. J., & Singh, S. (2017). Incidence, Risk Factors, and Outcomes of Colorectal Cancer in Patients With Ulcerative Colitis With Low-Grade Dysplasia: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol, 15(5), 665-674.e665. https://doi.org/10.1016/j.cgh.2016.11.025
Galon, J., Costes, A., Sanchez-Cabo, F., Kirilovsky, A., Mlecnik, B., Lagorce-Pages, C., . . . Pages, F. (2006). Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science, 313(5795), 1960-1964. https://doi.org/10.1126/science.1129139
Gastroenterological endoscopy. (2002). Stuttgart; New York: Thieme.
Gastrointestinal pathology: an atlas and text. (1999). (s. 961). Philadelphia: Lippincott-Raven.
Gavin, P. G., Colangelo, L. H., Fumagalli, D., Tanaka, N., Remillard, M. Y., Yothers, G., . . . Pogue-Geile, K. L. (2012). Mutation profiling and microsatellite instability in stage II and III colon cancer: an assessment of their prognostic and oxaliplatin predictive value. Clinical cancer research : an official journal of the American Association for Cancer Research, 18(23), 6531-6541. https://doi.org/10.1158/1078-0432.ccr-12-0605
Generelt om klinisk utprøving av legemidler. (2009).Oslo: Legemiddelverket. Hentet 09.12.2009, fra www.legemiddelverket.no
Georgiou, P., Tan, E., Gouvas, N., Antoniou, A., Brown, G., Nicholls, R. J., & Tekkis, P. (2009). Extended lymphadenectomy versus conventional surgery for rectal cancer: a meta-analysis. Lancet Oncol, 10(11), 1053-1062. https://doi.org/10.1016/s1470-2045(09)70224-4
Gerard, J. P., Conroy, T., Bonnetain, F., Bouche, O., Chapet, O., Closon-Dejardin, M. T., . . . Bedenne, L. (2006). Preoperative radiotherapy with or without concurrent fluorouracil and leucovorin in T3-4 rectal cancers: Results of FFCD 9203. Journal of Clinical Oncology, 24(28), 4620-4625. https://doi.org/10.1200/Jco.2006.06.7629
Giantonio, B. J., Catalano, P. J., Meropol, N. J., O'Dwyer, P. J., Mitchell, E. P., Alberts, S. R., . . . Eastern Cooperative Oncology Group Study, E. (2007). Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol, 25(12), 1539-1544. https://doi.org/10.1200/JCO.2006.09.6305
Gibson, J. A., & Odze, R. D. (2016). Pathology of premalignant colorectal neoplasia. Dig Endosc, 28(3), 312-323. https://doi.org/10.1111/den.12633
Gibson, K. M., Chan, C., Chapuis, P. H., Dent, O. F., & Bokey, L. (2014). Mural and extramural venous invasion and prognosis in colorectal cancer. Dis Colon Rectum, 57(8), 916-926. https://doi.org/10.1097/dcr.0000000000000162
Gill, S., Loprinzi, C. L., Sargent, D. J., Thome, S. D., Alberts, S. R., Haller, D. G., . . . Goldberg, R. M. (2004). Pooled analysis of fluorouracil-based adjuvant therapy for stage II and III colon cancer: who benefits and by how much? J Clin Oncol, 22(10), 1797-1806.
Glehen, O., Kwiatkowski, F., Sugarbaker, P. H., Elias, D., Levine, E. A., De Simone, M., . . . Rat, P. (2004). Cytoreductive surgery combined with perioperative intraperitoneal chemotherapy for the management of peritoneal carcinomatosis from colorectal cancer: a multi-institutional study. J Clin Oncol, 22(16), 3284-3292. https://doi.org/10.1200/JCO.2004.10.012
Glimelius, B. (2020). Adjuvant chemotherapy in rectal cancer: state of the art and future perspectives. Curr Opin Oncol, 32(4), 377-383. https://doi.org/10.1097/cco.0000000000000641
Glimelius, B., & Cavalli-Bjorkman, N. (2012). Metastatic colorectal cancer: Current treatment and future options for improved survival Medical approach - present status. Scandinavian Journal of Gastroenterology, 47(3), 296-314. https://doi.org/10.3109/00365521.2012.640828
Glimelius, B., Dahl, O., Cedermark, B., Jakobsen, A., Bentzen, S. M., Starkhammar, H., . . . Nordic Gastrointestinal Tumour Adjuvant Therapy, G. (2005). Adjuvant chemotherapy in colorectal cancer: a joint analysis of randomised trials by the Nordic Gastrointestinal Tumour Adjuvant Therapy Group. Acta Oncol, 44(8), 904-912. https://doi.org/10.1080/02841860500355900
Glimelius, B., Gronberg, H., Jarhult, J., Wallgren, A., & Cavallin-Stahl, E. (2003). A systematic overview of radiation therapy effects in rectal cancer. Acta Oncol, 42(5-6), 476-492. https://doi.org/10.1080/02841860310012301
Glimelius, B., Jakobsen, A., Graf, W., Berglund, A., Gadeberg, C., Hansen, P., . . . Gustavsson, B. (1998). Bolus injection (2-4 min) versus short-term (10-20 min) infusion of 5-fluorouracil in patients with advanced colorectal cancer: a prospective randomised trial. Nordic Gastrointestinal Tumour Adjuvant Therapy Group. Eur J Cancer, 34(5), 674-678. https://doi.org/10.1016/s0959-8049(97)10055-7
Glimelius, B., Myklebust, T., Lundqvist, K., Wibe, A., & Guren, M. G. (2016). Two countries - Two treatment strategies for rectal cancer. Radiother Oncol, 121(3), 357-363. https://doi.org/10.1016/j.radonc.2016.11.010
Glimelius, B., Ristamaki, R., Kjaer, M., Pfeiffer, P., Skovsgaard, T., Tveit, K. M., . . . Pyrhonen, S. (2002). Irinotecan combined with bolus 5-fluorouracil and folinic acid Nordic schedule as first-line therapy in advanced colorectal cancer. Annals of Oncology, 13(12), 1868-1873. https://doi.org/10.1093/annonc/mdf324
Glimelius, B., Sorbye, H., Balteskard, L., Bystrom, P., Pfeiffer, P., Tveit, K., . . . Berglund, A. (2008). A randomized phase III multicenter trial comparing irinotecan in combination with the Nordic bolus 5-FU and folinic acid schedule or the bolus/infused de Gramont schedule (Lv5FU2) in patients with metastatic colorectal cancer. Ann Oncol, 19(5), 909-914. https://doi.org/10.1093/annonc/mdm588
Glimelius, B., Tiret, E., Cervantes, A., & Arnold, D. (2013). Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 24 Suppl 6, vi81-88. https://doi.org/10.1093/annonc/mdt240
Glynne-Jones, R., Wyrwicz, L., Tiret, E., Brown, G., Rödel, C., Cervantes, A., & Arnold, D. (2017). Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 28(suppl_4), iv22-iv40. https://doi.org/10.1093/annonc/mdx224
Gondal, G., Grotmol, T., Hofstad, B., Bretthauer, M., Eide, T. J., & Hoff, G. (2005). Biopsy of colorectal polyps is not adequate for grading of neoplasia. Endoscopy, 37(12), 1193-1197.
Gonzalez, M., Poncet, A., Combescure, C., Robert, J., Ris, H. B., & Gervaz, P. (2013). Risk factors for survival after lung metastasectomy in colorectal cancer patients: a systematic review and meta-analysis. Ann Surg Oncol, 20(2), 572-579. https://doi.org/10.1245/s10434-012-2726-3
Gonzalez, M., Ris, H. B., Krueger, T., & Gervaz, P. (2012). Colorectal cancer and thoracic surgeons: close encounters of the third kind. Expert Rev Anticancer Ther, 12(4), 495-503. https://doi.org/10.1586/era.12.21
Gorissen, K. J., Benning, D., Berghmans, T., Snoeijs, M. G., Sosef, M. N., Hulsewe, K. W., & Luyer, M. D. (2012). Risk of anastomotic leakage with non-steroidal anti-inflammatory drugs in colorectal surgery. Br J Surg, 99(5), 721-727. https://doi.org/10.1002/bjs.8691
Gramont Lesparre, A. H., Chibaudel, B., Bourges, O., Perez-Staub, N., Tournigand, C., Maindrault-Goebel, F., . . . Louvet, C. (2009). Definition of oxaliplatin sensitivity in patients with advanced colorectal cancer previously treated with oxaliplatin-based therapy. [Foredrag på 2009 ASCO Annual Meeting]. J Clin Oncol, 27(15 Suppl), 4024.
Grothey, A. (2010). Reintroduction of oxaliplatin: a viable approach to the long-term management of metastatic colorectal cancer. Oncology, 79(5-6), 389-399. https://doi.org/10.1159/000323491
Grothey, A., Sobrero, A. F., Shields, A. F., Yoshino, T., Paul, J., Taieb, J., . . . Iveson, T. (2018). Duration of Adjuvant Chemotherapy for Stage III Colon Cancer. N Engl J Med, 378(13), 1177-1188. https://doi.org/10.1056/NEJMoa1713709
Grothey, A., Van Cutsem, E., Sobrero, A., Siena, S., Falcone, A., Ychou, M., . . . Laurent, D. (2013). Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet, 381(9863), 303-312. https://doi.org/10.1016/s0140-6736(12)61900-x
Group., C. C. C. (2001). Adjuvant radiotherapy for rectal cancer: a systematic overview of 8,507 patients from 22 randomised trials. Lancet, 358(9290), 1291-1304.
Gruenberger, B., Tamandl, D., Schueller, J., Scheithauer, W., Zielinski, C., Herbst, F., & Gruenberger, T. (2008). Bevacizumab, capecitabine, and oxaliplatin as neoadjuvant therapy for patients with potentially curable metastatic colorectal cancer. J Clin Oncol, 26(11), 1830-1835. https://doi.org/10.1200/jco.2007.13.7679
Gschwantler, M., Kriwanek, S., Langner, E., Goritzer, B., Schrutka-Kolbl, C., Brownstone, E., . . . Weiss, W. (2002). High-grade dysplasia and invasive carcinoma in colorectal adenomas: a multivariate analysis of the impact of adenoma and patient characteristics. Eur J Gastroenterol Hepatol, 14(2), 183-188. https://doi.org/10.1097/00042737-200202000-00013
Guay, J., Nishimori, M., & Kopp, S. (2016). Epidural local anaesthetics versus opioid-based analgesic regimens for postoperative gastrointestinal paralysis, vomiting and pain after abdominal surgery. Cochrane Database Syst Rev, 7(7), Cd001893. https://doi.org/10.1002/14651858.CD001893.pub2
Guenaga, K. F., Matos, D., & Wille-Jorgensen, P. (2011). Mechanical bowel preparation for elective colorectal surgery. Cochrane Database Syst Rev, (9), CD001544. https://doi.org/10.1002/14651858.CD001544.pub4
Guidelines for the management of colorectal cancer. (2007). London: The Association of Coloproctology of Great Britain & Ireland.
Guillou, P. J., Quirke, P., Thorpe, H., Walker, J., Jayne, D. G., Smith, A. M., . . . group, M. C. t. (2005). Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer (MRC CLASICC trial): multicentre, randomised controlled trial. Lancet, 365(9472), 1718-1726. https://doi.org/10.1016/S0140-6736(05)66545-2
Gunderson, L. L., Haddock, M. G., Nelson, H., Cha, S., Devine, R. M., Fieck, J. M., . . . OConnell, M. J. (1997). Locally recurrent colorectal cancer: IOERT and EBRT+/-5-FU and maximal resection. Intraoperative Radiation Therapy in the Treatment of Cancer, 31, 224-228.
Gupta, S., Lieberman, D., Anderson, J. C., Burke, C. A., Dominitz, J. A., Kaltenbach, T., . . . Rex, D. K. (2020). Recommendations for Follow-Up After Colonoscopy and Polypectomy: A Consensus Update by the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology, 158(4), 1131-1153.e1135. https://doi.org/10.1053/j.gastro.2019.10.026
Guren, M. G., Kørner, H., Pfeffer, F., Myklebust, T. Å., Eriksen, M. T., Edna, T. H., . . . Wibe, A. (2015). Nationwide improvement of rectal cancer treatment outcomes in Norway, 1993-2010. Acta Oncol, 54(10), 1714-1722. https://doi.org/10.3109/0284186x.2015.1034876
Guren, M. G., Undseth, C., Rekstad, B. L., Brændengen, M., Dueland, S., Spindler, K. L., . . . Tveit, K. M. (2014). Reirradiation of locally recurrent rectal cancer: a systematic review. Radiother Oncol, 113(2), 151-157. https://doi.org/10.1016/j.radonc.2014.11.021
Gustafsson, U. O., Scott, M. J., Schwenk, W., Demartines, N., Roulin, D., Francis, N., . . . Nutrition. (2013). Guidelines for perioperative care in elective colonic surgery: Enhanced Recovery After Surgery (ERAS((R))) Society recommendations. World J Surg, 37(2), 259-284. https://doi.org/10.1007/s00268-012-1772-0
Gaard, M., Drolsum A, Vikil E, & V., Y. (2014). CT kolografi (CTK) i utredningen av pasienter med koloncancer. Kirurgen, (1), 9-11.
Gaard, M., Tveit, K. M., & Hafstad, A. (2015). Kreftkirurgi i Norge (IS-2284). Oslo: Helsedirektoratet. Hentet fra https://helsedirektoratet.no/Documents/Nyheter/IS-2284%20Rapport%20om%20kreftkirurgi%20i%20Norge.pdf
Haggitt, R. C., Glotzbach, R. E., Soffer, E. E., & Wruble, L. D. (1985). Prognostic factors in colorectal carcinomas arising in adenomas: implications for lesions removed by endoscopic polypectomy. Gastroenterology, 89(2), 328-336. https://doi.org/10.1016/0016-5085(85)90333-6
Hagness, M., Foss, A., Line, P. D., Scholz, T., Jorgensen, P. F., Fosby, B., . . . Dueland, S. (2013). Liver transplantation for nonresectable liver metastases from colorectal cancer. Ann Surg, 257(5), 800-806. https://doi.org/10.1097/SLA.0b013e3182823957
Halligan, S., Altman, D. G., Taylor, S. A., Mallett, S., Deeks, J. J., Bartram, C. I., & Atkin, W. (2005). CT colonography in the detection of colorectal polyps and cancer: systematic review, meta-analysis, and proposed minimum data set for study level reporting. Radiology, 237(3), 893-904. https://doi.org/10.1148/radiol.2373050176
Hamilton, W., Lancashire, R., Sharp, D., Peters, T. J., Cheng, K. K., & Marshall, T. (2009). The risk of colorectal cancer with symptoms at different ages and between the sexes: a case-control study. Bmc Medicine, 7, 17. https://pubmed.ncbi.nlm.nih.gov/19374736/
10.1186/1741-7015-7-17
Hampel, H., Frankel, W. L., Martin, E., Arnold, M., Khanduja, K., Kuebler, P., . . . de la Chapelle, A. (2005). Screening for the Lynch syndrome (hereditary nonpolyposis colorectal cancer). N Engl J Med, 352(18), 1851-1860. https://doi.org/10.1056/NEJMoa043146
Han-Geurts, I. J., Hop, W. C., Kok, N. F., Lim, A., Brouwer, K. J., & Jeekel, J. (2007). Randomized clinical trial of the impact of early enteral feeding on postoperative ileus and recovery. Br J Surg, 94(5), 555-561. https://doi.org/10.1002/bjs.5753
Hannon, B., & Zimmermann, C. (2013). Early palliative care: moving from 'why' to 'how'. Oncology (Williston Park), 27(1).
Hansen, M. F., Johansen, J., Bjørnevoll, I., Sylvander, A. E., Steinsbekk, K. S., Sætrom, P., . . . Sjursen, W. (2015). A novel POLE mutation associated with cancers of colon, pancreas, ovaries and small intestine. Fam Cancer, 14(3), 437-448. https://doi.org/10.1007/s10689-015-9803-2
Hansen, M. H., Balteskard, L., Dorum, L. M., Eriksen, M. T., Vonen, B., & Norwegian Colorectal Cancer, G. (2009). Locally recurrent rectal cancer in Norway. Br J Surg, 96(10), 1176-1182. https://doi.org/10.1002/bjs.6699
Hansmann, A., & Burling, D. (2013). Essential requirements of a CT colonography service. Eur J Radiol, 82(8), 1187-1191. https://doi.org/10.1016/j.ejrad.2012.03.018
Hassan, C., Antonelli, G., Dumonceau, J. M., Regula, J., Bretthauer, M., Chaussade, S., . . . Quintero, E. (2020). Post-polypectomy colonoscopy surveillance: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2020. Endoscopy, 52(8), 687-700. https://doi.org/10.1055/a-1185-3109
Hassan, C., Pickhardt, P. J., Kim, D. H., Di Giulio, E., Zullo, A., Laghi, A., . . . Annibale, B. (2010). Systematic review: distribution of advanced neoplasia according to polyp size at screening colonoscopy. Aliment Pharmacol Ther, 31(2), 210-217. https://doi.org/10.1111/j.1365-2036.2009.04160.x
Hassan, C., Zullo, A., Winn, S., Eramo, A., Tomao, S., Rossini, F. P., & Morini, S. (2007). The colorectal malignant polyp: scoping a dilemma. Dig Liver Dis, 39(1), 92-100. https://doi.org/10.1016/j.dld.2006.06.039
Hatfield, P., Hingorani, M., Radhakrishna, G., Cooper, R., Melcher, A., Crellin, A., . . . Sebag-Montefiore, D. (2009). Short-course radiotherapy, with elective delay prior to surgery, in patients with unresectable rectal cancer who have poor performance status or significant co-morbidity. Radiother Oncol, 92(2), 210-214. https://doi.org/10.1016/j.radonc.2009.04.007
Haugland, H. K., Casati, B., Dorum, L. M., & Bjugn, R. (2011). Template reporting matters--a nationwide study on histopathology reporting on colorectal carcinoma resections. Hum Pathol, 42(1), 36-40. https://doi.org/10.1016/j.humpath.2010.06.009
Hausel, J., Nygren, J., Lagerkranser, M., Hellstrom, P. M., Hammarqvist, F., Almstrom, C., . . . Ljungqvist, O. (2001). A carbohydrate-rich drink reduces preoperative discomfort in elective surgery patients. Anesth Analg, 93(5), 1344-1350. https://doi.org/10.1097/00000539-200111000-00063
Hazebroek, E. J., & Color Study, G. (2002). COLOR: a randomized clinical trial comparing laparoscopic and open resection for colon cancer. Surg Endosc, 16(6), 949-953. https://doi.org/10.1007/s00464-001-8165-z
He, X., Hang, D., Wu, K., Nayor, J., Drew, D. A., Giovannucci, E. L., . . . Song, M. (2020). Long-term Risk of Colorectal Cancer After Removal of Conventional Adenomas and Serrated Polyps. Gastroenterology, 158(4), 852-861.e854. https://doi.org/10.1053/j.gastro.2019.06.039
Heald, R. J., Husband, E. M., & Ryall, R. D. (1982). The mesorectum in rectal cancer surgery--the clue to pelvic recurrence? Br J Surg, 69(10), 613-616. https://doi.org/10.1002/bjs.1800691019
Helse- og omsorgsdepartementet. (2018). Leve med kreft - nasjonal kreftstrategi 2018-2022. Oslo: Helse- og omsorgsdepartementet Hentet fra https://www.regjeringen.no/contentassets/266bf1eec38940888a589ec86d79da20/regjeringens_kreftstrategi_180418.pdf.
Herbert, G., Sutton, E., Burden, S., Lewis, S., Thomas, S., Ness, A., & Atkinson, C. (2017). Healthcare professionals' views of the enhanced recovery after surgery programme: a qualitative investigation. BMC Health Serv Res, 17(1), 617. https://doi.org/10.1186/s12913-017-2547-y
Hermanek, P., Merkel, S., Fietkau, R., Rodel, C., & Hohenberger, W. (2010). Regional lymph node metastasis and locoregional recurrence of rectal carcinoma in the era of TME [corrected] surgery. Implications for treatment decisions. Int J Colorectal Dis, 25(3), 359-368. https://doi.org/10.1007/s00384-009-0864-2
Hershman, D., Hall, M. J., Wang, X., Jacobson, J. S., McBride, R., Grann, V. R., & Neugut, A. I. (2006). Timing of adjuvant chemotherapy initiation after surgery for stage III colon cancer. Cancer, 107(11), 2581-2588. https://doi.org/10.1002/cncr.22316
Higgins, H., & Berger, D. L. (2006). RFA for liver tumors: does it really work? Oncologist, 11(7), 801-808.
Hjerkind, K. V., Qureshi, S. A., Møller, B., Weiderpass, E., Deapen, D., Kumar, B., & Ursin, G. (2017). Ethnic differences in the incidence of cancer in Norway. Int J Cancer, 140(8), 1770-1780. https://doi.org/10.1002/ijc.30598
Hoff, G., Botteri, E., Huppertz-Hauss, G., Kvamme, J. M., Holme, Ø., Aabakken, L., . . . Seip, B. (2021). The effect of train-the-colonoscopy-trainer course on colonoscopy quality indicators. Endoscopy, 53(12), 1229-1234. https://doi.org/10.1055/a-1352-4583
Hoff, G., Foerster, A., Vatn, M. H., Sauar, J., & Larsen, S. (1986). Epidemiology of polyps in the rectum and colon. Recovery and evaluation of unresected polyps 2 years after detection. Scand J Gastroenterol, 21(7), 853-862. https://doi.org/10.3109/00365528609011130
Hofheinz, R. D., Horisberger, K., Woernle, C., Wenz, F., Kraus-Tiefenbacher, U., Kahler, G., . . . Willeke, F. (2006). Phase I trial of cetuximab in combination with capecitabine, weekly irinotecan, and radiotherapy as neoadjuvant therapy for rectal cancer. International Journal of Radiation Oncology Biology Physics, 66(5), 1384-1390. https://doi.org/10.1016/j.ijrobp.2006.07.005
Hofstad, B., Vatn, M. H., Andersen, S. N., Huitfeldt, H. S., Rognum, T., Larsen, S., & Osnes, M. (1996). Growth of colorectal polyps: redetection and evaluation of unresected polyps for a period of three years. Gut, 39(3), 449-456. https://doi.org/10.1136/gut.39.3.449
Hohenberger, W., Reingruber, B., & Merkel, S. (2003). Surgery for colon cancer. Scand J Surg, 92(1), 45-52. https://doi.org/10.1177/145749690309200107
Hohenberger, W., Weber, K., Matzel, K., Papadopoulos, T., & Merkel, S. (2009). Standardized surgery for colonic cancer: complete mesocolic excision and central ligation - technical notes and outcome. Colorectal Disease, 11(4), 354-364. https://doi.org/10.1111/j.1463-1318.2008.01735.x
Hole, K. H., Larsen, S. G., Groholt, K. K., Giercksky, K. E., & Ree, A. H. (2013). Magnetic resonance-guided histopathology for improved accuracy of tumor response evaluation of neoadjuvant treatment in organ-infiltrating rectal cancer. Radiother Oncol, 107(2), 178-183. https://doi.org/10.1016/j.radonc.2013.03.017
Holm, T., Ljung, A., Haggmark, T., Jurell, G., & Lagergren, J. (2007). Extended abdominoperineal resection with gluteus maximus flap reconstruction of the pelvic floor for rectal cancer. Br J Surg, 94(2), 232-238. https://doi.org/10.1002/bjs.5489
Holme, Ø., Bretthauer, M., Fretheim, A., Odgaard-Jensen, J., & Hoff, G. (2013). Flexible sigmoidoscopy versus faecal occult blood testing for colorectal cancer screening in asymptomatic individuals. Cochrane Database Syst Rev, 9, CD009259. https://doi.org/10.1002/14651858.CD009259.pub2
Holme, Ø., Løberg, M., Kalager, M., Bretthauer, M., Hernán, M. A., Aas, E., . . . Hoff, G. (2014). Effect of flexible sigmoidoscopy screening on colorectal cancer incidence and mortality: a randomized clinical trial. JAMA, 312(6), 606-615. https://doi.org/10.1001/jama.2014.8266
Holte, K., Foss, N. B., Svensen, C., Lund, C., Madsen, J. L., & Kehlet, H. (2004). Epidural anesthesia, hypotension, and changes in intravascular volume. Anesthesiology, 100(2), 281-286. https://doi.org/10.1097/00000542-200402000-00016
Hoskin, P., Misra, V., Hopkins, K., Holt, T., Brown, G., Arnott, S., . . . Forsyth, S. (2017). SCORAD III: Randomized noninferiority phase III trial of single-dose radiotherapy (RT) compared to multifraction RT in patients (pts) with metastatic spinal canal compression (SCC). J Clin Oncol, 35(18 suppl), LBA10004. https://doi.org/10.1200/JCO.2017.35.18_suppl.LBA10004
Hovde, Ø., Høivik, M. L., Henriksen, M., Solberg, I. C., Småstuen, M. C., & Moum, B. A. (2017). Malignancies in Patients with Inflammatory Bowel Disease: Results from 20 Years of Follow-up in the IBSEN Study. J Crohns Colitis, 11(5), 571-577. https://doi.org/10.1093/ecco-jcc/jjw193
Howie, L., & Peppercorn, J. (2013). Early palliative care in cancer treatment: rationale, evidence and clinical implications. Therapeutic advances in medical oncology, 5(6), 318-323. https://doi.org/10.1177/1758834013500375
Huang, C. Q., Min, Y., Wang, S. Y., Yang, X. J., Liu, Y., Xiong, B., . . . Li, Y. (2017). Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy improves survival for peritoneal carcinomatosis from colorectal cancer: a systematic review and meta-analysis of current evidence. Oncotarget, 8(33), 55657-55683. https://doi.org/10.18632/oncotarget.17497
Hunter, J. A., Ryan, J. A., Jr., & Schultz, P. (1987). En bloc resection of colon cancer adherent to other organs. Am J Surg, 154(1), 67-71. https://doi.org/10.1016/0002-9610(87)90292-3
Hurwitz, H., Fehrenbacher, L., Novotny, W., Cartwright, T., Hainsworth, J., Heim, W., . . . Kabbinavar, F. (2004). Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med, 350(23), 2335-2342. https://doi.org/10.1056/NEJMoa032691
Hutchins, G., Southward, K., Handley, K., Magill, L., Beaumont, C., Stahlschmidt, J., . . . Quirke, P. (2011). Value of mismatch repair, KRAS, and BRAF mutations in predicting recurrence and benefits from chemotherapy in colorectal cancer. J Clin Oncol, 29(10), 1261-1270. https://doi.org/10.1200/jco.2010.30.1366
Hyltander, A., Bosaeus, I., Svedlund, J., Liedman, B., Hugosson, I., Wallengren, O., . . . Lundholm, K. (2005). Supportive nutrition on recovery of metabolism, nutritional state, health-related quality of life, and exercise capacity after major surgery: a randomized study. Clin Gastroenterol Hepatol, 3(5), 466-474. https://doi.org/10.1016/s1542-3565(05)00151-5
Ihnát, P., Guňková, P., Peteja, M., Vávra, P., Pelikán, A., & Zonča, P. (2016). Diverting ileostomy in laparoscopic rectal cancer surgery: high price of protection. Surg Endosc, 30(11), 4809-4816. https://doi.org/10.1007/s00464-016-4811-3
Improving outcomes in colorectal cancers: research evidence for the manual update. (2004). London: National Institute for Clinical Excellence.
Internullo, E., Cassivi, S. D., Van Raemdonck, D., Friedel, G., Treasure, T., & Group, E. P. M. W. (2008). Pulmonary metastasectomy: a survey of current practice amongst members of the European Society of Thoracic Surgeons. J Thorac Oncol, 3(11), 1257-1266. https://doi.org/10.1097/JTO.0b013e31818bd9da
Jacob, S., Aguado, M., Fallik, D., & Praz, F. (2001). The role of the DNA mismatch repair system in the cytotoxicity of the topoisomerase inhibitors camptothecin and etoposide to human colorectal cancer cells. Cancer Res, 61(17), 6555-6562.
Jafari, M. D., Halabi, W. J., Jafari, F., Nguyen, V. Q., Stamos, M. J., Carmichael, J. C., . . . Pigazzi, A. (2013). Morbidity of diverting ileostomy for rectal cancer: analysis of the American College of Surgeons National Surgical Quality Improvement Program. Am Surg, 79(10), 1034-1039.
Janssen-Heijnen, M. L., Houterman, S., Lemmens, V. E., Brenner, H., Steyerberg, E. W., & Coebergh, J. W. (2007). Prognosis for long-term survivors of cancer. Ann Oncol, 18(8), 1408-1413. https://doi.org/10.1093/annonc/mdm127
Jarvinen, H. J., Aarnio, M., Mustonen, H., Aktan-Collan, K., Aaltonen, L. A., Peltomaki, P., . . . Mecklin, J. P. (2000). Controlled 15-year trial on screening for colorectal cancer in families with hereditary nonpolyposis colorectal cancer. Gastroenterology, 118(5), 829-834. https://doi.org/10.1016/s0016-5085(00)70168-5
Jayne, D. G., Fook, S., Loi, C., & Seow-Choen, F. (2002). Peritoneal carcinomatosis from colorectal cancer. Br J Surg, 89(12), 1545-1550. https://doi.org/10.1046/j.1365-2168.2002.02274.x
Jayne, D. G., Thorpe, H. C., Copeland, J., Quirke, P., Brown, J. M., & Guillou, P. J. (2010). Five-year follow-up of the Medical Research Council CLASICC trial of laparoscopically assisted versus open surgery for colorectal cancer. Br J Surg, 97(11), 1638-1645. https://doi.org/10.1002/bjs.7160
Jeffery, M., Hickey, B. E., & Hider, P. N. (2019). Follow-up strategies for patients treated for non-metastatic colorectal cancer. Cochrane Database Syst Rev, 9, CD002200. https://doi.org/10.1002/14651858.CD002200.pub4
Jensen, A. G., Callesen, T., Hagemo, J. S., Hreinsson, K., Lund, V., & Nordmark, J. (2010). Scandinavian clinical practice guidelines on general anaesthesia for emergency situations. Acta Anaesthesiol Scand, 54(8), 922-950. https://doi.org/10.1111/j.1399-6576.2010.02277.x
Jeong, S. Y., Park, J. W., Nam, B. H., Kim, S., Kang, S. B., Lim, S. B., . . . Oh, J. H. (2014). Open versus laparoscopic surgery for mid-rectal or low-rectal cancer after neoadjuvant chemoradiotherapy (COREAN trial): survival outcomes of an open-label, non-inferiority, randomised controlled trial. Lancet Oncol, 15(7), 767-774. https://doi.org/10.1016/s1470-2045(14)70205-0
Jess, T., Loftus, E. V., Jr., Velayos, F. S., Harmsen, W. S., Zinsmeister, A. R., Smyrk, T. C., . . . Sandborn, W. J. (2006). Risk of intestinal cancer in inflammatory bowel disease: a population-based study from olmsted county, Minnesota. Gastroenterology, 130(4), 1039-1046. https://doi.org/10.1053/j.gastro.2005.12.037
Jestin, P., Nilsson, J., Heurgren, M., Pahlman, L., Glimelius, B., & Gunnarsson, U. (2005). Emergency surgery for colonic cancer in a defined population. Br J Surg, 92(1), 94-100. https://doi.org/10.1002/bjs.4780
Jesus, E. C., Karliczek, A., Matos, D., Castro, A. A., & Atallah, A. N. (2004). Prophylactic anastomotic drainage for colorectal surgery. Cochrane Database Syst Rev, (4), CD002100. https://doi.org/10.1002/14651858.CD002100.pub2
Jeurnink, S. M., Steyerberg, E. W., Hof, G., van Eijck, C. H., Kuipers, E. J., & Siersema, P. D. (2007). Gastrojejunostomy versus stent placement in patients with malignant gastric outlet obstruction: a comparison in 95 patients. J Surg Oncol, 96(5), 389-396. https://doi.org/10.1002/jso.20828
Jones, O. M., Rees, M., John, T. G., Bygrave, S., & Plant, G. (2005). Biopsy of resectable colorectal liver metastases causes tumour dissemination and adversely affects survival after liver resection. Br J Surg, 92(9), 1165-1168. https://doi.org/10.1002/bjs.4888
Jones, R. P., Hamann, S., Malik, H. Z., Fenwick, S. W., Poston, G. J., & Folprecht, G. (2014). Defined criteria for resectability improves rates of secondary resection after systemic therapy for liver limited metastatic colorectal cancer. Eur J Cancer, 50(9), 1590-1601. https://doi.org/10.1016/j.ejca.2014.02.024
Jonker, F. H., Tanis, P. J., Coene, P. P., & van der Harst, E. (2015). Impact of Neoadjuvant Radiotherapy on Complications After Hartmann Procedure for Rectal Cancer. Dis Colon Rectum, 58(10), 931-937. https://doi.org/10.1097/dcr.0000000000000432
Jorgensen, H., Wetterslev, J., Moiniche, S., & Dahl, J. B. (2000). Epidural local anaesthetics versus opioid-based analgesic regimens on postoperative gastrointestinal paralysis, PONV and pain after abdominal surgery. Cochrane Database Syst Rev, (4), CD001893. https://doi.org/10.1002/14651858.CD001893
Joye, I., & Haustermans, K. (2015). Clinical target volume delineation for rectal cancer radiation therapy: time for updated guidelines? Int J Radiat Oncol Biol Phys, 91(4), 690-691.
Clinical target volume delineation for rectal cancer radiation therapy: time for updated guidelines? - PubMed (nih.gov)
Kabbinavar, F. F., Hambleton, J., Mass, R. D., Hurwitz, H. I., Bergsland, E., & Sarkar, S. (2005). Combined analysis of efficacy: the addition of bevacizumab to fluorouracil/leucovorin improves survival for patients with metastatic colorectal cancer. J Clin Oncol, 23(16), 3706-3712. https://doi.org/10.1200/JCO.2005.00.232
Kaminski, M. F., Anderson, J., Valori, R., Kraszewska, E., Rupinski, M., Pachlewski, J., . . . Regula, J. (2016). Leadership training to improve adenoma detection rate in screening colonoscopy: a randomised trial. Gut, 65(4), 616-624. https://doi.org/10.1136/gutjnl-2014-307503
Kaminski, M. F., Regula, J., Kraszewska, E., Polkowski, M., Wojciechowska, U., Didkowska, J., . . . Butruk, E. (2010). Quality indicators for colonoscopy and the risk of interval cancer. N Engl J Med, 362(19), 1795-1803. https://doi.org/10.1056/NEJMoa0907667
Kanemitsu, Y., Shimizu, Y., Mizusawa, J., Inaba, Y., Hamaguchi, T., Shida, D., . . . Fukuda, H. (2021). Hepatectomy Followed by mFOLFOX6 Versus Hepatectomy Alone for Liver-Only Metastatic Colorectal Cancer (JCOG0603): A Phase II or III Randomized Controlled Trial. J Clin Oncol, 39(34), 3789-3799. https://doi.org/10.1200/jco.21.01032
Kansagra, A. J., & Stefan, M. S. (2016). Preoperative Anemia: Evaluation and Treatment. Anesthesiol Clin, 34(1), 127-141. https://doi.org/10.1016/j.anclin.2015.10.011
Karapetis, C. S., Khambata-Ford, S., Jonker, D. J., O'Callaghan, C. J., Tu, D., Tebbutt, N. C., . . . Zalcberg, J. R. (2008). K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med, 359(17), 1757-1765. https://doi.org/10.1056/NEJMoa0804385
Karliczek, A., Jesus, E. C., Matos, D., Castro, A. A., Atallah, A. N., & Wiggers, T. (2006). Drainage or nondrainage in elective colorectal anastomosis: a systematic review and meta-analysis. Colorectal Dis, 8(4), 259-265. https://doi.org/10.1111/j.1463-1318.2006.00999.x
Kaslow, S. R., Gani, F., Alshaikh, H. N., & Canner, J. K. (2018). Clinical outcomes following mechanical plus oral antibiotic bowel preparation versus oral antibiotics alone in patients undergoing colorectal surgery. BJS Open, 2(4), 238-245. https://doi.org/10.1002/bjs5.66
Kauer, W. K., Prantl, L., Dittler, H. J., & Siewert, J. R. (2004). The value of endosonographic rectal carcinoma staging in routine diagnostics: a 10-year analysis. Surg Endosc, 18(7), 1075-1078. https://doi.org/10.1007/s00464-003-9088-7
Kehlet, H., & Wilmore, D. W. (2002). Multimodal strategies to improve surgical outcome. Am J Surg, 183(6), 630-641. https://doi.org/10.1016/s0002-9610(02)00866-8
Kelder, W., Inberg, B., Schaapveld, M., Karrenbeld, A., Grond, J., Wiggers, T., & Plukker, J. T. (2009). Impact of the number of histologically examined lymph nodes on prognosis in colon cancer: a population-based study in the Netherlands. Dis Colon Rectum, 52(2), 260-267. https://doi.org/10.1007/DCR.0b013e3181979164
Kim, J. C., Lee, K. H., Yu, C. S., Kim, H. C., Kim, J. R., Chang, H. M., . . . Kim, T. W. (2004). The clinicopathological significance of inferior mesenteric lymph node metastasis in colorectal cancer. Eur J Surg Oncol, 30(3), 271-279. https://doi.org/10.1016/j.ejso.2003.12.002
Kim, J. H., Beets, G. L., Kim, M. J., Kessels, A. G., & Beets-Tan, R. G. (2004). High-resolution MR imaging for nodal staging in rectal cancer: are there any criteria in addition to the size? Eur J Radiol, 52(1), 78-83.
Kim, M. J., Jeong, S. Y., Choi, S. J., Ryoo, S. B., Park, J. W., Park, K. J., . . . Park, J. G. (2015). Survival paradox between stage IIB/C (T4N0) and stage IIIA (T1-2N1) colon cancer. Ann Surg Oncol, 22(2), 505-512. https://doi.org/10.1245/s10434-014-3982-1
Kishi, Y., Zorzi, D., Contreras, C. M., Maru, D. M., Kopetz, S., Ribero, D., . . . Vauthey, J. N. (2010). Extended preoperative chemotherapy does not improve pathologic response and increases postoperative liver insufficiency after hepatic resection for colorectal liver metastases. Ann Surg Oncol, 17(11), 2870-2876. https://doi.org/10.1245/s10434-010-1166-1
Klein, A., Tate, D. J., Jayasekeran, V., Hourigan, L., Singh, R., Brown, G., . . . Bourke, M. J. (2019). Thermal Ablation of Mucosal Defect Margins Reduces Adenoma Recurrence After Colonic Endoscopic Mucosal Resection. Gastroenterology, 156(3), 604-613.e603. https://doi.org/10.1053/j.gastro.2018.10.003
Klinger, A. L., Green, H., Monlezun, D. J., Beck, D., Kann, B., Vargas, H. D., . . . Margolin, D. (2019). The Role of Bowel Preparation in Colorectal Surgery: Results of the 2012-2015 ACS-NSQIP Data. Ann Surg, 269(4), 671-677. https://doi.org/10.1097/sla.0000000000002568
Ko, S., Jo, H., Yun, S., Park, E., Kim, S., & Seo, H. I. (2014). Comparative analysis of radiofrequency ablation and resection for resectable colorectal liver metastases. World J Gastroenterol, 20(2), 525-531. https://doi.org/10.3748/wjg.v20.i2.525
Kolfschoten, N. E., Wouters, M. W., Gooiker, G. A., Eddes, E. H., Kievit, J., Tollenaar, R. A., & Marang-van de Mheen, P. J. (2012). Nonelective colon cancer resections in elderly patients: results from the dutch surgical colorectal audit. Dig Surg, 29(5), 412-419. https://doi.org/10.1159/000345614
Koopman, M., Antonini, N. F., Douma, J., Wals, J., Honkoop, A. H., Erdkamp, F. L., . . . Punt, C. J. (2007). Sequential versus combination chemotherapy with capecitabine, irinotecan, and oxaliplatin in advanced colorectal cancer (CAIRO): a phase III randomised controlled trial. Lancet, 370(9582), 135-142. https://doi.org/10.1016/S0140-6736(07)61086-1
Kopetz, S., Grothey, A., Yaeger, R., Van Cutsem, E., Desai, J., Yoshino, T., . . . Tabernero, J. (2019). Encorafenib, Binimetinib, and Cetuximab in BRAF V600E-Mutated Colorectal Cancer. N Engl J Med, 381(17), 1632-1643. https://doi.org/10.1056/NEJMoa1908075
Koren, R., Siegal, A., Klein, B., Halpern, M., Kyzer, S., Veltman, V., & Gal, R. (1997). Lymph node-revealing solution: simple new method for detecting minute lymph nodes in colon carcinoma. Dis Colon Rectum, 40(4), 407-410. https://doi.org/10.1007/BF02258384
Korner, H., Soreide, K., Stokkeland, P. J., & Soreide, J. A. (2005). Systematic follow-up after curative surgery for colorectal cancer in Norway: a population-based audit of effectiveness, costs, and compliance. J Gastrointest Surg, 9(3), 320-328. https://doi.org/10.1016/j.gassur.2004.09.023
Koroulakis, A., Molitoris, J., Kaiser, A., Hanna, N., Bafford, A., Jiang, Y., . . . Regine, W. F. (2021). Reirradiation for Rectal Cancer Using Pencil Beam Scanning Proton Therapy: A Single Institutional Experience. Adv Radiat Oncol, 6(1), 100595. https://doi.org/10.1016/j.adro.2020.10.008
Koruth, N. M., Hunter, D. C., Krukowski, Z. H., & Matheson, N. A. (1985). Immediate resection in emergency large bowel surgery: a 7 year audit. Br J Surg, 72(9), 703-707. https://doi.org/10.1002/bjs.1800720910
Koskenvuo, L., Lehtonen, T., Koskensalo, S., Rasilainen, S., Klintrup, K., Ehrlich, A., . . . Sallinen, V. (2019). Mechanical and oral antibiotic bowel preparation versus no bowel preparation for elective colectomy (MOBILE): a multicentre, randomised, parallel, single-blinded trial. Lancet, 394(10201), 840-848. https://doi.org/10.1016/s0140-6736(19)31269-3
Kozloff, M., Yood, M. U., Berlin, J., Flynn, P. J., Kabbinavar, F. F., Purdie, D. M., . . . Grothey, A. (2009). Clinical outcomes associated with bevacizumab-containing treatment of metastatic colorectal cancer: the BRiTE observational cohort study. Oncologist, 14(9), 862-870. https://doi.org/10.1634/theoncologist.2009-0071
Kozloff, M., Yood, M. U., Berlin, J., Flynn, P. J., Kabbinavar, F. F., Purdie, D. M., . . . Investigators of the, B. s. (2009). Clinical outcomes associated with bevacizumab-containing treatment of metastatic colorectal cancer: the BRiTE observational cohort study. Oncologist, 14(9), 862-870. https://doi.org/10.1634/theoncologist.2009-0071
Kranke, P., & Eberhart, L. H. (2011). Possibilities and limitations in the pharmacological management of postoperative nausea and vomiting. Eur J Anaesthesiol, 28(11), 758-765. https://doi.org/10.1097/EJA.0b013e32834a4e1e
Kreftregisteret. (07.12.2009). [nettside]. Oslo: Kreftregisteret. Hentet 03.11.2009, fra http://www.kreftregisteret.no/
Krokstad, S., Ding, D., Grunseit, A. C., Sund, E. R., Holmen, T. L., Rangul, V., & Bauman, A. (2017). Multiple lifestyle behaviours and mortality, findings from a large population-based Norwegian cohort study - The HUNT Study. BMC Public Health, 17(1), 58. https://doi.org/10.1186/s12889-016-3993-x
Krook, J. E., Moertel, C. G., Gunderson, L. L., Wieand, H. S., Collins, R. T., Beart, R. W., . . . et al. (1991). Effective surgical adjuvant therapy for high-risk rectal carcinoma. N Engl J Med, 324(11), 709-715. https://doi.org/10.1056/NEJM199103143241101
Ku, G. Y., Haaland, B. A., & de Lima Lopes, G., Jr. (2012). Cetuximab in the first-line treatment of K-ras wild-type metastatic colorectal cancer: the choice and schedule of fluoropyrimidine matters. Cancer chemotherapy and pharmacology, 70(2), 231-238. https://doi.org/10.1007/s00280-012-1898-7
Kuhry, E., Bonjer, H. J., Haglind, E., Hop, W. C., Veldkamp, R., Cuesta, M. A., . . . Group, C. S. (2005). Impact of hospital case volume on short-term outcome after laparoscopic operation for colonic cancer. Surg Endosc, 19(5), 687-692. https://doi.org/10.1007/s00464-004-8920-z
Kuhry, E., Schwenk, W. F., Gaupset, R., Romild, U., & Bonjer, H. J. (2008). Long-term results of laparoscopic colorectal cancer resection. Cochrane Database Syst Rev, (2), CD003432. https://doi.org/10.1002/14651858.CD003432.pub2
Kumar, A., Peixoto, R. D., Kennecke, H. F., Renouf, D. J., Lim, H. J., Gill, S., . . . Cheung, W. Y. (2015). Effect of Adjuvant FOLFOX Chemotherapy Duration on Outcomes of Patients With Stage III Colon Cancer. Clin Colorectal Cancer, 14(4), 262-268.e261. https://doi.org/10.1016/j.clcc.2015.05.010
Kusters, M., Beets, G. L., van de Velde, C. J., Beets-Tan, R. G., Marijnen, C. A., Rutten, H. J., . . . Moriya, Y. (2009). A comparison between the treatment of low rectal cancer in Japan and the Netherlands, focusing on the patterns of local recurrence. Ann Surg, 249(2), 229-235. https://doi.org/10.1097/SLA.0b013e318190a664
Kusters, M., Marijnen, C. A., van de Velde, C. J., Rutten, H. J., Lahaye, M. J., Kim, J. H., . . . Beets, G. L. (2010). Patterns of local recurrence in rectal cancer; a study of the Dutch TME trial. Eur J Surg Oncol, 36(5), 470-476. https://doi.org/10.1016/j.ejso.2009.11.011
Lafaro, K. J., Roumanis, P., Demirjian, A. N., Lall, C., & Imagawa, D. K. (2013). Gd-EOB-DTPA-Enhanced MRI for Detection of Liver Metastases from Colorectal Cancer: A Surgeon's Perspective! Int J Hepatol, 2013, 572307. https://doi.org/10.1155/2013/572307
Laine, L., Kaltenbach, T., Barkun, A., McQuaid, K. R., Subramanian, V., & Soetikno, R. (2015). SCENIC international consensus statement on surveillance and management of dysplasia in inflammatory bowel disease. Gastrointest Endosc, 81(3), 489-501.e426. https://doi.org/10.1016/j.gie.2014.12.009
Lakatos, L., Mester, G., Erdelyi, Z., David, G., Pandur, T., Balogh, M., . . . Lakatos, P. L. (2006). Risk factors for ulcerative colitis-associated colorectal cancer in a Hungarian cohort of patients with ulcerative colitis: results of a population-based study. Inflamm Bowel Dis, 12(3), 205-211. https://doi.org/10.1097/01.MIB.0000217770.21261.ce
Land, S. R., Kopec, J. A., Cecchini, R. S., Ganz, P. A., Wieand, H. S., Colangelo, L. H., . . . Wolmark, N. (2007). Neurotoxicity from oxaliplatin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage II and III colon cancer: NSABP C-07. Journal of Clinical Oncology, 25(16), 2205-2211. https://doi.org/10.1200/Jco.2006.08.6652
Lange, M. M., Buunen, M., van de Velde, C. J., & Lange, J. F. (2008). Level of arterial ligation in rectal cancer surgery: low tie preferred over high tie. A review. Dis Colon Rectum, 51(7), 1139-1145. https://doi.org/10.1007/s10350-008-9328-y
Larsen, I. K., & Myklebust, T. Å. (2019). Risiko for kreft etter inntekt, utdanning og landbakgrunn. I: E. Vinberg, L. R. A. Karlsson, B. Møller, G. Ursin, & I. K. Larsen (red.), Sosial ulikhet, innvandring og kreft: en rapport om kreftforekomst etter landbakgrunn, utdanning, inntekt og bosted (s. 24-40). Oslo: Cancer Registry of Norway. Hentet fra https://www.kreftregisteret.no/globalassets/cancer-in-norway/2018/special-issue-2018/cin_special_issue.pdf
Larsen, S. G., Wiig, J. N., Emblemsvaag, H. L., Groholt, K. K., Hole, K. H., Bentsen, A., . . . Giercksky, K. E. (2009). Extended total mesorectal excision in locally advanced rectal cancer (T4a) and the clinical role of MRI-evaluated neo-adjuvant downstaging. Colorectal Dis, 11(7), 759-767. https://doi.org/10.1111/j.1463-1318.2008.01649.x
Larsen, S. G., Wiig, J. N., & Giercksky, K. E. (2005). Hydronephrosis as a prognostic factor in pelvic recurrence from rectal and colon carcinomas. American Journal of Surgery, 190(1), 55-60. https://doi.org/10.1016/j.amjsurg.2004.07.043
Larønningen, S., Ferlay, J., Bray, F., Engholm, G., Ervik, M., Gulbrandsen, J., . . . Storm, H. H. (01. mars 2021). NORDCAN: Cancer Incidence, Mortality, Prevalence and Survival in the Nordic Countries, Version 9.0. [nettressurs]. [s.l.]: Association of the Nordic Cancer Registries. Hentet 27. september 2021, fra https://nordcan.iarc.fr/
Lassen, K., Hannemann, P., Ljungqvist, O., Fearon, K., Dejong, C. H., von Meyenfeldt, M. F., . . . Enhanced Recovery After Surgery, G. (2005). Patterns in current perioperative practice: survey of colorectal surgeons in five northern European countries. BMJ, 330(7505), 1420-1421. https://doi.org/10.1136/bmj.38478.568067.AE
Lassen, K., & Nymo, L. (2019). Norsk register for gastrokirurgi-NoRGast: årsrapport for 2018 med plan for forbedringstiltak. Tromsø: Norsk register for gastrokirurgi. Hentet fra https://unn.no/Documents/Kvalitetsregistre/Norsk%20Register%20for%20Gastrokirurgi/%C3%85rsrapporter/%C3%85rsrapport%20NoRGast_2018.pdf
Lassen, K., Soop, M., Nygren, J., Cox, P. B., Hendry, P. O., Spies, C., . . . Enhanced Recovery After Surgery, G. (2009). Consensus review of optimal perioperative care in colorectal surgery: Enhanced Recovery After Surgery (ERAS) Group recommendations. Arch Surg, 144(10), 961-969. https://doi.org/10.1001/archsurg.2009.170
Le, D. T., Durham, J. N., Smith, K. N., Wang, H., Bartlett, B. R., Aulakh, L. K., . . . Diaz, L. A., Jr. (2017). Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade. Science, 357(6349), 409-413. https://doi.org/10.1126/science.aan6733
Le, D. T., Uram, J. N., Wang, H., Bartlett, B. R., Kemberling, H., Eyring, A. D., . . . Diaz, L. A., Jr. (2015). PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med, 372(26), 2509-2520. https://doi.org/10.1056/NEJMoa1500596
Le Voyer, T. E., Sigurdson, E. R., Hanlon, A. L., Mayer, R. J., Macdonald, J. S., Catalano, P. J., & Haller, D. G. (2003). Colon cancer survival is associated with increasing number of lymph nodes analyzed: a secondary survey of intergroup trial INT-0089. J Clin Oncol, 21(15), 2912-2919.
Lee, D. J., Sagar, P. M., Sadadcharam, G., & Tan, K. Y. (2017). Advances in surgical management for locally recurrent rectal cancer: How far have we come? World J Gastroenterol, 23(23), 4170-4180. https://doi.org/10.3748/wjg.v23.i23.4170
Lee, S., Woo, C. G., Lee, H. J., Kim, K. J., Ye, B. D., Byeon, J. S., . . . Yang, D. H. (2015). Effectiveness of adjuvant radiotherapy after local excision of rectal cancer with deep submucosal invasion: a single-hospital, case-control analysis. Surg Endosc, 29(11), 3231-3238. https://doi.org/10.1007/s00464-015-4065-5
Lee, T. J., Nickerson, C., Goddard, A. F., Rees, C. J., McNally, R. J., & Rutter, M. D. (2013). Outcome of 12-month surveillance colonoscopy in high-risk patients in the National Health Service Bowel Cancer Screening Programme. Colorectal Dis, 15(8), e435-442. https://doi.org/10.1111/codi.12278
Lee, Y. M., Law, W. L., Chu, K. W., & Poon, R. T. P. (2001). Emergency surgery for obstructing colorectal cancers: A comparison between right-sided and left-sided lesions. Journal of the American College of Surgeons, 192(6), 719-725.https://pubmed.ncbi.nlm.nih.gov/11400965/
Leggett, B., & Whitehall, V. (2010). Role of the serrated pathway in colorectal cancer pathogenesis. Gastroenterology, 138(6), 2088-2100. https://doi.org/10.1053/j.gastro.2009.12.066
Leighl, N. B., Bennouna, J., Yi, J., Moore, N., Hambleton, J., & Hurwitz, H. (2011). Bleeding events in bevacizumab-treated cancer patients who received full-dose anticoagulation and remained on study. Br J Cancer, 104(3), 413-418. https://doi.org/10.1038/sj.bjc.6606074
Lembersky, B. C., Wieand, H. S., Petrelli, N. J., O'Connell, M. J., Colangelo, L. H., Smith, R. E., . . . Wolmark, N. (2006). Oral uracil and tegafur plus leucovorin compared with intravenous fluorouracil and leucovorin in stage II and III carcinoma of the colon: results from National Surgical Adjuvant Breast and Bowel Project Protocol C-06. J Clin Oncol, 24(13), 2059-2064. https://doi.org/10.1200/JCO.2005.04.7498
Lemery, S., Keegan, P., & Pazdur, R. (2017). First FDA Approval Agnostic of Cancer Site - When a Biomarker Defines the Indication. N Engl J Med, 377(15), 1409-1412. https://doi.org/10.1056/NEJMp1709968
Lemmens, V. E., Klaver, Y. L., Verwaal, V. J., Rutten, H. J., Coebergh, J. W., & de Hingh, I. H. (2011). Predictors and survival of synchronous peritoneal carcinomatosis of colorectal origin: a population-based study. Int J Cancer, 128(11), 2717-2725. https://doi.org/10.1002/ijc.25596
Lenz, H. J., Van Cutsem, E., Luisa Limon, M., Wong, K. Y. M., Hendlisz, A., Aglietta, M., . . . Lonardi, S. (2022). First-Line Nivolumab Plus Low-Dose Ipilimumab for Microsatellite Instability-High/Mismatch Repair-Deficient Metastatic Colorectal Cancer: The Phase II CheckMate 142 Study. J Clin Oncol, 40(2), 161-170. https://doi.org/10.1200/jco.21.01015
Leo, S., Accettura, C., Gnoni, A., Licchetta, A., Giampaglia, M., Mauro, A., . . . Carr, B. I. (2013). Systemic treatment of gastrointestinal cancer in elderly patients. J Gastrointest Cancer, 44(1), 22-32. https://doi.org/10.1007/s12029-012-9447-5
Leufkens, A. M., van den Bosch, M. A., van Leeuwen, M. S., & Siersema, P. D. (2011). Diagnostic accuracy of computed tomography for colon cancer staging: a systematic review. Scand J Gastroenterol, 46(7-8), 887-894. https://doi.org/10.3109/00365521.2011.574732
Lev-Chelouche, D., Keidar, A., Rub, R., Matzkin, H., & Gutman, M. (2001). Hydronephrosis associated with colorectal carcinoma: treatment and outcome. Eur J Surg Oncol, 27(5), 482-486. https://doi.org/10.1053/ejso.2001.1143
Lewis, S. J., Egger, M., Sylvester, P. A., & Thomas, S. (2001). Early enteral feeding versus "nil by mouth" after gastrointestinal surgery: systematic review and meta-analysis of controlled trials. British Medical Journal, 323(7316), 773-776. https://doi.org/10.1136/bmj.323.7316.773
Lievre, A., Bachet, J. B., Boige, V., Cayre, A., Le Corre, D., Buc, E., . . . Laurent-Puig, P. (2008). KRAS mutations as an independent prognostic factor in patients with advanced colorectal cancer treated with cetuximab. Journal of Clinical Oncology, 26(3), 374-379. https://doi.org/10.1200/Jco.2007.12.5906
Ljungqvist, O. (2014). ERAS--enhanced recovery after surgery: moving evidence-based perioperative care to practice. JPEN J Parenter Enteral Nutr, 38(5), 559-566. https://doi.org/10.1177/0148607114523451
Lobo, D. N., Bostock, K. A., Neal, K. R., Perkins, A. C., Rowlands, B. J., & Allison, S. P. (2002). Effect of salt and water balance on recovery of gastrointestinal function after elective colonic resection: a randomised controlled trial. Lancet, 359(9320), 1812-1818. https://doi.org/10.1016/S0140-6736(02)08711-1
Lodeweges, J. E., Klinkenberg, T. J., Ubbels, J. F., Groen, H. J. M., Langendijk, J. A., & Widder, J. (2017). Long-term Outcome of Surgery or Stereotactic Radiotherapy for Lung Oligometastases. J Thorac Oncol, 12(9), 1442-1445. https://doi.org/10.1016/j.jtho.2017.05.015
Loeve, F., Boer, R., Zauber, A. G., Van Ballegooijen, M., Van Oortmarssen, G. J., Winawer, S. J., & Habbema, J. D. (2004). National Polyp Study data: evidence for regression of adenomas. Int J Cancer, 111(4), 633-639. https://doi.org/10.1002/ijc.20277
Lopez, M. J., Kraybill, W. G., Downey, R. S., Johnston, W. D., & Bricker, E. M. (1987). Exenterative surgery for locally advanced rectosigmoid cancers. Is it worthwhile? Surgery, 102(4), 644-651.
Loupakis, F., Cremolini, C., Masi, G., Lonardi, S., Zagonel, V., Salvatore, L., . . . Falcone, A. (2014). Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med, 371(17), 1609-1618. https://doi.org/10.1056/NEJMoa1403108
Loupakis, F., Cremolini, C., Salvatore, L., Masi, G., Sensi, E., Schirripa, M., . . . Falcone, A. (2014). FOLFOXIRI plus bevacizumab as first-line treatment in BRAF mutant metastatic colorectal cancer. Eur J Cancer, 50(1), 57-63. https://doi.org/10.1016/j.ejca.2013.08.024
Loupakis, F., Maddalena, G., Depetris, I., Murgioni, S., Bergamo, F., Dei Tos, A. P., . . . Fassan, M. (2019). Treatment with checkpoint inhibitors in a metastatic colorectal cancer patient with molecular and immunohistochemical heterogeneity in MSI/dMMR status. J Immunother Cancer, 7(1), 297. https://doi.org/10.1186/s40425-019-0788-5
Lov om humanmedisinsk bruk av bioteknologi m.m. (bioteknologiloven). LOV-2003-12-05-100. Hentet fra http://lovdata.no/all/hl-20031205-100.html
Lov om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven). LOV-2011-06-24-30.
Lowery, J. T., Ahnen, D. J., Schroy, P. C., 3rd, Hampel, H., Baxter, N., Boland, C. R., . . . Smith, R. (2016). Understanding the contribution of family history to colorectal cancer risk and its clinical implications: A state-of-the-science review. Cancer, 122(17), 2633-2645. https://doi.org/10.1002/cncr.30080
Lugli, A., Kirsch, R., Ajioka, Y., Bosman, F., Cathomas, G., Dawson, H., . . . Quirke, P. (2017). Recommendations for reporting tumor budding in colorectal cancer based on the International Tumor Budding Consensus Conference (ITBCC) 2016. Modern pathology : an official journal of the United States and Canadian Academy of Pathology, Inc, 30(9), 1299-1311. https://doi.org/10.1038/modpathol.2017.46
Lund, M., Trads, M., Njor, S. H., Erichsen, R., & Andersen, B. (2019). Quality indicators for screening colonoscopy and colonoscopist performance and the subsequent risk of interval colorectal cancer: a systematic review. JBI Database System Rev Implement Rep, 17(11), 2265-2300. https://doi.org/10.11124/jbisrir-2017-003927
Macbeth, F., & Treasure, T. (2016). Stereotactic Ablative Radiotherapy for 'Oligometastases': a Treatment in Search of Evidence. Clin Oncol (R Coll Radiol), 28(8), 501-502. https://doi.org/10.1016/j.clon.2015.12.025
MacDermid, E., Hooton, G., MacDonald, M., McKay, G., Grose, D., Mohammed, N., & Porteous, C. (2009). Improving patient survival with the colorectal cancer multi-disciplinary team. Colorectal Dis, 11(3), 291-295. https://doi.org/10.1111/j.1463-1318.2008.01580.x
Maessen, J., Dejong, C. H., Hausel, J., Nygren, J., Lassen, K., Andersen, J., . . . von Meyenfeldt, M. F. (2007). A protocol is not enough to implement an enhanced recovery programme for colorectal resection. Br J Surg, 94(2), 224-231.
Magro, F., Gionchetti, P., Eliakim, R., Ardizzone, S., Armuzzi, A., Barreiro-de Acosta, M., . . . Rieder, F. (2017). Third European Evidence-based Consensus on Diagnosis and Management of Ulcerative Colitis. Part 1: Definitions, Diagnosis, Extra-intestinal Manifestations, Pregnancy, Cancer Surveillance, Surgery, and Ileo-anal Pouch Disorders. J Crohns Colitis, 11(6), 649-670. https://doi.org/10.1093/ecco-jcc/jjx008
Majumdar, S. R., Fletcher, R. H., & Evans, A. T. (1999). How does colorectal cancer present? Symptoms, duration, and clues to location. Am J Gastroenterol, 94(10), 3039-3045.
Mandava, N., Kumar, S., Pizzi, W. F., & Aprile, I. J. (1996). Perforated colorectal carcinomas. Am J Surg, 172(3), 236-238. https://doi.org/10.1016/s0002-9610(96)00164-x
Mariathasan, A. B., Boye, K., Dueland, S., Flatmark, K., & Larsen, S. G. (2021). Metastases in locally advanced rectal cancer undergoing curatively intended treatment. Eur J Surg Oncol, 47(9), 2377-2383. https://doi.org/10.1016/j.ejso.2021.04.023
Mariathasan, A. B., Boye, K., Giercksky, K. E., Brennhovd, B., Gullestad, H. P., Emblemsvåg, H. L., . . . Larsen, S. G. (2018). Beyond total mesorectal excision in locally advanced rectal cancer with organ or pelvic side-wall involvement. Eur J Surg Oncol, 44(8), 1226-1232. https://doi.org/10.1016/j.ejso.2018.03.029
Maroney, S., de Paz, C. C., Reeves, M. E., Garberoglio, C., Raskin, E., Senthil, M., . . . Solomon, N. (2018). Benefit of Surgical Resection of the Primary Tumor in Patients Undergoing Chemotherapy for Stage IV Colorectal Cancer with Unresected Metastasis. J Gastrointest Surg, 22(3), 460-466. https://doi.org/10.1007/s11605-017-3617-5
Marret, E., Remy, C., Bonnet, F., & Postoperative Pain Forum, G. (2007). Meta-analysis of epidural analgesia versus parenteral opioid analgesia after colorectal surgery. Br J Surg, 94(6), 665-673. https://doi.org/10.1002/bjs.5825
Martel, G., Crawford, A., Barkun, J. S., Boushey, R. P., Ramsay, C. R., & Fergusson, D. A. (2012). Expert opinion on laparoscopic surgery for colorectal cancer parallels evidence from a cumulative meta-analysis of randomized controlled trials. PLoS One, 7(4), e35292. https://doi.org/10.1371/journal.pone.0035292
Martinez-Perez, A., Carra, M. C., Brunetti, F., & de'Angelis, N. (2017). Pathologic Outcomes of Laparoscopic vs Open Mesorectal Excision for Rectal Cancer: A Systematic Review and Meta-analysis. JAMA Surg, 152(4), e165665. https://doi.org/10.1001/jamasurg.2016.5665
Masi, G., Loupakis, F., Salvatore, L., Fornaro, L., Cremolini, C., Cupini, S., . . . Falcone, A. (2010). Bevacizumab with FOLFOXIRI (irinotecan, oxaliplatin, fluorouracil, and folinate) as first-line treatment for metastatic colorectal cancer: a phase 2 trial. Lancet Oncol, 11(9), 845-852. https://doi.org/10.1016/s1470-2045(10)70175-3
Matthiessen, P., Hallbook, O., Rutegard, J., & Sjodahl, R. (2006). Population-based study of risk factors for postoperative death after anterior resection of the rectum. Br J Surg, 93(4), 498-503. https://doi.org/10.1002/bjs.5282
Matthiessen, P., Hallböök, O., Rutegård, J., Simert, G., & Sjödahl, R. (2007). Defunctioning stoma reduces symptomatic anastomotic leakage after low anterior resection of the rectum for cancer: a randomized multicenter trial. Ann Surg, 246(2), 207-214. https://doi.org/10.1097/SLA.0b013e3180603024
Maughan, T. S., Adams, R. A., Smith, C. G., Meade, A. M., Seymour, M. T., Wilson, R. H., . . . Investigators, M. C. T. (2011). Addition of cetuximab to oxaliplatin-based first-line combination chemotherapy for treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet, 377(9783), 2103-2114. https://doi.org/10.1016/S0140-6736(11)60613-2
Maughan, T. S., James, R. D., Kerr, D. J., Ledermann, J. A., Seymour, M. T., Topham, C., . . . Medical Research Council Colorectal Cancer, G. (2003). Comparison of intermittent and continuous palliative chemotherapy for advanced colorectal cancer: a multicentre randomised trial. Lancet, 361(9356), 457-464. https://doi.org/10.1016/s0140-6736(03)12461-0
Mayer, R. J., Van Cutsem, E., Falcone, A., Yoshino, T., Garcia-Carbonero, R., Mizunuma, N., . . . Ohtsu, A. (2015). Randomized trial of TAS-102 for refractory metastatic colorectal cancer. N Engl J Med, 372(20), 1909-1919. https://doi.org/10.1056/NEJMoa1414325
McArdle, C. S., & Hole, D. J. (2004). Emergency presentation of colorectal cancer is associated with poor 5-year survival. British Journal of Surgery, 91(5), 605-609. https://doi.org/10.1002/bjs.4456
McClelland, D., & Murray, G. I. (2015). A Comprehensive Study of Extramural Venous Invasion in Colorectal Cancer. PLoS One, 10(12), e0144987. https://doi.org/10.1371/journal.pone.0144987
McCormack, P. M., Burt, M. E., Bains, M. S., Martini, N., Rusch, V. W., & Ginsberg, R. J. (1992). Lung resection for colorectal metastases. 10-year results. Arch Surg, 127(12), 1403-1406. https://doi.org/10.1001/archsurg.1992.01420120037006
McGory, M. L., Maggard, M. A., Kang, H., O'Connell, J. B., & Ko, C. Y. (2005). Malignancies of the appendix: beyond case series reports. Dis Colon Rectum, 48(12), 2264-2271. https://doi.org/10.1007/s10350-005-0196-4
McPhail, M. J., Abu-Hilal, M., & Johnson, C. D. (2006). A meta-analysis comparing suprapubic and transurethral catheterization for bladder drainage after abdominal surgery. Br J Surg, 93(9), 1038-1044. https://doi.org/10.1002/bjs.5424
McSorley, S. T., Steele, C. W., & McMahon, A. J. (2018). Meta-analysis of oral antibiotics, in combination with preoperative intravenous antibiotics and mechanical bowel preparation the day before surgery, compared with intravenous antibiotics and mechanical bowel preparation alone to reduce surgical-site infections in elective colorectal surgery. BJS Open, 2(4), 185-194. https://doi.org/10.1002/bjs5.68
MERCURY Study Group. (2006). Diagnostic accuracy of preoperative magnetic resonance imaging in predicting curative resection of rectal cancer: prospective observational study. BMJ, 333(7572), 779.
Merok, M. A., Ahlquist, T., Royrvik, E. C., Tufteland, K. F., Hektoen, M., Sjo, O. H., . . . Nesbakken, A. (2013). Microsatellite instability has a positive prognostic impact on stage II colorectal cancer after complete resection: results from a large, consecutive Norwegian series. Ann Oncol, 24(5), 1274-1282. https://doi.org/10.1093/annonc/mds614
Mesher, D., Dove-Edwin, I., Sasieni, P., Vasen, H., Bernstein, I., Royer-Pokora, B., . . . Thomas, H. (2014). A pooled analysis of the outcome of prospective colonoscopic surveillance for familial colorectal cancer. International Journal of Cancer, 134(4), 939-947. https://doi.org/10.1002/ijc.28397
Meulendijks, D., Henricks, L. M., Sonke, G. S., Deenen, M. J., Froehlich, T. K., Amstutz, U., . . . Schellens, J. H. (2015). Clinical relevance of DPYD variants c.1679T>G, c.1236G>A/HapB3, and c.1601G>A as predictors of severe fluoropyrimidine-associated toxicity: a systematic review and meta-analysis of individual patient data. Lancet Oncol, 16(16), 1639-1650. https://doi.org/10.1016/s1470-2045(15)00286-7
Meyer, L., & Pothuri, B. (2006). Decompressive percutaneous gastrostomy tube use in gynecologic malignancies. Curr Treat Options Oncol, 7(2), 111-120.
Milne, T., Solomon, M. J., Lee, P., Young, J. M., Stalley, P., & Harrison, J. D. (2013). Assessing the impact of a sacral resection on morbidity and survival after extended radical surgery for locally recurrent rectal cancer. Ann Surg, 258(6), 1007-1013. https://doi.org/10.1097/SLA.0b013e318283a5b6
Modest, D. P., Martens, U. M., Riera-Knorrenschild, J., Greeve, J., Florschütz, A., Wessendorf, S., . . . Geissler, M. (2019). FOLFOXIRI Plus Panitumumab As First-Line Treatment of RAS Wild-Type Metastatic Colorectal Cancer: The Randomized, Open-Label, Phase II VOLFI Study (AIO KRK0109). J Clin Oncol, 37(35), 3401-3411. https://doi.org/10.1200/jco.19.01340
Mohiuddin, M., Marks, G., & Marks, J. (2002). Long-term results of reirradiation for patients with recurrent rectal carcinoma. Cancer, 95(5), 1144-1150. https://doi.org/10.1002/cncr.10799
Moran, B., Baratti, D., Yan, T. D., Kusamura, S., & Deraco, M. (2008). Consensus statement on the loco-regional treatment of appendiceal mucinous neoplasms with peritoneal dissemination (pseudomyxoma peritonei). J Surg Oncol, 98(4), 277-282. https://doi.org/10.1002/jso.21054
Morino, M., Allaix, M. E., Arolfo, S., & Arezzo, A. (2013). Previous transanal endoscopic microsurgery for rectal cancer represents a risk factor for an increased abdominoperineal resection rate. Surg Endosc, 27(9), 3315-3321. https://doi.org/10.1007/s00464-013-2911-x
Moriya, Y., Hojo, K., Sawada, T., & Koyama, Y. (1989). Significance of Lateral Node Dissection for Advanced Rectal-Carcinoma at or Below the Peritoneal Reflection. Diseases of the Colon & Rectum, 32(4), 307-315. https://doi.org/10.1007/Bf02553486
Moss, A., Williams, S. J., Hourigan, L. F., Brown, G., Tam, W., Singh, R., . . . Bourke, M. J. (2015). Long-term adenoma recurrence following wide-field endoscopic mucosal resection (WF-EMR) for advanced colonic mucosal neoplasia is infrequent: results and risk factors in 1000 cases from the Australian Colonic EMR (ACE) study. Gut, 64(1), 57-65. https://doi.org/10.1136/gutjnl-2013-305516
Moss, A. C., Morris, E., & Mac, M. P. (2006). Palliative biliary stents for obstructing pancreatic carcinoma. Cochrane Database Syst Rev, (2), CD004200.
Muhi, A., Ichikawa, T., Motosugi, U., Sou, H., Nakajima, H., Sano, K., . . . Araki, T. (2011). Diagnosis of colorectal hepatic metastases: comparison of contrast-enhanced CT, contrast-enhanced US, superparamagnetic iron oxide-enhanced MRI, and gadoxetic acid-enhanced MRI. J Magn Reson Imaging, 34(2), 326-335. https://doi.org/10.1002/jmri.22613
Munkedal, D. L., Laurberg, S., Hagemann-Madsen, R., Stribolt, K. J., Krag, S. R., Quirke, P., & West, N. P. (2016). Significant Individual Variation Between Pathologists in the Evaluation of Colon Cancer Specimens After Complete Mesocolic Excision. Dis Colon Rectum, 59(10), 953-961. https://doi.org/10.1097/dcr.0000000000000671
Muto, T., Sawada, T., & Sugihara, K. (1991). Treatment of carcinoma in adenomas. World J Surg, 15(1), 35-40. https://doi.org/10.1007/BF01658958
Møller, P., Seppälä, T., Bernstein, I., Holinski-Feder, E., Sala, P., Evans, D. G., . . . Moslein, G. (2017). Cancer incidence and survival in Lynch syndrome patients receiving colonoscopic and gynaecological surveillance: first report from the prospective Lynch syndrome database. Gut, 66(3), 464-472. https://doi.org/10.1136/gutjnl-2015-309675
Møller, P., Stormorken, A., & Apold, J. (2006). Arvelig tarmkreft. Tidsskr Nor Lægeforen, 126(15), 1937-1939.
Nagtegaal, I. D., Marijnen, C. A., Kranenbarg, E. K., van de Velde, C. J., van Krieken, J. H., Pathology Review, C., & Cooperative Clinical, I. (2002). Circumferential margin involvement is still an important predictor of local recurrence in rectal carcinoma: not one millimeter but two millimeters is the limit. The American journal of surgical pathology, 26(3), 350-357. https://doi.org/10.1097/00000478-200203000-00009
Nagtegaal, I. D., & Quirke, P. (2008). What is the role for the circumferential margin in the modern treatment of rectal cancer? J Clin Oncol, 26(2), 303-312.
Nagtegaal, I. D., & van Krieken, J. H. (2002). The role of pathologists in the quality control of diagnosis and treatment of rectal cancer-an overview. Eur J Cancer, 38(7), 964-972. https://doi.org/10.1016/s0959-8049(02)00056-4
Nakadoi, K., Tanaka, S., Kanao, H., Terasaki, M., Takata, S., Oka, S., . . . Chayama, K. (2012). Management of T1 colorectal carcinoma with special reference to criteria for curative endoscopic resection. J Gastroenterol Hepatol, 27(6), 1057-1062. https://doi.org/10.1111/j.1440-1746.2011.07041.x
Nasjonal helseplan (2007-2010). Særtrykk av St.prp. nr.1 (2006-2007) kapittel 6. (2009). Oslo: Helse- og omsorgsdepartementet. Hentet fra http://www.regjeringen.no/upload/HOD/Sykehus/Nasjonal_helseplan_Sartrykk.pdf
Nasjonalt handlingsprogram for diagnosikk og behandling av kreft i tykk- og endetarm. (2019). (IS-2790). Oslo: Helsedirektoratet. Hentet fra https://helsedirektoratet.no/retningslinjer/nasjonalt-handlingsprogram-med-retningslinjer-for-diagnostikk-behandling-og-oppfolging-av-kreft-i-tykktarm-og-endetarm
Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen. (2019). (rev utg.). (IS-2800). Oslo: Helsedirektoratet. Hentet fra https://www.helsedirektoratet.no/retningslinjer/palliasjon-i-kreftomsorgen-handlingsprogram
Nasjonalt kvalitetsregister for tykk- og endetarmskreft. (2016). Årsrapport 2015. Oslo: Kreftregisteret. Hentet fra https://www.kreftregisteret.no/globalassets/publikasjoner-og-rapporter/arsrapporter/publisert-2016/arsrapport-2015-tykk--og-endetarmskreft.pdf
Nasjonalt kvalitetsregister for tykk- og endetarmskreft. (2021). Årsrapport 2020: resultater og forbedringstiltak fra nasjonalt kvalitetsregister for tykk- og endetarmskreft. Oslo: Kreftregisteret. Hentet fra https://www.kreftregisteret.no/globalassets/publikasjoner-og-rapporter/arsrapporter/publisert-2021/arsrapport-nasjonalt-kvalitetsregister-for-tykk--og-endetarmskreft-2020.pdf
Nasjonalt screeningprogram mot tarmkreft: status og anbefalinger. (2017). Oslo: Helsedirektoratet. Hentet fra https://helsedirektoratet.no/Documents/Rapport%20om%20et%20Nasjonalt%20screeningprogram%20mot%20tarmkreft.pdf
Nationella riktlinjer för kolorektalcancersjukvård: medicinskt och hälsoekonomiskt faktadokument. (2007). Stockholm: Socialstyrelsen. Hentet fra https://libris.kb.se/bib/10426413
Nationellt vårdprogram tjock- och ändtarmscancer. (2020). (2. utg.). Stockholm: Regionalt cancercentrum. Hentet fra https://kunskapsbanken.cancercentrum.se/diagnoser/tjock-och-andtarmscancer/vardprogram/
NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). (2009).Fort Washington, PA: National Comprehensive Cancer Network. Hentet 2009, fra http://www.nccn.org/professionals/physician_gls/f_guidelines.asp (krever registrering)
Nelson, R., Edwards, S., & Tse, B. (2007). Prophylactic nasogastric decompression after abdominal surgery. Cochrane Database Syst Rev, (3), CD004929. https://doi.org/10.1002/14651858.CD004929.pub3
Nelson, R. L., Gladman, E., & Barbateskovic, M. (2014). Antimicrobial prophylaxis for colorectal surgery. Cochrane Database Syst Rev, (5), CD001181. https://doi.org/10.1002/14651858.CD001181.pub4
Nelson, R. L., Glenny, A. M., & Song, F. (2009). Antimicrobial prophylaxis for colorectal surgery. Cochrane Database Syst Rev, (1), CD001181. https://doi.org/10.1002/14651858.CD001181.pub3
Neri, E., Halligan, S., Hellstrom, M., Lefere, P., Mang, T., Regge, D., . . . Laghi, A. (2013). The second ESGAR consensus statement on CT colonography. Eur Radiol, 23(3), 720-729. https://doi.org/10.1007/s00330-012-2632-x
Nesbakken, A., & Gaard, M. (2007). Kirurgisk behandling av tykktarmskreft (Surgical treatment of colon cancer). Tidsskr Nor Lægeforen, 127(22), 2942-2945.
Netzer, P., Forster, C., Biral, R., Ruchti, C., Neuweiler, J., Stauffer, E., . . . Schmassmann, A. (1998). Risk factor assessment of endoscopically removed malignant colorectal polyps. Gut, 43(5), 669-674. https://doi.org/10.1136/gut.43.5.669
Neugut, A. I., Matasar, M., Wang, X., McBride, R., Jacobson, J. S., Tsai, W. Y., . . . Hershman, D. L. (2006). Duration of adjuvant chemotherapy for colon cancer and survival among the elderly. J Clin Oncol, 24(15), 2368-2375. https://doi.org/10.1200/jco.2005.04.5005
Newell, K. J., Sawka, B. W., Rudrick, B. F., & Driman, D. K. (2001). GEWF solution. Arch Pathol Lab Med, 125(5), 642-645. https://doi.org/10.5858/2001-125-0642-GS
Ng, M. K., Leong, T., Heriot, A. G., & Ngan, S. Y. (2013). Once-daily reirradiation for rectal cancer in patients who have received previous pelvic radiotherapy. Journal of medical imaging and radiation oncology, 57(4), 512-518. https://doi.org/10.1111/1754-9485.12057
Ng, S. S., Lee, J. F., Yiu, R. Y., Li, J. C., Hon, S. S., Mak, T. W., . . . Leung, K. L. (2014). Long-term Oncologic Outcomes of Laparoscopic Versus Open Surgery for Rectal Cancer: A Pooled Analysis of 3 Randomized Controlled Trials. Ann Surg, 259(1), 139-147. https://doi.org/10.1097/SLA.0b013e31828fe119
Nieder, C., Pawinski, A., & Balteskard, L. (2009). Colorectal cancer metastatic to the brain: time trends in presentation and outcome. Oncology, 76(5), 369-374. https://doi.org/10.1159/000210026
Nielsen, M., Hes, F. J., Nagengast, F. M., Weiss, M. M., Mathus-Vliegen, E. M., Morreau, H., . . . Vasen, H. F. (2007). Germline mutations in APC and MUTYH are responsible for the majority of families with attenuated familial adenomatous polyposis. Clin Genet, 71(5), 427-433. https://doi.org/10.1111/j.1399-0004.2007.00766.x
Nielsen, M., Rasmussen, P., Pedersen, B., Hagemann-Madsen, R., Lindegaard, J., & Laurberg, S. (2015). Early and Late Outcomes of Surgery for Locally Recurrent Rectal Cancer: A Prospective 10-Year Study in the Total Mesorectal Excision Era. Ann Surg Oncol, 22(8), 2677-2684. https://doi.org/10.1245/s10434-014-4317-y
Nilsson, P. J., van Etten, B., Hospers, G. A., Påhlman, L., van de Velde, C. J., Beets-Tan, R. G., . . . Glimelius, B. (2013). Short-course radiotherapy followed by neo-adjuvant chemotherapy in locally advanced rectal cancer--the RAPIDO trial. BMC Cancer, 13, 279. https://doi.org/10.1186/1471-2407-13-279
Nitsche, U., Stöß, C., Stecher, L., Wilhelm, D., Friess, H., & Ceyhan, G. O. (2018). Meta-analysis of outcomes following resection of the primary tumour in patients presenting with metastatic colorectal cancer. Br J Surg, 105(7), 784-796. https://doi.org/10.1002/bjs.10682
Nivatvongs, S., Rojanasakul, A., Reiman, H. M., Dozois, R. R., Wolff, B. G., Pemberton, J. H., . . . Jacques, L. F. (1991). The risk of lymph node metastasis in colorectal polyps with invasive adenocarcinoma. Dis Colon Rectum, 34(4), 323-328. https://doi.org/10.1007/bf02050592
Noblett, S. E., Snowden, C. P., Shenton, B. K., & Horgan, A. F. (2006). Randomized clinical trial assessing the effect of Doppler-optimized fluid management on outcome after elective colorectal resection. Br J Surg, 93(9), 1069-1076. https://doi.org/10.1002/bjs.5454
Nordic Gastrointestinal Tumor Adjuvant Therapy Group. (1992). Expectancy or primary chemotherapy in patients with advanced asymptomatic colorectal cancer: a randomized trial. J Clin Oncol, 10(6), 904-911. https://doi.org/10.1200/JCO.1992.10.6.904
Nordlinger, B., Sorbye, H., Glimelius, B., Poston, G. J., Schlag, P. M., Rougier, P., . . . Federation Francophone de Cancerologie, D. (2008). Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial. Lancet, 371(9617), 1007-1016. https://doi.org/10.1016/S0140-6736(08)60455-9
Nordlinger, B., Sorbye, H., Glimelius, B., Poston, G. J., Schlag, P. M., Rougier, P., . . . Gruenberger, T. (2013). Perioperative FOLFOX4 chemotherapy and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC 40983): long-term results of a randomised, controlled, phase 3 trial. Lancet Oncol, 14(12), 1208-1215. https://doi.org/10.1016/s1470-2045(13)70447-9
Nygren, J., Thacker, J., Carli, F., Fearon, K. C., Norderval, S., Lobo, D. N., . . . Enhanced Recovery After Surgery, S. (2012). Guidelines for perioperative care in elective rectal/pelvic surgery: Enhanced Recovery After Surgery (ERAS(R)) Society recommendations. Clin Nutr, 31(6), 801-816. https://doi.org/10.1016/j.clnu.2012.08.012
O'Connell, M. J., Mailliard, J. A., Kahn, M. J., Macdonald, J. S., Haller, D. G., Mayer, R. J., & Wieand, H. S. (1997). Controlled trial of fluorouracil and low-dose leucovorin given for 6 months as postoperative adjuvant therapy for colon cancer. J Clin Oncol, 15(1), 246-250.
Oien, K., Forsmo, H. M., Rösler, C., Nylund, K., Waage, J. E., & Pfeffer, F. (2019). Endorectal ultrasound and magnetic resonance imaging for staging of early rectal cancers: how well does it work in practice? Acta Oncol, 58(sup1), S49-s54. https://doi.org/10.1080/0284186x.2019.1569259
Olsen, B. C., Sakkestad, S. T., Pfeffer, F., & Karliczek, A. (2019). Rate of Anastomotic Leakage After Rectal Anastomosis Depends on the Definition: Pelvic Abscesses are Significant. Scand J Surg, 108(3), 241-249. https://doi.org/10.1177/1457496918812223
Olsen, F., Uleberg, B., Jacobsen, B. K., & Balteskard, L. (2016). Norske pasienter med tykktarmskreft kommer for sent i gang med tilleggsbehandling. Tidsskr Nor Laegeforen, 136(1), 27-31. https://doi.org/10.4045/tidsskr.14.0812
Ooi, B. S., & Lai, J. H. (2009). Colonic J-Pouch, Coloplasty, Side-to-End Anastomosis: Meta-Analysis and Comparison of Outcomes. Seminars in Colon and Rectal Surgery, 20(2), 69-72.
Otchy, D., Hyman, N. H., Simmang, C., Anthony, T., Buie, W. D., Cataldo, P., . . . Rectal, S. (2004). Practice parameters for colon cancer. Dis Colon Rectum, 47(8), 1269-1284. https://doi.org/10.1007/s10350-004-0598-8
Overman, M. J., Lonardi, S., Wong, K. Y. M., Lenz, H. J., Gelsomino, F., Aglietta, M., . . . Andre, T. (2018). Durable Clinical Benefit With Nivolumab Plus Ipilimumab in DNA Mismatch Repair-Deficient/Microsatellite Instability-High Metastatic Colorectal Cancer. J Clin Oncol, 36(8), 773-779. https://doi.org/10.1200/jco.2017.76.9901
Overman, M. J., McDermott, R., Leach, J. L., Lonardi, S., Lenz, H. J., Morse, M. A., . . . Andre, T. (2017). Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study. Lancet Oncol, 18(9), 1182-1191. https://doi.org/10.1016/s1470-2045(17)30422-9
Pages, F., Berger, A., Camus, M., Sanchez-Cabo, F., Costes, A., Molidor, R., . . . Galon, J. (2005). Effector memory T cells, early metastasis, and survival in colorectal cancer. N Engl J Med, 353(25), 2654-2666. https://doi.org/10.1056/NEJMoa051424
Pai, R., Mäkinen, M., & Rosty, C. (2019). Colorectal serrated lesions and polyps. I: D. Lokuhetty, V. White, R. Watanabe, & I. Cree (red.), Digestive System Tumours (5 utg., s. 163-169). Lyon: International Agency for Reasearch on Cancer.
Palli, D., Trallori, G., Bagnoli, S., Saieva, C., Tarantino, O., Ceroti, M., . . . Masala, G. (2000). Hodgkin's disease risk is increased in patients with ulcerative colitis. Gastroenterology, 119(3), 647-653. https://doi.org/10.1053/gast.2000.16487
Parnaby, C. N., Bailey, W., Balasingam, A., Beckert, L., Eglinton, T., Fife, J., . . . Watson, A. J. (2012). Pulmonary staging in colorectal cancer: a review. Colorectal Dis, 14(6), 660-670. https://doi.org/10.1111/j.1463-1318.2011.02601.x
Parseghian, C. M., Napolitano, S., Loree, J. M., & Kopetz, S. (2019). Mechanisms of Innate and Acquired Resistance to Anti-EGFR Therapy: A Review of Current Knowledge with a Focus on Rechallenge Therapies. Clinical cancer research : an official journal of the American Association for Cancer Research, 25(23), 6899-6908. https://doi.org/10.1158/1078-0432.Ccr-19-0823
Patel, J. D., Galsky, M. D., Chagpar, A. B., Pyle, D., & Loehrer, P. J., Sr. (2011). Role of American Society of Clinical Oncology in low- and middle-income countries. J Clin Oncol, 29(22), 3097-3102. https://doi.org/10.1200/jco.2011.35.6378
Patel, U. B., & Brown, G. (2013). MRI-based assessment of tumor regression in rectal cancer. Curr Colorectal Cancer Rep, 9(2), 136-145. http://dx.doi.org/10.1007/s11888-013-0169-2
Pathology and genetics of tumours of the digestive system. (2000). (World Health Organization classification of tumours 2). Lyon: IARC Press.
IARC Publications Website - Pathology and Genetics of Tumours of the Digestive System
Pectasides, D., Karavasilis, V., Papaxoinis, G., Gourgioti, G., Makatsoris, T., Raptou, G., . . . Fountzilas, G. (2015). Randomized phase III clinical trial comparing the combination of capecitabine and oxaliplatin (CAPOX) with the combination of 5-fluorouracil, leucovorin and oxaliplatin (modified FOLFOX6) as adjuvant therapy in patients with operated high-risk stage II or stage III colorectal cancer. BMC Cancer, 15, 384. https://doi.org/10.1186/s12885-015-1406-7
Peeters, K. C., Tollenaar, R. A., Marijnen, C. A., Klein Kranenbarg, E., Steup, W. H., Wiggers, T., . . . Dutch Colorectal Cancer, G. (2005). Risk factors for anastomotic failure after total mesorectal excision of rectal cancer. Br J Surg, 92(2), 211-216. https://doi.org/10.1002/bjs.4806
Peeters, M., Price, T. J., Cervantes, A., Sobrero, A. F., Ducreux, M., Hotko, Y., . . . Gansert, J. (2010). Randomized Phase III Study of Panitumumab With Fluorouracil, Leucovorin, and Irinotecan (FOLFIRI) Compared With FOLFIRI Alone As Second-Line Treatment in Patients With Metastatic Colorectal Cancer. Journal of Clinical Oncology, 28(31), 4706-4713. https://doi.org/10.1200/Jco.2009.27.6055
Peixoto, R. D., Kumar, A., Speers, C., Renouf, D., Kennecke, H. F., Lim, H. J., . . . Gill, S. (2015). Effect of delay in adjuvant oxaliplatin-based chemotherapy for stage III colon cancer. Clin Colorectal Cancer, 14(1), 25-30. https://doi.org/10.1016/j.clcc.2014.10.002
Pellise, M., Burgess, N. G., Tutticci, N., Hourigan, L. F., Zanati, S. A., Brown, G. J., . . . Bourke, M. J. (2017). Endoscopic mucosal resection for large serrated lesions in comparison with adenomas: a prospective multicentre study of 2000 lesions. Gut, 66(4), 644-653. https://doi.org/10.1136/gutjnl-2015-310249
Pendse, D. A., & Taylor, S. A. (2013). Complications of CT colonography: a review. Eur J Radiol, 82(8), 1159-1165. https://doi.org/10.1016/j.ejrad.2012.04.011
Pfannschmidt, J., Dienemann, H., & Hoffmann, H. (2007). Surgical resection of pulmonary metastases from colorectal cancer: a systematic review of published series. Ann Thorac Surg, 84(1), 324-338. https://doi.org/10.1016/j.athoracsur.2007.02.093
Pfeiffer, P., Yilmaz, M., Möller, S., Zitnjak, D., Krogh, M., Petersen, L. N., . . . Qvortrup, C. (2020). TAS-102 with or without bevacizumab in patients with chemorefractory metastatic colorectal cancer: an investigator-initiated, open-label, randomised, phase 2 trial. Lancet Oncol, 21(3), 412-420. https://doi.org/10.1016/s1470-2045(19)30827-7
Phillips, R. K., Hittinger, R., Fry, J. S., & Fielding, L. P. (1985). Malignant large bowel obstruction. Br J Surg, 72(4), 296-302. https://doi.org/10.1002/bjs.1800720417
Phillips, R. K., Wallace, M. H., Lynch, P. M., Hawk, E., Gordon, G. B., Saunders, B. P., . . . Group, F. A. P. S. (2002). A randomised, double blind, placebo controlled study of celecoxib, a selective cyclooxygenase 2 inhibitor, on duodenal polyposis in familial adenomatous polyposis. Gut, 50(6), 857-860. https://doi.org/10.1136/gut.50.6.857
Pickhardt, P. J., Hassan, C., Halligan, S., & Marmo, R. (2011). Colorectal cancer: CT colonography and colonoscopy for detection--systematic review and meta-analysis. Radiology, 259(2), 393-405. https://doi.org/10.1148/radiol.11101887
Pietrzak, L., Bujko, K., Nowacki, M. P., Kepka, L., Oledzki, J., Rutkowski, A., . . . Polish Colorectal Study, G. (2007). Quality of life, anorectal and sexual functions after preoperative radiotherapy for rectal cancer: report of a randomised trial. Radiother Oncol, 84(3), 217-225. https://doi.org/10.1016/j.radonc.2007.07.007
Pohl, H., Srivastava, A., Bensen, S. P., Anderson, P., Rothstein, R. I., Gordon, S. R., . . . Robertson, D. J. (2013). Incomplete polyp resection during colonoscopy-results of the complete adenoma resection (CARE) study. Gastroenterology, 144(1), 74-80.e71. https://doi.org/10.1053/j.gastro.2012.09.043
Popiolek, M., Dehlaghi, K., Gadan, S., Baban, B., & Matthiessen, P. (2019). Total Mesorectal Excision for Mid-Rectal Cancer Without Anastomosis: Low Hartmann's Operation or Intersphincteric Abdomino-Perineal Excision? Scand J Surg, 108(3), 233-240. https://doi.org/10.1177/1457496918812219
Portier, G., Elias, D., Bouche, O., Rougier, P., Bosset, J. F., Saric, J., . . . Bedenne, L. (2006). Multicenter randomized trial of adjuvant fluorouracil and folinic acid compared with surgery alone after resection of colorectal liver metastases: FFCD ACHBTH AURC 9002 trial. J Clin Oncol, 24(31), 4976-4982. https://doi.org/10.1200/JCO.2006.06.8353
Pothuri, B., Montemarano, M., Gerardi, M., Shike, M., Ben-Porat, L., Sabbatini, P., & Barakat, R. R. (2005). Percutaneous endoscopic gastrostomy tube placement in patients with malignant bowel obstruction due to ovarian carcinoma. Gynecologic Oncology, 96(2), 330-334.https://doi.org/10.1016/j.ygyno.2004.09.058
Poulsen, L., Qvortrup, C., Pfeiffer, P., Yilmaz, M., Falkmer, U., & Sorbye, H. (2015). Review on adjuvant chemotherapy for rectal cancer - why do treatment guidelines differ so much? Acta Oncol, 54(4), 437-446. https://doi.org/10.3109/0284186x.2014.993768
Poultsides, G. A., Servais, E. L., Saltz, L. B., Patil, S., Kemeny, N. E., Guillem, J. G., . . . Paty, P. B. (2009). Outcome of primary tumor in patients with synchronous stage IV colorectal cancer receiving combination chemotherapy without surgery as initial treatment. J Clin Oncol, 27(20), 3379-3384.
Premaligne polypper og tidlig-cancer i rektum. (11.04.2011). [nettside]. Norwegian Gastrointestinal Cancer Group. Hentet 01.08.2011, fra https://ngicg.no/
Price, T. J., Peeters, M., Kim, T. W., Li, J., Cascinu, S., Ruff, P., . . . Sidhu, R. (2014). Panitumumab versus cetuximab in patients with chemotherapy-refractory wild-type KRAS exon 2 metastatic colorectal cancer (ASPECCT): a randomised, multicentre, open-label, non-inferiority phase 3 study. Lancet Oncol, 15(6), 569-579. https://doi.org/10.1016/s1470-2045(14)70118-4
Primrose, J. N., Perera, R., Gray, A., Rose, P., Fuller, A., Corkhill, A., . . . Mant, D. (2014). Effect of 3 to 5 years of scheduled CEA and CT follow-up to detect recurrence of colorectal cancer: the FACS randomized clinical trial. JAMA, 311(3), 263-270. https://doi.org/10.1001/jama.2013.285718
Prytz, M., Angenete, E., Ekelund, J., & Haglind, E. (2014). Extralevator abdominoperineal excision (ELAPE) for rectal cancer--short-term results from the Swedish Colorectal Cancer Registry. Selective use of ELAPE warranted. Int J Colorectal Dis, 29(8), 981-987. https://doi.org/10.1007/s00384-014-1932-9
Rabeneck, L., Rumble, R. B., Axler, J., Smith, A., Armstrong, D., Vinden, C., . . . Cancer Care Ontario's Colonoscopy Standards Expert, P. (2007). Cancer Care Ontario Colonoscopy Standards: standards and evidentiary base. Can J Gastroenterol, 21 Suppl D, 5D-24D.
Rades, D., Dahm-Daphi, J., Rudat, V., Schulte, R., Stalpers, L. J., Veninga, T., & Hoskin, P. J. (2006). Is short-course radiotherapy with high doses per fraction the appropriate regimen for metastatic spinal cord compression in colorectal cancer patients? Strahlenther Onkol, 182(12), 708-712.
radfag.no. (2014). [nettside]. Oslo: Norsk Radiografforbund. Hentet 17.11.2014, fra www.radfag.no
Radu, C., Berglund, A., Pahlman, L., & Glimelius, B. (2008). Short-course preoperative radiotherapy with delayed surgery in rectal cancer - a retrospective study. Radiother Oncol, 87(3), 343-349. https://doi.org/10.1016/j.radonc.2007.11.025
Rahbari, N. N., Weitz, J., Hohenberger, W., Heald, R. J., Moran, B., Ulrich, A., . . . Büchler, M. W. (2010). Definition and grading of anastomotic leakage following anterior resection of the rectum: a proposal by the International Study Group of Rectal Cancer. Surgery, 147(3), 339-351. https://doi.org/10.1016/j.surg.2009.10.012
Rahbari, N. N., Zimmermann, J. B., Schmidt, T., Koch, M., Weigand, M. A., & Weitz, J. (2009). Meta-analysis of standard, restrictive and supplemental fluid administration in colorectal surgery. Br J Surg, 96(4), 331-341. https://doi.org/10.1002/bjs.6552
Rasmussen, M. S., Jorgensen, L. N., & Wille-Jorgensen, P. (2009). Prolonged thromboprophylaxis with low molecular weight heparin for abdominal or pelvic surgery. Cochrane Database Syst Rev, (1), CD004318. https://doi.org/10.1002/14651858.CD004318.pub2
Recommendations for cross-sectional imaging in cancer management: computed tomography-CT, magnetic resonance imaging-MRI, positron emission tomography-PET-CT. (2006). London: The Royal College of Radiologists. Hentet fra http://www.rcr.ac.uk/docs/oncology/pdf/Cross_Sectional_Imaging_12.pdf
Resch, A., & Langner, C. (2015). Risk assessment in early colorectal cancer: histological and molecular markers. Dig Dis, 33(1), 77-85. https://doi.org/10.1159/000366036
Rex, D. K., Ahnen, D. J., Baron, J. A., Batts, K. P., Burke, C. A., Burt, R. W., . . . Church, J. (2012). Serrated lesions of the colorectum: review and recommendations from an expert panel. Am J Gastroenterol, 107(9), 1315-1329; quiz 1314, 1330. https://doi.org/10.1038/ajg.2012.161
Ribic, C. M., Sargent, D. J., Moore, M. J., Thibodeau, S. N., French, A. J., Goldberg, R. M., . . . Gallinger, S. (2003). Tumor microsatellite-instability status as a predictor of benefit from fluorouracil-based adjuvant chemotherapy for colon cancer. N Engl J Med, 349(3), 247-257. https://doi.org/10.1056/NEJMoa022289
Robinson, S. M., Wilson, C. H., Burt, A. D., Manas, D. M., & White, S. A. (2012). Chemotherapy-associated liver injury in patients with colorectal liver metastases: a systematic review and meta-analysis. Ann Surg Oncol, 19(13), 4287-4299. https://doi.org/10.1245/s10434-012-2438-8
Roels, S., Duthoy, W., Haustermans, K., Penninckx, F., Vandecaveye, V., Boterberg, T., & De Neve, W. (2006). Definition and delineation of the clinical target volume for rectal cancer. Int J Radiat Oncol Biol Phys, 65(4), 1129-1142. https://dx.doi.org/10.1016/j.ijrobp.2006.02.050
Rollins, K. E., Javanmard-Emamghissi, H., & Lobo, D. N. (2018). Impact of mechanical bowel preparation in elective colorectal surgery: A meta-analysis. World J Gastroenterol, 24(4), 519-536. https://doi.org/10.3748/wjg.v24.i4.519
Rominger, C. J., Gunderson, L. L., Gelber, R. D., & Conner, N. (1985). Radiation therapy alone or in combination with chemotherapy in the treatment of residual or inoperable carcinoma of the rectum and rectosigmoid or pelvic recurrence following colorectal surgery. Radiation Therapy Oncology Group study (76-16). Am J Clin Oncol, 8(2), 118-127. https://doi.org/10.1097/00000421-198504000-00003
Rondelli, F., Trastulli, S., Cirocchi, R., Avenia, N., Mariani, E., Sciannameo, F., & Noya, G. (2012). Rectal washout and local recurrence in rectal resection for cancer: a meta-analysis. Colorectal Dis, 14(11), 1313-1321. https://doi.org/10.1111/j.1463-1318.2011.02903.x
Ronnett, B. M., Yan, H., Kurman, R. J., Shmookler, B. M., Wu, L., & Sugarbaker, P. H. (2001). Patients with pseudomyxoma peritonei associated with disseminated peritoneal adenomucinosis have a significantly more favorable prognosis than patients with peritoneal mucinous carcinomatosis. Cancer, 92(1), 85-91. https://doi.org/10.1002/1097-0142(20010701)92:1<85::Aid-Cncr1295>3.0.Co;2-R
Rosati, G., Ambrosini, G., Barni, S., Andreoni, B., Corradini, G., Luchena, G., . . . Fossati, R. (2016). A randomized trial of intensive versus minimal surveillance of patients with resected Dukes B2-C colorectal carcinoma. Ann Oncol, 27(2), 274-280. https://doi.org/10.1093/annonc/mdv541
Rosenberg, R., Friederichs, J., Schuster, T., Gertler, R., Maak, M., Becker, K., . . . Siewert, J. R. (2008). Prognosis of patients with colorectal cancer is associated with lymph node ratio: a single-center analysis of 3,026 patients over a 25-year time period. Ann Surg, 248(6), 968-978.
Rosty, C., Brosens, L. A. A., Dekker, E., & Nagtegaal, I. D. (2019). Serrated polyposis. I: M. J. Arends, F. Carneiro, S. F. Lax, & A. J. Lazar (red.), WHO Classification of Tumours of the Digestive System (s. 532-534). Lyon: IARC Press:.
Rothenberger, D. A., & Garcia-Aguilar, J. (2002). Management of cancer in a polyp. I: L. B. Saltz (red.), Colorectal cancer: multimodality management (s. 325-335). Totowa, N.J.: Humana.
Russell, A. H., Clyde, C., Wasserman, T. H., Turner, S. S., & Rotman, M. (1993). Accelerated hyperfractionated hepatic irradiation in the management of patients with liver metastases: results of the RTOG dose escalating protocol. Int J Radiat Oncol Biol Phys, 27(1), 117-123. https://doi.org/10.1016/0360-3016(93)90428-x
Rusthoven, K. E., Kavanagh, B. D., Burri, S. H., Chen, C., Cardenes, H., Chidel, M. A., . . . Schefter, T. E. (2009). Multi-institutional phase I/II trial of stereotactic body radiation therapy for lung metastases. J Clin Oncol, 27(10), 1579-1584. https://doi.org/10.1200/JCO.2008.19.6386
Rutter, M. D., East, J., Rees, C. J., Cripps, N., Docherty, J., Dolwani, S., . . . Sharp, L. (2020). British Society of Gastroenterology/Association of Coloproctology of Great Britain and Ireland/Public Health England post-polypectomy and post-colorectal cancer resection surveillance guidelines. Gut, 69(2), 201-223. https://doi.org/10.1136/gutjnl-2019-319858
Rutter, M. D., Nickerson, C., Rees, C. J., Patnick, J., & Blanks, R. G. (2014). Risk factors for adverse events related to polypectomy in the English Bowel Cancer Screening Programme. Endoscopy, 46(2), 90-97. https://doi.org/10.1055/s-0033-1344987
Sahani, D. V., Bajwa, M. A., Andrabi, Y., Bajpai, S., & Cusack, J. C. (2014). Current status of imaging and emerging techniques to evaluate liver metastases from colorectal carcinoma. Ann Surg, 259(5), 861-872. https://doi.org/10.1097/sla.0000000000000525
Saltz, L. B., Clarke, S., Diaz-Rubio, E., Scheithauer, W., Figer, A., Wong, R., . . . Cassidy, J. (2008). Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol, 26(12), 2013-2019.
Saltz, L. B., Niedzwiecki, D., Hollis, D., Goldberg, R. M., Hantel, A., Thomas, J. P., . . . Mayer, R. J. (2007). Irinotecan fluorouracil plus leucovorin is not superior to fluorouracil plus leucovorin alone as adjuvant treatment for stage III colon cancer: results of CALGB 89803. J Clin Oncol, 25(23), 3456-3461.
Sandström, P., Røsok, B. I., Sparrelid, E., Larsen, P. N., Larsson, A. L., Lindell, G., . . . Björnsson, B. (2018). ALPPS Improves Resectability Compared With Conventional Two-stage Hepatectomy in Patients With Advanced Colorectal Liver Metastasis: Results From a Scandinavian Multicenter Randomized Controlled Trial (LIGRO Trial). Ann Surg, 267(5), 833-840. https://doi.org/10.1097/sla.0000000000002511
Sanoff, H. K. (2018). Best evidence supports annual surveillance for resected colorectal cancer. JAMA, 319(20), 2083-2085. https://doi.org/10.1001/jama.2018.5817
Sato, K., Inomata, M., Kakisako, K., Shiraishi, N., Adachi, Y., & Kitano, S. (2003). Surgical technique influences bowel function after low anterior resection and sigmoid colectomy. Hepatogastroenterology, 50(53), 1381-1384.
Sauer, R., Liersch, T., Merkel, S., Fietkau, R., Hohenberger, W., Hess, C., . . . Rodel, C. (2012). Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol, 30(16), 1926-1933. https://doi.org/10.1200/jco.2011.40.1836
Schmoll, H. J., Tabernero, J., Maroun, J., de Braud, F., Price, T., Van Cutsem, E., . . . Haller, D. G. (2015). Capecitabine Plus Oxaliplatin Compared With Fluorouracil/Folinic Acid As Adjuvant Therapy for Stage III Colon Cancer: Final Results of the NO16968 Randomized Controlled Phase III Trial. J Clin Oncol, 33(32), 3733-3740. https://doi.org/10.1200/jco.2015.60.9107
Schmoll, H. J., Van Cutsem, E., Stein, A., Valentini, V., Glimelius, B., Haustermans, K., . . . Cervantes, A. (2012). ESMO Consensus Guidelines for management of patients with colon and rectal cancer. a personalized approach to clinical decision making. Ann Oncol, 23(10), 2479-2516. https://doi.org/10.1093/annonc/mds236
Schrag, D., Weng, S., Brooks, G., Meyerhardt, J. A., & Venook, A. P. (2016). The relationship between primary tumor sidedness and prognosis in colorectal cancer. J Clin Oncol, 34(15 suppl), 3505. https://doi.org/10.1200/JCO.2016.34.15_suppl.3505
Scope, A., Agero, A. L., Dusza, S. W., Myskowski, P. L., Lieb, J. A., Saltz, L., . . . Halpern, A. C. (2007). Randomized double-blind trial of prophylactic oral minocycline and topical tazarotene for cetuximab-associated acne-like eruption. J Clin Oncol, 25(34), 5390-5396. https://doi.org/10.1200/JCO.2007.12.6987
Sebag-Montefiore, D., Stephens, R. J., Steele, R., Monson, J., Grieve, R., Khanna, S., . . . Parmar, M. (2009). Preoperative radiotherapy versus selective postoperative chemoradiotherapy in patients with rectal cancer (MRC CR07 and NCIC-CTG C016): a multicentre, randomised trial. Lancet, 373(9666), 811-820. https://doi.org/10.1016/s0140-6736(09)60484-0
Sebastian, S., Johnston, S., Geoghegan, T., Torreggiani, W., & Buckley, M. (2004). Pooled analysis of the efficacy and safety of self-expanding metal stenting in malignant colorectal obstruction. Am J Gastroenterol, 99(10), 2051-2057. https://doi.org/10.1111/j.1572-0241.2004.40017.x
Segnan, N., Patnick, J., & von Karsa, L. (red.). (2010). European guidelines for quality assurance in colorectal cancer screening and diagnosis. Lyon: International Agency for Research on Cancer
Seitz, U., Bohnacker, S., Seewald, S., Thonke, F., Brand, B., Braiutigam, T., & Soehendra, N. (2004). Is endoscopic polypectomy an adequate therapy for malignant colorectal adenomas? Presentation of 114 patients and review of the literature. Dis Colon Rectum, 47(11), 1789-1796.
Selzner, M., Hany, T. F., Wildbrett, P., McCormack, L., Kadry, Z., & Clavien, P. A. (2004). Does the novel PET/CT imaging modality impact on the treatment of patients with metastatic colorectal cancer of the liver? Ann Surg, 240(6), 1027-1034.
Senagore, A. J., Emery, T., Luchtefeld, M., Kim, D., Dujovny, N., & Hoedema, R. (2009). Fluid management for laparoscopic colectomy: a prospective, randomized assessment of goal-directed administration of balanced salt solution or hetastarch coupled with an enhanced recovery program. Dis Colon Rectum, 52(12), 1935-1940. https://doi.org/10.1007/DCR.0b013e3181b4c35e
Sepulveda, A. R., Hamilton, S. R., Allegra, C. J., Grody, W., Cushman-Vokoun, A. M., Funkhouser, W. K., . . . Nowak, J. A. (2017a). Molecular Biomarkers for the Evaluation of Colorectal Cancer: Guideline From the American Society for Clinical Pathology, College of American Pathologists, Association for Molecular Pathology, and the American Society of Clinical Oncology. J Clin Oncol, 35(13), 1453-1486. https://doi.org/10.1200/jco.2016.71.9807
Sepulveda, A. R., Hamilton, S. R., Allegra, C. J., Grody, W., Cushman-Vokoun, A. M., Funkhouser, W. K., . . . Nowak, J. A. (2017b). Molecular Biomarkers for the Evaluation of Colorectal Cancer: Guideline Summary From the American Society for Clinical Pathology, College of American Pathologists, Association for Molecular Pathology, and American Society of Clinical Oncology. J Oncol Pract, 13(5), 333-337. https://doi.org/10.1200/jop.2017.022152
Seymour, M. T., Maughan, T. S., Ledermann, J. A., Topham, C., James, R., Gwyther, S. J., . . . National Cancer Research Institute Colorectal Clinical Studies, G. (2007). Different strategies of sequential and combination chemotherapy for patients with poor prognosis advanced colorectal cancer (MRC FOCUS): a randomised controlled trial. Lancet, 370(9582), 143-152. https://doi.org/10.1016/S0140-6736(07)61087-3
Shaukat, A., Kaltenbach, T., Dominitz, J. A., Robertson, D. J., Anderson, J. C., Cruise, M., . . . Rex, D. K. (2020). Endoscopic Recognition and Management Strategies for Malignant Colorectal Polyps: Recommendations of the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology, 159(5), 1916-1934.e1912. https://doi.org/10.1053/j.gastro.2020.08.050
Shihab, O. C., Moran, B. J., Heald, R. J., Quirke, P., & Brown, G. (2009). MRI staging of low rectal cancer. Eur Radiol, 19(3), 643-650. https://doi.org/10.1007/s00330-008-1184-6
Shihab, O. C., Taylor, F., Bees, N., Blake, H., Jeyadevan, N., Bleehen, R., . . . Brown, G. (2011). Relevance of magnetic resonance imaging-detected pelvic sidewall lymph node involvement in rectal cancer. Br J Surg, 98(12), 1798-1804. https://doi.org/10.1002/bjs.7662
Shirouzu, K., Isomoto, H., Hayashi, A., Nagamatsu, Y., & Kakegawa, T. (1995). Surgical treatment for patients with pulmonary metastases after resection of primary colorectal carcinoma. Cancer, 76(3), 393-398. https://pubmed.ncbi.nlm.nih.gov/8625119/
Silva, I. L., Iskandarani, M., Hotouras, A., Murphy, J., Bhan, C., Adada, B., & Wexner, S. D. (2017). A systematic review to assess the management of patients with cerebral metastases secondary to colorectal cancer. Tech Coloproctol, 21(11), 847-852. https://doi.org/10.1007/s10151-017-1707-8
Simillis, C., Mistry, K., & Prabhudesai, A. (2013). Intraoperative rectal washout in rectal cancer surgery: a survey of current practice in the UK. Int J Surg, 11(9), 993-997. https://doi.org/10.1016/j.ijsu.2013.06.002
Single-stage treatment for malignant left-sided colonic obstruction: a prospective randomized clinical trial comparing subtotal colectomy with segmental resection following intraoperative irrigation. The SCOTIA Study Group. Subtotal Colectomy versus On-table Irrigation and Anastomosis. (1995). Br J Surg, 82(12), 1622-1627. https://doi.org/10.1002/bjs.1800821211
Sjo, O. H., Larsen, S., Lunde, O. C., & Nesbakken, A. (2009). Short term outcome after emergency and elective surgery for colon cancer. Colorectal Dis, 11(7), 733-739. https://doi.org/10.1111/j.1463-1318.2008.01613.x
Smedley, F., Bowling, T., James, M., Stokes, E., Goodger, C., O'Connor, O., . . . Silk, D. (2004). Randomized clinical trial of the effects of preoperative and postoperative oral nutritional supplements on clinical course and cost of care. Br J Surg, 91(8), 983-990. https://doi.org/10.1002/bjs.4578
Smith, A. J., Driman, D. K., Spithoff, K., Hunter, A., McLeod, R. S., Simunovic, M., . . . Pathology. (2010). Guideline for optimization of colorectal cancer surgery and pathology. J Surg Oncol, 101(1), 5-12. https://doi.org/10.1002/jso.21395
Smith, I., Kranke, P., Murat, I., Smith, A., O'Sullivan, G., Soreide, E., . . . European Society of, A. (2011). Perioperative fasting in adults and children: guidelines from the European Society of Anaesthesiology. Eur J Anaesthesiol, 28(8), 556-569. https://doi.org/10.1097/EJA.0b013e3283495ba1
Smith, M. D., McCall, J., Plank, L., Herbison, G. P., Soop, M., & Nygren, J. (2014). Preoperative carbohydrate treatment for enhancing recovery after elective surgery. Cochrane Database Syst Rev, (8), CD009161. https://doi.org/10.1002/14651858.CD009161.pub2
Smith, N. J., Barbachano, Y., Norman, A. R., Swift, R. I., Abulafi, A. M., & Brown, G. (2008). Prognostic significance of magnetic resonance imaging-detected extramural vascular invasion in rectal cancer. Br J Surg, 95(2), 229-236. https://doi.org/10.1002/bjs.5917
Smith, N. J., Bees, N., Barbachano, Y., Norman, A. R., Swift, R. I., & Brown, G. (2007). Preoperative computed tomography staging of nonmetastatic colon cancer predicts outcome: implications for clinical trials. Br J Cancer, 96(7), 1030-1036. https://doi.org/10.1038/sj.bjc.6603646
Snyder, R. A., Hu, C., Cuddy, A., & et al. (2018). Association between intensity of posttreatment surveillance testing and detection of recurrence in patients with colorectal cancer. JAMA, 319(20), 2104-2115. https://doi.org/10.1001/jama.2018.5816
Sobrero, A. F., Maurel, J., Fehrenbacher, L., Scheithauer, W., Abubakr, Y. A., Lutz, M. P., . . . Burris, H. A., 3rd. (2008). EPIC: phase III trial of cetuximab plus irinotecan after fluoropyrimidine and oxaliplatin failure in patients with metastatic colorectal cancer. J Clin Oncol, 26(14), 2311-2319. https://doi.org/10.1200/JCO.2007.13.1193
Solomon, S. D., Wittes, J., Finn, P. V., Fowler, R., Viner, J., Bertagnolli, M. M., . . . Hawk, E. (2008). Cardiovascular risk of celecoxib in 6 randomized placebo-controlled trials: the cross trial safety analysis. Circulation, 117(16), 2104-2113. https://doi.org/10.1161/circulationaha.108.764530
Song, F., & Glenny, A. M. (1998). Antimicrobial prophylaxis in colorectal surgery: a systematic review of randomized controlled trials. Br J Surg, 85(9), 1232-1241. https://doi.org/10.1046/j.1365-2168.1998.00883.x
Soop, M., Nygren, J., Myrenfors, P., Thorell, A., & Ljungqvist, O. (2001). Preoperative oral carbohydrate treatment attenuates immediate postoperative insulin resistance. Am J Physiol Endocrinol Metab, 280(4), E576-583. https://doi.org/10.1152/ajpendo.2001.280.4.E576
Sorbye, H., Berglund, A., Tveit, K. M., Ogreid, D., Wanderas, E. H., Wentzel-Larsen, T., . . . Glimelius, B. (2007). Secondary treatment and predictive factors for second-line chemotherapy after first-line oxaliplatin-based therapy in metastatic colorectal cancer. Acta Oncol, 46(7), 982-988. https://doi.org/10.1080/02841860701261568
Sorbye, H., Cvancarova, M., Qvortrup, C., Pfeiffer, P., & Glimelius, B. (2013). Age-dependent improvement in median and long-term survival in unselected population-based Nordic registries of patients with synchronous metastatic colorectal cancer. Ann Oncol, 24(9), 2354-2360. https://doi.org/10.1093/annonc/mdt197
Sorbye, H., Glimelius, B., Berglund, A., Fokstuen, T., Tveit, K. M., Braendengen, M., . . . Dahl, O. (2004). Multicenter phase II study of Nordic fluorouracil and folinic acid bolus schedule combined with oxaliplatin as first-line treatment of metastatic colorectal cancer. Journal of Clinical Oncology, 22(1), 31-38. https://doi.org/10.1200/Jco.2004.05.188
Sorbye, H., Mauer, M., Gruenberger, T., Glimelius, B., Poston, G. J., Schlag, P. M., . . . Federation Francophone de Cancerologie, D. (2012). Predictive factors for the benefit of perioperative FOLFOX for resectable liver metastasis in colorectal cancer patients (EORTC Intergroup Trial 40983). Ann Surg, 255(3), 534-539. https://doi.org/10.1097/SLA.0b013e3182456aa2
Sorbye, H., Pfeiffer, P., Cavalli-Bjorkman, N., Qvortrup, C., Holsen, M. H., Wentzel-Larsen, T., & Glimelius, B. (2009). Clinical trial enrollment, patient characteristics, and survival differences in prospectively registered metastatic colorectal cancer patients. Cancer, 115(20), 4679-4687. https://doi.org/10.1002/cncr.24527
Soreide, J. A., Eiriksson, K., Sandvik, O., Viste, A., Horn, A., Johnsen, G., & Gronbech, J. E. (2008). [Surgical treatment of liver metastases from colorectal cancer]. Tidsskr Nor Laegeforen, 128(1), 50-53.
Spanos, W. J., Jr., Wasserman, T., Meoz, R., Sala, J., Kong, J., & Stetz, J. (1987). Palliation of advanced pelvic malignant disease with large fraction pelvic radiation and misonidazole: final report of RTOG phase I/II study. Int J Radiat Oncol Biol Phys, 13(10), 1479-1482. https://doi.org/10.1016/0360-3016(87)90314-2
Spigelman, A. D., Williams, C. B., Talbot, I. C., Domizio, P., & Phillips, R. K. (1989). Upper gastrointestinal cancer in patients with familial adenomatous polyposis. Lancet, 2(8666), 783-785. https://doi.org/10.1016/s0140-6736(89)90840-4
Spinelli, P., Calarco, G., Mancini, A., & Ni, X. G. (2006). Operative colonoscopy in cancer patients. Minim Invasive Ther Allied Technol, 15(6), 339-347. https://doi.org/10.1080/13645700601038036
Stang, A., Fischbach, R., Teichmann, W., Bokemeyer, C., & Braumann, D. (2009). A systematic review on the clinical benefit and role of radiofrequency ablation as treatment of colorectal liver metastases. European Journal of Cancer, 45(10), 1748-1756. https://doi.org/10.1016/j.ejca.2009.03.012
Starck, M., Bohe, M., Simanaitis, M., & Valentin, L. (2003). Rectal endosonography can distinguish benign rectal lesions from invasive early rectal cancers. Colorectal Dis., 5(3), 246-250.
Stein, G. E. (2005). Regulated drug development and usage. I: T. M. Brody, J. Larner, L. Wecker, & K. P. Minneman (red.), Brody's human pharmacology: molecular to clinical (s. 71-75). Philadelphia: Elsevier Mosby.
Steinberg, S. M., Barkin, J. S., Kaplan, R. S., & Stablein, D. M. (1986). Prognostic indicators of colon tumors. The Gastrointestinal Tumor Study Group experience. Cancer, 57(9), 1866-1870.
https://pubmed.ncbi.nlm.nih.gov/3485470/
Stevenson, A. R., Solomon, M. J., Lumley, J. W., Hewett, P., Clouston, A. D., Gebski, V. J., . . . Simes, J. (2015). Effect of Laparoscopic-Assisted Resection vs Open Resection on Pathological Outcomes in Rectal Cancer: The ALaCaRT Randomized Clinical Trial. JAMA, 314(13), 1356-1363. https://doi.org/10.1001/jama.2015.12009
Stoltz, A., Gagniere, J., Dupre, A., & Rivoire, M. (2014). Radiofrequency ablation for colorectal liver metastases. J Visc Surg, 151 Suppl 1, S33-44. https://doi.org/10.1016/j.jviscsurg.2013.12.005
Storli, P. E., Johnsen, G., Juel, I. S., Grønbech, J. E., & Bringeland, E. A. (2019). Impact of increased resection rates and a liver parenchyma sparing strategy on long-term survival after surgery for colorectal liver metastases. A population-based study. Scand J Gastroenterol, 54(7), 890-898. https://doi.org/10.1080/00365521.2019.1641215
Stormark, K., Søreide, K., Søreide, J. A., Kvaløy, J. T., Pfeffer, F., Eriksen, M. T., . . . Kørner, H. (2016). Nationwide implementation of laparoscopic surgery for colon cancer: short-term outcomes and long-term survival in a population-based cohort. Surg Endosc, 30(11), 4853-4864. https://doi.org/10.1007/s00464-016-4819-8
Sugarbaker, P. H. (2003). Carcinomatosis--is cure an option? J Clin Oncol, 21(5), 762-764. https://doi.org/10.1200/JCO.2003.12.071
Sugarbaker, P. H. (2010). Surgical responsibilities in the management of peritoneal carcinomatosis. J Surg Oncol, 101(8), 713-724. https://doi.org/10.1002/jso.21484
Sugarbaker, P. H., & Chang, D. (1999). Results of treatment of 385 patients with peritoneal surface spread of appendiceal malignancy. Ann Surg Oncol, 6(8), 727-731. https://doi.org/10.1007/s10434-999-0727-7
Sugihara, K., Kobayashi, H., Kato, T., Mori, T., Mochizuki, H., Kameoka, S., . . . Muto, T. (2006). Indication and benefit of pelvic sidewall dissection for rectal cancer. Dis Colon Rectum, 49(11), 1663-1672. https://doi.org/10.1007/s10350-006-0714-z
Sun, Z., Adam, M. A., Kim, J., Nussbaum, D. P., Benrashid, E., Mantyh, C. R., & Migaly, J. (2016). Determining the Optimal Timing for Initiation of Adjuvant Chemotherapy After Resection for Stage II and III Colon Cancer. Dis Colon Rectum, 59(2), 87-93. https://doi.org/10.1097/dcr.0000000000000518
Sundermeyer, M. L., Meropol, N. J., Rogatko, A., Wang, H., & Cohen, S. J. (2005). Changing patterns of bone and brain metastases in patients with colorectal cancer. Clin Colorectal Cancer, 5(2), 108-113. https://doi.org/10.3816/ccc.2005.n.022
Suzuki, H., Fujii, T., Asao, T., Tsutsumi, S., Wada, S., Araki, K., . . . Kuwano, H. (2014). Extracapsular lymph node involvement is associated with colorectal liver metastases and impact outcome after hepatectomy for colorectal metastases. World J Surg, 38(8), 2079-2088. https://doi.org/10.1007/s00268-014-2488-0
Sørbye, H., Brændengen, M., & Balteskard, L. (2008). Palliativ kjemoterapi og strålebehandling ved metastatisk kolorektal cancer. Tidsskr Nor Lægeforen, 128(2), 194-197.
Søreide, K., Træland, J. H., Stokkeland, P. J., Glomsaker, T., Søreide, J. A., & Kørner, H. (2012). Adherence to national guidelines for surveillance after curative resection of nonmetastatic colon and rectum cancer: a survey among Norwegian gastrointestinal surgeons. Colorectal Dis, 14(3), 320-324. https://doi.org/10.1111/j.1463-1318.2011.02631.x
Sørensen, O., Flatmark, K., Reed, W., Wiig, J. N., Dueland, S., Giercksky, K. E., & Larsen, S. G. (2012). Evaluation of complete cytoreductive surgery and two intraperitoneal chemotherapy techniques in Pseudomyxoma peritonei. Eur J Surg Oncol, 38(10), 969-976. https://doi.org/10.1016/j.ejso.2012.06.552
Takahashi, T., Ueno, M., Azekura, K., & Ohta, H. (2000). Lateral node dissection and total mesorectal excision for rectal cancer. Dis Colon Rectum, 43(10 Suppl), S59-68. https://doi.org/10.1007/BF02237228
Tambyraja, A. L., Sengupta, F., MacGregor, A. B., Bartolo, D. C., & Fearon, K. C. (2004). Patterns and clinical outcomes associated with routine intravenous sodium and fluid administration after colorectal resection. World J Surg, 28(10), 1046-1051; discussion 1051-1042. https://doi.org/10.1007/s00268-004-7383-7
Tanaka, Y., Maniwa, Y., Nishio, W., Yoshimura, M., & Okita, Y. (2008). The optimal timing to resect pulmonary metastasis. Eur J Cardiothorac Surg, 33(6), 1135-1138. https://doi.org/10.1016/j.ejcts.2008.03.002
Tanis, E., Nordlinger, B., Mauer, M., Sorbye, H., van Coevorden, F., Gruenberger, T., . . . Ruers, T. J. (2014). Local recurrence rates after radiofrequency ablation or resection of colorectal liver metastases. Analysis of the European Organisation for Research and Treatment of Cancer #40004 and #40983. Eur J Cancer, 50(5), 912-919. https://doi.org/10.1016/j.ejca.2013.12.008
Tanis, P. J., Doeksen, A., & van Lanschot, J. J. (2013). Intentionally curative treatment of locally recurrent rectal cancer: a systematic review. Canadian journal of surgery. Journal canadien de chirurgie, 56(2), 135-144. https://doi.org/10.1503/cjs.025911
Taylor, F. G., Swift, R. I., Blomqvist, L., & Brown, G. (2008). A systematic approach to the interpretation of preoperative staging MRI for rectal cancer. AJR Am J Roentgenol, 191(6), 1827-1835. https://doi.org/10.2214/ajr.08.1004
Taylor, F. G. M., Quirke, P., Heald, R. J., Moran, B., Blomqvist, L., Swift, I., . . . Grp, M. S. (2011). One millimetre is the safe cut-off for magnetic resonance imaging prediction of surgical margin status in rectal cancer. British Journal of Surgery, 98(6), 872-879. https://doi.org/10.1002/bjs.7458
Tejpar, S., Stintzing, S., Ciardiello, F., Tabernero, J., Van Cutsem, E., Beier, F., . . . Heinemann, V. (2016). Prognostic and Predictive Relevance of Primary Tumor Location in Patients With RAS Wild-Type Metastatic Colorectal Cancer: Retrospective Analyses of the CRYSTAL and FIRE-3 Trials. JAMA Oncol, Oct 10 [Epub ahead of print]. https://doi.org/10.1001/jamaoncol.2016.3797
ten Broeke, S. W., Brohet, R. M., Tops, C. M., van der Klift, H. M., Velthuizen, M. E., Bernstein, I., . . . Wijnen, J. T. (2015). Lynch syndrome caused by germline PMS2 mutations: delineating the cancer risk. J Clin Oncol, 33(4), 319-325. https://doi.org/10.1200/jco.2014.57.8088
Thelen, A., Jonas, S., Benckert, C., Schumacher, G., Lopez-Hanninen, E., Rudolph, B., . . . Neuhaus, P. (2007). Repeat liver resection for recurrent liver metastases from colorectal cancer. Eur J Surg Oncol, 33(3), 324-328. https://doi.org/10.1016/j.ejso.2006.10.016
Tilney, H. S., Lovegrove, R. E., Purkayastha, S., Sains, P. S., Weston-Petrides, G. K., Darzi, A. W., . . . Heriot, A. G. (2007). Comparison of colonic stenting and open surgery for malignant large bowel obstruction. Surg Endosc, 21(2), 225-233. https://doi.org/10.1007/s00464-005-0644-1
Tjandra, J. J., & Chan, M. K. (2006). Systematic review on the short-term outcome of laparoscopic resection for colon and rectosigmoid cancer. Colorectal Dis, 8(5), 375-388. https://doi.org/10.1111/j.1463-1318.2006.00974.x
Tjandra, J. J., Kilkenny, J. W., Buie, W. D., Hyman, N., Simmang, C., Anthony, T., . . . Rectal, S. (2005). Practice parameters for the management of rectal cancer (revised). Dis Colon Rectum, 48(3), 411-423. https://doi.org/10.1007/s10350-004-0937-9
TNM: classification of malignant tumors. (2016). (8 utg.). Oxford: Wiley-Blackwell.
Tournigand, C., Andre, T., Achille, E., Lledo, G., Flesh, M., Mery-Mignard, D., . . . de Gramont, A. (2004). FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol, 22(2), 229-237. https://doi.org/10.1200/JCO.2004.05.113
Tranø, G., Wasmuth, H., Sjursen, W., & Vatten, L. (2011). Patient and tumor characteristics may raise clinicians' awareness of familial colorectal cancer: a Norwegian population-based study. Scand J Gastroenterol, 46(10), 1236-1242. https://doi.org/10.3109/00365521.2011.594086
Treasure, T., Fallowfield, L., Farewell, V., Ferry, D., Lees, B., Leonard, P., . . . Pulmonary Metastasectomy in Colorectal Cancer trial development, g. (2009). Pulmonary metastasectomy in colorectal cancer: time for a trial. Eur J Surg Oncol, 35(7), 686-689. https://doi.org/10.1016/j.ejso.2008.12.005
Troja, A., El-Sourani, N., Abdou, A., Antolovic, D., & Raab, H. R. (2015). Surgical options for locally recurrent rectal cancer--review and update. Int J Colorectal Dis, 30(9), 1157-1163. https://doi.org/10.1007/s00384-015-2249-z
Tronstad, P. K., Simpson, L. V. H., Olsen, B., Pfeffer, F., & Karliczek, A. (2020). Low rate of local recurrence detection by rectoscopy in follow-up of rectal cancer. Colorectal Dis, 22(3), 254-260. https://doi.org/10.1111/codi.14858
Tudyka, V., Blomqvist, L., Beets-Tan, R. G., Boelens, P. G., Valentini, V., van de Velde, C. J., . . . Brown, G. (2014). EURECCA consensus conference highlights about colon & rectal cancer multidisciplinary management: the radiology experts review. Eur J Surg Oncol, 40(4), 469-475. https://doi.org/10.1016/j.ejso.2013.10.029
Tveit, K. M., Guldvog, I., Hagen, S., Trondsen, E., Harbitz, T., Nygaard, K., . . . Hannisdal, E. (1997). Randomized controlled trial of postoperative radiotherapy and short-term time-scheduled 5-fluorouracil against surgery alone in the treatment of Dukes B and C rectal cancer. Norwegian Adjuvant Rectal Cancer Project Group. Br J Surg, 84(8), 1130-1135.
Tveit, K. M., Guren, T., Glimelius, B., Pfeiffer, P., Sorbye, H., Pyrhonen, S., . . . Christoffersen, T. (2012). Phase III trial of cetuximab with continuous or intermittent fluorouracil, leucovorin, and oxaliplatin (Nordic FLOX) versus FLOX alone in first-line treatment of metastatic colorectal cancer: the NORDIC-VII study. J Clin Oncol, 30(15), 1755-1762. https://doi.org/10.1200/JCO.2011.38.0915
Twelves, C., Wong, A., Nowacki, M. P., Abt, M., Burris, H., Carrato, A., . . . Scheithauer, W. (2005). Capecitabine as adjuvant treatment for stage III colon cancer. New England Journal of Medicine, 352(26), 2696-2704. https://doi.org/10.1056/NEJMoa043116
Tytherleigh, M. G., Warren, B. F., & Mortensen, N. J. (2008). Management of early rectal cancer. Br J Surg, 95(4), 409-423. https://doi.org/10.1002/bjs.6127
Uchida, I., Asoh, T., Shirasaka, C., & Tsuji, H. (1988). Effect of Epidural Analgesia on Postoperative Insulin Resistance as Evaluated by Insulin Clamp Technique. British Journal of Surgery, 75(6), 557-562. https://doi.org/10.1002/bjs.1800750618
Umar, A., Boland, C. R., Terdiman, J. P., Syngal, S., de la Chapelle, A., Ruschoff, J., . . . Srivastava, S. (2004). Revised Bethesda Guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability. J Natl Cancer Inst, 96(4), 261-268. https://doi.org/10.1093/jnci/djh034
Umpleby, H. C., & Williamson, R. C. (1984). Survival in acute obstructing colorectal carcinoma. Dis Colon Rectum, 27(5), 299-304. https://doi.org/10.1007/BF02555634
Vale, C. L., Tierney, J. F., Fisher, D., Adams, R. A., Kaplan, R., Maughan, T. S., . . . Meade, A. M. (2012). Does anti-EGFR therapy improve outcome in advanced colorectal cancer? A systematic review and meta-analysis. Cancer Treat Rev, 38(6), 618-625. https://doi.org/10.1016/j.ctrv.2011.11.002
Valentini, V., Glimelius, B., Haustermans, K., Marijnen, C. A., Rodel, C., Gambacorta, M. A., . . . van de Velde, C. J. (2014). EURECCA consensus conference highlights about rectal cancer clinical management: the radiation oncologist's expert review. Radiother Oncol, 110(1), 195-198. https://doi.org/10.1016/j.radonc.2013.10.024
Valentini, V., Morganti, A. G., Gambacorta, M. A., Mohiuddin, M., Doglietto, G. B., Coco, C., . . . Study Group for Therapies of Rectal, M. (2006). Preoperative hyperfractionated chemoradiation for locally recurrent rectal cancer in patients previously irradiated to the pelvis: A multicentric phase II study. Int J Radiat Oncol Biol Phys, 64(4), 1129-1139. https://doi.org/10.1016/j.ijrobp.2005.09.017
Van Cutsem, E., Cervantes, A., Adam, R., Sobrero, A., Van Krieken, J. H., Aderka, D., . . . Arnold, D. (2016). ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann Oncol, 27(8), 1386-1422. https://doi.org/10.1093/annonc/mdw235
Van Cutsem, E., Kohne, C. H., Hitre, E., Zaluski, J., Chang Chien, C. R., Makhson, A., . . . Rougier, P. (2009). Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med, 360(14), 1408-1417.
Van Cutsem, E., Labianca, R., Bodoky, G., Barone, C., Aranda, E., Nordlinger, B., . . . Cunningham, D. (2009). Randomized phase III trial comparing biweekly infusional fluorouracil/leucovorin alone or with irinotecan in the adjuvant treatment of stage III colon cancer: PETACC-3. J Clin Oncol, 27(19), 3117-3125. https://doi.org/10.1200/JCO.2008.21.6663
Van Cutsem, E., Peeters, M., Siena, S., Humblet, Y., Hendlisz, A., Neyns, B., . . . Amado, R. G. (2007). Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. J Clin Oncol, 25(13), 1658-1664. https://doi.org/10.1200/JCO.2006.08.1620
Van Cutsem, E., Rivera, F., Berry, S., Kretzschmar, A., Michael, M., DiBartolomeo, M., . . . First, B. i. (2009). Safety and efficacy of first-line bevacizumab with FOLFOX, XELOX, FOLFIRI and fluoropyrimidines in metastatic colorectal cancer: the BEAT study. Ann Oncol, 20(11), 1842-1847. https://doi.org/10.1093/annonc/mdp233
van de Velde, C. J., Boelens, P. G., Borras, J. M., Coebergh, J. W., Cervantes, A., Blomqvist, L., . . . Valentini, V. (2014). EURECCA colorectal: multidisciplinary management: European consensus conference colon & rectum. Eur J Cancer, 50(1):1.e1-1.e34. https://doi.org/10.1016/j.ejca.2013.06.048
van Delden, O. M., & Lameris, J. S. (2008). Percutaneous drainage and stenting for palliation of malignant bile duct obstruction. Eur Radiol, 18(3), 448-456. https://doi.org/10.1007/s00330-007-0796-6
van der Paardt, M. P., Zagers, M. B., Beets-Tan, R. G., Stoker, J., & Bipat, S. (2013). Patients who undergo preoperative chemoradiotherapy for locally advanced rectal cancer restaged by using diagnostic MR imaging: a systematic review and meta-analysis. Radiology, 269(1), 101-112. https://doi.org/10.1148/radiol.13122833
van der Valk, M. J. M., Marijnen, C. A. M., van Etten, B., Dijkstra, E. A., Hilling, D. E., Kranenbarg, E. M., . . . Hospers, G. A. P. (2020). Compliance and tolerability of short-course radiotherapy followed by preoperative chemotherapy and surgery for high-risk rectal cancer - Results of the international randomized RAPIDO-trial. Radiother Oncol, 147, 75-83. https://doi.org/10.1016/j.radonc.2020.03.011
van Dijk, T. H., Tamas, K., Beukema, J. C., Beets, G. L., Gelderblom, A. J., de Jong, K. P., . . . Havenga, K. (2013). Evaluation of short-course radiotherapy followed by neoadjuvant bevacizumab, capecitabine, and oxaliplatin and subsequent radical surgical treatment in primary stage IV rectal cancer. Ann Oncol, 24(7), 1762-1769. https://doi.org/10.1093/annonc/mdt124
van Gijn, W., Marijnen, C. A., Nagtegaal, I. D., Kranenbarg, E. M., Putter, H., Wiggers, T., . . . van de Velde, C. J. (2011). Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol, 12(6), 575-582. https://doi.org/10.1016/s1470-2045(11)70097-3
van Gijn, W., van Stiphout, R. G., van de Velde, C. J., Valentini, V., Lammering, G., Gambacorta, M. A., . . . Lambin, P. (2015). Nomograms to predict survival and the risk for developing local or distant recurrence in patients with rectal cancer treated with optional short-term radiotherapy. Ann Oncol, 26(5), 928-935. https://doi.org/10.1093/annonc/mdv023
van Ruth, S., Verwaal, V. J., & Zoetmulder, F. A. (2003). Pharmacokinetics of intraperitoneal mitomycin C. Surg Oncol Clin N Am, 12(3), 771-780. https://doi.org/10.1016/s1055-3207(03)00031-0
Vandermeulen, E. P., Van Aken, H., & Vermylen, J. (1994). Anticoagulants and spinal-epidural anesthesia. Anesth Analg, 79(6), 1165-1177. https://doi.org/10.1213/00000539-199412000-00024
Vasen, H. F., Blanco, I., Aktan-Collan, K., Gopie, J. P., Alonso, A., Aretz, S., . . . Moslein, G. (2013). Revised guidelines for the clinical management of Lynch syndrome (HNPCC): recommendations by a group of European experts. Gut, 62(6), 812-823. https://doi.org/10.1136/gutjnl-2012-304356
Vasen, H. F., Moslein, G., Alonso, A., Aretz, S., Bernstein, I., Bertario, L., . . . Wijnen, J. (2008). Guidelines for the clinical management of familial adenomatous polyposis (FAP). Gut, 57(5), 704-713. https://doi.org/10.1136/gut.2007.136127
Vasen, H. F., Tomlinson, I., & Castells, A. (2015). Clinical management of hereditary colorectal cancer syndromes. Nature reviews. Gastroenterology & hepatology, 12(2), 88-97. https://doi.org/10.1038/nrgastro.2014.229
Vasen, H. F., Watson, P., Mecklin, J. P., & Lynch, H. T. (1999). New clinical criteria for hereditary nonpolyposis colorectal cancer (HNPCC, Lynch syndrome) proposed by the International Collaborative group on HNPCC. Gastroenterology, 116(6), 1453-1456. https://doi.org/10.1016/s0016-5085(99)70510-x
Vatn, M. H., & Stalsberg, H. (1982). The prevalence of polyps of the large intestine in Oslo: an autopsy study. Cancer, 49(4), 819-825. https://pubmed.ncbi.nlm.nih.gov/7055790/
Veileder i biopsibesvarelse av maligne svulster. (2012). (2 utg.). (Skriftserie for leger: Utdanning og kvalitetsutvikling). Oslo: Den norske legeforening.
Venderbosch, S., Doornebal, J., Teerenstra, S., Lemmens, W., Punt, C. J., & Koopman, M. (2012). Outcome of first line systemic treatment in elderly compared to younger patients with metastatic colorectal cancer: a retrospective analysis of the CAIRO and CAIRO2 studies of the Dutch Colorectal Cancer Group (DCCG). Acta Oncol, 51(7), 831-839. https://doi.org/10.3109/0284186X.2012.699193
Vennix, S., Pelzers, L., Bouvy, N., Beets, G. L., Pierie, J. P., Wiggers, T., & Breukink, S. (2014). Laparoscopic versus open total mesorectal excision for rectal cancer. Cochrane Database Syst Rev, 4, Cd005200. https://doi.org/10.1002/14651858.CD005200.pub3
Venook, A. P., Niedzwiecki, D., Innocenti, F., Fruth, B., Greene, C., O'Neil, B. H., . . . Lenz, H.-J. (2016). Impact of primary (1º) tumor location on overall survival (OS) and progression-free survival (PFS) in patients (pts) with metastatic colorectal cancer (mCRC): Analysis of CALGB/SWOG 80405 (Alliance). J Clin Oncol, 34(15 suppl), 3504. https://doi.org/10.1200/JCO.2016.34.15_suppl.3504
Venook, A. P., Niedzwiecki, D., Lenz, H. J., Innocenti, F., Fruth, B., Meyerhardt, J. A., . . . Blanke, C. (2017). Effect of First-Line Chemotherapy Combined With Cetuximab or Bevacizumab on Overall Survival in Patients With KRAS Wild-Type Advanced or Metastatic Colorectal Cancer: A Randomized Clinical Trial. JAMA, 317(23), 2392-2401. https://doi.org/10.1001/jama.2017.7105
Verwaal, V. J., Bruin, S., Boot, H., van Slooten, G., & van Tinteren, H. (2008). 8-year follow-up of randomized trial: cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy in patients with peritoneal carcinomatosis of colorectal cancer. Ann Surg Oncol, 15(9), 2426-2432. https://doi.org/10.1245/s10434-008-9966-2
Verwaal, V. J., van Ruth, S., Witkamp, A., Boot, H., van Slooten, G., & Zoetmulder, F. A. (2005). Long-term survival of peritoneal carcinomatosis of colorectal origin. Ann Surg Oncol, 12(1), 65-71. https://doi.org/10.1007/s10434-004-1167-z
Vleugels, J. L. A., Hazewinkel, Y., Fockens, P., & Dekker, E. (2017). Natural history of diminutive and small colorectal polyps: a systematic literature review. Gastrointest Endosc, 85(6), 1169-1176.e1161. https://doi.org/10.1016/j.gie.2016.12.014
Vuik, F. E., Nieuwenburg, S. A., Bardou, M., Lansdorp-Vogelaar, I., Dinis-Ribeiro, M., Bento, M. J., . . . Spaander, M. C. (2019). Increasing incidence of colorectal cancer in young adults in Europe over the last 25 years. Gut, 68(10), 1820-1826. https://doi.org/10.1136/gutjnl-2018-317592
Walker, K. J., & Smith, A. F. (2009). Premedication for anxiety in adult day surgery. Cochrane Database Syst Rev, (4), CD002192. https://doi.org/10.1002/14651858.CD002192.pub2
Walsh, S. R., Tang, T., Bass, S., & Gaunt, M. E. (2008). Doppler-guided intra-operative fluid management during major abdominal surgery: systematic review and meta-analysis. Int J Clin Pract, 62(3), 466-470. https://doi.org/10.1111/j.1742-1241.2007.01516.x
Wanders, L. K., Dekker, E., Pullens, B., Bassett, P., Travis, S. P., & East, J. E. (2014). Cancer risk after resection of polypoid dysplasia in patients with longstanding ulcerative colitis: a meta-analysis. Clin Gastroenterol Hepatol, 12(5), 756-764. https://doi.org/10.1016/j.cgh.2013.07.024
Wanebo, H. J., Gaker, D. L., Whitehill, R., Morgan, R. F., & Constable, W. C. (1987). Pelvic recurrence of rectal cancer. Options for curative resection. Ann Surg, 205(5), 482-495. https://doi.org/10.1097/00000658-198705000-00006
Wasmuth, H. H., Faerden, A. E., Myklebust, T., Pfeffer, F., Norderval, S., Riis, R., . . . Rashid, G. (2020). Transanal total mesorectal excision for rectal cancer has been suspended in Norway. Br J Surg, 107(1), 121-130. https://doi.org/10.1002/bjs.11459
Watt, A. M., Faragher, I. G., Griffin, T. T., Rieger, N. A., & Maddern, G. J. (2007). Self-expanding metallic stents for relieving malignant colorectal obstruction: a systematic review. Ann Surg, 246(1), 24-30. https://doi.org/10.1097/01.sla.0000261124.72687.72
West, N. P., Anderin, C., Smith, K. J., Holm, T., & Quirke, P. (2010). Multicentre experience with extralevator abdominoperineal excision for low rectal cancer. Br J Surg, 97(4), 588-599. https://doi.org/10.1002/bjs.6916
West, N. P., Hohenberger, W., Weber, K., Perrakis, A., Finan, P. J., & Quirke, P. (2010). Complete mesocolic excision with central vascular ligation produces an oncologically superior specimen compared with standard surgery for carcinoma of the colon. J Clin Oncol, 28(2), 272-278. https://doi.org/10.1200/JCO.2009.24.1448
Westwood, M., Joore, M., Grutters, J., Redekop, K., Armstrong, N., Lee, K., . . . Kleijnen, J. (2013). Contrast-enhanced ultrasound using SonoVue(R) (sulphur hexafluoride microbubbles) compared with contrast-enhanced computed tomography and contrast-enhanced magnetic resonance imaging for the characterisation of focal liver lesions and detection of liver metastases: a systematic review and cost-effectiveness analysis. Health Technol Assess, 17(16), 1-243. https://doi.org/10.3310/hta17160
WHO Definition of Palliative Care. (2010). [nettdokument]. Geneva: World Health Organization. Hentet 16.12.2009, fra http://www.who.int/cancer/palliative/definition/en/
Wibe, A., Rendedal, P. R., Svensson, E., Norstein, J., Eide, T. J., Myrvold, H. E., & Soreide, O. (2002). Prognostic significance of the circumferential resection margin following total mesorectal excision for rectal cancer. Br J Surg, 89(3), 327-334. https://doi.org/10.1046/j.0007-1323.2001.02024.x
Wicherts, D. A., de Haas, R. J., Salloum, C., Andreani, P., Pascal, G., Sotirov, D., . . . Azoulay, D. (2013). Repeat hepatectomy for recurrent colorectal metastases. Br J Surg, 100(6), 808-818. https://doi.org/10.1002/bjs.9088
Wiering, B., Krabbe, P. F., Jager, G. J., Oyen, W. J., & Ruers, T. J. (2005). The impact of fluor-18-deoxyglucose-positron emission tomography in the management of colorectal liver metastases. Cancer, 104(12), 2658-2670. https://doi.org/10.1002/cncr.21569
Wieszczy, P., Kaminski, M. F., Franczyk, R., Loberg, M., Kobiela, J., Rupinska, M., . . . Regula, J. (2020). Colorectal Cancer Incidence and Mortality After Removal of Adenomas During Screening Colonoscopies. Gastroenterology, 158(4), 875-883.e875. https://doi.org/10.1053/j.gastro.2019.09.011
Wieszczy, P., Regula, J., & Kaminski, M. F. (2017). Adenoma detection rate and risk of colorectal cancer. Best Pract Res Clin Gastroenterol, 31(4), 441-446. https://doi.org/10.1016/j.bpg.2017.07.002
Wiig, J. N., Larsen, S. G., Dueland, S., & Giercksky, K. E. (2008). Preoperative irradiation and surgery for local recurrence of rectal and rectosigmoid cancer. Prognostic factors with regard to survival and further local recurrence. Colorectal Disease, 10(1), 48-57. https://doi.org/10.1111/j.1463-1318.2007.01398.x
Wilkinson, K. J., Chua, W., Ng, W., & Roohullah, A. (2015). Management of asymptomatic primary tumours in stage IV colorectal cancer: Review of outcomes. World journal of gastrointestinal oncology, 7(12), 513-523. https://doi.org/10.4251/wjgo.v7.i12.513
Wille-Jørgensen, P., Syk, I., Smedh, K., Laurberg, S., Nielsen, D. T., Petersen, S. H., . . . Sorensen, H. T. (2018). Effect of More vs Less Frequent Follow-up Testing on Overall and Colorectal Cancer-Specific Mortality in Patients With Stage II or III Colorectal Cancer: The COLOFOL Randomized Clinical Trial. JAMA, 319(20), 2095-2103. https://doi.org/10.1001/jama.2018.5623
Winther, K. V., Jess, T., Langholz, E., Munkholm, P., & Binder, V. (2004). Long-term risk of cancer in ulcerative colitis: a population-based cohort study from Copenhagen County. Clin Gastroenterol Hepatol, 2(12), 1088-1095. https://doi.org/10.1016/s1542-3565(04)00543-9
World Cancer Research Fund, & American Institute for Cancer Research. (2018). Diet, nutrition, physical activity and cancer: a global perspective: the third expert report. [nettdokument]. London: World Cancer Research Fund. Hentet 13. november 2019, fra https://www.wcrf.org/dietandcancer
Yan, T. D., Black, D., Savady, R., & Sugarbaker, P. H. (2007). A systematic review on the efficacy of cytoreductive surgery and perioperative intraperitoneal chemotherapy for pseudomyxoma peritonei. Ann Surg Oncol, 14(2), 484-492. https://doi.org/10.1245/s10434-006-9182-x
Yan, T. D., & Morris, D. L. (2008). Cytoreductive surgery and perioperative intraperitoneal chemotherapy for isolated colorectal peritoneal carcinomatosis: experimental therapy or standard of care? Ann Surg, 248(5), 829-835. https://doi.org/10.1097/SLA.0b013e31818a15b5
Yano, H., & Moran, B. J. (2008). The incidence of lateral pelvic side-wall nodal involvement in low rectal cancer may be similar in Japan and the West. Br J Surg, 95(1), 33-49.
Yoshii, S., Nojima, M., Nosho, K., Omori, S., Kusumi, T., Okuda, H., . . . Hosokawa, M. (2014). Factors associated with risk for colorectal cancer recurrence after endoscopic resection of T1 tumors. Clin Gastroenterol Hepatol, 12(2), 292-302.e293. https://doi.org/10.1016/j.cgh.2013.08.008
Yothers, G., O'Connell, M. J., Allegra, C. J., Kuebler, J. P., Colangelo, L. H., Petrelli, N. J., & Wolmark, N. (2011). Oxaliplatin as adjuvant therapy for colon cancer: updated results of NSABP C-07 trial, including survival and subset analyses. J Clin Oncol, 29(28), 3768-3774. https://doi.org/10.1200/jco.2011.36.4539
You, Y. N., Skibber, J. M., Hu, C. Y., Crane, C. H., Das, P., Kopetz, E. S., . . . Chang, G. J. (2016). Impact of multimodal therapy in locally recurrent rectal cancer. Br J Surg, 103(6), 753-762. https://doi.org/10.1002/bjs.10079
Yu, S., Shabihkhani, M., Yang, D., Thara, E., Senagore, A., Lenz, H. J., . . . Barzi, A. (2013). Timeliness of adjuvant chemotherapy for stage III adenocarcinoma of the colon: a measure of quality of care. Clin Colorectal Cancer, 12(4), 275-279. https://doi.org/10.1016/j.clcc.2013.08.002
Yu, S. K., Chand, M., Tait, D. M., & Brown, G. (2014). Magnetic resonance imaging defined mucinous rectal carcinoma is an independent imaging biomarker for poor prognosis and poor response to preoperative chemoradiotherapy. Eur J Cancer, 50(5), 920-927. https://doi.org/10.1016/j.ejca.2013.12.007
Zhang, C. D., Wang, J. N., Sui, B. Q., Zeng, Y. J., Chen, J. Q., & Dai, D. Q. (2016). Prognostic and Predictive Model for Stage II Colon Cancer Patients With Nonemergent Surgery: Who Should Receive Adjuvant Chemotherapy? Medicine (Baltimore), 95(1), e2190. https://doi.org/10.1097/md.0000000000002190
Zhao, S., Wang, S., Pan, P., Xia, T., Chang, X., Yang, X., . . . Bai, Y. (2019). Magnitude, Risk Factors, and Factors Associated With Adenoma Miss Rate of Tandem Colonoscopy: A Systematic Review and Meta-analysis. Gastroenterology, 156(6), 1661-1674.e1611. https://doi.org/10.1053/j.gastro.2019.01.260
Zhou, C., Ren, Y., Li, J., Li, X., He, J., & Liu, P. (2014). Systematic review and meta-analysis of rectal washout on risk of local recurrence for cancer. J Surg Res, 189(1), 7-16. https://doi.org/10.1016/j.jss.2014.01.030
Zhuang, C. L., Ye, X. Z., Zhang, X. D., Chen, B. C., & Yu, Z. (2013). Enhanced recovery after surgery programs versus traditional care for colorectal surgery: a meta-analysis of randomized controlled trials. Dis Colon Rectum, 56(5), 667-678. https://doi.org/10.1097/DCR.0b013e3182812842
Zimmermann, C., Swami, N., Krzyzanowska, M., Hannon, B., Leighl, N., Oza, A., . . . Lo, C. (2014). Early palliative care for patients with advanced cancer: a cluster-randomised controlled trial. Lancet, 383(9930), 1721-1730. https://doi.org/10.1016/s0140-6736(13)62416-2
Zutshi, M., Delaney, C. P., Senagore, A. J., Mekhail, N., Lewis, B., Connor, J. T., & Fazio, V. W. (2005). Randomized controlled trial comparing the controlled rehabilitation with early ambulation and diet pathway versus the controlled rehabilitation with early ambulation and diet with preemptive epidural anesthesia/analgesia after laparotomy and intestinal resection. Am J Surg, 189(3), 268-272. https://doi.org/10.1016/j.amjsurg.2004.11.012
Zaanan, A., Cuilliere-Dartigues, P., Guilloux, A., Parc, Y., Louvet, C., de Gramont, A., . . . Praz, F. (2010). Impact of p53 expression and microsatellite instability on stage III colon cancer disease-free survival in patients treated by 5-fluorouracil and leucovorin with or without oxaliplatin. Ann Oncol, 21(4), 772-780. https://doi.org/10.1093/annonc/mdp383
Zaanan, A., Flejou, J. F., Emile, J. F., Des, G. G., Cuilliere-Dartigues, P., Malka, D., . . . Taieb, J. (2011). Defective mismatch repair status as a prognostic biomarker of disease-free survival in stage III colon cancer patients treated with adjuvant FOLFOX chemotherapy. Clinical cancer research : an official journal of the American Association for Cancer Research, 17(23), 7470-7478. https://doi.org/10.1158/1078-0432.ccr-11-1048
Aasebø, K., Dragomir, A., Sundström, M., Mezheyeuski, A., Edqvist, P. H., Eide, G. E., . . . Sorbye, H. (2019). Consequences of a high incidence of microsatellite instability and BRAF-mutated tumors: A population-based cohort of metastatic colorectal cancer patients. Cancer Med, 8(7), 3623-3635. https://doi.org/10.1002/cam4.2205









