Assistert befruktning med donoregg og donorsæd
Assistert befruktning med donoregg og donorsæd
Sist faglig oppdatert: 31.01.2023
Innledning
Sist faglig oppdatert: 14.04.2021
Dette rundskrivet er en oppdatering av Rundskriv om assistert befruktning med donorsæd (IS-2418), siste versjon er fra november 2020.
Endringene i november 2020 gjaldt i hovedsak rutiner for registrering av sæddonorer i det sentrale sæddonorregisteret. Rundskrivet ble i denne høringen også oppdatert med flere endringer som følge av Stortingets vedtak til bioteknologiloven våren 2020. Det ble også foretatt noen språklige endringer og noen endringer i struktur og form.
Endringene i den versjonen som nå foreligger, er en følge av endringen i bioteknologiloven som innebærer at eggdonasjon ble tillatt fra 1. januar 2021.
Rundskrivet retter seg mot norske eggbanker og sædbanker som rekrutterer donorer og lagrer donoregg og donorsæd, og mot virksomheter som er godkjent for assistert befruktning med donoregg og donorsæd etter:
- lov om humanmedisinsk bruk av bioteknologi m.m (heretter bioteknologiloven)
- forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (heretter forskrift om håndtering av humane celler og vev).
Rundskrivet må leses sammen med Veileder til forskrift om håndtering av humane celler og vev.
Rundskrivet omfatter kun enslige og par som får behandling med egg- eller sæddonasjon fra andre enn partneren. Det gjelder ikke for partnerdonasjon av egg i likekjønnede par. Enslige kvinner kan ikke få assistert befruktning med eggdonasjon.
I kapitlene 1 til 3 er det generelle bestemmelser med definisjoner, om hvem som kan gis tilbud om assistert befruktning og om barnets rett til opplysninger om eggdonors og sæddonors identitet.
Kravene til virksomhetene er delt inn i to kapitler. I kapittel 4 er det krav til virksomheter som rekrutterer egg- og sæddonorer og som har et lager med donoregg/donorsæd for distribusjon, og i kapittel 5 er det krav til virksomheter som tilbyr assistert befruktning med donoregg og donorsæd.
Rundskrivet gir i kapittel 6 føringer om registrering i det sentrale egg- og sæddonorregisteret.
Generelle bestemmelser
2.1 Formål
Sist faglig oppdatert: 14.04.2021
Rundskrivet skal bidra til god og enhetlig praksis i:
- Virksomheter som rekrutterer eggdonorer og sæddonorer og/eller som har et lager med donoregg og donorsæd for distribusjon.
- Virksomheter som tilbyr assistert befruktning med donoregg og donorsæd.
Rundskrivet skal gi en overordnet veiledning om krav i lov og forskrift og anbefalinger fra Helsedirektoratet. Det gir ikke alle detaljer for hvordan virksomheten skal oppfylle kravene i praksis. Det er hver enkelt virksomhet som har ansvar for å tilby assistert befruktning i tråd med gjeldende krav og anbefalinger.
2.1 Formål
Sist faglig oppdatert: 14.04.2021
Rundskrivet skal bidra til god og enhetlig praksis i:
- Virksomheter som rekrutterer eggdonorer og sæddonorer og/eller som har et lager med donoregg og donorsæd for distribusjon.
- Virksomheter som tilbyr assistert befruktning med donoregg og donorsæd.
Rundskrivet skal gi en overordnet veiledning om krav i lov og forskrift og anbefalinger fra Helsedirektoratet. Det gir ikke alle detaljer for hvordan virksomheten skal oppfylle kravene i praksis. Det er hver enkelt virksomhet som har ansvar for å tilby assistert befruktning i tråd med gjeldende krav og anbefalinger.
2.2 Rettslig grunnlag
Sist faglig oppdatert: 14.04.2021
Rundskrivet bygger på bestemmelser i lov om humanmedisinsk bruk av bioteknologi m.m. (bioteknologiloven) kapittel 2 og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev).
2.2 Rettslig grunnlag
Sist faglig oppdatert: 14.04.2021
Rundskrivet bygger på bestemmelser i lov om humanmedisinsk bruk av bioteknologi m.m. (bioteknologiloven) kapittel 2 og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev).
2.3 Definisjoner og ordforklaringer
Sist faglig oppdatert: 02.02.2024
I dette rundskrivet betyr:
- Assistert befruktning: Inseminasjon eller befruktning utenfor kroppen.
- Befruktning utenfor kroppen: Befruktning av egg utenfor kvinnens kropp.
- DIS-delen av SEC-koden: Landskode, virksomhetskode og unikt donasjonsnummer.
- Donasjonsperiode: Perioden fram til sæd er frigitt for bruk.
- Donasjonsregister: Register som både eggbanker/sædbanker og virksomheter som tilbyr assistert befruktning med donoregg og/eller donorsæd skal ha. Registeret skal sikre sporbarhet mellom donor og mottaker etter forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev kapittel 9, hvor formålet er å oppnå et sterkt vern av menneskers helse og unngå at sykdommer overføres via celler og vev. Eggbanker/sædbanker og virksomheter som tilbyr assistert befruktning med donoregg og/eller donorsæd har ulike oppgaver. Krav til informasjonen i donasjonsregistre er avhengig av oppgavene som utføres, se §§ 47 og 48 i forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev.
- Donoregg: Egg fra andre enn partneren.
- Donorkode: Kode for sporing av donor etter forskrift om håndtering av humane celler og vev og etter bioteknologiloven.
- Donorsæd: Sæd fra andre enn partneren.
- Eggbank: Virksomhet som rekrutterer eggdonorer og/eller som har et lager med ubefruktede donoregg for distribusjon, som ved anskaffelse ikke er reservert for en bestemt mottaker.
- Eggbankens og sædbankens lokale donorregister: Register som brukes i norske eggbanker og sædbanker for å finne en egnet donor.
- Eggdonor: Den som avgir egg til assistert befruktning til andre enn partneren.
- Frigi for bruk: Arbeidsoperasjon som skal sikre at bare donerte egg og donert sæd som oppfyller kravene til kvalitet og sikkerhet frigis.
- Inseminasjon: Innføring av sæd i kvinnen på annen måte enn ved samleie.
- Kjønnsceller: Eggceller eller sædceller.
- Mor-donorkoderegister: Register for kobling av mors identitet og donorkode for å sikre riktig kobling mellom barnet og donoren, slik at barnet kan få opplysning om eggdonors eller sæddonors identitet fra det sentrale egg- og sæddonorregisteret.
- Personnummer: Et nummer som benyttes til å identifisere registrerte borgere i et land.
- SEC-kode: Felles europeisk kode (SEC) for korrekt identifisering av virksomheten som tar ut celler og vev, av donoren og sporbarhet for donert materiale, og opplysninger om de viktigste egenskapene og kjennetegnene ved celler og vev.
- Sentralt egg- og sæddonorregister: Register med informasjon om eggdonorers og sæddonorers identitet og donorkode, slik at barnets rett etter bioteknologiloven § 2-7 kan oppfylles. Registeret administreres av Folkehelseinstituttet.
- Sædbank: Virksomhet som rekrutterer sæddonorer og/eller har et lager med donorsæd for distribusjon, som ved anskaffelse ikke er reservert for en bestemt mottaker.
- Sæddonor: Den som avgir sæd til assistert befruktning til andre enn partneren.
2.3 Definisjoner og ordforklaringer
Sist faglig oppdatert: 02.02.2024
I dette rundskrivet betyr:
- Assistert befruktning: Inseminasjon eller befruktning utenfor kroppen.
- Befruktning utenfor kroppen: Befruktning av egg utenfor kvinnens kropp.
- DIS-delen av SEC-koden: Landskode, virksomhetskode og unikt donasjonsnummer.
- Donasjonsperiode: Perioden fram til sæd er frigitt for bruk.
- Donasjonsregister: Register som både eggbanker/sædbanker og virksomheter som tilbyr assistert befruktning med donoregg og/eller donorsæd skal ha. Registeret skal sikre sporbarhet mellom donor og mottaker etter forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev kapittel 9, hvor formålet er å oppnå et sterkt vern av menneskers helse og unngå at sykdommer overføres via celler og vev. Eggbanker/sædbanker og virksomheter som tilbyr assistert befruktning med donoregg og/eller donorsæd har ulike oppgaver. Krav til informasjonen i donasjonsregistre er avhengig av oppgavene som utføres, se §§ 47 og 48 i forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev.
- Donoregg: Egg fra andre enn partneren.
- Donorkode: Kode for sporing av donor etter forskrift om håndtering av humane celler og vev og etter bioteknologiloven.
- Donorsæd: Sæd fra andre enn partneren.
- Eggbank: Virksomhet som rekrutterer eggdonorer og/eller som har et lager med ubefruktede donoregg for distribusjon, som ved anskaffelse ikke er reservert for en bestemt mottaker.
- Eggbankens og sædbankens lokale donorregister: Register som brukes i norske eggbanker og sædbanker for å finne en egnet donor.
- Eggdonor: Den som avgir egg til assistert befruktning til andre enn partneren.
- Frigi for bruk: Arbeidsoperasjon som skal sikre at bare donerte egg og donert sæd som oppfyller kravene til kvalitet og sikkerhet frigis.
- Inseminasjon: Innføring av sæd i kvinnen på annen måte enn ved samleie.
- Kjønnsceller: Eggceller eller sædceller.
- Mor-donorkoderegister: Register for kobling av mors identitet og donorkode for å sikre riktig kobling mellom barnet og donoren, slik at barnet kan få opplysning om eggdonors eller sæddonors identitet fra det sentrale egg- og sæddonorregisteret.
- Personnummer: Et nummer som benyttes til å identifisere registrerte borgere i et land.
- SEC-kode: Felles europeisk kode (SEC) for korrekt identifisering av virksomheten som tar ut celler og vev, av donoren og sporbarhet for donert materiale, og opplysninger om de viktigste egenskapene og kjennetegnene ved celler og vev.
- Sentralt egg- og sæddonorregister: Register med informasjon om eggdonorers og sæddonorers identitet og donorkode, slik at barnets rett etter bioteknologiloven § 2-7 kan oppfylles. Registeret administreres av Folkehelseinstituttet.
- Sædbank: Virksomhet som rekrutterer sæddonorer og/eller har et lager med donorsæd for distribusjon, som ved anskaffelse ikke er reservert for en bestemt mottaker.
- Sæddonor: Den som avgir sæd til assistert befruktning til andre enn partneren.
2.4 Virkeområde
Sist faglig oppdatert: 14.04.2021
Rundskrivet gir føringer for rekruttering av eggdonorer og sæddonorer, og føringer for bruk, lagring, anskaffelse og import av donoregg og donorsæd til assistert befruktning.
2.4 Virkeområde
Sist faglig oppdatert: 14.04.2021
Rundskrivet gir føringer for rekruttering av eggdonorer og sæddonorer, og føringer for bruk, lagring, anskaffelse og import av donoregg og donorsæd til assistert befruktning.
Barnets rett til informasjon om donors identitet
Sist faglig oppdatert: 11.12.2022
Personer født etter bruk av donorsæd på norske klinikker fra og med 2005, har rett til å få opplysninger om sæddonors identitet fra det sentrale egg- og sæddonorregisteret, jf. bioteknologiloven § 2-7. Det samme gjelder de som er født etter bruk av donoregg fra og med 1. januar 2021.
Barn som er blitt til ved assistert befruktning med sæd donert fra og med 1. januar 2021, kan få opplysningene fra de har fylt 15 år. De som er født ved hjelp av sæd donert før 1. januar 2021, har ikke rett til opplysninger om donors identitet før de har fylt 18 år.
Barn som er blitt til ved assistert befruktning med donoregg kan få opplysningene fra de har fylt 15 år.
Det er bare barnet selv som har rett til å få opplysningene, se bioteknologiloven § 2-7 annet ledd og Ot. prp. nr. 64 (2002-2003) pkt.2.9.6.2. Donor og barnet har ingen rettigheter eller plikter overfor hverandre.
Foreldrene har etter endringen i bioteknologiloven § 2-7 1. januar 2021, en plikt til å fortelle barnet at det er blitt til ved hjelp av egg- eller sæddonasjon. Foreldrene skal informere om dette så snart det er tilrådelig. Helsedirektoratet anbefaler at behandlende lege informerer den eller de som søker om assistert befruktning med donoregg eller donorsæd om deres plikt til å fortelle eventuelle barn at det er brukt donoregg eller donorsæd i behandlingen, slik at barna senere kan få oppfylt sin rett. Legen skal informere om fra hvilken alder barnet kan få opplysninger om donors identitet.
Retten til å få opplysningene fra sentralt egg- og sæddonorregister gjelder uavhengig av om barnet har fått bekreftet at befruktningen har skjedd med donoregg eller donorsæd. De som vet med sikkerhet at de er unnfanget ved hjelp av donoregg eller donorsæd, og de som tror at dette kan være tilfelle, har rett til å be om bistand fra det sentrale egg- og sæddonorregisteret.
I desember 2023 åpnet det en tjeneste for informasjon fra Egg- og sæddonorregisteret på Helsenorge. Da er de første som er blitt til ved hjelp av donorsæd etter 1. januar 2005 snart fylt 18 år. De kan da be om informasjon om sin donors identitet.
Informasjon til foreldre som får barn ved hjelp av egg- og sæddonasjon er publisert på helsenorge.no.
På helsenorge.no er det også publisert informasjon til barn som ønsker å vite mer om sitt genetiske opphav.
Krav til norske eggbanker og sædbanker
Sist faglig oppdatert: 14.04.2021
Dette kapittelet omhandler krav til eggbanker og sædbanker som rekrutterer donorer og/eller som har et lager med donoregg eller donorsæd for distribusjon, som ved anskaffelse ikke er reservert for en bestemt mottaker. Det gir også veiledning om utvelgelse av donor, om samtykke og om informasjon til donor. Det gir videre føringer om kravene til donasjonsregister og lokalt donorregister, og prosedyrer for registrering av donor i det sentrale egg- og sæddonorregisteret.
4.1 Godkjenning i Helsedirektoratet og i Direktoratet for medisinske produkter og melding til Biobankregisteret
Sist faglig oppdatert: 02.02.2024
En virksomhet som håndterer donoregg og donorsæd må godkjennes av både av Helsedirektoratet og Direktoratet for medisinske produkter (DMP). DMP fatter vedtak om godkjenning etter forskrift om håndtering av humane celler og vev § 4 og Helsedirektoratet fatter vedtak om godkjenning etter bioteknologiloven kapittel 2.
Virksomhetene må i søknaden om godkjenning til Helsedirektoratet redegjøre for hvordan krav i lov og forskrift og føringer i rundskrivet skal ivaretas. Se også sjekkliste for godkjenning etter bioteknologiloven i vedlegg VII.
Krav til virksomheter som tilbyr behandling med donoreg og/eller donorsæd.
4.1 Godkjenning i Helsedirektoratet og i Direktoratet for medisinske produkter og melding til Biobankregisteret
Sist faglig oppdatert: 02.02.2024
En virksomhet som håndterer donoregg og donorsæd må godkjennes av både av Helsedirektoratet og Direktoratet for medisinske produkter (DMP). DMP fatter vedtak om godkjenning etter forskrift om håndtering av humane celler og vev § 4 og Helsedirektoratet fatter vedtak om godkjenning etter bioteknologiloven kapittel 2.
Virksomhetene må i søknaden om godkjenning til Helsedirektoratet redegjøre for hvordan krav i lov og forskrift og føringer i rundskrivet skal ivaretas. Se også sjekkliste for godkjenning etter bioteknologiloven i vedlegg VII.
Krav til virksomheter som tilbyr behandling med donoreg og/eller donorsæd.
4.2 Utvelgelse av donor
Sist faglig oppdatert: 19.10.2021
4.2.1 Vilkår sæddonor
Det stilles følgende vilkår:
- Sæddonor må være registrert i det norske Folkeregisteret og ha en permanent tilknytning til Norge, som for eksempel norsk statsborgerskap eller bosettingstillatelse.
- Sæddonor må oppfylle kravene til donor i forskrift om håndtering av humane celler og vev, se særlig kapittel 4 i forskriften.
- Sæddonasjon skal være frivillig.
- Sæddonor bør ha samtale med helsepersonell (se helsepersonelloven § 48), som har særlig kompetanse på de psykososiale aspekter ved donasjon, før han godkjennes som sæddonor. Tverrfaglig samarbeid ved den medisinske og psykososiale utredningen kan være hensiktsmessig.
- Sæddonor skal ha normalt spermatogram, og sæd vurderes til å tåle nedfrysning.
- Familieanamnese skal ikke gi mistanke om at sæddonor er bærer av kjent arvelig sykdom.
- Sæddonor bør ha god fysisk og psykisk helse.
- Sæddonor skal være over 18 år, og bør være over 25 år. Av hensyn til barnet bør sæddonor ikke være over 45 år.
- Sæddonor må være innforstått med at barn kan ta kontakt.
- Sæddonor bør ha en tilstrekkelig moden og innsiktsfull innstilling til sæddonasjon.
- Sæddonor kan ikke ha donert sæd ved en annen virksomhet. Unntak kan avtales mellom godkjente sædbanker, dersom donor ønsker dette og har samtykket, og dette for øvrig er i tråd med krav i regelverk.
4.2.2 Vilkår eggdonor
Det stilles følgende vilkår:
- Eggdonor må være registrert i det norske Folkeregisteret og ha en permanent tilknytning til Norge, som for eksempel norsk statsborgerskap eller bosettingstillatelse.
- Eggdonor må oppfylle kravene til donor i forskrift om håndtering av humane celler og vev, se særlig kapittel 4 i forskriften.
- Eggdonasjon skal være frivillig.
- Eggdonor skal ha samtale med helsepersonell (se helsepersonelloven § 48), som har særlig kompetanse på de psykososiale aspekter ved donasjon før hun kan godkjennes som eggdonor, jf. føringer fra Stortinget i Innst. 296 L (2019-2020) om Innstilling fra helse- og omsorgskomiteen om Endringer i bioteknologiloven mv. Tverrfaglig samarbeid ved den medisinske og psykososiale utredningen kan være hensiktsmessig.
- Eggdonor bør ha normale eggreserver, normal hormonstatus og ingen avvik ved ultralydundersøkelsen som kan indikere nedsatt fertilitet.
- Familieanamnese skal ikke gi mistanke om at eggdonor er bærer av kjent arvelig sykdom.
- Eggdonor bør ha god fysisk og psykisk helse.
- Eggdonor må være mellom 25 og 35 år.
- Eggdonor må være innforstått med at barn kan ta kontakt.
- Eggdonor bør ha en tilstrekkelig moden og innsiktsfull innstilling til eggdonasjon.
- Eggdonasjon bør utføres lokalt/regionalt, jf. føringer fra Stortinget i Innst. 296 L (2019-2020) om Innstilling fra helse- og omsorgskomiteen om Endringer i bioteknologiloven mv.
- Eggdonor kan ikke ha donert egg ved en annen virksomhet. Unntak kan avtales mellom godkjente eggbanker, dersom donor ønsker dette og har samtykket, og dette for øvrig er i tråd med krav i regelverk.
4.2.3 Samtale med lege
Potensielle donorer blir kalt inn til en samtale med lege.
På bakgrunn av samtalen skal legen vurdere om donor er egnet.
Samtalen med donor bør inneholde disse momentene:
- Innstilling: Innstilt på at barn kan ta kontakt.
- Motivasjon: Helhetsvurdering av donors motivasjon.
- Generell egnethet: Parforhold, sosiale interesser, utdanning, jobb.
- Anamnese: Legen gjennomgår skjema med helseopplysninger som donor har fylt ut, og spør om arvelig sykdom i familien.
Se vedlegg VI med støttepunkter til samtale og informasjon til donor.
4.2 Utvelgelse av donor
Sist faglig oppdatert: 19.10.2021
4.2.1 Vilkår sæddonor
Det stilles følgende vilkår:
- Sæddonor må være registrert i det norske Folkeregisteret og ha en permanent tilknytning til Norge, som for eksempel norsk statsborgerskap eller bosettingstillatelse.
- Sæddonor må oppfylle kravene til donor i forskrift om håndtering av humane celler og vev, se særlig kapittel 4 i forskriften.
- Sæddonasjon skal være frivillig.
- Sæddonor bør ha samtale med helsepersonell (se helsepersonelloven § 48), som har særlig kompetanse på de psykososiale aspekter ved donasjon, før han godkjennes som sæddonor. Tverrfaglig samarbeid ved den medisinske og psykososiale utredningen kan være hensiktsmessig.
- Sæddonor skal ha normalt spermatogram, og sæd vurderes til å tåle nedfrysning.
- Familieanamnese skal ikke gi mistanke om at sæddonor er bærer av kjent arvelig sykdom.
- Sæddonor bør ha god fysisk og psykisk helse.
- Sæddonor skal være over 18 år, og bør være over 25 år. Av hensyn til barnet bør sæddonor ikke være over 45 år.
- Sæddonor må være innforstått med at barn kan ta kontakt.
- Sæddonor bør ha en tilstrekkelig moden og innsiktsfull innstilling til sæddonasjon.
- Sæddonor kan ikke ha donert sæd ved en annen virksomhet. Unntak kan avtales mellom godkjente sædbanker, dersom donor ønsker dette og har samtykket, og dette for øvrig er i tråd med krav i regelverk.
4.2.2 Vilkår eggdonor
Det stilles følgende vilkår:
- Eggdonor må være registrert i det norske Folkeregisteret og ha en permanent tilknytning til Norge, som for eksempel norsk statsborgerskap eller bosettingstillatelse.
- Eggdonor må oppfylle kravene til donor i forskrift om håndtering av humane celler og vev, se særlig kapittel 4 i forskriften.
- Eggdonasjon skal være frivillig.
- Eggdonor skal ha samtale med helsepersonell (se helsepersonelloven § 48), som har særlig kompetanse på de psykososiale aspekter ved donasjon før hun kan godkjennes som eggdonor, jf. føringer fra Stortinget i Innst. 296 L (2019-2020) om Innstilling fra helse- og omsorgskomiteen om Endringer i bioteknologiloven mv. Tverrfaglig samarbeid ved den medisinske og psykososiale utredningen kan være hensiktsmessig.
- Eggdonor bør ha normale eggreserver, normal hormonstatus og ingen avvik ved ultralydundersøkelsen som kan indikere nedsatt fertilitet.
- Familieanamnese skal ikke gi mistanke om at eggdonor er bærer av kjent arvelig sykdom.
- Eggdonor bør ha god fysisk og psykisk helse.
- Eggdonor må være mellom 25 og 35 år.
- Eggdonor må være innforstått med at barn kan ta kontakt.
- Eggdonor bør ha en tilstrekkelig moden og innsiktsfull innstilling til eggdonasjon.
- Eggdonasjon bør utføres lokalt/regionalt, jf. føringer fra Stortinget i Innst. 296 L (2019-2020) om Innstilling fra helse- og omsorgskomiteen om Endringer i bioteknologiloven mv.
- Eggdonor kan ikke ha donert egg ved en annen virksomhet. Unntak kan avtales mellom godkjente eggbanker, dersom donor ønsker dette og har samtykket, og dette for øvrig er i tråd med krav i regelverk.
4.2.3 Samtale med lege
Potensielle donorer blir kalt inn til en samtale med lege.
På bakgrunn av samtalen skal legen vurdere om donor er egnet.
Samtalen med donor bør inneholde disse momentene:
- Innstilling: Innstilt på at barn kan ta kontakt.
- Motivasjon: Helhetsvurdering av donors motivasjon.
- Generell egnethet: Parforhold, sosiale interesser, utdanning, jobb.
- Anamnese: Legen gjennomgår skjema med helseopplysninger som donor har fylt ut, og spør om arvelig sykdom i familien.
Se vedlegg VI med støttepunkter til samtale og informasjon til donor.
4.3 Informasjon og samtykke fra donor
Sist faglig oppdatert: 14.04.2021
Etter bioteknologiloven § 2-9 tredje ledd må donor gi skriftlig samtykke til at sæden eller de ubefruktede eggene kan brukes til befruktning og at hans eller hennes identitet registreres og lagres i det sentrale egg- og sæddonorregisteret. Se forslag til mal for samtykke i vedlegg IA og IB. Samtykket kan tilbakekalles frem til befruktningen har funnet sted.
Inntil det er etablert en ordning med standardisert samtykke til registrering i det sentrale egg- og sæddonorregisteret på Helsenorge.no, skal eggbanken eller sædbanken oppbevare donors samtykkeerklæring på en sikker måte. Donorkoden skal ikke oppbevares sammen med samtykkene.
Det er videre krav til informasjon og samtykke i forskrift om håndtering av humane celler og vev § 27, hvor det fremgår at den som har ansvar for donasjonsprosessen før uttaket skal:
Sikre at donor på riktig måte mottar nødvendig og relevant informasjon om de forhold som er knyttet til donasjon og uttak. Den som informeres skal gis anledning til å stille spørsmål og få tilfredsstillende svar på disse.
Informasjon skal gis av en fagperson som er i stand til å formidle informasjonen på en egnet og klar måte, ved å benytte ord og uttrykk som lett forstås av mottakeren.
Virksomheten skal sørge for at de som skal samtykke til donasjon får informasjon om registrering av helseopplysninger og behandlingen av disse. Det skal også gis fullstendig informasjon om sporbarhetskravet etter § 40, og at dette til enhver tid går foran donorens ønske om å få slettet opplysninger om seg selv når det gjelder materiale som er brukt.
Donor må samtykke til at helseopplysningene registreres i eggbankens eller sædbankens donasjonsregister, sammen med opplysninger om donors identitet og donorkode. Donor må også samtykke til at donorkoden registreres i et mor-donorkoderegister og til at opplysninger registreres i det lokale donorregisteret for valg av donor etter bioteknologiloven § 2-10. Det må også fremgå av donors journal at donor har gitt et informert samtykke til behandlingen. Dette samtykket kommer i tillegg til samtykket til oppføring i registrene nevnt over. Se mer om samtykke og dokumentasjon i helsepersonelloven kapittel 8 og i Helsedirektoratets kommentarer til helsepersonelloven om dokumentasjonsplikt.
Det er bare samtykkekompetente personer som kan donere egg eller sæd til bruk ved assistert befruktning.
4.3 Informasjon og samtykke fra donor
Sist faglig oppdatert: 14.04.2021
Etter bioteknologiloven § 2-9 tredje ledd må donor gi skriftlig samtykke til at sæden eller de ubefruktede eggene kan brukes til befruktning og at hans eller hennes identitet registreres og lagres i det sentrale egg- og sæddonorregisteret. Se forslag til mal for samtykke i vedlegg IA og IB. Samtykket kan tilbakekalles frem til befruktningen har funnet sted.
Inntil det er etablert en ordning med standardisert samtykke til registrering i det sentrale egg- og sæddonorregisteret på Helsenorge.no, skal eggbanken eller sædbanken oppbevare donors samtykkeerklæring på en sikker måte. Donorkoden skal ikke oppbevares sammen med samtykkene.
Det er videre krav til informasjon og samtykke i forskrift om håndtering av humane celler og vev § 27, hvor det fremgår at den som har ansvar for donasjonsprosessen før uttaket skal:
Sikre at donor på riktig måte mottar nødvendig og relevant informasjon om de forhold som er knyttet til donasjon og uttak. Den som informeres skal gis anledning til å stille spørsmål og få tilfredsstillende svar på disse.
Informasjon skal gis av en fagperson som er i stand til å formidle informasjonen på en egnet og klar måte, ved å benytte ord og uttrykk som lett forstås av mottakeren.
Virksomheten skal sørge for at de som skal samtykke til donasjon får informasjon om registrering av helseopplysninger og behandlingen av disse. Det skal også gis fullstendig informasjon om sporbarhetskravet etter § 40, og at dette til enhver tid går foran donorens ønske om å få slettet opplysninger om seg selv når det gjelder materiale som er brukt.
Donor må samtykke til at helseopplysningene registreres i eggbankens eller sædbankens donasjonsregister, sammen med opplysninger om donors identitet og donorkode. Donor må også samtykke til at donorkoden registreres i et mor-donorkoderegister og til at opplysninger registreres i det lokale donorregisteret for valg av donor etter bioteknologiloven § 2-10. Det må også fremgå av donors journal at donor har gitt et informert samtykke til behandlingen. Dette samtykket kommer i tillegg til samtykket til oppføring i registrene nevnt over. Se mer om samtykke og dokumentasjon i helsepersonelloven kapittel 8 og i Helsedirektoratets kommentarer til helsepersonelloven om dokumentasjonsplikt.
Det er bare samtykkekompetente personer som kan donere egg eller sæd til bruk ved assistert befruktning.
4.4 Testing og undersøkelser av donor
Sist faglig oppdatert: 14.04.2021
4.4.1 Testing og undersøkelser av sæddonor før bruk av sæden til assistert befruktning
a) Test av sædkvalitet
Sædprøven analyseres med hensyn til spermiekonsentrasjon, bevegelighet (motilitet) og andre relevante karakteristika. Det gjøres frys/tin-test.
Den enkelte sædbank fastsetter kriterier for bedømmelse av sædkvalitet.
Basert på en samlet vurdering av undersøkelser, kliniske opplysninger og tilfredsstillende kvalitet på spermiemotiliteten etter frysing og tining, vurderes det om donor skal undersøkes videre.
Resultatene av donorevalueringen og testprosedyrene skal dokumenteres og underskrives av helsepersonell med nødvendige kvalifikasjoner for formålet.
Donor skal få informasjon om resultatene av undersøkelsene.
Menn med svært dårlig sædkvalitet bør få informasjon om hva dette kan innebære. Lege som er tilknyttet sædbanken avgjør om det er grunnlag for videre oppfølging/utredning.
b) Obligatoriske laboratorieundersøkelser for sæddonorer
Minstekrav til donasjonsprøver:
Alle sæddonorer skal ved tidspunkt for første og minimum siste donasjon avgi blodprøve for serologiske undersøkelser som angitt i forskrift om håndtering av humane celler og vev § 17. Se også bokstav c om karantene og ny testing etter 6 måneder.
Minstekrav til testing:
- HIV 1 og 2 (Anti-HIV 1,2)
- Hepatitt B (HBsAg og Anti-HBc)
- Hepatitt C (Anti-HCV)
- Syfilis (Treponema pallidum)
Sæddonorer som kommer fra høyrisikoområder, eller som har partnere eller foreldre med bakgrunn fra slike områder, skal også undersøkes for antistoffer mot HTLV-1 og HTLV-2. Det skal hos alle sæddonorer også tas prøve fra urinrøret eller førstestråle urinprøve for testing for klamydia og gonoré. Sædbanken kan også gjennomføre andre tester av donor dersom det er nødvendig.
Dersom de serologiske eller mikrobiologiske testene er positive, skal sæddonor tilbys oppfølging eller henvises til sin fastlege.
Testing skal bare utføres ved laboratorier som er godkjent for donortesting etter forskrift om håndtering av humane celler og vev.
c) Karantene og videre undersøkelser av sæddonor
Sæddonor avgir sæd over et lengre tidsrom. Sædkvaliteten testes og registreres i donors journal før hver nedfrysning. Når donor er ferdig med sin donasjonsperiode, skal all sæd oppbevares i karantene i 6 måneder. Deretter skal nye blodprøver tas av donor og testes som tidligere.
Sæd som ikke er godkjent for bruk må håndteres og oppbevares i tråd med retningslinjer for håndtering av smittefarlig materiale, og i henhold til kravene i forskrift om håndtering av humane celler og vev.
Sæden skal oppbevares fysisk atskilt fra materiale som er frigitt for bruk, og skal være tydelig merket.
Karantenetiden på 6 måneder starter etter siste donasjon. Dersom donasjonsprøven tatt ved tidspunkt for siste donasjon i tillegg undersøkes ved hjelp av PCR for HIV, HBV og HCV er det ikke nødvendig å gjenta undersøkelsen på en ny donasjonsprøve tatt etter 6 måneder, og krav om karantene bortfaller, se forskrift om håndtering av humane celler og vev § 19.
Se mer om krav til donasjon og laboratorieundersøkelser i forskrift om håndtering av humane celler og vev kapittel 4.
Dersom donor senere kommer tilbake for å avlevere en ny serie sædprøver tas det nye prøver til testing. Det tas også blodprøver for ny testing etter en ny karantenetid.
4.4.2 Testing og undersøkelser av eggdonor før bruk av eggene til assistert befruktning
a) Testing av eggstokkreserver med hormonanalyser og ultralydundersøkelser
Donor gjennomgår kliniske undersøkelser, blant annet vurdering av eggstokkreserver. Legen vurderer om donor kan godkjennes ut fra en samlet vurdering av undersøkelser og kliniske opplysninger.
Resultatene av donorevalueringen og testprosedyrene skal dokumenteres og underskrives av helsepersonell med nødvendige kvalifikasjoner for formålet. Donor skal få informasjon om resultatene av undersøkelsene. Kvinner med svært dårlige eggstokkreserver bør få informasjon om hva dette kan innebære. Lege som er tilknyttet eggbanken avgjør om det er grunnlag for videre oppfølging/utredning.
b) Serologiske og mikrobiologiske tester av eggdonor
Donor må avgi blodprøve for serologiske undersøkelser som angitt i forskrift om håndtering av humane celler og vev § 17.
Minstekravet til testing er:
- HIV 1 og 2 (Anti-HIV 1,2)
- Hepatitt B (HBsAg og Anti-HBc)
- Hepatitt C (Anti-HCV)
- Syfilis (Treponema pallidum)
Eggdonorer som kommer fra høyrisikoområder, eller som har partnere eller foreldre med bakgrunn fra slike områder, skal også undersøkes for antistoffer mot HTLV-1 og HTLV-2.
I tillegg skal det tas en donasjonsprøve for nye serologiske undersøkelser før hormonstimuleringen starter. Det anbefales at denne prøven også testes ved hjelp av PCR. Donasjonsprøven tas tidligst 30 dager før planlagt egguttak (se bokstav c). Hormonstimulering bør ikke starte før det er bekreftet at serologiske og mikrobiologiske tester er negative.
For testing for klamydia og gonoré benyttes selvtatt vaginalprøve eller cervix/vaginalprøve tatt av helsepersonell. Prøvene tas tidligst to uker før hvert egguttak ved planlagt bruk av ferske egg.
Eggbanken kan også gjennomføre andre tester av donor dersom det er nødvendig.
Dersom de serologiske eller mikrobiologiske testene er positive, skal eggdonor tilbys oppfølging eller henvises til sin fastlege.
Testing skal bare utføres ved laboratorier som Helsedirektoratet har godkjent for donortesting etter forskrift om håndtering av humane celler og vev, se Helsedirektoratets oversikt over godkjente laboratorier.
Dersom donor senere kommer tilbake for nytt egguttak, tas det nye prøver til testing.
Se mer om krav til donasjon og laboratorieundersøkelser i forskrift om håndtering av humane celler og vev kapittel 4.
c) Karantene og undersøkelser av eggdonor
Donasjonsprøve tas tidligst 30 dager før planlagt egguthenting. Det anbefales at donasjonsprøven undersøkes både ved serologi og ved hjelp av PCR.
Dersom donasjonsprøvene i forkant av hver egguthenting er undersøkt både ved serologi og ved hjelp av PCR for HIV, HBV og HCV, er det ikke nødvendig å gjenta undersøkelsen på en ny donasjonsprøve etter 6 måneder, og krav om karantene bortfaller, se forskrift om håndtering av humane celler og vev § 19. Hvis donasjonsprøven ikke er testet ved hjelp av PCR, skal nye blodprøver tas av donor etter 6 måneder og testes som tidligere. Egg kan frigis når det er bekreftet at prøven er negativ, forutsatt at krav i punkt 4.3.3 om frigiving av donoregg og donorsæd er oppfylt.
Kryopreserverte egg eller embryo som er i karantene (og derfor ikke godkjent for bruk) håndteres og oppbevares i tråd med retningslinjer for håndtering av smittefarlig materiale, og i henhold til kravene i forskrift om håndtering av humane celler og vev. Eggene skal oppbevares fysisk atskilt fra materiale som er frigitt for bruk, og skal være tydelig merket.
4.4.3 Frigiving av donoregg og donorsæd for bruk
Eggbanken/sædbanken skal ha et system som sikrer at celler og vev ikke kan frigis før alle krav fastsatt i forskrift om håndtering av humane celler og vev er oppfylt, jf. forskriften § 34 bokstav b.
Før frigiving for bruk til assistert befruktning, skal det dokumenteres at donoreggene og donorsæden oppfyller alle relevante spesifikasjoner etter forskrift om håndtering av humane celler og vev § 34 bokstav d.
4.4 Testing og undersøkelser av donor
Sist faglig oppdatert: 14.04.2021
4.4.1 Testing og undersøkelser av sæddonor før bruk av sæden til assistert befruktning
a) Test av sædkvalitet
Sædprøven analyseres med hensyn til spermiekonsentrasjon, bevegelighet (motilitet) og andre relevante karakteristika. Det gjøres frys/tin-test.
Den enkelte sædbank fastsetter kriterier for bedømmelse av sædkvalitet.
Basert på en samlet vurdering av undersøkelser, kliniske opplysninger og tilfredsstillende kvalitet på spermiemotiliteten etter frysing og tining, vurderes det om donor skal undersøkes videre.
Resultatene av donorevalueringen og testprosedyrene skal dokumenteres og underskrives av helsepersonell med nødvendige kvalifikasjoner for formålet.
Donor skal få informasjon om resultatene av undersøkelsene.
Menn med svært dårlig sædkvalitet bør få informasjon om hva dette kan innebære. Lege som er tilknyttet sædbanken avgjør om det er grunnlag for videre oppfølging/utredning.
b) Obligatoriske laboratorieundersøkelser for sæddonorer
Minstekrav til donasjonsprøver:
Alle sæddonorer skal ved tidspunkt for første og minimum siste donasjon avgi blodprøve for serologiske undersøkelser som angitt i forskrift om håndtering av humane celler og vev § 17. Se også bokstav c om karantene og ny testing etter 6 måneder.
Minstekrav til testing:
- HIV 1 og 2 (Anti-HIV 1,2)
- Hepatitt B (HBsAg og Anti-HBc)
- Hepatitt C (Anti-HCV)
- Syfilis (Treponema pallidum)
Sæddonorer som kommer fra høyrisikoområder, eller som har partnere eller foreldre med bakgrunn fra slike områder, skal også undersøkes for antistoffer mot HTLV-1 og HTLV-2. Det skal hos alle sæddonorer også tas prøve fra urinrøret eller førstestråle urinprøve for testing for klamydia og gonoré. Sædbanken kan også gjennomføre andre tester av donor dersom det er nødvendig.
Dersom de serologiske eller mikrobiologiske testene er positive, skal sæddonor tilbys oppfølging eller henvises til sin fastlege.
Testing skal bare utføres ved laboratorier som er godkjent for donortesting etter forskrift om håndtering av humane celler og vev.
c) Karantene og videre undersøkelser av sæddonor
Sæddonor avgir sæd over et lengre tidsrom. Sædkvaliteten testes og registreres i donors journal før hver nedfrysning. Når donor er ferdig med sin donasjonsperiode, skal all sæd oppbevares i karantene i 6 måneder. Deretter skal nye blodprøver tas av donor og testes som tidligere.
Sæd som ikke er godkjent for bruk må håndteres og oppbevares i tråd med retningslinjer for håndtering av smittefarlig materiale, og i henhold til kravene i forskrift om håndtering av humane celler og vev.
Sæden skal oppbevares fysisk atskilt fra materiale som er frigitt for bruk, og skal være tydelig merket.
Karantenetiden på 6 måneder starter etter siste donasjon. Dersom donasjonsprøven tatt ved tidspunkt for siste donasjon i tillegg undersøkes ved hjelp av PCR for HIV, HBV og HCV er det ikke nødvendig å gjenta undersøkelsen på en ny donasjonsprøve tatt etter 6 måneder, og krav om karantene bortfaller, se forskrift om håndtering av humane celler og vev § 19.
Se mer om krav til donasjon og laboratorieundersøkelser i forskrift om håndtering av humane celler og vev kapittel 4.
Dersom donor senere kommer tilbake for å avlevere en ny serie sædprøver tas det nye prøver til testing. Det tas også blodprøver for ny testing etter en ny karantenetid.
4.4.2 Testing og undersøkelser av eggdonor før bruk av eggene til assistert befruktning
a) Testing av eggstokkreserver med hormonanalyser og ultralydundersøkelser
Donor gjennomgår kliniske undersøkelser, blant annet vurdering av eggstokkreserver. Legen vurderer om donor kan godkjennes ut fra en samlet vurdering av undersøkelser og kliniske opplysninger.
Resultatene av donorevalueringen og testprosedyrene skal dokumenteres og underskrives av helsepersonell med nødvendige kvalifikasjoner for formålet. Donor skal få informasjon om resultatene av undersøkelsene. Kvinner med svært dårlige eggstokkreserver bør få informasjon om hva dette kan innebære. Lege som er tilknyttet eggbanken avgjør om det er grunnlag for videre oppfølging/utredning.
b) Serologiske og mikrobiologiske tester av eggdonor
Donor må avgi blodprøve for serologiske undersøkelser som angitt i forskrift om håndtering av humane celler og vev § 17.
Minstekravet til testing er:
- HIV 1 og 2 (Anti-HIV 1,2)
- Hepatitt B (HBsAg og Anti-HBc)
- Hepatitt C (Anti-HCV)
- Syfilis (Treponema pallidum)
Eggdonorer som kommer fra høyrisikoområder, eller som har partnere eller foreldre med bakgrunn fra slike områder, skal også undersøkes for antistoffer mot HTLV-1 og HTLV-2.
I tillegg skal det tas en donasjonsprøve for nye serologiske undersøkelser før hormonstimuleringen starter. Det anbefales at denne prøven også testes ved hjelp av PCR. Donasjonsprøven tas tidligst 30 dager før planlagt egguttak (se bokstav c). Hormonstimulering bør ikke starte før det er bekreftet at serologiske og mikrobiologiske tester er negative.
For testing for klamydia og gonoré benyttes selvtatt vaginalprøve eller cervix/vaginalprøve tatt av helsepersonell. Prøvene tas tidligst to uker før hvert egguttak ved planlagt bruk av ferske egg.
Eggbanken kan også gjennomføre andre tester av donor dersom det er nødvendig.
Dersom de serologiske eller mikrobiologiske testene er positive, skal eggdonor tilbys oppfølging eller henvises til sin fastlege.
Testing skal bare utføres ved laboratorier som Helsedirektoratet har godkjent for donortesting etter forskrift om håndtering av humane celler og vev, se Helsedirektoratets oversikt over godkjente laboratorier.
Dersom donor senere kommer tilbake for nytt egguttak, tas det nye prøver til testing.
Se mer om krav til donasjon og laboratorieundersøkelser i forskrift om håndtering av humane celler og vev kapittel 4.
c) Karantene og undersøkelser av eggdonor
Donasjonsprøve tas tidligst 30 dager før planlagt egguthenting. Det anbefales at donasjonsprøven undersøkes både ved serologi og ved hjelp av PCR.
Dersom donasjonsprøvene i forkant av hver egguthenting er undersøkt både ved serologi og ved hjelp av PCR for HIV, HBV og HCV, er det ikke nødvendig å gjenta undersøkelsen på en ny donasjonsprøve etter 6 måneder, og krav om karantene bortfaller, se forskrift om håndtering av humane celler og vev § 19. Hvis donasjonsprøven ikke er testet ved hjelp av PCR, skal nye blodprøver tas av donor etter 6 måneder og testes som tidligere. Egg kan frigis når det er bekreftet at prøven er negativ, forutsatt at krav i punkt 4.3.3 om frigiving av donoregg og donorsæd er oppfylt.
Kryopreserverte egg eller embryo som er i karantene (og derfor ikke godkjent for bruk) håndteres og oppbevares i tråd med retningslinjer for håndtering av smittefarlig materiale, og i henhold til kravene i forskrift om håndtering av humane celler og vev. Eggene skal oppbevares fysisk atskilt fra materiale som er frigitt for bruk, og skal være tydelig merket.
4.4.3 Frigiving av donoregg og donorsæd for bruk
Eggbanken/sædbanken skal ha et system som sikrer at celler og vev ikke kan frigis før alle krav fastsatt i forskrift om håndtering av humane celler og vev er oppfylt, jf. forskriften § 34 bokstav b.
Før frigiving for bruk til assistert befruktning, skal det dokumenteres at donoreggene og donorsæden oppfyller alle relevante spesifikasjoner etter forskrift om håndtering av humane celler og vev § 34 bokstav d.
4.5 Antall familier ved bruk av sæddonor og antall egguttak ved bruk av eggdonor
Sist faglig oppdatert: 14.04.2021
Begrensning på antall familier ved bruk av sæddonor
Sæd fra hver enkelt donor skal ikke gi opphav til barn i mer enn 6 familier.
Begrensning på antall egguttak fra eggdonor
Den øvre grensen for antall ganger hver eggdonor kan donere egg, er 3 uthentinger. Alle eggene som hentes ut ved de 3 uttakene, kan brukes til assistert befruktning.
4.5 Antall familier ved bruk av sæddonor og antall egguttak ved bruk av eggdonor
Sist faglig oppdatert: 14.04.2021
Begrensning på antall familier ved bruk av sæddonor
Sæd fra hver enkelt donor skal ikke gi opphav til barn i mer enn 6 familier.
Begrensning på antall egguttak fra eggdonor
Den øvre grensen for antall ganger hver eggdonor kan donere egg, er 3 uthentinger. Alle eggene som hentes ut ved de 3 uttakene, kan brukes til assistert befruktning.
4.6 Destruering av lagrede donerte egg eller donert sæd
Sist faglig oppdatert: 14.04.2021
Eggbanken/sædbanken skal destruere lagrede egg eller sæd dersom:
- det besluttes tilbakekall etter forskrift om håndtering av humane celler og vev § 42
- sæddonor ikke blir endelig godkjent
- donor dør
- donor trekker samtykket
Eggbanken/sædbanken skal melde fra om at ubrukte egg eller sæd skal destrueres til virksomheter som har fått utlevert egg eller sæd fra den aktuelle donoren, se også forskrift om håndtering av humane celler og vev § 55.
Se rutiner i vedleggene III og IV.
4.6 Destruering av lagrede donerte egg eller donert sæd
Sist faglig oppdatert: 14.04.2021
Eggbanken/sædbanken skal destruere lagrede egg eller sæd dersom:
- det besluttes tilbakekall etter forskrift om håndtering av humane celler og vev § 42
- sæddonor ikke blir endelig godkjent
- donor dør
- donor trekker samtykket
Eggbanken/sædbanken skal melde fra om at ubrukte egg eller sæd skal destrueres til virksomheter som har fått utlevert egg eller sæd fra den aktuelle donoren, se også forskrift om håndtering av humane celler og vev § 55.
Se rutiner i vedleggene III og IV.
4.7 Økonomisk kompensasjon til donor
Sist faglig oppdatert: 14.04.2021
Retningslinjene gjelder for alle virksomheter som rekrutterer donorer. Det er ikke anledning til å tilby høyere kompensasjon enn fastsatt.
4.7.1 Sæddonor
Sæddonor kan få utbetalt 0,7 % av 1 G (grunnbeløpet i Folketrygden) for hver donasjon. I tillegg kan donor få dekket dokumenterte reiseutgifter.
4.7.2 Eggdonor
Eggdonor kan få utbetalt 5 % av 1 G for hvert egguttak.
I tillegg kan donor få dekket dokumenterte reiseutgifter. Kompensasjonen utbetales i forbindelse med egguthentingen.
Hvis donor trekker samtykket før egguthentingen skal hun likevel få dekket dokumenterte reiseutgifter. Dette må det informeres om før prosessen starter.
4.7.3 Nærmere om retningslinjene for kompensasjon
Utgangspunktet for retningslinjene om kompensasjon er forbudet mot kommersiell utnytting av menneskekroppen og dens deler, jf. Biomedisinkonvensjonen, EU-regelverk og forskrift om håndtering av humane celler og vev § 14. Det fremgår her at kompensasjon for donasjonen skal være frivillig og vederlagsfri, og donor kan motta en kompensasjon begrenset til godtgjøring for utgifter og ulemper i forbindelse med donasjonen.
Reisekostnader dekkes etter dokumenterte utlegg, og holdes utenom den fastsatte kompensasjonen. Bakgrunnen for dette er å sikre at geografisk bosted ikke påvirker hvem som har anledning til å donere kjønnsceller.
Kompensasjon for donors belastning og tidsbruk er knyttet opp til Grunnbeløpet (G) i folketrygden.
Nærmere om grunnlaget for beregning av kompensasjon i rapporten om eggdonasjon kapittel 3: Forslag til veiledning og retningslinjer knyttet til etablering av tilbud om eggdonasjon.
4.7 Økonomisk kompensasjon til donor
Sist faglig oppdatert: 14.04.2021
Retningslinjene gjelder for alle virksomheter som rekrutterer donorer. Det er ikke anledning til å tilby høyere kompensasjon enn fastsatt.
4.7.1 Sæddonor
Sæddonor kan få utbetalt 0,7 % av 1 G (grunnbeløpet i Folketrygden) for hver donasjon. I tillegg kan donor få dekket dokumenterte reiseutgifter.
4.7.2 Eggdonor
Eggdonor kan få utbetalt 5 % av 1 G for hvert egguttak.
I tillegg kan donor få dekket dokumenterte reiseutgifter. Kompensasjonen utbetales i forbindelse med egguthentingen.
Hvis donor trekker samtykket før egguthentingen skal hun likevel få dekket dokumenterte reiseutgifter. Dette må det informeres om før prosessen starter.
4.7.3 Nærmere om retningslinjene for kompensasjon
Utgangspunktet for retningslinjene om kompensasjon er forbudet mot kommersiell utnytting av menneskekroppen og dens deler, jf. Biomedisinkonvensjonen, EU-regelverk og forskrift om håndtering av humane celler og vev § 14. Det fremgår her at kompensasjon for donasjonen skal være frivillig og vederlagsfri, og donor kan motta en kompensasjon begrenset til godtgjøring for utgifter og ulemper i forbindelse med donasjonen.
Reisekostnader dekkes etter dokumenterte utlegg, og holdes utenom den fastsatte kompensasjonen. Bakgrunnen for dette er å sikre at geografisk bosted ikke påvirker hvem som har anledning til å donere kjønnsceller.
Kompensasjon for donors belastning og tidsbruk er knyttet opp til Grunnbeløpet (G) i folketrygden.
Nærmere om grunnlaget for beregning av kompensasjon i rapporten om eggdonasjon kapittel 3: Forslag til veiledning og retningslinjer knyttet til etablering av tilbud om eggdonasjon.
4.8 Taushetsplikt og krav til ansatte som behandler helseopplysninger
Sist faglig oppdatert: 14.04.2021
Alle som behandler helseopplysninger etter dette rundskrivet har taushetsplikt etter de særlige kravene i helseregisterloven kapittel 3, se § 17, jf. forskrift om håndtering av humane celler og vev § 50. Se også helsepersonelloven kapittel 5 om taushetsplikt og opplysningsrett, og Helsedirektoratets rundskriv om helsepersonelloven med kommentarer kapittel 5.
Taushetsplikten gjelder også donorens fødselsdato, personnummer, adresse, bostedskommune og donorkode.
Kun ansatte som er særlig utpekt av eggbanken eller sædbanken kan registrere opplysningene om donor i det sentrale egg- og sæddonorregisteret.
Eggbanken/sædbanken bør organiseres slik at ansatte som har ansvar for å registrere donor i det sentrale registeret, ikke får informasjon om koblingen mellom donors identitet, donorkoden og kvinnen/paret som mottar assistert befruktning fra aktuell donor.
Ansatte med ansvar for registrering bør også underskrive en erklæring om taushetsplikt.
4.8 Taushetsplikt og krav til ansatte som behandler helseopplysninger
Sist faglig oppdatert: 14.04.2021
Alle som behandler helseopplysninger etter dette rundskrivet har taushetsplikt etter de særlige kravene i helseregisterloven kapittel 3, se § 17, jf. forskrift om håndtering av humane celler og vev § 50. Se også helsepersonelloven kapittel 5 om taushetsplikt og opplysningsrett, og Helsedirektoratets rundskriv om helsepersonelloven med kommentarer kapittel 5.
Taushetsplikten gjelder også donorens fødselsdato, personnummer, adresse, bostedskommune og donorkode.
Kun ansatte som er særlig utpekt av eggbanken eller sædbanken kan registrere opplysningene om donor i det sentrale egg- og sæddonorregisteret.
Eggbanken/sædbanken bør organiseres slik at ansatte som har ansvar for å registrere donor i det sentrale registeret, ikke får informasjon om koblingen mellom donors identitet, donorkoden og kvinnen/paret som mottar assistert befruktning fra aktuell donor.
Ansatte med ansvar for registrering bør også underskrive en erklæring om taushetsplikt.
4.9 Registrering av opplysninger om donor i det sentrale egg- og sæddonorregisteret
Sist faglig oppdatert: 14.04.2021
4.9.1 Tidspunkt for registrering av donor i det sentrale registeret
Senest før egguttaket eller før sæddonasjonen, skal eggbanken/sædbanken registrere donor med navn, fødselsdato og personnummer i det sentrale egg- og sæddonorregisteret, se kapittel 6.
4.9.2 Tildeling av donorkode fra det sentrale registeret
Når donor er registrert i det sentrale egg- og sæddonorregisteret, får eggbanken eller sædbanken tildelt en donorkode fra registeret.
Sæddonors donasjonsperiode kan ikke starte, og egg fra eggdonor kan ikke tas ut, før eggbanken/sædbanken har fått oppgitt en donorkode.
4.9.3 Informasjon om at donor er endelig godkjent
Eggbanken/sædbanken skal melde fra til det sentrale egg- og sæddonorregisteret om at donor er endelig godkjent.
Dersom resultatene fra undersøkelsene av donor viser at donor ikke kan brukes, skal eggbanken/sædbanken melde fra om dette til det sentrale registeret, slik at donor kan slettes.
4.9.4 Ny informasjon om donor
Eggbanken/sædbanken skal melde fra til det sentrale registeret dersom:
- donor ikke har gitt opphav til barn
- donor trekker samtykket og ikke har gitt opphav til barn
Det vises til at formålet med registeret er at barn skal få informasjon om donors identitet. Registeret skal ikke ha opplysninger om donorer som ikke har gitt opphav til barn. Opplysningene slettes derfor når det ikke lenger er relevant og nødvendig å oppbevare dem.
Virksomhetene som har registrert donor har også ansvar for at informasjonen om donor i det sentrale egg- og sæddonorregisteret er korrekt og oppdatert.
4.9 Registrering av opplysninger om donor i det sentrale egg- og sæddonorregisteret
Sist faglig oppdatert: 14.04.2021
4.9.1 Tidspunkt for registrering av donor i det sentrale registeret
Senest før egguttaket eller før sæddonasjonen, skal eggbanken/sædbanken registrere donor med navn, fødselsdato og personnummer i det sentrale egg- og sæddonorregisteret, se kapittel 6.
4.9.2 Tildeling av donorkode fra det sentrale registeret
Når donor er registrert i det sentrale egg- og sæddonorregisteret, får eggbanken eller sædbanken tildelt en donorkode fra registeret.
Sæddonors donasjonsperiode kan ikke starte, og egg fra eggdonor kan ikke tas ut, før eggbanken/sædbanken har fått oppgitt en donorkode.
4.9.3 Informasjon om at donor er endelig godkjent
Eggbanken/sædbanken skal melde fra til det sentrale egg- og sæddonorregisteret om at donor er endelig godkjent.
Dersom resultatene fra undersøkelsene av donor viser at donor ikke kan brukes, skal eggbanken/sædbanken melde fra om dette til det sentrale registeret, slik at donor kan slettes.
4.9.4 Ny informasjon om donor
Eggbanken/sædbanken skal melde fra til det sentrale registeret dersom:
- donor ikke har gitt opphav til barn
- donor trekker samtykket og ikke har gitt opphav til barn
Det vises til at formålet med registeret er at barn skal få informasjon om donors identitet. Registeret skal ikke ha opplysninger om donorer som ikke har gitt opphav til barn. Opplysningene slettes derfor når det ikke lenger er relevant og nødvendig å oppbevare dem.
Virksomhetene som har registrert donor har også ansvar for at informasjonen om donor i det sentrale egg- og sæddonorregisteret er korrekt og oppdatert.
4.10. Eggbankens/sædbankens lokale donorregister
Sist faglig oppdatert: 14.04.2021
4.10.1 Formålet med det lokale donorregisteret
Opplysninger i det lokale donorregisteret skal benyttes for å finne en egnet donor, se bioteknologiloven § 2-10 om Valg av eggdonor og sæddonor.
Opplysningene i det lokale donorregisteret skal også bidra til at sæd fra donor ikke utleveres til assistert befruktning til flere familier hvis donor har gitt opphav til barn i 6 familier.
4.10.2 Rettslig grunnlag
Det rettslige grunnlaget for registrering av opplysninger i eggbankens/sædbankens lokale donorregister er samtykke fra donor.
4.10.3 Opplysninger som skal registreres i det lokale donorregisteret
- donorkode
- donors fysiske karakteristika (høyde, etnisitet, hår og øyenfarge), se Ot. prp. nr. 64 (2002-2003) pkt. 2.9.6.4 om valg av sædgiver og Innst. 296 L (2019-200), kapittelet om eggdonasjon
- andre relevante opplysninger som skal sikre at donor er egnet for bruk i det aktuelle tilfellet
- antall familier hvor donor er brukt
4.10.4 Sletting av opplysningene om donor i det lokale donorregisteret
Opplysningene om donor skal slettes fra lokalt donorregister når donor ikke lenger kan brukes.
Opplysningene om donor i det lokale donorregisteret skal derfor slettes dersom:
- sæddonor ikke blir endelig godkjent.
- donor trekker samtykket.
- donors sæd har gitt opphav til barn i seks familier.
- donor dør.
- donor senere anses som uegnet.
- donors egg fra ett egguttak er brukt opp.
4.10. Eggbankens/sædbankens lokale donorregister
Sist faglig oppdatert: 14.04.2021
4.10.1 Formålet med det lokale donorregisteret
Opplysninger i det lokale donorregisteret skal benyttes for å finne en egnet donor, se bioteknologiloven § 2-10 om Valg av eggdonor og sæddonor.
Opplysningene i det lokale donorregisteret skal også bidra til at sæd fra donor ikke utleveres til assistert befruktning til flere familier hvis donor har gitt opphav til barn i 6 familier.
4.10.2 Rettslig grunnlag
Det rettslige grunnlaget for registrering av opplysninger i eggbankens/sædbankens lokale donorregister er samtykke fra donor.
4.10.3 Opplysninger som skal registreres i det lokale donorregisteret
- donorkode
- donors fysiske karakteristika (høyde, etnisitet, hår og øyenfarge), se Ot. prp. nr. 64 (2002-2003) pkt. 2.9.6.4 om valg av sædgiver og Innst. 296 L (2019-200), kapittelet om eggdonasjon
- andre relevante opplysninger som skal sikre at donor er egnet for bruk i det aktuelle tilfellet
- antall familier hvor donor er brukt
4.10.4 Sletting av opplysningene om donor i det lokale donorregisteret
Opplysningene om donor skal slettes fra lokalt donorregister når donor ikke lenger kan brukes.
Opplysningene om donor i det lokale donorregisteret skal derfor slettes dersom:
- sæddonor ikke blir endelig godkjent.
- donor trekker samtykket.
- donors sæd har gitt opphav til barn i seks familier.
- donor dør.
- donor senere anses som uegnet.
- donors egg fra ett egguttak er brukt opp.
4.11 Donasjonsregister etter forskrift om håndtering av humane celler og vev
Sist faglig oppdatert: 14.04.2021
4.11.1 Donasjonsregisterets innhold og formål
Eggbanken/sædbanken skal ha et donasjonsregister etter forskrift om håndtering av humane celler og vev.
Registeret skal inneholde en liste over donorer, helseopplysninger for disse, donerte celler og vev og tildelt felles europeisk kode (SEC) der det er relevant, se forskrift om håndtering av humane celler og vev § 45.
Formålet med donasjonsregisteret er å bidra til å sikre sporbarhet fra donor til mottaker og omvendt, jf. forskrift om håndtering av humane celler og vev §§ 40 og 45. Registeret skal samle inn og innenfor forskriftens rammer behandle opplysninger om celler og vev og donorer i Norge for å nå formålene som nevnt i forskriften § 1.
Formålet med registeret er styrende for hva man kan bruke opplysningene til eller hva man kan registrere.
4.11.2 Rettslig grunnlag
Det rettslige grunnlaget for donasjonsregisteret i eggbanken/sædbanken er samtykke fra donor, se også forskrift om håndtering av humane celler og vev § 48.
4.11.3 Opplysninger som virksomheten skal registrere i donasjonsregisteret
Kravene til registrering av opplysningene i eggbankens/sædbankens donasjonsregister fremgår av forskrift om håndtering av humane celler og vev § 48 første ledd.
Det fremgår her at det er krav om registrering av entydig donoridentifikasjon. For eggbanker/sædbanker vil det blant annet innebære registrering av donorkode og fødselsnummer. Formålet er at celler og vev skal kunne spores på alle trinn i håndteringsprosessen fra donor til mottaker og omvendt, se forskriften §§ 40 og 45.
Eggbanken/sædbanken skal derfor registrere entydig donoridentifikasjon i dette registeret som sikrer sporing av donor. Virksomheten skal ikke registrere informasjon om mottaker (mor) eller annen informasjon knyttet til bruk av donert egg eller sæd i dette registeret, kun navn på den virksomheten som mottar materialet.
Med sluttbruker i § 48 første ledd, bokstav o) og annet ledd, bokstav b), menes den kliniker eller virksomhet som benytter cellene eller vevet i pasientbehandlingen, se Veileder til forskrift om håndtering av humane celler og vev.
Virksomheter som både har egg- og/eller sædbank og tilbyr behandling med donoregg eller donorsæd, må ha separate registre for å oppfylle krav i § 48 første ledd og § 48 andre ledd.
Se avgrensing mot krav til innhold i donasjonsregister hos virksomheter som tilbyr assistert befruktning med donoregg og donorsæd i kapittel 5.
Øvrige krav og veiledning om donasjonsregisteret fremgår av forskrift om håndtering av humane celler og vev kapittel 9, se særlig forskriften § 45 og Veileder til forskrift om håndtering av humane celler og vev.
4.11 Donasjonsregister etter forskrift om håndtering av humane celler og vev
Sist faglig oppdatert: 14.04.2021
4.11.1 Donasjonsregisterets innhold og formål
Eggbanken/sædbanken skal ha et donasjonsregister etter forskrift om håndtering av humane celler og vev.
Registeret skal inneholde en liste over donorer, helseopplysninger for disse, donerte celler og vev og tildelt felles europeisk kode (SEC) der det er relevant, se forskrift om håndtering av humane celler og vev § 45.
Formålet med donasjonsregisteret er å bidra til å sikre sporbarhet fra donor til mottaker og omvendt, jf. forskrift om håndtering av humane celler og vev §§ 40 og 45. Registeret skal samle inn og innenfor forskriftens rammer behandle opplysninger om celler og vev og donorer i Norge for å nå formålene som nevnt i forskriften § 1.
Formålet med registeret er styrende for hva man kan bruke opplysningene til eller hva man kan registrere.
4.11.2 Rettslig grunnlag
Det rettslige grunnlaget for donasjonsregisteret i eggbanken/sædbanken er samtykke fra donor, se også forskrift om håndtering av humane celler og vev § 48.
4.11.3 Opplysninger som virksomheten skal registrere i donasjonsregisteret
Kravene til registrering av opplysningene i eggbankens/sædbankens donasjonsregister fremgår av forskrift om håndtering av humane celler og vev § 48 første ledd.
Det fremgår her at det er krav om registrering av entydig donoridentifikasjon. For eggbanker/sædbanker vil det blant annet innebære registrering av donorkode og fødselsnummer. Formålet er at celler og vev skal kunne spores på alle trinn i håndteringsprosessen fra donor til mottaker og omvendt, se forskriften §§ 40 og 45.
Eggbanken/sædbanken skal derfor registrere entydig donoridentifikasjon i dette registeret som sikrer sporing av donor. Virksomheten skal ikke registrere informasjon om mottaker (mor) eller annen informasjon knyttet til bruk av donert egg eller sæd i dette registeret, kun navn på den virksomheten som mottar materialet.
Med sluttbruker i § 48 første ledd, bokstav o) og annet ledd, bokstav b), menes den kliniker eller virksomhet som benytter cellene eller vevet i pasientbehandlingen, se Veileder til forskrift om håndtering av humane celler og vev.
Virksomheter som både har egg- og/eller sædbank og tilbyr behandling med donoregg eller donorsæd, må ha separate registre for å oppfylle krav i § 48 første ledd og § 48 andre ledd.
Se avgrensing mot krav til innhold i donasjonsregister hos virksomheter som tilbyr assistert befruktning med donoregg og donorsæd i kapittel 5.
Øvrige krav og veiledning om donasjonsregisteret fremgår av forskrift om håndtering av humane celler og vev kapittel 9, se særlig forskriften § 45 og Veileder til forskrift om håndtering av humane celler og vev.
4.12 Utlevering av opplysninger til donor
Sist faglig oppdatert: 14.04.2021
Donor har bare rett til å få opplysninger som er registrert om seg selv, og skal ikke gis opplysninger om kvinnens, parets eller barnets identitet, se bioteknologiloven § 2-9 fjerde ledd.
Donor har ikke rett til å få utlevert donorkoden, eller til å få informasjon om hvordan egg eller sæd er brukt.
4.12 Utlevering av opplysninger til donor
Sist faglig oppdatert: 14.04.2021
Donor har bare rett til å få opplysninger som er registrert om seg selv, og skal ikke gis opplysninger om kvinnens, parets eller barnets identitet, se bioteknologiloven § 2-9 fjerde ledd.
Donor har ikke rett til å få utlevert donorkoden, eller til å få informasjon om hvordan egg eller sæd er brukt.
4.13 Opplysninger i donors pasientjournal
Sist faglig oppdatert: 22.04.2021
Opplysninger om donor skal også føres i donors pasientjournal (forskrift om håndtering av humane celler og vev § 29 og forskrift om pasientjournal). Donorkoden skal ikke stå i pasientjournalen.
Det fremgår av forskrift om håndtering av humane celler og vev § 29 at:
Virksomhet som evaluerer donor etter forskriften kapittel 4 og 5, som uttar celler og vev eller som mottar celler og vev skal føre pasientjournal etter forskrift om pasientjournal
Det fremgår nærmere av § 29 hvilke opplysninger som skal føres i pasientjournalen.
4.13 Opplysninger i donors pasientjournal
Sist faglig oppdatert: 22.04.2021
Opplysninger om donor skal også føres i donors pasientjournal (forskrift om håndtering av humane celler og vev § 29 og forskrift om pasientjournal). Donorkoden skal ikke stå i pasientjournalen.
Det fremgår av forskrift om håndtering av humane celler og vev § 29 at:
Virksomhet som evaluerer donor etter forskriften kapittel 4 og 5, som uttar celler og vev eller som mottar celler og vev skal føre pasientjournal etter forskrift om pasientjournal
Det fremgår nærmere av § 29 hvilke opplysninger som skal føres i pasientjournalen.
4.14 Informasjonssikkerhet
Sist faglig oppdatert: 14.04.2021
Det er virksomheten som er databehandlingsansvarlig. Krav til virksomhetens styringssystem, inkludert krav til risikovurdering, omfang og dokumentasjon, fremgår av forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten og forskrift om håndtering av humane celler og vev § 8.
- Databehandlingsansvarlig skal ha skriftlig prosedyre for hvordan opplysninger skal håndteres og hvilke opplysninger som kan kobles. Prosedyren(e) skal særlig ivareta rutiner hvor den som registrerer opplysninger samtidig vil ha tilgang til informasjon om eggdonors eller sæddonors identitet og donorkode.
- Databehandlingsansvarlig skal foreta risikovurdering når det gjelder sikring av taushetsbelagte opplysninger, og har et selvstendig ansvar for at det til enhver tid gjeldende regelverk og gjeldende norm for informasjonssikkerhet i helsesektoren etterleves.
- Tilgang kan bare gis til personell der donasjonsregisteret eller det lokale donorregisteret føres, og som har tjenstlig behov for slik tilgang. Databehandlingsansvarlig skal kunne dokumentere hvem som har tilgang til registrene.
- Oppslag i registrene må loggføres.
4.14 Informasjonssikkerhet
Sist faglig oppdatert: 14.04.2021
Det er virksomheten som er databehandlingsansvarlig. Krav til virksomhetens styringssystem, inkludert krav til risikovurdering, omfang og dokumentasjon, fremgår av forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten og forskrift om håndtering av humane celler og vev § 8.
- Databehandlingsansvarlig skal ha skriftlig prosedyre for hvordan opplysninger skal håndteres og hvilke opplysninger som kan kobles. Prosedyren(e) skal særlig ivareta rutiner hvor den som registrerer opplysninger samtidig vil ha tilgang til informasjon om eggdonors eller sæddonors identitet og donorkode.
- Databehandlingsansvarlig skal foreta risikovurdering når det gjelder sikring av taushetsbelagte opplysninger, og har et selvstendig ansvar for at det til enhver tid gjeldende regelverk og gjeldende norm for informasjonssikkerhet i helsesektoren etterleves.
- Tilgang kan bare gis til personell der donasjonsregisteret eller det lokale donorregisteret føres, og som har tjenstlig behov for slik tilgang. Databehandlingsansvarlig skal kunne dokumentere hvem som har tilgang til registrene.
- Oppslag i registrene må loggføres.
4.15 Opphør eller nedleggelse av virksomhet
Sist faglig oppdatert: 14.04.2021
Biobankloven § 8 stiller krav til sædbanker og fertilitetsklinikker ved opphør eller nedleggelse av virksomheten.
4.15 Opphør eller nedleggelse av virksomhet
Sist faglig oppdatert: 14.04.2021
Biobankloven § 8 stiller krav til sædbanker og fertilitetsklinikker ved opphør eller nedleggelse av virksomheten.
Krav til virksomheter som tilbyr behandling med donoregg og/eller donorsæd
Sist faglig oppdatert: 14.04.2021
Dette kapittelet omhandler behandlingen med assistert befruktning med donoregg og/eller donorsæd, og stiller krav til virksomhetene som tilbyr slik behandling. Det gir videre føringer om kravene til donasjonsregister og mor-donorkoderegister.
Kapittelet gjelder både for virksomheter som bruker egg og/eller sæd fra utenlandske og fra norske eggbanker/sædbanker.
Det er særlige bestemmelser om bruk av egg og sæd fra utenlandske eggbanker og sædbanker. Her gis også veiledning om prosedyrer for registrering av donor i det sentrale egg- og sæddonorregisteret.
5.1 Godkjenning i Helsedirektoratet og i Direktoratet for medisinske produkter og melding til Biobankregisteret
Sist faglig oppdatert: 02.02.2024
En virksomhet som håndterer donoregg og donorsæd må godkjennes av både av Helsedirektoratet og Direktoratet for medisinske produkter (DMP). DMP fatter vedtak om godkjenning etter forskrift om håndtering av humane celler og vev § 4 og Helsedirektoratet etter bioteknologiloven kapittel 2.
Virksomhetene må i søknaden redegjøre for hvordan krav i lov og forskrift og føringer i rundskrivet vil ivaretas. Se sjekkliste for godkjenning etter bioteknologiloven i vedlegg VII.
Virksomheter som lagrer donoregg og/eller donorsæd over en viss tid må melde om opprettelse av behandlingsbiobank til Biobankregisteret, se biobankloven § 5. Biologisk materiale som uttas i forbindelse med undersøkelse, diagnostikk og behandling, og som destrueres etter kort tid, omfattes ikke av loven, se biobankloven § 3. Virksomheter som kun bruker donoregg og/eller donorsæd, og hvor materialet destrueres etter kort tid, trenger derfor ikke sende melding til Biobankregisteret. Se "om Biobankregisteret" på FHI.no.
5.1 Godkjenning i Helsedirektoratet og i Direktoratet for medisinske produkter og melding til Biobankregisteret
Sist faglig oppdatert: 02.02.2024
En virksomhet som håndterer donoregg og donorsæd må godkjennes av både av Helsedirektoratet og Direktoratet for medisinske produkter (DMP). DMP fatter vedtak om godkjenning etter forskrift om håndtering av humane celler og vev § 4 og Helsedirektoratet etter bioteknologiloven kapittel 2.
Virksomhetene må i søknaden redegjøre for hvordan krav i lov og forskrift og føringer i rundskrivet vil ivaretas. Se sjekkliste for godkjenning etter bioteknologiloven i vedlegg VII.
Virksomheter som lagrer donoregg og/eller donorsæd over en viss tid må melde om opprettelse av behandlingsbiobank til Biobankregisteret, se biobankloven § 5. Biologisk materiale som uttas i forbindelse med undersøkelse, diagnostikk og behandling, og som destrueres etter kort tid, omfattes ikke av loven, se biobankloven § 3. Virksomheter som kun bruker donoregg og/eller donorsæd, og hvor materialet destrueres etter kort tid, trenger derfor ikke sende melding til Biobankregisteret. Se "om Biobankregisteret" på FHI.no.
5.2 Valg av donor
Sist faglig oppdatert: 14.04.2021
Etter bioteknologiloven § 2-10 er det behandlende lege som skal velge egnet eggdonor eller sæddonor.
Se om valg av donor i Ot. prp. nr. 64 (2002-2003) pkt. 2.9.6.4 om Valg av sædgiver og Stortingets Innst. 296 L (2019-2020) hvor det fremgår at kvinner eller par som søker assistert befruktning i Norge, ikke har anledning til å velge donor selv. Det fremgår videre at behandlende lege bør velge en donor som i størst mulig grad ligner på foreldrene som mottar behandlingen. Det er ikke anledning til å velge donor ut fra andre egenskaper. I praksis vil behandlende lege henvende seg til en egg- eller sædbank for å få utlevert egg eller sæd fra en egnet donor.
5.2 Valg av donor
Sist faglig oppdatert: 14.04.2021
Etter bioteknologiloven § 2-10 er det behandlende lege som skal velge egnet eggdonor eller sæddonor.
Se om valg av donor i Ot. prp. nr. 64 (2002-2003) pkt. 2.9.6.4 om Valg av sædgiver og Stortingets Innst. 296 L (2019-2020) hvor det fremgår at kvinner eller par som søker assistert befruktning i Norge, ikke har anledning til å velge donor selv. Det fremgår videre at behandlende lege bør velge en donor som i størst mulig grad ligner på foreldrene som mottar behandlingen. Det er ikke anledning til å velge donor ut fra andre egenskaper. I praksis vil behandlende lege henvende seg til en egg- eller sædbank for å få utlevert egg eller sæd fra en egnet donor.
5.3 Destruering av lagrede egg, sæd og embryo
Sist faglig oppdatert: 14.04.2021
Virksomheten som tilbyr behandling med donoregg eller donorsæd skal destruere eventuelle lagrede ubefruktede donoregg eller ubrukt donorsæd som er lagret dersom:
- eggbanken/sædbanken beslutter tilbakekall etter forskrift om håndtering av humane celler og vev § 42
- donor dør
- donor trekker samtykket
Virksomheten som tilbyr behandling med donoregg eller donorsæd skal etter å ha informert kvinnen/paret destruere eventuelle lagrede befruktede egg med egg eller sæd fra en donor dersom:
- donor dør
- kvinnen det befruktede egget skulle settes inn i er fylt 46 år
Dersom det fødes barn med alvorlig arvelig sykdom som mest sannsynlig er overført fra donor, skal virksomheten som hovedregel destruere eventuelle lagrede befruktede egg. Det er i slike tilfeller imidlertid krav om samtykke fra den enslige kvinnen eller begge i paret før eggene destrueres.
Kravet om samtykke fra den enslige kvinnen/paret ses i sammenheng med at Den europeiske menneskerettighetsdomstolen (EMD) i sin praksis har vektlagt retten til rådighet over egne befruktede egg i sin tolkning av EMK artikkel 8, se også Prop. 34 L (2019-2020).
Etter forskrift om håndtering av celler og vev § 42 skal en eggbank/sædbank «på en rask, presis og verifiserbar måte, trekke tilbake alle produkter som kan ha forbindelse med en uønsket hendelse eller bivirkning.»
Dersom eggene eller sæden ikke er tilbakekalt, er det virksomheten som benytter eggene eller sæden må gjøre den medisinskfaglige forsvarlighetsvurderingen om risikoen for overføring av arvelige sykdommer fra donor til mottaker i det enkelte tilfelle. Forskrift om håndtering av humane celler og vev § 24 om Genetisk test stiller krav om at «det gjennom familieanamnese vurderes om det er risiko for overføring av arvelige sykdommer fra donor». Helsepersonellet må ta stilling til om bruk av donor i det enkelte tilfelle er forsvarlig, jf. helsepersonelloven § 4.
Ved bruk av lagrede egg eller sæd, skal virksomhetene melde fra til eggbanken eller sædbanken som har levert eggene eller sæden dersom det fødes barn med alvorlig arvelig sykdom, se forskrift om håndtering av humane celler og vev § 55.
Hendelsen skal etter forskrift om håndtering av humane celler og vev §§ 53 og 54 også meldes som en alvorlig uønsket bivirkning eller hendelse i tråd med gjeldende meldeordning.
Se rutiner som beskriver prosedyrene mer utførlig i vedleggene III og IV.
5.3 Destruering av lagrede egg, sæd og embryo
Sist faglig oppdatert: 14.04.2021
Virksomheten som tilbyr behandling med donoregg eller donorsæd skal destruere eventuelle lagrede ubefruktede donoregg eller ubrukt donorsæd som er lagret dersom:
- eggbanken/sædbanken beslutter tilbakekall etter forskrift om håndtering av humane celler og vev § 42
- donor dør
- donor trekker samtykket
Virksomheten som tilbyr behandling med donoregg eller donorsæd skal etter å ha informert kvinnen/paret destruere eventuelle lagrede befruktede egg med egg eller sæd fra en donor dersom:
- donor dør
- kvinnen det befruktede egget skulle settes inn i er fylt 46 år
Dersom det fødes barn med alvorlig arvelig sykdom som mest sannsynlig er overført fra donor, skal virksomheten som hovedregel destruere eventuelle lagrede befruktede egg. Det er i slike tilfeller imidlertid krav om samtykke fra den enslige kvinnen eller begge i paret før eggene destrueres.
Kravet om samtykke fra den enslige kvinnen/paret ses i sammenheng med at Den europeiske menneskerettighetsdomstolen (EMD) i sin praksis har vektlagt retten til rådighet over egne befruktede egg i sin tolkning av EMK artikkel 8, se også Prop. 34 L (2019-2020).
Etter forskrift om håndtering av celler og vev § 42 skal en eggbank/sædbank «på en rask, presis og verifiserbar måte, trekke tilbake alle produkter som kan ha forbindelse med en uønsket hendelse eller bivirkning.»
Dersom eggene eller sæden ikke er tilbakekalt, er det virksomheten som benytter eggene eller sæden må gjøre den medisinskfaglige forsvarlighetsvurderingen om risikoen for overføring av arvelige sykdommer fra donor til mottaker i det enkelte tilfelle. Forskrift om håndtering av humane celler og vev § 24 om Genetisk test stiller krav om at «det gjennom familieanamnese vurderes om det er risiko for overføring av arvelige sykdommer fra donor». Helsepersonellet må ta stilling til om bruk av donor i det enkelte tilfelle er forsvarlig, jf. helsepersonelloven § 4.
Ved bruk av lagrede egg eller sæd, skal virksomhetene melde fra til eggbanken eller sædbanken som har levert eggene eller sæden dersom det fødes barn med alvorlig arvelig sykdom, se forskrift om håndtering av humane celler og vev § 55.
Hendelsen skal etter forskrift om håndtering av humane celler og vev §§ 53 og 54 også meldes som en alvorlig uønsket bivirkning eller hendelse i tråd med gjeldende meldeordning.
Se rutiner som beskriver prosedyrene mer utførlig i vedleggene III og IV.
5.4 Bruk av egg og sæd fra utenlandske eggbanker og sædbanker og registrering i det sentrale egg- og sæddonorregisteret
Sist faglig oppdatert: 16.02.2024
5.4.1 Krav til registrering av opplysninger om donor fra eggbank/sædbank i utlandet
Virksomheter som bruker donoregg eller donorsæd fra eggbank eller sædbank i utlandet, skal registrere følgende opplysninger om donor i det sentrale egg- og sæddonorregisteret:
- navn
- fødselsdato
- personnummer
- navn på utenlandsk eggbank/sædbank
- DIS-delen av SEC-koden fra eggbank/sædbank i utlandet (se figur i vedlegg V)
- bekreftelse på at donor har samtykket
Virksomhetene som bruker donoregg eller donorsæd fra eggbank/sædbank i utlandet har ansvar for å registrere informasjonen om utenlandsk donor i det sentrale registeret, se bioteknologiloven § 2-10. Donor bør registreres så snart som mulig etter at dokumentasjonen er mottatt.
Dokumentasjonen (donors navn, fødselsdato og personnummer) makuleres med en gang donor er registrert i det sentrale registeret.
Virksomheten skal sikre at det er samme/korrekt donorkode som registreres både i det sentrale egg- og sæddonorregisteret og i mor-donorkoderegisteret.
5.4.2 Anskaffelse og import av donoregg og donorsæd
Import av donoregg og donorsæd krever godkjenning fra Helsedirektoratet, se bioteknologiloven §§ 2-11 og 7-1.
Helsedirektoratet kan gi godkjenning for import av
- donorsæd fra virksomheter utenfor EU/EØS-området
- donorsæd fra virksomheter i EU/EØS-området
- ubefruktede donoregg fra virksomheter i de nordiske landene
Det kan kun gis godkjenning for anskaffelse og import av donoregg fra nordiske land, se Innst. L 296 (2019-2020).
Direktoratet for medisinske produkter fatter vedtak om godkjenning av anskaffelse og import etter forskrift om håndtering av humane celler og vev.
Behandlingen i utlandet må være i tråd med kravene i bioteknologiloven og forskrift om håndtering av humane celler og vev.
I forskrift om håndtering av humane celler og vev § 9 er det krav til virksomhetens avtaler med tredjeparter. Forskriften § 9b har krav til hvilken dokumentasjon som sædbanken skal kunne fremlegge om tredjelandsleverandøren etablert utenfor EU/EØS-området.
Se mer om kravene til anskaffelse og import fra land i og utenfor EU/EØS-området i veileder til forskrift om håndtering av humane celler og vev.
I tillegg til kravene i forskriften, kommer anbefalingene til avtaler med utenlandske eggbanker og sædbanker i punktene under.
5.4.3 Avtalen med utenlandske eggbanker/sædbanker bør inneholde følgende krav:
- Dokumentasjon på at eggbanken/sædbanken i utlandet er godkjent av nasjonal myndighet etter EUs regelverk om celler og vev.
- Dokumentasjon på at samtykket fra donor omfatter de punktene som er beskrevet i vedlegg IA og IB til rundskrivet.
- Krav om at eggbankens/sædbankens praksis er i tråd med rutiner for varsling og oppsøkende genetisk virksomhet i vedleggene II og III.
- Krav om at eggbanken/sædbanken skal informere virksomheten dersom donor trekker sitt samtykke før eggene eller sæden er brukt, og eggene/sæden derfor ikke skal brukes.
- Krav om kontroll av eventuelle dødsfall hos donor før distribusjon.
- Plikt til å kontrollere og eventuelt melde om donors dødsfall etter distribusjon.
- Plikt til å formidle informasjon om donors SEC-kode, navn, fødselsdato og personnummer til virksomheten ved oversending av donoregg og donorsæd.
- Plikt til å gi informasjon til potensielle donorer i tråd med kravene til informasjon i dette rundskrivet.
- Krav om at sæd fra hver enkelt sæddonor ikke skal gi opphav til barn i mer enn 6 familier i Norge.
- Krav om at det maksimalt skal foretas 3 egguttak fra hver eggdonor som skal brukes i Norge.
- Krav om at kompensasjon til donor er på et nivå som er sammenlignbart med kompensasjonen som gis i Norge, se Innst. L 296 (2019-2020).
Når virksomheten er godkjent for anskaffelse og/eller import av donoregg eller donorsæd, kan virksomheten inngå nye avtaler med utenlandske eggbanker og sædbanker, både med tredjeparter og, for utenlandske sædbanker, med tredjelandsleverandører, forutsatt at innholdet i avtalene tilfredsstiller kravene i forskriften og punktene nevnt over.
Både Helsedirektoratet og DMP skal orienteres om nye avtaler med utenlandske eggbanker og sædbanker.
5.4.4 Kontroll av informasjon gitt til donor i utenlandsk eggbank og sædbank
Virksomheter som benytter egg eller sæd fra en utenlandsk eggbank eller sædbank skal ved inngåelse av avtalen kontrollere at de prosedyrer og krav som utenlandsk eggbank/sædbank følger når det gjelder donasjonsprosessen, herunder informasjonen til donor, er i tråd med kravene som gjelder for bruk av donoregg og donorsæd i Norge.
De utenlandske eggbankene/sædbankene skal ha informert potensielle donorer om følgende:
- At barna kan få opplysninger om donors identitet (navn, fødselsdato og personnummer).
- At donors identitet ikke blir gjort kjent for paret, behandlende lege eller andre uten tjenstlig behov.
- At opplysninger om donor registreres og lagres i det sentrale egg- og sæddonorregisteret i Norge.
5.4.5 Samtykke fra donor i utlandet
Donor i utlandet skal samtykke til at opplysninger om navn, fødselsdato, personnummer og eggbank/sædbank som er benyttet lagres i det sentrale egg- og sæddonorregisteret i Norge. Se forslag til mal for samtykke i vedlegg IA og IB.
Det er bare samtykkekompetente personer som kan donere egg eller sæd til bruk ved assistert befruktning.
5.4 Bruk av egg og sæd fra utenlandske eggbanker og sædbanker og registrering i det sentrale egg- og sæddonorregisteret
Sist faglig oppdatert: 16.02.2024
5.4.1 Krav til registrering av opplysninger om donor fra eggbank/sædbank i utlandet
Virksomheter som bruker donoregg eller donorsæd fra eggbank eller sædbank i utlandet, skal registrere følgende opplysninger om donor i det sentrale egg- og sæddonorregisteret:
- navn
- fødselsdato
- personnummer
- navn på utenlandsk eggbank/sædbank
- DIS-delen av SEC-koden fra eggbank/sædbank i utlandet (se figur i vedlegg V)
- bekreftelse på at donor har samtykket
Virksomhetene som bruker donoregg eller donorsæd fra eggbank/sædbank i utlandet har ansvar for å registrere informasjonen om utenlandsk donor i det sentrale registeret, se bioteknologiloven § 2-10. Donor bør registreres så snart som mulig etter at dokumentasjonen er mottatt.
Dokumentasjonen (donors navn, fødselsdato og personnummer) makuleres med en gang donor er registrert i det sentrale registeret.
Virksomheten skal sikre at det er samme/korrekt donorkode som registreres både i det sentrale egg- og sæddonorregisteret og i mor-donorkoderegisteret.
5.4.2 Anskaffelse og import av donoregg og donorsæd
Import av donoregg og donorsæd krever godkjenning fra Helsedirektoratet, se bioteknologiloven §§ 2-11 og 7-1.
Helsedirektoratet kan gi godkjenning for import av
- donorsæd fra virksomheter utenfor EU/EØS-området
- donorsæd fra virksomheter i EU/EØS-området
- ubefruktede donoregg fra virksomheter i de nordiske landene
Det kan kun gis godkjenning for anskaffelse og import av donoregg fra nordiske land, se Innst. L 296 (2019-2020).
Direktoratet for medisinske produkter fatter vedtak om godkjenning av anskaffelse og import etter forskrift om håndtering av humane celler og vev.
Behandlingen i utlandet må være i tråd med kravene i bioteknologiloven og forskrift om håndtering av humane celler og vev.
I forskrift om håndtering av humane celler og vev § 9 er det krav til virksomhetens avtaler med tredjeparter. Forskriften § 9b har krav til hvilken dokumentasjon som sædbanken skal kunne fremlegge om tredjelandsleverandøren etablert utenfor EU/EØS-området.
Se mer om kravene til anskaffelse og import fra land i og utenfor EU/EØS-området i veileder til forskrift om håndtering av humane celler og vev.
I tillegg til kravene i forskriften, kommer anbefalingene til avtaler med utenlandske eggbanker og sædbanker i punktene under.
5.4.3 Avtalen med utenlandske eggbanker/sædbanker bør inneholde følgende krav:
- Dokumentasjon på at eggbanken/sædbanken i utlandet er godkjent av nasjonal myndighet etter EUs regelverk om celler og vev.
- Dokumentasjon på at samtykket fra donor omfatter de punktene som er beskrevet i vedlegg IA og IB til rundskrivet.
- Krav om at eggbankens/sædbankens praksis er i tråd med rutiner for varsling og oppsøkende genetisk virksomhet i vedleggene II og III.
- Krav om at eggbanken/sædbanken skal informere virksomheten dersom donor trekker sitt samtykke før eggene eller sæden er brukt, og eggene/sæden derfor ikke skal brukes.
- Krav om kontroll av eventuelle dødsfall hos donor før distribusjon.
- Plikt til å kontrollere og eventuelt melde om donors dødsfall etter distribusjon.
- Plikt til å formidle informasjon om donors SEC-kode, navn, fødselsdato og personnummer til virksomheten ved oversending av donoregg og donorsæd.
- Plikt til å gi informasjon til potensielle donorer i tråd med kravene til informasjon i dette rundskrivet.
- Krav om at sæd fra hver enkelt sæddonor ikke skal gi opphav til barn i mer enn 6 familier i Norge.
- Krav om at det maksimalt skal foretas 3 egguttak fra hver eggdonor som skal brukes i Norge.
- Krav om at kompensasjon til donor er på et nivå som er sammenlignbart med kompensasjonen som gis i Norge, se Innst. L 296 (2019-2020).
Når virksomheten er godkjent for anskaffelse og/eller import av donoregg eller donorsæd, kan virksomheten inngå nye avtaler med utenlandske eggbanker og sædbanker, både med tredjeparter og, for utenlandske sædbanker, med tredjelandsleverandører, forutsatt at innholdet i avtalene tilfredsstiller kravene i forskriften og punktene nevnt over.
Både Helsedirektoratet og DMP skal orienteres om nye avtaler med utenlandske eggbanker og sædbanker.
5.4.4 Kontroll av informasjon gitt til donor i utenlandsk eggbank og sædbank
Virksomheter som benytter egg eller sæd fra en utenlandsk eggbank eller sædbank skal ved inngåelse av avtalen kontrollere at de prosedyrer og krav som utenlandsk eggbank/sædbank følger når det gjelder donasjonsprosessen, herunder informasjonen til donor, er i tråd med kravene som gjelder for bruk av donoregg og donorsæd i Norge.
De utenlandske eggbankene/sædbankene skal ha informert potensielle donorer om følgende:
- At barna kan få opplysninger om donors identitet (navn, fødselsdato og personnummer).
- At donors identitet ikke blir gjort kjent for paret, behandlende lege eller andre uten tjenstlig behov.
- At opplysninger om donor registreres og lagres i det sentrale egg- og sæddonorregisteret i Norge.
5.4.5 Samtykke fra donor i utlandet
Donor i utlandet skal samtykke til at opplysninger om navn, fødselsdato, personnummer og eggbank/sædbank som er benyttet lagres i det sentrale egg- og sæddonorregisteret i Norge. Se forslag til mal for samtykke i vedlegg IA og IB.
Det er bare samtykkekompetente personer som kan donere egg eller sæd til bruk ved assistert befruktning.
5.5 Taushetsplikt og krav til ansatte som behandler helseopplysninger
Sist faglig oppdatert: 14.04.2021
Alle som behandler helseopplysninger etter dette rundskrivet har taushetsplikt etter de særlige kravene i helseregisterloven kapittel 3, se § 17, jf. forskrift om håndtering av humane celler og vev § 50. Se også helsepersonelloven kapittel 5 om taushetsplikt og opplysningsrett, og Helsedirektoratets rundskriv om helsepersonelloven med kommentarer kapittel 5.
Taushetsplikten gjelder også donorens fødselsdato, personnummer, adresse, bostedskommune og donorkode.
Kun ansatte som er særlig utpekt av eggbanken eller sædbanken kan registrere opplysningene om donor i det sentrale egg- og sæddonorregisteret.
Eggbanken/sædbanken bør organiseres slik at ansatte som har ansvar for å registrere donor i det sentrale registeret, ikke får informasjon om koblingen mellom donors identitet, donorkoden og kvinnen/paret som mottar assistert befruktning fra aktuell donor.
Ansatte med ansvar for registrering bør også underskrive en erklæring om taushetsplikt.
5.5 Taushetsplikt og krav til ansatte som behandler helseopplysninger
Sist faglig oppdatert: 14.04.2021
Alle som behandler helseopplysninger etter dette rundskrivet har taushetsplikt etter de særlige kravene i helseregisterloven kapittel 3, se § 17, jf. forskrift om håndtering av humane celler og vev § 50. Se også helsepersonelloven kapittel 5 om taushetsplikt og opplysningsrett, og Helsedirektoratets rundskriv om helsepersonelloven med kommentarer kapittel 5.
Taushetsplikten gjelder også donorens fødselsdato, personnummer, adresse, bostedskommune og donorkode.
Kun ansatte som er særlig utpekt av eggbanken eller sædbanken kan registrere opplysningene om donor i det sentrale egg- og sæddonorregisteret.
Eggbanken/sædbanken bør organiseres slik at ansatte som har ansvar for å registrere donor i det sentrale registeret, ikke får informasjon om koblingen mellom donors identitet, donorkoden og kvinnen/paret som mottar assistert befruktning fra aktuell donor.
Ansatte med ansvar for registrering bør også underskrive en erklæring om taushetsplikt.
5.6 Virksomhetenes plikt til å melde fra om informasjon om donor til det sentrale egg- og sæddonorregisteret
Sist faglig oppdatert: 14.04.2021
Virksomheter som tilbyr behandling med donoregg eller donorsæd skal melde fra til det sentrale egg- og sæddonorregisteret dersom donor ikke har gitt opphav til barn etter assistert befruktning i virksomheten.
Det vises til at formålet med registeret er at barn skal få informasjon om donors identitet. Registeret skal ikke ha opplysninger om donorer som ikke har gitt opphav til barn. Opplysningene slettes derfor når det ikke lenger er relevant og nødvendig å oppbevare dem.
Virksomhetene som har registrert donor har også ansvar for at informasjonen om donor i det sentrale egg- og sæddonorregisteret er korrekt og oppdatert.
5.6 Virksomhetenes plikt til å melde fra om informasjon om donor til det sentrale egg- og sæddonorregisteret
Sist faglig oppdatert: 14.04.2021
Virksomheter som tilbyr behandling med donoregg eller donorsæd skal melde fra til det sentrale egg- og sæddonorregisteret dersom donor ikke har gitt opphav til barn etter assistert befruktning i virksomheten.
Det vises til at formålet med registeret er at barn skal få informasjon om donors identitet. Registeret skal ikke ha opplysninger om donorer som ikke har gitt opphav til barn. Opplysningene slettes derfor når det ikke lenger er relevant og nødvendig å oppbevare dem.
Virksomhetene som har registrert donor har også ansvar for at informasjonen om donor i det sentrale egg- og sæddonorregisteret er korrekt og oppdatert.
5.7 Samtykke fra paret eller kvinnen
Sist faglig oppdatert: 14.04.2021
Kvinnen og hennes eventuelle ektefelle eller samboer skal få informasjon om behandlingen og om de medisinske og rettslige virkninger behandlingen kan få. Informasjonen skal også omfatte informasjon om adopsjon, se bioteknologiloven § 2-5.
Før behandlingen påbegynnes, skal behandlende lege påse at det foreligger skriftlig samtykke fra kvinnen og hennes eventuelle ektefelle eller samboer. Ved gjentatte behandlinger skal nytt samtykke innhentes. Bare personer over 18 år som ikke er fratatt rettslig handleevne på det personlige området, kan gi slikt samtykke.
Hvis kvinnen har fått ny ektefelle eller samboer, skal samtykke til behandling gis av kvinnen og hennes nåværende ektefelle eller samboer.
Når kvinnens egne egg er befruktet med donert sæd, og kvinnen har fått ny ektefelle eller samboer, skal samtykke til behandling gis av kvinnen og hennes nåværende ektefelle eller samboer. Det kreves ikke samtykke fra tidligere ektefelle eller samboer, heller ikke dersom kvinnen skal bruke egget til assistert befruktning som enslig, se bioteknologiloven § 2-5 siste ledd. Paret eller kvinnen bør få informasjon om opprinnelsesland og om de undersøkelsene som er foretatt av eggene/sæden og donor. Dersom det er foretatt genetiske undersøkelser av donor, bør paret få informasjon om hvilke tester som er utført, og om resultatet.
Behandlende lege skal informere den eller de som søker om assistert befruktning om deres plikt til å fortelle eventuelle barn om at de er blitt til ved hjelp av assistert befruktning med donoregg/donorsæd, slik at barna senere kan få oppfylt sin rett. Se mer om dette i kapittel 3.
5.7 Samtykke fra paret eller kvinnen
Sist faglig oppdatert: 14.04.2021
Kvinnen og hennes eventuelle ektefelle eller samboer skal få informasjon om behandlingen og om de medisinske og rettslige virkninger behandlingen kan få. Informasjonen skal også omfatte informasjon om adopsjon, se bioteknologiloven § 2-5.
Før behandlingen påbegynnes, skal behandlende lege påse at det foreligger skriftlig samtykke fra kvinnen og hennes eventuelle ektefelle eller samboer. Ved gjentatte behandlinger skal nytt samtykke innhentes. Bare personer over 18 år som ikke er fratatt rettslig handleevne på det personlige området, kan gi slikt samtykke.
Hvis kvinnen har fått ny ektefelle eller samboer, skal samtykke til behandling gis av kvinnen og hennes nåværende ektefelle eller samboer.
Når kvinnens egne egg er befruktet med donert sæd, og kvinnen har fått ny ektefelle eller samboer, skal samtykke til behandling gis av kvinnen og hennes nåværende ektefelle eller samboer. Det kreves ikke samtykke fra tidligere ektefelle eller samboer, heller ikke dersom kvinnen skal bruke egget til assistert befruktning som enslig, se bioteknologiloven § 2-5 siste ledd. Paret eller kvinnen bør få informasjon om opprinnelsesland og om de undersøkelsene som er foretatt av eggene/sæden og donor. Dersom det er foretatt genetiske undersøkelser av donor, bør paret få informasjon om hvilke tester som er utført, og om resultatet.
Behandlende lege skal informere den eller de som søker om assistert befruktning om deres plikt til å fortelle eventuelle barn om at de er blitt til ved hjelp av assistert befruktning med donoregg/donorsæd, slik at barna senere kan få oppfylt sin rett. Se mer om dette i kapittel 3.
5.8 Det sentrale mor- donorkoderegisteret
Sist faglig oppdatert: 31.01.2023
5.8.1 Det sentrale mor-donorkoderegisterets innhold og formål
Alle virksomheter som tilbyr assistert befruktning med donoregg og/eller donorsæd må registrere opplysninger om mor og donorkode i det sentrale mor-donorkoderegisteret. Registeret skal inneholde navn på kvinner som har født barn etter assistert befruktning med donoregg eller donorsæd og donorkoden til donoren som er brukt (og som er registrert i det sentrale egg- og sæddonorregisteret).
Mor-donorkoderegisteret er opprettet for at:
- barn som er født etter assistert befruktning med donoregg eller donorsæd skal kunne få avklart om dette er tilfelle.
- sikre riktig kobling mellom barnet og donoren, slik at barnet får riktige opplysninger om donors identitet fra det sentrale egg- og sæddonorregisteret.
Formålet med registeret er styrende for hva man kan bruke opplysningene til eller hva man kan registrere.
Mor-donorkoderegisteret er nøkkelen til å få vite hvem som er donor. Formålet med registeret er å bidra til å oppfylle barns rett til informasjon om donors identitet etter bioteknologiloven § 2-7.
5.8.2 Rettslig grunnlag
Det rettslige grunnlaget for innsamling av opplysningene er bioteknologiloven § 2-7 og samtykke fra donor og mor til at opplysningene registreres i et mor-donorkoderegister.
5.8.3 Opplysninger som skal registreres i mor-donorkoderegisteret
Opplysninger som skal registreres er:
- mors fødselsdato og personnummer
- dato for hver behandling og donorkode for donoren som er brukt (DIS-koden fra eggbank eller sædbank i utlandet eller donorkode som eggbank eller sædbank i Norge har fått utlevert fra sentralt egg- og sæddonorregister)
Opplysningene bør registreres i mor-donorkoderegisteret enten når kvinnen mottar behandlingen, når graviditet er bekreftet, eller senest når barnet er født.
Virksomheten bør i sine rutiner beskrive når og hvordan de registrerer opplysningene i mor-donorkoderegisteret.
Dersom opplysningene ikke registreres før barn er født, må virksomheten ha rutiner for å avklare om det er født barn etter behandlingen.
Opplysningene om mor skal slettes når det ikke lenger er relevant og nødvendig å oppbevare dem.
Eggbanken/sædbanken skal informeres dersom bruk av aktuell donor ikke har ført til fødsel.
5.8.4 Utlevering av opplysninger om donorkode
Mor og donor har ikke rett til opplysning om donorkode, og må samtykke til at de ikke kan få denne opplysningen.
5.8 Det sentrale mor- donorkoderegisteret
Sist faglig oppdatert: 31.01.2023
5.8.1 Det sentrale mor-donorkoderegisterets innhold og formål
Alle virksomheter som tilbyr assistert befruktning med donoregg og/eller donorsæd må registrere opplysninger om mor og donorkode i det sentrale mor-donorkoderegisteret. Registeret skal inneholde navn på kvinner som har født barn etter assistert befruktning med donoregg eller donorsæd og donorkoden til donoren som er brukt (og som er registrert i det sentrale egg- og sæddonorregisteret).
Mor-donorkoderegisteret er opprettet for at:
- barn som er født etter assistert befruktning med donoregg eller donorsæd skal kunne få avklart om dette er tilfelle.
- sikre riktig kobling mellom barnet og donoren, slik at barnet får riktige opplysninger om donors identitet fra det sentrale egg- og sæddonorregisteret.
Formålet med registeret er styrende for hva man kan bruke opplysningene til eller hva man kan registrere.
Mor-donorkoderegisteret er nøkkelen til å få vite hvem som er donor. Formålet med registeret er å bidra til å oppfylle barns rett til informasjon om donors identitet etter bioteknologiloven § 2-7.
5.8.2 Rettslig grunnlag
Det rettslige grunnlaget for innsamling av opplysningene er bioteknologiloven § 2-7 og samtykke fra donor og mor til at opplysningene registreres i et mor-donorkoderegister.
5.8.3 Opplysninger som skal registreres i mor-donorkoderegisteret
Opplysninger som skal registreres er:
- mors fødselsdato og personnummer
- dato for hver behandling og donorkode for donoren som er brukt (DIS-koden fra eggbank eller sædbank i utlandet eller donorkode som eggbank eller sædbank i Norge har fått utlevert fra sentralt egg- og sæddonorregister)
Opplysningene bør registreres i mor-donorkoderegisteret enten når kvinnen mottar behandlingen, når graviditet er bekreftet, eller senest når barnet er født.
Virksomheten bør i sine rutiner beskrive når og hvordan de registrerer opplysningene i mor-donorkoderegisteret.
Dersom opplysningene ikke registreres før barn er født, må virksomheten ha rutiner for å avklare om det er født barn etter behandlingen.
Opplysningene om mor skal slettes når det ikke lenger er relevant og nødvendig å oppbevare dem.
Eggbanken/sædbanken skal informeres dersom bruk av aktuell donor ikke har ført til fødsel.
5.8.4 Utlevering av opplysninger om donorkode
Mor og donor har ikke rett til opplysning om donorkode, og må samtykke til at de ikke kan få denne opplysningen.
5.9 Donasjonsregister etter forskrift om håndtering av humane celler og vev
Sist faglig oppdatert: 14.04.2021
5.9.1 Donasjonsregisterets innhold og formål
Virksomheter som tilbyr assistert befruktning med donoregg og donorsæd skal ha et donasjonsregister etter forskrift om håndtering av humane celler og vev.
Registeret skal inneholde en liste over donorer, helseopplysninger for disse, donerte celler og vev og tildelt felles europeisk kode (SEC) der det er relevant, se forskrift om håndtering av humane celler og vev § 45.
Formålet med donasjonsregisteret er å bidra til å sikre sporbarhet fra donor til mottaker og omvendt, jf. forskrift om håndtering av humane celler og vev §§ 40 og 45. Registeret skal samle inn og innenfor forskriftens rammer behandle opplysninger om celler og vev og donorer i Norge for å nå formålene som nevnt i forskriften § 1.
Formålet med registeret er styrende for hva man kan bruke opplysningene til eller hva man kan registrere.
5.9.2 Rettslig grunnlag
Det rettslige grunnlaget for donasjonsregisteret er samtykke fra mor og donor, se også forskrift om håndtering av humane celler og vev § 48.
5.9.3 Opplysninger som virksomheten skal registrere i donasjonsregisteret
Kravene til registrering av opplysningene i donasjonsregisteret i virksomheter som tilbyr behandling med donoregg og/eller donorsæd fremgår av forskrift om håndtering av humane celler og vev § 48 andre ledd.
Det fremgår her at en virksomhet som kun anvender celler og vev i pasientbehandling blant annet skal registrere navn på eggbank/sædbank og identifikasjon av mottaker, det vil si pasienten (mor), dato for bruk av materialet i behandlingen og SEC-kode der dette er relevant.
Formålet er at celler og vev skal kunne spores på alle trinn i håndteringsprosessen fra donor til mottaker og omvendt, se forskriften §§ 40 og 45 (lenke).
Virksomheten skal derfor registrere SEC-kode, som skal sikre sporing av donor i eggbank/sædbank, og informasjon om mottaker (mor) i dette registeret.
Med sluttbruker i § 48 første ledd, bokstav o) og annet ledd, bokstav b), menes den kliniker eller virksomhet som benytter cellene eller vevet i pasientbehandlingen, se Veileder til forskrift om håndtering av humane celler og vev.
Virksomheter som både har egg- og/eller sædbank og tilbyr behandling med donoregg eller donorsæd, må ha separate registre for å oppfylle krav i § 48 første ledd og § 48 andre ledd.
Se avgrensing mot informasjon om krav til innhold i donasjonsregister hos eggbanker og sædbanker i kapittel 4.
Øvrige krav og veiledning fremgår av forskrift om håndtering av humane celler og vev og Veileder til forskrift om håndtering av humane celler og vev.
5.9 Donasjonsregister etter forskrift om håndtering av humane celler og vev
Sist faglig oppdatert: 14.04.2021
5.9.1 Donasjonsregisterets innhold og formål
Virksomheter som tilbyr assistert befruktning med donoregg og donorsæd skal ha et donasjonsregister etter forskrift om håndtering av humane celler og vev.
Registeret skal inneholde en liste over donorer, helseopplysninger for disse, donerte celler og vev og tildelt felles europeisk kode (SEC) der det er relevant, se forskrift om håndtering av humane celler og vev § 45.
Formålet med donasjonsregisteret er å bidra til å sikre sporbarhet fra donor til mottaker og omvendt, jf. forskrift om håndtering av humane celler og vev §§ 40 og 45. Registeret skal samle inn og innenfor forskriftens rammer behandle opplysninger om celler og vev og donorer i Norge for å nå formålene som nevnt i forskriften § 1.
Formålet med registeret er styrende for hva man kan bruke opplysningene til eller hva man kan registrere.
5.9.2 Rettslig grunnlag
Det rettslige grunnlaget for donasjonsregisteret er samtykke fra mor og donor, se også forskrift om håndtering av humane celler og vev § 48.
5.9.3 Opplysninger som virksomheten skal registrere i donasjonsregisteret
Kravene til registrering av opplysningene i donasjonsregisteret i virksomheter som tilbyr behandling med donoregg og/eller donorsæd fremgår av forskrift om håndtering av humane celler og vev § 48 andre ledd.
Det fremgår her at en virksomhet som kun anvender celler og vev i pasientbehandling blant annet skal registrere navn på eggbank/sædbank og identifikasjon av mottaker, det vil si pasienten (mor), dato for bruk av materialet i behandlingen og SEC-kode der dette er relevant.
Formålet er at celler og vev skal kunne spores på alle trinn i håndteringsprosessen fra donor til mottaker og omvendt, se forskriften §§ 40 og 45 (lenke).
Virksomheten skal derfor registrere SEC-kode, som skal sikre sporing av donor i eggbank/sædbank, og informasjon om mottaker (mor) i dette registeret.
Med sluttbruker i § 48 første ledd, bokstav o) og annet ledd, bokstav b), menes den kliniker eller virksomhet som benytter cellene eller vevet i pasientbehandlingen, se Veileder til forskrift om håndtering av humane celler og vev.
Virksomheter som både har egg- og/eller sædbank og tilbyr behandling med donoregg eller donorsæd, må ha separate registre for å oppfylle krav i § 48 første ledd og § 48 andre ledd.
Se avgrensing mot informasjon om krav til innhold i donasjonsregister hos eggbanker og sædbanker i kapittel 4.
Øvrige krav og veiledning fremgår av forskrift om håndtering av humane celler og vev og Veileder til forskrift om håndtering av humane celler og vev.
5.10 Utlevering av opplysninger til pasienten (mor)
Sist faglig oppdatert: 14.04.2021
Mor har bare rett til å få opplysninger som er registrert om seg selv. Hun har ikke rett til å få utlevert donorkoden.
5.10 Utlevering av opplysninger til pasienten (mor)
Sist faglig oppdatert: 14.04.2021
Mor har bare rett til å få opplysninger som er registrert om seg selv. Hun har ikke rett til å få utlevert donorkoden.
5.11 Opplysninger i mors pasientjournal
Sist faglig oppdatert: 14.04.2021
Opplysninger om mor skal også føres i mors journal. Donorkoden skal ikke stå i pasientjournalen.
5.11 Opplysninger i mors pasientjournal
Sist faglig oppdatert: 14.04.2021
Opplysninger om mor skal også føres i mors journal. Donorkoden skal ikke stå i pasientjournalen.
5.12 Informasjonssikkerhet
Sist faglig oppdatert: 14.04.2021
Krav til virksomhetens styringssystem, herunder krav til risikovurdering, omfang og dokumentasjon fremgår av forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten og forskrift om håndtering av humane celler og vev § 8.
- Virksomheten skal ha skriftlig prosedyre for hvordan opplysninger i virksomheten skal håndteres og for hvilke opplysninger som kan kobles.
- Virksomheten skal foreta en risikovurdering mht. sikring av de taushetsbelagte opplysningene, og har et selvstendig ansvar for at det til enhver tid gjeldende regelverk og gjeldende norm for informasjonssikkerhet i helsesektoren etterleves.
- Tilgang kan bare gis til personell der mor-donorkoderegisteret eller donasjonsregisteret føres, og som har tjenstlig behov for tilgang. Virksomheten skal kunne dokumentere hvem som har tilgang til registrene.
- Oppslag i registrerte opplysninger i mor-donorkoderegisteret skal kun foretas for å registrere nye opplysninger.
- Oppslag loggføres.
5.12 Informasjonssikkerhet
Sist faglig oppdatert: 14.04.2021
Krav til virksomhetens styringssystem, herunder krav til risikovurdering, omfang og dokumentasjon fremgår av forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten og forskrift om håndtering av humane celler og vev § 8.
- Virksomheten skal ha skriftlig prosedyre for hvordan opplysninger i virksomheten skal håndteres og for hvilke opplysninger som kan kobles.
- Virksomheten skal foreta en risikovurdering mht. sikring av de taushetsbelagte opplysningene, og har et selvstendig ansvar for at det til enhver tid gjeldende regelverk og gjeldende norm for informasjonssikkerhet i helsesektoren etterleves.
- Tilgang kan bare gis til personell der mor-donorkoderegisteret eller donasjonsregisteret føres, og som har tjenstlig behov for tilgang. Virksomheten skal kunne dokumentere hvem som har tilgang til registrene.
- Oppslag i registrerte opplysninger i mor-donorkoderegisteret skal kun foretas for å registrere nye opplysninger.
- Oppslag loggføres.
5.13 Opphør eller nedleggelse av virksomhet
Sist faglig oppdatert: 14.04.2021
Biobankloven § 8 stiller krav til virksomhetene ved opphør eller nedleggelse av virksomheten.
5.13 Opphør eller nedleggelse av virksomhet
Sist faglig oppdatert: 14.04.2021
Biobankloven § 8 stiller krav til virksomhetene ved opphør eller nedleggelse av virksomheten.
Det sentrale egg- og sæddonorregisteret
Formålet med behandlingen av opplysningene
Sist faglig oppdatert: 14.04.2021
Formålet med behandlingen av opplysningene i det sentrale egg- og sæddonorregisteret er å registrere opplysninger om donors identitet slik at barnets rett til opplysninger kan oppfylles, jf. bioteknologiloven § 2-7.
I det sentrale egg- og sæddonorregisteret er donors identitet (navn, fødselsdato og personnummer) koblet til en donorkode. Registeret er hjemlet i bioteknologiloven § 2-8.
Formålet med behandlingen av opplysningene
Sist faglig oppdatert: 14.04.2021
Formålet med behandlingen av opplysningene i det sentrale egg- og sæddonorregisteret er å registrere opplysninger om donors identitet slik at barnets rett til opplysninger kan oppfylles, jf. bioteknologiloven § 2-7.
I det sentrale egg- og sæddonorregisteret er donors identitet (navn, fødselsdato og personnummer) koblet til en donorkode. Registeret er hjemlet i bioteknologiloven § 2-8.
Rettslig grunnlag
Sist faglig oppdatert: 14.04.2021
Det rettslige grunnlaget for innsamling av opplysningene fremgår av bioteknologiloven §§ 2-8 og 2-9.
Donor skal samtykke skriftlig til at hans eller hennes identitet registreres i det sentrale egg- og sæddonorregisteret. Samtykket kan tilbakekalles frem til befruktning har funnet sted, se bioteknologiloven § 2-9.
Se mer om donors samtykke i vedlegg IA og IB.
Rettslig grunnlag
Sist faglig oppdatert: 14.04.2021
Det rettslige grunnlaget for innsamling av opplysningene fremgår av bioteknologiloven §§ 2-8 og 2-9.
Donor skal samtykke skriftlig til at hans eller hennes identitet registreres i det sentrale egg- og sæddonorregisteret. Samtykket kan tilbakekalles frem til befruktning har funnet sted, se bioteknologiloven § 2-9.
Se mer om donors samtykke i vedlegg IA og IB.
Hvilke opplysninger registreres
Sist faglig oppdatert: 12.01.2022
Opplysninger som registreres om donor fra norsk eggbank/sædbank:
- navn
- fødselsdato
- personnummer
- donorkode
- bekreftelse på at donor har samtykket
Opplysninger som registreres om donor fra utenlandsk eggbank/sædbank:
- navn
- fødselsdato
- personnummer
- navn på utenlandsk eggbank/sædbank
- DIS-delen av SEC-koden fra eggbank/sædbank i utlandet (se figur i vedlegg V )
- bekreftelse på at donor har samtykket
Donors personnummer skal registreres i registeret. Donor kan ikke brukes hvis det ikke foreligger et personnummer.
Barnas identitet skal ikke fremgå av registeret, og det skal heller ikke fremgå hvor mange barn som er født.
Hvilke opplysninger registreres
Sist faglig oppdatert: 12.01.2022
Opplysninger som registreres om donor fra norsk eggbank/sædbank:
- navn
- fødselsdato
- personnummer
- donorkode
- bekreftelse på at donor har samtykket
Opplysninger som registreres om donor fra utenlandsk eggbank/sædbank:
- navn
- fødselsdato
- personnummer
- navn på utenlandsk eggbank/sædbank
- DIS-delen av SEC-koden fra eggbank/sædbank i utlandet (se figur i vedlegg V )
- bekreftelse på at donor har samtykket
Donors personnummer skal registreres i registeret. Donor kan ikke brukes hvis det ikke foreligger et personnummer.
Barnas identitet skal ikke fremgå av registeret, og det skal heller ikke fremgå hvor mange barn som er født.
Utlevering av donorkode til eggbanken/sædbanken
Sist faglig oppdatert: 14.04.2021
Det sentrale egg- og sæddonorregisteret skal utlevere donorkode til norsk eggbank/sædbank når donor er foreløpig godkjent.
Utlevering av donorkode til eggbanken/sædbanken
Sist faglig oppdatert: 14.04.2021
Det sentrale egg- og sæddonorregisteret skal utlevere donorkode til norsk eggbank/sædbank når donor er foreløpig godkjent.
Donors rett til innsyn
Sist faglig oppdatert: 14.04.2021
Donor har bare rett til å få opplysninger som er registrert om seg selv. Donor har ikke rett til å få vite donorkoden.
Donors rett til innsyn
Sist faglig oppdatert: 14.04.2021
Donor har bare rett til å få opplysninger som er registrert om seg selv. Donor har ikke rett til å få vite donorkoden.
Utlevering av opplysninger om donors identitet
Sist faglig oppdatert: 14.04.2021
Formålet med registeret er styrende for hva man kan bruke opplysningene til eller hva man kan registrere. Opplysninger om en bestemt donors identitet kan bare utleveres til et barn som er født etter assistert befruktning ved hjelp av aktuell donors egg eller sæd, som har fylt 15 eller 18 år og som ber om slike opplysninger, se rundskrivet kapittel 3.
Donor skal kunne identifiseres gjennom donorkoden mottatt fra det sentrale egg- og sæddonorregisteret (donor fra eggbank/sædbank i Norge) eller DIS-delen av SEC-koden (donor fra eggbank/sædbank i utlandet) og som er registrert i mor- donorkoderegisteret.
Utlevering av opplysninger om donors identitet skal ikke skje til andre enn barnet.
Utlevering av opplysninger om donors identitet
Sist faglig oppdatert: 14.04.2021
Formålet med registeret er styrende for hva man kan bruke opplysningene til eller hva man kan registrere. Opplysninger om en bestemt donors identitet kan bare utleveres til et barn som er født etter assistert befruktning ved hjelp av aktuell donors egg eller sæd, som har fylt 15 eller 18 år og som ber om slike opplysninger, se rundskrivet kapittel 3.
Donor skal kunne identifiseres gjennom donorkoden mottatt fra det sentrale egg- og sæddonorregisteret (donor fra eggbank/sædbank i Norge) eller DIS-delen av SEC-koden (donor fra eggbank/sædbank i utlandet) og som er registrert i mor- donorkoderegisteret.
Utlevering av opplysninger om donors identitet skal ikke skje til andre enn barnet.
Brukerveiledning for deg som jobber i norsk eggbank eller sædbank
Sist faglig oppdatert: 31.01.2023
Alle egg- og sæddonorer, både norske og utenlandske, skal registreres i det sentrale egg- og sæddonorregisteret (ESDR). Løsningen er plassert i helsenettet, men klinikker som ikke er tilkoblet helsenettet har også tilgang til løsningen.
Helsedirektoratet etablerte ny løsning for det sentrale sædgiverregisteret
15. november 2019. Den 1. januar 2021 lanserte vi en oppdatert og utvidet løsning som inkluderte funksjonalitet for registrering av eggdonorer. Løsningen endret da navn til Egg- og sæddonorregisteret (ESDR).
Slik registrerer du ny donor
Sist faglig oppdatert: 31.01.2023
I Det sentrale egg- og sæddonorregisteret (ESDR) skal du registrere alle nye, norske donorer, både egg- og sæddonorer, senest før egguttaket eller før sæddonasjonen.
- Fyll inn donors fødsels- og personnummer
- Velg donortype (eggdonor eller sæddonor)
- Bekreft at donor har samtykket
NB: Registrering av eggdonorer blir tilgjengelig når virksomheten du tilhører er godkjent for dette.
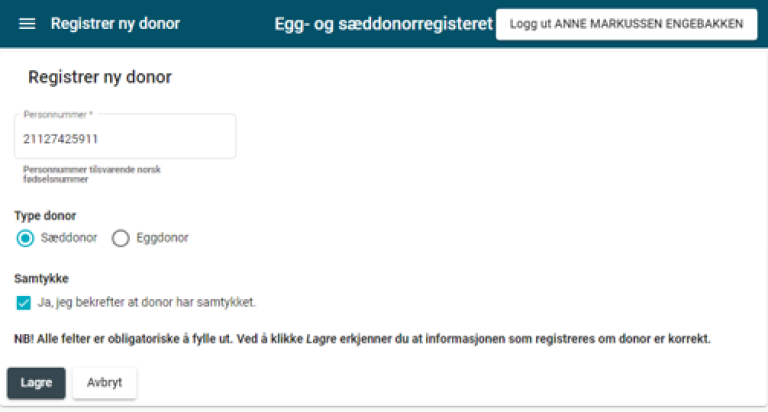
Du vil bli varslet dersom donor dør.
Donor må signere samtykke hos egg-/sædbanken. Når dette er gjort kan du som registrerer donor krysse av for at samtykke foreligger.

Er donor bare foreløpig godkjent? Slik gjør du godkjenningsprosessen trinnvis i systemet
Løsningen for egg- og sæddonorer ivaretar en eventuell trinnvis godkjenning av donor. Når testperioden er over og samtykke foreligger kan donoren godkjennes for bruk.
Steg 1: Donor er registrert - gi foreløpig godkjenning
Ved å gi foreløpig godkjenning bekreftes det at svar på første serologiske tester foreligger og at donor er foreløpig godkjent. Når foreløpig godkjenning og donors samtykke foreligger tildeles donorkode. Foreløpig godkjenning gis ved å klikke på knappen "Gi foreløpig godkjenning".

Steg 2: Godkjenn donor for bruk
Ved å godkjenne donor for bruk bekreftes det at det foreligger negativt svar på alle serologiske tester, at karanteneperioden er over og at donor er godkjent for bruk. Endelig godkjenning gis ved å klikke på knappen "Godkjenn donor for bruk".

Steg 3: Donor er godkjent og klar til bruk.
Personopplysninger er ikke lenger tilgjengelig på vis-donor-siden.

Slik gjør du oppslag og finner status på donor
Gjør et oppslag på donors donorkode eller fødsels- og personnummer for å
- vise donors status
- markere at donor har trukket sitt samtykke
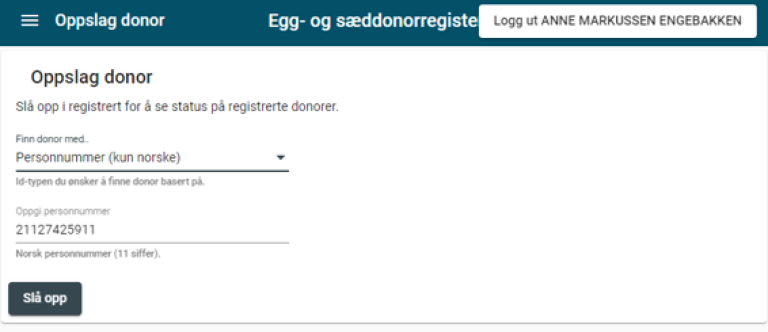
Hvis du får treff på donorkode så vil du se donorkode, donortype og status.
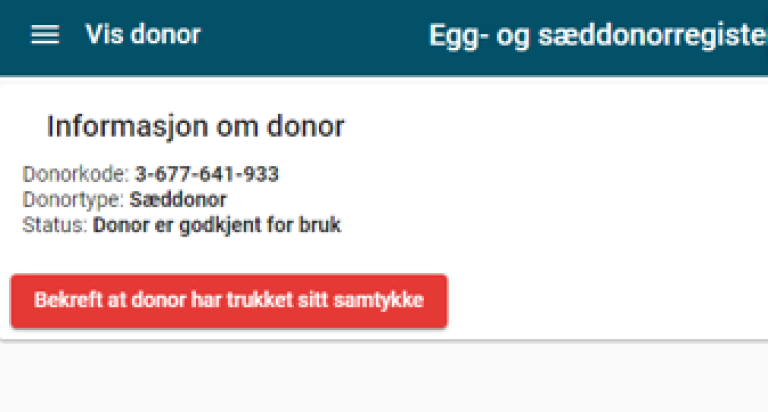
Slik registrerer du ny donor
Sist faglig oppdatert: 31.01.2023
I Det sentrale egg- og sæddonorregisteret (ESDR) skal du registrere alle nye, norske donorer, både egg- og sæddonorer, senest før egguttaket eller før sæddonasjonen.
- Fyll inn donors fødsels- og personnummer
- Velg donortype (eggdonor eller sæddonor)
- Bekreft at donor har samtykket
NB: Registrering av eggdonorer blir tilgjengelig når virksomheten du tilhører er godkjent for dette.

Du vil bli varslet dersom donor dør.
Donor må signere samtykke hos egg-/sædbanken. Når dette er gjort kan du som registrerer donor krysse av for at samtykke foreligger.

Er donor bare foreløpig godkjent? Slik gjør du godkjenningsprosessen trinnvis i systemet
Løsningen for egg- og sæddonorer ivaretar en eventuell trinnvis godkjenning av donor. Når testperioden er over og samtykke foreligger kan donoren godkjennes for bruk.
Steg 1: Donor er registrert - gi foreløpig godkjenning
Ved å gi foreløpig godkjenning bekreftes det at svar på første serologiske tester foreligger og at donor er foreløpig godkjent. Når foreløpig godkjenning og donors samtykke foreligger tildeles donorkode. Foreløpig godkjenning gis ved å klikke på knappen "Gi foreløpig godkjenning".

Steg 2: Godkjenn donor for bruk
Ved å godkjenne donor for bruk bekreftes det at det foreligger negativt svar på alle serologiske tester, at karanteneperioden er over og at donor er godkjent for bruk. Endelig godkjenning gis ved å klikke på knappen "Godkjenn donor for bruk".

Steg 3: Donor er godkjent og klar til bruk.
Personopplysninger er ikke lenger tilgjengelig på vis-donor-siden.

Slik gjør du oppslag og finner status på donor
Gjør et oppslag på donors donorkode eller fødsels- og personnummer for å
- vise donors status
- markere at donor har trukket sitt samtykke

Hvis du får treff på donorkode så vil du se donorkode, donortype og status.

Brukerveiledning for å registrere donorer fra utenlandsk bank
Sist faglig oppdatert: 31.01.2023
Alle egg- og sæddonorer, både norske og utenlandske, skal registreres i det sentrale egg- og sæddonorregisteret (ESDR). Løsningen er plassert i helsenettet, men klinikker som ikke er tilkoblet helsenettet har også tilgang til løsningen.
Helsedirektoratet etablerte ny løsning for det sentrale sædgiverregisteret
15. november 2019. Den 1. januar 2021 lanserte vi en oppdatert og utvidet løsning som inkluderte funksjonalitet for registrering av eggdonorer. Løsningen endret da navn til Egg- og sæddonorregisteret (ESDR).
Dette må du registrere
Sist faglig oppdatert: 31.01.2023
I ESDR skal du registrere alle utenlandske egg- og sæddonorer.
Opplysninger du må ha med
- Navn
- Personnummer
- Donortype
- Eksisterende donorkode (DIS-kode)
- Landkode
- Utenlandsk egg-/sædbank
- Samtykkestatus
- Marker om sæd ble donert før 2021, eller 2021 eller senere.
Dette er opplysninger du skal få fra den utenlandske egg-/sædbanken.
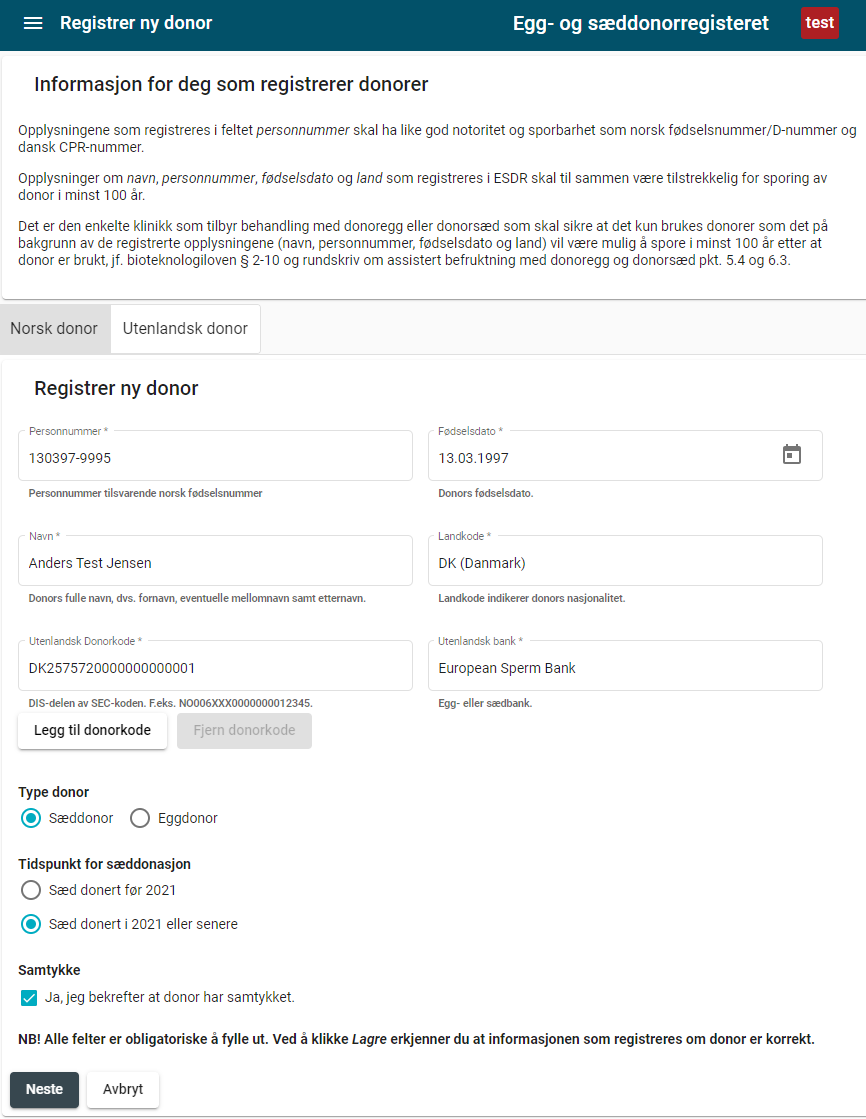
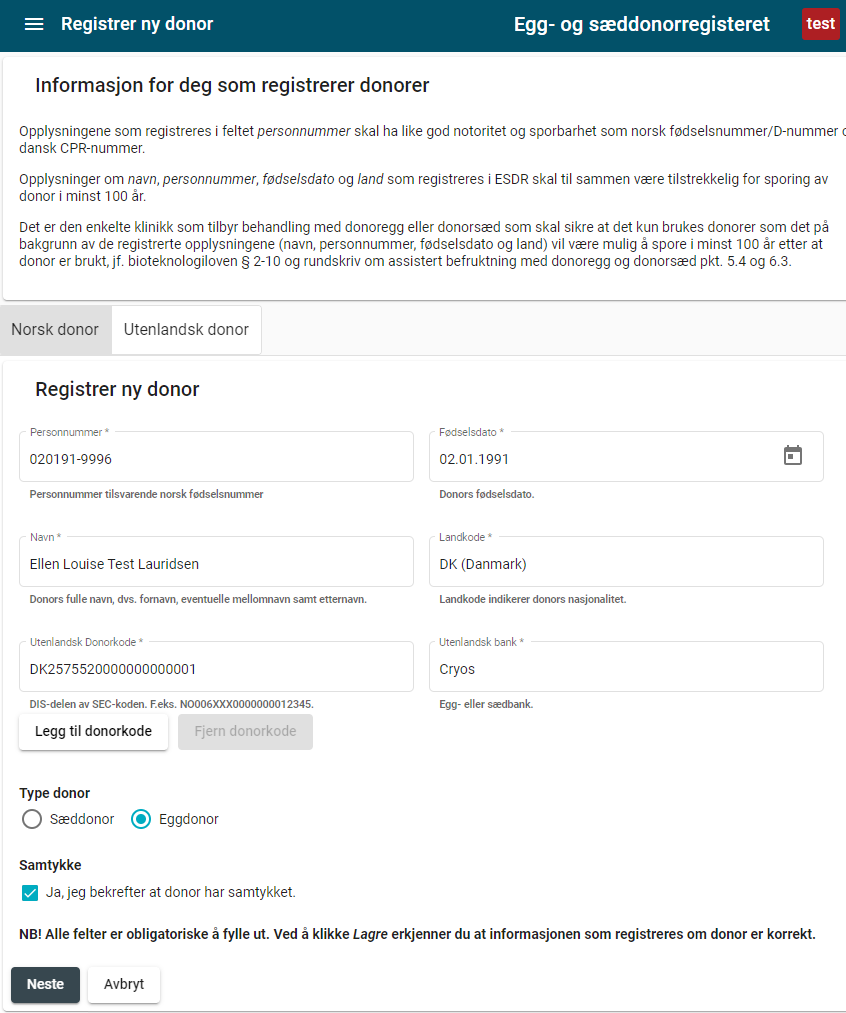
Slik gjør du oppslag og finner informasjon og status på donor
Gjør et oppslag på donorkode for mer informasjon om donor eller markere at donor
er død eller har trukket sitt samtykke.
Dersom donor dør eller trekker samtykket skal dette registreres i registeret.

Dette må du registrere
Sist faglig oppdatert: 31.01.2023
I ESDR skal du registrere alle utenlandske egg- og sæddonorer.
Opplysninger du må ha med
- Navn
- Personnummer
- Donortype
- Eksisterende donorkode (DIS-kode)
- Landkode
- Utenlandsk egg-/sædbank
- Samtykkestatus
- Marker om sæd ble donert før 2021, eller 2021 eller senere.
Dette er opplysninger du skal få fra den utenlandske egg-/sædbanken.


Slik gjør du oppslag og finner informasjon og status på donor
Gjør et oppslag på donorkode for mer informasjon om donor eller markere at donor
er død eller har trukket sitt samtykke.
Dersom donor dør eller trekker samtykket skal dette registreres i registeret.


Brukerveiledning for deg som skal registrere behandlinger i mor-donorkoderegisteret
Sist faglig oppdatert: 31.01.2023
Alle virksomheter som tilbyr assistert befruktning med donoregg og/eller donorsæd må registrere opplysninger om mor, donorkode og dato for behandling i det sentrale mor-donorkoderegisteret.
Det sentrale mor-donorkoderegisteret er et register over alle behandlinger med donoregg/donorsæd som har ført til barn i Norge.
Opplysninger du må registrere i mor- donorkoderegisteret
Sist faglig oppdatert: 31.01.2023
- Mors fødselsnummer (11 siffer)
- Dato for når behandlingen ble gjennomført (brukes til å estimere barnets fødselsdato)
- Donorkode for donoren som er brukt (DIS-koden fra eggbank eller sædbank i utlandet eller donorkode som eggbank eller sædbank i Norge har fått utlevert fra sentralt egg- og sæddonorregister). Denne koden må finnes i ESDR fra før. Hvis koden mangler må donor opprettes før behandlingen kan registreres.
Opplysningene bør registreres i mor-donorkoderegisteret når kvinnen mottar behandlingen, og senest når barnet er født.
Opplysningene om mor skal slettes når det ikke lenger er relevant og nødvendig å oppbevare dem, det vil si når det er sikkert at behandlingen ikke har ført til barn.

Opplysninger du må registrere i mor- donorkoderegisteret
Sist faglig oppdatert: 31.01.2023
- Mors fødselsnummer (11 siffer)
- Dato for når behandlingen ble gjennomført (brukes til å estimere barnets fødselsdato)
- Donorkode for donoren som er brukt (DIS-koden fra eggbank eller sædbank i utlandet eller donorkode som eggbank eller sædbank i Norge har fått utlevert fra sentralt egg- og sæddonorregister). Denne koden må finnes i ESDR fra før. Hvis koden mangler må donor opprettes før behandlingen kan registreres.
Opplysningene bør registreres i mor-donorkoderegisteret når kvinnen mottar behandlingen, og senest når barnet er født.
Opplysningene om mor skal slettes når det ikke lenger er relevant og nødvendig å oppbevare dem, det vil si når det er sikkert at behandlingen ikke har ført til barn.

Slik gjør du oppslag på behandlinger
Sist faglig oppdatert: 31.01.2023
Ved hjelp av mors fødselsnummer kan man slå opp behandlinger. En bruker kan kun slå opp behandlinger som tilhører egen virksomhet.

Er det uavklart om behandlingen har ført til barn kan du endre dette.

- Når man trykker på «Har ikke ført til barn», blir man bedt om å bekrefte dette
- Etter en uke blir behandlingen slettet fra registeret
- Hvis det likevel skulle vise seg at behandlingen førte til barn, må klinikken registrere samme behandling på nytt

Slik gjør du oppslag på behandlinger
Sist faglig oppdatert: 31.01.2023
Ved hjelp av mors fødselsnummer kan man slå opp behandlinger. En bruker kan kun slå opp behandlinger som tilhører egen virksomhet.

Er det uavklart om behandlingen har ført til barn kan du endre dette.

- Når man trykker på «Har ikke ført til barn», blir man bedt om å bekrefte dette
- Etter en uke blir behandlingen slettet fra registeret
- Hvis det likevel skulle vise seg at behandlingen førte til barn, må klinikken registrere samme behandling på nytt

Vedlegg
Sist faglig oppdatert: 14.04.2021
- Vedlegg IA – Mal for samtykke fra sæddonor (word)
- Vedlegg IB - Mal for samtykke fra eggdonor (word)
- Vedlegg IIA: Brukerveiledning for deg som jobber i norsk eggbank eller sædbank
- Vedlegg IIB: Brukerveiledning for å registrere donorer fra utenlandsk bank
- Vedlegg IIC: Brukerveiledning for deg som skal registrere behandlinger i mor-donorkoderegisteret
- Vedlegg III - Rutiner ved alvorlig arvelig sykdom hos donor (PDF)
- Vedlegg IV - Forslag til prosedyre når klinikker mottar melding om at det er påvist alvorlig genetisk sykdom hos en donor (PDF)
- Vedlegg V - DIS-kode (PDF)
- Vedlegg VI - Punkter til samtale med donor (PDF)
- Vedlegg VII - Sjekkliste for søknad om godkjenning etter bioteknologiloven (word)









