Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av analkreft (analcancer)
Forord
Sist faglig oppdatert: 02.07.2021
Mange medisinske faggrupper hadde i en årrekke lagt ned et betydelig arbeid for å komme frem til konsensusbaserte faglige anbefalinger for diagnostikk og behandling av ulike typer kreft. Som ledd i Nasjonal strategi for kreftområdet (2006–2009), fikk Helsedirektoratet i oppdrag å videreutvikle og oppdatere faggruppenes anbefalinger til nasjonale handlingsprogrammer for kreftbehandling, i nært samarbeid med fagmiljøene, de regionale helseforetakene, Nasjonalt kunnskapssenter for helsetjenesten, og andre relevante myndigheter.
Nasjonale handlingsprogrammer for kreft skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet. Målgrupper for retningslinjene er leger og legespesialister innen medisin, kirurgi, onkologi, radiologi, patologi og fastleger. De vil også være av interesse for andre faggrupper som er involvert i behandling og oppfølging av kreftpasienter og deres pårørende.
Nasjonale faglige retningslinjer fra Helsedirektoratet er å betrakte som anbefalinger og råd, basert på oppdatert faglig kunnskap som er fremskaffet på en systematisk, kunnskapsbasert måte. De nasjonale faglige retningslinjene gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet, og er ment som et hjelpemiddel ved de avveininger tjenesteyterne må gjøre for å oppnå forvarlighet og god kvalitet i tjenesten. Nasjonale faglige retningslinjer er ikke direkte rettslig bindende for mottagerne, men bør langt på vei være styrende for de valg som skal tas. Ved å følge oppdaterte nasjonale faglige retningslinjer vil fagpersonell bidra til å oppfylle kravet om faglig forsvarlighet. Dersom en velger løsninger som i vesentlig grad avviker fra de nasjonale faglige retningslinjene, bør en dokumentere dette, og være forberedt på å begrunne sine valg. Sykehusenes eiere og ledelse bør tilrettelegge virksomheten slik at de nasjonale faglige retningslinjene kan følges.
Helsedirektoratet takker arbeidsgruppen for stor innsats i utarbeidelsen av handlingsprogrammet. Vi håper handlingsprogrammet vil være et nyttig arbeidsredskap ved behandling av pasienter med analkreft. Innholdet i den nasjonale retningslinjen for analkreft vil vurderes årlig, og om nødvendig oppdateres. Disse nasjonale faglige retningslinjene for diagnostikk, behandling og oppfølging av pasienter med analkreft er publisert 02.07.2021.
Bjørn Guldvog
Helsedirektør
Sammendrag
Sist faglig oppdatert: 02.07.2021
| Forebygging | Evidensgrad |
| Forebygging av HPV-infeksjon gjennom vaksinasjonsprogrammet for HPV anbefales | A |
| Bruk av kondom gir en viss beskyttelse mot HPV-smitte | A |
| Forstadier til analcancer |
|
| Høygradig anal intraepitelial neoplasi (AIN) skal behandles, og hvis mulig, eradikeres og kontrolleres | B |
| Forløpstider og pakkeforløp |
|
| Forløpstider for utredning og start behandling ved analcancer følger Pakkeforløp for tykk- og endetarmskreft |
|
| Diagnostikk og utredning |
|
| Ved symptomer fra analregionen skal klinisk undersøkelse inkludert digital rektaleksplorasjon, inspeksjon av analområdet og palpasjon av lysker utføres | B |
| Ved mistanke om malignitet utføres anorektoskopi og biopsi | B |
| Økt årvåkenhet for analcancer anbefales ved symptomer hos immunsupprimerte, HIV positive og etter annen HPV-relatert neoplasi | C |
| MR-bekken etter egnet protokoll utføres for lokoregional kartlegging | B |
| CT-thorax, abdomen og bekken etter egnet protokoll utføres for kartlegging av fjernmetastaser | B |
| FDG-PET/CT bør utføres ved T2–T4-svulster, eller ved malignitetssuspekte lymfeknuter, og kan vurderes ved oligometastatisk sykdom | B |
| Utredning inkluderer generelle blodprøver og eventuelt HIV status | D |
| Diagnosen bør bekreftes med biopsi, og en bør undersøke for p16 eller HPV | B |
| Pasienter med analcancer skal som hovedregel diskuteres i MDT for beslutning av behandlingsplan | D |
| Kurativ behandling av lokalisert sykdom |
|
| Primær kirurgi kan være aktuelt ved små perianale tumores < 1 cm med høy/moderat differensiering | D |
| Sigmoideostomi bør vurderes før oppstart av strålebehandling ved alvorlig obstruksjon, inkontinens eller fistel | D |
| Lokalisert analcancer behandles primært med strålebehandling kombinert med kjemoterapi | A |
| Ved T1–2N0 svulst, gis 54 Gy til makroskopisk tumor (primærtumor) og 40 Gy til elektive lymfeknuteregioner, kombinert med 1 kur mitomycin/5-FU eller mitomycin/kapecitabin | A |
| Ved T3–4N0 eller ved N1, gis 58 Gy til makroskopisk primærtumor, 54 eller 58 Gy til patologiske lymfeknuter avhengig av størrelse (under/over 2 cm), og 40 Gy til elektive lymfeknuteregioner, kombinert med 2 kurer mitomycin/5-FU eller mitomycin/kapecitabin | A |
| Strålebehandling gis med 1,8–2 Gy fraksjoner til tumor, alternativt med simultan integrert boost (SIB), 5 dager per uke | D |
| Pauser i behandlingen bør unngås og vurderes kompensert | C |
| Svar på DPYD genotype bør foreligge før start av behandling med 5-FU eller kapecitabine | B |
| Kurativ kjemoradioterapi kan vurderes ved oligometastatisk sykdom som kan inkluderes i strålefeltet. | D |
| Ved perianalcancer T1N0M0 tumor <1cm med høy/moderat differensiering, kan elektive lymfeknuteregioner utelates | D |
| Strålebehandling gis med VMAT- eller IMRT-teknikk | B |
| Plateepitelkarsinom i rektum behandles med kjemoradioterapi som ved analcancer, ofte etterfulgt av kirurgi som ved anal- eller rectumcancer | C |
| Bestrålt område (perineum/endetarm, genitalia, lysker) bør inspiseres minst ukentlig under behandlingen | D |
| RTOG/EORTC-skalaen brukes for observasjon og gradering av akutt og sen toksisitet, og som beslutningsgrunnlag for å iverksette tiltak og behandling | D |
| Drikkeprosedyre for halvfull blære anbefales for å redusere risiko for blære-og tynntarmstoksisitet | D |
| Bruk av vaginal dilatator anbefales for å unngå sammenvoksninger i vagina | C |
| Klinisk vurdering av respons gjøres etter 4–6 uker | D |
| Fullstendig responsevaluering med klinisk undersøkelse og adekvat billeddiagnostikk gjøres etter 3 måneder | C |
| Ved partiell respons vurderes ytterligere observasjon eller kirurgi etter diskusjon i MDT | C |
| Kirurgi ved resttumor eller lokalt recidiv |
|
| Ved vedvarende resttumor eller lokalt residiv, vurderes pasienten for kirurgi etter diskusjon i MDT | B |
| Radikal abdominoperineal reseksjon for analcancer skal utføres av et erfarent team med kompetanse i multivisceral kirurgi og rekonstruksjon | C |
| Behandling av eldre |
|
| Behandlingen individualiseres hos eldre med redusert allmenntilstand eller funksjonsnivå. Strålebehandling prioriteres foran kjemoterapi | C |
| Oppfølging og etterkontroll etter avsluttet kurativ behandling |
|
| Pasienter som kan gjennomgå ev. behandling av tilbakefall bør kontrolleres i 5 år etter oppnådd klinisk remisjon | D |
| Ved T1–2N0 er det rutinemessig kun klinisk kontroll | D |
| Ved T3–4 eller N1, eller HPV16/p16 negativ tumor, eller pasienter operert med salvage kirurgi, er det tillegg av CT thorax/abdomen og MR-bekken de første årene | D |
| Ved stråleindusert kolitt/proktitt anbefales kostråd og avføringsregulerende midler, som fiberprodukter og loperamid | C |
| Ved kronisk diaré, bør kolestyramin vurderes |
|
| Ved mistanke om bakteriell overvekst, bør metronidazol vurderes |
|
| Kolostomi kan vurderes når konservative tiltak ikke gir tilfredsstillende resultater | D |
| Premenopausale kvinner bør vurderes for systemisk østrogenbehandling ved stråleindusert menopause | B |
| Ved symptomer på testosteronmangel hos menn, bør testosteronnivået kontrolleres og eventuell mangel behandles | D |
| Behandling av metastastisk sykdom |
|
| Karboplatin/paklitaksel anbefales som førstelinjes palliativ kjemoterapi | A |
| Andrelinjesbehandling, for eksempel med cisplatin/5-FU, kan vurderes hos pasienter med god allmenntilstand | C |
| Svar på DPYD genotype bør foreligge før start av behandling med 5-FU eller kapecitabine (evidensgrad B). | B |
| Palliativ strålebehandling kan være aktuelt | D |
| Patologi |
|
| Biopsi skal foreligge for å bekrefte diagnosen | C |
| Det bør testes for HPV-infeksjon | C |
Innledning
Sist faglig oppdatert: 02.07.2021
Analcancer, eller plateepitelkarsinom i analkanalen, er en sjelden sykdom. De fleste tilfeller er HPV positive. Utredningen er i store trekk som ved endetarmskreft.
Kurativ behandling består hovedsakelig av strålebehandling kombinert med kjemoterapi. Dersom tumor ikke går i komplett remisjon, eller det tilkommer lokoregionalt tilbakefall, vurderes kirurgi. Analcancer har relativt god prognose.
Etter fullført behandling kontrolleres pasientene for å oppdage eventuelt lokoregionalt tilbakefall eller spredning, og for å oppdage seneffekter. Ved spredning til andre organer er behandlingen palliativ kjemoterapi.
Handlingsprogrammet inneholder retningslinjer for diagnostikk, behandling og oppfølging av pasienter med analcancer.
Endringer i 3.utgave av handlingsprogrammet
I denne oppdateringen av handlingsprogrammet er det lagt til en anbefaling om at en bør undersøke for DPD-mangel før oppstart kjemoterapi med 5-FU eller kapecitabine, både ved kjemoradioterapi for lokalisert sykdom og ved kjemoterapi formetastatisk sykdom. For øvrig er det gjort enkelte mindre endringer/presiseringer. Kapitlet om epidemiologi er oppdatert. Det er lagt til tekst om behandling av AIN. I tabell som viser kontrollopplegg etter oppnådd komplett remisjon av tumor, er tidsangivelsen endret til tid etter avsluttet strålebehandling. Pasienter som er operert med salvage kirurgi og som kan være aktuelle for behandling av tilbakefall bør inngå i gruppen der radiologi er del av kontrollene.
Epidemiologi
Forekomst
Sist faglig oppdatert: 02.07.2021
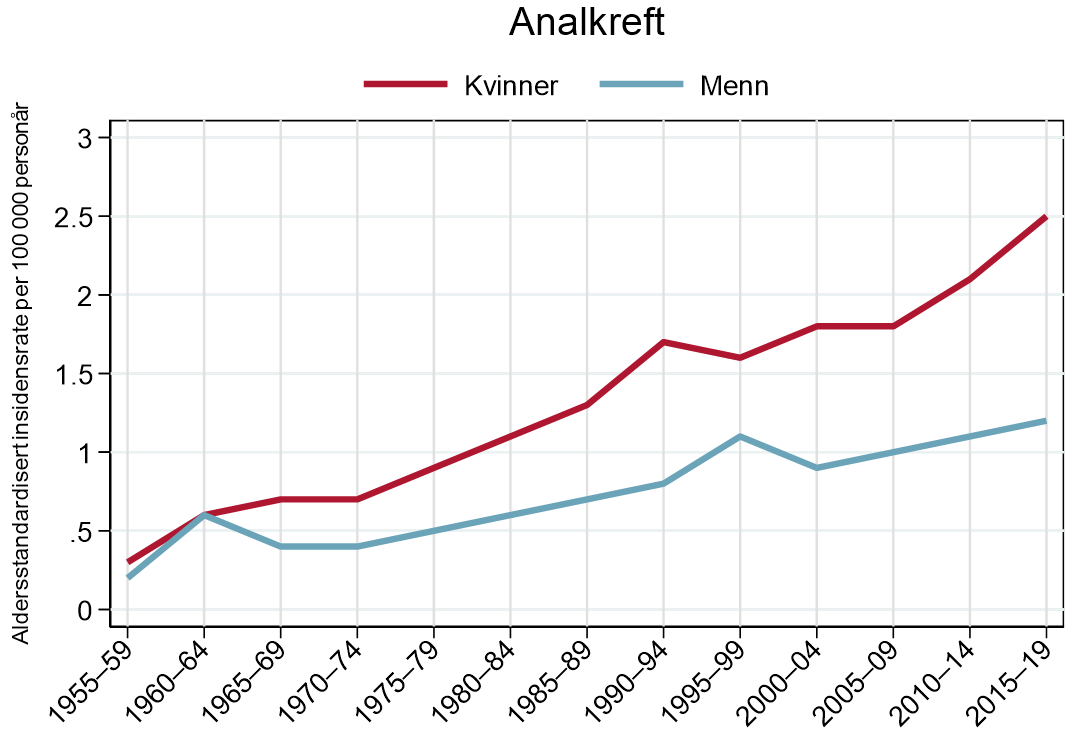
Analkreft er en sjelden kreftform, og i internasjonal kreftstatistikk blir tilfellene oftest rapportert sammen med endetarmskreft. Kreftregisteret har siden 2015 rapportert insidens- og prevalenstall for analkreft.
I Norge ble det i 2019 diagnostisert 112 nye tilfeller av analkreft. Denne kreftformen er en av få hvor kvinner har høyere forekomst enn menn, og rundt 70 % av tilfellene diagnostiseres blant kvinner (Cancer in Norway 2019: cancer incidence, mortality, survival and prevalence in Norway, 2020). De fleste tilfellene blir diagnostisert i aldersgruppen 60-69 år, og median alder ved diagnose er 66 år (Cancer in Norway 2019: cancer incidence, mortality, survival and prevalence in Norway, 2020).
Det har vært en jevn øking i insidensen over tid (Guren, Aagnes, Nygard, Dahl, & Moller, 2019), og de aldersstandardiserte insidensratene er nå 1,2 (menn) og 2,5 (kvinner) tilfeller per 100 000 personår (Cancer in Norway 2019: cancer incidence, mortality, survival and prevalence in Norway, 2020) (figur 1). En økende insidens er også vist i andre høy-inntektsland (Islami, Ferlay, Lortet-Tieulent, Bray, & Jemal, 2017), deriblant Danmark, som i tillegg til Norge rapporterer egen kreftstatistikk for denne kreftformen (Statistik om analkræft).
Overlevelse
Sist faglig oppdatert: 02.07.2021
Innen kreftepidemiologien brukes ofte begrepet relativ overlevelse (netto overlevelse). Dette er et mål som sier noe om sannsynligheten for å overleve sin kreft dersom man ser bort fra muligheten for å dø av andre årsaker. Overlevelsestall for analkreft er ikke tilgjengelig i Kreftregisterets statistikk. En nasjonal studie fra Norge viser at fem-års netto overlevelse av plateepitelkarsinom i anus har økt fra 63,4 % i perioden 1987–96 til 72,7 % i perioden fra 2007–16 (estimatene er for begge kjønn samlet). Økningen i overlevelse ble kun påvist for pasienter under 70 år. For de eldste pasientene (≥70 år) har overlevelsen vært uendret på omlag 57 %. Denne studien viste også at alder over 70 år, metastatisk sykdom og det å være mann var faktorer assosiert med dårligere overlevelse (Guren et al., 2019). Til sammenligning viser data publisert fra Kræftens Bekæmpelse at 5-års relativ overlevelse for analkreft i Danmark i perioden 2012–16, var 61 % for menn og 70 % for kvinner (Statistik om analkræft).
Etiologi og risikofaktorer
Sist faglig oppdatert: 02.07.2021
HPV
Humant papillomavirus (HPV) er en viktig etiologisk faktor for utvikling av analcancer (Krzowska-Firych, Lucas, Lucas, Lucas, & Pietrzyk, 2019; zur Hausen, 2000). Studier har vist at nær 90 % av anal plateepitelkarsinom er relatert til HPV (Gilbert et al., 2016). Mer enn 70 % av disse var HPV16 positive, og en mindre andel (7 %) var HPV18 (Serup-Hansen et al., 2014). En norsk studie harvist klar prognostisk forskjell basert på HPV uttrykket (Bruland et al., 2008), og flere studier har vist at pasienter med HPV-negativ svulst har dårligere prognose (Mai et al., 2015; Meulendijks, Tomasoa, et al., 2015; Rodel et al., 2015).
Man har funnet en signifikant sammenheng mellom tidligere HPV-relatert gynekologisk kreft og analcancer hos kvinner (Castor, da Silva, Gondim Martins, & de Mello, 2012). For menn som har sex med menn, finner man også en sammenheng mellom HPV-infeksjon og forstadier til kreft (Machalek et al., 2012).
Immunsuppresjon
Menn som er HIV-positive har økt risiko for å utvikle analcancer, spesielt i aldersgruppen under 50 år (Shiels, Pfeiffer, Chaturvedi, Kreimer, & Engels, 2012). Det er også økt forekomst av analcancer blant pasienter som har gjennomgått organtransplantasjon, eller er immunsupprimerte på grunn av annen sykdom eller medisinsk behandling (Hemminki, Liu, Ji, Sundquist, & Sundquist, 2012; Sunesen, Norgaard, Thorlacius-Ussing, & Laurberg, 2010).
Røyking
Man finner i flere studier en assosiasjon mellom analcancer og røyking (Coffey, Beral, Green, Reeves, & Barnes, 2015; Daling et al., 2004).
Forebygging
Forebygging i helsetjenesten
Sist faglig oppdatert: 02.07.2021
Humant papillomavirus (HPV) har en svært høy forekomst i befolkningen. Man anslår at 70 % av de som er seksuelt aktive, vil smittes med HPV i løpet av livet. Hos de med persisterende infeksjon (ca. 10 %) finner man økt risiko for celleforandringer og kreft i cervix, oropharynx, vulva, vagina, penis og anus (Humant papillomavirus (HPV), genitale infeksjoner - veileder for helsepersonell).
Vaksinering regnes som den beste forebygging mot HPV-smitte (Nilsen et al., 2007). Ettersom analcancer og forstadier til dette er sterkt knyttet til persisterende HPV-infeksjon, vil vaksinering være et forebyggende tiltak. I Norge tilbys vaksine til alle jenter i 7. klasse primært med tanke på forebygging av livmorhalskreft (HPV og HPV-vaksine, 2016). Fra høsten 2018 er vaksinasjon mot HPV tilbudt til gutter på lik linje med jenter i 7. klassetrinn som del av barnevaksinasjonsprogrammet (HPV og HPV-vaksine, 2016).
Generelle livsstilsråd som bruk av kondom for å unngå HPV-smitte og røykeslutt anbefales (Lam et al., 2014; Winer et al., 2006). Hos immunsupprimerte pasienter må forebygging vurderes i hvert enkelt tilfelle.
For kvinner som deltar i screeningprogram for livmorhalskreft, gjør man i økende grad testing for HPV-infeksjon. Det pågår en prøveordning med kun HPV-test for enklere screening for livmorhalskreft (HPV-test gir enklere screening mot livmorhalskreft for 9 av 10 kvinner mellom 34 og 69 år). Selv om det er påvist en sammenheng med HPV-infeksjon og analcancer, er ikke screening aktuelt ved en så sjelden sykdom. Det er ingen HPV-tester som er spesielt utviklet for menn.
Det finnes ingen medikamentell behandling av HPV, men genitale vorter og prekanserøse lesjoner kan behandles lokalt. På kjønnsvorter kan man benytte antivirale midler (podofyllotoksinløsning eller imikvimod). Celleforandringer ved anal intraepitelial neoplasi (AIN) kan utvikle seg til analcancer og behandling av disse kan gi en teoretisk redusert risiko for videre utvikling av sykdommen. Behandlingen kan være kirurgi eller bruk av linimenter som imikvimod (se eget avsnitt).
Anbefalinger
Forebygging av HPV-infeksjon gjennom vaksinasjonsprogrammet for HPV anbefales (evidensgrad A).
Bruk av kondom gir en viss beskyttelse mot HPV-smitte (evidensgrad A).
Forstadier til analcancer
Sist faglig oppdatert: 02.07.2021
Anal intraepitelial neoplasi (AIN) er en premalign tilstand for analcancer som er assosiert med HIV-seropositive pasienter og vedvarende HPV-infeksjon. Røyking og analt samleie er risikofaktorer for AIN. Immunsuppresjon ved organtransplantasjon gir også økt risiko. Risikofaktorene synes å forsterke hverandre. Hos pasienter med økt risiko bør man være ekstra oppmerksom.
Terminologien kan være forvirrende. WHO bruker terminologien Anal Intraepitelial Neoplasi (AIN). Denne deles inn i AIN I (mild), AIN II (moderat) og AIN III (grov) dysplasi (WHO Classification of Tumours of the Digestive System, 2010), men på grunn av lav grad av reproduserbarhet i diagnostikken vurderes et system med kun to grader. Anal Squamous Intraepithelial Neoplasia (ASIL) er et begrep anbefalt av American Joint Committee of Cancer (AJCC), og denne deles inn i lavgradig (LSIL) som svarer til AIN I og høygradig (HSIL) som svarer til AIN II/ AIN III. Dette svarer til inndeling av forstadier på livmorhalsen (cervix). Det er bare de høygradige variantene som er knyttet til mulig utvikling av analcancer.
LSIL synes å være knyttet til mer forbigående forandringer mens HSIL er relatert til kronisk HPV infeksjon. Immunsuppresjon synes å gi økt risiko for kronisk HPV-infeksjon på grunn av nedsatt evne til å håndtere/bli kvitt en virusinfeksjon, og denne gruppen av pasienter må følges særlig nøye.
Der hvor man finner høyrisiko HPV (spesielt HPV 16/18) er det større sjanse for overgang fra LSIL til HSIL (Liu, Sigel, & Gaisa, 2018). HIV-pasienter har større risiko for å utvikle HSIL enn de som ikke tilhører denne pasientgruppen, men det synes som mange forblir i gruppen av LSIL og mange har tilbakegang av sine forandringer. De fleste studier inkluderer HIV-pasienter, og er derfor ikke representative for den generelle befolkning. Bedre tilheling er registrert hos eldre pasienter, heteroseksuelle, pasienter uten kondylomer, ikke-røykende og de med kun en type av høyrisiko HPV-variant (Gautier et al., 2016). HSIL er et sannsynlig forstadium for anal kreft, men det er begrenset med studier, og denne overgangen kan ikke fastslåes med sikkerhet.
Noen pasienter får store kondylomer, ofte kalt Buschke-Lowenstein kondylomer. I disse finner man ofte HPV-varianter med lav risiko for utvikling av høygradige lesjoner, og regnes derfor som benigne. Tidligere har disse lesjonene blitt gruppert sammen med verrukøse karsinomer, men denne gruppen av lesjoner synes ikke å være relatert til HPV-infeksjoner og kan utvikle seg videre til (lavgradig) kreft (Zidar et al., 2017).
Behandling av AIN
Sist faglig oppdatert: 02.07.2021
AIN kan manifestere seg klinisk med blødning, kløe, væsking, irritasjon og tenesmer, eller kan være asymptomatisk. Ved klinisk undersøkelse kan man finne perianale/anale hud- eller slimhinneforandringer med verrucøst, erytematøst eller papuløst utseende, hypo- eller hyperpigmenterte eksemlignende plakk, enten velavgrenset eller diffust og vanskelig å identifisere.
Klinisk undersøkelse omfatter nøye inspeksjon, palpasjon og ano-/retoskopi. Pensling med 3-5% eddiksyre på aktuelle hudområder fører til avbleking av lesjoner.
Ved seksualanamnese på praktisering av analsex bør henvisning til avdeling med kompetanse innen seksuelt overførbare infeksjonssykdommer i analkanalen vurderes.
Kvinner med AIN (alle, også AIN I?) bør henvises til gynekologisk avdeling med tanke på intraepitelial atypi i cervix (CIN), vagina (VAIN) eller vulva (VIN).
Generelt anbefales eksisjon av hele lesjonen, eller adekvate stansebiopser dersom eksisjon medfører sfinkterskade.
Lavgradig AIN trenger ikke behandling, men kontrolleres etter vel ett år for om mulig å fange opp utvikling til høygradig AIN. Dersom det fortsatt er lavgradig AIN, kan kontrollene avsluttes. Hos risikopasienter er halvårlige kontroller rimelig for om mulig å avdekke utvikling til høygradig AIN (Macaya, Munoz-Santos, Balaguer, & Barbera, 2012).
Ved påvist høygradig AIN (II–III) kan behandling redusere risiko for utvikling av analcancer, men det er fortsatt diskusjon om hvilket behandlingsregime som er best (Alam, White, Narang, Daniels, & Smart, 2016; Macaya et al., 2012). Små områder kan fjernes kirurgisk, først og fremst for å fjerne lesjonen, men også for å undersøke om det er utvikling av plateepitelkarsinom. Det er ofte forandringer helt ut i reseksjonskantene som kan gi vedvarende sykdom, og det kan være nødvendig med gjentatte reseksjoner (Pineda & Welton, 2009).
Eradikering/nedgradering til lavgradig AIN kan forsøkes med imiquimod (AldaraÒ) liniment (Fox et al., 2010). som påsmøres 3 ganger per uke i 16 uker. Ablasjon med teknikker som argonplasma-koagulasjon og lignende kan forsøkes (Richel, de Vries, van Noesel, Dijkgraaf, & Prins, 2013). Tilbakefall er svært vanlig.
Pasienter med høygradig AIN bør følges og kontrolleres, men intervallet er det ikke enighet om, og dokumentasjonen for helsegevinst er usikker da risikoen er lav (Brogden et al., 2021). Kontrollene bør ta hensyn til pasientens immunstatus, og årlig kontroll hos immunkompetente, og halvårlige kontroller hos immunkompromitterte pasienter kan anses som god praksis.
I Norge vil dette gjelde svært få pasienter og utgjør ingen stor belastning for helsetjenesten. Det vil være hensiktsmessig at en eller få av kirurgene står for utredning og behandling av AIN ved den enkelte avdelingen.
Anbefaling
Høygradig anal intraepitelial neoplasi (AIN) skal behandles, og hvis mulig, eradikeres og kontrolleres (evidensgrad B).
Forløpstider
Pakkeforløp
Sist faglig oppdatert: 02.07.2021
Det er ikke utarbeidet et eget pakkeforløp for analcancer, men mange tilfeller vil påvises og utredes via pakkeforløp for tykk- og endetarmskreft, og pasienter med mistanke om analcancer skal henvises til utredning etter dette pakkeforløpet. Ved analcancer bør man benytte de samme tidsfrister for utredning og start til behandling som ved Pakkeforløp for tykk- og endetarmskreft (tabell 1).
| Forløpsbeskrivelse | Forløpstid | |
|---|---|---|
| Fra henvisning mottatt til første fremmøte utredende avdeling | 9 kalenderdager | |
| Fra første fremmøte i utredende avdeling til avsluttet utredning (beslutning tas) | 12 kalenderdager | |
| Fra avsluttet utredning til start behandling | Kirurgisk behandling | 14 kalenderdager |
| Fra avsluttet utredning til start behandling | Medikamentell behandling | 14 kalenderdager |
| Fra avsluttet utredning til start behandling | Strålebehandling | 18 kalenderdager |
| Fra henvisning mottatt til start behandling | Kirurgisk behandling | 35 kalenderdager |
| Fra henvisning mottatt til start behandling | Medikamentell behandling | 35 kalenderdager |
| Fra henvisning mottatt til start behandling | Strålebehandling | 39 kalenderdager |
Anbefaling
Forløpstider for utredning og start behandling ved analcancer følger Pakkeforløp for tykk- og endetarmskreft.
Diagnostikk og utredning
Utredning
Sist faglig oppdatert: 02.07.2021
Utredning er i hovedsak den samme som ved endetarmskreft, og bør følge samme utredningsforløp med de samme frister: https://helsedirektoratet.no/retningslinjer/pakkeforlop-for-tykk-og-endetarmskreft.
Koloskopi og CEA er ikke nødvendig.
Forslag til utredningsforløp
- Henvisning fra fastlege / annen lege basert på symptomer og funn. Digital rektaleksplorasjon (DRE) skal utføres. Ved sikre tumores og/eller blødning skal man henvise pasienten for utredning som ved pakkeforløp for tykk- og endetarmskreft.
- Kirurgisk poliklinikk: Digital rektal eksplorasjon, anorektokopi og biopsi (merkes med cito/haster), eventuelt gynekologisk undersøkelse.
- Utredning av analcancer omfatter:
- CT thorax/abdomen/bekken
- MR bekken
- FDG-PET/CT ved T2-4, eller N1, evt ved M1
Symptomer og anamnestiske opplysninger
Sist faglig oppdatert: 02.07.2021
De vanligste symptomer er blødning, kløe eller smerter. Pasienten har selv ofte oppdaget noe uvanlig i selve analkanalen eller i hudområdet rundt: en kul, en knast, et fast parti, noe som fyller opp, kommer ut, eller et sår som ikke forsvinner. Siving og inkontinens kan være symptomer på analcancer. Noen pasienter oppdager kuler i lyskene.
Mange av disse symptomene er generelle for benigne lidelser i analområdet. Det er vesentlig å vurdere om det foreligger en malignitetsmistanke før man konkluderer med benigne tilstander. Proktologiske tilstander som hemorroider og fissurer samt fistel/abscess må anses å være eksklusjonsdiagnoser etter at malign tilstand er utelukket. Rektal eksplorasjon er obligatorisk ved utredning av symptomer i og rundt analkanalen.
Overraskende kan diagnosen analcancer (eller AIN) rapporteres etter innsendelse av vevsmateriale for lesjoner som ser benigne ut, for eksempel marisker, sårkanter fra fissurer, fibroepiteliale polypper eller andre forandringer.
Anamnestiske opplysninger som skal øke årvåkenheten for mulig analcancer, er:
- Tidligere påvist HPV-infeksjon, kondylomer eller HPV-relaterte neoplasier (cervix, munnhule/svelg)
- HIV-infeksjon
- Menn som har sex med menn
- Immunsuppresjon ved organtransplantasjon eller annen årsak
Klinisk undersøkelse
Sist faglig oppdatert: 02.07.2021
Inspeksjon av analområdet og digital rektal eksplorasjon (DRE) skal utføres og beskrives.
Ved rektal eksplorasjon beskrives beliggenhet av unormale palpasjonsfunn. Lyskene skal palperes. Alle suspekte funn skal følges opp med anorektoskopi og biopseres under optimale forhold (kirurgisk kompetanse, anestesi ved behov). Biopsier skal helst tas uten bruk av elektrokoagulasjon (kald teknikk, eksisjon, tru-cut). En skal beskrive tumors lokalisasjon og beliggenhet (nivå, sirkumferent affeksjon) og angi størrelse på tumor. Rektovaginal undersøkelse bør gjøres hos kvinner ved mistanke om innvekst i vagina.
Ved forandringer i huden utenfor anal verge bør ufullstendige reseksjoner eller piecemeal- biopsier unngås – det vil si biopsier som fragmenterer vevet og lager uryddige sår i lesjonen. En må enten ta en liten diagnostisk biopsi eller en fullhudsreseksjon med god margin; se kapittel om behandling.
Anbefalinger
Ved symptomer fra analregionen skal klinisk undersøkelse inkludert digital rektaleksplorasjon, inspeksjon av analområdet og palpasjon av lysker utføres (evidensgrad B).
Ved mistanke om malignitet utføres anorektoskopi og biopsi (evidensgrad B).
Økt årvåkenhet for analcancer anbefales ved symptomer hos immunsupprimerte, HIV-positive og etter annen HPV-relatert neoplasi (evidensgrad C).
Anatomi
Sist faglig oppdatert: 02.07.2021
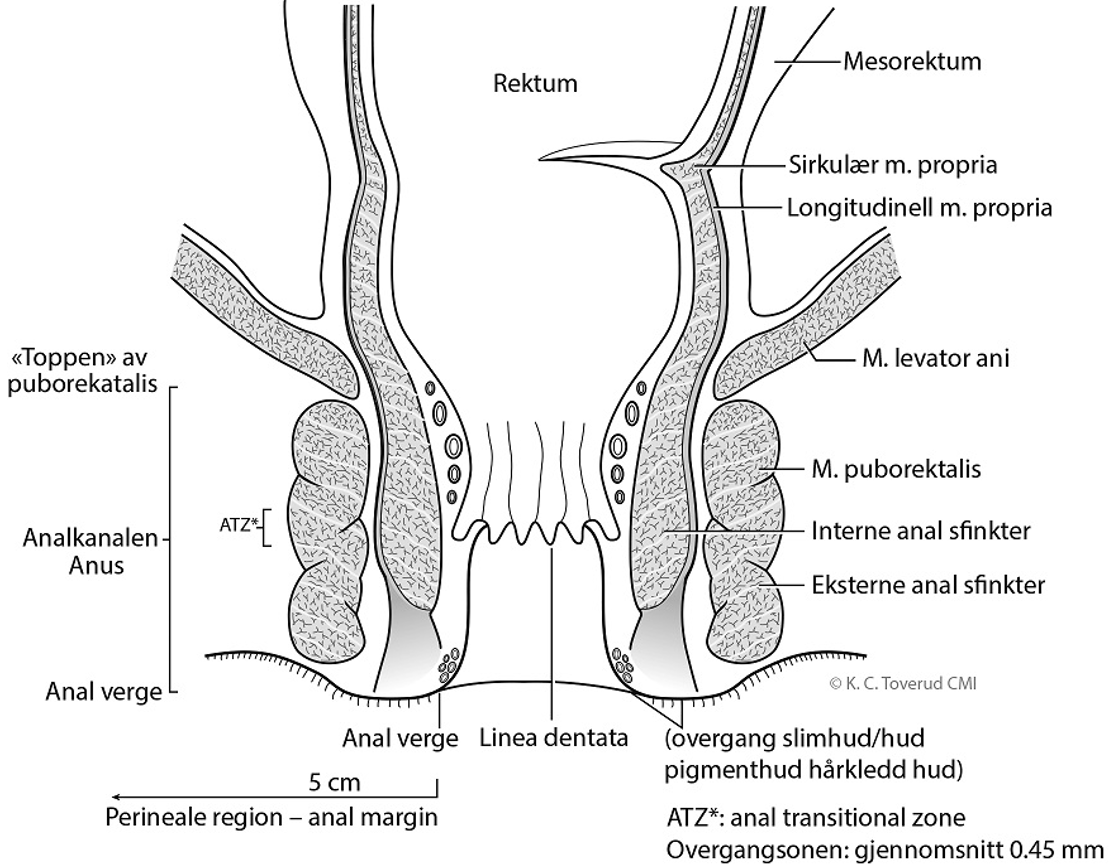
Figur 2: De anatomiske forhold rundt analkanalen og nedre del av endetarm.
Bildediagnostiskeundersøkelser
Sist faglig oppdatert: 02.07.2021
Kartlegging av tumors lokale utbredelse, lymfeknutestatus og eventuelle fjernmetastaser for stadieinndeling er nødvendig for planlegging av behandling og oppfølging. Tumorstørrelse og lymfeknutemetastaser er viktige prognostiske faktorer (Ajani et al., 2010; Bentzen et al., 2012; Gunderson et al., 2013).
MR bekken
MR av bekkenet er viktigste modalitet for lokoregional staging ved analcancer (Kochhar, Plumb, Carrington, & Saunders, 2012; Koh et al., 2008; Roach, Hulse, Moulding, Wilson, & Carrington, 2005; Salerno, Daniels, Heald, Brown, & Moran, 2004). MR brukes også i oppfølgingen etter kjemoradioterapi for evaluering av behandlingsrespons (Goh et al., 2010; Koh et al., 2008; Salerno et al., 2004; Stoker, Rociu, Wiersma, & Lameris, 2000).
MR-undersøkelsen gjennomføres med overflatespole, og protokollen bør inneholde høyoppløselige T2-vektede serier vinkelrett og parallelt med tumoren/analkanalen. Dette er for å kartlegge tumors innvekst i det anale sfinkterapparatet, tilgrensende organer som prostata og vagina/cervix og øvrige bekkenstrukturer.
Diffusjonsvektede serier brukes i økende grad og bør være en del av MR-protokollen. Disse er til hjelp ved deteksjon av tumor, ved avgrensning og stadieinndeling av tumor, og spesielt ved å skille residiv- eller resttumor fra behandlingsrelaterte forandringer som fibrose (Kochhar et al., 2012). Diffusjon kan være til hjelp for å detektere lymfeknuter, men kan foreløpig ikke brukes til å vurdere om en lymfeknute er malign eller benign.
En serie med T1 vekting bør være en del av MR protokollen for å fremstille bekkenskjelett og deler av lumbosacral-columna. Dette er for å se på behandlingsrelaterte forandringer som insuffisiensfrakturer og for å se etter skjelettmetastaser.
Serier av hele bekkenet med T2-vekting bør inkludere lymfeknutestasjonene i lyskene, ved iliacakarene og i mesorectum.
Karakterisering av lymfeknutene i bekkenet er en radiologisk utfordring. Det angis størrelseskriterier som 5 mm grense for perirektale og 10 mm grense for inguinale og iliaca interna lymfeknuter (Koh et al., 2008; Parikh et al., 2011). Nesten halvparten av affiserte lymfeknuter ved analcancer har vist seg å være mindre enn 5 mm (Wade, Herrera, Castillo, & Petrelli, 1989) slik at størrelseskriterier alene er usikre.
For pasienter med endetarmskreft er det vist at treffsikkerheten øker betydelig ved å bruke morfologiske MR-kriterier i lymfeknutevurderingen (G. Brown et al., 2003; J. H. Kim, Beets, Kim, Kessels, & Beets-Tan, 2004), og det anbefales derfor å bruke både morfologiske kriterier og størrelse ved vurdering av lymfeknuter i bekkenet (McMahon, Rofsky, & Pedrosa, 2010). Det er imidlertid publisert lite om dette temaet for analcancer. Det angis at lymfeknutemetastasene ofte har liknende signalintensitet på T2 som primærtumoren. Andre kriterier som manglende fetthilus, forandret kontur som avviker fra vanlig oval form, intern T1- og T2-signal heterogenitet og funn som ved sentral nekrose kan øke spesifisiteten i vurderingen av om en lymfeknute er malign eller benign (Roach et al., 2005).
Ved kontraindikasjon for MR er CT av bekkenet et alternativ, ev. i kombinasjon med endoanal ultralyd.
Endoanal ultralyd
Endoanal ultralyd kan være nyttig i vurderingen av små svulster og ved mistenkt infiltrasjon i sfinktermuskulaturen (Magdeburg, Fried, & Meyenberger, 1999; Otto et al., 2009). Undersøkelsen er avhengig av kompetanse og erfaring, og brukes oftest som et supplement, eventuelt ved kontraindikasjon for MR. Den er ikke obligatorisk i diagnostikk, staging eller oppfølging av analcancer (Lund et al., 2004).
CT av thorax, abdomen og bekken
Ved diagnosetidspunkt har enkelte pasienter fjernmetastaser, vanligst er i lever, lunge, skjelett, og ikke-regionale lymfeknuter. Multidetektor CT undersøkelse av thorax, abdomen og bekken med intravenøs kontrast ansees som grunnleggende diagnostikk for påvisning av fjernmetastaser (Benson et al., 2018; Glynne-Jones et al., 2014b; Guidelines for the management of anal cancer, 2007). Undersøkelsen bør tas i portovenøs kontrastfase og det bør helst lages 3 mm multiplanare reformater (MPR).
Kontrastforsterket ultralyd av lever eller MR av lever med diffusjonsvektede serier kan være gode alternativer ved nedsatt nyrefunksjon eller ved andre kontraindikasjoner mot CT kontrastmiddel.
FDG-PET/CT
FDG-PET/CT er nyttig for fastsettelse av stadium ved analcancer. Metoden har høy sensitivitet for deteksjon av regionale lymfeknutemetastaser, men også for deteksjon av primærtumor og fjernmetastaser. I flere studier er det vist at FDG-PET/CT endret staging hos 20–40 % av pasientene med analcancer; endringene var størst for lymfeknutestaging. Dette resulterte i endring av behandlingsregime for opptil 20–30 % av pasientene (Bhuva, Glynne-Jones, Sonoda, Wong, & Harrison, 2012; Nguyen et al., 2008; Wells & Fox, 2012). Med økende tumorstørrelse øker risikoen for lymfeknutemetastaser.
Utredning med FDG-PET/CT anbefales ved T2–T4-svulster og ved mistanke om patologiske lymfeknuter uavhengig av T-stadium, samt ved oligometastatisk sykdom.
FDG-PET/CT erstatter ikke diagnostisk CT for stadieinndeling og behandlingsplanlegging fordi den gjøres uten kontrast.
Ultralydveiledetlymfeknutebiopsi
Ultralydveiledet lymfeknutebiopsi/FNAC kan i noen tilfeller brukes for kartlegging av uklare inguinale lymfeknuter hvor dette vil ha konsekvens for utforming av strålefeltet.
Anbefalinger
MR-bekken etter egnet protokoll utføres for lokoregional kartlegging (evidensgrad B).
CT-thorax, abdomen og bekken etter egnet protokoll utføres for kartlegging av fjernmetastaser (evidensgrad B).
FDG-PET/CT bør utføres ved T2–T4-svulster, eller ved malignitetssuspekte lymfeknuter, og kan vurderes ved oligometastisk sykdom (evidensgrad B).
Laboratorieprøver
Sist faglig oppdatert: 02.07.2021
Ved utredning av primærsykdom tas vanlige generelle blodprøver og eventuelt HIV-status dersom det ikke er kjent. Det finnes foreløpig ingen spesifikk tumormarkør for anal cancer. CEA i serum (carcino-embryonalt antigen) har ingen plass ved utredning av analcancer.
Anbefaling
Utredning inkluderer generelle blodprøver og eventuelt HIV status (evidensgrad D).
Histopatologisk undersøkelse
Sist faglig oppdatert: 02.07.2021
Diagnosen bør bekreftes med biopsi (se kapittel Patologi for detaljer). Det bør testes for p16 eller HPV.
Anbefaling
Diagnosen bør bekreftes med biopsi, og en bør undersøke for p16 eller HPV (evidensgrad B)
Multidisiplinært team
Sist faglig oppdatert: 02.07.2021
Pasientene skal som hovedregel diskuteres i multidisiplinært team (MDT) for beslutning av behandlingsplan (Croke & El-Sayed, 2012; Nasjonal handlingsplan for kreft 2015-2017, 2015). Pasienter som ikke oppnår komplett remisjon, eller der det er mistanke om residiv, bør også diskuteres i MDT.
Før oppstart av stråleterapi bør aktuelle menn tilbys nedfrysning av spermier i sædbank.
Anbefaling
Pasienter med analcancer skal som hovedregel diskuteres i MDT for beslutning av behandlingsplan (evidensgrad D).
Stadieinndeling
Sist faglig oppdatert: 02.07.2021
Analcancer er betegnelsen på plateepitelkarsinom i analkanalen. Plateepitelkarsinom i nedre del av rectum (5 cm ovenfor linea dentata) anses også som analcancer. Perianal cancer (anal margin cancer på engelsk) brukes om plateepitelkarsinom som oppstår perianalt (innen 5 cm fra analåpningen). Se figur 2, kapittel Anatomi.
Ved diagnosetidspunkt har analcancer oftest lokal/lokoregional utbredelse, 30–40 % har spredning til lymfeknuter, mens kun 5–8 % har fjernmetastaser (Glynne-Jones et al., 2014a).
Stadieinndeling baserer seg på en kombinasjon av kliniske, radiologiske, og patologiske opplysninger, og gjøres etter TNM-klassifikasjon (tabell 2). Man bruker nå TNM versjon 8 (TNM Classification of Malignant Tumours, 2017). Den har en annen klassifisering av N-status enn tidligere versjoner. TNM status kan også benyttes til stadie-inndeling (tabell 3) (Shida, Kanemitsu, Hamaguchi, & Shimada, 2019).
Tabell 2
| Tx | Tumor, ingen informasjon |
| T0 | Tumor ikke påvist |
| Tis | Carcinoma in situ, Mb. Bowen, H-SIL, anal intraepitelial neoplasi II-III (AIN-II-III) |
| T1 | Tumor ≤ 2 cm i største diameter |
| T2 | Tumor >2 cm og ≤ 5 cm i største diameter |
| T3 | Tumor > 5 cm i største diameter |
| T4 | Tumor uansett størrelse som infiltrer naboorgan(er) som vagina, urethra, urinblære. OBS! Direkte infiltrasjon i rektalvegg, perianal hud, subcutant vev eller av bare sfinktermuskulatur regnes IKKE som T4. |
| NX | Regionale lymfeknuter ikke undersøkt |
| N0 | Ingen regionale lymfeknuter med metastase |
| N1 | Metastase i regionale lymfeknute(r) |
| N1a | Metastaser i inguinale, mesorectale og/eller iliaca interna lymfeknuter |
| N1b | Metastaser i iliaca externa lymfeknuter |
| N1c | Metastaser i iliaca externa og i inguinale, mesorectale og/eller iliaca interna lymfeknuter |
| M0 | Ingen fjernmetastaser |
| M1 | Fjernmetastaser |
Tabell 3
| Stadium I | T1N0M0 |
| Stadium IIA | T2N0M0 |
| Stadium IIB | T3N0M0 |
| Stadium IIIA | T1–2N1M0 |
| Stadium IIIB | T4N0M0 |
| Stadium IIIC | T3–4N1M0 |
| Stadium IV | T1–4N0–1M1 |
Kurativ behandling av lokalisert sykdom
Sist faglig oppdatert: 02.07.2021
Allerede tidlig på 1980-tallet begynte man å behandle analcancer primært med strålebehandling i stedet for kirurgi (Nigro, 1984; Nigro, Vaitkevicius, & Considine, 1974). Senere er det vist bedre resultater med strålebehandling i kombinasjon med kjemoterapi (Bartelink et al., 1997; Epidermoid anal cancer: results from the UKCCCR randomised trial of radiotherapy alone versus radiotherapy, 5-fluorouracil, and mitomycin. UKCCCR Anal Cancer Trial Working Party. UK Co-ordinating Committee on Cancer Research, 1996). Basert på disse studiene, anses strålebehandling kombinert med kjemoterapi å være primær behandling ved lokalisert analcancer (Benson et al., 2018; Glynne-Jones et al., 2014b; Rao et al., 2021). Primær kirurgi av tumor er kun aktuelt ved spesielle lokalisasjoner og i tidlige stadier som spesifisert nedenfor. Ved lokal behandlingssvikt etter gjennomgått kjemoradioterapi gjøres kirurgi som salvage-behandling (kapittel Kirurgi ved resttumor eller lokalt residiv). Behandlingsopplegg bør diskuteres i MDT. Kurativ behandling gjøres ved regionale sentra.
Kirurgi primært
Sist faglig oppdatert: 02.07.2021
Svulster i analkanalen
Analcancer, dvs. cancer i analkanalen, behandles ikke med kirurgi. Kirurgi i dette området er kun aktuelt for diagnostikk.
Høygradig AIN diagnostiseres ved biopsier, og en må forsikre seg om at det ikke er gjenværende tumorvev som kan være invasiv kreft.
Perianale svulster
Området perianalt (engelsk anal margin) er området i en radius på 5 cm fra analåpningen (engelsk anal verge), og tilsvarer som regel det pigmenterte området rundt anus som består av keratinisert plateepitel til hårgrensen (se figur 2, kapittel Anatomi).
Perianal cancer, T1N0M0, tumor < 1 cm, med høy/moderat differensiering: Disse kan fjernes med minst 1 cm makroskopisk margin (histologisk > 1 mm margin). Ingen tilleggsbehandling (Balamucki et al., 2011; Fuchshuber, Rodriguez-Bigas, Weber, & Petrelli, 1997). Ved ufrie render kan det gjøres rereseksjon og/eller kjemoradioterapi (Hatfield, Cooper, & Sebag-Montefiore, 2008; Leon, Hagberg, & Johnsson, 2018). Alternativet er kjemoradioterapi dersom kirurgi vil kunne skade sfinkterapparatet og resultere i symptomgivende redusert funksjon. Det gis da 54 Gy mot makrotumor/tumorseng med 2 cm margin til CTV og 1 kur mitomycin/5-FU eller mitomycin/kapecitabin. Elektive glandelområder kan utelates.
All annen primær behandling er onkologisk.
Annen kirurgi
Sigmoideostomi kan være aktuelt før oppstart av strålebehandling ved tømmingsproblemer, obstruksjon, inkontinens eller fistel.
Kirurgi kan være aktuelt ved plateepitelkarsinom i rectum (se eget avsnitt).
Anbefalinger
Primær kirurgi kan være aktuelt ved små perianale tumores < 1 cm med høy/moderat differensiering (evidensgrad D).
Sigmoideostomi bør vurderes før oppstart av strålebehandling ved alvorlig obstruksjon, inkontinens eller fistel (evidensgrad D).
Kjemoradioterapi
Sist faglig oppdatert: 02.07.2021
Introduksjon
Strålebehandling kombinert med mitomycin C og 5-FU er bedre enn strålebehandling alene (Bartelink et al., 1997; Epidermoid anal cancer: results from the UKCCCR randomised trial of radiotherapy alone versus radiotherapy, 5-fluorouracil, and mitomycin. UKCCCR Anal Cancer Trial Working Party. UK Co-ordinating Committee on Cancer Research, 1996; Leon et al., 2014). To store randomiserte studier (RTOG 98-11 og ACT II) har vist at mitomycin C bør foretrekkes framfor cisplatin; det er minst like effektivt og mindre toksisk (Ajani et al., 2008; Gunderson et al., 2012; James et al., 2013). Det er ikke vist gevinst av kjemoterapi før eller etter kjemoradioterapi. Med bakgrunn i de randomiserte studiene anbefales strålebehandling kombinert med mitomycin C og 5-FU (Glynne-Jones et al., 2014a).
I et norsk materiale som omfattet alle som fikk kurativ strålebehandling i perioden 2000–2007, fikk 87 % av pasientene komplett respons etter kjemoradioterapi (Bentzen et al., 2012). Med etterfølgende kirurgi av resttumor ble 93 % tumorfrie. Cirka en fjerdedel av pasientene fikk senere residiv, hovedsakelig lokoregionalt. Tre- og fem-års residivfri overlevelse var henholdsvis 79 % og 74 %. Prognosen var bedre ved lokalisert sykdom enn ved lokalavansert sykdom, og bedre for kvinner enn for menn. Et senter i Storbritannia har vist at andelen med lokal behandlingssvikt er lavere og det er bedre overlevelse i nyere tidsperiode enn tidligere (Sekhar et al., 2020). Nylige resultater fra 132 pasienter behandlet med kjemoradioterapi 2013-2017 ved ett norsk senter viser behandlingssvikt hos 14% og 3-års og 5-års sykdomsfri overlevelse på 85% og 78% (Slørdahl et al., 2021).
Strålebehandling
Strålebehandling gis sekvensielt med 1,8–2 Gy-fraksjoner, evt. med simultan integrert boost (SIB) teknikk (se kapittel Strålebehandlingsteknikker, avsnitt Simultan integrert boost (SIB) eller sekvensiell behandling), 5 dager per uke. Pauser i behandlingen bør unngås og eventuelt kompenseres. En må vurdere pasientens alder, allmenntilstand og komorbiditet med tanke på toleranse av kurativ kjemoradioterapi.
Optimal stråledose er ikke kjent verken for tumor eller risikoområder, og forskjellige doser er i bruk internasjonalt, men det anbefales at strålebehandling gis med minimum 50,4 Gy mot primærtumor (Glynne-Jones et al., 2014b; Rao et al., 2021). Studier tyder også på at store tumores trenger en høyere dose enn små tumores for å oppnå tumorkontroll (Johnsson, Leon, Gunnlaugsson, Nilsson, & Hoglund, 2018; Muirhead, Partridge, & Hawkins, 2015). Tilsvarende gjelder for N1 status og T4 sykdom (Johnsson et al., 2018). I tråd med dette er de norske anbefalingene at GTVp (primærtumor) får 54 Gy ved T1–2N0 tumor, og 58 Gy ved T3–4 tumor eller N1. Enkelte steder, for eksempel i Sverige, behandles pasienter med svulst >4 cm som ved T3 tumor. Internasjonalt har patologiske lymfeknuter blitt behandlet med forskjellige doser, og det er usikker dokumentasjon på hvilken stråledose som er nødvendig. I RTOG 0529-studien med intensitets-modulert radioterapi (IMRT) og SIB ble det f.eks. gitt 54 Gy til primærtumor og 54 eller 50,5 Gy til patologiske lymfeknuter avhengig av størrelse. De nordiske landene ligger generelt litt høyere i stråledose på analcancer, og i NOAC8 studien ble det med IMRT og SIB gitt 57,5 Gy til primærtumor og 54 Gy til patologiske lymfeknuter (Kachnic et al., 2012; Leon, Guren, Radu, Gunnlaugsson, & Johnsson, 2015). Basert på dette foreslås det at patologiske lymfeknuter < 2 cm i største diameter får 54 Gy, mens større lymfeknuter fortsatt får 58 Gy.
Stråledose til risikoområdet for subklinisk spredning (CTVe) varierer internasjonalt mellom 30 Gy og 46 Gy, der vi i Norden har gitt ca. 46 Gy mens man i USA og Storbritannia har ligget lavere. Sammenlignende studier foreligger ikke, men flere studier viser lav regional residivrisiko etter 30–36 Gy (sekvensiell behandling) (Henkenberens, Toklu, Tamme, & Bruns, 2016; Lepinoy et al., 2015). Studier indikerer også at doser ned mot 30 Gy kan være tilstrekkelig for å kontrollere svært små analcancere (Hatfield et al., 2008) og at det ved tumores < 2 cm ikke er signifikant sammenheng mellom «local tumor control probability» (LTCP) og stråledose i dosenivå 30–70 Gy (Johnsson et al., 2018). I de nyere nasjonale britiske retningslinjene for strålebehandling av analcancer (IMRT med SIB) gis 40 Gy (1,43 Gy x 28) til CTVe. I Sverige anbefales også tilsvarende 40 Gy (EQD2) til CTVe gitt enten sekvensielt eller som SIB i handlingsprogram for analcancer. Vi anbefaler nå tilsvarende i Norge med dose til CTVe = 40 Gy (EQD2). Forhåpentligvis vil dette kunne redusere både akutt og sein toksisitet og gi færre behandlingspauser som det er vist er negativt for prognosen (Glynne-Jones et al., 2011).
Kjemoterapi
Kjemoterapi gis med mitomycin 10 mg/m2 (maksdose 20 mg) iv dag 1, og 5-FU 1000 mg/m2/døgn kontinuerlig infusjon dag 1–4. Som alternativ kjemoterapi kan man benytte en kombinasjon av mitomycin og peroral kapecitabin (Glynne-Jones et al., 2008; Meulendijks et al., 2014; Thind, Johal, Follwell, & Kennecke, 2014). En gir da mitomycin 10 mg/m2 (maks dose 20 mg) iv dag 1, kombinert med kapecitabin 825 mg/m2 peroralt morgen og kveld, 5 dager per uke, alle dager med strålebehandling (Deenen et al., 2013; Glynne-Jones et al., 2008; Meulendijks et al., 2014). Hematologiske blodprøver følges ukentlig med tanke på dosereduksjon eller seponering av kapecitabin hvis nødvendig.
Ved lokalisert sykdom (T1–2N0) gis kjemoterapi samtidig med strålebehandlingen i uke 1. Ved mer lokalavansert sykdom (T3–4 eller N1) gis kjemoterapi samtidig med strålebehandling i uke 1 og 5.
I enkelte land (bl.a. i Storbritannia, ACT II-studien) gis mitomycin med dose 12 mg/m2 kun dag 1, slik at i uke 5 gis kun 5-FU ved kontinuerlig infusjon, med gode resultater (James et al., 2013). Ved toksisitet kan man vurdere å utelate mitomycin dag 29.
En liten andel pasienter har DPD-mangel (Dihydropyrimidin-dehydrogenase) og kan risikere alvorlig toksisitet av 5-FU og kapecitabin (Meulendijks, Henricks, et al., 2015). Det er mulig å undersøke på noen genetiske varianter ved å undersøke DPYD genotype (Deenen et al., 2016). European Medicines Agency (EMA) har anbefalt at alle pasienter som skal behandles med 5-FU eller kapecitabine bør testes for eventuell mangel på DPD før oppstart av behandling. DPYD testing er etablert i Norge. Ved genotype som tyder på redusert DPD-aktivitet, bør en følge anbefalinger i internasjonale retningslinjer med redusert startdose (Amstutz et al., 2018). Ved genotype som tyder på manglende DPD-aktivitet bør behandling med 5-FU eller kapecitabin unngås.
Annet
I enkelte spesielle tilfeller, for eksempel ved noen få eller usikre metastaser utenfor strålefeltet, som for eksempel patologiske lymfeknuter like ovenfor promontoriet, kan det være hensiktsmessig å gi mer kjemoterapi samtidig som en gir radikal behandling av primærtumor.
Det er lite evidens på dette, men en kan vurdere å gi for eksempel 2 kurer neoadjuvant cisplatin/5-FU, deretter starte strålebehandling samtidig med 3. kur cisplatin/5-FU, svarende til behandling som var vanlig i Norge tidligere (Ajani et al., 2008). Man kan vurdere å gi kjemoterapi som ved metastatisk sykdom med karboplatin/paklitaksel, og kjemoradioterapi som ved lokalisert sykdom til utvidet strålefelt med mitomycin/5-FU. Dette kan vurderes hos pasienter i god allmenntilstand dersom lymfeknutemetastasene kan inkluderes i strålefeltet (Hodges et al., 2009). En nylig publikasjon argumenterer for å vurdere behandling som potensielt kurativ dersom metastatiske lymfekenuter kan inkluderes i strålefeltet (M. P. Nilsson et al., 2020).
Ved perianal cancer, T1N0M0, tumor <1 cm, med høy/moderat differensiering, se kapittel Kirurgi ved resttumor eller lokalt residiv om kirurgi. Evt. kjemoradioterapi kan gis med 54 Gy til makrotumor/tumorseng med 2 cm margin til CTV kombinert med 1 kur mitomycin/5-FU eller mitomycin/kapecitabin. Elektive lymfeknuteregioner kan utelates.
Pasienter bør vurderes for inklusjon i kliniske studier dersom det er mulig. Det er utarbeidet en oversikt over hva som er viktig å undersøke i kliniske studier av analcancer (Fish et al., 2018). Dette inkluderer bl.a. behandlingseffekt, lokal/regional behandlingssvikt, fjernspredning, kirurgi, overlevelse, sykdomsfri overlevelse, anal inkontinens, «urgency», fistel, stomi, og livskvalitet.
Anbefalinger
Lokalisert analcancer behandles primært med strålebehandling kombinert med kjemoterapi (evidensgrad A).
Ved T1–2N0-svulst, gis 54 Gy til makroskopisk tumor (primærtumor) og 40 Gy til elektive lymfeknuteregioner, kombinert med 1 kur mitomycin/5-FU eller mitomycin/kapecitabin (evidensgrad A).
Ved T3–4N0- eller ved N1, gis 58 Gy til makroskopisk primærtumor, 54 eller 58 Gy til patologiske lymfeknuter avhengig av størrelse (under/over 2 cm), og 40 Gy til elektive lymfeknuteregioner, kombinert med 2 kurer mitomycin/5-FU eller mitomycin/kapecitabin (evidensgrad A).
Strålebehandling gis med 1,8–2 Gy-fraksjoner til tumor, alternativt med simultan integrert boost (SIB), 5 dager per uke (evidensgrad D).
Svar på DPYD genotype bør foreligge før start av behandling med 5-FU eller kapecitabine (evidensgrad B).
Pauser i behandlingen bør unngås og vurderes kompensert (evidensgrad C).Kurativ kjemoradioterapi kan vurderes ved oligometastatisk sykdom som kan inkluderes i strålefeltet (evidensgrad D).
Ved perianalcancer T1N0M0 tumor <1cm med høy/moderat differensiering, kan elektive lymfeknuteregioner utelates (evidensgrad D).
Inntegning av målvolum ved strålebehandling av analcancer
Sist faglig oppdatert: 02.07.2021
Det finnes to nyere atlas for inntegning av målvolum ved analcancer:
- RTOG (Myerson et al., 2009) for inntegning av elektive volum (risikoområder): Elective clinical target volumes for conformal therapy in anorectal cancer: A Radiation Therapy Oncology Group consensus panel contouring atlas. Atlaset ble utarbeidet fordi en stor del av planene (80 %) i RTOG 0529-studien, som skulle se på IMRT ved analcancer, krevde revisjon av målvolumene (Kachnic et al., 2012).
- AGITG (Ng et al., 2012): Australasian Gastrointestinal Trial Group (AGITG) Contouring Atlas and Planning Guidelines for Intensity-Modulated Radiotherapy in Anal Cancer som i tillegg til elektive volum beskrevet i RTOG guidelines også gir retningslinjer for inntegning av tumor og risikoorganer. Anbefalingen i handlingsprogrammet baserer seg i hovedsak på dette atlaset.
Denne type retningslinjer og atlas er konsensusbaserte og har basis i lymfeknutenes beliggenhet i bekkenet, organets lymfedrenasje, lokalisasjon av lymfeknutemetastaser primært og lokalisasjon av lokale residiv. Tumors beliggenhet, stadium og evne til mikroskopisk utbredelse har også betydning.
Ved inntegning av målvolum for stråleterapi benyttes begrepet Gross Tumour Volume (GTV) om makroskopisk tumor, både primærtumor og patologiske lymfeknuter. Clinical Target Volume (CTV) betegner risikoområder for subklinisk spredning. Planning Target Volume (PTV) er et geometrisk volum som sikrer at CTV med akseptabel sannsynlighet blir gitt rekvirert dose ved også å ta hensyn til intern organbevegelse, anatomiske endringer i behandlingsforløpet og usikkerhet i pasientopplegging og feltinnstilling.
Inntegning av primærtumor
GTVp: Tumor (med hele sirkumferensen av analkanalen i området med tumor), basert på tilgjengelig bildediagnostikk og klinisk undersøkelse.
CTVp _54/58: GTVp + 15 mm. Utvides manuelt til å inkludere hele analkanalen fra analåpningen til anorektalovergangen og interne og eksterne sfinkter.
Ved perianale lesjoner, vurder margin GTVp + 20 mm og ved større mesorektal tumorkomponent GTVp + 10 mm i dette området (som ved rectumcancer).
Korrigeres manuelt for skjelett, ev. noe for muskel og genitalia, hvis det ikke er mistanke om innvekst.
Inntegning av patologiske lymfeknuter
GTVn: Patologiske lymfeknuter (mindre/større enn 2 cm).
CTVn54/58: GTVn + 7–10 mm (avhengig av størrelse og utseende). Korreksjon for muskler og skjelett hvis ikke innvekst.
Inntegning av elektivt bekkenfelt
CTVe_40: Inkluderer lymfeknuteområder i mesorectum, presacralt, ved iliaca interna, obturator-området, samt fossa ischiorectalis. Ventralt tegnes det 5–10 mm inn i bevegelige strukturer (det vil si blære, vesicula seminalis, prostata, vagina, uterus). Det bør være minst mulig tynntarm beliggende innenfor CTVe_40.
Iliaca externa-området inkluderes hos alle T3–T4 og alle N1. Vurderes individuelt ved T2N0, ut i fra tumorstørrelse, risiko for tarmtoksisitet og alder/allmenntilstand. (Internasjonale retningslinjer anbefaler at iliaca externa-området inkluderes hos alle.)
For å dekke lymfeknuteregioner ved iliaca interna- og externa-området legges ca. 7 mm margin til kar (korreksjon for muskel og skjelett) (Taylor, Rockall, Reznek, & Powell, 2005).
Ved T1–2N0-svulster lokalisert kun i analkanal/perianalt legges kranielle grense av CTVe_4o i nivå med nedre kant av IS-ledd. Ellers ligger kraniale grense vanligvis i nivå med promontoriet ved delingen av iliaca communis. Vurder grense ved promontoriet ved stor T2N0-tumor.
Inntegning av elektivt lyskefelt
CTVe_ing_L/R_40: Lysker inkluderes som risikovolum hos alle, men kan vurderes utelatt der tumor kun er beliggende i rektum. Lymfeknuteområdet i lysker tegnes fra trochanter minor-nivå / 2–4 cm caudalt for innmunningen av v. saphena magna og opp til nivået der a. femoralis går over til arteria iliaca externa. Lymfeknutene ligger hovedsakelig medialt for kar. Karstammen og fettvevet medialt for denne samt alle synlige lymfeknuter i området inkluderes.
Planning target volume (PTV)
Institusjonsavhengig, vanligvis CTV + 5–10 mm.
Risikoorganer (Organs at risk, OAR)
Risikoorganene er satt opp i prioritert rekkefølge, og doserestriksjonene er veiledende, ikke absolutte. Ved bruk av IMRT/VMAT må det lages hjelpevolum (OAR minus PTV) for optimalisering. Dette gjelder spesielt for tynntarm/BowelBag. Doserestriksjonen gjelder imidlertid for hele OAR, ikke hjelpevolumet.
Tynntarm kan tegnes på to måter:
ENTEN: Tegnes som Bowelbag (den delen av bukhulen tarmen antas å bevege seg innenfor), inneholder både tynn- og tykktarm, men ikke blære, uterus, prostata, vesikler, mesorektum. Det er likevel ulike måter å tegne dette på, og det er viktig å være konsekvent og bruke doserestriksjon knyttet opp mot aktuell inntegningsmåte. I henhold til DeFoe tegnes BowelBag fra 1,5 cm over PTV ned til rektosigmoidovergangen. Anteroposteriort fra fremre bukvegg til bakerste del av bakerste tarmavsnitt. Lateralt fra mest laterale tarmvegg til tarmvegg. Veiledende doserestriksjon ved denne inntegningsmåten: V30 < 310cc, V40 < 70cc (DeFoe, Kabolizadeh, Heron, & Beriwal, 2013). En ny australsk studie konkluderer med at BowelBag tegnet på denne måten er den mest sensitive prediktor for grad 3 vs grad 0–2 diare og de anbefaler at man forsøker å holde V30 <300 cc (6 % vs 42 % risiko for grad 3 diare) (Ng et al., 2018).
ELLER: Tegnes som separate tynntarmslynger fra 1 cm over PTV, også eventuelle slynger innenfor CTVe_40 tegnes. Peroral kontrast er en fordel. Veiledende doserestriksjoner: 45 Gy < 20 cc, 35 Gy < 150 cc, 30 Gy < 200 cc (Kachnic et al., 2013).
Det er ofte vanskelig å holde seg innenfor disse doserestriksjonene, spesielt hos kvinner som kan ha mye tynntarm beliggende nede i bekkenet og ved N1b/c sykdom (E. Brown et al., 2015). Man må da forsøke å få dosen til tynntarm så lav som praktisk mulig samtidig som man har akseptabel dose til PTV. Disse pasientene har en økt risiko for tynntarmstoksisitet og må vurderes for tettere oppfølgning i stråleperioden.
Andre risikoorganer, doserestriksjoner:
- Caput femoris, D2 < 52 Gy (risiko for caput-nekrose).
- Blære, D mean < 45 Gy.
- Genitalia, så lavt som mulig.
- Beinmarg, så lavt som mulig.
Strålebehandlingsteknikker
Sist faglig oppdatert: 02.07.2021
Bakgrunn
Strålebehandling ved analcancer er kompleks på grunn av varierende størrelse og form på målvolum og nærhet til risikoorganer som ofte får en stor stråledose ved konvensjonell radioterapi. Bruk av IMRT og Volumetric Modulated Arc Therapy (VMAT) gir mulighet for høyere doser til tumor samtidig som en kan minimere dose til omgivende normalvev (Franco et al., 2016). Dosimetristudier viser at IMRT gir like god dekning til PTV som konvensjonell behandling, samtidig som en får signifikant dosereduksjon til friskt vev. Kliniske studier viser at bruk av IMRT kan redusere akutte og seine bivirkninger, spesielt i tynntarm og hud (Chuong et al., 2013), men også i genitalia og blære, samt hematologisk toksisitet (DeFoe et al., 2012; Kachnic et al., 2012). Større randomiserte studier som sammenligner IMRT og konvensjonell strålebehandling ved analcancer finnes ikke. Imidlertid bruker nå de fleste moderne sentre IMRT/VMAT-teknikk som standard ved strålebehandling av analcancer. Bruk av IMRT/VMAT gir mer konformal dosefordeling og brattere dosegradient som teoretisk kan gi økt risiko for lokoregionalt residiv (pga. geographical miss). Dette setter store krav til presisjon i hele stråleterapikjeden, ikke minst til målvoluminntegning og billedstyring (IGRT).
Så langt ser det ut til at IMRT/VMAT gir minst like gode resultater mht. overlevelse og lokal kontroll som konvensjonell behandling (Dasgupta et al., 2013), men dette må følges tett.
Simultan integrert boost (SIB) eller sekvensiell behandling
Tradisjonelt har man først behandlet det større elektive målvolumet, og deretter det mindre boostvolumet. Med bruk av SIB kan man behandle flere målvolum samtidig og gi ulike doser til de ulike målvolumer per fraksjon. En større dose kan gis til tumor og patologiske lymfeknuter og samtidig beholdes en lavere dose til risikovolumer. Med SIB planlegges og behandles boostvolumet i en og samme plan. Dette gir bedre utnytting av IMRT-planen ved at en får optimalisert alle dosebidragene. SIB gir bedre dosefordeling og er mer effektivt mht. tidsbruk både ved planlegging og behandling.
Behandlingsskjema for analcancer
Tabell 4 gir en kort oppsummering av anbefalt kjemoradioterapi av analcancer. Tabellen viser fraksjonering ved sekvensiell behandling og ved simultan integrert boost (SIB).
Tabell 4
|
| Behandlingsskjema A | Behandlingsskjema B | ||
|---|---|---|---|---|
| Stadium | T1-T2 N0 M0 | T3-T4 N0 M0 T1-T4 N1 M0 | ||
| Teknikk | Sekvensiell | SIB | Sekvensiell | SIB |
| Primærtumor D / n (d) | 54,0 / 27 (2,0) | 54,0 / 27 (2,0) | 58,0 / 29 (2,0) | 57,5 / 27 (2,13) |
| Lymfeknuter >2 cm |
| 58,0 / 29 (2,0) | 57,5 / 27 (2,13) | |
| Lymfeknuter <2 cm |
| 54,0 / 27 (2,0) | 54,0 / 27 (2,0) | |
| Elektivt felt bekken/lysker | 40,0 / 20 (2,0) | 41,6 / 27 (1,54) | 40,0 / 20 (2,0) | 41,6 / 27 (1,54) |
| Kjemoterapi | MiFu eller MiCap x 1 | MiFu eller MiCap x 2 | ||
D = totaldose (Gy), n = antall fraksjoner, d = fraksjonsdose (Gy)
Anbefalinger
Strålebehandling bør gis med VMAT- eller IMRT--teknikk (evidensgrad B).
Behandlingspauser
Det er godt dokumentert at total behandlingstid har betydning for lokal kontroll og sykdomsfri overlevelse ved kurativ behandling av plateepitelcarcinomer (f.eks. hode-hals kreft og livmorhalskreft). Man er særlig bekymret for at akselerert repopulasjon kan redusere lokal kontroll ved for lange ukompenserte pauser. Det finnes mindre spesifikk dokumentasjon på dette for analcancer, men data fra RTOG 8704 og 9811 konkluderte med at behandlingstid var signifikant assosiert med lokal kontroll og sykdomsfri overlevelse også ved anal cancer (Ben-Josef et al., 2010; Julie & Goodman, 2016).
Dagens dokumentasjon av behandlingseffekt foreligger på bakgrunn av behandling 5 dager per uke. Ved pauser i behandlingen (maskinstans, helligdager o.l.) bør det ved kurativ intensjon vurderes kompensasjons-behandlinger. Selv om ikke det spesifiseres i internasjonale studier, bør sammenhengende behandlingsfrie perioder (>3 dager) unngås (for eksempel påske) og man bør tilstrebe å opprettholde planlagt anbefalt total behandlingstid.
Bese et al. (Bese, Hendry, & Jeremic, 2007) og RCR Guidelines (The Royal College of Radiologists, 20019) skisserer mulige kompensasjonsløsninger i prioritert rekkefølge:
- Opprettholde total behandlingstid, totaldose og dose pr fraksjon ved å:
- Behandle i helg eller på annen helligdag
- Gi 2 fraksjoner på samme dag med minst 6 timers mellomrom (fortrinnsvis rett før helgefri)
- Det skal ikke gis mer enn 6 fraksjoner per 7 påfølgende dager.
- Opprettholde total behandlingstid med økt dose pr fraksjon
- Her må det velges om det skal gis ekvivalente doser med tanke på tumoreffekt eller med tanke på sene strålereaksjoner
- Akseptere økning av total behandlingstid og gi ekstra fraksjoner
- Her reduseres gjerne den terapeutiske bredden med følger både for tumorkontroll og forekomst av sene strålereaksjoner
Det må has i mente at en for aggressiv kompensasjon vil gi uker med høy dose som, særlig ved konkomitant kjemoterapi, kan øke forekomst av akutte strålereaksjoner (Erridge, Kerr, Downing, Duncan, & Price, 2002).
Plateepitelkarsinom i rectum
Sist faglig oppdatert: 02.07.2021
Plateepitelkarsinom i rectum er en sjelden tilstand.
Begrepet benyttes om en tumor som ikke strekker seg ned i analkanalen, der det er et intervall med sylinderepitel mellom analkanalen og nedre kant av plateepitelkarsinomet i rectum. En må forsikre seg om at tumor ikke er en metastase fra annet utgangspunkt og at det ikke er karsinom i en fistel til hud/anus og lignende. Diagnostikk gjøres etter vanlige retningslinjer, med klinisk undersøkelse, endoskopi, MR, CT og PET/CT. En bør bruke TNM-klassifiseringen for analcancer da det har betydning for valg av behandling.
Plateepitelcarcinom i rektum behandles primært med kjemoradioterapi, med. stråledoser og kjemoterapi som ved analcancer (Dutta et al., 2018; Jeong, Kim, & Kim, 2013; Musio et al., 2015). Behandlingsrespons vurderes etter 6 uker og etter 3 måneder, som ved analcancer. Ved resttumor vurderes salvage kirurgi (Dyson & Draganov, 2009). Kirurgien følger prinsippene som for endetarmskreft og analcancer som tilsikter frie marginer. Dersom klinisk komplett respons oppnås (cCR) kan man vurdere observasjon av pasienten, med kirurgi ved gjenvekst (Guerra et al., 2016; Peron et al., 2015; Sturgeon et al., 2017). Pasienten bør diskuteres i MDT.
Anbefalinger
Plateepitelkarsinom i rectum behandles med kjemoradioterapi som ved analcancer, ofte etterfulgt av kirurgi som ved anal- eller rectumcancer (evidensgrad C).
Akutte bivirkninger
Sist faglig oppdatert: 02.07.2021
Strålebehandling mot bekkenet gir ofte bivirkninger. Graden er relatert til stråledose, fraksjonering og bestrålt volum. Komorbiditet og livsstil har betydning. Faktorer som spiller negativt inn er hypertensjon, diabetes, HIV, inflammatorisk tarmsykdom, bindevevssykdommer og røyking. Samtidig kjemoterapi øker risikoen. Overgang til IMRT/VMAT har redusert forekomst og grad av bivirkninger, men behandlingen kan påvirke livskvaliteten i betydelig grad (Han et al., 2014). Akutte bivirkninger oppstår underveis eller like i etterkant av behandlingen. De vanligste er dermatitt, enteritt/proktitt, cystitt og slimhinneskader i genitalia hos kvinner. Seneffekter oppstår vanligvis flere måneder – opptil år – etter behandling og omtales senere. Forebygging og god behandling av akutte bivirkninger bidrar til å forebygge seneffekter etter strålebehandling.
Stråleskader på tarm og urinblære kan til en viss grad forebygges ved at blæren er delvis fylt under strålebehandlingen. En del av blære og tynntarm blir derved «løftet» ut av strålefeltet. Det anbefales for eksempel at man later vannet 60 minutter før behandling og deretter drikker 300 ml (to glass) vann og ikke later vannet før strålebehandlingen er gjennomført.
RTOG/EORTC-skalaen (Cox, Stetz, & Pajak, 1995) kan brukes for observasjon og objektiv gradering av både akutt og sen toksisitet, og bør brukes som beslutningsgrunnlag for å iverksette tiltak og behandling (tabell 5). Ved grad 3-toksisitet må det fortløpende vurderes om behandlingen (midlertidig) må avbrytes. Dersom det utvikles grad 4-toksistet, avbrytes strålebehandlingen. Om behandlingen skal avbrytes helt eller midlertidig, og om dette i så fall skal kompenseres med ekstra fraksjoner, må vurderes individuelt.
Tabell 5
| Grad | Beskrivelse |
|---|---|
| 0 | Ingen endring. |
| 1 | Svak diffus rødme eller tørr avskalling. |
| 2 | Moderat til kraftig rødme. Flekkvis fuktig, lett ødematøs avskalling begrenset til hudfolder. |
| 3 | Sammenflytende ødematøs fuktig avskalling ikke begrenset til hudfolder. Stor fare for infeksjon. |
| 4 | Sårdannelse, blødning, nekrose. Huden blir svart. |
Hud og slimhinner
Alle utvikler en større eller mindre grad av dermatitt. Bestrålt område (perineum/endetarm, genitalia, lysker) bør inspiseres minst ukentlig av stråleterapeut, sykepleier eller lege. Generelle råd som god hygiene, lufting av området, samt å unngå tettsittende klær, gniing og parfymerte produkter, gis pasienter før oppstart. Tiltak ved hudreaksjoner har varierende og til dels manglende dokumentasjon (Chan et al., 2014; Kumar, Juresic, Barton, & Shafiq, 2010). De fleste strålesentra har egne sårstellsprosedyrer for håndtering av stråleinduserte hudreaksjoner, og disse bør følges slik at pasientene får enhetlig behandling, informasjon og råd. Dermatitten kan forverres de første par ukene etter avsluttet behandling, og det må sikres god oppfølging ved hjemreise.
Ved slimhinnereaksjoner i vagina anbefales å følge samme rutiner som ved behandling av gynekologisk kreft (Strålebehandling og slimhinne-/hudreaksjoner ved gynekologisk kreft). Senere plager på grunn av atrofi og sammenvoksninger kan forebygges ved å holde vagina åpen. Tøying av vagina (dilatering) kan hindre sammenvoksninger når slimhinnene er såre og ligger klistret mot hverandre.
For å unngå vaginale sammenvoksninger, anbefales bruk av dilatator minimum to ganger ukentlig (Bahng, Dagan, Bruner, & Lin, 2012; International Clinical Guideline Group, 2012). Vanligvis anbefales oppstart når den akutte inflammasjonen har roet seg ned, dvs. 2–6 uker etter avsluttet strålebehandling. Andre mener at man bør starte på slutten av behandlingsperioden før tilhelingsprosessen starter og dermed redusere risikoen for sammenvoksninger. Dette gjelder ikke pasienter med kjent innvekst i bakre vaginalvegg på grunn av risiko for perforasjon og fisteldannelse. Pasienten bør fortsette med å bruke dilatator i minst 3–6 måneder etter at behandlingen er avsluttet, men noen har behov for lengre behandling.
Dersom kvinnene er seksuelt aktive og ikke har ubehag ved vaginal penetrasjon, kan forebygging med dilatator avsluttes. Søknad om refusjon sendes NAV på skjemaet Seksualteknisk hjelpemiddel. Det kan for seksuelt aktive være gunstig å gjenoppta samleie så fort som mulig, men mange kvier seg for dette etter en tøff behandlingsperiode. Både dilatering og seksuell aktivitet kan være forbundet med psykologisk stress, og det må brukes skjønn og åpen dialog med den enkelte pasient.
Enteritt og proktitt
Akutte stråleskader på tarm kan medføre smerter, diaré eller forstoppelse, sliming og/eller blødning fra endetarm, plutselig avføringstrang (urge), manglende evne til å holde på avføringen (inkontinens) og følelse av ufullstendig tømming. Det viktigste er symptomlindrende behandling, rikelig væskeinntak og eventuelt loperamid (Muehlbauer et al., 2009). Det kan være nødvendig med intravenøs væske, elektrolyttilskudd og ernæring. Ved behov bør ernæringsfysiolog involveres.
Cystitt
I akuttfasen er symptomene vanligvis hyppig vannlating, dysuri, blæresmerter og eventuelt hematuri. Det er viktig å avklare om det foreligger bakteriell årsak. Det anbefales å drikke rikelig (2 liter per døgn).
Hematologiske og andre bivirkninger
Benmargstoksisitet forekommer pga. kjemoterapi og strålebehandling mot bekkenskjelettet. Nyrefunksjon og ernæringstilstand kan påvirkes med påfølgende kreatininstigning og fall i albumin. Hematologi, kreatinin og albumin bør kontrolleres ukentlig, og vekt kontrolleres.
Ved grad 3-toksisitet må det fortløpende vurderes om behandlingen (midlertidig) må avbrytes. Dersom det utvikles grad 4-toksisitet, avbrytes strålebehandlingen. Om behandlingen skal avbrytes helt eller midlertidig, og om dette i så fall skal kompenseres med ekstra fraksjoner, må vurderes individuelt.
Anbefalinger
Bestrålt område (perineum/endetarm, genitalia, lysker) bør inspiseres minst ukentlig under behandlingen (evidensgrad D).
RTOG/EORTC-skalaen brukes for observasjon og gradering av akutt og sen toksisitet, og som beslutningsgrunnlag for å iverksette tiltak og behandling (evidensgrad D).
Drikkeprosedyre for halvfull blære anbefales for å redusere risiko for blære- og tynntarmstoksisitet (evidensgrad D).
Bruk av vaginal dilatator anbefales for å unngå sammenvoksninger i vagina (evidensgrad C).
Rehabilitering
Sist faglig oppdatert: 02.07.2021
Pasienter bør få kartlagt behov for rehabilitering. Dette kan omfatte hjelp til å håndtere psykiske reaksjoner, fysisk aktivitet, ernæring, rettigheter og arbeidsliv. En bør involvere relevante yrkesgrupper under behandlingen. En bør vurdere om det er behov for oppfølging i kommunen eller ved rehabiliteringsinstitusjon. Fastlegene har en viktig rolle i den videre oppfølgingen av pasienten etter fullført behandling.
Responsevaluering – de første kontroller etter strålebehandling
Sist faglig oppdatert: 02.07.2021
Hensikten med responsevaluering er å avklare om tumor er i komplett remisjon, eller om det foreligger resttumor som inneholder eller sannsynligvis inneholder malignitet. Ved vedvarende resttumor skal pasienten vurderes for kirurgi.
4–6 uker etter strålebehandlingen gjøres en klinisk undersøkelse av onkolog (ev. supplert med MR hvis klinisk vurdering er vanskelig) for vurdering av tumorrespons og bivirkninger av strålebehandlingen. Hensikten er i hovedsak å kontrollere at tumor er i tilbakegang. Ved progresjon (sjelden) tas pasienten opp på MDT-møte for å vurdere kirurgi. Ved respons gjøres ny kontroll om 6 uker (det vil si 3 måneder etter avsluttet strålebehandling).
3 måneder (12 uker) etter avsluttet strålebehandling gjøres responsevaluering: Klinisk undersøkelse inkludert rektaleksplorasjon og palpasjon av lysker, anoskopi, MR bekken, og CT eventuelt PET/CT.
Dersom det ikke er komplett remisjon ved 3 md., men det er partiell respons, kan pasienten observeres lengre, for eksempel til 6 mnd (Glynne-Jones et al., 2017). Noen pasienter vil være aktuelle å vurdere for kirurgi 3 mnd etter strålebehandling, mens andre vil det være aktuelt å observere lengre dersom man ser at resttumor fortsatt er i tilbakegang. De kan følges med ny klinisk og MR-kontroll; ved god respons for eksempel etter 3 mnd., ved dårlig respons hyppigere oppfølging for eksempel etter 6–8 uker. Ved vedvarende resttumor bør man tilstrebe at diagnosen bekreftes med biopsi. Ved resttumor uten bekreftet malignitet og som ikke progredierer, må nødvendige undersøkelser gjentas. Tumor med persisterende sårdannelse i analkanalen er sterk indikasjon for kirurgi.
Dersom det tilkommer progresjon etter en responsperiode, må kirurgi vurderes selv om man ikke får bekreftet malignitet ved gjentatte og flere biopsier.
Ved komplett remisjon skal pasienten følge anbefalt kontrollopplegg (se kapittel Oppfølging og etterkontroll etter avsluttet kurativ behandling om kontroll).
Anbefalinger
Klinisk vurdering av respons gjøres etter 4–6 uker (evidensgrad D).
Fullstendig responsevaluering med klinisk undersøkelse og adekvat billeddiagnostikk gjøres etter 3 måneder (evidensgrad C).
Ved partiell respons vurderes ytterligere observasjon eller kirurgi etter diskusjon i MDT (evidensgrad C).
Kirurgi ved resttumor eller lokalt residiv
Lokal behandlingssvikt (vedvarende resttumor eller lokalt tilbakefall)
Sist faglig oppdatert: 02.07.2021
Etter primærbehandling får en ofte komplett klinisk respons, det vil si at det ikke er gjenværende tumor å finne ved klinisk eller radiologisk undersøkelse. I noen tilfeller vil det likevel senere tilkomme tumorvekst på nytt. Malignitet har da vært til stede hele tiden på tross av klinisk komplett respons.
Noen ganger går ikke tumor fullstendig tilbake. Radiologisk eller klinisk påvist restforandringer kan enten inneholde malignitet eller ikke. Dette kan være vanskelig å avdekke. En lokal ulcerasjon gir mistanke om pågående sykdom, men endelig histologi er nødvendig. Tumor kan også progrediere under eller etter behandlingen.
Det er ikke grunnlag for å skille de ulike tilstandene, som alle er en form for lokal behandlingssvikt, fra hverandre da de alle krever samme vurdering knyttet til vurdering av omfattende kirurgi.
De fleste randomiserte studier har vurdert klinisk respons 6–12 uker etter fullført kjemoradioterapi, men mange mener man kan/bør vente til 3–6 måneder etter strålebehandling (Glynne-Jones et al., 2017).
Mye tyder på at aktiv kontroll for å oppdage lokal behandlingssvikt øker andel av pasienter som diagnostiseres tidlig, og som dermed er mulig å operere med radikalt siktemål med salvage-kirurgi. Vanligvis angis lokal behandlingssvikt til 20–25 % (10 % første år og 8–15 % senere) av behandlede pasienter innenfor en treårsperiode (Clark, Hartley, & Geh, 2004; Renehan, Saunders, Schofield, & O'Dwyer, 2005).
Salvage-kirurgi
Sist faglig oppdatert: 02.07.2021
Utredning før kirurgi
Pasienter med lokal behandlingssvikt skal vurderes for salvage-kirurgi med abdominoperineal eksisjon (rektumamputasjon). En bør sikre seg biopsi av tumor og utrede pasienten med tanke på operabilitet og resektabilitet. MR av bekkenet skal gjøres, og en må utelukke fjernspredning ved CT og FDG-PET/CT. Ved operable metastaser i lyskene er salvage-kirurgi aktuelt. Ved annen fjernmetastasering kan kirurgi i enkelte tilfeller vurderes, men nytten knyttet til overlevelse er ikke klarlagt. I forbindelse med utredningssamtalen ved den preoperative planleggingen bør pasienten forberedes på omfanget av det kommende inngrepet, vanlige komplikasjoner og forventet rehabilitering. En bør diskutere behovet for varig stomi med pasienten, og sørge for kontakt med stomiterapeut for stomimarkering og veiledning i utstyr.
CT er også viktig for å vurdere karanatomi dersom plastikk-kirurgi blir aktuelt – noe det ofte er. En bør derfor sørge for at kar i lysken og sidegrenene til musculus rectus abdominis (arteria epigastrica inferior) er kartlagt for å sikre god sirkulasjon til en musculocutan svinglapp.
Pasienten bør gjennomgå en klinisk bekkenundersøkelse preoperativt i dyp sedasjon ved behandlende kirurgisk senter for å planlegge framtidig inngrep. Pasienter med operabelt lokoregionalt residiv og som ikke har fjernmetastaser, bør vurderes for salvage-kirurgi av et multidisiplinært team med bred erfaring med denne pasientgruppen (P. J. Nilsson, Svensson, Goldman, & Glimelius, 2002; Renehan et al., 2005).
Lokal kirurgi
Noen få pasienter kan behandles med lokal reseksjon av residivet, kanskje særlig hvis tumor sitter i bløtvev og er mobil. Dette er imidlertid sjeldent tilfelle. Residiv av små perianale, tidligere lokalt kirurgisk behandlede svulster, kan reeksideres med vide marginer.
Radikal salvage-kirurgi
Radikal eller utvidet rektumamputasjon (APR) er nødvendig hvis sykdommen ikke er begrenset til tarmrøret eller endetarmsåpningen. Tumor har en tendens til å vokse spikulerende ut i omgivende vev slik at marginen mot omgivende organer eller strukturer er truet eller invadert. Det er også fare for innvekst i lokale kar og lymfebaner. Slike utvidede operasjoner må utføres som en bloc-reseksjoner der en må tilstrebe å oppnå gode marginer til alt svulstvev som mistenkes på grunnlag av MR-undersøkelsen. En vil tilstrebe å resesere stråleforandret og fibrotisk vev i tillegg. Hos kvinner er det ofte nødvendig å ta med bakre vaginalvegg. Det er også ofte nødvendig med vide reseksjoner i perineum, og eventuelt også av bekkenbunnsmuskulatur. Den perineale huden må eksideres vidt. Her skiller kirurgien seg fra tilsvarende kirurgi ved rektumcancer ved at den perineale reseksjonen er mer omfattende. Ved tumorvekst bakover bør reseksjon av os coccygis eller distale sacrum vurderes og må i så fall være en del av en bloc-reseksjonen. Det har vist seg gunstig å stoppe disseksjonen fra abdomen mot bekkenbunnen tidligere, og deretter fortsette i et plan utenfor bekkenbunnen nedenfra. En oppnår da et utvidet, sylindrisk preparat med videre marginer mot den truede perifere grensen. En slik sylindrisk reseksjon bør i alle tilfeller gjøres ved store, lavtsittende svulster (T3/T4). Ved primær lukning av perineum er forsinket tilheling vanlig (40–70 %) (Renehan et al., 2005).
Plastisk-kirurgisk rekonstruksjon
Salvage-kirurgi etterlater en stor defekt i perineum, bekkenbunn og bekkenhule. For å dekke defekten, lette vevstilheling og redusere faren for bekkenabscesser er det ofte nødvendig med plastisk-kirurgisk rekonstruksjon som del av den kirurgiske prosedyren. Bruk av lapper kan redusere sårtilhelingsproblemer til ned mot 15 %. Mobilisering av oment til det lille bekken kan være gunstig.
Det er to former for plastikkirurgisk rekonstruksjon som er mest brukt ved salvage-kirurgi:
- VRAM-lapp: Vertikal rectus abdominis myokutan lapp. Ved denne teknikken svinges en lapp bestående av rectus abdominis og hud ned i bekkenet. Denne teknikken er spesielt egnet ved større defekter i bekkenet og perianal hud.
- Gracilis transposisjonslapp: M. gracilis tunneleres opp fra ett, ev. begge lår til perineum og bekken. Denne lappen gir mindre volum, og blir derfor ofte for liten. Den kan være en løsning for eksempel hos pasienter med to stomier (kolostomi og urostomi) hvor rectus abdominis er skadet og ikke kan brukes til rekonstruksjon. En eller to musculocutane gluteallapper kan imidlertid være et godt alternativ i slike tilfeller.
I spesielle situasjoner kan andre teknikker vurderes. For denne behandlingen er omfattende plastikkirurgisk kompetanse nødvendig.
Lyskeglandeltoalett
Ved samtidig lymfeknutemetastase i lyske gjøres et formelt lymfeknutetoalett samtidig med bekkenkirurgien. Dette gjøres også dersom metastase til lymfeknute i lyske er eneste tumormanifestasjon.
Rehabilitering
Allerede ved utredningssamtalen bør pasienten være informert om forventet liggetid, mobilisering og mulige komplikasjoner. På sykehuset vil mobilisering, ernæring og stomitrening være viktige emner det fokuseres på allerede fra dag en. Omtrent 1–2 uker etter operasjonen (avhengig av svinglapp) burde pasienten være i stand til å reise hjem. Noen vil være tjent med et rehabiliteringsopphold, andre klarer dette fint i hjemmesituasjon, med støtte fra hjemmesykepleien og fastlegen, samt fysioterapeut og stomiterapeut i egen kommune eller ved lokalsykehuset. En tilstreber at pasienten skal bli selvhjulpen med stomi i løpet av kort tid. Noen har glede og nytte av å få kontakt med andre pasienter med stomi for å utveksle erfaringer. Slik kontakt med likepersonstjenesten får en gjennom pasientforeningen Norilco (www.norilco.no).
Prognose etter salvage-kirurgi
Salvage-kirurgi gir pasienter med lokal behandlingssvikt en sjanse for helbredelse. Fri reseksjonsmargin er den sterkeste prediktor for overlevelse etter salvage-kirurgi. Det er vanlig å angi en lokal sykdomskontrollrate på 50–60 % og en 5-års overlevelse på 40 % etter gjennomført salvage-kirurgi (Renehan & O'Dwyer, 2011). En studie fra Manchester viste 3- og 5-års overlevelse for de med lokal behandlingssvikt på henholdsvis 46 % og 29 %, mens overlevelsen i gruppen som fikk salvage-kirurgi, var henholdsvis 55 % og 40 % (P. J. Nilsson et al., 2002).
Sentralisering
Residiv av analcancer er en sjelden tilstand. Dette sammen med de kirurgiske utfordringene knyttet til omfattende kirurgi, behov for utvidede og radikale reseksjoner samt nødvendig samarbeid med andre kirurgiske disipliner (urologi, plastikkirurgi), taler for en sentralisering av salvage-kirurgien ved analcancer i Norge til avdelinger som utfører større kirurgiske bekkeninngrep som bekkeneksenterasjon.
Anbefalinger
Ved vedvarende resttumor eller lokalt residiv, vurderes pasienten for kirurgi etter diskusjon i MDT (evidensgrad B).
Radikal abdominoperineal reseksjon for analcancer skal utføres av et erfarent team med kompetanse i multivisceral kirurgi og rekonstruksjon (evidensgrad C).
Behandling av eldre pasienter
Sist faglig oppdatert: 02.07.2021
Eldre pasienter vurderes individuelt på bakgrunn av allmenntilstand, funksjonsnivå og eventuelt komorbiditet. Geriatrisk vurdering kan være nyttig (Wildiers et al., 2014) og beslutning om behandling bør tas i samråd med pasienten. Mange eldre kan behandles etter standard protokoller (Dale et al., 2017). Dersom standard kombinasjonsbehandling ikke kan gjennomføres, anbefales generelt at man prioriterer strålebehandling framfor kjemoterapi. En bør forsøke å gi et adekvat strålefelt og adekvate doser.
Ved rimelig god allmenntilstand gis ofte 2 Gy-fraksjoner, og en forsøker å komme opp i en totaldose på 50–58 Gy uten kjemoterapi. Endelig dose vil være avhengig av toleranse.
Ved redusert allmenntilstand og/eller alvorlig komorbiditet vurderes høyere fraksjonsdoser, for eksempel palliativ strålebehandling med 3 Gy x 10–13, der målet er å oppnå best mulig lokal tumorkontroll.
Anbefalinger
Behandlingen individualiseres hos eldre med redusert allmenntilstand eller funksjonsnivå. Strålebehandling prioriteres foran kjemoterapi (evidensgrad C).
Oppfølging og etterkontroll etter avsluttet kurativ behandling
Innledning
Sist faglig oppdatert: 02.07.2021
De fleste pasienter som behandles for analcancer i kurativ hensikt kan helbredes. Ifølge en norsk populasjonsbasert studie (Bentzen et al., 2012) fikk 18 % lokalt tilbakefall. De fleste tilbakefall (73 %) oppsto lokalt i analkanalen, om lag 23 % i lymfeknutene i lyskeregion og 12 % langs iliacakarene (Bentzen et al., 2012). Ca. 13 % av alle tilbakefall er metastaser til andre organer, først og fremst lungene, men også i lever og skjelett. Forekomst av tilbakefall og metastaser er hyppigere ved høyere T og N stadium, men kan oppstå ved alle stadier.
Det finnes ingen forskning som systematisk har sett på nytten av kontrollopplegg etter kurativ behandling for analcancer. Oppfølgingsdata fra randomiserte kliniske studier innen onkologisk behandling omhandler i all hovedsak respons på behandlingen som er gitt (EORTC 22861, UKCCCR ACT I, RTOG 98–11) (Ajani et al., 2008; Dasgupta et al., 2013).
Systematisk oppfølging etter kurativ behandling må ha hovedfokus på lokoregional status og å oppdage et eventuelt lokoregionalt residiv som kan behandles, i tillegg til mulige fjernmetastaser. Kontrollene bør også ha fokus på symptomer og funksjonsendringer relatert til eventuelle senfølger av behandlingen slik at pasienten kan få nødvendige råd og behandling.
Kjemoradioterapi kan medføre en rekke negative seneffekter med konsekvenser for funksjon (sfinkter, rektum, blære, seksualfunksjon) og dermed livskvalitet (Bentzen, Balteskard, et al., 2013; Bentzen, Guren, et al., 2013).
Det er publisert ulike retningslinjer, i hovedsak fra UK og ESMO (Glynne-Jones et al., 2014b), USA (Benson et al., 2018) og Canada (Alberta Provincial Gastrointestinal Tumour Team, 2013). I Norge har man hittil praktisert retningslinjer formulert av KVIST-gruppen i samarbeid med NGICG. Anbefalingene i det foreliggende handlingsprogrammet støtter seg i hovedsak på bakgrunnsinformasjon fra relevant litteratur, ekspertanbefalinger og øvrige internasjonale retningslinjer.
Utforming av kontrollopplegget – etter endelig responsevaluering
Sist faglig oppdatert: 02.07.2021
Kontrollopplegget etter komplett remisjon tar hensyn til utbredelse av sykdom ved diagnosetidspunktet, og må sees i sammenheng med responsevalueringen etter avsluttet primær behandling. Gjennomføring av kontrollopplegget med tanke på å avdekke lokoregionalt tilbakefall eller spredning forutsetter at pasientens alder og allmenntilstand tillater eventuell behandling av residiv. Risiko for tilbakefall er større ved avansert sykdomsstadium, og lokoregionalt tilbakefall forekommer oftere enn metastaser (Gunderson et al., 2013). Kontrollene etter T1–2N0-sykdom retter seg derfor mot lokoregional status, mens det hos pasienter med T3–4N0- og T1–4N1-sykdom også omfatter andre organer, først og fremst lunger og lever. Regelmessig kontroll av blodprøver inngår ikke i kontrollene. Kontrollene bør gjennomføres hos spesialist i onkologi eller gastrokirurgi ved avdeling med tilstrekkelig kompetanse og erfaring med pasientgruppen.
Lokoregional status
Undersøkelse av lokoregional status skal gjennomføres hos alle pasienter uansett T- eller N‑stadium ved diagnose.
- Klinisk undersøkelse av bekken og perineum med inspeksjon av perianalt område og digital eksplorasjon av analkanal, eventuelt anoskopi, palpasjon av inguinale lymfeknutestasjoner.
- Lav terskel for biopsi ved mistanke om residiv, enten stansebiopsi, tru-cut eller kirurgisk biopsi; om nødvendig i regional/generell anestesi.
- Biopsi er spesielt viktig ved oppfølging av premaligne tilstander/anal intraepitelial neoplasi (se kapittel Behandling av AIN).
Bildediagnostikk
Det er lite dokumentasjon for nytten av regelmessig kontroll med bildediagnostikk, en har lagt til grunn anbefalinger fra USA og Canada. Bildediagnostikk er kun aktuelt rutinemessig for pasienter med stadium T3–4 og T1–4N1 ved diagnosetidspunkt med hensyn til residiv dypt i bekkenet og fjernmetastaser. Pasienter med HPV negativ svulst har dårligere prognose, og disse pasientene bør også følges opp med bildediagnostikk. Det kan være aktuelt å kontrollere enkelte pasienter med T1–2 svulster også med billeddiagnostikk.
Bekkenresidiv
MR bekken for å oppdage residiv anbefales i 3 år for følgende pasientgrupper (Gunderson et al., 2013):
- Tumorstørrelse > 5 cm eller innvekst i naboorganer (T3-4)
- Pasienter med positive lymfeknuter (N1) uansett T-stadium
- Pasienter med HPV16 / p16 negativ tumor
- Pasienter som er operert for residual tumor/inkomplett respons
Fjernmetastaser
Bildediagnostikk for fjernmetastaser anbefales for pasienter med stadium T3-4N0 og T1-4N1, og evt. for pasienter med HPV negativ tumor, og pasienter operert med salvage kirurgi, i form av CT lunger, lever og bakre bukvegg med kontrast. FDG-PET/CT vurderes for enkelte pasienter.
Kontrollopplegg
Tiden fra avsluttet primærbehandling til en varig remisjon kan variere. Av den grunn vil antall måneder i forløpet fra avsluttet behandling til oppfølging av antatt endelig status variere. Kontrollene starter etter at responsevaluering har vist komplett remisjon, og ses i sammenheng med tid siden avsluttet behandling.
Tabell 6
| Undersøkelse (md.) | 3 | 6 | 9 | 12 | 18 | 24 | 30 | 36 | 42 | 48 | 54 | 60 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Klinisk kontroll1,2 | • | • | • | • | • | • | • | • | • | • | • | • |
| MR bekken3 | • | • | • | • | ||||||||
| CT thorax/abd.3 | • | • | • | • |
1 Tidspunkt etter avsluttet strålebehandling. Vurder tettere eller lengre oppfølging ved usikkerhet om residiv eller symptomgivende seneffekter.
2 Klinisk kontroll inkluderer vurdering og ev. behandling av seneffekter.
3 Kun rutinemessig for pasienter med lokalavansert sykdom, T3–4 eller N1 og HPV/p16 negativ tumor.
Enkelte pasienter kan ha smerter ved undersøkelsen, det gjelder særlig de som har noe grad av analstenose og dersom man forserer anorektal eksplorasjon eller bruker for grove skop. De aller fleste av disse tolererer greit undersøkelse med tynt, fleksibelt skop, og det er sjelden man trenger sedasjon for å gjennomføre adekvat undersøkelse.
Ved symptomer fra analområdet må oppfølgingen tilpasses individuelt.
Opplæring av pasient og pårørende
Det er viktig å ta opp med pasient og pårørende at kontrollopplegget retter seg mot de mest vanlige stedene der tilbakefall opptrer. Disse kan imidlertid også komme mellom kontrollene (intervallresidiv) slik at pasienten må ta kontakt ved suspekte plager.
Registrering av data mht. systematisk oppfølging
Det foreligger ingen relevant litteratur som omhandler systematisk oppfølging av pasienter med analcancer. I Norge ligger det til rette å fremskaffe denne kunnskapen ved hjelp av en prospektiv registrering – ideelt sett innenfor kvalitetsregister i Kreftregisteret ved hjelp av passende pasientrapporterte resultatmål.
Anbefalinger
Pasienter som kan gjennomgå ev. behandling av tilbakefall bør kontrolleres i 5 år etter oppnådd komplett remisjon.
Ved T1–2N0 er det rutinemessig kun klinisk kontroll.
Ved T3–T4 eller N1, eller HPV16/p16 negativ tumor, eller pasienter operert med salvage kirurgi, er det tillegg av CT thorax/abdomen og MR-bekken de første årene. Seneffekter må kartlegges og eventuelt behandles.
Seneffekter etter behandling
Sist faglig oppdatert: 02.07.2021
Problemer knyttet til seksualitet, endret avføringsmønster i form av diare, «urge» og inkontinens samt smerter og stivhet i bekkenregionen, medfører at en god del pasienter opplever redusert livskvalitet etter strålebehandling for analcancer (Bentzen, Balteskard, et al., 2013). Slike seneffekter kan oppstå etter noen måneder, men også flere år etter behandling. Generelle livsstilsråd kan være nyttige. Fastlegen har en sentral rolle i å identifisere seneffekter med tanke på adekvat oppfølging.
Tarmfunksjon
De vanligste plagene etter gjennomgått kjemoradioterapi er relatert til tømningsfunksjonen av rektum og inkontinensproblemer for avføring og luft. Hastefornemmelse (urgency) og fragmentert og ufullstendig defekasjon er vanlig, i tillegg til hudproblemer og kløe på grunn av fuktighet perianalt og lekkasje av avføring. Etter behandling for analcancer oppgir 43 % av norske pasienter problemer med inkontinens for avføring, sammenlignet med 5 % i normalbefolkningen (Bentzen, Guren, et al., 2013). En del pasienter får blødning fra tarmslimhinnen som kan gi jernmangelanemi.
Tilpassing av avføringskonsistens er et viktig tiltak. Kostråd, spesialfiber basert på loppefrø (eks. Vi-Siblin®, Lunelax®) og stoppende medikamenter som loperamid anbefales. Generelle kostråd kan være nyttige. Blødningsproktitt kan være selvbegrensende og gå spontant tilbake etter noen år. Ved blødning kan sukralfatklyster (Antepsin 2 g x 2), metronidazol i 4 uker eller formalinbehandling være god behandling for enkelte (Vanneste et al., 2015). Man bør involvere stomi- og kontinens-sykepleier som har spesialkompetanse om disse problemstillingene. Pasienter med betydelige plager bør henvises til gastrokirurgisk virksomhet med kompetanse innen bekkenbunns-sykdommer for vurdering av spesielle tiltak som f.eks. tarmskyll/anal irrigasjon i samarbeid med stomisykepleier.
Kolostomi kan vurderes når konservative tiltak ikke gir tilfredsstillende resultater. En må det første året etter behandling være oppmerksom på perforasjonsfare ved endoskopi av stråleskadet tarm, og også fare for fistulering ved biopsi, spesielt fra fremre rektum (Vanneste et al., 2015).
Stråleskadet tarm
Skademekanismen er dels direkte celleskade av stråling, dels skade pga. nedsatt vevssirkulasjon. I akuttfasen ser vi akutt inflammasjon, skade av arterioler med nedsatt mikrosirkulasjon og skade av lymfekar med ødem. Kronisk skade kommer til syne med iskemi og fibrose. Ved stråleskade av tynntarm kan oppsuging av næringsstoffer reduseres og en får diaré og mangelfullt opptak av fett, proteiner, vitaminer og sporstoffer. En kan også få kvalme, smerter, oppkast, redusert appetitt, og tegn på passasjehinder. Behandling retter seg mot symptomer og mangler. Feilernæring og underernæring bør håndteres i samarbeid med klinisk ernæringsfysiolog for å sikre nødvendig inntak av energi og næringsstoffer for å unngå unødvendig ekskludering av matvarer fra kosten. Energirik kost med mye fett og karbohydrater kan forverre malabsorpsjon og diaré og derfor anbefales redusert inntak av fett, fiber, fruktose og laktose. Ved diaré kan det også være nyttig med loperamid eller kolestyramin. Metronidazol forsøkes ved bakteriell overvekst. En prøver å unngå å operere i akuttfasen da fare for fistler og lekkasjer er tilstede. Hyperbar oksygenbehandling kan forsøkes ved stråleskade.
Pasienter som sliter med inkontinensplager eller bekkenbunnsdysfuksjoner etter gjennomført strålebehandling kan ha nytte av å bli henvist sykehus med bekkensenter eller stomiterapeut på hjemstedet.
Genitalia og seksualitet
Vaginale plager er vanskelig å unngå etter stråling mot bekkenet. Vagina blir mindre elastisk og ofte kortere, slimhinnene i vulva blir tynnere og kan lett blø. Det kan oppstå sammenvoksninger i øvre del av vagina. Dette medfører smerter ved samleie, nedsatt lystfølelse og det kan også være problematisk for vannlating og ved senere gynekologiske undersøkelser (Incrocci & Jensen, 2013). Ved vedvarende problemer kan det vurderes spalting av synekier eller blokking av vagina i narkose. Som nevnt under avsnittet om håndtering av akutte bivirkninger, er bruk av dilatator viktig for å redusere disse plagene forårsaket av sammenvoksninger. Bruk av dilatator starter vanligvis 2–4 uker etter strålebehandlingen og bør vedvare så lenge det er behov, for mange vil det si opptil 1 år eller lengre (Miles, 2012).
Redusert østrogennivå på grunn av stråleindusert menopause forsterker problemet. Alle fertile kvinner må regne med å komme i menopause og bli infertile fordi ovariene ligger i strålefeltet (eggstokkene tåler ikke mer enn cirka 14 Gy). Kvinner som var premenopausale før behandling bør ha systemisk østrogenbehandling. Lokalbehandling med østrogen og/eller glidemiddel kan gis i tillegg (Incrocci & Jensen, 2013).
Erektil dysfunksjon hos menn er vanlig i etterkant av behandlingen (Bentzen, Balteskard, et al., 2013). Testosteronnivået kan reduseres pga. stråling mot testiklene. Tretthet, energiløshet, svettetendens, samt nedsatt yteevne, muskelkraft, libido og seksuell funksjon er symptomer som kan forekomme ved hypogonadisme. Ved symptomer på testosteronmangel bør testosteronnivået kontrolleres. Ved unormale målinger og symptomer vurderes henvisning til endokrinolog. Det er høy risiko for sterilitet dersom begge testiklene har fått en stråledose > 2 Gy. Før oppstart av stråleterapi bør aktuelle menn tilbys nedfrysning av spermier i sædbank.
Kronisk proktitt og endret lukkemuskelfunksjon (stenose) kan påvirke muligheten for analsex. Dette kan spesielt være et problem for menn som har sex med menn.
Blærefunksjon
Urinblære og urinrør ligger tett inntil strålefeltet og kan ikke skånes helt. Resultatet kan bli en «stiv» og lite elastisk blære som kan gi hyppig vannlatingstrang, smerte og en følelse av mangelfull tømming av blæren. Urinrørets lukkemekanisme blir dårlig av samme grunn, og i tillegg kan slimhinnen atrofiere. Stråleskaden resulterer ofte i hemorragisk cystitt, gjerne flere år etter behandling.
Stråleindusert cystitt er en eksklusjonsdiagnose der infeksiøs eller malign årsak må utelukkes. Ved milde grader (1–2) er økt væskeinntak viktig, ofte i kombinasjon med antikolinergika. Ved alvorligere grader (3–4) kan det bli nødvendig å fjerne koagler ved cystoskopi eller utføre blæreskylling (Liem, Saad, & Delouya, 2015)
Hyperbar oksygenbehandling
Hyperbar oksygenbehandling i trykkammer kan vurderes hos utvalgte pasienter med store plager (Liem et al., 2015; Tahir et al., 2015). Det foreligger ikke god dokumentasjon for nytten av behandlingen (Glover et al., 2016). Haukeland universitetssjukehus har landsfunksjon for planlagt trykkammerbehandling.
Livskvalitet
Det er dokumentert at en del pasienter har redusert livskvalitet etter gjennomført strålebehandling for analcancer (Bentzen, Balteskard, et al., 2013; Sodergren et al., 2015). Dette gjelder både problemer med tarmfunksjon og seksuell funksjon, men også innen mer generelle områder som fatigue, og redusert sosial funksjon. Det er utarbeidet egne livskvalitetsskjema for pasienter med anal som anbefales brukt i forskning (Sodergren et al., 2018).
Annet
I tillegg til smerter i endetarms- og seteregion, kan mikrofrakturer oppstå pga. strålebehandlingen, og medføre smerter i bekkenet. Det er usikkert om dette bør behandles med bisfosfonater, men ved lav beintetthet eller andre risikofaktorer for brudd er dette anbefalt (Higham & Faithfull, 2015).
Langtidsoverlevere har økt angstnivå og utfordringer med rolleforståelse sammenlignet med personer som ikke er behandlet for analcancer (Bentzen, Balteskard, et al., 2013). Seneffekter kan gi betydelig redusert livskvalitet som også påvirker psykisk helse. Det anbefales derfor vurdering av psykisk helsetilstand ved kontroller.
Det kan være økt risiko for annen HPV-indusert cancer. Oppfølging med tanke på for eksempel cervix-cancer bør vurderes.
Rehabilitering
Det kan oppstå ulike seneffekter etter kreftbehandling, og en bør vurdere hvilke tiltak som kan bedre dette. Enkelte kan ha nytte av rehabiliteringsopphold. Det vises for øvrig til publikasjonen «Seneffekter etter kreftbehandling. Faglige råd» (Seneffekter etter kreftbehandling: faglige råd, 2017) utgitt av Helsedirektoratet.
Det er ingen pasientorganisasjon for pasienter med analcancer. Norsk forening for stomi, reservoar, mage- og tarmkreft (NORILCO) kan være aktuell da de ivaretar forhold som er aktuelle for en del pasienter behandlet for analcancer.
Anbefalinger
Ved stråleindusert kolitt/proktitt anbefales kostråd og avføringsregulerende midler, som fiberprodukter og loperamid (evidensgrad C).
Ved kronisk diaré, bør kolestyramin vurderes.
Ved mistanke om bakteriell overvekst, bør metronidazol vurderes.
Kolostomi kan vurderes når konservative tiltak ikke gir tilfredsstillende resultater (evidensgrad D).
Premenopausale kvinner bør vurderes for systemisk østrogenbehandling ved stråleindusert menopause (evidensgrad B).
Ved symptomer på testosteronmangel hos menn, bør testosteronnivået kontrolleres og eventuell mangel behandles (evidensgrad D).
Behandling av metastaserende sykdom
Kirurgi
Sist faglig oppdatert: 02.07.2021
Det finnes ikke større studier som har evaluert effekten av metastasekirurgi, og det finnes lite evidens. Det er aktuelt med kirurgi for lymfeknutemetastaser i lysken dersom ikke lokal kjemoradioterapi har ført fram (Akbari et al., 2004). Ved solitære eller få metastaser kan kirurgi vurderes på individuelt grunnlag. Det kan være aktuelt i selekterte tilfeller å vurdere kirurgi av begrenset antall lever- eller lungemetastaser, evt. i kombinasjon med kjemoterapi. Større lever- og lungekirurgi er ikke evaluert mht. til overlevelse.
Tumores som gir symptomer, for eksempel fra columna, skjelett og CNS, kan være aktuelle for palliativ kirurgi. Sigmoideostomi kan være aktuelt ved lokalt inoperabel tumor eller residiv.
Medikamentell behandling
Sist faglig oppdatert: 02.07.2021
Palliativ kjemoterapi ved ikke-kurabel sykdom har som mål å forlenge levetid, lindre eller forebygge symptomer og opprettholde best mulig livskvalitet. Cisplatin/5-FU har vært standardbehandling i de fleste land (Faivre et al., 1999). Det har nylig vært gjennomført en internasjonal multisenterstudie som randomiserte pasienter med metastatisk analcancer til enten cisplatin/5FU eller karboplatin/paklitaksel . Det var ingen forskjell i responsrate(57 vs 59 %), men signifikant forskjell i alvorlige bivirkninger (62 vs 36 %), og median progresjonsfri overlevelse var 5,7 vs 8,1 mnd ved cisplatin/5FU sammenlignet med karboplatin/paklitaksel (Rao et al., 2020). Karboplatin/paklitaksel anbefales som 1. linje behandling ved metastatisk analcancer (Rao et al., 2021). Det er tidligere publisert serier som viser effekt av karboplatin/paklitaksel (Eng et al., 2014; R. Kim et al., 2014). Kjemoterapi ved metastatisk analcancer er beskrevet i et par nylige oversiktsartikler (Rogers & Eng, 2017; Sclafani & Rao, 2018). En en-armet fase 2 studie har vist gode resultater med docetaxel, cisplatin og 5-FU (modifisert DCF) (S. Kim et al., 2018).
Andrelinje kjemoterapi kan vurderes til selekterte pasienter i god almenntilstand. Som 2. linje behandling kan man vurdere CiFu. Små retrospektive studier har vist at ulike regimer basert på docetaksel, irinotekan eller oksaliplatin kan ha effekt både i første- og andrelinjesbehandling (Cacheux et al., 2012; Lim & Glynne-Jones, 2011; Spithoff, Cummings, Jonker, & Biagi, 2014). Det har vært vist effekt av irinotekan og cetuximab (D. W. Kim et al., 2017; Lukan et al., 2009). Effekten av antistoff og tyrosinkinase-hemmere er ikke avklart.
European Medicines Agency (EMA) har anbefalt at alle pasienter som skal behandles med 5-FU eller kapecitabine bør testes for eventuell mangel på DPD før oppstart av behandling. DPYD testing på EDTA-fullblod er etablert i Norge, og inngår som en farmakogenetisk analyse. Ved genotype som tyder på redusert DPD-aktivitet, bør en følge anbefalinger i internasjonale retningslinjer med redusert startdose (Amstutz et al., 2018). Ved genotype som tyder på manglende DPD-aktivitet bør behandling med 5-FU eller kapecitabin unngås.
En studie har vist responsrate 24 % med nivolumab hos tidligere forbehandlede pasienter (Morris et al., 2017). Det planlegges ytterligere studier på bruk av immunterapi ved analcancer.
Pasienter bør tilbys deltakelse i kliniske studier der det er mulig.
Anbefalinger
Karboplatin/paklitaksel anbefales som førstelinjes palliativ kjemoterapi (evidensgrad A).
Andrelinjesbehandling, for eksempel med cisplatin/5-FU, kan vurderes hos pasienter med god allmenntilstand (evidensgrad C).
Svar på DPYD genotype bør foreligge før start av behandling med 5-FU eller kapecitabine (evidensgrad B).
Strålebehandling
Sist faglig oppdatert: 02.07.2021
Tumor i det lille bekken – lokalavansert primærtumor eller residiv – kan gi betydelig morbiditet med smerter, fistler, vannlatings- og avføringsproblemer. Det er derfor av stor verdi å oppnå lokal kontroll også dersom pasienten ikke behandles med kurativ intensjon. Ulike palliative stråleregimer kan være aktuelle, ofte benyttes 3 Gy x 10–13.
Palliativ strålebehandling mot andre metastaser, for eksempel skjelettmetastaser, kan være aktuelt.
Anbefaling
Palliativ strålebehandling kan være aktuelt (evidensgrad D).
Supplerende behandling (andre palliative tiltak, ernæring, fysisk aktivitet, psykososiale tiltak)
Sist faglig oppdatert: 02.07.2021
Det vises til Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen» (Aass et al., 2015).
Patologi
Definisjon
Sist faglig oppdatert: 02.07.2021
Histologisk deles analkanalen inn i tre områder. Helt proksimalt finner man sylinderepitel som histologisk ikke kan skilles fra rectumslimhinnen. Deretter følger transformasjonssonen, Anal Transitional Zone (ATZ), som karakteriseres av et flerlaget overgangsepitel som kan se ut som plateepitelmetaplasi eller urotel. Den mest distale delen av analkanalen består av plateepitelkledt slimhinne uten keratinisering eller adneksale stukturer (WHO Classification of Tumours of the Digestive System, 2010).
Utenfor analkanalen er det fortsatt plateepitel, men med hårfollikler og svettekjertler i det underliggende vev. Patologi i dette området klassifiseres under hud og ikke som en del av analkanalen.
Histopatologi
Sist faglig oppdatert: 02.07.2021
Histologisk kan man ha plateepitelkarsinomer med et vidt spekter av utseende; fra storcellede lyse keratiniserte celler til de småcellede, basaloide variantene. Flere varianter kan forekomme innen en enkelt tumor. WHO anbefaler at man kaller alle for plateepitelkarsinomer, men at man kan legge til en deskriptiv kommentar slik som dominerende cellestørrelse, basaloid uttrykk (ofte høy-risiko HPV positive), keratiniseringen osv. (Bilimoria et al., 2009). Det finnes en gruppe pasienter med svært overfladiske plateepitelkarsinomer som har blitt kalt for «superficially invasive squamous-cell carcinoma of the anus» (SISCCA) med invasiv dybde under 3 mm, som ikke strekker seg utover et område på 7 mmm og som er fjernet i sin helhet. Disse pasientene synes å ha en utmerket prognose (Arana, Fléjou, Si-Mohamed, Bauer, & Etienney, 2015; Gautier et al., 2016).
Verrukøse karsinomer er en variant av godt differensierte plateepitelkarsinomer som ikke er assosiert til HPV-infeksjon, og besvares i henhold til dette. Kjempekondylom, også kalt Buschke-Löwenstein tumor, regnes som en godartet svulst uten egenskaper til invasiv vekst, infisert med lavrisiko HPV-virus, og beskrives derfor som egen entitet (Zidar et al., 2017).
Forstadier
(se kapittel Forstadier til analcancer)
Kjønnsvorter: Kondyloma accuminata. Lavgradige og høygradige anal skvamøse intraepiteliale lesjoner (LSIL/HSIL).
HSIL antas å kunne progrediere videre til plateepitelkarsinom (Scholefield, Castle, & Watson, 2005; Watson, Smith, Whitehead, Sykes, & Frizelle, 2006).
Plateepitelkarsinom
90 % av tumorene i dette området er plateepitelkarsinomer. Gradering av plateepitelkarsinomer bør ikke gjøres på biopsier ettersom disse ofte ikke er representative for hele tumor. Lavt differensierte karsinomer har generelt dårlig prognose (Goldman, Auer, Erhardt, & Seligson, 1987).
Ved påvist plateepitelkarsinom i analkanalen / perianalt kan påvisning av aktivt HPV-virus være av prognostisk betydning ettersom man finner dårligere respons på terapi for gruppen som er HPV negative (Gilbert et al., 2013; Meulendijks, Tomasoa, et al., 2015; Serup-Hansen et al., 2014). Tumorvevet kan undersøkes med tanke på tilstedeværelse av HPV DNA, men dette gir ikke sikre holdepunkt for aktivt virus. p16 er et onkogen som vanligvis ikke uttrykkes i cellecyklus på grunn av spesifikke hemmere, men et aktivt HPV-virus opphever dette og p16 blir overuttrykt. Noen få svulster vil være p16 positive selv om det ikke foreligger HPV-infeksjon ettersom også andre mekanismer kan oppregulere uttrykk av dette proteinet. Undersøkelse av HPV DNA sammen med uttrykk av p16 synes derfor gi størst sikkerhet for at det virkelig foreligger en aktiv HPV-infeksjon (Sun et al., 2018), men undersøkelse av HPV DNA er ikke utbredt tilgjengelig. Uttrykk av p16 ved immunhistokjemisk metode ansees som en god surrogatmarkør med tanke på aktiv HPV infeksjon. Metoden er godt etablert i patologiavdelingene og bør utføres.
Adenokarsinom
Representerer oftest en nedvekst av adenokarsinom fra rectum. Disse kan ligge perianalt eller i anorektale fistler. En og annen gang kan man finne adenokarsinomer som er utgått fra anale kjertler, og immunhistokjemisk undersøkelse kan skille mellom opprinnelse i rektum eller anus. Graderes som adenokarsinomer i rektum, og adenomer regnes som et forstadium.
Andre varianter
Basalcellekarsinomer og ekstramammær Paget kan forekomme i analområdet. I tillegg kan man finne papillomer, keratoakantomer, neuroendokrine tumorer (storcellede/småcellede), maligne melanomer, mesenkymale tumorer og lymfomer, men alle disse er sjeldne. Sekundære tumorer kan forekomme med hyppigst utgangspunkt i colon eller rectum.
Fibroepiteliale polypper forekommer ganske ofte, mens inflammatoriske kloakogene polypper kan sees ved mucosale prolapser og hemorrhoider.
Stråleskader
Strålebehandling av kreft i cervix, prostata eller rectum omfatter også ofte anus. Forandringene kan være akutte eller kroniske. Akutte forandringer sees som ulcerasjoner med nekrose i karvegger, mens kroniske stråleskader gir fibrose og hyperplasi av nervevev.
Tumorspredning og stadieinndeling
Sist faglig oppdatert: 02.07.2021
Tumorene bør klassifiseres etter TNM-klassifikasjonen med tanke på tumor, lymfeknuter og metastase, se tabell 2 (TNM Classification of Malignant Tumours, 2017). Ut fra denne klassifiseringen kan pasientene stadieinndeles med tanke på utbredelse av sykdom, se tabell 3 (Edge et al., 2010). Regionale lymfeknuter er perirektale (anorektale, perirektale og laterale sakrale), iliaca interna, iliaca externa og inguinale (superficielle og dype femorale). Metastaser til andre lymfeknuter oppfattes som fjernmetastaser (M).
Se tabell for TNM-klassifisering i kapittel Stadieinndeling.
Anbefalinger
Biopsi skal foreligge for å bekrefte diagnosen (evidensgrad C).
Det bør testes for HPV-infeksjon (evidensgrad C)
Forslag til mal for besvarelse
Sist faglig oppdatert: 02.07.2021
Biopsier
Angi alltid kirurgens angivelse av lokalisasjon!
Resektater
Preparatets art, tumors lokalisasjon og hoveddiagnose med histologisk type.
Eksempel: Anorektalresektat med ulcererende tumor i anus.
Middels høyt differensiert plateepitelkarsinom.
Tabell 7
| Andre funn | Veiledning |
|---|---|
| Tumors største diameter: | mm |
| Tumors lokalisasjon: | Øvre del: Kledt med kolorectal epitel Midtre del (transformasjonssonen): Kledt med metaplastisk/varierende epitel Nedre del (analkanalen): Kledt med plateepitel |
| Infiltrasjon tykkelse: | Angi i mm fra basalmembranen (med tanke på SISCCA) |
| Dypeste infiltrasjon: | Angi uten eller med infiltrasjon i nærliggende organ (vagina, urethra, urinblære) |
| Minste avstand til reseksjonsflate: | mm Angi sted |
| Endereseksjonsrender: | Frie/ikke frie |
| Antall perirectale lymfeknuter: | Antall hvorav # med tumorvev |
| Antall iliacale og/eller inguinale lymfeknuter: | Antall hvorav # med tumorvev Angi hvorvidt unilateral eller bilateral |
| pTNM-klassifikasjon: |
|
| Annen patologi: | Adenomer, ulcera etc. |
| HPV / p16 | Positiv/negativ |
Angi klassifikasjon, f. eks. TNM Classification of Malignant Tumours, 8. utg.
Prosess og metode
Hva er nasjonale retningslinjer?
Sist faglig oppdatert: 02.07.2021
I henhold til Nasjonal helse- og sykehusplan (2015–2019) (Nasjonal helse- og sykehusplan (2016−2019), 2015) har Helsedirektoratet en normerende rolle for helsetjenesten på tvers av helseregioner og tjenestenivå. Helsedirektoratet har en koordinerende rolle for å utvikle overordnede referanserammer for kreftomsorgen, sammen med de regionale helseforetakene, kommunene og andre relevante myndighetsorganer og tjenester.
Lov om kommunale helse- og omsorgstjenester § 12‑5 (Lov om kommunale helse- og omsorgstjenester) fastslår at Helsedirektoratet er eneste aktør med mandat til å utvikle, formidle og vedlikeholde nasjonale faglige retningslinjer og veiledere som understøtter de mål som er satt for helse- og omsorgstjenesten.
De nasjonale faglige retningslinjene inneholder systematisk utviklede faglige anbefalinger som etablerer en nasjonal standard for utredning, behandling og oppfølging av pasientgrupper, diagnosegrupper og brukergrupper. Nasjonale faglige retningslinjer er et virkemiddel for å bidra til at helse- og omsorgstjenestene:
- Har god kvalitet
- Gjør riktige prioriteringer
- Ikke har uønsket variasjon i tjenestetilbudet
- Løser samhandlingsutfordringer
- Tilbyr helhetlige pasientforløp
Nasjonale faglige retningslinjer gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet. Sentrale fagmiljøer og tjenestemottakere er aktivt involvert i utarbeidelsen.
Helsepersonell og alle deler av helse- og omsorgstjenesten er forpliktet til å yte forsvarlig helsehjelp. Retningslinjer, anerkjent fagkunnskap og allmenngyldige samfunnsetiske normer inngår som aksepterte grunnlag for vurdering av hva som er faglig forsvarlig. Retningslinjer er ment som et hjelpemiddel ved avveiningene tjenesteyterne må gjøre for å oppnå forsvarlig og god kvalitet i tjenesten. De er ikke rettslig bindende, men faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet. Helsepersonell må likevel vise faglig skjønn i vurderingen av hver enkelt pasient for å ta hensyn til individuelle behov. Dersom helsepersonell eller institusjoner velger å fravike anbefalinger i en retningslinje, bør dette dokumenteres og begrunnes.
Helsetjenestens eiere og ledelse har ansvar for tilrettelegging av virksomheten slik at anbefalinger gitt i nasjonale faglige retningslinjer kan følges.
Kunnskapsbasert prosess
Sist faglig oppdatert: 02.07.2021
Helsedirektoratet legger til grunn at alle nasjonale faglige retningslinjer skal være utarbeidet etter en metode med vekt på forskningsbasert kunnskap, tydelig og tilgjengelig dokumentasjon, brukermedvirkning, tverrfaglighet, fokus på praksis, implementering og oppdatering.
Det er en omfattende prosess å lage gode retningslinjer som tilfredsstiller krav til prosess, metode og transparens som er det nivå Helsedirektoratet og andre internasjonale organisasjoner har lagt til grunn for utforming av anbefalinger.
I forbindelse med den første nasjonale retningslinjen for analcancer samarbeidet arbeidsgruppen, og daværende Nasjonalt kunnskapssenter for helsetjenesten (Kunnskapssenteret), for å sikre en god håndtering av kunnskapsgrunnlaget for anbefalingene:
I en tidlig fase av arbeidet avklarte arbeidsgruppen hva retningslinjene skulle omfatte når det gjaldt diagnostikk, behandling og oppfølging av analcancer.
Kunnskapssenteret, i samarbeid med arbeidsgruppen, gjennomgikk anbefalingene med hensyn til metode og hvilket kunnskapsgrunnlag de var basert på.
Arbeidsgruppen vurderte i samarbeid med Helsedirektoratet og Kunnskapssenteret hvilke områder det var behov for kunnskapsstøtte fra Kunnskapssenteret.
Kunnskapssenteret identifiserte og formidlet kunnskapsbaserte internasjonale retningslinjer og systematiske oversikter til faggruppen, ved søk på følgende nettsteder:
Søk etter retningslinjer:
Guidelines international network: http://www.g-i-n.net/ NICE, UK: http://www.nice.org.uk/page.aspx?o=home SIGN, Scotland: http://www.sign.ac.uk/
AHRQ, US: http://www.guideline.gov/
Cancer care Ontario: http://www.cancercare.on.ca/
Søk etter systematiske oversikter:
CRD-databasene: http://www.crd.york.ac.uk/crdweb/
Cochrane Library: http://www.mrw.interscience.wiley.com/cochrane/cochrane_search_fs.html
Clinical evidence: https://bestpractice.bmj.com/evidence
Bakgrunn og arbeidsprosess ved første utgave av handlingsprogrammet
Sist faglig oppdatert: 02.07.2021
Utvikling av de nasjonale handlingsprogrammene for kreftbehandling var et viktig tiltak under Nasjonal strategi for kreftområdet 2006–2009 (Nasjonal strategi for kreftområdet 2006-2009, 2006) (forlenget til 2011). Og videre utvikling av de nasjonale handlingsprogrammene var en kjerneoppgave i oppfølging av Sammen mot kreft – Nasjonal Kreftstrategi 2013–2017 (Sammen - mot kreft: nasjonal kreftstrategi 2013-2017, 2013), og i videreføringen og oppdateringen av denne, jf. Nasjonal kreftstrategi Leve med kreft (2018–2022) (Leve med kreft: nasjonal kreftstrategi (2018-2022), 2018). Nasjonale handlingsprogrammer for kreftbehandling skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
Nasjonale faggrupper tilsluttet Onkologisk Forum hadde i en årrekke arbeidet med – og utviklet – behandlingsveiledere og handlingsprogram for ulike krefttyper. Helsedirektoratet ønsket i arbeidet med nasjonale handlingsprogrammer å ta utgangspunkt i, og bygge på, dette arbeidet.
Helsedirektoratet rettet en henvendelse til NGICG og ba om forslag til representanter til en arbeidsgruppe som skulle settes sammen av legespesialister fra relevante spesialiteter. Alle nødvendige faggrupper skulle være representert, og gruppen skulle bestå av fagfolk fra alle helseregioner. Kunnskapssenteret bisto gruppen med søk og gradering av kunnskapsgrunnlaget.
De regionale helseforetakene (RHF-ene) ble gitt mulighet til å gi tilbakemelding på arbeidsgruppens sammensetning. RHF-ene ble også bedt om at fagfolk innenfor rammen av sin arbeidstid ble fristilt til retningslinjearbeidet, jf. Oppdragsdokumentet fra Helse- og omsorgsdepartementet.
NGICG-CR og NGICG hadde handlingsprogrammet til vurdering og ga innspill til arbeidsgruppen før utkast ble sendt til Helsedirektoratet.
Helsedirektoratet og Kunnskapssenteret, i samarbeid med arbeidsgruppen, ferdigstilte i 2016 et høringsutkast som ble sendt på høring til RHF-ene, Den norske legeforening og Kreftforeningen høsten 2016. Etter høringen ble høringsinnspillene gjennomgått av arbeidsgruppen og Helsedirektoratet. Endelig utgave ble ferdigstilt og publisert av Helsedirektoratet i mai 2017.
Arbeidsgruppens medlemmer – første utgave av handlingsprogrammet
| Marianne Grønlie Guren, leder av arbeidsgruppen | Avdeling for kreftbehandling | Oslo universitetssykehus HF |
| Eva Hofsli | Onkologisk avdeling | St Olavs hospital HF |
| Magnar Johansen | Kreftavdelingen | Universitetssykehuset Nord-Norge HF |
| Stein Larsen | Gastrokirurgisk avdeling | Oslo universitetssykehus HF |
| Bettina Hanekamp | Radiologisk avdeling | Oslo universitetssykehus HF |
| Sonja Steigen | Patologisk avdeling | UNN Tromsø |
| Hans Wasmuth | Gastrokirurgisk avdeling | St Olavs hospital HF |
| Hartwig Kørner | Gastrokirurgisk avdeling | Stavanger Universitetssjukehus HF |
| Christine Undseth | Avdeling for kreftbehandling | Oslo universitetssykehus HF |
| Sigrunn Sebjørnsen | Kreftavdelingen | Haukeland |
| Geir Tollåli | Gastromedisinsk avdeling | Nordlandssykehuset Bodø1 |
| Åse Skår fra Kunnskapssenteret i Folkehelseinstituttet bisto gruppen med metodestøtte. | ||
1Geir Tollåli deltok i arbeidsgruppen frem til han tiltrådte stillingen som fagdirektør i Helse Nord RHF.
Bakgrunn og arbeidsprosess ved andre utgave av handlingsprogrammet, 2019
Sist faglig oppdatert: 02.07.2021
Handlingsprogrammet er oppdatert av en oppdateringsgruppe med medlemmer oppnevnt fra RHF-ene. Representant fra Folkehelseinstituttet har bidratt med metodestøtte, søk og bistand til gradering av kunnskapsgrunnlaget. Utkast til revidert handlingsprogram er behandlet i NGICG styret før det ble oversendt til Helsedirektoratet for endelig ferdigstillelse.
Oppdateringsgruppens medlemmer – andre utgave av handlingsprogrammet
| Leder av arbeidsgruppen: Marianne Grønlie Guren, onkolog
|
Avdeling for kreftbehandling |
Oslo universitetssykehus HF |
| Hartwig Kørner, kirurg | Gastrokirurgisk avdeling | Stavanger Universitetssjukehus HF |
| Christine Undseth, onkolog | Avd. for kreftbehandling | Oslo universitetssykehus HF |
| Stein Larsen, kirurg | Avdeling for gastro- og barnekirurgi | Radiumhospitalet, Oslo universitetssykehus HF |
| Monika Eidem, onkolog | Stråleterapiavdelingen | St. Olavs Hospital |
Anne-Hilde Røsvik, FHI, har bidratt med søk og bistand til gradering
| Inger Kristin Larsen | Kreftregisteret |
| kapittel 2: Epidemiologi
|
| Sonja Steigen | Avd. for klinisk patologi | UNN, Tromsø | kapittel 3: Forebygging og 11 Patologi |
| Bettina Hanekamp | Avd. for radiologi og nukleærmedisin | Oslo universitetssykehus HF | kapittel 5: Diagnostikk og utredning |
| Marianne Sande | Avd. for radiologi | Stavanger Universitetssjukehus | kapittel 5: Diagnostikk og utredning |
Medlemmer av NGICG-CR har også gitt innspill til handlingsprogramarbeidet.
Oppdateringsgruppens medlemmer – tredje utgave av handlingsprogrammet (2021)
| Leder av arbeidsgruppen: Marianne Grønlie Guren, onkolog
|
Avdeling for kreftbehandling |
Oslo universitetssykehus HF |
| Hartwig Kørner, kirurg | Gastrokirurgisk avdeling | Stavanger Universitetssjukehus HF |
| Christine Undseth, onkolog | Avd. for kreftbehandling | Oslo universitetssykehus HF |
| Stein Larsen, kirurg | Avdeling for gastro- og barnekirurgi | Oslo universitetssykehus HF |
| Monika Eidem, onkolog | Stråleterapiavdelingen | St. Olavs Hospital |
Anne-Hilde Røsvik, FHI, har vært tilgjengelig for bidrag med søk og bistand til gradering.
| Inger Kristin Larsen | Kreftregisteret |
| kapittel 2: Epidemiologi |
| Tom-Andreas Wik | Avdeling for gastro- og barnekirurgi | Oslo universitetssykehus HF | kapittel 3: Forebygging |
| Sonja Steigen | Avd. for klinisk patologi | UNN, Tromsø | kapittel 11: Patologi |
Medlemmer av NGICG-CR har diskutert og gitt innspill til handlingsprogramarbeidet.
Gradering av kunnskapsgrunnlaget
Sist faglig oppdatert: 02.07.2021
Ved utarbeiding av nasjonale faglige retningslinjer stilles det krav om at all relevant kunnskap på området hentes frem, beskrives og vurderes på en systematisk og åpen måte.
I denne versjonen av retningslinjen har man i deler av handlingsprogrammet anvendt gradering av evidensnivå (A–D) for å vise hvilket vitenskapelig grunnlag kunnskapen er basert på.
| Studietype | Evidensnivå | Gradering av evidensnivå |
|---|---|---|
| Kunnskap som bygger på systematiske oversikter og meta-analyser av randomiserte kontrollerte studier. | Nivå 1a | A |
| Kunnskap som bygger på minst én randomisert kontrollert studie. | Nivå 1b | |
| Kunnskap som bygger på minst én godt utformet kontrollert studie uten randomisering. | Nivå 2a | B |
| Kunnskap som bygger på minst én annen godt utformet kvasi-eksperimentell studie uten randomisering. | Nivå 2b | |
| Kunnskap som bygger på godt utformede ikke eksperimentelle beskrivende studier, som sammenlignende studier, korrelasjonsstudier og case studier | Nivå 3 | C |
| Kunnskap som bygger på rapporter eller oppfatninger fra eksperter, komiteer og/eller klinisk ekspertise hos respekterte autoriteter | Nivå 4 | D |
Kunnskapsgrunnlaget i disse retningslinjene er gradert i henhold til tabellen over. I disse retningslinjene er kun kunnskapsgrunnlaget og ikke anbefalingene gradert. Hvis selve anbefalingene skal graderes, (for eksempel ved bruk av GRADE-systemet2, må man, i tillegg til å ha vurdert kunnskapsgrunnlaget, også legge inn en vurdering av både kost-nytte og andre forhold (klinisk erfaring, skjønn, etikk, osv.). Dette er ikke gjort eksplisitt i forbindelse med dette arbeidet, og anbefalingene er derfor ikke gradert.
For å indikere kunnskapsgrunnlaget for anbefalingene, er det brukt gradering A–D. En anbefaling som er anført med D behøver derfor ikke å være en svakere anbefaling enn en som er anført A, B eller C. Det henspeiler kun til kunnskapsgrunnlaget anbefalingen er basert på. I enkelte sammenhenger vil klinisk erfaring og gjeldende praksis være et godt grunnlag for anbefalingen. I andre sammenhenger er det uttrykk for at det ikke finnes tilstrekkelig vitenskapelig dokumentasjon for anbefalingen, selv om det hadde vært ønskelig.
2www.gradeworkinggroup.org – The Grading of Recommendations assessment.
Generelt om oppdatering av handlingsprogrammene
Sist faglig oppdatert: 02.07.2021
Utviklingen av ny behandling på kreftområdet går raskt. Handlingsprogrammet vil vurderes årlig og om nødvendig oppdateres.
I forbindelse med oppdatering oppretter Helsedirektoratet en arbeidsgruppe som skal bistå direktoratet med arbeidet. Arbeidsgruppen består av fagpersoner oppnevnt av RHF-ene. Folkehelseinstituttet deltar i arbeidet, og bistår med søk og gradering av kunnskapsgrunnlaget. De oppdaterte retningslinjene vil publiseres av direktoratet på helsedirektoratet.no som pdf, og i elektronisk versjon på helsebiblioteket.no.
Referanser
Sist faglig oppdatert: 02.07.2021
Ajani, J. A., Winter, K. A., Gunderson, L. L., Pedersen, J., Benson, A. B., 3rd, Thomas, C. R., Jr., . . . Willett, C. (2008). Fluorouracil, mitomycin, and radiotherapy vs fluorouracil, cisplatin, and radiotherapy for carcinoma of the anal canal: a randomized controlled trial. JAMA, 299(16), 1914-1921. https://doi.org/10.1001/jama.299.16.1914
Ajani, J. A., Winter, K. A., Gunderson, L. L., Pedersen, J., Benson, A. B., 3rd, Thomas, C. R., Jr., . . . Willett, C. G. (2010). Prognostic factors derived from a prospective database dictate clinical biology of anal cancer: the intergroup trial (RTOG 98-11). Cancer, 116(17), 4007-4013. https://doi.org/10.1002/cncr.25188
Akbari, R. P., Paty, P. B., Guillem, J. G., Weiser, M. R., Temple, L. K., Minsky, B. D., . . . Wong, W. D. (2004). Oncologic outcomes of salvage surgery for epidermoid carcinoma of the anus initially managed with combined modality therapy. Diseases of the Colon and Rectum, 47(7), 1136-1144. https://doi.org/10.1007/s10350-004-0548-5
Alam, N. N., White, D. A., Narang, S. K., Daniels, I. R., & Smart, N. J. (2016). Systematic review of guidelines for the assessment and management of high-grade anal intraepithelial neoplasia (AIN II/III). Colorectal Disease, 18(2), 135-146. https://doi.org/10.1111/codi.13215
Alberta Provincial Gastrointestinal Tumour Team. (2013). Anal canal cancer (Clinical practice guideline GI-001 version 4). Alberta: Alberta health Services. Hentet fra http://www.albertahealthservices.ca/assets/info/hp/cancer/if-hp-cancer-guide-gi001-anal-canal.pdf
Amstutz, U., Henricks, L. M., Offer, S. M., Barbarino, J., Schellens, J. H. M., Swen, J. J., . . . Schwab, M. (2018). Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for Dihydropyrimidine Dehydrogenase Genotype and Fluoropyrimidine Dosing: 2017 Update. Clinical Pharmacology and Therapeutics, 103(2), 210-216. https://doi.org/10.1002/cpt.911
Arana, R., Fléjou, J. F., Si-Mohamed, A., Bauer, P., & Etienney, I. (2015). Clinicopathological and virological characteristics of superficially invasive squamous-cell carcinoma of the anus. Colorectal Disease, 17(11), 965-972. https://doi.org/10.1111/codi.12951
Bahng, A. Y., Dagan, A., Bruner, D. W., & Lin, L. L. (2012). Determination of prognostic factors for vaginal mucosal toxicity associated with intravaginal high-dose rate brachytherapy in patients with endometrial cancer. International Journal of Radiation Oncology, Biology, Physics, 82(2), 667-673. https://doi.org/10.1016/j.ijrobp.2010.10.071
Balamucki, C. J., Zlotecki, R. A., Rout, W. R., Newlin, H. E., Morris, C. G., Kirwan, J. M., . . . Mendenhall, W. M. (2011). Squamous cell carcinoma of the anal margin: the university of Florida experience. American Journal of Clinical Oncology, 34(4), 406-410. https://doi.org/10.1097/COC.0b013e3181e9c0c0
Bartelink, H., Roelofsen, F., Eschwege, F., Rougier, P., Bosset, J. F., Gonzalez, D. G., . . . Pierart, M. (1997). Concomitant radiotherapy and chemotherapy is superior to radiotherapy alone in the treatment of locally advanced anal cancer: results of a phase III randomized trial of the European Organization for Research and Treatment of Cancer Radiotherapy and Gastrointestinal Cooperative Groups. Journal of Clinical Oncology, 15(5), 2040-2049. https://doi.org/10.1200/jco.1997.15.5.2040
Ben-Josef, E., Moughan, J., Ajani, J. A., Flam, M., Gunderson, L., Pollock, J., . . . Willett, C. (2010). Impact of overall treatment time on survival and local control in patients with anal cancer: a pooled data analysis of Radiation Therapy Oncology Group trials 87-04 and 98-11. Journal of Clinical Oncology, 28(34), 5061-5066. https://doi.org/10.1200/jco.2010.29.1351
Benson, A. B., Venook, A. P., Al-Hawary, M. M., Cederquist, L., Chen, Y. J., Ciombor, K. K., . . . Freedman-Cass, D. A. (2018). Anal Carcinoma, Version 2.2018, NCCN Clinical Practice Guidelines in Oncology. Journal of the National Comprehensive Cancer Network, 16(7), 852-871. https://doi.org/10.6004/jnccn.2018.0060
Bentzen, A. G., Balteskard, L., Wanderås, E. H., Frykholm, G., Wilsgaard, T., Dahl, O., & Guren, M. G. (2013). Impaired health-related quality of life after chemoradiotherapy for anal cancer: late effects in a national cohort of 128 survivors. Acta Oncologica, 52(4), 736-744. https://doi.org/10.3109/0284186x.2013.770599
Bentzen, A. G., Guren, M. G., Vonen, B., Wanderas, E. H., Frykholm, G., Wilsgaard, T., . . . Balteskard, L. (2013). Faecal incontinence after chemoradiotherapy in anal cancer survivors: long-term results of a national cohort. Radiotherapy and Oncology, 108(1), 55-60. https://doi.org/10.1016/j.radonc.2013.05.037
Bentzen, A. G., Guren, M. G., Wanderas, E. H., Frykholm, G., Tveit, K. M., Wilsgaard, T., . . . Balteskard, L. (2012). Chemoradiotherapy of anal carcinoma: survival and recurrence in an unselected national cohort. International Journal of Radiation Oncology, Biology, Physics, 83(2), e173-180. https://doi.org/10.1016/j.ijrobp.2011.12.062
Bese, N. S., Hendry, J., & Jeremic, B. (2007). Effects of prolongation of overall treatment time due to unplanned interruptions during radiotherapy of different tumor sites and practical methods for compensation. International Journal of Radiation Oncology, Biology, Physics, 68(3), 654-661. https://doi.org/10.1016/j.ijrobp.2007.03.010
Bhuva, N. J., Glynne-Jones, R., Sonoda, L., Wong, W. L., & Harrison, M. K. (2012). To PET or not to PET? That is the question. Staging in anal cancer. Annals of Oncology, 23(8), 2078-2082. https://doi.org/10.1093/annonc/mdr599
Bilimoria, K. Y., Bentrem, D. J., Rock, C. E., Stewart, A. K., Ko, C. Y., & Halverson, A. (2009). Outcomes and prognostic factors for squamous-cell carcinoma of the anal canal: analysis of patients from the National Cancer Data Base. Diseases of the Colon and Rectum, 52(4), 624-631. https://doi.org/10.1007/DCR.0b013e31819eb7f0
Brogden, D. R. L., Walsh, U., Pellino, G., Kontovounisios, C., Tekkis, P., & Mills, S. C. (2021). Evaluating the efficacy of treatment options for anal intraepithelial neoplasia: a systematic review. International Journal of Colorectal Disease, 36(2), 213-226. https://doi.org/10.1007/s00384-020-03740-6
Brown, E., Cray, A., Haworth, A., Chander, S., Lin, R., Subramanian, B., & Ng, M. (2015). Dose planning objectives in anal canal cancer IMRT: the TROG ANROTAT experience. Journal of medical radiation sciences, 62(2), 99-107. https://doi.org/10.1002/jmrs.99
Brown, G., Richards, C. J., Bourne, M. W., Newcombe, R. G., Radcliffe, A. G., Dallimore, N. S., & Williams, G. T. (2003). Morphologic predictors of lymph node status in rectal cancer with use of high-spatial-resolution MR imaging with histopathologic comparison. Radiology, 227(2), 371-377. https://doi.org/10.1148/radiol.2272011747
Bruland, O., Fluge, O., Immervoll, H., Balteskard, L., Myklebust, M., Skarstein, A., & Dahl, O. (2008). Gene expression reveals two distinct groups of anal carcinomas with clinical implications. British Journal of Cancer, 98(7), 1264-1273. https://doi.org/10.1038/sj.bjc.6604285
Cacheux, W., Lievre, A., De La Rochefordiere, A., Dieumegard, B., Cvitkovic, F., Labib, A., . . . Buecher, B. (2012). Chemotherapy in the treatment of anal canal carcinoma. Digestive and Liver Disease, 44(10), 803-811. https://doi.org/10.1016/j.dld.2012.04.013
Cancer in Norway 2019: cancer incidence, mortality, survival and prevalence in Norway. (2020). Oslo: Cancer Registry of Norway. Hentet fra https://www.kreftregisteret.no/globalassets/cancer-in-norway/2019/cin_report.pdf
Castor, M., da Silva, H. J., Gondim Martins, D. B., & de Mello, R. J. (2012). HPV and precancerous lesions of anal canal in women: systematic review. International Journal of Colorectal Disease, 27(3), 271-276. https://doi.org/10.1007/s00384-011-1298-1
Chan, R. J., Webster, J., Chung, B., Marquart, L., Ahmed, M., & Garantziotis, S. (2014). Prevention and treatment of acute radiation-induced skin reactions: a systematic review and meta-analysis of randomized controlled trials. BMC Cancer, 14, 53. https://doi.org/10.1186/1471-2407-14-53
Chuong, M. D., Freilich, J. M., Hoffe, S. E., Fulp, W., Weber, J. M., Almhanna, K., . . . Shridhar, R. (2013). Intensity-Modulated Radiation Therapy vs. 3D Conformal Radiation Therapy for Squamous Cell Carcinoma of the Anal Canal. Gastrointestinal Cancer Research, 6(2), 39-45.
Clark, M. A., Hartley, A., & Geh, J. I. (2004). Cancer of the anal canal. Lancet Oncology, 5(3), 149-157. https://doi.org/10.1016/s1470-2045(04)01410-x
Coffey, K., Beral, V., Green, J., Reeves, G., & Barnes, I. (2015). Lifestyle and reproductive risk factors associated with anal cancer in women aged over 50 years. British Journal of Cancer, 112(9), 1568-1574. https://doi.org/10.1038/bjc.2015.89
Cox, J. D., Stetz, J., & Pajak, T. F. (1995). Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). International Journal of Radiation Oncology, Biology, Physics, 31(5), 1341-1346. https://doi.org/10.1016/0360-3016(95)00060-c
Croke, J. M., & El-Sayed, S. (2012). Multidisciplinary management of cancer patients: chasing a shadow or real value? An overview of the literature. Current Oncology (Toronto, Ont.), 19(4), e232-238. https://doi.org/10.3747/co.19.944
Dale, J. E., Sebjornsen, S., Leh, S., Rosler, C., Aaserud, S., Moller, B., . . . Dahl, O. (2017). Multimodal therapy is feasible in elderly anal cancer patients. Acta Oncologica, 56(1), 81-87. https://doi.org/10.1080/0284186x.2016.1244356
Daling, J. R., Madeleine, M. M., Johnson, L. G., Schwartz, S. M., Shera, K. A., Wurscher, M. A., . . . McDougall, J. K. (2004). Human papillomavirus, smoking, and sexual practices in the etiology of anal cancer. Cancer, 101(2), 270-280. https://doi.org/10.1002/cncr.20365
Dasgupta, T., Rothenstein, D., Chou, J. F., Zhang, Z., Wright, J. L., Saltz, L. B., . . . Goodman, K. A. (2013). Intensity-modulated radiotherapy vs. conventional radiotherapy in the treatment of anal squamous cell carcinoma: a propensity score analysis. Radiotherapy and Oncology, 107(2), 189-194. https://doi.org/10.1016/j.radonc.2013.03.012
Deenen, M. J., Dewit, L., Boot, H., Beijnen, J. H., Schellens, J. H., & Cats, A. (2013). Simultaneous integrated boost-intensity modulated radiation therapy with concomitant capecitabine and mitomycin C for locally advanced anal carcinoma: a phase 1 study. International Journal of Radiation Oncology, Biology, Physics, 85(5), e201-207. https://doi.org/10.1016/j.ijrobp.2012.12.008
Deenen, M. J., Meulendijks, D., Cats, A., Sechterberger, M. K., Severens, J. L., Boot, H., . . . Schellens, J. H. (2016). Upfront Genotyping of DPYD*2A to Individualize Fluoropyrimidine Therapy: A Safety and Cost Analysis. Journal of Clinical Oncology, 34(3), 227-234. https://doi.org/10.1200/jco.2015.63.1325
DeFoe, S. G., Beriwal, S., Jones, H., Rakfal, S., Heron, D. E., Kabolizadeh, P., . . . Lalonde, R. (2012). Concurrent chemotherapy and intensity-modulated radiation therapy for anal carcinoma--clinical outcomes in a large National Cancer Institute-designated integrated cancer centre network. Clinical Oncology (Royal College of Radiologists), 24(6), 424-431. https://doi.org/10.1016/j.clon.2011.09.014
DeFoe, S. G., Kabolizadeh, P., Heron, D. E., & Beriwal, S. (2013). Dosimetric parameters predictive of acute gastrointestinal toxicity in patients with anal carcinoma treated with concurrent chemotherapy and intensity-modulated radiation therapy. Oncology, 85(1), 1-7. https://doi.org/10.1159/000348387
Dutta, S. W., Alonso, C. E., Waddle, M. R., Khandelwal, S. R., Janowski, E. M., & Trifiletti, D. M. (2018). Squamous cell carcinoma of the rectum: Practice trends and patient survival. Cancer medicine, 7(12), 6093-6103. https://doi.org/10.1002/cam4.1893
Dyson, T., & Draganov, P. V. (2009). Squamous cell cancer of the rectum. World Journal of Gastroenterology, 15(35), 4380-4386.
Edge, S. B., Byrd, D. R., Compton, C. C., Fritz, A. G., Greene, F. L., & Trotti, A. (2010). American Joint Committee on Cancer. Ajcc cancer staging handbook: from the AJCC cancer staging manual (7. utg.). New York: Springer
Eng, C., Chang, G. J., You, Y. N., Das, P., Rodriguez-Bigas, M., Xing, Y., . . . Wolff, R. A. (2014). The role of systemic chemotherapy and multidisciplinary management in improving the overall survival of patients with metastatic squamous cell carcinoma of the anal canal. Oncotarget, 5(22), 11133-11142. https://doi.org/10.18632/oncotarget.2563
Epidermoid anal cancer: results from the UKCCCR randomised trial of radiotherapy alone versus radiotherapy, 5-fluorouracil, and mitomycin. UKCCCR Anal Cancer Trial Working Party. UK Co-ordinating Committee on Cancer Research. (1996). Lancet, 348(9034), 1049-1054.
Erridge, S. C., Kerr, G. R., Downing, D., Duncan, W., & Price, A. (2002). The effect of overall treatment time on the survival and toxicity of radical radiotherapy for cervical carcinoma. Radiotherapy and Oncology, 63(1), 59-66. https://doi.org/10.1016/s0167-8140(02)00012-9
Faivre, C., Rougier, P., Ducreux, M., Mitry, E., Lusinchi, A., Lasser, P., . . . Eschwege, F. (1999). Carcinome epidermoide metastatique de l'anus: etude retrospective de l'efficacite de l'association de 5-fluoro-uracile en perfusion continue et de cisplatine [5-fluorouracile and cisplatinum combination chemotherapy for metastatic squamous-cell anal cancer]. Bulletin du Cancer, 86(10), 861-865.
Fish, R., Sanders, C., Adams, R., Brewer, J., Brookes, S. T., DeNardo, J., . . . Renehan, A. G. (2018). A core outcome set for clinical trials of chemoradiotherapy interventions for anal cancer (CORMAC): a patient and health-care professional consensus. The lancet. Gastroenterology & hepatology, 3(12), 865-873. https://doi.org/10.1016/s2468-1253(18)30264-4
Fox, P. A., Nathan, M., Francis, N., Singh, N., Weir, J., Dixon, G., . . . Bower, M. (2010). A double-blind, randomized controlled trial of the use of imiquimod cream for the treatment of anal canal high-grade anal intraepithelial neoplasia in HIV-positive MSM on HAART, with long-term follow-up data including the use of open-label imiquimod. AIDS, 24(15), 2331-2335. https://doi.org/10.1097/QAD.0b013e32833d466c
Franco, P., Arcadipane, F., Ragona, R., Mistrangelo, M., Cassoni, P., Munoz, F., . . . Ricardi, U. (2016). Volumetric modulated arc therapy (VMAT) in the combined modality treatment of anal cancer patients. British Journal of Radiology, 89(1060), 20150832.
Fuchshuber, P. R., Rodriguez-Bigas, M., Weber, T., & Petrelli, N. J. (1997). Anal canal and perianal epidermoid cancers. Journal of the American College of Surgeons, 185(5), 494-505.
Gautier, M., Brochard, C., Lion, A., Henno, S., Mallet, A. L., Bodere, A., . . . Siproudhis, L. (2016). High-grade anal intraepithelial neoplasia: Progression to invasive cancer is not a certainty. Digestive and Liver Disease, 48(7), 806-811. https://doi.org/10.1016/j.dld.2016.03.011
Gilbert, D. C., Serup-Hansen, E., Linnemann, D., Hogdall, E., Bailey, C., Summers, J., . . . Thomas, G. J. (2016). Tumour-infiltrating lymphocyte scores effectively stratify outcomes over and above p16 post chemo-radiotherapy in anal cancer. British Journal of Cancer, 114(2), 134-137. https://doi.org/10.1038/bjc.2015.448
Gilbert, D. C., Williams, A., Allan, K., Stokoe, J., Jackson, T., Linsdall, S., . . . Summers, J. (2013). p16INK4A, p53, EGFR expression and KRAS mutation status in squamous cell cancers of the anus: correlation with outcomes following chemo-radiotherapy. Radiotherapy and Oncology, 109(1), 146-151. https://doi.org/10.1016/j.radonc.2013.08.002
Glover, M., Smerdon, G. R., Andreyev, H. J., Benton, B. E., Bothma, P., Firth, O., . . . Yarnold, J. (2016). Hyperbaric oxygen for patients with chronic bowel dysfunction after pelvic radiotherapy (HOT2): a randomised, double-blind, sham-controlled phase 3 trial. Lancet Oncology, 17(2), 224-233. https://doi.org/10.1016/s1470-2045(15)00461-1
Glynne-Jones, R., Meadows, H., Wan, S., Gollins, S., Leslie, M., Levine, E., . . . Sebag-Montefiore, D. (2008). EXTRA--a multicenter phase II study of chemoradiation using a 5 day per week oral regimen of capecitabine and intravenous mitomycin C in anal cancer. International Journal of Radiation Oncology, Biology, Physics, 72(1), 119-126. https://doi.org/10.1016/j.ijrobp.2007.12.012
Glynne-Jones, R., Nilsson, P. J., Aschele, C., Goh, V., Peiffert, D., Cervantes, A., & Arnold, D. (2014a). Anal cancer: ESMO-ESSO-ESTRO clinical practice guidelines for diagnosis, treatment and follow-up. Radiotherapy and Oncology, 111(3), 330-339. https://doi.org/10.1016/j.radonc.2014.04.013
Glynne-Jones, R., Nilsson, P. J., Aschele, C., Goh, V., Peiffert, D., Cervantes, A., & Arnold, D. (2014b). Anal cancer: ESMO-ESSO-ESTRO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology, 25 Suppl 3, iii10-20. https://doi.org/10.1093/annonc/mdq171
Glynne-Jones, R., Sebag-Montefiore, D., Adams, R., McDonald, A., Gollins, S., James, R., . . . Jitlal, M. (2011). "Mind the gap"--the impact of variations in the duration of the treatment gap and overall treatment time in the first UK Anal Cancer Trial (ACT I). International Journal of Radiation Oncology, Biology, Physics, 81(5), 1488-1494. https://doi.org/10.1016/j.ijrobp.2010.07.1995
Glynne-Jones, R., Sebag-Montefiore, D., Meadows, H. M., Cunningham, D., Begum, R., Adab, F., . . . Kadalayil, L. (2017). Best time to assess complete clinical response after chemoradiotherapy in squamous cell carcinoma of the anus (ACT II): a post-hoc analysis of randomised controlled phase 3 trial. Lancet Oncology, 18(3), 347-356. https://doi.org/10.1016/s1470-2045(17)30071-2
Goh, V., Gollub, F. K., Liaw, J., Wellsted, D., Przybytniak, I., Padhani, A. R., & Glynne-Jones, R. (2010). Magnetic resonance imaging assessment of squamous cell carcinoma of the anal canal before and after chemoradiation: can MRI predict for eventual clinical outcome? International Journal of Radiation Oncology, Biology, Physics, 78(3), 715-721. https://doi.org/10.1016/j.ijrobp.2009.08.055
Goldman, S., Auer, G., Erhardt, K., & Seligson, U. (1987). Prognostic significance of clinical stage, histologic grade, and nuclear DNA content in squamous-cell carcinoma of the anus. Diseases of the Colon and Rectum, 30(6), 444-448.
Guerra, G. R., Kong, C. H., Warrier, S. K., Lynch, A. C., Heriot, A. G., & Ngan, S. Y. (2016). Primary squamous cell carcinoma of the rectum: An update and implications for treatment. World Journal of Gastrointestinal Surgery, 8(3), 252-265. https://doi.org/10.4240/wjgs.v8.i3.252
Guidelines for the management of anal cancer. I. (2007). Guidelines for the management of colorectal cancer (3. utg., s. 68-95). London: The Association of Coloproctology of Great Britain and Ireland.
Gunderson, L. L., Moughan, J., Ajani, J. A., Pedersen, J. E., Winter, K. A., Benson, A. B., 3rd, . . . Willett, C. G. (2013). Anal carcinoma: impact of TN category of disease on survival, disease relapse, and colostomy failure in US Gastrointestinal Intergroup RTOG 98-11 phase 3 trial. International Journal of Radiation Oncology, Biology, Physics, 87(4), 638-645. https://doi.org/10.1016/j.ijrobp.2013.07.035
Gunderson, L. L., Winter, K. A., Ajani, J. A., Pedersen, J. E., Moughan, J., Benson, A. B., 3rd, . . . Willett, C. G. (2012). Long-term update of US GI intergroup RTOG 98-11 phase III trial for anal carcinoma: survival, relapse, and colostomy failure with concurrent chemoradiation involving fluorouracil/mitomycin versus fluorouracil/cisplatin. Journal of Clinical Oncology, 30(35), 4344-4351. https://doi.org/10.1200/jco.2012.43.8085
Guren, M. G., Aagnes, B., Nygard, M., Dahl, O., & Moller, B. (2019). Rising Incidence and Improved Survival of Anal Squamous Cell Carcinoma in Norway, 1987-2016. Clinical Colorectal Cancer, 18(1), e96-e103. https://doi.org/10.1016/j.clcc.2018.10.001
Han, K., Cummings, B. J., Lindsay, P., Skliarenko, J., Craig, T., Le, L. W., . . . Kim, J. (2014). Prospective evaluation of acute toxicity and quality of life after IMRT and concurrent chemotherapy for anal canal and perianal cancer. International Journal of Radiation Oncology, Biology, Physics, 90(3), 587-594. https://doi.org/10.1016/j.ijrobp.2014.06.061
Hatfield, P., Cooper, R., & Sebag-Montefiore, D. (2008). Involved-field, low-dose chemoradiotherapy for early-stage anal carcinoma. International Journal of Radiation Oncology, Biology, Physics, 70(2), 419-424. https://doi.org/10.1016/j.ijrobp.2007.06.072
Hemminki, K., Liu, X., Ji, J., Sundquist, J., & Sundquist, K. (2012). Autoimmune disease and subsequent digestive tract cancer by histology. Annals of Oncology, 23(4), 927-933. https://doi.org/10.1093/annonc/mdr333
Henkenberens, C., Toklu, H., Tamme, C., & Bruns, F. (2016). Clinical Value of Squamous Cell Carcinoma Antigen (SCCAg) in Anal Cancer - A Single-Center Retrospective Analysis. Anticancer Research, 36(6), 3173-3177.
Higham, C. E., & Faithfull, S. (2015). Bone Health and Pelvic Radiotherapy. Clinical Oncology (Royal College of Radiologists), 27(11), 668-678. https://doi.org/10.1016/j.clon.2015.07.006
Hodges, J. C., Das, P., Eng, C., Reish, A. G., Beddar, A. S., Delclos, M. E., . . . Crane, C. H. (2009). Intensity-modulated radiation therapy for the treatment of squamous cell anal cancer with para-aortic nodal involvement. International Journal of Radiation Oncology, Biology, Physics, 75(3), 791-794. https://doi.org/10.1016/j.ijrobp.2008.11.021
HPV-test gir enklere screening mot livmorhalskreft for 9 av 10 kvinner mellom 34 og 69 år. (2013). [nettdokument]. Oslo: Kreftregisteret. Hentet 23. aug. 2016, fra https://www.kreftregisteret.no/Generelt/Nyheter/HPV-test-gir-enklere-screening-mot-livmorhalskreft-for-9-av-10-kvinner-mellom-34-og-69-ar-/
HPV og HPV-vaksine. (2016). [nettside]. Oslo: Folkehelseinstituttet. Hentet 23. aug. 2016, fra https://www.fhi.no/sv/vaksine/hpv/
Humant papillomavirus (HPV), genitale infeksjoner - veileder for helsepersonell. (21. feb 2016). Smittevernveilederen [nettdokument]. Oslo: Folkehelseinstituttet. Hentet 23. aug 2016, fra https://www.fhi.no/nettpub/smittevernveilederen/sykdommer-a-a/humant-papillomavirus-hpv-genitale-/
Incrocci, L., & Jensen, P. T. (2013). Pelvic radiotherapy and sexual function in men and women. Journal of Sexual Medicine, 10 Suppl 1, 53-64. https://doi.org/10.1111/jsm.12010
International Clinical Guideline Group. (2012). International guidelines on vaginal dilation after pelvic radiotherapy. Woodstock, UK: Owen Mumford. Hentet fra http://www.ncsi.org.uk/wp-content/uploads/Inter-Best-Practice-Guide-Vaginal-Dilators-July-2012.pdf
Islami, F., Ferlay, J., Lortet-Tieulent, J., Bray, F., & Jemal, A. (2017). International trends in anal cancer incidence rates. International Journal of Epidemiology, 46(3), 924-938. https://doi.org/10.1093/ije/dyw276
James, R. D., Glynne-Jones, R., Meadows, H. M., Cunningham, D., Myint, A. S., Saunders, M. P., . . . Sebag-Montefiore, D. (2013). Mitomycin or cisplatin chemoradiation with or without maintenance chemotherapy for treatment of squamous-cell carcinoma of the anus (ACT II): a randomised, phase 3, open-label, 2 x 2 factorial trial. Lancet Oncology, 14(6), 516-524. https://doi.org/10.1016/s1470-2045(13)70086-x
Jeong, B. G., Kim, D. Y., & Kim, S. Y. (2013). Concurrent chemoradiotherapy for squamous cell carcinoma of the rectum. Hepato-Gastroenterology, 60(123), 512-516. https://doi.org/10.5754/hge11293
Johnsson, A., Leon, O., Gunnlaugsson, A., Nilsson, P., & Hoglund, P. (2018). Determinants for local tumour control probability after radiotherapy of anal cancer. Radiotherapy and Oncology, 128(2), 380-386. https://doi.org/10.1016/j.radonc.2018.06.007
Julie, D. R., & Goodman, K. A. (2016). Advances in the Management of Anal Cancer. Current Oncology Reports, 18(3), 20. https://doi.org/10.1007/s11912-016-0503-3
Kachnic, L. A., Tsai, H. K., Coen, J. J., Blaszkowsky, L. S., Hartshorn, K., Kwak, E. L., . . . Hong, T. S. (2012). Dose-painted intensity-modulated radiation therapy for anal cancer: a multi-institutional report of acute toxicity and response to therapy. International Journal of Radiation Oncology, Biology, Physics, 82(1), 153-158. https://doi.org/10.1016/j.ijrobp.2010.09.030
Kachnic, L. A., Winter, K., Myerson, R. J., Goodyear, M. D., Willins, J., Esthappan, J., . . . Willett, C. G. (2013). RTOG 0529: a phase 2 evaluation of dose-painted intensity modulated radiation therapy in combination with 5-fluorouracil and mitomycin-C for the reduction of acute morbidity in carcinoma of the anal canal. International Journal of Radiation Oncology, Biology, Physics, 86(1), 27-33. https://doi.org/10.1016/j.ijrobp.2012.09.023
Kim, D. W., Byer, J., Kothari, N., Mahipal, A., Chang, Y. D., & Kim, R. D. (2017). EGFR Inhibitors in Patients with Advanced Squamous Cell Anal Carcinomas: A Single-Institution Experience. Oncology, 92(4), 190-196. https://doi.org/10.1159/000452766
Kim, J. H., Beets, G. L., Kim, M. J., Kessels, A. G., & Beets-Tan, R. G. (2004). High-resolution MR imaging for nodal staging in rectal cancer: are there any criteria in addition to the size? European Journal of Radiology, 52(1), 78-83. https://doi.org/10.1016/j.ejrad.2003.12.005
Kim, R., Byer, J., Fulp, W. J., Mahipal, A., Dinwoodie, W., & Shibata, D. (2014). Carboplatin and paclitaxel treatment is effective in advanced anal cancer. Oncology, 87(2), 125-132. https://doi.org/10.1159/000361051
Kim, S., François, E., André, T., Samalin, E., Jary, M., El Hajbi, F., . . . Borg, C. (2018). Docetaxel, cisplatin, and fluorouracil chemotherapy for metastatic or unresectable locally recurrent anal squamous cell carcinoma (Epitopes-HPV02): a multicentre, single-arm, phase 2 study. Lancet Oncology, 19(8), 1094-1106. https://doi.org/10.1016/s1470-2045(18)30321-8
Kochhar, R., Plumb, A. A., Carrington, B. M., & Saunders, M. (2012). Imaging of anal carcinoma. AJR: American Journal of Roentgenology, 199(3), W335-344. https://doi.org/10.2214/ajr.11.8027
Koh, D. M., Dzik-Jurasz, A., O'Neill, B., Tait, D., Husband, J. E., & Brown, G. (2008). Pelvic phased-array MR imaging of anal carcinoma before and after chemoradiation. British Journal of Radiology, 81(962), 91-98. https://doi.org/10.1259/bjr/96187638
Krzowska-Firych, J., Lucas, G., Lucas, C., Lucas, N., & Pietrzyk, L. (2019). An overview of Human Papillomavirus (HPV) as an etiological factor of the anal cancer. Journal of infection and public health, 12(1), 1-6. https://doi.org/10.1016/j.jiph.2018.06.005
Kumar, S., Juresic, E., Barton, M., & Shafiq, J. (2010). Management of skin toxicity during radiation therapy: a review of the evidence. Journal of Medical Imaging and Radiation Oncology, 54(3), 264-279. https://doi.org/10.1111/j.1754-9485.2010.02170.x
Lam, J. U., Rebolj, M., Dugue, P. A., Bonde, J., von Euler-Chelpin, M., & Lynge, E. (2014). Condom use in prevention of Human Papillomavirus infections and cervical neoplasia: systematic review of longitudinal studies. Journal of Medical Screening, 21(1), 38-50. https://doi.org/10.1177/0969141314522454
Leon, O., Guren, M., Hagberg, O., Glimelius, B., Dahl, O., Havsteen, H., . . . Johnsson, A. (2014). Anal carcinoma - Survival and recurrence in a large cohort of patients treated according to Nordic guidelines. Radiotherapy and Oncology, 113(3), 352-358. https://doi.org/10.1016/j.radonc.2014.10.002
Leon, O., Guren, M. G., Radu, C., Gunnlaugsson, A., & Johnsson, A. (2015). Phase I study of cetuximab in combination with 5-fluorouracil, mitomycin C and radiotherapy in patients with locally advanced anal cancer. European Journal of Cancer, 51(18), 2740-2746. https://doi.org/10.1016/j.ejca.2015.08.029
Leon, O., Hagberg, O., & Johnsson, A. (2018). Primary surgery with or without postoperative radiotherapy in early stage squamous cell carcinoma in the anal canal and anal margin. Acta Oncologica, 57(9), 1209-1215. https://doi.org/10.1080/0284186x.2018.1442931
Lepinoy, A., Lescut, N., Puyraveau, M., Caubet, M., Boustani, J., Lakkis, Z., . . . Bosset, J. F. (2015). Evaluation of a 36 Gy elective node irradiation dose in anal cancer. Radiotherapy and Oncology, 116(2), 197-201. https://doi.org/10.1016/j.radonc.2015.07.050
Leve med kreft: nasjonal kreftstrategi (2018-2022). (2018). Oslo: Helse- og omsorgsdepartementet. Hentet fra https://www.regjeringen.no/contentassets/266bf1eec38940888a589ec86d79da20/regjeringens_kreftstrategi_180418.pdf
Liem, X., Saad, F., & Delouya, G. (2015). A Practical Approach to the Management of Radiation-Induced Hemorrhagic Cystitis. Drugs, 75(13), 1471-1482. https://doi.org/10.1007/s40265-015-0443-5
Lim, F., & Glynne-Jones, R. (2011). Chemotherapy/chemoradiation in anal cancer: a systematic review. Cancer Treatment Reviews, 37(7), 520-532. https://doi.org/10.1016/j.ctrv.2011.02.003
Liu, Y., Sigel, K., & Gaisa, M. M. (2018). Human Papillomavirus Genotypes Predict Progression of Anal Low-Grade Squamous Intraepithelial Lesions. Journal of Infectious Diseases, 218(11), 1746-1752. https://doi.org/10.1093/infdis/jiy463
Lov om kommunale helse- og omsorgstjenester. LOV-2011-06-24-30.
Lukan, N., Ströbel, P., Willer, A., Kripp, M., Dinter, D., Mai, S., . . . Hofheinz, R. D. (2009). Cetuximab-based treatment of metastatic anal cancer: correlation of response with KRAS mutational status. Oncology, 77(5), 293-299. https://doi.org/10.1159/000259615
Lund, J. A., Sundstrom, S. H., Haaverstad, R., Wibe, A., Svinsaas, M., & Myrvold, H. E. (2004). Endoanal ultrasound is of little value in follow-up of anal carcinomas. Diseases of the Colon and Rectum, 47(6), 839-842. https://doi.org/10.1007/s10350-004-0529-8
Macaya, A., Munoz-Santos, C., Balaguer, A., & Barbera, M. J. (2012). Interventions for anal canal intraepithelial neoplasia. The Cochrane database of systematic reviews, 12, CD009244. https://doi.org/10.1002/14651858.CD009244.pub2
Machalek, D. A., Poynten, M., Jin, F., Fairley, C. K., Farnsworth, A., Garland, S. M., . . . Grulich, A. E. (2012). Anal human papillomavirus infection and associated neoplastic lesions in men who have sex with men: a systematic review and meta-analysis. Lancet Oncology, 13(5), 487-500. https://doi.org/10.1016/s1470-2045(12)70080-3
Magdeburg, B., Fried, M., & Meyenberger, C. (1999). Endoscopic ultrasonography in the diagnosis, staging, and follow-up of anal carcinomas. Endoscopy, 31(5), 359-364. https://doi.org/10.1055/s-1999-35
Mai, S., Welzel, G., Ottstadt, M., Lohr, F., Severa, S., Prigge, E. S., . . . Reuschenbach, M. (2015). Prognostic Relevance of HPV Infection and p16 Overexpression in Squamous Cell Anal Cancer. International Journal of Radiation Oncology, Biology, Physics, 93(4), 819-827. https://doi.org/10.1016/j.ijrobp.2015.08.004
McMahon, C. J., Rofsky, N. M., & Pedrosa, I. (2010). Lymphatic metastases from pelvic tumors: anatomic classification, characterization, and staging. Radiology, 254(1), 31-46. https://doi.org/10.1148/radiol.2541090361
Meulendijks, D., Dewit, L., Tomasoa, N. B., van Tinteren, H., Beijnen, J. H., Schellens, J. H., & Cats, A. (2014). Chemoradiotherapy with capecitabine for locally advanced anal carcinoma: an alternative treatment option. British Journal of Cancer, 111(9), 1726-1733. https://doi.org/10.1038/bjc.2014.467
Meulendijks, D., Henricks, L. M., Sonke, G. S., Deenen, M. J., Froehlich, T. K., Amstutz, U., . . . Schellens, J. H. (2015). Clinical relevance of DPYD variants c.1679T>G, c.1236G>A/HapB3, and c.1601G>A as predictors of severe fluoropyrimidine-associated toxicity: a systematic review and meta-analysis of individual patient data. Lancet Oncology, 16(16), 1639-1650. https://doi.org/10.1016/s1470-2045(15)00286-7
Meulendijks, D., Tomasoa, N. B., Dewit, L., Smits, P. H., Bakker, R., van Velthuysen, M. L., . . . Cats, A. (2015). HPV-negative squamous cell carcinoma of the anal canal is unresponsive to standard treatment and frequently carries disruptive mutations in TP53. British Journal of Cancer, 112(8), 1358-1366. https://doi.org/10.1038/bjc.2015.20
Miles, T. (2012). International Guidelines on Vaginal Dilation after Pelvic Radiotherapy. Brook Hill, Woodstock, Oxon: Owen Mumford Ltd. Hentet fra http://www.ncsi.org.uk/wp-content/uploads/Inter-Best-Practice-Guide-Vaginal-Dilators-July-2012.pdf
Morris, V. K., Salem, M. E., Nimeiri, H., Iqbal, S., Singh, P., Ciombor, K., . . . Eng, C. (2017). Nivolumab for previously treated unresectable metastatic anal cancer (NCI9673): a multicentre, single-arm, phase 2 study. Lancet Oncology, 18(4), 446-453. https://doi.org/10.1016/s1470-2045(17)30104-3
Muehlbauer, P. M., Thorpe, D., Davis, A., Drabot, R., Rawlings, B. L., & Kiker, E. (2009). Putting evidence into practice: evidence-based interventions to prevent, manage, and treat chemotherapy- and radiotherapy-induced diarrhea. Clinical Journal of Oncology Nursing, 13(3), 336-341. https://doi.org/10.1188/09.cjon.336-341
Muirhead, R., Partridge, M., & Hawkins, M. A. (2015). A tumor control probability model for anal squamous cell carcinoma. Radiotherapy and Oncology, 116(2), 192-196. https://doi.org/10.1016/j.radonc.2015.07.014
Musio, D., De Felice, F., Manfrida, S., Balducci, M., Meldolesi, E., Gravina, G. L., . . . Valentini, V. (2015). Squamous cell carcinoma of the rectum: The treatment paradigm. European Journal of Surgical Oncology, 41(8), 1054-1058. https://doi.org/10.1016/j.ejso.2015.03.239
Myerson, R. J., Garofalo, M. C., El Naqa, I., Abrams, R. A., Apte, A., Bosch, W. R., . . . Kachnic, L. A. (2009). Elective clinical target volumes for conformal therapy in anorectal cancer: a radiation therapy oncology group consensus panel contouring atlas. International Journal of Radiation Oncology, Biology, Physics, 74(3), 824-830. https://doi.org/10.1016/j.ijrobp.2008.08.070
Nasjonal handlingsplan for kreft 2015-2017. (2015). (IS-2298). Oslo: Helsedirektoratet. Hentet fra https://helsedirektoratet.no/publikasjoner/nasjonal-handlingsplan-for-kreft-2015-2017
Nasjonal helse- og sykehusplan (2016−2019). (2015). (Meld. St. 11 (2015–2016)). Oslo: Helse- og omsorgsdepartemenetet. Hentet fra https://www.regjeringen.no/contentassets/7b6ad7e0ef1a403d97958bcb34478609/no/pdfs/stm201520160011000dddpdfs.pdf
Nasjonal strategi for kreftområdet 2006-2009. (2006). Oslo: Helse- og omsorgsdepartementet. Hentet fra https://www.regjeringen.no/globalassets/upload/hod/sykehus/kreftstrategi-2006-2009.pdf
Ng, M., Ho, H., Skelton, J., Guerrieri, M., Guiney, M., Chao, M., . . . Melven, L. (2018). Intensity-modulated Radiotherapy for Anal Cancer: Dose-Volume Relationship of Acute Gastrointestinal Toxicity and Disease Outcomes. Clinical Oncology (Royal College of Radiologists), 30(10), 634-641. https://doi.org/10.1016/j.clon.2018.07.020
Ng, M., Leong, T., Chander, S., Chu, J., Kneebone, A., Carroll, S., . . . Kachnic, L. (2012). Australasian Gastrointestinal Trials Group (AGITG) contouring atlas and planning guidelines for intensity-modulated radiotherapy in anal cancer. International Journal of Radiation Oncology, Biology, Physics, 83(5), 1455-1462. https://doi.org/10.1016/j.ijrobp.2011.12.058
Nguyen, B. T., Joon, D. L., Khoo, V., Quong, G., Chao, M., Wada, M., . . . Scott, A. (2008). Assessing the impact of FDG-PET in the management of anal cancer. Radiotherapy and Oncology, 87(3), 376-382. https://doi.org/10.1016/j.radonc.2008.04.003
Nigro, N. D. (1984). An evaluation of combined therapy for squamous cell cancer of the anal canal. Diseases of the Colon and Rectum, 27(12), 763-766.
Nigro, N. D., Vaitkevicius, V. K., & Considine, B., Jr. (1974). Combined therapy for cancer of the anal canal: a preliminary report. Diseases of the Colon and Rectum, 17(3), 354-356.
Nilsen, E., Alfsen, C. G., Feiring, B., Skjeldestad, F. E., Steen, R., & Sæterdal, I. (2007). Vaksiner mot humant papillomavirus (HPV): vurdering av effekt av profylaktiske HPV-vaksiner (Rapport fra Kunnskapssenteret Nr 5-2007). Oslo: Nasjonalt kunnskapssenter for helsetjenesten. Hentet fra http://www.kunnskapssenteret.no/publikasjoner/vaksiner-mot-humant-papillomavirus-hpv-vurdering-av-effekt-av-profylaktiske-hpv-vaksiner
Nilsson, M. P., Nilsson, E. D., Johnsson, A., Leon, O., Gunnlaugsson, A., & Scherman, J. (2020). Patterns of recurrence in anal cancer: a detailed analysis. Radiation Oncology (London, England), 15(1), 125. https://doi.org/10.1186/s13014-020-01567-7
Nilsson, P. J., Svensson, C., Goldman, S., & Glimelius, B. (2002). Salvage abdominoperineal resection in anal epidermoid cancer. British Journal of Surgery, 89(11), 1425-1429. https://doi.org/10.1046/j.1365-2168.2002.02231.x
Otto, S. D., Lee, L., Buhr, H. J., Frericks, B., Hocht, S., & Kroesen, A. J. (2009). Staging anal cancer: prospective comparison of transanal endoscopic ultrasound and magnetic resonance imaging. Journal of Gastrointestinal Surgery, 13(7), 1292-1298. https://doi.org/10.1007/s11605-009-0870-2
Parikh, J., Shaw, A., Grant, L. A., Schizas, A. M., Datta, V., Williams, A. B., & Griffin, N. (2011). Anal carcinomas: the role of endoanal ultrasound and magnetic resonance imaging in staging, response evaluation and follow-up. European Radiology, 21(4), 776-785. https://doi.org/10.1007/s00330-010-1980-7
Peron, J., Bylicki, O., Laude, C., Martel-Lafay, I., Carrie, C., & Racadot, S. (2015). Nonoperative management of squamous-cell carcinoma of the rectum. Diseases of the Colon and Rectum, 58(1), 60-64. https://doi.org/10.1097/dcr.0000000000000218
Pineda, C. E., & Welton, M. L. (2009). Management of anal squamous intraepithelial lesions. Clinics in Colon and Rectal Surgery, 22(2), 94-101. https://doi.org/10.1055/s-0029-1223840
Rao, S., Guren, M. G., Khan, K., Brown, G., Renehan, A. G., Steigen, S. E., . . . Arnold, D. (2021). Anal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology, Jun 22 Epub ahead of print. https://doi.org/10.1016/j.annonc.2021.06.015
Rao, S., Sclafani, F., Eng, C., Adams, R. A., Guren, M. G., Sebag-Montefiore, D., . . . Cunningham, D. (2020). International Rare Cancers Initiative Multicenter Randomized Phase II Trial of Cisplatin and Fluorouracil Versus Carboplatin and Paclitaxel in Advanced Anal Cancer: InterAAct. Journal of Clinical Oncology, 38(22), 2510-2518. https://doi.org/10.1200/jco.19.03266
Renehan, A. G., & O'Dwyer, S. T. (2011). Management of local disease relapse. Colorectal Disease, 13 Suppl 1, 44-52. https://doi.org/10.1111/j.1463-1318.2010.02500.x
Renehan, A. G., Saunders, M. P., Schofield, P. F., & O'Dwyer, S. T. (2005). Patterns of local disease failure and outcome after salvage surgery in patients with anal cancer. British Journal of Surgery, 92(5), 605-614. https://doi.org/10.1002/bjs.4908
Richel, O., de Vries, H. J., van Noesel, C. J., Dijkgraaf, M. G., & Prins, J. M. (2013). Comparison of imiquimod, topical fluorouracil, and electrocautery for the treatment of anal intraepithelial neoplasia in HIV-positive men who have sex with men: an open-label, randomised controlled trial. Lancet Oncology, 14(4), 346-353. https://doi.org/10.1016/s1470-2045(13)70067-6
Roach, S. C., Hulse, P. A., Moulding, F. J., Wilson, R., & Carrington, B. M. (2005). Magnetic resonance imaging of anal cancer. Clinical Radiology, 60(10), 1111-1119. https://doi.org/10.1016/j.crad.2005.05.008
Rodel, F., Wieland, U., Fraunholz, I., Kitz, J., Rave-Frank, M., Wolff, H. A., . . . Rodel, C. (2015). Human papillomavirus DNA load and p16INK4a expression predict for local control in patients with anal squamous cell carcinoma treated with chemoradiotherapy. International Journal of Cancer, 136(2), 278-288. https://doi.org/10.1002/ijc.28979
Rogers, J. E., & Eng, C. (2017). Pharmacotherapy of Anal Cancer. Drugs, 77(14), 1519-1530. https://doi.org/10.1007/s40265-017-0792-3
Salerno, G., Daniels, I., Heald, R. J., Brown, G., & Moran, B. J. (2004). Management and imaging of low rectal carcinoma. Surgical Oncology, 13(2-3), 55-61. https://doi.org/10.1016/j.suronc.2004.09.013
Sammen - mot kreft: nasjonal kreftstrategi 2013-2017. (2013). Oslo: Helse- og omsorgsdepartementet.
Scholefield, J. H., Castle, M. T., & Watson, N. F. (2005). Malignant transformation of high-grade anal intraepithelial neoplasia. British Journal of Surgery, 92(9), 1133-1136. https://doi.org/10.1002/bjs.4994
Sclafani, F., & Rao, S. (2018). Systemic Therapies for Advanced Squamous Cell Anal Cancer. Current Oncology Reports, 20(7), 53. https://doi.org/10.1007/s11912-018-0698-6
Sekhar, H., Malcomson, L., Kochhar, R., Sperrin, M., Alam, N., Chakrbarty, B., . . . Renehan, A. G. (2020). Temporal improvements in loco-regional failure and survival in patients with anal cancer treated with chemo-radiotherapy: treatment cohort study (1990-2014). British Journal of Cancer, 122(6), 749-758. https://doi.org/10.1038/s41416-019-0689-x
Seneffekter etter kreftbehandling: faglige råd. (2017). (IS-2551). Oslo: Helsedirektoratet. Hentet fra https://helsedirektoratet.no/Lists/Publikasjoner/Attachments/1276/Seneffekter%20etter%20kreftbehandling-IS-2551.pdf
Serup-Hansen, E., Linnemann, D., Skovrider-Ruminski, W., Hogdall, E., Geertsen, P. F., & Havsteen, H. (2014). Human papillomavirus genotyping and p16 expression as prognostic factors for patients with American Joint Committee on Cancer stages I to III carcinoma of the anal canal. Journal of Clinical Oncology, 32(17), 1812-1817. https://doi.org/10.1200/jco.2013.52.3464
Shida, D., Kanemitsu, Y., Hamaguchi, T., & Shimada, Y. (2019). Introducing the eighth edition of the tumor-node-metastasis classification as relevant to colorectal cancer, anal cancer and appendiceal cancer: a comparison study with the seventh edition of the tumor-node-metastasis and the Japanese Classification of Colorectal, Appendiceal, and Anal Carcinoma. Japanese Journal of Clinical Oncology, 49(4), 321-328. https://doi.org/10.1093/jjco/hyy198
Shiels, M. S., Pfeiffer, R. M., Chaturvedi, A. K., Kreimer, A. R., & Engels, E. A. (2012). Impact of the HIV epidemic on the incidence rates of anal cancer in the United States. Journal of the National Cancer Institute, 104(20), 1591-1598. https://doi.org/10.1093/jnci/djs371
Slørdahl, K. S., Klotz, D., Olsen, J., Skovlund, E., Undseth, C., Abildgaard, H. L., . . . Guren, M. G. (2021). Treatment outcomes and prognostic factors after chemoradiotherapy for anal cancer. Acta Oncologica, Dec 15 [Epub ahead of print]. https://doi.org/10.1080/0284186x.2021.1918763
Sodergren, S. C., Johnson, C. D., Gilbert, A., Tomaszewski, K. A., Chu, W., Chung, H. T., . . . Vassiliou, V. (2018). Phase I-III development of the EORTC QLQ-ANL27, a health-related quality of life questionnaire for anal cancer. Radiotherapy and Oncology, 126(2), 222-228. https://doi.org/10.1016/j.radonc.2017.11.018
Sodergren, S. C., Vassiliou, V., Dennis, K., Tomaszewski, K. A., Gilbert, A., Glynne-Jones, R., . . . Johnson, C. D. (2015). Systematic review of the quality of life issues associated with anal cancer and its treatment with radiochemotherapy. Supportive Care in Cancer, 23(12), 3613-3623. https://doi.org/10.1007/s00520-015-2879-2
Spithoff, K., Cummings, B., Jonker, D., & Biagi, J. J. (2014). Chemoradiotherapy for squamous cell cancer of the anal canal: a systematic review. Clinical Oncology (Royal College of Radiologists), 26(8), 473-487. https://doi.org/10.1016/j.clon.2014.03.005
Statistik om analkræft. (12. august 2019). [nettside]. København: Kræftens Bekæmpelse. Hentet 6. april 2021, fra https://www.cancer.dk/analkraeft-analcancer/statistik-analkraeft/
Stoker, J., Rociu, E., Wiersma, T. G., & Lameris, J. S. (2000). Imaging of anorectal disease. British Journal of Surgery, 87(1), 10-27. https://doi.org/10.1046/j.1365-2168.2000.01338.x
Sturgeon, J. D., Crane, C. H., Krishnan, S., Minsky, B. D., Skibber, J. M., Rodriguez-Bigas, M. A., . . . Das, P. (2017). Definitive Chemoradiation for Squamous Cell Carcinoma of the Rectum. American Journal of Clinical Oncology, 40(2), 163-166. https://doi.org/10.1097/coc.0000000000000126
Sun, G., Dong, X., Tang, X., Qu, H., Zhang, H., & Zhao, E. (2018). The prognostic value of HPV combined p16 status in patients with anal squamous cell carcinoma: a meta-analysis. Oncotarget, 9(8), 8081-8088. https://doi.org/10.18632/oncotarget.23545
Sunesen, K. G., Norgaard, M., Thorlacius-Ussing, O., & Laurberg, S. (2010). Immunosuppressive disorders and risk of anal squamous cell carcinoma: a nationwide cohort study in Denmark, 1978-2005. International Journal of Cancer, 127(3), 675-684. https://doi.org/10.1002/ijc.25080
Tahir, A. R., Westhuyzen, J., Dass, J., Collins, M. K., Webb, R., Hewitt, S., . . . McKay, M. (2015). Hyperbaric oxygen therapy for chronic radiation-induced tissue injuries: Australasia's largest study. Asia-Pacific Journal of Clinical Oncology, 11(1), 68-77. https://doi.org/10.1111/ajco.12289
Taylor, A., Rockall, A. G., Reznek, R. H., & Powell, M. E. (2005). Mapping pelvic lymph nodes: guidelines for delineation in intensity-modulated radiotherapy. International Journal of Radiation Oncology, Biology, Physics, 63(5), 1604-1612. https://doi.org/10.1016/j.ijrobp.2005.05.062
The Royal College of Radiologists. (20019). The timely delivery of radical radiotherapy: standards and guidelines for the management of unscheduled treatment interruptions (4. utg.). London: The Royal College of Radiologist. Hentet fra https://www.rcr.ac.uk/system/files/publication/field_publication_files/bfco191_radiotherapy-treatment-interruptions.pdf
Thind, G., Johal, B., Follwell, M., & Kennecke, H. F. (2014). Chemoradiation with capecitabine and mitomycin-C for stage I-III anal squamous cell carcinoma. Radiation Oncology (London, England), 9, 124. https://doi.org/10.1186/1748-717x-9-124
TNM Classification of Malignant Tumours. (2017). (8. utg.). New York: John Wiley & Sons.
Vanneste, B. G., Van De Voorde, L., de Ridder, R. J., Van Limbergen, E. J., Lambin, P., & van Lin, E. N. (2015). Chronic radiation proctitis: tricks to prevent and treat. International Journal of Colorectal Disease, 30(10), 1293-1303. https://doi.org/10.1007/s00384-015-2289-4
Wade, D. S., Herrera, L., Castillo, N. B., & Petrelli, N. J. (1989). Metastases to the lymph nodes in epidermoid carcinoma of the anal canal studied by a clearing technique. Surgery, Gynecology and Obstetrics, 169(3), 238-242.
Watson, A. J., Smith, B. B., Whitehead, M. R., Sykes, P. H., & Frizelle, F. A. (2006). Malignant progression of anal intra-epithelial neoplasia. ANZ Journal of Surgery, 76(8), 715-717. https://doi.org/10.1111/j.1445-2197.2006.03837.x
Wells, I. T., & Fox, B. M. (2012). PET/CT in anal cancer - is it worth doing? Clinical Radiology, 67(6), 535-540. https://doi.org/10.1016/j.crad.2011.10.030
WHO Classification of Tumours of the Digestive System. (2010). (4. utg.). Lyon: International Agency for Research on Cancer.
Wildiers, H., Heeren, P., Puts, M., Topinkova, E., Janssen-Heijnen, M. L., Extermann, M., . . . Hurria, A. (2014). International Society of Geriatric Oncology consensus on geriatric assessment in older patients with cancer. Journal of Clinical Oncology, 32(24), 2595-2603. https://doi.org/10.1200/jco.2013.54.8347
Winer, R. L., Hughes, J. P., Feng, Q., O'Reilly, S., Kiviat, N. B., Holmes, K. K., & Koutsky, L. A. (2006). Condom use and the risk of genital human papillomavirus infection in young women. New England Journal of Medicine, 354(25), 2645-2654. https://doi.org/10.1056/NEJMoa053284
Zidar, N., Langner, C., Odar, K., Hošnjak, L., Kamaradova, K., Daum, O., . . . Poljak, M. (2017). Anal verrucous carcinoma is not related to infection with human papillomaviruses and should be distinguished from giant condyloma (Buschke-Lowenstein tumour). Histopathology, 70(6), 938-945. https://doi.org/10.1111/his.13158
zur Hausen, H. (2000). Papillomaviruses causing cancer: evasion from host-cell control in early events in carcinogenesis. Journal of the National Cancer Institute, 92(9), 690-698. https://doi.org/10.1093/jnci/92.9.690
Aass, N., Haugne, D. F., Rosland, J. H., HJordhøy, M., Dønnem, T., & Knudsen, A. K. (2015). Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen (5. utg.). (IS-2285). Oslo: Helsedirektoratet. Hentet fra https://helsedirektoratet.no/retningslinjer/nasjonalt-handlingsprogram-med-retningslinjer-for-palliasjon-i-kreftomsorgen









