Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av pasienter med brystkreft
Hva er nytt?
Sist faglig oppdatert: 02202402.07.2024
Juli 2024
- Ny omtale av kardial utredning for pasienter som skal motta HER2-rettet behandling eller adjuvant kjemoterapi som inkluderer antracyklin.
- Avsnittene som omhandler boostbestråling er endret, inkludert omtale/anbefaling av simultan integrert boostbestråling (SIB).
- Tidligere grense i forhold til strålebehandling av alle axillenivåer (10 fjernede axillære lymfeknuter), hvis indikasjon for lokoregional strålebehandling, er fjernet. Dette er erstattet med begrepet «adekvat axilledisseksjon».
- Det er gjort endringer i grunnlaget for vurdering av/anbefaling av bestråling av parasternale lymfeknuter etter nye studieresultater.
- Det er inkludert oversikt over anbefalinger knyttet til eventuell samtidig strålebehandling og nye medikamenter
- Flere tabeller/figurer knyttet til oversikt over behandlingsanbefalinger er revidert/oppdatert
- Det er gjort endringer i spesifikk oversikt over anbefalingene knyttet til adjuvant endokrin behandling
- Det er gjort oppdateringer knyttet til nye studieresultater for flere aktuelle medikamentelle behandlinger
- Det er lagt til veiledende «dosebegresning» ved bruk av carboplatin (AUC x 150)
- En klarere anbefaling og omtale om bruk av genekspresjonsprofilering (Prosigna) ved HR+HER2- lymfeknute negativ sykdom er beskrevet.
- Det er lagt til omtale av ny studie knyttet til medikamentell behandling ved DCIS.
- Det er gjort noen endringer i omtale/anbefalinger av metastatisk hormonreseptor positiv brystkreft. Bruk av CDK4/6 hemmere i kombinasjon med hormonbehandling bør nå benyttes primært også ved mer omfattende viscerale metastaser i 1. linje dersom sykdommen forventes å kunne være endokrin sensitiv. Det er også inkludert råd som utgangspunkt for valg mellom de forskjellige CDK4/6 hemmere
- Nytt avsnitt om fett-transplantasjon er inkludert.
- Diagnostikk: et nytt avsnitt som omhandler kontrastmammografi er lagt til.
- Nytt oppdatert kapittel om arvelig brystkreft er inkludert.
- Epidemiologikapitlet er oppdatert med nye tall fra Kreftregisteret.
- Det er gjort mindre endringer i beskrivelsen av kontrollopplegget ved brystkreft hos menn.
- Det er ellers gjort noen mindre tekstlige endringer, klargjøringer og andre oppdateringer av studieresultater
Epidemiologi
Forekomst av brystkreft
Sist faglig oppdatert: 02202402.07.2024
Brystkreft er den klart hyppigste kreftformen hos kvinner, og utgjør 23 % av alle krefttilfeller hos kvinner. Den kumulative risiko for å utvikle brystkreft fram til 80 års alder er 10.7 %. I 2020 var det 3494 nye tilfellerav brystkreft i Norge (hos kvinner; i tillegg 31 menn). Tilsvarende tall for 2019 var 3738 (+27 menn). Det ble funnet en reduksjon av nye tilfeller på cirka 10% fra 2019 til 2020, noe som sannsynligvis har sammenheng med at mammografiscreeningen ble stoppet noen måneder i 2020 som følge av Covid-19 pandemien (Larsen, 2021). I 2022 var det en markant økning til 4247 nye tilfeller, inkludert 23 menn. Det var en økning i insidensraten på 5.2% i perioden 2018-2022 sammenlignet med forrige 5-års periode. Økningen var tydeligst for kvinner i screeningalder. Til sammenligning rammet sykdommen 1235 kvinner i 1970. Den aldersstandardiserte insidensen har økt fra 66.8 per 100 000 i perioden 1963–1967 til 133.6 i perioden 2018-2022. Brystkreft rammer først og fremst kvinner over 50 år. Kun 4.8 % av nye tilfeller inntraff hos kvinner under 40 år i årene 2014–2019. Brystkreft utgjør 34.8 % av all kreft hos kvinner i alderen 25–49 år. I perioden 2018–2022 hadde Rogaland den høyeste aldersjusterte forekomst av brystkreft og Troms og Finnmark den laveste (henholdsvis 143.6 og 122.8 per 100 000 personår) (Larsen, 2023).
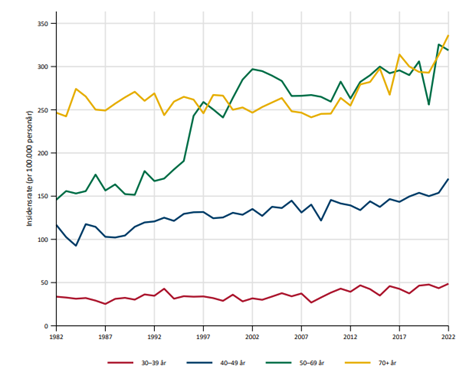
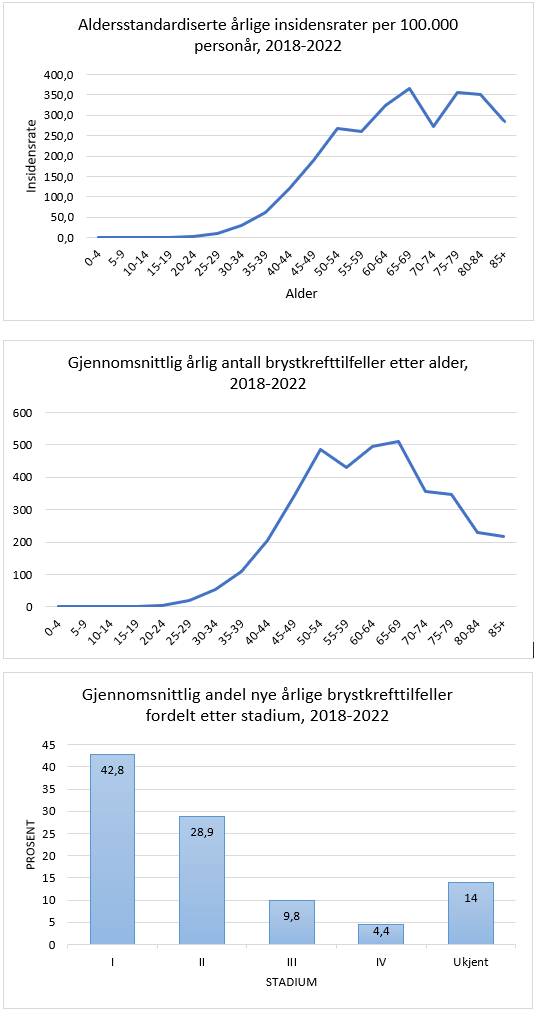
Overlevelse
Sist faglig oppdatert: 02202402.07.2024
I 2021 døde 587 kvinner og 19 menn av brystkreft (Larsen, 2023). Brystkreft er den viktigste årsak til tapte leveår hos kvinner opp til 65 år og rangerer således foran både hjerte/kar sykdommer og ulykker. Ved utgangen av 2022 hadde var brystkreftprevalensen i Norge 57118 (Larsen, 2023). Prognosen ved brystkreft er sterkt avhengig av stadium, som igjen kan påvirkes av tidlig diagnostikk. Resultater fra det norske mammografiscreeningprogrammet viser at de som møtte til screening hadde en 43 % lavere brystkreftdødelighet enn de som ikke møtte (Hofvind et al., 2013).
For årene 2018-2022 var fem års relativ overlevelse 100 % ved stadium I (svulststørrelse ≤ 2 cm uten spredning til lymfeknuter) mot 39.1 % hvis det forelå fjernspredning på diagnosetidspunktet. Brystkreftpasienter har en klar overdødelighet i mer enn 20 år etter at diagnosen er stillet. Ett år etter operasjon er 98,1 % i live. Etter 15 år er 83.3 % i live (Larsen, 2021).
Stadium | 1983-87 | 1988-92 | 1993-97 | 1998-02 | 2003-07 | 2008-12 | 2013-17 | 2018-22* |
|---|---|---|---|---|---|---|---|---|
Alle | 74.3 | 76.7 | 80.3 | 85.7 | 88.0 | 898.6 | 91.8 | 92.5 |
I | 88.6 | 94.9 | 95.9 | 99.3 | 99.6 | 100.6 | 100.5 | 100.7 |
II | 69.3 | 74.5 | 78.2 | 86.4 | 89.3 | 93.8 | 95.5 | 96.4 |
III | 49.5 | 49.1 | 58.1 | 65.6 | 67.1 | 79.3 | 78.4 | 79.8 |
IV | 16.4 | 22.5 | 21.7 | 21.4 | 23.7 | 23.4 | 35.0 | 39.1 |
Ukjent | 84.1 | 86.1 | 83.2 | 88.2 | 76.1 | 69.6 | 78.4 | 82.8 |

Mammografiscreening og oppfølging av kvinner med økt risiko for brystkreft
Mammografiscreening (50–69 år)
Sist faglig oppdatert: 02202402.07.2024
Mammografi er røntgenundersøkelse av brystene, og brukes som screeningundersøkelse for å finne brystkrefttilfeller i tidlig stadium i den hensikt å redusere dødeligheten av sykdommen.
Det foreligger resultater fra flere undersøkelser i Skandinavia, Europa for øvrig og USA som viser en klar reduksjon av brystkreftdødeligheten som følge av systematisk screening (Breast cancer screening, 2002; Broeders et al., 2012; Gøtzsche & Nielsen, 2011; Hofvind et al., 2013; Njor et al., 2012; Nystrom et al., 2002; Tabar et al., 2001; Yen et al., 2003) (Evidensnivå A). Det norske Mammografiprogrammet (MP), som ble landsdekkende fra februar 2004, tilbyr alle norske kvinner i alderen 50–69 år 2-plans mammografi av hvert bryst hvert 2. år. Dette er et kvalitetssikret program som legger til grunn de europeiske retningslinjer for screening. Forskningsrådet publiserte i 2015 en uavhengig vurdering av resultater fra Mammografiprogrammet. Evalueringen konkluderer med at Mammografiprogrammet tilnærmet oppfyller målet om 30 % redusert dødelighet av brystkreft blant de som blir invitert og anbefaler at programmet fortsetter (Research based evaluation of the Norwegian Breast Cancer Screening Program: final report, 2015).
Anbefaling:
Det anbefales at alle norske kvinner i alderen 50–69 år bør gjennomgå 2-plans mammografi av hvert bryst hvert 2. år. Dette bør skje i regi av Mammografiprogrammet. Det er per i dag ingen offentlig anbefaling om mammografiscreening utenfor denne aldersgruppen. Kvinner med innlagt (silikon-)proteser skal også inngå i Mammografiprogrammet selv om diagnostikken er mindre sikker i disse tilfeller. Ultralyd er ikke aktuell som screeningmetode i Mammografiprogrammet, selv ikke hos kvinner med innsatt brystprotese.
Kvinner med arvelig økt risiko for brystkreft
Sist faglig oppdatert: 02202402.07.2024
Ved mistanke om arvelig økt risiko for brystkreft, skal kvinnen henvises genetisk utredning før eventuelle tiltak i form av radiologiske kontroller blir satt i verk. Dette er viktig både for å sikre seg at det virkelig foreligger en økt risiko, og for at kvinnen får en korrekt oppfølging avhengig av risikonivå (se kapitlet "Arvelig brystkreft").
Dersom det er påvist høypenetrant eller moderat penetrant genfeil, se avsnitt "Kvinner med påvist høypenetrant genfeil (risikogruppe A)" og "Kvinner med påvist moderat penetrant genfeil (risikogruppe B)" i kapittel "Radiologisk brystdiagnostikk hos kvinner med genetisk økt risiko for brystkreft" for anbefalinger om billeddiagnostiske kontroller. For anbefalinger for kvinner med økt risiko vurdert ut ifra familiehistorie se avsnitt "Kvinner med økt risiko vurdert ut ifra familiehistorie (risikogruppe C)". Tabellarisk oversikt over kontrollanbefalingene finnes også i kapittel "Radiologisk brystdiagnostikk hos kvinner med genetisk økt risiko for brystkreft", avsnitt "Oversikt over anbefaling for bruk av billeddiagnostikk ved arvelig kreft".
Kvinner operert for brystkreft/DCIS
Sist faglig oppdatert: 02202402.07.2024
- Det anbefales årlig mammografi i 10 år både etter brystbevarende kirurgi (BCT) og etter mastectomi (ablatio).
- Kvinner som er i målgruppen for Mammografiprogrammet (50-69 år) kan om ønskelig møte på screeninginvitasjoner annet hvert år og bli henvist til klinisk mammografi årene i mellom.
- Etter 10 år uten påvisning av residiv skal alle over 50 år tilbys deltagelse i Mammografiprogrammet med mammografi hvert annet år, på lik linje med kvinner som ikke har hatt brystkreft. Merk at noen kvinner kan være 51- 53 år før de får sin første invitasjon til Mammografiprogrammet.
- For pasienter som 10 år etter brystkreftoperasjon ikke har nådd screeningalder, er det aktuelt å fortsette med årlig mammografi frem til de kan inngå i Mammografiprogrammet. Merk at noen kvinner kan være 51- 53 år før de får sin første invitasjon til Mammografiprogrammet.
- Ved høy alder ved diagnose gjøres det individuell vurdering om det er indisert med årlige mammografikontroller i 10 år, med spesielt fokus på komorbiditet, biologisk alder/forventet levetid.
- Pasienter operert med rekonstruksjon med eget vev eller protese etter mastektomi har ikke behov for radiologiske kontroller av det nye brystet.
- Det er ikke behov for radiologisk kontroll av brystvegg etter mastectomi.
- Ved kontroller av gravide/ammende bør det gjøres ultralyd i tillegg til mammografi
For mer informasjon om kontrollhyppighet og innhold, se også kapittel "Oppfølging og etterkontroll etter avsluttet kurativ behandling" (inkl. pkt. "Kontrollhyppighet og innhold")
Kvinner som har fått påvist epitelhyperplasier med atypi eller LCIS
Sist faglig oppdatert: 02202402.07.2024
For kontrollopplegg hos kvinner som har fått påvist epitelhyperplasier med atypi eller LCIS, vises det til oversikten i kapittel Oversikt over behandlings- og kontrollforslag ved premaligne tilstander.
Kvinner behandlet med strålebehandling mot thorax i ung alder
Sist faglig oppdatert: 02202402.07.2024
Kvinner som har mottatt strålebehandling mot thorax i ung alder har økt risiko for sekundær brystkreft (Mulder et al., 2020). Denne risiko øker med tiden etter strålebehandling og ser ut til å vedvare livet ut. Detaljer om dette står i Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av maligne lymfomer.
På bakgrunn av dette anbefales tidlig diagnostikk til kvinnelige kreftoverlevere der onkolog etter individuell risikovurdering finner behov for slik oppfølging. Onkolog, fastlege og pasient må sammen passe på at oppfølging blir startet på rett tidspunkt. Tilbudet er differensiert etter brysttetthet da MR som tillegg til mammografi er viktigst hos kvinner med høy brysttetthet. Radiolog må derfor informere om brystetthet i svaret slik at tilbudet kan justeres ved behov.
Anbefaling:
- Disse kvinnene skal ha tilbud om årlig billeddiagnostikk fra 8-10 år etter mottatt strålebehandling, men ikke før fylte 25 år.
- Ved brysttetthet c og d tilbys pasienten årlig mammografi (ett skråbilde av hvert bryst) samt årlig MR mamma fram til fylte 70 år.
- Ved brystetthet a og b tilbys pasienten årlig to-plans mammografi fram til fylte 70 år.
- Etter 70 års alder er det onkolog eller fastlege som har ansvar for å vurdere om risikoprofil og generell helse tilsier at det er nødvendig med videre oppfølging med mammografi. Det er ikke aktuelt å gjøre MR mamma etter fylte 70 år.
Screening for brystkreft hos kvinner som skal gjennomgå benign brystkirurgi
Sist faglig oppdatert: 02202402.07.2024
Reduksjon/løft eller forstørrelse av bryst
Før reduksjon/løft eller forstørrelse av bryst bør det gjøres en grundig klinisk undersøkelse. Behov for mammografiundersøkelse anbefales i tråd med følgende:
- Kvinner <40 år: Mammografi ikke nødvendig.
- Kvinner >40 år: Mammografi (eller screening-mammografi for pasienter som deltar i mammografiprogrammet) bør være gjort innen 6 måneder før inngrepet.
- Ved fjernelse av vev fra brystet skal preparatet orienteres og sendes til histologisk undersøkelse.
Oppfølging av transseksuelle personer
Sist faglig oppdatert: 02202402.07.2024
Transpersoner har økt risiko for brystkreft i forhold til cisseksuelle menn (de Blok et al., 2019). Dette er en så liten gruppe pasienter at vi anbefaler at fastlegene henviser transkvinner som får/fikk hormonbehandling, og transmenn som ikke har utført (adekvat) mastektomi, til klinisk mammografi ved lokalt BDS. I mangel av dokumenterte screeningresultater for denne gruppen, anbefales i utgangspunktet å gjennomføre slike kontroller innenfor alder for anbefalt mammografiscreening av ciskvinner (50–69 år) (C. N. Clarke et al., 2021).
Mammografiscreening (50–69 år)
Sist faglig oppdatert: 02202402.07.2024
Mammografi er røntgenundersøkelse av brystene, og brukes som screeningundersøkelse for å finne brystkrefttilfeller i tidlig stadium i den hensikt å redusere dødeligheten av sykdommen.
Det foreligger resultater fra flere undersøkelser i Skandinavia, Europa for øvrig og USA som viser en klar reduksjon av brystkreftdødeligheten som følge av systematisk screening (Breast cancer screening, 2002; Broeders et al., 2012; Gøtzsche & Nielsen, 2011; Hofvind et al., 2013; Njor et al., 2012; Nystrom et al., 2002; Tabar et al., 2001; Yen et al., 2003) (Evidensnivå A). Det norske Mammografiprogrammet (MP), som ble landsdekkende fra februar 2004, tilbyr alle norske kvinner i alderen 50–69 år 2-plans mammografi av hvert bryst hvert 2. år. Dette er et kvalitetssikret program som legger til grunn de europeiske retningslinjer for screening. Forskningsrådet publiserte i 2015 en uavhengig vurdering av resultater fra Mammografiprogrammet. Evalueringen konkluderer med at Mammografiprogrammet tilnærmet oppfyller målet om 30 % redusert dødelighet av brystkreft blant de som blir invitert og anbefaler at programmet fortsetter (Research based evaluation of the Norwegian Breast Cancer Screening Program: final report, 2015).
Anbefaling:
Det anbefales at alle norske kvinner i alderen 50–69 år bør gjennomgå 2-plans mammografi av hvert bryst hvert 2. år. Dette bør skje i regi av Mammografiprogrammet. Det er per i dag ingen offentlig anbefaling om mammografiscreening utenfor denne aldersgruppen. Kvinner med innlagt (silikon-)proteser skal også inngå i Mammografiprogrammet selv om diagnostikken er mindre sikker i disse tilfeller. Ultralyd er ikke aktuell som screeningmetode i Mammografiprogrammet, selv ikke hos kvinner med innsatt brystprotese.
Kvinner med arvelig økt risiko for brystkreft
Sist faglig oppdatert: 02202402.07.2024
Ved mistanke om arvelig økt risiko for brystkreft, skal kvinnen henvises genetisk utredning før eventuelle tiltak i form av radiologiske kontroller blir satt i verk. Dette er viktig både for å sikre seg at det virkelig foreligger en økt risiko, og for at kvinnen får en korrekt oppfølging avhengig av risikonivå (se kapitlet "Arvelig brystkreft").
Dersom det er påvist høypenetrant eller moderat penetrant genfeil, se avsnitt "Kvinner med påvist høypenetrant genfeil (risikogruppe A)" og "Kvinner med påvist moderat penetrant genfeil (risikogruppe B)" i kapittel "Radiologisk brystdiagnostikk hos kvinner med genetisk økt risiko for brystkreft" for anbefalinger om billeddiagnostiske kontroller. For anbefalinger for kvinner med økt risiko vurdert ut ifra familiehistorie se avsnitt "Kvinner med økt risiko vurdert ut ifra familiehistorie (risikogruppe C)". Tabellarisk oversikt over kontrollanbefalingene finnes også i kapittel "Radiologisk brystdiagnostikk hos kvinner med genetisk økt risiko for brystkreft", avsnitt "Oversikt over anbefaling for bruk av billeddiagnostikk ved arvelig kreft".
Kvinner operert for brystkreft/DCIS
Sist faglig oppdatert: 02202402.07.2024
- Det anbefales årlig mammografi i 10 år både etter brystbevarende kirurgi (BCT) og etter mastectomi (ablatio).
- Kvinner som er i målgruppen for Mammografiprogrammet (50-69 år) kan om ønskelig møte på screeninginvitasjoner annet hvert år og bli henvist til klinisk mammografi årene i mellom.
- Etter 10 år uten påvisning av residiv skal alle over 50 år tilbys deltagelse i Mammografiprogrammet med mammografi hvert annet år, på lik linje med kvinner som ikke har hatt brystkreft. Merk at noen kvinner kan være 51- 53 år før de får sin første invitasjon til Mammografiprogrammet.
- For pasienter som 10 år etter brystkreftoperasjon ikke har nådd screeningalder, er det aktuelt å fortsette med årlig mammografi frem til de kan inngå i Mammografiprogrammet. Merk at noen kvinner kan være 51- 53 år før de får sin første invitasjon til Mammografiprogrammet.
- Ved høy alder ved diagnose gjøres det individuell vurdering om det er indisert med årlige mammografikontroller i 10 år, med spesielt fokus på komorbiditet, biologisk alder/forventet levetid.
- Pasienter operert med rekonstruksjon med eget vev eller protese etter mastektomi har ikke behov for radiologiske kontroller av det nye brystet.
- Det er ikke behov for radiologisk kontroll av brystvegg etter mastectomi.
- Ved kontroller av gravide/ammende bør det gjøres ultralyd i tillegg til mammografi
For mer informasjon om kontrollhyppighet og innhold, se også kapittel "Oppfølging og etterkontroll etter avsluttet kurativ behandling" (inkl. pkt. "Kontrollhyppighet og innhold")
Kvinner som har fått påvist epitelhyperplasier med atypi eller LCIS
Sist faglig oppdatert: 02202402.07.2024
For kontrollopplegg hos kvinner som har fått påvist epitelhyperplasier med atypi eller LCIS, vises det til oversikten i kapittel Oversikt over behandlings- og kontrollforslag ved premaligne tilstander.
Kvinner behandlet med strålebehandling mot thorax i ung alder
Sist faglig oppdatert: 02202402.07.2024
Kvinner som har mottatt strålebehandling mot thorax i ung alder har økt risiko for sekundær brystkreft (Mulder et al., 2020). Denne risiko øker med tiden etter strålebehandling og ser ut til å vedvare livet ut. Detaljer om dette står i Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av maligne lymfomer.
På bakgrunn av dette anbefales tidlig diagnostikk til kvinnelige kreftoverlevere der onkolog etter individuell risikovurdering finner behov for slik oppfølging. Onkolog, fastlege og pasient må sammen passe på at oppfølging blir startet på rett tidspunkt. Tilbudet er differensiert etter brysttetthet da MR som tillegg til mammografi er viktigst hos kvinner med høy brysttetthet. Radiolog må derfor informere om brystetthet i svaret slik at tilbudet kan justeres ved behov.
Anbefaling:
- Disse kvinnene skal ha tilbud om årlig billeddiagnostikk fra 8-10 år etter mottatt strålebehandling, men ikke før fylte 25 år.
- Ved brysttetthet c og d tilbys pasienten årlig mammografi (ett skråbilde av hvert bryst) samt årlig MR mamma fram til fylte 70 år.
- Ved brystetthet a og b tilbys pasienten årlig to-plans mammografi fram til fylte 70 år.
- Etter 70 års alder er det onkolog eller fastlege som har ansvar for å vurdere om risikoprofil og generell helse tilsier at det er nødvendig med videre oppfølging med mammografi. Det er ikke aktuelt å gjøre MR mamma etter fylte 70 år.
Screening for brystkreft hos kvinner som skal gjennomgå benign brystkirurgi
Sist faglig oppdatert: 02202402.07.2024
Reduksjon/løft eller forstørrelse av bryst
Før reduksjon/løft eller forstørrelse av bryst bør det gjøres en grundig klinisk undersøkelse. Behov for mammografiundersøkelse anbefales i tråd med følgende:
- Kvinner <40 år: Mammografi ikke nødvendig.
- Kvinner >40 år: Mammografi (eller screening-mammografi for pasienter som deltar i mammografiprogrammet) bør være gjort innen 6 måneder før inngrepet.
- Ved fjernelse av vev fra brystet skal preparatet orienteres og sendes til histologisk undersøkelse.
Oppfølging av transseksuelle personer
Sist faglig oppdatert: 02202402.07.2024
Transpersoner har økt risiko for brystkreft i forhold til cisseksuelle menn (de Blok et al., 2019). Dette er en så liten gruppe pasienter at vi anbefaler at fastlegene henviser transkvinner som får/fikk hormonbehandling, og transmenn som ikke har utført (adekvat) mastektomi, til klinisk mammografi ved lokalt BDS. I mangel av dokumenterte screeningresultater for denne gruppen, anbefales i utgangspunktet å gjennomføre slike kontroller innenfor alder for anbefalt mammografiscreening av ciskvinner (50–69 år) (C. N. Clarke et al., 2021).
Pakkeforløp for kreft
Sist faglig oppdatert: 02202402.07.2024
Fra 1. januar 2015 ble Pakkeforløp for brystkreft innført.
Om pakkeforløp for brystkreft
Sist faglig oppdatert: 02202402.07.2024
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er et standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Les mer om Pakkeforløp for brystkreft.
Det er egne Diagnoseveiledere for inngang til pakkeforløp for kreft.
Pakkeforløp hjem for pasienter med kreft
Sist faglig oppdatert: 02202402.07.2024
Pakkeforløp hjem for pasienter med kreft skal bidra til å sikre god struktur og logistikk i helsetjenesten, samt sikre trygghet og forutsigbarhet for personer som lever med kreft eller etter endt kreftbehandling.
Tilleggsanbefalinger vedrørende pasientforløp for brystkreftpasienter
Sist faglig oppdatert: 02202402.07.2024
Tid fra avsluttet kirurgi til oppstart av kjemoterapi
Det foreligger ingen randomiserte studier med tanke på eventuell påvirkning av overlevelse relatert til ventetid mellom kirurgi og kjemoterapi. En del retrospektive studier med ulike «ventetider» og ulike kjemoterapiregimer er publisert. Noen mindre studier har påvist at relativt tidlig oppstart av kjemoterapi har gitt bedre overlevelse (innen 35 dager (CMF): (Pronzato et al., 1989); innen 21 dager hos ER negative: (Colleoni et al., 2000); innen 44 dager: (Alkis et al., 2011). To større studier fra første del av 2000-tallet har ikke funnet en slik sammenheng innenfor 12 uker etter kirurgi (Cold et al., 2005): n=7501; (Shannon et al., 2003): n=1161. Derimot viser en populasjonsbasert studie redusert overlevelse ved kjemoterapi gitt mer enn 12 uker etter kirurgi (Lohrisch et al., 2006): n=2594. Det er sannsynlig at tumorkarakteristika kan påvirke viktigheten av tidspunkt for oppstart av kjemoterapi innenfor de første 12 uker etter kirurgi. Det er publisert resultater fra en original studie og en meta-analyse som viser at der er signfikant dårligere overlevelse hos pasienter operert for trippel negativ brystkreft (TNBC) dersom adjuvant kjemoterapi starter >30 dager postoperativt (Morante et al., 2021; Zhan et al., 2018). Det er ikke vist samme reduserte overlevelse hos pasienter operert for HER2 positiv eller hormonreseptor positiv brystkreft. Videre viser data fra Norsk Brystcancerregister (NBCR) for 2017 at ved mange sykehus i Norge er det en median tid fra operasjon til start av kjemoterapi på over 40 dager (Kreftregisteret, 2018). Tall fra NBCR for 2018 viser at kun 65 % av pasientene får oppstart av kjemoterapi innen 42 dager. Lang tid fra operasjon til start av adjuvant kjemoterapi vil kunne påvirke overlevelsen negativt hos pasienter operert for aggressiv, høy-proliferativ brystkreft, især TNBC.
Anbefaling: Det anbefales at adjuvant kjemoterapi ved høyproliferativ sykdom, spesielt trippel negativ brystkreft, starter innen 30 dager fra operasjonsdato. Det bør være en målsetning at også andre undergrupper av brystkreft starter opp kjemoterapi innenfor samme tidsrom, men oppstart av kjemoterapi innen 6 uker etter avsluttet kirurgi er akseptabelt. Grunnlaget for dette er at det bør etterstrebes så effektiv som mulig behandlingsplan, hvor det også ønskes å unngå unødvendige forsinkelser i oppstart av strålebehandlingen (som mange får i etterkant av kjemoterapien). En forutsetning for oppstart av kjemoterapi er at operasjonssåret har grodd og at det ikke er noen infeksjonskomplikasjoner.
Tid fra avsluttet kirurgi til oppstart av strålebehandling eller fra avsluttet kjemoterapi til oppstart av strålebehandling
For pasienter som ikke gjennomgår kjemoterapi, er det ikke funnet sikker påvirkning av residiv/overlevelse for tidsintervaller for oppstart av strålebehandling innen 20 uker etter avsluttet kirurgi (Froud et al., 2000; Karlsson et al., 2011; Olivotto et al., 2009), men det er observert redusert overlevelse ved utsettelse ut over 20 uker (Olivotto et al., 2009).
For pasienter som gjennomgår kjemoterapi bør strålebehandlingen startes opp snarest mulig etter avsluttet kjemoterapi. Det synes ikke å være sikre forskjeller i residiv eller overlevelse som følge av å oppstarte strålebehandling etter kjemoterapi innen 7 måneder etter avsluttet kirurgi (Hickey et al., 2006; Tsoutsou et al., 2009).
Det anbefales at alle behandlingsmodaliteter gjennomføres uten unødvendige ventetider. Samtidig vil det kirugiske behandlingsforløpet kunne strekke seg over varierende lang tid (for eksempel ved rereseksjoner), noe som i individuelle tilfeller kan påvirke vurderingen av tidsintervallet mellom kirurgi og strålebehandling.
Følgende oppfattes som veiledende grunnlag for vurdering av tider:
- Der hvor det ikke er indikasjon for kjemoterapi bør det etterstrebes at strålebehandingen oppstartes innen 6–8 uker etter avsluttet kirurgi.
- Ved indikasjon for kjemoterapi bør det etterstrebes at strålebehandling oppstartes innen 3–4 uker etter at kjemoterapi er avsluttet.
Diagnostisering og utredning
Utredning ved mistanke om brystkreft
Sist faglig oppdatert: 02202402.07.2024
Hvem skal henvises til brystdiagnostikk?
Kuler og andre symptom fra bryst er vanlig og skyldes oftest godartede forandringer. Det er imidlertid vanskelig å skille mellom benigne og maligne forandringer ved klinisk undersøkelse alene, og pasienter med nye kliniske funn i brystene trenger derfor ofte henvisning til videre utredning.
Fastlege utreder pasient med anamnese samt inspeksjon og palpasjon av bryst, aksiller og fossa supra- og infraclaviculares og avgjør ut fra dette om pasienten trenger videre undersøkelser.
Pasientene med uavklarte kuler/symptomer fra bryst bør henvises til et brystdiagnostisk senter (BDS) eller annet senter med samme kvalitative innhold. Leger ved senteret vil som følge av symptomer og funn avgjøre hvilke undersøkelser som er indisert. Se lokale retningslinjer ved hvert enkelt BDS for hvordan/til hvem henvisning skal sendes.
Ved begrunnet mistanke om brystkreft skal pasienten henvises i pakkeforløp, se Begrunnet mistanke – kriterier for henvisning til pakkeforløp. Andre pasienter henvises på vanlig måte, avhengig av rutiner ved det enkelte BDS
Indikasjoner for henvisning til videre utredning
- Nye palpasjonsfunn(1)
- Hudinndragning
- Kontroll etter mastitt hos kvinne som ikke ammer
- Hudfortykkelse av uklar etiologi
- Ensidig serøs eller blodig spontan sekresjon fra brystvorte(2)
- Nytilkommet inndradd brystvorte som ikke lar seg trekke ut
- Eksem/sår/hudfortykkelse i relasjon til areola/brystvorte
- Smerter hos postmenopausal kvinne(3)
- Mistanke om aksillære lymfeknutemetastaser(4)
- Uavklarte funn ved billeddiagnostikk (mammografi, ultralyd, CT, PET)
(1)Brystkreft hos unge kvinner er svært sjelden og normale syklusavhengige forandringer i brystene hos kvinner under 35 år oppfattes ofte som nye kuler eller klumper. Disse forsvinner ofte spontant. Det kan derfor være grunn til å se an situasjonen i 1–2 menstruasjons-sykluser hos unge kvinner før henvisning.
(2)Sekresjon fra brystene er vanlig, men ved nyoppstått ensidig spontan serøs eller blodig sekresjon, er det indikasjon for utredning.
(3)Smerter i bryst uten ledsagende palpasjonsfunn er normalt, særlig hos yngre, og er hos unge kvinner ikke indikasjon for bildeutredning. Hos postmenopausale kvinner er imidlertid nyoppståtte smerter, uten annen åpenbar årsak, indikasjon for henvisning til brystutredning.
(4)Hos slanke kvinner er det vanligvis mulig å palpere små lymfeknuter i begge aksiller. Stor palpabel lymfeknute i kun en aksille kan være suspekt på lymfeknutemetastase.
Henvisning fra fastlege bør inneholde følgende opplysninger
Sist faglig oppdatert: 02202402.07.2024
Anamnese:
- Tidligere brystsykdommer, evt. med biopsisvar.
- Forekomst av brystkreft og/eller ovarialkreft hos førstegrads slektninger (mor, søstre, døtre) eller annengradslektning gjennom far (farmor, fars søstre) – helst inkludert alder ved diagnose
- Bruk av hormonpreprarat
- Anamnese for aktuelle symptom/funn; hvordan det ble påvist, hvor lenge det har vært til stede og om det varierer med menstruasjonssyklus.
Funn:
- Detaljert beskrivelse av aktuelle funn. Palpasjonsfunn beskrives med størrelse (mm), lokalisasjon (4 kvadranter + retroareolært område), konsistens og bevegelighet i forhold til omliggende strukturer. Trekker huden seg inn når armene løftes over hodet (hudinndragning)?
Tverrfaglig samarbeid
Sist faglig oppdatert: 02202402.07.2024
Tverrfaglig samarbeid mellom radiolog, patolog, kirurg og onkolog er viktig for å sikre brystdiagnostikk av god kvalitet. Samarbeidet bør etableres på en slik måte at man til enhver tid kan ha god kommunikasjon med hverandre om enkeltkasus. Det enkelte BDS må ha skriftlige rutiner som avklarer hvem som har ansvar for den enkelte pasient og skal trekke de nødvendige kliniske konsekvenser av de funn som blir gjort.
Det skal avholdes tverrfaglige møter med radiologer, patologer, kirurger og evt onkologer til stede. Det er også ønskelig at sykepleiere, radiografer og kreftkoordinator deltar. Se for øvrig Kvalitetsmanualen for Mammografiprogrammet. I det tverrfaglige møtet bør bildediagnostiske og kliniske funn sammenstilles og diskuteres i forhold til resultater fra histologiske og cytologiske prøver. Det skal tas beslutning om anbefaling av eventuelle videre undersøkelser og behandling. Avgjørelsene skal journalføres. Etter kirurgisk behandling skal resultatet av histopatologisk undersøkelse vurderes og sammenstilles med tidligere funn. Lokale prosedyrer må sikre at også prøver som ikke diskuteres på tverrfaglig møte blir vurdert på en sikker måte.
Trippeldiagnostikk
Sist faglig oppdatert: 02202402.07.2024
Trippeldiagnostikk ved mistanke om brystkreft består av klinisk undersøkelse (utført av radiolog eller kirurg), billeddiagnostikk og eventuelt nåleprøve. Hvis undersøkende lege vurderer palpasjons- og billedfunn som normalt kan man avstå fra nåleprøve. Kreftsvulster kan en sjelden gang være occulte både ved mammografi og ultralyd. Det er derfor viktig at palpasjonsfunn som vurderes usikkert blir biopsert selv om billeddiagnostikk er negativ. Alle kreftsvulster skal som en hovedregel ha histologisk diagnose stilt ved grovnålsbiopsi eller vacumbiopsi før de opereres.
Klinisk undersøkelse ved BDS
Sist faglig oppdatert: 02202402.07.2024
For anamnese og klinisk undersøkelse, se kapittel Henvisning fra fastlege bør inneholde følgende opplysninger.
Anamnese kan om nødvendig suppleres med informasjon om menstruasjonsstatus, alder ved første fødsel, antall barn, alder ved menarche og menopause.
Billeddiagnostikk
Sist faglig oppdatert: 02202402.07.2024
Klinisk mammografi
Mammografi er den billeddiagnostiske basisundersøkelsen ved symptom fra bryst. Det tas to projeksjoner av hvert bryst. Dersom nødvendig kan det også suppleres med spesialbilder, tomosyntese (se under) eller kontrastmammografi.
Unge kvinner
Hos unge kvinner er mammografi mindre sensitiv pga tett kjertelvev og kjertelvevet er mer strålefølsomt samtidig som insidensen av brystkreft er svært lav. Hos unge kvinner er derfor ultralyd vanligvis tilstrekkelig som primærundersøkelse ved palpasjonsfunn (Harvey et al., 2016; Lehman, Lee, & Lee, 2014). Lege som er ansvarlig for diagnostikken (som regel en radiolog) avgjør hvilken metode som er best egnet i hvert enkelt tilfelle. Det er ikke mange studier man kan bruke for å anbefale aldersgrense for når ultralyd kan/bør være primærundersøkelse. I henhold til amerikanske retningslinjer for utredning ved palpasjonsfunn i bryst anbefales ultralyd som førstevalg hos kvinner <30 år, ultralyd alene og mammografi + ultralyd er likestilte som førstevalg for kvinner 30–40 år og mammografi + ultralyd er førstevalg for kvinner > 40 år (Harvey et al., 2016).
Hvis ultralyd og/eller kliniske funn gir mistanke om brystkreft bør det suppleres med mammografi uansett alder.
Graviditet
Ved mistanke om brystkreft er ikke graviditet noen kontraindikasjon mot mammografi. Stråledosen ved mammografi er lav, og utgjør ingen fare for fosteret (Sechopoulos, Suryanarayanan, Vedantham, D'Orsi, & Karellas, 2008). Det er heller ikke vist at mammografi under svangerskap medfører økt carcinogen effekt på kjertelvevet i brystet (Kopans, 2007). Mammografi har imidlertid lavere sensitivitet under graviditet pga tettere kjertelvev. Se også "Brystkreft under graviditet".
Hos gravide kvinner med palpasjonsfunn som ikke gir mistanke om brystkreft er ultralyd ofte tilstrekkelig som primærundersøkelse.
Det anbefales å benytte grovnålsbiopsi for å få sikrest mulig nålediagnostikk. Finnålsaspirasjonscytologi (FNAC) er vanskelig å bedømme ved graviditet. Hvis FNAC benyttes er det viktig å informere patolog om at pasienten er gravid.
Kvinner med silkonimplantat i bryst
Mammografi er også primærundersøkelsen hos kvinner med silikonimplantat. Det skal da om mulig suppleres med projeksjoner der protesen blir luksert bak kompresjonsplaten.
Indikasjoner for mammografi for tidlig diagnostikk/screening av asymptomatiske kvinner finnes i kapittel "Mammografiscreening (50–69 år)".
Ultralyd
Ultralyd skal alltid utføres som et supplement til mammografi hvis pasienten har nye palpasjonsfunn i brystene eller hvis mammografi viser patologi. Hvis det er malignitetssuspekte forandringer ved ultralyd bør hele det aktuelle brystet samt ipsilaterale aksille og kontralaterale bryst undersøkes for å påvise eventuell multifokalitet, bilateral cancer eller lymfeknutemetastaser.
Ved akutt mastitt med mistanke om abscess er ultralyd primærundersøkelse
Ultralyd kan også være primærundersøkelse ved benignt preget palpasjonsfunn hos unge kvinner og ved benignt preget palpasjonsfunn hos gravid kvinne, se kapittel "Billeddiagnostikk" - "Klinisk mammografi".
Mammografi kan være smertefullt, og noen pasienter ønsker derfor kun å gjøre ultralyd. Det må da gjøres klart oppmerksom på at ultralyd alene ikke er god nok diagnostikk for å utelukke brystkreft.
MR bryst
MR er den brystradiologiske metoden som har høyest sensitivitet for å påvise brystkreft. Den utføres med intravenøs kontrast og forutsetter at pasienten har normal nyrefunksjon. MR er en ressurskrevende metode som også har en del falsk positive funn og er ikke en primærundersøkelse ved symptom(er) fra bryst.
MR gir en mer detaljert vurdering av tumorutbredelse enn mammografi og ultralyd. Selv om dette burde medføre mer skreddersydd kirurgi har man til nå ikke overbevisende resultat for at preoperativ MR gir redusert forekomst av reeksisjoner for alle brystkreftpasienter (Gonzalez et al., 2014; Houssami, Turner, & Morrow, 2013; Peters et al., 2011; Sakakibara et al., 2008; Turnbull et al., 2010). Foreløpig anbefaler man derfor preoperativ MR for utvalgte pasientgrupper (Mann et al., 2015). Det er viktig med god kommunikasjon mellom radiolog og kirurg ved det enkelte BDS slik at man har en felles forståelse av når MR bryst er nyttig og nødvendig som del av staging av primært operabel brystkreft.
Før henvisning til MR bryst må man sikre seg at det ikke foreligger kontraindikasjoner mot undersøkelsen og det må fylles ut en sjekkliste.
Indikasjoner der MR bryst bør gjøres som del av trippeldiagnostikk
- Preoperativ kartlegging ved påvist brystkreft og planlagt brystbevarende kirurgi hos kvinner med
- Infiltrerende lobulært carcinom (Mann et al., 2010), med unntak av pasienter som har helt fettrike bryst ved mammografi
- Diskrepans mellom tumorstørrelse ved ultralyd/mammografi/klinisk undersøkelse der dette har innvirkning på behandling
- Vanskelig vurderbart brystvev ved mammografi og ultralyd der man mener det er vanskelig å utelukke multifokalitet.
- T2 svulster som skal ha neoadjuvant kjemoterapi (Marinovich, Houssami, et al., 2013; Marinovich, Macaskill, et al., 2013) (primærundersøkelse samt kontroll av behandlingseffekt og planlegging av brystbevarende kirurgi)
- Kjent arvelig risiko for brystkreft med genfeil
- Ved neoadjuvant behandling (Marinovich et al., 2012): Primærundersøkelse samt kontroll av behandlingseffekt ved behov og preoperativt hvis brystbevarende kirurgi er aktuelt (se tabell "Oversikt over veiledende neoadjuvant behandlingsopplegg for pasienter utenfor klinisk studie 28.01.2020" i kapittel "Neoadjuvant behandling").
- Aksillære lymfeknutemetastaser fra adenokarsinom med ukjent utgangspunkt der mammografi og ultralyd ikke har vist patologi i brystet
- Som tilleggsinformasjon ved utvalgte problemkasus.
Hvis MR ved preoperativ staging av brystkreft viser nye funn av usikker betydning vil en ny målrettet ultralydundersøkelse ofte være avklarende. Malignitetssuspekte tilleggsfunn ved MR bør bekreftes med vevsprøve hvis de får konsekvens for behandlingen av pasienten.
For anbefalinger om MR som tidlig diagnostikk av brystkreft hos asymptomatiske pasienter med arvelig risiko for brystkreft: se kapittel "Radiologisk brystdiagnostikk hos kvinner med genetisk økt risiko for brystkreft".
Utførelse
MR bryst utføres som en multiparametrisk protokoll bestående av T2–vektet serie, diffusjon og dynamisk T1 vektet serie før og etter iv kontrast (Baltzer et al., 2020; Friedrich, 1998; Mann et al., 2008).
T2- vektede bilder øker spesifisiteten til å skille mellom maligne og benigne lesjoner, kartlegging av lymfeknuter og perifokalt ødem (Friedrich, 1998). DWI-bilder kan bidra til å skille maligne og benigne lesjoner og in situ fra invasiv sykdom samt brukes til responsevaluering av neoadjuvant terapi (Mann et al., 2008).
T1- vektet serie med dynamisk kontrastopptak er den viktigste serien for deteksjon av kreftsvulster og kan utføres med eller uten fettsuppresjon. Anbefalt dose av Gadoliniumkontrast er 0,1 mmol/kg (Friedrich, 1998; Mann et al., 2008). Etter tomserie anbefales raske repeterte serier i 5-7 minutter etter kontrastinjeksjon. Subtraksjonsbilder fra pre- og post kontrast serier anbefales og er nyttig også ved bruk av fettsuppresjon (Friedrich, 1998). De fleste brystkreftsvulster lader mest på tidlige post- kontrastserier. MR bør kunne påvise alle kontrastladende cancere som er ≥ 5 mm. For mer detaljer om sekvenser henvises til referansene (Baltzer et al., 2020; Friedrich, 1998; Mann et al., 2008).
Kontrastopptak i brystvev hos premenopausale kvinner varierer gjennom menstruasjonssyklus og MR bryst bør derfor ideelt utføres mellom dag 5- 12 etter start av menstruasjonssyklus (Friedrich, 1998). Ved staging av brystkreft tar man ikke hensyn til dette.
Tomosyntese i klinisk brystdiagnostikk
Tomosyntese er en videreutvikling av digital mammografi som de siste årene har blitt introdusert i klinisk praksis (Cardoso et al., 2019; Sardanelli et al., 2017). Mammografiapparater fra ulike leverandører har teknisk litt forskjellige løsninger (Michell et al., 2018). Det er derfor viktig at radiologen har god kjennskap til mammografiapparatene i sin avdeling, relevante forskningsresultater og hvordan teknikkene best kan benyttes.
Tomosyntese gir en kvasi-3D fremstilling av brystet. Røntgenrøret beveger seg i en bue over brystet mens det blir tatt flere lav-dose bilder som senere blir rekonstruert til en serie av tynnsnittbilder gjennom brystet. Tomosyntese kan redusere problemet med overlapp av kjertelvev og er nyttig for avklaring av patologiske funn ved 2D mammografi (Chong et al., 2019; Ko et al., 2021). Tomosyntese kan gi bedre karakteristikk av et mammografifunn enn 2D mammografi, og er mer nøyaktig i å vurdere størrelse av et mammografifunn og om det er multifokalitet. Hvis tomosyntese viser kalk, kan det fortsatt være behov for 2D bilder og/eller konbilder med forstørrelse som gir bedre oppløsning. Kvasi-3D informasjon gjør det enklere å lokalisere en lesjon i brystet enn tilfellet er ved 2D mammografi.
På nye mammografiapparat kan man også rekonstruere syntetiske 2D bilder ut fra rådatabildene. Hvis man har apparat der de syntetiske bildene er av god nok kvalitet, er det dermed mulig å erstatte 2D mammografi med tomosyntese + syntetisk mammografi. Dette er en løsning som kan gi en enklere arbeidsflyt for klinisk henviste pasienter der færre har behov for ekstra undersøkelser.
Mammografiapparat fra noen leverandører har mulighet for tomosynteseveiledet biopsi/merking, noe som kan forenkle prosedyren i forhold til stereotaktisk veiledet biopsi/merking, da man ikke er avhengig av å lokalisere lesjonen på to stereobilder.
Kontrastmammografi
Kontrastmammografi (Contrast Enhanced Digital Mammography CEDM) bruker intravenøs injeksjon av jodholdig kontrastvæske for å påvise neoangiogenese i maligne svulster (Jochelson et al., 2021). Den biologiske bakgrunnen for kontrastoppladning og farmakokinetikken er den samme som ved MR. I motsetning til MR mangler imidlertid kontrastmammografi tredimensjonal og dynamisk informasjon. Kontrastvæsken skilles ut renalt og man må ta samme hensyn som ved andre undersøkelser som bruker jodholdig kontrast (allergi/nyrefunksjon).
Kontrastmammografi er en dual energi røntgenundersøkelse som utføres med det samme apparatet som mammografi og kan kombineres med tomosyntese og 2D-mammografi i samme kompresjon. Stereotaktisk/tomosyntese-veiledet biopsi basert på tomosyntese kan ofte være mulig. En kontrastmammografi-veiledet biopsi er utviklet, eller er under utvikling hos de store mammografi-leverandører.
Studieresultater viser at sensitivitet og spesifisitet ved CEDM er tilnærmet sammenlignbar med MR bryst uten kontrastdynamikk. Dynamisk MR med kontrast viser bedre resultater enn CEDM, mens tomosyntese og mammografi alene har klart lavere sensitivitet og spesifisitet enn CEDM (Fallenberg et al., 2017; Petrillo et al., 2020; Zhu et al., 2018). CEDM viser også en god korrelasjon med prognostiske faktorer (Vasselli et al., 2022). CEDM kan bidra til en økt diagnostisk sikkerhet ved utredning av mulig brystkreft. Dette gjelder spesielt hos kvinner med tette bryst der kontrastmammografi er en bra problemløser. I situasjoner der utbredelse av cancerforandringer er usikker kan CEDM gi en bedre angivelse av utbredelse enn tomosyntese og mammografi, og således bidra til at korrekt behandling kommer raskere i gang (Skaane, 2022).
I to små studier som evaluerte CEDM i sammenheng med kontroll av neoadjuvant terapi ble det observert god korrelasjon med MR i evaluering av terapieffekt, og en bedre sensitivitet og spesifisitet for påvisning av komplett remisjon (Iotti et al., 2017; Patel et al., 2018). Kontrastmammografi bør kun erstatte MR der det foreligger kontraindikasjoner mot MR (for eks. klaustrofobi, overvekt, choclea-implantat).
Nåleprøve/vevsprøve
Sist faglig oppdatert: 02202402.07.2024
- I utgangspunktet skal man ta vevsprøve av alle lesjoner som ikke er sikkert benigne.
- Ved lesjoner som klinisk og billedmessig er vurdert som sannsynlig benigne av utredningsansvarlige lege kan FNAC benyttes såfremt kompetansen og samarbeidet med cytolog er etablert på en slik måte at kvaliteten ivaretas.
- Ved mistanke om brystkreft skal det dersom det er teknisk mulig gjøres grovnålsbiopsi eller vakuumbiopsi for å få en preoperativ histologisk diagnose (Wallis, Tardivon, Helbich, & Schreer, 2007).
- Vevsprøver gjøres med nåler av varierende kaliber og utføres oftest ultralydveiledet. Ved patologi som ikke vises ved ultralyd kan man gjøre stereotaktisk/tomosyntese-veiledet biopsi ved hjelp av et mammografiapparat.
- Biopsi av kalk krever større biopsivolum enn biopsi av solide lesjoner og det bør derfor ikke brukes nåler som er tynnere enn 14G. Vacuumteknikk gir større biopsivolum enn vanlig grovnålsbiopsi og gir dermed større treffsikkerhet. Når det blir tatt vevsprøver av kalk bør det tas røntgenbilde av biopsiene for å bekrefte funn av kalk. Man bør da legge biopsier med kalk i ett formalinglass og biopsier uten kalk i et annet formalinglass for å lette arbeidet for patologen.
- I sjeldne tilfeller kan det være behov for MR veiledet biopsi. Antallet slike biopsier er så lite at det kun gjøres på 2–3 sentra i Norge.
- Det er viktig at det er samsvar mellom bildefunn og histologi og at volumet av biopsimaterialet er tilstrekkelig for å stille en sikker diagnose. Ved biopsi av kalk er det særlig viktig å være sikker på at volumet av vevsprøven er stort nok og representativt for lesjonen før man utelukker en malign diagnose.
FNAC (finnålsaspirasjonscytologi)
- Ved å føre en tynn nål fram og tilbake i en lesjon, og evt bruke aspirasjon, henter man ut celler som strykes ut på objektglass som enten sprayfikseres eller lufttørkes.
- Det bør være etablert et system for en umiddelbar vurdering av om prøvene teknisk sett er av god nok kvalitet, slik at nye prøver kan tas med en gang hvis så ikke er tilfelle.
- FNAC er velegnet for å påvise maligne celler ved mistanke om lymfeknutemetastase i aksillen.
- FNAC skal ikke brukes ved diagnostikk av kalk.
Cystepunksjoner
- Cyster er vanlige og trenger ikke diagnostisk punksjon med mindre man er usikker på om det dreier seg om en vanlig cyste.
- Hvis cysteinnholdet er blodig eller man er usikker på om cysten er del av en er solid lesjon bør cysteinnholdet sendes til cytologisk vurdering
Grovnålsbiopsi
- Grovnålsbiopsi er en nåleprøve der man tar ut en eller flere små vevssylindre fra aktuelle lesjon for histopatologisk vurdering.
- Grovnålsbiopsi reduserer sjansen for falskt negative svar sammenlignet med FNAC og gir mer detaljert informasjon om en lesjon enn FNAC.
- Vanligvis tas prøven i lokalanestesi med bruk av 14G eller 16G nål. Ved behov for rask diagnose kan det gjøres et avtrykk eller «imprint» av grovnålsbiopsien på et objektglass som kan hurtigfarges og analyseres på samme måte som FNAC.
- Grovnålsbiopsi gir liten risiko for alvorlig blødning og blodfortynnende medikament trenger sjelden seponeres. Det er imidlertid viktig å vite om pasienten bruker blodfortynnende medikament slik at en kan ta hensyn til dette (valg av anestesi/nåletykkelse/kompresjon etter biopsi/observasjon etter biopsi).
Vakuumbiopsi
- Vakuumbiopsi er en nåleprøve der man tar ut vevssylindere for histopatologisk undersøkelse, men her bruker man vakuum-teknikk for å trekke brystvevet inn i nålen. Dette gjør at man kan bruke tykkere nåler og få vevsprøver med større volum.
- Vakuumbiopsi er spesielt godt egnet ved lesjoner der man trenger et større vevsvolum, som for eksempel sannsynlig benign eller usikker kalk.
- Prøven tas i lokalanestesi og det blir tatt flere biopsier.
- Vakuumbiopsi er mer ressurskrevende og gir større sjanse for blødning enn grovnålsbiopsi.
- Blodfortynnende medikamenter: eventuelt behov for seponering vurderes etter lokale retningslinjer og man må ha rutiner for kompresjon/bandasjering etter biopsi.
- Metoden brukes oftest stereotaktisk/tomosyntese-veiledet, men den kan også brukes ultralydveiledet.
Diagnostisk åpen biopsi/merkebiopsi
Sist faglig oppdatert: 02202402.07.2024
- Diagnostisk åpen biopsi brukes hvis grovnålsbiopsi eller vakuumbiopsi ikke er avklarende* eller hvis nålebiopsi ikke er teknisk mulig.
- Biopsi utføres av kirurg, enten palpatorisk veiledet eller etter at radiolog har merket området veiledet av billeddiagnostikk. Det er også gunstig å merke huden med tusj rett over aktuelle område.
- Ved ikke-palpable lesjoner må det tas røntgenbilde og evt. ultralyd av preparatet for å bekrefte at aktuelle forandring er med i biopsien. Lokalisasjon merkes av på røntgenbildet til veiledning for patolog.
- Noen ganger er det også aktuelt å ta røntgenbilde av preparatet etter at dette er delt opp i skiver (skivefoto) og avmerke hvilke skiver som inneholder aktuelle tumor eller kalk.
- Det er viktig med god kommunikasjon mellom radiolog og kirurg i forkant av biopsitaking for å sikre at merking og eksisjon skjer på en optimal måte. Det er også viktig med god kommunikasjon mellom radiolog, kirurg og patolog for å sikre orientering av preparatet og lokalisasjon av aktuell lesjon.
* Hvis det er diskrepans mellom vevsprøve og radiologiske/kliniske funn bør det i første omgang gjøres fornyet grovnålsbiopsi eller vakuumbiopsi. På den måten unngår man å gjøre unødvendige åpne diagnostiske biopsier som kan være ugunstige for den endelige kirugiske behandlingen av bryst og aksille.
Indikasjoner for diagnostisk åpen biopsi/merkebiopsi
- Trippelutredning har ikke gitt konklusivt resultat (for eksempel når vevsprøve er usikker og/eller ikke kan forklare radiologiske eller kliniske funn)
- Nålebiopsi har vist ADH
- Nålebiopsi har vist papillom eller papillomatose (se kapittel Behandling av papillomer)
- Nålebiopsi har vist LCIS av florid eller pleomorf type
- Nålebiopsi har vist radiært arr (se kapittel Behandling av radiære arr)
- Nålebiopsi er teknisk umulig (for eksempel lesjon som ligger nær silikonprotese eller kalk som ligger svært nær brystvegg eller i et bryst som er for tynt til å utføre vakuumbiopsi)
Kommentar: klassisk LCIS og ALH er i seg selv ikke indikasjon for merkebiopsi. Det samme gjelder isolert funn av flat epitelial atypia (FEA).
Videre prosessering og undersøkelse
Sist faglig oppdatert: 02202402.07.2024
Sylinderbiopsiene bør innstøpes i atskilte blokker, i hvert fall bør sylindere med røntgenologisk verifisert kalk innstøpes separat. Representativitet i forhold til mammografisk lesjon må vurderes nøye. Påvist kalk ved histologi må nevnes i diagnosen, særlig hvis man avgir en benign diagnose. Manglende påvisning av kalk ved biopsi fra lesjon med røntgenologisk verifisert kalk må også nevnes da prøven i slike tilfeller neppe er representativ.
Pga. nålebiopsienes beskjedne størrelse vil man kunne støte på noen diagnostiske problemer, som for eksempel:
- skleroserende adenose versus invasivt karsinom
- pseudoinvasjon ved DCIS versus invasivt karsinom
- pseudoinvasjon ved benigne tilstander med sklerose
- radiært arr versus tubulært carcinom
- intracystisk (innkapslet) papillært karsinom versus invasivt karsinom
- cellerikt fibroadenom versus benign phyllodes tumor
- atypisk ductal hyperplasi (ADH) versus lavgradig DCIS.
- mucinøse lesjoner
Mange av disse problemstillingene (punkt 1–5) kan oftest løses ved immunhistokjemisk undersøkelse (antistoff mot myoepitel, som actin og/eller smooth muscle myosin, CK14, p63).
Ved problemet ADH eller lavgradig DCIS (punkt 7) vil lesjoner mindre enn 2 mm måtte diagnostiseres som ADH. De fleste av disse ender opp med diagnosen DCIS. Det viktigste er at patologen ved sin diagnose signaliserer at videre histologisk undersøkelse er nødvendig.
Gradering av invasivt karsinom og DCIS ved nålebiopsi
Hovedregelen er at histologisk gradering ikke utføres på sylinderbiopsier, da grad ofte endres i det endelige preparatet. Ved tydelig histologisk grad III (in situ eller invasivt karsinom) kan dette angis ved besvarelse av sylinderbiopsi. Ved store tumores/T4 med indikasjon for neoadjuvant behandling, bør histologisk gradering gjøres.
Sylinderbiopsi eller FNAC kan bekrefte et radiologisk/klinisk malignt/premalignt funn, men aldri avkrefte malignitet. Det er viktig at avgitte svar vurderes i sammenheng med bildediagnostikk i tverrfaglig kommunikasjon, spesielt ved benignt funn og avsluttende utredning.
Ved fibroadenomer med størrelse over 3 cm, bør det vurderes (på individuelt grunnlag) eventuell ekstirpasjon (differensialdiagnose phyllodestumor, kfr for øvrig kapittelet Oppfølging og etterkontroll etter avsluttet kurativ behandling om sarcomatoide svulster).
Mucinøse lesjoner kan være svært cellefattige og ha lavgradig atypi.
Premaligne forandringer i brystet
Sist faglig oppdatert: 02202402.07.2024
Premaligne tilstander kjennetegnes ved at det er histologisk tegn på unormal (atypisk) proliferativ aktivitet enten i gangsystemet (duktalt) eller i de terminale kjertelendestykker (lobulært), men at det ikke er tegn til at epitelceller har brutt gjennom basalmembranen. Hvis et gjennombrudd av basalmembranen identifiseres sikkert og utenfor lobulært stroma, foreligger det et infiltrerende karsinom, og behandlingen skal være deretter.
Normalt har kjertelen to cellelag. Tre eller flere cellelag er uttrykk for en proliferativ aktivitet. Avhengig av proliferasjonsgrad, vevsarkitektur og cellenes atypi kan en skille ut følgende premaligne tilstander:
- Lobulær og duktal epitelhyperplasi uten atypi
- Lobulær og duktal epitelhyperplasi med atypi (ALH og ADH)
- Lobulært (LCIS) og ductalt carcinoma in situ (DCIS) (van Nuys gradering) (Silverstein et al., 1995)
Det er en glidende overgang mellom de forskjellige typer og grader, noe som gjør at en må regne med interobservatør variasjon i histologiske diagnoser.
Dupont og Page (Dupont & Page, 1985) fant følgende kumulative absolutte risiko for mammacarcinom i prosent etter revisjon av vel 10 000 mammabiopsier med mer enn 17 års oppfølgningstid (jfr. tabell 4.1):
Biopsisvar | Risiko for brystkreft | ||
|---|---|---|---|
Etter 10 år | Etter 20 år | Relativ risiko | |
Epitelhyperplasi uten atypi | 3 % | 5 % | 1.6 |
Epitelhyperplasi med atypi | 7 % | 13 % | 4.4 |
Epitelhyperplasi med atypi og samtidig førstegradsslektning med brystkreft | 11 % | 32 % | 8.9 |
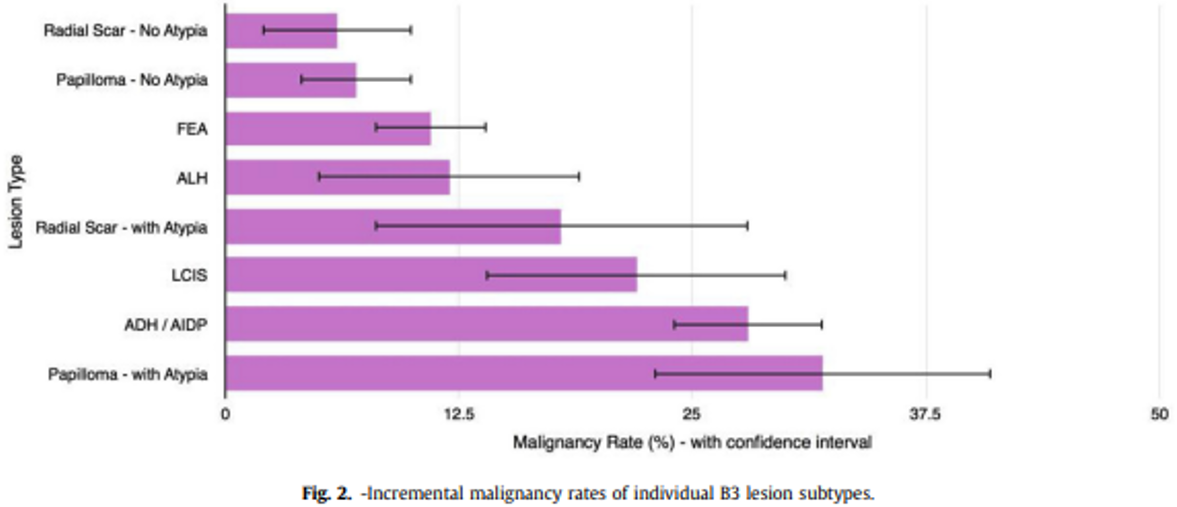
Normalbefolkningens risiko for å utvikle mammakarsinom over en 20-årsperiode fra 35–55 år er ca. 2,5 %, og i perioden 50–70 år 4,8 %. Kvinner med epitelproliferasjon uten atypi har knapt noen høyere risiko enn gjennomsnittet. Det synes derfor ikke å være grunnlag for spesiell oppfølging (Bellini et al., 2023; Rubio et al., 2024).
Risikoen er atskillig høyere for kvinner hvor det er påvist epitelprofilerasjon med atypi, og særlig hvis de har en førstegradsslektning med brystkreft .
Sylindercellelesjoner og Flat epitelial atypi (FEA)
Interessen for disse entitetene har økt fordi de ses hyppigere i screeningprøver. Lesjoner med sylinderepitelkledning i terminale ductolobulære enheter kan deles inn i 3 entiteter; sylindercelleforandringer (columnar cell change), sylindercellehyperplasi (columnar cell hyperplasia) og flat epitelial atypi (FEA) (S. J. Schnitt & Collins, 2005).
Sylindercelleforandringer og sylindercellehyperplasi
(Columnar cell change (CCC) og columnar cell hyperplasia (CCH))
Lesjoner med forstørrede ductolobulære enheter kledt med sylinderepitel uten atypi med henholdsvis 1–2 lag sylinderepitel (CCC) eller > 2 cellelag (CCH)
Disse entitetene beskrives med ulike navn i litteraturen som f eks columnar metaplasia og blunt duct adenosis (S. J. Schnitt & Vincent-Salomon, 2003).
Flat epitelial atypi (FEA)
Lesjoner med forstørrede terminale ductolobulære enheter med ett eller flere lag kubisk eller sylindrisk epitel som viser lavgradig cytologisk atypi (S. Schnitt, Collins, Lakhani, & Simpson, 2019).
«Flat» er en relativ terminologi og indikerer fravær av komplekse strukturer. Sylinderepitellesjoner med lavgradig atypi som danner komplekse strukturer (broer, arkader, mikropapiller) representerer ADH eller DCIS.
Genetiske studier har indikert at FEA er en klonal lesjon som har de samme genetiske forandringer som lavgradig DCIS og tubulært karsinom. Det er også observert en assosiasjon mellom sylinderpitellesjoner/flat epitelial atypi og lobulære neoplasier (LCIS og atypisk lobulær hyperplasi). Utfra disse observasjonene sammen med genetiske data kan man anta at noen av disse lesjonene, i alle fall FEA, er neoplastiske proliferasjoner og kan være forstadier eller tidlige manifestasjoner av lavgradig DCIS og forstadier til invasivt karsinom, spesielt tubulært karsinom (Moinfar, Man, Bratthauer, Ratschek, & Tavassoli, 2000; P. T. Simpson et al., 2005).
Det foreligger svært lav risiko for residiv eller progresjon til kreft når disse opptrer som isolerte lesjoner, men siden FEA oftest ses sammen med andre lesjoner er det vanskelig å si noe om prognose, men WHO working group (2011) mener at FEA utgjør lavere risiko for kreft enn ADH og ALH (de Mascarel, MacGrogan, Picot, Dougazz, & Mathoulin-Pelissier, 2006).
Det bemerkes at columnar cell change og columnar cell hyperplasi og flat epitelial atypi kan forekomme i samme bryst og til og med i samme ductolobulære enhet.
Ved funn av FEA i nålebiopsi bør man skjære dypere snitt for å lete etter assosierte lesjoner. Rutinemessig fjerning av lesjoner med FEA anses ikke nødvendig. Det vil være tilleggsfunn og radiologisk vurdering som bestemmer om det skal gjøres merkebiopsi for å utelukke mer avansert lesjon (S. Schnitt et al., 2019).
Atypisk duktal hyperplasi
Atypisk duktal hyperplasi (ADH) er en intraduktal epitelproliferasjon som delvis har de cellulære og arkitektoniske kjennetegnene til DCIS. Lesjonen defineres også som ADH hvis den har alle morfologiske trekk av lavgradig DCIS, men er < 2 mm i størrelse. Siden forskjellen mellom ADH og DCIS er delvis kvantitativ, skal funn av ADH i grovnålsbiopsi alltid lede til merkebiopsi. ADH har imidlertid så lavt cancerpotensial i seg selv at påvisning i reseksjonsrender i mammaresektat ikke indiserer rereseksjon. Se tabell i kapittel "Oversikt over behandlings- og kontrollforslag ved premaligne tilstander".
Lobulær neoplasi – ALH og LCIS
Preneoplastiske forandringer i kjertellobuli (lobulær neoplasi) er kjennetegnet ved at de terminale kjertelstykkene er overfylt av epitelceller med lav innbyrdes kohesivitet. Det er to hovedtyper, basert på grad av utbredelse i kjertlene: atypisk lobulær hyperplasi (ALH), som kun affiserer en del av lobulus og lobulært carcinoma in situ (LCIS), som affiserer hele lobulus. De prolifererende cellene er oftest immunhistokjemisk negative for markøren E-cadherin.
LCIS deles igjen inn i klassisk, pleomorf, og florid type med comedonekrose (Lakhani et al., 2019):
- Klassisk LCIS har lavgradige kjerner og oppdages praktisk talt alltid tilfeldig i et mammaresektat eller en biopsi gjort for lesjon som er av en annen histologisk type. Den absolutte risiko for utvikling av infiltrerende karsinom ved LCIS er ca. 10 % etter 10 år, 20 % etter 20 år, og ved livstidsobservasjon henimot 30 %. Infiltrerende karsinom hos pasienter med påvist LCIS vil oftest være av duktal type. Risikoen for utvikling av infiltrerende karsinom er like stor i det kontralaterale som i det biopserte brystet. Siden klassisk LCIS (og ALH) er en «systemisk» lidelse i mamma, er det ikke indikasjon for merkebiopsi når det oppdages tilfeldig i grovnålsbiopsi. Unntaket er hvis radiologi og funn for øvrig indikerer en signifikant tilleggslesjon. Kvinnen følges opp med mammografiscreening. Ablatio og profylaktisk antiøstrogen-behandling er ikke aktuelle behandlingsalternativer i Norge. For aktuell referanse, se (Lakhani et al., 2019; Morrow, Schnitt, & Norton, 2015).
- Ved pleomorf LCIS viser cellene uttalt kjerneatypi, og tilstanden er til forveksling lik høygradig DCIS morfologisk. E-cadherin er imidlertid negativ. Siden erkjennelsen av tilstanden er relativt ny, vet vi ikke sikkert den assosierte risiko for invasiv brystkreft. Man regner imidlertid med at risikoen er høyere enn for klassisk LCIS og sannsynligvis like stor som for DCIS. Behandlingen bør derfor tilpasses dette (se fra kapittel "Lokalavansert brystkreft" til kapittel "Kirurgisk behandling av DCIS").
- Florid LCIS med comedonekrose har lavgradige kjerner, men danner tettliggende, meget utvidede kjertelendestykker, ofte med sentral nekrose og kalk. Det er ikke uvanlig at denne tilstanden detekteres ved mammografi. Morfologisk ligner den lavgradig DCIS. Anbefales behandlet som DCIS (se fra kapittel "Lokalavansert brystkreft" til kapittel "Kirurgisk behandling av DCIS"). For aktuell referanse, se (Lakhani et al., 2019; Morrow et al., 2015).
Ad behandling: Det henvises også til WHO-klassifikasjon der utgangspunktet er behandling av b og c som for DCIS (f. eks. render 2 mm), men at det utvises forsiktighet/nøye overveielse ved mer aggressiv terapi (for eksempel ablatio).
Ductalt carcinoma in situ (DCIS)
DCIS, også betegnet intraduktalt karsinom, må ikke forveksles med invasivt karsinom av duktal type. Ved DCIS er melkegangene fylt med carcinomceller og det er ikke infiltrasjon gjennom basalmembranen som omgir gangen. Cellene er oftest immunhistokjemisk positive for E-cadherin.
Forekomst
Tidligere var DCIS en sjelden tilstand og utgjorde kun mellom 1,4 og 5,3 % av alle nydiagnostiserte brystkrefttilfeller. Etter hvert som mammografi er blitt mer utbredt, påvises mistanke om slike forandringer hyppigere (mellom 5–10 %). I områder med etablert mammografiscreening utgjør DCIS 25–30 % av de nye brystkrefttilfeller i første screeningrunde. I senere screening-runder vil andelen være 10–20 %.
Fare for residiv
Hovedproblemet med DCIS er at risikoen for lokalt residiv i brystet etter reseksjon alene er betydelig større enn ved andre premaligne lesjoner i brystkjertelvevet. Risiko for residiv avhenger av flere faktorer, og er større for:
- Palpable enn for ikke-palpable DCIS svulster (Kerlikowske et al., 2003)
- DCIS grad 3 enn for DCIS grad 1 og 2 (Kerlikowske et al., 2003; MacDonald et al., 2005)
- Diffust utbredt enn for mikrofokale
- Hos yngre kvinner (Schouten van der Velden, Peeters, Koot, & Hennipman, 2006)
Størrelse
Det er vist at residivfaren øker med størrelse, men det kan være vanskelig å få gode data på størrelse og residivfrekvens, på grunn av vanskelig målbarhet av lesjonen, ofte flere etterfølgende inngrep og heterogenitet i klassifikasjon og behandling (Bijker et al., 2001; Fisher et al., 2001; Mokbel & Cutuli, 2006; Ottesen, Graversen, Blichert-Toft, Christensen, & Andersen, 2000; G. F. Schwartz, Solin, Olivotto, Ernster, & Pressman, 2000).
Reseksjonskanter
De fleste residiv kommer lokalt i nær tilslutning til det primære arret. Det er i litteraturen bred enighet om at frie reseksjonkanter er viktig for å hindre residiv, men antall mm på reseksjonsmarginene diskuteres (MacDonald et al., 2005; Mokbel et al., 2006; Schwartz et al., 2000). Det anbefales minst 2 mm mikroskopisk avstand fra DCIS (uten samtidig infiltrerende komponent i tumor) til nærmeste reseksjonskant mot omgivende mammavev for å ta høyde for histopatologisk usikkerhet i vurderingen av frie reseksjonskanter. Så kort avstand i definisjonen av fri reseksjonsrand forutsetter nøye histologisk undersøkelse.
Utredning og diagnostikk ved påvist invasiv brystkreft
Sist faglig oppdatert: 02202402.07.2024
Når brystkreftdiagnosen er verifisert, er det viktig å identifisere pasienter som har en primært inoperabel sykdom (se egen tabell for TNM-systemet og Stadie-inndeling). I dette begrepet legges lokalavansert brystkreft hvor neoadjuvant behandling er aktuelt. Skillet mellom operabel og inoperabel brystkreft har betydning for de undersøkelser som er aktuelle før behandlingsstart, og for de behandlingsvalg som må overveies.
Operabel brystkreftsykdom betegnes som kliniskT1-2N0-1M0
Primært inoperabel brystkreftsykdom betegnes som kliniskT3-4N0-3M0-1 eller T1-2N2-3M0-1.
Utredning av operabel brystkreftsykdom
Uten at det er anamnestiske opplysninger, symptomer eller funn som skulle gi mistanke om fjernmetastaser, er det i utgangspunktet ikke indikasjon for blodprøver og billeddiagnostikk av andre organ enn bryst som preoperative screeningundersøkelser. Grunnlag for disse undersøkelser vil i så fall være interne vurderinger av behov på et generelt medisinsk grunnlag.
Den preoperative utredning vil vanligvis begrense seg til:
- Mammografi og utralyd av begge bryst samt ultralyd av ipsilaterale aksille
- Ved behov: MR mammae
Postoperativ utredning av høyrisikogrupper ved operabel brystkreft
Det er grunnlag for å gjennomføre metastaseutredning (se pkt. "Stadieinndeling") av høyrisikogrupper før oppstart av adjuvant systemisk behandling, hvis dette ikke nevneverdig forsinker tidspunkt for behandlingsstart. Følgende grupper oppfattes til å spesielt tilhøre høyrisikogruppen:
- Lymfeknutepositive HER2 positive pasienter
- Lymfeknutepositive trippel negative pasienter
Utredning av inoperabel brystkreftsykdom/før neoadjuvant behandling
Hos kvinner med lokalavansert stadium eller metastaser vil det være aktuelt med en mer omfattende utredning før man tar stilling til behandlingsalternativer. Dette vurderes også for pasienter som er operable men som planlegges for neoadjuvant behandling. Det er viktig at man diskuterer hvert enkelt tilfelle med onkolog før behandlingstiltak iverksettes, slik at rasjonell utredning og adekvat behandling i størst mulig grad tilbys.
Som basisutredning vil følgende være aktuelt, beslutning gjøres etter helhetsvurdering av hvilket sensitivitetsnivå som er ønskelig/nødvendig:
- Mammografi og ultralyd begge bryst og UL ipsilateral aksille, eventuelt MR bryst
- CT Thorax/Abdomen/bekken
- Skjelettscintigrafi eller MR columna/bekken. PET/CT kan benyttes som alternativ til MR.
- Blodprøver (preoperative rutineprøver inkludert ALP, gamma-GT og s-Ca++)
- Andre undersøkelser på individuelle indikasjoner
Kardial utredning og monitorering hos pasienter som skal gjennomføre behandling med antracyklininneholdende kjemoterapi og/eller HER2-rettet behandling
Både antracyklininneholdende kjemoterapi og HER2-rettet behandling kan gi påvirkning av hjertefunksjon. De nye retningslinjene til European Society of Cardiology er vurdert i forhold til hvilke anbefalinger som er sentrale ved brystkreft (Lyon et al., 2022). Følgende anbefales som utgangspunkt for pasienter som er kandidater for behandling med antracyklininneholdende kjemoterapi og/eller HER2-rettet behandling, for å forebygge utvikling av hjertesvikt:
- EKG og BT på alle pasienter før oppstart behandling
- Videre utredning avhengig av risiko:
- Høyrisikopasient defineres som en av følgende: anamnestisk hjertesykdom (eks. tidligere hjerteinfarkt, hjertesvikt etc); tidligere kreftbehandling med kardiotoksiske medikamenter; alder ≥80 år; eller kombinasjonen av alder 65-79 år, hypertensjon, kronisk nyresykdom og diabetes
- Lavere risikopasienter: Øvrige
Ved indikasjon for antracyclininneholdende kjemoterapi i adjuvant situasjon:
- Høyrisikopasient
- EKKO ved baseline
- Kardiolog vurderer behov for å rekvirere hjertemarkører, evt andre tiltak
- EKKO etter avsluttet behandling (innen 12 mnd), evt under behandling dersom kardiolog vurderer behov
- Pasient med lavere risiko
- EKKO ved baseline dersom HER2 positiv med indikasjon for påfølgende HER2-rettet behandling
- Øvrige: ikke generelt grunnlag for EKKO eller andre undersøkelser
Ved indikasjon for antracyclininneholdende kjemoterapi i metastatisk situasjon:
-
- De samme anbefalinger som over gjelder som utgangspunkt, men behov/indikasjon kan variere i det enkelte tilfelle.
- Dersom det høyere kumulativ antracyklindose er gitt, kfr Medikamentell cytostatisk behandling av metastatisk brystkreft
Ved indikasjon for HER2-rettet behandling:
- Adjuvant situasjon:
- EKKO før oppstart av behandlingen
- EKKO hver 3 mnd til behandlingen avsluttes
- EKKO etter avsluttet behandling vurderes av kardiolog
- For ytterligere omtale av kardiale forhold og anbefalinger før og under bruk av HER2-rettet behandling, se "Spesielle forhold ved adjuvant behandling av HER2 positive pasienter hvor det er indikasjon for anti-HER2 behandling i kapitlet Alternative adjuvante behandlingsregimer
- Metastatisk situasjon:
- Dersom EKKO us hver 3. mnd er normal/stabil første året, kan EKKO tas hver 6. mnd fra og med det 2. året
Kan MUGA erstatte EKKO?
EKKO anbefales. MUGA bør kun erstatte EKKO ved kapasitetsmessige begrensninger på EKKO. MUGA gir økt strålebelastning og er en mindre god undersøkelse.
Annen utredning:
MUGA eller EKKO cor bør tas av HER2-positive pasienter som skal ha EC90 etterfulgt av taxan/trastuzumab. Dette for å best mulig avdekke cardial status og tolerabilitet av antracyclin, samt for å kunne avdekke endringer i ejeksjonsfraksjon av betydning før trastuzumab oppstartes.
Patologidiagnostikk av betydning for behandlingsvalg ved invasiv brystkreft
Typebestemmelse: Faggruppen for mammapataologi anbefaler at klassifikasjon og terminologi for mammakarsinomer følger WHOs anbefallinger (TNM: classification of malignant tumours, 2017). Her har man fra og med 2012 gått bort fra betegnelsen infiltrerende duktalt karsinom og erstattet denne med betegnelsen infiltrerende karsinom NST («invasive carcinoma of no special type»), og dette begynner å bli innarbeidet internasjonalt og i litteraturen.
70–80 % av brystkjertelens invasive karsinomer er infiltrerende karsinom NST. Disse karsinomene antas å utgå fra celler i TDLU (terminal duktulolobulær enhet) og viser ulike morfologiske uttrykk. Betegnelsen «duktal» er således misvisende.
Når mer enn 50 % av en gitt tumor viser en slik uspesifisert morfologi vil karsinomet betegnes «infiltrerende karsinom NST». Øvrige karsinomer er spesifiserte karsinomer («special types»). Den vanligste blant disse er infiltrerende lobulært karsinom. Dersom et karsinom skal klassifiseres som en spesifisert type, må mer enn 90 % av tumorvevet vise den spesifiserte morfologien. Dersom 50–90 % viser en spesifisert morfologi, betegnes karsinomet som blandet uspesifisert og spesifisert type. Et eksempel kan være «karsinom av blandet uspesifisert og lobulær type».
Dersom man er usikker på om det foreligger en spesialisert type (ved sylinderbiopsi) men ønsker å gjøre immunhistokjemisk undersøkelse, anbefales det at man benytter samme betegnelse, men angir at dette er en foreløpig vurdering (foreløpig diagnose).
Det gjøres ingen endringer i terminologi når det gjelder In situ karsinomer. I tråd med WHOs retningslinjer benevnes disse duktalt karsinom in situ (DCIS) og lobulært karsinom in situ (LCIS) som tidligere.
10–20 % av invasive karsinomer er av infiltrerende lobulær type, mens ulike andre typer utgjør resten. Noen av disse har bedre prognose enn gjennomsnittet, f.eks. tubulært karsinom, mucinøst karsinom og adenoid cystisk karsinom. Andre typer (uten spesielt god prognose) er mikropapillært, sekretorisk og apokrint karsinom. Pagets sykdom regnes som alltid å være forbundet med et underliggende duktalt karsinom, eller duktalt karsinom in situ (DCIS).
Invasiv brystkreft kan spres både lymfogent og hematogent. Det er gode holdepunkter for at tidlig diagnostikk og behandling reduserer risikoen for spredning begge veier. Den kirurgiske behandlingen er i prinsippet lik for alle invasive karsinomer (kfr Kirurgi). De viktigste etablerte prognostiske faktorer er tumorstørrelse, histologisk grad, og tilstedeværelse og omfang av axillære lymfeknutemetastaser. Disse faktorer, sammen med hormonreseptorstatus, HER2 status og proliferativ aktivitet i tumor, danner i dag det viktigste grunnlaget for om pasienten skal tilbys adjuvant behandling.
Gradering: Patologgruppen i NBCG har distribuert veldefinerte kriterier for histologisk gradering av mammakarsinomer til alle landets patologilaboratorier. Alle invasive karsinomer skal graderes etter de samme kriteriene (Nottingham-kriteriene). DCIS graderes etter Van Nuys-kriteriene.
I tillegg skal det utføres HER2 undersøkelse (ved hjelp av immunhistokjemi og/eller FISH/CISH/SISH) og immunhistokjemisk (IHC) bestemmelse av Ki67 (som kvantiteres etter definerte retningslinjer). Kit’ene som benyttes til IHC er standardisert til histologisk materiale, men kan også brukes på innstøpt celleblokk fra cytologisk materiale. Konferer under.
Analyse av lymfeknutestatus, tumorstørrelse, histologisk grad, HER2, hormonreseptor og proliferasjonsgrad har også betydning for det behandlingsopplegg som anbefales ved indikasjon for adjuvant behandling. Ved brystbevarende behandling vil en vurdering av risikoen for lokale residiv ut fra histologiske forandringer i primærtumor og tumors omgivelser være viktig. Utbredt DCIS i og spesielt utenfor det infiltrerende karsinomet, alder under 35 år og tumor i reseksjonsflaten synes å gi en øket risiko for lokalt residiv i brystet. Tumorstørrelse alene synes å være av mindre betydning.
Lymfeknuter: Teknikken med å påvise vaktpost-lymfeknuter («sentinel node» teknikk) brukes regelmessig ved brystkreftoperasjoner. Systematisk undersøkelse av randsinus i disse vaktpostlymfeknutene er viktig. Dersom primærtumor er av lobulær type, må man undersøke lymfeknutene særlig nøye, da metastaser fra slike svulster ellers kan overses, og her bør det benyttes immunhistokjemi. Det er ikke full enighet om betydningen av en detaljert karakterisering av små metastaser (størrelse, lokalisasjon i lymfeknuten, m.m.). Inntil videre bør man rapportere størrelsen på det største metastasefokus, og hvorvidt det er multiple metastaser, estimere antall tumorceller dersom disse stort sett ligger enkeltvis eller i små grupper. Det vises til egne retningslinjer fra DNP’s Faggruppe for Mammapatologi.
Ved undersøkelse av lymfeknuter etter gjennomgått neoadjuvant behandling kan det være vanskelig å fastslå om det foreligger resterende tumorvev i tillegg til funn av regressive forandringer. Bruk av IHC bør overveies; dette er et felt som diskuteres.
Dersom det gjøres immunhistokjemisk undersøkelse av lymfeknutene med antistoff mot cytokeratin, og sikre metastaser diagnostiseres først etter denne undersøkelsen, skal dette tydelig fremgå i besvarelsen.
Det er foreløpig noe usikkert hva som er nytten av å snitte systematisk dypere i blokkene (også ved frysesnitt), og hva som eventuelt er optimal protokoll her. Dette kan være avhengig av orientering og snittplan primært.
Dersom det foreligger perinodal vekst (ekstra-nodal infiltrasjon, gjennom lymfeknutekapsel), anbefales det nå at man beskriver dette, angir om det er flere foci, og måler utbredelse av det største focus ved å måle utbredelsen på det perinodale området langs lymfeknutekapselen (circumferent diameter) og i tillegg perpendiculært på kapselen (perpendikulær diameter, avstand målt fra kapsel til det «ytterste» punkt for tumorvev) (Aziz et al., 2017). Det er ikke internasjonal konsensus om dette.
Preparatene håndteres og vurderes i tråd med siste WHO-klassifikasjon (2019), og DNPs veileder i Biopsibesvarelse (siste utgave). Se også DNP’s nettside.
Hormonreseptorer: Bestemmelse av østrogenreseptor (ER) og progesteronreseptor (PR) (hormonreseptor) skal gjøres på alle invasive karcinomer, både på primærtumor og eventuelt senere residiv/ metastaser.
Hormonreseptoranalyse (immunhistokjemisk) gir viktig informasjon med tanke på behandlingsvalg, både i den adjuvante situasjonen og hvis pasienten senere får residiv. Immunhistokjemisk undersøkelse for å påvise østrogen- og progesteronreseptor i tumorkjernene kan gjøres på både cytologisk og histologisk materiale. Overensstemmelsen mellom reseptorstatus undersøkt på cytologisk og histologisk materiale er høy.
Kjernefargning regnes som reell positivitet, mens cytoplasmafargning oppfattes som uspesifikk. For ER regnes 1 % som cut-off verdi for positivitet. Det angis i tillegg om andel positive kjerner er over 10 %, eventuelt over 50 %. For PR regnes 10 % som terskelverdi for positivitet, og det angis gjerne om verdien er over 50 %. Fargningens intensitet inngår ikke i vurderingen etter dagens retningslinjer.
ER/PR bør gjentas på operasjonspreparatet hvis ER 1-9% i preoperativ biopsi.
HER2-status: Undersøkelse av HER2 status utføres på primære (invasive) mammakarsinomer og i tillegg på metastatiske lesjoner etter rekvisisjon fra kliniker. Patologigruppen tilknyttet NBCG har oppdatert retningslinjene siste gang i 2019 (se DNP’s nettside).
I tråd med dominerende internasjonal praksis anvender nesten alle nasjonale miljøer en todelt algoritme: først undersøkelse ved immunhistokjemi (IHC), deretter in situ hybridisering (ISH). ISH kan som alternativ også anvendes primært.
1. Immunhistokjemi
Det anbefales å benytte en standardisert metode (kit), og en anmodes om å delta i eksternt kvalitetssikringsprogram i tillegg til at interne kontroller inkluderes. Ved IHC 0 eller 1+ regnes prøven som negativ. Ved 2+ regnes prøven som usikker, og det gjøres ISH. Ved 3+ regnes prøven som positiv, og dette kan utløse behandling direkte. Eventuelt kan også 3+ verifiseres ved ISH.
Score 0 | ingen eller svak inkomplett membranfarging i <10 % av tumorcellene. |
Score 1+ | Inkomplett, svak membranfarging i >10 % av tumorcellene. |
Score 2+ | svak/moderat komplett membranfarging fokalt eller i alle tumorcellene (>10 %), eller sterk komplett farging i ≤10 % av tumorcellene. |
Score 3+ | sterk komplett membranfargning foreligger i >10 % av tumorcellene. |
Ved grenseverdier (10–30 %) kan en overveie ISH i tillegg.
Norsk Patolgiforening har også laget nye retningslinjer for HER2-low analyse, som er relevant ved behandling med trastuzumab deruxtecan ved HER2 score 1+/2+.
2. In situ hybridisering
Det anbefales å benytte en standardisert metode (kit), og det anmodes om at en deltar i eksterne kvalitetssikringsprogram. Probe for både HER2 og Kromosom 17 (K17) anvendes, og mange benytter nå dobbelfargning der begge prober fremstilles på samme snitt. Ulike metoder kan anvendes (FISH, CISH, SISH).
Den observerte verdi (etter telling av minst 20 celler) rapporteres eksakt til kliniker, som vurderer resultatet videre i forhold til behandling.
Det anbefales at en forholder seg til følgende retningslinjer i henhold til oppdatering fra ASCO (Wolff et al., 2018) og britiske retningslinjer (Rakha et al., 2015):
HER 2 negativ: | Dersom HER2/CEP17 ratio <2.0 OG gjennomsnittlig antall HER2 signaler er <4. |
HER2 positiv: | Dersom HER2/CEP17ratio er 2.0 eller høyere ELLER gjennomsnittlig antall HER2signaler per celle er 6 eller høyere. |
HER2 borderline/ikke amplifisert: | Dersom HER2/CEP17 ratio er <2 med gjennomsnittlig antall HER2signaler per celle 4–6 ELLER ratio 1,80–1,99. |
I grensetilfeller, både for IHC og ISH, bør en være ekstra oppmerksom angående optimal kvalitet av vev og analyseoppsett, og usikre fargninger bør repeteres, eventuelt med begge teknikker. Dersom operasjonspreparater må anvendes, er det mulig at ISH er en noe mer pålitelig teknikk som er mindre følsom for suboptimal fiksering, enn immunhistokjemi.
Heterogene svulster: I sjeldne tilfeller kan det foreligge områder med ulik HER2 status i ulike områder i tumor. I slike tilfeller må en se over hele snittet og velge ut områder med avvikende HER2 uttrykk, telle signaler per celle og beregne ratio i det enkelte område. Det er anbefalt at en teller og beregner ratio for minst tre synsfelt med minst 20 celler i hvert. En bør overveie å sammenholde funn med IHC snitt.
Dersom ratio i ett eller flere slike områder er 2 eller høyere kan tumor ansees HER2 positiv. Det bemerkes at dersom ratio er 1.8–2.2 bør en telle minst 60 celler i hvert område før en konkluderer. Ved ratio mellom 1.8 og 1.99 etter gjentatte tellinger, kan kasus ansees HER2 negativt.
Tumorcelleproliferasjon (Ki67): Proliferasjonsgrad (Ki67) skal etter retningslinjene vurderes for de fleste invasive karsinomer. Ved HER2-positiv status er ikke Ki67 analyse avgjørende for behandlingsbeslutninger, unntatt ved pT1apN0 hvor individuelle behandlingsbeslutninger kan forekomme og hvor Ki67 kan gi tilleggsinformasjon. Det samme gjelder for eldre pasienter med komorbiditet, hvor det kan være nødvendig å gjøre individuelle tilpasninger. Dersom HER2 status ikke er utført eller ikke er konklusiv på preoperativ biopsi, bør uansett Ki67 gjøres parallelt med HER2 på operasjonspreparatet.
Det gjøres ved immunhistokjemisk analyse av Ki67 ekspresjon i tumor, etter nærmere angitte kriterier fra NBCGs patologigruppe.
Metode:
- Undersøkelsen utføres på operasjonspreparat, der dette foreligger, og det velges en blokk der tumors mest cellerike del foreligger, der tumors mest høygradige del foreligger dersom tumor er heterogen, og der tumors periferi er med.
- Ki-67 farges etter den kvalitetssikrede metode som laboratoriet har etablert.
- Det området som har den mest aktive (høyeste) proliferasjon i tumorceller («hot spot») ringes inn.
- Innenfor det avmerkede området vurderes 500 tumorcellekjerner. Tellingen utføres på x400 forstørrelse ved hjelp av et raster (rutenett).
- Resultatet angis som andel kjerner som er positive for Ki-67 (%).
Kommentarer: «Hot spot» metode velges da dette er i overensstemmelse med hvordan mitoser telles ved vanlig gradering av mammacarcinomer. Disse skal telles i de mest aktive områder og fortrinnsvis perifert i tumor.
Det er kjent at Ki-67 fargning vil kunne variere etter antistoff og laboratoriemetoder for øvrig. Det finnes foreløpig ikke internasjonale retningslinjer for dette, og gruppen foreslår at det enkelte laboratorium benytter det antistoff (for eksempel MIB-1) og den metode som er innarbeidet, forutsatt at laboratoriet deltar i en ekstern kvalitetssikring av Ki-67 (for eksempel NordiQC).
Ansvarlig patolog vurderer om Ki-67 fargningen er teknisk tilfredsstillende, og hva som er det mest aktive området hvor kvantitering skal gjøres. Dette området ringes inn med tusj.
Tellingen gjøres av patolog eller bioingeniør i samarbeid med patolog. Det benyttes et raster (rutenett) for å gjøre tellingen systematisk, og x400 anbefales. (Alternativt kan benyttes x630 eller x1000. For eksempel kan alle kjerner som faller på linjer i rutenettet telles).
Det kan i enkelte svulster foreligge mange celler som ikke er tumorceller, for eksempel lymfocytter, fibroblaster og endotelceller. Det må da sikres at de kjerner som telles representerer tumorkjerner.
En skjønnsmessig vurdering av proliferasjon, for eksempel over eller under en gitt verdi, er etter gruppens oppfatning ikke tilstrekkelig for å vurdere en så viktig parameter.
Utviklingen fremover vil kunne resultere i at Ki-67 alternativt kan analyseres ved hjelp av billedanalyse, men utstyr og standardisering foreligger ikke i de fleste avdelinger, og der er ikke retningslinjer på dette punkt.
Resultatet, etter telling av 500 kjerner, oppgis i besvarelsen som % positive kjerner.
Det har vært og er mye diskusjon om hva som er riktig terskelverdi for innslag av tilleggsbehandling, og dette må sees i forhold til hvilken preparattype som vurderes og hvilken tellemetode som anvendes. Det er i NBCG enighet om valg av operasjonspreparat og hot-spot-basert telling. Dette er også i overenstemmelse med hvordan proliferasjon vurderes i forbindelse med histologisk gradering (som telling av mitoser). Hvordan Ki67-verdien benyttes av klinikere for å vurdere adjuvant behandlingsvalg er noe endret i forhold til tidligere, konferer kapittel Adjuvant og neo-adjuvant systemisk behandling).
Tumorcelleproliferasjon (mitosetall):
På grunn av variasjon i Ki67-tallet mellom ulike avdelinger, manglende standardisering av metoder, og det faktum at det internasjonalt ikke er konsensus om klinisk bruk av Ki67, er det nå vedtatt at patologene også rapporterer mitosetall ved alle invasive karsinomer. Dette er antall mitoser, slik som det telles i forbindelse med histologisk gradering, og dette oppgis i diagnosen separat. Mitosetallet oppgis som antall mitoser per mm2 (for å justere for ulike størrelser av synsfeltet på x400). Tallet angis med en desimal. DNP’s Patologigruppe har utarbeidet egne retningslinjer for dette.
PD-L1 status:
Patologigruppen tilknyttet NBCG har utgitt nasjonale retningslinjer for bestemmelse av PD-L1 status med virkning fra 15.4.20, på bakgrunn av vedtak i Beslutningsforum (se DNP’s nettside for detaljer).
Vurdering og rapportering av PD-L1 status:
Dersom aktuelt å behandle med atezolizumab: Det skal anvendes PD-L1 antistoff klon SP142. Tonsille-vev anbefales som positiv kontroll, dette viser positivitet særlig i kimsentre. Epitelceller i krypte-epitelet skal også vise positivitet.
Ved denne problemstillingen (indikasjonen) vurderes PD-L1 positivitet i lymfoide celler, uavhengig av fargeintensitet («tumor-infiltrating immune cells»: lymfocytter, makrofager, dendrittiske celler, granulocytter). I forhold til behandling er det svulster med PD-L1 positivitet lik eller større enn 1 % som vurderes som positive og som derved er aktuelle for behandling. Det er positiv arealfraksjon innenfor tumorkonturen som rapporteres (stroma inkludert).
Det er kun areal med invasivt tumorvev som skal vurderes; områder med assosiert DCIS eller LCIS, nekroser, arrdannelse uten tumorceller, og partier med kun reaktive forandringer som for eksempel fremmedlegeme-reaksjon, skal ikke inkluderes i arealet som estimeres.
Det anvendes vevsmateriale med så mye tumorvev som mulig, da det kan være lite lymfocytter tilstede. Snitt fra metastaser (mest relevant der dette foreligger) eller fra primærtumor er aktuelt materiale. Nedre grense for mengde tumorvev (for at prøvematerialet skal regnes for å være adekvat) angis å være 50 viable tumorceller med assosiert stroma.
Dersom aktuelt å behandle med pembrolizumab: Dersom det er aktuelt å behandle med pembrolizumab benyttes et annet PD-L1 antistoff (22C3 PharmDx) og et annet scoringssystem (CPS = Combined Positive Score). Med dette antistoffet farges ofte både tumorceller og leukocytter positivt, og CPS score er bestemt av antall positive tumorceller pluss lymfocytter og makrofager, delt på totalt antall tumorceller. PD-L1 status (mht pembrolizumab-behandling i trippel-negativ brystkreft) er positiv hvis >= 10 %. Det vises til metodebeskrivelse for CPS score beregning hos produsenten (Agilent DAKO).
Dersom andre PD-1/PD-L1 hemmere (enn atezolizumab og pembrolizumab) planlegges benyttet i behandlingen må PD-L1 analysen også være den som er anbefalt ved bruk av det spesifikke medikament.
Anbefalinger:
Diagnoseformulering og oppsummering
Det anbefales en strukturert diagnoseformulering og oppsummering. Denne ble støttet av NBCG’s styringsgruppemøte 19.11.14. Det anbefales at alle avdelinger og laboratorier anvender dette punktvise formatet (i fritekst) i diagnosefeltet. Der er rom for nyanseringer der dette er faglig nødvendig i forhold til behandling og oppfølgning.
- Preparattype.
- Hoveddiagnose.
- Invasivt karsinom, histologisk type.
- In situ karsinom (alene eller i kombinasjon med invasivt dersom tilstede utenom invasiv komponent).
- Histologisk grad (Nottingham, for invasiv; Van Nuys, for DCIS).
- Mitosetall: antall mitoser per mm2 (hot-spot).
- Tumors størrelse og utstrekning (invasiv + evt. In situ).
- Invasjon i spesielle strukturer: kar (lymfekar, blodkar), hud/papille, muskel, nerver.
- Reseksjonsflater.
- Lymfeknutestatus (SLN + evt. aksille).
- Vaktpostlymfeknuter (SLN) (antall positive, antall totalt, størrelse/mengde av tumorvev, ekstra-nodal vekst).
- Aksillære lymfeknuter: antall positive, antall totalt; størrelse/mengde av tumorvev; ekstra-nodal vekst (tilstede eller ikke, med mål).
- Biomarkører (invasiv cancer): ER, PR, HER2, Ki67.
Dersom det gjennomføres neoadjuvant behandling bør det fremkomme i beskrivelsen av operasjonspreparatet størrelse på resttumor i brystet (hvis denne kan målsettes). Responsvurdering bør også gjøres.
Kommentarer
Remisse og diagnosefelt skal foreligge i fritekst, et format som gir rom for detaljert beskrivelse av hva som er mottatt, makrobeskrivelse med uttak av snitt, mikrobeskrivelse med diagnostiske kriterier, supplerende undersøkelser, vurdering med nyanseringer og differensial-diagnostiske overveielser inkludert adekvat diskusjon og kommunisering av usikkerhet, konklusjon, og diagnoseoppsummering (formulering av selve diagnosen). Fritekstformatet gir rom for nyanseringer og presiseringer, også i diagnosefeltet. Formatet frembyr ikke problemer i forhold til oppdateringer og justeringer som følge av faglig utvikling og nye anbefalinger.
Enkelte av diagnosefeltene legger opp til å oppsummere og integrere informasjon fra flere remisser da dette kan lette oversikten og kommunikasjonen i forhold til rekvirenter og registerenheter. Det anses da nødvendig at en i parentes henviser til den spesifikke remisse som informasjonen hentes fra, med remissenummer, slik at det ikke skapes tvil om juridisk ansvar, da det ikke forutsettes at disse preparatene vurderes på nytt selv om informasjonen integreres i en hovedremisse. For brystkreft vil dette vanligvis gjelde vaktpostlymfeknuter og biomarkører, eventuelt annen informasjon.
Ved kombinert invasiv og in situ kan punkt 2 og punkt 3 eventuelt kombineres, ved at type og grad nevnes først for invasiv, deretter DCIS med grad.
Størrelse angis for invasiv, mens begrepet «utbredelse» (samlet utstrekning) benyttes for kombinasjon av invasiv og DCIS der sistnevnte komponent foreligger utenfor invasiv del. Ved multifokalitet (avstand > 5 mm mellom lesjoner) kan de aktuelle parametre oppgis per tumor (T1, T2, etc).
Invasjon i spesielle strukturer baseres på vanlige kriterier. Det skal tas særlige hensyn til kriterier for pT4. Innvekst i hud forutsetter ulcerasjon av epidermis eller noduler (makroskopiske) av tumorvev i dermis; for sistnevnte foreligger gråsoner. For innvekst i muskulatur legges vekt på innvekst i intercostal muskulatur. (Kfr. siste utgave av TNM.)
For invasive rapporteres «frie reseksjonsflater» eller det motsatte («ink on tumor»). For in situ (DCIS) rapporteres «fri reseksjonsflate» ved avstand > 2 mm. Ved «fri» rand men mindre avstand til reseksjonsflaten enn 2 mm ved DCIS anbefales følgende formulering: Reseksjonsflate med knapp margin (angi korteste avstand mellom DCIS lesjon og tusjmerket flate, og hvor dette er lokalisert).
Biomarkører: Her summeres informasjon, også fra andre remisser, på ER, PR, HER2, og Ki67. Dersom oppsummerende informasjon hentes fra andre remisser, anbefales at remissenr. anføres i parentes, av legale grunner).
Stadieinndeling
Sist faglig oppdatert: 02202402.07.2024
Stadieinndelingen ved brystkreft i Norge har tidligere ikke vært helt i tråd med den stadieinndeling som har vært benyttet internasjonalt. Man har bygget på Kreftregisterets stadieinndeling. Blant annet har lymfeknute negative pasienter med T2 tumorstørrelse vært klassifisert som stadium I, i motsetning til internasjonalt hvor de har vært klassifisert som stadium II. Denne diskrepansen var uhensiktsmessig. I de senere år har stadieinndelingen blitt endret til å være lik internasjonal praksis (UICC/AJCC).
Stadium I | kliniskT1N0M0 |
Stadium II | kliniskT0-2N1M0 |
kliniskT2N0M0 |
Stadium II | kliniskT3N0M0 |
Stadium III | kliniskT0-2N2M0 |
kliniskT3N1-2M0 | |
kliniskT4N0-2M0 | |
kliniskT0-4N3M0 | |
Stadium IV | kliniskT1-4N0-3M1 |
TNM-klassifikasjon
Sist faglig oppdatert: 02202402.07.2024
(AJCC 2017 = UICC 2017)
Primærtumor* (T) |
| |
TX | Klassifikasjon ikke mulig pga manglede informasjon |
|
T0 | Ingen erkjent primærtumor |
|
Tis | Carcinoma in situ |
|
Tis (DCIS) | Ductalt carcinoma in situ |
|
Tis (LCIS) | Lobulært carcinoma in situ |
|
Tis (Paget) | Paget’s sykdom uten primærtumor. Pagets sykdom med primærtumor klassifiseres i henhold til størrelsen på primærtumor |
|
T1 | Tumor ≤ 2 cm i største diameter |
|
T1mic | Tumor ≤ 0.1 cm i største diameter |
|
T1a | Tumor > 0.1 ≤ 0.5 cm i største diameter |
|
T1b | Tumor > 0.5 ≤ 1.0 cm i største diameter |
|
T1c | Tumor > 1.0 ≤ 2.0 cm i største diameter |
|
T2 | Tumor > 2.0 ≤ 5.0 cm i største diameter |
|
T3 | Tumor > 5.0 i største diameter |
|
T4 | Tumor uavhengig av størrelse, men med affeksjon av hud eller brystvegg slik som anført under T4a, T4b eller T4d |
|
T4a | Innvekst til brystvegg (ribben, intercostalmuskulatur, serratus anterior) |
|
| forts. | |
T4b | Synlig ødem, peau d’orange eller ulcerasjon vurdert ved klinisk undersøkelse, eller tumorinfiltrasjon i hud som synlig (makroskopisk) og/eller palpabel tumorknute som er adskilt fra primærtumor (som satellitt tumorknute) (Kun mikroskopisk satellitt tumorknute vil ellers klassifiseres i tråd med tumorstørrelse. Det samme gjelder ved tumor med direkte innvekst i hud men uten ødem, ulcerasjon eller makroskopisk satellitt tumorknute) |
|
T4c | Både T4a og T4b |
|
T4d | Inflammatorisk carcinom |
|
Etter TNM: classification of malignant tumours (Brierley et al., 2017). Copyright 2017 Wiley.
Klinisk lymfeknutestatus (N) | |
NX | N-klassifikasjon ikke mulig på grunn av manglende informasjon |
N0 | Ingen påvisbare regionale lymfeknutemetastaser |
N1 | Bevegelige ipsilaterale axillære lymfeknutemetastaser |
N2 | Ipsilaterale axillære lymfeknutemetastaser fiksert til hverandre eller andre strukturer, eller klinisk eller billeddiagnostisk påvisbare metastaser til ipsilaterale mammaria interna lymfeknuter i fravær av klinisk påvisbare axillære lymfeknutemetastaser |
N2a | Ipsilaterale axillære lymfeknutemetastaser fiksert til hverandre eller andre strukturer |
N2b | Klinisk eller billeddiagnostisk påvisbare metastaser til ipsilaterale mammaria interna lymfeknuter i fravær av klinisk påvisbare axillære lymfeknutemetastaser |
N3 | Ipsilateral spredning til infraclaviculære lymfeknuter, eller spredning til klinisk eller billeddiagnostisk påvisbare ipsilaterale mammaria interna lymfeknuter og samtidig klinisk påvisbare axillære lymfeknutemetastaser, eller ipsilateral spredning til supraclaviculære lymfeknuter med eller uten axillære, eller mammaria interna lymfeknutemetastaser |
N3a | Klinisk påvisbare ipsilaterale infraclaviculære lymfeknutemetastaser |
N3b | Klinisk eller røntgenologisk påvisbare ipsilaterale mammaria interna lymfeknuter og samtidig klinisk påvisbare axillære lymfeknutemetastaser |
N3c | Klinisk påvisbare ipsilaterale supraclaviculære lymfeknutemetastaser |
Etter TNM: classification of malignant tumours (Brierley et al., 2017). Copyright 2017 Wiley.
Histologisk lymfeknutestatus (pN) | |
pNX | N-klassifikasjon ikke mulig på grunn av manglende informasjon |
pN0 | Ingen histologisk påvisbare regionale lymfeknutemetastaser, ikke utført immun-histokjemisk undersøkelse for påvisning av tumorcelleansamlinger ≤0.2 mm |
pN0(i-) | Ingen histologisk påvisbare regionale lymfeknutemetastaser, negativ immunhistokjemisk analyse |
pN0(i+) | Ingen påvisbare regionale lymfeknutemetastaser, positiv immunhistokjemisk analyse, men ingen tumorcelleansamlinger >0.2 mm |
pN0(mol-) | Ingen påvisbare regionale lymfeknutemetastaser, negativ molekylær undersøkelse (rt‑pcr) |
pN0(mol+) | Ingen påvisbare regionale lymfeknutemetastaser, positiv molekylær undersøkelse (rt‑pcr) |
pN1mi | Mikrometastase > 0.2 ≤ 2.0 mm i største diameter |
pN1 | Metastase til 1–3 axillære lymfeknuter og/eller mikroskopisk påvisbar spredning til mammaria interna lymfeknute etter sentinel node undersøkelse (ikke klinisk påvisbar) |
pN1a | Metastase til 1–3 axillære lymfeknuter |
pN1b | Mikroskopisk påvisbar spredning til mammaria interna lymfeknute etter sentinel node undersøkelse (ikke klinisk påvisbar) |
pN1c | Metastase til 1–3 axillære lymfeknuter og mikroskopisk påvisbar spredning til mammaria interna lymfeknute etter sentinel node undersøkelse (ikke klinisk påvisbar) |
pN2 | Metastase til:
|
pN2a | Metastase til 4–9 axillære lymfeknuter (største metastase > 2.0 mm) |
pN2b | Metastase til klinisk eller billeddiagnostisk påvisbare ipsilaterale mammaria interna lymfeknute(r) uten samtidige axillære lymfeknutemetastaser |
pN3 | Metastase til:
|
pN3a | Metastase til:
|
pN3b | Metastase til:
|
pN3c | Metastase til ipsilaterale supraclaviculære lymfeknute(r) |
* NB! Metastase til intramammær lymfeknute rubriseres som axillær lymfeknutemetastase
Etter TNM: classification of malignant tumours (Brierley et al., 2017). Copyright 2017 Wiley.
Fjernspredning (M) | |
MX | M-klassifikasjon ikke mulig på grunn av manglende informasjon |
M0 | Ingen fjernspredning påvist |
M1 | Fjernspredning påvist |
Etter TNM: classification of malignant tumours (Brierley et al., 2017). Copyright 2017 Wiley.
Genpaneler og annen mutasjonstesting av tumorvev ved brystkreft (somatiske mutasjoner)
Sist faglig oppdatert: 02202402.07.2024
Dette avsnittet omhandler ikke testing for kimcellemutasjoner som man i stedet analyserer i blodprøver ved medisinsk genetiske avdelinger.
Det pågår stor forskningsaktivitet for å finne prediktive biomarkører basert på mutasjoner i brystkreftsvulstene, såkalte somatiske mutasjoner. Slike somatiske mutasjoner detekteres ved ekstraksjon av DNA fra kreftsvulsten og påfølgende sekvensering av DNA. Man kan enten sekvensere enkeltgener (klassisk Sanger sekvensering), sekvensere et sett av gener (genpaneler) eller sekvensere hele eksomet (whole exome sequencing, WES) eller genomet (whole genome sequencing, WGS).
Foreløpig er teknologien slik at DNA sekvensering i rutinediagnostikk i praksis gjøres for enkeltgener eller som genpaneler. Genpanelene kan inneholde alt ifra 4–5 opp til flere hundre kreftgener. Ettersom panoramaet av genmutasjoner er forskjellig ved ulike krefttyper vil ikke et genpanel for tykktarmskreft nødvendigvis være dekkende for bruk ved brystkreft. Videre forandrer panoramaet av genmutasjoner seg fra tidlig brystkreft til metastatisk situasjon, slik at enkelte mutasjoner som er sjelden forekommende ved tidlig brystkreft er mer vanlige i senere faser av sykdomsutviklingen, og dette bildet kan igjen endre seg etter flere linjer med behandling i metastatisk situasjon.
Mutasjonsanalysene gjøres som regel på en biopsi tatt fra primærtumor eller fra en metastase, og representerer således en svært liten del av det totale antallet kreftceller hos pasienten. På grunn av tumorheterogenitet må man anta at mutasjonsanalysen fra biopsien i noen tilfeller IKKE representerer den delen av tumor som er av størst betydning for videre sykdomsutvikling. Hvor vidt analyse av tumorceller/sirkulerende tumor DNA i blodbanen vil kunne redusere usikkerhet knyttet til tumorheterogenitet er foreløpig uavklart.
Det kan også være slik at mutasjoner er til stede, men i en svært liten andel av kreftcellene, som gjør at det konkluderes med at biopsien ikke inneholder mutasjon for det aktuelle genet ved første gangs analyse. Ved senere residiv/progresjon av sykdommen, kan dette endre seg ved at den muterte klonen av kreftceller har ekspandert og hvor ny biopsi vil avdekke mutasjon for aktuelle gen. Situasjonen er altså ikke statisk.
Nedenfor følger en beskrivelse av spesifikke somatiske mutasjoner der genanalyser vil kunne få terapeutiske implikasjoner i nær fremtid. At de nå omtales betyr ikke at det er formulert spesifikke anbefalinger om bruk i klinisk rutine.
ESR1 mutasjoner er sjelden forekommende ved tidlig brystkreft, men vanlig forekommende ved hormonreseptor positiv (HR positiv), HER2 negativ metastatisk brystkreft (Fribbens et al., 2016; Razavi et al., 2018). Disse mutasjonene predikerer for resistens mot aromatasehemmer. Der man vurderer å starte opp med AI i metastatisk situasjon kan det derfor være grunnlag for å avklare om brystkreftsykdommen har ESR1 mutasjoner. Ved ESR1 mutasjoner vil man i stedet kunne velge fulvestrant i metastatisk situasjon (Fribbens et al., 2016).
Aktivering av PI3K-Akt-mTOR signalveien er en kjent resistensmekanisme ved endokrin terapi (Baselga, 2011). Dette skyldes i de fleste tilfeller lav PTEN proteinekspresjon, PIK3CA eller AKT mutasjoner. PIK3CA mutasjoner medfører økt aktivitet i PI3K enzymet og dermed økt PI3K-Akt-mTOR signalering. Slike mutasjoner er vist å gi prediktiv informasjon for effekt av PI3K hemmere, slik som taselisib (Dickler et al., 2018), buparlisib (Baselga et al., 2017) og alpelisib (Andre et al., 2019a), ved HR positiv, HER2 negativ metastatisk brystkreft. Fra 1/7-22 ble alpelisib godkjent for bruk i Norge, ved HR positiv, HER2 negativ metastatisk brystkreft, etter forutgående endokrin behandling (se omtale under "Medikamentell endokrin behandling" og anbefalinger under "Anbefalt endokrin behandling av postmenopausale pasienter med metastaser"). Når det gjelder AKT mutasjoner så er disse sjelden forekommende, men kan være aktuelle å detektere for å styre behandling med Akt hemmere i fremtiden (Kim et al., 2017; Schmid et al., 2020a).
FGFR mutasjoner, hovedsaklig amplifikasjoner, forekommer også ved brystkreft (Giltnane et al., 2017; N. Turner et al., 2010), kanskje i opp mot 18 % av svulstene (Helsten et al., 2016). Tilstedeværelse av slike mutasjoner testes som terapeutisk angrepspunkt (Musolino et al., 2017), men det er behov for flere avklarende studier.
HER2 mutasjoner som oppstår under behandling kan medføre resistens mot endokrin terapi (Nayar et al., 2018) ved HR positiv, HER2 negativ brystkreft, men kan også medføre resistens mot tyrosin kinasehemmeren lapatinib (men ikke neratinib) ved HER2 positiv brystkreft (Bose et al., 2013). Videre kan trunkerende mutasjoner i HER2 medføre at det ekstracellulære domenet av HER2 reseptoren er borte og dermed vil HER2 rettede antistoff være uvirksomme (Scaltriti et al., 2007). Således kan analyse for HER2 mutasjoner bli aktuelt før behandlingsbeslutninger.
NTRK genfusjon er svært sjelden forekommende ved brystkreft, men predikerer for effekt av TRK hemmere (Demetri et al., 2022; Forsythe et al., 2020). Entrektinib er godkjent av Beslutningsforum med tumoragnostisk indikasjon for pasienter med avansert kreftsykdom uten andre behandlingsalternativer. NTRK genfusjon er hyppig forekommende (93% av tilfellene) ved en sjelden undertype (<1%) av brystkreft; sekretorisk brystkreft (Cocco et al., 2018; Forsythe et al., 2020), slik at ved bruk av genpanel for å identifisere nye behandlingsmuligheter kan dette komme frem som en sjelden opsjon for pasienter med metastatisk brystkreft.
Utover kimcelle BRCA mutasjoner, er somatiske mutasjoner relatert til homolog rekombinasjon (HR) (DNA reparasjon) av økende betydning. Somatiske HR mutasjoner eller epigenetisk inaktivering av slike gen kan medføre funksjonell HR mangel (HR deficiency: HRD), dette omtales en del steder i litteraturen som BRCAness (Rigakos & Razis, 2012; N. Turner, Tutt, & Ashworth, 2004). Det er ulike typer analyser som har vært brukt for slik HRD analyse, og det er varierende resultater for prediktiv verdi av slike analyser i hvert fall når det gjelder respons av platinum kjemoterapi (Telli et al., 2016; A. Tutt et al., 2018). Ved andre typer metastatisk cancer, slik som ovarial og prostatacancer, har man sett at PARP hemmere er effektive hos dem som har mutasjoner relatert til HR; slik som somatiske BRCA og PALB2 mutasjoner (Mateo et al., 2020; K. N. Moore et al., 2019). Det er således mulig at man også ved trippel negativ brystkreft med somatiske HR mutasjoner vil finne effekt av PARP hemmere, men resultater fra studier må avventes.
Mikrosatelitt instabilitet (MSI) er vist å være prediktivt for respons på immunterapi og påfølgende overlevelsesgevinst, på tvers av mange typer metastatisk kreftsykdom (Le et al., 2017; Le et al., 2015). MSI er sjelden ved brystkreft, men for subgruppen med trippel negativ brystkreft (TNBC) er det ved helgenomsekvensering påvist «mismatch repair deficiency» hos 4.7 % ved tidlig brystkreft (Staaf et al., 2019). Ved mer begrenset PCR basert diagnostikk for hot-spot MSI loci ble det ved TNBC funnet forekomst av MSI high status hos kun 0.9 % (Kurata et al., 2020), og enda lavere dersom man studerte brystkreft av alle subtyper (Anbazhagan, Fujii, & Gabrielson, 1999).
Kirurgisk behandling av lokalisert sykdom/Kurativ behandling
Innledning
Sist faglig oppdatert: 02202402.07.2024
Målsetting for kirurgisk behandling er å oppnå lokal kontroll for dermed å bedre overlevelsen. I dette ligger intensjonen om å unngå lokoregionale residiv, herunder også residiv etter brystbevarende behandling.
Kirurgiske behandlingsmuligheter av primærtumor er enten ablatio (mastektomi) eller brystbevarende kirurgi (BCT). Aksilleinngrep utføres i form av vaktpostlymfeknutebiopsi (sentinel node biopsi/ SNB), med eller uten påfølgende aksilledisseksjon eller direkte aksilledisseksjon (AD), definert som fjerning av aksillære lymfeknuter i nivå 1 og 2).
Hos pasienter med fjernspredning på diagnosetidspunktet eller hos pasienter med komorbiditet, kan man etter individuell vurdering velge mindre omfattende kirurgi, eventuelt i kombinasjon med systemisk behandling for å oppnå maksimal sykdomskontroll.
Kirurgisk taktikk og teknikk
Sist faglig oppdatert: 02202402.07.2024
Operative metoder som benyttes ved brystkreft:
- Diagnostisk biopsi
- Brystbevarende kirurgi (BCT) med eller uten onkoplastisk korreksjon (OBCS)
- Ablatio mammae (mastektomi) med eller uten primær rekonstruksjon
- Vaktpostlymfeknutebiopsi (SNB)
- Aksilledisseksjon (AD)
Ved operativ behandling av maligne forandringer i brystvevet skal det tas hensyn til så vel kirurgiske, onkologiske, samt kosmetiske forhold. Onkologiske prinsipper prioriteres over kosmetiske hensyn. Kosmetiske problemer i forbindelse med operasjon for brystkreft dreier seg i første omgang om hudoverskudd omkring arret etter mastektomi, deformering av brystet etter brystbevarende kirurgi samt skjemmende arr. Planlegging og utførelse av diagnostiske eller terapeutiske inngrep må derfor tilstrebe å unngå slike problemer.
Gjennom vurdering av den individuelle pasients brystkonfigurasjon som bryststørrelse, ptosegrad og komorbiditet må inngrepet planlegges ut fra grunnprinsipper og tekniske anbefalinger.
I tverrfaglig møte der kirurgi planlegges bør følgende tas med i betraktning:
- Tumorlokalisasjon og størrelse
Store eksisjoner er mulig i øvre laterale kvadrant uten behov for større korreksjoner. Risiko for asymmetri og deformitet av brystet øker ved selv mindre eksisjoner i de andre kvadrantene uten bruk av onkoplastiske teknikker. Prosent eksidert brystvolum er den viktigste faktoren av betydning for kosmetisk utseende (S. W. Chan, Cheung, & Lam, 2010; Cochrane, Valasiadou, Wilson, Al-Ghazal, & Macmillan, 2003).
- Brystkjerteltetthet (densitet)
Kjertel med økt tetthet krever i høyere grad mobilisering og lukning av kaviteten. Ved redusert tetthet skal en være forsiktig med mobilisering av vev grunnet risiko for fettvevsnekrose (Clough et al., 2003).
Diagnostisk biopsi
Indisert der hvor man ikke har preoperativ diagnose ved hjelp av FNAC, sylinderbiopsi eller vakumbiopsi. Se kapittel Diagnostisk åpen biopsi/merkebiopsi.
Teknikk
Følger teknikk som ved BCT der en tilstreber at snittet ikke kommer i konflikt med et eventuelt senere ablatio-snitt eller OBCS. Snittføring periareolært gir ofte et godt kosmetisk resultat. Som ved brystbevarende operasjon, skal tumorkaviteten alltid klipses, men antall klips kan være mindre der sårhulen er liten og/eller mistanken om cancer/DCIS er liten. Det bør alltid benyttes minst 5 klips slik at dorsalt, medialt, lateralt, kranialt og kaudalt i sårhulen er definert.MR kompatible klips skal benyttes.
Palpabel tumor: Bør om mulig gjøres ved at tumor fjernes fullstendig.
Merkebiopsi er aktuelt ved ikke-palpable malignitetssuspekte mikroforkalkninger eller ikke-palpabel malignitetssuspekt lesjon hvor man ikke har stilt klar diagnose ved vakumbiopsi, sylinderbiopsi eller FNAC. Merking gjøres preoperativt enten ultralyd- eller stereotaktisk veiledet. Preparatet må billedmessig verifiseres, kfr. utredningskapitlet.
Brystbevarende kirurgi
Målsetning for brystbevarende kirurgi
- Samme overlevelse som ved ablatio
- God lokal kontroll ved å sikre lav risiko for ipsilateralt residiv (< 1 % per år)
- Kosmetisk resultat må forventes å bli like godt og ofte bedre enn ablatio fulgt av rekonstruksjon
- Brystbevarende kirurgi foretrekkes der det er teknisk mulig og forholdene ligger til rette for det (de Boniface, Szulkin, & Johansson, 2021).
Kontraindikasjoner / relative kontraindikasjoner mot brystbevarende kirurgi (Bartelink et al., 2001; Cabioglu et al., 2005; M. Clarke et al., 2005; Fisher et al., 2002; Houssami et al., 2010; Larson, Grobmyer, & Valente, 2018; Litiere et al., 2012; Veronesi et al., 2002; Veronesi et al., 1995)
Absolutte:
- Hos gravide der strålebehandling (etter eventuelt brystbevarende inngrep) ikke kan utsettes til etter avsluttet svangerskap
- Diffuse malignitetssuspekte mikroforkalkninger som omfatter flere segmenter av brystet. Utbredelsen bør verifiseres histologisk preoperativt.
- Ikke frie reseksjonsrender der videre rereseksjon ikke er mulig
- Der strålebehandling ikke lar seg gjennomføre (f.eks alvorlig hjerte-/lungesykdom eller thoraxmalformasjon)
- Lokalavansert situasjon som tilsier bruk av neoadjuvant systemisk behandling (kfr Aksillemetastase(r) fra brystkreft uten påvist primærtumor i bryst)
Relative:
- Aktiv bindevevssykdom som affiserer hud (f.eks. sklerodermi og lupus)
- Stor tumor i et lite bryst (se avsnittet lengre ned om onkoplastisk kirurgi, samt kapittel Lokalavansert brystkreft)
- Kjent mutasjon i BRCA 1 eller 2 (utgjør 3–5 % av all brystkreft). Disse pasientene har en økt risiko for å få et ipsilateralt recidiv og kontralateral brystkreft. Retrospektive studier har vist en overlevelsesgevinst ved å gjøre bilateral mastektomi hos pasienter med BRCA 1 og 2 mutasjon (Metcalfe et al., 2014; Valachis, Nearchou, & Lind, 2014). Hos mange pasienter kan det være hensiktsmessig å gjøre et brystbevarende inngrep i første omgang og det endelige profylaktiske inngrepet etter evt. adjuvant kjemoterapi og før evt. strålebehandling.
- Tidligere strålebehandling mot bryst eller brystvegg etter brystbevarende kirurgi vanskeliggjør ny brystbevarende kirurgi, men kfr. kapittel Risikoorganer.
- Mastektomi er førstevalg hos kvinner med brystkreft og kimbane genfeil i TP53 (Tung et al., 2020). Strålebehandling bør unngås hos disse pasientene på grunn av økt risiko for stråleindusert kreft.
Neoadjuvant behandling og brystbevarende inngrep
Der tumor er så stor i forhold til brystets størrelse at et brystbevarende inngrep med eller uten OBCS, ikke lar seg gjøre, evt. at tumor er beliggende i ugunstige lokalisasjoner av brystet, kan neoadjuvant behandling (kjemoterapi eller endokrin behandling) bidra til å legge forholdene til rette for et brystbevarende inngrep dersom det oppnås en tilstrekkelig reduksjon i tumorstørrelsen (Mieog, van der Hage, & van de Velde, 2007). Respons på neoadjuvant behandling er størst ved trippel negative og HER2 positive svulster (Houssami, Macaskill, von Minckwitz, Marinovich, & Mamounas, 2012).
Spesielle forhold for DCIS
Det oppfattes ikke å være grunnlag for å sette en øvre grense for utbredelse av DCIS for at BCT kan gjennomføres så lenge det ligger til rette for radikal eksisjon med frie marginer og brystets størrelse tillater dette (Bijker, Donker, Wesseling, den Heeten, & Rutgers, 2013; Collins et al., 2013; Rakovitch et al., 2013).
Makromasti
Stor bryststørrelse alene er nå svært sjelden årsak til at postoperativ strålebehandling ikke kan gis. Dersom det likevel anses vanskelig, bør det foretas en reduksjonsplastikk samtidig med det brystbevarende inngrepet med mindre det foreligger kontraindikasjoner. Der det gjøres et brystbevarende inngrep som medfører en stor volumasymmetri i forhold til motsatt bryst, bør et symmetriserende inngrep i forbindelse med primærinngrepet tilstrebes.
Konvensjonell brystbevarende operasjon (BCT)
Teknikk
Periareolære snitt er å foretrekke. Det er viktig å legge snittet slik at eventuelt senere ablatio snittføring vil omfatte dette. Vanligvis fjernes vevet mellom hud og pectoralismuskelen. Ved hudnær tumor kan det være nødvendig å fjerne huden over tumor. Preparatet orienteres i enighet med patologen. Tusjmerking peroperativt av kirurg kan være en fordel (Landercasper et al., 2015).
Reseksjonen skal være fullstendig og inngrepet må planlegges med tanke på å oppnå en tumorfri margin.
For å underlette strålebehandlingen skal sårhulen alltid klipses, men antall klips kan være mindre der sårhulen er liten og/eller mistanken om cancer/DCIS er liten. Det bør alltid benyttes minst 5 klips slik at dorsale, mediale, laterale, kraniale og kaudale del av sårhulen er definert.
Onkoplastisk brystkirurgi (OBCS)
Onkoplastisk brystkirurgi (OBCS) innebærer bruk av plastikkirurgiske teknikker ved fjerning av tumor for å opprettholde brystets form og ofte også volum. I videste forstand gjelder det også primær rekonstruksjon med implantater, men det er vanlig å snevre inn begrepet OBCS til remodellering/rekonstruksjon av brystet i forbindelse med et brystbevarende inngrep.
Der hvor tumorstørrelse relatert til brystets størrelse, tumorlokalisasjon eller andre forhold taler for at det ikke kan oppnås et tilfredsstillende kosmetisk resultat ved et konvensjonelt brystbevarende inngrep, bør onkoplastiske teknikker vurderes. I tillegg til mulighet for et bedre kosmetisk resultat, vil bruk av OBCS kunne redusere behov for reeksisjoner og øke andelen som kan få et brystbevarende inngrep uten at det blir flere postoperative komplikasjoner eller forsinket oppstart av adjuvant behandling (Campbell & Romics, 2017). Onkoplastisk kirurgi kan utføres med samme onkologiske sikkerhet som konvensjonell BCT og ablatio (De La Cruz et al., 2016; Mansell et al., 2017). Studier som har sett på lokalt tilbakefall og brystkreftspesifikk overlevelse etter OBCS har dog begrensninger i form av kort observasjonstid og suboptimalt sammenligningsgrunnlag mht tumorkarakteristika og manglende informasjon om boostbestråling er gitt. OBCS kan pga vevs-rearrangering medføre vansker med sikker lokalisering av primær tumorseng som anbefales bestrålt med boost hos pasienter <40(50) år/og eller ved ufrie reseksjonsrender (se for øvrig kapittel 6). Vurdering av om BCT og evt. OBCS kan være aktuelt, bør gjøres i et MDT møte og vurderes klinisk av kirurg med kompetanse på OBCS.
På generelt grunnlag vil fjerning av mer enn ca. 15 % av brystkjertelvevet gi et dårlig kosmetisk resultat dersom ikke onkoplastiske teknikker benyttes. Er tumor lokalisert i nedre kvadranter eller i øvre mediale kvadrant, kan OBCS også være indisert ved eksisjon av et volum brystkjertelvev mindre enn 15 % (S. W. Chan et al., 2010). Se figur 5.1 for vurdering av tumorstørrelse mot brystvolum, såkalt «tumor to breast size ratio». Ulike prosedyrer er aktuelle ved ulike bryststørrelser.
(Gjengitt med tillatelse av Christian Korvald, NBCG)
Operatør må være kjent med at boostområdet kan bli vanskeligere å identifisere ved stråleplanleggingen. Videre kan området for boostbestråling øke i størrelse, noe som kan medføre økt risiko for redusert kosmetisk resultat, fibrose og/eller økt stråledose på underliggende organer. Pasienten må informeres godt om inngrepet og at det ved ufrie reseksjonskanter, kan bli nødvendig å gjøre en mastektomi dersom rereseksjon ikke er mulig. Videre må pasientene informeres om at det kan være nødvendig med et kontralateralt inngrep dersom man ønsker symmetri. Tidspunkt for et slikt inngrep må diskuteres med pasienten. Det kan være praktisk å gjøre det samtidig med primærkirurgien, men det kan også være grunn for å avvente et slikt symmetriserende inngrep til noen tid etter strålebehandlingen da denne kan påvirke brystets volum.
Det bør gjøres fotodokumentasjon til journal av overkroppen til alle pasienter som opereres med BCT og spesielt av pasienter som tilbys OBCS. Bilder tas av stående pasient i 5 projeksjoner (front, skrått og side bilateralt) med tumorområdet inntegnet på brystet før og et bilde etter inngrepet.
Med tanke på postoperativ strålebehandling er det spesielt viktig å huske klips i sårhulen (se avsnittet over om Brystbevarende kirurgi). Dersom det benyttes klips for hemostase i brystet, må det beskrives i operasjonsbeskrivelsen slik at det ikke skaper unødvendige vansker ved innstilling av strålefelt. En detaljert beskrivelse av det kirurgiske inngrepet er viktig. Operasjonspreparatet må orienteres for histopatologisk undersøkelse og tusjmerking ved kirurg anbefales (Landercasper et al., 2015).
De vanligste teknikkene ved OBCS er:
- Vid lokal excisjon med underminering og lukking
- Terapeutisk mastopeksi (brystløft)
- Terapeutisk reduksjonsplastikk
- Erstatning av volumtap med lappeplastikk
Dersom tumor er liten, ligger et sted i brystet der volumtap tolereres godt og brystet er tilstrekkelig stort, vil teknikk 1 være en god og enkel løsning med eller uten flytting av areolakomplekset. Teknikk 2–4 krever at kirurg har spesiell onkoplastisk kompetanse og vanligvis gjøres dette som et samarbeid mellom bryst- og plastikkirurg. Teknikk 2–3 innebærer rearrangering av kjertelvevet for å lukke defekten etter tumoreksisjon enten med en lappe- eller en rotasjonsplastikk av kjertelvevet. Ved et brystløft fjernes kun tumorområdet og i varierende grad hud. Det gir en moderat til liten reduksjon av brystets volum, men endrer dets form. Ved en reduksjonsplastikk fjerner man en god del av brystes volum og gjør brystet mindre.
Teknikk 4, erstatning av volumtap, benyttes der tumor versus brystets størrelse gjør at det gjenværende brystet blir for lite eller at kjerteldefekten ikke kan lukkes med en intern plastikk. Man må da vurdere å tilføre nytt vev fra brystets omgivelse. Lapper basert på blodtilførsel fra intercostalarterienes perforatorer både medialt (MICAP), anteriørt (AICAP) og lateralt (LICAP) i forhold til brystkassen kan tilføre brystet volum. I tillegg kan det lages større eller mindre lapper basert på den laterale thoracale arterien og den thoracodorsale arterien (latissimus dorsi, LD, TDAP) fra mer lateralt eller dorsalt på brystkassen (Hamdi et al., 2008; McCulley, Schaverien, Tan, & Macmillan, 2015; Rusby, Paramanathan, Laws, & Rainsbury, 2008).
Radiologiske undersøkelser etter OBCS
Til tross for til dels store remodelleringer av brystkjertelvevet i forbindelse med OBCS, er det ikke vist å medføre noen flere uklare mammografifunn med behov for biopsi 6 måneder, 2 og 5 år postoperativt (Piper et al., 2016).
Boost-bestråling etter OBCS
Indikasjon for strålebehandling med boost er den samme som ved BCT. Bruk av boost ved stråleterapi er vist å redusere lokale tilbakefall etter BCT og i særlig grad hos pasienter <40 (50) år, men har ikke vist overlevelsesgevinst (Bartelink et al., 2015). OBCS kan vanskeliggjøre boost- bestråling pga usikker lokalisering av primær tumorseng. Remodellering av brystet kan gjøre det umulig å gjenfinne opprinnelig tumorområde dersom sårhulen ikke merkes med klips som er plassert like etter tumorreseksjonen og før den onkoplastiske rekonstruksjonen (Furet et al., 2014; Schaverien, Stallard, Dodwell, & Doughty, 2013). Klips gir bedre definering av området som bør bestråles med boost. Det forutsettes også en grundig operasjonsbeskrivelse og et nært samarbeid mellom kirurg og onkolog. På denne måten sikres at adekvat område får tiltenkt boost og at vev utenfor målområdet spares for unødvendig strålebelastning da dette kan medføre et dårligere kosmetisk resultat med mer fibrose (Murphy et al., 2011).
Reseksjonskanter ved BCT (A. S. Coates et al., 2015; Moran et al., 2014)
- Ved BCT for invasivt carsinom skal det være frie reseksjonskanter både når det gjelder invasivt carsinom og DCIS (ink not on tumor). Det er ikke nødvendig med reseksjonsmarginer til / avstand mellom tumor og reseksjonsflate (uavhengig av om DCIS er i kontinuum med invasivt carcinom eller isolert fokus).
Det samme gjelder for BCT etter neoadjuvant behandling.
Dersom det er tvil om reseksjonskantene er frie/ evt påvist ikke frie kanter, må det gjøres reoperasjon i form av re-reseksjon eller mastektomi. Dersom det blir behov for flere re-reseksjoner, bør man overveie mastektomi, fordi det er holdepunkter for sammenheng mellom gjentatte reseksjoner og lokalt residiv i brystet (Menes et al., 2005).
- Ved BCT for kun DCIS «pure DCIS» skal det fortsatt være ≥2 mm reseksjonsmarginer (avstand mellom tumorvev og reseksjonskant) (kfr kapittel "Premaligne forandringer i brystet", avsnitt "Ductalt carcinoma in situ (DCIS)", samt kapittel "Oversikt over behandlings- og kontrollforslag ved premaligne tilstander") (Morrow et al., 2016). Årsak til dette er at disse pasientene ikke mottar adjuvant endokrin behandling eller cellegiftbehandling og at de i noen tilfeller (DCIS grad 1 ≤10mm) ikke mottar postoperativ strålebehandling.
Ablatio/mastektomi
Indikasjon
- Når brystbevarende kirurgi ikke er indisert ut fra ovennevnte kriterier
- Når pasienten ikke ønsker brystbevarende behandling, inkludert strålebehandling
- Når strålebehandling ikke lar seg gjennomføre.
- Ved lokalt tilbakefall/ny tumor etter tidligere brystbevarende kirurgi med postoperativ stråleterapi. (Det finnes dog ingen randomiserte studier på hvilken kirurgisk behandling som er best ved lokale tilbakefall.)
- Ved inflammatorisk cancer eller annen T4 cancer etter neoadjuvant behandling
- Genmutasjonsbærere (i henhold til kapittelet om arvelig brystkreft): Profylaktisk bilateral mastektomi med eller uten primær rekonstruksjon.
Typer mastektomi
- Enkel mastektomi med eller uten aksilleinngrep
- Hudbesparende mastektomi med fjerning av areolamamillekomplekset (SSM)
- Hudbesparende mastektomi med bevaring av areolamamillekomplekset (NSM)
For pasienter som ikke er genbærere er det ikke generell indikasjon for profylaktisk fjerning av kontralateralt bryst (med eller uten rekonstruksjon) ved diagnose brystkreft da dette ikke bedrer prognosen.
Teknikk
Enkel mastektomi
Kirurgisk snittføring bør forut for operasjonen tegnes opp på pasientene (spesielt de adipøse) i oppreist stilling. Dette fordi brystkjertelen i liggende stilling glir lateralt og oppad og det blir vanskelig å bedømme hvorledes arret vil fremtre i stående eller sittende stilling. Dette er sannsynligvis den hyppigste årsak til at det oppstår hudoverskudd i relasjon til arret lateralt og medialt. Hele brystkjertelen inkludert processus axillaris må fjernes komplett ned til pectoralisfascien. Eventuelt tidligere sårhuler må omfattes av inngrepet. Generelt sett bør den nederste incisjonen legges så langt caudalt som mulig og helst i inframammærfolden. Aksilleinngrep kan vanligvis gjøres gjennom samme snitt.
Oftest brukes båtformet snitt, og det bør legges slik at det etter lukking blir horisontalt og ikke på skrå inn i aksillen. Det tilstrebes velsirkulerte lapper med lik tykkelse uten at en etterlater kjertelvev. Lappene kan være fra mm til cm tykke. Det er ikke vist noen sikker korrelasjon mellom mastektomiplanets tykkelse, BMI, alder eller bryststørrelse (S. A. Robertson, Rusby, & Cutress, 2014). Det vil i de fleste tilfeller være restkjertelvev og en bør være spesielt oppmerksom på ikke å etterlate vev i ytterkantene av brystet (Griepsma et al., 2014). Preparatet orienteres i enighet med patolog. Snittføringen må modifiseres dersom tumor er beliggende slik at det blir nødvendig. Dren er ikke nødvendig, men kan benyttes slik den enkelte avdeling finner det best. Ved bruk av dren bør dette dog ikke ligge for lenge på grunn av infeksjonsfare.
NB: Hel bakre reseksjonsflate er avgjørende for patologens vurdering. Ved muskelnær tumor litt av pectoralismuskulatur eksideres for å sikre radikalitet.
Hudbesparende mastektomi
Ved primær rekonstruksjon gjenvinnes brystets volum og form med et implantat (proteserekonstruksjon) alternativt kroppens eget vev (autolog rekonstruksjon). Anbefaling om primær rekonstruksjon bør være tatt i et tverrfaglig møte med onkologisk kompetanse. Teknikken er en sikker metode uten kjent økt risiko for lokalt tilbakefall, selv om observasjonstiden i de fleste studier er kort og det ikke finnes i randomiserte prospektive studier der en sammenligner primær rekonstruksjon med sekundær rekonstruksjon eller ingen rekonstruksjon. Valget mellom primær eller sekundær rekonstruksjon bestemmes av ulike pasient- og sykdomsmessige forhold, se kapittel "Rekonstruktiv kirurgi etter mastektomi".
Ved planlagt primær rekonstruksjon gjøres mastektomien som et hudbesparende inngrep. Areola kan bevares etter individuelle vurderinger basert på tumors avstand til areola, DCIS utbredelse og tumorstørrelse (Timbrell et al., 2017). Det anbefales enten å ta separate biopsier retroareolært som merkes spesielt for patologisk undersøkelse eller at det settes en merketråd i det subareolære området. Peroperativt frysesnitt anbefales ikke. Snittføring tilpasses lokalisasjon av tumorområdet samt brystets form og størrelse. Det tilstrebes velsirkulerte lapper med lik tykkelse uten at en etterlater kjertelvev. Lappene kan være fra mm til cm tykke.
En studie har vist at risiko for lokalt recidiv etter mastektomi ved utbredt DCIS er større dersom det er gjort hudbesparende inngrep kontra konvensjonell mastektomi (Zhang et al., 2015). Risikoen synes størst hos unge pasienter og dersom det er knappe marginer ventralt. Det anbefales derfor at man hos disse tilstreber 2 mm margin ventralt.
Flytskjema for brystkirurgiske alternativ ved brystkreft og/eller DCIS
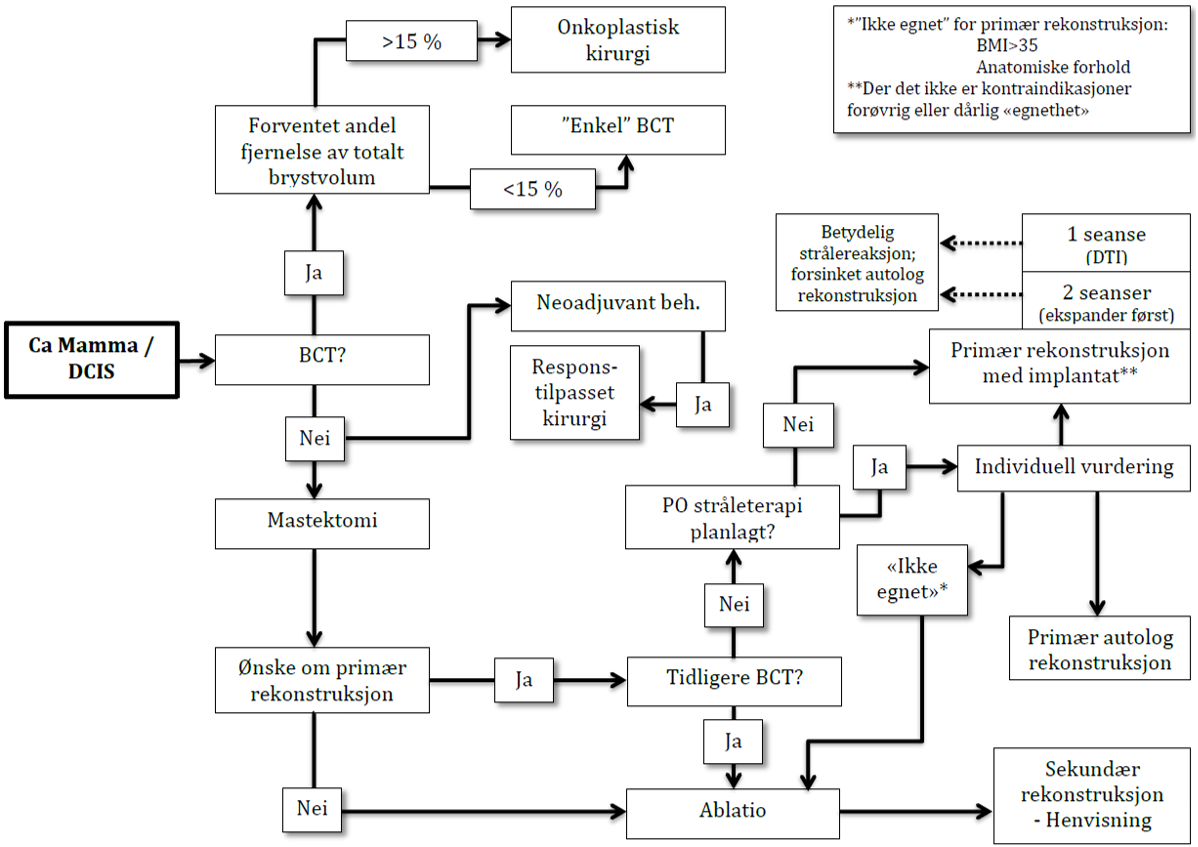
Vaktpostlymfeknutebiopsi (SNB) (evidensnivå A)
Indikasjoner
- Ved invasivt karsinom i stadium T1 og T2 uten påvist klinisk palpable lymfeknutemetastaser.
- Etter neoadjuvant systemisk behandling ved initialt cT2 eller cT3 tumorstørrelse og cN0 eller cN1 lymfeknutestatus hvor nodal status etter behandling er ycN0 (vurdert palpatorisk og eventuelt med ultralyd)
- Ved DCIS van Nuys grad 3 histologisk der det skal gjøres ablatio. Det skal imidlertid ikke gjøres AD i denne situasjonen dersom man ikke påviser SN.
- Dersom det skal gjøres brystbevarende kirurgi ved diagnostisert DCIS er det ikke indisert med SNB. Skulle det likevel i endelig diagnose vise seg å foreligge invasivt carsinom, kan SNB gjøres i etterkant.
Teknikk
Det anbefales å benytte to metoder for påvisning av vaktpostlymfeknute: både radioaktivitet og blåfarve. Dette fordi deteksjonsraten er høyere ved bruk av to metoder, og det synes å være en direkte sammenheng mellom høy deteksjonsrate og lav frekvens av falsk negativ vaktpostlymfeknutebiopsi. Radioaktiv isotop injiseres noen timer preoperativt (eventuelt dagen før inngrep). Blåfarge (f. eks. metylblått eller patentblått 2 ml uttynnet i 3 ml saltvann) injiseres umiddelbart preoperativt. Injeksjonsmetode varierer enten peritumoralt, eventuelt kombinert med subcutan injeksjon ved tumor, eller periareolær injeksjon.
Lymfoscintigrafi er sjelden nødvendig. Dersom man likevel skulle ønske en visualisering av hvor (aksille eller parasternalt, ipsi- eller kontalateralt) og om det er opptak av radioaktivitet, kan dette gjøres etter injeksjon av radioaktivt isotop, vanligvis 30 minutter etterpå, eventuelt dynamisk serie først, supplert med bilder etter 2–4 timer (flere undersøkelser) dersom det ikke er funn på første scintigram. Undersøkelsen kan gjøres både samme dag og dagen før operasjonen.
Ved inngrepet fjernes blå og/eller radioaktive lymfeknuter, som sendes til histopatologisk undersøkelse, som kan inkludere frysesnittsundersøkelse. Frysesnittundersøkelse av vaktpostlymfeknuten anses ikke nødvendig med unntak av vaktpostlymfeknuter fjernet hos neoadjuvant behandlede pasienter. Vaktpostlymfeknuter skal ha aktivitet over 5 ganger, helst > 10 ganger bakgrunnsaktivitet (Galimberti et al., 2012; Giuliano et al., 2011; Giuliano et al., 2010; T. Kim, Giuliano, & Lyman, 2006; Leidenius, Krogerus, Toivonen, Leppanen, & von Smitten, 2006; Lyman et al., 2005; Veronesi et al., 2003).
Eventuell utelatelse av SNB
Hos pasienter over 70 år med cT1N0, HR+, HER2- NST tumores har ASCO guidelines (Brackstone et al., 2021), med støtte fra tidligere rapporterte studier (Agresti et al., 2014; Liang et al., 2017; Martelli et al., 2012; Rudenstam et al., 2006), åpnet for å kunne utelate sentinel node biopsi. I tråd med ASCO guidelines, åpnes det for slik vurderingsmulighet, etter gjennomgang på MDT møte, gitt cT1N0, ER+ (>50%), HER2- IC NST tumores, dersom endokrin behandling tilbys. Selv om det er observert flere aksilleresidiv uten aksillekirurgi er det meget lav frekvens av slike residiver og ingen forskjell i overlevelse (Liang et al., 2017). Dersom undersøkelsene av operasjonspreparatet konkluderer med høyere risk Luminal B subtype på operasjonspreparat kan sekundær SN diagnostikk være aktuelt.
For pasienter der endokrin terapi ikke er indisert, bør SN operasjon uansett gjennomføres.
Aksilledisseksjon etter SNB ved primær kirurgi
Det er ikke indikasjon for AD ved negativ SNB eller ≤2 mm metastasefokus uavhengig av om det gjøres ablatio eller BCT. Dette gjelder også i de fleste tilfeller hvor det i operasjonspreparatet ble påvist pT3 tumor i brystet. Men pasienter med pT3 tumor skal ha lokoregional strålebehandling.
For SN positiv med metastasefokus > 2 mm kan AD utelates dersom alle følgende kriterier er oppfylt (Galimberti et al., 2012; Giuliano et al., 2011; Giuliano et al., 2010):
- T1/T2 tumor
- Palpatorisk negativ aksille
- 1 eller 2 positive SN
- Ingen perinodal vekst eller perinodal vekst ≤2 mm
- Planlagt systemisk adjuvant behandling
- Planlagt ekstern stråleterapi mot lokoregionalt område
- Ikke preoperativ kjemoterapi
Pasienter som har makroskopisk tumorinfiltrasjon i SN vil uansett motta strålebehandling mot regionale lymfeknutestasjoner (aksille, periclaviculært område) i tillegg til brystet. De gjeldende kriterier for strålebehandling av pN+ status benyttes for å vurdere behandlingen av disse pasientene. Dette betyr at aksillenivå 1–2 også inkluderes i strålefeltet som følge av at det ikke er utført aksilledisseksjon.
Aksillekirurgi etter neoadjuvant systemisk behandling
Pasienter med T4 tumores er ikke kandidater for SNB og anbefales aksilledisseksjon (AD).
Ved cN2/3 før neoadjuvant behandling skal det gjøres AD uten SNB, uavhengig av tumorrespons.
Studier viser at pasienter som har T2 eller T3 svulster og cN0 eller cN1 status i aksillen før oppstart av preoperativ systemisk behandling kan gjennomføre SN diagnostikk etter preoperativ kjemoterapi med tilfredsstillende deteksjonsrate og falsk negativ rate (Fontein, van de Water, Mieog, Liefers, & Van de Velde, 2013; Hunt et al., 2009; Kaufmann, Karn, & Ruckhaberle, 2012). Dersom det påvises klinisk negativ aksille etter preoperativ behandling (ycN0) anbefales derfor SN diagnostikk, dersom forholdene for øvrig ligger til rette for dette. Ved SN negativitet er det ikke nødvendig å gjennomføre AD.
Isolert positiv intramammær lymfeknute (neoadjuvant situasjon), klassifiseres som cN1, men kan opereres med 1 SN med frysesnitt.
Når det gjøres SN diagnostikk ved ycN0 status etter terapi der aksillestatus var cN1 før terapi, må man fjerne minst tre lymfeknuter som inkluderer minst 1–2 blå eller radioaktive lymfeknuter hvor de/den resterende er palpabel/papable lymfeknute(r). Det gjøres AD dersom sentinel node (SN) prosedyre mislykkes. Ved SN positivitet (> 0.2 mm) er det indikasjon for aksilledisseksjon. Uavhengig av N status og aksilleinngrep vil lokoregional strålebehandling gjennomføres i tråd med gjeldende anbefaling for T3/4 tumores. Dette sikrer at aksillen blir behandlet adekvat, selv om det skulle foreligge falsk SN negativitet (Giuliano et al., 2011).
Utdypende kommentar spesielt knyttet til pasienter med cT2cN0 tumores: Stadig flere pasienter i denne gruppen får neoadjuvant behandling (spesielt i studier). Dersom de etter neoadjuvant behandling har positiv SN (>0,2 mm) skal det gjennomføres AD, selv om det ved cT2 tumores uten neoadjuvant behandling ikke det er nødvendig i henhold til Z0011 studien. Årsaken er at responsen på den neoadjuvante behandlingen hos disse pasientene ikke oppfattes som god nok (fortsatt tilstedeværende mikrometastaser). Vanligvis skal pasienter med cT2cN0 stadium hvor endelig klassifisering av axillen etter operasjonen er pN1(mi), heller ikke ha strålebehandling mot regionale lymfeknuter, i motsetning til pasienter med cT3/4 tumores.
Dersom frysesnitt av SN er negativt, men senere undersøkelse viser metastase, skal det gjøres AD i senere seanse i henhold til retningslinjene beskrevet ovenfor. Immunhistokjemisk undersøkelse av SN anbefales ikke som basisrutine (Weaver et al., 2011), men bør gjøres dersom primærtumor er av lobulær type; (Weaver et al., 2011)utført på frysesnitt vil dette redusere falske negative resultat ved lobulært carsinom. Immunhistokjemisk undersøkelse vil kunne forlenge svartiden på SN frysesnitt med 20-30 minutter.
Andre forhold
Ved opptak parasternalt på scintigram, bør det gjøres aksilleeksplorasjon først. Det er fra litteraturen usikkert om det er indisert å ta ut eventuell vaktpostlymfeknute parasternalt, der den vesentligste gevinsten vil være i de meget få tilfeller hvor dette funnet vil føre til annen og mer adjuvant behandling, dersom vaktpostlymfeknuten i aksillen er negativ. Det er ingen holdepunkter for at fjerning av lymfeknuter parasternalt påvirker residivfrekvensen.
Aksilledisseksjon (AD)
Indikasjon
- Som ledd i primærbehandlingen ved påviste lymfeknutemetastaser (preoperativt/peroperativt eller postoperativt) i henhold til retningslinjer beskrevet ovenfor.
- Dersom ikke vaktpostlymfeknute finnes ved operasjon for invasiv cancer.
Teknikk
Snitt enten som eget tverrsnitt i nedre del av aksille eller ved ablatio gjennom samme snitt. Alt aksillefett som inkluderer lymfeknuter i nivå 1 og 2 fjernes. Det vil si opp til vena axillaris, medialt ved mediale kant av m. pectoralis minor, bakre begrensning nervus thoracodorsalis/musculus latissimus dorsi. Nervus thoracodorsalis og nervus thoracicus longus må identifiseres og respekteres. Costobrachiale nerver bør identifiseresom mulig bevares og beskrives i operasjonsbeskrivelsen. Ved brystbevarende kirurgi er det spesielt viktig å eksplorere godt i nedre, fremre del av aksillen slik at man ikke overser lymfeknuter der. Ublodig teknikk slik at man har god oversikt over strukturene peroperativt. Vær forsiktig med diatermibruk nær nervene.
Dren postoperativt (etter avdelingens rutiner) kan fjernes etter et døgn eller beholdes inntil det siste døgn er kommet < 50–70 ml, men ikke mer enn 5 døgn.
Intramammær lymfeknutemetastase
Nye oversikter konkluderer med at det ikke er nødvendig med AD ut over hva det for øvrig er indikasjon for (på bakgrunn av SN og sykdomssituasjon for øvrig) (Diaz, Degnim, Boughey, Nassar, & Jakub, 2012).
Ikke lokalavanserte tumores med cN0-1 aksillestatus hvor det utføres preoperativ systemisk behandling
Sist faglig oppdatert: 02202402.07.2024
Preoperativ systemisk behandling kan benyttes som downstaging for å bedre mulighetene for brystbevarende kirurgi og redusere risiko for AD. Spesielt ved HER2 positiv eller trippelnegativ brystkreft ser man god effekt av målrettet primær systemisk terapi. Merking av tumor med markør sentralt i tumorområdet bør gjøres før oppstart av eller tidlig i den neoadjuvante behandlingen. MR bør gjøres før oppstart neoadjuvant behandling og mot slutten av neoadjuvant behandling for å vurdere respons på tumorstørrelse og mulighet for å gjøre brystbevarende inngrep.
SN diagnostikk i forbindelse med det brystkirurgiske inngrep (etter preoperativ systemisk behandling) aksepteres alene som adekvat kirurgi i aksille (AD kan utelates) dersom SN er negativ. Se ellers retningslinjer ovenfor (kapittel Kirurgisk taktikk og teknikk, avsnitt "Vaktpostlymfeknutebiopsi (SNB)").
Det anbefales å gjøres frysesnitt peroperativt for neoadjuvant behandlede pasienter for å redusere risiko for et ekstra inngrep.
Ved positiv SN (>0.2 mm) gjøres AD. Strålebehandling er indisert dersom pasienten hadde cN1 status før oppstart neoadjuvant behandling, uavhengig av endelig ypN-status ved operasjon. Ved cN0 status vil det være indikasjon for stråleterapi dersom pasienten er operert brystbevarende, ved makroskopiske lymfeknutemetastaser (>2 mm) påvist ved AD etter preoperativ behandling og/eller ved frie tumorøyer i axillært fettvev. Ved makroskopiske lymfeknutemetastaser (>2 mm) og/eller ved frie tumorøyer i axillært fettvev gis postoperativ strålebehandling mot bryst/brystvegg og regionale lymfeknuter. Bestråling av dissekert aksille (aksillenivå 1/2=CTVn_L1/L2) inkluderes dersom det ikke er utført adekvat aksilledisseksjon, ved ekstranodal vekst >2 mm og/eller ved frie tumorøyer i axillært fettvev.
Se kapittel Neoadjuvant behandling, avsnitt "Adjuvant behandling for pasienter med rest-tumor etter neoadjuvant kjemoterapi" for ytterligere opplysninger om retningslinjer for neoadjuvant behandling av T2 tumores.
Lokalavansert brystkreft
Sist faglig oppdatert: 02202402.07.2024
Definert som:
- T3: primærtumor > 5 cm i størrelse, etter en totalvurdering av palpatoriske mål, ultralyd, mammografi og eventuelt MR.
- T4: Tumor uavhengig av størrelse, men med affeksjon av hud eller brystvegg som angitt i TNM-klassifikasjonen eller inflammatorisk cancer
- N2-3: sammenvokste lymfeknutemetastaser, spredning til infraclaviculære/supraclaviculære lymfeknuter, eller spredning til parasternale lymfeknuter med samtidig metastaser til aksille.
Dersom det ved diagnosetidspunkt foreligger lokalavansert brystkreft (stadium 3) skal ikke pasienten opereres primært. Det skal da gjøres staging med tanke på fjernmetastaser, og pasienten skal behandles med (primær) systemisk terapi, etter konsultasjon og henvisning til regionalt onkologisk senter, før lokalbehandling gjennomføres (kirurgi og strålebehandling).
Kirurgisk behandling etter preoperativ systemisk behandling av lokalavansert brystkreft vil i mange tilfeller inkludere mastectomi, men effekten av den preoperative behandling vil kunne påvirke type brystkirurgisk inngrep.
I tråd med internasjonale anbefalinger er det enighet om at brystbevarende kirurgi kan gjennomføres ved lokalavanserte tumores på følgende grunnlag:
- cT3 tumor klassifikasjon.
- Gjennomført MR før oppstart og mot slutten av neoadjuvant behandling.
- MR og kirurgisk vurdering konkluderer med at BCT kan gjennomføres (i tråd med vanlige vurderingskriterier). Det må være så god respons etter preoperativ behandling at man må forvente å få frie reseksjonsrender.
- Mikroforkalkninger som gjenstår på rtg mammografi etter behandling bør være med i resektatet (Feliciano et al., 2017).
- ved cT4 tumores med kun lokalisert hudaffeksjon hvor det har vært meget god effekt av neoadjuvant behandling. Dette forutsetter at hudforandringen er gått tilbake i løpet av behandlingen. Man bør fjerne tidligere involvert hud. Disse pasienter bør diskuteres grundig tverrfaglig.
Merking av tumor bør gjøres før oppstart eller tidlig i den neoadjuvante behandling. Det bør gjøres grundig kirurgisk forberedelse til BCT inngrepet, eventuelt med vurdering av onkoplastisk kirurgi for å sikre at tumorområdet fjernes med god margin.
For aksillekirurgi etter neoadjuvant behandling ved lokalavansert brystkreft, se retningslinjer ovenfor (under kapittel Kirurgisk taktikk og teknikk, avsnitt "Aksilledisseksjon (AD)"). Dersom det er grunnlag for å gjøre SN diagnostikk og SN er negativ, er det ikke nødvendig å gjøre AD.
Ved positiv SN (>0.2 mm) er det indikasjon for AD. Pasientene vil uansett få strålebehandling mot bryst/brystvegg og regionale lymfeknutestasjoner på grunn av lokalavansert stadium. Bestråling av dissekert aksille inkluderes dersom det ikke er utført adekvat aksilledisseksjon, ved ekstranodal vekst >2 mm og/eller frie tumorøyer i aksillært fettvev, eller hvis det kliniske bildet før oppstart av neoadjuvant behandling vurderes å gi grunnlag for dette.
Se kapittel Adjuvant hormonbehandling, avsnitt "Anbefalt behandling ved hormonreseptor positiv sykdom" for ytterligere opplysninger om retningslinjer for neoadjuvant behandling av lokalavansert brystkreft.
Oversikt over anbefalinger for lokal behandling ved brystkreft
Sist faglig oppdatert: 02202402.07.2024
Kirurgi | SN status (I) | SN status (II) | Grunnlag for aksilledisseksjon | Stråleterapi |
|---|---|---|---|---|
BCT + SN | SN negativ |
| Ingen aksilledisseksjon | Bryst 2.67 Gy x 15 (alternativt 5.2 Gy x 5 for pasienter i henhold til avsnitt "Etter brystbevarende operasjon" i kapittel 6.1) Boost ved alder <50 (40 år): Simultan integrert boost eller sekvensielt 2 Gy x (5-)8 |
SN positiv (>0.2 mm) | Mikrometastaser (>0.2–≤2 mm) | Ingen aksilledisseksjon | Bryst 2.67 Gy x 15 (alternativt 5.2 Gy x 5 for pasienter i henhold til avsnitt "Etter brystbevarende operasjon" i kapittel 6.1) Boost ved alder <50 (40 år): Simultan integrert boost eller sekvensielt 2 Gy x (5-)8 | |
Metastaser (>2 mm) i ≤2 lymfeknuter | +/– aksilledisseksjon Dersom alle følgende kriterier er til stede kan AD utelates:
| Bryst + regionale lymfeknuter: 2.67 Gy x 15 Boost ved alder <50 (40 år): Simultan integrert boost eller sekvensielt 2 Gy x (5-)8 | ||
Metastaser (>2 mm) i >2 lymfeknuter | Aksilledisseksjon | Bryst + regionale lymfeknuter: 2.67 Gy x 15 Boost ved alder <50 (40 år): Simultan integrert boost eller sekvensielt 2 Gy x (5-)8 | ||
Ablatio + SN | SN negativ |
| Ingen aksilledisseksjon | Ingen |
SN positiv (>0.2 mm) | Mikrometastaser (>0.2–≤2 mm) | Ingen aksilledisseksjon | Ingen hvis ikke indikasjon for strålebehandling av brystvegg som følge av ikke frie reseksjonsrender (i så fall 2.67 Gy x 15). | |
Metastaser (>2 mm) i ≤2 lymfeknuter | +/– aksilledisseksjon
| Brystvegg + regionale lymfeknuter: 2.67 Gy x 15 | ||
Metastaser (>2 mm) i >2 lymfeknuter | Aksilledisseksjon | Brystvegg + regionale lymfeknuter: 2.67 Gy x 15 |
Stadium før preoperativ behandling | Forberedelse hvis BCT er aktuelt | Kirurgi (I) | SN status* | Kirurgi (II) | Aksillestatus (II) | Stråleterapi |
|---|---|---|---|---|---|---|
cT2 cN0 | Markør i tumor MR mammae | BCT eller ablatio/subcutan mastectomi + SN diagnostikk# | SN negativ | Ingen aksilledisseksjon |
| Hvis BCT: mot bryst 2.67 Gy x 15 (kfr avsnitt "Etter brystbevarende operasjon" i kapittel 6.1). Boost ved alder <50 (40 år): Simultan integrert boost eller sekvensielt 2 Gy x (5-)8 Hvis ablatio: Ingen |
SN positiv (>0.2–≤2 mm) | Aksilledisseksjon | Ingen metastaser (>2mm) i aksillepreparatet | ||||
Metastaser (>2mm) i aksillepreparatet | Bryst eller brystvegg + regionale lymfeknuter: 2.67 Gy x 15 Boost ved BCT ved alder ≤40 (50 år): Simultan integrert boost eller sekvensielt 2 Gy x (5-)8 | |||||
SN positiv (>2 mm) | Aksilledisseksjon |
| ||||
cT2 cN1¤ | Markør i tumor MR mammae | Dersom ycN0 etter preoperativ behandling: BCT eller ablatio/ subcutan mastectomi + SN diagnostikk | SN negativ | Aksilledisseksjon kan utelates dersom det ved SN diagnostikken er brukt både fargestoff og radioaktivt stoff og det fjernes enten
Hvis ikke, bør aksilledisseksjon utføres. |
| Bryst eller brystvegg + regionale lymfeknuter: 2.67 Gy x 15 Boost ved BCT ved alder ≤40 (50 år): Simultan integrert boost eller sekvensielt 2 Gy x (5-)8 |
SN positiv (>0.2–≤2 mm) | Aksilledisseksjon |
| ||||
SN positiv (>2 mm) | Aksilledisseksjon |
| ||||
Dersom ycN1 etter preoperativ behandling: BCT eller ablatio/ subcutan mastectomi + aksilledisseksjon |
|
|
| |||
cT2 cN2-3 | Markør i tumor MR mammae | BCT eller ablatio/subcutan mastectomi + aksilledisseksjon |
|
|
| Bryst eller brystvegg + regionale lymfeknuter: 2.67 Gy x 15 Boost ved BCT ved alder ≤40 (50)år: Simultan integrert boost eller sekvensielt 2 Gy x (5-)8 |
cT3 cN0 | Markør i tumor MR mammae | BCT eller ablatio/subcutan mastectomi + SN diagnostikk# | SN negativ | Ingen aksilledisseksjon |
| Bryst eller brystvegg + regionale lymfeknuter: 2.67 Gy x 15 Boost ved BCT ved alder ≤40 (50 år): Simultan integrert boost eller sekvensielt 2 Gy x (5-)8 |
SN positiv (>0.2 mm) | Aksilledisseksjon |
| ||||
cT3 cN1¤ | Markør i tumor MR mammae | Dersom ycN0 etter preoperativ behandling: BCT eller ablatio/subcutan mastectomi + SN diagnostikk* | SN negativ | Aksilledisseksjon kan utelates dersom det ved SN diagnostikken er brukt både fargestoff og radioaktivt stoff og det fjernes enten
Hvis ikke bør aksilledisseksjon utføres. |
| Bryst eller brystvegg + regionale lymfeknuter: 2.67 Gy x 15
Boost ved BCT ved alder ≤40 (50 år): Simultan integrert boost eller sekvensielt 2 Gy x (5-)8 |
SN positiv (>0.2–≤2 mm) | Aksilledisseksjon |
| ||||
SN positiv (>2 mm) | Aksilledisseksjon |
| ||||
Dersom ycN1 etter preoperativ behandling: BCT eller ablatio/subcutan mastectomi + aksilledisseksjon |
|
|
| |||
cT3 cN2-3 | Markør i tumor MR mammae | BCT eller ablatio/subcutan mastectomi + aksilledisseksjon |
|
|
| Bryst eller brystvegg + regionale lymfeknuter: 2.67 Gy x 15 Boost ved BCT ved alder ≤40 (50 år): 2 Gy x 8 |
cT4 cN0-3 | Ablatio anbefales for de fleste. Hvis BCT kan være aktuelt (cT4b med kun lokalisert hudaffeksjon): Markør i tumor MR mammae | Ablatio + aksilledisseksjon Ved cT4b tumores med kun lokalisert hudaffeksjon hvor det har vært meget god effekt av neoadjuvant behandling: BCT + aksilledisseksjon. Tidligere involvert hud må fjernes.! |
|
|
| Brystvegg (eller bryst) + regionale lymfeknuter: 2.67 Gy x 15 |
* SN diagnostikk bør inkludere frysesnittsundersøkelse.
# Dersom utgangspunktet før terapi var cN0, er det tilstrekkelig å fjerne minst 1 SN.
! Disse pasienter bør diskuteres grundig tverrfaglig.
¤ Isolert positiv intramammær lymfeknute klassifiseres som cN1, men kan opereres med 1 SN med frysesnitt
Aksillemetastase(r) fra brystkreft uten påvist primærtumor i bryst
Sist faglig oppdatert: 02202402.07.2024
Brystet bør behandles som del av den lokoregionale behandling (strålebehandling, eventuelt kirurgi i tillegg) (NCCN clinical practice guidelines in oncology (NCCN Guidelines): breast cancer. Version 2.2022, 2022).
Kirurgisk behandling av DCIS
Sist faglig oppdatert: 02202402.07.2024
Behandles DCIS med mastektomi vil selv pasienter med utbredte og palpable tumores oppnå nær 100 % 10-års residivfri overlevelse (Stuart et al., 2015). Dette skaper et klinisk dilemma, da pasienter som er behandlet med reseksjon etter strenge indikasjoner (5 mm utbredelse, ikke palpabel), vil få mellom 10 og 15 % residiv hvorav ca. halvparten vil være DCIS, resten infiltrerende karsinomer. Langtidsoppfulgte materialer viser imidlertid ikke øket kreftspesifikk dødelighet hos de som har fått gjort brystbevarende kirurgi i forhold til ablatio ved DCIS (Elshof et al., 2018; Lee et al., 2006; Mannu et al., 2020). Brystbevarende kirurgi kan derfor anvendes der en kan oppnå tilfredsstillende kosmetisk resultat med minst 2 mm histopatologisk fri kant. Fri kant angis i hele mm. Rereseksjon eller ablatio anbefales ved < 2 mm fri kant til sidene. Mot hud og mot brystvegg vil ikke disse grensene gjelde hvis det er utført reseksjon ut til hud og ned til pectoralisfascien. Dersom det er utbredt mikrokalk tydende på diffus eller multisentrisk utbredelse av DCIS, er det vanskelig å få sikker radikal kirurgi og det bør derfor gjøres mastektomi. Flere foci av DCIS er vanlig og er disse beliggende innen et avgrenset område som kan innbefattes i samme reseksjon, vil ikke det være kontraindikasjon mot brystbevarende behandling.
Lymfeknutemetastaser forekommer praktisk talt aldri ved DCIS, og aksilledisseksjon skal derfor ikke utføres (T. Kim et al., 2006; Lyman et al., 2005). Dersom pasienten opereres med ablatio bør det gjøres SN diagnostikk (kfr kapittel Kirurgisk taktikk og teknikk, avsnitt "Vaktpostlymfeknutebiopsi (SNB) (evidensnivå A)") ved DCIS grad 3. Om en ikke finner SN, skal en avstå fra AD fordi gevinstpotensialet er for lite i forhold til sannsynligheten for komplikasjoner som lymfødem, nevralgier og redusert skulderbevegelighet. Dersom det gjøres brystbevarende inngrep ved DCIS, kan man initialt avstå fra SNB, fordi dette er fullt mulig å gjøre i etterkant dersom histologisk undersøkelse likevel skulle vise invasivt carsinom (Virnig, Tuttle, Shamliyan, & Kane, 2010).
Kirurgisk behandling av LCIS
Sist faglig oppdatert: 02202402.07.2024
Slik som beskrevet under kapittel Diagnostisk åpen biopsi/merkebiopsi, er det grunnlag for kirurgisk behandling av pleomorf LCIS og florid LCIS med comedonekrose. I slike tilfeller vil behandlingsopplegget samsvare med hva som er beskrevet for kirurgisk behandling av DCIS.
Behandling av papillomer
Sist faglig oppdatert: 02202402.07.2024
Papillære lesjoner i bryst kan fremstå i ulike former, alt fra benigne intraductale papillomer til in situ eller invasive papillære carcinom. I en metaanalyse fra 2021 med data fra over 7000 pasienter operert på grunn av funn av papillom i sylinder- eller vakuumbiopsi, fant man at papillom med atypi ble oppgradert til karsinom hos 36%. Papillom uten atypi ble oppgradert til karsinom hos 5%. I tillegg identifiserte analysen prediktive faktorer for oppgradering av lesjon etter åpen biopsi (kfr nedefor) (X. Zhang, Liu, Hai, & Li, 2021). I NCCN-guidelines åpnes det for at selekterte pasienter med biopsiverifisert papillom kan observeres i stedet for å fjernes med åpen biopsi (NCCN clinical practice guidelines in oncology (NCCN Guidelines): breast cancer. Version 2.2022, 2022). Dette støttes av blant annet American Society of Breast Surgeons (The American Society of Breast surgeons, 2018). Europeiske anbefalinger åpner for fjerning av papillom med vakuumbiopsi (Rageth et al., 2019).
På dette grunnlaget anbefales det at papillomer med atypi fjernes med åpen biopsi. Det samme gjelder papillom uten atypi der der det foreligger blodig sekresjon, lesjonen er palpabel eller der radiologiske funn tilsier det (BI-RADS 4 og 5, masse med kalk, perifer lokalisasjon eller størrelse ≥1cm) Små, ikke-palpable og asymptomatiske papillomer uten atypi kan vurderes for fjerning med vakuumbiopsi, og beslutningen om dette bør gjøres i MDT-møte.
Multiple papillomer er en egen undergruppe av proliferative brystsykdommer. De utgjør 0,6 % av alle benigne brystsykdommer. Multiple papillomer har en signifikant økt risiko for brystkreft selv om det ikke påvises atypi på grovnålsbiopsi. Brystkreftrisikoen er 3–7 ganger større enn alders-matchede kvinner i befolkningen for øvrig. Risikoen anses å ligge på nivå mellom det å ha en proliferativ sykdom i brystet og atypisk hyperplasi. Det anbefales i litteraturen at disse pasientene følges godt opp uten mer spesifikk angivelse av det.
Anbefaling vedrørende kontroll etter påvisning av multiple papillomer: årlig mammografi til 50 års alder. Kvinnene bør deretter oppfordres til å møte i det offentlige screeningprogrammet fra 50–70 år. Det er ikke indisert med videre kontroller etter fylte 70 år. Det er ikke behov for kliniske kontroller.
Behandling av radiære arr
Sist faglig oppdatert: 02202402.07.2024
Nålebiopsi har beskjeden størrelse og det kan være vanskelig å skille radiært arr fra tubulært karsinom. Det har derfor tradisjonelt vært anbefalt kirurgisk fjerning av radiære arr. Insidensen av radiære arr er rapporter fra 0,6 – 3,7% og har økt pga innføring av screeningprogram og økt bruk av digital tomosyntese (Martaindale, Omofoye, Teichgraeber, Hess, & Whitman, 2020). En metaanalyse fra 2019 presenterte data fra over 3000 pasienter som var operert pga funn av radiært arr i biopsi (sylinder eller vakuum). Resultatene viste at dersom biopsien var en vakuumbiopsi og det ikke var atypi i biopsien, fant man oppgradering til DCIS kun hos 1% når merkebiopsien var undersøkt (Farshid & Buckley, 2019).
I NCCN-guidelines åpnes det for at selekterte pasienter med biopsiverifisert radiært arr kan observeres i stedet for å fjernes med åpen biopsi (NCCN clinical practice guidelines in oncology (NCCN Guidelines): breast cancer. Version 2.2022, 2022). Dette støttes av blant annet American Society of Breast Surgeons (The American Society of Breast surgeons, 2018). Europeiske anbefalinger åpner for fjerning av radiært arr med vakuumbiopsi (Rageth et al., 2019).
På dette grunnlaget kan små radiære arr vurderes for fjerning vha vakuumbiopsi, etter gjennomgang på MDT møte. Dersom ikke hele lesjonen kan fjernes og vakuumbiopsi ikke har vist atypi, anbefales årlig mammografi til 50 års alder. Kvinnene bør deretter oppfordres til å møte i det offentlige screeningprogrammet fra 50–70 år. Det er ikke indisert med videre kontroller etter fylte 70 år. Det er ikke behov for kliniske kontroller. Ved funn av atypi i vakuumbiopsi bør hele lesjonen fjernes.
Oversikt over behandlings- og kontrollforslag ved premaligne tilstander
Sist faglig oppdatert: 02202402.07.2024
Lesjon | Kirurgi | Reseksjons-kant | Stråle-behandling | Mammografi-kontroll | Klinisk kontroll1 |
|---|---|---|---|---|---|
Epitelproliferasjon (lobulær eller ductal) uten atypi | Ingen, kun nålebiopsi (sylinder eller vakuum) | ikke aktuelt | Nei | Nei | Nei |
| Flat epitelial atypi | Ingen, kun nåle-biopsi (sylinder eller vakuum) | Ikke aktuelt | Nei | Diskusjon i MDT2 | Nei |
Atypisk duktal epitelproliferasjon (ADH) | Diagnostisk åpen biopsi | fri eller affisert | Nei | 3 | Nei |
Atypisk lobulær epitelproliferasjon (ALH) | Ingen, kun nålebiopsi (sylinder eller vacum) | ikke aktuelt | Nei | 3 | Nei |
Papillomer | Åpen eller vakuumassistert eksisjon | fri eller affisert | Nei | Ved multiple: 3 | Nei |
Klassisk LCIS | Ingen, kun nålebiopsi (sylinder eller vacuum) | ikke aktuelt | Nei | 3 | Nei |
Pleomorf LCIS evt. florid LCIS med comedonekrose | Vid eksisjon | Fri4 | 5 | Som for DCIS6, men årlig til 60 år hvis førstegradsslektning med brystkreft | som for DCIS6 |
DCIS, unifocal, grad 1, ≤10 mm | Vid eksisjon | Fri4 | Nei | 6 | 6 |
DCIS unifocal, øvrige | Vid eksisjon | Fri4 | Ja | 6 | 6 |
DCIS grad 3, multisentrisk | Ablatio + SNB6 | Fri4 | Nei | 6 | 6 |
- Klinisk kontroll kan foregå på sykehus (lege eller spesialsykepleier) eller hos fastlege, for detaljer se kapitlet om etterkontroller.
- Ren FEA kan kontrolleres i det ordinære screeningprogrammet, men det anbefales diskusjon i MDT møte for beslutning.
- Hvis <50 år: årlig kontroll. Hvis 50–69 år: annethvert år i Mammografiprogrammet. Hvis >70 år: annethvert år hvis <10 år siden diagnose, for øvrig ingen kontroll.
Unntak: kvinner 50–60 år som har førstegradsslektning med brystkreft skal ha årlig kontroll. - Hvis vid eksisjon er utført, anbefales minst 2mm fri reseksjonskant (dokumentasjon foreligger for DCIS).
- Denne type lesjon er ikke hyppig forekommende og det mangler dokumentasjon i studier for betydningen av strålebehandling (Masannat et al., 2013). Det oppfattes ikke å være generelt grunnlag for å strålebehandle, men det anbefales en individuell vurdering der man tar hensyn til tumorstørrelse, marginer, pasientens alder, komorbiditet og preferanser.
- Kontrollrutiner ved DCIS: kapittel Kvinner operert for brystkreft/DCIS.
- Hvis SNB ikke kan gjennomføres, anbefales det å avstå fra AD.
Brystkreft hos eldre
Sist faglig oppdatert: 02202402.07.2024
Brystkreft hos eldre bør i prinsipp behandles på samme måte som ovenfor, men man må ta hensyn til andre sykdommer/ begrensede leveutsikter. SNB kan ha lavere deteksjonsrate hos eldre, men metoden synes sikker og anbefales også hos eldre. I noen tilfeller kan strålebehandling etter brystbevarende operasjon utelates, dette vurderes på individuelt grunnlag i samråd med onkolog.
Avansert (metastaserende) brystkreft
Sist faglig oppdatert: 02202402.07.2024
Brystkreft i stadium 4 behandles individuelt. Kirurgien her vil vanligvis være begrenset, men tilstrekkelig til å opprettholde lokal kontroll over sykdommen leveutsiktene tatt i betraktning.
Risikoreduserende kirurgi
Sist faglig oppdatert: 02202402.07.2024
Det henvises til kapittel om risikoreduserende kirurgi i forbindelse med arvelig brystkreft.
Rekonstruktiv kirurgi etter mastektomi
Sist faglig oppdatert: 02202402.07.2024
Rekonstruksjon av bryst ved behandling for brystkreft/DCIS skal ikke gå på bekostning av onkologisk behandling og må ikke føre til utsettelse av annen nødvendig adjuvant behandling. Alle pasienter som må gjennomgå mastektomi for brystkreft bør vurderes for, og eventuelt tilbys, primær eller sekundær brystrekonstruksjon. Målet med brystrekonstruksjon er å gjenskape et bryst med form og volum som på en god måte erstatter det brystet som skal fjernes. I praksis vil målet være å gjenskape et naturlig utseende bryst i BH, og det er viktig å informere pasienten om det. For noen pasienter kan det å avstå fra rekonstruksjon, være det beste alternativet. Hos andre pasienter kan det være en god løsning å bare gjøre en reduksjon av det gjenværende brystet, slik at de kan bruke en mindre ekstern protese. Studier blant pasienter som har gjennomført brystrekonstruksjon, enten primært eller sekundært, viser gjennomgående bevart livskvalitet og høy grad av tilfredshet (J. A. Nelson et al., 2019; Seth & Cordeiro, 2020).
Pasienter skal få god muntlig og skriftlig informasjon om de ulike rekonstruksjonsmetoder og en vurdering av hvilke(n) metode(r) som kan være aktuell for den enkelte. Informasjonen må være grundig i forhold til at det ved primær rekonstruksjon ofte er nødvendig med flere kirurgiske inngrep og polikliniske kontroller/ behandlinger. Det er en fordel om det finnes en kontaktsykepleier som kan ivareta praktisk oppfølgning og spørsmål fra pasientene i forbindelse med rekonstruksjonen.
For å oppnå en best mulig rekonstruksjon med minst mulig kirurgisk og onkologisk risiko bør følgende vurderes før en velger rekonstruksjonsmetode og tidspunkt for rekonstruksjon av bryst:
- Vil tidligere kirurgi og/eller strålebehandling begrense valg av rekonstruksjonsmetode?
- Pasientens helsetilstand
- Hvilke kontraindikasjoner, risikofaktorer og komorbiditeter finnes?
- Hvilken motivasjon og forventning har pasienten til rekonstruksjonen?
Indikasjoner for rekonstruksjon
Pasienter der det planlegges mastektomi skal få et tilbud om rekonstruktiv brystkirurgi dersom det ikke foreligger kontraindikasjoner. Ved hudsparende mastektomi vil dette vanligvis innebære primær rekonstruksjon med implantat. Videre skal pasienter som enten selv velger- eller anbefales mastektomi uten primær rekonstruksjon, informeres om mulighet for sekundær rekonstruksjon etter endt kreftbehandling.
Hos alle pasienter med brystkreft/DCIS der MDT finner indikasjon for mastektomi, skal primær rekonstruksjon vurderes og diskuteres med tanke på nedenstående indikasjoner, kontraindikasjoner og/eller risikofaktorer. Det er en fordel om plastikkirurg er til stede på MDT møtene.
Primær rekonstruksjon med brystimplantat
Kan tilbys alle pasienter der mastektomi planlegges og kontraindikasjoner ikke foreligger.
- Kontraindikasjoner: Røyking, stor narkoserisiko grunnet forlenget operasjonstid, BMI >35, inflammatorisk brystkreft, lokalavansert brystkreft med innvekst i hud/brystvegg (cT4) (ved cT4b med kun lokalisert hudaffeksjon kan det gjøres en individuell vurdering av egnethet etter gjennomført neoadjuvant behandling), prepectoral protese ved innvekst i m. pectoralis.
- Risikofaktorer som har betydning for rekonstruksjonsforløpet: Diabetes, aksilledisseksjon, neoadjuvant behandling, planlagt strålebehandling, tidligere brystkirurgi med strålebehandling, BMI >30, store bryst med høy mastektomivekt.
- Det bør utvises forsiktighet med prepectoralt implantat der tumor/kalk ligger tett an mot strukturer som vil dekkes av implantatet.
Primær rekonstruksjon med eget vev (autolog rekonstruksjon)
Dette er sjelden aktuelt på grunn av større grad av postoperativ morbiditet, operasjonstid og ressurstilgjengelighet. Inngrepet kan likevel vurderes på individuell basis. Lav alder, behov for samtidig kontralateralt risikoreduserende inngrep eller residiv etter tidligere brystbevarende inngrep der pasienten er strålebehandlet er viktige momenter ved slik vurdering. Hos en del overvektige pasienter der implantat eller fri lapp ikke er et alternativ kan hudsparende mastektomi og mammaplastikk («Goldilock’s») være et alternativ (J. D. Schwartz, 2019).
Forsinket primær autolog rekonstruksjon
Kan vurderes i tilfeller der pasienten har mange risikofaktorer (se ovenfor), og et problematisk forløp med implantat forventes. Her kan tapet av volum etter mastektomi erstattes med et brystimplantat som senere igjen erstattes med eget vev (autolog rekonstruksjon) etter gjennomført adjuvant strålebehandling.
Risikoreduserende mastektomi
Bærere av sykdomsgivende mutasjoner i genene BRCA1, BRCA2 m.fl. vil vanligvis anbefales mastektomi som risikoreduserende kirurgi. Primær rekonstruksjon tilbys alle. Tilnærmingen til rekonstruksjonen vil være som tidligere omtalt. Der det er operasjonsteknisk mulig vil areola og mamiller kunne bevares.
Sekundær rekonstruksjon
Se avsnitt "Sekundær rekonstruksjon etter mastektomi" lengere ned på siden.
Primær implantatbasert brystrekonstruksjon
Implantatbasert brystrekonstruksjon (IBBR) er den vanligste metoden for primær rekonstruksjon ved hudsparende mastektomi for cancer mamma/DCIS. Implantatet kan enten være en permanent brystprotese eller en ekspansjonsprotese, og operasjonen planlegges henholdsvis i én eller to seanser. Implantatet plasseres fortrinnsvis foran den store brystmuskelen (prepectoralt) og sjeldnere under. I tillegg brukes det ofte et tilleggsmateriale (mesh/nett) som skal støtte eller fiksere implantatet i riktig leie. Et slikt materiale kan være et biologisk antigenredusert homo-/xenograft eller en syntetisk netting (permanent eller resorberbar) (DeLong et al., 2021).
Anbefaling av IBBR må gjøres på individuell basis og kontraindikasjoner og risikofaktorer (se over) må vurderes nøye. Lokalisasjon av tumor i brystet kan ha betydning for valg av implantatleie; generelt bør det utvises forsiktighet med prepectoralt implantat der tumor/kalk ligger tett på pectoralismuskulaturen. I tillegg må pasienten være informert om mulige komplikasjoner til denne type rekonstruksjon (Caplin, Calobrace, Wixtrom, Estes, & Canady, 2021; Johnson, 2021; Potter et al., 2019). Det mangler gode langtidsdata for rekonstruksjon med prepectoral protese mht deteksjon av lokale tilbakefall. Videre tyder tidlige PROM-data på at prepectoral rekonstruksjon foretrekkes (Casella, Di Taranto, Marcasciano, et al., 2019; Safran, Al-Halabi, Viezel-Mathieu, Boileau, & Dionisopoulos, 2021; Sewart et al., 2021). Det kan også se ut som prepectoral plassering gir lavere forekomst av kapselkontraktur etter strålebehandling sammenliknet med subpectoral plassering (Sobti et al., 2020) samt lavere grad av ischemiske komplikasjoner (Avila et al., 2020).
Postoperativ strålebehandling har generelt en negativ innvirkning på resultatet etter IBBR både når det gjelder smerte, kapselkontraktur og endret utseende av brystet, samt i form av pasientrapporterte utfallsmål (PROM). På lang sikt kan det likevel se ut til at denne effekten er avtagende og ikke er like lett målbar (B. N. Kelly et al., 2022; Seth & Cordeiro, 2020; Sewart et al., 2020). Behovet for korreksjoner og ikke-planlagte reoperasjoner er høyere hos pasienter som får IBBR med påfølgende strålebehandling (L. Zhang et al., 2019) , og noen rapporterer også høyere grad av tapt rekonstruksjon (Tang et al., 2015; F. Wang et al., 2016). Strålebehandling er ikke en kontraindikasjon for primær rekonstruksjon med implantat, men pasienten må informeres nøye om risikoen for komplikasjoner. Ved planlagt eller forventet postoperativ strålebehandling, bør protesen legges prepectoralt (Sobti et al., 2020), med unntak av tilfeller der tumors dorsale beliggenhet tilsier submuskulært leie.
Rapporter om utfallet etter IBBR blant pasienter som tidligere har gjennomgått brystbevarende behandling og postoperativ strålebehandling varierer (Frederick et al., 2015; Gentile et al., 2021; Olinger et al., 2020; Tang et al., 2015). Arr, operasjonsteknikk (snittføring) og langtidseffekten av strålebehandlingen ser ut til å ha betydning for utfallet med noe høyere risiko for tidlige komplikasjoner som infeksjon, nekrose og hematom (Potter et al., 2019; Tang et al., 2015).
Bruk av biologisk mesh/nett for å stabilisere implantatet ser ikke ut til påvirke resultatet av rekonstruksjonen (DeLong et al., 2021; Safran et al., 2021; Salibian et al., 2021; Sewart et al., 2020). Et ekstra fremmedlegeme kan teoretisk komplisere forløpet av en rekonstruksjon ytterligere, spesielt etter strålebehandling (Gravina, Pettit, Davis, Winocour, & Selber, 2019).
Aksilledisseksjon synes å øke risikoen for at implantatet må fjernes etter IBBR sammenlignet med «sentinel node» biopsi uavhengig av om rekonstruksjonen utsettes for påfølgende strålebehandling (F. Wang et al., 2016). Videre er det rapportert om økt grad av infeksjon (Banuelos et al., 2019) og serom (Baker et al., 2020) etter aksilledisseksjon. Som selvstendig risikofaktor er aksilledisseksjon likevel vanskelig å skille ut siden de fleste også har mottatt postoperativ strålebehandling (Blough et al., 2018; Frey, Salibian, Choi, & Karp, 2020).
Neoadjuvant kjemoterapi fremholdes av mange som en risikofaktor, men dette er ikke godt dokumentert. En metaanalyse finner noe øket risiko for hudnekrose og tapt implantat etter neoadjuvant kjemoterapi, men ingen signifikant utsettelse i adjuvant behandling(Varghese et al., 2021).
Kroppsmasseindeks (BMI) er en individuell risikofaktor for komplikasjoner etter IBBR. Relativ risiko for komplikasjoner (infeksjon, tapt implantat, reoperasjon) øker med 1,07 for hver enhet (kg/m2) BMI går opp (Potter et al., 2019). Samtidig er det vist at også lav BMI (<22 kg/m2) og prepectoral rekonstruksjon kan gi høyere risiko for komplikasjoner, spesielt kapselkontraktur og synlig implantat (Casella, Di Taranto, Onesti, Greco, & Ribuffo, 2019).
Brystets størrelse er viktig å vurdere. Store bryst, og dermed høy mastektomivekt, gir øket risiko for ischemi, sannsynligvis på grunn av lengden på hudlappene, med påfølgende sårproblematikk og nekrose (Frey et al., 2020; Salibian, Frey, Karp, & Choi, 2019; Willey et al., 2020). Likeledes er faren for nekrose også stor ved bruk av hudreduserende teknikker (dermal slynge, «Wise-pattern»). Faren for ischemi kan reduseres ved å unngå store implantater (>300 ml) primært og heller gjøre rekonstruksjonen i to seanser (Radovanovic et al., 2018; Salibian, Frey, Bekisz, Karp, & Choi, 2019; Yazar, Bengur, Altinkaya, Kara, & Uras, 2021).
Planlagt postoperativ strålebehandling er trolig viktigst å ta hensyn til av de ovennevnte risikofaktorene (Colwell & Taylor, 2020). Risiko for komplikasjoner, og senere korreksjoner, øker med antallet identifiserte risikofaktorer (Tang et al., 2015). Dette gjør individuell vurdering og tilpasning spesielt viktig slik at pasientene er informert om egen risiko.
Følgende er veiledende og oppsummerende for primær IBBR:
- Primær rekonstruksjon skal ikke gå på bekostning av nødvendig adjuvant behandling, og derfor må noen pasienter med høy risikoprofil rådes til sekundær rekonstruksjon.
- Enhver primær eller sekundær rekonstruksjon, enten autolog eller med implantat, blir estetisk best der brystets naturlige hud +/- mamille bevares. Dersom øvrig risiko tillater det kan pasienten tilbys et implantat (ekspander eller permanent protese) samtidig med subcutan mastektomi som uansett videre forløp kan fungere som en bro til senere definitiv rekonstruksjon.
- Velg fortrinnsvis å plassere implantatet foran m. pectoralis major så sant ikke onkologiske eller spesielle lokale anatomiske forhold tilsier noe annet.
- Forsøk å minimere antall fremmedlegemer i rekonstruksjonen hos pasienter med høy postoperativ risiko.
- Unngå primær implantatfylling på >300 ml når adjuvant strålebehandling er planlagt, siden større implantater >300 ml ofte vil kreve forsterkning med mesh/nett.
- Man trenger ikke å fjerne hele areola dersom mamillen ikke kan bevares. Snittføring ved mammillesparende mastektomi bør være i inframammærfolden eller lateralt/vertikalt fra areolakanten (Colwell & Taylor, 2020).
Primær rekonstruksjon med eget vev
Indikasjoner for primær rekonstruksjon med eget vev (autolog) er nevnt tidligere. I tillegg vil dette være et alternativ for motiverte pasienter som er anbefalt risikoreduserende mastektomi på grunn av sykdomsgivende genmutasjon.
Autologt vev vil påvirkes av strålebehandling og kan føles fastere på lang sikt, men generelt vil slik etterbehandling tolereres bedre enn strålebehandling av proteser. En autolog rekonstruksjon er definitiv og livsvarig når den er vellykket. Mikrokirurgi med fri lapp fra mage (DIEP) vurderes som førstevalg. Alternativt kan stilkede lapper fra brystkasse/rygg (LD, L-TAP, LICAP) vurderes som alternativer. Frie lapper er forbundet med større grad av postoperativ morbiditet og vil medføre øket fare (risiko) for utsatt adjuvant behandling. I tillegg er dette ressurskrevende kirurgi med begrenset tilgjengelighet. Derfor vil oftest forsinket primær autolog rekonstruksjon (se tidligere) være et mer realistisk alternativ for de fleste (Thamm & Andree, 2018).
Operasjoner med frie lapper gjøres bare på plastikkirurgiske avdelinger med mikrokirurgisk kompetanse. Det anbefales at det tas kontakt med den regionale plastikkirurgiske avdelingen for planlegging av et slikt inngrep.
Sekundær rekonstruksjon etter mastektomi
Dette kan være indisert dersom det av ulike grunner ikke kan tilbys primær rekonstruksjon. Sekundær rekonstruksjon utføres tidligst 12 måneder etter avsluttet adjuvant behandling. Pasienten bør være fysisk og psykisk restituert før hun opereres. Sekundær autolog eller implantatbasert rekonstruksjon skårer ofte bedre enn primær rekonstruksjon ved undersøkelse av PROMs (Thorarinsson et al., 2017). Det er viktig å merke seg at det ved slike undersøkelser er to forskjellige grupper pasienter som sammenlignes – den ene gruppen har aldri levd uten «to bryst», mens den andre ofte har hatt mer enn 2 år uten ett eller to bryst før rekonstruksjon. Pasienter som ønsker sekundær rekonstruksjon henvises nærmeste plastikkirurgiske avdeling fortrinnsvis med mikrokirurgisk kompetanse.
Sekundær rekonstruksjon av bryst tilpasses individuelt. Vanligvis vil pasienten tilbys autolog rekonstruksjon. To-trinns operasjon med ekspander og permanent implantat eller hybridløsninger med fettransplantasjon med/uten implantat vurderes også.
Rekonstruksjon av defekter etter tidligere brystbevarende operasjon
Skjemmende defekter og volumtap etter brystbevarende operasjon kan henvises til en plastikkirurgisk avdeling. Generelt anbefales forsiktighet med hensyn til underminering og disseksjon av vevslapper i tidligere strålebehandlet vev. Volumdefekter bør i all hovedsak rettes opp ved hjelp av lokale lapper eller distanselapper, alternativt med perkutan løsning av arr med skarp kanyle og samtidig fett-transplantasjon (se kapittel Rekonstruktiv kirurgi etter mastektomi, avsnitt "Hva kreves av ressurser for å tilby rekonstruktiv brystkirurgi?").
Implantater og utikling av lymfom (BIA-ALCL)
Breast Implant Associated-Anaplastic Large Cell Lymphoma (BIA-ALCL) er en sjelden undergruppe av non-Hodgkin lymfom som er CD30 positiv og ALK negativ. Tilstanden forekommer sjelden med en prevalens på mellom 0,05 – 4.1 per million innbyggere innad i Europa (Stark et al., 2021). Årsaken er ukjent, men BIA-ALCL synes å opptre hyppigere sammen med grovt teksturerte implantater. Dersom diagnosen stilles tidlig og implantat med omgivende kapsel fjernes kirurgisk, er prognosen svært god. Tilstanden bør mistenkes ved sent-debuterende seromdannelse omkring implantatet. Diagnosen stilles ved en ultralydveiledet aspirasjonscytologi og immunhistokjemi mot CD30 og ALK. Væsken sendes inn på vanlig måte til patologi/cytologi laboratorium for morfologisk vurdering og immunhistokjemi (på celleblokk) (Turton et al., 2021). Radiumhospitalet er referansesenter for BIA-ALCL i Norge.
Fettransplantasjon
Fettransplantasjon er en lite invasiv metode for å øke volum, jevne ut vevsdefekter, behandle arrvev og rehabilitere vev etter strålebehandling. Fordelen er at pasientens eget vev brukes til disse formål, mens ulempene først og fremst ligger i at effekt (i form av volum og vevsforbedring) til en viss grad er uforutsigbar. Standard fettsugingsteknikk brukes for å høste fett fra et sted der pasienten har overskudd. Fettet sentrifugeres, renses og settes tilbake til ønsket område på bryst med små kanyler. Teknikken anses som trygg kirurgi-teknisk, med liten grad av komplikasjoner, men må ofte gjentas for å oppnå ønsket effekt og minimere komplikasjoner (Spear et al., 2016). Mulige indikasjoner for fettransplantasjon er:
- Korreksjon av defekter etter BCT eller OBCS
- Bedring av bløtdelsdekning og kapseldannelse/kontraktur etter IBBR
- Økning av volum og/eller utjevning etter annen autolog rekonstruksjon
- Vevsforbedrende og/eller smertelindrende behandling etter strålebehandling
- Total brystrekonstruksjon
- Korreksjon av benigne eller medfødte brystdefekter (tuberøse bryst, Poland syndrom m.fl.)
- Forstørrelse av bryster og annen kosmetisk kirurgi
Det har vært reist spørsmål om økt risiko for residiv av brystkreft når pasienten har gjennomgått fettransplantasjon som del av rekonstruktiv behandling. Per ultimo 2023 er det ingen bevis for at fettransplantasjon har negativ innvirkning på påvisning, overvåking eller residivrate av brystkreft eller DCIS (Gentile et al., 2022; Krastev et al., 2019; Krastev et al., 2018; Skillman et al., 2022; Sorrentino et al., 2019). Det finnes heller ikke bevis for at injeksjon av fettceller til brystparenkymet er utrygt. Med tanke på nyere teknikker som stamcelleberiket fett og fettransplantasjon samtidig med BCT finnes det foreløpig ingen langtidsstudier.
Det er ikke vist at fettransplantasjon til bryst gjør det vanskeligere å oppdage lokale residiv, klinisk eller radiologisk (Osswald et al., 2020). Det kan imidlertid ta tid (12-18 måneder) før fettvevsnekrose eller oljecyster blir synlig radiologisk. Gjennomgått fettransplantasjon må angis ved bestilling av radiologisk undersøkelse. Pasienter bør også informeres om at behandlingen kan medføre hyppigere biopsier av uklare radiologiske funn (Skillman et al., 2022).
Fettransplantasjon er en rekonstruktiv metode som vurderes på linje med andre former for rekonstruksjon. Det er viktig at den enkelte pasients sykdomstilfelle vurderes før eventuell fettransplantasjon. Blant pasienter som er strålebehandlet bør de akutte stråleforandringene ha gått tilbake. Det finnes ikke dokumentasjon for at man skal vente lenger med å utføre fettransplantasjon enn annen rekonstruktiv kirurgi, men ut fra generelle hensyn til forsiktighet er 6-12 måneder etter endt strålebehandling et rimelig tidsvindu.
For fettransplantasjon kan følgende retningslinjer fungere som veiledende:
- Ved behandling av defekter etter BCT bør siste mammografi (og/eller ultralyd) ikke være eldre enn 6 måneder, videre at mammografi utsettes til 6 måneder etter transplantasjonen.
- Pasienten bør kontrolleres hos utøvende kirurg etter 3-6 måneder og videre som anbefalt i kapittelet Oppfølging og etterkontroll etter avsluttet kurativ behandling og inngå i avdelingens kvalitetsregister.
- Fettransplantasjon frarådes ved inadekvate reseksjonsmarginer, etter inkomplett adjuvant behandling og hos pasienter med særlig høy risiko for lokoregionalt residiv (slik som inflammatorisk brystkreft og sarkom).
Hva kreves av ressurser for å tilby rekonstruktiv brystkirurgi?
Rekonstruktiv brystkirurgi krever erfaring og spesiell trening. Alle aktuelle pasienter bør primært vurderes på et sykehus der man har mulighet for multidisiplinær vurdering ved brystkirurg, radiolog, patolog, onkolog og plastikkirurg. Primær rekonstruktiv kirurgi forutsetter et nært samarbeid mellom brystkirurg og plastikkirurg. Dette er en forutsetning ved moderne brystkreftbehandling.
Dedikerte og opplærte sykepleiere kan bidra med god informasjon til pasientene. Personalet på postoperativ avdeling og sengepost må være godt kjent med observasjon etter denne type operasjoner. Det er viktig at sykehuset har et velfungerende og godt kvalifisert multidisiplinært team som kan håndtere rekonstruktive brystinngrep, eventuelt sender pasienten til et sykehus som har slikt tilbud.
Oppfølging/kontroller
Alle rekonstruksjoner som gjøres på brystkreftopererte registreres i Norsk Bryst Cancer Register (NBCR).
Pasienter operert med rekonstruksjon med eget vev eller protese etter mastektomi, har ikke behov for radiologiske kontroller av det nye brystet. Pasienter operert med BCT og onko-plastiske inngrep følger vanlig kontrollopplegg etter BCT. Ved profylaktisk mastektomi uten tidligere påvist brystkreft er det ikke behov for kliniske eller radiologiske kontroller.
Kirurgiske koder
Sist faglig oppdatert: 02202402.07.2024
Det anbefales ensartet koding av brystkirurgiske inngrep ved alle sykehus i Norge i tråd med nedenstående oversikt, som også inkluderer beskrivelse av inngrepet som den enkelte kode definerer.
Kode | Brystkirurgisk prosedyre | Plastikk/onkoplastisk prosedyre | Brystreseksjon | Teknikk | Hoffman-Wallwener |
|---|---|---|---|---|---|
HAB00 | Ekstirpasjon av lesjon mamma (dign) |
| Ikke fjernelse friskt vev | Direkte lukning, lokal adapatasjon av vev | Grad 1 <25% |
HAB40 | Kilereseksjon av mamma (terapeutisk) |
| Ikke fjernelse friskt vev | Direkte lukning, lokal adapatasjon av vev | Grad 2 <25% |
HAB40 HAD99 | Kilereseksjon av mamma (terapeutisk) | Annen plastisk opr mamma | Ikke/liten fjernelse friskt vev | Round block, tennis racket etc | Grad 3 enkel |
HAB40 HAD90 | Kilereseksjon av mamma (terapeutisk) | Mastopeksi | Ikke/liten fjernelse friskt vev | Terapeutisk kileres og mastopexi | Grad 4 enkel |
HAB40 HAD30 (ZZR70) | Kilereseksjon av mamma (terapeutisk) | Reduksjonsplastikk, melom slice | Fjernelse friskt vev | Terapeutisk kileres og reduksjonsplastikk, melom slice | Grad 5 kompleks |
HAB40 HAE10 ZZR05 ZZS10 | Kilereseksjon av mamma (terapeutisk) | Partiell brystrekonstruksjon | Fjernelse og erstatning | Terapeutisk kileres og lokal erstatn lapp LICAP etc | Grad 6 kompleks |
Kode | Brystkirurgisk prosedyre | Plastikk/onkoplastisk prosedyre | Brystreseksjon | Teknikk | Hoffman-Wallwener |
|---|---|---|---|---|---|
HAC20 | Enkel mastektomi |
| mastektomi |
| Grad 1 |
HAC10 HAE00 ZZS50 | Subcutan mast m/bevaring av nippel | Brystrekonstruksjon med protese | mastektomi ekskl nippel | Rekon med ekspander | Grad 2a enkel |
HAC15 HAE00 ZZS50 | Subcutan mast u/bevaring av nippel | mastektomi | Rekon med ekspander | Grad 2b | |
HAC10 HAE00 | Subcutan mast m/bevaring av nippel | mastektomi ekskl nippel | Direkte rekon med protese | Grad 3a | |
HAC15 HAE00 | Subcutan mast u/bevaring av nippel | mastektomi | Direkte rekon med protese | Grad 3b | |
HAC10 HAE10 ZZS20 | Subcutan mast m/bevaring av nippel | Brystrekonstruksjon med eget vev | mastektomi ekskl nippel | eks Latissimus dorsi | Grad 4a kompleks |
HAC15 HAE10 ZZS20 | Subcutan mast u/bevaring av nippel | mastektomi | eks Latissimus dorsi | Grad 4b | |
HAC10 HAE10 ZZQ00 | Subcutan mast m/bevaring av nippel | mastektomi ekskl nippel | DIEP etc | Grad 5a | |
HAC25 HAE10 ZZR05 ZZS10 | Subcutan mast u/bevaring av nippel | mastektomi | DIEP etc | Grad 5b |
HAB99/HWW99 | Annen reseksjon/Annen reop |
HAF00 | Exisisjon av lokalt residiv ved ca mamma |
HAF10 | Rekonstruksjon av mamma med transplantat eller lapp etter exisisjon lokalt residiv |
HAF20 | Rekonstruksjon av mamma med protese etter exisisjon av lokalt residiv |
Strålebehandling ved lokalisert sykdom
Sist faglig oppdatert: 02202402.07.2024
Hensikten med postoperativ strålebehandling er primært å redusere risikoen for lokalt og/eller regionalt residiv, men også å øke sjansen for overlevelse (M. Clarke et al., 2005; M. J. Clarke, 2002; S. Darby et al., 2011; Overgaard et al., 1997; Overgaard et al., 1999; Ragaz et al., 1997; Ragaz et al., 2005; Recht et al., 2016; Recht et al., 2001).
For å oppnå minimal risiko for lokale residiv, skal infiltrerende tumor være fjernet med frie reseksjonskanter («ink not on tumor») før strålebehandling. For DCIS anbefales minimum 2 mm (avrundet til hele mm) avstand mellom DCIS og reseksjonskant. Hvis ikke disse kriterier tilfredsstilles, anbefales rereseksjon før strålebehandling både ved invasivt karcinom og DCIS. Mot hud og mot brystvegg vil ikke disse grensene gjelde hvis det er utført reseksjon ut til hud og ned til pectoralisfascien.
Anbefalinger
Postoperativ strålebehandling anbefales når følgende faktorer er til stede:
- Etter brystbevarende operasjon (BCT).
- Ved stor primærtumor (T > 50 mm)/lokalavansert stadium.
- Etter ikke radikalt kirurgisk inngrep.
- Ved N+ sykdom.
Aktuelle målområder for postoperativ strålebehandling:
- Bryst eller delbryst (etter nærmere kriterier) etter brystbevarende kirurgi.
- Brystvegg.
- Regionale lymfeknuter.
«Timing» av strålebehandling:
- Der det ikke er indikasjon for kjemoterapi bør strålebehandingen starte innen 6–8 uker etter avsluttet kirurgi.
- Ved indikasjon for kjemoterapi bør strålebehandling starte innen 3–4 uker etter at kjemoterapi er avsluttet.
- Ved lokalavansert brystkreft hvor det gis preoperativ kjemoterapi bør pasienten starte strålebehandling innen 6 uker etter det kirurgiske inngrepet.
- Oppstart og gjennomføring av strålebehandling påvirkes ikke av om trastuzumab benyttes.
Ved høy alder gjøres individuell vurdering, med spesielt fokus på komorbiditet, biologisk alder og forventet levetid.
Forutsetninger for anbefalingene:
- Adekvat fjernelse av primærtumor (se over).
- Gjennomført aksillekirurgisk inngrep (sentinel node eller adekvat aksilledisseksjon nivå I+II).
Anbefaling knyttet til fraksjonsdose/totaldose
Hypofraksjonert behandling 2.67 Gy x 15 anbefales generelt for all kurativt rettet lokoregional strålebehandling for følgende grupper:
- Pasienter med infiltrerende brystkreft etter BCT med pT1-2pN0 status
- Pasienter med infiltrerende brystkreft hvor det er indikasjon for strålebehandling av regionale lymfeknuter (uavhengig av om det er gjennomført BCT eller mastektomi).
- Der det er behov for strålebehandling av kun brystvegg etter mastectomi.
- Etter BCT ved DCIS med grunnlag for stråleterapi.
- Etter neoadjuvant behandling pga stor primærtumor (T3)/lokalavansert sykdom.
Fraksjonering 5,2 Gy x 5 til 26 Gy (nøyaktig i henhold til FAST Forward protokollen) kan benyttes som alternativ til 2.67 Gy x 15 etter BCT uten bruk av onkoplastiske teknikker for pasienter med infiltrerende pT1-2pN0 brystkreft.
Bakgrunn for anbefalingene
Etter brystbevarende kirurgi reduserer strålebehandling av brystet lokal residivfrekvens med cirka 70 % (relativ risikoreduksjon). EBCTCG overview analysen fra 2005 viste at reduksjon av lokal residivfrekvens med ³10 % (absolutt), førte til en klar reduksjon i mortalitet etter 15 år (4.8 %) (Clarke et al., 2005). EBCTCG overview analysen publisert i 2011 viste at for hvert fjerde lokale residiv som unngås innen 10 år, vil 1 pasient unngå brystkreftdød ved år 15 (Darby et al., 2011), evidensnivå A. Effekten på overlevelse vil avhenge av hvor stor risikoen for lokalt tilbakefall er i det enkelte tilfelle.
Ved strålebehandling av bryst/brystvegg og regionale lymfeknutestasjoner, viser EBCTCG overview analysen fra 2005 en bedret totaloverlevelse etter strålebehandling på om lag 4–6 % (evidensnivå A). Analysen inkluderer også flere eldre studier med høy stråledose mot hjertet. Den brystkreftspesifikke overlevelse bedres i større grad enn totaloverlevelse etter strålebehandling (Clarke et al., 2005). DBCG-studiene og den kanadiske studien (som nylig er oppdatert) viser at strålebehandling mot brystvegg og regionale lymfeknutestasjoner bedrer både lokoregional kontroll, brystkreftspesifikk overlevelse og totaloverlevelse (8–10 % reduksjon av mortalitet) (Overgaard et al., 1997; Overgaard et al., 1999; Ragaz et al., 1997; Ragaz et al., 2005). EBCTCG overview analyser bekrefter bedring i overlevelse ved lokoregional strålebehandling av mastectomerte lymfeknute positive pasienter, inkludert pasienter med pN1 lymfeknutestadium (Early Breast Cancer Trialists' Collaborative Group (EBCTCG), 2023; McGale et al., 2014). Etter innføring av sentinel node teknikk, som innbefatter mer detaljert undersøkelse av lymfeknuten(e), påvises klart flere pasienter med mikrometastaser til aksille. Det finnes ikke dokumentasjon for at strålebehandling gir overlevelsesgevinst i denne pasientgruppen, som jo i de fleste tilfeller tidligere ble klassifisert som pN0 (Clarke et al., 2005; Nieweg et al., 2004). Basert på EBCTCG overview analysene og også en ny amerikansk studie (HR 0.76 for DFS; ikke signifikant for OS) (Whelan et al., 2015), er det grunnlag for å strålebehandle regionale lymfeknuteområder ved pN1 status der det er makroskopisk tumorinfiltrasjon (>2 mm).
Men for pasienter med mikrometastaser til aksille (pN1(mic)) er det ikke generelt grunnlag for å strålebehandle regionale lymfeknutestasjoner, dersom ikke tumorforholdene i selve brystet tilsier dette. Pasienter operert for lokalavansert brystkreft anbefales lokoregional strålebehandling, selv ved pN1 (mi) (og pN0).
Følgende regionale lymfeknutestasjoner vurderes for lokoregional strålebehandling:
- Aksillære lymfeknuter: Etter adekvat aksilledisseksjon er strålebehandling av den dissekerte aksillen ikke nødvendig (tilsvarer minst ESTRO guideline nivå 1), da denne er kirurgisk adekvat behandlet. Kun bestråling av den ikke-dissekerte delen av aksillen anses da nødvendig (tilsvarer fra ESTRO guideline nivå 2 eller mediale halvpart av nivå 2 – med overgang til infraclaviculær region). Aksilleresidiv er relativt sjelden etter lokoregional strålebehandling. Det er ingen god dokumentasjon på at det er nødvendig å bestråle hele aksillen ved mikroskopisk perinodal vekst. Det anses likevel riktig å bestråle hele aksillen der det foreligger makroskopisk perinodal vekst (>2mm) eller tumorøyer i fettvevet og det samtidig er indikasjon for regional lymfeknutebestråling (se indikasjoner senere), da dette kan øke muligheten for gjenværende tumorvev etter det kirurgiske inngrep.
- Supra/infraclavikulære lymfeknuter(ESTRO guideline nivå 3-4): vanligste område for regionale residiv og anses derfor som nødvendig å bestråle.
- Parasternale lymfeknuter (mammaria interna lymfeknuter): Det har vært usikkerhet knyttet til nytten av å inkludere ipsilaterale parasternale lymfeknuter i strålefeltet ved indikasjon for lokoregional strålebehandling, også fordi det fører tilstørre strålebelastning mot lunge og hjertenært område. To «nyere» studier har vist nytte av slik strålebehandling, men behandlingen har da vært sammenlignet med å utelate bestråling av alle regionale lymfeknutestasjoner (Poortmans et al., 2015; Whelan et al., 2015). To andre studier har skilt ut effekt av parasternal bestråling fra de øvrige regionale lymfeknutestasjoner, den eldste (og minste) av disse studiene fant man ingen overlevelsesgevist ved strålebehandling av dette området, mens den andre (og største; dansk studie) viste signifikant bedret totaloverlevelse. (Hennequin et al., 2013; Thorsen et al., 2016; Thorsen et al., 2022). I sistnevnte studie, DBCG IMN1, med ca 15 års oppfølgingstid ble det rapportert 4,7% redusert risiko for død og 3% for metastaser (ved parasternal stråleterapi (Thorsen et al., 2022). Subgruppeanalyse for å identifisere pasienter som hadde spesiell nytte av parasternal stråleterapi ga ikke klare svar, og det er også en viss usikkerhet om disse data fra denne studien fortsatt er gyldige i dagens pasient-populasjon. DBCG IMN2-studien presentert på ESTRO 2024 viste dokumentasjon for nytten av å strålebehandle IMN uavhengig av tumor lokalisasjon. Av data fremkommer det at nytten ser ut til å være størst hos premenopausale, trippel negativ subtype, økende størrelse primærtumor og ved pN3. Studien inkluderte ikke pasienter som fikk neoadjuvant behandling. Mens IMN1 studien hadde data som indikerte mindre sikker nytte ved lateral primær-tumor og pN1 var denne trenden mindre synlig i data fra IMN2-studien (Nielsen et al., 2024). En metaanalyse fra EBCTCG viser at gevinsten av strålebehandling mot regionale lymfeknuter inkludert IMN er tydeligere på fjernmetastaser fremfor lokale tilbakefall (Early Breast Cancer Trialists' Collaborative Group (EBCTCG), 2023). Lymfedrenasje til mammaria interna gebetet har vært rapportert hyppigere fra mediale/sentrale enn fra laterale deler av brystet (Blumgart et al., 2011).
Konklusjon: Det er uklart hvilke pasienter som ikke har nytte av strålebehandling mot IMN. Data fra IMN2-studien peker på at særlig premenopausale pasienter og de med høyere risikoprofil basert på subtype, størrelse primærtumor og antall positive lymfeknuter bør vurderes for strålebehandling mot IMN uavhengig av tumor lokalisasjon i brystet. Ved pN1 må det gjøres en totalvurdering av risikoprofil balansert mot dose til hjerte og lunger. - Interpectorale lymfeknuter. I følge en stor studie som har kartlagt lymfedrenasje fra brystkreftsvulster, er det meget lav drenasje til interpectorale lymfeknuter (Blumgart et al., 2011). Samtidig er det svært begrenset dokumentasjon på effekt av strålebehandling av denne regionen i forhold til effekt på tilbakefall. Det oppfattes å være grunnlag for å inkludere interpectorale lymfeknuter når det er indikasjon for å bestråle alle aksille-nivåer, da dette ikke bidrar til større strålefelt. Der det ikke er indikasjon for å strålebehandle dissekert aksille bør heller ikke de interpectorale lymfeknuter i området foran den dissekerte del av aksille bestråles. Dette ville ført til utvidelse av strålefeltet i forhold til tidligere anbefalinger, noe som ikke anbefales.
Hypofraksjonert strålebehandling
Det foreligger nå flere publikasjoner med lang observasjonstid, der hypofraksjonert strålebehandling ved invasiv brystkreft er sammenliknet med konvensjonell fraksjonering 2 Gy x 25, de største med 2.67 Gy x 15–16 (Bentzen et al., 2008; Haviland et al., 2013; Offersen et al., 2020; Whelan et al., 2010). De fleste pasientene i disse studiene hadde gjennomført brystbevarende kirurgi (I Start-B studien var cirka 8 % av pasientene mastektomert). Det er også utført en metaanalyse av Start-A og Start-B studiene, som danner grunnlag for dagens kunnskap (Haviland et al., 2013). Etter 10 års median observasjonstid gir hypofraksjonert strålebehandling (2.67 Gy x 15–16) like god lokoregional kontroll som 2 Gy x 25, og det ble i START-B studien funnet lavere frekvens av moderat til markerte seneffekter i normalt vev (HR 0.77; CI 0.66–0.89). Pasientgrunnlaget for studiene har vært både pre- og postmenopausale pasienter, og selv om andelen pasienter som har fått kjemoterapi er relativt lav (11–30 %), er denne pasientgruppen også inkludert. Det er ikke funnet undergrupper av pasienter i START-A/B metaanalysen hvor effekten av hypofraksjonert behandling er mindre enn ved konvensjonell fraksjonering. Snarere er det vist bedret metastasefri overlevelse ved 2.67 Gy x 15 (Haviland et al., 2013). I tillegg viser resultater fra en studie med 2706 pasienter at det i løpet av 15 år ikke var forskjell i hospitalisering pga primær eller bidragende cardiovaskulær årsak mellom dem som var behandlet med konvensjonell eller hypofraksjonert bestråling, (Chan et al., 2012). Etter 11.7 års median observasjonstid fant Stokes et al. heller ingen forskjell i cerebro/cardiovasculær mortalitet mellom fraksjonsdoser ≤2Gy og >2Gy (Stokes et al., 2011). Selv om det er ønskelig med enda lenger observasjonstid, viste Darby et al. at høyeste risiko (excess rate ratio) for cardiovaskulær sykdom forårsaket av strålebehandling synes å være i de første 10 år (Darby et al., 2013). En nyere studie viste også at moderne hypofraksjonering reduserer fraksjons-korrigert dose til hjertet sammenlignet med konvensjonell fraksjonering (Appelt et al., 2013).
I START studiene (A+B) fikk 11 % av de 4451 inkluderte pasientene strålebehandling mot regionale lymfeknuter. 12 % av alle pasientene var mastektomert (Haviland et al., 2013). Omregnet i 2 Gy fraksjoner gir 2.67 Gy x 15 en tilsvarende dose til lymfeknuteområdene som ved konvensjonell fraksjonert strålebehandling (2 Gy x 23/24). Hypofraksjonert behandling har vært standard behandling for pasienter med N+ sykdom i Storbritannia og Canada i flere år. Både på St Gallen konsensus konferansen i 2015 og 2019 åpnet et lite flertall for hypofraksjonert strålebehandling ved N+ (Burstein et al., 2019; Coates et al., 2015).
Når det gjelder DCIS viser en metaanalyse av cirka 2500 pasienter inkludert i observasjonsstudier at hypofraksjonert behandling og konvensjonell fraksjonering gir samme lokale residiv-risiko, selv om randomiserte studier savnes som dokumentasjonen ved DCIS (Nilsson et al., 2015). Basert på dagens kunnskap oppfattes det ikke at DCIS og infiltrerende carcinom vil reagere forskjellig på de fraksjoneringsregimer som nevnes her. Det forventes heller ikke at det på mange år vil komme ytterligere studieresultater som vil belyse residivfri overlevelse av hypofraksjonering i forhold til konvensjonell fraksjonering.
Hypofraksjonert post-operativ stråleterapi med total behandlingstid fra en til to uker (ekstrem hypofraksjonering) er nå undersøkt i flere studier (Meattini et al., 2020; Murray Brunt et al., 2020; Vicini et al., 2019; Whelan et al., 2019). Resultatene viser samsvarende lav risiko for lokale tilbakefall sammenlignet med standard behandling på tre uker. I FAST-Forward studien (Murray Brunt et al., 2020) ble to ulike eksperimentelle behandlingsarmer med enten 5,2 Gy x 5 = 26 Gy eller 5,4 Gy x 5 = 27 Gy undersøkt mot standard 2,67 Gy x 15 for pasienter som var operert for pT1-3, pN0-1, brystkreft. Målvolum var brystkjertel eller brystvegg ned til fascie. Regionale lymfeknuter ble ikke strålebehandlet i denne studien, men ble inkludert i en understudie fra 2017. En av fire pasienter fikk i tillegg sekvensiell boost, enten 2 Gy x 5 eller 2 Gy x 8. Etter snart 6 års oppfølging viser studien at 26 Gy og 27 Gy gitt med 5 fraksjoner over en uke er non-inferior til 2,67 Gy x 15 med hensyn på lokal tumorkontroll. Samlet er forekomst av seneffekter ikke statistisk forskjellig når 26 Gy-regimet og standard 2.67Gy x 15 sammenlignes (hhv 12,2% og 10,6%). For behandlingsarmen 5,4 Gy x 5 = 27 Gy var det signifikant mer bivirkninger fra bryst/brystvegg sammenlignet med standardarmen (15,9%). Observasjonstiden på nesten 6 år oppfattes ennå å være relativt kort og oppfølging i FAST-Forward vil foregå i 10 år. En subgruppeanalyse har også vist lav risiko for akutte bivirkninger (Brunt et al., 2016). En ukes stråleterapi mot bryst/brystvegg med 5,2 Gy x 5 = 26 Gy nøyaktig i henhold til krav i FAST-Forward protokollen er et alternativt tilbud til pasienter med pT1-2N0 brystkreftsykdom. Dette er i tråd med konsensusanbefaling fra ESTRO (Meattini et al., 2022). Ved bruk av dette fraksjoneringsregime bør det gjøres registrering av bivirkninger/seneffekter for kvalitetssikring år 5 og 10 etter avsluttet strålebehandling. Det var få pasienter i Fast-Forward som ble operert med onkoplastiske teknikker så for denne gruppen er det begrenset data og det anbefales derfor ikke bruk av ultra hypofraksjonering hos denne gruppen, spesielt der det er indikasjon for boost. Det samme gjelder ved umiddelbar rekonstruksjon. Ultra hypofraksjonering anbefales foreløpig ikke ved DCIS siden denne pasientgruppen ikke ble inkludert i FAST-Forward. Slik fraksjonering bør heller ikke gis konkomitant med T-DM1. Der det er indikasjon for delbryst stråleterapi utenfor Natural-studien kan 5,2 Gy x 5 vurderes som alternativ til 2,67 Gy x 15.
Boostbestråling
Boostbestråling av tumorsengen 2 Gy x 8 etter gjennomført helbrystbestråling har i en stor EORTC studie vist å kunne gi betydelig redusert risiko for lokale residiver hos kvinner <40 år, men også redusert risiko for kvinner mellom 40 og 50 år (Bartelink et al., 2001). Oppdateringen av denne studien har også vist redusert risiko for pasienter over 50 år, men i denne gruppen er den absolutte risiko for lokale residiv lav (Bartelink et al., 2007; Bartelink et al., 2015). Etter meget lang oppfølgingstid er det ikke vist overlevelsesgevinst av å gi boost (Bartelink et al., 2015). I den senere tid har moderne behandlingsteknikker gjort det mulig å gi tilleggsdose mot tumorområdet samtidig med bestråling av hele brystet etter brystbevarende kirurgi (simultan integrert boost). Hensikten er å korte ned behandlingstiden uten å øke risiko for lokalt tilbakefall eller toksisitet. Det foreligger nå resultater fra tre randomiserte studier med simultan integrert boost (SIB). Den største av disse, IMPORT High, inkluderte 2617 pasienter. Med en median oppfølgingstid på 74 måneder var det lik rate lokale tilbakefall når standard arm (40Gy/15 fraksjoner med sekvensiell boost 16Gy/8 fraksjoner) ble sammenlignet med SIB arm 1 (40Gy/15 fraksjoner med SIB 48Gy /15 fraksjoner) og arm 2 (40Gy/15 fraksjoner med SIB 53Gy/15 fraksjoner). Det var lik forekomst av bivirkninger i arm 1 som i standard armen, men noe høyere forekomst av bivirkninger for arm 2 (Coles et al., 2023). Samsvarende resultater med samme fraksjoneringsopplegg er funnet i NRG-RTOG 1005 studien som inkluderte 2262 pasienter, som ble presentrert på ASTRO i 2022 (Vicini et al., 2022). Akseptable rater for lokal kontroll og bivirkninger er også funnet i en annen studie som benyttet 50.4 Gy/28 fraksjoner med SIB dose 64.4 Gy/28 fraksjoner (Hörner-Rieber et al., 2021). På dette grunnlag kan simultan integrert boost anbefales som et alternativ til sekvensiell boost, når det er indikasjon for slik behandling.
Hyppighet av lokale residiver har blitt redusert etter hvert som det har skjedd forbedringer i den adjuvante systemiske behandling. Boostbestrålingstudiene som testet SIB har rapportert 5 års lokal residivhyppighet på cirka 2%, som er mer enn en halvering av 5 års resultatene med boostbestråling i EORTC studien nevnt innledningsvis (Bartelink et al., 2001). Selv om studiepopulasjonene ikke er like, taler dette for at den absolutte nytteeffekten av boost er redusert som følge av mer effektiv adjuvant behandling. I tillegg til yngre alder, kan tumorkarakteristika enten i form av høy histologisk grad eller DCIS i relasjon til tumor begge øke risiko for lokale residiv, men med økt nytte av boostbestråling (Vrieling et al., 2017).
Oversikt over indikasjoner og behandlingsopplegg ved postoperativ strålebehandling ved infiltrerende cancer
Sist faglig oppdatert: 02202402.07.2024
Etter brystbevarende operasjon
Generelt om stråleterapi og marginer etter BCT ved infiltrerende cancer
For å oppnå minimal risiko for lokale residiv, skal infiltrerende cancer være fjernet med frie reseksjonskanter («not ink on tumor») før strålebehandling. Mot hud og mot brystvegg vil vanligvis ikke disse grensene gjelde hvis det er utført reseksjon ut til hud og ned til epimysium.
Ingen lymfeknutemetastaser
Bestråling 2.67 Gy x 15 til 40 Gy, alternativt kan 5,2 Gy x 5 til 26 Gy benyttes, til pasienter med pT1-2N0 sykdom. I tillegg gis boost, enten i form av simultan integrert boost (3.2 Gy x 15 til 48 Gy; dose til hele brystet 2.67 Gy x 15) eller 16 Gy i 2 Gy fraksjoner (etter avsluttet helbrystbestråling), mot tumorsengen hos pasienter ≤40 (50) år. Avhengig av vurderingen av dose mot risikoorganer/vev kan boost vurderes redusert til 10 Gy. I EORTC studien boost vs no-boost fant man at risiko for lokale residiv uten boost er høyest for kvinner under 40 år og faller med økende alder (Bartelink et al., 2015). Den relative nytten av boost er tilnærmet sammenlignbar uavhengig av alder. Dette betyr at for kvinner som er 40 år eller yngre fører boostbestråling til størst risikoreduksjon for lokale residiv. For kvinner mellom 40 og 50 år er den absolutte effekten av boost mer moderat, og man vil overlate til det enkelte senter å definere sitt behandlingsopplegg. For kvinner over 50 år er den absolutte nytten av boostbestråling liten.
Det var økt forekomst av mer betydelig fibrose hos pasienter som fikk boostbestråling.
I de tilfeller der det er tumorceller i reseksjonskanten og ikke mer å hente kirugisk, er det grunnlag for boost uavhengig av alder.
Både Lumina-studien (Whelan et al., 2023) og IDEA-studien (Jagsi et al., 2024) har vist lav risiko for tilbakefall etter 5 år hos post-menopausale pasienter med pT1N0, lav-risiko, ER+HER2- brystkreft som ikke har fått post-operativ stråleterapi, men som mottar adjuvant endokrin behandling. Oppfølgingstiden er noe kort og begge studiene er relativt små (500 hhv 200 pas), men i spesielle tilfeller der det ikke er ønskelig å gi post-operativ stråleterapi grunnet komorbiditet eller tidligere stråleterapi kan det være et alternativ å utelate post-operativ stråleterapi forutsatt at det gis endokrin adjuvant behandling. Det avventes resultater fra studier som ser på om stråleterapi kan utelates også hos pasienter i denne risikogruppen som ikke mottar adjuvant endokrin behandling.
Med lymfeknutemetastaser(>2 mm tumorfokus)
Bestråling av brystet og regionale lymfeknuter til 40 Gy (2.67 Gy fraksjoner), eventuelt med boost mot tumorsengen (se over). Hvis det er gjennomført adekvat aksilledisseksjon anbefales ikke bestråling av dissekert aksille (CTVn_L1/L2*; kfr 6.7 for målvolumsdefinisjoner). Hvis det er makroskopisk ekstranodal infiltrasjon (> 2mm) eller tumorøyer i fettvevet inkluderes aksillen selv om det er utført adekvat aksilledisseksjon.
* dissekert aksille inkluderer vanligvis den caudale og laterale del av CTVn_L2.
Bestråling av parasternalområdet vurderes/anbefales ved følgende situasjoner:
- Vurder IMN bestråling ved høyere risikoprofil basert på alder, subtype, størrelse primærtumor og antall positive lymfeknuter uavhengig av tumor lokalisasjon i brystet. Ved pN1 må det gjøres en totalvurdering av risikoprofil balansert mot dose til hjerte og lunger.
- Positiv sentinel node i mammaria interna området.
Ved høy alder gjøres individuell vurdering, med spesielt fokus på komorbiditet, biologisk alder og forventet levetid.
Det er ikke generelt grunnlag for å strålebehandle regionale lymfeknutestasjoner ved isolert metastase til lymfeknute i selve brystet (intramammær lymfeknutemetastase) med samtidig negativ SN/aksille.
Etter mastektomi
Ingen lymfeknutemetastaser eller lymfeknutemetastaser ≤2 mm
Det er indikasjon for strålebehandling av brystvegg
- ved ikke sikkert frie reseksjonsrender etter gjennomført komplett kirurgisk inngrep.
Bestråling av brystvegg til 40 Gy (2.67 Gy fraksjoner), alternativt kan 5,2 Gy x 5 til 26 Gy benyttes.
Med lymfeknutemetastaser(>2 mm tumorfokus)
Bestråling av brystvegg og regionale lymfeknuter til 40 Gy (2.67 Gy fraksjoner). Hvis det er gjennomført adekvat aksilledisseksjon. anbefales ikke bestråling av dissekert aksille (CTVn_L1/L2*; kfr 6.7 for målvolumsdefinisjoner). Hvis det er makroskopisk ekstranodal infiltrasjon (> 2mm) eller tumorøyer i fettvevet inkluderes aksillen selv om det er utført adekvat aksilledisseksjon.
* dissekert aksille inkluderer vanligvis den caudale og laterale del av CTVn_L2.
Bestråling av parasternalområdet vurderes/anbefales ved følgende situasjoner:
- Vurder IMN bestråling ved høyere risikoprofil basert på alder, subtype, størrelse primærtumor og antall positive lymfeknuter uavhengig av tumor lokalisasjon i brystet. Ved pN1 må det gjøres en totalvurdering av risikoprofil balansert mot dose til hjerte og lunger.
Ved høy alder gjøres individuell vurdering med spesielt fokus på komorbiditet, biologisk alder og forventet levetid.
Det er ikke generelt grunnlag for å strålebehandle regionale lymfeknutestasjoner ved isolert metastase til lymfeknute i selve brystet (intramammær lymfeknutemetastase) med negativ SN/aksille.
Ved stor primærtumor (T3)/lokalavansert sykdom
Pasienter med T3 tumores/lokalavansert sykdom skal vurderes for neoadjuvant behandling ved regionalt onkologisk senter.
Strålebehandling etter neoadjuvant behandling vurderes med utgangspunkt i både «det kliniske bildet» før oppstart av neoadjuvant behandling og det histopatologiske svar ved avsluttende operasjon. Selv ved patologisk komplett remisjon etter preoperativ behandling, rapporteres det nytte av å gi lokoregional strålebehandling (Buchholz et al., 2002; Huang et al., 2004; McGuire et al., 2007).
Følgende retningslinjer gjelder:
Bestråling av bryst/brystvegg og regionale lymfeknuter til 40 Gy (2.67 Gy fraksjoner) (også ved N0). Dersom det gjøres brystbevarende kirurgi etter neoadjuvant behandling av T3 tumores, gis i tillegg boost, enten i form av simultan integrert boost (3.2 Gy x 15 til 48 Gy; dose til hele brystet 2.67 Gy x 15) eller 16 Gy, 2 Gy fraksjoner) mot tumorsengen hos pasienter ≤40(50) år. Avhengig av vurderingen av dose mot risikoorganer/vev kan sekvensiell boost vurderes redusert til 10 Gy. Dersom det utført adekvat aksilledisseksjon, anbefales ikke bestråling av dissekert aksille (CTVn_L1/L2*; kfr 6.7 for målvolumsdefinisjoner) – heller ikke der axillære lymfeknutemetastaser er påvist. Men vurderingen kan påvirkes av «det kliniske bildet» før oppstart av neoadjuvant behandling (for eksempel omfattende lymfeknutemetastaser).
* dissekert aksille inkluderer vanligvis den caudale og laterale del av CTVn_L2.
Hele aksillen (CTVn_L1-L3) (i tillegg til supraclaviculære lymfeknuter: CTVn_L4) inkluderes hvis det ikke er utført adekvat aksilledisseksjon, ved makroskopisk ekstranodal infiltrasjon (>2mm) og/eller tumorøyer i fettvevet (selv om det er gjennomført adekvat aksilledisseksjon), eller hvis «det kliniske bildet» før oppstart av neoadjuvant behandling vurderes å gi grunnlag for dette (for eksempel ved omfattende lymfeknutemetastaser).
Bestråling av parasternalområdet vurderes/anbefales ved følgende situasjoner:
- Vurder IMN bestråling ved høyere risikoprofil basert på alder, subtype, størrelse primærtumor og antall positive lymfeknuter uavhengig av tumor lokalisasjon i brystet. Ved pN1 må det gjøres en totalvurdering av risikoprofil balansert mot dose til hjerte og lunger.
- Positiv sentinel node i mammaria interna området.
En del pasienter med T3 tumores blir av og til operert primært (ikke erkjent før operasjonen). I så fall gjelder de samme retningslinjer som over vedrørende postoperativ strålebehandling.
Ved høy alder gjøres det individuell vurdering, med spesielt fokus på komorbiditet, biologisk alder/forventet levetid.
Ved massivt ikke frie reseksjonsflater etter mastektomi
Hvis det er massiv infiltrasjon i reseksjonsflaten eller hvis det er makroskopisk gjenværende tumor, vurderes boostbestråling mot den del av brystveggen hvor tumorvev oppfattes å være lokalisert (ut i fra tilgjengelige informasjon fra klinisk undersøkelse, operasjonsbeskrivelse og billeddiagnostikk). Fraksjoneres 2 Gy x 5–8 (10–16 Gy), etter individuell vurdering i forhold til risiko/nytteverdi. Boostbestrålingen gis etter gjennomført bestråling mot hele brystveggen. Dette forutsetter at ytterligere kirurgi ikke er mulig.
Samtidig systemisk behandling?
Strålebehandlingen skal av toksisitetshensyn ikke gis samtidig med adjuvant kjemoterapi.
Strålebehandling kan gis samtidig med trastuzumab og pertuzumab. T-DM1 kan vanligvis gis samtidig med strålebehandling 2.67 Gy x 15, men ikke ved fraksjonering 5,2 Gy x 5. Ved sistnevnte fraksjoneringsregime bør behandlingen oppstartes etter avslutte strålebehandling. Konkomitant behandling med T-DM1 kan medføre noe økt risiko for strålereaksjoner.
For detaljert oversikt over anbefalinger knyttet til samtidig stråleterapi og nye medikamenter henvises til nylig publisert ESTRO retningslinjer (Meattini et al., 2024), og er angitt i tabellarisk oversikt under:
|
| Kan kombineres | Kombineres ikke |
|---|---|---|---|
Lokoregional strålebehandling | CDK4/6 hemmere |
| X |
trastuzumab/pertuzumab | X |
| |
T-DM1 | X |
| |
lapatinib | X |
| |
Anti PD1/PD-L1 hemmere | X |
| |
Strålebehandling av metastaser | CDK4/6 hemmere | X | X |
trastuzumab/pertuzumab | X |
| |
T-DM1 | X | X | |
lapatinib | X |
| |
Anti PD1/PD-L1 hemmere | X |
| |
tucatinib |
| X | |
Trastuzumab deruxtecan |
| X |
Strålebehandling og brystproteser
Hos pasienter som har proteser (eller vevsekspander) gjelder de samme anbefalinger som hos andre pasienter. Det er ikke nødvendig å fjerne protese eller vevsekspander før strålebehandling. Pasienter med protese bør informeres om økt risiko for komplikasjoner, som kan føre til at protesen senere må skiftes ut.
Strålebehandling og VAP (veneport)
Hvis det er foreligger unilateral cancer med behov for VAP også i perioden under og etter strålebehandling (for eksempel ved trastuzumab behandling) er det best å planlegge at denne legges på kontralateral side. Samtidig oppfattes det ikke som noe vesentlig problem for gjennomføringen av strålebehandling dersom den er på samme side.
Strålebehandling og pacemaker
Moderne pacemakere er meget strålefølsomme. Forholdsregler og oppfølgning ved strålebehandling av pasienter som har pacemaker er avhengig av indikasjon for pacemakerbehandling og risiko for alvorlig rytmeforstyrrelse ved svikt av pacemaker. Det henvises til egne retningslinjer for dette ved stråleterapiavdelingene.
Samtidig adjuvant endokrin behandling
Adjuvant tamoxifen og aromatasehemmer kan gis samtidig med strålebehandlingen.
Protonbestråling
Protonterapi kan være aktuelt ved bestråling av spesielt vanskelig beliggende metastaser, nær kritiske strukturer eller nært opptil tidligere bestrålt område hvor overlapp ikke er ønskelig, og der foton/elektronbestråling ikke vil gi et tilfredsstillende resultat. Protonterapi bør kun benyttes i kliniske studier.
Strålebehandling ved arvelig brystkreft med påvist genfeil
Strålebehandling bør gis uavhengig av mutasjoner i BRCA1, BRCA2 eller moderat penetrante gener. Det er ingen holdepunkter for økt toksisitet eller kontralateral brystkreft ved strålebehandling dersom det foreligger slike mutasjon (N. M. Tung et al., 2020). Men ved TP53 mutasjoner bør strålebehandling unngås dersom mulig, på grunn av økt risiko for stråleindusert kreft. Mastektomi er førstevalg hos kvinner med brystkreft og kimbane genfeil i TP53 (N. M. Tung et al., 2020).
DCIS
Sist faglig oppdatert: 02202402.07.2024
Anbefaling:
Strålebehandling ved DCIS anbefales etter brystbevarende kirurgi ved alle størrelser grad II og III, samt ved grad I > 10 mm. DCIS skal vanligvis være fjernet med ≥2 mm frie reseksjonskanter før strålebehandling. Mot hud og mot brystvegg vil ikke disse grensene gjelde hvis det er utført reseksjon ut til hud og ned til epimysium.
Strålebehandling etter mastektomi for DCIS er ikke indisert dersom det ikke er «DCIS on ink». Ved utbredt knapp rand 0,1-2 mm må det utøves klinisk skjønn med tanke på om det er indikasjon for postmastektomi stråleterapi. Indikasjon for stråleterapi anbefales drøftet i MDT møte.
Behandlingsopplegg: Bestråling av bryst (evt brystvegg) til 40 Gy (2.67 Gy fraksjoner). Tidligere har det ikke vært anbefalt boostbestråling ved DCIS, men en fase 3 studie publisert i 2022 viser at en boostdose på 16Gy/8 fraksjoner reduserer absolutt risiko for lokalt tilbakefall med 4,4 % etter fem år (fra 7.3% uten boost til 2.9% med boost). 44% av tilbakefallene var invasive. Boost ga ingen endring i overlevelse etter fem år, men førte til økt risiko for smerte og indurasjon (Chua et al., 2022). Boost anbefales ikke generelt ved DCIS, men kan vurderes i enkelte tilfeller etter nøye vurdering av residivrisiko uten boost (for eksempel alder under 50 år og DCIS grad 3) sammenholdt med risiko for seneffekter (som kan påvirkes av boost-volumets størrelse og lokalisasjon i brystet).
Flere randomiserte studier inkludert en EBCTCG metaanalyse, har vist at stråleterapi halverer risiko for residiv etter brystbevarende operasjon for DCIS (Bijker et al., 2006; Early Breast Cancer Trialists' Collaborative Group (EBCTCG) et al., 2010; Fisher et al., 1998; Holmberg et al., 2008a; Houghton et al., 2003). EBCTCG metaanalysen viste at hos pasienter som ikke mottok adjuvant tamoxifen var forekomsten av recidiv etter 10 år 29% uten stråleterapi, sammenlignet med 13 % ved bruk av stråleterapi (Early Breast Cancer Trialists' Collaborative Group (EBCTCG) et al., 2010). Resultater etter 15 års observasjonstid viser en liten økning i residivrisiko for begge grupper, men effekten av stråleterapi er uendret (Donker et al., 2013). Risikoreduksjonen er uavhengig av subklassifikasjonen av DCIS, men den absolutte risiko for residiv er forskjellig. Risikoen for residiv var (uavhengig) assosiert med ung alder, middels eller lavt differensiert histologi, cribriformt eller solid vekstmønster, usikre marginer og manglende bruk av stråleterapi.
Med den lave residivfrekvens en ser ved små grad 1 DCIS-lesjoner, synes det forsvarlig å utelate postoperativ strålebehandling til disse.
Partiell brystbestråling
Sist faglig oppdatert: 02202402.07.2024
Risiko for lokalt tilbakefall etter brystbevarende kirurgi og postoperativ stråleterapi med moderne teknikker er i dag svært lav og avhengig av pasientens alder og prognostiske faktorer. Spronk et al fant i en nylig publisert oversiktsartikkel at årlig insidensrate for ipsilateralt residiv var 0.6 % pr år og for kontralateral brystkreft 0.5 % (Spronk, Schellevis, Burgers, de Bock, & Korevaar, 2018). I den danske HYPO-studien med deltakelse fra to norske sentre fant man 1.4 % lokale residiver etter 5 års oppfølging og ingen forskjell mellom moderat hypofraksjonert behandling 40 Gy/15 fraksjoner og konvensjonell behandling 50 Gy/25fraksjoner (B. Offersen et al., 2018). Risiko for ipsilateralt residiv etter brystbevarende kirurgi med moderne teknikker er altså svært lav og på nivå med risiko for kontralateralt residiv. I tillegg vil de fleste lokale residiv opptre i nærheten av det opprinnelige tumorområdet (Bartelink et al., 2001; B. V. Offersen, Overgaard, Kroman, & Overgaard, 2009).
På denne bakgrunn og ut fra et ønske om å redusere morbiditeten ved strålebehandling uten økt risiko for tilbakefall har man i flere internasjonale studier undersøkt effekten av partiell brystbestråling. Resultater med ekstern postoperativ partiell brystbestråling har nylig blitt publisert i en britisk multisenterstudie, IMPORT LOW (Coles et al., 2017). Dette er den første fase 3 studien som har rapportert 5 års resultater for lokalt tilbakefall og morbiditet etter partiell brystbestråling med standard ekstern strålebehandlingsteknikk. Med median oppfølging på 72.2. måneder ble det funnet 1.1 % (95 % CI 0.5–2.3) lokale residiver etter 5 år i kontrollgruppen og 0.5 % (0.2–1.4) i gruppen som fikk partiell brystbestråling. Studien inkluderte kvinner ≥ 50 år operert med brystbevarende kirurgi ± adjuvant systemisk behandling, pT≤3 cm, pN0-N1, unifokalt invasivt adenokarsinom, grad 1–3 med reseksjonsmargin ≥2 mm.
Resultater fra den randomiserte danske studien DBCG PBI (n=880) fant 16 lokale residiver etter median 7.6 års oppfølgingstid og ingen forskjell mellom strålebehandling av hele brystet og partiell strålebehandling gitt med standard ekstern strålebehandlingsteknikk. Primært endepunkt i studien var grad 2-3 brystindurasjon 3 år etter strålebehandlingen, hvor partiell brystbestråling var non-inferiort sammenlignet med helbrystbestråling. Det var heller ingen forskjell i andre bivirkninger. Denne studien inkluderte kvinner ≥60 år etter brystbevarende kirurgi, med pT1 ER pos HER2 neg invasivt ikke lobulært karsinom grad 1–2, pN0.
Det er videre publisert resultater fra en randomisert fase 3 studie som sammenlignet partiell brachyterapi med helbrystbestråling med tilsvarende oppfølgingstid som IMPORT LOW studien, som også fant sammenlignbar frekvens av lokale residiv i begge behandlingsarmene, henholdsvis 1.44 og 0.92 % (Strnad et al., 2016).
På bakgrunn av spesielt IMPORT LOW resultatene kan partiell strålebehandling fraksjonert 2,67 Gy x 15 vurderes som alternativ til helbrystbestråling til en definert lavrisiko-gruppe av pasienter etter brystbevarende kirurgi. Dette gjelder pasientpopulasjonen som er representert i både IMPORT LOW og DBCG PBI, definert med følgende karateristika (alle):
- pasienter ≥60 år
- unifokal pT1 tumor grad 1–2, pN0, ER positiv, HER2 negativ
- invasivt ikke-lobulært karsinom med frie reseksjonsrender (ingen «tumor on ink»)
Pasienter med frittliggende infiltrerende carcinom eller DCIS utenfor tumor er således ikke kandidater for partiell strålebehandling. Det er ingen forskjell på stråledosen som gis til tumorseng eller nærliggende område ved partiell ekstern strålebehandling, sammenlignet med helbrystbestråling. Derfor følger vurderingen av reseksjonsmarginer de anbefalinger som gjelder for helbrystbestråling.
Intraoperativ strålebehandling (IORT)
IORT har blitt undersøkt i Targit-A og ELIOT studiene som randomiserte pasienter mellom IORT og standard ekstern stråleterapi (Orecchia et al., 2021; Vaidya et al., 2020; Vaidya et al., 2010). Etter median oppfølging på hhv 8,6 og 12,4 år viser IORT non-inferiority sammenlignet med helbrystbestråling i TARGIT-A og signifikant mer lokale og regionale tilbakefall i ELIOT. Targit-A studien har vært omdiskutert som følge av usikkerhet vedrørende dosimetri, faktisk behov for stråleterapi i denne overveiende lavrisikopopulasjonen og kosmetisk resultat. I tillegg ble IORT gitt uten kunnskap om endelig histopatologisk diagnose/konklusjon, noe som førte til at 20% av IORT- pasientene etterpå ble behandlet med standard ekstern stråleterapi.
IORT bør helst gis innenfor rammen av en klinisk studie. Dersom slik behandling gis utenfor klinisk studie forutsettes det at pasientene på forhånd mottar adekvat informasjon om usikkerhetsaspektene ved behandlingen (kfr over), inkludert informasjon om hva som er primært anbefalt strålebehandling ved tilstanden i Handlingsprogrammet.
Definisjon av målvolum i henhold til ICRU
Sist faglig oppdatert: 02202402.07.2024
CT basert doseplan er nå sentral i strålebehandling av brystkreft. Det er derfor viktig å bringe retningslinjene i samsvar med de begreper som benyttes innenfor stråleterapi i henhold til International Comission on Radiation Units and Measurements (ICRU) rapport ICRU 50 og oppdateringen i ICRU 62. Det norske KVIST-utvalget har beskrevet de forskjellige målvolum slik (se tabell 6.1).
| Volumdefinisjoner |
|
| GTV (Gross Tumor Volume, Tumorvolum) | Dette er den palperbare eller synlig/demonstrerbare utstrekning av malign vekst (i øyeblikksbilde). |
| CTV (Clinical Target Volume, Klinisk målvolum) | Dette er det vevsvolum som inneholder GTV og/eller subklinisk mikroskopisk malign sykdom (i øyeblikksbilde). Det inngår ikke marginer for bevegelser eller endringer av CTV under behandlingen. CTV kan inneholde ingen eller flere GTV. Utstrekningen av CTV må vurderes opp i mot hvilken sannsynlighet det er for mikroskopisk sykdom i ulike deler av vevet. Det er rom for skjønn, men bør følge fastlagte strategier og protokoller. |
| ITV (Internal Target Volume, Målvolum) | Dette er et volum som inneholder CTV pluss en indre margin som tar hensyn til indre bevegelser og endringer av CTV. Det er et geometrisk volum i pasient, definert i pasientgeometri, som med stor sannsynlighet omslutter CTV i alle de posisjonene CTV vil ha under behandling. ITV vil være det volumet en ønsker å gi en optimal dose, mens utenfor dette ønsker en å minimalisere dosen. ITV brukes vanligvis ikke i doseplanlegging ved brystkreft |
| PTV (Planning Target Volume, Planleggingsvolum) | Dette er et geometrisk volum som inneholder ITV pluss en «Setup margin» som tar hensyn til antatte variasjoner i pasientopplegging og feltinnstilling. For ekstern terapi er PTV definert i feltgeometri, det er avhengig av behandlingsteknikk og vil kunne gå på utsiden av pasienten. Dette volumet brukes til å bestemme feltform og feltstørrelse, men for bestemmelse av disse trenger en normalt bare projeksjon av PTV i BEV (Beams Eye View). |
| Margindefinisjoner |
|
| IM (Internal Margin, Indre margin) | Dette er en anatomisk margin som legges på CTV p.g.a. forventede bevegelser og/eller endringer av CTV for å definere Målvolumet (ITV) gjennom behandlingsforløpet. Pusteavhengig bevegelse i thoraxveggen i fri pust er minimal, ca. 2–3 mm. Slike endringer og bevegelser kan skyldes:
OBS! Det må også tas hensyn til usikkerhet i inntegning av CTV på grunn av snittykkelse (partielle volumeffekter ved rekonstruering av snitt). |
| SM (Set-up Margin, Setup margin) | Dette er en margin som legges på Målvolumet (ITV) p.g.a. antatte bevegelser under bestrålingen og usikkerhet av pasientoppleggingen ved hver behandling i forhold til strålefeltet. Slike usikkerheter og bevegelser kan skyldes:
|
|
| forts. |
| Ulike organ |
|
| OAR (Organ at Risk, Risikoorgan) | Dette er normalvev (i øyeblikksbilde) hvor strålefølsomheten signifikant kan påvirke planlegging og/eller rekvirering av dose. (OR er analogt til GTV). |
| IRV (Internal Risk Volume, Risikovolum) | Dette er Risikoorgan (OAR) pluss margin for indre bevegelser og forandringer (tilsvarende Indre margin). (IRV er analogt til ITV). IRV brukes vanligvis ikke i doseplanlegging ved brystkreft |
| PRV (Planning Organ at Risk Volume) | Dette er Risikovolum (IRV) pluss Setup marginer. (PRV er analogt til PTV). |
| Interessevolum |
|
|
| Dette er et volum (organ) der en ønsker å registrere doser med tanke på bivirkninger (men ikke påvirker rekvirering og planlegging som IRV). |
Oversikt over volumdefinisjonene
Sist faglig oppdatert: 02202402.07.2024
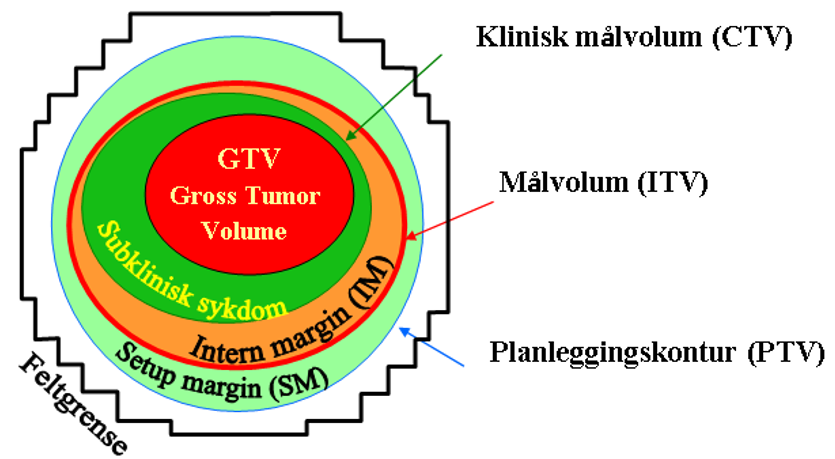
Definering av feltgrenser
Ved definering av feltgrenser må en legge til en avstand fra terapeutisk isodose tilsvarende P90/50. Denne er typisk 5–7 mm (Volum og doser ved strålebehandling: definisjoner, retningslinjer for bruk, dokumentasjon og rapportering).
Anbefalte målvolum og doser for postoperativ bestråling ved cancer mammae
Sist faglig oppdatert: 02202402.07.2024
GTV
Ved postoperativ bestråling har man som regel ikke noe GTV.
CTV
Basis for definisjon av CTV bryst/brystvegg/lymfeknuteregioner ved primært operabel brystkreft er presentert i ESTRO consensus guidelines (B. V. Offersen et al., 2015; B. V. Offersen et al., 2016). For tabellarisk oversikt, se avsnitt "CTV brystvegg (CTVp_thoracic wall)" lengere ned på siden. Praktisk tilnærming til bruk av malen i klinisk rutine vil være opp til de enkelte stråleterapiavdelinger.
CTV mamma CTVp_breast
CTVp_breast skal omfatte corpus mammae og processus axillaris.
Grenser:
- Ventralt – 5 mm under hudoverflaten.
- Dorsalt – fascien over brystmuskulaturen. Hvis det dreier seg om dyptsittende tumor (ned mot fascie), vurderes å utvide CTV noe lenger dorsdalt.
Som hjelp til inntegning kan man legge metalltråd på operasjonsarret og rundt palpabelt kjertelvev før CT scanningen. Synlig kjertelvev (CT) og eventuelle klips i tumorsengen inkluderes i CTVp_breast.
Det er viktig å huske at det kan være vanskelig å visualisere mammavevet hos eldre kvinner.
Måldose og fraksjonering: 2.67 Gy x 15
CTV partielt bryst
CTV partielt bryst er ikke en veldefinert anatomisk struktur, men tilsvarer tilnærmet en kvadrant av brystet. Det defineres ut fra synlig tumorseng som avgrenses av kirurgiske klips, eventuelt serom og arrforandringer, og inntegning må baseres på preoperativ diagnostikk, operasjonsbeskrivelse og histologi. CTV genereres med 15 mm margin til tumorseng, men avgrenses av muskelfascien dorsalt i det CTV partielt bryst ikke skal være større enn CTV ved helbryst-bestråling (CTVp_breast).
Måldose og fraksjonering: 2.67 Gy x 15
CTV boost
Med CT som grunnlag, omfatter dette volumet (ved postoperativ strålebehandling) tumorsengen definert ut i fra operasjonskavitet og den synlige postoperative reaksjon med cirka 0.5 cm omkringliggende vev som margin. Avgrensningen av tumorsengen (=CTV boost) gjøres ved hjelp av preoperativ diagnostikk, operasjonsbeskrivelse, operasjonshistologi og klips i tumorsengen. Klips er nødvendig ved boost-bestråling. Det anbefales å sette 2 klips i fascien under tumor samt i cranal, caudal, lateral og medial reseksjonkant. Hvor dypt (mot brystveggen) målvolumet skal defineres, vil være avhengig av tumorlokalisasjon. Pasientens angivelse av tumors beliggenhet kan av og til også være til hjelp. Arret er ikke målvolum i seg selv. CTV boost bør alltid være innenfor området for CTVp_breast.
Boost kan gis med følgende fraksjoneringer:
Enten sekvensiell boost med 5-8 fraksjoner á 2 Gy (dvs. 10-16 Gy i tillegg til måldose gitt til hele brystet) eller som simultan integrert boost med 3,2 Gy x 15 fraksjoner til 48 Gy (dose til hele brystet 40 Gy).
Måldose og fraksjonering: Enten sekvensiell boost med 8 fraksjoner á 2 Gy (dvs. 16 Gy i tillegg til måldose gitt til hele brystet) eller som simultan integrert boost med 3,2 Gy x 15 fraksjoner til 48 Gy (dose til hele brystet 40 Gy)
Målvolum
CTVp_Tumorbed = tumorsengen definert av klips og synlig postoperativ reaksjon. CTVp_Tumorbed skal omsluttes av CTVp_Breast
PTVp_Tumorbed = CTVp_ Tumorbed + 5 mm margin konsentrisk. PTVp_Tumorbed skal omsluttes av PTVp_Breast.
Residualvolumet:= CTVp_Breast– CTVp_Tumorbed
Max 30% av residualvolumet kan få 95% av rekvirert dose til boostvolumet
Fraksjonering:
Etter brystbevarende kirurgi:
15 fraksjoner á 2.67 (helbryst) hhv 3.2 Gy (boostvolum) til totaldose 40.05 Gy (helbryst) og 48.0 Gy (boostvolum).
Boost etter mastektomi:
I sjeldne tilfeller kan det etter mastektomi være indikasjon for å gi boost mot et område med usikker eller ufri reseksjonsflate. Definering av målvolum vil i slike tilfeller være etter individuell vurdering. De samme fraksjoneringsregimer som er nevnt over kan benyttes som veiledende utgangspunkt.
Onkoplastikk og boost-bestråling
Indikasjon for strålebehandling inkludert boost mot tumorseng er den samme ved onkoplastisk BCT (OBCT) som ved BCT uten onkoplastiske teknikker. OBCS kan vanskeliggjøre boost-bestråling pga usikker lokalisering av primær tumorseng. Remodellering av brystet kan gjøre det umulig å gjenfinne opprinnelig tumorområde dersom sårhulen ikke merkes med klips som er plassert like etter tumorreseksjonen og før den onkoplastiske rekonstruksjonen. En studie av pasienter som gjennomgikk onkoplastisk brystkirurgi har vist at onkolog definerer et betydelig mindre boost-område enn operatør (Garreffa et al., 2020). I planleggingsprosessen er det viktig med tett samarbeid mellom kirurg og onkolog. På denne måten økes treffsikkerheten og vev utenfor målområdet kan spares for unødvendig strålebelastning, da dette kan medføre et dårligere kosmetisk resultat med mer fibrose.
CTV parasternal (CTVn_IMN)
Langt de fleste parasternale lymfeknuter (73–96 %) finnes i de tre øverste intercostalrommene.
CTVn_IMN skal inneholde de ipsilaterale parasternale lymfeknutene i 1–3 intercostalrom. Dette svarer vanligvis til området fra den caudale begrensning av sternoclavikluærleddet til kranielle begrensning av costa IV.
Måldose og fraksjonering: 2.67 Gy x 15.
CTV aksille (CTVn_L1-L3)
Beliggenheten av aksillens nivåer er undersøkt med MR og CT (Dijkema et al., 2004; Takeda et al., 2000). Nivå I (CTVn_L1) ligger lateralt for m. pectoralis minor, nivå II (CTVn_L2) posteriørt for og nivå III (CTVn_L3; apikale aksillære lymfeknuter/infraclaviculære lymfeknuter) medialt for den samme muskel (laterale begrensning av nivå III er mediale kant av processus coracoideus).
Måldose og fraksjonering: 2.67 Gy x 15.
CTV supraclavikulærområdet (CTVn_L4)
Lymfeknutene ligger langs de store kar og nervefletninger i supraclavikulærregionen. Vanligvis defineres craniale grense av CTVn_L4 til arteria subclavias craniale begrensning.
Måldose og fraksjonering: 2.67 Gy x 15.
CTV brystvegg (CTVp_thoracic wall)
Omfatter brystveggområdet som lå under brystkjertelen samt operasjonsarret. Etter operasjon for lateralt beliggende tumores kan det ved arr som strekker seg utover mediale begrensning av brystkjertelen, vurderes å utelate den helt mediale del av arret i CTV. De ytterste 5 mm av huden omfattes vanligvis ikke av klinisk målvolum.
Ved postoperativ strålebehandling ved lokalavansert situasjon vil det være grunnlag for å definere CTV ut til hud på brystveggen ved T4 tumores, samt på spesielt store T3 tumores med liten respons på neoadjuvant behandling etter individuell vurdering. Det samme gjelder situasjoner der det er ufri reseksjonsrand mot hud. I dypet går målvolumet ned til musculus pectoralis major eller costas anteriore flate der pectoralismuskelen ikke kan defineres.
Vanligvis påvirker ikke tilstedeværelse av serom inntegningen av CTV. Dette gjør at det ikke er nødvendig å inkludere et seromområde der det ikke er en naturlig del av CTV.
Man definerer mediale grense med utgangspunkt i forholdene i gjenværende mamma. Hvis det ikke er mulig, settes mediale grense til 25 mm lateralt for sternums ipsilaterale laterale grense.
Måldose og fraksjonering: 2.67 Gy x 15.
CTV etter rekonstruksjon med protese
Nye ESTRO retningslinjer for inntegning av CTV etter rekonstruksjon med protese er publisert (Kaidar-Person et al., 2019). Disse retningslinjene benyttes som anbefalt utgangspunkt for inntegning av målvolum ved primær rekonstruksjon i Norge. En må være oppmerksom på om protesen ligger prepectoralt eller bak pectoralis, og at også ved protese bak pectoralis kan deler av protesen lateralt/caudalt ligge uten dekke av m. pectoralis major. Ved slike inngrep er det viktig å ikke fylle ekspanderprotesen for mye (dersom slik benyttes), da det ved stor fylling kan øke stråledosen til hud som følge av at inntegning av CTV kan bli nærmere hud. Kan evt. også bruke permanent protese først i stedet for ekspander for å unngå ventil i strålefeltet.
Tabell 6.2
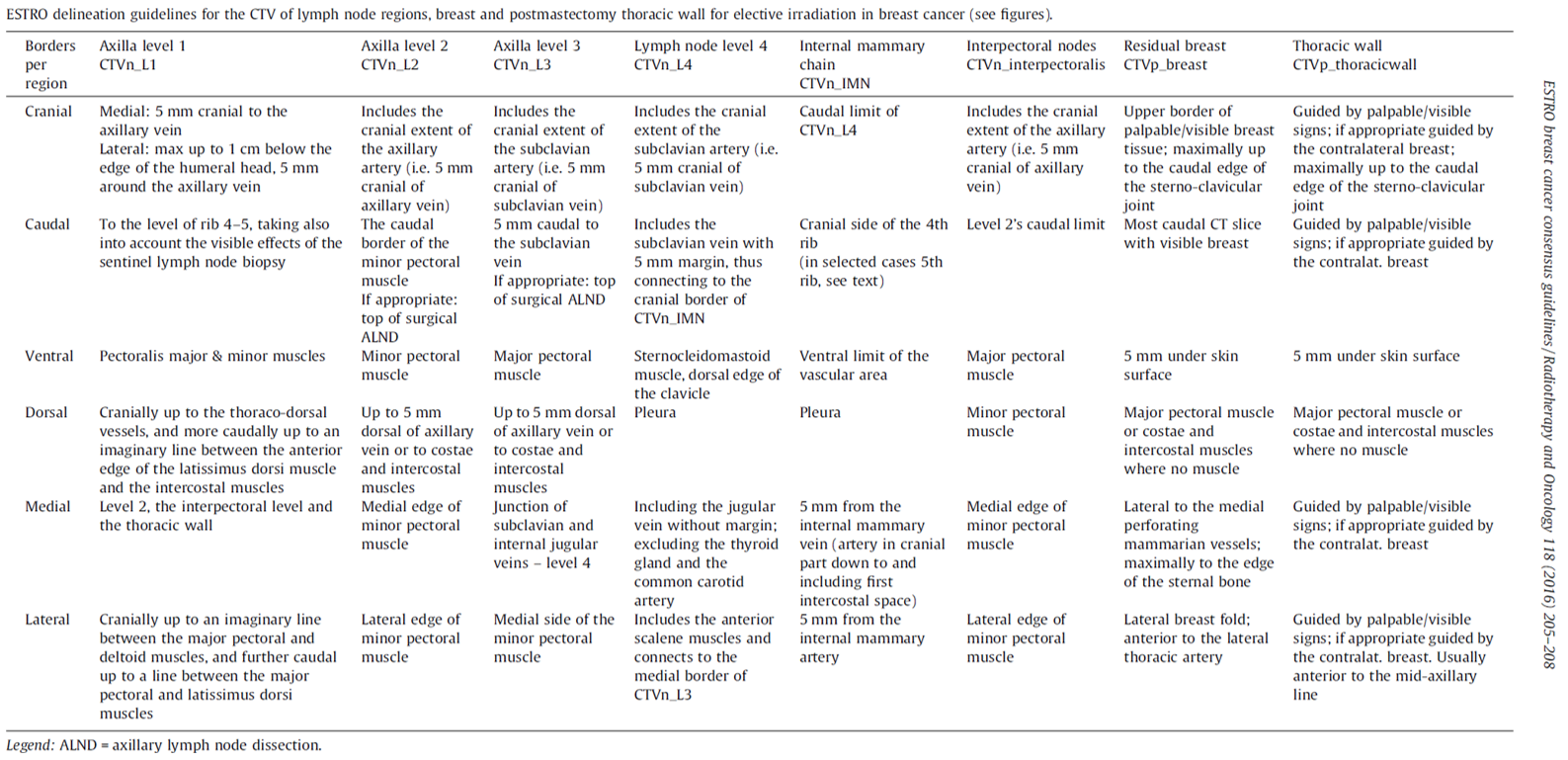
ITV
ITV settes lik CTV. Man søker å oppnå 95–107 % av måldosen i CTV/ITV.
PTV
Marginer fra ITV til PTV settes til 5–7 mm. Mot hjertet settes denne til 0. Minimumdosen i PTV bør være 90 % av måldosen.
Bruk av bolus ved strålebehandling mot brystvegg etter masektomi, med eller uten gjennomgått rekonstruksjon
Sist faglig oppdatert: 02202402.07.2024
Risiko for lokalt residiv etter postmastektomi stråleterapi hos pasienter uten hudinfiltrasjon er svært lav, om lag 3% etter 10 år. Bruk av bolus øker risiko for akutt og sen hudtoksisitet. Samtidig er det ikke vist at bolus reduserer risiko for lokalt tilbakefall eller brystkreftrelatert død, men vi har ikke resultater fra randomiserte studier (Nichol et al., 2021).
Bruk av bolus ved strålebehandling etter mastektomi anbefales ved hudinfiltrasjon, inflammatorisk tumor, inoperable og eksofytiske tumores (klinisk stadium T4b, c, d uavhengig av neoadjuvant behandlingseffekt og alle ypT4 uavhengig av cT klassifikasjon), lokale brystvegg-residiver, og i situasjoner med tumorinfiltrasjon (også ved DCIS) i ventral reseksjonsflate (Kaidar-Person et al., 2021). Tynn brystvegg vil i seg selv ikke være en indikasjon for bruk av bolus, men det kan være behov for individuell vurdering i slike tilfeller. Standard tangentielle teknikker vil vanligvis gi tilstrekkelig dosedekning ut mot hud, også ved tynn brystvegg.
Strålebehandlingsteknikk
Sist faglig oppdatert: 02202402.07.2024
Strålebehandlingsteknikk besluttes i tråd med den enkelte stråleterapiinstitusjons behandlingsopplegg. Konvensjonell strålebehandling (3D-CRT) oppfattes som standard per i dag. Tangentiell intensity modulated radiation therapy (t -IMRT) kan være et godt alternativ der en ikke oppnår adekvat dosedekning til CTV. I enkelte tilfeller kan m-IMRT eller volumetric modulated arc therapy (VMAT) vurderes benyttet. Disse teknikker kan være spesielt aktuelle der en ikke får en akseptabel doseplan med konvensjonell teknikk, enten ved inadekvat dose til CTV eller ved for høy dose til risikoorgan. Det understrekes likevel at både m-IMRT og VMAT gir et større volum med lavdosebestråling til kontralateralt bryst og lunge. Det mangler langtidsobservasjon etter bruk av disse dynamiske teknikkene med tanke på risiko for sekundærkreft og andre senskader. Valget om å bruke slike teknikker bør derfor gjøres etter en grundig vurdering av risiko/nytte profilen ved strålebehandlingsplanen.
Risikoorganer
Sist faglig oppdatert: 02202402.07.2024
Hjerte
En studie som har analysert stråledoser til hjertet og risiko for cardiovaskulær sykdom og hjertedød (S. C. Darby et al., 2013) viste at det ikke er noen nedre dosegrense for risiko, men en relativ risikoøkning på 7.4 % for hver Gy i gjennomsnittsdose til hjerte. Den absolutte risiko for potensiell hjerteskade er avhengig av pasientens cardiovaskulære risiko (komorbiditet) og hvor høy gjennomsnittsdose som gis til hjertet. Ut i fra beregningene som er utført i studien, er økt risiko for cardiovasculær sykdom i løpet av 30 år meget lav dersom gjennomsnittsdosen til hjerte ikke overstiger 2–3 Gy. DBCG-studiene har også inkludert en undersøkelse av cardiotoksisitet, som ikke viser endring i cardiovasculær sykdomshyppighet ved mer moderne strålebehandling (Højris, Overgaard, Christensen, & Overgaard, 1999). Dette understøttes også av to store populasjonsbaserte studier (S. C. Darby, McGale, Taylor, & Peto, 2005; S.H. Giordano et al., 2005). Likevel understrekes det at enda lenger observasjonstid er nødvendig for sikker avklaring av stråleterapiens eventuelle påvirkning på kardiovaskulær sykdom. En ny EBCTCG overview analyse har gjennomgått risiko for spesielt lungecancer og hjertesykdom etter strålebehandling (C. Taylor et al., 2017). Studien viser at risikoen øker med økende doser til henholdsvis lunge og hjerte og spesielt at røykere har økt risiko for å utvikle lungecancer og til en viss grad død av hjertesykdom mens ikke-røykere som har fått stråledose til lunge/hjerte i tråd med moderne stråleplanlegging har svært lav risiko.
Inntegning av hjertet som risikoorgan kan gjøres ved å inkludere kun myocard (C. Taylor et al., 2017; C. W. Taylor et al., 2011) eller ved å inkludere pericard (C. Taylor et al., 2018), hvor erfaringen er at begge inntegningsmåter gir tilsvarende estimering av gjennomsnittlige stråledoser til hjertet (Carolyn Taylor, University of Oxford, personlig kommunikasjon). Det foreligger nå flere atlas for inntegning av hjerte basert på inklusjon av pericard der det nyeste (Duane et al., 2017) kan være et godt hjelpemiddel for denne risikoorganinntegningen.
Anbefaling:
Stråledosen mot hjertet bør beskrives og rapporteres som gjennomsnittlig hjertedose (mean dose) i Gy (erstatter V25 %). Det anbefales at man etterstreber en gjennomsnittsdose til cor på ≤ 2 Gy og at alle pasienter som skal ha strålebehandling for venstresidig ca mammae i utgangspunktet bør tilbys slik behandling pustestyrt (i dyp innpust). Hvis ikke man oppnår ønsket lav stråledose mot hjertet, bør målvolumet vurderes (justering av CTV til et tilpasset doseringsvolum, hvis dette oppfattes akseptabelt klinisk) og/eller risk/benefit ratio spesielt vurderes.
Lunge
Strålebehandling mot lunge kan medføre risiko for strålepneumonitt. Risikoen for dette er lav dersom volumet av bestrålt lunge er i tråd med anbefalingene nevnt under. En ny EBCTCG overview analyse har gjennomgått risiko for spesielt lungecancer og hjertesykdom etter strålebehandling (C. Taylor et al., 2017). Studien viser at risikoen øker med økende doser til henholdsvis lunge og hjerte og spesielt at røykere har økt risiko for å utvikle lungecancer og til en viss grad død av hjertesykdom, mens ikke-røykere med doser til lunge/hjerte i tråd med moderne stråleplanlegging har lav/ingen risiko.
Anbefaling:
Ved strålebehandling 2.67 Gy x 15 mot bryst/brystvegg og regionale lymfeknutestasjoner bør maksimum 35 % av lungen få en dose på 18 Gy eller mer (V18Gy ≤ 35 %). Dette tilsvarer V20≤35 % ved fraksjonering 2Gy x 25 (Lind, Wennberg, Gagliardi, & Fornander, 2001).
Ved strålebehandling 2.67 Gy x 15 kun mot bryst bør det tilstrebes at maksimum 15 % av samsidig lunge får en stråledose på 18 Gy eller mer ( V18Gy ≤ 15 %).
Det anbefales røykeslutt på grunn av økt risiko for lungecancer etter adjuvant strålebehandling hos røykere.
Medulla
Maksimaldosen bør ikke overstige en middeldose på 50 Gy (vurdert i 2 Gy fraksjoner) i et volum på 1 cm3.
Kontralateral mamma
Det ansees ikke nødvendig at dette risikoorgan tegnes inn da man ut fra doseplanene kan ettergranske hvilke områder av organet som har fått hvilke doser. Det vil være opp til det enkelte stråleterapisenter om man vil gjøre det.
Ved tangentiell bestråling vil middeldosen til kontralateralt bryst ligge mellom 0,5 og 2,0 Gy. Stråleterapi som en del av brystkonserverende behandling ser ikke ut til å være en signifikant risikofaktor for utvikling av cancer eller sarkom i kontralateralt bryst, men dosen bør holdes så lavt som mulig. I utgangspunktet bør motsatt bryst ikke inkluderes i strålefeltet, dersom ikke dette er nødvendig for å sikre tilfredsstillende dosedekning i målvolumet. Man har foreløpig ikke tilstrekkelig kunnskap om langtidsvirkningene av å bestråle motsatt bryst ved moderne teknikker, da studier med tilstrekkelig lang oppfølging bygger på erfaringer gjort med konvensjonell innstilling av felt på simulator.
Plexus brachialis
Risiko for stråleindusert skade på plexus brachialis (radiation induced brachial plexopathy, RIBP) er avhengig av totaldose, fraksjonsdose, bestrålt volum, bruk av nevrotoksisk kjemoterapi, kirurgi og pasientrelaterte faktorer. Gamle og for lengst utdaterte strålebehandlingsteknikker med høy fraksjonsdose/totaldose og høy risiko for overlapp mellom fraksjoner hadde svært høy risiko for RIBP (Johansson, Svensson, & Denekamp, 2002; Westling, Svensson, & Hele, 1972). Med dagens teknikker er RIBP en sjelden komplikasjon. Insidensen er under 1–2 % ved totaldose < 55 Gy til plexusnært område gitt med 2 Gy fraksjoner (Delanian, Lefaix, & Pradat, 2012).
Det anbefales å etterstrebe en max punktdose i plexus brachialis på mindre eller lik 52 Gy vurdert i 2 Gy fraksjoner, men at punktdoser opp til 54 Gy i spesielle tilfeller vil kunne aksepteres. Dette er i tråd med retningslinjer i andre europeiske land, f. eks. Danmark.
Ved moderat hypofraksjonert behandling, slik det praktiseres i dag, bør det etterstrebes noe lavere max punktdose fordi man har mindre erfaring med slik fraksjonering og begrenset tilgang på kliniske data.
Det er viktig å være klar over at utstrakt bruk av kjemoterapi i moderne behandling av brystkreft vil kunne gi økt risiko for skade på nervevev. Dette kan ha betydning for hvilken maxdose som aksepteres for den enkelte pasient.
Som hjelp i planleggingen og vurderingen presenteres noen beregningseksempler:
- Det legges til grunn en alfa/beta verdi for nervevev på 2 Gy.
- Ved maksimal punktdose 111 % vil moderat hypofraksjonert behandling (2.67 Gy x 15) til lymfeknuteregionene gi en Dmax på 44.5 Gy (nominelt), svarende til EQD2 = 55.1 Gy.
- Ved maksimal punktdose 108 % vil moderat hypofraksjonert behandling (2.67 Gy x 15) til lymfeknuteregionene gi en Dmax på 43,3 Gy (nominelt), svarende til EQD2 =52.8 Gy.
- Ved maksimal punktdose 105 % vil moderat hypofraksjonert behandling (2.67 Gy x 15) til lymfeknuteregionene gi en Dmax på 42.05 Gy (nominelt), svarende til EQD2 = 50.5 Gy.
I noen tilfeller må det gjøres individuelle vurderinger på bakgrunn av behov for høyere dose til lymfeknutestasjonene på grunn av gjenværende tumor i området.
Rebestråling ved lokoregionale residiv
Sist faglig oppdatert: 02202402.07.2024
Ved lokoregionale residiv kan rebestråling vurderes individuelt etter grundig gjennomgang av alle behandlingsalternativer i multidisiplinært team inkludert onkolog med stråleterapierfaring. Det må tas hensyn til særlig to momenter. Først, muligheten for stråleresistens i tumor hvis det er kort tid mellom primær stråleterapi og et residiv som er lokalisert i et område hvor det tidligere er gitt adekvat stråledose. I tillegg må summert stråledose til omkringliggende normalvev vurderes akseptabel ved doseplanlegging. Forventet klinisk nytteverdi av rebestråling må være større enn potensielle bivirkninger (Kaidar-Person et al., 2018).
Selv om pasienter med lokoregionale residiv har høy risiko for samtidige eller senere metastaser vil mange pasienter ha lang sykdomsfri overlevelse eller kurasjon etter residivbehandling [2]. Også ved utbredt sykdom kan lokalbehandling gi god palliasjon. Det må utvises forsiktighet med tanke på høye akkumulerte stråledoser i overlappssoner; pleuxus brachialis, beinvev og lymfeåresystemet. Ved ipsilaterale residiv i brystet etter tidligere standard behandling med brystbevarende operasjon og stråleterapi gir behandling med mastektomi alene under 10 % risiko for senere sekundært residiv (Abner et al., 1993; Alpert et al., 2005).
Hos pasienter med lokaliserte sene residiv i brystet etter tidligere brystbevarende behandling og som ikke ønsker mastektomi kan brystbevarende behandling etterfulgt av rebestråling i enkelttilfeller vurderes etter nøye gjennomgang av risiko/nytte i følgende tilfeller som veiledende utgangspunkt (uten å utelukke andre potensielle kandidater): residivfritt intervall flere år, østrogen-reseptor positiv/HER2negativ sykdom, lav histologisk grad, lite og fritt fjernet ikke-lobulært carsinom og fravær av uttalt DCIS, forventet godt kosmetisk resultat basert på ratio mellom tumorstørrelse og størrelse på brystet, begrensede bivirkninger fra primær stråleterapi. I tillegg anbefales alder ≥50 år, basert på at denne aldersgruppen i størst grad har vært inkludert i studier av rebestråling etter brystbevarende kirurgi (Abeloos et al., 2023), samt at lokal residivrisiko generelt er lavere hos eldre enn yngre pasienter (etter primærbehandlingen) (Bartelink et al., 2001; Bartelink et al., 2015). Vurderingen krever gjennomgang i multidisiplinært team som inkluderer onkolog med stråleterapierfaring. Ved beslutning om å gjennomføre brystbevarende kirurgi etterfulgt av rebestråling vil partiell brystbestråling være å anbefale fremfor helbrystbestråling som vil innebære større risiko for skade på friskt vev. De største studiene på dette området har vært gjort med kateterbasert interstitiell brachyterapi (Hannoun-Levi et al., 2013), men partiell strålebehandling gitt med standard ekstern strålebehandlingsteknikk vil også være et godt alternativ og er undersøkt i en nylig publisert RTOG studie (Arthur et al., 2020). I denne studien, som ble startet i 2010, ble det gitt partiell brystbestråling i fraksjonering 1,5 Gy 2 ganger daglig til totaldose 45 Gy. Standard fraksjonering ved brystbestråling i dag er 2,67 Gy x 15 til totaldose 40 Gy og dette anses som et godt alternativ også i denne situasjonen, selv om data fra prospektive studier mangler.
Adjuvant og neo-adjuvant systemisk behandling
Adjuvant behandling
Sist faglig oppdatert: 02202402.07.2024
For skjematisk oversikt over anbefalt behandling, henvises til tabellariske oversikter senere i kapitlet ("Anbefalinger for pasienter med HR+HER2- pT1-2pN0 status dersom Prosignatest er utført" og "Anbefalinger for pasienter hvor det ikke er indikasjon for genekspresjonstest eller det ikke foreligger").
Risikoen for senere metastaser etter kun lokal behandling av brystkreft (kirurgi +/– stråleterapi) øker med økende tumorstørrelse, ved lymfeknutespredning og økende antall affiserte lymfeknuter (Quiet, Ferguson, Weichselbaum, & Hellman, 1995; P. P. Rosen, S. Groshen, P. E. Saigo, D. W. Kinne, & S. Hellman, 1989; P. R. Rosen, S. Groshen, P. E. Saigo, D. W. Kinne, & S. Hellman, 1989). Men selv pasienter med små tumores uten lymfeknutemetastaser kan utvikle fjernspredning (Hanrahan, Valero, Gonzalez-Angulo, & Hortobagyi, 2006). Histologisk gradering kan benyttes til å bedre skille ut risiko for senere tilbakefall i denne gruppen og benyttes rutinemessig i mange land, i tillegg til tumorstørrelse og lymfeknutestatus, for seleksjon av pasienter til systemisk adjuvant behandling (Grogan, Tabar, Chua, Chen, & Boyages, 2001; Kollias et al., 1999; Reed et al., 2000). Effekt av systemisk adjuvant behandling på overlevelse har vært testet ut i en rekke store randomiserte studier, – hvor resultatene fra enkeltstudier i tillegg har blitt registrert i European Breast Cancer Triallist Collaborative Group’s (EBCTCG) database. Dette har ført til at data har kunnet analyseres fra mer enn 140.000 kvinner i randomiserte studier med klinisk oppfølgning over mer enn 15–20 år (Early Breast Cancer Trialists' Collaborative Group (EBCTCG), 2005). Resultatene viser at kjemoterapi reduserer 10 års risiko for død av brystkreft med 1/3 (Peto et al., 2012). Endokrin behandling i form av tamoxifen i 5 år hos østrogen-reseptor positive pasienter fører til ca 30 % relativ mortalitetsreduksjon (Davies et al., 2011). For hormonreseptor positive pasienter som mottar både kjemoterapi og tamoxifen kan den relative mortalitetsreduksjonen etter 15 år forventes å bli mellom 45 og 57 %. Den absolutte nytteeffekten for den enkelte pasient vil være avhengig av hvor god prognose pasienten har uten systemisk behandling (Early Breast Cancer Trialists' Collaborative Group (EBCTCG), 2005).
Det benyttes prediktive faktorer for valg av nivå og type adjuvant systemisk behandling. Østrogenreseptor (ER) status er en viktig prediktiv faktor for effekt av endokrin behandling. HER2 tilhører EGF reseptor familien og har tyrosin kinase aktivitet. HER2 amplifikasjon/overekspresjon har vært oppfattet som en negativ prognostisk faktor assosiert med mer aggressiv sykdom (D. J. Slamon et al., 1987; D. J. Slamon et al., 1989). HER2-rettet behandling av pasienter med HER2 positive svulster i form av ett års adjuvant behandling med trastuzumab i tillegg til kjemoterapi har vist betydelige effekter både på sykdomsfri overlevelse og totaloverlevelse (kfr kapittel "Spesifikk behandling for HER2-positive pasiente", avsnitt "Spesifikk behandling for HER2-positive pasienter") (Cameron et al., 2017; Early Breast Cancer Trialists’ Collaborative group (EBCTCG), 2021; E. A. Perez et al., 2014; E.A. Perez et al., 2011; Piccart-Gebhart et al., 2005; Romond et al., 2005; D. Slamon et al., 2011).
Genprofiltester (Oncotype Dx/Mammaprint/Prosigna/Endopredict) har nå god dokumentasjon for å gi prognostisk informasjon ut over tradisjonelle histopatologiske analyser om prognose og indikasjon for kjemoterapi innenfor selekterte pasientgrupper. Spesielt er testene nyttige som verktøy for å skille risikoprofil hos pasienter med ER+HER2- svulster, uten aksillemetastaser (skiller høy/lav-proliferative; LumA vs LumB), som har betydning for behandlingsvalg ADDIN EN.CITE.DATA (Albain et al., 2010; Cardoso et al., 2016; Dowsett et al., 2013; Filipits et al., 2014; Gluz et al., 2016; Gnant et al., 2015; Nielsen et al., 2010; Paik et al., 2006; Sestak et al., 2013; Sparano et al., 2015; Wirapati et al., 2008). Resultater fra randomiserte studier viser også at genekspresjonsprofil-tester (Oncotype Dx og Mammaprint) kan identifisere pasienter som ikke eller i meget liten grad drar nytte av kjemoterapi, – som ellers ville vært kandidat for slik behandling (Cardoso et al., 2016; Sparano et al., 2018). I tillegg har nylig en stor DBCG studie dokumentert meget lav residivrisiko for postmenopausale lymfeknute negative pasienter som ikke har mottatt kjemoterapi (kun endokrin terapi; grad 2–3 uavhengig av tumorstørrelse, pT2pN0 uavhengig av grad) dersom Prosigna test resultatet viste lav eller intermediær ROR score (Lænkholm et al., 2018). Dog anses fremdeles bruk av genekspresjonsprofil-tester ikke å være godt nok dokumentert som verktøy for å unnlate bruk av kjemoterapi for pN+ pasienter (L. N. Harris et al., 2016; I. Krop et al., 2017), men både DBCG studien og MINDACT studien gav også informasjon om pN1 pasienter. RxPONDER studien rapporterte at postmenopausale HR+HER2- pN1 pasienter med OncotypeDx RS score <25 så langt hadde samme sykdomsfrie overlevelse med eller uten kjemoterapi, mens premenopausale pasienter som fikk kjemoterapi hadde bedre sykdomsfri overlevelse (Kalinsky et al., 2021). Det er også utført eksplorative subgruppeanalyser i TAILOR-X og MINDACT studiene basert på alder/menopausal status (se under).
Forhold av betydning for vurdering av grunnlag for bruk av kjemoterapi for pasienter med HR+HER2- brystkreft inkludert bruk av genekspresjonprofiler og i forhold til alder.
Både TAILOR-X, MINDACT og RxPONDER viste ingen nytte av kjemoterapi hos postmenopausale >50 år hos pN0 (TAILORx, MINDACT) eller pN1 ER+HER2- pasienter (MINDACT, RxPONDER) med lavere risikoprofil ut fra genekspresjonresultat (TAILORx, RxPONDER: OncotypeDx; MINDACT: Mammaprint), uavhengig av klinisk risikoprofil (pTpN+Grad) (Kalinsky et al., 2021; M. Piccart et al., 2021; Sparano et al., 2018). Men det er rapportert cirka 5% lavere residivrisiko ved kjemoterapi etterfulgt av endokrin behandling hos premenopausale pasienter <50 år med høy klinisk risikoprofil. Samtidig er det ikke kontrollert for den overariesupprimerende effekt av kjemoterapi i armene med kun endokrin behandling. Av de som var i behandlingsarm uten kjemoterapi mottok kun 13-20% av pasientene LH/RH agonist. Resultatene viser at forskjellen i metastasefri overlevelse mellom armene i MINDACT studien først fremkom etter cirka 4 års follow-up og ble tydeligere ved lengre tids follow-up. Dette er i kontrast til resultatene fra EBCTCG overview analysene som viser at effektforskjell ved bruk av kjemoterapi er til stede de første 5 årene etter behandlingen er gitt. Videre indikerte analyser i TAILORx studien at kjemoterapi + endokrin terapi ga færre residiv enn endokrin terapi alene hos premenopausale i 40-årene, og at forskjellen ikke var synlig for pasienter under 40 år, postmenopausale i aldersgruppen 45-50 år eller hos pasienter over 50 år (Sparano et al., 2019). I SOFT studien, som testet effekt av å gi goserelin i kombinasjon med tamoxifen sammenlignet med tamoxifen alene, var effekten av goserelin på overlevelse først signifikant ved analyse etter 8 års median observasjonstid (ikke signifikant ved cirka 5 års oppfølgingstid) og med effektforskjeller i samme omfang som de over nevnte studier (P. A. Francis et al., 2018; P. A. Francis et al., 2015). Disse resultatene taler for at hele eller deler av effekten av kjemoterapi hos premenopausale er knyttet til ovariesupprimerende effekt. Vi må avvente resultatet av ytterligere studier, inkludert OPTIMA studien, før vi kan skille ut eventuell tumorrettet kjemoterapi effekt fra effekten på ovariene. Hos premenopausale HR+HER2- pN0 pasienter med høyere klinisk risikoprofil vil det være grunnlag for kjemoterapi etterfulgt av endokrin behandling. Endokrin behandling som inkluderer goserelin kan vurderes som alternativ til kjemoterapi. Genprofilanalyse vil kunne påvirke grunnlaget for bruk av kjemoterapi. Hos premenopausale HR+HER2- pN1 pasienter vil primærvalget i utgangspunktet være kjemoterapi etterfulgt av endokrin behandling. Hvis ikke kjemoterapi benyttes bør endokrin behandling inkludere goserelin. Konferer tabellariske oversikter over adjuvant behandlingsanbefaling i slutten av kapitlet.
Bruk av Ki67 oppfattes som et alternativ for å estimere proliferasjon i tumor, men det er utfordringer knyttet til cut-off problematikk og variabilitet mellom laboratorier. St. Gallen konsensus fra 2009 og senere åpnet for bruk av Ki67 til å estimere proliferasjonsgrad og vurdere grunnlag for bruk av kjemoterapi (A. S. Coates et al., 2015; Goldhirsch et al., 2009; Goldhirsch, Winer, et al., 2013; Goldhirsch et al., 2011). Genprofiltestene har klart bedre dokumentasjon enn Ki67 som prognostiske verktøy i større kliniske studier (kfr over), inkludert studier som ikke viser prognostisk informasjon av Ki67 i mulitvariatanalyser når genprofiltester er inkludert (Gluz et al., 2016; Nielsen et al., 2010). Men det mangler fremdeles større prospektive sammenligninger. Vurdering av mitoseantallet kan også gi informasjon om proliferasjon, men cut-off verdier og variabilitet er ikke testet i stort omfang i internasjonale studier, selv om det finnes noe dokumentasjon (Baak et al., 2008; Baak et al., 2007; Klintman et al., 2013; Lende et al., 2011). Histologisk grad gir også informasjon om proliferasjonsgrad.
Anbefalingene baserer seg på vurdering av dokumentasjon for nytteeffekt av de enkelte adjuvante behandlingsmuligheter, den absolutte risiko for residiv hos pasienten, bivirkningsnivået og gjennomførbarheten av den aktuelle behandling. Anbefalinger er også vurdert opp mot internasjonale anbefalinger om indikasjon for adjuvant behandling (Burstein et al., 2019). Dette inkluderer også anbefalinger om bruk av prognostiske og prediktive biomarkører (Andre et al., 2019b; Harris et al., 2016). Anbefalingene for bruk av adjuvant systemisk behandling inkluderer pasienter ned til cirka 5 % risiko for fjernspredning i løpet av 10 år, uten bruk av adjuvant systemisk behandling. Dette er i tråd med internasjonal praksis. Risikovurderinger for den enkelte pasient og absolutte nytteeffekter av en foreslått behandling kan belyses gjennom bruk av dataverktøyet http://www.predict.nhs.uk/predict.html, men inkluderer ikke informasjon om genekspresjonsprofiler eller risiko for sene residiver.
Anbefalinger:
Pasienter med følgende tumorkarakteristika er kandidater for adjuvant systemisk behandling:
- Lymfeknute-positive pasienter (største metastasefokus > 0.2 mm), ie pN1-3.
- Lymfeknutenegative pasienter (pN0) med:
- tumorstørrelse > 20 mm (pT2)
- tumorstørrelse 11-20 mm (pT1c) (de fleste)
- tumorstørrelse >1-10 mm (pT1a-b) og samtidig HER2+ og/eller hormonreseptor negativ og/eller høy proliferasjon/høy risikoprofil/Luminal B subtype ved genekspresjonsanalyse.
For spesifiserte anbefalinger, se kapittel Oversikt over anbefalt adjuvant behandling, avsnitt "Anbefalinger for pasienter hvor det ikke er indikasjon for genekspresjonstest eller det ikke foreligger (01.02.20 – med korreksjon 04.06.20)".
Avhengig av alder, tumor og lymfeknutestatus, hormonreseptorstatus (østrogen- og progesteronreseptorstatus), HER2 status og genprofilstatus/proliferasjonsstatus vil indikasjon for og type systemisk adjuvant behandling være forskjellig og i tråd med følgende hva som er beskrevet i de følgende avsnitt (kapittel Adjuvant hormonbehandling til Neoadjuvant behandling).
Ved høy alder/morbiditet vil det kunne være behov for at behandlingsopplegget tilpasses individuelt. I slike tilfeller kan det være behov for geriatrisk vurdering, vurdering av forventet levetid, - i hvilken grad andre sykdommer kan påvirke nytten av en behandling, - og pasientpreferanse. Det henvises til retningslinjer fra EUSOMA og International Society of Geriatric Oncology for ytterligere informasjon (Biganzoli et al., 2021). Disse inneholder også vurderinger innenfor andre områder enn det som er relevant for dette kapitlet.
Adjuvant hormonbehandling
Sist faglig oppdatert: 02202402.07.2024
Brystkjertelvevets vekst og funksjon er avhengig av et komplekst samspill mellom mange hormoner. Denne følsomheten for hormoner vil et tumorvev beholde i varierende grad.
Det har vært kjent i snart 100 år at man oppnår effekter på brystkreftsykdommen ved å påvirke kroppens østrogenbalanse. Ny forskning har bidratt til bedre forutsetninger for endokrin behandling, gjennom både utvikling av nye medikamenter og ved økt kunnskap om østrogen effekter ved hormonpåvirkelig brystkreft. Tilstedeværelse av østrogenreseptor (ER) og progesteronreseptor (PR) i tumor indikerer sannsynlighet for respons på hormonell behandling. De viktigste medikamentgruppene til bruk i adjuvant behandling er anti-østrogen (tamoxifen (TAM)) og aromatasehemmere (AI). Adjuvant tamoxifen i 5 år har vist betydelige effekter på overlevelse og er det viktigste enkeltmedikamentet ved slik behandling (kfr over) (Davies et al., 2011). Tamoxifen har i tillegg en rekke østrogene effekter, spesielt hos postmenopausale kvinner. Dette synes å gi positive «bivirkninger» på skjelettet og lipidstoffskiftet. Videre reduserer tamoxifen risikoen for kontralateral brystkreft, men kan gi en liten økning i endometriecancer hos postmenopausale pasienter.
Bruk av AI som monoterapi er kun aktuelt hos postmenopausale kvinner/kvinner med utslukket eggstokkfunksjon. Flere store studier har vist at AI gir høyere sykdomsfri overlevelse enn tamoxifen (Bliss et al., 2012; A.S. Coates et al., 2007; Coombes et al., 2007; Cuzick et al., 2010; Forbes et al., 2008; Jakesz et al., 2005; Mouridsen et al., 2009; Muss et al., 2008; M.M. Regan et al., 2011; Ruhstaller et al., 2019). En EBCTCG overview analyse har dokumentert dette ytterligere, og det er også vist bedret totaloverlevelse (Dowsett et al., 2015). Å introdusere AI fra start har vist å gi best effekt på overlevelse (enten som AI i 5 år eller AI i 2–3 år etterfulgt av 2–3 år med tamoxifen), men hvor tamoxifen etterfulgt av AI også gir reduksjon i residivhyppighet sammenlignet med tamoxifen i 5 år. BIG 1–98 studien, en fire-armet studie (tamoxifen vs letrozol vs tamoxifen etterfulgt av letrozol vs letrozol etterfulgt av tamoxifen), har belyst disse forhold spesielt (Mouridsen et al., 2009).
Den absolutte effekt på residivhyppighet i studiene ligger mellom 2.6 % og 6 % i favør av AI armene. Videre reduserer også AI risikoen for kontralateral brystkreft.
Ut i fra data fra de randomiserte studiene av postmenopasuale pasienter er det registrert forskjellig hyppighet av følgende viktige bivirkninger mellom tamoxifen og AI:
Birvirkning | Favør av | Studie som signifikant støtter dette |
|---|---|---|
Tromboembolisk Sykdom | AI | ATAC, IES, ARNO/ABCSG |
Endometriecancer | AI | ATAC, BIG1 98 |
Cerebrovasculære events | AI | ATAC |
Hetetokter | AI | ATAC, BIG1 98 |
Vaginal blødning | AI | ATAC, IES, BIG1 98, MA171 |
Artralgi | Tam | BIG1 98, IES, ATAC, MA171 |
Frakturer | Tam | ATAC, IES, BIG1 98, ARNO/ABCSG |
1 For MA17 er kontrollarmen placebo, ikke tamoxifen
Hormonreseptorstatus og Her-2 status og Ki67 ekspresjon skal alltid analyseres. Hormonreseptor negative pasienter har ikke nytte av adjuvant endokrin behandling.
«Extended» adjuvant behandling
Det er publisert resultater fra to store randomiserte studier (ATLAS og aTTom) som har testet adjuvant bruk av tamoxifen i 10 år vs 5 år (Davies et al., 2013; Gray et al., 2013). I tillegg er det gjort en metaanalyse av disse studiene (Gray et al., 2013). Resultatene viser at bruk av tamoxifen i 10 år gir 3–4 % absolutt reduksjon i tilbakefall (relativ risiko 0.75 for ATLAS, 0.85 for aTTom), og 2–3 % redusert risiko for brystkreftdød (relativ risiko i metaanalysen 0.75). Totaldødelighet var også redusert i ATLAS studien og i metaanalysen. Det var ingen forskjell i all død uten tilbakefall, men dødelighet av endometriecancer økte fra 0.2 % til 0.4 % ved bruk av tamoxifen i 10 år (ATLAS studien).
I MA17 studien ble pasienter randomisert mellom letrozol og placebo, etter 5 års tamoxifen. I en subgruppeanalyse ble effekten av letrozol sammenlignet for pasienter som var premenopausale på diagnosetidspunktet med de som var postmenopausale. Det ble funnet bedre nytte av letrozol hos de som var premenopausale på diagnosetidspunktet (MERK: alle pasientene måtte ha postmenopausal status for å kunne bli randomisert mellom placebo og letrozol). Hazard ratio for tilbakefall for premenopausale ved letrozol sammenlignet med placebo var 0.26 (0.13–0.55) (Goss et al., 2013).
En rekke studier har testet forskjellige utvidede behandlingslengder med AI, fra 6–10 år total behandlingstid (MA17R, IDEAL, DATA, NSABP B-42, ABCSG-16, AERAS) (Blok et al., 2018; Gnant et al., 2021; Goss et al., 2016; Iwase et al., 2023; Mamounas et al., 2019; Tjan-Heijnen et al., 2017). MA17R studien (ytterligere 5 år letrozol vs placebo etter initialt 0–5 år med tamoxifen [median 5 år], etterfulgt av 5 år letrozol) viste forlenget sykdomsfri overlevelse (4 % forbedring) ved forlenget behandling med letrozol. Denne gevinsten var størst hos høyrisikogrupper, men var i all hovedsak betinget i reduksjon i kontralateral cancer. Det er ikke vist effekt på totaloverlevelse så langt (Goss et al., 2016). Resultater fra EBCTCG overview-analysene presentert på samme møte, viste at det er vedvarende risiko for sene residiv hos hormonreseptor positive pasienter, og at dette er spesielt viktig for pasienter som vurderes som høyrisikopasienter (Pan et al., 2017). NSABP B-42 studien viste ikke signifikant høyere sykdomsfri overlevelse (DFS) for pasienter med 5 års utvidet behandling med AI etter behandling enten med AI eller tam etterfulgt av AI i de første 5 år (HR 0.85, p=0.048) Analyse av metastasefri overlevelse (sekundært endepunkt) viste 1.9 % bedret overlevelse 7 år etter randomisering, uten forskjell i totaloverlevelse så langt (Mamounas et al., 2019). Ved SABCS2019 viste oppdatert overlevelsesanalyse av samme studie signifikant høyere DFS hos pasienter som fikk utvidet behandling med AI etter median 9.3 års oppfølgingstid (HR 0.84, p=0.011), men fremdeles ingen forskjell i totaloverlevelse (Mamounas et al., 2020). DATA studien randomiserte mellom 3 og 6 års behandling med AI etter initialt 2 års tamoxifenbehandling. Studien viste en grensesignifikant bedring i DFS ved 6 års behandlingstid med AI (3 års «adopted DFS» forskjell på 1.8 %; p=0.07). Subgruppeanalyse av DATA studien viste forbedret DFS i favør av 6 år med AI hos pasienter med høyest risk for recidiv (Tjan-Heijnen et al., 2017). I GIM4 studien (publisert i 2021), hvor pasientene ble randomisert til 2-3 år versus 5 år AI behandling etter 2-3 år med tamoxifen, ble det etter median 12 års oppfølgingstid funnet en klar bedring i DFS (5%) og OS (4%)(HR 0·78, 95% CI 0·65–0·93 og HR 0·78, 95% CI 0·65–0·93, henholdsvis). IDEAL studien viste ingen forskjell mellom 2.5 års og 5 års utvidet AI-behandling etter forutgående 5 års adjuvant endokrin behandling (tamoxifen/AI/tamoxifen etterfulgt av AI). Det var heller ingen subgrupper med overlevelsesgevinst (Blok et al., 2018). I ABCSG-16 studien som sammenlignet ytterligere 2 år versus 5 år med AI etter gjennomført 5 års adjuvant endokrin behandling, ble det heller ikke funnet forskjell i sykdomsfri overlevelse (Gnant et al., 2021). I AERAS studien som nylig ble publisert ble det funnet bedring i DFS men ikke totaloverlevelse ved AI i 5 år etter 5 år med AI eller 2-3 år med tamoxifen etterfulgt av 2-3 års AI (Iwase et al., 2023). Samlet sett er studiedesign forskjellig ved de forskjellige refererte studiene, noe som vanskeliggjør tolkningen.
Som utgangspunkt for vurderingen av potensiell nytte av å benytte aromatasehemmer som utvidet adjuvant behandling etter 5 års tidligere endokrin behandling, vil både type endokrin behandling som har vært benyttet og sykdomstadium være av betydning. For pasienter som har mottatt AI i de første 5 år, er det fremdeles begrensede og ikke konklusive data for utvidet bruk (Chen et al., 2021). I denne situasjonen er det ikke generelt grunnlag for å anbefale AI behandling ut over 5 år, men for pasienter med høy risiko (stor T, N+ sykdom), høy ER- og PR-ekspresjon og god tolerabilitet, kan det vurderes å forlenge AI behandlingen på individuelt grunnlag til totalt 7-10 år.
Det er publisert en såkalt «CTS5 score» som gir informasjon om risiko for metastaser ved residivfri status etter 5 år med endokrin adjuvant behandling – i de neste 5 år (Dowsett et al., 2018). Dette kan bidra til vurdering av potensiell nytte for bruk av forlenget endokrin adjuvant behandling (>5 år).
Videre henvises også til tabellarisk oversikt fra St Gallen konsensus konferanse under adjuvant behandling av hormonreseptor positive HER2 negative under "Kjemoterapi" i kapittelet Adjuvant ikke-hormonell behandling
Bruk av goserelin (OFS) til premenopausale i kombinasjon med tamoxifen eller AI
Resultater fra SOFT/TEXT studiene av premenopausale pasienter, inkludert oppdaterte resultater fra studiene, viste bedret sykdomsfri overlevelse ved å benytte OFS+exemastane vs OFS+tamoxifen. Begge disse ga klart bedre overlevelse sammenlignet med tamoxifen alene hos pasienter som fikk kjemoterapi (Francis et al., 2018; Francis et al., 2015; Pagani et al., 2014). Totaloverlevelsen var ikke forskjellig for OFS+exemestane vs OFS + tamoxifen, men det er fremdeles kort observasjonstid (Francis et al., 2018). Pasienter under 35 år som fikk kjemoterapi hadde en betydelig bedring i 5 års residivfri overlevelse ved å legge til OFS (≥11 %). OFS ble startet opp samtidig med kjemoterapi i TEXT studien, mens i SOFT studien startet man OFS ved premenopausal status innen 8 måneder etter kjemoterapi). En senere oppdatering av resultatene fra disse to studiene tydeliggjorde effektene på sykdomsfri overlevelse av OFS i kombinasjon med exemestane i større grad enn tamoxifen +/- OFS, hvor effekten av kombinasjonen kun var tydelig for pasienter med høy risiko og som typisk også fikk kjemoterapi (Pagani et al., 2020). Studiene er siden oppdatert etter median 13 års oppfølgingstid, med effekt på totaloverlevelse hos pasienter med høyere risiko (<35 år (4%); tumorstørrelse >2 cm (4.5%) eller grad 3 (5.5%) ved bruk av OFS i kombinasjon med exemestane sammenlignet med goserelin i kombinasjon med tamoxifen. SOFT studien viser også forskjell i totaloverlevelse med økende observasjonstid ved tillegg av OFS til tamoxifen eller AI. (Francis et al., 2023; Pagani et al., 2023).
De siste resultatene fra SOFT/TEXT indikerer at HER2+ ikke har bedre overlevelse ved bruk av AI+OFS enn tamoxifen + OFS, men det er få HER2 positive som er inkludert i studiene og store konfidensintervaller. Tross usikkerhet, kan det for denne gruppen gjøre valget mellom tamoxifen eller aromatasehemmer mer åpent.
Etter 8 års oppfølgingstid i ASTRRA studien ble det observert 5.2% bedring i DFS ved å benytte OFS i 2 år i tillegg til tamoxifen (i 5 år) sammenlignet med kun tamoxifen (Baek et al., 2023). Nylig ble det også publisert en EBCTCG metaanalyse som fant en reduksjon i tilbakefallsrisiko (HR 0.79), med 3.2% absolutt reduksjon i tilbakefall i behandlingsperioden på 5 år (Early Breast Cancer Trialists' Collaborative Group (EBCTCG), 2022). Foreløpig er det ikke observert forskjell i totaloverlevelse.
CDK4/6 hemmer i kombinasjon med endokrin behandling
Det finnes data fra 4 studier av adjuvant CDK4/6 hemmer i kombinasjon med endokrin behandling.
MonarchE studien (abemaciclib) viste etter median oppfølgingstid på 42 mnd en klar forskjell i residivfri overlevelse (invasive disease-free survival: IDFS) ved bruk av adjuvant abemaciclib i 2 år sammen med endokrin terapi hos HR+/HER2- pasienter med enten pN2 sykdom eller pN1 og enten grad 3 eller T3 tumorstørrelse ADDIN EN.CITE.DATA (Harbeck et al., 2021; Johnston et al., 2020; Johnston et al., 2023). Forskjellen i IDFS var 6.4% ved 4 år, og metastasefri overlevelse var 5.9% (HR 0.659 (95% CI 0.567-0.767). Cirka ¾ av tilbakefallene var metastaser. Nylig ble studien oppdatert med 5 års resultater, som viste ytterligere økt forskjell i IDFS til 7.6% og metastasefri overlevelse til 6.7% (Rastogi et al., 2024). Foreløpig er det ingen forskjell i overall survival.
Endelige resultater fra PALLAS studien (palbociclib)(median oppfølgingstid 31 mnd) har ikke vist overlevelsesgevinst (IDFS) av adjuvant palbociclib sammen med endokrin terapi hos pasienter operert for høyrisiko brystkreft (Gnant et al., 2022a). I denne studien avsluttet >40% av pasientene palbociclib før planen (som var to år). I PenelopeB studien som inkluderte pasienter som ikke oppnådde pCR etter neoadjuvant kjemoterapi, ble det heller ikke vist effekt av 1 års palbociclib sammen med endokrin terapi (median oppfølgingstid 43 mnd) (Loibl et al., 2021).
De første resultater fra NATALEE studien (ribociclib) er nylig publisert (Slamon et al., 2024). Studien testet ribociclib i 400 mg dosering over 3 år og inkluderte også pasienter med lavere stadium/risiko enn i MonarchE studien. Ved 3 år var IDFS 90.4% i ribociclibarmen versus 87.1% i kontrollarmen (HR 0.748; 95% CI 0.618-0.906). Metastasefri overlevelsesforskjell var 2.2%. Observasjonstiden er foreløpig for kort (28 mnd) og videre vurdering avventes.
Selv om observasjonstiden ennå er relativt kort i MonarchE studien, viser resultatene tydelige forskjeller i metastaseforekomst. Dette betyr på sikt alvorlig utfall for pasientene. Reduksjon av metastaser forventes å gi bedret totaloverlevelse på lengre sikt. Studier har vist god effekt av adjuvant abemaciclib i 2 år hos pasienter HR+/HER2- pasienter med enten pN2 sykdom eller pN1 og enten grad 3 eller T3 tumorstørrelse (Curigliano et al., 2023; Giordano et al., 2022). Abemaciclib anbefales for denne indikasjon i flere internasjonale retningslinjer og guidelines. Abemaciclib for denne indikasjonen er ikke godkjent i Nye metoder (24.04.23).
Foreløpig avventes publikasjon og oppdaterte resultater fra NATALEE studien før videre vurdering av adjuvant ribociclib.
Anbefalt behandling ved hormonreseptor positiv sykdom
Hva oppfattes som hormonreseptor positivt?
I tråd med internasjonal konsensus (Goldhirsch et al., 2009) defineres grensen for østrogenreseptor (ER) positivitet til tilstedeværelse av ER ekspresjon uavhengig av andel positive celler (praktisk cut off ≥1 %). Ved komplett ER negativitet, vil PR ekspresjon ≥10 % også gjøre at tumor oppfattes som hormonreseptor positiv. Men hormonreseptorundersøkelse bør da gjentas for å utelukke falskt positivt resultat.
Anbefalinger premenopausale kvinner:
Behandlingen starter opp etter at adjuvant kjemoterapi er avsluttet (ved indikasjon) og inkluderer en av følgende:
- Behandling med tamoxifen 20 mg x 1 daglig i 5 år anbefales for pasienter med lav risiko og stadium.
- Ovariefunksjonsuppresjon (OFS) i 5 år med goserelin i tillegg til AI (som følge av best sykdomsfri overlevelse), subsidiært OFS + tamoxifen (dersom tolerabilitet nødvendiggjør dette), anbefales til følgende høyere risiko pasienter/situasjoner (på bakgrunn av primært resultatene fra SOFT/TEXT studiene):
- Pasienter under 35 år hvor det i utgangspunktet er indikasjon for kjemoterapi.
- Ved alder over 35 år med høyere risikoprofil. Vurderingen av OFS kan påvirkes av om kjemoterapi gis og pasientens alder (sannsynlighet for kjemoterapiindusert menopause)
- Dersom ikke kjemoterapi benyttes vil goserelin anbefales til undergrupper med midlere eller høyere risikoprofil (kfr 7.2 og oversiktene over adjuvant behandling 7.4.1 og 7.4.2.)
- Dersom ikke OFS gis primært og pasienten ikke mister menstruasjonen etter kjemoterapi eller hvor menstruasjon kommer tilbake innen 8 måneder etter kjemoterapi bør OFS gis i tillegg til AI eller tamoxifen.
- Vurdering av subtype brystkreft (LumA vs LumB), risikoprofil ved genekspresjonstest, histologisk grad og stadium kan bidra til å avklare absolutte nytteeffekter og understøtte et behandlingsvalg.
Dersom OFS skal gis oppstartes OFS så snart som mulig etter at endokrin behandling er besluttet. Ingen forskjell i plan ved tillegg av tamoxifen eller AI, men det tar noe tid før AI kan ha ønsket virkning
Som supplerende informasjon for behandlingsvalg henvises til teksten under 7.2. og tabellarisk oversikt fra St Gallen konsensus veiledning over adjuvant behandling av hormonreseptor positive HER2 negative under under "Kjemoterapi" i kapittelet Adjuvant ikke-hormonell behandling
- Dersom risikoprofil taler for utvidet adjuvant behandling (inntil 10 år) bør det vurderes å kontinuere tilleggsbehandling basert på menopausal status i henhold til følgende:
- Dersom tamoxifen er benyttet de første 5 år og kvinnen på det tidspunktet er pre- eller perimenopausal eller har ukjent menopausal status eller det ikke kan bestemmes, bør det fortsettes med tamoxifen i ytterligere 5 år dersom tolerabilitet/sannsynlig absolutt nytteverdi underbygger dette.
- Dersom tamoxifen er benyttet de første 5 år og på det tidspunkt er sikkert postmenopausal, bør kvinnen fortsette med aromatasehemmer i 2-5 år, subsidiært fortsette med tamoxifen i ytterligere 5 år dersom tolerabilitet/sannsynlig absolutt nytteverdi underbygger dette.
- Dersom tamoxifen er benyttet primært men i mindre enn 5 år og kvinnen er vurdert å være postmenopausal, kan det skiftes til aromatasehemmer i 5 år på et tidligere tidspunkt.
- Dersom aromatasehemmer er benyttet (kjemoterapi-indusert og/eller OFS-indusert postmenopausal) de første 5 år, kan videre behandling være 5 år med tamoxifen eller 2-5 år med aromatasehemmer. Det foreligger studier som ikke viser forskjell i effekt mellom 7-8 års behandlingstid og 10 år.
Som supplerende informasjon for behandlingsvalg henvises til teksten under 7.2. og tabellarisk oversikt fra St Gallen konsensus veiledning over adjuvant behandling av hormonreseptor positive HER2 negative under "Kjemoterapi" i kapittelet Adjuvant ikke-hormonell behandling
Behandlingslengde med goserelin bør i utgangspunktet være 5 år. I valget mellom tamoxifen og AI ved samtidig bruk av goserelin, bør pasienter som er klart overvektige uansett få tamoxifen. Dersom AI velges er det viktig å monitorere hormonstatus for eventuelt å oppdage inadekvat OFS (tilsier i så fall bruk av tamoxifen). Samtidig er det verdt å merke seg at sensitivitetsnivået av dagens østradiolmålingsmetoder i Norge, ikke er nøyaktige nok til å måle om tilstrekkelig lave verdier av østradiol oppnås, når OFS benyttes. Haukeland Universitetssykehus har nylig etablert en ny og mer sensitiv metode med nedre deteksjonsgrense 20 pmol/l for østradiol. Det er viktig å følge opp bivirkningsnivå på en god måte. Pasienter som mottar goserelin er kandidater for adjuvant bisfosfonatbehandling (kapittel "Adjuvant ikke-hormonell behandling", avsnitt om "Spesifikk behandling for HER2-positive pasienter"). Dersom det ikke er mulig å gjennomføre slik behandling, bør det gjøres regelmessige bentetthetsundersøkelser (se under avsnittet for postmenopausale pasienter).
Basert på resultatene i SOFT og TEXT studiene er det laget et «sammensatt risikoscore-verktøy» hvor det er mulig å plotte inn individuelle parametre for en enkelt pasient, for vurdering av tilbakefallsrisiko ved de behandlinger som ble testet i disse studiene, via følgende lenke: https://rconnect.dfci.harvard.edu/CompositeRiskSTEPP/
Pasienter som har inneliggende hormonspiral og skal ha OFS + AI bør få fjernet hormonspiral.
Ved residiv i behandlingsperioden seponeres preparatet.
Tamoxifenbivirkninger er vanligvis moderate. Hyppigst rapporteres kvalme, abdominelt ubehag og hetetokter. Tabletter kan da forsøksvis tas om kvelden. Andre bivirkninger er vaginalblødninger (også ved seponering), lett vektøkning, kolpitt og pruritus vulvae. Ca 50 % av kvinnene kan miste menstruasjonen (obs. graviditet må unngås), 20 % får uregelmessig menstruasjon og 30 % beholder en normal menstruasjon ved hormonell behandling alene. Dette vil være avhengig av kvinnens alder, yngre kvinner vil ha større tilbøyelighet til å opprettholde menstruasjonen enn kvinner som er nær menopausen. Tamoxifen medfører en liten økt risiko for dyp venetrombose (DVT) og lungeemboli (LE). I tillegg er det en økt risiko for endometriecancer hos postmenopausale.
Spesielle forhold for pasienter med påvist lav ER-ekspresjon
ER/PR bør gjentas på operasjonspreparatet hvis ER 1-9% i preoperativ biopsi (og ellers ved enhver tvil om reseptoruttrykk). Ved konklusjon ER 1-9% bør det gjøres en individuell vurdering av grunnlag for endokrin behandling i samtale med pasient hvor både risiko, effekt og bivirkninger legges til grunn. Forventet nytteverdi av endokrin behandling ved meget lav ER ekspresjon er liten og sykdommen kan ofte ha karakteristika samsvarende med trippel negative (Dieci et al., 2021). Men det er nødvendig med en helhetsvurdering av alle tilgengelige biologiske karakteristika.
Anbefalinger postmenopausale kvinner:
Dersom det er aktuelt med adjuvant kjemoterapi, startes hormonbehandlingen opp etter at kjemoterapien er avsluttet. Evidensnivå A.
Det har i mange år vært internasjonal konsensus på at adjuvant endokrin behandling i de fleste tilfellene bør inkludere en aromatasehemmer (Burstein et al., 2019; Coates et al., 2015; Goldhirsch et al., 2009; Goldhirsch et al., 2013b; Goldhirsch et al., 2011; Goldhirsch et al., 2007). Resultatene fra BIG 1-98 studien gir grunnlag for å benytte aromatasehemmer og tamoxifen i sekvens eller å benytte aromatasehemmer i 5 år (Regan et al., 2011). Slik behandling sidestilles effektmessig. Vurderingen av hva som bør benyttes i det enkelte tilfelle, kan være avhengig av bivirkningssituasjon eller andre forhold.
Følgende behandlingsvalg er aktuelle for postmenopausale pasienter, hvor valget kan være avhengig av risikoprofil, tolerabilitet og komorbiditet:
- Aromatasehemmer i 5 år
- Tamoxifen i 5–10 år
- Tamoxifen i 5 år etterfulgt av AI i 5 år
- Tamoxifen i 2–3 år etterfulgt av AI i 5 år
- Kvinner som har intoleranse overfor tamoxifen eller AI, kan skifte over til det andre alternativet. Hvis en kvinne har mottatt AI for mindre enn 5 år (2-<5 år), kan det tilbys tamoxifen til pasienten har fått totalt 5 år med endokrin behandling.
- Aromatasehemmer i 7-8 år for høyrisikopasienter. Ved spesielt høy risiko og god tolerabilitet av aromatasehemmer og sterk hormonreseptorpositivitet kan det i enkelte tilfeller vurderes 10 års behandlingstid.
Anbefalte behandlingsvalg ved indikasjon for adjuvant endokrin behandling er følgende (Evidensnivå A):
- Aromatasehemmer i 5 år. Foreliggende data gir ikke generelt grunnlag for utvidet behandling etter 5 år med aromatasehemmer. Men pasienter med høy risikoprofil, sterk hormonreseptorpositivitet og god toleranse kan vurderes for videre aromatasehemmerbehandling i 2–5 år. Det foreligger studier som ikke viser forskjell i effekt mellom 7-8 års behandlingstid og 10 år.
- Aromatasehemmer i 2–3 år etterfulgt av tamoxifen i 2–3 år
- Der det er besluttet å oppstarte tamoxifen primært (av medisinske eller pasientrelaterte årsaker): Tamoxifen i 2–5 år etterfulgt av aromatasehemmer i 5 år hvor grunnlaget for endokrin behandlingstid ut over 5 år vil kunne påvirkes av tolerabilitet/sannsynlig absolutt nytteverdi.
- Der det er besluttet å oppstarte tamoxifen primært og aromatasehemmer ikke er ønsket benyttet: tamoxifen i 10 år hvor grunnlaget for endokrin behandlingstid ut over 5 år vil kunne påvirkes av tolerabilitet/sannsynlig absolutt nytteverdi.
- Der det er startet opp aromatasehemmer men det på grunn av medisinske eller pasientrelaterte årsaker er skiftet til tamoxifen før 2 års behandling med AI er gjennomført: tamoxifen til totalt 10 års endokrin behandlingstid, hvor grunnlaget for endokrin behandlingstid ut over 5 år vil kunne påvirkes av tolerabilitet/sannsynlig absolutt nytteverdi.
Oppstart av aromatasehemmer anbefales som første valg, hvor pasientpreferanse, risikovurdering og toleranse kan påvirke behandlingsvalget eller endringer underveis.
Calcium/VitD (1000 mg/800 IE daglig) skal i utgangspunktet gis til alle som står på AI (for eksempel Calcigran forte tyggetabletter).
- Som supplerende informasjon for behandlingsvalg henvises til teksten under 7.2. og tabellarisk oversikt fra St Gallen konsensus veiledning over adjuvant behandling av hormonreseptor positive HER2 negative under "Kjemoterapi" i kapittelet Adjuvant ikke-hormonell behandling
Tilleggsopplysninger:
- Kvinner som er disponert for DVT eller LE, bør få AI.
- Kvinner som får DVT eller LE under pågående tamoxifenbehandling, bør skifte over til AI.
- I tilfeller hvor det ikke er aktuelt å benytte aromatasehemmer i 2–3 år, er det grunnlag for å vurdere utvidet andjuvant behandling med tamoxifen i totalt 10 år
Aktuelle preparater er:
- Anastrozol 1 mg daglig
- Letrozol 2.5 mg daglig
- Exemestan 25 mg daglig
Det henvises for øvrig til Felleskatalogen for indikasjonsstilling og refusjonsregler for de enkelte AI.
De viktigste bivirkninger ved bruk av AI er stivhet og smerter i ledd/muskler, redusert bentetthet, tynne vaginale slimhinner og andre østrogenmangelsymptomer.
Det er publisert en metaanalyse som omhandler toksisitet ved aromatasehemmer sammenlignet med tamoxifen (Amir, Seruga, Niraula, Carlsson, & Ocana, 2011). Konklusjonen av studien er at bytting («switch») mellom aromatasehemmer og tamoxifen (2–3 år med hvert medikament) kan gi den beste balansen mellom effekt og toksisitet. Man skal være bevisst bruken av både aromatasehemmer og tamoxifen. Bivirkningsvurdering bør skje både i forkant av oppstart av behandlingen og i forløpet av behandlingen, slik at utformingen av den endokrine behandling tar hensyn til disse forhold.
Bentetthetsmåling
Dersom det ikke er indikasjon for adjuvant bisfosfonatbehandling (kapittel "Adjuvant ikke-hormonell behandling", avsnitt om "Spesifikk behandling for HER2-positive pasienter") og pasienten enten skal oppstarte aromatasehemmerbehandling eller er ung og planlegges behandlet med goserelin i kombinasjon med tamoxifen, bør det gjøres bentettshetsmåling (DEXA-scan). Dette gjentas etter 1 år og deretter hvert 2. år. Evidensnivå B. Dersom det er indikasjon for å gi zoledronsyre som adjuvant behandling, vil grunnlaget for å gjøre bentetthetsundersøkelser knyttet til overvåking av effekten av aromatasehemmer på ben falle bort. Ved indikasjon for bentetthetsmålinger uten bruk av bisfosfonat anbefales følgende:
- Osteoporose og meget uttalt osteopeni på et hvilket som helst tidspunkt under pågående antiøstrogen behandling tilsier bruk av bisfosfonat
- Lett til moderat osteopeni ved oppstart tilsier ny vurdering ved bentetthetsmåling om ett år. Ved fall i BMD på ≥10 % bør bisfosfonat oppstartes
Definisjon av postmenopausal status og anbefaling om monitorering av menopausal status under endokrin behandling
Definisjon av postmenopausal
- Pasienter med amenorre >1 år før diagnose og postmenopausal hormonstatus ved diagnosetidspunkt.
- Pasienter som har fjernet ovariene eller benytter LH/RH agonist med postmenopausale hormonverdier.
Situasjoner med usikkerhet vedr. menopausal status:
- Pasienter under 55 år (som var premenopausale før oppstart adjuvant behandling) som får tamoxifen i 2 år og ikke har hatt menstruasjon i denne perioden.
- Pasienter under 55 år (som var premenopausale før oppstart adjuvant behandling) som har amenorre og postmenopausale hormonverdier etter cellegiftbehandling.
- Pasienter under 55 år som har amenorre og som har inneliggende hormonspiral
- Der det er tvil om menopausal status i forbindelse med primærkirurgien og hvor adjuvant endokrin behandling er aktuelt i forløpet, bør det tas FSH/LH og østradiolmålinger ved 2 anledninger (hvis den første er inkonklusiv, helst med 14 dagers mellomrom) før adjuvant systemisk behandling startes. Dette vil sikre best mulig vurdering av menopausal status.
Monitorering av menopausal status under endokrin behandling:
Premenopausale pasienter (på diagnosetidspunktet) som blir postmenopausale i løpet av eller etter kjemoterapi eller som er yngre enn 55 år og blir postmenopausale under pågående tamoxifen og hvor det er aktuelt å gi aromatasehemmer bør følges med analyse av FSH/LH og østradiolnivå 2–3 ganger i løpet av de første 6 måneder. Det er rapportert at pasienter med kjemoterapiindusert amenorre kan få indusert ovarial østrogenproduksjon etter oppstart av AI, og risikoen for dette er høyest hos pasienter under 50 år (van Hellemond et al., 2017). Dette tilsier forsiktighet jo lavere alderen er, og gjør at gjentatt FSH/LH og østradiol analyser også bør vurderes i perioden mellom 6–12(24) måneder (van Hellemond et al., 2017). Der hvor det er tvil om sikker postmenopausal status, bør det gjøres sensitive østradiolanalyse (sendes til HUS). Dersom det tross slike analyser er tvil kan goserelin benyttes i tillegg til AI.
CYP2D6 analyse – til bruk for vurdering av tamoxifen?
Tamoxifen metaboliseres og dens aktive metabolitter dannes via CYP2D6 enzymene i lever, og det er stor variasjon i hvor langsomt eller hurtig denne metaboliseringen av tamoxifen skjer hos enkeltpasienter. Det har vært publisert studier som viser at grad av CYP2D6 metabolisering av tamoxifen kan ha klinisk betydning, mens andre studier ikke har vist noen slik klinisk relevans, og det er ikke anbefalt i dag, verken i Norge eller internasjonalt at man analyserer CYP2D6 m.t.p. å avklare om pasienter som skal ha tamoxifen er "slow" eller "fast metabolizer" (D. F. Hayes & Rae, 2020). Samtidig har der vært ulike metoder brukt for å vurdere CYP2D6 funksjon, og nå i 2020 er det publisert en konsensusrapport m.t.p. hvordan man skal analysere CYP2D6 for å vurdere om der foreligger langsom eller hurtig metabolisme i dette enzymet hos pasientene, hvilket forhåpentlig vil gjøre fortolkning av slike analyser lettere i fremtidige studier (Caudle et al., 2020). Videre har det blitt publisert 2 nye studier i JCO i 2020, der en retrospektiv analyse fra et svensk brystkreftregister viser dårligere overlevelse hos "slow metabolizers" og mer problemer med bivirkninger av tamoxifen hos "fast metabolizers" (He et al., 2020), mens der i en japansk, prospektiv og randomisert studie med 184 pasienter med metastatisk brystkreft ikke ble funnet noen effekt på progresjonsfri overlevelse om tamoxifen dosen ble doblet hos dem som var "slow metabolizers" (Tamura et al., 2020). Disse to artiklene omtales også i en editorial i JCO, der det igjen konkluderes med at CYP2D6 analyse ikke er anbefalt m.t.p. å styre tamoxifenbehandling i dag (D. F. Hayes & Rae, 2020).
Anbefaling:
Det foreligger ikke data som éntydig viser at CYP2D6 analyse kan brukes til å styre tamoxifenbehandling, og slike analyser anbefales derfor ikke utenfor kliniske studier. Dette er også i samsvar med anbefalingene fra ASCO og NCCN (D. F. Hayes & Rae, 2020).
Adjuvant behandling av DCIS
Det er tidligere rapportert effekter av adjuvant tamoxifen eller aromatasehemmere for rene DCIS tilfeller (referanse). Behandlingen har ikke fått generell gjennomslag som følge av at prognosen ved DCIS er meget god og betydning av bivirkninger har desto større betydning. Det er nylig poblisert oppdaterte 10-års resultater fra en studie av DCIS pasienter hvor tamoxifen 5 mg x 1 i 3 år er sammenlignet med observasjon (TAM-01). Det ble funnet en 50% reduksjon i lokale tilbakefall hos DCIS pasientene (HR 0.5 95% CI 0.28-0.91; p=0.02). Behandlingen var tolerert godt (ingen forskjeller i alvorlige hendelser), selv om det var observert noe mer menopausale symptomer i tamoxifenarmen (Lazzeroni et al., 2023). Behandlingen kan være aktuell for enkelte pasienter etter individuell vurdering.
Adjuvant ikke-hormonell behandling
Sist faglig oppdatert: 02202402.07.2024
Kjemoterapi
Det finnes en rekke kjemoterapiregimer i bruk ved adjuvant behandling. Bruk av kombinasjon av flere cytostatika er vist å være mer effektivt enn bruk av ett enkelt cytostatikum (Early Breast Cancer Trialists' Collaborative Group (EBCTCG), 2005). I litteraturen skilles det grovt mellom kurer som benytter kombinasjonen av cyclofosfamid (C), metotrexate (M) og fluorouracil (F)(CMF), antracyclin-holdige kurer (enten doxorubicin (A) eller epirubucin (E), i form av moderat doserte eller høyt doserte kurer (AC, FEC, FAC, EC) og kurer som inkluderer taxaner (paclitaxel eller docetaxel) enten samtidig med eller i sekvens med antracyclin-holdig kjemoterapi.
Det benyttes forskjellig dosenivå og også forskjellig behandlingslengde innenfor disse hovedgrupper. Sammenlignende studier av cirka 6 mnd behandling med antracyclin-holdig polykjemoterapi mot samme lengde CMF behandling viser en 16 % relativ reduksjon i risiko for død (Early Breast Cancer Trialists' Collaborative Group (EBCTCG), 2005). Adjuvant kjemoterapi i 3–6 mnd anses å være adekvat behandlingslengde, tilpasset risiko og biologiske egenskaper. Sett under ett antyder EBCTCG overview analysen hazard ratio for residiv og død for aldersgruppen ≥70 år i samme område som for 60–69 år (henholdsvis 0.87/0.88 for sykdomsfri overlevelse/død), men det er få pasienter som er inkludert i denne aldersgruppen og konfidensintervallene passerer 1.0 (Crivellari et al., 2007).
Pasienter over 70 år har ikke nødvendigvis en bedre prognose enn yngre eller en biologisk forskjellig tumor fra yngre (Bouchardy et al., 2007) og i denne aldersgruppen er det er klarest grunnlag for effekt av kjemoterapi for hormonreseptor (HR) negative pasienter og lymfeknutepositive pasienter (Crivellari et al., 2007; Muss et al., 2007). Antracyclin-holdige kurer med høyere epirubicindose eller mer dose-tett behandling (14 dagers intervall i stedet for 3 ukers intervall) gir bedret overlevelse i høyrisikogrupper (Bonneterre et al., 2005; Del Mastro et al., 2005; Thor et al., 1998; Trudeau et al., 2005; Venturini et al., 2005). Det rapporteres forskjellig nytte av intensivert kjemoterapi hos hormonreseptor positive og hormonreseptor negative pasienter.
Hormonreseptorpositive pasienter har lite eller usikker nytte av mer intensivert kjemoterapi mens hormonreseptor negative pasienter kan oppleve en betydelig bedring i prognosen (Berry et al., 2006; Venturini et al., 2005). En nylig EBCTCG metaanalyse har analysert spesielt effektene av antracyclin/taxan regimer sammenlignet med non-antracyklin regimer og konkluderer med at antracyclin/taxan regimer er mest effektive i å redusere tilbakefall og død av brystkreft, spesielt ved høyere kumulative doser (Early Breast Cancer Trialists’ Collaborative Group (EBCTCG), 2023).
En rekke kliniske studier har testet ut effekten av å legge til taxaner (paclitaxel og docetaxel) i adjuvant behandling, for det meste hos lymfeknute positive pasienter. En Cochrane review om taxaner i adjuvant (Ferguson, Wilcken, Vagg, Ghersi, & Nowak, 2007) konkluderte blant annet med følgende:
- 19 % relativ bedring i både sykdomsfri overlevelse og totaloverlevelse ved bruk av taxaner (median 5 års follow up).
- Ingen forskjell i effekter innen subgrupper, men ikke utført analyse mot hormonreseptorstatus og HER2 status.
- Ingen sikre opplysninger om optimal dosering eller «regime».
EBCTCG overview analysen fra 2012 viser en gjennomsnittlig 1/3 relativ reduksjon i død av brystkreft ved optimal bruk av dagens tilgjengelige kjemoterapi (Peto et al., 2012). Bruk av taxan i sekvens med antracyclinholdig kjemoterapi gir 14 % reduksjon i brystkreftdød (RR 0.86) sammenlignet med lavere doserte antracyclinhodlige regimer, mens det ikke er funnet signifikante forskjeller dersom det sammenlignes med non-taxan regimer (som inkluderer antracyclin) hvor det er benyttet like mange kurer som i taxan-armen (Peto et al., 2012).
BCIRG001 studien (TAC vs FAC) har vist effekter ved tillegg av docetaxel uavhengig av hormonreseptorstatus (Martin et al., 2005), noe som er videre rapportert om i en samleanalyse av PACS01 og BCIRG001 studien (Andre et al., 2008). Men der hvor det er utført analyser på subgruppenivå som inkluderer HER2 analyse/Ki67 i tillegg til hormonreseptorstatus, kan det oppsummeres følgende effekter av å legge til taxaner til antracyclinholdig kjemoterapi (D.F. Hayes et al., 2007; Hugh et al., 2009; Penault-Llorca et al., 2009):
- Bedret overlevelse
- for HR-negative pasienter
- for HER2-positive pasienter (grensesignifikant)
- for HR-positive pasienter med >14 % Ki67 positive celler (gjennomsnitt) (BCIRG001) eller ≥20 % Ki67 positive celler (gjennomsnitt) (PACS01) i tumor
- Ingen overlevelsesforskjell
- for HER2-negative ER positive pasienter med <14 % Ki67 positive celler (gjennomsnitt) (BCIRG001) eller ER positive pasienter med <20 % Ki67 positive celler (gjennomsnitt) (PACS01) i tumor
Det er internasjonal enighet om at indikasjon for bruk av kjemoterapi påvirkes av hvilken biologisk subtype av brystkreft som foreligger. En måte å klassifisere pasientene på er ved PAM50 molekylære genprofilering med følgende resultat :
- Luminal A lignende (sterkt HR positiv HER2 negativ med lav proliferasjon).
- Luminal B lignende (HR positiv HER2 positiv eller HR positiv HER2 negativ Ki67 høy/PgR neg/lav).
- Erb-B2 overexpression type (HER2 positive non luminal: HR negativ HER2 positiv).
- Basal like (Trippel negative: HR negativ HER2 negativ).
Betydningen av genekspresjonsprofiler i subklassifikasjon av brystkreft som grunnlag for adjuvant behandlingsbeslutning har blitt tydeligggjort i alle internasjonale anbefalinger. Likevel har St Gallen anbefalingene valgt å holde på en hovedinndeling av brystkreftsvulstene i tråd med uttrykk av hormonreseptor og HER2, hvor andre biomarkører, genprofiler, stadium og grad kan nyansere behandlingen innenfor hovedgruppene.
Følgende gjeldende anbefaling om bruk av adjuvant systemisk behandling er publisert fra siste St. Gallen konsensus 2023 (Curigliano et al., 2023):
Stage | Tumor subtype | ||
|---|---|---|---|
HER2 positive | TNBC | ||
Stage I Typically as adjuvant therapy | T1a | TH-case by case (with ET therapy if HR positive) | Chemo – case by case |
T1b | TH | TC or AC(EC chemo | |
T1c | TH | AC/T chemo | |
Stage II Neoadjuvant therapy preferred | AC/TH og THC, with addition of P If neoadjuvant and/or node-positive | AC/T chemoa (For cT2 cN0, consider addition of pembrolizumabb) | |
Stage III Neoadjuvant therapy preferred | AC/THP og TCHPc | AC/T chemoa and pembrolizumabd | |
Residual invasive cancer after neoadjuvant therapy | Trastuzumab emtansine (T-DM1) For 14 cycles | Capecitabine every 3 weeks for six or eight cycles if gBRACA1/2-wt Olaparib for 1 year if bBRACA1/2-mut Pembrolizumab for nine courses (if given in the neoadjuvant setting) | |
A, anthracycline such as doxorubicin or epirubicin; C, cyclophosphamide; ET, Endocrine therapy; H, trastuzumab; HER2, human epidermal growth factor reseptor 2; HR, hormonereeptoer; P, pertuzumab; T, taxane; TC, Docetaxel and cyclophosphamide; TNBC, triple-negative breast cancer.
a Some panelists favor inclusion of carboplatin in neoadjuvant therapy for TNBC, particularly if used in node-positive cancers and in conjunction with pembrolizumab-based treatment.
b In KEYNOTE-522, patients cT2 cN0 were eligible to pembrolizumab.
c Consider addition of adjuvant neratinib after trastuzumab if tumor is ER-positive and four or more positive LN; however, the panel noted there are no data for use in patients alsoreceiving pertuzumab or trastuzumabemtansine as is often standard for such patients.
d Consider adjuvant pembrolizumab regardless of extent of response
Gjengitt fra Curigliano et al., 2023. Med tillatelse fra Elsevier i 2024.
Anatomic stage | TN | Type and duration of endocine therapya | Ovarian suppression | Chemotherapyb/abemaciclib | Olaparib | |
|---|---|---|---|---|---|---|
Premenopausal | Postmenopausal | Premenopausal and postmenopausal
| ||||
Stage I | T1ab N0 | AI or Tam, 5 yearsc | No OFS
| No | No | No |
T1c N0 | AI og Tam, 5 years | Consider OFS and AI/Tam for higher risk, particularly those warranting chemotherapy, age <40 years, hight grade, or intermeiate genomic scores (e.g. recurrence score 16-25) | Consider no chemotherapy for favorable biology tumors especially if not pursuing OFSd
Yes for less favorable biology tumors | No for favorable biology tumorsd
Yes for less favorable biology tumors | No | |
Stage II | N0 (node negative) | Consider extended therapye, especially after initial 5 years of tamoxifen | OFS and AI/Tam for higher risk, particularly those warranting chemotherapy, age <40 years, high grade, or intermediate genomic scores (e.g. recurrence score 16-25) | Consider no chemotherapy for favorable biology tumors especially if not pursuing OFSd
Yes for less favorable biology tumors
| No for favorable biology tumorsd
Yes for less favorable biology tumors | No |
| N1 (1-3 LN)+ | Extended therapye | OFS and AI/Tam | Consider for favorable biology tumorsd
Yes for less favorable biology tumors Abemaciclib for 2 years | No for favorable biology tumorsd
Yes for less favorable biology tumors Abemaciclib for 2 years for high-risk stage II | Nof |
Stage III |
| Extended therapye | OFS and AI/Tam | Yes Abemaciclib for 2 years | Yes Abemaciclib for 2 years | Yes for patients with ≥ 4 pathologgically confirmed positive lymph nodes in the adjuvant setting Yes for patients ER and/or PgR-positive/HER2-negative with residual invasive cancer in the breast and/or the resected lymph nodes (non-pCR) and a CPS and EG score ≥ 3 |
AC, doxorubicin-cyclophosphamide; Al, aromatase inhibitor; CPS, clinical and pathological stage; EG, estrogen receptor status and histologic grade; ER, estrogen receptor; HER2, human epidermal growth factor receptor 2; LN, lymph node; OFS, ovarian function suppression; pCR, pathologic complete response; PgR, progesterone receptor; Tam, tamoxifen; TC, Docetaxel and cydophsphamide; TN, triple-negative.
a Historically, the St Gallen Panel has favored Al-based therapy in higher-risk tumors defined by T and N stage, grade, and Ki67 score.
bThe panel recommended anthracycline- and taxane-based adjuvant chemotherapy regimens for stage III, ER-positive tumors; for stage I or II presentations, the panel was divided between taxane-based regimens (e.g. TC, 44%), anthracydine-only regimens (e.g. AC, 14%), and anthracycline- and taxane-based regimens (42%).
c Minimal risk may be managed without adjuvant treatment.
d Risk stratification: 'Favorable biology': lower-risk genomic signature (e.g. recurrence score <25 (node-positive) or 16-25 (node-negative), or 70-gene signature 'low'); strongly ER positive with low to intermediate grade, and/or lower baseline Ki67, or decrease in Ki67 with preoperative exposure to endocrine therapy. 'Less favorable biology': higher-risk genomic signature (e.g. recurrence score >25 or 70-gene signature 'high'); lower ER expression, intermediate to high grade, and/or higher baseline Ki67, or lack of decline in Ki67 with preoperative exposure to endocrine therapy.
e Extended therapy implies 10 years of treatment though some studies indicate that 10 years may not offer benefit beyond that seen with 7.5-8 years of endocrine therapy. F
f In the original trial were eligible patients ER- and/or PgR-positive/HER2-negative with residual invasive cancer in the breast and/or the resected lymph nodes (non-pCR) and a CPS) and EG score >3. The CPS&EG score is a staging system for disease-specific survival in patients with breast cancer treated with neoadjuvant chemotherapy. This incorporates pretreatment clinical stage, ER status, nuclear grade, and post-neoadjuvant chemotherapy pathological stage.
Gjengitt fra Curigliano et al., 2023. Med tillatelse fra Elsevier i 2024.
I hovedtrekk følger handlingsprogrammet retningslinjene fra St. Gallen konsensus. Når det gjelder valg av kjemoterapiregime gjelder følgende utgangspunkt:
Resultater fra NSABP B-36 studien demonstrerte at AC60 x 4 (tilsvarer EC90 x 4) og FEC100 x 6 gav helt sammenlignbar sykdomsfri overlevelse hos pN0 pasienter (Samuel et al., 2014).
Som følge av disse resultatene og understøttende resultater fra andre studier og anbefalinger gis adjuvant kjemoterapi med følgende utgangspunkt:
- EC90 er standard for alle hvor det er indikasjon for bruk av antracyklinholdige adjuvant kjemoterapi. Behandlingen gis med G-CSF som primærprofylakse.
- Det anbefales 4 kurer som eneste kjemoterapi (EC90x4) eller 4 kurer (EC90 x 4) i sekvens med 12 ukers taxanbehandling
- taxan kan kombineres med carboplatin etterfulgt av EC90 (se punkt 7.6.3 for omtale og anbefaling)
Det er spesielt grunnlag for å legge til taxaner til pasienter med HER2 positive tumores, trippel negative, eller Luminal B tumores med høy proliferasjon/høy risiko ved genekspresjonsprofiltest eller ved stort tumorvolum (konferer over).
Det er foreløpig ingen sikker dokumentasjon for forskjell i effekt ved bruk av taxan i form av paklitaxel eller docetaxel, eller om dette skal gis i sekvens eller samtidig med antracyclin (M. J. Piccart et al., 2005). Men BIG 02–98 studien indikerer at sekvensiell behandling kan gi bedring i DFS sammenlignet med samtidig bruk (P. Francis et al., 2008).
Bruk av adjuvant TC i stedet for EC
I PlanB studien fra 2019 ble 6 TC (docetaxel 75 mg/m2 + cyclofosfamid 600 mg/m2 hver 3. uke (q3w) sammenlignet med 4 EC (epirubicin 90 mg/m2 + cyclofosfamid 600 mg/m2 q3w) etterfulgt av 4 docetaxel (100 mg/m2 q3w)(EC-T) (Nitz et al., 2019). Studien inkluderte HER2 negative pT1-pT4c pasienter med enten positiv lymfeknutestatus (42 % av pasientene) eller pN0 og én eller flere av følgende: pT≥2, grad 2–3, høy urokinase-type plasminogen activator/plasminogen activator inhibitor-1, HR negativ tumor, alder <35 år. Alle med HR+ sykdom ble analysert med Oncotype DX, og ved lav «recurrence score» (RS) og samtidig pN0-1 status fikk pasientene ingen kjemoterapi. Fem års sykdomsfri overlevelse (DFS) var 89.9 vs 89.6 % for TC vs. EC-T (non-inferiority), og 5-års totaloverlevelse (OS) var 94.7 vs. 94.5 %. Det ble totalt sett rapportert mer toksisitet for EC-T. Samsvarende resultater ble funnet i en nylig publisert studie av HER2 negative pasienter, hovedsakelig HR+ pasienter (92%) med lymfeknute-positiv status (59%) eller høy risiko lymfeknute-negativ status; det var ingen forskjell i overlevelse for 6TC sammenlignet med 4EC90 etterfulgt av 12 kurer ukentlig paklitaxel (Yu et al., 2021).
I USOR studien (n=1016, follow-up 7 år) som sammenlignet 4 TC vs. 4 AC (doxorubicin 60 mg/m2 + cyclofosfamid 600 mg/m2 q3w) for stadium I-III brystkreft, var det lik OS for de to behandlingsarmene, men noe bedre DFS for TC-regimet (7 års DFS 81 % vs 75 %) (Jones et al., 2006).
ABC metaanalysen (n=4200) viste bedre DFS, men lik OS, for behandlingsregimer som inkluderte både taxan og antracyklin versus 6 TC (J. L. Blum et al., 2017). Her ble 6 TC sammenlignet med 6 TAC kurer q3w (USOR 06-090/NSABP B-46), og med 4 AC q3w→ 12 ukentlige paclitaxelkurer, 4 AC q2w → 12 ukentlige paclitaxelkurer eller 4 AC q2w → 4 paclitaxel q2w(NSABP B-49). I den danske DBCG7-READ studien (n=2000, kun topoisomerase 2-normale) var der samme overlevelse med 6 TC som med 3 EC90 etterfulgt av 3 T (docetaxel 100 mg/m2) (Ejlertsen et al., 2017) – og dette er den eneste studien der total behandlingstid er lik for de to gruppene.
Vurdering av foreliggende data:
Det konkluderes med at TC x 4 er ekvipotent med EC90 x 4 for midlere risikogruppe.
I denne forbindelse oppfattes docetaxel 75 mg/m2 + cyclofosfamid 600 mg/m2 q3w som ekvipotent med paclitaxel 80 mg/m2 ukentlig + cyclofosfamid 600 mg/m2 q3w.
6 TC er sannsynligvis like effektivt som 4 EC90 etterfulgt av 4 docetaxel (PlanB studien og DBCG-07 READ studien (kun topoisomerase 2-normale)) eller 4 EC90 etterfulgt av 12 ukentlige paklitaxelkurer (Yu et al., 2021), men muligens inferior ved høy pN+ status basert på ABC metaanalysen og ved pN+ status i NSABP B-30 studien. Der er færre høyrisiko-pasienter i PlanB enn i NSABP B-30 studien. NSABP B-30 viser at AC-T (4+4 kurer sekvensielt) er bedre enn ACT 4 kurer (konkomitant) eller AT (=TC) 4 kurer (S. M. Swain et al., 2010) – men her fikk altså pasienter med AT 4 og ikke 6 kurer, samt at doxorubicindosen var lavere enn ved AC-T. I NSABP-30 hadde alle pasientene N+ sykdom, 42 % var pT1, og 25 % HR negative. I PlanB hadde 58 % N0 sykdom, 57 % pT1, 18 % HR negative. NSABP B-30 studien ligger som del av grunnlaget for bruk av EC-T hos pasienter med lymfeknute-positiv sykdom i norske guidelines.
Ut fra de foreliggende studier kan vi ikke med sikkerhet si at 6 TC er like effektivt som EC-T (4+4) for pasienter med høyest risikoprofil. Likevel, i PlanB studien var der ingen subgrupper, inkludert dem med lymfeknute positiv sykdom, som kom dårligere ut med TC enn EC-T. En nylig publisert sammenstillingsstudie av PlanB og SUCCESS C viste ingen forskjell i sykdomsfri eller totaloverlevelse mellom 6TC og AC-T, men på subgruppenivå var sykdomsfri overlevelse markant bedre med AC-T for pasienter med lobulær brystkreft med pN2-3 lymfeknutestatus (de Gregorio et al., 2022).
Det konkluderes med at TC-regimet (6 TC) oppfattes som et akseptabelt alternativ til EC-Docetaxel (4+4) eller EC-paklitaxel ukentlig (4 EC + 12 uker paclitaxel), især for dem med kardiale risikofaktorer som gjør at man vil unngå antracyclin. Pasienter med lobulær brystkreft som har pN2-3 axillær status bør primært motta antracyklinholdig regime hvis ingen kontraindikasjoner.
Videre er der en økende dokumentasjon som viser at adjuvant antracyclin behandling senere i livet gir økt risk for hjerteproblemer (Banke et al., 2018; D. Slamon et al., 2011).
Anbefalinger - kjemoterapi
Basert på en helhetsvurdering av de tilgjengelige adjuvante kjemoterapistudier og den voksende molekylærgenetiske kunnskap anbefales at indikasjon for kjemoterapi og valg av type kjemoterapi bør besluttes ut i fra vurdering av subtype/risikoprofil av brystkreftsvulsten, i tråd med anbefalingene fra St Gallen (Curigliano et al., 2023), som inkluderer vurdering av histologisk grad, genekspresjonsprofil/proliferasjonsgrad og pTpN stadium. Genekspresjonsprofiler gir informasjon om undergrupper av spesielt hormonreseptor positive og lymfeknutenegative pasienter, hvor prognosen er så god at nytten av kjemoterapi må anses å være meget liten/begrenset ADDIN EN.CITE.DATA (Albain et al., 2010; Cardoso et al., 2016; Dowsett et al., 2013; Filipits et al., 2014; Gluz et al., 2016; Gnant et al., 2015; Lænkholm et al., 2018; Paik et al., 2006; Sestak et al., 2013; Sparano et al., 2015). Det anbefales primært å benytte genekspresjonsanalyse som grunnlag for å vurdere bruk av kjemoterapi for pasienter med HR+HER2- pT1-2pN0 status da slike tester gir sikrest prognostisk (og prediktiv) informasjon med lav interlaboratorievariabilitet.
Både St.Gallen 2021 (Burstein et al., 2021a), ASCO guidelines (Andre et al., 2022) og International Ki67 working group in breast cancer (Nielsen et al., 2021) konkluderer med at Ki67 verdier ved gjennomsnittsmåling mellom 5-30% ikke er egnet for vurderinger vedrørende adjuvant behandlingsbeslutning basert på manglende samsvar. I de internasjonale anbefalingene anbefales bruk av genekspresjonssignaturer dersom tilgjengelig.
Anbefalinger:
Adjuvant behandling anbefales i tråd med de tabellariske oversiktene under pkt. "Oversikt over anbefalt adjuvant behandling" (konferer også fotnotene i tabellene for ytterligere bakgrunn for anbefalingene)
Ved HER2 negativ status og lavere risikoprofil anbefales 4 EC90 kurer eller 4 TC kurer. Ved høyere risikoprofil anbefales 4 EC90 kurer etterfulgt av 12 ukers taxanbehandling. Et akseptabelt alternativ til denne behandling er 6 TC, spesielt for pasienter med kardiale risikofaktorer som gjør at man vil unngå antracyclin.
Ved HER2 positiv status anbefales 4 EC90 kurer etterfulgt av 12 ukers taxanbehandling i kombinasjon med trastuzumab for pasienter med pN0 status, og trastuzumab/pertuzumab for pasienter med pN1 status. Men HER2 positive pasienter med lavest utgangsrisiko, stadium pT1pN0, behandles med 12 ukers taxanbehandling i kombinasjon med trastuzumab. Etter avsluttet kjemoterapi gis videre HER2-rettet antistoffbehandling til totalt 1 års behandlingstid. Se under, avsnitt "Spesifikk behandling for HER2-positive pasienter".
Betraktninger knyttet til vurdering av risikoprofil/suptyper i beslutningsgrunnlaget for bruk av kjemoterapi ved HR+HER2- pN0 brystkreft (se tabellarisk oversikt for komplett oversikt):
Alle pasienter operert for HR+ HER2- pN0 sykdom bør gjennomføre genekspresjonstest (Prosigna test) for optimalt valg av adjuvant behandling. Genekspresjonstester har vist meget god dokumentasjon for prognostisk informasjon ut over tradisjonelle histopatologiske analyser og kan bidra til beslutning om kjemoterapi og også om endokrin behandling bør benyttes, innenfor selekterte pasientgrupper. Testene er nyttige verktøy for å skille ut pasienter med høy og lav risiko for residiv hos pasienter med ER+HER2- status, samt for å skille mellom Luminal A og Luminal B. Det anbefales at man primært benytter Prosigna test, da denne testen kan analyseres på laboratorier i Norge. Ytterligere spesifisering av anbefalinger om bruk av Prosigna test avventes resultater fra EMIT1 studien. Ki67 analyse er ikke nødvendig når genekspresjonsanalyse gjennomføres.
Pasienter med pT1pN1(mi): I denne lille gruppen av pasienter som prognostisk er i en gråsone mellom pN0 og pN1 vil Prosigna test sannsynligvis også kunne gi informasjon av betydning for adjuvant behandlingsbeslutning og hvor det ikke forventes avklarende resultater fra studier. Behandlingsbeslutningsalgoritme som er benyttet i EMIT1 studien kan derfor benyttes (se senere).
Dersom genekspresjonstest ikke er tilgjengelig, kan Ki67 proliferasjonsindeks (analysert i henhold til internasjonale og nasjonale anbefalinger), i tillegg til histologisk grad, bidra til å skille ut pasienter som har Luminal A lignede og Luminal B lignende subtyper av brystkreft med følgende presisering: I hehold til internasjonale anbefalinger bør ikke Ki67 verdier mellom 5% og 30% (ved bruk av gjennomsnittsmåling, hot spot verdier vil ligge min. cirka 5 prosentenheter over) benyttes til beslutning om bruk av kjemoterapi, kun hvis verdiene er under eller over dette området. I de tilfeller hvor endokrin behandling uansett vil anbefales og det uansett ikke er aktuelt å benytte kjemoterapi, kan grunnlaget for å gjennomføre genekspresjonstest bortfalle. Hos pasienter som har spesielt små svulster er nytten av genekspresjonstest som grunnlag for vurdering av bruk av kjemoterapi usikker. Men når anbefalingene uten Prosignatest er at det ikke er grunnlag for verken endokrin behandling eller kjemoterapi, vil Prosignatest kunne identifisere pasienter med høyere residivrisiko som kan ha betydning for adjuvant behandlingsvalg.
Høy risikoprofil ut i fra genekspresjonstest eller grad 3 og høy Ki67 taler for høyere residivrisiko og dermed potensielt større nytte av intensivert kjemoterapi i form av 4 EC90 kurer etterfulgt av 12 ukers taxanbehandling.
Konferer punkt "Alternative adjuvante behandlingsregimer" for oversikt over alternative adjuvante behandlingsregimer.
Ved indikasjon bør i utgangspunktet den skisserte adjuvante kjemoterapi gis opp til minimum 75 års alder. Men det anbefales ikke å benytte høy alder alene som grunn for å utelate bruk av kjemoterapi (Biganzoli et al., 2012). Dette gjelder spesielt for trippel negative og HER2 positive. Ved alder over 70–75 år må behandling med kjemoterapi vurderes nøye i forhold til komorbiditet og leveutsikter – og individuell tilpasning av behandlingsopplegget kan være nødvendig. Det anbefales spesiell årvåkenhet for eventuell cardiovasculær morbiditet. MUGA eller EKKO bør benyttes på liberal indikasjon.
Spesifikk behandling for HER2-positive pasienter
Pasienter med tumores med HER2 amplifikasjon/overekspresjon (dvs pasienter med IHC 3+ eller FISH-positive) har et mer aggressivt sykdomsforløp (Slamon et al., 1987; Slamon et al., 1989). Adjuvant behandling med trastuzumab (humaniserte monoklonalt antistoff mot HER2) har endret prognosen for denne gruppen (Perez et al., 2014; Perez et al., 2011; Piccart-Gebhart et al., 2005; Romond et al., 2005; Slamon et al., 2011). Studiene har vurdert effekten av trastuzumab benyttet i totalt ett år, oppstartet enten i kombinasjon med taxanbasert behandling (NCCTCG-N9831/NSABP B31/BCIRG 006) eller etter avsluttet kjemoterapi (HERA/BIG01–01 studien). De viser en betydelig bedret totaloverlevelse, sykdomsfri overlevelse og overlevelse uten fjernspredning hos pasienter som fikk trastuzumab i kombinasjon med kjemoterapi versus de som fikk kjemoterapi alene (Johansen et al., 2006).
Dette bekreftes i en nylig publisert metananalyse fra EBCTCG (Early Breast Cancer Trialists’ Collaborative group (EBCTCG), 2021). Alle studiene bortsett fra BCIRG 006 studien inkluderte antracyklinholdig kjemoterapi som del av behandlingen i alle behandlingsarmene. Studiene som har kombinert bruk av taxan og trastuzumab har de største reduksjoner i hazard ratio (HR 0.60–0.64) (Perez et al., 2014; Perez et al., 2011; Piccart-Gebhart et al., 2005; Romond et al., 2005; Slamon et al., 2011). I HERA studien ble også 2 års behandling med trastuzumab testet, men viste ingen ytterligere effekt ut over trastuzumab i 1 år (Goldhirsch et al., 2013a). Trastuzumab var assosiert med en økt forekomst av alvorlige kardiovaskulære hendelser (0.5–4 % versus 0–1.0 % i kontrollgruppen). Det er kjent at behandlingen kan gi asymptomatisk nedgang i hjertefunksjonen, som ved god overvåking kan føre til normalisering ved tidlig seponering av medikamentet.
En annen studie testet 6 mnd behandling med trastuzumab mot 12 mnd, og fant at 6 mnd behandling var inferiort (Pivot et al., 2013). FINHER studien rapporterte at 9 ukers trastuzumab-behandling kombinert med kjemoterapi også ga en reduksjon i risiko for tilbakefall, men dokumentasjonen er svak og må ansees klart inferior, sammenlignet med dokumentasjon for ett års trastuzumab-behandling (Joensuu et al., 2009; Joensuu et al., 2006). Senere har SOLD studien ikke vist «non-inferiority» ved 9 ukers behandlingslengde versus 12 mnd (bedre overlevelse med 12 mnd behandling) (Joensuu et al., 2018). Helt nylig viste resultater fra ShortHER studien publisert med samme behandlingslengde som SOLD, at 9 ukers behandlingstid ikke var «non-inferior». Men resultatene indikerte at forskjellen var liten for pasienter med pN0 og pN1 (Conte et al., 2023).
Persephone studien ble presentert på ASCO 2018 og viste «non-inferiority» for 6 måneders behandling versus 12 måneders behandling. Men i denne studien var det bedre effekt av 12 måneders behandling enn 6 måneder dersom man gav behandling i tråd med nasjonale retningslinjer (EC/AC etterfulgt av taxan i kombinasjon med trastuzumab) (Earl et al., 2019). Ut i fra alle de foreliggende resultater anses 12 måneders trastuzumab behandling å være standard. Men hvis det på grunn av morbiditet/intolerabilitet er grunnlag for å avslutte trastuzumab tidligere, vil en slik behandling oppfattes som tilnærmet adekvat, da den største effekten av behandlingen vil komme som følge av de første 9–26 uker av trasuzumab behandlingen.
Kombinasjon av trastuzumab og pertuzumab (dobbel HER2-blokade) ble testet i Aphinity studien. Primæranalysen fra studien viste signifikant forbedret invasiv DFS (IDFS) ved tillegg av både pertuzumab og trastuzumab til adjuvant kjemoterapi hos pasienter med HER2 positiv brystkreft. Overlevelsesgevinsten var liten for hele pasientpopulasjonen, men signifikant bedre for subgruppen av pasienter med lymfeknutepositiv brystkreft (von Minckwitz et al., 2017). Oppdaterte resultater etter henholdsvis 6 år og 8 år viste henholdsvis 4.5 % og 4.9% bedring i IDFS hos lymfeknute positive pasienter, mens effekten ikke er til stede for lymfeknute negative (Loibl et al., 2022a; Piccart et al., 2021a). St. Gallen konsensus 2019 anbefalte at pertuzumab/trastuzumab brukes sammen med taxan cellegift ved adjuvant/neoadjuvant behandling av stadium 2 brystkreft med lymfeknutemetastaser eller ved stadium 3 (Burstein et al., 2019). ASCO guideline oppdaterting fra 2018 inkluderer også bruk av pertuzumab/trastuzumab sammen med cellegift for HER2 positiv brystkreft (Denduluri et al., 2018).
I en enarmet studie av pN0 pasienter med HER2 positiv brystkreft med tumorstørrelse opp til 3 cm hvor pasientene mottok kun paclitaxel i 12 uker i kombinasjon med trastuzumab etterfulgt av trastuzumab monoterapi til totalt 1 års behandlingstid, ble det observert kun 1.5 % lokoregionale residiv, metastaser eller død av brystkreft etter 4 års median observasjonstid (Tolaney et al., 2015). Oppdaterte resultater fra studien (hvor 42 % av pasientene hadde pT1c tumores) viste 7 års sykdomsfri overlevelse (DFS) på 93% (95% CI, 90.4 to 96.2)(kun 1% med metastaser) (Tolaney et al., 2019). Avsluttende 10-års oppfølgingsdata fra studien viste DFS 91.3%, «recurrence free interval»(RFI) 94.3%, totaloverlevelse 94.3% (Tolaney et al., 2023). Studien er også basis for at St Gallen Consensus åpner for at antracyklin kan utelates hos pT1pN0 pasienter (Burstein et al., 2019; Coates et al., 2015; Curigliano et al., 2017). P
å grunn av den meget gode prognose ved kun bruk av paklitaxel i kombinasjon med trastuzumab anbefales bruk av paklitaxel/trastuzumab (uten EC90) for pasienter med pT1pN0 status. Samtidig åpnes det for at docetaxel (hver 3. uke) kan benyttes som alternativ til paklitaxel ukentlig. ATEMPT studien testet T-DM1 som alternativ til paklitaxel/trastuzumab til stadium 1 pasienter. Etter 3.9 års median FU var invasiv DFS 97.8% (95% CI, 96.3 to 99.3) (Tolaney et al., 2021). Resultatene viser meget god prognose, men observasjonstiden er ennå relativt kort. Det var ingen generell reduksjon i toksisitet mellom T-DM1 og TH armen i studien, men det ble observert redusert nevropatifrekvens (11% vs 23%), som kan ha klinisk betydning i behandlingen av enkelte pasienter på individuelt grunnlag.
I WSG-ADAPT-TP studien ble det funnet at deskalering av neoadjuvant behandling med T-DM1 uten preoperativ klassisk kjemoterapi ga utmerket overlevelse uten ytterligere adjuvant kjemoterapi, dersom det ble opnådd pCR (Harbeck et al., 2023a). Resultatene viser at slike deeskaleringsstrategier kan være av klinisk betydning.
I en åpen randomisert studie av pasienter mellom 70-80 år (n=275) ble det ikke funnet non-inferiority ved bruk av trastuzumab monoterapi sammenlignet med kjemoterapi+trastuzumab (Sawaki et al., 2020). Men det var liten forskjell mellom behandlingsarmene de første 3-5 år. Dette gir støtte for å kunne vurdere anti-HER2-rettet behandling som monoterapi (evt i kombinasjon med endokrin behandling), vurdert ut fra risikoprofil (og forventede leveutsikter).
Anbefaling:
- Adjuvant behandling av HER2 positiv brystkreft anbefales i tråd med de tabellariske oversiktene under pkt. "Oversikt over anbefalt adjuvant behandling", med følgende hovedprinsipper (Evidensnivå A):
- Lymfeknute negative pasienter som har tumorstørrelse over 2 cm anbefales EC90 x 4 (antracyklinholdig kjemoterapi) etterfulgt av 12 ukers behandling med paklitaxcel (ukentlig) eller docetaxel (q3w) i kombinasjon med trastuzumab (q3w) etterfulgt av videre behandling med trastuzumab (q3w) til totalt 17 kurer. Hos lymfeknute negative pasienter med tumorstørrelse ≤ 2 cm anbefales å utelate antracyklinholdig kjemoterapi. Pasienter med lymfeknute positiv sykdom bør få pertuzumab i tillegg til trastuzumab. For pasienter som kun har mikrometastaser er gevinsten av pertuzumab mindre og vurderes individuelt.
- Trastuzumab kan gis i.v. eller s.c., hver 3. uke i 12 måneder. Subcutan administrasjon: 600 mg fiksert dose. Intravenøs administrasjon: 8 mg/kg loading dose etterfulgt av 6 mg/kg vedlikeholdsdose.
- Pertuzumab kan gis i.v. eller s.c. hver 3. uke i 12 måneder. Subcutan administrasjon: 1200 mg loading dose etterfulgt av 600 mg vedlikeholdsdose (sammen med s.c. trastuzumab som Phesgo). Intravenøs administrasjon: 840 mg loading dose, etterfulgt av 420 mg vedlikeholdsdose.
- Konferer punkt "Alternative adjuvante behandlingsregimer". for oversikt over alternative adjuvante behandlingsregimer.
- Hvis kjemoterapi ikke kan gis som følge av komorbiditet/toksisitet/andre årsaker (spesielt hos eldre pasienter) samtidig som HER2-rettet behandling kan tolereres, bør bruk av anti-HER2-behandling som monoterapi (eller i kombinasjon med endokrin behandling hvis indikasjon) vurderes ut fra risikoprofil (og forventede leveutsikter).
Som følge av at pertuzumab benyttes for stadium 2 pasienter med lymfeknutemetastaser og for lokalavanserte, har vi ikke dokumentasjonsgrunnlag for å anbefale neratinib etter avsluttet trastuzumab/pertuzumab. I ExteNet studien som viste effekt av neratinib etter trastuzumab, ble det kun påvist forskjell i sykdomsfri overlevelse hos hormonreseptor positive pasienter (Martin et al., 2017). Det var kun 24 % av pasientene i studien som var lymfeknute negative, men for denne gruppen var det ingen sikker forskjell i sykdomsfri overlevelse (HR 0.83 (95 % CI 0.41-1.65)). Grunnlaget for bruk av neratinib kan således kun være for HR+HER2+ pN+ pasienter som ikke tolererer pertuzumab. Beslutningsforum godkjente ikke bruk av neratinib som forlenget adjuvant behandling etter avsluttet trastuzumab behandling av hormonreseptor positive pasienter (juni 2020).
Bruk av bisfosfonat
Det er publisert/presentert data fra flere studier som har funnet gunstige effekter av å benytte spesielt zoledronsyre som del av adjuvant behandling ved brystkreft dersom det foreligger postmenopausal status. Alle, bortsett fra en studie (E-ZO-FAST), viser dette (Brufsky et al., 2012; Coleman et al., 2011; de Boer et al., 2011; Eidtmann et al., 2010; Gnant et al., 2011a; Möbus et al., 2011; Paterson et al., 2011).
Gnant et al (ABCSG12) fant både bedret DFS og OS for premenopausale pasienter som kun fikk adjuvant endokrin behandling (ingen kjemoterapi, god prognosegruppe), men hvor denne behandlingen inkluderte både goserelin og enten tamoxifen eller anastrozole (Gnant et al., 2009; Gnant et al., 2011b). Azure studien, som også inkluderte bruk av kjemoterapi til de fleste av pasientene, samt endokrin behandling til alle de ER positive (cirka 80 %), viste ingen effekt av zoledronsyre dersom alle pasientene ble analysert (Coleman et al., 2011). På ASCO2012 ble det presentert ytterligere resultater fra denne studien, som viste at sikkert postmenopausale pasienter (definert i studien som 5 år uten menstruasjon) hadde signifikant nytte av zoledronsyre, dette gjelder både for invasiv DFS (HR 0.75) og OS (HR 0.76).
Derimot var det ugunstige effekter av å benytte zoledronsyre på pre/perimenopausale pasienter. Dette var som følge av økt risiko for ekstraossøse metastaser hos premenopausale (HR 1.32). Hos postmenopausale beskyttet zoledronsyre for slike metastaser (HR 0.70). Det synes ikke å være noen forskjell mellom post- og premenopausale pasienter i effektene av zoledronsyre på å hindre benmetastaser. To metaanalyser av effektene av zoledronsyre/bisfosfonater har vist at zoledronsyre reduserte risikoen tilbakefall med 19–24 % hos postmenopausale pasienter (Gregory et al., 2012; Vidal et al., 2012). Resultatene fra disse studiene kan ikke overføres til mannlige brystkreftpasienter.
Det er benyttet forskjellige doseringer i en del av studiene. I SUCCESS A studien ble zoledronsyre hver 3. mnd i 2 år sammenlignet med hver 6. mnd i 5 år (Friedl et al., 2021) . Studien viste ingen forskjell i DFS eller OS mellom behandlingsarmene. Både 2 års behandling hver 3. mnd og 5 års behandling hver 6. mnd anses som likeverdige alternativer (Eisen et al., 2022) . Behandlingen kan starte opp under adjuvant kjemoterapi. Dersom 2 års behandlingstid benyttes bør pasientene som 1) er unge og indusert postmenopausale eller 2) er postmenopausale >50 år og benytter aromatasehemmer, følges med bentetthetsmåling hvert 2. år så lenge adjuvant endokrin behandling benyttes (med baseline undersøkelse innen ca. 6 mnd etter siste infusjon med zometa).
Nytten av å benytte denosumab som adjuvant behandling er ikke entydig dokumentert og anbefales ikke som alternativ ttil adjuvant bisfosfonat (Coleman et al., 2020; Gnant et al., 2022b)
Anbefalinger:
- For postmenopausale kvinnelige pasienter foreligger det nå god samlet dokumentasjon for at zoledronsyre gir adjuvante tilleggseffekter. Denne gruppen får også regelmessig aromatasehemmere, som gir negativ effekt på bentetthet. Det anbefales derfor:
- Zoledronsyre 4 mg. i.v. hver 6. måned i 5 år eller hver 3. måned i 2 år hos spontant eller indusert postmenopausale kvinnelige pasienter (uavhengig av alder) hvor det er indikasjon for systemisk adjuvant behandling. Behandlingen gjennomføres i regi av onkolog ved de avdelinger som gir adjuvant kjemoterapi. Tidspunktet for oppstart av zoledronsyre ved primært operabel brystkreft: innen 6 måneder etter operasjon (pragmatisk oppstartstidspunkt). Det anbefales ikke en absolutt aldersgrense for bruk av zoledronsyre, men bør i utgangspunktet gis opp til minimum 75 års alder. Ved alder over 70–75 år må det vurderes helhetlig nytte ut i fra komorbiditet og forventede leveutsikter.
Man må ha lav terskel for sensitiv hormonanalyse (østradiolanalyse), hvis det foreligger tvil om menopausal status. I tråd med retningslinjer godkjent av NBCG og Tannlegeforeningen (se Informasjon om tann- og kjeveproblemer og bisfosfonatbehandling (nbcg.no, pdf)) skal det gjøres målrettet tannlegeundersøkelse med problemstilling «undersøkelse før oppstart av bisfosfonat», før zoledronsyre oppstartes. Dersom det foreligger aktive tannproblemer eller det er planlagt tannkirurgi bør ikke zoledronsyre gis før behandlingen er avsluttet. Denne behandlingen sikrer optimal benhelse og bidrar til redusert tilbakefallshyppighet. Pasienter som mottar zoledronsyre som del av adjuvant behandling trenger ikke å gjøre rutinemessige bentetthetsundersøkelser. Blodprøver anbefales minst 1 gang i året. Det anbefales ikke å gi zoledronsyre hvis kreatininverdien er over 1.5 ganger øvre normalverdi (Coleman et al., 2011).
Oversikt over anbefalt adjuvant behandling
Sist faglig oppdatert: 02202402.07.2024
Basert på overstående gjennomgang anbefales adjuvant systemisk behandling i tråd med figuren under og nærmere spesifikasjoner i de følgende tabellariske oversikter (kfr også spesifikasjoner/kommentarer) delt opp etter om genekspresjonstest er utført eller ikke:

Anbefalinger for primæropererte pasienter med HR+HER2- pT1-2pN0 status hvor svar på anbefalt genekspresjonstest (Prosigna) foreligger
Hoved-gruppe | Prosignatest* | Ytterligere subgruppering | Generell terapianbefaling** | Grunnlag for eventuell vurdering av annet terapivalg (eskalering eller de-eskalering)** |
|---|---|---|---|---|
HR+ HER2- | Luminal A ROR low (0–40) | pT1a-b | Ingen behandling |
|
pT1c | Grad 1: Grad 2- 3: |
| ||
pT2 | Endokrin behandling Zoledronsyre ved postmenopausal status |
| ||
Luminal A** ROR intermediate (41–60) | pT1a-b | Ingen behandling |
| |
pT1c | Endokrin behandling Zoledronsyre ved postmenopausal status |
| ||
pT2 | Premenopausal: EC90 x 4 eller TC x 4 etterfulgt av endokrin behandling. Endokrin behandling som inkluderer goserelin kan vurderes som alternativ til kjemoterapi.*** Postmenopausal: Endokrin beh og zoledronsyre |
| ||
Luminal B** ROR intermediate (41–60) | pT1a-b | ER≥50 %: Endokrin behandling ER<50 %: Vurder EC90 x 4 eller TC x 4 → endokrin behandling Zoledronsyre ved postmenopausal status |
| |
pT1c | ER≥50 %: Premenopausal: EC90 x 4 eller TC x 4 etterfulgt av endokrin behandling. Endokrin behandling som inkluderer goserelin kan vurderes som alternativ til kjemoterapi.*** Postmenopausal: Endokrin behandling og zoledronsyre ER<50 %: EC90 x 4 eller TC x 4 → endokrin behandling Zoledronsyre ved postmenopausal status |
| ||
pT2 | ER≥50 %: EC90 x 4 eller TC x 4 → endokrin behandling ER<50 %: EC90 x 4 → taxan → endokrin behandling Zoledronsyre ved postmenopausal status |
| ||
ROR high (>60) | pT1a-b | ER≥50 %: Endokrin behandling ER<50 %: EC90 x 4 eller TC x 4 → endokrin behandling Zoledronsyre ved postmenopausal status |
| |
pT1c | EC90 x 4 → taxan → endokrin behandling Zoledronsyre ved postmenopausal status |
| ||
pT2 | EC90 x 4 → taxan → endokrin behandling Zoledronsyre ved postmenopausal status |
|
* I noen få tilfeller vil molekylær subtype for HR+HER2- svulster være «Basal»- eller «HER2-enriched», adjuvant behandling vil da følge ROR score og Luminal B subtype.
** Alder og absolutt ER ekspresjonsnivå kan gi grunnlag for individuell vurdering av behandlingsvalg. Dersom absolutt ROR score er meget nær cut-off verdier
for ROR risk klassifiseringen (low/intermediate/high) kan det gi grunnlag for individuell vurdering av behandlingsvalg.
*** Beslutningsgrunnlaget vedrørende endokrin behandling som alternativ til kjemoterapi er indirekte, og sikker kunnskap om dette alternativet for premenopausale pasienter er enda ikke tilgjengelig
Anbefalinger for pasienter hvor det ikke er indikasjon for genekspresjonstest eller det ikke foreligger
Hoved-gruppe | Subgruppering ved undersøkelser av tumor | Ytterligere subgruppering | Generell terapi-anbefaling | Grunnlag for annet terapi-valg |
|---|---|---|---|---|
HR+ HER2-
| Lum A-liknende*
*Følgende karakteristika: | pT1a-b pN0 | Ingen behandling |
|
pT1c pN0 grad 1 | Ingen behandling |
| ||
pT1c grad 2 pN0 | Endokrin behandling |
| ||
pT2pN0 Grad 2
| Premenopausal: EC90 x 4 eller TC x 4 etterfulgt av endokrin behandling. Endokrin behandling som inkluderer goserelin kan vurderes som alternativ til kjemoterapi. Postmenopausal: Endokrin behandling og zoledronsyre |
| ||
pT1-2pN1 | Premenopausal: EC90 x 4 eller TC x 4 etterfulgt av endokrin behandling. Postmenopausal: Endokrin behandling og zoledronsyre | Premenopausale: Hvis ikke kjemoterapi benyttes bør endokrin behandling inkludere goserelin (ut i fra vurdering av tumorstørrelse, omfang av lymfeknutemetastaser og grad). Postmenopausale: Tumorstørrelse og omfang av lymfeknutemetastaser kan gi grunnlag for kjemoterapi (EC90 x 4, alternativt TC x 4) | ||
pN2-3 | EC90 x 4 eller TC x 4 | Spesielt omfattende lymfeknutemetastasering sykdom kan gi grunnlag for å gi EC90 x 4 ® taxan | ||
LumB-liknende*
*Følgende karakteristika: 1) Ki67>35% eller 2) Grad 3 og sam- svarende høy Ki67 eller 3)HR<50% | pT1a-b pN0 | Endokrin behandling | Lav HR positivitet eller høyere proliferasjongrad kan gi grunnlag for kjemoterapi (EC90 x 4 eller TC x 4) Individuell vurdering av grunnlag for systembehandling kan gjøres ved små pT1apN0 tumores | |
pT1c-pT2 pN0 pT1-2pN1-3 | EC90 x 4 eller TC x 4 | Høyere proliferasjongrad og/eller mange lymfeknutemetastaser kan gi grunnlag for å gi EC90 x 4 ® taxan (alternativt TC x 6 dersom ikke beh.plan er lagt som følge av mange lymfeknutemetastaser) | ||
Ikke konklusiv Luminal gruppe (ikke passende i de luminale grupper over)
| pN0 | Generell anbefaling om behandlingsvalg ikke mulig uten geneksprepsjonsanalyse |
| |
pN1-3 | EC90 x 4 eller TC x 4 Ved postmenopausal status alternativt endokrin behandling ved pN1 eller individuell vurdering Zoledronsyre ved postmenopausal status |
| ||
HR+ HER2+ |
| pT1pN0 | Taxan/trastuzumab Zoledronsyre ved postmenopausal status | Individuell vurdering av grunnlag for systembehandling kan gjøres ved små pT1apN0 tumores Spesielt høy risikoprofil kan gi grunnlag for EC90 x 4 ® taxan/trastuzumab |
pT2pN0 | EC90 x 4 ® taxan/trastuzumab Zoledronsyre ved postmenopausal status
|
| ||
pT1-2pN1-3 | EC90 x 4 ® taxan/trastuzumab/pertuzumab Zoledronsyre ved postmenopausal status |
| ||
HR- HER2+ |
| pT1pN0 | Taxan/trastuzumab Zoledronsyre ved postmenopausal status | Individuell vurdering av grunnlag for systembehandling kan gjøres ved små pT1apN0 tumores Spesielt høy risikoprofil kan gi grunnlag for EC90 x 4 ® taxan/trastuzumab |
pT2pN0 | EC90 x 4 ® taxan/trastuzumab Zoledronsyre ved postmenopausal status |
| ||
pT1-2pN1-3 | EC90 x 4 ® taxan/trastuzumab/pertuzumab Zoledronsyre ved postmenopausal status |
| ||
HR- HER2- |
| pT1pN0 | Stadium 1: EC90 x 4 ® taxan Zoledronsyre ved postmenopausal status | Lav proliferasjongrad og histologisk grad kan gi grunnlag for å utelate taxaner (evt kun gi TC x 4) Individuell vurdering av grunnlag for systembehandling kan gjøres ved små pT1apN0 tumores |
|
| pT2pN0-3 | Dersom ikke neoadjuvant behandling er gitt: taxan/carboplatin® EC90 x 4 Zoledronsyre ved postmenopausal status |
TC x 6 er et akseptabelt alternativ ved mindre omfattende lymfeknutemetastaser og med kardiale risikofaktorer som gjør at man vil unngå antracycliner.
|
Fotnote/spesifikasjoner/kommentarer til anbefalingene anført i tabellene over
*Beslutningsgrunnlaget vedrørende endokrin behandling som alternativ til kjemoterapi er indirekte, og sikker kunnskap om dette alternativet for premenopausale pasienter er enda ikke tilgjengelig.
Metastaseutredning: Lymfeknute-positive pasienter som enten er HER2 positive eller trippel negative bør metastasescreenes, dersom dette ikke nevneverdig forsinker tidspunkt for behandlingsstart.
Hormonreseptorstatus: Dersom ER er negativ og PR er positiv, bør reseptorundersøkelsene gjentas for å avdekke med sikkerhet om endokrin behandling er aktuelt. PgR positivitet/ER negativitet er sjelden og oftest uttrykk for falsk positivitet (for PR) eller falsk negativitet (for ER).
Genekspresjonstester anbefales benyttet til å vurdere bruk av kjemoterapi for pasienter med HR+HER2- pT1-2pN0 status da slike tester gir sikrest prognostisk (og prediktiv) informasjon med lav interlaboratorievariabilitet. Dersom Prosigna test utføres, henvises til egen oversikt over retningslinjer, hvor testsvaret er inkludert i vurderingsgrunnlaget.
Vurdering av proliferasjon og Luminale subtyper dersom genekspresjonstest ikke er utført: Ki67 proliferasjonsindeks (estimeres som % Ki67 positive celler i hot spot) kan i tillegg til histologisk grad bidra til å skille mellom Luminal A liknende og Luminal B liknende subtyper av brystkreft (ER positive subtyper) dersom Ki67 er <10% eller >35%. Ki67 verdier mellom 10% og 35% bør ikke benyttes for vurdering av grunnlag for kjemoterapi.
Endokrin behandling. Det henvises til tekstlige anbefalinger i Handlingsprogrammet.
Calcium/VitD (1000 mg/800 IE daglig) skal i utgangspunktet gis til alle som står på AI (for eksempel Calcigran forte tyggetabletter).
Bentetthetsundersøkelser ved bruk av AI eller unge kvinner som benytter goserelin: Dersom ikke zoledronsyre benyttes som adjuvant behandling, bør det gjøres bentetthetsmålinger ved oppstart, etter 1 år og deretter hvert 2. år inntil avslutning av AI.
Zoledronsyre: Zoledronsyre gis i.v. i dosering 4 mg hver 3. måned i 2 år eller hver 6. måned i 5 år ved avdeling som vanligvis gir kjemoterapi. Behandlingslengde 5 år. Behandlingen er kun aktuell for pasienter med postmenopausal status (naturlig eller indusert) som skal gjennomføre systemisk adjuvant behandling. Tannstatus bør vurderes før oppstart av behandlingen.
Ikke-hormonell behandling. EC90 (epirubicin 90 mg/m2 + cyklofosfamid 600 mg/m2) gis hver 3. uke. TC i form av docetaxel 75 mg/m2 + cyklofosfamid 600 mg/m2 gis også hver 3. uke. Det gis G-CSF som primærprofylakse mot febrile neutropenier. Paklitaxel 80mg/m2 hver uke kan benyttes som alternativ til docetaxel hver 3. uke i TC regimet. I så fall gis ikke G-CSF som primærprofylakse. Ved indikasjon for taxan i sekvens med EC90: Docetaxel 100 mg/m2 hver tredje uke x 4 eller paclitaxel 80mg/m2 hver uke x 12. Ved bruk av docetaxel gis G-CSF som primærprofylakse mot febrile neutropenier. Ved HER2 positiv status og indikasjon for kjemoterapi: Trastuzumab eller trastuzumab+pertuzumab infusjon hver 3. uke i 1 år med oppstart samtidig med taxanbehandlingen. Gjør LVEF måling før oppstart av EC90, før oppstart av anti-HER2 behandling, deretter hver 3. mnd til avsluttet behandling. Følg egen algoritme for vurdering av LVEF i forhold til anti-HER2-behandlingen. For alternative kjemoterapiregimer, konferer tekst.
Alder og bruk av kjemoterapi og/eller zoledronsyre: Ved indikasjon, bør i utgangspunktet den skisserte adjuvante kjemoterapi og/eller zoledronsyrebehandling gis opp til minimum 75 års alder, men det anbefales ikke å benytte høy alder alene som grunn for å utelate bruk av kjemoterapi/zoledronsyre. Ved alder >70–75 år må behandling vurderes nøye i forhold til komorbiditet og leveutsikter – og individuell tilpasning kan være nødvendig.
Strålebehandling (for pasienter som ikke gjennomgår neoadjvuant behandling): Aktuelt hvis 1) operert brystbevarende, 2) ikke fri margin etter ablatio, eller 3) pN1(>2 mm)-pN3.
Ved indikasjon for kjemoterapi og planlagt 12 ukers behandlingsperiode, henvis til stråleterapi i forbindelse med eller 3 uker etter oppstart av behandlingen. Dersom det er planlagt 18-24 ukers behandlingsperiode, henvis til stråleterapi midtveis i behandlingen. Dersom det ikke er indikasjon for kjemoterapi, henvis til stråleterapi umiddelbart.
Veiledende behandlingsbeslutning ved bruk av Prosigna ved pT1pN1(mi)
Hovedgruppe | pT pN status | Prosignatest* | Generell terapi-anbefaling** | Grunnlag for eventuell vurdering av annet terapi-valg (eskalering eller de-ekskalering) |
|---|---|---|---|---|
HR +
HER2- | pT1pN1(mi)
pT1pN1(mi) | Luminal A ROR score 0-40
Luminal A** ROR score 41-60 | Endokring behandling Zoledronsyre ved postmenopausal status
Premenopausal: E C 90 x 4 eller TC x 4 etterfulgt av endokring behandling. Endokring behandling som inkluderer goserelin kan vurderes som alternativ til kjemoterapi.***
Postmenopausal: Endokrin behandling Zoledronsyre ved postmenopausal status |
|
pT1pN1(mi) | Luminal B** ROR score 41-60
| ER ≥50%: E C 90 x 4 eller TC x 4 → endokrin behandling ER < 50%: E C 90 x 4 → taxan → endokring behandling Zoledronsyre ved postmenopausal status
|
| |
pT1pN1(mi) | Luminal B** ROR score >60
| E C 90 x 4 → taxan → endokring behandling Zoledronsyre ved postmenopausal status |
|
* I noen få tilfeller vil molekylær subtype for HR+HER2- svulster være «Basal»- eller «HER2-enriched», adjuvant behandling vil da følge ROR score og Luminal B subtype.
** Alder og absolutt ER ekspresjonsnivå kan gi grunnlag for individuell vurdering av behandlingsvalg. Dersom absolutt ROR score er meget nær cut-off verdier
for å skifte subgruppe kan det gi grunnlag for individuell vurdering av behandlingsvalg.
*** Beslutningsgrunnlaget vedrørende endokrin behandling som alternativ til kjemoterapi er indirekte, og sikker kunnskap om dette alternative for premenopausale pasienter er enda ikke tilgjengelig.
Alternative adjuvante behandlingsregimer
Sist faglig oppdatert: 02202402.07.2024
For HER2-positive pasienter viste BCIRG 006 studien at å erstatte antracyclin med carboplatin i adjuvant behandling som inkluderer trastuzumab (TCH) kan gjøres med redusert hjertetoksisitet og samtidig med god effekt på sykdomsfri overlevelse (D. Slamon et al., 2011). Resultater etter 10 års oppfølging viste kun 10 flere DFS hendelser mellom TCH og AC etterfulgt av docetaxel + trastuzumab (AC-TH) (DJ Slamon et al., 2016). Videre viser TRAIN-2 studien ingen forskjell i pCR etter neoadjuvant behandling ved bruk av 9 kurer paklitaxel dag 1+dag 8 (q3w) i kombinasjon med carboplatin gitt enten som AUC6 hver 3. uke eller AUC3 dag 1 + dag 8 (q3w)(sammen med med trastuzumab/pertuzumab), sammenlignet med armen hvor tre av syklusene var erstattet med FEC90 + trastuzumab/pertuzumab. Deskriptiv statistikk ble benyttet til å analysere event-free survival, med HR 0.9 (95% CI 0.50-1.63) (van der Voort et al., 2021).
TCH x 6 hver 3. uke (docetaxel 75mg/m2 + carboplatin (AUC 6) + standard trastuzumab) eller TCHP (dvs + pertuzumab hvis indikasjon), kan benyttes ved behandling av HER2 positive når det er ønsket å utelate antracycliner. Behandlingsopplegget for TRAIN-2 studien er også en behandlingsopsjon.
Dose-dense behandling er diskutert i kapittel Neoadjuvant behandling, avsnitt "Dose dense kjemoterapi vs. «konvensjonell» dosering", med bakgrunn i EBCTCG metananalysen av slik behandling. Anbefalingen om sekvensiell behandling med antracyklin (EC90) etterfulgt av taxan (docetaxel 3qw eller paklitaxel ukentlig) tar høyde for de viktigste resultatene i metaanalysen. Å vurdere bruk av EC90 x 4 (q2w) etterfulgt av docetaxel x 4 (2qw) eller paklitaxel ukentlig er i utgangspunktet begrenset til lokalavanserte høyrisikopasienter med spesielt rask sykdomsutvikling (på individuelt grunnlag).
Det er publisert en kinesisk studie (Yu et al, JAMA Oncology 2021) som sammenlignet adjuvant behandling med FEC x 3 (q3w) etterfulgt av Docetaxel x 3 (q3w) med ukentlig paklitaxel/Carboplatin (3 av 4 uker) – 6 sykler, hos trippel negative hvor 3/4 av pasientene var pN0. Studien viste ingen forskjell i overall survival, en liten bedring i DFS med ukentlig paklitaxel/Carboplatin (Yu et al., 2020). Studien gir ikke grunnlag for å justere vår generelle anbefaling for trippel negative, men er et mulig alternativt behandlingsopplegg i individuelle tilfeller.
I tilfeller der det oppstår hypersensitivitet/alvorlig intoleranse for paklitaxel og docetaxel, kan albuminbundet paklitaxel (nab-paklitaxel) alternativt benyttes. Det foreligger ikke nok data til å avgjøre om ukentlig behandling eller behandling 3 av 4 uker (28 dagers syklus) med nab-paclitaxel 125 mg i.v. bør benyttes (Gianni et al., 2018; Untch et al., 2019). Men behandling 2 av 3 uker ga redusert pCR sammenlignet med ukentlig behandling (Blohmer et al., 2022). Doseringsvalget vil være avhengig av risiko og tolerabilitet i det individuelle tilfelle.
Spesielle instruksjoner ved ikke-hormonell behandling
Det gis kurer med tre ukers mellomrom.
Dosering beregnes ut fra pasientens kroppsoverflate.
- EC gis med tre ukers mellomrom
- Docetaxel gis med tre ukers mellomrom
- Paclitaxel gis ukentlig
Stoff | Dose mg/m2 | Utblanding | Infusjonstid | Kurdag |
|---|---|---|---|---|
Epirubicin | 90 | 100 ml NaCl 9 mg/ml | 3–10 min | 1 |
Cyklofosfamid | 600 | 100 ml NaCl 9 mg/ml | 3–10 min | 1 |
Dosen av cyclofosfamid avrundes oppover til nærmeste nivå delelig med 50, dosen av epirubicin avrundes oppover til nærmeste nivå delelig med 5.
Stoff | Dose mg/m2 | Utblanding | Infusjonstid | Kurdag |
|---|---|---|---|---|
Docetaxel | 100 | 250ml NaCl 9 mg/ml | 1 time | 1 |
Det gis dexametason 8 mg x 2 (eller metylprednisolon 32 mg x 2) i tre døgn, med oppstart kvelden før kur.
Stoff | Dose mg/m2 | Utblanding | Infusjonstid | Kurdag |
|---|---|---|---|---|
Paclitaxel | 80 | 250ml NaCl 9 mg/ml | 1 time | 1 |
Premedikasjon:
- Dexametason 8 mg eller metylprednisolon 32 mg p.o. minst 2 timer før kur de første 2 kurene. Dersom ingen reaksjon gis halvert dose de neste 2 kurer.
- Dersom ingen reaksjon seponeres dexamethason/metylprednisolon deretter.
- Antihistamin gis i tillegg som premedikasjon (for eksempel cetirizin 10 mg p.o. minst 1 time før kur), samt ranitidin 150 mg eller famotidin 80 mg (eller tilsvarende) p.o. minst 1 time før kur.
Stoff | Dose mg/m2 | Utblanding | Infusjonstid | Kurdag |
|---|---|---|---|---|
Cyklofosfamid | 600 | 100 ml NaCl 9 mg/ml | 3–10 min | 1 |
Docetaxel | 75 | 250 ml NaCl 9 mg/ml | 1 time | 1 |
Dosen av cyclofosfamid avrundes oppover til nærmeste nivå delelig med 50, dosen av epirubicin avrundes oppover til nærmeste nivå delelig med 5.
Det gis dexametason 8 mg x 2 (eller metylprednisolon 32 mg x 2) i tre døgn, med oppstart kvelden før kur.
Kurer som inneholder carboplatin
For å redusere risiko for overdosering ved fallende GFR bør det vurderes dosecapping (maksimaldosering) ved «target AUC (mg/ml/min) x (150)». Alternativt analyseres reell GFR med en av de tilgjengelige metoder (Iohexol, cystatin C).
Ved fallende kreatinin underveis i behandling med carboplatin bør opprinnelig GFR verdi benyttes som utgangspunkt for kurdosering.
Bivirkninger av kjemoterapi – overvåking og håndtering av disse
Neutropeni
Sett under ett, taler dagens kunnskap for at det er gunstig å opprettholde dosenivå/intensitet i standard behandlingen, i alle fall for reseptor negative/(svake). Neutropeni er den vanligste dosebegrensende årsak, dersom ingen støttebehandling igangsettes. Neutropeni påvises ved måling av neutrofile granulocytter. G-CSF kan effektivt begrense komplikasjoner av neutropeni.
Anbefalinger:
Ved kurer med tre ukers intervall anbefales å vurdere grunnlaget for kur og eventuelt støttbehandling med G-CSF på følgende måte:
- I tråd med EORTC retningslinjene for bruk av G-CSF anbefales G-CSF som primærprofylakse ved adjuvant behandling som gir minst 20 % risiko for febrile neutropenier (det vil si EC90, docetaxel, TC). Ut over dette vil eventuell primærprofylakse kunne gis etter individuell medisinsk vurdering av risiko for febrile neutropenier (Aapro et al., 2011).
- Nederste akseptable grense for å gi kur uten G-CSF er neutrofile granulocytter 1.0 x 109/l.
- Ved verdier under 1.0 vil oftest kur kunne gis med tillegg av G-CSF. Er det grunner som taler i mot (meget lave neutrofile/usikkerhet om neutrofile granulocytter er stigende), vurderes pasienten på nytt etter 1–3 dager, med mål om å gi kur med tillegg av G-CSF.
- Ved forutgående febril neutropeni-episode, gis G-CSF ved de påfølgende kurer (sekundær profylakse).
For ukentlig behandling må nederste akseptable grense for å gi kur vurderes ut i fra forløpet av et eventuelt fall i neutrofile granulocytter. Det vil ofte være mulig å gi kur ved neutrofile granulocyttverdier ≥0.7 x 109/l. Det gis ikke G-CSF ved ukentlige kurer. Dersom kur må utsettes bør pasienten vurderes på nytt etter 1–3 dager.
Trombocytopeni
Trombocytopeni utgjør sjeldent et problem ved adjuvant kjemoterapi, men generelt bør ikke kur gis ved verdier under 50.
Øvrige bivirkninger
Epirubicin gir håravfall hos de fleste pasientene. Cyclofosfamid kan gi håravfall, av og til parykkrevende. Pasienten må informeres om dette og om at håret kommer tilbake etter at behandlingen er avsluttet.
Cyclofosfamid gir kvalme og brekninger hos minst 50 % av pasientene. Symptomene kan komme fra 1 til flere timer etter infusjonen. Kombinasjonen av NK1 og 5HT3-reseptorblokkere er idag standard antiemetisk behandling i forbindelse med EC – kurene. I tillegg gis vanligvis dexamethason. Ytterligere tiltak/medikasjon bør vurderes avhengig av den individuelle tolerabilitet. Docetaxel og paclitaxel gir vanligvis lite eller ingen kvalme.
Docetaxel og paclitaxel kan begge gi hypersensitivitetsreaksjoner/anafylaktoide reaksjoner. Overvåkning er derfor nødvendig, spesielt ved de første kurene. Det henvises til kurskjema (Nasjonalt Register for Medikamentell Kreftbehandling eller Cytodose) for spesifikt opplegg. Risikoen for alvorlige reaksjoner er minimal hvis glucokortikoid benyttes i tilslutning til kurene, i henhold til spesifikasjonen nevnt over. Hvis reaksjoner oppstår, stoppes infusjonen midlertidig, og relevant behandling gis. Når symptomene går tilbake, igangsettes infusjonen med redusert dråpetakt, med gradvis økning av takten hvis ikke symptomene kommer tilbake.
Ved sepsis eller blødninger må individuelle hensyn tas før neste kur gis. EKG må tas ved mistanke om hjertesykdom. Epirubicin er meget vevstoksisk og må bare gis gjennom en sikker intravenøs tilgang for å unngå ekstravasasjon.
Bruk av kjølehansker/votter/hette
Ved alvorlige bivirkninger under adjuvant docetaxel som tilsier bruk av kjølevotter/hansker bør det vurderes skifte til paklitaxel. Dokumentasjonen for effekt av kjølevotter/hansker er svak/motstridende (Bailey, Brown, & Hammond, 2021). Det kan derfor ikke gis en anbefaling om slik bruk. Men slik bruk har ikke vist skadelige effekter.
Det anbefales ikke bruk av kjølehette på det nåværende tidspunkt.
Spesielle forhold ved adjuvant behandling av HER2 positive pasienter hvor det er indikasjon for anti-HER2 behandling
Kandidater for trastuzumab eller trastuzumab+pertuzumab er utelukkende pasienter med HER2 positiv sykdom (FISH/CISH/SISH+ eller IHC 3+) som tilfredsstiller de gjeldende kriterier for å gi adjuvant kjemoterapi. Behandlingen bør ikke gis sammen med antracyclinholdig (EC) kjemoterapi. Pasienten bør ha LVEF måling >50 før opptart av HER2-rettet behandling. Ved usikkerhet knyttet til hjertefunksjon eller cardial risiko bør cardiolog involveres i vurderingen før oppstart av behandlingen.
Kontraindikasjoner
- Overfølsomhet for trastuzumab, murine proteiner eller noen av hjelpestoffene. Alvorlig hvile-dyspné pga. komplikasjoner ved alvorlig fremskredet sykdom, eller ved behov for oksygentilskudd.
- Graviditet.
Forsiktighetsregler:
- Ved kumulativ Epirubicindose som overstiger 720 mg/m2 vil risikoen for hjertepåvirkning være betydelig. Dette vil vanskeliggjøre bruk av HER2-rettet behandling. Risiko/nytte-effekter må vurderes nøye.
- Pasienter med alvorlig hjertesykdom som for eksempel dokumentert hjertesvikt, høy risiko for ukontrollerte arrytmier, medisinkrevende angina pectoris, klaffesykdom, transmuralt hjerteinfarkt, dårlig kontrollert hypertensjon (Systolisk > 180, diastolisk > 100) ble ikke inkludert i de adjuvante studiene som ligger til grunn for bruk av HER2-rettet behandling. Dette gjør at vurdering av slik behandling må gjøres i nært samarbeid med cardiolog og med nøye risiko/nyttevurdering.
Nødvendige for-undersøkelser
- Hematologiske prøver: ASAT, ALAT, ALP, kreatinin, bilirubin
- EKG og BT
- Ekkokardiografiundersøkelse (kfr eget avsnitt 4.11.3)
Det kreves i utgangspunktet en LVEF på 50 % for å kunne starte trastuzumab
Behandlings-/kontrollopplegg – trastuzumab eller trastuzumab/pertuzumab
Dersom behandlingen gis etter antracyklinholdig kjemoterapi (EC kurer), startes den vanligvis 3 uker etter siste EC kur og gis vanligvis samtidig med taxanbehandling som kombinasjonsterapi. Hvis LVEF <50 %, avventes oppstart av anti-HER2 behandling og en ny MUGA eller Echo gjøres etter 3–6 uker. Etter avsluttet taxanbehandling fortsetter anti-HER2 behandling som monoterapi, uavhengig av om pasienten skal ha strålebehandling.
Ved intravenøs trastuzumab-behandling gis første infusjon med trastuzumab i loadingdose 8 mg/kg. Ved tillegg av intravenøs pertuzumab gis første infusjon i loadingdose 840 mg (fiksert dose). Deretter gis kur hver 3. uke i en dose på trastuzumab 6 mg/kg og pertuzumab (hvis aktuelt) 420 mg (fiksert dose). Ved subcutan trastuzumab-behandling gis 600 mg som fiksert dose. Til sammen 17 kurer (cirka 1 års behandlingstid). Behandling med trastuzumab eller pertuzumab krever ikke blodprøver bortsett fra før oppstart.
Ekkocardiografi (sekundært MUGA dersom kapasitetsmessige begrensninger på EKKO) gjøres hver 12 uke. Justering i behandlingsopplegget som følge av denne undersøkelsen skjer i henhold til følgende algoritme:
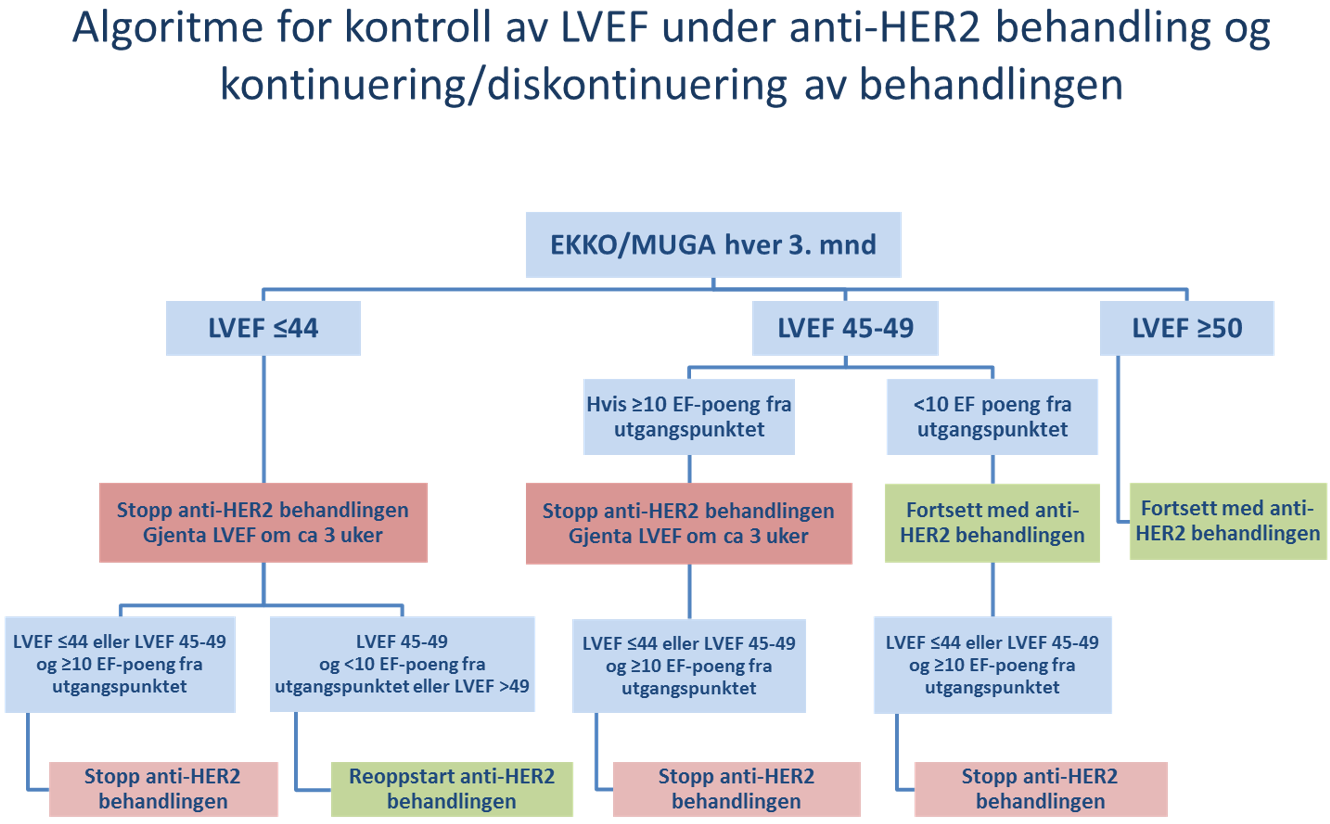
De fleste cardiale hendelser kommer i løpet av 1. året. Det oppfattes at man har så få hendelser senere at gevinsten er svært liten ved lenger monitorering hos pasienter som har normal LVF ved endt behandling (vanligvis avsluttes monitoreringen etter endt behandling). Det er likevel viktig med god informasjon til pasienter og fastleger slik at en har lav terskel for å undersøke LVEF ved symptomer som kan ha kardial årsak i etterkant av behandlingen. Ekstra påpasselig bør en være hos pasienter som også mottar antracyclinbehandling og hos pasienter som har hatt eller er disponert for hjertesykdom.
Pasienter som er HER2 positive og får LVEF fall under trastuzumab skal følges til normalisering.
Spesielle forhold ved cardiovasculære risikofaktorer eller lav men normal LVEF
LVEF gjøres rutinemessig før EC90 oppstartes hos alle HER2-positive pasienter. Antracyclinholdig kjemoterapi kan forårsake permanent skade på hjerte. Trastuzumab-behandlingen kan påvirke LVEF i etterkant av denne behandlingen. Det bør derfor vises forsiktighet ved LVEF rett over nedre normalområde før EC90 oppstartes eller ved cardiovasvulære risikofaktorer. Det anbefales at dersom det foreligger cardiovasculære risikofaktorer eller LVEF er mellom 50 og 55, bør det vurderes å gi TCH (konferer over) eller tettere LVEF monitorering (for eksempel etter 2 kurer).
Neoadjuvant behandling
Sist faglig oppdatert: 02202402.07.2024
Neoadjuvant behandling innebærer systemisk behandling før lokal behandling (kirurgi og/eller strålebehandling). I mange tilfeller inkluderer neoadjuvant behandling bruk av kjemoterapi. For utvalgte pasienter kan primær endokrin behandling være et alternativ til kjemoterapi.
Følgende faktorer bør være på plass for å gjennomføre neoadjuvant behandling: Gode og detaljerte behandlingsforløp med komplett multidisiplinært team er av stor betydning for kvalitet i den neoadjuvante behandling. Multidisiplinær tilnærming inkluderer tilstedeværende kompetanse i form av onkolog, BDS med tilstrekkelig MR kapasitet og kompetanse for å vurdere tumor respons og gjenværende tumorvev etter neoadjuvant behandling, biopsimulighet, logistikk for innleggelse av klips, både kirurgisk og plastikkirurgisk miljø som behersker og har tilstrekkelig erfaring både for vurderinger av BCT mulighet etter neoadjuvant behandling, samt primære rekonstruksjonskompetanse. Se "Adjuvant hormonbehandling".
Det er fremdeles ønskelig at neoadjuvant behandling av lokalavansert brystkreft gjøres ved de regionale sentra som per i dag gjennomfører slik behandling. Dette er begrunnet i at det fremdeles er behov for erfaring med den radiologiske diagnostikk underveis i behandlingen i forhold til beslutninger om valg av brystbevarende behandling, samt for å få etablert kirurgisk kvalitet og kunnskap knyttet til denne behandlingen hos pasienter med lokalavanserte cancere som er i den høyeste risikogruppen m.t.p. tilbakefall. Denne erfaringen ved regionsykehusene er viktig for å gi oss bedrede fremtidige retningslinjer for alle sykehus.
Pasienter som er kandidater for neoadjuvant behandling bør, dersom tilgjengelig, tilbys inklusjon i kliniske studier, – da denne behandlingssituasjonen er velegnet for å kunne avdekke effekter av nye behandlingsprinsipper med kurativt potensiale.
Bakgrunn lokalavansert brystkreft
Lokalavansert brystkreft omfatter svulster klassifisert som cT3 eller cT4 og/eller brystkreftsykdom med lokalavansert lymfeknutemetastasering (cN2-3), men hvor det ikke er påvist fjernmetastaser. Denne pasientgruppen er nokså heterogen, med varierende prognose. Moderne systemisk behandling har ført til klart bedret overlevelse. Pasienter med cT3 svulster synes å ha en vesentlig bedre prognose enn pasienter med cT4 svulster.
Det er ingen generell konsensus vedrørende behandlingen av pasienter med lokalavansert brystkreft på diagnosetidspunktet. De fleste er enige om at denne pasientgruppen har behov for multimodal terapi, som inkluderer både optimal systemisk behandling, kirurgisk behandling (hvis mulig) og lokoregional strålebehandling.
Responsraten ved bruk av kjemoterapi i denne sammenheng synes å være høyere enn hva man ser ved metastatisk sykdom. Dette synes å være uavhengig av behandlingsregimene. Generelt synes det å være høyest responsrate ved de «aggressive» regimer (tilsvarende det man ser ved metastatisk sykdom), men også mildere kjemoterapiregimer kan gi en høy responsrate. Samtidig er det for pasienter med HR positiv HER2 negativ brystkreft ikke sett høyere responsrater med neoadjuvant kjemoterapi enn med neoadjuvant endokrin terapi (Spring et al., 2016). Endokrin neoadjuvant behandling er således aktuelt for utvalgte pasienter basert på kartlegging av tumorbiologiske egenskaper.
Status for neoadjuvant kjemoterapi ved stadium III – oppsummering
Ved neoadjuvant kjemoterapi kan man oppnå å minske tumorstørrelsen slik at tumor blir operabel eller at en kan deeskalere kirurgisk behandling.
Samtlige kjemoterapiregimer som er vist å være effektive i adjuvant brystkreftbehandling synes å gi gode responsrater også ved primærbehandling av primær lokalavansert brystkreft. De beste adjuvante kjemoterapiregimer ved postoperativ adjuvant behandling, vil også være aktuelle å benytte som preoperativ behandling.
Å oppnå patologisk komplett remisjon eller minimal restsykdom etter preoperativ behandling gir bedret prognose (både residivfri og total overlevelse). Prognosen kan likevel være god uavhengig av grad av respons etter kjemoterapi hos pasienter med høyt uttrykt ER, lavere histologisk grad, med lav proliferasjonsgrad.
En fordel med primær kjemoterapi (eller endokrin behandling) iverksatt før kirurgi, er at behandlingseffekten kan evalueres og behandlingen kan endres dersom den viser manglende effekt.
Teoretisk skulle det være en fordel å sette inn systemisk behandling så tidlig som mulig med tanke på effekt på mikrometastaser. Det understøttes av en studie som har sammenlignet overlevelse mellom preoperativ og postoperativ kjemoterapi (i primært operable tilfeller), hvor det vises grensesignifikant bedret overlevelse ved preoperativ behandling (p=0.053) (Rastogi et al., 2008).
Dose dense kjemoterapi vs. «konvensjonell» dosering
EBCTCG har publisert en metaanalyse som viser at adjuvant, dose dense kjemoterapi (q2w) bedrer overlevelsen med 2–3 % i forhold til konvensjonell dosering (q3w) for pasienter med høyere risikoprofil (Early Breast Cancer Trialists' Collaborative Group (EBCTCG), 2019). Videre viser studien at sekvensiell behandling med antracyclin etterfulgt av taxan, gir bedre overlevelse enn konkomitant behandling med antracyklin og taxan, for samme pasientgruppe. Sistnevnte er samsvarende med det adjuvante behandlingsopplegg i Norge gjennom flere år, hvor det har vært indikasjon for å benytte taxan. Metaanalysen inkluderer ikke sammenlignende studier av dose dense behandling mot 4 EC90 q3w etterfulgt av 12 paclitaxel ukentlig (se under).
Studiene med paclitaxel som inngår i metaanalysen har benyttet paclitaxel 175 mg/m2 q2w eller q3w, og ikke ukentlig slik praksis er både nasjonalt og internasjonalt i dag. Det er vist at adjuvant paclitaxel ukentlig er mer effektivt enn paclitaxel q3w og gir samme overlevelse som docetaxel q3w (Sparano et al., 2008). Hvor vidt ukentlig paclitaxel, slik den brukes adjuvant i dag, er like bra som docetaxel q2w, vet vi ikke. Hvorvidt effekt av dose dense behandling er avhengig av både q2w EC og docetaxel q2w, eller om taxanbehandlingen kan byttes ut med 12 ukentlige paklitaxelkurer med samme gevinst, har vi således ikke sikre data på.
Gjeldende anbefaling om sekvensiell behandling med antracyklin (EC90) etterfulgt av taxan (docetaxel 3qw eller paklitaxel ukentlig) tar høyde for de viktigste resultatene i metaanalysen. Men for lokalavanserte høyrisikopasienter med spesielt rask sykdomsutvikling kan det på individuelt grunnlag vurderes å kombinere både dose dense og sekvensiell behandling i form av 4 EC90 q2w etterfulgt av 4 docetaxel 75 mg/m2 q2w eller 12 paklitaxel ukentlig (kfr. under).
Total behandlingstid reduseres når man gir behandlingen dose dense, fra 24 til ned mot 16 uker. Det er samtidig mer utfordrende å gi dose dense behandling enn q3w m.t.p. toxicitet, og det er derfor viktig med årvåkenhet med tanke på neutropene infeksjoner og å bruke G-CSF profylakse (ikke under paclitaxel ukentlig).
Dose dense behandling som anført over er også inkludert som behandlingsopsjoner i St. Gallen consensus guidelines og i ASCO guidelines (Curigliano et al., 2017; Denduluri et al., 2018).
Bakgrunn for vurdering av eventuell bruk av platinum i neoadjuvant behandling av pasienter med kimcelle BRCA mutasjon og trippel negativ brystkreft
Effekter av platinum har vært rapportert i studier fra flere år tilbake. I de første studiene ble det ikke påvist bedret totaloverlevelse ved å gi platinum ut over antracyklin i kombinasjon med cyklofosfamid + taxan ved BRCA mutert eller trippel negativ brystkreft (Poggio et al., 2018; Sikov et al., 2015). Men oppdaterte resultater fra BrighTNess studien som inkluderte pasienter med trippel negativ brystkreft, fant bedring i 4 års «event-free survival» (descriptiv sekundæranalyse) (Geyer et al., 2022b). Flere kliniske studier har vist høy patologisk komplett responsrate (pCR) ved BRCA mutert og/eller trippel negativ brystkreft behandlet med neoadjuvant platinum cellegift (Byrski et al., 2014; Loibl et al., 2018; Sikov et al., 2015; Silver et al., 2010; von Minckwitz et al., 2014).
Videre har en metaanalyse av publiserte studier inkludert de randomiserte studiene med balanserte behandlingsarmer utenom platinum, vist høyere andel pCR ved å legge til carboplatin (Poggio et al., 2018). Effekten har vært tydeligst i studier av trippel negativ brystkreft, mens det ikke er sikre resultater for effekt hos kimcelle BRCA muterte når behandlingsarmene har inkludert antracyklin i kombinasjon med cyklofosfamid. Dette kan skyldes at BRCA muterte har høyere pCR også i behandlingsarm uten platinum, samsvarende med mer kjemosensitiv tumor (Loibl et al., 2018; von Minckwitz et al., 2014). Selv om pasienter med BRCA1/2 mutert brystkreft kan ha spesiell sensitivitet for platinum cellegift (pga. mangelfull evne til DNA reparasjon forårsaket av defekt homolog rekombinasjon), vil allerede tilstedeværelsen av alkylerende kjemoterapi i standardbehandlingen kunne påvirke størrelsen av effekten.
Det foreligger nå resultater fra ytterligere studier som viser bedre sykdomsfri overlevelse og totaloverlevelse ved å legge til carboplatin til standard (neo)adjuvant kjemoterapi (Fasching et al., 2023; Gupta et al., 2023; Pathak et al., 2022). På SABCS2022 presenterte Gupta et al. resultater hos TNBC pasienter hvor ukentlig carboplatin ble lagt til neoadjuvant behandling med paklitaxel etterfulgt av antracyclin/taxan. Resultatene viste 6.1% bedring i DFS og 7.3% bedring i totaloverlevelse, hvor effekten primært var til stede hos premenopausale pasienter. En metaanalyse som inkluderte 8 studier og 2425 pasienter viste betydelig bedring i både DFS (HR 0.66; 95% CI. 0.55-0.8; p<0.001) og totaloverlevelse (HR0.68; 95% CI 0.54-0.87; p=0.002) ved å legge til carboplatin som del av adjuvant eller neoadjuvant behandling (Pathak et al., 2022). St Gallen konsensus 2023 anbefalte også å inkludere carboplatin som del av (neo)adjuvant behandling (Curigliano et al., 2023). Således bør pasienter med TNBC tilbys tillegg av carboplatin til taxan etterfulgt av EC90 kjemoterapi dersom ikke tolerabilitet/komorbiditet hindrer slik behandling. Anbefalt neoadjuvant behandlingsopplegg for stadium 2-3: carboplatin (AUC 1.5-2 ukentlig/paklitaxel 80 mg/m2 ukentligx12 (eller carboplatin (AUC6 qw3)/taxan) etterfulgt av EC90x4 som neoadjuvant kjemoterapi. Primæropererte pasienter med stadium 2-3 bør tilbys samme behandling. Pasienter som kan motta neoadjuvant pembrolizumab (ved tilgjengelighet) anbefales slik behandling i tråd med Keynote 522 (kfr under).
Det finnes foreløpig ikke data på betydningen av capecitabine etter neoadjuvant behandling som har inkludert carboplatin/taxan i sekvens med antracyklin/cyklofosfamid, noe som betyr at det er vanskelig å gi en klar anbefaling om bruk av capecitabine i disse tilfeller. Slik bruk må i så fall skje etter individuell vurdering.
Neoadjuvant/adjuvant behandling av trippel negative med immunterapi
Behandling med pembrolizumab i kombinasjon med kjemoterapi (paklitaxel/carboplatin etterfulgt av EC90) – i neoadjuvant etterfulgt av adjuvant behandling pembrolizumab har vært testet i Keynote 522 studien. Publiserte resultater visser betydelig bedring i EFS (HR 0.61) og innledende informasjon om forbedret OS (HR 0.71, 95% CI 0.51-1.02) ved å legge til pembrolizumab (Schmid et al., 2022). Det foreligger også andre studier som underbygger disse resultater (Loibl et al., 2022b; Mittendorf et al., 2020). ASCO og St. Gallen har anbefalt bruk av kjemoterapi + immunterapi neoadjuvant og etterfølgende adjuvant immunterapi for TNBC (Korde et al., 2022) i tråd med Keynote 522 studien. Behandlingen ble 28.08.2023 godkjent i Nye Metoder (nyemetoder.no).
Anbefaling
Følgende behandling av TNBC anbefales: Pasienter med klinisk T1cN1-2 eller T2-4N0-3 (stadium II eller III)(i tråd med inklusjonskriteriene i Keynote 522) anbefales pembrolizumab (200 mg hver 3. uke eller 400 mg hver 6. uke) i kombinasjon med neoadjuvant kjemoterapi i form av ukentlig paklitaxel 80 mg/m2 + carboplatin AUC 1.5 i 12 uker etterfulgt av i kombinasjon med EC90 hver 3 uke x 4), etterfulgt av 9 kurer adjuvant pembrolizumab q3w. Behandlingen kan benyttes uavhengig av PD-L1 status (effekt ble funnet uavhengig av P-DL1 status). P.t. er Keynote 522 den klart største studien med de sikreste resultater for pCR og overlevelse, som gjøre at behandlingsopplegget som er benyttet i denne studien primært anbefales.
Dersom det ikke oppnås pCR eller ypT1a-b ypN0 finnes det foreløpig ingen data som kan informere om nytteverdi/støtte bruk av PD-1/PD-L1 hemmere i kombinasjon med capecitabine eller olaparib post-neoadjuvant. Men Keynote 522 har rapportert at behandlingsarmen med pembrolizumab bedret «event-free survival» med 10.6% for pasienter med non-PCR. Før eventuell oppstart av behandlingen må risiko/nytteverdi kartlegges spesielt i forhold til immunrelaterte bivirkninger, og det må vises årvåkenhet i forhold til slike bivirkninger etter at behandlingen er iverksatt. Aktiv autoimmun sykdom er en relativ kontraindikasjon for behandling med immunterapi.
Optimalisert neoadjuvant HER2-rettet behandling
Ved å legge pertuzumab til neoadjuvant trastuzumab og taxan, fikk man en 60 % økning i pCR i NeoSphere studien. Senere er det publisert data for progresjonsfri overlevelse og sykdomsfri overlevelse fra denne studien (sekundære endepunkter), som viser at pasienter som mottok pertuzumab hadde 86 % 5 års progresjonsfri overlevelse sammenlignet med 81 % for trastuzumab/taxan ((HR 0.69; 95 % CI 0.34–1.40), og pasienter som oppnådde pCR (uavhengig av behandlingsarm) hadde lenger progresjonsfri overlevelse enn de som ikke oppnådde dette (HR 0.54;)5 % CI 0.29–1.00) (eksplorativ analyse). Studien var ikke dimensjonert for å gi overlevelsesresultater med smale konfidesintervaller (Gianni et al., 2016). Resultater ved bruk av pertuzumab i kombinasjon med trastuzumab i adjuvant situasjon viser klar bedring i invasiv sykdomsfri overlevelse (Aphinitystudien) for pasienter som var lymfeknute positive (von Minckwitz et al., 2017). Resultatene underbygger betydningen av bruk av pertuzumab spesielt hos høyrisikopasienter som vanligvis er kandidater for neoadjuvant behandling (betydelig effekt på pCR).
Neoadjuvant endokrin behandling
Pasienter med tumorbiologi som taler for primær nytte av endokrin behandling bør vurderes for neoadjuvant endokrin terapi. Dette gjelder Luminal A-lignende lokalavanserte svulster. Ved manglende tumorskrumpning under slik behandling eller manglende fall i Ki67 (dersom denne undersøkelsen gjentas), skal man skifte til kjemoterapi. Klinisk evaluering anbefales hver 3.‑4. uke av onkolog med erfaring i slik behandling, idet man må monitorere slike pasienter nøye og skifte behandling raskt ved vedvarende stabil sykdom (>2 mndr) eller progresjon. Det anbefales at man gjennomfører PAM50 analyse og/eller Ki67 på sylinderbiopsi tatt før behandlingsstart. Uten PAM50 kan Luminal A svulster best kjennetegnes ved lav Ki67, grad 1–2 differensiering og høy ER ekspresjon. Behandlingsvarighet av neoadjuvant endokrin behandling ved respons bør styres av effekten underveis, hvor fortsatt tilbakegang tilsier fortsatt endokrin behandling før operasjon. Behandlingsvarighet anbefales å være minimum 6 måneder (ved effekt), men bør fortsette opp til 8–12 måneder under nøye overvåking ved fortsatt tilbakegang av tumor etter 6 måneder. Dersom tumor ikke fortsetter å minske i størrelse bør pasienten enten opereres eller skiftes til annen behandling dersom resttumor er inoperabel / for stor for operasjon. Etter gjennomført operasjon vurderes respons på den endokrine behandling endelig. Dersom det vurderes å være ikke tilfredsstillende effekt av den neoadjuvante behandling og det ikke er tumorbiologiske karakteristika, medisinske grunner eller andre pasientrelaterte faktorer som eventuelt skulle tale mot kjemoterapi, bør det gis adjuvant kjemoterapi.
Retningslinjer for behandling av lokalavansert brystkreft
Anbefalinger:
Det anbefales at man alltid konsulterer og henviser pasienter til det regionale onkologiske senter før behandlingsvalg tas for pasienter med primært inoperabel brystkreftsykdom.
Pasienter som planlegges for neoadjuvant behandling bør primært vurderes for inklusjon i tilgjengelige prospektive studier.
Behandling utenfor studier
Det henvises til behandlingsveiledning i tabell under avnsittet "Oversikt over veiledende neoadjuvant behandlingsopplegg for pasienter utenfor klinisk studie" for oversikt.
Mange med lokalavansert brystkreft er i høyrisikogruppen og bør tilbys optimal kjemoterapi slik anført under avsnittet "Oversikt over veiledende neoadjuvant behandlingsopplegg for pasienter utenfor klinisk studie". Progresjon/manglende effekt underveis i behandlingen skal føre til endringer i behandlingsopplegget.
Studier taler for at non-respondere på for eksempel antracyklinholdig kjemoterapi som regime 1 gir redusert mulighet for effekt av regime 2 (inkludert taxan). Men likevel er det pasienter som responderer ved et skifte av behandling. Motsatt vil respons på regime 1 også tale for respons på regime 2.
Ved karakteristika som taler for mindre nytte av kjemoterapi (inkludert sterkt ER positivitet og lav proliferasjonsgrad og Grad <3) kan det være aktuelt å vurdere mindre intens kjemoterapi, eventuelt kun endokrin behandling (Petruolo et al., 2017). Endokrin neoadjuvant behandling anbefales til pasienter med tumorbiologi som taler for primært nytte av slik type behandling (i tråd med beskrivelsen tidligere i kapitlet).
HER2 positive pasienter skal behandles med taxan i kombinasjon med HER2-rettet behandling. Pasienter med lokalavansert brystkreft bør tilbys (neo)adjuvant behandling som inkluderer pertuzumab. Det anbefales å benytte kombinasjonen av taxan, trastuzumab og pertuzumab som del av den neoadjuvant behandling, som også er i tråd med med internasjonale anbefalinger. Grunnlaget er optimal skrumpning av store svulster før kirurgisk behandling og der det en klar sammenheng mellom pCR og bedre overlevelse (Broglio et al., 2016; Cortazar et al., 2014) (Evidensnivå A).
Responsevaluering skal gjøres regelmessig under behandlingen.
Etter kirurgi behandles HER2 positive pasienter som oppnådde pCR videre med adjuvant pertuzumab/trastuzumab postoperativt til totalt 12 mnd behandling (Evidensnivå A). Det foreligger ikke data som kan gi informasjon om varigheten av pertuzumab/trastuzumab kan forkortes til <12 mnd dersom det oppnås pCR ved operasjon (Denduluri et al., 2018). Pertuzumab/trastuzumab-behandlingen gis derfor i 12 mnd uavhengig av om operasjonen viste pCR eller ikke. For pasienter med hormonreseptor positiv og HER2 positiv sykdom kombineres pertuzumab/trastuzumab med endokrin terapi etter avsluttet kjemoterapi, inntil gjennomført 12 mnd anti-HER2 rettet behandling, deretter kun endokrin terapi videre. Ved påvist restsykdom i operasjonspreparatet endres adjuvant HER2-rettet behandling til trastuzumab-emtasin (kfr punkt 7.6.8).
Etter gjennomført neoadjuvant behandling av trippel negativ sykdom gis adjuvant behandling i tråd med anbefaling under avnittene "Bakgrunn for vurdering av eventuell bruk av platinum i neoadjuvant behandling av pasienter med kimcelle BRCA mutasjon og trippel negativ brystkreft" og "Adjuvant behandling av pasienter med BRCA1/BRCA2 kimcellemutasjon etter enten adjuvant kjemoterapi eller etter neoadjuvant kjemoterapi".
Ved hormonreseptor positiv HER2 negativ sykdom gis adjuvant endokrin behandling i tråd med retningslinjer anført tidligere (avnittet "Anbefalt behandling ved hormonreseptor positiv sykdom" i kapittelet Adjuvant hormonbehandling).
Responsevaluering skal gjøres regelmessig under behandlingen.
Planlegging av lokal behandling: Se kapitlene om kirurgisk behandling og om strålebehandling.
Veiledende behandlingsalgoritme (se nedenfor).
Oversikt over veiledende neoadjuvant behandlingsopplegg for pasienter utenfor klinisk studie
Hoved-gruppe | Subgruppe | Behandlingsopplegg ved tilfredsstillende respons | Evaluering – oppfølging | Ved utilfredsstillende respons |
|---|---|---|---|---|
ER+ HER2- | Sterkt ER+ og lav proliferasjon/Luminal A subtype | Endokrin behandling i form av AI (+ goserelin til premenopausale) til maksimal respons er oppnådd (6.-12. mnd) | Klinisk responsevaluering hver 3.-6. uke, billeddiagnostisk evaluering underveis ved behov. Dersom pasienten er kandidat for BCT gjennomføres MR mot slutten av behandlingstiden | Progresjon eller sikkert manglende respons på et hvilket som helst tidspunkt underveis i behandlingen bør medføre seponering og skifte til kjemoterapi eller vurdering for operasjon |
Alle andre | EC90 x 4 etterfulgt av 12 ukers taxan Mindre intens kjemoterapi kan vurderes på individuelt grunnlag ved for eksempel klassiske lobulære carcinomer eller andre med mer usikker nytte av kjemoterapi | Klinisk responsevaluering hver 3. uke, billeddiagnostisk evaluering underveis ved behov. Dersom pasienten er kandidat for BCT gjennomføres MR mot slutten av behandlingstiden | Progresjon eller sikkert manglende respons på et hvilket som helst tidspunkt underveis i behandlingen bør medføre seponering og skifte til annen behandling eller vurdering for operasjon | |
HER2+ | Alle | EC90 x 4 etterfulgt av 12 ukers taxan i kombinasjon med trastuzumab og pertuzumab hver 3. uke | Klinisk responsevaluering hver 3. uke, billeddiagnostisk evaluering underveis ved behov. Dersom pasienten er kandidat for BCT gjennomføres MR mot slutten av behandlingstiden | Progresjon eller sikkert manglende respons på et hvilket som helst tidspunkt underveis i behandlingen bør medføre seponering og skifte til annen behandling eller vurdering for operasjon |
Trippel negativ | BRCA ukjent, normal eller mutert | Pembrolizumab + 12 ukers paklitaxel/carboplatin etterfulgt av pembrolizumab + 4EC90 Paklitaxel/carboplatin etterfulgt av EC90 x 4 dersom ikke pembrolizumab kan gis Alternative behandlingsopsjoner (etter individuell vurdering):
| Klinisk responsevaluering hver 3. uke, billeddiagnostisk evaluering underveis ved behov. Dersom pasienten er kandidat for BCT gjennomføres MR mot slutten av behandlingstiden | Progresjon eller sikkert manglende respons på et hvilket som helst tidspunkt underveis i behandlingen bør medføre seponering og skifte til annen behandling eller vurdering for operasjon |
Adjuvant behandling for pasienter med rest-tumor etter neoadjuvant kjemoterapi
For HER2 positiv og trippel negativ brystkreft vet vi at der er en sterk assosiasjon mellom patologisk komplett respons (pCR) og overlevelse (Cortazar et al., 2014). Pasienter som ved operasjon etter neoadjuvant behandling ikke har fått pCR i bryst/aksille har klart dårligere prognose og økt risiko for tilbakefall av brystkreftsykdommen. I slike situasjoner kan det være aktuelt å gi ekstra behandling postoperativt (adjuvant situasjon).
Trippel negativ brystkeft
CREATE-X studien (n=910) undersøkte overlevelsesgevinsten av adjuvant capecitabine for pasienter med HER2 negativ brystkreft der neoadjuvant behandling (som inkluderte både antracyklin/cyklofosfamid og taxan hos de aller fleste) ikke gav pCR (Masuda et al., 2017). Studien ble avbrutt tidlig da man ved interimsanalyse fant forbedret overlevelse hos dem som fikk adjuvant capecitabine.
Sykdomsfri overlevelse (DFS) var 74.1 vs. 67.6 % i favør adjuvant capecitabine, etter 5 år (HR 0.70, p=0.01), mens totaloverlevelsen (OS) var 89.2 vs. 83.6 % (HR 0.59, P=0.01). For subgruppen med trippel negativ brystkreft var DFS 69.8 vs. 56.1 % i favør adjuvant capecitabine etter 5 år (HR 0.58), mens totaloverlevelsen var 78.8 vs. 70.3 % (HR 0.52, P=0.01). Subgruppeanalyser basert på grad av resttumor etter neoadjuvant behandling kan ikke tolkes direkte inn i den måten vi vanligvis klassifiserer grad av effekt av slik behandling i klinisk rutine, men resultatene tyder på at effekten først og fremst er til stede for pasienter som har litt større gjenværende svulster. Etter inklusjon av de første 157 pasientene ble studien endret fra 6 til 8 sykluser med capecitabine 1250 mg/m2 x2 daglig i 14 av 21 dager per syklus. Med 8 sykluser og denne dosen var det kun 38 % som klarte å fullføre behandlingen uten dosereduksjon og 25 % måtte avbryte behandlingen pga. toxisitet. Vanligste bivirkning var hånd-fotsyndrom (73 %), med 11 % grad 3 bivirkning.
Det har vært uklarhet knyttet til effekten av å legge til capecitabine i adjuvant behandling (Del Mastro et al., 2015; Joensuu et al., 2012; Lluch et al., 2020; Martín et al., 2015; Varshavsky-Yanovsky et al., 2020). I en tidligere publisert meta-analyse av studier av adjuvant capecitabine fant man ingen effekt av behandlingen ved brystkreft generelt, men kun hos pasienter med trippel negativ brystkreft (Natori et al., 2017). Ved SABCS 2019 ble det presentert en ny metaanalyse og en adjuvant studie som viste at å legge til capecitabine (uten at den erstattet annen kjemoterapi) som begge viste overlevelseseffekt av å benytte capecitabine (Li et al., 2020; van Mackelenbergh et al., 2020).
Ved ASCO2021 ble det også fremlagt en studie som sammenlignet adjuvant platinum med adjuvant capecitabine hos pasienter med ≥1 cm resttumor etter neoadjuvant behandling (ECOG-ACRIN EA1131)(primært basal-like subtype). Studien ble stoppet tidlig som følge av at det var klart høyere toksisitet i platinumarmen samtidig som sykdomsfri overlevelse etter 3 år ikke var forskjellig for behandlingsarmene (Mayer et al., 2021).
Anbefaling: Pasienter med trippel negativ brystkreft og betydelig gjenværende tumor ved operasjon bør vurderes for adjuvant capecitabine dersom neoadjuvant behandling ble gitt i form av EC90 i sekvens med taxan. Dette betyr pasienter som ved operasjon har ypN+ eller ≥ypT1c (>1 cm residual tumor). Anbefalt dosering av capecitabine er 8 sykluser, med 1000 mg/m2 x 2 i 14 av 21 dager. Dosen er lavere enn startdosen i CREATE-X, men de fleste i den studien måtte dosereduseres, og vår anbefalte dose er erfaringsmessig den høyeste akseptable dose i metastatisk setting. Tidspunkt for oppstart av capecitabine vil vanligvis være etter avsluttet strålebehandling. DPYD testing for å avklare DPD enzymaktivitet må bestilles for pasienter som er planlagt for capecitabine. Svar på denne undersøkelse vil avklare mulighet for å gjennomføre capecitabinebehandlingen og evt dosering.
Det finnes foreløpig ikke data på betydningen av capecitabine etter neoadjuvant behandling som har inkludert carboplatin/taxan i sekvens med antracyklin/cyklofosfamid, noe som betyr at det er vanskelig å gi en klar anbefaling om bruk av capecitabine i disse tilfeller. Slik bruk må i så fall skje etter individuell vurdering.
For pasienter som behandles med immunterapi (se 7.6.3) og ikke oppnår patologisk komplett respons foreligger det ingen resultater som direkte kan veilede postneoadjuvant behandling med capecitabine. Det er derfor ikke mulig å gi noen konkret anbefaling om bruk av capecitabine i kombinasjon med adjuvant pembrolizumab.
HER2-positiv brystkreft
På samme måte som CREATE-X studien studerte man effekten av adjuvant trastuzumab-emtansine (Kadcyla) i KATHERINE studien (von Minckwitz et al., 2019).
I KATHERINE-studien (n=1486) ble pasienter som hadde gjenværende cancer i bryst/armhule etter neoadjuvant behandling for HER2 positiv brystkreft randomisert til 14 sykluser med trastuzumab-emtansine eller trastuzumab. Neoadjuvant mottok pasientene taxan +/– anthracyklin (75 % fikk begge deler) og trastuzumab, dessuten hadde 18 % fått pertuzumab neoadjuvant.
Etter 3 år var 88.3 av pasientene som fikk trastuzumab-emtansine residivfrie sammenlignet med 77 % av pasientene som fikk trastuzumab (HR 0.50, p<0.001), mens totaloverlevelsen foreløpig ikke var forskjellig. Subgruppeanalyser taler for at det er effekten av trastuzumab-emtansine er uavhengig av størrelsen på resttumor etter neoadjuvant behandling, selv om effekten kan være mindre ved lite gjenværende tumorvev ved operasjonen.
Anbefaling: Adjuvant trastuzumab-emtansine 14 sykluser bør benyttes til pasienter med resttumor (i bryst eller lymfeknuter) etter neoadjuvant behandling for HER2 positiv brystkreft.
På individuelt grunnlag kan vurderingen påvirkes av forholdet mellom opprinnelig tumorutbredelse i brystet og funnene i operasjonspreparatet, spesielt hos pasienter med svært lite gjenværende tumorvev. T-DM1 bør startes opp så snart som mulig etter at histopatologi foreligger og vanligvis gis behandlingen samtidig med strålebehandling (dersom indikasjon for dette). Konkomitant behandling kan medføre noe økt risiko for strålereaksjoner. Dersom pasientene er hormonreseptor positive kan endokrin behandling startes opp samtidig med T-DM (i tråd med hva som ble gjennomført i KATHERINE studien).
Adjuvant trastuzumab-emtansine ved non-pCR etter neoadjuvant behandling for HER2 positiv anbefales også i St. Gallen consensus guidelines (Burstein et al., 2019; Burstein et al., 2021) og i ASCO guidelines (Denduluri et al., 2018).
Adjuvant behandling av pasienter med BRCA1/BRCA2 kimcellemutasjon etter enten adjuvant kjemoterapi eller etter neoadjuvant kjemoterapi
PARP hemmere har vist effekter ved kreftsykdommer som har defekter i homolog rekombinasjon reparasjon, slik som hos BRCA1/2 kimcellemuterte. Det er nå publisert resultater fra OlympiA studien som randomiserte BRCA1/2 kimcellemuterte pasienter mellom adjuvant olaparib (300 mg x 2 i ett år) eller placebo etter gjennomgått (neo)adjuvant kjemoterapi (Tutt et al., 2021). Inklusjonkriteriene var 1) pasienter med TNBC som fikk adjuvant kjemoterapi i stadium pT2 eller pN+, eller de fikk neoadjuvant behandling og hadde resttumor i operasjonspreparatet; 2) Hormonreseptor positive HER2 negative pasienter med pN2 eller pN3 lymfeknutestatus som fikk adjuvant kjemoterapi, eller de fikk neoadjuvant behandling og hadde resttumor og CPS+EG score ≥3 (se under) (Mittendorf et al., 2011). Etter median 2.5 års FU viste resultatene at 3 års invasiv sykdomsfri overlevelse var 85.9% for pasienter som fikk olaparib sammenlignet med 77.1% i placebogruppen (HR 0.58, 95% CI 0.41-0.82). Forskjell i metastasefri overlevelse var 7.1% (Tutt et al., 2021). Oppdaterte interimresultater etter 3.5 års median oppfølging viser hhv 7.3% og 7.4% bedring i 4 års invasiv sykdomsfri overlevelse og metastasefri overlevelse ved bruk av olaparib. Totaloverlevelsen var også signifikant bedret (HR 0.68; 98.5% CI 0.47-0.97; P = 0.009), 3.8% og 3.4% bedring i OS etter hhv 3 og 4 år (Geyer et al., 2022a). Behandlingen er godt tolerert sammenlignet med kjemoterapi. Resultatene er meget overbevisende. Behandlingen ble 28.08 2023 godkjent i Nye Metoder (nyemetoder.no).
Anbefaling: Følgende pasienter bør tilbys adjuvant olaparib 300 mg x 2 i ett år:
- TNBC BRCA1/2 muterte pasienter med N+ eller T2 sykdom dersom primæroperert eller dersom neoadjuvant behandling og restsykdom i bryst eller lymfeknuter. Dersom pasienten også faller innenfor kriteriene for å motta postneoadjuvant capecitabine, anbefales olaparib fremfor capecitabine.
- Hormonreseptor positive HER2 negative BRCA1/2 muterte pasienter med pN2 eller pN3 lymfeknutestatus dersom primæroperert, eller dersom neoadjuvant behandling ved stadium 2/3 og restsykdom i bryst eller lymfeknuter og CPS+EG score ≥3 (kalkulering av score (medilib.ir).
Behandlingen oppstartes etter stråleterapi, dersom det er indikasjon for dette.
For trippel negative pasienter som behandles med immunterapi (se 7.6.3) og ikke oppnår patologisk komplett respons foreligger det ingen resultater som direkte kan veilede postneoadjuvant behandling. Det er derfor ikke mulig å gi noen konkret anbefaling om bruk av olaparib i kombinasjon med adjuvant pembrolizumab.
Pasienter med T2 svulster eller cT1N1 stadium
Det kan være vanskelig å vurdere om en pasient har en svulst som skal klassifiseres som cT2 eller cT3. Vurdering av neoadjuvant behandling kan være aktuell selv om det til slutt konkluderes med cT2 som T stadium. I tillegg har St. Gallen konsensus også anbefalt bruk av neoadjuvant behandling både av T2-svulster og ved cT1N1 stadium spesielt ved HER2 positiv eller trippel negativ status (Curigliano et al., 2017). I tråd med dette bør det vurderes neoadjuvant behandling av disse pasientene. Behandlingen kan også foregå på de sykehus som innehar kompetanse, men som ikke tidligere har hatt ansvar for neoadjuvant behandling – se anbefalinger innledningsvis i kapitlet (kapittel "Adjuvant hormonbehandling").
Fordelene med også å behandle pasienter med T2-svulster/cT1cN1 stadium preoperativt er:
- Prospektivt å kunne evaluere effekt av behandlingen og eventuelt endre den.
- Å kunne de-eskalere kirurgi, dvs øke andel BCT med små inngrep og å redusere antall aksilledisseksjoner. Det presiseres behovet for merking av tumor før oppstart neoadjuvant behandling.
- Deltagelse i kliniske studier oppfattes som viktig ved neoadjuvant behandling, også ved T2‑svulster.
Man har per i dag ikke evidens for å si at neoadjuvant behandling bedrer prognosen, sammenlignet med adjuvant behandling, men det gir mulighet for å kunne monitorere effekt av terapi og ved manglende respons grunnlag for å endre behandlingen. Neoadjuvant behandling krever at den faglige kompetansen hos alle i det tverrfaglige temaet er høy (patologidiagnostikk, radiologi, kirurgi, onkologi; konferer innledningsvis i kapitlet). Ved neoadjuvant behandling av T2 svulster/cT1cN1 stadium vil man hos langt flere av pasientene ha behov for gjentatte MR mamma-undersøkelser underveis i behandlingen for å monitorere behandlingseffekt da svulstene oftere ikke er palpable, sammenlignet med T3/T4 svulster.
Anbefalinger:
Den neoadjuvante og adjuvante behandling som anbefales er samsvarende med det som er beskrevet i avsnittet om lokalavansert brystkreft og i avsnittet om adjuvant behandling, ut i fra tumorutbredelse, stadium, og eventuelt vurdering av resttumor etter den neoadjuvante behandling.
Planlegging av lokal behandling: Se kapitlene om kirurgisk behandling og om strålebehandling.
Fertilitetsbevarende tilbud ved brystkreft
Hensikt og omfang
Sist faglig oppdatert: 02202402.07.2024
Hensikten er å beskrive aktuelle fertilitetsbevarende tiltak for brystkreftpasienter i reproduktiv alder.
Anbefalingene gjelder for onkologer, kirurger og gynekologer som vurderer pasienter med nylig diagnostisert brystkreft.
Risiko for nedsatt fertilitet ved brystkreft
Sist faglig oppdatert: 02202402.07.2024
Fertiliteten hos de fleste kvinner som har vært behandlet for brystkreft er redusert (Stensheim et al., 2011). Årsaken er sammensatt, men kreftbehandling er en viktig faktor. Cyklofosfamid, som tilhører gruppen alkylerende cellegifter, er særlig kjent for å gi risiko for infertilitet, og dette middelet benyttes i flere kombinasjonsregimer for pasienter med brystkreft. Vær oppmerksom på at man mangler dokumentasjon om effekten av nyere behandlingsregimer (Bines et al., 1996; Koyama et al., 1977; Warne et al., 1973).
Tabellen viser forekomst av kjemoterapi-assosiert amenoré ved vanlige behandlingsregimer (Waks et al., 2016). De fleste studier har undersøkt amenoré som primært endepunkt, som er et unøyaktig mål for å estimere forekomst av infertilitet og sterilitet.
Chemotherapy | Age ≤30 y | Age 31–35 y | Age 36–40 y | Age >40 y |
|---|---|---|---|---|
CMF50,a | 19 % | 30–40 % |
| 80–95 % |
CMF14,a,b | 40 % |
|
| 76 % |
CMF14,a | 4 % |
| 50 % | 86–100 % |
CEF51 | 47 % |
|
| 80–100 % |
A-containing14 | 0 % | 33 % |
| 96–100 % |
AC12 | 13.9 % |
| 68.2 % |
|
AC-T12 | 9–13 % |
| 65–73 % |
|
AC-T +/– H 15 | 9–20 % | 19–47 % | 21–61 % | No data |
AC-TH12 | 0–14 % |
| 56–67 % |
|
TH18 | 28 % |
|
|
|
Abbreviations: A, doxorubicin; AC, doxorubicin/cyclophosphamide; CEF, cyclophosphamide/epirubicin/5‑fluorouracil; CMF, cyclophosphamide/methotrexate/5-fluorouracil; H, trastuzumab; T, paclitaxel; TH, paclitaxel/trastuzumab.
a. Either these data reflect combinations of cyclophosphamide administration raute (intravenous vs oral) and duration, or those specifics are not available.
b. AII patients treated with CMF for at least 3 months.
Gjengitt fra Waks et al., 2016. Med tillatelse fra Harborside Press i 2024.
Pasientinformasjon
Sist faglig oppdatert: 02202402.07.2024
Pasienten må få individuelt tilpasset informasjon om forventet fertilitetstap og mulige behandlingsalternativer. Rask henvisning til fertilitetsspesialist og grundig diskusjon av fordeler og ulemper ved mulige alternativer øker pasienttilfredsheten. Kreftpasienter kan ha urealistiske forventninger til behandlingsresultater (Deshpande, Braun, & Meyer, 2015). Overbehandling kan forekomme, siden erfaringsvis få pasienter benytter nedfrosset biologisk materiale for å gjenetablere fertilitet (Cobo, Garcia-Velasco, Domingo, Pellicer, & Remohi, 2018; Moravek et al., 2018).
Informasjonsmateriale for pasienter om fertilitet etter kreftbehandling er tilgjengelig på internett. Informasjon om nedfrysing av ovarialvev er tilgengelig på nettsidene til Kreftlex og Ungkreft.
Regelverk
Sist faglig oppdatert: 02202402.07.2024
Nedfrysing av egg, embryo eller eggstokkvev er ikke en rettighetsbehandling etter pasientrettighetsloven § 2‑1 b, bestemmelser om rett til nødvendig helsehjelp. Tilgang til nedfrysing av egg, embryo eller eggstokkvev reguleres i bioteknologiloven.
Nedfrysing av befruktede egg er kun aktuelt når pasienten tilfredsstiller lovens krav om assistert befruktning, dvs paret er gift eller samboere i ekteskapslignende forhold; paret er medisinsk og psykososialt egnet med hensyn til omsorgsevne og det fremtidige barnets beste. Nedfryste embryo kan oppbevares i 5 år uten mulighet til forlengelse.
Lagrede ubefruktede egg og lagret eggstokkvev kan bare oppbevares så lenge hensynet til kvinnen som har avgitt materialet, tilsier det og det kan anses medisinsk forsvarlig, i praksis til kvinnen er 42 år gammel.
Lagrede egg, embryo og eggstokkvev kan kun settes tilbake til kvinnen som har avgitt vev. Ved pasientens død skal materialet destrueres.
Behandlingsalternativer for å forebygge tap av fertilitet
Sist faglig oppdatert: 02202402.07.2024
Nedfrysing av ubefruktede egg
Pasienten må gjennomgå gonadotropinstimulering med FSH for å øke antall modne oocytter som kan høstes ved transvaginal ultralydveiledet punksjon. Gonadotropinstimulering varer ca 7–14 dager og medfører en kortvarig økning i serum østradiol (ca tidobling; toppkonsentrasjon 1–20 nmol/l; referanseverdier i follikkelfase 0,09–0,21 nmol/l).
Pasienten gis antiøstrogen eller aromatasehemmer under hormonstimulering (tamoksifen 40 mg daglig eller letrozol 2,5 mg daglig; off-label foreskriving, unntak må begrunnes i pasientjournalen). Ovulasjonsinduksjon med hCG bør unngås, bruk av GnRH agonist analog foretrekkes (for eksempel bolus injeksjon med Gonapeptyl 100 μg). Hormonstimulering med samtidig antiøstrogen antas å være trygg og gir ikke økt risiko for tilbakefall (Azim, Costantini-Ferrando, & Oktay, 2012).
I en vanlig behandlingssyklus høstes 10–15 oocytter som fryses ned ved vitrifisering. Det er begrenset erfaring med nedfrysing av oocytter i Norge. Publiserte data viser at for å oppnå et svangerskap, må det fryses 12 oocytter når kvinnen er 30–36 år og 30 oocytter når kvinnen er 36–39 år (Chang et al., 2013). Behandlingen kan utføres ved Reproduksjonsmedisinsk seksjon, OUS.
Nomogram for estimering av sannsynlighet for fødsel er tilgjengelig [lenke].
Behandlingen kan utføres ved offentlige fertilitetsklinikker.
Nedfrysing av befruktede egg
Behandlingen innebærer gonadotropinstimulering som beskrevet ovenfor, uttak av egg, befruktning utenfor kroppen og langtidslagring av befruktede egg. Behandlingen er godt etablert ved flere fertilitetsklinikker, kumulativ fødselsrate etter ett forsøk med nedfrysing antas å være ca 20–25 %. Behandlingen kan utføres ved alle fertilitetsklinikker. Vær oppmerksom på stengetid rundt høytider og i fellesferien. OUS har beredskap gjennom hele året.
Nedfrysing av ovarialvev
Prosedyren innebærer unilateral ooforektomi og langtidslagring av eggstokkvev. Prosedyren er utprøvende. Det er født flere friske barn i Norge etter tilbakesetting av nedfrosset og opptint eggstokkvev (Tanbo et al., 2015), og ca. 50 på verdensbasis. Risikoen for kontaminering av vev med mikrometastaser ansees som liten ved brystkreft. Vær oppmerksom på at unilateral ooforektomi kan redusere spontan fertilitet (Wilkosz, Greggains, Tanbo, & Fedorcsak, 2014), og nedfrysing av eggstokkvev kun anbefales ved høy risiko (> 50 %) for kjemoterapi-indusert sterilitet. Samlet suksessrate etter tilbakesetting av eggstokkvev er usikker. Ved Rigshospitalet i Købehavn, har 10 av 32 kvinner født barn etter autotransplantasjon av eggstokkvev (Jensen et al., 2015). Per april 2020 har 7 av 20 kvinner (35 %) blitt gravide etter autotransplantasjon av eggstokkvev ved OUS.
Kjemoproteksjon med GnRH agonist
Kontinuerlig behandling med GnRH agonist analoger supprimerer eggstokkens funksjon og kan forebygge tap av ovarialreserve. Det er publisert flere studier hvor pasientene er randomisert til kjemoterapi med og uten GnRH. Få av studiene har graviditet som endepunkt, de fleste bruker «andel kvinner med amenore». To studier har vist beskyttende effekt (PROMISE og POEMS). Behandling med GnRH agonist i POEMS studien (Pasienter med hormonreseptor-negative brystkreftsvulster) økte fødselsraten etter kjemoterapi fra 11 % til 21 %. I PROMISE studien (80 % pasienter med hormonreseptor-positive brystkreftsvulster) ble forekomst av tidlig menopause redusert fra 25,9 til 8,9 % med GnRH agonist (L. Del Mastro, Boni, Michelotti, & et al., 2011; Lucia Del Mastro et al., 2014; H. C. F. Moore et al., 2015).
Enkelte metaanalyser har rapportert lavere andel pasienter med amenore med tillegg av GnRH (Lambertini et al., 2015). Andre metaanalyser har ikke kunnet påvise de samme signifikante forskjeller med tillegg av GnRH (Elgindy, Sibai, Abdelghani, & Mostafa, 2015; Vitek et al., 2014). Det er noe motstridende evidens på å anbefale GnRH agonist alene som fertilitetsbevarende behandling. Behandling med GnRH agonist skal derfor ikke erstatte de etablerte metodene som nedfrysing av embryo og egg. GnRH kan tilbys pasienter i håp om å redusere sannsynligheten for kjemoindusert ovariesvikt.
Behandlingen bør starte 1–2 uker før oppstart av kjemoterapi og gis under kjemoterapiperioden. Kvinner som har en hormonreseptor positiv sykdom bør fortsette med GnRH agonist sammen med tamoksifen eller aromatasehemmer. Anbefalt regime er goserelin 3.6 mg hver 4. uke. Behandlingen igangsettes av av onkologisk avdeling der pasientens kreftsykdom behandles. Oppstart med GnRH agonist må avventes hvis pasienten skal til nedfrysing av egg eller eggstokkvev.
Vurderingskriterier
Sist faglig oppdatert: 02202402.07.2024
Alder
Viktigste vurderingskriterium, bestemmer risiko for fertilitetstap og mulig gevinst av fertilitetsbevarende behandling.
Sivilstatus
Nedfrysing av befruktede egg er kun aktuelt hos kvinner som er gifte eller samboere i ekteskapslignende forhold. Videre må paret være medisinsk og psykososialt egnet for å gjennomgå assistert befruktning.
Reproduksjonsanamnese
Pasienter som allerede har barn med sin partner bør ikke tilbys nedfrysing av eggstokkvev.
Ovarialreserve
Sammen med alder, er ovarialreserve estimert ved serum AMH (anti-müllersk hormon) eller antall antrallfollikler det viktigste vurderingskriterium. Pasienter med svært nedsatt ovarialreserve (AMH < 3 pmol/l) har redusert nytte av fertilitetsbevarende behandling. Uforholdsmessig lav AMH i forhold til alder må kontrolleres med ny test.
Histologi
Histologisk type eller reseptorstatus bør ikke påvirke valg av fertilitetsbevarende behandling.
Stadium
Pasienter med fjernmetastaser bør ikke tilbys fertilitetsbevarende behandling.
Adjuvant behandling
Lengden av postoperativ adjuvant behandling må tas hensyn til. Man tror ikke at graviditet etter brystkreftbehandling øker risiko for tilbakefall, men det er foreløpig uavklart om det er trygt å avbryte eller forkorte eventuell hormonbehandlingen for å prøve å bli gravid.
BRCA
Nedfrysing av eggstokkvev er ikke aktuelt for pasienter som er bærere av BRCA-mutasjon på grunn av stor risiko for ovarialkreft.
Henvisningsinformasjon
Sist faglig oppdatert: 02202402.07.2024
Henvisning sendes til regionalt fertilitetsbevarende senter.
Henviser må opplyse om:
- personalia
- sivilstatus
- partners personalia, hvis aktuelt
- reproduksjonsanamnese
- histologi og stadium
- BRCA-status
- serum AMH, helst også antall antralfollikler sett ved transvaginal ultralydundersøkelse
- hvis mulig, serum FSH, LH og østradiol, som bør tas på 3. syklusdag
- infeksjonsserologi for HIV, HBV, HCV og syfilis
Anbefalinger
Sist faglig oppdatert: 02202402.07.2024
Alle brystkreftpasienter i reproduktiv alder bør få informasjon om risiko for infertilitet og alternativer for fertilitetsbevaring.
Informasjon bør tilpasses individuelt.
Pasienten bør henvises til vurdering av fertilitetsbevarende tiltak så tidlig som mulig, helst ved første kirurgiske konsultasjon, for å få tid til slik behandling før oppstart av adjuvant kjemoterapi.
Fertilitetsbevarende behandling må ikke forsinke oppstart med kjemoterapi.
Alder | Sivilstatus | Nedfrysing av ubefruktede egg | Nedfrysing av befruktede egg | Nedfrysing av eggstokkvev | Suppresjon med GnRH agonist |
|---|---|---|---|---|---|
<30 år | Enslig | X |
|
| X |
gift/samboer |
| X |
| X | |
30–35 år | Enslig | X |
| X | X |
gift/samboer |
| X | X | X | |
>35 år | Enslig | X |
|
| X |
gift/samboer |
| X |
| X |
Definisjoner
Ovarialreserve – eggstokkens gjenværende anlegg av primordialfollikler.
Kan i begrenset grad estimeres med serum AMH eller antall antralfollikler ved utlralyd.
Aktuelle anbefalinger
Fertility Preservation for Patients With Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update (2013) ASCO [lenke]
Fertilitetsbevaring ved malign sykdom (2014) Dansk fertilitetsselskab [lenke]
Pregnancy and breast cancer (2011) Royal College of Obstetricians & Gynaecologists [lenke]
Cryopreservation to preserve fertility in people diagnosed with cancer (2016) National Institute for Health and Care Excellence [lenke]
Fertilitetsbevarende tiltak hos kvinner med kreft (2015) Veileder for gynekologi [lenke]
Nedfrysing av ovarialvev (2012) Pasientinformasjon ved kreftlex.no [lenke]
Fertilitetsbevarende behandling (2020) Pasientinformasjon ved ungkreft.no [lenke]
Hensikt og omfang
Sist faglig oppdatert: 02202402.07.2024
Hensikten er å beskrive aktuelle fertilitetsbevarende tiltak for brystkreftpasienter i reproduktiv alder.
Anbefalingene gjelder for onkologer, kirurger og gynekologer som vurderer pasienter med nylig diagnostisert brystkreft.
Risiko for nedsatt fertilitet ved brystkreft
Sist faglig oppdatert: 02202402.07.2024
Fertiliteten hos de fleste kvinner som har vært behandlet for brystkreft er redusert (Stensheim et al., 2011). Årsaken er sammensatt, men kreftbehandling er en viktig faktor. Cyklofosfamid, som tilhører gruppen alkylerende cellegifter, er særlig kjent for å gi risiko for infertilitet, og dette middelet benyttes i flere kombinasjonsregimer for pasienter med brystkreft. Vær oppmerksom på at man mangler dokumentasjon om effekten av nyere behandlingsregimer (Bines et al., 1996; Koyama et al., 1977; Warne et al., 1973).
Tabellen viser forekomst av kjemoterapi-assosiert amenoré ved vanlige behandlingsregimer (Waks et al., 2016). De fleste studier har undersøkt amenoré som primært endepunkt, som er et unøyaktig mål for å estimere forekomst av infertilitet og sterilitet.
Chemotherapy | Age ≤30 y | Age 31–35 y | Age 36–40 y | Age >40 y |
|---|---|---|---|---|
CMF50,a | 19 % | 30–40 % |
| 80–95 % |
CMF14,a,b | 40 % |
|
| 76 % |
CMF14,a | 4 % |
| 50 % | 86–100 % |
CEF51 | 47 % |
|
| 80–100 % |
A-containing14 | 0 % | 33 % |
| 96–100 % |
AC12 | 13.9 % |
| 68.2 % |
|
AC-T12 | 9–13 % |
| 65–73 % |
|
AC-T +/– H 15 | 9–20 % | 19–47 % | 21–61 % | No data |
AC-TH12 | 0–14 % |
| 56–67 % |
|
TH18 | 28 % |
|
|
|
Abbreviations: A, doxorubicin; AC, doxorubicin/cyclophosphamide; CEF, cyclophosphamide/epirubicin/5‑fluorouracil; CMF, cyclophosphamide/methotrexate/5-fluorouracil; H, trastuzumab; T, paclitaxel; TH, paclitaxel/trastuzumab.
a. Either these data reflect combinations of cyclophosphamide administration raute (intravenous vs oral) and duration, or those specifics are not available.
b. AII patients treated with CMF for at least 3 months.
Gjengitt fra Waks et al., 2016. Med tillatelse fra Harborside Press i 2024.
Pasientinformasjon
Sist faglig oppdatert: 02202402.07.2024
Pasienten må få individuelt tilpasset informasjon om forventet fertilitetstap og mulige behandlingsalternativer. Rask henvisning til fertilitetsspesialist og grundig diskusjon av fordeler og ulemper ved mulige alternativer øker pasienttilfredsheten. Kreftpasienter kan ha urealistiske forventninger til behandlingsresultater (Deshpande, Braun, & Meyer, 2015). Overbehandling kan forekomme, siden erfaringsvis få pasienter benytter nedfrosset biologisk materiale for å gjenetablere fertilitet (Cobo, Garcia-Velasco, Domingo, Pellicer, & Remohi, 2018; Moravek et al., 2018).
Informasjonsmateriale for pasienter om fertilitet etter kreftbehandling er tilgjengelig på internett. Informasjon om nedfrysing av ovarialvev er tilgengelig på nettsidene til Kreftlex og Ungkreft.
Regelverk
Sist faglig oppdatert: 02202402.07.2024
Nedfrysing av egg, embryo eller eggstokkvev er ikke en rettighetsbehandling etter pasientrettighetsloven § 2‑1 b, bestemmelser om rett til nødvendig helsehjelp. Tilgang til nedfrysing av egg, embryo eller eggstokkvev reguleres i bioteknologiloven.
Nedfrysing av befruktede egg er kun aktuelt når pasienten tilfredsstiller lovens krav om assistert befruktning, dvs paret er gift eller samboere i ekteskapslignende forhold; paret er medisinsk og psykososialt egnet med hensyn til omsorgsevne og det fremtidige barnets beste. Nedfryste embryo kan oppbevares i 5 år uten mulighet til forlengelse.
Lagrede ubefruktede egg og lagret eggstokkvev kan bare oppbevares så lenge hensynet til kvinnen som har avgitt materialet, tilsier det og det kan anses medisinsk forsvarlig, i praksis til kvinnen er 42 år gammel.
Lagrede egg, embryo og eggstokkvev kan kun settes tilbake til kvinnen som har avgitt vev. Ved pasientens død skal materialet destrueres.
Behandlingsalternativer for å forebygge tap av fertilitet
Sist faglig oppdatert: 02202402.07.2024
Nedfrysing av ubefruktede egg
Pasienten må gjennomgå gonadotropinstimulering med FSH for å øke antall modne oocytter som kan høstes ved transvaginal ultralydveiledet punksjon. Gonadotropinstimulering varer ca 7–14 dager og medfører en kortvarig økning i serum østradiol (ca tidobling; toppkonsentrasjon 1–20 nmol/l; referanseverdier i follikkelfase 0,09–0,21 nmol/l).
Pasienten gis antiøstrogen eller aromatasehemmer under hormonstimulering (tamoksifen 40 mg daglig eller letrozol 2,5 mg daglig; off-label foreskriving, unntak må begrunnes i pasientjournalen). Ovulasjonsinduksjon med hCG bør unngås, bruk av GnRH agonist analog foretrekkes (for eksempel bolus injeksjon med Gonapeptyl 100 μg). Hormonstimulering med samtidig antiøstrogen antas å være trygg og gir ikke økt risiko for tilbakefall (Azim, Costantini-Ferrando, & Oktay, 2012).
I en vanlig behandlingssyklus høstes 10–15 oocytter som fryses ned ved vitrifisering. Det er begrenset erfaring med nedfrysing av oocytter i Norge. Publiserte data viser at for å oppnå et svangerskap, må det fryses 12 oocytter når kvinnen er 30–36 år og 30 oocytter når kvinnen er 36–39 år (Chang et al., 2013). Behandlingen kan utføres ved Reproduksjonsmedisinsk seksjon, OUS.
Nomogram for estimering av sannsynlighet for fødsel er tilgjengelig [lenke].
Behandlingen kan utføres ved offentlige fertilitetsklinikker.
Nedfrysing av befruktede egg
Behandlingen innebærer gonadotropinstimulering som beskrevet ovenfor, uttak av egg, befruktning utenfor kroppen og langtidslagring av befruktede egg. Behandlingen er godt etablert ved flere fertilitetsklinikker, kumulativ fødselsrate etter ett forsøk med nedfrysing antas å være ca 20–25 %. Behandlingen kan utføres ved alle fertilitetsklinikker. Vær oppmerksom på stengetid rundt høytider og i fellesferien. OUS har beredskap gjennom hele året.
Nedfrysing av ovarialvev
Prosedyren innebærer unilateral ooforektomi og langtidslagring av eggstokkvev. Prosedyren er utprøvende. Det er født flere friske barn i Norge etter tilbakesetting av nedfrosset og opptint eggstokkvev (Tanbo et al., 2015), og ca. 50 på verdensbasis. Risikoen for kontaminering av vev med mikrometastaser ansees som liten ved brystkreft. Vær oppmerksom på at unilateral ooforektomi kan redusere spontan fertilitet (Wilkosz, Greggains, Tanbo, & Fedorcsak, 2014), og nedfrysing av eggstokkvev kun anbefales ved høy risiko (> 50 %) for kjemoterapi-indusert sterilitet. Samlet suksessrate etter tilbakesetting av eggstokkvev er usikker. Ved Rigshospitalet i Købehavn, har 10 av 32 kvinner født barn etter autotransplantasjon av eggstokkvev (Jensen et al., 2015). Per april 2020 har 7 av 20 kvinner (35 %) blitt gravide etter autotransplantasjon av eggstokkvev ved OUS.
Kjemoproteksjon med GnRH agonist
Kontinuerlig behandling med GnRH agonist analoger supprimerer eggstokkens funksjon og kan forebygge tap av ovarialreserve. Det er publisert flere studier hvor pasientene er randomisert til kjemoterapi med og uten GnRH. Få av studiene har graviditet som endepunkt, de fleste bruker «andel kvinner med amenore». To studier har vist beskyttende effekt (PROMISE og POEMS). Behandling med GnRH agonist i POEMS studien (Pasienter med hormonreseptor-negative brystkreftsvulster) økte fødselsraten etter kjemoterapi fra 11 % til 21 %. I PROMISE studien (80 % pasienter med hormonreseptor-positive brystkreftsvulster) ble forekomst av tidlig menopause redusert fra 25,9 til 8,9 % med GnRH agonist (L. Del Mastro, Boni, Michelotti, & et al., 2011; Lucia Del Mastro et al., 2014; H. C. F. Moore et al., 2015).
Enkelte metaanalyser har rapportert lavere andel pasienter med amenore med tillegg av GnRH (Lambertini et al., 2015). Andre metaanalyser har ikke kunnet påvise de samme signifikante forskjeller med tillegg av GnRH (Elgindy, Sibai, Abdelghani, & Mostafa, 2015; Vitek et al., 2014). Det er noe motstridende evidens på å anbefale GnRH agonist alene som fertilitetsbevarende behandling. Behandling med GnRH agonist skal derfor ikke erstatte de etablerte metodene som nedfrysing av embryo og egg. GnRH kan tilbys pasienter i håp om å redusere sannsynligheten for kjemoindusert ovariesvikt.
Behandlingen bør starte 1–2 uker før oppstart av kjemoterapi og gis under kjemoterapiperioden. Kvinner som har en hormonreseptor positiv sykdom bør fortsette med GnRH agonist sammen med tamoksifen eller aromatasehemmer. Anbefalt regime er goserelin 3.6 mg hver 4. uke. Behandlingen igangsettes av av onkologisk avdeling der pasientens kreftsykdom behandles. Oppstart med GnRH agonist må avventes hvis pasienten skal til nedfrysing av egg eller eggstokkvev.
Vurderingskriterier
Sist faglig oppdatert: 02202402.07.2024
Alder
Viktigste vurderingskriterium, bestemmer risiko for fertilitetstap og mulig gevinst av fertilitetsbevarende behandling.
Sivilstatus
Nedfrysing av befruktede egg er kun aktuelt hos kvinner som er gifte eller samboere i ekteskapslignende forhold. Videre må paret være medisinsk og psykososialt egnet for å gjennomgå assistert befruktning.
Reproduksjonsanamnese
Pasienter som allerede har barn med sin partner bør ikke tilbys nedfrysing av eggstokkvev.
Ovarialreserve
Sammen med alder, er ovarialreserve estimert ved serum AMH (anti-müllersk hormon) eller antall antrallfollikler det viktigste vurderingskriterium. Pasienter med svært nedsatt ovarialreserve (AMH < 3 pmol/l) har redusert nytte av fertilitetsbevarende behandling. Uforholdsmessig lav AMH i forhold til alder må kontrolleres med ny test.
Histologi
Histologisk type eller reseptorstatus bør ikke påvirke valg av fertilitetsbevarende behandling.
Stadium
Pasienter med fjernmetastaser bør ikke tilbys fertilitetsbevarende behandling.
Adjuvant behandling
Lengden av postoperativ adjuvant behandling må tas hensyn til. Man tror ikke at graviditet etter brystkreftbehandling øker risiko for tilbakefall, men det er foreløpig uavklart om det er trygt å avbryte eller forkorte eventuell hormonbehandlingen for å prøve å bli gravid.
BRCA
Nedfrysing av eggstokkvev er ikke aktuelt for pasienter som er bærere av BRCA-mutasjon på grunn av stor risiko for ovarialkreft.
Henvisningsinformasjon
Sist faglig oppdatert: 02202402.07.2024
Henvisning sendes til regionalt fertilitetsbevarende senter.
Henviser må opplyse om:
- personalia
- sivilstatus
- partners personalia, hvis aktuelt
- reproduksjonsanamnese
- histologi og stadium
- BRCA-status
- serum AMH, helst også antall antralfollikler sett ved transvaginal ultralydundersøkelse
- hvis mulig, serum FSH, LH og østradiol, som bør tas på 3. syklusdag
- infeksjonsserologi for HIV, HBV, HCV og syfilis
Anbefalinger
Sist faglig oppdatert: 02202402.07.2024
Alle brystkreftpasienter i reproduktiv alder bør få informasjon om risiko for infertilitet og alternativer for fertilitetsbevaring.
Informasjon bør tilpasses individuelt.
Pasienten bør henvises til vurdering av fertilitetsbevarende tiltak så tidlig som mulig, helst ved første kirurgiske konsultasjon, for å få tid til slik behandling før oppstart av adjuvant kjemoterapi.
Fertilitetsbevarende behandling må ikke forsinke oppstart med kjemoterapi.
Alder | Sivilstatus | Nedfrysing av ubefruktede egg | Nedfrysing av befruktede egg | Nedfrysing av eggstokkvev | Suppresjon med GnRH agonist |
|---|---|---|---|---|---|
<30 år | Enslig | X |
|
| X |
gift/samboer |
| X |
| X | |
30–35 år | Enslig | X |
| X | X |
gift/samboer |
| X | X | X | |
>35 år | Enslig | X |
|
| X |
gift/samboer |
| X |
| X |
Definisjoner
Ovarialreserve – eggstokkens gjenværende anlegg av primordialfollikler.
Kan i begrenset grad estimeres med serum AMH eller antall antralfollikler ved utlralyd.
Aktuelle anbefalinger
Fertility Preservation for Patients With Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update (2013) ASCO [lenke]
Fertilitetsbevaring ved malign sykdom (2014) Dansk fertilitetsselskab [lenke]
Pregnancy and breast cancer (2011) Royal College of Obstetricians & Gynaecologists [lenke]
Cryopreservation to preserve fertility in people diagnosed with cancer (2016) National Institute for Health and Care Excellence [lenke]
Fertilitetsbevarende tiltak hos kvinner med kreft (2015) Veileder for gynekologi [lenke]
Nedfrysing av ovarialvev (2012) Pasientinformasjon ved kreftlex.no [lenke]
Fertilitetsbevarende behandling (2020) Pasientinformasjon ved ungkreft.no [lenke]
Brystkreft under graviditet
Sist faglig oppdatert: 02202402.07.2024
Brystkreft diagnostisert under graviditet forekommer sjelden og er rapportert i en frekvens av 1 per 3000 graviditeter.
Utredning
Sist faglig oppdatert: 02202402.07.2024
Kul/kuler i brystet under graviditet er vanskelig å tolke på grunn av forandringene i brystene som skyldes graviditeten. Dersom lege etter anamneseopptak og klinisk undersøkelse mistenker tilstedeværelse av en bakenforliggende tumor, bør pasienten utredes for å avkrefte/bekrefte en eventuell kreftdiagnose. Utredningen må gjennomføres uten at fosteret skades. Utredning følger samme prinsipp som hos ikke-gravide kvinner, se kapittelet Diagnostisering og utredning.
Ytterligere utredning gjennomføres dersom man antar at det vil få behandlingsmessige følger. Metastaseutredning kan utføres med røntgen thorax og ultralyd lever. Ved mistanke om skjelettmetastaser kan skjelettscintigrafi med innlagt blærekateter utføres (blærekateter for å fjerne opphopning av radioaktivitet i blæren), men MR columna/bekken (eventuelt med tillegg av MR thoraxskjelett) (uten gadolinium) anbefales primært.
Det er også viktig å få vurdert fosterets alder så nøyaktig som mulig, samt vurdere/dokumentere status til fosteret før behandlingsstart.
Behandling
Sist faglig oppdatert: 02202402.07.2024
Brystkreft under graviditet krever et velfungerende, multidisiplinært team som har erfaring med problemstillingen og som har nært samarbeid med obstetrisk spesialavdeling. Dette gjør at behandling og oppfølging bør sentraliseres.
Kirurgisk behandling i form av mastektomi eller brystbevarende kirurgi er trygt gjennom hele graviditetsforløpet ved bruk av moderne anestesi. Kirurgisk behandling må gjennomføres med minst mulig stress for pasienten for å unngå at fosteret påvirkes; unngå hypoksi, hypotensjon, hypoglykemi, feber, infeksjon og trombose.
Under operasjonen må livmor sammentrekninger og hjertefrekvens til foster registreres. Sentinel node diagnostikk kan gjennomføres med lavdose teknesium, men uten blåfarge (metylblått), for å unngå allergisk reaksjon hos mor, noe som i sin tur kan stresse fosteret. Lavmolekulært heparin gis for å redusere tromboserisiko.
Strålebehandling etter brystbevarende kirurgi eller ved indikasjon for lokoregional strålebehandling gis etter forløsning. Det samme er tilfelle dersom det er indikasjon for strålebehandling av regionale lymfeknuteområder basert på positiv lymfeknutestatus i aksille.
Cytostatikabehandling skal ikke gis i 1. trimester på grunn av høy risiko for skader under fosterets organogenese. I 2. og 3. trimester er det ikke rapportert om økt forekomst av fosterskader, men langtidsoppfølging av barnet i samarbeid med pediater etter forløsning anbefales. Generelt kan man gi samme cytostatikaregimer som hos ikke-gravide brystkreftpasienter. Både neoadjuvant og adjuvant behandling kan benyttes.
Antracyklinholdige regimer som doxorubicin/cyclofosfamid (AC) eller epirubicin/cyclofosfamid (EC) er trygge å benytte da disse preparatene blir filtrert av placenta. Det foreligger mindre data på bruk av taxaner under graviditet, selv om det ikke er vist alvorlige fosterskadelige effekter av denne typen cellegift. Om mulig kan derfor taxan behandlingen gjennomføres etter forløsning, slik det anbefales i de danske retningslinjene (DBCG).
Cytostatika doseres i utgangspunktet etter kroppsoverflate som for ikke-gravide, tross graviditetsforandringer som endringer i plasma- og distribusjonsvolum, metabolisering i lever, og forandring av plasma bindingsproteiner.
For å unngå komplikasjoner i forbindelse med fødselen (anemi, infeksjoner, blødning) bør det gå ≥3 uker etter siste kur før forløsning. Ved brystkreft som diagnostiseres sent i 3. trimester kan det vurderes å utsette oppstart kjemoterapi og heller fremskynde fødselen (men etter 35. uke).
Det er viktig med godt samarbeid mellom fødselslege, barnelege, kirurg og onkolog for å bestemme tidspunkt og metode for forløsning til beste for mor og barn.
Støttebehandling under cytostatika behandling
Selv om det er rapportert mindre kvalme hos gravide som får cytostatika, anbefales det å benytte noen av de samme medikamenter mot kvalme som for ikke-gravide, men ikke alle. Ondansetron kan trygt benyttes, mens aprepitant (Emend) og palonosetron (Aloxi) frarådes på grunn av mangel på data fra kliniske studier. Methylprednisolon eller hydrokortison kan også benyttes som kvalmeforebyggende, og ved profylakse mot allergiske reaksjoner dersom taxaner benyttes. Deksametason og betametason passerer placenta og bør ikke benyttes.
Bruk av G-CSF er ikke anbefalt til gravide da man fremdeles har begrenset erfaring. Dersom indikasjonen er sterk nok, det vil si at risikoen for mor og barnets helse er truet kan det forsvares brukt.
Endokrin behandling bør utsettes til etter fødsel på grunn av mulig teratogen effekt av tamoxifen (aromatasehemmer er ikke aktuelt hos denne pasientgruppen).
Målrettet «nyere» behandling som trastuzumab, lapatinib, og andre tyrosin kinasehemmere skal ikke benyttes under svangerskapet. Svulster som oppdages i graviditet er ofte HER2 positive (>40 %). Da fosterets nyreepitelceller er sterkt HER2 positive, er det stor fare for fosterskade ved bruk av HER2-rettet behandling. Tyrosin kinasehemmere er lite undersøkt i forhold til fosterskade. Det anbefales å utsette bruk av slike medikamenter til etter forløsning.
Adjuvant bisfosfonat behandling er ikke aktuelt å benytte i denne aldersgruppe.
Strålebehandling ved hjernemetastaser
Ved hjernemetastaser kan strålebehandling trygt gis under graviditet.
Forløsning
Forløsning anbefales etter 35.–37. uke (helst etter 37. uke) for å unngå barn med lungeproblemer. Eventuell videre onkologisk behandling kan starte snarlig etter forløsning.
Placenta skal undersøkes for eventuelle metastaser. Dette er sjeldent, men dersom det påvises skal barnet følges nøye opp.
Amming
Amming er kontraindisert under og de første ukene etter cellegiftbehandling. Det er heller ikke anbefalt under strålebehandling. Laktasjon hemmes med kabergolin (Dostinex) gitt innen 24 timer etter fødsel.
Oppfølgning
For å få økt kunnskap og erfaring anbefales det at mor og barn følges over lang tid. Den brystkreftspesifikke oppfølgning kan i utgangspunkt gjennomføres i tråd med vanlig kontrollopplegg, og barnet i samarbeide med pediater i 15 år.
I samråd med pasientene kan inklusjon i internasjonale studier og registre vurderes; «European Society of Gynaecological Oncology» (ESGO) (www.cancerinpregnancy.org), «German Breast Cancer Group» (https://www.gbg.de/en/).
Genetisk veiledning
Pasientene bør henvises til genetisk veiledning på grunn av ung alder.
Sentrale referanser for anbefalingene: ADDIN EN.CITE.DATA (Amant, Han, et al., 2015; Amant, Loibl, Neven, & Van Calsteren, 2012; Amant, Vandenbroucke, et al., 2015; Amant et al., 2013; H. A. Azim, Jr. et al., 2012; Loibl et al., 2012; Loibl et al., 2015; NCCN clinical practice guidelines in oncology (NCCN Guidelines): breast cancer. Version 2.2022, 2022; Peccatori et al., 2013; Sechopoulos et al., 2008; R. L. Theriault & Litton, 2013; Untch et al., 2015; Van Calsteren et al., 2010).
Utredning
Sist faglig oppdatert: 02202402.07.2024
Kul/kuler i brystet under graviditet er vanskelig å tolke på grunn av forandringene i brystene som skyldes graviditeten. Dersom lege etter anamneseopptak og klinisk undersøkelse mistenker tilstedeværelse av en bakenforliggende tumor, bør pasienten utredes for å avkrefte/bekrefte en eventuell kreftdiagnose. Utredningen må gjennomføres uten at fosteret skades. Utredning følger samme prinsipp som hos ikke-gravide kvinner, se kapittelet Diagnostisering og utredning.
Ytterligere utredning gjennomføres dersom man antar at det vil få behandlingsmessige følger. Metastaseutredning kan utføres med røntgen thorax og ultralyd lever. Ved mistanke om skjelettmetastaser kan skjelettscintigrafi med innlagt blærekateter utføres (blærekateter for å fjerne opphopning av radioaktivitet i blæren), men MR columna/bekken (eventuelt med tillegg av MR thoraxskjelett) (uten gadolinium) anbefales primært.
Det er også viktig å få vurdert fosterets alder så nøyaktig som mulig, samt vurdere/dokumentere status til fosteret før behandlingsstart.
Behandling
Sist faglig oppdatert: 02202402.07.2024
Brystkreft under graviditet krever et velfungerende, multidisiplinært team som har erfaring med problemstillingen og som har nært samarbeid med obstetrisk spesialavdeling. Dette gjør at behandling og oppfølging bør sentraliseres.
Kirurgisk behandling i form av mastektomi eller brystbevarende kirurgi er trygt gjennom hele graviditetsforløpet ved bruk av moderne anestesi. Kirurgisk behandling må gjennomføres med minst mulig stress for pasienten for å unngå at fosteret påvirkes; unngå hypoksi, hypotensjon, hypoglykemi, feber, infeksjon og trombose.
Under operasjonen må livmor sammentrekninger og hjertefrekvens til foster registreres. Sentinel node diagnostikk kan gjennomføres med lavdose teknesium, men uten blåfarge (metylblått), for å unngå allergisk reaksjon hos mor, noe som i sin tur kan stresse fosteret. Lavmolekulært heparin gis for å redusere tromboserisiko.
Strålebehandling etter brystbevarende kirurgi eller ved indikasjon for lokoregional strålebehandling gis etter forløsning. Det samme er tilfelle dersom det er indikasjon for strålebehandling av regionale lymfeknuteområder basert på positiv lymfeknutestatus i aksille.
Cytostatikabehandling skal ikke gis i 1. trimester på grunn av høy risiko for skader under fosterets organogenese. I 2. og 3. trimester er det ikke rapportert om økt forekomst av fosterskader, men langtidsoppfølging av barnet i samarbeid med pediater etter forløsning anbefales. Generelt kan man gi samme cytostatikaregimer som hos ikke-gravide brystkreftpasienter. Både neoadjuvant og adjuvant behandling kan benyttes.
Antracyklinholdige regimer som doxorubicin/cyclofosfamid (AC) eller epirubicin/cyclofosfamid (EC) er trygge å benytte da disse preparatene blir filtrert av placenta. Det foreligger mindre data på bruk av taxaner under graviditet, selv om det ikke er vist alvorlige fosterskadelige effekter av denne typen cellegift. Om mulig kan derfor taxan behandlingen gjennomføres etter forløsning, slik det anbefales i de danske retningslinjene (DBCG).
Cytostatika doseres i utgangspunktet etter kroppsoverflate som for ikke-gravide, tross graviditetsforandringer som endringer i plasma- og distribusjonsvolum, metabolisering i lever, og forandring av plasma bindingsproteiner.
For å unngå komplikasjoner i forbindelse med fødselen (anemi, infeksjoner, blødning) bør det gå ≥3 uker etter siste kur før forløsning. Ved brystkreft som diagnostiseres sent i 3. trimester kan det vurderes å utsette oppstart kjemoterapi og heller fremskynde fødselen (men etter 35. uke).
Det er viktig med godt samarbeid mellom fødselslege, barnelege, kirurg og onkolog for å bestemme tidspunkt og metode for forløsning til beste for mor og barn.
Støttebehandling under cytostatika behandling
Selv om det er rapportert mindre kvalme hos gravide som får cytostatika, anbefales det å benytte noen av de samme medikamenter mot kvalme som for ikke-gravide, men ikke alle. Ondansetron kan trygt benyttes, mens aprepitant (Emend) og palonosetron (Aloxi) frarådes på grunn av mangel på data fra kliniske studier. Methylprednisolon eller hydrokortison kan også benyttes som kvalmeforebyggende, og ved profylakse mot allergiske reaksjoner dersom taxaner benyttes. Deksametason og betametason passerer placenta og bør ikke benyttes.
Bruk av G-CSF er ikke anbefalt til gravide da man fremdeles har begrenset erfaring. Dersom indikasjonen er sterk nok, det vil si at risikoen for mor og barnets helse er truet kan det forsvares brukt.
Endokrin behandling bør utsettes til etter fødsel på grunn av mulig teratogen effekt av tamoxifen (aromatasehemmer er ikke aktuelt hos denne pasientgruppen).
Målrettet «nyere» behandling som trastuzumab, lapatinib, og andre tyrosin kinasehemmere skal ikke benyttes under svangerskapet. Svulster som oppdages i graviditet er ofte HER2 positive (>40 %). Da fosterets nyreepitelceller er sterkt HER2 positive, er det stor fare for fosterskade ved bruk av HER2-rettet behandling. Tyrosin kinasehemmere er lite undersøkt i forhold til fosterskade. Det anbefales å utsette bruk av slike medikamenter til etter forløsning.
Adjuvant bisfosfonat behandling er ikke aktuelt å benytte i denne aldersgruppe.
Strålebehandling ved hjernemetastaser
Ved hjernemetastaser kan strålebehandling trygt gis under graviditet.
Forløsning
Forløsning anbefales etter 35.–37. uke (helst etter 37. uke) for å unngå barn med lungeproblemer. Eventuell videre onkologisk behandling kan starte snarlig etter forløsning.
Placenta skal undersøkes for eventuelle metastaser. Dette er sjeldent, men dersom det påvises skal barnet følges nøye opp.
Amming
Amming er kontraindisert under og de første ukene etter cellegiftbehandling. Det er heller ikke anbefalt under strålebehandling. Laktasjon hemmes med kabergolin (Dostinex) gitt innen 24 timer etter fødsel.
Oppfølgning
For å få økt kunnskap og erfaring anbefales det at mor og barn følges over lang tid. Den brystkreftspesifikke oppfølgning kan i utgangspunkt gjennomføres i tråd med vanlig kontrollopplegg, og barnet i samarbeide med pediater i 15 år.
I samråd med pasientene kan inklusjon i internasjonale studier og registre vurderes; «European Society of Gynaecological Oncology» (ESGO) (www.cancerinpregnancy.org), «German Breast Cancer Group» (https://www.gbg.de/en/).
Genetisk veiledning
Pasientene bør henvises til genetisk veiledning på grunn av ung alder.
Sentrale referanser for anbefalingene: ADDIN EN.CITE.DATA (Amant, Han, et al., 2015; Amant, Loibl, Neven, & Van Calsteren, 2012; Amant, Vandenbroucke, et al., 2015; Amant et al., 2013; H. A. Azim, Jr. et al., 2012; Loibl et al., 2012; Loibl et al., 2015; NCCN clinical practice guidelines in oncology (NCCN Guidelines): breast cancer. Version 2.2022, 2022; Peccatori et al., 2013; Sechopoulos et al., 2008; R. L. Theriault & Litton, 2013; Untch et al., 2015; Van Calsteren et al., 2010).
Brystkreft hos menn
Forekomst
Sist faglig oppdatert: 02202402.07.2024
Brystkreft hos menn utgjør mindre enn 1 % av all brystkreft. I 2020 fikk 31 menn brystkreft i Norge. Det har vært en svakt økende insidens de siste 10 årene. Sykdommen opptrer hovedsakelig hos eldre menn, 8 av 10 er over 60 år. Ved diagnose er tumor oftere større og har oftere lymfeknutemetastaser, enn hos kvinner.
Risikofaktorer: Menn uten barn, med nedsatt testisfunksjon, overvekt eller familiær disposisjon (20 %) synes å ha noe høyere risiko for brystkreft (Brinton et al., 2015). Omtrent 10 % av brystkreft hos menn finnes hos BRCA2 mutasjonsbærere. Alle menn med brystkreft skal derfor tilbys gentest.
Biologi
Sist faglig oppdatert: 02202402.07.2024
Brystkreft hos menn er biologisk ikke helt lik brystkreft hos kvinner. Nesten alle tumores er infiltrerende duktale carcinom og østrogenreceptor positive. Trippel negative svulster forekommer sjelden.
Utredning
Sist faglig oppdatert: 02202402.07.2024
På samme måte som hos kvinner ved trippeldiagnostikk. De fleste årsaker til kul/hevelse i brystet hos menn er godartede forandringer, og det mest vanlige er gynekomasti. Mammografi har en høy sensitivitet og spesifisitet (>95 %) til å kunne skille benigne fra maligne forandringer i et mannlig bryst og anbefales som første undersøkelse hos menn >20 år. Ved klassisk funn av gynekomasti på mammografi er det ikke nødvendig med supplerende ultralyd eller vevsprøve. Ved suspekt eller usikkert funn på mammografi skal det suppleres med ultralyd og biopsi.
Behandling
Sist faglig oppdatert: 02202402.07.2024
Det foreligger ingen randomiserte kliniske studier vedrørende behandling av denne pasientgruppen. Av denne grunn har menn med brystkreft tradisjonelt vært behandlet etter de samme retningslinjer som kvinner med brystkreft.
Kirurgisk behandling av brystkreft kan være ablatio eller brystbevarende operasjon med sentinel node eller aksilledisseksjon etter samme retningslinjer som hos kvinner med brystkreft (Cloyd, Hernandez-Boussard, & Wapnir, 2013; Zaenger, Rabatic, Dasher, & Mourad, 2016).
Tamoxifen er gullstandard ved systemisk adjuvant endokrin behandling (Eggemann et al., 2013; NCCN clinical practice guidelines in oncology (NCCN Guidelines): breast cancer. Version 2.2022, 2022). Varigheten bør være 5 år (Eggemann et al., 2013), men behandling i 10 år kan vurderes på individuelt grunnlag basert på risiko for recidiv og bivirkninger av behandlingen. Bivirkninger av tamoxifen hos menn kan være dyp venetrombose, katarakt, seksuell dysfunksjon, humørsvingninger, hetetokter og leggkramper. Østrogen hos menn produseres hovedsakelig ved bruk av aromatase (80 %) og for øvrig fra testiklene (20 %). Hos friske menn finner man en signifikant reduksjon av østrogen, samtidig med en økning av FSH, LH og testosteron ved bruk av aromatasehemmere (Zagouri et al., 2015). Økningen i testosteron kan begrense nytten av aromatasehemmere. GnRH analoger reduserer nivå av FSH, LH og testosteron. Effekten av aromatasehemmere hos menn kan være lavere enn hos kvinner. Populasjonsbaserte studier har vist redusert overlevelse hos menn behandlet med aromatasehemmere enn tamoxifen. Mangelen på komplett østradiolsuppresjon hos menn som behandles med aromatasehemmere kan skyldes feedback loops til hypothalamus og hypofysen, og dette kan reduseres med tillegg av en GnRH analog. Hos menn som ikke bør anbefales tamoxifen (f.eks. tidligere trombose), kan en GnRH analog benyttes som adjuvant terapi, med eller uten en aromatasehemmer. I en studie på metastatisk brystkreft hos menn fant man bedre klinisk nytte med kombinasjon av AI med GnRH analoger (ikke statistisk signifikant pga små tall) (Zagouri et al., 2015). Kun aromatasehemmer bør ikke benyttes som standard adjuvant behandling.
Strålebehandling og kjemoterapi følger retningslinjer som for brystkreft hos kvinner. Det foreligger ingen studier med bruk av zoledronsyre adjuvant ved brystkreft hos menn, og det kan derfor ikke anbefales.
Forekomst
Sist faglig oppdatert: 02202402.07.2024
Brystkreft hos menn utgjør mindre enn 1 % av all brystkreft. I 2020 fikk 31 menn brystkreft i Norge. Det har vært en svakt økende insidens de siste 10 årene. Sykdommen opptrer hovedsakelig hos eldre menn, 8 av 10 er over 60 år. Ved diagnose er tumor oftere større og har oftere lymfeknutemetastaser, enn hos kvinner.
Risikofaktorer: Menn uten barn, med nedsatt testisfunksjon, overvekt eller familiær disposisjon (20 %) synes å ha noe høyere risiko for brystkreft (Brinton et al., 2015). Omtrent 10 % av brystkreft hos menn finnes hos BRCA2 mutasjonsbærere. Alle menn med brystkreft skal derfor tilbys gentest.
Biologi
Sist faglig oppdatert: 02202402.07.2024
Brystkreft hos menn er biologisk ikke helt lik brystkreft hos kvinner. Nesten alle tumores er infiltrerende duktale carcinom og østrogenreceptor positive. Trippel negative svulster forekommer sjelden.
Utredning
Sist faglig oppdatert: 02202402.07.2024
På samme måte som hos kvinner ved trippeldiagnostikk. De fleste årsaker til kul/hevelse i brystet hos menn er godartede forandringer, og det mest vanlige er gynekomasti. Mammografi har en høy sensitivitet og spesifisitet (>95 %) til å kunne skille benigne fra maligne forandringer i et mannlig bryst og anbefales som første undersøkelse hos menn >20 år. Ved klassisk funn av gynekomasti på mammografi er det ikke nødvendig med supplerende ultralyd eller vevsprøve. Ved suspekt eller usikkert funn på mammografi skal det suppleres med ultralyd og biopsi.
Behandling
Sist faglig oppdatert: 02202402.07.2024
Det foreligger ingen randomiserte kliniske studier vedrørende behandling av denne pasientgruppen. Av denne grunn har menn med brystkreft tradisjonelt vært behandlet etter de samme retningslinjer som kvinner med brystkreft.
Kirurgisk behandling av brystkreft kan være ablatio eller brystbevarende operasjon med sentinel node eller aksilledisseksjon etter samme retningslinjer som hos kvinner med brystkreft (Cloyd, Hernandez-Boussard, & Wapnir, 2013; Zaenger, Rabatic, Dasher, & Mourad, 2016).
Tamoxifen er gullstandard ved systemisk adjuvant endokrin behandling (Eggemann et al., 2013; NCCN clinical practice guidelines in oncology (NCCN Guidelines): breast cancer. Version 2.2022, 2022). Varigheten bør være 5 år (Eggemann et al., 2013), men behandling i 10 år kan vurderes på individuelt grunnlag basert på risiko for recidiv og bivirkninger av behandlingen. Bivirkninger av tamoxifen hos menn kan være dyp venetrombose, katarakt, seksuell dysfunksjon, humørsvingninger, hetetokter og leggkramper. Østrogen hos menn produseres hovedsakelig ved bruk av aromatase (80 %) og for øvrig fra testiklene (20 %). Hos friske menn finner man en signifikant reduksjon av østrogen, samtidig med en økning av FSH, LH og testosteron ved bruk av aromatasehemmere (Zagouri et al., 2015). Økningen i testosteron kan begrense nytten av aromatasehemmere. GnRH analoger reduserer nivå av FSH, LH og testosteron. Effekten av aromatasehemmere hos menn kan være lavere enn hos kvinner. Populasjonsbaserte studier har vist redusert overlevelse hos menn behandlet med aromatasehemmere enn tamoxifen. Mangelen på komplett østradiolsuppresjon hos menn som behandles med aromatasehemmere kan skyldes feedback loops til hypothalamus og hypofysen, og dette kan reduseres med tillegg av en GnRH analog. Hos menn som ikke bør anbefales tamoxifen (f.eks. tidligere trombose), kan en GnRH analog benyttes som adjuvant terapi, med eller uten en aromatasehemmer. I en studie på metastatisk brystkreft hos menn fant man bedre klinisk nytte med kombinasjon av AI med GnRH analoger (ikke statistisk signifikant pga små tall) (Zagouri et al., 2015). Kun aromatasehemmer bør ikke benyttes som standard adjuvant behandling.
Strålebehandling og kjemoterapi følger retningslinjer som for brystkreft hos kvinner. Det foreligger ingen studier med bruk av zoledronsyre adjuvant ved brystkreft hos menn, og det kan derfor ikke anbefales.
Oppfølging og etterkontroll etter avsluttet kurativ behandling
Etterkontroll - generelt
Sist faglig oppdatert: 02202402.07.2024
Oppfølging etter gjennomført primærbehandling for brystkreft og DCIS har mange aspekter, både medisinske, funksjonelle, psykososiale og økonomiske. Pasientenes individuelle behov for støtte vil variere. Alle pasienter trenger noe praktisk veiledning. Tidlig påvising av isolert lokoregionalt residiv er det viktigste aspekt ved kontrollene, samt å motivere til anbefalt bruk av endokrin behandling, dersom indikasjon, og å følge opp behandlingsrelaterte bivirkninger og seneffekter (de Bock, Bonnema, van der Hage, Kievit, & van de Velde, 2004; Lu et al., 2009; Moschetti, Cinquini, Lambertini, Levaggi, & Liberati, 2016). I den forbindelse har Franzoi et al publisert en grundig oversikt over evidensgrunnlaget for forskjellige tiltak knyttet til bivirkninger av adjuvant endokrin behandling (Franzoi et al., 2021). Det er imidlertid ikke vist at omfattende og hyppige kontroller eller bruk av undersøkelser med tanke på tidlig diagnostikk av fjernmetastaser bedrer overlevelsen (Palli et al., 1999; Rojas et al., 2005) , men for pasienten er det viktig å føle seg ivaretatt på en trygg måte.
Forslag til kontrollopplegg etter behandling for premaligne/lavgradig maligne tilstander er skissert i kapittelet Kirurgisk behandling av lokalisert sykdom/Kurativ behandling (spesielt punkt Behandling av radiære arr).
Anbefalinger:
Hensikten med etterkontroll bør være:
- Tidlig diagnostikk av lokoregionalt residiv/ny tumor i det opererte bryst eller det kontralaterale brystet.
- Motivere til anbefalt bruk av endokrin behandling (ved hormonreseptor positiv brystkreft), følge opp behandlingsrelaterte bivirkninger og seneffekter, og vurdere eventuelle komplikasjoner eller funksjonsreduksjoner som følge av gjennomført primærbehandling.
- Generell rådgivning og veiledning (f.eks. om arvelige risikofaktorer i familien, svangerskap, bruk av østrogener).
- Å sørge for at pasienter som ønsker sekundær rekonstruksjon henvises til plastisk kirurgisk vurdering.
- Følge opp pasienter i kliniske studier.
- Diagnostikk av symptomgivende fjernmetastaser.
Første postoperative kontroll (2–4 uker etter primæroperasjon)
Sist faglig oppdatert: 02202402.07.2024
Pasienter som er operert for brystkreft bør ha en konsultasjon hos kirurg 2–4 uker etter utskrivning fra sykehus. De fleste pasienter har da behov for å få en samlet informasjon om sin sykdom og anbefalt etterbehandling etter gjeldende retningslinjer. For pasienter som trenger adjuvant systemisk behandling, eller som kan være aktuelle for inklusjon i prospektive studier, vil informasjonsbehovet være ekstra stort på dette tidspunktet. Generelt er det viktig at sårtilheling, skulderbevegelighet, ødemtendens, eventuelt brystprotese og kvinnens arbeidssituasjon vurderes.
Videre etterkontroller
Sist faglig oppdatert: 02202402.07.2024
De fleste pasientene bør vanligvis følges opp i 10 år etter primærbehandlingen. Kontrollopplegget gjelder for både menn og kvinner. Den individuelle risiko for lokoregionalt residiv og metastaser er avhengig av både stadium og sykdommens biologiske egenskaper. Residivraten er generelt lav det første postoperative året, er høyere i perioden 2–3 (5) år postoperativt før den faller, men hvor residivraten, er ganske konstant i mange ytterligere år etter diagnose hos pasienter med hormonreseptor positiv sykdom (Ignatov, Eggemann, Burger, & Ignatov, 2018; Pan et al., 2017).
Kontrollene vil måtte tilpasses ulike forhold; pasientens individuelle behov og alder, men også behandlende avdelings behov for å dokumentere behandlingsresultater og mulige side/seneffekter ved/av gjennomført behandling. Disponering av knappe ressurser ved poliklinikkene med oppgavefordeling mellom sykehuspoliklinikker og fastleger må også vurderes i denne sammenheng.
Alle pasienter bør informeres om risikoen for lokoregionalt residiv, og muligheten for ny svulst i det kontralaterale bryst. De fleste recidiv oppdages ved mammografi og av kvinnen selv (Montgomery, Krupa, & Cooke, 2007). Pasientene bør derfor oppmuntres til regelmessig egenundersøkelse og skal kontakt med fastlege/ ved nyoppståtte forandringer i opererte bryst eller på brystveggen/armhulen. I tillegg bør de informeres om viktigheten av årlig mammografiundersøkelse.
Organisering av etterkontroll-tilbudet for den enkelte pasient kan utformes i sykehuset og etter nærmere avtale overføres til fastlegen. Overføring og oppfølgning hos fastlege må trygges gjennom tydelig informasjon og veiledning til pasient og fastlege. Det er vist like gode resultat mht deteksjon av recidiv/metastaser hos fastlege som på sykehus (Moschetti et al., 2016). For noen sykehus kan det være hensiktsmessig at noen kontroller utføres av sykepleier på poliklinikk med lege som ansvarlig for dette. Studier har vist at sykepleierkontroller kan benyttes til utvalgte pasienter (Browall, Forsberg, & Wengström, 2017; Brown, Cruickshank, & Noblet, 2021; R. J. Chan et al., 2020).
Anbefalinger:
Følgende grupper bør følges ved sykehus de første 5 år, da de oppfattes å ha mer kompliserte problemstillinger:
- Pasienter under 40 år som har fått systembehandling
- Pasienter med primært lokalavanserte svulster
- Pasienter med brystkreft i relasjon til svangerskap/amming
Kontrollhyppighet og innhold
Sist faglig oppdatert: 02202402.07.2024
Veiledende opplegg for etterkontroller
Mammografi skal gjennomføres årlig med første kontroll innen 1 år fra diagnosetidspunkt og videre til totalt 10 års oppfølgingingstid. Mammografi rekvireres fra behandlende sykehus. Men konferer "Kvinner operert for brystkreft/DCIS" eller under for ytterligere spesifikasjon. Ved infiltrerende brystkreft anbefales kontroll på sykehus 1, 2 og 5 år etter diagnosetidspunkt (med individuell vurdering ved lavt stadium, snill biologi og høy alder). Det kan være grunnlag for å individualisere kontrollhyppigheten hos noen pasienter (f.eks. hos pasienter med betydelige bivirkninger av endokrin terapi, samt andre årsaker nevnt under). Årlig klinisk undersøkelse inngår som del av etterkontrollene ved infiltrerende brystkreft.
Årlig livslang kontroll av thyreoideafunksjon anbefales hos pasienter som har gjennomført lokoregional strålebehandling (se nedenfor).
Begrunnelse for kontroller år 1, 2 og 5 på sykehuset:
- Etter det første året (kirurgisk resultat, bivirkninger, compliance ved endokrin behandling)
- Etter 2 år (oppfølging og eventuell justering av endokrin behandling, oppfølging av bivirkninger etter kjemoterapi, annet)
- Etter fem år (seponering eller videreføring av endokrin behandling).
Noen pasienter vil ha plager/problemstillinger som kan trenge spesiell oppmerksomhet etter avsluttet behandling (fatigue, konsentrasjons-/hukommelsesproblemer, østrogenmangelsymptomer, seksuelle problemer, psykiske ettervirkninger, lymfødem, lokoregionale plager). Behandlende sykehus har et ansvar for å kvalitetssikre oppfølgningen av slike forhold. Det er viktig å sikre at oppfølgning av pasientene ved årskontrollene og ved recidiv/metastaser dokumenteres i Norsk Bryst Cancer Register (NBCR).
Individualisert kontrollopplegg
Generelt
Klinisk oppfølgning bør videre individualiseres på bakgrunn av diagnose, stadium, aktuell behandling, risiko for recidiv, alder og komorbiditet. Det er viktig å vurdere om det er økt kontrollbehov for pasienter som benytter endokrin behandling, avhengig av bivirkningsnivå, behandlingsplan og complianceutfordringer. Dersom det gis utvidet endokrin behandling (ut over 5 år), er det også grunnlag for kontroll ved sykehuset i forbindelse med avslutningen av denne behandling inkludert registrering i NBCR.
1. Alder
Ved høy alder og kort forventet levetid kan årlige mammografikontroller og kliniske kontroller utgå.
2. Pasienter under 40 år som har fått adjuvant systembehandling og pasienter med brystkreft i relasjon til svangerskap og amming kan ha behov for tettere oppfølgning
Det anbefales årlig kontroll hos sykehuslege minimum de 5 første årene, deretter individuelt tilpasset kontroll videre, men med sykehuslegekontroll i hvert fall ved år 10. Årlige kontroller som ikke gjennomføres hos sykehuslege, kan utføres hos fastlege.
Yngre pasienter har større sannsynlighet for å stoppe adjuvant anti-hormonell behandling underveis i anbefalt behandlingsperiode (Partridge, Wang, Winer, & Avorn, 2003). Pasienter yngre enn 40 år har 40% større sannsynlighet for å ikke ta anbefalt adjuvant anti-hormonell behandling sammenlignet med middelaldrende pasienter (Hershman et al., 2010). Lav utdanning, lite sosial støtte og manglende trygghet i beslutning om adjuvant anti-hormonell behandling er assosiert med lav compliance (Wassermann et al., 2019). Kommunikasjon med lege og samvalg har også betydning for om pasienter stopper adjuvant anti-hormonell behandling i løpet av behandlingsperioden (Cluze et al., 2012; Liu, Malin, Diamant, Thind, & Maly, 2013). Samlet understreker dette behovet for å identifisere slike hindre tidlig i behandlingen slik at det kan sørges for at pasienter får tilstrekkelig trygghet for beslutning om og oppfølging av adjuvant anti-hormonell behandling (Wassermann et al., 2019).
Se under vedrørende mammografikontroller.
3. DCIS
Det anbefales kontroll hos kirurg etter 1 og eventuelt 2 år for oppfølgning av det kirurgiske resultatet og eventuelt strålerelaterte problem. Risiko for død av brystkreft øker 3 ganger etter en DCIS diagnose (Giannakeas, Sopik, & Narod, 2020).
Se under vedrørende mammografikontroller.
4. Lokalavanserte pasienter
Følges av onkologer og behandles på regionsykehus, individualisert opplegg.
5. Menn
Dersom mannen har genetisk disposisjon for brystkreft eller det er utført brystbevarende operasjon, anbefales mammografikontroller årlig i 10 år avhengig av almentilstand og alder. For mastektomerte menn uten genetisk disposisjon holder det med årlige kliniske kontroller, gjerne hos fastlege. Risiko for kontralateral brystkreft er liten. Det er få menn som får brystkreft og det er få studier som foreligger (Hassett et al., 2020; Yadav et al., 2022).
Utdypende opplysninger om kontrollinnhold
Mammografikontroll (etter gjennomført primærbehandling for Stadium I–III sykdom). De fleste residiv oppdages ved mammografi og ikke ved klinisk undersøkelse (Ashkanani et al., 2001).
- Det anbefales årlig mammografi i 10 år både etter brystbevarende kirurgi (BCT) og etter mastectomi (ablatio).
- Kvinner som er i målgruppen for Mammografiprogrammet (50-69 år) kan møte på screeninginvitasjoner annet hvert år og bli henvist til klinisk mammografi årene i mellom.
- Etter 10 år uten påvisning av residiv skal alle over 50 år tilbys deltagelse i Mammografiprogrammet med mammografi hvert annet år, på lik linje med kvinner som ikke har hatt brystkreft. Merk at noen kvinner kan være 51- 53 år før de får sin første invitasjon til Mammografiprogrammet.
- For pasienter som 10 år etter brystkreftoperasjon ikke har nådd screeningalder, anbefales det at fastlege henviser til årlig mammografi inntil pasienten får sin første invitasjon til Mammografiprogrammet. Merk at noen kvinner kan være 51- 53 år før de får sin første invitasjon til Mammografiprogrammet.
- Ved høy alder ved diagnose gjøres det individuell vurdering om det er indisert med årlige mammografikontroller i 10 år, med spesielt fokus på komorbiditet, biologisk alder/forventet levetid.
- Pasienter operert med rekonstruksjon med eget vev eller protese etter mastektomi har ikke behov for radiologiske kontroller av det nye brystet.
- Det er ikke behov for radiologisk kontroll av brystvegg etter mastectomi.
- Ved kontroller av gravide/ammende bør det gjøres ultralyd i tillegg til mammografi
Gynekologisk undersøkelse i forbindelse med bruk av tamoxifen
Det er ikke er påvist økt risiko for endometriecancer ved bruk av tamoxifen hos premenopausale, kun hos postmenopausale. Endometrieovervåking har ikke vist nytteeffekt med tanke på å øke sjansen for tidlig påvisning av endometriecancer hos kvinner som tar tamoxifen (Tamoxifen and Uterine Cancer, 2014). Klinikere bør informere kvinner som tar tamoxifen om risikoen for endometrieproliferasjon, endometriehyperplasi og livmorkreft ved postmenopausal status. Rutinemessig gynekologisk undersøkelse med ultralyd er ikke nødvendig hos kvinner uten gynekologiske symptomer. Ved unormal vaginal blødning, blodig utflod (og lignende) bør pasienten henvises til gynekolog.
Laboratorie-/billeddiagnostiske undersøkelser
Det er ikke vist effekt av å ta blodprøver hos pasienter med upåfallende anamnese og normal klinisk undersøkelse. Rtg. thorax eller andre billeddiagnostiske tiltak er ikke rutine ved etterkontroll (Goldhirsch et al., 2005; Khatcheressian et al., 2006).
En god anamnese og en nøyaktig klinisk undersøkelse av de lokoregionale forhold betyr mest for påvisning av residiv/metastase ved etterkontrollene.
Ved mistanke om residiv/metastaser, vil supplerende undersøkelser være aktuelt. Det kliniske bildet vil avgjøre hvilke undersøkelser som gjennomføres.
Aktuelle undersøkelser er:
- Utvidet blodprøveprofil
- Hematologiske prøver, kreatinin, s-Ca, albumin, leverprøver
- Evt. tumormarkører (for eksempel MUC1 (CA 15-3), CEA).
- Skjelettundersøkelser
- MR columna/bekken som et minimum (evt. også thoraxskjelett) For å lete etter multiplisitet ved for eksempel mistanke om skjelettmetastaser er MR av et begrenset skjelettområde av mindre verdi.
- Skjelettscintigrafi
- Leverundersøkelser
- Ultralyd lever eller
- CT lever
- CT thorax
- CT thorax/abdomen/bekken
- PET/CT
- MR/CT caput/cerebri
Overvåking av thyreoideafunksjon
Pasienter som har fått kurativ strålebehandling mot nedre del av hals som ledd i behandling av Hodgkin’s lymfom og øre-nese-hals kreft, har økt risiko for senere å utvikle stoffskifteforstyrrelser (Alterio et al., 2007; Bookman & Longo, 1986; Hancock, Cox, & McDougall, 1991; Jereczek-Fossa et al., 2004). Hypothyreose er den vanligste thyreoideadysfunksjonen hos disse pasientene, og rammer 20–30 % av dem som har fått slik behandling (Jereczek-Fossa et al., 2004). Også kvinner som er behandlet for brystkreft, har høyere risiko for hypothyreose sammenliknet med den generelle befolkning (Falstie-Jensen et al., 2020; Joensuu & Viikari, 1986; Reinertsen et al., 2009). Strålebehandling mot supra- og infraclavikulære lymfeknuter kan være en medvirkende årsak til dette (Falstie-Jensen et al., 2020; Joensuu & Viikari, 1986; Reinertsen et al., 2009). Vi anbefaler derfor at alle kvinner som kommer til kurativ strålebehandling for brystkreft, tar fT4, TSH og anti-TPO før de starter strålebehandlingen. (Personer med TPO antistoffer, har økt risiko for utvikling av autoimmun thyreoideasykdom – og da særlig hypothyreose. De bør derfor følges mht utvikling av dysfunksjon.)
Anbefalinger:
Som kontroll etter avsluttet lokoregional stråle-behandling anbefaler vi at fT4 og TSH tas årlig livet ut (evt. hyppigere ved avvik). I oppfølging av kvinner behandlet for brystkreft bør TSH og fT4 måles ved mistanke om hypothyreose – selv ved beskjeden symptomatologi.
Andre forhold
Noen kvinner vil bli inkludert i prospektive kliniske studier med ulike former for adjuvant behandling. Detaljer i etterkontrollopplegget for pasienter i slike studier vil eventuelt kunne være noe forskjellig fra det som er skissert ovenfor. Disse pasientene vil også vanligvis bli kontrollert ved de respektive kirurgiske (eller onkologiske) poliklinikker som har inkludert pasientene i studiene.
Behandling av lokoregionale residiv
Sist faglig oppdatert: 02202402.07.2024
Lokoregionale residiv etter behandling for brystkreft kan opptre både tidlig og sent i oppfølgningen. Hyppigheten av lokoregionale residiver hos lymfeknute positive pasienter er betydelig redusert etter rutinemessig bruk av lokoregional strålebehandling (M. Clarke et al., 2005).
Både behandlingen og prognosen er forskjellig, avhengig av både hva slags primærbehandling som pasienten har vært gjennom, hvor det lokoregionale residiv forekommer og intervallet mellom primærkirurgi og residiv. I tillegg er det en rekke andre faktorer som kan spille en rolle. Det finnes få randomiserte studier som har testet forskjellige behandlingsopplegg mot hverandre, mye av kunnskapen baserer seg derfor på ikke-randomiserte prospektive studier eller retrospektive studier.
Hovedinndelingen av lokoregionale residiv er følgende:
- Brystveggresidiv etter mastektomi
- Residiv i regionale lymfeknutestasjoner
- Brystresidiv etter brystbevarende behandling
- Lokoregionale residiv med samtidige metastaser
Ved lymfeknute positiv sykdom er hyppigheten av lokoregionale residiv etter mastektomi og aksilledisseksjon etterfulgt av postoperativ strålebehandling cirka 6 % etter 5 år. Dersom ikke strålebehandling er benyttet primært vil 25–30 % av pasientene oppleve lokoregionalt residiv. Ved lymfeknutenegativ sykdom vil tilsvarende residivhyppighet være henholdsvis 3 % og 8 % (M. Clarke et al., 2005). Fordelingen av lokoregionale residiver etter mastektomi kan variere etter hvilken lokoregional behandling som er gjennomført primært, men det kan anslås at cirka 2/3 av tilfellene er isolerte brystveggresidiver, ca 20 % kun regionale lymfeknuteresidiv, og i 10 % en kombinasjon. Residivene på brystveggen dreier seg om knuter i huden/underhuden med eller uten erytem eller erytematøse gjerne kløende forandringer. I noen få tilfeller kan det oppstå omfattende residiver gjerne over større områder karakterisert ved betydelig ødem og hardhet i hud/underhud med fargeendring og indurasjon, de kan strekke seg rundt hele trunchus (carcinoma en cuirasse).
Residiv i regionale lymfeknuteområder er stort sett lymfeknuteresidiver. I cirka 25–30 % av tilfellene opptrer metastaser før lokoregionalt tilbakefall, hos 25 % er det samtidig lokoregionalt tilbakefall og metastaser og hos 50 % lokoregionalt tilbakefall alene. Det er rapportert betydelige variasjoner i prognosen, sannsynligvis forårsaket av variasjoner i pasientpopulasjonene og behandlingen de har gjennomført. Cirka 35–66 % 5–10 års lokal kontroll har vært rapportert. 25–75 % har vært rapportert metastaserfri etter 5 år, 7–49 % etter 10 år. Totaloverlevelse etter hhv 5 og 10 år er cirka 44–82 % og 13–62 % Faktorer som influerer på prognosen er sykdomsfritt intervall, lymfeknutestatus, operabilitet, nekrose, LDH og lokal kontroll (Aberizk, Silver, Henderson, Cady, & Harris, 1986; Borner et al., 1994; Buchanan et al., 2006; Halverson et al., 1990; Haylock, Coppin, Jackson, Basco, & Wilson, 2000; Kamby & Sengelov, 1997; Kuo et al., 2008; Mendenhall et al., 1988; Schuck et al., 2002; Schwaibold, Fowble, Solin, Schultz, & Goodman, 1991; van Tienhoven et al., 1999; Willner, Kiricuta, & Kolbl, 1997; Willner, Kiricuta, Kolbl, & Flentje, 1999).
Behandling av brystveggresidiver innbefatter kirurgi, stråleterapi og/eller systemisk terapi.
Ved bruk av stråleterapi, reduseres sjansen for tilbakefall ved økende stråledose, men dette er også avhengig av residiv karakteristika og -størrelse. Effekten av stråleterapi er sikrest etter forutgående kirurgisk fjernelse av makroskopisk tumorresidiv. Det er høyere residivrisiko etter stråleterapi ved makroskopisk tumor på brystvegg. Kombinasjon av kirurgi og stråleterapi gir lavere tilbakefallsrisiko. Overlevelsen øker klart ved komplett remisjon eller vedvarende lokal kontroll. Men det kan ikke ut fra de resultater som er rapportert skilles mellom effekt av behandling eller naturlig sykdomsforløp. Det er også verdt å merke seg at i enkelstående tilfeller kan rebestråling i tidligere strålefelt gi meningsfull palliasjon hos selekterte pasienter med få eller ingen andre behandlingsopsjoner, se også kapittel 6.9.6. Vanligvis tolereres slik behandling godt, men kan gi økt risiko for seneffekter (Abner et al., 1993; Alpert et al., 2005; Kaidar-Person et al., 2018). Kun små studier er publisert ved bruk av kirurgi alene (Faneyte, Rutgers, & Zoetmulder, 1997; McCormack et al., 1989; Muscolino, Valente, Lequaglie, & Ravasi, 1992; Salvadori et al., 1992). Ved begrenset kirurgi er det rapportert høy tilbakefallshyppighet (60–75 %). Ved seleksjon av pasienter og meget vide lokale eksisjoner eller brystveggsreseksjoner er det rapportert residivhyppighet på rundt 25 %. Ved bruk av systemisk behandling alene (kjemoterapi eller hormonbehandling) oppnår man sjelden varige effekter. Det er rapportert responsrater på 40–80 % i noen studier (Beck, Hart, Woodard, & Smith, 1983; Donegan, Perez-Mesa, & Watson, 1966; Gilliland, Barton, & Copeland, 1983; Hoogstraten et al., 1984). Median varighet av respons kan forventes mellom 8–18 mnd. Systemisk behandling før lokoregional behandling kan i en del tilfeller optimalisere mulighetene for kirurgi og/eller stråleterapi, og gir dessuten mulighet for å evaluere behandlingsrepons hos den aktuelle pasient. I andre tilfeller kan det være rasjonale for å benytte systembehandling som en form for «adjuvant» eller konsoliderende behandling etter avsluttet lokoregional behandling. Endokrin behandling (tamoxifen) etter kirurgi + stråleterapi har vist å kunne gi betydelig økning i 5 års residivfri overlevelse, ved utvelgelse av pasienter med gode prognostiske karakteristika (lengre sykdomsfritt intervall, begrenset omfang, få lesjoner) (Borner et al., 1994). CALOR studien inkluderte pasienter som ble radikaloperert for lokoregionale residiv. Disse ble randomisert til «adjuvant» behandling med eller uten kjemoterapi, Det ble det funnet forbedret sykdomsfri overlevelse ved bruk av kjemoterapi ved HR negativ sykdom, mens dette ikke ble observert for HR positiv sykdom (Aebi et al., 2014; Wapnir et al., 2017; Wapnir et al., 2018).
Regionale lymfeknuteresidiv kan gi forskjellige symptomer, slik som armødem, nevrologiske symptomer og tegn, smerte, tumor. Det kan også forekomme uten symptomer. Prognosen er bedre ved aksilleresidiv enn ved andre regionale residiv (Willner et al., 1997). Ved supraklavikulære residiv er det hyppig med samtidige metastaser, men ikke alltid. Det anbefales oftest kirurgi ved aksilleresidiv hvis mulig, supplert med strålebehandling hvis ikke tidligere utført.
Ved andre regionale residiv er det oftest kun aktuelt med strålebehandling som lokal behandling. Systembehandling alene ved regionale lymfeknuteresidiv har lite dokumentasjon. Oftest gis dette som et supplement til lokalbehandling.
Lokoregionale residiv etter brystbevarende kirurgi (BCT) som inkluderer stråleterapi, forekommer hos cirka 8–13 % (Anderson et al., 2009; M. Clarke et al., 2005), avhengig av alder, hormonreseptorstatus og primært stadium. Lokale residiv (i brystet) har klart bedre prognose enn andre lokoregionale residiv. Residivene påvises i 30–50 % av tilfellene ved mammografi, 25 % påvises ved klinisk undersøkelse og 25 % påvises ved både klinisk undersøkelse og mammografi. Lokale residiv kan ha forskjellig presentasjon, slik som masseeffekt, hardhet, retraksjon, hudforandringer. Fettnekrose kan være differensialdiagnose. Av de med lokale residiv (i brystet) etter BCT har cirka 5–10 % samtidige metastaser, 5–10 % utbredte lokalt tilbakefall, 80–90 % har lokalt tilbakefall alene. Mastektomi er lokoregionalt behandlingsvalg nr 1, men brystbevarende kirurgi med etterfølgende strålebehandling kan i noen tilfeller være et alternativ, se også kapittel 6.9.6. Det er rapportert 5 års metastasefri overlevelse på cirka 67 % og totaloverlevelse på 77 % (Anderson et al., 2009). Det er <10 % som får brystveggsresidiver. Hudaffeksjon predikerer dette.
Utredning ved lokoregionale residiv
CT, UL, og MR kan gi viktig informasjon i diagnostikken av et lokoregionalt residiv. I enkelte tilfeller hvor disse undersøkelser ikke er konklusive, kan PET gi tilleggsinformasjon. Det kreves alltid bioptisk verifisering av et residiv. Differensialdiagnose kan være strålefibrose.
Det bør rutinemessig screenes for metastaser (for eksempel CT thorax/abdomen/bekken, og skjelettscintigrafi/MR).
Anbefalinger:
- Dersom ikke metastaser er påvist, er målsetning ved behandlingen i utgangspunktet kurasjon eller langvarig sykdomskontroll (avhenger av residivkarakteristika som sier noe om det potensielt kurative potensiale). Dette gjelder alle residivtypene.
Beslutningene om behandlingsopplegg må gjøres innenfor et multimodalt behandlingsteam bestående av onkolog, kirurg, radiolog, og av og til plastikkirurg.
Brystveggresidiv etter mastektomi
- Hvis mulig (operabilitet) kan optimal kirurgisk reseksjon gjennomføres først. Men preoperativ systemisk behandling kan vurderes i en del tilfeller og pasienten bør derfor diskuteres mellom kirurg og onkolog før kirurgi foretas (se nedenfor). Det er ønskelig å oppnå frie reseksjonskanter. Aksilleglandeltoalett er ikke nødvendig ved negativ aksilleutredning. Plastisk kirurgi kan være aktuelt for å oppnå dette, men vil oftest ikke benyttes dersom stråleterapi kan gis isteden (se neste punkt). Ved negativ aksilleutredning vurderes det i MDT møte om aksilledisseksjon bør gjennomføres eller kan utelates.
- Postoperativ strålebehandling hvis ikke tidligere gitt mot samme område. Det bør gis 2,67 Gy x 15 primært mot brystvegg. Dersom kjemoterapi planlegges, bør denne behandling gjennomføres før strålebehandlingen. Eventuell inkludering av aksille/infra-/supraclav-region er avhengig av lokalisasjon av residiv eller andre individuelle forhold.
Dersom det vurderes rebestråling av tidligere bestrålt område, se kapittel Rebestråling ved lokoregionale residiv for grunnlag og vurderinger. - Systembehandling:
- «Adjuvant» systembehandling bør vanligvis benyttes hvis ikke benyttet i primærsituasjonen. Ved hormonreseptor positive residiv kan endokrin behandling benyttes alene i mange tilfeller. Ved hormonreseptor negative residiv er det indikasjon for kjemoterapi (Wapnir et al., 2017).
Dersom adjuvant behandling har vært benyttet i primærsituasjonen, er det oftest grunnlag for ny endokrin behandling ved hormonreseptor positivt residiv (eller skifte av pågående endokrin behandling hvis residiv under pågående adjuvant endokrin behandling). Ved hormonresepotor negativt residiv er det grunnlag for å vurdere kjemoterapi (type kjemoterapi etter grundig gjennomgang av onkolog). Sannsynligvis er det liten/mindre nytte av kjemoterapi hvis residiv kort tid etter initial adjuvant behandling. Det samme gjelder for endokrin behandling ved tidlige residiv under pågående endokrin adjuvant behandling.
-
- Ved inoperable eller mer omfattende lokoregionale residiv bør preoperativ systemisk behandling benyttes, og dette gir også muligheten til å vurdere effekt av systemisk behandling før evt. kirurgi. I noen tilfeller kan dette også være aktuelt som tumorreduserende behandling før kun stråleterapi. Bruk av cytostatika eller endokrin behandling vil være avhengig av individuell vurdering av sykdomssituasjon og tumorbiologi.
- Ved inoperable tilfeller hvor strålebehandling tidligere er gjennomført, vil systembehandling være aktuelt alene, evt med senere kirurgisk behandling ved god tumorreduserende effekt og etter individuell vurdering.
Lymfeknuteresidiv
- Ved operable tilfeller
- Kirurgi (aktuelt i aksille først og fremst) etterfulgt av
- stråleterapi (hvis ikke tidligere gitt) oftest 2.67 Gy x 15 mot aksille/infra-/supraclav-region + eventuelt brystvegg.
- Systembehandling kan være aktuelt på samme vilkår som for brystveggsresidiv (se over)
- Øvrige/inoperable tilfeller:
- Strålebehandling (hvis ikke tidligere gitt), oftest 2.67 Gy x 15-16 mot aksille/infra-/supraclav-region + eventuelt brystvegg.
- Systemisk behandling før stråleterapi kan være aktuelt i en del tilfeller for å redusere tumorstørrelse. Systemisk behandling kan også være aktuelt på samme vilkår som for brystveggsresidiver (se ovenfor). Når lokale behandlingsformer er brukt opp, vil det være grunnlag for systemisk behandling alene.
Ved kombinasjoner av brystveggsresidiv og regionale lymfeknuteresidiv vurderes de overnevnte behandlingsanbefalinger i kombinasjon.
Behandling av isolerte lokale residiv etter BCT
- Vanligvis mastektomi ved operable tilfeller. Dersom pasienten ikke ønsker mastektomi kan brystbevarende behandling etterfulgt av rebestråling i enkelttilfeller vurderes etter nøye gjennomgang av risiko/nytte i følgende tilfeller som veiledende utgangspunkt (uten å utelukke andre potensielle kandidater): residivfritt intervall flere år, østrogen-reseptor positiv/HER2negativ sykdom, lav histologisk grad, lite og fritt fjernet ikke-lobulært carsinom og fravær av uttalt DCIS, forventet godt kosmetisk resultat basert på ratio mellom tumorstørrelse og størrelse på brystet, begrensede bivirkninger fra primær stråleterapi. I tillegg anbefales alder ≥50 år, basert på at denne aldersgruppen i størst grad har vært inkludert i studier av rebestråling etter brystbevarende kirurgi (Abeloos et al., 2023), samt at lokal residivrisiko generelt er lavere hos eldre enn yngre pasienter (etter primærbehandlingen) (Bartelink et al., 2001; Bartelink et al., 2015). Vurderingen krever gjennomgang i multidisiplinært team som inkluderer onkolog med stråleterapierfaring. Ved beslutning om å gjennomføre brystbevarende kirurgi etterfulgt av rebestråling vil partiell brystbestråling være å anbefale fremfor helbrystbestråling som vil innebære større risiko for skade på friskt vev.
- Der det tidligere er utført sentinel node (SN) inngrep kun, bør det gjøres ny SN diagnostikk for å avdekke om det er behov for aksilledisseksjon. Før kirurgisk inngrep gjennomføres bør det også vurderes i MDT møte om aksilledisseksjon bør gjennomføres eller kan utelates dersom ikke SN lar seg påvise.
- Systembehandling:
- «Adjuvant» systembehandling bør gis hvis ikke tidligere gitt, i tråd med standard retningslinjer i primærsituasjonen.
- Dersom adjuvant systembehandling har vært benyttet i primærsituasjonen, er det oftest grunnlag for ny endokrin behandling ved hormonreseptor positivt residiv (eller skifte av pågående endokrin behandling hvis residiv under pågående adjuvant endokrin behandling). Ved hormonresepotor negativt residiv er det grunnlag for å vurdere kjemoterapi (type kjemoterapi etter grundig gjennomgang av onkolog). Sannsynligvis er det liten/mindre nytte av kjemoterapi hvis residiv kort tid etter initial adjuvant behandling. Det samme gjelder for endokrin behandling ved tidlige residiv under pågående endokrin adjuvant behandling.
- Ved inoperable eller mer omfattende lokale residiv bør preoperativ systemisk behandling benyttes. Bruk av cytostatika eller endokrin behandling vil være avhengig av individuell vurdering av sykdomssituasjon og tumorbiologi. Det etterstrebes deretter å gjennomføre kirurgisk behandling. Hvis ikke mulig, må en vurdere systemisk behandling som vedlikeholdsbehandling.
- I individuelle tilfeller hvor pasienten ikke vil gjennomføre mastektomi og hvor brystbevarende kirurgi er teknisk mulig, vil vurdering av rebestråling av tidligere bestrålt område være aktuelt. Se avsnitt Behandling av radiære arr for eventuelt grunnlag og vurderinger av slik behandling.
Andre forhold
Ved samtidig metastaser vil det gjøres en individuell vurdering av behandlingsopplegg i regi av onkolog. Metastaser tilsier økt vekt på systembehandling, men dette påvirkes av risiko for plagsomme symptomer fra lokale residiv og effekt av tidligere tiltak.
Ved gjentatte residiver kreves også individuell vurdering av behandlingsopplegg avhengig av tidligere gjennomgått behandling, oftest i regi av onkolog.
Behandling av metastaserende sykdom / Livsforlengende og palliativ behandling
Kirurgi ved avansert (metastaserende) brystkreft
Sist faglig oppdatert: 02202402.07.2024
Brystkreft i stadium 4 behandles individuelt. Kirurgien her vil vanligvis være begrenset, men tilstrekkelig til å opprettholde lokal kontroll over sykdommen leveutsiktene tatt i betraktning.
Strålebehandling
Sist faglig oppdatert: 02202402.07.2024
Strålebehandling ved metastaserende brystkreft gis mot metastaser for å lindre plager og/eller for å stoppe lokal tumorvekst som kan medføre mer alvorlige situasjoner i neste omgang.
Der hvor indikasjonen er plagsomme symptomer, bør det være klar sammenheng mellom aktuell metastase(r) og symptom(ene).
Det er ønskelig med god oversikt over tumorutbredelse, både i aktuelt behandlingsområde og i andre regioner, for tilpasning av behandlingsopplegget. Man krever vanligvis detaljert billeddiagnostisk vanligvis i form av MR og/eller CT undersøkelser.
Vanlig fraksjonering ved palliativ konvensjonell strålebehandling er 3 Gy x 10, 8 Gy x 1 eller 4 Gy x 5 (se under).
I enkelte tilfeller (lang tid siden primærbehandling, lang forventet levetid) kan andre fraksjoneringsregimer være aktuelle (for eksempel 2 Gy x 20–25). Stereotaktisk strålebehandling benyttes i økende grad ved oligometastaser i CNS, men kan også benyttes ved ekstrakraniale metastaser.
CNS metastaser
Ved indikasjon for stråleterapi mot multiple hjernemetastaser gis vanligvis 3 Gy x 10 mot total hjerne. I en del tilfeller kan andre fraksjoneringsregimer som 4 Gy x 5 (hvor det er ønskelig med forkortet fraksjonert behandling) eller 2 Gy x 15-20 (hvor langtidstoksisitet kan være av spesiell betydning) vurderes. Ved få hjernemetastaser bør en vurdere stereotaktisk stråleterapi i stedet for total hjernebestråling (Chao et al., 2018; Tsao et al., 2012). Maksimalt antall hjernemetastaser som kan behandles med stereotaktiske teknikker er under gradvis utvikling. Det finnes studier som viser lik overlevelse hos pasienter med opptil 10 eller 15 hjernemetastaser sammenlignet med gruppen som fikk behandlet to til fire metastaser (Hughes et al., 2019; Yamamoto et al., 2014). Men antall hjernemetastaser (totalt) som kan gi grunnlag for stereotaktisk stråleterapi vil være en klinisk vurdering av hele sykdomssituasjonen inkludert behandlingsforløp og prognose i det enkelte tilfelle, i tillegg til tekniske/risiko vurderinger. For spørsmål om valg mellom primær operasjon av hjernemetastaser eller primær stereotaktisk stråleterapi kan multidisiplinær (MDT) vurdering være til hjelp. Stråleterapi etter operativ behandling av CNS metastase(r) starter når operasjonsfeltet er helt tilhelet, vanligvis i løpet av 2–4 uker.
Ekstrakraniale metastaser
Ved indikasjon smertefulle skjelettmetastaser er engangsfraksjon 8 Gy x 1 å foretrekke fordi engangsfraksjon gir like god smertelindrende effekt som multiple fraksjoner og fordi behandlingen kan gjentas ved tilbakefall av smertene (Habberstad et al., 2021). Ved nerverotskompresjon/truende tverrsnittslesjon, frakturrisiko i columna og lange rørknokler eller hvor målsetningen er lengrevarig lokal tumorkontroll, gis vanligvis 3 Gy x 10, men 4 Gy x 5 kan vurderes. Operativ fiksering ved frakturrisiko bør vurderes før stråleterapi for pasienter i god allmenntilstand.
For selekterte pasienter med kun få (1 til 3) ekstrakraniale metastaser i en ellers stabil og kontrollert sykdomssituasjon kan det i enkelte tilfelle vurderes å gi stråleterapi mot alle lesjonene (konvensjonell eller stereotaksi) med mål om lengrevarig sykdomsremisjon. Vi trenger nye studier og resultater fra eventuelt pågående studier for å kunne klargjøre nytteverdien av slik behandling.
For selekterte pasienter med multiple metastaser hvor meget få (1 til 2) av disse er langsomt-voksende metastaser i en ellers helt stabil og kontrollert sykdomssituasjon, kan det med bakgrunn i særskilt biologi vurderes å behandle med stråleterapi (fraksjonert eller stereotaksi) for lokal kontroll.
Medikamentell endokrin behandling
Sist faglig oppdatert: 02202402.07.2024
Målet med systemisk behandling av metastatisk/avansert brystkreftsykdom er å hindre sykdomsprogresjon/redusere sykdomsutbredelsen, å lindre symptomer, og å forlenge overlevelsen.
Ved potensielt endokrin følsom metastatisk sykdom, vil det primært være grunnlag for å velge endokrin behandling fremfor cytostatika. Selv om cytostatika sammenlignet med kun endokrin behandling gir en noe høyere responsrate, er det ingen overlevelsesgevinst ved å benytte dette først. I tillegg gir endokrin behandling mindre bivirkninger (Wilcken et al., 2003). Endokrin behandling som monoterapi ved hormonsensitiv brystkreft kan benyttes uavhengig av tilstedeværelse av viscerale metastaser, med unntak av pasienter med omfattende og raskt progredierende viscerale metastaser (visceral crisis). I sistnevnte tilfelle har det inntil nylig vært anbefalt cytostatika innledningsvis. Men resultatene fra Right Choice studien hvor endokrin behandling gitt i kombinasjon med CDK4/6 hemmeren ribociclib (CDK4/6 hemmere er omtalt i detalj senere i avsnittet) ble sammenlignet med kjemoterapi, viste at endokrin behandling/ribociclib ga bedre progresjonsfri overlevelse enn kjemoterapi ved «visceral crisis» (22 mnd vs 13 mnd) (Lu et al., 2024). Derfor kan CDK4/6 hemmer i kombinasjon med endokrin behandling vurderes som et (bedre) alternativ til kjemoterapi ved mer omfattende visceral sykdom etter vurdering av tumorkarakteristika og sannsynlig endokrin sensitivitet.
Det avgjørende kriterium for å velge endokrin behandling er derfor:
- Tumor er ER positiv
Tidligere var antiøstrogenet tamoxifen førstevalget i behandlingen av reseptor positiv metastatisk sykdom pga. medikamentets effektivitet og lave toksisitet. Etter introduksjonen av spesifikke aromatasehemmere, ble dette bildet endret. Aromatasehemmere (non-steroidale eller steroidale) ble et førstevalg hos postmenopausale kvinner enten de har brukt tamoxifen adjuvant eller ikke (Gibson et al., 2009). Av nyere medikamenter har anti-østrogenet fulvestrant vist effekter ved metastatisk brystkreft, også etter bruk av aromatasehemmer (Flemming et al., 2009). I tillegg viser flere studier at fulvestrant kan være et sammenlignbart alternativ til aromatasehemmer (Lønning et al., 2013; Robertson et al., 2016). Megestrol acetat ble benyttet regelmessig etter progresjon på tamoxifen før aromatasehemmerne ble introdusert (Parazzini et al., 1993). I dag vil dette medikamentet i noen tilfeller kunne ha en plass etter behandling med de overnevnte medikamenter. Det er flere studier som viser effekt av å benytte steroidal aromatasehemmer (exemestane) etter non-steroidal (letrozole, anastrozole) mens det er mindre dokumentasjon for bruk av non-steroidal etter steroidal (Beresford et al., 2011). I tillegg finnes det studier som viser effekter av østrogenterapi (Ellis et al., 2009; Lønning et al., 2001).
Everolimus i kombinasjon med exemestane eller tamoxifen, etter tidligere bruk av aromatasehemmer (for exemestane, etter non-steroidal aromatasehemmer), har vist betydelig effekt på progresjonsfri overlevelse (Bachelot et al., 2012; Baselga et al., 2012a). Bolero-2 studien (fase 3) viste 7 mnd økning i progresjonsfri overlevelse (HR 0.36; 95 % CI 0.28–0.45), men totaloverlevelsen ble ikke forbedret av denne behandlingen (Piccart et al., 2014). Tamrad studien (fase 2) viste 4.5 mnd økning i progresjonsfri overlevelse (HR 0.54; 95 % CI 0.36–0.81), og også bedring i totaloverlevelse (HR 0.45; 95 % CI 0.24–0.81). Det er også rapportert økt progresjonsfri overlevelse med everolimus i kombinasjon med fulvestrant sammenlignet med fulvestrant alene (Schmid et al., 2019). Resultatene viser at endokrin behandling kombinert med everolimus kan gi betydelige effekter ved progresjon/tilbakefall etter bruk av aromatasehemmer.
Everolimus i kombinasjon med eksemestan er derfor et behandlingsvalg etter progresjon på letrozol/anastrozol, vanligvis i 2. eller 3. linje. Everolimus i kombinasjon med tamoxifen eller fulvestrant kan være et alternativ, dersom eksemestan tidligere er benyttet.
Det foreligger nå resultater fra mange studier som har testet CDK4/6 hemmere (palbociclib, ribociclib og abemaciclib) i kombinasjon med endokrin behandling (se følgende referanser: ADDIN EN.CITE.DATA ADDIN EN.CITE.DATA (Cristofanilli et al., 2016; Dickler et al., 2017; Finn et al., 2015; Finn et al., 2014; Finn et al., 2016; Goetz et al., 2017; Hortobagyi et al., 2016; Hortobagyi et al., 2018; Loibl et al., 2017; O'Shaughnessy et al., 2018; Rugo et al., 2019; Slamon et al., 2018; Sledge et al., 2017; Tripathy et al., 2018; Turner et al., 2015; Turner et al., 2018)). Oppsummert viser studiene betydelig bedring i progresjonsfri overlevelse (PFS) ved kombinasjon av CDK4/6 hemmer og aromatasehemmer eller fulvestrant i 1. linje metastatisk situasjon (cirka 10 mnd bedring i progresjonsfri overlevelse).
Etter progresjon på aromatasehemmer har CDK4/6 hemmerne i kombinasjon med fulvestrant også vist tydelig effekt på progresjonsfri overlevelse (5–8 mnd bedring) (Slamon et al., 2020). I både 1. og 2. linje er det i flere studier også rapportert bedring i totaloverlevelse (cirka 10 mnd). Det er i løpet av de siste par år kommet ytterligere oppdateringer fra flere av studiene i tillegg til metaanalyser, som bekrefter tydelige effekter på totaloverlevelse både i kombinasjon med aromatasehemmer og i kombinasjon med fulvestrant (for eksempel Monaleesa-2: ribociclib+letrozol, 12.5 mnd, Monaleesa-3: ribociclib+fulvestrant 14.4 mnd) (Gao et al., 2021b; Hortobagyi et al., 2022; Im et al., 2019; Schettini et al., 2020; Slamon et al., 2020; Sledge et al., 2020).
På ESMO 2022 ble det også presentert data fra MONARCH3 studien (interimanalyse) som viste en tilsvarende 12.6 mnd forskjell i median totaloverlevelse ved bruk av abemaciclib+AI, men i hht statistisk plan foreløpig ikke signifikant (p=0.0392). Paloma-2/1 (palbociclib+letrozol) fant ikke signifikant overlevelsesforskjell for hele populasjonen, kun for pasientene med residivfritt intervall på > 12 mnd (ikke prespesifisert analyse) (Finn et al., 2022). Ut i fra responsrater og resultater på progresjonsfri overlevelse er det ingen sikre forskjeller mellom abemaciclib, ribociclib og palbociclib, ADDIN EN.CITE.DATA ADDIN EN.CITE.DATA (Cristofanilli et al., 2016; Dickler et al., 2017; Finn et al., 2015; Finn et al., 2014; Finn et al., 2016; Goetz et al., 2017; Hortobagyi et al., 2016; Hortobagyi et al., 2018; Loibl et al., 2017; O'Shaughnessy et al., 2018; Rugo et al., 2019; Slamon et al., 2018; Sledge et al., 2017; Tripathy et al., 2018; Turner et al., 2015; Turner et al., 2018). Men for totaloverlevelse viser de foreliggende hovedresultater at ribociclib gir klart bedret totaloverlevelse, foreløpige data for abemaciclib med begrenset observasjonstid antyder samsvarende overlevelseseffekt som for ribociclib, mens det ikke er vist forbedring av totaloverlevelse for palbociclib.
De ikke helt samsvarende resultatene for PFS og OS for de tre CDK4/6 hemmerne kan ha flere årsaker, inkludert forskjeller i studiedesign, studiepopulasjon eller potensielle reelle effektforskjeller. Det foreligger foreløpig ikke «head to head» sammenligninger mellom de forskjellige CDk4/6 hemmerne. Men totaloverlevelsesresultatene nevnt over taler for valg av ribociclib eller abemaciclib fremfor palbociclib. Bivirkningsmessig er det klare forskjeller mellom abemaciclib på ene siden og ribociclib/palbociclib på andre siden når det gjelder bivirkninger. Mens ribociclib/palbociclib gir en høyere forekomst av nøytropeni/beinmargsdepresjon, gir abemaciclib en høyere forekomst av diaré. Mens pasientene generelt merker svært lite til beinmargsdepresjonen, kan det være mer utfordrende å gjennomføre behandling med abemaciclib pga. diaréproblematikken.
Bruk av CDK4/6 hemmer bør benyttes i kombinasjon med aromatasehemmer (eller eventuelt fulvestrant) i 1. linje eller i kombinasjon med fulvestrant i 2. linje (etter progresjon på aromatasehemmer alene). Som oftest anbefales at CDK4/6 hemmer introduseres i 1. linje, heller enn å vente til 2. linje. Dette støttes også av MONALEESA-3-studien som viste en større gevinst i totaloverlevelse for dem som fikk behandling med ribociclib i 1. linje enn dem som fikk det i 2. linje. Det foreligger nå resultater fra en sekvensiell studie, som kan bidra til ytterligere veiledning vedrørende dette spørsmålet. SONIA studien ble presentert på ASCO2023.
Studien randomiserte mellom bruk av AI i første linje +/- CDK4/6 hemmer etterfulgt av fulvestrant ved progresjon +/- CDK4/6 hemmer, hvor pasienter som mottok CDK4/6 hemmer i 1. linje ikke mottok det i 2. linje, samt motsatt for pasienter som kun fikk AI i første linje. Studien viste betydelig forskjell i PFS i 1. linje, i tråd med de publikasjoner som er nevnt over, mens det ikke var forskjell i PFS etter 2. linje og heller ikke for totaloverlevelse (Sonke et al., 2023). Resultatene i studien endrer ikke på at CDK4/6 hemmer primært anbefales i 1. linje, men kan benyttes til støtte for å vente til 2. linje for pasienter som vurderes å være best tjent med en enklere behandling i første linje (ut fra alder/biologi/annet).
På generelt grunnlag vurderes tolerabiliteten av ribociclib/palbociclib å være bedre enn abemaciclib, valg av CDK4/6 hemmer bør avgjøres av tilgjengelighet og klinisk vurdering ut fra nytte/tolerabilitet. Dersom pasienten har problemer knyttet til beinmargsdepresjon, slik som repeterende nøytropene infeksjoner, transfusjonsbehov eller lignende kan abemaciclib være å foretrekke. Behandling med CDK4/6 hemmere er kun aktuell for kvinner med metastatisk brystkreft som er naturlig eller indusert postmenopausale. Det foreligger ikke nok data per idag til å konkludere på eventuell bruk av CDK4/6 hemmer «beyond progression», det vil si at man skifter til annen endokrin behandling ved progresjon, men beholder CDK4/6 hemmeren, selv om MAINTAIN studien presentert på ASCO2022 viste noe bedring i median progresjonsfri overlevelse ved å legge til ribociclib til ny endokrin behandling (2.5 mnd) (Kalinsky et al., 2022).
Det er også publisert resultater fra 2 studier der man har sammenlignet cellegift og kombinert endokrin terapi + CDK4/6 hemmer hos pasienter med hormonreseptor positiv, HER2 negativ brystkreft. I Young-PEARL studien fikk premenopausale kvinner med metastatisk brystkreft palbociclib + exemestane (sammen med LHRH analog) her fant man bedre progresjonsfri overlevelse og mindre bivirkninger enn med capecitabine (Park et al., 2019). En sammenligning av ribocliclib kombinert med letrozol mot kjemoterapi hos postmenopausale kvinner hos luminal-B pasienter i stadium I-IIIA (CORALLEEN-studien) ble også nylig publisert av Prat et al. (Prat et al., 2020).
Spesielle forholdsregler ved bruk av ribociclib: Behandling med ribociclib skal kun initieres ved QTcF <450 millisekunder. Bruk bør unngås ved eksisterende eller signifikant risiko for utvikling av QTC-forlengelse. Samtidig bruk av legemidler som gir QTC-forlengelse og/eller er sterke CYP3A4-hemmere bør unngås (Kisqali, 2020). Det henvises til felleskatalogtekst vedrørende EKG monitorering og overvåking av leverprøver i starten av behandlingen med ribociclib.
Den prospektive, randomisert kliniske studien S0226 inkluderte postmenopausale kvinner med HR+, HER2- metastatisk brystkreft (MBC) til førstelinjes behandling med anastrozole +/– fulvestrant 250 mg månedlig. Studien viste forlenget progresjonsfri overlevelse for pasienter som mottok kombinasjonen av anastrozol og fulvestrant som ikke hadde benyttet endokrin behandling i adjuvant situasjon (Mehta et al., 2019). Resultatene fra denne studien endrer ikke retningslinjer som anbefaler aromatasehemmer (AI) + CDK4/6 hemmer i første linje (evt andre linje) ved HR+, HER2- MBC. Kombinasjonen av AI + CDK4/6 hemmer gir PFS på 25 mndr. med bruk av ribociclib og palbociclib i hhv. MONALEESA-2 og PALOMA-2 studiene (Finn et al., 2016; Hortobagyi et al., 2016). Dessuten var dosen av fulvestrant på 250 mg månedlig i S0226 for lav i.f.t. dagens anbefalinger (500 mg) – det kan derfor være at tilleggseffekten av AI sammen med fulvestrant er lavere når fulvestrant gis i adekvat dose på 500 mg månedlig. Man har heller ikke i S0226 studien sammenlignet fulvestrant + anastrozole kombinasjon mot sekvensiell fulvestrant etterfulgt av anastrozole.
Kombinasjonen av AI + fulvestrant kan vurderes der CDK4/6 hemmer ikke er aktuelt og spesielt hos pasienter som er behandlingsnaive m.t.p. endokrin terapi.
Mange pasienter kan ha nytte av flere behandlingslinjer. Hvordan behandlingsforløpet for den enkelte pasient vil bli, avhenger både av effekt av den enkelte behandling, toksisitet og pasientens allmenntilstand. Det er ingen internasjonal konsensus for hvilken medikamentrekkefølge som bør benyttes. Onkolog bør ha ansvar for all sekvensiell endokrinbehandling ved avansert brystkreftsykdom.
Alpelisib for PIK3CA muterte HR+HER2-.
SOLAR-1 studien som ble publisert i 2019 viste overlevelsesgevinst (PFS) for alpelisib + fulvestrant vs. fulvestrant alene hos HR+/HER2- pasienter med metastaser med PIK3CA mutasjon i tumor etter progresjon på én linje endokrin terapi (hovedsaklig aromatasehemmer alene) (Andre et al., 2019a). Oppdaterte data for totaloverlevelse er også publisert (André et al., 2021). Det var ingen signifikant bedre totaloverlevelse med tillegg av alpelisib (prespesifisert effektgrense satt til p≤0.0161), men numerisk var OS klart forbedret med 39 vs. 31 mnd for pasienter med PIK3CA mutert sykdom. Samtidig viser BYLIEVE studien en responsrate på 20% og clinical benefit rate (respons eller stabil sykdom) på 42% med alpelisib + «endokrin terapi B» etter progresjon på CDK4/6 hemmer og «endokrin terapi A», og der 50% var uten sykdomsprogresjon etter 6 mnd behandling med alpelisib + endokrin terapi (Rugo et al., 2020). Turner et al fant også at alpelisib i kombinasjon med fulvestrant etter CDK4/6 hemmer i BYLIEVE studien var bedre enn real world data for fulvestrant i samme situasjon (ikke randomisert) (Turner et al., 2021). Det anbefalesbruk av Alpelisib etter progresjon på endokrin behandling (sammen med CDK4/6 hemmer), dersom tumor er PIK3CA mutert. Alpelisib er godkjent i Nye metoder. Alpelisib gir høy risiko for hyperglykemi. En ny «real world» studie viser betydelig økt risiko i forhold til hva som ble rapportert i studiene (40% grad 3-4 hyperglykemi) (Biganzoli et al., 2021). Det bør tas HBA1c før oppstart av behandlingen og oppstart og oppfølging gjøres i dialog med endokrinolog/etter plan anbefalt av endokrinolog.
Følgende medikamentgrupper anses å kunne ha en plass som ledd i medikamentell endokrin behandling:
- Antiøstrogener (fulvestrant, tamoxifen)
- Aromatasehemmere (anatrozole, exemestane, letrozole)
- CDK4/6 hemmer i kombinasjon med aromatasehemmer eller fulvestrant
- Everolimus i kombinasjon med exemestane (kan også kombineres med tamoxifen eller fulvestrant)
- Alpelisib i kombinasjon med endokrin behandling
- Gestagener (megestrol acetat)
- Østrogener (omtales ikke i den nedenstående anbefaling, da det gjelder enkeltpasienter og krever spesialkompetanse)
Nye orale selektive estrogen reseptor «degradatorer» (SERD) er utviklet i den senere tid hvor det er rapportert meget gode resultater for enkelte av disse, og det forventes ytterligere resultater for flere andre de nærmeste år. Foreløpig omtales kun elacestrant: Resultatene fra EMERALD studien viser at elacestrant gir bedre progresjonsfri overlevelse enn fulvestrant etter AI+CDK4/6 hemmer (HR 0.70; 95% CI, 0.55 to 0.88; P =0.002) både for alle inkluderte pasienter og for ESR1 ctDNA muterte pasienter (HR 0.55) (Bidard et al., 2022). Interim resultater for totaloverlevelse viser HR på 0.59 i ESR1 mutert populasjon (i ikke mutert populasjon HR 0.92) og HR 0.75 i hele populasjonen. OS resultatene er ikke signifikante på dette tidspunktet og de endelige resultatene må avventes før endelig konklusjon. Resultatene ved bruk av elacestrant er gode.. Medikamentet er under vurdering i Nye Metoder. Vi vet ikke hvordan effekten av elacestrant vil være sammenlignet med fulvestrant + alpelisib for pasienter med PIK3CA mutert sykdom.
Spesielle forhold for HER2 positive
TransATAC/BIG 1–98 gir holdepunkter for kortvarig/beskjeden effekt av endokrin behandling hos HER2 positive. Men så lenge sykdomsutviklingen tillater å avvente en endokrin respons, bør likevel endokrin behandling forsøkes. To studier (TAnDEM og EGF30008) viser effekt på progresjonsfri overlevelse ved å kombinere endokrin behandling med HER2 rettet behandling, sammenlignet med kun endokrin behandling (HR henholdsvis 0.63 og 0.71) (Johnston et al., 2009; Kaufman et al., 2009). Studiene mangler en arm med bare HER2 rettet behandling alene, noe som gir en viss usikkerhet i hva en oppnår med kombinasjonsbehandling. I tillegg har vi ikke data som sier noe om sekvensiell behandling versus kombinasjonsbehandling. Resultatene fra studien kan likevel understøtte bruk av HER2-rettet behandling i kombinasjon med endokrin behandling. Dette oppfattes som en behandlingsopsjon.
Endokrin behandling hos pre- og perimenopausale kvinner
Hvis man er usikker på menopausal status, mål FSH og LH og østradiol (med høy-sensitivt assay).
1. linje
LHRH analog (for eksempel goserelin (Zoladex®) 3.6 mg s.c. hver 4. uke). Hvis man observerer effekt, skal LHRH-analog vurderes erstattet med ovarialbestråling eller oophorectomi.
Det bør vurderes å legge til behandling som for førstelinje ved postmenopausal status, og alltid hvis østrogen-nivået anses å ha falt i god tid før metastaser oppstod.
2. linje og videre som for postmenopausale (fra 1. linje) (se nedenfor)
Endokrin behandling hos postmenopausale kvinner. Se oversikten under.
Spesielle forhold for HER2 positive
TransATAC/BIG 1–98 gir holdepunkter for kortvarig/beskjeden effekt av endokrin behandling hos HER2 positive. Men så lenge sykdomsutviklingen tillater å avvente en endokrin respons, bør likevel endokrin behandling forsøkes. To studier (TAnDEM og EGF30008) viser effekt på progresjonsfri overlevelse ved å kombinere endokrin behandling med HER2 rettet behandling, sammenlignet med kun endokrin behandling (HR henholdsvis 0.63 og 0.71) (S. Johnston et al., 2009; B. Kaufman et al., 2009). Studiene mangler en arm med bare HER2 rettet behandling alene, noe som gir en viss usikkerhet i hva en oppnår med kombinasjonsbehandling. I tillegg har vi ikke data som sier noe om sekvensiell behandling versus kombinasjonsbehandling. Resultatene fra studien kan likevel understøtte bruk av HER2-rettet behandling i kombinasjon med endokrin behandling. Dette oppfattes som en behandlingsopsjon.
Alpelisib for PIK3CA muterte HR+HER2-
SOLAR-1 studien som ble publisert i 2019 viste overlevelsesgevinst (PFS) for alpelisib + fulvestrant vs. fulvestrant alene hos HR+/HER2- pasienter med metastaser med PIK3CA mutasjon i tumor etter progresjon på én linje endokrin terapi (hovedsaklig aromatasehemmer alene) (Andre et al., 2019a). Oppdaterte data for totaloverlevelse er også publisert (André et al., 2021). Det var ingen signifikant bedre totaloverlevelse med tillegg av alpelisib (prespesifisert effektgrense satt til p≤0.0161), men numerisk var OS klart forbedret med 39 vs. 31 mnd for pasienter med PIK3CA mutert sykdom. Samtidig viser BYLIEVE studien en responsrate på 20% og clinical benefit rate (respons eller stabil sykdom) på 42% med alpelisib + «endokrin terapi B» etter progresjon på CDK4/6 hemmer og «endokrin terapi A», og der 50% var uten sykdomsprogresjon etter 6 mnd behandling med alpelisib + endokrin terapi (Rugo et al., 2020). Turner et al fant også at alpelisib i kombinasjon med fulvestrant etter CDK4/6 hemmer i BYLIEVE studien var bedre enn real world data for fulvestrant i samme situasjon (ikke randomisert) (Turner et al., 2021). Det anbefalesbruk av Alpelisib etter progresjon på endokrin behandling (sammen med CDK4/6 hemmer), dersom tumor er PIK3CA mutert. Alpelisib er godkjent i Nye metoder. Alpelisib gir høy risiko for hyperglykemi. Det bør tas HBA1c før oppstart av behandlingen og oppstart og oppfølging gjøres i dialog med endokrinolog/etter plan anbefalt av endokrinolog.
Følgende medikamentgrupper anses å kunne ha en plass:
- Antiøstrogener (fulvestrant, tamoxifen)
- Aromatasehemmere (anatrozole, exemestane, letrozole)
- CDK4/6 hemmer i kombinasjon med aromatasehemmer eller fulvestrant
- Everolimus i kombinasjon med exemestane (kan også kombineres med tamoxifen eller fulvestrant)
- Alpelisib i kombinasjon med endokrin behandling
- Gestagener (megestrol acetat)
- Østrogener (omtales ikke i den nedenstående anbefaling, da det gjelder enkeltpasienter og krever spesialkompetanse)
Elacestrant. Resultatene fra EMERALD studien viser at elacestrant gir bedre progresjonsfri overlevelse enn fulvestrant etter AI+CDK4/6 hemmer (HR 0.70; 95% CI, 0.55 to 0.88; P =0.002) både for alle inkluderte pasienter og for ESR1 ctDNA muterte pasienter (HR 0.55) (Bidard et al., 2022). Interim resultater for totaloverlevelse viser HR på 0.59 i ESR1 mutert populasjon (i ikke mutert populasjon HR 0.92) og HR 0.75 i hele populasjonen. OS resultatene er ikke signifikante på dette tidspunktet og de endelige resultatene må avventes før endelig konklusjon. Resultatene ved bruk av elacestrant er gode og gir grunnlag for bruk av dette medikamentet etter godkjenning. Samtidig vet vi ikke hvordan effekten av elacestrant vil være sammenlignet med fulvestrant + alpelisib for pasienter med PIK3CA mutert sykdom. Medikamentet er under vurdering i EMA.
Anbefalt endokrin behandling av postmenopausale pasienter med metastaser
Ved premenopausal status anbefales LHRH agonist og videre behandling som for postmenopausale.
Under følger tabellarisk oversikt over behandlingsanbefalingene. I tillegg skisseres anbefalingene også i figuren under. Det er anført flere anbefalte behandlingsvalg i behandlingslinjene, da det ikke foreligger sikre data som tilsier at en spesiell behandlingsrekkfølge bør følges.
I noen tilfeller kan det være aktuelt å starte behandling i tråd med behandlingslinje 2+3 nedenfor.
Spesifikasjon | Medikament | Kommentar | |
|---|---|---|---|
Behandlings-linje 1 | Dersom aromatasehemmer (AI) ikke ble benyttet i adjuvant eller metastaser ble påvist >12 mnd etter avsluttet AI behandling | Aromatasehemmer + CDK4/6 hemmer Alternativt kan fulvestrant (500 mg) + CDK4/6 hemmer gis | Valg av CDK4/6 hemmer: de foreliggende resultater taler primært for valg av ribociclib eller abemaciclib fremfor palbocilib. Dersom det er langt sykdomsfritt intervall mellom adjuvant behandling og metastasesituasjon, begrenset sykdom og lavgradig biologi, eller eldre pasienter med behov for enkelt behandlingsopplegg, kan CDK4/6 hemmer avventes og heller benyttes i 2. linje Dersom påvisning av metastaser under adjuvant behandling og aromatasehemmer (AI) har vært benyttet adjuvant men ikke i de siste 24 mnd før metastasetidspunkt kan det vurderes å benytte AI i kombinasjon med CDK4/6 hemmer på individuelt grunnlag. |
Dersom AI ble benyttet i adjuvant situasjon med påvisning av metastaser under eller innen 12 mnd etter avsluttet adjuvant AI behandling | Fulvestrant (500 mg) + CDK4/6 hemmer | ||
Behandlingsnaive pasienter | Aromatasehemmer + CDK4/6 hemmer el. Fulvestrant (500 mg) + CDK4/6 hemmer | ||
Dersom det vurderes at CDK4/6 hemmer og alpelisib ikke er aktuell behandling i noen av behandlingslinjene og pas ikke har mottatt endokrin behandling tidligere | Aromatasehemmer, fulvestrant (500 mg) eller aromatasehemmer i kombinasjon med fulvestrant (250 mg) | Sekvensiell behandling (endokrin monoterapi) foretrekkes foran konkomitant behandling | |
Behandlings-linje 2+3 | Dersom PIK3CA mutasjon påvises og letrozol + CDK4/6 hemmer er benyttet tidligere | Fulvestrant (500 mg) + alpelisib¤ |
|
Dersom PIK3CA mutasjon påvises og fulvestrant (500 mg) + CDK4/6 hemmer er benyttet tidligere | Aromatasehemmer + alpelisib¤ | Pasienter ble behandlet med letrozol i kombinasjon med alpelisib i Cohort B i ByLieve studien – endelige resultater fra denne cohort er ikke publisert men median PFS synes å være sammenlignbar med undergruppe av pasienter som fikk fulvestrant+alpelisib etter tidligere AI (PMID: 35348782) | |
Dersom AI ble benyttet uten CDK4/6 hemmer i tidligere behandlingslinje | Fulvestrant (500 mg) + CDK4/6 hemmer | Bør gis som 2. linjes behandling | |
Dersom det ikke påvises PIK3CA mutasjon og fulvestrant (500 mg) + CDK4/6 hemmer er benyttet tidligere | Exemestan + everolimus |
| |
Dersom det ikke påvises PIK3CA mutasjon og letrozol + CDK4/6 hemmer er benyttet tidligere | Exemestan eller fulvestrant + everolimus | Tamoxifen kan benyttes som alternativ til fulvestrant, men som sekundært valg basert på effektestimater | |
Dersom morbiditet og/eller tolerabilitet ikke gjør kombinasjonsbehandling mulig, eller kombinasjonsbehandling ikke lenger er aktuelt | Aromatasehemmer, fulvestrant eller tamoxifen | Bruk det medikament som ikke tidligere er gitt. Dersom ikke-steroidal AI er benyttet tidligere, kan det skiftes til steroidal AI, eller motsatt. Effekten av fulvestrant oppfattes sammenlignbar med AI. Tamoxifen er et sekundært alternativ, og oppfattes å ha noe mindre effekt sammenlignet med AI | |
Behandlings-linje 4 og senere |
| Ett av de tidligere nevnte behandlingsvalg som ikke er benyttet | Vil være de primære valg |
| Megestrol Acetat | ||
| Østradiol | Hvis aktuelt, bør slik behandling styres av onkolog med spesialkompetanse i endokrin terapi |
# effektene av palbociclib, ribociclib og abemaciclib er sammenlignbare for PFS og oppfattes å være en klasseeffekt. Det foreligger forskjeller i rapportert effekt på totaloverlevelse mellom medikamentene, p.t. i favør av ribociclib og abemaciclib. Valg av medikament kan for øvrig vurderes ut ifra bivirkningsprofil og på individuelt grunnlag.
Vedrørende bruk av ribociclib: Behandling med ribociclib skal kun initieres ved QTcF <450 millisekunder. Bruk bør unngås ved eksisterende eller signifikant risiko for utvikling av QTc-forlengelse. Samtidig bruk av legemidler som gir QTc-forlengelse og/eller er sterke CYP3A4-hemmere bør unngås. Det henvises til felleskatalogtekst vedrørende EKG-monitorering og overvåking av leverprøver i starten av behandlingen.
Pasienter med BRCA1/2 mutert HR+ brystkreft som er endokrint behandlingsresistente/ikke er kandidater for endokrin behandling og hvor bruk av kjemoterapi ikke er ønskelig, kan vurderes for talazoparib (kfr "Spesielle forhold for BRCA muterte pasienter"). Dette er i tråd med oppdaterte ASCO guidelines (Burstein et al., 2021b)
¤Alpelisib gir høy risiko for hyperglykemi. Det bør tas HBA1c før oppstart av behandlingen og oppstart og oppfølging gjøres i dialog med endokrinolog/etter plan anbefalt av endokrinolog.
Kontinuert CDK4/6 behandling ved progresjon. Det foreligger nå resultater fra 4 randomiserte studier som har testet videre bruk av CDK4/6 hemmere med endret endokrin behandling (hovedsakelig fulvestrant) ved progresjon. I to av studiene har palbociclib blitt videreført i begge linjer (PACE:90% av pasientene; PALMIRA: 100% av pasientene) (Llombart-Cussac et al., 2023; Mayer et al., 2023). Studiene viste ingen effekt på PFS ved å fortsette med CDK4/6 hemmer etter progresjon i 1. linje. I MAINTAIN studien ble palbociclib benyttet i 1. linje (84% av pasientene) mens pasientene ble skiftet til ribociclib i 2. linje (Kalinsky et al., 2023). Studien viste en forskjell i PFS på 2.5 mnd i favør av ribociclibarmen (HR 0.57 95% CI 0.39-0.85). Men for alle studiene var median PFS i armene som benyttet CDK4/6 hemmer i 2. linje lav (5.3 mnd MAINTAIN; 4.6 mnd PACE; 4.9 mnd PALMIRA). Resultatene kan tyde på at ribociclib kan gi tilleggseffekter etter palbociclib i 1. linje for noen pasienter, mens kontinuert behandling med samme CDK4/6 hemmer ikke viser effekt. På ASCO 2024 ble det presentert resultater fra fase 3 studien postMONARCH, som testet abemaciclib i kombinasjon med fulvestrant versus fulestrant alene. Resultatene viste bedret PFS (HR 0.73 (0.57-0.95)) (Kalinsky et al., 2024). Subgruppeanalysene taler for at effekten primært er knyttet til pasienter som fikk palbociclib i første linje.
Kontinuert CDK4/6 behandling anbefales ikke på generelt grunnlag. Men for pasienter som progredierer på palbociclib i 1. linje og hvor annen type kombinasjonsbehandling er vanskeliggjort/mindre aktuelt kan kombinasjonsbehandling med ribociclib eller abemaciclib vurderes på individuelt grunnlag
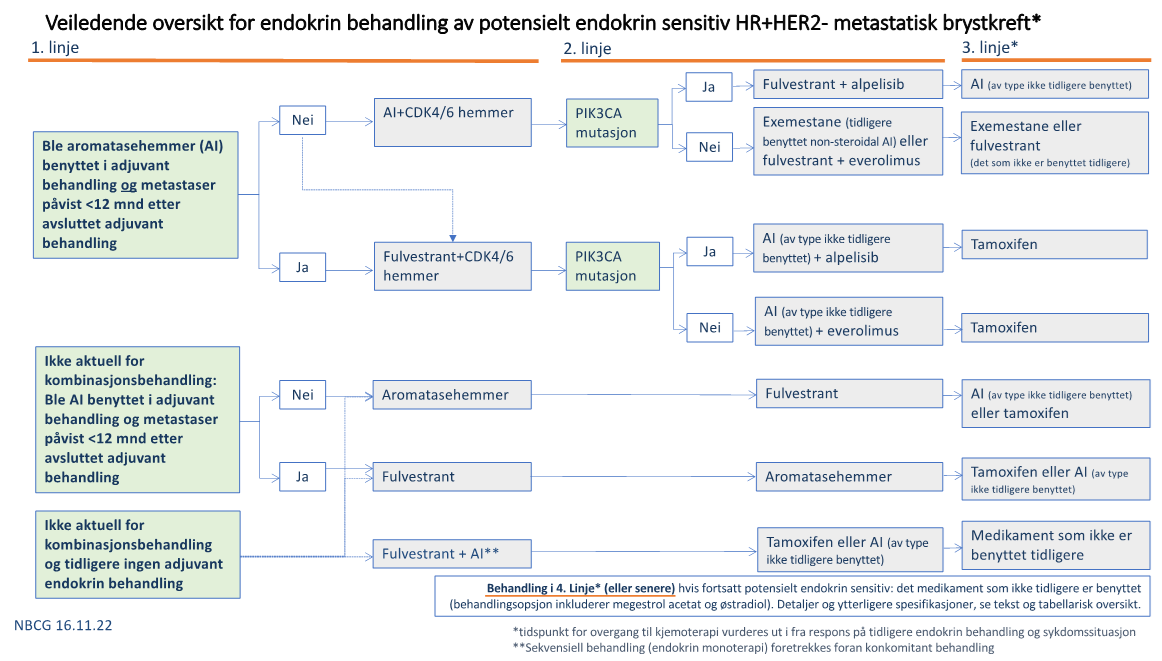
Kilde: Norsk bryst cancer gruppe (2022b) Copyright NBCG 2022. Gjengitt med tillatelse.
Medikamentell cytostatisk behandling av metastatisk brystkreft
Sist faglig oppdatert: 02202402.07.2024
Målet med systemisk behandling av metastatisk/avansert brystkreftsykdom er å hindre sykdomsprogresjon og å lindre symptomer med så liten toksisitet som mulig samt om mulig å forlenge overlevelsen. Introduksjonen av moderne systemisk behandling synes å ha økt overlevelsen hos pasienter med metastatisk sykdom. Mange pasienter kan ha nytte av flere behandlingslinjer. Hvordan behandlingsforløpet for den enkelte pasient vil bli, avhenger både av effekt av den enkelte behandling, toksisitet og pasientens allmenntilstand. Onkolog bør ha ansvar for all cytostatikabehandling ved avansert brystkreftsykdom. I tråd med ASCO guidelines bør utgangspunktet være at et kjemoterapiregime gis inntil progresjon, dersom tolerert tilfredsstillende, da dette kan bedre overlevelsen. Men dette må balanseres mot toksisitet og livskvalitet. Korte pauser og fleksibilitet i behandlingsopplegget vurderes på individuelt grunnlag (Partridge et al., 2014).
Ved avansert/metastatisk ca. mammae skal man (dersom det ikke er gjort tidligere) hvis mulig biopsere metastasen og undersøke for hormonreseptorstatus og HER2-status.
Cytostatikabehandling er aktuell som førstelinjebehandling av metastatisk brystkreft når tumor er østrogenreseptor negativ og progesteronreseptor negativ. Hvis tumor initialt er hormonreseptor positiv, er cytostatikabehandling aktuell etter at endokrine regimer ikke lenger har effekt. Ved HER2 positive tumores er det grunnlag for HER2-rettet behandling i kombinasjon med cytostatika. Dette har klare konsekvenser for valg av behandling. Indikasjon for ikke-hormonell systemisk behandling bør alltid vurderes av onkolog (eller spesialist med bred medisinsk onkologisk kompetanse).
De to mest effektive enkeltgrupper av cytostatika i behandlingen av metastatisk brystkreft er anthracykliner og taxaner (Ghersi, Wilcken, Simes, & Donoghue, 2005; Lord et al., 2004). Om det har noen betydning hvilken rekkefølge disse anvendes i, er usikkert. Det kan være forskjeller med hensyn til responsrate og tid til progresjon (TTP), men det er sjelden at dette oversettes til forlenget totaloverlevelse. I Norge, som i svært mange andre land, har man siden 80-tallet brukt anthracyklinholdige regimer som 1. linjebehandling. Men internasjonalt er det nå vanlig at HER2 positive pasienter får trastuzumab i kombinasjon med annen type kjemoterapi i førstelinje. For pasienter som har fått både antracycliner og taxaner i adjuvant med metastaser innen 12 måneder er det lite trolig at gjentatt bruk av noen av disse cytostatika være til nytte. Hos pasienter som har fått residiv mellom 12 og 24 måneder etter adjuvant behandling, er også forventningen om effekt begrenset. Dette tilsier at det er mest aktuelt å forsøke annen type cytostatika.
Ved trippel negativ brystkreft, metastatisk sykdom, viste TNT studien at carboplatin monoterapi gav betydelig bedre objektiv respons og lengre PFS enn behandling med docetaxel for pasienter med kimcelle BRCA1/2 mutasjon, mens det ikke var noen forskjell i effekt for øvrige trippel negative pasienter (A. Tutt et al., 2018).
Cardiotoksisitet og antracyklinbehandling
Ryberg og medarbeidere har kartlagt cardiotoksisitet, i forbindelse med bruk av epirubicin ved metastaser (Ryberg et al., 2008). Studien omfatter pasienter behandlet i Danmark mellom 1983 og 2003, og vil ikke direkte kunne avspeile dagens behandling av brystkreftpasienter, inkludert stråleterapi og hormonell behandling. Likevel påpeker den at blant annet alder, predisposisjon for hjertesykdom, hormonbehandling ved metastaser, påvirker risiko for utvikling av hjertesvikt innenfor de neste 2.5 år. På grunnlag av disse resultatene bør presiseres følgende ved bruk av antracycliner ved metastaser:
Behov for kardial utredning og eventuell monitorering vurderes i tråd med hva som er beskrevet under avsnittet "Kardial utredning og monitorering..." i kapittelet Utredning og diagnostikk ved påvist invasiv brystkreft. Det anbefales årvåkenhet for hjertetoksisitet ved lengre tids bruk av antracyclin, og å ha lav terskel for å benytte Ekkokardiografi/sekundært MUGA i behandlingsoppfølgning. 900 mg/m2 epirubicin (550 mg doxorubicin) må oppfattes som en maksimal grense dersom ikke liposomalt doxorubicin benyttes, og den reelle faregrense kan avhenge av blant annet alder og predisposisjon for hjertesykdom.
Behandlingsanbefalinger: HER2 negative pasienter
Generelt: De primære behandlingsabefalingene tar utgangspunkt i at pasienten ikke hadde tilbakefall under pågående adjuvant behandling eller hadde kort residivfritt intervall etter adjuvant behandling, - med det behandlingsregimet som foreslås. Dersom det er tilfelle vil annet alternativ medikament i samme linje eller påfølgende behandlingslinje benyttes.
1. linjebehandling
Spesielle forhold for trippel negative
Behandling med anti-PD-1/anti-PD-L1 hemmere i kombinasjon med kjemoterapi har vært testet i flere fase 3 studier. Hos pasienter med tidligere ubehandlet, metastatisk trippel negativ brystkreftsykdom og PD-L1 positiv status, viste resultater fra Impassion130 studien 7 måneders forlenget totaloverlevelse på behandling med nab-paklitaxel i kombinasjon med atezolizumab (anti-PD-L1 antistoff) sammenlignet med nab-paklitaxel og placebo (median 25 mnd versus 18 mnd). DePD-L1 positiv status var definert som PD-L1 ekspresjon≥1 % i immuncellene i tumor (ikke tumorcellene; målt som positiv arealfraksjon innenfor tumorkonturen), med bruk av Ventana PD-L1 (SP142) assay. Det ble ikke påvist effekt av atezolizumab hos pasienter med <1 % PD-L1 positive celler. Studien inkluderte pasienter med debut av metastatisk sykdom mer enn 12 måneder etter avsluttet adjuvant taxanbehandling (Emens et al., 2021; Schmid et al., 2020b). Impassion 131 studien benyttet vanlig paklitaxel sammen med atezolizumab, i stedet for nab-paklitaxel. I denne studien fant man ingen overlevelsesgevinst av å legge til atezolizumab (Miles et al., 2020). Årsaken til denne forskjellen er ikke avklart. Resultatene som foreligger til nå viser at det er viktig at man benytter nab-paclitaxel som partner til atezolizumab.
KEYNOTE-355 studien viste effekt av PD-1 hemmeren pembrolizumab i 1. linje behandling av metastatisk trippel negativ brystkreft (Cortes et al., 2020). Pasienter med combined positive score (CPS) score ≥10 som fikk kjemoterapi sammen med pembrolizumab økte progresjonsfri overlevelse fra 5.6 til 9.7 mnd. Totaloverlevelsen ble forlenget med 7 måneder (fra median 16 mnd til 23 mnd) (Cortes et al., 2022). Subgruppeanalyser tyder på at effekten av bruk av medikamentet er sikrest ved kombinasjon med paklitaxel eller nab-paklitaxel, sammenlignet med gemcitabine/carboplatin, samt hos pasienter som er behandlingsnaive eller hvor det er ≥12 mnd residivfritt intervall.
Som følge av resultatene fra disse studiene anbefales en av følgende til pasienter med metastatisk trippel negativ brystkreft i første linje som tilfredsstiller kriteriene under:
- behandling med nab-paklitaxel (100 mg/m2 ukentlig 3 av 4 uker, 28 dagers syklus) i kombinasjon med atezolizumab (840 mg hver 2. uke)
- behandling med pembrolizumab (200 mg hver 3. uke) i kombinasjon med primært paklitaxel (90 mg/m2 ukentlig 3 av 4 uker, 28 dagers syklus) eller nab-paklitaxel (100 mg/m2 ukentlig 3 av 4 uker, 28 dagers syklus), sekundært gemcitabine/carboplatin (1000 mg/m2 gemcitabine og carbolatin AUC2 ukentlig 2 av 3 uker, 21 dagers syklus).
Kriterier for bruk av PD-L1/PD1 hemmer:
- tidligere ikke mottatt adjuvant kjemoterapi eller avsluttet adjuvant kjemoterapi (med eller uten taxaner) for ≥6-12 måneder siden. Inklusjonskriteriene i Impassion130 (≥12 mnd) og KEYNOTE-355 (≥6 mnd) er forskjellige. I KEYNOTE-355 inkluderte tidsperioden uten kjemoterapi eventuelt bruk av adjuvant capecitebine (etter neoadjuvant kjemoterapi). I Impassion130 er det ingen informasjon knyttet til bruk av adjuvant capecitabine. For pasienter hvor det er gått <12 måneder fra avsluttet capecitabine aksepteres også å kunne gi atezolizumab.
- egnet til å motta slik behandling
påvist ≥1 % PD-L1 positive immunceller i tumor (ved atezolizumab) eller CPS≥10 (ved pembrolizumab)
PD-L1 analyse bør primært gjøres på biopsi av metastase. Dersom metastase ikke er tilgjengelig for biopsi eller det er tvil om grunnlaget for å gi PD-L1/PD-1 hemmer kan man også benytte arkivmateriale (fra primærtumor). Ved immunfarging for PD-L1 er det viktig at benyttes riktig (og validert) antistoff og metode til det medikament som benyttes, ettersom det er vist at ulike PD-L1 antistoff har ulik deteksjonsgrad ved brystkreft, og også i ulik grad vil farge immunceller og tumorceller (presentert av Hope Rugo på ESMO2019). Ventana PD-L1 (SP142) Assay benyttes for atezolizumab. PD-L1 IHC 22C3 pharmDx assay benyttes for pembrolizumab.
Alle andre (eller for trippel negative hvor behandling med atezolizumab ikke er aktuelt):
Ved følgende scenarier er det aktuelt med antracyklinholdige regimer:
- Pasienten har ikke fått adjuvant kjemoterapi,
- Pasienten har fått adjuvant kjemoterapi som ikke inneholdt anthracykliner (eksempelvis CMF)
- Det er gått ≥ 12 mnd etter avsluttet adjuvant/neoadjuvant behandling som inneholder anthracykliner (for eksempel (F)EC, epirubicin)
- Pasienten har ikke kimcelle BRCA 1/2 mutasjon
Følgende antracyklinholdige regimer vurderes som mest aktuelle:
- EC60 (epirubicin 60 mg/m2 + cyklofosfamid 600mg/m2) (Conte et al., 2000; Esteva et al., 2001; Lopez et al., 1989)
- Epirubicin monoterapi (20–25 mg/m2 eller 40 mg fiksert dose ukentlig eller
80–100 mg/m2 hver 3. uke) (Fountzilas et al., 1997) - Lavdose doxorubicin (15–20 mg/m2 eller 20 mg fiksert dose ukentlig) (Gundersen et al., 1994; Gundersen et al., 1986; Aas et al., 1996)
- Pegylert liposomalt doxorubicin (PLD) (Robert et al., 2004). Dosering: 40–50 mg/m2 i.v. hver 28. dag.
- Non-pegylert liposomalt doxorubicin (Batist et al., 2001; Chan et al., 2004; Harris et al., 2002). Dosering 60–75 mgm2 i.v. hver 21. dag
Liposomalt doxorubicin har vist sammenlignbar effekt med doxorubicin i behandling av metastatisk brystkreft, men med en redusert risiko for hjertetoksisitet (L. Harris et al., 2002; O'Brien et al., 2004; van Dalen, Michiels, Caron, & Kremer, 2010). Videre foreligger data som viser at PLD kan benyttes med tilfredsstillende sikkerhet ut over den dosebegrensingen som i dag benyttes på antracycliner (Safra et al., 2000).
Lavdose doxorubicin/ukentlig epirubicin er et regime som tolereres godt hos eldre pasienter. Dersom det er behov for maksimal tumorreduserende effekt og tolerabiliteten tillater det, vil de mer høydoserte regimene være å foretrekke.
Liposomalt doxorubicin kan ha spesiell nytte der hvor det er viktig å ta hensyn til hjertetoksisitet på grunn av alder, predisposisjon for hjertesykdom, ved høye kumulative doser av antracykliner og ved HER2 positiv sykdom.
Hvorvidt man skal velge kombinasjonsregimer eller enkeltstoffregimer er under stadig diskusjon. Kombinasjonsregimer har nok høyere responsrater og lengre TTP, men heller ikke her oversettes dette nødvendigvis til økt totaloverlevelse (Carrick et al., 2009).
Hvis pasienten (ikke BRCA mutert) har fått antracyklinholdig adjuvant/neoadjuvant behandling (uten taxan) < 12 måneder tidligere anbefales bruk av taxaner.
Følgende taxanregimer er aktuelle. Valget kan være avhengig av funksjonstilstand, toksisitet, alder eller andre faktorer:
- Docetaxel monoterapi 75–100 mg/m2 hver 3. uke
Docetaxel 100 mg/m2 hver 3 uke har gjennom to fase III studier dokumentert bedret TTP enn annen 2. linje kjemoterapi (Nabholtz et al., 1999; Sjöstrom et al., 1999). - Paclitaxel 80 mg/m2 ukentlig (Eniu, Palmieri, & Perez, 2005; Luck & Roche, 2002; E. A. Wist, Sommer, Østenstad, Risberg, & Fjæstad, 2004)
Ukentlig paclitaxel i doser på 80–100 mg/m2 har i flere fase-II studier viste høye responsrater, men nivå 1 evidens finnes ikke. En norsk fase II studie med ukedose paclitaxel i 1. linje har vist responsrate på 39.4 % og clinical benefit på 66.7 %. Docetaxel® (docetaxel) 35 mg/m2 ukentlig (6 av 8 uker) (Eniu et al., 2005). Ukentlig docetaxel har vist responsrater mellom 30 og 40 % i flere fase-II studier. Nivå 1 evidens finnes ikke. Oppfattes ikke å gi vesentlige bivirkningsfordeler sammenlignet med docetaxel hver 3. uke. - Albuminbundet paclitaxel. Det foreligger en studie som har vist likeverdig eller bedre effekt ved bruk av albuminbundet paclitaxel (Abraxane) enn docetaxel (W.J. Gradishar et al., 2009), mens en annen studie viste bedre effekt enn paclitaxel hver 3. uke (W. J. Gradishar et al., 2005). Derimot har en nylig studie ikke vist bedre effekt enn ukentlig paclitaxel (trend mot inferiort), men mer toksisitet (H. S. Rugo et al., 2015). Doseringen er 260 mg/m2 i.v. hver 3 uke over 30 min., eller 125 mg/m2 over 30 min dag 1,8 og 15 (4 ukers syklus). Sistnevnte dosering er nå vanligst.
Ved påvist kimcelle BRCA mutasjon
Ut i fra resultatene i TNT studien anbefales bruk av carboplatin AUC6 hver 3. uke i førstelinjebehandling av metastatisk brystkreft hos pasienter med kimcelle BRCA1/2 mutasjon. Deretter vil i utgangspunktet anbefalingene være like.
2. linjebehandling
Hvis man har benyttet antracyklinholdig regime som 1 linje
- Docetaxel 75–100 mg/m2 hver 3. uke (se 1. linjebehandling).
- Paclitaxel 80 mg/m2 ukentlig (se 1. linjebehandling).
- Docetaxel 35 mg/m2 ukentlig (6 av 8 uker) (se 1. linjebehandling).
- Albuminbundet paclitaxel (se 1. linjebehandling).
Hvis taxaner ble benyttet som 1. linje, men ikke i kombinasjon med capecitabine:
- Capecitabine 1000–1250 mg/m2 x 2 dag 1–14 hver 21. dag (J.L. Blum et al., 2001; S. H. Lee et al., 2004; E. A. Wist, Sommer, Østenstad, Risberg, Bremnes, et al., 2004). Capecitabine har i flere studier og en norsk forskrivningsstudie vist responsrater på 20–30 % etter antracykliner og taxaner. Det anbefales DPYD genotyping for pasienter som behandles med 5FU/fluoropyrimidiner. Metabolismen og detoksifiseringen av capecitabine avhenger av enzymet dehydropyrimidin dehydrogenase (DPD; kodet av genet DPYD). Blant kaukasiere er ca. 3–5 % heterozygote og ca. 0,2 % homozygote for DPYD-genvarianter som gir manglende DPD-enzymaktivitet. Studier har vist at pasienter med redusert DPD-aktivitet (heterozygote) har mer enn 4-ganger økt risiko for fatal toksisitet ved behandling med fluoropyrimidiner, mens risikoen er enda høyere blant pasienter som mangler funksjonelt DPD-enzym (homozygote). Testen vil kunne avdekke pasienter som bør unngå 5FU/fluoropyrimidiner eller trenger dosereduksjon. En studie som ble presentert på ASCO2023 (Khan et al., 2023) hvor fiksert dose capecitabine 1500 mg x 2 i 7 dager etterfulgt av 7 dagers pause ble sammenlignet med standard dosering 1250 mg/m2 x 2 dag 1–14 hver 21. dag, viste ingen forskjell i PFS eller totaloverlevelse. Denne doseringen er en behandlingsopsjon når capecitabine skal benyttes, spesielt ved tolerabilitetsutfordringer.
- Vinorelbine 25–30 mg/m2 ukentlig eller (25)/30–35 mg/m2 dag 1 og dag 8 hver 3. uke (Papaldo et al., 2006), eller peroral vinorelbine (60 mg/m2 ukentlig de første 3 uker, før økning til 80 mg/m2 ukentlig). Dokumentasjonen for vinorelbine etter antracykliner og taxaner er ikke så god som for capecitabine, men regimet benyttes regelmessig ved flere institusjoner i Norge, med observasjon av responser og liten grad av toksisitet.
- Eribulin 1.23 mg/m2 dag 1 og dag 8 (21 dagers syklus).
EMBRACE studien randomiserte pasienter som hadde gjennomgått flere behandlingslinjer, inkludert antracycliner og taxaner, mellom eribulin og «physicians treatment choice». Resultatene viste signifikant økt overlevelse for pasienter som fikk eribulin (2.5 mnd økt median overlevelse) (Cortes et al., 2011). Subgruppeanalyse viste at effekten av eribulin også var til stede hos pasienter som tidligere hadde fått capecitabine. En randomisert fase 3 studie av eribulin versus capecitabine, hos pasienter som tidligere har vært behandlet med antracykliner og taxaner, viste ingen statistisk signifikant forskjell i totaloverlevelse mellom eribulin og capecitabine (HR 0.879; 95 % CI: 0.770–1.003; p=0.056) (P. A. Kaufman et al., 2015). Eksplorativ subgruppeanalyse tyder på at trippel negative kan ha større nytte av eribulin, men dette trenger bekreftende studier. Resultatene taler for at Halaven (eribulin mesylat) bør sidestilles med capecitabine som behandlingsvalg etter gjennomgått behandling med antracyclin og taxan).
Vurdering av sacituzumab-govitecan for trippel negative, se under.
Hvis docetaxel/capecitabine blir benyttet i 1. linje
- Vinorelbine 25–30 mg/m2 ukentlig, eller (25)/30–35 mg/m2 dag 1 og dag 8 hver 3. uke (Papaldo et al., 2006), eller peroral vinorelbine (60 mg/m2 ukentlig de første 3 uker, før økning til 80 mg/m2 ukentlig).
- Eribulin 1.23 mg/m2 dag 1 og dag 8 (21 dagers syklus).
3. linjebehandling
Indikasjon bør vurderes nøye. Avhengig av hva som ble benyttet i 2. linje kan et av følgende være aktuelt:
- Capecitabine 1000–1250 mg/m2 x 2 dag 1–14 hver 21. dag.
- Vinorelbine 25–30 mg/m2 ukentlig, eller (25)/30–35 mg/m2 dag 1 og dag 8 hver 3. uke (Papaldo et al., 2006), eller peroral vinorelbine (60 mg/m2 ukentlig de første 3 uker, før økning til 80 mg/m2 ukentlig).
- Eribulin 1.23 mg/m2 dag 1 og dag 8 (21 dagers syklus), se ovenfor.
- Gemcitabine 1000 mg/ m2 i.v. dag 1, 8 og 15. 28 dagers syklus (Brodowicz et al., 2000).
Vurdering av sacituzumab-govitecan for trippel negative, se under.
Det finnes en rekke andre regimer i litteraturen som det ikke er tatt stilling til, men de angitte regimer er ansett som veletablerte og tar hensyn til det viktigste elementet i palliativ kjemoterapi: Å lindre gjennom å hindre sykdomsprogresjon med samtidig lav toksisitet.
For trippel negative er det rapportert om relativt gode responsdata på kombinasjonen carboplatin og gemcitabine etter bruk av antracyclin/taxan. Responsrater på rundt 33 % er rapportert (Loesch et al., 2008; O'Shaughnessy et al., 2011; Yardley et al., 2008). Utover bruk av carboplatin for BRCA mutasjonsbærere i 1. linje, kan denne behandlingsopsjon være til nytte ved trippel negativ mammacancer. Monoterapi er vanligvis er å foretrekke ved metastatisk brystkreft, slik at det primært anbefales bruk av carboplatin AUC6 hver 3. uke.
Andre behandlingsmuligheter spesielt rettet mot trippel negative pasienter
Sacituzumab govitecan
Antistoff-kjemoterapikonjugater har nå også blitt testet ved trippel negativ brystkreft. Sacituzumab govitecan består at et antistoff mot Trop-2, som er et membranprotein uttrykt på mange trippel negative brystkreftceller, og govitecan, som er en topoisomerase I-hemmer. Medikamentet ble i ASCENT studien sammenlignet mot standard kjemoterapi for pasienter med trippel negativ metastatisk brystkreft som har mottatt 2 eller flere kjemoterapiregimer, spesifisert til progresjon på minimum 2 tidligere kjemoterapiregimer inkludert bruk av taxan, hvorav et av medikamentene må ha vært benyttet i metastatisk situasjon; hvis kun ett av medikamentene er benyttet i metastatisk situasjon må residivet ha inntruffet innen 12 mnd etter bruk av (neo)adjuvant kjemoterapi) (Bardia et al., 2024). De endelige resultatene viste at sacituzumab govitecan (10 mg/kg i.v. dag 1 + dag 8 q3w) økte objektiv responsrate fra 5 til 35%, bedret progresjonsfri overlevelse fra median 1.7 til 4.8 mnd (hele populasjonen), og økte totaloverlevelse fra 6.9 til 11.8 mnd. Effekten var tydelig både ved 2-3 og flere enn 3 tidligere behandlingslinjer. Sacituzumab govitecan ble godkjent i Nye Metoder juni 2023. Medikamentet anbefales som behandling av trippel negative pasienter etter bruk av antracyklin og taxan i 2. linje og senere, i tråd med ASCENT studien og slik det fremkommer i avsnittet "Skjematisk oversikt fra NBCG over cytostatisk behandling av metastaser" nedenfor.
Andre behandlingsmuligheter for HR+HER2- pasienter
Sacituzumab govitecan har også vært testet i den randomiserte fase 3 studien Tropics-02 hvor pasienter ble randomisert mellom Sacituzumab govitecan og kjemoterapi etter tidligere behandling med minst ett endokrint regime, CDK4/6 hemmer og 2-4 kjemoterapiregimer i metastatisk situasjon. Nylig er de avsluttende resultater publisert. Studien viste at median totaloverlevelse økte fra 11.2 mnd til 14.4 mnd (HR 0.79 95% CI 0.65-0-96) (Rugo et al., 2023). Resultatene er interessante. Behandlingen er til vurdering i Nye Metoder.
Spesielle forhold for BRCA muterte pasienter
Olaparib eller talazoparib (PARP-hemmere) for pasienter med kimcelle BRCA1/2 mutasjon og metastatisk brystkreft.
Olaparib og talazoparib har begge vært sammenlignet med kjemoterapi («physician’s choice») hos pasientene som tidligere har fått antracyklin og/eller taxanbehandling (og dessuten endokrin terapi dersom de var hormonreseptor positive HER2 negative). Studiene krevde at pasientene var enten platinum-naïve eller fremdeles platinum-sensitive når de startet med PARP hemmer.
OlympiAD studien (n=302) viste forlengelse i progresjonsfri overlevelse på cirka 3 mnd med olaparib, men ingen forskjell i totaloverlevelse etter median FU 25 mnd (M. Robson et al., 2017; M. E. Robson et al., 2019). Tilsvarende har EMBRACA studien vist en forlengelse i progresjonsfri overlevelse på 3 mnd for talazoparib, men ingen signifikant forskjell i totaloverlevelse (Litton et al., 2018).
Anbefaling:
Olaparib og talazoparib anbefales som alternativ til standard kjemoterapi, dersom pasientene tidligere har fått anthracyklin og/eller taxanbehandling (og endokrin terapi dersom de er hormonreseptorpositive HER2 negative) og enten har respondert på platinum cellegift (og fremdeles oppfattes som platinum-sensitive) eller platinum ikke gis pga kontraindikasjoner/intoleranse. Bruk av Talazoparib er godkjent av Beslutningsforum og kan benyttes i tråd med dette..
Alternativene til pasienter i denne situasjonen vil være cellegiftbehandling med eribulin, capecitabine, o.a. og disse regimene gir generelt mer bivirkninger enn olaparib/talazoparib. Det er viktig å merke seg at PARP hemmerbehandling ikke er aktuelt etter progresjon på platinum kjemoterapi, pga. sannsynlig kryssresistens.
Pasienter med HR+ brystkreft som er endokrint behandlingsresistente/ikke er kandidater for endokrin behandling og hvor bruk av kjemoterapi ikke er ønskelig, kan vurderes for talazoparib/olaparib. Dette er i tråd med oppdaterte ASCO guidelines (Burstein et al., 2021b).
HER2-low pasienter
Antistoff-kjemoterapi konjugatet trastuzumab-deruxtecan (irinotecanlignende kjemoterapi) ble testet i DestinyBreast04 studien som ble publisert juli 2022. Pasienter med HER2 IHC 1+ eller 2+ (ISH negative) som var endokrin ressistente (hvis ER+) og som hadde gjennomgått 1-2 linjer med kjemoterapi (for både ER+ og ER-) ble randomisert til behandling med trastuzumab deruxtecan eller kjemoterapi besluttet av behandlende lege. Denne studien viste en betydelig bedring i både progresjonsfri overlevelse (HR 0.50) og totaloverlevelse (HR 0.64) med median overlevelse forlenget med 6.6 mnd (Modi et al., 2022; Moy et al., 2022). ASCO anbefaler bruk av trastuzumab-deruxtecan for HER2 lav pasienter som har motatt minst en linje kjemoterapi i metastatisk situasjon. Behandlingen er nå godkjent av Beslutningsforum.
Tilsvarende anbefales det å benytte trastuzumab-deruxtecan til pasienter med HER2 lav status, dersom de har fått tidligere behandling med minst ett behandlingsregime som inkluderer kjemoterapi. Ved hormonreseptor negativ status vil i utgangspunktet antistoff-kjemoterapi konjugatet sazutuzumab govitecan (se tidligere) være det primære valg da dokumentasjonsgrunnlaget for denne behandling foreløpig er bedre for denne pasientgruppen.
Behandlingsanbefalinger HER2-positive pasienter
Det er vist meget gode responser og overlevelsesresultater ved bruk av kjemoterapi sammen med HER2 rettet behandling. Anthracyklin-basert kjemoterapi, som må gis uten HER2 rettet behandling for å unngå hjertetoxicitet, benyttes derfor senere i behandlingslinjene.
Generelt: De primære behandlingsabefalingene tar utgangspunkt i at pasienten ikke hadde tilbakefall under pågående adjuvant behandling eller hadde kort residivfritt intervall etter adjuvant behandling, - med det behandlingsregimet som foreslås. Dersom det er tilfelle vil annet alternativ medikament i samme linje eller påfølgende behandlingslinje benyttes.
Da HER2-rettet behandling kan påvirke hjertefunksjonen er det anbefalt kardial utredning før oppstart og under slik behandling i tråd med hva som er beskrevet under avsnittet "Kardial utredning og monitorering..." i kapittelet Utredning og diagnostikk ved påvist invasiv brystkreft.
1. linjebehandling
Hvis tumor er HER2 positiv, bør første linjes behandling være trastuzumab og pertuzumab i kombinasjon (Gasparini et al., 2007; Marty et al., 2005; Slamon et al., 2001). CLEOPATRA studien, som randomiserte HER2 positive pasienter mellom docetaxel (75 mg/m2/3qw + trastuzumab/3qw og docetaxel + trastuzumab + pertuzumab i 1. linje, viste betydelig bedring i progresjonsfri overlevelse (HR 0.62; 95 % CI 0.51–0.75) og totaloverlevelse (HR 0.64; 95 % CI 0.47–0.88) i pertuzumab armen (Baselga et al., 2012b; Swain et al., 2013). De endelige resultatene viste en 15.7 måneders økning i median totaloverlevelse (Swain et al., 2015). ASCO guidelines og en rekke andre nasjonale retningslinjer anbefaler bruk av pertuzumab i kombinasjon med trastuzumab og taxan som første valg ved HER2 positiv metastatisk brystkreft (Giordano et al., 2014).
Det anbefales vanligvis følgende behandling for HER-2 positive:
- Primært taxan (paklitaxel 80 mg/m2 ukentlig eller q3w docetaxel 75–80 mg/m2 + q3w trastuzumab (s.c. 600 mg eller i.v. 6 mg/kg etter loadingdose 8 mg/kg) + q3w pertuzumab (s.c. 600 mg etter 1200 mg loadingdose (A. R. Tan et al., 2021) eller i.v. 420 mg etter loading dose 840 mg) hver 3. uke
Det kan vurderes overgang til trastuzumab + pertuzumab vedlikeholdsbehandling dersom sykdomskontroll men ikke tilfredsstillende tolerabilitet av taxan, eller meget god respons og ønske om å deeskalere behandlingen. - Hos pasienter hvor bruk av taxaner ikke er mulig, kan det vurderes å gi vinorelbine (25)/30–35 mg/m2 dag 1+dag 8/hver 3. uke sammen med trastuzumab og pertuzumab. Dokumentasjon for tilleggseffekt av pertuzumab ved slik behandling er imidlertid svak.
- Dersom ikke pertuzumab tolereres kan behandling virdereføres med kjemoterapi i kombinasjon med kun trastuzumab (Andersson et al., 2011; A. Chan et al., 2006; Gasparini et al., 2007; Marty et al., 2005; Papaldo et al., 2006; D. J. Slamon et al., 2001)
Hvis det er indikasjon for taxan+pertuzumab+trastuzumab og pasienten ikke kan motta taxan som følge av toksisitet, kan man ved hormonreseptor positiv, HER2 positiv sykdom kombinere pertuzumab+trastuzumab med endokrin behandling (primært AI), som har vist forbedret progresjonsfri overlevelse i forhold til trastuzumab og endokrin behandling (Rimawi et al., 2018).
Huober et al. rapporterte resultater fra en studie som randomiserte pasientene mellom pertuzumab/trastuzumab uten kjemoterapi versus pertuzumab/trastuzumab i kombinasjon med paklitaxel eller vinorelbine ≥4 mnd etterfulgt av pertuzumab/trastuzumab som vedlikeholdsbehandling, etterfulgt av T-DM1 ved progresjon (for begge armene). Både ER positive og ER negative pasienter var inkludert. Median progresjonsfri overlevelse på første linjes behandling var 8.4 mnd (uten kjemoterapi) versus 23.3 mnd (med kjemoterapi), men det var ikke markert forskjell i totaloverlevelse (Huober et al., 2023). Bivirkningsnivået var lavere uten kjemoterapi. Resultatene støtter bruk av pertuzumab/trastuzumab som monoterapi der pasientene ikke kan motta tradisjonell kjemoterapi.
Hvis sykdomssituasjon, allmenntilstand, alder, forventet tolerabilitet eller pasientpreferanse ikke taler for bruk av taxan eller vinorelbine, kan også trastuzumab monoterapi vurderes, men sannsynligheten for effekt av slik monoterapi er betydelig mindre enn ved kombinasjon med kjemoterapi og pasienten bør følges tett (Vogel et al., 2002).
Videre HER2-rettet behandling
T-DM1
Antistoff-kjemoterapi konjugatet trastuzumab-emtasine (T-DM1) gitt i hovedsak i 2. og 3. (eller senere) linje viste i EMILIA studien bedret progresjonsfri overlevelse og totaloverlevelse i forhold til lapatinib+capecitabine (Verma et al., 2012). Videre viste TH3RESA studien at bruk av T-DM1 etter tidligere bruk av både trastuzumab og lapatinib ga bedret progresjonsfri overlevelse sammenlignet med «physicians choice» (Krop et al., 2014). Disse studiene underbygger sterkt grunnlaget for å benytte T‑DM1 i 2. eller 3. linjes behandling.
Trastuzumab deruxtecan
Antistoff-kjemoterapi konjugatet trastuzumab-deruxtecan (irinotecanlignende kjemoterapi) har vist meget overbevisende effekter etter behandling med T-DM1 hos HER2+ metastatisk brystkreftpasienter. Modi et al viste i en enarmet studie en responsrate på 60% etter flere HER2-rettede behandlingslinjer (Modi et al., 2020). Progresjonsfri overlevelse var på hele 16.2 mnd (senere oppdatert til 19.4 mnd, ESMO2021). Dette er overbevisende resultater, selv om studien ikke inkluderte kontrollarm eller sammenligning mot tucatinib-kombinasjonen (se over). Resultater fra DESTINY-breast03 studien, hvor pasientene ble randomisert til behandling med T-DM1 eller trastuzumab deruxtecan, viste svært stor forskjell i progresjonsfri overlevelse i favør av trastuzumab deruxtecan (HR 0.28 95% CI 0.22-0.37) med median progresjonsfri overlevelse som ennå ikke er nådd (Cortés et al., 2022; Cortes et al., 2021). Oppdaterte overlevelsesanalyser ble publisert nylig som viser median PFS forskjell på 22 måneder (28.8 vs 6.8 mnd), og betydelig bedring i totaloverlevelse hvor median ikke er nådd (HR 0.64 95% CI 0.47-0.87) (Hurvitz et al., 2023). På SABCS2021 ble det også presentert en eksplorativ subgruppeanalyse for pasienter med CNS metastaser hvor median p rogresjonsfri overlevelse ved bruk av trastuzumab-deruxtecan var 15 mnd (mot 3 mnd med T-DM1) (Hurvitz et al., 2022). Trastuzumab deruxtecan er primært behandlingsvalg etter progresjon på trastuzumab/pertuzumab. Medikamentet ble godkjent av Beslutningsforum til bruk fra 15.11.22.
Destiny Breast02 studien rapporterte nylig median 12.7 mnd bedring i totaloverlevelse etter T-DM1, sammenlignet med treeatment of physician´s choice (HR 0.66 95% CI 0.50-0.86). Bedring i progresjonsfri overlevelse var 10.9 mnd (André et al., 2023) (referanse) Dette betyr at behandlingen er anbefalt også for de pasienter som er behandlet med T-DM1 etter progresjon på trastuzumab/pertuzumab.
Man må være obs på at trastuzumab-deruxtecan kan gi mer alvorlige pneumonitter og pasientene må observeres nøye for slike symptomer.
Tucatinib
Kombinasjonen av tucatinib+trastuzumab+capecitabine har vist å gi bedre progresjonsfri overlevelse (2.2 mnd) og totaloverlevelse (4.5 mnd) hos HER2+ metastatisk brystkreftpasienter sammenlignet med trastuzumab+capecitabine (etter bruk av pertuzumab og T-DM1) (Murthy et al., 2020). Studien viste også klar effekt hos pasienter med hjernemetastaser. Tucatinib ble godkjent av Beslutningsforum til bruk fra 01.11.22. Det ble nylig rapportert oppdaterte ekplorativer analyser fra studien med fokus på pasienter med hjerrnemetastaser. Resultatene viser at det var 6.3 mnd økning av median overlevelse hos pasienter med aktive hjernemetastaser. I tillegg var totaloverlevelsen 9.1 mnd lenger for pasienter som fikk tucatinib (vurdert i hele populasjonen) (Lin et al., 2023). Medikamentet anbefales til pasienter som tidligere har gjennomgått behandling med minst to anti-HER2 rettede behandlingsregimer tidligere, i tråd med skjematisk oversikt i 13.4.4. Tucatinib 300 mg x 2, gis i kombinasjon med capecitabine 1000 mg/m2 x 2 14/21 dager og trastuzumab i standard dosering.
Annen kjemoterapi i kombinasjon med HER2-rettet behandling
Det er vist effekt av å fortsette bruk av trastuzumab i kombinasjon med capecitabine, sammenlignet med capecitabine som monoterapi, – etter progresjon på trastuzumab sammen med annen type kjemoterapi (von Minckwitz et al., 2009).
Den kombinerte HER2/HER1 hemmeren lapatinib har i kombinasjon med capecitabine vist dobling av progresjonsfri overlevelse (4 måneder) sammenlignet med capecitabine alene hos pasienter som tidligere har benyttet antracyclin, taxan og trastuzumab (Geyer et al., 2006). I tillegg har lapatinib vist effekt i monoterapistudier etter tidligere trastuzumab. Det er også vist effekter hos pasienter med hjernemetastaser.
Det finnes også en rekke mindre studier som har vist nytte av å benytte andre typer kjemoterapeutikum i kombinasjon med HER2-rettet behandling.
Følgende behandlingsvalg foreligger ved 2. og videre linjers behandling (uten resistens for HER2-rettet behandling):
- Primært bør trastuzumab deruxtecan (5.4 mg/kg i.v. q3w) benyttes i 2. linje. Medikamentet kan også benyttes i senere linjer.
- Etter progresjon på trastuzumab deruxtecan finnes foreløpig ikke data som kan gi grunnlag for klar anbefaling om den foretrukne neste linjes behandlingsvalg, men følgende er mest aktuelle:
- tucatinib 300 mg p.o. x 2 daglig + trastuzumab (q3w) + capecitabine (14/21 dager syklus) (spesielt ved CNS metastaser)
- T-DM1 (3.6 mg/kg) hver 3. uke
- Hvis de over nevnte medikamentene er benyttet eller ikke er tilgjengelige/aktuelle, er følgende behandlingsregimer aktuelle:
- Vinorelbine p.o./i.v. + trastuzumab s.c./i.v.
- Capecitabine p.o. + trastuzumab s.c./i.v.
- Capecitabine p.o. + lapatinib 1250 mg po x 1 daglig*
- Kombinasjon av HER2-rettet behandling og andre cytostatika med dokumentert effekt ved brystkreft, kan også vurderes
- Trastuzumab s.c./i.v. + lapatinib, men denne behandling gir lavere respons enn kjemoterapi i kombinasjon med HER2-rettet behandling
*Det er publisert resultater fra NALA studien der kombinasjonen av neratinib + capecitabine viste bedre PFS (2.2 mnd gevinst) og lavere sannsynlighet for intervensjon for CNS metastaser enn behandling med lapatinib + capecitabine ved HER2 positiv, metastatisk sykdom i 3. linje (Saura et al., 2020) Der var diaré som bivirkning hos 83 vs. 66% av pasientene. I denne studien hadde svært få pasienter fått pertuzumab og T-DM1 i 1. og 2. linje og kun 40% hadde fått trastuzumab tidligere, således en underbehandlet pasientpopulasjon etter dagens praksis. Vi vet heller ikke hvordan effekten av denne behandlingen ville vært, sammenlignet med trastuzumab + capecitabine. Neratinib + capecitabine kan være er et alternativ til lapatinib + capecitabine for pasienter som ønsker et rent peroralt regime, men det er sannsynligvis mer bivirkninger enn med capecitabine + trastuzumab.
-
- MonarcHER studien (Tolaney et al., 2020) inkluderte 237 pasienter med HR+ HER2 positiv, metastatisk sykdom til 3. linjes behandling 1:1:1 med abemaciclib + fulvestrant + trastuzumab (Arm A) eller abemaciclib + trastuzumab (Arm B) eller kjemoterapi + trastuzumab (Arm C). En svakhet med studien er at man ikke hadde med fulvestrant + trastuzumab som kontrollarm. Studien viste signifikant lengre PFS 8.3 for Arm A vs. 5.7 mndr. for Arm C. Ingen forskjell Arm B vs. Arm C. Objektiv responsrate var 33% i Arm A, og 14% i Arm B og C. Dette er en liten studie som indikerer at abemaciclib/fulvestrant/trastuzumab er minimum sammenlignbart med kjemoterapi + trastuzumab. Men vi vet likevel ikke om dette er bedre enn fulvestrant + trastuzumab. Behandlingen kan være aktuell hos pasienter med HR+/HER2+ metastatisk sykdom der kjemoterapi ikke tolereres.
Behandling hos pasienter som er resistente mot HER2-rettet behandling
- Pegylert liposomalt doxorubicin (PLD) (Robert et al., 2004). Dosering: 40–50 mg/m2 i.v. hver 28. dag.
- Non-pegylert liposomalt doxorubicin (Batist et al., 2001; S. Chan et al., 2004; L. Harris et al., 2002). Dosering 60–75 mg/m2 i.v. hver 21. dag
Liposomalt doxorubicin har vist sammenlignbar effekt med doxorubicin i behandling av metastatisk brystkreft, men med en redusert risiko for hjertetoksisitet (O'Brien et al., 2004; van Dalen et al., 2010). Videre foreligger data som viser at PLD kan benyttes med tilfredsstillende sikkerhet ut over den dosebegrensingen som i dag benyttes på antracycliner (Safra et al., 2000).
Liposomalt doxorubicin kan ha spesiell nytte der hvor det er viktig å ta hensyn til hjertetoksisitet på grunn av alder, predisposisjon for hjertesykdom, ved høye kumulative doser og ved HER2 positiv sykdom.
Ytterligere informasjon og valg som kan være relevant for behandlingsbeslutninger i Norge presenteres i ASCO guidelines for HER2-rettet behandling av HER2 positive metastatisk brystkreft (S. H. Giordano et al., 2014), og mer spesifikt i ASCO guidelines for behandling av HER2 positiv, metastatisk sykdom hos pasienter med hjernemetastaser (Ramakrishna et al., 2018).
Skjematisk oversikt over cytostatisk behandling av metastaser


Utgangspunkt for dosering av ikke-hormonell medikamentell behandling ved metastaser
Medikament | Dosering | Anmerkning |
|---|---|---|
Atezolizumab i kombinasjon med nab-paklitaxel | Atezolizumab 840 mg/m2 i.v. hver 2. uke + | |
Capecitabine | Capecitabine 1000(-1250) mg/m2 p.o. x 2 dag 1 – 14 hver 21. dag | |
Carboplatin | Carboplatin AUC5-6 i.v. hver 3. uke (eller AUC 1.5-2 hver uke) | |
EC60 | Epirubicin 60 mg/m2 i.v. + cyklofosfamid 600mg/m2 i.v. hver 3. uke | |
Epirubicin | Epirubicin 20-25 mg/m2 i.v. ukentlig eller 80-100 mg/m2 hver 3 uke i.v. | Epirubicin anvendes også i fiksert dose 40 mg ukentlig |
Eribulin | Eribulin 1.23 mg/m2 i.v. dag 1 og dag 8 (21 dagers syklus) | |
Docetaxel | Docetaxel 75-80 mg/m2 i.v. hver 3. uke | 75 mg/m2 hver 3. uke i.v i kombinasjon med trastuzumab/pertuzumab |
Doxorubicin | Doxorubicin: 15-20 mg/m2 i.v. ukentlig Pegylert doxorubicin: 40-50 mg/m2 i.v. hver 4. uke | Doxorubicin anvendes også i fiksert dose 20 mg ukentlig |
Gemcitabine | Gemcitabine 800-1000 mg/m2 i.v. dag 1, 8 og 15. 28 dagers syklus | |
Lapatinib | Lapatinib 1250 mg p.o. x 1 daglig | |
Paclitaxel | Paclitaxel: 80 mg/m2 i.v. ukentlig Albuminbundet (nab) paclitaxel: 260 mg/m2 i.v. hver 3. uke eller 125 mg/m2 ukentlig 3 av 4 uker | |
Pembrolizumab i kombinasjon med kjemoterapi | Pembrolizumab 200 mg i.v. hver 3.uke i kombinasjon med: nab-paklitaxel 100 mg/m2 i.v. ukentlig 3 av 4 uker eller paclitaxel 90 mg/m2 i.v. ukentlig 3 av 4 uker eller gemcitabine 1000 mg/m2 + carboplatin AUC2 i.v dag 1. og dag 8. hver 3. uke | |
Pertuzumab | i.v.: 840 mg loading dose etterfulgt av 420 mg hver 3. uke s.c: 1200 mg loading dose etterfulgt av 600 mg hver 3. uke | |
Talazoparib | talazoparib 1 mg x 1 p.o. | |
Trastuzumab | i.v.: 8 mg/kg loading dose etterfulgt av 6 mg/kg vedlikeholdsdose s.c: 600 mg fiksert dose | |
Trastuzumabemtasine (T-DM1) | T-DM1 3.6 mg/kg i.v. hver 3. uke | |
Trastuzumabderuxtecan | 5.4 mg/kg i.v. hver 3. uke | |
Tucatinib | 300 mg p.o. x 2 | |
Sacituzumab govitecan | 10 mg/kg i.v. dag 1 + dag 8 – hver 3. uke | |
Vinorelbine | i.v.: Vinorelbine 25 – 30 mg/m2 ukentlig, eller 25 – 35 mg/m2 dag 1 og dag 8 hver 3. uke i.v. p.o.: vinorelbine 60-80 mg/m2 ukentlig | Dersom i.v. og i kombinasjon med trastuzumab/ (pertuzumab) er utgangspunkt for dosering 30-35 mg/m2 dag 1+ dag 8 hver 3. uke (+ anti-HER2 rettet behandling hver 3. uke) |
Kilde: Norsk bryst cancer gruppe (Norsk bryst cancer gruppe, 2024) Copyright NBCG 2024. Gjengitt med tillatelse.
Skjelettmetastaser og bruk av benresorpsjonshemmer
Sist faglig oppdatert: 02202402.07.2024
Cirka 70 % av pasientene som opplever utvikling av metastaser, vil på et eller annet tidspunkt utvikle skjelettmetastaser. Til sammenligning ses lunge og levermetastaser hos 27 % (Fisher et al., 1968). Hos 26 % er skjelettet det sted hvor tilbakefall først manifesterer seg (Fisher et al., 1968).
Typisk er median overlevelse for kvinner med bare spredning til skjelett 3 år (Hillner et al., 2000). Skjelettmetastaser oppstår når tumorceller i primærtumor løsner og vandrer med blodstrømmen og slår seg ned i ben. Tumorcellene frigjør osteoklast-aktiverende faktorer som leder til benresorpsjon og svekkelse av benet. Det er påvist IL-11 genekspresjon hos enkelte primære invasive mammacancere og det er antydet at dette cytokinet er en mulig biologisk prediktiv faktor for utvikling av skjelettmetastaser (Sotiriou et al., 2001).
Spredning til skjelett forårsaker betydelig morbiditet. Pasienten opplever til dels meget sterke smerter og aktivitetsnivået blir redusert. Patologiske frakturer kan ha meget store konsekvenser for pasienten. Sammenfall av vertebrae eller frakturer av femora kan fullstendig invalidisere pasienten.
Bruk av benresopsjonshemmere hos pasienter med metastaser til skjelett medfører reduksjon i skjelett-relaterte hendelser og bruk av stråleterapi. Dette er vist gjennom behandling med intravenøs pamidronat (G.N. Hortobagyi et al., 1996; R.L. Theriault et al., 1999) og zoledronat (Rosen et al., 2001). Ibandronat oralt eller intravenøst er et annet alternativ (Body et al., 2003; Body et al., 2004). Zoledronat er vist å være noe mer effektiv enn pamidronat (Rosen et al., 2003). Det er ikke gjort direkte head-to-head-sammenligninger mellom zoledronat og ibandronat.
En slik behandling har ingen innflytelse på levetiden, men man oppnår å redusere omfanget av komplikasjoner fra skjelett (patologiske frakturer, kirurgi for truende frakturer, nødvendig strålebehandling, kompresjon av medulla spinalis og hypercalcemi). Evidensnivå A.
CALGB 70604 (Alliance) studien ble presentert på ASCO2015 (Himelstein et al., 2015) og viste sammenlignbar effekt av zoledronsyre 4 mg i.v. gitt hver 3 mnd og samme behandling gitt med 1 mnd interval. Basert på disse resultatene har er det grunnlag for å gi zoledronsyre hver 3. mnd fra start ved brystkreft med skjelettmetastaser der det er indikasjon for bisfofonat.
Denosumab (subcutan administrasjon) har vist seg å gi mindre skjelettrelaterte hendelser enn zoledronsyre (Stopeck et al., 2010), men zoledronsyre er har betraktelig lavere kostnader, jfr. Statens legemiddelverk (Refusjonsrapport: denosumab (Xgenva) til forebygging av skjelett-realterte hendelser hos voksne med benmetastaser fra solide tumorer: vurdering av søknad om forhåndsgodkjent refusjon §2).
Anbefalinger:
Hvis det foreligger osteolytiske metastaser, med eller uten ledsagende smerter, vil behandling med bisfosfonater eller denosumab være en aktuell tilleggsbehandling til endokrin behandling eller behandling med cytostatika, i henhold til følgende:
- Bruk av benresorpsjonshemmere anbefales der det er skjelettmetastaser med destruksjon (osteolyse/destruksjon). Hos pasienter med én eller noen få skjelettlesjoner, og der brystkreftsykdommen oppfattes å kunne respondere godt på endokrin behandling, kan det etter individuell vurdering velges å starte endokrin terapi alene uten benresorpsjonshemmer, for å avvente behandlingseffekt.
- Behandlingslengde med benresorpsjonshemmer vurderes ut i fra klinisk skjønn.
Doser og administrasjonsmåte
Bisfosfonat
- Zoledronat 4 mg i.v. hver 3. mnd.
- Pamidronat 90 mg iv hver 3.–4. uke.
- Ibandronat 6 mg i.v. hver 3.–4. uke.
- Ibandronat finnes også som kapsler (til peroral behandling) og doseres 50 mg x 1.
Denosumab
- Denosumab (Xgeva) 120 mg s.c. hver 4 uke. Etter dagens regler er denosumab kun et alternativ til bisfosfonat dersom bisfosfonat ikke kan benyttes. Medikamentet forskrives som helseforetaksresept (H-resept).
Det er rapportert økt frekvens av komplikasjoner fra kjeven inkludert osteonekrose og infeksjoner etter bruk av intravenøs bifosfonatbehandling (Wilkinson, Kuo, Freeman, & Goodwin, 2007). Det samme gjelder denosumab. Det er laget norske anbefalinger m.t.p. behov for tannlegeundersøkelse og -behandling før bisfosfonater eller denosumab oppstartes, da tanntrekking og infeksjoner gir risiko for osteonekrose og osteomyelitt (Eikesdal, Løes, & Herlofson, 2014). Invasiv tannbehandling bør om mulig unngås hos pasienter under behandling med bisfosfonater eller denosumab. Tannkirurgi kan forverre tilstanden hos pasienter som utvikler osteonekrose i kjeven under behandling med bisfosfonater.
Det henvises til felleskatalogen for retningslinjer for bruk av det enkelte preparat.
Konsekvens for oppfølging?
Når skjelettmetastaser er så hyppig, skal man da gjøre undersøkelser med henblikk på å oppdage slike før pasienten får symptomer f. eks i form av smerter? Skjelettscintigrafi er en følsom metode, men hvis pasienten ikke har noen symptomer, rtg. thorax er negativ og alkaliske fosfataser er normale, vil bare 1 % av undersøkelsene vise patologi (Loprinzi, 1994). Å gjøre repeterende skjelettscintigrafier anbefales derfor ikke (se for øvrig kapittelet Fertilitetsbevarende tilbud ved brystkreft).
Hyperkalsemi
Hyperkalsemi observeres hos en tredel av kvinner med avansert og metastatisk brystkreft (Fisher et al., 1968). Hypercalcemi gir en rekke plagsomme symptomer og kan være livstruende. Disse forsvinner når normalisering av calciumverdien finner sted. Det er derfor viktig å behandle raskt og korrekt.
Anbefaling: Standardbehandling av hypercalcemi (E. Wist, 2000):
- Rehydrering av pasienten
- Rikelig væsketilførsel
- Intravenøs zoledronat 4 mg i.v. over 5–10 minutter.
Zoledronat er i en sammenlignende studie vist å være pamidronat overlegen (Major et al., 2001), men pamidronat 60–90 mg over 2 timer kan benyttes.
Sjeldne svulster
Sist faglig oppdatert: 02202402.07.2024
Disse svulstene er sjeldne, men er viktig å være klar over, da de skal behandles forskjellig fra de øvrige mammakarsinomer.
Anbefaling:
Alle sarkomatoide svulster bør henvises til regionale mammakirurgiske sentra for behandling.
Sarkomatoide karsinomer (metaplastisk karsinom)
Sist faglig oppdatert: 02202402.07.2024
Sarkomatoide karsinomer er svulster med maligne epiteliale og heterologe elementer (Widner & Dabbs, 2012). Svulstene utgjør under 1 % av de maligne svulstene i mamma. Klinisk skiller disse seg lite fra de vanlige karsinomene. Mikroskopisk sees varierende grad av epitelial differensiering, enten i form av DCIS og/eller epitelial differensiering av den invasive komponenten. Av og til kan den epiteliale differensieringen kun gjenkjennes ved hjelp av immunhistokjemisk undersøkelse med epiteliale markører eller elektronmikroskopisk. Den sarkomatoide komponenten ser oftest ut som varianter av et høygradig malignt sarkom. Svulstene metastaserer som oftest hematogent.
Anbefaling:
Sarkomatoide karsinomer skal behandles multimodalt med mammakirurgi, SN‑diagnostikk, eventuelt aksilledisseksjon, og eventuelt adjuvant kjemoterapi som i så fall også bør være sarkomorientert. Nytten av adjuvant kjemoterapi er ikke dokumentert, og må diskuteres i hvert enkelt tilfelle. Evidensnivå B.
Phyllodestumor (tidligere kalt cystosarcoma phyllodes)
Sist faglig oppdatert: 02202402.07.2024
WHO definerer phyllodestumor som «en mer eller mindre velavgrenset lesjon bestående av bindevev og epiteliale elementer, som ved fibroadenomer, men med større celletetthet og varierende grad av atypi i den stromale komponenten» (Esposito, 2012). Phyllodestumor utgjør et bredt spekter av fibroepiteliale lesjoner, og klassifiseres som benign, borderline eller malign. Ved mikroskopisk diagnostikk anbefales at man vurderer mitoser, vekstmønster, stromal atypi, stromal overvekst, stromal cellerikdom, eventuelle maligne heterologe elementer og reseksjonsflater (P. H. Tan et al., 2012). En benign phyllodestumor kan være vanskelig å skille fra et fibroadenom. De er som regel større og snittflaten har et kløftet utseende. Det er viktig å skille phyllodestumor fra fibroadenomer, idet phyllodestumor har en utpreget residivtendens. Phyllodestumor oppstår oftere hos middelaldrende eller eldre pasienter (median alder 43 år) enn fibroadenomer. Den lokale residivtendensen gjelder både de benigne og maligne phyllodestumores, men metastaser ses kun ved malign phyllodes (ca. 15 %). Man må være oppmerksom på at tilsynelatende benigne phyllodestumores kan være heterogene med maligne områder. Ved residiv kan en benign phyllodestumor en sjelden gang utvikle seg i malign retning. En malign phyllodestumor kan videre dedifferensiere til et høygradig malignt sarkom. Metastasering skjer hematogent.
Anbefalinger:
Phyllodestumores skal alle fjernes i fritt vev, dvs. makro- og mikroskopisk radikalt (R0‑reseksjon). Dersom tumor blottlegges ved inngrepet, øker risikoen for residiv.
Ved klinisk, billedmessig (mammografi, ultralyd eller MR) eller cytologisk/histologisk(grovnål) mistanke om borderline eller malign phyllodestumor, bør pasienten henvises sarkomsenter. Rask vekst/og eller stor tumor bør gi slik mistanke. Ved usikkerhet om det foreligger fibroadenom eller phyllodes, anbefales nålebiopsi fremfor eksisjon. Benign phyllodes i nålebiopsi kan opereres av erfaren mammakirurg, eventuelt henvises sarkomsenter. Benign phyllodes operert med positiv margin (R1‑reseksjon), henvises sarkomsenter for vurdering med tanke på re-eksisjon. Borderline eller malign phyllodes som uventet funn i operasjonspreparat henvises sarkomsenter uavhengig av margin.
Benign og borderline phyllodes operert med fri margin kontrolleres årlig i fem år med klinisk undersøkelse og mammografi/ultralyd (klinisk undersøkelse tilstrekkelig etter mastektomi). Malign phyllodes kontrolleres hver 6. måned i fem år, deretter årlig i ytterligere fem år, med mammografi/ultralyd og røntgen thorax.
Sarkomer
Sist faglig oppdatert: 02202402.07.2024
En sjelden gang forekommer rene sarkomer i bryst. Disse behandles etter de samme retningslinjer som sarkomer lokalisert andre steder. De skal behandles ved sarkomsenter. For å oppnå vide marginer er oftest mastectomi nødvendig, uten aksilledisseksjon.
Tiltak ved østrogenmangel-symptomer etter brystkreft
Sist faglig oppdatert: 02202402.07.2024
Det finnes både naturlige østrogener (østradiol, østriol, østron og equint østrogen), syntetiske østrogener (ethinyløstradiol, etifollin, tibolon) og fytoøstrogener (isoflavoner, lignaner). I Europa benyttes hovedsakelig østradiol, mens det i USA nesten bare benyttes equint østrogen. Dette gjør det vanskelig å sammenligne europeiske og amerikanske studier.
Østrogen kan ha generelt gunstige effekter på hetetokter, osteoporose, sentralnervøst utløste symptomer og atrofi av slimhinner, hud og hår, men også lokalt virkende effekter på tørre slimhinner i vagina og atrofi av slimhinnen. Østrogen kan gis per os, transkutant eller lokalt i form av krem eller stikkpiller.
Ved spontan eller medikamentell indusert menopause vil flertallet av kvinner få plager som hetetokter og nattesvette. Årsaken er fall i østrogenproduksjonen. Behandling med østrogenpreparater kan være effektivt, men er forbundet med økt risiko for brystkreftutvikling. Women’s Health Initiative Study og Million Women Study fra 2002 viste signifikant økt risiko for utvikling av brystkreft ved bruk av østrogen kombinert med gestagen for perimenopausalt besvær (Beral, 2003; Rossouw et al., 2002). Bruk av bare østrogen viste derimot ikke økt risiko (Chlebowski et al., 2015; Luck & Roche, 2002). Studien resulterte i at hormonforbruket i verden ble redusert til en tredjedel. Imidlertid var gjennomsnittsalder for oppstart av hormonterapi i denne studien 63 år og østrogenet var ikke det som ble brukt i Norge og Europa. En oppfølgningsstudie av WHI-studien viste at brystkreftdødeligheten var redusert 18 år etter studiestart (Manson et al., 2017). Rundt 170.000 norske kvinner benyttet menopausal hormonterapi før 2002, mens det i 2016 bare var om lag 50.000 kvinner som benyttet det for å lette plager i forbindelse med overgangsalderen (resultater fra Folkehelseinstituttet, referert til i Eriksen et al. 2018 (Eriksen, Moen, & Iversen, 2018)). Nye studier viser at menopausal hormonbehandling med oppstart før 60 års alder og varighet inntil fem år, overveiende har positive helse-effekter (Eriksen et al., 2018). Det er også slik at hormonterapi har positive virkninger på livskvalitet med mindre hetetokter, bedre søvn og seksualfunksjon. Ved spontan menopause, vil de vasomotoriske symptomene vanligvis begynne å avta etter ca. 12 måneder.
Ved kirurgisk, radiologisk eller medikamentell ovarie-ablasjon inntrer menopausen akutt, noe som ofte bevirker kraftigere bivirkninger enn dem man får ved naturlig menopause, der østrogennivåene faller suksessivt. Man har ikke data som viser hvorvidt plagene ved artifisiell menopause i snitt varer lengre eller kortere enn ved naturlig overgangsalder. Et annet symptom på østrogenmangel kan være redusert libido.
Behandlingsmuligheter
Sist faglig oppdatert: 02202402.07.2024
Hormontilskudd
Naturlige hormoner
Hos noen kvinner oppnår man ikke god symptomlindring med ikke hormonelle alternativ (se under). Dersom kvinnen har betydelige plager og lav risiko for residiv av sin brystkreftsykdom kan man vurdere å seponere bruk av endokrin behandling eller bruke østrogen for en kort periode (fortrinnsvis lokal behandling om plagene tilsier dette, men ikke samtidig med bruk av aromatasehemmer) (ikke mer enn 5 år). I slike situasjoner er det viktig med informasjon til pasienten om de usikkerheter som foreligger.
En randomisert, kontrollert studie (HABITS) viste en tre ganger økning i risiko for en ny primær eller et lokalt tilbakefall av brystkreft hos kvinner som brukte østrogensupplement («hormonal replacement therapy» (HRT)) (Holmberg, Iversen, et al., 2008). Den andre av de to randomiserte studiene som foreligger (Stockholmsstudien), viste ikke økt residivrisiko (von Schoultz & Rutqvist, 2005). Disse to studiene belyser ikke effekten av østrogen alene (i begge ble gestagen benyttet i tillegg, men på forskjellig måte). Østrogenbruk alene har til nå kun vært rapportert hos tidligere friske (dvs ikke brystkreft), hvor det er funnet lavere risiko for å utvikle brystkreft enn ved bruk av kombinasjonspreparater. Da vi ikke har andre data tilgjengelige for sikkerhet ved bruk etter brystkreft, frarådes på generelt grunnlag bruk av østrogen etter brystkreft. Gestagen i seg selv kan være effektivt for hetetokter og var mye brukt tidligere, men tillegg av gestagen til østrogen synes klart å øke risikoen for å utvikle brystkreft. En bør derfor være tilbakeholden med å bruke gestagen alene til brystkreftopererte kvinner.
Ca. 40 % av alle postmenopausale kvinner vil oppleve symptomer på vaginal tørrhet, kløe og urinveissymptomer. I motsetning til hetetokter, vil denne plagen gjerne øke med tiden fra menopause. Tamoxifen har noe østrogenlignende effekt i vagina og endometriet og gir derfor mindre vaginaltørrhet enn aromatasehemmere (AI). Med økende bruk av aromatasehemmere, vil problemet med atrofisk vaginitt øke. Både systemisk og vaginalt østrogen er effektiv behandling, men det er mulig vaginal behandling virker best. Ved vaginal behandling kan man bruke lavere doser østrogen enn ved systemisk behandling. Lokal østrogen-applikasjon øker sirkulerende østradiol til et slikt nivå at det må antas å kunne interferere med terapeutisk effekt hos AI brukere (Kendall, Dowsett, Folkerd, & Smith, 2006). Bruk av østrogener lokalt er derfor kontraindisert hos pasienter som bruker aromatasehemmere. Man kan evt. vurdere å skifte fra AI til tamoxifen for at kvinnen skal kunne benytte vaginalt østrogen.
Planteøstrogener
Planteøstrogen (fytoøstrogener) er naturlige, kjemiske forbindelser fra planter som har strukturell likhet med østrogener og som kan påvirke østrogenreceptorer (Madsen, 2009). Kilder til planteøstrogener er bl.a. soya, rødkløver, linfrø og nattlys. Soya i mat kan trygt benyttes, men det er ikke holdepunkt for at planteøstrogener er virksomme mot overgangsalderplager. Planteøstrogener som ekstra kostholdstilskudd i form av f.eks. kapsler trenger ytterligere studier før en kan vurdere effekt og sikkerhet (Fritz et al., 2013; Kucuk, 2017; F. F. Zhang et al., 2017).
Syntetiske hormoner
Tibolone (Livial) er en syntetisk forbindelse med svak østrogen, progesteron og androgen-agonistisk virkning (Kenemans et al., 2009). Det virker godt på hetetokter og vaginal tørrhet. Tibolone hemmer enzymet sulfatase i brystet. Sulfatase regulerer dannelsen av østrogen og reduserer derved østrogenstimuleringen. I humane brystceller vil tibolone hemme proliferasjon, og medikamentet stimulerer apoptose i brystkreftcellelinjer (Gompel et al., 1997). Tibolone gir ikke økt bryst-tetthet, og en stor studie (Beral, 2003) viste at assosiasjonen med brystkreft var mindre enn ved bruk av HRT, men høyere enn ren østrogenbehandling. Imidlertid er en større prospektiv, randomisert, placebo-kontrollert studie med tibolone til brystkreftopererte nylig stoppet fordi sikkerheten ved preparatet ikke var lik placebo (LIBERATE trial, Organon 8). Vi kan derfor ikke anbefale tibolone brukt til brystkreftopererte kvinner.
Ikke-hormonelle alternativ
Det er utført få kliniske, randomiserte studier på ikke-hormonelle behandlingsalternativer. Placebo-effekten synes å spille en viktig rolle både i forbindelse med medikamentinduserte hetetokter og i behandlingen av disse. Det er rapportert effekt på hetetokter hos 25–70 % av placebo-behandlede pasienter (H. D. Nelson et al., 2006). Studier med akupunktur har vist varierende resultat (Borud, Alraek, & White, 2010; Deng et al., 2007). Studiene er generelt små, og gir ikke grunnlag for sikre konklusjoner. Hetetokter er mer uttalt hos kvinner som er overvektige eller som røyker. Mange kvinner forteller om symptombedring ved fysisk aktivitet. Avslapningsteknikker kan ha god effekt hos noen og hypnose har vist ca. 60 % reduksjon i hetetokter i en pilotstudie (Elkins, Marcus, Stearns, & Hasan, 2007).
Anti-depressiva har vært prøvd ut mot østrogenmangelsymptomer ved adjuvant antihormonell behandling hos tidligere brystkreftopererte kvinner (Henry et al., 2018).
SSRI (selektive serotonin reopptak inhibitorer) og SNRI (selektive noradrenalin reopptak inhibitorer) har en virkningsmekanisme i forhold til effekt på østrogenmangelsymptomer som er ukjent og uavhengig av deres antidepressive effekt. De har en del bivirkninger som hodepine, kvalme, redusert appetitt og 10–20 % avbryter behandlingen pga disse bivirkningene. Effekten er bedre enn placebo, men generelt dårligere enn for HRT.
Man skal være oppmerksom på risiko for interaksjon mellom antidepressiva og tamoxifen; SSRI/SNRI (for eksempel Seroxat (paroxetin), Fontex (fluoksetin), Efexor (venlafaxin), Zoloft (sertralin) og Cipramil (citalopram) og Cipralex (escitalopram)) konkurrerer om binding til cytokrom P450 2D6 (CYP2D6)), som aktiverer tamoxifen gjennom konvertering til 4-hydroxy-N‑desmethyltamoxifen (endoxifen) (M.P. Goetz et al., 2007). Graden av hemming av CYP2D6 er forskjellig, fra irreversibel (paroxetin) til svak hemming (for eksempel venlaflaxin og cipralex). Selv om den potensielle kliniske betydning av slike interaksjoner med tanke på behandlingseffekten av tamoxifen ennå er uklar (Aubert et al., 2009; Schroth et al., 2009), er det nylig rapportert at paroxetin i kombinasjon med tamoxifen øker brystkreftdødelighet (C. M. Kelly et al., 2010). Dette oppfattes å være på grunn av hemming av tamoxifen. Studien viste ikke slike effekter når tamoxifen var kombinert med andre SSRI/SNRI (fluoxetine, sertraline, citalopram, venlaflaxine). Likevel utelukkes det ikke at det kan være ugunstige effekter av å kombinere tamoxifen med en av disse. I andre studier har det blant annet vært sett hemmende effekter av aktivering av tamoxifen ved samtidig bruk av fluoxetin. Inntil resultater fra ytterligere studier foreligger, anbefales det å benytte antidepressiva med svak/ingen hemming av CYP2D6 (venlaflaxin og citalopram), der hvor det er klar indikasjon for å benytte slik medikasjon i kombinasjon med tamoxifen. I en del tilfeller kan dette også være på bakgrunn av betydelige plager med hetetokter, selv om en da primært bør vurdere andre behandlingsvalg.
Gabapentin (Neurontin) brukes oftest i behandling av epilepsi og kroniske smerter. Medikamentet er også rapportert å gi god effekt på hetetokter, men resultatene så langt er begrenset, og man trenger mer data for å gi endelige anbefalinger. Svimmelhet og trøtthet kan være et problem hos opptil 20 %, men vil raskt avta og er oftest borte etter 4 ukers bruk (Butt, Lock, Lewis, Ross, & Moineddin, 2008; Toulis, Tzellos, Kouvelas, & Goulis, 2009).
Clonidin er en alfa-adrenerg agonist som tidligere ble benyttet til behandling av hypertensjon. Medikamentet har opp til moderat effekt på behandling av hetetokter (40–50 % reduksjon) (H. D. Nelson et al., 2006). Bivirkninger som kan opptre er munntørrhet, søvnvansker og trøtthet.
Anbefaling ved hetetokter
For kvinner med moderate til kraftige hetetokter, kan man benytte SSRI/SNRI dersom pasienten ikke benytter tamoxifen (vurderes som førstevalg ved siden av gabapentin (se nedenfor)). Dersom pasienten benytter tamoxifen og trenger antidepressiv behandling (som også vil være gunstig for hetetoktene), bør det velges et middel med svak/ingen hemming av CYP2D6. Dersom ikke pasienten trenger antidepressiva, bør en vurdere andre behandlingsalternativer for hetetokter primært. Hvis det likevel er aktuelt å benytte SSRI/SNRI, bør det velges et middel med svak/ingen hemming av CYP2D6 (for eksempel venlafaxin eller citalopram).
Behandlingsforslag når SSRI/SNRI ønskes benyttet:
- Venlafaxin (Efexor) 37,5 mg daglig, økende til 75 mg daglig etter en uke.
- Paroxetin (Seroxat) 10 mg økende til 20 mg daglig etter en uke dersom symptomene vedvarer. Bør ikke benyttes sammen med tamoxifen.
- Hvis ikke tamoxifen benyttes og venlafaxin ikke har effekt, er det grunn til å skifte til paroxetin og vice versa.
SSRI og SNRI er kontraindisert hos kvinner som bruker monoaminoksidase inhibitorer (Aurorix (moklobemid)) og skal brukes med forsiktighet hos kvinner med bipolar eller manisk depresjon fordi det kan gi mani (M. Hickey et al., 2008). Dersom behandlingen ikke har effekt innen 4 uker, så vil den trolig ikke ha effekt.
Gabapentin kan benyttes i opptrappende doser til 900 mg/døgn (nedre doseområde ved epilepsi-behandling). Det ser ikke ut til å være noen tilleggsgevinst ved å bruke gabapentin i tillegg til SSRI/SNRI (Loprinzi et al., 2007).
Catapressan i dosering 25–75 mikrogram 2 ganger daglig kan benyttes. Tilgjengelig preparat er nå kun Carexarit. Doser som brukes for å behandle hetetokter ser ikke ut til å ha effekt på blodtrykket (Pandya et al., 2000).
Det er kommet noen publikasjoner som viser effekt av peroral oxybutinin mot hetetokter (Leon-Ferre et al., 2020; Simon, Gaines, & LaGuardia, 2016). Studiene har benyttet peroral formulering. Det rapporteres om bivirkninger som munntørrhet og urineringsvansker. Medikamentet foreligger i Norge kun som plaster (Kentera) med indikasjon urge inkontinens.
Anbefaling ved atrofisk vaginitt
Ikke hormonelle behandlingsalternativ inkluderer Replens eller Repadina Plus som er tilførsel av fuktighet. Dette er ikke så effektivt som østrogen. Dersom Replens/Repadina Plus ikke har effekt, bør man vurdere vaginalt østrogen/østriol dersom pasienten ikke bruker aromatasehemmer. Andre glidemidler og saliva kan ha god effekt på vaginal tørrhet.
Behandlingsmuligheter ved redusert libido
Libido er avhengig av både østrogennivå og testosteronnivå. Peroral eller transdermal østrogen vil i utgangspunktet ikke anbefales etter brystkreft. Vaginal østrogen kan potensielt være aktuelt for pasienter som ikke benytter aromatasehemmere. Dersom det ikke er motforestillinger mot østrogen vil medikamentell behandling mot redusert libido vanligvis starte med å optimalisere østrogenerstatningen og deretter legge til testosteron. Det anbefales i så fall at østrogenbehandlingen gis vaginalt (eller transdermalt dersom det er besluttet å gi systemisk) for å unngå førstepassasje-effekten i lever. Når østrogen ikke skal/kan benyttes, kan det være grunnlag for å gi testosteron alene. Men selv om testosteronbehandling er effektivt for kvinner med redusert sexlyst, skjer det en perifer omdanning av testosteron til østrogen og undergrupper av brystkreft uttrykker også androgenreseptor. Dette gjør at den enkelte pasient må informeres om disse forhold, og at vi så langt ikke har tilstrekkelig data på betydningen. En mindre studie av testosteronbehandling i kombinasjon med aromatasehemmere til kvinner med gjennomgått brystkreft viste at det ikke var noen tilbakefall av brystkreft eller økning i østrogen (Glaser & Dimitrakakis, 2015).
Hormonspiral
Når det gjelder risiko for residiv ved inneliggende hormonspiral etter brystkreft foreligger det lite dokumentasjon. Det betyr at vi ikke kan gi evidensbaserte vurderinger av denne problemstilling. Som et utgangspunkt for valg av prevensjon etter brystkreft, anbefales ikke hormonspiral som førstevalg. Dersom pasienten har inneliggende hormonspiral fra før diagnosen brystkreft, bør grunnlaget for å videreføre denne prevensjonsmåte vurderes. Hvis den har sittet inne i flere år, oppfattes det som lite sannsynlig at dette vil medføre risiko (hormon-nivået avtar med tiden).
Behandlingsmuligheter
Sist faglig oppdatert: 02202402.07.2024
Hormontilskudd
Naturlige hormoner
Hos noen kvinner oppnår man ikke god symptomlindring med ikke hormonelle alternativ (se under). Dersom kvinnen har betydelige plager og lav risiko for residiv av sin brystkreftsykdom kan man vurdere å seponere bruk av endokrin behandling eller bruke østrogen for en kort periode (fortrinnsvis lokal behandling om plagene tilsier dette, men ikke samtidig med bruk av aromatasehemmer) (ikke mer enn 5 år). I slike situasjoner er det viktig med informasjon til pasienten om de usikkerheter som foreligger.
En randomisert, kontrollert studie (HABITS) viste en tre ganger økning i risiko for en ny primær eller et lokalt tilbakefall av brystkreft hos kvinner som brukte østrogensupplement («hormonal replacement therapy» (HRT)) (Holmberg, Iversen, et al., 2008). Den andre av de to randomiserte studiene som foreligger (Stockholmsstudien), viste ikke økt residivrisiko (von Schoultz & Rutqvist, 2005). Disse to studiene belyser ikke effekten av østrogen alene (i begge ble gestagen benyttet i tillegg, men på forskjellig måte). Østrogenbruk alene har til nå kun vært rapportert hos tidligere friske (dvs ikke brystkreft), hvor det er funnet lavere risiko for å utvikle brystkreft enn ved bruk av kombinasjonspreparater. Da vi ikke har andre data tilgjengelige for sikkerhet ved bruk etter brystkreft, frarådes på generelt grunnlag bruk av østrogen etter brystkreft. Gestagen i seg selv kan være effektivt for hetetokter og var mye brukt tidligere, men tillegg av gestagen til østrogen synes klart å øke risikoen for å utvikle brystkreft. En bør derfor være tilbakeholden med å bruke gestagen alene til brystkreftopererte kvinner.
Ca. 40 % av alle postmenopausale kvinner vil oppleve symptomer på vaginal tørrhet, kløe og urinveissymptomer. I motsetning til hetetokter, vil denne plagen gjerne øke med tiden fra menopause. Tamoxifen har noe østrogenlignende effekt i vagina og endometriet og gir derfor mindre vaginaltørrhet enn aromatasehemmere (AI). Med økende bruk av aromatasehemmere, vil problemet med atrofisk vaginitt øke. Både systemisk og vaginalt østrogen er effektiv behandling, men det er mulig vaginal behandling virker best. Ved vaginal behandling kan man bruke lavere doser østrogen enn ved systemisk behandling. Lokal østrogen-applikasjon øker sirkulerende østradiol til et slikt nivå at det må antas å kunne interferere med terapeutisk effekt hos AI brukere (Kendall, Dowsett, Folkerd, & Smith, 2006). Bruk av østrogener lokalt er derfor kontraindisert hos pasienter som bruker aromatasehemmere. Man kan evt. vurdere å skifte fra AI til tamoxifen for at kvinnen skal kunne benytte vaginalt østrogen.
Planteøstrogener
Planteøstrogen (fytoøstrogener) er naturlige, kjemiske forbindelser fra planter som har strukturell likhet med østrogener og som kan påvirke østrogenreceptorer (Madsen, 2009). Kilder til planteøstrogener er bl.a. soya, rødkløver, linfrø og nattlys. Soya i mat kan trygt benyttes, men det er ikke holdepunkt for at planteøstrogener er virksomme mot overgangsalderplager. Planteøstrogener som ekstra kostholdstilskudd i form av f.eks. kapsler trenger ytterligere studier før en kan vurdere effekt og sikkerhet (Fritz et al., 2013; Kucuk, 2017; F. F. Zhang et al., 2017).
Syntetiske hormoner
Tibolone (Livial) er en syntetisk forbindelse med svak østrogen, progesteron og androgen-agonistisk virkning (Kenemans et al., 2009). Det virker godt på hetetokter og vaginal tørrhet. Tibolone hemmer enzymet sulfatase i brystet. Sulfatase regulerer dannelsen av østrogen og reduserer derved østrogenstimuleringen. I humane brystceller vil tibolone hemme proliferasjon, og medikamentet stimulerer apoptose i brystkreftcellelinjer (Gompel et al., 1997). Tibolone gir ikke økt bryst-tetthet, og en stor studie (Beral, 2003) viste at assosiasjonen med brystkreft var mindre enn ved bruk av HRT, men høyere enn ren østrogenbehandling. Imidlertid er en større prospektiv, randomisert, placebo-kontrollert studie med tibolone til brystkreftopererte nylig stoppet fordi sikkerheten ved preparatet ikke var lik placebo (LIBERATE trial, Organon 8). Vi kan derfor ikke anbefale tibolone brukt til brystkreftopererte kvinner.
Ikke-hormonelle alternativ
Det er utført få kliniske, randomiserte studier på ikke-hormonelle behandlingsalternativer. Placebo-effekten synes å spille en viktig rolle både i forbindelse med medikamentinduserte hetetokter og i behandlingen av disse. Det er rapportert effekt på hetetokter hos 25–70 % av placebo-behandlede pasienter (H. D. Nelson et al., 2006). Studier med akupunktur har vist varierende resultat (Borud, Alraek, & White, 2010; Deng et al., 2007). Studiene er generelt små, og gir ikke grunnlag for sikre konklusjoner. Hetetokter er mer uttalt hos kvinner som er overvektige eller som røyker. Mange kvinner forteller om symptombedring ved fysisk aktivitet. Avslapningsteknikker kan ha god effekt hos noen og hypnose har vist ca. 60 % reduksjon i hetetokter i en pilotstudie (Elkins, Marcus, Stearns, & Hasan, 2007).
Anti-depressiva har vært prøvd ut mot østrogenmangelsymptomer ved adjuvant antihormonell behandling hos tidligere brystkreftopererte kvinner (Henry et al., 2018).
SSRI (selektive serotonin reopptak inhibitorer) og SNRI (selektive noradrenalin reopptak inhibitorer) har en virkningsmekanisme i forhold til effekt på østrogenmangelsymptomer som er ukjent og uavhengig av deres antidepressive effekt. De har en del bivirkninger som hodepine, kvalme, redusert appetitt og 10–20 % avbryter behandlingen pga disse bivirkningene. Effekten er bedre enn placebo, men generelt dårligere enn for HRT.
Man skal være oppmerksom på risiko for interaksjon mellom antidepressiva og tamoxifen; SSRI/SNRI (for eksempel Seroxat (paroxetin), Fontex (fluoksetin), Efexor (venlafaxin), Zoloft (sertralin) og Cipramil (citalopram) og Cipralex (escitalopram)) konkurrerer om binding til cytokrom P450 2D6 (CYP2D6)), som aktiverer tamoxifen gjennom konvertering til 4-hydroxy-N‑desmethyltamoxifen (endoxifen) (M.P. Goetz et al., 2007). Graden av hemming av CYP2D6 er forskjellig, fra irreversibel (paroxetin) til svak hemming (for eksempel venlaflaxin og cipralex). Selv om den potensielle kliniske betydning av slike interaksjoner med tanke på behandlingseffekten av tamoxifen ennå er uklar (Aubert et al., 2009; Schroth et al., 2009), er det nylig rapportert at paroxetin i kombinasjon med tamoxifen øker brystkreftdødelighet (C. M. Kelly et al., 2010). Dette oppfattes å være på grunn av hemming av tamoxifen. Studien viste ikke slike effekter når tamoxifen var kombinert med andre SSRI/SNRI (fluoxetine, sertraline, citalopram, venlaflaxine). Likevel utelukkes det ikke at det kan være ugunstige effekter av å kombinere tamoxifen med en av disse. I andre studier har det blant annet vært sett hemmende effekter av aktivering av tamoxifen ved samtidig bruk av fluoxetin. Inntil resultater fra ytterligere studier foreligger, anbefales det å benytte antidepressiva med svak/ingen hemming av CYP2D6 (venlaflaxin og citalopram), der hvor det er klar indikasjon for å benytte slik medikasjon i kombinasjon med tamoxifen. I en del tilfeller kan dette også være på bakgrunn av betydelige plager med hetetokter, selv om en da primært bør vurdere andre behandlingsvalg.
Gabapentin (Neurontin) brukes oftest i behandling av epilepsi og kroniske smerter. Medikamentet er også rapportert å gi god effekt på hetetokter, men resultatene så langt er begrenset, og man trenger mer data for å gi endelige anbefalinger. Svimmelhet og trøtthet kan være et problem hos opptil 20 %, men vil raskt avta og er oftest borte etter 4 ukers bruk (Butt, Lock, Lewis, Ross, & Moineddin, 2008; Toulis, Tzellos, Kouvelas, & Goulis, 2009).
Clonidin er en alfa-adrenerg agonist som tidligere ble benyttet til behandling av hypertensjon. Medikamentet har opp til moderat effekt på behandling av hetetokter (40–50 % reduksjon) (H. D. Nelson et al., 2006). Bivirkninger som kan opptre er munntørrhet, søvnvansker og trøtthet.
Anbefaling ved hetetokter
For kvinner med moderate til kraftige hetetokter, kan man benytte SSRI/SNRI dersom pasienten ikke benytter tamoxifen (vurderes som førstevalg ved siden av gabapentin (se nedenfor)). Dersom pasienten benytter tamoxifen og trenger antidepressiv behandling (som også vil være gunstig for hetetoktene), bør det velges et middel med svak/ingen hemming av CYP2D6. Dersom ikke pasienten trenger antidepressiva, bør en vurdere andre behandlingsalternativer for hetetokter primært. Hvis det likevel er aktuelt å benytte SSRI/SNRI, bør det velges et middel med svak/ingen hemming av CYP2D6 (for eksempel venlafaxin eller citalopram).
Behandlingsforslag når SSRI/SNRI ønskes benyttet:
- Venlafaxin (Efexor) 37,5 mg daglig, økende til 75 mg daglig etter en uke.
- Paroxetin (Seroxat) 10 mg økende til 20 mg daglig etter en uke dersom symptomene vedvarer. Bør ikke benyttes sammen med tamoxifen.
- Hvis ikke tamoxifen benyttes og venlafaxin ikke har effekt, er det grunn til å skifte til paroxetin og vice versa.
SSRI og SNRI er kontraindisert hos kvinner som bruker monoaminoksidase inhibitorer (Aurorix (moklobemid)) og skal brukes med forsiktighet hos kvinner med bipolar eller manisk depresjon fordi det kan gi mani (M. Hickey et al., 2008). Dersom behandlingen ikke har effekt innen 4 uker, så vil den trolig ikke ha effekt.
Gabapentin kan benyttes i opptrappende doser til 900 mg/døgn (nedre doseområde ved epilepsi-behandling). Det ser ikke ut til å være noen tilleggsgevinst ved å bruke gabapentin i tillegg til SSRI/SNRI (Loprinzi et al., 2007).
Catapressan i dosering 25–75 mikrogram 2 ganger daglig kan benyttes. Tilgjengelig preparat er nå kun Carexarit. Doser som brukes for å behandle hetetokter ser ikke ut til å ha effekt på blodtrykket (Pandya et al., 2000).
Det er kommet noen publikasjoner som viser effekt av peroral oxybutinin mot hetetokter (Leon-Ferre et al., 2020; Simon, Gaines, & LaGuardia, 2016). Studiene har benyttet peroral formulering. Det rapporteres om bivirkninger som munntørrhet og urineringsvansker. Medikamentet foreligger i Norge kun som plaster (Kentera) med indikasjon urge inkontinens.
Anbefaling ved atrofisk vaginitt
Ikke hormonelle behandlingsalternativ inkluderer Replens eller Repadina Plus som er tilførsel av fuktighet. Dette er ikke så effektivt som østrogen. Dersom Replens/Repadina Plus ikke har effekt, bør man vurdere vaginalt østrogen/østriol dersom pasienten ikke bruker aromatasehemmer. Andre glidemidler og saliva kan ha god effekt på vaginal tørrhet.
Behandlingsmuligheter ved redusert libido
Libido er avhengig av både østrogennivå og testosteronnivå. Peroral eller transdermal østrogen vil i utgangspunktet ikke anbefales etter brystkreft. Vaginal østrogen kan potensielt være aktuelt for pasienter som ikke benytter aromatasehemmere. Dersom det ikke er motforestillinger mot østrogen vil medikamentell behandling mot redusert libido vanligvis starte med å optimalisere østrogenerstatningen og deretter legge til testosteron. Det anbefales i så fall at østrogenbehandlingen gis vaginalt (eller transdermalt dersom det er besluttet å gi systemisk) for å unngå førstepassasje-effekten i lever. Når østrogen ikke skal/kan benyttes, kan det være grunnlag for å gi testosteron alene. Men selv om testosteronbehandling er effektivt for kvinner med redusert sexlyst, skjer det en perifer omdanning av testosteron til østrogen og undergrupper av brystkreft uttrykker også androgenreseptor. Dette gjør at den enkelte pasient må informeres om disse forhold, og at vi så langt ikke har tilstrekkelig data på betydningen. En mindre studie av testosteronbehandling i kombinasjon med aromatasehemmere til kvinner med gjennomgått brystkreft viste at det ikke var noen tilbakefall av brystkreft eller økning i østrogen (Glaser & Dimitrakakis, 2015).
Hormonspiral
Når det gjelder risiko for residiv ved inneliggende hormonspiral etter brystkreft foreligger det lite dokumentasjon. Det betyr at vi ikke kan gi evidensbaserte vurderinger av denne problemstilling. Som et utgangspunkt for valg av prevensjon etter brystkreft, anbefales ikke hormonspiral som førstevalg. Dersom pasienten har inneliggende hormonspiral fra før diagnosen brystkreft, bør grunnlaget for å videreføre denne prevensjonsmåte vurderes. Hvis den har sittet inne i flere år, oppfattes det som lite sannsynlig at dette vil medføre risiko (hormon-nivået avtar med tiden).
Fysioterapi til brystkreftopererte kvinner
Forekomst av behandlingsrelaterte plager etter brystkreft
Sist faglig oppdatert: 02202402.07.2024
De vanligste komplikasjonene etter brystkreftbehandling er smerter; både i operasjonsarr, bryst og arm. Opptil 48 % av brystkreftopererte kvinner har rapportert om vedvarende smerter 2 år etter operasjonen (Schou Bredal et al., 2014). Videre er nedsatt skulderbevegelighet, overvekt og lymfødem som følge av brystkreftbehandlingen vanlig forekommende. Rapportene om lymfødem i bryst og arm etter aksilledisseksjon varierer i forhold til målemetode. Selvrapportert lymfødem angis i opp mot 40–50 %, mens med mer objektive målemetoder for lymfødem i armen er variasjonen i forekomst mellom 13 og 20 % (Lawenda et al., 2009). Tyngdefølelse og ubehag i armen rapporteres ofte som en del av diagnosen lymfødem (Schou Bredal et al., 2014), men gir seg ikke nødvendigvis utslag i hevelse (Sagen et al., 2009). Det viktigste symptomet på lymfødem er hevelse (Lawenda et al., 2009; McNeely et al., 2010). Fatigue (kronisk tretthet etter kreftbehandling) er svært vanlig hos brystkreftpasienter. Både symptomer og forekomst av fatigue øker med alderen (Cramp et al., 2008).
Fysioterapi til brystkreftopererte
Sist faglig oppdatert: 02202402.07.2024
Transcutan elektrisk nervestimulering (TENS) kan være et effektivt fysioterapiverktøy mot smerter etter brystkreftbehandling (McNeely et al., 2010). Tilrettelagte øvelser for økt skuldermobilitet tidlig i behandlingsforløpet (ment som dagen etter eller få dager etter operasjonen) med instruksjon av fysioterapeut virker forebyggende på nedsatt skulderbevegelighet og lymfødemutvikling (McNeely et al., 2010; Torres et al., 2010). Antall repetisjoner og hyppighet på øvelsene skal gradvis økes i ukene etter operasjonen. Tilrettelagt fysisk aktivitet med fokus på kondisjon, vekttrening, generell styrketrening, samt aerobic har positiv effekt på skulderfunksjonen, generell fysisk funksjon, maksimalt O2 opptak, helserelatert livskvalitet, overvekt og fatigue (Cramp & Daniel, 2008; McNeely et al., 2010; Speck, Courneya, Masse, Duval, & Schmitz, 2010). Treningen skal doseres individuelt etter; hvilke ønsker og behov pasienten har, pasientens forutsetninger (fysisk form før diagnosen) og hvilken type behandling pasienten har gjennomgått. Fysisk aktivitet og trening organisert i grupper kan virke mer motiverende enn trening alene. Cytostaticabehandling bidrar til å redusere pasientens allmenntilstand og et minstenivå for blodverdier bør derfor følges før trening eller anstrengende fysisk aktivitet settes i gang (Thune, 2008). Fysisk aktivitet har forebyggende effekt på tilbakefall av brystkreft (Schmitz et al., 2010), men de eksakte mekanismene bak dette er foreløpig ukjent. (Om redusert risiko for tilbakefall skyldes økt fysisk aktivitet etter diagnose, eller tidligere fysisk aktivitet er foreløpig noe usikkert).
Kompresjonsbehandling er svært effektivt for å redusere lymfødem i armen etter brystkreftbehandling (McNeely et al., 2010), i tillegg virker manuell lymfedrenasje smertedempende (McNeely et al., 2004). Flere detaljer om lymfødembehandling er beskrevet på www.fysio.no.
Tverrfaglig informasjonsskriv til brystkreftopererte pasienter
Sist faglig oppdatert: 02202402.07.2024
Informasjon til deg som har fjernet lymfeknutene i armhulen (aksilledisseksjon) i forbindelse med brystkreftoperasjonen
I forbindelse med operasjonen ble det fjernet lymfeknuter i armhulen. Når lymfeknuter fjernes i armhulen vil store lymfeårer i armen kuttes over og væsketransporten i armen blir hemmet. Lymfeåresystemet er i tillegg et rensesystem og en del av immunforsvaret i kroppen. Etter operasjonen skal du derfor være oppmerksom på hevelse (lymfødem) i armen, samt sår og infeksjoner i armen på den opererte siden.
Hevelse (lymfødem): er opphoping av lymfe-væske i armen som gjør at den blir hoven, enten i brystet, hånden, deler av armen eller hele armen. Av alle som gjennomgår operasjon med fjerning av lymfeknuter i armhulen, utvikler 15 til 20 % lymfødem. Hevelsen kan være ubehagelig og armen kan kjennes tung. Hevelsen kan komme spontant, eller over tid. Den kan forsvinne spontant etter noen dager eller bli vedvarende. Hvis hevelsen i armen ikke gir seg i løpet av noen dager, skal du kontakte fastlegen din for henvisning til lymfødembehandling (som utføres av fysioterapeuter med spesialkompetanse). Behandlingen består av dreneringsteknikker og bandasjering for å redusere hevelsen mest mulig. Lymfødem som får være ubehandlet over lang tid, er vanskeligere å redusere.
Sår: Forebygging av kutt og rifter i armen ved å bruke hansker f. eks i forbindelse med hagearbeid er hensiktsmessig. Det er bakterier i jord og kommer dette inn i sår på hånden eller armen på den opererte siden, kan det bli en stor belastning på immunsystemet i armen og resultere i hevelse. Når du får sår, rens det og hold det under oppsyn. Oppsøk fastlegen din dersom det skulle bli rødt og hovent. Du vil da få antibiotika for å bli kvitt bakteriene.
Vaksiner: Vaksine bør settes i den armen som ikke er operert eller dersom det er operert på begge sider, i en annen kroppsdel. Man kan få hevelse i armen etter vaksine, og evt. forstørrelse av lymfeknuter som vedvarer en stund og kan forveksles som forstørrede lymfeknuter pga spredning av brystkreft. Bruk derfor den andre armen, eller en hvilken som helst annen kroppsdel enn den opererte armen.
Blodprøver: Blodprøver er ufarlig å ta i armen på operert side fordi utstyret som brukes er sterilt.
Blodtrykksmåling: Én blodtrykksmåling er ufarlig. Skal du inn til en planlagt operasjon, (hvor blodtrykket blir tatt med korte intervaller over lang tid) anbefales det å sette blodtrykks-mansjetten på den ikke-opererte siden.
Øvelser og fysioterapi: Det er viktig å gjenvinne normal funksjon i arm og skulder så raskt som mulig. Gjør øvelser fra 1. dag etter operasjonen og så lenge du synes det er nødvendig. Det er viktig for å opprettholde din normale fysiske funksjon i størst mulig grad for unngå nedsatt styrke i muskulatur og bevegelsesinnskrenkninger i skulderen. Fysioterapeuten på sykehuset instruerer deg i enkle øvelser og du vil få henvisning til fysioterapi som du kan benytte etter operasjonen. Fysioterapi kan startes opp 2–3 uker etter operasjonen. Fysioterapeuten vil gi deg ytterligere hjelp til bevegelsestrening av armen og veiledning til styrkeøvelser eller annen behandling du måtte ha behov for etter brystkreftoperasjonen. Når såret har grodd, etter 2–3 uker, er det ingen restriksjoner i bruken av armen. Prøv deg frem for å finne ut hva som er riktig for deg. De aller fleste kan regne med å være fullt restituert i løpet av et halvt års tid. Sørg for å holde deg i fysisk form med varierende aktiviteter, da takler du rekreasjonstiden med eventuelle tilleggsbehandlinger bedre.
Forekomst av behandlingsrelaterte plager etter brystkreft
Sist faglig oppdatert: 02202402.07.2024
De vanligste komplikasjonene etter brystkreftbehandling er smerter; både i operasjonsarr, bryst og arm. Opptil 48 % av brystkreftopererte kvinner har rapportert om vedvarende smerter 2 år etter operasjonen (Schou Bredal et al., 2014). Videre er nedsatt skulderbevegelighet, overvekt og lymfødem som følge av brystkreftbehandlingen vanlig forekommende. Rapportene om lymfødem i bryst og arm etter aksilledisseksjon varierer i forhold til målemetode. Selvrapportert lymfødem angis i opp mot 40–50 %, mens med mer objektive målemetoder for lymfødem i armen er variasjonen i forekomst mellom 13 og 20 % (Lawenda et al., 2009). Tyngdefølelse og ubehag i armen rapporteres ofte som en del av diagnosen lymfødem (Schou Bredal et al., 2014), men gir seg ikke nødvendigvis utslag i hevelse (Sagen et al., 2009). Det viktigste symptomet på lymfødem er hevelse (Lawenda et al., 2009; McNeely et al., 2010). Fatigue (kronisk tretthet etter kreftbehandling) er svært vanlig hos brystkreftpasienter. Både symptomer og forekomst av fatigue øker med alderen (Cramp et al., 2008).
Fysioterapi til brystkreftopererte
Sist faglig oppdatert: 02202402.07.2024
Transcutan elektrisk nervestimulering (TENS) kan være et effektivt fysioterapiverktøy mot smerter etter brystkreftbehandling (McNeely et al., 2010). Tilrettelagte øvelser for økt skuldermobilitet tidlig i behandlingsforløpet (ment som dagen etter eller få dager etter operasjonen) med instruksjon av fysioterapeut virker forebyggende på nedsatt skulderbevegelighet og lymfødemutvikling (McNeely et al., 2010; Torres et al., 2010). Antall repetisjoner og hyppighet på øvelsene skal gradvis økes i ukene etter operasjonen. Tilrettelagt fysisk aktivitet med fokus på kondisjon, vekttrening, generell styrketrening, samt aerobic har positiv effekt på skulderfunksjonen, generell fysisk funksjon, maksimalt O2 opptak, helserelatert livskvalitet, overvekt og fatigue (Cramp & Daniel, 2008; McNeely et al., 2010; Speck, Courneya, Masse, Duval, & Schmitz, 2010). Treningen skal doseres individuelt etter; hvilke ønsker og behov pasienten har, pasientens forutsetninger (fysisk form før diagnosen) og hvilken type behandling pasienten har gjennomgått. Fysisk aktivitet og trening organisert i grupper kan virke mer motiverende enn trening alene. Cytostaticabehandling bidrar til å redusere pasientens allmenntilstand og et minstenivå for blodverdier bør derfor følges før trening eller anstrengende fysisk aktivitet settes i gang (Thune, 2008). Fysisk aktivitet har forebyggende effekt på tilbakefall av brystkreft (Schmitz et al., 2010), men de eksakte mekanismene bak dette er foreløpig ukjent. (Om redusert risiko for tilbakefall skyldes økt fysisk aktivitet etter diagnose, eller tidligere fysisk aktivitet er foreløpig noe usikkert).
Kompresjonsbehandling er svært effektivt for å redusere lymfødem i armen etter brystkreftbehandling (McNeely et al., 2010), i tillegg virker manuell lymfedrenasje smertedempende (McNeely et al., 2004). Flere detaljer om lymfødembehandling er beskrevet på www.fysio.no.
Tverrfaglig informasjonsskriv til brystkreftopererte pasienter
Sist faglig oppdatert: 02202402.07.2024
Informasjon til deg som har fjernet lymfeknutene i armhulen (aksilledisseksjon) i forbindelse med brystkreftoperasjonen
I forbindelse med operasjonen ble det fjernet lymfeknuter i armhulen. Når lymfeknuter fjernes i armhulen vil store lymfeårer i armen kuttes over og væsketransporten i armen blir hemmet. Lymfeåresystemet er i tillegg et rensesystem og en del av immunforsvaret i kroppen. Etter operasjonen skal du derfor være oppmerksom på hevelse (lymfødem) i armen, samt sår og infeksjoner i armen på den opererte siden.
Hevelse (lymfødem): er opphoping av lymfe-væske i armen som gjør at den blir hoven, enten i brystet, hånden, deler av armen eller hele armen. Av alle som gjennomgår operasjon med fjerning av lymfeknuter i armhulen, utvikler 15 til 20 % lymfødem. Hevelsen kan være ubehagelig og armen kan kjennes tung. Hevelsen kan komme spontant, eller over tid. Den kan forsvinne spontant etter noen dager eller bli vedvarende. Hvis hevelsen i armen ikke gir seg i løpet av noen dager, skal du kontakte fastlegen din for henvisning til lymfødembehandling (som utføres av fysioterapeuter med spesialkompetanse). Behandlingen består av dreneringsteknikker og bandasjering for å redusere hevelsen mest mulig. Lymfødem som får være ubehandlet over lang tid, er vanskeligere å redusere.
Sår: Forebygging av kutt og rifter i armen ved å bruke hansker f. eks i forbindelse med hagearbeid er hensiktsmessig. Det er bakterier i jord og kommer dette inn i sår på hånden eller armen på den opererte siden, kan det bli en stor belastning på immunsystemet i armen og resultere i hevelse. Når du får sår, rens det og hold det under oppsyn. Oppsøk fastlegen din dersom det skulle bli rødt og hovent. Du vil da få antibiotika for å bli kvitt bakteriene.
Vaksiner: Vaksine bør settes i den armen som ikke er operert eller dersom det er operert på begge sider, i en annen kroppsdel. Man kan få hevelse i armen etter vaksine, og evt. forstørrelse av lymfeknuter som vedvarer en stund og kan forveksles som forstørrede lymfeknuter pga spredning av brystkreft. Bruk derfor den andre armen, eller en hvilken som helst annen kroppsdel enn den opererte armen.
Blodprøver: Blodprøver er ufarlig å ta i armen på operert side fordi utstyret som brukes er sterilt.
Blodtrykksmåling: Én blodtrykksmåling er ufarlig. Skal du inn til en planlagt operasjon, (hvor blodtrykket blir tatt med korte intervaller over lang tid) anbefales det å sette blodtrykks-mansjetten på den ikke-opererte siden.
Øvelser og fysioterapi: Det er viktig å gjenvinne normal funksjon i arm og skulder så raskt som mulig. Gjør øvelser fra 1. dag etter operasjonen og så lenge du synes det er nødvendig. Det er viktig for å opprettholde din normale fysiske funksjon i størst mulig grad for unngå nedsatt styrke i muskulatur og bevegelsesinnskrenkninger i skulderen. Fysioterapeuten på sykehuset instruerer deg i enkle øvelser og du vil få henvisning til fysioterapi som du kan benytte etter operasjonen. Fysioterapi kan startes opp 2–3 uker etter operasjonen. Fysioterapeuten vil gi deg ytterligere hjelp til bevegelsestrening av armen og veiledning til styrkeøvelser eller annen behandling du måtte ha behov for etter brystkreftoperasjonen. Når såret har grodd, etter 2–3 uker, er det ingen restriksjoner i bruken av armen. Prøv deg frem for å finne ut hva som er riktig for deg. De aller fleste kan regne med å være fullt restituert i løpet av et halvt års tid. Sørg for å holde deg i fysisk form med varierende aktiviteter, da takler du rekreasjonstiden med eventuelle tilleggsbehandlinger bedre.
Arvelig brystkreft
Sist faglig oppdatert: 02202402.07.2024
Brystkreft er den vanligste kreftformen blant kvinner, og mange har derfor slektninger med brystkreft uten at det er en genfeil i familien. Cirka 3 % av alle kvinner med brystkreft har en medfødt genfeil som er forbundet med høy risiko for brystkreft, oftest BRCA1 eller BRCA2 ADDIN EN.CITE.DATA (Breast Cancer Association Consortium et al., 2021; Grindedal et al., 2017; Hoberg-Vetti et al., 2016; Hu et al., 2021). Like mange har medfødt genfeil som er forbundet med moderat økt risiko for brystkreft .
Behandling og oppfølging ved brystkreft er i stadig økende grad persontilpasset, og særlig høypenetrante genfeil vil kunne legge føringer på pasientens behandling (Tung et al., 2020).
Samtidig er det indisert med spesiell oppfølging av friske kvinner med arvelig økt risiko for brystkreft, i den hensikt å redusere sjansen for å dø av brystkreft. Hvilken type oppfølging som er aktuell avhenger av hvor stor den reelle risikoen for brystkreft er. Ved påvist høypenetrant genfeil er både årlig MR og risikoreduserende kirurgi aktuelt.
Ved mistanke om arvelig risiko for brystkreft skal man derfor utrede kvinner i henhold til underkapittel 2 før eventuelle tiltak i form av radiologiske kontroller eller risikoreduserende kirurgi blir satt i verk.
Definisjon av genetiske risikogrupper for brystkreft
Sist faglig oppdatert: 02202402.07.2024
A. Påvist høypenetrant genfeil
Kvinner med påvist genfeil som er forbundet med svært høy risiko for brystkreft, oftest genfeil i BRCA1 eller BRCA2 (Kuchenbaecker et al., 2017). Kvinner med påvist genfeil i TP53, PTEN, STK11, CDH1 og PALB2 har også høy livstidsrisiko for å få brystkreft, og vil derfor også regnes i denne gruppen ADDIN EN.CITE.DATA (Breast Cancer Association Consortium et al., 2021; Fortuno et al., 2018; Hendricks et al., 2023; Hu et al., 2021; Sessa et al., 2023; Xicola et al., 2019). Se tabell 17.1.
B. Påvist moderat penetrant genfeil
Med økende bruk av multigen paneltester, der flere gener testes samtidig i én prøve, vil stadig flere kvinner få påvist varianter i gener som er assosiert med brystkreft, der risikoen for brystkreft er moderat forhøyet ADDIN EN.CITE.DATA (Breast Cancer Association Consortium et al., 2021; Hu et al., 2021; Sessa et al., 2023). Dette gjelder blant annet ved trunkerende genfeil i CHEK2 eller ATM. Ved slike genfeil vil imidlertid risikoen i stor grad påvirkes av familiehistorie og individuelle risikofaktorer(Gao et al., 2021a; Hanson et al., 2023). Se tabell 17.1.
C. Økt risiko vurdert ut ifra familiehistorie
Kvinner som tilhører familier med brystkreft, der genetisk utredning er gjennomført uten funn av genfeil. Familiehistorien indikerer likevel en økt risiko for brystkreft. Kvinner i slike familier vil oftest ha en moderat økt risiko for brystkreft, sammenlignet med bakgrunnsrisikoen (Møller et al., 2014). Individuell risikovurdering, der man tar hensyn til både familiehistorie, resultat av gentest og individuelle risikofaktorer blir i økende grad anbefalt i internasjonale og andre lands retningslinjer (Danish Breast Cancer Group, 2023; Regionala cancercentrum i samverkan, 2023; Sessa et al., 2023). Det finnes validerte digitale verktøy som kan benyttes for slik kompleks risikovurdering, f.eks. online verktøyet CanRisk (https://www.canrisk.org/), men dette er har foreløpig ikke blitt tatt i bruk i Norge. I stedet har vi brukt forenklede kriterier for å definere familiær brystkreft når genfeil ikke er påvist (Møller et al., 2014):
- To førstegradsslektninger* med brystkreft, gjennomsnittsalder ≤ 55 år.
- Tre førstegradsslektninger* med brystkreft, gjennomsnittsalder ≤ 60 år.
Risikopersoner i disse familiene er de som selv har eller har hatt brystkreft, og deres friske førstegradsslektninger*.
- Risikopersoner er også døtre og søstre til kvinne med brystkreft ≤ 40 år.
* Inkluderer andregradsslektning via mann.
Alle krefttilfellene skal være på samme side av familien.
Gen | Forekomst (Breast Cancer Association Consortium et al., 2021; Hu et al., 2021) | Gjennomsnittlig livstidsrisiko for brystkreft ADDIN EN.CITE.DATA ADDIN EN.CITE.DATA ADDIN EN.CITE.DATA (Breast Cancer Association et al., 2022; Breast Cancer Association Consortium et al., 2021; Hendricks et al., 2023; Hu et al., 2021; Kuchenbaecker et al., 2017; Sessa et al., 2023; Xicola et al., 2019; Yang et al., 2020a; Yang et al., 2020b) | Årlig radiologisk kontroll for friske bærere (Sessa et al., 2023) | Risikoreduserende bilateral kirurgi for friske bærere (Sessa et al., 2023) | Risiko for andre kreftformer | Anbefaling om kontroller/risikoreduksjon for andre kreftformer | ||
|---|---|---|---|---|---|---|---|---|
I befolkningen | Pasienter med brystkreft | MR | Mammografi | |||||
BRCA1 | 0.1 % | 1.0 % (Norge: 2 %) (Grindedal et al., 2017) | >60 % | 25 – 60/70 år | 30 år - | Ja | Eggstokkreft (Brystkreft hos menn, pankreaskreft) | Kvinner: Risikoreduserende bilateral salpingooforektomi 35-40 år |
BRCA2 | 0.3 % | 1.4 % (Norge: 1 %) (Grindedal et al., 2017) | >60 % | 25 – 60/70 år | 30 år - | Ja | Eggstokkreft Prostatakreft (Brystkreft hos menn, pankreaskreft) | Kvinner: Risikoreduserende bilateral salpingooforektomi 40-45 år Menn: Årlig PSA fra 40 år (Sessa et al., 2023) |
PALB2 | 0.1 % | 0.5 % | 40-60 % | 30 – 60/70 år | 30 år - | Kan vurderes* | (Eggstokkreft, brystkreft hos menn, Pankreaskreft) | Kvinner: Risikoreduserende bilateral salpingooforektomi kan vurderes > 50 år* Nei (Tischkowitz et al., 2021) |
PTEN | <0.1 % | <0.1 % | 60 %
| 30 – 60/70 år | 30 år - | Kan vurderes* | PTEN hamartoma tumor syndrom | Ja, se ERN Genturis retningslinjer (Tischkowitz et al., 2020) |
TP53 | <0.1 % | <0.1 % (8 % < 30 år)(Fortuno et al., 2018) | 40 %
| 20 – 60/70 år | Nei | Kan vurderes* | Li-Fraumeni syndrom | Ja, se ERN Genturis retningslinjer (Frebourg et al., 2020) |
STK11 | <0.1 % | <0.1 % | 40 %
| 30 – 60/70 år | 30 år - | Kan vurderes* | Peutz-Jeghers syndrom | Ja, se egne retningslinjer (Wagner et al., 2021) |
CDH1 | <0.1 % | <0.1 % | 40 % (lobulært karsinom) | 30 – 60/70 år | 30 år - | Kan vurderes* | Diffus ventrikkelkreft | Ja. Risikoreduserende gastrektomi aktuelt. Se egne retningslinjer (Blair et al., 2020) |
NF1 | <0.1 % |
| Moderat
| 30 – 50 år |
| Nevrofibromatose type 1 | Ja, se ERN Genturis retningslinjer (Carton et al., 2023) | |
ATM | 0.5 % | 0.7 % | 20-30 %
|
| 40 – 60 år |
| Uavklart | Vurderes ut ifra familiehistorie |
CHEK2 | 0.3 % | 1.3 % | 20-30 %
|
| 40 – 60 år |
| Uavklart | Vurderes ut ifra familiehistorie (Hanson et al., 2023) |
RAD51C/ RAD51D | 0.1 % | 0.2 % | 20 % (særlig trippel neg) |
| Individuell vurdering* |
| Ikke kjent | Kvinner: Risikoreduserende bilateral salpingooforektomi 45-50 år |
BARD1 | <0.1 % | 0.1 % | 20 % (særlig trippel neg) |
| Individuell vurdering* |
| Ikke kjent |
|
*Individuell risikovurdering anbefales før oppstart av kontrollopplegg og evt. risikoreduserende kirurgi
Utredning for arvelig brystkreft
Sist faglig oppdatert: 02202402.07.2024
Ved spørsmål om familiær/arvelig brystkreft bør utredningen som hovedregel primært utføres hos en eller flere personer i familien som selv har eller har hatt kreftsykdom. Dersom ingen kreftsyke er tilgjengelig for slik utredning, kan friske førstegradsslektninger til affisert person henvises til genetisk veiledning.
Personer som selv har eller har hatt brystkreft
Behandlende lege bør gi informasjon om arvelig brystkreft og kan rekvirere diagnostisk gentest hos pasienter med påvist invasiv brystkreft eller DCIS, se kriterier under (Evans et al., 2023). Pasienter som er ferdigbehandlet ved sykehus, kan henvises fra fastlege til genetisk utredning ved medisinsk genetisk avdeling.
Ved alle medisinsk-genetiske avdelinger i Norge utføres DNA-analyser i dag primært ved hjelp av såkalt NGS-teknologi (next generation sequencing). NGS-teknologien gjør det mulig å sekvensere flere gener samtidig i én prøve, og det er vanlig å gjøre et utvalg av bestemte gener for analyse i et «genpanel». Ved mistanke om arvelig brystkreft er det relevant å undersøke gener hvor genfeil er forbundet med høy eller moderat risiko for brystkreft. En oversikt over disse genene er gitt i tabell 17.1.
Pasienten bør få både muntlig og skriftlig informasjon.
Rekvisisjon til gentest må alltid fylles ut med gode kliniske opplysninger, der indikasjon for testen tydelig kommer frem. På genetikkportalen.no finnes samlet informasjon om medisinsk-genetiske analyser som tilbys ved genetiske laboratorier i Norge, inkl. hvilke gener som inngår i ulike analysepakker, estimert svartid og rekvisisjonsskjemaer til nedlasting.
NB! Dersom resultatet av gentesten har umiddelbar betydning for pasientens behandling, må det tilstrebes å få sendt blodprøve til genetisk laboratorium med minst mulig tidstap, og rekvisisjonen må merkes med grad av hast.
Den som har rekvirert gentesten, har ansvar for å formidle resultatet av testen til pasienten. Dersom det påvises genfeil ved diagnostisk gentest, bør pasienten henvises til medisinsk genetisk avdeling for genetisk veiledning, etter at rekvirerende lege har formidlet resultatet til pasienten. Dette er særlig viktig når genfeilen ikke er kjent i familien fra tidligere, da videre familieutredning og genetisk veiledning av familiemedlemmer vil være av stor betydning.
Dersom laboratoriet opplyser at det er påvist en DNA-sekvensvariant av usikker klinisk betydning («VUS»), kan også pasienten henvises til medisinsk genetisk avdeling for nærmere informasjon og diskusjon om muligheter for videre utredning. En VUS må ikke tolkes som påvist genfeil!
Kriterier for diagnostisk gentest hos pasient med brystkreft
- Kvinne med brystkreft/DCIS ≤ 60 år
- Mann med brystkreft uansett alder
- Kvinne med brystkreft > 60 år kan også få tilbud om gentest dersom det er grunn til å mistenke at det foreligger arvelig brystkreft (se også avsnitt "Friske personer som ikke selv har hatt brystkreft eller eggstokkreft").
- Gentest av relevante gener kan også rekvireres dersom pasienten er kandidat for behandling med PARP-hemmer, se avsnitt "Adjuvant behandling av pasienter med BRCA1/BRCA2 kimcellemutasjon etter enten adjuvant kjemoterapi eller etter neoadjuvant kjemoterapi" i kapittelet Adjuvant og neoadjuvant systemisk behandling..
Friske personer som ikke selv har hatt brystkreft eller eggstokkreft
Familiehistorien gir grunnlag for mistanke om arvelig brystkreft
Friske personer som ønsker genetisk utredning pga brystkreft hos slektning, bør informeres om at slik utredning er mest informativ når den gjennomføres hos den/de i familien som selv har eller har hatt brystkreft eller annen relevant kreftsykdom. Så langt det er mulig, bør derfor kreftsyk slektning involveres i den genetiske utredningen. Dersom ingen kreftsyke er tilgjengelig for slik utredning, kan friske personer henvises til genetisk veiledning dersom de er førstegradsslektning* til en person som oppfyller minst ett av kriteriene nedenfor. Genetisk utredning bør være gjennomført i familien før kvinnen henvises til regelmessig radiologisk oppfølging (se kapittel Radiologisk brystdiagnostikk hos kvinner med genetisk økt risiko for brystkreft).
- Kvinne med brystkreft ≤ 50 år
- Mann med brystkreft uansett alder
- Kvinne med trippel negativ brystkreft ≤ 60 år
- Kvinne med bilateral brystkreft ≤ 60 år
- Kvinne med eggstokkreft
- Kvinne med brystkreft og positiv familiehistorie, definert ved at minst ett av følgende kriterier er oppfylt:
- førstegradsslektning* med brystkreft, gjennomsnittsalder for de to ved brystkreftdiagnose ≤ 55 år
- to førstegradsslektninger* med brystkreft, uansett alder (totalt tre tilfeller av brystkreft)
- førstegradsslektning* med eggstokkreft
- førstegradsslektning* med prostatakreft ≤ 55 år
Alle krefttilfellene skal være på samme side av familien.
* Inkluderer andregradsslektning via mann.
Kjent genfeil i familien
Friske personer som ønsker prediktiv gentest for genfeil som er kjent i familien, henvises til medisinsk genetisk avdeling for genetisk veiledning og gjennomføring av målrettet prediktiv gentest.
Radiologisk brystdiagnostikk hos kvinner med genetisk økt risiko for brystkreft
Sist faglig oppdatert: 02202402.07.2024
Alle kvinner som er i en genetisk risikogruppe for brystkreft, skal ha tilbud om spesiell oppfølging i form av radiologiske kontroller. Hvilke undersøkelser som er indisert avhenger av kvinnens alder og hvilken risikogruppe hun tilhører. Kvinner som har fått påvist en høypenetrant genfeil skal også ha informasjon og tilbud om risikoreduserende kirurgi. Når det gjelder forebyggende medikamentell behandling dersom man ikke gjennomfører risikoreduserende kirurgi, se kapittel Onkologisk behandling av arvelig brystkreft.
Genetisk utredning bør være gjennomført i familien før kvinnen henvises til regelmessig radiologisk oppfølging (se kapittel "Utredning for arvelig brystkreft"). Anbefalingene for radiologisk brystdiagnostikk hos kvinner med arvelig økt risiko for brystkreft er oppsummert i tabeller under avnsittet "Oversikt over anbefaling for bruk av billeddiagnostikk ved arvelig kreft" og beskrives nærmere under.
Kvinner med påvist høypenetrant genfeil (risikogruppe A)
MR bryst og mammografi
Kvinner med påvist genfeil i BRCA1 eller BRCA2 skal gis tilbud om årlig MR av bryst (Evans et al., 2014; Sardanelli et al., 2010; Sessa et al., 2023). Kvinner med påvist genfeil i TP53, PTEN, STK11, CDH1 eller PALB2 gis også dette tilbudet, men utgjør en mye mindre gruppe (Sessa et al., 2023).
Det bør i tillegg tas 1-plans mammografi (skråprojeksjon) av hvert bryst med tanke på å påvise malignitetssuspekte mikroforkalkninger, da sensitiviteten for påvisning av DCIS ved MR er lavere enn sensitiviteten ved mammografi (Sardanelli et al., 2010). Unntak: Mammografi skal ikke tas ved TP53 genfeil på grunn av høyere risiko for sekundær strålerelatert cancer hos disse kvinnene (Frebourg et al., 2020; Sardanelli et al., 2010).
Det er ikke vist nytte av mammografi i tillegg til MR hos unge kvinner, og det kan derfor være grunn til å avstå fra å ta mammografi hos kvinner <30 år(Berrington de Gonzalez et al., 2009; Vreemann et al., 2018).
Oppstart av MR bryst
Tidspunkt for oppstart av MR undersøkelsene er avhengig av type genfeil (Sessa et al., 2023)- se tabell 17.1.
Øvre aldersgrense for MR bryst
Det finnes ikke vitenskapelig grunnlag for å avgjøre når MR kontroller skal opphøre (Sardanelli et al., 2010; Sessa et al., 2023). Øvre aldersgrense for MR kontroller varierer mellom ulike land (Marmolejo et al., 2021). . Ved økende alder avtar tettheten i brystvevet og sensitiviteten ved mammografi øker. I en metaanalyse fra 2015 konkluderes det imidlertid med at MR + mammografi gir økt sensitivitet for påvisning av brystkreft også etter fylte 50 år (Phi et al., 2015). Etter en samlet vurdering, basert på retningslinjer i flere andre land (Madorsky-Feldman et al., 2016; Marmolejo et al., 2021; NICE, 2019) og tidligere norsk praksis, har vi i Norge valgt en foreløpig øvre aldersgrense for MR bryst på 70 år for kvinner med mammografisk tetthet ACR C og D, og øvre aldersgrense 60 år for kvinner med mammografisk tetthet ACR A og B.
Oppfølging etter fylte 60/70 år
Etter opphør av MR bryst pga oppnådd aldersgrense kan kvinner med høypenetrant genfeil henvises til årlig 2-plans mammografi så lenge det anses som hensiktsmessig i forhold til pasientens generelle helse. Det vil si så lenge man mener kvinnen vil ha nytte av å få påvist ikke-klinisk kreftsykdom.
Oppfølging av kvinner med høypenetrant genfeil under svangerskap
Under svangerskap skal det ikke gjøres MR av bryst, både fordi sensitiviteten ved MR faller pga økt kontrastoppladning i kjertelvevet, og fordi Gadolinium-kontrast ikke skal gis i forbindelse med svangerskap med mindre det er helt nødvendig. Det skal da i stedet gjøres 2-plans mammografi og ultralyd av begge bryst. Stråledosen ved mammografi utgjør ingen fare for fosteret (Sechopoulos et al., 2008) og det er heller ikke vist at mammografi under svangerskap har carcinogen effekt på kjertelvevet (Kopans).
Oppfølging av kvinner med høypenetrant genfeil under amming
Under amming er det økt bakgrunnsoppladning av Gadoliniumholdig kontrast i kjertelvevet, noe som reduserer sensitiviteten ved MR bryst. Involusjon av kjertelvevet skjer over en ca. 3 måneder lang periode etter avsluttet amming (Sabate et al., 2007).
Da det er lavere sensitivitet ved MR bryst under amming anses det som et akseptabelt alternativ til MR å gjøre 2-plans mammografi og ultralyd av begge bryst. Det bør da suppleres med MR bryst ca. 4 måneder etter avsluttet amming.
Billeddiagnostikk før risikoreduserende mastektomi
Det bør gjøres MR bryst og 1-plans mammografi ≤ 6 måneder før risikoreduserende mastektomi.
Kvinner med påvist moderat penetrant genfeil (risikogruppe B)
Kvinner som har fått påvist genfeil forbundet med moderat økt risiko for brystkreft kan være kandidater for mammografikontroller (Sessa et al., 2023). Ved påvist sykdomsgivende genfeil i CHEK2 eller ATM bør kvinnene tilbys årlig mammografi fra 40-60 års alder tilsvarende anbefaling for kvinner med økt risiko vurdert ut ifra familiehistorie, se avsnittene "Kvinner med økt risiko vurdert ut ifra familiehistorie (risikogruppe C)" og "Oversikt over anbefaling for bruk av billeddiagnostikk ved arvelig kreft".
En spesiell variant i ATM-genet, c.7271T>G (p.Val2424Gly), er i flere studier vist å være forbundet med vesentlig høyere risiko for brystkreft enn andre varianter i ATM-genet ADDIN EN.CITE.DATA (Bernstein et al., 2006; Goldgar et al., 2011; Southey et al., 2016). Kvinner som får påvist denne varianten bør vurderes for MR-kontroller av bryst tilsvarende kvinner med påvist høypenetrant genfeil, se avsnittet "Kvinner med påvist høypenetrant genfeil (risikogruppe A)".
Det er de senere år dokumentert at kvinner med nevrofibromatose type 1 (NF1) har økt risiko for brystkreft, særlig før 50 års alder og at de oftere får cancere med dårlig prognose (Seminog et al., 2015; Sharif et al., 2007; Uusitalo et al., 2016; Yap et al., 2018). På bakgrunn av dette bør kvinner med påvist genfeil i NF1-genet tilbys årlig MR fra 30-50 års alder (Carton et al., 2023). Etter fylte 50 år er det ikke indisert med oppfølging bortsett fra at de kan møte på invitasjoner til det offentlige Mammografiprogrammet annenhvert år.
Kvinner med økt risiko vurdert ut ifra familiehistorie (risikogruppe C)
Dette gjelder kvinner som har gjennomgått en risikovurdering hos klinisk genetiker, der man konkluderer med forhøyet risiko for brystkreft ut fra familiehistorie (uten påvist høypenetrant genfeil).
Mammografi
Kvinnene bør tilbys årlig 2-plans mammografi fra 40–60 års alder. I familier med tilfeller av brystkreft før 40 års alder, kan det vurderes å starte mammografikontroller fra 30 års alder.
Mellom 50–60 års alder bør kvinnen oppfordres til å møte på invitasjoner i det offentlige Mammografiprogrammet annet hvert år med henvisning til klinisk mammografi årene i mellom.
Kvinnene bør oppfordres til å møte på invitasjoner i det offentlige Mammografiprogrammet annet hvert år fra 60–70 års alder.
Etter fylte 70 år er det ikke indikasjon for spesiell oppfølging.
Oppfølging under svangerskap og amming
Under svangerskap og amming bør det tas mammografi på vanlig måte, men det bør suppleres med ultralyd ettersom mammografi har redusert sensitivitet. Stråledosen ved mammografi utgjør ingen fare for fosteret (Sechopoulos et al., 2008). Det er heller ikke vist at mammografi under svangerskap medfører økt carcinogen effekt på kjertelvevet (Kopans).
Spesielle tilfeller
I noen få familier kan det ut fra en medisinsk genetisk vurdering være mistanke om svært høy genetisk risiko for brystkreft, selv om man per i dag ikke har klart å identifisere den molekylærgenetiske årsaken til krefttilfellene i familien. Særskilt oppfølging av slike familier kan gjøres etter individuell vurdering.
Oversikt over anbefaling for bruk av billeddiagnostikk ved arvelig kreft
| Indisert | Oppstart | Øvre aldersgrense | Indisert ved graviditet? | Indisert ved amming? |
|---|---|---|---|---|---|
MR | Årlig | 20/25/301 | 60 år ved tetthet ACR A/B og 70 år ved tetthet ACR C/D1 | Nei | Evt2 |
Mammografi | Årlig skrå | 303 | Når det ikke anses nyttig å påvise ikke-klinisk kreftsykdom | 2-plan3 | Skrå ved MR/2 plan ved ingen MR |
Ultralyd | Nei |
|
| Ja | Ja dersom ingen MR |
1 Avhengig av type genfeil, se tabell 17.1 for detaljer
2 MR eller 2-plans mammografi + ultralyd. Hvis ikke MR bør det suppleres med MR 4mnd etter avsluttet amming
3 Ingen mammografi ved TP53
| Indisert | Oppstart | Øvre aldersgrense | Indisert ved graviditet? | Indisert ved amming? |
|---|---|---|---|---|---|
Mammografi | Årlig | 401 | 602 | Ja | Ja |
Ultralyd | Nei |
|
| Ja | Ja |
1 Kan vurderes fra 30 år hvis tilfeller av brystkreft før 40 år i familien
2 Oppfordres til å møte i Mammografiprogrammet til 70 år
Risikoreduserende kirurgi
Sist faglig oppdatert: 02202402.07.2024
Risikoreduserende mastektomi (RRM) er primært et tilbud til kvinner med påvist høypenetrant genfeil. Med dagens kunnskap gjelder dette BRCA1, BRCA2, PALB2, TP53, PTEN, STK11 og CDH1 (tabell 17.1). Pasientene bør være godt informert om ulike alternativer for risikoreduserende kirurgi, nytteverdien av det enkelte tiltak og eventuelle komplikasjoner. I mange tilfeller vil det være behov for flere samtaler. Basert på type genfeil, alder, komorbiditet og evt. index cancer med prognostiske faktorer vil behandlingsanbefalingene variere. Det er derfor viktig at pasientene får informasjon av et team som har tilstrekkelig kompetanse. Endelig beslutning om kirurgisk intervensjon bør tas i et multidisiplinært samarbeid der pasient, genetiker, onkolog, brystkirurg og plastikk kirurg i varierende grad vil være involvert, basert på problemstillingen i det enkelte tilfellet. Brystkirurg med bred kjennskap til pasientgruppen bør utføre mastektomien. Nytteverdi av kirurgisk intervensjon, mulige komplikasjoner og potensielle psykiske og fysiske senfølger må diskuteres grundig med pasienten før operasjonen.
Kompliserende faktorer som pasienten selv kan ha en innflytelse på (f.eks. røyking) bør om mulig være optimalisert for å redusere risiko for komplikasjoner. Relative kontraindikasjoner og mulige kompliserende faktorer må tas med som en del av den individuelle vurderingen. Erkjent noe høyere risiko, som f.eks. BMI > 30, er ikke en absolutt kontraindikasjon mot rekonstruksjon, men pasienten skal være grundig informert på forhånd. Videre vil disse faktorene kunne medføre at pasienten ikke er aktuell for alle typer inngrep grunnet økt risiko for komplikasjoner. Medikamentell risikoreduserende behandling kan i noen tilfeller diskuteres der kirurgi ikke er aktuelt (se kapittel Onkologisk behandling av arvelig brystkreft).
Rekonstruksjonsmulighetene inkluderer rekonstruksjon med implantat og mer omfattende autologe rekonstruksjoner. Valg av operasjonsmetode må ta hensyn til pasientens eget ønske, kroppsbygning, komorbiditet og evt. risikofaktorer for komplikasjoner. Det er ikke mulig å oppnå 100 % risikoreduksjon. Hudbesparende mastektomi med eller uten bevaring av nippelareolakomplekset etterlater mer kjertelvev enn total mastektomi, men gir et bedre kosmetisk resultat og anses å gi tilstrekkelig risikoreduksjon selv om langtidsresultater ikke foreligger (Peled et al., 2014; Yao et al., 2015).
Risikoreduserende mastektomi hos genfeilbærere uten brystkreft i sykehistorien
For friske kvinner med påvist BRCA genfeil reduseres risikoen for brystkreft ved RRM betydelig (Carbine et al. 2018; Xiao et al 2016; (Domchek et al., 2010; Hartmann et al., 2001). I en stor, prospektiv, internasjonal multisenterstudie som inkluderte over 2400 pasienter med kjent BRCA genfeil utviklet ingen pasienter brystkreft etter mastektomi (0 av 247) mens 98 av 1372 i gruppen som ikke hadde utført inngrepet fikk brystkreft (Ludwig et al., 2016). For pasienter med andre høypenetrante genfeil (tabell 17.1) savnes datagrunnlag, men det er sannsynlig at de også vil ha en risikoreduksjon og bør vurderes mtp RRM.
Tidspunkt for RRM bør diskuteres grundig med den enkelte kvinne.
Flere studier har kartlagt effekten av RRM hos bærere av BRCA-genfeil. Det er viktig å skille mellom redusert risiko for utvikling av brystkreft og en eventuell overlevelsesgevinst. Svært få får brystkreft før 30 års alder, og nytten av RRM er sannsynligvis høyest når det gjøres i alderen 30 – 55 år (Giannakeas et al., 2018; Kurian et al., 2010; Sessa et al., 2023). Med økende alder er indikasjonen for RRM mer relativ fordi nytten er mer usikker.
Unntaksvis kan det også være aktuelt med RRM hos kvinner med svært høy familiær belasting uten kjent genfeil, men det finnes ikke datagrunnlag for at dette gir noen overlevelsesgevinst.
Det er ingen holdepunkt for at sentinel node diagnostikk er nødvendig (Nagaraja et al., 2016).
Det er ikke indikasjon for radiologiske eller kliniske kontroller av friske pasienter operert med RRM.
Risikoreduserende mastektomi hos BRCA genfeilbærere med brystkreft i sykehistorien
Anbefaling om kirurgi hos BRCA1/2 pasienter med brystkreft er kompleks og kirurgisk strategi bør ta hensyn til behandling av aktuell kreftsykdom, prognose, alder og eventuell komorbiditet.
BRCA genfeilbærere har økt risiko for så vel ipsilateral som kontralateral brystkreft (Trainer et al., 2010).
Pasienter som har fått eller er under behandling for ovarialkreft kan i noen tilfeller være aktuell for RRM. Dette må vurderes individuelt basert på alder, sykdomsstadium og prognose (Oliveira et al., 2023).
Primær kirurgisk behandling
Prospektive, randomiserte studier som sammenligner brystbevarende kirurgi (BCT) med mastektomi hos kvinner med BRCA-genfeil vil mest sannsynlig aldri gjennomføres. En metaanalyse som inkluderer data fra 23 observasjonsstudier, inkluderer 3807 pasienter fra BRCA-positive familier, viser i overkant fire ganger forhøyet risiko for lokoregionale tilbakefall etter brystbevarende kirurgi når en sammenligner med mastektomi (HR = 4.54; 95 % CI = 2,77–7,42). Det er ingen signifikant forskjell i brystkreftspesifikk eller total dødelighet mellom de to gruppene (Davey et al 2021). På generelt grunnlag anbefales ikke BCT hos kvinner med BRCA-genfeil. BCT kan likevel vurderes der økt risiko for ipsilateralt residiv eller kontralateral cancer ikke vil ha prognostisk betydning eller kvinnen selv ønsker det etter grundig informasjon om den økte risikoen. Ved ukjent mutasjonsstatus vil BCT kunne være et godt alternativ i påvente av resultatet av gentest. Senere komplementerende kirurgi kan da gjøres tilpasset den adjuvante behandlingen.
Kontralateral profylaktisk mastektomi (CPM)
Hos pasienter uten påvist genfeil er den kumulative risikoen for kontralateral brystkreft omkring 0,5–0,7 % per år % med en livstidsrisiko på omkring 14 % (Kuchenbaecker et al., 2017; Nichols et al., 2011; Rubino et al., 2010). Kvinner med BRCA-genfeil har økt risiko for kontralateral brystkreft (Metcalfe et al., 2014; Metcalfe et al., 2004; Molina-Montes et al., 2014; Morra et al., 2023; Yadav et al., 2023). I en prospektiv studie ble den kumulative insidensen 20 år etter index cancer funnet å være 41 % hos kvinner med BRCA1-genfeil og 26 % hos kvinner med BRCA2- genfeil (Kuchenbaecker et al., 2017. Risiko for kontralateral brystkreft avtar med økende alder. Gevinsten av CPM er mest sannsynlig høyere jo yngre pasientene er, men det er usikkert om inngrepet gir en gevinst på overlevelse (Carbine et al 2018). Den økte risikoen for ny sykdom kan være argument for CPM. Bilateral mastektomi bør tilbys ved påvist høypenetrant genfeil, men alder og prognostiske faktorer ved index cancer bør være med i behandlingsanbefalingen.
Risikoreduserende bilateral salpingo-ooforektomi
Kvinner med genfeil i BRCA1 eller BRCA2 har økt risiko for epitelial eggstokkreft, oftest av høygradig serøs type (Kuchenbaecker et al., 2017). Friske kvinner med påvist genfeil i BRCA1 eller BRCA2 anbefales risikoreduserende salpingo-ooforektomi, se Nasjonalt handlingsprogram for gynekologisk kreft (Sessa et al., 2023). Hormonsubstitusjon etter inngrepet skal gis til alle kvinner som ikke har hatt brystkreft, fram til alder for naturlig menopause (Nasjonalt handlingsprogram for gynekologisk kreft) (Sessa et al., 2023). Risikoreduserende salpingo-ooforektomi har også vist effekt på overlevelse hos kvinner med gjennomgått brystkreft (Finch et al., 2014; Metcalfe et al., 2015), men i slike tilfeller bør det som vanlig tas hensyn til behandling av aktuell kreftsykdom, prognose, alder og eventuell komorbiditet.
Genfeil i RAD51C eller RAD51D er forbundet med moderat økt risiko for brystkreft og eggstokkreft (Yang et al., 2020b). Kvinner med genfeil i disse genene bør få tilbud om risikoreduserende bilateral salpingooforektomi ved 45-50 års alder (Sessa et al., 2023).
Onkologisk behandling av arvelig brystkreft
Sist faglig oppdatert: 02202402.07.2024
For neoadjuvant behandling av brystkreft hos kvinner med BRCA-genfeil vises det til kapittelet Adjuvant og neo-adjuvant systemisk behandling.
Adjuvant behandling, se avsnittet "Adjuvant behandling av pasienter med BRCA1/BRCA2 kimcellemutasjon etter enten adjuvant kjemoterapi eller etter neoadjuvant kjemoterapi" i kapittelet Adjuvant og neo-adjuvant systemisk behandling (olaparib). St Gallen konsensus 2023 anbefalte tilbud om genetisk testing til alle pasienter som passer inklusjonskriteriene for OlympiA-studien og dermed er aktuell for adjuvant PARP-hemmer (Curigliano et al., 2023).
Metastatisk brystkreft, avsnittene "Behandlingsanbefalinger: HER2 negative pasienter" og "Spesielle forhold for BRCA muterte pasienter" (PARP-hemmere) i kapittelet Medikamentell cytostatisk behandling av metastatisk brystkreft.
Stråleterapi, se avsnittet "Strålebehandling ved arvelig brystkreftmed påvist genfeil" i kapittelet Strålebehandling ved lokalisert sykdom.
NB! Spesielt ved kimbane genfeil i TP53: På grunn av økt risiko for stråleindusert kreft bør strålebehandling unngås dersom mulig. Mastektomi er førstevalg hos kvinner med brystkreft og kimbane genfeil i TP53 (Tung et al., 2020).
Risiko-reduserende medikamentell behandling:
Risiko-reduserende medikamentell behandling med tamoxifen, raloxifen eller aromatasehemmer er drøftet av ESMO clinical practical guideline i 2023. Det er lite data på nytte hos pasienter med kjent patogen variant i germline predisponerende gener som BRCA1/2, men oppsummert i konsensus-anbefalingen så åpnes det for å vurdere dette hos pasienter som ikke ønsker risiko-reduserende kirurgi eller som har en risikovurdering som ikke fører til anbefaling om kirurgi (anbefaling C) (Sessa et al., 2023). Dette støttes også av en artikkel som ser på bruken av tamoxifen ved kjent BRCA1/2 mutasjon hvor det var lavere andel brystkreft hos de som tar tamoxifen sammenlignet med kontroll-gruppen etter en median oppfølging på 6.8 år (HR 0.64, p=0.05) (Kotsopoulos et al., 2023).
P-piller
Sist faglig oppdatert: 02202402.07.2024
P-piller er ikke kontraindisert som prevensjon til kvinner med arvelig økt risiko for brystkreft, dersom det foreligger prevensjonsbehov. Meta-analyser har vist at P-piller gir redusert risiko for eggstokkreft hos kvinner med genfeil i BRCA1 eller BRCA2, og ingen sikker dokumentert økt risiko for brystkreft (Iodice et al., 2010; Moorman et al., 2013).
Selv om det ikke er kontraindisert med p-piller, bør friske kvinner med arvelig økt risiko for brystkreft tilbys ikke-hormonelle prevensjonsmidler som alternativ når dette er egnet, og unngå lengre perioder med eksogen hormontilførsel (Sessa et al., 2023).
Definisjon av genetiske risikogrupper for brystkreft
Sist faglig oppdatert: 02202402.07.2024
A. Påvist høypenetrant genfeil
Kvinner med påvist genfeil som er forbundet med svært høy risiko for brystkreft, oftest genfeil i BRCA1 eller BRCA2 (Kuchenbaecker et al., 2017). Kvinner med påvist genfeil i TP53, PTEN, STK11, CDH1 og PALB2 har også høy livstidsrisiko for å få brystkreft, og vil derfor også regnes i denne gruppen ADDIN EN.CITE.DATA (Breast Cancer Association Consortium et al., 2021; Fortuno et al., 2018; Hendricks et al., 2023; Hu et al., 2021; Sessa et al., 2023; Xicola et al., 2019). Se tabell 17.1.
B. Påvist moderat penetrant genfeil
Med økende bruk av multigen paneltester, der flere gener testes samtidig i én prøve, vil stadig flere kvinner få påvist varianter i gener som er assosiert med brystkreft, der risikoen for brystkreft er moderat forhøyet ADDIN EN.CITE.DATA (Breast Cancer Association Consortium et al., 2021; Hu et al., 2021; Sessa et al., 2023). Dette gjelder blant annet ved trunkerende genfeil i CHEK2 eller ATM. Ved slike genfeil vil imidlertid risikoen i stor grad påvirkes av familiehistorie og individuelle risikofaktorer(Gao et al., 2021a; Hanson et al., 2023). Se tabell 17.1.
C. Økt risiko vurdert ut ifra familiehistorie
Kvinner som tilhører familier med brystkreft, der genetisk utredning er gjennomført uten funn av genfeil. Familiehistorien indikerer likevel en økt risiko for brystkreft. Kvinner i slike familier vil oftest ha en moderat økt risiko for brystkreft, sammenlignet med bakgrunnsrisikoen (Møller et al., 2014). Individuell risikovurdering, der man tar hensyn til både familiehistorie, resultat av gentest og individuelle risikofaktorer blir i økende grad anbefalt i internasjonale og andre lands retningslinjer (Danish Breast Cancer Group, 2023; Regionala cancercentrum i samverkan, 2023; Sessa et al., 2023). Det finnes validerte digitale verktøy som kan benyttes for slik kompleks risikovurdering, f.eks. online verktøyet CanRisk (https://www.canrisk.org/), men dette er har foreløpig ikke blitt tatt i bruk i Norge. I stedet har vi brukt forenklede kriterier for å definere familiær brystkreft når genfeil ikke er påvist (Møller et al., 2014):
- To førstegradsslektninger* med brystkreft, gjennomsnittsalder ≤ 55 år.
- Tre førstegradsslektninger* med brystkreft, gjennomsnittsalder ≤ 60 år.
Risikopersoner i disse familiene er de som selv har eller har hatt brystkreft, og deres friske førstegradsslektninger*.
- Risikopersoner er også døtre og søstre til kvinne med brystkreft ≤ 40 år.
* Inkluderer andregradsslektning via mann.
Alle krefttilfellene skal være på samme side av familien.
Gen | Forekomst (Breast Cancer Association Consortium et al., 2021; Hu et al., 2021) | Gjennomsnittlig livstidsrisiko for brystkreft ADDIN EN.CITE.DATA ADDIN EN.CITE.DATA ADDIN EN.CITE.DATA (Breast Cancer Association et al., 2022; Breast Cancer Association Consortium et al., 2021; Hendricks et al., 2023; Hu et al., 2021; Kuchenbaecker et al., 2017; Sessa et al., 2023; Xicola et al., 2019; Yang et al., 2020a; Yang et al., 2020b) | Årlig radiologisk kontroll for friske bærere (Sessa et al., 2023) | Risikoreduserende bilateral kirurgi for friske bærere (Sessa et al., 2023) | Risiko for andre kreftformer | Anbefaling om kontroller/risikoreduksjon for andre kreftformer | ||
|---|---|---|---|---|---|---|---|---|
I befolkningen | Pasienter med brystkreft | MR | Mammografi | |||||
BRCA1 | 0.1 % | 1.0 % (Norge: 2 %) (Grindedal et al., 2017) | >60 % | 25 – 60/70 år | 30 år - | Ja | Eggstokkreft (Brystkreft hos menn, pankreaskreft) | Kvinner: Risikoreduserende bilateral salpingooforektomi 35-40 år |
BRCA2 | 0.3 % | 1.4 % (Norge: 1 %) (Grindedal et al., 2017) | >60 % | 25 – 60/70 år | 30 år - | Ja | Eggstokkreft Prostatakreft (Brystkreft hos menn, pankreaskreft) | Kvinner: Risikoreduserende bilateral salpingooforektomi 40-45 år Menn: Årlig PSA fra 40 år (Sessa et al., 2023) |
PALB2 | 0.1 % | 0.5 % | 40-60 % | 30 – 60/70 år | 30 år - | Kan vurderes* | (Eggstokkreft, brystkreft hos menn, Pankreaskreft) | Kvinner: Risikoreduserende bilateral salpingooforektomi kan vurderes > 50 år* Nei (Tischkowitz et al., 2021) |
PTEN | <0.1 % | <0.1 % | 60 %
| 30 – 60/70 år | 30 år - | Kan vurderes* | PTEN hamartoma tumor syndrom | Ja, se ERN Genturis retningslinjer (Tischkowitz et al., 2020) |
TP53 | <0.1 % | <0.1 % (8 % < 30 år)(Fortuno et al., 2018) | 40 %
| 20 – 60/70 år | Nei | Kan vurderes* | Li-Fraumeni syndrom | Ja, se ERN Genturis retningslinjer (Frebourg et al., 2020) |
STK11 | <0.1 % | <0.1 % | 40 %
| 30 – 60/70 år | 30 år - | Kan vurderes* | Peutz-Jeghers syndrom | Ja, se egne retningslinjer (Wagner et al., 2021) |
CDH1 | <0.1 % | <0.1 % | 40 % (lobulært karsinom) | 30 – 60/70 år | 30 år - | Kan vurderes* | Diffus ventrikkelkreft | Ja. Risikoreduserende gastrektomi aktuelt. Se egne retningslinjer (Blair et al., 2020) |
NF1 | <0.1 % |
| Moderat
| 30 – 50 år |
| Nevrofibromatose type 1 | Ja, se ERN Genturis retningslinjer (Carton et al., 2023) | |
ATM | 0.5 % | 0.7 % | 20-30 %
|
| 40 – 60 år |
| Uavklart | Vurderes ut ifra familiehistorie |
CHEK2 | 0.3 % | 1.3 % | 20-30 %
|
| 40 – 60 år |
| Uavklart | Vurderes ut ifra familiehistorie (Hanson et al., 2023) |
RAD51C/ RAD51D | 0.1 % | 0.2 % | 20 % (særlig trippel neg) |
| Individuell vurdering* |
| Ikke kjent | Kvinner: Risikoreduserende bilateral salpingooforektomi 45-50 år |
BARD1 | <0.1 % | 0.1 % | 20 % (særlig trippel neg) |
| Individuell vurdering* |
| Ikke kjent |
|
*Individuell risikovurdering anbefales før oppstart av kontrollopplegg og evt. risikoreduserende kirurgi
Utredning for arvelig brystkreft
Sist faglig oppdatert: 02202402.07.2024
Ved spørsmål om familiær/arvelig brystkreft bør utredningen som hovedregel primært utføres hos en eller flere personer i familien som selv har eller har hatt kreftsykdom. Dersom ingen kreftsyke er tilgjengelig for slik utredning, kan friske førstegradsslektninger til affisert person henvises til genetisk veiledning.
Personer som selv har eller har hatt brystkreft
Behandlende lege bør gi informasjon om arvelig brystkreft og kan rekvirere diagnostisk gentest hos pasienter med påvist invasiv brystkreft eller DCIS, se kriterier under (Evans et al., 2023). Pasienter som er ferdigbehandlet ved sykehus, kan henvises fra fastlege til genetisk utredning ved medisinsk genetisk avdeling.
Ved alle medisinsk-genetiske avdelinger i Norge utføres DNA-analyser i dag primært ved hjelp av såkalt NGS-teknologi (next generation sequencing). NGS-teknologien gjør det mulig å sekvensere flere gener samtidig i én prøve, og det er vanlig å gjøre et utvalg av bestemte gener for analyse i et «genpanel». Ved mistanke om arvelig brystkreft er det relevant å undersøke gener hvor genfeil er forbundet med høy eller moderat risiko for brystkreft. En oversikt over disse genene er gitt i tabell 17.1.
Pasienten bør få både muntlig og skriftlig informasjon.
Rekvisisjon til gentest må alltid fylles ut med gode kliniske opplysninger, der indikasjon for testen tydelig kommer frem. På genetikkportalen.no finnes samlet informasjon om medisinsk-genetiske analyser som tilbys ved genetiske laboratorier i Norge, inkl. hvilke gener som inngår i ulike analysepakker, estimert svartid og rekvisisjonsskjemaer til nedlasting.
NB! Dersom resultatet av gentesten har umiddelbar betydning for pasientens behandling, må det tilstrebes å få sendt blodprøve til genetisk laboratorium med minst mulig tidstap, og rekvisisjonen må merkes med grad av hast.
Den som har rekvirert gentesten, har ansvar for å formidle resultatet av testen til pasienten. Dersom det påvises genfeil ved diagnostisk gentest, bør pasienten henvises til medisinsk genetisk avdeling for genetisk veiledning, etter at rekvirerende lege har formidlet resultatet til pasienten. Dette er særlig viktig når genfeilen ikke er kjent i familien fra tidligere, da videre familieutredning og genetisk veiledning av familiemedlemmer vil være av stor betydning.
Dersom laboratoriet opplyser at det er påvist en DNA-sekvensvariant av usikker klinisk betydning («VUS»), kan også pasienten henvises til medisinsk genetisk avdeling for nærmere informasjon og diskusjon om muligheter for videre utredning. En VUS må ikke tolkes som påvist genfeil!
Kriterier for diagnostisk gentest hos pasient med brystkreft
- Kvinne med brystkreft/DCIS ≤ 60 år
- Mann med brystkreft uansett alder
- Kvinne med brystkreft > 60 år kan også få tilbud om gentest dersom det er grunn til å mistenke at det foreligger arvelig brystkreft (se også avsnitt "Friske personer som ikke selv har hatt brystkreft eller eggstokkreft").
- Gentest av relevante gener kan også rekvireres dersom pasienten er kandidat for behandling med PARP-hemmer, se avsnitt "Adjuvant behandling av pasienter med BRCA1/BRCA2 kimcellemutasjon etter enten adjuvant kjemoterapi eller etter neoadjuvant kjemoterapi" i kapittelet Adjuvant og neoadjuvant systemisk behandling..
Friske personer som ikke selv har hatt brystkreft eller eggstokkreft
Familiehistorien gir grunnlag for mistanke om arvelig brystkreft
Friske personer som ønsker genetisk utredning pga brystkreft hos slektning, bør informeres om at slik utredning er mest informativ når den gjennomføres hos den/de i familien som selv har eller har hatt brystkreft eller annen relevant kreftsykdom. Så langt det er mulig, bør derfor kreftsyk slektning involveres i den genetiske utredningen. Dersom ingen kreftsyke er tilgjengelig for slik utredning, kan friske personer henvises til genetisk veiledning dersom de er førstegradsslektning* til en person som oppfyller minst ett av kriteriene nedenfor. Genetisk utredning bør være gjennomført i familien før kvinnen henvises til regelmessig radiologisk oppfølging (se kapittel Radiologisk brystdiagnostikk hos kvinner med genetisk økt risiko for brystkreft).
- Kvinne med brystkreft ≤ 50 år
- Mann med brystkreft uansett alder
- Kvinne med trippel negativ brystkreft ≤ 60 år
- Kvinne med bilateral brystkreft ≤ 60 år
- Kvinne med eggstokkreft
- Kvinne med brystkreft og positiv familiehistorie, definert ved at minst ett av følgende kriterier er oppfylt:
- førstegradsslektning* med brystkreft, gjennomsnittsalder for de to ved brystkreftdiagnose ≤ 55 år
- to førstegradsslektninger* med brystkreft, uansett alder (totalt tre tilfeller av brystkreft)
- førstegradsslektning* med eggstokkreft
- førstegradsslektning* med prostatakreft ≤ 55 år
Alle krefttilfellene skal være på samme side av familien.
* Inkluderer andregradsslektning via mann.
Kjent genfeil i familien
Friske personer som ønsker prediktiv gentest for genfeil som er kjent i familien, henvises til medisinsk genetisk avdeling for genetisk veiledning og gjennomføring av målrettet prediktiv gentest.
Radiologisk brystdiagnostikk hos kvinner med genetisk økt risiko for brystkreft
Sist faglig oppdatert: 02202402.07.2024
Alle kvinner som er i en genetisk risikogruppe for brystkreft, skal ha tilbud om spesiell oppfølging i form av radiologiske kontroller. Hvilke undersøkelser som er indisert avhenger av kvinnens alder og hvilken risikogruppe hun tilhører. Kvinner som har fått påvist en høypenetrant genfeil skal også ha informasjon og tilbud om risikoreduserende kirurgi. Når det gjelder forebyggende medikamentell behandling dersom man ikke gjennomfører risikoreduserende kirurgi, se kapittel Onkologisk behandling av arvelig brystkreft.
Genetisk utredning bør være gjennomført i familien før kvinnen henvises til regelmessig radiologisk oppfølging (se kapittel "Utredning for arvelig brystkreft"). Anbefalingene for radiologisk brystdiagnostikk hos kvinner med arvelig økt risiko for brystkreft er oppsummert i tabeller under avnsittet "Oversikt over anbefaling for bruk av billeddiagnostikk ved arvelig kreft" og beskrives nærmere under.
Kvinner med påvist høypenetrant genfeil (risikogruppe A)
MR bryst og mammografi
Kvinner med påvist genfeil i BRCA1 eller BRCA2 skal gis tilbud om årlig MR av bryst (Evans et al., 2014; Sardanelli et al., 2010; Sessa et al., 2023). Kvinner med påvist genfeil i TP53, PTEN, STK11, CDH1 eller PALB2 gis også dette tilbudet, men utgjør en mye mindre gruppe (Sessa et al., 2023).
Det bør i tillegg tas 1-plans mammografi (skråprojeksjon) av hvert bryst med tanke på å påvise malignitetssuspekte mikroforkalkninger, da sensitiviteten for påvisning av DCIS ved MR er lavere enn sensitiviteten ved mammografi (Sardanelli et al., 2010). Unntak: Mammografi skal ikke tas ved TP53 genfeil på grunn av høyere risiko for sekundær strålerelatert cancer hos disse kvinnene (Frebourg et al., 2020; Sardanelli et al., 2010).
Det er ikke vist nytte av mammografi i tillegg til MR hos unge kvinner, og det kan derfor være grunn til å avstå fra å ta mammografi hos kvinner <30 år(Berrington de Gonzalez et al., 2009; Vreemann et al., 2018).
Oppstart av MR bryst
Tidspunkt for oppstart av MR undersøkelsene er avhengig av type genfeil (Sessa et al., 2023)- se tabell 17.1.
Øvre aldersgrense for MR bryst
Det finnes ikke vitenskapelig grunnlag for å avgjøre når MR kontroller skal opphøre (Sardanelli et al., 2010; Sessa et al., 2023). Øvre aldersgrense for MR kontroller varierer mellom ulike land (Marmolejo et al., 2021). . Ved økende alder avtar tettheten i brystvevet og sensitiviteten ved mammografi øker. I en metaanalyse fra 2015 konkluderes det imidlertid med at MR + mammografi gir økt sensitivitet for påvisning av brystkreft også etter fylte 50 år (Phi et al., 2015). Etter en samlet vurdering, basert på retningslinjer i flere andre land (Madorsky-Feldman et al., 2016; Marmolejo et al., 2021; NICE, 2019) og tidligere norsk praksis, har vi i Norge valgt en foreløpig øvre aldersgrense for MR bryst på 70 år for kvinner med mammografisk tetthet ACR C og D, og øvre aldersgrense 60 år for kvinner med mammografisk tetthet ACR A og B.
Oppfølging etter fylte 60/70 år
Etter opphør av MR bryst pga oppnådd aldersgrense kan kvinner med høypenetrant genfeil henvises til årlig 2-plans mammografi så lenge det anses som hensiktsmessig i forhold til pasientens generelle helse. Det vil si så lenge man mener kvinnen vil ha nytte av å få påvist ikke-klinisk kreftsykdom.
Oppfølging av kvinner med høypenetrant genfeil under svangerskap
Under svangerskap skal det ikke gjøres MR av bryst, både fordi sensitiviteten ved MR faller pga økt kontrastoppladning i kjertelvevet, og fordi Gadolinium-kontrast ikke skal gis i forbindelse med svangerskap med mindre det er helt nødvendig. Det skal da i stedet gjøres 2-plans mammografi og ultralyd av begge bryst. Stråledosen ved mammografi utgjør ingen fare for fosteret (Sechopoulos et al., 2008) og det er heller ikke vist at mammografi under svangerskap har carcinogen effekt på kjertelvevet (Kopans).
Oppfølging av kvinner med høypenetrant genfeil under amming
Under amming er det økt bakgrunnsoppladning av Gadoliniumholdig kontrast i kjertelvevet, noe som reduserer sensitiviteten ved MR bryst. Involusjon av kjertelvevet skjer over en ca. 3 måneder lang periode etter avsluttet amming (Sabate et al., 2007).
Da det er lavere sensitivitet ved MR bryst under amming anses det som et akseptabelt alternativ til MR å gjøre 2-plans mammografi og ultralyd av begge bryst. Det bør da suppleres med MR bryst ca. 4 måneder etter avsluttet amming.
Billeddiagnostikk før risikoreduserende mastektomi
Det bør gjøres MR bryst og 1-plans mammografi ≤ 6 måneder før risikoreduserende mastektomi.
Kvinner med påvist moderat penetrant genfeil (risikogruppe B)
Kvinner som har fått påvist genfeil forbundet med moderat økt risiko for brystkreft kan være kandidater for mammografikontroller (Sessa et al., 2023). Ved påvist sykdomsgivende genfeil i CHEK2 eller ATM bør kvinnene tilbys årlig mammografi fra 40-60 års alder tilsvarende anbefaling for kvinner med økt risiko vurdert ut ifra familiehistorie, se avsnittene "Kvinner med økt risiko vurdert ut ifra familiehistorie (risikogruppe C)" og "Oversikt over anbefaling for bruk av billeddiagnostikk ved arvelig kreft".
En spesiell variant i ATM-genet, c.7271T>G (p.Val2424Gly), er i flere studier vist å være forbundet med vesentlig høyere risiko for brystkreft enn andre varianter i ATM-genet ADDIN EN.CITE.DATA (Bernstein et al., 2006; Goldgar et al., 2011; Southey et al., 2016). Kvinner som får påvist denne varianten bør vurderes for MR-kontroller av bryst tilsvarende kvinner med påvist høypenetrant genfeil, se avsnittet "Kvinner med påvist høypenetrant genfeil (risikogruppe A)".
Det er de senere år dokumentert at kvinner med nevrofibromatose type 1 (NF1) har økt risiko for brystkreft, særlig før 50 års alder og at de oftere får cancere med dårlig prognose (Seminog et al., 2015; Sharif et al., 2007; Uusitalo et al., 2016; Yap et al., 2018). På bakgrunn av dette bør kvinner med påvist genfeil i NF1-genet tilbys årlig MR fra 30-50 års alder (Carton et al., 2023). Etter fylte 50 år er det ikke indisert med oppfølging bortsett fra at de kan møte på invitasjoner til det offentlige Mammografiprogrammet annenhvert år.
Kvinner med økt risiko vurdert ut ifra familiehistorie (risikogruppe C)
Dette gjelder kvinner som har gjennomgått en risikovurdering hos klinisk genetiker, der man konkluderer med forhøyet risiko for brystkreft ut fra familiehistorie (uten påvist høypenetrant genfeil).
Mammografi
Kvinnene bør tilbys årlig 2-plans mammografi fra 40–60 års alder. I familier med tilfeller av brystkreft før 40 års alder, kan det vurderes å starte mammografikontroller fra 30 års alder.
Mellom 50–60 års alder bør kvinnen oppfordres til å møte på invitasjoner i det offentlige Mammografiprogrammet annet hvert år med henvisning til klinisk mammografi årene i mellom.
Kvinnene bør oppfordres til å møte på invitasjoner i det offentlige Mammografiprogrammet annet hvert år fra 60–70 års alder.
Etter fylte 70 år er det ikke indikasjon for spesiell oppfølging.
Oppfølging under svangerskap og amming
Under svangerskap og amming bør det tas mammografi på vanlig måte, men det bør suppleres med ultralyd ettersom mammografi har redusert sensitivitet. Stråledosen ved mammografi utgjør ingen fare for fosteret (Sechopoulos et al., 2008). Det er heller ikke vist at mammografi under svangerskap medfører økt carcinogen effekt på kjertelvevet (Kopans).
Spesielle tilfeller
I noen få familier kan det ut fra en medisinsk genetisk vurdering være mistanke om svært høy genetisk risiko for brystkreft, selv om man per i dag ikke har klart å identifisere den molekylærgenetiske årsaken til krefttilfellene i familien. Særskilt oppfølging av slike familier kan gjøres etter individuell vurdering.
Oversikt over anbefaling for bruk av billeddiagnostikk ved arvelig kreft
| Indisert | Oppstart | Øvre aldersgrense | Indisert ved graviditet? | Indisert ved amming? |
|---|---|---|---|---|---|
MR | Årlig | 20/25/301 | 60 år ved tetthet ACR A/B og 70 år ved tetthet ACR C/D1 | Nei | Evt2 |
Mammografi | Årlig skrå | 303 | Når det ikke anses nyttig å påvise ikke-klinisk kreftsykdom | 2-plan3 | Skrå ved MR/2 plan ved ingen MR |
Ultralyd | Nei |
|
| Ja | Ja dersom ingen MR |
1 Avhengig av type genfeil, se tabell 17.1 for detaljer
2 MR eller 2-plans mammografi + ultralyd. Hvis ikke MR bør det suppleres med MR 4mnd etter avsluttet amming
3 Ingen mammografi ved TP53
| Indisert | Oppstart | Øvre aldersgrense | Indisert ved graviditet? | Indisert ved amming? |
|---|---|---|---|---|---|
Mammografi | Årlig | 401 | 602 | Ja | Ja |
Ultralyd | Nei |
|
| Ja | Ja |
1 Kan vurderes fra 30 år hvis tilfeller av brystkreft før 40 år i familien
2 Oppfordres til å møte i Mammografiprogrammet til 70 år
Risikoreduserende kirurgi
Sist faglig oppdatert: 02202402.07.2024
Risikoreduserende mastektomi (RRM) er primært et tilbud til kvinner med påvist høypenetrant genfeil. Med dagens kunnskap gjelder dette BRCA1, BRCA2, PALB2, TP53, PTEN, STK11 og CDH1 (tabell 17.1). Pasientene bør være godt informert om ulike alternativer for risikoreduserende kirurgi, nytteverdien av det enkelte tiltak og eventuelle komplikasjoner. I mange tilfeller vil det være behov for flere samtaler. Basert på type genfeil, alder, komorbiditet og evt. index cancer med prognostiske faktorer vil behandlingsanbefalingene variere. Det er derfor viktig at pasientene får informasjon av et team som har tilstrekkelig kompetanse. Endelig beslutning om kirurgisk intervensjon bør tas i et multidisiplinært samarbeid der pasient, genetiker, onkolog, brystkirurg og plastikk kirurg i varierende grad vil være involvert, basert på problemstillingen i det enkelte tilfellet. Brystkirurg med bred kjennskap til pasientgruppen bør utføre mastektomien. Nytteverdi av kirurgisk intervensjon, mulige komplikasjoner og potensielle psykiske og fysiske senfølger må diskuteres grundig med pasienten før operasjonen.
Kompliserende faktorer som pasienten selv kan ha en innflytelse på (f.eks. røyking) bør om mulig være optimalisert for å redusere risiko for komplikasjoner. Relative kontraindikasjoner og mulige kompliserende faktorer må tas med som en del av den individuelle vurderingen. Erkjent noe høyere risiko, som f.eks. BMI > 30, er ikke en absolutt kontraindikasjon mot rekonstruksjon, men pasienten skal være grundig informert på forhånd. Videre vil disse faktorene kunne medføre at pasienten ikke er aktuell for alle typer inngrep grunnet økt risiko for komplikasjoner. Medikamentell risikoreduserende behandling kan i noen tilfeller diskuteres der kirurgi ikke er aktuelt (se kapittel Onkologisk behandling av arvelig brystkreft).
Rekonstruksjonsmulighetene inkluderer rekonstruksjon med implantat og mer omfattende autologe rekonstruksjoner. Valg av operasjonsmetode må ta hensyn til pasientens eget ønske, kroppsbygning, komorbiditet og evt. risikofaktorer for komplikasjoner. Det er ikke mulig å oppnå 100 % risikoreduksjon. Hudbesparende mastektomi med eller uten bevaring av nippelareolakomplekset etterlater mer kjertelvev enn total mastektomi, men gir et bedre kosmetisk resultat og anses å gi tilstrekkelig risikoreduksjon selv om langtidsresultater ikke foreligger (Peled et al., 2014; Yao et al., 2015).
Risikoreduserende mastektomi hos genfeilbærere uten brystkreft i sykehistorien
For friske kvinner med påvist BRCA genfeil reduseres risikoen for brystkreft ved RRM betydelig (Carbine et al. 2018; Xiao et al 2016; (Domchek et al., 2010; Hartmann et al., 2001). I en stor, prospektiv, internasjonal multisenterstudie som inkluderte over 2400 pasienter med kjent BRCA genfeil utviklet ingen pasienter brystkreft etter mastektomi (0 av 247) mens 98 av 1372 i gruppen som ikke hadde utført inngrepet fikk brystkreft (Ludwig et al., 2016). For pasienter med andre høypenetrante genfeil (tabell 17.1) savnes datagrunnlag, men det er sannsynlig at de også vil ha en risikoreduksjon og bør vurderes mtp RRM.
Tidspunkt for RRM bør diskuteres grundig med den enkelte kvinne.
Flere studier har kartlagt effekten av RRM hos bærere av BRCA-genfeil. Det er viktig å skille mellom redusert risiko for utvikling av brystkreft og en eventuell overlevelsesgevinst. Svært få får brystkreft før 30 års alder, og nytten av RRM er sannsynligvis høyest når det gjøres i alderen 30 – 55 år (Giannakeas et al., 2018; Kurian et al., 2010; Sessa et al., 2023). Med økende alder er indikasjonen for RRM mer relativ fordi nytten er mer usikker.
Unntaksvis kan det også være aktuelt med RRM hos kvinner med svært høy familiær belasting uten kjent genfeil, men det finnes ikke datagrunnlag for at dette gir noen overlevelsesgevinst.
Det er ingen holdepunkt for at sentinel node diagnostikk er nødvendig (Nagaraja et al., 2016).
Det er ikke indikasjon for radiologiske eller kliniske kontroller av friske pasienter operert med RRM.
Risikoreduserende mastektomi hos BRCA genfeilbærere med brystkreft i sykehistorien
Anbefaling om kirurgi hos BRCA1/2 pasienter med brystkreft er kompleks og kirurgisk strategi bør ta hensyn til behandling av aktuell kreftsykdom, prognose, alder og eventuell komorbiditet.
BRCA genfeilbærere har økt risiko for så vel ipsilateral som kontralateral brystkreft (Trainer et al., 2010).
Pasienter som har fått eller er under behandling for ovarialkreft kan i noen tilfeller være aktuell for RRM. Dette må vurderes individuelt basert på alder, sykdomsstadium og prognose (Oliveira et al., 2023).
Primær kirurgisk behandling
Prospektive, randomiserte studier som sammenligner brystbevarende kirurgi (BCT) med mastektomi hos kvinner med BRCA-genfeil vil mest sannsynlig aldri gjennomføres. En metaanalyse som inkluderer data fra 23 observasjonsstudier, inkluderer 3807 pasienter fra BRCA-positive familier, viser i overkant fire ganger forhøyet risiko for lokoregionale tilbakefall etter brystbevarende kirurgi når en sammenligner med mastektomi (HR = 4.54; 95 % CI = 2,77–7,42). Det er ingen signifikant forskjell i brystkreftspesifikk eller total dødelighet mellom de to gruppene (Davey et al 2021). På generelt grunnlag anbefales ikke BCT hos kvinner med BRCA-genfeil. BCT kan likevel vurderes der økt risiko for ipsilateralt residiv eller kontralateral cancer ikke vil ha prognostisk betydning eller kvinnen selv ønsker det etter grundig informasjon om den økte risikoen. Ved ukjent mutasjonsstatus vil BCT kunne være et godt alternativ i påvente av resultatet av gentest. Senere komplementerende kirurgi kan da gjøres tilpasset den adjuvante behandlingen.
Kontralateral profylaktisk mastektomi (CPM)
Hos pasienter uten påvist genfeil er den kumulative risikoen for kontralateral brystkreft omkring 0,5–0,7 % per år % med en livstidsrisiko på omkring 14 % (Kuchenbaecker et al., 2017; Nichols et al., 2011; Rubino et al., 2010). Kvinner med BRCA-genfeil har økt risiko for kontralateral brystkreft (Metcalfe et al., 2014; Metcalfe et al., 2004; Molina-Montes et al., 2014; Morra et al., 2023; Yadav et al., 2023). I en prospektiv studie ble den kumulative insidensen 20 år etter index cancer funnet å være 41 % hos kvinner med BRCA1-genfeil og 26 % hos kvinner med BRCA2- genfeil (Kuchenbaecker et al., 2017. Risiko for kontralateral brystkreft avtar med økende alder. Gevinsten av CPM er mest sannsynlig høyere jo yngre pasientene er, men det er usikkert om inngrepet gir en gevinst på overlevelse (Carbine et al 2018). Den økte risikoen for ny sykdom kan være argument for CPM. Bilateral mastektomi bør tilbys ved påvist høypenetrant genfeil, men alder og prognostiske faktorer ved index cancer bør være med i behandlingsanbefalingen.
Risikoreduserende bilateral salpingo-ooforektomi
Kvinner med genfeil i BRCA1 eller BRCA2 har økt risiko for epitelial eggstokkreft, oftest av høygradig serøs type (Kuchenbaecker et al., 2017). Friske kvinner med påvist genfeil i BRCA1 eller BRCA2 anbefales risikoreduserende salpingo-ooforektomi, se Nasjonalt handlingsprogram for gynekologisk kreft (Sessa et al., 2023). Hormonsubstitusjon etter inngrepet skal gis til alle kvinner som ikke har hatt brystkreft, fram til alder for naturlig menopause (Nasjonalt handlingsprogram for gynekologisk kreft) (Sessa et al., 2023). Risikoreduserende salpingo-ooforektomi har også vist effekt på overlevelse hos kvinner med gjennomgått brystkreft (Finch et al., 2014; Metcalfe et al., 2015), men i slike tilfeller bør det som vanlig tas hensyn til behandling av aktuell kreftsykdom, prognose, alder og eventuell komorbiditet.
Genfeil i RAD51C eller RAD51D er forbundet med moderat økt risiko for brystkreft og eggstokkreft (Yang et al., 2020b). Kvinner med genfeil i disse genene bør få tilbud om risikoreduserende bilateral salpingooforektomi ved 45-50 års alder (Sessa et al., 2023).
Onkologisk behandling av arvelig brystkreft
Sist faglig oppdatert: 02202402.07.2024
For neoadjuvant behandling av brystkreft hos kvinner med BRCA-genfeil vises det til kapittelet Adjuvant og neo-adjuvant systemisk behandling.
Adjuvant behandling, se avsnittet "Adjuvant behandling av pasienter med BRCA1/BRCA2 kimcellemutasjon etter enten adjuvant kjemoterapi eller etter neoadjuvant kjemoterapi" i kapittelet Adjuvant og neo-adjuvant systemisk behandling (olaparib). St Gallen konsensus 2023 anbefalte tilbud om genetisk testing til alle pasienter som passer inklusjonskriteriene for OlympiA-studien og dermed er aktuell for adjuvant PARP-hemmer (Curigliano et al., 2023).
Metastatisk brystkreft, avsnittene "Behandlingsanbefalinger: HER2 negative pasienter" og "Spesielle forhold for BRCA muterte pasienter" (PARP-hemmere) i kapittelet Medikamentell cytostatisk behandling av metastatisk brystkreft.
Stråleterapi, se avsnittet "Strålebehandling ved arvelig brystkreftmed påvist genfeil" i kapittelet Strålebehandling ved lokalisert sykdom.
NB! Spesielt ved kimbane genfeil i TP53: På grunn av økt risiko for stråleindusert kreft bør strålebehandling unngås dersom mulig. Mastektomi er førstevalg hos kvinner med brystkreft og kimbane genfeil i TP53 (Tung et al., 2020).
Risiko-reduserende medikamentell behandling:
Risiko-reduserende medikamentell behandling med tamoxifen, raloxifen eller aromatasehemmer er drøftet av ESMO clinical practical guideline i 2023. Det er lite data på nytte hos pasienter med kjent patogen variant i germline predisponerende gener som BRCA1/2, men oppsummert i konsensus-anbefalingen så åpnes det for å vurdere dette hos pasienter som ikke ønsker risiko-reduserende kirurgi eller som har en risikovurdering som ikke fører til anbefaling om kirurgi (anbefaling C) (Sessa et al., 2023). Dette støttes også av en artikkel som ser på bruken av tamoxifen ved kjent BRCA1/2 mutasjon hvor det var lavere andel brystkreft hos de som tar tamoxifen sammenlignet med kontroll-gruppen etter en median oppfølging på 6.8 år (HR 0.64, p=0.05) (Kotsopoulos et al., 2023).
P-piller
Sist faglig oppdatert: 02202402.07.2024
P-piller er ikke kontraindisert som prevensjon til kvinner med arvelig økt risiko for brystkreft, dersom det foreligger prevensjonsbehov. Meta-analyser har vist at P-piller gir redusert risiko for eggstokkreft hos kvinner med genfeil i BRCA1 eller BRCA2, og ingen sikker dokumentert økt risiko for brystkreft (Iodice et al., 2010; Moorman et al., 2013).
Selv om det ikke er kontraindisert med p-piller, bør friske kvinner med arvelig økt risiko for brystkreft tilbys ikke-hormonelle prevensjonsmidler som alternativ når dette er egnet, og unngå lengre perioder med eksogen hormontilførsel (Sessa et al., 2023).
Metode og prosess – handlingsprogram på kreftområdet
Bakgrunn
Sist faglig oppdatert: 02202402.07.2024
Nasjonalt handlingsprogram med retningslinje for diagnostikk, behandling og oppfølging av pasienter med brystkreft er utarbeidet av en oppdateringsgruppe for nasjonalt brystkrefthandlingsprogram med representanter for alle de regionale helseforetakene, og i samarbeid med Helsedirektoratet.
Mange onkologiske faggrupper la i en årrekke ned et betydelig arbeid for å komme frem til konsensusbaserte faglige anbefalinger for diagnostikk og behandling av ulike typer kreft. Som ledd i Nasjonal strategi for kreftområdet (2006–2009) fikk Helsedirektoratet i oppdrag å videreutvikle og oppdatere faggruppenes anbefalinger til nasjonale handlingsprogrammer for kreftbehandling, i nært samarbeid med fagmiljøene, de regionale helseforetakene, Nasjonalt kunnskapssenter for helsetjenesten, og andre relevante myndigheter.
De nasjonale handlingsprogrammene representerte en videreføring av faggruppenes arbeid.
Helsedirektoratet takker arbeidsgruppen for stor innsats i utarbeidelsen av handlingsprogrammet.
Formål med handlingsprogrammet
Sist faglig oppdatert: 02202402.07.2024
Nasjonale handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av kreft (Nasjonale handlingsprogram) skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
Rettslig betydning
Sist faglig oppdatert: 02202402.07.2024
Helsedirektoratet skal utvikle, formidle og vedlikeholde normerende produkter, det vil si nasjonale faglige retningslinjer, nasjonale veiledere, nasjonal faglige råd og pakkeforløp, som understøtter målene for helse- og omsorgstjenesten.
Nasjonale anbefalinger og råd skal baseres på kunnskap om god praksis, og skal bidra til kontinuerlig forbedring av virksomhet og tjenester, jf. spesialisthelsetjenesteloven § 7-3 (lovdata.no), helse- og omsorgstjenesteloven § 12-5 (lovdata.no) og folkehelseloven § 24 (lovdata.no).
Anbefalinger/råd utgitt av Helsedirektoratet er ikke rettslig bindende, men er faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet.
I situasjoner der helsepersonell velger løsninger som i vesentlig grad avviker fra gitte anbefalinger, skal dette dokumenteres, jf. journalforskriften § 6, bokstav g (lovdata.no). Helsepersonell bør være forberedt på å begrunne sine valg i eventuelle klagesaker eller ved tilsyn.
Målgrupper
Sist faglig oppdatert: 02202402.07.2024
Målgrupper for de nasjonale handlingsprogrammene er spesialister innen medisin, kirurgi, onkologi, radiologi og patologi. De vil også være av interesse for allmennleger, pasienter, pårørende og andre aktører på kreftfeltet.
Handlingsprogram og Nye metoder
Sist faglig oppdatert: 02202402.07.2024
Arbeidsgruppenes medlemmer har i forbindelse med arbeidet bedt om å oppgi potensielle interessekonflikter. Medlemmene er vurdert til å være habile i forhold til å delta i arbeidet.
Kunnskapsbasert metode
Sist faglig oppdatert: 02202402.07.2024
Kunnskapsbasert praksis innebærer at både forskningsbasert kunnskap, erfaringsbasert klinisk kunnskap og pasientenes/ brukernes ønsker og behov vurderes samlet. I utarbeidelsen og revidering av nasjonale handlingsprogram har det ikke vært med brukerrepresentanter i gruppene.
Innholdet i en retningslinje skal baseres på et oppdatert, gjennomarbeidet og dokumentert kunnskapsgrunnlag. Det innebærer at forskningslitteratur, klinisk erfaring og brukererfaring vurderes opp mot ønskede og uønskede konsekvenser av et tiltak. På områder der det er funnet mindre forskningsbasert kunnskap, og/eller overføringsverdien fra internasjonal til norsk helsetjeneste er lav, blir klinisk kunnskap og brukerkunnskap tillagt større vekt.
Dette nasjonale handlingsprogrammet inneholder svært mange anbefalinger. Det er ikke praktisk mulig, innenfor gitte ressursrammer, å samle all relevant forskningsbasert kunnskap for hver anbefaling. Den forskningsbaserte kunnskapen er hovedsakelig basert på forskning identifisert i anerkjente internasjonale retningslinjer og nyere studier. Det er heller ikke praktisk mulig å gjennomgående bruke GRADE eller SIGN-metodikken for gradering av kunnskapsgrunnlaget.
Handlingsprogram og andre normerende produkter skal også forholde seg til prioriteringskriteriene og ressursbruk. Med ressurser menes direkte kostnader, men også personell og tidsbruk.
Grad av normering
Sist faglig oppdatert: 02202402.07.2024
Grad av normering angis i teksten i hver enkelt anbefaling/råd:
- Når Helsedirektoratet skriver «skal», betyr det at anbefalingen/rådet er basert på lov eller forskrift, eller når det er så klart faglig forankret at det sjelden er forsvarlig å ikke gjøre som anbefalt
- Når det står bør» eller «anbefaler», er det en sterk anbefaling/råd som vil gjelde i de aller fleste tilfeller
- Når det står «kan» eller «foreslår» er det en svak anbefaling/råd der ulike valg kan være riktig for ulike pasienter
Tilhørende normerende publikasjoner
Sist faglig oppdatert: 02202402.07.2024
Arbeidsform og deltagere
Sist faglig oppdatert: 02202402.07.2024
Handlingsprogrammet utarbeides/oppdateres av en arbeidsgruppe/oppdateringsgruppe oppnevnt av Helsedirektoratet. Representantene i gruppen er utnevnt av de regionale helseforetakene. Etter Helsedirektoratets bearbeidelse og gjennomgang av utkast til handlingsprogram, blir handlingsprogrammet publisert på Helsedirektoratets nettside:
Dette er en 22. utgave av Nasjonalt handlingsprogram for brystkreft.
Bjørn Naume (leder) | onkolog | Avd. for kreftbehandling | Oslo universitetssykehus |
Ellen Schlichting | kirurg | Avd. for kreftbehandling | Oslo universitetssykehus |
Egil Støre Blix | onkolog | Avd. for kreftbehandling | Universitetssykehuset Nord-Norge |
Annette Heie | kirurg | Avd. bryst- og endokrinkirurgi | Haukeland universitetssykehus |
Bodil Aasvang Olsen | allmennpraktiker | Fastlege |
|
Line Christiansen | allmennpraktiker | Fastlege |
|
Kontaktpersoner i Helsedirektoratet
Hege Wang, seniorrådgiver, Avdeling fagutvikling spesialisthelsetjenester: hege.wang@helsedir.no
Fagansvarlig på kreftområdet er Sissi Espetvedt: sissi.leyell.espetvedt@helsedir.no
Habilitet
Sist faglig oppdatert: 02202402.07.2024
Representantene i arbeids-/oppdateringsgruppen har fylt ut Helsedirektoratets habilitetsskjema. Ingen interesser med konsekvenser for deltakelse i arbeidet er identifisert. Skjemaene er arkivert i Helsedirektoratet.
Referanser
Sist faglig oppdatert: 02202402.07.2024
Helsedirektoratet. (2012). Veileder for utvikling av kunnskapsbaserte retningslinjer (IS-1870). ISBN-nr. 978-82-8081-225-4. Hentet fra https://www.helsedirektoratet.no/
Øvrige referanser fremkommer bakerst i handlingsprogrammet.









