Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av gynekologisk kreft
Forord
Sist faglig oppdatert: 21202221.12.2022
Nasjonale handlingsprogram med faglige retningslinjer for kreft skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet. Målgrupper for retningslinjene er leger og legespesialister innen medisin, kirurgi, onkologi, radiologi, patologi og fastleger. De vil også være av interesse for andre faggrupper som er involvert i behandling og oppfølging av kreftpasienter og deres pårørende.
Nasjonale faglige retningslinjer fra Helsedirektoratet er å betrakte som anbefalinger og råd, basert på oppdatert faglig kunnskap. De nasjonale faglige retningslinjene gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet, og er ment som et hjelpemiddel ved de avveininger tjenesteyterne må gjøre for å oppnå forvarlighet og god kvalitet i tjenesten. Nasjonale faglige retningslinjer er ikke direkte rettslig bindende for mottagerne, men bør langt på vei være styrende for de valg som skal tas. Ved å følge oppdaterte nasjonale faglige retningslinjer, vil fagpersonell bidra til å oppfylle kravet om faglig forsvarlighet. Dersom en velger løsninger som i vesentlig grad avviker fra de nasjonale faglige retningslinjene, bør en dokumentere dette, og være forberedt på å begrunne sine valg. Sykehusenes eiere og ledelse bør tilrettelegge virksomheten slik at de nasjonale faglige retningslinjene kan følges.
Helsedirektoratet takker arbeidsgruppen for stor innsats i utarbeidelsen av handlingsprogrammet. Vi håper handlingsprogrammet vil være et nyttig arbeidsredskap ved behandling av pasienter med gynekologisk kreft. Innholdet i den nasjonale retningslinjen for gynekologisk kreft vil vurderes årlig, og om nødvendig oppdateres.
I denne utgaven er det fire kapitler som er oppdatert: kap. 3, kap. 5, kap. 7 og kap. 10. I kapittel 7 er det nye flytskjema og algoritmer. Handlingsprogrammet er publisert den 21.12.2022.
Bjørn Guldvog
Helsedirektør
Forløpstider for gynekologisk kreft
Sist faglig oppdatert: 28202128.06.2021
Fra 1. mai 2015 ble Pakkeforløp for livmorkreft (2017), Pakkeforløp for eggstokkreft (Pakkeforløp for eggstokkreft, 2016) og Pakkeforløp for livmorhalskreft (Pakkeforløp for livmorhalskreft 2016) innført i helsetjenesten. Disse tre pakkeforløpene kom i reviderte utgaver i juni 2015 og ble implementert fra 1. september 2015. Den 1. september 2016 kom alle pakkeforløpene i reviderte, oppdaterte utgaver.
Om Pakkeforløp for kreft
Pakkeforløp for kreft skal gi forutsigbarhet og trygghet for pasient og pårørende, og er et standard pasientforløp som beskriver organisering av utredning og behandling, kommunikasjon/dialog med pasient og pårørende samt ansvarsplassering og konkrete forløpstider. Pakkeforløpet starter når et helseforetak eller privat ideelt sykehus mottar en henvisning med begrunnet mistanke om kreft, eller når helseforetaket selv starter utredning med begrunnet mistanke om kreft.
Formålet med Pakkeforløp for kreft er at pasienter skal oppleve et godt organisert, helhetlig og forutsigbart forløp uten unødvendig ikke-medisinsk begrunnet forsinkelse i utredning, diagnostikk, behandling og rehabilitering.
Forløpstidene i pakkeforløpet beskriver den maksimale tiden de ulike fasene i forløpet bør ta for et flertall av pasientene. Forløpstidene angis i kalenderdager. De enkelte fasenes forløpstid legges til slutt sammen til en samlet forløpstid, som angir tiden fra henvisning er mottatt til start behandling. Med utgangspunkt i pakkeforløpet skal et individuelt forløp tilrettelegges for hver enkelt pasient.
De regionale helseforetakene har det overordnede ansvaret for å sikre at pakkeforløpene med forløpstidene blir implementert og fulgt opp. Forløpstidene er normerende og er ikke en pasientrettighet. Fortsatt er det lovmessige grunnlaget pasientrettighetsloven (Elit et al., 2004) § 2‑2 og forskrift om prioritering av helsetjenester (Colombo et al., 2006). Av og til vil det av faglige grunner være noen pasienter som ikke kan utredes ferdig innen normert forløpstid for oppstart av første behandling.
Forløpstider for livmorkreft, eggstokkreft og livmorhalskreft
I Pakkeforløp for livmorkreft (2017), Pakkeforløp for eggstokkreft (Pakkeforløp for eggstokkreft, 2016) og Pakkeforløp for livmorhalskreft (Pakkeforløp for livmorhalskreft 2016) er det følgende forløpstider:
Fra henvisning mottatt til første fremmøte utredende avdeling |
| 6 kalenderdager |
Fra første fremmøte i utredende avdeling til avsluttet utredning (beslutning tas) |
| 16 kalenderdager |
Fra avsluttet utredning til start behandling | Kirurgisk behandling | 14 kalenderdager |
Fra avsluttet utredning til start behandling | Medikamentell behandling | 8 kalenderdager |
Fra avsluttet utredning til start behandling | Strålebehandling | 14 kalenderdager |
Fra henvisning mottatt til start behandling | Kirurgisk behandling | 36 kalenderdager |
Fra henvisning mottatt til start behandling | Medikamentell behandling | 30 kalenderdager |
Fra henvisning mottatt til start behandling | Strålebehandling | 36 kalenderdager |
Pakkeforløp for livmorkreft, Pakkeforløp for eggstokkreft og Pakkeforløp for livmorhalskreft finnes på Helsedirektoratets nettsider Se www.helsedirektoratet.no
Det er egne Diagnoseveiledere for fastleger for inngang til pakkeforløp. Diagnoseveileder finnes på www.helsedirektoratet.no
Det er også pasientinformasjonsskriv om Pakkeforløp for kreft, som finnes på www.helsedirektoratet.no
Livmorkreft (endometriecancer)
Innledning
Sist faglig oppdatert: 28202128.06.2021
ICD-10
| C54 | Ondartet svulst i livmorlegeme |
| C54.0 | Nedre uterinsegment (isthmus uteri) |
| C54.1 | Livmorslimhinne (endometrium) |
| C54.2 | Muskulatur i livmorvegg (myometrium) |
| C54.3 | Fundus uteri |
| C54.8 | Overlappende svulst i livmorlegeme |
| C54.9 | Livmorlegeme (corpus uteri) uspesifisert |
| C55 | Ondartet svulst i livmor, uspesifisert del |
Definisjon
Sist faglig oppdatert: 28202128.06.2021
Cancer utgående fra livmorslimhinnen.
Forekomst og prognose
Sist faglig oppdatert: 28202128.06.2021
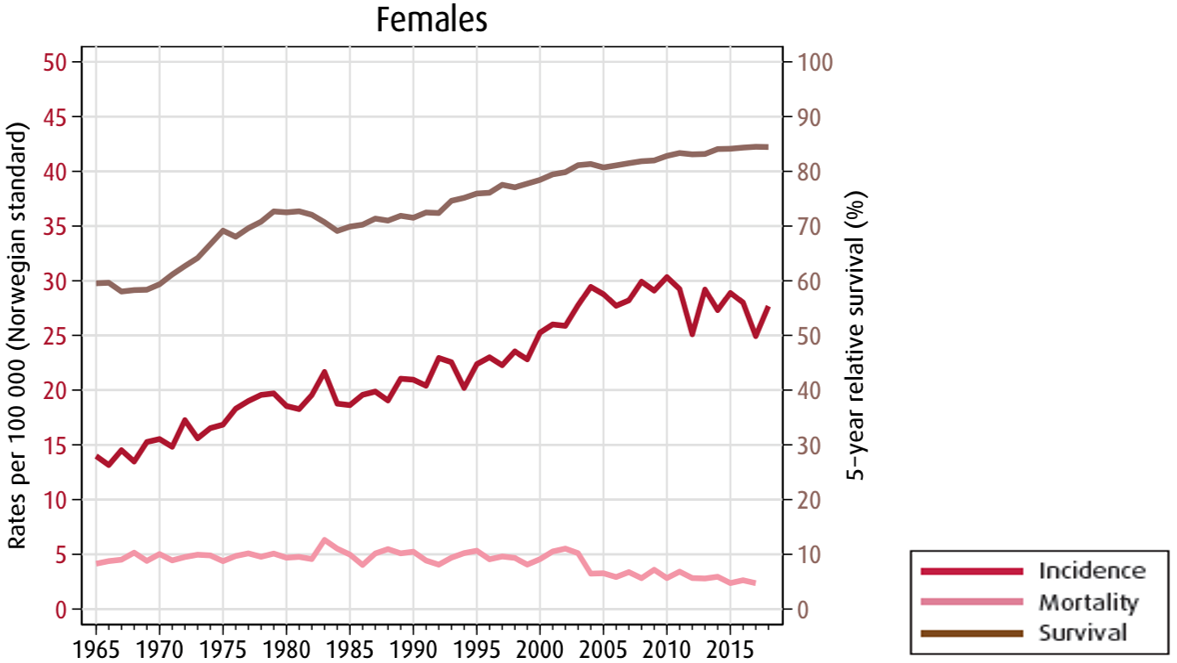
Livmorkreft, også kalt endometriecancer (EC), er den vanligste gynekologiske kreftsykdommen i den vestlige verden. Det er den 5. hyppigste kreftformen hos kvinner i Norge (etter bryst-, colon-, lunge- og hudkreft). Insidens: 27,7 nye tilfeller per 100.000 kvinner per år i Norge (Larsen, 2019). Årlig diagnostiseres 762 (2014–2018) nye tilfeller i Norge. Sykdommen rammer i hovedsak eldre kvinner, men forekommer i økende grad også hos premenopausale. Gjennomsnittlig alder ved diagnose er 65 år. Mortaliteten er lav.
EC er tradisjonelt delt inn i to typer:
Type I: Endometroid
Type II: Ikke-endometroid (serøs og klarcellet).
Type I utgjør 80–90 % av alle EC mens type II utgjør 10–20 % av tilfellene, med følgende fordeling: Endometroid: 70–80 %, Serøs: 5–10 %, Klarcellet: 3 %. Ca 80 % av type I diagnostiseres ved stadium I, for klarcellede EC er dette 50 %, og for serøse EC 37 %.
Prognose
Relativ 5-års overlevelse for hele gruppen er 84,4 % og 10-års overlevelse på 83,1 % (2014–2018) (Larsen, 2019). Ved antatt lokalisert sykdom er relativ 5-års overlevelse 96.3 %, og ved fjernmetastaser 39.3 % (2014–2018) (Larsen, 2019).
Kjente prognostiske faktorer (Rose, 1996):
- Alder, paritet (Albrektsen, Heuch, Wik, & Salvesen, 2009).
- FIGO stadium, tumorstørrelse (Ytre-Hauge et al., 2015)
- Histologisk type og grad, karinfiltrasjon (Abeler & Kjørstad, 1991; Salvesen, Iversen, & Akslen, 1999)
- Hormonreseptorkonsentrasjon (Salvesen, Haldorsen, & Trovik, 2012; Trovik et al., 2013)
- Proliferativ aktivitet i tumor (Ki-67), patologisk uttrykking av tumorsuppressorgenet p 53 (Salvesen et al., 1999) (IIb)
- De siste årene har flere studier beskrevet 4 distinkte molekylære sub-grupper av EC, med ulik risikoprofil for tilbakefall og progresjonsfri overlevelse. Enn så lenge finnes ingen resultater fra prospektive studier hvor disse molekulære risikogruppene er lagt til grunn for behandling (Talhouk et al., 2017).
Etiologi (epidemiologi)
Ca. 5 % av tilfeller av EC er arvelig betinget, de fleste av disse er assosiert med Lynch syndrom. De resterende tilfellene av EC er sporadiske.
| Sporadisk form: | Ukjent etiologi, se risikofaktorer. |
| Arvelig form: | Nedarvet mutasjon i DNA reparasjonsgener (Lynch syndrom/HNPCC) (hMLH1, hMSH2, hMSH6, hPMS2) (Wijnen et al., 1999) (B) |
Risikofaktorer
- Langvarig, økt (endogent/eksogent), ensidig østrogenstimulering (Ali, 2014; Doherty et al., 2007; Pike et al., 1997)
- Høy alder
- Lav paritet (Dossus et al., 2010)
- Overvekt (Zhang et al., 2014)
- Diabetes mellitus (Luo et al., 2014)
- Polycystisk ovariesyndrom (Harris & Terry, 2016)
- Østrogenproduserende svulster (Knab, 1977)
- Antiøstrogen-behandling hos postmenopausale (Tamoxifen) (Committee on Gynecologic Practice, 2014)
Tidlig diagnostikk/screening
Sist faglig oppdatert: 28202128.06.2021
Endometriecancer gir ofte symptomer i form av vaginal blødning, og oppdages vanligvis i et tidlig stadium hvor det er stor sannsynlighet for helbredelse. Det er ikke dokumentert gevinst av masseundersøkelse for endometriecancer (Colombo et al., 2016; Gentry-Maharaj & Karpinskyj, 2020; Jacobs et al., 2011).
Kvinner som tar tamoxifen
Den amerikanske gynekologiforening oppdaterte i 2014 sine retningslinjer vedrørende gynekologisk oppfølgning ved tamoxifenbruk (Committee on Gynecologic Practice, 2014). Norsk Bryst Kreft Gruppe (NBCG) og Norsk Forum for Gynekologisk Onkologi (NFGO) har gjennomgått anbefalingene og støtter disse.
Anbefalingen har grunnlag i at det ikke er påvist økt risiko for endometriecancer ved bruk av Tamoxifen hos premenopausale, kun postmenopausale. Hos pasienter uten symptomer er det ikke funnet nytteverdi av screening for endometriecancer med gynekologisk undersøkelse, inkludert transvaginal ultralydundersøkelse (Committee on Gynecologic Practice, 2014).
Klinikere bør informere postmenopausale kvinner som tar tamoxifen om økt risiko for endometrieproliferasjon, endometriehyperplasi, polypp og livmorkreft. Rutinemessig gynekologisk undersøkelse med ultralyd er ikke nødvendig hos kvinner uten gynekologiske symptomer. Ved unormal vaginalblødning, blodig utflod, mellomblødninger eller lignende bør pasienten henvises til gynekolog.
Diagnostikk og utredning
Sist faglig oppdatert: 28202128.06.2021
Symptomer
- Postmenopausal blødning
- Menometroragi
- Utflod
- Nytilkomne bekkensmerter
Utredning
Symptomatiske kvinner bør henvises til og utredes hos gynekolog med gynekologisk undersøkelse, transvaginal ultralyd og endometriebiopsi til histologisk vurdering. Ved påvist cancer utløses pakkeforløp endometriecancer. Hensikten med videre preoperativ utredning er å undersøke om det er tegn til ekstrauterin spredning samt klassifisere pasienter i antatt stadium I i henhold til risiko-grupper mtp risiko for glandelmetastaser.
Alle kvinner med EC bør screenes for Lynch Syndrom. Pasienter hvor patogen MMR variant er detektert, henvises til genetisk veiledning og ytterligere testing, se egent avsnitt om Lynch syndrom i kapittelet om genetikk.
Klinisk undersøkelse
- Gynekologisk undersøkelse
- Vaginal ultralydundersøkelse
- Endometriebiopsi eller fraksjonert abrasio for histologisk undersøkelse
Bildediagnostikk
Sist faglig oppdatert: 28202128.06.2021
- CT thorax/abdomen/bekken tas hos alle pasienter for å kartlegge evt. ekstrauterin sykdom.
- MR bekken er regnet som den beste modalitet for fremstilling av primærtumor og dens avgrensing mot omkringliggende strukturer. MR bekken kan tas i tilfeller hvor transvaginal ultralyd ikke er tilstrekkelig for å avklare infiltrasjonsdybden i myometriet, eller hvor nedvekst i cervix og ev. innvekst i naboorgan (ved lokalavansert sykdom) skal kartlegges. (Haldorsen & Salvesen, 2016).
- Helkropps PET-CT (som inkluderer diagnostisk/høydose CT thorax/abdomen/bekken) kan være et alternativ til CT thorax/abdomen/bekken for å kartlegge ekstrauterin sykdom. (Haldorsen & Salvesen, 2016). PET-CT er særlig aktuelt hos høyrisikopasienter, hvor det er rapportert bedre diagnostisk treffsikkerhet for påvisning av lymfeknutemetastaser og fjernmetastaser ved PET-CT enn ved CT (Bollineni, Ytre-Hauge, Bollineni-Balabay, Salvesen, & Haldorsen, 2016; Fasmer et al., 2021).
- Ved mistanke om infiltrasjon av naboorganer (blære eller rektum) eller metastaser basert på klinisk undersøkelse og bildediagnostikk, bør dette kartlegges og det bør tas vevsprøver fra affiserte områder.
Utredningen skal kartlegge
- Sykdommens utbredelse:
- infiltrasjonsdybde i myometriet
- infiltrasjon i andre naboorganer
- metastaser
- Histologisk subtype og differensieringsgrad (Stefansson, Salvesen, Immervoll, & Akslen, 2004).
- Det er viktig at utredningen er tilstrekkelig til å identifisere pasienter i henhold til preoperative risikogrupper.
Pasienter med antatt stadium I som tilhører høy- og mellomrisikogrupper, dvs stadium IA, G3, st. IB, G2/G3, og st IA og IB klarcellet, serøs papilær, carcinosarcom og udifferensiert karsinom skal alltid henvises til avdelinger for gynekologisk kreft, samt pasienter med mistanke om ekstrauterin sykdom (stadium >I).
I helseregioner hvor vaktpostlymfeknute teknikk er implementert gjelder egne henvisningskriterer for alle risikogrupper (se kapittelet om vaktpostlymfeknuteteknikk).
Differensialdiagnoser
- Inflammatoriske forandringer i endometriet
- Endometriehyperplasi
- Primær ovarialcancer, tubecancer eller andre organer med spredning til endometriet
- Primær cancer i cervix/endocervix med infiltrasjon i endometriet
Stadieinndeling
Sist faglig oppdatert: 28202128.06.2021
Stadium er basert på patologisk anatomisk undersøkelse av operasjonspreparat, bildediagnostikk og funn ved operasjon (revidert av FIGO; the International Federation of Gynecology and Obstetrics i 2009 (Pecorelli, 2009).
FIGO stadium, 2009
Stadium settes etter bildediagnostikk, funn ved operasjon og patologisk undersøkelse, og er i henhold FIGO (The International Federation of Gynecology and Obstetrics).
Stadium I
Tumor begrenset til corpus uteri
Stadium 1A: Tumor infiltrasjon <50 % av myometriet
Stadium 1B: Tumor infiltrasjon ≥50 % av myometriet
Stadium II
Tumor infiltrasjon i cervixstroma, men ikke utenfor livmor.
(Infiltrasjon av kun slimhinnen i cervicalkanalen inkluderes i stadium 1A)
Stadium III
Lokal og/eller regional spredning av tumor
Stadium IIIA: Infiltrasjon i uterus serosa og/eller adnex
Stadium IIIB: Infiltrasjon i vagina og/eller parametriet
Stadium IIIC: Metastase til retroperitoneale lymfeknuter i bekkenet (IIIC1) og eller paraaortalt (IIIC2)
Stadium IV
Tumor infiltrerer blære og eller tarmslimhinner og eller fjernmetastaser
Stadium IVA: Infiltrasjon i blære eller tarmslimhinner
Stadium IVB: Fjernmetastaser inkludert intraabdominale metastaser og/eller metastaser til inguinale lymfeknuter
Behandling
Sist faglig oppdatert: 28202128.06.2021
Primærbehandling
Primærbehandling av endometriecancer er tilpasset stadium og risiko for tilbakefall.
Inklusjon i studier skal alltid tilstrebes der det er mulig.
Antatt stadium I/II
- Man anbefaler minimal invasiv kirurgi hos pasienter med endometriecancer (Galaal et al., 2012; Janda et al., 2017; Walker et al., 2009).
- Total laparoskopisk hysterektomi (TLH) og bilateral salpingo-ooforektomi (BSO) for lavrisiko-pasienter, evt med vaktpostlymfeknute.
- TLH, BSO og glandelevaluering for mellom- og høyrisiko-pasienter.
- Vaktpostlymfeknute-teknikk (SLN) sidestilles med lymfeglandeltoilette (se kapittelet om vaktpostlymfeknuteteknikk).
- Vaginal hysterektomi med BSO kan vurderes hos pasienter hvor anbefalt prosedyre (over) ikke kan gjennomføres pga komorbiditet, og hos selekterte pasienter med lavrisiko endometriecancer.
- Man kan vurdere å la ovariene stå igjen hos pasienter < 45 år med grad 1 endometroid adenocarcinom stadium 1A uten opplagt ovarial eller ekstrauterin sykdom. Tubene bør fjernes.
- Man anbefaler ikke å la ovariene stå igjen hos pasienter med familiehistorie som gir økt risiko for ovarial cancer (BRCA mutasjon, Lynch syndrom etc.).
- Omentreseksjon anbefales ved høyrisiko EC dersom det ikke foreligger kontraindikasjoner.
- Prøve til cytologi av bukskyllevæske kan tas ved operasjonens start.
- Hos kvinner som ikke vil tåle adjuvant behandling, slik at staging ikke anses som relevant, eller hvor det kirurgiske inngrepet skal være så skånsomt som mulig, kan individuell vurdering mtp å avstå fra fjerning av lymfeknuter og omentektomi gjøres. Disse pasientene kan, etter å ha vært diskutert ved regionalt MDT møte, eventuelt opereres ved lokalsykehus med total laparoskopisk hysterektomi og bilateral salpingo-ooforektomi.
- Hos kvinner som ikke antas å tåle kirurgi, kan strålebehandling eller hormonbehandling vurderes.
- For fertilitetsbevarende behandling, se kapittelet om vulvar intraepitelial neoplasi (VIN).
Antatt stadium III/IV
Pasienter vurdert operable:
- Cytoreduktiv kirurgi med mål å fjerne all synlig sykdom, inkludert forstørrede glandler, dersom null restsykdom kan oppnås.
Pasienter vurdert inoperable primært:
Hos denne pasientgruppen kan man, etter diskusjon på tumormøte og med pasienten, tilby neoadjuvant kjemoterapi (i hovedsak i form av 3 kurer Carboplatin AUC5 + Paclitaxel 175 mg/m2) med påfølgende vurdering med billeddiagnostikk og diskusjon på tumormøte etter 3 kurer mtp forsinket primærkirurgi.
I enkelte tilfeller kan palliativ kirurgi utføres for å redusere plager og symptomer.
Restaging
Restaging gjøres kun hos pasienter hvor det vil ha betydning mtp beslutning vedrørende administrasjon av adjuvant behandling, eller inklusjon i studier. Det skal foreligge CT thorax/abdomen/bekken. Restaging i form av glandeltoilette (og omentektomi på indikasjon) med minimalinvasiv kirurgi anbefales.
Adjuvant behandling
Risikogrupper som veiledning for adjuvant behandling
| Risikogruppe |
|
|---|---|
| Lav risiko |
|
| Intermediær risiko |
|
| Høy risiko |
|
|
|
|
|
| |
|
| |
|
| |
Adjuvant behandling gis til pasienter i høyrisiko-gruppen samt pasienter med >st I. Adjuvant behandling vil vanligvis være Carboplatin (AUC 5) og Paclitaxel 175 mg/m2. Dette gis hver 3. uke, totalt 6 sykluser. Det gjøres avsluttende evaluering etter 6 kurer. Adjuvant kjemoterapi er aktuell for høyrisikopasienter med følgende histologi: Endometrioid adenocarcinom st 1B, grad 3, serøs, klarcellet og karsinosarkomer (Johnson, Bryant, Miles, Hogberg, & Cornes, 2011) samt pasienter med ekstrauterin spredning (Miller et al., 2020).
Adjuvant strålebehandling brukes i andre land for å motvirke bekkenresidiv, men effekten på overlevelse for stadium I er ikke dokumentert (Creutzberg et al., 2000; Kong, Johnson, Kitchener, & Lawrie, 2012; Aalders, Abeler, Kolstad, & Onsrud, 1980). Det er signifikant toksisitet forbundet med strålebehandling. Vi anbefaler derfor ikke adjuvant strålebehandling som rutine.
Hos kvinner med stadium II, og knapp margin, kan adjuvant strålebehandling vurderes (Harkenrider et al., 2018).
Individuelle vurderinger gjøres hos pasienter hvor adjuvant kjemoterapi ikke kan administreres, eller hvor det er behov for kombinasjonsbehandling (se adjuvant kjemoterapi).
Adjuvant behandling med progestagener har ikke dokumentert effekt (Martin-Hirsch, Bryant, Keep, Kitchener, & Lilford, 2011; Vergote, Kjørstad, Abeler, & Kolstad, 1989).
Som nevnt i avsnittet "Antatt stadium III/IV" over, kan neoadjuvant kjemoterapi (NACT) etterfulgt av kirurgi eller supplerende stråleterapi vurderes i hvert enkelt tilfelle hvor pasienten ikke er vurdert operabel primært. Påfølgende kirurgi, stråleterapi eller videre kjemoterapi avhenger av respons på NACT og på sykdomsbildet. Individuelle vurderinger gjøres.
Palliativ strålebehandling er aktuelt ved blødning hos pasienter som ikke er kandidater for kirurgi.
Ved hormonreseptorpositive tumorer kan hormonbehandling være aktuelt hos denne pasientgruppen.
Komplikasjoner
Sist faglig oppdatert: 28202128.06.2021
Peroperative
- Blødning: Skade på store kar (spesielt ved lymfeknutefjerning); diffus blødning (Creutzberg et al., 2000) (A)
- Blære-/tarm-skade
- Allergisk reaksjon på tracer (brukt ved SLN)
- Anestesikomplikasjoner
Postoperative
- Hematom
- Infeksjon, overfladisk og dyp (antibiotikaprofylakse gis peroperativt)
- Tromboemboliske. Alle skal ha tromboseprofylakse
- Blæreparese, spesielt ved utvidet hysterektomi (nerveskade)
- Lymfødem etter lymfeknutetoilette i 5–40 %
- Lymfecyster på bekkenveggen
- Brokk
- Vaginaltopp dehiscence
- Fisteldannelse
Vaktpostlymfeknuteteknikk
Sist faglig oppdatert: 28202128.06.2021
Fjerning av lymfeknuter for stadieinndeling vurderes tradisjonelt i henhold til risikogrupper (Chan et al., 2006; K. May, Bryant, Dickinson, Kehoe, & Morrison, 2010). (se også punktet "Utredningen skal kartlegge", kapittel Bildediagnostikk).
Lymfadenektomi har ikke vist økt overlevelse (ASTEC study group et al., 2009; Benedetti Panici et al., 2008). Vaktpostlymfeknuteteknikk (Sentinel node, SLN) har vist høy sensitivitet og spesifisitet mtp å detektere lymfeknutemetastaser hos kvinner med endometriecancer for alle risikogrupper (Ballester et al., 2011; Cusimano et al., 2021; Hagen et al., 2016; Rossi et al., 2017), og er sidestilt med lymfadenektomi mtp staging. Eksisjon av forstørrede lymfeknuter (over 1 cm) i bekkenet og paraaortalt skal foretas (Creasman et al., 1987).
I helseregioner hvor SLN teknikk er innført skal pasienter henvises til sykehus med regionalt ansvar for behandling av gynekologisk kreft, med mindre regionale retningslinjer tilsier annen pasientflyt.
SLN prosedyre
Ved SLN prosedyre må en etablert SLN algoritme følges (Barlin et al., 2012). Indocyaneen green (ICG) er gullstandard for SLN ved minimal invasiv kirurgi.
ICG 1.25 mg/ml, dvs 25 mg ICG pulver fortynnes i 20 ml sterilt vann. Fire ml ICG-blanding injiseres i cervix; 0.5–1 ml dypt i stroma og 0.5–1 ml submucosalt kl 3 og 9 før applikasjon av vaginal-rør. Sakte injeksjon.
Hos pasienter hvor SLN og patologisk ultrastaging er gjennomført regnes følgende som positive lymfeknuter (st IIIC):
- Makrometastaser (>2.0 mm) og micrometastaser (<0.2 mm – 2.0 mm).
- Isolerte tumor celler (ITCs) regnes ikke som metastatisk sykdom da det ikke er konsensus internasjonalt mtp behov/indikasjon for adjuvant behandling (Bogani, Mariani, Paolini, Ditto, & Raspagliesi, 2019; Gómez-Hidalgo et al., 2020; Plante et al., 2017).
Pasientinformasjon
Sist faglig oppdatert: 28202128.06.2021
Preoperativ informasjon bør omfatte
- Funn som er gjort (ved vevsprøver og andre preoperative undersøkelser)
- Plan for videre behandling; planlagt inngrep (operasjonssnitt) med presisering av hvilke organer som skal fjernes (livmor, eggledere, eggstokker, eventuelt oment, lymfeknuter), muligheten for utvidelse av inngrepet utover det planlagte dersom sykdomsutbredelsen tilsier dette (f.eks. konvertering til laparotomi, tarmoperasjon, utlagt tarm)
- Komplikasjoner til inngrepet (se "Komplikasjoner")
- Man bør også opplyse om forhold knyttet til den postoperative fasen, som behov for innlagt blærekateter, intravenøs væsketilførsel, samt antatt liggetid i avdelingen og behov for sykemelding.
Postoperativ informasjon bør omfatte
- Forløp av og funn gjort ved primæroperasjonen
- Plan for videre behandling dersom dette er aktuelt, samt planlagt oppfølging når histologisk svar foreligger
- Fordeler og ulemper og dokumentasjonsgrunnlaget for ev. tilleggsbehandling bør særlig diskuteres med pasienter der det kan være tvil om indikasjonen
- Aktuelle studier for inklusjon av pasienten
- Forholdsregler vedrørende karbad, samleie og fysisk aktivitet. Forholdsregler for å forebygge utvikling av lymfødem dersom pasienten har fått utført lymfadenektomi, samt informasjon om nytte av fysioterapi/lymfødembehandling ved lymfødem.
Organisering av behandling
Høy- og mellomrisikopasienter i antatt FIGO stadium I og alle pasienter med FIGO stadium >I skal henvises til avdeling med spesialkompetanse innen behandling av gynekologisk kreft. I regioner som tilbyr vaktpostlymfeknuteteknikk skal alle risikogrupper henvises til avdeling med spesialkompetanse innen behandling av gynekologisk kreft, med mindre regionale retningslinjer tilsier annen pasientflyt (Helsedirektoratet, 2017).
Oppfølging og kontroller etter primærbehandling
Sist faglig oppdatert: 28202128.06.2021
Kontroller og prøvetaking
Gevinsten av skjematiske rutinekontroller etter behandling for endometriecancer er dårlig dokumentert (Schmeler et al., 2006). Det er vist at rutinekontroller i liten grad fanger opp asymptomatiske residiv (Salvesen, Akslen, Iversen, & Iversen, 1997) (C). Det er liten evidens for verdien av dagens oppfølgningsrutiner, og det pågår for tiden en studie ved 10 norske sykehus som skal se nærmere på dette (The Lifestyle and Empowerment Techniques in Survivorship of Gynecologic Oncology Study (LETSGO), 2019-2030).
Det anbefales individuelt tilpasset oppfølging der hensynet til pasientens livskvalitet vektlegges (Fung-Kee-Fung et al., 2006) (C), særlig der residiv ikke kan ha et kurativt siktemål.
Kvinnene bør, uavhengig av kontrollopplegg, informeres om å ta kontakt med lege ved blødning i intervallene mellom kontrollene.
Rutinekontroller kan i samråd med pasienten gjennomføres hos fastlege, gynekolog eller spesialavdeling.
Grupper som utfra tidligere behandling, alder og allmenntilstand potensielt kan tilbys kurativ behandling ved et lokalt residiv, bør kontrolleres av gynekolog.
Veiledende kontrollintervall inntil nye retningslinjer foreligger:
1. og 2. år: 3–4 kontroller årlig
3. til 5. år: hver 6 mnd
Kontrollen består av klinisk undersøkelse, inkludert gynekologisk undersøkelse med UL. Klinisk undersøkelse kan suppleres med CT og MR bekken på indikasjon.
Ved mistanke om residiv tas biopsi.
Postoperativ hormonsubstitusjon
Peroral hormonsubstitusjon er omdiskutert, men med lite dokumentasjonsgrunnlag.
Det er ikke vist at risikoen for residiv eller total overlevelse påvirkes av hormonsubstitusjon etter behandling for endometriecancer (R. R. Barakat, Bundy, Spirtos, Bell, & Mannel, 2006; Di Donato et al., 2020).
For kvinner radikalt behandlet for endometriecancer Stadium I med klimakterielle plager bør hormonsubstitusjon vurderes.
Det er ikke dokumentert at man bør vente et visst tidsrom etter avsluttet behandling før hormoner gis.
Det er ikke vist at bruk av kombinasjonen østrogen-gestagen har noen fordeler sammenliknet med bruk av bare østrogen.
Det er mindre motforestillinger mot lokal behandling med østriol, da det gjennom godt østrogeniserte slimhinner er minimal absorbsjon av medikamentet (Crean-Tate, Faubion, Pederson, Vencill, & Batur, 2020)
Behandling av tilbakefall (residivbehandling)
Sist faglig oppdatert: 11202311.04.2023
Før oppstart av behandling skal residiv verifiseres histologisk med biopsi.
Det skal klargjøres om behandlingen har kurativ, livsforlengende eller palliativ intensjon (T. D. Moore, Phillips, Nerenstone, & Cheson, 1991).
Inklusjon i studier skal alltid etterstrebes hvis mulig.
Kirurgi
Kirurgi vurderes for selekterte pasienter.
Bekkeneksenterasjon kan være aktuelt ved isolert lokalt, sentralt residiv i tidligere strålebehandlet område dersom fri margin kan oppnås.
Kirurgi vurderes ved solitær hjerne-, lunge-, og levermetastase, eller ved residiv i lymfeknuter.
Aktuell palliativ kirurgi:
- Avlastende stomi fra urinveier / tarmsystemet
- Ved truende fraktur
Strålebehandling
Strålebehandling med kurativ intensjon er indisert hos pasienter som har et isolert vaginalt residiv etter kirurgi. Strålebehandling er også indisert for palliasjon av symptomer relatert til lokale residiv og systemisk sykdom.
Medikamentell behandling
Hormonbehandling
Biopsi av residivsvulst bør gjøres da det kan være forskjell i hormonreseptorstatus i primær og residiv svulst. Grad 1 eller 2 endometroide svulster har størst sannsynlighet for å være reseptor positive, og har følgelig størst sannsynlighet for behandlingsrespons. Behandlingen kan pågå til progresjon. Det er få bivirkninger (Jerzak, Duska, & MacKay, 2019).
Man kan oppnå ca samme responsrate med endokrin behandling som med kjemoterapi ved ER/PR positivitet.
- Megace: Eneste gestagen på markedet i Norge godkjent for cancerbehandling (Megace, Megestrolacetat, 160 mg x1).
- Provera, Medroxyprogesteron, 200 mg x1.
Aromatasehemmer
- Femar, Letrozole, 2.5 mg x1
- Aromasin, Eksemestan, 25 mg x1
Kjemoterapi
Gevinst av behandling med kjemoterapi utover førstelinje er usikker (Amant et al., 2005). For andrelinje behandling kjemoterapi foreligger ingen etablert klinisk standard for behandling. Ved residiv er platinumbaserte regimer, antracykliner og taxaner mest vanlig brukt alene eller i kombinasjoner (Colombo et al., 2013). Tumorrespons er godt dokumentert og gir lengre tid til progresjon, men det er usikker effekt på overlevelse. Studiene viser betydelig toksisitet. Hensynet til pasientens allmenntilstand og livskvalitet må derfor veie tungt (Vale, Tierney, Bull, & Symonds, 2012).
Kombinasjonsbehandling:
Carboplatin + Paclitaxel x 6 er førstevalg.
Doxorubicin + Cisplatin har vist høyere responsrate og PFS enn Doxorubicin singel (Thigpen et al., 2004), således kan Doxorubicin + Cisplatin eller Carboplatin gis til pasienter som vil tåle dublett-behandling, hvor Taxol er kontraindisert.
Enkeltstoffer:
Enkeltstoff har responsrate på 15–40 %.
Enkeltstoff gis til pasienter med recidiv som oppstår <6 mnd etter avsluttet primærbehandling, eller som ikke tåler kombinasjonsbehandling. De mest brukte stoffene er:
Doxorubicin, Epirubicin, Paclitaxel, Carboplatin, Cisplatin
Persontilpasset behandling
I Norge i dag er det ikke tilbud om persontilpasset behandling av kvinner med endometriecancer.
Hos kvinner med serøs corpuscancer og overekspresjon av HER2/neu er det demonstrert at Herceptin/Trastuzumab i tillegg til Carboplatin og Paclitaxel gir økt overlevelse, både ved recidiv og ved metastatisk sykdom i første linje (stadium III og IV) (Fader et al., 2020).
Keynote 158-studien viste lovende responsrate og sykdomskontroll ved behandling med Pembrolizumab hos kvinner med MSI-H tumores og tilbakefall etter tidligere behandling av EC (Marabelle, Le, et al., 2020).
Kombinasjon av Lenvatinib (tyrosinkinasehemmer) og Pembrolizumab (PD-1 hemmer) har vist klinisk signifikant responsrate hos kvinner med tilbakefall av corpuscancer uavhengig av MSI-status (Makker et al., 2019).
Dostarlimab (PD-1 hemmer) har i en fase 1 studie vist responsrate hos 42 % av kvinner med avansert corpuscancer (stadium III, IV) eller tilbakefall, med deficient mismatch mutation repair mechanism (dMMR) (Oaknin et al., 2020).
Det ble gjort en beslutning i Nye metoder 23. januar 2023 som sier at Dostarlimab (Jemperli) innføres som monoterapi til behandling av voksne pasienter med tilbakevennende eller fremskreden dMMR/MSI-H endometriekreft som har utviklet seg under eller etter tidligere behandling med platinaholdig regime.
ENGOT-EN3/NSGO-PALEO, en fase-II-studie, viste at Palbociclib (CDK4/6 hemmer) i tillegg til Letrozol gav økt PFS og sykdomskontroll enn Letrozol pluss placebo, hos kvinner med østrogenreseptor-positiv, residiverende eller avansert (stadium IV) EC (Moehler et al., 2020).
Kvinner kan henvises til ekspertpanelet for vurdering av ovennevnte behandling.
Organisering av behandling
Behandling av metastaserende og residiverende sykdom bør konsulteres med avdeling med spesialkompetanse innen behandling av gynekologisk kreft.
Fertilitetsbevarende behandling
Endometriecancer hos fertile kvinner er sjeldent. Bare 4 % av pasienter med endometriecancer er under 40 år (Duska et al., 2001). Yngre og premenopausale kvinner med endometriecancer har en bedre prognose enn eldre fordi de oftere blir diagnostisert med tidlig stadium og lavgradig sykdom (Duska et al., 2001).
Konservativ behandling av endometriecancer er basert på medisinsk behandling med progesteron. Det aller viktigste for å kunne vurdere konservativ behandling ved endometriecancer er klinisk og patologisk tumorkarakterstikk samt velge riktig medisinsk behandling.
Indikasjoner for fertilitetsbevarende behandling:
- Endometroid adenokarsinom grad 1. Re-gransket av gynonkologisk patolog.
- Sykdom begrenset til endometriet.
- Ingen infiltrasjon i myometriet på MR
- Ingen tegn til ekstrauterin spredning
- Alder 40 år, relativ indikasjon.
- Sterkt ønske om å bevare fertilitet.
- Ingen kontraindikasjon for medisinsk behandling med progesteron
- Informert samtykke med en forståelse at dette ikke er standard behandling og gir høyere residiv risiko.
- Pasienten skal henvises gyn-onkologisk avdeling.
Det anbefales fraksjonert abrasio fremfor endometriebiopsi for bedre bedømmelse av tumorgrad (Leitao et al., 2009). MR tas for å bedømme infiltrasjon i myometriet samt vurdere adenex og bekkenglandler. Pasienten må akseptere tett oppfølging under behandlingen. Det må informeres om at det anbefales senere hysterektomi etter evt svangerskap eller ved behandlings svikt.
Behandling
- Megestrol acetat (MA) 160–320 mg/dag (Evans-Metcalf, Brooks, Reale, & Baker, 1998). (Megace).
- Hormonspiral (Minig et al., 2011).
Behandlingsvarighet: 6 mdr før ny kontroll med fraksjonert abrasio og gynekologisk undersøkelse.
Responsrate ved konservativ behandling av endometriekarsinom er ca 75 % (Gallos et al., 2012; J. Y. Park et al., 2013).
Residivfrekvens er 30–40 % (J. Y. Park et al., 2013).
Standard behandling med hysterektomi bør utføres hos de som ikke responderer på behandlingen. Kontinuerer ytterligere 6 mdr med progesteron hos de med respons som ønsker å utsette evt graviditet (Rodolakis et al., 2015).
Selv om progesteron reseptor status kan predikere behandlingsrespons, er det ikke nødvendig med rutine progesteron status da 50 % av progesteron negative pasienter også responderer på progesteron behandling (Yamazawa et al., 2007).
Graviditet er assosiert med redusert risiko for endometriecancerresidiv. Ved behandlingsrespons etter 6 mdr behandling med progesteron anbefales å forsøke å bli gravid raskt evt. henvise til infertilitetsbehandling.
Det anbefales hysterektomi og BSOE etter graviditet. Å evt beholde eggstokker kan vurderes i hvert enkelt tilfelle, avhengig av pasientens alder og genetiske risikofaktorer.
Genetikk
Sist faglig oppdatert: 28202128.06.2021
Arvelig endometriecancer er en del av Lynch syndrom (LS). Syndromet gir nedarvet økt risiko for hovedsaklig colorectal- og endometriecancer, men også for prostatacancer, ovarialcancer, cancer i øvre urinveier og øvrige gastrointestinaltractus.
LS er en autosomal dominant nedarvet tilstand som er forårsaket av germline mutasjon i ett av flere DNA mismatch reparasjonsgener (MLH1, MSH2, MSH6 og PMS2) og EPCAM (Barrow et al., 2009; Dowty et al., 2013; Koornstra et al., 2009).
Livstidsrisiko: for EC varierer fra 43–57 %., og risiko varierer mellom de ulike gener (Møller et al., 2018).
Gjennomsnittsalder: 46–54 år (Larsen, 2018; Møller et al., 2018; Aaltonen, Johns, Järvinen, Mecklin, & Houlston, 2007), gjennomsnittlig debut alder er 50 år.
Kvinner med LS har 40–60 % sjanse for å debutere med EC som første kliniske manifestasjon. Ved å tilby rutinemessig analyse av svulstvev fra endometriecancere, vil dette øke deteksjon av LS, noe som er hensiktsmessig for å fremme tidlig deteksjon, screening og forebygging av andre LS-assosierte kreftformer. Kontrollopplegg vil ta sikte på å enten hindre kolorectalcancer (CRC) eller oppdage det tidlig. Dødeligheten av CRC er høyere enn ved EC (Banno et al., 2009; Bonadona et al., 2011; Wang et al., 2013).
Tumor screening anbefales av alle EC for å identifisere pasienter med LS (Crosbie et al., 2019; Genetic/Familial High-Risk Assessment: Colorectal. [NCCN Guideline]. Version 1, 2020). Kombinert MSI-, metylering- og IHC-analyse er nyttig, for enkelte bærere har en MSI-positiv tumor uten IHC-defekt (Hampel et al., 2007; Mills et al., 2014).
Diagnostisk gentest
Alle med EC kan tilbys diagnostisk gentest av DNA mismatch reparasjonsgener (MLH1, MSH2, MSH6, PMS2 og EPCAM) i forbindelse med behandling. Omlag 25 % av LS mutasjonsbærere debuterte med EC i alderen> 60 år, og ved aldersgrense for genetisk testing på 50 år vil bare 25–40 % av tilfellene bli fanget opp (Goodfellow et al., 2015).Kriterier for genetisk utredning ved EC i familien
- 1 familiemedlem med EC eller CRC ≤ 50 år
- 2 familiemedlemmer med EC uansett alder
- 1 kvinne med både EC og CRC uansett alder
- 1 kvinne med EC som har minst 1 førstegradsslektning
(foreldre, søsken eller barn) med CRC - Påvist mikrosatelittinstabilitet (MSI) eller unormal immunhistokjemi (IHC) etter undersøkelse av svulstvev
- IH/MSI bør utføres rutinemessig i forbindelse med behandling av alle EC uavhengig av alder og histologisk subtype. Pasienten informeres av behandlende lege om at analysen kan avdekke arvelig årsak.
- Kombinert MSI-, metylering- og IHC-analyse kan vise seg nyttig, da noen bærere kan ha en MSI-positiv tumor uten IHC-defekt (Weiderpass et al., 1999).
- Ved påvist MSI skal BRAF V600E og/eller MLH1 promoter hypermetylering være utelukket
- I tilfeller der affisert slektning ikke er tilgjengelig, kan friske familiemedlemmer vurderes testet prediktivt etter genetisk veiledning.
Kontrollopplegg ved påvist mutasjon
Nytte av screening for endometrie cancer er dokumentert for tidlig diagnose, men ikke for overlevelse (Schmeler et al., 2006; Walker et al., 2009).
Årlig gynekologisk undersøkelse fra 35 årsalder (Colombo et al., 2016).
- Vaginal ultralydundersøkelse av endometriets tykkelse og av ovarier.
- Endometriebiopsi på indikasjon eller ved usikre funn (Pecorelli, 2009)
- CA125, HE4, CEA
Urin stix (hematuri) hos fastlege årlig fra 30 års alder.
Koloskopi hvert annet år fra 25 år. Ved påvist adenomatøs polypp, ny kontroll etter ett år. Viser for øvrig til Handlingsprogram tykk- og endetarmskreft kapittel Fastlegens arbeid og ansvar ved tykk- og endetarmskreft.
Risikoreduserende tiltak
Gestagen spiral synes å reduserer risiko for endometriecancer, særlig type I tumor. Ved alder > 35 år er dette anbefalt i høyrisiko-gruppen, men er ikke dokumentert (Colombo et al., 2016; Fu & Zhuang, 2014).
P-pille er vist å minske risiko for EC, men er ikke dokumentert i høyrisiko gruppen (Combination oral contraceptive use and the risk of endometrial cancer. The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development, 1987).
Hysterektomi, bilateral salpingektomi evt med bilateral oophorectomi kan vurdereres ved 45–50 års alder, avhengig av familiehistorie/type mutasjon. Beslutning tas av pasienten i samråd med gynekolog/genetiker.
Andre sjeldne genetiske tilstander med økt risiko for endometriecancer
Cowden syndrom: EC kan også skyldes genfeil i PTEN (Cowden syndrom).
Det er få data angående dette sjeldne syndromet; tilgjengelige studier rapporterer en livstidsrisiko for EC fra 13–28 % (Heald et al., 2010; Pilarski, Stephens, Noss, Fisher, & Prior, 2011).
Sjeldne svulster
Sist faglig oppdatert: 28202128.06.2021
Uterine sarkomer, se eget kapittel i Nasjonal veileder i Gynekologisk Onkologi (Uterussarkom 2009); http://www.legeforeningen.no.
Palliativ behandling – Nasjonalt handlingsprogram
Helsedirektoratet har utgitt Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen (Helsedirektoratet, 2019) med anbefalinger om palliativ behandling for kreftpasienter.
Innledning
Sist faglig oppdatert: 28202128.06.2021
ICD-10
| C54 | Ondartet svulst i livmorlegeme |
| C54.0 | Nedre uterinsegment (isthmus uteri) |
| C54.1 | Livmorslimhinne (endometrium) |
| C54.2 | Muskulatur i livmorvegg (myometrium) |
| C54.3 | Fundus uteri |
| C54.8 | Overlappende svulst i livmorlegeme |
| C54.9 | Livmorlegeme (corpus uteri) uspesifisert |
| C55 | Ondartet svulst i livmor, uspesifisert del |
Definisjon
Sist faglig oppdatert: 28202128.06.2021
Cancer utgående fra livmorslimhinnen.
Forekomst og prognose
Sist faglig oppdatert: 28202128.06.2021

Livmorkreft, også kalt endometriecancer (EC), er den vanligste gynekologiske kreftsykdommen i den vestlige verden. Det er den 5. hyppigste kreftformen hos kvinner i Norge (etter bryst-, colon-, lunge- og hudkreft). Insidens: 27,7 nye tilfeller per 100.000 kvinner per år i Norge (Larsen, 2019). Årlig diagnostiseres 762 (2014–2018) nye tilfeller i Norge. Sykdommen rammer i hovedsak eldre kvinner, men forekommer i økende grad også hos premenopausale. Gjennomsnittlig alder ved diagnose er 65 år. Mortaliteten er lav.
EC er tradisjonelt delt inn i to typer:
Type I: Endometroid
Type II: Ikke-endometroid (serøs og klarcellet).
Type I utgjør 80–90 % av alle EC mens type II utgjør 10–20 % av tilfellene, med følgende fordeling: Endometroid: 70–80 %, Serøs: 5–10 %, Klarcellet: 3 %. Ca 80 % av type I diagnostiseres ved stadium I, for klarcellede EC er dette 50 %, og for serøse EC 37 %.
Prognose

Relativ 5-års overlevelse for hele gruppen er 84,4 % og 10-års overlevelse på 83,1 % (2014–2018) (Larsen, 2019). Ved antatt lokalisert sykdom er relativ 5-års overlevelse 96.3 %, og ved fjernmetastaser 39.3 % (2014–2018) (Larsen, 2019).
Kjente prognostiske faktorer (Rose, 1996):
- Alder, paritet (Albrektsen, Heuch, Wik, & Salvesen, 2009).
- FIGO stadium, tumorstørrelse (Ytre-Hauge et al., 2015)
- Histologisk type og grad, karinfiltrasjon (Abeler & Kjørstad, 1991; Salvesen, Iversen, & Akslen, 1999)
- Hormonreseptorkonsentrasjon (Salvesen, Haldorsen, & Trovik, 2012; Trovik et al., 2013)
- Proliferativ aktivitet i tumor (Ki-67), patologisk uttrykking av tumorsuppressorgenet p 53 (Salvesen et al., 1999) (IIb)
- De siste årene har flere studier beskrevet 4 distinkte molekylære sub-grupper av EC, med ulik risikoprofil for tilbakefall og progresjonsfri overlevelse. Enn så lenge finnes ingen resultater fra prospektive studier hvor disse molekulære risikogruppene er lagt til grunn for behandling (Talhouk et al., 2017).
Etiologi (epidemiologi)
Ca. 5 % av tilfeller av EC er arvelig betinget, de fleste av disse er assosiert med Lynch syndrom. De resterende tilfellene av EC er sporadiske.
| Sporadisk form: | Ukjent etiologi, se risikofaktorer. |
| Arvelig form: | Nedarvet mutasjon i DNA reparasjonsgener (Lynch syndrom/HNPCC) (hMLH1, hMSH2, hMSH6, hPMS2) (Wijnen et al., 1999) (B) |
Risikofaktorer
- Langvarig, økt (endogent/eksogent), ensidig østrogenstimulering (Ali, 2014; Doherty et al., 2007; Pike et al., 1997)
- Høy alder
- Lav paritet (Dossus et al., 2010)
- Overvekt (Zhang et al., 2014)
- Diabetes mellitus (Luo et al., 2014)
- Polycystisk ovariesyndrom (Harris & Terry, 2016)
- Østrogenproduserende svulster (Knab, 1977)
- Antiøstrogen-behandling hos postmenopausale (Tamoxifen) (Committee on Gynecologic Practice, 2014)
Tidlig diagnostikk/screening
Sist faglig oppdatert: 28202128.06.2021
Endometriecancer gir ofte symptomer i form av vaginal blødning, og oppdages vanligvis i et tidlig stadium hvor det er stor sannsynlighet for helbredelse. Det er ikke dokumentert gevinst av masseundersøkelse for endometriecancer (Colombo et al., 2016; Gentry-Maharaj & Karpinskyj, 2020; Jacobs et al., 2011).
Kvinner som tar tamoxifen
Den amerikanske gynekologiforening oppdaterte i 2014 sine retningslinjer vedrørende gynekologisk oppfølgning ved tamoxifenbruk (Committee on Gynecologic Practice, 2014). Norsk Bryst Kreft Gruppe (NBCG) og Norsk Forum for Gynekologisk Onkologi (NFGO) har gjennomgått anbefalingene og støtter disse.
Anbefalingen har grunnlag i at det ikke er påvist økt risiko for endometriecancer ved bruk av Tamoxifen hos premenopausale, kun postmenopausale. Hos pasienter uten symptomer er det ikke funnet nytteverdi av screening for endometriecancer med gynekologisk undersøkelse, inkludert transvaginal ultralydundersøkelse (Committee on Gynecologic Practice, 2014).
Klinikere bør informere postmenopausale kvinner som tar tamoxifen om økt risiko for endometrieproliferasjon, endometriehyperplasi, polypp og livmorkreft. Rutinemessig gynekologisk undersøkelse med ultralyd er ikke nødvendig hos kvinner uten gynekologiske symptomer. Ved unormal vaginalblødning, blodig utflod, mellomblødninger eller lignende bør pasienten henvises til gynekolog.
Diagnostikk og utredning
Sist faglig oppdatert: 28202128.06.2021
Symptomer
- Postmenopausal blødning
- Menometroragi
- Utflod
- Nytilkomne bekkensmerter
Utredning
Symptomatiske kvinner bør henvises til og utredes hos gynekolog med gynekologisk undersøkelse, transvaginal ultralyd og endometriebiopsi til histologisk vurdering. Ved påvist cancer utløses pakkeforløp endometriecancer. Hensikten med videre preoperativ utredning er å undersøke om det er tegn til ekstrauterin spredning samt klassifisere pasienter i antatt stadium I i henhold til risiko-grupper mtp risiko for glandelmetastaser.
Alle kvinner med EC bør screenes for Lynch Syndrom. Pasienter hvor patogen MMR variant er detektert, henvises til genetisk veiledning og ytterligere testing, se egent avsnitt om Lynch syndrom i kapittelet om genetikk.
Klinisk undersøkelse
- Gynekologisk undersøkelse
- Vaginal ultralydundersøkelse
- Endometriebiopsi eller fraksjonert abrasio for histologisk undersøkelse
Bildediagnostikk
Sist faglig oppdatert: 28202128.06.2021
- CT thorax/abdomen/bekken tas hos alle pasienter for å kartlegge evt. ekstrauterin sykdom.
- MR bekken er regnet som den beste modalitet for fremstilling av primærtumor og dens avgrensing mot omkringliggende strukturer. MR bekken kan tas i tilfeller hvor transvaginal ultralyd ikke er tilstrekkelig for å avklare infiltrasjonsdybden i myometriet, eller hvor nedvekst i cervix og ev. innvekst i naboorgan (ved lokalavansert sykdom) skal kartlegges. (Haldorsen & Salvesen, 2016).
- Helkropps PET-CT (som inkluderer diagnostisk/høydose CT thorax/abdomen/bekken) kan være et alternativ til CT thorax/abdomen/bekken for å kartlegge ekstrauterin sykdom. (Haldorsen & Salvesen, 2016). PET-CT er særlig aktuelt hos høyrisikopasienter, hvor det er rapportert bedre diagnostisk treffsikkerhet for påvisning av lymfeknutemetastaser og fjernmetastaser ved PET-CT enn ved CT (Bollineni, Ytre-Hauge, Bollineni-Balabay, Salvesen, & Haldorsen, 2016; Fasmer et al., 2021).
- Ved mistanke om infiltrasjon av naboorganer (blære eller rektum) eller metastaser basert på klinisk undersøkelse og bildediagnostikk, bør dette kartlegges og det bør tas vevsprøver fra affiserte områder.
Utredningen skal kartlegge
- Sykdommens utbredelse:
- infiltrasjonsdybde i myometriet
- infiltrasjon i andre naboorganer
- metastaser
- Histologisk subtype og differensieringsgrad (Stefansson, Salvesen, Immervoll, & Akslen, 2004).
- Det er viktig at utredningen er tilstrekkelig til å identifisere pasienter i henhold til preoperative risikogrupper.
Pasienter med antatt stadium I som tilhører høy- og mellomrisikogrupper, dvs stadium IA, G3, st. IB, G2/G3, og st IA og IB klarcellet, serøs papilær, carcinosarcom og udifferensiert karsinom skal alltid henvises til avdelinger for gynekologisk kreft, samt pasienter med mistanke om ekstrauterin sykdom (stadium >I).
I helseregioner hvor vaktpostlymfeknute teknikk er implementert gjelder egne henvisningskriterer for alle risikogrupper (se kapittelet om vaktpostlymfeknuteteknikk).
Differensialdiagnoser
- Inflammatoriske forandringer i endometriet
- Endometriehyperplasi
- Primær ovarialcancer, tubecancer eller andre organer med spredning til endometriet
- Primær cancer i cervix/endocervix med infiltrasjon i endometriet
Stadieinndeling
Sist faglig oppdatert: 28202128.06.2021
Stadium er basert på patologisk anatomisk undersøkelse av operasjonspreparat, bildediagnostikk og funn ved operasjon (revidert av FIGO; the International Federation of Gynecology and Obstetrics i 2009 (Pecorelli, 2009).
FIGO stadium, 2009
Stadium settes etter bildediagnostikk, funn ved operasjon og patologisk undersøkelse, og er i henhold FIGO (The International Federation of Gynecology and Obstetrics).
Stadium I
Tumor begrenset til corpus uteri
Stadium 1A: Tumor infiltrasjon <50 % av myometriet
Stadium 1B: Tumor infiltrasjon ≥50 % av myometriet
Stadium II
Tumor infiltrasjon i cervixstroma, men ikke utenfor livmor.
(Infiltrasjon av kun slimhinnen i cervicalkanalen inkluderes i stadium 1A)
Stadium III
Lokal og/eller regional spredning av tumor
Stadium IIIA: Infiltrasjon i uterus serosa og/eller adnex
Stadium IIIB: Infiltrasjon i vagina og/eller parametriet
Stadium IIIC: Metastase til retroperitoneale lymfeknuter i bekkenet (IIIC1) og eller paraaortalt (IIIC2)
Stadium IV
Tumor infiltrerer blære og eller tarmslimhinner og eller fjernmetastaser
Stadium IVA: Infiltrasjon i blære eller tarmslimhinner
Stadium IVB: Fjernmetastaser inkludert intraabdominale metastaser og/eller metastaser til inguinale lymfeknuter
Behandling
Sist faglig oppdatert: 28202128.06.2021
Primærbehandling
Primærbehandling av endometriecancer er tilpasset stadium og risiko for tilbakefall.
Inklusjon i studier skal alltid tilstrebes der det er mulig.
Antatt stadium I/II
- Man anbefaler minimal invasiv kirurgi hos pasienter med endometriecancer (Galaal et al., 2012; Janda et al., 2017; Walker et al., 2009).
- Total laparoskopisk hysterektomi (TLH) og bilateral salpingo-ooforektomi (BSO) for lavrisiko-pasienter, evt med vaktpostlymfeknute.
- TLH, BSO og glandelevaluering for mellom- og høyrisiko-pasienter.
- Vaktpostlymfeknute-teknikk (SLN) sidestilles med lymfeglandeltoilette (se kapittelet om vaktpostlymfeknuteteknikk).
- Vaginal hysterektomi med BSO kan vurderes hos pasienter hvor anbefalt prosedyre (over) ikke kan gjennomføres pga komorbiditet, og hos selekterte pasienter med lavrisiko endometriecancer.
- Man kan vurdere å la ovariene stå igjen hos pasienter < 45 år med grad 1 endometroid adenocarcinom stadium 1A uten opplagt ovarial eller ekstrauterin sykdom. Tubene bør fjernes.
- Man anbefaler ikke å la ovariene stå igjen hos pasienter med familiehistorie som gir økt risiko for ovarial cancer (BRCA mutasjon, Lynch syndrom etc.).
- Omentreseksjon anbefales ved høyrisiko EC dersom det ikke foreligger kontraindikasjoner.
- Prøve til cytologi av bukskyllevæske kan tas ved operasjonens start.
- Hos kvinner som ikke vil tåle adjuvant behandling, slik at staging ikke anses som relevant, eller hvor det kirurgiske inngrepet skal være så skånsomt som mulig, kan individuell vurdering mtp å avstå fra fjerning av lymfeknuter og omentektomi gjøres. Disse pasientene kan, etter å ha vært diskutert ved regionalt MDT møte, eventuelt opereres ved lokalsykehus med total laparoskopisk hysterektomi og bilateral salpingo-ooforektomi.
- Hos kvinner som ikke antas å tåle kirurgi, kan strålebehandling eller hormonbehandling vurderes.
- For fertilitetsbevarende behandling, se kapittelet om vulvar intraepitelial neoplasi (VIN).
Antatt stadium III/IV
Pasienter vurdert operable:
- Cytoreduktiv kirurgi med mål å fjerne all synlig sykdom, inkludert forstørrede glandler, dersom null restsykdom kan oppnås.
Pasienter vurdert inoperable primært:
Hos denne pasientgruppen kan man, etter diskusjon på tumormøte og med pasienten, tilby neoadjuvant kjemoterapi (i hovedsak i form av 3 kurer Carboplatin AUC5 + Paclitaxel 175 mg/m2) med påfølgende vurdering med billeddiagnostikk og diskusjon på tumormøte etter 3 kurer mtp forsinket primærkirurgi.
I enkelte tilfeller kan palliativ kirurgi utføres for å redusere plager og symptomer.
Restaging
Restaging gjøres kun hos pasienter hvor det vil ha betydning mtp beslutning vedrørende administrasjon av adjuvant behandling, eller inklusjon i studier. Det skal foreligge CT thorax/abdomen/bekken. Restaging i form av glandeltoilette (og omentektomi på indikasjon) med minimalinvasiv kirurgi anbefales.
Adjuvant behandling
Risikogrupper som veiledning for adjuvant behandling
| Risikogruppe |
|
|---|---|
| Lav risiko |
|
| Intermediær risiko |
|
| Høy risiko |
|
|
|
|
|
| |
|
| |
|
| |
Adjuvant behandling gis til pasienter i høyrisiko-gruppen samt pasienter med >st I. Adjuvant behandling vil vanligvis være Carboplatin (AUC 5) og Paclitaxel 175 mg/m2. Dette gis hver 3. uke, totalt 6 sykluser. Det gjøres avsluttende evaluering etter 6 kurer. Adjuvant kjemoterapi er aktuell for høyrisikopasienter med følgende histologi: Endometrioid adenocarcinom st 1B, grad 3, serøs, klarcellet og karsinosarkomer (Johnson, Bryant, Miles, Hogberg, & Cornes, 2011) samt pasienter med ekstrauterin spredning (Miller et al., 2020).
Adjuvant strålebehandling brukes i andre land for å motvirke bekkenresidiv, men effekten på overlevelse for stadium I er ikke dokumentert (Creutzberg et al., 2000; Kong, Johnson, Kitchener, & Lawrie, 2012; Aalders, Abeler, Kolstad, & Onsrud, 1980). Det er signifikant toksisitet forbundet med strålebehandling. Vi anbefaler derfor ikke adjuvant strålebehandling som rutine.
Hos kvinner med stadium II, og knapp margin, kan adjuvant strålebehandling vurderes (Harkenrider et al., 2018).
Individuelle vurderinger gjøres hos pasienter hvor adjuvant kjemoterapi ikke kan administreres, eller hvor det er behov for kombinasjonsbehandling (se adjuvant kjemoterapi).
Adjuvant behandling med progestagener har ikke dokumentert effekt (Martin-Hirsch, Bryant, Keep, Kitchener, & Lilford, 2011; Vergote, Kjørstad, Abeler, & Kolstad, 1989).
Som nevnt i avsnittet "Antatt stadium III/IV" over, kan neoadjuvant kjemoterapi (NACT) etterfulgt av kirurgi eller supplerende stråleterapi vurderes i hvert enkelt tilfelle hvor pasienten ikke er vurdert operabel primært. Påfølgende kirurgi, stråleterapi eller videre kjemoterapi avhenger av respons på NACT og på sykdomsbildet. Individuelle vurderinger gjøres.
Palliativ strålebehandling er aktuelt ved blødning hos pasienter som ikke er kandidater for kirurgi.
Ved hormonreseptorpositive tumorer kan hormonbehandling være aktuelt hos denne pasientgruppen.
Komplikasjoner
Sist faglig oppdatert: 28202128.06.2021
Peroperative
- Blødning: Skade på store kar (spesielt ved lymfeknutefjerning); diffus blødning (Creutzberg et al., 2000) (A)
- Blære-/tarm-skade
- Allergisk reaksjon på tracer (brukt ved SLN)
- Anestesikomplikasjoner
Postoperative
- Hematom
- Infeksjon, overfladisk og dyp (antibiotikaprofylakse gis peroperativt)
- Tromboemboliske. Alle skal ha tromboseprofylakse
- Blæreparese, spesielt ved utvidet hysterektomi (nerveskade)
- Lymfødem etter lymfeknutetoilette i 5–40 %
- Lymfecyster på bekkenveggen
- Brokk
- Vaginaltopp dehiscence
- Fisteldannelse
Vaktpostlymfeknuteteknikk
Sist faglig oppdatert: 28202128.06.2021
Fjerning av lymfeknuter for stadieinndeling vurderes tradisjonelt i henhold til risikogrupper (Chan et al., 2006; K. May, Bryant, Dickinson, Kehoe, & Morrison, 2010). (se også punktet "Utredningen skal kartlegge", kapittel Bildediagnostikk).
Lymfadenektomi har ikke vist økt overlevelse (ASTEC study group et al., 2009; Benedetti Panici et al., 2008). Vaktpostlymfeknuteteknikk (Sentinel node, SLN) har vist høy sensitivitet og spesifisitet mtp å detektere lymfeknutemetastaser hos kvinner med endometriecancer for alle risikogrupper (Ballester et al., 2011; Cusimano et al., 2021; Hagen et al., 2016; Rossi et al., 2017), og er sidestilt med lymfadenektomi mtp staging. Eksisjon av forstørrede lymfeknuter (over 1 cm) i bekkenet og paraaortalt skal foretas (Creasman et al., 1987).
I helseregioner hvor SLN teknikk er innført skal pasienter henvises til sykehus med regionalt ansvar for behandling av gynekologisk kreft, med mindre regionale retningslinjer tilsier annen pasientflyt.
SLN prosedyre
Ved SLN prosedyre må en etablert SLN algoritme følges (Barlin et al., 2012). Indocyaneen green (ICG) er gullstandard for SLN ved minimal invasiv kirurgi.
ICG 1.25 mg/ml, dvs 25 mg ICG pulver fortynnes i 20 ml sterilt vann. Fire ml ICG-blanding injiseres i cervix; 0.5–1 ml dypt i stroma og 0.5–1 ml submucosalt kl 3 og 9 før applikasjon av vaginal-rør. Sakte injeksjon.
Hos pasienter hvor SLN og patologisk ultrastaging er gjennomført regnes følgende som positive lymfeknuter (st IIIC):
- Makrometastaser (>2.0 mm) og micrometastaser (<0.2 mm – 2.0 mm).
- Isolerte tumor celler (ITCs) regnes ikke som metastatisk sykdom da det ikke er konsensus internasjonalt mtp behov/indikasjon for adjuvant behandling (Bogani, Mariani, Paolini, Ditto, & Raspagliesi, 2019; Gómez-Hidalgo et al., 2020; Plante et al., 2017).
Pasientinformasjon
Sist faglig oppdatert: 28202128.06.2021
Preoperativ informasjon bør omfatte
- Funn som er gjort (ved vevsprøver og andre preoperative undersøkelser)
- Plan for videre behandling; planlagt inngrep (operasjonssnitt) med presisering av hvilke organer som skal fjernes (livmor, eggledere, eggstokker, eventuelt oment, lymfeknuter), muligheten for utvidelse av inngrepet utover det planlagte dersom sykdomsutbredelsen tilsier dette (f.eks. konvertering til laparotomi, tarmoperasjon, utlagt tarm)
- Komplikasjoner til inngrepet (se "Komplikasjoner")
- Man bør også opplyse om forhold knyttet til den postoperative fasen, som behov for innlagt blærekateter, intravenøs væsketilførsel, samt antatt liggetid i avdelingen og behov for sykemelding.
Postoperativ informasjon bør omfatte
- Forløp av og funn gjort ved primæroperasjonen
- Plan for videre behandling dersom dette er aktuelt, samt planlagt oppfølging når histologisk svar foreligger
- Fordeler og ulemper og dokumentasjonsgrunnlaget for ev. tilleggsbehandling bør særlig diskuteres med pasienter der det kan være tvil om indikasjonen
- Aktuelle studier for inklusjon av pasienten
- Forholdsregler vedrørende karbad, samleie og fysisk aktivitet. Forholdsregler for å forebygge utvikling av lymfødem dersom pasienten har fått utført lymfadenektomi, samt informasjon om nytte av fysioterapi/lymfødembehandling ved lymfødem.
Organisering av behandling
Høy- og mellomrisikopasienter i antatt FIGO stadium I og alle pasienter med FIGO stadium >I skal henvises til avdeling med spesialkompetanse innen behandling av gynekologisk kreft. I regioner som tilbyr vaktpostlymfeknuteteknikk skal alle risikogrupper henvises til avdeling med spesialkompetanse innen behandling av gynekologisk kreft, med mindre regionale retningslinjer tilsier annen pasientflyt (Helsedirektoratet, 2017).
Oppfølging og kontroller etter primærbehandling
Sist faglig oppdatert: 28202128.06.2021
Kontroller og prøvetaking
Gevinsten av skjematiske rutinekontroller etter behandling for endometriecancer er dårlig dokumentert (Schmeler et al., 2006). Det er vist at rutinekontroller i liten grad fanger opp asymptomatiske residiv (Salvesen, Akslen, Iversen, & Iversen, 1997) (C). Det er liten evidens for verdien av dagens oppfølgningsrutiner, og det pågår for tiden en studie ved 10 norske sykehus som skal se nærmere på dette (The Lifestyle and Empowerment Techniques in Survivorship of Gynecologic Oncology Study (LETSGO), 2019-2030).
Det anbefales individuelt tilpasset oppfølging der hensynet til pasientens livskvalitet vektlegges (Fung-Kee-Fung et al., 2006) (C), særlig der residiv ikke kan ha et kurativt siktemål.
Kvinnene bør, uavhengig av kontrollopplegg, informeres om å ta kontakt med lege ved blødning i intervallene mellom kontrollene.
Rutinekontroller kan i samråd med pasienten gjennomføres hos fastlege, gynekolog eller spesialavdeling.
Grupper som utfra tidligere behandling, alder og allmenntilstand potensielt kan tilbys kurativ behandling ved et lokalt residiv, bør kontrolleres av gynekolog.
Veiledende kontrollintervall inntil nye retningslinjer foreligger:
1. og 2. år: 3–4 kontroller årlig
3. til 5. år: hver 6 mnd
Kontrollen består av klinisk undersøkelse, inkludert gynekologisk undersøkelse med UL. Klinisk undersøkelse kan suppleres med CT og MR bekken på indikasjon.
Ved mistanke om residiv tas biopsi.
Postoperativ hormonsubstitusjon
Peroral hormonsubstitusjon er omdiskutert, men med lite dokumentasjonsgrunnlag.
Det er ikke vist at risikoen for residiv eller total overlevelse påvirkes av hormonsubstitusjon etter behandling for endometriecancer (R. R. Barakat, Bundy, Spirtos, Bell, & Mannel, 2006; Di Donato et al., 2020).
For kvinner radikalt behandlet for endometriecancer Stadium I med klimakterielle plager bør hormonsubstitusjon vurderes.
Det er ikke dokumentert at man bør vente et visst tidsrom etter avsluttet behandling før hormoner gis.
Det er ikke vist at bruk av kombinasjonen østrogen-gestagen har noen fordeler sammenliknet med bruk av bare østrogen.
Det er mindre motforestillinger mot lokal behandling med østriol, da det gjennom godt østrogeniserte slimhinner er minimal absorbsjon av medikamentet (Crean-Tate, Faubion, Pederson, Vencill, & Batur, 2020)
Behandling av tilbakefall (residivbehandling)
Sist faglig oppdatert: 11202311.04.2023
Før oppstart av behandling skal residiv verifiseres histologisk med biopsi.
Det skal klargjøres om behandlingen har kurativ, livsforlengende eller palliativ intensjon (T. D. Moore, Phillips, Nerenstone, & Cheson, 1991).
Inklusjon i studier skal alltid etterstrebes hvis mulig.
Kirurgi
Kirurgi vurderes for selekterte pasienter.
Bekkeneksenterasjon kan være aktuelt ved isolert lokalt, sentralt residiv i tidligere strålebehandlet område dersom fri margin kan oppnås.
Kirurgi vurderes ved solitær hjerne-, lunge-, og levermetastase, eller ved residiv i lymfeknuter.
Aktuell palliativ kirurgi:
- Avlastende stomi fra urinveier / tarmsystemet
- Ved truende fraktur
Strålebehandling
Strålebehandling med kurativ intensjon er indisert hos pasienter som har et isolert vaginalt residiv etter kirurgi. Strålebehandling er også indisert for palliasjon av symptomer relatert til lokale residiv og systemisk sykdom.
Medikamentell behandling
Hormonbehandling
Biopsi av residivsvulst bør gjøres da det kan være forskjell i hormonreseptorstatus i primær og residiv svulst. Grad 1 eller 2 endometroide svulster har størst sannsynlighet for å være reseptor positive, og har følgelig størst sannsynlighet for behandlingsrespons. Behandlingen kan pågå til progresjon. Det er få bivirkninger (Jerzak, Duska, & MacKay, 2019).
Man kan oppnå ca samme responsrate med endokrin behandling som med kjemoterapi ved ER/PR positivitet.
- Megace: Eneste gestagen på markedet i Norge godkjent for cancerbehandling (Megace, Megestrolacetat, 160 mg x1).
- Provera, Medroxyprogesteron, 200 mg x1.
Aromatasehemmer
- Femar, Letrozole, 2.5 mg x1
- Aromasin, Eksemestan, 25 mg x1
Kjemoterapi
Gevinst av behandling med kjemoterapi utover førstelinje er usikker (Amant et al., 2005). For andrelinje behandling kjemoterapi foreligger ingen etablert klinisk standard for behandling. Ved residiv er platinumbaserte regimer, antracykliner og taxaner mest vanlig brukt alene eller i kombinasjoner (Colombo et al., 2013). Tumorrespons er godt dokumentert og gir lengre tid til progresjon, men det er usikker effekt på overlevelse. Studiene viser betydelig toksisitet. Hensynet til pasientens allmenntilstand og livskvalitet må derfor veie tungt (Vale, Tierney, Bull, & Symonds, 2012).
Kombinasjonsbehandling:
Carboplatin + Paclitaxel x 6 er førstevalg.
Doxorubicin + Cisplatin har vist høyere responsrate og PFS enn Doxorubicin singel (Thigpen et al., 2004), således kan Doxorubicin + Cisplatin eller Carboplatin gis til pasienter som vil tåle dublett-behandling, hvor Taxol er kontraindisert.
Enkeltstoffer:
Enkeltstoff har responsrate på 15–40 %.
Enkeltstoff gis til pasienter med recidiv som oppstår <6 mnd etter avsluttet primærbehandling, eller som ikke tåler kombinasjonsbehandling. De mest brukte stoffene er:
Doxorubicin, Epirubicin, Paclitaxel, Carboplatin, Cisplatin
Persontilpasset behandling
I Norge i dag er det ikke tilbud om persontilpasset behandling av kvinner med endometriecancer.
Hos kvinner med serøs corpuscancer og overekspresjon av HER2/neu er det demonstrert at Herceptin/Trastuzumab i tillegg til Carboplatin og Paclitaxel gir økt overlevelse, både ved recidiv og ved metastatisk sykdom i første linje (stadium III og IV) (Fader et al., 2020).
Keynote 158-studien viste lovende responsrate og sykdomskontroll ved behandling med Pembrolizumab hos kvinner med MSI-H tumores og tilbakefall etter tidligere behandling av EC (Marabelle, Le, et al., 2020).
Kombinasjon av Lenvatinib (tyrosinkinasehemmer) og Pembrolizumab (PD-1 hemmer) har vist klinisk signifikant responsrate hos kvinner med tilbakefall av corpuscancer uavhengig av MSI-status (Makker et al., 2019).
Dostarlimab (PD-1 hemmer) har i en fase 1 studie vist responsrate hos 42 % av kvinner med avansert corpuscancer (stadium III, IV) eller tilbakefall, med deficient mismatch mutation repair mechanism (dMMR) (Oaknin et al., 2020).
Det ble gjort en beslutning i Nye metoder 23. januar 2023 som sier at Dostarlimab (Jemperli) innføres som monoterapi til behandling av voksne pasienter med tilbakevennende eller fremskreden dMMR/MSI-H endometriekreft som har utviklet seg under eller etter tidligere behandling med platinaholdig regime.
ENGOT-EN3/NSGO-PALEO, en fase-II-studie, viste at Palbociclib (CDK4/6 hemmer) i tillegg til Letrozol gav økt PFS og sykdomskontroll enn Letrozol pluss placebo, hos kvinner med østrogenreseptor-positiv, residiverende eller avansert (stadium IV) EC (Moehler et al., 2020).
Kvinner kan henvises til ekspertpanelet for vurdering av ovennevnte behandling.
Organisering av behandling
Behandling av metastaserende og residiverende sykdom bør konsulteres med avdeling med spesialkompetanse innen behandling av gynekologisk kreft.
Fertilitetsbevarende behandling
Endometriecancer hos fertile kvinner er sjeldent. Bare 4 % av pasienter med endometriecancer er under 40 år (Duska et al., 2001). Yngre og premenopausale kvinner med endometriecancer har en bedre prognose enn eldre fordi de oftere blir diagnostisert med tidlig stadium og lavgradig sykdom (Duska et al., 2001).
Konservativ behandling av endometriecancer er basert på medisinsk behandling med progesteron. Det aller viktigste for å kunne vurdere konservativ behandling ved endometriecancer er klinisk og patologisk tumorkarakterstikk samt velge riktig medisinsk behandling.
Indikasjoner for fertilitetsbevarende behandling:
- Endometroid adenokarsinom grad 1. Re-gransket av gynonkologisk patolog.
- Sykdom begrenset til endometriet.
- Ingen infiltrasjon i myometriet på MR
- Ingen tegn til ekstrauterin spredning
- Alder 40 år, relativ indikasjon.
- Sterkt ønske om å bevare fertilitet.
- Ingen kontraindikasjon for medisinsk behandling med progesteron
- Informert samtykke med en forståelse at dette ikke er standard behandling og gir høyere residiv risiko.
- Pasienten skal henvises gyn-onkologisk avdeling.
Det anbefales fraksjonert abrasio fremfor endometriebiopsi for bedre bedømmelse av tumorgrad (Leitao et al., 2009). MR tas for å bedømme infiltrasjon i myometriet samt vurdere adenex og bekkenglandler. Pasienten må akseptere tett oppfølging under behandlingen. Det må informeres om at det anbefales senere hysterektomi etter evt svangerskap eller ved behandlings svikt.
Behandling
- Megestrol acetat (MA) 160–320 mg/dag (Evans-Metcalf, Brooks, Reale, & Baker, 1998). (Megace).
- Hormonspiral (Minig et al., 2011).
Behandlingsvarighet: 6 mdr før ny kontroll med fraksjonert abrasio og gynekologisk undersøkelse.
Responsrate ved konservativ behandling av endometriekarsinom er ca 75 % (Gallos et al., 2012; J. Y. Park et al., 2013).
Residivfrekvens er 30–40 % (J. Y. Park et al., 2013).
Standard behandling med hysterektomi bør utføres hos de som ikke responderer på behandlingen. Kontinuerer ytterligere 6 mdr med progesteron hos de med respons som ønsker å utsette evt graviditet (Rodolakis et al., 2015).
Selv om progesteron reseptor status kan predikere behandlingsrespons, er det ikke nødvendig med rutine progesteron status da 50 % av progesteron negative pasienter også responderer på progesteron behandling (Yamazawa et al., 2007).
Graviditet er assosiert med redusert risiko for endometriecancerresidiv. Ved behandlingsrespons etter 6 mdr behandling med progesteron anbefales å forsøke å bli gravid raskt evt. henvise til infertilitetsbehandling.
Det anbefales hysterektomi og BSOE etter graviditet. Å evt beholde eggstokker kan vurderes i hvert enkelt tilfelle, avhengig av pasientens alder og genetiske risikofaktorer.
Genetikk
Sist faglig oppdatert: 28202128.06.2021
Arvelig endometriecancer er en del av Lynch syndrom (LS). Syndromet gir nedarvet økt risiko for hovedsaklig colorectal- og endometriecancer, men også for prostatacancer, ovarialcancer, cancer i øvre urinveier og øvrige gastrointestinaltractus.
LS er en autosomal dominant nedarvet tilstand som er forårsaket av germline mutasjon i ett av flere DNA mismatch reparasjonsgener (MLH1, MSH2, MSH6 og PMS2) og EPCAM (Barrow et al., 2009; Dowty et al., 2013; Koornstra et al., 2009).
Livstidsrisiko: for EC varierer fra 43–57 %., og risiko varierer mellom de ulike gener (Møller et al., 2018).
Gjennomsnittsalder: 46–54 år (Larsen, 2018; Møller et al., 2018; Aaltonen, Johns, Järvinen, Mecklin, & Houlston, 2007), gjennomsnittlig debut alder er 50 år.
Kvinner med LS har 40–60 % sjanse for å debutere med EC som første kliniske manifestasjon. Ved å tilby rutinemessig analyse av svulstvev fra endometriecancere, vil dette øke deteksjon av LS, noe som er hensiktsmessig for å fremme tidlig deteksjon, screening og forebygging av andre LS-assosierte kreftformer. Kontrollopplegg vil ta sikte på å enten hindre kolorectalcancer (CRC) eller oppdage det tidlig. Dødeligheten av CRC er høyere enn ved EC (Banno et al., 2009; Bonadona et al., 2011; Wang et al., 2013).
Tumor screening anbefales av alle EC for å identifisere pasienter med LS (Crosbie et al., 2019; Genetic/Familial High-Risk Assessment: Colorectal. [NCCN Guideline]. Version 1, 2020). Kombinert MSI-, metylering- og IHC-analyse er nyttig, for enkelte bærere har en MSI-positiv tumor uten IHC-defekt (Hampel et al., 2007; Mills et al., 2014).
Diagnostisk gentest
Alle med EC kan tilbys diagnostisk gentest av DNA mismatch reparasjonsgener (MLH1, MSH2, MSH6, PMS2 og EPCAM) i forbindelse med behandling. Omlag 25 % av LS mutasjonsbærere debuterte med EC i alderen> 60 år, og ved aldersgrense for genetisk testing på 50 år vil bare 25–40 % av tilfellene bli fanget opp (Goodfellow et al., 2015).Kriterier for genetisk utredning ved EC i familien
- 1 familiemedlem med EC eller CRC ≤ 50 år
- 2 familiemedlemmer med EC uansett alder
- 1 kvinne med både EC og CRC uansett alder
- 1 kvinne med EC som har minst 1 førstegradsslektning
(foreldre, søsken eller barn) med CRC - Påvist mikrosatelittinstabilitet (MSI) eller unormal immunhistokjemi (IHC) etter undersøkelse av svulstvev
- IH/MSI bør utføres rutinemessig i forbindelse med behandling av alle EC uavhengig av alder og histologisk subtype. Pasienten informeres av behandlende lege om at analysen kan avdekke arvelig årsak.
- Kombinert MSI-, metylering- og IHC-analyse kan vise seg nyttig, da noen bærere kan ha en MSI-positiv tumor uten IHC-defekt (Weiderpass et al., 1999).
- Ved påvist MSI skal BRAF V600E og/eller MLH1 promoter hypermetylering være utelukket
- I tilfeller der affisert slektning ikke er tilgjengelig, kan friske familiemedlemmer vurderes testet prediktivt etter genetisk veiledning.
Kontrollopplegg ved påvist mutasjon
Nytte av screening for endometrie cancer er dokumentert for tidlig diagnose, men ikke for overlevelse (Schmeler et al., 2006; Walker et al., 2009).
Årlig gynekologisk undersøkelse fra 35 årsalder (Colombo et al., 2016).
- Vaginal ultralydundersøkelse av endometriets tykkelse og av ovarier.
- Endometriebiopsi på indikasjon eller ved usikre funn (Pecorelli, 2009)
- CA125, HE4, CEA
Urin stix (hematuri) hos fastlege årlig fra 30 års alder.
Koloskopi hvert annet år fra 25 år. Ved påvist adenomatøs polypp, ny kontroll etter ett år. Viser for øvrig til Handlingsprogram tykk- og endetarmskreft kapittel Fastlegens arbeid og ansvar ved tykk- og endetarmskreft.
Risikoreduserende tiltak
Gestagen spiral synes å reduserer risiko for endometriecancer, særlig type I tumor. Ved alder > 35 år er dette anbefalt i høyrisiko-gruppen, men er ikke dokumentert (Colombo et al., 2016; Fu & Zhuang, 2014).
P-pille er vist å minske risiko for EC, men er ikke dokumentert i høyrisiko gruppen (Combination oral contraceptive use and the risk of endometrial cancer. The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development, 1987).
Hysterektomi, bilateral salpingektomi evt med bilateral oophorectomi kan vurdereres ved 45–50 års alder, avhengig av familiehistorie/type mutasjon. Beslutning tas av pasienten i samråd med gynekolog/genetiker.
Andre sjeldne genetiske tilstander med økt risiko for endometriecancer
Cowden syndrom: EC kan også skyldes genfeil i PTEN (Cowden syndrom).
Det er få data angående dette sjeldne syndromet; tilgjengelige studier rapporterer en livstidsrisiko for EC fra 13–28 % (Heald et al., 2010; Pilarski, Stephens, Noss, Fisher, & Prior, 2011).
Sjeldne svulster
Sist faglig oppdatert: 28202128.06.2021
Uterine sarkomer, se eget kapittel i Nasjonal veileder i Gynekologisk Onkologi (Uterussarkom 2009); http://www.legeforeningen.no.
Palliativ behandling – Nasjonalt handlingsprogram
Helsedirektoratet har utgitt Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen (Helsedirektoratet, 2019) med anbefalinger om palliativ behandling for kreftpasienter.
Endometriehyperplasi
Bakgrunn
Sist faglig oppdatert: 28202128.06.2021
ICD-10
| N85.0 | Glandulær hyperplasi i endometrium (tilsvarer simpel hyperplasi) |
| N85.1 | Adenomatøs hyperplasi i endometrium |
| D07.0 | Carcinoma in situ (preinvasivt carcinom) i endometrium |
Definisjon
Sist faglig oppdatert: 28202128.06.2021
Endometriehyperplasi er overvekst av endometrieslimhinne og representerer en heterogen gruppe av morfologiske forandringer som dekker hele spekteret mellom proliferativt endometrium og høyt differensiert carcinom (R. J. Kurman, Kaminski, & Norris, 1985).
WHO klassifikasjon/histologisk klassifisering
I WHO 2014 klassifiseringen inndeles hyperplasiene i to kategorier:
- Endometriehyperplasi (EH)
- Endometrial intraepitelial neoplasi (EIN)/Kompleks atypisk hyperplasi
Endometriehyperplasi defineres her som benign lesjon med svært lav risiko for malign utvikling. EIN defineres som premalign lesjon med endret cytologi i kjertelcellene og endret vevsarkitektur som tydelig skiller seg fra omkringliggende vev. Forandringen må være av en viss størrelse.
Klassifiseringen utføres lysmikroskopisk. Kategori 1 er forbundet med svært lav sannsynlighet for kreftutvikling. Kategori 2 har vist høy sannsynlighet for kreftutvikling eller ko-eksisterende kreft (opptil 60 %) (R.J. Kurman, Carcangiu, Herrington, & Young, 2014; Owings & Quick, 2014; Trimble et al., 2006; Ørbo et al., 2008; Ørbo et al., 2000).
WHO 2014 avløser WHO 1994 klassifikasjonen som tidligere har vært regnet som gullstandard. Her deles hyperplasier inn i fire ulike kategorier (R.J. Kurman et al., 2014; R. J. Kurman et al., 1985).
- Simpel hyperplasi
- Kompleks hyperplasi uten atypi
- Simpel atypisk hyperplasi
- Kompleks atypisk hyperplasi
Kategoriene 1 og 2 regnes i henhold til 2014 klassifikasjonen som kategori 1. Kategoriene 3 og 4 regnes til kategori 2 i den nyeste klassifiseringen.
Studier har vist at disse histologiske klassifikasjonssystemene har hatt lav reproduserbarhet blant patologer (Bergeron et al., 1999; Kendall et al., 1998; Zaino et al., 2006).
D-score-metoden
Flere laboratorier benytter D-score-metoden som beslutningsstøtte for risikovurdering og terapianbefaling i tillegg til WHO klassifikasjonen (Baak et al., 2005; Baak, Nauta, Wisse-Brekelmans, & Bezemer, 1988; Baak, Wisse-Brekelmans, Fleege, van der Putten, & Bezemer, 1992; Baak et al., 2001; Dunton et al., 1996; Mutter, 2002; Mutter et al., 2000; Mutter et al., 2001; Vereide, Arnes, Straume, Maltau, & Ørbo, 2003; Ørbo, Vereide, Arnes, Pettersen, & Straume, 2014).
D-score-metoden er en matematisk/statistisk beregning av risiko for kreftutvikling som er basert på objektive morfometriske målinger på histologiske snitt. Ved hjelp av et stort antall mikroskopisk målte vevsparametere (volum prosent stroma, kjernediameter, overflatetetthet av kjertler) beregnes en risiko-score for malign utvikling hos den enkelte pasient ved hjelp av et spesialtilpasset dataprogram. Risikovurdering ved hjelp av D-score har en inndeling i tre ulike kategorier:
| D > 1: | Pasienten har lav risiko for kreftutvikling. |
| D 0–1: | Pasienten har lett økt risiko for kreftutvikling. |
| D < 0: | Pasienten har høy risiko for kreftutvikling (ca 60 %) samt risiko for ko-eksisterende cancer (>40 %) (Garuti, Mirra, & Luerti, 2006; Trimble et al., 2006). |
For alle praktiske formål kan D-score deles i D>0 og D<0.
Hyperplasi med D-score < 0 tilsvarer EIN (Hecht et al., 2005; Mutter, 2002; Mutter et al., 2000; Mutter et al., 2001; Mutter, Zaino, Baak, Bentley, & Robboy, 2007).
Klassifiseringen er objektiv og har vist seg å ha god reproduserbarhet. Metoden er velegnet som grunnlag for terapianbefalinger (Baak et al., 2005; Baak et al., 1988; Baak et al., 1992; Baak et al., 2001; Mutter, 2002; Mutter et al., 2000; Mutter et al., 2001; Vereide et al., 2003; Ørbo et al., 2008; Ørbo et al., 2000; Ørbo et al., 2014). Tabell 1 viser sammenhengen mellom WHO2014 og D-score.
| WHO 2014 | D-score |
|---|---|
| Endometriehyperplasi | D-score ≥ 0 |
| Endometrial intraepitelial neoplasi, EIN | D-score < 0 |
Endometriepolypper
Sist faglig oppdatert: 28202128.06.2021
Polypper som utgår fra endometriet kan variere i størrelse, de beskrives gjerne som bredbasede eller stilkete. De kan være solitære eller multiple. Forekomsten av endometriepolypper varierer mellom 10 og 40 % hos kvinner med blødningforstyrrelser og i opptil 12 % hos kvinner uten symptomer (Anastasiadis et al., 2000; Lieng et al., 2007).
Hyperplasilignende forandringer forekommer ofte i polypper.
Endometriepolypper med hyperplasi (hyperplastiske polypper) kan mest sannsynlig vurderes på samme måte som endometriehyperplasi uten polyppforandringer. Morfologiske forandringer i hyperplastiske polypper svarer til de man finner i hyperplasier i ikke polyppøst endometrium. Diagnostikk i henhold til WHO klassifikasjon og D-score kan derfor benyttes på hyperplastiske polypper. Det finnes imidlertid foreløpig ingen studier som med sikkerhet viser at hyperplastiske polypper har patogenese/ klinisk forløp som tilsvarer hyperplasi i endometriet forøvrig. Oppfølgingsstudier pågår.
Forekomst
Sist faglig oppdatert: 28202128.06.2021
Det finnes ingen fullstendig nasjonal registrering av endometriehyperplasier i Norge. Med mer enn 750 tilfeller av endometriecancer per år anslår man antallet hyperplasier til mellom 3000 og 4000. Optimal diagnostikk og korrekt behandling av forstadier må derfor ansees å være av stor betydning. De fleste hyperplasier forekommer hos peri-og postmenopausale kvinner, men kan forekomme i alle aldersgrupper (Crissman, Azoury, Barnes, & Schellhas, 1981).
Risikofaktorer
Sist faglig oppdatert: 28202128.06.2021
- HRT (Bjarnason, Cerin, Lindgren, & Weber, 1999; Furness, Roberts, Marjoribanks, & Lethaby, 2012; Grady, Gebretsadik, Kerlikowske, Ernster, & Petitti, 1995; Persson, Weiderpass, Bergkvist, Bergström, & Schairer, 1999)
- Tamoxifen (Cohen, 2004; Fisher et al., 1994; Neri & Maggino, 2009)
- Overvekt (Fader, Arriba, Frasure, & von Gruenigen, 2009; Kaaks, Lukanova, & Kurzer, 2002)
- Anovulasjon (Tingthanatikul, Choktanasiri, Rochanawutanon, & Weerakeit, 2006)
- Østrogenproduserende svulster (Zanagnolo, Pasinetti, & Sartori, 2004)
- PCO (Chittenden, Fullerton, Maheshwari, & Bhattacharya, 2009; Fearnley et al., 2010)
- Lynch (Buchanan, Rosty, Clendenning, Spurdle, & Win, 2014; Mork et al., 2017)
Det finnes svært få studier som vurderer effekten av profylakse mot endometriehyperplasi, men forebyggende tiltak kan være aktuelt hos kvinner med særskilte risikofaktorer som f.eks. betydelig adipositas eller kronisk anovulasjon. Hormonspiral kan vurderes (Linkov et al., 2008).
Diagnostikk
Sist faglig oppdatert: 28202128.06.2021
Symptomer
Endometriehyperplasi har ingen spesifikke symptomer, men gir som oftest blødningsforstyrrelser.
- Postmenopausal blødning
- Menometrorrhagi (L. M. Bachmann, ter Riet, Clark, Gupta, & Khan, 2003; Vakiani et al., 1996)
- Krever individuell vurdering
Undersøkelser
- Vaginal ultralydundersøkelse.
- Det er ingen absolutt endometrietykkelse som garanterer fravær av hyperplasi og cancer, men sannsynligvis lav risiko ved tykkelse under 4 mm og jevnt avgrenset endometrium (Gull, Karlsson, Milsom, & Granberg, 2003).
- Histologisk prøve fra endometriet.
- Endometriebiopsi/aspirasjon kan brukes primært (Dijkhuizen, Mol, Brolmann, & Heintz, 2000)
- Fraksjonert abrasio anbefales (eventuelt med tillegg av hysteroskopi) ved ikke avklart diagnose (Committee on Gynecologic Practice, Society of Gynecologic Oncology,, 2015). Transcervical reseksjon (TCR) er ikke egnet som diagnostisk metode for endometriehyperplasi grunnet varmeskade som endrer både enkeltceller og vevsarkitektur.
- Vurdere videre utredning ved mistanke om hormonproduserende tumor (mistenkes ved histologisk funn av hyperplastisk endometrium hos langvarig postmenopausale kvinner som ikke bruker hormonsubstitusjon).
Differensialdiagnoser ved histologisk undersøkelse
Sist faglig oppdatert: 28202128.06.2021
Ved histologisk undersøkelse kan de under nevnte tilstander forveksles med endometriehyperplasi:
- Endometriecarcinom
- Sekretoriske forandringer
- Endometrium med lettere grad av hormonforstyrrelse
- Graviditetsforandringer
- Basale lag av endometriet
Tiltak/behandling
Sist faglig oppdatert: 28202128.06.2021
Hyperplasi med lav risiko for kreftutvikling
Pasienter med lav risiko for kreftutvikling kan behandles konservativt.
| WHO-2014 klassifikasjon | D-score |
|---|---|
| Endometriehyperplasi | D-score ≥ 0 |
Konservativ behandling med progestin
Det finnes ikke entydige retningslinjer i litteraturen med henblikk på dose, varighet og type av progestin og ulike regimer er fortsatt i bruk. I de senere årene er det kommer flere populasjonsbaserte studier som viser god effekt av hormonspiral som behandling ved endometriehyperplasi (Gallos et al., 2010; Varma et al., 2008; Wildemeersch et al., 2007; Ørbo et al., 2008). Ved inneliggende hormonspiral er konsentrasjonen av progestin i endometriet vist å være 100 ganger høyere sammenlignet med den konsentrasjonen som er målt ved per oral behandling (Nilsson, Haukkamaa, Vierola, & Luukkainen, 1982). En nylig publisert nasjonal RCT viste 100 % respons hos alle som fikk hormonspiral, men bare 69 % respons hos de som fikk lavdosert per oral progestin syklisk. Av de som fikk kontinuerlig per oral progestinbehandling hadde 96 % respons (Ørbo et al., 2014).
- Eksempel på intrauterin behandling:
- Levonorgestrel hormonspiral. Behandlingen er vist å ha effekt etter 3-6 måneder, men ved god toleransen kan den med fordel kontinueres, særlig hos premenopausale kvinner med vedvarende risikofaktorer, da det er vist at mer enn 40 % får tilbakefall etter seponering (Ørbo, Arnes, Vereide, & Straume, 2016). Spiralen bør skiftes hvert femte år. Forandringene i endometriet er de samme som ved høye doser progestin per oralt (Perino, Quartararo, Catinella, Genova, & Cittadini, 1987; Scarselli et al., 1988; Vereide et al., 2003; Ørbo et al., 2014).
- Eksempel på syklisk per oral behandling:
- Medroksyprogesteronacetat 10 mg per os i 10-14 dager per syklus i 3–6 mnd. (Ferenczy & Gelfand, 1989).
- Eksempel på kontinuerlig per oral behandling:
- Medroksyprogesteronacetat 10 mg per os daglig 3-6 måned (Randall & Kurman, 1997).
- Medroksyprogesteronacetat 30 mg per os daglig 3-6 måneder (Ferenczy & Gelfand, 1989).
Hyperplasi med høy risiko for kreftutvikling
Pasienter med høy risiko for kreftutvikling behandles kirurgisk.
| WHO 2014 | D-score |
|---|---|
| Endometrial intraepitelial neoplasi, EIN | D-score < 0 |
På grunn av høy risiko for ko-eksisterende cancer bør disse pasientene utredes preoperativt som endometriecancer (Garuti et al., 2006; Trimble et al., 2006).
Disse pasientene inngår i pakkeforløp.
Kirurgisk behandling
- Hysterektomi eventuelt med bilateral salpingo-ooforektomi.
- Endometrieablatio/TCR-E er ikke anbefalt primærbehandling av hyperplasi. Slik behandling kan vanskeliggjøre adekvat oppfølging. Histologi etter slik behandling er ofte lite representativ pga. adheranser og tildekking av kjertelvev. Gjelder alle typer hyperplasi.
Dersom pasienten har kontraindikasjoner mot kirurgisk behandling eller ønsker bevaring av fertilitet, kan høye doser progestin unntaksvis benyttes ved de alvorligste hyperplasiene (EIN/ kompleks hyperplasi med atypi, D- score <0) under tett oppfølging i samarbeid med gynekologisk onkologisk senter (Baker, Pierce, Mills, Gehrig, & Duska, 2017; Randall & Kurman, 1997). Slik behandling kan være intrauterin (hormonspiral) eller per oral (f.eks. Megace 160 mg /dag) (Baker et al., 2017).
Forløp og prognose
Sist faglig oppdatert: 28202128.06.2021
Det naturlige forløp av endometriehyperplasier har vært lite kjent (R. J. Kurman et al., 1985). Dette skyldes blant annet at:
- Klassifiseringen varierer og at reproduserbarheten at blant patologer ikke er optimal (Zaino et al., 2006).
- Lesjonene fjernes helt eller delvis ved abrasio, hormonell og/eller kirurgisk behandling.
Nye studier viser at hyperplasi vil residivere i betydelig grad etter primær behandlingsrespons etter at behandlingen seponeres (Gallos, Ganesan, & Gupta, 2013; Gallos, Krishan, Shehmar, Ganesan, & Gupta, 2013; Ørbo et al., 2008; Ørbo et al., 2016). Kreftrisiko for de ulike gruppene av endometriehyperplasi er svært varierende i de ulike studier (2–50 %). De oppfølgingsstudiene som foreligger er ikke direkte sammenlignbare og oppfølging er kortvarig (R. J. Kurman et al., 1985).
I en nylig publisert RCT med 2 års oppfølging etter avsluttet behandling (n=153) fikk mer enn 40 % av kvinnene tilbakefall av hyperplasi under oppfølgingsperioden.
Tilbakefallsfrekvensen var uavhengig av om kvinnene hadde fått hormonspiral eller per oral progestin (Ørbo et al., 2016). De fleste residiverte i løpet av de første 2 år etter seponering av behandling.
En populasjonsbasert studie (n=57) fra UNN med mer enn 15 års oppfølging etter avsluttet behandling viste at mer enn 20 % fikk residiv av hyperplasi mens en pasient utviklet endometriecancer i løpet av oppfølgingstiden (Sletten et al., 2017).
Oppfølging
På bakgrunn av at det er påvist betydelig recidivfrekvens de 2 første årene etter behandling, anbefales kontroller i 2 år etter avsluttet progestinbehandling.
Her gir vi forslag til oppfølging ut fra eksisterende kunnskap om alvorlighetsgrad og residiv.
- Endometriehyperplasi (WHO 2014, type 1) og D-score ≥ 0 som responderer på progestinbehandling bør kontrolleres med histologisk prøve hver 6–12 måned i minst 2 år etter avsluttet behandling med normalisering av endometriet. Kontinuering av intrauterin progestin med hormonspiral bør overveies, særlig hos premenopausale kvinner med vedvarende risikofaktorer (Ørbo et al., 2016). Under pågående spiralbehandling ser risikoen for tilbakefall av endometriehyperplasi ut til å være svært lav (Ørbo et al., 2008). Det foreslås derfor at det ikke er nødvendig med rutinemessige kontroller av kvinner med inneliggende hormonspiral som er vellykket behandlet for sin endometriehyperplasi. Dette forutsetter normalisert histologi (ved minst to kontroller), tynt endometrium ved vaginal ultralyd og fravær av blødningsuregelmessigheter.
- Endometrial intraepitelial neoplasi, EIN (WHO 2014, type 2) og D-score < 0 som får konservativ behandling med progestiner, for eksempel ut fra ønske om bevart fertilitet, bør følges av lege med gynekologisk onkologisk kompetanse og med histologisk kontroll hver (3.–)6. måned. Kontroller etter normalisering individualiseres.
Ved persisterende hyperplasi bør behandling intensiveres ved øking av dose progestin eventuelt kirurgisk behandling.
Komplikasjoner
Sist faglig oppdatert: 28202128.06.2021
Per/postoperative
Se endometriecancer.
Bivirkning av progestinhormoner
Mest uttalt ved høye doser.
- Blødningsforstyrrelser
- Vektøkning, væskeretensjon
- Hodepine
- Kvalme, dyspepsi
- Mastalgi
- Hirsutisme, akne
- Svette, tremor, insomni, nedstemthet
- Kardiovaskulære komplikasjoner
Råd til primærlegen
Sist faglig oppdatert: 28202128.06.2021
Vevsprøve fra endometriet ved postmenopausal blødning, menometrorrhagi eller endret blødningsmønster peri-menopausalt. Vurdere langvarig intrauterin progestinbehandling som profylakse til risikogrupper eller som langtidsbehandling ved hyperplasi dersom pasienten tolererer dette.
Pasientinformasjon
Sist faglig oppdatert: 28202128.06.2021
- Informasjon bør omfatte:
- Funn som er gjort (Ultralyd, Histologisk prøve) og plan for videre behandling.
- Ved hormonell behandling:
- Informasjon om bivirkninger og opplegg for kontroll av behandlingseffekt
- Funn ved oppfølgingskontroll (histologisk prøve)
- Plan for videre behandling som f. eks fortsatt hormonterapi, utelukkende kontroll, eller (ved persistens/ forverring) operativ behandling
- Ved operativ behandling: pre- og postoperativ informasjon: se kapittel om endometriecancer.
Eggstokk-, eggleder- og bukhinnekreft (OC)
Sist faglig oppdatert: 28202128.06.2021
C56 | Ondartet svulst i eggstokk (Ca ovarii) Definisjon: Malign tumor som utgår fra overflateepitelet i ovariet. |
C57.0 | Egglederkreft (Ca tubae) Definisjon: Malign tumor som utgår fra tube (fimbrieenden 80 %) via ikke invasive karsinom (hos 60 %) «Serøst Tubart Intraepitelialt Carsinom» (STIC) til tubecancer. Nyere studier har vist at tubene er origo for en vesentlig andel av høygradig serøs eggstokkreft (Erickson et al., 2013; Kuhn et al., 2012; Sieh et al., 2013). |
C48.2 | Bukhinnekreft (Ca peritonei) Definisjon: Primært peritonealt karsinom kan ikke skilles mikroskopisk fra et epitelialt serøst karsinom i tube eller ovarium. Følgende kriterier må oppfylles:
Diagnosen kan kun stilles når pasienten opereres primært uten forutgående kjemoterapi, ettersom ovenstående kriterier ikke kan vurderes for pasienter som har fått kjemoterapi. |
Histopatologi
Sist faglig oppdatert: 28202128.06.2021
Anbefalt klassifikasjon i henhold til WHO 2014 (Kurman et al., 2014):
De epiteliale svulstene klassifiseres som serøs, mucinøs, endometrioid, klarcellet, seromucinøs og Brenner tumor der alle kategorier har benigne, borderline og maligne svulster.
Maligne epiteliale svulster
- Lavgradig og høygradig serøse karsinomer
- Mucinøst karsinom (ikke etablerte kriterier for gradering)
- Seromucinøst karsinom
- Endometrioid karsinom, grad 1–3
- Klarcellet karsinom (ikke etablerte kriterier for gradering)
- Malign Brenner tumor
- Blandete typer
- Udifferensiert karsinom
Maligne blandete mesenkymale og epiteliale svulster
- Adenosarkom (her er det bare den mesenkymale komponent som er malign)
- Karsinosarkom (med eller uten heterologe elementer)
Forekomst
Sist faglig oppdatert: 28202128.06.2021
I Norge er ovarialcancer den 6. mest vanlige kreftformen blant kvinner. I 2018 og 2019 fikk henholdsvis 478 og 504 kvinner eggstokk-, eggleder og bukhinnekreft (Larsen, 2019). Insidensen øker med alder. Livstidsrisiko for sykdommen hos norske kvinner: 1,2 % (Larsen, 2018). Gjennomsnittsalder ved diagnosetidspunkt er 68 år. Insidensen varierer i ulike land fra 9–17/100 000 kvinner, høyest i I-land.
Etiologi
Ukjent hos 80–85 % (sporadisk form).
Nedarvete mutasjoner som gir øket risiko for kreft hos 10–20 %. Viktigste er mutasjoner i BRCA1 og BRCa2 genet. Se Genetikk.
Risikofaktorer
Sist faglig oppdatert: 28202128.06.2021
Økt risiko
Familiær opphoping utgjør 10–15 % av tilfellene, og skyldes oftest sykdomsgivende mutasjoner i BRCA1 og BRCA2 genene. En mindre andel skyldes Lynch syndrom med mutasjoner i mismatch repair (MMR) genene MLH1, MSH2, MSH6, PMS2 (Nakamura et al., 2014).
Infertilitet, tidlig menarche, sen menopause, østrogen-/progesteron-ubalanse og endometriose er etiologiske faktorer. En akutt eller en kronisk inflammasjon og aktivering av immunsystemet i tuben og fimbrieapparat kan forårsakes av gjentatte eggløsninger, retrograd blødning og reparasjoner av overflateepitelet i østrogenrike follikler antas å gi økt risiko for karsinom utvikling. (Fathalla, 1971; Purdie et al., 2003).
OC risiko er assosiert med økende høyde og body mass index (BMI) (Collaborative Group on Epidemiological Studies of Ovarian Cancer, 2012).
Redusert risiko
Flere graviditeter og amming gir en viss beskyttelse, sannsynligvis på grunn av ovulasjons-hemning (Hunn et al., 2012).
Bruk av p-piller i mer enn 5 år kan redusere risikoen for OC med > 50 %. Ved bruk av p-piller etter 30 års alder vedvarer risikoreduksjonen flere år etter avsluttet bruk (Collaborative Group on Epidemiological Studies of Ovarian Cancer et al., 2008).
Sterilisering og hysterektomi og lavdose aspirin reduserer risiko (Brinton et al., 2009; Trabert et al., 2014).
Screening
Sist faglig oppdatert: 28202128.06.2021
Det er ikke vist redusert mortalitet ved ulike screeningtiltak. Screening er anbefalt i høyrisiko-gruppene, se avsnitt Økt risiko.
Prognose
Sist faglig oppdatert: 28202128.06.2021
Viktige prognostiske faktorer er:
- Stadium
Stadium I: | Komplett staging, differensieringsgrad, DNA ploiditet og tumorruptur (Paulsen et al., 2011; Vergote et al., 2001). |
Stadium II–IV: | Mengde resttumor etter primærkirurgi, allmenntilstand, albumin, (alder), histologisk type (Winter et al., 2007). |
- Klarcellet tumor (alle stadier) og mucinøs tumor med resttumor etter primær kirurgi har dårligere prognose enn andre histologiske typer (Harrison et al., 2008; Itamochi et al., 2008).
- Forhøyet CA125 etter 2 kurer kan indikere dårlig respons og prognose (Makar et al., 1993).
- BRCA1 og 2 mutasjonsbærere synes å ha bedre prognose (Modan et al., 2001).
Symptomer
Sist faglig oppdatert: 28202128.06.2021
En norsk systematisk oversikt tyder på at 93 % har symptomer før diagnose (Paulsen et al., 2005).
Utflod og vaginalblødning kan være symptomer ved egglederkreft.
Abdominalplager
Trykk, endret avføringsmønster, smerter*, utspilthet*, akutte smerter (torkvering, ruptur, blødning)
Rask metthetsfølelse, vanskeligheter med spising*
Endret vannlatingsmønster*
Redusert allmenntilstand, vekttap
Halsbrann, anoreksi, kvalme
Vaginalblødning (sjeldent)
Symptom på DVT i underekstremiteter
Dyspné (pleuravæske)
Paraneoplastiske fenomener
* Disse inngår i ovarialcancer symptomindeks.
(Sensitivitet: 57 % i tidlig stadium, 80 % i avansert. Spesifisitet 90 %) (Goff et al., 2007) (B)
Diagnostikk
Sist faglig oppdatert: 28202128.06.2021
Forslag henvisningsmal
Pakkeforløp eggstokkreft (ovarialcancer)
Det skal være mistanke om kreft i eggstokk/eggleder/bukhinne, RMI > 200.
Pasientdata |
Pasientens navn: Adresse: Telefonnr: Mobil: |
Henviserdata |
Henvisende sykehus: Henvisende lege: Hvem skal kontaktes hvis vi trenger mer informasjon: Telefonnr: |
Juridiske data |
Ansennitetsdatum: Frist helsehjelp og til hva dvs utredning eller utredning/behandling Datum for sent henvisning: Pakkeforløp start: Ventetid slutt: |
Anamnese og status |
Resymé av sykdommen: Andre sykdommer / operasjoner: Obs hvis andre sykdommer som kan påvirke mulighet for anestesi, utredes dette lokalt, f.eks. av kardiologisk / indre medisinsk type. Kopi av aktuelle tilsynsnotater og resultater vedlegges. Medisinliste: Kort status presens: performance status (ECOG), høyde og vekt. |
Undersøkelsesfunn:
- GU med ultralyd/beskrivelse
- CA 125, HE4 og CEA. Beregning av RMI
- Ved mistanke om germinalcelle tumor: inkl AFP og beta-HCG
- Ved mistanke om granulosacelletumor: inkl Inhibin B og Anti-Müllerian hormon.
- Ved mistanke om tarmaffeksjon og/eller forhøyet CEA> 5 ng/ml: vurder kolonoskopi og gastroskopi
CT thorax abdomen bekken (diagnostisk kvalitet; max 3 mm snitt i 3 plan, ikke strålebesparende protokoll, intravenøs og peroral kontrast), ikke eldre enn 4 uker.
- Beskrivelse med kortfattet relevante funn.
Påvisning av incidentalom i binyrer utredes med hormonprøver, ev. CT. - Bilder sendes elektronisk eller på CD.
Biopsi ved St III–IV er ønskelig, og må foreligge før neoadjuvant kjemoterapi. Histologi vedlegges (inkludert immunundersøkelse: minimum P53, WT1, PAX8). Evnt cytologi ascites- og pleuravæske til «celleblokk».
Ved hydronefrose bør urinveier avlastes.
Tromboseprofylakse: Hvis store tumores eller avansert sykdom, vurder profylaktisk Fragmin.
Utredning
Sist faglig oppdatert: 28202128.06.2021
- Funksjonstilstand (ECOG).
- GU med ultralyd/beskrivelse.
- CA 125, HE4 og CEA. Beregning av RMI.
- Ved mistanke om germinalcelle tumor: inkl AFP og beta-HCG.
- Ved mistanke om granulosacelletumor: inkl Inhibin B og Anti-Müllerian hormon.
- Ved mistanke om tarmaffeksjon og/eller forhøyet CEA> 5 ng/ml, CA125/CEA >25 (Buamah et al., 1990; Sørensen et al., 2011; Yedema et al., 1992): vurder kolonoskopi eller CT kolon og gastroskopi.
- Beregning av RMI (Risk of Malignancy Index). Score > 200 gir høy sensitivitet for ovarialcancer (Tingulstad et al., 1999).
- CT TAB, rekonstruert til tynne snitt (max 3 mm) i tre plan. Viktig for best bildekvalitet; derfor bør det ikke anvendes lav stråledose, selv på unge pasienter. Etter europeiske retningslinjer (ESUR) kan det gjøres multiparametrisk MR for å avklare usikre lesjoner i ovariene, det vil si lesjoner som er «indeterminate» etter vanlig utredning med tumormarkører og TVU. Påvisning av incidentalom i binyrer utredes med hormonprøver.
- Biopsi ved St III-IV er ønskelig, og obligatorisk før neoadjuvant kjemoterapi. Histologi/ immunundersøkelse: minimum P53, WT1, PAX8. Ascites til stede: send rikelig med væske nok til «celleblokk»/immunundersøkelse, kan erstatte biopsi.
- Hvis biopsi/histologi viser mucinøst karsinom, men immunundersøkelse er inkonklusiv, diskuter preoperativt med patolog og evnt gastrokirurg.
- Hvis pleuravæske, ta cytologisk undersøkelse for stadium 4-dokumentasjon.
- Genetisk testing for BRCA1 og BRCA2 mutasjon i germline tilbys alle. Det skal gis informasjon om risiko for annen kreft, for nytte av ny targeted terapi (PARP inhibitor) og kreftrisiko for øvrige familie hvis positiv test.
Pasient med påvist mutasjon: -
- har høy risiko for brystkreft, får tilbud om follow-up av bryst.
- Friske familiemedlemmer til mutasjonsbærere tilbys genetisk veiledning og gentest/evnt. informasjon om profylaktiske risikoreduserende tiltak (p-pille, risikoreduserende salpingectomi, oophorectomi og HRT) (Domchek et al., 2010; Erickson et al., 2013; Gaba et al., 2019), årlig MR/mammografi og tilbud om profylaktisk mastectomi. Gynekologisk kontroll avsluttes når tuber og ovarier er fjernet.
- Skal tilbys behandling med PARP inhibitor vedlikeholdsbehandling i 1. linje eller ved recidiv av carboplatin sensitiv sykdom.
- Genetisk testing for BRCA1–2 mutasjon i tumor (somatisk BRCA1–2 test) skal tilbys til pasienter som ikke er mutasjonsbærere. Tilbys ved Radiumhospitalet.
Supplerende undersøkelser på spesielle indikasjoner
- Ved lav albumin, vurder preoperativ ernæringstilskudd, henvisning til ernæringsfysiolog
- Ved hydronefrose bør urinveier avlastes.
- Tromboseprofylakse: Hvis store tumores eller avansert sykdom, vurder profylakse
- Endometriebiopsi ved unormal vaginalblødning.
- Cytologisk prøve ved uklar årsak til ascites og pleuravæske. Send rikelig med væske nok til «celleblokk»/immunundersøkelse P53, WT1, PAX8.
- Laparoskopi/ekspl laparatomi (Decloedt et al., 1999) ved ikke konklusive preoperative undersøkelser, eller for å vurdere om man kan maksimalt debulke.
- Ikke nordiske pasienter; vurder Hepatitt B- og C testing, samt HIV status. Høy forekomst av hepatitt i sør-øst Asia, Russland, Latvia, Baltikum og Afrika (betydning for optimal onkologisk behandling. Konf Infeksjonsmedisinsk avd OUS for vurdering).
Differensialdiagnoser
Benign ovarialtumor
Endometriose
Tubo-ovarial abscess (actinomycose)
Tbc (i bekkenet)
Myoma uteri
Ikke-epitelial ovarialtumor
Sarcom utgått fra ovarier eller uterus
Metastaser til ovariene
GI-tumor (rectumcancer, coloncancer)
Divertikulitt
Urologisk tumor (bekkennyre)
Lymfom
Spredningsmønster
(Tropé et al., 2010)
Intraperitonealt
Intrapleuralt
Lymfogent til lymfeknuter i bekkenet og langs aorta
Hematogent til lever og/eller lunger
Stadieinndeling
Sist faglig oppdatert: 28202128.06.2021
| Stadium I: Tumor begrenset til eggstokk(ene) eller eggleder(e). | |
| IA: | Tumor begrenset til en eggstokk (kapsel intakt) eller eggleder; ingen tumor på eggstokk- eller egglederoverflaten; ingen maligne celler i ascites eller skyllevæske. |
| IB: | Tumor i begge eggstokker (kapsel intakt) eller eggledere; ingen tumor på eggstokk- eller egglederoverflaten; ingen maligne celler i ascites eller skyllevæske. |
| IC: | Tumor begrenset til en eller begge eggstokker eller eggledere inkl en av følgende: |
| 1C1: | kirurgisk søl |
| 1C2: | kapselruptur før kirurgi eller tumor på eggstokk- eller egglederoverflaten |
| 1C3: | maligne celler i ascites eller skyllevæske |
|
|
|
| Stadium II: Tumor i en eller begge eggstokker eller eggledere med utbredelse begrenset til bekkenet eller primær peritoneal cancer | |
| IIA: | Tumorutbredelse i bekkenet og/eller med innvekst/metastasering til livmor og/eller eggledere og/eller eggstokker |
| IIB: | Tumorinnvekst/metastasering til andre vev i det lille bekkenet |
|
|
|
| Stadium III: Tumor i en eller begge eggstokker eller eggledere eller primær peritoneal cancer, med (verifisert) spredning utenfor bekkenet, men begrenset til bukhulen og/eller metastaser til lymfeknuter retroperitonealt (bekken eller para-aortalt). | |
| IIIA1: | Bare positive retroperitoneale lymfeknuter (verifisert) |
| IIIA1.1: | Metastaser opp til 10 mm i diameter til øvre del av buken |
| IIIA1.2 | Metastaser mer enn 10 mm i diameter til øvre del av buken |
| IIIA2: | Mikroskopisk spredning utenfor bekkenet begrenset til bukhulen med eller uten positive lymfeknuter retroperitonealt |
| IIIB: | Metastaser på høyst 2 cm i øvre del av buken, med eller uten positive retroperitoneale lymfeknuter |
| IIIC: | Metastaser på mer enn 2 cm i øvre del av buken, med eller uten positive retroperitoneale lymfeknuter (inkl tumor til lever- eller miltkapsel uten innvekst i parenkym) |
|
|
|
| Stadium IV: Fjernmetastaser ekskl. peritoneale metastaser | |
| IVA: | Pleuravæske med positiv cytologi |
| IVB: | Metastaser i parenkym og metastaser til ekstra-abdominale organer (inkl. inguinale lymfeknuter og lymfeknuter utenfor bukhulen). |
Behandling
Sist faglig oppdatert: 28202128.06.2021
Behandling for ovarial cancer i Norge er sentralisert da studier viser at behandling på sykehus med spesialkompetanse i gynekologisk onkologi kan gi bedre langtidsoverlevelse (Giede et al., 2005; Paulsen et al., 2006; Vernooij et al., 2007) (B) og er kostnadseffektivt (Bristow et al., 2007) (B).
Ved RMI > 200 sendes henvisning til gynekologisk kreft senter med spesialkompetanse for primæroperasjon (Paulsen et al., 2006; Tingulstad et al., 1999; Vernooij et al., 2007) (B)
Kirurgi
Primær kirurgi er viktig for:
- Riktig stadium påvises. Er vist å gi bedre prognose.
- Maksimal tumorreduksjon (cytoreduktiv kirurgi). Målet er ingen makroskopisk resttumor. Hvis det ikke er mulig å oppnå 0 resttumor ved primær debulking kirurgi (PDS), er neoadjuvant kjemoterapi (NACHT) med interval debulking kirurgi (IDS) ved kjemosensitiv sykdom å foretrekke. Ved lavgradig eller mucinøs sykdom med mindre kjemosensitivitet kan PDS med resttumor være aktuelt (Chi et al., 2006; Fotopoulou et al., 2021) (B). Ved funn som gir som gir resttumor >1 cm, skal det angis indikasjon for kirurgi/neoadjuvant kjemoterapi / evnt. forsinket primær kirurgi. Vurdering og konklusjon på MDT møte (dokumenteres i journal).
Neoadjuvant kjemoterapi/forsinket primær kirurgi:(Bristow et al., 2006; Fotopoulou et al., 2021; Gill et al., 2017; Kehoe et al., 2015; Kessous et al., 2017; Marchetti et al., 2017; Phillips et al., 2018; Vergote et al., 2010). Vurdering og konklusjon på MDT møte (dokumenteres i journal). Det tas CA125 ved hver kur.
- Det er vist at kirurgi etter 3. kur fortsatt kan gi overlevelsesgevinst, hvis resttumor < 1 cm kan oppnås. Ved forventede restforandringer mellom 1 og 2 cm, foretas individuell vurdering, idet gevinsten er mindre. Derfor vil man normalt ikke utføre store, langvarige eller risikable operasjoner for å oppnå dette målet (Bristow et al., 2006; Gill et al., 2017; Kehoe et al., 2015; Kessous et al., 2017; Marchetti et al., 2017; Phillips et al., 2018; Vergote et al., 2010).
- Hvis forsinket primær operasjon utføres etter 5. kur, er det kun vist overlevelses gevinst ved 0 resttumor. Ytterligere 2 kurer må vurderes postoperativt.
Ved alvorlig komorbiditet/palliasjon/symptomlindring:
- Palliativ kirurgi kan være aktuelt ved stor primærtumor og/eller omentmetastase.
- Evnt symptomlindrende kjemoterapi alene.
Veiledende indikasjoner for neoadjuvant kjemoterapi (NACT):
- Etter eksplorativ laparatomi/skopi med funn som gir som gir resttumor >1 cm.
- Betydelig komorbiditet, pasienten vurderes til mindre radikal kirurgi.
- Fersk blodpropp (< 6 uker), pasienten kan vanligvis primæropereres etter 4–6 ukers behandling med antikoagulering.
- Multiple lungemetastaser.
- Mediastinale lymfeknuter over 2 cm.
- Intrahepatiske metastaser (ikke absolutt stopp-kriterium).
- Metastatiske lymfeknuter (feks ved porta hepatis eller mesenterica superior) som ikke anses resektable.
- Tumor som trenger reseksjon av duodenum eller store deler av tynntarm.
- Betydelig tynntarmscarcinomatose eller infiltrativ tumorvekst sentralt i tynntarmskrøs.
- Ikke resektable pleurametastaser over 1 cm.
Anbefalt kirurgisk prosedyre
(Tropé et al., 2010)
Primær kirurgi
Stadium I
Anbefalt kirurgisk prosedyre
- Midtlinjesnitt.
- Ascites eller peritoneal skyllevæske for cytologi.
- Systematisk beskrivelse av hele bukhulen og angi evnt PCI score (peritoneal cancer index) (Jacquet et al., 1996).
- Suspekte lesjoner ekstirperes.
- Frysesnitt er aktuelt.
- Tumorruptur skal registreres (bør unngås), sammen med grad av adheranser.
- Hysterektomi.
- Bilateral salpingo-oophorektomi (BSO).
- Omentektomi, infrakolisk.
- Lymfadenektomi i bekkenet og para-aortalt opp til venstre nyrevene, inngår som ledd i stadieinndeling (Camara et al., 2009; Harter et al., 2017).
Ved kjent histologi, se Restaging ved st I (Heitz et al., 2018).
Ved «serøs tubart intraepitelialt karsinom» (STIC) (Weinberger et al., 2016; Wethington et al., 2013) følges angitt kirurgisk prosedyre beskrevet over. Premenopausale vurderes individuelt. Skyllevæske tas fordi bukhulen er vanligste sted for spredning. Det er ikke vist at lymfadnectomi og/eller kjemoterapi gir bedre prognose, hvis kun STIC er påvist (Wethington et al., 2013), og anbefales derfor ikke. Histologi med SEE-FIM prosedyre (3 mm tette snitt) av tuber/ovarier (Powell et al., 2011). Pasienten bør anbefales BRCA1–2 testing. Follow-up som ved karsinom.
-
- Ved mucinøs tumor (Hess et al., 2004) fjernes også appendix. Full tumorekstirpasjon har prognostisk betydning.
- Ved usikkert origo eller mistenkt pseudomyxoma peritonei bør gastrokirurg konsulteres, helst preoperativt. Det kan være aktuelt med HIPEC (hyperterm intraperitoneal kjemoperfusjon
Fertilitetsbevarende kirurgi (Bentivegna et al., 2016)
Fertilitetsbevarende behandling krever en grundig samtale med pasienten med objektiv informasjon som inkluderer vurdering av mulighet for å bli gravid, behandlingsalternativ, risiko for tilbakefall og prognose.
- Regranskning av histologi.
- Endometriebiopsi anbefales ved diagnose.
- Ensidig salpingo-ooforektomi, cytologi, omentektomi og eventuelt lymfeknute-staging kan vurderes hvis følgende gjelder:
- Kvinner i fertil alder med barneønske
- Stadium IA grad 12 karsinom og stadium IC1 grad 1 karsinom
- klarcellet histologisk type ble tidligere ikke anbefalt, men diskuteres nå
- Etter avsluttet barneønske, bør man vurdere å fjerne gjenværende adnex/ovarium hos kvinner med tumor med serøs histologi.
Restaging ved stadium I (Heitz et al., 2018)
Ved antatt benign tumor, der histologien uventet er malign, henvises til gynekologisk kreftsenter til vurdering for komplett staging og kjemoterapi.
Restaging utføres etter primæroperasjon uten full staging, hvis det er relevant risiko for metastaser og vurderes i forhold til tumortype, valg av videre adjuvant behandling og pasientens almentilstand. Se kapittelet om medikamentell behandling og flytskjema for adjuvant behandling.
Høyrisikogruppen: Restaging utføres etter primæroperasjon uten full staging. Lymfadenectomi for restaging alene kan unnlates, hvis lymfeknute status ikke endrer pasientens videre behandling. Dokumentasjonen er svak og gir øket mortalitet (Heitz et al., 2018). (Ved Radiumhospitalet er det consensus at lymfadenectomi ikke utføres ved normale lymfeknuter på CT og lymfeknute status ikke endrer pasientens videre behandling).
Restaging kan utføres med minimal invasiv kirurgi:
- Alle med høygradig eller grad 3 karsinom.
- Klarcellet histologi; IA-IC1: adjuvant kjemoterapi kan unnlates, hvis fullt staget.
Lavrisikogruppen (lavgradige og grad 1–2, ikke klarcellet og mucinøs type):
Restaging vurderes i forhold til valg av videre adjuvant behandling og pasientens allmenntilstand. Det er lav risiko for okkulte metastaser (Gouy et al., 2017; Heitz et al., 2018; Lago et al., 2016; Minig et al., 2017; Muyldermans et al., 2013). Det forutsettes at hysterektomi og BSO er utført.
- Omentektomi vurderes individuelt.
- Reoperasjon for å gjøre manglende lymfadenektomi anses ikke indisert når CT ikke viser suspekte lymfeknuter, men kan påvirke indikasjon for adjuvant kjemoterapi. Se kapittelet om medikamentell behandling og flytskjema for adjuvant behandling.
- Ved mucinøst karsinom: appendectomi. Reoperasjon for appendectomi er ikke indisert hvis appendix er beskrevet normal.
- Hos premenopausale må fertilitet og risiko diskuteres med pasienten (Heitz et al., 2018). Se Fertilitetsbevarende behandling beskrevet over.
Stadium II–IV
Anbefalt kirurgisk prosedyre
Buken åpnes med begrenset midtlinjesnitt/diagnostisk laparatomi eller laparskopi, hvis usikkerhet om radiologiske funn.
- Målet er å oppnå 0 resttumor (Fotopoulou et al., 2021).
- Hvis det ikke anses mulig å fjerne all tumor over 1 cm eller det kreves langvarige eller risikable operasjoner med usikkert utfall for å oppnå dette, avsluttes inngrepet.
- Pasienten vurderes for neoadjuvant kjemoterapi og forsinket primær kirurgi.
- Det bør tas en representativ biopsi uten å risikere forsinket oppstart kjemoterapi.
- Tarmkirurgi skal kun vurderes ved truende ileus.
- Palliativ kirurgi kan være aktuelt ved stor primærtumor og/eller store omentmetastaser som er lett tilgjengelig for ekstirpasjon.
Midtlinjesnitt
Ascites eller peritoneal skyllevæske for cytologi.
Systematisk beskrivelse av hele bukhulen.
PCI score registreres.
Grad av adheranser / innvekst / tumorruptur registreres
Hysterektomi
Bilateral salpingo-oophorektomi
Omentektomi
- infrakolisk ved stadium II,
- ved stadium III inkludert suprakolisk og ut mot begge flexurer.
Extirpation av all carcinomatose hvis mulig.
Tarmreseksjon, splenektomi, diafragmastripping ved behov.
Ved avansert sykdom er det vanlig via retroperitoneal tilgang å fjerne alle tumores «en bloc» i bekkenet (preparat inkluderer da uterus/ovarial tumores/bekken peritoneum/ rektosigmoid resektat).
Lymfadenektomi (Bachmann et al., 2015; Camara et al., 2009)
- Ved stadium IIA utføres lymfadenektomi i bekkenet og paraaortalt (som ved st I).
- Ved stadium IIB–IIIC fjernes «bulky nodes» og metastasesuspekte lymfeknuter beskrevet på CT (Harter et al., 2017; Panici et al., 2005)
- Ved stadium IV fjernes forstørrede, resektable lymfeknuter beskrevet på CT (kardiofrenisk, supraklavikulært, i lysker og axiller).
Ved mucinøs tumor viktig å oppnå tumorfrihet, appendix fjernes. Ved usikker origo bør gastrokirurg konsulteres peroperativt. HIPEC behandling kan være aktuelt.
Konklusjon i operasjonsbeskrivelse med dokumentasjon av resttumor, størrelse og lokalisasjon og limiterende årsak.
Forsinket primærkirurgi
Utføres vanligvis 3–4 uker etter 2.–3. kur etter ny vurdering som ved primær kirurgi.
Det er overlevelsesgevinst ved resttumor 0, men også hvis <1 cm kan oppnås (du Bois et al., 2009b). Det er kun vist overlevelses gevist ved 0 resttumor hvis forsinket primær operasjon utføres etter 5. kur. Ved forventede restforandringer mellom 1 og 2 cm, foretas individuell vurdering, idet gevinsten er mindre. Derfor vil man normalt ikke utføre store, langvarige eller risikable operasjoner for å oppnå dette målet (Bristow et al., 2006; Gill et al., 2017; Kehoe et al., 2015; Kessous et al., 2017; Marchetti et al., 2017; Phillips et al., 2018; Vergote et al., 2010)
Recidiv kirurgi
Kirurgi skal vurderes. Aktuelt ved lokaliserte, særlig ved sene og potensielt platinum-sensitive residiver uten ascites (Coleman et al., 2019; Szczesny et al., 2018). Positiv effekt på overlevelse forutsetter 0 resttumor og etterfølges av adjuvant kjemoterapi. PET-CT kan være aktuelt.
Medikamentell behandling
Sist faglig oppdatert: 21202221.12.2022
Terminologi
Terapeutisk behandling: Medikamentell behandling som virker mot manifest sykdom. Gis postoperativt ved avansert sykdom (stadium II–V), neoadjuvant eller hvor medikamentell behandling gis alene.
Adjuvant behandling: Tilleggsbehandling med medikamentell behandling etter operasjon hvor all detekterbar sykdom er fjernet, men hvor det gjenstår en statistisk risiko for tilbakefall på grunn av okkult sykdom.
Neoadjuvant behandling: Medikamentell behandling gis før planlagt operasjon for å redusere tumormengde eller optimalisere pasientens almenntillstand før kirurgi.
Primærbehandling/1. linjebehandling
Stadium I
Indikasjon for adjuvant behandling
Serøs |
|
1A, lavgradig | Ingen adjuvant kjemoterapi |
1B-C, lavgradig | Adjuvant kjemoterapi (kan unnlates hvis fullt staget) |
1A-C, høygradig | Adjuvant kjemoterapi |
Endometrioid |
|
1A, grad 1–2 | Ingen adjuvant kjemoterapi |
1A, grad 3 | Adjuvant kjemoterapi |
1B-C, grad 1–2 | Adjuvant kjemoterapi (kan unnlates hvis fullt staget) |
1B-C, grad 3 | Adjuvant kjemoterapi |
Mucinøs |
|
1A expansil grad 1–2 | Ingen adjuvant kjemoterapi |
1A infiltrativ (assosiert med høy risiko) | Adjuvant kjemoterapi (kan unnlates hvis fullt staget), dokumentasjon er usikker for kjemoterapi (Gouy et al., 2017; Muyldermans et al., 2013) |
1B-C, expansil grad 1–2 | Adjuvant kjemoterapi (kan unnlates hvis fullt staget) |
1B-C, infiltrativ | Adjuvant kjemoterapi (Gouy et al., 2017; Muyldermans et al., 2013) |
Klarcellet |
|
1A-1C1: | Adjuvant kjemoterapi (kan unnlates hvis fullt staget) |
1C2–3: | Adjuvant kjemoterapi |
Flytskjema for adjuvant behandling
(ESMO–ESGO consensus conference recommendations (Colombo et al., 2019b))
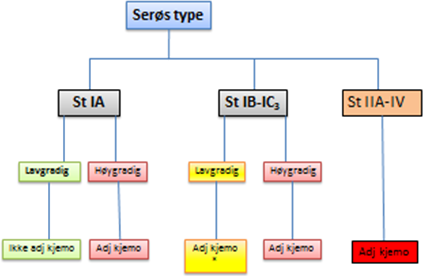
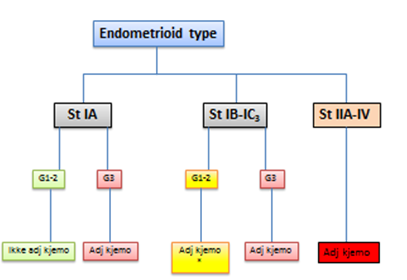
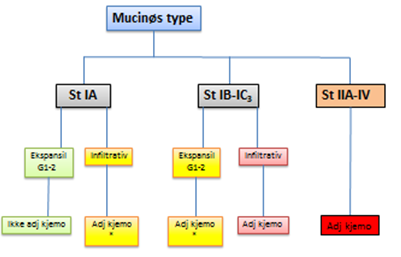
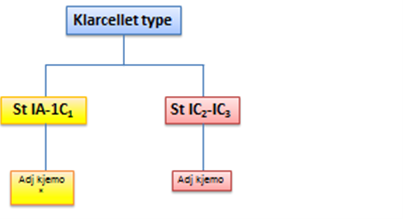
Type adjuvant kjemoterapi:
Det mangler evidens for type kjemoterapi (Chan et al., 2010; Colombo et al., 2019a; Hogen et al., 2017).
Behov for adjuvant kjemoterapi vurderes i forhold til gjennomført kirurgi og pasientens almentilstanl. Se detaljer i Flytskjema for adjuvant behandling.
- Ved st IA-B anbefales 6 kurer carboplatin single, forutsatt fullstendig staget eller carboplatin/paclitaksel, minimum 3 kurer.
- Ved høygradig serøse og stadium 1C (uavhengig av histologi) anbefales 6 kurer carboplatin/paclitaxel eller carboplatin single (Chan et al., 2010; Colombo et al., 2019b; Hogen et al., 2017; Paulsen et al., 2011; Trimbos et al., 2003).
- Ved mucinøs histologi: Behandling som ved coloncancer (konf gastro-onkolog): 5‑fluorouracil, kalsiumfolinat og oxaliplatin (FLOX/FOLFOX) totalt 9 kurer med 2 ukers intervaller (Hess et al., 2004). Oxaliplatin hver 3. uke + Capecitabin (per os) 14 dager, 6 kurer (Gore et al., 2015; Shi et al., 2017) kan vurderes. Alternativt 5-fluorouracil, kalsiumfolinat og irinotekan (FLIRI/FOLFIRI).
Stadium II–IV
Alle tilbys medikamentell behandling forutsatt tilfredsstillende almenntillstand.
Behandlingen bør starte når pasienten er rimelig restituert etter kirurgi. Tid fra kirurgi til oppstart kjemoterapi der det var 0 resttumor, er en prognostisk faktor, og tilstrebes innen 3uker (Mahner et al., 2013). Hvis preoperativ histologi foreligger, kan behandlingen startes tidligere.
Neoadjuvant behandling
(se detaljer under Logistikk)
Ved kontraindikasjon mot primærkirurgi skal neoadjuvant medikamentell behandling vurderes.
Det tas CA125 ved hver kur.
Det gis 2–3 kurer før ny CT og ny vurdering på MDT møte av operabilitet.
Postoperativt kontinueres kjemoterapi vanligvis inntil 6 kurer.
Hvis pasienten ikke er operabel, kontinueres kjemoterapi, totalt 6 kurer.
Type medikamentell behandling
Standard behandling:
Kombinasjonsbehandling med Karboplatin (AUC=5, GFR 40–125 ml/min) og Paklitaxel (175 mg/m2) iv, 6 kurer med 3 ukers intervaller (Ozols et al., 2003) (ikke ved mucinøs cancer).
Bevacizumab:
DMP/Beslutningsforum godkjent bruk på bakgrunn av:
- 2 prospektive, randomiserte studier, GOG-218 og ICON7 (Perren et al., 2011). Økt totaloverlevelse vist for pasienter med dårligst prognose, «høyrisiko-gruppen»: inoperable, st IV og st III med resttumor >1 cm etter primær operasjon.
- Aurelia studien med Bevazicumab ved resistent symptomgivende OC (Pujade-Lauraine et al., 2014; Stockler et al., 2014).
Definisjon for bruk (i alle helseforetak, bekreftet av NFGO styremøte april 2018):
- Inoperable, st IV, st III primæroperert med resttumor > 1 cm, og pasienter som fikk forsinket primæroperasjon/neoadjuvant kjemoterapi inngår i «høyrisikogruppen».
- Uttalt ascites og pleuravæske hos residivpasienter, helst i kombinasjon med ukentlig taxol.
Bruk av bevacizumab: Anbefalt dosering er 7,5 mg/kg hver 3. uke:
- Ved st III med resttumor> 1 cm og st IV i tillegg til kjemoterapi (uavhengig av histologi).
- Ved neoadjuvant kjemoterapi
- Ved MDT konklusjon «inoperabel»: bevacizumab gis ved alle kurene.
- Bevacizumab gis ikke ved kur før og etter kirurgi.
Ved mucinøs histologi:
Primærbehandling som ved coloncancer, konf med gastro-onkolog: 5-fluorouracil, kalsiumfolinat og oxaliplatin (FLOX/FOLFOX) totalt 9 kurer med 2 ukers intervaller (Hess et al., 2004). Oxaliplatin hver 3. uke + Capecitabin (per os) 14 dager, 6 kurer (Gore et al., 2015; Shi et al., 2017) kan vurderes. Alternativt 5-fluorouracil, kalsiumfolinat og irinotekan (FLIRI/FOLFIRI).
Tillegg av Bevazicumab kan vurderes (Gore et al., 2015; Perren, 2016).
Dessuten bør pasienter som ikke har RAS (KRAS/NRAS) mutasjon tilbys EGFR hemmer, mens de med MSI (4 % av coloncancerne) kan ha effekt av PD-1 (må søkes). Konf onkolog.
- Ved neuropati. Ved funksjonsnedsettende/svært plagsom/høy risiko for neuropati (ved persisterende grad 2 neuropati ved neste syklus, CTCAE kriterier) byttes paclitaxel ut med docetaxel (Vasey et al., 2001). Hvis taxaner er kontraindisert (nevropati eller allergi), kan det erstattes med Pegylert liposomal doxorubicin (Pignata et al., 2011), alternativt Gemcitabin.
- Ved allergi (men ikke ved anafylaxi) mot Carboplatin kan Cisplatin i hypersensitivitetsregime forsøkes. Ved kontraindikasjon mot platinum, kan trabectidine og pegylert liposomal doxorubicin forsøkes.
- Ved sterkt redusert almenntillstand eller høy alder, kan enkeltstoffbehandling (Carboplatin, AUC 5 eller 4) være aktuelt (von Gruenigen et al., 2017).
- Ved estimert GFR <40ml/min gjøres renografi med GFR måling (Oguri et al., 2015). Ved sterkt redusert nyrefunksjon (GFR < 40) kan enkeltstoff gis, paclitaxel, eller pegylert liposomal doxorubicin.
Vedlikeholdsbehandling:
Bevacizumab dosering er 7,5 mg/kg etter avsluttet primærbehandling til «høyrisikogruppen», gis hver 3. uke inntil progresjon eller toksisitet, inntil 12 kurer (Hinde et al., 2016).
Samme «høyrisikogruppe» kan få Bevacizumab kombinert med PARPinhibitor hvis BRCA 1-2-mutert (i kimbane eller i tumor), høygradig kreft i eggstokk-, eggleder- eller bukhinnekreft, som har respondert (fullstendig eller delvis) etter fullført platinabasert kjemoterapi. PARP inhibitor har best effekt der det foreligger BRCA1–2 mutasjon i kimbanen eller somatisk (i tumor) eller ved HRD positiv tumor som vedlikeholdsbehandling etter respons på platinum basert behandling i 1. og 2. linje (Essel & Moore, 2018; Ledermann et al., 2012; Ledermann et al., 2014).
PARP inhibitorene olaparib (Lynparza) og Niraparib (Zejula) er godkjente vedlikeholdsbehandlinger i 1. linje ved FIGO stadium III og IV, BRCA 1-2-mutert (i kimbane eller i tumor), høygradig kreft i eggstokk-, eggleder- eller bukhinnekreft, som har respondert (fullstendig eller delvis) etter fullført platinabasert kjemoterapi.
Se beslutninger i nye metoder:
- Olaparib (Lynparza) – indikasjon IV (nyemetoder.no)
- Niraparib (Zejula) - Indikasjon IV (nyemetoder.no) gjelder for PARP hemmer i 1. linje, men ikke i kombinasjon med bevacizumab
Olaparib (Lynparza) skal prioriteres framfor niraparib grunnet kostnad, se LIS-avtaler: Onkologiske og kolonstimulerende legemidler (pdf, sykehusinnkjop.no)
(Radiumhospitalet tilbyr somatisk BRCA1–2 test av fersk biopsi, pas kan henvises)
- Aromatasehemmere bør vurderes som vedlikeholdsbehandling og har lav bivirkningsprofil (feks Letrozol (Femar 2.5 mg x1)) til progresjon.
- Lavgradig serøs hormonreseptor positiv karsinom: Disse svulstene responderer dårlig på kjemoterapi. En retrospektiv studie har vist at pasienter med stadium II-IV har forbedret PFS ved antihormonell vedlikeholdsbehandling etter avsluttet 1. linjebehandling (Gershenson et al., 2017)
Samtidig behandling med calcium og D-vitamin skal gis for å motvirke osteoporose; Calcigran Forte 1000 mg/800IE x 1. Bentetthetsmåling anbefales før/ved oppstart, deretter etter ett år og deretter hvert 2. år. Må vurderes etter leveutsikt.
- Lavgradig serøs hormonreseptor positiv karsinom: Disse svulstene responderer dårlig på kjemoterapi. En retrospektiv studie har vist at pasienter med stadium II-IV har forbedret PFS ved antihormonell vedlikeholdsbehandling etter avsluttet 1. linjebehandling (Gershenson et al., 2017)
Recidivbehandling
Sist faglig oppdatert: 21202221.12.2022
Alle bør vurderes for deltagelse i kliniske studier.
Kirurgi er aktuelt ved lokalisert, sent og potensielt platinumsensitivt residiv uten ascites (Coleman et al., 2019; Muallem et al., 2015; Szczesny et al., 2018). PET CT kan være aktuelt.
Positiv effekt på overlevelse forutsetter at komplett tumorfrihet oppnås og skal etterfølges av adjuvant kjemoterapi.
Ved medikamentell behandling bør pasientens ønsker vektlegges i forhold til bivirkninger. Følgende faktorer vurderes:
Det platinum-frie intervallet, pasientens allmenntilstand, tumorbiologi/histologisk type, antall og tidligere linjers respons og toksisitet, samt pasientens BRCA status.
Definisjoner
Det platinumfrie intervall (PFI): Tiden fra siste platinumbasterte behandling. Er en prognostisk faktor for overlevelse (Champer et al., 2018). Det er vist at moderat respons og særlig komplett respons etter siste platinumbehandling har betydning for platinum respons igjen (Gore et al., 1990).
Resistens. Utvikling av resistens til platinum ansees som en kontinuerlig utvikling.
Det finnes i dag ingen prediktive biomarkører for platinum sensitivitet.
Tradisjonelt velges behandling utifra PFI. Ny kunnskap har vist at PFI grensene kun er veiledende og må anvendes med skjønn, særlig hos pasienter med BRCA1–2 mutasjon i tumor/germline eller HRD positiv tumor der carboplatin har vist særlig god effekt (Mirza et al., 2016). Lengden av PFI er usikker idet registrering av tidspunkt for CA125 måling og/eller CT vil variere.
Platinum refraktær sykdom, hvis det foreligger progresjon under behandling eller innen 4 uker etter avsluttet behandling.
Tidligere forlatte definisjoner (Blackledge et al., 1989):
PFI>6 mnd definert som platinum sensitiv.
PFI<6 mnd definert som platinum resistent.
Platinum sensitiv sykdom
Kirurgi
skal alltid vurderes, jmf det overstånde
Medikamentell behandling
- Kombinasjonsbehandling bør tilbys (Parmar et al., 2003; Raja et al., 2013). Platinumbasert behandling er vist å gi bedre overlevelse enn nonplatinum basert behandling (Champer et al., 2018), tradisjonelt 6 sykler.
- Førstevalg er ofte carboplatin og pegylert liposomalt doxorubicin (PLD) foretrukket pga bivirkningsprofil og toleranse (Pujade-Lauraine et al., 2014).
- Hvis carboplatin er kontraindisert, kan cisplatin i tillegg til PLD gis.
- Hvis PLD er kontraindisert, ansees carboplatin kombinert med paclitaxel/docetaxel likeverdig (Parmar et al., 2003) evnt. kan gemcitabine gis.
- Hvis pasienten ikke kan tåle to-stoffsbehandling, er carboplatin single et alternativ.
- Ved besværlig ascites (og/eller pleuravæske) kan Bevacizumab single tilbys (7.5 mg/kg hver 3. uke eller 5 mg/kg hver 2. uke), best effekt er vist ved kombinasjon med ukentlig Paclitaxel (Stockler et al., 2014). Gjentatte instillasjoner av Mitoxantron (Novantrone) eller permanent ascitesdrenage kan også vurderes.
Vedlikeholdsbehandling
- PARP inhibitor har størst effekt hvis det påvises BRCA1–2 mutasjon i germline eller somatisk (i tumor) etter respons på platinum-basert behandling. Radiumhospitalet tilbyr somatisk BRCA1–2 test (biopsi fra fersk tumorvev), hos pasienter som er testet negative i germline.
Pasienten bør da tilbys vedlikeholdsbehandling med PARP inhibitor. Brukes inntil toksisitet eller progresjon (Essel et al., 2018; Ledermann et al., 2012; Mirza et al., 2016; Oza et al., 2015).- Både olaparib (Lynparza) og Niraparib (Zejula) er godkjent for bruk uavhengig av BRCA1–2 mutasjon status ved tilbakefall av carboplatinsensitiv sykdom (Ledermann et al., 2012; Mirza et al., 2016; Oza et al., 2015). Gir forlenget progresjonsfri overlevelse ved carboplatinsensitiv sykdom uavhengig av BRCA1–2 mutasjon status eller HRD status (Mirza et al., 2016)
Se beslutninger i nye metoder:
- Både olaparib (Lynparza) og Niraparib (Zejula) er godkjent for bruk uavhengig av BRCA1–2 mutasjon status ved tilbakefall av carboplatinsensitiv sykdom (Ledermann et al., 2012; Mirza et al., 2016; Oza et al., 2015). Gir forlenget progresjonsfri overlevelse ved carboplatinsensitiv sykdom uavhengig av BRCA1–2 mutasjon status eller HRD status (Mirza et al., 2016)
Niraparib (Zejula) skal prioriteres framfor olaparib grunnet kostnad, se LIS-avtaler: Onkologiske og kolonstimulerende legemidler (pdf, sykehusinnkjop.no)
- Aromatasehemmere bør vurderes som vedlikeholdsbehandling og har lav bivirkningsprofil (feks Letrozol 2.5 mg x1) til progresjon.
- Lavgradig serøst karsinom: Positiv ER status i tumor kan være en prediktor av respons på antihormonell behandling (Colombo et al., 2019b). Disse svulstene responderer dårlig på kjemoterapi. En retrospektiv studie har vist at pasienter med stadium II-IV har forbedret PFS ved antihormonell vedlikeholdsbehandling (Gershenson et al., 2017) (i søknad til HELFO bør denne anbefaling i veilederen brukes som begrunnelse for refusjon). Hormonreseptorstatus må innhentes. Samtidig behandling med calcium og D-vitamin for å motvirke osteoporose må vurderes etter leveutsikt; Calcigran Forte 1000 mg/800IE x 1. Bentetthetsmåling anbefales før/ved oppstart, deretter etter ett år og deretter hvert 2. år.
Platinum resistent sykdom
Omlag 20 % får progresjon innen 6 mndr, har manglende respons til førstelinje behandling eller får tilbakefall innen få uker etter siste platinum-baserte kjemoterapi (Monk et al., 2016). Det foreligger ingen markører som kan predikere resistens. Utvikling av resistens til platinum ansees som en kontinuerlig utvikling. I dag styres valg av behandling ofte fra PFI, men grensene er kun veiledende og må anvendes med skjønn.
- Når behandling velges, vurderes allmenntilstand, tidligere toksisitet og respons.
- Behandlingen er palliativ, fokus på livskvalitet og symptomlindring.
- Hos pasienter med BRCA1–2 mutasjon i tumor/germline eller HRD pos tumor som har hatt kortvarig god respons (Mirza et al., 2016), kan carboplatin evnt forsøkes igjen.
- Enstoffsbehandling inntil progresjon eller toksisitet med ukentlig Paclitaxel (vurder å legge inn fri-uke hver 3.–4. uke etter 8. kur), PLD eller Gemcitabin.
- Responsrate under 15 %, forventet PFS 3–4 mnd.
- Tamoxifen (20–40 mg daglig p.o.) kan ha en stabiliserende virkning på ovarialcancer og klinisk respons er rapportert (Lindemann et al., 2017), evnt kan Letrozol 2.5 mg daglig forsøkes, da bør hormonreseptor status undersøkes.
- Besværlig ascites (og/eller pleuravæske):
- Bevacizumab single (Stockler et al., 2014) tilbys (7.5 mg/kg hver 3. uke eller 5 mg/kg hver 2. uke), best effekt er vist ved kombinasjon med ukentlig Paclitaxel (Pujade-Lauraine et al., 2014).
- Gjentatte instillasjoner av Mitoxantron (Novantrone) eller permanent ascites-/pleuradrenage kan også vurderes.
- Strålebehandling
I enkelte tilfeller kan det være aktuelt å gi palliativ strålebehandling. -
- ved tumor som har brutt gjennom til vagina og gir blødningsproblemer.
- ved skjelettmetastaser og hjernemetastaser. Solitære metastaser kan henvises til nevrokirurg (Tropé et al., 2010) (C).
Oppfølging og kontroller
Sist faglig oppdatert: 28202128.06.2021
Første konsultasjon etter avsluttet behandling skal inneholde en sammenfatning av forløp og behandling. Samtale med både lege og sykepleier. Samtalen bør være strukturert. Følgende punkter bør berøres:
- Oppsummering av sykdom, behandling, forventede seneffekter og prognose.
- Symptomer på recidiv og hvor pasienten skal henvende seg.
- Fremtidige seksuelle problemer/redusert libido bør diskuteres: Indikasjon for henvisning til sexolog.
- Behov for kontakt med kreftsykepleier i kommunen.
Formål med oppfølgning
Kirurgi bør vurderes og er aktuelt ved kjemo sensitiv og lokalisert sykdom (Bristow et al., 2009; Harter et al., 2006; Oksefjell et al., 2009).
Behandling etter flere linjer kjemoterapi bør vurderes i forhold til gevinst på overlevelse, symptomlindring og livskvalitet. I en stor undersøkelse fant man ingen forskjell i overlevelse på pasienter kontrollert med CA 125 og pasienter som kun ble kontrollert klinisk (Rustin et al., 2010) (A).
Ved bruk av CA125 i oppfølgningen anbefales bruk av GCIG kriteriene for progresjon (Rustin et al., 2004) (B), dvs økning til minst 70 IE/ml hos pasienter som hadde normal verdi etter avsluttet behandling evnt. skal verdien fordobles for å være signifikant. Forhøyede verdier skal alltid kontrolleres med en ny prøve.
Oppfølgningen kan ha betydning for tiltak vedrørende psykiske og somatiske senfølger etter kirurgi og kjemoterapi; for eksempel fatigue, angst og depresjon (Liavaag et al., 2007) (C).
CT, MR eller andre undersøkelser tas på individuell indikasjon, ved symptom og ved mistanke om residiv.
Kontrollintervall er kun veiledende.
Planlegging av kontroller vurderes i forhold til alder, komorbiditet og gevinst av å påvise recidiv tidlig:
3–4 mnd intervaller, første 24 måneder
6 mnd intervaller 25–60 måneder
Kontroll etter > 5 år individualiseres avhenger av cancer type, alder eller i samarbeid pasient.
Det er liten evidens for verdien av dagens oppfølgingsrutiner.
Hormonsubstitusjon
Obs unngå østrogentilskudd ved hormonreseptor positiv lavgradige karsinom >stadium I.
Østrogenerstatning anbefales ved premenopausal alder; plaster anbefales for jevn serumdose og for å unngå «first passed effect» i lever (Estradot plaster 50–100 mikorgram/24 time).
Blåresept: Eggstokksvikt etter behandling E89.4. (før 52 år). Ved intakt uterus legg til progesteron.
Genetikk
Sist faglig oppdatert: 28202128.06.2021
ICD-10
Z80.4 Kontakt med helsetjenesten ved opplysning om ondartet svulst i kjønnsorganer i familianamnesen
Om lag 15 % av OC skyldes autosomal dominant arvede mutasjoner i gener som gir økt risiko for kreft i spesifikke organer, inkludert ovarier, dvs at en har 50 % risiko for å arve mutasjonen hvis en av foreldrene er mutasjonsbærer.
Behandling og oppfølging ved OC er i økende grad persontilpasset, og påvist BRCA1 eller BRCA2-mutasjon har behandlingsmessige konsekvenser (se kapittel Medikamentell behandling, avsnitt "Type medikamentell behandling" og kapittel Recidivbehandling, avsnitt "Vedlikeholdsbehandling".
Livstidsrisiko
Hereditær brystkreft (BC)- ovarialcancer (OC) (HBOC)
Skyldes oftest mutasjoner i BRCA1 eller BRCA2 genene, som gir betydelig forhøyet risiko for OC og BC hos kvinner. Tall for livstidsrisiko varierer, og vil være avhengig av studiedesign, etnisitet, andre risikofaktorer (ooforektomistatus, paritet, bruk av p-piller) samt genetiske variasjoner i befolkningen (Friebel et al., 2014).
BRCA1
(Antoniou et al., 2003; Kuchenbaecker et al., 2017; Lakhani et al., 2004; Piver, 2002)
Gjennomsnittlig OC risiko: 40–45 %.
Alder: Sjelden før 40 år. Gjennomsnittlig 54 år ved BRCA1. Sporadisk OC 65 år (Larsen, 2018).
Histologi: Oftest høygradig serøs, etterfulgt av endometrioid og klarcellet karsinom, sjeldnere mucinøs og borderline.
BRCA2
(Antoniou et al., 2003; Kuchenbaecker et al., 2017; Lakhani et al., 2004; Piver, 2002)
Gjennomsnittlig OC risiko: 15–20 %
Alder: Gjennomsnittlig 59 år ved BRCA2. Sporadisk OC 65 år (Larsen, 2018).
Histologi: Som BRCA1.
Lynch syndrome (før Hereditær NonPolypose Colorectal Cancer HNPCC)
Lynch syndrom (LS) er en autosomal dominant nedarvet tilstand som skyldes mutasjoner i et av flere DNA mismatch repair (MMR) gener (MLH1, MSH2, MSH6, PMS2) og EPCAM. LS gir økt risiko hovedsakelig for colorectalcancer (CRC) og endometriecancer (EC), men også økt risiko for OC. Livstidsrisiko for OC varierer fra 10–17 %, avhengig av hvilket av MMR-genene som er mutert (Møller et al., 2018).
Alder: Gjennomsnittlig 40–45 år (Crijnen et al., 2005; Watson et al., 2001).
Histologi/prognose: Det er beskrevet flere histologiske typer av LS relatert OC, og man ser ikke den samme assosiasjon til høygradig serøst karsinom som ved BRCA-relatert OC (Nakamura et al., 2014). LS relatert OC er ved diagnosetidspunkt ofte av lavgradig type, i tidlig stadium, har tidligere debut og bedre prognose sammenlignet med sporadisk OC. Diagnose i tidlig stadium kan ha sammenheng med cancerutvikling via forstadier i ovariet (type II tumor) og derfor enklere å diagnostisere med vaginal ultralyd (Crijnen et al., 2005; Grindedal et al., 2010; Kurman et al., 2010; Toss et al., 2015; Watson et al., 2001).
Kontrollopplegg
Regelmessig gynekologisk kontroll fra 30 års alder, også pga økt risiko for EC, se Genetikk. Risikoreduserende kirurgi kan vurderes fra 45–50 årsalder, denne beslutningen tas av pasienten i samråd med gynekolog/genetiker.
Annen arvelig årsak til ovarialcancer
Med økende tilgjengelighet av multigen paneltester, vil stadig flere kvinner få påvist varianter i gener assosiert med OC hvor risikoøkningen er moderat og/eller usikker.
Hvis BRCA1 og BRCA2 genene er normale hos en med OC, og familiehistorien gir grunn til å mistenke arvelig faktor, bør hun henvises til genetisk veiledning/utredning.
Diagnostisk gentest (BRCA1, BRCA2)
Behandlende lege (gynekolog, onkolog) bør gi informasjon om arvelig bryst- og eggstokkreft og informere om at funn har konsekvens for behandlingen. Diagnostisk gentest av BRCA1 og BRCA2 tilbys alle med OC uansett alder. Pasienten bør få både muntlig og skriftlig informasjon. Den som har rekvirert gentesten, har ansvar for å formidle resultatet til pasienten.
Rekvisisjonen
- Fylles ut med gode kliniske opplysninger der indikasjon for testen tydelig fremgår.
- Skal inneholde informasjon om kreftsykdom i nær familie. NB! Hvis resultatet haster, merkes rekvisisjonen med grad av hast
Ved normalt funn
- Arvelig årsak kan ikke utelukkes. Dersom det er opphopning av kreftsykdom i familien, bør pasienten tilbys henvisning til genetisk veiledning/utredning.
Ved funn av sykdomsgivende genfeil
- Pasienten bør henvises til medisinsk genetisk veiledning etter at lege har informert om resultatet. Familieutredning og genetisk veiledning av familiemedlemmer er av stor betydning.
Ved funn av genvariant av usikker klinisk betydning (Variant of Uncertain Significance (VUS)
- Dersom laboratoriet opplyser om VUS skal pasienten henvises til medisinsk genetisk avdeling for informasjon om mulighet for videre utredning. En VUS må ikke behandles som en sykdomsgivende genfeil!
Genetisk utredning og veiledning ved genetiker
Genetisk veiledning inkluderer vurdering av egen risiko for kreft, tilbud om gentester og informasjon om konsekvenser av denne.
Ved påvist sykdomsgivende mutasjon skal genetiker tilby:
- Henvisning til brystdiagnosatisk senter for medisinsk oppfølging og risikoreduserende tiltak.
- Henvisning til gynekolog for orienterende samtale og en plan for tiltak vedr risiko for kreft i eggestokk/eggleder/peritoneum, reproduksjon, risikoreduserende tiltak inkludert kirurgi og seneffekter av disse.
I tilfeller hvor affisert slektning med OC ikke er tilgjengelig for testing, kan friske familiemedlemmer henvises til genetisk utredning.
Oppfølging ved påvist BRCA1 eller BRCA2 mutasjon
Bryster
Viser til Nasjonalt handlingsprogram for brystkreft, kap. 173 (Helsedirektoratet, 2019b).
Ovarier/salpinges/peritoneum
- Kvinner med BRCA mutasjon skal tilbys henvisning til gynekolog for orienterende samtale om risiko for sykdom, reproduksjon, risikoreduserende tiltak inkl kirurgi og seneffekter av disse.
Konsultasjonen skal inneholde gynekologisk anamnese og klinisk status. I samråd med pasienten lages en plan for gjennomføring av tiltak og follow-up som kan inkludere regelmessig ultralyd med OC-markører, informasjon om tiltak som berører seksualitet, reproduksjon (behov for nedfrysning av egg, tilbys ved KK RH), amming, prevensjon (p-piller), risikoreduserende tiltak som salpingectomi og oophorectomi, HRT og risiko for seneffekter etter oophorectomi og alternativ til hormonerstatning, hvis kvinnen har hatt brystkreft.
Tryggeste risikoreduserende tiltak er bilateral salpingoophorectomi. Det er ikke dokumentert effekt av regelmessig gynekologisk undersøkelse for å detektere OC på et tidlig nok tidspunkt (Dørum et al., 1999; Gaarenstroom et al., 2006; Hermsen et al., 2007; Hogg et al., 2004; Stirling et al., 2005).
- Kvinner med BRCA mutasjon tilbys henvisning til gynekolog fra 25 års alder for oppfølging i påvente av operasjon. De tilbys oppfølging med transvaginal ultralyd og måling av CA125 fra 30 års alder, tilpasses individuelt hver 6.-1 mnd. Det skal gis informasjon om undersøkelsens begrensninger for tidlig diagnose av kreft.
- Kvinner med BRCA mutasjon som ikke ønsker risikoreduserende operasjon, skal tilbys henvisning til gynekolog for oppfølging. De tilbys oppfølging med transvaginal ultralyd og måling av CA125 fra 30 års alder, tilpasses individuelt hver 6.-12. mnd. Det skal gis informasjon om undersøkelsens begrensninger for tidlig diagnose av kreft.
-
Gynekologisk oppfølging /kontroller før operasjon
(Dørum et al., 1999; Gaarenstroom et al., 2006; Hermsen et al., 2007; Hogg et al., 2004)
En plan for medisinsk oppfølging og tiltak lages i samråd med pasienten.
- Tema som skal berøres er regelmessig ultralyd med OC-markører, informasjon om tiltak som berører seksualitet, reproduksjon (behov for nedfrysning av egg, tilbys ved KK RH), amming, prevensjon (p-piller), risikoreduserende tiltak som salpingectomi og oophorectomi, HRT og risiko for seneffekter etter oophorectomi og alternativ til hormonerstatning, hvis kvinnen har hatt brystkreft.
- Det skal gis informasjon om screeningens begrensninger (Kehoe et al., 2007; 2014a). Publiserte screeningstudier har ikke dokumentert effekt på overlevelse (Sharma et al., 2006; Tailor et al., 2003). BRCA1/2 mutasjonsassosiert OC er oftest høygradig og utgår fra tube med hurtig spredning til peritonealhulen (Kurman et al., 2011). Diagnose i tidligst mulig stadium har betydning for prognose. Lavgradig OC som utgår fra ovariet, er bedre er egnet for vaginal ultralyd diagnostikk.
- Gynekologisk us m/vaginal ultralyd årlig (start 30års alder).
- Premenopausale cyster > 3 cm: oppfølging.
- Postmenopausal cyster > 1 cm: oppfølging/vurder BSO.
- Nytilkommet postmenopausalcyste > 1 cm: vurder BSO.
- obs ascites (tubecancer)
- Terskel for ny kontroll etter 23 mndr eller diagnostisk laparascopi bør ligge lavt.
- Serum CA 125 og HE4 (Langmar et al., 2011) hver 6. mnd. (CA-125 er forhøyet hos ca 50 % ved St I sykdom)
- Rask diagnostisk scopi/tomi hvis mistanke om malignitet
Risikoreduserende tiltak ved påvist BRCA1 eller BRCA2 mutasjon
Risikoreduserende bilateral salpingoophorectomi (RR-BSO)
BSO har dokumentert effekt (Barakat et al., 2002; Domchek et al., 2010; Finch et al., 2014; Rebbeck et al., 2009) reduserer risiko for ovarialcancer og øker overlevelse. Risikoreduserende BSO (RR-BSO) anbefales etter at hun har fått de barna hun ønsker og fra angitt alder. Kvinnen gis informasjon om at BSO gir signifikant reduksjon i OC risiko på 80 % for BRCA1 og BRCA2 mutasjonsbærere (Hartmann et al., 2016). Livskvalitetsstudier viser at BSO gir signifikant reduksjon i kreftrelatert bekymring, og 95 % er fornøyd med beslutningen. I noen studier har BSO vist å redusere risiko for brystkreft hos BRCA mutasjonsbærere hvis utført premenopausalt. Det bør utvises forsiktighet med bruk av BSO som risikoreduserende tiltak mot brystkreft da et nyere studie ikke viser samme reduksjon i BC risiko (Heemskerk-Gerritsen et al., 2015).
Preoperativ informasjon
Kvinnen tilbys henvisning til gynekolog for informasjon om inngrepet som inkluderer informasjon om seneffekter av inngrepet. Ved premenopausal BSO gis informasjon om langtids- og korttidseffekter av prematur menopause; risiko for kognitive og vasomotoriske besvær, redusert libido, osteoporose og økt risiko for hjerte- karsykdom (Dørum et al., 2008; Lobo, 2007; Madalinska et al., 2006).
Postoperativ informasjon
Hormonerstatning (HRT) anbefales hvis premenopausal BSO. Kvinnen bør tilbys oppfølgingssamtale hos gynkolog for justering av HRT og vurdering av dyspareuni og testosterontilskudd etter noen måneder og «samtale om livet» – eventuelt henvisning til sexolog (pasient og partner). Fastlege skal orienteres om risiko og kontroll av osteoporose.
Anbefalt alder for RR-BSO
BRCA1: 35–40 år.
BRCA2: 40–45 år.
Debut av ovarialcancer hos BRCA2 mutasjonsbærere er i gjennomsnitt 8–10 år senere enn for BRCA1 mutasjonsbærere, og RR-BSO kan derfor hos BRCA2 mutasjonsbærere vurderes utsatt til 40–45 årsalder (Kauff et al., 2008).
Peroperative undersøkelser
Grunnet høy rate av okkult cancer, skaldet gjøres nøye inspeksjon av peritoneale flater, liberalt med biopsier, samt skyllevæske til cytologi. Ved patologisk undersøkelse av ovarier/tuber skal alt materiale støpes inn og undersøkes med 2–3 mm snitt, obs STIC (SEE-FIM prosedyre) (Powell et al., 2011).
Restrisiko etter RR-BSO
Etter RR-BSO avsluttes eventuelle kontroller. Gjenværende risiko for peritonealcancer anses som lav (Evans et al., 2009).
Risikoreduserende salpingektomi
Origo for høygradig serøs OC, som er hyppigst, angis å være i tubene (Hanley et al., 2015). Salpingektomi anbefales som risikoreduserende tiltak, men er ikke tilstrekkelig for fullverdig risikoreduksjon (Kotsopoulos et al., 2020; Kurman et al., 2010). Det pågår en internasjonal multisenterstudie der Norge deltar, TUBA WISP II study (TUBectomy With Delayed Oophorectomy in High Risk Women to Assess the Safety of Prevention (TUBA-WISP-II), 2020-2040), hvor man undersøker effekten av salpingektomi på et tidligere tidspunkt, med utsatt ooforektomi (45 år ved BRCA1 mutasjon og 50 år ved BRCA2 mutasjon) (Harmsen et al., 2015; Nebgen et al., 2018).
P-piller
P-piller reduserer risiko for OC opptil 50 % hos BRCA1- og BRCA2-mutasjonsbærere særlig etter 30-års alder og ved langvarig bruk (Moorman et al., 2013). Det er uklart hvorvidt p-pillebruk øker brystkreftrisiko ved bruk før 30 års alder (Brohet et al., 2007; Iodice et al., 2010; Pasanisi et al., 2009).
Annet
- Hysterektomi (inkl tuber) med bevaring av ovarier gir redusert ovarialcancer risiko (Hankinson et al., 1993).
- Amming gir redusert risiko for OC hos BRCA1 mutasjonsbærere, men ikke signifikant reduksjon hos BRCA2 mutasjonsbærere (Hankinson et al., 1993).
Hormonerstatning (HRT) etter RR-BSO
HRT etter RR-SO skal tilbys kvinner som ikke har hatt brystkreft, fram til alder for naturlig menopause (Domchek et al., 2016). Behandlingen startes umiddelbart etter inngrepet og justeres etter noe tid. HRT fram til naturlig menopausealder vil ikke ha ugunstig effekt mht kreftrisiko (Hartmann et al., 2016).
- Østrogen og evnt progesteron (hvis uterus er intakt) erstattes. Gestagenspiral og østrogen-plaster anbefales for å unngå «first pass effect» i lever. Kvinnen bør følges til optimal erstatning er oppnådd.
- Testosteron bør vurderes som tillegg til østrogen for libidobesvær.
- Hvis kvinnen har hatt brystkreft, må østrogen-, progesteron- og testosteronerstatning diskuteres med onkolog.
Refusjon:
Østrogen/progesteron tabl/plaster: Blåresept E89.4 Eggstokksvikt etter behandling.
Hormonspiral og testosteron: søknad HELFO: E89.4 Eggstokksvikt etter behandling, vilkår 125.
Onkologisk behandling av arvelig ovarialcancer
BRCA status har behandlingsmessige konsekvenser for OC, se kap. 2.4, Medikamentell behandling, i handlingsprogrammet.
Histopatologi
Sist faglig oppdatert: 28202128.06.2021
Anbefalt klassifikasjon i henhold til WHO 2014 (Kurman et al., 2014):
De epiteliale svulstene klassifiseres som serøs, mucinøs, endometrioid, klarcellet, seromucinøs og Brenner tumor der alle kategorier har benigne, borderline og maligne svulster.
Maligne epiteliale svulster
- Lavgradig og høygradig serøse karsinomer
- Mucinøst karsinom (ikke etablerte kriterier for gradering)
- Seromucinøst karsinom
- Endometrioid karsinom, grad 1–3
- Klarcellet karsinom (ikke etablerte kriterier for gradering)
- Malign Brenner tumor
- Blandete typer
- Udifferensiert karsinom
Maligne blandete mesenkymale og epiteliale svulster
- Adenosarkom (her er det bare den mesenkymale komponent som er malign)
- Karsinosarkom (med eller uten heterologe elementer)
Forekomst
Sist faglig oppdatert: 28202128.06.2021
I Norge er ovarialcancer den 6. mest vanlige kreftformen blant kvinner. I 2018 og 2019 fikk henholdsvis 478 og 504 kvinner eggstokk-, eggleder og bukhinnekreft (Larsen, 2019). Insidensen øker med alder. Livstidsrisiko for sykdommen hos norske kvinner: 1,2 % (Larsen, 2018). Gjennomsnittsalder ved diagnosetidspunkt er 68 år. Insidensen varierer i ulike land fra 9–17/100 000 kvinner, høyest i I-land.

Etiologi
Ukjent hos 80–85 % (sporadisk form).
Nedarvete mutasjoner som gir øket risiko for kreft hos 10–20 %. Viktigste er mutasjoner i BRCA1 og BRCa2 genet. Se Genetikk.
Risikofaktorer
Sist faglig oppdatert: 28202128.06.2021
Økt risiko
Familiær opphoping utgjør 10–15 % av tilfellene, og skyldes oftest sykdomsgivende mutasjoner i BRCA1 og BRCA2 genene. En mindre andel skyldes Lynch syndrom med mutasjoner i mismatch repair (MMR) genene MLH1, MSH2, MSH6, PMS2 (Nakamura et al., 2014).
Infertilitet, tidlig menarche, sen menopause, østrogen-/progesteron-ubalanse og endometriose er etiologiske faktorer. En akutt eller en kronisk inflammasjon og aktivering av immunsystemet i tuben og fimbrieapparat kan forårsakes av gjentatte eggløsninger, retrograd blødning og reparasjoner av overflateepitelet i østrogenrike follikler antas å gi økt risiko for karsinom utvikling. (Fathalla, 1971; Purdie et al., 2003).
OC risiko er assosiert med økende høyde og body mass index (BMI) (Collaborative Group on Epidemiological Studies of Ovarian Cancer, 2012).
Redusert risiko
Flere graviditeter og amming gir en viss beskyttelse, sannsynligvis på grunn av ovulasjons-hemning (Hunn et al., 2012).
Bruk av p-piller i mer enn 5 år kan redusere risikoen for OC med > 50 %. Ved bruk av p-piller etter 30 års alder vedvarer risikoreduksjonen flere år etter avsluttet bruk (Collaborative Group on Epidemiological Studies of Ovarian Cancer et al., 2008).
Sterilisering og hysterektomi og lavdose aspirin reduserer risiko (Brinton et al., 2009; Trabert et al., 2014).
Screening
Sist faglig oppdatert: 28202128.06.2021
Det er ikke vist redusert mortalitet ved ulike screeningtiltak. Screening er anbefalt i høyrisiko-gruppene, se avsnitt Økt risiko.
Prognose
Sist faglig oppdatert: 28202128.06.2021
Viktige prognostiske faktorer er:
- Stadium
Stadium I: | Komplett staging, differensieringsgrad, DNA ploiditet og tumorruptur (Paulsen et al., 2011; Vergote et al., 2001). |
Stadium II–IV: | Mengde resttumor etter primærkirurgi, allmenntilstand, albumin, (alder), histologisk type (Winter et al., 2007). |
- Klarcellet tumor (alle stadier) og mucinøs tumor med resttumor etter primær kirurgi har dårligere prognose enn andre histologiske typer (Harrison et al., 2008; Itamochi et al., 2008).
- Forhøyet CA125 etter 2 kurer kan indikere dårlig respons og prognose (Makar et al., 1993).
- BRCA1 og 2 mutasjonsbærere synes å ha bedre prognose (Modan et al., 2001).
Symptomer
Sist faglig oppdatert: 28202128.06.2021
En norsk systematisk oversikt tyder på at 93 % har symptomer før diagnose (Paulsen et al., 2005).
Utflod og vaginalblødning kan være symptomer ved egglederkreft.
Abdominalplager
Trykk, endret avføringsmønster, smerter*, utspilthet*, akutte smerter (torkvering, ruptur, blødning)
Rask metthetsfølelse, vanskeligheter med spising*
Endret vannlatingsmønster*
Redusert allmenntilstand, vekttap
Halsbrann, anoreksi, kvalme
Vaginalblødning (sjeldent)
Symptom på DVT i underekstremiteter
Dyspné (pleuravæske)
Paraneoplastiske fenomener
* Disse inngår i ovarialcancer symptomindeks.
(Sensitivitet: 57 % i tidlig stadium, 80 % i avansert. Spesifisitet 90 %) (Goff et al., 2007) (B)
Diagnostikk
Sist faglig oppdatert: 28202128.06.2021
Forslag henvisningsmal
Pakkeforløp eggstokkreft (ovarialcancer)
Det skal være mistanke om kreft i eggstokk/eggleder/bukhinne, RMI > 200.
Pasientdata |
Pasientens navn: Adresse: Telefonnr: Mobil: |
Henviserdata |
Henvisende sykehus: Henvisende lege: Hvem skal kontaktes hvis vi trenger mer informasjon: Telefonnr: |
Juridiske data |
Ansennitetsdatum: Frist helsehjelp og til hva dvs utredning eller utredning/behandling Datum for sent henvisning: Pakkeforløp start: Ventetid slutt: |
Anamnese og status |
Resymé av sykdommen: Andre sykdommer / operasjoner: Obs hvis andre sykdommer som kan påvirke mulighet for anestesi, utredes dette lokalt, f.eks. av kardiologisk / indre medisinsk type. Kopi av aktuelle tilsynsnotater og resultater vedlegges. Medisinliste: Kort status presens: performance status (ECOG), høyde og vekt. |
Undersøkelsesfunn:
- GU med ultralyd/beskrivelse
- CA 125, HE4 og CEA. Beregning av RMI
- Ved mistanke om germinalcelle tumor: inkl AFP og beta-HCG
- Ved mistanke om granulosacelletumor: inkl Inhibin B og Anti-Müllerian hormon.
- Ved mistanke om tarmaffeksjon og/eller forhøyet CEA> 5 ng/ml: vurder kolonoskopi og gastroskopi
CT thorax abdomen bekken (diagnostisk kvalitet; max 3 mm snitt i 3 plan, ikke strålebesparende protokoll, intravenøs og peroral kontrast), ikke eldre enn 4 uker.
- Beskrivelse med kortfattet relevante funn.
Påvisning av incidentalom i binyrer utredes med hormonprøver, ev. CT. - Bilder sendes elektronisk eller på CD.
Biopsi ved St III–IV er ønskelig, og må foreligge før neoadjuvant kjemoterapi. Histologi vedlegges (inkludert immunundersøkelse: minimum P53, WT1, PAX8). Evnt cytologi ascites- og pleuravæske til «celleblokk».
Ved hydronefrose bør urinveier avlastes.
Tromboseprofylakse: Hvis store tumores eller avansert sykdom, vurder profylaktisk Fragmin.
Utredning
Sist faglig oppdatert: 28202128.06.2021
- Funksjonstilstand (ECOG).
- GU med ultralyd/beskrivelse.
- CA 125, HE4 og CEA. Beregning av RMI.
- Ved mistanke om germinalcelle tumor: inkl AFP og beta-HCG.
- Ved mistanke om granulosacelletumor: inkl Inhibin B og Anti-Müllerian hormon.
- Ved mistanke om tarmaffeksjon og/eller forhøyet CEA> 5 ng/ml, CA125/CEA >25 (Buamah et al., 1990; Sørensen et al., 2011; Yedema et al., 1992): vurder kolonoskopi eller CT kolon og gastroskopi.
- Beregning av RMI (Risk of Malignancy Index). Score > 200 gir høy sensitivitet for ovarialcancer (Tingulstad et al., 1999).
- CT TAB, rekonstruert til tynne snitt (max 3 mm) i tre plan. Viktig for best bildekvalitet; derfor bør det ikke anvendes lav stråledose, selv på unge pasienter. Etter europeiske retningslinjer (ESUR) kan det gjøres multiparametrisk MR for å avklare usikre lesjoner i ovariene, det vil si lesjoner som er «indeterminate» etter vanlig utredning med tumormarkører og TVU. Påvisning av incidentalom i binyrer utredes med hormonprøver.
- Biopsi ved St III-IV er ønskelig, og obligatorisk før neoadjuvant kjemoterapi. Histologi/ immunundersøkelse: minimum P53, WT1, PAX8. Ascites til stede: send rikelig med væske nok til «celleblokk»/immunundersøkelse, kan erstatte biopsi.
- Hvis biopsi/histologi viser mucinøst karsinom, men immunundersøkelse er inkonklusiv, diskuter preoperativt med patolog og evnt gastrokirurg.
- Hvis pleuravæske, ta cytologisk undersøkelse for stadium 4-dokumentasjon.
- Genetisk testing for BRCA1 og BRCA2 mutasjon i germline tilbys alle. Det skal gis informasjon om risiko for annen kreft, for nytte av ny targeted terapi (PARP inhibitor) og kreftrisiko for øvrige familie hvis positiv test.
Pasient med påvist mutasjon: -
- har høy risiko for brystkreft, får tilbud om follow-up av bryst.
- Friske familiemedlemmer til mutasjonsbærere tilbys genetisk veiledning og gentest/evnt. informasjon om profylaktiske risikoreduserende tiltak (p-pille, risikoreduserende salpingectomi, oophorectomi og HRT) (Domchek et al., 2010; Erickson et al., 2013; Gaba et al., 2019), årlig MR/mammografi og tilbud om profylaktisk mastectomi. Gynekologisk kontroll avsluttes når tuber og ovarier er fjernet.
- Skal tilbys behandling med PARP inhibitor vedlikeholdsbehandling i 1. linje eller ved recidiv av carboplatin sensitiv sykdom.
- Genetisk testing for BRCA1–2 mutasjon i tumor (somatisk BRCA1–2 test) skal tilbys til pasienter som ikke er mutasjonsbærere. Tilbys ved Radiumhospitalet.
Supplerende undersøkelser på spesielle indikasjoner
- Ved lav albumin, vurder preoperativ ernæringstilskudd, henvisning til ernæringsfysiolog
- Ved hydronefrose bør urinveier avlastes.
- Tromboseprofylakse: Hvis store tumores eller avansert sykdom, vurder profylakse
- Endometriebiopsi ved unormal vaginalblødning.
- Cytologisk prøve ved uklar årsak til ascites og pleuravæske. Send rikelig med væske nok til «celleblokk»/immunundersøkelse P53, WT1, PAX8.
- Laparoskopi/ekspl laparatomi (Decloedt et al., 1999) ved ikke konklusive preoperative undersøkelser, eller for å vurdere om man kan maksimalt debulke.
- Ikke nordiske pasienter; vurder Hepatitt B- og C testing, samt HIV status. Høy forekomst av hepatitt i sør-øst Asia, Russland, Latvia, Baltikum og Afrika (betydning for optimal onkologisk behandling. Konf Infeksjonsmedisinsk avd OUS for vurdering).
Differensialdiagnoser
Benign ovarialtumor
Endometriose
Tubo-ovarial abscess (actinomycose)
Tbc (i bekkenet)
Myoma uteri
Ikke-epitelial ovarialtumor
Sarcom utgått fra ovarier eller uterus
Metastaser til ovariene
GI-tumor (rectumcancer, coloncancer)
Divertikulitt
Urologisk tumor (bekkennyre)
Lymfom
Spredningsmønster
(Tropé et al., 2010)
Intraperitonealt
Intrapleuralt
Lymfogent til lymfeknuter i bekkenet og langs aorta
Hematogent til lever og/eller lunger
Stadieinndeling
Sist faglig oppdatert: 28202128.06.2021
| Stadium I: Tumor begrenset til eggstokk(ene) eller eggleder(e). | |
| IA: | Tumor begrenset til en eggstokk (kapsel intakt) eller eggleder; ingen tumor på eggstokk- eller egglederoverflaten; ingen maligne celler i ascites eller skyllevæske. |
| IB: | Tumor i begge eggstokker (kapsel intakt) eller eggledere; ingen tumor på eggstokk- eller egglederoverflaten; ingen maligne celler i ascites eller skyllevæske. |
| IC: | Tumor begrenset til en eller begge eggstokker eller eggledere inkl en av følgende: |
| 1C1: | kirurgisk søl |
| 1C2: | kapselruptur før kirurgi eller tumor på eggstokk- eller egglederoverflaten |
| 1C3: | maligne celler i ascites eller skyllevæske |
|
|
|
| Stadium II: Tumor i en eller begge eggstokker eller eggledere med utbredelse begrenset til bekkenet eller primær peritoneal cancer | |
| IIA: | Tumorutbredelse i bekkenet og/eller med innvekst/metastasering til livmor og/eller eggledere og/eller eggstokker |
| IIB: | Tumorinnvekst/metastasering til andre vev i det lille bekkenet |
|
|
|
| Stadium III: Tumor i en eller begge eggstokker eller eggledere eller primær peritoneal cancer, med (verifisert) spredning utenfor bekkenet, men begrenset til bukhulen og/eller metastaser til lymfeknuter retroperitonealt (bekken eller para-aortalt). | |
| IIIA1: | Bare positive retroperitoneale lymfeknuter (verifisert) |
| IIIA1.1: | Metastaser opp til 10 mm i diameter til øvre del av buken |
| IIIA1.2 | Metastaser mer enn 10 mm i diameter til øvre del av buken |
| IIIA2: | Mikroskopisk spredning utenfor bekkenet begrenset til bukhulen med eller uten positive lymfeknuter retroperitonealt |
| IIIB: | Metastaser på høyst 2 cm i øvre del av buken, med eller uten positive retroperitoneale lymfeknuter |
| IIIC: | Metastaser på mer enn 2 cm i øvre del av buken, med eller uten positive retroperitoneale lymfeknuter (inkl tumor til lever- eller miltkapsel uten innvekst i parenkym) |
|
|
|
| Stadium IV: Fjernmetastaser ekskl. peritoneale metastaser | |
| IVA: | Pleuravæske med positiv cytologi |
| IVB: | Metastaser i parenkym og metastaser til ekstra-abdominale organer (inkl. inguinale lymfeknuter og lymfeknuter utenfor bukhulen). |
Behandling
Sist faglig oppdatert: 28202128.06.2021
Behandling for ovarial cancer i Norge er sentralisert da studier viser at behandling på sykehus med spesialkompetanse i gynekologisk onkologi kan gi bedre langtidsoverlevelse (Giede et al., 2005; Paulsen et al., 2006; Vernooij et al., 2007) (B) og er kostnadseffektivt (Bristow et al., 2007) (B).
Ved RMI > 200 sendes henvisning til gynekologisk kreft senter med spesialkompetanse for primæroperasjon (Paulsen et al., 2006; Tingulstad et al., 1999; Vernooij et al., 2007) (B)
Kirurgi
Primær kirurgi er viktig for:
- Riktig stadium påvises. Er vist å gi bedre prognose.
- Maksimal tumorreduksjon (cytoreduktiv kirurgi). Målet er ingen makroskopisk resttumor. Hvis det ikke er mulig å oppnå 0 resttumor ved primær debulking kirurgi (PDS), er neoadjuvant kjemoterapi (NACHT) med interval debulking kirurgi (IDS) ved kjemosensitiv sykdom å foretrekke. Ved lavgradig eller mucinøs sykdom med mindre kjemosensitivitet kan PDS med resttumor være aktuelt (Chi et al., 2006; Fotopoulou et al., 2021) (B). Ved funn som gir som gir resttumor >1 cm, skal det angis indikasjon for kirurgi/neoadjuvant kjemoterapi / evnt. forsinket primær kirurgi. Vurdering og konklusjon på MDT møte (dokumenteres i journal).
Neoadjuvant kjemoterapi/forsinket primær kirurgi:(Bristow et al., 2006; Fotopoulou et al., 2021; Gill et al., 2017; Kehoe et al., 2015; Kessous et al., 2017; Marchetti et al., 2017; Phillips et al., 2018; Vergote et al., 2010). Vurdering og konklusjon på MDT møte (dokumenteres i journal). Det tas CA125 ved hver kur.
- Det er vist at kirurgi etter 3. kur fortsatt kan gi overlevelsesgevinst, hvis resttumor < 1 cm kan oppnås. Ved forventede restforandringer mellom 1 og 2 cm, foretas individuell vurdering, idet gevinsten er mindre. Derfor vil man normalt ikke utføre store, langvarige eller risikable operasjoner for å oppnå dette målet (Bristow et al., 2006; Gill et al., 2017; Kehoe et al., 2015; Kessous et al., 2017; Marchetti et al., 2017; Phillips et al., 2018; Vergote et al., 2010).
- Hvis forsinket primær operasjon utføres etter 5. kur, er det kun vist overlevelses gevinst ved 0 resttumor. Ytterligere 2 kurer må vurderes postoperativt.
Ved alvorlig komorbiditet/palliasjon/symptomlindring:
- Palliativ kirurgi kan være aktuelt ved stor primærtumor og/eller omentmetastase.
- Evnt symptomlindrende kjemoterapi alene.
Veiledende indikasjoner for neoadjuvant kjemoterapi (NACT):
- Etter eksplorativ laparatomi/skopi med funn som gir som gir resttumor >1 cm.
- Betydelig komorbiditet, pasienten vurderes til mindre radikal kirurgi.
- Fersk blodpropp (< 6 uker), pasienten kan vanligvis primæropereres etter 4–6 ukers behandling med antikoagulering.
- Multiple lungemetastaser.
- Mediastinale lymfeknuter over 2 cm.
- Intrahepatiske metastaser (ikke absolutt stopp-kriterium).
- Metastatiske lymfeknuter (feks ved porta hepatis eller mesenterica superior) som ikke anses resektable.
- Tumor som trenger reseksjon av duodenum eller store deler av tynntarm.
- Betydelig tynntarmscarcinomatose eller infiltrativ tumorvekst sentralt i tynntarmskrøs.
- Ikke resektable pleurametastaser over 1 cm.
Anbefalt kirurgisk prosedyre
(Tropé et al., 2010)
Primær kirurgi
Stadium I
Anbefalt kirurgisk prosedyre
- Midtlinjesnitt.
- Ascites eller peritoneal skyllevæske for cytologi.
- Systematisk beskrivelse av hele bukhulen og angi evnt PCI score (peritoneal cancer index) (Jacquet et al., 1996).
- Suspekte lesjoner ekstirperes.
- Frysesnitt er aktuelt.
- Tumorruptur skal registreres (bør unngås), sammen med grad av adheranser.
- Hysterektomi.
- Bilateral salpingo-oophorektomi (BSO).
- Omentektomi, infrakolisk.
- Lymfadenektomi i bekkenet og para-aortalt opp til venstre nyrevene, inngår som ledd i stadieinndeling (Camara et al., 2009; Harter et al., 2017).
Ved kjent histologi, se Restaging ved st I (Heitz et al., 2018).
Ved «serøs tubart intraepitelialt karsinom» (STIC) (Weinberger et al., 2016; Wethington et al., 2013) følges angitt kirurgisk prosedyre beskrevet over. Premenopausale vurderes individuelt. Skyllevæske tas fordi bukhulen er vanligste sted for spredning. Det er ikke vist at lymfadnectomi og/eller kjemoterapi gir bedre prognose, hvis kun STIC er påvist (Wethington et al., 2013), og anbefales derfor ikke. Histologi med SEE-FIM prosedyre (3 mm tette snitt) av tuber/ovarier (Powell et al., 2011). Pasienten bør anbefales BRCA1–2 testing. Follow-up som ved karsinom.
-
- Ved mucinøs tumor (Hess et al., 2004) fjernes også appendix. Full tumorekstirpasjon har prognostisk betydning.
- Ved usikkert origo eller mistenkt pseudomyxoma peritonei bør gastrokirurg konsulteres, helst preoperativt. Det kan være aktuelt med HIPEC (hyperterm intraperitoneal kjemoperfusjon
Fertilitetsbevarende kirurgi (Bentivegna et al., 2016)
Fertilitetsbevarende behandling krever en grundig samtale med pasienten med objektiv informasjon som inkluderer vurdering av mulighet for å bli gravid, behandlingsalternativ, risiko for tilbakefall og prognose.
- Regranskning av histologi.
- Endometriebiopsi anbefales ved diagnose.
- Ensidig salpingo-ooforektomi, cytologi, omentektomi og eventuelt lymfeknute-staging kan vurderes hvis følgende gjelder:
- Kvinner i fertil alder med barneønske
- Stadium IA grad 12 karsinom og stadium IC1 grad 1 karsinom
- klarcellet histologisk type ble tidligere ikke anbefalt, men diskuteres nå
- Etter avsluttet barneønske, bør man vurdere å fjerne gjenværende adnex/ovarium hos kvinner med tumor med serøs histologi.
Restaging ved stadium I (Heitz et al., 2018)
Ved antatt benign tumor, der histologien uventet er malign, henvises til gynekologisk kreftsenter til vurdering for komplett staging og kjemoterapi.
Restaging utføres etter primæroperasjon uten full staging, hvis det er relevant risiko for metastaser og vurderes i forhold til tumortype, valg av videre adjuvant behandling og pasientens almentilstand. Se kapittelet om medikamentell behandling og flytskjema for adjuvant behandling.
Høyrisikogruppen: Restaging utføres etter primæroperasjon uten full staging. Lymfadenectomi for restaging alene kan unnlates, hvis lymfeknute status ikke endrer pasientens videre behandling. Dokumentasjonen er svak og gir øket mortalitet (Heitz et al., 2018). (Ved Radiumhospitalet er det consensus at lymfadenectomi ikke utføres ved normale lymfeknuter på CT og lymfeknute status ikke endrer pasientens videre behandling).
Restaging kan utføres med minimal invasiv kirurgi:
- Alle med høygradig eller grad 3 karsinom.
- Klarcellet histologi; IA-IC1: adjuvant kjemoterapi kan unnlates, hvis fullt staget.
Lavrisikogruppen (lavgradige og grad 1–2, ikke klarcellet og mucinøs type):
Restaging vurderes i forhold til valg av videre adjuvant behandling og pasientens allmenntilstand. Det er lav risiko for okkulte metastaser (Gouy et al., 2017; Heitz et al., 2018; Lago et al., 2016; Minig et al., 2017; Muyldermans et al., 2013). Det forutsettes at hysterektomi og BSO er utført.
- Omentektomi vurderes individuelt.
- Reoperasjon for å gjøre manglende lymfadenektomi anses ikke indisert når CT ikke viser suspekte lymfeknuter, men kan påvirke indikasjon for adjuvant kjemoterapi. Se kapittelet om medikamentell behandling og flytskjema for adjuvant behandling.
- Ved mucinøst karsinom: appendectomi. Reoperasjon for appendectomi er ikke indisert hvis appendix er beskrevet normal.
- Hos premenopausale må fertilitet og risiko diskuteres med pasienten (Heitz et al., 2018). Se Fertilitetsbevarende behandling beskrevet over.
Stadium II–IV
Anbefalt kirurgisk prosedyre
Buken åpnes med begrenset midtlinjesnitt/diagnostisk laparatomi eller laparskopi, hvis usikkerhet om radiologiske funn.
- Målet er å oppnå 0 resttumor (Fotopoulou et al., 2021).
- Hvis det ikke anses mulig å fjerne all tumor over 1 cm eller det kreves langvarige eller risikable operasjoner med usikkert utfall for å oppnå dette, avsluttes inngrepet.
- Pasienten vurderes for neoadjuvant kjemoterapi og forsinket primær kirurgi.
- Det bør tas en representativ biopsi uten å risikere forsinket oppstart kjemoterapi.
- Tarmkirurgi skal kun vurderes ved truende ileus.
- Palliativ kirurgi kan være aktuelt ved stor primærtumor og/eller store omentmetastaser som er lett tilgjengelig for ekstirpasjon.
Midtlinjesnitt
Ascites eller peritoneal skyllevæske for cytologi.
Systematisk beskrivelse av hele bukhulen.
PCI score registreres.
Grad av adheranser / innvekst / tumorruptur registreres
Hysterektomi
Bilateral salpingo-oophorektomi
Omentektomi
- infrakolisk ved stadium II,
- ved stadium III inkludert suprakolisk og ut mot begge flexurer.
Extirpation av all carcinomatose hvis mulig.
Tarmreseksjon, splenektomi, diafragmastripping ved behov.
Ved avansert sykdom er det vanlig via retroperitoneal tilgang å fjerne alle tumores «en bloc» i bekkenet (preparat inkluderer da uterus/ovarial tumores/bekken peritoneum/ rektosigmoid resektat).
Lymfadenektomi (Bachmann et al., 2015; Camara et al., 2009)
- Ved stadium IIA utføres lymfadenektomi i bekkenet og paraaortalt (som ved st I).
- Ved stadium IIB–IIIC fjernes «bulky nodes» og metastasesuspekte lymfeknuter beskrevet på CT (Harter et al., 2017; Panici et al., 2005)
- Ved stadium IV fjernes forstørrede, resektable lymfeknuter beskrevet på CT (kardiofrenisk, supraklavikulært, i lysker og axiller).
Ved mucinøs tumor viktig å oppnå tumorfrihet, appendix fjernes. Ved usikker origo bør gastrokirurg konsulteres peroperativt. HIPEC behandling kan være aktuelt.
Konklusjon i operasjonsbeskrivelse med dokumentasjon av resttumor, størrelse og lokalisasjon og limiterende årsak.
Forsinket primærkirurgi
Utføres vanligvis 3–4 uker etter 2.–3. kur etter ny vurdering som ved primær kirurgi.
Det er overlevelsesgevinst ved resttumor 0, men også hvis <1 cm kan oppnås (du Bois et al., 2009b). Det er kun vist overlevelses gevist ved 0 resttumor hvis forsinket primær operasjon utføres etter 5. kur. Ved forventede restforandringer mellom 1 og 2 cm, foretas individuell vurdering, idet gevinsten er mindre. Derfor vil man normalt ikke utføre store, langvarige eller risikable operasjoner for å oppnå dette målet (Bristow et al., 2006; Gill et al., 2017; Kehoe et al., 2015; Kessous et al., 2017; Marchetti et al., 2017; Phillips et al., 2018; Vergote et al., 2010)
Recidiv kirurgi
Kirurgi skal vurderes. Aktuelt ved lokaliserte, særlig ved sene og potensielt platinum-sensitive residiver uten ascites (Coleman et al., 2019; Szczesny et al., 2018). Positiv effekt på overlevelse forutsetter 0 resttumor og etterfølges av adjuvant kjemoterapi. PET-CT kan være aktuelt.
Medikamentell behandling
Sist faglig oppdatert: 21202221.12.2022
Terminologi
Terapeutisk behandling: Medikamentell behandling som virker mot manifest sykdom. Gis postoperativt ved avansert sykdom (stadium II–V), neoadjuvant eller hvor medikamentell behandling gis alene.
Adjuvant behandling: Tilleggsbehandling med medikamentell behandling etter operasjon hvor all detekterbar sykdom er fjernet, men hvor det gjenstår en statistisk risiko for tilbakefall på grunn av okkult sykdom.
Neoadjuvant behandling: Medikamentell behandling gis før planlagt operasjon for å redusere tumormengde eller optimalisere pasientens almenntillstand før kirurgi.
Primærbehandling/1. linjebehandling
Stadium I
Indikasjon for adjuvant behandling
Serøs |
|
1A, lavgradig | Ingen adjuvant kjemoterapi |
1B-C, lavgradig | Adjuvant kjemoterapi (kan unnlates hvis fullt staget) |
1A-C, høygradig | Adjuvant kjemoterapi |
Endometrioid |
|
1A, grad 1–2 | Ingen adjuvant kjemoterapi |
1A, grad 3 | Adjuvant kjemoterapi |
1B-C, grad 1–2 | Adjuvant kjemoterapi (kan unnlates hvis fullt staget) |
1B-C, grad 3 | Adjuvant kjemoterapi |
Mucinøs |
|
1A expansil grad 1–2 | Ingen adjuvant kjemoterapi |
1A infiltrativ (assosiert med høy risiko) | Adjuvant kjemoterapi (kan unnlates hvis fullt staget), dokumentasjon er usikker for kjemoterapi (Gouy et al., 2017; Muyldermans et al., 2013) |
1B-C, expansil grad 1–2 | Adjuvant kjemoterapi (kan unnlates hvis fullt staget) |
1B-C, infiltrativ | Adjuvant kjemoterapi (Gouy et al., 2017; Muyldermans et al., 2013) |
Klarcellet |
|
1A-1C1: | Adjuvant kjemoterapi (kan unnlates hvis fullt staget) |
1C2–3: | Adjuvant kjemoterapi |
Flytskjema for adjuvant behandling
(ESMO–ESGO consensus conference recommendations (Colombo et al., 2019b))




Type adjuvant kjemoterapi:
Det mangler evidens for type kjemoterapi (Chan et al., 2010; Colombo et al., 2019a; Hogen et al., 2017).
Behov for adjuvant kjemoterapi vurderes i forhold til gjennomført kirurgi og pasientens almentilstanl. Se detaljer i Flytskjema for adjuvant behandling.
- Ved st IA-B anbefales 6 kurer carboplatin single, forutsatt fullstendig staget eller carboplatin/paclitaksel, minimum 3 kurer.
- Ved høygradig serøse og stadium 1C (uavhengig av histologi) anbefales 6 kurer carboplatin/paclitaxel eller carboplatin single (Chan et al., 2010; Colombo et al., 2019b; Hogen et al., 2017; Paulsen et al., 2011; Trimbos et al., 2003).
- Ved mucinøs histologi: Behandling som ved coloncancer (konf gastro-onkolog): 5‑fluorouracil, kalsiumfolinat og oxaliplatin (FLOX/FOLFOX) totalt 9 kurer med 2 ukers intervaller (Hess et al., 2004). Oxaliplatin hver 3. uke + Capecitabin (per os) 14 dager, 6 kurer (Gore et al., 2015; Shi et al., 2017) kan vurderes. Alternativt 5-fluorouracil, kalsiumfolinat og irinotekan (FLIRI/FOLFIRI).
Stadium II–IV
Alle tilbys medikamentell behandling forutsatt tilfredsstillende almenntillstand.
Behandlingen bør starte når pasienten er rimelig restituert etter kirurgi. Tid fra kirurgi til oppstart kjemoterapi der det var 0 resttumor, er en prognostisk faktor, og tilstrebes innen 3uker (Mahner et al., 2013). Hvis preoperativ histologi foreligger, kan behandlingen startes tidligere.
Neoadjuvant behandling
(se detaljer under Logistikk)
Ved kontraindikasjon mot primærkirurgi skal neoadjuvant medikamentell behandling vurderes.
Det tas CA125 ved hver kur.
Det gis 2–3 kurer før ny CT og ny vurdering på MDT møte av operabilitet.
Postoperativt kontinueres kjemoterapi vanligvis inntil 6 kurer.
Hvis pasienten ikke er operabel, kontinueres kjemoterapi, totalt 6 kurer.
Type medikamentell behandling
Standard behandling:
Kombinasjonsbehandling med Karboplatin (AUC=5, GFR 40–125 ml/min) og Paklitaxel (175 mg/m2) iv, 6 kurer med 3 ukers intervaller (Ozols et al., 2003) (ikke ved mucinøs cancer).
Bevacizumab:
DMP/Beslutningsforum godkjent bruk på bakgrunn av:
- 2 prospektive, randomiserte studier, GOG-218 og ICON7 (Perren et al., 2011). Økt totaloverlevelse vist for pasienter med dårligst prognose, «høyrisiko-gruppen»: inoperable, st IV og st III med resttumor >1 cm etter primær operasjon.
- Aurelia studien med Bevazicumab ved resistent symptomgivende OC (Pujade-Lauraine et al., 2014; Stockler et al., 2014).
Definisjon for bruk (i alle helseforetak, bekreftet av NFGO styremøte april 2018):
- Inoperable, st IV, st III primæroperert med resttumor > 1 cm, og pasienter som fikk forsinket primæroperasjon/neoadjuvant kjemoterapi inngår i «høyrisikogruppen».
- Uttalt ascites og pleuravæske hos residivpasienter, helst i kombinasjon med ukentlig taxol.
Bruk av bevacizumab: Anbefalt dosering er 7,5 mg/kg hver 3. uke:
- Ved st III med resttumor> 1 cm og st IV i tillegg til kjemoterapi (uavhengig av histologi).
- Ved neoadjuvant kjemoterapi
- Ved MDT konklusjon «inoperabel»: bevacizumab gis ved alle kurene.
- Bevacizumab gis ikke ved kur før og etter kirurgi.
Ved mucinøs histologi:
Primærbehandling som ved coloncancer, konf med gastro-onkolog: 5-fluorouracil, kalsiumfolinat og oxaliplatin (FLOX/FOLFOX) totalt 9 kurer med 2 ukers intervaller (Hess et al., 2004). Oxaliplatin hver 3. uke + Capecitabin (per os) 14 dager, 6 kurer (Gore et al., 2015; Shi et al., 2017) kan vurderes. Alternativt 5-fluorouracil, kalsiumfolinat og irinotekan (FLIRI/FOLFIRI).
Tillegg av Bevazicumab kan vurderes (Gore et al., 2015; Perren, 2016).
Dessuten bør pasienter som ikke har RAS (KRAS/NRAS) mutasjon tilbys EGFR hemmer, mens de med MSI (4 % av coloncancerne) kan ha effekt av PD-1 (må søkes). Konf onkolog.
- Ved neuropati. Ved funksjonsnedsettende/svært plagsom/høy risiko for neuropati (ved persisterende grad 2 neuropati ved neste syklus, CTCAE kriterier) byttes paclitaxel ut med docetaxel (Vasey et al., 2001). Hvis taxaner er kontraindisert (nevropati eller allergi), kan det erstattes med Pegylert liposomal doxorubicin (Pignata et al., 2011), alternativt Gemcitabin.
- Ved allergi (men ikke ved anafylaxi) mot Carboplatin kan Cisplatin i hypersensitivitetsregime forsøkes. Ved kontraindikasjon mot platinum, kan trabectidine og pegylert liposomal doxorubicin forsøkes.
- Ved sterkt redusert almenntillstand eller høy alder, kan enkeltstoffbehandling (Carboplatin, AUC 5 eller 4) være aktuelt (von Gruenigen et al., 2017).
- Ved estimert GFR <40ml/min gjøres renografi med GFR måling (Oguri et al., 2015). Ved sterkt redusert nyrefunksjon (GFR < 40) kan enkeltstoff gis, paclitaxel, eller pegylert liposomal doxorubicin.
Vedlikeholdsbehandling:
Bevacizumab dosering er 7,5 mg/kg etter avsluttet primærbehandling til «høyrisikogruppen», gis hver 3. uke inntil progresjon eller toksisitet, inntil 12 kurer (Hinde et al., 2016).
Samme «høyrisikogruppe» kan få Bevacizumab kombinert med PARPinhibitor hvis BRCA 1-2-mutert (i kimbane eller i tumor), høygradig kreft i eggstokk-, eggleder- eller bukhinnekreft, som har respondert (fullstendig eller delvis) etter fullført platinabasert kjemoterapi. PARP inhibitor har best effekt der det foreligger BRCA1–2 mutasjon i kimbanen eller somatisk (i tumor) eller ved HRD positiv tumor som vedlikeholdsbehandling etter respons på platinum basert behandling i 1. og 2. linje (Essel & Moore, 2018; Ledermann et al., 2012; Ledermann et al., 2014).
PARP inhibitorene olaparib (Lynparza) og Niraparib (Zejula) er godkjente vedlikeholdsbehandlinger i 1. linje ved FIGO stadium III og IV, BRCA 1-2-mutert (i kimbane eller i tumor), høygradig kreft i eggstokk-, eggleder- eller bukhinnekreft, som har respondert (fullstendig eller delvis) etter fullført platinabasert kjemoterapi.
Se beslutninger i nye metoder:
- Olaparib (Lynparza) – indikasjon IV (nyemetoder.no)
- Niraparib (Zejula) - Indikasjon IV (nyemetoder.no) gjelder for PARP hemmer i 1. linje, men ikke i kombinasjon med bevacizumab
Olaparib (Lynparza) skal prioriteres framfor niraparib grunnet kostnad, se LIS-avtaler: Onkologiske og kolonstimulerende legemidler (pdf, sykehusinnkjop.no)
(Radiumhospitalet tilbyr somatisk BRCA1–2 test av fersk biopsi, pas kan henvises)
- Aromatasehemmere bør vurderes som vedlikeholdsbehandling og har lav bivirkningsprofil (feks Letrozol (Femar 2.5 mg x1)) til progresjon.
- Lavgradig serøs hormonreseptor positiv karsinom: Disse svulstene responderer dårlig på kjemoterapi. En retrospektiv studie har vist at pasienter med stadium II-IV har forbedret PFS ved antihormonell vedlikeholdsbehandling etter avsluttet 1. linjebehandling (Gershenson et al., 2017)
Samtidig behandling med calcium og D-vitamin skal gis for å motvirke osteoporose; Calcigran Forte 1000 mg/800IE x 1. Bentetthetsmåling anbefales før/ved oppstart, deretter etter ett år og deretter hvert 2. år. Må vurderes etter leveutsikt.
- Lavgradig serøs hormonreseptor positiv karsinom: Disse svulstene responderer dårlig på kjemoterapi. En retrospektiv studie har vist at pasienter med stadium II-IV har forbedret PFS ved antihormonell vedlikeholdsbehandling etter avsluttet 1. linjebehandling (Gershenson et al., 2017)
Recidivbehandling
Sist faglig oppdatert: 21202221.12.2022
Alle bør vurderes for deltagelse i kliniske studier.
Kirurgi er aktuelt ved lokalisert, sent og potensielt platinumsensitivt residiv uten ascites (Coleman et al., 2019; Muallem et al., 2015; Szczesny et al., 2018). PET CT kan være aktuelt.
Positiv effekt på overlevelse forutsetter at komplett tumorfrihet oppnås og skal etterfølges av adjuvant kjemoterapi.
Ved medikamentell behandling bør pasientens ønsker vektlegges i forhold til bivirkninger. Følgende faktorer vurderes:
Det platinum-frie intervallet, pasientens allmenntilstand, tumorbiologi/histologisk type, antall og tidligere linjers respons og toksisitet, samt pasientens BRCA status.
Definisjoner
Det platinumfrie intervall (PFI): Tiden fra siste platinumbasterte behandling. Er en prognostisk faktor for overlevelse (Champer et al., 2018). Det er vist at moderat respons og særlig komplett respons etter siste platinumbehandling har betydning for platinum respons igjen (Gore et al., 1990).
Resistens. Utvikling av resistens til platinum ansees som en kontinuerlig utvikling.
Det finnes i dag ingen prediktive biomarkører for platinum sensitivitet.
Tradisjonelt velges behandling utifra PFI. Ny kunnskap har vist at PFI grensene kun er veiledende og må anvendes med skjønn, særlig hos pasienter med BRCA1–2 mutasjon i tumor/germline eller HRD positiv tumor der carboplatin har vist særlig god effekt (Mirza et al., 2016). Lengden av PFI er usikker idet registrering av tidspunkt for CA125 måling og/eller CT vil variere.
Platinum refraktær sykdom, hvis det foreligger progresjon under behandling eller innen 4 uker etter avsluttet behandling.
Tidligere forlatte definisjoner (Blackledge et al., 1989):
PFI>6 mnd definert som platinum sensitiv.
PFI<6 mnd definert som platinum resistent.
Platinum sensitiv sykdom
Kirurgi
skal alltid vurderes, jmf det overstånde
Medikamentell behandling
- Kombinasjonsbehandling bør tilbys (Parmar et al., 2003; Raja et al., 2013). Platinumbasert behandling er vist å gi bedre overlevelse enn nonplatinum basert behandling (Champer et al., 2018), tradisjonelt 6 sykler.
- Førstevalg er ofte carboplatin og pegylert liposomalt doxorubicin (PLD) foretrukket pga bivirkningsprofil og toleranse (Pujade-Lauraine et al., 2014).
- Hvis carboplatin er kontraindisert, kan cisplatin i tillegg til PLD gis.
- Hvis PLD er kontraindisert, ansees carboplatin kombinert med paclitaxel/docetaxel likeverdig (Parmar et al., 2003) evnt. kan gemcitabine gis.
- Hvis pasienten ikke kan tåle to-stoffsbehandling, er carboplatin single et alternativ.
- Ved besværlig ascites (og/eller pleuravæske) kan Bevacizumab single tilbys (7.5 mg/kg hver 3. uke eller 5 mg/kg hver 2. uke), best effekt er vist ved kombinasjon med ukentlig Paclitaxel (Stockler et al., 2014). Gjentatte instillasjoner av Mitoxantron (Novantrone) eller permanent ascitesdrenage kan også vurderes.
Vedlikeholdsbehandling
- PARP inhibitor har størst effekt hvis det påvises BRCA1–2 mutasjon i germline eller somatisk (i tumor) etter respons på platinum-basert behandling. Radiumhospitalet tilbyr somatisk BRCA1–2 test (biopsi fra fersk tumorvev), hos pasienter som er testet negative i germline.
Pasienten bør da tilbys vedlikeholdsbehandling med PARP inhibitor. Brukes inntil toksisitet eller progresjon (Essel et al., 2018; Ledermann et al., 2012; Mirza et al., 2016; Oza et al., 2015).- Både olaparib (Lynparza) og Niraparib (Zejula) er godkjent for bruk uavhengig av BRCA1–2 mutasjon status ved tilbakefall av carboplatinsensitiv sykdom (Ledermann et al., 2012; Mirza et al., 2016; Oza et al., 2015). Gir forlenget progresjonsfri overlevelse ved carboplatinsensitiv sykdom uavhengig av BRCA1–2 mutasjon status eller HRD status (Mirza et al., 2016)
Se beslutninger i nye metoder:
- Både olaparib (Lynparza) og Niraparib (Zejula) er godkjent for bruk uavhengig av BRCA1–2 mutasjon status ved tilbakefall av carboplatinsensitiv sykdom (Ledermann et al., 2012; Mirza et al., 2016; Oza et al., 2015). Gir forlenget progresjonsfri overlevelse ved carboplatinsensitiv sykdom uavhengig av BRCA1–2 mutasjon status eller HRD status (Mirza et al., 2016)
Niraparib (Zejula) skal prioriteres framfor olaparib grunnet kostnad, se LIS-avtaler: Onkologiske og kolonstimulerende legemidler (pdf, sykehusinnkjop.no)
- Aromatasehemmere bør vurderes som vedlikeholdsbehandling og har lav bivirkningsprofil (feks Letrozol 2.5 mg x1) til progresjon.
- Lavgradig serøst karsinom: Positiv ER status i tumor kan være en prediktor av respons på antihormonell behandling (Colombo et al., 2019b). Disse svulstene responderer dårlig på kjemoterapi. En retrospektiv studie har vist at pasienter med stadium II-IV har forbedret PFS ved antihormonell vedlikeholdsbehandling (Gershenson et al., 2017) (i søknad til HELFO bør denne anbefaling i veilederen brukes som begrunnelse for refusjon). Hormonreseptorstatus må innhentes. Samtidig behandling med calcium og D-vitamin for å motvirke osteoporose må vurderes etter leveutsikt; Calcigran Forte 1000 mg/800IE x 1. Bentetthetsmåling anbefales før/ved oppstart, deretter etter ett år og deretter hvert 2. år.
Platinum resistent sykdom
Omlag 20 % får progresjon innen 6 mndr, har manglende respons til førstelinje behandling eller får tilbakefall innen få uker etter siste platinum-baserte kjemoterapi (Monk et al., 2016). Det foreligger ingen markører som kan predikere resistens. Utvikling av resistens til platinum ansees som en kontinuerlig utvikling. I dag styres valg av behandling ofte fra PFI, men grensene er kun veiledende og må anvendes med skjønn.
- Når behandling velges, vurderes allmenntilstand, tidligere toksisitet og respons.
- Behandlingen er palliativ, fokus på livskvalitet og symptomlindring.
- Hos pasienter med BRCA1–2 mutasjon i tumor/germline eller HRD pos tumor som har hatt kortvarig god respons (Mirza et al., 2016), kan carboplatin evnt forsøkes igjen.
- Enstoffsbehandling inntil progresjon eller toksisitet med ukentlig Paclitaxel (vurder å legge inn fri-uke hver 3.–4. uke etter 8. kur), PLD eller Gemcitabin.
- Responsrate under 15 %, forventet PFS 3–4 mnd.
- Tamoxifen (20–40 mg daglig p.o.) kan ha en stabiliserende virkning på ovarialcancer og klinisk respons er rapportert (Lindemann et al., 2017), evnt kan Letrozol 2.5 mg daglig forsøkes, da bør hormonreseptor status undersøkes.
- Besværlig ascites (og/eller pleuravæske):
- Bevacizumab single (Stockler et al., 2014) tilbys (7.5 mg/kg hver 3. uke eller 5 mg/kg hver 2. uke), best effekt er vist ved kombinasjon med ukentlig Paclitaxel (Pujade-Lauraine et al., 2014).
- Gjentatte instillasjoner av Mitoxantron (Novantrone) eller permanent ascites-/pleuradrenage kan også vurderes.
- Strålebehandling
I enkelte tilfeller kan det være aktuelt å gi palliativ strålebehandling. -
- ved tumor som har brutt gjennom til vagina og gir blødningsproblemer.
- ved skjelettmetastaser og hjernemetastaser. Solitære metastaser kan henvises til nevrokirurg (Tropé et al., 2010) (C).
Oppfølging og kontroller
Sist faglig oppdatert: 28202128.06.2021
Første konsultasjon etter avsluttet behandling skal inneholde en sammenfatning av forløp og behandling. Samtale med både lege og sykepleier. Samtalen bør være strukturert. Følgende punkter bør berøres:
- Oppsummering av sykdom, behandling, forventede seneffekter og prognose.
- Symptomer på recidiv og hvor pasienten skal henvende seg.
- Fremtidige seksuelle problemer/redusert libido bør diskuteres: Indikasjon for henvisning til sexolog.
- Behov for kontakt med kreftsykepleier i kommunen.
Formål med oppfølgning
Kirurgi bør vurderes og er aktuelt ved kjemo sensitiv og lokalisert sykdom (Bristow et al., 2009; Harter et al., 2006; Oksefjell et al., 2009).
Behandling etter flere linjer kjemoterapi bør vurderes i forhold til gevinst på overlevelse, symptomlindring og livskvalitet. I en stor undersøkelse fant man ingen forskjell i overlevelse på pasienter kontrollert med CA 125 og pasienter som kun ble kontrollert klinisk (Rustin et al., 2010) (A).
Ved bruk av CA125 i oppfølgningen anbefales bruk av GCIG kriteriene for progresjon (Rustin et al., 2004) (B), dvs økning til minst 70 IE/ml hos pasienter som hadde normal verdi etter avsluttet behandling evnt. skal verdien fordobles for å være signifikant. Forhøyede verdier skal alltid kontrolleres med en ny prøve.
Oppfølgningen kan ha betydning for tiltak vedrørende psykiske og somatiske senfølger etter kirurgi og kjemoterapi; for eksempel fatigue, angst og depresjon (Liavaag et al., 2007) (C).
CT, MR eller andre undersøkelser tas på individuell indikasjon, ved symptom og ved mistanke om residiv.
Kontrollintervall er kun veiledende.
Planlegging av kontroller vurderes i forhold til alder, komorbiditet og gevinst av å påvise recidiv tidlig:
3–4 mnd intervaller, første 24 måneder
6 mnd intervaller 25–60 måneder
Kontroll etter > 5 år individualiseres avhenger av cancer type, alder eller i samarbeid pasient.
Det er liten evidens for verdien av dagens oppfølgingsrutiner.
Hormonsubstitusjon
Obs unngå østrogentilskudd ved hormonreseptor positiv lavgradige karsinom >stadium I.
Østrogenerstatning anbefales ved premenopausal alder; plaster anbefales for jevn serumdose og for å unngå «first passed effect» i lever (Estradot plaster 50–100 mikorgram/24 time).
Blåresept: Eggstokksvikt etter behandling E89.4. (før 52 år). Ved intakt uterus legg til progesteron.
Genetikk
Sist faglig oppdatert: 28202128.06.2021
ICD-10
Z80.4 Kontakt med helsetjenesten ved opplysning om ondartet svulst i kjønnsorganer i familianamnesen
Om lag 15 % av OC skyldes autosomal dominant arvede mutasjoner i gener som gir økt risiko for kreft i spesifikke organer, inkludert ovarier, dvs at en har 50 % risiko for å arve mutasjonen hvis en av foreldrene er mutasjonsbærer.
Behandling og oppfølging ved OC er i økende grad persontilpasset, og påvist BRCA1 eller BRCA2-mutasjon har behandlingsmessige konsekvenser (se kapittel Medikamentell behandling, avsnitt "Type medikamentell behandling" og kapittel Recidivbehandling, avsnitt "Vedlikeholdsbehandling".
Livstidsrisiko
Hereditær brystkreft (BC)- ovarialcancer (OC) (HBOC)
Skyldes oftest mutasjoner i BRCA1 eller BRCA2 genene, som gir betydelig forhøyet risiko for OC og BC hos kvinner. Tall for livstidsrisiko varierer, og vil være avhengig av studiedesign, etnisitet, andre risikofaktorer (ooforektomistatus, paritet, bruk av p-piller) samt genetiske variasjoner i befolkningen (Friebel et al., 2014).
BRCA1
(Antoniou et al., 2003; Kuchenbaecker et al., 2017; Lakhani et al., 2004; Piver, 2002)
Gjennomsnittlig OC risiko: 40–45 %.
Alder: Sjelden før 40 år. Gjennomsnittlig 54 år ved BRCA1. Sporadisk OC 65 år (Larsen, 2018).
Histologi: Oftest høygradig serøs, etterfulgt av endometrioid og klarcellet karsinom, sjeldnere mucinøs og borderline.
BRCA2
(Antoniou et al., 2003; Kuchenbaecker et al., 2017; Lakhani et al., 2004; Piver, 2002)
Gjennomsnittlig OC risiko: 15–20 %
Alder: Gjennomsnittlig 59 år ved BRCA2. Sporadisk OC 65 år (Larsen, 2018).
Histologi: Som BRCA1.
Lynch syndrome (før Hereditær NonPolypose Colorectal Cancer HNPCC)
Lynch syndrom (LS) er en autosomal dominant nedarvet tilstand som skyldes mutasjoner i et av flere DNA mismatch repair (MMR) gener (MLH1, MSH2, MSH6, PMS2) og EPCAM. LS gir økt risiko hovedsakelig for colorectalcancer (CRC) og endometriecancer (EC), men også økt risiko for OC. Livstidsrisiko for OC varierer fra 10–17 %, avhengig av hvilket av MMR-genene som er mutert (Møller et al., 2018).
Alder: Gjennomsnittlig 40–45 år (Crijnen et al., 2005; Watson et al., 2001).
Histologi/prognose: Det er beskrevet flere histologiske typer av LS relatert OC, og man ser ikke den samme assosiasjon til høygradig serøst karsinom som ved BRCA-relatert OC (Nakamura et al., 2014). LS relatert OC er ved diagnosetidspunkt ofte av lavgradig type, i tidlig stadium, har tidligere debut og bedre prognose sammenlignet med sporadisk OC. Diagnose i tidlig stadium kan ha sammenheng med cancerutvikling via forstadier i ovariet (type II tumor) og derfor enklere å diagnostisere med vaginal ultralyd (Crijnen et al., 2005; Grindedal et al., 2010; Kurman et al., 2010; Toss et al., 2015; Watson et al., 2001).
Kontrollopplegg
Regelmessig gynekologisk kontroll fra 30 års alder, også pga økt risiko for EC, se Genetikk. Risikoreduserende kirurgi kan vurderes fra 45–50 årsalder, denne beslutningen tas av pasienten i samråd med gynekolog/genetiker.
Annen arvelig årsak til ovarialcancer
Med økende tilgjengelighet av multigen paneltester, vil stadig flere kvinner få påvist varianter i gener assosiert med OC hvor risikoøkningen er moderat og/eller usikker.
Hvis BRCA1 og BRCA2 genene er normale hos en med OC, og familiehistorien gir grunn til å mistenke arvelig faktor, bør hun henvises til genetisk veiledning/utredning.
Diagnostisk gentest (BRCA1, BRCA2)
Behandlende lege (gynekolog, onkolog) bør gi informasjon om arvelig bryst- og eggstokkreft og informere om at funn har konsekvens for behandlingen. Diagnostisk gentest av BRCA1 og BRCA2 tilbys alle med OC uansett alder. Pasienten bør få både muntlig og skriftlig informasjon. Den som har rekvirert gentesten, har ansvar for å formidle resultatet til pasienten.
Rekvisisjonen
- Fylles ut med gode kliniske opplysninger der indikasjon for testen tydelig fremgår.
- Skal inneholde informasjon om kreftsykdom i nær familie. NB! Hvis resultatet haster, merkes rekvisisjonen med grad av hast
Ved normalt funn
- Arvelig årsak kan ikke utelukkes. Dersom det er opphopning av kreftsykdom i familien, bør pasienten tilbys henvisning til genetisk veiledning/utredning.
Ved funn av sykdomsgivende genfeil
- Pasienten bør henvises til medisinsk genetisk veiledning etter at lege har informert om resultatet. Familieutredning og genetisk veiledning av familiemedlemmer er av stor betydning.
Ved funn av genvariant av usikker klinisk betydning (Variant of Uncertain Significance (VUS)
- Dersom laboratoriet opplyser om VUS skal pasienten henvises til medisinsk genetisk avdeling for informasjon om mulighet for videre utredning. En VUS må ikke behandles som en sykdomsgivende genfeil!
Genetisk utredning og veiledning ved genetiker
Genetisk veiledning inkluderer vurdering av egen risiko for kreft, tilbud om gentester og informasjon om konsekvenser av denne.
Ved påvist sykdomsgivende mutasjon skal genetiker tilby:
- Henvisning til brystdiagnosatisk senter for medisinsk oppfølging og risikoreduserende tiltak.
- Henvisning til gynekolog for orienterende samtale og en plan for tiltak vedr risiko for kreft i eggestokk/eggleder/peritoneum, reproduksjon, risikoreduserende tiltak inkludert kirurgi og seneffekter av disse.
I tilfeller hvor affisert slektning med OC ikke er tilgjengelig for testing, kan friske familiemedlemmer henvises til genetisk utredning.
Oppfølging ved påvist BRCA1 eller BRCA2 mutasjon
Bryster
Viser til Nasjonalt handlingsprogram for brystkreft, kap. 173 (Helsedirektoratet, 2019b).
Ovarier/salpinges/peritoneum
- Kvinner med BRCA mutasjon skal tilbys henvisning til gynekolog for orienterende samtale om risiko for sykdom, reproduksjon, risikoreduserende tiltak inkl kirurgi og seneffekter av disse.
Konsultasjonen skal inneholde gynekologisk anamnese og klinisk status. I samråd med pasienten lages en plan for gjennomføring av tiltak og follow-up som kan inkludere regelmessig ultralyd med OC-markører, informasjon om tiltak som berører seksualitet, reproduksjon (behov for nedfrysning av egg, tilbys ved KK RH), amming, prevensjon (p-piller), risikoreduserende tiltak som salpingectomi og oophorectomi, HRT og risiko for seneffekter etter oophorectomi og alternativ til hormonerstatning, hvis kvinnen har hatt brystkreft.
Tryggeste risikoreduserende tiltak er bilateral salpingoophorectomi. Det er ikke dokumentert effekt av regelmessig gynekologisk undersøkelse for å detektere OC på et tidlig nok tidspunkt (Dørum et al., 1999; Gaarenstroom et al., 2006; Hermsen et al., 2007; Hogg et al., 2004; Stirling et al., 2005).
- Kvinner med BRCA mutasjon tilbys henvisning til gynekolog fra 25 års alder for oppfølging i påvente av operasjon. De tilbys oppfølging med transvaginal ultralyd og måling av CA125 fra 30 års alder, tilpasses individuelt hver 6.-1 mnd. Det skal gis informasjon om undersøkelsens begrensninger for tidlig diagnose av kreft.
- Kvinner med BRCA mutasjon som ikke ønsker risikoreduserende operasjon, skal tilbys henvisning til gynekolog for oppfølging. De tilbys oppfølging med transvaginal ultralyd og måling av CA125 fra 30 års alder, tilpasses individuelt hver 6.-12. mnd. Det skal gis informasjon om undersøkelsens begrensninger for tidlig diagnose av kreft.
-
Gynekologisk oppfølging /kontroller før operasjon
(Dørum et al., 1999; Gaarenstroom et al., 2006; Hermsen et al., 2007; Hogg et al., 2004)
En plan for medisinsk oppfølging og tiltak lages i samråd med pasienten.
- Tema som skal berøres er regelmessig ultralyd med OC-markører, informasjon om tiltak som berører seksualitet, reproduksjon (behov for nedfrysning av egg, tilbys ved KK RH), amming, prevensjon (p-piller), risikoreduserende tiltak som salpingectomi og oophorectomi, HRT og risiko for seneffekter etter oophorectomi og alternativ til hormonerstatning, hvis kvinnen har hatt brystkreft.
- Det skal gis informasjon om screeningens begrensninger (Kehoe et al., 2007; 2014a). Publiserte screeningstudier har ikke dokumentert effekt på overlevelse (Sharma et al., 2006; Tailor et al., 2003). BRCA1/2 mutasjonsassosiert OC er oftest høygradig og utgår fra tube med hurtig spredning til peritonealhulen (Kurman et al., 2011). Diagnose i tidligst mulig stadium har betydning for prognose. Lavgradig OC som utgår fra ovariet, er bedre er egnet for vaginal ultralyd diagnostikk.
- Gynekologisk us m/vaginal ultralyd årlig (start 30års alder).
- Premenopausale cyster > 3 cm: oppfølging.
- Postmenopausal cyster > 1 cm: oppfølging/vurder BSO.
- Nytilkommet postmenopausalcyste > 1 cm: vurder BSO.
- obs ascites (tubecancer)
- Terskel for ny kontroll etter 23 mndr eller diagnostisk laparascopi bør ligge lavt.
- Serum CA 125 og HE4 (Langmar et al., 2011) hver 6. mnd. (CA-125 er forhøyet hos ca 50 % ved St I sykdom)
- Rask diagnostisk scopi/tomi hvis mistanke om malignitet
Risikoreduserende tiltak ved påvist BRCA1 eller BRCA2 mutasjon
Risikoreduserende bilateral salpingoophorectomi (RR-BSO)
BSO har dokumentert effekt (Barakat et al., 2002; Domchek et al., 2010; Finch et al., 2014; Rebbeck et al., 2009) reduserer risiko for ovarialcancer og øker overlevelse. Risikoreduserende BSO (RR-BSO) anbefales etter at hun har fått de barna hun ønsker og fra angitt alder. Kvinnen gis informasjon om at BSO gir signifikant reduksjon i OC risiko på 80 % for BRCA1 og BRCA2 mutasjonsbærere (Hartmann et al., 2016). Livskvalitetsstudier viser at BSO gir signifikant reduksjon i kreftrelatert bekymring, og 95 % er fornøyd med beslutningen. I noen studier har BSO vist å redusere risiko for brystkreft hos BRCA mutasjonsbærere hvis utført premenopausalt. Det bør utvises forsiktighet med bruk av BSO som risikoreduserende tiltak mot brystkreft da et nyere studie ikke viser samme reduksjon i BC risiko (Heemskerk-Gerritsen et al., 2015).
Preoperativ informasjon
Kvinnen tilbys henvisning til gynekolog for informasjon om inngrepet som inkluderer informasjon om seneffekter av inngrepet. Ved premenopausal BSO gis informasjon om langtids- og korttidseffekter av prematur menopause; risiko for kognitive og vasomotoriske besvær, redusert libido, osteoporose og økt risiko for hjerte- karsykdom (Dørum et al., 2008; Lobo, 2007; Madalinska et al., 2006).
Postoperativ informasjon
Hormonerstatning (HRT) anbefales hvis premenopausal BSO. Kvinnen bør tilbys oppfølgingssamtale hos gynkolog for justering av HRT og vurdering av dyspareuni og testosterontilskudd etter noen måneder og «samtale om livet» – eventuelt henvisning til sexolog (pasient og partner). Fastlege skal orienteres om risiko og kontroll av osteoporose.
Anbefalt alder for RR-BSO
BRCA1: 35–40 år.
BRCA2: 40–45 år.
Debut av ovarialcancer hos BRCA2 mutasjonsbærere er i gjennomsnitt 8–10 år senere enn for BRCA1 mutasjonsbærere, og RR-BSO kan derfor hos BRCA2 mutasjonsbærere vurderes utsatt til 40–45 årsalder (Kauff et al., 2008).
Peroperative undersøkelser
Grunnet høy rate av okkult cancer, skaldet gjøres nøye inspeksjon av peritoneale flater, liberalt med biopsier, samt skyllevæske til cytologi. Ved patologisk undersøkelse av ovarier/tuber skal alt materiale støpes inn og undersøkes med 2–3 mm snitt, obs STIC (SEE-FIM prosedyre) (Powell et al., 2011).
Restrisiko etter RR-BSO
Etter RR-BSO avsluttes eventuelle kontroller. Gjenværende risiko for peritonealcancer anses som lav (Evans et al., 2009).
Risikoreduserende salpingektomi
Origo for høygradig serøs OC, som er hyppigst, angis å være i tubene (Hanley et al., 2015). Salpingektomi anbefales som risikoreduserende tiltak, men er ikke tilstrekkelig for fullverdig risikoreduksjon (Kotsopoulos et al., 2020; Kurman et al., 2010). Det pågår en internasjonal multisenterstudie der Norge deltar, TUBA WISP II study (TUBectomy With Delayed Oophorectomy in High Risk Women to Assess the Safety of Prevention (TUBA-WISP-II), 2020-2040), hvor man undersøker effekten av salpingektomi på et tidligere tidspunkt, med utsatt ooforektomi (45 år ved BRCA1 mutasjon og 50 år ved BRCA2 mutasjon) (Harmsen et al., 2015; Nebgen et al., 2018).
P-piller
P-piller reduserer risiko for OC opptil 50 % hos BRCA1- og BRCA2-mutasjonsbærere særlig etter 30-års alder og ved langvarig bruk (Moorman et al., 2013). Det er uklart hvorvidt p-pillebruk øker brystkreftrisiko ved bruk før 30 års alder (Brohet et al., 2007; Iodice et al., 2010; Pasanisi et al., 2009).
Annet
- Hysterektomi (inkl tuber) med bevaring av ovarier gir redusert ovarialcancer risiko (Hankinson et al., 1993).
- Amming gir redusert risiko for OC hos BRCA1 mutasjonsbærere, men ikke signifikant reduksjon hos BRCA2 mutasjonsbærere (Hankinson et al., 1993).
Hormonerstatning (HRT) etter RR-BSO
HRT etter RR-SO skal tilbys kvinner som ikke har hatt brystkreft, fram til alder for naturlig menopause (Domchek et al., 2016). Behandlingen startes umiddelbart etter inngrepet og justeres etter noe tid. HRT fram til naturlig menopausealder vil ikke ha ugunstig effekt mht kreftrisiko (Hartmann et al., 2016).
- Østrogen og evnt progesteron (hvis uterus er intakt) erstattes. Gestagenspiral og østrogen-plaster anbefales for å unngå «first pass effect» i lever. Kvinnen bør følges til optimal erstatning er oppnådd.
- Testosteron bør vurderes som tillegg til østrogen for libidobesvær.
- Hvis kvinnen har hatt brystkreft, må østrogen-, progesteron- og testosteronerstatning diskuteres med onkolog.
Refusjon:
Østrogen/progesteron tabl/plaster: Blåresept E89.4 Eggstokksvikt etter behandling.
Hormonspiral og testosteron: søknad HELFO: E89.4 Eggstokksvikt etter behandling, vilkår 125.
Onkologisk behandling av arvelig ovarialcancer
BRCA status har behandlingsmessige konsekvenser for OC, se kap. 2.4, Medikamentell behandling, i handlingsprogrammet.
Sjelden (ikke epitelial) ovarialcancer
Sist faglig oppdatert: 05202405.07.2024
ICD-10
C56 Ondartet svulst i eggstokk
Innledning
Sist faglig oppdatert: 05202405.07.2024
Definisjon
Maligne svulster utgått fra germinalceller eller stromaceller i ovariet.
Histopatologi
«WHO Classification of Tumours, Female Genital Tumours, IARC 2020, 5th edition»
Germinalcelletumores:
- Teratomer (modne, umodne, monodermale, malign transformerte)
- Dysgerminom
- Plommesekktumor
- Embryonalt karsinom
- Choriokarsinom
- Blandede former
- Germinalcelle – sex cord-stromale tumores: Gonadoblastom, uklassifisert blandet germinalcelle – sex cord-stromal tumor
Sex cord-stromale tumores:
- Stromale tumores: fibrom, tekom, luteinisert tekom med skleroserende peritonitt, skleroserende stromal tumor, mikrocystisk stromal tumor, signet-ring stromal tumor, Leydigcelletumor, steroid celle tumor, fibrosarkom
- Sex cord tumores: Granulosacelletumor av adult type, Granulosacelletumor av juvenil type, Sertolicelletumor, sex cord tumor med anulære tubuli
- Sex cord-stromale tumores: Sertoli-Leydigcelletumor, sex-cord stromal tumor NOS, Gynandroblastom
Forekomst og overlevelse
- Insidens maligne tumores i Norge: ca 45 tilfelle pr år (ca 10 % av all ovarialcancer).
- Det rapporteres 98 % 5-årsoverlevelse ved stadium I og 95 % 5-års overlevelse ved avansert sykdom (D. M. Gershenson, 1993, 2007; Peccatori et al., 1995). Ved residiver er prognosen generelt dårlig.
- Det er rapportert normal fertilitet og 96 % 5-års overlevelse etter fertilitetsbevarende operasjon og 3 kurer med BEP (Brewer et al., 1999). Det er ikke rapportert økt forekomst av fosteranomalier (D. M. Gershenson, 2007).
Germinalcelletumorer
(Berek & Hacker, 2010)
Germinalceller (kimceller) kan utvikles til enten fosterliknende eller placentaliknende strukturer, vokse udifferensiert (dysgerminom) eller etterlikne extraembryonale strukturer (plommesekktumor). Germinalcelletumores er en heterogen gruppe med mange forskjellige tumortyper. De maligne teratomer er svært sjeldne.
- Forekommer fortrinnsvis hos yngre og sees sjelden hos kvinner over 30 år.
- Utgjør cirka 3 % av all ovarialcancer. Hos kvinner under 20 år vil cirka 70 % av alle ovarialtumorer være germinalcelletumorer – hvorav 1/3 er maligne (Berek & Hacker, 2010).
Lysmikroskopibilde av tumoren på bildet til venstre.
- Dysgerminom – utgjør den hyppigste formen for malign germinalcelletumor. Cirka 5 % opptrer hos fenotypiske kvinner med abnorme gonader, for eksempel 46XY (bilaterale strekgonader), 46XX/46XY (unilateral streggonade, contralateral testis) eller 46XY (testiculær feminization). Det anbefales å gjøre karyotype-bestemmelse på alle pre menarche pasienter med bekkentumor.
- Plommesekktumor. Disse produserer som oftest alfa-føto protein (AFP).
- Embryonalt karsinom.
- Choriokarsinom oppstår vanligvis fra trofoblastvev, men kan også oppstå fra germinalcelletumorer, enten i ren form eller som komponenter i en blandet tumor og produserer alltid hCG.
- Teratom
- Malign (somatisk) transformasjon av et modent teratom er sjelden.
Den hyppigste form er utvikling av et plateepitelkarsinom i et modent teratom.
- Malign (somatisk) transformasjon av et modent teratom er sjelden.
-
- Umodne teratomer inneholder vev som likner på vev utviklet fra embryo.
De graderes (1–3) etter mengde umodent neuroektodermalt vev.
- Umodne teratomer inneholder vev som likner på vev utviklet fra embryo.
- Mixed/blandede tumores er svulster hvor det i noen tilfeller forekommer en blanding av forskjellige komponenter i samme tumor.
Stromacelletumores
(Berek & Hacker, 2010)
- Utgjør 5–8 % av alle ovarialcancertilfeller.
- Granulosacelletumores utgjør ca 70 %. De sees i alle aldersklasser og deles i en adult (95 %) og en juvenil form (5 %) (Colombo, Parma, Zanagnolo, & Insinga, 2007).
Etiologi (epidemiologi)
- Ukjent
Risikofaktorer
- Dysgerminomer forekommer med økt hyppighet hos kvinner med dysgenetiske gonader (testikulær feminisering og Turners syndrom).
Diagnostikk
Sist faglig oppdatert: 05202405.07.2024
Diagnostikken er svært viktig da kjemoterapi helbreder flesteparten av pasientene med germinalcellesvulster.
Symptomer
(Berek & Hacker, 2010)
- Bekkensmerter hos ca 85 %. Germinalcelletumorer vokser hurtig og forårsaker ofte bekkensmerter på grunn av kapseldistensjon, blødning, nekrose eller ruptur av tumor. Ca. 10 % debuterer med akutt abdomen som kan ligne appendisitt eller ekstrauterin graviditet.
- Trykksymptomer fra blære eller tarm.
- Ca 33 % av unge kvinner med germinalcellesvulster debuterer med økende bukomfang. Obs differensialdiagnose til graviditet ved hCG-produserende tumor.
- Blødningsuregelmessigheter. Granulosacelletumorer produserer ofte østrogen og 10 % har blødningsuregelmessigheter.
- Pubertas precox. Forekomst av granulosacelletumor må overveies.
- Virilisering. Sertoli-Leydigcelletumorer produserer ofte androgen.
- Ovarialtumor hos en gravid kan være en ikke-epitelial tumor.
Preoperative undersøkelser
(Berek & Hacker, 2010)
- Gynekologisk undersøkelse.
- Ultralyd (vaginal og evt. abdominal)
- Ikke-epiteliale tumores er ofte mer solide enn epiteliale ovarialtumores.
- Hos en ung kvinne med en overveiende solid bekkentumor må man mistenke germinalcelletumor.
- Ved en overveiende solid bekkentumor hos en eldre kvinne mistenkes først og fremst en ikke-epitelial eggstokktumor (fibrom), sarkom eller metastase.
- Evt. CT bekken/abdomen, hos yngre og gravide MR.
- Tumormarkører
- Germinal elle svulster: s-AFP, hCG, CA-125, NSE, LD.
- Sex-cord svulster: s-østradiol og s-testosteron, progesteron LH, FSH, prolactin, inhibin, AMH.
- Karyotypebestemmelse anbefales tatt preoperativt ved mistanke om germinalcelletumor hos alle pasienter med primær amenore.
- Vurder abrasio ved mistanke om granulosacelletumor.
Differensialdiagnoser
- Benign ovarialtumor (feks endometriom)
- Ovarialkarsinom og borderlinetumorer
- Graviditet
- hCG-produserende tumor
Behandling
Sist faglig oppdatert: 05202405.07.2024
Behandling av ikke-epitelial ovarialcancer bør henvises til senter for gynekologisk kreftbehandling.
Kirurgi ved germinalcelletumorer
(Abu-Rustum & Aghajanian, 1998; Billmire et al., 2004; Brewer et al., 1999; D. M. Gershenson, 1993, 2007; Peccatori et al., 1995; Williams, 1998)
- Unge kvinner med ønske om fertilitetsbevarende behandling anbefales henvist til primærkirurgi ved senter for gynekologisk kreftbehandling.
- Det gjøres unilateral oophorektomi. Ved tumoraffeksjon av det andre ovariet kan det gjøres tumorreseksjon med bevaring av ovariet. Vanligvis fjernes alt tumorvev. Ved fertilitetsønske kan resttumor tillates da disse svulstene er ekstremt kjemosensitive. Ved utbredt metastasering tas kun biopsi (kan gjøres ultralydveiledet) etterfulgt av kjemoterapi.
- Forstørrede lymfeknuter ekstirperes. Det foreligger ingen dokumentasjon for lymfeknutestaging.
- Kvinner som ikke har fertilitetsønske:
- Det gjøres unilateral adnexekstirpasjon samt omentektomi, ascites eller skyllevæske.
- Ved avansert sykdom gjøres debulkingkirurgi inkludert fjernelse av begge ovarier.
- Kvinner med Y kromosom:
- Begge ovarier fjernes alltid på grunn av mer enn 50 % risiko for residiv i gjenværende ovarium.
- Second look laparotomi anbefales ikke.
Kirurgi ved stromacelletumorer
(Colombo et al., 2007; Sehouli et al., 2004; Williams, 1998)
- Hovedbehandlingen er kirurgi, da stromacelletumores er lite sensitive for kjemoterapi. 90 % er unilaterale uten spredning.
- Det gjøres unilateral oophorektomi. Ved tumoraffeksjon av det andre ovariet kan det gjøres tumorreseksjon med bevaring av ovariet ved fertilitetsønske, ellers fjernes begge ovarier og uterus.
- Som minimum gjøres palpasjon med fjerning av forstørrede lymfeknuter. Det foreligger ingen dokumentasjon for nytten av lymfeknutestaging og reoperasjon for staging anbefales ikke.
- Ved avansert sykdom er kirurgisk fjerning av allt synlig tumorvev avgjørende. Preoperativ kjemoterapi kan overveies.
- Second look laparotomi anbefales ikke.
- Ved granulosacelletumor der uterus ikke fjernes vurderes abrasio for å utelukke endometriecancer.
Kjemoterapi
Ikke-epitelial ovarialcancer er kjemosensitiv, særlig germinalcelletumores er generelt mer kjemosensitiv enn epitelial ovarialcancer.
Germinalcelletumor stadium I
(D. M. Gershenson, 2007)
- Det gis vanligvis ingen adjuvant behandling ved:
- Dysgerminomer stadium Ia
- Umodne teratomer stadium Ia grad 1
- For alle andre anbefalles adjuvant kjemoterapi vanligvis gitt som 3 kurer Bleomycin-Etoposid-Cisplatin (BEP) ved:
- Dysgerminomer stadium >Ia
- Plommesekktumor
- Umodne teratomer stadium >Ia, grad 2-3.
- Blandede typer
- Embryonalt carcinom
- Polyembryom
- Choriocarcinom
Internasjonalt er det en tendens til observasjon uten kjemoterapi av germinalcelletumorer i stadium I forutsatt negative tumormarkører (D. M. Gershenson, 2007) (IIa). Dette krever nøye oppfølgning med CT, kontroll av tumormarkører og hyppig klinisk kontroll. Observasjon med tett oppfølging anbefales i regelen ikke.
Germinalcelletumor stadium II–IV
(Berek & Hacker, 2010)
- Etter operativ behandling uten resttumor anbefales adjuvant kjemoterapi med 3 kurer BEP. Ved gjenværende tumor etter operasjon suppleres med 1–3 kurer Etoposid-cisplatin (EP) avhengig av respons. Cisplatin kan erstattes med carboplatin ved nevrotox.
Residiv av germinalcelletumorer
(Berek & Hacker, 2010; De Giorgi et al., 2017)
Alle pasienter med residiv av germinalcellesvulster skal henvises til vurdering av videre utredning og behandling ved avd. for gynekologisk kreft DNR som er medlem av EUROCAN (European Reference Network on Rare Adult Cancer).
- Kjemonaive pasienter: BEP
- Tidligere behandlet med BEP, men ikke platinumresistent (residiv > 6 uker etter avsluttet behandling: cisplatin-etoposide, HMAS.
- Platinumresistent (residiv under pågående behandling eller 4–6 uker etter avsluttet behandling): Vanskelig å behandle, vurderes individuelt, kirurgi, strålebehandling, immunoterapy med PDL hemmere kan forsøkes i enkelte tilfeller etter ekspert vurdering.
Stromacelletumorer
(Colombo et al., 2007; Sehouli et al., 2004; Williams, 1998)
- Det er ikke vist effekt av adjuvant kjemoterapi som derfor ikke anbefales rutinemessig.
- Ved resttumor etter kirurgi anbefales kjemoterapi med BEP eller platinum-taxane-kombinasjon som gir responsrater på 60–80 %.
Residiv av stromacelletumorer
(Colombo et al., 2007; Ovarian cancer. Version 3.2014, 2014; Sehouli et al., 2004; Williams, 1998)
- Kirurgi hvis mulig, evt. preoperativ kjemoterapi.
- Det er ofte nødvendig med gjentatt operasjoner.
- Aromatasehemmere, BEP, EP eller platinol-taxane-kombinasjon kan forsøkes.
Komplikasjoner
(Berek & Hacker, 2010)
- Cisplatinbehandling kan forårsake perifer neuropati og nefropati.
- Behandling med etoposid kan forårsake sekundær leukemi.
- Behandling med bleomycin kan forårsake lungefibrose men liten risiko ved totaldoser < 270.000 IE (3 kurer).
Oppfølging og kontroller
Sist faglig oppdatert: 05202405.07.2024
- De fleste residiver kommer innen 1–2 år, men især granulosacelletumorer kan residivere etter flere tiår.
- Det anbefales kontroll hver 3. måned i 2 år, deretter hver 6. måned inntil 5 år og deretter én gang årlig.
- Ved hver kontroll gjørs g.u. og tas tumormarkører (s-AFP, hCG, CA-125, AMH).
- Ved viriliserende tumores kan s-testosteron anvendes som tumormarkør.
Palliativ behandling – Nasjonalt handlingsprogram
Sist faglig oppdatert: 05202405.07.2024
Helsedirektoratet har utgitt Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen (2019) med anbefalinger om palliativ behandling for kreftpasienter.
Borderline ovarialtumor (BOT)
Sist faglig oppdatert: 28202128.06.2021
ICD-10
D39.1 Svulst med usikkert eller ukjent malignitetspotensiale i eggstokk
Definisjon
Sist faglig oppdatert: 28202128.06.2021
Lavgradig malign tumor som utgår fra adnexae eller peritoneum (Hauptmann et al., 2017).
Histopatologi
Sist faglig oppdatert: 28202128.06.2021
Karakterisert av cellulær proliferasjon, økt mitoser og kjerneatypi, men uten infiltrerende vekst.
Anbefalt klassifikasjon
Sist faglig oppdatert: 28202128.06.2021
(Kurman et al., 2014; Prat et al., 2014)
De epiteliale svulstene klassifiseres som serøse, mucinøse, seromucinøse, endometroide, klarcellete og Brenner tumores, der alle kategorier har benigne, borderline og maligne svulster.
Terminologien er endret. De defineres enten som «implantater» eller «lavgradig serøst karsinom».
Serøse og mucinøse BOT med mikroinfiltrasjon (stromainfiltrasjon som måler < 5 mm i største lineære utbredelse) klassifiseres og behandles som borderlinetumor.
Serøs borderline tumor
Mucinøs borderlinetumor
Seromucinøse
Endometrioid borderlinetumor*
Klarcellet borderlinetumor*
Borderline Brennertumor*
* er sjeldne
Forekomst (referansene er i forhold til gammel BOT klassifikasjon fra før 2014 og nytte må vurderes på denne bakgrunn)
Sist faglig oppdatert: 28202128.06.2021
10–20 % av all epitelial ovarialcancer (du Bois et al., 2009a; Lalwani et al., 2010; Lenhard et al., 2009; Silva et al., 2006).
Insidens i Norge: 157 tilfeller i 2017.
Median alder 57 år, og 16 % er yngre enn 40 år (Larsen, 2018).
Serøs BOT er hyppigst, om lag 50 %.
- > 70 % diagnostiseres med stadium I, nesten 100 % 5 års overlevelse.
- 30 % er avanserte, omlag 95 % 5 års overlevelse.
- 1/3 bilateralitet (28–66 %).
- Mindre enn 1/3 har peritoneale implantater.
- Serøse BOT med mikroinfiltrasjon (5–10 % av serøse BOT) (stromainfiltrasjon som måler < 5 mm i største lineære utbredelse) klassifiseres og behandles som borderlinetumor:
- Er ikke alene en uavhengig prognostisk faktor og kun de tilfellene som er assosiert med invasiv peritoneal sykdom (lavgradig serøst karsinom) har vist kortere sykdomsfri overlevelse og generell overlevelse.
- Mikropapillær variant av serøse BOT presenteres oftere i et mer avansert stadium sammenlignet med konvensjonell serøs borderlinetumor (27 vs 13 %) og er oftere assosiert med invasiv peritoneal sykdom.
Mucinøs BOT oppgis å være om lag 40 %
- 0–13 % bilateralitet.
- Intestinal type (85 %), ofte store unilaterale svulster, vanskelig å differensiere fra GI-cancer.
- 82 % stadium I (99–100 % 5 års overlevelse).
- 18 % > stadium I (50 % 5 års overlevelse).
- Intestinal type (85 %), ofte store unilaterale svulster, vanskelig å differensiere fra GI-cancer.
- Mucinøse BOT med intraepitelialt karsinom (grov kjerneatypi) og mucinøse BOT med mikroinfiltrasjon (stromainfiltrasjon som måler < 5 mm i største lineære utbredelse) klassifiseres og behandles som borderlinetumor.
Etiologi
Sist faglig oppdatert: 28202128.06.2021
Genetikk: Det er rapportert mulig assosiasjon av BOT ved Lynch syndrom med mutasjoner i mismatch repair gener og ved «Hereditær bryst ovarialcancer syndrom» med BRCA1–2 mutasjoner (Park et al., 2014).
Risikofaktorer
Sist faglig oppdatert: 28202128.06.2021
(Burger et al., 2009; Fortin et al., 2007; Riman et al., 2001)
Økt risiko
0-paritet
Infertilitet
IVF-behandling
Behandling med rent østrogen (for serøse svulster)
Overvekt
Røyking (mucinøse BOT)
Redusert risiko
Høy paritet
Amming
Screening
Effektiv screening for tidlig diagnose er ikke etablert.
Forløp
Sist faglig oppdatert: 28202128.06.2021
NB. Referansene er usikre pga ny klassifikasjon 2014.
Total 5-års overlevelse var 90–100 % avhengig FIGO stadium, histologisk type og alder ved diagnose (Bjørge et al., 1998), og full staging prosedyre ved primær kirurgi (du Bois et al., 2009a; du Bois et al., 2013).
90 % diagnostiseres i tidlig stadium.
5–10-års overlevelse er:
Stadium I: 97 %
Stadum II–IV: 90 %
5- og 10-års total overlevelse for serøs tumor er 93 % og 90 %, og for mucinøs 97 % og 95 %.
Prognose
Sist faglig oppdatert: 28202128.06.2021
Pognostiske faktorer (Bjørge et al., 1998; Lenhard et al., 2009; Seidman et al., 2000).
- FIGO stadium er den sterkeste prognostiske faktor.
5 % av FIGO stadium I pasienter får tilbakefall.
Inntil 25 % av pasienter med >FIGO I pasienter får tilbakefall. - Histologisk type: bedre for mucinøse.
- Ploiditet.
- Alder.
Diagnostikk
Sist faglig oppdatert: 28202128.06.2021
Som ved ovarialcancer (se eget program).
Symptomer
(Paulsen, 2007; Paulsen et al., 2005)
75 % har minst ett symptom, abdominale smerter, ubehag, tarmbesvær, tretthet, vekttap, men mindre utpreget enn hos ovarialcancerpasientene. Pasientene er oftest i god almenntilstand.
Supplerende undersøkelser på spesielle indikasjoner
Frysesnitt kan anvendes for å skille mellom benigne og borderline/invasive tumorer, men tolkningen kan være vanskelig. HE-4 ofte bedre enn CA125 hos premenopausale.
Differensialdiagnoser
Som beskrevet ved Ovarialcancer, se punkt "Differensialdiagnoser" i kapittel Utredning.
Stadieinndeling FIGO 2014
Sist faglig oppdatert: 28202128.06.2021
Som ved ovarialcancer. For å kartlegge sykdomsutbredelsen på en standardisert måte ved behandlingens start.
Behandling
Sist faglig oppdatert: 28202128.06.2021
Kirurgi
Anbefalt kirurgisk staging prosedyre
Laparoskopi eller laparotomi er avhengig av tumor størrelse. Det er viktig at man unngår cysteruptur peroperativt (Ødegaard et al., 2007).
- Cytologisk undersøkelse av ascites eller peritoneal skyllevæske.
- Systematisk gjennomgang og beskrivelse av hele bukhulen.
- Suspekte lesjoner biopseres, i tillegg tas «blinde» biopsier (EORTC retningslinjer for ovarialcancer). Dette gjøres for å finne invasive implantater/lavgradig karsinom.
- Tumorruptur, grad av adheranser/innvekst registreres.
- Begge adnex, oment og uterus fjernes. Et adnex kan bevares hvis pasienten er ung / se fertilitetsbevarende kirurgi.
- Appendektomi ved mucinøse svulster, for å utelukke ovarialmetastase fra mucinøs appendixtumor.
- Størrelse, lokalisasjon og antall av gjenværende tumorforandringer etter operasjonen beskrives systematisk.
Lymfeknuter
Fjerning av lymfeknuter anbefales ikke (Cadron et al., 2007; Coumbos et al., 2009; Tinelli et al., 2006).
Lymfeknutemetastaser er beskrevet i opptil 20–30 % (Camatte et al., 2004; Fadare, 2009; Kurman et al., 2005; McKenney et al., 2006), men flere studier har konkludert at tilbakefall og prognose for pasienter med og uten lymfeknutemetastaser er den samme.
Kjemoterapi
Kjemoterapi har ikke vist å gi signifikant effekt på overlevelse uavhengig av stadium (Longacre et al., 2005; Tropé et al., 1993).
Restaging
Ved borderline histologi etter operasjon for antatt benign tumor eller manglende anbefalt staging prosedyre (hysterectomi, bilateral salpingo-oophorectomi, omentectomi, skyllevæske til cytology, suspekte forandringer biopseres) bør det konfereres med senter for gynkologisk kreft for vurdering av videre håndtering og ettergranskning av preparatet (du Bois et al., 2009a; Trillsch et al., 2015).
Det er vist at recidiv er hyppigere hos dem som fikk konservativ behandling, 10–20 % versus ~5 % ved full staging (du Bois et al., 2009a; Trillsch et al., 2015), men resulterte ikke i høyere mortalitet i den største studien (du Bois et al., 2013).
Anbefalinger vedr restaging bør diskuteres med pasienten:
- Ved manglende omentektomi eller ikke nøyaktig beskrevet bukhule/peritoneum. Obs. implantater.
- Appendektomi ved mucinøse svulster, for å utelukke ovarialmetastase fra mucinøs appendixtumor, behøves ikke, hvis appendix er beskrevet normal.
- Gjenværende ovarium/adnex bør fjernes hvis postemenopausal.
- Uterus bør vurderes fjernet, særlig hvis endometroid BOT fordi 39 % av disse har synkron hyperplasi eller karsinom, hvis ikke hysterectomi utføres, skal endometriebiopsi/pipelle tas. Ved andre typer BOT er betydning av hysterectomi ikke sikkert dokumentert.
- Risiko for tilbakefall er større hos de med konservativ behandling. De fleste tilbakefall er i gjenværende ovarium.
- Det er også akseptert å avvente et evnt tilbakefall pga god prognose (Cadron et al., 2007; Coumbos et al., 2009; Tinelli et al., 2006).
- Fjerning av lymfeknuter påvirker ikke prognosen, og anbefales ikke.
Fertilitetsbevarende behandling
(Fauvet et al., 2005; Harter et al., 2014; Morice et al., 2003; Tinelli et al., 2006; Vandenput et al., 2005)
Pasienten bør henvises til samtale med gyn-onkolog. Fertilitetsbevarende behandling krever en samtale med pasienten med objektiv informasjon som inkluderer vurdering av mulighet for å bli gravid, behandlingsalternativ, risiko for tilbakefall og prognose, evnt. henvisning til spesialist på infertilitet.
- Ovariestimulering og risiko for ovarialcancer er omdiskutert, i en metaanalyse fant man ikke økt risiko, når man korrigerte for infertilitetsfaktorer (Siristatidis et al., 2013).
- Ved serøse BOT er det viktig å avgjøre at det ikke foreligger invasive lesjoner/lavgradig karsinom metastaser.
- Ved mucinøse BOT må primær patologi i GI-tractus utelukkes.
- Ved endometrioide BOT, skal endometriebiopsi/pipelle tas, da 39 % av disse har synkron hyperplasi eller karsinom (Hauptmann et al., 2017).
- 50 % oppnår graviditet etter fertilitetsbevarende kirurgi, men 10–20 % forblir infertile.
- De fleste tilbakefall er BOT, som igjen kan behandles med kurativ intensjon.
- Man anbefaler vanligvis fertilitetsbevarende kirurgi selv om data bekrefter at tilbakefall er hyppigere etter konservativ behandling (Chan et al., 2003; Lenhard et al., 2009; Morice, 2006; Suh-Burgmann, 2006), men det resulterte ikke i høyere mortalitet i den største studien (du Bois et al., 2013).
Kirurgi-fertilitetsbevarende
Unilateral salpingo-ooforektomi eller cystektomi er aktuelt (Fauvet et al., 2005; Harter et al., 2014; Morice et al., 2003; Tinelli et al., 2006; Vandenput et al., 2005).
- Staging må utføres (peritoneal cytologi, omentectomi, peritoneale biopsier og evt. appendektomi).
- Biopsi av normalt utseende kontralateralt ovarium frarådes (reduserer fertiliteten).
- Etter fertilitetsbevarende kirurgi og når barneønske ikke lenger er til stede:
- Vurder om gjenværende ovarium/adnex bør fjernes, ev også uterus, særlig hvis endomtroid BOT, idet risiko for tilbakefall er større hos de med konservativ behandling. De fleste tilbakefall er i gjenværende ovarium.
- det er også akseptert å avvente ev tilbakefall pga god prognose (Cadron et al., 2007; Coumbos et al., 2009; Tinelli et al., 2006).
Tilbakefall
Residiv opptrer som oftest i form av ny BOT med gjentatt mulighet for samme type kurativ behandling som primært (i motsetning til karsinomene).
Residivfrekvens er (obs gammel klassifikasjon):
fra 3 % til 10 % (du Bois et al., 2009a; Kaern et al., 1993; Lenhard et al., 2009)
- FIGO stage 1: 5 %
- >Figo 1: opp til 25 %
- Etter fjerning av affisert adnex 0–20 %, ved cystektomi 12–58 % og ved anbefalt radikal kirurgi 2–6 % (Fauvet et al., 2005; Morice et al., 2003; Silva et al., 2006)
På grunn av sene tilbakefall er det reist spørsmål om det heller foreligger ny primær tumor (Ortiz et al., 2001). Et systematisk review av Du Bois 2009 påviste (du Bois et al., 2009a; Lalwani et al., 2010; Silva et al., 2006):
- 37 % fikk tilbakefall I løpet av 2 år
- 31 % i løpet av 2–5 år
- 32 % fikk tilbakefall > 5 år senere, av disse kom 10 % >10 år etter diagnose
Behandling av tilbakefall
Kirurgisk behandling med optimal tumorreduksjon er hovedbehandling.
Omkring 2 % progredierer til invasiv cancer, både serøse og mucinøse.
Kjemoterapi har ikke vist å ha signifikant effekt på overlevelsen (Plaxe, 2008).
Fertilitetsbevarende kirurgi kan være aktuelt, med de samme krav til vurdering og informasjon som ved primærbehandlingen.
Oppfølging og kontroll
Kontrollopplegg individualiseres basert på gjennomført kirurgi, stadium og prognostiske faktorer og komorbiditet.
Veiledende kontroll intervall
- Etter konservativ behandling vurderes 4–6 måneder de første 5 år, deretter individualiseres.
- Etter full staging prosedyre er det ikke dokumentert at kontroller har betydning.
Anamnese, klinisk undersøkelse, CA 125-måling og vaginal ultralyd utføres ved alle kontroller. HE4 tas hvis HE4, og ikke CA125, har vært sensitivt primært.
Utredning med bildediagnostikk etter behov.
Residiv bør verifiseres histologisk eller cytologisk før ny behandling.
Pasienter med mucinøs BOT har høyere forekomst av sekundær malignitet i GI-tractus og lungene (Sherman et al., 2004).
Genetikk
Sist faglig oppdatert: 28202128.06.2021
Det er uvisst om BRCA mutasjonsbærere har økt risiko for å utvikle borderline ovarial tumor (BOT), men BRCA1-2 mutasjoner er påvist hos kvinner med BOT og kan også utvikle seg til infiltrerende cancer av lavgradig type. Det ser ut til at forekomsten av BRCA mutasjoner er lavere blant kvinner med BOT enn kvinner med invasivt ovarialcarcinom (Antoniou et al., 2003; Friebel et al., 2014; Kuchenbaecker et al., 2017). Det er behov for oppfølgende studier.
Livmorhalskreft (cervixcancer)
Epidemiologi
Sist faglig oppdatert: 11202311.04.2023
ICD-10
| C53 | Ondartet svulst i livmorhals |
Definisjon
Sist faglig oppdatert: 11202311.04.2023
Utgått fra slimhinnen i endo- og/eller ektocervix
Forekomst
Sist faglig oppdatert: 11202311.04.2023
I 2021 var det 345 nye tilfeller per år (Larsen, 2022). (B)
Livstidsrisiko ved 80 år: 1,1% (2017-2021) (Larsen 2022).
I 2021 hadde Norge høyest forekomst av livmorhalskreft i Norden med en aldersjustert insidensrate på 9,6 per 100 000 kvinner (Engesæther et al., 2022). Fra 2013 er det registrert en økning i aldersgruppen 25 - 34 år (Kreftregisteret, 2022). Fra 2010 til 2021 er andel adenokarsinomer i cervix økt fra 10% til >25%.
Etiologi og genetikk
Sist faglig oppdatert: 11202311.04.2023
Persisterende infeksjon med onkogene typer av Humant Papilloma Virus (HPV) er en nødvendig, men ikke tilstrekkelig faktor for utvikling av cervixcancer og er påvist i 95 % av tilfellene (Muñoz et al., 2003; Muñoz et al, 2006).
Infeksjon med onkogene HPV-typer er nødvendig for utvikling av CIN, AIS og invasiv cancer (Gravitt, 2011; Schiffman et al., 2010; Stanley, 2010) (B), og HPV 16/18 er viktigste faktor for 2/3 av karsinomene.
Ingen vesentlig arvelig faktor er påvist, men HLA-type kan ha betydning (de Araujo Souza et al., 2009; Muñoz et al., 2006).
Se kapittel 7, Premaligne lidelser i cervix uteri.
Histologi
Sist faglig oppdatert: 11202311.04.2023
Svulstene i cervix klassifiseres i henhold til WHO klassifikasjon 2020 (WHO Classification of Tumours Editorial Board, 2020). De viktigste endringene siden forrige versjon er at karsinomene inndeles i HPV assosierte eller HPV uavhengige. Serøse karsinomer utgår.
Vel 80 % av cervixcancer er plateepitelkarsinomer, nesten alle er HPV assosiert. HPV negative plateepitelkarsinomer er beskrevet i litteraturen (Casey et al., 2015; Morrison et al., 2001). Histologisk gradering har ikke vist å ha prognostisk betydning for plateepitelkarsinomer (C) (Zaino et al., 1992). Histologisk gradering har ikke vist å ha prognostisk betydning for plateepitelkarsinomer (C) (Zaino et al., 1992). I henhold til WHO klassifikasjon 2020 graderes ikke adenokarsinomer og plateepitelkarsinomer i cervix.
Insidens av adenokarsinomer er økende. De fleste er av konvensjonell type, disse er HPV assosiert. Det finnes noen sjeldne subtyper av adenokarsinomer som ikke er assosiert med HPV; adenokarsinom av gastrisk type, klarcellet type og mesonefrisk type (Park, 2020). For korrekt klassifikasjon av de HPV uavhengige adenokarsinomer anbefales HPV analyse med PCR teknikk.
De neuroendokrine svulstene i cervix er sjeldne, de er som oftest HPV assosiert og klassifiseres i henhold til WHO klassifikasjon 2020:
- lavgradig eller intermediær neuroendokrin tumor (NET) (oppgi antall mitoser/2mm2)
- lite differensiert neuroendokrint karsinom (NEC)
- måcellet neuroendokrint karsinom (SCNEC)
- storcellet neuroendokrint karsinom (LCNEC)
Av hensyn til behandlingen må diagnosen verifiseres med immunhistokjemi (synaptophysin og chromogranin). HPV assosierte karsinomer i cervix (oftest adenokarsinomer) kan ha en komponent av neuroendokrint karsinom.
Risikofaktorer
Sist faglig oppdatert: 11202311.04.2023
- Røyking øker risikoen for plateepitelcancer, men ikke for adenocarcinomer (Gadducci et al., 2011; International Collaboration of Epidemiological Studies of Cervical Cancer et al., 2006; Kjellberg et al., 2000; Vaccarella et al., 2008) (A).
- Nedsatt immunforsvar (HIV-infeksjon/AIDS, SLE, immunsuppresjon) (Gadducci et al., 2011; Jordan et al., 2009).
- Tidlig seksuell debutalder og mange partnere (Dillner et al., 1996) (C).
- Arvelig faktorer som HLA-type kan ha betydning (de Araujo Souza et al., 2009; Muñoz et al., 2006).
- Annen HPV-relatert pre-cancer eller cancer (Forman et al., 2012).
Forebygging
Sist faglig oppdatert: 11202311.04.2023
HPV-vaksinasjon ble innført i Barnevaksinasjonsprogrammet høsten 2009: 12–13 år gamle jenter og gutter (i 7. klassetrinn), f.o.m. årskull 1997, blir gitt tilbud om vaksinering.
Se mer i kappteil 7, Premaligne lidelser i cervix uteri.
Screening
Sist faglig oppdatert: 11202311.04.2023
Nasjonalt screeningsprogram for livmorhalskreft – Livmorhalsprogrammet – ble innført i 1995.
Se kapittelet 7, Premaligne lidelser i cervix uteri.
Hovedmålet er å redusere forekomst og dødelighet av cervixcancer ved å oppdage forstadiene og behandle disse.
Tall fra Kreftregisteret viser at 64 % av de som får påvist cervixcancer og er i screeningalderen (25–69 år), ikke har tatt celleprøver siste 3,5 år. Av de som får påvist cervixcancer har 18 % hatt en normal celleprøve mindre enn 3,5 år før diagnosen (Kreftregisteret, 2014).
Pakkeforløp
Sist faglig oppdatert: 11202311.04.2023
Det er i regi av Helsedirektoratet utarbeidet Pakkeforløp for livmorhalskreft. I dette dokumentet beskrives hvordan utredning og behandling av cervixcancer er organisert i Norge (Helsedirektoratet, 2016b).
Kvalitetsregister/ kreftmelding
I regi av Fagrådet for Nasjonalt kvalitetsregister for gynekologisk kreft er det utarbeidet og innført nye og mer omfattende kreftmeldinger for cervixcancer. Nå registreres detaljer vedrørende utredning og behandling av disse pasientene slik at man etter hvert kan utarbeide årsrapporter for denne pasientgruppen. Det er gynekologisk kreftsenter som har ansvar for innsending av kreftmeldinger for cervixcancer. Dette gjelder også der hvor pasienten er konisert ved lokalsykehus og hvor man konkluderer med at pasienten er ferdig behandlet (Kreftregisteret, [s.a.]).
Diagnostikk og utredning
Sist faglig oppdatert: 11202311.04.2023
Symptomer
Blødningsforstyrrelser, blødning under eller etter samleie og økt fluor vaginalis.
Underlivssmerter og allmennsymptomer gir mistanke om avansert sykdom. Det er viktig at også unge pasienter med symptomer blir undersøkt, selv om de er under screeningsalder.
Utredning
Klinisk undersøkelse
- Ved cytologisk mistanke om kreft uten synlig tumor:
Kolposkopisk rettede biopsier og cervical abrasio. - Ved makroskopisk tumor:
Ta biopsi og evt cervical abrasio. - Gynekologisk undersøkelse i narkose med inspeksjon, palpasjon av cervix og parametrier og eventuelt vaginal ultralyd. Gynekologisk undersøkelse i narkose gir opplysninger om tumors lokale vekst. Tumors størrelse bør angis i 2 dimensjoner; transversalt og AP-diameter, lokalisasjon, parametrieinfiltrasjon og overvekst på vagina beskrives.
Diagnostisk konisering:
Kan utføres når biopsier viser malignitet og man mistenker at det foreligger stadium IA.
Infiltrasjondybde, horisontale utbredelse, karinfiltrasjon og avstand til reseksjonsrender avgjør videre behandling. I noen tilfeller kan rekonisering avklare videre behandling. Ved adenokarsinom utføres cervical abrasio.
Bildediagnostiske undersøkelser
- MR bekken bør utføres ved behandlende sykehus, i tilknytning til gynekologisk undersøkelse i narkose. Undersøkelsen kartlegger tumorutbredelsen i cervix og eventuell parametrieinfiltrasjon, lymfeknutestatus, avløpsforhold i urinveiene og eventuelle metastaser til bekkenskjelett (Patel et al., 2010).
- CT thorax, abdomen og bekken skal utføres og gir informasjon om avløpsforhold i urinveiene, lymfeknutestatus samt perifere metastaser (Patel et al., 2010).
- PET-CT vurderes som et supplement ved usikkerhet ved konvensjonell utredning eller mistanke om fjernmetastaser.
PET-CT skal vurderes dersom det planlegges radikal strålebehandling. - Ved mistanke om skjelettmetastaser bør det tas supplerende MR (Haldorsen et al., 2019; S. I. Lee et al., 2019).
MR-protokoll:
Diffusjonssekvenser i to plan (axial og sagittal). Axial 3D SE T2W. Sagittal og vinklet 2D SE T2W. SE T2W DIXON i coronalplan (fett- og vannvektede serier gir god fremstilling av benmarg), alternativt SE T1W og STIR i coronalplan.
Intravenøs kontrast anbefales og er ofte avklarende. Etter kontrast: dynamisk undersøkelse etterfulgt av axial 3D GE T1W (DIXON).
Gravide: undersøkes som hovedregel uten intravenøs kontrast, obs. forsiktighet ved SAR-tunge sekvenser.
Som forberedelse til MR bør man tilstrebe tømming av rektum (Toilax 1 time før undersøkelsen) og pasientene bør faste i 4 timer før undersøkelsen. Med tanke på å kunne bruke bildene i stråleplanlegging er det en fordel at undersøkelsen tas på flatt bord.
Spasmolytika anbefales brukt, dersom det ikke foreligger kontraindikasjoner (Buscopan og Glucagon).
Tumorstørrelse | Mål i 3 plan, transversal, AP og craniocaudal (målt langs cervix lengdeakse og perpendikulært på denne). |
Tumorutbredelse | Angi eventuell dyp infiltrasjon i cervixtroma (ytre 1/3), affeksjon av vagina (til nedre 1/3?), isthmus, corpus uteri, parametrier (ingen, minimal, etablert, til bekkenvegg) eller naboorganer (urinblære, ureteres, mesorectum, rectum). |
Lymfeknutestatus | Størrelse, antall og plassering (Balleyguier et al., 2011). |
Fjernmetastaser | Benmarg, peritoneum. |
Supplerende undersøkelser
- Cystoskopi vurderes hvis MR gir mistanke om affeksjon av blæren
- Rektoskopi ved mistanke om infiltrasjon i rektum.
- Finnålsbiopsi eller laparoskopisk lymfeknutereseksjon kan være aktuelt ved usikre funn ved bildediagnostikk og hvis dette er avgjørende for behandlingsstrategi.
Histologisk undersøkelse
Histologi skal innkalles for regranskning på regionalt senter. Alle cervixkon med karsinom FIGO stadium 1A1 skal regranskes.
For sikker klassifikasjon av de mere sjeldne subtyper av adenokarsinomer i cervix, bør supplerende metoder benyttes; immunhistokjemisk undersøkelse for p 16 og HPV analyse (PCR teknologi anbefales). Ved tvil om origo er corpus eller cervix (f.eks. ved svulster i istmusregionen) bør HPV analyse utføres.
Ved tvil om det er karinfiltrasjon bør immunhistokjemisk undersøkelse for karmarkører benyttes
- Preoperative biopsier (kolposkopisk rettede portiobiopsier og cervicalt uskrap):
- viktig å få med overgangssonen i cervix, både plateepitelet og kjertelepitelet skal kunne vurderes.
- angir type cancer, karinvasjon.
- Cervixkon og trachelectomipreparat med infiltrerende kreft angis:
- tumor type
- tumors utstrekning i mm langs cervikalkanalen
- invasjonsdybde i mm, i trachelektomi preparat der parametriene er med angis også invasjonsdybde i tredjedeler av cervixveggen
- om øvre, nedre og laterale reseksjonsrand er fri og avstanden i mm fra tumor til nærmeste reseksjonsrand
- Ved radikal hysterektomi med blokk-disseksjon av lymfeknuter i bekkenet angis:
- tumor type
- tumors utstrekning i mm langs cervikalkanalen
- invasjonsdybde i mm samt i tredjedeler av cervixveggen
- infiltrasjon i corpus uteri, parametrier og vagina
- karinfiltrasjon
- reseksjonsrender i vagina og parametriene
- antall lymfeknuter med og uten metastaser fra hver lokalisasjon, inkludert mikrometastaser
- perinodal vekst ved lymfeknutemetastaser (WHO Classification of Tumours Editorial Board, 2020). Bruk diagnosemal
Prosedyre for ultrastaging av vaktpostlymfeknute/sentinel node (SN) ved cervixcancer (Oslo universitetssykehus, [s.a.]).
SN er anbefalt hos pasienter med Figo stadium IA-IIB (Cibula et al., 2018). Ved OUS benyttes ESGO’s retningslinjer og samme prosedyre som for SN av vulvaca og endometrieca (Oonk et al., 2017). For immunfargning benytter OUS CK ved plateepitelkarsinomer og CK 8 ved adenokarsinomer (se figur).
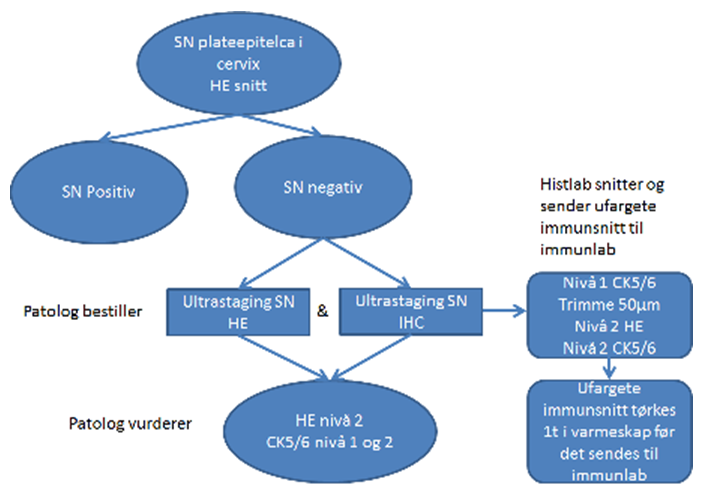
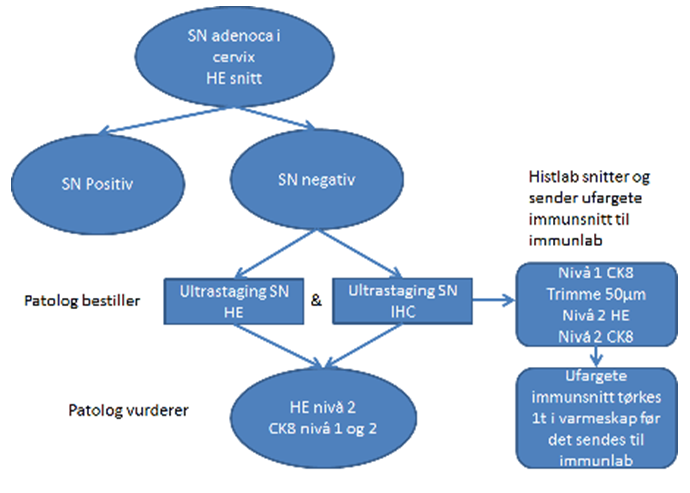
Differensialdiagnoser
Benigne tilstander:
- Infeksjoner
- Polypper
- Iatrogene blødninger (p-piller, HRT, IUD)
Premalign tilstand:
Maligne tilstander:
- Endometriecancer med nedvekst i cervix
- Annen malignitet i cervix (sarkom, lymfom, metastase)
- Innvekst i cervix fra cancer i nærliggende organ
- Blærecancer
- Rektumcancer
- Vaginal cancer
Stadieinndeling
Sist faglig oppdatert: 11202311.04.2023
Formål
Å kartlegge sykdomsutbredelsen før behandlingens start
- Internasjonal stadieinndeling for cervix cancer ble innført i 1929, FIGO (The International Federation of Gynecology and Obstetrics)
- Ved revisjon av FIGO stageing 2018 er det innført betydelig endring i forhold til tidligere stadieinndeling som ikke tok hensyn til bildediagnostikken, man vil se en endring i stadiefordelingen i forhold til tiden før 2018. Gjør oppmerksom på at det foreligger en korrigert klassifisering i 2019, og at denne må anvendes for korrekt stageing.
- Det er i prinsippet ikke forskjell på reglene for stadieinndeling for opererte og ikke opererte.
- Utredningen før behandlingen skal avklare: tumors størrelse, graden av innvekst i cervix stroma og parametrier, affeksjon av tilstøtende organer (vagina/blære/rektum), affeksjon av urinveier/hydronefrose, metastaser til lymfeknuter i og utenfor bekkenet, samt metastaser til lungene eller andre organer.
- Ved tvil om hvilket stadium som foreligger, skal det laveste alternativet velges.
- Ved mikroinvasiv kreft baseres stadiebestemmelsen på det histologiske funn (cervixkon eller hysterektomi).
I TNM klassifikasjonssystemet tas det hensyn til alle faktorer ved utredningen som uttrykk for sykdomsomfanget. I ESGO guidelines anbefales bruk at TNM klassifikasjon i tillegg til FIGO klassifikasjon ved stadiebestemmelse, se tabell:
FIGO staging og TNM
(Bhatla, Aoki, Sharma, & Sankaranarayanan, 2018)
Cervix cancer FIGO
| T-kategori | Figo stad. | Definisjon |
|---|---|---|
| Tx | Primærtumor kan ikke beskrives | |
| T0 | Ingen tegn til primærtumor | |
| I | Tumors utbredelse begrenset til cervix, spredning til corpus uteri ignoreres | |
| T1a | IA | Invasiv tumor diagnostisert kun med mikroskopi. Stroma invasjon med maksimum infiltrasjon < 5 mm uavhengig av utbredelse |
| T1a1 | IA1 | Stromal invasjon ≤3 mm. |
| T1a2 | IA2 | Stromal invasjon >3 og ≤5 mm. |
| T1b | IB | Tumor med infiltrasjon >5 mm, tumor begrenset til cervix |
| T1b1 | IB1 | Invasivt carcinom ≤ 2 cm (i største diameter) |
| T1b2 | IB2 | Invasivt carcinom>2cm og ≤ 4 cm (i største diameter) |
| T1b3 | IB3 | Invasivt carcinom>4cm (i største diameter) |
| T2 | II | Cervix cancer som vokser utenfor uterus, men ikke til bekkenveggen eller til den ytre tredjedelen av vagina |
| T2a | IIA | Tumor uten parametrieinfiltrasjon, begrenset til øvre 2/3 del av vagina |
| T2a1 | IIA1 | Invasivt carcinom ≤4 cm (i største diameter) |
| T2a2 | IIA2 | Invasivt carcinom >4 cm (i største diameter) |
| T2b | IIB | Tumor med parametrieinfiltrasjon men når ikke bekkenveggen |
| T3 | III | Tumor som vokser til bekkenveggen og/eller til ytre tredjedel av vagina |
| T3a | IIIA | Tumor vokser til den ytre tredjedel av vagina, men vokser ikke ut til bekkenveggen |
| T3b | IIIB | Tumor vokser til bekkenveggen og/eller forårsaker hydronefrose eller en ikke fungerende nyre (der det ikke er kjent annen årsak) (r eller p noteres) |
| T3C | IIIC | Tumor involverer lymfeknuter i bekken og/eller paraaortalt |
| IIIC1 | Metastaser bare til bekkenlymfeknuter | |
| IIIC2 | Metastaser til paraaortale lymfeknuter | |
| T4 | IV | Tumor har vokst (biopsiverifisert) inn i mucosa i blære eller rektum og/eller vokser utenfor bekkenet |
| IVA | Spredning til inntilliggende organer i bekkenet | |
| IVB | Fjernmetastaser |
| T-kategori | Figo.stad. | Definisjon |
|---|---|---|
| NX | Regionale lymfeknutemetastaser kan ikke utelukkes | |
| N0 | Ingen regionale lymfeknutemetastaser | |
| N1 | Regionale lymfeknutemetastaser |
| T-kategori | Figo.stad. | Definisjon |
|---|---|---|
| M0 | Ingen fjernmatastaser | |
| M1 | Fjernmetastaser (inkl. lyske lymfeknuter og intraperitoneale metastaser). Gjelder ikke metastaser til vagina, bekkenperitoneum og adnex |
Prognose
Sist faglig oppdatert: 11202311.04.2023
Sykdomsutbredelse (FIGO stadium/ TNM klassifikasjon) og tumorvolum viktigste prognostiske parametre (Green et al., 2001; Van de Putte et al,, 2005).
I stadium I er karinvasjon funnet av betydning i noen studier, men ikke i alle (Kristensen, 1999).
Fem års overlevelse (omfatter alle dødsårsaker) relatert til FIGO stadium 2017–21 (Larsen, 2022) (B).
| Total | 82,6 % |
|---|---|
| I | 95,7 % |
| II | 79,6 % |
| III | 55,3 % |
| IV | 20,7 % |
| Unknown | 82,4 % |
Multidisiplinære team
Sist faglig oppdatert: 11202311.04.2023
I tråd med føringer i pakkeforløp for livmorhalskreft skal utredning og behandlingsbeslutninger tas i multidisiplinære team for den enkelte pasient på regionssykehus. Teamene bør bestå av representanter for alle involverte faggrupper: Gynonkolog, stråleonkolog, radiolog og patolog samt andre ved behov (Helsedirektoratet, 2016b).
Behandling i primærsituasjonen tidlig stadium
Sist faglig oppdatert: 11202311.04.2023
Kirurgisk behandling versus strålebehandling ved tidlig stadium
Prognosen ved tidlig cervixcancer er den samme etter strålebehandling kombinert med konkomitant cellegift (Landoni et al., 1997), kalt radiokjemoterapi, som etter operasjon. Ved små tumores foretrekkes kirurgi for å unngå risikoen for seneffekter etter stråling. Flere behandlingsmodaliteter bør unngås da dette øker morbiditeten (Chai et al., 2014; Landoni et al., 1997; Pieterse et al., 2013).
Hvis den diagnostiske utredning tilsier at pasienten sannsynligvis må ha strålebehandling etter kirurgi, anbefales derfor primær radiokjemoterapi.
Kirurgisk behandling av lokalisert sykdom
Stadium IA1
Konisering:
- Hvis konus har frie reseksjonsrender, også for premaligne forandringer, og er uten karinfiltrasjon, er pasienten oftest ferdigbehandlet (konferer med senter for gynekologisk kreft).
- Ved CIN III i reseksjonsranden skal pasienten rekoniseres.
- Ved påvist karinfiltrasjon/LVSI bør sentinel node (SN) overveies.
- Ved tumorinfiltrasjon i reseksjonsranden, foreligger sannsynligvis et mer avansert stadium, som må utredes videre. Hvis MR ikke viser målbar tumor kan det foretas rekonisering.
Stadium IA2
Radikal hysterektomi (oftest type B etter Querleu Morrow klassifikasjonen) med bekkenlymfadenektomi har vært standard behandling (Querleu & Morrow, 2008). SHAPE studien er en stor internasjonal multisenter studie som har randomisert pasienter med tumor under 2 cm til radikal hysterektomi eller enkel hysterektomi. I begge grupper er det utført lymfadenektomi. Studien er ferdigrekruttert, men vi har ikke data fra den pr i dag. Det finnes noen mindre studier som støtter at enkel hysterektomi er tilstrekkelig behandling, blant annet ConCerv studien. ESGO anbefaler enkel hysterektomi med lymfeknutetoalett, SN kan overveies. Arbeidsgruppen konkluderer med at resultatene fra SHAPE studien bør avventes før enkel hysterektomi innføres som vanlig praksis.
Fertilitetsbevarende behandling kan vurderes.
Stadium IB1
Radikal hysterektomi med bekkenlymfadenektomi, type B.
Fertilitetsbevarende behandling kan vurderes.
Stadium IB2
Behandlingen styres av sannsynligheten for at pasienten trenger adjuvant radiokjemoterapi etter operasjon. Behandling med 2 modaliteter bør unngås (Chai et al., 2014; Landoni et al., 1997; Pieterse et al., 2013).
Ved infiltrasjon til ytre tredjedel av cervixstroma på MR anbefales primær radiokjemoterapi. Hvis tumor ikke infiltrerer i ytre tredjedel anbefales operasjon med radikal hysterektomi type B/C og lymfadenektomi i bekkenet.
Ved exofytisk tumor, med utbredelse nedenfor omslagsfolden, trenger man ikke ta hensyn til om tumor affiserer ytre tredjedel av cervixstroma i den delen som ikke er i relasjon til parametriet. Dette ettersom det i så tilfelle ikke medfører risiko for parametrieinfiltrasjon.
Stadium IB3
Risiko for residiv etter primær kirurgisk behandling er forholdsvis stor (Soutter et al., 2001). Derfor er anbefalt primærbehandling radiokjemoterapi. En randomisert studie har vist at det å gi neoadjuvant kjemoterapi og siden operere pasienten resulterer i dårligere overlevelse (Gupta et al., 2018). Se for øvrig avsnitt om medikamentell behandling.
Stadium IIA
Tilfeller med begrenset vaginalutbredelse (< 1 cm) kan behandles som stadium IBI. Ved større tumor er standardbehandling radikal radiokjemoterapi.
Behandlingsvalg er avhengig av øvrige forhold etter utredning, se avsnitt over vedrørende Stadium IB1-3.
Minimal invasiv kirurgi ved tidlig livmorhalskreft
De siste årene er mange av pasientene med livmorhalskreft som egnet seg for kirurgi blitt operert med minimal invasiv kirurgi, i Norge først og fremst robotassistert. Det er tidligere publisert retrospektive data som viste at det ga likeverdige resultater sammenlignet med åpen kirurgi. I 2019 ble det publisert en randomisert studie som sammenlignet minimal invasiv kirurgi med åpen kirurgi, LACC studien (Ramirez et al., 2018).
Den viste overraskende høyere risiko for tilbakefall og død for pasienter som ble operert med minimal invasiv kirurgi. En Europeisk retrospektiv studie, Succor studien viste lignende resultat med flere tilbakefall og dårligere overlevelse hos den minimalinvasive gruppen (Chiva et al., 2020). I denne studien fant man at hvis det ble gjort tiltak for å unngå søl (lukke vagina over tumor før kolpotomien) og ikke bruke uterine manipulator, var det ikke forskjell i resultatene.
Det pågår nå en nordisk initiert studie som skal sammenligne åpen radikal hysterektomi med robotassistert laparoskopisk radikal hysterektomi, RACC studien.
Inntil det foreligger nye data er åpen kirurgi standardbehandling. Minimal invasiv kirurgi kan utføres når det ikke foreligger synlig tumor på MR eller klinisk.
Lymfeknutestaging/sentinel node (SN) kan utføres ved minimal invasiv kirurgi.
Vaktpostlymfeknute (Sentinel Node (SN))
Konseptet er godt kjent fra andre diagnoser og er standard for blant annet kreft i kjønnsleppene. Fordelen er mindre morbiditet for pasienten som i stedet for å gjøre full lymfadenektomi i bekkenet får fjernet 1–2 lymfeknuter fra bekkenveggen, noe som gir lavere risiko for lymfødem. Det er dokumentert at negative SN predikerer at andre lymfeknuter også er negative. Det pågår nå 2 større randomiserte studier, Senticol III (International Validation Study of Sentinel Node Biopsy in Early Cervical Cancer (SENTICOLIII) [pågående studie], 2018-2026) og Sentix (Sentinel Lymph Node Biopsy in Patients With Early Stages Cervical Cancer (SENTIX) [pågående studie], 2016-2022) for å se om det er trygt å unnlate full lymfadenektomi hvis SN er negative.
ESGO anbefaler sterkt at SN identifiseres ved alle operasjoner for cervixcancer og at de sendes til frysesnitt før man går videre med operasjonen. Frysesnitt identifiserer makrometastaser men kan være falsk negativ når det foreligger små metastaser (Cibula et al., 2019, Ciluba et. a., 2018a).
En annen fordel med SN er at det kan utføres ultrastaging, det vil si at lymfeknutene blir snittet i svært fine snitt for å bedre patologidiagnostikken. Dette gir mulighet for å oppdage meget små metastaser.
Dette gir opphav til nye kategorier av metastaser. Mikrometastaser er metastaser mellom 0,2–2 mm i størrelse og Isolerte Tumor Celler (ITC) er metastaser mindre en 0,2 mm i størrelse. Det funnet at mikrometastaser gir høyere risiko for residiv men det er mer usikker om ITC påvirker prognosen.
SN kan med fordel identifiseres ved radikal hysterektomi på grunn av livmorhalskreft i og med det øker den diagnostiske sikkerheten. I Norge har vi en relativ lav insidens av lymfeknutemetastaser sammenlignet med mange land, noe vi antar har sammenheng med god radiologi som identifiserer de fleste metastasene på forhånd. Vi anbefaler derfor ikke frysesnitt på lymfeknuter.
Lymfadenektomi kan unnlates hos stadium IA1 med karinfiltrasjon der det er gjort SN.
Fertilitetsbevarende kirurgi
Fertilitetsbevarende kirurgi bør tilbys til alle unge kvinner med tidlig livmorhalskreft som har graviditetsønske og der tumor oppfyller kriterier. Behandlingen er sentralisert og pasientene skal henvises for vurdering og behandling ved Nasjonal behandlingstjeneste for fertilitetsbevarende kirurgisk behandling av livmorhalskreft ved OUS Radiumhospitalet.
Akseptert indikasjonsområde er tumor opp til 2 cm i diameter, uavhengig av invasjon i kar/lymfebaner. Det gjøres ikke fertilitetsbevarende kirurgi på tumor med neuroendokrin histologi eller tumor med utbredelse der standard behandling er radiokjemoterapi. Fors svulster mindre enn 2 cm er det ikke vist noen gevinst av at gjøre radikal vaginal trachelektomi mot enkel trachelektomi eller konisering. Residivrisiko er rapportert rundt 4% (Bentivegna et al., 2016a) (Bentivegna et al., 2016b; Tseng et al., 2018)
Ved tumorstørrelse > 2 cm foretas en individuell vurdering (Amant et al., 2014; Bouchard-Fortier, Reade, & Covens, 2014; Plante, 2013). Behandlingen må anses som eksperimentell. Vaginal radikal trachelektomi har en høy risiko for residiv hos disse pasienter på 17%. Abdominal radikal trachelektomi har lavere risiko for residiv på ca 5-6% men dårligere graviditetsutfall. Smith et al rapporterer en graviditetsrate på 10.4% mot 37.8% for vaginale radikale trachelektomier (Smith et al., 2020).
Norske resultater rapporteres årlig til Helsedirektoratet. Her er tall fra 2021.
Fra og med 2010 er det operert 155 pasienter. Av disse har 4 blitt behandlet for residiv og lever fortsatt uten påvisbar sykdom. (2,6% residiv rate) Dette er et godt resultat og er på høyde med internasjonale resultater (1,6-3,8% Betivegna 2017). Siden starten (1997) har vi registrert at 42 pasienter har født barn, hvorav 7 pasienter har født 2 barn, 48 barn totalt. 12 (25%) barn er født prematurt (graviditetsuke <37), kun 7 (14,5%) av disse er født før graviditetsuke 34 . Det er mulig at flere kvinner har født barn uten at det er registrert i vår database.
Radial radiokjemoterapi ved lokalregional sykdom i primærsituasjonen
Sist faglig oppdatert: 11202311.04.2023
Introduksjon
Standard behandling av lokalavansert cervixcancer er radikal radiokjemoterapi gitt som en kombinasjon av ekstern strålebehandling med konkomitant kjemoterapi og brakyterapi.
Behandlingstid
Den totale behandlingstiden, inkludert ekstern og brakyterapi, bør ikke overstige 7 uker/50 dager (Board of Faculty of Clinical Oncology, 2008; Girinsky et al., 1993; Perez et al., 1995, Royal College of Radiologist, 2019, Viswanathan et al., 2012). Studier indikerer at lokal kontroll og sykdomsfri overlevelse kompromitteres ved betydelig forlengelse utover dette (Perez et al., 1995; Pieterse et al., 2013; Viswanathan et al., 2012). Man er særlig bekymret for at akselerert repopulasjon kan redusere lokal kontroll ved for lange ukompenserte pauser (Fyles et al, 1992, Huang et al., 2012).
RCR (Royal College of Radiologist) Guidelines fra 2019 (Royal College of Radiologists, 2019) anbefaler at man om mulig unngår pauser i stråleterapi og at man følger Mackillop’s ASARA prinsipp om at pauser skal være «as short as reasonably achievable».
For pasienter med plateepitelcarcinom i cervix, vagina og vulva bør man unngå øket behandlingstid da det kan påvirke utfallet av behandlingen. For pasienter som bare har ekstern strålebehandling, ev i kombinasjon med kjemoterapi, bør ikke behandlingstiden økes med mer enn to dager ut over planlagt behandlingstid. Det må da has i mente at standard behandlingstid varierer med to dager avhengig av om behandlingsstart er på en mandag eller ikke.
Behandlingspauser
Dagens dokumentasjon foreligger på bakgrunn av behandling 5 dager per uke. Ved pauser i behandlingen (maskinstans, helligdager o.l.) bør det ved kurativ intensjon vurderes kompensasjons-behandlinger som hindrer at total behandlingstid overstiger 50 dager (Fyles et al., 1992; Mazeron et al., 2015; Perez et al., 1995; Tanderup et al., 2016). Selv om eksakt antall behandlingsfrie dager ikke spesifiseres i internasjonale studier, er det dokumentasjon som taler for behandlingspauser øker risiko for manglende sykdomskontroll. Det er derfor ønskelig med maksimalt 3 påfølgende dager uten behandling i perioden hvor det gis ekstern strålebehandling (Bese, Hendry, & Jeremic, 2007).
RCR (Royal Collage of Radiologist) Guidelines fra 2019 (Royal Collage of Radiologist, 2019) skisserer mulige kompensasjonsløsninger i prioritert rekkefølge:
- Opprettholde total behandlingstid, totaldose og dose pr fraksjon ved å:
- Behandle i helg eller på annen helligdag
- Gi 2 fraksjoner på samme dag med minst 6 timers mellomrom (fortrinnsvis rett før helgefri)
- Det skal ikke gis mer enn 6 fraksjoner per 7 påfølgende dager.
- Opprettholde total behandlingstid med økt dose per fraksjon
- Her må det velges om det skal gis ekvivalente doser med tanke på tumoreffekt eller med tanke på sene strålereaksjoner
- Akseptere økning av total behandlingstid og gi ekstra fraksjoner
- Her reduseres gjerne den terapeutiske bredden med følger både for tumorkontroll og forekomst av sene strålereaksjoner
Det må has i mente at en for aggressiv kompensasjon, vil gi uker med høy dose som, særlig ved konkomitant kjemoterapi, kan øke forekomst av akutte strålereaksjoner (Erridge et al., 2002).
Ekstern strålebehandling
Forberedelser
Fiksering/pasientleie
Det anbefales at hvert stråleterapisenter etablerer standard pasientfiksering i ryggleie. Spesielt fokus på reproduserbarhet av svai i ryggen da det kan ha stor betydning for nødvendige marginer spesielt ved paraaortal bestråling.
Bildeopptak for 3D-planlegging
Doseplanleggingen baseres på en CT undersøkelse med intravenøs kontrast. Snitt-tykkelse bør maksimalt være 3 mm. Det anbefales å benytte en drikkeprotokoll som gir komfortabel fylt blære. Målet med dette er å ha så lik blærefylling som mulig ved planlegging og behandling og å redusere dosen til blære og/eller tarm (Buchali et al., 1999). Rektum og sigmoid bør være så tom som mulig.
Inntegning av volumer
Inntegning av volumer utføres på bakgrunn av planleggings CT, T2-vektede MR bilder, eventuelt PET-CT og funn ved gynekologisk undersøkelse. MR, axial 3D T2W, i behandlingsposisjon (flatt bord, fiksering) anbefales for god samregistrering med CT’en.. Hvis det ikke foreligger MR med flatt bord/fiksering og en akseptabel samregistrering ikke oppnås, må samregistreringen gjøres på bløtvev for veiledning ved inntegning av tumor og cervix og eventuelt på bein ved inntegning av lymfeknuter.
Volumdefinisjoner i dette dokumentet bygger på retningslinjer gitt i StrålevernRapport 2012:09 (Levernes, 2012).
Inntegning av risikoorganer
Ved bestråling av cervixcancer bør følgende risikoorgan tegnes inn.
Risikoorgan | Beskrivelse av inntegning |
|---|---|
Bladder | Hele blæren inkludert blæreveggen og blærehalsen. |
Rectum | Rektum inkludert rektumveggen fra anorektal sfinkter til overgangen til sigmoideum. |
Sigmoid | Sigmoideum fra overgangen fra rektum til venstre fossa iliaca. Kan eventuelt tegnes inn som en del av Bowel. |
Bowel | Ytterkontur av tarmslyngene, inkludert mesenterium (ikke abdominalkavitet, store kar eller muskler). Kranielle begrensning: til og med L1 ved paraortal bestråling, L4 ved bekkenbestråling, blære, rectum og (sigmoid) skal ikke inkluderes. |
FemoralHeads | Hoftekulene. |
Kidneys | Ved bestråling av paraaortal regionen: hele nyrene, nyrebekkenet skal ikke tas med. |
Kidneys_PRV | Hvis ønskelig: Nyrene med PRV-margin i cranio/caudal retning for å ta høyde for nyrenes mulige bevegelse under strålebehandling. |
SpinalCord | Ved bestråling av paraaortal region: medulla fra toppen av nyrene og til cauda equina (mellom L2 og L3). |
Duodenum | Hvis ønskelig ved bestråling av paraaortal region over L1: Hele tolvfingertarmen. |
CaudaEquina | Hvis ønskelig ved lymfeknuteboost |
Inntegning av målvolumer
I nomenklaturen som benyttes for målvolumene i dette dokumentet, vil indeks p benyttes som en indikasjon på målvolum knyttet til tumor, n benyttes som en indikasjon på målvolum knyttet til lymfeknuter (nodes), og e benyttes som en indikasjon på målvolum hvor det ikke er påvist tumor, det vil si områder som skal ha elektiv bestråling. Dette er en nomenklatur som er i tråd med nasjonal anbefaling (Levernes, 2019).
Gross Tumor Volume (GTV), Tumorvolum
GTVp_MR: Primærtumor uten margin tegnes inn på T2‐vektet MR med støtte fra klinisk undersøkelse.
GVTp_PT: Primærtumor uten margin på FDG PET‐CT kan tegnes der denne er tatt i behandlingsposisjon.
GTVn#_dose:Patologiske lymfeknuter uten margin tegnes inn på CT eventuelt på en samregistrert MR. Ved inntegning av flere GTVn skal disse nummereres og dose bør angis, for eksempel GTVn1_55.
Patologiske lymfeknuter defineres i hovedregel ved hjelp av radiologi. European Society of Urogenital Radiology anbefaler at følgende retningslinjer benyttes (Balleyguier et al., 2011):
- FDG PET positiv
- Og/eller: kortakse større eller lik 1 cm på CT eller MR
- Og/eller: mindre lymfeknuter med patologisk morfologi på MR med en eller flere egenskaper:
- Uregelmessig avgrensning
- Høyt intensitetssignal
- Rund fasong
Dersom histologisk prøve av radiologiske usikre lymfeknuter er mulig, kan dette være aktuelt når diagnostikk har betydning for behandlingsvalg (f.eks primærbehandling med kirurgi vs. radiokjemoterapi eller om det foreligger indikasjon for paraaortal bestråling).
Clinical Target Volume (CTV), Klinisk målvolum
CTVp_HR: GTVp_MR + resterende del av cervix
CTVp_LR: Skal inkludere:
- CTVp_HR
- Parametriene på begge sider
- Hele uterus
- Ikke involvert vagina med 20 mm margin målt fra kaudale begrensning av CTVp_HR langs vaginal aksen (starter ikke i fornix).
- CTVp_HR med en 5 mm margin anteriort og posteriort mot blære og rektum (ikke inn i blære og rektum hvis det ikke er innvekst).
- Hvis det er innvekst i bekkenveggen, sakrouterine ligamenter, mesorektum eller andre involverte strukturer, vil det ofte være nødvendig å legge til en ekstra margin rundt CTVp_HR inn i disse strukturene.
CTVn: CTVn skal minimum inkludere hele lymfekuten på MR og CT. Ekstrakapsulær vekst må tas hensyn til. En typisk margin er 0–3 mm fra GTVn bortsett fra mot sikre anatomiske barrierer.
CTVe: Lymfeknuteregioner som skal inkluderes i CTVe er avhengig av risiko for spredning og er spesifisert i forhold til de ulike risikogruppene (lav, intermediær og høy) (Keenan et al., 2018; Lim et al., 2011; Taylor et al., 2007; Toita et al., 2011).
- Lymfeknuteregioner inkludert blodårer med omtrent 7 mm perivaskulært vev.
- Patologiske lymfeknuter (CTVn) skal inkluderes.
- CTV skal ikke tegnes inn i naturlige barrierer (bein/muskulatur/tarm).
- CTV tegnes i noen områder inn i tarm utfra individuelle vurderinger.
- Ovarier kan vurderes inkludert for eksempel ved utbredt affeksjon av uterus eller ligamentum latum infiltrasjon.
- Dersom patologiske lymfeknuter i mesorectum eller innvekst i rectum, bør hele mesorectum inkluderes.
EMBRACEII appendix 5: EBRT contouring atlas
Paraaortal inntegningsatlas (Keenan et al., 2018)
Risikogruppe | Definisjon | Lymfeknuteregioner inkludert i CTVe |
|---|---|---|
Lav risiko | Tumorstørrelse ≤4 cm og FIGO 1A/1B/IIA1 og N0 og plateepitel karsinom og ingen infiltrasjon i uterus | «Lille bekken»:
|
Intermediær risiko | Ikke «Lav risiko» Ikke «Høy risiko» | «Store bekken»:
|
Høy risiko | ≥ 1 patologisk lymfeknute i iliaca communis regionen eller høyere eller ≥ 3 patologiske lymfeknuter | «Store bekken + paraaortal»:
|
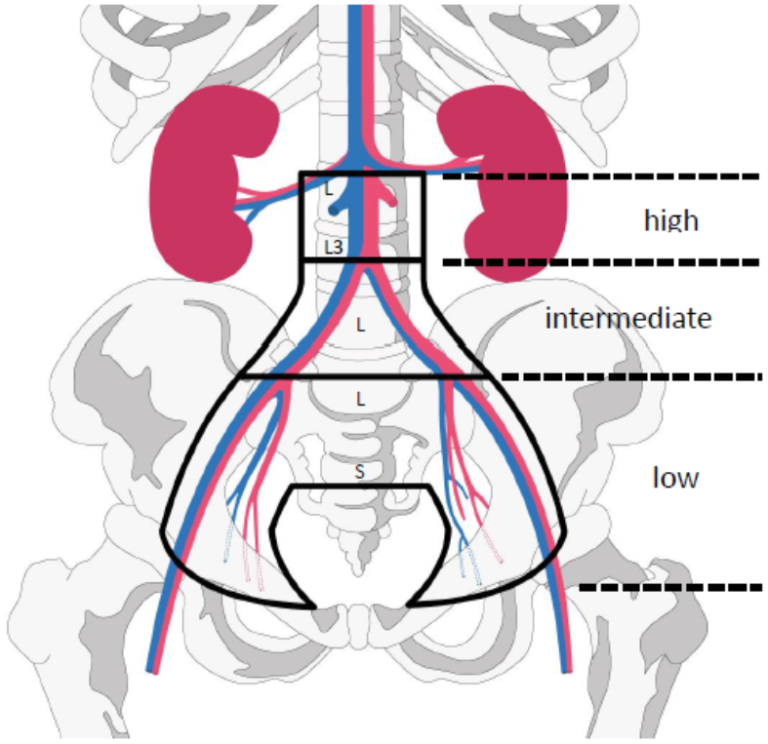
Marginer og marginrelaterte volumer
For å sikre rekvirert dose til CTV må det i tillegg til tumorutbredelse tas med marginer for ulike usikkerheter og variasjoner. ITV tar hensyn til usikkerhet og variasjon i størrelse, form og posisjon på CTV i pasienten. I tillegg inngår variasjon i ulike legers inntegning av målvolum. PTV er et geometrisk volum som skal sikre at rekvirert dose med akseptabel sannsynlighet blir gitt til alle deler av CTV når det tas hensyn til alle geometriske usikkerheter og variasjoner av pasient og utstyr (Levernes, 2012).
Internal Target Volume (ITV)
Margin mellom CTV og ITV: Intern bevegelse av cervix og uterus kan være store.
Det anbefales å bruke individualiserte ITV marginer.
I praksis er det anbefalt å starte med standard marginer og tilpasse volumet individuelt for hver pasient basert på bevegelsesinformasjon fra bildegrunnlagene (CT/MR).
Følgende marginer kan benyttes som et utgangspunkt:
ITVp marginer for CTVp:
- 10 mm anterior/posterior
- 10 mm superior/inferior
- 5 mm lateralt
Individuell vurdering av marginene:
Diagnostiske bilder og doseplan CT kan gi informasjon om anatomiske forhold av betydning for doseplanlegging hos den enkelte pasient. MR eller CT med ulik blære/rektum fylling i forhold til planleggings CT’en vil for eksempel kunne bidra til å definere individualiserte ITV marginer. Ved daglig adaptiv behandling kan ITV-marginene reduseres. Hvis bildene er tatt i behandlingsposisjon vil de kunne samregistreres og dermed gi mer eksakt informasjon.
ITVp_45:
- Ikke inn i naturlig barrierer (bein/muskulatur).
- Det skal ikke legges til ekstra marginer caudalt i vagina.
- Ved tumorinfiltrasjon i den øvre delen av corpus uteri bør det i legges til en ekstra 5 mm margin utenfor livmor i alle retninger.
For lymfeknutestasjoner anses den interne bevegelsen å være ubetydelig og dermed vil ITV være lik CTV for CTVn og CTVe.
Planning Target Volume (PTV), Planleggingsvolum
Hver enkelt avdeling må vurdere sine PTV marginer ut i fra sitt eget behandlingsopplegg og rutiner for posisjonskontroll av behandlingen.
Fraksjonering
Ved radikal radiokjemoterapi av cervixcancer gis en kombinasjon av ekstern strålebehandling og brakyterapi. Det er derfor viktig å ta hensyn til bidraget fra begge disse behandlingsmodalitetene når dosen beregnes. For å kunne summere dosebidragene må dosen angis i 2 Gy’s ekvivalent dose, som beregnes ved hjelp av α/β –formelverket (Joiner et al., 2019). Det er benyttet α/β=3 for sentreagerende (normalvev) vev og α/β=10 for tumor.
| Fraksjonsdose | Totaldose | EQD2 (α/β =10) |
|---|---|---|---|
CTVp | 1.8 Gy | 45 Gy | 44.3 Gy |
CTVe | 1.8 Gy | 45 Gy | 44.3 Gy |
CTVn i bekkenet | 2.2 Gy | 55 Gy | 56 Gy |
CTVn utenfor bekkenet | 2.3 Gy | 57.5 Gy | 59 Gy |
Det anbefales å benytte simultanintegrert boost (SIB) til lymfeknutemetastaser.
For lymfeknuter i bekkenet som antas å få lite dosebidrag fra braky, kan det vurderes å øke fraksjonsdosen til 2.3 Gy.
Den ekstra dosen til lymfeknutene kan alternativt gis som en sekvensiell boost.
Bakgrunn for doser til CTVn
Anbefalte doser til CTVn er mellom 55–65 Gy: Ifølge Mohamed SM (Mohamed et al., 2015) kan den forventede dosen fra brakyterapi bli tatt hensyn til ved at det anslås 3–4 Gy (EQD2) i lille bekken (iliaca externa/interna og obturator lymfeknuter), og neglisjerbar dose utenfor bekkenet (iliaca communis, paraaortale og inguinale lymfeknuter).
Med denne forutsetningen oppnås rundt 60 Gy til lymfeknuter i bekkenet ved å gi 56 Gy (EQD2) ved ekstern stråleterapi samt at de mottar 3–4 Gy (EQD2) ved brakyterapi.
Strålebehandlingsteknikker
Intensitetsmodulert strålebehandling (IMRT) eller intensitetsmodulert buebehandling (VMAT) anbefales for å redusere dosen til risikoorganer (Chopra et al., 2021; D'Souza et al., 2012; Gandhi et al., 2013; Klopp et al., 2018; Yeung et al., 2020).
Beregningsalgoritmer og energi
Det er anbefalt å bruke algoritmer som vil gi pålitelige beregninger også ved betydelige inhomogeniteter for eksempel: «Monte Carlo», «Acuros XB», «Collapsed Cone» eller «AAA»
Ved bruk av høye energier vil nøytrondosen øke, derfor er lavere energier (6 MV, 10 MV) å foretrekke.
Normering
Ved ett dosenivå (uten lymfeknuteboost) anbefales det å normere til median i ITV_45 (Alternativt PTV_45).
Ved flere dosenivåer og simultanintegrert boost er en mulighet å normere til median i et volum som består av ITV_45 der alle PTVn er ekskludert. (Alternativt PTV_45 ekskludert PTVn).
En alternativ mulighet er å normere til D98 til CTVn for det høyeste dosenivået.
DMin | Dosen til 99.9 % av volumet |
D98 | Dosen til 98 % av volumet |
Dvolum | Dosen til angitt volum |
Vdose | Volumet som mottar angitt dose |
| Dmaks | Punktdosemaks |
Volum | Dosevolum krav | Dosevolum ønske |
|---|---|---|
ITV_45 | DMin >95 % (42.8 Gy) | DMaks < 107 % (48.2 Gy) |
PTV_45 | D98 % > 95 % (42.8 Gy)* DMaks <107 % (48.2 Gy)** |
|
CTVn | D98 > 100 % av rekvirert dose | D50 > 102 % av rekvirert dose*** |
PTVn | D98 > 90 % av rekvirert dose DMaks < 107 % av rekvirert dose | |
xCTVp_HR+10 |
| DMaks < 103 % (46.4 Gy) |
* EMBRACE 2 har en dosevolumkrav D95% > 95% for å spare risikoorgan.
** Maksdosekravene til ITV_45 og PTV_45 gjelder i tilfeller uten lymfeknuter som skal boostes. Ved lymfeknuteboost anbefales å lage et volum det PTVn ekskluderes og se på maksodsene til disse volumene.
*** For større lymfeknuter. Vanskelig å oppnå på små lymfeknuter.
Dosefordeling i CTVn
Det brukes en dosefordeling for lymfeknuteboost som tar hensyn til sannsynligheten for dosedekning. Det vil si at det antas at CTVn oppholder seg mer i det sentrale området enn i kanten av PTVn. Som følge av dette er målet å oppnå en heterogen dose i PTVn med sentraldose høyere enn 100 % og dose i kanten til 90 %. Hvis det er store lymfeknuter, er det mulig å eskalere sentral del av GTVn til for eksempel D50 > 102 %, samtidig som øvre grense på 107 % respekteres (Ramlov et al., 2017a).
Dosefordeling i brakyområdet
Det er viktig å unngå høye doser til risikoorganer som får dosebidrag fra brakyterapi. Det vil si de risikoorganene som ligger nært CTVp_HR (blære, rektum, sigmoid og tynntarm). For å unngå høye doser i dette området genereres det en hjelpekontur (xCTVp_HR_10) som er CTVp_HR med 10 mm margin. Dosen innen denne hjelpekonturen anbefales å være mindre enn 103 % av 45 Gy for å unngå varme områder i risikoorganene som vil få vesentlig bidrag fra braky.
Toleransedoser
Normalvevstoleranse handler ikke bare om dosenivåer, men ofte også om hvor stort volum som blir bestrålt til hvilken dose. (Dawson et al., 2010; Jensen et al., 2021; Spampinato et al., 2021a, 2021b; Spampinato et al., 2022; Westerveld et al., 2022). Karakteristikken på denne dose-volum-sammenhengen varierer mellom ulike organer.
Organ | Dosevolum krav | Dosevolum ønske |
|---|---|---|
Bowel | DMaks < 105 % (47.3 Gy) | V40 Gy < 250cm3* V30 Gy < 500cm3* |
Sigmoid | DMaks < 105 % (47.3 Gy) |
|
Bladder | DMaks < 105 % (47.3 Gy) | V40 Gy < 60 %* V30 Gy < 80 %* |
Rectum | DMaks < 105 % (47.3 Gy) | V40 Gy < 75 %* V30 Gy < 95 %* |
SpinalCord | DMaks < 48 Gy |
|
FemoralHead | DMaks < 50 Gy |
|
Kidney | DMean < 15 Gy | DMean < 10 Gy |
Body | DMaks < 107 % (48.2 Gy) |
|
Duodenum | V55 Gy < 15 cm3 |
|
Organ | Dosevolum krav | Dosevolum ønske |
|---|---|---|
Bowel | DMaks < rekvirert dose til PTVn | Bekkenbestråling: V40 Gy < 250 cm3 |
| DMaks < 47.3 Gy (i områder utenfor 10–15 mm fra PTVn) | Paraortal bestråling: V40 Gy < 300 cm3 |
Sigmoid | DMaks < rekvirert dose til PTVn DMaks < 47.3 Gy (i områder 10–15 mm fra PTVn) |
|
Bladder | DMaks < rekvirert dose til PTVn DMaks < 47.3 Gy (i områder utenfor 10–15 mm fra PTVn) | V40 Gy < 60 %* V30 Gy < 80 %* |
Rectum | DMaks < rekvirert dose til PTVn DMaks < 47.3 Gy (i områder utenfor 10–15 mm fra PTVn) | V40 Gy < 75 %* V30 Gy < 95 %* |
SpinalCord | DMaks < 48 Gy |
|
FemoralHead | DMaks < 50 Gy |
|
Kidney | DMean < 15 Gy | DMean < 10 Gy |
Body | DMaks < 48.2 Gy (i områder utenfor 10–15 mm fra PTVn) |
|
Duodenum | V55 Gy < 15 cm3 |
|
Gjennomføring av behandlingen
Det er vanlig å posisjonere pasienten etter påtegninger/tatoveringer på hud og/eller ved hjelp av overflateskanningssystemer.
Det anbefales at det gjennomføres daglig bildematch på skjelettstrukturer og posisjoneringskorreksjon før behandling. Hvis det er mulighet for å korrigere bord for pitch, roll og rotasjon, gjøres dette.
Ved paraaortal bestråling vil en liten rotasjon i bekkenet kan ha stor påvirkning på posisjonen til lymfeknutene. Det anbefales derfor ikke å korrigere for pitch i disse tilfellene.
Ved daglig matching på skjelettstrukturer i bekkenet inkludert bordkorreksjon er det mulig å redusere PTV-marginene fra 10 til 5 mm for elektivt lymfeknutevolum uten å gå på kompromiss med målvolumdekningen (Laursen et al., 2012) .
Ved cone beam CT (CBCT), er det mulig å se om den daglige uterus posisjonen er signifikant forskjellig fra forventet, og denne kunnskapen kan brukes til å avgjøre om det er behov for en ny behandlingsplan.
Hvis CBCT’en viser at signifikante deler av CTV’ene er gjentagende utenfor 95 % isodosevolumet anbefales det å:
- Vurdere om det er tilstrekkelig blærefylning
- Ta ny planleggings CT for å replanlegge
- Redefinere ITV og ta hensyn til informasjonen en får ut fra CBCT’ene
- Justere PTV marginene
- Det er aksept for 10 % underdosering av ikke‐involvert fundus uteri så lenge bidraget fra ekstern strålebehandling er minimum 40 Gy (EQD2)
Brakyterapi
Boost til tumor i form av brakyterapi er nødvendig for å oppnå høy nok stråledose for kurasjon (Gill et al., 2014). Behandlingen gis gjerne mot slutten av eller etter den eksterne stråleterapien for å oppnå størst mulig tumorskrumpning. De siste 10–15 årene har brakyterapi basert på volumetrisk/3D avbildning blitt tatt i bruk. Pasienten får da en individuell tilpasset behandling ved hver fraksjon, såkalt adaptiv billedveiledet brakyterapi (IGABT). Internasjonale publikasjoner har beskrevet økt lokal kontroll, bedret overlevelse og redusert forekomst av alvorlige bivirkninger hos pasienter behandlet med IGABT sammenliknet med historiske kontroller behandlet med konvensjonell, punktdosert brakyterapi (Charra-Brunaud et al., 2012; Fokdal et al., 2018; Jensen et al., 2018; Lindegaard et al., 2013; Rijkmans et al., 2014; Sturdza et al., 2016).
Utstyr
Gynekologisk brakyterapi i Norge gis med med etterladningsapparater, og det benyttes høydoserate (HDR). Det gis behandling med ringapplikator og intrauterinsonde, eventuelt benyttes også interstitielle nåler.
Gynekologisk undersøkelse
Før innleggelse av applikator, skal tumorutbredelse og lokale forhold i vagina/cervix/uterus som har betydning for valg av applikator og teknikk bedømmes klinisk ved gynekologisk undersøkelse under anestesi. Transrektal UL kan være til hjelp i denne vurderingen.
Bildeopptak for 3D-planlegging
Det anbefales at det tas MR eller CT med applikator i pasient før hver fraksjon (Cibula et al., 2018b; The International Commission on Radiation Units & Measurements (ICRU) et al., 2016).
MR anbefales framfor CT på grunn av bedre evne til å skille tumor fra øvrig bløtvev i og rundt cervix..
CT/MR tas med liten snitttykkelse for å få en mest mulig riktig avbildning av applikatorene (maksimalt 3 mm). Ved MR-opptak vil T2 vektede bilder og 3D-sekvenser gi den beste informasjonen.
Blærevolumet skal være så likt som mulig på bildeopptaket og under behandling.
Inntegning av volumer og definering av punkter
Inntegning av volumer utføres på bakgrunn av planleggings MR eller CT (fortrinnsvis med samregistrerte T2-vektede MR bilder) og gynekologisk undersøkelse.
Inntegning av risikoorganer
Risikoorganene skal tegnes inn på planleggingsbildene for aktuell fraksjon.
Følgende risikoorgan bør tegnes inn.
Risikoorgan | Beskrivelse av inntegning |
|---|---|
Bladder | Hele blæren inkludert blæreveggen og blærehalsen. |
Rectum* | Rektum inkludert rektumveggen fra innenfor relevant avstand |
Sigmoid* | Sigmoid fra overgangen fra rektum. |
Bowel | Ytterkontur av tarmslyngene som er posisjonert innenfor relevant avstand |
* Hvis overgangen mellom rektum og sigmoideum kommer i nærheten av applikatoren er det anbefalt å flytte overgangen opp eller ned slik at maksimal D2ccm kommer i ett organ. Dette området bør ligge i samme organ ved alle fraksjoner.
Inntegning av målvolumer
Det er anbefalt at målvolumer tegnes inn i henhold til GEC ESTRO anbefalingene (Haie-Meder et al., 2005).
Følgende målvolum bør tegnes inn:
Målvolum | Beskrivelse av inntegning |
|---|---|
GTV | Synlig gjenværende tumor på MR. |
CTV_HR | Adaptivt høyrisiko klinisk målvolum inkluderer resttumor inklusiv usikre områder i parametriene (på MR) samt resterende del av cervix. |
Følgende punkter defineres:
Punkter | Beskrivelse av plassering |
|---|---|
ICRU recto‐vaginal | 5 mm posterior for vaginalveggen. (Skal defineres). |
ICRU bladder | Den mest posteriore posisjonen i det snittet hvor kateterballongen har størst utstrekning (valgfritt). |
Vaginal point | 5 mm fra vaginalapplikatorens overflate i sin og dxt (valgfritt). |
A1 og A2 | 20 mm kranielt for vaginalapplikator langs uterinsonden og 20 mm lateralt for uterinsonden (The International Commission on Radiation Units & Measurements (ICRU) et al., 2016). |
Strålebehandlingsteknikker ved brakyterapi
Det anbefales å benytte seg av applikatorbibliotek for å rekonstruere applikator hvis det er tilgjengelig.
Standard dosefordeling basert på dose til punkt A vil ofte ikke gi en optimal behandling, verken med hensyn på dekning av målvolum eller dose til kritiske organ. Det anbefales likevel å ta utgangpunkt i en standardplan (The International Commission on Radiation Units & Measurements (ICRU) et al., 2016). Hvis det ikke tas utgangspunkt i en standardplan, er det ekstra viktig å se på hvor den høye dosen blir avsatt etter optimalisering.
Interstitielle nåler
I en del situasjoner vil det ikke være mulig å oppnå ønsket dose til tumor og/eller akseptabel dose til risikoorganer kun ved bruk av intrakavitære applikatorer. Det anbefales da å benytte interstitielle nåler/katetre. I RetroEMBRACE studien fant man at brakyterapi med intrakavitær/insterstitiell teknikk til store svulster ga signifikant bedret lokal kontroll uten økt morbiditet (Fokdal et al., 2016).
Interstitielle katetre kan plasseres ved hjelp av definerte posisjoner i utstyret eller direkte i tumorvevet der standardposisjonene ikke gir et tilfredsstillende resultat. Interstitielle kateterposisjoner må rekonstrueres manuelt. Generelt anbefales det ikke å lade nålene mer enn 20–30 % i forhold til liggetiden i de intrakavitære applikatorene. Hvis nålene skal lades mer, må posisjonen til nålen og den aktuelle kildeposisjonen vurderes. Den endelige planen må vurderes nøye med hensyn på dosefordeling og lokalisasjon av de kildeposisjonene som benyttes (Dimopoulos et al., 2006; Fokdal et al., 2013).
Det anbefales at avdelinger uten erfaring med/tilgang til behandling med interstitiell teknikk henviser til avdeling med slik kompetanse ved behov.
Fraksjonering
Brakybehandlingen med høydoserate gis vanligvis med 4–5 fraksjoner slik at de anbefalte summerte dosene oppgitt under oppnås. EQD2 dosene inkluderer 45 Gy/25 fraksjoner som er gitt ved ekstern strålebehandling.
Det anbefales maksimalt 3 fraksjoner med brakyterapi per uke. Ved 3 fraksjoner på en uke forutsettes at ekstern strålebehandling er avsluttet.
I EMBRACE 1 studien ga en median dose på 90 Gy til D90 av CTV HR en 5-års lokal kontrollrate på 92%* (Pötter et al., 2021). EMBRACE 2 studien har følgende dosekrav (totaldose med ekstern stråledose og dose fra brakyterapi):
Målvolum: | Dosevolum krav EQD2 (α/β=10 | Dosevolum ønsker EQD2 (α/β=10 |
|---|---|---|
GTV | D98 > 90 Gy | D98 > 95 Gy |
CTV_HR | D90 > 85 Gy | 95 Gy < D90 > 90 Gy D98 > 75 Gy |
Punkter: |
|
|
Punkt A |
| > 65 Gy (kun aktuelt ved intracavitær behandling) |
Toleransedoser
Organ | Dosevolumkrav D2ccm (EQD2 (α/β=3)) | Dosevolumønsker D2ccm D2ccm (EQD2 (α/β=3)) |
|---|---|---|
Bladder | < 90 Gy | < 80 Gy |
Rectum | < 75 Gy | < 65 Gy |
Sigmoid | < 75 Gy | < 70 Gy |
Bowel | < 75 Gy | < 70 Gy |
Det er et ønske å redusere dosen til øvre vagina hvis mulig. Vaginalpunktene kan brukes til dette. Vurdering av 200 %-isodosen rundt vaginalapplikatoren er også nyttig. Ved å redusere dosen i vaginalapplikatorenog øke dosen i sonden og eventuelle nåler kan dose til vagina reduseresuten å redusere dosen til målvolumene (Mohamed et al., 2016).
| Ønsker | Prioritet |
|---|---|---|
ICRU recto-vaginal punkt dose | < 65 Gy (EQD2α/β=3 ekstern + braky) | Primær |
Konkomitant kjemoterapi
Bedre resultater av strålebehandling kombinert med cellegift sammenlignet med strålebehandling alene ble demonstrert i en meta-analyse fra 2001 og senere i en Cochrane review fra 2010 (Chemoradiotherapy for Cervical Cancer Meta-analysis Collaboration (CCCMAC), 2010; Green et al., 2001). Standard behandling ved lokalavansert livmorhalskreft i dag er derfor strålebehandling i kombinasjon med cellegift.
Det anbefales at cisplatin som hovedregel gis mandag, tirsdag eller onsdag, men kan unntaksvis gis på en torsdag for så å fremskynde uken etter. Minimum 5 dager mellom 2 på følgende kurer.
Cisplatin bør tilstrebes å ha blitt ferdig infundert før pasienten får sin daglige strålebehandling.
Ukentlig Cisplatin (40 mg/m2) gitt konkomitant med ekstern strålebehandling er det foretrukne regimet da studier med andre medikamenter eller kombinasjoner til nå ikke har vist å gi bedre resultater, men har medført økt toksisitet (Chemoradiotherapy for Cervical Cancer Meta-analysis Collaboration (CCCMAC), 2010; Chen et al., 2017; Deng et al., 2022; Mohamed et al., 2016). Man har i EMBRACE I sett flere residiver når mindre enn 5 kurer er gitt (Schmid et al., 2014). Det tilstrebes derfor at det gis 5–6 kurer totalt. De fleste studier og retningslinjer opererer med en maksimal dose med Cisplatin på 70 mg.
Individuell vurdering, men veiledende grenser på ≥ 1-x 109/L for neutrofile og TPK > 75 x109/L for å gi kur. Veiledende grense estimert GFR > 50.
Man bør redusere Cisplatindosen til 30 mg/m2 ved mer enn en kurutsettelse grunnet for lave hematologiske verdier, eller etter en episode med febril neutropeni.
En bør avstå fra konkomitant kjemoterapi framfor å risikere å avbryte strålebehandlingen hos pasienter med redusert toleranse på grunn av nedsatt allmenntilstand eller komorbiditet.
Ukentlig Cisplatin må regnes som et høyemetogent kur-regime, særlig pga kombinasjon med abdominal bestråling. Det anbefales derfor at det gis et antiemetisk regime i tråd med de til enhver tids gjeldende anbefalinger for slike kur-regimer (Einhorn et al., 2017).
Dersom cisplatin er kontraindisert kan ukentlig Karboplatin (AUC2) være et alternativ, selv om man har begrenset med data som viser effekt i denne settingen (Cetina et al., 2008; Dubay et al., 2004; Katanyoo et al., 2011; Nam et al., 2013; Tharavichitkul et al., 2016)
Postoperativ radiokjemoterapi
Overlevelsen etter radikal kirurgi uten adjuvant behandling for cervixcancer i tidlig stadium er god med ca. 90 % 5-års overlevelse (Larsen, 2015). Ved hjelp av histopatologiske prognostiske faktorer kan man velge ut pasienter som kan ha nytte av adjuvant behandling og dermed bedre prognosen.
Postoperativ strålebehandling har i flere studier vist signifikant redusert residivfrekvens ved tidlig cervixcancer med risikofaktorer (L. Rogers, Siu, Luesley, Bryant, & Dickinson, 2012; Rotman et al., 2006; Sedlis et al., 1999; Van de Putte et al., 2005).
Konkomitant kjemoterapi (Cisplatin) anbefales.
Indikasjon:
I tråd med ESGO-guidelines (Cibula et al., 2018b) er adjuvant radiokjemoomterapi indisert i høyrisikogruppen, dvs dersom minst en av følgende kriterier foreligger:
- Lymfeknutemetastaser i bekkenet. Gjelder makrometastaser pN1 eller mikrometastaser pN1 (mi).
- Parametrieinfiltrasjon
- Ufrie kirurgiske marginer (Estape et al., 1998; Khanna et al., 2016; McCann et al., 2013; Viswanathan et al., 2006)
- Adjuvant behandling kan i tillegg vurderes ved funn av isolerte tumorceller i sentinel LNs, selv om klinisk betydning er usikker.
- Adjuvant radiokjemoterapi kan vurderes i intermediær risikogruppe (kombinasjon av risikofaktorer basert på endelig histologi; tumorstørrelse, invasjon i kar/lymfebaner og dybde på stromainvasjon. Adjuvant radiokjemoterapi kan i denne gruppen vurderes på bagrunn av Sedlis kriterier:
Postoperativ strålebehandling (+/- konkomitant cisplatin) på bakgrunn av andre risikofaktorer* for tilbakefall vurderes i MDT møter i de enkelte kasus.
Invasjon i kar/lymfebaner | Dybde på stromainvasjon | Tumorstørrelse |
|---|---|---|
Ja | Ytre 1/3 | Alle |
Ja | Midtre 1/3 | >= 2 cm |
Ja | Indre 1/3 | >= 5 cm |
Nei | Midtre eller ytre | >= 4 cm |
Anbefalinger for adjuvant radiokjemoterapi i intermediærgruppen er basert på to gamle prospektive studer fra 1999 (Sedlis et al., 1999) og 2000 (Peters et al., 2000). Det har nylig blitt publisert en reviewartikkel i Int J Gynecol Cancer (Rodriguez et al., 2022) hvor forfatterne stiller spørsmål om det er på tide å oppdatere anbefalingene for adjuvant behandling etter radikal kirurgi ved cervix cancer i intermediær risikogruppe. GOG92, med sine begrensninger, er den eneste studien med evidens som støtter adjuvant behandling i intermediær risikogruppen. Det har vært en formidabel forbedring i billeddiagnostikk, patologi, staging og behandling (både kirurgi og strålebehandling) i løpet av de siste årene. På bagrunn av det er det mulig at flere i intermediærgruppen blir overbehandlet. Foreløpig foreligger det ikke evidens for at man bør utelate adjuvant behandling i denne gruppen. Rodrigez et al konkluderer med at inntil ny evidens blir publisert, bør vi forsette å individualisere behandlingen i intermediær risikogruppen (Rodriguez et al., 2022).
Oppstart postoperativ strålebehandling anbefales 4–8 uker etter operasjon.
Fiksering/pasientleie/Bildeopptak for 3D-planlegging/Inntegning av risikoorgan:
Se avsnitt "Ekstern strålebehandling, Forberedelser" og "Brakyterapi, Bildeopptak for 3D-planlegging" over.
Inntegning av målvolumer:
Internasjonale konsensus dokumenter for inntegning av målvolum for postoperativ radioterapi (Small et al., 2008; Toita et al., 2010).
Clinical Target Volume (CTV), Klinisk målvolum:
CTVe:
- Øvre begrensning av CTVe bør ligge et snitt under aortabifurkaturen.
- Nedre begrensning av CTVe bør ligge minst 2 cm kaudalt for vaginaltoppen eller 1 cm kranialt for foramen obturatorius nedre begrensning.
- Følgende strukturer bør inkluderes i CTV:
- Lymfeknutestasjoner ved iliaca communis, iliaca externa, iliaca interna og presakralt.
- Eventuelle lymfoceler
- Øvre vagina, minst 2 cm, samt paravaginalt bløtvev lateralt for vagina
- Parametrier
CTVn:
Gjenstående patologiske lymfeknuter defineres som CTVn.
ITVe
Det anbefales å bruke individualiserte ITV marginer. Caudale del av CTV som ligger mellom rektum og blære, vil ha behov for ITV-margin (spesielt i anterior/posterior retning avhengig av rektumfylning).
I praksis er det anbefalt å starte med standard marginer og tilpasse volumet individuelt for hver pasient basert på bevegelsesinformasjon fra bildegrunnlagene (CT/MR).
Planning Target Volume (PTV):
se avsnitt "Inntegning av volumer" over.
Fraksjonering:
- Ekstern strålebehandling opp til minst 45 Gy (EQD2). 1,8–2 Gy per fraksjon. 5 fraksjoner pr uke.
- Evt. boost (ekstern eller braky) ved ufri eller knapp margin. Vanligvis vil det gis en summert dose på 60 Gy (EQD2α/β=10). Ved ekstern teknikk kan SIB med fordel benyttes.
- Evt. CTVn boostes til samme dosenivå som gjelder for primær radiokjemoterapi (se avsnitt "Fraksjonering" over).
Strålebehandlingsteknikker: Se "Strålebehandlingsteknikker ved brakyterapi" over.
Beregningsalgoritmer og energi: Se "beregningsalgoritmer og energi under "radikal radiokjemoterapi ved lokoregional sykdom".
Akutte bivirkninger under stråleterapi
Strålebehandling mot bekkenet gir ofte bivirkninger. Grad er avhengig av dose, fraksjonering og volum samt komorbiditet og livsstil, for eksempel røyking (Eifel et al., 2002). Pasienter med bindevevssykdom, inflammatorisk tarmsykdom og karsykdom har høyere risiko for bivirkninger (Willett et al., 2000; Wo et al., 2007). I tillegg er det stor individuell variasjon i toleranse.
Cisplatin i kombinasjon med bekkenbestråling øker risikoen for bivirkninger (Keys et al., 1999).
Akutte strålebivirkninger oppstår underveis eller kort tid (opptil 4 uker) etter strålebehandlingen.
Akutte strålebivirkninger bør graderes ved hjelp av Common Terminology Criteria for Adverse Events (CTCAE) (U.S. Department of Health and Human Services, 2017). Denne graderingen kan være til hjelp for å iverksette tiltak.
Organer som ofte blir affisert ved strålebehandling mot bekkenet:
Urinveier:
Akutt strålecystitt som skyldes inflammasjon og ødem i blæreslimhinnen, ses hyppig (Viswanathan et al., 2010). Gir dysuri, hyppig vannlating, urge, nocturi og blærespasme. Det er viktig å utelukke urinveisinfeksjon.
Spontan bedring inntrer oftest 1 -2 uker etter fullført strålebehandling. Antiflogistika kan brukes ved plagsom dysuri.
Gastrointestinaltraktus:
Tarmen er svært sensitiv for strålebehandling. Hyppige bivirkninger er kvalme og oppkast. Symptomer på skade av tarmslimhinnen inkluderer kolikksmerter, diare, anorexi, rektumsmerter, blod/slim i avføringen og tenesmus.
Det viktigste er symptomlindrende behandling, rikelig væskeinntak, kostråd, antiemetika og eventuelt Loperamid (Muehlbauer et al., 2009). Enkelte pasienter får såpass uttalte bivirkninger at de får behov for intravenøs væske (og eventuelt elektrolyttilskudd) og parenteral ernæring.
Ovarier:
Ovariene er svært strålesensitive. Sensiviteten er aldersavhenig (økt ved høy alder) (Bisharah et al., 2003; Morice et al., 1998; Panay et al., 2009).
Strålebehandling av ovariene medfører prematur menopause og infertilitet. Symptomer på menopause kan være for eksempel hetetokter, søvnforstyrrelser, urinveisplager, tørre slimhinner, nedsatt libido, muskel/leddplager, nedstemthet og depressive symptomer. I tillegg økt risiko for osteoporose, hjertekarsykdom, utvikling av demens og Parkinsonisme. Den økte risikoen er mest uttalt for de yngste pasientene. Klimakteriet før fylte 40 år er forbundet med redusert levealder.
Beinmarg:
Hematopoietiske celler er strålesensitive. Cirka 25 % av beinmargsreservene er lokalisert i bekkenet. Hematologisk toksisitet kan reduseres ved bruk av IMRT (Hui et al., 2014).
Hud/slimhinner:
Akutt hudreaksjon varierer fra erytem til våt deskvamasjon og sjeldent ulserasjon. Moderne strålebehandling er hudbesparende.
De fleste pasientene får kun milde hudbivirkninger ved strålebehandling av cervixcancer. Pasienter som får lyskefelt er mer utsatt for akutte hudbivirkninger.
God hygiene, lufting av området, unngå tettsittende klær og parfymerte produkter. Vulvaskylling kan forebygge sårhet og infeksjoner. For øvrig vises det til hvert enkelt strålesenters lokale prosedyrer.
Dermatitten kan forverres de første par ukene etter avsluttet behandling.
Oppfølging av akutte strålebivirkninger underveis i behandlingsløpet:
Det anbefales ukentlige strålekontroller hos lege/sykepleier underveis i strålebehandlingen. Det må da være fokus på akutte bivirkninger fra blære, tarm, vagina, hud samt beinmarg med blodprøvekontroll (Hb, leukocytter, neutrofile granulocytter og trombocytter).
Neoadjuvant og adjuvant kjemoterapi
Neoadjuvant kjemoterapi før kirurgi
Endelige og preliminære resultater fra randomiserte fase III studier støtter norsk praksis om å ikke bruke neoadjuvant kjemoterapi etterfulgt av kirurgi som alternativ til radiokjemoterapi. Flere randomiserte studier har blitt piblisert etter enCochrane review i 2012. Samlet viste studiene ingen gevinst i overlevelse, men an høy andel med pasienter som ble behandlet med postoperatic strålebehandling etter NCT og kirurgi (Gupta et al., 2018; Kenter et al., 2019; Rydzewska et al., 2012; Tangjitgamol et al., 2019).
I spesielle tilfeller (f.eks. fertilitetsbevarende kirurgi, graviditet og ved kontraindikasjoner for strålebehandling) kan NACT likevel vurderes. Individuelt tilpasset opplegg anbefales da. Viser til eget avsnitt .
Neoadjuvant kjemoterapi før radikal radiokjemoterapi
For neoadjuvant kjemoterapi før strålebehandling må man avvente nye studier før dette kan anbefales (da Costa et al., 2019; Wang et al., 2021). Kan likevel vurderes på enkeltpasienter med særdeles lokalavanserte svulster hvor det er spesielt høy risiko for fjernmetastaser utenfor strålefeltet og brakyterapi-dekning fordrer en optimal lokal respons (Kitagawa et al., 2015).
Det anbefales da 3 kurer med taxan-cisplatin kombinasjon, 3 ukers intervall. Bevacizumab er ikke anbefalt i denne settingen så lenge intensjonen med NACT er å gi strålebehandling. Om man ved evaluering ikke ser indikasjon for strålebehandling, bør man vurdere å behandle pasienten i tråd med regime beskrevet under «Medikamentell behandling ved metastatisk sykdom. Viser til avsnitt om medikamentell behandling for indikasjon for bevacizumab. Evaluering med CT/MR. Oftest bør man unngå flere kurer før strålebehandling, selv med god respons (Davis et al., 2000). Cisplatin kan fortsatt gis konkomitant med strålebehandlingen etterpå.
Det pågår en randomisert internasjonal multisenter studie (INTERLACE studien), NCT01566240 (Induction Chemotherapy Plus Chemoradiation as First Line Treatment for Locally Advanced Cervical Cancer (INTERLACE) [pågående studie], 2012-2026), for pasienter med FIGO stadium IB2-IVA med 6 ukentlige kurer Paclitaxel/Carboplatin etterfulgt av standard radikal radiokjemoterapi versus standard radikal radiokjemoterapi. Inklusjonsmål (500 pas) forventes nådd i 2022 og resultater få år etter dette.
Adjuvant kjemoterapi etter radiokjemoterapi:
Det er så langt ikke vist klar nytteverdi av adjuvant kjemoterapi etter gjennomført kjemoradioterapi. Flere studier har vist sprikende resultater og med svakheter knyttet til design, rekruttering og økt toksisitet (Dueñas-González et al., 2011; Tangjitgamol et al., 2019). Flere oversiktsartikler som vurderte adjuvant kjemoterapi etter konkomitant kjemoradioterapi ved lokalavansert cervixcancer, konkluderte med at det ikke var evidens for å støtte adjuvant kjemoterapi- analyser (Horeweg et al., 2022; Tangjitgamol et al., 2014; Zhong et al., 2022). En randomisert fase III studie i regi av ANZGOG (Cisplatin and Radiation Therapy With or Without Carboplatin and Paclitaxel in Patients With Locally Advanced Cervical Cancer [pågående studie], 2012-2018), for pasienter med stad IB1 med lymfeknutemetastaser og IB2-IVA, sammenlignet 10–25 % av cervixcancer er adenokarsinomer, disse skal graderes. De fleste er av konvensjonell eller endometroid type, disse er HPV assosiert. Det finnes noen sjeldne subtyper av adenokarsinomer som ikke er assosiert med HPV; adenokarsinom av gastrisk type, klarcellet type og mesonefrisk type (Park, 2020) etterfulgt av 4 kurer med paclitaxel og karboplatin med standard kjemoradioterapi. Resultatene ble publisert i abstrakt-form i 2021 (Mileshkin et al., 2021) og viste ingen benefit av adjuvant kjemoterapi på overlevelse eller lokal kontroll, kun økt toksisitet.
Videre forskning på adjuvant behandling vil avklare nytteverdi på subgrupper som for eksempel adenocarcinom (Tang et al., 2012), persisterende HPV-DNA (Wang et al., 2019). Bruk av konkomitant og eller adjuvant bruk av sjekkpunkthemmer undersøkes også i aktuelle studier (Garcia-Duran et al., 2022; Mayadev et al., 2020; Nivolumab in Association With Radiotherapy and Cisplatin in Locally Advanced Cervical Cancers Followed by Adjuvant Nivolumab for up to 6 Months (NiCOL) [pågående studie], 2017-2022; Study of Chemoradiotherapy With or Without Pembrolizumab (MK-3475) For The Treatment of Locally Advanced Cervical Cancer (MK-3475-A18/KEYNOTE-A18/ENGOT-cx11/GOG-3047) [pågående studie], 2020-2024)
Behandling av metastatisk sykdom i primærsituasjon
Sist faglig oppdatert: 11202311.04.2023
Strålebehandling
Kapittelet omhandler palliativ strålebehandling mot bekkenet. Strålebehandling gitt i lindrende hensikt mot metastaser fra cervixcancer andre steder i kroppen omtales ikke her.
Når det gjelder palliativ strålebehandling vil individuelle vurderinger være viktige. Pasientens allmenntilstand, egne ønsker, grad av plager og forventet levetid vil kunne påvirke fraksjonering og behandlingslengde. For enkeltpasienter kan det være riktig å avstå fra behandling og heller satse på annen form for smertelindring.
Palliativ strålebehandling kan være aktuelt både ved primær lokalavansert cervixcancer der kurativ behandling ikke er aktuelt eller i residivsituasjon/tilkomne metastaser. Palliativ strålebehandling kan gis både innenfor og utenfor tidligere strålebehandlet område.
Ekstern strålebehandling vil som regel være foretrukken teknikk, men i enkelttilfeller kan brakyterapi være et alternativ. Brakyterapi vil ikke bli omtalt ytterligere.
For bløtvevssvulster i bekkenet vil smerte, blødning og evt. utflod være de vanligste indikasjonene for behandling, men også obstruksjon av tarm eller urinveier kan være indikasjoner. Målet med behandlingen er rask og vedvarende respons innenfor pasientens forventede livslengde.
Dokumentasjon på området bygger i stor grad på eldre, retrospektive serier med relativt få pasienter. Andre svakheter ved studiene er at de ikke har brukt pasient rapporterte utfall, tid til optimal symptomkontroll er ikke dokumentert, det er stort sett brukt total bekken bestråling med tofelts eller firefelts teknikk og ikke mer moderne teknikker der risikoorganer i større grad kan spares, oppfølging av pasientene har vært varierende og toksisitet av behandling er også registrert bare i varierende grad. Mange av studiene har inkludert pasienter med alle gynekologiske kreftformer, ikke bare cervixcancer. Anbefalingene bygger derfor både på foreliggende dokumentasjon, men også bred klinisk erfaring.
Flere studier har sett på 10 Gy x 1–3 med 3–4 ukers mellomrom mellom fraksjonene (Boulware et al., 1979; Halle et al., 1986; Onsrud et al., 2001; Spanos et al., 1987) Alle disse studiene viser partiell eller komplett respons på 70–100 % på blødning og 45–80 % på smerte. Det er dog antydet høy både tidlig og sen GI toksisitet. Mange har derfor brukt 8 Gy x 1 som engangsfraksjon de senere år, dette kan også repeteres ved behov. Det er i tillegg stor klinisk erfaring med fraksjoneringsregimer som 4 Gy x 5, 3 Gy x 10–13 beskrevet i flere oversiktsartikler (Kim et al., 2013; van Lonkhuijzen et al., 2011). Det foreligger ingen studier som sammenlikner disse fraksjoneringsregimene.
Ved blødningsproblematikk er det viktig å vurdere embolisering som et alternativ eller tillegg til strålebehandling (Yalvac et al., 2002).
Ved lengre forventet levetid (over 1 år) bør mer langvarig lokal kontroll tilstrebes. Klinisk erfaring tilsier da at man bør høyere opp i total stråledose, vanlige regimer er 1.8–2.0 Gy per fraksjon opp til totaldose på 50–60 Gy.
Det kan i enkelte situasjoner være vanskelig å skille mellom palliativ/lokal kontroll/kurativ intensjon. En lokalavansert cervixcancer med oligometastater (f.eks. singel supraklavikulær patologisk lymfeknute eller oligometastaser til lunge) kan tilsi en mer intensiv behandlingstilnærming. Ved patologisk supraklavikulær lymfeknute uten tegn til andre metastaser vil standard strålebehandling mot bekken/paraaortalfelt med konkomitant kjemoterapi og samtidig ekstern strålebehandling supraklavikulært til 60–70 Gy være et aktuelt behandlingsopplegg (Lee et al., 2012).
Medikamentell behandling ved metastatisk sykdom eller ved residiv
Medikamentell kreftbehandling er aktuelt ved metastatisk (FIGO IVb) eller residiverende sykdom som ikke egner seg for kurativ behandling som for eksempel bekkeneksenterasjon eller strålebehandling. Målet med behandlingen er å lindre symptomer og øke livskvaliteten.
Kombinasjonsbehandling med platinumbasert kjemoterapi og bevacizumab (15 mg/kg) inntil progresjon eller intolerabel toksisitet er anbefalt (Tewari et al., 2014). I denne GOG studien var det høyere risiko for progresjon i den gruppen som fikk ikke platinum basert kjemoterapi (Topotekan/Paclitaxel), men uten forskjell i total overlevelse. Behandling med Bevacizumab resulterte i flere grad ≥ 2 bivirkninger som hypertensjon (25 % vs 2 %), gastrointestinal fistulering (3 vs 0 %), urogenital fistulering (3 % vs <1 %), neutropeni (36 % vs 26 %) og tromboemboliske hendelser (8 % vs 2 %). For pasienter som tidligere er behandlet med cisplatin (inklusiv konkomitant i forbindelse med strålebehandling) anbefales karboplatin og paclitaxel.
Keynote 826 studien viste signifikant bedre overlevelse med overlevelse på 24 months på 50.4% vs 40.4% hos pasienter som fikk prembrolizumab i tillegg til platinumbasert kjemoterapi +/-bevacizumab (Colombo et al., 2021). Behandling med sjekkpunkthemmer kombinert med platinumbasert kjemoterapi +/-bevacizumab ligger til beslutning i Nye metoder (per 30. Nov 2022) (Sekretariatet for nye metoder, 2022b). På bakgrunn av Keynote 826 studien er det innvilget et gruppeunntak for pasienter med PD-L1 combined positive score =>1.
Ved progresjon på tidligere platinum-basert kombinasjonsbehandling eller om man ikke anser pasienten som kandidat for platinumbehandling men tenker at pasienten tåler kombinasjonsbehandling kan single stoff behandling være aktuell. EMPOWER/ENGOT Cx-9 studien viste signifikant bedre overlevelse på behandling med sjekkpunkthemmer semiplimab sammenliknet med single stoff, ikke platinum basert kjemoterap med total overlevelse 12.0 vs 8.5 måneder (HR .69, 95%CI: 0-56-0.84, p<0.001) (Tewari et al., 2022). Metoden ligger til vurdering i Nyemetoder (per 30. Nov 2022) og det er innvilget et gruppeunntak for bruk av cemiplimab eller pembrolizumab for pasienter med PD-L1 combined positive score =>1 (Sekretariatet for nye metoder, 2022a).
I forhold til behandling med Pembrolizumab må man være oppmerksom på bivirkninger som skyldes bruk av immunterapi, og som til dels kan være svært alvorlig. Se også e-håndbok fra OUS (esmo.org).
Ved progresjon på immunterapi eller hvor den ikke kan anvendes, kan annen type kjemoterapi vurderes (karboplatin singel, paklitaxel, topotecan eller gemcitabine gis, dog med lav forventet respons rate (Homesley et al., 2008) og usikker overlevelsesgevinst sammenliknet med støttende palliative tiltak. Disse pasientene bør vurderes for inklusjon i kliniske studier.
Spesielle grupper
Sist faglig oppdatert: 11202311.04.2023
Cervixcancer under graviditet
Det er viktig at vurdering av behandling er multidisiplinær, pasienten diskuteres med gynonkolog, stråleonkolog, hvis det ansees som indisert, radiolog, patolog og obstetrikker. Alle pasienter henvises til regionsykehus. Utredning skal ikke forsinkes av svangerskap og pasienter utredes etter samme prinsipper som ikke gravide med unntak av CT. De gis ikke kontrast ved MR.
Konisering kan foretas frem til uke 14. Lymfadenektomi kan utføres opp til graviditetsuke 20–22 beroende av livmors størrelse.
Behandlingen er avhengig av sykdomsstadie og når i graviditeten den oppdages.
Noen ganger kan fertilitetsbevarende kirurgi under tidlig graviditet være et alternativ.
For større svulster kan neoadjuvant kjemoterapi vurderes (cisplatin og paklitaxel). Neoadjuvant kjemoterapi kan trygt gis fra 2. trimester. Pasienten må følges tett under hele behandlingen.
Strålebehandling gis ikke på gravid uterus med mindre graviditeten ikke skal bevares.
Fødsel fremskyndes ikke til før uke 37 med mindre det er nødvendig pga tumorprogresjon. Hvis det foreligger tumor i cervix ved fødsel, bør kvinnen føde med sectio (Amant et al., 2014; Favero et al., 2010; Halaska et al., 2016a; Halaska et al., 2016b; Vercellino et al., 2014).
Neuroendokrine tumores
Utgjør under 2 % av alle cervixcancere. Kjennetegnes av aggressivt forløp med tidlig lymfatisk og hematogen spredning. 5 års overlevelse 36 %, median OS 22–25 mnd (Satoh et al., 2014).
Pasienter med NET svulster anses å ha systemisk sykdom fra stadium I fordi de har høyt metastaseringspotensiale og dårlig prognose selv i stadium I (Satoh et al., 2014).
Det er derfor indikasjon for cisplatinbasert kjemoterapi for alle pasienter uansett stadium. Pasienter med tidlig stadium sykdom (IA1, IA2 og IB1) bør utføre radikal hysterektomi med bekkenlymfadenektomi før oppstart kjemoterapi.
Det anbefales 6 kurer cisplatin pluss etoposid totalt (cisplatin 60 mg/m2, etoposid 100 mg/m2): for pasienter med tidlig stadium adjuvant.
For pasienter med lokalavansert sykdom (stadium IB2-IVA) er multimodal tilnærming indisert. Kjemoterapi med cisplatin/etoposid eventuelt etterfult av stråling (45–50 GY ekstern og +/- brakyterapi). Reponsen evalueres etter hver kur med kjemoterapi. Vurdering av strålebehandling vil være avhengig av respons på kjemoterapi og sykdomsutbredelsen.
Pasienter med metastatisk sykdom (IVB) behandles primært med kjemoterapi cisplatin 60 mg/m2 og etoposid 120 mg/m2 totalt 4–6 kurer.
For pasienter med Kreatinin clearence <60 ml/min anbefales Karboplatin/Etoposid (Frumovitz et al., 2017; Salvo et al., 2019; Satoh et al., 2014).
Stumpcancer
Cervix stumpcancer behandles på samme måte som øvrig cervixcancer.
Cervixcancer oppdaget etter hysterektomi på benign indikasjon
Utredning inkludert kartlegging av metastaser med CT og gynekologisk undersøkelse i narkose samt MR dersom tvil om radikal kirurgi. Pasienten bør diskuteres i MDT.
Behandlingprinnsippene er de samme som for øvrig cervix cancer.
Glandeltoilette utføres med mindre det uansett er indikasjon for strålebehandling eller dersom det foreligger stadium IAI.
Oppfølging og etterkontroller etter avsluttet kurativt rettet behandling
Sist faglig oppdatert: 11202311.04.2023
Innledning
Verdien av rutinemessig oppfølging etter avsluttet kurativ behandling er omdiskutert pga. manglende dokumentert overlevelsesgevinst (Lanceley et al., 2013; Salani et al., 2011; Zanagnolo et al., 2009) . Samtidig er fokus på støttetiltak i forhold til rehabilitering og seneffekter et viktig område som hos deler av pasientgruppen krever en systematisk tilnærming (Westin et al., 2016).
Responsevaluering
Pasienter som har gjennomgått radikal radiokjemoterapi ved lokoregional sykdom:
Formål med responsevaluering er å avklare om tumor er i komplett remisjon eller om det foreligger resttumor.
Responsevaluering gjøres ved behandlende institusjon, med involvering av behandlende leger, ca 4 mnd. etter avsluttet radiokjemoterapi. Det anbefales (Bourgioti et al., 2016; Cibula et al., 2018b).
- Klinisk undersøkelse inkludert gynekologisk undersøkelse
- MR bekken (Manganaro et al., 2021)
- CT thorax/abdomen/bekken
- Gjennomgang av undersøkelsesresultat i MDT-møte for endelig beslutning om videre strategi bør gjøres dersom tvil foreligger.
- Ved komplett remisjon går pasienten over i oppfølgingsprogram.
- Ved tvil følges pasienten videre med ny evaluering etter 2-3 mndr
- Ny MR for revurdering av cervixtumor
- CT/PET-CT for revurdering av metastaser
- Ved resttumor, histologisk verifisert, må pasienten vurderes for salvage kirurgi.
Oppfølging etter endelig responsevaluering
Formål med oppfølgingsprogram er å avdekke residiv av sykdom samt å avdekke og behandle evt. seneffekter etter sykdom og behandling. Man mangler randomiserte, prospektive studier for å kunne avgjøre den optimale oppfølgingsstrategi (Elit et al., 2009; Lanceley et al., 2013; Zola et al., 2015).
Oppfølging bør individualiseres etter risiko for tilbakefall hvor det vektlegges om man har en kurativ behandlingsmulighet og utfra hvilken behandling pasienten har fått.
De fleste residiv er symptomatiske, og median tid til residiv varierer i litteraturen fra 7–36 mnd. (Elit et al., 2009; Salani et al., 2011). Data fra norsk residivstudie publisert i 2017, viste at 66 % av pasienter som fikk residiv, fikk sitt første residiv innen 2 år og 85 % innen 3 år (Vistad et al., 2017). Studien innhold dog kun 58 pasienter med residiv av cervixcancer, og tallene må derfor tolkes med noe forsiktighet. Samtidig er tallene godt overensstemt med funn i øvrige studier (Elit et al., 2009; Salani et al., 2011). Oppfølging anbefales på bakgrunn av dette tettere de 2–3 første årene.
Pasienter som har gjennomgått kurativ kirurgisk behandling av lokalisert sykdom
Pasienter som primært bare har fått kirurgisk behandling følges generelt med klinisk undersøkelse. Lav terskel for biopsi av suspekte lesjoner i vagina.
Kontrollopplegg 1A1
Det finnes ingen dokumentasjon på verdien av kontroller. Risiko for tilbakefall etter behandling for stadium IA1 sykdom er lav (Taarnhøj et al., 2018). Pasienter som har blitt behandlet med konisering bør følges med kolposkopi, cytologi og HPV test etter 6 måneder. Genotypeinformasjon er nødvendig for å vurdere risiko for persisterende sykdom ved 6 mnd kontrollen. Dersom ikke genotypeinformasjon er tilgjengelig før konisering (fra screeningprøve) må cervixkon genotypes med PCR teknologi.
Ved negativ HPV og cytologi etter 6 mndr, anbefales kontroll med HPV og cytologi hos fastlege etter 6 mnd. Dersom også denne er negativ, HPV og cytologi hvert 3. år, livslang oppfølging.
Ved pos HPV og normal cytologi etter 6 mndr og samme genotype, bør det utføres kolposkopi og biopsi.
Ved pos HPV og ny genotype, kontroll med HPV og cytologi etter 6 mndr. Videre kontroller hver 6. måned i 2 år, deretter årlige kontroller i 3 år. Ved persisterende genotype etter 12 mnd, kolposkopi og biopsi.
Suspekte lesjoner bør biopseres.
Stadium IA2 og over kontrolleres med gynekologisk undersøkelse og vaginal ultralyd hver 3. måned for 2 år, deretter hver 6. måned i 3 år. Nytten av cytologi fra vaginaltopp er omdiskutert. Suspekte lesjoner bør biopseres
Pasienter som har gjennomgått radikal radiokjemoterapi ved lokoregional sykdom
Pasienter med lokalavansert primærsykdom har risiko for residiv utenfor strålefeltet. Verdien av rutinemessig radiologisk undersøkelse er omdiskutert (Zanagnolo et al., 2009). 9Samtidig har retrospektive undersøkelser vist at prognose ved asymptomatiske residiv er bedre enn ved symptomatiske residiv (Bodurka-Bevers et al., 2000; Choi et al., 2009; Chou et al., 2001; Zola et al., 2007). Studier på isolerte paraaortale glandelresidiv viser relativt god overlevelse på > 50 % ved salvage radioterapi evt. kombinert med kjemoterapi (Chou et al., 2001; Niibe et al., 2006b). Debulkende kirurgi forut er omdiskutert med usikker gevinst (Kupets et al., 2002). Oppfølging med PET har blitt lansert som en mulig modalitet for oppdagelse av asymptomatiske residiv (Brooks et al., 2009; Chung et al., 2006; Grigsby, 2007; Zola et al., 2007).
Utforming av kontrollopplegget etter endelig responsevaluering for pasienter som har gjennomgått radikal radiokjemoterapi ved lokoregional sykdom
Kontrollopplegget etter komplett remisjon bør ta hensyn til initial sykdomsutbredelse og hvilken behandling som er gitt. Et isolert paraaortalt residiv hos pasienten som tidligere ikke er bestrålt paraaortalt, kan behandles med radikalt radiokjemoterapi med potensiell kurativ intensjon. Isolerte fjernmetastaser med andre lokalisasjoner, vil også potensielt sett kunne behandles radikalt, men dokumentasjon her er mangelfull og basert på mindre retrospektive studier (Anraku et al., 2004; Lim et al., 2010). Radikal metastasebehandling i form av metastasekirurgi, stereotaksi eller radiofrekvensablasjon vil først og fremst vurderes dersom det oppstår et isolert residiv etter en lengre residivfri periode etter primærbehandling da dette taler for en mindre aggressiv sykdomsbiologi.
Det er etter hvert innenfor flere andre tumorgrupper blitt en dreining mot risikostratifisert oppfølging i nasjonale handlingsprogrammer og at det utarbeides en individuelt basert oppfølgingsplan for pasientene.
I den norske studien for oppfølging etter gynekologisk kreft, LETSGO, , er risikostratifisering i tillegg til en rekke andre tiltak tatt i bruk for å skaffe kunnskap som kan gi bedre oppfølging etter gynekologisk kreftbehandling. Studien er lukket for inklusjon, men resultat er foreløpig ikke gjort opp.
Per i dag anbefales som standard klinisk kontroll, gynekologisk undersøkelse og vaginal ultralyd samt vurdering av eventuelle seneffekter hver 3. mnd. de første 2 år, deretter hver 6. mnd. de neste 3 årene. Etter 5 år er verdien av fortsatt kontroll diskutabel, og kan evt. foretas hos egen lege etter individuell vurdering. Dersom mye seneffekter, bør oppfølging tilpasses.
- Ikke god dokumentasjon på overlevelses gevinst ved rutinemessig radiologisk oppfølging, men bør vurderes dersom man ut fra en total risikovurdering og hvorvidt tidlig avdekning av metastaser vil kunne få behandlingsmessig konsekvens. For de fleste pasienter behandlet for lokalavansert sykdom vil CT thorax/abdomen/bekken eller PET CT etter ca 12 og 24 mnd kunne være et rimelig oppsett ut fra tidsaspekt for funn i residivstudier.
- Hvorvidt pasienten følges videre av onkolog/gyn.onkolog eller om pasienten følges av gynekolog ved sitt lokale sykehus, avgjøres individuelt utfra hvilket symptombilde pasienten utvikler og hvilken kompetanse som fins lokalt.
- Det bør ikke tas cervixcytologi da stråleinduserte forandringer gjør tolkning av cytologi vanskelig. Dersom klinisk mistanke om patologi, bør det i så fall tas biopsi.
- Pasient og pårørende bør gis grundig informasjon om:
- Symptomer som kan være tegn på residiv og om tidlig kontakt med fremskyndelse av kontroll
- Seneffekter
Seneffekter etter sykdom og behandling
Sist faglig oppdatert: 11202311.04.2023
Seneffekter etter kirurgisk behandling
Risiko for skader etter kirurgisk behandling vil variere mye, ikke minst i forhold til hvilket inngrep som er gjennomført. Ved siden av vanlige postoperative komplikasjoner bør man være oppmerksom på blæretømningsplager og lymfødemproblematikk ved radikal kirurgi samt klimakterielle og seksuelle plager.
Se omfattende beskrivelse av seneffekter etter strålebehandling vedr psykososiale momenter (se neste pkt).
Seneffekter etter radiokjemoterapi
Seneffekter kan ofte ha et sammensatt preg som krever tverrfaglig tilnærming. Begrepet «Pelvic radiation disease» belyser kompleksiteten, og det er beskrevet opptil 25 symptomer samtidig (Andreyev et al., 2010).
Komorbiditet som inflammatorisk tarmsykdom, kollagen vaskulær sykdom, diabetes mellitus og arteriosklerose samt tidligere kirurgi i abdomen/bekken, gir økt risiko for å utvikle seneffekter. Seneffekter kan oppstå etter noen måneder, men andre ganger først flere år etter sykdom og behandling. Plagene kan ofte være kroniske, men kan variere i intensitet og uttrykk over tid (Vittrup et al., 2021).
Tarmfunksjonen
Data fra den prospektive multisenterstudien EMBRACE 1 har også gitt informasjon om langtidseffekt på tarm etter radikal radiokjemoterapi. Etter henholdsvis 3 og 5 år var insidens på tarmmorbiditet grad 3-4 på 5.0 % og 5,9 %. Grad 1-2 morbiditet hos 28-33 %. Diare, flatulens inkontinens oftest rapportert (Jensen et al., 2018).
Kronisk diare
Årsak ofte sammensatt. Symptomatisk behandling uavhengig av etiologi vil ha til formål å normalisere avføringskonsistens. Det kan benyttes:
- Romoppfyllende preparater som øker fekalmassen. Effekten er avhengig av tilstrekkelig væskeinntak (resorberende effekt) og kan komme først etter flere dager.
- Vi-Siblin 1–3 doser daglig.
- Stoppende medikasjon:
- Loperamid 1–2 tabletter, maks 8 pr døgn.
- Ved manglende effekt: Opiumsdråper 5–10 dråper x 2–3
Ved mer omfattende problem bør diare utredes nærmere for behandling rettet mot mulige årsak. Kronisk diare kan være sekundært til malabsorpsjon av karbohydrat eller gallesalter, bakteriell overvekst eller pankreasenzym insuffisiens (Andreyev et al., 2013; Andreyev et al., 2012; Andreyev et al., 2015; Ferreira et al., 2014; van de Wetering et al., 2016). Utredning og tiltak bør da gjøres i samarbeid med gastroenterolog og ernæringsfysiolog. Ved mistanke om malabsorpsjon bør vitamin B12, jern, kalsium og vitamin D kontrolleres og ev. korrigeres ved mangel (Vistad et al., 2009).
Kolikksmerter
Kan være utløst av næringsmiddelintoleranse eller dysmotilitet i tarm pga. fibrose som forårsaker stenoser og adheranser. Dette kan gi subileus/ileus hvor kirurgisk behandling og evt. stomi kan bli nødvendig.
Stråleindusert proktitt
Kronisk ischemi kan gi rektalblødning. Pasienter med persisterende rektalblødning bør colo-/sigmoideoskoperes for å utelukke sykdomsresidiv eller ny primærtumor samt for å avdekke omfang og alvorlighetsgrad. Biopsi bør unngås så fremst man ikke mistenker ny malign prosess da dette øker risiko for fistulering pga. nedsatt tilheling i bestrålt område (Andreyev et al., 2012; van de Wetering et al., 2016; Vanneste et al., 2015; Viswanathan et al., 2014). Sukralfat klyster, metronidazolkur, endoskopisk koagulasjonsbehandling eller hyperbar oksygenbehandling kan være mulig behandling.
Tømningsbesvær som urge, anal inkontinens og ufullstendig tarmtømming er funksjonelle tarmproblemer som kan gi store begrensninger i livsutfoldelse. Konservative tiltak som nevnt ovenfor som gir normalisering av avføringskonsistens samt bekkenbunnstrening, anal plug, biofeedback og irrigasjon vil kunne bidra til bedring. Mer informasjon fins i «Faglige retningslinjer for utredning og konservativ behandling av anorektale funksjonsforstyrrelser» utarbeidet av Norsk gruppe for konservativ behandling av anorektale funksjonsforstyrrelser.
Sakral nervestimulering kan vurderes dersom man ikke kommer til målet ved konservative tiltak ved fekal inkontinens (Maeda et al., 2010), men sikker dokumentasjon på effekt mangler. Ved uttalte plager hvor man ikke kommer til målet med andre tiltak, kan sigmoideostomi være en løsning.
Blærefunksjonen
Normal vannlatning forutsetter et komplekst samspill mellom urinblære, urinrør, nerver i bekkenet og sentralnervesystemet. Utredning og tiltak bør gjøres i samarbeid med urolog, uroterapeut og/eller gynekolog. Dysfunksjon i avløp med svekket lukkemekansime vil kunne gi stressinkontinens, som kjennetegnes av lekkasje ved økt buktrykk som hoste, nys og tunge løft. Overaktiv urinblære kjennetegnes av brå og unormalt sterk vannlatningstrang (urgency), hyppig vannlatning dag og natt og er evt. ledsaget av urininkontinens. Stråleindusert fibrose kan gi stivere og mindre elastisk urinblærevegg, såkalt nedsatt compliance. Dette kan resultere i nedsatt blærekapasitet og inkontinens. Det kan oppstå avløpshinder ved stenosedannelse i ureter eller urethra (Fokdal et al., 2019). Blæreslimhinnen kan bli atrofisk og lettblødende. Muskulære endringer kan gi smertefulle blærespasmer. Data fra den tidligere omtalte prospektive multisenterstudien på EMBRACE, har også gitt informasjon om seneffekter fra urinveiene etter radikal radiokjemoterapi. Vanligste rapporterte symptomer grad 2-4 var økt frekvens/urgency 4,3 %, inkontinens 5,0 % og cystitt 1,7 % (Fokdal et al., 2018).
Stressinkontinens kan behandles konservativt med bekkenbunnstrening, elektrostimulering eller mekaniske hjelpemidler som vaginaltampong eller inkontinensbue eller ved kirurgisk behandling med slyngeoperasjon. Ved overaktiv blære og urgeinkontinens kan blæretrening og urologisk spasmolytikum ha effekt. Ved utilfredsstillende effekt, kan cystoskopisk injeksjon av botulinumtoksin for å dempe muskelaktiviten eller sakral nervestimulering, vurderes. Utstyr til inkontinens rekvireres som medisinsk forbruksmateriell med refusjon jfr. blåreseptforskriften § 5 punkt 1. Behandling av stråleindusert hemorragisk cystitt er først og fremst symptomatisk med blæreskylling, evakuering av blodkoagler og koagulasjon via cystoskop. Instillasjon av hyaluronsyre eller kondroitinsulfat kan også forsøkes ved kronisk cystitt på bakgrunn av skade av blæreslimhinnens beskyttende glykosaminoglykan (GAG) lag (Liem et al., 2015).
Ved urinretensjon bør pasienten henvises for opplæring i selvkateterisering. Ved mistanke om striktur eller fistler, bør pasienten henvises for kirurgisk intervensjon. Noen pasienter vil pga. fibrose i ureter ha et vedvarende behov for JJ-stent.
Hyperbar oksygenbehandling kan være en behandlingsmulighet ved stråleindusert proktitt, cystitt og refraktær smerter (Bennett et al., 2016; Clarke et al., 2008; Rud et al., 2009), men effekt er omdiskutert (Glover et al., 2016). Yrkesmedisinsk avdeling ved Haukeland universitetssykehus er nasjonal behandlingstjeneste for elektiv hyperbar oksygenbehandling (HBO). Stråleproktitt, strålecystitt og osteoradionekrose inngår som elektive indikasjoner. Resultat fra en skandinavisk randomisert og kontrollert studie på strålecystitt behandlet med hyperbar oksygenbehandling, RICH-ART, ble publisert i Lancet i 2019, ga støtte for effekt av HBO ved stråleindusert cystitt (Oscarsson et al., 2019).
Genitalia og seksualitet
Denne pasientgruppen har høy risiko for utvikling av problemer knyttet til seksualfunksjonen. Manglende interesse, nedsatt lubrikasjon og følsomhet i vagina, småblødninger, dyspareuni, trang og forkortet vagina kan medføre seksuelle og vaginale problemer som kompromitterer seksuell aktivitet og tilfredsstillelse (Jensen et al., 2003; Kirchheiner et al., 2016). Seksuallivet bør gjenopptas så snart som pasienten føler seg klar for det, imidlertid kan dette for en del pasienter være utfordrende på bakgrunn av både fysiske og psykiske endringer. Bistand fra sexolog kan være indisert.
Vaginal dilatator anbefales for å motvirke vaginale synekier (Law et al., 2015; Miles et al., 2014). Seksualtekniske hjelpemidler kan bestilles av lege på rekvisisjon til NAV (Seksualtekniske hjelpemidler).
Strålingens effekt på gjenværende ovarier utslokker hormonproduksjon. Hormonsubstitusjon anbefales kvinner fram til normal menopausealder dersom det ikke foreligger kontraindikasjon. Så fremst uterus ikke er fjernet, anbefales kombinasjonspreparat med både østrogen og progesteron da ensidig østrogenstimulering av endometriet gir økt risiko for utvikling av endometriecancer. Det anbefales progesteron og østrogen i faste kombinasjoner. Sekvens preparater øker risiko for hematometra og smerter ved cervix stenose som mange av disse pasienter utvikler. Plaster kan være fordel med tanke på «first-pass-metabolismen». Refusjon omfattes av blåreseptordningen. Lokalbehandling med østrogen vagitorier/krem kan dempe lokale plager knyttet til atrofiske slimhinner. Kan være aktuelt alene hos eldre kvinner, men også i kombinasjon med systemisk hormonsubstitusjon hos yngre pasienter da fibrose og atrofi vaginalt kan medføre utilstrekkelig lokal effekt av systemisk behandling. Lokal østrogenbehandling omfattes ikke av refusjonsordning. Hormonfri vaginalgel eller vagitorier for behandling av tørrhet i skjeden fins og kan være aktuelle for pasienter hvor østrogenbehandling ikke er ønskelig.
Enkelte kvinner opplever symptomer på testoteronmangel etter medisinsk eller kirurgisk kastrasjon. Dokumentasjon er sparsom, men det er rapportert klinisk gevinst (Davis et al., 2008; Huang et al., 2014). Topikale testosteronprodukter kan forsøkes, men viktig å bruke lav dose (10–15 % av mannlig dose) i samarbeid med gynekolog. Nærmere omtale i nasjonal veileder i gynekologi 2021.En sjelden gang kan kreftsykdommen eller behandlingen medføre gynekologiske fistler. Behandlingstilbudet av slike fistler er sentralisert i Norge til Nasjonal behandlingstjeneste for gynekologiske fistler ved Seksjon for generell gynekologi ved Kvinneklinikken på Haukeland universitetssykehus.
Muskel/skjelett
Smerter i bekkenet etter strålebehandling er ikke uvanlig. Strålebehandlingen kan resultere i mikrofrakturer i bekkenskjelett (Baxter et al., 2005; Higham et al., 2015; Mehmood et al., 2014; Ramlov et al., 2017b) samt fibroseutvikling i bekkenmuskulatur og bindevev. MR undersøkelse av bekkenskjelett kan avdekke mikrofraturer. Mulig effekt av HBO (hyperbar oksygenbehandling) er beskrevet (Rud et al., 2009). Smertebildet ofte kompleks. Vurdering og behandling av fysioterapeut/psykomotorisk fysioterapeut kan være nyttig for mange i denne gruppen.
Lymfødem
Pasienter som har fått utført kirurgisk fjerning av bekkenglandler eller fått strålebehandling mot bekkenglandler, har økt risiko for utvikling av lymfødem (Najjari Jamal et al., 2018) Dette gjelder særlig for pasienter som har gjennomgått både kirurgi og strålebehandling (Biglia et al., 2017). Estimater etter 3 og 5 år fra EMBRCA studien hvor pasienter har gjennomgått radikal radiokjemoterapi viste hhv. 27 % og 31 % G ≥ 1 lymfødem, 6,1 % og 6,6 % G ≥ 2, og 0,5 % og 0,5 % G ≥ 3. Pasienter som utvikler lymfødem skal henvises fysioterapeut med kompetanse på lymfødembehandling.
Fatigue
Fatigue er en belastende seneffekt av mer generell karakter som dessverre hyppig rammer denne gruppen (Smet et al., 2018; Steen et al., 2017; Vistad et al., 2007). For nærmere informasjon rundt fatigue, vises til publikasjonen fra Helsedirektoratet 2020: Seneffekter etter kreftbehandling. Faglige råd.
Kjemoterapi indusert nevrotoksisitet
Nevrotoksisitet er en velkjent bivirkning av Cisplatin som kan gi seneffekter i form av vedvarende ototoksisitet med hørselssvekkelse og tinnitus og perifer polynevropati i form av sensorisk perifer nevropati og Raynauds fenomen (Matsuoka et al., 2018)
Residiv
Sist faglig oppdatert: 11202311.04.2023
Utredning
Utbredelse av recidiv bør kartlegges med relevant billeddiagnostikk og verifiseres med histologi
Residiv behandling
Det er viktig å kartlegge om det foreligger kurativt potensiale.
Bekkenresidiv
Isolert, sentralt bekkenresidiv uten affeksjon av bekkenveggen
Bekkenresidiv hos opererte, ikke tidligere strålebehandlete
Ved isolert sentralt bekkenresidiv hos pasienter som tidligere ikke er strålebehandlet i bekkenregionen, anbefales definitiv radiokjemoterapi. Bør kombineres med bildeveiledet adaptiv brakyterapi så fremst dette er mulig. Ekstern boost som likeverdig erstatning for brakyyterapi er ikke anbefalt. For små overfladiske lesjoner i vagina, dvs. < 5 mm tykkelse, kan vaginal sylinder anvendes, men for øvrig kreves kombinert intracavitær-interstitiell teknikk. For teknikk og doser, vises til prinsipper ved primær radiokjemoterapi.
Bekkenresidiv i tidligere strålebehandlet område
Sentrale residiver
Pasienter med sentrale residiv i tidligere strålebehandlet område bør vurderes for bekkeneksenterasjon. Disse operasjoner er sentralisert til Avdelingen for gynekologisk kreft ved OUS, Radiumhospitalet og pasienten bør henvises «Nasjonal behandlingstjeneste for avansert bekkeneksentrasjon ved gynekologisk kreft» for vurdering. Bekkeneksenterasjon er ett mutilerende inngrep med relativ stor risiko for komplikasjoner, derfor må pasienten vurderes nøye med tanke på utbredelse av tumor samt fysisk almenntilstand og komorbiditet før beslutningen tas. Operasjonen innebærer at det fjernes livmor og skjede og både rektum og anus samt blære og urethra ved en total bekkeneksenterasjon og pasienten for lagt ut en kolostomi og en urostomi. Noen ganger kan blæren eller rektum spares. 5 års overlevelse etter bekkeneksenterasjon for tilbakefall av livmorhalskreft er ca 50 %.
Residiv som affiserer laterale bekkenvegg
Bekkenresidiv hos opererte, ikke tidligere strålebehandlet
Ved isolert bekkenveggsresidiv hos pasienter som tidligere ikke er strålebehandlet i bekkenregionen, anbefales definitiv radiokjemoterapi. Hvor høy dose som er ønskelig og mulig å gi avhenger av tumors størrelse og beliggenhet. Ofte kan det være umulig å komme opp i tilstrekkelig dose for kurasjon.
Bekkenveggskirurgi kan hos utvalgte pasienter vurderes i tilfeller hvor tumor ikke invaderer dypt i bekkenveggen.
Bekkenresidiv i tidligere kurativt strålebehandlet område
Individuell vurdering
Residiv utenfor bekkenet
Isolerte lymfeknute residiver
Isolerte paraaortale residiver
Litteraturen er begrenset, men en insidens på 2–5 % etter primær radiokjemoterapi er rapportert (Hong et al., 2004; Nomden et al., 2019; Tan et al., 2019). Pasienter med lymfeknutemetastaser ved primærdiagnose har økt risiko for paraortalt residiv (Niibe et al., 2006a).
Ved asymptomatiske paraaortale residiver ser det ut til at kjemoradioterapi med totaldoser på minst 50–60 Gy kan gi langtidsoverlevelse hos et signifikant antall pasienter (Hong et al., 2004; Huang et al., 2008; Singh et al., 2005).
Dersom pasienten ikke tidligere har fått strålebehanding mot paraaortalregionen, anbefales strålebehandling som førstevalg ved isolerte paraaortale residiver.
Tidligere gitt behandling må det alltid vurderes ved supplerende paraaortalbestråling. IMRT/VMAT plan med simultanintegrert boost anbefales.
Det skal planlegges med en overlapp med tidligere gitt behandling. Overlappen bør være minst 1 cm i lengderetning for å sikre full dose i dette området ved rebestråling. Adekvat dose i skjøt mot tidligere bekken felt og fokus på å unngå høye doser i tidligere bestrålt avsnitt av medulla vektlegges.
Isolerte supraklaviculære residiver
Individuell vurdering. Strålebehandling eventuelt kirurgi.
…
Andre lokalisasjoner
Behandling av isolerte organ metastaser (lunge, lever etc) bør diskuteres tverrfaglig. Radiofrekvens ablasjon, stereotaktisk strålebehandling eller metastasekirurgi kan overveies ut fra en helthetsvurdering.
Palliativ behandling
Sist faglig oppdatert: 11202311.04.2023
Kjemoterapi
Viser til avsnitt "Kjemoterapi" i kapittel Behandling i primærsituasjonen.
Strålebehandling
Viser til avsnitt "Strålebehandling" i kapittel Behandling i primærsituasjonen.
Re-bestråling
Når rebestråling vurderes må man ta hensyn til hvilke stråledoser som er gitt i det aktuelle området, grad av forventet reparasjon, pasientens effekt og bivirkninger av tidligere gitt strålebehandling og hvilke risikoorganer som er mest utsatt. Individuelle vurderinger for hver enkelt pasient bør diskuteres i team med lege, fysiker og stråleterapeut.
Det er sannsynlig at mer moderne stråleteknikker som IMRT/VMAT vil redusere normalvevstoksisiteten og dermed er å foretrekke ved rebestråling. Dette gjelder også ved palliativ behandling med lave stråledoser. Det er imidlertid lite dokumentasjon på dette området. Ved kliniske tegn på respons under fraksjonert rebestråling burde man ha lav terskel for replanlegging for å redusere det bestrålte volumet.
Hvis målet er symptomlindring vil det som regel være mulig å gi 8 Gy x 1 nesten uansett tidligere avgitt dose (Boulware et al., 1979). Mer fraksjonert behandling kan også være mulig så lenge totaldose til risikoorganer er akseptable.
Ved mål om lokal kontroll i tidligere bestrålt område må man høyere opp i dose. Hyperfraksjonert akselerert behandling med 1,5 Gy gitt to ganger daglig opp til totaldose på 30–45 Gy er vel dokumentert som rebestrålingsprotokoll for rectumcancer. Dette har vist akseptabel lokal kontroll og toksisitet (Das et al., 2010; Guren et al., 2014; Tao et al., 2017). Man må anta at dette også kan være en aktuell protokoll for rebestråling av cervixcancer.
Andre rebestrålingsregimer benyttet er 3 Gy x 7 eller 2 Gy x 15, alt må vurderes ut fra normalvevstoleranse og tidligere gitt behandling.
Stereotaktisk strålebehandling (SBRT) er også rapportert å være en mulig rebestrålingsstrategi (Guckenberger et al., 2010).
Protoner
Per i dag finnes det ingen etablert indikasjon for strålebehandling med protoner ved primær cervixcancer. Ved residiv i tidligere bestrålt område, hvor det er aktuelt med rebestråling, kan det vurderes å henvise pasienten for protonbehandling. Fordelen med protoner er potensialet til å gi høy dose til tumor samtidig som man sparer normalvevet. Noe som kan gi mindre bivirkninger både på kort og lang sikt. Doseplanstudier har vist at behandling med protoner gir lavere dose til tynntarm, rektum, blære og beinmarg sammenlignet med fotoner (Marnitz et al., 2015; van de Sande et al., 2016; Verma et al., 2016). For å finne ut om dette har klinisk relevans er det viktig å inkludere aktuelle pasienter i kliniske studier.
Det er vedtatt at Norge skal få to protonsentre, et i Oslo og et i Bergen. Sentrene skal etter planen være klare til å behandle pasienter i 2024. Fram til da må aktuelle pasienter henvises til utlandet.
Epidemiologi
Sist faglig oppdatert: 11202311.04.2023
ICD-10
| C53 | Ondartet svulst i livmorhals |
Definisjon
Sist faglig oppdatert: 11202311.04.2023
Utgått fra slimhinnen i endo- og/eller ektocervix
Forekomst
Sist faglig oppdatert: 11202311.04.2023
I 2021 var det 345 nye tilfeller per år (Larsen, 2022). (B)
Livstidsrisiko ved 80 år: 1,1% (2017-2021) (Larsen 2022).
I 2021 hadde Norge høyest forekomst av livmorhalskreft i Norden med en aldersjustert insidensrate på 9,6 per 100 000 kvinner (Engesæther et al., 2022). Fra 2013 er det registrert en økning i aldersgruppen 25 - 34 år (Kreftregisteret, 2022). Fra 2010 til 2021 er andel adenokarsinomer i cervix økt fra 10% til >25%.
Etiologi og genetikk
Sist faglig oppdatert: 11202311.04.2023
Persisterende infeksjon med onkogene typer av Humant Papilloma Virus (HPV) er en nødvendig, men ikke tilstrekkelig faktor for utvikling av cervixcancer og er påvist i 95 % av tilfellene (Muñoz et al., 2003; Muñoz et al, 2006).
Infeksjon med onkogene HPV-typer er nødvendig for utvikling av CIN, AIS og invasiv cancer (Gravitt, 2011; Schiffman et al., 2010; Stanley, 2010) (B), og HPV 16/18 er viktigste faktor for 2/3 av karsinomene.
Ingen vesentlig arvelig faktor er påvist, men HLA-type kan ha betydning (de Araujo Souza et al., 2009; Muñoz et al., 2006).
Se kapittel 7, Premaligne lidelser i cervix uteri.
Histologi
Sist faglig oppdatert: 11202311.04.2023
Svulstene i cervix klassifiseres i henhold til WHO klassifikasjon 2020 (WHO Classification of Tumours Editorial Board, 2020). De viktigste endringene siden forrige versjon er at karsinomene inndeles i HPV assosierte eller HPV uavhengige. Serøse karsinomer utgår.
Vel 80 % av cervixcancer er plateepitelkarsinomer, nesten alle er HPV assosiert. HPV negative plateepitelkarsinomer er beskrevet i litteraturen (Casey et al., 2015; Morrison et al., 2001). Histologisk gradering har ikke vist å ha prognostisk betydning for plateepitelkarsinomer (C) (Zaino et al., 1992). Histologisk gradering har ikke vist å ha prognostisk betydning for plateepitelkarsinomer (C) (Zaino et al., 1992). I henhold til WHO klassifikasjon 2020 graderes ikke adenokarsinomer og plateepitelkarsinomer i cervix.
Insidens av adenokarsinomer er økende. De fleste er av konvensjonell type, disse er HPV assosiert. Det finnes noen sjeldne subtyper av adenokarsinomer som ikke er assosiert med HPV; adenokarsinom av gastrisk type, klarcellet type og mesonefrisk type (Park, 2020). For korrekt klassifikasjon av de HPV uavhengige adenokarsinomer anbefales HPV analyse med PCR teknikk.
De neuroendokrine svulstene i cervix er sjeldne, de er som oftest HPV assosiert og klassifiseres i henhold til WHO klassifikasjon 2020:
- lavgradig eller intermediær neuroendokrin tumor (NET) (oppgi antall mitoser/2mm2)
- lite differensiert neuroendokrint karsinom (NEC)
- måcellet neuroendokrint karsinom (SCNEC)
- storcellet neuroendokrint karsinom (LCNEC)
Av hensyn til behandlingen må diagnosen verifiseres med immunhistokjemi (synaptophysin og chromogranin). HPV assosierte karsinomer i cervix (oftest adenokarsinomer) kan ha en komponent av neuroendokrint karsinom.
Risikofaktorer
Sist faglig oppdatert: 11202311.04.2023
- Røyking øker risikoen for plateepitelcancer, men ikke for adenocarcinomer (Gadducci et al., 2011; International Collaboration of Epidemiological Studies of Cervical Cancer et al., 2006; Kjellberg et al., 2000; Vaccarella et al., 2008) (A).
- Nedsatt immunforsvar (HIV-infeksjon/AIDS, SLE, immunsuppresjon) (Gadducci et al., 2011; Jordan et al., 2009).
- Tidlig seksuell debutalder og mange partnere (Dillner et al., 1996) (C).
- Arvelig faktorer som HLA-type kan ha betydning (de Araujo Souza et al., 2009; Muñoz et al., 2006).
- Annen HPV-relatert pre-cancer eller cancer (Forman et al., 2012).
Forebygging
Sist faglig oppdatert: 11202311.04.2023
HPV-vaksinasjon ble innført i Barnevaksinasjonsprogrammet høsten 2009: 12–13 år gamle jenter og gutter (i 7. klassetrinn), f.o.m. årskull 1997, blir gitt tilbud om vaksinering.
Se mer i kappteil 7, Premaligne lidelser i cervix uteri.
Screening
Sist faglig oppdatert: 11202311.04.2023
Nasjonalt screeningsprogram for livmorhalskreft – Livmorhalsprogrammet – ble innført i 1995.
Se kapittelet 7, Premaligne lidelser i cervix uteri.
Hovedmålet er å redusere forekomst og dødelighet av cervixcancer ved å oppdage forstadiene og behandle disse.
Tall fra Kreftregisteret viser at 64 % av de som får påvist cervixcancer og er i screeningalderen (25–69 år), ikke har tatt celleprøver siste 3,5 år. Av de som får påvist cervixcancer har 18 % hatt en normal celleprøve mindre enn 3,5 år før diagnosen (Kreftregisteret, 2014).
Pakkeforløp
Sist faglig oppdatert: 11202311.04.2023
Det er i regi av Helsedirektoratet utarbeidet Pakkeforløp for livmorhalskreft. I dette dokumentet beskrives hvordan utredning og behandling av cervixcancer er organisert i Norge (Helsedirektoratet, 2016b).
Kvalitetsregister/ kreftmelding
I regi av Fagrådet for Nasjonalt kvalitetsregister for gynekologisk kreft er det utarbeidet og innført nye og mer omfattende kreftmeldinger for cervixcancer. Nå registreres detaljer vedrørende utredning og behandling av disse pasientene slik at man etter hvert kan utarbeide årsrapporter for denne pasientgruppen. Det er gynekologisk kreftsenter som har ansvar for innsending av kreftmeldinger for cervixcancer. Dette gjelder også der hvor pasienten er konisert ved lokalsykehus og hvor man konkluderer med at pasienten er ferdig behandlet (Kreftregisteret, [s.a.]).
Diagnostikk og utredning
Sist faglig oppdatert: 11202311.04.2023
Symptomer
Blødningsforstyrrelser, blødning under eller etter samleie og økt fluor vaginalis.
Underlivssmerter og allmennsymptomer gir mistanke om avansert sykdom. Det er viktig at også unge pasienter med symptomer blir undersøkt, selv om de er under screeningsalder.
Utredning
Klinisk undersøkelse
- Ved cytologisk mistanke om kreft uten synlig tumor:
Kolposkopisk rettede biopsier og cervical abrasio. - Ved makroskopisk tumor:
Ta biopsi og evt cervical abrasio. - Gynekologisk undersøkelse i narkose med inspeksjon, palpasjon av cervix og parametrier og eventuelt vaginal ultralyd. Gynekologisk undersøkelse i narkose gir opplysninger om tumors lokale vekst. Tumors størrelse bør angis i 2 dimensjoner; transversalt og AP-diameter, lokalisasjon, parametrieinfiltrasjon og overvekst på vagina beskrives.
Diagnostisk konisering:
Kan utføres når biopsier viser malignitet og man mistenker at det foreligger stadium IA.
Infiltrasjondybde, horisontale utbredelse, karinfiltrasjon og avstand til reseksjonsrender avgjør videre behandling. I noen tilfeller kan rekonisering avklare videre behandling. Ved adenokarsinom utføres cervical abrasio.
Bildediagnostiske undersøkelser
- MR bekken bør utføres ved behandlende sykehus, i tilknytning til gynekologisk undersøkelse i narkose. Undersøkelsen kartlegger tumorutbredelsen i cervix og eventuell parametrieinfiltrasjon, lymfeknutestatus, avløpsforhold i urinveiene og eventuelle metastaser til bekkenskjelett (Patel et al., 2010).
- CT thorax, abdomen og bekken skal utføres og gir informasjon om avløpsforhold i urinveiene, lymfeknutestatus samt perifere metastaser (Patel et al., 2010).
- PET-CT vurderes som et supplement ved usikkerhet ved konvensjonell utredning eller mistanke om fjernmetastaser.
PET-CT skal vurderes dersom det planlegges radikal strålebehandling. - Ved mistanke om skjelettmetastaser bør det tas supplerende MR (Haldorsen et al., 2019; S. I. Lee et al., 2019).
MR-protokoll:
Diffusjonssekvenser i to plan (axial og sagittal). Axial 3D SE T2W. Sagittal og vinklet 2D SE T2W. SE T2W DIXON i coronalplan (fett- og vannvektede serier gir god fremstilling av benmarg), alternativt SE T1W og STIR i coronalplan.
Intravenøs kontrast anbefales og er ofte avklarende. Etter kontrast: dynamisk undersøkelse etterfulgt av axial 3D GE T1W (DIXON).
Gravide: undersøkes som hovedregel uten intravenøs kontrast, obs. forsiktighet ved SAR-tunge sekvenser.
Som forberedelse til MR bør man tilstrebe tømming av rektum (Toilax 1 time før undersøkelsen) og pasientene bør faste i 4 timer før undersøkelsen. Med tanke på å kunne bruke bildene i stråleplanlegging er det en fordel at undersøkelsen tas på flatt bord.
Spasmolytika anbefales brukt, dersom det ikke foreligger kontraindikasjoner (Buscopan og Glucagon).
Tumorstørrelse | Mål i 3 plan, transversal, AP og craniocaudal (målt langs cervix lengdeakse og perpendikulært på denne). |
Tumorutbredelse | Angi eventuell dyp infiltrasjon i cervixtroma (ytre 1/3), affeksjon av vagina (til nedre 1/3?), isthmus, corpus uteri, parametrier (ingen, minimal, etablert, til bekkenvegg) eller naboorganer (urinblære, ureteres, mesorectum, rectum). |
Lymfeknutestatus | Størrelse, antall og plassering (Balleyguier et al., 2011). |
Fjernmetastaser | Benmarg, peritoneum. |
Supplerende undersøkelser
- Cystoskopi vurderes hvis MR gir mistanke om affeksjon av blæren
- Rektoskopi ved mistanke om infiltrasjon i rektum.
- Finnålsbiopsi eller laparoskopisk lymfeknutereseksjon kan være aktuelt ved usikre funn ved bildediagnostikk og hvis dette er avgjørende for behandlingsstrategi.
Histologisk undersøkelse
Histologi skal innkalles for regranskning på regionalt senter. Alle cervixkon med karsinom FIGO stadium 1A1 skal regranskes.
For sikker klassifikasjon av de mere sjeldne subtyper av adenokarsinomer i cervix, bør supplerende metoder benyttes; immunhistokjemisk undersøkelse for p 16 og HPV analyse (PCR teknologi anbefales). Ved tvil om origo er corpus eller cervix (f.eks. ved svulster i istmusregionen) bør HPV analyse utføres.
Ved tvil om det er karinfiltrasjon bør immunhistokjemisk undersøkelse for karmarkører benyttes
- Preoperative biopsier (kolposkopisk rettede portiobiopsier og cervicalt uskrap):
- viktig å få med overgangssonen i cervix, både plateepitelet og kjertelepitelet skal kunne vurderes.
- angir type cancer, karinvasjon.
- Cervixkon og trachelectomipreparat med infiltrerende kreft angis:
- tumor type
- tumors utstrekning i mm langs cervikalkanalen
- invasjonsdybde i mm, i trachelektomi preparat der parametriene er med angis også invasjonsdybde i tredjedeler av cervixveggen
- om øvre, nedre og laterale reseksjonsrand er fri og avstanden i mm fra tumor til nærmeste reseksjonsrand
- Ved radikal hysterektomi med blokk-disseksjon av lymfeknuter i bekkenet angis:
- tumor type
- tumors utstrekning i mm langs cervikalkanalen
- invasjonsdybde i mm samt i tredjedeler av cervixveggen
- infiltrasjon i corpus uteri, parametrier og vagina
- karinfiltrasjon
- reseksjonsrender i vagina og parametriene
- antall lymfeknuter med og uten metastaser fra hver lokalisasjon, inkludert mikrometastaser
- perinodal vekst ved lymfeknutemetastaser (WHO Classification of Tumours Editorial Board, 2020). Bruk diagnosemal
Prosedyre for ultrastaging av vaktpostlymfeknute/sentinel node (SN) ved cervixcancer (Oslo universitetssykehus, [s.a.]).
SN er anbefalt hos pasienter med Figo stadium IA-IIB (Cibula et al., 2018). Ved OUS benyttes ESGO’s retningslinjer og samme prosedyre som for SN av vulvaca og endometrieca (Oonk et al., 2017). For immunfargning benytter OUS CK ved plateepitelkarsinomer og CK 8 ved adenokarsinomer (se figur).


Differensialdiagnoser
Benigne tilstander:
- Infeksjoner
- Polypper
- Iatrogene blødninger (p-piller, HRT, IUD)
Premalign tilstand:
Maligne tilstander:
- Endometriecancer med nedvekst i cervix
- Annen malignitet i cervix (sarkom, lymfom, metastase)
- Innvekst i cervix fra cancer i nærliggende organ
- Blærecancer
- Rektumcancer
- Vaginal cancer
Stadieinndeling
Sist faglig oppdatert: 11202311.04.2023
Formål
Å kartlegge sykdomsutbredelsen før behandlingens start
- Internasjonal stadieinndeling for cervix cancer ble innført i 1929, FIGO (The International Federation of Gynecology and Obstetrics)
- Ved revisjon av FIGO stageing 2018 er det innført betydelig endring i forhold til tidligere stadieinndeling som ikke tok hensyn til bildediagnostikken, man vil se en endring i stadiefordelingen i forhold til tiden før 2018. Gjør oppmerksom på at det foreligger en korrigert klassifisering i 2019, og at denne må anvendes for korrekt stageing.
- Det er i prinsippet ikke forskjell på reglene for stadieinndeling for opererte og ikke opererte.
- Utredningen før behandlingen skal avklare: tumors størrelse, graden av innvekst i cervix stroma og parametrier, affeksjon av tilstøtende organer (vagina/blære/rektum), affeksjon av urinveier/hydronefrose, metastaser til lymfeknuter i og utenfor bekkenet, samt metastaser til lungene eller andre organer.
- Ved tvil om hvilket stadium som foreligger, skal det laveste alternativet velges.
- Ved mikroinvasiv kreft baseres stadiebestemmelsen på det histologiske funn (cervixkon eller hysterektomi).
I TNM klassifikasjonssystemet tas det hensyn til alle faktorer ved utredningen som uttrykk for sykdomsomfanget. I ESGO guidelines anbefales bruk at TNM klassifikasjon i tillegg til FIGO klassifikasjon ved stadiebestemmelse, se tabell:
FIGO staging og TNM
(Bhatla, Aoki, Sharma, & Sankaranarayanan, 2018)
Cervix cancer FIGO
| T-kategori | Figo stad. | Definisjon |
|---|---|---|
| Tx | Primærtumor kan ikke beskrives | |
| T0 | Ingen tegn til primærtumor | |
| I | Tumors utbredelse begrenset til cervix, spredning til corpus uteri ignoreres | |
| T1a | IA | Invasiv tumor diagnostisert kun med mikroskopi. Stroma invasjon med maksimum infiltrasjon < 5 mm uavhengig av utbredelse |
| T1a1 | IA1 | Stromal invasjon ≤3 mm. |
| T1a2 | IA2 | Stromal invasjon >3 og ≤5 mm. |
| T1b | IB | Tumor med infiltrasjon >5 mm, tumor begrenset til cervix |
| T1b1 | IB1 | Invasivt carcinom ≤ 2 cm (i største diameter) |
| T1b2 | IB2 | Invasivt carcinom>2cm og ≤ 4 cm (i største diameter) |
| T1b3 | IB3 | Invasivt carcinom>4cm (i største diameter) |
| T2 | II | Cervix cancer som vokser utenfor uterus, men ikke til bekkenveggen eller til den ytre tredjedelen av vagina |
| T2a | IIA | Tumor uten parametrieinfiltrasjon, begrenset til øvre 2/3 del av vagina |
| T2a1 | IIA1 | Invasivt carcinom ≤4 cm (i største diameter) |
| T2a2 | IIA2 | Invasivt carcinom >4 cm (i største diameter) |
| T2b | IIB | Tumor med parametrieinfiltrasjon men når ikke bekkenveggen |
| T3 | III | Tumor som vokser til bekkenveggen og/eller til ytre tredjedel av vagina |
| T3a | IIIA | Tumor vokser til den ytre tredjedel av vagina, men vokser ikke ut til bekkenveggen |
| T3b | IIIB | Tumor vokser til bekkenveggen og/eller forårsaker hydronefrose eller en ikke fungerende nyre (der det ikke er kjent annen årsak) (r eller p noteres) |
| T3C | IIIC | Tumor involverer lymfeknuter i bekken og/eller paraaortalt |
| IIIC1 | Metastaser bare til bekkenlymfeknuter | |
| IIIC2 | Metastaser til paraaortale lymfeknuter | |
| T4 | IV | Tumor har vokst (biopsiverifisert) inn i mucosa i blære eller rektum og/eller vokser utenfor bekkenet |
| IVA | Spredning til inntilliggende organer i bekkenet | |
| IVB | Fjernmetastaser |
| T-kategori | Figo.stad. | Definisjon |
|---|---|---|
| NX | Regionale lymfeknutemetastaser kan ikke utelukkes | |
| N0 | Ingen regionale lymfeknutemetastaser | |
| N1 | Regionale lymfeknutemetastaser |
| T-kategori | Figo.stad. | Definisjon |
|---|---|---|
| M0 | Ingen fjernmatastaser | |
| M1 | Fjernmetastaser (inkl. lyske lymfeknuter og intraperitoneale metastaser). Gjelder ikke metastaser til vagina, bekkenperitoneum og adnex |
Prognose
Sist faglig oppdatert: 11202311.04.2023
Sykdomsutbredelse (FIGO stadium/ TNM klassifikasjon) og tumorvolum viktigste prognostiske parametre (Green et al., 2001; Van de Putte et al,, 2005).
I stadium I er karinvasjon funnet av betydning i noen studier, men ikke i alle (Kristensen, 1999).
Fem års overlevelse (omfatter alle dødsårsaker) relatert til FIGO stadium 2017–21 (Larsen, 2022) (B).
| Total | 82,6 % |
|---|---|
| I | 95,7 % |
| II | 79,6 % |
| III | 55,3 % |
| IV | 20,7 % |
| Unknown | 82,4 % |
Multidisiplinære team
Sist faglig oppdatert: 11202311.04.2023
I tråd med føringer i pakkeforløp for livmorhalskreft skal utredning og behandlingsbeslutninger tas i multidisiplinære team for den enkelte pasient på regionssykehus. Teamene bør bestå av representanter for alle involverte faggrupper: Gynonkolog, stråleonkolog, radiolog og patolog samt andre ved behov (Helsedirektoratet, 2016b).
Behandling i primærsituasjonen tidlig stadium
Sist faglig oppdatert: 11202311.04.2023
Kirurgisk behandling versus strålebehandling ved tidlig stadium
Prognosen ved tidlig cervixcancer er den samme etter strålebehandling kombinert med konkomitant cellegift (Landoni et al., 1997), kalt radiokjemoterapi, som etter operasjon. Ved små tumores foretrekkes kirurgi for å unngå risikoen for seneffekter etter stråling. Flere behandlingsmodaliteter bør unngås da dette øker morbiditeten (Chai et al., 2014; Landoni et al., 1997; Pieterse et al., 2013).
Hvis den diagnostiske utredning tilsier at pasienten sannsynligvis må ha strålebehandling etter kirurgi, anbefales derfor primær radiokjemoterapi.
Kirurgisk behandling av lokalisert sykdom
Stadium IA1
Konisering:
- Hvis konus har frie reseksjonsrender, også for premaligne forandringer, og er uten karinfiltrasjon, er pasienten oftest ferdigbehandlet (konferer med senter for gynekologisk kreft).
- Ved CIN III i reseksjonsranden skal pasienten rekoniseres.
- Ved påvist karinfiltrasjon/LVSI bør sentinel node (SN) overveies.
- Ved tumorinfiltrasjon i reseksjonsranden, foreligger sannsynligvis et mer avansert stadium, som må utredes videre. Hvis MR ikke viser målbar tumor kan det foretas rekonisering.
Stadium IA2
Radikal hysterektomi (oftest type B etter Querleu Morrow klassifikasjonen) med bekkenlymfadenektomi har vært standard behandling (Querleu & Morrow, 2008). SHAPE studien er en stor internasjonal multisenter studie som har randomisert pasienter med tumor under 2 cm til radikal hysterektomi eller enkel hysterektomi. I begge grupper er det utført lymfadenektomi. Studien er ferdigrekruttert, men vi har ikke data fra den pr i dag. Det finnes noen mindre studier som støtter at enkel hysterektomi er tilstrekkelig behandling, blant annet ConCerv studien. ESGO anbefaler enkel hysterektomi med lymfeknutetoalett, SN kan overveies. Arbeidsgruppen konkluderer med at resultatene fra SHAPE studien bør avventes før enkel hysterektomi innføres som vanlig praksis.
Fertilitetsbevarende behandling kan vurderes.
Stadium IB1
Radikal hysterektomi med bekkenlymfadenektomi, type B.
Fertilitetsbevarende behandling kan vurderes.
Stadium IB2
Behandlingen styres av sannsynligheten for at pasienten trenger adjuvant radiokjemoterapi etter operasjon. Behandling med 2 modaliteter bør unngås (Chai et al., 2014; Landoni et al., 1997; Pieterse et al., 2013).
Ved infiltrasjon til ytre tredjedel av cervixstroma på MR anbefales primær radiokjemoterapi. Hvis tumor ikke infiltrerer i ytre tredjedel anbefales operasjon med radikal hysterektomi type B/C og lymfadenektomi i bekkenet.
Ved exofytisk tumor, med utbredelse nedenfor omslagsfolden, trenger man ikke ta hensyn til om tumor affiserer ytre tredjedel av cervixstroma i den delen som ikke er i relasjon til parametriet. Dette ettersom det i så tilfelle ikke medfører risiko for parametrieinfiltrasjon.
Stadium IB3
Risiko for residiv etter primær kirurgisk behandling er forholdsvis stor (Soutter et al., 2001). Derfor er anbefalt primærbehandling radiokjemoterapi. En randomisert studie har vist at det å gi neoadjuvant kjemoterapi og siden operere pasienten resulterer i dårligere overlevelse (Gupta et al., 2018). Se for øvrig avsnitt om medikamentell behandling.
Stadium IIA
Tilfeller med begrenset vaginalutbredelse (< 1 cm) kan behandles som stadium IBI. Ved større tumor er standardbehandling radikal radiokjemoterapi.
Behandlingsvalg er avhengig av øvrige forhold etter utredning, se avsnitt over vedrørende Stadium IB1-3.
Minimal invasiv kirurgi ved tidlig livmorhalskreft
De siste årene er mange av pasientene med livmorhalskreft som egnet seg for kirurgi blitt operert med minimal invasiv kirurgi, i Norge først og fremst robotassistert. Det er tidligere publisert retrospektive data som viste at det ga likeverdige resultater sammenlignet med åpen kirurgi. I 2019 ble det publisert en randomisert studie som sammenlignet minimal invasiv kirurgi med åpen kirurgi, LACC studien (Ramirez et al., 2018).
Den viste overraskende høyere risiko for tilbakefall og død for pasienter som ble operert med minimal invasiv kirurgi. En Europeisk retrospektiv studie, Succor studien viste lignende resultat med flere tilbakefall og dårligere overlevelse hos den minimalinvasive gruppen (Chiva et al., 2020). I denne studien fant man at hvis det ble gjort tiltak for å unngå søl (lukke vagina over tumor før kolpotomien) og ikke bruke uterine manipulator, var det ikke forskjell i resultatene.
Det pågår nå en nordisk initiert studie som skal sammenligne åpen radikal hysterektomi med robotassistert laparoskopisk radikal hysterektomi, RACC studien.
Inntil det foreligger nye data er åpen kirurgi standardbehandling. Minimal invasiv kirurgi kan utføres når det ikke foreligger synlig tumor på MR eller klinisk.
Lymfeknutestaging/sentinel node (SN) kan utføres ved minimal invasiv kirurgi.
Vaktpostlymfeknute (Sentinel Node (SN))
Konseptet er godt kjent fra andre diagnoser og er standard for blant annet kreft i kjønnsleppene. Fordelen er mindre morbiditet for pasienten som i stedet for å gjøre full lymfadenektomi i bekkenet får fjernet 1–2 lymfeknuter fra bekkenveggen, noe som gir lavere risiko for lymfødem. Det er dokumentert at negative SN predikerer at andre lymfeknuter også er negative. Det pågår nå 2 større randomiserte studier, Senticol III (International Validation Study of Sentinel Node Biopsy in Early Cervical Cancer (SENTICOLIII) [pågående studie], 2018-2026) og Sentix (Sentinel Lymph Node Biopsy in Patients With Early Stages Cervical Cancer (SENTIX) [pågående studie], 2016-2022) for å se om det er trygt å unnlate full lymfadenektomi hvis SN er negative.
ESGO anbefaler sterkt at SN identifiseres ved alle operasjoner for cervixcancer og at de sendes til frysesnitt før man går videre med operasjonen. Frysesnitt identifiserer makrometastaser men kan være falsk negativ når det foreligger små metastaser (Cibula et al., 2019, Ciluba et. a., 2018a).
En annen fordel med SN er at det kan utføres ultrastaging, det vil si at lymfeknutene blir snittet i svært fine snitt for å bedre patologidiagnostikken. Dette gir mulighet for å oppdage meget små metastaser.
Dette gir opphav til nye kategorier av metastaser. Mikrometastaser er metastaser mellom 0,2–2 mm i størrelse og Isolerte Tumor Celler (ITC) er metastaser mindre en 0,2 mm i størrelse. Det funnet at mikrometastaser gir høyere risiko for residiv men det er mer usikker om ITC påvirker prognosen.
SN kan med fordel identifiseres ved radikal hysterektomi på grunn av livmorhalskreft i og med det øker den diagnostiske sikkerheten. I Norge har vi en relativ lav insidens av lymfeknutemetastaser sammenlignet med mange land, noe vi antar har sammenheng med god radiologi som identifiserer de fleste metastasene på forhånd. Vi anbefaler derfor ikke frysesnitt på lymfeknuter.
Lymfadenektomi kan unnlates hos stadium IA1 med karinfiltrasjon der det er gjort SN.
Fertilitetsbevarende kirurgi
Fertilitetsbevarende kirurgi bør tilbys til alle unge kvinner med tidlig livmorhalskreft som har graviditetsønske og der tumor oppfyller kriterier. Behandlingen er sentralisert og pasientene skal henvises for vurdering og behandling ved Nasjonal behandlingstjeneste for fertilitetsbevarende kirurgisk behandling av livmorhalskreft ved OUS Radiumhospitalet.
Akseptert indikasjonsområde er tumor opp til 2 cm i diameter, uavhengig av invasjon i kar/lymfebaner. Det gjøres ikke fertilitetsbevarende kirurgi på tumor med neuroendokrin histologi eller tumor med utbredelse der standard behandling er radiokjemoterapi. Fors svulster mindre enn 2 cm er det ikke vist noen gevinst av at gjøre radikal vaginal trachelektomi mot enkel trachelektomi eller konisering. Residivrisiko er rapportert rundt 4% (Bentivegna et al., 2016a) (Bentivegna et al., 2016b; Tseng et al., 2018)
Ved tumorstørrelse > 2 cm foretas en individuell vurdering (Amant et al., 2014; Bouchard-Fortier, Reade, & Covens, 2014; Plante, 2013). Behandlingen må anses som eksperimentell. Vaginal radikal trachelektomi har en høy risiko for residiv hos disse pasienter på 17%. Abdominal radikal trachelektomi har lavere risiko for residiv på ca 5-6% men dårligere graviditetsutfall. Smith et al rapporterer en graviditetsrate på 10.4% mot 37.8% for vaginale radikale trachelektomier (Smith et al., 2020).
Norske resultater rapporteres årlig til Helsedirektoratet. Her er tall fra 2021.
Fra og med 2010 er det operert 155 pasienter. Av disse har 4 blitt behandlet for residiv og lever fortsatt uten påvisbar sykdom. (2,6% residiv rate) Dette er et godt resultat og er på høyde med internasjonale resultater (1,6-3,8% Betivegna 2017). Siden starten (1997) har vi registrert at 42 pasienter har født barn, hvorav 7 pasienter har født 2 barn, 48 barn totalt. 12 (25%) barn er født prematurt (graviditetsuke <37), kun 7 (14,5%) av disse er født før graviditetsuke 34 . Det er mulig at flere kvinner har født barn uten at det er registrert i vår database.
Radial radiokjemoterapi ved lokalregional sykdom i primærsituasjonen
Sist faglig oppdatert: 11202311.04.2023
Introduksjon
Standard behandling av lokalavansert cervixcancer er radikal radiokjemoterapi gitt som en kombinasjon av ekstern strålebehandling med konkomitant kjemoterapi og brakyterapi.
Behandlingstid
Den totale behandlingstiden, inkludert ekstern og brakyterapi, bør ikke overstige 7 uker/50 dager (Board of Faculty of Clinical Oncology, 2008; Girinsky et al., 1993; Perez et al., 1995, Royal College of Radiologist, 2019, Viswanathan et al., 2012). Studier indikerer at lokal kontroll og sykdomsfri overlevelse kompromitteres ved betydelig forlengelse utover dette (Perez et al., 1995; Pieterse et al., 2013; Viswanathan et al., 2012). Man er særlig bekymret for at akselerert repopulasjon kan redusere lokal kontroll ved for lange ukompenserte pauser (Fyles et al, 1992, Huang et al., 2012).
RCR (Royal College of Radiologist) Guidelines fra 2019 (Royal College of Radiologists, 2019) anbefaler at man om mulig unngår pauser i stråleterapi og at man følger Mackillop’s ASARA prinsipp om at pauser skal være «as short as reasonably achievable».
For pasienter med plateepitelcarcinom i cervix, vagina og vulva bør man unngå øket behandlingstid da det kan påvirke utfallet av behandlingen. For pasienter som bare har ekstern strålebehandling, ev i kombinasjon med kjemoterapi, bør ikke behandlingstiden økes med mer enn to dager ut over planlagt behandlingstid. Det må da has i mente at standard behandlingstid varierer med to dager avhengig av om behandlingsstart er på en mandag eller ikke.
Behandlingspauser
Dagens dokumentasjon foreligger på bakgrunn av behandling 5 dager per uke. Ved pauser i behandlingen (maskinstans, helligdager o.l.) bør det ved kurativ intensjon vurderes kompensasjons-behandlinger som hindrer at total behandlingstid overstiger 50 dager (Fyles et al., 1992; Mazeron et al., 2015; Perez et al., 1995; Tanderup et al., 2016). Selv om eksakt antall behandlingsfrie dager ikke spesifiseres i internasjonale studier, er det dokumentasjon som taler for behandlingspauser øker risiko for manglende sykdomskontroll. Det er derfor ønskelig med maksimalt 3 påfølgende dager uten behandling i perioden hvor det gis ekstern strålebehandling (Bese, Hendry, & Jeremic, 2007).
RCR (Royal Collage of Radiologist) Guidelines fra 2019 (Royal Collage of Radiologist, 2019) skisserer mulige kompensasjonsløsninger i prioritert rekkefølge:
- Opprettholde total behandlingstid, totaldose og dose pr fraksjon ved å:
- Behandle i helg eller på annen helligdag
- Gi 2 fraksjoner på samme dag med minst 6 timers mellomrom (fortrinnsvis rett før helgefri)
- Det skal ikke gis mer enn 6 fraksjoner per 7 påfølgende dager.
- Opprettholde total behandlingstid med økt dose per fraksjon
- Her må det velges om det skal gis ekvivalente doser med tanke på tumoreffekt eller med tanke på sene strålereaksjoner
- Akseptere økning av total behandlingstid og gi ekstra fraksjoner
- Her reduseres gjerne den terapeutiske bredden med følger både for tumorkontroll og forekomst av sene strålereaksjoner
Det må has i mente at en for aggressiv kompensasjon, vil gi uker med høy dose som, særlig ved konkomitant kjemoterapi, kan øke forekomst av akutte strålereaksjoner (Erridge et al., 2002).
Ekstern strålebehandling
Forberedelser
Fiksering/pasientleie
Det anbefales at hvert stråleterapisenter etablerer standard pasientfiksering i ryggleie. Spesielt fokus på reproduserbarhet av svai i ryggen da det kan ha stor betydning for nødvendige marginer spesielt ved paraaortal bestråling.
Bildeopptak for 3D-planlegging
Doseplanleggingen baseres på en CT undersøkelse med intravenøs kontrast. Snitt-tykkelse bør maksimalt være 3 mm. Det anbefales å benytte en drikkeprotokoll som gir komfortabel fylt blære. Målet med dette er å ha så lik blærefylling som mulig ved planlegging og behandling og å redusere dosen til blære og/eller tarm (Buchali et al., 1999). Rektum og sigmoid bør være så tom som mulig.
Inntegning av volumer
Inntegning av volumer utføres på bakgrunn av planleggings CT, T2-vektede MR bilder, eventuelt PET-CT og funn ved gynekologisk undersøkelse. MR, axial 3D T2W, i behandlingsposisjon (flatt bord, fiksering) anbefales for god samregistrering med CT’en.. Hvis det ikke foreligger MR med flatt bord/fiksering og en akseptabel samregistrering ikke oppnås, må samregistreringen gjøres på bløtvev for veiledning ved inntegning av tumor og cervix og eventuelt på bein ved inntegning av lymfeknuter.
Volumdefinisjoner i dette dokumentet bygger på retningslinjer gitt i StrålevernRapport 2012:09 (Levernes, 2012).
Inntegning av risikoorganer
Ved bestråling av cervixcancer bør følgende risikoorgan tegnes inn.
Risikoorgan | Beskrivelse av inntegning |
|---|---|
Bladder | Hele blæren inkludert blæreveggen og blærehalsen. |
Rectum | Rektum inkludert rektumveggen fra anorektal sfinkter til overgangen til sigmoideum. |
Sigmoid | Sigmoideum fra overgangen fra rektum til venstre fossa iliaca. Kan eventuelt tegnes inn som en del av Bowel. |
Bowel | Ytterkontur av tarmslyngene, inkludert mesenterium (ikke abdominalkavitet, store kar eller muskler). Kranielle begrensning: til og med L1 ved paraortal bestråling, L4 ved bekkenbestråling, blære, rectum og (sigmoid) skal ikke inkluderes. |
FemoralHeads | Hoftekulene. |
Kidneys | Ved bestråling av paraaortal regionen: hele nyrene, nyrebekkenet skal ikke tas med. |
Kidneys_PRV | Hvis ønskelig: Nyrene med PRV-margin i cranio/caudal retning for å ta høyde for nyrenes mulige bevegelse under strålebehandling. |
SpinalCord | Ved bestråling av paraaortal region: medulla fra toppen av nyrene og til cauda equina (mellom L2 og L3). |
Duodenum | Hvis ønskelig ved bestråling av paraaortal region over L1: Hele tolvfingertarmen. |
CaudaEquina | Hvis ønskelig ved lymfeknuteboost |
Inntegning av målvolumer
I nomenklaturen som benyttes for målvolumene i dette dokumentet, vil indeks p benyttes som en indikasjon på målvolum knyttet til tumor, n benyttes som en indikasjon på målvolum knyttet til lymfeknuter (nodes), og e benyttes som en indikasjon på målvolum hvor det ikke er påvist tumor, det vil si områder som skal ha elektiv bestråling. Dette er en nomenklatur som er i tråd med nasjonal anbefaling (Levernes, 2019).
Gross Tumor Volume (GTV), Tumorvolum
GTVp_MR: Primærtumor uten margin tegnes inn på T2‐vektet MR med støtte fra klinisk undersøkelse.
GVTp_PT: Primærtumor uten margin på FDG PET‐CT kan tegnes der denne er tatt i behandlingsposisjon.
GTVn#_dose:Patologiske lymfeknuter uten margin tegnes inn på CT eventuelt på en samregistrert MR. Ved inntegning av flere GTVn skal disse nummereres og dose bør angis, for eksempel GTVn1_55.
Patologiske lymfeknuter defineres i hovedregel ved hjelp av radiologi. European Society of Urogenital Radiology anbefaler at følgende retningslinjer benyttes (Balleyguier et al., 2011):
- FDG PET positiv
- Og/eller: kortakse større eller lik 1 cm på CT eller MR
- Og/eller: mindre lymfeknuter med patologisk morfologi på MR med en eller flere egenskaper:
- Uregelmessig avgrensning
- Høyt intensitetssignal
- Rund fasong
Dersom histologisk prøve av radiologiske usikre lymfeknuter er mulig, kan dette være aktuelt når diagnostikk har betydning for behandlingsvalg (f.eks primærbehandling med kirurgi vs. radiokjemoterapi eller om det foreligger indikasjon for paraaortal bestråling).
Clinical Target Volume (CTV), Klinisk målvolum
CTVp_HR: GTVp_MR + resterende del av cervix
CTVp_LR: Skal inkludere:
- CTVp_HR
- Parametriene på begge sider
- Hele uterus
- Ikke involvert vagina med 20 mm margin målt fra kaudale begrensning av CTVp_HR langs vaginal aksen (starter ikke i fornix).
- CTVp_HR med en 5 mm margin anteriort og posteriort mot blære og rektum (ikke inn i blære og rektum hvis det ikke er innvekst).
- Hvis det er innvekst i bekkenveggen, sakrouterine ligamenter, mesorektum eller andre involverte strukturer, vil det ofte være nødvendig å legge til en ekstra margin rundt CTVp_HR inn i disse strukturene.
CTVn: CTVn skal minimum inkludere hele lymfekuten på MR og CT. Ekstrakapsulær vekst må tas hensyn til. En typisk margin er 0–3 mm fra GTVn bortsett fra mot sikre anatomiske barrierer.
CTVe: Lymfeknuteregioner som skal inkluderes i CTVe er avhengig av risiko for spredning og er spesifisert i forhold til de ulike risikogruppene (lav, intermediær og høy) (Keenan et al., 2018; Lim et al., 2011; Taylor et al., 2007; Toita et al., 2011).
- Lymfeknuteregioner inkludert blodårer med omtrent 7 mm perivaskulært vev.
- Patologiske lymfeknuter (CTVn) skal inkluderes.
- CTV skal ikke tegnes inn i naturlige barrierer (bein/muskulatur/tarm).
- CTV tegnes i noen områder inn i tarm utfra individuelle vurderinger.
- Ovarier kan vurderes inkludert for eksempel ved utbredt affeksjon av uterus eller ligamentum latum infiltrasjon.
- Dersom patologiske lymfeknuter i mesorectum eller innvekst i rectum, bør hele mesorectum inkluderes.
EMBRACEII appendix 5: EBRT contouring atlas
Paraaortal inntegningsatlas (Keenan et al., 2018)
Risikogruppe | Definisjon | Lymfeknuteregioner inkludert i CTVe |
|---|---|---|
Lav risiko | Tumorstørrelse ≤4 cm og FIGO 1A/1B/IIA1 og N0 og plateepitel karsinom og ingen infiltrasjon i uterus | «Lille bekken»:
|
Intermediær risiko | Ikke «Lav risiko» Ikke «Høy risiko» | «Store bekken»:
|
Høy risiko | ≥ 1 patologisk lymfeknute i iliaca communis regionen eller høyere eller ≥ 3 patologiske lymfeknuter | «Store bekken + paraaortal»:
|

Marginer og marginrelaterte volumer
For å sikre rekvirert dose til CTV må det i tillegg til tumorutbredelse tas med marginer for ulike usikkerheter og variasjoner. ITV tar hensyn til usikkerhet og variasjon i størrelse, form og posisjon på CTV i pasienten. I tillegg inngår variasjon i ulike legers inntegning av målvolum. PTV er et geometrisk volum som skal sikre at rekvirert dose med akseptabel sannsynlighet blir gitt til alle deler av CTV når det tas hensyn til alle geometriske usikkerheter og variasjoner av pasient og utstyr (Levernes, 2012).
Internal Target Volume (ITV)
Margin mellom CTV og ITV: Intern bevegelse av cervix og uterus kan være store.
Det anbefales å bruke individualiserte ITV marginer.
I praksis er det anbefalt å starte med standard marginer og tilpasse volumet individuelt for hver pasient basert på bevegelsesinformasjon fra bildegrunnlagene (CT/MR).
Følgende marginer kan benyttes som et utgangspunkt:
ITVp marginer for CTVp:
- 10 mm anterior/posterior
- 10 mm superior/inferior
- 5 mm lateralt
Individuell vurdering av marginene:
Diagnostiske bilder og doseplan CT kan gi informasjon om anatomiske forhold av betydning for doseplanlegging hos den enkelte pasient. MR eller CT med ulik blære/rektum fylling i forhold til planleggings CT’en vil for eksempel kunne bidra til å definere individualiserte ITV marginer. Ved daglig adaptiv behandling kan ITV-marginene reduseres. Hvis bildene er tatt i behandlingsposisjon vil de kunne samregistreres og dermed gi mer eksakt informasjon.
ITVp_45:
- Ikke inn i naturlig barrierer (bein/muskulatur).
- Det skal ikke legges til ekstra marginer caudalt i vagina.
- Ved tumorinfiltrasjon i den øvre delen av corpus uteri bør det i legges til en ekstra 5 mm margin utenfor livmor i alle retninger.
For lymfeknutestasjoner anses den interne bevegelsen å være ubetydelig og dermed vil ITV være lik CTV for CTVn og CTVe.
Planning Target Volume (PTV), Planleggingsvolum
Hver enkelt avdeling må vurdere sine PTV marginer ut i fra sitt eget behandlingsopplegg og rutiner for posisjonskontroll av behandlingen.
Fraksjonering
Ved radikal radiokjemoterapi av cervixcancer gis en kombinasjon av ekstern strålebehandling og brakyterapi. Det er derfor viktig å ta hensyn til bidraget fra begge disse behandlingsmodalitetene når dosen beregnes. For å kunne summere dosebidragene må dosen angis i 2 Gy’s ekvivalent dose, som beregnes ved hjelp av α/β –formelverket (Joiner et al., 2019). Det er benyttet α/β=3 for sentreagerende (normalvev) vev og α/β=10 for tumor.
| Fraksjonsdose | Totaldose | EQD2 (α/β =10) |
|---|---|---|---|
CTVp | 1.8 Gy | 45 Gy | 44.3 Gy |
CTVe | 1.8 Gy | 45 Gy | 44.3 Gy |
CTVn i bekkenet | 2.2 Gy | 55 Gy | 56 Gy |
CTVn utenfor bekkenet | 2.3 Gy | 57.5 Gy | 59 Gy |
Det anbefales å benytte simultanintegrert boost (SIB) til lymfeknutemetastaser.
For lymfeknuter i bekkenet som antas å få lite dosebidrag fra braky, kan det vurderes å øke fraksjonsdosen til 2.3 Gy.
Den ekstra dosen til lymfeknutene kan alternativt gis som en sekvensiell boost.
Bakgrunn for doser til CTVn
Anbefalte doser til CTVn er mellom 55–65 Gy: Ifølge Mohamed SM (Mohamed et al., 2015) kan den forventede dosen fra brakyterapi bli tatt hensyn til ved at det anslås 3–4 Gy (EQD2) i lille bekken (iliaca externa/interna og obturator lymfeknuter), og neglisjerbar dose utenfor bekkenet (iliaca communis, paraaortale og inguinale lymfeknuter).
Med denne forutsetningen oppnås rundt 60 Gy til lymfeknuter i bekkenet ved å gi 56 Gy (EQD2) ved ekstern stråleterapi samt at de mottar 3–4 Gy (EQD2) ved brakyterapi.
Strålebehandlingsteknikker
Intensitetsmodulert strålebehandling (IMRT) eller intensitetsmodulert buebehandling (VMAT) anbefales for å redusere dosen til risikoorganer (Chopra et al., 2021; D'Souza et al., 2012; Gandhi et al., 2013; Klopp et al., 2018; Yeung et al., 2020).
Beregningsalgoritmer og energi
Det er anbefalt å bruke algoritmer som vil gi pålitelige beregninger også ved betydelige inhomogeniteter for eksempel: «Monte Carlo», «Acuros XB», «Collapsed Cone» eller «AAA»
Ved bruk av høye energier vil nøytrondosen øke, derfor er lavere energier (6 MV, 10 MV) å foretrekke.
Normering
Ved ett dosenivå (uten lymfeknuteboost) anbefales det å normere til median i ITV_45 (Alternativt PTV_45).
Ved flere dosenivåer og simultanintegrert boost er en mulighet å normere til median i et volum som består av ITV_45 der alle PTVn er ekskludert. (Alternativt PTV_45 ekskludert PTVn).
En alternativ mulighet er å normere til D98 til CTVn for det høyeste dosenivået.
DMin | Dosen til 99.9 % av volumet |
D98 | Dosen til 98 % av volumet |
Dvolum | Dosen til angitt volum |
Vdose | Volumet som mottar angitt dose |
| Dmaks | Punktdosemaks |
Volum | Dosevolum krav | Dosevolum ønske |
|---|---|---|
ITV_45 | DMin >95 % (42.8 Gy) | DMaks < 107 % (48.2 Gy) |
PTV_45 | D98 % > 95 % (42.8 Gy)* DMaks <107 % (48.2 Gy)** |
|
CTVn | D98 > 100 % av rekvirert dose | D50 > 102 % av rekvirert dose*** |
PTVn | D98 > 90 % av rekvirert dose DMaks < 107 % av rekvirert dose | |
xCTVp_HR+10 |
| DMaks < 103 % (46.4 Gy) |
* EMBRACE 2 har en dosevolumkrav D95% > 95% for å spare risikoorgan.
** Maksdosekravene til ITV_45 og PTV_45 gjelder i tilfeller uten lymfeknuter som skal boostes. Ved lymfeknuteboost anbefales å lage et volum det PTVn ekskluderes og se på maksodsene til disse volumene.
*** For større lymfeknuter. Vanskelig å oppnå på små lymfeknuter.
Dosefordeling i CTVn
Det brukes en dosefordeling for lymfeknuteboost som tar hensyn til sannsynligheten for dosedekning. Det vil si at det antas at CTVn oppholder seg mer i det sentrale området enn i kanten av PTVn. Som følge av dette er målet å oppnå en heterogen dose i PTVn med sentraldose høyere enn 100 % og dose i kanten til 90 %. Hvis det er store lymfeknuter, er det mulig å eskalere sentral del av GTVn til for eksempel D50 > 102 %, samtidig som øvre grense på 107 % respekteres (Ramlov et al., 2017a).
Dosefordeling i brakyområdet
Det er viktig å unngå høye doser til risikoorganer som får dosebidrag fra brakyterapi. Det vil si de risikoorganene som ligger nært CTVp_HR (blære, rektum, sigmoid og tynntarm). For å unngå høye doser i dette området genereres det en hjelpekontur (xCTVp_HR_10) som er CTVp_HR med 10 mm margin. Dosen innen denne hjelpekonturen anbefales å være mindre enn 103 % av 45 Gy for å unngå varme områder i risikoorganene som vil få vesentlig bidrag fra braky.
Toleransedoser
Normalvevstoleranse handler ikke bare om dosenivåer, men ofte også om hvor stort volum som blir bestrålt til hvilken dose. (Dawson et al., 2010; Jensen et al., 2021; Spampinato et al., 2021a, 2021b; Spampinato et al., 2022; Westerveld et al., 2022). Karakteristikken på denne dose-volum-sammenhengen varierer mellom ulike organer.
Organ | Dosevolum krav | Dosevolum ønske |
|---|---|---|
Bowel | DMaks < 105 % (47.3 Gy) | V40 Gy < 250cm3* V30 Gy < 500cm3* |
Sigmoid | DMaks < 105 % (47.3 Gy) |
|
Bladder | DMaks < 105 % (47.3 Gy) | V40 Gy < 60 %* V30 Gy < 80 %* |
Rectum | DMaks < 105 % (47.3 Gy) | V40 Gy < 75 %* V30 Gy < 95 %* |
SpinalCord | DMaks < 48 Gy |
|
FemoralHead | DMaks < 50 Gy |
|
Kidney | DMean < 15 Gy | DMean < 10 Gy |
Body | DMaks < 107 % (48.2 Gy) |
|
Duodenum | V55 Gy < 15 cm3 |
|
Organ | Dosevolum krav | Dosevolum ønske |
|---|---|---|
Bowel | DMaks < rekvirert dose til PTVn | Bekkenbestråling: V40 Gy < 250 cm3 |
| DMaks < 47.3 Gy (i områder utenfor 10–15 mm fra PTVn) | Paraortal bestråling: V40 Gy < 300 cm3 |
Sigmoid | DMaks < rekvirert dose til PTVn DMaks < 47.3 Gy (i områder 10–15 mm fra PTVn) |
|
Bladder | DMaks < rekvirert dose til PTVn DMaks < 47.3 Gy (i områder utenfor 10–15 mm fra PTVn) | V40 Gy < 60 %* V30 Gy < 80 %* |
Rectum | DMaks < rekvirert dose til PTVn DMaks < 47.3 Gy (i områder utenfor 10–15 mm fra PTVn) | V40 Gy < 75 %* V30 Gy < 95 %* |
SpinalCord | DMaks < 48 Gy |
|
FemoralHead | DMaks < 50 Gy |
|
Kidney | DMean < 15 Gy | DMean < 10 Gy |
Body | DMaks < 48.2 Gy (i områder utenfor 10–15 mm fra PTVn) |
|
Duodenum | V55 Gy < 15 cm3 |
|
Gjennomføring av behandlingen
Det er vanlig å posisjonere pasienten etter påtegninger/tatoveringer på hud og/eller ved hjelp av overflateskanningssystemer.
Det anbefales at det gjennomføres daglig bildematch på skjelettstrukturer og posisjoneringskorreksjon før behandling. Hvis det er mulighet for å korrigere bord for pitch, roll og rotasjon, gjøres dette.
Ved paraaortal bestråling vil en liten rotasjon i bekkenet kan ha stor påvirkning på posisjonen til lymfeknutene. Det anbefales derfor ikke å korrigere for pitch i disse tilfellene.
Ved daglig matching på skjelettstrukturer i bekkenet inkludert bordkorreksjon er det mulig å redusere PTV-marginene fra 10 til 5 mm for elektivt lymfeknutevolum uten å gå på kompromiss med målvolumdekningen (Laursen et al., 2012) .
Ved cone beam CT (CBCT), er det mulig å se om den daglige uterus posisjonen er signifikant forskjellig fra forventet, og denne kunnskapen kan brukes til å avgjøre om det er behov for en ny behandlingsplan.
Hvis CBCT’en viser at signifikante deler av CTV’ene er gjentagende utenfor 95 % isodosevolumet anbefales det å:
- Vurdere om det er tilstrekkelig blærefylning
- Ta ny planleggings CT for å replanlegge
- Redefinere ITV og ta hensyn til informasjonen en får ut fra CBCT’ene
- Justere PTV marginene
- Det er aksept for 10 % underdosering av ikke‐involvert fundus uteri så lenge bidraget fra ekstern strålebehandling er minimum 40 Gy (EQD2)
Brakyterapi
Boost til tumor i form av brakyterapi er nødvendig for å oppnå høy nok stråledose for kurasjon (Gill et al., 2014). Behandlingen gis gjerne mot slutten av eller etter den eksterne stråleterapien for å oppnå størst mulig tumorskrumpning. De siste 10–15 årene har brakyterapi basert på volumetrisk/3D avbildning blitt tatt i bruk. Pasienten får da en individuell tilpasset behandling ved hver fraksjon, såkalt adaptiv billedveiledet brakyterapi (IGABT). Internasjonale publikasjoner har beskrevet økt lokal kontroll, bedret overlevelse og redusert forekomst av alvorlige bivirkninger hos pasienter behandlet med IGABT sammenliknet med historiske kontroller behandlet med konvensjonell, punktdosert brakyterapi (Charra-Brunaud et al., 2012; Fokdal et al., 2018; Jensen et al., 2018; Lindegaard et al., 2013; Rijkmans et al., 2014; Sturdza et al., 2016).
Utstyr
Gynekologisk brakyterapi i Norge gis med med etterladningsapparater, og det benyttes høydoserate (HDR). Det gis behandling med ringapplikator og intrauterinsonde, eventuelt benyttes også interstitielle nåler.
Gynekologisk undersøkelse
Før innleggelse av applikator, skal tumorutbredelse og lokale forhold i vagina/cervix/uterus som har betydning for valg av applikator og teknikk bedømmes klinisk ved gynekologisk undersøkelse under anestesi. Transrektal UL kan være til hjelp i denne vurderingen.
Bildeopptak for 3D-planlegging
Det anbefales at det tas MR eller CT med applikator i pasient før hver fraksjon (Cibula et al., 2018b; The International Commission on Radiation Units & Measurements (ICRU) et al., 2016).
MR anbefales framfor CT på grunn av bedre evne til å skille tumor fra øvrig bløtvev i og rundt cervix..
CT/MR tas med liten snitttykkelse for å få en mest mulig riktig avbildning av applikatorene (maksimalt 3 mm). Ved MR-opptak vil T2 vektede bilder og 3D-sekvenser gi den beste informasjonen.
Blærevolumet skal være så likt som mulig på bildeopptaket og under behandling.
Inntegning av volumer og definering av punkter
Inntegning av volumer utføres på bakgrunn av planleggings MR eller CT (fortrinnsvis med samregistrerte T2-vektede MR bilder) og gynekologisk undersøkelse.
Inntegning av risikoorganer
Risikoorganene skal tegnes inn på planleggingsbildene for aktuell fraksjon.
Følgende risikoorgan bør tegnes inn.
Risikoorgan | Beskrivelse av inntegning |
|---|---|
Bladder | Hele blæren inkludert blæreveggen og blærehalsen. |
Rectum* | Rektum inkludert rektumveggen fra innenfor relevant avstand |
Sigmoid* | Sigmoid fra overgangen fra rektum. |
Bowel | Ytterkontur av tarmslyngene som er posisjonert innenfor relevant avstand |
* Hvis overgangen mellom rektum og sigmoideum kommer i nærheten av applikatoren er det anbefalt å flytte overgangen opp eller ned slik at maksimal D2ccm kommer i ett organ. Dette området bør ligge i samme organ ved alle fraksjoner.
Inntegning av målvolumer
Det er anbefalt at målvolumer tegnes inn i henhold til GEC ESTRO anbefalingene (Haie-Meder et al., 2005).
Følgende målvolum bør tegnes inn:
Målvolum | Beskrivelse av inntegning |
|---|---|
GTV | Synlig gjenværende tumor på MR. |
CTV_HR | Adaptivt høyrisiko klinisk målvolum inkluderer resttumor inklusiv usikre områder i parametriene (på MR) samt resterende del av cervix. |
Følgende punkter defineres:
Punkter | Beskrivelse av plassering |
|---|---|
ICRU recto‐vaginal | 5 mm posterior for vaginalveggen. (Skal defineres). |
ICRU bladder | Den mest posteriore posisjonen i det snittet hvor kateterballongen har størst utstrekning (valgfritt). |
Vaginal point | 5 mm fra vaginalapplikatorens overflate i sin og dxt (valgfritt). |
A1 og A2 | 20 mm kranielt for vaginalapplikator langs uterinsonden og 20 mm lateralt for uterinsonden (The International Commission on Radiation Units & Measurements (ICRU) et al., 2016). |
Strålebehandlingsteknikker ved brakyterapi
Det anbefales å benytte seg av applikatorbibliotek for å rekonstruere applikator hvis det er tilgjengelig.
Standard dosefordeling basert på dose til punkt A vil ofte ikke gi en optimal behandling, verken med hensyn på dekning av målvolum eller dose til kritiske organ. Det anbefales likevel å ta utgangpunkt i en standardplan (The International Commission on Radiation Units & Measurements (ICRU) et al., 2016). Hvis det ikke tas utgangspunkt i en standardplan, er det ekstra viktig å se på hvor den høye dosen blir avsatt etter optimalisering.
Interstitielle nåler
I en del situasjoner vil det ikke være mulig å oppnå ønsket dose til tumor og/eller akseptabel dose til risikoorganer kun ved bruk av intrakavitære applikatorer. Det anbefales da å benytte interstitielle nåler/katetre. I RetroEMBRACE studien fant man at brakyterapi med intrakavitær/insterstitiell teknikk til store svulster ga signifikant bedret lokal kontroll uten økt morbiditet (Fokdal et al., 2016).
Interstitielle katetre kan plasseres ved hjelp av definerte posisjoner i utstyret eller direkte i tumorvevet der standardposisjonene ikke gir et tilfredsstillende resultat. Interstitielle kateterposisjoner må rekonstrueres manuelt. Generelt anbefales det ikke å lade nålene mer enn 20–30 % i forhold til liggetiden i de intrakavitære applikatorene. Hvis nålene skal lades mer, må posisjonen til nålen og den aktuelle kildeposisjonen vurderes. Den endelige planen må vurderes nøye med hensyn på dosefordeling og lokalisasjon av de kildeposisjonene som benyttes (Dimopoulos et al., 2006; Fokdal et al., 2013).
Det anbefales at avdelinger uten erfaring med/tilgang til behandling med interstitiell teknikk henviser til avdeling med slik kompetanse ved behov.
Fraksjonering
Brakybehandlingen med høydoserate gis vanligvis med 4–5 fraksjoner slik at de anbefalte summerte dosene oppgitt under oppnås. EQD2 dosene inkluderer 45 Gy/25 fraksjoner som er gitt ved ekstern strålebehandling.
Det anbefales maksimalt 3 fraksjoner med brakyterapi per uke. Ved 3 fraksjoner på en uke forutsettes at ekstern strålebehandling er avsluttet.
I EMBRACE 1 studien ga en median dose på 90 Gy til D90 av CTV HR en 5-års lokal kontrollrate på 92%* (Pötter et al., 2021). EMBRACE 2 studien har følgende dosekrav (totaldose med ekstern stråledose og dose fra brakyterapi):
Målvolum: | Dosevolum krav EQD2 (α/β=10 | Dosevolum ønsker EQD2 (α/β=10 |
|---|---|---|
GTV | D98 > 90 Gy | D98 > 95 Gy |
CTV_HR | D90 > 85 Gy | 95 Gy < D90 > 90 Gy D98 > 75 Gy |
Punkter: |
|
|
Punkt A |
| > 65 Gy (kun aktuelt ved intracavitær behandling) |
Toleransedoser
Organ | Dosevolumkrav D2ccm (EQD2 (α/β=3)) | Dosevolumønsker D2ccm D2ccm (EQD2 (α/β=3)) |
|---|---|---|
Bladder | < 90 Gy | < 80 Gy |
Rectum | < 75 Gy | < 65 Gy |
Sigmoid | < 75 Gy | < 70 Gy |
Bowel | < 75 Gy | < 70 Gy |
Det er et ønske å redusere dosen til øvre vagina hvis mulig. Vaginalpunktene kan brukes til dette. Vurdering av 200 %-isodosen rundt vaginalapplikatoren er også nyttig. Ved å redusere dosen i vaginalapplikatorenog øke dosen i sonden og eventuelle nåler kan dose til vagina reduseresuten å redusere dosen til målvolumene (Mohamed et al., 2016).
| Ønsker | Prioritet |
|---|---|---|
ICRU recto-vaginal punkt dose | < 65 Gy (EQD2α/β=3 ekstern + braky) | Primær |
Konkomitant kjemoterapi
Bedre resultater av strålebehandling kombinert med cellegift sammenlignet med strålebehandling alene ble demonstrert i en meta-analyse fra 2001 og senere i en Cochrane review fra 2010 (Chemoradiotherapy for Cervical Cancer Meta-analysis Collaboration (CCCMAC), 2010; Green et al., 2001). Standard behandling ved lokalavansert livmorhalskreft i dag er derfor strålebehandling i kombinasjon med cellegift.
Det anbefales at cisplatin som hovedregel gis mandag, tirsdag eller onsdag, men kan unntaksvis gis på en torsdag for så å fremskynde uken etter. Minimum 5 dager mellom 2 på følgende kurer.
Cisplatin bør tilstrebes å ha blitt ferdig infundert før pasienten får sin daglige strålebehandling.
Ukentlig Cisplatin (40 mg/m2) gitt konkomitant med ekstern strålebehandling er det foretrukne regimet da studier med andre medikamenter eller kombinasjoner til nå ikke har vist å gi bedre resultater, men har medført økt toksisitet (Chemoradiotherapy for Cervical Cancer Meta-analysis Collaboration (CCCMAC), 2010; Chen et al., 2017; Deng et al., 2022; Mohamed et al., 2016). Man har i EMBRACE I sett flere residiver når mindre enn 5 kurer er gitt (Schmid et al., 2014). Det tilstrebes derfor at det gis 5–6 kurer totalt. De fleste studier og retningslinjer opererer med en maksimal dose med Cisplatin på 70 mg.
Individuell vurdering, men veiledende grenser på ≥ 1-x 109/L for neutrofile og TPK > 75 x109/L for å gi kur. Veiledende grense estimert GFR > 50.
Man bør redusere Cisplatindosen til 30 mg/m2 ved mer enn en kurutsettelse grunnet for lave hematologiske verdier, eller etter en episode med febril neutropeni.
En bør avstå fra konkomitant kjemoterapi framfor å risikere å avbryte strålebehandlingen hos pasienter med redusert toleranse på grunn av nedsatt allmenntilstand eller komorbiditet.
Ukentlig Cisplatin må regnes som et høyemetogent kur-regime, særlig pga kombinasjon med abdominal bestråling. Det anbefales derfor at det gis et antiemetisk regime i tråd med de til enhver tids gjeldende anbefalinger for slike kur-regimer (Einhorn et al., 2017).
Dersom cisplatin er kontraindisert kan ukentlig Karboplatin (AUC2) være et alternativ, selv om man har begrenset med data som viser effekt i denne settingen (Cetina et al., 2008; Dubay et al., 2004; Katanyoo et al., 2011; Nam et al., 2013; Tharavichitkul et al., 2016)
Postoperativ radiokjemoterapi
Overlevelsen etter radikal kirurgi uten adjuvant behandling for cervixcancer i tidlig stadium er god med ca. 90 % 5-års overlevelse (Larsen, 2015). Ved hjelp av histopatologiske prognostiske faktorer kan man velge ut pasienter som kan ha nytte av adjuvant behandling og dermed bedre prognosen.
Postoperativ strålebehandling har i flere studier vist signifikant redusert residivfrekvens ved tidlig cervixcancer med risikofaktorer (L. Rogers, Siu, Luesley, Bryant, & Dickinson, 2012; Rotman et al., 2006; Sedlis et al., 1999; Van de Putte et al., 2005).
Konkomitant kjemoterapi (Cisplatin) anbefales.
Indikasjon:
I tråd med ESGO-guidelines (Cibula et al., 2018b) er adjuvant radiokjemoomterapi indisert i høyrisikogruppen, dvs dersom minst en av følgende kriterier foreligger:
- Lymfeknutemetastaser i bekkenet. Gjelder makrometastaser pN1 eller mikrometastaser pN1 (mi).
- Parametrieinfiltrasjon
- Ufrie kirurgiske marginer (Estape et al., 1998; Khanna et al., 2016; McCann et al., 2013; Viswanathan et al., 2006)
- Adjuvant behandling kan i tillegg vurderes ved funn av isolerte tumorceller i sentinel LNs, selv om klinisk betydning er usikker.
- Adjuvant radiokjemoterapi kan vurderes i intermediær risikogruppe (kombinasjon av risikofaktorer basert på endelig histologi; tumorstørrelse, invasjon i kar/lymfebaner og dybde på stromainvasjon. Adjuvant radiokjemoterapi kan i denne gruppen vurderes på bagrunn av Sedlis kriterier:
Postoperativ strålebehandling (+/- konkomitant cisplatin) på bakgrunn av andre risikofaktorer* for tilbakefall vurderes i MDT møter i de enkelte kasus.
Invasjon i kar/lymfebaner | Dybde på stromainvasjon | Tumorstørrelse |
|---|---|---|
Ja | Ytre 1/3 | Alle |
Ja | Midtre 1/3 | >= 2 cm |
Ja | Indre 1/3 | >= 5 cm |
Nei | Midtre eller ytre | >= 4 cm |
Anbefalinger for adjuvant radiokjemoterapi i intermediærgruppen er basert på to gamle prospektive studer fra 1999 (Sedlis et al., 1999) og 2000 (Peters et al., 2000). Det har nylig blitt publisert en reviewartikkel i Int J Gynecol Cancer (Rodriguez et al., 2022) hvor forfatterne stiller spørsmål om det er på tide å oppdatere anbefalingene for adjuvant behandling etter radikal kirurgi ved cervix cancer i intermediær risikogruppe. GOG92, med sine begrensninger, er den eneste studien med evidens som støtter adjuvant behandling i intermediær risikogruppen. Det har vært en formidabel forbedring i billeddiagnostikk, patologi, staging og behandling (både kirurgi og strålebehandling) i løpet av de siste årene. På bagrunn av det er det mulig at flere i intermediærgruppen blir overbehandlet. Foreløpig foreligger det ikke evidens for at man bør utelate adjuvant behandling i denne gruppen. Rodrigez et al konkluderer med at inntil ny evidens blir publisert, bør vi forsette å individualisere behandlingen i intermediær risikogruppen (Rodriguez et al., 2022).
Oppstart postoperativ strålebehandling anbefales 4–8 uker etter operasjon.
Fiksering/pasientleie/Bildeopptak for 3D-planlegging/Inntegning av risikoorgan:
Se avsnitt "Ekstern strålebehandling, Forberedelser" og "Brakyterapi, Bildeopptak for 3D-planlegging" over.
Inntegning av målvolumer:
Internasjonale konsensus dokumenter for inntegning av målvolum for postoperativ radioterapi (Small et al., 2008; Toita et al., 2010).
Clinical Target Volume (CTV), Klinisk målvolum:
CTVe:
- Øvre begrensning av CTVe bør ligge et snitt under aortabifurkaturen.
- Nedre begrensning av CTVe bør ligge minst 2 cm kaudalt for vaginaltoppen eller 1 cm kranialt for foramen obturatorius nedre begrensning.
- Følgende strukturer bør inkluderes i CTV:
- Lymfeknutestasjoner ved iliaca communis, iliaca externa, iliaca interna og presakralt.
- Eventuelle lymfoceler
- Øvre vagina, minst 2 cm, samt paravaginalt bløtvev lateralt for vagina
- Parametrier
CTVn:
Gjenstående patologiske lymfeknuter defineres som CTVn.
ITVe
Det anbefales å bruke individualiserte ITV marginer. Caudale del av CTV som ligger mellom rektum og blære, vil ha behov for ITV-margin (spesielt i anterior/posterior retning avhengig av rektumfylning).
I praksis er det anbefalt å starte med standard marginer og tilpasse volumet individuelt for hver pasient basert på bevegelsesinformasjon fra bildegrunnlagene (CT/MR).
Planning Target Volume (PTV):
se avsnitt "Inntegning av volumer" over.
Fraksjonering:
- Ekstern strålebehandling opp til minst 45 Gy (EQD2). 1,8–2 Gy per fraksjon. 5 fraksjoner pr uke.
- Evt. boost (ekstern eller braky) ved ufri eller knapp margin. Vanligvis vil det gis en summert dose på 60 Gy (EQD2α/β=10). Ved ekstern teknikk kan SIB med fordel benyttes.
- Evt. CTVn boostes til samme dosenivå som gjelder for primær radiokjemoterapi (se avsnitt "Fraksjonering" over).
Strålebehandlingsteknikker: Se "Strålebehandlingsteknikker ved brakyterapi" over.
Beregningsalgoritmer og energi: Se "beregningsalgoritmer og energi under "radikal radiokjemoterapi ved lokoregional sykdom".
Akutte bivirkninger under stråleterapi
Strålebehandling mot bekkenet gir ofte bivirkninger. Grad er avhengig av dose, fraksjonering og volum samt komorbiditet og livsstil, for eksempel røyking (Eifel et al., 2002). Pasienter med bindevevssykdom, inflammatorisk tarmsykdom og karsykdom har høyere risiko for bivirkninger (Willett et al., 2000; Wo et al., 2007). I tillegg er det stor individuell variasjon i toleranse.
Cisplatin i kombinasjon med bekkenbestråling øker risikoen for bivirkninger (Keys et al., 1999).
Akutte strålebivirkninger oppstår underveis eller kort tid (opptil 4 uker) etter strålebehandlingen.
Akutte strålebivirkninger bør graderes ved hjelp av Common Terminology Criteria for Adverse Events (CTCAE) (U.S. Department of Health and Human Services, 2017). Denne graderingen kan være til hjelp for å iverksette tiltak.
Organer som ofte blir affisert ved strålebehandling mot bekkenet:
Urinveier:
Akutt strålecystitt som skyldes inflammasjon og ødem i blæreslimhinnen, ses hyppig (Viswanathan et al., 2010). Gir dysuri, hyppig vannlating, urge, nocturi og blærespasme. Det er viktig å utelukke urinveisinfeksjon.
Spontan bedring inntrer oftest 1 -2 uker etter fullført strålebehandling. Antiflogistika kan brukes ved plagsom dysuri.
Gastrointestinaltraktus:
Tarmen er svært sensitiv for strålebehandling. Hyppige bivirkninger er kvalme og oppkast. Symptomer på skade av tarmslimhinnen inkluderer kolikksmerter, diare, anorexi, rektumsmerter, blod/slim i avføringen og tenesmus.
Det viktigste er symptomlindrende behandling, rikelig væskeinntak, kostråd, antiemetika og eventuelt Loperamid (Muehlbauer et al., 2009). Enkelte pasienter får såpass uttalte bivirkninger at de får behov for intravenøs væske (og eventuelt elektrolyttilskudd) og parenteral ernæring.
Ovarier:
Ovariene er svært strålesensitive. Sensiviteten er aldersavhenig (økt ved høy alder) (Bisharah et al., 2003; Morice et al., 1998; Panay et al., 2009).
Strålebehandling av ovariene medfører prematur menopause og infertilitet. Symptomer på menopause kan være for eksempel hetetokter, søvnforstyrrelser, urinveisplager, tørre slimhinner, nedsatt libido, muskel/leddplager, nedstemthet og depressive symptomer. I tillegg økt risiko for osteoporose, hjertekarsykdom, utvikling av demens og Parkinsonisme. Den økte risikoen er mest uttalt for de yngste pasientene. Klimakteriet før fylte 40 år er forbundet med redusert levealder.
Beinmarg:
Hematopoietiske celler er strålesensitive. Cirka 25 % av beinmargsreservene er lokalisert i bekkenet. Hematologisk toksisitet kan reduseres ved bruk av IMRT (Hui et al., 2014).
Hud/slimhinner:
Akutt hudreaksjon varierer fra erytem til våt deskvamasjon og sjeldent ulserasjon. Moderne strålebehandling er hudbesparende.
De fleste pasientene får kun milde hudbivirkninger ved strålebehandling av cervixcancer. Pasienter som får lyskefelt er mer utsatt for akutte hudbivirkninger.
God hygiene, lufting av området, unngå tettsittende klær og parfymerte produkter. Vulvaskylling kan forebygge sårhet og infeksjoner. For øvrig vises det til hvert enkelt strålesenters lokale prosedyrer.
Dermatitten kan forverres de første par ukene etter avsluttet behandling.
Oppfølging av akutte strålebivirkninger underveis i behandlingsløpet:
Det anbefales ukentlige strålekontroller hos lege/sykepleier underveis i strålebehandlingen. Det må da være fokus på akutte bivirkninger fra blære, tarm, vagina, hud samt beinmarg med blodprøvekontroll (Hb, leukocytter, neutrofile granulocytter og trombocytter).
Neoadjuvant og adjuvant kjemoterapi
Neoadjuvant kjemoterapi før kirurgi
Endelige og preliminære resultater fra randomiserte fase III studier støtter norsk praksis om å ikke bruke neoadjuvant kjemoterapi etterfulgt av kirurgi som alternativ til radiokjemoterapi. Flere randomiserte studier har blitt piblisert etter enCochrane review i 2012. Samlet viste studiene ingen gevinst i overlevelse, men an høy andel med pasienter som ble behandlet med postoperatic strålebehandling etter NCT og kirurgi (Gupta et al., 2018; Kenter et al., 2019; Rydzewska et al., 2012; Tangjitgamol et al., 2019).
I spesielle tilfeller (f.eks. fertilitetsbevarende kirurgi, graviditet og ved kontraindikasjoner for strålebehandling) kan NACT likevel vurderes. Individuelt tilpasset opplegg anbefales da. Viser til eget avsnitt .
Neoadjuvant kjemoterapi før radikal radiokjemoterapi
For neoadjuvant kjemoterapi før strålebehandling må man avvente nye studier før dette kan anbefales (da Costa et al., 2019; Wang et al., 2021). Kan likevel vurderes på enkeltpasienter med særdeles lokalavanserte svulster hvor det er spesielt høy risiko for fjernmetastaser utenfor strålefeltet og brakyterapi-dekning fordrer en optimal lokal respons (Kitagawa et al., 2015).
Det anbefales da 3 kurer med taxan-cisplatin kombinasjon, 3 ukers intervall. Bevacizumab er ikke anbefalt i denne settingen så lenge intensjonen med NACT er å gi strålebehandling. Om man ved evaluering ikke ser indikasjon for strålebehandling, bør man vurdere å behandle pasienten i tråd med regime beskrevet under «Medikamentell behandling ved metastatisk sykdom. Viser til avsnitt om medikamentell behandling for indikasjon for bevacizumab. Evaluering med CT/MR. Oftest bør man unngå flere kurer før strålebehandling, selv med god respons (Davis et al., 2000). Cisplatin kan fortsatt gis konkomitant med strålebehandlingen etterpå.
Det pågår en randomisert internasjonal multisenter studie (INTERLACE studien), NCT01566240 (Induction Chemotherapy Plus Chemoradiation as First Line Treatment for Locally Advanced Cervical Cancer (INTERLACE) [pågående studie], 2012-2026), for pasienter med FIGO stadium IB2-IVA med 6 ukentlige kurer Paclitaxel/Carboplatin etterfulgt av standard radikal radiokjemoterapi versus standard radikal radiokjemoterapi. Inklusjonsmål (500 pas) forventes nådd i 2022 og resultater få år etter dette.
Adjuvant kjemoterapi etter radiokjemoterapi:
Det er så langt ikke vist klar nytteverdi av adjuvant kjemoterapi etter gjennomført kjemoradioterapi. Flere studier har vist sprikende resultater og med svakheter knyttet til design, rekruttering og økt toksisitet (Dueñas-González et al., 2011; Tangjitgamol et al., 2019). Flere oversiktsartikler som vurderte adjuvant kjemoterapi etter konkomitant kjemoradioterapi ved lokalavansert cervixcancer, konkluderte med at det ikke var evidens for å støtte adjuvant kjemoterapi- analyser (Horeweg et al., 2022; Tangjitgamol et al., 2014; Zhong et al., 2022). En randomisert fase III studie i regi av ANZGOG (Cisplatin and Radiation Therapy With or Without Carboplatin and Paclitaxel in Patients With Locally Advanced Cervical Cancer [pågående studie], 2012-2018), for pasienter med stad IB1 med lymfeknutemetastaser og IB2-IVA, sammenlignet 10–25 % av cervixcancer er adenokarsinomer, disse skal graderes. De fleste er av konvensjonell eller endometroid type, disse er HPV assosiert. Det finnes noen sjeldne subtyper av adenokarsinomer som ikke er assosiert med HPV; adenokarsinom av gastrisk type, klarcellet type og mesonefrisk type (Park, 2020) etterfulgt av 4 kurer med paclitaxel og karboplatin med standard kjemoradioterapi. Resultatene ble publisert i abstrakt-form i 2021 (Mileshkin et al., 2021) og viste ingen benefit av adjuvant kjemoterapi på overlevelse eller lokal kontroll, kun økt toksisitet.
Videre forskning på adjuvant behandling vil avklare nytteverdi på subgrupper som for eksempel adenocarcinom (Tang et al., 2012), persisterende HPV-DNA (Wang et al., 2019). Bruk av konkomitant og eller adjuvant bruk av sjekkpunkthemmer undersøkes også i aktuelle studier (Garcia-Duran et al., 2022; Mayadev et al., 2020; Nivolumab in Association With Radiotherapy and Cisplatin in Locally Advanced Cervical Cancers Followed by Adjuvant Nivolumab for up to 6 Months (NiCOL) [pågående studie], 2017-2022; Study of Chemoradiotherapy With or Without Pembrolizumab (MK-3475) For The Treatment of Locally Advanced Cervical Cancer (MK-3475-A18/KEYNOTE-A18/ENGOT-cx11/GOG-3047) [pågående studie], 2020-2024)
Behandling av metastatisk sykdom i primærsituasjon
Sist faglig oppdatert: 11202311.04.2023
Strålebehandling
Kapittelet omhandler palliativ strålebehandling mot bekkenet. Strålebehandling gitt i lindrende hensikt mot metastaser fra cervixcancer andre steder i kroppen omtales ikke her.
Når det gjelder palliativ strålebehandling vil individuelle vurderinger være viktige. Pasientens allmenntilstand, egne ønsker, grad av plager og forventet levetid vil kunne påvirke fraksjonering og behandlingslengde. For enkeltpasienter kan det være riktig å avstå fra behandling og heller satse på annen form for smertelindring.
Palliativ strålebehandling kan være aktuelt både ved primær lokalavansert cervixcancer der kurativ behandling ikke er aktuelt eller i residivsituasjon/tilkomne metastaser. Palliativ strålebehandling kan gis både innenfor og utenfor tidligere strålebehandlet område.
Ekstern strålebehandling vil som regel være foretrukken teknikk, men i enkelttilfeller kan brakyterapi være et alternativ. Brakyterapi vil ikke bli omtalt ytterligere.
For bløtvevssvulster i bekkenet vil smerte, blødning og evt. utflod være de vanligste indikasjonene for behandling, men også obstruksjon av tarm eller urinveier kan være indikasjoner. Målet med behandlingen er rask og vedvarende respons innenfor pasientens forventede livslengde.
Dokumentasjon på området bygger i stor grad på eldre, retrospektive serier med relativt få pasienter. Andre svakheter ved studiene er at de ikke har brukt pasient rapporterte utfall, tid til optimal symptomkontroll er ikke dokumentert, det er stort sett brukt total bekken bestråling med tofelts eller firefelts teknikk og ikke mer moderne teknikker der risikoorganer i større grad kan spares, oppfølging av pasientene har vært varierende og toksisitet av behandling er også registrert bare i varierende grad. Mange av studiene har inkludert pasienter med alle gynekologiske kreftformer, ikke bare cervixcancer. Anbefalingene bygger derfor både på foreliggende dokumentasjon, men også bred klinisk erfaring.
Flere studier har sett på 10 Gy x 1–3 med 3–4 ukers mellomrom mellom fraksjonene (Boulware et al., 1979; Halle et al., 1986; Onsrud et al., 2001; Spanos et al., 1987) Alle disse studiene viser partiell eller komplett respons på 70–100 % på blødning og 45–80 % på smerte. Det er dog antydet høy både tidlig og sen GI toksisitet. Mange har derfor brukt 8 Gy x 1 som engangsfraksjon de senere år, dette kan også repeteres ved behov. Det er i tillegg stor klinisk erfaring med fraksjoneringsregimer som 4 Gy x 5, 3 Gy x 10–13 beskrevet i flere oversiktsartikler (Kim et al., 2013; van Lonkhuijzen et al., 2011). Det foreligger ingen studier som sammenlikner disse fraksjoneringsregimene.
Ved blødningsproblematikk er det viktig å vurdere embolisering som et alternativ eller tillegg til strålebehandling (Yalvac et al., 2002).
Ved lengre forventet levetid (over 1 år) bør mer langvarig lokal kontroll tilstrebes. Klinisk erfaring tilsier da at man bør høyere opp i total stråledose, vanlige regimer er 1.8–2.0 Gy per fraksjon opp til totaldose på 50–60 Gy.
Det kan i enkelte situasjoner være vanskelig å skille mellom palliativ/lokal kontroll/kurativ intensjon. En lokalavansert cervixcancer med oligometastater (f.eks. singel supraklavikulær patologisk lymfeknute eller oligometastaser til lunge) kan tilsi en mer intensiv behandlingstilnærming. Ved patologisk supraklavikulær lymfeknute uten tegn til andre metastaser vil standard strålebehandling mot bekken/paraaortalfelt med konkomitant kjemoterapi og samtidig ekstern strålebehandling supraklavikulært til 60–70 Gy være et aktuelt behandlingsopplegg (Lee et al., 2012).
Medikamentell behandling ved metastatisk sykdom eller ved residiv
Medikamentell kreftbehandling er aktuelt ved metastatisk (FIGO IVb) eller residiverende sykdom som ikke egner seg for kurativ behandling som for eksempel bekkeneksenterasjon eller strålebehandling. Målet med behandlingen er å lindre symptomer og øke livskvaliteten.
Kombinasjonsbehandling med platinumbasert kjemoterapi og bevacizumab (15 mg/kg) inntil progresjon eller intolerabel toksisitet er anbefalt (Tewari et al., 2014). I denne GOG studien var det høyere risiko for progresjon i den gruppen som fikk ikke platinum basert kjemoterapi (Topotekan/Paclitaxel), men uten forskjell i total overlevelse. Behandling med Bevacizumab resulterte i flere grad ≥ 2 bivirkninger som hypertensjon (25 % vs 2 %), gastrointestinal fistulering (3 vs 0 %), urogenital fistulering (3 % vs <1 %), neutropeni (36 % vs 26 %) og tromboemboliske hendelser (8 % vs 2 %). For pasienter som tidligere er behandlet med cisplatin (inklusiv konkomitant i forbindelse med strålebehandling) anbefales karboplatin og paclitaxel.
Keynote 826 studien viste signifikant bedre overlevelse med overlevelse på 24 months på 50.4% vs 40.4% hos pasienter som fikk prembrolizumab i tillegg til platinumbasert kjemoterapi +/-bevacizumab (Colombo et al., 2021). Behandling med sjekkpunkthemmer kombinert med platinumbasert kjemoterapi +/-bevacizumab ligger til beslutning i Nye metoder (per 30. Nov 2022) (Sekretariatet for nye metoder, 2022b). På bakgrunn av Keynote 826 studien er det innvilget et gruppeunntak for pasienter med PD-L1 combined positive score =>1.
Ved progresjon på tidligere platinum-basert kombinasjonsbehandling eller om man ikke anser pasienten som kandidat for platinumbehandling men tenker at pasienten tåler kombinasjonsbehandling kan single stoff behandling være aktuell. EMPOWER/ENGOT Cx-9 studien viste signifikant bedre overlevelse på behandling med sjekkpunkthemmer semiplimab sammenliknet med single stoff, ikke platinum basert kjemoterap med total overlevelse 12.0 vs 8.5 måneder (HR .69, 95%CI: 0-56-0.84, p<0.001) (Tewari et al., 2022). Metoden ligger til vurdering i Nyemetoder (per 30. Nov 2022) og det er innvilget et gruppeunntak for bruk av cemiplimab eller pembrolizumab for pasienter med PD-L1 combined positive score =>1 (Sekretariatet for nye metoder, 2022a).
I forhold til behandling med Pembrolizumab må man være oppmerksom på bivirkninger som skyldes bruk av immunterapi, og som til dels kan være svært alvorlig. Se også e-håndbok fra OUS (esmo.org).
Ved progresjon på immunterapi eller hvor den ikke kan anvendes, kan annen type kjemoterapi vurderes (karboplatin singel, paklitaxel, topotecan eller gemcitabine gis, dog med lav forventet respons rate (Homesley et al., 2008) og usikker overlevelsesgevinst sammenliknet med støttende palliative tiltak. Disse pasientene bør vurderes for inklusjon i kliniske studier.
Spesielle grupper
Sist faglig oppdatert: 11202311.04.2023
Cervixcancer under graviditet
Det er viktig at vurdering av behandling er multidisiplinær, pasienten diskuteres med gynonkolog, stråleonkolog, hvis det ansees som indisert, radiolog, patolog og obstetrikker. Alle pasienter henvises til regionsykehus. Utredning skal ikke forsinkes av svangerskap og pasienter utredes etter samme prinsipper som ikke gravide med unntak av CT. De gis ikke kontrast ved MR.
Konisering kan foretas frem til uke 14. Lymfadenektomi kan utføres opp til graviditetsuke 20–22 beroende av livmors størrelse.
Behandlingen er avhengig av sykdomsstadie og når i graviditeten den oppdages.
Noen ganger kan fertilitetsbevarende kirurgi under tidlig graviditet være et alternativ.
For større svulster kan neoadjuvant kjemoterapi vurderes (cisplatin og paklitaxel). Neoadjuvant kjemoterapi kan trygt gis fra 2. trimester. Pasienten må følges tett under hele behandlingen.
Strålebehandling gis ikke på gravid uterus med mindre graviditeten ikke skal bevares.
Fødsel fremskyndes ikke til før uke 37 med mindre det er nødvendig pga tumorprogresjon. Hvis det foreligger tumor i cervix ved fødsel, bør kvinnen føde med sectio (Amant et al., 2014; Favero et al., 2010; Halaska et al., 2016a; Halaska et al., 2016b; Vercellino et al., 2014).
Neuroendokrine tumores
Utgjør under 2 % av alle cervixcancere. Kjennetegnes av aggressivt forløp med tidlig lymfatisk og hematogen spredning. 5 års overlevelse 36 %, median OS 22–25 mnd (Satoh et al., 2014).
Pasienter med NET svulster anses å ha systemisk sykdom fra stadium I fordi de har høyt metastaseringspotensiale og dårlig prognose selv i stadium I (Satoh et al., 2014).
Det er derfor indikasjon for cisplatinbasert kjemoterapi for alle pasienter uansett stadium. Pasienter med tidlig stadium sykdom (IA1, IA2 og IB1) bør utføre radikal hysterektomi med bekkenlymfadenektomi før oppstart kjemoterapi.
Det anbefales 6 kurer cisplatin pluss etoposid totalt (cisplatin 60 mg/m2, etoposid 100 mg/m2): for pasienter med tidlig stadium adjuvant.
For pasienter med lokalavansert sykdom (stadium IB2-IVA) er multimodal tilnærming indisert. Kjemoterapi med cisplatin/etoposid eventuelt etterfult av stråling (45–50 GY ekstern og +/- brakyterapi). Reponsen evalueres etter hver kur med kjemoterapi. Vurdering av strålebehandling vil være avhengig av respons på kjemoterapi og sykdomsutbredelsen.
Pasienter med metastatisk sykdom (IVB) behandles primært med kjemoterapi cisplatin 60 mg/m2 og etoposid 120 mg/m2 totalt 4–6 kurer.
For pasienter med Kreatinin clearence <60 ml/min anbefales Karboplatin/Etoposid (Frumovitz et al., 2017; Salvo et al., 2019; Satoh et al., 2014).
Stumpcancer
Cervix stumpcancer behandles på samme måte som øvrig cervixcancer.
Cervixcancer oppdaget etter hysterektomi på benign indikasjon
Utredning inkludert kartlegging av metastaser med CT og gynekologisk undersøkelse i narkose samt MR dersom tvil om radikal kirurgi. Pasienten bør diskuteres i MDT.
Behandlingprinnsippene er de samme som for øvrig cervix cancer.
Glandeltoilette utføres med mindre det uansett er indikasjon for strålebehandling eller dersom det foreligger stadium IAI.
Oppfølging og etterkontroller etter avsluttet kurativt rettet behandling
Sist faglig oppdatert: 11202311.04.2023
Innledning
Verdien av rutinemessig oppfølging etter avsluttet kurativ behandling er omdiskutert pga. manglende dokumentert overlevelsesgevinst (Lanceley et al., 2013; Salani et al., 2011; Zanagnolo et al., 2009) . Samtidig er fokus på støttetiltak i forhold til rehabilitering og seneffekter et viktig område som hos deler av pasientgruppen krever en systematisk tilnærming (Westin et al., 2016).
Responsevaluering
Pasienter som har gjennomgått radikal radiokjemoterapi ved lokoregional sykdom:
Formål med responsevaluering er å avklare om tumor er i komplett remisjon eller om det foreligger resttumor.
Responsevaluering gjøres ved behandlende institusjon, med involvering av behandlende leger, ca 4 mnd. etter avsluttet radiokjemoterapi. Det anbefales (Bourgioti et al., 2016; Cibula et al., 2018b).
- Klinisk undersøkelse inkludert gynekologisk undersøkelse
- MR bekken (Manganaro et al., 2021)
- CT thorax/abdomen/bekken
- Gjennomgang av undersøkelsesresultat i MDT-møte for endelig beslutning om videre strategi bør gjøres dersom tvil foreligger.
- Ved komplett remisjon går pasienten over i oppfølgingsprogram.
- Ved tvil følges pasienten videre med ny evaluering etter 2-3 mndr
- Ny MR for revurdering av cervixtumor
- CT/PET-CT for revurdering av metastaser
- Ved resttumor, histologisk verifisert, må pasienten vurderes for salvage kirurgi.
Oppfølging etter endelig responsevaluering
Formål med oppfølgingsprogram er å avdekke residiv av sykdom samt å avdekke og behandle evt. seneffekter etter sykdom og behandling. Man mangler randomiserte, prospektive studier for å kunne avgjøre den optimale oppfølgingsstrategi (Elit et al., 2009; Lanceley et al., 2013; Zola et al., 2015).
Oppfølging bør individualiseres etter risiko for tilbakefall hvor det vektlegges om man har en kurativ behandlingsmulighet og utfra hvilken behandling pasienten har fått.
De fleste residiv er symptomatiske, og median tid til residiv varierer i litteraturen fra 7–36 mnd. (Elit et al., 2009; Salani et al., 2011). Data fra norsk residivstudie publisert i 2017, viste at 66 % av pasienter som fikk residiv, fikk sitt første residiv innen 2 år og 85 % innen 3 år (Vistad et al., 2017). Studien innhold dog kun 58 pasienter med residiv av cervixcancer, og tallene må derfor tolkes med noe forsiktighet. Samtidig er tallene godt overensstemt med funn i øvrige studier (Elit et al., 2009; Salani et al., 2011). Oppfølging anbefales på bakgrunn av dette tettere de 2–3 første årene.
Pasienter som har gjennomgått kurativ kirurgisk behandling av lokalisert sykdom
Pasienter som primært bare har fått kirurgisk behandling følges generelt med klinisk undersøkelse. Lav terskel for biopsi av suspekte lesjoner i vagina.
Kontrollopplegg 1A1
Det finnes ingen dokumentasjon på verdien av kontroller. Risiko for tilbakefall etter behandling for stadium IA1 sykdom er lav (Taarnhøj et al., 2018). Pasienter som har blitt behandlet med konisering bør følges med kolposkopi, cytologi og HPV test etter 6 måneder. Genotypeinformasjon er nødvendig for å vurdere risiko for persisterende sykdom ved 6 mnd kontrollen. Dersom ikke genotypeinformasjon er tilgjengelig før konisering (fra screeningprøve) må cervixkon genotypes med PCR teknologi.
Ved negativ HPV og cytologi etter 6 mndr, anbefales kontroll med HPV og cytologi hos fastlege etter 6 mnd. Dersom også denne er negativ, HPV og cytologi hvert 3. år, livslang oppfølging.
Ved pos HPV og normal cytologi etter 6 mndr og samme genotype, bør det utføres kolposkopi og biopsi.
Ved pos HPV og ny genotype, kontroll med HPV og cytologi etter 6 mndr. Videre kontroller hver 6. måned i 2 år, deretter årlige kontroller i 3 år. Ved persisterende genotype etter 12 mnd, kolposkopi og biopsi.
Suspekte lesjoner bør biopseres.
Stadium IA2 og over kontrolleres med gynekologisk undersøkelse og vaginal ultralyd hver 3. måned for 2 år, deretter hver 6. måned i 3 år. Nytten av cytologi fra vaginaltopp er omdiskutert. Suspekte lesjoner bør biopseres
Pasienter som har gjennomgått radikal radiokjemoterapi ved lokoregional sykdom
Pasienter med lokalavansert primærsykdom har risiko for residiv utenfor strålefeltet. Verdien av rutinemessig radiologisk undersøkelse er omdiskutert (Zanagnolo et al., 2009). 9Samtidig har retrospektive undersøkelser vist at prognose ved asymptomatiske residiv er bedre enn ved symptomatiske residiv (Bodurka-Bevers et al., 2000; Choi et al., 2009; Chou et al., 2001; Zola et al., 2007). Studier på isolerte paraaortale glandelresidiv viser relativt god overlevelse på > 50 % ved salvage radioterapi evt. kombinert med kjemoterapi (Chou et al., 2001; Niibe et al., 2006b). Debulkende kirurgi forut er omdiskutert med usikker gevinst (Kupets et al., 2002). Oppfølging med PET har blitt lansert som en mulig modalitet for oppdagelse av asymptomatiske residiv (Brooks et al., 2009; Chung et al., 2006; Grigsby, 2007; Zola et al., 2007).
Utforming av kontrollopplegget etter endelig responsevaluering for pasienter som har gjennomgått radikal radiokjemoterapi ved lokoregional sykdom
Kontrollopplegget etter komplett remisjon bør ta hensyn til initial sykdomsutbredelse og hvilken behandling som er gitt. Et isolert paraaortalt residiv hos pasienten som tidligere ikke er bestrålt paraaortalt, kan behandles med radikalt radiokjemoterapi med potensiell kurativ intensjon. Isolerte fjernmetastaser med andre lokalisasjoner, vil også potensielt sett kunne behandles radikalt, men dokumentasjon her er mangelfull og basert på mindre retrospektive studier (Anraku et al., 2004; Lim et al., 2010). Radikal metastasebehandling i form av metastasekirurgi, stereotaksi eller radiofrekvensablasjon vil først og fremst vurderes dersom det oppstår et isolert residiv etter en lengre residivfri periode etter primærbehandling da dette taler for en mindre aggressiv sykdomsbiologi.
Det er etter hvert innenfor flere andre tumorgrupper blitt en dreining mot risikostratifisert oppfølging i nasjonale handlingsprogrammer og at det utarbeides en individuelt basert oppfølgingsplan for pasientene.
I den norske studien for oppfølging etter gynekologisk kreft, LETSGO, , er risikostratifisering i tillegg til en rekke andre tiltak tatt i bruk for å skaffe kunnskap som kan gi bedre oppfølging etter gynekologisk kreftbehandling. Studien er lukket for inklusjon, men resultat er foreløpig ikke gjort opp.
Per i dag anbefales som standard klinisk kontroll, gynekologisk undersøkelse og vaginal ultralyd samt vurdering av eventuelle seneffekter hver 3. mnd. de første 2 år, deretter hver 6. mnd. de neste 3 årene. Etter 5 år er verdien av fortsatt kontroll diskutabel, og kan evt. foretas hos egen lege etter individuell vurdering. Dersom mye seneffekter, bør oppfølging tilpasses.
- Ikke god dokumentasjon på overlevelses gevinst ved rutinemessig radiologisk oppfølging, men bør vurderes dersom man ut fra en total risikovurdering og hvorvidt tidlig avdekning av metastaser vil kunne få behandlingsmessig konsekvens. For de fleste pasienter behandlet for lokalavansert sykdom vil CT thorax/abdomen/bekken eller PET CT etter ca 12 og 24 mnd kunne være et rimelig oppsett ut fra tidsaspekt for funn i residivstudier.
- Hvorvidt pasienten følges videre av onkolog/gyn.onkolog eller om pasienten følges av gynekolog ved sitt lokale sykehus, avgjøres individuelt utfra hvilket symptombilde pasienten utvikler og hvilken kompetanse som fins lokalt.
- Det bør ikke tas cervixcytologi da stråleinduserte forandringer gjør tolkning av cytologi vanskelig. Dersom klinisk mistanke om patologi, bør det i så fall tas biopsi.
- Pasient og pårørende bør gis grundig informasjon om:
- Symptomer som kan være tegn på residiv og om tidlig kontakt med fremskyndelse av kontroll
- Seneffekter
Seneffekter etter sykdom og behandling
Sist faglig oppdatert: 11202311.04.2023
Seneffekter etter kirurgisk behandling
Risiko for skader etter kirurgisk behandling vil variere mye, ikke minst i forhold til hvilket inngrep som er gjennomført. Ved siden av vanlige postoperative komplikasjoner bør man være oppmerksom på blæretømningsplager og lymfødemproblematikk ved radikal kirurgi samt klimakterielle og seksuelle plager.
Se omfattende beskrivelse av seneffekter etter strålebehandling vedr psykososiale momenter (se neste pkt).
Seneffekter etter radiokjemoterapi
Seneffekter kan ofte ha et sammensatt preg som krever tverrfaglig tilnærming. Begrepet «Pelvic radiation disease» belyser kompleksiteten, og det er beskrevet opptil 25 symptomer samtidig (Andreyev et al., 2010).
Komorbiditet som inflammatorisk tarmsykdom, kollagen vaskulær sykdom, diabetes mellitus og arteriosklerose samt tidligere kirurgi i abdomen/bekken, gir økt risiko for å utvikle seneffekter. Seneffekter kan oppstå etter noen måneder, men andre ganger først flere år etter sykdom og behandling. Plagene kan ofte være kroniske, men kan variere i intensitet og uttrykk over tid (Vittrup et al., 2021).
Tarmfunksjonen
Data fra den prospektive multisenterstudien EMBRACE 1 har også gitt informasjon om langtidseffekt på tarm etter radikal radiokjemoterapi. Etter henholdsvis 3 og 5 år var insidens på tarmmorbiditet grad 3-4 på 5.0 % og 5,9 %. Grad 1-2 morbiditet hos 28-33 %. Diare, flatulens inkontinens oftest rapportert (Jensen et al., 2018).
Kronisk diare
Årsak ofte sammensatt. Symptomatisk behandling uavhengig av etiologi vil ha til formål å normalisere avføringskonsistens. Det kan benyttes:
- Romoppfyllende preparater som øker fekalmassen. Effekten er avhengig av tilstrekkelig væskeinntak (resorberende effekt) og kan komme først etter flere dager.
- Vi-Siblin 1–3 doser daglig.
- Stoppende medikasjon:
- Loperamid 1–2 tabletter, maks 8 pr døgn.
- Ved manglende effekt: Opiumsdråper 5–10 dråper x 2–3
Ved mer omfattende problem bør diare utredes nærmere for behandling rettet mot mulige årsak. Kronisk diare kan være sekundært til malabsorpsjon av karbohydrat eller gallesalter, bakteriell overvekst eller pankreasenzym insuffisiens (Andreyev et al., 2013; Andreyev et al., 2012; Andreyev et al., 2015; Ferreira et al., 2014; van de Wetering et al., 2016). Utredning og tiltak bør da gjøres i samarbeid med gastroenterolog og ernæringsfysiolog. Ved mistanke om malabsorpsjon bør vitamin B12, jern, kalsium og vitamin D kontrolleres og ev. korrigeres ved mangel (Vistad et al., 2009).
Kolikksmerter
Kan være utløst av næringsmiddelintoleranse eller dysmotilitet i tarm pga. fibrose som forårsaker stenoser og adheranser. Dette kan gi subileus/ileus hvor kirurgisk behandling og evt. stomi kan bli nødvendig.
Stråleindusert proktitt
Kronisk ischemi kan gi rektalblødning. Pasienter med persisterende rektalblødning bør colo-/sigmoideoskoperes for å utelukke sykdomsresidiv eller ny primærtumor samt for å avdekke omfang og alvorlighetsgrad. Biopsi bør unngås så fremst man ikke mistenker ny malign prosess da dette øker risiko for fistulering pga. nedsatt tilheling i bestrålt område (Andreyev et al., 2012; van de Wetering et al., 2016; Vanneste et al., 2015; Viswanathan et al., 2014). Sukralfat klyster, metronidazolkur, endoskopisk koagulasjonsbehandling eller hyperbar oksygenbehandling kan være mulig behandling.
Tømningsbesvær som urge, anal inkontinens og ufullstendig tarmtømming er funksjonelle tarmproblemer som kan gi store begrensninger i livsutfoldelse. Konservative tiltak som nevnt ovenfor som gir normalisering av avføringskonsistens samt bekkenbunnstrening, anal plug, biofeedback og irrigasjon vil kunne bidra til bedring. Mer informasjon fins i «Faglige retningslinjer for utredning og konservativ behandling av anorektale funksjonsforstyrrelser» utarbeidet av Norsk gruppe for konservativ behandling av anorektale funksjonsforstyrrelser.
Sakral nervestimulering kan vurderes dersom man ikke kommer til målet ved konservative tiltak ved fekal inkontinens (Maeda et al., 2010), men sikker dokumentasjon på effekt mangler. Ved uttalte plager hvor man ikke kommer til målet med andre tiltak, kan sigmoideostomi være en løsning.
Blærefunksjonen
Normal vannlatning forutsetter et komplekst samspill mellom urinblære, urinrør, nerver i bekkenet og sentralnervesystemet. Utredning og tiltak bør gjøres i samarbeid med urolog, uroterapeut og/eller gynekolog. Dysfunksjon i avløp med svekket lukkemekansime vil kunne gi stressinkontinens, som kjennetegnes av lekkasje ved økt buktrykk som hoste, nys og tunge løft. Overaktiv urinblære kjennetegnes av brå og unormalt sterk vannlatningstrang (urgency), hyppig vannlatning dag og natt og er evt. ledsaget av urininkontinens. Stråleindusert fibrose kan gi stivere og mindre elastisk urinblærevegg, såkalt nedsatt compliance. Dette kan resultere i nedsatt blærekapasitet og inkontinens. Det kan oppstå avløpshinder ved stenosedannelse i ureter eller urethra (Fokdal et al., 2019). Blæreslimhinnen kan bli atrofisk og lettblødende. Muskulære endringer kan gi smertefulle blærespasmer. Data fra den tidligere omtalte prospektive multisenterstudien på EMBRACE, har også gitt informasjon om seneffekter fra urinveiene etter radikal radiokjemoterapi. Vanligste rapporterte symptomer grad 2-4 var økt frekvens/urgency 4,3 %, inkontinens 5,0 % og cystitt 1,7 % (Fokdal et al., 2018).
Stressinkontinens kan behandles konservativt med bekkenbunnstrening, elektrostimulering eller mekaniske hjelpemidler som vaginaltampong eller inkontinensbue eller ved kirurgisk behandling med slyngeoperasjon. Ved overaktiv blære og urgeinkontinens kan blæretrening og urologisk spasmolytikum ha effekt. Ved utilfredsstillende effekt, kan cystoskopisk injeksjon av botulinumtoksin for å dempe muskelaktiviten eller sakral nervestimulering, vurderes. Utstyr til inkontinens rekvireres som medisinsk forbruksmateriell med refusjon jfr. blåreseptforskriften § 5 punkt 1. Behandling av stråleindusert hemorragisk cystitt er først og fremst symptomatisk med blæreskylling, evakuering av blodkoagler og koagulasjon via cystoskop. Instillasjon av hyaluronsyre eller kondroitinsulfat kan også forsøkes ved kronisk cystitt på bakgrunn av skade av blæreslimhinnens beskyttende glykosaminoglykan (GAG) lag (Liem et al., 2015).
Ved urinretensjon bør pasienten henvises for opplæring i selvkateterisering. Ved mistanke om striktur eller fistler, bør pasienten henvises for kirurgisk intervensjon. Noen pasienter vil pga. fibrose i ureter ha et vedvarende behov for JJ-stent.
Hyperbar oksygenbehandling kan være en behandlingsmulighet ved stråleindusert proktitt, cystitt og refraktær smerter (Bennett et al., 2016; Clarke et al., 2008; Rud et al., 2009), men effekt er omdiskutert (Glover et al., 2016). Yrkesmedisinsk avdeling ved Haukeland universitetssykehus er nasjonal behandlingstjeneste for elektiv hyperbar oksygenbehandling (HBO). Stråleproktitt, strålecystitt og osteoradionekrose inngår som elektive indikasjoner. Resultat fra en skandinavisk randomisert og kontrollert studie på strålecystitt behandlet med hyperbar oksygenbehandling, RICH-ART, ble publisert i Lancet i 2019, ga støtte for effekt av HBO ved stråleindusert cystitt (Oscarsson et al., 2019).
Genitalia og seksualitet
Denne pasientgruppen har høy risiko for utvikling av problemer knyttet til seksualfunksjonen. Manglende interesse, nedsatt lubrikasjon og følsomhet i vagina, småblødninger, dyspareuni, trang og forkortet vagina kan medføre seksuelle og vaginale problemer som kompromitterer seksuell aktivitet og tilfredsstillelse (Jensen et al., 2003; Kirchheiner et al., 2016). Seksuallivet bør gjenopptas så snart som pasienten føler seg klar for det, imidlertid kan dette for en del pasienter være utfordrende på bakgrunn av både fysiske og psykiske endringer. Bistand fra sexolog kan være indisert.
Vaginal dilatator anbefales for å motvirke vaginale synekier (Law et al., 2015; Miles et al., 2014). Seksualtekniske hjelpemidler kan bestilles av lege på rekvisisjon til NAV (Seksualtekniske hjelpemidler).
Strålingens effekt på gjenværende ovarier utslokker hormonproduksjon. Hormonsubstitusjon anbefales kvinner fram til normal menopausealder dersom det ikke foreligger kontraindikasjon. Så fremst uterus ikke er fjernet, anbefales kombinasjonspreparat med både østrogen og progesteron da ensidig østrogenstimulering av endometriet gir økt risiko for utvikling av endometriecancer. Det anbefales progesteron og østrogen i faste kombinasjoner. Sekvens preparater øker risiko for hematometra og smerter ved cervix stenose som mange av disse pasienter utvikler. Plaster kan være fordel med tanke på «first-pass-metabolismen». Refusjon omfattes av blåreseptordningen. Lokalbehandling med østrogen vagitorier/krem kan dempe lokale plager knyttet til atrofiske slimhinner. Kan være aktuelt alene hos eldre kvinner, men også i kombinasjon med systemisk hormonsubstitusjon hos yngre pasienter da fibrose og atrofi vaginalt kan medføre utilstrekkelig lokal effekt av systemisk behandling. Lokal østrogenbehandling omfattes ikke av refusjonsordning. Hormonfri vaginalgel eller vagitorier for behandling av tørrhet i skjeden fins og kan være aktuelle for pasienter hvor østrogenbehandling ikke er ønskelig.
Enkelte kvinner opplever symptomer på testoteronmangel etter medisinsk eller kirurgisk kastrasjon. Dokumentasjon er sparsom, men det er rapportert klinisk gevinst (Davis et al., 2008; Huang et al., 2014). Topikale testosteronprodukter kan forsøkes, men viktig å bruke lav dose (10–15 % av mannlig dose) i samarbeid med gynekolog. Nærmere omtale i nasjonal veileder i gynekologi 2021.En sjelden gang kan kreftsykdommen eller behandlingen medføre gynekologiske fistler. Behandlingstilbudet av slike fistler er sentralisert i Norge til Nasjonal behandlingstjeneste for gynekologiske fistler ved Seksjon for generell gynekologi ved Kvinneklinikken på Haukeland universitetssykehus.
Muskel/skjelett
Smerter i bekkenet etter strålebehandling er ikke uvanlig. Strålebehandlingen kan resultere i mikrofrakturer i bekkenskjelett (Baxter et al., 2005; Higham et al., 2015; Mehmood et al., 2014; Ramlov et al., 2017b) samt fibroseutvikling i bekkenmuskulatur og bindevev. MR undersøkelse av bekkenskjelett kan avdekke mikrofraturer. Mulig effekt av HBO (hyperbar oksygenbehandling) er beskrevet (Rud et al., 2009). Smertebildet ofte kompleks. Vurdering og behandling av fysioterapeut/psykomotorisk fysioterapeut kan være nyttig for mange i denne gruppen.
Lymfødem
Pasienter som har fått utført kirurgisk fjerning av bekkenglandler eller fått strålebehandling mot bekkenglandler, har økt risiko for utvikling av lymfødem (Najjari Jamal et al., 2018) Dette gjelder særlig for pasienter som har gjennomgått både kirurgi og strålebehandling (Biglia et al., 2017). Estimater etter 3 og 5 år fra EMBRCA studien hvor pasienter har gjennomgått radikal radiokjemoterapi viste hhv. 27 % og 31 % G ≥ 1 lymfødem, 6,1 % og 6,6 % G ≥ 2, og 0,5 % og 0,5 % G ≥ 3. Pasienter som utvikler lymfødem skal henvises fysioterapeut med kompetanse på lymfødembehandling.
Fatigue
Fatigue er en belastende seneffekt av mer generell karakter som dessverre hyppig rammer denne gruppen (Smet et al., 2018; Steen et al., 2017; Vistad et al., 2007). For nærmere informasjon rundt fatigue, vises til publikasjonen fra Helsedirektoratet 2020: Seneffekter etter kreftbehandling. Faglige råd.
Kjemoterapi indusert nevrotoksisitet
Nevrotoksisitet er en velkjent bivirkning av Cisplatin som kan gi seneffekter i form av vedvarende ototoksisitet med hørselssvekkelse og tinnitus og perifer polynevropati i form av sensorisk perifer nevropati og Raynauds fenomen (Matsuoka et al., 2018)
Residiv
Sist faglig oppdatert: 11202311.04.2023
Utredning
Utbredelse av recidiv bør kartlegges med relevant billeddiagnostikk og verifiseres med histologi
Residiv behandling
Det er viktig å kartlegge om det foreligger kurativt potensiale.
Bekkenresidiv
Isolert, sentralt bekkenresidiv uten affeksjon av bekkenveggen
Bekkenresidiv hos opererte, ikke tidligere strålebehandlete
Ved isolert sentralt bekkenresidiv hos pasienter som tidligere ikke er strålebehandlet i bekkenregionen, anbefales definitiv radiokjemoterapi. Bør kombineres med bildeveiledet adaptiv brakyterapi så fremst dette er mulig. Ekstern boost som likeverdig erstatning for brakyyterapi er ikke anbefalt. For små overfladiske lesjoner i vagina, dvs. < 5 mm tykkelse, kan vaginal sylinder anvendes, men for øvrig kreves kombinert intracavitær-interstitiell teknikk. For teknikk og doser, vises til prinsipper ved primær radiokjemoterapi.
Bekkenresidiv i tidligere strålebehandlet område
Sentrale residiver
Pasienter med sentrale residiv i tidligere strålebehandlet område bør vurderes for bekkeneksenterasjon. Disse operasjoner er sentralisert til Avdelingen for gynekologisk kreft ved OUS, Radiumhospitalet og pasienten bør henvises «Nasjonal behandlingstjeneste for avansert bekkeneksentrasjon ved gynekologisk kreft» for vurdering. Bekkeneksenterasjon er ett mutilerende inngrep med relativ stor risiko for komplikasjoner, derfor må pasienten vurderes nøye med tanke på utbredelse av tumor samt fysisk almenntilstand og komorbiditet før beslutningen tas. Operasjonen innebærer at det fjernes livmor og skjede og både rektum og anus samt blære og urethra ved en total bekkeneksenterasjon og pasienten for lagt ut en kolostomi og en urostomi. Noen ganger kan blæren eller rektum spares. 5 års overlevelse etter bekkeneksenterasjon for tilbakefall av livmorhalskreft er ca 50 %.
Residiv som affiserer laterale bekkenvegg
Bekkenresidiv hos opererte, ikke tidligere strålebehandlet
Ved isolert bekkenveggsresidiv hos pasienter som tidligere ikke er strålebehandlet i bekkenregionen, anbefales definitiv radiokjemoterapi. Hvor høy dose som er ønskelig og mulig å gi avhenger av tumors størrelse og beliggenhet. Ofte kan det være umulig å komme opp i tilstrekkelig dose for kurasjon.
Bekkenveggskirurgi kan hos utvalgte pasienter vurderes i tilfeller hvor tumor ikke invaderer dypt i bekkenveggen.
Bekkenresidiv i tidligere kurativt strålebehandlet område
Individuell vurdering
Residiv utenfor bekkenet
Isolerte lymfeknute residiver
Isolerte paraaortale residiver
Litteraturen er begrenset, men en insidens på 2–5 % etter primær radiokjemoterapi er rapportert (Hong et al., 2004; Nomden et al., 2019; Tan et al., 2019). Pasienter med lymfeknutemetastaser ved primærdiagnose har økt risiko for paraortalt residiv (Niibe et al., 2006a).
Ved asymptomatiske paraaortale residiver ser det ut til at kjemoradioterapi med totaldoser på minst 50–60 Gy kan gi langtidsoverlevelse hos et signifikant antall pasienter (Hong et al., 2004; Huang et al., 2008; Singh et al., 2005).
Dersom pasienten ikke tidligere har fått strålebehanding mot paraaortalregionen, anbefales strålebehandling som førstevalg ved isolerte paraaortale residiver.
Tidligere gitt behandling må det alltid vurderes ved supplerende paraaortalbestråling. IMRT/VMAT plan med simultanintegrert boost anbefales.
Det skal planlegges med en overlapp med tidligere gitt behandling. Overlappen bør være minst 1 cm i lengderetning for å sikre full dose i dette området ved rebestråling. Adekvat dose i skjøt mot tidligere bekken felt og fokus på å unngå høye doser i tidligere bestrålt avsnitt av medulla vektlegges.
Isolerte supraklaviculære residiver
Individuell vurdering. Strålebehandling eventuelt kirurgi.
…
Andre lokalisasjoner
Behandling av isolerte organ metastaser (lunge, lever etc) bør diskuteres tverrfaglig. Radiofrekvens ablasjon, stereotaktisk strålebehandling eller metastasekirurgi kan overveies ut fra en helthetsvurdering.
Palliativ behandling
Sist faglig oppdatert: 11202311.04.2023
Kjemoterapi
Viser til avsnitt "Kjemoterapi" i kapittel Behandling i primærsituasjonen.
Strålebehandling
Viser til avsnitt "Strålebehandling" i kapittel Behandling i primærsituasjonen.
Re-bestråling
Når rebestråling vurderes må man ta hensyn til hvilke stråledoser som er gitt i det aktuelle området, grad av forventet reparasjon, pasientens effekt og bivirkninger av tidligere gitt strålebehandling og hvilke risikoorganer som er mest utsatt. Individuelle vurderinger for hver enkelt pasient bør diskuteres i team med lege, fysiker og stråleterapeut.
Det er sannsynlig at mer moderne stråleteknikker som IMRT/VMAT vil redusere normalvevstoksisiteten og dermed er å foretrekke ved rebestråling. Dette gjelder også ved palliativ behandling med lave stråledoser. Det er imidlertid lite dokumentasjon på dette området. Ved kliniske tegn på respons under fraksjonert rebestråling burde man ha lav terskel for replanlegging for å redusere det bestrålte volumet.
Hvis målet er symptomlindring vil det som regel være mulig å gi 8 Gy x 1 nesten uansett tidligere avgitt dose (Boulware et al., 1979). Mer fraksjonert behandling kan også være mulig så lenge totaldose til risikoorganer er akseptable.
Ved mål om lokal kontroll i tidligere bestrålt område må man høyere opp i dose. Hyperfraksjonert akselerert behandling med 1,5 Gy gitt to ganger daglig opp til totaldose på 30–45 Gy er vel dokumentert som rebestrålingsprotokoll for rectumcancer. Dette har vist akseptabel lokal kontroll og toksisitet (Das et al., 2010; Guren et al., 2014; Tao et al., 2017). Man må anta at dette også kan være en aktuell protokoll for rebestråling av cervixcancer.
Andre rebestrålingsregimer benyttet er 3 Gy x 7 eller 2 Gy x 15, alt må vurderes ut fra normalvevstoleranse og tidligere gitt behandling.
Stereotaktisk strålebehandling (SBRT) er også rapportert å være en mulig rebestrålingsstrategi (Guckenberger et al., 2010).
Protoner
Per i dag finnes det ingen etablert indikasjon for strålebehandling med protoner ved primær cervixcancer. Ved residiv i tidligere bestrålt område, hvor det er aktuelt med rebestråling, kan det vurderes å henvise pasienten for protonbehandling. Fordelen med protoner er potensialet til å gi høy dose til tumor samtidig som man sparer normalvevet. Noe som kan gi mindre bivirkninger både på kort og lang sikt. Doseplanstudier har vist at behandling med protoner gir lavere dose til tynntarm, rektum, blære og beinmarg sammenlignet med fotoner (Marnitz et al., 2015; van de Sande et al., 2016; Verma et al., 2016). For å finne ut om dette har klinisk relevans er det viktig å inkludere aktuelle pasienter i kliniske studier.
Det er vedtatt at Norge skal få to protonsentre, et i Oslo og et i Bergen. Sentrene skal etter planen være klare til å behandle pasienter i 2024. Fram til da må aktuelle pasienter henvises til utlandet.
Premaligne lidelser i cervix uteri
Innledning
Sist faglig oppdatert: 28202128.06.2021
ICD-10 skiller ikke mellom de to hovedtypene premalignitet (carcinoma in situ) i plateepitel og sylinderepitel, som er forstadier for henholdsvis plateepitelcarcinom og adenocarcinom i cervix. Cervical intraepitelial neoplasi (CIN) brukes synonymt med plateepiteldysplasi.
CIN1(LSIL) vurderes som lavgradig, CIN2 og CIN3(HSIL) og Adenocarcinoma in situ (AIS/ACIS) som høygradig dysplasi. CIN2+ omfatter høygradig dysplasi og karsinom. Tiden fra AIS oppdages til utvikling av adenokarsinom kan være kortere, se anbefalinger i avsnitt "Adenocarcinoma in situ" i kapittel Diagnostikk. Ved blandingsdiagnose CIN/ AIS, skal retningslinjer for AIS følges.
N87.0 | CIN 1 – Lett dysplasi | |
N87.1 | CIN 2 – Moderat dysplasi | |
D06 | CIN 3 – Grov dysplasi eller carcinoma in situ | |
| D06.0 | CIN 3 i endocervix (inkl. AIS) |
| D06.1 | CIN 3 på ektocervix (portio) |
| D06.9 | CIN 3 uspesifisert del av livmorhals |
(Normal) | Normal morfologi |
|---|---|
ASCUS* | Irregulært plateepitel av usikker betydning (undetermined significans) |
ASC-H* | Atypisk plateepitel der høygradige celleforandringer i plateepitelet ikke kan utelukkes |
AGUS* | Irregulært sylinderepitel av usikker opprinnelse eller betydning |
LSIL* | Lavgradige intraepiteliale forandringer i plateepitel |
HSIL* | Høygradige intraepiteliale forandringer i plateepitel |
AIS/ACIS* | Høygradige intraepiteliale forandringer i sylinderepitel/Adenokarsinom in situ |
Cancer | Invasivt karsinom |
* Se ordforklaring i kapittelet om forkortelser/ordforklaringer
Forekomst
Kreftregisteret publiserer årsrapporter med en oversikt over blant annet antall livmorhalsprøver, dekningsgrad, oppfølging og behandling for celleforandringer.
Årsrapport Livmorhalsprogrammet.
Etiologi og risikofaktorer
- Humant Papilloma Virus (HPV) er kausalfaktor for utvikling av cervixkarsinom og er påvist i > 99 % av tilfellene. Infeksjon med onkogene HPV-typer er nødvendig for utvikling av CIN 2+ og AIS (Bosch et al., 2013; IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, 2012; Muñoz et al., 2003; Walboomers et al., 1999).
- Høyrisikotypene 16, 18, 31, 33, 45, 52 og 58, er påvist over 80–90 % av CIN 2+ (Arbyn et al., 2014; Smith et al., 2007; Tjalma et al., 2013).
- Livstidsrisiko for cervikal HPV-infeksjon hos seksuelt aktive er opp til 80 % (Stanley, 2010).
- De fleste genitale HPV infeksjoner er asymptomatiske og går i spontan klinisk remisjon innen 2 år (90 %) (Gravitt, 2011).
- Persisterende HPV-infeksjon og utrykk av onkoproteiner er forutsetning for utvikling av CIN 2+, og risikoen øker med infeksjonens varighet (Schiffman et al., 2010) .
- Ved påviste CIN forandringer er risikoen for karsinomutvikling angitt under «Forløp/Prognose».
- Samtidig infeksjon med flere onkogene HPV-genotyper øker risikoen for CIN 2+ (Schiffman et al., 2010).
- HPV-genotype 16 er hyppigst forekommende i CIN2+ (Stanley, 2010).
- Prevalensen av onkogene HPV-infeksjoner varierer med alder (Castle et al., 2005). HPV-infeksjoner er hyppigst forekommende hos unge kvinner. En studie viser at ca 50 % av norske kvinner mellom 18 og 26 år tester positivt for HPV (Dillner et al., 2018).
Risikogruppe | HPV-genotype |
|---|---|
Høy | 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 |
Sannsynlig høy | 68 |
Mulig høy | 26, 53, 66, 67, 69, 70, 73, 82 |
Lav | 6, 11, 40, 42, 43, 44, 54, 61, 72, 81 |
Risikofaktorer for utvikling av CIN2+
- Røyking (Gadducci et al., 2011; Kjellberg et al., 2000; Vaccarella et al., 2008).
- Nedsatt immunforsvar (HIV-infeksjon/AIDS, SLE, immunsuppresjon) (Gadducci et al., 2011; Jordan et al., 2009).
- Tidlig seksuell debutalder og antall partnere (Dillner et al., 1996).
- Langvarig bruk av p-piller (Gadducci et al., 2011; Kjellberg et al., 2000; Smith et al., 2003).
- Samtidig infeksjon med Chlamydia trachomatis og andre seksuelt overførbare infeksjoner (Silins et al., 2005).
- Arvelige faktorer som HLA-variasjon kan ha betydning for utvikling av CIN2+ (de Araujo Souza et al., 2009; Leo et al., 2017).
- Annen HPV-relatert pre-cancer eller cancer (Forman et al., 2012).
Forløp/prognose
- Det er få studier som omfatter naturlig forløp av CIN. En studie har vist at 31 % av CIN3 som ikke ble behandlet progredierte til cancer i løpet av 30 år (McCredie et al., 2008). En betydelig andel CIN går i spontan regress (Castle et al., 2009; Tainio et al., 2018). Det finnes per i dag ingen metode for å skille mellom dysplasier som går i regress og dysplasier som vil kunne progrediere til karsinom.
- Behov for re-behandling etter konisering er oppgitt å være ca 10 % første 2 år, uavhengig av frie reseksjonsrender (Ghaem-Maghami et al., 2009; Kocken et al., 2011; Paraskevaidis et al., 1991).
- Persisterende HPV-infeksjon etter konisering øker risikoen for residiv, størst risiko for residiv første 10 år etter behandling (Kocken et al., 2011). Negativ HPV test etter eksisjon av premaligne forandringer er assosiert med meget lav risiko for ny CIN2+ (Arbyn et al., 2017).
- Forløp av AIS er ikke godt dokumentert, men erfaringsmessig kan tiden fra diagnosen AIS til utvikling av adenocarcinom være kortere, enn fra CIN til plateepitelcarcinom, se avsnitt "Adenocarcinoma in situ" i kapittel Diagnostikk
- Immunsupprimerte kvinner med dysplasi bør følges opp av gynekolog med kompetanse på dette området, evt. i samråd med immunolog og revmatolog for å optimalisere behandlingen i forhold til immunforsvaret. Det er vanlig med multifokal dysplasi (cervix, vagina, vulva og perianalt) hos disse pasientene. For nærmere informasjon, se svenske (SFOG riktlinjer) og engelske (Screening and management of immunosuppressed individuals) retningslinjer.
Diagnostikk
Sist faglig oppdatert: 30202330.06.2023
Norske helsemyndigheter anbefaler kvinner mellom 25 og 69 år å delta i livmorhals screening-programmet. Fra 1. juli 2023 får alle kvinner primær HPV screening etter følgende algoritme: Flytskjema for HPV primær screening. Intervallet mellom screeningprøvene blir da hvert femte år.
Se Kreftregisterets nettsider for mer generell informasjon om Livmorhalsprogrammet.
- Symptomer: vanligvis ingen.
- Gynekologisk undersøkelse: oftest normal.
- Primær cytologi: Ved unormal cytologi er sensitiviteten for CIN2+ lav (71 %) og spesifisiteten høy (99 %) (Mayrand et al., 2007; Naucler et al., 2009).
- Livmorhalsprøven bør tas før eksplorasjon. Ta prøven fra overgang sylinder-platepitel /Squamo collumnar junction (SCJ). Bruk lite og vannbasert eksplorasjons gel (se bruksanvisning) på spekulum. Unngå blod og slim i prøven om mulig. Trekk børsten raskt ut hvis det begynner å blø. Prøvetakere bør ta e-lærings kurs som ligger på legeforeningens e-lærings kurs side og få praktisk erfaring på gynekologisk poliklinikk.
- Cytologi har lav sensitivitet for cancer, ved makroskopisk tumor er det indikasjon for kolposkopi og biopsi.
- Cytologi alene er uegnet for utredning av gynekologiske symptomer og funn.
- Metaplasi beskriver en normal fysiologisk prosess, og trenger ingen utredning.
- AIS/ACIS, se avsnitt "Adenocarcinoma in situ" under.
Oppfølging av Livmorhalsprøver
Anbefalinger gitt av Livmorhalsprogrammet. Gjeldende fra 01.01.2023
Fra 01.07.18 ble det innført ny screeningalgoritme, sist oppdatert 01.01.2023.
HPV-test i primærscreening ble innført for alle kvinner mellom 34–69 år i Rogaland, Hordaland og Trøndelag fra 2015-2018. I perioden fra 2019–2022 ble cytologi erstattet av HPV-test som primær screeningtest for alle kvinner mellom 34 og 69 år i resten av landet og fra 01.01.23 for kvinner mellom 30–33 år (Flytskjema primær HPV screening). Fra og med 01.07.23 blir også kvinner mellom 25 og 29 år screenet med HPV-test.
OBS! En mangel ved dagens screeningprogram er at prøvehistorikken kan være ukjent for prøvetaker. Patologilaboratoriene har f.o.m. 2019 hatt tilgang til allcervixcytologi (registret fra 1992), cervixhistologi (registret fra 2002 og HPV analyser (registret fra 2005) som er tatt i Norge. Dette undersøkes ikke rutinemessig i alle laboratorier, og det er derfor svært viktig at prøvetager angir det som er kjent av tidligere aktuell sykehistorie.
I noen tilfeller er det indikasjon for individuell vurdering og avvik fra gjeldende anbefalinger.
Kolposkopi
Er veiledende for histologisk prøvetaking, ikke en selvstendig diagnostisk metode (Gage et al., 2006; Guido et al., 2003; Pretorius et al., 2011). Før man ufører kolposkopi bør man ha tatt godkjent kolposkopi kurs. Det finnes nasjonale og internasjonale kurs. Nettkurs finnes på legeforeningens nettsider. Kvalitetssikring av kolposkopifunn ved utredning og behandling er avgjørende for kvaliteten. Se internasjonale EFC retningslinjer.
Prosedyre kolposkopi
Før kolposkopi:
- Ha alltid cytologi/HPV-funnet klart for deg. Ved HSIL i cytologi, er det 75–80 % risiko for at det foreligger cervix dysplasi.
- Vær bevisst hvem du skal utrede/behandle: ung, eldre, paritet og barneønske, gestagen dominert prevensjon, HRT eller lokal østrogen bruk, tidligere konisert, røyker, immunsupprimert, tidligere/ aktuell SOS.
- Anamnese ift intermenstruelle blødninger, postmenopausale blødninger, postkoitale blødninger, påfallende fluor, tidligere/ aktuell sykehistorie med kodylomer/ VIN/ cervix dysplasi og familieanamnese på cervix dysplasi/cervix cancer.
Systematisk undersøkelse med kolposkop:
- Inspiser vulva for kondylomer og andre lesjoner, bruk evt. eddiksyre og kolposkoper der også (obs eddisyren trenger 2–5 min på å virke optimalt i hud, se evt. over en gang til etter du har kolposkopert cervix).
- Vaginal slimhinnene kan inspiseres når spekelet trekkes ut.
- Sørg for å få god oversikt over portio/cervix med selvholdende spekel.
- Fjern blod og slim for å få optimal oversikt.
- Makroskopiske forandringer? Avgrensning ift cervikalkanal og fornix?
- De fleste kolposkop forstørrer fra 6–24 x. Start med liten forstørrelse og hvitt lys for å få oversikt. Med grønt lys får man tydeligere frem atypiske kar og ujevnheter på overflaten.
- Representativ kolposkopiundersøkelse? Overgang mellom plate- og sylinderepitel (SCJ) må da være synlig, og øvre begrensning av evt. lesjoner opp mot kanalen må være helt synlige.
- Transformasjonssonen er feltet mellom den opprinnelige og nye overgangen mellom sylinder-platepitel. Det er den nye overgangen mellom sylinder-plateepitel (SCJ), som beskrives ved TZ1, 2 og 3:
- Type 1: synlig på portio overflaten
- Type 2: hele eller deler går inn mot cervikal kanalen, men blir synlig ved manipulasjon med tupfer, vattpinne eller tang
- Type 3: helt eller delvis ikke synlig. Det er også type 3 dersom øvre kant av lesjonen ikke er synlig
- Beskriv evt forandringer med klokken (eks. kl 1, mellom kl 3 og 7). Dokumenter med foto eller tegning (husk samtykke og trygg lagring):
- Intensitet av acetohvit farging
-
- Raskt opptak og sterk acetohvit forandring er oftest tegn på høygradig forandring
- Avgrensninger og overflatekontur av acetohvite lesjoner
- Atypiske karmønstre: Punktuasjoner, mosaikk, atypiske kar
- Størrelse på lesjonen(e)
- Evt. fargeendringer ved påføring av jod
- Swede score (se vedlegg A, s. 98) anbefales å bruke for å systematisere beskrivelsen. Poengene kan hjelpe å skille mellom lavgradige og høygradige forandringer, men er lite sensitiv for funn ved poeng 5–7.
- Lugols/Jod 3–5 % løsning kan brukes som diagnostisk hjelpemiddel. Den kan også være et godt hjelpemiddel ved konisering, for å få med overgang sylinder-platepitel / atypiske forandringer og vurdere vagina etter kolposkopi. OBS! CAVE JOD. Farger ikke / i mindre grad atrofiske slimhinner, bruk kun på postmenopausale dersom HRT/ lokal østrogen bruk.
Portiobiopsi
For histologisk verifisering av diagnose før eventuell behandling.
NB! «see and treat» bør unngås, pga økt risiko for overbehandling. Det er kun erfarne kvalitetssikrede kolposkopister som skal utføre «see and treat», for eksempel hos eldre kvinner med HSIL eller ACIS og klare høygradige kolposkopiske funn. EFC guidelines treatment
For gode prøver er vedlikehold av instrumentene viktig.
Lokalanestesi bør vurderes. Bedøvelse med Vasopressin er anbefalt, unngå Adrenalin grunnet bivirkninger.
- Portiobiopsier ved kolposkopifunn (kolposkopi rettet): Ved uventet negativ biopsi etter positivt kolposkopifunn, vurder regranskning av biopsi eller ny biopsi. For representativ biopsi, må patolog beskrive at overgang sylinder-platepitel (SCJ) er med.
- Prøvetagning uten kolposkopifunn: En biopsi fra hver kvadrant ved overgang sylinder- platepitel (SCJ), antall (og størrelse) kan begrenses dersom senere graviditetsønske (Pretorius et al., 2011).
Cervikal abrasio
Lokalanestesi bør vurderes.
- Kan utelates ved CIN med avgrenset kolposkopisk lesjon og fullt synlig overgang mellom plate- og sylinderepitel.
- Skal alltid tas med skarp curette ved ACIS og AGUS (lesjonene kan være multifokale endo-cervicalt) (Baasland et al., 2016). 21 % ikke-representative utskrap med Novacs curette.
- Skal i regelen utføres hos tidligere koniserte.
Oppfølging etter portiobiopsier og cervikal abrasio
Dersom forutgående cytologi viser høygradige celleforandringer (HSIL, AIS, ASC-H) eller lavgradige celleforandringer positiv for HPV16 og/ eller HPV18, og cervixbiopsi er normal eller viser CIN1:
- Ved HSIL i cytologi er det 75–80 % risiko for CIN2+ og ved ASC-H er det ca 50 % risiko for CIN2+ (Baasland et al., 2016).
- Dersom man ikke finner CIN2+, men kun CIN1 eller normal histologi, anbefales ny kolposkopi, cytologi og HPV-test om 6 mndr, forutsatt at biopsiene var representative.
- Ikke-publiserte data fra Kreftregisteret viser at hos kvinner med CIN1 var risikoen for senere å påvise CIN2+ den samme ved lavgradige HPV16/18 positive celleforandringer som ved høygradige celleforandringer i cytologien som ledet til CIN1. Derfor anbefales tid til første kontroll hos disse kvinnene å være 6 mnd.
Ved lavgradige celleforandringer (ASCUS og LSIL med HPV andre enn 16 og 18) og normal eller CIN1 i cervix biopsi:
- Cytologi og HPV-test om 12 mndr.
Ved vedvarende normal cytologi, representativ for kjertelvev, men persisterende HPV positive prøver og representative normale biopsier:
- Bør diagnostisk konisering unngås, under forutsetning at det foreligger TZ 1 eller 2 og normale funn ved kolposkopi.
- Ved TZ3 blir det individuell vurdering, under forutsetning av representativt cervikalt utskrap.
- Kvinnen kontrolleres først og fremst med cytologi og HPV test, evt. nye biopsier/utskrap, etter risikoprofil.
Utredning ved vedvarende diskrepans mellom cytologi, kolposkopi og histologi
- Diagnostisk konisering bør vurderes, særlig hos postmenopausale der overgang sylinder-platepitel (SCJ) ikke er synlig.
- Sjekk at det er gjort utvidet kolposkopi av hele vagina med tanke på VAIN (evt bruk av Lugol’s væske/ Jod ved østrogeniserte slimhinner).
- Be om revurdering av samlet prøvemateriale for cytologi, histologi og evt. HPV-test resultat.
Indikasjon for HPV-testing
Se avsnitt "Oppfølging av livmorhalsprøver" over, for link til algoritme HPV-test i primærscreening.
- Oppfølging etter behandling (konisering). Se avsnittet om oppfølging og kontroller, veiledende algoritme for oppfølging etter behandling for CIN2+.
- HPV test på klinisk indikasjon: – Ved CIN 1 i biopsi tatt som ledd i utredning/oppfølging av unormal cytologi
- Ved normal biopsi etter høygradig dysplasi i cytologisk prøve
- Ved normal biopsi post partum etter høygradig dysplasi i graviditet
- Se HPV-test på klinisk indikasjon, utvidet liste for kliniske indikasjoner.
- Obs: I HPV primær screening kan man be om cytologi på klinisk indikasjon.
Adenocarcinoma in situ (AIS/ACIS)
Flytskjema for oppfølging av AIS
- Ved påvist AIS i cytologi skal patologilaboratoriet gjøre HPV genotyping evt. henvise til annet laboratorium som kan gjøre dette. Snarlig henvisning til gynekolog, time senest innen 4 uker fra cytologisvar.
- I forbindelse med utredning av AIS bør også vaginal ultralyd gjøres, endometriebiopsi vurderes dersom indikasjon.
- Behandling av AIS er utfordrende og bør kun utføres av gynekologer med IFCPC (International Federation of Cervical Pathology and Colposcopy) sertifisering, gjennomført kolposkopi kurs godkjent av Legeforeningen eller lignende og med erfaring innen eksisjonsbehandling av AIS.
- Alle kvinner med AIS i cytologi skal behandles, selv om dette ikke bekreftes i histologi.
- Behandling bør utføres raskt, senest innen 8 uker etter svar på cytologi.
- Alle histologiprøver ved utredning og behandling må sendes som prioriterte prøver der det bes om svar innen 1 uke.
AIS er forstadiet til adenokarsinom. Det foreligger en betydelig risiko for at kvinner med AIS allerede har kreft. Upublisert data fra Kreftregisteret (2022) viser at 89 kvinner fikk påvist AIS i cytologiprøven i 2020. Innen et år fikk 26% påvist livmorhalskreft og 1 % annen gynekologisk kreft, mens 62% hadde behandlingstrengende forstadier. Totalt sett fikk 89% påvist en behandlingstrengende tilstand innen 1 år.
Utredning
- Kolposkopiske funn ved AIS er vanskeligere å tyde enn ved CIN2-3, og kan også være helt fraværende. Fokus kan sitte høyt oppe i cervikalkanalen, og 15% er multifokale (Baalbergen et al., 2014). Man kan derfor ikke stole fullt på biopsiene er representative selv om overgangssonen (SCJ) er påvist. Ofte foreligger kolposkopisk synlige CIN-forandringer samtidig, mens kjertelepiteldysplasien ikke har de typiske kolposkopiske kjennetegnene.
- Gynekologisk palpasjon og cervikalt utskrap skal alltid tas i tillegg til biopsier, for å detektere eventuell invasiv cancer og for å planlegge videre behandling. Det er viktig med skarp nok curette.
- Dersom blødningsforstyrrelser, overvekt, PCO eller kvinner ≥40 år skal endometriekreft utelukkes med ultralyd og eventuelt endometriebiopsi (pipelle/ corpus abrasio) tas før konisering, i tillegg til biopsier og cervikalt utskrap.
- Vevsprøvene sendes prioritert, der man ber om svar innen en uke.
- «See and treat» kan vurderes, særlig ved mistanke om dårlig compliance.
- Dersom TZ3, vurder oppstart med Vagifem daglig frem til behandling. Hos unge kan kombinert p-pille være et alternativ. I tillegg kan Cytotec 600 mcg gis kvelden før behandling.
Behandling
- Behandlingen skal utføres av gynekolog som har erfaring med eksisjon av AIS.
- Skal prioriteres til konisering raskere enn CIN2 og CIN3 (Arbyn et al., 2017), senest innen 8 uker fra svar på cytologi foreligger
- For å få optimale betingelser, vurder konisering i narkose
- Hos alle kvinner bør eksisjonen gå langt nok ut lateralt for å sikre at man får med seg kryptene (minimum 6 mm). Trekantslynge er kontraindisert, da det er fare for å kappe kryptene.
- Hos kvinner med barneønske og TZ1 eller 2 anbefales bueformet slynge 10 mm dybde over SCJ.
- Hos kvinner med TZ3 og barneønske anbefales forbehandling med østrogen/Cytotec (se Utredning). Individuell vurdering ang. dybde.
- Etter endt barneønske bør det utføres en sylinderformet høy eksisjon (20–25 mm) med diaterminål, laser eller kniv uansett type TZ (Munro et al., 2015). Dersom bueformet slynge brukes hos kvinner som er ferdige med barn og man ikke kommer høyt nok, må «top-hat» gjøres i tillegg. Trådmerk øvre reseksjonsrand.
- Etter eksisjon gjøres cervikalt utskrap. Dette øker sannsynligheten for å diagnostisere eventuelt gjenværende dysplasi.
- Konpreparat spennes opp med nåler på isopor/ korkplate med slimhinnen opp (angi hvor preparatet er åpnet) (Tierney et al., 2014).
- Be om prioritert histologisvar innen 1 uke.
Oppfølging (se egne flytskjemaer for frie og ufrie render)
- Etter behandling skal kvinner med AIS følges opp hos gynekolog.
- Dersom ikke frie render, bør ny eksisjon utføres. AIS i reseksjonsrender er en viktig prediktor for gjenværende AIS og adenokarsinom. En metaanalyse (35 studier) fra 2014 viste at det ved frie render var 16.5% restdysplasi og 0.6% kreft, ved ufrie render 49.3% restdysplasi og 5,9% kreft (Baalbergen et al., 2014).
- Dersom pasient med fertilitetsønske og ufrie render, kan man vurdere kontroll innen 4 uker med kolposkopi, cytologi og HPV genotyping, biopsi og cervikalt utskrap.
- Oppfølgingscytologi må være representativ, dvs inneholde både plate og kjertelepitel.
- Ved kontroll etter frie render, men vanskelig å ta representative prøver fra stenotisk cervikalkanalen til tross for blokking, bør hysterektomi anbefales.
- Der det ikke er full stenose men vanskelig å få representativ cytologi, kan man i tillegg bruke en litt hardere børste som man skyller i samme prøve beholder.
- Kvinner behandlet for AIS men som ikke er hysterektomert, bør følges opp med kontroller hele livet.
Gravide
- Ved blødning er cervixpatologi en differensialdiagnose.
- Graviditet predisponerer ikke for CIN og påvirker sannsynligvis ikke det naturlige forløpet (SFOG, 2010).
- Risikoen for at CIN3 i løpet av svangerskapet progredierer til plateepitelkarsinom er rapportert å være 0,3 % (Hunter et al., 2008a; Hunter et al., 2008b).
- Vanlig screeningintervall følges (Nygård et al., 2007).
- Ved positiv HPV test og ASCUS/ LSIL, følges pasienten i henhold til retningslinjene til livmorhalsprogrammet.
Ved påvist ASC-H/ HSIL/ AGUS, eller histologisk verifisert CIN2–3, følges den gravide med kolposkopi/cytologi hver 12. uke (Kärrberg et al., 2013). Dersom kolposkopi funn er cancersuspekte, cytologi indikerer karsinom eller det foreligger progresjon fra tidligere funn, må nye biopsier tas. Tilstreb at gravide følges av samme gynekolog med erfaring innen cervix dysplasi.
- Ved mistanke om karsinom og AIS, henvis pasienten raskt til spesialavdeling for gynekologisk onkologi.
- Første postpartum konsultasjon med kolposkopi, cyt og HPV anbefales 12 uker etter fødselen hos erfaren kolposkopist. Kontroll tidligere ved mistanke om mikroinvasivt karsinom og AIS. – Dersom cytologisk og/ eller histologisk verfisert høygradig dysplasi, før eller i svanger-skapet, skal det også tas biopsier ved 12 ukers kontrollen.
- Ved histologisk verifisert høygradig dysplasi før eller i svangerskapet og klare kolposkopiske funn som indikerer høygradig forandringer eller mikroinvasivt karsinom, bør man vurdere å gå rett på konisering.
- Dersom cytologisk lavgradige funn før eller i svangerskapet ikke har blitt biopsert etter retningslinjene fordi pasienten var gravid, kan dette gjøres ved 12 ukers kontrollen post partum i tillegg til cytologi med HPV.
Differentialdiagnoser
- Metaplasi (er en normal fysiologisk prosess og trenger ingen utredning)
- Kondylomer
- Cervixkarsinom
- Endometrieatypi
- Genitale infeksjonssykdommer
- Metastaser, lymfom, maligne mesenchymale svulster eller nevroendokrin cancer i cervix
Behandling
Sist faglig oppdatert: 28202128.06.2021
Generelt
- For behandling av AIS, se avsnitt "Adenocarcinoma in situ" i kapittel Diagnostikk.
- Lokale destruktive metoder (kryo, laservaporisering, diatermi) anbefales ikke som primær behandling for CIN2+, fordi man ikke får histologi til vurdering av grad og utbredelse.
- Konisering øker risiko for preterm fødsel (Kyrgiou et al., 2016). Se kapittel «Premaligne og maligne forandringer i cervix i svangerskapet», veileder i obstetrikk.
- Man må få med overgang sylinder-platepitel (SCJ) og øvre del av lesjonen dersom man velger å konisere.
- Ved ufri øvre/endocervikale reseksjonskant er risikoen for residiv høyere enn ved ufri nedre/vaginale reseksjonskant.
- CIN1 er uttrykk for HPV infeksjon, og behandles i utgangspunktet ikke. Ved persistens i 12–24 måneder, kan man gjøre en klinisk vurdering i forhold til alder og fremtidig fertilitets ønske hvis man skal behandle. Unngå diagnostisk konisering pga persisterende HPV infeksjon uten cytologiske funn. Erfarne kolposkopister kan vurdere å behandle med ablasjon (vaporisering med diatermi eller laser) ved vedvarende CIN 1, dersom TZ 1 og 2 foreligger. Man må sørge for minst 6 mm dybde ved behandlingen.
- CIN 2 skal i regelen behandles, men kan observeres hos kvinner under 30 år dersom: lesjonen er liten, avgrensbar og ikke omfatter cervical kanalen (TZ1 og TZ2), lesjonen ikke er forårsaket av HPV16 og dersom utgangscytoloig ikke viste HSIL. Studier har vist at opptil 60 % av CIN2 lesjoner hos kvinner under 30 år går i regress i løpet av 2 år, mens risikoen for progresjon er 11 % (Tainio et al., 2018). Ekspektanse kun ved forventet god compliance; kontroll hver 6 mnd. med cytologi, HPV test, kolposkopi og ev biopsi, i maksimum 2 år.
- Utredning og behandling av premaligne lidelser i cervix skal meldes til Kreftregisteret på eget IN-skjema.
Konisering
- Indikasjon for konisering:
- CIN 2+ (hos ikke-gravide), se ovenfor.
- Ved mistanke om mikroinvasjon ved kolposkopi vurdert av erfaren kolposkopist, skal det gjøres diagnostisk konisering.
- Dersom biopsier viser tidlig/mikroinvasivt karsinom, uten makroskopisk tumor, er diagnostisk kon indisert.
- Ved makroskopisk tumor, ta biopsi og evt cervikal abrasio. Angi tumors størrelse og utbredelse.
- Ved uavklart histologisk diagnose, dvs. diskrepans mellom cytologisk og histologisk diagnose (diagnostisk konisering).
- I utvalgt tilfeller ved persisterende CIN 1.
- Metode:
- Kolposkoper alltid før konisering.
- Slynge (LEEP / LOOP / LLETZ)/ nåleeksisjon (NETZ) / laser.
- Fortrinnsvis i lokalanestesi. I vanskelige tilfeller kan narkose vurderes.
- Konus størrelse:
- Lesjonen bør fjernes kolposkopiveiledet med en dybde på minimum 8 mm.
- Behandling tilpasses type transformasjonssone (TZ).
- TZ bør tilstrebes fjernet i sin helhet.
- Overgangen mellom sylinder og plateepitel (SCJ) skal fjernes (Tatti et al., 2013).
- Hos unge med fremtidig barneønske bør minst mulig vev fjernes (konus dybde viktigere å begrense, enn konus overflate) (Nøhr et al., 2007; Sadler et al., 2004; Tropé, 2014).
- Generell vaporisering/elektrokoagulering av sårbunn og reseksjonskantene er kun for hemostase. Unngå cervical kanalen pga økt stenose risiko.
- Ved endocervical lesjon eller AIS, og bekymring for om øvre reseksjonsrand er fri, kan det tas avsluttende prøve fra endocervix med curette for vurdering av inngrepets radikalitet.
Hysterektomi
- Vurderes ved persisterende eller residiverende CIN 2+ etter tidligere konisering/re-konisering eller ved tilleggsindikasjon. Vurder om man kan komme til mål med re-konisering før hysterektomi.
- Vaginal hysterektomi er egnet, da man har best oversikt over evt. forandringer på ektocervix. Uansett operasjonsmetode, skal man kartlegge dysplastiske forandringer og utbredelse ved å kolposkopere og evt. bruke jod for å få fjernet forandringene med god margin. Slimhinnene i vaginaltoppen bør ikke dras inn i suturene, da evt. gjenværende dysplasi kan bli vanskelig å oppdage ved påfølgende kontroller.
- Mer liberal holdning til hysterektomi ved AIS da dette er en multifokal sykdom, fri rand kan være vanskelig å oppnå og cytologibasert kontroll av sylinderepitel er mer usikker (Li et al., 2013).
- Hysterektomi bør anbefales til kvinner over fertil alder, hvis det ikke er frie render etter rekonisering og det er unormal celleprøve eller positiv HPV test ved kontroll.
- Ved ikke fri nedre rand etter hysterektomi for CIN2+ skal suspekte lesjoner biopseres.
Komplikasjoner etter konisering
Tidlige komplikasjoner (innen 1 dag)
- Peroperativ perforasjon til nabo organer.
- Per- eller postoperativ blødning (Hagen et al., 1998). Behandles med: Tampong/kompresjon, Cyklokapron (lokalt/systemisk), sutur.
- Infeksjon: Behandles med antibiotika iht. resistensbestemmelse, evt.: Flagyl/Doxycyclin.
Senkomplikasjoner (senere enn 14 dager)
- Cervix stenose (dysmenorè, hematometra) (Hagen et al., 1998). Risikoen øker hos postmenopausale kvinner, og kan maskere senere endometriecancer. Det finnes få studier som omhandler dette.
- Prematur fødsel (cervix insuffisiens) (Kyrgiou et al., 2006; Sjøborg et al., 2007).
- Sen abort (Larsen, 2011).
Angående cerclage i aktuelt, og kontroller i påfølgende svangerskap; se Veileder i Obstetrikk (Iversen et al., 2014) på Den norske legeforening sine nettsider.
Oppfølging og kontroller
Sist faglig oppdatert: 18202318.01.2023
Algoritme oppfølging etter konisering for AIS med frie render
Algoritme oppfølging etter konisering for AIS med frie render (pdf)
Algoritme oppfølging etter konisering for AIS med ufrie render
Algoritme oppfølging etter konisering for AIS med ufrie render (pdf)
Algoritme oppfølging etter konisering for CIN2 og 3 eller diagnostisk kon pga høygradig cyt
Algoritme oppfølging etter konisering for CIN2 og 3 eller diagnostisk kon pga høygradig cyt (pdf)
Oppfølging etter hysterektomi
- Dersom hysterektomert pga andre indikasjoner enn CIN – ingen videre oppfølging forutsatt normal cervix cytologi før operasjonen.
- Dersom atypisk cervix cytologi eller HPV pos. funn i forkant, men ingen funn i histologi av uterus – HPV og cyt. 6 mndr postoperativt. Dersom normal cyt. og HPV neg., kan videre kontroller med cyt. og HPV avsluttes.
- De som er hysterektomert pga CIN2+ med/eller uten fri rand vaginalt, ktr med cyt. og HPV 6 mndr. postoperativt.
- Dersom normale funn, videre kontroller hvert 5. år (Jordan et al., 2009).
- Ved atypisk cyt. og/ eller HPV pos., kolposkopi og evt. biopsi. Hos postmenopausale kvinner, anbefales lokal østrogen for å få bedre celleprøver, samt se evt. lesjoner bedre ved påføring av eddik og jod.
- Obs! Ta cytologibrushen godt opp i hjørnene.
HPV-vaksinering etter behandling for CIN2+
Sist faglig oppdatert: 28202128.06.2021
Dagens HPV-vaksiner virker profylaktisk og beskytter mot infeksjon forårsaket av de HPV-genotypene som inngår i vaksinene, samt mot noen kryssbeskyttende HPV typer. Det finnes få studier på effekt av vaksinasjon etter gjennomgått behandling for CIN2+, og ingen av vaksinene på markedet har dette som godkjent indikasjon for vaksinasjon. I perioden 2012–2019 er det publisert fem studier på effekt av HPV vaksinasjon etter behandling for dysplasi. Resultatene antyder at HPV-vaksinene som er på markedet i dag potensielt kan redusere risiko for ny HPV relatert sykdom (Garland et al., 2016b; Joura et al., 2012; Kang et al., 2013; Sand et al., 2020), men dokumentasjonen av effekt er fortsatt begrenset og The European Society of Gynaecologic Oncology and the European Federation for Colposcopy (ESGO-EFC) skriver i sin anbefaling fra 2019 at pasienter som er behandlet for CIN2+ på et ikke nærmere spesifisert individuelt grunnlag – kan tilbys HPV vaksine (Joura et al., 2019). De viser videre til pågående og planlagte studier som på sikt vil kunne bidra til økt kunnskap om effekten av HPV vaksinasjon hos kvinner som er behandlet for CIN.
Det foreligger per i dag ingen anbefaling fra norske helsemyndigheter om HPV-vaksinering etter behandling for CIN2+. Etter det nye «System for innføring av vaksiner i offentlig regi» som ble implementert i 2018, kreves metodevurdering for evaluering av effekt, sikkerhet og kostnadseffektivitet før vaksiner til nye grupper kan tas inn i nasjonale retningslinjer. Folkehelseinstituttet sendte i januar 2020 et forslag til vurdering i dette systemet om evaluering av HPV-vaksine til kvinner som er behandlet for CIN2+.
Så vidt man kjenner til er nasjonale retningslinjer heller ikke innført i andre land. I enkelte land har det likevel utviklet seg en gynekologisk praksis hvor det gis råd om vaksinasjon etter konisering på tross av manglende nasjonale anbefalinger.
Etter innføring av HPV-vaksine i barnevaksinasjonsprogrammet i 2009 blir forekomst og end-ringer av HPV genotyper i forstadier til livmorhalskreft eller livmorhalskreft i Norge overvåket som en del av det nasjonale oppfølgingsprogrammet for HPV-vaksinasjonsprogrammet (Folkehelseinstituttet, 2020a).
Fra 2017 registreres derfor forekomst av HPV-genotyper i livmorhalskreft og forstadier til liv-morhalskreft i Meldesystem for infeksjonssykdommer (MSIS) ved Folkehelseinstituttet. Det innebærer at vevsprøver fra livmorhalsen som tas i forbindelse med utredning/ behandling av forstadier til livmorhalskreft eller livmorhalskreft HPV-testes (biopsier, koner) innkalles fra patologilaboratoriene og testes for HPV ved det nasjonale HPV-referanselaboratoriet. HPV-resultatene analyseres ved Folkehelseinstituttet og lagres i MSIS (Folkehelseinstituttet, 2018). Overvåkingen er hjemlet i MSIS-forskriften.
Profylakse
Sist faglig oppdatert: 28202128.06.2021
HPV-vaksinering
HPV-vaksine ble inkludert i det norske barnevaksinasjonsprogrammet høsten 2009 og tilbys alle jenter i 7. klasse (12–13 år). Fra høsten 2018 startet man og tilby gutter i 7. klasse HPV-vaksine gjennom barnevaksinasjonsprogrammet. Kvinner født 1991 eller senere har mellom november 2016 og desember 2018 fått tilbud om HPV-vaksine gjennom et to-årig innhentingsprogram.
Det finnes tre HPV-vaksiner på markedet: Cervarix (HPV 16/18), Gardasil (HPV 6,11,16,18) og Gardasil 9 (HPV 6, 11, 16, 18, 31, 33, 45, 52, 58). I Norge benyttes HPV-vaksinen Cervarix både i barnevaksinasjonsprogrammet og i innhentingsprogrammet for unge kvinner. Gardasil ble benyttet i barnevaksinasjonsprogrammet frem til høsten 2017.
HPV-vaksinene har i randomiserte studier vist > 90 % beskyttelse mot HPV 16/18 relatert infeksjon og høygradige lesjoner i livmorhalsen. Cervarix har dokumentert 93 % beskyttelse mot CIN3+ uavhengig av HPV-type (Lehtinen et al., 2012). Tilsvarende beskyttelse for Gardasil er 43 % (Lehtinen et al., 2012)). Den høye beskyttelsen for Cervarix skyldes kryssbeskyttelse mot HPV 31/33/45. Gardasil 9 forventes å gi 90 % beskyttelse mot livmorhalskreft (Huh et al., 2017).
Gardasil og Cervarix har vært brukt i vaksinasjonsprogram siden 2007, og det er vist høy og langvarig beskyttelse for begge (Garland et al., 2016a; Kavanagh et al., 2017). I en studie fra Skottland blant jenter vaksinert med Cervarix som 12-åringer, fant man 89 % beskyttelse mot infeksjon med HPV 16/18, og høy kryssbeskyttelse mot HPV 31/33/45 (94 %, 79 %, 83 %) mer enn syv år etter vaksinasjon. I tillegg fant man høy grad av beskyttelse mot alle fem HPV-typer også hos uvaksinerte jenter, som uttrykk for flokkbeskyttelse (Kavanagh et al., 2017). Skotske data viser også 94 % reduksjon i CIN3+ uavhengig av HPV-type etter vaksinasjon med Cervarix (Pollock, 2017).
Mer enn 90 % av alle jenter som tilbys HPV vaksine i barnevaksinasjonsprogrammet takker i dag ja (Folkehelseinstituttet, 2020b), og vaksinasjonsdekningen i Norge er blant de høyeste i verden.
Det er Folkehelseinstituttet (FHI) som er ansvarlig for utformingen og oppfølgingen av vaksinasjonsprogrammet.
HPV og cervixkarsinom
- Andelen HPV-16/18 i invasiv kreft (70–82 %) er høyere enn i behandlingstrengende forstadier (53–78 %), derfor har vaksinen potensial til å ha større effekt på forebygging av invasiv kreft enn forstadier til kreft (de Araujo Souza et al., 2009).
- Dagens vaksine dekker ikke alle onkogene HPV-typer, men viser høy og langvarig beskyttelse mot CIN uavhengig av HPV type på grunn av kryssbeskyttende egenskaper.
- Vaksinering kan ikke erstatte screeningsprogrammet, men innføring av vaksinen vil med tiden kreve en modifisering av programmet.
- HPV-vaksine er godkjent til bruk i Norge til vaksinering av kvinner og menn fra 9 år.
Pasientinformasjon
Sist faglig oppdatert: 28202128.06.2021
Noen anbefalinger og stikkord om pasientinformasjon, innhold og form:
- Informasjon om HPV og celleforandringer finner pasient på kreftregisterets hjemmesider/ Livmorhalsprogrammet.
- Enkel definisjon: bruk celleforandringer, ikke «kreftceller», unngå «alvorlige» celleforandringer.
- At kausalfaktor for utvikling av livmorhalskreft er HPV, men at en HPV-infeksjon i seg selv ikke er farlig, at den er svært vanlig og at den går over av seg selv i de aller fleste tilfellene.
- At utviklingen av celleforandringer går over lang tid (år).
- At celleforandringer kan gå tilbake av seg selv.
- Begrunnelsen for at behandling anbefales, inklusive informasjon om mulighet for overbehandling.
- Hvilke undersøkelser som blir gjort før en anbefaler operativt inngrep.
- Enkel forklaring på konisering («lite inngrep»).
- Hvilken type bedøvelse som er aktuell.
- Hvor lang tid inngrepet tar.
- Hvor lenge pasienten må oppholde seg på sykehuset.
- Når foreligger cytologi/histologi svar.
- Forløp.
- De vanligste komplikasjonene.
- Bør ikke bli gravid før svar på operasjonspreparatet foreligger.
- Behov for egenmelding ev. sykmelding.
- Kontroll – oppfølging.
- Informasjon om risiko for persistens / residiv.
Forkortelser/ordforklaringer
Sist faglig oppdatert: 28202128.06.2021
| Forkortelser (alfabetisk) | Forklaring (norsk oversettelse) |
|---|---|
| AGUS | Atypical Glandular cells of Undetermined Significance (Atypisk sylinderepitel av usikker betydning,(usikkert benignt/ malignt)) |
| AIS/ACIS | Adenocarcinoma In Situ (Høygradige intraepiteliale forandringer i sylinderepitel/Adenokarsinom in situ) |
| ASC-H | Atypical Squamous Cells cannot exclude HSIL (Atypisk plateepitel, der høygradige celleforandringer i plateepitelet ikke kan utelukkes,(usikkert benignt/ malignt)) |
| ASC-US | Atypical Squamous Cells of Undetermined Significance (Atypisk plateepitel av usikker betydning) |
| CIN | Cervikal Intraepithelial Neoplasia (Cervixdysplasi;(histologisk diagnose) inkluderer: CIN1, CIN2, CIN3, CIN2+) |
| CIS | Carcinoma In Situ kan sløyfes eller føres inn under CIN |
| ECC | Endocervical curettage (Cervikal abrasio) |
| HPV | Human Papilloma Virus |
| HSIL | High grade Squamous Intraepithelial Lesion (Høygradige intraepiteliale forandringer i plateepitel) |
| ICC | Invasiv Cervical Cancer |
| LEEP | Loop Electrosurgical Excision Procedure (Slyngekonisering) |
| LLETZ | Large Loop Excision of the Transformation Zone |
| LSIL | Low grade Squamous Intraepithelial Lesion (Lavgradige intraepiteliale forandringer i plateepitel) |
| Metaplasi | Fysiologisk og normal omdanning og dekning av sylinderepitel med plateepitel |
| Refleks HPV-test | HPV-test av væskebasert celleprøve som allerede er tatt |
| SCJ | Squamo Columnar Junction (Grensen (overgangslinjen) mellom sylinder- og plateepitel ≠ TZ) |
| TZ | Transformation Zone (Området mellom nye og gamle overgang mellom sylinder- og plateepitel) |
Vedlegg A
Swede kolposkopi score
Fem variabler tilsvarende 1–5 ovenfor får verdi på 0, 1 eller 2. Ved fullt utslag kan man få maksimalt 10 poeng. 1–4 poeng taler imot CIN2+ mens 8–10 taler for (Bowring et al., 2010).
Poeng | 0 | 1 | 2 |
|---|---|---|---|
Aceto opptak | 0 eller transparent | Slørete | Stearinflekk |
Kanter | 0 eller diffuse | Uregelmessige, flikete, skarpe. Satelitter | Regelmessige, skarpe eller nivåforskjell |
Kapillær mønster | Fint, regelmessig | Savnet | Grove eller bisarre kar |
Størrelse | < 5 mm | 5–15 mm eller 2 kvadranter | > 15 mm, 3–4 kvadranter eller endocervikalt uavgrensbart |
Jod-opptak | Brunt | Svakt gult eller flekkete | Kanarigult |
Flytskjemaer/algoritmer
Oppfølging av AIS i cytologi (pdf)
Oppfølging etter konisering for AIS med frie render (pdf)
Oppfølging etter konisering for AIS med ufrie render (pdf)
Opfølging etter konisering for CIN2 og 3 eller diagnostisk kon pga høygradig cyt (pdf)
Vulvacancer
Bakgrunn
Sist faglig oppdatert: 05202405.07.2024
ICD-10
C51.9 Ondartet tumor i ytre kvinnelige kjønnsorganer (vulva)
Definisjon
- Kreft utgått fra ytre kjønnsorgan (vulva) som omfatter labia majora og minora, perineum, mons pubis, vestibulum, Bartholinis kjertler, urethra ostiet og klitoris.
- Vulvas ytre grense: Anteriort mons pubis, lateralt den genitocrurale fold som skiller labia major fra låret, og posteriort perineum. Den indre avgrensning er hymenalringen
Forekomst
- Om lag 4 % av gynekologisk kreft.
- Nasjonale og internasjonale studier viser økende forekomst av vulva cancer (Howe et al., 2001; Iversen & Tretli, 1998; Lai & Mercurio, 2010; Schuurman et al., 2013), spesielt hos yngre kvinner (Kumar et al., 2009; Meltzer-Gunnes et al., 2017).
- Insidensen i Norge er nå 4.66 per 100,000 /år (Meltzer-Gunnes et al., 2017), ca 98 nye tilfeller i 2021 (data fra NORDCAN 2023) 11
- Rammer oftest eldre, hyppigst mellom 60–70 år, men økende insidens blant kvinner < 60 år i Norge (Meltzer-Gunnes et al., 2017).
Prognostiske faktorer
- Viktigst er lymfeknutestatus i lyskene, 5-års overlevelse:
- Ingen lymfeknutemetastaser 80,7 %
- Én lymfeknutemetastase 62,9 %
- Mer enn 3 lymfeknutemetastaser 19,2 %
- Tumordiameter > 2,5 cm
- Multifokalitet
- Karinfiltrasjon
- Perinevral infiltrasjon
- Koeksisterende høygradig VIN og ufrie render
- Infiltrasjonsdybde
- Økende evidens for at HPV er en prediktiv faktor
(Beller et al., 2006; De Hullu et al., 2002; de Hullu et al., 2006; Dhakal et al., 2013; Eva et al., 2020; Ferrari et al., 2019; FIGO (International Federation of Gynecology and Obstetrics) 26th Annual Report on the Results of Treatment in Gynecological Cancer, 2006; Holthoff et al., 2015; Iversen et al., 1981; Jones & Rowan, 1994; Knopp, 2006; Lindell et al., 2010; McAlpine et al., 2017; Micheletti & Preti, 2014; Monk et al., 1995; Scheistrøen et al., 2002; van de Nieuwenhof et al., 2009; Woelber et al., 2011b)
Gjengitt med tillatelse fra IARC
Etiologi og risikofaktorer
Sist faglig oppdatert: 05202405.07.2024
Etiologi
Delvis kjent for plateepitelkarsinom Ca. 60 % assosiert med lichen sclerosus via differensiert VIN/villtype p53 VIN (se kap. 9, VIN)
Ca. 40 % assosiert med HPV (hyppigst genotypene 16, 18, 33) via høygradig VIN
(de Sanjosé et al., 2013; Eva et al., 2020; Knopp, 2006; Meltzer-Gunnes et al., 2024; Rasmussen et al., 2023; Smith et al., 2009; Tran et al., 2019; Zięba et al., 2020)
Risikofaktorer
- HPV infeksjon (Srodon et al., 2006)
- TP53 mutasjon?
- VIN
- Annen HPV relatert cancer (særlig cervix cancer)
- Lichen sclerosus
- Pagets sykdom
- Immunsuppresjon
- Diabetes
- Røyking
- Lav sosioøkonomisk status
Spredningsmønster
- Primært ved invasjon til omgivende vev.
- Tumorceller kan invadere blod- og lymfekar og gi metastaser, primært i regionale lymfeknuter.
- Ved tumor lokalisert lateralt i vulva (minst 1 cm fra midtlinjen), går lymfedrenasjen til lymfeknuter i lysken på samme side.
- Ved tumor over 4 cm lokalisert lateralt samt ved tumor beliggende i midtlinjen, kan spredning gå til lymfeknuter i begge lyskene.
- Videre spredning kan gå til lymfeknuter i iliaca eksterna og interna området, og videre til iliaca communis og para-aortalt.
- Risiko for metastasering til lymfeknuter øker med økende tumorvolum.
- Ved invasjon i blodkar kan tumorceller føres til lunge og lever.
Histologi
Sist faglig oppdatert: 05202405.07.2024
Maligne svulster i vulva klassifiseres i henhold til WHO Classification of Tumours 5th ed Female Genital Tumours IARC 2020.
- Plateepitelkarsinomene utgjør ca 85% og inndeles i HPV-assosierte eller HPV-uavhengige typer basert på HPV analyse med PCR teknikk (evt immunhistokjemisk undersøkelse for p16 som surrogatmarkør)
- Malignt melanom ca10 %
Utgjør 2–3 % av maligne melanom hos kvinner
Ikke assosiert med UV-stråling
Mutasjoner i KIT (NRAS/KRAS/BRAF/NF1), arvelig familiært melanom
Eldre aldersgrupper (60–80 år)
25 % er amelanotiske; immunhistologisk undersøkelse ofte nødvendig for korrekt diagnose
Hyppigste typer: Lentiginøs, nodulær, superficiell spredende og uklassifiserbar (se Handlingsprogram for Melanomer for diagnostikk, diagnoseoppsetting og TNM stadiering av maligne melanomer) - Øvrige maligne svulster utgjør ca 5 % :
- Pagets sykdom 2 % (Edey et al., 2013)
Intraepitelial neoplasi med proliferasjon av atypisk kjertelepitel i epidermis.
10–20 % har underliggende adenokarsinom utgående fra hudadnexstrukturer eller naboorgan
Sprer seg ofte okkult utenfor den synlige lesjonen
Lesjonen er ofte ødematøs, hvit, rød og skjellende, med intensiv kløe og brennende smerte
Rammer i hovedsak postmenopausale, hvite kvinner
HPV analyse og immunhistokjemi kan være nødvendig for å utelukke malignt melanoma in situ og phagetoid variant av høygradig VIN
- Pagets sykdom 2 % (Edey et al., 2013)
-
- Plateepitelkarsinom (hyppigere) eller Adenokarsinomutgått fra Bartholinsk kjertel
Lokalisert posterolateralt på labia majora.
Kan forveksles med Bartholinitt. - Sarkom/mesenchymale neoplasier/Neuroendokrine neoplasmer
- Plateepitelkarsinom (hyppigere) eller Adenokarsinomutgått fra Bartholinsk kjertel
Diagnosemal for vulvaresektat:
- Resektat fra vulva med malign tumor
- Type:
- Største tumordiameter: ... mm (målt makroskopisk/mikroskopisk)
- Infiltrasjonsdybde/tumortykkelse: ... mm
- Infiltrasjon i urethra:
- Karinfiltrasjon:
- Perineural infiltrasjon:
- HSIL (høygradig VIN):
- Differensiert VIN/villtype p53 VIN:
- Lichen sclerosus:
- Reseksjonsrender/flater: (fri/ikke fri/usikker). Dersom det er ufrie render skal det vedlegges fotodokumentasjon og oppgis om det er påvist karsinom og/eller VIN
- Totalt … sentinelle lymfeknuter uten påviste metastaser ved primærvurdering eller ultrastaging/ med metastase med følgende utbredelse:
- Makrometastase, diameter … mm, påvist i H&E snitt, nivå 1
- Makrometastase, diameter … mm, påvist i H&E snitt, nivå 2
- Mikrometastase, påvist i H&E snitt, nivå 1
- Mikrometastase, påvist i H&E snitt, nivå 2
- Mikrometastase, påvist ved immunhistokjemi, nivå 1/nivå 2
- Isolerte tumorceller (ITC), påvist i H&E snitt, nivå 1
- Isolerte tumorceller (ITC), påvist i H&E snitt, nivå 2
- Isolerte tumorceller (ITC), påvist ved immunhistokjemi, nivå 1/nivå 2
- Perinodal tumorinfiltrasjon påvist /ikke påvist
Figo Stadium 2021/TNM
Diagnostikk
Sist faglig oppdatert: 05202405.07.2024
Symptomer
- Kan være asymptomatisk
- Kløe/brenning 40 %
- Tumor 25 %
- Sårdannelse 20 %
- Blødning 10 %
- Smerte 5 %
Kliniske funn
- Tumor
- Lesjonene kan være røde, hvite eller pigmenterte, flate, vortelignende
- Ulcerasjon
- Lichenifisering
- Eksematøse forandringer
- Pigmenterte forandringer
Utredning
Klinisk undersøkelse
Klinisk undersøkelse må beskrive:
- Tumor størrelse
- Avstand til medlinje/klitoris/anus/vagina/urethra
- Lymfeknute status i lysker
- Foto-dokumentasjon (foretrekkes) eller klinisk tegning anbefales
- Vagina, cervix (cytologi), rektum og anus skal også undersøkes
Kolposkopi av vulva ved suspekte lesjoner
Henvises til VIN (kap. 9)
Biopsi
For klassifikasjon av dermatoser, VIN og maligne svulster må det tas biopsi. Ingen indikasjon for vulva cytologi.
- Biopsi (helst stansebiopsi i overgang mot frisk vev, viktig for korrekt orientering/innstøping i parafinblokk slik at patologen får vurdert relasjon mellom plateepitel og underliggende stroma).
- Eksisjonbiopsi må unngås, da det reduserer mulighet for bruk av SN teknikk og vanskeliggjør utvidet reseksjon.
- Ved multiple lesjoner må biopsi tas fra hver lesjon.
- Merk/tegn på remissen så patolog/ kliniker ser hvor biopsiene er tatt. Husk at utvidet reseksjon kan bli aktuelt.
- Ved melanom henvisning til melanom kirurg/onkolog, evnt. ved små solitære lesjoner diagnostisk eksisjon. Ved suspekte lymfeknuter i lyskene: Ultralyd-veiledet cytologi. Ev. histologisk (grov nålbiopsi) undersøkelse hvis det har betydning for behandling.
Supplerende undersøkelser
- CT thorax + abdomen + lysker (for kartlegging av metastaser)
- MR bekken (ved behov for detaljkartlegging av primærtumor, ved usikkerhet om operabilitet og/eller ved nærhet til anus/uretra, skal alltid utføres der radiokjemoterapi er primærbehandling). For anbefalt protokoll se avsnitt "Bildediagnostiske undersøkelser" i kapittel "Diagnostikk og utredning".
- PET-CT anbefales ved mistanke om lokalavansert sykdom der kurativ strålebehandling er aktuelt, alltid ved malignt melanom (Rogers & Cuello, 2018).
Differensialdiagnoser
- Eksematøs sykdom
- Benigne sår/tumorer
- Infeksjon
- Kondylom
- Bartholinitt
Stadier
Sist faglig oppdatert: 05202405.07.2024
Sykdomsstadium i henhold til FIGO stadium 2021 (Olawalyse et al., 2021) og TNM klassifikasjon. Siden 1988 er stadieinndeling basert på kirurgi og histopatologi. Lymfeknutestatus er vesentlig.
Behandling
Sist faglig oppdatert: 05202405.07.2024
Prinsipper:
- Sentralisert behandling: Pasientene skal henvises til gynekologisk-onkologisk senter
- Primært kirurgi med en konservativ, individualisert tilnærming (Ansink & van der Velden, 2000; Beller et al., 2006; De Hullu et al., 2002; de Hullu et al., 2006; FIGO (International Federation of Gynecology and Obstetrics) 26th Annual Report on the Results of Treatment in Gynecological Cancer, 2006; Iversen et al., 1981; Jones & Rowan, 1994; Micheletti & Preti, 2014; Scheistrøen et al., 2002)
Behandling – vulva
Primærtumor
- Radikal eksisjon av primærtumor med histologisk fri rand. Utvidet eksisjon i form av skinning for å fjerne dVIN/LS primært anbefales. Behandling av patologisk positive margin er re-eksisjon.(Chan et al., 2007; Nooij et al., 2016; Woelber et al., 2016b; Woelber et al., 2011b).
- Radikal vulvektomi er sjelden indisert og innebærer at hele vulva fjernes. Musculus bulbocavernosus, musculus ischiocavernosus og musculus transversus perinei superficialis fjernes med fri rand.
- Ved affeksjon av eller kort avstand til meatus externum urethra, kan 1–2 cm av urethra reseseres. Ved behov for større reseksjon, konferer med urolog. Primær strålebehandling er et alternativ.
- Ved affeksjon av eller kort avstand (1–2 cm) til sphincter ani, vurderes anleggelse av stomi. Videre behandling kan være kirurgi eller strålebehandling.
- Ved større reseksjoner eller ved stort vevstap kan plastikkirurgisk assistanse ved rekonstruksjon være nødvendig (Aviki et al., 2015).
- Palliativ kirurgi med simpel tumor reseksjon eller palliativ strålebehandling kan vurderes ved kort levetid og komorbiditet.
- Lokalavansert tumor bør vurderes sammen med stråleteam for behandlingsvalg (operasjon, kjemoterapi og/eller stråling). (Ansink & van der Velden, 2000; De Hullu et al., 2002; de Hullu & van der Zee, 2006; Jones & Rowan, 1994).
- Ved resektable lesjoner vurderes ultraradikal kirurgi:
• Vulvectomi
• Lyskeglandeltoilette
• Plastikkirurgisk rekonstruksjon
• Delvis eller full bekkeneksentrasjon kan vurderes i enkelte tilfeller
• Krever team av gyn onkologi, gastro, urologi, og plastikk spes. kompetanse
- Ved resektable lesjoner vurderes ultraradikal kirurgi:
Kjemo/strålebehandling primært eller neoadjuvant er beskrevet, men ikke sammenlignet med kirurgi i randomiserte studier (Scheistrøen et al., 2002).
Inoperable tilfeller
Radikal radiokjemoterapi er førstevalg for inoperable tilfeller (Oonk et al., 2017). Ved St IVB sykdom kan det være aktuelt å gi kjemoterapi alene. Utilstrekkelig data for anbefaling av kjemoterapi regime. Aktuelle kurer: cisplatin/paclitaxel eller cisplatin/5-FU.
Radikal radiokjemoterapi ved lokoregional sykdom
Standard behandling av inoperable lokalavanserte vulva cancer er ekstern strålebehandling med kjemoterapi (Moore et al., 2012; Oonk et al., 2017; Rao et al., 2017).
Det fins ikke randomiserte studier på radikal radiokjemoterapi vs. strålebehandling alene ved vulvacancer. Men utfra studier på plateepitel karsinom i cervix og ØNH med konkomitant kjemoterapi, anbefales også konkomitant kjemoterapi ved strålebehandling ved vulvacancer. Ved definitiv radiokjemoterapi er strålebehandlingen den viktigste komponenten av behandlingen. En bør derfor avstå fra konkomitant kjemoterapi framfor å risikere å avbryte strålebehandlingen hos pasienter med redusert toleranse på grunn av nedsatt allmenntilstand eller komorbiditet.
Kjemoterapi gis i form av cisplatin 40 mg/m2 (maxdose 70 mg) en gang per uke, max 6 ukedoser. Ved nedsatt nyrefunksjon kan ukentlig karboplatin AUC2 brukes som alternativ.
Brakyterapi med interstitiell teknikk som boost mot tumor kan være aktuelt for enkeltpasienter (bl.a. Bartholini cancere). Disse pasientene skal henvises til Radiumhospitalet for vurdering.
Behandlingstid
Vi anbefaler å opprettholde planlagt behandlingsintensitet med 5 behandlinger per uke og unngå pauser i behandlingen. Man er særlig bekymret for at akselerert repopulasjon kan redusere lokal kontroll ved for lange ukompenserte pauser. Ved behandlingspauser gjelder tilsvarende prioritering for kompensasjon som ved cervix, (se avsnitt "Behandlingstid" i kapittel Behandling i primærsituasjonen.
Forberedelser
Fiksering/pasientleie
Det anbefales at hvert stråleterapisenter etablerer standard pasientfiksering i ryggleie med støtte under knærne og bena fiksert. Det anbefales ikke å legge pasientene i frog-posisjon.
Tumor kan eventuelt markeres med blystreng. Ved vekst av tumor inn i vagina kan gullkorn satt inn ved kranielle begrensning hjelpe ved inntegning.
Ved bruk av bolus over vulva anbefales det å plassere bolusen under CT-undersøkelsen for bedre reproduserbarhet ved behandlingen. 5 mm bolustykkelse er som regel tilstrekkelig. Eventuell bolus for å oppnå dose til huden i lysker kan defineres i doseplanleggingssystemet.
Hvis det tas cone-beam CT (CBCT) ved behandling bør denne brukes til å kontrollere plasseringen av bolusen.
Bildeopptak for 3D planlegging
Doseplanleggingen baseres på en CT undersøkelse med intravenøs kontrast. Snitt-tykkelse bør maksimalt være 3mm. Drikkeprotokoll anbefales.
Inntegning av volumer
Inntegning av volumer utføres på bakgrunn av planleggings CT, samregistrerte T2-vektede MR bilder, eventuelt PET-CT og funn ved gynekologisk undersøkelse. Hvis det foreligger en MR i behandlingsposisjon (flatt bord, fiksering), kan denne samregistreres med CT med matching på ben. 3D serie er en forutsetning for en god match. Hvis det ikke foreligger MR med flatt bord/fiksering og en akseptabel match ikke oppnås, må samregistreringen gjøres på bløtvev for veiledning ved inntegning av tumor og på bein ved inntegning av lymfeknuter.
Volumdefinisjoner i dette dokumentet bygger på retningslinjer gitt i StrålevernRapport 9:2012 Volum og doser i ekstern stråleterapi (Levernes, 2012).
Inntegning av risikoorganer
Ved bestråling av vulvacancer bør følgende risikoorgan tegnes inn:
Risikoorgan | Beskrivelse av inntegning |
|---|---|
AnalCanal | Hvis ønskelig |
Bladder | Hele blæren inkludert blæreveggen og blærehalsen. |
Rectum | Rektum inkludert rektumveggen fra anorektal sfinkter til overgangen til sigmoideum. |
Bowel | Ytterkontur av tarmslyngene, inkludert mesenterium (ikke abdominalkavitet, store kar eller muskler) og sigmoideum. |
FemoralHeads | Hoftekulene |
CaudaEquina | Hvis ønskelig |
Urethra | Hvis relevant |
Inntegning av målvolumer ved primær strålebehandling av vulva
I nomenklaturen som benyttes for målvolumene i dette dokumentet, vil indeks p benyttes som en indikasjon på målvolum knyttet til primærtumor, n benyttes som en indikasjon på målvolum knyttet til lymfeknuter (nodes), og e benyttes som en indikasjon på målvolum hvor det ikke er påvist tumor, det vil si områder som skal ha elektiv bestråling. Dette er en nomenklatur som er i tråd med nasjonal anbefaling: Faglige anbefalinger for nomenklatur for volumer i stråleterapi (Levernes, 2019).
Gross Tumor Volume (GTV), Tumorvolum
GTVp_MR: Primærtumor uten margin kan tegnes inn på T2‐vektet MR med støtte fra klinisk undersøkelse.
GVTp_PT: Primærtumor uten margin kan tegnes inn på FDG PET‐CT der denne er tatt i behandlingsposisjon.
GTVn_dose: Patologiske lymfeknuter uten margin tegnes inn på CT eventuelt på en samregistrert MR. Ved inntegning av flere GTVn skal disse nummereres og dose bør angis.
Patologiske lymfeknuter defineres i hovedregel ved hjelp av radiologi. European Society of Urogenital Radiology anbefaler at følgende retningslinjer benyttes (Balleyguier et al., 2011):
- FDG PET positiv
- Og/eller: kortakse større eller lik 1 cm på CT eller MR
- Og/eller: mindre lymfeknuter med patologisk morfologi på MR med en eller flere egenskaper:
- Uregelmessig avgrensning
- Høyt intensitetssignal
- Rund fasong
Dersom histologisk prøve av radiologiske usikre lymfeknuter er mulig, kan dette være aktuelt når diagnostikk har betydning for behandlingsvalg (f.eks primærbehandling med kirurgi vs. radiokjemoterapi).
Clinical Target Volume (CTV), Klinisk målvolum (Gaffney et el., 2016)
CTVp: GTVp_MR + 10mm og korrigeres for naturlige barrierer der det ikke er innvekst.
Avhengig av utbredelse må større marginer vurderes. Faktorer som har vist å gi økt risiko for residiv (Te Grootenhuis et al., 2018) og som kan være argument for større margin er
- dVIN og lichen sclerosus i reseksjonsrand
- Multifokalitet
- FIGO II og høyere
Det kan settes inn gullkorn for å markere øvre avgrensning i vagina.
CTVn: skal minimum inkludere hele lymfekuten på MR og CT. Ekstrakapsulær vekst må tas hensyn til. En typisk margin er 0‐3 mm fra GTVn bortsett fra mot sikre anatomiske barrierer.
CTVe:
- Hele vulva skal inkluderes
- Lymfeknuteregioner (bilateralt):
- Lymfeknutestasjoner i iliaca externa + iliaca interna + obturator + i lysken.
- Ved positive lymfeknuter i bekkenet utvides til aorta bifurkatur.
- Ved innvekst i analkanal/anale sfinkter inkluderes perirektale (mesorektum) samt presakrale lymfeknuter.
- Ved innvekst i anus/analkanal, blære eller rektum: GTV + 2 cm av anorectum/blære.
- Ved innvekst vaginalt: GTV + 3 cm proksimalt (vaginalt). Dersom usikker proksimal utbredelse eller ved LVSI, bør hele vagina inkluderes i CTV.
- Ved periuretrale lesjoner: GTV + 2 cm av uretra. Dersom utbredelse til midtre eller proksimale del av uretra bør hele uretra og blærehals inkluderes i CTV.
- Ved innvekst rundt klitoris: GTV + 2 cm og ligamentum suspensorium som strekker seg helt opp til os pubis
- CTV skal ikke tegnes inn i naturlige barrierer (bein/muskulatur).
- CTVe tegnes i noen områder inn i tarm utfra individuelle vurderinger.
- Volumet skal ligge cirka 5 mm under ytterkonturen hvis ikke det er indikasjon for dosedekning i huden.
Planning Target Volume (PTV), Planleggingsvolum
Hver enkelt avdeling må vurdere sine PTV marginer ut ifra sitt eget behandlingsopplegg og rutiner for posisjonskontroll av behandlingen.
Fraksjonering
Volum | Totaldose EQD2 (α/β =10) |
|---|---|
CTVe | 45 Gy |
CTVn_pelvis | 59 Gy |
CTVn_groin | 66 Gy |
CTVp | 66–69 Gy |
Det anbefales å gi den ønskede dosen til CTV- volumene med 28 fraksjoner, i alle fall ved totaldoser over 66 Gy, da det er lite erfaring med fraksjonsdoser høyere enn 2.4 Gy. Individuell vurdering av dosenivå ut fra størrelse og beliggenhet av patologiske lymfeknuter kan være fornuftig.
Volumnavn | Fraksjonsdose | Nominell totaldose | Totaldose EQD2 (α/β =10) |
|---|---|---|---|
CTVe_48 | 1.7 Gy | 47.6 Gy | 46.4 Gy |
CTVn_pelvis_59 | 2.1 Gy | 58.8 Gy | 59.3 Gy |
CTVn_groin_64 | 2.3 Gy | 64.4 Gy | 66.0 Gy |
CTVp_67 | 2.4 Gy | 67.2 Gy | 69.4 Gy |
Beregningsalgoritmer og energi
Her benyttes tilsvarende som for livmorhalskreft (se avsnitt "Beregningsalgoritmer og energi" i kapittel Behandling i primærsituasjonen.
Strålebehandlingsteknikker
Intensitetsmodulert strålebehandling (IMRT) eller intensitetsmodulert buebehandling (VMAT) med simultanintegrert boost bør benyttes.
Normering
Ved kun ett dosenivå anbefales det å normere til median i PTV eller CTV.
Ved flere dosenivåer med simultanintegrert boost er en mulighet å normere til median i et volum som består av PTV/CTVe der PTV til høyere dosenivå er ekskludert.
En alternativ mulighet er å normere til D98 til CTV til det høyeste dosenivået.
Dosefordeling i CTVn
Det kan brukes en dosefordeling for lymfeknuteboost som tar hensyn til sannsynligheten for dosedekning (Pötter et al., 2018). Det vil si at det antas at CTVn oppholder seg mer i det sentrale området enn i kanten av PTVn. Som følge av dette er målet å oppnå en heterogen dose i PTVn med sentraldose høyere enn 100 % og dose i kanten til 90 %. Det er ønskelig å eskalere sentral del av GTVn til for eksempel D50 > 102 %, samtidig som øvre grense på 107 % respekteres.
Dosevolumkrav og ønsker til målvolumene
Volum | Dosevolum krav | Dosevolum ønske |
|---|---|---|
CTVe | D99.9 > 95 % | |
CTVn | D98 > 100 % | D50 > 102 % |
CTVp | D99.9 > 95 % | |
PTVe | D98 > 95 % DMaks < 107 % * |
|
PTVn | D98 > 90 % DMaks < 107 % * |
|
PTVp | D98 > 95 % DMaks < 107 % |
|
* Maksdosekravene gjelder hvis det ikke er målvolum som skal til høyere dose.
Toleransedoser for risikoorgan
Normalvevstoleranse handler ikke bare om dosenivåer, men ofte også om hvor stort volum som blir bestrålt til hvilken dose. Karakteristikken på denne dose-volum-sammenhengen varierer mellom ulike organer.
EMBRACE2 er en studie for livmorhals kreft der dosevolumkrav og ønsker for risikoorgan er angitt. Det anbefales å benytte en del av disse også ved vulva cancer. Erfaringsmessig kan ofte en del av disse dosevolumønskene oppfylles for vulva. Det et ikke alltid mulig å oppfylle ønskene, men parameterene kan likevel være nyttige ved optimalisering av doseplanen.
Organ | Dosevolum ønske |
|---|---|
Bowel | V40 Gy < 250 ccm V30 Gy < 500 ccm |
Bladder | V40 Gy < 60 % V30 Gy < 80 % |
Rectum | V40 Gy < 75 % V30 Gy < 95 % |
FemoralHead | DMaks < 50 Gy |
Body | DMaks < 107 % |
Når alle dosevolumkrav og ønsker ikke er mulig å oppfylle anbefales det å benytte følgende prioritering:
- PTV
- Rectum
- Bowel
- Bladder
- FemoralHead
Denne prioriteringen er generell, og bør vurderes for hver pasient.
Gjennomføring av behandlingen
Det er vanlig å posisjonere pasienten etter påtegninger/tatoveringer på hud og/eller ved hjelp av overflateskanningssystemer.
Det anbefales at det gjennomføres daglig bildematch på skjelettstrukturer og posisjoneringskorreksjon før behandling. Hvis det er mulighet for å korrigere bord for pitch, roll og rotasjon, gjøres dette.
Hvis det tas cone beam CT (CBCT), anbefales det å benytte denne til å kontrollere bolusplasseringen i de tilfellene bolus benyttes.
Ved endret anatomi i løpet av strålebehandlingen må replanlegging vurderes. Ødem i lyske er en vanlig årsak til endret anatomi for denne pasientgruppen.
Behandling – lymfeknuter
Hovedprinsipper
Inguinal lymfeknuteekstirpasjon er ikke indisert hvis stromal invasjon er ≤ 1 mm (Ansink & van der Velden, 2000; Chan et al., 2007; de Hullu et al., 2006; Iversen et al., 1981; Jones & Rowan, 1994; Micheletti & Preti, 2014; Pouwer et al., 2017; Scheistrøen et al., 2002; Woelber et al., 2011b).
- inguinofemoral lymfadenectomi gir mindre lyskeresidiv og bedre overlevelse enn primær strålebehandling (de Hullu & van der Zee, 2006; Micheletti et al., 2005; van der Velden et al., 2011; Woelber et al., 2011a).
- Patologiske lymfeknuter i bekken > 2 cm bør fjernes.
Ved forstørrede og cytologisk/patologisk bekreftet lymfeknutemetastase i lysker, er optimal behandling usikkert, men vi anbefaler inguinofemoral lymfadenectomi inntil videre kunnskap foreligger (Oonk et al., 2017).
- Radikal inguinofemoral lymfadenectomi gjøres ved å åpne femoralistriangelen og fjerne de overfladiske og dype inguinofemorale lymfeknutene.
- Lyskedren etter lymfadenectomi beholdes i minst 2 dager og fjernes når produksjon < 30 ml/døgn (senest etter 1 måned).
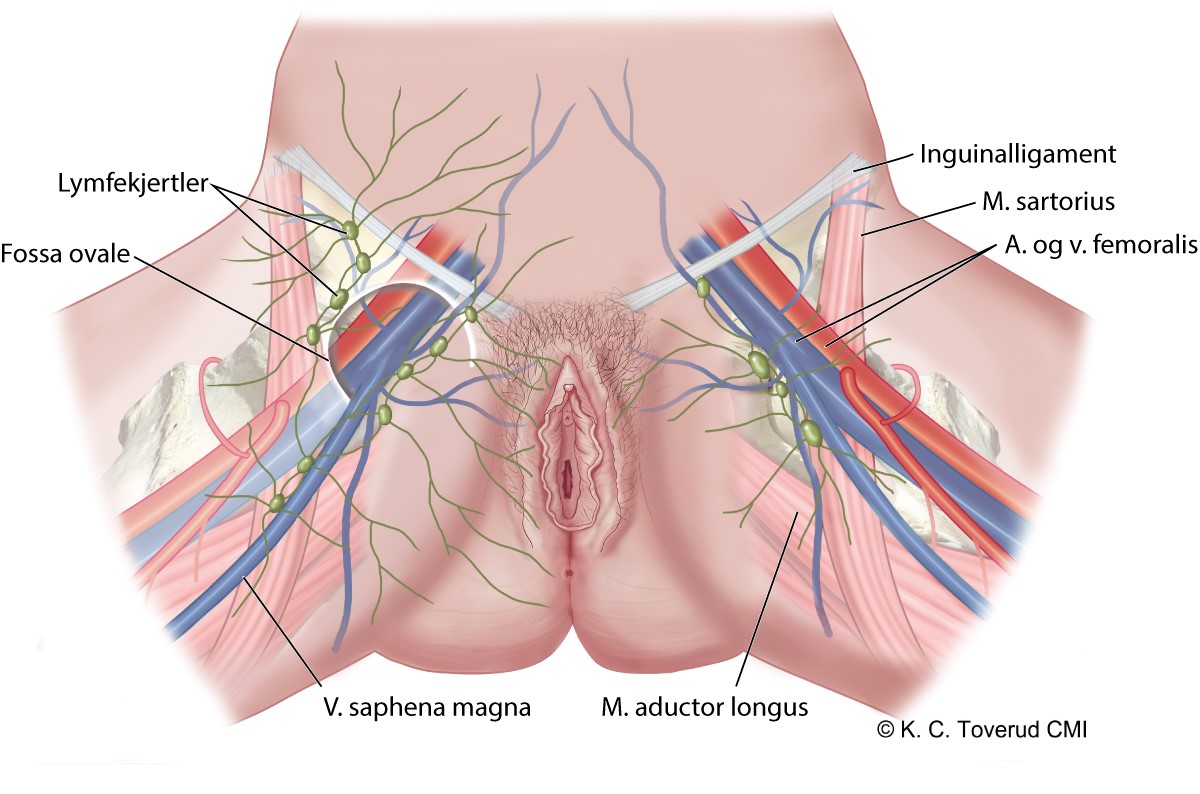
Sentinel node (SN)-vaktpostlymfeknute-teknikk
Bør kun brukes ved senter med kirurgisk erfaring og histopatologisk kompetanse.
Indikasjon: Unifokal tumor <4 cm og invasjon > 1 mm uten suspekte lymfeknuter (Ansink & van der Velden, 2000; Coleman et al., 2013; de Hullu & van der Zee, 2006; Hauspy et al., 2007; Lawrie et al., 2014; Levenback et al., 2001; Levenback et al., 2004; Levenback et al., 2012; Oonk et al., 2010; Pouwer et al., 2017; Robison et al., 2014; Stehman et al., 1992; Woelber et al., 2011b).
- SN ipsilateralt ved lateralt lokalisert tumor (>1 cm fra midtlinje).
- SN bilateralt ved midtlinje lokalisert tumor (≤ 1 cm fra midtlinje).
- Ved mislykkes SN prosedyre, bør bilateralt inguinofemoral lymfadenectomi utføres hvis tumor krysser midtlinje. Kontralateralt inguinofemoral lymfadenectomi kan unnlates hvis tumor ikke krysser midtlinje.
- Ved positiv SN > 2 mm bør ipsilateralt inguinofemoral lymfadenectomi utføres. Dersom negativ SN i kontralaterale lyske, kan inguinofemoral lymfadenectomi unnlates her. Teknisk utførelse:
- Pr i dag anvendes både radioaktivt Technetium99 og methylenblått intracutant rundt tumor.
- Lymfescintigrafi vurderes for å identifisere lokalisasjon og antall SN.
Histologisk us av SN: Følger de Europeiske retningslinjer for behandling av vulva cancer (Oonk et al., 2017).
- De uttatte lymfeknutene fikseres i formalin før makrobeskjæring (ikke frysesnitt).
- Ultrastaging med serieavsnitt på nivå på minst hver 200um. Hvis H&E negativ, bør immunohistokjemi undersøkelse utføres.
- SN måles og todeles i hilus, begge halvdeler legges i samme brikett. En brikett per SN. Ved store SN snittes det hver 3 mm på tvers av lymfeknuten gjennom hilus; alt innstøpes. Angi om snittflaten er metastasesuspekt
- Dersom det ikke påvises metastaser med lysmikroskopi bestilles dypere snitt og immunfarginger (se figur 8.7). Ved OUS benyttes CK 5 ved immunhistokjemisk us.
- Dersom man finner metastase skal største diameter måles, angi om det er perinodal infiltrasjon. Lymfadenectomi utføres.
- Prosedyre for histologisk undersøkelse av SN. (IHC = immunhistokjemi)
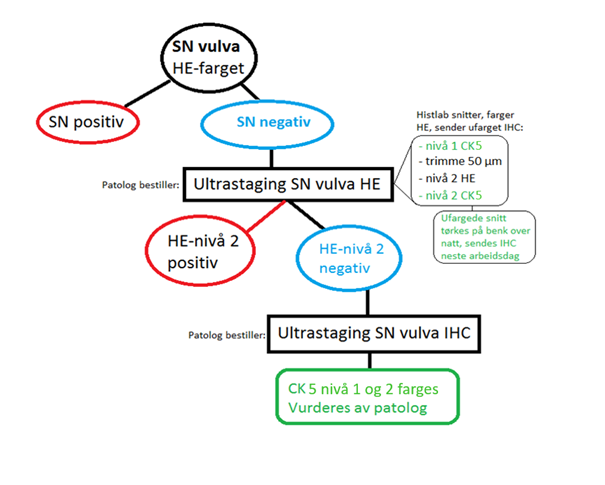
Adjuvant behandling
Adjuvant strålebehandling startes så fort som mulig, og helst innenfor 8-10 uker postoperativt. Det er usikkert om det har noen verdi, hvis det utsettes utover 12 uker postoperativt. En studie har vist at hvis tiden fra operasjonsdato til avsluttet adjuvant strålebehandling overstiger 105 dager faller median total overlevelse. (Oonk et al., 2023; Ashmore et al., 2021)
Indikasjoner:
Ekstern strålebehandling mot lymfeknutestasjoner inguinalt og iliacalt evnt med kjemoterapi gis ved:(Ansink & van der Velden, 2000; Chan et al., 2007; de Hullu & van der Zee, 2006; Jones & Rowan, 1994; Levenback et al., 2004; Mahner et al., 2012; Oonk et al., 2010; Oonk et al., 2021; Robison et al., 2014; Scheistrøen et al., 2002; van der Velden et al., 2011; Woelber et al., 2011a; Woelber et al., 2011b):
- Positiv SN ≤ 2mm eller isolert tumor celler (ITC) etter SN ekstirpasjon
- Positive inguinofemorale lymfeknuter etter glandeltoalett:
- Ved 2 eller flere inguinofemorale lymfeknutemetastaser
- En lymfeknute med perinodal vekst
- Ved histologisk positive iliacale lymfeknuter.
Ekstern strålebehandling mot vulva gis ved:
- Positiv reseksjonskant på fiksert preparat der videre re-reseksjon ikke er mulig.
- Ved knapp rand med uttalt LVSI, perinevral infiltrasjon eller positive lymfeknuter kan postoperativ radiokjemoterapi mot vulva vurderes ut fra en individualisert vurdering (skal diskuteres multidisplinært). Det finnes ingen etablert grense for antall millimeter knapp rand i slike tilfeller.
Ved indikasjon for strålebehandling av lysker/bekken, men hvor det er operert fritt i vulva, skal vulva som hovedregel utelates fra strålefeltet (Gaffney et al., 2016). Tilleggsfaktorer som tumorstørrelse, multifokalitet og dVIN/lichen sclerosus i reseksjonskant vil favorisere tillegg av strålebehandling (Yap et al., 2016). Andre tilleggsfaktorer kan være diffus LVSI og/eller perinevral infiltrasjon. Nedsatt allmentilstand vil være argument for å avstå fra det. I praksis vil et lokalt residiv i vulva være vanskelig å rebestråle hvis begge lysker er bestrålt tidligere og dette må tas med i betraktningen. Man ender derfor som regel opp med en total vurdering av risikoforhold og fare for lokalt residiv målt opp mot toksisitet ved å inkludere vulva ved denne problemstillingen. For hvilke lymfeknutestasjoner som skal inkluderes se under CTVe under.
Konkomitant kjemoterapi, vanligvis ukentlig cisplatin 40 mg/m2, max 70 mg, vurderes for pasienter i god allmentilstand.
Behandlingstid og forberedelser inkludert fiksering/pasientleie og bildeoppdak for 3D planlegging er tilsvarende som ved Radikal radiokjemoterapi ved lokoregional sykdom, se avnitt "Radikal radiokjemoterapi ved lokoregional sykdom" ovenfor.
Inntegning av volumer
Inntegning av volumer utføres på bakgrunn av planleggings CT, samregistrerte T2-vektede MR bilder, eventuelt PET-CT og funn ved gynekologisk undersøkelse. Hvis det foreligger en MR i behandlingsposisjon (flatt bord, fiksering), kan denne samregistreres med CT. 3D serie er en forutsetning for en god match. Hvis det ikke foreligger MR med flatt bord/fiksering og en akseptabel match ikke oppnås, må samregistreringen gjøres på bløtvev for veiledning ved inntegning av tumor og på bein ved inntegning av lymfeknuter.
Volumdefinisjoner i dette dokumentet bygger på retningslinjer gitt i Strålevern Rapport 9:2012 Volum og doser i ekstern stråleterapi (Levernes, 2012).
Inntegning av risikoorganer
Tilsvarende som ved Radikal radiokjemoterapi ved lokoregional sykdom, se avnitt "Radikal radiokjemoterapi ved lokoregional sykdom" ovenfor.
Inntegning av målvolumer ved adjuvant strålebehandling av vulva
I nomenklaturen som benyttes for målvolumene i dette dokumentet, vil indeks sb benyttes som en indikasjon på målvolum knyttet til tumortomt etter kirurgi, n benyttes som en indikasjon på målvolum knyttet til lymfeknuter (nodes), og e benyttes som en indikasjon på målvolum hvor det ikke er påvist tumor, det vil si områder som skal ha elektiv bestråling. Dette er nomenklatur som er i tråd med nasjonal anbefaling: Faglige anbefalinger for nomenklatur for volumer i stråleterapi (Levernes, 2019).
Gross Tumor Volume (GTV), Tumorvolum
Clinical Target Volume (CTV), Klinisk målvolum
CTVsb: Tumorseng ved ufri rand i vulva samt fjernet lymfeknute med perinodal vekst. Evt. serom i tilslutning skal som hovedregel inkluderes.
CTVe:
- Hele vulva skal inkluderes ved ufri rand. Ved indikasjon for lyskebestråling alene skal vulva som hovedregel ikke inkluderes.
- Lymfeknuteregioner som skal inkluderes er:
- Lymfeknutestasjoner i iliaca externa + iliaca interna + obturator + i lysken.
- Ved positive lymfeknuter i bekkenet utvides til aorta bifurkatur.
- Ved innvekst i analkanal/anale sfinkter inkluderes perirektale (mesorektum) samt presakrale lymfeknuter.
- Ved indikasjon for strålebehandling i én lyske og der det ikke er indikasjon for strålebehandling av vulva skal kontralateral lyske og bekken utelates (Jackson et al., 2006).
- Ved indikasjon for strålebehandling av vulva og én lyske bør som hovedregel også kontralateral lyske inkluderes i strålefeltet. Unntaket kan være ved strikt lateraliserte svulster (Oonk et al., 2017; Woelber et al., 2016a).
- Evt gjenværende patologiske lymfeknuter (CTVn) skal inkluderes.
- CTV skal ikke tegnes inn i naturlige barrierer (bein/muskulatur).
- CTV tegnes i noen områder inn i tarm utfra individuelle vurderinger.
- Volumet skal ligge cirka 5 mm under ytterkonturen hvis ikke det er indikasjon for å dosedekning i huden.
Planning Target Volume (PTV), Planleggingsvolum
Hver enkelt avdeling må vurdere sine PTV marginer ut i fra sitt eget behandlingsopplegg og rutiner for posisjonskontroll av behandlingen.
Fraksjonering
Volum | Totaldose EQD2 (α/β =10) |
|---|---|
CTVe | 45 Gy |
CTVsb | 59 Gy |
Det anbefales å gi den ønskede dosen til CTV- volumene med 25 fraksjoner.
CTVsb inkluderer tumortomt ved ufri rand.
Volum | Fraksjonsdose | Nominell totaldose | Totaldose EQD2 (α/β =10) |
|---|---|---|---|
CTVe_45 | 1.8 Gy | 45.0 Gy | 44.3 Gy |
CTVsb_58 | 2.3 Gy | 57.5 Gy | 58.9 Gy |
Beregningsalgoritmer og energi
Her benyttes tilsvarende som for livmorhalskreft.
Strålebehandlingsteknikker
Intensitetsmodulert strålebehandling (IMRT) eller intensitetsmodulert buebehandling (VMAT) med simultanintegrert boost bør benyttes.
Normering
Det anbefales å normere til median i PTV eller CTV som skal til høyest dose.
Dosevolumkrav og ønsker til målvolumene
Volum | Dosevolum krav | Dosevolum ønske |
|---|---|---|
CTV | D99.9 > 95 % | |
PTV | V98 > 95 % DMaks < 107 % * |
|
* Maksdosekravene gjelder for det målvolumet som skal til høyeste dose.
Toleransedoser for risikoorgan
Tilsvarende som ved radikal radiokjemoterapi ved lokoregional sykdom, se avnitt "Radikal radiokjemoterapi ved lokoregional sykdom" ovenfor.
Gjennomføring av behandlingen
Tilsvarende som ved radikal radiokjemoterapi ved lokoregional sykdom, se avnitt "Radikal radiokjemoterapi ved lokoregional sykdom" ovenfor.
Komplikasjoner
Sist faglig oppdatert: 05202405.07.2024
Tidlige:
- Infeksjon (Gaarenstroom et al., 2006)
- Sårruptur 20–40 %
- Blødning
- Nekrose
Sene:
- Dyspareuni
- Lymfocele
- Lymfødem 30–70 %
- Infeksjon, erysipelas
- Vannlating/avføringsproblem
Behandling av residiv
Sist faglig oppdatert: 05202405.07.2024
Målsetning er kurasjon eller palliasjon med lokal kontroll. Inklusjon i studier tilstrebes (De Hullu et al., 2002). Residiv må verifiseres histologisk og suppleres med bildediagnostikk.
Kirurgi
Residiv i vulva:
- Kirurgi hvis mulig. Ved kirurgi i tidligere bestrålt vev er det ofte behov for plastikkirurgisk kompetanse for å rekonstruere med friskt vev.
- Ved stromainfiltrasjon > 1 mm og SN ekstirpasjon tidligere, anbefales lyskeglandeltoilette.
- Ved residiv i motsatt side i vulva, hvor SN ekstirpasjon ikke ble utført ved primær operasjon, kan SN ekstirpasjon vurderes.
Residiv i lysker:
- Radikal eksisjon hvis mulig, deretter postoperativ stråling for strålenaive pasienter.
Strålebehandling
- Strålebehandling kan vurderes hos strålenaive pasienter som ved primærbehandling.
- Lokale eller regionale residiv etter tidligere radikal operasjon kan i noen tilfeller kureres med radikal strålebehandling. Pasientene behandles da som beskrevet under radikal radiokjemoterapi ved lokoregional sykdom.
- Strålebehandling ved residiv andre steder i kroppen vil ikke bli omhandlet i dette handlingsprogrammet.
Kjemoterapi
Det kan være aktuelt å gi kjemoterapi alene. Utilstrekkelig data for anbefaling av kjemoterapi regime. Aktuelle kurer: cisplatin/paclitaxel eller cisplatin/5-FU.
Palliativ strålebehandling
Sist faglig oppdatert: 05202405.07.2024
Palliativ strålebehandling kan være aktuelt både i primær situasjon og ved residiv eller metastaser. Behandlingen gis med det formål å redusere eller forebygge smerter, blødninger, sekresjon, trykksymptomer, tarm- eller urinveisstenoser eller hudplager. Strålebehandling bør tilbys liberalt ved lokale plager. Samtidig må omfanget av akutte bivirkninger ved denne type behandling nøye veies opp mot antatt symptomlindring for pasienten.
For generelle betraktninger (herunder fraksjonering) rundt palliativ strålebehandling vises det til tilsvarende kapittel for cervixcancer.
Andre histologiske typer
Sist faglig oppdatert: 05202405.07.2024
Malignt melanom
Henviser til kap. 12.3 Melanom i genitaltractus i Nasjonalt handlingsprogram med retningslinjer for maligne melanomer
Utredning og behandling skal konfereres med melanomansvarlig (plastikk-kirurg, onkolog).
Sarkom
Individualisert behandling. Korrekt utført primærkirurgi er avgjørende for sluttresultat og overlevelse. Konferer sarkomansvarlig.
Bartholinikarsinom (adenokarsinom)
- Hevelse og lokal ømhet kan være vanskelig å skille fra benign bartholinitt.
- Ultralyd kan forsøkes, vær liberal med biopsi, spesielt hos kvinner over 45 år.
- Pga. tumorlokalisasjon ofte vanskelig å oppnå fri kant, derfor skal alle vurderes sammen med stråleonkolog mtp. interstitiell strålebehandling istedenfor kirurgi. Konferer DNR.
Pagets sykdom
- Invasiv komponent er sjelden. Spredning ofte okkult utenfor den synlige lesjonen.
- Nøye biopsitagning for å sikre diagnose og avdekke områder med infiltrasjon.
- Fotodokumentasjon må foreligge, gjentas ved hver kontroll.
- Behandling (Edey et al., 2013):
Hyppig residiv er vanlig, og behovet for kirurgi bør derfor vurderes bl.a. ift. pasientens symptomer. Kirurgi av overfladisk type, skinning og eksisjoner er anbefalt brukt, ikke evidensbekreftet. Annen behandling forsøkt uten sikker effekt: Imiquimod, fotodynamisk terapi og CO2 laser.
Prognose
Sist faglig oppdatert: 05202405.07.2024
5-års totaloverlevelse for plateepitelkarsinom
Basert på FIGO stadium (Beller et al., 2006; FIGO (International Federation of Gynecology and Obstetrics) 26th Annual Report on the Results of Treatment in Gynecological Cancer, 2006)
Stadium I : 90 % (Ia 98 %, Ib 88 %)
Stadium II: 81 %
Stadium III: 68 %
Stadium IV: 20 %
Residiv: 25–35 %
5-års overlevelse for ikke-plateepitel vulvacancer
- Bartholini cancer 64,5 % (Beller et al., 2006; FIGO (International Federation of Gynecology and Obstetrics) 26th Annual Report on the Results of Treatment in Gynecological Cancer, 2006)
- Melanom 61,9 %
- Adenokarsinom 32,5 %
Livskvalitet og seksuell helse etter behandling
Sist faglig oppdatert: 05202405.07.2024
Behandling medfører ofte fysiske og psykiske utfordringer for pasientene. Livskvalitet og psykososiale utfordringer bør adresseres ved kontroller. Viktig med god informasjon om mulige bivirkninger og behandlingsmuligheter (f. eks. lymfødem, blære-/tarmproblemer etter stråleterapi m. fl.). Seksuell dysfunksjon er ikke uvanlig og det bør vurderes henvisning til sexologisk rådgiver (Björkholm, 2000; Carter et al., 2021; Malandrone et al., 2021).
Palliativ behandling – Nasjonalt handlingsprogram
Sist faglig oppdatert: 05202405.07.2024
Helsedirektoratet har utgitt Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen (2019) med anbefalinger om palliativ behandling for kreftpasienter.
Oppfølging og kontroller
Sist faglig oppdatert: 05202405.07.2024
Individualiseres (alder og komorbiditet).
- Veiledende intervall for oppfølging:
- 1. året – hver 3. måned
- 2. året – hver 6. måned
- > 24 måneder – årlig inntil 5 år. Pasienter og fastleger bør informeres om mulighet for sene residiv. Ta kontakt ved symptomer.
Kolposkopi, biopsi ved suspekte lesjoner, palpasjon av lysker.
Bruk av billeddiagnostikk i oppfølging etter individuell vurdering. For pasienter som er behandlet med radiokjemoterapi med kurativ intensjon anbefales MR ved første kontroll (3 mnd) da resttumor kan være aktuell for kirurgi
Pasienter som har gjennomgått behandling for vulvacancer kan ha seneffekter av ulik alvorlighetsgrad og med ulik grad av innvirkning på den enkelte kreftoverlever. Seneffektene kan være av somatisk, psykisk eller sosial art. Oppfølgingen av disse pasientene bør derfor i stor grad individualiseres og må bør tilstrebe tverrfaglig samarbeid der kompleksiteten tilsier det.
Vulvar intraepitelial neoplasi (VIN)
Bakgrunn
Sist faglig oppdatert: 28202128.06.2021
Klassifisering av vulvar intraepitelial neoplasi (VIN) er endret i tråd med ny kunnskap. WHO-klassifiseringen er oppdatert i 2020 erstatter International Society of the Study of Vulvar Diseases (ISSVD)-klassifiseringen.
I henhold til WHO 2020 klassifiseringen skal VIN inndeles i HPV-assosiert VIN (lavgradig og høygradig VIN) og ikke HPV-assosiert VIN (dVIN), sistnevnte også høygradig og med stort malignitetspotensiale (R.J. Kurman et al., 2014).
Definisjon
Sist faglig oppdatert: 28202128.06.2021
Vulva intraepiteliale forandringer i plateepitel med ukjent malignitetspotensiale.
ICD-10
| D07.1 | Carsinoma in situ i ytre kvinnelige kjønnsorgan |
| ISSVD (2003) | ISSVD (2004) | WHO 2020 |
|---|---|---|
| VIN 1 | Flatt kondylom | Lavgradig VIN – HPV-assosiert |
| VIN 2 | Usual VIN | Høygradig VIN – HPV-assosiert |
| VIN 3 | Usual VIN | Høygradig VIN – HPV-assosiert |
| Differensiert VIN (simplex VIN) | Differensiert VIN | dVIN – ikke HPV-assosiert VIN |
Ifølge WHO (R.J. Kurman et al., 2014) svarer lavgradig VIN til aktiv infeksjon med både lavrisiko og høyrisiko HPV-virus, og vil ikke bli omtalt videre her.
HPV-assosiert VIN og ikke HPV-assosiert VIN er grunnleggende forskjellige m.h.t.:
- Epidemiologi
- Etiologi
- Klinikk
- Patologi
- Molekylære analyser
- Onkologisk potensiale
Forekomst
Sist faglig oppdatert: 28202128.06.2021
HPV-assosiert VIN: Økende, spesielt hos yngre kvinner.
75 % er kvinner under 50 år (Up to date)
dVIN: ukjent, sannsynlig 5–10 % av VIN, sjeldent forekommende (Kokka, Singh, Faruqi, Gibbon, & Rosenthal, 2011).
Høyest forekomst hos kvinner > 70 år
Forekomst av VIN (både HPV-assosiert VIN, men spesielt dVIN) i Norge er antatt underdiagnostisert og underrapportert til Kreftregisteret.
Prognose
Sist faglig oppdatert: 28202128.06.2021
Studier har ikke differensiert mellom HPV assosiert høygradig VIN og differensiert VIN.
Majoriteten av VIN er HPV assosiert høygradig VIN (ca. 2/3) (Jones, Rowan, & Stewart, 2005).
HPV assosiert høygradig VIN har en klart bedre prognose enn differensiert VIN (Jones et al., 2005).
Naturlig forløp kan variere (HPV assosiert høygradig VIN): persistens, progresjon eller regresjon (van Seters, van Beurden, & de Craen, 2005). Progresjon av HPV assosiert høygradig VIN til cancer 9–18 % (van Seters et al., 2005).
80 % av cancertilfelle utgjøres av dVIN.
Cancer etter VIN behandling: 4–8 % (Holschneider, 2014).
Etiologi
Sist faglig oppdatert: 28202128.06.2021
HPV assosiert høygradig VIN er hyppigst relatert til HPV 16 (i mer enn 70 % WHO), 18 og 31
dVIN er ikke HPV-relatert, usikker etiologi, ofte på basis av lichen sclerosus (Terlou, Blok, Helmerhorst, & van Beurden, 2010).
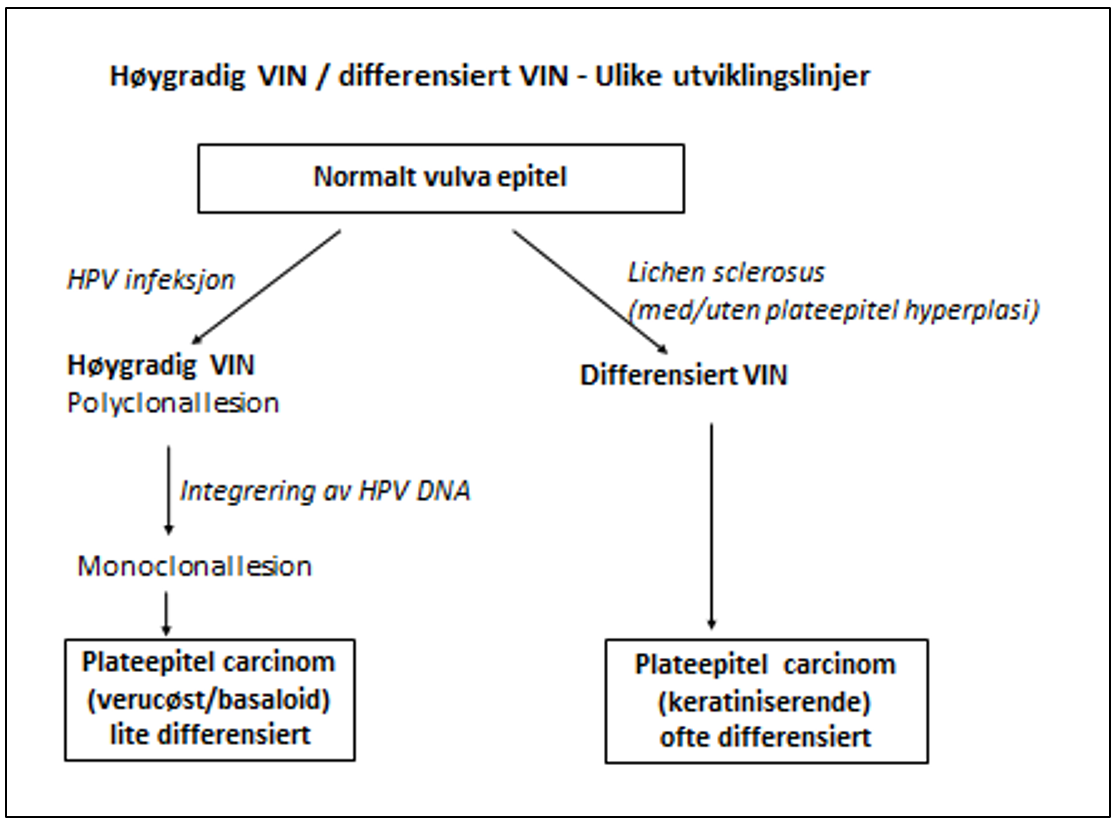
Risikofaktorer
Sist faglig oppdatert: 28202128.06.2021
| Høygradig VIN: | HPV (Srodon et al., 2006) |
|
| Røyk (Jones, 2001) |
|
| Immunsuppresjon (Holschneider, 2014) |
| Differensiert VIN: | Lichen sclerosis (risk for cancer 2–5 %) ref GFD og lichen planus |
Histologi
Sist faglig oppdatert: 28202128.06.2021
Viktig å skille HPV assosiert høygradig VIN og dVIN grunnet ulikt malignt potensiale (Preti, Van Seters, Sideri, & Van Beurden, 2005; Terlou et al., 2010).
HPV assosiert høygradig VIN og dVIN har ulik morfologi.
HPV assosiert høygradig VIN
3 subtyper (basaloid, verucøs, mixed) > 90 %.
Karakterisert ved:
- Modningsforstyrrelse i plateepitel
- Cellulær atypi: hyperkromasi, pleomorfe nuclei, atypiske mitoser
P53 er negativ. Immunhistokjemisk farging med p 16 er diffust uttrykt, og Ki-67 er uttrykt oppover i epitelet.
dVIN
Karakterisert ved:
- Basal celleatypi
- Differensiering
- Ofte hyperkeratose
Immunhistokjemisk farging med p 53 kan være nyttig, er positiv i basale lag. P16 er negativ. Proliferasjonsmarkør Ki-67 er sterkt uttrykt basalt og parabasalt, men ikke oppover i epitelet.
Diagnosen dVIN kan være vanskelig å stille, ettersom forandringene er mer subtile. Oppstår ofte på basis av lichen sclerosis, og kan sees i kanten av vulva cancer 5 %.
Diagnostikk
Sist faglig oppdatert: 28202128.06.2021
Symptomer
- Kløe
- brenning, sårhet, dysparenui, dysuri
- Mange asymptomatiske
Pasienter med HPV assosiert høygradig VIN har ofte CIN/kondylomer i sykehistorien.
60 % med VIN/VAIN har eller har hatt CIN forandringer (Hørding, Junge, Poulsen, & Lundvall, 1995).
Pasienter med dVIN har ofte en lang historie med kløe og/eller brennende følelse i vulva.
dVIN forekommer som oftest hos eldre med lichen sclerosis (Preti et al., 2005).
Kliniske funn
Ved inspeksjon og palpasjon av vulva og lysker:
- Fargeforandringer, leukoplakier, pigmenterte lesjoner
- Hudfortykkelse, tumor
- Sårdannelse, sår som ikke gror
HPV assosiert høygradig VIN finnes ofte flere steder (multifokale lesjoner og multisentriske) i vulva, vagina, cervix, perineum og anus (VIN, VAIN, CIN, AIN).
d VIN er ofte unifokale og unisentriske lesjoner.
Undersøkelser
- Vulvaundersøkelse med kolposkopi (vulva, perineum, perianalt, vagina, cervix)
- eksplorasjon
- Bildedokumentasjon og/eller tegning
- Eddiksyre 2–5 % må appliseres minimum 5 minutter før undersøkelse (Ferris, Cox, O'Connor, Wright, & Foerster, 2004).
- Biopsi (Stansebiopsi er egnet i vulva, biopsitang vaginalt, ta flere for å kartlegge omfanget).
Lav terskel for undersøkelse i narkose for optimale forhold.
Tas for å bekrefte mistanke om VIN, for å skille mellom HPV assosiert høygradig VIN og dVIN og for å utelukke cancer.
Tas både av lesjoner som blir avfarget og ikke, likeledes røde eller pigmenterte lesjoner (Obs! mikropapillae som avfarges er normalt). Mistenk invasiv vekst når du ser: -
- Ulcerasjon
- Tumor
- Infiltrasjon
- Leukoplaki
- Vevsfortykkelse
VaIN
Det er en svært sjelden tilstand. VaIN ses ofte sammen med annen dysplasi i nedre genitalia, fordi HPV-assosierte lesjoner ofte er multifokale og multisentriske.
50–90 % av pasientene med VaIN har hatt eller har dysplasi i cervix eller vagina (Holschneider & Berek, 2021).
Definisjon/histologi
VaIN er definert som vaginal intraepitelial neoplasi. Tilstedeværelse av atypiske plateepitelceller i vaginalt sylinderepitel uten invasjon.
VaIN 1 og 2 involverer nedre 1/3 og 2/3 av epitelet.
VaIN involverer mer enn 2/3 av epitelet.
Insidens
Insidensen av VaIN er estimert til 0,2-0,3 tilfeller pr. 100 000 kvinner (USA).
Hos kvinner som er hysterektomert for CIN er insidensen for senere utvikling av VaIN 2+ på 7,4 %.
Risikofaktorer
HPV er den vanligste årsaken til VaIN.
HPV 16 og HPV 18 er dominerende.
HPV-vaksine er derfor forebyggende for utvikling av VaIN.
Andre predisponerende faktorer:
- Immunsuppresjon
- Røyking
Risikoen for at VaIN skal utvikle seg til kreft er ikke helt klarlagt, men enkelte studier viser en risiko mellom 2–8 %.
Symptomer/Undersøkelse
VaIN er vanligvis asymptomatisk. VaIN oppdages oftest ved en kolposkopisk undersøkelse pga en unormal cytologi.
Majoriteten av VaIN-lesjoner er lokalisert i øvre 1/3 av vagina, og multiple lesjoner ses hos over 50 % av pasientene. Undersøkelsen innebærer derfor en grundig kolposkopisk undersøkelse etter applisering av hele vagina med 5 % edikksyre. Multiple biopsier kan bli nødvendig og undersøkelse i narkose kan være indisert.
Hos postmenopausale kvinner anbefales lokale østrogenpreparater i et par uker før undersøkelsen.
Behandling
Målet med behandlingen er å forebygge progresjon med minimalt behandlingssekvele. Behandling av VaIN er en spesialistoppgave og pasienter bør henvises til regionalt senter med kompetanse på aktuell behandling.
Lavgradige lesjoner/VaIN 1 (LSIL) trenger ingen behandling. Disse lesjonene er ofte et resultat av infeksjon med ikke-onkogene subtyper av HPV eller atrofi som vil kunne gå i spontan regress. Det anbefales kontroller.
Biopsiverifiserte høygradige lesjoner/VaIN 2 og 3 (HSIL) skal behandles enten med eksisjon eller ablasjon.
Eksisjon innebefatter vid lokal eksisjon, partiell vaginektomi eller total vaginektomi.
Ablasjon kan gjøre med CO2-laser.
Medisinsk behandling: Imiquimod, Fluorouracil.
Det kan ofte være nødvendig med flere runder med behandling.
Kontroll
Pasienter skal følges med kontroller etter behandling. Recidivfrekvensen av VaIN 3 er på 31 % og recidiv frekvensen VaIN 2 er 57 %.
Differensialdiagnoser
Sist faglig oppdatert: 28202128.06.2021
- Kondylomer
- Lichen sclerosus. Viktig å behandle for å redusere risiko for utvikling av dVIN.
- Lichen planus
- Eksematøse hudsykdommer
- Benigne sår/fissurer/rhagader
- Candida vulvovaginitt
- Psoriasis
- Herpes genitalis
- Paget’ sykdom – en premalign tilstand som utgår fra sylinderepitel (ikke plateepitel)
- Malignt melanom
- Adenokarsinom
- Basalcellekarsinom
- Sarkom
- Metastaser
Forebygging
Sist faglig oppdatert: 28202128.06.2021
Profylaktisk HPV-vaksinering er vist å redusere forekomsten av HPV relaterte anogenitale lesjoner (Hampl, Sarajuuri, Wentzensen, Bender, & Kueppers, 2006; G. G. Kenter et al., 2009; Muñoz et al., 2010). Det gis ikke refusjon på vaksinen.
Behandling
Sist faglig oppdatert: 28202128.06.2021
Mål:
- Lindre symptomer
- Hindre progresjon til cancer
- Bevare anatomi og funksjon
Betyr: individuell behandling (Lai & Mercurio, 2010).
OBS! Unngå overbehandling, spesielt av HPV assosiert høygradig VIN hos yngre kvinner.
- Medikamentell (gjelder HPV assosiert høygradig VIN):
Immunstimulerende lokalbehandling: Imiquimod (Clinical Effectiveness Group & British Association for Sexual Health and HIV, 2014; Pepas, Kaushik, Nordin, Bryant, & Lawrie, 2015; van Seters et al., 2005). Erfaringsmessig kan det være lurt å starte med forsiktig behandling/dosering:
Påsmøres lesjonene om kvelden én gang i uken i 2 uker, deretter 2 ganger i uken, så 3 ganger i uken. Totalt 16 uker behandling. Anbefal gjerne lokalbedøvende krem/gel i forkant. - Kirurgisk (HPV assosiert høygradig VIN og dVIN):
Ofte vanskelig å definere utbredelsen og oppnå frie render. -
- Lokal eksisjon/skinning (Clinical Effectiveness Group & British Association for Sexual Health and HIV, 2014)
- Vulvareseksjon/vulvektomi ev m lappeplastikk, bør sentraliseres til gyn onkologisk senter
- Laservaporisering ved HPV assosiert høygradig VIN
- I behåret område og ved fortykkede lesjoner anbefales kirurgisk eksisjon
- Hos unge kvinner med HPV assosiert høygradig VIN anbefales medikamentell behandling el laservaporisering der dette er mulig
- Ved dVIN anbefales kirurgi. Etterfølgende behandling for lichen sklerosus.
Komplikasjoner
Sist faglig oppdatert: 28202128.06.2021
Smerter og psykoseksuell dysfunksjon. Vurdere henvisning til seksologisk rådgiver.
Palliativ behandling – Nasjonalt handlingsprogram
Sist faglig oppdatert: 28202128.06.2021
Helsedirektoratet har utgitt Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen (2019) med anbefalinger om palliativ behandling for kreftpasienter.
Oppfølging og kontroller
Sist faglig oppdatert: 28202128.06.2021
Individuell.
Bør være ulik for HPV assosiert høygradig VIN versus dVIN.
Fortrinnsvis hos gynekolog 6+ 12 mndr etter behandling, deretter årlig neste 4 år.
Selvhenvendelse ved symptomer.
- Vulvaundersøkelse med kolposkopi (vulva, perineum, perianalt, vagina, cervix)
- eksplorasjon
- Bildedokumentasjon og/eller tegning
- Cytologi er ikke indisert
- Biopsi: Ved residivmistanke tas målrettede biopsier. «Blinde» biopsier anbefales ikke.
Trofoblastsykdom
Sist faglig oppdatert: 28202128.06.2021
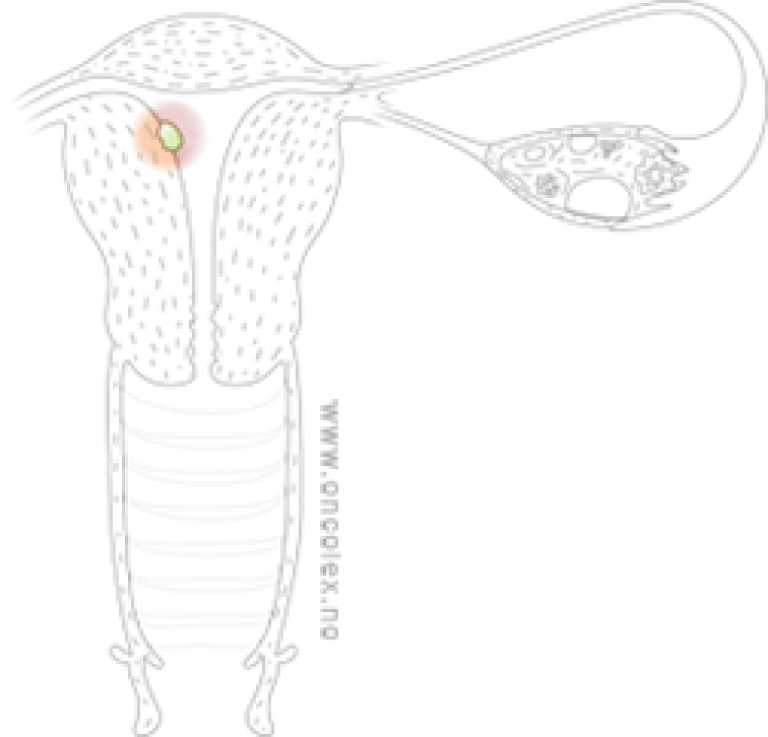
Innledning/bakgrunn
Sist faglig oppdatert: 28202128.06.2021
ICD-10
| O01 | Blæremola (mola hydatidosa) | |
|
| O01.0 | Komplett mola |
|
| O01.1 | Partiell blæremola |
|
| O01.9 | Blæremola, uspesifisert |
| D39.2 | Svulst med usikkert eller ukjent malignitetspotensiale i morkake | |
| D39.21 | Invasiv mola | |
| C58.9 | Ondartet tumor i morkaken (Neoplasma malignum placentae) | |
| C58.9 | Choriocarcinom | |
| C58.9 | Placenta site trophoblastic tumor (PSTT) | |
| C58.9 | Epiteloid trofoblasttumor (ETT) | |
Definisjon
Trofoblastene utgjør det ytre laget av embryoet.
Trofoblastsykdommer har sitt utgangspunkt i svangerskapet. Ved normal befrukning invaderer trofoblastcellene endometriet, blodkar og myometriet for å etablere en foetomaternel sirkulasjon. Ved trofoblastsykdommer ses uhemmet invasjon av trofoblastceller i myometriet og i morens blodbane.
Sykdommen kan oppstå etter normal graviditet, ekstrauterin graviditet og ved spontan- og provosert abort.
Forekomst
Sist faglig oppdatert: 28202128.06.2021
- 0.9 tilfeller per 1000 fødsler (Berkowitz et al., 1994; Hancock et al., 2015; Soper et al., 2005) fødsler.
- Mola er en premalign tilstand og skal meldes til Kreftregisteret (Larsen, 2014). I Norge har ikke mola vært systematisk meldt, men det registreres ca 10–20 kvinner med malign trofoblastsykdom i året (Larsen, 2014).
- Choriokarsinom forekommer i 0.2 tilfeller per 1000 fødsler (Berkowitz et al., 1994).
- Placenta-site-trofoblasttumor (PSTT) forekommer i cirka 1 tilfelle per 500 000 fødsler (Hancock et al., 2015), og utgjør i Norge ca 1 tilfelle per 10 år.
Prognose
Blæremola: Sannsynlighet for helbredelse = 100 %. Fertiliteten bevares.
Lavrisikogruppen: Sannsynligheten for helbredelse er tilnærmet 100 %.
Fertiliteten bevares med mindre det gjøres hysterektomi.
Høyrisikogruppen: Mulighet for helbredelse er redusert og varierer: 80–90 % (Berkowitz et al., 1994; Hancock et al., 2015; Soper et al., 2005).
Risikofaktorer/årsaker
Sist faglig oppdatert: 28202128.06.2021
I de fleste tilfeller ukjent, men:
- Alder er av betydning, fordi forekomsten er høyere hos kvinner som blir gravide i helt ung alder eller i spesielt høy alder.
- Genetiske faktorer spiller en rolle.
- Risiko for gjentatt mola etter tidligere komplett mola er 8–15 %, mens risiko for ny mola etter tidligere partiell mola er 2–5 % (Hancock et al., 2015; Soper et al., 2005).
Inndeling
Sist faglig oppdatert: 28202128.06.2021
Trofoblastsykdommenen klassifiseres i henhold til WHO klassifikasjon 2014 (Kurman et al., 2014). Immunhistokjemi og ploidi/molekylære analyser er ofte nødvendig for korrekt klassifikasjon.
Blæremola:
- Partiell mola
- Komplett mola
- Persisterende mola
- Invasiv mola
Maligne svulster:
- Choriokarsinom
- Placental-site-trophoblastic tumor (PSTT)
- Epitelioid trofoblasttumor (ETT)
Ikke neoplastiske lesjoner:
- Exaggerated placental site (uttalt trofoblastreaksjon på placentas implantasjonssted).
- Placental site nodule/plague.
Trofoblastsykdommene er sjeldne og det er ofte nødvendig med immunhistokjemi og ploidi/molekylære analyser for korrekt klassifikasjon.
Blæremola – Trofoblastsykdom med usikkert eller ukjent malignitetspotensiale
- Partiell hydatidiform mola
- Oftest genetisk triploid med to kromosomsett fra far og ett fra mor.
- Fosteranlegg kan forekomme, vanligvis med misdannelser, fosteret dør som oftest tidlig i graviditeten.
- Forandringene i placenta er fokale og trofoblastproliferasjonen er mindre uttalt enn ved komplett mola.
- Komplett hydatidiform mola
- Genetisk diploid.
- Begge kromosomsett fra far.
- Kjennetegnet ved fravær av embryo/foster og hinnesekk.
- Placenta er helt forandret av store chorionvilli og hyperplastiske trofoblastceller, som danner store blærer.
Genetikk
Trofoblastcellene representerer et fremmed genetisk (paternelt) materiale.
Histologi
Diagnostikk-mikroskopi: Det kan være vanskelig å skille komplett og partiell mola. I tillegg likner disse på degenerative tilstander i placenta. Den mikroskopiske diagnostikken krever erfaring og i tillegg ofte supplerende undersøkelsesmetoder som immunhistokjemi og DNA-ploidi.
Ved:
- Komplett mola sees chorionvilli med hydrop «swelling», og sentrale cisterner og generell tilvekst av trofoblastceller på choriontottenes overflate.
- Partiell mola sees ofte to populasjoner av choriontotter: en populasjon med normale choriontotter og en populasjon med hydrope totter. Også her ses trofoblastproliferasjon. I tillegg ses indenteringer av choriontottenes overflate slik at disse kan ha utseende som «Norwegian fjords». Fosterdeler ses en sjelden gang.
Maligne trofoblastsvulster
- Persisterende trofoblastsykdom – etter evacuation av blæremola normaliseres i regelen hCG spontant. I noen tilfelle oppstår et platå eller økning i hCG verdiene. Dette er tegn på gjenværende aktivt trofoblastvev.
- Invasiv mola – molavevet invaderer myometriet og kan medføre perforasjon og intraabdominal blødning. Det kan forekomme metastaser, enten i nærliggende organ eller som fjernmetastaser.
- Choriokarsinom – skiller seg fra invasiv mola ved å mangle choriontotter. Tumor vokser bifasisk med vekst av to typer av trofoblastceller: syncytio- og cytotrofoblaster med malign differensiering. Det sees ofte blødning og store nekroser. Tumor vokser raskt og metastaserer tidlig.
- Placenta-site-trofoblasttumor (PSTT) – utgår fra trofoblastvev på placentas implantasjonssted.
- Malign differensiering særlig av cytotrofoblaster, i mindre grad av syncytiotrofoblaster, derfor lav hCG. Er meget sjelden.
- Epitelioid trofoblasttumor (ETT) – antas å utgå fra spesialiserte intermediære trofoblastceller på implantasjonsstedet i likhet med Placenta-site-trofoblasttumores. Tumor er vanskelig å diagnostisere uten spesiell kompetanse innen gynekologisk patologi.
Stadier
Sist faglig oppdatert: 28202128.06.2021
WHO risikoscore (Kurman et al., 2014) skal brukes for vurdering av prognose og valg av behandling. Unntaket er placenta-site trofoblasttumores som klassifiseres i henhold til FIGO (The International Federation of Gynecology and Obstetrics) stadium (Gamer et al., 2004; Kohorn, 1995).
WHO-risiko score
| Faktorer | 09 | 1 | 2 | 4 |
|---|---|---|---|---|
| Alder | < 40 | ≥ 40 |
|
|
| Svangerskap | Mola | Abort | Fullgått |
|
| Intervall* (mnd) | < 4 | 4–6 | 7–12 | > 12 |
| Serum hCG (IU/L) ** | < 103 | 103–104 | 104–105 | > 105 |
| Største tumor*** (cm) |
| 3–5 | > 5 |
|
| Metastasens lokalisasjon | lunge****/vagina | milt/nyre | tarm | hjerne/lever |
| Antall metastaser***** | 0 | 1–4 | 4–8 | > 8 |
| Tidligere kjemoterapi |
|
| Ett stoff | Multiple stoff |
Lavrisikogruppe: <=6
Høyrisikogruppe: > 6
* Antall måneder fra siste avsluttet svangerskap (evacuatio uteri) til start av kjemoterapi
** hCG-verdi på tidspunkt for oppstart behandling
*** Inklusiv tumor i uterus
**** Lungemetastaser vurderes på rtg thorax, ikke CT-thorax
***** Alle metastaser skal telles, uavhengig av lokalisasjon
FIGO-stadieinndeling
| Stadium I | Sykdommen begrenset til uterus |
| Stadium II | Spredning til adnexa, parametriet eller vagina |
| Stadium III | Lungemetastaser. Antall lungemetastaser synlige på røntgen thorax inkluderes i scoringssystemet. Små metastaser som kun ses på CT-thorax inkluderes ikke, med mindre det er mange av dem. |
| Stadium IV | Metastaser til andre lokalisasjoner |
Spredningsmønster
Trofoblast svulstene metastaserer primært hematogent, hyppigst til lunger. Metastasering til hjerne, lever og nyre samt intraperiotealt kan forekomme, likeledes metastasering til skjede, livmorhals og adnexa uteri. Placenta-site-tumorer spres oftest lymfogent og har derfor et annet spredningsmønster
Diagnostikk
Sist faglig oppdatert: 28202128.06.2021
(Goldstein et al., 2010; Seckl et al., 2010; Soper et al., 2005)
Allmennsymptomer:
- Vaginalblødning
- Abdominalsmerter (torkvert ovariecyste)
- Ekstrem svangerskapskvalme
- Hyperemesis
- Mastalgi
- Tidlig preeklampsi
- Hyperthyreose, eventuell thyreotoksisk krise (grunnet høy hCG)
Symptomer fra metastaser:
- Hemoptyse fra lungemetastase
- Intracerebral blødning fra hjernemetastase
- Emboli
- Hematuri
Noen debuterer med symptomer fra metastaser uten almen symptomer. Ved vedvarende hoste eller dysnoe etter graviditet bør det tas hCG og rtg Thorax. Ved multiple lungemetastaser hos kvinner i fertil alder er trofoblastsykdom en differensialdiagnose.
Undersøkelser/funn
- Evacuatio uteri: Makroskopiske blærer i abortmateriale.
- Gynekologisk undersøkelse med ultralyd:
- Uterus større enn svarende til menostasien med blæredannelser intrauterint.
- Bilateralt forstørrede eggstokker (thecalutein cyster).
- Ascites og pleuravæske p.g.a. ovarial hyperstimulering.
- Blodprøver:
- Serum hCG-patologisk forhøyet
- Thyroideaverdier kan være patologisk forhøyet. OBS! Thyreotoxikose
- Hb: OBS! Anemi
- Røntgen thorax og CT thorax
- CT abdomen eller ultralyd abdomen/lever
- MR caput ved multiple lungemetastaser og ved høyrisiko score
Det skal ikke tas biopsi av metastasesuspekte lesjoner på grunn av blødningsfare. Lungebiopsi kan utløse fatal blødning!
Differensialdiagnoser
Sist faglig oppdatert: 28202128.06.2021
- Normal graviditet
- Ektopisk graviditet
- Andre hCG produserende tumores, for eksempel germinalcelletumores i eggstokk, primær lungekreft og hjernetumores kan være hCG produserende
Behandling
Sist faglig oppdatert: 28202128.06.2021
Avhenger av histologi, sykdomsutbredelse og hCG nivå + WHO risicoscore (gjelder ikke for placenta site trofoblasttumores) (Goldstein et al., 2010; Osborne et al., 2011; Seckl et al., 2010; Soper et al., 2005).
Behandling av mola (Lok et al., 2020)
- Evacuatio uteri. aviteten tømmes helt og alt materiale sendes til histologisk undersøkelse.
- Serum hCG:
- Første kontroll 1 uke etter evacuatio.
- Følges deretter hver 14. dag i 8 uker.
- Pasienter med partiell mola ved normalisering av s-hCG (<1 IE/l ved to gjentatte målinger) innen 8 uker etter evacuatio trenger ingen videre kontroller.
- Pasienter med komplett mola ved normal serum hCG (< 1 IE/l) etter 8 uker kontrolleres hCG 1 gang/måned i 6 måneder.
- Ved forhøyet hCG etter 8 uker (både komplett mola og partiell mola) følges hCG hver 14. dag hvis fortsatt fallende til normalisering, deretter hCG kontroll 1 gang/måned i 6 måneder.
- Re-evacuatio bør ikke foretas hvis uterinkaviteten primært har vært tømt fullstendig.
Radiumhospitalet kontaktes ved:
- Stigende serum hCG eller manglende normalisering av hCG etter evacuatio uteri.
- Serum hCG-platå i mer enn 4 uker.
- Histologisk diagnose choriocarcinom eller placenta-site-trofoblasttumor (PSTT) eller epitelioid trofoblasttumor (ETT).
- Påvisning av metastase.
Behandling av persisterende mola, invasiv mola, choriokarsinom
Trofoblasttumorer er svært følsomme for cytostatikabehandling (gjelder ikke PSTT og ETT), og kan i de fleste tilfeller kureres. Fertiliteten kan nesten alltid bevares.
Medikamentell behandling
(Goldstein et al., 2010; May et al., 2011; Osborne et al., 2011; Seckl et al., 2010)
Valg av behandling avhenger av WHO-risikoscore (ikke FIGO-stadium) (Gamer et al., 2004; Kohorn, 1993, 1995):
- Lavrisiko: behandles med lavdose Metotrexat
- Ved manglende effekt skiftes til Actinomycin-D
- Ved utvikling av resistens gis kombinasjonsbehandling som for høyrisiko
- Høyrisiko: behandles med kombinasjonsterapi
- Ved utbredte lungemetastaser og ved hjerne- eller levermetastaser gis 12 kurer med lavdose Metotrexat før kombinasjonsbehandling.
Aktuelle kurer (Oslo universitetssykehus, 2016):
- Metotrexat lavdose: Metotrexat 25 mg s.c. daglig i 4 dager/12. dag
- Dactinomycin: Actinomycin-D 0,5 mg i.v. daglig i 4 dager/12. dag
- EMA-CO: Etoposid 100 mg/m2, Metotrexat 300 mg/m2 og Dactinomycin 0,5 mg (dag 1+2) og Cyclophosfamid 600 mg/m2 og Vincristin 0,8 mg/m2 (dag 8)/14. dag
- EMA-EP: Etoposid 100 mg/m2, Metotrexat 300 mg/m2 og Dactinomycin 0,5 mg (dag 1+2) og Etoposid 125/m2 og Cisplatin 25/m2 (dag 8)/14. dag
- PC/PE: Paclitaxel 135/m2 og Cisplatin 60/m2 (dag 1) + Paclitaxel 135 mg/m2 og Etoposid 150 mg/m2 (dag 14)/4. uke
- EMA-CNS
- Metotrexat intrathecalt
Behandlingsvarighet:
- Lavrisiko: inntil 2 kurer etter s-hCG < 1IE
- Høyrisiko: inntil 3 kurer etter s-hcg < 1IE
Kirurgi (Lurain et al., 2006)
- Hysterektomi overveies ved lokalisert sykdom hos eldre.
- Placenta-site-trofoblasttumores (PSTT) og epiteloide trofoblasttumores (ETT) behandles primært med hysterektomi p.g.a. liten følsomhet for kjemoterapi, også metastaser behandles med lokal ekstirpasjon hvis mulig, hvis ikke gis cisplatinbasert kjemoterapi (EMA-EP) (Baergen et al., 2006; Palmer et al., 2008).
Strålebehandling
- Strålebehandling er ikke aktuelt
Komplikasjoner
Sist faglig oppdatert: 28202128.06.2021
- Komplikasjoner relatert til sykdommen:
- Tumorblødning
- Uterinblødning
- Hjerneblødning
- Hemoptyse
- Komplikasjoner relatert til utredning/behandling:
- Perforasjon av livmor ved evacuatio.
- Blødning ved biopsitaking.
- Blødning ved behandlingsstart p.g.a. tumornekrose og henfall OBS! intraabdominal blødning, hjerneblødning, lungeblødning.
- Respirasjonsinsuffisens ved behandlingsstart hos pasient med uttalte lungemetastaser.
- Nyre-, lever-, nevrotoxitet på grunn av cellegiftbehandlingen.
- Benmargssvikt med følgende blødning/infeksjoner p.g.a. benmargstoxisk cellegiftbehandling.
Palliativ behandling – Nasjonalt handlingsprogram
Sist faglig oppdatert: 28202128.06.2021
Helsedirektoratet har utgitt Nasjonalt handlingsprogram med retningslinjer for palliasjon i kreftomsorgen (2019a) med anbefalinger om palliativ behandling for kreftpasienter.
Oppfølging etter behandling
Sist faglig oppdatert: 28202128.06.2021
(Goldstein et al., 2010; Hancock et al., 2015; May et al., 2011)
Etter evacuatio av mola:
- 1. serum-hCG måling 1 uke etter evacuatio.
- Følges deretter hver 14. dag i 8 uker.
- Pasienter med partiell mola ved normalisering av s-hCG (<1 IE/l ved to gjentatte målinger) innen 8 uker etter evacuatio trenger ingen videre kontroller.
- Pasienter med komplett mola ved normal serum hCG (< 1 IE/l) etter 8 uker kontrolleres hCG 1 gang/måned i 6 måneder.
- Ved forhøyet hCG etter 8 uker (både komplett mola og partiell mola) følges hCG hver 14. dag hvis fortsatt fallende til normalisering, deretter hCG kontroll 1 gang/måned i 6 måneder.
- Prevensjon anbefales under behandling og under hele oppfølgning periode.
Etter kjemoterapi av trofoblastsykdom kontrolleres serum hCG:
- Før start av hver kur
- Ukentlig de 3 første måneder etter avsluttet behandling
- Hver annen uke i 3–6 måneder etter avsluttet behandling
- Månedlig fra 6–12 måneder
Lavrisikopasienter avslutter kontroller 12 måneder etter normalisering av hCG (< 1IE/L). Det anbefales sikker prevensjon i ett år etter første normale hCG (< 1IE/L).
Høyrisikopasienter kontrollerer hCG som beskrevet overfor i 12 måneder, deretter hver 3. måned i ytterligere 12 måneder. Det anbefales sikker prevensjon i 24 måneder etter første normale hCG.
Pasienter med placenta-site-trofoblasttumorer kontrollerer hCG som beskrevet overfor i 2 år, deretter hver sjette måned i 3–8 år (totalt 5–10 år). Deretter følges i prinsippet livslang kontroll årlig på grunn av risiko for sent residiv.
Graviditet etter trofoblastsykdom
Pasienter behandlet for komplett mola med normalisering av hCG etter evacuatio og pasienter behandlet for partiell mola ved manglende normalisering av HCG innen 8 uker frarådes å bli gravide første 6 måneder etter normalisering av hCG.
Lavrisikopasienter frarådes å bli gravide før det er gått ett år etter første normale hCG (< 1IE/L).
Høyrisikopasienter frarådes å bli gravide før det er gått to år etter første normale hCG (< 1IE/L).
Skulle graviditet likevel oppstå i kontrollperioden forløper denne oftest normalt.
Ved graviditet etter tidligere trofoblastsykdom, dvs malign tumor som har fått behandling ved DNR, er det viktig at pasienten kontrolleres første trimester med gjentatte hCG målinger og tidlig ultralyd for å utelukke eventuell ny sydom. Fornyet trofoblastsykdom ved neste graviditet er sjelden, men kan forekomme. Gjelder ikke ukompliserte molaer, disse trenger ingen etterkontroller.
Etter fødselen bør placenta inspiseres nøye og sendes til histologisk undersøkelse.
HCG tilrådes ved 6–8 ukers kontroll etter fødsel.
Prosess og metode
Hva er nasjonale faglige retningslinjer?
Sist faglig oppdatert: 28202128.06.2021
I henhold til Nasjonal helseplan (2007–2010) (Nasjonal helseplan (2007–2010), 2006) har Helsedirektoratet en normerende rolle for helsetjenesten på tvers av helseregioner og tjenestenivå. Helsedirektoratet har en koordinerende rolle for å utvikle overordnede referanserammer for kreftomsorgen, sammen med de regionale helseforetakene, kommunene og andre relevante myndighetsorganer og tjenester.
Lov om kommunale helse- og omsorgstjenester (Lov om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven)) § 12‑5 fastslår at Helsedirektoratet er eneste aktør med mandat til å utvikle, formidle og vedlikeholde nasjonale faglige retningslinjer og veiledere. De nasjonale faglige retningslinjene inneholder systematisk utviklede faglige anbefalinger som etablerer en nasjonal standard for utredning, behandling og oppfølging av pasientgrupper, brukergrupper eller diagnosegrupper.
Nasjonale faglige retningslinjer inneholder systematisk utviklede faglige anbefalinger som etablerer en nasjonal standard for utredning, behandling og oppfølgning av pasientgrupper eller diagnosegrupper. Nasjonale faglige retningslinjer er et virkemiddel for å bidra til at helse- og omsorgstjenestene:
- har god kvalitet
- gjør riktige prioriteringer
- ikke har uønsket variasjon i tjenestetilbudet
- løser samhandlingsutfordringer
- tilbyr helhetlige pasientforløp
Nasjonale faglige retningslinjer gir uttrykk for hva som anses som god praksis på utgivelsestidspunktet. Sentrale fagmiljøer og tjenestemottakere er aktivt involvert i utarbeidelsen.
Helsepersonell og alle deler av helse- og omsorgstjenesten er forpliktet til å yte forsvarlig helsehjelp. Retningslinjer, anerkjent fagkunnskap og allmenngyldige samfunnsetiske normer inngår som aksepterte grunnlag for vurdering av hva som er faglig forsvarlig. Retningslinjer er ment som et hjelpemiddel ved avveiningene tjenesteyterne må gjøre for å oppnå forsvarlig og god kvalitet i tjenesten. De er ikke rettslig bindende, men faglig normerende for valg man anser fremmer kvalitet, god praksis og likhet i tjenesten på utgivelsestidspunktet. Helsepersonell må likevel vise faglig skjønn i vurderingen av hver enkelt pasient for å ta hensyn til individuelle behov. Dersom helsepersonell eller institusjoner velger å fravike anbefalinger i en retningslinje, skal dette dokumenteres og begrunnes.
Helsetjenestens eiere og ledelse har ansvar for tilrettelegging av virksomheten slik at anbefalinger gitt i nasjonale faglige retningslinjer kan følges.
Kunnskapsbasert prosess
Sist faglig oppdatert: 28202128.06.2021
Helsedirektoratet legger til grunn at alle nasjonale retningslinjer skal være utarbeidet etter en metode med vekt på forskningsbasert kunnskap, tydelig og tilgjengelig dokumentasjon, brukermedvirkning, tverrfaglighet, fokus på praksis, implementering og oppdatering.
Det er en omfattende prosess å lage gode retningslinjer som tilfredsstiller krav til prosess, metode og transparens som er det nivå Helsedirektoratet og andre internasjonale organisasjoner har lagt til grunn for utforming av anbefalinger.
Helsedirektoratet ønsker i arbeidet med nasjonale retningslinjer for kreftbehandling å bygge på det arbeid faggruppene tilsluttet Onkologisk Forum i en årrekke har gjort med å lage behandlingsveiledere/handlingsprogram.
Folkehelseinstituttet har bistått arbeidsgruppen med gjennomgang av faglige anbefalinger med hensyn til metode og vurdering av hvilket kunnskapsgrunnlag de er basert på.
Arbeidsgruppen har i samarbeid med Helsedirektoratet og Folkehelseinstituttet vurdert om det har vært behov for utredning av kunnskapsgrunnlaget for enkelt problemstillinger.
Folkehelseinstituttet har identifisert og formidlet kunnskapsbaserte internasjonale retningslinjer og systematiske oversikter til faggruppen, ved søk på følgende nettsteder:
Søk etter retningslinjer
- Guidelines international network: http://www.g-i-n.net/
- NICE, UK: http://www.nice.org.uk/
- SIGN, Scotland: http://www.sign.ac.uk/
- AHRQ, US: http://www.guideline.gov/
- Cancer care Ontario: http://www.cancercare.on.ca/
- ESGO guidelines: https://www.esgo.org/explore/guidelines/
Søk etter systematiske oversikter
- CRD-databasene: http://www.crd.york.ac.uk/crdweb/
- Cochrane Librar:
http://www.mrw.interscience.wiley.com/cochrane/cochrane_search_fs.html - Clinical evidence: https://bestpractice.bmj.com/evidence
Gradering av kunnskapsgrunnlaget i første utgave av handlingsprogrammet (2016)
Sist faglig oppdatert: 28202128.06.2021
Ved utarbeiding av nasjonale retningslinjer er det forventet at relevant kunnskap på området hentes frem, beskrives og vurderes på en systematisk og åpen måte.
I denne retningslinjen har man i deler av handlingsprogrammet anvendt gradering av evidensnivå (A–D) for å vise hvilket vitenskapelig grunnlag kunnskapen er basert på.
| Studietype | Evidensnivå | Gradering av evidensnivå |
|---|---|---|
| Kunnskap som bygger på systematiske oversikter og meta-analyser av randomiserte kontrollerte studier. | Nivå 1a
Nivå 1b | A |
| Kunnskap som bygger på minst én godt utformet kontrollert studie uten randomisering. | Nivå 2a
Nivå 2b | A |
| Kunnskap som bygger på godt utformede ikke eksperimentelle beskrivende studier, som sammenlignende studier, korrelasjonsstudier og case studier. | Nivå 3 | C |
| Kunnskap som bygger på rapporter eller oppfatninger fra eksperter, komiteer og/eller klinisk ekspertise hos respekterte autoriteter. | Nivå 4 | D |
Kunnskapsgrunnlaget for anbefalingene er gradert i henhold til tabellen over. I denne retningslinjen er kun kunnskapsgrunnlaget og ikke anbefalingene gradert, og det er gjort i deler av handlingsprogrammet. Ved senere oppdatering av handlingprogrammet skal dette gjøres gjennomgående i alle kapitler.
For å indikere kunnskapsgrunnlaget for våre anbefalinger, har vi brukt gradering A–D for en del av anbefalingene. En anbefaling som er anført med D behøver derfor ikke å være en svakere anbefaling enn en som er anført A, B eller C. Det henspeiler kun til kunnskapsgrunnlaget anbefalingen er basert på. I enkelte sammenhenger vil klinisk erfaring og gjeldende praksis være et godt grunnlag for anbefalingen. I andre sammenhenger er det uttrykk for at det ikke finnes tilstrekkelig vitenskapelig dokumentasjon for anbefalingen, selv om det hadde vært ønskelig.
Bakgrunn og arbeidsprosess ved første utgave av handlingsprogrammet (utgitt 2016)
Sist faglig oppdatert: 28202128.06.2021
Utvikling av de nasjonale handlingsprogrammene for kreftbehandling var et viktig tiltak under Nasjonal strategi for kreftområdet (2006–2009 (forlenget til 2011). Og videre utvikling av de nasjonale handlingsprogrammene er en kjerneoppgave i oppfølging av Sammen mot kreft –Nasjonal Kreftstrategi 2013–2017 (Sammen mot kreft: nasjonal kreftstrategi 2013-2017, 2013). Nasjonale handlingsprogrammer for kreftbehandling skal bidra til at det offentlige tilbudet i kreftomsorgen blir av god kvalitet og likeverdig over hele landet.
Nasjonale faggrupper tilsluttet Onkologisk Forum har i en årrekke arbeidet med – og utviklet behandlingsveiledere og handlingsprogram for ulike krefttyper. Helsedirektoratet har tatt utgangspunkt i, og bygget på dette arbeidet. Helsedirektoratet rettet derfor i juli 2006 en henvendelse til Norsk Forum for Gynekologisk Onkologi og ba om forslag til representanter til en arbeidsgruppe som skulle settes sammen av fagekspertise, Nasjonalt kunnskapssenter for helsetjenesten og Helsedirektoratet. Det ble bedt om at alle nødvendige faggrupper skulle være representert og at gruppen skulle bestå av fagfolk fra alle helseregioner.
De regionale helseforetakene (RHF-ene) er gitt mulighet til å gi tilbakemelding på arbeidsgruppenes sammensetning. RHF-ene ble også bedt om at fagfolk innenfor rammen av sin arbeidstid ble fristilt til retningslinjearbeidet, jf. Oppdragsdokumentet fra Helse- og omsorgsdepartementet.
Helsedirektoratet ferdigstilte i samarbeid med forfatterne i 2015 arbeidet med første utgave av handlingsprogrammet, og utkast til retningslinjer ble sendt på høring til RHF-ene, Den norske legeforening og Kreftforeningen. Etter høring ble endelig utgave ferdigstilt og publisert i september 2016.
Oppdatering av retningslinjene
Sist faglig oppdatert: 28202128.06.2021
Utviklingen av ny behandling på kreftområdet er rask.
Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av gynekologisk kreft vil vurderes årlig og om nødvendig oppdateres.
Ved revisjon av handlingsprogrammet vil også kunnskapsgrunnlaget graderes i alle kapitler. Oppdateringen skal utføres av en redaksjonskomité som består av fagpersoner oppnevnt av De regionale helseforetakene og Helsedirektoratet.
De oppdaterte retningslinjene vil publiseres på helsedirektoratet.no (pdf) og i nettversjon på helsebiblioteket.no
Arbeidsgruppe og forfattere av kapitlene i andre utgave av handlingsprogrammet – juni 2020
Sist faglig oppdatert: 28202128.06.2021
| Kapittel | Navn |
|---|---|
| 1. Livmorkreft (Endometriecancer) |
|
| 2. Endometriehyperplasi |
|
| 3. Eggstokkreft, tubekreft og bukhinnekreft |
|
| 4. Sjelden (ikke epitelial) ovarialcancer. Germinalcelle- og stromale svulster. |
|
| 5. Borderline ovarialtumor (BOT) |
|
| 6. Livmorhalskreft (Cervixcancer) |
|
| Strålegruppen |
|
| 7. Premaligne lidelser i cervix uteri |
|
| 8. Vulvacancer |
|
| Strålegruppen |
|
| 9. Vulva intreepitelial neoplasi (VIN) |
|
| 10. Trofoblastsykdom |
|
Arbeidsgruppe og forfattere av kapitlene i tredje utgave av handlingsprogrammet – juni 2021
Sist faglig oppdatert: 28202128.06.2021
(kapittelleder i parantes)
Kapittel | Navn | Helseforetak |
|---|---|---|
1 LIVMORKREFT (Woie) | Elise Sletten | UNN |
| Nina Nordskar | St. Olav |
| Ane Gerda Zahl Eriksen | OUS |
| Yun Wang | OUS |
| Kathrine Woie | HUS |
| Ingfrid Helene Salvesen Haldorsen | HUS |
| Ingvild Vistad | Sørlandet |
| Tormod Eggen | UNN |
|
|
|
2 ENDOMETRIEHYPERPLASI (Sletten) | Elise Sletten | UNN |
Anne Ørbo | UNN | |
| Anne Beate Vereide | Kalnes |
|
|
|
3 EGGSTOKKKREFT (Dørum) | Martin Lindblad | UNN |
| Elisabeth Araya | St. Olav |
| Anne Dørum | OUS |
| Bente Vilming | OUS |
| Anne Fangberget | OUS |
| Line Bjørge | HUS |
| Ellen Veronika Vesterfjell | St. Olav |
|
|
|
4 SJELDNE OVARIALTUMORES (Solheim) | Martin Lindblad | UNN |
Solveig Tingulstad | St. Olav | |
| Kristina Lindeman | OUS |
| Olesya Solheim | OUS |
| Line Bjørge | HUS |
| Guro Horni Gløersen | AHUS |
|
|
|
5 BORDERLINE TUMORES (Dørum) | Martin Lindblad | UNN |
| Solveig Tingulstad | St. Olav |
| Anne Dørum | OUS |
| Torbjørn Paulsen | OUS |
| Eva Karin Lamark | HUS |
| Bent Fiane | SUS |
| Ellen Veronika Vesterfjell | St. Olav |
|
|
|
6 CERVIX CANCER (Sundset) | Martin Lindblad | UNN |
| Marit Sundset | St. Olav |
| Brynhildur Eyjolfsdottir | OUS |
| Kristina Lindeman | OUS |
| Anne Fangberget | OUS |
| Kathrine Woie | HUS |
| Elisabeth Berge Nilsen | SUS |
| Agnes Kathrine Lie | SOHF |
Stråledel cervix cancer (Bruheim) | Anne Gry Bentzen | UNN |
| Monica Eidem | St. Olav |
| Marit Sundset | St. Olav |
| Kjersti Bruheim | OUS |
| Irene Berntsen | OUS |
| Taran Paulsen Hellebust | OUS |
| Esten Nakken | OUS |
| Linda Holth Djupvik | OUS |
| Anne Fangberget | OUS |
| Terje Nordberg | HUS |
| Britt Nygaard | HUS |
|
|
|
7 PREMALIGNE CERVIX LIDELSER (Munk) | Gunn Fallås Dahl | OUS |
Jannicke Mohr Berland | SUS | |
Ameli Trope | Kreftregisteret | |
| Ingrid Baasland | NTNU |
| Ane Cecilie Munk | Sørlandet |
| Lill Iren Trogstad | Folkehelseinst |
|
|
|
8 VULVA CANCER (Wang) | Anne Hansson | UNN |
| Merethe Ravlo | St. Olav |
| Anne Dørum | OUS |
| Yun Wang | OUS |
| Kjersti Lund | OUS |
| Henrik L. Svendsen | HUS |
| Line Bjørge | HUS |
| Elisabeth Berge Nilsen | SUS |
| Agnes Kathrine Lie | SOHF |
Stråledel Vulva cancer (Nakken) | Anne Gry Bentzen | UNN |
| Monica Eidem | St. Olav |
| Kjersti Bruheim | OUS |
| Irene Berntsen | OUS |
| Taran Paulsen Hellebust | OUS |
| Esten Nakken | OUS |
| Linda Holth Djupvik | OUS |
| Kjersti Lund | OUS |
| Terje Nordberg | HUS |
| Britt Nygaard | HUS |
|
|
|
9 VIN (Berge Nilsen) | Anne Hansson | UNN |
| Merethe Ravlo | St. Olav |
| Gunn Fallås Dahl | OUS |
| Ingrid K.M. Kolseth | HUS |
| Elisabeth Berge Nilsen | SUS |
| Jannicke Mohr Berland | SUS |
|
|
|
10 TROFOBLAST (Solheim) | Martin Lindblad | UNN |
| Marit Sundset | St. Olav |
| Olesya Solheim | OUS |
| Rita Steen | OUS |
| Line Bjørge | HUS |
| Gitte Turowski | OUS |
| Justina Matilde Iversen | SIV |
Arbeidsgruppe og forfattere av kapitlene i fjerde utgave av handlingsprogrammet – november 2022
Sist faglig oppdatert: 18202318.01.2023
Leder av handlingsprogramgruppene/koordinator (fra januar 2022): Elisabeth Berge Nilsen, Helse Stavanger.
Genetikk: Siri Briskemyr, overlege, Medisinsk genetisk avdeling, Universitetssykehuset i Nord-Norge
Fastlegerepresentant: Svendsen
Sammensetning av oppdateringsgruppen
«Helsedirektoratet etablerer oppdateringsgruppen, men det enkelte medlem skal være oppnevnt via RHF-ene. I praksis foreslår faggruppen (NFGO) hvem som skal delta, men formelt sett oppnevnes man via RHF-et.»
NFGO ønsker at arbeidsgruppene er satt sammen med minst en representant fra gyn onk avd ved DNR, St Olav, UNN og HUS, i tillegg til en representant fra et annet sykehus som Helse Stavanger, Sørlandet, Bodø, Skien, Østfold, AHUS, Drammen, Tønsberg. I tillegg består arbeidsgruppene av en patolog, samt en radiolog der det ansees som nødvendig. Andre spesialister med kompetanse innen fagfeltet vil i tillegg bli spurt om å delta der det er aktuelt.
| Navn | Helseforetak |
|---|---|
Elise Sletten | Universitetssykehuset i Nord-Norge |
Nina Nordskar | St. Olavs hospital |
Ane Gerda Zahl Eriksen | Oslo universitetssykehus |
Yun Wang | Oslo universitetssykehus |
Kathrine Woie, leder | Helse Bergen |
Ingfrid Helene Salvesen Haldorsen | Helse Bergen |
Ingvild Vistad | Sørlandet sykehus |
Tormod Eggen, patolog | Universitetssykehuset i Nord-Norge |
| Navn | Helseforetak |
|---|---|
Elise Sletten, leder | Universitetssykehuset i Nord-Norge |
? | patolog |
Anne Beate Vereide | Sykehuset Østfold |
Catrine Hjelle Størksen | Oslo universitetssykehus |
Grete Alræk Iversen | Helse Stavanger |
Nina Nordskar | St. Olavs hospital |
| Navn | Helseforetak |
|---|---|
Martin Lindblad | Universitetssykehuset i Nord-Norge |
Elisabeth Araya | St. Olavs hospital |
Yun Wang | Oslo universitetssykehus |
Bente Vilming, leder | Oslo universitetssykehus |
Kjersti Vassmo Lund | Oslo universitetssykehus |
Line Bjørge | Helse Bergen |
Ellen Veronika Vesterfjell, patolog | St. Olavs hospital |
Cecilie Fredvik Torkildsen | Helse Stavanger |
| Navn | Helseforetak |
|---|---|
Martin Lindblad | Universitetssykehuset i Nord-Norge |
Solveig Tingulstad | St. Olavs hospital |
Kristina Lindeman | Oslo universitetssykehus |
Olesya Solheim, leder | Oslo universitetssykehus |
Line Bjørge | Helse Bergen |
Frida Andræ | Nordlandssykehuset Bodø |
Guro Horni Gløersen, patolog | Akershus universitetssykehus |
| Navn | Helseforetak |
|---|---|
Martin Lindblad | Universitetssykehuset i Nord-Norge |
Solveig Tingulstad | St. Olavs hospital |
Olesya Solheim | Oslo universitetssykehus |
Torbjørn Paulsen | Oslo universitetssykehus |
Eva Karin Lamark | Helse Bergen |
Ala Haug | Akershus universitetssykehus |
Ellen Veronika Vesterfjell, patolog | St. Olavs hospital |
| Navn | Helseforetak |
|---|---|
Elena Garibaldi | Universitetssykehuset i Nord-Norge |
Marit Sundset, leder | St. Olavs hospital |
Brynhildur Eyjolfsdottir | Oslo universitetssykehus |
Kristina Lindeman | Oslo universitetssykehus |
Kjersti Vassmo Lund, radiolog | Oslo universitetssykehus |
Kathrine Woie | Helse Bergen |
Ingvild Vistad | Sørlandet sykehus |
Agnes Kathrine Lie, patolog | Sykehuset Østfold |
| Navn | Helseforetak |
|---|---|
Anne Gry Bentzen | Universitetssykehuset i Nord-Norge |
Monica Eidem | St. Olavs hospital |
Marit Sundset | St. Olavs hospital |
Kjersti Bruheim, leder | Oslo universitetssykehus |
Trine Martens | Oslo universitetssykehus |
Taran Paulsen Hellebust | Oslo universitetssykehus |
Esten Nakken | Oslo universitetssykehus |
Linda Holth Djupvik | Oslo universitetssykehus |
Anne Fangberget | Oslo universitetssykehus |
Terje Nordberg | Helse Bergen |
Britt Nygaard | Helse Bergen |
| Navn | Helseforetak |
|---|---|
Gunn Fallås Dahl | Oslo universitetssykehus |
Agnes Kathrine Lie, patolog Jannicke Mohr Berland, patolog | Sørlandet sykehus Helse Stavanger |
Ameli Trope | Kreftregisteret |
Ingrid Baasland | NTNU |
Ane Cecilie Munk, leder | Sørlandet sykehus |
Mark L.B. Barbero | Helse Bergen |
Trine Stokstad | St. Olavs hospital |
Øystein Grundvåg-Pedersen | Universitetssykehuset i Nord-Norge |
Lill Iren Trogstad | Folkehelseinstituttet |
| Navn | Helseforetak |
|---|---|
Øystein Grundvåg-Pedersen | Universitetssykehuset i Nord-Norge |
Merethe Ravlo | St. Olavs hospital |
Tone Skeie-Jensen | Oslo universitetssykehus |
Yun Wang, leder | Oslo universitetssykehus |
Kjersti Vassmo Lund | Oslo universitetssykehus |
Henrik L. Svendsen | Helse Bergen |
Line Bjørge | Helse Bergen |
Christin Julia Meltzer- Gunnes | Sørlandet sykehus |
Agnes Kathrine Lie, patolog | Sykehuset Østfold |
| Navn | Helseforetak |
|---|---|
Vibeke A Ingebrigtsen | Universitetssykehuset i Nord-Norge |
Monica Eidem | St. Olavs hospital |
Kjersti Bruheim | Oslo universitetssykehus |
Trine Martens | Oslo universitetssykehus |
Taran Paulsen Hellebust | Oslo universitetssykehus |
Esten Nakken, leder | Oslo universitetssykehus |
Linda Holth Djupvik | Oslo universitetssykehus |
Kjersti V Lund | Oslo universitetssykehus |
Terje Nordberg | Helse Bergen |
Britt Nygaard | Helse Bergen |
| Navn | Helseforetak |
|---|---|
Øystein Grundvåg-Pedersen | Universitetssykehuset i Nord-Norge |
Merethe Ravlo | St. Olavs hospital |
Gunn Fallås Dahl | Oslo universitetssykehus |
Ingrid K.M. Kolseth | Helse Bergen |
Elisabeth Berge Nilsen, leder | Helse Stavanger |
Jannicke Mohr Berland, patolog | Helse Stavanger |
| Navn | Helseforetak |
|---|---|
Anne Hansson | Universitetssykehuset i Nord-Norge |
Marit Sundset | St. Olavs hospital |
Olesya Solheim, leder | Oslo universitetssykehus |
Elisabeth Lillo | Oslo universitetssykehus |
Line Bjørge | Helse Bergen |
Gitte Turowski, patolog | Oslo universitetssykehus |
Justina Matilde Iversen | Sykehuset i Vestfold |
Referanser
Sist faglig oppdatert: 05202405.07.2024
Ansink, A., & van der Velden, J. (2000). Surgical interventions for early squamous cell carcinoma of the vulva. Cochrane Database of Systematic Reviews, (2), CD002036. https://doi.org/10.1002/14651858.cd002036
Aviki, E. M., Esselen, K. M., Barcia, S. M., Nucci, M. R., Horowitz, N. S., Feltmate, C. M., . . . Muto, M. G. (2015). Does plastic surgical consultation improve the outcome of patients undergoing radical vulvectomy for squamous cell carcinoma of the vulva? Gynecologic Oncology, 137(1), 60-65. https://doi.org/10.1016/j.ygyno.2015.02.001
Balleyguier, C., Sala, E., Da Cunha, T., Bergman, A., Brkljacic, B., Danza, F., . . . Kinkel, K. (2011). Staging of uterine cervical cancer with MRI: guidelines of the European Society of Urogenital Radiology. European Radiology, 21(5), 1102-1110. https://doi.org/10.1007/s00330-010-1998-x
Beller, U., Quinn, M. A., Benedet, J. L., Creasman, W. T., Ngan, H. Y., Maisonneuve, P., . . . Heintz, A. P. (2006). Carcinoma of the vulva. FIGO 26th Annual Report on the Results of Treatment in Gynecological Cancer. International Journal of Gynaecology and Obstetrics, 95 Suppl 1, S7-27. https://doi.org/10.1016/s0020-7292(06)60028-3
Björkholm, E. (2000). Vulvacancer (Rapport / Svensk förenings för obstetrik och gynekologi arbets- och referensgrupp nr. 44). Stockholm: Svenska läkaresällskapet.
Carter, J., Huang, H. Q., Armer, J., Carlson, J. W., Lockwood, S., Nolte, S., . . . Wenzel, L. B. (2021). GOG 244 - The Lymphedema and Gynecologic cancer (LeG) study: The impact of lower-extremity lymphedema on quality of life, psychological adjustment, physical disability, and function. Gynecologic Oncology, 160(1), 244-251. https://doi.org/10.1016/j.ygyno.2020.10.023
Chan, J. K., Sugiyama, V., Pham, H., Gu, M., Rutgers, J., Osann, K., . . . Disaia, P. J. (2007). Margin distance and other clinico-pathologic prognostic factors in vulvar carcinoma: a multivariate analysis. Gynecologic Oncology, 104(3), 636-641. https://doi.org/10.1016/j.ygyno.2006.10.004
Coleman, R. L., Ali, S., Levenback, C. F., Gold, M. A., Fowler, J. M., Judson, P. L., . . . Trimble, C. L. (2013). Is bilateral lymphadenectomy for midline squamous carcinoma of the vulva always necessary? An analysis from Gynecologic Oncology Group (GOG) 173. Gynecologic Oncology, 128(2), 155-159. https://doi.org/10.1016/j.ygyno.2012.11.034
De Hullu, J. A., Hollema, H., Lolkema, S., Boezen, M., Boonstra, H., Burger, M. P., . . . Van Der Zee, A. G. (2002). Vulvar carcinoma. The price of less radical surgery. Cancer, 95(11), 2331-2338. https://doi.org/10.1002/cncr.10969
de Hullu, J. A., van der Avoort, I. A., Oonk, M. H., & van der Zee, A. G. (2006). Management of vulvar cancers. European Journal of Surgical Oncology, 32(8), 825-831. https://doi.org/10.1016/j.ejso.2006.03.035
de Hullu, J. A., & van der Zee, A. G. (2006). Surgery and radiotherapy in vulvar cancer. Critical Reviews in Oncology/Hematology, 60(1), 38-58. https://doi.org/10.1016/j.critrevonc.2006.02.008
de Sanjosé, S., Alemany, L., Ordi, J., Tous, S., Alejo, M., Bigby, S. M., . . . Bosch, F. X. (2013). Worldwide human papillomavirus genotype attribution in over 2000 cases of intraepithelial and invasive lesions of the vulva. European Journal of Cancer, 49(16), 3450-3461. https://doi.org/10.1016/j.ejca.2013.06.033
Dhakal, H. P., Nesland, J. M., Førsund, M., Trope, C. G., & Holm, R. (2013). Primary tumor vascularity, HIF-1alpha and VEGF expression in vulvar squamous cell carcinomas: their relationships with clinicopathological characteristics and prognostic impact. BMC Cancer, 13, 506. https://doi.org/10.1186/1471-2407-13-506
Edey, K. A., Allan, E., Murdoch, J. B., Cooper, S., & Bryant, A. (2013). Interventions for the treatment of Paget's disease of the vulva. Cochrane Database of Systematic Reviews, (10), CD009245. https://doi.org/10.1002/14651858.CD009245.pub2
Eva, L. J., Sadler, L., Fong, K. L., Sahota, S., Jones, R. W., & Bigby, S. M. (2020). Trends in HPV-dependent and HPV-independent vulvar cancers: The changing face of vulvar squamous cell carcinoma. Gynecologic Oncology, 157(2), 450-455. https://doi.org/10.1016/j.ygyno.2020.01.029
Ferrari, F., Forte, S., Ardighieri, L., Bonetti, E., Fernando, B., Sartori, E., & Odicino, F. (2019). Multivariate analysis of prognostic factors in primary squamous cell vulvar cancer: The role of perineural invasion in recurrence and survival. European Journal of Surgical Oncology, 45(11), 2115-2119. https://doi.org/10.1016/j.ejso.2019.07.029
FIGO (International Federation of Gynecology and Obstetrics) 26th Annual Report on the Results of Treatment in Gynecological Cancer. (2006). International Journal of Gynaecology and Obstetrics, 95 Suppl 1, S1-257.
Gaffney, D. K., King, B., Viswanathan, A. N., Barkati, M., Beriwal, S., Eifel, P., . . . Bosch, W. (2016). Consensus Recommendations for Radiation Therapy Contouring and Treatment of Vulvar Carcinoma. International Journal of Radiation Oncology, Biology, Physics, 95(4), 1191-1200. https://doi.org/10.1016/j.ijrobp.2016.02.043
Gaarenstroom, K. N., van der Hiel, B., Tollenaar, R. A. E. M., Vink, G. R., Jansen, F. W., van Asperen, C. J., & Kenter, G. G. (2006). Efficacy of screening women at high risk of hereditary ovarian cancer: results of an 11-year cohort study. International Journal of Gynecological Cancer, 16 Suppl 1, 54-59. https://doi.org/10.1111/j.1525-1438.2006.00480.x
Hauspy, J., Beiner, M., Harley, I., Ehrlich, L., Rasty, G., & Covens, A. (2007). Sentinel lymph node in vulvar cancer. Cancer, 110(5), 1015-1023. https://doi.org/10.1002/cncr.22874
Helsedirektoratet. (2019). Nasjonalt handlingsprogram for palliasjon i kreftomsorgen: nasjonal faglig retningslinje (rev utg.). (IS-2800). Oslo: Helsedirektoratet. Hentet fra https://www.helsedirektoratet.no/retningslinjer/palliasjon-i-kreftomsorgen-handlingsprogram/Palliasjon%20i%20kreftomsorgen%20%E2%80%93%20Nasjonalt%20handlingsprogram%20med%20retningslinjer.pdf
Holthoff, E. R., Jeffus, S. K., Gehlot, A., Stone, R., Erickson, S. W., Kelly, T., . . . Post, S. R. (2015). Perineural Invasion Is an Independent Pathologic Indicator of Recurrence in Vulvar Squamous Cell Carcinoma. The American Journal of Surgical Pathology, 39(8), 1070-1074. https://doi.org/10.1097/pas.0000000000000422
Howe, H. L., Wingo, P. A., Thun, M. J., Ries, L. A., Rosenberg, H. M., Feigal, E. G., & Edwards, B. K. (2001). Annual report to the nation on the status of cancer (1973 through 1998), featuring cancers with recent increasing trends. Journal of the National Cancer Institute, 93(11), 824-842.
Iversen, T., Abeler, V., & Aalders, J. (1981). Individualized treatment of stage I carcinoma of the vulva. Obstetrics and Gynecology, 57(1), 85-89.
Iversen, T., & Tretli, S. (1998). Intraepithelial and invasive squamous cell neoplasia of the vulva: trends in incidence, recurrence, and survival rate in Norway. Obstetrics and Gynecology, 91(6), 969-972. https://doi.org/10.1016/s0029-7844(98)00101-x
Jackson, K. S., Fankam, E. F., Das, N., Naik, R., Lopes, A. D., Godfrey, K. A., . . . Taylor, W. T. (2006). Unilateral groin and pelvic irradiation for unilaterally node-positive women with vulval carcinoma. International Journal of Gynecological Cancer, 16(1), 283-287. https://doi.org/10.1111/j.1525-1438.2006.00370.x
Jones, R. W., & Rowan, D. M. (1994). Vulvar intraepithelial neoplasia III: a clinical study of the outcome in 113 cases with relation to the later development of invasive vulvar carcinoma. Obstetrics and Gynecology, 84(5), 741-745.
Knopp, S. (2006). Prognostic studies in vulvar squamous cell carcinoma: with emphasis on cell cycle components, human papillomavirus and occult metastases (doktorgrad). (Series of dissertations submitted to the Faculty of Medicine, University of Oslo No. 492). Oslo: University of Oslo.
Kumar, S., Shah, J. P., & Malone, J. M., Jr. (2009). Vulvar cancer in women less than fifty in United States, 1980-2005. Gynecologic Oncology, 112(1), 283-284; author reply 234. https://doi.org/10.1016/j.ygyno.2008.07.003
Lai, K. W., & Mercurio, M. G. (2010). Medical and surgical approaches to vulvar intraepithelial neoplasia. Dermatologic Therapy, 23(5), 477-484. https://doi.org/10.1111/j.1529-8019.2010.01351.x
Lawrie, T. A., Patel, A., Martin-Hirsch, P. P., Bryant, A., Ratnavelu, N. D., Naik, R., & Ralte, A. (2014). Sentinel node assessment for diagnosis of groin lymph node involvement in vulval cancer. Cochrane Database of Systematic Reviews, (6), CD010409. https://doi.org/10.1002/14651858.CD010409.pub2
Levenback, C., Coleman, R. L., Burke, T. W., Bodurka-Bevers, D., Wolf, J. K., & Gershenson, D. M. (2001). Intraoperative lymphatic mapping and sentinel node identification with blue dye in patients with vulvar cancer. Gynecologic Oncology, 83(2), 276-281. https://doi.org/10.1006/gyno.2001.6374
Levenback, C., van der Zee, A. G. J., & Coleman, R. (red.). (2004). Clinical lymphatic mapping in gynecologic cancers. London and New York: Taylor & Francis.
Levenback, C. F., Ali, S., Coleman, R. L., Gold, M. A., Fowler, J. M., Judson, P. L., . . . Trimble, C. L. (2012). Lymphatic mapping and sentinel lymph node biopsy in women with squamous cell carcinoma of the vulva: a gynecologic oncology group study. Journal of Clinical Oncology, 30(31), 3786-3791. https://doi.org/10.1200/JCO.2011.41.2528
Levernes, S. (2012). Volum og doser i ekstern stråleterapi: definisjoner og anbefalinger (StrålevernRapport 2012:9). Østerås: Statens strålevern. Hentet fra https://dsa.no/publikasjoner/stralevernrapport-9-2012-volum-og-doser-i-ekstern-straleterapi/StralevernRapport_09-2012.pdf
Levernes, S. (2019). Nomenklatur for volumer i stråleterapi (Teknisk dokument 14). Østerås: Direktoratet for strålevern og atomsikkerhet. Hentet fra https://dsa.no/medisinsk-stralebruk/kvist/_/attachment/download/2f7317b7-e2f3-423e-b388-7d1d8d07b271:e947e054b123c9af0fa0fae10c867ce43e3d149e/TekniskDokument14.pdf
Lindell, G., Näsman, A., Jonsson, C., Ehrsson, R. J., Jacobsson, H., Danielsson, K. G., . . . Larson, B. (2010). Presence of human papillomavirus (HPV) in vulvar squamous cell carcinoma (VSCC) and sentinel node. Gynecologic Oncology, 117(2), 312-316. https://doi.org/10.1016/j.ygyno.2009.12.031
Mahner, S., Jueckstock, J. K., Hilpert, F., Lubbe, D., Harter, P., De Gregorio, N., . . . Woelber, L. L. (2012). Impact of adjuvant therapy in lymph-node positive vulvar cancer: The AGO CARE 1 study. Journal of Clinical Oncology, 30(15 SUPPL. 1), abstract 5007.
Malandrone, F., Bevilacqua, F., Merola, M., Gallio, N., Ostacoli, L., Carletto, S., & Benedetto, C. (2021). The Impact of Vulvar Cancer on Psychosocial and Sexual Functioning: A Literature Review. Cancers, 14(1). https://doi.org/10.3390/cancers14010063
McAlpine, J. N., Leung, S. C. Y., Cheng, A., Miller, D., Talhouk, A., Gilks, C. B., & Karnezis, A. N. (2017). Human papillomavirus (HPV)-independent vulvar squamous cell carcinoma has a worse prognosis than HPV-associated disease: a retrospective cohort study. Histopathology, 71(2), 238-246. https://doi.org/10.1111/his.13205
Meltzer-Gunnes, C. J., Lie, A. K., Jonassen, C. G. M., Rangberg, A., Nystrand, C. F., Småstuen, M. C., & Vistad, I. (2024). Time trends in human papillomavirus prevalence and genotype distribution in vulvar carcinoma in Norway. Acta Obstetricia et Gynecologica Scandinavica, 103(1), 153-164. https://doi.org/10.1111/aogs.14702
Meltzer-Gunnes, C. J., Smastuen, M. C., Kristensen, G. B., Trope, C. G., Lie, A. K., & Vistad, I. (2017). Vulvar carcinoma in Norway: A 50-year perspective on trends in incidence, treatment and survival. Gynecologic Oncology, 145(3), 543-548. https://doi.org/10.1016/j.ygyno.2017.03.008
Micheletti, L., Bogliatto, F., & Levi, A. C. (2005). La linfoadenectomia inguino-femorale: fondamenti embriologici, anatomotopografici, anatomochirurgici sulla preservazione della fascia femorale. Roma: CIC Edizioni Internazionali.
Micheletti, L., & Preti, M. (2014). Surgery of the vulva in vulvar cancer. Best Practice & Research: Clinical Obstetrics & Gynaecology, 28(7), 1074-1087. https://doi.org/10.1016/j.bpobgyn.2014.07.011
Monk, B. J., Burger, R. A., Lin, F., Parham, G., Vasilev, S. A., & Wilczynski, S. P. (1995). Prognostic significance of human papillomavirus DNA in vulvar carcinoma. Obstetrics and Gynecology, 85(5 Pt 1), 709-715. https://doi.org/10.1016/0029-7844(95)00045-s
Moore, D. H., Ali, S., Koh, W. J., Michael, H., Barnes, M. N., McCourt, C. K., . . . Walker, J. L. (2012). A phase II trial of radiation therapy and weekly cisplatin chemotherapy for the treatment of locally-advanced squamous cell carcinoma of the vulva: a gynecologic oncology group study. Gynecologic Oncology, 124(3), 529-533. https://doi.org/10.1016/j.ygyno.2011.11.003
Nooij, L. S., van der Slot, M. A., Dekkers, O. M., Stijnen, T., Gaarenstroom, K. N., Creutzberg, C. L., . . . van Poelgeest, M. I. (2016). Tumour-free margins in vulvar squamous cell carcinoma: Does distance really matter? European Journal of Cancer, 65, 139-149. https://doi.org/10.1016/j.ejca.2016.07.006
Oonk, M. H., van Hemel, B. M., Hollema, H., de Hullu, J. A., Ansink, A. C., Vergote, I., . . . van der Zee, A. G. (2010). Size of sentinel-node metastasis and chances of non-sentinel-node involvement and survival in early stage vulvar cancer: results from GROINSS-V, a multicentre observational study. Lancet Oncology, 11(7), 646-652. https://doi.org/10.1016/s1470-2045(10)70104-2
Oonk, M. H. M., Planchamp, F., Baldwin, P., Bidzinski, M., Brannstrom, M., Landoni, F., . . . van der Zee, A. G. J. (2017). European Society of Gynaecological Oncology Guidelines for the Management of Patients With Vulvar Cancer. International Journal of Gynecological Cancer, 27(4), 832-837. https://doi.org/10.1097/igc.0000000000000975
Oonk, M. H. M., Slomovitz, B., Baldwin, P. J. W., van Doorn, H. C., van der Velden, J., de Hullu, J. A., . . . van der Zee, A. G. J. (2021). Radiotherapy Versus Inguinofemoral Lymphadenectomy as Treatment for Vulvar Cancer Patients With Micrometastases in the Sentinel Node: Results of GROINSS-V II. Journal of Clinical Oncology, 39(32), 3623-3632. https://doi.org/10.1200/jco.21.00006
Pouwer, A. W., Hinten, F., van der Velden, J., Smolders, R. G. V., Slangen, B. F. M., Zijlmans, H., . . . de Hullu, J. A. (2017). Volume-controlled versus short drainage after inguinofemoral lymphadenectomy in vulvar cancer patients: A Dutch nationwide prospective study. Gynecologic Oncology, 146(3), 580-587. https://doi.org/10.1016/j.ygyno.2017.06.031
Pötter, R., Tanderup, K., Kirisits, C., de Leeuw, A., Kirchheiner, K., Nout, R., . . . Jürgenliemk-Schulz, I. (2018). The EMBRACE II study: The outcome and prospect of two decades of evolution within the GEC-ESTRO GYN working group and the EMBRACE studies. Clin Transl Radiat Oncol, 9, 48-60. https://doi.org/10.1016/j.ctro.2018.01.001
Rao, Y. J., Chin, R. I., Hui, C., Mutch, D. G., Powell, M. A., Schwarz, J. K., . . . Markovina, S. (2017). Improved survival with definitive chemoradiation compared to definitive radiation alone in squamous cell carcinoma of the vulva: A review of the National Cancer Database. Gynecologic Oncology, 146(3), 572-579. https://doi.org/10.1016/j.ygyno.2017.06.022
Rasmussen, C. L., Thomsen, L. T., Baandrup, L., Franzmann, M. B., Kjaer, A. K., Larsen, L. G., . . . Kjaer, S. K. (2023). Time trends in prevalence of p16 positivity and combined HPV/p16 positivity in a large cohort of Danish vulvar cancer patients. International Journal of Cancer, 152(11), 2424-2432. https://doi.org/10.1002/ijc.34446
Robison, K., Roque, D., McCourt, C., Stuckey, A., DiSilvestro, P. A., Sung, C. J., . . . Moore, R. G. (2014). Long-term follow-up of vulvar cancer patients evaluated with sentinel lymph node biopsy alone. Gynecologic Oncology, 133(3), 416-420. https://doi.org/10.1016/j.ygyno.2014.03.010
Rogers, L. J., & Cuello, M. A. (2018). Cancer of the vulva. International Journal of Gynaecology and Obstetrics, 143 Suppl 2, 4-13. https://doi.org/10.1002/ijgo.12609
Scheistrøen, M., Nesland, J. M., & Trope, C. (2002). Have patients with early squamous carcinoma of the vulva been overtreated in the past? The Norwegian experience 1977-1991. European Journal of Gynaecological Oncology, 23(2), 93-103.
Schuurman, M. S., van den Einden, L. C., Massuger, L. F., Kiemeney, L. A., van der Aa, M. A., & de Hullu, J. A. (2013). Trends in incidence and survival of Dutch women with vulvar squamous cell carcinoma. European Journal of Cancer, 49(18), 3872-3880. https://doi.org/10.1016/j.ejca.2013.08.003
Smith, J. S., Backes, D. M., Hoots, B. E., Kurman, R. J., & Pimenta, J. M. (2009). Human papillomavirus type-distribution in vulvar and vaginal cancers and their associated precursors. Obstetrics and Gynecology, 113(4), 917-924. https://doi.org/10.1097/AOG.0b013e31819bd6e0
Srodon, M., Stoler, M. H., Baber, G. B., & Kurman, R. J. (2006). The distribution of low and high-risk HPV types in vulvar and vaginal intraepithelial neoplasia (VIN and VaIN). American Journal of Surgical Pathology, 30(12), 1513-1518. https://doi.org/10.1097/01.pas.0000213291.96401.48
Stehman, F. B., Bundy, B. N., Thomas, G., Varia, M., Okagaki, T., Roberts, J., . . . Heller, P. B. (1992). Groin dissection versus groin radiation in carcinoma of the vulva: a Gynecologic Oncology Group study. International Journal of Radiation Oncology, Biology, Physics, 24(2), 389-396. https://doi.org/10.1016/0360-3016(92)90699-i
Te Grootenhuis, N. C., Pouwer, A. W., de Bock, G. H., Hollema, H., Bulten, J., van der Zee, A. G. J., . . . Oonk, M. H. M. (2018). Prognostic factors for local recurrence of squamous cell carcinoma of the vulva: A systematic review. Gynecologic Oncology, 148(3), 622-631. https://doi.org/10.1016/j.ygyno.2017.11.006
Tran, D. A., Tan, X., Macri, C. J., Goldstein, A. T., & Fu, S. W. (2019). Lichen Sclerosus: An autoimmunopathogenic and genomic enigma with emerging genetic and immune targets. International Journal of Biological Sciences, 15(7), 1429-1439. https://doi.org/10.7150/ijbs.34613
van de Nieuwenhof, H. P., van Kempen, L. C., de Hullu, J. A., Bekkers, R. L., Bulten, J., Melchers, W. J., & Massuger, L. F. (2009). The etiologic role of HPV in vulvar squamous cell carcinoma fine tuned. Cancer Epidemiology, Biomarkers and Prevention, 18(7), 2061-2067. https://doi.org/10.1158/1055-9965.Epi-09-0209
van der Velden, J., Fons, G., & Lawrie, T. A. (2011). Primary groin irradiation versus primary groin surgery for early vulvar cancer. Cochrane Database of Systematic Reviews, (5), CD002224. https://doi.org/10.1002/14651858.CD002224.pub2
Woelber, L., Choschzick, M., Eulenburg, C., Hager, M., Jaenicke, F., Gieseking, F., . . . Mahner, S. (2011a). Prognostic value of pathological resection margin distance in squamous cell cancer of the vulva. Annals of Surgical Oncology, 18(13), 3811-3818. https://doi.org/10.1245/s10434-011-1778-0
Woelber, L., Eulenburg, C., Grimm, D., Trillsch, F., Bohlmann, I., Burandt, E., . . . Prieske, K. (2016a). The Risk of Contralateral Non-sentinel Metastasis in Patients with Primary Vulvar Cancer and Unilaterally Positive Sentinel Node. Annals of Surgical Oncology, 23(8), 2508-2514. https://doi.org/10.1245/s10434-016-5114-6
Woelber, L., Griebel, L. F., Eulenburg, C., Sehouli, J., Jueckstock, J., Hilpert, F., . . . Mahner, S. (2016b). Role of tumour-free margin distance for loco-regional control in vulvar cancer-a subset analysis of the Arbeitsgemeinschaft Gynäkologische Onkologie CaRE-1 multicenter study. European Journal of Cancer, 69, 180-188. https://doi.org/10.1016/j.ejca.2016.09.038
Woelber, L., Kock, L., Gieseking, F., Petersen, C., Trillsch, F., Choschzick, M., . . . Mahner, S. (2011b). Clinical management of primary vulvar cancer. European Journal of Cancer, 47(15), 2315-2321. https://doi.org/10.1016/j.ejca.2011.06.007
Yap, J. K., Fox, R., Leonard, S., Ganesan, R., Kehoe, S. T., Dawson, C. W., . . . Luesley, D. M. (2016). Adjacent Lichen Sclerosis predicts local recurrence and second field tumour in women with vulvar squamous cell carcinoma. Gynecologic Oncology, 142(3), 420-426. https://doi.org/10.1016/j.ygyno.2016.06.019
Zięba, S., Chechlińska, M., Kowalik, A., & Kowalewska, M. (2020). Genes, pathways and vulvar carcinoma - New insights from next-generation sequencing studies. Gynecologic Oncology, 158(2), 498-506. https://doi.org/10.1016/j.ygyno.2020.05.034









